E. Brasnu, A. Labbé, C. Baudouin
-
L’examen biomicroscopique du segment antérieur du globe oculaire et de la surface oculaire est capital chez tout patient atteint de glaucome primitif à angle ouvert (GPAO).
Les effets secondaires des collyres antiglaucomateux prescrits au long cours sur la surface oculaire, souvent sous-estimés, sont réels, pouvant aller des classiques réactions allergiques au plus fréquent syndrome sec, jusqu’à la pseudo-pemphigoïde et surtout à l’échec de la chirurgie filtrante.
Au vu des résultats de nombreuses études publiées, il paraît logique d’incriminer les conservateurs, en particulier le chlorure de benzalkonium (BAK) présent dans la plupart des collyres.
Un examen clinique rigoureux et complet du segment antérieur est indispensable au diagnostic positif de GPAO, principalement pour éliminer un glaucome secondaire à angle ouvert ou un glaucome par fermeture de l’angle (voir chapitre 9-III paragraphe « Biomicroscopie du segment antérieur ») [1].
En effet, en dehors des anomalies de la surface oculaire d’origine iatrogène détaillées plus loin, l’examen du segment antérieur est sans particularité dans le GPAO. Ainsi, l’examen biomicroscopique retrouve une cornée de taille normale (absence de mégalocornée). L’examen de la face postérieure de celle-ci élimine la présence de ruptures de la membrane de Descemet (stries de Haab), d’un faisceau de Krükenberg, de précipités rétrodescemétiques ou d’un aspect en argent martelé de l’endothélium pouvant faire évoquer respectivement un glaucome congénital, un syndrome de dispersion pigmentaire, un glaucome uvéitique ou un syndrome irido-cornéo-endothélial.
De même, la chambre antérieure, surtout en périphérie, est classiquement « profonde » dans le GPAO. Cette profondeur pourra être évaluée de façon plus objective par le test de Van Herick (voir chapitre 9-III paragraphe « Biomicroscopie du segment antérieur ») qui ne dispense néanmoins en aucun cas de la réalisation d’un examen gonioscopique, examen qui, seul, permettra de confirmer le caractère ouvert de l’angle iridocornéen.
De même, comme cela a été détaillé dans le chapitre 9-III (paragraphe « Biomicroscopie du segment antérieur »), l’examen de l’iris et du cristallin est typiquement sans particularité dans le GPAO, en dehors d’une éventuelle cataracte qui peut y être associée. Aussi la présence de nodules iriens, de synéchies iridocristalliniennes, d’un ectropion uvéal, de néovaisseaux, de zones d’atrophie, d’une corectopie ou de dépôts pseudo-exfoliatifs sera-t-elle plutôt en faveur du diagnostic de glaucome « secondaire » à angle ouvert.
Aujourd’hui, la plupart des patients glaucomateux bénéficient d’un traitement médical, proposé en première intention dans la majorité des cas, comme cela est préconisé d’ailleurs dans les directives de l’EGS (European Glaucoma Society) [16]. Ainsi le traitement médical est-il administré sur de longues périodes, le plus souvent à vie, avec passage à une multi-thérapie lorsque la cible pressionnelle n’est pas atteinte, excepté en cas de recours à la chirurgie ou au laser.
D’après les données des études cliniques prospectives randomisées, la tolérance des traitements antiglaucomateux semble satisfaisante, avec seulement une faible proportion de patients exclus en raison d’une intolérance locale ou d’une allergie oculaire. Dans l’étude de van der Valk et al. [43], méta-analyse de 28 études cliniques randomisées, le pourcentage global de patients exclus était de 0 à 16 %, la plupart des études ayant un taux d’exclusion inférieur à 8 %. Ainsi, nous pensons que les effets indésirables des collyres sur la surface oculaire sont le plus souvent sous-estimés dans ces études, et ce pour plusieurs raisons [4]. Premièrement, les études cliniques sur le traitement du glaucome sont rarement réalisées sur de longues périodes, en général sur quelques mois seulement, ce qui est éloigné de la réalité de la vie des patients glaucomateux [4]. En effet, les effets de composés toxiques peuvent mettre plusieurs années avant de s’accumuler au point de s’exprimer cliniquement, et sont ainsi probablement largement sous-estimés par les études cliniques randomisées réalisées sur des durées courtes. De plus, pour des raisons éthiques de méthodologie, les patients présentant une hypersensibilité connue au principe actif d’un collyre ou d’un conservateur, ou les patients présentant une pathologie associée de la surface oculaire (sécheresse oculaire sévère, blépharite, allergie chronique) ne sont pas inclus dans ces études afin d’éviter des biais potentiels. Or 15 à 34 % des patients de plus de 65 ans (glaucomateux ou non) présenteraient une sécheresse oculaire [45] pouvant majorer les effets indésirables liés au collyre et réduisant les capacités de défense de la cornée et de la conjonctive vis-à-vis du toxique. Enfin, en pratique clinique, plusieurs traitements concomitants sont souvent prescrits, une large proportion de patients nécessitant une multi-thérapie. Cela est bien illustré par les données de l’OHTS (Ocular Hypertension Treatment Study), où environ 40 % des patients présentant une hypertension intra-oculaire oculaire (HTO) initialement bénéficiaient d’une bithérapie à cinq ans, et 9 % de trois traitements ou plus (proportion plus élevée encore chez les Afro-Américains) [21]. Il est facile de comprendre qu’une multi-thérapie soit susceptible de majorer les effets secondaires de chaque composé pris individuellement, soit par l’existence d’interactions médicamenteuses, soit par un effet additif. Cela est particulièrement vrai pour les conservateurs, qui sont susceptibles d’être instillés jusqu’à quatre ou cinq fois par jour en fonction du traitement prescrit.
Ainsi les essais cliniques randomisés ne sont-ils pas toujours révélateurs de la réalité, pour toutes les raisons citées précédemment. Or les effets secondaires des collyres antiglaucomateux prescrits au long cours, souvent sous-estimés par ces études, sont réels, pouvant aller des classiques réactions allergiques au plus fréquent syndrome sec, jusqu’à la pseudo-pemphigoïde.
Les réactions allergiques sont souvent incriminées par les praticiens dans l’intolérance aux conservateurs. Or l’allergie vraie aux collyres est loin d’être l’effet secondaire le plus fréquent des collyres antiglaucomateux, et se manifeste cliniquement par des symptômes variés : œdème palpébral, eczéma, hyperhémie conjonctivale, larmoiement, sensations de brûlure ou démangeaisons, pouvant aller jusqu’à la conjonctivite gigantopapillaire qui, en général, fait évoquer le diagnostic et motive un arrêt du traitement (fig. 10-1). Les signes peuvent également être plus discrets (chémosis isolé, discrètes papilles conjonctivales), sans eczéma palpébral systématique, rendant le diagnostic parfois plus difficile. Contrairement aux effets toxiques des collyres, l’allergie se manifeste souvent de façon assez bruyante, survenant classiquement quelques jours après l’instauration du traitement et disparaissant rapidement à l’arrêt de celui-ci. Néanmoins, l’allergie à un médicament peut être parfois plus difficile à incriminer, des réactions plus retardées pouvant survenir, mimant souvent une blépharite avec inflammation a minima, ce qui explique probablement le faible pourcentage de patients exclus des études [43]. L’examen clinique devra savoir rechercher ces signes cliniques évocateurs.
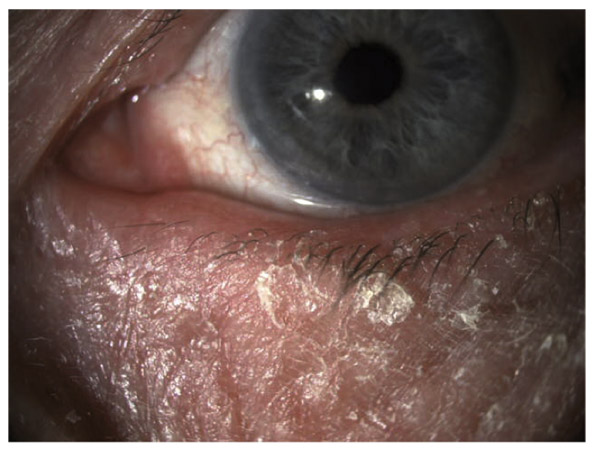
Fig. 10-1 Allergie de contact chez un patient glaucomateux multi-traité.
Pour les raisons expliquées plus haut, les signes cliniques et symptômes en rapport avec la surface oculaire contrastent avec les données des études prospectives chez les patients traités pour un glaucome.
Ainsi, dans une étude européenne portant sur 9 658 patients, plus de 40 % des patients traités pour un glaucome ou une HTO présentaient des symptômes d’atteinte de la surface oculaire comme des douleurs ou un inconfort à l’instillation, des sensations de corps étranger, des brûlures ou démangeaisons, des sensations d’œil sec, et plus de 20 % des signes cliniques à type de blépharites, d’hyperhémies conjonctivales ou de kératites [20]. Plus récemment, Leung et al. [25] ont analysé, aux États-Unis, l’impact de la surface oculaire dans la prise en charge de patients atteints de GPAO ou d’HTO chez 101 patients. Dans cette étude utilisant le questionnaire OSDI (ocular surface disease index), plus de la moitié des patients (59 %) ont rapporté des symptômes dans un œil au moins, avec une atteinte sévère chez 27 % d’entre eux. Le test de Schirmer a révélé une diminution de la production lacrymale chez 61 % des patients sur un œil au moins, avec 35 % d’atteinte sévère. Le test au vert de lissamine était positif sur la conjonctive et/ou la cornée dans 22 % des cas, et le temps de rupture du film lacrymal diminué chez 78 % des patients (sévère dans 65 % des cas). Une autre étude observationnelle multicentrique récente, réalisée sur 20 506 patients glaucomateux en Allemagne, a retrouvé une sécheresse oculaire chez près de la moitié des patients, la prévalence étant plus élevée chez les femmes (56,9 versus 45,7 %) [15]. Ces résultats étaient concordants avec ceux de l’étude multicentrique américaine plus récente de Fechtner et al. [17] chez 630 patients traités, où 48,4 % d’entre eux présentaient des symptômes de sécheresse oculaire. De plus, dans cette étude, le score OSDI était plus élevé chez les patients multi-traités, par rapport aux patients n’utilisant qu’une monothérapie. Dans une autre étude, française celle-ci, réalisée chez 204 patients, 25,4 % des patients présentaient une sensation de brûlure, 20,8 % une vision floue, 20,2 % un larmoiement, ces symptômes étant par ailleurs pourvoyeurs d’une diminution de l’adhérence au traitement [31].
Récemment, Van Went et al. [44] ont, sur 88 patients traités pour glaucome ou HTO, retrouvé une atteinte significative de la surface oculaire (OSDI > 22) dans 82 % des cas. Pour un nombre important de patients, ces pathologies influençaient non seulement leur qualité de vie, mais surtout la prise en charge thérapeutique même du glaucome. Ces résultats étaient corrélés à ceux d’une autre étude observationnelle multicentrique française réalisée très récemment sur 516 patients traités pour un GPAO ou une HTO qui visait à déterminer la prévalence des pathologies de la surface oculaire chez les patients glaucomateux traités, et à identifier des facteurs de risque chez ces patients [6]. Les résultats de cette étude ont retrouvé une atteinte de la surface oculaire plus fréquente et plus sévère chez les patients âgés recevant plus de collyres et ayant un glaucome plus avancé. Par ailleurs, dans cette même étude, pour 40 % des patients, un changement de thérapeutique a dû être effectué en rapport avec une intolérance locale au traitement, ce qui était corrélé avec les résultats de l’étude de Van Went et al. précédemment citée [44].
L’utilisation de traitements antiglaucomateux au long cours a aussi été incriminée dans le développement d’une fibrose conjonctivale, entraînant une rétraction conjonctivale avec cicatrisation conjonctivale excessive pouvant être à l’origine d’une pseudo-pemphigoïde ou évoluer vers une rétraction conjonctivale avec atteinte cornéenne [37] (fig. 10-2). Sur le plan histologique, cette fibrose est vraisemblablement la conséquence d’une augmentation de la densité fibroblastique dans la substantia propria, en rapport avec une augmentation du nombre de cellules inflammatoires [5, 11, 38]. Dans une série de 145 patients présentant une pseudo-pemphigoïde, publiée par Thorne et al. [39], la première cause de pseudo-pemphigoïde était l’exposition aux collyres antiglaucomateux [39].
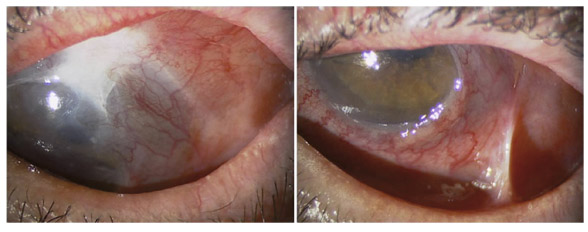
Fig. 10-2 Photographie clinique d’un patient présentant une pseudo-pemphigoïde oculaire suite à l’utilisation de collyres antiglaucomateux.
L’échec de la chirurgie filtrante du glaucome, quelle que soit la technique utilisée (trabéculectomie perforante ou non), est dans la majorité des cas la résultante d’une cicatrisation conjonctivale excessive au niveau de la bulle de filtration dans les mois suivant la chirurgie (fig. 10-3 et 10-4). Cela se caractérise par une prolifération fibroblastique anormale et une inflammation conjonctivale accrue, associées à une production excessive de la matrice extracellulaire, qui viennent bloquer la sortie d’humeur aqueuse au niveau de l’espace sous-conjonctival. Aux classiques facteurs de risque de fibrose (patients mélanodermes, contexte inflammatoire, jeune âge, reprise chirurgicale, etc.) vient s’ajouter l’inflammation préopératoire conjonctivale, conséquence d’un traitement au long cours par les collyres antiglaucomateux [10]. En effet, cela fait une vingtaine d’années environ que le rôle des collyres sur l’échec de la chirurgie filtrante a été évoqué, principalement par les équipes d’outre-Manche [12, 24]. Broadway et al. [12], notamment, ont montré une relation significative entre le risque d’échec de la chirurgie et, d’une part, le nombre de collyres utilisés et, d’autre part, la durée du traitement. Cela a fait l’objet, pendant la même période et par la suite, à la fois d’études histopathologiques sur des biopsies ou empreintes conjonctivales et d’études cliniques prospectives ou observationnelles qui ont incriminé notamment les conservateurs.
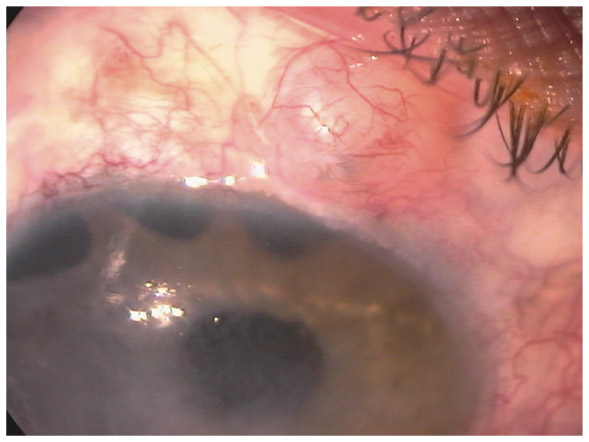
Fig. 10-3 Patient ayant subi un échec de plusieurs chirurgies filtrantes avec présence d’une bulle de filtration encapsulée et de deux bulles de filtration plates.
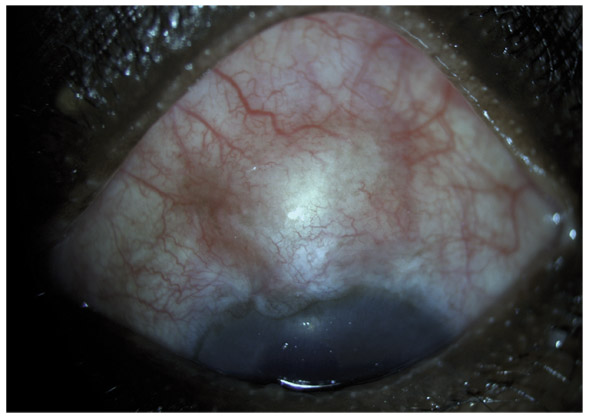
Fig. 10-4 Photographie clinique d’un patient présentant une bulle de filtration encapsulée.
La pharmacopée européenne requiert des préparations ophtalmologiques qu’elles contiennent un agent antimicrobien (conservateur) afin d’assurer leur stérilité et d’empêcher l’introduction de contaminants et la croissance de micro-organismes [4, 42]. Il existe un grand nombre de conservateurs utilisés en association avec un ou plusieurs principes actifs dans les collyres. On les distingue habituellement par leur mode d’action : chimique, antioxydant ou complexant. Les ammoniums quaternaires, conservateurs chimiques dont le chef de file est le chlorure de benzalkonium (BAK), sont les plus utilisés [4, 42] et agissent par altération des membranes cellulaires en induisant une lyse cellulaire. Or les effets délétères d’un traitement au long cours par collyres contenant du BAK sont actuellement bien connus et ont été démontrés sur plusieurs modèles in vivo ou in vitro, chez l’animal, chez l’homme et sur les cellules conjonctivales ou trabéculaires : effet détergent sur le film lacrymal, effets pro-apoptotiques, pro-nécrotiques, pro-oxydants et pro-inflammatoires directs sur les cellules de la surface oculaire et du trabéculum, mais aussi effets indirects d’activation immuno-inflammatoire et de neurotoxicité [3, 4, 8, 22, 26, 27, 30, 36].
Dans le glaucome, au début, seule une seule classe thérapeutique, celle des bêtabloquants, a bénéficié des formes sans conservateur (unidoses ou ABAK®), le tout premier étant le Bétoptic® en unidose (Alcon, Fort Worth, Texas, États-Unis). Quelques années plus tard, avec l’apparition des collyres de la classe des prostanoïdes de synthèse (prostaglandines et prostamide) dont l’efficacité sur la baisse de la PIO était supérieure à celle des bêtabloquants, les ophtalmologistes furent dans l’obligation de faire un choix thérapeutique entre efficacité et suppression du conservateur (tolérance). La première alternative, représentée par l’association fixe timolol/dorzolamide en récipient unidoses (Cosopt®, MSD, Whitehouse Station, New Jersey, États-Unis) n’arrivera que plusieurs années plus tard (fin des années 2000). Par la suite, les laboratoires pharmaceutiques développèrent des analogues des prostaglandines sans BAK, dans des formulations sans conservateur ou utilisant un conservateur moins, voire non toxique comme le Polyquad® (Alcon). Notons que tous ces collyres ont fait l’objet de plusieurs études in vitro ou in vivo chez l’animal, toutes retrouvant des effets moins toxiques des formes sans conservateur ou sans BAK sur les modèles cellulaires ou chez l’animal, seuls ou en association avec le timolol, par rapport aux formes en contenant [7, 9, 28, 29]. Par ailleurs, la suppression du conservateur ne s’accompagne a priori pas de baisse d’efficacité sur la PIO [14, 18, 41].
Sur le plan histopathologique, le nombre de traitements antiglaucomateux et leur durée ont été identifiés comme étant des facteurs favorisant la prolifération fibroblastique et l’inflammation conjonctivale. Cela soulève plusieurs questions sur la corrélation entre le nombre et la durée des traitements et la clinique, et surtout le rôle des conservateurs qui sont présents dans presque tous les collyres.
Une étude observationnelle récente a montré la prévalence élevée de sécheresse oculaire chez les patients glaucomateux, mais surtout une relation évidente avec le nombre de collyres instillés : 39 % et 43 % pour deux ou trois collyres par jour respectivement (8,7 % et 15 % de sécheresse oculaire sévère) contre 11 % seulement pour les patients bénéficiant d’une monothérapie, avec un retentissement important sur la qualité de vie [35]. Dans l’étude d’Erb et al. [15], une sécheresse oculaire était plus fréquemment retrouvée dans les cas de glaucome sévère pour lesquels trois collyres ou plus étaient utilisés. Celle-ci était également accrue avec la durée de la maladie. Récemment, Labbé et al. [23] ont retrouvé également une relation entre l’augmentation de l’osmolarité des larmes et le nombre de collyres instillés chez les patients glaucomateux. Par ailleurs, Broadway et al. [12] ont montré une relation significative entre le nombre de collyres utilisés, la durée du traitement et le risque d’échec de la chirurgie. Toutes ces études, associées aux données histopathologiques rapportées dans la littérature [4], soulignent l’effet délétère des collyres antiglaucomateux au long cours sur la surface oculaire, cet effet augmentant avec le nombre de collyres et la durée du traitement. Ainsi, au vu des résultats de ces études, il paraît logique d’incriminer les conservateurs, en particulier le BAK présent dans la plupart des collyres, dans cette toxicité qui semble présenter un effet additif.
Plusieurs études observationnelles et prospectives ont ainsi été réalisées au cours des quinze dernières années dans le but de mettre en évidence le rôle des conservateurs, notamment des études évaluant la surface oculaire de patients traités par des collyres avec et sans conservateur. Dans ces études, les symptômes d’irritation de la surface oculaire et les signes cliniques étaient plus fréquents chez les patients traités avec des collyres conservés par rapport aux patients traités avec des produits sans conservateur [2, 19, 20, 32-34, 46].
Des études plus récentes ont par ailleurs retrouvé une diminution de la sensibilité cornéenne chez les patients glaucomateux traités, avec des modifications du nombre ou de la morphologie des nerfs cornéens en microscopie confocale in vivo, ce rôle du BAK pouvant expliquer la relative et « fausse » bonne tolérance des collyres contenant du BAK chez certains patients traités au long cours par des collyres en contenant [22, 30].
Des études de substitution, moins nombreuses, ont également été réalisées afin d’étudier l’évolution des symptômes à l’arrêt des conservateurs, retrouvant une diminution de l’incidence des symptômes et des signes cliniques après réduction de la quantité de conservateurs, soit par réduction des collyres en contenant, soit par passage à une forme sans conservateur [13, 20, 33, 40].
Toutes ces études soulignent donc l’importance en pratique de rechercher des symptômes ou signes cliniques d’atteinte de la surface oculaire chez les patients glaucomateux, afin d’améliorer la prise en charge thérapeutique, en particulier la tolérance et l’observance du traitement, et le succès d’une éventuelle chirurgie filtrante.
Retenir
-
L’examen de la surface oculaire et du segment antérieur doit être systématique chez tout patient glaucomateux ou hypertone, à la recherche de signes de sécheresse ou d’inflammation de la surface oculaire.
-
En cas d’atteinte de la surface oculaire, une réduction des conservateurs et un traitement spécifique de la surface oculaire pourront être proposés afin d’améliorer la tolérance et l’observance du traitement, et de réduire le risque de fibrose postopératoire en cas de chirurgie ultérieure.
[1] AAO. Cours de sciences fondamentales et cliniques. Issy-les-Moulineaux, Elsevier-Masson, 2010.
[2] Baudouin C, de Lunardo C. Short-term comparative study of topical 2 % carteolol with and without benzalkonium chloride in healthy volunteers. Br J Ophthalmol. 1998 ; 82 : 39-42.
[3] Baudouin C, Denoyer A, Desbenoit N, et al. In vitro and in vivo experimental studies on trabecular meshwork degeneration induced by benzalkonium chloride (an American Ophthalmological Society thesis). Trans Am Ophthalmol Soc. 2012 ; 110 : 40-63.
[4] Baudouin C, Labbe A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res. 2010 ; 29 : 312-34.
[5] Baudouin C, Pisella PJ, Fillacier K, et al. Ocular surface inflammatory changes induced by topical antiglaucoma drugs : human and animal studies. Ophthalmology. 1999 ; 106 : 556-63.
[6] Baudouin C, Renard JP, Nordmann JP, et al. Prevalence and risk factors for ocular surface disease among patients treated over the long term for glaucoma or ocular hypertension. Eur J Ophthalmol. 2012 ; doi : 10.5301.
[7] Brasnu E, Brignole-Baudouin F, Riancho L, et al. In vitro effects of preservative-free tafluprost and preserved latanoprost, travoprost, and bimatoprost in a conjunctival epithelial cell line. Curr Eye Res. 2008 ; 33 : 303-12.
[8] Brignole-Baudouin F, Desbenoit N, Hamm G, et al. A new safety concern for glaucoma treatment demonstrated by mass spectrometry imaging of benzalkonium chloride distribution in the eye, an experimental study in rabbits. PLoS One. 2012 ; 7 : e50180.
[9] Brignole-Baudouin F, Riancho L, Liang H, et al. In vitro comparative toxicology of polyquad-preserved and benzalkonium chloride-preserved travoprost/timolol fixed combination and latanoprost/timolol fixed combination. J Ocul Pharmacol Ther. 2011 ; 28 : 273-80.
[10] Broadway DC, Chang LP. Trabeculectomy, risk factors for failure and the preoperative state of the conjunctiva. J Glaucoma. 2001 ; 10 : 237-49.
[11] Broadway DC, Grierson I, O’Brien C, Hitchings RA. Adverse effects of topical antiglaucoma medication. I. The conjunctival cell profile. Arch Ophthalmol. 1994 ; 112 : 1437-45.
[12] Broadway DC, Grierson I, O’Brien C, Hitchings RA. Adverse effects of topical antiglaucoma medication. II. The outcome of filtration surgery. Arch Ophthalmol. 1994 ; 112 : 1446-54.
[13] Bron A, Chiambaretta F, Pouliquen P, et al. Intérêt de la substitution d’un traitement journalier de 2 instillations de timolol par 1 instillation quotidienne de bêtabloquant non conservé chez des patients présentant un glaucome chronique ou une hypertonie oculaire. J Fr Ophtalmol. 2003 ; 26 : 668-74.
[14] Daull P, Buggage R, Lambert G, et al. A comparative study of a preservative-free latanoprost cationic emulsion (Catioprost) and a BAK-preserved latanoprost solution in animal models. J Ocul Pharmacol Ther. 2012 ; 28 : 515-23.
[15] Erb C, Gast U, Schremmer D. German register for glaucoma patients with dry eye. I. Basic outcome with respect to dry eye. Graefes Arch Clin Exp Ophthalmol. 2008 ; 246 : 1593-601.
[16] European Glaucoma Society. Terminology and guidelines for glaucoma. Savone (Italie), Dogma, 2008.
[17] Fechtner RD, Godfrey DG, Budenz D, et al. Prevalence of ocular surface complaints in patients with glaucoma using topical intraocular pressure-lowering medications. Cornea. 2010 ; 29 : 618-21.
[18] Henry JC, Peace JH, Stewart JA, Stewart WC. Efficacy, safety, and improved tolerability of travoprost BAK-free ophthalmic solution compared with prior prostaglandin therapy. Clin Ophthalmol. 2008 ; 2 : 613-21.
[19] Ishibashi T, Yokoi N, Kinoshita S. Comparison of the short-term effects on the human corneal surface of topical timolol maleate with and without benzalkonium chloride. J Glaucoma. 2003 ; 12 : 486-90.
[20] Jaenen N, Baudouin C, Pouliquen P, et al. Ocular symptoms and signs with preserved and preservative-free glaucoma medications. Eur J Ophthalmol. 2007 ; 17 : 341-9.
[21] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13 ; discussion : 829-30.
[22] Labbe A, Alalwani H, Van Went C, et al. The relationship between subbasal nerve morphology and corneal sensation in ocular surface disease. Invest Ophthalmol Vis Sci. 2012 ; 53 : 4926-31.
[23] Labbe A, Terry O, Brasnu E, et al. Tear film osmolarity in patients treated for glaucoma or ocular hypertension. Cornea. 2012 ; 31 : 994-9.
[24] Lavin MJ, Wormald RP, Migdal CS, Hitchings RA. The influence of prior therapy on the success of trabeculectomy. Arch Ophthalmol. 1990 ; 108 : 1543-8.
[25] Leung EW, Medeiros FA, Weinreb RN. Prevalence of ocular surface disease in glaucoma patients. J Glaucoma. 2008 ; 17 : 350-5.
[26] Liang H, Baudouin C, Dupas B, Brignole-Baudouin F. Live conjunctiva-associated lymphoid tissue analysis in rabbit under inflammatory stimuli using in vivo confocal microscopy. Invest Ophthalmol Vis Sci. 2010 ; 51 : 1008-15.
[27] Liang H, Baudouin C, Labbe A, et al. Conjunctiva-associated lymphoid tissue (CALT) reactions to antiglaucoma prostaglandins with or without BAK-preservative in rabbit acute toxicity study. PLoS One. 2012 ; 7 : e33913.
[28] Liang H, Brignole-Baudouin F, Pauly A, et al. Polyquad-preserved travoprost/timolol, benzalkonium chloride (BAK)-preserved travoprost/timolol, and latanoprost/timolol in fixed combinations : a rabbit ocular surface study. Adv Ther. 2011 ; 28 : 311-25.
[29] Liang H, Pauly A, Riancho L, et al. Toxicological evaluation of preservative-containing and preservative-free topical prostaglandin analogues on a three-dimensional-reconstituted corneal epithelium system. Br J Ophthalmol. 2011 ; 95 : 869-75.
[30] Martone G, Frezzotti P, Tosi GM, et al. An in vivo confocal microscopy analysis of effects of topical antiglaucoma therapy with preservative on corneal innervation and morphology. Am J Ophthalmol. 2009 ; 147 : 725-35.
[31] Nordmann JP, Auzanneau N, Ricard S, Berdeaux G. Vision related quality of life and topical glaucoma treatment side effects. Health Qual Life Outcomes. 2003 ; 1 : 75.
[32] Nuzzi R, Finazzo C, Cerruti A. Adverse effects of topical antiglaucomatous medications on the conjunctiva and the lachrymal response. Int Ophthalmol. 1998 ; 22 : 31-5.
[33] Pisella PJ, Pouliquen P, Baudouin C. Prevalence of ocular symptoms and signs with preserved and preservative free glaucoma medication. Br J Ophthalmol. 2002 ; 86 : 418-23.
[34] Rolando M, Brezzo V, Giordano G, et al. The effect of different benzalkonium chloride concentrations on human normal ocular surface. In : Van Bijsterveld O, Lemp M, Spinelli D (eds.). The lacrimal system. Amsterdam, Berkely, Milano, Kugler and Ghedini Publications, 1991.
[35] Rossi GC, Tinelli C, Pasinetti GM, et al. Dry eye syndrome-related quality of life in glaucoma patients. Eur J Ophthalmol. 2009 ; 19 : 572-9.
[36] Sarkar J, Chaudhary S, Namavari A, et al. Corneal neurotoxicity due to topical benzalkonium chloride. Invest Ophthalmol Vis Sci. 2012 ; 53 : 1792-802.
[37] Schwab IR, Linberg JV, Gioia VM, et al. Foreshortening of the inferior conjunctival fornix associated with chronic glaucoma medications. Ophthalmology. 1992 ; 99 : 197-202.
[38] Sherwood MB, Grierson I, Millar L, Hitchings RA. Long-term morphologic effects of antiglaucoma drugs on the conjunctiva and Tenon’s capsule in glaucomatous patients. Ophthalmology. 1989 ; 96 : 327-35.
[39] Thorne JE, Anhalt GJ, Jabs DA. Mucous membrane pemphigoid and pseudopemphigoid. Ophthalmology. 2004 ; 111 : 45-52.
[40] Uusitalo H, Chen E, Pfeiffer N, et al. Switching from a preserved to a preservative-free prostaglandin preparation in topical glaucoma medication. Acta Ophthalmol. 2010 ; 88 : 329-36.
[41] Uusitalo H, Pillunat LE, Ropo A. Efficacy and safety of tafluprost 0.0015 % versus latanoprost 0.005 % eye drops in open-angle glaucoma and ocular hypertension : 24-month results of a randomized, double-masked phase III study. Acta Ophthalmol. 2010 ; 88 : 12-9.
[42] Vaede D, Baudouin C, Warnet JM, Brignole-Baudouin F. Les conservateurs des collyres : vers une prise de conscience de leur toxicité. J Fr Ophtalmol. 2010 ; 33 : 505-24.
[43] van der Valk R, Webers CA, Schouten JS, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs : a meta-analysis of randomized clinical trials. Ophthalmology. 2005 ; 112 : 1177-85.
[44] Van Went C, Brasnu E, Hamard P, et al. Influence des pathologies de la surface oculaire sur le traitement du glaucome. J Fr Ophtalmol. 2011 ; 34 : 230-7.
[45] WorkShop DE. The epidemiology of dry eye disease : report of the Epidemiology Subcommittee of the International Dry Eye WorkShop. Ocul Surf. 2007 ; 5 : 93-107.
[46] Yalvac IS, Gedikoglu G, Karagoz Y, et al. Effects of antiglaucoma drugs on ocular surface. Acta Ophthalmol Scand. 1995 ; 73 : 246-8.
Y. Lachkar, H. Cohn
-
Le glaucome chronique à angle ouvert inclut dans sa définition l’ouverture de l’angle iridocornéen et impose donc la réalisation systématique d’une gonioscopie.
-
Les variations anatomiques peuvent être importantes, même lorsque l’angle est ouvert.
-
Les différentes structures de l’angle visibles en gonioscopie doivent être bien connues : anneau de Schwalbe, trabéculum, éperon scléral et bande ciliaire. Il est ainsi important de se familiariser avec l’anatomie normale de l’angle iridocornéen.
L’examen de l’angle iridocornéen (AIC) dans le glaucome primitif à angle ouvert (GPAO) est fondamental car, par définition, il doit être ouvert. C’est dire l’importance de la réalisation d’une gonioscopie : dans cette neuropathie, où l’œil n’est pas inflammatoire et la chambre antérieure profonde, des erreurs diagnostiques sont possibles [1].
La technique de gonioscopie la plus couramment pratiquée est celle de la gonioscopie indirecte [2]. Elle consiste à placer un verre sur la cornée préalablement anesthésiée et à étudier l’angle à travers un miroir utilisant la lumière réfléchie [3, 4] (voir chapitre 9-III).
Les structures anatomiques visibles de l’angle sont à bien connaître et à rechercher de façon systématique lors de la réalisation d’une gonioscopie, soit d’avant en arrière [5, 6] : l’anneau de Schwalbe, le trabéculum, l’éperon scléral, la bande ciliaire et l’iris. On commencera préférentiellement par l’examen de l’angle supérieur, car l’AIC est en général plus étroit en haut et en nasal qu’en bas et en temporal. Il est parfois difficile de les visualiser car la configuration de l’œil peut masquer certaines parties : soit en raison d’une très faible pigmentation, soit parce que la convexité de l’iris masque les structures sous-jacentes, soit encore parce qu’il existe des éléments dans l’angle dont il faut savoir reconnaître le caractère pathologique [2-4].
Il s’agit d’une condensation de collagène (terminaison de la membrane de Descemet), marquant la limite antérieure de l’AIC et de la cornée, qui apparaît comme une fine ligne translucide. Elle peut être parfois très proéminente (embryotoxon postérieur) ou très pigmentée (avec parfois, en avant, la ligne de Sampaolesi). Lorsque l’anneau de Schwalbe est pigmenté, il ne s’agit pas toujours d’une dispersion pigmentaire avec un angle très large et un iris concave : le piège serait de le confondre avec le trabéculum (si de surcroît l’iris est convexe), et de considérer cette ligne pigmentée comme le trabéculum qui peut donc être masqué par l’iris [5, 6]. C’est dans ce type de cas que la gonioscopie dynamique prend tout son intérêt [7].
On pourra également s’aider, pour repérer l’anneau de Schwalbe, des deux lignes lumineuses des surfaces externe et interne de la cornée formant un parallélépipède. En effet, la transition entre la cornée transparente et le trabéculum translucide peut être appréciée lorsque l’on projette la fente dans l’AIC suivant un angle oblique. La fente au niveau de la cornée prend une forme de parallélépipède à trois dimensions, qui se transforme en une fente à deux dimensions au niveau de l’anneau de Schwalbe pour atteindre le trabéculum.
Le trabéculum s’étend de la ligne de Schwalbe à l’éperon scléral. Sans revenir sur l’anatomie fine du trabéculum, ou sur des anomalies évidentes (traumatisme, tumeur, corps étranger), les principaux pièges concernant son étude sont liés aux éléments que l’on peut y trouver afin de savoir si ceux-ci sont pathologiques ou non : pigments, trabécules, sang, vaisseaux sanguins [8].
On distingue classiquement une partie antérieure de couleur blanchâtre non fonctionnelle adjacente à l’anneau de Schwalbe et une partie postérieure fonctionnelle pigmentée adjacente à l’éperon scléral. Ces repères sont importants à connaître avant d’envisager en particulier un traitement laser par trabéculoplastie.
Il apparaît comme une fine bande blanc nacré ou gris clair, mais peut parfois être caché par des trabécules ou processus iriens, une insertion antérieure de l’iris, des synéchies antérieures périphériques ou une pigmentation dense. C’est un repère très important à visualiser car d’apparence relativement constante d’un œil à l’autre.
L’iris s’insère habituellement à la face antérieure du corps ciliaire, mais son site d’insertion peut varier (voir classification de l’angle). La bande ciliaire peut être largement visible (myopie, aphakie, récession angulaire) ou étroite, voire absente (hypermétropie, insertion antérieure de l’iris). Plus rarement, l’iris peut avoir une racine plus épaisse, une insertion plus antérieure sur le corps ciliaire et être plus angulé en périphérie avec des procès ciliaires plus volumineux et/ou déplacés antérieurement par rapport à la normale : c’est l’iris plateau (fig. 10-5 à 10-7 ; eFig. 10-1 à 10-9).
Les pièges de la gonioscopie sont en fait très nombreux et nécessitent une parfaite connaissance de l’anatomie et de la sémiologie de l’AIC. Ils doivent être connus car leur méconnaissance peut avoir des conséquences thérapeutiques fâcheuses. La gonioscopie permet souvent de confirmer ou de corriger certains diagnostics : dispersion pigmentaire, récession angulaire, iris plateau.

Fig. 10-5 Angle iridocornéen grand ouvert jusqu’à une bande ciliaire grisâtre pas très large. L’iris périphérique est plat indiquant l’absence de bloc pupillaire relatif. Le trabéculum présente une pigmentation relativement importante, montrant bien ses limites antérieure et postérieure.
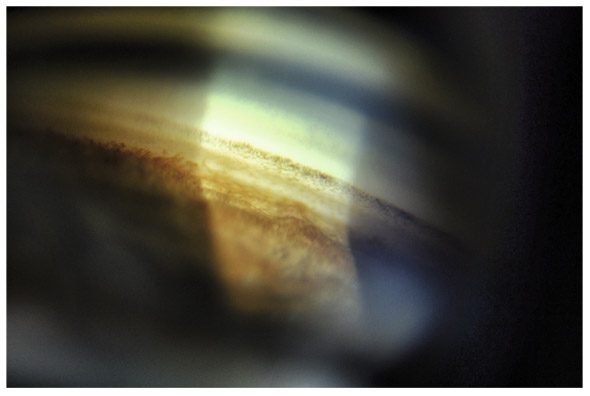
Fig. 10-6 Bande ciliaire de couleur beige, trabéculum beige clair et ligne de Sampaelesi.

Fig. 10-7 Bloc pupillaire relatif d’importance moyenne, angle ouvert jusqu’à la bande ciliaire, trabéculum peu pigmenté.
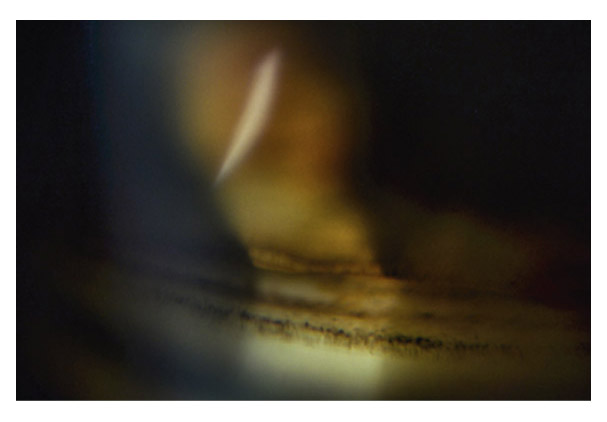
eFig. 10-1 Angle ouvert jusqu’à la bande ciliaire ici de couleur beige. Le trabéculum présente une pigmentation modérée. Il y a aussi du pigment déposé sur l’anneau de Schwalbe (dite ligne de Sampaolesi) : un élément non pathologique.

eFig. 10-2 Insertion de la racine de l’iris très postérieure laissant une bande ciliaire très large de couleur brun. L’iris périphérique est plat (pas de bloc pupillaire relatif). L’œil est myope de – 6D.

eFig. 10-3 Bande ciliaire brune, moins large ; le trabéculum est non pigmenté.

eFig. 10-4 Angle ouvert jusqu’à la jonction mal définie entre la bande ciliaire et l’éperon scléral. L’iris périphérique termine en plateau peu élevé sans aucune menace de fermeture. Pigmentation un peu beige de la portion postérieure du trabéculum.

eFig. 10-5 Angle grand ouvert jusqu’à la bande ciliaire, ici de couleur grise ; l’éperon scléral est bien défini, avec un trabéculum peu pigmenté.
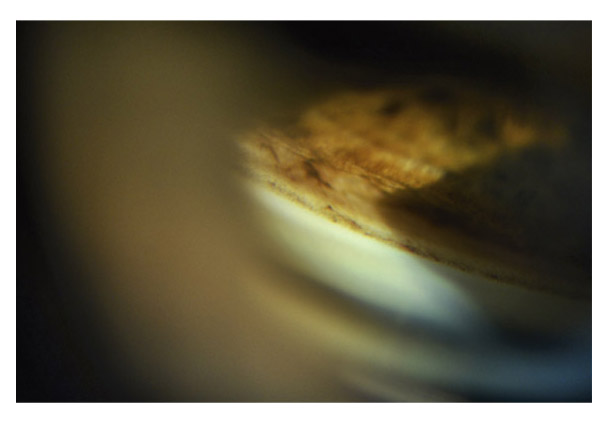
eFig. 10-6 Quelques procès iriens couvrant la bande ciliaire. Le trabéculum présente une pigmentation foncée peu dense.

eFig. 10-7 Angle ouvert jusqu’à la jonction entre la bande ciliaire et l’éperon scléral ; trabéculum complètement sans pigment. Notez également un iris plateau minime. Angle difficile d’interprétation : un examen soigneux de 360° a été effectué pour bien comprendre l’anatomie.

eFig. 10-8 Iris périphérique convexe à cause d’un bloc pupillaire relatif assez important. L’angle est quand même grand ouvert jusqu’à l’éperon scléral : le trabéculum est sans pigment, mais avec quelques procès iriens en nappe. Le patient a 65 ans.
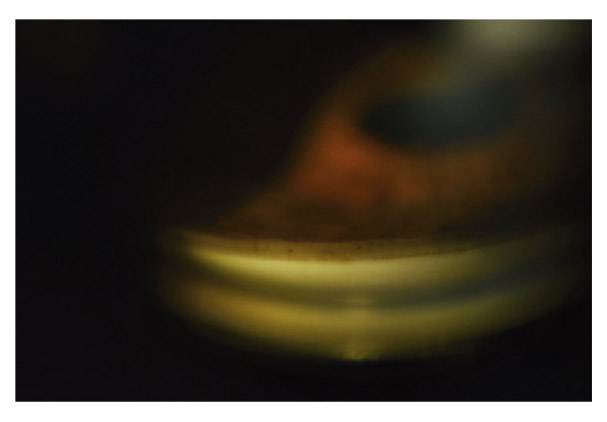
eFig. 10-9 Insertion de l’iris assez haute, au niveau de l’éperon scléral ; trabéculum peu pigmenté.
La pigmentation du trabéculum s’observe essentiellement dans sa partie postérieure et dans le secteur inférieur de l’AIC. On la constate surtout chez l’adulte (elle est rare avant la puberté). Les principales causes d’hyperpigmentation du trabéculum sont : le syndrome pseudo-exfoliatif (principale cause), le syndrome de dispersion pigmentaire, les antécédents de traumatisme, d’uvéite antérieure, de crise de fermeture de l’angle aiguë ou subaiguë et les tumeurs de l’iris ou du corps ciliaire.
Les trabécules ou processus iriens sont présents dans un tiers des yeux normaux et sont plus fréquemment retrouvés chez l’enfant et dans des yeux bruns. Ils suivent la concavité de l’angle et peuvent passer en pont de l’iris à la partie postérieure du trabéculum. Contrairement aux synéchies antérieures périphériques, ils ne bloquent pas les mouvements de l’iris en gonioscopie dynamique. Lorsque ceux-ci sont très nombreux et/ou proéminents, il faut se poser la question de savoir s’ils ne s’intègrent pas à une pathologie congénitale (syndrome d’Axenfeld) ou dysgénésique (glaucome juvénile).
On distingue ainsi les procès iriens « en pont » et les procès iriens « en nappe » qu’il ne faut pas confondre avec des synéchies antérieures périphériques [1, 7] (fig. 10-8 et 10-9 ; eFig. 10-10 à 10-12).
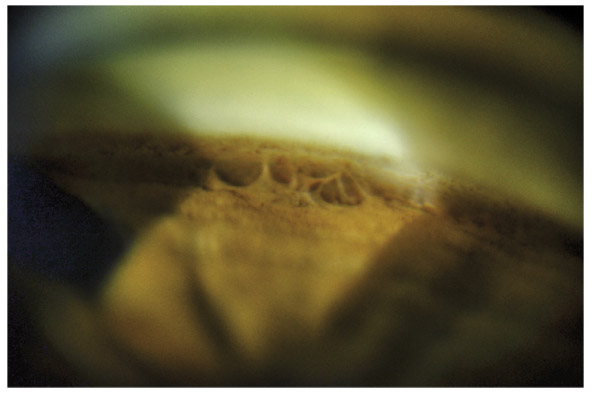
Fig. 10-8 Procès iriens en pont, fin dentelé.
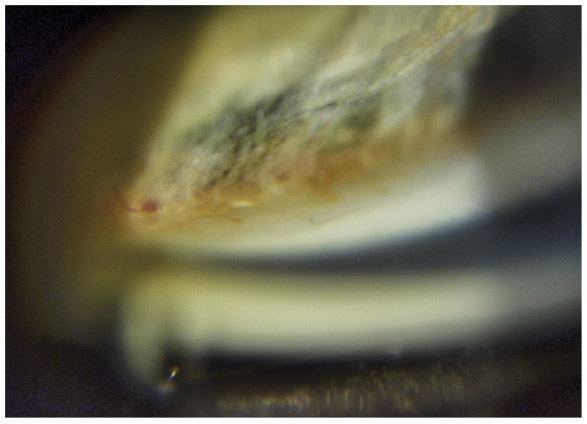
Fig. 10-9 Procès iriens de deux types dans le même œil : grisâtres et nuageux en pont, et beiges en nappe sur la bande ciliaire ; trabéculum non pigmenté.

eFig. 10-10 Iris périphérique fenêtré créant des bandes larges de procès iriens.

eFig. 10-11 Procès iriens en nappe couvrant la bande ciliaire, l’éperon scléral et le trabéculum de façon irrégulière selon l’endroit.
Angle d’interprétation difficile.

eFig. 10-12 Procès iriens en nappe plus dense sur la bande ciliaire et moins dense sur le trabéculum.
Le canal de Schlemm n’est le plus souvent pas visible. La présence de sang à l’intérieur permet parfois de l’identifier. Ce sang reflue des veines épisclérales et peut donc être retrouvé en cas de compression de celles-ci par le verre à gonioscopie et dans les pathologies où la pression veineuse épisclérale est augmentée : fistule carotido-caverneuse, syndrome de Sturge-Weber, compression de la veine cave. Enfin, on peut également observer du sang dans le canal de Schlemm en cas d’hypotonie ou de drépanocytose [8].
Il peut exister, à l’état normal, des vaisseaux dans l’AIC. Ces vaisseaux sont caractérisés par leur orientation radiaire ou circonférentielle (branche du cercle artériel), la pauvreté de leur anastomose et par le fait qu’ils ne traversent jamais l’éperon scléral. Ils sont surtout visibles sur des iris clairs. Les vaisseaux pathologiques sont plus fins, avec un cheminement anarchique (en serpent de mer), traversent l’éperon scléral et sont associés à un tissu fibreux en cas de glaucome néovasculaire. Des vaisseaux sanguins pathologiques peuvent être également retrouvés en cas de cyclite hétérochromique de Fuchs ou d’uvéite antérieure chronique (fig. 10-10 et 10-11).
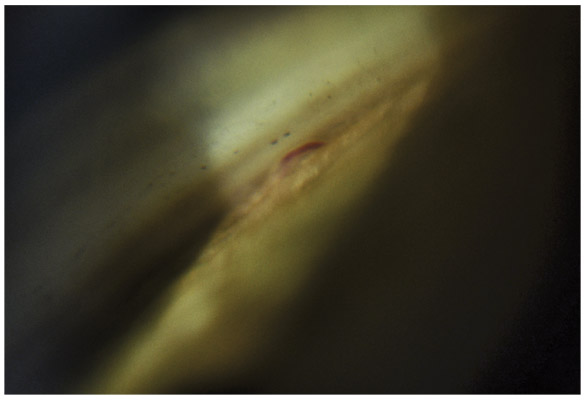
Fig. 10-10 Vaisseau normal au niveau de la bande ciliaire : partie du grand cercle artériel de l’iris.
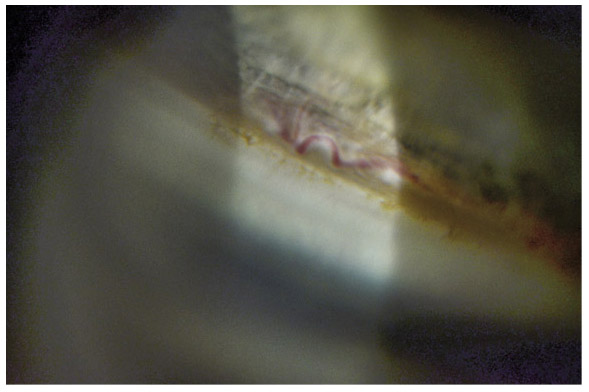
Fig. 10-11 Boucle vasculaire physiologique, faisant partie du grand cercle artériel.
Des différences dans l’anatomie de l’angle ont été rapportées suivant les ethnies. Ainsi, l’insertion de l’iris est plus postérieure chez les Caucasiens, plus antérieure chez les sujets d’origine africaine et chez les sujets asiatiques. L’incidence des angles étroits ou fermés est plus élevée en Asie. De plus, le corps ciliaire est positionné plus en avant chez les sujets asiatiques, expliquant que la fermeture de l’angle soit plus fréquente, sans pour autant que le bloc pupillaire relatif soit le mécanisme prédominant. L’examen de l’angle est ainsi plus difficile chez ces sujets avec des angles étroits, mais ouverts, avec des structures difficiles à examiner.
Les sujets africains n’ont pas de pigmentation plus importante de l’AIC.
Retenir
-
La gonioscopie fait partie de l’examen clinique initial de tout patient atteint de GPAO.
-
Elle doit être renouvelée régulièrement au cours du suivi, tous les deux à trois ans en moyenne.
-
L’éperon scléral est un repère important à connaître, car le plus constant et le moins sujet à des variations anatomiques.
-
Différents éléments peuvent être présents dans l’AIC : pigments, trabécules, vaisseaux. Leur caractère physiologique ou pathologique doit pouvoir être différencié.
-
En général, un vaisseau qui passe en pont l’éperon scléral est pathologique.
-
Il est important de ne pas confondre des procès iriens avec des synéchies antérieures périphériques.
-
Il est parfois difficile de différencier un angle ouvert d’un angle étroit, et il faut alors s’aider de la gonioscopie dynamique avec indentation.
[1] Alward W. Color atlas of gonioscopy. Londres, Mosby, 1994. www.gonioscopy.org.
[2] Béchetoille A. Les glaucomes. Éditions Japperrenard, 1997.
[3] Epstein D. The angle of the anterior chamber. In : Chandler and Grant’s Glaucoma, 4th ed. Lea and Feibiger, 1997.
[4] Palmberg P. Gonioscopy. In : Ritch R, Shields MB, Kupin T (eds). The glaucomas. Mosby, 1996.
[5] Shaffer RN. Stereoscopic manual of gonioscopy. St. Louis, Mosby, 1992.
[6] Shields MB. Textbook of glaucoma. Baltimore, Williams and Wilkins, 1992.
[7] Spaeth GL. Distinguishing between the normally narrow, the suspiciously shallow and the particularly pathological anterior chamber angle. Perspect Ophthalmol. 1977 ; 1 : 205-14.
[8] Zalta A. Gonioscopy. In : Kaufman P, Mittag P (eds). Glaucoma. Mosby Year Book, 1994.
M. Puech, M. Streho
-
L’imagerie de l’angle iridocornéen (AIC) dans le cadre du glaucome primitif à angle ouvert (GPAO) permet d’éliminer un certain nombre de diagnostics différentiels.
-
Après traitement, l’imagerie de l’AIC permet un bilan de la réponse de l’angle à différentes interventions comme la qualité d’une chirurgie filtrante avec visualisation de la chambre de décompression et de la bulle de filtration.
L’imagerie de l’AIC dans le GPAO peut apporter des éléments de diagnostic au début de la prise en charge du patient avec une approche anatomique complémentaire de la gonioscopie. L’imagerie peut aussi jouer un rôle appréciable dans le suivi des patients traités soit pour confirmer le mécanisme d’action et la réponse positive au traitement, soit pour évaluer le mécanisme d’échec du traitement choisi [6, 8, 11, 15].
L’apport de l’imagerie de l’angle en matière d’angle ouvert apporte un complément de classification des glaucomes par visualisation de l’angle en coupe permettant de quantifier son ouverture. Un angle dont l’ouverture est supérieure à 20° est considéré comme ouvert. Cette appréciation peut être réalisée sur plusieurs méridiens, comme par exemple les quatre méridiens principaux 3 heures, 6 heures, 9 heures et 12 heures, de façon à donner un reflet assez précis de l’état de l’angle. Un angle ouvert sur plus de la moitié des méridiens pourra faire classer ce patient en GPAO. Cependant, pour les angles ouverts mais présentant un aspect étroit, un test de provocation de fermeture de l’angle permettra de différencier les patients à risque de fermeture de l’angle intermittente, notamment dans l’obscurité (fig. 10-12). La supériorité de l’imagerie en ce domaine réside dans la possibilité d’obtenir des images en condition scotopique avec un avantage pour la biomicroscopie ultrasonore (UBM) qui semble donner des images plus proches des conditions naturelles [13], l’exploration par OCT semblant entraîner un léger myosis par utilisation du faisceau infrarouge [12, 14, 15].
La visualisation d’un aspect d’angle ouvert par l’imagerie de très haute fréquence permet parfois de rectifier un diagnostic en cas de glaucome unilatéral, avec mise en évidence d’une lésion tumorale au niveau du corps ciliaire (fig. 10-13).
La visualisation, dans les différentes conditions d’éclairage, d’une inversion de la racine de l’iris plus ou moins associée à une majoration du contact entre l’iris et le cristallin, ou entre l’iris et la zonule, permet d’identifier un patient prédisposé au glaucome pigmentaire [4]. Cette exploration peut se faire en OCT ou en UBM [2] (fig. 10-14). Elle documente l’inversion de courbure de l’iris avant de prendre la décision d’une iridotomie périphérique afin de réduire le contact iridocristallinien (fig. 10-15).
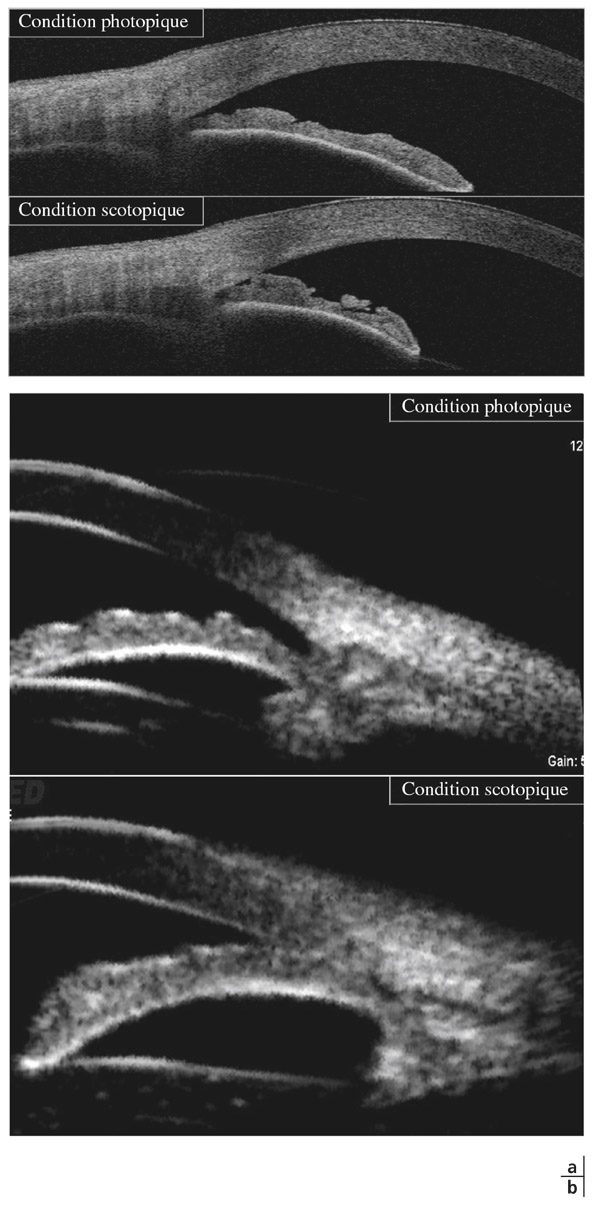
Fig. 10-12 Analyse dynamique de l’AIC en fonction de l’éclairage en OCT-Visante (a) et UBM (b).
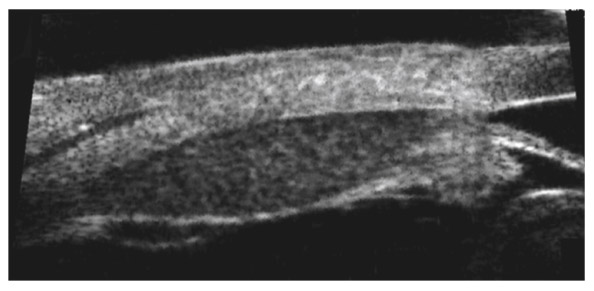
Fig. 10-13 Aspect de tumeur du corps ciliaire ayant entraîné une hypertonie unilatérale avec diagnostic de lésion ciliaire par UBM qui a permis de faire le diagnostic différentiel d’un GPAO unilatéral.
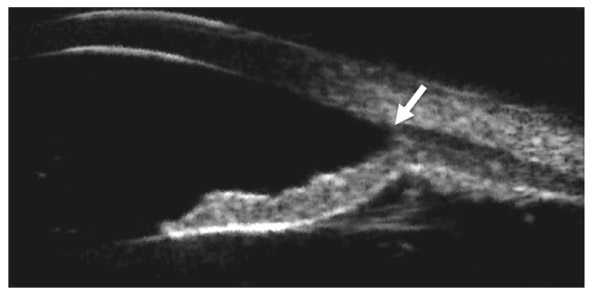
Fig. 10-14 Inversion de la courbure de l’iris témoignant d’une prédisposition au glaucome pigmentaire par majoration du contact iridocristallinien (UBM).
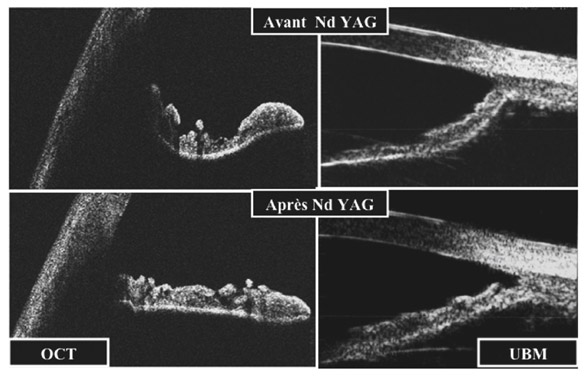
Fig. 10-15 Imagerie par OCT et UBM d’un AIC avec inversion de courbure de l’iris avant et après iridotomie périphérique.
Les traitements du glaucome peuvent faire intervenir différentes techniques – lasers, chirurgies filtrantes ou cylodestructions. Les chirurgies filtrantes peuvent être explorées par UBM ou OCT. L’effet de la cyclodestruction ne peut être observé que par UBM, car seuls les ultrasons permettent une visualisation du corps ciliaire.
L’exploration du site de trabéculectomie peut être accessible à l’imagerie en coupe, avec des coupes méridiennes passant par la trappe de filtration ou des coupes orthogonales. Une chirurgie filtrante fonctionnelle permet d’identifier l’ouverture trabéculaire dans l’AIC, la chambre de décompression située sous le volet scléral, le volet scléral lui-même et la qualité de la bulle de filtration. Une bulle de filtration fonctionnelle prend un aspect épaissi avec une réflectivité comparable à un tissu spongieux témoignant de l’imprégnation de l’humeur aqueuse (HA) dans la conjonctive (fig. 10-16) [5, 7, 10].
La conjonctive peut prendre un aspect peu épaissi mais fonctionnel, et parfois donner une bulle de filtration volumineuse avec visualisation d’une collection plus ou moins importante d’HA sous la conjonctive et un aspect fibrosé de la conjonctive qui ne laisse plus échapper l’HA en arrière (fig. 10-17).
Parfois, une cicatrisation trop fibreuse entre le volet scléral et la sclère environnante ne permet pas d’évacuer l’HA vers la conjonctive. Dans quelques cas, des synéchies iridocornéennes en regard de la chirurgie filtrante peuvent limiter le potentiel de filtration (fig. 10-18).
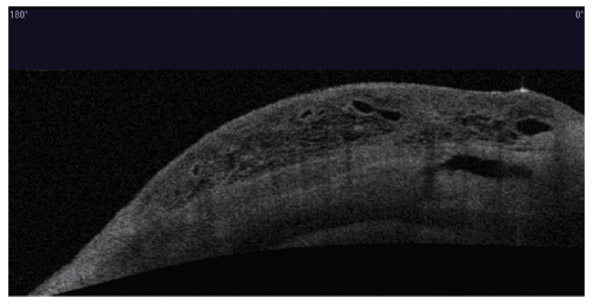
Fig. 10-16 Aspect en OCT d’une trabéculectomie avec bulle de filtration conjonctivale d’aspect fonctionnel.
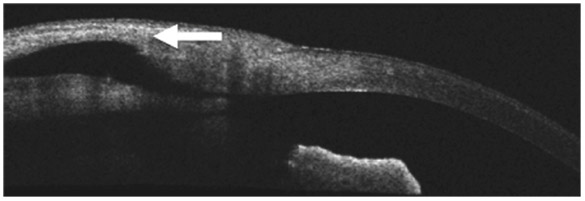
Fig. 10-17 Bulle de filtration d’aspect fibrosé au niveau conjonctival (OCT).
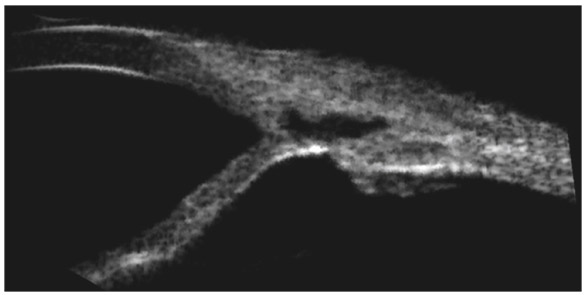
Fig. 10-18 Synéchies iridocornéennes en regard d’un site de trabéculectomie limitant la fonctionnalité de la chirurgie filtrante (UBM).
La chirurgie par sclérectomie non perforante peut être observée par imagerie avec visualisation du feuillet trabéculaire résiduel séparant la chambre antérieure de la chambre de décompression (fig. 10-19). En cas de nécessité, ce trabéculum peut bénéficier d’une réouverture en postopératoire pour optimiser le résultat, faisant regagner parfois quelques points de réduction tensionnelle (fig. 10-20).
Cette goniopuncture peut, dans certains cas, entraîner une incarcération de l’iris dans le site de sclérectomie, rendant la chirurgie filtrante inopérante. Cet incident est plus fréquent en absence d’iridotomie périphérique en regard du site de chirurgie filtrante (fig. 10-21).
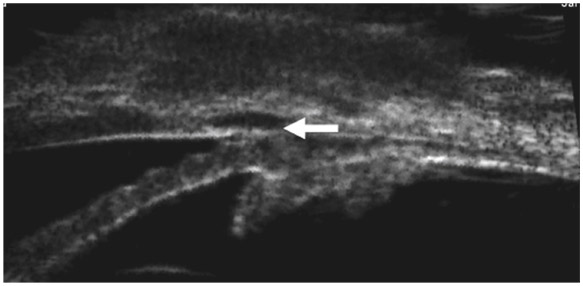
Fig. 10-19 Image en coupe d’une sclérectomie non perforante, avec très bonne visualisation du feuillet de trabéculum séparant la chambre antérieure de la chambre de décompression (OCT).
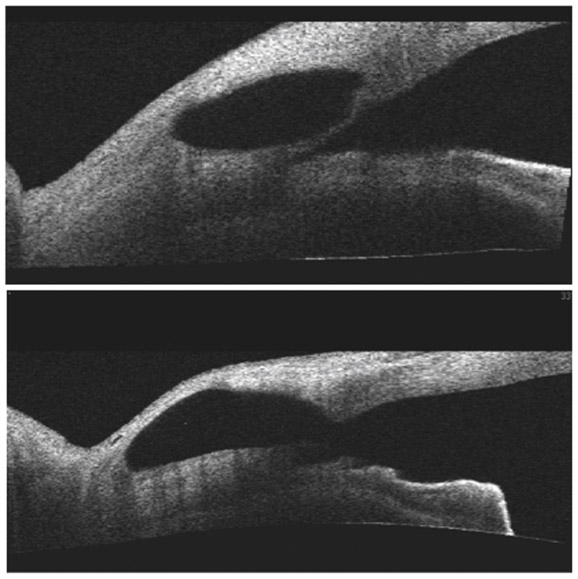
Fig. 10-20 Ouverture par laser YAG du feuillet de trabéculum après effet limité de la chirurgie filtrante sur la baisse pressionnelle (OCT).
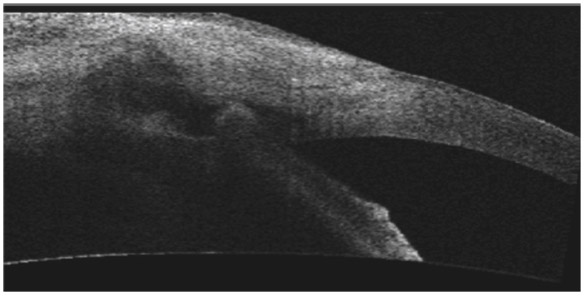
Fig. 10-21 Incarcération de la racine de l’iris dans un orifice de sclérectomie non perforante traitée par goniopuncture (OCT).
Des dispositifs sont disponibles pour améliorer le fonctionnement des chirurgies filtrantes. Il s’agit soit de matériaux insérés dans la trappe de filtration pour en améliorer le fonctionnement (éponge de collagène, T-Flux™, etc.) (fig. 10-22), soit de valves de dérivation pour évacuer l’HA de la chambre antérieure vers l’espace sous-conjonctival (valve de Molteno, etc.) [1] (fig. 10-23).
L’imagerie de l’AIC en coupe peut être pratiquée par UBM ou OCT avec une amélioration de la résolution des images [3, 16]. L’imagerie en coupe permet de classifier les différents types de glaucome à angle étroit ou à angle ouvert [9]. L’imagerie intervient soit en début de bilan pour préciser les relations anatomiques de l’angle, soit dans le suivi régulier des patients glaucomateux avec la possibilité d’observer les réponses aux différents traitements. La surveillance des sites de chirurgie filtrante permet d’identifier la cause d’une mauvaise filtration et de guider les différentes options thérapeutiques.
Retenir
-
L’imagerie de l’AIC en cas de GPAO peut se faire par UBM et OCT avec une approche en coupe méridienne de l’angle.
-
La visualisation en coupe des sites de chirurgie filtrante permet une meilleure analyse des échecs de filtration.
-
Le suivi des dispositifs médicaux implantés pour traiter le GPAO peut bénéficier de l’imagerie de l’angle par UBM ou OCT pour mieux apprécier l’efficacité et la tolérance de ces dispositifs.
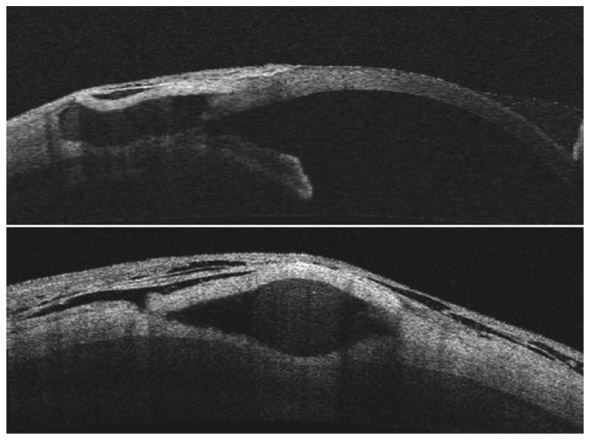
Fig. 10-22 Implant de collagène inséré sous le volet scléral d’une chirurgie filtrante, pour limiter le risque de mauvaise filtration (OCT).
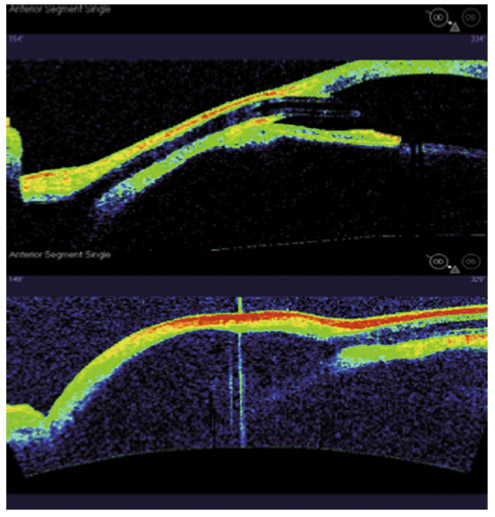
Fig. 10-23 Image en coupe longitudinale d’un tube de Molteno avec son réservoir sous-conjonctival. (Clichés OCT : P. Hamard et A. El Maftouhi.)
[1] Aptel F, Dumas S, Denis P. Ultrasound biomicroscopy and optical coherence tomography imaging of filtering blebs after deep sclerectomy with new collagen implant. Eur J Ophthalmol. 2009 ; 19 : 223-30.
[2] Aptel F, Beccat S, Fortoul V, Denis P. Biometric analysis of pigment dispersion syndrome using anterior segment optical coherence tomography. Ophthalmology. 2011 ; 118 : 1563-70.
[3] Aptel F, Chiquet C, Beccat S, Denis P. Biometric evaluation of anterior chamber changes after physiologic pupil dilation using Pentacam and anterior segment optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 4005-10.
[4] Bron A, Sellem EA. [Pigmentary glaucoma]. J Fr Ophtalmol. 1999 ; 22 : 982.
[5] Blumen-Ohana E, Hamelin N, Nordmann JP. [Glaucoma and ultrasound biomicroscopy]. J Fr Ophtalmol. 2004 ; 27 : 469-76.
[6] Dada T, Mohan S, Bali SJ, et al. Ultrasound biomicroscopic assessment of angle parameters in patients with primary angle closure glaucoma undergoing phacoemulsification. Eur J Ophthalmol. 2011 ; 21 : 559-65.
[7] Dada T, Gadia R, Sharma A, et al. Ultrasound biomicroscopy in glaucoma. Surv Ophthalmol. 2011 ; 56 : 433-50.
[8] Fénolland JR, Puech M, Baudouin C, Labbé A. [Imaging of the iridocorneal angle in glaucoma]. J Fr Ophtalmol. 2013 ; 36 : 378-83.
[9] Goldsmith JA, Li Y, Chalita MR, et al. Anterior chamber width measurement by high-speed optical coherence tomography. Ophthalmology. 2005 ; 112 : 238-44.
[10] Golez E, Latina M. The use of anterior segment imaging after trabeculectomy. Semin Ophthalmol. 2012 ; 27 : 155-9.
[11] Labbé A, Puech M, Vera L, et al. L’analyse de l’AIC en UBM et en OCT de segment antérieur dans le glaucome. In : La nouvelle imagerie du segment antérieur. Rapport annuel des Sociétés d’ophtalmologie de France, 2009 : 123-38.
[12] Memarzadeh F, Li Y, Francis BA, et al. Optical coherence tomography of the anterior segment in secondary glaucoma with corneal opacity after penetrating keratoplasty. Br J Ophthalmol. 2007 ; 91 : 189-92.
[13] Pavlin CJ, Harasiewicz K, Sherar MD, Foster FS. Clinical use of ultrasound biomicroscopy. Ophthalmology. 1991 ; 98 : 287-95.
[14] Puech M, El Maftouhi A. L’exploration du segment antérieur par OCT3. J Fr Ophthalmol. 2004 ; 27 : 459-66.
[15] Radhakrishnan S, Goldsmith J, Huang D, et al. Comparison of optical coherence tomography and ultrasound biomicroscopy for detection of narrow anterior chamber angles. Arch Ophthalmol. 2005 ; 123 : 1053-9.
[16] Radhakrishnan S, Rollins AM, Roth JE, et al. Real-time optical coherence tomography of the anterior segment at 1310 nm. Arch Ophthalmol. 2001 ; 119 : 1179-85.
J.-P. Romanet, D. Bernheim, C. Noël, F. Aptel, C. Chiquet
-
Une pression intra-oculaire (PIO) élevée est un facteur de risque majeur du glaucome primitif à angle ouvert (GPAO).
-
La PIO et ses variations nycthémérales présentent certaines particularités dans le GPAO.
-
Tout patient à risque glaucomateux ou chez qui a été découvert un glaucome devrait bénéficier d’une courbe de PIO diurne avant tout traitement.
-
En revanche, les tests de provocation ont perdu de leur intérêt.
La PIO anormalement élevée n’est pas un critère de diagnostic de la maladie glaucomateuse. Elle est, en revanche, un facteur de risque – un des plus importants et des plus intéressants à considérer. C’est en effet celui qui est le plus accessible au traitement, donc susceptible d’être corrigé et, de ce fait, pouvant avoir une action positive sur l’évolution de la maladie.
De grandes études cliniques multicentriques randomisées ont évalué le rôle de la PIO élevée dans l’apparition et l’évolution de la maladie glaucomateuse.
Cette étude s’est intéressée à l’efficacité d’un traitement hypotenseur oculaire topique pour retarder ou prévenir la survenue du glaucome chez des patients présentant une hypertonie oculaire (HTO) jusque-là isolée. Mille six cent trente-sept patients ont été inclus dans l’étude et randomisés. Le critère principal de conversion était l’apparition d’altérations du champ visuel et/ou la constatation clinique d’anomalie de type glaucomateux de la papille.
Les résultats ont montré que la probabilité de développer un GPAO était de 4,4 % pour les patients traités contre 9,5 % pour les patients non traités. Quatre-vingt-dix pour cent des HTO non traitées n’ont cependant pas développé de GPAO à cinq ans. Cette étude a mis en évidence les facteurs de risque de conversion, notamment la PIO très élevée, l’âge avancé, une grande excavation papillaire et une faible épaisseur cornéenne centrale.
Cette étude a comparé 316 yeux de 255 patients suédois présentant un glaucome débutant naïf de traitement (GPAO, glaucome à pression normale et glaucome pseudo-exfoliatif) avec et sans traitement sur une durée moyenne de huit ans. Le protocole de traitement standardisé comportait l’association d’une trabéculoplastie au laser à argon et la prescription de bétaxolol. L’objectif principal était d’évaluer l’efficacité de la baisse pressionnelle sur l’évolution du champ visuel.
Les résultats ont montré que 44 % des patients traités et seulement 24 % des patients non traités n’avaient pas présenté de modification du champ visuel. Chaque millimètre de mercure de diminution de la PIO a été associé à une baisse d’environ 10 % du risque de progression du glaucome. Les PIO élevées se sont avéré un facteur majeur de risque de progression du glaucome.
Cette étude suggère que les glaucomes à angle ouvert à PIO élevée, comme par exemple les glaucomes exfoliatifs, doivent être traités précocement et énergiquement avec un suivi rapproché.
Cette étude a comparé une population de 140 patients suivis cinq à sept ans et présentant un glaucome à pression normale (GPN) avec et sans traitement. Le critère principal de l’étude était la progression du champ visuel. Dans le groupe des patients traités, le traitement pouvait faire appel au traitement médical, à la trabéculoplastie au laser et à la trabéculectomie.
Les résultats ont montré une diminution de 30 % de la PIO de base obtenue dans la moitié des cas avec le traitement médical, la trabéculoplastie ou les deux combinés. Une progression du glaucome a été notée dans 12 % des yeux traités et 35 % des yeux contrôles. L’effet bénéfique de la baisse de PIO a été évalué sur les données du champ visuel après éventuel traitement de la cataracte. La progression du glaucome, malgré le traitement, a pu être expliquée par une baisse insuffisante de la PIO ou par un facteur de risque indépendant de la PIO. Cette étude plaide pour une action salutaire d’une baisse de la PIO dans la progression de la maladie chez certains patients présentant un GPN.
Cette étude a évalué l’efficacité de la réduction de PIO par dorzolamide pour prévenir ou retarder la survenue du GPAO sur cinq ans dans une population de 1 081 patients présentant une HTO.
Les résultats ont confirmé les facteurs prédictifs de conversion vers un GPAO comme la PIO très élevée, l’âge, une cornée centrale fine et un rapport C/D vertical élevé.
Pour résumer ces études, on peut donc constater qu’elles ont toutes conclu au facteur de risque que constituait une PIO anormalement élevée pour la maladie glaucomateuse. Toutes ont également reconnu le rôle bénéfique d’un traitement hypotenseur oculaire dans l’apparition ou la dégradation d’un GPAO, à l’exception de l’EGPS. Cette dernière est, en effet, la seule étude à ne pas avoir mis en évidence de différence statistiquement significative concernant l’apparition d’un GPAO avec et sans traitement. Il faut néanmoins noter que le traitement médical institué dans cette étude a abaissé la PIO de 22 % alors que le placebo, de façon inattendue, l’a abaissée de 19 %, ce qui relativise les conclusions de cette étude.
Le terme HTO doit être réservé aux PIO supérieures de deux à trois écarts types par rapport à la moyenne dans un œil normal par ailleurs. Il est donc classique de retenir comme HTO une PIO supérieure à 21 mmHg, la pachymétrie cornéenne centrale étant normale (530 à 560 mm). La conversion glaucomateuse se définit comme le passage d’une HTO, jusque-là isolée, à un GPAO avéré, diagnostiqué sur l’apparition d’altérations structurales des fibres nerveuses rétiniennes (FNR) et/ou de la papille optique qui précèdent la survenue des déficits périmétriques.
La PIO est une grandeur physiologique très variable d’un moment à l’autre avec des fluctuations parfois très importantes, notamment lors de la maladie glaucomateuse. Un véritable GPAO pressionnel peut ainsi avoir à certains moments de la journée des valeurs normales de la PIO, sans qu’aucun traitement hypotenseur oculaire n’ait encore été prescrit.
D’étiologie et de physiopathologie actuellement mal connues, ce glaucome est défini comme une neuropathie optique ayant les principales caractéristiques d’un GPAO mais dont toutes les mesures de PIO sur 24 heures sont inférieures à 21 mmHg, en tenant compte de l’incidence de la pachymétrie cornéenne. Bien que les valeurs de PIO ne soient jamais élevées et parfois même plutôt basses dans certains cas, les résultats de l’étude CNTGS ont montré qu’une diminution de la PIO dans les GPN limitait la progression de la maladie chez un bon nombre de patients [1]. Même s’il existe d’autres facteurs en cause lors de GPN, la PIO reste un des rares éléments sur lequel les traitements peuvent montrer une efficacité.
Le GPAO est une neuropathie optique chronique progressive qui, de façon isolée, engendre une perte de FNR à l’origine d’une modification morphologique de la papille.
Comme l’ont montré les grandes études randomisées relatées ci-dessus, l’HTO est un des principaux facteurs de risque de la maladie glaucomateuse. Elle n’est cependant pas indispensable pour porter le diagnostic puisqu’un certain nombre de GPAO sont des glaucomes à pression peu élevée, voire normale comme le GPN. Cela rend compte de l’intervention d’autres facteurs de risque, par exemple vasculaires, et nous conduit à dire que la mesure de la PIO n’est certainement pas le bon examen pour argumenter le diagnostic de GPAO.
Le dépistage de la maladie par une mesure unique et isolée de PIO en dehors de tout examen associé, comme cela peut être proposé dans certains environnements non médicaux, doit être considéré comme inutile, voire dangereux.
Certes, la constatation d’une PIO anormalement élevée doit être un signe d’alerte et conduire obligatoirement à un bilan classique comprenant un interrogatoire avec la recherche notamment d’antécédents familiaux, un examen de la fonction visuelle, un examen de la papille et des FNR, et un examen de l’angle iridocornéen. La pachymétrie cornéenne couplée systématiquement à la mesure de la PIO pour permettre un ajustement de son niveau réel fera également partie de ce bilan.
Cependant, même en présence d’un GPAO à PIO élevée, compte tenu des grandes variations de cette grandeur, et ce particulièrement chez le sujet glaucomateux, une mesure isolée peut être prise au moment où la courbe est basse, lors de la bathyphase. La valeur mesurée est alors faussement rassurante sur la possibilité d’un glaucome si le dépistage s’arrête là.
Enfin, en présence d’un GPN, par définition, la seule exploration de la PIO sera faussement rassurante, pouvant conduire à un retard diagnostique des plus préjudiciables pour le patient.
En résumé, le dépistage d’une neuropathie glaucomateuse ne doit donc jamais faire appel à une mesure de la PIO unique et isolée. Si un seul examen devait être effectué dans le cadre d’un dépistage de masse, ce serait probablement un examen de la papille et des FNR qu’il faudrait privilégier.
En présence d’un glaucome diagnostiqué, quels renseignements la mesure de la PIO fournit-elle ? Le cas de cette patiente de 48 ans est assez exemplaire. Le diagnostic de GPN avait été porté sur la constatation de déficits périmétriques et d’altérations papillaires de type glaucomateux et d’une PIO toujours mesurée en deçà de 21 mmHg, la pachymétrie cornéenne étant de 540 μm. Les mesures de PIO avaient été multiples mais effectuées toujours aux mêmes heures de la journée, après les obligations professionnelles de la patiente. L’aggravation de la maladie malgré le traitement bien suivi avait finalement conduit à effectuer une courbe diurne de la PIO. Des valeurs pressionnelles bien au-delà de 21 mmHg furent alors constatées à plusieurs reprises, permettant ainsi de réfuter le diagnostic de GPN, de porter celui de GPAO avec PIO élevée et d’optimiser la prise en charge thérapeutique (fig. 10-24).
Ce cas clinique fournit un bon argumentaire sur la nécessité d’effectuer des mesures répétées de la PIO sur la journée lorsqu’est diagnostiqué un glaucome, et nous incite à mieux connaître les particularités de la PIO lors d’un GPAO par rapport à celles d’un sujet sain.
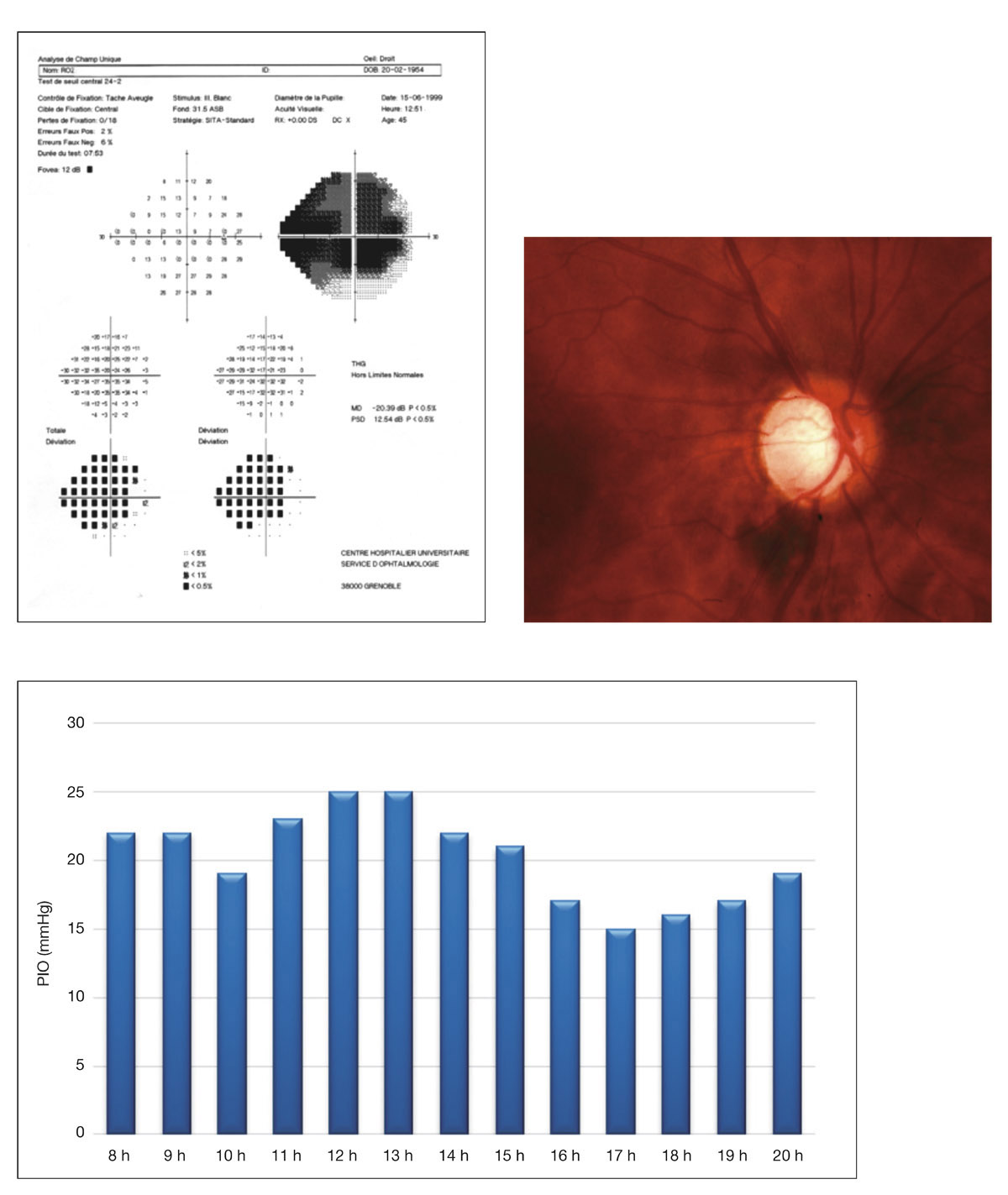
Fig. 10-24 Courbe diurne de PIO permettant de réfuter le diagnostic de GPN et d’affirmer celui de GPAO dans ce cas de glaucome évolué.
L’élévation pathologique de la PIO résulte d’un déséquilibre entre production et élimination de l’humeur aqueuse. Lors d’un GPAO, c’est essentiellement la voie trabéculo-canaliculaire, et plus précisément la portion juxtacanaliculaire du trabéculum, qui est responsable de la PIO anormalement élevée. Elle constitue, en effet, le site majeur de résistance à l’écoulement de l’humeur aqueuse, de nombreuses publications faisant état d’anomalies structurelles et fonctionnelles à son niveau [4] (voir chapitre 7).
L’influence de l’épaisseur cornéenne centrale sur la PIO est bien connue et a été largement évoquée dans le chapitre 9-II. Les cornées épaisses étant source de surestimation de la PIO, un certain nombre de diagnostics d’HTO isolée sont donc erronés. La mesure de la PIO doit donc toujours être interprétée en fonction de l’épaisseur cornéenne centrale qui doit systématiquement être évaluée lors du même examen [27].
Comme chez le sujet sain, la PIO chez le patient glaucomateux est soumise à de nombreux facteurs qui sont responsables de ses variations. Ces derniers ont été détaillés dans le chapitre 9-II. Certains s’avèrent identiques chez le sujet sain et le patient glaucomateux, et ne seront donc pas repris dans le détail. D’autres voient leur effet modifié chez le patient glaucomateux et seront, de ce fait, plus développés. Les variations de la PIO ne seront envisagées que chez le patient glaucomateux non traité. L’incidence des différents traitements hypotenseurs oculaires sera abordée dans les chapitres concernant le traitement du GPAO.
Des études récentes chez les patients porteurs de GPAO ont confirmé que la posture influençait le niveau de PIO avec des valeurs statistiquement plus élevées en décubitus latéral qu’en position assise [26]. Par ailleurs, lors du décubitus, il a été montré que la position latérale augmentait la PIO de l’œil le plus déclive par rapport à la PIO du même œil mesurée en décubitus dorsal [16]. Enfin, en présence d’une asymétrie d’atteinte périmétrique, l’effet de la position décubitus latéral sur la PIO est plus important au niveau de l’œil le plus atteint vis-à-vis de la maladie glaucomateuse et pourrait expliquer, au moins en partie, l’asymétrie d’évolution [13].
À partir de ces constatations, sur le plan pratique, on peut donc conseiller au patient porteur d’un GPAO de préférer, lors du sommeil, le décubitus dorsal au décubitus latéral ou ventral.
Lors d’un exercice physique, une diminution rapide de la PIO est constatée, l’entraînement physique au long cours abaissant son niveau de base [20]. Cet effet serait plus marqué chez le patient glaucomateux que chez le sujet sain sans qu’il soit possible d’en préciser le mécanisme exact [24].
Comme chez le sujet sain, l’augmentation de la pression veineuse centrale (PVC) chez le patient porteur d’un GPAO est responsable d’une élévation de la PIO (1 mmHg d’augmentation de la PVC entraîne une augmentation d’environ 0,8 mmHg de la PIO).
Peu d’études se sont intéressées aux répercussions de l’élévation rapide de la pression artérielle systémique sur la PIO du sujet glaucomateux. Les travaux effectués chez le sujet sain, néanmoins, ont montré une forte corrélation entre les variations de pression artérielle systémique et celles de la PIO. Ces résultats conduisent donc à s’interroger systématiquement sur le niveau pressionnel artériel au moment d’une mesure de PIO chez un patient porteur d’un GPAO qui, par ailleurs, avoue une tension artérielle instable et un terrain volontiers émotif et anxieux.
L’hypertension artérielle chronique peut avoir une répercussion sur la maladie glaucomateuse par l’intermédiaire des facteurs de risque vasculaires qu’elle génère mais non par un effet délétère sur la PIO [23, 28].
Une baisse de PIO est classiquement constatée chez le sujet non glaucomateux après chirurgie de cataracte comportant phako-émulsification et implantation intra-oculaire postérieure. Plusieurs auteurs ont confirmé cette baisse chez le patient porteur d’un GPAO. Certains ont montré qu’elle était volontiers proportionnelle à la PIO préopératoire, les PIO préopératoires les plus hautes bénéficiant des baisses les plus importantes. Par ailleurs, les diminutions de PIO constatées un an après la chirurgie se prolongeraient les dix années suivantes [21]. Une étude récente, de 2012, a comparé chez un même patient glaucomateux la PIO de l’œil opéré de cataracte avec celle de l’œil adelphe non opéré, servant ainsi de témoin. Cette étude a retrouvé une baisse de PIO de l’œil opéré par rapport à l’œil non opéré pendant les quatre premiers mois suivant la chirurgie, mais a cependant montré qu’il n’y avait plus aucune différence significative entre les deux yeux trois ans après [7]. Ainsi, si tous les auteurs s’accordent à constater dans les mois qui suivent une chirurgie de cataracte une baisse de PIO chez les patients glaucomateux, il faut probablement être plus réservé quant à la pérennisation de cette réduction à long terme.
Chez le patient porteur de GPAO, les variations nycthémérales de la PIO semblent subir l’influence, comme chez les sujets sains, d’un rythme nycthéméral. Bien que les études ne soient pas très nombreuses, les mieux documentées sont en faveur d’un retard de phase du rythme de la PIO, de 4 à 12 heures, chez le patient glaucomateux par rapport au rythme du sujet sain (voir chapitre 9-II). L’acrophase du rythme surviendrait au cours de la journée, dans la matinée ou dans l’après-midi. Quant à la constatation de PIO moyennes nocturnes plus élevées que les PIO moyennes diurnes, relatée chez le sujet sain, elle s’avérerait inconstante chez le patient glaucomateux, voire même inversée dans certaines études [17, 19] (fig. 10-25). Un certain nombre d’incertitudes concernant le rythme nycthéméral de la PIO persiste. En dehors d’une caractérisation plus précise de ce rythme qui pourrait bénéficier des méthodes d’enregistrement continu de la PIO, l’aspect reproductible des variations nycthémérales chez un même patient demande confirmation.
Le profil pressionnel nycthéméral des GPN a été, de même, insuffisamment étudié. Une étude assez récente semble montrer que les variations nycthémérales de la PIO lors d’un GPN adoptent des profils divers : soit proches de ceux des sujets sains, soit proches de ceux des patients porteurs de glaucome pressionnel, soit sans aucun rythme défini [22].
Enfin, l’impact que la chronobiologie de la PIO peut avoir sur nos prises en charge thérapeutiques mérite également une évaluation complémentaire.
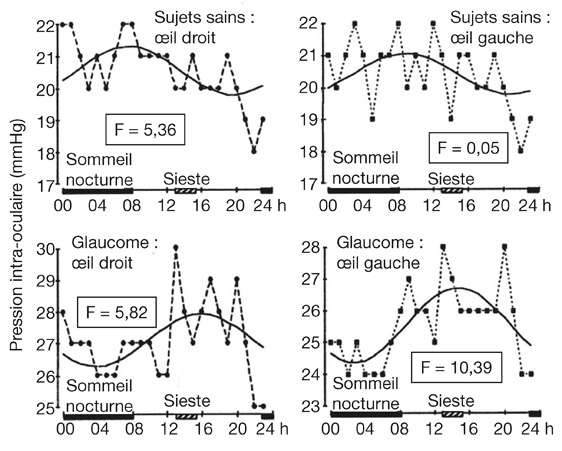
Fig. 10-25 Rythme nycthéméral de la PIO lors de GPAO. Comparaison des courbes de PIO de 24 heures établies à partir de mesures horaires chez un sujet sain et un patient glaucomateux.
L’amplitude des variations de la PIO sur 24 heures, appelées aussi fluctuations, serait classiquement plus importante chez le patient glaucomateux que chez le sujet sain. Chez les sujets sains, les fluctuations sont volontiers trouvées entre 2 et 6 mmHg. L’équipe de Liu [17] relate néanmoins des amplitudes supérieures à 8 mmHg, proches des valeurs trouvées lors de GPAO. Pour certains auteurs, l’amplitude des variations entre les mesures diurnes serait plus grande que celle constatée entre les mesures nocturnes [17], alors que pour d’autres, les résultats sont contraires [8].
Les fluctuations de la PIO comme facteur de risque indépendant d’évolution de la maladie glaucomateuse sont défendues par un certain nombre d’auteurs [2, 5], alors que d’autres ne partagent pas cette opinion [3].
Tout patient à risque glaucomateux ou chez qui a été découvert un glaucome doit bénéficier d’une courbe de PIO diurne avant tout traitement. Elle permettra d’avoir une idée du profil pressionnel de la maladie et de différencier notamment les GPAO des GPN. Elle pourra mettre en évidence d’éventuels pics pressionnels qui seraient passés inaperçus en cas de mesure unique. Elle donnera la possibilité de calculer la PIO moyenne diurne et estimera l’importance des fluctuations. Elle renseignera sur l’acrophase diurne, moment où la valeur de PIO est la plus élevée, et sur la bathyphase, moment où la valeur de PIO est la plus basse.
Il sera ainsi possible de déterminer ce qu’on pourrait appeler le niveau de sévérité pressionnelle du GPAO expertisé. On pourrait le qualifier d’important lorsque la PIO moyenne diurne est élevée (≥ 24-25 mmHg) et s’il existe de nombreux pics pressionnels (deux à cinq) et une grande amplitude des fluctuations (10-12 mmHg) (eFig. 10-13).
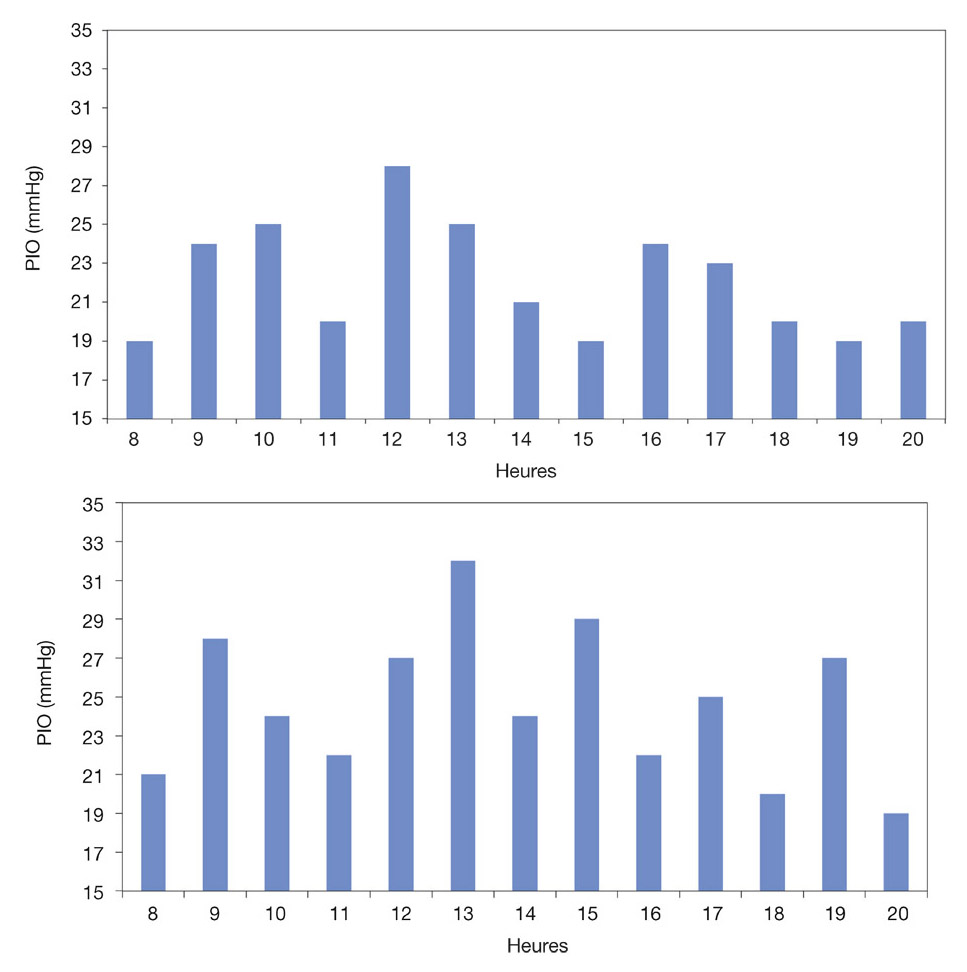
eFig. 10-13 Niveau de sévérité pressionnelle d’un GPAO à partir de courbes diurnes de PIO. a. GPAO de sévérité pressionnelle moyenne (PIO moyenne : 22 mmHg). b. GPAO plus sévère sur le plan pressionnel (PIO moyenne : 24,5 mmHg).
Le traitement du GPAO a pour but de maintenir une fonction visuelle et une qualité de vie à un coût raisonnable. Jusqu’à maintenant, seul l’abaissement de la PIO a fait la preuve d’une efficacité pour arrêter la progression de la maladie [1, 10]. Ce traitement, qui sera largement détaillé dans les chapitres dédiés à ce sujet, doit être personnalisé et adapté, et il est classique de parler de PIO cible. Idéalement, cette PIO cible se caractérise par la PIO moyenne en dessous de laquelle la neuropathie est stabilisée (voir chapitre 17-II). Plutôt qu’une valeur précise et unique de PIO, c’est probablement une fourchette que nous devons nous donner comme objectif, en recourant toujours à un traitement efficace minimal et le moins générateur d’effets secondaires.
La mise en route d’un traitement hypotenseur oculaire nécessite, quelques semaines après, une évaluation de son efficacité sur la PIO et l’assurance que les objectifs pressionnels intra-oculaires attendus sont bien atteints. L’effet sur la PIO sera jugé sur la PIO moyenne diurne, la réduction des fluctuations, le lissage des pics pressionnels et la diminution de leur nombre [2, 5]. La comparaison d’une courbe diurne de PIO sous traitement par rapport à celle pratiquée préalablement avant tout traitement est donc recommandée (eFig. 10-14). Elle sera renouvelée régulièrement, au moins annuellement, pour déceler les éventuels échappements au traitement. Elle pourra ainsi aboutir à un réajustement du traitement médical concernant aussi bien sa nature, sa posologie que ses horaires, ce qui est une démarche chronothérapeutique.
L’efficacité d’un traitement antiglaucomateux ne se juge cependant pas sur des critères pressionnels mais sur l’arrêt de progression des anomalies structurelles et fonctionnelles liées à la maladie. La mesure du taux de progression de l’atteinte glaucomateuse est donc indispensable et permettra de confirmer ou de réévaluer la PIO cible prédéterminée.
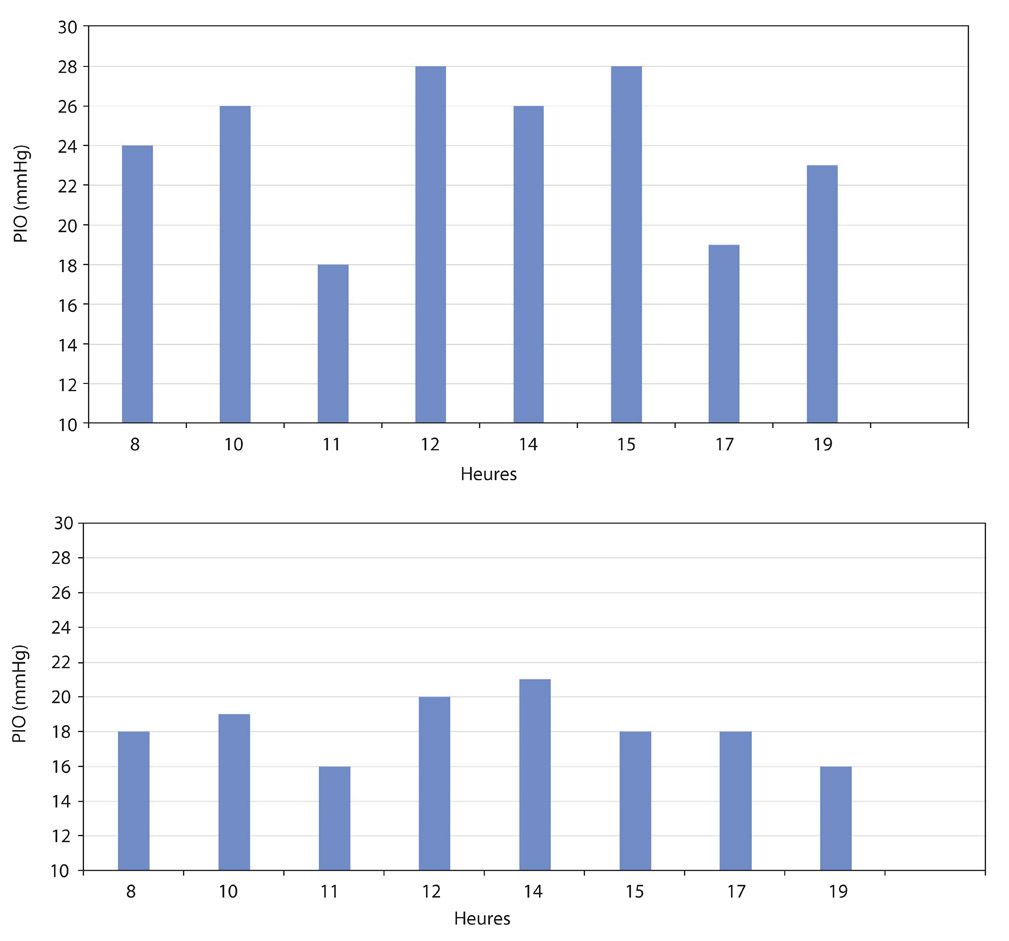
eFig. 10-14 Évaluation de l’efficacité d’un traitement hypotenseur oculaire en comparant les courbes diurnes de PIO avant tout traitement et lors du traitement mis en route quelques semaines auparavant. a. Courbe diurne (huit mesures) de PIO chez un patient porteur de GPAO avant traitement (PIO moyenne : 24 mmHg). b. Courbe diurne (huit mesures) de PIO chez le même patient après un mois de traitement (PIO moyenne : 18,25 mmHg).
Compte tenu de l’influence quasi immédiate de la pression artérielle systémique sur la PIO, il est intéressant de coupler simultanément la mesure de la PIO avec celle de la pression artérielle. On comprendra ainsi mieux certaines mesures élevées inattendues de la PIO chez un patient observant mais présentant des accès d’HTA liés au stress ou à l’émotion.
La réalisation d’une courbe diurne de PIO a été décrite dans le chapitre 9-II. Il en est de même pour les techniques de mesure de PIO.
La courbe de PIO sur 24 heures permet une analyse plus complète que la simple courbe diurne. Elle est systématiquement couplée à un enregistrement de la tension artérielle et un enregistrement polysomnographique du sommeil. Elle permet ainsi de détecter les pics pressionnels oculaires nocturnes, les rythmes atypiques ou inexistants comme en cas de GPN. Elle peut dépister les anomalies de variation de la pression artérielle et l’existence d’un syndrome d’apnée du sommeil qui constituent des facteurs de risque supplémentaires de la maladie glaucomateuse, et ont une influence sur le niveau de PIO. Enfin, elle seule est capable de donner des indications sur l’efficacité pressionnelle du traitement sur 24 heures et plus particulièrement la nuit.
Actuellement, la courbe sur 24 heures est utilisée en deuxième intention du fait de la difficulté de sa réalisation. Elle est pratiquée en cas de dégradation de la neuropathie glaucomateuse malgré une courbe diurne avec des valeurs de PIO correctes ou en cas de recherche de pathologies associées (hypotension nocturne délétère, syndrome d’apnée du sommeil) (fig. 10-26). Dans de rares cas, elle peut être utile en cas de suspicion de GPN.
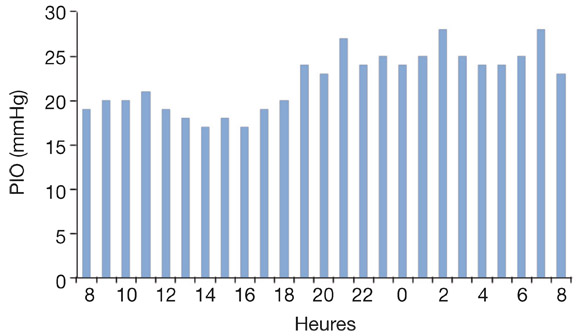
Fig. 10-26 Courbe de PIO sur 24 heures. Patient porteur d’un GPAO traité, aux pressions diurnes bien contrôlées, mais continuant de s’aggraver du fait d’un échappement pressionnel la nuit.
Les courbes de PIO sur 24 heures sont, jusque-là, toutes établies à partir de mesures discontinues. Il est préconisé d’avoir recours à des mesures horaires, en respectant l’orthostatisme dans la journée et le décubitus la nuit. Elles ne sont réalisées actuellement que dans certains centres de glaucome.
Les systèmes d’enregistrement continu de la PIO, actuellement encore en évaluation, permettront très probablement un développement de ce type d’exploration sur 24 heures, avec la garantie d’obtenir des profils pressionnels beaucoup plus exacts et précis et la perspective de réalisation en ambulatoire.
Les tests de provocation reproduisent les conditions responsables d’une élévation pressionnelle anormalement haute chez un patient glaucomateux par rapport à celle constatée dans les mêmes conditions chez un sujet sain. Ils pourraient ainsi être une aide à un diagnostic précoce ou hésitant.
Le test repose sur l’ingestion rapide, en moins de 5 minutes, d’une quantité d’eau proportionnelle au poids du sujet (10 mL/kg). Une mesure de la PIO est effectuée avant le test puis toutes les 15 minutes pendant l’heure qui suit l’ingestion. L’élévation de la PIO est constante. Le mécanisme en cause n’est pas totalement élucidé, l’augmentation de la résistance à l’écoulement de l’humeur aqueuse intervenant néanmoins très probablement [9].
Actuellement, ce test n’est plus retenu comme test diagnostique du GPAO. Un bon nombre d’auteurs lui reconnaissent néanmoins une valeur prédictive en ce qui concerne les pics de PIO. Plusieurs études ont, en effet, établi une corrélation entre les pics de PIO constatés après le test d’ingestion d’eau et les pics survenant au cours du nycthémère, ce qui pourrait alerter sur la sévérité pressionnelle du glaucome et apporter une information complémentaire aux courbes de PIO diurnes [15] (27). Ce test pourrait être, en outre, utile pour évaluer l’efficacité des traitements médicaux, physiques et chirurgicaux. On constate ainsi que tous les traitements améliorant l’élimination de l’humeur aqueuse atténuent l’importance de la réponse à ce test [9].
L’élévation de la PIO lors du passage de la position assise à la position couchée, décubitus dorsal ou latéral, est reconnue par tous les auteurs [13, 16, 26]. Certains ont considéré qu’elle pouvait constituer un test permettant de prévoir l’importance des pics pressionnels nycthéméraux. Comme pour le test d’ingestion d’eau, ce changement de position exacerbant la résistance à l’écoulement de l’humeur aqueuse pourrait provoquer des élévations de la PIO plus importantes pour les glaucomes à fortes fluctuations [25].
Le test aux corticostéroïdes a pu être utilisé dans les années 1960 dans le but d’un éventuel dépistage d’un GPAO chez des patients présentant des facteurs de risque. Il consistait à instiller un collyre à la dexaméthasone 0,1 % trois fois par jour pendant quatre semaines.
Depuis de nombreuses études ont montré que ce test avait un faible pouvoir prédictif de diagnostic de la maladie. L’une d’entre elles, portant sur 134 patients, a montré que 25 % des sujets testés avaient une forte réponse à la dexaméthasone (élévation de la PIO > 16 mmHg), 50 % une réponse intermédiaire (élévation de la PIO entre 6 et 16 mmHg) et 25 % une faible réponse (élévation de la PIO < 6 mmHg). Sur les 21 % de cette population qui ont développé un GPAO, moins du tiers avait une forte réponse au test et un quart avait une faible réponse [14].
Retenir
-
La PIO élevée est un facteur de risque majeur de la maladie glaucomateuse et de sa progression, mais n’est pas un critère diagnostique.
-
Comme chez le sujet sain, la PIO chez le patient glaucomateux est sous l’influence de nombreux facteurs – génétiques, hémodynamiques, hormonaux, chronobiologiques – mais est aussi influencée par l’épaisseur cornéenne centrale, le positionnement du corps ou l’exercice physique.
-
Son estimation par des mesures répétées sur la période diurne est indispensable pour s’assurer de la forme clinique, GPAO ou GPN, et pour une prise en charge thérapeutique la mieux adaptée (PIO cible).
-
Les tests de provocation ne sont plus utilisés actuellement dans le dépistage des GPAO à un stade préclinique.
-
En arrêtant la progression de la maladie glaucomateuse, seul l’abaissement de la PIO a fait la preuve d’efficacité en matière de traitement.
[1] Anderson DR, Drance SM, Schulzer M. Collaborative Normal Tension Glaucoma Study Group. Factors that predict the benefit of lowering intraocular pressure in normal tension glaucoma. Am J Ophthalmol. 2003 ; 136 : 820-9.
[2] Asrani S, Zeimer R, Wilensky J, et al. Large diurnal fluctuations in intraocular pressure are an independent risk factor in patients with glaucoma. J Glaucoma. 2000 ; 9 : 134-42.
[3] Bengtsson B, Leske MC, Hyman L, Heijl A. Early Manifest Glaucoma Trial Group. Fluctuation of intraocular pressure and glaucoma progression in the early manifest glaucoma trial. Ophthalmology. 2007 ; 114 : 205-9.
[4] Bhattacharya SK, Rockwood EJ, Smith SD, et al. Proteomics reveal Cochlin deposits associated with glaucomatous trabecular meshwork. J Biol Chem. 2005 ; 280 : 6080-4.
[5] Caprioli J. Intraocular pressure fluctuation : an independent risk factor for glaucoma ? Arch Ophthalmol. 2007 ; 125 : 1124-5.
[6] Caprioli J. Target pressure. Ophthalmology. 2001 ; 108 : 1367-8.
[7] Chang TC, Budenz DL, Liu A, et al. Long-term effect of phacoemulsification on intraocular pressure using phakic fellow eye as control. J Cataract Refract Surg. 2012 ; 38 : 866-70.
[8] Fogagnolo P, Rossetti L, Mazzolani F, Orzalesi N. Circadian variations in central corneal thickness and intraocular pressure in patients with glaucoma. Br J Ophthalmol. 2006 ; 90 : 24-8.
[9] Goldberg I, Clement CI. The water drinking test. Am J Ophthalmol. 2010 ; 150 : 447-9.
[10] Heijl A, Leske MC, Bengtsson B, et al. Early Manifest Glaucoma Trial Group. Reduction of intraocular pressure and glaucoma progression : results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 ; 120 : 1268-79.
[11] Jampel HD. Target pressure in glaucoma therapy. J Glaucoma. 1997 ; 6 : 133-8.
[12] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study. A randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13.
[13] Kim KN, Jeoung JW, Park KH, et al. Effect of lateral decubitus position on intraocular pressure in glaucoma patients with asymmetric visual field loss. Ophthalmology. 2013 ; 120 : 731-5.
[14] Klemetti A. The dexamethasone provocative test : a predictive tool for glaucoma ? Acta Ophthalmol. 1990 ; 68 : 29-33.
[15] Kumar RS, de Guzman MH, Ong PY, Goldberg I. Does peak intraocular pressure measured by water drinking test reflect peak circadian levels ? À pilot study. Clin Experiment Ophthalmol. 2008 ; 36 : 312-5.
[16] Lee JY, Yoo C, Kim YY. The effect of lateral decubitus position on intraocular pressure in patients with untreated open-angle glaucoma. Am J Ophthalmol. 2013 ; 155 : 329-35.
[17] Liu JH, Zhang X, Kripke DF, Weinreb RN. Twenty-four-hour intraocular pressure pattern associated with early glaucomatous changes. Invest Ophthalmol Vis Sci. 2003 ; 44 : 1586-90.
[18] Miglior S, Zeyen T, Pfeiffer N, et al. European Glaucoma Prevention Study (EGPS) Group. Results of the European Glaucoma Prevention Study. Ophthalmology. 2005 ; 112 : 366-75.
[19] Noel C, Kabo AM, Romanet JP, et al. Twenty-four-hour time course of intraocular pressure in healthy and glaucomatous Africans : relation to sleep patterns. Ophthalmology. 2001 ; 108 : 139-44.
[20] Passo MS, Goldberg L, Elliot DL, Van Buskirk EM. Exercise training reduces intraocular pressure among subjects suspected of having glaucoma. Arch Ophthalmol. 1991 ; 109 : 1096-8.
[21] Poley BJ, Lindstrom RL, Samuelson TW, Schulze R. Intraocular pressure reduction after phacoemulsification with intraocular lens implantation in glaucomatous and nonglaucomatous eyes : evaluation of a causal relationship between the natural lens and open-angle glaucoma. J Cataract Refract Surg. 2009 ; 35 : 1946-55.
[22] Renard E, Palombi K, Gronfier C, et al. Twenty-four hour (nyctohemeral) rhythm of intraocular pressure and ocular perfusion pressure in normal-tension glaucoma. Invest Ophthalmol Vis Sci. 2008 ; 51 : 882-9.
[23] Renard JP. Les facteurs de risque vasculaire dans le glaucome. J Fr Ophtalmol. 2007 ; 30 : 18-21.
[24] Risner D, Ehrlich R, Kheradiya NS, et al. Effects of exercise on intraocular pressure and ocular blood flow : a review. J Glaucoma. 2009 ; 18 : 429-36.
[25] Sakata R, Aihara M, Murata H, et al. Intraocular pressure change over a habitual 24-hour period after changing posture or drinking water and related factors in normal tension glaucoma. Invest Ophthalmol Vis Sci. 2013 ; 54 : 5313-20.
[26] Sawada A, Yamamoto T. Posture-induced intraocular pressure changes in eyes with open-angle glaucoma, primary angle closure with or without glaucoma medications, and control eyes. Invest Ophthalmol Vis Sci. 2012 ; 53 : 7631-5.
[27] Shetgar AC, Mulimani MB. The central corneal thickness in normal tension glaucoma, primary open angle glaucoma and ocular hypertension. J Clin Diagn Res. 2013 ; 7 : 1063-7.
[28] Yanagi M, Kawasaki R, Wang JJ, et al. Vascular risk factors in glaucoma : a review. Clin Experiment Ophthalmol. 2011 ; 39 : 252-8.
[29] Zeyen T. Target pressure in glaucoma. Bull Soc Belge Ophtalmol. 1999 ; 74 : 701-13.
P. Hamard, H. El Chehab, J.-P. Renard
-
Si l’hypertension intra-oculaire reste le facteur de risque (FDR) majeur du glaucome primitif à angle ouvert (GPAO), des FDR non pressionnels conditionnent sa survenue et/ou sa progression.
-
Les grandes études épidémiologiques et/ou longitudinales prospectives ont déterminé les FDR non pressionnels considérés majeurs qui leur sont communs. D’autres FDR non pressionnels doivent cependant être considérés dans la prise en charge clinique.
-
Les récentes acquisitions physiopathogéniques ont permis de mieux comprendre le rôle de FDR bien connus et de mettre en exergue de nouveaux FDR du GPAO, en particulier les facteurs environnementaux et neurotoxiques.
-
Certains FDR sont inaccessibles sur le plan thérapeutique car innés (âge, ethnie, antécédents familiaux, myopie, certaines caractéristiques du disque optique, etc.), d’autres facteurs sont contrôlables (pathologies vasculaires, syndrome d’apnée du sommeil, facteurs socioprofessionnels, facteurs liés au mode de vie, etc.) et doivent être bien connus.
Les FDR du GPAO sont les facteurs physiologiques, pathologiques ou liés au mode de vie, associés statistiquement à l’incidence et/ou au développement du GPAO, présents avant qu’il se déclare et pouvant jouer un rôle déterminant dans sa survenue [10].
On distingue classiquement les FDR de prévalence (nombre de cas dénombrés dans une population donnée), les FDR d’incidence (nombre de nouveaux cas pour une période donnée) et les FDR de conversion d’une hypertension intra-oculaire (HTO) vers un GPAO.
Les FDR de progression d’un GPAO sont, quant à eux, définis selon la conférence de consensus de la World Glaucoma Association de 2011 [24] comme « des facteurs associés à une élévation du taux de progression du glaucome qui n’est pas totalement expliquée par un facteur intercurrent ou par un biais ». Pour être reconnu en tant que facteur causal de progression du GPAO, ce FDR doit avoir été identifié dans plusieurs études indépendantes et bien conduites, avec un lien probable entre le FDR et le GPAO, et l’on doit pouvoir démontrer que la progression du glaucome est moindre dans la population non exposée à ce facteur de risque.
Si la pression intra-oculaire (PIO) reste sans conteste le facteur majeur, « dose-dépendant », qui peut à lui seul entraîner un GPAO caractéristique, il n’existe pas de lien direct entre la PIO et le GPAO puisque toutes les HTO n’évoluent pas vers un glaucome, que la moitié des GPAO ont une PIO considérée normale lors du diagnostic et qu’une grande partie des glaucomes évolue malgré une PIO « normalisée ». La susceptibilité du nerf optique aux valeurs de la PIO paraît conditionnée par la présence d’autres facteurs qui interviennent dans la détermination de la PIO cible à atteindre, propre à chaque patient. De nombreuses études ont ainsi montré l’implication plus ou moins directe de FDR autres que la PIO aussi bien dans la conversion d’une HTO vers un GPAO, que dans la survenue et la progression du GPAO, le classant en neuropathie optique polygénique et multifactorielle.
La recherche des différents FDR est donc indispensable aussi bien pour le dépistage des sujets à risque que tout au long du suivi du patient atteint de GPAO. Leur mise en évidence joue un rôle dans la décision d’initier un traitement comme dans celle de la modification d’un objectif thérapeutique en fonction de la progression, car il est possible en pratique d’en contrôler un certain nombre.
En effet, si certains FDR sont inaccessibles sur le plan thérapeutique (génétiques ou innés) et définissent les populations à risque pour lesquelles la surveillance est accrue, d’autres facteurs sont potentiellement contrôlables.
Les FDR de prévalence sont déterminés à partir d’études cliniques, d’études cas-témoins (encore appelées cas-contrôles) ou de surveillance de populations.
Les FDR d’incidence proviennent d’études de cohortes longitudinales, notamment celles fondées sur un échantillon de la population vivant dans une zone géographiquement bien définie.
Les FDR de survenue d’un GPAO chez un sujet sain ont été déterminés à partir d’essais cliniques suivant l’histoire naturelle d’une population sélectionnée et essentiellement grâce aux études longitudinales de population suivantes :
-
la Rotterdam Eye Study (RES, 3 842 personnes, concernant essentiellement des sujets caucasiens européens) ;
-
la Barbados Incidence Study of Eye Disease (BISED, 3 222 personnes, comportant essentiellement des sujets africains des Antilles) ;
-
la Melbourne Visual Impairment Project (VIP, 3 271 personnes, comptant essentiellement des sujets européens caucasiens).
Les FDR de conversion d’une HTO vers un glaucome ont été principalement définis à partir de deux grandes études prospectives randomisées, comparant le risque d’évolution vers un GPAO des patients hypertones selon qu’ils étaient traités ou non [23] :
-
l’OHTS (Ocular Hypertension Treatment Study ; 1 636 participants) ;
-
l’EGPS (European Glaucoma Prevention Study ; avec 181 participants).
Un calculateur de risque de développer à cinq ans un GPAO chez un sujet atteint d’HTO a été créé en prenant en compte les FDR retrouvés dans ces deux études : l’âge, la PIO de base, l’épaisseur cornéenne centrale (ECC), le rapport cup/disk (C/D) et l’indice PSD (Humphrey) ou CLV (Octopus) du champ visuel Ce calculateur de risque est disponible en ligne sur Internet : http://ohts.wustl.edu/risk/calculator.html.
Ce calculateur de risque de GPAO peut être d’une certaine aide en pratique clinique courante, en se rappelant toutefois que les résultats ne peuvent s’appliquer qu’aux sujets qui remplissent les critères d’inclusion de ces études (âge > 40 ans, PIO > 22 mmHg, sujet blanc ou noir africain) et que ce calculateur ne prend en compte que les paramètres évalués dans ces deux études sans considérer tous les autres FDR.
Les FDR de progression sont généralement renseignés à partir d’études ou d’essais cliniques avec un minimum de cinq ans de suivi ; les quatre principales études cliniques multicentriques randomisées avec un minimum de cinq ans de suivi ayant permis d’évaluer les FDR de progression du GPAO sont : l’EMGT (Early Manifest Glaucoma Trial) et la CIGTS (Collaborative Initial Glaucoma Treatment Study) pour les glaucomes débutants et modérés, l’AGIS (Advanced Glaucoma Intervention Study) pour les glaucomes évolués et la CNTGS (Collaborative Normal Tension Glaucoma Study) pour les glaucomes à pression normale [24]. Les FDR de progression sont différents selon le stade du glaucome : ceux d’un glaucome débutant à modéré sont assez bien renseignés, ceux concernant l’évolution d’une forme modérée à sévère de glaucome sont moins bien définis, et nous manquons encore d’études suffisamment puissantes pour établir les facteurs de risque de cécité chez les patients présentant un GPAO.
Bien que toutes ces études cliniques bien contrôlées aient permis de préciser les caractéristiques de ces FDR, un consensus sur leur réalité n’est pas toujours retrouvé. Ces différences peuvent être liées aux stades évolutifs variés des patients, aux types de traitement et aux modes de recueil des données.
Toutefois, en pratique, ces FDR doivent être recherchés systématiquement chez tout patient atteint de GPAO, lors de chaque visite de contrôle et avec d’autant plus d’attention que le GPAO progresse malgré un bon contrôle apparent de la PIO. À l’opposé, l’effet potentiellement bénéfique d’un certain nombre d’autres facteurs – par leur influence favorable sur l’évolution ou le traitement de la neuropathie – doit être connu.
L’âge est un FDR indépendant d’incidence et de prévalence de GPAO [10] ainsi qu’un facteur de conversion d’une HTO vers un glaucome, le risque augmentant de 22 % par décennie selon l’OHTS [39]. L’âge est également un FDR de progression du GPAO, qu’il s’agisse des glaucomes débutants de l’étude EMGT ou des formes cliniques avancées de l’étude [23].
En France, 2 % des sujets de plus de 40 ans seraient suivis pour un GPAO [12]. Comme nous l’avons vu, cette prévalence nationale est en accord avec la récente méta-analyse de l’ensemble des études concernant les facteurs de risque du GPAO, réalisées de janvier 1950 à janvier 2013, regroupant les résultats de 41 études séparées dont 34 randomisées avec un niveau de preuves élevé (qualité de niveaux I et II) (voir chapitre 8). Elle rapporte une prévalence estimée du GPAO (fondée sur ces études de niveaux I et II, soit plus de 86 000 participants) de 2,6 %, avec un intervalle de confiance très étroit (IC95 % : 2,1-3,1) (tableau 10-1).
La prévalence varie en fonction de la tranche d’âge considérée et passe de 1,3 % pour les sujets de 40 à 49 ans à 5,1 % (OR : 2,5 ; IC : 1,9-3,1) pour les sujets de 70 à 79 ans. Elle est maximale au-delà de 80 ans où elle atteint 7,8 % (OR : 2,9 ; IC : 1,9-4,3) [49].
Les résultats de l’étude européenne concernant à ce jour l’effectif le plus important de sujets caucasiens ayant bénéficié d’un dépistage du GPAO (32 918 sujets) a permis de retrouver que la proportion de glaucomes non dépistés augmente également avec l’âge. Il est estimé que seulement 50 % des patients glaucomateux sont diagnostiqués. La prévalence des cas non connus est cinq fois plus importante chez les patients âgés de 75 à 79 ans (2,73 %) par rapport aux patients de 55 à 59 ans (0,55 %) [45].
Nous avons vu que les facteurs épigénétiques permettent de mieux comprendre l’augmentation de la prévalence du GPAO avec l’âge et d’en entrevoir les conséquences (voir chapitre 8). Ainsi la prévalence globale du GPAO de 2,6 % permet de retenir pour la France une estimation de 1 710 800 patients atteints, dont la moitié n’est pas diagnostiquée (65 800 000 habitants – données INSEE 2013). Si actuellement les sujets de 40 ans et plus (33 232 000) représentent 50,5 % de la population et ceux âgés d’au moins 65 ans 18 % de cette population (11 860 000), les estimations pour 2020 d’un tiers des Français âgés de plus de 65 ans laissent entrevoir dans un avenir proche un nombre important de patients ayant ce FDR.
En pratique, le dépistage et le suivi du GPAO seront l’objet d’une attention particulière avec l’âge croissant des patients, d’autant plus qu’il s’associe à une augmentation de la prévalence des autres FDR.
En épidémiologie, le risque relatif (RR) mesure l’effet d’un facteur sur une pathologie. Il est estimé dans les études de cohorte ayant des patients exposés et non exposés. Il correspond au rapport entre le risque de développer la maladie chez les sujets exposés sur le risque de développer la maladie chez les non-exposés. Il correspond en général à des études prospectives.
L’odds ratio (OR), rapport des cotes ou rapport des chances, est utilisé dans les études cas-témoins pour appréhender le risque relatif qui ne peut pas être directement calculé. En effet, dans ce type d’étude, les cas et les témoins sont fixés par l’investigateur et il n’est donc pas possible de calculer le risque d’être un « cas » en fonction du facteur considéré. Il correspond en général à des études observationnelles ou rétrospectives.
Si le risque de la pathologie est faible, inférieur à 25 %, il est démontré statistiquement que l’OR et le RR sont équivalents. Au-delà de cette limite, l’OR surestime l’effet du facteur pris en compte.
L’interprétation de l’OR est similaire à celle du RR. Elle doit être réalisée en prenant en compte son intervalle de confiance. S’il est égal à un ou que l’intervalle de confiance contient cette valeur, cela correspond à l’absence d’effet du facteur. S’il est inférieur à un et que l’intervalle de confiance ne contient pas cette valeur, il y a un effet bénéfique, protecteur, du facteur considéré. S’il est supérieur à un et que l’intervalle de confiance ne contient pas cette valeur, le facteur aggrave le risque ou est délétère pour la pathologie.
Tableau 10.1 Facteurs de risque de GPAO rapportés comme facteurs significatifs dans les différentes études cliniques [49, 89].
Les antécédents familiaux augmentent le risque de développer un glaucome, qui est une entité clinique et génétique hétérogène. L’augmentation du risque de glaucome chez les descendants de patients atteints de GPAO et la concordance plus importante chez des jumeaux monozygotes par rapport à des jumeaux dizygotes soulignent le caractère héréditaire du GPAO [10]. Le GPAO chez les enfants et les adultes jeunes répond à une génétique mendélienne à la différence du GPAO de l’adulte âgé. En effet, seuls quatre gènes ont été incriminés pour une transmission mendélienne et ils seraient la cause de moins de 5 % des cas de GPAO (voir chapitres 4 et 8-IV).
Bien que le GPAO de l’adulte, d’étiologie complexe, ne suive en général pas une simple génétique mendélienne, plusieurs études rapportent que la majeure partie des autres cas de GPAO de l’adulte serait liée à une action combinée d’une susceptibilité génétique, dont certains gènes ont déjà été isolés, influencée par une action de l’environnement (voir chapitres 4 et 8-IV).
Plusieurs études rapportent la prédisposition au GPAO dans le cas d’antécédents familiaux [16, 30]. Dans la Baltimore Eye Survey, le risque pour les membres de la famille de développer un GPAO a été retrouvé supérieur chez les frères et sœurs (OR : 3,69) par rapport aux parents (OR : 2,17) et aux enfants (OR : 1,12) des patients. Il est intéressant de noter que les OR étaient supérieurs chez les membres de la famille des patients connaissant déjà leur diagnostic de glaucome par rapport à ceux qui l’apprenaient pour la première fois. Il s’agit d’un biais à connaître pour les études sur le risque lié aux antécédents familiaux [29].
La méta-analyse récente précédemment citée permet d’obtenir une synthèse intéressante des données de l’ensemble des études réalisées à ce jour, et classiquement rapportées dans les analyses des différents FDR du GPAO.
Ainsi, les patients avec un antécédent familial de GPAO (patient du premier degré) ont une fréquence augmentée de GPAO (avec un taux de prévalence de 7,6 %) et un risque relatif OR : 3,3 (IC95 % : 2-5,6) pour l’ensemble des neuf études à niveau de preuves élevé (qualité de niveaux I et II) ayant analysé ce facteur [49].
Une étude au sein d’une population comparable à une population européenne (base de données de l’Utah avec 3 391 GPAO) a également rapporté une augmentation du risque de GPAO chez des apparentés du deuxième degré RR : 1,45 (IC95 % : 1,16-1,8), pour les cousins du premier degré et RR = 1,19 (IC95 % : 1,08-1,32) chez les cousins du second degré [47].
Les antécédents familiaux de GPAO ne semblent cependant pas être un FDR de progression de la pathologie [8].
En pratique, il faut donc retenir que l’existence d’antécédent familial de GPAO est un facteur fortement prédisposant à l’apparition de glaucome. Il représente globalement un facteur de risque de GPAO multiplié par trois en cas de glaucome chez un parent du premier degré. Un antécédent familial de GPAO est ainsi un facteur de risque indéniable en cas de parenté au premier degré, indispensable à rechercher à l’interrogatoire quel que soit l’âge du patient en raison de l’association possible au sein d’une même famille de différentes formes cliniques de glaucome (GPAO, glaucome juvénile, glaucome à pression normale, etc.).
La prévalence et la progression du GPAO sont très variables d’une ethnie à l’autre (voir chapitre 3) [12]. La prévalence du GPAO dans la population afro-américaine est trois fois supérieure à celle des Caucasiens, avec des glaucomes plus précoces et plus graves, et un certain nombre de facteurs prédisposant à cette augmentation du risque : cornée plus fine, disque optique (DO) plus large avec une surface d’anneau neurorétinien non proportionnelle à la taille du disque, et plus faible épaisseur de la couche des fibres nerveuses rétiniennes (FNR) au sein d’un disque qui subit plus de contraintes mécaniques du fait de sa taille [10, 38]. Des facteurs économiques, géographiques et culturels peuvent s’associer à ces facteurs de prédisposition anatomiques rendant le diagnostic souvent plus tardif. Ce diagnostic tardif retarde la prise en charge des patients chez qui l’apparition de la pathologie est plus précoce et l’évolution vers la cécité plus rapide [88].
Chez les habitants des îles des Antilles, la prévalence du GPAO est également plus élevée avec un plus grand nombre de formes cliniques évoluées [12].
La Los Angeles Latino Eye Study rapporte un risque intermédiaire dans cette population, dont le risque serait multiplié par deux par rapport à la population caucasienne [21].
Cependant, la récente méta-analyse concernant les FDR avec les études à niveau de preuve élevé retrouve chez les patients de race noire une prévalence de l’ordre de 7,5 % – avec un OR : 2,9 (IC95 % : 1,4-5,9) [49].
En pratique, le risque de GPAO est globalement multiplié par trois chez les patients mélanodermes. Ce FDR d’apparition n’est cependant pas rapporté comme facteur de progression du GPAO dans les résultats des études à niveau de preuve élevé.
Le risque de GPAO augmente avec l’importance de la myopie. Une méta-analyse de treize études publiées entre 1994 et 2010, impliquant 48 161 individus chez lesquels l’association entre la myopie et le GPAO a été recherchée, a montré que celle-ci était d’autant plus forte que la myopie était plus importante (OR : 1,65 pour les myopies inférieures ou égales à 3 dioptries, et OR : 2,46 pour les myopies supérieures à trois dioptries) [70]. La méta-analyse de 2013 rapporte des données similaires avec une prévalence de 6 % (OR : 2,1 ; IC : 1,3-3,4) pour les myopies inférieures à – 3D s’élevant à 11 % (OR : 5,7 ; IC : 3,1-11) pour les myopies au-delà de – 6D [49] (voir tableau 10-1).
La prévalence de la myopie varie entre 6,6 et 38 % chez les patients glaucomateux, chez qui elle représente un FDR indépendant des autres facteurs [16]. L’incidence du GPAO augmente avec l’accroissement de la longueur axiale (11,2 % pour une longueur axiale de 26,5 mm et 23,1 % pour une longueur axiale de 31,5 mm) [30].
Si les patients myopes présentent une PIO supérieure de 0,5 à 1 mmHg par rapport aux patients emmétropes [30], cette différence statistiquement – mais non cliniquement – significative ne peut pas expliquer à elle seule l’augmentation de la prévalence du glaucome dans cette population.
L’anatomie et la morphologie de la tête du nerf optique (TNO) du sujet myope expliquent sa plus grande susceptibilité aux dommages glaucomateux que le sujet emmétrope. Les forces de cisaillements supérieures liées à une insertion oblique de la TNO, la faiblesse du tissu de soutien au niveau du disque optique, une lame criblée plus fine et l’absence de la choriocapillaire péripapillaire responsable d’anomalie microcirculatoire contribueraient à la plus grande susceptibilité de la TNO aux altérations glaucomateuses, notamment aux fluctuations pressionnelles (voir chapitre 8-IV) [51]. L’hypothèse du rôle des facteurs génétiques et épigénétiques impliqués dans la structure du collagène est en plein développement [68] (fig. 10-27).
L’analyse biomicroscopique et paraclinique de la papille des patients myopes forts reste difficile du fait de la conformation anatomique souvent dysmorphique (dysversion, atrophie péripapillaire, conus et staphylome myopique, etc.) (voir chapitre 13-IV) [16].
En pratique, la myopie représente un facteur de risque de GPAO globalement multiplié par trois. Le dépistage du glaucome doit être systématique chez les sujets myopes, surtout en cas de myopie forte qu’il ne faudra pas hésiter à traiter dès que la PIO atteint 20 mmHg, en visant des niveaux de PIO cible plus bas que pour les patients emmétropes.
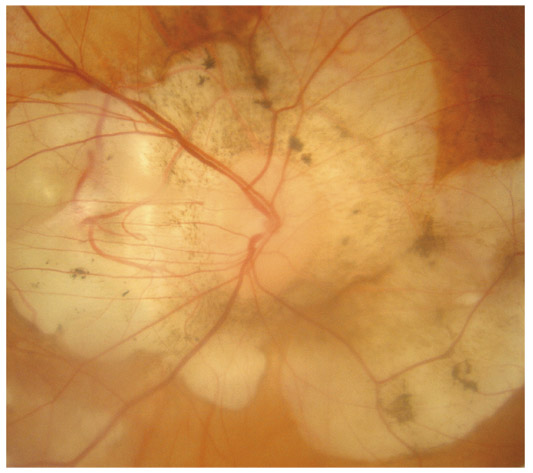
Fig. 10-27 Myopie forte.
S’il est bien acquis qu’une cornée mince sous-estime les valeurs de la PIO mesurées en pratique par la tonométrie de Goldmann ou à jet d’air, majorant ainsi le risque de ne pas dépister à temps un glaucome hypertensif du fait d’une cornée mince, il n’est pas formellement acquis qu’une cornée fine soit un FDR de survenue ou de progression d’un GPAO, comme le prouve la profusion de publications contradictoires à ce sujet [10, 13, 23, 51, 62, 113].
La difficulté à démontrer que l’ECC est un FDR indépendant de glaucome tient entre autres au fait que l’ECC et la PIO sont deux paramètres très intimement liés. Dans une étude française, Sellem [94] n’a pas mis en évidence de différence statistique entre l’épaisseur cornéenne de patients glaucomateux (554 ± 37 μm) par rapport à des individus sains (566 ± 31 μm). Plusieurs études ont rapporté des résultats similaires [13, 32, 48, 95].
La question qui sous-tend la démarche visant à valider ou invalider une corrélation entre ECC et survenue ou aggravation du glaucome est la suivante : une cornée fine serait-elle le reflet d’une fragilité oculaire particulière prédisposant à l’atteinte glaucomateuse ? Si la question est posée, les réponses sont à venir avec toutefois quelques pistes du côté de la génétique. Il pourrait en effet exister des associations entre la survenue de certains GPAO et la mutation de gènes impliqués dans le métabolisme du collagène du stroma cornéen chez des patients aux cornées fines. La mutation du gène COL8A2 serait impliquée dans l’augmentation de la prévalence du glaucome ; cette mutation a été observée chez un groupe de patients glaucomateux caucasiens ayant une pachymétrie faible (voir chapitre 8-IV) [29].
Une récente étude rétrospective chez 153 glaucomateux suivis en moyenne cinq ans a retrouvé une corrélation entre l’ECC et l’hystérèse cornéenne, montrant qu’une cornée fine avec une hystérèse abaissée était un FDR de progression du glaucome [26]. En revanche, aucune étude n’a mis en évidence de corrélation entre une ECC fine et des paramètres anatomiques susceptibles de modifications dans le cadre de la pathologie glaucomateuse, comme l’épaisseur de la sclère péripapillaire ou celle de la lame criblée [51].
Des variations de l’ECC sont connues d’une ethnie à l’autre. Les patients caucasiens présentent des ECC supérieures à celles des patients mélanodermes (respectivement 544,7 ± 31 μm et 524,8 ± 38,4 μm). Si l’ECC des patients latino-américains est supérieure à celle des Caucasiens (ECC : 563,6 ± 29,1 μm) elle est très variable chez les Asiatiques (Chinois : 569,5 ± 31,8 μm, Japonais : 538,5 ± 29,4 μm, Philippins : 559 ± 24,9 μm) [31].
Ces études prouvent l’importance de la mesure de l’ECC chez tout patient suspect de glaucome ou glaucomateux avéré. En cas de cornée fine, la vigilance doit être accrue lors du dépistage et tout au long du suivi, ne serait-ce que parce qu’une PIO sous-estimée risquerait d’être faussement rassurante.
Un DO de grande taille, plus vulnérable au stress mécanique, serait un FDR de GPAO chez les Européens [44] comme chez les Africains [86]. Ces derniers, à taille de DO équivalente, auraient une plus faible quantité de FNR que les autres ethnies, et cumuleraient ainsi deux facteurs potentiels de vulnérabilité papillaire [104] (fig. 10-28).
Fig. 10-28 Grand disque optique et grande excavation.
Dans de nombreuses études, une grande excavation papillaire, pondérée par la taille du DO, est considérée comme un FDR de GPAO [117]. L’excavation papillaire semble avoir un caractère familial. Les données de la récente méta-analyse de 2013 rapportent à ce sujet un certain nombre d’éléments intéressants :
-
un rapport de l’excavation (C/D) supérieur ou égal à 0,7 était le seuil évalué dans la plupart des études. Les patients dont le C/D était supérieur avaient un risque probable positif global de 14 (IC95 % : 5,3-39) ;
-
une asymétrie du rapport C/D supérieur ou égal à 0,3 était le facteur le plus fréquemment rapporté avec une probabilité de glaucome nettement augmentée [49].
L’atrophie péripapillaire est un FDR de prévalence de GPAO, et son extension un FDR de progression du glaucome, notamment en cas de glaucome à pression normale (GPN), avec une correspondance topographique entre l’atrophie péripapillaire, les altérations papillaires et celles du champ visuel [2, 52, 83].
Étroitement corrélées à la perte en FNR, elles sont trois fois plus fréquentes lorsque le glaucome progresse et doivent donc être considérées comme un FDR d’aggravation du GPAO [109], notamment du GPN. Une étude prospective suédoise, avec un suivi de dix ans [8], rapporte qu’un DO suspect par sa taille ou une asymétrie de son excavation ou encore par la présence d’hémorragies péripapillaires, est associé à un risque de glaucome multiplié par 2,9 (IC95 % : 1,34-6,30).
Elles correspondent à une perte localisée de l’anneau neurorétinien et à la disparition de la lame criblée, et sont plus souvent localisées dans la partie inférieure du DO avec généralement une atteinte périmétrique paracentrale. Plus fréquentes en cas de GPN que de GPAO, elles représentent un FDR de progression du glaucome [103] (fig. 10-29).
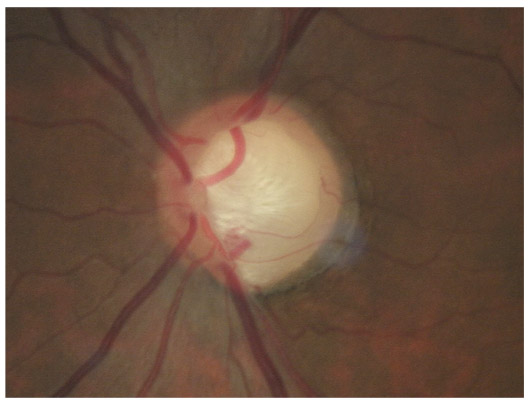
Fig. 10-29 Fossette colobomateuse acquise.
La pression de perfusion oculaire moyenne (PPOM) dépend de la PIO ainsi que de la pression artérielle moyenne (PAM) qui elle-même dépend de la pression artérielle systolique (PAS) et diastolique (PAD :
PPOM = 2/3PAM – PIO
PAM = PAD + (PAS – PAD)/3
Si la baisse du flux sanguin oculaire (FSO) est incriminée dans la physiopathogénie de la neuropathie glaucomateuse, l’impossibilité de mesurer ce flux en pratique courante explique qu’aucune étude épidémiologique n’ait pu évaluer son rôle dans la survenue ou la progression du GPAO.
Une baisse du FSO s’explique soit par une baisse des pressions de perfusion (baisse de la tension artérielle ou élévation de la PIO), soit par une augmentation des résistances vasculaires (lésion vasculaire organique, vasospasme, élévation de la viscosité sanguine locale), soit par une défaillance de l’autorégulation locale (sujets âgés, hypertendus artériels, diabétiques, certains glaucomateux, syndrome de dysrégulation vasculaire notamment en cas de GPN.
De nombreuses études épidémiologiques ont montré qu’un abaissement des pressions de perfusion, notamment diastoliques (différence entre la PAD et la PIO), est un FDR de prévalence, d’incidence et de progression du GPAO [50], avec un risque global multiplié par 3,2 pour des pressions de perfusion inférieures à 55 mmHg (IC95 % : 1,6-6,6) et multiplié par six pour des pressions de perfusion diastoliques inférieures à 30 mmHg [11, 50, 62, 63, 72, 102, 118].
L’hypotension artérielle surtout diastolique est associée à une augmentation de la prévalence du GPAO dans la population Latinos [75].
L’hypotension artérielle systolique (< 125 mmHg) est associée au risque de progression à huit ans des glaucomes nouvellement diagnostiqués selon les résultats de l’étude EMGT [62].
L’hypotension artérielle nocturne, qui définit les sujets dits « overdippers » (baisse de plus de 20 % de la pression artérielle la nuit), est un FDR de progression du GPAO, particulièrement du GPN [20, 62, 79].
Cause d’abaissement du FSO, elle s’explique par une atteinte vasculaire athéroscléreuse, un vasospasme ou une hyperviscosité sanguine :
-
l’athérosclérose peut aboutir à une sténose carotidienne qu’il faut rechercher chez tout patient glaucomateux lorsque la neuropathie s’aggrave ou est très asymétrique ;
-
le vasospasme fonctionnel, vasoconstriction anorganique réversible, témoin d’une dysrégulation vasculaire (migraine, extrémités froides, syndrome de Raynaud, angor instable de Prinzmetal), a été retrouvé associé au glaucome dans certaines études. L’existence d’un vasospasme dans la circulation choroïdienne et dans celle du nerf optique a été confirmée par angiographie, et l’hypothèse que le syndrome vasospastique puisse être un FDR de glaucome a été soulevée [81]. Une étude prospective canadienne a rapporté que le vasospasme (mesuré objectivement) pourrait être un FDR de progression des déficits périmétriques chez les GPAO ayant des PIO normalisées [17] ;
-
l’hyperviscosité sanguine. Plusieurs études ont rapporté chez les GPAO comme chez les GPN une hyperviscosité sanguine par hyperagrégabilité érythrocytaire et/ou diminution de la déformabilité érythrocytaire [18, 42]. Hamard et al. [42] ont montré que l’hyperagrégabilité érythrocytaire retrouvée chez les GPAO et les GPN est contemporaine d’une réduction significative des vitesses circulatoires dans le réseau capillaire de la TNO. Le rôle de ces anomalies dans la survenue ou la progression du glaucome reste à déterminer.
Plusieurs études rapportent une relation significative entre HTA et prévalence du GPA, non retrouvée par d’autres auteurs [49]. L’étude de Baltimore [102] fut la première à rapporter que les jeunes hypertendus artériels étaient moins susceptibles de développer un GPAO que les sujets hypertendus plus âgés. Ainsi, sur un réseau circulatoire encore préservé, l’HTA pourrait contrecarrer l’effet néfaste de l’HTO sur le flux sanguin dans le réseau microcirculatoire en augmentant les pressions de perfusion. A contrario, une HTA de longue durée favorise des altérations vasculaires par le biais de l’athérosclérose, une augmentation des résistances vasculaires, une perte de l’autorégulation locale, et donc une baisse du FSO qui peut favoriser le développement de la neuropathie glaucomateuse. Le rôle de la tension artérielle ne doit donc pas être évalué isolément, mais considéré en fonction de son retentissement potentiel sur le FSO. On peut ainsi comprendre que si une HTA de longue durée est susceptible d’augmenter le risque de glaucome par les lésions vasculaires qu’elle induit, une tension artérielle basse contemporaine d’une élévation de la PIO peut également aboutir à une diminution de la pression de perfusion et augmenter le risque de glaucome.
Les résultats sont controversés concernant la corrélation entre maladies cardiovasculaires et glaucome. En revanche, les antécédents de pathologie cardiovasculaire seraient un FDR de progression chez les GPAO ayant une PIO élevée au moment du diagnostic et suivis en moyenne huit ans [62].
L’étude française « Une vision si précieuse » portant sur un effectif de 4 210 patients glaucomateux (3 263 GPAO, 847 HTO, 100 GPN) retrouve des différences significatives entre les glaucomateux bien contrôlés et ceux qui ne le sont pas, en ce qui concerne l’incidence de cinq facteurs de risque vasculaire : l’HTA traitée, une maladie cardiovasculaire suivie et traitée, l’hypotension artérielle diagnostiquée et traitée, l’existence d’un syndrome vasospastique, et de mains froides ou de céphalées. Les FDR vasculaires sont en effet plus fréquents chez les patients dont le glaucome est mal contrôlé, mais également chez ceux dont le glaucome continue d’évoluer malgré une PIO cible atteinte. La présence d’une maladie cardiovasculaire est retrouvée chez 17 % de l’ensemble des patients (20 % des GPAO, 10 % des HTO et 30 % des GPN). Chez les patients suivis pour une maladie cardiovasculaire, on retrouve beaucoup plus de GPAO que chez les patients sans maladie cardiovasculaire connue. Les patients atteints de maladie cardiovasculaire présentent par ailleurs un plus grand nombre d’autres facteurs de risque vasculaire associés : HTA traitée, hypercholestérolémie, diabète traité, mains froides. L’analyse rapporte également un plus grand nombre de glaucomes non contrôlés dans le groupe de patients suivis pour maladie cardiovasculaire.
Une HTA traitée mal contrôlée, une hypotension artérielle diagnostiquée et la présence d’une maladie cardiovasculaire sont les principaux facteurs de risque retrouvés chez les patients atteints de GPAO non contrôlés dans cette étude.
Dans l’HTA même traitée, à l’augmentation initiale du FSO succède une augmentation des résistances périphériques. Celle-ci est à l’origine de lésions microvasculaires et ischémiques survenant sur un terrain où l’autorégulation de la perfusion ciliaire postérieure du nerf optique est déjà altérée avec l’âge, expliquant une plus grande vulnérabilité vis-à-vis de la PIO. On retrouve d’ailleurs plus de FDR vasculaires chez les patients dont le glaucome est mal contrôlé, mais aussi lorsque la PIO cible est atteinte et que le glaucome continue à évoluer [90].
Au total, les FDR vasculaires sont à rechercher chez tout patient glaucomateux tout au long de sa vie, notamment lorsque le glaucome s’aggrave malgré des PIO normalisées, en insistant sur la réalisation d’un bilan cardiovasculaire pour repérer les risques d’hypotension artérielle, notamment en cas d’HTA traitée et de vasospasme.
Durant le sommeil, des phénomènes d’autorégulation cardiovasculaire maintiennent une pression de perfusion oculaire normale. Dans le syndrome d’apnée du sommeil, cette régulation physiologique est dépassée [36]. Le syndrome d’apnée obstructif du sommeil (SAOS), FDR de prévalence et de progression du GPAO, concerne 20 à 50 % des glaucomes selon les études, notamment en cas de GPN [10, 76, 80], alors qu’il s’observe chez 2 à 5 % de la population générale [10, 64, 65, 75].
Cliniquement, le syndrome d’apnée du sommeil se caractérise par des épisodes nocturnes répétés d’obstruction des voies aériennes supérieures et des endormissements diurnes. L’obstruction des voies aériennes supérieures est exacerbée par une langue large, un petit tractus respiratoire, un cou large et l’obésité, sources de ronflements nocturnes, de fatigue au réveil (traduisant un sommeil de mauvaise qualité), de céphalées matinales, de troubles de la concentration, de pertes de mémoire, voire d’un état dépressif. Le SAOS corrélé à plusieurs affections oculaires dont le GPAO (neuropathie optique ischémique antérieure, choriorétinopathie séreuse centrale, etc.) génère des épisodes d’hypoxie et une augmentation des résistances vasculaires qui peuvent compromettre l’oxygénation et le flux sanguin de la tête du nerf optique [34]. Non traité, il expose à terme à un certain nombre de complications cardiovasculaires.
L’enregistrement polysomnographique nocturne permet d’évaluer son importance et la nécessité de sa prise en charge.
En pratique, la recherche d’un SAOS doit être systématique chez tout patient atteint de GPAO lors de l’évaluation des antécédents (recherche de ronflements nocturnes, de somnolence diurne), a fortiori en cas de glaucome évolutif malgré un bon contrôle des autres FDR.
Les résultats de différentes études épidémiologiques sont contradictoires [21, 27, 61, 74]. Plus la durée du diabète est longue, plus le risque de développer un glaucome augmente [21]. La surveillance régulière des patients diabétiques dans le cadre du dépistage de la rétinopathie diabétique peut également expliquer qu’un glaucome soit plus fréquemment dépisté que dans les populations non diabétiques (fig. 10-30).
L’étude de Sato et al. [92] montre que l’augmentation du niveau de glucose dans l’humeur aqueuse chez les patients diabétiques pourrait augmenter la synthèse de fibronectine et son accumulation au niveau du trabéculum. Pasquale et al. [83] ont relevé une corrélation entre l’hémoglobine glyquée et l’élévation de la PIO, et ont supposé que la glycosylation des protéines de la matrice extracellulaire trabéculaire peut réduire l’écoulement de l’humeur aqueuse chez des patients atteints de diabète de type 2. Si le diabète peut donc être un FDR d’HTO, les relations entre diabète et GPAO restent l’objet de controverses dans les plus récentes analyses [19].
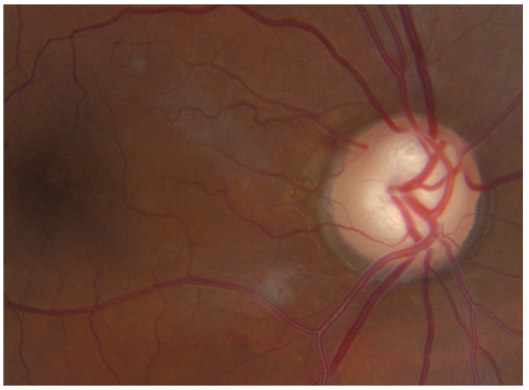
Fig. 10-30 Rétinopathie diabétique et GPAO.
Si l’hypothyroïdie peut favoriser le dépôt de mucopolysaccharides dans le trabéculum et donc induire une élévation de la PIO, l’hypothyroïdie en tant que FDR de GPAO reste là encore une hypothèse controversée. Une récente étude rétrospective suggère le rôle protecteur des hormones thyroïdiennes en montrant que si le risque de développer un GPAO dans les cinq ans qui suivent le diagnostic d’une hypothyroïdie est multiplié par 1,78, ce risque diminue significativement lorsque l’hypothyroïdie est traitée [66].
Plusieurs études rapportent une diminution de la pression du liquide céphalorachidien (LCR) chez certains glaucomateux, notamment les GPN, alors qu’elle serait plutôt augmentée dans les HTO. Par ailleurs, la lame criblée serait moins épaisse chez les GPAO et chez les GPN associés à des hémorragies du DO [82]. Ces résultats soulèvent l’hypothèse d’une élévation du gradient de pression translaminaire chez les GPAO [défini par le rapport (PIO – pression du LCR)/épaisseur de la lame criblée] [9] qui pourrait altérer le flux axoplasmique et celui des vaisseaux traversant la lame criblée. Si ces données se confirment, la pression du LCR et les particularités anatomiques de la lame criblée pourraient devenir des FDR de glaucome au même titre que la PIO.
Nos connaissances dans le domaine de la physiopathogénie du GPAO ont nettement progressé ces dernières années (voir chapitre 8-IV). Si elles permettent de mieux comprendre le rôle et le déterminisme de FDR connus (âge, antécédents familiaux, facteurs oculaires, etc.), leurs nouvelles données mettent en exergue un certain nombre de facteurs jusqu’alors mal connus ou insoupçonnés. Ils doivent maintenant être recherchés pour une meilleure prise en charge des patients, d’autant plus qu’un certain nombre d’entre eux est contrôlable.
Un certain nombre de facteurs communs à ceux d’autres maladies neurodégénératives, comme la maladie d’Alzheimer ou la maladie de Parkinson, ont été plus récemment évoqués parmi les FDR du GPAO.
L’étude Photograf réalisée en France, concernant l’évaluation des FDR connus et potentiels différenciant les patients atteints de GPAO de ceux suivis pour une HTO, est la première étude rapportant l’utilisation des pesticides en tant que facteur plus fréquemment associé au glaucome. Réalisée à l’échelon national avec la collaboration d’épidémiologistes, un de ses buts principaux a été d’évaluer plus spécifiquement les FDR associés aux expositions neurodégénératives dans le glaucome chez 339 GPAO et 339 HTO appariés selon l’âge (m ≅ 63,5 ± 10 ans), le sexe et la durée de suivi de l’affection (76,4 ± 63 mois). Les résultats rapportent que l’exposition professionnelle aux pesticides est associée de façon significative au GPAO (OR : 2,65 ; IC : 1,04-6,78). La majorité concerne essentiellement des expositions à des insecticides, des herbicides et des fongicides. Dans cette étude, la durée moyenne d’utilisation des pesticides durant la vie professionnelle, principalement observée chez les sujets travaillant dans le milieu agricole, était de 23,9 ± 12,3 ans [81]. Comme pour la majorité des études concernant les pesticides, les patients atteints de GPAO dans l’étude française ne se souvenaient pas du type de pesticides utilisé, et l’association avec un agent chimique spécifique n’a pas été possible [89] (voir tableau 10-1).
Il est maintenant bien reconnu que les pesticides sont des FDR des maladies neurodégénératives cérébrales [116]. Un certain nombre d’études épidémiologiques retrouvent une association entre l’exposition professionnelle aux pesticides et un risque augmenté d’autres maladies neurodégénératives, comme la maladie d’Alzheimer ou la maladie de Parkinson [4, 5, 33, 91] (fig. 10-31).
Ces données ont été plus récemment confirmées par une étude prospective réalisée en milieu bordelais chez 614 vignerons exposés aux pesticides [6]. Une étude chez 5 092 agriculteurs de l’Utah (États-Unis) rapporte également que l’utilisation de pesticides augmente le risque de démence (OR : 1,38 ; IC : 1,09-1,76), et notamment le risque de maladie d’Alzheimer (OR : 1,42 ; IC : 1,06-1,96) [43].
L’étude de cohorte ALIENOR, réalisée en France sur 812 participants, indemnes de démence à l’inclusion, retrouve que les patients développant une démence (41 patients), après trois ans de suivi, présentent statistiquement plus de GPAO (7/41 patients, soit 17 %) [46].
Enfin, différents biomarqueurs de la maladie d’Alzheimer (protéine TAU phosphorylée, protéine amyloïde bêta) ont été rapportés chez les patients glaucomateux (rétine, vitré et LCR) (voir chapitre 8-IV) [47, 78, 115].
Si les preuves d’un lien étroit entre maladie d’Alzheimer et GPAO s’accumulent, le partage et la reconnaissance de l’exposition aux pesticides en tant que FDR du glaucome sont plus récents et doivent donc désormais faire partie des facteurs à rechercher dans le cadre du bilan de tout patient glaucomateux.

Fig. 10-31 Pulvérisation de pesticides. (Copyright Fotolia.)
Plusieurs études, réalisées dans différents pays industrialisés (Angleterre, Canada, Europe du Nord, etc.), ont montré que la découverte du GPAO au sein de classes sociales à niveau socio-économique bas se fait à des stades cliniques évolués du glaucome et à un âge plus avancé [15, 35, 97, 106]. Plusieurs hypothèses sont proposées pour expliquer ce retard : faible niveau socioculturel avec peu de connaissance de cette pathologie, éloignement géographique des centres d’ophtalmologie, pathologies générales qui sont prioritairement traitées, problèmes économiques de prise en charge thérapeutique.
Ces récentes études viennent souligner la relation entre les formes cliniques avancées du GPAO avec un risque de cécité et le niveau socio-économique défavorisé, sans que l’âge soit toujours retrouvé en tant que facteur associé dans toutes ces études.
Elles rapportent également la faible fréquence, voire l’absence, de campagne de dépistage au sein de ces groupes sociaux, et donc l’importance de considérer le niveau socio-économique en tant que FDR.
L’étude Photograf, avec l’objectif d’analyser les associations potentielles des différents facteurs liés au mode de vie et aux expositions professionnelles au sein d’un échantillon de toutes les classes socioprofessionnelles, rapporte qu’un plus grand nombre de patients suivis pour un GPAO avait exercé une activité professionnelle en milieu agricole. La catégorie socioprofessionnelle des agriculteurs est significativement plus fréquente au sein du groupe des sujets glaucomateux GPAO (OR : 2,57 ; IC : 1,26-5,25). Ce facteur, après ajustement en fonction de l’âge, du sexe et de la durée de l’affection, est proportionnel à la durée pendant laquelle cette activité est exercée, et il n’a pas été mis en évidence de lien direct avec une exposition professionnelle particulière [89].
Le rôle des graisses alimentaires dans le GPAO est difficile à mettre en évidence chez l’homme. Le rôle protecteur ou délétère des omégas 3, des omégas 6, des acides gras mono- et poly-insaturés sur la survenue du glaucome est difficile à préciser chez l’homme en raison des régimes variés et du faible recueil des données. Si aucune différence significative sur le risque de GPAO n’a été mise en évidence entre les différents régimes (lipides totaux, graisses saturées, graisses mono- ou poly-insaturées), il semble que la consommation en omégas 3 et 6 soit plus faible chez les patients atteints de GPAO [89].
L’étude Photograf avait également pour objectif d’évaluer les associations potentielles du GPAO avec le mode de vie des patients, en particulier le régime alimentaire en acide gras oméga 3 ainsi que l’utilisation de compléments alimentaires, la consommation de tabac et d’alcool. Un questionnaire détaillé élaboré avec la collaboration de nutritionnistes a permis de préciser la fréquence de la consommation des différents aliments chez les 339 patients ayant un GPAO, et de la comparer avec celle relevée au sein du groupe témoin de 339 patients ayant une HTO isolée, appariés selon l’âge, le sexe et l’ancienneté de l’affection.
Le questionnaire spécifiquement développé pour l’étude comportait des questions sur l’usage quantitatif et préférentiel de certaines huiles et matières grasses riches en omégas 3 et 6 et en acides gras mono-insaturés.
La plus faible consommation de poissons gras (inférieure à une fois par semaine) chez les patients atteints de GPAO, suivis en moyenne depuis sept ans, était significative (OR : 2,14 ; IC95 % : 1,10-4,17), ainsi que la plus faible consommation de noix (moins de huit fois par an) (OR : 2,02 ; IC95 % : 1,18-3,47). L’analyse de la consommation des différents autres types d’huiles (oméga 6) et de poissons blancs ne montrait pas de différence significative avec le groupe témoin suivi pour HTO [89].
Ces résultats suggèrent un rôle protecteur potentiel des acides gras poly-insaturés oméga 3 dans le GPAO qui pourrait être expliqué par leur effet vasculaire et neuroprotecteur. De fortes concentrations plasmatiques et un régime riche en oméga 3 ont été associés à une réduction du risque de maladie d’Alzheimer, et pourraient partager un mécanisme commun avec le glaucome [25, 112]. Les omégas 3 ont également une fonction structurale et protectrice dans la rétine et ont été associés à un risque réduit de dégénérescence maculaire liée à l’âge [28, 73]. En fait, c’est le rapport oméga 6/oméga 3 qui semble le plus important et qui, selon les recommandations de l’AFSSA, devrait être proche de cinq, c’est-à-dire que l’alimentation devrait apporter cinq molécules d’oméga 6 pour une d’oméga 3 – rapport qui est toutefois souvent plus élevé (favorisant l’obésité). Des études sont encore nécessaires pour une meilleure évaluation de la consommation des différents types d’acides gras (fig. 10-32).
Au total, on peut retenir qu’il semblerait qu’un apport nutritif suffisant en acides gras poly-insaturés de type oméga 3 permettrait de diminuer l’incidence du GPAO. Ces données sont en accord avec l’effet protecteur des acides gras pour les maladies cardiovasculaires [59] et neurodégénératives [3] avec lesquelles le glaucome partage des similitudes physiopathogéniques [89].

Fig. 10-32 Aliments riches en oméga 3.
Ils semblent également jouer un rôle dans la pathogénie du GPAO [60]. Une analyse récente du taux plasmatique des antioxydants rapporte une corrélation directe de son abaissement avec la sévérité du glaucome indépendante du niveau de la PIO et du traitement [1].
Dans une étude multicentrique chez 1 155 femmes comptant 95 GPAO souffrant d’ostéoporose, il semblerait qu’un régime alimentaire riche en fruits, légumes verts, vitamines B2 et A serait associé à un plus faible risque de glaucome [22]. Une plus récente analyse dans la même population féminine de race noire et chez 77 GPAO rapporte l’intérêt d’une consommation de fruits et légumes riches en vitamines A et C et caroténoïdes [37]. Cependant, Kang et al. [54], dans une étude prospective, n’ont pas mis en évidence de relation significative entre la consommation de caroténoïdes, vitamine C, vitamine E ou consommation de fruits et légumes riches en antioxydants et le risque de développer un GPAO. D’autres études à niveau de preuve plus élevé sont encore nécessaires pour établir une éventuelle relation du GPAO avec la consommation d’antioxydants.
Il est controversé, car les études cliniques montrent des résultats disparates. Dans une large étude chinoise portant sur 2 945 patients, la prévalence du glaucome chez ceux ayant une hypercholestérolémie était identique à celle des sujets n’ayant pas d’hypercholestérolémie (32/1 332 soit 2,4 %, versus 39/1 619 soit 2,4 %) [108].
Le tabac, également rapporté comme facteur de risque de glaucome, reste discuté. Ce facteur a, en effet, été évalué dans plusieurs études avec des résultats variables.
Les études avec un recueil des données sur le mode déclaratif, sans prise en compte de la quantité en paquets-année (PA), ne mettent pas de lien en évidence [57, 85]. À l’inverse, si les données quantitatives en nombre de PA sont précisées, les études rapportent une augmentation du risque, notamment pour les tabagismes importants.
L’étude Photograf isole le fait qu’un tabagisme actif important, supérieur à 40 PA, multiplie par quatre le risque de développer un glaucome (OR : 3,87 ; IC : 1,41-10,59) [89]. Ce risque est multiplié par deux chez des femmes mélanodermes américaines de moins de 50 ans ayant un tabagisme actif supérieur à 20 PA (= 1 paquet de cigarettes par jour pendant 20 ans) (OR : 2,26 ; IC : 1,05-4,84) [110].
De nombreuses études sur l’alcool et le GPAO ne rapportent pas d’association, mais il s’agissait d’études cas-témoins [57, 85]. Une étude prospective récente retrouve une association significative entre la consommation chronique d’alcool et le GPAO (RR : 1,35 ; IC : 1,05-1,73). Entre 10 et 60 grammes d’alcool par semaine (soit un à six verres de vin rouge de 12 cL), le risque relatif est de 1,28 (IC : 1,01-1,62). Pour les patients buvant plus de 70 grammes (sept verres) par semaine, le risque est multiplié par 1,60 (IC : 1,06-2,43) [110].
À l’inverse, certaines études plus anciennes mettent en évidence une diminution transitoire de la PIO avec la prise d’alcool (diminution en moyenne de 1 à 6 mmHg qui serait liée à une diminution de la sécrétion d’humeur aqueuse) [96]. Fondée sur ces résultats, une étude prospective de grande échelle conduite en 2007 [55] a suivi pendant plus de 20 ans une cohorte de patients (femmes et hommes professionnels de santé) âgés de plus de 40 ans, non porteurs de glaucome initialement. Les patients remplissaient un questionnaire tous les deux ans, avec des informations concernant leur consommation d’alcool et la découverte ou non de GPAO (diagnostic confirmé par la relecture des examens médicaux). Cette étude ne rapporte pas de modification du risque de GPAO pour les consommations d’alcool de moins de 30 g/j (représentant moins de trois verres de vin de 12 cL), et même une tendance à un effet protecteur de la consommation d’alcool de plus de 30 g/j (RR : 0,71 ; IC95 % : 0,49-1,04) ! Cependant aucun résultat n’était statistiquement significatif…
Les statines à visée hypolipémiante auraient un effet protecteur avec une efficacité pour la stabilisation de la progression des altérations campimétriques chez des patients présentant un GPN. Dans cette population glaucomateuse où les facteurs vasculaires jouent un rôle important, le risque de progression serait divisé par trois (OR : 0,36 ; IC : 0,14-0,91) [108]. Un effet protecteur de l’utilisation des statines a été rapporté avec une diminution de la prévalence du GPAO d’un tiers (OR : 0,60 ; IC : 0,39-0,92) chez les patients traités par statines sur une durée prolongée, supérieure à deux ans [71].
Si les bêtabloquants prescrits par voie systémique et les inhibiteurs du système rénine-angiotensine (antagonistes de l’angiotensine 2) peuvent entraîner une diminution relative de la PIO, on n’a jamais démontré d’association significative entre l’utilisation de ces antihypertenseurs et le GPAO. Il en est de même pour les inhibiteurs calciques.
Seule l’utilisation de diurétiques thiazidiques a été associée au risque de GPAO dans l’étude EGPS [40].
La corticothérapie par voie locale, locorégionale et par voie générale au long cours reste un FDR d’élévation de la PIO, voire un facteur causal de GPAO.
Une contraception orale prise depuis trois ans et au-delà multiplierait le risque de GPAO par 2,05 selon la NHANES (National Health and Nutrition Examination Survey) qui a suivi 3 406 femmes de 40 ans pendant au moins trois ans. Des études précédentes avaient rapporté que les œstrogènes pouvaient jouer un rôle significatif dans la pathogenèse du glaucome [84, 107].
Les sports tels que la marche, le jogging ou le vélo diminuent la PIO, et donc le risque de GPAO [87]. Les personnes ayant une activité physique quotidienne professionnelle ou occupationnelle intense (plus d’une heure) ont moins de risque d’avoir de basses pressions de perfusion oculaire, notamment diastoliques – qui sont des FDR de GPAO –, que celles dont l’activité est inexistante ou modeste (moins d’une heure) [114]. Une pratique sportive régulière pourrait donc s’avérer être un facteur protecteur contre le risque de GPAO.
Une étude italienne chez 50 patients atteints de GPAO a évalué l’anxiété des patients, par un questionnaire distinguant leur personnalité en type A (patients hyperactifs, anxieux, irritables, très investis professionnellement) ou en type B (patient détendu, amical, avec un équilibre professionnel et une vie familiale). La majorité, 30 patients (64 %), présentait une personnalité de type A, avec une anxiété statistiquement plus élevée. Chez ces patients, l’altération du champ visuel était statistiquement plus importante (p = 0,001) [14].
La relation entre la caféine et la PIO a également été étudiée avec des résultats divergents : certaines rapportent une augmentation modérée (2 mmHg) mais significative de la PIO, non retrouvée par d’autres [96]. Une étude prospective plus récente chez 79 120 femmes et 42 052 hommes ne retrouve pas d’association nette entre la consommation de café et l’élévation de la PIO, excepté peut-être en cas de consommation importante (supérieure à cinq tasses par jour – OR : 1,61 ; IC95 % : 1-2,59) et en cas d’antécédents de GPAO, avec la nécessité d’une confirmation de ces résultats, que précisent les auteurs [56].
Si certaines études anciennes suggèrent que l’héroïne et le cannabis diminuent temporairement la PIO, nous ne disposons pas à ce jour de données permettant de confirmer ou d’infirmer cette assertion [96].
Certaines activités comme la pratique de l’altérophilie [105] ou celle d’un instrument à vent [93] sont responsables d’une élévation de la PIO et pourraient donc être des FDR de progression du glaucome. Cette conclusion mérite d’être tempérée si l’on considère que le principal FDR est la PPOM qui dépend de la PIO et des PAS et PAD, comme nous l’avons vu précédemment (voir plus haut « Baisse du flux sanguin oculaire »).
Si la PIO augmente lors de l’effort, il est également possible que la PPOM soit maintenue par une augmentation conjointe de la PAM. L’augmentation de la PIO, lors de l’effort, maintiendrait alors une PPOM stable et aurait donc un rôle protecteur [53].
Cependant, des études récentes suggèrent que la pression translaminaire (définie par la PIO moins la pression intracérébrale) est impliquée dans la physiopathologie du GPAO. L’augmentation de la pression intracérébrale lors des activités sus-citées pourrait expliquer une aggravation du GPAO en diminuant cette pression translaminaire [96].
La tenue vestimentaire influence également la PIO : un col serré entraîne une augmentation de la PIO tant chez les sujets sains que chez les sujets ayant un GPAO. L’évaluation de l’impact sur le développement du GPAO de cette ascension pressionnelle reste difficile à évaluer ! [100, 101]
Lors de la pratique du yoga, la PIO double lors d’une posture inverse pour revenir dans les minutes suivantes à la normale. Cependant, aucune augmentation du risque de glaucome n’a été retrouvée chez les pratiquants ! [7]
La position de la tête et du corps entraîne des variations de la PIO chez les sujets sains. La pression minimale est retrouvée en position assise avec la tête en position neutre, et la variation maximale est mesurée en décubitus latéral [69, 111]. Cette notion est importante à connaître car, lors de l’examen clinique, les mesures de la PIO se font dans des conditions optimales où elle est la plus basse.
Une étude récente, parue en avril 2013, a étudié l’effet du décubitus latéral sur la PIO chez des patients présentant un glaucome asymétrique. Chez les 49 patients inclus avec une atteinte asymétrique du champ visuel, la PIO des 98 yeux a été mesurée au tonomètre dans différentes positions : assis, couché sur le dos, en décubitus latéral droit et en décubitus latéral gauche. Un questionnaire portant sur la position préférentiellement prise pendant la nuit était également remis au patient. La position préférentielle était le décubitus latéral pour 75 % des sujets. En position assise, la PIO de l’œil le plus atteint ne diffère pas de celle de l’autre l’œil. En supination, la pression de l’œil le plus atteint est plus élevée que l’autre l’œil. En décubitus latéral, la PIO de l’œil le plus proche du lit augmente en moyenne de 1,6 mmHg par rapport à l’autre œil.
Le côté du décubitus latéral choisi était dans 75,5 % des cas le côté de l’œil le plus atteint. Le décubitus latéral est donc corrélé à une augmentation de la PIO, et cette augmentation est plus importante sur l’œil le plus atteint dans les glaucomes asymétriques [58].
Ainsi, si certaines pratiques telles que l’haltérophilie, la pratique d’un instrument à vent, ou la position de la tête comme dans le yoga influent sur la PIO, considérer cette variation de PIO en tant que FDR de GPAO reste à démontrer.
Pour conclure, les principaux facteurs de risque sont résumés de façon schématique dans un tableau simplifié (tableau 10-2).
Retenir
-
La recherche des différents FDR du GPAO est indispensable aussi bien pour le dépistage des sujets à risque que tout au long du suivi du patient atteint de glaucome.
-
Leur mise en évidence joue un rôle aussi bien dans la décision d’initier un traitement que dans la modification d’un objectif thérapeutique.
-
Les classiques FDR du GPAO doivent être systématiquement considérés : âge, antécédents familiaux de glaucome, ethnie, facteurs oculaires (myopie, facteurs cornéens, etc.).
-
La mesure de l’épaisseur cornéenne centrale est essentielle pour l’interprétation des valeurs de la PIO.
-
Les FDR vasculaires doivent être recherchés chez tout patient glaucomateux tout au long de sa vie, notamment lorsque le glaucome s’aggrave malgré des PIO normalisées, avec la nécessité d’un bilan cardiovasculaire.
-
Le dépistage d’un SAOS doit être systématique chez tout patient atteint de GPAO lors de l’évaluation des antécédents et a fortiori en cas de glaucome évolutif malgré un bon contrôle des autres FDR.
-
La reconnaissance de l’exposition aux pesticides en tant que FDR du glaucome est plus récente et doit désormais faire partie des facteurs à rechercher dans le cadre du bilan.
Enfin, il semble qu’un apport nutritif suffisant en acides gras poly-insaturés de type oméga 3 permettrait de diminuer l’incidence du GPAO.
Tableau 10.2 FDR non pressionnels de conversion d’une HTO vers un GPAO, de survenue et de progression d’un glaucome (en gras : FDR majeurs) – liste non exhaustive.
[1] Abu-Amero KK, Kondkar AA, Mousa A, et al. Decreased total antioxidants in patients with primary open angle glaucoma. Curr Eye Res. 2013 ; 38 : 959-64.
[2] Araie M, Sekine M, Suzuki Y, Koseki N. Factors contributing to the progression of visual field damage in eyes with normal-tension glaucoma. Ophthalmology. 1994 ; 101 : 1440-4.
[3] Arterburn LM, Hall EB, Oken H. Distribution, interconversion, and dose response of n-3 fatty acids in humans. Am J Clin Nutr. 2006 ; 83 (Suppl. 6) : 1467S-1476S.
[4] Baldi I, Cantagrel A, Lebailly P, et al Association between Parkinson’s disease and exposure to pesticides in southwestern France. Neuroepidemiology. 2003 ; 22 : 305-10.
[5] Baldi I, Lebailly P, Mohammed-Brahim B, et al. Neurodegenerative diseases and exposure to pesticides in the elderly. Am J Epidemiol. 2003 ; 157 : 409-14.
[6] Baldi I, Gruber A, Rondeau V. Neurobehavioral effects of long-term exposure to pesticides : results from the 4-year follow-up of the PHYTONER study. Occup Environ Med. 2011 ; 68 : 108-15.
[7] Baskaran M, Raman K, Ramani KK, et al. Intraocular pressure changes and ocular biometry during Sirsasana (headstand posture) in yoga practitioners. Ophthalmology. 2006 ; 113 : 1327-32.
[8] Bengtsson B, Heijl A. A long-term prospective study of risk factors for glaucomatous visual field loss in patients with ocular hypertension. J Glaucoma. 2005 ; 14 : 135-8.
[9] Berdhal JP, Allingham RR. Intracranial pressure and glaucoma. Curr Opin Ophthalmol. 2010 ; 21 : 106-11.
[10] Boland M, Quigley HJ. Risk factors and open-angle glaucoma. Classification and application. J Glaucoma. 2007 ; 16 : 406-18.
[11] Bonomi L, Marchini G, Marrafa M, et al. Vascular risk factors for primary open angle glaucoma : the Egna-Neumarkt Study. Ophthalmology. 2000 ; 107 : 1287-93.
[12] Bron A, Chaine G, Villain M, et al. Risk factors for primary open-angle glaucoma. J Fr Ophtalmol. 2008 ; 31 : 435-44.
[13] Bron AM, Creuzot-Garcher C, Goudeau-Boutillon S, d’Athis P. Falsely elevated intraocular pressure due to increased central corneal thickness. Graefes Arch Clin Exp Ophthalmol. 1999 ; 237 : 220-4.
[14] Bubella RM, Bubella DM, Cillino S. Type A behavior pattern : is it a risk factor for open-angle chronic glaucoma ? J Glaucoma. 2012 [ePub].
[15] Buys YM, Jin YP. Canadian Glaucoma Risk Factor Study Group. Socioeconomic status as a risk factor for late presentation of glaucoma in Canada. Can J Ophthalmol. 2013 ; 48 : 83-7.
[16] Chang RT, Singh K. Myopia and glaucoma : diagnostic and therapeutic challenges. Curr Opin Ophthalmol. 2013 ; 24 : 96-101.
[17] Chauhan BC, Mikelberg FS, Balasi AG, et al. Canadian Glaucoma Study Group. Canadian Glaucoma Study : 2. Risk factors for the progression of open angle glaucoma. Arch Ophthalmol. 2008 ; 126 : 1030-6.
[18] Cheng HC, Chan CM, Yeh SI, et al. The hemorheological mechanisms in normal tension glaucoma. Curr Eye Res. 2011 ; 36 : 647-53.
[19] Chihara E. Myopia and diabetes mellitus as modificatory factors of glaucomatous optic neuropathy. Jpn J Ophthalmol. 2013 [ePub].
[20] Choi J, Kim KH, Jeong J, et al. Circadian fluctuation of mean ocular perfusion pressure is a consistent risk factor for normal-tension glaucoma. Invest Ophthalmol Vis Sci. 2007 ; 48 : 104-11.
[21] Chopra V, Varma R, Francis BA, et al. Type 2 diabetes mellitus and the risk of open-angle glaucoma the Los Angeles Latino Eye Study. Ophthalmology. 2008 ; 115 : 227-32.
[22] Coleman AL, Stone KL, Kodjebacheva G, et al. Glaucoma risk and the consumption of fruits and vegetables among older women in the study of osteoporotic fractures. Am J Ophthalmol. 2008 ; 145 : 1081-9.
[23] Coleman A, Miglior S. Risk Factors for glaucoma onset and progression. Surv Ophthalmol. 2008 ; 53 (Suppl.) : S3-10.
[24] Crowston JG, Lerner SF, He M, et al. Risk factors. In : Weinreb NR et al. (eds). Progression of glaucoma. The 8th consensus report of the WGA. Amsterdam, Kugler Publications, 2011 : 102-16.
[25] Cunnane SC, Plourde M, Pifferi F, et al. Fish, docosahexaenoic acid and Alzheimer’s disease. Prog Lipid Res. 2009 ; 48 : 239-56.
[26] De Moreas CG, Hill V, Tello C, et al. Lower corneal hysteresis is associated with more rapid glaucomatous visual field progression. J Glaucoma. 2012 ; 21 : 209-13.
[27] De Voogd S, Ikram MK, Wolfs RCW, et al. Is diabetes mellitus a risk factor for open-angle glaucoma ? The Rotterdam Study. Ophthalmology. 2006 ; 113 : 1827-31.
[28] Delcourt C, Carriere I, Cristol JP, et al. Dietary fat and the risk of age-related maculopathy : the POLANUT study. Eur J Clin Nutr. 2007 ; 61 : 1341-44.
[29] Desronvil T, Logan-Wyatt D, Abdrabou W, et al. Distribution of COL8A2 and COL8A1 gene variants in Caucasian primary open angle glaucoma patients with thin central corneal thickness. Mol Vis. 2010 ; 16 : 2185-91.
[30] Detry-Morel M. Is myopia a risk factor for glaucoma ? J Fr Ophtalmol. 2011 ; 34 : 392-5.
[31] Dimasi DP, Burdon KP, Craig JE. The genetics of central corneal thickness. Br J Ophthalmol. 2010 ; 94 : 971-6.
[32] Dueker DK, Singh K, Lin SC, et al. Corneal thickness measurement in the management of primary open-angle glaucoma : a report by the American Academy of Ophthalmology. Ophthalmology. 2007 ; 114 : 1779-87.
[33] Elbaz A, Tranchant C. Epidemiologic studies of environmental exposures in Parkinson’s disease. J Neurol Sci. 2007 ; 262 : 37-44.
[34] Faridi O, Park SC, Liebmann JM, Ritch R. Glaucoma and obstructive sleep apnoea syndrome. Clin Exper Ophthalmol. 2012 ; 40 : 408-19.
[35] Fraser S, Bunce C, Wormald R, Brunner E. Deprivation and late presentation of glaucoma : case-control study. BMJ. 2001 ; 322 : 639-43.
[36] Gherghel D, Hosking SL, Orgül S. Autonomic nervous system, circadian rhythms, and primary open-angle glaucoma. Surv Ophthalmol. 2004 ; 49 : 491-508.
[37] Giaconi JA, Yu F, Stone KL, et al. The association of consumption of fruits/vegetables with decreased risk of glaucoma among older African-American women in the study of osteoporotic fractures. Am J Ophthalmol. 2012 ; 154 : 635-44.
[38] Girkin CA, Sample PA, Liebmann JM, et al. ADAGES GroupAfrican Descent and Glaucoma Evaluation Study (ADAGES) : II. Ancestry differences in optic disc, retinal nerve fiber layer, and macular structure in healthy subjects. Arch Ophthalmol. 2010 ; 128 : 541-50.
[39] Gordon MO, Beiser JA, Brandt JD, et al. The Ocular Hypertension Treatment Study : baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 714-20.
[40] Gordon MO, Torri V, Miglior S, et al. Validated prediction model for the development of primary open-angle glaucoma in individuals with ocular hypertension. Ocular Hypertension Treatment Study Group ; European Glaucoma Prevention Study Group. Ophthalmology. 2007 ; 114 : 10-9.
[41] Graham SL, Drance SM. Nocturnal hypotension : role in glaucoma progression. Surv Ophthalmol. 1999 ; 43 (Suppl. 1) : S10-16.
[42] Hamard P, Hamard H, Dufaux J, Quesnot S. Optic nerve head blood flow using a laser Doppler velocimeter and haemorheology in primary open angle glaucoma and normal pressure glaucoma. Br J Ophthalmol. 1994 ; 78 : 449-53.
[43] Hayden KM, Norton MC, Darcey D, et al. Occupational exposure to pesticides increases the risk of incident AD : the Cache Country study. Neurology. 2010 ; 74 : 1524-30.
[44] Healey PR, Mitchell P. The relationship between optic disc area and open angle glaucoma. J Glaucoma. 2009 ; 9 : 203-4.
[45] Heijl A, Bengtsson B, Oskarsdottir SE. Prevalence and severity of undetected manifest glaucoma : results from the Early Manifest Glaucoma Trial Screening. Ophthalmology. 2013 ; 120 : 1541-5.
[46] Helmer C, Malet F, Rougier MB, et al. Is there a link between open-angle glaucoma and dementia ? The 3C-alienor cohort. Ann Neurol. 2013 [ePub].
[47] Ho WL, Leung Y, Tsang AWT, et al. Review. Tauopathy in the retina and optic nerve : does it shadow pathological changes in the brain ? Mol Vis. 2012 ; 18 : 2700-10.
[48] Hoffmann EM, Lamparter J, Mirshahi A, et al. Distribution of CCT and its association with ocular parameters in a large central European cohort : the Gutenberg health study. Plos One 2013 ; 8 : e66158.
[49] Hollands H, Johnson D, Hollands S, et al. Do findings on routine examination identify patients at risk for primary open-angle glaucoma ? The rational clinical examination systematic review. JAMA. 2013 ; 309 : 2035-42.
[50] Ishikawa M, Sawada Y, Sato N, et al. Risk factors for primary open-angle glaucoma in Japanese subjects attending community health screenings. Clin Ophthalmol. 2011 ; 5 : 1531-7.
[51] Jonas JB, Holbach L. Central corneal thickness and thickness of the lamina cribrosa in human eye. Invest Ophthalmol Vis Sci. 2005 ; 46 : 1287-9.
[52] Jonas JB, Martus P, Horn FK, et al. Predictive factors of the optic nerve head for development or progression of glaucomatous visual field loss. Invest Ophthalmol Visc Sci. 2004 ; 45 : 2613-8.
[53] Jonas JB. Intraocular pressure during weight lifting. Arch Ophthalmol. 2008 ; 126 : 287-8.
[54] Kang JH, Pasquale LR, Willett, et al. Antioxidant intake and primary open-angle glaucoma : a prospective study. Am J Epidemiol. 2003 ; 158 : 337-46.
[55] Kang JH, Willett WC, Rosner BA, et al. Prospective study of alcohol consumption and the risk of primary open-angle glaucoma. Ophthalmic Epidemiol. 2007 ; 14 : 141-7.
[56] Kang JH, Willnet WC, Rosner BA, et al. Cafeine cosumption and the risk of POAG : a prospective cohort study. Invest Ophthamol Visc Sci. 2008 ; 49 : 1924-31.
[57] Katz J, Sommer A. Risk factors for primary open angle glaucoma. Am J Prev Med. 1988 ; 4 : 110-4.
[58] Kim KN, Jeoung JW, Park KH, et al. Effect of lateral decubitus position on intraocular pressure in glaucoma patients with asymmetric visual field loss. Ophthalmology. 2013 ; 120 : 731-5.
[59] Kris-Etherton PM, Harris WS, Appel LJ. American Heart Association. Nutrition Committee. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation. 2002 ; 106 : 2747-57.
[60] Kumar DM, Agarwal N. Oxidative stress in glaucoma : a burden of evidence. J Glaucoma. 2007 ; 16 : 334-43.
[61] Le A, Mukesh BN, McCarty CA, Taylor HR. Risk factors associated with the incidence of open-angle glaucoma : the visual impairment project. Invest Ophthalmol Vis Sci. 2003 ; 44 : 3783-9.
[62] Leske MC, Heijl A, Hyman L, et al. Predictors of long-term progression in the early manifest glaucoma trial. Ophthalmology. 2007 ; 114 : 1965-72.
[63] Leske MC, Wu SY, Nemesure B, Hennis A. Incident open-angle glaucoma and blood pressure. Arch Ophthalmol. 2002 ; 120 : 954-9.
[64] Liang YB, Friedman DS, Zhou Q, et al. Prevalence of primary open angle glaucoma in a rural adult Chinese population : the Handan eye study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8250-7.
[65] Lin CC, Hu CC, Ho JD, et al. Obstructive sleep apnea and increased risk of glaucoma : a population-based matched-cohort study. Ophthalmology. 2013 ; 120 : 1559-64.
[66] Lin HC, Kang JH, Jiang YD, Ho JD. Hypothyroidism and the risk of developing open-angle glaucoma : a five-year population-based follow-up study. Ophthalmology. 2010 ; 117 : 1960-6.
[67] Lin PW, Friedman M, Lin HC, et al. Normal tension glaucoma in patients with obstructive sleep apnea/hypopnea syndrome. J Glaucoma. 2011 ; 20 : 553-8.
[68] Ma F, DaiJ, Sun X. Progress in understanding the association between high myopia and POAG. Clin Experiment Ophthalmol. 2013 [ePub].
[69] Malihi M, Sit AJ. Effect of head and body position on intraocular pressure. Ophthalmology. 2012 ; 119 : 987-91.
[70] Marcus MW, de Vries MM, Junoy Montolio FG, Jansonius NM. Myopia as a risk factor for open-angle glaucoma : a systematic review and meta-analysis. Ophthalmology. 2011 ; 118 : 1989-94.
[71] McGwin G, McNeal S, Owsley C, et al. Statins and other cholesterol-lowering medications and the presence of glaucoma. Arch Ophthalmol. 2004 ; 122 : 822-6.
[72] Memarzadeh F, Ying-Lai M, Chung J, et al. Blood pressure, perfusion pressure, and open-angle glaucoma : the Los Angeles Latino Eye Study. Invest Ophthalmol Vis Sci. 2010 ; 51 : 2872-7.
[73] Merle B, Delyfer MN, Korobelnik JF, et al. Dietary omega-3 fatty acids and the risk for age-related maculopathy : the alienor studdy. Invest Ophthalmol Visc Sci. 2011 ; 52 : 6004-11.
[74] Mitchell P, Smith W, Chey T, Healey PR. Open-angle glaucoma and diabetes : the Blue Mountains eye study, Australia. Ophthalmology. 1997 ; 104 : 712-8.
[75] Mojon DS, Hess CW, Goldblum D, et al. Normal-tension glaucoma is associated with sleep apnea syndrome. Ophthalmologica. 2002 ; 216 : 180-4.
[76] Mojon Ds, Hess CW, Goldblum D, et al. Primary open angle glaucoma is associated with sleep apnea syndrome. Ophthalmologica. 2000 ; 214 : 115-8.
[77] Nakagami T, Yamazaki Y, Hayamizu F. Prognostic factors for progression of visual field damage in patients with normal-tension glaucoma. Jpn J Ophthalmol. 2006 ; 50 : 38-43.
[78] Nucci C, Martucci A, Martorana A, et al. Glaucoma progression associated with altered cerebral spinal fluid levels of amyloid beta and tau proteins. Clin Experiment Ophthalmol. 2011 ; 39 : 279-81.
[79] Okumura Y, Yuki K, Tsubota K. Low diastolic blood pressure is associated with the progression of normal tension glaucoma. Ophthalmologica. 2012 ; 228 : 36-41.
[80] Onen SH, Mouriaux F, Berramdane L, et al. High prevalence of sleep-disordered breathing in patients with primary open-angle glaucoma. Acta Ophthalmol Scand. 2000 ; 78 : 638-41.
[81] Pache M, Dubler B, Flammer J. Peripheral vasospasm and nocturnal blood pressure dipping-two distinct risk factors for glaucomatous damage ? Eur J Ophthalmol. 2003 ; 13 : 20-5.
[82] Park HYL, Jeon SH, Park CK. Enhanced depth imaging detects lamina cribrosa thickness differences in normal tension glaucoma and primary open-angle glaucoma. Ophthalmology. 2012 ; 119 : 10-20.
[83] Pasquale LR, Kang JH, Manson JE, et al. Prospective study of type 2 diabetes mellitus and risk of primary open-angle glaucoma in women. Ophthalmology. 2006 ; 113 : 1081-6.
[84] Pasquale LR, Kang JH. Female reproductive factors and primary open angle glaucoma in the Nurses’Health Study. Eye. 2011 ; 25 : 633-41.
[85] Ponte F, Giuffré G, Giammanco R, Dardanoni G. Risk factors of ocular hypertension and glaucoma. The Casteldaccia Eye Study. Doc. Ophthalmol Adv Ophthalmol. 1994 ; 85 : 203-10.
[86] Quigley H, Varma R, Tielsch JM, et al. The relationship between optic disc area and open angle glaucoma : the Baltimore Eye Survey. J Glaucoma. 1999 ; 8 : 347-52.
[87] Qureshi IA. Effects of mild, moderate and severe exercise on intraocular pressure of sedentary subjects. Ann Hum Biol. 1995 ; 22 : 545-53.
[88] Ramdas WD, Wolfs RCW, Hofman A, et al. Ocular perfusion pressure and the incidence of glaucoma : real effect or artifact ? The Rotterdam Study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 6875-81.
[89] Renard JP, Rouland JF, Bron A, et al. Nutritional, lifestyle and environmental factors in ocular hypertension and primary open-angle glaucoma : an exploratory case-control study. Acta Ophthalmol. 2013 ; 91 : 505-13.
[90] Renard JP. High blood pressure-low ocular pressure : the parallels. Vascular risk factors in glaucoma. J Fr Ophtalmol. 2007 ; 30 : 3S18-21.
[91] Santibanez M, Bolumar F, Garcia AM. Occupational risk factors in Alzheimer’s disease : a review assessing the quality of published epidemiological studies. Occup Environ Med. 2007 ; 64 : 723-32.
[92] Sato T, Roy S. Effect of high glucose on fibronectin expression and cell proliferation in trabecular meshwork cells. Invest Ophthalmol Vis Sci. jav 2002 ; 43 : 170-5.
[93] Schuman JS, Massicotte EC, Connolly S, et al. Increased intraocular pressure and visual field defects in high resistance wind instrument players. Ophthalmology. 2000 ; 107 : 127-33.
[94] Sellem E. Existe-t-il une relation entre l’épaisseur cornéenne centrale et le diamètre papillaire ? 12e Symp. Rech. Glaucome. Sèvres EDK, 2005 : 65-74.
[95] Shetgar AC, Mulimani MB. The central corneal thickness in normal tension glaucoma, POAG and OHT. J Clin Diagn Res. 2013 ; 7 : 1063-7.
[96] Stewart WC. The effect of lifestyle on the relative risk to develop open-angle glaucoma. Curr Opin Ophthalmol. 1995 ; 6 : 3-9.
[97] Sukumar S, Spencer F, Fenerty C, et al. The influence of socioeconomic and clinical factors upon the presenting visual field status of patients with glaucoma. Eye (Lond). 2009 ; 23 : 1038-44.
[98] Suzuki Y, Iwase A, Araie M, et al. Risk factors for open-angle glaucoma in a Japanese population : the Tajimi Study. Ophthalmology. 2006 ; 113 : 1613-7.
[99] Taibbi G, Cromwell RL, Kapoor KG, et al. The effect of microgravity on ocular structures and visual function : a review. Surv Ophthalmol. 2013 ; 58 : 155-63.
[100] Talty P, O’Brien PD. Does extended wear of a tight necktie cause raised intraocular pressure ? J Glaucoma. 2005 ; 14 : 508-10.
[101] Teng C, Gurses-Ozden R, Liebmann JM, et al. Effect of a tight necktie on intraocular pressure. Br J Ophthalmol. 2003 ; 87 : 946-8.
[102] Tielsch JM, Katz J, Sommer A, et al. Hypertension, perfusion pressure, and primary open angle glaucoma. A population-based assessment. Arch Ophthalmol. 1995 ; 113 : 216-21.
[103] Ugurlu S, Weitzman M, Nduaguba C, Caprioli J. Acquired pit of the optic nerve : a risk factor for progression of glaucoma. Am J Ophthalmol. 1998 ; 125 : 457-64.
[104] Varma R, Tielsch JM, Quigley HA, et al. Race, age, gender, and refractive error-related differences in the normal optic disc. Arch Ophthalmol. 1994 ; 112 : 1068-76.
[105] Vieira GM, Oliveira HB, de Andrade DT, et al. Intraocular pressure variation during weight lifting. Arch Ophthalmol. 2006 ; 124 : 1251-4.
[106] Wai S, Agarwal PK, Sidiki S, et al. The effect of socio-economic deprivation on severity of glaucoma at presentation. Br J Ophthalmol. 2010 ; 94 : 85-7.
[107] Wang YE, Barbosa DTQ, Wang S, et al. Association between oral contraceptive use and glaucoma in United States. Abstract PO339 AAO 2013.
[108] Wang S, Xu L, Jonas JB, et al. Dyslipidemia and eye diseases in the adult chinese population : The Beijing Eye Study. Plos One. 2012. Disponible sur : http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3419255/
[109] Wang YX, Hu LN, Yang H, et al. Frequency and associated factors of structural progression of open-angle glaucoma in the Beijing Eye Study. Br J Ophthalmol. 2012 ; 96 : 811-5.
[110] Wise LA, Rosenberg L, Radin RG, et al. A prospective study of diabetes, lifestyle factors, and glaucoma among African-American women. Ann Epidemiol. 2011 ; 21 : 430-9.
[111] Wong MHY, Lai AHO, Singh M, Chew PTK. Sleeping posture and intraocular pressure. Singapore Med J. 2013 ; 54 : 146-8.
[112] Wostyn MR, AudenaertK, De Deyn PP. Alzheimer’s disease and glaucoma is there a causal relationship ? Br J Ophthalmol. 2009 ; 93 : 1557-9.
[113] Xu L, Zhang H, Wang YX, Jonas JB. Central corneal thickness and glaucoma in adult Chinese : the Beijing Eye Study. J Glaucoma. 2008 ; 17 : 647-53.
[114] Yip JLY, Broadway DC, Luben R, et al. Physical activity and ocular perfusion pressure : the EPIC-Norfolk eye study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8186-92.
[115] Yoneda S, Hara H, Hirata A, et al. Vitreous fluid levels of beta-amyloid (1-42) and tau in patients with retinal diseases. Jpn J Ophthalmol. 2005 ; 49 : 106-8.
[116] Zaganas I, Kapetanaki S, Mastorodemos V, et al. Linking pesticide exposure and dementia : what is the evidence ? Toxicology. 2013 ; 307 : 3-11.
[117] Zangwill LM, Weinreb RN, Beiser JA, et al. Baseline topographic optic disc measurements are associated with the development of primary open-angle glaucoma : the Confocal Scanning Laser Ophthalmoscopy Ancillary Study to the Ocular Hypertension Treatment Study. Arch Ophthalmol. 2005 ; 123 : 1188-97.
[118] Zheng Y, Wong TY, Mitchell P, et al. Distribution of ocular perfusion pressure and its relationship with open-angle glaucoma : the Singapore Malay Eye Study. Invest Ophthalmol Vis Sci. 2010 ; 51 : 3399-404.
E. Sellem
-
L’observation de la papille et de la région péripapillaire chez un patient glaucomateux – ou suspect de l’être – doit obéir à un carnet des charges rigoureux.
-
Les hémorragies papillaires sont fréquentes dans le glaucome primitif à angle ouvert (GPAO), mais passent souvent inaperçues.
-
La perte des fibres nerveuses rétiniennes (FNR) peut être repérée, sur les rétinophotographies, aux stades précoces et modérés du GPAO.
-
Les difficultés diagnostiques concernent les petites papilles, les dysversions et les drusen papillaires, et souvent les papilles des globes très myopes.
L a constitution et la progression d’une excavation pathologique de la papille, traduisant la perte des FNR, appartiennent à la définition du GPAO. Elle est visible en biomicroscopie et sur les rétinophotographies, au mieux examinée en trois dimensions. Elle s’accompagne inconstamment d’hémorragies papillaires et d’une atrophie parapapillaire progressive. La perte des FNR peut être repérée sur les clichés fournis par le rétinographe.
L’excavation glaucomateuse ne doit pas être confondue avec une excavation physiologique qui, elle, n’évolue pas tout au long de la vie. Le corollaire de l’expansion pathologique de l’excavation est, naturellement, un amincissement de l’anneau neurorétinien (ANR) et une augmentation du rapport cup/disc. Trois modalités évolutives sont individualisables :
-
apparition d’une encoche localisée (notch des Anglo-Saxons) de l’ANR, pouvant rejoindre l’anneau scléral, plus fréquemment dans sa portion inférieure que supérieure (fig. 10-33) ;
-
progression verticale, avec un amincissement sectoriel plus large de l’ANR, jusqu’à sa rupture, habituellement plus rapide dans le secteur inférieur que dans le secteur supérieur (fig. 10-34) ;
-
progression concentrique, lorsque la perte des FNR est diffuse, plutôt l’apanage des GPAO à pression élevée et de constitution rapide (fig. 10-35).
Cette évolution s’accompagne du rejet nasal des vaisseaux émergents. Jonas [12] insiste sur la relation entre la distance d’émergence des vaisseaux centraux de la rétine au niveau de la lame criblée et la localisation de l’amincissement de l’ANR : plus cette distance est grande, plus la perte glaucomateuse est marquée dans le secteur correspondant.
Au stade ultime, l’excavation est totale, il n’y a plus d’ANR, tous les vaisseaux sont plaqués contre l’anneau scléral mis à nu, qu’ils franchissent avec une coudure plus ou moins abrupte selon la profondeur de l’excavation (fig. 10-36).
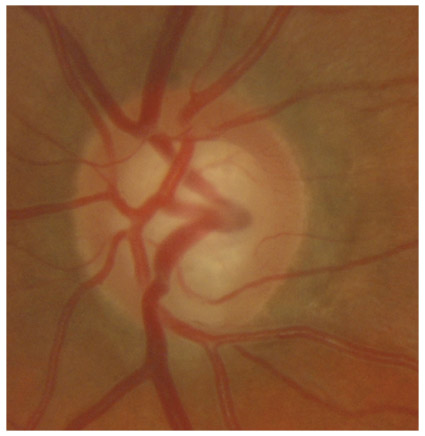
Fig. 10-33 Encoche localisée sur la portion inférieure de l’ANR dans une grande papille.
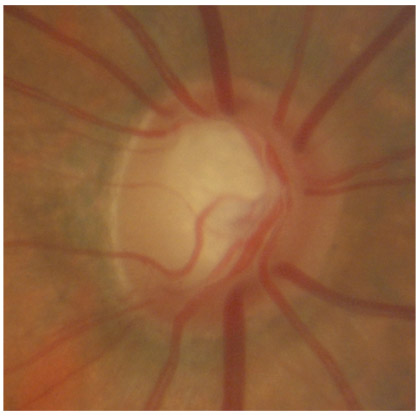
Fig. 10-34 Amincissement bipolaire de l’ANR.
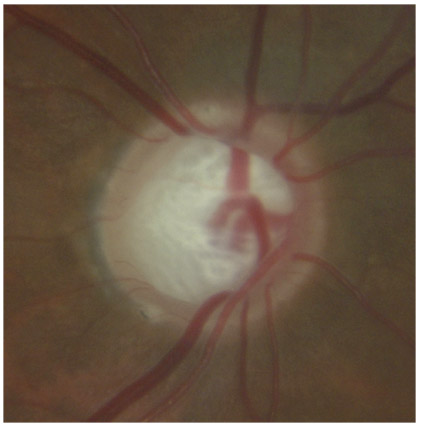
Fig. 10-35 Amincissement concentrique de l’ANR.
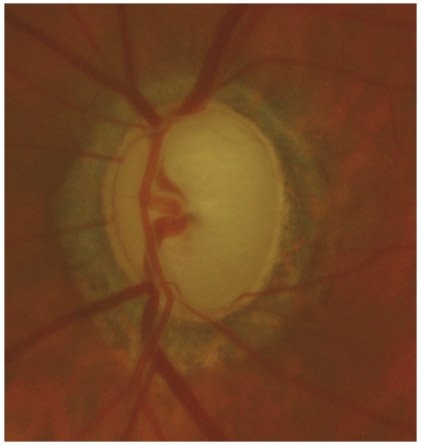
Fig. 10-36 Excavation totale, mettant à nu l’anneau scléral.
Les excavations les plus profondes sont constatées habituellement dans les formes à PIO élevée, comme dans les glaucomes juvéniles ou les glaucomes pigmentaires. À l’opposé, les formes séniles et celles de la myopie forte ont rarement une excavation profonde, ou même réelle.
La lame criblée – qui devient plus apparente avec la perte des FNR – se modifie (fig. 10-37) : sa zone centrale et sa moyenne périphérie bombent vers l’arrière, comme cela a été confirmé par l’OCT [8] ; ses pores s’élargissent et s’ovalisent verticalement ou horizontalement, de manière plus marquée aux pôles supérieur et inférieur de la papille [17]. L’amincissement des cloisons de la lame criblée aboutit parfois à leur rupture, créant un pseudo-colobome papillaire, localisé essentiellement au pôle inférieur de la papille, à différencier d’un colobome congénital (fig. 10-38).
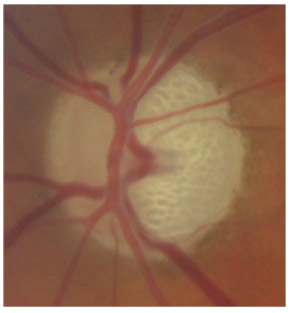
Fig. 10-37 Visibilité marquée de la lame criblée ; l’ANR a disparu dans tout le secteur temporal.
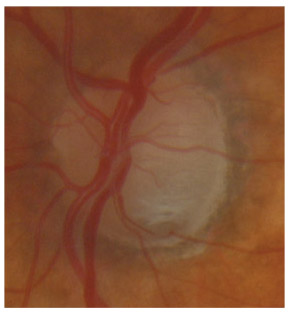
Fig. 10-38 Pseudo-colobome au pôle inférieur de la papille.
Elle signe l’atrophie des FNR. Elle évolue avec la même progression topographique que l’excavation, mais n’en a pas toujours les dimensions ; ainsi, le rapport pâleur-disque est souvent plus petit que le rapport excavation-disque dans le GPAO (à l’inverse de ce que l’on observe dans les hyperpressions intra-oculaires aiguës et majeures, ou les neuropathies non glaucomateuses – fig. 10-39).
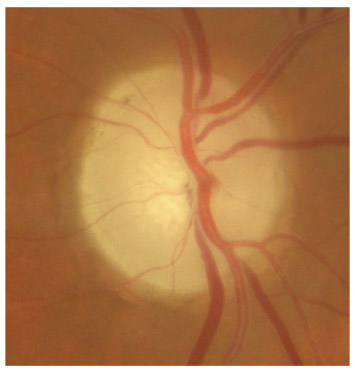
Fig. 10-39 Atrophie papillaire totale par section traumatique du nerf optique, avec une excavation physiologique de 3/10.
Lorsqu’un vaisseau circum-linéaire – ou plusieurs – est présent (voir chapitre 9-III, paragraphe « Biomicroscopie de la papille et des fibres nerveuses rétiniennes »), l’amincissement de l’ANR laisse sur place ce vaisseau qui se retrouve dans l’excavation, « exclu » du bord interne de l’ANR (fig. 10-40).
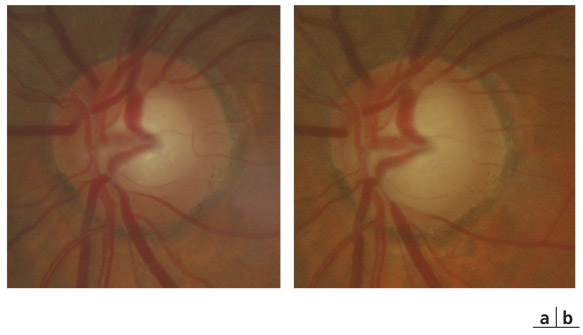
Fig. 10-40 Deux clichés d’une même papille, séparés de trois ans. Le fin vaisseau circum-linéaire inférieur est exclu sur le cliché b et se retrouve dans l’excavation.
Il faut rappeler que les petites papilles ne se creusent que tardivement dans l’évolution du glaucome (fig. 10-41). Par ailleurs, dans certaines papilles dysmorphiques (voir plus loin), la présence d’une excavation papillaire (innée ou a fortiori glaucomateuse) est cependant très difficile ou impossible à affirmer : myopie forte, dysversion papillaire majeure ou drusen.
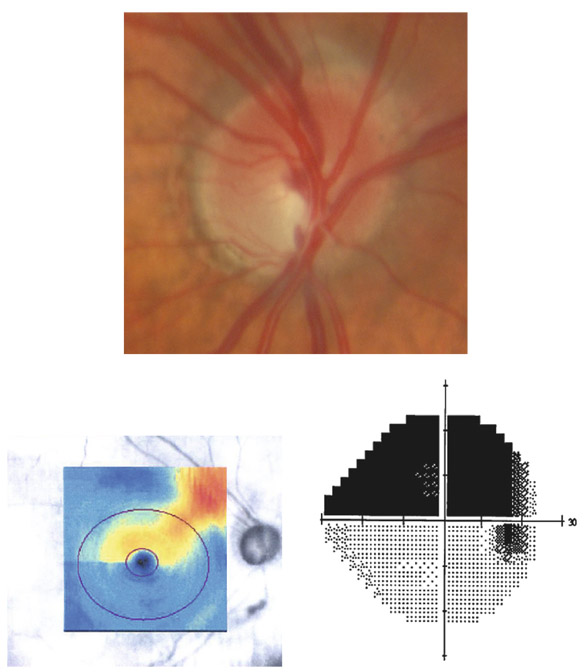
Fig. 10-41 Petite papille avec une excavation glaucomateuse inférieure modeste. Toutefois, l’analyse des cellules ganglionnaires dans le cube maculaire en OCT confirme la perte majeure dans tout le secteur inférieur, et le champ visuel présente une hémianopsie absolue altitudinale supérieure.
Bjerrum les avaient décrites dès la fin de xixe siècle. Mais cette manifestation discrète, et pendant longtemps considérée comme très rare, fut pratiquement oubliée jusqu’à ce que Drance en 1970 [6] insistât, à juste titre, sur son importance clinique, diagnostique et évolutive. Avec le développement des rétinographes numériques non mydriatiques et, partant, la multiplication des prises de vue du fond d’œil, il est vite apparu que les hémorragies papillaires (HP) sont des événements fréquents dans l’évolution d’un GPAO. En effet, les clichés obtenus permettent, à tête reposée, d’examiner avec précision la papille et de découvrir ce que l’examen in vivo du fond d’œil avait négligé. Les HP sont devenues aujourd’hui des éléments séméiologiques essentiels pour le diagnostic d’un glaucome, quand celui-ci est incertain, comme pour la surveillance de son évolution.
La découverte d’une HP est un signe d’alerte majeur [3, 13] concomitant de la progression, indicateur de la localisation de la progression, indicateur de la rapidité de la progression et enfin prédictif de la conversion d’une hypertension oculaire en glaucome (voir chapitre 11-II). Sa constatation doit donc alerter l’ophtalmologiste, qui ne doit plus la considérer comme un événement négligeable ou une curiosité d’examen. Les HP furent le thème retenu pour la lecture donnée par J. Liebmann en 2009 au Glaucoma Subspecialty Day, durant l’American Academy de San Francisco. Celui-ci concluait son exposé ainsi : « Ne jetez pas votre ophtalmoscope ! […] Le signe clinique le plus important sur la papille peut ne pas être repéré avec les équipements d’imagerie les plus sophistiqués. L’appareil d’imagerie le plus fiable peut être encore votre rétinographe. »
Plusieurs propositions ont été faites depuis Drance (infarcissement traduisant une ischémie aiguë, micro-occlusion veineuse, etc.), et le problème n’est peut-être pas encore résolu. Si la découverte d’une HP peut être un indicateur de l’aggravation du glaucome, elle est aussi précédée par l’amincissement de la couche des FNR [9] et même par l’atteinte du champ visuel dans ce territoire [5]. En d’autres termes, la progression du glaucome évolue avant et après la survenue de l’hémorragie. Celle-ci n’est donc pas inaugurale, mais accompagne plutôt la perte des FNR. Il est ainsi probable qu’un saignement du disque optique puisse être une manifestation transitoire du collapsus des tissus de la tête du nerf optique, et qu’il signe un claquage vasculaire mécanique provoqué par les modifications anatomiques locales.
Dans l’Ocular Hypertension Treatment Study (OHTS), le risque de présenter une hémorragie a été estimé à 0,5 % par an [4]. Après neuf années de suivi, l’Early Manifest Glaucoma Trial (EMGT) a retrouvé une hémorragie papillaire au moins une fois chez 55 % des patients glaucomateux [10]. A contrario, chez des sujets non glaucomateux, la prévalence des HP ne serait que de 0,2 %… encore faudrait-il être convaincu que ces patients ne soient pas des glaucomateux en puissance. Les HP sont plus fréquentes aux stades précoce et modéré du GPAO et dans le glaucome à pression normale, où 20 % des patients présentent une HP au moment du diagnostic [7]. Toutefois, aucune forme de glaucome n’en est exempte.
Les HP sont superficielles, posées le plus souvent au bord papillaire ou sur la pente de l’excavation, parfois situées à l’intérieur de l’excavation elle-même, plus rarement parapapillaires. Le plus souvent uniques, parfois multiples, elles sont volontiers localisées en temporal supérieur ou inférieur, rarement en nasal (fig. 10-42 à 10-46). Plus ou moins étendues, elles affectent volontiers un aspect de flammèche radiaire. Elles sont souvent objectivées sur le même méridien qu’une encoche de l’ANR ou qu’un déficit fasciculaire des FNR, ou sur le méridien voisin. Classiquement fugaces, elles persistent de deux semaines à quelques mois. Elles sont enfin volontiers récidivantes et bilatérales de manière séquentielle ou simultanée dans plus de 25 % des cas. Elles peuvent renforcer le diagnostic de glaucome lorsqu’elles s’observent dans des papilles d’interprétation difficile : petite papille (fig. 10-47), dysversion (fig. 10-48), myopie forte (fig. 10-49). Les analyseurs (HRT, OCT) sont, à l’heure actuelle, incapables de les repérer.
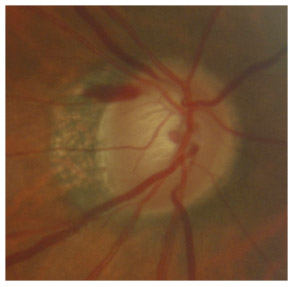
Fig. 10-42 Hémorragie en flammèche, temporale supérieure.
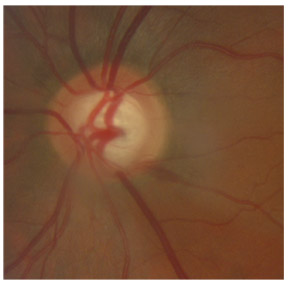
Fig. 10-43 Hémorragie en flammèche, temporale inférieure, à proximité d’une perte visible des FNR.
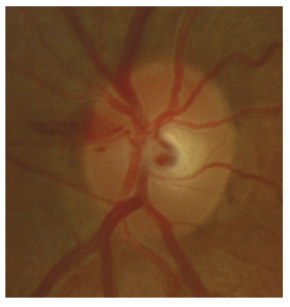
Fig. 10-44 Hémorragie en flammèche, nasale.
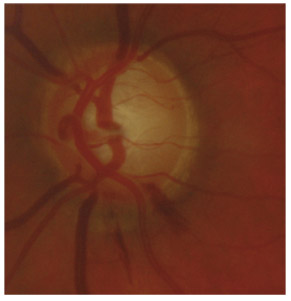
Fig. 10-45 Deux hémorragies, à 5 heures en flammèche et à 6 heures.
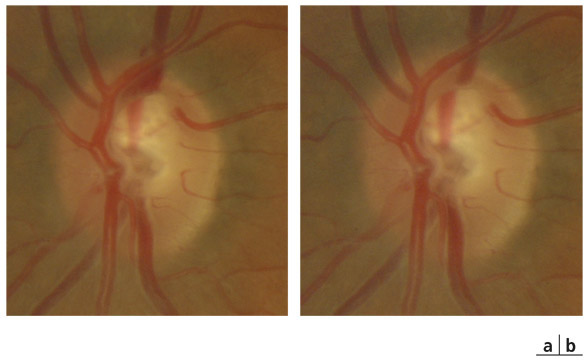
Fig. 10-46 Hémorragie sous le croisement artérioveineux au pôle supérieur de la papille, repérée seulement après sa disparition sur le cliché b pris six mois plus tard.
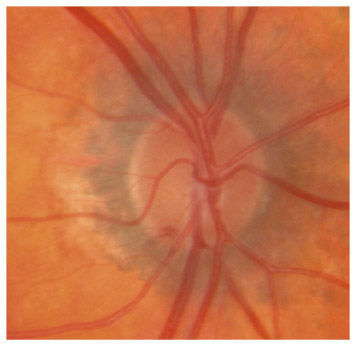
Fig. 10-47 Hémorragie en temporal inférieur dans une petite papille non encore excavée.
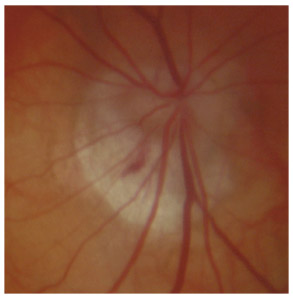
Fig. 10-48 Hémorragie en temporal inférieur au bord d’une petite papille en dysversion.
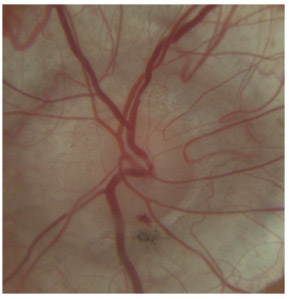
Fig. 10-49 Hémorragie punctiforme au pôle inférieur d’une papille dans une myopie forte.
Très rarement, une hémorragie isolée peut se constater dans le champ rétinien, posée sur les FNR, à distance de la papille. Il avait été suggéré qu’une HP puisse parfois « glisser » progressivement le long de ces fibres, mais ce déplacement n’est plus admis, et ces hémorragies éloignées surviennent bien in situ (fig. 10-50 et 10-51).
Classiquement, les HP ne surviennent plus dans les régions du disque où l’ANR a disparu [12]. Nous avons pourtant observé à plusieurs reprises de minimes saignements posées sur la lame criblée dans des excavations totales ou subtotales, véritables pétéchies laminaires, volontiers récidivantes par ailleurs (fig. 10-52).
Non également décrites dans la littérature, nous avons constaté – dans des GPAO manifestes – quelques cas exceptionnels d’hémorragies juxtapapillaires situées sous la couche des FNR, nappe rouge foncée plus ou moins étendue et plaquée contre l’anneau scléral (fig. 10-53 et 10-54).
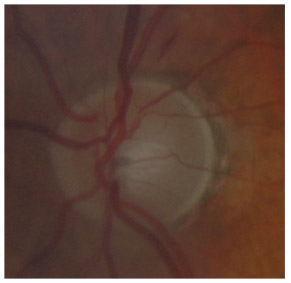
Fig. 10-50 Hémorragie en flammèche, au-delà du bord supérieur de la papille.
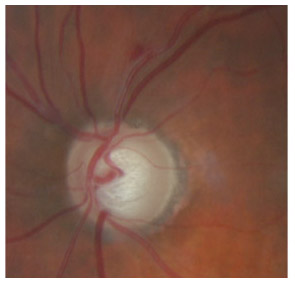
Fig. 10-51 Hémorragie en flammèche, très à distance du bord supérieur de la papille.
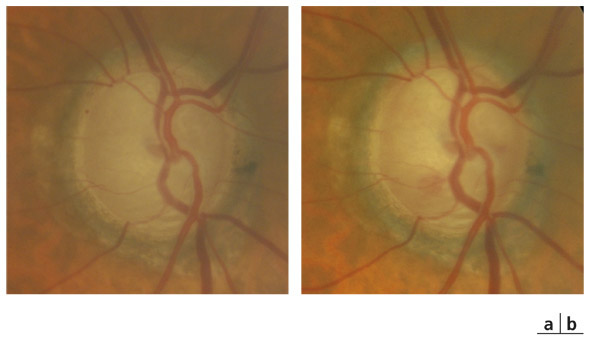
Fig. 10-52 Pétéchies laminaires en temporal et en nasal dans une excavation totale sur le cliché b, pris un an après le cliché a où la papille présente une hémorragie punctiforme sur l’anneau scléral à 10 heures.
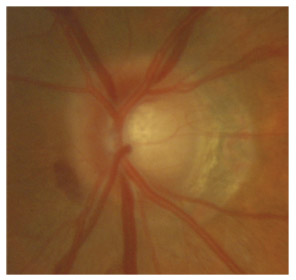
Fig. 10-53 Hémorragie juxtapapillaire profonde en nasal.
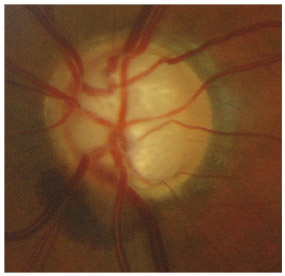
Fig. 10-54 Grosse nappe hémorragique profonde en nasal inférieur au bord d’une papille très excavée.
L’écueil principal est de ne pas repérer les HP, soit qu’elles sont d’emblée très petites, soit qu’elles sont en voie de résorption. Un travail de Budenz et al. [4] a ainsi montré que des observateurs entraînés au fond d’œil pouvaient passer dans plus de 84 % des cas à côté de ce signe à l’examen direct ! Disposer de clichés successifs du fond d’œil, pour les comparer, permet parfois a posteriori de retrouver sur des clichés antérieurs une ou plusieurs HP que l’on n’avait pas repérées à cause de leur discrétion (voir chapitre 9-IV, paragraphe « Imagerie de la papille et des fibres nerveuses rétiniennes »).
Les HP peuvent longer le trajet d’un vaisseau et passer ainsi inaperçues. Une observation attentive permettra de ne pas les confondre avec une portion ou une boucle vasculaire (fig. 10-55), un dépôt pigmentaire ou des hémorragies d’extravasation d’une occlusion veineuse (fig. 10-56).
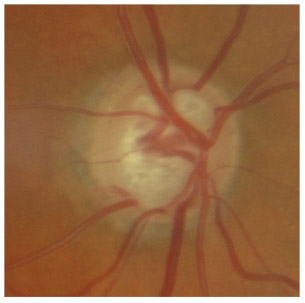
Fig. 10-55 Brève émergence vasculaire à 7-8 heures, mimant une hémorragie, retrouvée identique sur chaque cliché pris de six mois en six mois.
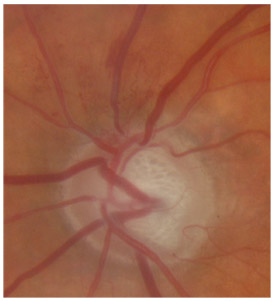
Fig. 10-56 Hémorragies d’extravasation d’une occlusion veineuse rétinienne supérieure.
Dans les yeux glaucomateux, les zones α et β de l’atrophie parapapillaire (ou péripapillaire) sont significativement plus larges, et la zone β est plus souvent retrouvée que dans les yeux sains [14]. Cette dernière zone, dans les pertes concentriques de l’ANR, peut aller jusqu’à cerner circonférentiellement la papille (fig. 10-57). Elle est régulièrement plus étendue dans la région du méridien opposé à celui de l’émergence des vaisseaux centraux de la rétine au niveau de la lame criblée (fig. 10-58). Des rétrécissements des vaisseaux rétiniens, localisés ou diffus, peuvent y être associés.
Cette atrophie n’est donc toutefois pas spécifique du glaucome. Elle augmente physiologiquement avec l’âge et est parfois difficile à différencier des atrophies constitutionnelles péripapillaires, comme dans la myopie. Elle peut toutefois représenter un argument diagnostique supplémentaire dans des situations cliniques litigieuses.
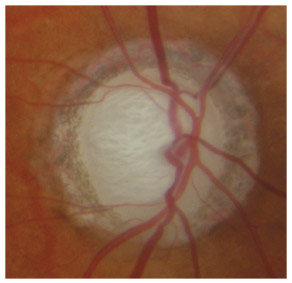
Fig. 10-57 Zone β concentrique autour d’une papille très excavée.
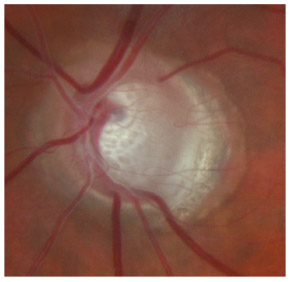
Fig. 10-58 Large zone β temporale inférieure, à distance de l’émergence des vaisseaux centraux de la rétine qui est nasale supérieure.
La réduction du calibre des vaisseaux rétiniens se rencontre aussi bien dans le glaucome (d’autant plus qu’il est plus évolué) que dans les autres neuropathies optiques, et est probablement secondaire à une demande métabolique réduite de la rétine. Ce rétrécissement est parfois localisé (fig. 10-59), et cette constatation est plus fréquente en cas d’atrophie péripapillaire, dans le glaucome à pression normale et dans les neuropathies optiques ischémiques antérieures.
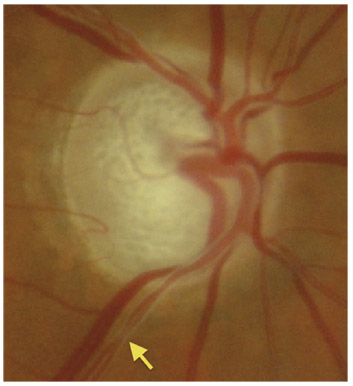
Fig. 10-59 Rétrécissement artériel localisé (flèche jaune).
L’observation des FNR, difficile ou impossible à l’examen biomicroscopique direct à moins d’utiliser un filtre anérythre parfois révélateur (fig. 10-60), a grandement bénéficié du développement des procédés modernes de rétinographie.
La perte des FNR s’observe essentiellement dans les secteurs temporaux supérieur et inférieur [2, 19] et se traduit selon son importance et sa localisation par :
-
un déficit isolé, dans le prolongement habituel d’une zone d’amincissement de l’ANR, parfois accompagné d’une hémorragie papillaire dans le même secteur. Il affecte l’aspect d’une bande assombrie, branchée sur la papille, radiaire, arciforme et s’évasant vers la périphérie, avec des capillaires rétiniens plus nets à son niveau. Il se différencie du fond plus brillant et fibreux du champ rétinien. Lorsque la perte des FNR est moins dense, elle prend un aspect peigné de même géométrie (fig. 10-61) ;
-
des déficits multiples (fig. 10-62 à 10-64) ;
-
au maximum, et à la condition que l’on soit certain de la bonne qualité du cliché, plus aucune structure fibreuse n’est visible sur la rétine, et tous les vaisseaux rétiniens sont anormalement nets (fig. 10-65).
La plus grande densité des FNR à midi et à 6 heures rend plus difficile à ce niveau le repérage des déficits débutants. Dans le secteur nasal, les pertes axonales sont trop tardives pour qu’habituellement, à un stade évolué de la maladie, un déficit puisse y être observé.
Fig. 10-60 Déficit des FNR en temporal supérieur, visible au biomicroscope en lumière anérythre.
Fig. 10-61 Déficit temporal inférieur des FNR prolongeant l’amincissement de l’ANR.
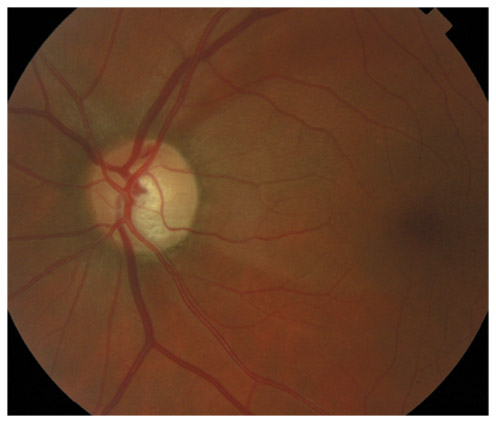
Fig. 10-62 Déficits temporaux supérieur et inférieur des FNR.
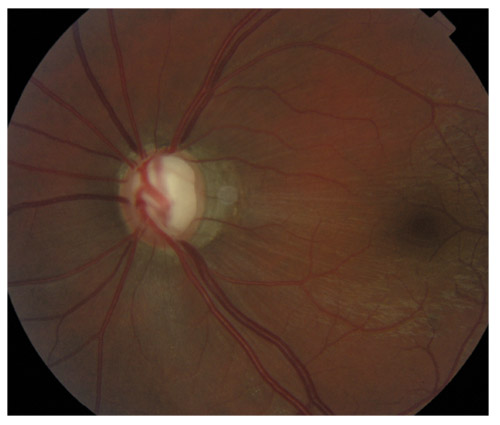
Fig. 10-63 Déficits diffus des FNR, donnant un aspect peigné à l’ensemble du champ rétinien temporal.
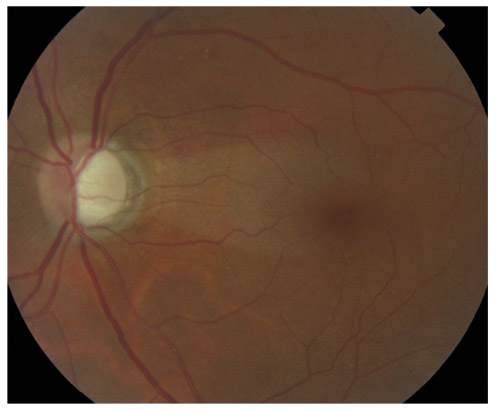
Fig. 10-64 Glaucome très évolué, avec visibilité des FNR uniquement dans le secteur papillomaculaire.
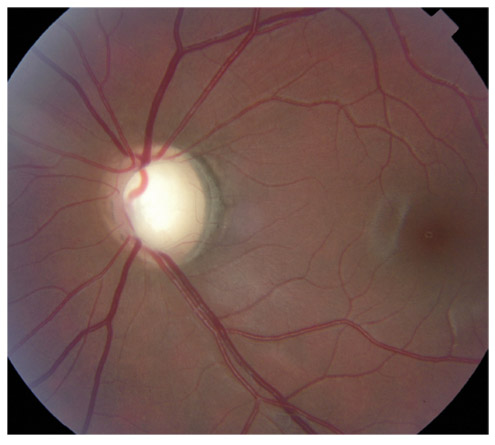
Fig. 10-65 Glaucome très évolué : les FNR ne sont plus repérables et les vaisseaux rétiniens sont anormalement nets.
En fonction des modifications papillaires et parapapillaires provoquées par le GPAO, cinq formes anatomocliniques sont régulièrement retrouvées dans la littérature :
-
les formes unidirectionnelles, les plus fréquentes, amincissant le plus souvent l’ANR d’abord dans sa portion inférieure, avant de concerner tous les méridiens de la papille ;
-
les formes concentriques avec une excavation grossièrement ronde, dont le caractère pathologique est moins évident dans les premiers stades de l’affection, pouvant mimer une grosse excavation physiologique, se constituant plutôt lorsque la PIO augmente rapidement et fortement ;
-
les formes focales ischémiques avec une encoche nette très localisée de l’ANR, le plus souvent inféro-temporale, associée volontiers à un déficit sectoriel visible des FNR et parfois à une HP en regard, décrite surtout dans le glaucome à pression normale et affectant plus volontiers les femmes ayant un terrain vasospastique ;
-
les formes scléreuses liées à l’âge où, chez le sujet âgé, le disque optique est excavé en pente douce (en « verre de montre »), avec une importante atrophie parapapillaire et la survenue fréquente d’HP, là encore plus spécifique du glaucome à pression normale ;
-
les formes du myope fort où prédominent l’atrophie papillaire et parapapillaire, avec souvent une absence d’excavation ou une excavation difficilement repérable.
Les plus grandes difficultés d’interprétation concernent les papilles en dysversion, les papilles avec des drusen et, précisément, les papilles des globes fortement myopes. Tous les autres tests actuellement disponibles, champs visuels et analyseurs, peuvent aussi être défaillants pour évaluer la présence concomitante d’une atteinte glaucomateuse.
Le nerf optique aborde normalement la coque oculaire perpendiculairement, ou légèrement de façon oblique avec une direction temporale. Lorsque cette obliquité est plus marquée, quelle que soit d’ailleurs sa direction, la papille est dite « en dysversion » (titled disc des Anglo-Saxons), avec une inclinaison plus ou moins forte du disque et du bouquet vasculaire papillaire à l’examen du fond d’œil. Cette situation est fréquente dans les yeux très myopes, mais peut se constater dans des yeux emmétropes ou hypermétropes. L’aspect observé est très variable, allant de la simple ovalisation (avec des vaisseaux un peu trop obliques) jusqu’à un aspect d’aplatissement de la papille (fig. 10-66). Le plus souvent, l’orientation de l’inclinaison est inférieure ou temporale inférieure, mais elle peut être aussi franchement nasale, la papille droite ayant l’aspect d’une papille gauche, et inversement (fig. 10-67). Souvent, la taille d’une papille en dysversion est elle-même inhabituelle, fréquemment très petite, plus rarement très grande. Dans les formes les plus inclinées et dans la direction de cette inclinaison, l’aspect « en gueule de four » associe un conus papillaire avec un amincissement inné ou même une absence d’ANR et, au-delà, une atrophie péripapillaire (fig. 10-68). Cet aspect peut évoquer fortement une excavation glaucomateuse, surtout si l’examen du fond d’œil n’est que monoculaire ou si l’on observe des photographies en deux dimensions. La confusion peut être d’autant plus grande lorsque, fonctionnellement, ces dysversions marquées s’associent à une amblyopie relative et à des scotomes pouvant parfaitement mimer des déficits glaucomateux (absolus ou relatifs, arciformes, limités par le méridien horizontal). La dysversion papillaire n’est pas évolutive en elle-même, mais elle peut naturellement s’associer à une atteinte glaucomateuse (fig. 10-69).
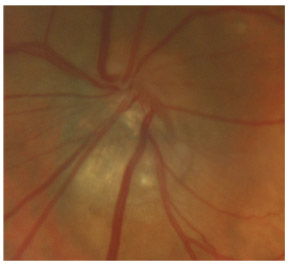
Fig. 10-66 Papille droite non glaucomateuse, aplatie par une dysversion majeure à direction temporale inférieure.
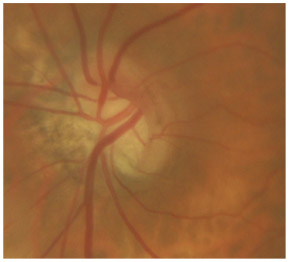
Fig. 10-67 Papille gauche (!) non glaucomateuse en franche dysversion à direction nasale.
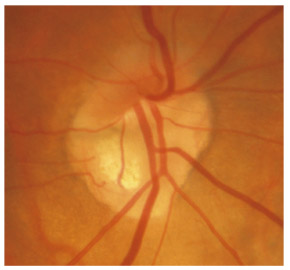
Fig. 10-68 Papille droite non glaucomateuse en dysversion à direction inférieure, avec absence d’ANR inférieur et large atrophie péripapillaire inférieure.
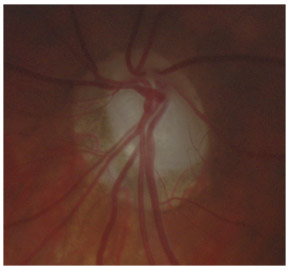
Fig. 10-69 Papille droite glaucomateuse en dysversion modérée à direction inférieure, de grande taille (2,5 mm) avec atrophie péripapillaire temporo-inférieure.
Les drusen papillaires s’accompagnent également de déficits périmétriques, souvent moins systématisables que les déficits glaucomateux, mais il est parfois difficile de faire la part des choses lorsqu’un glaucome surajouté est suspecté. Elles affectent généralement des papilles de petite taille [11]. Dans les formes les plus évidentes biomicroscopiquement, la papille est envahie de verrucosités et ne peut se creuser (fig. 10-70). Lorsque ces drusen sont en petit nombre et peu saillantes, une excavation glaucomateuse est souvent repérable (fig. 10-71). Mais les drusen sont parfois plus profondes, donnant un aspect d’atrophie papillaire plate (fig. 10-72). Elles peuvent exceptionnellement saigner, et la survenue d’une hémorragie papillaire ne peut alors conforter un éventuel diagnostic de glaucome (fig. 10-73). L’autofluorescence, parfois aidée de l’échographie en mode B, des analyseurs [18], voire du scanner et de l’IRM, permet généralement de confirmer ce diagnostic, mais tous ces examens n’apportent que peu ou pas de renseignements concernant la concomitance éventuelle d’un glaucome, à moins qu’il y ait une franche discordance entre l’atteinte papillaire et la perte en FNR.
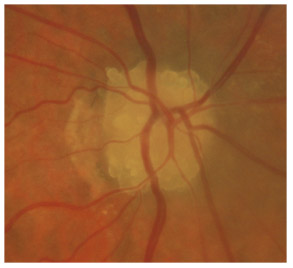
Fig. 10-70 Drusen très bourgeonnantes envahissant la tête du nerf optique.
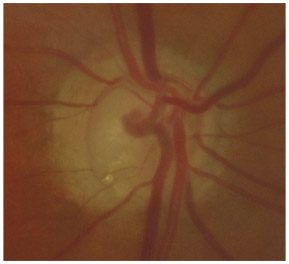
Fig. 10-71 Quelques drusen isolées dans la portion inférieure d’une papille glaucomateuse.
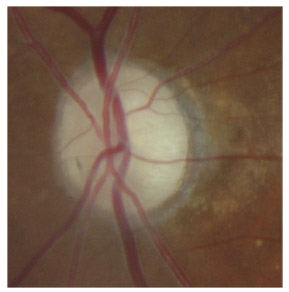
Fig. 10-72 Drusen profondes de la papille, donnant un aspect d’atrophie papillaire plate.
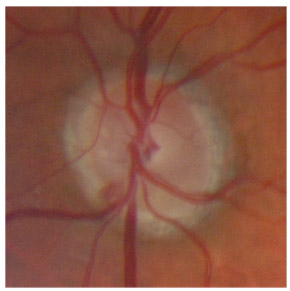
Fig. 10-73 Drusen nasales avec hémorragie papillaire.
Le GPAO de la myopie forte, déjà évoqué, fait l’objet d’un chapitre particulier (voir chapitre 13-IV). L’absence fréquente d’excavation expliquée par la position très antérieure de la lame criblée (fig. 10-74), alliée à des déficits périmétriques directement liés à la rétinochoroïdose myopique, rend difficile le diagnostic d’un GPAO surajouté, d’autant que les analyseurs peuvent rarement faire la part de ce qui revient à chacune des affections. Il semble que les FNR provenant de la rétine centrale soient plus vulnérables dans le glaucome débutant [16]. Cela dit, ces papilles souvent dysmorphiques en taille et en orientation, sans ANR bien individualisable, peuvent parfois se creuser de manière flagrante, et l’attention doit surtout se porter vers la recherche de coudures au niveau du canal scléral (fig. 10-75). Et il est heureusement des papilles de globes très myopes qui présentent un fond d’œil proche de la normale.
Retenir
-
Plus que l’observation de l’excavation, c’est l’analyse circonférentielle de l’ANR qui renseigne sur le caractère glaucomateux de la tête du NO.
-
Jusqu’à preuve du contraire, la présence d’une hémorragie papillaire confirme le glaucome, et n’est souvent repérée que sur les photographies.
-
L’atrophie parapapillaire, particulièrement sa zone β, est plus fréquente dans le glaucome, mais non spécifique.
-
La perte des FNR se repère essentiellement dans les secteurs temporaux supérieur et inférieur.
-
Les petites papilles ne se creusent que tardivement dans l’évolution du glaucome.
-
L’observateur, comme les analyseurs et la périmétrie, peut être pris en défaut en cas de dysversion papillaire, de drusen papillaires et de myopie forte.
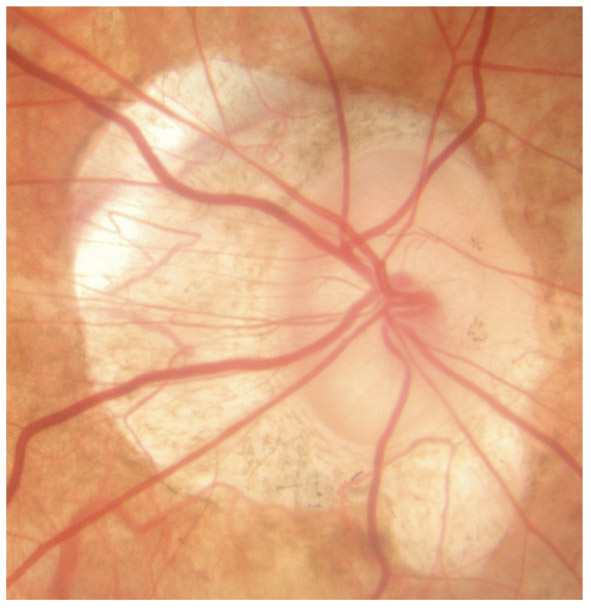
Fig. 10-74 Glaucome très évolué dans un globe très myope, sans excavation repérable.
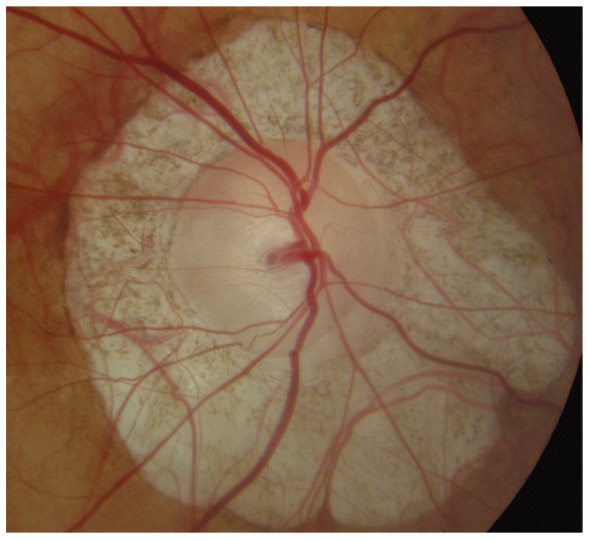
Fig. 10-75 Papille glaucomateuse dans un globe très myope, dans laquelle une excavation est repérable au pôle inférieur grâce à la coudure de la veine temporale inférieure et à un certain degré d’atrophie papillaire dans le même secteur.
[1] Airaksinen PJ. Fellow eyes of glaucomatous patients with uniocular optic disc haemorrhage. Acta Ophtalmol. 1981 ; 59 : 231-6.
[2] Airaksinen PJ, Drance SM, Douglas GR, Mawson DK. Diffused and localized nerve fiber loss in glaucoma. Am J Ophthalmol. 1984 ; 98 : 566-71.
[3] Bengtsson B, Leske MC, Yang Z, Heijl A. Disc hemorrhages and treatment in the early manifest glaucoma trial. Ophthalmology. 2008 ; 115 : 2044-8.
[4] Budenz DL, Anderson DR, Feuer WJ, et al. Ocular Hypertension Treatment Study Group. Detection and prognostic significance of optic disc hemorrhages during the Ocular Hypertension Treatment Study. Ophthalmology. 2006 ; 113 : 2137-43.
[5] De Moraes CG, Prata TS, Liebmann CA, et al. Spatially consistent localized visual field loss before and after disc hemorrhage. Invest Ophthalmol Visc Sci. 2009 ; 50 : 4727-33.
[6] Drance SM, Begg IS. Sector haemorrhage. A probable acute ischaemic disc change in chronic simple glaucoma. Can J Ophthalmol. 1970 ; 5 : 127-41.
[7] Drance S, Anderson DR, Schulzer M, et al. Risk factors for progression of visual field abnormalities in normal tension glaucoma. Am J Ophthalmol. 2001 ; 131 : 699-708.
[8] Furlanetto RL, Park SC, Damle UJ, et al. Posterior displacement of the lamina cribrosa in glaucoma : in vivo interindividual and intereye comparisons. Invest Ophthalmol Vis Sci. 2013 ; 54 : 4836-42.
[9] Gunvant P, Zheng Y, Essock EA, et al. Predicting subsequent visual field loss in glaucomatous subjects with disc hemorrhage using retinal nerve fiber layer polarimetry. J Glaucoma. 2005 ; 14 : 20-5.
[10] Heijl A, Leske MC, Bengtsson B, et al. Reduction of intraocular pressure and glaucoma progression : results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 ; 120 : 1268-79.
[11] Jonas JB. Frequency of optic disc drusen and size of the optic disc. Ophthalmology. 1997 ; 104 : 1531-32.
[12] Jonas J. Évaluation clinique du DO normal et glaucomateux. In : Schnyder C, Mermoud A (eds). Glaucome. Paris, Elsevier, 2005 : 69-81.
[13] Jonas J, Martus P, Budde WM, Hayler J. Morphologic predictive factors for development of optic disc hemorrhages in glaucoma. Invest Ophthalmol Vis Sci. 2002 ; 43 : 2956-61.
[14] Jonas JB, Nguyen XN, Gusek GC, Naumann GO. Parapapillary chorioretinal atrophy in normal and glaucoma eyes. I. Morphometric data. Invest Ophthalmol Vis Sci. 1989 ; 30 : 908-18.
[15] Jonas J, Xu L. Optic disk hemorrhages in glaucoma. Am J Ophthalmol. 1994 ; 118 : 1-8.
[16] Kimura Y, Hangai M, Morooka S, et al. Retinal nerve fiber layer defects in highly myopic eyes with early glaucoma. Invest Ophthalmol Vis Sci. 2012 ; 53 : 6472-8.
[17] Miller KM, Quigley HA. The clinical appearance of the lamina cribrosa as a function of the extent of glaucomatous optic nerve damage. Ophthalmology. 1988 ; 95 : 135-8.
[18] Lefrançois A, Barrault O, Parc C, et al. Drusen papillaire : intérêt des nouvelles imageries. J Fr Ophtalmol. 2003 ; 26 : S23-30.
[19] Quigley HA, Miller NR, George T. Clinical evaluation of nerve fiber layer atrophy as an indicator of glaucomatous optic nerve damage. Arch Ophthalmol. 1980 ; 98 : 1564-71.
[20] Sugiyama K, Uchida H, Tomita G, et al. Localized wedge-shaped defects of retinal nerve fiber layer and disc hemorrhage in glaucoma. Ophthalmology. 1999 ; 106 : 1762-67.
[21] Susanna R, Drance SM, Douglas GR. Disc hemorrhages in patients with elevated intraocular pressure. Occurrence with and without field changes. Arch Ophthalmol. 1979 ; 97 : 284-5.
H. Lemij, J.-P. Renard, E. Sellem
-
La polarimétrie à balayage laser GDx PRO™ permet d’estimer l’épaisseur de la couche des fibres nerveuses rétiniennes.
-
Son principe, fondé sur les propriétés de biréfringence de la couche des FNR, a bénéficié de nombreuses améliorations avec une sensibilité diagnostique du glaucome primitif à angle ouvert (GPAO) bien démontrée.
-
Malgré l’arrêt récent de sa production, l’interprétation des relevés doit être connue en fonction du contexte clinique propre à chaque patient.
En général, le GDx avec ECC (enhanced corneal compensation) ou GDx PRO™ permet un dépistage fiable de l’atteinte de la couche des fibres nerveuses rétiniennes (FNR).
Le GDx PRO™ présente un net avantage par rapport à la génération précédente du GDx VCC (variable corneal compensation) dont les résultats rapportent un taux important d’images de biréfringence aberrante, encore appelées « atypies » des FNR, retrouvées chez 10 à 25 % des yeux normaux et 15 à 51 % des patients glaucomateux avec une fréquence qui augmente avec l’âge, en cas de myopie, d’astigmatisme et d’épithélium rétinien peu pigmenté [1, 6, 9].
Plusieurs études rapportent la plus grande sensibilité diagnostique du GDx PRO™ dans le dépistage de l’atteinte précoce des FNR dans le GPAO. Elle est nettement supérieure à celle du GDx VCC [2, 4, 8], notamment en cas d’image atypique sévère [11] et également dans le glaucome débutant [4, 5] (fig. 10-76 et 10-77).
Dans le cas d’image de biréfringence anormale ou d’atypie, incomplètement compensée par le GDx PRO™, l’indice NFI (nerve fiber indicator) semble rester le meilleur paramètre pour reconnaître un œil affecté de GPAO [2, 4].
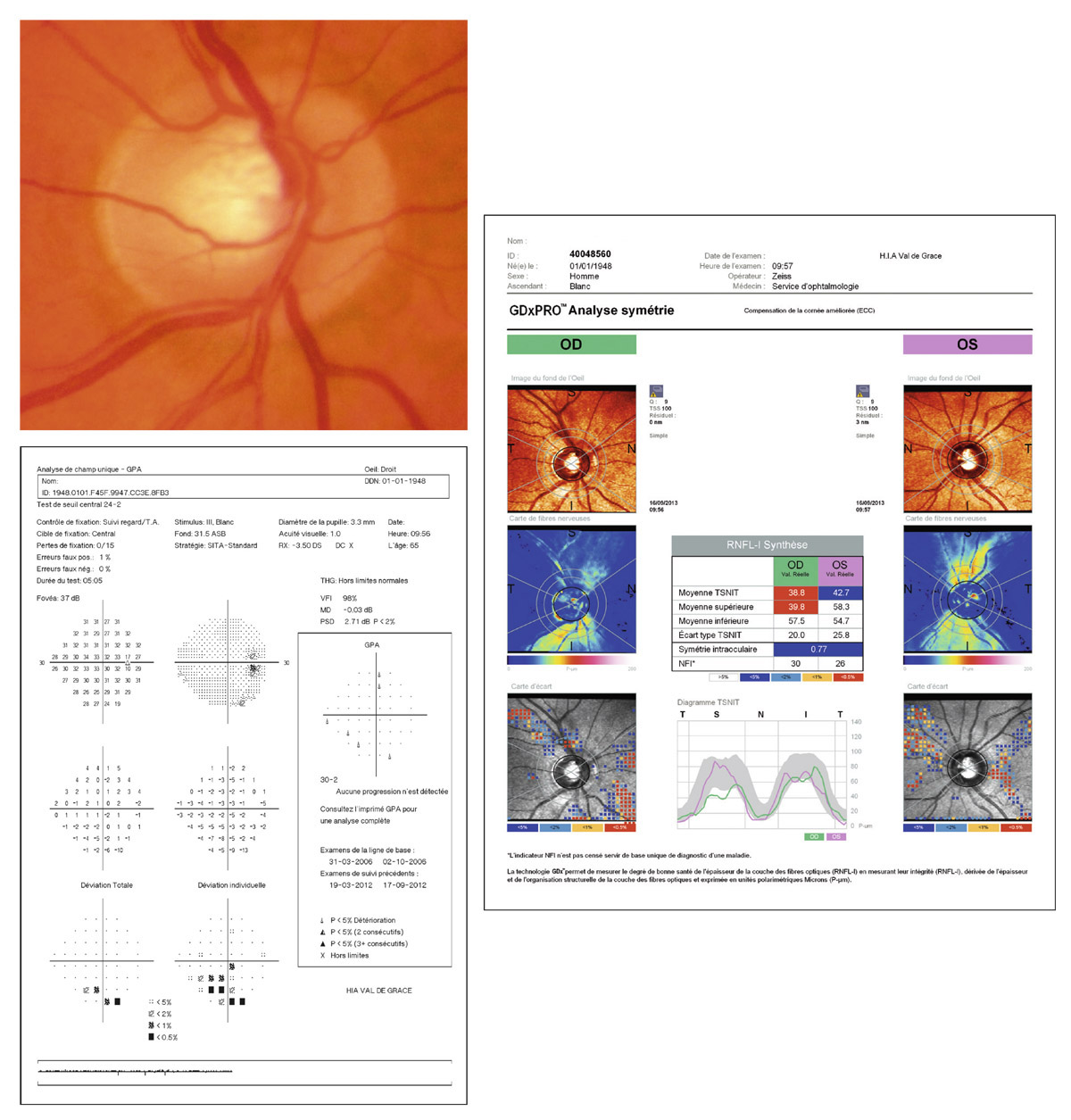
Fig. 10-76 Relevé d’analyse des FNR au GDx PRO™ dans un cas de glaucome débutant, confronté à la papille de l’œil droit et au champ visuel correspondant.
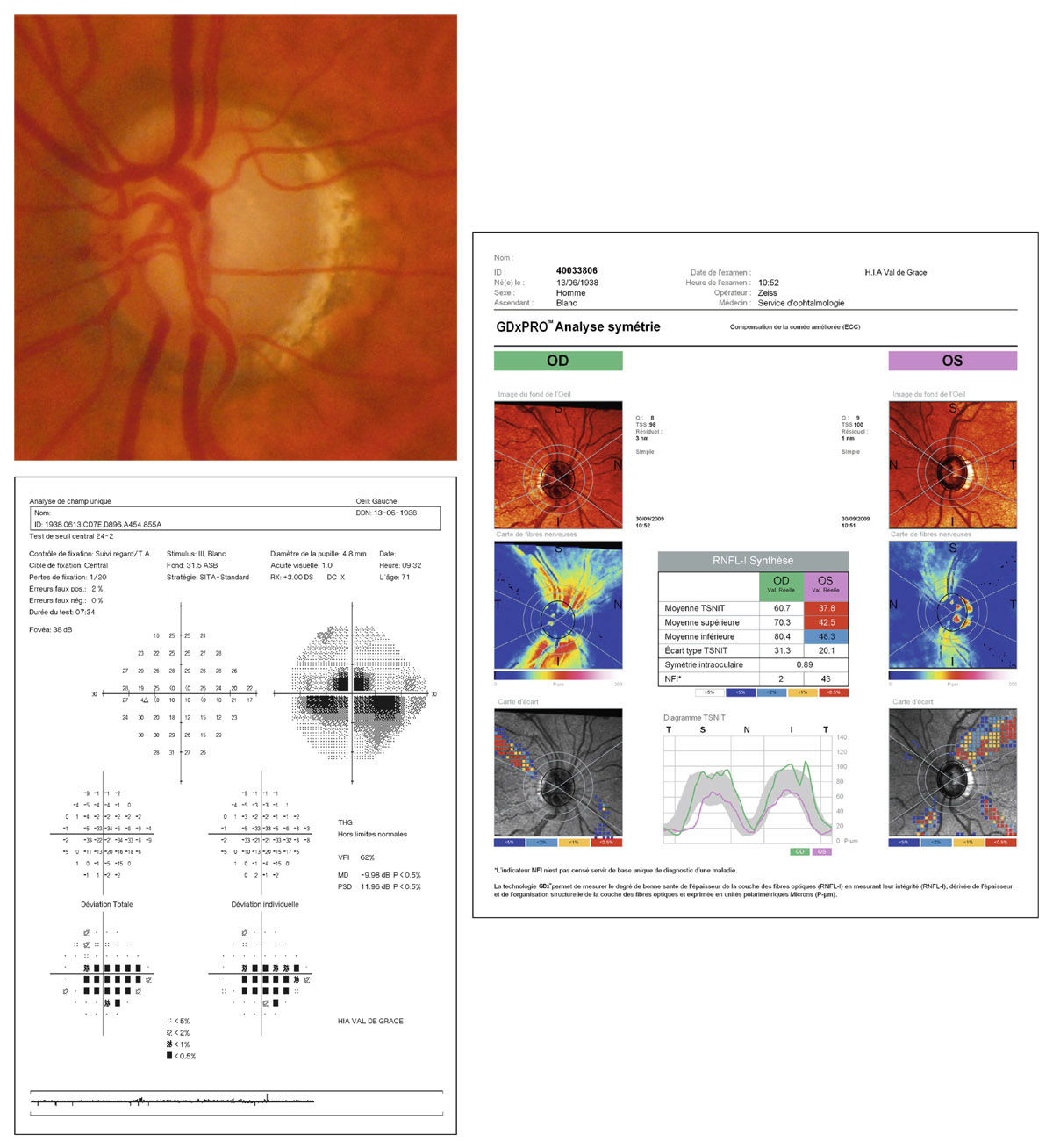
Fig. 10-77 Relevé d’analyse des FNR au GDx PRO™ dans un cas de glaucome évolué, confronté à la papille de l’œil gauche et au champ visuel correspondant.
En général, la relation entre l’atteinte structurale par l’évaluation de l’épaisseur de la couche des FNR et l’atteinte fonctionnelle en périmétrie automatisée standard (PAS) est curvilinéaire [8, 10]. Ces données indiquent une atteinte de la structure, comme celle décelée en périmétrie à balayage laser, plus facilement mise en évidence aux stades précoces du GPAO que par l’analyse de l’atteinte fonctionnelle en PAS. En revanche, les formes cliniques plus évoluées sont probablement mieux suivies par l’analyse fonctionnelle que par les mesures structurales. Les études de l’atteinte des FNR en GDx ECC ou GDx PRO™ rapportent une plus grande corrélation entre structure et fonction par rapport au GDx VCC [3, 11].
Comme pour toutes les techniques d’imagerie automatisée de l’analyse des FNR à notre disposition, les résultats relevés au GDx PRO™ doivent être interprétés après une confrontation des données de l’examen clinique et de l’analyse de l’atteinte fonctionnelle [7].
Les techniques d’imagerie en tomographie par cohérence optique ont actuellement largement dépassé les évaluations de la couche des FNR par la polarimétrie à balayage laser qui lui a cédé la place en pratique clinique courante pour le diagnostic de l’atteinte structurale dans le GPAO.
Retenir
-
La sensibilité diagnostique du GDx PRO™ est plus grande que celle du GDx VCC dans le dépistage de l’atteinte précoce des FNR dans le GPAO.
-
L’indice NFI est le meilleur paramètre pour reconnaître un œil affecté de GPAO en cas d’image de biréfringence anormale ou d’atypie incomplètement compensée par le GDx PRO™.
-
Les formes évoluées de GPAO sont mieux suivies par l’analyse fonctionnelle que par les mesures structurales.
-
La tomographie par cohérence optique a maintenant dépassé les évaluations de la couche des FNR par le GDx, qui n’est plus commercialisé.
[1] Lemij HG, Reus NJ. New developments in scanning laser polarimetry. Curr Opin. 2008 ; 19 : 136-40
[2] Mai TA, Reus NJ, Lemij HG. Diagnostic accuracy of scanning laser polarimetry with enhanced versus variable corneal compensation. Ophthalmology. 2007 ; 114 : 1988-93.
[3] Mai TA, Reus NJ, Lemij HG. Structure-function relationship is stronger with enhanced corneal compensation than with variable corneal compensation in scanning laser polarimetry. Invest Ophthalmol Vis Sci. 2007 ; 48 : 1651-1658.
[4] Medeiros FA, Bowd C, Zangwill LM, et al. Detection of glaucoma using scanning laser polarimetry with enhanced corneal compensation. Invest Ophthalmol Vis Sci. 2007 ; 48 : 3146-53.
[5] Na JH, Lee KS, Lee JR, et al The glaucoma detection capability of SD-OCT and GDx-VCC deviation maps in early glaucoma patients with localized visual field defects. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 2371-82.
[6] Renard JP, Giraud JM. Glaucomes. Imagerie de la structure : HRT, GDx et OCT. J Fr Ophtalmol. 2006 ; 29 : 64-73
[7] Reus NJ, Lemij HG. The relationship between standard automated perimetry and GDx VCC measurements. Invest Ophthalmol Vis Sci. 2004 ; 45 : 840-5.
[8] Reus NJ, Zhou Q, Lemij HG. Enhanced imaging algorithm for scanning laser polarimetry with variable corneal compensation. Invest Ophthalmol Vis Sci. 2006 ; 47 : 3870-77.
[9] Saito H, Tomidokoro A, Yanagisawa M, et al. Scanning laser polarimetry with enhanced corneal compensation in patients with open angle glaucoma. J Glaucoma. 2008 ; 17 : 24-9.
[10] Schlottmann PG, De Cilla S, Greenfield DS, et al. Relationship between visual field sensitivity and retinal nerve fiber alyer thickness as measured by scanning laser polarimetry. Invest Ophthalmol Vis Sci. 2004 ; 45 : 1823-29.
[11] Sehi M, Guaqueta DC, Feuer WJ, et al. Scanning laser polarimetry with variable and enhanced corneal compensation in normal and glaucomatous eyes. Am J Ophthalmol. 2007 ; 143 : 272-9.
J.-F. Rouland
-
La sensibilité et la spécificité de l’examen par le Heidelberg Retina Tomograph (HRT) chez des patients suspects ou glaucomateux avérés sont excellentes pour l’analyse de la papille optique, mais peu informatives pour l’analyse de la couche des fibres nerveuses rétiniennes.
-
La place de l’HRT comme examen clé du dépistage du glaucome est limitée.
-
En revanche, de grandes études l’ont utilisé comme outil de quantification des paramètres papillaires.
L’HRT est un appareil destiné principalement à l’analyse de la tête du nerf optique. L’évaluation de l’épaisseur de la couche des fibres nerveuses rétiniennes (FNR) qu’il donne ne correspond pas à une mesure objective de celle-ci.
L’HRT est un instrument destiné aux mesures des paramètres de la tête du nerf optique et est moins adapté à l’exploration de la couche des FNR.
Dans la littérature [2, 4, 8-10, 13], la sensibilité de l’examen de la papille optique est estimée entre 86 et 93 % et la spécificité entre 75 et 92 % (IC95 %). La sensibilité de l’HRT est meilleure que celle de l’examen ophtalmoscopique, des rétinophotographies de la papille et des FNR avec filtres interférentiels. Elle est équivalente à celle des mesures du champ visuel standard et de la périmétrie à doublage de fréquence (FDT).
La sensibilité de l’examen de la couche des FNR est estimée entre 24 et 35 % pour une spécificité de 87 % (IC95 %). Ces résultats sont très inférieurs à ceux obtenus par la tomographie à cohérence optique (OCT).
Les facteurs qui influencent la sensibilité et la spécificité de l’examen sont la valeur de la déviation standard topographique (inférieure à 20) et la qualité de la détermination de la ligne de contour.
Pour l’analyse de la papille optique, si l’on compare les mesures obtenues par OCT-spectral domain et HRT, il existe une différence significative pour tous les paramètres. L’OCT donne des valeurs inférieures à celles de l’HRT dans la majorité des études publiées.
Cela confirme l’impossibilité de comparer l’évolution d’une papille optique glaucomateuse par des examens successifs réalisés par des principes optiques différents.
Est-il envisageable de dépister une atteinte glaucomateuse de la papille optique uniquement par l’HRT ?
Au cours des premières années d’utilisation de l’HRT 2, la littérature confirmait la capacité de discrimination patient sain/patient glaucomateux [1, 14]. Si l’on se fonde sur une spécificité de 97,5 %, qui est la valeur communément retenue dans les études épidémiologiques, la sensibilité de l’HRT est insuffisante [3]. Ces résultats ont été confirmés dans des études sur différentes ethnies [11].
De surcroît, les troubles des milieux et les fortes amétropies, notamment myopiques, ne sont pas toujours compatibles avec des mesures fiables [16].
Il ne semble donc pas réaliste de baser un dépistage de l’atteinte glaucomateuse de la tête du nerf optique sur ce seul examen [6].
En revanche, il est très souvent utilisé dans de grandes études (OHTS) [15] comme instrument de mesure des paramètres de la papille optique [5, 7, 12]. Il confirme sa place dans la quantification initiale de la papille optique et sa capacité de reproductibilité indispensable pour le suivi des patients dans ces grandes études épidémiologiques (cas clinique 10-1 ; eCas cliniques 10-1 à 10-4).
Cas clinique 10-1
Glaucome débutant (fig. 10-78 à 10-82)
Madame B., 52 ans, consulte pour confirmer un diagnostic de GPAO récemment diagnostiqué. La PIO sans traitement est de 25 mmHg aux deux yeux (pachymétrie : 540 μm).
Conclusion : GPAO débutant. Les déficits sont plus sévères pour l’HRT que sur le champ visuel.
Retenir
-
Le grand nombre de données stéréométriques et leurs sensibilité et spécificité permettent à l’HRT d’être un examen de référence pour la quantification objective de la papille optique.
-
Cette qualité de mesure a permis à l’HRT d’être l’examen de référence pour de grandes études épidémiologiques dont l’OHTS.
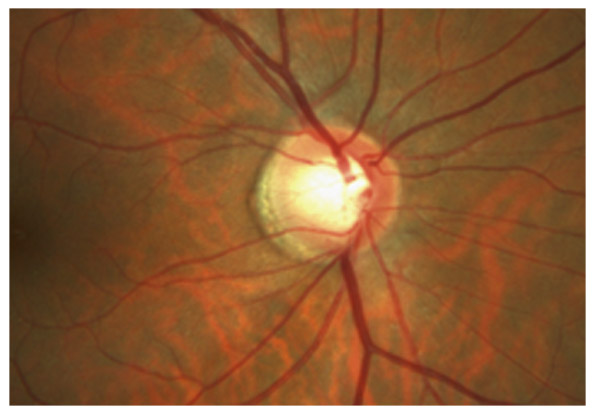
Fig. 10-78 Cliché en couleur de la tête du nerf optique droite.
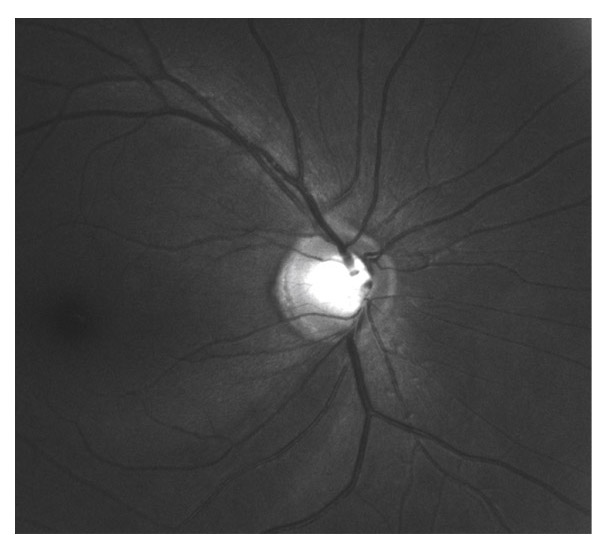
Fig. 10-79 Cliché en lumière bleue : perte en FNR temporale inférieure en regard de l’encoche et fin faisceau déficitaire en temporal supérieur.
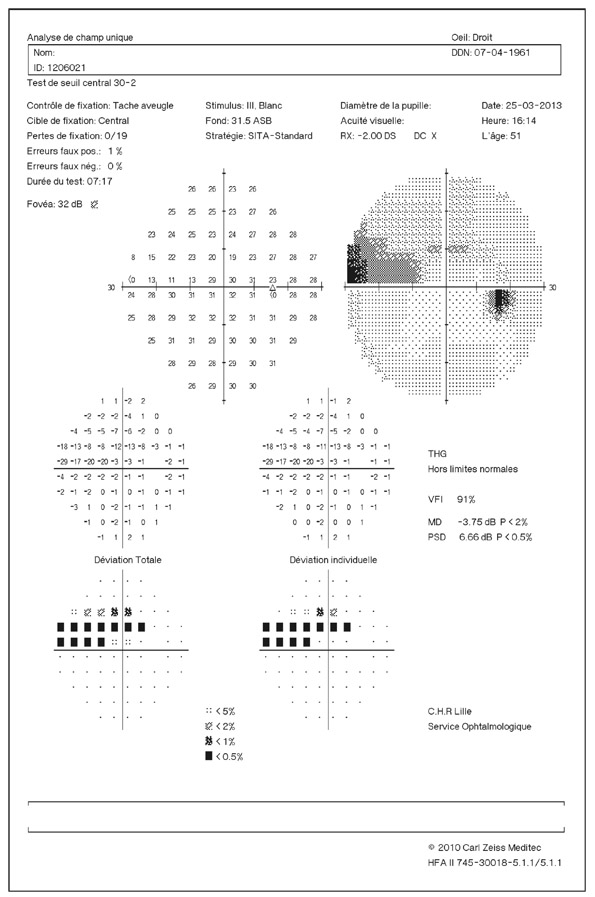
Fig. 10-80 Champ visuel Humphrey Sita de l’œil droit : encoche nasale supérieure. VFI : 91 %.
Fig. 10-81 Tracé de l’HRT 3 : critère de fiabilité correct. Papille de 2 mm2. Atteinte nasale et temporale inférieure.
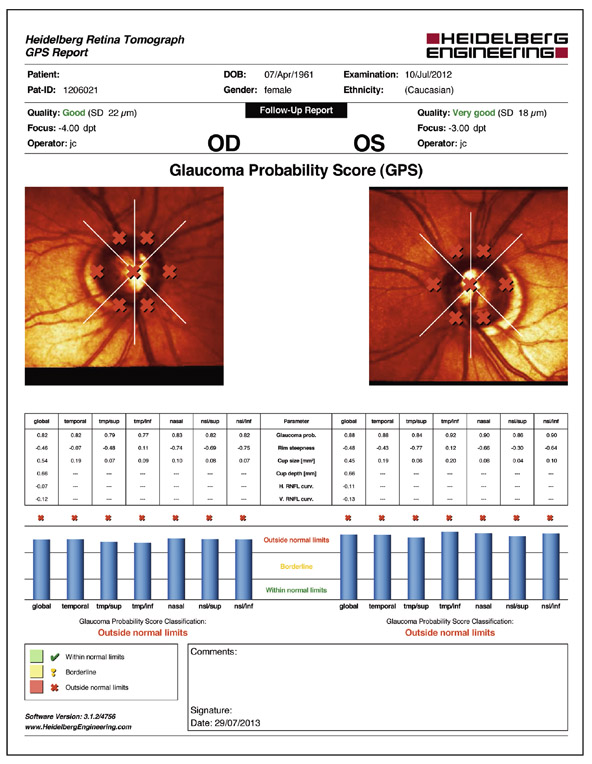
Fig. 10-82 Tracé du score de probabilité de glaucome : tracé pathologique dans tous les secteurs.



eCas clinique 10-1 Glaucome pré-périmétrique
Fig. A Monsieur D., 65 ans, est adressé pour bilan d’une excavation papillaire bilatérale dans un contexte de PIO aux limites de la normale.
L’acuité visuelle est de 10/10 avec correction. L’angle est ouvert.
La PIO est mesurée à 20 mmHg (pachymétrie de 560 μm) sans traitement.
L’examen clinique retrouve une papille légèrement pâle avec une excavation papillaire à pente douce. L’anneau neurorétinien est régulier.
Fig. B Cliché en lumière bleue : discret pinceau de pertes en FNR en temporal supérieure ?
Fig. C Champ visuel Humphrey Sita de l’œil droit : critère de fiabilité limite (25 % de perte de fixation). VFI : 99 %. Examen du champ visuel droit normal.




eCas clinique 10-2 Glaucome évolué
Fig. A Monsieur G., 66 ans, se présente aux urgences pour une sensation de baisse de l’acuité visuelle bilatérale plus marquée à l’œil gauche.
L’acuité visuelle est de 10/10 à droite et 5/10 non améliorable à l’œil gauche (correction myopique de – 2 dioptries).
La PIO est 28 mmHg (pachymétrie de 500 μm).
L’angle est ouvert. L’examen clinique de la papille optique retrouve une papille pâle et très excavée.
Fig. B Le champ visuel Humphrey Sita de l’œil gauche : VFI 29 %, MD – 20,23 dB. Déficit nasal absolu affleurant l’axe visuel.
Fig. C Tracé de l’HRT 3 : critère de fiabilité très bon. Papille de 3,03 mm2 (très grande papille). L’analyse de régression de Moorsfield confirme l’altération majeure de la papille optique dans tous les secteurs.
Fig. D Tracé du score de probabilité de glaucome : tracé pathologique dans tous les secteurs.
Conclusion : GPAO à un stade avancé survenant sur une papille de grande taille et une cornée fine qui ont probablement retardé le diagnostic. L’HRT confirme l’atteinte de la fonction et servira de base au suivi.








eCas clinique 10-3 Asymétrie papillaire
Fig. A Madame L., 54 ans, est adressée pour bilan d’une asymétrie papillaire.
L’acuité visuelle est de 10/10 aux deux yeux (réfraction myopie de – 2D). La PIO est de 14 mmHg aux deux yeux (pachymétrie : 540 μm). L’angle est ouvert.
L’examen clinique note une papille droite avec une excavation arrondie et un anneau neurorétinien respectant la règle ISNT.
Fig. B L’examen de la papille gauche confirme l’asymétrie papillaire : la papille optique gauche est pratiquement sans excavation.
Fig. C Cliché en lumière bleue de la papille optique droite : normal.
Fig. D Cliché en lumière bleue de la papille optique gauche : la zone supérieure est plus sombre (déficits en FNR ?).
Fig. E Champ visuel Humphrey Sita de l’œil droit : examen du champ visuel droit normal.
Fig. F Champ visuel Humphrey Sita de l’œil gauche : examen du champ visuel gauche normal.
Fig. G Tracé de l’HRT 3 : critère de fiabilité très bon. Papille droite de 1,53 mm2 et de 1,56 mm2 à gauche (pas de différence de taille de la papille pouvant expliquer l’asymétrie). L’analyse de régression de Moorsfield retrouve une zone limite en nasal à droite et nasal inférieur à gauche.
Fig. H Tracé du score de probabilité de glaucome : tracé anormal dans tous les secteurs à droite et limite pour tous les secteurs à gauche.
Conclusion : l’asymétrie de l’excavation papillaire plus marquée à l’œil droit ne s’associe pas à une atteinte papillaire, aussi bien pour la fonction que pour la structure.
Le tracé du score de probabilité de glaucome montre ses limites dans ce cas. L’analyse de régression de Moorsfield normale est retenue. Au total, asymétrie papillaire physiologique.







eCas clinique 10-4 Dysversion papillaire
Fig. A Papille optique droite : dysversion papillaire avec petit colobome inférieur et atrophie sectorielle inférieure.
Fig. B Papille optique gauche : dysversion papillaire avec colobome moins marqué en inférieur et grande plage d’atrophie inférieure.
Fig. C Tracé de l’HRT 3 : l’analyse de régression du Moorsfield est certes perturbée par le colobome inférieur mais permet une quantification des paramètres papillaires.
Fig. D Papille optique droite : dysversion papillaire avec vergence nasale des vaisseaux. Zones α et β en temporal.
Fig. E Papille de l’œil gauche : dysversion papillaire avec vergence nasale des vaisseaux. Zones α et β en temporal.
Fig. F Tracé de l’HRT 3 : résultats non interprétables à gauche et peu instructifs à droite par l’analyse de régression du Moorsfield.
Fig. G Résultat du score de probabilité de glaucome : examen normal pour tous les secteurs.
Conclusion : les malformations papillaires, comme les dysversions papillaires, peuvent être analysées par l’HRT. En confrontant l’analyse de régression du Moorsfield et le score de probabilité de glaucome, on peut obtenir de précieux renseignements et confirmer ou non une atteinte glaucomateuse.
[1] Burgansky-Eliash Z, Wollstein G, Bilonick RA, et al. Glaucoma detection with the Heidelberg retina tomograph 3. Ophthalmology. 2007 ; 114 : 466-71.
[2] Geimer SA. Glaucoma diagnostics. Acta Ophthalmol. 2013 ; 91 : 1-32.
[3] Healey PR, Lee AJ, Aung T, et al. Diagnostic accuracy of the Heidelberg Retina Tomograph for glaucoma a population-based assessment. Ophthalmology. 2010 ; 117 : 1667-73.
[4] Leung CK, Ye C, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography a study on diagnostic agreement with Heidelberg Retinal Tomograph. Ophthalmology. 2010 ; 117 : 267-74.
[5] Li H, Healey PR, Tariq YM, et al. Symmetry of optic nerve head parameters measured by the heidelberg retina tomograph 3 in healthy eyes : the Blue Mountains Eye study. Am J Ophthalmol. 2013 ; 155 : 518-23.
[6] Lisboa R, Leite MT, Zangwill LM, et al. Diagnosing preperimetric glaucoma with spectral domain optical coherence tomography. Ophthalmology. 2012 ; 119 : 2261-9.
[7] Moore GH, Bowd C, Medeiros FA, et al. African descent and glaucoma evaluation study : asymmetry of structural measures in normal participants. J Glaucoma. 2013 ; 22 : 65-72.
[8] Moreno-Montanes J, Anton A, Garcia N, et al. Comparison of retinal nerve fiber layer thickness values using Stratus Optical Coherence Tomography and Heidelberg Retina Tomograph-III. J Glaucoma. 2009 ; 18 : 528-34.
[9] Mowatt G, Burr JM, Cook JA, et al. OAGS Project. Screening tests for detecting open-angle glaucoma : systematic review and meta-analysis. Invest Ophthalmol Vis Sci. 2008 ; 49 : 5373-85.
[10] Saarela, V., A. Falck, P.J. Airaksinen, and A. Tuulonen, Factors affecting the sensitivity and specificity of the Heidelberg Retina Tomograph parameters to glaucomatous progression in disc photographs. Acta Ophthalmol, 2012. 90(2) : p. 132-8.
[11] Saito H, Tsutsumi T, Araie M, et al. Sensitivity and specificity of the Heidelberg Retina Tomograph II Version 3.0 in a population-based study : the Tajimi Study. Ophthalmology. 2009 ; 116 : 1854-61.
[12] Seider MI, Lee RY, Wang D, et al. Optic disk size variability between African, Asian, white, Hispanic, and Filipino Americans using Heidelberg retinal tomography. J Glaucoma. 2009 ; 18 : 595-600.
[13] Toth M, Kothy P, Hollo G. Accuracy of scanning laser polarimetry, scanning laser tomography, and their combination in a glaucoma screening trial. J Glaucoma. 2008 ; 17 : 639-46.
[14] Yip LW, Mikelberg FS. A comparison of the glaucoma probability score to earlier heidelberg retina tomograph data analysis tools in classifying normal and glaucoma patients. J Glaucoma. 2008 ; 17 : 513-6.
[15] Zangwill LMW. Use of the Heidelberg Retina Tomograph (HRT) in the Ocular Hypertension Treatment Study (OHTS). In : Fingeret MF, Liebmann JG (eds). The Essential HRT Primer. San Ramon, CA, Heidelberg Engineering, 2005 : 85-91.
[16] Zheng Y, Cheung CY, Wong TY, et al. Determinants of image quality of Heidelberg Retina Tomography II and its association with optic disc parameters in a population-based setting. Am J Ophthalmol. 2011 ; 151 : 663-70.
J.-P. Renard, J.-R. Fénolland, M. Delbarre
-
Les indications d’une imagerie par OCT sont les suivantes :
-
le patient suspect de glaucome et le suivi du patient hypertone ;
-
le suivi d’un glaucome pour compléter l’évaluation d’une progression de l’atteinte structurale.
-
-
L’analyse structurale, en cas de champs visuels peu fiables, est importante.
-
Les acquisitions maculaires (ganglion cell complex ou GCC), péripapillaires et de la tête du nerf optique (TNO) sont complémentaires avec un intérêt plus spécifique et différent de chaque type de relevé dans le diagnostic initial et également en fonction du stade clinique du glaucome primitif à angle ouvert (GPAO).
-
Intérêt des acquisitions GCC dans certaines formes cliniques : papilles « difficiles », dysversion, atrophie péripapillaire, myopie forte, etc.
-
Les appareils ne sont pas interchangeables.
-
Une décision thérapeutique ne doit pas être prise uniquement sur l’aspect anormal d’une imagerie en OCT, mais sur un cortège d’arguments cliniques et paracliniques.
Les acquisitions en OCT-spectral domain (SD) fournissent des vues sans précédent des lésions glaucomateuses, permettant la détection et précisant l’évolution des lésions structurales dans le GPAO. Les nouveaux algorithmes des OCT-SD complètent l’évaluation de la couche des fibres nerveuses rétiniennes (FNR) par la possibilité d’obtenir des données quantitatives plus précises des caractéristiques de la TNO et du complexe maculaire cellulaire ganglionnaire.
La plus grande capacité de résolution axiale des OCT-SD, de l’ordre de 3 à 5 microns, permet, grâce à une segmentation intrarétinienne plus fine, une évaluation séparée plus performante des différentes couches de la rétine. Les études rapportent une bonne reproductibilité des examens avec un faible coefficient de variation des mesures entre deux examens, de seulement 2 à 3 % chez les sujets normaux ainsi que chez les patients présentant un glaucome précoce.
Les nouvelles générations d’OCT-SD parviennent à une nette amélioration de la reproductibilité des examens, permettant ainsi de réduire de façon importante les variations intra-individuelles de l’évaluation de l’atteinte structurale [14, 15, 47].
Si l’analyse des FNR péripapillaires représente le paramètre le plus largement utilisé actuellement, il faut souligner la grande variabilité interindividuelle des caractéristiques structurales qui peuvent être relevées avec les techniques d’imagerie au sein des sujets normaux. Sa connaissance est nécessaire pour comprendre les capacités diagnostiques de l’analyse des FNR dans le GPAO et leurs limites.
RAPPELS CHEZ LE SUJET NORMAL
Les études rapportent chez les sujets normaux une variation des mesures des paramètres des FNR évalués avec les différents OCT [19, 57] avec des valeurs moyennes de l’épaisseur de la couche des FNR péripapillaires globalement de 89,8 à 113 μm [3, 19, 27, 33, 47, 57, 75] (voir chapitre 9-IV paragraphe « Tomographie par cohérence optique (OCT) – Méthode d’examen : technique et interprétation »). Les résultats obtenus ne sont donc pas interchangeables aussi bien entre les différents OCT-SD qu’avec les OCT-time domain (TD). À côté de ces variations relatives interindividuelles chez les sujets de même âge et interappareils, d’autres facteurs de variations doivent être connus :
-
l’âge : l’amincissement progressif de la couche des FNR en fonction de l’âge retrouvé en OCT-TD [4, 49] et OCT-SD [3] n’a pas été chiffré de façon précise à ce jour, et il est source de difficultés pour le différencier d’une authentique atteinte des FNR et de sa progression (voir chapitre 11-II) ;
-
la taille du disque optique : en cas de disque optique de grand diamètre, la taille constante du cercle de mesure péripapillaire, selon un diamètre de 3,46 mm pour l’évaluation de la valeur de l’épaisseur de la couche des FNR, permet de comprendre la plus grande épaisseur mesurée de la couche des FNR. La mesure plus proche du bord du disque optique concerne des zones d’épaisseur maximale des FNR, comme cela a bien été démontré par les études histologiques [3, 24, 58] ;
-
la longueur axiale : l’épaisseur de la couche des FNR, rapportée plus faible chez les patients myopes et plus élevée chez les patients hypermétropes, pourrait être liée à un effet de magnification optique [25, 31, 56]. L’acquisition d’un scan-B circulaire péripapillaire de 12° donne une projection d’environ 3,40 mm chez le sujet emmétrope. Le diamètre du scan-B projeté sur le fond d’œil augmente avec la longueur axiale et se situe au-delà de 3,40 mm avec pour corollaire une mesure plus fine de l’épaisseur de la couche des FNR. Le phénomène est inverse en cas de longueur axiale plus courte. L’amétropie doit donc toujours être considérée dans l’interprétation de l’analyse.
PERFORMANCE DIAGNOSTIQUE DANS LE GPAO
Toutes les études cliniques confirment les bonnes capacités diagnostiques de l’analyse des FNR en OCT dans le GPAO [5, 8, 23, 33, 37, 51, 61, 69] avec une plus grande sensibilité de l’OCT-SD rapportée par certains auteurs dans la classification des patients glaucomateux [4, 69]. Ces résultats concernent cependant des populations variées de patients sans toujours préciser le stade clinique de la neuropathie, et les données concernant les formes cliniques précoces du GPAO sont rares.
Glaucome pré-périmétrique
La carte des épaisseurs des retinal nerve fiber layers (RNFL), lorsqu’elle est disponible, doit être examinée avec attention sur toute sa surface à la recherche d’un déficit débutant, sur l’échelle colorimétrique, souvent en périphérie, au sein des zones les plus épaisses de la couche des FNR (couleurs chaudes jaune-rouge), en particulier dans le secteur temporal inférieur, plus fréquemment atteint au stade débutant [20]. Il se présente en général sous la forme d’une encoche ou d’une « image en coin » (couleur plus claire) faisant irruption en périphérie (fig. 10-83).
L’analyse de la carte des écarts ou carte des déviations recherche une atteinte correspondante dans le même secteur.
L’observation attentive du tracé TSNIT s’attachera à déceler une anomalie prédominante également dans le secteur temporal inférieur, en particulier sur le méridien de 7 heures pour un œil droit et de 5 heures pour un œil gauche (voir fig. 10-83).
Les valeurs numériques des épaisseurs moyennes sectorielles et méridiennes des FNR du relevé ne permettent pas, dans l’état actuel de nos connaissances, un diagnostic assuré d’atteinte structurale de glaucome pré-périmétrique ni celui de glaucome précoce débutant en raison, en partie, des variations interindividuelles déjà évoquées de l’épaisseur de la couche des FNR (voir fig. 10-83).
L’étude des cartographies d’épaisseur des FNR s’oriente vers de nouveaux logiciels fondés sur le principe d’une segmentation en « super-pixels » avec une analyse comparant des cartographies 3D à celles d’une base de référence qui serait d’une plus grande sensibilité diagnostique [77].
Glaucome débutant à modéré
Un recouvrement des mesures structurales caractéristiques de l’épaisseur de la couche des FNR entre certains yeux normaux et des lésions débutantes doit être connu. Nous avons vu les limites de l’interprétation de la représentation colorimétrique de l’analyse des données qui ne prennent pas en compte toutes les variations de la distribution des valeurs normales au sein de la population. La détection d’une atteinte débutante isolée de la couche des FNR en OCT reste donc difficile et son affirmation doit être prudente.
Ici encore, l’observation attentive de toute la surface d’acquisition des cartes d’épaisseur a bien démontré son intérêt dans le dépistage précoce d’un déficit des FNR, comme nous le verrons dans la surveillance de sa progression (fig. 10-84). Dans la majorité des cas, cette dernière se caractérise par un élargissement, plus fréquent qu’un approfondissement du déficit initial [34].
L’analyse de la courbe TSNIT garde tout son intérêt pour la recherche d’une atteinte débutante marquée par une déflexion localisée du tracé qui peut s’accentuer rapidement dans certains cas.
Les paramètres numériques de l’épaisseur de la couche des FNR ont un intérêt diagnostique limité dans ces stades cliniques débutants en raison de la dispersion des valeurs normales. Leurs valeurs doivent cependant être relevées dans le dossier du patient pour le suivi de l’évolution (voir chapitre 11-II, paragraphe « Évaluation de la progression de l’atteinte structurale »).
Les nouveaux logiciels d’acquisition ont nettement amélioré les performances de détection d’une atteinte. Ils offrent également l’avantage d’obtenir, dans le cadre du bilan initial, une base de données structurales, importante pour le suivi de l’évolution (voir fig. 10-84).
La performance diagnostique des acquisitions OCT dans le glaucome modéré a largement été rapportée.
Les récents travaux ont bien montré que les études péripapillaires du disque optique en OCT-SD démontrent typiquement que l’amincissement des FNR dans les quadrants supérieur et inférieur du disque est une mesure plus sensible [32].
Ces résultats sont en étroite corrélation avec le modèle schématique de l’atteinte précoce des FNR établi par Hood et al. [17] dans la zone la plus épaisse de la couche des FNR péripapillaires. Ce secteur péripapillaire temporal inférieur est connu pour être particulièrement vulnérable aux lésions glaucomateuses précoces, avec une localisation préférentielle des hémorragies du disque optique, plus fréquentes en cas de GPAO [17] (fig. 10-85).
Il a bien été démontré que l’analyse des glaucomes précoces et des patients suspects de glaucome rapporte une plus faible corrélation des résultats de l’OCT avec le niveau de sensibilité relevé au champ visuel que celle réalisée en cas de glaucome modéré plus sévère en raison d’une variation de sensibilité fonctionnelle plus étroite dans les formes débutantes du GPAO [1, 32, 53].
La corrélation entre l’atteinte structurale et l’atteinte fonctionnelle a également été évaluée avec les autres techniques d’imagerie de la couche des FNR. Horn et al. [18] ont notamment comparé les résultats de corrélation entre les déficits du champ visuel et l’amincissement de la couche des FNR relevé en polarimétrie à balayage laser (GDx VCC, Carl Zeiss Meditec, États-Unis) [18, 44]. La corrélation entre déficit périmétrique et amincissement en FNR reste plus forte pour l’OCT-SD que pour le GDx.
Enfin, on retiendra que la variabilité des mesures de la couche des FNR en OCT-SD est plus faible pour la mesure de l’épaisseur moyenne de la couche des FNR que pour les mesures par quadrant (avec des variations de l’épaisseur moyenne de la couche des FNR qui peuvent s’étendre de 5,8 à 18,9 μm) [47].
Glaucome évolué
Dans le glaucome évolué, les déficits de la couche des FNR à l’examen OCT sont importants. Dans les glaucomes sévères associés à une atteinte fonctionnelle importante (VFI < 70 %), la sensibilité et la spécificité diagnostiques rapportées par l’OCT RTVue sont très élevées [54] (fig. 10-86).
À partir d’un certain stade évolutif très avancé, l’analyse des FNR péripapillaires atteint un effet dit « plancher », correspondant à un seuil à partir duquel l’expression des résultats se fait selon un code maximal d’anomalie au-delà duquel l’évaluation des FNR reste à une valeur minimale, de l’ordre de 40 à 50 μm, correspondant à une couche résiduelle de tissu glial, comme cela a bien été démontré par les études histologiques de Quigley, et au-delà duquel la progression ne peut pas être exprimée par ce type de résultat (fig. 10-87).
L’évaluation fonctionnelle de l’atteinte du champ visuel peut alors être plus intéressante pour le suivi des pertes glaucomateuses dans ces formes cliniques sévères.
Les OCT-SD utilisent des protocoles d’acquisition différents et des algorithmes non comparables d’un appareil à l’autre, comme nous l’avons vu dans le chapitre 9-IV paragraphe « Principes de l’OCT ». Il faut retenir que les résultats obtenus par ces différents appareils ne doivent pas être comparés et ne sont pas interchangeables d’un appareil à l’autre avec les différents OCT-SD [8, 16, 27, 52, 69, 75].
Le suivi de la progression chez un patient doit être effectué avec le même OCT-SD.
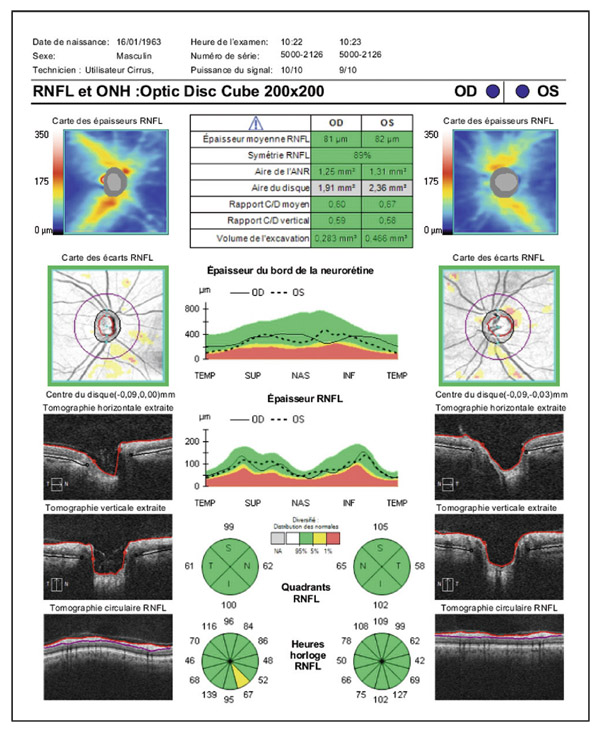
Fig. 10-83 Glaucome pré-périmétrique. Relevé OCT : analyse des FNR avec atteinte débutante au-delà du cercle de mesure habituel dans le secteur temporal inférieur de l’œil gauche.
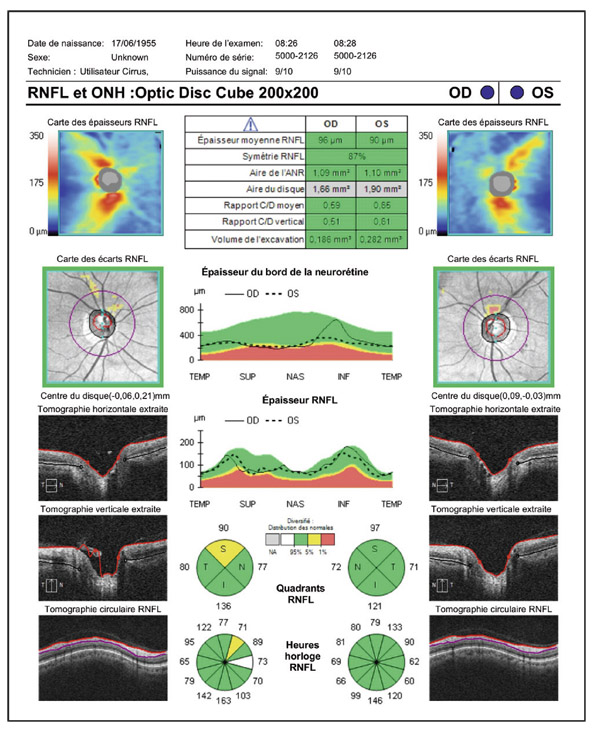
Fig. 10-84 Glaucome débutant. Relevé OCT : analyse des FNR (atteinte débutante confirmée dans le secteur temporal supérieur de l’œil droit).
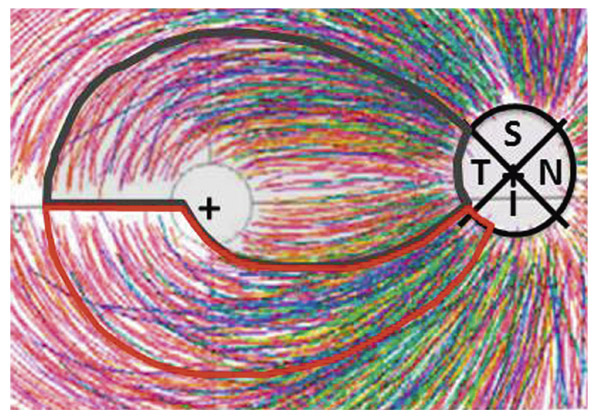
Fig. 10-85 Modèle schématique de la projection des lésions glaucomateuses des cellules ganglionnaires et de la couche des FNR. Ce modèle schématique superpose le tracé des lésions des CGR et des FNR. (D’après Hood et al. [17]. Reproduit avec autorisation.)
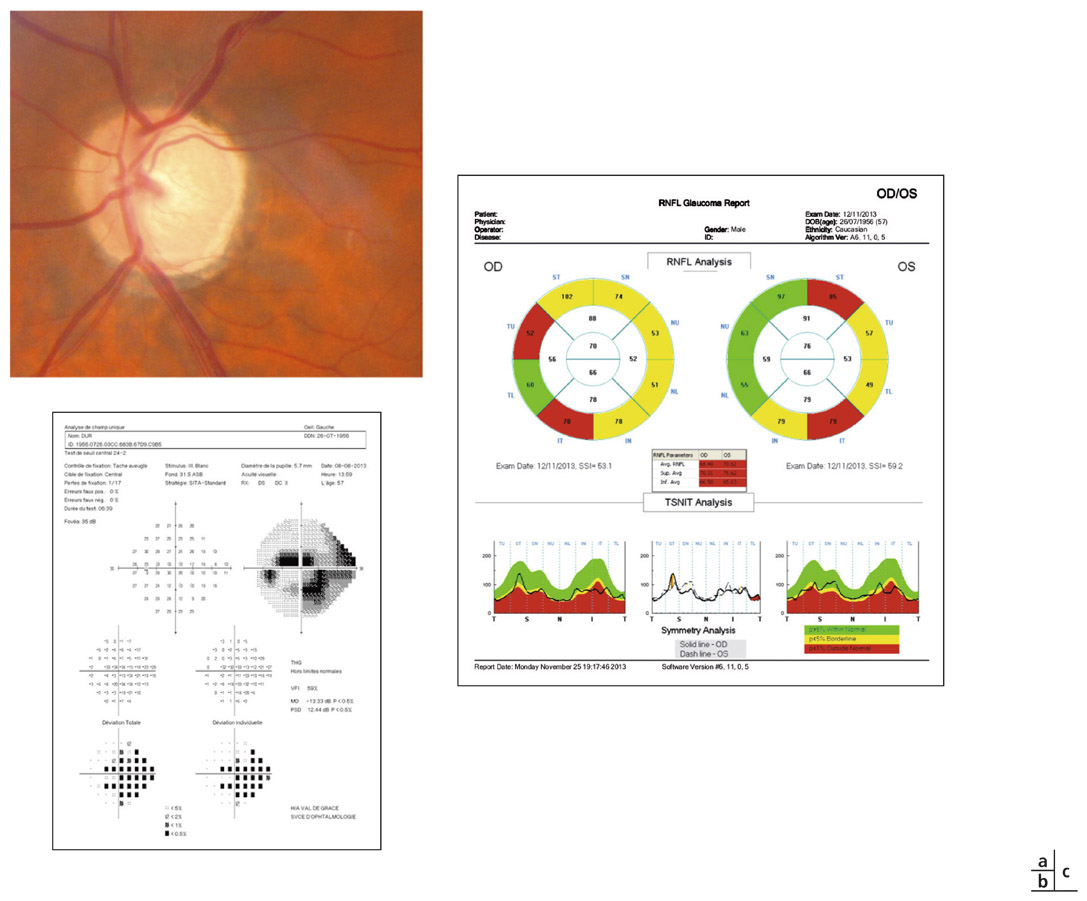
Fig. 10-86 Glaucome évolué. a. Rétinophotographie de papille. b. Relevé du champ visuel. c. Relevé OCT RTVue : analyse des FNR.
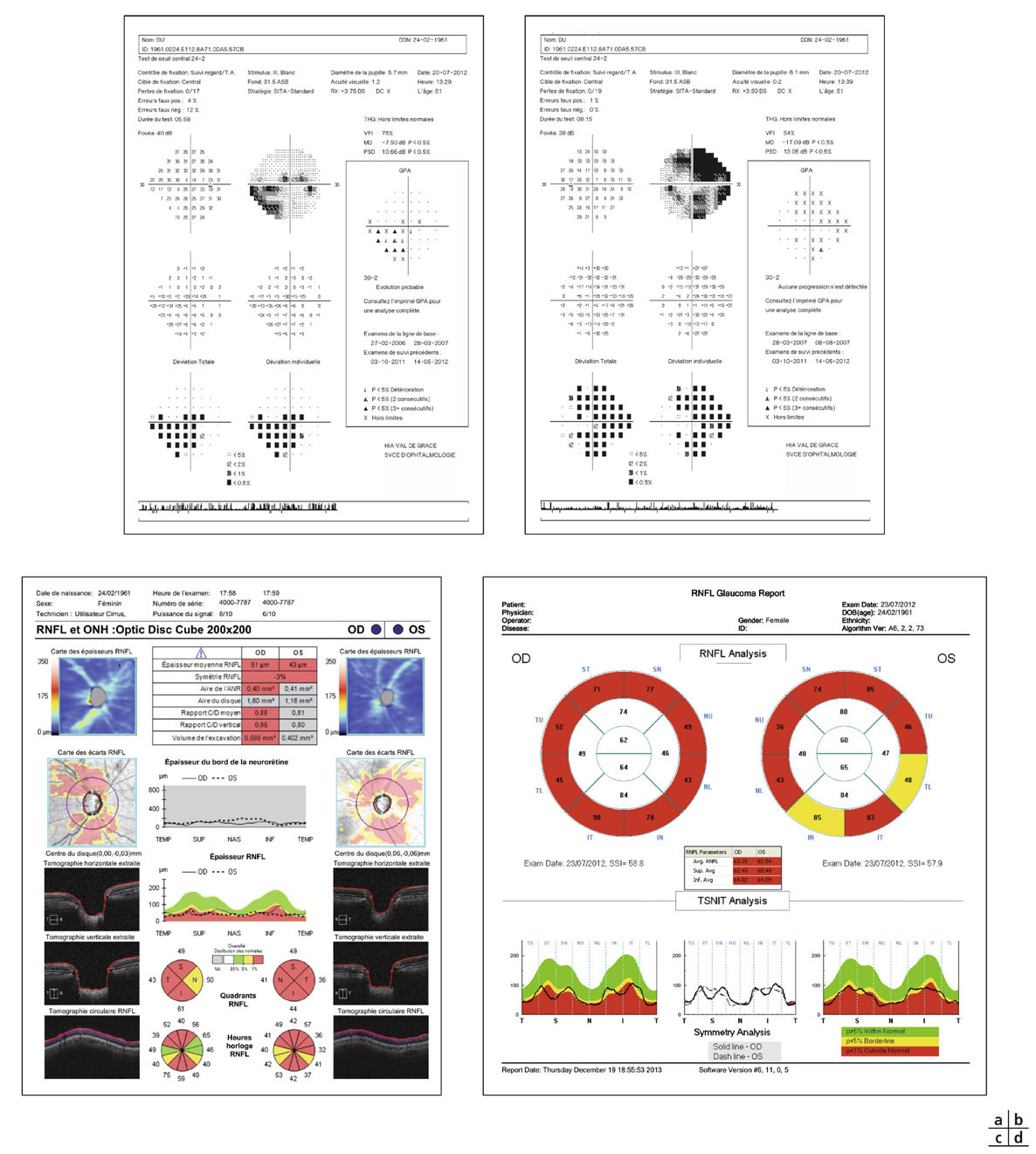
Fig. 10-87 Glaucome évolué. Relevés champs visuels OD (a) et OG (b). Relevé Cirrus HD-OCT (c) et RTVue (d).
FIABILITÉ ET REPRODUCTIBILITÉ DES MESURES
Les différentes études rapportent une bonne reproductibilité des mesures avec un coefficient de variation entre deux examens de seulement 2 à 3 % pour l’OCT-SD RTVue 100 (soit 4,51 μm, sans évaluation d’une différence potentielle entre les sujets normaux, avec ceux présentant une HTO, un glaucome modéré ou sévère) [14, 15], ainsi qu’une bonne capacité discriminante des glaucomes pré-périmétriques et débutants avec un intérêt particulier de l’analyse de l’indice FLV [72]. Cette haute reproductibilité des mesures obtenues est retrouvée avec le SD-OCT 3D-2000 Topcon [47]. Enfin, les études avec le Cirrus HD-OCT démontrent une excellente reproductibilité entre deux mesures avec un coefficient de variation inférieur à 2 % correspondant à une variation de mesure d’un examen à l’autre de l’ordre de 1,16 μm [41]. Elles ont été complétées plus récemment par une étude chez des sujets normaux présentant une HTO ou un glaucome évolué. Cette étude rapporte un coefficient de variation qui reste de l’ordre de 2 % sans variation avec la sévérité de la neuropathie optique glaucomateuse, identique chez les patients glaucomateux et chez les témoins, avec un taux de variation entre deux examens de l’ordre de 1,1 μm [12].
PERFORMANCE DIAGNOSTIQUE DANS LE GPAO
De nombreuses études cliniques ont évalué la sensibilité de l’analyse du GCC dans le diagnostic et le suivi de la neuropathie optique glaucomateuse. À partir des données actuelles, un certain nombre d’éléments peuvent être retenus.
Glaucome pré-périmétrique
L’analyse de la sensibilité des différents paramètres du relevé a montré son intérêt comparé à l’analyse de la couche des FNR et à celle de l’épaisseur maculaire totale en OCT-SD [28, 41, 47].
Elle rapporte une plus grande sensibilité diagnostique pour les atteintes précoces, du secteur temporal inférieur quand il peut être évalué (Cirrus HD-OCT) et du secteur maculaire inférieur, ainsi que des indices supplémentaires fournis par certains OCT-SD : indices FLV (focal loss volume) et GLV (global loss volume) pour l’OCT RTVue 100, indice GCIPL (couche des cellules ganglionnaires et plexiforme interne) minimum pour le Cirrus HD-OCT. Les études retrouvent une meilleure sensibilité diagnostique de ces indices complémentaires, avec une aire sous la courbe ROC supérieure à celle de l’analyse de l’épaisseur de la couche des FNR péripapillaires, qui reste cependant sans différence statistiquement significative [10, 13, 45] (fig. 10-88).
Cette localisation préférentielle de l’atteinte maculaire inférieure dans les formes débutantes, rapportée dans d’autres études, correspond à la fréquence de l’atteinte précoce de l’hémi-champ visuel supérieur aux stades précoces de l’atteinte fonctionnelle de la neuropathie optique glaucomateuse [17, 52, 59, 68, 73].
Une analyse de la projection au niveau du disque optique des déficits correspondant à cette zone maculaire temporale inférieure d’atteinte précoce se fait au niveau d’un secteur étendu de la partie inférieure du quadrant temporal à la partie temporale du quadrant inférieur du bord du disque optique que Hood appelle la « zone de vulnérabilité maculaire » (ZVM) localisée dans la zone la plus épaisse de la couche des FNR péripapillaires. Ce secteur péripapillaire temporal inférieur est particulièrement vulnérable aux lésions glaucomateuses précoces. L’ensemble de ces récentes données ont conduit Hood et al. [17] à proposer un modèle schématique de projection de la couche des FNR maculaires, ainsi que des lésions de la couche des FNR et des cellules ganglionnaires, dans lequel il suppose que la plupart des cellules ganglionnaires de la région maculaire inférieure se projette au niveau de la ZVM, les autres cellules ganglionnaires de la région maculaire inférieure (région cæco-centrale) et celles de la macula supérieure se projetant au niveau du quadrant temporal du disque optique (fig. 10-89).
Ces données concordent avec la fréquence des atteintes maculaires précoces du champ visuel associant une prépondérance des déficits dans les 5° centraux spécialement au niveau du champ visuel supérieur, et même dans les 3° centraux chez plus de 50 % des yeux atteints de glaucome débutant ou modéré, et avec une atteinte classique des faisceaux arciformes dans les 15° centraux du champ visuel (zones plus épaisses de la couche des FNR) [32, 53, 59].
Il est donc important, lors de l’interprétation des résultats du relevé GCC, de rechercher une atteinte débutante dans le secteur temporal inférieur, ainsi que dans le secteur maculaire inférieur au niveau des cartes des épaisseurs et de déviations, afin de dépister un déficit précoce.
Le fait que l’épaisseur moyenne du complexe soit moins sensible et moins spécifique pour la détection précoce d’une atteinte (GCIPL moyen) peut être lié aux particularités des stades précoces affectant le plus souvent les pôles maculaires supérieur et inférieur en premier alors que la moyenne reste dans les limites normales [40].
Glaucome débutant à modéré
Les paramètres maculaires rapportent un haut pouvoir discriminant et une haute reproductibilité comparable à celle de l’analyse de la couche des FNR. Les OCT-SD augmentent ainsi la valeur diagnostique des paramètres paramaculaires pour le glaucome précoce comparable à celle de la mesure des FNR péripapillaires [40, 60, 74].
Les paramètres maculaires ont démontré leur grand intérêt dans le diagnostic des glaucomes débutants avec des atteintes initiales du champ visuel centrales et paracentrales [30, 63].
Une étude française a évalué les capacités diagnostiques des différentes couches maculaires relevées avec le Cirrus HD-OCT dans 252 GPAO (164 glaucomes débutants, 44 glaucomes modérés, 44 glaucomes évolués) et 223 sujets témoins. Elle rapporte l’absence de modification des couches externes, une plus grande sensibilité diagnostique de l’épaisseur des couches maculaires internes et en particulier de l’indice complémentaire GCIPL minimum. Ce dernier présente une sensibilité diagnostique supérieure à celle des autres indices évalués, y compris à celle de l’épaisseur de la couche des FNR péripapillaires, bien que la différence reste à la limite de la significativité statistique, pour l’ensemble des 252 GPAO étudiés et surtout dans les groupes de patients atteints de glaucome débutants et de glaucomes évolués [10]. D’autres études sont venues confirmer ces données, en particulier la sensibilité de cet indice GCIPL minimum du Cirrus HD-OCT dans les glaucomes débutants [22, 71] (fig. 10-90).
Dans les glaucomes plus évolués, la sensibilité diagnostique est similaire à celle des paramètres des FNR ou papillaires.
Ces résultats soulignent que la mesure de la couche des FNR péripapillaires reste le paramètre OCT optimal qui doit être retenu pour le diagnostic des glaucomes périmétriques plus évolués sans toujours préciser le stade évolutif. L’analyse du complexe GCC peut améliorer la précision diagnostique et, dans tous les cas, elle reste, à ce jour, supérieure à celle de l’analyse des paramètres de la TNO.
Glaucome évolué
La précision diagnostique de l’analyse du complexe GCC a été évaluée en fonction de la sévérité de l’atteinte fonctionnelle de la neuropathie optique glaucomateuse.
Dans le glaucome modéré, les résultats rapportent une sensibilité similaire ; enfin, au stade de glaucome sévère, l’analyse de la couche des FNR reste le meilleur paramètre, en particulier dans le secteur inférieur pour le diagnostic du glaucome sévère quoique, là encore, sans différence statistiquement significative.
Un certain nombre de facteurs doivent être considérés lors de l’interprétation des relevés (voir chapitre 9-IV paragraphe « Tomographie par cohérence optique (OCT) – Méthode d’examen : technique et interprétation ») :
-
des facteurs liés au patient : sa réfraction (épaisseurs souvent plus faibles chez le sujet myope et plus fortes possibles en cas d’hypermétropie) ; une plus grande longueur axiale du globe (épaisseur plus fine) ; enfin, un intérêt particulier de l’analyse du GCC en cas de dysversion ou autre anomalie papillaire d’examen difficile [48] ;
-
des facteurs liés à l’OCT-SD : l’observation d’un résultat avec un code coloré rouge (théoriquement observé chez moins de 1 % de la population normale) doit attirer l’attention, mais ne pas classer systématiquement le résultat en tant que valeur anormale [9].
Un certain nombre de résultats sont exprimés par un code coloré rouge alors que l’analyse des résultats fonctionnels chez le même patient montre la persistance d’une fonction dans le secteur analysé. Il semblerait qu’il existe, comme pour l’analyse des FNR péripapillaires, un effet dit « plancher » correspondant à un seuil à partir duquel l’expression des résultats se fait selon un code maximal d’anomalie au-delà duquel l’évaluation de la progression ne puisse pas être exprimée par l’intermédiaire de ce type de résultat (fig. 10-91a,b).
Cependant, des études récentes réalisées chez des patients atteints de glaucome avancé (MD ≤ – 15 dB) rapportent la persistance de cellules ganglionnaires résiduelles en SD-OCT [39]. Des études sont encore nécessaires pour préciser ces données.
Il faut retenir que, dans l’état actuel de nos connaissances, les capacités diagnostiques des paramètres GCIPL sont particulièrement intéressantes dans les atteintes initiales paracentrales débutantes – fréquentes – qu’il faut savoir rechercher et dans celles des FNR péripapillaires pour les atteintes du champ visuel périphérique [10, 36].
Les protocoles d’acquisition utilisés par les OCT sont différents. Les résultats obtenus par ces appareils ne doivent pas être comparés et ne sont pas interchangeables d’un appareil à l’autre comme c’est le cas pour l’analyse des FNR péripapillaires avec les différents OCT-SD.
Enfin, certains OCT-SD donnent, avec l’analyse du complexe maculaire cellulaire ganglionnaire, des indices supplémentaires de quantifications des pertes cellulaires ganglionnaires (indices GCIPL minimum pour le Cirrus, indices FLV et GLV pour le RTVue), venant compléter les informations et semblant présenter un intérêt clinique.
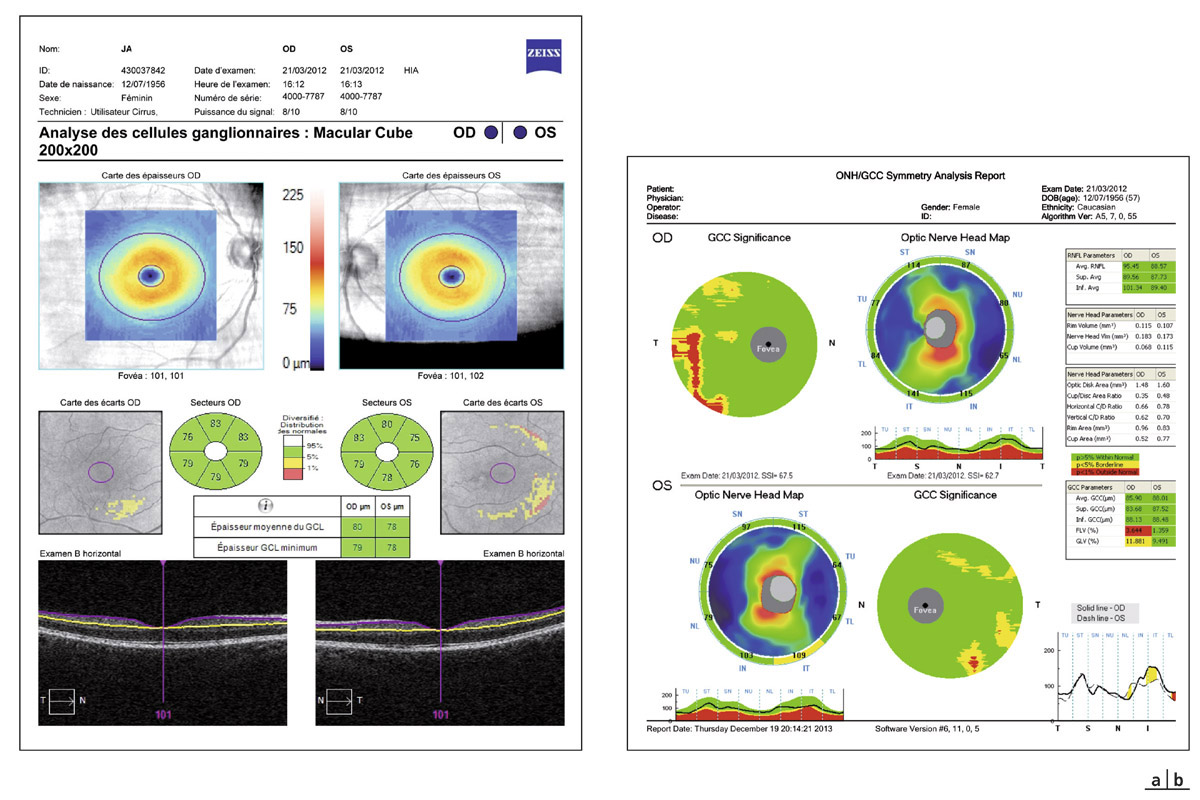
Fig. 10-88 Glaucome pré-périmétrique. Analyse du complexe maculaire cellulaire ganglionnaire : relevé GCIPL (a) et RTVue (b).
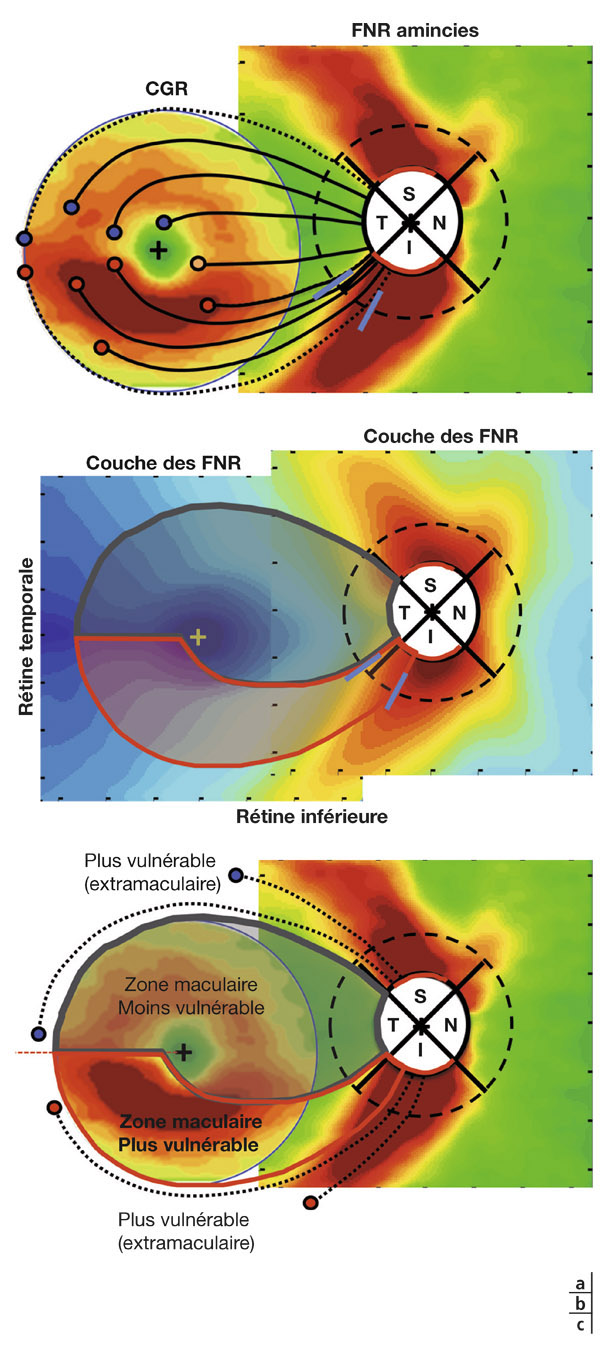
Fig. 10-89 a, b. Modèle schématique avec, à l’intérieur des limites rouges, les CGR, qui se projettent à la ZVM. Les CGR des autres régions maculaires se projettent dans le secteur temporal du disque optique. c. Les faisceaux arciformes des FNR issues des CGR juste en dehors de la macula se projettent au niveau des quadrants supérieur et inférieur du disque optique (arcs rouges) où se situent la majorité des lésions et comprenant la ZVM des CGR maculaires inférieures. (D’après Hood et al. [17]. Reproduit avec autorisation.)
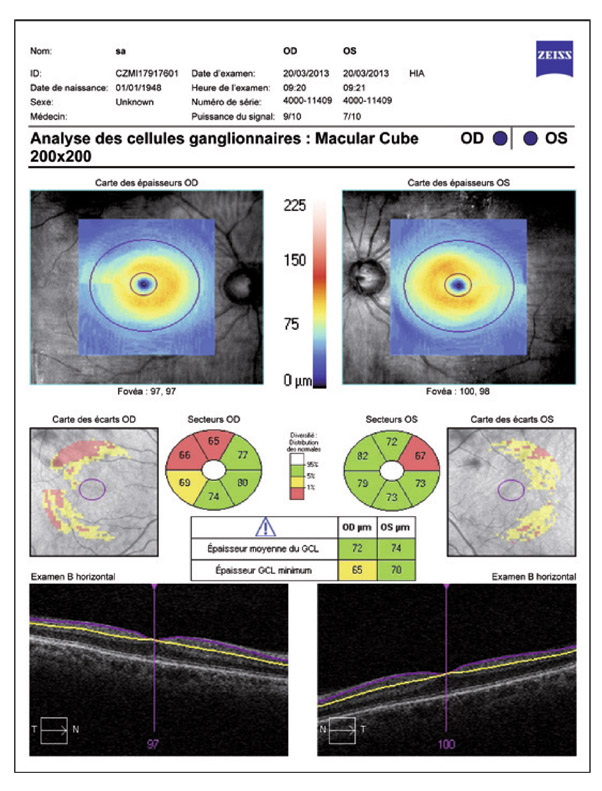
Fig. 10-90 Glaucome débutant : relevé GCIPL.
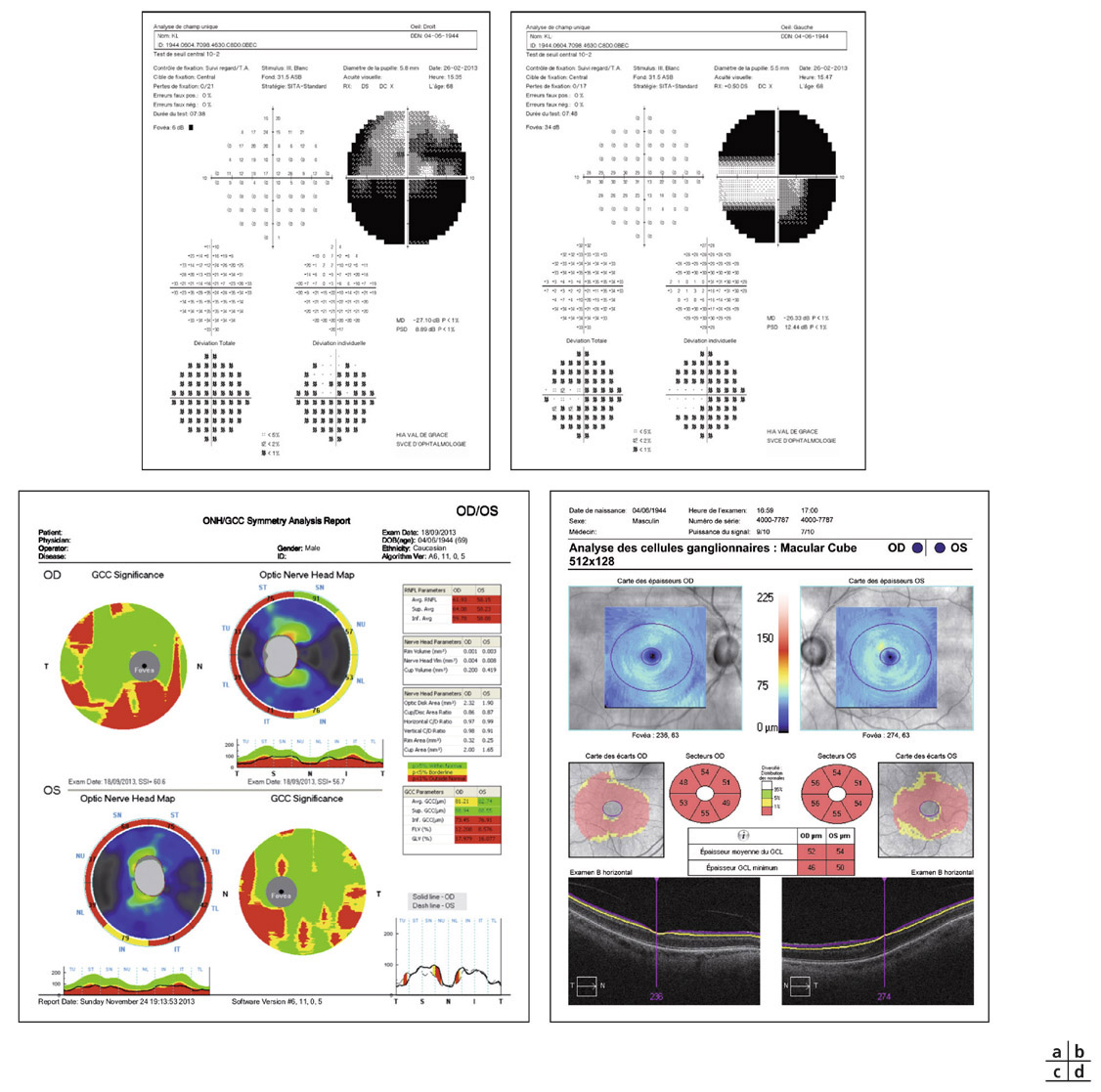
Fig. 10-91 Glaucome sévère. Relevés des champs visuels OD (a) et OG (b) et relevés maculaires GCC du RTVue (c), GCIPL du Cirrus HD-OCT (d).
PERFORMANCES DIAGNOSTIQUES DANS LE GPAO
L’analyse des paramètres de la tête du nerf optique a nettement progressé avec les nouvelles générations d’OCT-SD et augmente la puissance diagnostique de l’examen OCT dans le glaucome.
Les paramètres rapportés comme les plus discriminants à ce jour en OCT-SD au niveau de la TNO sont représentés par l’aire de l’anneau neurorétinien (ANR), son épaisseur dans le secteur temporal inférieur et le rapport C/D vertical [21, 36, 42].
Ces paramètres évalués individuellement semblent avoir une puissance diagnostique équivalente à celle de l’évaluation de l’épaisseur de la couche des FNR [42].
La puissance diagnostique de l’ANR semble supérieure à celle du rapport C/D, car elle prend en compte l’ensemble de la papille alors que le rapport C/D est évalué sur un seul axe [46].
La diminution significative de l’aire de l’ANR (rim area) et l’augmentation de celle de l’excavation et du rapport C/D chez les patients glaucomateux représentent les modifications d’autant plus marquées que le stade clinique du GPAO [14] est évolué.
Les études des programmes d’analyse de la TNO doivent encore être poursuivies afin d’isoler les paramètres papillaires diagnostiques et évolutifs les plus performants en OCT-SD. La performance diagnostique de l’analyse de l’épaisseur de la couche des FNR et du complexe GCC en OCT-SD reste à ce jour supérieure à celle de l’analyse de la TNO [69].
VERS DE NOUVELLES ACQUISITIONS DE LA TNO
Une approche récente en OCT-Spectralis repose sur la meilleure capacité de l’OCT-SD à déterminer les limites OCT de l’anneau neurorétinien ou limites histomorphiques selon la dénomination de Strouthidis [7, 55, 66, 67]. Chauhan et al. [7] proposent une nouvelle façon d’évaluer les limites de l’ANR en repérant en OCT sur 24 scans-B radiaires de haute résolution la limite de la membrane de Bruch. Celle-ci délimite en effet le passage des axones des cellules ganglionnaires rétiniennes et ainsi de façon plus précise les limites de l’ANR. Les auteurs ont développé une segmentation semi-automatique afin de déterminer sur les scans-B les épaisseurs de l’ANR au niveau de la TNO. Deux nouveaux indices sont introduits : le BMO-HRW (Bruch’s membrane opening-horizontal rim witdth) et le BMO-MRW (Bruch’s membrane opening-minimum rim witdth). Le BMO-HRW correspond à l’épaisseur de l’ANR dans le plan horizontal de la membrane de Bruch, tandis que le BMO-MRW correspond à l’épaisseur de l’ANR la plus faible, entre la limite interne de la membrane de Bruch et la projection au niveau de la limitante interne. Les auteurs comparent la performance diagnostique de ces nouveaux paramètres à celle des FNR et retrouvent une meilleure sensibilité pour l’indice BMO-MRW (81 %) qui est retenu dans le dernier logiciel d’analyse pour l’évaluation de la surface de l’ANR développé sur l’OCT-Spectralis par Heidelberg [7] (fig. 10-92).
Plus récemment, ils ont confirmé l’intérêt de l’analyse selon le méridien passant par la fovéa et le centre de la membrane de Bruch qui, en diminuant la variabilité interindividuelle des mesures, augmente la sensibilité diagnostique d’une altération précoce [6]. D’autres études doivent encore confirmer ces récentes données.
Une autre approche en développement consiste à utiliser le mode EDI (enhanced depth imaging) de l’OCT-Spectralis pour repérer les limites de la lame criblée avec un intérêt encore à préciser en fonction de la forme et du stade clinique du GPAO [50] (fig. 10-93).
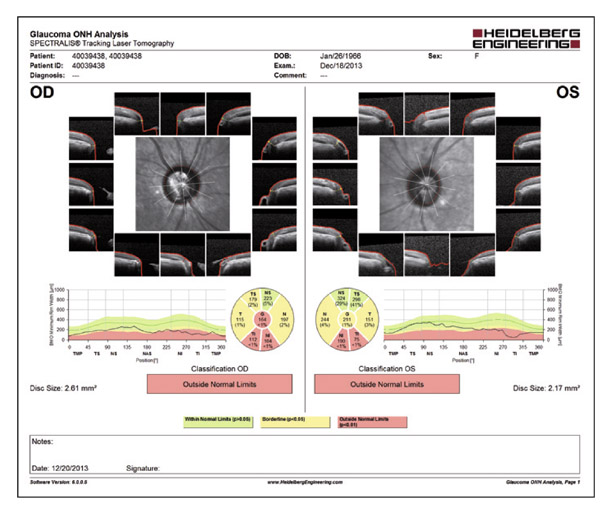
Fig. 10-92 Glaucome débutant. Relevé de prototype de logiciel d’analyse de la TNO, indice BMO, OCT-Spectralis.

Fig. 10-93 Imagerie de la lame criblée en OCT-Spectralis mode EDI.
GLAUCOME À PRESSION NORMALE
L’analyse des RNFL et du complexe GCC présente une capacité discriminante identique pour les glaucomes à pression normale débutants avec un déficit précoce du champ visuel proche du point de fixation. Dans les yeux avec des déficits avancés ou périphériques du champ visuel au delà des 10° centraux, la mesure de la couche des FNR montre une meilleure capacité diagnostique [11, 62].
GLAUCOME DU MYOPE FORT
Le diagnostic du glaucome chez le myope fort est toujours difficile en raison des modifications de l’anatomie des yeux myopes modérés ou forts : dysversion papillaire, atrophie péripapillaire, voire conus myopique ainsi que staphylome myopique. Si l’imagerie en OCT joue désormais un rôle important chez ces patients, il convient toutefois de connaître les modifications induites par la myopie sur ces différents examens afin pouvoir diagnostiquer de façon pertinente une atteinte glaucomateuse.
De récentes données chez les sujets myopes non glaucomateux (– 2 à – 10 dioptries) soulignent la relative fréquence de résultats anormaux, avec un plus grand taux de résultats faux positifs qui peut atteindre 17 % et doit être connu pour une interprétation prudente des résultats lors de la recherche d’une atteinte chez ces patients [35].
Les paramètres du complexe GCC et des FNR peuvent être complémentaires.
Plusieurs études rapportent une capacité diagnostique performante supérieure des paramètres maculaires chez les myopes forts, en particulier des indices complémentaires (GLV, FLV), avec toutefois des qualités d’acquisitions insatisfaisantes dans au moins 10 % des cas.
La capacité de détecter un changement glaucomateux dans le groupe des myopes forts semble plus importante avec l’étude de l’épaisseur moyenne du complexe GCC qu’avec la mesure de la couche des FNR, cependant sans différence statistiquement significative. Les mesures de chaque hémi-champ sont préférables, car plus interprétables, notamment pour le suivi, que les mesures des différents secteurs par quadrant supérieur, inférieur temporal et nasal, étant donnée la topographie des déficits glaucomateux. Enfin, seul l’indice FLV montre une différence significative chez les patients présentant une myopie forte [26, 43, 64, 65].
Les relations entre myopie et épaisseur du complexe cellulaire ganglionnaire maculaire doivent encore être mieux précisées [2].
DYSVERSIONS PAPILLAIRES
Le diagnostic biomicroscopique précoce de GPAO reste difficile dans les dysversions papillaires. L’analyse en OCT-SD des FNR péripapillaires et de la TNO reste à ce jour moins performante que l’analyse du complexe GCC dans ces formes cliniques [38]. Les nouveaux repérages de la limite de la membrane de Bruch dans les acquisitions de la TNO (voir plus haut), afin de mieux délimiter l’anatomie du passage des axones des cellules ganglionnaires rétiniennes, sont pleins de promesses pour une meilleure analyse de ces formes cliniques [29, 38].
KYSTES DE LA COUCHE NUCLÉAIRE INTERNE
Une observation récemment décrite est la présence de kystes au sein de la couche nucléaire externe chez certains patients glaucomateux, mais également dans certaines maladie neurodégénératives. Cet aspect a été publié par diverses équipes [76]. Au moment de la rédaction de ce chapitre, l’histophysiopathologie de ces kystes reste inconnue. Cet aspect particulier rapporté justifie cependant, lors de la réalisation d’acquisition en OCT maculaire, une observation fine de ces couches nucléaires internes à leur recherche.
Pour conclure, nous retiendrons que tout scan, même avec un signal d’acquisition de haute qualité précis et reproductible, peut présenter des artéfacts qui doivent être connus et recherchés pour une bonne interprétation car susceptibles d’affecter l’interprétation finale (voir chapitre 9-IV paragraphe « Tomographie par cohérence optique (OCT) »).
Retenir
-
Détection des pertes cellulaires ganglionnaires rétiniennes précoces en OCT.
-
Demander un examen OCT pour un diagnostic précoce de glaucome, idéalement dès le stade pré-périmétrique.
-
Lors de l’interprétation du relevé GCC, rechercher une atteinte débutante dans le secteur temporal inférieur, ainsi que dans le secteur maculaire inférieur au niveau des cartes des épaisseurs et de déviations, afin de dépister un déficit précoce.
-
Sensibilité diagnostique assez semblable des acquisitions GCC et FNR pour les glaucomes débutants et modérés, notamment grâce aux cartes des épaisseurs des nouvelles acquisitions qui élargissent la zone d’analyse des FNR à toute la surface du cube papillaire.
-
Les capacités diagnostiques des paramètres GCIPL sont particulièrement intéressantes dans les atteintes paracentrales initiales débutantes qu’il faut savoir rechercher et celles des FNR péripapillaires dans les atteintes du champ visuel périphérique.
-
L’imagerie en OCT n’est pas utile pour diagnostiquer un glaucome très évolué.
-
Intérêt de l’acquisition du GCC à tous les stades du glaucome et en particulier des indices complémentaires de certains OCT-SD (FLV, GLV, GCIPL minimum) qui rapportent une plus grande sensibilité diagnostique dans les formes débutantes du GPAO.
-
Toujours associer les acquisitions maculaires, RNFL et papillaires.
-
Connaître les limites de l’acquisition des FNR dans les stades évolués où l’acquisition du GCC semble présenter un plus grand intérêt.
-
Intérêt des acquisitons GCC dans certaines formes cliniques : papilles « difficiles », APP, myopie forte, etc.
-
Les résultats des différents OCT ne sont pas interchangeables.
-
L’imagerie en OCT est une aide pour les papilles difficiles, dont il faut toutefois connaître les limites.
[1] Ajtony C, Balla Z, Somoskeoy S, Kovacs B. Relationship between visual field sensitivity and retinal nerve fiber layer thickness as measured by optical coherence tomography. Invest Ophthalmol Vis Sci. 2007 ; 48 : 258-63.
[2] Aref AA. The diagnosis of glaucoma in highly myopic individuals requires longitudinal data. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 1453-4.
[3] Bendschneider D, Tornow RP, Horn FK, et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J Glaucoma. 2010 ; 19 : 475-82.
[4] Budenz DL, Anderson DR, Varma R, et al. Determinants of normal retinal nerve fiber layer thickness measured by Stratus OCT. Ophthalmology. 2007 ; 114 : 1046-52.
[5] Chang RT, Knight OJ, Feuer WJ, Budenz DL. Sensitivity and specificity of time-domain versus spectral-domain optical coherence tomography in diagnosing early to moderate glaucoma. Ophthalmology. 2009 ; 116 : 2294-9.
[6] Chauhan BC, Burgoyne CF. Perspective from clinical examination of the optic disc to clinical assessment of the optic nerve head : a paradigm change. Am J Ophtahlmol. 2013 ; 156 : 218-27.
[7] Chauhan BC, O’Leary N, Almobarak FA, et al. Enhanced detection of open-angle glaucoma with an anatomically accurate optical coherence tomography-derived neuroretinal rim parameter. Ophthalmology. 2013 ; 120 : 535-43.
[8] Cho JW, Sung KR, Hong JT, et al. Detection of glaucoma by spectral domain-scanning laser ophthalmoscopy/optical coherence tomography (SD-SLO/OCT) and time domain optical coherence tomography. J Glaucoma. 2011 ; 20 : 15-20.
[9] Chong GT, Lee RK. Glaucoma versus red disease : imaging and glaucoma diagnosis. Curr Opin Ophthalmol. 2012 ; 23 : 79-88.
[10] Delbarre M, El Chehab H, Francoz M, Renard JP. Diagnostic use of macular layers analysis by SD-OCT in primary open angle glaucoma. J Fr Ophtalmol. 2013 ; 36 : 723-31.
[11] Firat PG, Doganay S, Demirel EE, Colak C. Comparison of ganglion cell and retinal nerve fiber layer thickness in primary open-angle glaucoma and normal tension glaucoma with spectral-domain OCT. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 831-8.
[12] Francoz M, Fénolland JR, Giraud JM, Renard JP. Reproducibility of macular ganglion cell-inner plexiform layer thickness measurement with Cirrus HD-Optical Coherence Tomography in normal, hypertensive and glaucomatous eyes. Br J Ophthalmol. 2013 ; doi : 10.1136.
[13] Francoz M, El Chehab H, Fénolland JR, Renard JP. Ganglion cell complex measurement and glaucoma diagnosis using two SD-OCT. Acta Ophthalmologica. 2013 ; 91 : 0. doi : 10.1111.
[14] Garas A, Vargha P, Hollo G. Diagnostic accuracy of nerve fibre layer, macular thickness and optic disc measurements made with the RTVue-100 optical coherence tomograph to detect glaucoma. Eye (Lond). 2011 ; 25 : 57-65.
[15] Garas A, Vargha P, Hollo G. Reproducibility of retinal nerve fiber layer and macular thickness measurement with the RTVue-100 optical coherence tomograph. Ophthalmology. 2010 ; 117 : 738-46.
[16] Gonzalez-Garcia AO, Vizzeri G, Bowd C, et al. Reproducibility of RTVue retinal nerve fiber layer thickness and optic disc measurements and agreement with Stratus optical coherence tomography measurements. Am J Ophthalmol. 2009 ; 147 : 1067-741.
[17] Hood DC, Raza AS, de Moraes CG, et al. Glaucomatous damage of the macula. Prog Retin Eye Res. 2013 ; 32 : 1-21.
[18] Horn FK, Mardin CY, Laemmer R, et al. Correlation between local glaucomatous visual field defects and loss of nerve fiber layer thickness measured with polarimetry and spectral domain OCT. Invest Ophthalmol Vis Sci. 2009 ; 50 : 1971-7.
[19] Huang J, Liu X, Wu Z, et al. Macular and retinal nerve fiber layer thickness measurements in normal eyes with the Stratus OCT, the Cirrus HD-OCT, and the Topcon 3D OCT-1000. J Glaucoma. 2011 ; 20 : 118-25.
[20] Hwang YH, Kim YY, Kim HK, Sohn YH. Ability of cirrus high-definition spectral-domain optical coherence tomography clock-hour, deviation, and thickness maps in detecting photographic retinal nerve fiber layer abnormalities. Ophthalmology. 2013 ; 120 : 1380-7.
[21] Hwang YH, Kim YY. Glaucoma diagnostic ability of quadrant and clock-hour neuroretinal rim assessment using cirrus HD optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 2226-34.
[22] Jeoung JW, Choi YJ, Park KH, Kim DM. Macular ganglion cell imaging study : glaucoma diagnostic accuracy of spectral-domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2013 ; 54 : 4422-9.
[23] Jeoung JW, Park KH. Comparison of Cirrus OCT and Stratus OCT on the ability to detect localized retinal nerve fiber layer defects in preperimetric glaucoma. Invest Ophthalmol Vis Sci. 2010 ; 51 : 938-45.
[24] Jonas JB, Gusek GC, Naumann GO. Optic disc, cup and neuroretinal rim size, configuration and correlations in normal eyes. Invest Ophthalmol Vis Sci. 1988 ; 29 : 1151-8.
[25] Kang SH, Hong SW, Im SK, et al. Effect of myopia on the thickness of the retinal nerve fiber layer measured by Cirrus HD optical coherence tomography. Invest Ophthalmol Vis Sci. 2010 ; 51 : 4075-83.
[26] Kimura Y, Hangai M, Morooka S, et al. Retinal nerve fiber layer defects in highly myopic eyes with early glaucoma. Invest Ophthalmol Vis Sci. 2012 ; 53 : 6472-8.
[27] Knight OJ, Chang RT, Feuer WJ, Budenz DL. Comparison of retinal nerve fiber layer measurements using time domain and spectral domain optical coherent tomography. Ophthalmology. 2009 ; 116 : 1271-7.
[28] Kotera Y, Hangai M, Hirose F, et al. Three-dimensional imaging of macular inner structures in glaucoma by using spectral-domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2011 ; 52 : 1412-21.
[29] Law SK, Tamboli DA, Giaconi J, Caprioli J. Characterization of retinal nerve fiber layer in nonglaucomatous eyes with tilted discs. Arch Ophthalmol. 2010 ; 128 : 141-2.
[30] Lee J, Hangai M, Kimura Y, et al. Measurement of macular ganglion cell layer and circumpapillary retinal nerve fiber layer to detect paracentral scotoma in early glaucoma. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 2003-12.
[31] Lee J, Kim NR, Kim H, et al. Negative refraction power causes underestimation of peripapillary retinal nerve fibre layer thickness in spectral-domain optical coherence tomography. Br J Ophthalmol. 2011 ; 95 : 1284-9.
[32] Leite MT, Zangwill LM, Weinreb RN, et al. Structure-function relationships using the Cirrus spectral domain optical coherence tomograph and standard automated perimetry. J Glaucoma. 2012 ; 21 : 49-54.
[33] Leung CK, Cheung CY, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography : a variability and diagnostic performance study. Ophthalmology. 2009 ; 116 : 1257-63.
[34] Leung CK, Choi N, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography : pattern of RNFL defects in glaucoma. Ophthalmology. 2010 ; 117 : 2337-44.
[35] Leung CK, Yu M, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography : interpreting the RNFL maps in healthy myopic eyes. Invest Ophthalmol Vis Sci. 2012 ; 53 : 7194-200.
[36] Li S, Wang X, Li S, et al. Evaluation of optic nerve head and retinal nerve fiber layer in early and advance glaucoma using frequency-domain optical coherence tomography. Graefes Arch Clin Exp Ophthalmol. 2010 ; 248 : 429-34.
[37] Moreno-Montanes J, Olmo N, Alvarez A, et al. Cirrus high-definition optical coherence tomography compared with Stratus optical coherence tomography in glaucoma diagnosis. Invest Ophthalmol Vis Sci. 2010 ; 51 : 335-43.
[38] Moschos MM, Triglianos A, Rotsos T, et al. Tilted disc syndrome : an OCT and mfERG study. Documenta Ophthalmologica Advances in Ophthalmology. 2009 ; 119 : 23-8.
[39] Moura AL, Raza AS, Lazow MA, et al. Retinal ganglion cell and inner plexiform layer thickness measurements in regions of severe visual field sensitivity loss in patients with glaucoma. Eye (Lond). 2012 ; 26 : 1188-93.
[40] Mwanza JC, Durbin MK, Budenz DL, et al. Glaucoma diagnostic accuracy of ganglion cell-inner plexiform layer thickness : comparison with nerve fiber layer and optic nerve head. Ophthalmology. 2012 ; 119 : 1151-8.
[41] Mwanza JC, Oakley JD, Budenz DL, et al. Macular ganglion cell-inner plexiform layer : automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8323-9.
[42] Mwanza JC, Oakley JD, Budenz DL, Anderson DR. Ability of cirrus HD-OCT optic nerve head parameters to discriminate normal from glaucomatous eyes. Ophthalmology. 2011 ; 118 : 241-8.
[43] Mwanza JC, Sayyad FE, Aref AA, Budenz DL. Rates of abnormal retinal nerve fiber layer and ganglion cell layer OCT scans in healthy myopic eyes : Cirrus versus RTVue. Ophthalmic Surg Lasers Imaging. 2012 ; 43 : S67-74.
[44] Na JH, Lee KS, Lee JR. The glaucoma detection capability of SD-OCT and GDx-VCC deviation maps in early glaucoma patients with localized visual field defects. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 2371-82.
[45] Na JH, Lee JR, Baek S, et al. Detection of macular ganglion cell loss in preperimetric glaucoma patients with localized RNF defects by SD-OCT. Clin Exper Ophthalmol. 2013 ; 41 : 870-80.
[46] Na JH, Sung KR, Lee JR, et al. Detection of glaucomatous progression by SD-Oct. Ophthalmology. 2013 ; 120 : 1388-95.
[47] Nakatani Y, Higashide T, Ohkubo S, et al. Evaluation of macular thickness and peripapillary retinal nerve fiber layer thickness for detection of early glaucoma using spectral domain optical coherence tomography. J Glaucoma. 2011 ; 20 : 252-9.
[48] Oner V, Aykut V, Tas M, et al. Effect of refractive status on peripapillary retinal nerve fibre layer thickness : a study by RTVue spectral domain optical coherence tomography. Br J Ophthalmol. 2013 ; 97 : 75-9.
[49] Parikh RS, Parikh SR, Sekhar GC, et al. Normal age-related decay of retinal nerve fiber layer thickness. Ophthalmology. 2007 ; 114 : 921-6.
[50] Park HY, Park CK. Diagnostic capability of lamina cribrosa thickness by enhanced depth imaging and factors affecting thickness in patients with glaucoma. Ophthalmology. 2013 ; 120 : 745-52.
[51] Park SB, Sung KR, Kang SY, et al. Comparison of glaucoma diagnostic capabilities of Cirrus HD and Stratus optical coherence tomography. Arch Ophthalmol. 2009 ; 127 : 1603-9.
[52] Pierro L, Gagliardi M, Iuliano L, et al. Retinal nerve fiber layer thickness reproducibility using seven different OCT instruments. Invest Ophthalmol Vis Sci. 2012 ; 53 : 5912-20.
[53] Rao HL, Babu JG, Addepalli UK, et al. Retinal nerve fiber layer and macular inner retina measurements by spectral domain optical coherence tomograph in Indian eyes with early glaucoma. Eye (Lond). 2012 ; 26 : 133-9.
[54] Rao HL, Leite MT, Weinreb RN, et al. Effect of disease severity and optic disc size on diagnostic accuracy of RTVue spectral domain optical coherence tomograph in glaucoma. Invest Ophthalmol Vis Sci. 2011 ; 52 : 1290-6.
[55] Reis AS, Sharpe GP, Yang H, et al. Optic disc margin anatomy in patients with glaucoma and normal controls with spectral domain optical coherence tomography. Ophthalmology. 2012 ; 119 : 738-47.
[56] Savini G, Barboni P, Parisi V, Carbonelli M. The influence of axial length on retinal nerve fibre layer thickness and optic-disc size measurements by spectral-domain OCT. Br J Ophthalmol. 2012 ; 96 : 57-61.
[57] Savini G, Carbonelli M, Barboni P. Retinal nerve fiber layer thickness measurement by Fourier-domain optical coherence tomography : a comparison between cirrus-HD OCT and RTVue in healthy eyes. J Glaucoma. 2010 ; 19 : 369-72.
[58] Savini G, Zanini M, Carelli V, et al. Correlation between retinal nerve fibre layer thickness and optic nerve head size : an optical coherence tomography study. Br J Ophthalmol. 2005 ; 89 : 489-92.
[59] Schiefer U, Papageorgiou E, Sample PA, et al. Spatial pattern of glaucomatous visual field loss obtained with regionally condensed stimulus arrangements. Invest Ophthalmol Vis Sci. 2010 ; 51 : 5685-9.
[60] Schulze A, Lamparter J, Pfeiffer N, et al. Diagnostic ability of retinal ganglion cell complex, retinal nerve fiber layer, and optic nerve head measurements by Fourier-domain optical coherence tomography. Graefes Arch Clin Exp Ophthalmol. 2011 ; 249 : 1039-45.
[61] Sehi M, Grewal DS, Sheets CW, Greenfield DS. Diagnostic ability of Fourier-domain vs time-domain optical coherence tomography for glaucoma detection. Am J Ophthalmol. 2009 ; 148 : 597-605.
[62] Seong M, Sung KR, Choi EH, et al. Macular and peripapillary retinal nerve fiber layer measurements by spectral domain optical coherence tomography in normal-tension glaucoma. Invest Ophthalmol Vis Sci. 2010 ; 51 : 1446-52.
[63] Shin HY, Park HY, Jung KI, et al. Glaucoma diagnostic ability of ganglion cell-inner plexiform layer thickness differs according to the location of visual field loss. Ophthalmology. 2014 ; 121 : 93-9.
[64] Shoji T, Nagaoka Y, Sato H, Chihara E. Impact of high myopia on the performance of SD-OCT parameters to detect glaucoma. Graefes Arch Clin Exp Ophthalmol. 2012 ; 250 : 1843-9.
[65] Shoji T, Sato H, Ishida M, et al. Assessment of glaucomatous changes in subjects with high myopia using spectral domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2011 ; 52 : 1098-102.
[66] Strouthidis NG, Yang H, Downs JC, Burgoyne CF. Comparison of clinical and three-dimensional histomorphometric optic disc margin anatomy. Invest Ophthalmol Vis Sci. 2009 ; 50 : 2165-74.
[67] Strouthidis NG, Yang H, Reynaud JF, et al. Comparison of clinical and spectral domain optical coherence tomography optic disc margin anatomy. Invest Ophthalmol Vis Sci. 2009 ; 50 : 4709-18.
[68] Su D, Park SC, Simonson JL, et al. Progression pattern of initial parafoveal scotomas in glaucoma. Ophthalmology. 2013 ; 120 : 520-7.
[69] Sung KR, Kim DY, Park SB, Kook MS. Comparison of retinal nerve fiber layer thickness measured by Cirrus HD and Stratus optical coherence tomography. Ophthalmology. 2009 ; 116 : 1264-70.
[70] Sung KR, Na JH, Lee Y. Glaucoma diagnostic capabilities of optic nerve head parameters as determined by Cirrus HD optical coherence tomography. J Glaucoma. 2012 ; 21 : 498-504.
[71] Takayama K, Hangai M, Durbin M, et al. A novel method to detect local ganglion cell loss in early glaucoma using spectral-domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 6904-13.
[72] Tan O, Chopra V, Lu AT, et al. Detection of macular ganglion cell loss in glaucoma by Fourier-domain optical coherence tomography. Ophthalmology. 2009 ; 116 : 2305-14.
[73] Tan O, Li G, Lu AT, et al. Mapping of macular substructures with optical coherence tomography for glaucoma diagnosis. Ophthalmology. 2008 ; 115 : 949-56.
[74] Um TW, Sung KR, Wollstein G, et al. Asymmetry in hemifield macular thickness as an early indicator of glaucomatous change. Invest Ophthalmol Vis Sci. 2012 ; 53 : 1139-44.
[75] Vizzeri G, Weinreb RN, Gonzalez-Garcia AO, et al. Agreement between spectral-domain and time-domain OCT for measuring RNFL thickness. Br J Ophthalmol. 2009 ; 93 : 775-81.
[76] Wolff B, Basdekidou C, Vasseur V, et al. Retinal inner nuclear layer microcystic changes in optic nerve head atrophy, anovel SD-OCT findings. Retina. 2013 ; 33 : 2133-8.
[77] Xu J, Ishikawa H, Wollstein G, et al. Three-dimensional spectral-domain optical coherence tomography data analysis for glaucoma detection. PLoS One. 2013 ; 8 : e55476.
W. Drexler, J.E. Morgan
Le diagnostic du glaucome repose classiquement sur la triade perte du champ visuel-élévation de la pression intra-oculaire (PIO)-altération de la tête du nerf optique (TNO). Actuellement son diagnostic peut être fondé sur les lésions caractéristiques du nerf optique comme l’excavation et l’amincissement de la couche des fibres nerveuses rétiniennes (FNR). Notre espoir d’un seul critère diagnostique a été facilité par le développement des techniques récentes d’imagerie, en particulier de la tomographie par cohérence optique qui permet une visualisation des lésions du nerf optique avec des détails sans précédent [27, 28, 44]. Des stratégies diagnostiques peuvent effectivement être mises au point pour une détection précoce et de meilleurs résultats thérapeutiques.
Les possibilités actuelles de l’OCT seront ici décrites, aussi bien dans le choix des biomarqueurs topographiques de la TNO et de l’amélioration de l’appréciation de l’épaisseur de la couche des FNR, que dans l’évaluation biomécanique de la lame criblée. En augmentant la vitesse de balayage (jusqu’à des millions de scans-A par seconde) et la profondeur de pénétration (en accroissant la longueur d’ondes en imagerie OCT jusqu’à 1 060 nm), puis en combinant les deux, il est possible de générer des images rétiniennes et de la TNO afin d’atteindre pratiquement la résolution cellulaire. Plus récemment, l’imagerie initiale OCT a été améliorée grâce à l’imagerie OCT dite de « polarisation sensible » (PS-OCT). Lorsqu’elle est associée à l’OCT fonctionnelle (Doppler-OCT), elle peut fournir des informations diagnostiques supplémentaires importantes concernant la biréfringence de la couche des FNR et le flux sanguin rétinien. Pour le moment encore au stade expérimental préclinique, les futures technologies fondées sur l’OCT comprennent la détection sans marquage de la dégénérescence des cellules ganglionnaires rétiniennes, l’amélioration de l’analyse de la physiologie des couches profondes de la rétine (optophysiologie) et la combinaison multimodale de l’OCT avec l’imagerie photo-acoustique pour augmenter la détection des chromophores rétiniens par absorption moléculaire.
Le développement des systèmes incorporant l’analyse spectral domain (SD) a représenté une amélioration significative dans la détection du signal de l’OCT, et les versions utilisées en pratique courante ont maintenant des vitesses de balayage d’environ 40 à 110 fois plus rapide que les premières générations [10].
Pourtant, l’intérêt diagnostique de l’OCT-SD pour le diagnostic du glaucome reste sujet à débat. Il semble néanmoins être supérieur pour la détection des stades précoces de la maladie et pour ce qui concerne la détection de la progression avec ses meilleures résolution et reproductibilité (la limite de tolérance intervisite de 95 % pour l’épaisseur moyenne de la couche des FNR est d’environ 4 μm). L’évaluation de l’œil glaucomateux par l’OCT s’étend à toutes les couches de la rétine, et la profondeur du nerf optique lui-même peut être pénétrée.
COUCHE DES FIBRES NERVEUSES RÉTINIENNES
Des démonstrations récentes à partir de glaucomes expérimentaux chez des primates non humains indiquent que la diminution détectable de l’épaisseur de la couche des FNR péripapillaires ne survient pas avant une perte de 10 à 15 % des axones de la tête du nerf optique. Or ces modifications sont habituellement précédées par des déformations substantielles de la surface de la TNO [26] et des structures situées en dessous de cette surface. L’imagerie « polarisation-sensible » (GDx-VCC et PS-OCT [6, 15, 16, 24, 42]) pourrait être une approche pleine de promesses pour la détection précoce du glaucome, fondée sur sa capacité à quantifier de façon très sensible la densité des axones des cellules ganglionnaires et de leurs microtubules (biréfringence, « retard de phase ») [11, 41]. Deux études récentes ont montré que la survenue d’une perte progressive du retard de phase de la couche des FNR précède la survenue de l’amincissement de la couche des FNR [11]. Une autre étude clinique longitudinale prospective a montré que la progression était détectée plus fréquemment et plus précocement pour les mesures de l’épaisseur de la couche des FNR en SD-OCT qu’avec la polarimétrie laser (GDx) [41].
ÉPAISSEUR DE LA COUCHE DES CELLULES GANGLIONNAIRES RÉTINIENNES
L’épaisseur de la couche des cellules ganglionnaires rétiniennes (ganglion cels layer ou GCL) inclut la couche plexiforme interne (internal plexiform layer ou IPL) (complexe GCIPL).
La haute résolution tissulaire de l’OCT a offert une base solide pour la mesure de l’épaisseur des couches rétiniennes dans le diagnostic du glaucome et la détection de lésions progressives. Elle a permis des mesures régulières du complexe cellulaire ganglionnaire en pratique clinique. Par définition, la macula est la région rétinienne où la couche des cellules ganglionnaires rétiniennes est pluricellulaire. Comme la perte de cellules rétiniennes ganglionnaires est une preuve de glaucome, la mesure de l’épaisseur de la couche des cellules ganglionnaires maculaires a depuis longtemps été proposée pour mesurer les lésions glaucomateuses [45]. Des travaux récents ont montré que l’évaluation de l’épaisseur des couches rétiniennes maculaires les plus internes était plus performante que l’analyse de l’épaisseur maculaire totale et similaire (mais pas meilleure) à l’épaisseur de la couche des FNR dans le diagnostic du glaucome. Comme la mesure de l’épaisseur maculaire a démontré de meilleures performances dans le diagnostic du glaucome et dans la détection de sa progression dans des cas spécifiques, la combinaison de ces deux mesures pourrait permettre de meilleurs résultats diagnostiques [36]. L’imagerie de la région maculaire présente l’avantage d’éviter l’imprécision liée à la variabilité du disque optique alors que l’imagerie de la macula est relativement invariable.
Le but ultime de l’OCT serait l’imagerie directe des cellules ganglionnaires rétiniennes. Malheureusement, le contraste entre les cellules est insuffisant pour le permettre avec les techniques actuelles. La limite postérieure de la couche des cellules ganglionnaires peut être difficile à discriminer et, pour cette raison, beaucoup de systèmes incorporent la couche plexiforme interne (qui comprend les dendrites des cellules ganglionnaires rétiniennes et leurs connexions avec les cellules bipolaires et amacrines). Un certain nombre d’études a confirmé l’utilité de cette approche qui a été incorporée dans les systèmes d’analyse par défaut au sein des systèmes OCT commercialisés.
CHOROÏDE
Le choix d’une longueur d’onde à 1 060 nm combinée avec l’OCT-swept source (OCT-SS) de haute vitesse permet une pénétration plus profonde dans la choroïde et de meilleures performances dans les yeux avec des milieux oculaires troubles (cataracte, trouble cornéen) [5, 7-9, 25, 38]. La cartographie de l’épaisseur choroïdienne et la quantification de la vascularisation choroïdienne apporteraient, grâce à cette nouvelle technologie OCT, un biomarqueur complémentaire utile pour le diagnostic ophtalmologique. La réalisation de cartes d’épaisseur choroïdienne a été développée et appliquée tout d’abord chez les sujets sains pour établir une base de données normatives (fig. 10-94a). Il a été démontré que l’épaisseur choroïdienne est inversement proportionnelle à la longueur axiale. Les yeux hypermétropes ont tendance à avoir une épaisseur choroïdienne plus importante avec moins de variations, alors que les yeux myopes présentent des épaisseurs choroïdiennes moindres avec de plus grandes variations interindividuelles (fig. 10-94b). La fig. 10-94c représente un relevé OCT rétinien à très haute résolution à 800 nm (résolution axiale de 2 à 3 μm) versus une résolution standard (résolution axiale 8 à 10 μm), et un OCT à très haute résolution de 1 060 nm (résolution axiale < 5 μm).
LAME CRIBLÉE : ÉVALUER LE « DISQUE À RISQUE »
Avec ce qui se fait de mieux en technologie laser à OCT-SS [4, 14, 17-20, 43], les vitesses de balayage plus rapides ont facilité l’emploi de techniques de traitement du signal qui, suffisamment moyenné, permet de minimiser les bruits parasites, ce qui est particulièrement utile dans l’analyse des structures du disque optique comme la lame criblée. Les pores de la lame criblée peuvent de la sorte être déterminés ainsi que leur relation avec l’épaisseur de celle-ci [2, 3, 34, 35]. Un défi significatif non encore atteint reste une mesure fiable de l’épaisseur de la lame criblée. Avec les longueurs d’onde habituellement utilisées en imagerie OCT, d’environ 800 nm, les signaux montrent une atténuation considérable en allant vers la partie postérieure de la lame criblée. L’utilisation de longueurs d’onde plus longues permet une meilleure pénétration en profondeur, mais avec une sensibilité réduite pour les couches les plus superficielles de la lame criblée et la couche des FNR.
Par ailleurs, il ne faut pas oublier que l’OCT fournit une résolution de haut niveau dans la direction du faisceau incident, mais que la résolution latérale reste limitée pour différentes raisons (caractéristiques de l’œil et présence d’aberrations optiques). Des tentatives ont été faites pour limiter ces effets en combinant l’OCT avec l’optique adaptative. Ces solutions ont fourni des images volumétriques de haute résolution de la lame criblée humaine, mais en pratique, elles restent encore un défi technique et ne sont pas tout à fait prêtes pour une utilisation clinique courante.
FONCTION RÉTINIENNE
Même avec les limites actuelles encore rencontrées, il est possible d’exploiter la résolution axiale pour fournir des informations en imagerie qui sont corrélées avec des données infracellulaires. La première de celles-ci rapporte les changements de l’indice de réfraction cellulaire qui surviennent pendant une modification de la différence de potentiel à travers une membrane cellulaire.
Des modifications subtiles des propriétés optiques locales des tissus biologiques restent en effet détectables. L’OCT est extrêmement sensible aux modifications de l’indice de réfraction, et ce phénomène de dispersion pourrait permettre de parvenir à une analyse non invasive de la physiologie des couches profondes de la rétine, technique dénommée optophysiologie [1, 33, 37]. De telles mesures ont d’abord été rapportées in vitro avec l’étude de l’adaptation à l’obscurité de rétines vivantes de lapins. De multiples OCT étaient couplés à un enregistrement synchrone de l’électrorétinogramme (ERG). La fig. 10-95a montre une image OCT de la rétine de lapin, attestant qu’il est bien capable de visualiser toutes les couches rétiniennes majeures. Cette image OCT morphologique (scan-M), acquise au voisinage de la région où les données fonctionnelles OCT étaient enregistrées, est comparée avec des scans-M représentatifs bruts (fig. 10-95b) et différentiels (fig. 10-95c) acquis pendant une stimulation avec un flash unique (ERG et stimulus représentés dans la fig. 10-95d). La modification de la rétrodiffusion optique rétinienne à une localisation correspondant aux segments externes des photorécepteurs en tant que fonction du temps est présentée en fig. 10-95e, où les marques jaunes représentent la durée du stimulus lumineux. Le signal montre une augmentation rapide de la rétrodiffusion optique, commençant de façon simultanée avec le flash, puis un retour lent à la ligne de base. Les fig. 10-95f,g,h comparent les scans-M différentiels en 3D pour une meilleure visualisation dans le temps de l’amplitude des modifications optiques positives et négatives acquises pendant le scan réalisé dans l’obscurité [dark scan – DS –, absence de stimulus lumineux, fig. 10-95f,i) ; stimulus flash unique (SF, fig. 10-95g,j) ; SF + inhibition des photorécepteurs (fig. 10-95h)]. Comme prévu pour le scan dans l’obscurité, la réflectivité optique de la couche des photorécepteurs ne change pas de façon significative avec le temps (fig. 10-95f,i). Dans le premier et le second type d’expérimentation pendant l’enregistrement du stimulus flash unique réalisé sur les rétines normales adaptées à l’obscurité, la réflectivité des segments internes et externes de la couche des photorécepteurs montrait respectivement des modifications négatives et positives significatives après le stimulus lumineux (fig. 10-95g,j). Le début des signaux optiques était en bonne corrélation avec celui du flash lumineux. Le chlorure de potassium était utilisé pour inhiber la fonction des photorécepteurs et les changements optiques observés sur les segments internes et externes des photorécepteurs apparaissaient proches du niveau de rétrodiffusion optique et ne montraient pas de corrélation avec la survenue du stimulus lumineux (fig. 10-95h). La comparaison des signaux optophysiologiques en 3D pour le scan à l’obscurité et après stimulus avec flash unique est également représentée pour plus de clarté dans les fig. 10-95i,j [1].
Les études in vivo préliminaires suggèrent que la capture optophysiologique de l’activité neuronale est aussi possible. Techniquement, ces mesures sont un défi car l’imprécision générée par les mouvements de l’œil et les pulsations rétiniennes secondaires aux pulsations cardiaques doit être minimisée pendant l’acquisition des images. En laboratoire, les artéfacts dus aux mouvements peuvent être réduits sur les yeux de modèles animaux anesthésiés et paralysés, et les effets de la pulsation rétinienne peuvent être minimisés en déclenchant l’acquisition des images OCT au même moment dans le cycle cardiaque (fig. 10-95k,l). Un stimulus lumineux d’une seconde était appliqué sur une zone réduite, après deux secondes au cours d’une mesure de cinq secondes. La fig. 10-95k montre le tomogramme rétinien visualisant toutes les couches de la rétine (sur la gauche) ; l’encadré rouge indique la zone analysée. La valeur de base était calculée comme la moyenne à partir des données préstimulus. La fig. 10-95k montre la modification relative d’intensité par rapport à la ligne de base. Les signaux intrinsèques à partir des segments internes/externes surviennent seulement dans les zones stimulées (encadré blanc) ; aucun signal n’est observé dans les zones non stimulées. L’évolution dans le temps de la modification du signal moyen est montrée en fig. 10-95l. Après la survenue du stimulus, la réflectivité change et commence à baisser environ deux secondes après l’arrêt du stimulus.
Ces résultats préliminaires démontrent le potentiel significatif de l’OCT permettant l’optophysiologie, autrement dit les réponses physiologiques des couches profondes de la rétine, véritable analogue optique de l’électrophysiologie, malgré des signaux rétiniens optiques intrinsèques pourtant très subtils. Ainsi, en plus des mesures optiques non invasives, extrêmement sensibles avec une longueur d’onde appropriée et une vitesse de mesure extrêmement élevée (probablement en combinaison avec des eye trackers sophistiqués), on pourra éviter les artéfacts causés par des mouvements de l’œil afin d’adapter cette extension fonctionnelle intéressante de l’OCT à des études chez l’homme, incluant des patients avec des pathologies rétiniennes.
IMAGERIE CELLULAIRE : DÉTECTION DE CELLULES MALADES
De nombreuses études sur des modèles animaux de glaucome ont montré que les cellules ganglionnaires rétiniennes ont une période prolongée de dégénérescence avant la survenue de la mort neuronale [22]. Cela se manifeste sur le plan structurel par un élagage de l’arbre dendritique et fonctionnellement par une réduction de l’efficacité de la transduction du signal. Étant donné les potentialités de l’OCT pour détecter l’activité neuronale, la possibilité d’une détection par OCT des cellules ganglionnaires rétiniennes malades a été prise en considération, idéalement avant le moment où la cellule s’engage dans l’apoptose. Les techniques d’imagerie fondées sur la fluorescence ont démontré l’utilité de cette approche. Ainsi l’annexine V a-t-elle été utilisée en combinaison avec l’ophtalmoscopie conventionnelle afin de visualiser les cellules ganglionnaires rétiniennes apoptotiques. L’application de cette technologie chez l’homme inclut plusieurs défis dont la sécurité, le caractère si possible non invasif et la spécificité [12, 23].
L’OCT à très haute résolution a récemment été mise en œuvre pour démontrer la faisabilité d’une détection non invasive sans marquage de la dégénérescence neuronale rétinienne précoce. Une analyse de texture a été utilisée pour fournir des informations subcellulaires (incluant des modifications des organites dues à la dégénérescence neuronale) en dessous de la résolution du système. Une méthode éprouvée d’analyse des images OCT, fondée sur la théorie des ondelettes spatiales et le paramétrage de la texture des « tavelures » (= effet de chatoiement) de l’image, a été développée et appliquée afin de démontrer la détection non invasive et la quantification des modifications apoptotiques neuronales précoces, dans les 30 minutes suivant un traumatisme neuronal suffisant pour aboutir à une apoptose (fig. 10-96a). Une corrélation positive a pu être démontrée entre le marquage immunofluorescent des mitochondries et les modifications dans la texture des images OCT des neurones cultivés. En outre, cette analyse de base de la texture peut aussi être appliquée aux cellules ganglionnaires rétiniennes/couche plexiforme interne dans des explants rétiniens obtenus après section du nerf optique (fig. 10-96b). Ces études suggèrent que l’OCT combinée avec des algorithmes d’analyse de texture serait utilisable dans une évaluation quantitative non invasive de la mort neuronale avec une application particulière pour l’évaluation précoce des maladies rétiniennes.
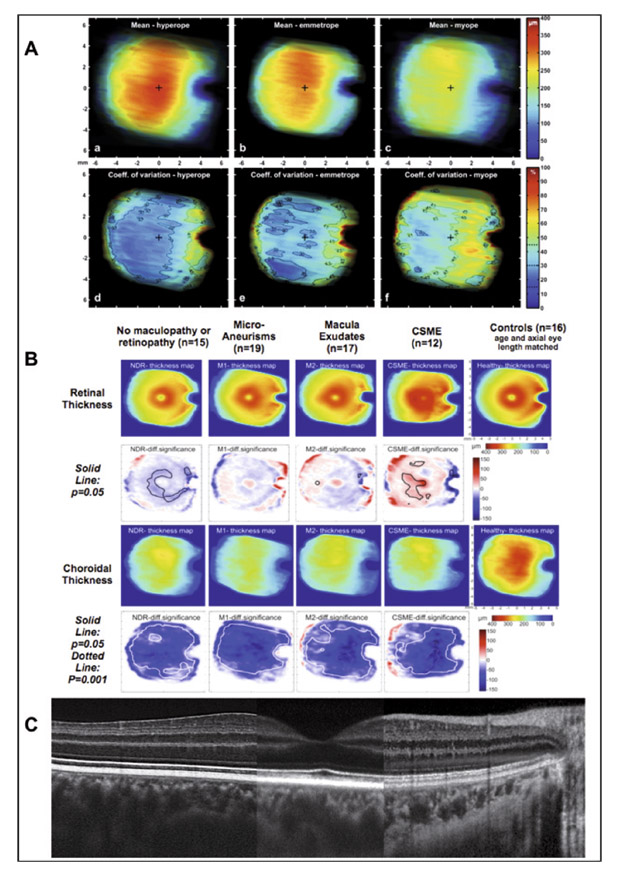
Fig. 10-94 OCT choroïdien à 1 060 nm. Carte d’épaisseur choroïdienne en deux dimensions chez les sujets normaux : myope (gauche), emmétrope (milieu) hypermétrope (droite) et leurs variations (a). Épaisseur rétinienne et choroïdienne et variations chez les patients diabétiques de type 2 (b). Avancée technologique récente (c) : OCT à très haute résolution 800 nm (gauche) ; résolution standard 1 060 nm (milieu), très haute résolution 1 060 nm OCT (droite).
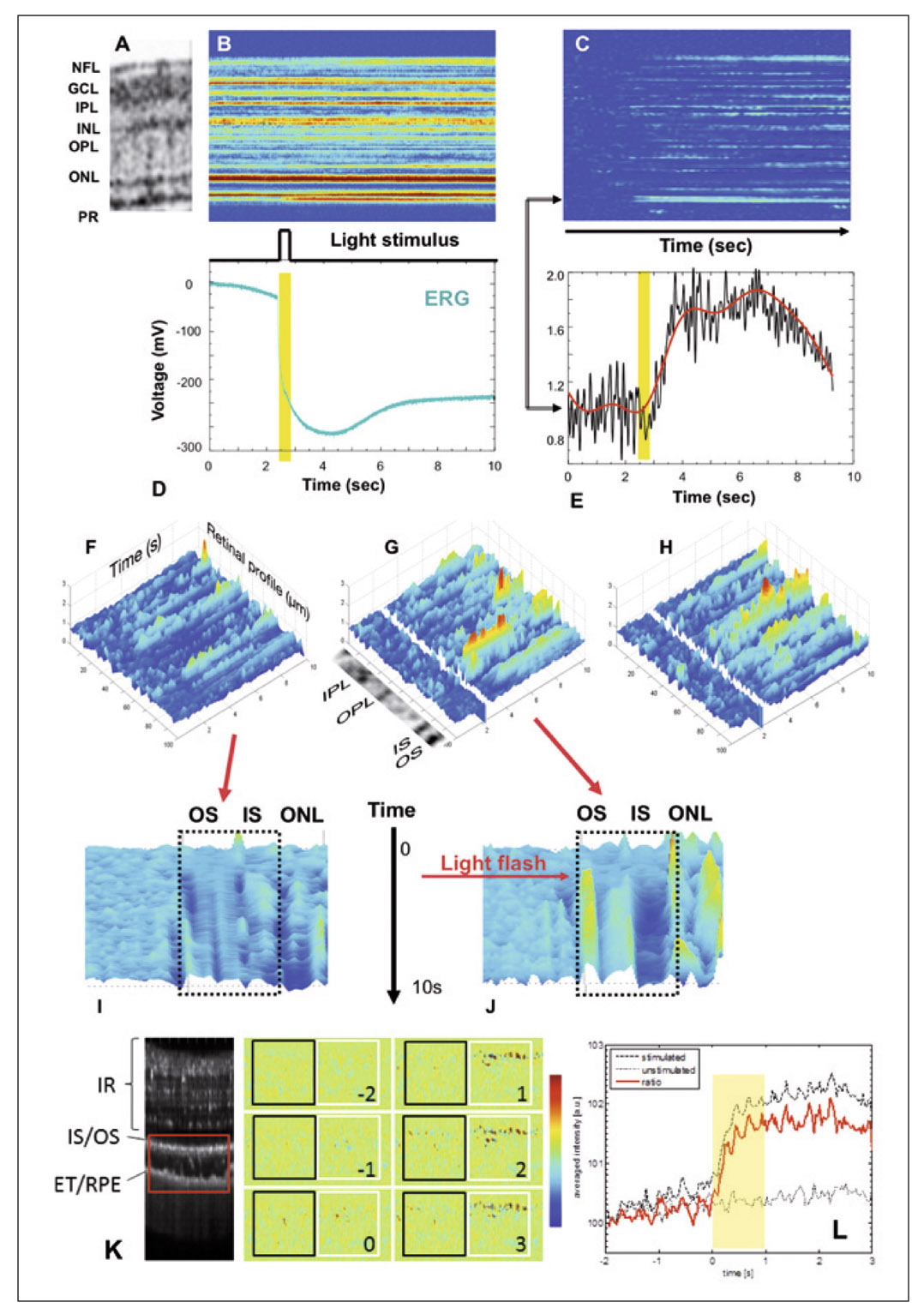
Fig. 10-95 Optophysiologie – physiologie rétinienne résolue profonde non invasive. OCT in vitro de rétine de lapin (a), scans-M bruts (b) et différentiel (c) optophysiologiques acquis pendant une stimulation par flash simple (ERG et stimulus représentés en d). La modification dans la rétrodiffusion optique rétinienne (couche des photorécepteurs) en tant que fonction du temps est présentée en e, où les encadrés jaunes indiquent la durée du stimulus lumineux. Scans-M différentiels en 3D pour une meilleure visualisation au cours du temps et de l’amplitude des modifications optiques positives et négatives observées acquises durant le scan à l’obscurité (f ; DS). Stimulus à flash unique (g ; SF) et SF plus inhibition photorécepteurs (h). La comparaison des signaux optophysiologiques en 3D pour DS et SF est représentée pour plus de clarté en i, j. k, l. Stimulation rétinienne expérimentale sur un modèle animal de musaraigne d’arbre. Tomogramme visualisant toutes les couches rétiniennes majeurs (k) (IR : rétine interne avec la couche des FNR, plexiforme interne et externe et couches nucléaires ; OS/IS : jonction entre les segments internes et externes des photos récepteurs ; ET/RPE : terminaison des photorécepteurs/épithélium pigmentaire rétinien). Tomogrammes réalisés à différents moments en fonction du stimulus (temps en secondes). Les encadrés noirs indiquent les zones non stimulées, les encadrés blancs indiquent les zones stimulées (k milieu). Le changement d’intensité moyenné de la zone, la survenue et la durée du stimulus sont indiqués par les marques jaunes (l).
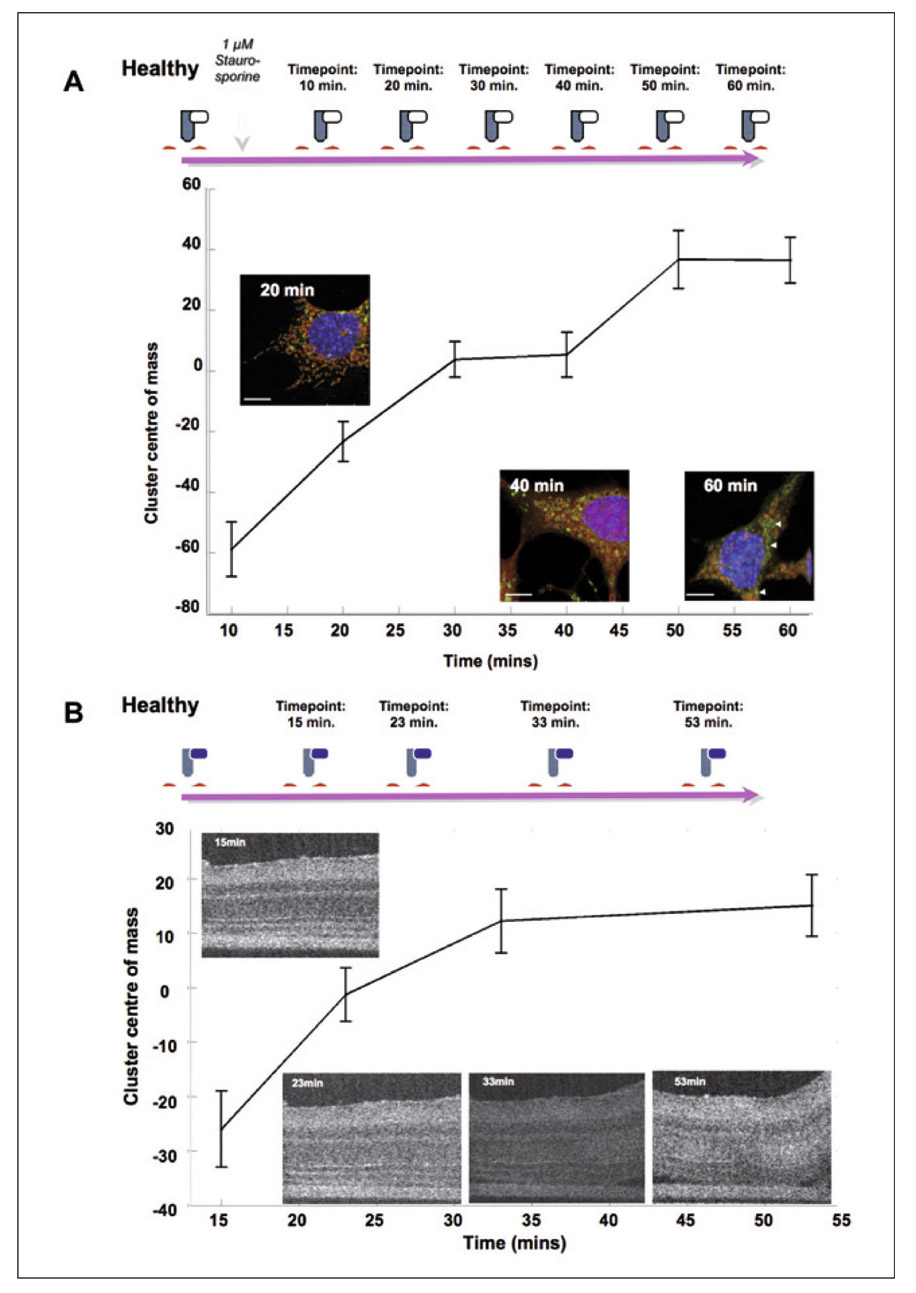
Fig. 10-96 Détection non invasive sans marquage de la dégénérescence neuronale rétinienne précoce par OCT. Analyse de texture (centre cluster de masse) des modifications apoptotiques précoces des neurones dans les 30 minutes suivant un traumatisme neuronal suffisant pour aboutir à une apoptose (a) et dans les cellules rétiniennes ganglionnaires/couche plexiforme interne des explants rétiniens suivant une section du nerf optique (b).
La combinaison des OCT-SD ou -SS avec l’optique adaptative améliore de façon significative la résolution transverse de l’OCT rétinienne en corrigeant les aberrations individuelles de l’œil étudié, et augmente ainsi la résolution cellulaire rétinienne en imagerie. Ainsi la visualisation des cônes et, plus récemment, des bâtonnets peut-elle être obtenue en plus de celle des petits capillaires rétiniens, de la choriocapillaire, des faisceaux isolés de fibres nerveuses, de la même façon que celle des pores de la lame criblée. L’imagerie sans marquage des cellules ganglionnaires rétiniennes par l’OCT reste encore extrêmement difficile, essentiellement parce que ces cellules sont presque totalement transparentes et donc invisibles aux systèmes optiques. De nombreuses expérimentations ont cependant démontré que, dans le glaucome, les cellules ganglionnaires rétiniennes meurent par apoptose. On a pu parvenir à voir les cellules ganglionnaires rétiniennes et leurs dendrites sur des modèles animaux en utilisant une accentuation du contraste par l’intermédiaire d’un marquage. Dans l’œil de la souris, une meilleure résolution a effectivement été obtenue en utilisant une optique adaptative à balayage confocal, comprenant un détecteur de front d’onde intervenant sur la lumière rétrodiffusée [13, 29].
En microscopie/tomographie photo-acoustique, les signaux sont générés en utilisant l’effet photo-acoustique : le tissu est irradié avec de courtes impulsions (typiquement en nanosecondes) pour créer une augmentation thermique localisée au niveau d’éléments absorbants endogènes comme l’hémoglobine et la mélanine, ou des agents de contraste absorbants exogènes [39, 40]. L’absorption de ces impulsions conduit à une distribution initiale de pressions telles qu’elles aboutissent à des ondes ultrasoniques à large bande se propageant à travers le tissu étudié et tout milieu acoustique couplé, ondes détectées par un transducteur. Des travaux préliminaires décrivant la combinaison multimodale de l’OCT et l’imagerie photo-acoustique ont démontré le potentiel de ces deux techniques qui se complètent et fournissent des informations concernant respectivement la dispersion et l’absorption tissulaire. En ophtalmologie, et en particulier pour le diagnostic du glaucome, le couplage imagerie photo-acoustique-OCT pourrait permettre une imagerie moléculaire des chromophores rétiniens (caroténoïde, mélanine), la visualisation de la vascularisation à une profondeur plus importante aussi bien que l’oxygénation sanguine dans la vascularisation rétinienne [21, 30-32, 46, 47].
Malgré les récents développements de ce qui se fait de mieux en technique diagnostique, le défi dans l’utilisation de l’évaluation structurale et fonctionnelle pour le diagnostic du glaucome résulte, chez les sujets normaux, de la grande variabilité des caractéristiques structurales évaluées cliniquement ou avec les techniques d’imagerie. Pour le diagnostic précis de la progression du glaucome, les défis concernent les difficultés à faire la part des changements réels liés à la maladie des variabilités des mesures ainsi que ceux liées à l’âge.
L’OCT a révolutionné notre perception des modifications qui surviennent dans la rétine et le disque optique dans le glaucome. Deux problèmes importants persistent cependant : l’imagerie des cellules ganglionnaires rétiniennes individuelles et la délimitation de la lame criblée. Il y a peu de doute que certains yeux soient plus capables que d’autres de résister aux effets de la pression intra-oculaire. Notre capacité à quantifier les caractéristiques structurales de ces yeux fournira de précieux renseignements sur les facteurs qui initient la mort des cellules ganglionnaires rétiniennes dans le glaucome. À partir des données de l’optique physique, l’OCT a le potentiel de déterminer ces particularités. Les limites de cette résolution restent du domaine de l’ingénierie et du coût.
[1] Bizheva K, et al. Optophysiology : depth-resolved probing of retinal physiology with functional ultrahigh-resolution optical coherence tomography. Proceed Natl Acad Sci USA. 2006 ; 103 : 5066-71.
[2] Burgoyne CF. Image analysis of optic nerve disease. Eye. 2004 ; 18 : 1207-13.
[3] Chauhan BC, Burgoyne CF. From clinical examination of the optic disc to clinical assessment of the optic nerve head : a paradigm change. Am J Ophthalmol. 2013 ; 156 : 218-27.
[4] Choma MA, Sarunic MV, Yang CH, Izatt JA. Sensitivity advantage of swept source and Fourier domain optical coherence tomography. Optics Express. 2003 ; 11 : 2183-9.
[5] de Bruin DM, et al. In vivo three-dimensional imaging of neovascular age-related macular degeneration using optical frequency domain imaging at 1050 nm. Invest Ophthalmol Vis Sci. 2008 ; 49 : 4545-52.
[6] deBoer JF, Milner TE, vanGemert MJC, Nelson JS. Two-dimensional birefringence imaging in biological tissue by polarization-sensitive optical coherence tomography. Optics Letters. 1997 ; 22 : 934-6.
[7] Esmaeelpour M, et al. Choroidal thinning in diabetes type 1 detected by 3-dimensional 1 060 nm optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 6803-9.
[8] Esmaeelpour M, et al. Mapping choroidal and retinal thickness variation in type 2 diabetes using three-dimensional 1 060-nm optical coherence tomography. Invest Ophthalmol Vis Sci.2011 ; 52 : 5311-6.
[9] Esmaeelpour M, et al. Three-dimensional 1 060-nm OCT : choroidal thickness maps in normal subjects and improved posterior segment visualization in cataract patients. Invest Ophthalmol Vis Sci. 2010 ; 51 : 5260-6.
[10] Folio LS, Wollstein G, Schuman JS. Optical coherence tomography : future trends for imaging in glaucoma. Optom Vis Sci. 2012 ; 89 : E554-62.
[11] Fortune B, Burgoyne CF, Cull G, et al. Onset and progression of peripapillary retinal nerve fiber layer (RNFL) retardance changes occur earlier than RNFL thickness changes in experimental glaucoma. Invest Ophthalmol Vis Sci. 2013 ; 54 : 5653-61.
[12] Galvao J, Davis BM, Cordeiro MF. In vivo imaging of retinal ganglion cell apoptosis. Curr Opin Pharmacol. 2013 ; 13 : 123-7.
[13] Geng Y, et al. Adaptive optics retinal imaging in the living mouse eye. Biomedical Optics Express. 2012 ; 3 : 715-34.
[14] Golubovic B, Bouma BE, Tearney GJ, Fujimoto JG. Optical frequency-domain reflectometry using rapid wavelength tuning of a Cr/sup 4+/ : forsterite laser. Optics Letters. 1997 ; 22 : 1704-6.
[15] Hee MR, Huang D, Swanson EA, Fujimoto JG. Polarization-sensitive low-coherence reflectometer for birefringence characterization and ranging. J Opt Soc Am. 1992 ; B9 : 903-8.
[16] Hitzenberger CK, Gotzinger E, Sticker M, et al. Measurement and imaging of birefringence and optic axis orientation by phase resolved polarization sensitive optical coherence tomography. Optics Express. 2001 ; 9 : 780-90.
[17] Huber R, Adler DC, Srinivasan VJ, Fujimoto JG. Fourier domain mode locking at 1050 nm for ultra-high-speed optical coherence tomography of the human retina at 236,000 axial scans per second. Opt Lett. 2007 ; 32 : 2049-51.
[18] Huber R, Adler DC, Fujimoto JG. Buffered Fourier domain mode locking : unidirectional swept laser sources for optical coherence tomography imaging at 370,000 lines/s. Opt Lett. 2006 ; 31 : 2975-7.
[19] Huber R, Wojtkowski M, Fujimoto JG, et al. Three-dimensional and C-mode OCT imaging with a compact, frequency swept laser source at 1300 nm. Optics Express. 2005 ; 13 : 10523-38.
[20] Klein T, Andre R, Wieser W, et al. Joint aperture detection for speckle reduction and increased collection efficiency in ophthalmic MHz OCT. Biomedical Optics Express. 2013 ; 4 : 619-34.
[21] Liu T, Wei Q, Wang J, et al. Combined photoacoustic microscopy and optical coherence tomography can measure metabolic rate of oxygen. Biomedical Optics Express. 2011 ; 2 : 1359-65.
[22] Morgan JE. Retina ganglion cell degeneration in glaucoma : an opportunity missed ? A review. Clin Exper Ophthalmol. 2012 ; 40 : 364-8.
[23] Normando EM, Turner LA, Cordeiro MF. The potential of annexin-labelling for the diagnosis and follow-up of glaucoma. Cell Tissue Res. 2013 ; 353 : 279-85.
[24] Pircher M, Hitzenberger CK, Schmidt-Erfurth U. Polarization sensitive optical coherence tomography in the human eye. Prog Retin Eye Res. 2011 ; 30 : 431-51.
[25] Povazay B, et al. Wide field optical coherence tomography of the choroid in vivo. Invest Ophthalmol Vis Sci. 2009 ; 50 : 1856-63.
[26] Reis AS, et al. Influence of clinically invisible, but optical coherence tomography detected, optic disc margin anatomy on neuroretinal rim evaluation. Invest Ophthalmol Vis Sci. 2012 ; 53 : 1852-60.
[27] Rohrschneider K, Burk RO, Kruse FE, Volcker HE. Reproducibility of the optic nerve head topography with a new laser tomographic scanning device. Ophthalmology. 1994 ; 101 : 1044-9.
[28] Rohrschneider K, Burk RO, Volcker HE. [Comparison of two laser scanning tomography systems for three-dimensional analysis of the optic papilla]. Der Ophthalmologe : Zeitschrift der Deutschen Ophthalmologischen Gesellschaft. 1993 ; 90 : 613-9.
[29] Sharma R, et al. In vivo two-photon imaging of the mouse retina. Biomedical Optics Express. 2013 ; 4 : 1285-93.
[30] Song W, Wei Q, Jiao S, Zhang HF. Integrated photoacoustic ophthalmoscopy and spectral-domain optical coherence tomography. Journal of Visualized Experiments. 2013 ; e4390 ; doi : 10.3791/4390.
[31] Song W, et al. Integrating photoacoustic ophthalmoscopy with scanning laser ophthalmoscopy, optical coherence tomography, and fluorescein angiography for a multimodal retinal imaging platform. J Biomed Opt. 2012 ; 17 : 061206.
[32] Song W, et al. Multimodal photoacoustic ophthalmoscopy in mouse. Journal of Biophotonics. 2013 ; 6 : 505-12.
[33] Srinivasan VJ, Wojtkowski M, Fujimoto JG, Duker JS. In vivo measurement of retinal physiology with high-speed ultrahigh-resolution optical coherence tomography. Opt Lett. 2006 ; 31 : 2308-10.
[34] Strouthidis NG, Yang H, Fortune B, et al. Detection of the optic nerve head neural canal opening within three-dimensional histomorphometric and spectral domain optical coherence tomography data sets. Invest Ophthalmol Vis Sci. 2009 ; 50 : 214-23.
[35] Strouthidis NG, et al. A comparison of optic nerve head morphology viewed by spectral domain optical coherence tomography and by serial histology. Invest Ophthalmol Vis Sci. 2010 ; 51 : 1464-74.
[36] Sung KR, et al. Macular assessment using optical coherence tomography for glaucoma diagnosis. Br J Ophthalmol. 2012 ; 96 : 1452-5.
[37] Tumlinson AR, et al. Techniques for extraction of depth-resolved in vivo human retinal intrinsic optical signals with optical coherence tomography. Jpn J Ophthalmol. 2009 ; 53 : 315-26.
[38] Unterhuber A, et al. In vivo retinal optical coherence tomography at 1040 nm-enhanced penetration into the choroid. Optics Express. 2005 ; 13 : 3252-8.
[39] Wang L, et al. Combined photoacoustic and molecular fluorescence imaging in vivo. Conf Proc IEEE Eng Med Biol Soc. 2005 ; 1 : 190-2.
[40] Wang X, et al. Noninvasive laser-induced photoacoustic tomography for structural and functional in vivo imaging of the brain. Nat Biotechnol. 2003 ; 21 : 803-6.
[41] Xu G, Weinreb RN, Leung CK. Retinal nerve fiber layer progression in glaucoma : a comparison between retinal nerve fiber layer thickness and retardance. Ophthalmology. 2013 ; 120 : 2493-500.
[42] Yasuno Y, et al. Polarization-sensitive complex Fourier domain optical coherence tomography for Jones matrix imaging of biological samples. Applied Physics Letters. 2004 ; 85 : 3023-5.
[43] Yun SH, Tearney, de-Boer GJ, et al. High-speed optical frequency-domain imaging. Optics Express. 2003 ; 11 : 2953-63.
[44] Zangwill LM, van Horn S, de Souza Lima M, et al. Optic nerve head topography in ocular hypertensive eyes using confocal scanning laser ophthalmoscopy. Am J Ophthalmol. 1996 ; 122 : 520-5.
[45] Zeimer R, Asrani S, Zou S, et al. Quantitative detection of glaucomatous damage at the posterior pole by retinal thickness mapping. A pilot study. Ophthalmology. 1998 ; 105 : 224-31.
[46] Zhang EZ, et al. Multimodal photoacoustic and optical coherence tomography scanner using an all optical detection scheme for 3D morphological skin imaging. Biomedical Optics Express. 2011 ; 2 : 2202-15.
[47] Zhang X, Zhang HF, Jiao S. Optical coherence photoacoustic microscopy : accomplishing optical coherence tomography and photoacoustic microscopy with a single light source. J Biomed Opt. 2012 ; 17 : 030502.
J.-P. Nordmann
La périmétrie cinétique a peu d’intérêt dans le glaucome primitif à angle ouvert excepté dans les formes très évoluées (voir plus loin). En général, les isoptères situés dans les 30° centraux sont touchés, alors que les isoptères les plus périphériques, correspondant à des spots de grande taille et de forte luminosité, sont peu perturbés. En revanche, la périmétrie cinétique a du mal à détecter les petits scotomes paracentraux, surtout si ceux-ci sont relatifs. L’analyse de la région de la papille peut être intéressante en périmétrie cinétique dans la mesure où la périmétrie statique ne mesure pas vraiment la taille de la tâche aveugle, ne se contentant que de la localiser (fig. 10-97 et 10-98).
Fig. 10-97 Périmétrie cinétique automatisée. Atteinte nasale supérieure et inférieure ; relevé œil gauche.
Fig. 10-98 Périmétrie de Goldmann. Large scotome arciforme supérieur dans l’aire de Bjerrum (œil droit).
J.-P. Nordmann
-
L’existence de points anormaux dans le champ visuel correspond à un début de glaucome à condition qu’ils répondent à un certain nombre de critères concernant leur localisation et leur profondeur.
-
Les principaux déficits périmétriques du glaucome sont le déficit diffus, le ressaut nasal, le scotome arciforme et le déficit paracentral.
-
Dans les formes avancées, ces déficits deviennent coalescents et une vision tubulaire persiste.
-
L’analyse de l’évolution des déficits doit tenir compte de la variabilité des réponses, d’autant plus importante que le glaucome est plus avancé.
Pour savoir si un relevé de champ visuel est anormal, il faut bien sûr avoir une idée de ce qui est considéré comme normal. L’altération progressive et homogène du champ avec l’âge rentre donc en ligne de compte.
Une anomalie peut être mise en évidence de plusieurs façons, par comparaison avec des sujets du même âge, par comparaison des différents points d’un même champ visuel (points adjacents ou à distance, d’un hémisphère à l’autre) et par comparaison entre les deux yeux. En fonction des patients, on pourra choisir des critères plus ou moins stricts qui sont précisés dans le tableau 10-3 (reproduction des critères proposés par l’American Academy of Ophthalmology). En réalité, ces critères permettent de cerner les déficits fasciculaires (scotome arciforme, ressaut nasal, scotome paracentral, etc.), mais ne sont pas suffisants en cas de déficit diffus.
La comparaison entre les deux yeux d’un même sujet peut avoir un intérêt en cas d’hypertension intra-oculaire (HTO) unilatérale. La variabilité interoculaire est en effet beaucoup plus faible que la variabilité d’un sujet à l’autre. On estime que la différence de sensibilité moyenne entre les deux yeux est inférieure à 1 dB dans 95 % des cas et à 1,5 dB dans 99 % des cas. Une différence supérieure à 2 dB en moyenne est donc très suspecte, surtout si l’œil ayant la sensibilité la plus basse présente la pression la plus élevée.
Tableau 10.3 Critères déterminant une anomalie du champ visuel sur un test des 30° centraux.
Un déficit diffus peut être le mode de découverte du glaucome [3] (fig. 10-99). En général, une atteinte diffuse est présente lorsqu’il existe une forte HTO. Ce déficit atteint l’ensemble du champ, y compris le seuil fovéal. Il est probablement la conséquence directe de la compression des cellules ganglionnaires par l’HTO et peut régresser rapidement dès que l’hypertonie est jugulée. Le principal diagnostic différentiel à évoquer chez le sujet âgé est la présence d’une cataracte débutante.
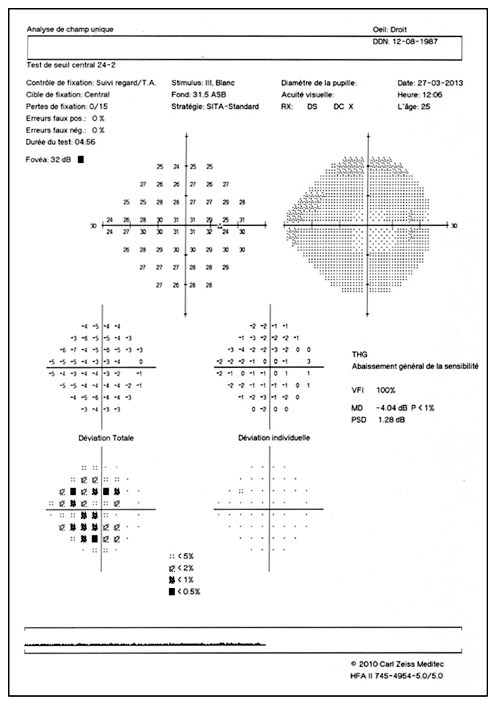
Fig. 10-99 Déficit diffus chez un patient de 25 ans présentant une hypertonie oculaire à 32 mmHg.
Le ressaut nasal est un signe très fréquent de début d’atteinte glaucomateuse [4] (fig. 10-100). Il siège à la limite des 30° centraux dans un hémi-champ et réalise un déficit plus ou moins absolu en périphérie qui se poursuit par un déficit relatif dans la région plus centrale. Il traduit une destruction de la couche des fibres nerveuses rétiniennes au niveau du rebord de l’anneau neurorétinien dans sa région périphérique. Ce déficit est rarement réversible après la mise en route du traitement.
Certains ressauts nasaux débutants ne se traduisent que par un déficit relatif minime pouvant apparaître douteux. Il est important d’analyser le caractère localisé sur un seul hémi-champ de cette atteinte. En effet, s’il est possible d’avoir d’importantes variations de sensibilité lumineuse d’un sujet à l’autre, voire d’un œil à l’autre, la sensibilité rétinienne est en général symétrique d’un hémi-champ à l’autre sur un même œil.
En cas de déficit très périphérique, l’atteinte ne serait pas perceptible dans les 30° centraux. Une telle éventualité survient dans 5 % des cas. Lorsqu’un ressaut nasal est présent dans les 30° centraux, il peut être souhaitable d’évaluer son extension dans une région plus périphérique. Les tests G1 et G2 d’Octopus permettent aisément d’étudier ce point.
Un ressaut nasal supérieur et inférieur symétrique de part et d’autre de l’axe horizontal est parfois observé. Bien que possible, ce type de scotome est souvent un artéfact provoqué par le bord de la correction.
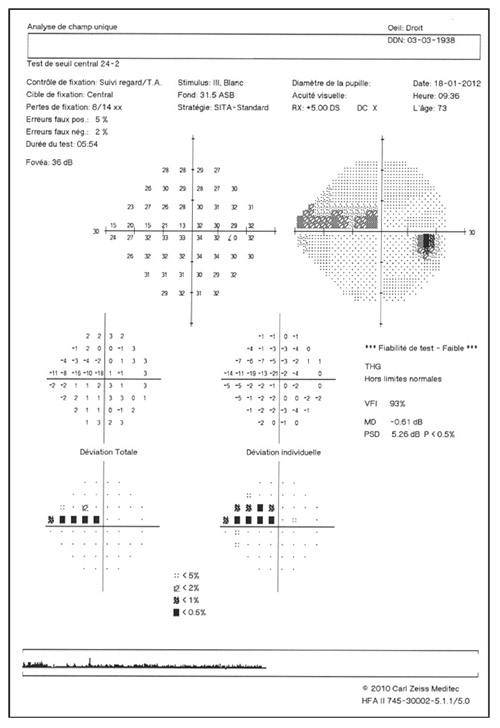
Fig. 10-100 Ressaut nasal.
Un scotome paracentral isolé est une forme classique de début de glaucome (fig. 10-101 et 10-102). Il siège le plus souvent entre 1 et 10° du point de fixation, sans atteinte initiale du seuil fovéal ni de l’acuité visuelle, même si le scotome absolu semble jouxter le point de fixation. S’il s’était agi d’une affection rétinienne, le déficit serait en général non pas paracentral mais central, avec atteinte associée du seuil fovéal.
Un déficit profond de 4° est possible et peut passer inaperçu lors d’un test de Humphrey 24-2, car cette mesure évalue des points distants de 6° les uns des autres. Si un tel déficit est suspecté, une nouvelle mesure du champ avec un test des 10° (distance entre les points : 2°) doit être faite. Lorsqu’un patient « ressent » son déficit et que le relevé classique ne met rien en évidence, il est certain qu’il existe une atteinte dans la région centrale, au sein des 5° du champ.
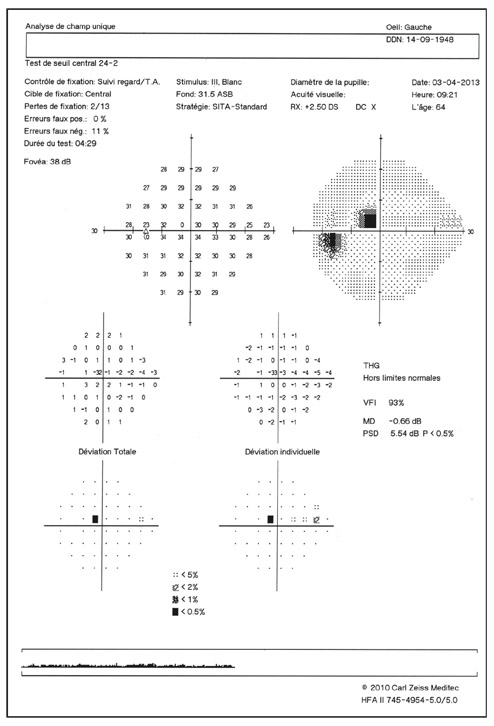
Fig. 10-101 Scotome paracentral : test des 24° centraux.
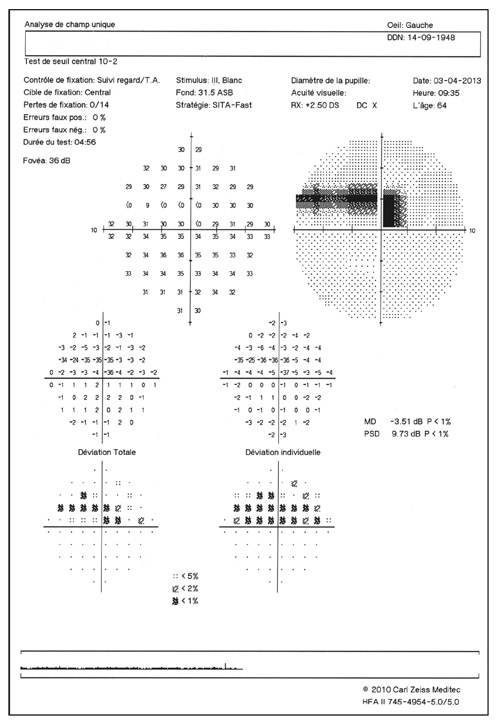
Fig. 10-102 Scotome paracentral : test des 10° centraux.
Le scotome arciforme ou scotome de Bjerrum correspond à un déficit fasciculaire complet [2] (fig. 10-103). Décrit initialement « en doigt de gant », il réalise plutôt en périmétrie automatisée standard une atteinte « en éventail » s’élargissant en périphérie. Le scotome arciforme du glaucome est souvent situé dans l’aire du Bjerrum, c’est-à-dire entre 10 et 30° du point de fixation. Il a tendance à s’arquer nettement autour du centre si bien qu’il est le plus souvent bien visible sur un test des 24 ou 30° centraux, ou le test G1 ou G2 de l’Octopus. S’il envahit le champ nasal, il sera limité par le méridien horizontal.
Un scotome arciforme débute souvent par une atteinte périphérique qui se prolonge secondairement vers le point de fixation. Cela correspond à une lésion de l’extérieur du nerf optique qui se poursuit vers le centre.
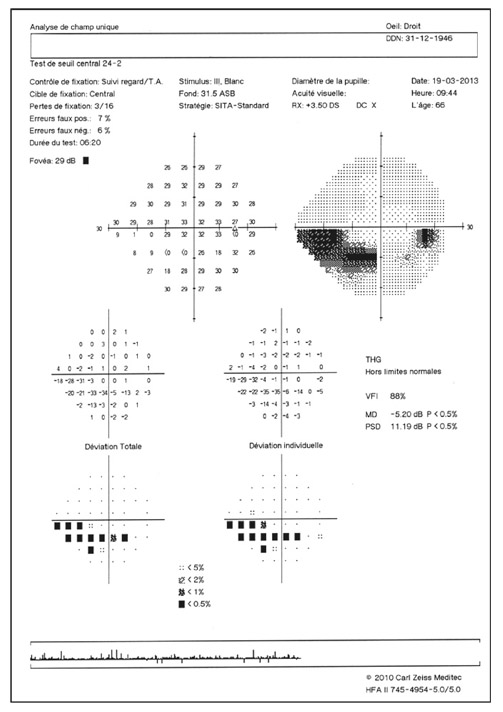
Fig. 10-103 Scotome arciforme inférieur.
Le déficit avancé dans le glaucome réalise un scotome de l’ensemble du champ visuel avec une relative préservation de la région la plus centrale et de la région périphérique temporale [1] (fig. 10-104 et 10-105). À ce stade, il est souvent souhaitable d’évaluer la vision par un test des 10° centraux ou par un test maculaire.
La mesure régulière du champ visuel en périmétrie automatisée standard chez ces patients est souhaitable, car elle permet de déterminer s’il existe réellement une évolution dans le temps. En effet, la plupart des patients présentant un déficit avancé se plaignent subjectivement d’une aggravation permanente de leur champ, même si celui-ci reste en fait stable.
La mesure du seuil fovéal est toujours importante car sa valeur témoigne du degré d’atteinte du point de fixation. Il peut alors être intéressant de compléter l’examen par un test périphérique avec le périmètre de Goldmann.

Fig. 10-104 Déficit avancé, test des 24° centraux
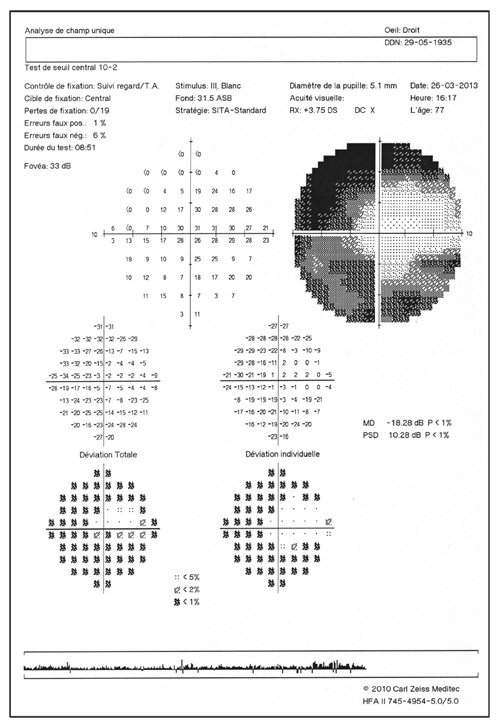
Fig. 10-105 Déficit avancé, test des 10° centraux (même patient que la fig. 10-104).
Un champ visuel agonique correspond à un déficit de la presque totalité de la vision centrale avec conservation d’un fin faisceau de fibres maculaires expliquant la persistance d’une acuité visuelle notable et la sensation d’une vision tubulaire. La simple surveillance de l’acuité visuelle peut, dans de tels cas, permettre d’évaluer de façon approximative cette périmétrie centrale. Sur le relevé de champ, les modifications du seuil fovéal doivent être suivies avec attention. Le champ visuel « agonique » correspond à un déficit pratiquement total de la région centrale. Une analyse de la région périphérique en périmétrie de Goldmann peut être intéressante, mais sa fiabilité est limitée chez un sujet n’ayant pratiquement plus de fixation.
Retenir
-
L’examen du champ visuel est primordial dans l’analyse du glaucome et ne peut en aucun cas être remplacé par la seule étude de la structure oculaire par OCT.
-
Dans les formes évoluées, la périmétrie permet seule d’apprécier une réelle évolution du glaucome.
-
Le type du champ visuel doit être adapté au stade de glaucome et une analyse soigneuse de la région paracentrale doit être réalisée dès qu’un scotome s’approche des 10° centraux.
[1] Chauhan BC, Garway-Heath DF, Goñi FJ, et al. Practical recommendations for measuring rates of visual field change in glaucoma. Br J Ophthalmol. 2008 ; 92 : 569-73.
[2] Hood DC, Raza AS, de Moraes CG, et al. Initial arcuate defects within the central 10 degrees in glaucoma. Invest Ophthalmol Vis Sci. 2011 ; 52 : 940-6.
[3] Kitazawa Y, Yamamoto T. Glaucomatous visual field defects : their characteristics and how to detect them. Clin Neurosci. 1997 ; 4 : 279-83.
[4] Lau LI, Liu CJ, Chou JC, et al. Patterns of visual field defects in chronic open angle glaucoma with different disease severity. Ophthalmology. 2003 ; 110 : 1890-4.
[5] Rao HL, Senthil S, Choudhari NS, et al. Behavior of visual field index in advanced glaucoma. Invest Ophthalmol Vis Sci. 2013 ; 54 : 307-12.
F.Maÿ
-
La périmétrie bleu-jaune (PBJ) et la périmétrie FDT-Matrix™ testent des cellules ganglionnaires rétiniennes dont la répartition sur la rétine est dispersée et dont les champs récepteurs sont larges avec peu de chevauchement. Leur disparition serait donc logiquement plus rapidement détectée.
-
Elles peuvent se révéler très utiles pour le diagnostic des glaucomes pré-périmétriques.
-
Elles détectent des déficits précoces, parfois avant la périmétrie automatisée standard (PAS).
-
Elles testent des voies fonctionnelles différentes, koniocellulaire pour la PBJ et magnocellulaires pour la périmétrie FDT, qui peuvent être atteintes précocement, simultanément ou de manière décalée.
-
Leur utilisation conjointe permet d’augmenter la capacité à détecter des déficits glaucomateux précoces.
La neuropathie optique glaucomateuse résulte d’une perte anormale et progressive des cellules ganglionnaires rétiniennes (CGR). Cette disparition insidieuse reste longtemps indécelable par les moyens diagnostiques conventionnels fonctionnels ou structuraux. Un certain nombre de techniques dites non conventionnelles de l’analyse du champ visuel présentent un intérêt diagnostique dans le dépistage précoce de l’atteinte fonctionnelle du glaucome primitif à angle ouvert (GPAO).
Quigley a montré, dès 1987, que les premiers déficits du champ visuel apparaissaient alors que 20 à 50 % des CGR avaient déjà disparu [35, 36]. L’intervalle entre le début de la maladie et les premières atteintes périmétriques en PAS constitue la phase pré-périmétrique de la neuropathie optique glaucomateuse. Les CGR transmettent chacune des informations visuelles issues de champs récepteurs de taille variable, couvrant l’ensemble de la rétine. La densité des CGR et le chevauchement de leurs champs récepteurs contribuent aux phénomènes de sommation spatiale et temporelle qui compensent la disparition des cellules pendant la phase précoce de la maladie, constituant ainsi une réserve fonctionnelle. Harwerth et al. [11] ont montré que la relation entre l’effectif des CGR et la sensibilité périmétrique n’est pas linéaire. Une perte de cellules se manifeste par un déficit d’autant plus large et précoce qu’elle se produit en périphérie, là où les CGR sont moins denses avec un chevauchement plus rare. Ces phénomènes expliquent que le champ visuel central reste classiquement longtemps préservé malgré la disparition progressive des CGR centrales. À la perte des cellules s’ajoute également le retentissement du dysfonctionnement des CGR en souffrance responsable des fluctuations de la sensibilité en périmétrie, notamment en bordure des déficits constitués [47].
La pathogénie fait intervenir plusieurs types de mécanismes souvent intriqués : vasculaire, mécanique, inflammatoire, neurotrophique. Des études psychophysiques ont montré que tous les types de CGR étaient susceptibles d’être atteints au début de la neuropathie optique glaucomateuse, qu’elles appartiennent à la voie magno-, parvo- ou koniocellulaire [29, 30] (voir chapitre 9-V paragraphe « Périmétrie automatisée bleu-jaune »).
La PBJ et la périmétrie FDT dont les principes sont exposés dans le chapitre 9-V ont rapidement démontré leur capacité à détecter des déficits précoces et leur utilité pour le diagnostic des glaucomes pré-périmétriques.
Les stratégies SITA, actuellement utilisées, fournissent des tests assez rapides de l’ordre de 3 à 5 minutes, réduisant le phénomène de fatigue (voir chapitre 9-V paragraphe « Périmétrie automatisée bleu-jaune »).
Les critères minimaux d’anormalité, déterminés par Polo et al. [34], permettent de différencier les déficits pathologiques avec une bonne sensibilité et une bonne spécificité.
Un scotome est reconnu comme pathologique s’il réunit au moins quatre points contigus assortis d’une probabilité p < 5 %, ou au moins trois points contigus assortis d’une probabilité p < 1 %.
La PBJ se révèle très sensible pour la détection des déficits précoces. La taille des déficits est habituellement plus large que celle des déficits en PAS, et la progression des déficits en PBJ est plus importante qu’en PAS, avec une vitesse de progression jusqu’à deux fois plus rapide [2, 13, 24, 45].
La PBJ présente l’inconvénient d’être influencée par l’opacité des milieux oculaires et notamment par l’existence d’une cataracte. Les courtes longueurs d’onde sont en effet absorbées en partie par le cristallin, et cette absorption augmente régulièrement avec l’âge [39, 52]. Cette absorption se traduit par une diminution diffuse de la sensibilité, qui est majorée en cas de cataracte, surtout s’il s’agit d’une opacité postérieure et centrale [50]. En cas d’association cataracte-glaucome, la baisse diffuse de la sensibilité liée au trouble des milieux limite les capacités de détection et rend difficile le suivi des déficits glaucomateux.
Les appareils actuels ne fournissent pas de logiciel d’analyse statistique de la progression, car la PBJ est essentiellement vouée à la détection des déficits débutants. Le suivi de la progression est réalisable mais il est essentiellement clinique, reposant sur la confrontation des relevés successifs. L’existence des fluctuations nécessite un nombre suffisant d’examens, et une progression ne sera raisonnablement validée qu’après confirmation de la présence d’une aggravation sur trois examens successifs.
La version la plus ancienne, le Humphrey FDT Perimeter™ (Welch Allyn, Carl Zeiss Meditec), est commercialisée depuis 1997. La deuxième version, le Humphrey FDT-Matrix™ (Welch Allyn, Carl Zeiss Meditec), disponible depuis 2003, est plus complète et fournit les prestations d’une périmétrie automatisée classique.
Le FDT Perimeter™ est essentiellement utilisé pour le dépistage, car les tests de seuil sont trop peu précis pour caractériser les déficits et l’appareil manque d’un bon contrôle de la fixation. Les tests de dépistage sont simples à réaliser et rapides, de l’ordre d’une minute (voir chapitre 9-V paragraphe « Périmétrie à doublage de fréquence – FDT-Matrix™ »). L’appareil est facilement transportable et l’examen ne nécessite pas de technicien expérimenté. Ces avantages en font un moyen de choix pour le dépistage de masse et les études épidémiologiques [9, 51].
Le FDT-Matrix™, tout aussi compact, est bien plus complet (voir chapitre 9-V paragraphe « Périmétrie à doublage de fréquence – FDT-Matrix™ »). Deux programmes de dépistage sont fournis, N-30 et 24-2, mais ce dernier est le plus détaillé et le plus précis [48]. Plusieurs tests de seuil sont proposés. Les tests de seuils 24-2, 30-2 et 10-2 utilisent une stratégie proche de la stratégie SITA. Plus précis que le FDT Perimeter, le Matrix™ fournit tous les moyens d’interprétation d’une périmétrie automatisée [1, 17, 28, 37]. De nombreuses études ont montré qu’il présente des performances comparables à la PAS pour distinguer sujets sains et glaucomateux, et pour catégoriser les déficits selon les grades de gravité [5, 26, 31, 46]. Dans une étude publiée en 2012, Lamparter et al. [23] montraient que la relation structure-fonction était meilleure avec le Matrix™ qu’avec la PAS. Peu influencé par le degré de transparence des milieux intra-oculaires, le FDT-Matrix™ conserve sa capacité de détection des déficits en cas de phakosclérose ou de cataracte.
Les indications découlent logiquement de leurs propriétés et de leurs performances. La PBJ partage avec la périmétrie FDT la capacité de détecter des déficits très précoces, parfois avant même la PAS.
De nombreuses études se sont attachées à démontrer la capacité de la PBJ à détecter des déficits précoces chez les patients présentant une hypertension intra-oculaire (HTO). Dès 1995, Johnson [19] montrent que chez des patients présentant une HTO, la PBJ détecte davantage de déficits que la PAS. Dans l’étude de Demirel et Jonhson en 2001, la PBJ relève des déficits chez 9,4 % des patients présentant une HTO [7]. Les yeux hypertones à haut risque de développer un GPAO présentent plus de déficits que ceux qui ont un risque plus faible [15, 33, 41].
Le FDT-Matrix™ se révèle également capable de détecter des déficits précoces chez les patients présentant une HTO. Dans une étude prospective récente concernant 44 yeux présentant une HTO et 29 yeux normaux, Lamparter et al. [22] montrent de bonnes corrélations entre le Matrix™ et la PAS (24-2 SITA).
Il existe une corrélation entre l’existence de déficits en PBJ et la présence d’une altération structurelle localisée de la tête du nerf optique (TNO) ou des fibres nerveuses rétiniennes. La PBJ permet de détecter plus de déficits chez les patients hypertones présentant une anomalie de la TNO [10, 16, 32, 43]. De nombreuses études ont démontré la capacité de la PBJ à détecter les déficits glaucomateux avant la PAS, révélant des déficits chez environ 20 à 25 % des patients à risque de développer un glaucome et qui avaient des champs visuels normaux en PAS à plusieurs reprises [7, 13, 14, 18, 20, 26, 39, 40, 42, 44, 52]. La PBJ serait capable de prédire l’apparition des déficits en PAS cinq à dix ans avant (fig. 10-106) [7, 14, 18-20, 26, 39, 40, 42, 44, 52]. Ferreras et al. [8] ont montré, dans une étude publiée en 2007, que 20 % des glaucomes pré-périmétriques sans déficit en PAS présentaient une anomalie en PBJ.
Ces résultats ont été contredits par l’étude de Van der Schoot et al. [49] en 2010 : au cours d’un suivi de sept à dix ans de 416 patients présentant une HTO, la PAS s’est révélée aussi sensible que la PBJ pour détecter une conversion vers un glaucome. Les résultats de ces nombreuses études doivent être compris en tenant compte d’un certain nombre de réserves : le manque de bases de données normales par tranche d’âge dans les premières études, la variabilité entre les études des critères d’anormalité et des critères de progression, la variabilité des critères diagnostiques de glaucome, et la variabilité des stratégies utilisées d’une étude à l’autre et au cours du suivi.
On retiendra que dans le glaucome pré-périmétrique la meilleure indication de la PBJ est la recherche de déficits précoces chez le sujet aux milieux oculaires encore clairs.
Les premières études cliniques concernant le Matrix™ ont montré rapidement sa capacité à détecter des déficits précoces avant la PAS [4, 21, 26]. Cette performance est liée à la nature du stimulus mais aussi à la disposition des zones testées qui sont larges et contiguës, contiguïté qui permettrait logiquement de détecter de petits déficits pouvant passer inaperçus en PAS et dont les points testés sont distants de 4 à 6°. Les déficits présentés par les relevés du Matrix™ paraissent plus larges et plus sévères qu’en PAS. Dans une étude comportant 99 glaucomes pré-périmétriques et 122 sujets normaux, et se basant sur une analyse statistique fondée sur le PSD (pattern standard deviation), Choi et al. [6] montrent l’intérêt diagnostique du Matrix™ avec une sensibilité estimée supérieure à 75 %.
Les performances du Matrix™ et de la PBJ sont globalement comparables dans la détection de déficits pré-périmétriques. Les deux techniques testent des voies fonctionnelles différentes qui peuvent être lésées simultanément ou de façon décalée dans le temps. Lorsque le suivi combine Matrix™ et PBJ, des déficits peuvent apparaître simultanément aux deux tests ou de manière décalée dans le temps [3, 8, 26, 43]. L’association du Matrix™ et de la PBJ, quand elle est possible, est donc pertinente dans le suivi des glaucomes pré-périmétriques, des hypertones ou des sujets à risques (fig. 10-107). L’association des périmétries non conventionnelles avec des explorations de structure permet d’augmenter la performance de la démarche diagnostique [43].
Le programme 24-2 est généralement le plus utilisé en pratique, que ce soit avec le Matrix™ ou avec la PBJ, mais le 10-2 garde sa pertinence dans le dépistage précoce des déficits juxta-centraux, car ceux-ci sont susceptibles de passer inaperçus alors qu’ils apparaissent dans 15 à 30 % des formes débutantes de glaucome [12, 25].
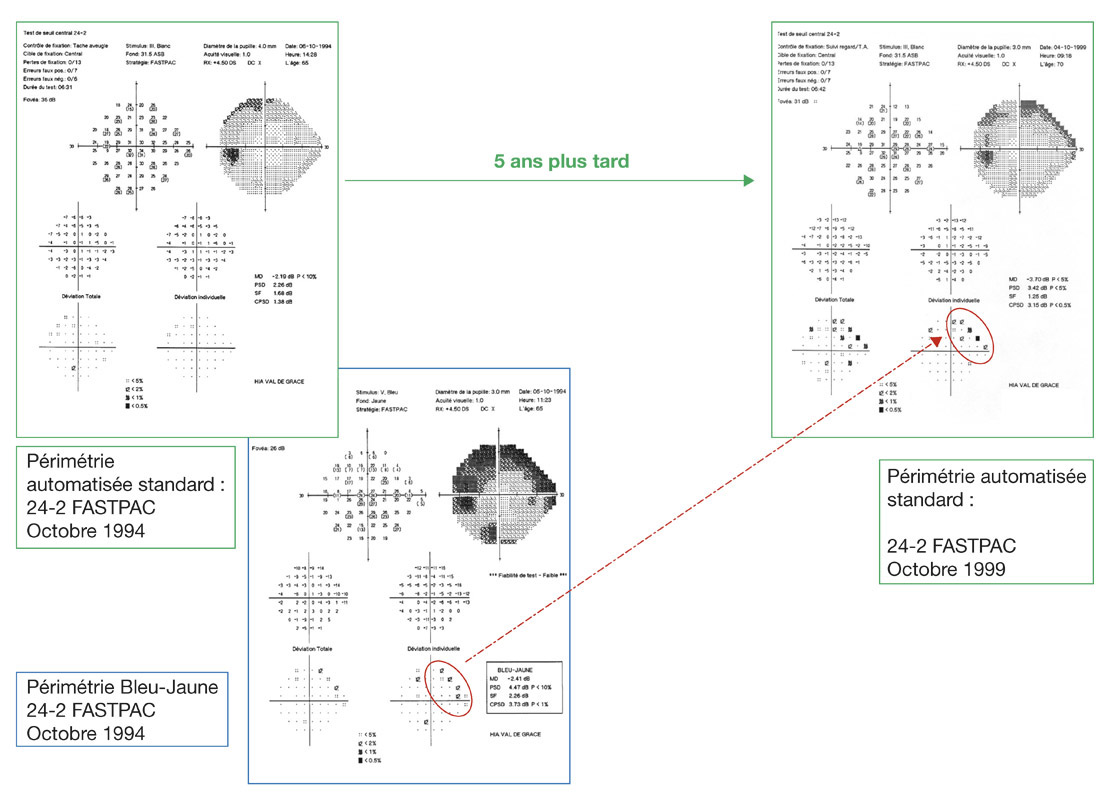
Fig. 10-106 Apparition d’un déficit en périmétrie bleu-jaune cinq ans avant la périmétrie automatisée standard.
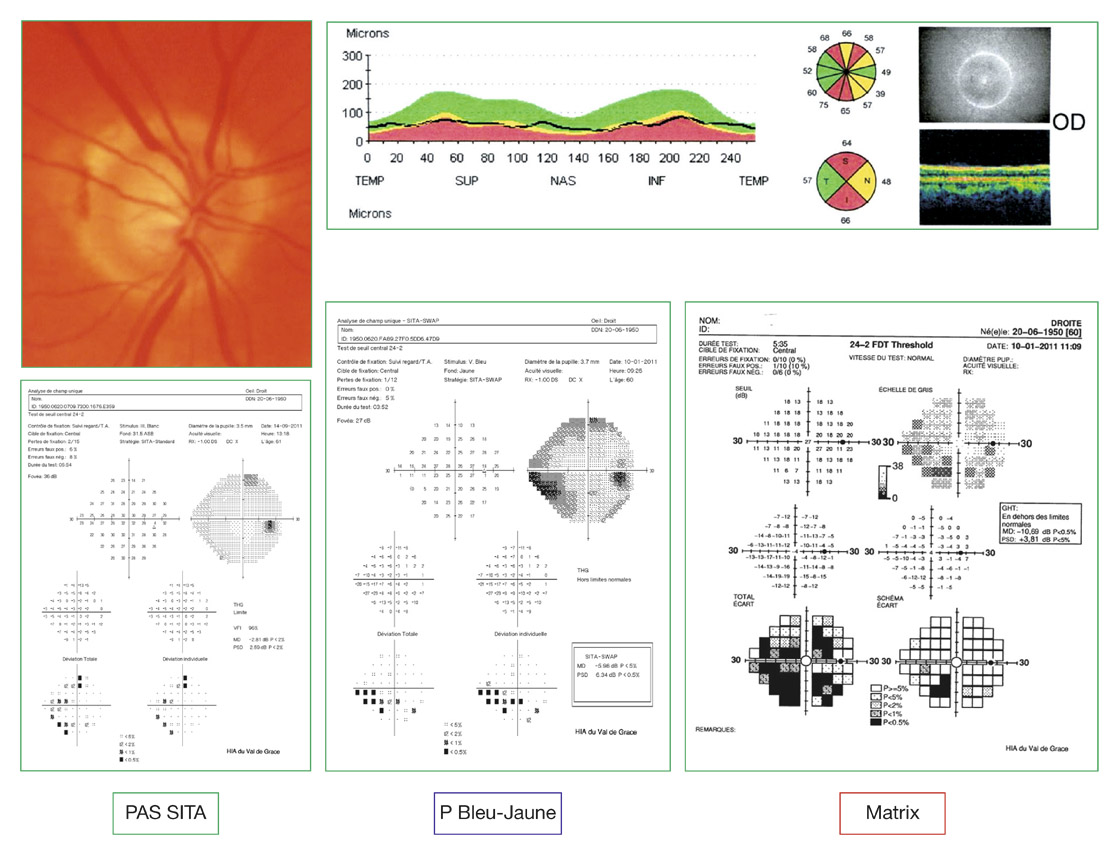
Fig. 10-107 Patient de 61 ans, suivi depuis 25 ans pour glaucome débutant et présentant une hémorragie papillaire et un amincissement diffus de la couche des fibres nerveuses rétiniennes en OCT Stratus : déficits supérieurs et inférieurs en SITA, déficit inférieur plus marqué en PBJ, et déficit supérieur et inférieur plus marqués en Matrix™.
La PBJ et le Matrix™ peuvent garder un intérêt dans le glaucome débutant car les déficits sont mieux identifiés et plus étendus qu’en PAS.
Certains patients ont des difficultés à réaliser des examens en PAS avec des résultats alors peu fiables. Dans ces cas, le Matrix™, qui est en général ressenti plus aisé par les patients, peut constituer une alternative intéressante à la PAS et livrer des résultats plus conformes à la réalité. Le suivi par Matrix™ seul est possible mais la recherche d’une progression sera moins objective car réalisée par la confrontation des examens successifs (eFig. 10-15).
Le Matrix™ peut catégoriser les déficits en fonction de la gravité. Il se révèle cependant moins précis dans les glaucomes avancés. La forme des zones testées, larges et contiguës, contribue à présenter des déficits d’emblée plus étendus et plus sévères sous la forme de vastes zones sombres perturbant la lisibilité ainsi que l’interprétation.
Dès que les déficits sont identifiés et confirmés en PAS « blanc-blanc », les périmétries non conventionnelles perdent rapidement leur pertinence, et le suivi devra être réalisé en PAS « blanc-blanc ».
Retenir
-
La meilleure indication de la PBJ est la recherche de déficits précoces chez le sujet de moins de 60 ans aux milieux oculaires encore clairs et porteur de facteurs de risque de développer un GPAO.
-
Le principal inconvénient de la PBJ est d’être facilement altérée par la cataracte et le degré de transparence des milieux oculaires.
-
Le Matrix™, à l’inverse, est peu influencé par la cataracte et par la nature des implants intra-oculaires. Il constitue un bon moyen de dépistage des déficits glaucomateux et peut représenter un recours utile pour les patients mauvais répondeurs en PAS.
-
La périmétrie bleu-jaune et la périmétrie FDT-Matrix™ sont conçues pour le dépistage et la détection des déficits précoces du GPAO. Dès lors que les déficits apparaissent en PAS « blanc-blanc », leur suivi devra être réalisé en PAS « blanc-blanc ».
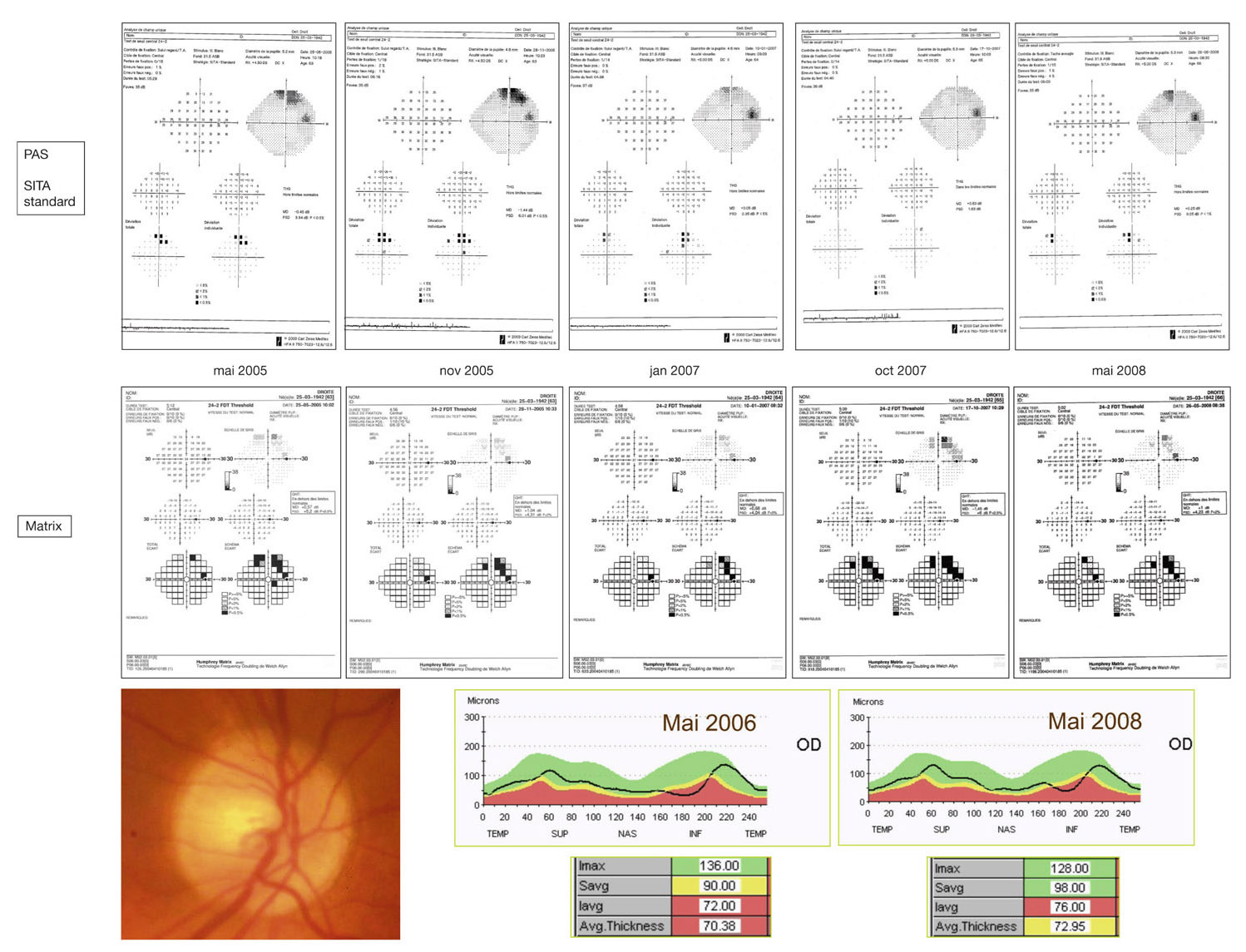
eFig. 10-15 Suivi en périmétrie automatisée standard et en Matrix™ d’un sujet de 63 ans présentant un déficit débutant.
[1] Artes PH, Hutchison DM, Nicolela MT, et al. Threshold and variability properties of Matrix Frequency-Doubling Technology and Standard Automated Perimetry in glaucoma. Invest Ophthalmol Vis Sci. 2005 ; 46 : 2451-7.
[2] Bayer AU, Erb C. Short wavelength automated perimetry, frequency doubling technology perimetry, and pattern electroretinography for prediction of progressive glaucomatous standard visual field defects. Ophthalmology. 2002 ; 109 : 1009-17.
[3] Bluwol E, Blumen-Ohana E, Nordmann JP. Apport du GDx-VCC chez les patients hypertones oculaires : complémentarité avec la périmétrie bleu-jaune ou le FDT Matrix ? J Fr Ophthalmol. 2009 ; 32 : 326-34.
[4] Brusini P, Salvetat ML, Zeppieri M, et al. Frequency doubling technology perimetry with the Humphrey Matrix 30-2 test. J Glaucoma. 2006 ; 15 : 77-83.
[5] Burgansky-Eliash Z, Wollstein G, Patel A, et al. Glaucoma detection with matrix and standard achromatic perimetry. Br J Ophthalmol. 2007 ; 91 : 933-8.
[6] Choi JA, Lee NY, Park CK. Interpretation of the Humphrey Matrix 24-2 test in the diagnosis of preperimetric glaucoma. Jpn J Ophthalmol. 2009 ; 53 : 24-30.
[7] Demirel S, Johnson CA. Incidence and prevalence of short-wavelength automated perimetry deficits in ocular hypertensive patients. Am J Ophthalmol. 2001 ; 131 : 709-15.
[8] Ferreras A, Polo V, Larrosa JM, et al. Can frequency-doubling technology and short-wavelength automated perimetries detect visual field defects before standard automated perimetry in patients with preperimetric glaucoma ? J Glaucoma 2007 ; 16 : 372-83.
[9] Gangwani RA, Chan J, Lee J, et al. Detection of glaucoma in a cohort of chinese subjects with systemic hypertension. J Ophthalmol. 2013 : 463710
[10] Girkin CA, Emdadi A, Sample PA, et al. Short wavelength automated perimetry and standard perimetry in the detection of progressive optic disc cupping. Arch Ophthalmol. 2000 ; 118 : 1231-5.
[11] Harwerth RS, Carter-Dawson L, Smith EL, Crawford ML. Scaling the structure-function relationship for clinical perimetry. Acta Ophthalmol Scand. 2005 ; 83 : 448-55.
[12] Hood DC, Raza AS, de Moraes CG, Liebmann JM, Ritch R. Glaucoma damage of the macula. Prog Retin Eye Res. 2013 ; 31 : 1-21.
[13] Johnson CA, Adams AJ, Casson EJ, Brandt JD. Blue-on-yellow perimetry can predict the development of glaucomatous visual field loss. Arch Ophthalmol. 1993 ; 111 : 645-50.
[14] Johnson CA, Adams AJ, Casson EJ, Brandt JD. Progression of early glaucomatous visual field loss as detected by blue-on-yellow and standard white-on-white automated perimetry. Arch Ophthalmol. 1993 ; 111 : 651-6.
[15] Johnson CA, Brandt JD, Khong AM, Adams AJ. Short-wavelength automated perimetry in low-, medium- and high-risk ocular hypertensive eyes. Initial baseline results. Arch Ophthalmol. 1995 ; 113 : 70-6.
[16] Johnson CA, Sample PA, Zangwill LM, et al. Structure and function evaluation (SAFE) : II. Comparison of optic disk and visual field characteristics. Am J Ophthalmol. 2003 ; 135 : 148-54.
[17] Johnson CA, Samuels SJ. Screening for glaucomatous visual field loss with frequency-doubling perimetry. Invest Ophthalmol Vis Sci. 1997 ; 38 : 413-25.
[18] Johnson CA. Diagnostic value of short-wavelength perimetry. Curr Opin Ophthalmol. 1996 ; 7 : 54-58.
[19] Johnson CA. Early losses of visual function in glaucoma. Optom Vis Sci.1995 ; 72 : 359-70.
[20] Johnson CA. Recent developments in automated perimetry in glaucoma diagnosis and management. Curr Opin Ophthalmol. 2002 ; 13 : 77-84.
[21] Kim TW, Zangwill LM, Bowd C, et al. Retinal nerve fiber layer damage as assessed by optical coherence tomography in eyes with a visual field defect detected by frequency doubling technology perimetry but not by standard automated perimetry. Ophthalmology. 2007 ; 114 : 1053-7.
[22] Lamparter J, Aliyeva S, Schulze A, et al. Standard automated perimetry versus matrix frequency doubling technology perimetry in subjects with ocular hypertension and healthy control subjects. PLoS One. 2013 ; 8 : e57663.
[23] Lamparter J, Russel RA, Schulze A, et al. Structure-function relationship between FDF, FDT, SAP and scanning laser ophthalmoscopy in glaucoma patients. Invest Ophthalmol Vis Sci. 2012 ; 53 : 7553-9.
[24] Landers JA, Goldberg I, Graham SL. Detection of early visual field loss in glaucoma using frequency-doubling perimetry and short-wavelength automated perimetry. Arch Ophthalmol. 2003 ; 121 : 1705-10.
[25] Langerhorst CT, Carenini LL, Bakker D, De Bie-Raakman MAC. Measurements for description of very early glaucoma field defects. In : Wall M, Heijl A (eds). Perimetry Update 1996 : 1997. New-York, Kugler Publications, 1997 : 67-73.
[26] Leeprechanon N, Giangiacomo A, Fontana H, et al. Frequency-doubling perimetry : comparison with standard automated perimetry to detect glaucoma. Am J Ophthalmol. 2007 ; 143 : 263-71.
[27] Lewis RA, Johnson CA, Adams AJ. Automated perimetry and short-wavelength sensitivity in patients with asymmetric intraocular pressures. Graefe’s Arch Clin Exp Ophthalmol. 1993 ; 231 : 274-8.
[28] Liu S, Lam S, Weinreb RN, et al. Comparison of standard automated perimetry, frequency-doubling technology perimetry, and short-wavelength automated perimetry for detection of glaucoma. Invest Ophthalmol Vis Sci. 2011 ; 52 : 7325-31.
[29] Martin L, Wanger P, Vancea L, Gothlin B. Concordance of high-pass resolution perimetry and frequency-doubling technology perimetry results in glaucoma : no support for selective ganglion cell damage. J Glaucoma. 2003 ; 12 : 40-4.
[30] McKendrick AM, Badcock DR, Morgan WH. Psychophysical measurement of neural adaptation abnormalities in magnocellular and parvocellular pathways in glaucoma. Invest Ophthalmol Vis Sci. 2004 ; 45 : 1846-53.
[31] Nam YP, Park SB, Kang SY, et al. Glaucoma diagnostic performance of Humphrey Matrix and standard automated perimetry. Jpn J Ophthalmol. 2009 ; 53 : 482-5.
[32] Polo V, Abeccia E, Pablo LE, et al. Short-wavelength automated perimetry and retinal nerve fiber layer evaluation in suspected cases of glaucoma. Arch Ophthalmol. 1998 ; 116 : 1295-8.
[33] Polo V, Larrosa JM, Gomez ML, et al. Functional and structural measurements in a multifactorial glaucoma risk model. Acta Ophthalmol Scand. 2001 ; 79 : 10-14.
[34] Polo V, Larrosa JM, Pinilla I, et al. Optimum criteria for short-wavelength automated perimetry. Ophthalmology. 2001 ; 108 : 265-9.
[35] Quigley HA, Dunkelberger GR, Green WR. Retinal ganglion cell atrophy correlated with automated perimetry in human eyes with glaucoma. Am J Ophthalmol. 1989 ; 107 : 453-64.
[36] Quigley HA, Sanchez RM, Dunkelberger GR, et al. Chronic glaucoma selectively damages large optic nerve fibers. Invest Ophthalmol Vis Sci. 1987 ; 28 : 913-20.
[37] Racette L, Medeiros FA, Zangwill LM, et al. Diagnostic accuracy of the Matrix 24-2 and original N-30 frequency-doubling technology tests compared with standard automated perimetry. Invest Ophthalmol Vis Sci. 2008 ; 49 : 954-60.
[38] Racette L, Sample PA. Short-wavelength automated perimetry. Ophthalmol Clin North Am. 2003 ; 16 : 227-36.
[39] Sample PA, Esterson FD, Weinreb RN. The ageing lens : in vivo assessment of light absorption in 84 human eyes. Invest Ophthalmol Vis Sci. 1988 ; 29 : 1306-11.
[40] Sample PA, Medeiros FA, Racette L, et al. Identifying glaucomatous vision loss with visual-function-specific perimetry in the diagnostic innovations in glaucoma study. Invest Ophthalmol Vis Sci. 2006 ; 47 : 3381-9.
[41] Sample PA, Taylor JDN, Martinez GA, et al. Short wavelength colour visual fields in glaucoma suspects at risk. Am J Ophthalmol. 1993 ; 115 : 225-33.
[42] Sample PA, Weinreb RN. Color perimetry for assessment of primary open angle glaucoma. Invest Ophthalmol Vis Sci. 1990 ; 31 : 1869-75.
[43] Shah NN, Bowd C, Medeiros FA, et al. Combining structural and functional testing for detection of glaucoma. Ophthalmology. 2006 ; 113 : 1593-602.
[44] Sit AJ, Medeiros FA, Weinreb RN. Short-wavelength automated perimetry can predict glaucomatous standard visual field loss by ten years. Semin Ophthalmol. 2004 ; 19 : 122-4.
[45] Soliman MA, deJong LA, Ismaeil AA, et al. Standard achromatic perimetry, short wavelength automated perimetry, and frequency doubling technology for detection of glaucoma damage. Ophthalmology. 2002 ; 109 : 444-54.
[46] Spry PG, Hussin HM, Sparrow JM. Clinical evaluation of frequency doubling technology perimetry using the Humphrey Matrix 24-2 threshold strategy. Br J Ophthalmol. 2005 ; 89 : 1031-5.
[47] Swanson WH, Felius J, Pan F. Perimetric defects and ganglion cell damage : interpreting linear relations using a two-stage neural model. Invest Ophthalmol Vis Sci. 2004 ; 45 : 466-72.
[48] Terry AL, Paulose-Ram R, Tilert TJ, et al. The methodology of visual field testing with frequency doubling technology in the National Health and Nutrition Examination Survey, 2005-2006. Ophthalmic Epidemiol. 2010 ; 17 : 411-21.
[49] Van der Schoot J, Reus NJ, Colen TP, Lemij HG. The ability of short-wavelength automated perimetry to predict conversion to glaucoma. Ophthalmology. 2010 ; 117 : 30-4.
[50] Vital-Durand F, Bullier J. Systématisation fonctionnelle des voies optiques. In : Risse JF (dir.). Explorations de la fonction visuelle. Rapport de la Société Française d’Ophtalmologie. Paris, Masson, 1999 : 37-57.
[51] Wang YX, Xu L, Sun XY, et al. Five year incidence of visual field loss in adult chinese. The Beijing Eye Study. PLoS One. 2012 ; 7 : e37232.
[52] Wild JM. Short-wavelength automated perimetry. Acta Ophthalmol Scand. 2001 ; 79 : 546-59.
X. Zanlonghi
-
Les résultats de la plupart des techniques d’électrophysiologie et d’examen psychophysique sont corrélés à la gravité du glaucome.
-
Certains sont perturbés précocement, avant l’atteinte du champ visuel blanc-blanc.
-
La sensibilité au contraste, en variant ses paramètres de stimulation, est la technique permettant d’étudier les différents canaux marvo- et parvocellulaires dans le glaucome.
La sensibilité au contraste spatial fovéale est altérée précocement dans le glaucome. Une méthode simple de contraste mésopique retrouve une corrélation significative avec l’excavation papillaire. C’est surtout l’atteinte de la fréquence spatiale de six cycles par degré qui est corrélée à la sévérité du glaucome [17]. La sensibilité au contraste binoculaire est également corrélée à la perte de qualité de vie et à l’atteinte du champ visuel binoculaire dans les glaucomes évolués [24] (fig. 10-108).
La sensibilité au contraste temporel fovéale est utile dans certains glaucomes sans atteinte du champ visuel. On retrouve une atteinte des hautes fréquences temporelles (30/40 Hz). La méthode peut être sensibilisée par un éblouissement préalable [10]. La sensibilité au contraste est également utilisée comme marqueur du retentissement fonctionnel d’un traitement : par exemple, elle est altérée dans les minutes qui suivent l’installation de collyres ou gels antiglaucomateux [15].
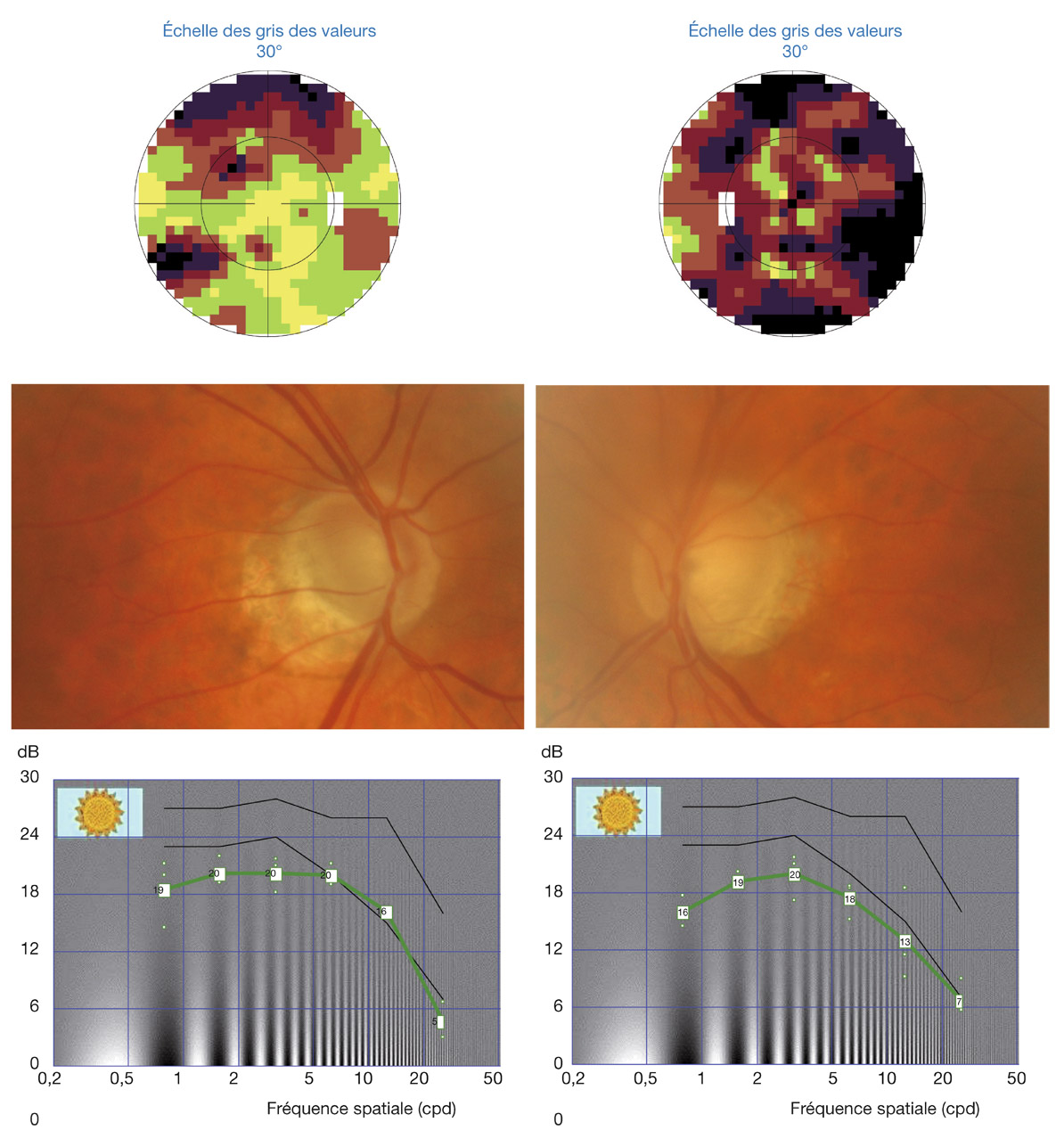
Fig. 10-108 Altération de la sensibilité au contraste spatial fovéale en fonction de la gravité du glaucome. Œil droit : champ visuel Octopus G2 avec atteinte de moyenne importance, papille excavée, atteinte des basses et moyennes fréquences spatiales. Œil gauche : champ visuel Octopus G2 encore plus altéré, papille très excavée, atteinte plus marquée des basses et moyennes fréquences spatiales.
La mesure de l’acuité visuelle, des potentiels évoqués visuels et du champ visuel ne permet pas toujours d’affirmer une atteinte infraclinique du nerf optique. Dans 30 % des cas de neuropathie optique fruste, il est relevé une atteinte de la perception du contraste. L’atteinte entraîne une baisse de sensibilité sur toutes les fréquences spatiales explorées en cas de poussée aiguë et une baisse limitée aux hautes et moyennes fréquences dans les autres cas.
Les hautes fréquences spatiales sont particulièrement altérées, contrairement aux basses fréquences qui peuvent être conservées assez longtemps (maladie de Stargardt, DMLA).
Classiquement, le déficit fonctionnel dans le glaucome est d’abord périphérique. Cependant, comme pour la sensibilité au contraste, plusieurs auteurs ont retrouvé des atteintes précoces de la perception colorée, précédant parfois les atteintes périmétriques [20]. Cette dyschromatopsie acquise est particulière car « bleu-jaune » (fig. 10-109). Elle a été étudiée à l’aide d’album pseudo-isochromatique [14], mais ce sont surtout les tests de classement de type 100 Hue et 15 Hue désaturé qui sont utilisés [20].
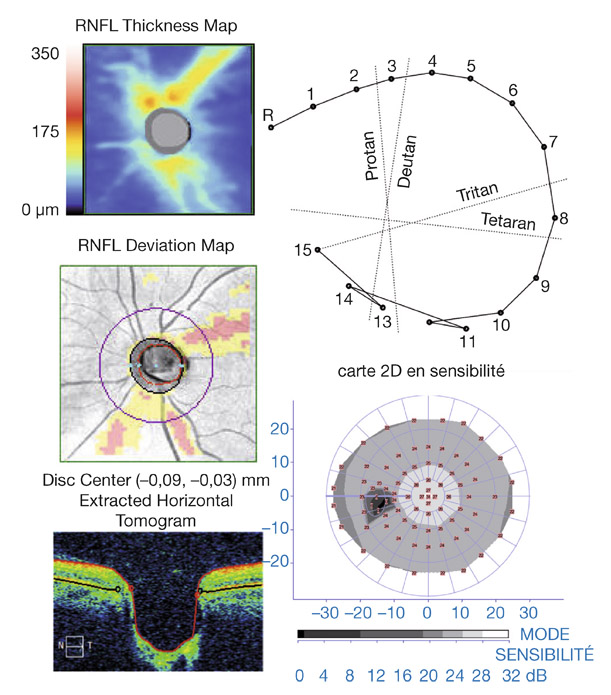
Fig. 10-109 15 Hue désaturé avec une discrète dyschromatopsie acquise bleu-jaune chez un patient de 42 ans avec des antécédents familiaux de glaucome, présentant une excavation avec une atteinte localisée de l’anneau neurorétinien, un champ visuel relevé au « moniteur » normal, une HTO à 25 mmHg, une pachymétrie normale, mais une couche des fibres nerveuses rétiniennes discrètement altérée.
La première difficulté vient de l’âge et de l’opalescence du cristallin qui provoque aussi une dyschromatopsie acquise bleu-jaune [19]. Une dyschromatopsie bleu-jaune (eFig 10-16) associée à une pâleur papillaire orientera vers une atrophie optique génétique par mutation OPA1, ce d’autant que certains patients présentent une excavation papillaire [11]. D’autres atteintes du nerf optique (drusen de la papille, troubles de la conduction dans les scléroses en plaques, séquelle de neuropathie optique antérieure aiguë ischémique) peuvent donner une dyschromatopsie acquise bleu-jaune, mais le contexte clinique est différent.
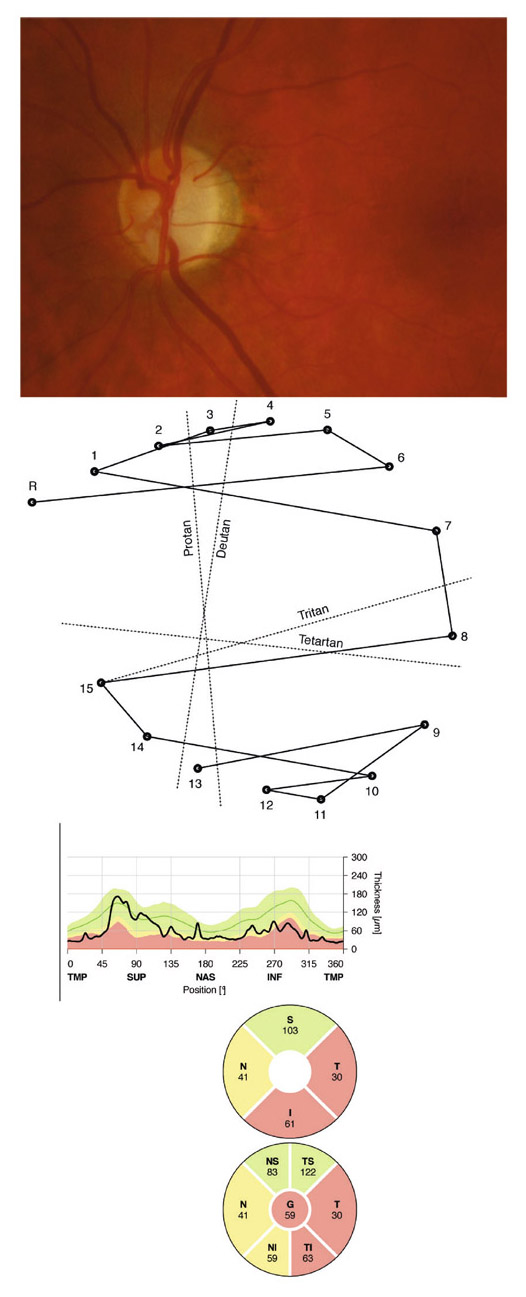
eFig. 10-16 15 Hue désaturé chez un patient de 45 ans présentant sur les deux yeux une acuité corrigée de 0,8 (8/10), une excavation papillaire en pente douce, une discrète pâleur dans son secteur temporal et une couche des fibres nerveuses rétiniennes altérée, par mutation du gène OPA1.
Le test d’adaptation à l’obscurité est utilisé depuis les années 1950 [16]. Il consiste à mesurer le sens lumineux brut. L’examen est très sensible mais peu spécifique et très long, d’une durée minimale de 30 minutes (eFig 10-17).
La courbe d’adaptation à l’obscurité réalisée en binoculaire retrouve un segment photopique correct, mais une perte de 10 dB par rapport aux sujets normaux dans la partie scotopique.
Les tests d’éblouissement n’apportent rien au diagnostic de glaucome, mais sont utiles en basse vision pour les essais de verres filtrants [12].
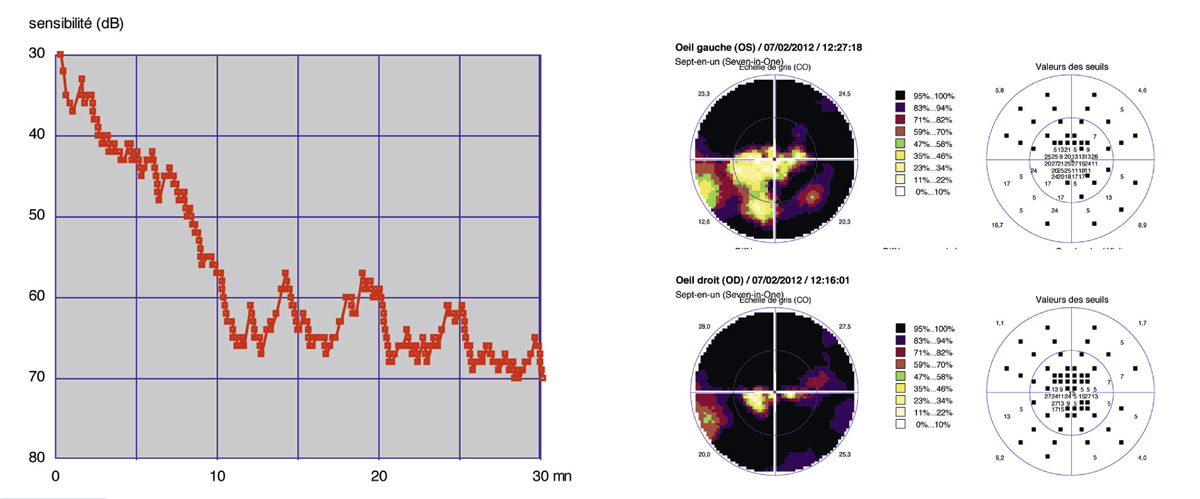
eFig. 10-17 Patient de 51 ans présentant un glaucome bilatéral très évolué et se plaignant à la fois d’une photophobie et d’une cécité nocturne.
L’électrorétinogramme global n’a pas d’intérêt dans le diagnostic positif d’un glaucome.
L’électrorétinogramme global est surtout utile pour les diagnostics différentiels de glaucome, en cas d’atteinte du champ visuel atypique, d’imagerie du fond d’œil montrant à la fois une atteinte de la papille et une atteinte rétinienne locale ou diffuse.
L’amplitude de l’électrorétinogramme multifocal (MERG) est diminuée à un stade précoce de glaucome [8]. L’atteinte des photorécepteurs en nasal de la fovéa est également démontrée par une atteinte locale du MERG [26].
C’est surtout dans les déficits paracentraux atypiques que l’atteinte localisée du MERG orientera plutôt vers une souffrance des photorécepteurs que vers une atteinte des fibres ganglionnaires.
Le pattern ERG (PERG) est atteint précocement et fait partie des techniques permettant de séparer un patient avec une HTO isolée d’un glaucome débutant [1]. Le PERG est capable de détecter des glaucomes lentement évolutifs alors même que le champ visuel reste stable [3]. L’atteinte du PERG précéderait même l’atteinte anatomique [2] (fig. 10-110).
Le PERG est cependant moins sensible et spécifique que le champ visuel [4].
Fig. 10-110 Glaucome asymétrique chez une patiente de 48 ans. PERG : l’amplitude du P50 et le retard de latence du N95 sont d’autant plus perturbés (OG) que le glaucome est grave.
Le PERG est parfois utilisé pour séparer une atteinte maculaire qui donnera une atteinte portant sur l’amplitude du P50, alors qu’une anomalie du N95 signifie un dysfonctionnement des cellules ganglionnaires [11]. Les causes les plus fréquentes sont les neuropathies optiques génétiques (Leber, OPA1) où l’atteinte du N95 est précoce, et les neuropathies optiques démyélinisantes où l’atteinte du N95 est variable.
La latence et l’amplitude du P100, en faisant varier le contraste de la stimulation, sont altérées dans le glaucome [23]. Plus le glaucome est grave, plus la latence du P100 augmente et plus l’amplitude du P100 diminue [22].
Les potentiels évoqués visuels (PEV) transitoires seront surtout utilisés en cas d’atteinte atypique du champ visuel, de baisse d’acuité visuelle centrale inexpliquée ou de discordance entre les examens d’imagerie et les examens fonctionnels [11].
Seront surtout recherchés avec les PEV :
-
une neuropathie optique non glaucomateuse ;
-
une atteinte des voies visuelles chiasmatique et rétrochiasmatique ;
-
une estimation de l’acuité visuelle objective ;
-
de façon indirecte, une fovéolopathie non visible en imagerie.
Le PEV multifocal (MVEP) se présente comme un « champ visuel objectif » avec l’amplitude en fonction de l’excentricité. Dans le glaucome, l’atteinte est statistiquement corrélée avec celle de la périmétrie « classique », avec une bonne sensibilité et spécificité [13] (fig. 10-111). Le MVEP peut être altéré même en cas de champ visuel blanc-blanc normal [25].
Fig. 10-111 a. OD : altération du MPEV en fonction de l’excentricité ; même échelle que le champ visuel : en noir absence de réponse locale en PEV. b. OD : même patient ; champ visuel « moniteur » : en noir le scotome absolu pratiquement annulaire.
Il est surtout utilisé dans le cas de rétrécissement concentrique inexpliqué du champ visuel, pour avoir des arguments en faveur d’une atteinte « fonctionnelle ».
Le réflexe photomoteur est d’autant plus altéré que le glaucome est grave [9]. Dans un glaucome asymétrique, il est noté une atteinte plus marquée du côté le plus atteint du réflexe pupillaire afférent [5]. Cependant, une méta-analyse récente portant sur 30 études montre le faible intérêt de la pupillographie par une source de lumière unique [7]. Des stimulations par hémi-champ peuvent être utilisées pour sensibiliser la méthode [6, 21].
L’étude du réflexe pupillaire sera surtout utilisée en cas de suspicion de neuropathie optique ou de troubles « fonctionnels » [11].
Même en cas d’atteinte modérée du champ visuel, les patients ont plus de difficultés à réaliser la tâche de saccade-poursuite, qui nécessite l’analyse de la vitesse d’une cible en périphérie du champ visuel [18].
Retenir
-
Le PEV multifocal (M-VEP) le PEV transitoire, l’ERG multifocal (M-ERG) et le Pattern-ERG trouvent une corrélation entre la gravité du glaucome et leur atteinte.
-
Le PEV multifocal (M-VEP) et le Pattern-ERG semblent les deux techniques électro-physiologiques les plus intéressantes.
-
La sensibilité au contraste spatial et temporel est altérée précocement souvent avant l’atteinte du champ visuel blanc-blanc.
[1] Bach M, Unsoeld AS, Philippin H, et al. Pattern ERG as an early glaucoma indicator in ocular hypertension : a long-term, prospective study. Invest Ophthalmol Vis Sci. 2006 ; 47 : 4881-7.
[2] Banitt MR, Ventura LM, Feuer WJ, et al. Progressive loss of retinal ganglion cell function precedes structura loss by several years in glaucoma suspects. Invest Ophthalmol Vis Sci. 2013 ; 54 : 2346-52.
[3] Bayer AU, Erb C. Short wavelenght automated perimetry, frequency doubling technology perimetry, and pattern electro-retinography for prediction of progressive glaucomatous standard visual field defects. Ophthalmology. 2002 ; 109 : 1009-17.
[4] Bowd C, Vizzeri G, Tafreshi A. Diagnostic accuracy of pattern electroretingram optimized for glaucoma detection. Ophthalmology. 2009 ; 116 : 437-43.
[5] Brown RH, Zilis JD, Lynch MG, Sanborn GE. The afferent pupillary defect in asymmetric glaucoma. Arch Ophthalmol. 1987 ; 105 : 1540-3.
[6] Chang DS, Arora KS, Boland MV, et al. Development and validation of an associative model for the detection of glaucoma using pupillography. Am J Ophthalmol. 2013 ; 156 : 1285-96.
[7] Chang DS, Xu L, Boland MV, Friedman DS. Accuracy of pupil assessment for the detection of glaucoma : a systematic review and meta-analysis. Ophthalmology. 2013 ; 120 : 2217-25.
[8] Chu PHW, Chan HHL, Brown B. Luminance-modulated adaptation of global flash mfERG : fellow eye losses in asymmetric glaucoma. Invest Ophthalmol Vis Sci. 2007 ; 48 : 2626-33.
[9] Clark CV, Mapstone R. Pupil cycle time in primary closed-angle glaucoma. Can J Ophthalmol. 1986 ; 21 : 88-91.
[10] Cursiefen C, Horn F, Jünemann AG, Korth M. Reduced recovery of temporal contrast sensitivity after flicker stress in patients with glaucoma. J Glaucoma. 2000 ; 9 : 296-302.
[11] Defoort-Dhellemmes S, Meunier I, Arndt C, et al. Du signe clinique au diagnostic, imagerie et exploration de la vision. Rapport spécial Bull Soc Ophtal Fr. Marseille, Lamy, 2012, 455 pages.
[12] Fusco R. The comparison of kinetic and static perimetry by means of the Arden test, the glare test, the colour vision and PERG in patients with glaucoma and hypertension. Automated Esterman testing of disability in glaucoma. Seventh International Visual Field Symposium, Amsterdam, September, 1986, Dr Junk Publ., The Hague. Doc Ophthalmol Proc Series. 1987 ; 49 : 365-70.
[13] Goldberg I, Graham SL, Klistorner AI. Multifocal objective perimetry in the detection of glaucomatous field loss. Am J Ophthalmol. 2002 ; 133 : 29-39.
[14] Heron G, Erskine NA, Farquharson E, et al. Colour vision screening in glaucoma : the Tritan Album and other simple tests. Ophthalmic Physiol Opt. 1994 ; 14 : 233-8.
[15] Hiraoka T, Daito M, Okamoto F, et al. Contrast sensitivity and optical quality of the eye after instillation of timolol maleate gel-forming solution and brinzolamide ophthalmic suspension. Ophthalmology. 2010 ; 117 : 2080-7.
[16] Jayle GE, Ourgaud AG. La vision nocturne et ses troubles. Rapport de la Société française d’ophtalmologie. Paris, Masson, 1950 : 552-86.
[17] Lahav K, Levkovitch-Verbin H, Belkin M, et al. Reduced mesopic and photopic foveal contrast sensitivity in glaucoma. Arch Ophthalmol. 2011 ; 129 : 16-22.
[18] Lamirel C, Milea D, Cochereau I, et al. Modifications des mouvements oculaires dans le glaucome chronique à angle ouvert. Eye movements disorders in open angle glaucoma. J Fr Ophtalmol. 2009 ; 32 (HS1) : 42-3.
[19] Lanthony P. Évaluation du panel D15 désaturé. I : Méthode de quantification et scores normaux. J Fr Ophtalmol. 1986 ; 12 : 843-7.
[20] Lanthony P. Le glaucome. In : Les dyschromatopsies. Rapport annuel des Bulletins des Sociétés d’ophtalmologie de France. Marseilles, Lamy, 2001 : 249-51.
[21] Link B, Jünemann A, Rix R, et al. Pupillographic measurements with pattern stimulation : the pupil’s response in normal subjects and first measurements in glaucoma patients. Invest Ophthalmol Vis Sci. 2006 ; 47 : 4947-55.
[22] Pillai C, Ritch R, Derr P, et al. Sensitivity and specificity of short-duration transient visual evoked potentials (SD-tVEP) in discriminating normal from glaucomatous eyes. Invest Ophthalmol Vis Sci. 2013 ; 54 : 2847-52.
[23] Prata TS, Lima VC, De Moraes CGV, et al. Short duration transient visual evoked potentials in glaucomatous eyes. J Glaucoma. 2012 ; 21 : 415-20.
[24] Richman J, Lorenzana LL, Lankaranian D, et al. Importance of visual acuity and contrast sensitivity in patients with glaucoma. Arch Ophthalmol. Dec ; 128 : 1576-82.
[25] Thienprasiddhi P, Greenstein VC, Chen CS, et al. Multifocal visual evoked potential responses in glaucoma patients with unilateral hemifield defects. Am J Ophthalmol. 2003 ; 136 : 34-40.
[26] Vincent A, Shetty R, Devi SA, et al. Functional involvement of cone photoreceptors in advanced glaucoma : a multifocal electroretinogram study. Doc Ophthalmol. 2010 ; 121 : 21-7.
E. Sellem, J.-P. Renard
-
La répartition des fibres nerveuses rétiniennes explique la localisation des scotomes dans le glaucome, et le raphé médian est le substratum anatomique de la limitation nette des scotomes par le méridien horizontal.
-
Une bonne concordance entre l’atteinte de la structure et de la fonction est régulièrement constatée.
-
Des discordances sont toutefois possibles, particulièrement dans les stades très précoces du glaucome primitif à angle ouvert (GPAO) où l’atteinte structurale précède celle de la fonction.
-
La confrontation des examens de la fonction et de la structure n’en devient que plus indispensable.
-
L’analyse de la relation structure-fonction passe par la connaissance des facteurs spécifiques de chaque élément à mettre en relation.
-
Les récentes approches ouvrent de nouvelles perspectives d’évaluation de cette relation particulièrement enthousiasmantes.
La perte glaucomateuse des fibres nerveuses rétiniennes (FNR) s’accompagne légitimement d’une atteinte fonctionnelle dans le (ou les) territoires(s) correspondant(s) du champ visuel (CV). Cette « relation structure-fonction » est retrouvée dans une majorité de cas, mais n’est pas toujours constatée. Les discordances sont en effet nombreuses, surtout chronologiquement, les atteintes de la structure précédant habituellement les atteintes de la fonction, ce que confirment encore plus qu’auparavant les analyseurs. Ces discordances dépendent essentiellement du stade du GPAO et de la configuration de la tête du nerf optique (TNO). Cependant, les dernières générations de cartographies proposées, regroupant atteintes structurale et fonctionnelle, sont mieux adaptées aux réalités anatomiques à surmonter, concernant en particulier la corrélation avec la position des zones testées lors du relevé du champ visuel. Enfin, les récentes approches statistiques selon les modèles dits « bayésiens » pourraient augmenter la probabilité diagnostique en regroupant les résultats des tests de la structure et ceux de la fonction.
Le chapitre 6 décrit en détail la répartition des FNR sur le plan rétinien et au niveau de la TNO. La connaissance de cette répartition est essentielle pour comprendre la disposition des atteintes périmétriques dans le glaucome. Les axones issus de la rétine nasale ont un parcours relativement droit vers la TNO, alors que ceux provenant de la rétine temporale ont un parcours arciforme autour de la région maculaire, formant un raphé horizontal et médian, temporal à la macula. Les axones provenant de la fovéa se dirigent, presque directement, au bord temporal de la TNO, formant le faisceau papillomaculaire (fig. 10-112). Les axones des cellules ganglionnaires rétiniennes (CGR) périphériques sont progressivement recouverts par les axones des cellules ganglionnaires plus centrales, réalisant une véritable stratification expliquant que l’épaisseur de la couche des FNR augmente de la périphérie de la rétine vers la papille, avec des différences régionales. Au niveau de la TNO, les axones des cellules ganglionnaires proches de la papille se retrouvent dans la portion la plus centrale de l’anneau neurorétinien (ANR) (fig. 10-113). La largeur de l’ANR – plus petite dans le secteur temporal que dans les secteurs nasal, inférieur et supérieur – est donc le reflet de la topographie de l’épaisseur de la couche des FNR. La localisation des déficits périmétriques est ainsi directement corrélée avec celle d’une (ou de) lésion(s) de l’ANR.
Dans le GPAO, l’amincissement de l’ANR est habituellement d’abord unidirectionnel, le plus souvent inférieur. Lorsqu’il devient bidirectionnel ou concentrique, il le fait de façon asymétrique, de telle sorte que les déficits périmétriques se répartissent différemment dans les différents quadrants des hémi-champs supérieur et inférieur, le méridien horizontal (correspondant anatomiquement au raphé médian) étant une ligne de limitation des scotomes très évocatrice dans le glaucome.
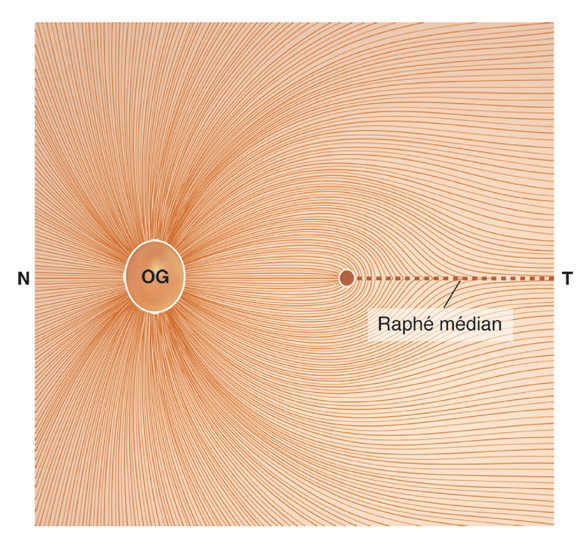
Fig. 10-112 Répartition des FNR sur la rétine d’un œil gauche.
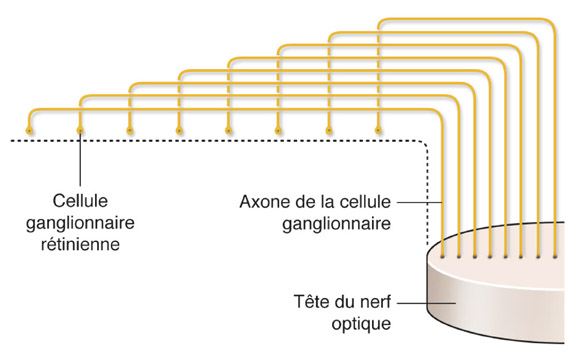
Fig. 10-113 Répartition verticale des FNR et leur localisation dans la TNO.
Il existe une grande variabilité dans l’aspect et dans la progression de l’atteinte initiale structurale et fonctionnelle du glaucome [21, 30, 33].
Une atteinte localisée de la TNO s’exprimera par un scotome situé dans le territoire correspondant : ainsi, une encoche inférieure de l’ANR entraîne l’apparition d’un scotome supérieur. La profondeur du scotome est directement en rapport avec l’importance de la perte des FNR dans un secteur donné ; sa localisation dépend de la position de cette atteinte, plus ou moins centrale, au niveau de l’ANR, et sa surface est le reflet de la dispersion des FNR dans le champ rétinien correspondant. Ainsi, un ressaut nasal périphérique a tendance à être initialement moins profond mais plus étendu qu’un scotome paracentral débutant (fig. 10-114 et 10-115).
En cas de rétrécissement diffus de l’ANR, l’atteinte périmétrique est plus tardive en raison de la redondance considérable des cellules ganglionnaires avec un large recouvrement de leurs champs récepteurs (voir « Relations chronologiques »), et s’exprime sur le plan périmétrique par une hyposensibilité diffuse (fig. 10-116), qu’il convient de distinguer d’un trouble des milieux ou d’une autre pathologie oculaire, ou encore d’un artéfact provoqué par une pupille en myosis.
Dans les formes plus évoluées, mais toujours unidirectionnelles, l’atteinte périmétrique affecte l’aspect classique et fréquent du « scotome de Bjerrum », large déficit fasciculaire plus ou moins profond, branché sur la tache aveugle et rejoignant le méridien horizontal dans le secteur nasal en s’évasant (fig. 10-117).
Lorsque la perte des FNR devient plus importante, les scotomes envahissent progressivement les deux hémi-champs rétiniens, mais le méridien horizontal demeure une ligne de démarcation habituellement nette entre les déficits supérieurs et inférieurs (fig. 10-118).
Lorsque l’excavation est totale, il persiste souvent, avant le stade de cécité totale, quelques FNR maculopapillaires assurant pour un temps une acuité visuelle plus ou moins utile, et d’autres « accrochées » au paquet vasculaire expliquant la perception d’un croissant temporal très périphérique de vision (fig. 10-119).
Des discordances entre le champ visuel et l’aspect papillaire sont toujours possibles toutefois, a priori moins fréquentes qu’avec les résultats des analyseurs. Elles peuvent être la conséquence d’une mauvaise interprétation de l’état de la TNO, souvent provoquée par une dysversion ou par une taille inhabituelle de la papille : dans les petites papilles, les déficits sont souvent beaucoup plus étendus que ne le laisserait supposer l’excavation (fig. 10-120) ; dans les grandes papilles, l’ANR est concentriquement plus mince, et la localisation de l’atteinte papillaire y est plus difficilement repérable (fig. 10-121).
Dans un travail récent, il avait été demandé à 109 ophtalmologistes européens aguerris d’observer des clichés stéréoscopiques de la TNO et de choisir, parmi quatre champs visuels, lequel correspondait au cliché présenté. Dans 59 % des cas, le champ visuel correct avait été repéré. Lorsqu’il ne l’avait pas été, les observateurs avaient surestimé dans la plupart des cas l’atteinte du champ visuel [31].
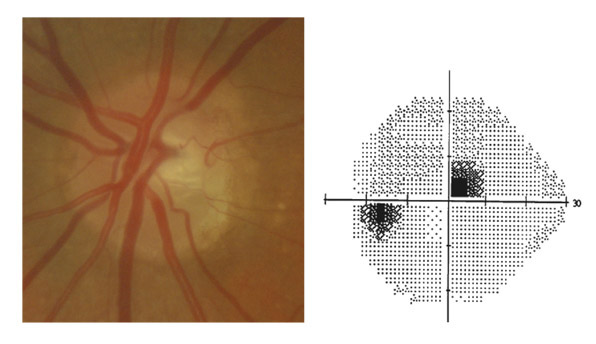
Fig. 10-114 Excavation modeste progressant en inférieur, repérée par la coudure vasculaire au bord interne de l’ANR ; déficit paracentral absolu.
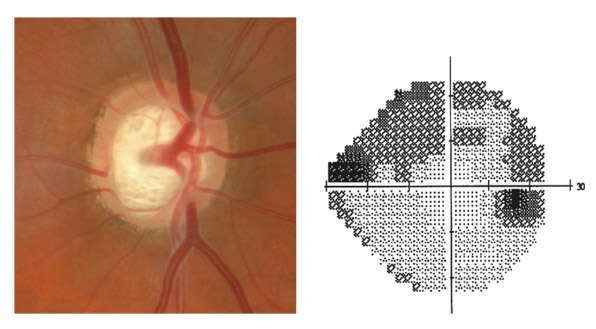
Fig. 10-115 Excavation progressant vers le bas avec une exclusion du vaisseau circum-linéaire ; large ressaut nasal relatif se prolongeant dans le champ visuel supérieur, sans atteinte centrale.
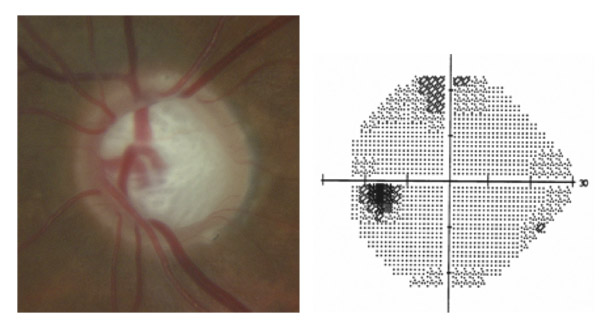
Fig. 10-116 Excavation progressant concentriquement ; hyposensibilité diffuse au champ visuel.
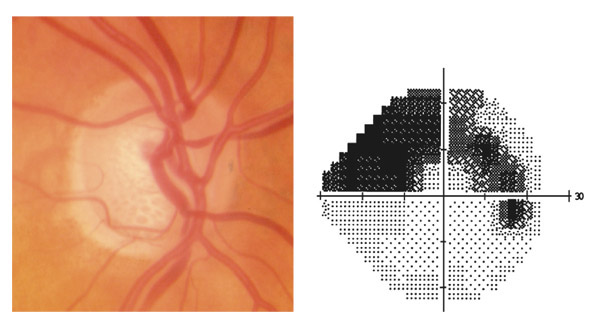
Fig. 10-117 Rupture inférieure de l’ANR ; scotome de Bjerrum typique.
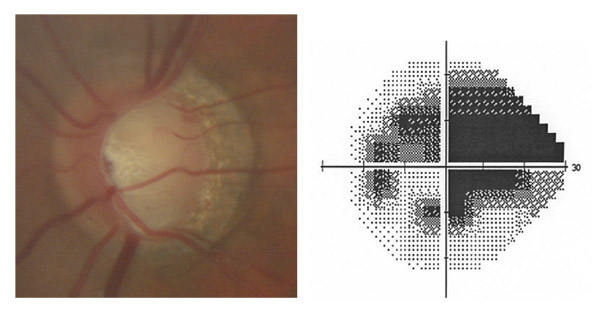
Fig. 10-118 Excavation verticale ayant atteint les deux pôles de la TNO ; déficits absolus asymétriques de part et d’autre du méridien horizontal.
Fig. 10-119 Excavation totale ; îlots centraux de faible sensibilité associés à un croissant temporal résiduel.
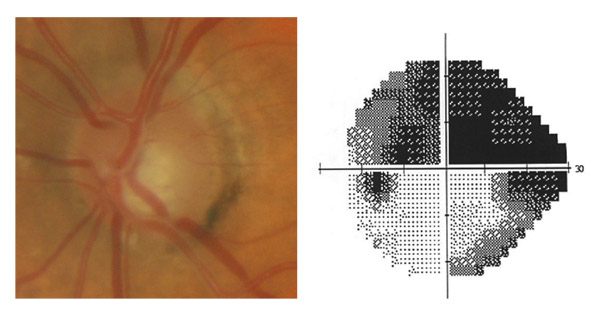
Fig. 10-120 Discordance entre l’aspect papillaire, où la papille de petite taille présente une excavation modeste, et l’atteinte importante du champ visuel.
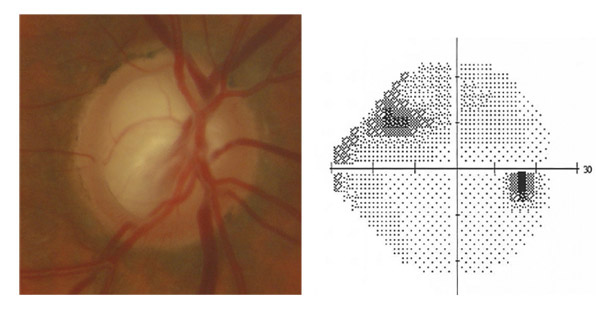
Fig. 10-121 Excavation glaucomateuse dans une grande papille ; l’ANR est nettement rétréci dans sa portion supérieure, mais l’atteinte périmétrique modérée s’exprime dans la moitié supérieure du champ visuel sous la forme d’un scotome relatif.
Les analyseurs repèrent avec une plus grande précision les atteintes de la TNO et des FNR, et les quantifient. Elles sont volontiers objectivées plus précocement qu’à l’observation biomicroscopique ou sur les clichés fournis par les rétinographes (voir « Relations chronologiques »). Cela dit, la concordance régionale entre les résultats des analyseurs et ceux du champ visuel est généralement bonne dès lors que le glaucome s’exprime sur le plan périmétrique. Avec le Heidelberg Retinal Tomograph (HRT), les relations topographiques sont d’ailleurs meilleures pour les paramètres sectoriels que pour les paramètres globaux [17], mais la variabilité interindividuelle est importante [2, 17].
Avec la tomographie par cohérence optique (OCT), les corrélations régionales entre la couche des FNR et celle des cellules ganglionnaires rétiniennes (GCC) au niveau maculaire sont habituellement très significatives (fig. 10-122) [18].
À l’heure où cet ouvrage est écrit, de multiples travaux sont en cours ou vont être conduits pour explorer ce territoire nouvellement conquis par les techniques d’OCT en constant développement. Ainsi, il apparaît que les paramètres concernant la couche GCIPL (complexe cellules ganglionnaires-plexiforme interne) avec l’OCT-SD Cirrus ont plus de valeur pour repérer une atteinte glaucomateuse paracentrale que périphérique du champ visuel [26], ou encore qu’un amincissement supérieur des FNR (avec donc une atteinte inférieure du champ visuel) est plus large et plus proche du méridien horizontal du disque optique qu’un amincissement inférieur [4].
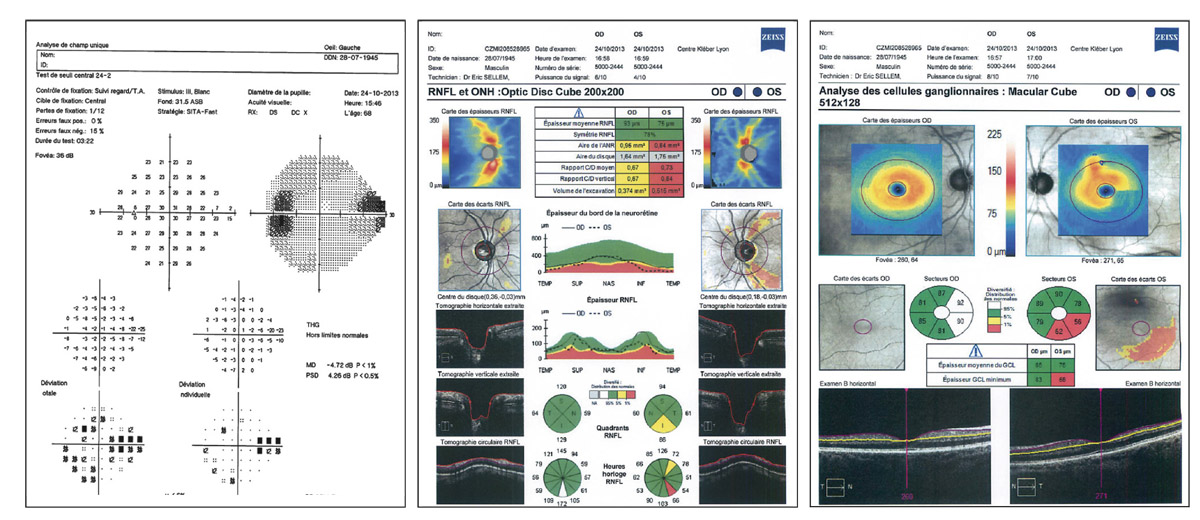
Fig. 10-122 Excellente corrélation entre l’atteinte du champ visuel de l’œil gauche et les résultats de l’analyse OCT-SD de la TNO, des FNR et des cellules ganglionnaires maculaires (Cirrus, Zeiss).
Depuis les études de Sommer et al. [28] sur une population de patients hypertones et les résultats de l’étude de l’OHTS [9] (où 50 % des conversions vers le glaucome sont diagnostiquées sur des modifications de la TNO), il est cliniquement prouvé que les modifications de la structure précèdent les atteintes du champ visuel. Mais c’est à Quigley et son équipe que revient le mérite d’avoir montré histologiquement, sur la rétine humaine, qu’une perte de CGR survient avant des atteintes du champ visuel en périmétrie automatisée standard (PAS) [10, 22]. Les nouvelles techniques d’imagerie en OCT permettent toutefois d’envisager ce rapport structure-fonction avec plus de puissance, à la fois sur le versant histologique mais également avec une meilleure approche topographique.
Sur le plan structural, seule l’observation de la TNO a longtemps permis le diagnostic de glaucome en montrant la présence d’une excavation papillaire pathologique. Avec l’avènement des rétinophotographies et des analyseurs, il est devenu évident que la perte des FNR et l’amincissement de l’ANR précèdent plus encore l’apparition des déficits fonctionnels en PAS [1, 3, 7, 19, 32] (fig. 10-123).
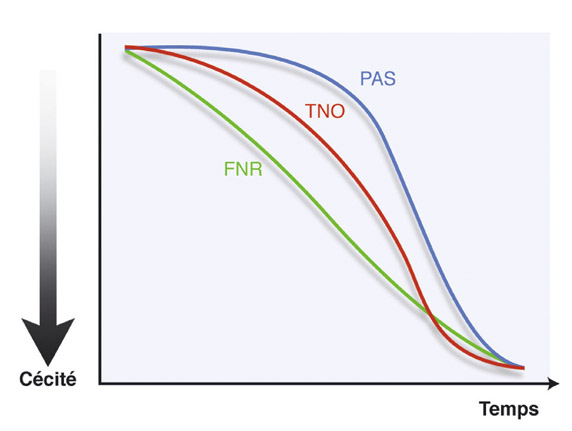
Fig. 10-123 Progression schématique de l’atteinte des FNR, de la TNO et du champ visuel en PAS.
La redondance des cellules ganglionnaires, particulièrement considérable au centre de la rétine, explique que leur perte puisse ne s’exprimer qu’à un stade tardif en PAS. L’utilisation de techniques périmétriques interrogeant les cellules préférentiellement atteintes dans le glaucome peut toutefois les détecter plus précocement (voir chapitre 9-V paragraphes « Périmétrie automatisée bleu-jaune » et « Périmétrie à doublage de fréquence »). Cette constatation se vérifie particulièrement lorsque cette perte est diffuse et homogène, et une papille très excavée et atrophique ne s’accompagne pas toujours d’une atteinte périmétrique ou de déficits auxquels l’observateur aurait pu s’attendre (fig. 10-124).
À l’opposé, certaines papilles peuvent être normales ou peu excavées à l’observation, avec cependant un champ visuel déjà très altéré. C’est le cas des papilles de petite taille, dans lesquelles les FNR sont très ramassées à l’entrée du nerf optique, expliquant que la constitution d’une excavation ne puisse se faire qu’à un stade tardif de l’évolution du glaucome (voir fig. 10-120 et fig. 10-125).
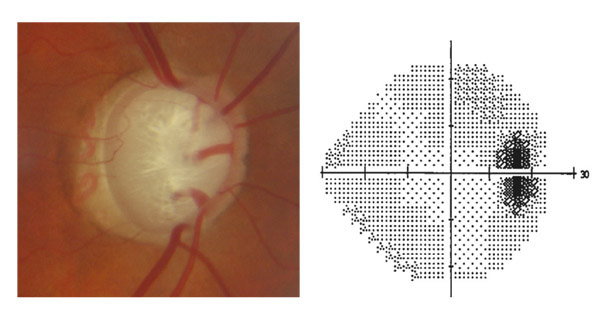
Fig. 10-124 Large excavation pathologique, avec une rupture inférieure de l’ANR, alors que le champ visuel est pratiquement indemne.
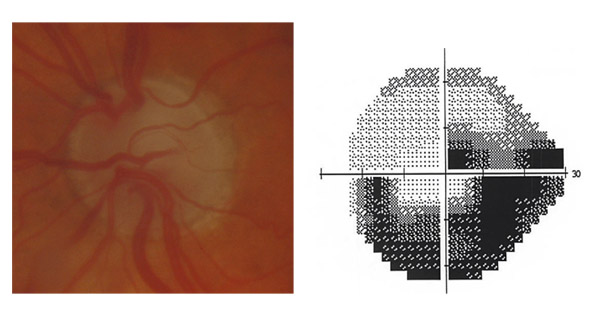
Fig. 10-125 Petite papille glaucomateuse sans excavation flagrante avec une hémorragie à 7 heures, mais le champ visuel est lourdement et typiquement altéré.
Les mêmes constatations peuvent être faites, avec d’ailleurs une discordance souvent plus flagrante encore compte tenu de la sensibilité des analyseurs de la structure (fig. 10-126).
Dans certains cas où les résultats de l’examen du champ visuel sont parfois discutables, car c’est un examen subjectif, ceux-ci peuvent être confirmés par la confrontation aux données apportées par l’analyseur (fig. 10-127).
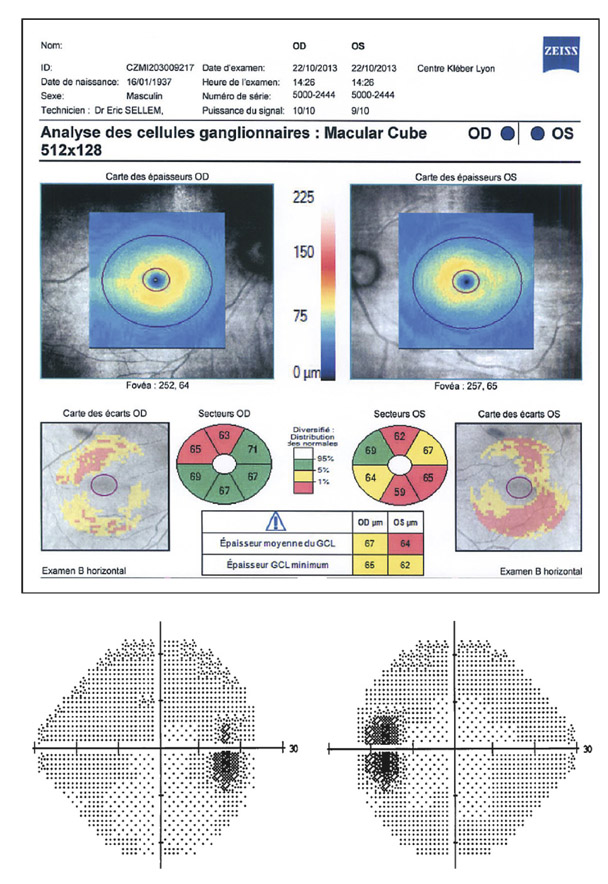
Fig. 10-126 Atteinte glaucomateuse bilatérale, objectivée par l’amincissement de la couche des CGR maculaires ; le champ visuel de l’œil droit présente un scotome très relatif dans l’hémi-champ supérieur, celui de l’œil gauche est normal alors que l’OCT-SD (Cirrus, Zeiss) est plus pathologique qu’à droite.
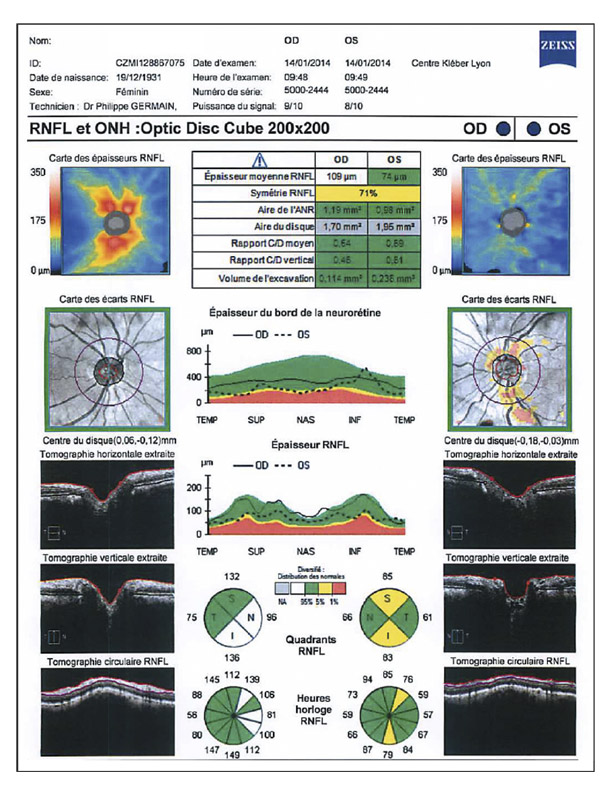
Fig. 10-127 Relevé de l’analyse de la TNO et des FNR à l’OCT-SD (Cirrus, Zeiss) correspondant au cas de la fig. 10-125 où sont présentés la papille et le champ visuel. L’altération glaucomateuse est confirmée pour l’œil gauche, avec toutefois une atteinte périmétrique plus importante que ne le laisseraient supposer les résultats de l’OCT.
La recherche d’une relation entre l’atteinte structurale et l’atteinte fonctionnelle dans la neuropathie optique glaucomateuse a toujours suscité l’intérêt des cliniciens et fait l’objet de nombreuses recherches. Si la détermination d’une telle relation présente un intérêt clinique pratique, elle se heurte à la difficulté de comparer des données fonctionnelles obtenues par l’analyse du champ visuel avec des pertes de sensibilité exprimées en décibels et relevant d’une échelle logarithmique, avec l’épaisseur de la couche des fibres nerveuses rétiniennes et celle du complexe cellulaire ganglionnaire évaluées par l’OCT selon une échelle linéaire en microns. L’avènement des dernières générations d’OCT-SD et l’évolution constante de leurs logiciels d’analyse suscitent un vif regain d’intérêt dans l’évaluation de cette relation structure-fonction qui se précise mieux depuis peu.
Un rappel de quelques spécificités des deux éléments à mettre en relation est nécessaire.
Les pertes de sensibilité de l’atteinte fonctionnelle par l’analyse du champ visuel en PAS sont évaluées en décibels selon une échelle logarithmique.
Les patients suspects et/ou atteints de GPAO sont dans la majorité des cas suivis en PAS avec les programmes 24-2 ou 30-2 du périmètre Humphrey, ou encore DG2 de l’Octopus. Avec ces programmes, les points testés sont espacés de 6°, et les premiers points de part et d’autre des méridiens vertical et horizontal sont situés à 3° de ces derniers. Ainsi l’analyse des 10° centraux par un test en PAS 24-2 ou 30-2 est représentée seulement par les quatre points centraux du relevé.
Les programmes d’analyse des 10° centraux du champ visuel en PAS (10-2) évaluent la sensibilité des points espacés de 2° (à partir de 1° de la fovéa), soit 32 points dans les 8° centraux, par rapport aux quatre points centraux testés dans ce même secteur par le relevé PAS 24-2.
L’atteinte de la région centrale dans le glaucome débutant a été rapportée depuis de nombreuses années avec la mise en évidence de déficits du champ visuel aux stades précoces dans les 5° centraux, et de façon spécifique au niveau de l’hémichamp visuel maculaire supérieur [11]. Des donnés plus récentes soulignent que plus de 50 % des yeux présentant un glaucome léger à modéré ont un déficit du champ visuel au niveau des 3° centraux. Ces données soulignent l’importance d’une analyse du champ visuel central quel que soit le stade clinique du GPAO [25].
L’amincissement de la couche des FNR et des CGR maculaires augmente progressivement, le plus souvent au début au niveau de la rétine inférieure au fur et à mesure de l’apparition et de l’aggravation des déficits du champ visuel. À un certain stade, la couche des FNR et des CGR s’amincit également au niveau de l’hémi-rétine atteinte par les déficits du champ visuel [16].
Plusieurs études sont venues confirmer la concordance qualitative des relevés actuels obtenus en OCT-SD par rapport aux résultats des analyses histologiques. Récemment, des travaux ont suggéré un très haut degré de correspondances entre les données OCT réalisées in vivo et l’ensemble des donnés histologiques post mortem (fig. 10-128) [5, 20].
Les nouveaux logiciels de segmentation des couches rétiniennes par les OCT-SD nous permettent des vues sans précédent des structures tissulaires à partir desquelles les mesures des épaisseurs des différentes couches rétiniennes en microns évaluent l’atteinte structurale (fig. 10-129).
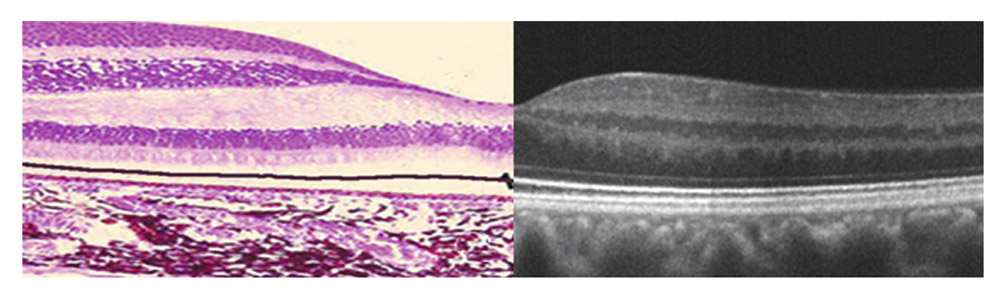
Fig. 10-128 Correspondance histologie rétinienne et relevé OCT-SD.
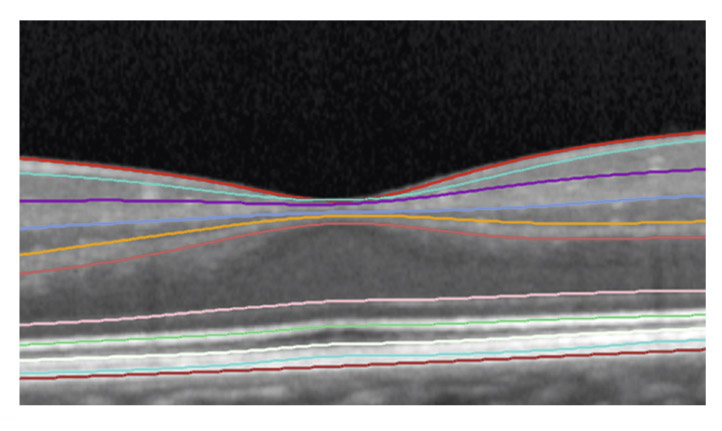
Fig. 10-129 Relevé OCT-SD : nouveau logiciel d’acquisition et de segmentation OCT-SD Spectralis (Heidelberg).
La macula correspond aux 8° centraux autour du centre fovéal avec, à son niveau, environ 50 % de la population cellulaire ganglionnaire totale. La forte densité de CGR dans cette région, avec un recouvrement important de leurs champs récepteurs et la variété de ceux-ci (on/off), explique la haute sensibilité des points centraux du relevé du CV 24-2.
Au niveau central fovéolaire, il existe un déplacement latéral des cellules ganglionnaires. Ce déplacement des CGR fovéales connectées aux cônes centraux a été étudié par Drasdo et al. [6]. Sur des yeux humains post mortem, ils ont en effet tracé et analysé le trajet des connexions depuis les cônes centraux récepteurs jusqu’à la région des CGR associées. Une variation de la longueur des fibres de Henlé de 406 à 675 microns est ainsi rapportée.
Dans la partie centrale du champ visuel s’étendant presque jusqu’à 15° du point de fixation, les champs récepteurs cellulaires sont ainsi déplacés à partir de la position de leurs cellules ganglionnaires, principalement en raison de la longueur de la connexion latérale des fibres de Henlé et, dans une moindre mesure, des connexions obliques avec les cellules bipolaires. Les résultats rapportent que les premières cellules ganglionnaires apparaissent à 150 à 200 microns du centre fovéal. Ce déplacement latéral par rapport aux photorécepteurs est d’autant plus important que les points à tester sont centraux. Il diminue progressivement à l’approche de la tête du nerf optique (environ à 3,4 mm du côté nasal du centre fovéal), mais il est encore détectable jusqu’à 4,5 mm du côté temporal de la fovéa [6].
Le déplacement des cellules ganglionnaires déjetées latéralement et la longueur des fibres de Henlé doivent être pris en compte dans l’évaluation de la relation structure-fonction.
Les variabilités intra- et interindividuelles, aussi bien dans l’évaluation de l’atteinte structurale de la couche des FNR que dans celle de l’atteinte fonctionnelle en PAS, ont été confirmées par plusieurs études dont celle de Hood et al. en 2009 [12] chez 140 sujets glaucomateux et 82 sujets normaux témoins (fig. 10-130).
Fig. 10-130 Modèle linéaire de représentation des variabilités intra- et interindividuelles des mesures de la couche des FNR et de la PAS, aux différents stades de la maladie glaucomateuse (d), exprimés en dB de pertes du champ visuel. Reproduit avec l’aimable autorisation de Donald C. Hood (Hood DC, Anderson SC, Wall M, et al. A test of a linear model of glaucomatous structure-function loss reveals sources of variability in retinal nerve fiber and visual fielf measurements. Invest Ophthamol Visc Sci. 2009 ; 50 : 4254-66).
La variabilité intra-individuelle des données recueillies en PAS augmente avec les déficits du champ visuel jusqu’à un niveau d’environ MD = – 8 dB. L’impact relatif de cette variation intra-individuelle de la PAS peut être observé sur la figure 10-130.
Dans les glaucomes débutants avec des sensibilités en PAS meilleures que – 6 dB, les variations intra-individuelles des mesures (largeur horizontale de l’ellipse bleue qui la représente) étaient plus faibles que les variations interindividuelles (représentées par la largeur horizontale de l’ellipse rouge). Dans les stades cliniques plus évolués avec des sensibilités du champ visuel plus mauvaises ou égales à – 6 dB, les variations intra-individuelles prédominaient jusqu’à des pertes extrêmes du champ visuel à partir de – 22 dB environ).
La variabilité interindividuelle reste le facteur dominant dans les pertes débutantes du champ visuel (champ meilleur que – 6 dB).
Les variations intra-individuelles des relevés en OCT-SD sont moins perturbées et restent plus constantes avec une excellente reproductibilité des mesures (hauteur de l’ellipse bleue).
Les variabilités interindividuelles de l’épaisseur de la couche des FNR sont plus importantes chez les sujets sains et dans les formes débutantes du GPAO (hauteur de l’ellipse rouge plus importante que celle de l’ellipse bleue) (voir fig. 10-130).
L’analyse du relevé de l’atteinte fonctionnelle par l’étude du champ visuel est ainsi caractérisée par une variabilité intra- et interindividuelle importante, alors que l’analyse de l’atteinte structurale en OCT-SD est essentiellement marquée par une variation interindividuelle des mesures, avec une très faible variation intra-individuelle.
En 2000, Garway-Heath et al. [8] proposèrent une carte de corrélation entre les points du CV 24-2 et les différents secteurs de la TNO. Les localisations des déficits et leurs projections anatomiques sur la TNO ont été établies sur les rétinophotographies digitalisées de la couche des FNR de 69 yeux (63 patients) qui présentaient des déficits localisés en FNR. La projection conjointe sur ces photographies des points du CV 24-2, en corrigeant les effets de magnification optique liés aux amétropies, leur a permis de proposer une carte de correspondance structure-fonction inédite, dérivée de l’observation de déficits chez l’homme (fig. 10-131). Un des enseignements de cette carte est l’asymétrie entre les projections des hémi-champs supérieur et inférieur en raison de la position de la TNO au-dessus du méridien horizontal [8].
Les travaux plus récents concernant l’analyse des CGR et de la couche des FNR chez les patients suspects de glaucome et dans les glaucomes périmétriques approchent cette relation structure-fonction à partir des données de la déviation moyenne rapportée par le CV 24-2 et l’OCT-SD [15, 29]. Ces travaux rapportent que les plus grandes pertes en FNR sont situées dans les régions arciformes qui correspondent aux régions les plus épaisses de la couche des FNR chez les sujets sains. L’amincissement apparaît plus important dans le secteur inférieur par rapport à l’hémi-secteur supérieur, expliquant ainsi que les lésions glaucomateuses rapportées sont plus sévères au niveau de l’hémi-champ visuel supérieur en fonction de l’importance de l’indice MD. L’amincissement est plus apparent au niveau de la rétine inférieure que de la rétine supérieure. À noter que l’amincissement des CGR est prédominant dans le secteur temporal et inférieur de la macula.
Il existe une relation tout au moins qualitative entre la diminution de l’épaisseur de la couche des CGR relevée en OCT-SD et la sensibilité des points déficitaires sur les relevés obtenus en PAS. Les atteintes de l’hémi-champ visuel supérieur, y compris au niveau de la zone hémi-maculaire supérieure, sont plus fréquentes et de type arciforme.
Peut-on comparer les déficits focaux du champ visuel aux atteintes localisées des cellules ganglionnaires ? Peut-on corréler de façon quantitative les variations focales de la couche des CGR et les déficits locaux de la sensibilité rétinienne ?
Les régions les plus denses en CGR chez les sujets sains ainsi que les amincissements les plus importants de cette couche se situent à l’intérieur des quatre points centraux testés par le relevé du CV 24-2 avec une grille de points séparés de 6°. Il s’agit pourtant du protocole d’analyse de la fonction visuelle le plus couramment utilisé en pratique clinique.
La plus forte association structure-fonction en utilisant l’OCT-SD a été retrouvée pour la mesure de la couche des FNR au niveau des faisceaux arciformes et pour celle de l’épaisseur des couches rétiniennes internes au niveau des mesures maculaires [23].
Les épaisseurs moyennes et sectorielles du complexe de la couche des CGR et de la couche plexiforme interne déterminées par le Cirrus HD OCT étaient associées de façon significative avec la sensibilité globale et régionale du champ visuel chez les patients atteints de glaucome. L’épaisseur maculaire du complexe GCIPL semble donner des informations plus pertinentes que la couche des FNR péripapillaires pour la compréhension d’une relation structure-fonction de la région maculaire [27].
Plusieurs études se sont fondées sur une correspondance de la localisation des points testés au CV 24-2 et leur superposition sur la rétine. Cependant, les localisations des CGR stimulées par les points centraux du test 24-2 sont plus éloignées de la fovéa que ne le laisse supposer une superposition simple de la grille de points testés sur l’image rétinienne.
Une correspondance de la localisation des points testés aux champs visuels 24-2 ou 10-2 directement superposés sur la rétine avec les données d’analyse des épaisseurs des différentes couches des FNR et du GCC dans les mêmes secteurs en OCT-SD, rapportée dans certaines études, ne peut pas être retenue. Si la déformation du relevé du champ visuel en deux dimensions est remise à l’échelle, le relevé du scan OCT selon la courbure rétinienne doit également être remis à la même échelle pour une superposition adéquate des différents secteurs.
Le champ visuel correspond au champ de perception visuelle depuis la macula, soit 10° ou 24° respectivement avec les programmes 10-2 et 24-2 (globalement, 1° correspond à une largeur de pouce à l’extrémité d’un bras tendu, et les 6° séparant chaque point testé du 24-2 à une largeur de main).
L’émission du signal OCT à partir du point de sortie du système optique couvre sur la courbure rétinienne un champ rétinien non directement superposable au champ visuel.
Les localisations des cellules ganglionnaires stimulées par les points centraux des tests 24-2 et 10-2 sont plus éloignées de la fovéa que ne le laisse supposer une superposition simple de la grille de points testés sur l’image rétinienne OCT.
L’analyse de l’atteinte fonctionnelle d’un point ou d’un secteur rétinien déterminé ne peut donc pas être envisagée par une superposition simple des relevés du champ visuel et de l’OCT en deux dimensions tels qu’ils sont obtenus actuellement.
Les travaux de Hood ont comparé l’épaisseur de la couche des cellules ganglionnaires en OCT-SD aux déficits du champ visuel relevés en PAS 10-2 (32 points dans les 8° centraux versus 4 points au relevé 24-2) [13].
L’importance de prendre en compte le déplacement latéral des cellules ganglionnaires en relation avec les photorécepteurs centraux a bien été démontrée dans l’évaluation de l’épaisseur locale de la couche des cellules ganglionnaires par rapport aux déficits focaux relevés dans les quatre points centraux du champ visuel. De récents travaux rapportent que la prise en compte de ce déplacement latéral des CGR et de la longueur des fibres de Henlé permet de réduire de façon importante la variabilité dans la relation structure fonction [14].
Fig. 10-131 Cartographie de projection des données du CV 24-2 construite à partir de l’étude. (D’après Garway-Heath et al., 2000 [8].)
Ces mêmes auteurs, pour améliorer la détection des atteintes maculaires ont proposé une procédure qui permet de combiner les données mesurées en PAS et celles relevées en OCT-SD (épaisseur de la couche des FNR et des CGR).
La localisation des points testés lors d’un CV 24-2 ou 10-2 prend en compte le déplacement des CGR évalué par les données des études histologiques de Drasdo. Si les déplacements des points centraux du CV 24-2 sont relativement mineurs, ils sont cependant substantiels pour les points centraux du champ visuel 10° (10-2) (fig. 10-132).
De nouvelles cartographies de superposition des différents points de sensibilité testés au niveau du champ visuel prenant en compte le déplacement latéral des CGR centrales et les données d’acquisition du scan OCT-SD, avec une remise à l’échelle du relevé, ont été ainsi proposées. Elles permettent d’obtenir dans certains cas, grâce à de nouveaux logiciels et algorithmes, des rapports combinés associant le relevé des données du CV 10-2 ou 24-2 avec les relevés de l’OCT-SD en champ élargi ou en relevé maculaire (fig. 10-133 et 10-134).
Ces nouvelles approches sont en cours d’évaluation.
Fig. 10-132 Représentation des points du CV 10-2 avec le déplacement des points centraux correspondant au déplacement latéral des CGR périfovéolaires.
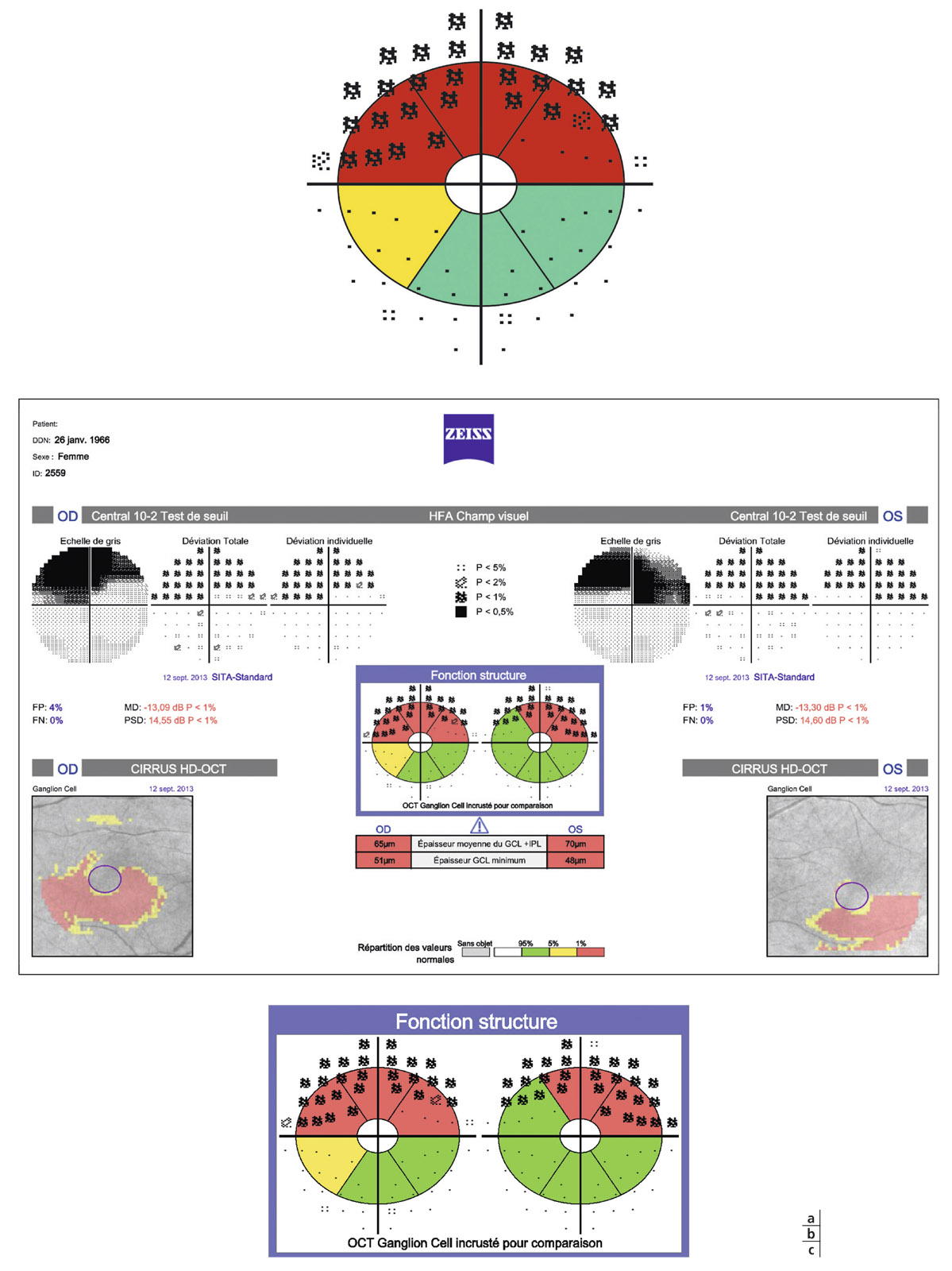
Fig. 10-133 a. Superposition du relevé d’analyse de la couche des CGR et des points testés au CV 10-2. b. Rapport combiné relevé CV 10-2 et relevé du complexe GCIPL. c. Carte de rapport structure-fonction tenant compte de la mise à l’échelle du relevé OCT et de la topographie des CGR centrales périfovéolaires.
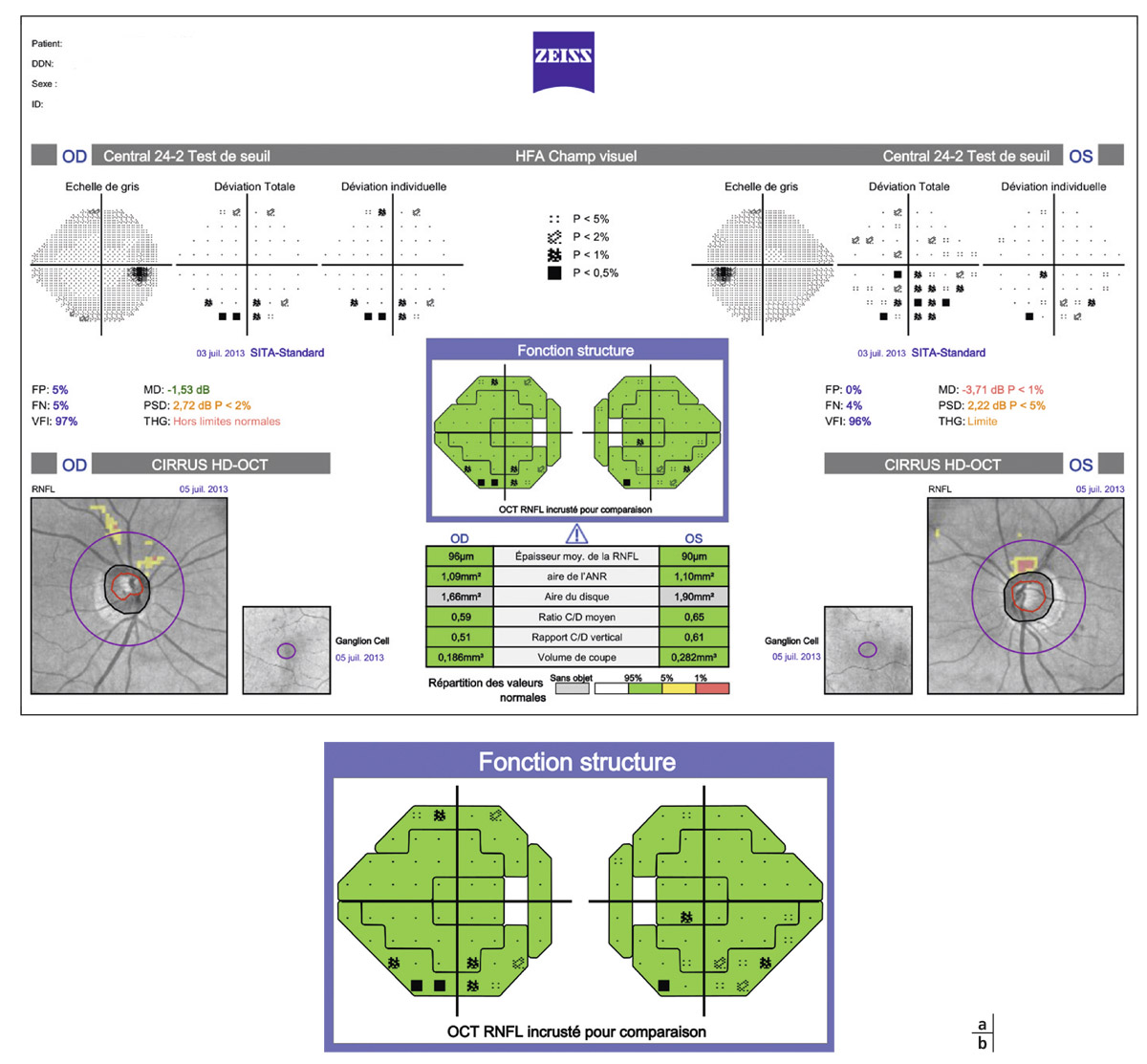
Fig. 10-134 a . Rapport combiné relevé CV 24-2 et relevé HD-OCT. b. Carte de rapport structure-fonction tenant compte de la mise à l’échelle du relevé OCT.
Les variations interindividuelles de la position du disque optique (DO) par rapport à la macula doivent être considérées pour évaluer leurs retentissements sur les variations éventuelles de localisation des zones de lésions structurales débutantes. Si le centre du DO est classiquement environ 6° au-dessus de la ligne horizontale passant par le centre fovéal, l’axe du centre du DO à la fovéa présente des variations interindividuelles rapportées de 6° à 20°. La concordance des différents tracés des faisceaux des FNR reste donc difficile et marque certaines limites à l’origine de variations interindividuelles.
Une autre interrogation concernant ces variations interindividuelles de la position du DO par rapport à la macula est celle de la position constante du raphé médian. Les études récentes rapportent que si l’emplacement du centre du DO peut varier, la localisation du raphé médian reste identique [14]. L’utilisation de logiciels pour effectuer une rotation circulaire des données relevées après l’acquisition en OCT-SD permet de réduire la variabilité interindividuelle des cartes d’acquisition entre les différentes positions de l’axe fovéa-disque optique.
Notre compréhension de la relation entre les déficits du champ visuel et l’amincissement de la couche des FNR et des CGR maculaires est incomplète.
Un modèle linéaire simple semble décrire une relation entre l’amincissement de la couche des FNR et les déficits du champ visuel en dehors de la macula.
Dans la région maculaire, les résultats des différentes études ne rapportent pas une relation linéaire pour l’analyse de la relation structure-fonction dans cette région.
La comparaison simple et directe des cartes de probabilité issues des relevés de l’analyse du champ visuel en PAS et de l’analyse de la structure en OCT-SD ne représente qu’une première étape.
Si nos connaissances progressent avec la mise en évidence de la nécessité d’une prise en compte d’un certain nombre d’éléments importants, il est encore nécessaire d’évaluer les logiciels actuels qui tiennent compte du déplacement latéral des CGR périfovéolaires. Dans l’analyse de la relation structure-fonction, en particulier pour les relevés du CV 10-2 et de l’OCT maculaire, il faut retenir que pour le relevé du CV 24-2 seuls les quatre points centraux correspondent à cette même région (fig. 10-135).
Si les cartes des épaisseurs en OCT-SD de la couche des FNR et des cellules ganglionnaires ont permis de prédire dans certains cas la topographie de l’apparition du déficit du champ visuel [34], il n’a pas encore été établi à ce jour de seuil lésionnel évolutif d’amincissement de ces couches structurales en OCT signant de façon objective l’atteinte fonctionnelle. Ces données restent encore à préciser.
De plus, l’interprétation de certaines formes anatomiques et distributions topographiques de la couche des FNR, en particulier en cas de dysversion papillaire, posera toujours des difficultés. Les études de la couche des FNR présentent donc de considérables variabilités pour une localisation donnée étant donné la grande variation d’aspect de la TNO.
Dans l’idéal, il serait bon d’individualiser pour chaque sujet des cartes structure-fonction qui nécessiteraient de prendre en compte la taille et la pente tridimensionnelle du DO, aussi bien que l’anatomie rétinienne comme l’angle de l’axe DO-fovéa et la position et/ou le recouvrement du raphé.
Les essais de représentation cartographique mettent en corrélation des aires du champ visuel avec l’analyse de la couche des FNR des différents secteurs rétiniens. Cependant, la couche des FNR est mesurée sur une échelle linéaire, alors que l’analyse du champ visuel utilise une échelle logarithmique. La relation entre les deux n’est pas linéaire ; une petite modification en décibels au niveau des seuils représente une modification de bien plus grande amplitude de variation que le changement de la couche des FNR mesuré sur une échelle linéaire en microns. Ces éléments expliquent l’« effet plancher » du suivi des FNR observé sur les relevés OCT dans les stades évolués alors que l’analyse fonctionnelle du champ visuel est de façon parfois discordante encore très satisfaisante (fig. 10-136).
De récentes études ont suggéré qu’en combinant les données, par exemple en utilisant les modèles hiérarchiques bayésiens, on pourrait obtenir une meilleure sensibilité diagnostique du glaucome avec une estimation de la relation structure-fonction et du taux de progression plus performante (voir l’encadré « Utilisation de la méthode bayésienne pour combiner structure et fonction dans l’évaluation du glaucome » en fin de texte).
Enfin, Hood a récemment rapporté, en 2014, une méthode logicielle permettant de combiner les valeurs de la périmétrie à celles de l’OCT-SD par le repérage de clusters de points anormaux, avec une meilleure sensibilité diagnostique des paramètres combinés structure-fonction que celle des seuls examens périmétriques ou d’imagerie en OCT maculaire ou péripapillaire pour la détection des glaucomes débutants [24].
Les techniques évoluent, comme nous l’avons vu, vers de nouveaux systèmes de cartographie combinant les données structurales et fonctionnelles. Leur évaluation en cours demande une prise en compte des différentes variations et limites anatomiques, mais elles laissent envisager une progression significative dans l’évaluation d’une meilleure relation structure-fonction dans le glaucome qui doit toujours rester intégrée au jugement clinique adapté.
M. Delbarre, M. Maréchal, J.-P. Renard
La méthode bayésienne est un mécanisme d’inférence permettant de déduire la probabilité d’un événement à partir des probabilités d’autres événements déjà évaluées. L’inférence désigne les actions de mise en relation d’un ensemble de propositions, aboutissant à une démonstration de vérité, de fausseté ou de probabilité, sous la forme d’une proposition appelée conclusion.
Cette méthode a été développée par Thomas Bayes, ministère presbytérien anglais, puis affinée par un mathématicien français, Pierre Simon Laplace.
Devant un champ visuel évocateur de déficit glaucomateux, il est difficile de connaître précisément l’étiologie de cette atteinte du champ visuel. Si la pression intra-oculaire est de 32 mmHg, une neuropathie optique glaucomateuse sera évoquée. Mais si l’examen du fond d’œil retrouve un rétrécissement artériolaire, une papille légèrement excavée mais particulièrement pâle, le diagnostic évoqué sera alors celui d’une neuropathie optique ischémique antérieure artéritique. Cet exemple illustre que chaque nouvelle information modifie la probabilité d’un diagnostic.
Le modèle bayésien est utilisé dans le dépistage et le suivi de la neuropathie glaucomateuse grâce à l’analyse et à la combinaison de deux types de test (structural et fonctionnel). Le principe consiste à incorporer les résultats du premier test aux résultats du second, et d’incorporer les résultats du second test au premier. L’interprétation est alors modifiée, permettant d’augmenter la sensibilité de chacun de ces tests pour détecter la présence d’un éventuel glaucome mais également de prédire l’évolution [a,b].
En utilisant des modèles à variables aléatoires, on génère plusieurs modèles combinés qui sont alors confrontés aux résultats de l’étude histologique expérimentale de Harwerth [c]. La confrontation des résultats permet de choisir le modèle le plus approprié.
Ce modèle permet d’obtenir une estimation du nombre de cellules ganglionnaires rétiniennes (CGR) sur l’ensemble du relevé du champ visuel par périmétrie automatisée standard (PAS), à partir des estimations du nombre CGR pour chacun des points testés. Une deuxième estimation du nombre de CGR est réalisée à partir des données de l’OCT (âge, MD, épaisseur moyenne des fibres nerveuses rétiniennes). Ces deux estimations sont combinées en les pondérant selon le stade de la maladie (prédominance des données de l’OCT pour les stades débutants et prédominance des données du champ visuel pour les stades plus avancés) pour obtenir une estimation finale du nombre de CGR [d,e,f].
Les différentes études réalisées par Medeiros et son équipe ont montré une bonne corrélation entre les estimations du nombre de CRG issues de la PAS et les estimations du nombre de CGR issues de l’OCT [e,g].
Formules utilisées pour estimer le nombre de CGR dans une zone de la rétine correspondant à une zone spécifique du champ visuel :
m = [0,054(ec × 1,32)] + 0,9
b = [– 1,5(ec × 1,32)] – 14,8SAPCGR = Σ 10(gc × 0,1)
gc = {[(s – 1) – b]/m} + 4,7
ec : excentricité
s : sensibilité (dB) à une excentricité donnée
Les données de pente (m) et d’intersection (b) de la courbe de la fonction linéaire mettent en relation le nombre de CGR et la sensibilité (dB) du champ visuel à une excentricité donnée.
Formules utilisées pour obtenir le nombre de CGR à partir de l’OCT grâce à l’épaisseur des fibres nerveuses péripapillaires (RNFL) :
d = (– 0,007 × âge) + 1,4
c = (– 0,26 × MD) + 0,12OCTCGR = 10[(log(a) × 10 – c)0,1]
a = épaisseur moyenne du RNFL × 10,870 × d
Estimation du nombre de cellules ganglionnaires = (OCTCGR + SAPCGR)/2
Pour les glaucomes débutants, une perte de CGR correspond à une petite variation de MD et une variation plus importante des fibres nerveuses péripapillaires en OCT. À l’inverse, dans les stades évolués, une perte de CGR identique produit une large modification de MD, mais une diminution légère de l’épaisseur des fibres nerveuses rétiniennes péripapillaires [d].
L’estimation du nombre de CGR a une sensibilité plus élevée que le RNFL pour détecter un déficit précoce du champ visuel [f] et une évolution du glaucome [e]. Il existe une corrélation entre l’hémi-rétine (supérieure ou inférieure) où sont estimées la perte de CGR et la zone du champ visuel présentant un déficit [f].
Une perte moyenne de 28,4 % en CGR estimée est nécessaire pour le développement d’un déficit précoce glaucomateux [f]. Cette perte de CGR avant l’apparition d’un déficit au champ visuel est en accord avec les études histologiques de Kerrigan-Baumrind sur des yeux humains [g] et celle de Harwerth sur des yeux de singe (sur laquelle ce modèle est basé) [c].
Pour les GPAO débutants, l’estimation de la perte moyenne de CGR varie selon les études de – 18,987 (MD moyen : – 0,84 dB) [i] à – 31,009 cellules/an (MD moyen : – 2,51 dB) [4].
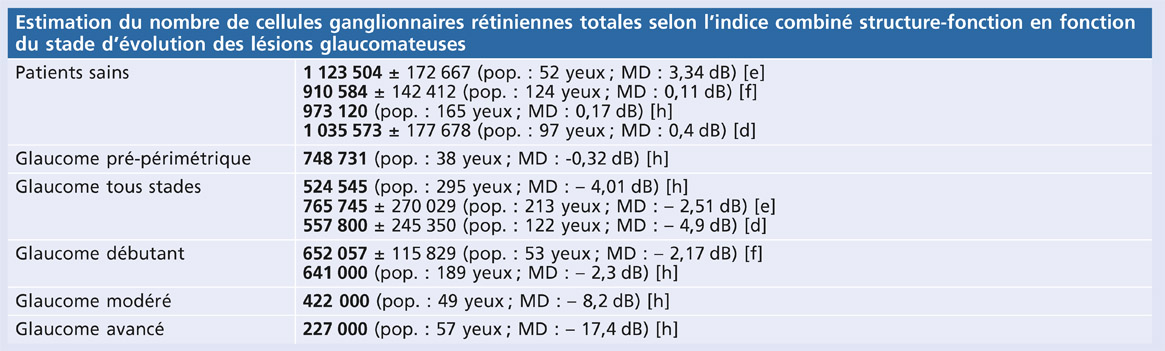
[a] Medeiros FA, Leite MT, Zangwill LM, Weinreb RN. Combining structural and functional measurements to improve detection of glaucoma progression using Bayesian hierarchical models. Invest Ophthalmol Vis Sci. 2011 ; 52 : 5794-803.
[b] Medeiros FA, Zangwill LM, Girkin CA, et al. Combining structural and functional measurements to improve estimates of rates of glaucomatous progression. Am J Ophthalmol. 2012 ; 153 : 1197-205.
[c] Harwerth RS, Wheat JL, Fredette MJ, Anderson DR. Linking structure and function in glaucoma. Prog Retin Eye Res. 2010 ; 29 : 249-71.
[d] Medeiros FA, Zangwill LM, Bowd C, et al. The structure and function relationship in glaucoma : implications for detection of progression and measurement of rates of change. Invest Ophthalmol Vis Sci. 2012 ; 53 : 6939-46.
[e] Medeiros FA, Zangwill LM, Anderson DR, et al. Estimating the rate of retinal ganglion cell loss in glaucoma. Am J Ophthalmol. 2012 ; 154 : 814-24.
[f] Medeiros FA, Lisboa R, Weinreb RN, et al. Retinal ganglion cell count estimates associated with early development of visual field defects in glaucoma. Ophthalmology. 2013 ; 120 : 736-44.
[g] Kerrigan-Baumrind LA, Quigley HA, Pease ME, et al. Number of ganglion cells in glaucoma eyes compared with threshold visual field tests in the same persons. Invest Ophthalmol Vis Sci. 2000 ; 41 : 741-8.
[h] Medeiros FA, Lisboa R, Weinreb RN et al. A combined index of structure and function for staging glaucomatous damage. Arch Ophthalmol. 2012 ; 130 : 1107-16.
[i] Meira-Freitas D, Lisboa R, Tatham A, et al. Predicting progression in glaucoma suspects with longitudinal estimates of retinal ganglion cell counts. Invest Ophthalmol Vis Sci. 2013 ; 54 : 4174-83.
Retenir
-
En règle générale, les premiers déficits périmétriques du GPAO apparaissent habituellement dans un hémi-champ, supérieur ou inférieur, en raison de l’atteinte préférentiellement unidirectionnelle des FNR au début de la maladie.
-
Lorsque les déficits s’étendent, ils sont longtemps asymétriques de part et d’autre du méridien horizontal, ligne de démarcation nette de grande valeur diagnostique.
-
Par leur grande sensibilité, les analyseurs permettent une détection encore plus précoce des altérations structurales avant l’apparition des déficits périmétriques.
-
Malgré les discordances possibles d’un test à l’autre, la confrontation des tests de la structure et de la fonction s’avère indispensable pour établir le diagnostic de glaucome, évaluer son stade évolutif et in fine sa progression éventuelle.
-
À ce jour, le seuil lésionnel évolutif d’amincissement des couches structurales en OCT signant de façon objective l’atteinte fonctionnelle n’a pas encore été établi et reste à préciser.
-
Les récentes cartographies de rapports combinés, en cours d’évaluation, nous ont permis de nets progrès dans la compréhension et l’évaluation de cette relation structure-fonction qui devient plus performante et précise.
-
Une estimation du nombre de CGR totales selon l’indice combiné structure-fonction en fonction du stade d’évolution des lésions glaucomateuses, avec les modèles bayésiens, apporte de nouvelles données importantes pour le dépistage et le suivi du glaucome.
-
De nouveaux paramètres combinés structure/fonction apportent des perspectives intéressantes dans l’évaluation de cette relation.
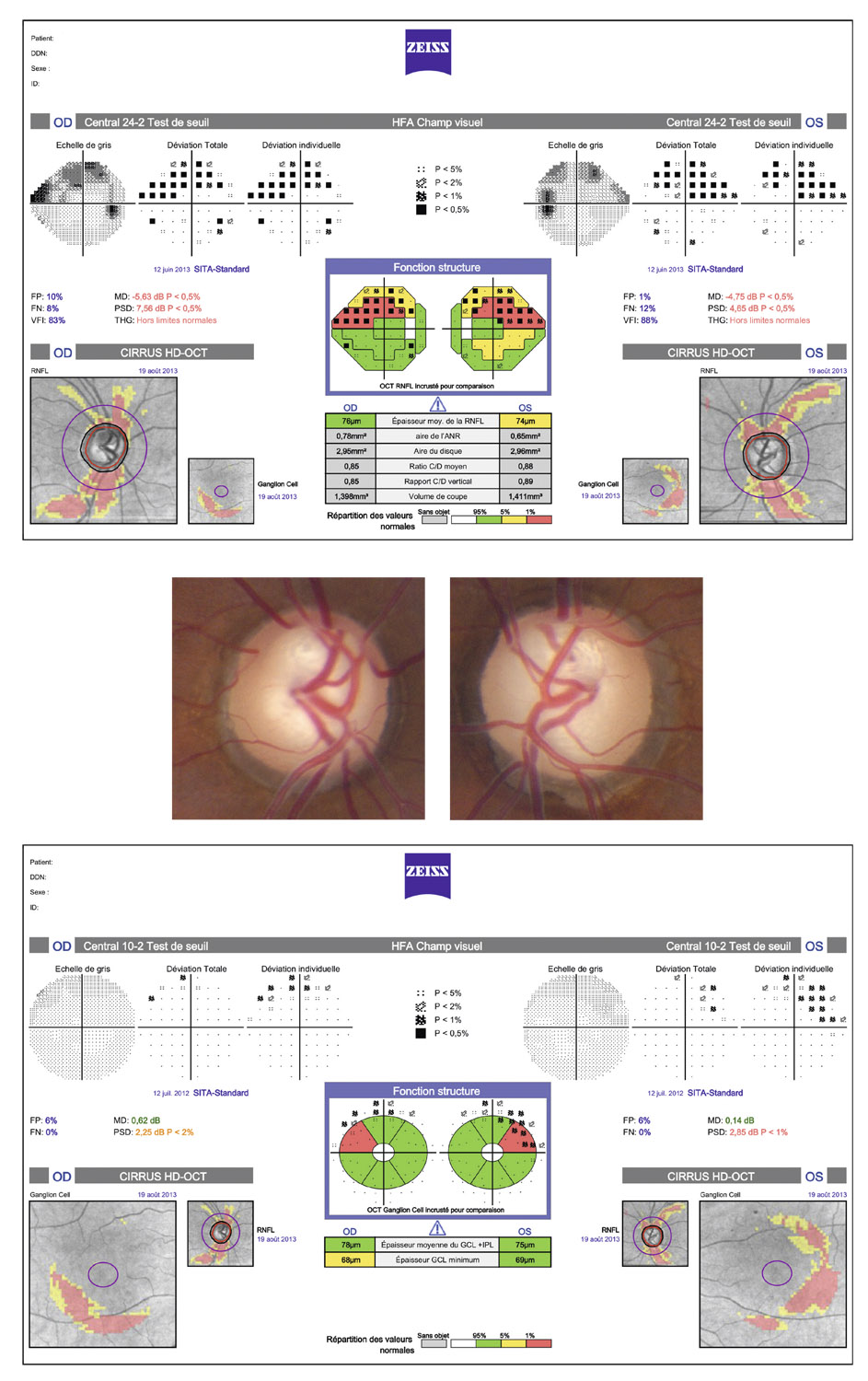
Fig. 10-135 Glaucome modéré : rapport combiné CV 24-2 et relevé OCT de la couche des FNR, rétinophotographies des papilles et rapport combiné CV 10-2 et relevé du complexe GCIPL.
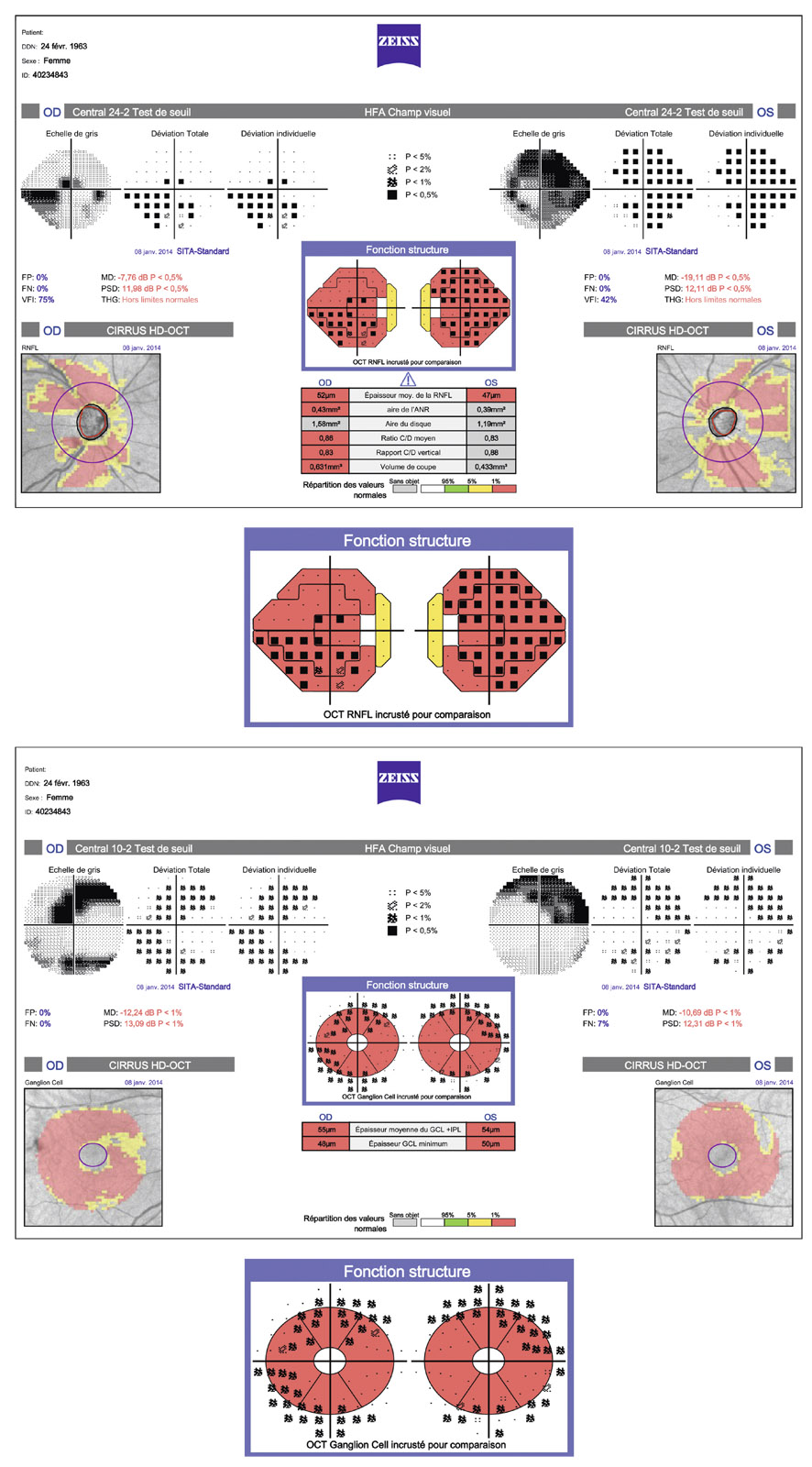
Fig. 10-136 Glaucome évolué : rapport combiné CV 24-2 et relevé OCT de la couche des FNR avec en particulier au niveau de l’œil droit un relevé fonctionnel et structural a priori discordants, et rapport combiné CV 10-2 et relevé du complexe GCIPL.
[1] Airaksinen PJ, Nieminen H. Retinal nerve fiber layer photography in glaucoma. Ophthalmology. 1985 ; 92 : 877-9.
[2] Anton A, Yamagishi N, Zangwill L, et al. Mapping structural to functional damage in glaucoma with standard automated perimetry and confocal scanning laser ophthalmoscopy. Am J Ophthalmol. 1998 ; 125 : 436-46.
[3] Bowd C, Zangwill LM, Berry CC, et al. Detecting early glaucoma by assessment of retinal nerve fiber layer thickness and visual function. Invest Ophthalmol Vis Sci. 2001 ; 42 : 1993-2003.
[4] Choi JA, Park HY, Jung KI, et al. Difference in the properties of retinal nerve fiber layer defect between superior and inferior visual field loss in glaucoma. Invest Ophthalmol Vis Sci. 2013 ; 54 : 6982-90.
[5] Curcio CA, Messinger JD, Sloan KR, et al. Human chorioretinal layer thicknesses measured in macula-wide, high-resolution histologic sections. Invest Ophthalmol Visc Sci. 2011 ; 52 : 3943-54.
[6] Drasdo N, Millican CL, Katholi CR, Curcio CA. The length of Henle fibers in the human retina and a model of ganglion receptive field density in the visual field. Vis Res. 2007 ; 47 : 2901-11.
[7] Ford BA, Artes PH, McCormick TA, et al. Comparison of data analysis tools for detection of glaucoma with the Heidelberg Retina Tomograph. Ophthalmology. 2003 ; 110 : 1145-50.
[8] Garway-Heath D, Poinoosawmy D, Fitke FW, et al. Mapping the visual field to the optic disc in normal tension glaucoma eyes. Ophthalmology. 2000 ; 107 : 1809-15.
[9] Gordon MO, Beiser JA, Brandt JD, et al. The Ocular Hypertension Treatment Study : baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 714-20 ; discussion : 829-30.
[10] Harwerth RS, Quigley HA. Visual field defects and retinal ganglion cell losses in patients with glaucoma. Arch Ophthalmol. 2006 ; 124 : 853-9.
[11] Heijl A, Lundqvist L. The frequency distribution of early glaucomatous visual field defect documented by automated perimetry. Acta Ophtalmol. 1984 ; 62 : 657-64.
[12] Hood DC, Anderson SC, Wall M, et al. A test of a linear model of glaucomatous structure-function loss reveals sources of variability in retinal nerve fiber and visual field measurements. Invest Ophthamol Visc Sci. 2009 ; 50 : 4254-66.
[13] Hood DC, Raza As, de Moraes CG, et al. Initial arcuate defects within the central 10 degrees in glaucoma. Invest Ophthalmol Visc Sci. 2011 ; 52 : 940-6.
[14] Hood DC, Raza AS, de Moraes CGV, et al. Glaucomatous damage of the macula. Prog Retin Eye Res. 2013 ; 32 : 1-21.
[15] Hood DC, Raza AS, de Moraes CGV, et al. The nature of macular damage and glaucoma as revealed by averaging Optical Coherence Tomography data. Trans Vis Sci Technol. 2012 ; 1 : 3.
[16] Keltner JL, Johson CA, Celllo KE, et al. Classification of visual field abnormalities and the Ocular Hypertension Ttreatment Study. Arch Ophthalmol. 2003 ; 121 : 643-50.
[17] Lan YW, Henson DB, Kwartz AJ. The correlation between optic nerve head topographic measurements, peripapillary nerve fibre layer thickness, and visual field indices in glaucoma. Br J Ophthalmol. 2003 ; 87 : 1135-41.
[18] Le PV, Tan O, Chopra V, et al. Regional correlation among ganglion cell complex, nerve fiber layer, and visual field loss in glaucoma. Invest Ophthalmol Vis Sci. 2013 ; 54 : 4287-95.
[19] Medeiros FA, Bowd C, Zangwill LM, et al. Detection of glaucoma using scanning laser polarimetry with enhanced corneal compensation. Invest Ophthalmol Vis Sci. 2007 ; 48 : 3146-53.
[20] Moura AL, Raza AS, Lazow MA, et al. Retinal ganglion cell and inner plexiform layer thickness measurements in regions of severe visual field sensitivity loss in patients with glaucoma. Eye. 2012 ; 26 : 1188-93.
[21] Pederson JE, Anderson DR. The mode of progressive disc cupping in ocular hypertension and glaucoma. Arch Ophthalmol. 1980 ; 98 : 490-5.
[22] Quigley HA, Dunkelberger GR, Green WR. Retinal ganglion cell atrophy correlated with automated perimetry in human eyes with glaucoma. Am J Ophthalmol. 1989 ; 107 : 453-64.
[23] Rao HL, Zangwill LM, Weinreb RN. Structure function relationship and glaucoma using SD OCT. Arch Ophthalmol. 2011 ; 129 : 864-71.
[24] Raza AS, Zhang X, De Moraes CG, et al. Improving glaucoma detection using spatially correspondent clusters of damage and by combining standard automated perimetry and optical coherence tomography. Invest Ophthalmol Vis Sci. 2014 [Epub ahead of print].
[25] Schiefer U, Papageorgiou E, Sample PA, et al Spatial pattern of glaucomatous visual field loss obtained with regionally condensed stimulus arrangements. Invest Ophthalmol Visc Sci. 2010 ; 51 : 5685-89.
[26] Shin HY, Park HY, Jung KI, et al. Glaucoma diagnostic ability of ganglion cell-inner plexiform layer thickness differs according to the location of visual field loss. Ophthalmology. 2014 ; 121 : 93-9.
[27] Shin HY, Park HY, Jung KI. Comparative study of macular ganglion cell-inner plexiform layer and peripapillary retinal nerve fiber layer : structure fonction analysis. Invest Ophthalmol Visc Sci. 2013 ; 54 : 7344-53.
[28] Sommer A, Katz J, Quigley HA, et al. Clinically detectable nerve fiber atrophy precedes the onset of glaucomatous field loss. Arch Ophthalmol. 1991 ; 109 : 77-83.
[29] Tan O, Chopra V, Lu AT, et al. Detection of macular ganglion loss and glaucoma by Fourier-Domain OCT. Ophthalmology. 2009 ; 116 : 2305-14.
[30] Tuulonen A, Airaksinen PJ. Initial glaucomatous optic disk and retinal nerve fiber layer abnormalities and their progression. Am J Ophthalmol. 1991 ; 111 : 485-90.
[31] Van der Schoot J, Reus NJ, Garway-Heath DF, et al. Accuracy of matching optic discs with visual fields : the European Structure and Function Assessment Trial (ESAFAT). Ophthalmology. 2013 ; 120 : 2470-5.
[32] Zangwill LM, Bowd C, Berry CC, et al. Discriminating between normal and glaucomatous eyes using the Heidelberg Retina Tomograph, GDx Nerve Fiber Analyzer, and Optical Coherence Tomograph. Arch Ophthalmol. 2001 ; 119 : 985-93.
[33] Zeyen TG, Caprioli J. Progression of disc and field damage in early glaucoma. Arch Ophthalmol. 1993 ; 111 : 62-5.
[34] Zhang X, Bregman CJ, Raza AS, et al. Deriving visual field loss based upon OCT on inner retinal thicknesses of the macula. Biomed Opt Express. 2011 ; 2 : 1734-42.
- Chapitre 10
Caractéristiques cliniques du GPAO- I - Biomicroscopie du segment antérieur
- II - Gonioscopie
- III - Imagerie de l’angle iridocornéen
- IV - Pression intra-oculaire dans le GPAO
- V - Facteurs de risque non pressionnels
- VI - Atteinte structurale de la papille et des cellules ganglionnaires
- VII - Atteinte fonctionnelle
- VIII - Relations entre les atteintes structurale et fonctionnelle
- Introduction
- Matériels et méthodes
- Résultats
- Discussion
- Conclusion
- Pour en savoir plus
- Bibliographie

