J.-L. Bourges, G. Renard
Le phénomène de l’accommodation n’est pratiquement pas évoqué dans la littérature jusqu’au xviie siècle. Jusqu’à cette époque, le mécanisme de la vision n’était pas correctement compris et on a longtemps cru que c’était l’œil qui projetait l’image et non pas l’image qui pénétrait dans l’œil. De plus, la durée de vie moyenne ne dépassait guère quarante-cinq ans, ce qui ne laissait pas le temps aux humains d’atteindre l’âge de la presbytie. Pour ceux qui dépassaient cet âge, le besoin de vision de près était moins important qu’il ne l’est de nos jours. Enfin, l’usage de la loupe était courant depuis l’Antiquité, les joailliers ayant su très tôt tailler le verre et les pierres transparentes selon une forme convexe.
La première mention claire du phénomène de l’accommodation est apportée en 1604 par Kepler [35], qui affirme que la vision est le fait de la rétine et non du cristallin comme on l’imaginait à l’époque. Dans un second ouvrage de 1611 [36], il évoque un déplacement du cristallin pour expliquer la mise au point de près, ce qui est la première affirmation du rôle du cristallin.
Il faut attendre 1637 pour que René Descartes évoque une modification de forme du cristallin dans le phénomène de l’accommodation [16]. Il est, dès cette époque, le fondateur de l’optique moderne dans la mesure où il conçoit un support physique à la lumière (qui deviendra le photon) et explique ainsi son mode de propagation dans les milieux transparents, en particulier dans l’œil. C’est cette théorie fondée sur la courbure d’une lentille qui lui fait évoquer l’accommodation par augmentation de la courbure de la face antérieure ou de la face postérieure du cristallin. Il est le véritable inventeur d’une théorie qui n’a plus jamais été contestée par la suite.
Parallèlement, Christopher Scheiner, en 1619, montre qu’une image se forme sur la rétine mais il attribue l’accommodation au seul myosis [53].
Après ce bouillonnement intellectuel du début du xviie siècle, il n’y aura pas d’avancée majeure jusqu’au milieu du xixe siècle. De nombreux auteurs expriment des théories plus ou moins étayées sur l’accommodation mais sans convaincre leurs contemporains. Citons Haller en 1763 sur le rôle de la contraction de la pupille, Porterfield en 1759 sur le rôle du déplacement du cristallin, Sturm et Boerhaave en 1694 et 1708 sur le rôle des muscles extraoculaires, Home en 1795 sur le rôle éventuel d’une modification de courbure de la cornée. Tous ces auteurs sont des physiciens ou des physiologistes qui ne cherchent pas systématiquement à relier les théories de la propagation de la lumière aux pathologies oculaires.
En 1858, Franciscus Cornelis Donders a été le premier médecin à publier sur l’optique de l’œil [18] et à identifier clairement la myopie, l’hypermétropie et la presbytie. Travaillant à Utrecht, il fonde ce qu’on considère comme le premier service de médecine consacré à l’ophtalmologie. Pour l’accommodation, Donders n’a pas été retenu comme un véritable inventeur car il attribue à la pression de l’iris (myosis) et à celle du vitré le bombement de la partie du cristallin située en face de la pupille.
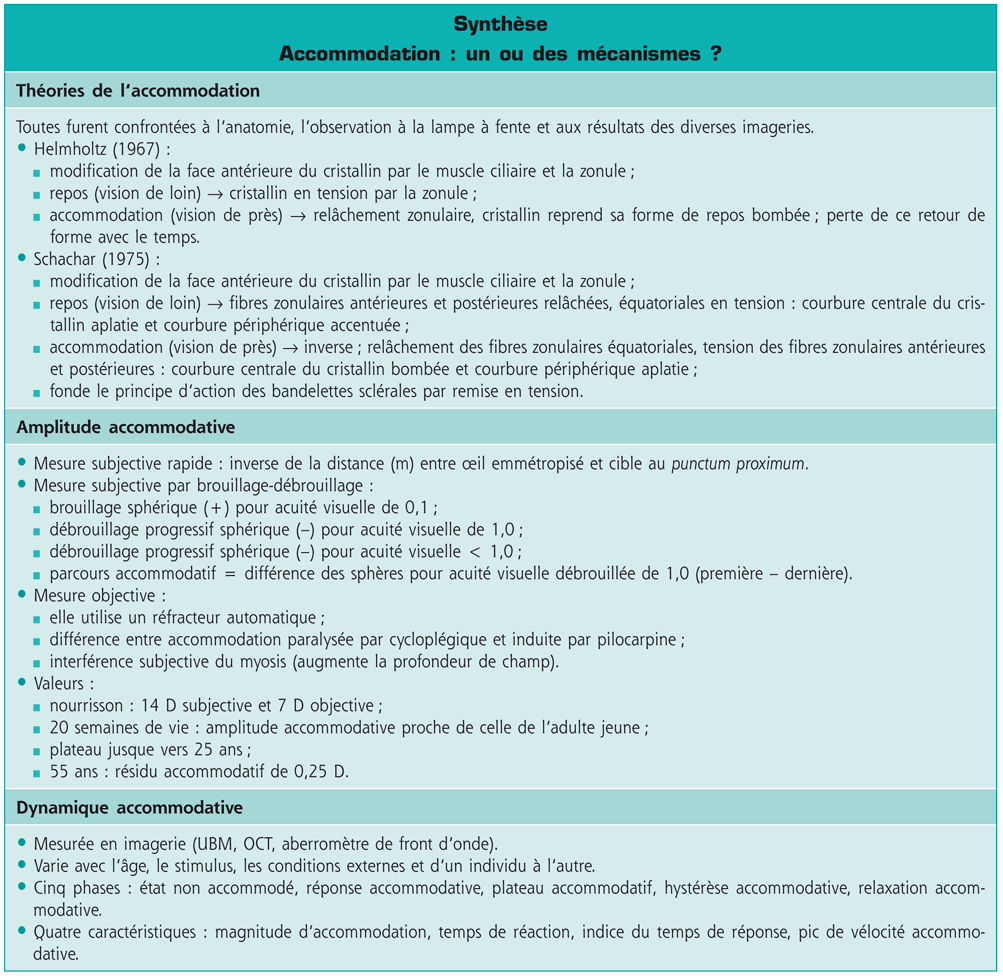
C’est paradoxalement le nom d’Hermann Ludwig von Helmholtz qui reste attaché à la théorie moderne de l’accommodation. Ce scientifique, physiologiste et acousticien né le 31 août 1821 à Potsdam et décédé à Berlin en 1894, a publié surtout sur la physiologie de la musique, sur la physique et la chimie. Ses travaux sur l’optique se résument à l’invention d’un ophtalmoscope pour l’observation de la rétine et à un traité d’optique physiologique qui connaîtra plusieurs éditions et sera traduit en français en 1867 [26]. Cette traduction, validée et complétée par Helmholtz lui-même, est la référence idéale pour juger de la pertinence de l’attachement de la communauté scientifique aux théories qui y sont exposées. Dans cet ouvrage de plus de mille pages, l’accommodation n’en occupe que trente (pp. 142 à 172) mais l’anatomie des organes en cause est exposée dans les chapitres précédents. Helmholtz démontre la modification de la face antérieure du cristallin en observant la réflexion spéculaire (« image catoptrique » dans le texte) sur le cristallin. Il note l’absence de modification de la face postérieure du cristallin. Il relie de façon certaine la modification de courbure de la face antérieure du cristallin à l’action du muscle ciliaire par l’intermédiaire de la zonule. Il pose surtout comme postulat que le cristallin à l’état de repos accommodatif (vision de loin) est mis sous tension par la zonule et que c’est le relâchement de cette tension qui laisse le cristallin reprendre une forme plus bombée qui est sa forme de repos. Cette théorie est effectivement très novatrice dans le contexte de l’époque, même si d’autres auteurs (cités par Helmholtz dans son texte) l’avaient évoquée auparavant. Elle permet d’expliquer la presbytie par une perte du pouvoir du cristallin de revenir à sa position de repos du fait du durcissement des fibres.
Bien qu’elle n’explique pas tout le mécanisme de l’accommodation, en particulier le phénomène de la désaccommodation, la théorie de Helmholtz va rester utilisée par tous les auteurs jusqu’à nos jours.
Les deux principaux contestateurs de cette théorie seront Marius Tscherning et Ronald Schachar.
Marius Hans Erik Tscherning est né au Danemark mais travailla longtemps à Paris à la Sorbonne et se lia à Émile Javal avec lequel il produira de nombreux travaux [58]. Il réfuta la théorie de l’avancement du cristallin au cours de l’accommodation en montrant qu’il faudrait l’avancer de 10 mm pour obtenir une vision de près. Il décrivit un « Ophthalmophacometer » pour mesurer les changements des courbures antérieure et postérieure du cristallin. Il conclut que la tension zonulaire sous l’effet de la contraction du muscle ciliaire comprime activement le cristallin contre le vitré et entraîne un bombement de sa courbure antérieure [59]. Bien que sa théorie de compression directe du cristallin par le muscle ciliaire n’ait reçu aucun soutien ultérieur, son apport sur la modification de la courbure antérieure conforte indirectement la théorie de Helmholtz.
Ronald Schachar est américain et s’intéressa dès 1975 au cristallin. Il inventa un nouveau type d’implant cristallinien en 1979 puis publia sur la kératotomie radiaire. Il fit sensation en 1992 en présentant un premier article sur la technique de l’expansion sclérale [45] avec des résultats étonnants pour le traitement de la presbytie. Sa théorie de l’accommodation repose sur un fonctionnement différent des fibres zonulaires antérieures, équatoriales et postérieures. Pour Schachar, dans l’état non accommodé, les fibres zonulaires équatoriales sont sous tension maximale tandis que les fibres zonulaires antérieures et postérieures sont relâchées. Sous l’effet de la contraction du muscle ciliaire, les fibres équatoriales sont relâchées, alors que les fibres antérieures et postérieures sont mises sous tension, ce qui provoque un aplatissement de la courbure périphérique du cristallin et un bombement de la courbure centrale. Plus le cristallin vieillit, plus son diamètre augmente, ce qui rend inefficace la mise sous tension des fibres antérieures et postérieures de la zonule et explique ainsi la presbytie. Pour supprimer ou retarder la presbytie, il suffit de « retendre » les fibres zonulaires par un système d’expansion sclérale. La théorie de Schachar a été contestée par de nombreux auteurs et, surtout, se heurte aux mauvais résultats de sa technique chirurgicale, aucun autre auteur que lui ne pouvant reproduire des résultats significatifs (cf. chapitre 11 « Techniques d’expansion sclérale »). Schachar insista pourtant sur le bien-fondé de sa théorie [46-50] avec un dernier article en 2008 [51] étudiant par OCT le fonctionnement du cristallin. Même si sa théorie n’est pas acceptée par la plupart des auteurs, il a eu le mérite de contester la théorie de Helmholtz et d’obliger les anatomistes et les physiologistes à revoir le fonctionnement du corps ciliaire et du cristallin et à préciser le mécanisme de l’accommodation et de la presbytie.
Si le phénomène de l’accommodation est aussi peu connu et les théories aussi contestées, c’est que les bases anatomiques manquent pour expliquer un mécanisme aussi complexe. Il faut reconnaître que l’étude de l’anatomie du corps ciliaire et du cristallin n’était possible qu’en ouvrant le globe oculaire, ce qui modifiait considérablement les structures internes, et que les fibres zonulaires n’étaient pas visibles avant l’arrivée des premiers microscopes. Que penser alors des théories fondées sur un cristallin déshabillé de sa capsule dont les propriétés physiques sont bien loin de ce qui se passe in vivo.
La première publication sur l’anatomie et la physiologie du muscle ciliaire est à mettre au bénéfice de Jeffries en 1866 [31]. C’est la première description du muscle ciliaire, encore très insuffisante pour expliquer son action. Dans son traité publié en France en 1867 [26], Helmholtz donnait déjà une description assez précise des rapports entre le corps ciliaire, la zonule et le cristallin.
Les anatomistes du début du xxe siècle sont plus précis. Dans l’ouvrage de A. Vogt de 1931 [60], la description faite à partir des observations à la lampe à fente rapproche l’anatomie de la réalité chez le vivant. Vogt décrit la présence d’environ soixante-dix procès ciliaires, l’insertion des fibres zonulaires sur le cristallin en trois zones principales (antérieure, équatoriale et postérieure) avec un point de contact sur la capsule de 0,5 mm à 2 mm en avant et de 0,2 à 2 mm en arrière. Il précise qu’aucune fibre zonulaire ne part des procès ciliaires et que toutes les fibres partent de la pars plana ou de l’ora serrata. Il note cependant que certaines fibres partent de l’ora serrata mais semblent s’attacher aux procès ciliaires.
Fincham [22] confirme qu’un cristallin jeune, isolé de sa zonule, prend une forme bombée pratiquement sphérique, ce qui augmente la puissance réfractive et correspond à l’état d’accommodation. Il indique également qu’un cristallin isolé et débarrassé de sa capsule revient à une forme plus plate.
Un bon résumé des connaissances anatomiques peut être trouvé dans le livre Biophtalmologie publié en 1992 [56].
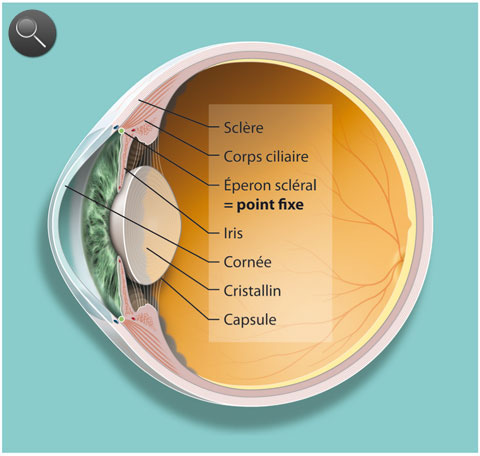
Détaillons les trois acteurs principaux dans le phénomène de l’accommodation, le cristallin, la zonule et le muscle ciliaire (fig. 1-1 ; animation 1.1), avant d’envisager leurs rapports respectifs et, surtout, la dynamique de leurs mouvements.
Les principales constantes anatomiques du cristallin sont parfaitement déterminées :
– le cristallin à un poids de 93 mg à l’âge de trois mois et de 258 mg à l’âge de quatre-vingt-dix ans ;
– son volume est de 93 mm3 à trois mois et de 293 mm3 à quatre-vingt-dix ans ;
– ses dimensions sont un diamètre vertical de 9 à 10 mm et antéropostérieur de 4 mm ;
– son rayon de courbure antérieur est de 16 mm à huit ans et de 8 mm à quatre-vingt-deux ans, alors que le rayon de courbure postérieur ne change pas à 6 mm ;
– l’indice de réfraction du cristallin est de 1,420.
La capsule du cristallin forme une enveloppe transparente et élastique [14] (fig. 1-2a ; animation 1.2). On considère qu’elle est la membrane basale des cellules épithéliales cristalliniennes. La capsule est plus épaisse en avant qu’en arrière et également plus épaisse à l’équateur au niveau de l’insertion des fibres zonulaires [9]. La capsule s’épaissit avec l’âge et son module d’élasticité décroît. À l’intérieur de la capsule se trouve la couche des cellules épithéliales, qui recouvre toute la face antérieure du cristallin sur une seule couche et qui se développe à l’équateur en plusieurs couches. Les cellules épithéliales semblent ne jouer aucun rôle dans le phénomène de l’accommodation.
Plus profondément se trouvent les cellules corticales (fig. 1-2a), avec leur forme allongée caractéristique et la présence de nombreuses interdigitations qui les lient entre elles. Ces cellules corticales s’accumulent avec l’âge, les plus anciennes étant les plus centrales. Avec le temps, ces cellules perdent leurs organelles et le cytoplasme devient amorphe. Ces cellules contiennent de l’actine comme on en trouve dans les muscles striés. Cette combinaison d’une certaine élasticité du cytoplasme et d’une possibilité de déplacement des fibres les unes par rapport aux autres fait que le cortex du cristallin possède un module d’élasticité propre, indépendant de celui de la capsule (fig. 1-2b,c et fig. 1-3).
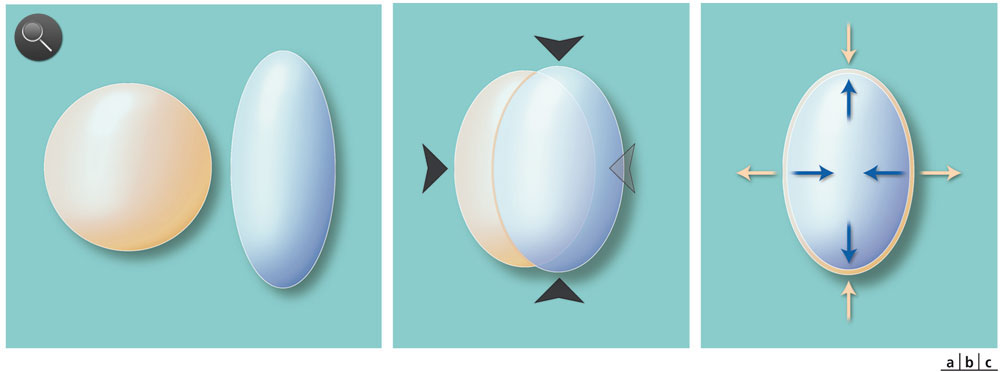
Fig. 1-2 Illustration des contraintes cristalliniennes intrinsèques.
Le cristallin est principalement constitué de deux structures (a), la capsule (à gauche) et le cortex (à droite). La capsule isolée du cortex tend à prendre une forme sphérique comme toute enveloppe contenant un liquide et plongée dans un liquide. Le cortex isolé, au contraire, tend à s’allonger du fait de sa structure faite de fibres parallèles. La réunion de ces deux structures (b) s’accompagne de contraintes mécaniques (têtes de flèche) que permettent l’élasticité de la capsule et la plasticité du cortex avant la presbytie. Ces contraintes s’équilibrent (c) pour donner sa forme à un cristallin isolé. Elles constituent une réserve d’énergie capsulaire (flèches jaunes) et corticale (flèches bleues) qui permet les modifications du cristallin au cours de l’accommodation et de la désaccommodation.
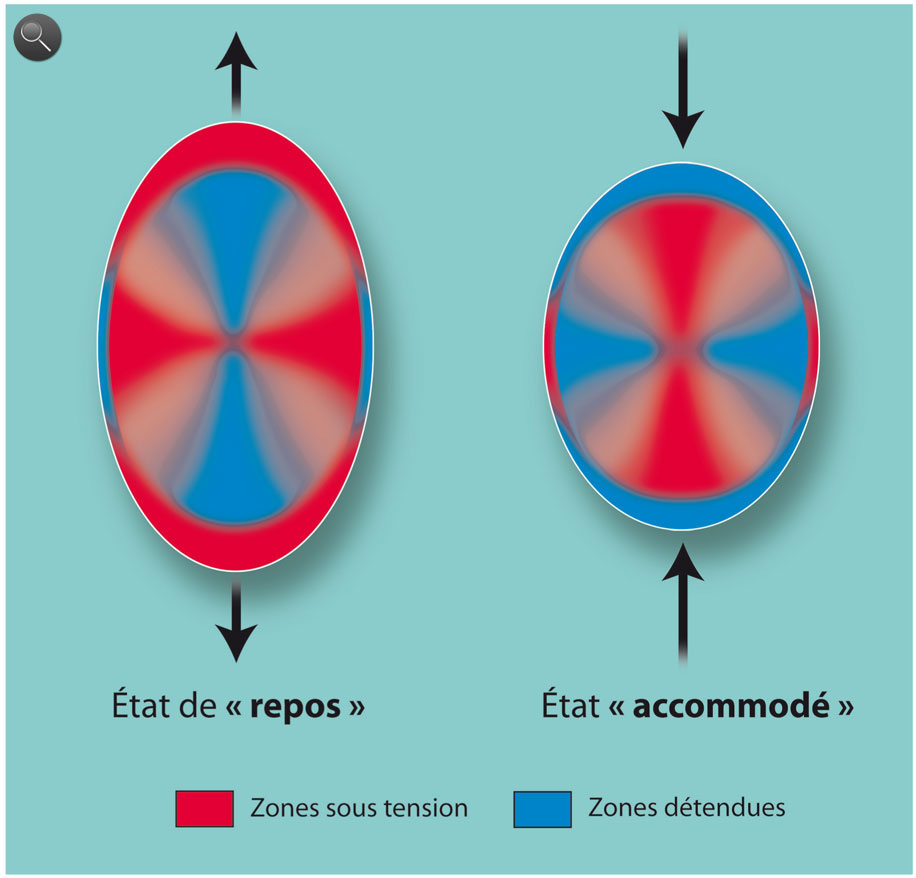
Fig. 1-3 Illustration des contraintes zonulaires appliquées au cristallin.
Les plages rouges illustrent les zones sous tension et les plages bleues les zones détendues. À gauche, le cristallin est soumis à la traction des fibres zonulaires. Il est en position dite de « repos » qui correspond à la focalisation de loin. Sa structure n’en est pas moins soumise à des contraintes qui touchent surtout la capsule à l’équateur et le cortex aux pôles. À droite, les fibres zonulaires sont détendues. Le cristallin atteint un état « accommodé » qui correspond à la focalisation de près. Les contraintes s’inversent et touchent maintenant la capsule aux pôles et le cortex à l’équateur. Dans les deux cas, l’élasticité des structures autorise ces modifications et constitue une réserve d’énergie qui permet, à moindre frais énergétiques, d’évoluer rapidement entre ces deux états. Le cristallin, avant la presbytie, est toujours prêt à répondre aux sollicitations du muscle ciliaire par l’intermédiaire de la zonule.
La zonule est constituée de microfibrilles de base de 10 nm de diamètre avec une striation périodique tous les 38 nm. Elles sont groupées en microfibres de 0,35 µm à 1 µm de diamètre qui se regroupent elles-mêmes en fibres de 60 µm. Elles sont constituées majoritairement d’une protéine non collagénique, la fibrilline, qui présente un taux élevé de glycosylation et une forte proportion de cystine. Ces fibres sont insensibles aux collagénases mais dissoutes par l’α-chymotrypsine comme les autres tissus élastiques. Elles sont semblables aux fibrilles associées à l’élastine dans la paroi des vaisseaux sanguins. Leur module d’élasticité est également celui de l’élastine (3,5 · 105 N/m2). Elles supportent une force d’aspiration jusqu’à 200 mm Hg et une élongation jusqu’à 4 mm sans rupture. Une bonne description peut être trouvée dans l’article de Ludwig [38]. La zonule a été particulièrement étudiée par Rohen [43] en microscopie électronique à balayage. Il décrit trois catégories de fibres zonulaires, en allant du cristallin à la pars plana (fig. 1-4 ; animation 1.3). La première catégorie inclut toutes les fibres qui partent du cristallin (antérieures, équatoriales et postérieures) jusqu’à leur passage dans les vallées de la pars plicata du corps ciliaire (fig. 1-4a,b). À ce niveau, elles sont attachées au corps ciliaire par une seconde catégorie de fibres qui forment un plexus empêchant les fibres d’aller directement du cristallin à la pars plana (fig. 1-4b,c). Ce plexus fonctionne comme le tendon de réflexion du muscle grand oblique : il lie directement les fibres zonulaires au corps ciliaire et leur impose de suivre les mouvements du muscle ciliaire. La troisième catégorie de fibres est en fait le prolongement de la première catégorie en arrière du plexus des vallées ciliaires (fig. 1-4c). Les fibres recouvrent la pars plana et se fixent à la membrane limitante des cellules de l’épithélium ciliaire non pigmenté. Il n’y a pas de rapport direct entre les fibrilles de la zonule et les cellules de l’épithélium. Au total, la zonule est élastique, avec des fibres qui sont aussi longues en arrière qu’en avant des procès ciliaires et un point d’ancrage dans le fond des vallées ciliaires. Tout mouvement du corps ciliaire agit directement sur ce point d’ancrage. Tout relâchement de la partie antérieure des fibres s’accompagne obligatoirement d’une mise en tension de la partie postérieure et vice versa. La zonule agit donc comme un couple de muscles opposés dont l’un se relâche quand l’autre se contracte. Cette dualité de fonction explique le rôle de la zonule dans l’accommodation, qui est sous la dépendance de la contraction du muscle ciliaire, et la désaccommodation, qui est sous la dépendance de l’élasticité de la partie postérieure des fibres.
Au niveau du cristallin, les fibres zonulaires antérieures, équatoriales et postérieures divergent et forment un angle antéropostérieur d’environ 30°. De ce fait, les fibres antérieures sont pratiquement dans le prolongement des vallées ciliaires, alors que les fibres postérieures forment un angle plus important, les fibres équatoriales étant dans une situation intermédiaire. Le mouvement en avant et en dedans du muscle ciliaire sera donc plus efficace sur les fibres antérieures puisque l’angle d’attaque est plus faible.
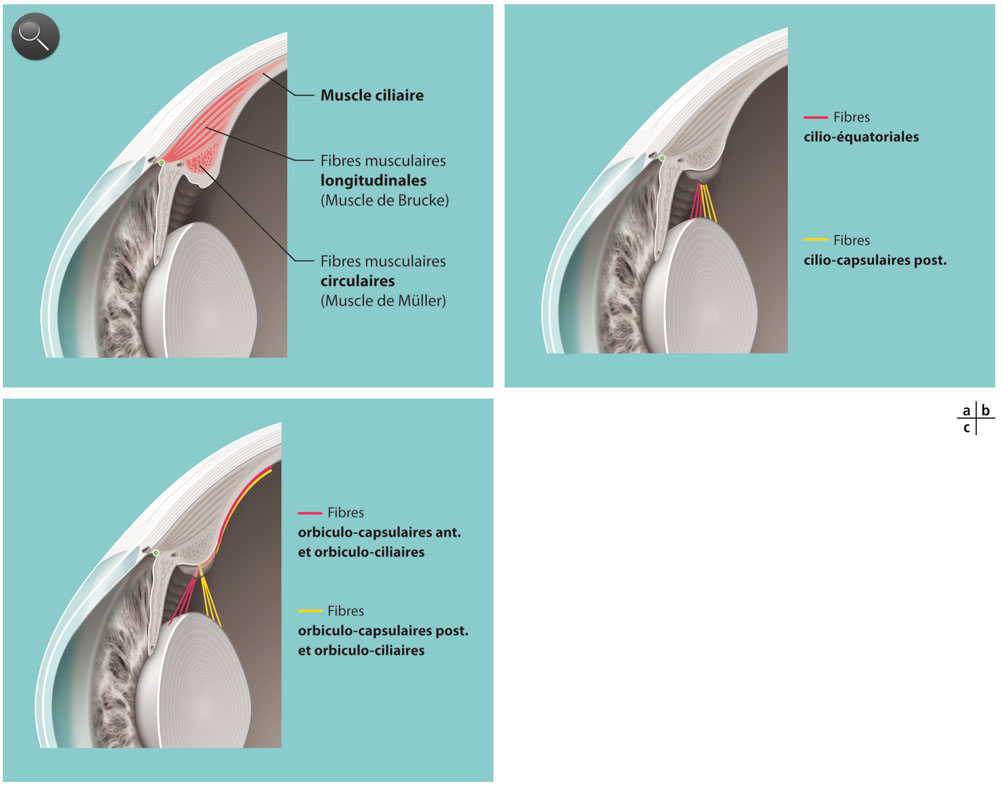
Fig. 1-4 Anatomie fonctionnelle de la zonule.
Les fibres zonulaires viennent se fixer sur le corps ciliaire pour transmettre au cristallin les mouvements du muscle ciliaire (a). Elles comportent deux groupes principaux. Les fibres cilio-équatoriales et cilio-capsulaires postérieures (b) vont directement vers l’équateur du cristallin. Les fibres orbiculo-capsulaires antérieures et postérieures (c) se réfléchissent au fond des cryptes ciliaires et se prolongent par des fibres orbiculo-ciliaires qui s’étendent sur toute la pars plana. Ces fibres postérieures constituent une zone élastique qui emmagasine l’énergie développée par le muscle ciliaire lors de l’accommodation et la restitue lors de la désaccommodation. Les fibres orbiculo-capsulaires antérieures ont le même axe que leur prolongement postérieur alors que les fibres orbiculo-capsulaires postérieures forment un angle notable avec leur prolongement postérieur (c). Cette différence d’incidence explique que la partie antérieure de la capsule cristallinienne soit plus sollicitée par le phénomène d’accommodation que la partie postérieure de la capsule.
Le muscle ciliaire est un muscle lisse qui se distingue des autres muscles lisses de l’organisme humain par le fait qu’on peut lui décrire deux tendons, comme on le fait pour les muscles striés [39] (fig. 1-4a ; animation 1.4). Le tendon antérieur s’insère sur l’éperon scléral et accessoirement sur le trabéculum et la cornée ; le tendon postérieur s’insère sur la membrane de Bruch de la pars plana et le réseau élastique de la choroïde. On lui décrit classiquement trois portions, longitudinale, réticulée et circulaire, mais cette division est artificielle car il ne s’agit pas de trois muscles séparés mais d’un seul réseau de fibres musculaires organisées selon des angles différents. Sur le plan ultrastructural, les cellules du muscle ciliaire ressemblent à celles de la paroi des artères coronaires avec une structure cylindrique mais sans jonctions communicantes (gap-junctions). Chaque cellule possède des terminaisons nerveuses, essentiellement cholinergiques. Ces terminaisons nerveuses sont particulièrement abondantes dans la portion longitudinale antérieure. Cette portion comporte également des myofibrilles arrangées de façon parallèle qui remplissent l’essentiel de l’espace cytoplasmique et ne laissent que peu de place pour les mitochondries. À l’inverse, les cellules de la portion circulaire ont moins de myofibrilles et beaucoup de mitochondries. Elles ont aussi des terminaisons nerveuses qui ne sont pas de type cholinergique et qui pourraient être liées à des cellules ganglionnaires nitrergiques intrinsèques. Au total, le muscle ciliaire se présente comme l’association d’un muscle lisse longitudinal, élastique, et d’un muscle circulaire plus proche de la structure d’un muscle strié.
Des deux tendons du muscle ciliaire, seul le tendon antérieur peut être considéré comme attaché à un point fixe, dans la mesure où l’éperon scléral fait partie intégrante de la coque oculaire et n’a pas la possibilité de se déplacer. C’est donc à partir de ce point fixe qu’on devra raisonner pour expliquer les mouvements du muscle ciliaire et leur transmission à la zonule et au cristallin. Le tendon postérieur est élastique du fait de son attache sur des structures potentiellement mobiles au niveau de la choroïde. Les deux tendons possèdent des filaments de collagène. Le tendon antérieur a une ultrastructure proche de celle du trabéculum. Les fibres centrales contiennent peu d’élastine et sont entourées d’une enveloppe de collagène réticulé — structure très proche de celle d’un tendon de muscle strié. À l’inverse, le tendon postérieur est formé de bandes homogènes de tissu élastique qui ne semblent pas avoir un rôle mécanique actif mais seulement un rôle passif de recul du muscle ciliaire dans le relâchement de l’accommodation.
À l’état relâché, la portion circulaire ne se distingue pas du reste du muscle. À l’état de contraction, la partie circulaire apparaît avec un mouvement de l’apex du muscle vers l’intérieur de l’œil et vers l’avant. C’est donc bien l’éperon scléral qui constitue le point fixe, tandis que la partie postérieure de la portion longitudinale se trouve mise sous tension et participera passivement à la relaxation en ramenant l’apex du muscle vers l’arrière et en dehors.
Elle est parasympathique, par le même circuit nerveux que la commande de la constriction pupillaire. Le noyau d’Edinger-Westphal [21, 61] est situé dans le plancher du troisième ventricule. Selon les auteurs, on l’associe avec le noyau du III ou le noyau du V. Les fibres suivent le trajet du III jusqu’au ganglion ophtalmique en passant par le nerf de l’oblique inférieur. Elles entrent dans le globe oculaire par les nerfs ciliaires courts pour rejoindre le muscle ciliaire et l’iris.
Les trois acteurs en cause étant détaillés, comment interagissent-ils pour provoquer l’accommodation et la désaccommodation ?
À l’état non accommodé, le muscle ciliaire n’est pas contracté. Il tend la zonule qui déforme le cristallin en étirant sa face antérieure et donc en réduisant sa puissance optique. Au cours de l’accommodation, le rayon de courbure antérieur passe de 10 mm à 6 mm et le rayon de courbure postérieur de 6 mm à 5,5 mm. La capsule du cristallin ainsi mise sous tension est prête à reprendre une forme plus bombée du fait de son élasticité (fig. 1-5a ; animation 1.5 et 1.6). À l’intérieur du cristallin, les fibres cristalliniennes sont comprimées par cette déformation et constituent une « réserve d’énergie » pour faciliter le retour à une forme sphérique. On peut assimiler ce qui se passe pour le cristallin à ce qui se passe pour un ballon de baudruche plongé dans un liquide et que l’on étire jusqu’à lui donner une forme elliptique. Tout relâchement de la force d’étirement se traduit par un retour du ballon à une forme sphérique du fait des tensions appliquées à sa paroi et de la pression exercée sur l’air qu’il contient. L’état dit « de repos » pour le système muscle ciliaire-zonule-cristallin n’est donc un état d’équilibre que pour le couple muscle ciliaire-zonule et pas pour le cristallin.
Sous l’effet de la commande parasympathique, le muscle ciliaire se contracte. À partir du point fixe constitué par l’éperon scléral, les fibres longitudinales attirent le corps ciliaire vers l’avant et les fibres circulaires l’attirent en dedans en réduisant le diamètre du sphincter que constitue ce muscle. Ce double mouvement a deux conséquences :
– la fermeture du sphincter relâche la partie de la zonule située entre les vallées des procès ciliaires et le cristallin ;
– les fibres longitudinales postérieures du muscle ciliaire et la partie postérieure des fibres zonulaires sont mises sous tension, constituant une réserve d’énergie pour un retour passif à un état de repos.
Le mouvement du muscle ciliaire induit un relâchement des fibres zonulaires portant surtout sur les fibres s’attachant à la partie antérieure du cristallin. Sous l’effet de l’élasticité de la capsule cristallinienne et de la pression accumulée par les fibres du cristallin, la face antérieure tend à se rapprocher d’une forme sphérique et donc augmenter son pouvoir réfractif (fig. 1-5b). Les fibres zonulaires équatoriales accompagnent ce mouvement, tandis que les fibres postérieures sont moins relâchées du fait d’un angle d’attaque plus important. La face postérieure du cristallin joue donc un rôle minime dans l’accommodation.
Lorsque la commande parasympathique cesse, le muscle ciliaire retourne à son état de repos avec un mouvement de son apex en arrière et en dehors. Ce mouvement est la conséquence de l’énergie élastique accumulée par la partie postérieure des fibres longitudinales du muscle et de la partie postérieure des fibres zonulaires. Ce mouvement a donc une composante passive majeure. Le rôle des fibres musculaires ciliaires réticulaires reste encore mal exploré dans ce processus désaccommodatif. Du fait du déplacement en arrière et en dedans du muscle ciliaire, les fibres zonulaires se tendent et infligent au cristallin une déformation qui aplatit sa face antérieure et réduit son pouvoir réfractif. Cette déformation active met en tension la capsule cristallinienne et comprime les fibres du cristallin, préparant ainsi la possibilité d’un nouveau mouvement d’accommodation.
Cette alternance de mouvements actifs et passifs et de jeu de l’élasticité des différents composants du système est un moyen de conservation de l’énergie permettant à l’œil d’assurer sa fonction d’accommodation en permanence sans épuisement du système musculaire (animation 1.7).
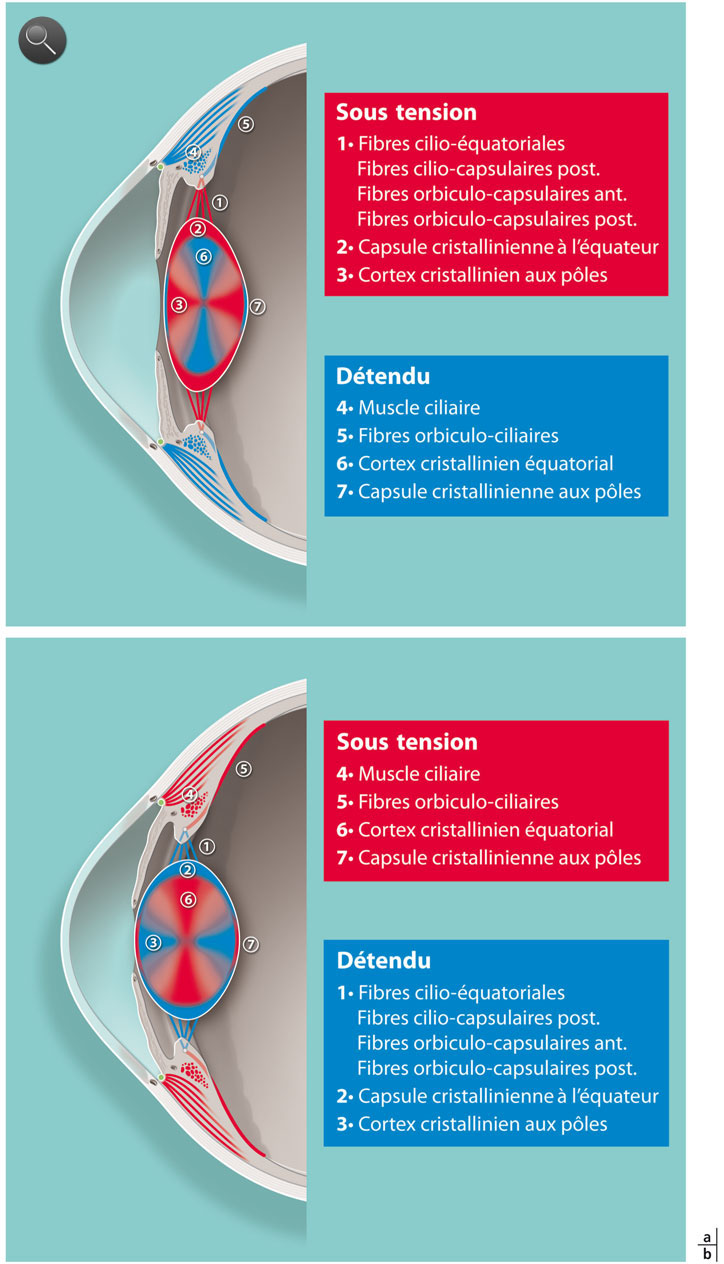
Fig. 1-5 Avant la presbytie.
a. À l’état de repos (non accommodé) les fibres zonulaires (1) sont sous tension et imposent au cristallin une mise sous tension de la capsule à l’équateur (2) et du cortex aux pôles (3) alors que le cortex est détendu à l’équateur (6) ainsi que la capsule aux pôles (7). Le muscle ciliaire (4) n’est pas contracté et les fibres orbiculo-ciliaires (5) sont également détendues. b. À l’état accommodé, le muscle ciliaire (4) se contracte, ce qui détend les fibres zonulaires (1). Au niveau du cristallin, les tensions sur la capsule (2, 7) s’inversent de même que celles sur le cortex (3, 6). Le cristallin modifie sa courbure antérieure et avance en direction de la chambre antérieure. Les fibres orbiculo-ciliaires (5) sont mises sous tension et constituent une réserve d’énergie qui permet le retour à l’état non accommodé.
L’amplitude accommodative est assimilable au parcours accommodatif (ou course accommodative) auquel s’additionne le tonus végétatif accommodatif. Il correspond à la portion d’espace objet (trajet optique compris entre l’objet « à voir » situé au punctum remotum et le système réfractif oculaire) qui peut être vue net par un œil. Pour que cette portion d’espace objet ne soit pas nulle et qu’il y ait un parcours accommodatif, la puissance réfractive de l’œil doit changer. C’est cette différence réfractive qui estime le parcours accommodatif. L’unité est donc la dioptrie (D). Le punctum remotum étant différent selon l’amétropie, les yeux emmétropes, myopes ou hypermétropes n’ont donc pas le même parcours accommodatif naturel. Enfin, la mesure de l’amplitude accommodative peut être subjective ou objective (animations 1.8 et 1.9).
La mesure subjective de l’accommodation s’attache surtout à quantifier le parcours accommodatif. Elle fait appel à la perception visuelle et à la formulation de celle-ci par le sujet examiné. Bien qu’imprécise et variable, elle a le mérite de renseigner sur la part utile de l’accommodation du sujet examiné. Elle est influencée par les nombreux facteurs qui modulent l’accommodation proprement dite[12, 13]. Le facteur associé le plus confondant est la profondeur de champ, qui est naturellement modulée par le diamètre pupillaire et la quantité d’aberrations sphériques. On recense par ailleurs d’autres facteurs connus pour influencer la mesure subjective de l’amplitude accommodative [30]. Parmi eux, on citera les autres aberrations optiques de bas et de haut degré, l’intensité et la nature ondulatoire de l’environnement lumineux[37, 44], la taille de la cible visuelle d’évaluation et son contraste [2], la stratégie oculomotrice pour acquérir l’information visuelle, l’entraînement et l’apprentissage cortical des tests. Enfin, l’évaluation subjective mesure surtout le parcours accommodatif et ignore une partie variable du tonus accommodatif neurovégétatif. Ce dernier est, chez le sujet, fonction de son âge, de son état général physique et psychologique ainsi que de son imprégnation pharmacologique locale ou générale [2, 3, 40]. Pour minimiser l’influence de ces facteurs au cours de la mesure, il convient donc de se placer dans un environnement connu, adapté et stable.
La manière la plus rapide de mesurer l’amplitude accommodative est aussi la plus approximative. Elle consiste à déterminer la distance œil-optotype (en mètre) du punctum proximum sur le sujet emmétropisé (par exemple, par « push-down test » ou « push-up test »). On convertit ensuite cette distance en dioptries. La dioptrie étant l’unité de proximité, c’est l’inverse d’une distance (cf. encadré). La correction réfractive doit rester constante pendant la manœuvre. En revanche, la taille des optotypes (T) doit en principe évoluer au besoin en fonction de la distance (d) pour pouvoir évaluer un angle minimum de résolution (α) constant (cf. encadré) et, de fait, garder la même taille de foyer image (image rétinienne). C’est le principe de base de l’échelle de Parinaud utilisée en vision de près [5].
Il est aussi possible d’utiliser le principe du conoïde de Sturm des focales cylindriques. Avec une correction optique totale au punctum proximum, on présente deux lignes droites perpendiculaires. On place un cylindre croisé de Jackson, typiquement de ± 0,50 D, dans l’axe/contre-axe des droites. Au niveau du cercle de moindre diffusion du cylindre, l’image n’est pas déformée. Le cercle de moindre diffusion qui correspond à l’image est focalisé au niveau de la rétine. Les deux lignes sont vues nettes. On additionne ensuite progressivement une correction sphérique pour pratiquer une défocalisation. Tant que l’œil peut accommoder, la focale de toute l’image (les deux lignes perpendiculaires) reste nette. Si l’accommodation est trop importante ou, au contraire, si elle est dépassée, l’une des lignes sera vue nette et l’autre floue. La puissance sphérique maximum permettant de garder une vision nette des deux lignes correspond alors approximativement au parcours accommodatif.
Une autre méthode proche fait appel conjointement à la règle de Swaine et la méthode du brouillage-débrouillage. La règle de Swaine (cf. encadré) stipule qu’un œil emmétrope, non accommodé (accommodation relâchée), possède une acuité visuelle décimale qui dépend directement du nombre de dioptries ajoutées à sa puissance naturelle.
Pour effectuer la mesure, on effectue un brouillage afin de minimiser le tonus accommodatif. On ajoute à la réfraction naturelle de l’œil examiné la correction optique totale manifeste, c’est-à-dire la puissance dioptrique emmétropisante utile. On additionne ensuite la puissance réfractive nécessaire à brouiller l’acuité visuelle, jusqu’à obtenir une acuité visuelle maximum de 1/10. Selon la règle de Swaine, il faut théoriquement ajouter à un œil emmétrope + 2,50 D pour qu’il voie 1/10, car 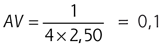 . Ensuite, on ajoute par paliers progressifs de + 0,25 D, la puissance réfractive sphérique minimum nécessaire pour obtenir une acuité visuelle égale à 10/10. C’est le débrouillage. La puissance réfractive totale ajoutée à ce moment là (δ0), est équivalente à celle de l’entrée dans le parcours accommodatif. Puis, on continue d’augmenter la puissance de réfraction sphérique par paliers de + 0,25 D. À une puissance δ1, l’acuité visuelle du sujet chute et n’est plus de 10/10. La puissance immédiatement précédente à δ1 est celle de sortie du parcours accommodatif ; elle est appelée δ0 : on retient donc que δ0 = δ1 – 0,25 D. L’amplitude accommodative subjective correspond à la différence entre la puissance d’entrée et celle de sortie du parcours accommodatif. Le parcours accommodatif PA est donc PA = δ0 – δ0. Il varie naturellement en fonction de l’âge[17, 20, 25].
. Ensuite, on ajoute par paliers progressifs de + 0,25 D, la puissance réfractive sphérique minimum nécessaire pour obtenir une acuité visuelle égale à 10/10. C’est le débrouillage. La puissance réfractive totale ajoutée à ce moment là (δ0), est équivalente à celle de l’entrée dans le parcours accommodatif. Puis, on continue d’augmenter la puissance de réfraction sphérique par paliers de + 0,25 D. À une puissance δ1, l’acuité visuelle du sujet chute et n’est plus de 10/10. La puissance immédiatement précédente à δ1 est celle de sortie du parcours accommodatif ; elle est appelée δ0 : on retient donc que δ0 = δ1 – 0,25 D. L’amplitude accommodative subjective correspond à la différence entre la puissance d’entrée et celle de sortie du parcours accommodatif. Le parcours accommodatif PA est donc PA = δ0 – δ0. Il varie naturellement en fonction de l’âge[17, 20, 25].
Il existe une variante semi-objective de mesure du parcours accommodatif, sans toutefois être objective. Elle consiste à défocaliser l’image vue par l’œil utilisé pour la lecture des optotypes, tandis qu’un réfractomètre évalue la différence de réfraction observée entre l’entrée et la sortie du parcours accommodatif sur l’œil controlatéral, par des mesures itératives. La validité de cette méthode a ses limites. Elle néglige la différence accommodative existant entre chaque œil, car elle extrapole le parcours accommodatif d’un œil sur l’autre. Par ailleurs, elle ne peut être pratiquée que chez un sujet capable d’isoacuité, sans anisoéiconie significative. Elle suppose enfin que le réfractomètre fonctionne sans utiliser de longueur d’onde lumineuse visible [32]. Le parcours accommodatif mis en évidence avec cette méthode semi-objective est en moyenne inférieur de 0,70 D à celui quantifié par les méthodes purement subjectives[10, 62].

La mesure est dite « objective » car elle fait appel à une mesure provenant d’un réfractomètre automatique et limite la participation accommodative volontaire de l’œil examiné. Elle tend à surestimer l’accommodation physiologique, qui permet en pratique au sujet de focaliser une cible présentée à distance variable (foyer objet) en permanence sur sa rétine (foyer image). Elle renseigne en effet sur la somme du tonus accommodatif basal et de l’effort accommodatif induit. L’objectivité de cette méthode n’est pas totale quand il est demandé au sujet de participer en accommodant. Elle consiste à mesurer la réfraction objective d’un œil accommodé au punctum proximum à l’aide d’un réfractomètre automatique
Pour se rapprocher de l’objectivité, il est possible de mimer pharmacologiquement l’accommodation en instillant de la pilocarpine dans l’œil examiné [1, 41]. Il faut alors garder en mémoire que la courbe de réactivité à la pilocarpine est variable d’un œil à un autre. Par ailleurs, l’induction d’un myosis serré et non physiologique augmente la profondeur de champ artificiellement [15]. On soustrait la réfraction d’un œil obtenue sous cycloplégie à sa réfraction accommodée sous pilocarpine. Les états d’accommodation artificielle doivent être stables, ce qui nécessite plusieurs mesures pour s’en assurer. Le résultat de la soustraction correspond à l’accommodation du sujet (parcours accommodatif et tonus accommodatif basal).
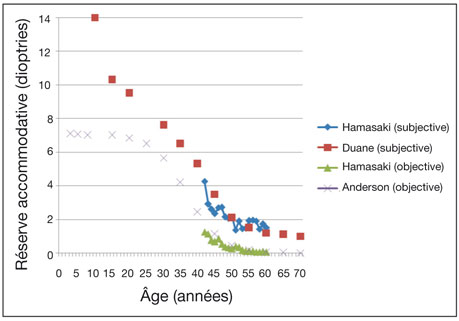
Les valeurs de l’accommodation varient selon la mesure et l’âge (fig. 1-6). Il semble que leur évolution réponde à une courbe sigmoïde où l’âge serait une donnée à pondération exponentielle [4]. À la naissance, un œil accommode : à l’aide de stimuli à fort contraste, on peut mesurer chez le nourrisson une accommodation semi-objective de plus de 14 D [20] et objective de plus de 7 D[4, 7, 8]. On estime qu’à partir de vingt semaines de vie, l’accommodation atteint une amplitude proche de celle d’un adulte jeune [11]. On observe ensuite un plateau jusque vers vingt-cinq ans, où la réserve accommodative reste supérieure à 7 D. Après, le pouvoir accommodatif décroît rapidement jusqu’à la quatrième décennie. Cette décroissance devient quasi linéaire jusque vers quarante-cinq ans. Enfin, la décroissance du potentiel accommodatif résiduel devient plus lente. Si ce résidu accommodatif est objectivement mesuré à moins de 0,25 D après l’âge de cinquante-cinq ans, une faculté d’adaptation à la vision de près n’en reste pas moins possible, comprise entre 0,50 D et 1,5 D [7, 8, 19, 25]. Le myosis sénile, par exemple, contribue à l’augmentation de la profondeur de champ, offrant un potentiel pseudo-accommodatif résiduel variable. De fait, l’œil possède une tolérance optique à la défocalisation proximale qui a pu être quantifiée subjectivement à plus de 1,50 D [25].
Il est possible d’illustrer la dynamique du processus accommodatif à l’aide de dispositifs d’imagerie oculaire. Pour cela, la biomicroscopie à ultrasons (UBM) [6, 33] et la tomographie en cohérence optique à haute résolution de segment antérieur (HR-OCT SA) [7, 8, 24, 42, 54, 55] sont particulièrement adaptées. Elles permettent de vérifier et d’illustrer la théorie de la dynamique accommodative (cf. supra), en observant les courbures lenticulaires et les modifications dynamiques du muscle ciliaire au cours des différentes phases accommodatives. L’aberrométrie de front d’onde objective les modifications de profondeur de champ qui s’ajoutent au processus accommodatif proprement dit [23]. Elles sont principalement le fait de la syncinésie pupillaire. De toutes les aberrations optiques constatées en marge de la défocalisation accommodative, l’augmentation des aberrations sphériques (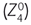 ) est la plus importante.
) est la plus importante.
Quel que soit le moyen utilisé, les mesures dynamiques réalisées restent hautement variables d’un individu à un autre, mais elles sont très reproductibles pour un même individu à un âge donné [52].
En utilisant l’OCT de segment antérieur sur cent quatre yeux normaux de sept à quatre-vingt-deux ans, Baikoff et al.[7, 8] ont quantifié les modifications dynamiques oculaires engendrées par un stimulus accommodatif. D’après ces observations, le pôle antérieur du cristallin est susceptible d’avancer de 300 µm à l’âge de vingt ans pour 10 D d’accommodation, correspondant à une diminution de rayon de courbure d’environ 3 mm. La protrusion de la face antérieure cristallinienne décroît ensuite avec l’âge pour n’être plus que de 100 µm à quarante ans et pratiquement nulle à soixante-cinq ans (fig. 1-7). La diminution syncinétique de diamètre pupillaire est à peu près de 1,5 mm pour 10 D d’accommodation. Elle est significativement corrélée au stimulus accommodatif jusqu’à la quatrième décennie, pour ne l’être plus ensuite.
L’étude de la dynamique accommodative évalue l’amplitude accommodative en fonction du temps (fig. 1-8). L’exploration de la durée des phases accommodatives démontre que, si toutes ces phases dépendent de l’âge [27-29, 37, 57], la plus dépendante de l’âge du sujet semble être celle où la contraction ciliaire se produit et où le cristallin se déforme en conséquence.
On peut étudier schématiquement quatre entités de la dynamique accommodative : la magnitude d’accommodation, le temps de réaction, l’indice du temps de réponse et le pic de vélocité accommodative [37].
La magnitude d’accommodation est la différence d’équivalent sphérique entre les deux états stables accommodé et non accommodé. Elle transcrit l’amplitude accommodative déjà évoquée.
Le temps de réaction est le temps écoulé entre l’application d’un stimulus et le début de la réponse accommodative. Pour un stimulus défocalisateur de 3 D, il a été mesuré en ambiance photopique comme nécessitant en moyenne 220 ms, 350 ms et 425 ms respectivement pour en enfant, un jeune adulte et un adulte autour de la quatrième décennie [37].
L’indice du temps de réponse correspond au temps écoulé entre le début et la fin de l’accommodation, divisé par la distance focale parcourue pendant cette période. Cet indice standardise le temps de réponse accommodatif complet. L’unité est la seconde par mètre (s · m–1) ou, de manière équivalente, en dioptrie-seconde (D · s). Dans les mêmes conditions que précédemment, cet indice a été évalué à 318 ms · m–1, 356 ms · m–1 et 438 ms · m–1 respectivement chez l’enfant, le jeune adulte et le quadragénaire [37].
Le pic de vélocité accommodative reflète la vitesse maximum de changement accommodatif durant la phase d’accommodation. Il se conçoit donc en dioptries par seconde (D · s–1). Il augmente avec l’importance du stimulus d’une manière linéaire chez l’enfant, tandis que chez l’adulte jeune, l’augmentation n’est plus vraiment linéaire [34]. Il change selon l’intensité de l’exposition lumineuse [37]. Il est compris entre 2 D · s–1 chez l’enfant et 0,5 D · s–1 autour de la quarantaine.
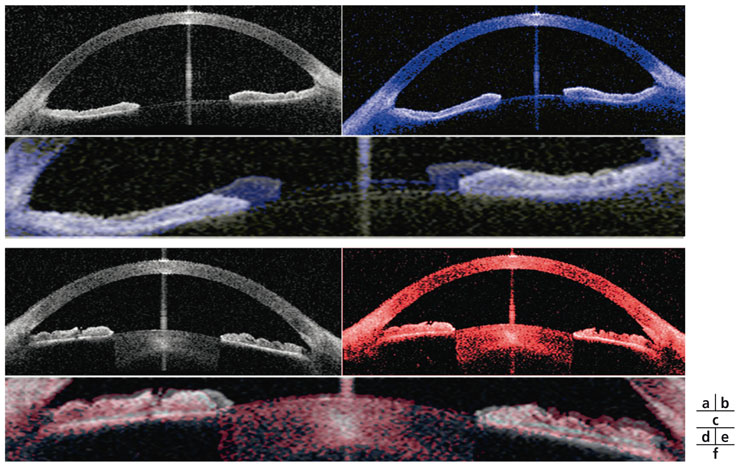
Fig. 1-7 Observation OCT du segment antérieur avant (a, d) et après (b, e) effort accommodatif suivant un stimulus de 10 D, d’après Baikoff et al., 2004 [7] et 2005 [8].
a., b., c. L’accommodation d’un enfant de 10 ans occasionne une protrusion de la face antérieure cristallinienne de 314 µm (c).
d., e., f. Chez l’adulte de 55 ans, cette protrusion n’est plus que de 14 µm (f).
(Clichés de G. Baikoff.)
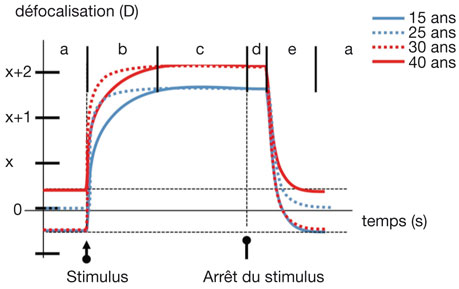
Fig. 1-8 Dynamique accommodative en fonction de l’âge pour un stimulus de (x + 2) dioptries.
On peut individualiser plusieurs phases :
– l’état non accommodé, où aucun stimulus défocalisateur n’est appliqué (a) ;
– la défocalisation, qui correspond au stimulus provoquant la réponse accommodative (flèche) ;
– la réponse accommodative, au cours de laquelle le muscle ciliaire se contracte et où une partie ou tout le parcours accommodatif est sollicité (b) ;
– le plateau accommodatif, pendant lequel l’effort accommodatif est maintenu en réponse au stimulus (c) ;
– l’hystérèse accommodative, correspondant au maintien de l’accommodation après que le stimulus a stoppé (d) ;
– la relaxation accommodative (ou désaccommodation), où l’action musculaire ciliaire cesse, correspondant au rappel passif exercé par la zonule postérieure, qui permet le retour à l’état non accommodé stable (e), préexistant au stimulus.
L’amplitude, l’efficacité et la dynamique accommodative varient en fonction de l’âge (lignes rouge et bleue, continues ou pointillées).
(D’après Kasthurirangan et Glasser, 2006 [34].)
[1] Abramson D.H., Coleman D.J., Forbes M., Franzen L.A. Pilocarpine. Effect on the anterior chamber and lens thickness. Arch Ophthalmol, 1972 ; 87 : 615-20.
[2] Allen P.M., Hussain A., Usherwood C., Wilkins A.J. Pattern-related visual stress, chromaticity, and accommodation. Invest Ophthalmol Vis Sci, 2010 ; 51 : 6843-9.
[3] Alpern M. Accommodation, the stimulus. In : Davson H. (ed.). The Eye. Muscular Mechanisms. Academic Press, London, 1962 : 221-5.
[4] Anderson H.A., Hentz G., Glasser A. et al. Minus-lens-stimulated accommodative amplitude decreases sigmoidally with age: a study of objectively measured accommodative amplitudes from age 3. Invest Ophthalmol Vis Sci, 2008 ; 49 : 2919-26.
[5] Atchison D.A., Capper E.J., McCabe K.L. Critical subjective measurement of amplitude of accommodation. Optom Vis Sci, 1994 ; 71 : 699-706.
[6] Bacskulin A., Gast R., Bergmann U., Guthoff R. Ultraschallbiomikroskopische Darstellung der akkommodativen Konfigurationsanderungen des presbyopen Ziliarkorpers. Ophthalmologe, 1996 ; 93 : 199-203.
[7] Baikoff G., Lutun E., Ferraz C., Wei J. Static and dynamic analysis of the anterior segment with optical coherence tomography. J Cataract Refract Surg, 2004 ; 30 : 1843-50.
[8] Baikoff G., Lutun E., Ferraz C., Wei J. Analyse du segment antérieur de l’œil avec un tomographe à cohérence optique. Étude statique et dynamique. J Fr Ophtalmol, 2005 ; 28 : 343-52.
[9] Barraquer R.I., Michael R., Abreu R. et al. Human lens capsule thickness as a function of age and location along the sagittal lens perimeter. Invest Ophthalmol Vis Sci, 2006 ; 47 : 2053-60.
[10] Benzoni J.A., Collier J.D., McHugh K. et al. Does the dynamic cross cylinder test measure the accommodative response accurately? Optometry, 2009 ; 80 : 630-4.
[11] Brookman K.E. Ocular accommodation in human infants. Am J Optom Physiol Opt, 1983 ; 60 : 91-9.
[12] Campbell F.W., Robson J.G., Westheimer G. Fluctuations of accommodation under steady viewing conditions. J Physiol, 1959 ; 145 : 579-94.
[13] Campbell F.W., Westheimer G. Factors influencing accommodation responses of the human eye. J Opt Soc Am, 1959 ; 49 : 568-71.
[14] Courtois Y. The capsule of the crystalline lens. In : Stark L., Obrecht G. (eds). Presbyopia – Recent Research and Reviews from the 3rd International Symposium. Fairchild Publications, New York, 1987 : 45-52.
[15] Crawford K.S., Kaufman P.L., Bito L.Z. The role of the iris in accommodation of rhesus monkeys. Invest Ophthalmol Vis Sci, 1990 ; 31 : 2185-90.
[16] Descartes R. Dioptrice. Lugdunum Batavorum, 1637.
[17] Donders R.C. On the anomalies of accommodation and refraction of the eye; with a preliminary essay on physiological dioptrics. The New Sydenham Society, London, 1858.
[18] Donders RC. Winke Betreffend den Gebrauch und die Wahl des Brillen. Archiv für Ophthalm, 1858 ; 4 : 286-300.
[19] Duane A. An attempt to determine the normal range of accommodation at various ages, being a revision of Donder’s experiments. Trans Am Ophthalmol Soc, 1908 ; 11 : 634-41.
[20] Duane A. Normal values of the accommodation at all ages. JAMA, 1912 ; LIX : 1010-3.
[21] Edinger L. Über den Verlauf der zentralen Himnervenbahnen. Arch f Psychiat u Nervenkrankh, 1885 ; 16 : 858-89.
[22] Fincham E.F. The mechanism of accommodation. Brit J Ophthalmol, 1937 ; (Monograph suppl. VIII) : 1-80.
[23] Fritzsch M., Dawczynski J., Vollandt R., Strobel J. Aberrationen hoherer Ordnung bei Akkommodation. Dynamische Wellenfrontmessung. Ophthalmologe, 2011 ; 108 : 553-60.
[24] Furukawa H., Hiro-Oka H., Satoh N. et al. Full-range imaging of eye accommodation by high-speed long-depth range optical frequency domain imaging. Biomed Opt Express, 2010 ; 1 : 1491-501.
[25] Hamasaki D., Ong J., Marg E. The amplitude of accommodation in presbyopia. Am J Optom Arch Am Acad Optom, 1956 ; 33 : 3-14.
[26] Helmholtz H. Optique physiologique. Trad. E. Javal et N.Th. Klein. Victor Masson et fils, Paris, 1867.
[27] Heron G., Charman W.N., Schor C. Dynamics of the accommodation response to abrupt changes in target vergence as a function of age. Vision Res, 2001 ; 41 : 507-19.
[28] Heron G., Charman W.N., Gray L.S. Accommodation dynamics as a function of age. Ophthalmic Physiol Opt, 2002 ; 22 : 389-96.
[29] Heron G., Charman W.N. Accommodation as a function of age and the linearity of the response dynamics. Vision Res, 2004 ; 44 : 3119-30.
[30] Hung G.K., Ciuffreda K.J., Khosroyani M., Jiang B.C. Models of accommodation. In : Hung G.K., Ciuffreda K.J. (eds). Models of the visual system. Kluwer Academic/Plenum Publishers, New York, 2002 : 287-339.
[31] Jeffries B.J. Anatomy and physiology of the ciliary muscle in man. Trans Am Ophthalmol Soc, 1866 ; 1 : 42-4.
[32] Johnson C.A. Effects of luminance and stimulus distance on accommodation and visual resolution. J Opt Soc Am, 1976 ; 66 : 138-42.
[33] Kano K., Kuwayama Y., Mizoue S. et al. [Observation of physiological change in the human ciliary body using an ultrasound biomicroscope during accommodation.] Nihon Ganka Gakkai Zasshi, 1999 ; 103 : 297-300.
[34] Kasthurirangan S., Glasser A. Age-related changes in accommodative dynamics in humans. Vision Res, 2006 ; 46 : 1507-19.
[35] Kepler J. Ad Vitellionem Paralipomena, quibus astronomiae pars optica traditur. Frankfurt, 1604 [Les fondements de l’optique moderne, Paralipomènes à Vitellion. Vrin, Paris, 1980].
[36] Kepler J. Dioptricae. Augsbourg, 1611.
[37] Lockhart T.E., Shi W. Effects of age on dynamic accommodation. Ergonomics, 2010 ; 53 : 892-903.
[38] Ludwig K. Zonular apparatus. Anatomy, biomechanics and coupling to the lens. In : Guthoff K., Ludwig K. (eds). Current aspects of human accommodation. Kaden Verlag, Heidelberg, 2001.
[39] Lütjen-Drecoll E. Morphology and age-related changes of the accommodation apparatus. In : Guthoff K., Ludwig K. (eds). Current aspects of human accommodation. Kaden Verlag, Heidelberg, 2001.
[40] Mordi J.A., Ciuffreda K.J. Static aspects of accommodation: age and presbyopia. Vision Res, 1998 ; 38 : 1643-53.
[41] Poinoosawmy D., Nagasubramanian S., Brown N.A. Effect of pilocarpine on visual acuity and on the dimensions of the cornea and anterior chamber. Br J Ophthalmol, 1976 ; 60 : 676-9.
[42] Richdale K., Bullimore M.A., Zadnik K. Lens thickness with age and accommodation by optical coherence tomography. Ophthalmic Physiol Opt, 2008 ; 28 : 441-7.
[43] Rohen J.W. Scanning electron microscopic studies of the zonular apparatus in human and monkey eyes. Invest Ophthalmol Vis Sci, 1979 ; 18 : 133-44.
[44] Rucker F.J., Kruger P.B. Accommodation responses to stimuli in cone contrast space. Vision Res, 2004 ; 44 : 2931-44.
[45] Schachar R.A. Cause and treatment of presbyopia with a method for increasing the amplitude of accommodation. Ann Ophthalmol, 1992 ; 24 : 445-7.
[46] Schachar R.A., Cudmore D.P., Black T.D. Experimental support for Schachar’s hypothesis of accommodation. Ann Ophthalmol, 1993 ; 25 : 404-9.
[47] Schachar R.A., Huang T., Huang X. Mathematic proof of Schachar’s hypothesis of accommodation. Ann Ophthalmol, 1993 ; 25 : 5-9.
[48] Schachar R.A. Zonular function: a new hypothesis with clinical implications. Ann Ophthalmol, 1994 ; 26 : 36-8.
[49] Schachar R.A. Qualitative effect of zonular tension on freshly extracted intact human crystalline lenses: implications for the mechanism of accommodation. Invest Ophthalmol Vis Sci, 2004 ; 45 : 2691-5.
[50] Schachar R.A., Abolmaali A., Kamangar F. Comment on the publication « Three-dimensional ultrasound, biomicroscopy environmental and conventional scanning electron microscopy investigations of the human zonula ciliaris for numerical modelling of accommodation » by O. Stachs et al. Graefes Arch Clin Exp Ophthalmol, 2006 ; Mar 8.
[51] Schachar R.A., Koivula A. The stress on the anterior lens surface during human in vivo accommodation. Br J Ophthalmol, 2008 ; 92 : 348-50.
[52] Schaeffel F., Wilhelm H., Zrenner E. Inter-individual variability in the dynamics of natural accommodation in humans: relation to age and refractive errors. J Physiol, 1993 ; 461 : 301-20.
[53] Scheiner C. Oculus, hoc est, fundamentum opticum. Inspruck, Austria, 1619.
[54] Shen M., Wang M.R., Yuan Y. et al. SD-OCT with prolonged scan depth for imaging the anterior segment of the eye. Ophthalmic Surg Lasers Imaging, 2010 ; 41 : S65-9.
[55] Sheppard A.L., Davies L.N. In vivo analysis of ciliary muscle morphologic changes with accommodation and axial ametropia. Invest Ophthalmol Vis Sci, 2010 ; 51 : 6882-9.
[56] Solé P., Dalens H., Genton C. Biophtalmologie. Masson, Paris, 1992.
[57] Sun F.C., Stark L., Nguyen A. et al. Changes in accommodation with age: static and dynamic. Am J Optom Physiol Opt, 1988 ; 65 : 492-8.
[58] Tcherning M. Optique physiologique. Dioptrique oculaire – Fonctions de la rétine – Les mouvements oculaires et la vision binoculaire. Leçons professées à la Sorbonne. Carré et Naud, Paris, 1898 : 62-3.
[59] Tscherning M. Herman von Helmholtz et la Théorie de l’Accommodation. Doin, Paris, 1909.
[60] Vogt A. Lehrbuch und Atlas der Spaltlampenmikroskopie des lebenden Auges. Zweiter Teil : Linse und Zonula. Springer, Berlin, 1931.
[61] Westphal C.F.O. Über ein Fall von chronischer progressiver Lähmung der Augenmuskeln (Ophthalmoplegia externa) nebst Beschreibung von Ganglienzellengruppen im Bereiche des Oculomotoriuskerns. Arch f Psychiat u Nervenkrankh, 1887 ; XVIII : 846-71.
[62] Wold J.E., Hu A., Chen S., Glasser A. Subjective and objective measurement of human accommodative amplitude. J Cataract Refract Surg, 2003 ; 29 : 1878-88.