S. Zaluski
Environ sept cent mille cataractes sont opérées chaque année en France. De nombreux patients peuvent être potentiellement bénéficiaires d’une correction réfractive la plus parfaite possible, incluant celle de la perte d’accommodation. De plus, les techniques d’extraction du cristallin clair avec implantation multifocale à visée strictement réfractive bénéficient d’une demande croissante à tous les âges. Ainsi, des formes frontières apparaissent de patients présentant une cataracte relativement peu invalidante, source d’un retentissement seulement sur la qualité de vision (contrastes et gêne à la lumière), mais qui, informés de la qualité potentielle des résultats, expriment le souhait de bénéficier d’une chirurgie à visée fonctionnelle et réfractive. C’est dire que la chirurgie d’extraction du cristallin est la plus accessible aux chirurgiens pour la correction de la presbytie.
Les exigences liées à la qualité des résultats réfractifs attendus justifient de techniques de phacoémulsification reproductibles, sûres, non astigmatogènes ; à l’inverse, ce sont également les progrès constants des techniques de phacoémulsification, les développements des implants et la maîtrise du geste chirurgical qui permettent d’aborder la chirurgie de la cataracte ou du cristallin en général comme une chirurgie réfractive à part entière pour la sphère, le cylindre et la perte d’accommodation.
Le développement des techniques de micro-incisions a largement contribué à cette évolution et l’objectif des avancées en phacoémulsification est de permettre une chirurgie optimisée et sécurisée en réalisant des micro-incisions coaxiales ou bi-axiales. Les enjeux sont donc liés à la garantie d’une efficacité ultrasonique, au maintien d’une aspiration de qualité à travers des pointes de plus petit diamètre et à la sécurisation thermique sur des incisions miniaturisées.
Le principe technique de la chirurgie par phacoémulsification, décrite par Charles Kelman dès 1967 [51], dépend de deux éléments de base : une énergie ultrasonique utilisée pour émulsifier le cristallin et un circuit fluidique destiné à aspirer les éléments phacoémulsifiés.
Le circuit fluidique d’irrigation et d’aspiration doit maintenir une profondeur de chambre antérieure la plus stable possible tout en limitant l’effet thermique dû à la délivrance d’énergie. Ce système fluidique tire ses caractéristiques :
– de composantes hydrodynamiques, liées à l’existence d’un système d’aspiration (pompe) au niveau du phacoémulsificateur dont le rôle est de créer un vide (donc une pression négative) dans la ligne d’aspiration ;
– de composantes hydrostatiques, liées à la hauteur de la bouteille d’irrigation.
Les phacoémulsificateurs actuels ont des systèmes fluidiques clos (fig. 7-1) [12], synonymes de sécurité microbiologique [106], connectés à un capteur de pression permettant le fonctionnement de la pompe selon les paramètres de réglage choisis. Si d’autres systèmes ont été utilisés, les pompes sont aujourd’hui essentiellement représentées par les pompes péristaltiques et les systèmes Venturi.
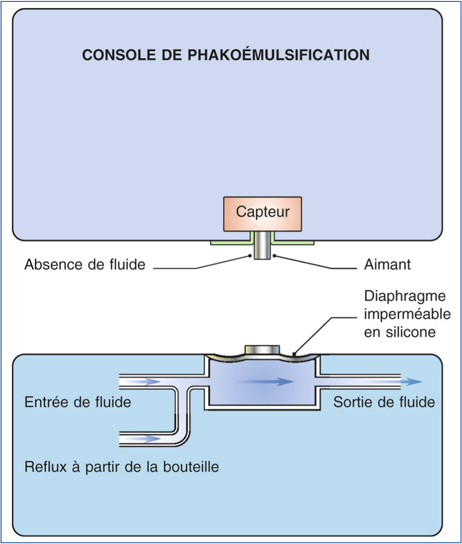
Fig. 7-1 Système clos.
(In : J.-L. Arné, Th. Amzallag, P. Fournié, Chirurgie de la cataracte, Paris, Masson, 2005.)
Les pompes péristaltiques sont constituées d’un cylindre rotatoire à galets (fig. 7-2 et 7-3) [12]. La tubulure est enroulée autour de ces galets dont le mouvement collabe la ligne d’aspiration à chaque point de contact, avec rotation continue des bolus de liquide. Ces bolus se trouvant entre les galets se déplacent de façon péristaltique dans la direction de la rotation. Ce déplacement crée une pression différentielle qui aspire le liquide tout au long de la tubulure d’aspiration jusqu’à la pointe. Trois paramètres interviennent dans le circuit fluidique : la hauteur de la bouteille d’irrigation, qui peut être positionnée à des niveaux différents, le flux d’aspiration (en cm3/min) et la limite de vide (en mm Hg). Le réglage du flux correspond à la vitesse de rotation de la pompe. Cette vitesse et sa rapidité d’augmentation sont des paramètres qui déterminent les capacités d’aspiration dans la chambre antérieure ; la limite de vide fixe le niveau maximum qui peut être atteint en cas d’occlusion à la pointe. De nombreuses autres caractéristiques, telles que la vitesse de montée en vide ou de retour au seuil après la libération de l’occlusion, vont influer sur la stabilité de la chambre antérieure. Les pompes péristaltiques peuvent augmenter le flux quelle que soit la hauteur de la bouteille mais les interconnexions entre la pompe et les tubulures permettent au système de ralentir ce flux et d’agir comme élément régulateur. La pression liée à la hauteur de la bouteille d’irrigation ne peut pas entraîner un flux supérieur à celui que permet la rotation de la pompe péristaltique.
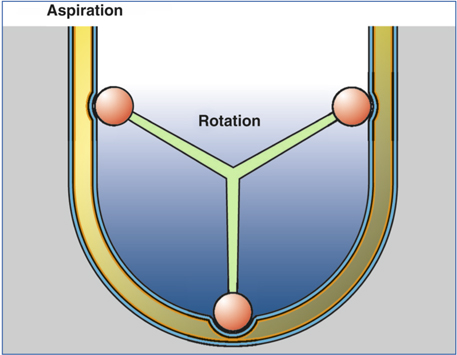
Fig. 7-2 Pompe péristaltique : principe.
(In : J.-L. Arné, Th. Amzallag, P. Fournié, Chirurgie de la cataracte, Paris, Masson, 2005.)
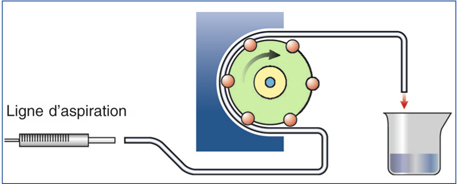
Fig. 7-3 Pompe péristaltique : fonctionnement.
(In : J.-L. Arné, Th. Amzallag, P. Fournié, Chirurgie de la cataracte, Paris, Masson, 2005.)
Dans un système Venturi, le vide est créé par un court-circuit entre les circuits d’aspiration et une chambre de compression des gaz (nitrogène ou air) (fig. 7-4 et 7-5) [12]. L’interface est constituée par de l’air et la pression différentielle dans cette zone tampon d’air entraîne les fluides vers la cassette de drainage en proportion du niveau de vide lorsque l’orifice d’aspiration est libre. Dans ce système, aucun flux d’aspiration ne peut être réglé, seul le niveau de vide est paramétré sur la machine. Le niveau de vide réel n’est pas ici fonction du caractère occlus ou non de l’orifice d’aspiration. Une pompe Venturi produisant une dépression à l’extrémité du circuit fluidique, elle ne peut qu’augmenter le flux au-dessus d’une limite inférieure. Traditionnellement, le vide était créé à partir d’un raccordement à l’air comprimé médical externe. Actuellement, ce raccord n’est souvent plus nécessaire et le vide peut être produit à partir d’une pompe centrifuge à l’intérieur du module compresseur.
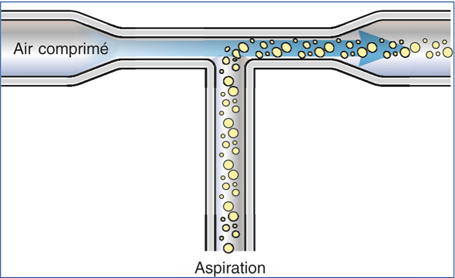
Fig. 7-4 Pompe Venturi : principe.
(In : J.-L. Arné, Th. Amzallag, P. Fournié, Chirurgie de la cataracte, Paris, Masson, 2005.)
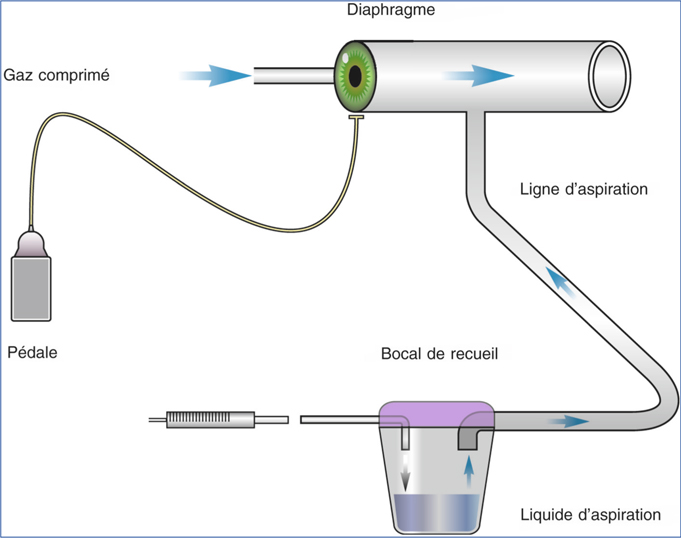
Fig. 7-5 Pompe Venturi : fonctionnement.
(In : J.-L. Arné, Th. Amzallag, P. Fournié, Chirurgie de la cataracte, Paris, Masson, 2005.)
L’énergie ultrasonique est produite par un cristal piézoélectrique oscillant à une fréquence variable, aujourd’hui de 28 kHz à 45 kHz. Le cristal se trouve dans la pièce à main et l’énergie est transmise et amplifiée jusqu’à la pointe de phacoémulsification, créant un mouvement longitudinal de la pointe d’avant en arrière variable, en règle jusqu’à un maximum de 100 µm. En fait, quatre à six cristaux sont présents qui, après syntonisation, oscillent de façon simultanée afin de créer une force suffisante pour mobiliser la pointe. L’énergie ultrasonique maximum est préréglée sur la machine et le niveau des ultrasons délivrés se module, classiquement, de façon linéaire par la pédale en position 3 jusqu’à la limite maximale déterminée.
Le mécanisme réel de l’action des ultrasons reste en fait controversé [83, 91]. Les théories principales sont en rapport avec la fragmentation par un effet acoustique des morceaux de noyau du fait de la propagation des ultrasons dans le liquide de chambre antérieure, la présence de bulles de microcavitation produites à l’extrémité distale de la pointe dont l’implosion crée une énergie capable d’émulsifier les fragments de matériel, et l’effet mécanique de marteau-piqueur de la pointe qui, par ailleurs, explique les phénomènes de répulsion des fragments.
En mode « sculpture », l’énergie ultrasonique n’est pas potentialisée par le vide et l’efficacité des ultrasons ne s’exprime que sur la portion basse de la lumière de la pointe ; en mode « occlusif », l’ensemble du volume de la lumière de la pointe est utilisé. L’énergie sera donc d’autant plus efficacement utilisée qu’on travaille en mode « occlusif ». Selon sa dureté, chaque noyau nécessitera une énergie différente et on pourra optimiser l’efficacité, par réduction de l’énergie dissipée, en recherchant le meilleur couple énergie-vide pour chaque type de noyau.
La quantité d’énergie ultrasonique délivrée n’est pas anodine et cette énergie est un des paramètres de la production de radicaux libres [35, 69] et de la toxicité des ultrasons lors de la chirurgie.
Quels que soient les paramétrages du phacoémulsificateur, la pédale reste le système de commande du fonctionnement de la machine :
– la position 0 est la position de repos, ou point mort de la machine ;
– la position 1 enclenche l’irrigation sans aspiration ni délivrance d’ultrasons ;
– en position 2, la pompe commence à agir et un vide est créé, qui augmente progressivement alors que la pédale est plus appuyée ; ce vide augmente jusqu’au niveau maximum préréglé sur la machine ; des réglages peuvent modifier le caractère linéaire ou non de l’aspiration en fonction de la position du pied en position 2 ;
– en position 3, l’énergie ultrasonique commence à être délivrée, en général de façon linéaire selon la position de la pédale en position 3. Le contrôle linéaire de la puissance des ultrasons n’a été introduit que plus de vingt ans après l’apparition des premières machines de phacoémulsification ; auparavant, la pédale en position 3 entraînait immédiatement une délivrance maximum des ultrasons tels que préréglés sur la machine. Des modifications du mode de délivrance peuvent également être programmées sur la pédale permettant de passer, au pied, à des paramétrages et à des modes de délivrance d’ultrasons différents.
Un reflux peut également être commandé à partir de la pédale, permettant de désengager de l’orifice d’aspiration tout fragment non souhaité. La course de la pédale peut être programmée afin de l’optimiser pour chaque position en fonction de l’efficacité recherchée.
Le développement de pédales sans fil est un apport ergonomique appréciable.
Les avancées et la sécurisation de la procédure sont permanentes. Elle a bénéficié d’améliorations récentes depuis les précédentes mises au point et revues de la littérature [12, 46, 92].
En cas d’occlusion associée à un niveau de vide élevé, la compliance (changement de volume en réponse à un changement de pression) des tubulures est à l’origine de leur déformation. La qualité des matériaux des tubulures d’aspiration doit permettre d’obtenir une compliance satisfaisante, afin que la compression soit possible au niveau des galets de la pompe péristaltique tout en conservant une rigidité suffisante pour limiter les phénomènes de collapsus.
À la levée de l’occlusion, les modifications liées à la remise des tubulures à leur forme initiale ainsi que le collapsus des bulles d’air créent une dépression additionnelle qui n’est pas équilibrée par la hauteur de la bouteille et qui entraîne de façon brève un aplatissement plus ou moins important de la chambre antérieure. Ce phénomène peut avoir des effets délétères à la fois pour l’endothélium cornéen et la capsule postérieure.
L’importance et la durée de ce phénomène de surge augmentent proportionnellement, pouvant aller jusqu’à entraîner des pressions négatives susceptibles d’entraîner un collapsus de chambre antérieure. De façon basique, les différents moyens de limiter le phénomène de surge sont l’élévation de la hauteur de la bouteille d’irrigation, l’utilisation d’une association pointe-tubulure plus adaptée, notamment avec des pointes et des tubulures de petit diamètre, et la diminution du flux associée à des paramétrages de machines adaptés.
Le venting correspond à un reflux automatisé du liquide d’aspiration. Il se déclenche classiquement lorsque le niveau de vide maximum est atteint. Il est également déclenché en passant la pédale de la position 2 à la position 1 et permet alors de libérer des fragments de tissus (iris, capsule), qui auraient pu s’incarcérer dans l’orifice d’aspiration. S’il est insuffisant, il peut être nécessaire d’y adjoindre un reflux. Actuellement, le venting air est quasi abandonné au profit du venting fluidique.
Récemment, des systèmes plus sophistiqués d’aide à l’efficacité fluidique et au maintien de la chambre antérieure ont été développés.
Pour le Signature® (Abbott Medical Optics), le circuit Fusion® Fluidics repose sur le système CASE (Chamber Automated Stabilization Environment), qui diminue le vide avant la rupture d’occlusion. Il minimise ainsi le risque de surge lors des phases de phacoémulsification des quartiers, même pour des niveaux de vide ou des débits d’aspiration élevés. Le principe est celui d’une reconnaissance de l’occlusion et d’une réaction automatique de la pompe péristaltique. Son sens de rotation s’inverse dès qu’on atteint la valeur cible. Le vide est alors diminué dans un délai de 20 ms.
Bausch & Lomb a développé sur le Stellaris® un système nommé StableChamber® à double chambre qui est placé sur la tubulure d’aspiration de la machine (fig. 7-6). Ce système présente une chambre interne dont le diamètre d’entrée est de 2 mm puis se rétrécit progressivement jusqu’à 1,1 mm, piégeant les fragments cristalliniens supérieurs à 0,5 mm. Il permet de maintenir une fluidité constante de la ligne d’aspiration, évitant d’éventuels phénomènes de surge à la levée d’une occlusion de la tubulure et garantissant l’absence d’augmentation de l’effet thermique en cas d’interruption du flux par obstruction de la ligne d’aspiration (clogging).
La pédale à double linéarité du Stellaris® permet de séparer les commandes d’intensité d’aspiration et de délivrance d’ultrasons en deux plans distincts (haut/bas, droite/gauche), ce qui autorise une totale modularité du couplage aspiration/ultrasons : ainsi, le niveau de vide peut être diminué avant de débuter l’émulsification d’un fragment de noyau occluant la pointe, minimisant ainsi le phénomène de surge.
Le système Cruise Control® de Staar peut être adapté entre la pièce à main de phacoémulsification et la tubulure d’aspiration. Il présente un limitateur de flux d’un diamètre interne de 0,3 mm et est pourvu d’un filtre qui retient également les fragments cristalliniens. Le principe est d’éviter les phénomènes de surge tout en travaillant avec des niveaux de vide élevés. Wade [99] a démontré que son efficacité est d’autant meilleure que la machine sur laquelle il est installé est plus génératrice de surge.
L’Infiniti® d’Alcon bénéficie du système de gestion fluidique Intrepid® associant une technologie de double détection du niveau de vide et une tubulure d’aspiration de faible compliance. Le système ABS (Aspiration Bypass System) est caractérisé par l’existence d’un micro-orifice de 175 µm dans la paroi de la pièce à main, au niveau du manchon (fig. 7-7) [12]. Il assure un flux permanent et empêche toute interruption de ce flux en cas d’occlusion à la pointe, limitant ainsi le phénomène de surge.
Oertli a intégré un système de réduction de l’effet de surge dans sa pointe CO-MICS 2.
Il est à noter que l’ensemble de ces systèmes additionnels entraîne des modifications des flux réels par rapport à ceux affichés sur les machines, accentuant les erreurs d’affichage constatées sur la plupart des machines [34, 82].
Georgescu [37] a comparé les performances fluidiques de l’Infiniti®, du Stellaris® et du Signature® avec des résultats en faveur du Signature®. Han [39] comparant les trois mêmes machines va dans le sens d’un avantage de l’Infiniti®.
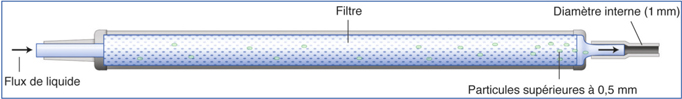
Fig. 7-6 Système StableChamber® à double chambre sur le Stellaris® (Bausch & Lomb).
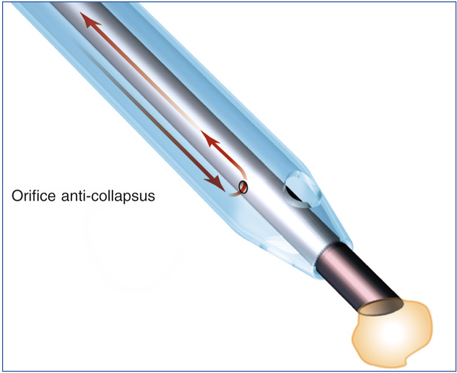
Fig. 7-7 Courts-circuits anticollapsus (anticollapsus bypass system).
(In : J.-L. Arné, Th. Amzallag, P. Fournié, Chirurgie de la cataracte, Paris, Masson, 2005.)
Le Signature® est aujourd’hui équipé de deux systèmes de pompe d’aspiration : péristaltique et Venturi. Ce système de double pompe permet un passage instantané de l’une à l’autre sans changement de cassette. Le choix de la pompe peut ainsi être prédéterminé par programme ou sous-programme. De nombreuses pompes actuelles (Signature®, Stellaris®…) peuvent fonctionner en mode hybride et simuler en mode péristaltique les caractéristiques d’un système Venturi ou, inversement, simuler en mode Venturi les caractéristiques d’une pompe péristaltique. Les nouvelles générations de pompes Venturi (Signature®, Millenium®) sont réputées diminuer notablement l’effet de surge à des niveaux de vide élevés.
Les performances fluidiques des machines permettent de travailler aujourd’hui sur des niveaux de vide élevés, qui peuvent aller jusqu’à 600 ou 650 mm Hg, dans des conditions de sécurité optimisées. Valoriser le niveau d’aspiration permet, parallèlement, de réduire les besoins en ultrasons.
Les fabricants ont amélioré la compliance du couple cassette/tubulure. Plus faible est la compliance, plus sera rapide le temps de montée du vide (rise time) lors de l’occlusion jusqu’à la limite prédéfinie et plus faible sera le surge. Ainsi, cette faible compliance associée à des diamètres internes réduits et des parois plus épaisses réduit le phénomène de rebond élastique de la tubulure et l’effet de surge.
En évolution par rapport à la délivrance continue des ultrasons, les phacoémulsificateurs récents ont développé des modes de délivrance discontinue permettant d’optimiser l’effet pour une délivrance d’énergie plus faible et un échauffement thermique moindre.
Ces modes, communément dénommés « pulse » et « burst », représentent une des avancées dans la délivrance des ultrasons traditionnels. Le mode pulsé permet classiquement de délivrer l’énergie sur une période courte suivie d’une période de repos d’une durée équivalente ou supérieure. La programmation peut être faite en nombre de pulses par seconde, dont la durée peut être de l’ordre de 50 ms (pulse) ou de l’ordre de 1 ms (micropulse). Le cycle actif (duty cycle) représente la fraction de temps de délivrance d’énergie (par exemple 33 % pour des pulses de 6 ms suivies d’intervalles libres de 12 ms). Brinton [21] a montré une réduction de l’échauffement de l’ordre de 50 % en mode « pulse » comparé à une délivrance linéaire.
Le mode « burst » correspond à des rafales d’ultrasons dont la durée est, en règle, déterminée de façon linéaire par la position de la pédale. Lors de l’entrée en position 3, une courte rafale est suivie d’un temps de repos important, les rafales se succèdent ensuite plus rapidement, jusqu’à obtenir au maximum, en dépression complète de la pédale, une délivrance continue des ultrasons. La période de repos permet un refroidissement relatif de la pointe évitant les brûlures au niveau de l’incision. En pratique, la plupart des programmes limitent la production de rafales à un maximum de 50 % ou 70 % de la durée du cycle.
Le mode pulsé permet un contrôle linéaire de la puissance ultrasonique maximum, alors que le mode « burst » permet un contrôle linéaire de la fréquence des rafales pour une puissance ultrasonique prédéterminée.
Le mode « hyperpulse » a été également récemment développé, notamment sur les machines Alcon, AMO et Bausch & Lomb. Sa caractéristique est de pouvoir délivrer jusqu’à cent pulses par seconde avec des durées de l’ordre de 5 ms. La très faible durée de ces pulses suivie de périodes plus longues de repos évite de façon importante l’échauffement des pointes et augmente l’efficacité ultrasonique. L’incidence des brûlures cornéennes, évaluée à environ un cas pour mille dans une étude nord-américaine [79], varie selon les machines. Dans cette comparaison, les machines qui bénéficiaient de systèmes « hyperpulse » engendraient des taux de brûlure cornéenne huit fois moindres en comparaison des délivrances ultrasoniques traditionnelles. Ce mode de délivrance, avec une efficacité variable selon les machines, permet pour certaines de réaliser des phacoémulsifications par micro-incisions inférieures à 2 mm (phacoémulsification par micro-incisions bi-axiales) sans manchon et sans échauffement significatif de l’incision [20].
Pour le Signature®, le système de délivrance des ultrasons repose sur la technologie WhiteStar®, c’est-à-dire sur une distribution programmable de micropulses séparées par des intervalles de repos variables en fonction de la demande de puissance de l’utilisateur. Cette technique permet d’augmenter à moindre coût énergétique l’efficacité de la pointe tout en limitant le risque d’élévation thermique. Fishkind a montré une réduction de l’énergie utilisée et de la perte cellulaire endothéliale [33]. La technologie WhiteStar® ICE (Increased Control and Efficiency) ajoute aux micropulses un pic initial de puissance (« kick ») augmenté jusqu’à 12 % pour la première impulsion durant 1 ms, ce qui augmente l’effet cavitationnel (fig. 7-8 et 7-9). L’efficacité en est significativement accrue et le temps effectif d’ultrasons réduit [9, 107].
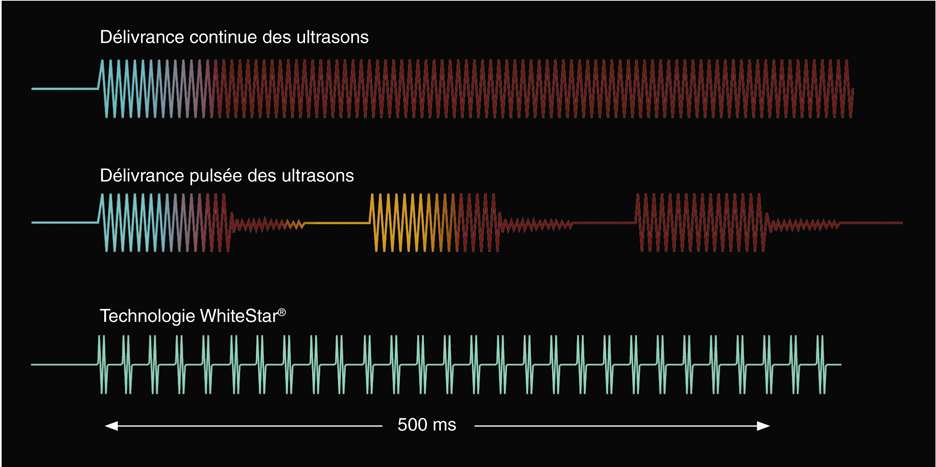
Fig. 7-8 Technologie Whitestar® ICE.
(Avec l’aimable autorisation d’Advanced Medical Optics.)
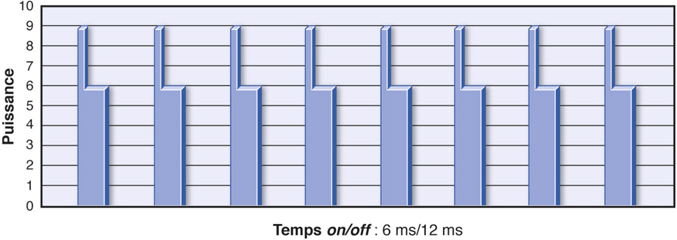
Fig. 7-9 Technologie Whitestar® ICE : pic initial de puissance, ou « kick ».
(Avec l’aimable autorisation d’Advanced Medical Optics.)
Le mode Aqualase® est une modalité originale de phacoémulsification développée par Alcon en 2004 [61]. Le principe repose, comme avec les ultrasons traditionnels, sur l’utilisation d’une pointe d’aspiration entourée d’un manchon de silicone pour l’irrigation. L’énergie est délivrée par des jets de 4 µl de BSS chauffé à 60 °C, ce qui permet l’émulsification d’un noyau peu dense, y compris jusqu’à des grades 3. L’échauffement est restreint, mais Hu [47] rapporte une perte cellulaire endothéliale comparable à celle des ultrasons.
La technologie OZil® de Alcon (fig. 7-10) est définie par un mouvement oscillatoire à 32 kHz d’une pointe angulée d’environ 20°. Ce mouvement latéral – et non plus longitudinal – crée un cisaillement du noyau. Le mouvement latéral a une excursion maximale de 90 µm, assez comparable au mouvement maximum longitudinal, qui est de l’ordre de 100 µm. Contrairement à la phacoémulsification longitudinale durant laquelle seul 50 % du cycle est efficace, la délivrance d’énergie se fait que la pointe soit mobilisée vers la droite ou vers la gauche : de cette façon, l’ensemble du mouvement participe au processus de phacoémulsification. Dans la phacoémulsification traditionnelle, 50 % du mouvement de la pointe n’est pas énergétiquement utilisable (lorsque celui-ci se fait vers l’arrière). Pour certains, la nécessité d’utiliser une pointe angulée de type Kelman représente un avantage dans le sens où elle permet à tout moment une parfaite visualisation des mouvements de la pointe. OZil® peut être utilisé en mode de délivrance continue des ultrasons autant qu’en micropulses ou en mode « burst ». Il évite également la répulsion des fragments de noyau fréquemment observée en mode longitudinal. Il a été démontré, dans de nombreux travaux [13, 14, 28, 40, 48, 87], une efficacité accrue, une réduction d’échauffement et une diminution de production de radicaux libres lorsqu’il est comparé au mode longitudinal de l’Infiniti® dont la fréquence est de 44 kHz. En termes de résultat fonctionnel et de perte cellulaire endothéliale, les résultats semblent cependant comparables [88]. La technique OZil® est susceptible d’entraîner, particulièrement sur des noyaux durs, un phénomène de clogging à l’origine d’une obstruction de la ligne d’aspiration. L’application Intelligence Phaco (OZil® IP), qui associe de manière préprogrammée des ultrasons torsionnels et longitudinaux, y a apporté une solution : cette technique a pour but d’améliorer l’efficacité de la phacoémulsification, l’attraction vers et à travers la pointe ultrasonique ainsi que la fluidité de la phacoaspiration, et d’éviter les phénomènes de clogging par adjonction d’ultrasons longitudinaux aux ultrasons torsionnels.
Le système Ellips® (fig. 7-11) puis Ellips® FX du Signature®, développé à la suite de l’OZil®, associe simultanément des ultrasons en mode longitudinal et transversal à hauteur de 50 %. Cette technique mixte n’entraîne pas de phénomène de clogging et ne nécessite pas de modification de la technique opératoire, car elle est fonctionnelle avec tous les types de pointe, droite ou courbe. Le couplage des ultrasons latéraux et longitudinaux permet de diminuer l’amplitude du mouvement d’avant en arrière de la pointe de 50 % tout en conservant une efficacité optimale. Schmutz [90] a comparé l’échauffement thermique de OZil® et Ellips®, qui serait en faveur de Ellips®.
En théorie, les technologies torsionnelles OZil® et Ellips® permettent une phacoémulsification de meilleure qualité en dehors de toute occlusion, garantissant une excellente stabilité de chambre antérieure du fait de l’évitement des phénomènes de surge. Cependant, il n’est pas certain que ces technologies soient supérieures à tous les modes de délivrance des ultrasons traditionnels, particulièrement sur des noyaux durs.
Le mode torsionnel n’est pas le choix universel des fabricants pour réduire l’échauffement en optimisant l’efficacité. Le Stellaris® est équipé d’une pièce à main possédant six cristaux piézoélectriques dont la fréquence de 28,5 kHz permet d’obtenir une excellente efficacité ultrasonique pour tous les noyaux, associée à un effet thermique modéré (fig. 7-12). Cette fréquence est actuellement la plus basse de toutes les machines en mode longitudinal.
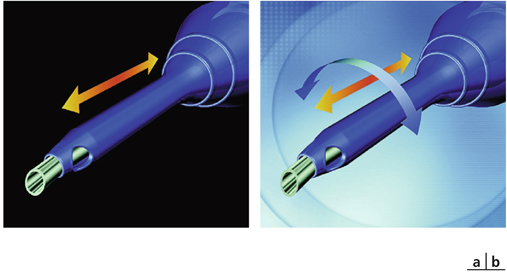
Fig. 7-10 Pièces à main.
a. Traditionnelle. b. Technologie OZil®.
(Avec l’aimable autorisation d’Alcon.)
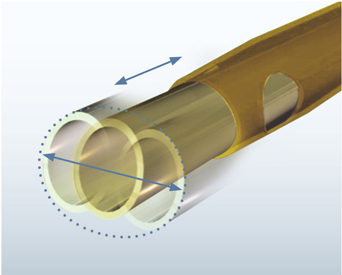
Fig. 7-11 Mouvement de la pointe du système Ellips®.
(Avec l’aimable autorisation d’Abbott Medical Optics.)

Fig. 7-12 Système Stellaris®.
(Avec l’aimable autorisation de Baush & Lomb.)
L’efficacité et la sécurisation thermique ont également bénéficié des avancées dans l’élaboration des pointes et manchons.
La pointe historique de référence est une pointe 19 G d’un diamètre externe de 1,1 mm et d’un diamètre interne de 0,9 mm. Des pointes de 21 G peuvent être utilisées actuellement. Leurs diamètres sont de 0,8 mm en externe et 0,5 mm ou 0,6 mm en interne. Elles agissent en créant une résistance au mouvement fluidique, diminuant le flux pour une valeur de vide paramétrée. Par ailleurs, les plus petits diamètres des pointes diminuent le pouvoir de préhension du noyau en occlusion. Les facteurs permettant de compenser cette diminution de préhension sont l’augmentation de la hauteur de la bouteille d’irrigation et l’importance du vide. Menapace [65] a montré la relation existant entre la capacité de préhension du noyau et le diamètre interne de la pointe et l’angulation : plus le diamètre interne est grand et plus l’angulation est importante, plus la capacité de préhension est importante.
Plusieurs modèles de pointes, MicroFlow® (Bausch & Lomb), Flared Tip® (Alcon), MicroSeal® (Alcon), Cobra®, ont un diamètre distal identique à celui d’une pointe standard, leur permettant d’avoir un pouvoir de préhension identique à celui d’une pointe classique pour un niveau de vide donné. Leur diamètre interne proximal réduit crée une résistance évitant les flux très importants qu’on pourrait observer avec des niveaux de vide élevés et les risques de surge inhérents. Les diamètres distaux élevés permettent par ailleurs d’augmenter la capacité d’aspiration et donc de phacoémulsification du matériel nucléaire (fig. 7-13) [12].
Différentes mesures ont été développées en ce qui concerne la géométrie du couple pointe-manchon de façon à lutter spécifiquement contre l’échauffement thermique. Le flux de liquide s’écoulant dans la ligne d’irrigation entre la pointe et le manchon en silicone participe au refroidissement de la pointe. Cependant, a contrario, sur une incision très étroite, si le flux est interrompu à ce niveau, le manchon peut faire office de conducteur thermique et participer au mécanisme de brûlure cornéenne au niveau de l’incision. La protection thermique peut être améliorée par différentes mesures : l’une d’elles consiste à rainurer l’embout de la pièce à main, comme dans les pointes MicroFlow®, de façon à maintenir en permanence une irrigation autour de la pointe même en cas de constriction du manchon ; parfois, un second manchon en polyamide est interposé, comme dans les pointes Mackool, ce qui permet en toutes circonstances de maintenir une irrigation.
Dans les techniques de micro-incisions bimanuelles, le manchon n’est pas utilisé et l’irrigation se fait par une seconde voie d’abord. Même dans ces conditions, les progrès dans la délivrance des ultrasons et dans la géométrie des pointes permettent d’éviter tout échauffement anormal au niveau de l’incision de phacoémulsification.

Fig. 7-13 Différents types de micropointes.
(In : J.-L. Arné, Th. Amzallag, P. Fournié, Chirurgie de la cataracte, Paris, Masson, 2005.)
De considérables progrès dans l’ergonomie des machines rendent plus aisé le travail du chirurgien et des équipes de bloc opératoire : paramétrages accessibles aisément à partir de l’écran, facilité de mise en place des cassettes, système Venturi sans branchement mural, pédales Bluetooth sans fil, pièces à main plus légères, pointe d’irrigation-aspiration à bout siliconé, couplage à des unités d’enregistrement numérique des images et des paramètres de la phacoémulsification.


T. Amzallag
Corriger la presbytie lors d’une chirurgie du cristallin utilisant un implant multifocal ou accommodatif nécessite de considérer l’astigmatisme préopératoire. En effet, un astigmatisme postopératoire supérieur à une dioptrie peut constituer une cause d’échec ou d’insatisfaction du patient. L’avènement des lentilles intraoculaires multifocales toriques, même si celles-ci élargissent le champ des indications opératoires, nécessite d’autant plus une limitation de l’astigmatisme chirurgicalement induit si on souhaite un résultat précis. L’incision de phacoémulsification constituant une kératotomie par aplatissement du méridien concerné, le choix de sa taille [52, 62, 81] et celui de son site [97] ont une influence sur l’astigmatisme chirurgicalement induit. La tendance actuelle est à la limitation de l’astigmatisme induit principalement par deux mécanismes : éloignement de l’incision, le plus souvent cornéenne, par rapport à l’axe optique et réduction de sa taille. L’objectif étant de limiter l’astigmatisme chirurgicalement induit, les tailles d’incisions, en fonction des publications, se situent aux alentours de 2 mm en cornée claire. Plus rarement, il s’agit de réduire un astigmatisme préexistant par le choix des caractéristiques de l’incision.
La réduction de la taille des incisions a nécessité le développement de technologies et de techniques permettant de phacoémulsifier par des mini-incisions ou des micro-incisions. Cela passe par la mise au point de machines plus performantes en termes d’équilibre hydrodynamique et d’efficacité ultrasonique (cf. supra), de matériel adéquat, d’implant et d’injecteurs adaptés. Il faut signaler que, quelle que soit la taille d’incision utilisée pour la phacoémulsification (jusque moins de 1 mm), c’est l’implant (surtout son matériau) et les systèmes d’injection qui déterminent les valeurs en fin d’intervention. Les implants constituent donc aujourd’hui un des facteurs limitant à la réduction de la taille des incisions, comme cela a toujours été le cas depuis l’avènement de la phacoémulsification. Par ailleurs, il est important de considérer le comportement postopératoire de ces implants destinés à la micro-incision, dont le nécessaire changement de dessin ou de matériau ne doit pas dégrader les performances à moyen et long terme, d’autant que la chirurgie de la presbytie s’adresse fréquemment à des patients plus jeunes que ceux atteints de cataracte.
Il n’existe pas de définition consensuelle de la cataracte par micro-incision ou mini-incision, l’utilisation des différents termes relevant essentiellement des usages courants. C’est la séparation de l’irrigation et des ultrasons [93], jusque-là coaxiales, qui a initialement permis une réduction importante de la taille des incisions et les débuts de la micro-incision, l’irrigation et les ultrasons étant connectés à deux pièces à main distinctes. Par la suite les améliorations de la phacoémulsification coaxiale ont permis de s’approcher puis de passer sous la barre des 2 mm. Aujourd’hui, la phacoémulsification micro-coaxiale a pris le pas sur la micro-bi-axiale essentiellement pour deux raisons :
– l’implantation nécessite le plus souvent un élargissement de l’incision initiale, car les implants actuels ne sont pas adaptés à des incisions dont la taille est inférieure à 1,6 mm ;
– malgré d’importants progrès, l’équilibre hydrodynamique est plus difficile à obtenir en phacoémulsification bi-axiale qu’en coaxiale : la sécurité peropératoire s’avère donc plus aléatoire entre des mains moins entraînées.
C’est Jorge Alió, en 2005, qui a proposé le terme de MicroIncision Cataract Surgery (MICS) pour désigner la chirurgie de la cataracte par micro-incision. Il entendait par là une incision de taille inférieure à 2 mm (fig. 7-14). Il présente les résultats d’une étude prospective non comparative observationnelle de quarante-cinq cas opérés à travers des incisions de 1,9 mm utilisant une technique bi-axiale [3].
L’évolution rapide des technologies a ensuite rendu possible la phacoémulsification par des incisions de moins de 2 mm à l’aide de technique coaxiale proche des techniques de référence.
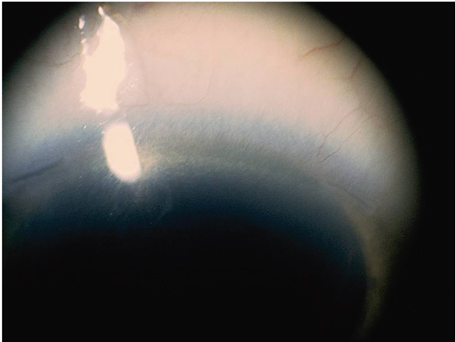
Fig. 7-14 Micro-incisions bi-axiale de 1,7 mm.
Les premières publications concernant la chirurgie par micro-incision remontent au milieu des années soixante-dix et aux années quatre-vingt [38, 42, 94, 93]. En 1985, c’est à Shearing [93] qu’on attribue la séparation des ultrasons et de l’irrigation. Il publie une série de phacoémulsifications par 1 mm. Amar Agarwal, en Inde, popularise la phacoémulsification bi-axiale par 0,9 mm à partir de 1999 [1, 2] ; il dénomme cette technique PHAKONIT (N pour needle, I pour incision, T pour tip).
En 2002, Hiroshi Tsuneoka publie les résultats de la première grande série non comparative de six cent trente-sept phacoémulsifications bi-axiales par des incisions inférieures à 1,4 mm [98]. Il considère cette technique comme sûre, ne rapporte pas de brûlure cornéenne et retrouve des pertes endothéliales de 4,6 %, selon lui comparables aux techniques de référence.
Suite aux avancées importantes dues à la phacoémulsification bi-axiale, la phacoémulsification coaxiale a progressé jusqu’à permettre des interventions par moins de 2 mm. Ces technologies ont été qualifiées de phacoémulsifications micro-coaxiales. Elles répondent à la définition proposée par Alió.
C’est le matériau des implants qui détermine cette catégorie d’incision. En effet, les matériaux acryliques hydrophobes ne pouvant pas être injectés par des incisions inférieures à 2 mm, un environnement technique et technologique a été développé autour d’incisions de 2,2 mm, qualifiées par certains de mini-incision et rattachées par d’autres à la micro-incision coaxiale.
Il est donc délicat d’opposer mini-incision et micro-incision dans la mesure où la phacoémulsification coaxiale permet les deux et que seule l’implantation les différencie. Les résultats réfractifs sont proches. L’astigmatisme induit est difficile à distinguer. Entre 1,6 et 2,2 mm, le comportement postopératoire dépend plus du type de lentille intraoculaire que de la taille d’incision. Ce sont donc les techniques bi-axiales et coaxiales ou les comportements des lentilles intraoculaires en fonction de leur matériau qui pourraient être opposés.
Un des intérêts de la chirurgie de la cataracte par micro-incision réside dans la réduction de l’astigmatisme chirurgicalement induit [3, 22, 24, 29, 44, 45, 50, 54, 62, 102, 105]. En pratique, ces techniques comportent d’autres avantages, permettant une récupération plus rapide dans de meilleures conditions de sécurité opératoires et postopératoires comparées aux incisions de taille standard (autour de 3 mm).
Un certain nombre de principes de base sont connus de longue date. Les incisions induisent moins d’astigmatisme d’autant qu’elles sont plus éloignées de l’axe optique [45] et qu’elles sont de petite taille [3, 22, 24, 29, 44, 45, 50, 54, 62, 102, 105]. En moyenne, le limbe est plus éloigné de l’axe optique sur le méridien vertical que sur le méridien horizontal. C’est donc logiquement que, à taille égale, les incisions temporales sont moins astigmatogènes que les incisions supérieures [97]. Pour un site donné, quelle est la taille d’incision en deçà de laquelle l’incision n’influence plus l’astigmatisme chirurgicalement induit ?
Concernant les incisions de taille standard, Khonen compare des incisions cornéennes temporales de 3,5 mm, 4 mm et 5 mm [52]. L’astigmatisme chirurgicalement induit est significativement plus faible dans le groupe 3,5 mm que dans le groupe 4 mm (p < 0,05) et le groupe 5 mm (p < 0,005) après six mois. Tejedor retrouve une différence significative en fonction du site pour des incisions de 2,8 mm [97], l’astigmatisme chirurgicalement induit étant plus faible si l’incision est placée dans le secteur temporal, puis nasal, puis supérieur.
En 2005 Jorge Alió [3], pionnier de la phacoémulsification bi-axiale, publie une série de cent cas comparant des incisions de 1,5 mm bi-axiales et 2,8 mm coaxiales. Outre une réduction significative du temps effectif de phacoémulsification, il retrouve une réduction significative de l’astigmatisme chirurgicalement induit moyen dans le groupe « micro-incisions » : 0,43 D contre 1,2 D. Yao compare des incisions de 1,7 mm et 3,2 mm [105] et montre une réduction significative de l’astigmatisme chirurgicalement induit dans le groupe « micro-incisions » : 0,78 D contre 1,29 D.
D’autres auteurs ne mettent pas en évidence de différence significative [29, 54, 68]. Kurtz [54] montre une réduction du temps effectif de phacoémulsification et une récupération plus rapide de l’acuité visuelle postopératoire mais pas de différence significative en termes d’astigmatisme chirurgicalement induit entre des incisions bi-axiales de 1,5 mm et des incisions coaxiales de 2,75 mm (0,15 D contre 0,31 D), ni en termes de perte endothéliale ou de mesure au laser flare.
Masket a publié une étude comparant avantageusement les incisions de 2,2 mm coaxiales par rapport à celles de 3 mm en termes d’astigmatisme induit (0,35 ± 0,21 D par 2,2 mm et 0,67 ± 0,48 D par 3,0 mm ; p = 0,006) [62]. Hayashi retrouve également une différence significative entre des incisions de 2,0 mm coaxiales par rapport à celles de 2,65 mm en termes d’astigmatisme induit (0,56 D par 2,0 mm et 0,74 D par 3,0 mm) [44]. Le même démontre que l’astigmatisme chirurgicalement induit est plus important pour des incisions de 3 mm cornéennes comparées à des incisions sclérales de même taille [45] ; cette différence disparaît à partir de 2 mm et en dessous.
Peu d’études ont comparé micro-incisions et mini-incisions. Can montre une différence significative d’astigmatisme chirurgicalement induit entre des incisions de 2,8 mm, 2,2 mm et 1,4 mm, avec des valeurs de 0,46 D, 0,24 D et 0,13 D [22]. Lee, dans une étude prospective randomisée incluant quatre-vingt-six yeux [55], ne montre pas de différence en termes d’astigmatisme chirurgicalement induit entre des incisions de 2,2 mm et 1,8 mm.
En 2009, Wilczinski retrouve des valeurs faibles et proches d’astigmatisme induit en utilisant des incisions coaxiales de 1,8 mm et bi-axiales de 1,7 mm (0,42 ± 0,29 D contre 0,5 ± 0,25 D) [103], les pertes endothéliales étant par ailleurs comparables dans les deux groupes [104].
Outre la comparaison entre les différentes tailles d’incisions et les différentes techniques, il est intéressant de constater que les valeurs moyennes d’astigmatisme chirurgicalement induit peuvent varier d’une étude à l’autre : de 0,13 D [22] à 0,78 D [105] pour les micro-incisions et de 0,24 D [22] à 0,4 D [102] pour les mini-incisions. S’il semble délicat de distinguer nettement micro- et mini-incisions en termes d’astigmatisme chirurgicalement induit, les valeurs, dans la majorité des études, sont faibles et permettent une assez bonne prédiction autour de 2 mm.
Outre l’astigmatisme chirurgicalement induit, Denoyer montre que des micro-incisions bi-axiales de 1,7 mm comparées à des incisions coaxiales de 2,8 mm améliorent les performances optiques postopératoires en limitant les aberrations de hauts ordres induites par la chirurgie [29]. Yao trouve des résultats comparables [105].
S’il est possible de choisir une incision destinée à réduire l’astigmatisme induit (courte et temporale), il est également possible de faire varier les caractéristiques de l’incision pour réduire l’astigmatisme préopératoire en l’absence d’utilisation d’implant torique. Cette action est multiparamétrique et peu précise, mais des tendances peuvent se dégager. Bien qu’il soit utile de s’éloigner de l’axe optique pour limiter l’astigmatisme induit, il faut signaler que la plupart des chirurgiens ont abandonné les incisions sclérales, en particulier dans le secteur temporal où elles sont peu confortables et peu esthétiques. Il est par ailleurs démontré que cela est inutile en dessous de 2 mm [45].
S’il n’existe pas ou peu d’astigmatisme cornéen préopératoire (inférieur ou égal à 0,75 D), une incision la plus courte possible située dans le secteur temporal sera le mieux à même de préserver l’astigmatisme préopératoire. S’il existe un astigmatisme inverse préopératoire, l’utilisation d’une incision temporale standard (3 mm) limitera l’astigmatisme inverse induit par une incision supérieure et pourra éventuellement corriger une partie de l’astigmatisme préopératoire. La limite en termes de taille est constituée par la sécurité postopératoire : l’incision n’étant pas suturée, il existe un risque de défaut d’étanchéité, d’autant qu’elle aura été sollicitée au cours de l’intervention.
S’il existe un astigmatisme préopératoire significatif conforme ou oblique (supérieur à 0,75 D), une incision de taille standard sur le méridien le plus cambré pourra avoir un effet correcteur.
En cas d’utilisation d’un implant torique, on choisit habituellement une incision la plus neutre possible afin de mieux prédire le résultat final. Cette incision sera donc la plus courte possible et située sur le site temporal, éloignée de l’axe optique. L’astigmatisme chirurgicalement induit limité permet de mieux prévoir l’astigmatisme final.
Outre la réduction de l’astigmatisme chirurgicalement induit, la micro-incision présente d’autres avantages diversement appréciés dans la littérature. Les mini-incisions et micro-incisions n’étant habituellement pas suturées, leur taille réduite accroît la sécurité postopératoire en limitant théoriquement le risque de fuite ou de contamination pour peu qu’elles aient été bien structurées et convenablement préservées pendant la chirurgie.
La rupture de la barrière hématoaqueuse est proportionnelle à la taille de l’incision. Il est connu de longue date que la réduction de la taille d’incision limite l’inflammation postopératoire. Chee a comparé des extractions extracapsulaires à la phacoémulsification et retrouve des valeurs significativement moindres de flare dans le second groupe [26]. Les valeurs se normalisent au premier mois pour le groupe des phacoémulsifications et au second mois pour le groupe des extractions extracapsulaires. En est-il de même entre des incisions standards et des micro-incisions ? Kahraman ne retrouve pas de différence significative en termes de flare entre des incisions 3,2 mm et des incisions bi-axiales de 1,4 mm élargies pour l’implantation [49]. Kurz arrive aux mêmes conclusions entre des incisions de 2,75 mm et des incisions de 1,5 mm [54], même si l’efficacité ultrasonique est supérieure et l’acuité visuelle finale acquise plus rapidement dans le groupe « micro-incision ».
Lundström a montré que les incisions cornéennes et/ou la localisation temporale accroissaient le risque d’endophtalmie d’un cas pour 5 500 procédures par rapport à des incisions sclérocornéennes et/ou supérieures [60]. Le plus souvent, un défaut d’affrontement des berges est retrouvé [64]. La réduction de taille d’incisions réduit théoriquement le risque de contamination postopératoire. Cependant, il semble que la préservation de la structure incisionnelle doive être prise en considération, en particulier concernant la phacoémulsification bi-axiale pour laquelle l’absence de manchon en silicone et la taille très réduite des incisions peuvent constituer des facteurs traumatiques menant à un défaut d’étanchéité.
Si Kahraman [49] retrouve des pertes endothéliales supérieures dans un groupe d’incisions bi-axiales 1,4 mm comparé à des incisions coaxiales de 3,2 mm, la majorité des auteurs [24, 66, 104] ne montre pas de différence significative de pertes endothéliales entre micro-incision bi-axiale et micro-incision coaxiale.
L’incidence de la chirurgie de la cataracte non compliquée sur la rétine dépend essentiellement des tractions mécaniques par des adhérences vitréorétiniennes et de la production de prostaglandines dues à la rupture de la barrière hématoaqueuse et à la libération de radicaux libres dans la période postopératoire due à la plus grande exposition rétinienne à la lumière. Il est possible que la réduction de la taille des incisions, par la limitation des traumatismes peropératoires, puisse avoir un effet favorable.
Deux principales techniques permettent de réaliser une phacoémulsification par mini- ou micro-incision : bi-axiale, pour laquelle l’irrigation est séparée des ultrasons, et coaxiale. Si la technique coaxiale est dans son principe assez proche de la technique standard et ne nécessite habituellement que quelques cas pour démarrer, il n’en va pas de même pour la technique bi-axiale. Par ailleurs, les lasers femtoseconde destinés à la chirurgie de la cataracte font leur apparition (cf. infra). La réalisation automatisée, assistée par OCT, des incisions, du capsulorhexis et du traitement du noyau facilite le traitement de la cataracte par des micro-incisions.
C’est cette technique – même si elle ne s’est pas imposée actuellement – qui permet les plus petites tailles d’incisions (fig. 7-15). L’avènement de nouveaux implants et de nouvelles cartouches est susceptible de lui procurer un regain d’intérêt dans le futur si elle n’est pas supplantée par le laser femtoseconde. Elle nécessite une certaine habileté chirurgicale, sa courbe d’apprentissage peut inclure quelques dizaines de cas et elle ne peut devenir routinière que par une utilisation systématique. Elle requiert une instrumentation spécifique (couteaux, pinces à capsulorhexis, irrigateur). L’absence de manchon coaxial en silicone rend plus aléatoire l’équilibre fluidique, d’autant que l’infusion est réduite et le risque de dommage à l’incision accru dans un premier temps. Enfin, si la taille d’incision est inférieure à 1,7 mm, un agrandissement préalable à l’injection est le plus souvent requis. Les principaux écueils sont constitués par les incisions, qui doivent être construites de manière très rigoureuse et de taille adéquate, par la réalisation du capsulorhexis à l’aiguille ou à la pince à commande distale, par le maintien de la chambre antérieure pendant la phase de quadrant en particulier à la désocclusion. Les réglages hydrodynamiques sont plus délicats au départ et doivent tenir compte de tous les éléments de chaque configuration.
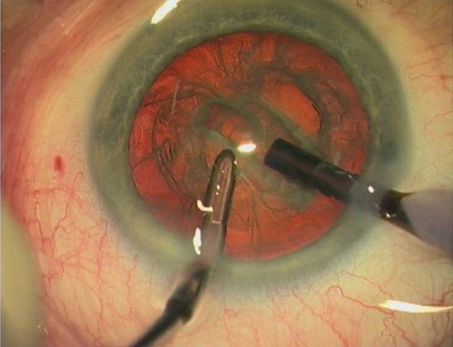
Fig. 7-15 Phacoémulsification micro-bi-axiale par 1,6 mm.
La phacoémulsification coaxiale ne nécessite que peu de modifications de la technique chirurgicale habituelle. Elle peut être réalisée à l’aide d’ultrasons longitudinaux, torsionnels ou mixtes. Certaines études [87] montrent une plus grande efficacité des ultrasons torsionnels par rapport aux ultrasons longitudinaux (vidéo 7-3). Cette technique ne nécessite pas ou peu de modifications des paramètres de la machine et sa courbe d’apprentissage est très brève, d’autant que l’infusion est bien préservée. L’équilibre hydrodynamique, y compris à la désocclusion, est aisé à maintenir. Aucune instrumentation spécifique n’est nécessaire en dehors d’une pince à capsulorhexis adaptée à des incisions comprises entre 1,8 mm (fig. 7-16) et 2,2 mm.
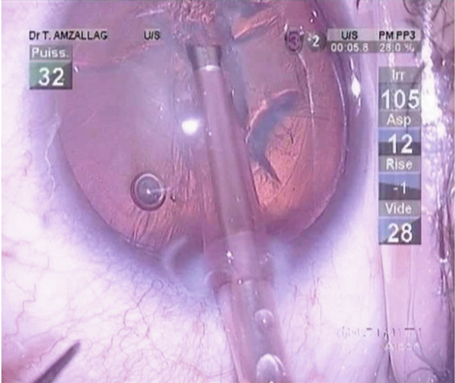
Fig. 7-16 Phacoémulsification micro-coaxiale par 1,8 mm.
Les lentilles destinées aux micro-incisions (fig. 7-17) doivent répondre à un cahier des charges incluant la déformabilité permettant de passer sans dommage à travers la micro-incision, mais produisant également un comportement intrasacculaire postopératoire équivalent à celui des meilleures lentilles existantes.
Il faut distinguer deux grandes catégories de lentilles intraoculaires :
– celles destinées aux incisions supérieures 2,0 mm, qui sont des implants monoblocs déjà utilisés à travers des incisions de taille standard, faits d’acrylique hydrophobe ou hydrophile au comportement éprouvé ;
– celles destinées aux incisions de moins de 2 mm, qui sont le plus souvent des implants en acrylique hydrophile et adoptent des dessins spécifiques destinés à améliorer leur comportement postopératoire.
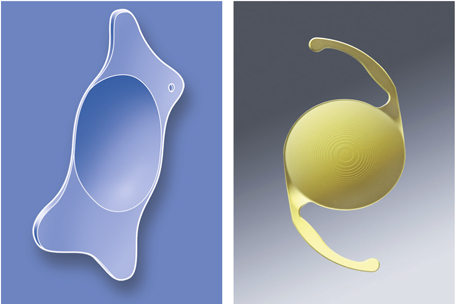
Fig. 7-17 Lentilles intraoculaires destinées aux micro-incisions et mini-incisions.
C’est essentiellement le matériau qui détermine la taille d’incision. Il détermine également en partie (avec le dessin) le comportement intraoculaire postopératoire de l’implant. Il existe deux principales catégories de matériaux : les acryliques hydrophobes et les acryliques hydrophiles [7]. Les silicones ne sont pas utilisés pour la micro-incision. Les lentilles intraoculaires faites de matériaux acryliques hydrophobes, dont les qualités optiques et le comportement postopératoire sont réputés et démontrés, ne peuvent pas encore rivaliser avec celles faites d’acryliques hydrophiles, plus déformables, en termes de taille d’incision. Pour ces matériaux hydrophobes, les tailles possibles d’incisions se situent actuellement autour de 2,2 mm si l’injection est pratiquée en chambre antérieure et autour de 2 mm si l’injection est réalisée à la berge. Les matériaux acryliques hydrophiles, forts de leur déformabilité, peuvent être injectés par des incisions de 2 mm en chambre antérieure et moins de 1,8 mm à la berge.
Un matériau résistant au stress mécanique est une condition préalable à la conception d’une lentille intraoculaire destinée à la micro-incision. En effet, il doit permettre le passage de l’implant à travers le tunnel d’injection d’une cartouche dont le diamètre interne est inférieur à 1,30 mm pour des tailles d’incisions inférieures à 2 mm, voire 1,10 mm pour des tailles d’incisions inférieures à 1,5 mm. Ce matériau doit donc accepter sans dommage les contraintes très importantes de la micro-injection. Ici, des propriétés comme la déformabilité ou la résistance à la déchirure s’avèrent plus importantes que, par exemple, l’indice de réfraction qui permet pourtant de réduire les épaisseurs des optiques. Ce sont probablement de nouveaux matériaux qui nous mèneront vers des incisions encore plus petites, avec un comportement encore meilleur et des capacités optiques supérieures.
Si le matériau joue un rôle indéniable pour réduire la taille des incisions, il joue également un rôle dans le comportement intrasacculaire postopératoire [5] : opacification de la capsule postérieure, opacification de la capsule antérieure, rétraction sacculaire et stabilité de la lentille intraoculaire.
Avec la diminution croissante de la taille des incisions, de nouvelles études prospectives devront confirmer le bon comportement des nouveaux produits. Modifier le matériau ou le dessin d’une lentille intraoculaire même de manière minime n’est jamais anodin d’un point de vue biologique.
Les premiers implants destinés à la micro-incision avaient pour principal objectif la taille d’incision plus que le comportement postopératoire. Faits d’acrylique hydrophile, particulièrement fins, dénués de barrière postérieure sur 360°, ils comportaient deux zones d’appui équatoriales, les rendant susceptibles de favoriser des opacifications capsulaires postopératoires précoces, des contractions sacculaires excessives pouvant aller jusqu’au capsulophimosis, voire des subluxations. Les modèles suivants ont tenu compte de ces points faibles pour un meilleur comportement à moyen et long terme.
Le volume de l’optique doit être réduit afin de respecter la micro-incision. Le diamètre de la zone optique doit cependant se situer aux alentours de 6,00 mm à + 20 D. Diminuer ce diamètre à 5,00 mm voire moins pour réduire les épaisseurs centrales des implants et donc leur volume lors de l’injection fait courir le risque d’observer des aberrations optiques gênantes pour le patient si un décentrement même faible apparaît. La plupart des modèles récents ont été munis d’une barrière postérieure circulaire destinée à limiter la migration cellulaire et l’opacification capsulaire postérieure.
Tous les implants destinés à la micro-incision sont monoblocs. Les haptiques sont conçues pour stabiliser l’optique de la lentille intraoculaire et éviter tout déplacement lors de la contraction sacculaire postopératoire. Leur angulation postérieure peut également contribuer à la limitation de l’opacification capsulaire postérieure par accroissement de l’angulation capsulaire postérieure précocement après l’intervention. Ces haptiques doivent accepter 1 mm à 2,00 mm de compression dans le sac capsulaire sans décentrement de l’optique. Ce point est d’autant plus important que la réduction d’épaisseur des implants, facteur indispensable pour espérer passer par une petite incision, modifie de façon importante la stabilité de l’implant et oblige de ce fait à reconcevoir totalement les anses pour les adapter à cette situation nouvelle. Des anses larges, multiples pour répartir les efforts, voire angulées pour accentuer la pression sur la capsule postérieure et ainsi renforcer l’effet de la barrière de 360°, sont autant d’éléments favorables. Les feuillets capsulaires antérieur et postérieur ont ainsi la possibilité d’adhérer précocement l’un à l’autre.
L’aptitude effective à la micro-incision dépend du matériau (déformable et résistant), du dessin (volume et forme compatibles avec une injection par une cartouche de petit diamètre) et du système d’injection (en particulier la cartouche). C’est la cartouche qui détermine la taille de l’incision après injection, en particulier son diamètre interne à l’extrémité dans le cas d’une injection « à la berge » (sans introduire le biseau dans la chambre antérieure).
Les injecteurs destinés aux mini-incisions sont assez proches des injecteurs habituels. Ils sont fréquemment le fruit d’une adaptation d’injecteurs classiques et de leurs cartouches aux contraintes mécaniques d’incisions autour de 2,2 mm. En revanche, implanter à travers une micro-incision inférieure à 2 mm nécessite l’utilisation d’injecteurs dédiés [8] (fig. 7-18).
La plupart des injecteurs destinés à la micro-incision présentent une structure comparable. Le corps de l’injecteur à usage unique est fait de matière plastique. Le piston, de type seringue, permet une injection par pression simple, monomanuelle, particulièrement utile si une contre-pression est nécessaire à l’aide d’un second instrument. Ce piston est muni d’un ressort de rappel qui accroît sa précision et facilite son rappel en fin d’injection. L’embout de piston en silicone déformable permet une visco-injection qui facilite et sécurise l’injection. Le principe de visco-injection, ou injection hydraulique, associant un embout de piston souple fréquemment fait de silicone et l’emploi d’une substance viscoélastique, est utilisé par la plupart des chirurgiens utilisant des tailles d’incisions inférieures à 2 mm. Il est en pratique très pertinent. En effet, ce dispositif permet de maintenir la substance viscoélastique et la lentille intraoculaire constamment en avant de l’embout de piston. Cela présente le double avantage de préserver les haptiques lors de l’injection – elles ne peuvent pas être coincées par l’embout – et de faciliter la poussée sur le piston lors du passage par des diamètres très réduits. Les injections en sont grandement facilitées et sécurisées. Par ailleurs, la déformabilité de cet embout de piston évite l’éclatement du tunnel ou du biseau de la sonde auxquels exposerait un embout rigide imposant une taille déterminée. La cartouche à ailettes est de type Bartel, proche de celle que nous utilisons habituellement pour des incisions de taille standard. Elle est généralement faite de polypropylène et possède des capacités de glissement accrues par l’association au matériau d’un agent glissant ou par un traitement de surface. Il existe une règle théorique permettant d’approcher la mesure incisionnelle post-implantation en fonction du diamètre interne ou externe de la cartouche et en fonction de la technique d’injection utilisée. Pour les injections à la berge, on utilise la valeur de diamètre interne, alors que pour les incisions avec introduction du biseau dans la chambre antérieure, on utilise la valeur du diamètre externe. Globalement, une incision de moins de 2,00 mm signifie un diamètre interne de cartouche de moins de 1,40 mm, et une incision de 1,50 mm une cartouche de moins de 1,10 mm. Pour réaliser la performance technologique que représente ce type de cartouche, gardons à l’esprit que le diamètre de l’optique est généralement de 6 mm. Pour revendiquer de telles tailles d’incision, les lentilles intraoculaires doivent pouvoir passer par ces diamètres réduits à toutes les puissances disponibles sans dommage pour l’implant, mais également sans dommage pour la cartouche, que ce soit le dommage important avec éclatement de l’extrémité, le dommage moyen avec blanchiment et microfracture de l’extrémité ou même le dommage minime qui se traduit par le phénomène de « fish mouth », ou élargissement de l’extrémité de la cartouche. Une cartouche endommagée peut s’avérer en effet particulièrement délétère pour l’implant qui peut alors présenter des dommages variables, depuis la microdéchirure linéaire dans la région optique paracentrale jusqu’à la rupture d’anses, parfois couplée à une large déchirure optique.
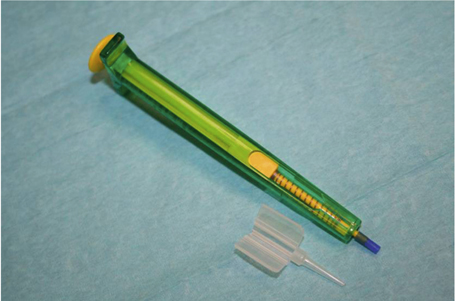
Fig. 7-18 Injecteur destiné aux micro-incisions.
L’injection à travers une mini-incision de 2,2 mm ou plus rejoint les règles habituelles d’injection. Elles sont réalisées en chambre antérieure, le biseau de la cartouche étant introduit à travers l’incision et l’implant injecté directement dans le sac capsulaire.
En revanche, pour injecter une lentille intraoculaire à travers une incision dont la taille est comprise entre 1,5 mm et 2 mm, une technique de visco-injection à la berge est généralement requise (fig. 7-19) [8] (vidéos 7-4 et 7-5). Elle concerne principalement des lentilles intraoculaires monoblocs faites d’acrylique hydrophile. Un certain nombre de règles sont à retenir. La construction de l’incision doit être rigoureuse et sa taille adéquate au système d’injection, afin d’assurer l’étanchéité après injection. La chambre antérieure est pressurisée par injection de substance viscoélastique de préférence cohésive. La lentille intraoculaire est chargée de manière rigoureuse, afin d’éviter que les haptiques ne soient endommagées lors de l’injection. L’embout de piston est fait de silicone et donc déformable. Son introduction dans la chambre de chargement s’effectue lentement, afin de laisser à l’embout de piston le temps de se déformer et de se positionner convenablement. Une position inadéquate de l’embout souple peut provoquer l’éclatement de la cartouche. L’implant est poussé vers le tunnel d’injection sous contrôle de la vue. L’embout commence alors à s’étirer à mesure que le diamètre diminue. La poussée est facile du fait du caractère hydraulique de l’injection. L’injection doit être réalisée dans la foulée, sans temps de latence. L’injecteur doit être maintenu dans un plan horizontal afin de suivre le plan de construction de l’incision, et non incliné vers l’arrière comme pour une injection dans la chambre antérieure. Une contre-pression est exercée par la seconde incision à l’aide d’un manipulateur. La lentille intraoculaire est ensuite positionnée dans le sac capsulaire.
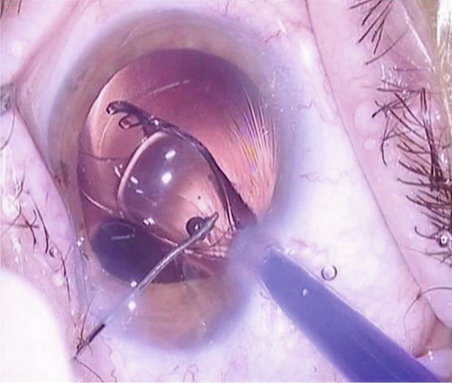
Fig. 7-19 Technique d’injection par micro-incision à la berge.
Les implants intraoculaires destinés à compenser la presbytie doivent, outre être adaptés à la micro-incision ou la mini-incision, adopter un comportement postopératoire au moins équivalent à celui des meilleures lentilles intraoculaires destinées à des incisions standards, tant en termes d’opacification de la capsule postérieure, d’opacification de la capsule antérieure que de stabilité intrasacculaire. Les implants destinés aux incisions de 2,2 mm ont un comportement équivalent à ceux destinés aux incisions standard. Les lentilles intraoculaires spécifiques aux incisions inférieures à 2 mm sont faites de matériaux acryliques hydrophiles et adoptent des dessins variés destinés à améliorer leur comportement. Celui-ci peut donc varier en fonction de la nature du matériau et du dessin utilisés.
L’opacification de la capsule postérieure est la complication la plus fréquente à long terme après chirurgie de la cataracte. La capsulotomie au laser YAG, surtout si elle est précoce et pratiquée chez un patient jeune, est associée à des complications potentielles qu’il est souhaitable d’éviter [18] chez l’opéré presbyte. Par ailleurs, il semblerait que les patients porteurs de lentilles intraoculaires multifocales soient fonctionnellement plus sensibles à l’opacification de la capsule postérieure que les porteurs de monofocaux [31, 85], ce qui peut mener à un capsulotomie plus fréquente et plus précoce.
Outre la technique chirurgicale, les caractéristiques de la lentille intraoculaire, matériau et dessin, interviennent dans la limitation de l’opacification de la capsule postérieure. À l’heure actuelle, seuls les matériaux acryliques hydrophiles sont couramment utilisés pour les implants destinés aux micro-incisions. Les spécificités du dessin des lentilles intraoculaires destinées à la micro-incision – plus faible volume, nécessaire résistance mécanique à l’injection à travers des cartouches dont le diamètre interne est de l’ordre de 1,3 mm – rendent plus sensible la lutte contre l’opacification de la capsule postérieure.
Les phénomènes de cicatrisation postopératoire sont dus à la prolifération de cellules résiduelles du sac capsulaire [10]. Ce sont principalement les cellules équatoriales qui interviennent lors de la survenue de l’opacification de la capsule postérieure. Ces cellules migrent et prolifèrent, formant à l’équateur l’anneau de Soemmering et sur la capsule postérieure des perles d’Elschnig. La prévention de l’opacification de la capsule postérieure comprend donc actuellement, du fait de sa pathogenèse, deux principales stratégies :
– limiter le nombre de cellules épithéliales cristalliniennes et le cortex résiduel lors de la procédure chirurgicale par la qualité du geste opératoire ;
– contenir la prolifération et la migration des cellules épithéliales cristalliniennes résiduelles en dehors de l’optique de l’implant par la création d’une barrière mécanique liée à l’implant. C’est là qu’interviennent certaines caractéristiques de l’implant, dont sa morphologie.
La géométrie des implants ne peut être considérée de manière isolée mais s’intègre dans une interprétation multifactorielle. David Apple, suite à une série d’examens post mortem [11], propose six facteurs chirurgicaux ou liés à l’implant susceptibles de limiter l’opacification de la capsule postérieure :
– la qualité de l’hydrodissection ;
– le positionnement de l’implant dans le sac capsulaire : nécessaire à l’amélioration de l’effet barrière de l’optique [84] ; celui-ci est maximal lorsque l’implant est strictement dans le sac capsulaire et en contact direct avec la capsule postérieure ;
– un capsulorhexis plus petit que l’optique, aidant à séquestrer l’optique dans le sac capsulaire par rapport à l’humeur aqueuse : placer le rhexis sur le bord de l’optique aide à créer un rapport étroit avec la capsule postérieure ;
– la biocompatibilité de l’implant ;
– l’angulation postérieure de la lentille intraoculaire et la convexité postérieure [10, 41] : tout ce qui peut créer un rapport intime entre la capsule postérieure et la face postérieure de la lentille intraoculaire est efficace ; une relative adhésivité du matériau peut favoriser ce phénomène [19, 56-59, 71, 80] ;
– un effet barrière de l’optique comme une seconde ligne de défense vis-à-vis du matériel cortical ou des cellules résiduelles [41, 43, 70, 76, 77, 80, 84].
Dans une revue Cochrane, Findl a analysé cinquante-trois essais randomisés, contrôlés et prospectifs évaluant l’impact de différents facteurs sur l’opacification de la capsule postérieure [32]. Ces facteurs incluent une modification de la technique chirurgicale spécifiquement destinée à limiter l’opacification de la capsule postérieure, des modifications du design de la lentille intraoculaire (matériau et dessin), l’implantation de dispositifs médicaux additionnels ainsi que la thérapie pharmacologique. Toutes les études incluses dans la revue ont duré au minimum douze mois. L’effet de l’intervention sur l’opacification de la capsule postérieure a été évalué en mesurant l’acuité visuelle (subjective ou objective), les scores d’opacification de la capsule postérieure et le nombre de capsulotomies au laser Nd:YAG. Les résultats de cette revue revêtent trois aspects :
– le taux d’opacification de la capsule postérieure est influencé par le matériau, avec un avantage à l’acrylique hydrophobe par rapport à l’acrylique hydrophile ;
– les taux d’opacification de la capsule postérieure sont significativement plus faibles pour les lentilles intraoculaires présentant un bord postérieur carré que pour les lentilles intraoculaires présentant un bord arrondi ; aucune différence n’est retrouvée entre les lentilles intraoculaires monoblocs et celles de type trois-pièces ;
– influence de la technique chirurgicale et des traitements pharmacologiques : une étude a retrouvé des taux d’opacification de la capsule postérieure plus faibles pour les lentilles intraoculaires placées dans le sac capsulaire que pour les lentilles intraoculaires placées dans le sulcus ; une autre étude a mis en évidence de plus faibles taux d’opacification de la capsule postérieure dans les yeux opérés avec un petit rhexis que dans les yeux opérés avec de plus grand rhexis.
Très peu d’études comparent les taux d’opacification de la capsule postérieure entre des lentilles intraoculaires destinées à des micro-incisions ou à des mini-incisions. Gauthier, dans une étude rétrospective incluant cent cinquante-six patients avec un recul de deux ans [36], retrouve un taux de capsulotomies inférieur dans le groupe des lentilles intraoculaires multifocales acryliques hydrophobes (incisions de 2,2 mm) versus acrylique hydrophile (incisions inférieures à 2 mm) à dix-huit mois (4,4 % contre 14,6 %) et à vingt-quatre mois (8,8 % contre 37,2 %) avec un risque relatif de 4,5 fois. Concernant le matériau, ses résultats rejoignent ceux de la revue Cochrane [32].
Les premières lentilles intraoculaires destinées à la micro-incision étaient faites d’acrylique hydrophile et adoptaient des dessins à deux zones d’appuis sans bords carrés postérieurs. Certains d’entre elles présentaient non seulement des taux élevés d’opacification de la capsule postérieure mais également des capsulophimosis et des décentrements pouvant mener à une explantation. Par la suite, l’important travail réalisé sur les dessins a permis une nette amélioration de la stabilité de ces lentilles intraoculaires qui, pour la grande majorité d’entre elles, sont devenues fiables [3, 4, 6] tant sur le plan antéropostérieur que sur le plan frontal.
D. Smadja, D. Touboul, J. Colin
L’objectif principal du traitement de la cataracte s’est toujours résumé à sa cure chirurgicale pour lever le handicap visuel causé par l’opacification du cristallin. L’erreur réfractive résiduelle, le retard de récupération visuelle postopératoire ainsi que le risque d’éventuelles complications peropératoires ont toujours été relativement tolérés, à la fois par les ophtalmologistes et les patients. Cependant, avec les avancées technologiques de ces dernières années, telles que le développement d’implants dits « premiums » comprenant les implants toriques, multifocaux et accommodatifs, ainsi que l’apparition de nouvelles techniques chirurgicales micro-incisionnelles, les objectifs ancestraux de la chirurgie de la cataracte ont basculé aujourd’hui vers une exigence qui rejoint celle des chirurgies à visée réfractive. Ils tendent à la fois vers l’excellence en termes d’acuité visuelle et proposent des solutions afin de surmonter les symptômes de la presbytie.
C’est dans ce contexte toujours plus exigeant, que le laser femtoseconde a été introduit pour aider à la réalisation des étapes les plus délicates de la chirurgie de la cataracte : incisions cornéennes principales, capsulorhexis, nucléofragmentation et incisions relaxantes pour la correction de l’astigmatisme.
La technologie femtoseconde pour la chirurgie de la cataracte a déjà prouvé à ce jour son efficacité et garantit une chirurgie encore plus sûre, notamment dans les cas les plus compliqués. Nous discutons dans ce chapitre l’aide apportée par le laser femtoseconde au cours des différentes étapes de la chirurgie de la cataracte, en nous appuyant sur les récents résultats cliniques publiés dans la littérature. Le tableau 7-I résume les avantages et inconvénients de la technologie phaco-laser développée ci après.
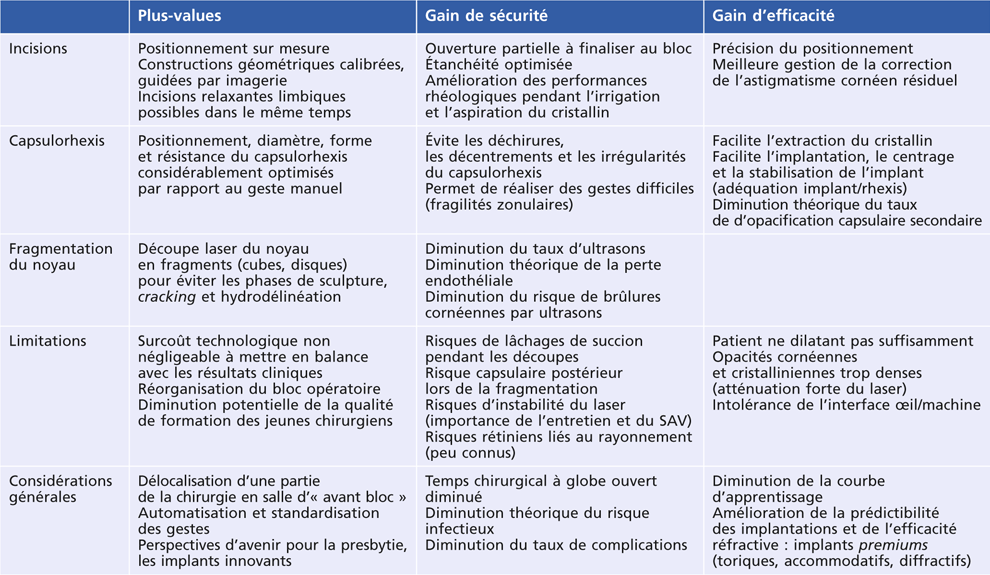
Tableau 7 Avantages et inconvénients des phaco-lasers femtoseconde.
À ce jour, cinq plateformes proposent la technologie femtoseconde pour la chirurgie de la cataracte, à des stades de développement différents. Le laser LenSx® (Alcon) est le seul système commercialisé (depuis fin 2010). Ce laser est déjà entré dans la pratique courante de nombreux centres privés et universitaires aux États-Unis, ainsi qu’à Sydney et Budapest. Le système LensAR® (LensAR Inc., Winter Park, FL) est déjà homologué par la FDA pour la réalisation du capsulorhexis et de la nucléofragmentation, sa commercialisation est attendue pour le premier trimestre 2012. Enfin, les mises sur le marché des systèmes OptiMedica Catalys® (OptiMedica Corporation, Santa Clara, CA) et CustomLens® (Technolas, Bausch & Lomb) sont prévues plus tard dans le courant de l’année 2012 (fig. 7-20), tandis que la plateforme Rowiak® (Rowiak GmbH), développée par l’équipe du Pr. Lubatschowski en Allemagne, est toujours en cours de développement. De toutes ces plateformes, le laser femtoseconde Technolas se distingue des autres par le couplage au sein du même système de son application cornéenne (LASIK et IntraCOR®) et cristallinienne (femtocataracte).
Ces lasers se différencient par un certain nombre de caractéristiques technologiques, telles que leurs systèmes d’aplanation et le design de l’interface œil/laser, ainsi que par les systèmes d’imagerie utilisés pour visualiser les structures intraoculaires et guider le traitement. L’enjeu de l’optimisation du design de l’interface œil/laser vise à diminuer au maximum le stress imposé au tissu cornéen au moment de la délivrance du traitement. Les aberrations optiques induites par les plis cornéens au moment de l’aplanation du dôme cornéen peuvent altérer la qualité du faisceau laser au moment de sa traversée et, ainsi, conduire à des capsulorhexis incomplets avec des brides résiduelles en regard de ces plis cornéens [27] (tags). Les lasers LenSx® et Technolas utilisent un système d’aplanation courbe permettant de diminuer la déformation du tissu cornéen au moment de la découpe, tandis que les lasers LensAR® et Optimedica sont équipés d’un système d’interface liquide maintenu à l’aide d’un anneau de succion.

Fig. 7-20 Les différentes plateformes des phaco-lasers femtoseconde en 2011. À ce jour, seul le système LenSx® est commercialisé et est utilisé en pratique clinique courante.
La délivrance du traitement laser au sein du cristallin est guidée par un système d’imagerie qui permet de scanner et de visualiser en temps réel les différentes structures intraoculaires. La visualisation de structures critiques, telles que la capsule postérieure, les bords de l’iris, la conformation et l’inclinaison précise de la lentille cristallinienne par rapport au plan de découpe ou encore la localisation précise des impulsions laser au sein du cristallin sont autant de paramètres qui potentialisent la sûreté du traitement et qui sont conditionnés par la qualité du système d’imagerie associé.
Les systèmes LenSx®, Optimedica et Technolas ont incorporé une tomographie en cohérence optique haute résolution (OCT-HR) qui permet de visualiser les structures intraoculaires du segment antérieur avant la délivrance du traitement. Une fois l’aplanation réalisée, les structures intraoculaires sont scannées de façon à positionner le traitement au sein du cristallin avant sa délivrance. Le système Technolas est le seul permettant de répéter l’imagerie au cours de la réalisation du traitement de façon à contrôler en temps réel la délivrance du traitement en profondeur. Le système Optimedica est équipé d’une OCT en domaine de Fourier améliorée qui permet à la fois d’identifier les structures critiques dans le segment antérieur (faces antérieure et postérieure de la cornée, faces antérieure et postérieure du cristallin) et de reconstruire en trois dimensions les structures intraoculaires en y superposant virtuellement les zones de sécurité à protéger lors du traitement (capsule postérieure et bords de l’iris). Le système LensAR® se distingue des trois autres lasers par l’utilisation d’un système d’imagerie unique, dénommé le 3D-CSI (Confocal Structured Illumination), qui combine l’imagerie confocale à haute résolution (fig. 7-21) et la fonction ray-tracing qui aide à la reconstruction précise des structures intraoculaires en trois dimensions. Ce système d’imagerie très perfectionné permet de calculer l’inclinaison de la lentille cristallinienne par rapport à l’axe optique, assurant ainsi une localisation très précise de la délivrance du traitement au sein du cristallin. Une autre spécificité de ce système d’imagerie réside dans sa capacité à fournir des images à fort contraste, même pour des cataractes très denses, en faisant varier la fréquence de balayage du scanner. Ces images sont ensuite analysées par un logiciel qui permet de déterminer le grade de la cataracte fondé sur le niveau de diffusion optique, et de proposer l’algorithme de traitement optimal pour fragmenter le noyau du cristallin.
Ronald Krueger, utilisateur du laser LensAR® (études cliniques en cours aux Philippines), a confirmé que ce système d’imagerie permettait une excellente visualisation de la capsule postérieure, y compris dans les cataractes de grade 5 (classification LOCS II). Zoltan Nagy, qui travaille avec le laser LenSx® à Budapest, a rapporté avoir traité jusque des grades 4 uniquement. Enfin, Juan Battle, qui travaille avec le laser Optimedica, a confié ne traiter que jusqu’aux grades 4, puisque la faible qualité de visualisation de la capsule postérieure dans les grades 5 ne permettait pas de délivrer le traitement en toute sécurité.
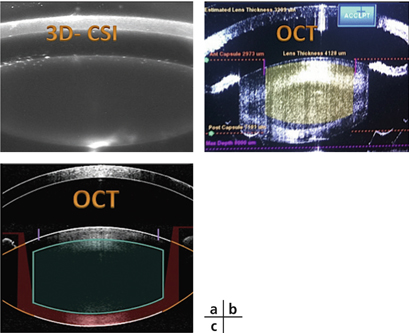
Fig. 7-21 Images obtenues par les différents systèmes d’imagerie.
a. Visualisation des structures intraoculaires avec le 3D-CSI (Confocal Structured Illumination) de LensAR®. b. OCT du LenSx®. c. OCT avec reconstruction en trois dimensions d’OptiMedica.
La principale préoccupation concernant les incisions en cornée claire au cours de la chirurgie de la cataracte réside dans sa relation avec le risque d’endophtalmie aiguë postopératoire. La construction des incisions cornéennes en cornée claire est d’une extrême importance, puisqu’il a été démontré que les incisions non étanches constituaient un facteur de risque majeur d’endophtalmie aiguë postopératoire [17, 101].
Le laser femtoseconde permet la réalisation d’incisions autoétanches en cornée claire de manière fiable et reproductible, garantissant ainsi un gain de sûreté au cours de la chirurgie de la cataracte [63]. Les différentes plateformes lasers femtocataracte disposent d’un système de programmation de ces incisions cornéennes. Ainsi, la géométrie des incisions, l’emplacement de l’incision principale et de sa paracentèse peuvent être facilement modifiés à la guise du chirurgien à l’aide d’une interface visuelle obtenue d’après l’imagerie enregistrée du segment antérieur (fig. 7-22).

Fig. 7-22 Interface de programmation du traitement laser avec la plateforme LenSx®. On peut observer l’architecture et les dimensions des trois types d’incisions désirées dans deux plans.
a. Vu d’en haut. b. Coupe sagittale. Primary incision (incision principale) avec la longueur de l’incision programmée à 2 mm (mentionné en violet) et sa position correspondante, en jaune, à 6 h sur la vue (a). c. Coupe sagittale. Secondary incision (paracentèse) avec une longueur d’incision programmée à 1,24 mm (mentionné en violet) et sa position correspondante, en orange, à 3 h sur la vue (a). d. Coupe sagittale. Arcuate incision (incision arciforme relaxante) programmée à une profondeur de 80 % de l’épaisseur cornéenne et sa position correspondante, en blanc, à 11 h sur la vue (a). Dans cette illustration, il s’agit d’une incision de 15 degrés d’arc centrée sur l’axe à 285°.
La qualité de réalisation du capsulorhexis est un des facteurs pronostiques importants conditionnant le succès du résultat réfractif escompté. Le diamètre, la forme et le centrage sont les trois éléments majeurs qui définissent la qualité du capsulorhexis. L’apport du laser femtoseconde a permis de réaliser de manière extrêmement précise et reproductible cette étape délicate de la chirurgie de la cataracte. Nagy et al. ont démontré le gain important de précision obtenu avec la réalisation d’un capsulorhexis laser avec le système LenSx® par rapport à une technique manuelle standard. Pour un objectif de capsulotomie prévu à 5 mm de diamètre, le laser permettait une découpe de 5,02 ± 0,04 mm, alors qu’on obtenait avec la technique manuelle un diamètre de 5,88 ± 0,74 mm [72]. Le groupe Optimedica a rapporté des capsulorhexis réalisés avec une déviation standard de 27 µm du diamètre, alors que la méthode manuelle rapportait 338 µm [15]. De la même façon, le groupe LensAR® retrouvait une déviation de 100 µm avec le laser contre 500 µm manuellement [75].
La taille du capsulorhexis est susceptible d’avoir une influence importante sur la position effective finale de l’implant (ELP, Effective Lens Position) ainsi que sur sa performance optique. Sanders et al. ont montré que la réalisation d’un petit capsulorhexis (sous 5,5 mm) pouvait entraîner une fibrose capsulaire antérieure à l’origine d’un léger déplacement de l’implant et générant ainsi un shift hypermétropique [89]. À l’inverse, un capsulorhexis trop large est un facteur de risque non négligeable de déplacement de l’implant (tilt, décentrement) et de cataracte secondaire [86, 100]. Il a été démontré que la plus grande source d’erreur réfractive postopératoire était liée à l’estimation erronée de la position effective de l’implant, censée se situer au niveau du plan zonulaire auquel s’ajoutent quelques ajustements (constante A) [78]. Ainsi, la taille du capsulorhexis serait un élément affectant significativement la position de l’implant [25] et donc la précision réfractive. Slade a étudié la position effective de l’implant après chirurgie de la cataracte et la prédictibilité des résultats réfractifs entre deux groupes ayant reçu un capsulorhexis réalisé soit avec le laser LenSx® soit de façon manuelle [95]. Les résultats rapportés montrent une diminution significative de la variabilité de la position de l’implant dans les capsulorhexis réalisés au laser. Cette diminution a pour conséquence directe une amélioration de la prédictibilité des résultats réfractifs, avec une déviation moyenne par rapport à l’objectif réfractif évaluée à 0,4 D avec le laser contre 0,6 D avec la méthode manuelle.
Le centrage du capsulorhexis est considéré comme une aide précieuse pour le centrage de l’implant. Un implant décentré pouvant être responsable à la fois d’un résultat réfractif imparfait ainsi que de la génération d’aberrations optiques de type comatiques retentissant sur la qualité de vision [16]. Le groupe Optimedica a rapporté avec leur laser un centrage du capsulorhexis d’une déviation standard par rapport à la position prévue de 86 µm [15], tandis que Nagy et al., utilisant la plateforme LenSx®, ont retrouvé un centrage du capsulorhexis plus précis et reproductible après capsulotomies réalisées au laser par rapport à la technique manuelle, contribuant à un meilleur centrage de l’implant [74]. En analysant les aberrations optiques induites après chirurgie de la cataracte dans des yeux traités au laser ou par technique conventionnelle, cette même équipe a rapporté significativement moins d’aberrations internes et une meilleure qualité de vision (Strehl ratio et MTF) dans les yeux ayant eu une capsulotomie réalisée au laser, ces résultats étant la conséquence d’une induction moindre de coma verticale après ouverture de la capsule au laser, permettant ainsi d’assurer un meilleur centrage de l’implant [67].
La forme du capsulorhexis demeure un élément majeur puisque la circularité de la découpe capsulaire influence la distribution des forces qui s’y exercent et donc sa résistance à l’étirement. Dans une étude expérimentale utilisant le laser LenSx® sur des yeux porcins, Nagy et al. ont démontré une plus grande tolérance à l’étirement capsulaire après capsulorhexis réalisés au laser par rapport à la technique manuelle [72]. La force d’étirement nécessaire pour provoquer une déchirure du sac était plus importante dans le groupe laser. Des résultats similaires ont été retrouvés avec le système LensAR®, où une force jusqu’à 30 % supérieure était requise pour entraîner une déchirure capsulaire dans les capsulorhexis réalisés au laser [53].
La fragmentation du noyau constitue l’une des étapes les plus critiques de la chirurgie de la cataracte, en particulier en cas de noyaux denses ou de fragilités zonulaires, où le risque de complication peropératoire est significativement augmenté. La sculpture des sillons, le « cracking » et la rotation du noyau sont des étapes cruciales au cours desquelles des forces mécaniques sont appliquées et transmises de la capsule à la zonule, augmentant ainsi le risque de rupture capsulaire ou de désinsertion zonulaire. De ce fait, l’apport de la technologie femtoseconde, pour aider à fragmenter le noyau cristallinien et diminuer les manipulations intraoculaires, trouve tout son intérêt dans les cataractes dites à risques : blanches avec mauvaise visibilité, denses ou avec fragilité zonulaire.
D’un point de vue optique, la découpe cristallinienne cible un volume en profondeur et, de ce fait, requiert une énergie importante ainsi qu’une ouverture numérique large. À l’inverse, la découpe cornéenne (incisions principales et relaxantes) cible un plan focal et requiert donc une ouverture numérique plus étroite, de façon à réaliser des découpes précises. De plus, le seuil énergétique à atteindre pour pouvoir fragmenter le noyau cristallinien de façon fiable et efficace est très dépendant à la fois de la densité du noyau et de ses dimensions. L’équipe du LenSx® a rapporté une fragmentation efficace jusqu’à des grades 3,5 de cataracte sur la classification LOCS III [73] ; Optimedica estime pouvoir passer jusqu’à des cataractes de grade 4 [15], LensAR® jusqu’à des grades 5 [96]. De nombreux profils de fragmentation sont proposés par chaque plateforme en fonction de la densité du noyau et des préférences du chirurgien (fig. 7-23).
Outre le gain de sécurité lié à la réduction des manipulations intraoculaires, limitant ainsi le risque des complications mécaniques associées, deux résultats majeurs découlent directement de l’utilisation du laser femtoseconde pour la fragmentation du cristallin : la réduction significative du taux d’énergie ultrasonique délivré au cours de la chirurgie et la préservation du taux de cellules endothéliales en postopératoire. Nagy et al., ont rapporté une réduction d’énergie dissipée au cours de la chirurgie de 37 % pour des cataractes de grades 1 à 3 et de 40 % pour des grades 4 avec le laser LenSx®, ainsi qu’une réduction du temps de phacoémulsification de 51 % [73]. Edwards et al. ont retrouvé des résultats similaires avec le système LensAR®, pour lequel ils rapportent une réduction de 100 %, 64 %, 39 % et 42 % pour des cataractes de grades 1, 2, 3 et 4 respectivement [30].
Slade et al. ont rapporté une diminution significative du taux de perte de cellules endothéliales dans les cristallins prétraités avec le laser LenSx® [95]. À trois mois, la perte de cellules endothéliales dans le groupe prétraité au laser était de 2,5 % contre 6,3 % dans les cristallins ayant été traités par phacoémulsification conventionnelle, soit une réduction de près de 60 % de la perte cellulaire endothéliale.
Fig. 7-23 Différents profils de fragmentation.
a. Modèle de découpe en quatre quadrants avec découpes circulaires utilisé par le laser LenSx®. b. Modèle en forme de « parts de tarte » utilisé par le laser LensAR®.
Les incisions limbiques relaxantes ont montré leur efficacité dans la correction des astigmatismes modérés au cours de la chirurgie de la cataracte [23]. Cependant, une erreur de 5° d’angle dans l’axe de l’incision peut entraîner une diminution de l’effet attendu de 17 %. De même, la profondeur de l’incision, sa taille et sa distance par rapport à la zone optique sont autant de paramètres qui conditionnent le succès de ces incisions et qui sont habituellement réalisés manuellement, avec une efficacité variable. La précision apportée par le laser femtoseconde dans la réalisation de ces incisions ainsi que le support d’imagerie haute résolution permettant de guider le traitement viennent pallier la variabilité des résultats réfractifs attendus après ce type d’incisions.
Les différentes plateformes femtocataracte proposent la possibilité de réaliser à la fin de la procédure laser (capsulorhexis, fragmentation, incision principale et paracentèse) des incisions limbiques relaxantes pour des astigmatismes cornéens allant jusqu’à 3 D. Étant donné le caractère récent de cette nouvelle technologie, des nomogrammes appropriés restent à développer pour optimiser l’efficacité de ces incisions en fonction de la magnitude de l’astigmatisme.

[1] Agarwal A., Agarwal S., Agarwal A. et al. Phakonit-lens removal through a 0,9 mm incision. J Cataract Refract Surg, 2001 ; 27 : 1531-3.
[2] Agarwal A., Agarwal A., Agarwal S. et al. Phakonit: phacoemulsification through a 0,9 mm corneal incision. J Cataract Refract Surg, 2001 ; 27 : 1548-52.
[3] Alió J.L., Rodriguez-Prats J.L., Vianello A., Galal A. Visual outcome of microincision cataract surgery with implantation of an Acri.Smart lens. J Cataract Refract Surg, 2005 ; 31 : 1549-56.
[4] Alió J.L. et al. New MICS IOL: the AKREOS MI60. ESCRS 2007, Stockholm.
[5] Amzallag T. Morphologie des lentilles intraoculaires et cataracte secondaire. In : Cataracte secondaire : physiopathogénie, prévention et traitement. Milazzo S., Riss I. (éd.). Rapport du BSOF, 2006 : 155-74.
[6] Amzallag T., Pynson J. Akreos Microincision Lens Pilot Study: 1-year follow-up. ESCRS 2006, London.
[7] Amzallag T., Pynson J. Biomatériaux dans la chirurgie du cristallin. J Fr Ophtalmol, 2007 ; 30 : 757-67.
[8] Amzallag T. Implantation techniques. In : Minimizing incisions and maximizing outcomes in cataract surgery. Alió J.L., Fine I.H. (eds). Springer Verlag, Berlin-Heidelberg, 2010 : 220-35.
[9] Antao S.F., Kasaby H. Increased cutting efficiency in phacoemulsification with Sovereign WhiteStar ICE technology. J Cataract Refract Surg, 2008 ; 34 : 173-4.
[10] Apple D., Solomon K.D., Tetz M. et al. Posterior capsule opacification. Surv Ophthalmol, 1992 ; 37 : 73-116.
[11] Apple D., Peng Q., Vissook N. et al. Eradication of posterior capsule opacification: documentation of marked decrease in Nd:YAG laser posterior capsulotomy rates noted in an analysis of 5416 pseuphakic human eyes obtained post mortem. Ophthalmology, 2001 ; 108 : 505-18.
[12] Arné J.-L. Biomécanique de la phacoémulsification. In : Chirurgie de la cataracte. Paris, Masson, 2005 : 80-91.
[13] Aust S.D., Hedbon T., Humbert J. et al. Hydroxyl free radical production during torsional phacoemulsification. J Cataract Refract Surg, 2010 ; 36 : 2146-9.
[14] Aust S.D., Terry S., Hedbon T. et al. Determining the local origin of hydroxyl radical generation during phacoemulsification. J Cataract Refract Surg, 2011 ; 37 : 1154-9.
[15] Battle J. Prospective study of size and shape accuracy of OptiMedica Femtosecond Laser Capsulotomy vs. manual capsulorohexis. Communication orale. ESCRS 2010, Paris.
[16] Baumeister M., Buhren J., Kohnen T. Tilt and decentration of spherical and aspheric intraocular lenses: effect on higher-order aberrations. J Cataract Refract Surg, 2009 ; 35 : 1006-12.
[17] Belazzougui R., Monod S., Baudouin C., Labbé A. Analyse architecturale des incisions cornéennes par OCT Visante® au cours des endophtalmies aiguës après chirurgie de la cataracte. J Fr Ophtalmol, 2010 ; 33 : 10-5.
[18] Billotte C., Berdeaux G. Adverse clinical consequences of neodymium:YAG laser treatment of posterior capsule opacification. J Cataract Refract Surg, 2004 ; 30 : 2064-71.
[19] Boulton M., Saxby L. Adhesion of IOLs to the posterior capsule (Editorial). Br J Ophthalmol, 1998 ; 82 : 468.
[20] Braga-Mele R. Thermal effect of microburst and hyperpulse settings during sleeveless bimanual phacoemulsification with advanced power modulations. J Cataract Refract Surg, 2006 ; 32 : 639-42.
[21] Brinton J.P., Adams W., Kumar R. et al. Comparison of thermal features associated with 2 phacoemulsification machines. J Cataract Refract Surg, 2006 ; 32 : 288-93.
[22] Can I., Takmaz T., Yildiz Y. et al. Coaxial, microcoaxial, and biaxial microincision cataract surgery: prospective comparative study. J Cataract Refract Surg, 2010 ; 36 : 740-6.
[23] Carvalho M., Suzuki S., Freitas L. Limbal relaxing incisions to correct corneal astigmatism during phacoemulsification. J Refract Surg, 2007 ; 23 : 499-504.
[24] Cavallini G.M., Campi L., Masini C. et al. Bimanual microphacoemulsification versus coaxial miniphacoemulsification: prospective study. J Cataract Refract Surg, 2007 ; 33 : 387-92.
[25] Cekic O., Batman C. The relationship between capsulorhexis size and anterior chamber depth relation. Ophtalmic Surg, 1999 ; 30 : 185-90.
[26] Chee S.P., Ti S.E., Sivakumar M. et al. Postoperative inflammation: extracapsular cataract extraction versus phacoemulsification. J Cataract Refract Surg, 1999 ; 25 : 1280-5.
[27] Culbertson W.W. Experience with the Optimedica system. Communication orale. ICFLO 4th. 2011, Dana Point (CA).
[28] Davison J.A. Cumulative tip travel and implied followability of longitudinal and torsional phacoemulsification. J Cataract Refract Surg, 2008 ; 34 : 986-90.
[29] Denoyer A., Denoyer L., Marotte D. et al. Intraindividual comparative study of corneal and ocular wavefront aberrations after biaxial microincision versus coaxial small-incision cataract surgery. Br J Ophthalmol, 2008 ; 92 : 1679-84.
[30] Edwards K., Uy H., Scheinder S. The effect of laser lens fragmentation on the use of ultrasound energy in cataract surgery. Poster. ARVO 2011.
[31] Elgohary M.A., Beckingsale A.B. Effect of posterior capsular opacification on visual function in patients with monofocal and multifocal intraocular lenses. Eye (Lond), 2008 ; 22 : 613-9.
[32] Findl O., Buehl W., Bauer P., Sycha T. Interventions for preventing posterior capsule opacification. Cochrane Database Syst Rev, 2007 : CD003738.
[33] Fishkind W., Bakewell B., Donnenfeld E.D. et al. Comparative clinical trial of ultrasound phacoemulsification with and without the WhiteStar system. J Cataract Refract Surg. 2006 ; 32 : 45-9.
[34] Floyd M.S., Valentine J.R., Olson R.J. Fluidics and heat generation of Alcon Infiniti and Legacy, Bausch & Lomb Millennium, and advanced medical optics sovereign phacoemulsification systems. Am J Ophthalmol, 2006 ; 142 : 387-92.
[35] Gardner J.M., Aust S.D. Quantification of hydroxyl radical produced during phacoemulsification. J Cataract Refract Surg, 2009 ; 35 : 2149-53.
[36] Gauthier L., Lafuma A., Laurendeau C., Berdeaux G. Neodymium:YAG laser rates after bilateral implantation of hydrophobic or hydrophilic multifocal intraocular lenses: twenty-four month retrospective comparative study. J Cataract Refract Surg, 2010 ; 36 : 1195-200.
[37] Georgescu D., Kuo A.F., Kinard K.I. et al. A fluidics comparison of Alcon Infiniti, Bausch & Lomb Stellaris, and Advanced Medical Optics Signature phacoemulsification machines. Am J Ophthalmol, 2008 ; 145 : 1014-7.
[38] Girard L.J., Nieves R., Hawkins R.S. The Girard ultrasonic fragmentor. Adv Ophthalmol, 1978 ; 37 : 45-50.
[39] Han Y.K., Miller K.M. Comparison of vacuum rise time, vacuum limit accuracy, and occlusion break surge of 3 new phacoemulsification systems. J Cataract Refract Surg, 2009 ; 35 : 1424-9.
[40] Han Y.K., Miller K.M. Heat production: Longitudinal versus torsional phacoemulsification. J Cataract Refract Surg, 2009 ; 35 : 1799-805.
[41] Hansen S., Solomon K.D., McKnight G.T. et al. Posterior capsular opacification and intraocular lens decentration. Part I – Comparison of various posterior chamber lense designs implanted in the rabbit model. J Cataract Refract Surg, 1988 ; 14 : 605-13.
[42] Hara T. Endocapsular phacoemulsification and aspiration (ECPEA) – Recent surgical technique and clinical results. Ophthalmic Surg, 1989 ; 20 : 469-75.
[43] Hara T., Hara T.K., Yamada Y. « Equator ring » for maintenance of completely circular contour of the capsular bag aquator after cataract removal. Ophthalmic Surg, 1991 ; 22 : 358-9.
[44] Hayashi, K., Yoshida M., Hayashi H. Postoperative corneal shape changes: microincision versus small-incision coaxial cataract surgery. J Cataract Refract Surg, 2009 ; 35 : 233-9.
[45] Hayashi K., Yoshida M., Hayashi H. Corneal shape changes after 2.0-mm or 3.0-mm clear corneal versus scleral tunnel incision cataract surgery. Ophthalmology, 2010 ; 117 : 1313-23.
[46] Hoffman R.S., Fine I.H., Packer M. New phacoemulsification technology. Curr Opin Ophthalmol, 2005 ; 16 : 38-43.
[47] Hu V., Hughes E.H., Patel N., Whitefield L.A. The effect of aqualase and phacoemulsification on the corneal endothelium. Cornea, 2010 ; 29 : 247-50.
[48] Jun B., Berdahl J.P., Kim T. Thermal study of longitudinal and torsional ultrasound phacoemulsification: tracking the temperature of the corneal surface, incision, and handpiece. J Cataract Refract Surg, 2010 ; 36 : 832-7.
[49] Kahraman G., Amon M., Franz C. et al. Intraindividual comparison of surgical trauma after bimanual microincision and conventional small-incision coaxial phacoemulsification. J Cataract Refract Surg, 2007 ; 33 : 618-22.
[50] Kaufmann C., Krishnan A., Landers J. et al. Astigmatic neutrality in biaxial microincision cataract surgery. J Cataract Refract Surg, 2009 ; 35 : 1555-62.
[51] Kelman C.D. Phaco-emulsification and aspiration. A new technique of cataract removal. A preliminary report. Am J Ophthalmol, 1967 ; 64 : 23-35.
[52] Kohnen T., Dick B., Jacobi K.W. Comparison of the induced astigmatism after temporal clear corneal tunnel incisions of different sizes. J Cataract Refract Surg, 1995 ; 21 : 417-24.
[53] Krueger R.R. Personnal experience with the LensAR system. Communication orale. ESCRS, 2011, Vienna.
[54] Kurz S., Krummenauer F., Gabriel P. et al. Biaxial microincision versus coaxial small-incision clear cornea cataract surgery. Ophthalmology, 2006 ; 113 : 1818-26.
[55] Lee K.M., Kwon H.G., Joo C.K. Microcoaxial cataract surgery outcomes: comparison of 1.8 mm system and 2.2 mm system. J Cataract Refract Surg, 2009 ; 35 : 874-80.
[56] Linnola R. Sandwich theory: bioactivity-based explanation for posterior capsule opacification. J Cataract Refract Surg, 1997 ; 23 : 1539-42.
[57] Linnola R., Sund M., Ylonen R., Pihlajaniemi T. Adhesion of soluble fibronectin, laminin, and collagen type IV to intraocular lens materials. J Cataract Refract Surg, 1999 ; 25 : 1486-91.
[58] Linnola R., Salonen J.I., Happonen R.P. Intraocular lens bioactivity tested using rabbit corneal tissue cultures. J Cataract Refract Surg, 1999 ; 25 : 1480-5.
[59] Linnola R., Werner L., Pandey S.K. et al. Adhesion of fibronectin, vitronectin, laminin, and collagen type IV to intraocular lens materials in pseudophakic human autopsy eyes. Part 1: histological sections. J Cataract Refract Surg, 2000 ; 26 : 1792-806.
[60] Lundström M., Wejde G., Stenevi U. et al. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology, 2007 ; 114 : 866-70.
[61] Mackool R.J., Brint S.F. AquaLase: a new technology for cataract extraction. Curr Opin Ophthalmol, 2004 ; 15 : 40-3.
[62] Masket S., Wang L., Belani S. Induced astigmatism with 2.2- and 3.0-mm coaxial phacoemulsification incisions. J Refract Surg, 2009 ; 25 : 21-4.
[63] Masket S., Sarayba M., Ignacio T., Fram N. Femtosecond laser-assisted cataract incisions: Architectural stability and reproducibility. J Cataract Refract Surg, 2010 ; 36 : 1048-9.
[64] Maxwell D.P. Jr., Diamond J.G. May D.R. Surgical wound defects associated with endophthalmitis. Ophthalmic Surg, 1994 ; 25 : 157-61.
[65] Menapace R., Di Nardo S. How to better use fluidics with MICS. In : Minimizing incisions and maximizing outcomes in cataract surgery. Alió J.L., Fine I.H. (eds). Springer Verlag, Berlin-Heidelberg, 2010 : 59-62.
[66] Mencucci R., Ponchietti C., Virgili G. et al. Corneal endothelial damage after cataract surgery: Microincision versus standard technique. J Cataract Refract Surg, 2006 ; 32 : 1351-4.
[67] Miháltz K., Knorz M.C., Alió J.L. et al. Internal aberrations and optical quality after femtosecond laser anterior capsultomy in cataract surgery. J Refract Surg, 2011 ; 10 : 711-6.
[68] Morcillo-Laiz R., Zato M.A., Muñoz-Negrete F.J., Arnalich-Montiel F. Surgically induced astigmatism after biaxial phacoemulsification compared to coaxial phacoemulsification. Eye (Lond), 2009 ; 23 : 835-9.
[69] Murano N., Ishizaki M., Sato S. et al. Corneal endothelial cell damage by free radicals associated with ultrasound oscillation. Arch Ophthalmol, 2008 ; 126 : 816-2.
[70] Nagata T., Watanabe I. Optic sharp edge or convexity: comparison of effects on posterior capsule opacification. Jpn J Opthalmol, 1996 ; 40 : 397-403.
[71] Nagata T., Minakata A., Watanabe I. Adhesiveness of Acrysof to a collagen film. J Cataract Refract Surg, 1998 ; 24 : 367-70.
[72] Nagy Z.Z., Takacs A., Filkorn T., Sarayba M. Initial clinical evaluation of an intraocular femtosecond laser in cataract surgery. J Refract Surg, 2009 ; 25 (December).
[73] Nagy Z.Z. Femtosecond laser lens fragmentation, personnal communication. ASCRS 2011, San Diego, CA.
[74] Nagy Z.Z. Comparison of IOL decentration parameters after femtosecond and manual capsulotomies. J Refract Surg, 2011 ; 8 : 564-9.
[75] Nichamin L. Laser capsulotomy with the LensAR laser system. Communication, ESCRS 2010, Paris.
[76] Nishi O., Nishi K., Menapace R. Capsule-bending ring for the prevention of capsular opacification: a preliminary report. Ophthalmic Surg Lasers, 1998 ; 29 : 749-53.
[77] Nishi O., Nishi K. Preventing posterior casule opacification by creating a discontinuous sharp bend in the capsule. J Cataract Refract Surg, 1999 ; 25 : 521-6.
[78] Norrby S. Sources of error in intraocular lens power calculation. J Cataract Refract Surg, 2008 ; 34 : 368-76.
[79] Olson R.J., Jin Y., Kefalopoulos G. et al. Legacy AdvanTec and Sovereign WhiteStar: a wound temperature study. J Cataract Refract Surg, 2004 ; 30 : 1109-13.
[80] Oshika T., Nagata T., Ishii Y. Adhesion of lens capsule to intra ocular lenses materials: an experimental study. Br J Ophthalmol, 1998 ; 82 : 549-53.
[81] Oshika T., Nagahara K., Yaguchi S. et al. Three year prospective, randomized evaluation of intraocular lens implantation through 3.2 and 5.5 mm incisions. J Cataract Refract Surg, 1998 ; 24 : 509-14.
[82] Payne M., Georgescu D., Waite A.N. et al. Phacoemulsification tip vacuum pressure: Comparison of 4 devices. J Cataract Refract Surg, 2006 ; 32 : 1374-7.
[83] Packer M., Fishkind W.J., Fine I.H. et al. The physics of phaco: A review. J Cataract Refract Surg, 2005 ; 31 : 424-31.
[84] Peng Q., Visessook N., Apple D.J. et al. Surgical prevention of posterior capsule opacification. Part 3: intraocular lens optic barrier effect as a second line of defence. J Cataract Refract Surg, 2000 ; 26 : 198-213.
[85] Ram J., Sukhija J., Kumzuk T. et al. Visual outcome and posterior capsular opacification following implantation of silicone and acrylic refractive multifocal intraocular lenses. Ann Ophthalmol (Skokie), 2008 ; 40 : 81-6.
[86] Ravalico G., Tognetto D., Palomba M. Capsulorhexis size and posterior capsule opacification. J Cataract Refract Surg, 1996 ; 22 : 98-103.
[87] Rekas M., Montés-Mico R., Krix-Jachym K. et al. Comparison of torsional and longitudinal modes using phacoemulsification parameters. J Cataract Refract Surg, 2009 ; 35 : 1719-24.
[88] Reuschel A., Bogatsch H., Barth T., Wiedelmann R. Comparison of endothelial changes and power settings between torsional and longitudinal phacoemulsification. J Cataract Refract Surg, 2010 ; 36 : 1855-61.
[89] Sanders D.R., Higginbotham R., Opatowsky I., Confino J. Hyperopic shift in refraction associated with implantation of the single-piece Collamer intraocular lens. J Cataract Refract Surg, 2006 ; 32 : 2110-2.
[90] Schmutz J.S., Olson R.J. Thermal comparison of Infiniti OZil and Signature Ellips phacoemulsification systems. Am J Ophthalmol, 2010 ; 149 : 762-7.
[91] Seibel B.S. Phacodynamics: Mastering the Tools and Techniques of Phacoemulsification Surgery. 4th edition. Thorofare, NJ, Slack, 2005 : 108.
[92] Shah P.A., Yoo S. Innovations in phacoemulsification technology. Curr Opin Ophthalmol, 2007 ; 18 : 23-6.
[93] Shearing S.P., Relyca R.L., Louiza A. et al. Routine phacoemulsification through a one-millimeter non-sutured incision. Cataract, 1985 ; 2 : 6-11.
[94] Shock J.P. Removal of cataracts with ultrasonic fragmentation and continuous irrigation. Trans Pac Coast Otoophthalmol Soc Annu Meet, 1972 ; 53 : 139-44.
[95] Slade S.G. First U.S. clinical experience with laser cataract surgery. In : Laser Refractive Cataract Surgery. Krueger R.R., Talamo J., Lindström R. (eds). Springer, 2011.
[96] Smadja D., Krueger R.R. Femtosecond laser lens fragmentation. In : Cornea. Copeland R.A. (ed.). Vol. 2. Femtosecond laser applications in anterior segment surgery. 2011.
[97] Tejedor J., Perez-Rodriguez J.A. Astigmatic change induced by 2.8-mm corneal incisions for cataract surgery. Invest Ophthalmol Vis Sci, 2009 ; 50 : 989-94.
[98] Tsuneoka H., Shiba T., Takahashi Y. Ultrasonic phacoemulsification using a 1.4 mm incision: clinical results. J Cataract Refract Surg, 2002 ; 28 : 81-6.
[99] Wade M., Iso M.R., Georgescu D. et al. Efficacy of Cruise Control in controlling postocclusion surge with Legacy and Millennium venturi phacoemulsification machines. J Cataract Refract Surg, 2007 ; 33 : 1071-5.
[100] Walkow T., Anders N., Pham D., Wollensak J. Causes of severe decentration and subluxation of intraocular lenses. Graefes Arch Clin Exp Ophthalmol, 1998 ; 236 : 9-12.
[101] Wallin T., Parker J., Jin Y. et al. No Cohort study of 27 cases of endophthalmitis at a single institution. J Cataract Refract Surg, 2005 ; 31 : 735-41.
[102] Wang J., Zhang E.K., Fan W.Y. et al. The effect of micro-incision and small-incision coaxial phaco-emulsification on corneal astigmatism. Clin Experiment Ophthalmol, 2009 ; 37 : 664-9.
[103] Wilczynski M., Supady E., Piotr L. et al. Comparison of surgically induced astigmatism after coaxial phacoemulsification through 1.8 mm microincision and bimanual phacoemulsification through 1.7 mm microincision. J Cataract Refract Surg, 2009 ; 35 : 1563-9.
[104] Wilczynski M., Supady E., Loba P. et al. Comparison of early corneal endothelial cell loss after coaxial phacoemulsification through 1.8 mm microincision and bimanual phacoemulsification through 1.7 mm microincision. J Cataract Refract Surg, 2009 ; 35 : 1570-4.
[105] Yao K., Tang X., Ye P. Corneal astigmatism, high order aberrations, and optical quality after cataract surgery: microincision versus small incision. J Refract Surg, 2006 ; 22 : S1079-82.
[106] Zaluski S., Clayman H.M., Karsenti G. et al. Pseudomonas aeruginosa endophthalmitis caused by contamination of the internal fluid pathways of a phacoemulsifier. J Cataract Refract Surg, 1999 ; 25 : 540-5.
[107] Zaluski S. Comparison of the Sovereign phacoparameters with AMO WhiteStar and WhiteStar ICE Technologies. ESCRS 2006, London.
D. Gatinel
Les techniques médico-chirurgicales dites multifocales sont destinées à compenser la perte du pouvoir accommodatif qui définit la presbytie. Elles reposent sur l’augmentation de la multifocalité de l’œil. Cette multifocalité peut être induite par la pose d’une lentille de contact multifocale, un remodelage du profil cornéen (presbyLASIK) ou encore le remplacement du cristallin par un implant pseudophake multifocal. L’utilisation d’une correction multifocale diffère des techniques de monovision – qui reposent sur la délivrance de traitements monofocaux et où un œil (généralement l’œil dominant, le plus souvent directeur) est destiné à la vision de loin, alors que l’autre l’est à la vision de près. Le design d’une correction diffractive fait appel à des principes spécifiques.
Nous excluons de cette section les corrections multifocales diffractives (par exemple, par implant diffractif), dont l’étude aberrométrique n’est pas toujours possible ni pertinente avec les technologies d’exploration actuelles [8].
La multifocalité est souvent assimilée à une multiplicité de puissances réfractives affectées à différentes zones pupillaires ; cependant, ce type de représentation ne permet pas de véritablement apprécier l’effet d’une correction multifocale sur la vision de loin, quand la lumière incidente est réfractée par plusieurs zones à la fois. En plus de la restauration d’une acuité visuelle non corrigée de près, c’est le maintien d’une certaine qualité visuelle de loin qui constitue l’élément clé d’une multifocalité efficace et bien tolérée. L’aberrométrie et l’analyse du front d’onde permettent la mesure objective de la qualité de l’image rétinienne. Cette section est consacrée aux relations entre les aberrations optiques de haut degré et la multifocalité ; elle présente en esquisse une méthode destinée à induire une multifocalité efficace et contrôlée pour la correction de la presbytie.
Plusieurs indices pointent vers le front d’onde oculaire comme un élément clé pour la multifocalité.
L’aberrométrie fournit au clinicien la possibilité d’étudier avec précision les propriétés réfractives de l’œil et d’estimer la qualité de l’image rétinienne. Grâce au recueil et à l’analyse du front d’onde oculaire, il devient possible de prédire la réfraction locale en tout point de la pupille. Cette prédiction concerne un large diamètre pupillaire, car on effectue généralement la mesure de front d’onde en conditions mésopiques.
La mesure du front d’onde sur un large diamètre pupillaire permet d’en caractériser n’importe quel sous-domaine, c’est-à-dire calculer la puissance réfractive locale sur n’importe quelle sous-pupille. Par ailleurs, la mesure des aberrations contribuant à la distorsion du front d’onde oculaire permet aussi de prédire la qualité de l’image rétinienne, ainsi que les performances optiques pour des cibles distantes ou proches (observées en vision de loin ou de près) [6].
Dans le cadre du design de solutions multifocales pour la presbytie, cette approche aberrométrique apparaît donc puissante sur le plan computationnel, puisqu’elle permet de prédire la puissance réfractive au sein de sous-domaines pupillaires.
À l’inverse, l’asphéricité cornéenne (facteur Q) ou tout autre type de description semi-quantitative du profil cornéen (front d’onde cornéen seul) ne fournissent qu’un aspect parcellaire, plus topographique que fonctionnel, et relié de manière très indirecte aux propriétés réfractives de l’œil concerné. L’asphéricité cornéenne est légèrement prolate [5]. Dans le cadre de la multifocalité, manipuler l’asphéricité cornéenne vise d’ailleurs à induire une modulation (bénéfique pour la profondeur de champ) du taux d’aberration sphérique. Le taux physiologique de l’aberration sphérique totale est légèrement positif [7, 15]. Une asphérisation plus négative du profil cornéen (la cornée devient plus prolate) peut aboutir à inverser le signe de l’aberration sphérique, qui de positive devient négative. Le taux de cette aberration dépend non seulement du changement d’asphéricité mais également de la kératométrie centrale. Comme nous le verrons plus loin, c’est l’aberration sphérique négative et non l’asphéricité cornéenne qui est directement pourvoyeur de la multifocalité induite.
Pour approfondir le lien entre aberrations et profondeur de champ, examinons une situation théorique où la mesure du front d’onde oculaire conclut à l’absence d’aberration de haut degré. Dans cette situation, le front d’onde émergeant de l’œil est plan (après correction d’une éventuelle amétropie sphérocylindrique). Dans cette situation, les rayons lumineux incidents issus d’un point source éloigné sont focalisés de manière ponctuelle dans une région de l’espace (la rétine du patient quand celui-ci est emmétrope). La qualité optique est excellente – l’image d’un point est un point : le stigmatisme est aussi ponctuel que possible –, mais la profondeur de champ est faible, ce qui signifie que si on éloigne ou rapproche le point source fixé, la qualité de l’image rétinienne se dégrade rapidement (fig. 7-24).
Si on introduit certaines aberrations optiques de haut degré – l’utilisation d’un miroir d’optique adaptative est une méthode objective qui offre la possibilité de sélectionner le type et le taux d’aberration optique souhaité –, le front d’onde est déformé et la qualité optique se détériore, car la ou les aberrations induisent une réduction du stigmatisme. Cependant, la profondeur de champ augmente : si on déplace le point source vis-à-vis de l’œil, la dégradation de l’image induite par ce déplacement est moindre que dans le cas précédent, quand l’œil était optiquement « parfait ». Le point objet est vu moins net, mais la qualité de l’image qu’il forme sur la rétine est moins sensible à son déplacement.
Le défocus est une aberration de bas degré responsable d’une erreur de vergence constante au sein de la pupille. Un œil myope de – 1 D, par ailleurs dépourvu de toute autre aberration optique, a une puissance locale constante au sein de l’aire pupillaire. À l’inverse, l’introduction d’aberrations de haut degré provoque nécessairement une fluctuation de la puissance dioptrique locale au sein de la pupille. Les aberrations de haut degré sont donc consubstantielles à la notion de multifocalité ! Ces aberrations de haut degré sont habituellement définies et classées selon la pyramide des polynômes de Zernike. Les propriétés mathématiques conférées par cette classification sont utiles et permettent d’exprimer la totalité des déphasages du front d’onde sous la forme d’une combinaison linéaires des termes de Zernike, chacun de ces termes étant pondéré par un coefficient RMS, qui représente le « poids » de l’aberration dans le déphasage infligé au front d’onde.
L’enjeu d’une correction multifocale efficace et bien tolérée est d’accroître la profondeur de champ de l’œil incapable d’accommoder suffisamment, sans trop réduire la qualité optique de celui-ci, en particulier pour la vision de loin. En effet, l’expérience clinique auprès de patients opérés avec une technique multifocale (implants multifocaux réfractifs, par exemple) révèle que si l’absence de vision utile non corrigée de près constitue de principe un échec pour le presbyte désireux de s’affranchir des lunettes, c’est la dégradation de qualité de la vision de loin qui est à l’origine des plaintes les plus véhémentes de ces patients.
L’induction d’un taux élevé d’aberrations optiques de haut degré peut être à l’origine d’une réduction de la qualité de vision, alors même que l’acuité visuelle à contraste maximal demeure préservée. Certaines plaintes fonctionnelles (halos, images fantômes, éblouissements) observées après chirurgie réfractive cornéenne plus ou moins empirique de la presbytie ou insertion d’implants multifocaux, sont souvent corrélées à l’induction d’un taux particulièrement élevé d’aberrations optiques de haut degré [1, 14, 16, 17]. L’étude du front d’onde permet de qualifier et quantifier la distorsion du front d’onde chez ces patients. L’aberration de type coma est classiquement responsable d’images fantômes, de diplopie monoculaire, tandis que l’aberration sphérique est souvent incriminée en cas de halos ou d’éblouissements [3]. Il est à noter que nous ne sommes pas, à ce jour, capables de décrypter les aberrations optiques d’un degré supérieur à 6, mais la combinaison de telles aberrations d’ordres importants est source de polyplopie invalidante.
Ces constatations suggèrent que pour optimiser le design d’une correction multifocale, il est souhaitable de déterminer le type et le taux des aberrations optiques de haut degré qui pourraient permettre d’accroître la profondeur de champ, tout en limitant la dégradation de la qualité optique en vision mésopique. Pour atteindre cet objectif, il faut confronter données cliniques et données théoriques.
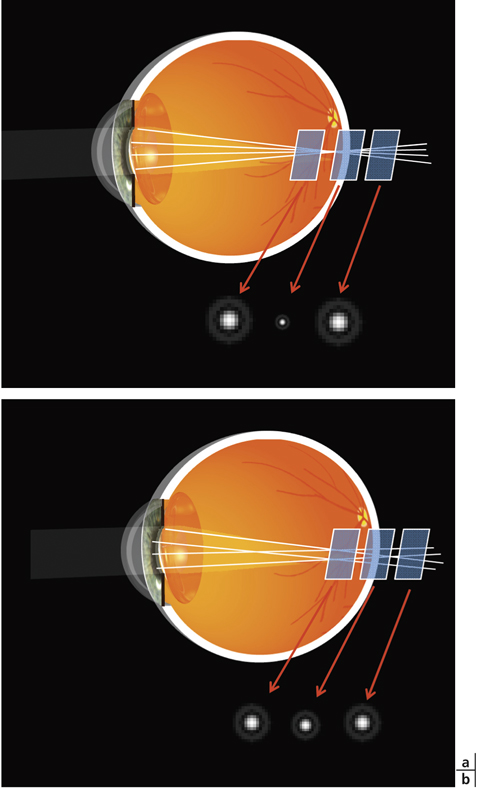
Fig. 7-24 Aberrations optiques et profondeur de foyer (les yeux représentés ont le même diamètre pupillaire). L’image d’un point source lumineux est représentée schématiquement le long du trajet optique des rayons réfractés par le couple cornée-cristallin.
a. En l’absence d’aberrations optiques de haut degré, le stigmatisme est respecté, la profondeur de foyer (la profondeur de champ dans l’espace objet) est réduite : il existe un intervalle relativement restreint au sein duquel le stigmatisme est respecté. b. En présence d’aberrations optiques de haut degré, il existe une réduction du stigmatisme (le point image est plus « étalé »), mais la profondeur de foyer augmente : l’intervalle où la qualité du stigmatisme varie peu est plus long. La correction multifocale de la presbytie consiste en l’induction de la situation représentée schématiquement en (b), à condition qu’elle soit efficace et bien tolérée.
Nous avons étudié avec attention le profil aberrométrique d’yeux adaptés avec succès avec divers types de lentilles multifocales [12]. Les aberrations retrouvées significativement élevées lors du port de ces lentilles étaient de type coma et aberrations sphériques. Une partie de ces aberrations reflétait le caractère multifocal des lentilles testées, en étant par ailleurs liées à l’induction d’une acuité visuelle de près. L’analyse sur banc optique de lentilles intraoculaires multifocales réfractives, où les zones de puissance sont réparties de manière concentrique, révèle la présence d’une combinaison d’aberrations optiques de type sphérique. Ces aberrations se retrouvent au sein du front d’onde d’un œil implanté avec ce type de lentille (fig. 7-25).
La contribution des aberrations de type coma et aberration sphérique à la multifocalité est particulièrement intéressante en raison des caractéristiques du déphasage qu’elles infligent au front d’onde.
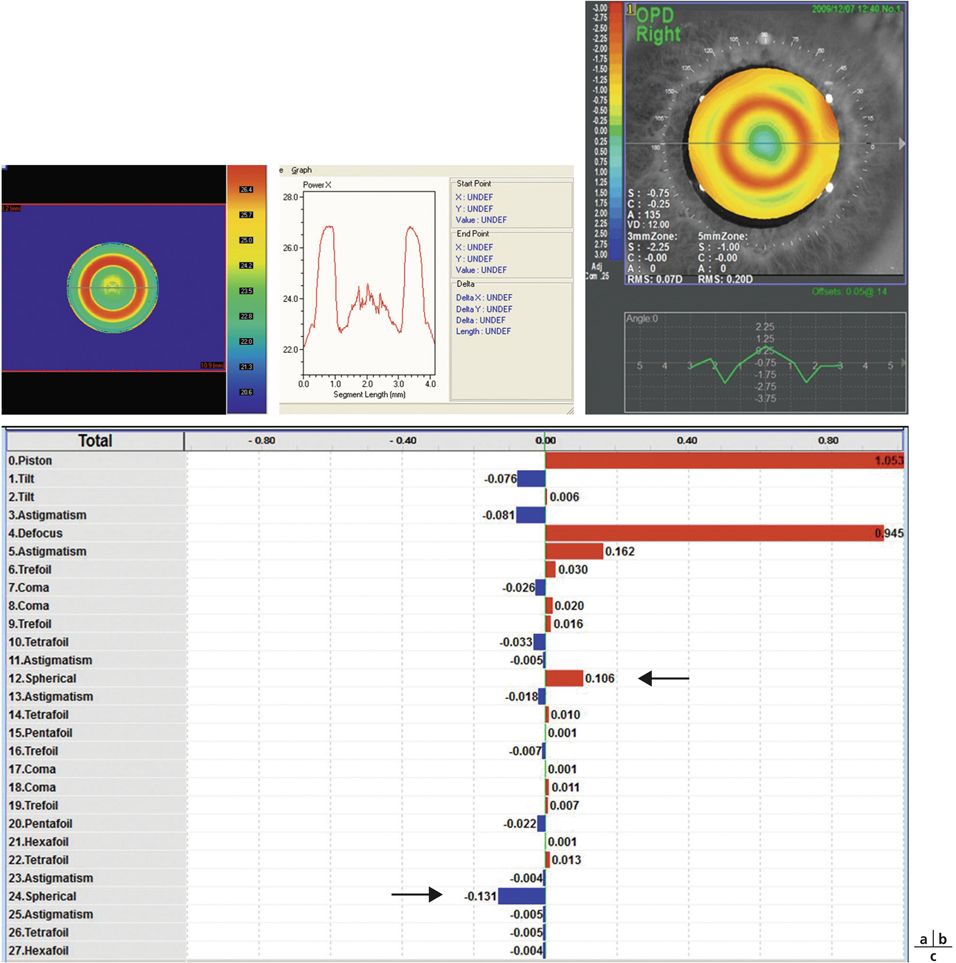
Fig. 7-25 Étude de la variation de puissance locale induite par un implant intraoculaire multifocal réfractif (ReZoom®, Abbott Medical Optics).
a. La mesure sur banc optique montre une variation concentrique de la puissance avec un anneau de puissance additionnelle situé dans la portion intermédiaire de la surface optique de l’implant. Cette distribution est représentée en profil à la partie inférieure de la figure. b. Le recueil des variations de la puissance réfractive au sein de la pupille (skiascopie automatisée, instrument OPD-Scan, Nidek) retrouve une distribution de puissance similaire. c. Le calcul des aberrations internes de haut degré (n° 6 à 27) sur un diamètre proche de celui de l’optique de l’implant (5,8 mm) révèle la présence d’une combinaison d’aberration sphérique de quatrième (n° 12) et de sixième (n° 24) ordre (flèches). Ces aberrations sont la traduction au niveau du front d’onde des variations de puissance optique de l’implant multifocal.
L’aberration sphérique correspond à un différentiel concentrique de réfraction entre le centre et les bords de pupille. Un œil qui présente un taux élevé d’aberration sphérique est donc un œil avec une variation de la réfraction entre le centre et les bords de la pupille (fig. 7-26) : c’est un œil multifocal ! Les lentilles multifocales avec addition pour la vision de près au centre induisent de l’aberration sphérique négative, alors que les lentilles avec addition pour la vision de près en périphérie induisent de l’aberration sphérique positive [12]. Nous avons postulé que si une partie de ces aberrations sphériques était directement liée à la géométrie asphérique de ces lentilles, les aberrations de type coma étaient probablement induites par leur décentrement relatif vis-à-vis de la pupille irienne. En effet, les lentilles multifocales testées présentaient toutes une symétrie de révolution et ne pouvaient donc induire d’aberrations impaires en cas de centrage optimal sur l’axe visuel. Le décentrement de la pupille vis-à-vis de la cornée et du sac capsulaire, l’absence d’axe optique commun de ces structures (la discordance entre ces axes étant corrélée à la valeur de l’angle kappa) rendent quasi inéluctable l’induction de coma lors de l’insertion ou la pose de lentilles multifocales. Le taux de défocus myopique induit par l’aberration sphérique au sein d’une zone concentrique peut être calculé de manière analytique.
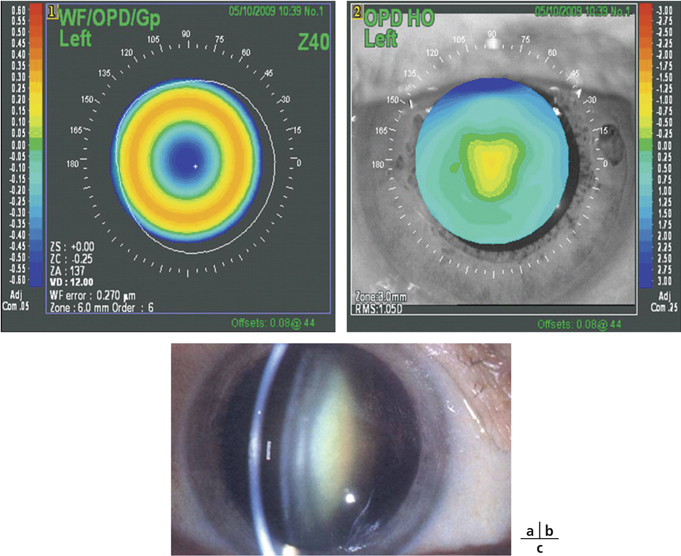
Fig. 7-26 Mesure du front d’onde oculaire (OPD-Scan, Nidek).
a. La déformation du front d’onde est dominée par l’aberration sphérique négative. Cette aberration est majoritairement induite par une cataracte nucléaire (cf. cliché (c)) et impose un aspect en « sombrero » au front d’onde. Les rayons lumineux correspondant à la direction locale de propagation du front d’onde ont été ajoutés de manière schématique (en rouge). L’examen du profil du front d’onde sur la carte WF (wavefront) révèle la présence d’une concavité centrale (au milieu du « sombrero »), qui correspond à une zone de « myopisation » centrale. b. Cette addition dioptrique centrale est évidente sur la carte OPD-HO qui montre des variations de la puissance dioptrique dans la pupille induites par les seules aberrations de haut degré. c. Aspect biomicroscopique du segment antérieur de l’œil examiné.
La coma peut être comprise comme une aberration qui naît d’un gradient de pouvoir réfractif entre deux bords opposés de la pupille. Si ce gradient est tel qu’il corresponde à une augmentation de la puissance réfractive en nasal inférieur (direction habituelle du myosis accommodatif), il y a alors une possibilité au moins théorique pour que cette aberration de coma soit source de multifocalité et de meilleure vision de près (fig. 7-27).
L’existence d’un myosis accommodatif permet de sélectionner la partie centrale (réduction concentrique du diamètre) ou paracentrale (réduction non concentrique du diamètre, avec décalage généralement nasal inférieur) de l’aberration considérée. Dans le cas de l’aberration sphérique négative, la constriction pupillaire modifie la réfraction dans le sens d’une myopisation, utile à la vision de près. Une aberration de coma oblique positive pourrait également induire de la myopisation en cas de déplacement du centre de la pupille avec la constriction (shift pupillaire).
Ceci suggère que l’analyse des mouvements de constriction pupillaire doit être effectuée si on veut établir un traitement multifocal optimisé.
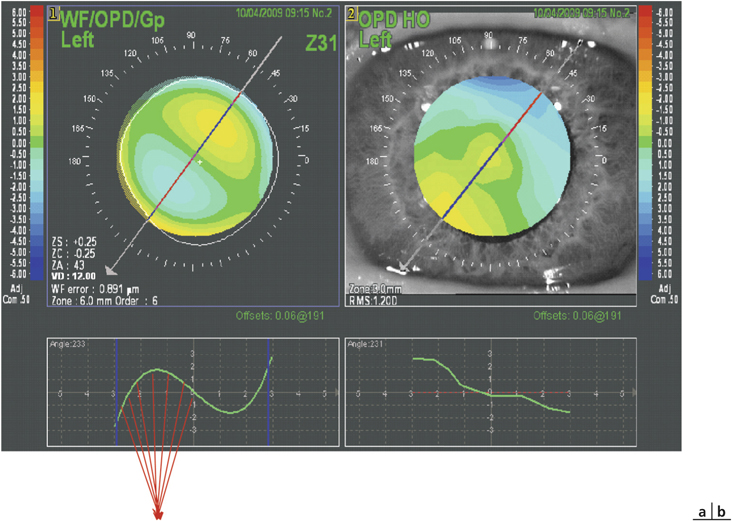
Fig. 7-27 Le front d’onde oculaire a été mesuré chez un patient de 59 ans opéré de LASIK hypermétropique (OPD-Scan, Nidek). L’acuité visuelle non corrigée est de 8/10 (loin) et Parinaud 2 (près).
a. Le front d’onde est déformé par une aberration de coma oblique, orientée en nasal inférieur.b. Cette aberration induit une augmentation de puissance dioptrique en nasal inférieur, elle-même à l’origine d’une meilleure performance visuelle en vision de près non corrigée.
Oshika et al. ont calculé le taux d’aberrations optiques de la cornée de patients pseudophakes [11]. L’influence de ces aberrations était évaluée en stimulant la fonction d’étalement du point (PSF, Point Spread Function) et la courbe de contraste d’origine optique (MTF, Modulation Transfer Function) à partir du recueil du front d’onde. Une corrélation entre pseudo-accommodation et aberration de type coma verticale a été retrouvée. Ces auteurs ont également démontré qu’une variation de puissance de 0,50 D (défocalisation) avait plus d’effet délétère sur la qualité de l’image rétinienne lorsque l’œil ne présentait aucune aberration de haut degré que lorsqu’il présentait un taux modéré de coma. Certains auteurs ont récemment suggéré que le taux d’aberration sphérique résiduel après chirurgie de la cataracte puisse être légèrement positif, afin de satisfaire à un compromis entre maintien d’une légère profondeur de champ et qualité de vision [10].
Rocha et al. ont étudié l’effet de certaines aberrations de haut degré sur la profondeur de champ [13]. Ces auteurs ont utilisé un miroir d’optique adaptative permettant de corriger les aberrations optiques de l’œil examiné (ces aberrations étant mesurées par un aberromètre de Hartmann-Shack). Une fois les aberrations corrigées par le miroir, ce dernier était déformé de manière à induire un taux choisi d’aberration de haut degré : coma, trefoil et aberration sphérique ont été induits à des taux variables, et la profondeur de champ induite pour chaque induction évaluée grâce à la lecture d’optotypes placés à différentes vergences. L’aberration sphérique a fourni une augmentation de profondeur de champ notable (jusqu’à 2 D pour 0,6 µm d’aberration sphérique pour une pupille de 6 mm). Yi et al. ont également étudié l’effet de combinaisons d’aberration sphériques primaire (4e degré) et secondaire (6e degré) grâce à l’optique adaptative [18]. Certaines combinaisons de ces aberrations, en particulier quand leurs signes étaient opposés, étaient à même de procurer une extension utile de la profondeur de champ des yeux examinés.
Les résultats énumérés ci-avant laissent augurer d’une perspective intéressante : moduler de manière intentionnelle les aberrations optiques de haut degré doit logiquement permettre d’induire une multifocalité efficace et contrôlée pour un œil donné. L’objectif de cette approche est d’ajuster le type de multifocalité aux caractéristiques et besoins visuels de l’œil presbyte considéré, afin d’en accroître performance et tolérance.
Pour améliorer la prédictibilité du traitement multifocal de la presbytie, il faut d’abord concevoir un profil personnalisé destiné à augmenter la profondeur de champ de l’œil considéré, puis le délivrer. Ceci implique de mesurer certains paramètres, comme le taux et le type des aberrations optiques préexistantes et la dynamique pupillaire, et suppose également de disposer d’un algorithme permettant de calculer un taux d’aberration optimal, suffisant pour induire la profondeur de champ souhaitée pour l’œil traité, mais contrôlé pour éviter de dégrader la vision de loin.
Une fois ce front d’onde multifocal théorique conçu, il devra être induit par une méthode de correction optique afin de devenir celui de l’œil du patient. Différents vecteurs permettent, selon le contexte clinique, d’induire la multifocalité souhaitée : profil d’ablation cornéen au laser à excimères (obtenu par « soustraction » cornéenne du chemin optique séparant les aberrations optiques préopératoires du front d’onde multifocal idéal), lentille de contact ou implant intraoculaire customisés, etc.
La récente introduction des implants ajustables par irradiation lumineuse ultraviolette (LAL®, Light-Adjustable Lens, cf. chapitre 9) fournit un vecteur particulièrement adapté à la mise en pratique de ce type de concept [9] : une fois l’implant posé, il est possible de prendre en compte sa position relative au jeu pupillaire et au dioptre cornéen. On substituerait à une approche plus grossière comme l’induction d’une « pastille » d’addition dioptrique centrale, une irradiation de la lentille incluant dans son profil à la fois la correction des aberrations « inutiles » (pour la multifocalité et qualitativement nuisibles) et l’induction du « cocktail » d’aberrations souhaité. Ce cocktail correspond au meilleur compromis entre respect d’une certaine qualité optique de loin et augmentation de la profondeur de champ.
Le contrôle de la multifocalité induite par un jeu d’aberrations optiques de haut degré exige entre autres la compréhension des relations entre le jeu pupillaire, le taux et le type d’aberrations de haut degré et la puissance dioptrique induite. Il est possible de prédire mathématiquement la variation moyenne de focale induite par une aberration donnée, et ce pour n’importe quel diamètre pupillaire plus petit que le diamètre initial sur lequel est présente l’aberration considérée. Nous avons par exemple effectué le calcul de la variation de focale induite par l’aberration sphérique introduite sur un large diamètre pupillaire quand celle-ci se réduit (fig. 7-28a).
La pratique de la conduite de nuit et/ou d’activités en ambiance mésopique représente une situation particulièrement exigeante pour la multifocalité, qui expose au risque de dégradation de la qualité de vision nocturne. Plutôt que raisonner en zones d’additions dioptriques et espérer ne pas trop réduire la vision de loin, induire un taux contrôlé d’aberrations optiques de haut degré sélectionnées en fonction du jeu pupillaire permet de contrôler addition et qualité de vision. Il est possible de calculer l’addition de puissance optique (en dioptries) induite par l’aberration sphérique négative présente sur un diamètre supérieur ou égal au diamètre mésopique, sur une sous-pupille particulière (fig. 7-28b). Pour cela, il faut connaître l’amplitude de variation du diamètre pupillaire ainsi que l’éventuel déplacement du centre pupillaire mis en jeu lors du myosis accommodatif.
Le pourtour des zones respectivement dédiées à différentes puissances focales (vision de loin, vision intermédiaire, vision de près) doit logiquement être déterminé en fonction du jeu pupillaire de l’œil considéré, après étude des variations du diamètre et du centrage de la pupille dans différentes conditions de luminosité (photopique, mésopique, scotopique) et de distance de travail (33 cm, 70 cm, infini, etc.). En particulier, l’amplitude et la direction du shift pupillaire en vision de près doivent être mesurées. Le recueil de ces données (jeu pupillaire) pourra permettre de définir les contours des zones réfractives.
Fig. 7-28 Effet du jeu pupillaire sur la multifocalité.
a. Effet des variations du diamètre pupillaire (constriction-myosis) sur l’aberration sphérique. Le front d’onde recueilli sur un large diamètre (conditions mésopiques) est déformé par de l’aberration sphérique négative Si on « sélectionne » le centre de la déformation du front d’onde (comme le ferait naturellement une constriction pupillaire), on passe d’un profil large en « sombrero » à un profil étroit en « calot ». Mathématiquement, cette déformation du front d’onde correspond à une focalisation des rayons lumineux vers un punctum remotum situé à une distance finie (c’est-à-dire une myopie). L’induction d’une myopie centrale par l’aberration sphérique négative est synonyme de l’induction d’une addition centrale utile pour la vision de près. La constriction pupillaire en vision de près permet de démasquer et d’amplifier l’effet de cette « myopisation ».
b. Défocus ( ) induit par l’aberration sphérique (
) induit par l’aberration sphérique ( ) sur une sous-pupille (constriction pupillaire concentrique). L’aberration sphérique est exprimée par le polynôme de Zernike
) sur une sous-pupille (constriction pupillaire concentrique). L’aberration sphérique est exprimée par le polynôme de Zernike  sur un large diamètre initial. Elle induit du défocus sur une zone concentrique centrale, qu’on peut quantifier en cas de réduction du diamètre d’analyse (cf. schémas en médaillons et figure 7-27) grâce à un algorithme qui permet le calcul du défocus présent sur n’importe quelle sous-pupille située au sein du domaine de définition de chacune des aberrations répertoriées dans la classification de Zernike. Dans cet exemple, le taux de défocus maximal (myopique si l’aberration sphérique est négative) est atteint quand le diamètre pupillaire est réduit de 30 % de sa valeur initiale. Toutes les aberrations de haut degré ne sont pas égales en termes de défocus induit ni de pourcentage de réduction pupillaire optimal : certaines aberrations, comme la coma, n’induisent du défocus que sur des sous-pupilles non concentriques.
sur un large diamètre initial. Elle induit du défocus sur une zone concentrique centrale, qu’on peut quantifier en cas de réduction du diamètre d’analyse (cf. schémas en médaillons et figure 7-27) grâce à un algorithme qui permet le calcul du défocus présent sur n’importe quelle sous-pupille située au sein du domaine de définition de chacune des aberrations répertoriées dans la classification de Zernike. Dans cet exemple, le taux de défocus maximal (myopique si l’aberration sphérique est négative) est atteint quand le diamètre pupillaire est réduit de 30 % de sa valeur initiale. Toutes les aberrations de haut degré ne sont pas égales en termes de défocus induit ni de pourcentage de réduction pupillaire optimal : certaines aberrations, comme la coma, n’induisent du défocus que sur des sous-pupilles non concentriques.
Les aberrations de haut degré ont le potentiel pour induire une augmentation de la puissance réfractive locale au sein du sous-domaine pupillaire mesuré en vision de près. La sélection des aberrations de haut degré nécessaires pour bâtir la correction multifocale repose sur les zones pupillaires précédemment établies et le maintien d’une qualité optique « acceptable » en vision de loin et en conditions mésopiques (fig. 7-29). À partir du front d’onde théorique construit sur le domaine de référence, on peut calculer l’expression des fronts d’onde correspondant aux pupilles mésopique et photopique. De ces données, il devient possible de prédire les conséquences sur la qualité de vision de la combinaison des aberrations optiques introduites par la correction multifocale, et ce pour différents diamètres pupillaires. Ceci est accompli par le biais du calcul de plusieurs métriques objectives qui permettent d’apprécier le retentissement de ces aberrations sur la qualité de l’image rétinienne.
La connaissance du taux des aberrations induites permet la simulation de l’effet de la correction multifocale envisagée et le calcul de métriques objectives de qualité optique, comme la fonction d’étalement du point (Point Spread Function, PSF) et la courbe de transfert de modulation (Modulation Transfer Function, MTF) (fig. 7-30).
Ces paramètres peuvent guider l’élaboration d’un profil multifocal constitué par un ensemble d’aberrations optiques sélectionnées pour induire la multifocalité souhaitée et ajustées pour optimiser la qualité de vision. Il existe des mécanismes de compensation neuronale pouvant pondérer l’effet subjectif d’une aberration donnée sur la fonction visuelle [2]. Une autre possibilité de personnalisation offerte par une méthode reposant sur la sélection objective d’un ensemble d’aberrations optiques est de favoriser l’expression de certaines aberrations dans le front d’onde résultant final par une technique de pondération sélective.
À côté de ces tests objectifs (calcul de l’impact sur la qualité de l’image rétinienne), il pourrait s’avérer également possible de recourir à des tests subjectifs. La réalisation d’images simulant la déformation d’optotypes, de lentilles comportant les corrections générées ou d’une technique d’optique adaptative peut également permettre d’étudier la perception et l’adaptation subjective d’un patient donné à la multifocalité proposée.
Il est possible de proposer en préopératoire pour un même patient une ou plusieurs corrections multifocales, en pondérant différemment les aberrations destinées à équilibrer la répartition entre vision de loin et vision de près, etc. Par exemple, différentes magnitudes pour l’addition de près peuvent être testées, afin de déterminer une marge de sécurité pour la préservation de la qualité de vision de loin.
Au final, un front d’onde oculaire théorique résultant de l’intégration de la correction pour la vision de loin et la vision de près (voire d’une ou plusieurs visions intermédiaires) est sélectionné. L’intégration des données correspondant à la vision de loin et de près en un seul profil d’ablation constitue un progrès tangible, éliminant le risque de superposition des zones optiques et de transition induit par les traitements séquentiels.
Nous avons attentivement étudié les résultats issus de simulations théoriques réalisées à partir d’un algorithme développé pour générer des corrections multifocales : les valeurs utilisées pour les simulations étaient issues du recueil de données cliniques (dynamique pupillaire, degré d’addition dioptrique à pourvoir). Les profils générés étaient très semblables en qualité (type d’aberrations induites) et en quantité (taux RMS) à ceux mesurés en pratique clinique chez des sujets présentant une multifocalité efficace et bien tolérée (naturelle ou obtenue après chirurgie comme le LASIK hypermétropique ou le port de lentilles multifocales). De plus, certaines simulations induisent après recalcul pour des diamètres pupillaires intermédiaires un faible degré d’astigmatisme oblique ou inverse, dont l’effet bénéfique sur la multifocalité est admis et documenté [18].
Fig. 7-29 Construction d’un front d’onde multifocal.
À partir des données du jeu pupillaire, on définit des domaines (domaine principal, sous-pupilles pour les visions de loin et de près). Connaissant le « degré de multifocalité » induit par chaque aberration de haut degré sur un domaine particulier, on peut générer un front d’onde oculaire multifocal destiné à induire exactement le degré d’addition dioptrique souhaité sur le(s) domaine(s) précédemment déterminés (par exemple, 1,5 D sur une sous-pupille de 1,5 mm).
Fig. 7-30 Exemple de front d’onde multifocal (avec carte des aberrations et taux RMS) défini sur un domaine de référence (en haut), englobant les domaines de vision mésopique (au milieu) et photopique (en bas).
Les diamètres pupillaires et le centre de ces zones ont été obtenus par des mesures effectuées dans diverses conditions de luminosité et de distances d’observation. La zone de puissance additionnelle destinée à induire une vision de près non corrigée est située au sein de la sous-pupille photopique. L’utilisation d’une méthode analytique et non purement empirique permet de prédire de façon précise le taux RMS et la nature exacte de chaque aberration induite pour l’obtention de la multifocalité en plus de la correction éventuelle de la vision de loin. La connaissance de ces aberrations permet en retour de prédire l’effet du traitement sur la qualité de vision : ici, par exemple, le calcul de la fonction de transfert de modulation (MTF). En pratique, le traitement final pourrait être établi de manière à corriger les aberrations optiques préexistantes de l’œil opéré et à induire les aberrations définies sur le domaine de référence.

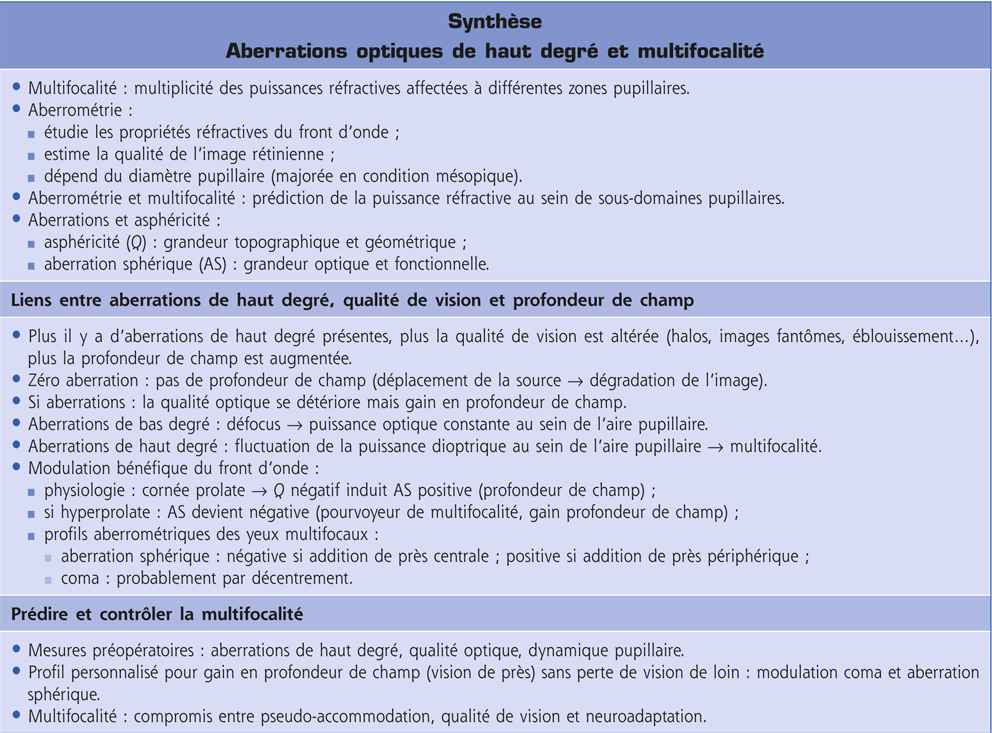
[1] Applegate R.A., Hilmantel G., Howland H.C. et al. Corneal first surface optical aberrations and visual performance. J Refract Surg, 2000 ; 16 : 507-14.
[2] Artal P., Chen L., Fernández E.J. et al. Adaptive optics for vision: the eye’s adaptation to point spread function. J Refract Surg, 2003 ; 19 : S585-7.
[3] Chalita M.R., Xu M., Krueger R.R. Correlation of aberrations with visual symptoms using wavefront analysis in eyes after laser in situ keratomileusis. J Refract Surg, 2003 ; 19 : S682-6.
[4] Datiles M.B., Gancayco T. Low myopia with low astigmatic correction gives cataract surgery patients good depth of focus. Ophthalmology, 1990 ; 97 : 922-6.
[5] Gatinel D., Haouat M., Hoang-Xuan T. Étude des paramètres permettant la description mathémathique de l’asphéricité cornéenne. J Fr Ophtalmol, 2002 ; 25 : 81-90.
[6] Gatinel D. Aberrations monochromatiques de haut degré : définitions et conséquences sur la fonction visuelle. In : Le LASIK, de la théorie à la pratique. Gatinel D., Hoang-Xuan T. (éd.). Elsevier, Paris, 2003 : 151-9.
[7] Gatinel D., Delair E., Abi-Farah H., Hoang-Xuan T. Étude de la distribution et de l’énantiomorphisme des aberrations optiques oculaires de haut degré. J Fr Ophtalmol, 2005 ; 28 : 1041-50.
[8] Gatinel D. Optical performance of monofocal versus multifocal intraocular lenses. J Cataract Refract Surg, 2008 ; 34 : 1817-8.
[9] Hengerer F.H., Conrad-Hengerer I., Buchner S.E., Dick H.B. Evaluation of the Calhoun Vision UV Light Adjustable Lens implanted following cataract removal. J Refract Surg, 2010 ; 26 : 716-21.
[10] Nochez Y., Majzoub S., Pisella P.-J. Effect of residual ocular spherical aberration on objective and subjective quality of vision in pseudophakic eyes. J Cataract Refract Surg, 2011 ; 37 : 1076-81.
[11] Oshika T., MimuraT., Tanaka S. et al. Apparent accommodation and corneal wavefront aberration in pseudophakic eyes. Invest Ophtalmol Vis Sci, 2002 ; 43 : 2882-6.
[12] Peyre C., Fumery L., Gatinel D. Comparaison des aberrations optiques oculaires d’ordre élevé induites par différentes géométries de lentilles multifocales. J Fr Ophtalmol, 2005 ; 28 : 599-604.
[13] Rocha K.M., Vabre L., Chateau N., Krueger R.R. Expanding depth of focus by modifying higher-order aberrations induced by an adaptive optics visual simulator. J Cataract Refract Surg, 2009 ; 35 : 1885-92.
[14] Seiler T., Kaemmerer M., Mierdel P., Krinke H.E. Ocular optical aberrations after photorefractive keratectomy for myopia and myopic astigmatism. Arch Ophthalmol, 2000 ; 118 : 17-21.
[15] Thibos L.N., Bradley A., Hong X. A statistical model of the aberation structure of normal, well-corrected eyes. Ophthalmic Physiol Opt, 2002 ; 22 : 427-33.
[16] Tomidokoro A., Soya K., Miyata K. et al. Corneal irregular astigmatism and contrast sensitivity after photorefractive keratectomy. Ophthalmology, 2001 ; 108 : 2209-12.
[17] Verdon W., Bullimore M., Maloney R.K. Visual performance after photorefractive keratectomy: a prospective study. Arch Ophthalmol, 1996 ; 114 : 1465-72.
[18] Yi F., Robert Iskander D., Collins M. Depth of focus and visual acuity with primary and secondary spherical aberration. Vision Res, 2011 ; 51 : 1648-58.
P. Rozot
Les implants réfractifs comportent une juxtaposition de zones optiques en nombre variable (deux à cinq selon les modèles), le plus souvent circonférentielles, chacune de puissance optique réfractive différente [7]. Les zones peuvent être sphériques ou asphériques [4] :
– lorsqu’elles sont sphériques, elles produisent une distance focale avec une multifocalité alternante ;
– lorsqu’elles sont asphériques, elles produisent plusieurs focales, avec une distribution uniforme de multifocalité à la surface de la lentille.
Ce principe optique n’induit pas de perte significative de lumière incidente au niveau rétinien, contrairement à la multifocalité diffractive. Chaque zone, en fonction de sa puissance optique, va concentrer la lumière vers un foyer qui dépend directement de cette puissance et peut se faire à une distance focale variable, qui peut être de loin, en intermédiaire ou encore de près. La quantité d’énergie lumineuse donnée par chaque zone est dépendante de la surface de cette zone ; ainsi, chaque constructeur d’implants peut déterminer à l’avance la quantité d’énergie lumineuse dévolue à tel ou tel foyer, tant de loin qu’intermédiaire ou de près. Il y aura une variation de proportion d’énergie lumineuse pour les différents types de zone en fonction de la pupille et, par voie de conséquence, la courbe de transmission de l’énergie lumineuse loin/près va dépendre du diamètre pupillaire en fonction des choix faits par le constructeur. Historiquement, les premiers implants réfractifs comportaient une zone centrale dévolue à la vision de près : soit individualisée (implant en PMMA bifocal « Bull’s eye » NuVue® de IOLab avec addition de + 4 D (fig. 7-31) : premier implant multifocal posé au monde en 1987 par J.L. Pearce), soit par une asphérisation de la surface antérieure sur 4,7 mm (implants en PMMA progressifs de Domilens, Progress® 1 et Progress® 3, dont l’addition était de 5 D à sa partie la plus centrale) (fig. 7-32) [23]. Ensuite est apparu l’implant TrueVista® de Storz (Bausch & Lomb), en PMMA également, qui comportait une zone annulaire intermédiaire d’addition + 4 D entre la zone centrale et la zone périphérique dévolues à la vision de loin [14], ce qui apporte une addition de 3,00 D au plan lunettes. Pour les implants dont la zone centrale est dévolue à la vision de loin, il faut un diamètre pupillaire minimal pour obtenir une vision de près utilisable, évaluée selon les études entre 3,4 mm [13] et 4,5 mm [11] pour l’implant réfractif à cinq zones Array® SA40 (AMO). Plus récemment, une zone additive non circonférentielle a été proposée sur un nouveau modèle d’implant [16] (cf. infra). Une variante théorique mais en pratique non utilisée à ce jour, consiste en une alternance de zones annulaires concentriques d’indices de réfraction différents [8]. Classiquement, les implants multifocaux réfractifs sont plus sensibles au décentrement que les implants diffractifs, avec pour conséquence une détérioration de la qualité visuelle de loin et en intermédiaire, le décentrement maximal tolérable pouvant néanmoins atteindre 0,9 mm [11]. Les implants réfractifs, de par leur construction optique avec superposition de zones de loin et de près, génèrent des effets optiques indésirables, ou effets photiques, dont le plus important est le phénomène de halo, défini par l’existence d’un disque de lumière atténuée ou cercle concentrique à bords plus ou moins flous entourant l’image d’une source lumineuse. Ce phénomène dépend du diamètre pupillaire, de la puissance cornéenne, de la puissance du foyer de loin de l’implant, ainsi que de la puissance d’addition portée par l’implant (fig. 7-33) [22]. Les phénomènes de halos sont majorés en cas d’amétropie postopératoire de type myopique [26].
Fig. 7-31 Implant NuVue® (IOLab).
(Cliché : P. Rozot.)
Fig. 7-32 Implant Progress® (Domilens).
(D’après Ravalico et al., 1994 [23].)
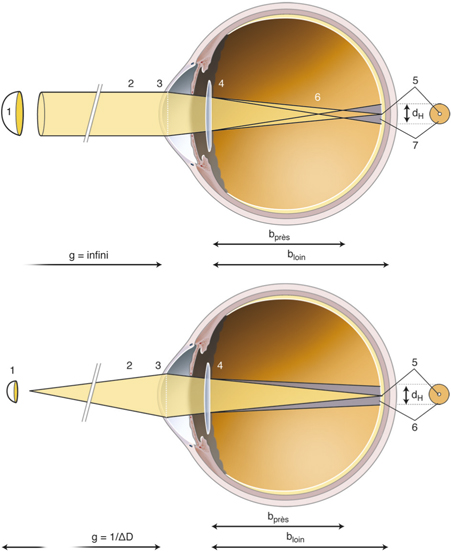
Fig. 7-33 Détermination optique du halo.
a. Une source lumineuse située à l’infini (1) émet des rayons lumineux parallèles (2) qui sont focalisés par la cornée (3) et l’implant bifocal (4). Le foyer de loin de l’implant bifocal produit une image ponctuelle sur la rétine (5). Sur la présentation axiale, cette image est représentée par le point blanc central (5). Le point focal de près est situé devant la rétine (6), produisant une image défocalisée sur la rétine (7). Le grand diamètre de cette image défocalisée est représenté par le bord externe du spot gris de la présentation axiale (7) autour de l’image défocalisée (5).
b. Une source lumineuse située à la distance de lecture (1) et les rayons atteignant la cornée sont dessinés en (2). Ces rayons sont focalisés par la cornée (3) et l’implant bifocal (4). Le foyer de près de l’implant bifocal produit une image punctiforme sur la rétine (5) reproduite également sur la présentation axiale (5). Le foyer de loin de l’implant produit une image théorique derrière la rétine, avec donc une image défocalisée sur la rétine (6). Le grand diamètre de cette image défocalisée est responsable du halo (6).
g, distance objet ; bprès, distance de l’image produite par le foyer de près ; bloin, distance de l’image produite par le foyer de loin ; dH, diamètre du halo ; ΔD, différence de puissances entre les foyers de loin et de près.
(D’après Pieh et al., 2001 [22].)
Cet implant composé d’acrylique hydrophile présente une optique réfractive à quatre zones prédominant en vision de près : la zone centrale d’addition + 4 D est dévolue à la vision de près, puis les zones suivantes alternent selon la séquence loin/près/loin vers la périphérie (fig. 7-34) ; l’addition est équivalente à environ + 3,00 D au plan lunettes ; sa constante A est à 118,2.
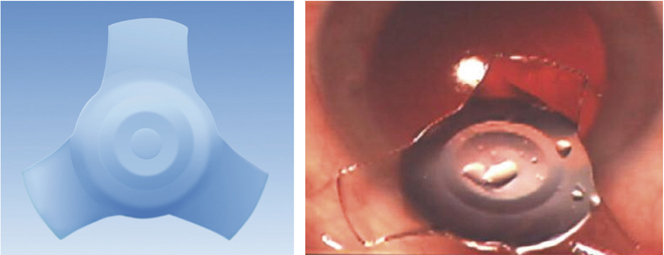
Fig. 7-34 Implant MF4® (Zeiss-Meditec/IOLtech).
(D’après des données du laboratoire IOLtech ; cliché : P. Rozot.)
Cet implant composé de silicone à anses en PMMA présente une optique réfractive à cinq zones prédominant en vision de loin : zone centrale dévolue à la vision de loin, puis d’addition + 3,50 D dévolue à la vision de près, puis zones alternantes loin/près/loin vers la périphérie. L’addition est équivalente à environ + 2,70 D au plan lunettes.
La zone centrale a un diamètre de 2,1 mm (fig. 7-35) ; chaque zone (1, 3 et 5) pour la vision de loin a une puissance qui augmente à sa périphérie pour assurer une transition douce avec la zone de près contiguë, ce qui réduit la dépendance pupillaire. La distribution de l’énergie lumineuse, pour un diamètre pupillaire de plus de 2 mm, se fait à 50 % pour la vision de loin, 13 % pour la vision intermédiaire et 37 % pour la vision de près. Sa constante A est à 118,4.
Fig. 7-35 Implant Array® SA40 (Allergan/AMO).
(Schémas reproduits d’après des données du laboratoire Allergan ; cliché : P. Rozot.)
C’est la version actuelle de l’implant Array®, désormais en acrylique hydrophobe et bénéficiant d’une réduction de largeur des deux zones les plus périphériques (Balanced View Optics) (fig. 7-36), afin de mieux équilibrer les niveaux de vision de loin, intermédiaire et de près quel que soit le diamètre pupillaire et de réduire les effets photiques. La distribution de l’énergie lumineuse du principe Array® favorise la vision éloignée et intermédiaire à pupille peu dilatée, la vision de près devenant utile à partir d’un diamètre pupillaire de 3 mm (fig. 7-37). La courbe de défocalisation indique clairement qu’il s’agit d’un implant à prédominance loin et intermédiaire (fig. 7-38).
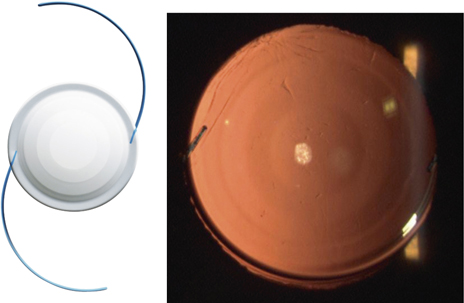
Fig. 7-36 Implant Array® ReZoom ® (AMO).
(Schéma reproduit d’après des données du laboratoire Abbott Medical Optics ; cliché : P. Rozot.)
Fig. 7-37 Implant Array® ReZoom® : distribution de l’énergie lumineuse en fonction de la pupille.
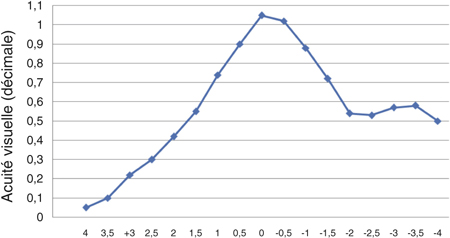
Fig. 7-38 Implant Array® ReZoom® : courbe de défocalisation.
Cet implant composé d’acrylique hydrophile présente une optique réfractive à quatre ou cinq zones selon la puissance optique de la lentille (fig. 7-39), la zone centrale étant dévolue à la vision de loin ; deux additions sont disponibles (+ 3 D et + 4 D) et il peut également être décliné en version torique. Selon le modèle, l’addition est équivalente à environ + 2,25 D ou + 3,00 D au plan lunettes. Sa constante A est à 118,4.
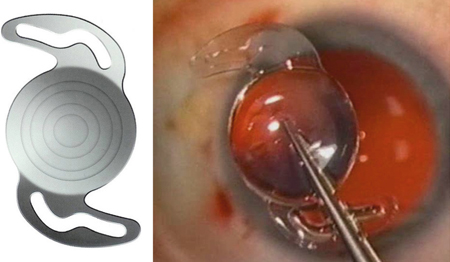
Fig. 7-39 Implant M-flex®(Rayner).
(Schéma reproduit d’après des données du laboratoire Rayner/Ophta France ; cliché : P. Rozot.)
Cet implant est composé d’acrylique hydrophobe à anses en PMMA et comporte un filtre jaune filtrant les radiations bleues ; il est présenté en injecteur préchargé et s’insère par 2,4 mm. Son optique est réfractive, avec une zone annulaire de 0,96 mm de largeur pour la vision rapprochée et d’addition + 3 D (fig. 7-40), ce qui équivaut à environ + 2,25 D au plan lunettes ; la zone centrale dévolue à la vision de loin a un diamètre de 2,3 mm. La constante A est à 118,4. La courbe de défocalisation montre qu’il s’agit d’un implant favorisant la vision éloignée et la vision intermédiaire (fig. 7-41).
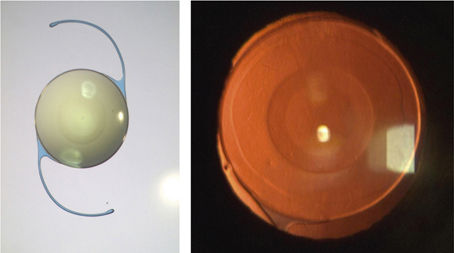
Fig. 7-40 Implant iSii (Hoya).
(Reproduit d’après des données du laboratoire Hoya ; cliché : P. Rozot.)
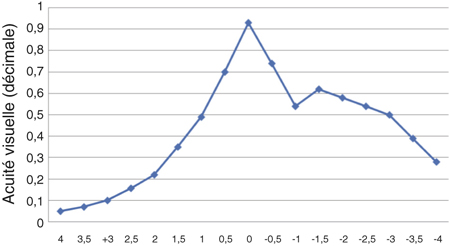
Fig. 7-41 Implant iSii : courbe de défocalisation.
Cet implant est monobloc et peut être inséré par 1,8 mm, composé d’acrylique hydrophile à revêtement hydrophobe avec deux modèles d’haptiques différents. Le LS312 a des anses en « C » ; sa constante A est à 117,8. L’optique est réfractive, avec une zone asymétrique asphérique pour la vision de loin et une plage additive en secteur sur les 160° inférieurs de l’optique (fig. 7-42), de puissance + 1,50 D (modèles MF15) ou + 3 D (modèles MF30), ce qui équivaut à + 1,00 D ou + 2,25 D environ au plan lunettes selon le modèle ; la transition entre les deux secteurs est réfléchie en dehors de l’axe visuel pour éviter une superposition d’image. Au-delà de 2 mm, le diamètre pupillaire n’influe quasi pas la répartition de l’énergie lumineuse – contrairement aux autres multifocaux réfractifs –, la courbe de distribution d’énergie lumineuse objectivant une variation de répartition loin/près surtout significative pour un diamètre inférieur à 2 mm, où est alors favorisée la vision de loin ; au-delà de 2,5 mm, la différence de répartition n’excède pas 15 % (fig. 7-43). La courbe de défocalisation montre qu’il s’agit d’un implant favorisant la vision éloignée et la vision intermédiaire (fig. 7-44).
Fig. 7-42 Implant Lentis® Mplus® (Oculentis).
(Schémas reproduits d’après des données des laboratoires Oculentis/Topcon ; cliché : P. Rozot.)
Fig. 7-43 Implant Mplus® : distribution de l’énergie lumineuse en fonction de la pupille.
Fig. 7-44 Implant Mplus® : courbe de défocalisation.
Les bénéfices en vision de près de cet implant – l’Array® SA40 a reçu l’agrément de la FDA en 1997 pour la cataracte – ont été rapidement évidents, avec une étude prospective randomisée montrant 84 % de patients implantés en pose bilatérale obtenant une vision de près de 0,8 (Jaeger 2) avec la meilleure correction de loin en binoculaire, contre 4 % seulement pour le groupe témoin monofocal [20]. Pieh et al. [21] ont trouvé que la vision des contrastes avec l’implant Array® était supérieure à celle obtenue avec l’implant 3M modèle 815 diffractif. Dans une étude prospective intra-individuelle, l’œil porteur de l’implant Array® gagne en moyenne deux lignes d’acuité de près, tandis que l’acuité de loin est comparable [26] ; une autre évaluation de même type montre une meilleure profondeur de champ pour le multifocal [27]. Dans une étude multicentrique randomisée [12], 96 % des patients opérés des deux yeux atteignent 0,5 de loin (20/40) et 0,67 (Jaeger 3) de près sans correction en binoculaire, contre 65 % des témoins avec implants monofocaux ; la moyenne de l’acuité de près non corrigée est de 0,8 pour le multifocal contre 0,5 pour le monofocal, et atteint 0,7 contre 0,45 avec la meilleure correction de loin ; 32 % des patients sont totalement indépendants aux lunettes contre 8 % des monofocaux ; la vision sans correction est meilleure avec le multifocal en intermédiaire et de près. Il y a significativement plus de halos et d’éblouissement avec le multifocal, cette donnée étant confirmée par Häring et al. [9], qui retrouvent 41 % d’effets photiques dans leur groupe multifocal contre 9 % dans leur groupe monofocal, 5 % des patients étant sévèrement gênés dans le premier groupe contre 0 % dans le second. La vision des faibles contrastes (à 11 %) est statistiquement plus basse avec le multifocal [25, 27]. Dick et al. obtiennent au moins 0,67 de loin (20/30) et 0,8 de près (Jaeger 4) pour chacun de leurs vingt-cinq patients opérés de cristallin clair avec pose bilatérale d’implant Array® [6], résultats proches de ceux de Packer et al. [19] dans la même indication. Une étude comparative entre le SA40 N et le P359 TrueVista® montre des résultats en vision de loin équivalents, mais plus favorables pour le TrueVista® en vision de près (avec la meilleure correction de loin) [15] et ce en raison de l’addition plus forte dont est pourvu ce dernier ; les niveaux de satisfaction étaient toutefois équivalents, de même que la fréquence des effets photiques. La vision binoculaire et stéréoscopique n’est pas altérée et même parfois améliorée par l’implantation bilatérale de l’implant Array® [3]. L’évaluation automatique de la réfraction avec cet implant donne des résultats fiables pour l’astigmatisme, mais trouve des résultats en sphère trop marqués sur les valeurs négatives, les zones de vision de près « trompant » la mesure d’autoréfractométrie [17]. Au total, cet implant a constitué une avancée majeure dès le début des années quatre-vingt-dix dans le développement de l’implantation multifocale, non seulement par son optique innovante mais également grâce à son matériau pliable (silicone) le faisant insérer, grâce à la phacoémulsification, par une incision plus étroite que ses prédécesseurs, dont les qualités optiques étaient pénalisées par l’importance de l’astigmatisme postopératoire. Son utilité en chirurgie de la cataracte a ainsi permis les premières validations pour l’extraction d’un cristallin clair afin de compenser la presbytie : l’acronyme PRELEX (PREsbyopicLens EXchange) a vu le jour grâce à K.L. Waltz, premier ophtalmologiste à s’être fait opérer avec l’implant Array® et qui a décrit son expérience, et R.B. Wallace.
Une étude multicentrique européenne [14] a montré les principaux résultats suivants : l’acuité visuelle de loin corrigée était à 0,5 dans 98 % des cas, tandis que l’acuité de près avec la meilleure correction de loin atteignait 0,67 dans 79 % des cas. La vision des faibles contrastes de loin (planches de Regan) à 11 % est statistiquement plus basse avec le multifocal qu’avec un monofocal, alors que les visions à tous les niveaux de contrastes de près sont inférieures pour le multifocal. Dans le sous-groupe de patients avec un monofocal sur le second œil, 78 % des patients sont satisfaits de leur vision de loin corrigée contre 96 % pour le monofocal. Une étude japonaise trouve d’excellents résultats, avec 93 % d’acuité de loin corrigée à 1,0 ou mieux et 93 % ont une acuité de près supérieure ou égale à 1,0 (Jaeger 1) avec la meilleure correction de loin [24].
Implanté de façon bilatérale, il donne des acuités en vision non corrigée et corrigée de loin comparables à celles du groupe témoin monofocal, et significativement meilleures à 50 cm et 30 cm ; la vision des contrastes en ambiance mésopique et avec éblouissement est similaire dans les deux groupes. Le diamètre pupillaire n’a pas d’influence significative et la présence d’un tilt ou d’un décentrement n’a pas d’effet optique défavorable [10]. Au total, cet implant apporte une profondeur de champ intéressante sans pénalisation de la performance visuelle de loin ; dans une série personnelle non publiée, la fréquence des halos recherchée par questionnaire est toutefois de l’ordre de 20 %.
La version avec addition + 3 D a récemment été évaluée [5], avec de très bons résultats de loin et en vision intermédiaire ; 90 % des patients ont une indépendance aux lunettes de loin et 70 % aux lunettes de près. Aucun effet photique n’est rencontré à un an dans cette étude, ce qui contraste avec une série personnelle non publiée, qui montrait 25 % de halos avec cet implant – le modèle avec addition de + 4 D représentant toutefois la majorité des implants posés.
Cet implant réfractif de dernière génération a été initialement étudié par G. Auffarth sur cent trente-quatre yeux de soixante-dix-neuf patients (données non publiées, présentées au congrès ESCRS 2009), utilisant la version d’addition + 3,00 D. L’acuité visuelle non corrigée de loin était à 0,1 logMAR à trois mois ; la vision de près non corrigée était à 0,08 ± 0,12 logMAR, alors que la courbe de défocalisation montrait un pic à 0,0 D et le second à – 2,50 D.
Alió a évalué vingt-quatre yeux porteurs du modèle LS 312 [1] et a trouvé une acuité de loin non corrigée à 0,25 ± 0,33 logMAR pour le multifocal, contre 0,09 ± 0,15 logMAR pour un monofocal comparé ; la vision de loin corrigée était à 0,09 ± 0,18 logMAR pour l’implant multifocal, pour 0,02 ± 0,05 logMAR pour le monofocal : ces acuités corrigées et non corrigées n’étaient pas significativement différentes pour les deux modèles d’implants. L’acuité visuelle de près était en moyenne à Jaeger 2 pour le multifocal contre Jaeger 5 pour le monofocal. L’étude des aberrations optiques de haut degré montrait plus d’incidence de coma dans le groupe multifocal. Il n’y avait toutefois pas de différence de sensibilité aux contrastes ni en ambiance photopique ni en ambiance mésopique entre le modèle multifocal et la référence monofocale, évaluée par le CST 1800. McAlinden et Moore ont étudié quarante-quatre yeux de vingt-deux patients chez qui était posée la version d’addition + 3,00 D sur l’œil non dominant et la version d’addition + 1,50 D sur l’œil dominant [16] : l’acuité visuelle de loin non corrigée était à 0,04 ± 0,25 logMAR, alors que corrigée elle atteignait – 0,08 ± 0,07 logMAR ; les résultats en acuité visuelle de près étaient exprimés en « M-notation », avec M 0,75 ± 0,33 à 32 cm (soit environ 0,25 logMAR), M 0,90 ± 0,27 à 66 cm (soit environ 0,35 logMAR), tandis que la distance de lecture préférée était obtenue à M 0,57 ± 0,18 (soit environ 0,16 logMAR). Deux patients signalaient des effets photiques nocturnes gênants, soit 10 % des patients. L’étude des contrastes, évaluée par les cartes de Pelli-Robson, obtenait 1,55 log-Cs, score supérieur à ceux obtenus avec le même test sur d’autres implants multifocaux. Alió a comparé vingt-deux yeux porteurs d’un implant Mplus® LS 312 MF15, porteurs d’une addition + 1,50 D, à vingt et un yeux porteurs d’un Mplus® LS 312 MF30, porteurs d’une addition de 3,00 D [2] ; l’âge des patients comportait des extrêmes de cinquante-cinq à quatre-vingt-trois ans. Les résultats ont montré une acuité de loin non corrigée non significativement différente, tant à trois mois qu’à six mois ; il en était de même pour l’acuité avec la meilleure correction qui, à six mois, atteignait 0,06 ± 0,08 logMAR dans le groupe d’addition + 1,50 D et 0,06 ± 0,07 logMAR dans le groupe d’addition + 3,00 D. L’acuité visuelle non corrigée de près était meilleure dans le groupe d’addition + 3,0 (0,25 ± 0,10 logMAR contre 0,45 ± 0,19 logMAR), alors que l’acuité visuelle à 80 cm n’était significativement meilleure qu’à trois mois pour le groupe d’addition + 1,50 D. La comparaison des courbes de défocalisation entre les deux modèles montrait une supériorité pour le modèle d’addition + 1,50 D seulement pour un défocus de – 0,50 D, la tendance s’inversant en faveur du modèle d’addition + 3,00 D dès le défocus de – 1,00, – 1,50, – 2,00 et – 2,50 D. Enfin, il existait une tendance pour plus de halos dans le groupe d’addition + 3,00 D, mais sans significativité. Au total, les modèles d’addition + 1,50 D semblent logiquement capables d’améliorer la vision intermédiaire mais plutôt limités pour la vision de près, et ils n’apportent finalement pas d’amélioration significative pour la qualité optique en vision de loin.
Ainsi, cet implant semble mieux préserver la performance visuelle que d’autres implants multifocaux réfractifs, tout en évitant la perte d’environ 20 % de lumière incidente inhérente aux optiques diffractives. Il peut être qualifié d’implant à profondeur de champ restant dominant pour la vision de loin ; reste toutefois à définir le choix entre des versions d’addition + 1,50 D et + 3,00 D : il pourra être discuté selon les activités sociales ou professionnelles du candidat à cette chirurgie.
L’implant Mplus® a également été évalué par Munoz et al. [18], avec une implantation bilatérale, qui a apporté une acuité de loin binoculaire à – 0,04 ± 0,007 logMAR à 6 mètres, 0,11 ± 0,10 logMAR à 1 mètre et 0,06 ± 0,07 logMAR à 40 cm. La sensibilité aux contrastes photopiques était identique à celle d’un groupe monofocal témoin en vision de loin ; toutefois, en vision rapprochée, photopique, et en vision mésopique de loin, il y avait une réduction de sensibilité aux hautes fréquences spatiales. Les halos n’étaient retrouvés que dans 6,2 % des cas, un éblouissement dans 12,5 % des cas et des difficultés à la vision nocturne pour 15,6 % des cas. Il est conclu et confirmé que l’implant est prédominant pour la vision de loin et intermédiaire, avec des taux d’effets photiques moins importants que pour d’autres implants multifocaux, notamment diffractifs.

[1] Alió J.L., Pinero D.P., Plaza-Puche A.B. Visual outcomes and optical performance of a monofocal intraocular lens and a new-generation multifocal intraocular lens. J Cataract Refract Surg, 2011 ; 37 : 241-50.
[2] Alió J.L., Plaza-Puche A.B., Piñero D.P. et al. Comparative analysis of the clinical outcomes with 2 multifocal intraocular lens models with rotational asymmetry. J Cataract Refract Surg, 2011 ; 37 : 1605-14.
[3] Arens B., Freudenthaler N., Quentin C.D. Binocular function after bilateral implantation of monofocal and refractive multifocal intraocular lenses. J Cataract Refract Surg, 1999 ; 25 : 399-404.
[4] Bellucci R. Multifocal intraocular lenses. Curr Opin Ophthalmol, 2005 ; 16 : 33-7.
[5] Cezon Prieto J., Bautista M.J. Visual outcomes after implantation of a refractive multifocal intraocular lens with a + 3.00 D addition. J Cataract Refract Surg, 2010 ; 36 : 1508-16.
[6] Dick H.B., Gross S., Tehrani M. et al. Refractive lens exchange with an array multifocal intraocular lens. J Refract Surg, 2002 ; 18 : 509-18.
[7] Eisenmann D., Jacobi K.W. [The Array multifocal lens – functional principle and clinical results.] Klin Monbl Augenheilkd, 1993 ; 203 : 189-94.
[8] Fiala W. Birefringent multifocal lenses: theory and application to the correction of refractive error. Optom Vis Sci, 1990 ; 67 : 787-91.
[9] Haring G., Dick H.B., Krummenauer F. et al. Subjective photic phenomena with refractive multifocal and monofocal intraocular lenses. Results of a multicenter questionnaire. J Cataract Refract Surg, 2001 ; 27 : 245-9.
[10] Hayashi K., Yoshida M., Hayashi H. All-distance visual acuity and contrast visual acuity in eyes with a refractive multifocal intraocular lens with minimal added power. Ophthalmology, 2009 ; 116 : 401-8.
[11] Hayashi K., Hayashi H., Nakao F., Hayashi F. Correlation between pupillary size and intraocular lens decentration and visual acuity of a zonal-progressive multifocal lens and a monofocal lens. Ophthalmology, 2001 ; 108 : 2011-7.
[12] Javitt J.C., Steinert R.F. Cataract extraction with multifocal intraocular lens implantation: a multinational clinical trial evaluating clinical, functional, and quality-of-life outcomes. Ophthalmology, 2000 ; 107 : 2040-8.
[13] Kawamorita T., Uozato H. Modulation transfer function and pupil size in multifocal and monofocal intraocular lenses in vitro. J Cataract Refract Surg, 2005 ; 31 : 2379-85.
[14] Knorz M.C. Results of a European multicenter study of the True Vista bifocal intraocular lens. J Cataract Refract Surg, 1993 ; 19 : 626-34.
[15] Lesueur L., Gajan B., Nardin M. et al. Résultats comparatifs visuels et qualité de vision de deux implants multifocaux. J Fr Ophtalmol, 2000 ; 23 : 355-9.
[16] McAlinden C., Moore J.E. Multifocal intraocular lens with a surface-embedded near section: Short-term clinical outcomes. J Cataract Refract Surg, 2011 ; 37 : 441-5.
[17] Muñoz G., Albarrán-Diego C., Sakla H.F. Validity of autorefraction after cataract surgery with multifocal ReZoom intraocular lens implantation. J Cataract Refract Surg, 2007 ; 33 : 1573-8.
[18] Muñoz G., Albarrán-Diego C., Ferrer-Blasco T. et al. Visual function after bilateral implantation of a new zonal refractive aspheric multifocal intraocular lens. J Cataract Refract Surg, 2011 ; 37 : 2043-52.
[19] Packer M., Fine I.H., Hoffman R.S. Refractive lens exchange with the array multifocal intraocular lens. J Cataract Refract Surg, 2002 ; 28 : 421-4.
[20] Percival S.P., Setty S.S. Prospectively randomized trial comparing the pseudoaccommodation of the AMO ARRAY multifocal lens and a monofocal lens. J Cataract Refract Surg, 1993 ; 19 : 26-31.
[21] Pieh S., Weghaupt H., Skorpik C. Contrast sensitivity and glare disability with diffractive and refractive multifocal intraocular lenses. J Cataract Refract Surg, 1998 ; 24 : 659-62.
[22] Pieh S., Lackner B., Hanselmayer G. et al. Halo size under distance and near conditions in refractive multifocal intraocular lenses. Br J Ophthalmol, 2001 ; 85 : 816-21.
[23] Ravalico G., Baccara F., Isola V. Évaluation fonctionnelle d’un nouveau type de lentille intraoculaire : Domilens type PROGRESS 1. J Fr Ophtalmol, 1994 ; 17 : 175-81.
[24] Shoji N., Shimizu K. Clinical evaluation of a 5.5 mm three-zone refractive multifocal intraocular lens. J Cataract Refract Surg, 1996 ; 22 : 1097-101.
[25] Steinert R.F., Post C.T. Jr, Brint S.F. et al. A prospective, randomized, double-masked comparison of a zonal-progressive multifocal intraocular lens and a monofocal intraocular lens. Ophthalmology, 1992 ; 99 : 853-60.
[26] Steinert R.F., Aker B.L., Trentacost D.J. et al. A prospective comparative study of the AMO ARRAY zonal-progressive multifocal silicone intraocular lens and a monofocal intraocular lens. Ophthalmology, 1999 ; 106 : 1243-55.
[27] Vaquero-Ruano M., Encinas J.L., Millan I. et al. AMO array multifocal versus monofocal intraocular lenses: long-term follow-up. J Cataract Refract Surg, 1998 ; 24 : 118-23.
D. Gatinel
Les implants multifocaux sont proposés afin de rendre aux patients opérés de cataracte une indépendance à la correction en lunettes pour la vision de loin et la vision de près [34, 51, 59]. La réalisation d’une optique diffractive est une solution élégante au défi que représente la conception d’une lentille multifocale permettant de réduire la dépendance à la correction optique en lunettes des patients opérés de cataracte. Les implants diffractifs sont conçus pour exploiter certaines propriétés physiques du spectre lumineux visible : leur particularité vis-à-vis des implants classiques monofocaux et multifocaux réfractifs réside dans la capacité conférée par une structure diffractive de séparer l’énergie lumineuse en différents foyers distincts. Le plus souvent, les foyers utiles pour la vision sont au nombre de deux (foyer dit « de loin » et foyer dit « de près ») [22].
La diffraction de la lumière est un phénomène dont l’étude approfondie est complexe. Même si on souhaite s’affranchir du formalisme mathématique inhérent aux équations qui permettent d’appréhender le comportement des ondes lumineuses au travers d’optiques diffractives, il est nécessaire de rappeler quelques concepts propres à la nature même des ondes lumineuses. Ce préalable est nécessaire, avant d’aborder les propriétés optiques particulières des structures diffractives, que cette section vise à exposer de manière aussi simple que possible.
La lumière est un phénomène physique qui n’a cessé d’intriguer les esprits curieux et scientifiques. Les partisans d’une conception corpusculaire (photons) ou d’une conception ondulatoire (déplacement d’une onde, dont on sut plus tard qu’elle portait la variation du champ électromagnétique) se sont longuement affrontés dans le passé. Newton était un ardent partisan de la conception corpusculaire de la lumière, même si le résultat de certaines expériences d’optique était difficile à expliquer au moyen de modèles purement « balistiques ». D’autres, comme le savant hollandais Huyghens, avaient théorisé que la lumière pouvait correspondre à une perturbation se propageant de proche en proche, comme une onde. Cette conception supposait que la lumière se propage à partir d’une source ponctuelle dans toutes les directions de l’espace ; à chaque fois que la lumière rencontre un point adjacent, celui-ci devient une source secondaire, qui « irradie » à nouveau la perturbation initiale dans toutes les directions. En raison de la présence des autres sources contiguës, et du jeu d’interférences constructrices et destructrices, la seule interférence constamment constructive qui en résulte alors forme l’enveloppe d’une onde sphérique. Les bases de la théorie du front d’onde reposent sur ce modèle de propagation [55]. Un des obstacles à l’acceptation générale de cette théorie fut qu’il était inconcevable à cette époque qu’une perturbation, une onde, puisse se propager sans support. Ainsi, les tenants de la théorie ondulatoire étaient obligés d’admettre l’existence d’une substance (un « éther ») qui baignerait ainsi l’ensemble des choses et des êtres et servirait de « support » mécanique à la lumière. Or, cet éther était une substance que personne n’avait pourtant réussi à identifier. Pourtant, certaines observations de franges lumineuses semblaient trahir la nature au moins partiellement ondulatoire de la lumière. Thomas Young, au cours d’une célèbre expérience réalisée en 1801, finit par rallier certains esprits sceptiques (et peu enclins à remettre en question la pensée newtonienne) au modèle ondulatoire de la propagation des ondes lumineuses [9]. Ce modèle portait en lui une propriété remarquable, la notion d’interférence (fig. 7-45), qui implique que l’addition de lumière puisse dans certaines conditions résulter en une absence de lumière !
Fig. 7-45 Les propriétés ondulatoires impliquent la notion d’interférence, constructive ou destructive.
Quand les ondes lumineuses sont « en phase », l’addition de leur amplitude est constructive. À l’inverse, un déphasage d’une demi-longueur d’onde résulte en une « extinction » de l’onde lumineuse (interférence destructive).
Le recours à la conception ondulatoire n’est pas nécessaire pour prédire comment la lumière incidente peut être, par exemple, focalisée vers un foyer par une simple lentille. L’application des lois de la réfraction de l’optique géométrique suffit : ces lois prédisent avec une précision acceptable la propagation de la lumière, tant que les dimensions des objets traversés sont largement supérieures à celle de la longueur d’onde lumineuse. Pour autant, le modèle ondulatoire est compatible avec l’observation de la focalisation de la lumière vers un foyer, car les lois de l’optique géométrique découlent de l’interaction entre les ondes lumineuses et la matière transparente de la lentille. Les ondes lumineuses y sont ralenties et, du fait de l’épaisseur variable de la lentille, il survient un déphasage progressif qui est responsable d’une interférence constructive au niveau du foyer de la lentille : les ondes « convergent » vers celui-ci et ce renforcement explique l’amplitude maximale perçue si on recueille l’intensité de la lumière au foyer (fig. 7-46). Le foyer de la lentille est la distance au centre de celle-ci, sur l’axe optique de la lentille, pour laquelle les ondes arrivent « en phase » et interfèrent constructivement. Ceci peut s’exprimer autrement : le chemin optique des ondes incidentes provenant d’une source à l’infini et traversant la lentille est le même. Le chemin optique est le nombre d’oscillations (longueur d’onde), à plus ou moins n longueur d’onde près (si on enlève ou rajoute une longueur d’onde, cela ne change rien, la phase n’est pas modifiée).
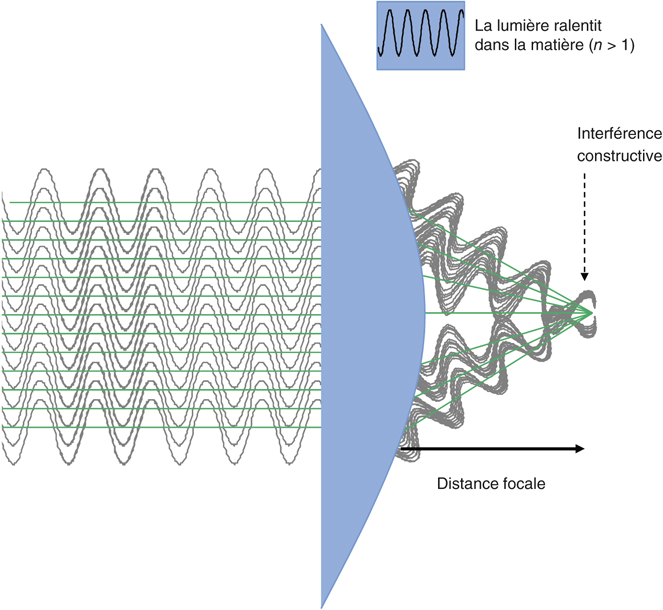
Fig. 7-46 Représentation schématique de la propagation d’ondes lumineuses issues d’un point source de lumière monochromatique éloigné (situé à l’« infini ») et focalisées au foyer (situé à la distance focale).
Les rayons (représentés en vert) matérialisent la direction de propagation locale des ondes lumineuses. Les variations de l’épaisseur de la lentille induisent un déphasage sélectif approprié qui aboutit à « rediriger » les ondes de manière à ce qu’elles interfèrent constructivement au foyer (le chemin optique jusqu’au foyer est identique pour tous les trains d’ondes).
La diffraction peut être définie comme une déviation du trajet lumineux non liée à un phénomène réfractif (lentille), ni gravitationnel (objet très massif et courbant l’espace comme un trou noir : effet de lentille gravitationnelle), mais à la présence d’un obstacle, d’un passage ou d’une structure répétitive dont les dimensions sont inférieures ou proches de la longueur d’onde lumineuse considérée.
C’est seulement si on connaît le déplacement des ondes lumineuses et des modulations de leur amplitude le long de leur trajet, qu’il est possible de prédire l’image (intensité lumineuse) que recueillerait une surface sensible (rétine neurosensorielle ou capteur CCD) placée sur le trajet de la lumière. L’étude des propriétés diffractives d’un objet vise à prédire le comportement des ondes lumineuses qui le rencontrent. La compréhension de ces propriétés peut être mise à profit pour réaliser un système optique tirant parti de ces propriétés, pour rediriger de manière intentionnelle la lumière en un ou plusieurs points de l’espace. L’objectif est de réaliser un système qui focalise la lumière vers au moins deux foyers, avec une concentration lumineuse maximale au sein de ceux-ci et une déperdition minimale de la lumière incidente.
Avant d’envisager la création de plusieurs foyers, il est utile de comprendre la manière dont on peut réaliser une optique diffractive monofocale, en utilisant les propriétés ondulatoires de la lumière, qui impliquent qu’on peut atténuer ou augmenter la concentration de celle-ci en jouant avec les interférences des ondes lumineuses. Pour arriver à faire interférer de manière constructive les ondes lumineuses en un point donné, un moyen simple comme la sélection des trains d’ondes en phase peut suffire – on l’obtient en empêchant les trains d’ondes déphasés d’une moitié de longueur d’onde de se propager au-delà du dispositif. Un tel principe est représenté sur la figure 7-47 ; il est matérialisé par un masque diffractif, où les zones opaques concentriques obstruent sélectivement le trajet de certaines ondes lumineuses vers le foyer : il s’agit des ondes qui y arriveraient avec un déphasage proche d’une demi-longueur d’onde vis-à-vis des ondes ayant traversé le centre du masque. Le rendement de ce type de masque n’est pas très bon, puisqu’une partie de la lumière incidente est bloquée. Rappelons au passage que ce système est a priori monofocal : le procédé vise à diriger une partie de la lumière incidente vers un foyer.
Cependant, les équations prédisent – et l’expérience confirme – qu’un tel système possède non pas un foyer unique mais plusieurs. Une partie de la lumière incidente est certes bloquée pour permettre à la lumière propagée d’interférer constructivement au foyer principal (et destructivement de part et d’autre), mais il existe d’autres foyers secondaires sur l’axe optique, où un pourcentage important des ondes lumineuses arrive à nouveau « en phase ». Ces foyers additionnels peuvent être théoriquement désirables, si on souhaite réaliser une optique multifocale. Toutefois, le rendement de ce type de masque n’est pas très bon, car une bonne partie de l’énergie lumineuse incidente est « bloquée », donc perdue.
Pour améliorer ce rendement, il s’avère a priori plus intéressant de rephaser les trains d’onde déphasés d’une demi-longueur d’onde plutôt que les bloquer. Pour cela, on peut réaliser un dispositif dont l’épaisseur est modulée de manière à déphaser les ondes dont le chemin optique s’écarterait d’une demi-longueur d’onde (ou d’un multiple de la demi-longueur d’onde) vis-à-vis du foyer désiré. C’est le principe des lames de phase dite de « Fresnel » (Fresnel zone plate), dont les variations d’épaisseur sont conçues pour rephaser certaines ondes émergentes en vue de les faire interférer de manière constructive au foyer choisi. Le foyer principal (F) demeure cependant accompagné de foyers secondaires situés à des distances de F/2, F/4, F/5, etc. La distance focale principale (F) et les distances secondaires (dans l’air) étant données par une formule qui les relie au carré du rayon de la première zone :
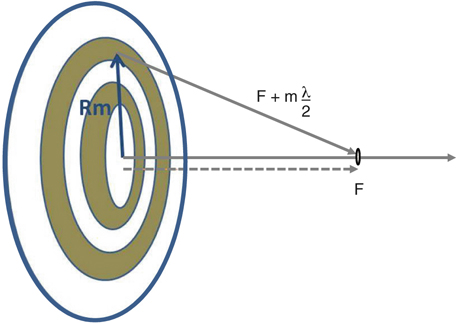
Fig. 7-47 Principe de sélection des trains d’ondes en phase par masque diffractif.
Un masque constitué de zones alternativement transparentes et opaques pour la lumière monochromatique (longueur d’onde λ) peut diriger une partie de cette lumière vers un foyer F. Il suffit de calculer l’espacement des anneaux opaques de manière à ce que leur distance radiaire (Rm) au foyer soit telle que le chemin optique depuis chaque anneau soit égal à F + un nombre entier de demi-longueur d’onde (soit F + m 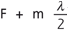 ). Ainsi, les interférences en F deviennent constructives. Ce principe réduit toutefois l’éclairement en F, puisqu’une partie de la lumière incidente est bloquée.
). Ainsi, les interférences en F deviennent constructives. Ce principe réduit toutefois l’éclairement en F, puisqu’une partie de la lumière incidente est bloquée.
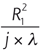
Là encore, il est difficile de concilier efficacité énergétique (concentration suffisante d’énergie au foyer principal) et réduction de nombre de foyers secondaires si le but est de diriger la lumière vers un foyer principal. Si l’objectif est au contraire de réaliser une optique multifocale, il est difficile de restreindre le nombre de foyers utiles à deux ou trois, et y concentrer l’énergie lumineuse nécessaire.
Une solution à ce problème de répartition énergétique fut proposée à la fin des années soixante. Le système diffractif réalisé prit le nom de kinoforme.
Un kinoforme est constitué d’une structure transparente constituée de marches et est destiné à moduler la phase des ondes lumineuses incidentes pour les concentrer avec un minimum de déperdition énergétique vers un foyer principal. C’est la structure asymétrique de ce système – les marches asymétriques ressemblent à de petites « prismes » dont les profils mis bout à bout épouseraient le profil d’une hyperbole – qui permet aux ondes lumineuses d’être progressivement déphasées et à la lumière de converger de manière plus intense vers le foyer souhaité [45].
L’espacement entre les marches du kinoforme est donné par une fonction qui dépend de la longueur d’onde et de la distance focale :
Avec : R(m) rayon de la marche m, F distance focale de la lentille (pondérée par l’indice de réfraction du milieu environnant) et λ longueur d’onde lumineuse (dans l’air) utilisée pour le calcul. On choisit en pratique une longueur d’onde proche du pic de la sensibilité rétinienne (550 nm, par exemple). Cette formule explique que la largeur des marches se réduise du centre vers les bords : elle subit une progression géométrique (en racine carrée).
Pour une longueur d’onde déterminée λ et une longueur focale souhaitée (F), on peut établir un profil kinoforme dont l’espacement (la largeur) des marches est dicté par ces variables et qui permet de diriger la lumière incidente le traversant vers un foyer principal. Cela suppose toutefois de remplir une condition importante : bien régler la hauteur des marches ! En effet, de la hauteur des marches dépendent la répartition d’énergie lumineuse au sein du foyer principal et l’apparition de foyers secondaires. Il existe en effet une relation qui relie, pour une longueur d’onde donnée (dans l’air), la hauteur des marches diffractives avec le pourcentage d’énergie diffractée dans le foyer principal (F1) et les foyers secondaires (F0, F2, etc.).
On attribue à chaque foyer la notion d’ordre de diffraction ; l’ordre 0 correspond aux ondes lumineuses diffractées « à l’infini » (foyer F0), l’ordre 1 correspond aux foyers où convergent les ondes lumineuses au foyer principal (foyer F1), etc.
La répartition de l’énergie entre les ordres de diffraction dépend de la valeur d’une constante dite « de design », notée α, la différence d’indice entre le milieu et la lentille, la hauteur des marches diffractives (Zmax), et la longueur d’onde lumineuse de référence dans l’air (λ0).
Ce nombre α est sans dimension et peut être assimilé à la différence de chemin optique dans le matériau diffractif (implant) vis-à-vis du milieu environnant (humeur aqueuse dans le cas d’une lentille intraoculaire), pour une distance correspondant à la hauteur des marches du kinoforme, le tout étant rapporté à la valeur de la longueur d’onde λ0.
Selon les valeurs prises par ce paramètre α, l’énergie est modulée entre les différents ordres de diffraction. En particulier, quand le paramètre prend des valeurs nulle ou entières (0, 1, 2, etc.), alors 100 % de l’énergie est dirigée vers l’ordre de diffraction correspondant (0, 1, 2, etc.) :
– quand α = 0, 100 % de l’énergie est diffractée dans l’ordre 0 : tout se passe comme si la lumière n’était pas déviée ; si α = 0, cela veut dire que la hauteur des marches est nulle… : l’ordre 0 correspond à de la lumière non focalisée ou diffractée à l’infini ;
– quand α = 1, 100 % de l’énergie est diffractée dans l’ordre 1 ;
– quand α = 2, 100 % de l’énergie est diffractée dans l’ordre 2 (dont la distance focale est la moitié de celle de l’ordre 1), etc.
Dans le cadre de la réalisation d’un implant diffractif, il faut ajuster la valeur de la constante α pour assurer une répartition de l’énergie lumineuse en plusieurs foyers : deux pour un implant bifocal.
Ainsi, l’ordre 0 correspond à un foyer situé à l’infini (absence de déviation lumineuse) ; l’ordre 1 correspond au foyer principal, situé à distance finie (distance qui dépend de l’espacement des marches) ; l’ordre 2 correspond à un foyer situé à la moitié de la distance de l’ordre 1 (la vergence est doublée). La répartition de l’énergie entre ces foyers, pour une longueur d’onde donnée, est liée à α, qui dépend lui-même de la hauteur des marches diffractives.
En pratique, le seul paramètre susceptible de moduler la valeur d’α est Zmax. En effet, le matériau de la lentille intraoculaire possède un indice de réfraction déterminé par le choix du matériau et le foyer principal vers lequel on veut faire diffracter tout ou partie de la lumière est également une variable choisie à l’avance.
On remarque que si Zmax est égal à λ0/(np – ne), c’est-à-dire la dimension physique d’une longueur d’onde de la lumière dans le vide divisée par la différence d’indice dans le matériau de la lentille, alors α = 1. Une lentille diffractive monofocale (et non bifocale) est ainsi réalisée puisque théoriquement, 100 % de l’énergie lumineuse est diffractée dans l’ordre 1. Le déphasage induit par chacune des marches est un multiple de la longueur d’onde dans le matériau. Dans le cas d’une lentille d’indice n = 1,55 placée dans l’humeur aqueuse n = 1,33, la différence d’indice est égale à 0,22. Ainsi, la hauteur de la marche de diffraction sera alors égale à environ cinq fois la longueur d’onde dans le vide, soit 2,5 µm environ pour le milieu du spectre visible. Cette configuration permettrait donc de réaliser un implant monofocal diffractif, en choisissant une vergence adéquate pour l’ordre 1 (22 D, par exemple). Cet implant aurait l’avantage d’être particulièrement fin mais devrait comporter un nombre élevé d’anneaux finement espacés (la distance focale F étant petite dans l’équation (2)).
Si on choisit une hauteur de marche qui permette de réduire de moitié la valeur du paramètre α (α = 0,5), alors la courbe de répartition de l’énergie est modulée : 40 % de l’énergie est située dans l’ordre 0, 40 % et dans l’ordre 1 (fig. 7-48), les 20 % restant étant divisés dans des ordres supérieurs : 2, 3, etc. Signalons que, parmi ces 20 %, 5 % sont affectés à l’ordre 2, dont le foyer est situé à 2 × 3,50 = 7 D : ceci a son importance dans le cadre de la réalisation d’un implant trifocal.
Fig. 7-48 Représentation schématique d’une structure diffractive de type kinoforme, telle qu’utilisée pour la réalisation d’implants diffractifs pour une lumière monochromatique.
La hauteur des marches diffractives est calculée de manière à ce que 40 % de la lumière soit diffractée dans l’ordre 1 et 40 % dans l’ordre 0 – cette lumière semble traverser le réseau sans être déviée. (Pour plus de clarté, seule la transmission par une moitié de l’implant est représentée.)
Un dispositif kinoforme diffractant la lumière vers deux foyers principaux, l’un à l’infini, l’autre à une distance finie, peut donc être conçu selon ces principes, en ajustant la hauteur des marches pour obtenir une valeur α proche de 0,5. Pour aboutir à la réalisation un implant diffractif bifocal, il suffit d’additionner ce réseau diffractif de type kinoforme à l’une des surfaces d’un implant monofocal [18]. La courbure « de base » de l’implant fournit la puissance pour la correction de loin, où ira l’énergie diffractée dans l’ordre 0 par le réseau kinoforme (40 %). La diffraction dans l’ordre 1 (40 %) correspond à l’énergie qui sera placée au foyer destiné à la vision de près. Dans le cas d’un implant bifocal destiné à permettre la lecture, il faut ajuster la vergence de l’ordre 1 autour de 3 D (dans le plan lunettes). Toutefois, 20 % de l’énergie lumineuse restante sera perdue car diffractée dans des ordres non utiles pour la vision – par exemple, l’ordre 2, dont la vergence est proche de 6 D et où 5 % de l’énergie incidente est focalisée.
Un implant diffractif bifocal résulte de l’addition d’un implant monofocal et d’un kinoforme (fig. 7-49). La hauteur des marches du kinoforme est généralement conçue de telle manière qu’il existe une répartition « équitable » entre l’énergie diffractée dans l’ordre 0 et celle diffractée dans l’ordre 1. Le premier implant multifocal diffractif fut introduit à la fin des années quatre-vingt (implant 3M). Toutefois, ce pourcentage peut être modulé en faveur de l’ordre 0 : il suffit de réduire légèrement la hauteur des marches, afin d’obtenir une répartition proche de 45 % pour l’ordre 0 et 35 % pour l’ordre 1 (implant Acri.LISA® 366D, Zeiss).
Le recours à l’apodisation peut être utile pour moduler les pourcentages de répartition de l’énergie diffractée vers les ordres 0, 1, etc. en fonction de l’ouverture pupillaire : l’implant devient en partie pupillodépendant [31]. La réduction de la hauteur des marches vers la périphérie permet logiquement d’augmenter la proportion d’énergie diffractée dans l’ordre 0 (non déviée) et utile à la vision de loin (pour la longueur d’onde de « référence ») (fig. 7-50). Une fonction d’apodisation est appliquée afin de recalculer la hauteur des marches, qui décroissent du centre vers la périphérie de l’implant. La fonction d’apodisation peut être calculée pour que les marches disparaissent avant d’atteindre le bord de l’optique (implants de la gamme ReSTOR®, Alcon). Le lissage des marches permet de réduire certains phénomènes diffractifs indésirables. Il reflète par ailleurs certaines contraintes manufacturières, car il est difficile de réaliser des bords très abrupts avec certains matériaux, notamment hydrophiles.
Le bénéfice apporté par l’asphérisation au design optique des lentilles monofocales (réduction de l’aberration sphérique positive cornéenne) demeure intéressant dans le cadre des implants diffractifs ; il améliore la qualité du foyer de loin (ordre 0) pour les larges diamètres pupillaires, grâce à la correction totale ou partielle de l’aberration sphérique cornéenne [31]. L’implémentation d’un réseau diffractif sur un implant torique permet d’élargir les indications des implants multifocaux diffractifs aux yeux dont les cornées présentent une toricité importante (astigmatisme cornéen). Le motif diffractif est alors situé sur la face non torique de l’implant.
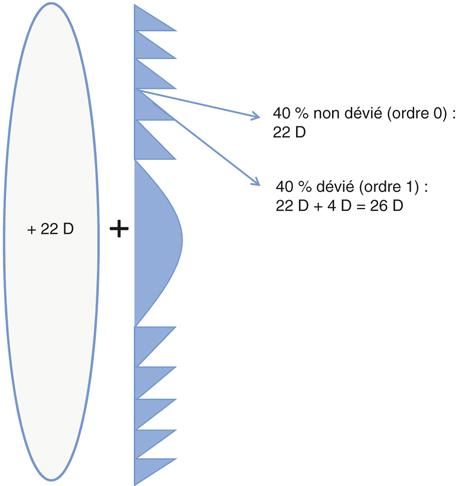
Fig. 7-49 Représentation schématique de la conception d’un implant diffractif bifocal comme l’addition d’un kinoforme et d’une optique monofocale.
Fig. 7-50 Apodisation.
Si on réduit la hauteur des marches, on peut moduler la répartition de l’énergie lumineuse incidente entre l’ordre 0 (loin) et l’ordre 1 (addition) : plus les marches sont basses, plus l’ordre 0 est favorisé. Si les marches disparaissent, seul l’ordre 0 demeure !
Les principes énoncés ci-avant permettent d’envisager la réalisation d’autres réseaux diffractifs que bifocaux. Comme énoncé précédemment, un kinoforme est dit « bifocal » quand il répartit la lumière incidente dans deux ordres principaux. Comme nous l’avons vu, ce même réseau n’est cependant pas purement bifocal, car il diffracte environ 20 % de la lumière incidente dans d’autres ordres non utiles pour la vision dans le cadre de la réalisation d’un implant de cristallin artificiel multifocal. Nous avons travaillé sur la conception d’un implant diffractif trifocal [28] en reprenant une partie de ces principes et en conjuguant deux profils diffractifs d’addition différente et dont nous allons décrire les caractéristiques principales.
Rien n’empêche de concevoir, au moins théoriquement, un implant diffractif bifocal (optique monofocale et kinoforme) dont la puissance d’addition (ordre 1) serait de 1,75 D. Pour cet implant, on peut déterminer une hauteur de marches telle que 40 % de l’énergie incidente visible n’est pas déviée (ordre 0) et se concentre au foyer de loin (fonction de la courbure de l’optique monofocale sur lequel le kinoforme est « greffé ») et 40 % est diffractée dans l’ordre 1, vers un foyer situé à environ 65 cm de l’œil (distance focale correspondant à une vergence proche de + 1,75 D dans le plan lunettes). Cet implant correspondrait à un implant diffractif bifocal conçu pour permettre de voir de loin et en intermédiaire sans lunettes. Toutefois, en vertu des lois de la diffraction, parmi les 20 % d’énergie lumineuse diffractés dans d’autres ordres, 5 % environ le sont vers l’ordre 2, dont la vergence est le double de celle de l’ordre 1, soit 2 × 1,75 D = 3,50 D…, ce qui, fait important, correspond à une distance de lecture utile, car située à 35 cm environ. Malheureusement, l’énergie consacrée à ce foyer de près (5 %) est trop faible pour faire de cet implant un implant véritablement trifocal.
Toutefois, si on combine deux profils diffractifs (principalement) bifocaux mais dont les foyers pour l’ordre 1 possèdent chacun deux focales différentes (+ 1,75 D et + 3,50 D), on peut alors créer un réseau original qui va diffracter 40 % de la lumière vers le foyer de loin, environ 30 % vers le foyer de près (+ 3,50 D) et 15 % vers le foyer de vision intermédiaire – donnant lieu au concept surnommé « bi-bi » car combinant en quelque sorte deux optiques diffractives. L’énergie diffractée dans l’ordre 2 de la structure bifocale de foyer principal + 1,75 D n’est pas perdue et vient s’ajouter à celle générée par l’ordre 1 de la structure bifocale + 3,50 D (fig. 7-51). Le rendement optique (vision utile) de cette combinaison réfractive, dont une demande de brevet a été déposée, est ainsi légèrement supérieur à celui d’une optique diffractive bifocale classique (85 % contre 80 %). Ce motif original trifocal (fig. 7-52) a été implémenté en surface d’un implant multifocal présenté dans la section suivante (implant FineVision®, PhysIOL, Belgique).
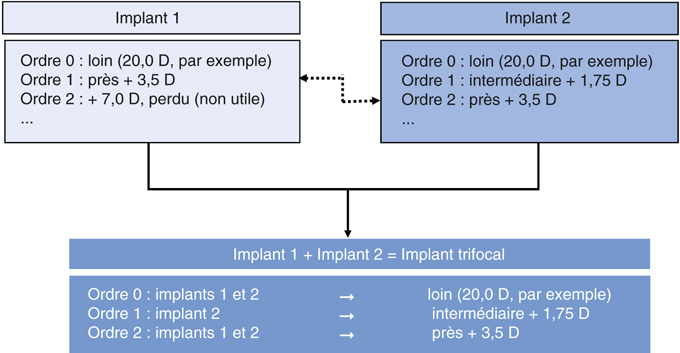
Fig. 7-51 Implant diffractif trifocal.
Il est conçu à partir de la combinaison de deux profils diffractifs bifocaux, dont les additions respectives (diffraction dans l’ordre 1) sont de + 1,75 D et + 3,50 D. L’énergie diffractée dans l’ordre 2 par le réseau d’addition + 1,75 D (ordre 1) possède une vergence de + 3,50 D et est utile à la vision de près.
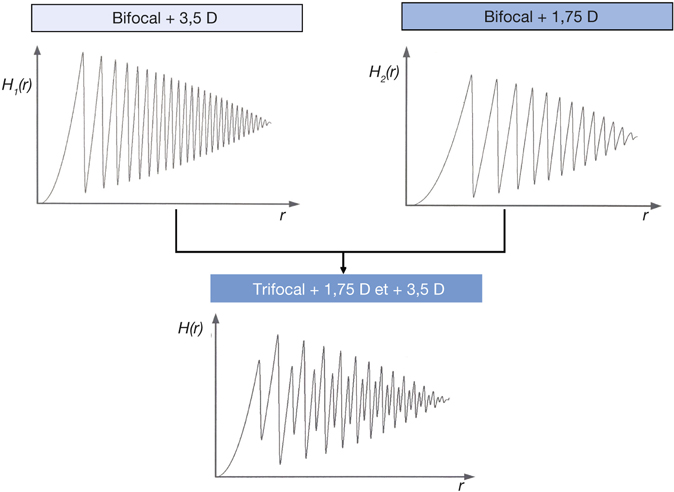
Fig. 7-52 Représentation des profils bifocaux combinés pour la réalisation du profil diffractif trifocal.
Noter les différences d’espacement entre les marches de ces réseaux. La réalisation d’une apodisation explique la réduction de la hauteur du centre vers la périphérie.
Avant de clore cette section consacrée au design des implants diffractifs, il est intéressant de souligner l’influence du choix de la longueur d’onde pour le calcul du motif diffractif. L’équation (3) montre que la répartition énergétique entre les différents ordres de diffraction dépend du rapport entre la hauteur des marches () et la longueur d’onde de référence (λ0). De fait, un implant diffractif conçu pour diffracter de manière équitable (α = 0,5) la lumière jaune-vert (560 nm) dans l’ordre 0 et l’ordre 1 est un implant dont le comportement vis-à-vis des autres radiations lumineuses (rouges et bleues) sera différent. L’œil humain est (subjectivement) peu sensible aux effets des aberrations chromatiques et la dispersion chromatique provoquée par la diffraction est opposée à celle causée par la réfraction. Les patients implantés par des optiques diffractives ne signalent pas d’anomalies de la vision colorée.
Au contraire, il pourrait s’avérer judicieux d’ajouter à des implants monofocaux certaines caractéristiques diffractives, en vue de corriger l’aberration chromatique en vision de loin. Un motif diffractif peut être conçu de manière à diriger 100 % dans l’ordre 1 vers le foyer réfractif de l’implant monofocal : la dispersion chromatique liée cette diffraction visant alors à compenser l’aberration chromatique induite par la réfraction du dioptre cornéen. Ces principes sont déjà mis en œuvre pour la correction de l’aberration chromatique de certains objectifs photographiques où des lentilles et doublets achromatiques sont remplacés par de fins réseaux de diffraction. La commercialisation d’une lentille intraoculaire destinée à corriger l’aberration chromatique oculaire pourrait intervenir dans le futur [40].
Enfin, la dépendance à la longueur d’onde des implants diffractifs a également des conséquences en matière d’explorations cliniques. Pour un implant conçu comme « équilibré » entre ordre 0 et ordre 1 pour la lumière visible (jaune-vert), le pourcentage de lumière infrarouge diffracté dans l’ordre 0 devient nettement supérieur à celui diffracté dans l’ordre 1. Or, les aberromètres utilisés pour l’étude in vivo de la qualité de vision utilisent une lumière infrarouge, non éblouissante car non perçue par le patient. Après implantation multifocale diffractive, il est classique de considérer les mesures aberrométriques comme peu fiables ou erronées [26]. En effet, l’implant diffracte la lumière incidente de manière à créer au moins deux fronts d’onde (vision de loin, vision de près). La reconstruction du front d’onde correspondant aux aberrations de haut degré est rendue difficile. Toutefois, en ce qui concerne l’estimation de l’erreur réfractive sphérocylindrique, il est a priori possible de prendre en compte les mesures fournies par un aberromètre (voire un autoréfractomètre). Contrairement à la lumière visible (jaune), la lumière infrarouge utilisée pour les mesures est peu diffractée dans l’ordre 1 par les marches de l’implant. En termes simples, on peut considérer qu’un implant bifocal ou trifocal dans le visible est un implant beaucoup plus monofocal en infrarouge [27]. De fait, le parcours de la lumière infrarouge émise puis recueillie par un aberromètre après réflexion rétinienne est surtout conditionné par la puissance dioptrique de l’implant, même si certaines anomalies comme la présence de doubles spots de focalisation par les matrices de microlentilles des systèmes Hartmann-Shack attestent de la présence d’une diffraction dans l’ordre 1 (fig. 7-53).

Fig. 7-53 Détail d’une image capturée par le capteur CCD d’un aberromètre Hartmann-Schack pour la mesure du front d’onde d’un œil pseudophake dont l’implant est diffractif bifocal.
On note un aspect dédoublé de la plupart des centroïdes (flèches). Cet aspect traduit la présence d’une diffraction dans l’ordre 1 par l’implant d’une partie de la lumière infrarouge (utilisée pour la mesure par l’aberromètre). En raison de leur vergence accrue, ces spots secondaires sont focalisés vers le centre de la lentille. Leur aspect estompé provient du fait que la lumière infrarouge, dont la longueur d’onde est supérieure au domaine visible, diffracte principalement dans l’ordre 0.

P. Rozot
Historiquement, la société 3M a produit le premier implant diffractif au milieu des années quatre-vingt ; cet implant a été l’objet de nombreuses publications avec des résultats cliniques parfois limités en raison, d’une part, de la structure de l’implant – large implant en PMMA introduit par une incision de 7 mm au moins – et, d’autre part, des modalités chirurgicales de l’époque : extraction extracapsulaire encore prédominante, calculs biométriques et phacoémulsification encore rudimentaires avec centrage de la lentille aléatoire. Néanmoins, les études sur cette lentille ont permis pour la première fois d’obtenir des résultats visuels non corrigés de loin et de près significatifs avec, par exemple, dans le suivi de l’étude FDA à un an, 57 % des patients obtenant 0,5 au moins de loin et Jaeger 3 chez 78 % d’entre eux [39] ; une étude à long terme, avec huit ans de suivi [58], a montré l’indépendance aux lunettes de loin pour 68 % et aux lunettes de près pour 63,9 % des patients avec implantation bilatérale. Le brevet de la lentille a ensuite été repris par la société Pharmacia qui a produit le diffractif 811 au design certes amélioré mais toujours en PMMA le faisant insérer par 6 mm. Jacobi, en 1999 [33], a proposé une combinaison de deux implants diffractifs (Acri.Twin® set, Acri.Tec) : l’implant dévolu à l’œil dominant avait une répartition d’énergie lumineuse à 70 % pour la vision de loin et 30 % pour la vision de près (fig. 7-54), tandis que l’implant dévolu à l’œil non dominant avait la répartition exactement inverse. Il s’est avéré que l’implant prédominant de près générait une gêne fonctionnelle importante en vision de loin, d’où son abandon pour proposer uniquement le modèle dominant de loin en pose bilatérale – qui a ensuite constitué la maquette de l’implant Acri.LISA®, après quelques modifications minimes. Ces trois modèles d’implants (3M, 811C et Acri.Twin®) n’ont toutefois, à notre connaissance, jamais été proposés pour un traitement de la presbytie mais seulement dans le cadre de la cataracte.

Fig. 7-54 Implant Acri.Twin® (Acri.Tec).
(Schéma reproduit d’après des données du laboratoire Acri.Tec.)
La longueur totale de l’implant monobloc, aux haptiques non angulées, est de 13 mm, l’optique ayant un diamètre de 6 mm (fig. 7-55). Il comporte douze zones diffractives réparties sur les 3,6 mm centraux de la surface antérieure de la lentille ; la zone centrale a un diamètre de 0,742 mm, la zone périphérique de 2,4 mm de large étant réfractive simple et destinée à la seule vision de loin. La constante A est 118,9 en biométrie par contact et 119 en biométrie optique. L’addition est de 4 D, ce qui donne environ 3,2 D au plan lunettes. Il s’agit d’un acrylique hydrophobe disponible en monobloc avec filtre jaune, mais une version à anses rapportées trois-pièces (de + 10 D à + 30 D) peut être obtenue auprès du fabricant (fig. 7-56). L’addition est de + 4 D, ce qui en fait un implant à comportement bifocal loin/près, la vision intermédiaire étant plutôt faible, comme le montre la courbe de défocalisation (fig. 7-57). Son optique est porteuse d’une correction asphérique de – 0,11 µm et les puissances disponibles s’étalent entre + 6 D et + 34 D. La caractéristique principale de cet implant concerne l’apodisation des zones diffractives (cf. supra), ce qui correspond à une diminution progressive de la hauteur des marches de diffraction (de 1,3 µm à 0,2 µm) du centre vers la périphérie. Ce principe permet de répartir l’énergie lumineuse de la façon la plus appropriée en fonction de la lumière ambiante, rendant ainsi l’implant pupillodépendant : on constate sur la courbe de répartition de l’énergie lumineuse (fig. 7-58) que la lumière incidente se répartit de façon à peu près équilibrée pour une pupille de 2 mm, alors que l’énergie lumineuse sera prédominante pour la vision de loin lorsque la pupille atteint 5 mm ou plus. Cela permet de diminuer les phénomènes photiques, notamment la perception des halos dont l’intensité est ainsi amoindrie. L’injection de cet implant se fait par une micro-incision de 2,2 mm actuellement.

Fig. 7-55 Implant AcrySof® ReSTOR® (Alcon).
(Schéma reproduit d’après des données du laboratoire Alcon.)
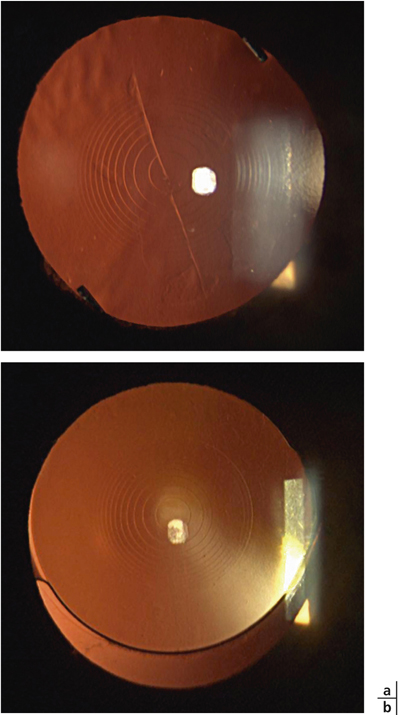
Fig. 7-56 Implant ReSTOR®.
a. Version trois-pièces. b. Version monobloc. (Clichés : P. Rozot.)
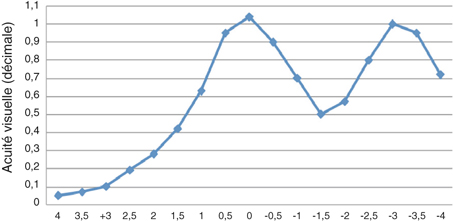
Fig. 7-57 Implant ReSTOR® + 4 : courbe de défocalisation.
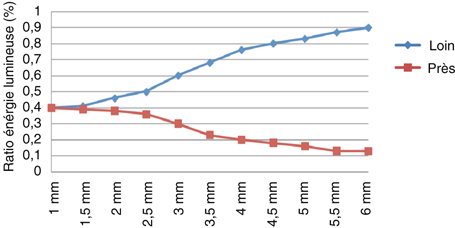
Fig. 7-58 Implant ReSTOR® : distribution de l’énergie lumineuse en fonction de la pupille.
Il ne comporte que neuf zones diffractives réparties sur les 3,6 mm centraux de la surface antérieure de la lentille, la zone centrale ayant un diamètre de 0,856 mm. L’addition est de 3 D, ce qui donne environ 2,70 D au plan lunettes et améliore ainsi significativement la profondeur de champ et la vision intermédiaire, comme le montre la courbe de défocalisation (fig. 7-59), lesquelles étaient moins performantes sans correction avec la version SN6AD1.
Le modèle SN6AD3 est actuellement le plus utilisé, d’autant que l’implantation bilatérale donne une vision de près tout à fait satisfaisante à une distance de lecture légèrement plus grande. Les puissances disponibles s’étalent entre + 10 D et + 34 D.
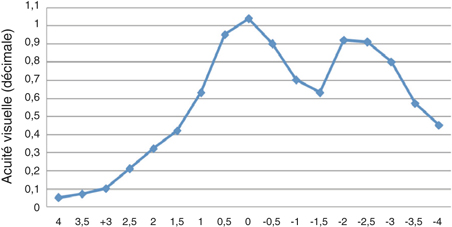
Fig. 7-59 Implant ReSTOR® + 3 : courbe de défocalisation.
La longueur totale de cet implant désormais disponible en acrylique hydrophobe monobloc, aux haptiques non angulées, est de 13 mm, l’optique ayant un diamètre de 6 mm et présentant des bords carrés sur 360° (ProTEC), les haptiques étant décalées de l’optique (fig. 7-60). La version initiale était en silicone à anses rapportées (fig. 7-61). Il comporte un réseau diffractif réparti sur toute la surface postérieure de la lentille (fig. 7-62), reprenant la structure initiale de l’implant 3M puis du Pharmacia 811 ; le siège postérieur du réseau diffractif permettrait de réduire les reflets internes de la lentille. Les marches de diffraction ont été « lissées » dans la dernière version dans le but de limiter les effets photiques. Cet implant corrige au mieux les aberrations chromatiques, avec un nombre d’Abbe élevé, comparé à d’autres implants diffractifs, ce qui contribue à améliorer les contrastes (fig. 7-63). La constante A est 119,1 en biométrie par contact et 119,2 en biométrie optique. L’addition est de 4 D, ce qui donne environ 2,85 D au plan lunettes en raison du siège postérieur du réseau diffractif ; il s’agit d’un implant à comportement plutôt bifocal, comme le montre la courbe de défocalisation (fig. 7-64). Son optique est porteuse d’une correction asphérique de – 0,27 µm compensant la totalité des aberrations sphériques cornéennes moyennes ; les puissances disponibles s’étalent entre + 5 D et + 34 D. La diffraction est équilibrée entre la vision de loin et la vision de près avec 41 % de loin et 41 % de près, les 18 % résiduels étant perdus dans des foyers diffractifs secondaires ; la répartition d’énergie lumineuse n’est pas dépendante du diamètre pupillaire, avec une courbe de répartition de la lumière incidente équilibrée entre la vision de loin et la vision de près (fig. 7-65). Son injection se fait par 2,2 mm.

Fig. 7-60 Implant Tecnis® Multifocal (AMO) : version monobloc.
(Reproduit d’après des données du laboratoire Abbott Medical Optics ; cliché : P. Rozot.)
Fig. 7-61 Implant Tecnis® Multifocal : version trois-pièces.
(Cliché : P. Rozot.)
Fig. 7-62 Implant Tecnis® Multifocal : structure du réseau diffractif.
(Reproduit d’après des données du laboratoire Abbott Medical Optics.)
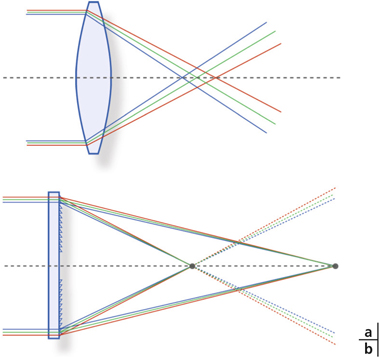
Fig. 7-63 Implant Tecnis® Multifocal : correction des aberrations chromatiques.
a. Aberrations chromatiques. b. Implant Tecnis® Multifocal.
(Reproduit d’après des données du laboratoire Abbott Medical Optics.)
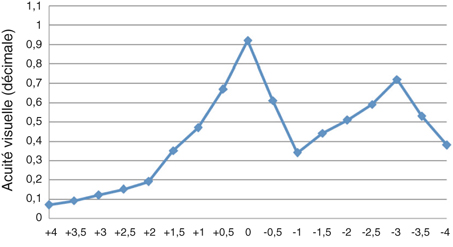
Fig. 7-64 Implant Tecnis® Multifocal : courbe de défocalisation.
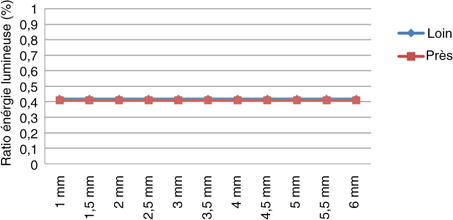
Fig. 7-65 Implant Tecnis® Multifocal : distribution de l’énergie lumineuse en fonction de la pupille.
Il s’agit d’un implant monobloc acrylique hydrophile (fig. 7-66) avec traitement de surface hydrophobe, dont toute la surface de la face antérieure est le siège d’une diffraction répartissant 65 % de l’énergie lumineuse à la vision de loin et 35 % à la vision de près : la courbe de répartition est constante quel que soit le diamètre pupillaire (fig. 7-67). L’addition est de 3,75 D, soit environ 2,80 D au plan lunettes. Le lissage des marches de diffraction tend à réduire les effets photiques (fig. 7-68). Son optique corrige les aberrations sphériques lenticulaires ; la constante A est de l’ordre de 117, 8 ; il est de forme « navette » mais extrêmement stable du fait de son épaisseur (presque 1 mm) et de son diamètre total à 11,5 mm ; il est injectable par 1,8 mm, soit de façon classique par injecteur de type Médicel avec cartouche de type Bartel, soit désormais par injecteur préchargé de type Bluemixs®. Les puissances disponibles s’étalent entre 0 et + 32 D par pas de 0,50 D. Une version trifocale est actuellement en évaluation, avec l’adjonction d’un foyer pour la vision intermédiaire (fig. 7-69), l’optique présentant un réseau diffractif trifocal sur les 4,34 mm centraux et un réseau diffractif bifocal au-delà. La répartition d’énergie lumineuse de ce nouveau modèle n’est que très peu dépendante du diamètre pupillaire (fig. 7-70). La courbe de défocalisation permet d’apprécier un effet significatif favorable à la vision intermédiaire et de près (fig. 7-71).
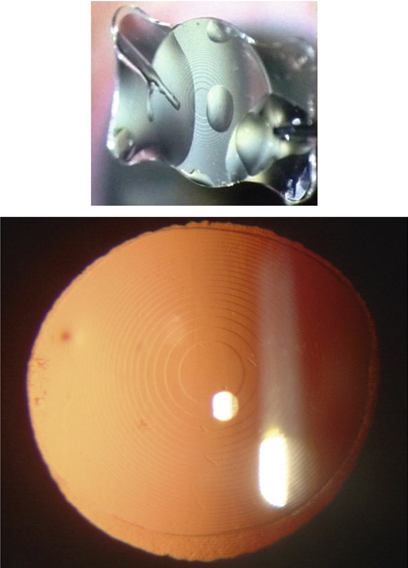
Fig. 7-66 Implant AT-LISA® (Zeiss-Meditec).
(Clichés : P. Rozot.)
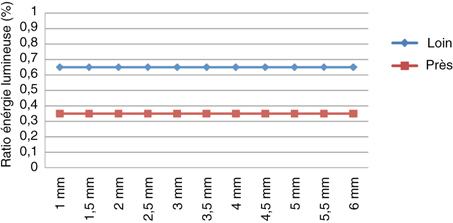
Fig. 7-67 Implant AT-LISA® : distribution de l’énergie lumineuse en fonction de la pupille.
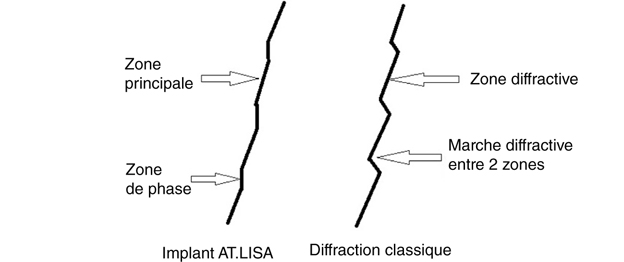
Fig. 7-68 Implant AT-LISA® : lissage des anneaux de diffraction.
(Schéma reproduit d’après des données du laboratoire Zeiss-Meditec.)

Fig. 7-69 Implant AT-LISA® trifocal.
(Reproduit d’après des données du laboratoire Zeiss-Meditec ; cliché : P. Rozot.)
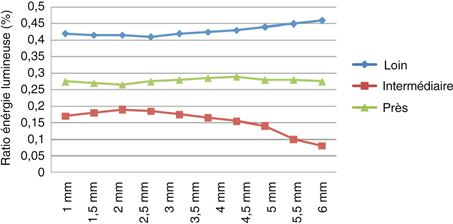
Fig. 7-70 Implant AT-LISA® trifocal : distribution de l’énergie lumineuse en fonction de la pupille.
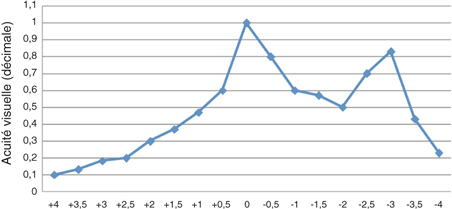
Fig. 7-71 Implant AT-LISA® trifocal : courbe de défocalisation.
Sa forme (fig. 7-72) et son optique sont très proches de l’AT-LISA®. Il est composé d’acrylique hydrophile avec surface hydrophobe. Sa constante A est à 118,0 en biométrie ultrasonique et 118,3 à 118,5 en biométrie optique. Son optique est asphérique, l’addition de 3,75 D. Il existe trois designs différents d’haptiques.
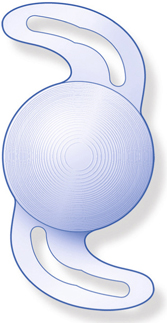
Fig. 7-72 Implant Acriva-Reviol, modèle MFB625 (VSY Biotechnology).
C’est un implant monobloc en acrylique hydrophile (fig. 7-73), dont la constante A est de 118,6. Il est injectable par 2,2 mm. Son addition est de 3,5 D, soit 2,6 D au plan lunettes. La diffraction, de siège antérieur qui ne couvre pas totalement la face antérieure de l’optique, est équilibrée entre la vision de loin et la vision de près ; il présente une réduction linéaire de la hauteur des marches à partir de la quatrième zone, ce qui donne plus d’énergie lumineuse pour la vision de loin, à pupille dilatée, comme on le voit sur la courbe de répartition d’énergie lumineuse en fonction de la pupille (fig. 7-74). La courbe de défocalisation montre sa relative polyvalence pour les visions éloignée, intermédiaire et rapprochée (fig. 7-75).
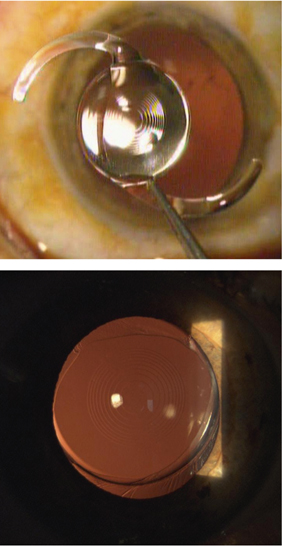
Fig. 7-73 Implant Diffractiva® Diff-aA (HumanOptics).
(Clichés : P. Rozot.)
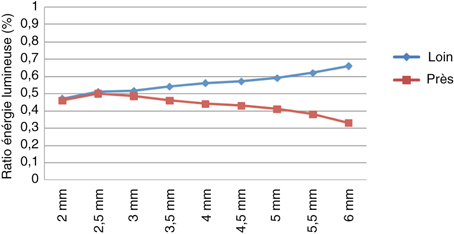
Fig. 7-74 Implant Diff-aA : distribution de l’énergie lumineuse en fonction de la pupille.
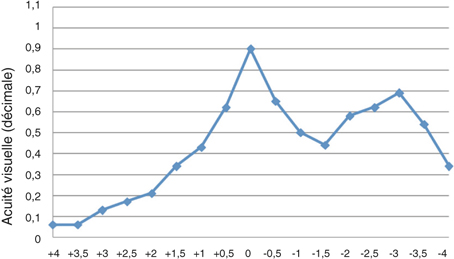
Fig. 7-75 Implant Diff-aA : courbe de défocalisation.
Il s’agit d’un implant monobloc (fig. 7-76) en acrylique hydrophile, à optique asphérique, dont la constante A est de 118,1. Il est injectable par 2,2 mm. Les marches diffractives sont apodisées, de siège postérieur et placées entre les diamètres 1,5 et 3,8 mm ; elles octroient une addition effective de 2,8 D. Pour une pupille de 2 mm, l’énergie lumineuse se distribue en 27 % seulement pour la vision de loin, 38 % pour la vision intermédiaire et 33 % pour la vision de près ; lorsque la pupille est à 5 mm, la vision de loin est favorisée, avec 68 % d’énergie lumineuse.
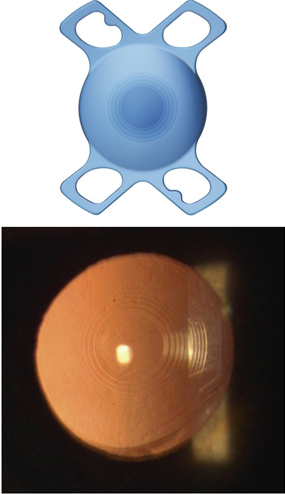
Fig. 7-76 Implant OptiVis®.
(Schéma d’après des données du laboratoire Aaren ; cliché : P. Rozot.)
C’est un implant monobloc (fig. 7-77) en acrylique hydrophile, à optique asphérique, dont la constante A est de 118,3 (ultrasons) à 118,6 (biométrie optique). Il est injectable par 1,8 mm. Les marches diffractives sont situées sur la face antérieure et la distribution d’énergie lumineuse est indépendante de la pupille : 60 % pour la vision de loin et 40 % pour la vision de près. Son originalité se situe dans la progressivité de l’addition entre la périphérie de l’implant et le centre, avec deux versions : + 4,00 D au centre et + 3,50 D en périphérie pour la première, + 3,50 D au centre et + 3,00 D en périphérie pour la seconde. Plus anecdotique est la possibilité de commander une puissance d’implant à 0,01 D près.
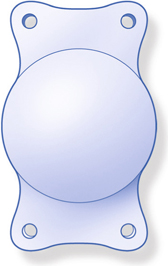
Fig. 7-77 Implant PresbySmart Plus (MTO).
L’implant est en acrylique hydrophile monobloc, dont le diamètre total est de 10,75 mm avec une angulation postérieure de 5° et dont l’optique fait un diamètre de 6,15 mm (fig. 7-78). Les deux réseaux diffractifs juxtaposés, d’addition 1,75 D et 3,50 D sont situés sur la face antérieure de la lentille, sur une optique asphérique. La constante A est donnée en SRK/T à 118,9 en biométrie optique, et 118,6 en biométrie ultrasonique. La courbe de répartition d’énergie lumineuse en fonction de la pupille montre une proportion d’énergie lumineuse pour la vision de loin qui augmente avec le diamètre pupillaire en raison de l’apodisation dont est porteuse son optique (fig. 7-79). La courbe de défocalisation montre sa polyvalence pour les visions éloignée, intermédiaire et rapprochée (fig. 7-80).

Fig. 7-78 Implant FineVision® (PhysIOL).
(Clichés : P. Rozot.)
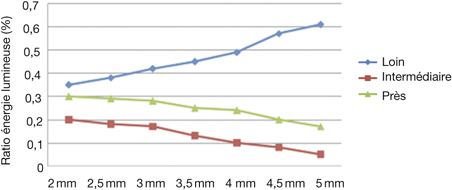
Fig. 7-79 Implant FineVision® : distribution de l’énergie lumineuse en fonction de la pupille.
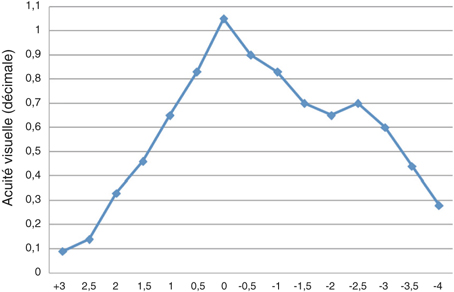
Fig. 7-80 Implant FineVision® : courbe de défocalisation.
P. Rozot
De très nombreuses études cliniques ont permis de mettre en évidence le bénéfice des implants multifocaux, tant diffractifs que réfractifs, par rapport aux implants monofocaux en matière de chirurgie de la cataracte : le principal avantage étant bien évidemment l’obtention d’une acuité visuelle de près non corrigée statistiquement supérieure, tout en maintenant une acuité de loin comparable, apportant ainsi une moindre dépendance aux lunettes par un facteur de 3,62 [17] dans une méta-analyse récente, reprenant onze cohortes de patients porteurs d’implants monofocaux contre trente-cinq cohortes de patients porteurs d’implants multifocaux, chaque patient étant implanté avec le même dispositif de façon bilatérale ; cette étude de Cochener et al. a même mis en évidence dans cette méta-analyse de meilleurs résultats en vision de loin non corrigée après pose d’implant multifocal qu’après pose d’implant monofocal, sans doute par le plus grand soin porté au calcul biométrique, visant à obtenir l’emmétropie pour la multifocalité. Leyland et al. avaient déjà mis en évidence, en 2006 [38], en ne reprenant que des études randomisées multifocaux/monofocaux, l’amélioration de la vision de près, au prix toutefois d’effets adverses de type photiques et de baisse de sensibilité aux contrastes. De même, les études de qualité de vie (VF-7) montrent des scores significativement plus élevés avec les multifocaux qu’avec les monofocaux [14]. Secondairement, la qualité visuelle de loin a été optimisée par la mise en place sur les optiques diffractives d’une correction des aberrations sphériques positives d’origine cornéenne et lenticulaire, surtout ressentie à pupille large, et donc en conditions de basse luminosité [22, 43, 61].
Cet implant, qui a signé le renouveau des implants diffractifs au début des années deux mille, a été largement étudié dans l’extraction du cristallin clair, peu après l’étude multicentrique européenne menée en cataracte sur le modèle à trois pièces MA60 D3 [35]. Fernandez-Vega et al. ont montré l’efficacité du remplacement du cristallin clair par un implant de type ReSTOR® de première génération sur cent douze yeux divisés en deux groupes [23] : soixante-six yeux myopes et soixante-six yeux hypermétropes sur cent douze patients consécutifs. Les équivalents sphériques préopératoires des myopes étaient à – 6,01 ± 2,75 et les équivalents sphériques préopératoires des hypermétropes étaient à 3,75 ± 3,52. En vision de loin, les indices d’efficacité1 oscillaient entre 0,97 pour les sujets myopes et 0,96 pour les hypermétropes, alors que les indices de sécurité2 étaient de 1,05 pour les myopes et de 1,02 pour les yeux hypermétropes. En vision de près, les indices d’efficacité étaient de 1,03 pour les myopes et de 1,10 pour les hypermétropes, les indices de sécurité de 1,05 pour les myopes et de 1,11 pour les hypermétropes. Au total, l’efficacité était donc supérieure pour la vision de près dans la population des hypermétropes. Les auteurs comparent favorablement leurs résultats à ceux de Packer [49] et ceux de Dick [21], qui avaient évalué l’implant réfractif Array® SA40. Au total, l’ensemble des études comparant l’implant ReSTOR® à l’implant Array® SA40 ou ReZoom® (AMO) montrent une supériorité du premier en matière de vision de loin [54], vision de près [13], fréquence moindre des halos [12] ou d’aberrations optiques pour une pupille de 3 mm ou 5 mm [48], indépendance aux lunettes [18] ; seule la vision intermédiaire pour la version de ReSTOR® d’addition + 4,00 D est inférieure à celle du ReZoom® [52]. Les courbes de fonction de transfert de modulation du ReSTOR® obtenues avec l’aberromètre iTrace® sont supérieures à celles du ReZoom® [57].
Chez l’hypermétrope, la sensibilité aux contrastes a été évaluée pour l’implant ReSTOR® [24], avec des résultats comparables à ceux du cristallin naturel dans les conditions photopiques, mais une baisse de performance significative dans les sensibilités aux contrastes en milieu mésopique ; les études de qualité de vie après pose de cet implant [11] montrent des taux d’amélioration de qualité de vie plus élevés dans les populations hypermétropes, cependant qu’une discrète réduction de la sensibilité aux contrastes apparaissait ne pas influencer significativement cette qualité de vie. Quoi qu’il en soit, l’importance de l’anomalie réfractive sphérique est corrélée à une moindre performance : plus l’amétropie est importante, qu’elle soit de type, hypermétropique ou myopique, plus les résultats sont atténués par rapport à une population plus proche de l’emmétropie. Il est à noter qu’en cas de myopie, les performances visuelles avec l’implant ReSTOR® sont moindres lorsque la myopie est importante, par rapport à une petite myopie [4]. Les hypermétropes restent, quoi qu’il en soit, la population où les taux de satisfaction sont les plus élevés [41]. L’implant a également été étudié dans des populations emmétropes [5], où l’indication est longtemps restée contestée en raison des risques d’insatisfaction postopératoire, pouvant être liés tant à la réduction de la sensibilité aux contrastes qu’à l’effet d’une éventuelle amétropie postopératoire qui, même minime, va naturellement pénaliser la vision de loin non corrigée. Il est toutefois intéressant de noter que, dans cette étude, les indices d’efficacité en vision de loin étaient de 1,00 et les indices de sécurité de 1,03 en vision de loin. Ces mêmes indices pour la vision de près étaient respectivement de 1,01 et 1,03. Les questionnaires de satisfaction montraient de hauts pourcentages de satisfaction avec cette technique chez le sujet emmétrope et il est conclu que l’apodisation joue un rôle important dans la bonne tolérance de l’implant.
L’implant ReSTOR® a également été étudié après LASIK hypermétropique, dans sa version SN60D3, soit le modèle d’addition + 4,00 D [3], avec des résultats tout à fait intéressants compte tenu du terrain sous-jacent : il est nécessaire de préciser qu’il s’agissait de la version non asphérique de l’implant, qu’il est donc logique d’utiliser sur un profil cornéen de laser hypermétropique préalable afin de limiter les aberrations optiques. Les mêmes auteurs [1] ont étudié trente et un patients porteurs d’implants diffractifs après extraction de cristallin clair avec amétropie résiduelle, en leur effectuant un laser femtoseconde cornéen secondairement, améliorant tous les patients pour leur vision de loin non corrigée et obtenant 96,2 % d’yeux à ± 0,50 D de la réfraction cible. Une autre étude [46] a montré des résultats visuels plus aléatoires, avec la nécessité d’effectuer un laser cornéen complémentaire dans 42,9 % des cas sur les yeux opérés avec un implant ReSTOR® sur fond de LASIK préalable.
Il est apparu après quelques années que le modèle SN60D3 de l’implant ReSTOR®, d’addition + 4 D, était légèrement insuffisant en vision intermédiaire [11], avec toutefois une gêne significative seulement dans 25 % des cas. Diverses études ont donc comparé la version d’addition + 3,00 D (SN6AD1) à celle d’addition + 4,00 D (SN60D3) [19, 37, 42, 53, 56]. Il ressort globalement de ces évaluations comparatives entre les deux modèles, que les acuités de loin et de près sont en général équivalentes, mais que la vision intermédiaire à 40 cm est supérieure pour la version d’addition + 3,00 D, alors que les taux de satisfaction sont globalement bons. Lors de l’étude multicentrique européenne sur le ReSTOR® d’addition + 3,00 D [36], Kohnen et al. ont montré que les résultats de loin et de près étaient comparables à ceux d’autres études d’implants évaluant la version d’addition + 4,00 D, mais qu’il existait une amélioration significative de la vision intermédiaire ; 88 % des patients étaient totalement indépendants aux lunettes, résultat très proche de la valeur retrouvée par Cochener et al. [16]. De Vries et al. [19] ont montré que l’acuité intermédiaire était supérieure avec le modèle d’addition + 3,00 D aux distances 40 cm, 50 cm, 60 cm et 70 cm, que la distance optimale de travail avec la version de + 3,00 D était supérieure à celle du modèle d’addition + 4,00 D, alors que la sensibilité aux contrastes était équivalente ; les aberrations optiques de haut degré étaient plus marquées sur le modèle + 4,00 D. Santhiago et al. ont montré, dans une comparaison en ambiance photopique [56], une distance moyenne de lecture de 39,7 cm avec le modèle d’addition + 3,00 D et 31,6 cm avec le modèle d’addition + 4,00 D, les patients ne présentant toutefois pas de différence de vitesse de lecture à ces distances de près préférentielles, choisies spontanément. Maxwell et al. [42] ont montré que les taux de satisfaction étaient aussi élevés toutefois pour les deux modèles et que 76,1 % des patients étaient indépendants totalement aux lunettes pour la version à l’addition + 3,00 D, pour 80,2 % pour la version + 4,00 D, les porteurs de l’implant SN6AD1 pouvant toutefois requérir plus souvent une correction complémentaire pour les travaux précis de près ; il est également montré que les myopes avaient un profil de défocalisation plus étroit que les hypermétropes et qu’il pourrait être donc préférable d’utiliser la version + 4,00 D sur une telle amétropie.
Par ailleurs de Vries et al. [20] ont montré une meilleure acuité visuelle de près avec la version asphérique de l’implant ReSTOR® d’addition + 3,00 D par rapport à la version sphérique, bien qu’il n’y ait pas de différence de fréquence des halos, ni de sensibilité aux contrastes. Pour Petermeier et al. [53], de meilleurs taux de satisfaction sont obtenus avec le modèle d’addition + 3,00 D pour l’acuité intermédiaire par rapport au modèle d’addition + 4,00 D, alors que les sensibilités aux contrastes étaient équivalentes pour les deux modèles, le modèle d’addition + 3,00 D présentant plus d’éblouissement mais moins de halos que le modèle + 4,00 D. Ainsi, actuellement, le modèle préféré est donc celui d’addition + 3,00 D, compte tenu d’un profil de défocalisation moins bifocal, améliorant la vision intermédiaire ; le modèle d’addition + 4,00 peut être réservé à une population particulière, essentiellement sur fond de myopie.
L’implant a été également comparé en pose unilatérale par rapport à la pose bilatérale : si les indices de satisfaction sont plus élevés en cas d’implantation bilatérale – en raison d’une meilleure vision stéréoscopique, qui n’est pas significativement altérée [25], d’une meilleure acuité visuelle de près non corrigée et d’une meilleure vision intermédiaire corrigée –, il y a toutefois moins de halos lors de l’implantation unilatérale (57 % contre 77 % en cas d’implantation bilatérale) sur des données d’interrogatoire [15].
Lors d’une étude prospective, cinquante-neuf yeux de trente patients (cinquante-sept yeux étant hypermétropes) ont été évalués dans le cadre d’une extraction de cristallin clair et pose d’implant Tecnis® Multifocal [30]. À un mois, 90 % des yeux atteignaient 0,0857 ± 0,085 en acuité logMAR, soit environ 0,66, tout en atteignant, dans 100 % des yeux Jaeger 2 (soit Parinaud 3) ; 92,8 % des patients étaient complètement indépendants aux lunettes ; on notait dans 7,2 % des cas la nécessité de porter des verres en vision intermédiaire. À noter qu’il a été procédé dans cette étude à un traitement réfractif cornéen complémentaire pour un quart des yeux, probablement en raison de la nécessité d’ajuster la constante A ; la neuroadaptation a permis d’améliorer significativement les résultats réévalués à six mois. Packer et al. [50], dans une évaluation comparative du Tecnis® Multifocal avec un implant monofocal de même forme, ont obtenu 84,8 % de dépendance totale aux lunettes pour le multifocal, contre 5,2 % pour l’implant monofocal au cours de cette étude FDA. Les acuités binoculaires non corrigées étaient de 7,54 ± 0,94 pour la version multifocale, contre 7,98 ± 1,06 pour la version monofocale ; la meilleure acuité visuelle corrigée était de 8,35 ± 0,82 pour le multifocal et 8,68 ± 0,78 pour le monofocal ; 84,2 % des porteurs de multifocaux atteignaient une acuité combinée de 20/25 de loin et 20/35 de près, contre 6,2 % pour les porteurs d’implants monofocaux. Une baisse des contrastes était toutefois retrouvée, les halos étaient présents dans 22,4 % des cas mais, globalement, les porteurs de multifocaux gagnaient quatre à cinq lignes d’acuité visuelle de près par rapport aux monofocaux. Une comparaison des acuités de loin et de près entre le ReSTOR® d’addition + 4,00 D et le Tecnis® Multifocal a montré des résultats visuels similaires entre ces deux lentilles [60] ; une autre étude [47] trouve une supériorité du Tecnis® Multifocal pour la vision rapprochée par rapport au ReSTOR® d’addition + 4,00 D à optique sphérique ou asphérique. Comparé au ReZoom® [10], le Tecnis® Multifocal induit moins de halos et d’éblouissement, octroie une meilleure vision de près [44] mais une moins bonne vision intermédiaire ; de même, les courbes de fonction de transfert de modulation du Tecnis® Multifocal obtenues avec l’aberromètre iTrace® sont supérieures à celles du ReZoom®, qui induit également plus d’aberrations sphériques [57]. Le taux d’opérés indépendants aux lunettes est supérieur avec le Tecnis® Multifocal, comparé au ReZoom® (80 % contre 70 %) [29], et il en est de même avec les taux de satisfaction [44]. L’implant Tecnis® Multifocal a été étudié en implantation unilatérale sur l’œil non dominant, l’autre œil relevant d’une implantation monofocale – ce qui est dénommé « monovision hybride » par Iida – ; trente-deux patients d’âge moyen 61,2 ans ± 14 ont été étudiés [32] : l’acuité moyenne binoculaire était meilleure que 0,1 logMAR, alors que la sensibilité aux contrastes montrait des scores améliorés en binoculaire par rapport à la sensibilité aux contrastes en monoculaire de l’implant diffractif. La vitesse de lecture était de 418 caractères par minute (± 55,8), alors qu’un quart seulement des patients portait des lunettes en complément. Aucun patient ne se plaignait de halos ni d’éblouissements, ni de vision brouillée ; quelques patients signalaient une gêne par manque de clarté en vision intermédiaire et de près ; 60 % des patients avaient une vision stéréoscopique de près normale. Il n’y avait aucun cas d’exotropie, comme on peut le voir en monovision. Cet implant peut donc être proposé en pose unilatérale en aide à la vision de près, avec une réduction significative des effets photiques, qui est souvent la deuxième cause d’insatisfaction en multifocalité.
La première étude disponible [7] concernait soixante-neuf yeux porteurs de cataracte, avec de bons résultats visuels, tant en vision de loin que de près : la vision de loin non corrigée était à 0,75 ± 0,20 en monoculaire, la meilleure acuité corrigée de 0,94 ± 0,11. De près, 91,76 % des patients atteignaient Jaeger 1 (Parinaud 2) et 4,75 % obtenaient Jaeger 2 (Parinaud 3). Les halos étaient présents dans moins de 10 % des cas ; 69,3 % des patients étaient à ± 0,50 D de l’emmétropie. Les évaluations aberrométriques de haut ordre, de Straehl ratio et de fonction de transfert de modulation, à pupille dilatée à 6 mm, montraient globalement une bonne performance visuelle de l’implant. Une évaluation plus récente par la même équipe [8] a étudié quarante-huit yeux de vingt-quatre patients de façon prospective, porteurs de cataracte sur fond d’hypermétropie (équivalence sphérique à 2,61 ± 2,42). Les acuités de loin non corrigées étaient à 0,11 ± 0,11 logMAR et de près non corrigées à 12,00 ± 0,11 logMAR. L’acuité de près avec la meilleure correction de loin était à 0,08 ± 0,10 logMAR. La vitesse de lecture était équivalente à celle d’autres implants diffractifs utilisant les mêmes tests (carte de Radner, test MNRead). Enfin, les scores de qualité de vie, évalués par le test du National Eye Institute Visual Function Questionnaire (NEI-VFQ-25), étaient augmentés grâce aux facultés de lecture améliorées par la multifocalité. Une étude réfractive spécifique de l’Acri.LISA® 366 D sur extraction de cristallin clair [6] a évalué soixante-six yeux de trente-trois patients consécutifs : les indices d’efficacité étaient à 0,73 pour les yeux myopes et 0,785 pour les hypermétropes à six mois ; les indices de sécurité étaient à 1,07 pour les yeux myopes et 1,03 pour les yeux hypermétropes. De près, les indices de sécurité étaient à 1,03 pour les yeux myopes et 1,00 pour les hypermétropes, alors que l’efficacité était à 1,00 pour les yeux myopes et 0,99 pour les yeux hypermétropes, les auteurs concluant à la validité de l’usage de cette lentille à visée réfractive. Une comparaison des acuités de loin et de près et des contrastes entre le ReSTOR® d’addition + 4,00 D et l’Acri.LISA® a montré des résultats similaires entre ces deux lentilles [2]. La nouvelle version de l’implant AT-LISA®, de structure trifocale, est actuellement en évaluation, la modification du réseau diffractif contribuant à améliorer l’acuité visuelle intermédiaire : sur une série préliminaire multicentrique, l’acuité visuelle de loin non corrigée monoculaire est à 0,78, et à 0,99 avec la meilleure correction ; l’acuité en vision intermédiaire non corrigée monoculaire est à 0,59, alors que l’acuité en vision de près non corrigée monoculaire est à 0,80.
Les premiers résultats d’une étude prospective multicentrique, non publiée, dont dix-sept patients (trente-quatre yeux) ont complété le suivi de six mois, montrent des acuités visuelles binoculaires non corrigées de 1,00 ± 0,13 (loin), 0,93 ± 0,10 (près) et 0,82 ± 0,18 (intermédiaire). La courbe de défocalisation confirme une bonne vision intermédiaire, avec le point le plus bas se situant en moyenne à 6/10. Par ailleurs, l’addition de + 3,5 D du Diff-aA permet une lecture optimale à une distance confortable de 40 cm. Les résultats du questionnaire montrent que 93,3 % des patients ne portent jamais de lunettes et 6,7 %, très rarement. Aucun des patients ne se plaint d’éblouissements ou d’étoiles en vision nocturne et seulement un patient se plaint d’un inconfort généré par des halos. Le niveau de satisfaction des patients (87 % « très satisfaits » ; 13 % « satisfaits ») reflète bien la très bonne performance de l’implant Diff-Aa.
Une série non publiée présentée en 2011 (G. Rosca, J.-M. Bosc), sur quarante yeux de vingt patients d’âge moyen 75,4 ans, a montré une acuité visuelle non corrigée de loin d’au moins 8/10 dans 73,5 % des cas, l’acuité corrigée étant à 98, % des cas à 8/10 au moins ; 100 % des patients atteignaient P3 au moins en acuité visuelle de près non corrigée ou avec la meilleure correction visuelle de loin ; 100 % des patients avaient une acuité intermédiaire à 8/10 sans correction ou avec la meilleure correction de loin ; un tiers des patients signalaient des halos à trois mois, 30 % un éblouissement ; 98 % des patients ne portaient pas de lunettes ; 96 % étaient satisfaits de leur vision de jour sans verres d’appoint, 87 % satisfaits de leur vision sans verre d’appoint pour les conditions mésopiques.
Cent quatorze yeux de quatre-vingt-dix-sept patients ont été étudiés lors d’une étude prospective multicentrique franco-belge. L’âge moyen était de 66,7 ± 9 ans et le sex-ratio de 63 % de femmes pour 37 % d’hommes. L’acuité préopératoire était de 0,22 ± 0,26 logMAR (extrême 0,01 à 1,6 logMAR) avec, dans la série, trente-cinq extractions de cristallins clairs. Les longueurs axiales étaient en moyenne à 23,38 ± 1,04 (20,53 à 26,15). Au total, cent quatre-vingt-huit yeux ont été revus avec un suivi moyen de cinq mois ± 3,8. L’acuité visuelle postopératoire monoculaire de loin non corrigée était à 0,07 ± 0,10 logMAR et, avec la meilleure correction, de 0,03 ± 0,06 logMAR. L’acuité visuelle intermédiaire était à 0,09 ± 0,10 logMAR non corrigée en monoculaire et de 0,09 ± 0,10 logMAR avec la meilleure correction de loin. L’acuité monoculaire de près obtenue était à 0,01 ± 0,05 logMAR non corrigée, et 0,00 ± 0,04 logMAR avec la meilleure correction de loin. Concernant l’acuité binoculaire non corrigée : elle était à 0,01 ± 0,03 logMAR en vision de loin, 0,06 logMAR ± 0,08 en intermédiaire, 0,00 logMAR ± 0,03 en vision de près. L’acuité visuelle binoculaire de loin était inchangée en vision photopique ou mésopique (0,02 logMAR dans chaque cas) et passait de 0,06 à 0,15 pour l’acuité intermédiaire et de 0,00 logMAR à 0,06 logMAR pour la vision de près. Le plus intéressant est la courbe de défocalisation qui montre un quasi-continuum d’acuité entre la meilleure acuité visuelle de loin et une défocalisation jusqu’à – 2,50 D en binoculaire qui ne descend pas en dessous de 0,1 d’acuité logMAR (cf. fig. 7-72). Au total, cet implant apporte une relative polyvalence pour les différentes distances, loin, intermédiaire et près, sans pénaliser significativement la vision de loin. Les taux de halos et d’éblouissement sont proches de ceux d’autres implants diffractifs, avec environ 20 % de halos et 10 % d’éblouissement.


[1] Alfonso J.F., Fernández-Vega L., Montés-Micó R., Valcárcel B. Femtosecond laser for residual refractive error correction after refractive lens exchange with multifocal intraocular lens implantation. Am J Ophthalmol, 2008 ; 146 : 244-50.
[2] Alfonso J.F., Puchades C., Fernández-Vega L. et al. Visual acuity comparison of 2 models of bifocal aspheric intraocular lenses. J Cataract Refract Surg, 2009 ; 35 : 672-6.
[3] Alfonso J.F., Fernández-Vega L., Baamonde B. et al. Refractive lens exchange with spherical diffractive intraocular lens implantation after hyperopic laser in situ keratomileusis. J Cataract Refract Surg, 2009 ; 35 : 1744-50.
[4] Alfonso J.F., Fernández-Vega L., Ortí S. et al. Differences in visual performance of AcrySof ReSTOR IOL in high and low myopic eyes. Eur J Ophthalmol, 2010 ; 20 : 333-9.
[5] Alfonso J.F., Fernández-Vega L., Valcárcel B. et al. Outcomes and patient satisfaction after presbyopic bilateral lens exchange with the ResTOR IOL in emmetropic patients. J Refract Surg, 2010 ; 26 : 927-33.
[6] Alfonso J.F., Fernández-Vega L., Baamonde B. et al. Refractive lens exchange with Acri.LISA bifocal intraocular lens implantation. Eur J Ophthalmol, 2011 ; 21 : 125-31.
[7] Alió J.L., Elkady B., Ortiz D., Bernabeu G. Clinical outcomes and intraocular optical quality of a diffractive multifocal intraocular lens with asymmetrical light distribution. J Cataract Refract Surg, 2008 ; 34 : 942-8.
[8] Alió, J.L., Plaza-Puche A.B., Piñero D.P. et al. Optical analysis, reading performance, and quality-of-life evaluation after implantation of a diffractive multifocal intraocular lens. J Cataract Refract Surg, 2011 ; 37 : 27-37.
[9] Atchison D.A., Charman W.N. Thomas Young’s contribution to visual optics: the Bakerian Lecture « on the mechanism of the eye ». J Vis, 2010 ; 10 : 16.
[10] Barisic A., Dekaris I., Gabric N. et al. Comparison of diffractive and refractive multifocal intraocular lenses in presbyopia treatment. Coll Antropol, 2008 ; 32 Suppl 2 : 27-31.
[11] Blaylock J.F., Si Z., Aitchison S., Prescott C. Visual function and change in quality of life after bilateral refractive lens exchange with the ReSTOR multifocal intraocular lens. J Refract Surg, 2008 ; 24 : 265-73.
[12] Chang D.F. Prospective functional and clinical comparison of bilateral ReZoom and ReSTOR intraocular lenses in patients 70 years or younger. J Cataract Refract Surg, 2008 ; 34 : 934-41.
[13] Chiam P.J., Chan J.H., Haider S.I. et al. Functional vision with bilateral ReZoom and ReSTOR intraocular lenses 6 months after cataract surgery. J Cataract Refract Surg, 2007 ; 33 : 2057-61.
[14] Cillino S., Casuccio A., Di Pace F. et al. One-year outcomes with new-generation multifocal intraocular lenses. Ophthalmology, 2008 ; 115 : 1508-16.
[15] Cionni R.J., Osher R.H., Snyder M.E. et al. Visual outcome comparison of unilateral versus bilateral implantation of apodized diffractive multifocal intraocular lenses after cataract extraction: prospective 6-month study. J Cataract Refract Surg, 2009 ; 35 : 1033-9.
[16] Cochener B., Fernández-Vega L., Alfonso J.F. et al. Spectacle independence and subjective satisfaction of ReSTOR multifocal intraocular lens after cataract or presbyopia surgery in two European countries. Clin Ophthalmol, 2010 ; 4 : 81-9.
[17] Cochener B., Lafuma A., Khoshnood B. et al. Comparison of outcomes with multifocal intraocular lenses: a meta-analysis. Clin Ophthalmol, 2011 ; 5 : 45-56.
[18] Davison J.A., Simpson M.J. History and development of the apodized diffractive intraocular lens. J Cataract Refract Surg, 2006 ; 32 : 849-58.
[19] De Vries N.E., Webers C.A., Montés-Micó R. Visual outcomes after cataract surgery with implantation of a + 3.00 D or + 4.00 D aspheric diffractive multifocal intraocular lens: Comparative study. J Cataract Refract Surg, 2010 ; 36 : 1316-22.
[20] De Vries N.E., Webers C.A., Verbakel F. et al. Visual outcome and patient satisfaction after multifocal intraocular lens implantation: aspheric versus spherical design. J Cataract Refract Surg, 2010 ; 36 : 1897-904.
[21] Dick H.B., Gross S., Tehrani M. et al. Refractive lens exchange with an array multifocal intraocular lens. J Refract Surg, 2002 ; 18 : 509-18.
[22] Eppig T., Scholz K., Langenbucher A. Assessing the optical performance of multifocal (diffractive) intraocular lenses. Ophthalmic Physiol Opt, 2008 ; 28 : 467-74.
[23] Fernández-Vega L., Alfonso J.F., Rodriguez P.P. et al. Clear lens extraction with multifocal apodized diffractive intraocular lens implantation. Ophthalmology, 2007 ; 114 : 1491-8.
[24] Ferrer-Blasco T., Montés-Micó R., Cerviño A. et al. Contrast sensitivity after refractive lens exchange with diffractive multifocal intraocular lens implantation in hyperopic eyes. J Cataract Refract Surg, 2008 ; 34 : 2043-8.
[25] Ferrer-Blasco T., Madrid-Costa D., Garcia-Lazaro S. et al. Stereopsis in bilaterally multifocal pseudophakic patients. Graefes Arch Clin Exp Ophthalmol, 2011 ; 249 : 245-51.
[26] Gatinel D. Limited accuracy of Hartmann-Shack wavefront sensing in eyes with diffractive multifocal IOLs. J Cataract Refract Surg, 2008 ; 34 : 528.
[27] Gatinel D. Double pass-technique limitations for evaluation of optical performance after diffractive IOL implantation. J Cataract Refract Surg, 2011 ; 37 : 621-2.
[28] Gatinel D., Pagnoulle C., Houbrechts Y., Gobin L. Design and qualification of a diffractive trifocal optical profile for intraocular lenses. J Cataract Refract Surg, 2011 ; 37 : 2060-7.
[29] Gierek-Ciaciura S., Cwalina L., Bednarski L., Mrukwa-Kominek E. A comparative clinical study of the visual results between three types of multifocal lenses. Graefes Arch Clin Exp Ophthalmol, 2010 ; 248 : 133-40.
[30] Goes F.J. Refractive lens exchange with the diffractive multifocal Tecnis ZM900 intraocular lens. J Refract Surg, 2008 ; 24 : 243-50.
[31] Hong X., Zhang X. Optimizing distance image quality of an aspheric multifocal intraocular lens using a comprehensive statistical design approach. Opt Express, 2008 ; 16 : 20920-34.
[32] Iida Y., Shimizu K., Ito M. Pseudophakic monovision using monofocal and multifocal intraocular lenses: Hybrid monovision. J Cataract Refract Surg, 2011 ; 37 : 2001-5.
[33] Jacobi F.K., Kammann J., Jacobi W.K. et al. Bilateral implantation of asymmetrical diffractive multifocal intraocular lenses. Arch Ophthalmol, 1999 ; 117 : 17-23.
[34] Javitt J.C., Wang F., Trentacost D.J. et al. Outcomes of cataract extraction with multifocal intraocular lens implantation: functional status and quality of life. Ophthalmology, 1997 ; 104 : 589-99.
[35] Kohnen T., Allen D., Boureau C. et al. European multicenter study of the AcrySof ReSTOR apodized diffractive intraocular lens. Ophthalmology, 2006 ; 113 : 584 e1.
[36] Kohnen T., Nuijts R., Levy P. et al. Visual function after bilateral implantation of apodized diffractive aspheric multifocal intraocular lenses with a + 3.0 D addition. J Cataract Refract Surg, 2009 ; 35 : 2062-9.
[37] Lane S.S., Javitt J.C., Nethery D.A., Waycaster C. Improvements in patient-reported outcomes and visual acuity after bilateral implantation of multifocal intraocular lenses with + 3.0 diopter addition: multicenter clinical trial. J Cataract Refract Surg, 2010 ; 36 : 1887-96.
[38] Leyland M., Pringle E. Multifocal versus monofocal intraocular lenses after cataract extraction. Cochrane Database Syst Rev, 2006 (4): CD003169.
[39] Lindstrom R.L. Food and Drug Administration study update. One-year results from 671 patients with the 3M multifocal intraocular lens. Ophthalmology, 1993 ; 100 : 91-7.
[40] López-Gil N., Montés-Micó R. New intraocular lens for achromatizing the human eye. J Cataract Refract Surg, 2007 ; 33 : 1296-302.
[41] Maliugin B.E., Fedorova I.S., Antonian S.A. et al. [Surgical correction of presbyopia with multifocal diffractive intraocular lenses.] Vestn Oftalmol, 2007 ; 123 : 3-6.
[42] Maxwell W.A., Waycaster C.R., D’Souza A.O. et al. A United States cost-benefit comparison of an apodized, diffractive, presbyopia-correcting, multifocal intraocular lens and a conventional monofocal lens. J Cataract Refract Surg, 2008 ; 34 : 1855-61.
[43] Maxwell W.A., Lane S.S., Zhou F. Performance of presbyopia-correcting intraocular lenses in distance optical bench tests. J Cataract Refract Surg, 2009 ; 35 : 166-71.
[44] Mester U., Hunold W., Wesendahl T., Kaymak H. Functional outcomes after implantation of Tecnis ZM900 and Array SA40 multifocal intraocular lenses. J Cataract Refract Surg, 2007 ; 33 : 1033-40.
[45] Moreno V., Roman J.F., Salgueiro J.R. High efficiency diffractive lenses : deduction of a kinoform profile. Am J Phys, 1997 ; 65 : 556-62.
[46] Muftuoglu O., Dao L., Mootha V.V. et al. Apodized diffractive intraocular lens implantation after laser in situ keratomileusis with or without subsequent excimer laser enhancement. J Cataract Refract Surg, 2010 ; 36 : 1815-21.
[47] Ngo C., Singh M., Sng C. et al. Visual acuity outcomes with SA60 D3, SN60 D3, and ZM900 multifocal IOL implantation after phacoemulsification. J Refract Surg, 2010 ; 26 : 177-82.
[48] Ortiz D., Alió J.L., Bernabeu G. et al. Optical performance of monofocal and multifocal intraocular lenses in the human eye. J Cataract Refract Surg, 2008 ; 34 : 755-62.
[49] Packer M., Fine I.H., Hoffman R.S. Refractive lens exchange with the array multifocal intraocular lens. J Cataract Refract Surg, 2002 ; 28 : 421-4.
[50] Packer M., Chu R.Y., Waltz K.L. et al. Evaluation of the aspheric tecnis multifocal intraocular lens: one-year results from the first cohort of the food and drug administration clinical trial. Am J Ophthalmol, 2010 ; 149 : 577-584 e1.
[51] Pearce J.L. Multifocal intraocular lenses. Curr Opin Ophthalmol, 1996 ; 7 : 2-10.
[52] Pepose J.S., Qazi M.A., Davies J. et al. Visual performance of patients with bilateral vs combination Crystalens, ReZoom, and ReSTOR intraocular lens implants. Am J Ophthalmol, 2007 ; 144 : 347-357.
[53] Petermeier K., Messias A., Gekeler F., Szurman P. Effect of + 3.00 diopter and + 4.00 diopter additions in multifocal intraocular lenses on defocus profiles, patient satisfaction, and contrast sensitivity. J Cataract Refract Surg, 2011 ; 37 : 720-6.
[54] Renieri G., Kurz S., Schneider A., Eisenmann D. ReSTOR diffractive versus Array 2 zonal-progressive multifocal intraocular lens: a contralateral comparison. Eur J Ophthalmol, 2007 ; 17 : 720-8.
[55] Rosmorduc J., Rosmorduc V., Dutour F. Les révolutions de l’optique et l’œuvre de Fresnel. Naissance de l’optique ondulatoire. Vuibert, 2004 : 27-39.
[56] Santhiago M.R., Netto M.V., Espindola R.F. et al. Comparison of reading performance after bilateral implantation of multifocal intraocular lenses with + 3.00 or + 4.00 diopter addition. J Cataract Refract Surg, 2010 ; 36 : 1874-9.
[57] Santhiago M.R., Netto M.V., Barreto J. et al. Wavefront analysis and modulation transfer function of three multifocal intraocular lenses. Indian J Ophthalmol, 2010 ; 58 : 109-13.
[58] Slagsvold J.E. 3M diffractive multifocal intraocular lens: eight year follow-up. J Cataract Refract Surg, 2000 ; 26 : 402-7.
[59] Steinert R.F., Post C.T. Jr, Brint S.F. et al. A prospective, randomized, double-masked comparison of a zonal-progressive multifocal intraocular lens and a monofocal intraocular lens. Ophthalmology, 1992 ; 99 : 853-60.
[60] Toto L., Falconio G., Vecchiarino L. et al. Visual performance and biocompatibility of 2 multifocal diffractive IOLs: six-month comparative study. J Cataract Refract Surg, 2007 ; 33 : 1419-25.
[61] Vega F., Alba-Bueno F., Millan M.S. Energy distribution between distance and near images in apodized diffractive multifocal intraocular lenses. Invest Ophthalmol Vis Sci, 2011 ; 52 : 5695-701.
P. Levy
Les implants multifocaux toriques permettent de corriger l’astigmatisme et la presbytie en une seule étape lors d’une chirurgie du cristallin. Il est vrai qu’à ce jour, les progrès de la phacoémulsification, avec l’avènement de la mini-incision et de la micro-incision, et ceux des implants et de leurs injecteurs, permettant l’introduction de ces derniers sans élargissement de la porte d’entrée, ont permis de rendre cette chirurgie non astigmatogène. Dans ces conditions, il devenait envisageable de prétendre corriger l’astigmatisme cornéen du patient opéré.
La prise en charge de l’astigmatisme au cours d’une chirurgie avec implantation multifocale est un point essentiel dans la réussite fonctionnelle de cette technique [8].
Que cela soit au cours d’une chirurgie de cataracte ou d’une chirurgie d’extraction du cristallin clair, la persistance d’un astigmatisme postopératoire après implantation monofocale et multifocale a des conséquences négatives essentiellement sur la vision de loin, sur la vision de près et sur les phénomènes photiques rencontrés en postopératoire ; ce d’autant que l’astigmatisme est important, dépassant 1,5 D [8, 22]. Or, cette limite n’est pas négligeable si on considère que près d’un tiers des patients est porteur d’un cylindre d’au moins 1 D. Il est actuellement reconnu que plus l’astigmatisme subjectif postopératoire sera faible, meilleur sera le résultat après implantation multifocale.
La prise en compte de l’astigmatisme au moment de la chirurgie du cristallin peut être envisagée de quatre façons différentes.
Il s’agit d’une technique facile et rapide. Elle présente l’inconvénient d’être peu prédictible, d’avoir un maximum d’efficacité de 0,75 à 1 D et de ne corriger que sur un hémiméridien, à moins d’y associer une incision cornéenne opposée. Elle n’est pas toujours techniquement facile à réaliser en fonction du siège du méridien cambré.
Il s’agit d’une technique déjà éprouvée, facile à réaliser. Elle est relativement précise et assez reproductible pour les astigmatismes inférieurs ou égaux à 1,5 D.
Elle nécessite de se référer à des abaques de traitement et utilise une instrumentation particulière (couteau diamant, couteau à usage unique ou… femtoseconde). Cette technique augmente le temps de la chirurgie et semble moins efficace chez les patients jeunes. Les incisions limbiques relaxantes peuvent entraîner des douleurs ou simplement un inconfort au cours des premières heures postopératoires.
Plus l’astigmatisme à corriger est important, moins les incisions limbiques relaxantes seront prédictibles. Par ailleurs, comme toutes les techniques d’incisions cornéennes, leur effet à tendance à régresser avec le temps du fait de phénomènes cicatriciels.
Il s’agit d’une chirurgie en deux temps associant une phacoémulsification avec implant multifocal à une prise en charge chirurgicale secondaire de l’astigmatisme (et d’une éventuelle imprécision sphérique associée) par laser à excimères. Cette technique est contraignante (chirurgie en deux temps) et onéreuse ; elle n’a plus lieu d’être aujourd’hui dans cette indication sauf cas exceptionnel. Le recours récent au laser femtoseconde pour la pratique d’incisions cornéennes trans-épithéliales voire intrastromales pourrait offrir un gain en précision et assurer un confort optimal pour le patient. Cependant, la stabilité dans le temps, la capacité de correction limitée aux astigmatismes de moins de 4 D et la nécessité de pratiquer ce geste à distance de l’implantation constituent des limites dans la technique incisionnelle.
En revanche, la réalisation d’une photokératectomie réfractive ou d’un LASIK pourra être éventuellement proposée afin d’améliorer le résultat fonctionnel d’une implantation multifocale torique avec un résultat réfractif non optimum et perfectible.
Les implants multifocaux toriques sont d’apparition récente en France, puisque la distribution du premier implant multifocal torique date de 2007 (Acri.LISA® Torique, Zeiss). Ils ont bénéficié du large développement des implants multifocaux et de celui des implants toriques monofocaux.
Ils présentent l’avantage de ne pas entraîner de modification du geste chirurgical. Le temps de chirurgie est par ailleurs très peu augmenté. Enfin, il n’y a pas d’augmentation des douleurs postopératoires comme dans les incisions limbiques relaxantes.
Le résultat réfractif après implantation torique est très dépendant de la rotation postopératoire de l’implant, qui est influencée par la taille du capsulorhexis, par le matériau de l’implant et par sa géométrie.
Il faut savoir qu’une rotation de 10° diminue l’effet d’un tiers et qu’une rotation supérieure à 30° aggravera l’astigmatisme préopératoire. Par ailleurs, toute rotation entraînera un changement d’axe de l’astigmatisme et aura tendance à entraîner une hypermétropie postopératoire.
La correction d’un astigmatisme par implant torique présente des avantages par rapport aux techniques d’incisions cornéennes avec lesquels les phénomènes de régression et de cicatrisation existent, pouvant nuire aux résultats à moyens et longs termes : l’action d’un implant est définitive – en l’absence de rotation secondaire de la lentille intraoculaire. Par ailleurs, les incisions limbiques relaxantes sont génératrices d’aberrations optiques d’ordre élevé, surtout pour la correction des astigmatismes de haut degré, qui peuvent nuire à la qualité du résultat postopératoire, ce qui n’est pas souhaitable, en particulier dans le cadre d’une implantation multifocale.
À ce jour, nous disposons de quatre implants multifocaux toriques distribués en France. Ils sont tous conçus pour être injectés au cours d’une chirurgie du cristallin par une micro-incision de taille supérieure ou égale à 1,8 mm. Chaque fabricant dispose d’un site Internet pour le calcul et la commande de ses implants toriques. Ils sont répartis en deux catégories : les implants diffractifs et les implants réfractifs.
Implant monobloc injectable en berge par 1,8 mm, dédié à l’implantation dans le sac capsulaire, en acrylique hydrophobe (matériau AcrySof®) de 6 mm de diamètre d’optique pour 13 mm de longueur totale (fig. 7-81), il est conçu sur la fusion de la plateforme du ReSTOR® IQ + 3 (modèle SN6AD1) et de l’implant monofocal torique SN60T, comportant un filtre de lumière bleue. La gamme de correction sphérique de cet implant va de + 6 D à + 30 D.
La face antérieure de l’implant est dédiée à la multifocalité et à l’asphéricité.
Le principe optique de multifocalité combine réfraction, diffraction et apodisation, comme sur la plateforme ReSTOR® (cf. section précédente). Il existe neuf marches de diffraction. L’addition au niveau de l’implant est de + 3 D, correspondant à 2,4 D au plan des lunettes. L’asphéricité située au niveau de la face antérieure est de 0,1 µm.
La face postérieure est torique, afin de corriger l’astigmatisme. Il existe quatre modèles actuellement, du SND1T2 au SND1T5, qui corrigent de 1 D à 3 D au niveau de l’implant, correspondant à une correction de 0,68 D à 2,06 D au niveau cornéen.

Fig. 7-81 Implant AcrySof® ReSTOR® Toric SND1T (Alcon).
(Reproduit avec l’aimable autorisation d’Alcon.)
Implant monobloc acrylique hydrophile à surface hydrophobe, asphérique, il a ses marches de multifocalité lissées dans le but d’optimiser la qualité de vision (fig. 7-82). Cette lentille est destinée à l’injection dans le sac capsulaire, injectable par 1,5 mm, non angulée, de diamètre optique 6 mm et de longueur totale 11 mm. Il correspond à la fusion des plateformes multifocales AT-LISA® 809 M et toriques AT TORBI®. Il comporte dans sa version MV un filtre de lumière violette. La gamme de correction sphérique va de – 10 D à + 32 D.
La face antérieure de l’implant est torique de + 1 D à + 12 D au niveau de l’implant, par incrément de 0,5 D, ce qui correspond à une correction maximale de + 9 D d’astigmatisme au plan cornéen.
La face postérieure est dédiée à la multifocalité diffractive, avec addition de + 3,75 D au niveau de limplant correspondant à une addition de + 2,80 D au plan des lunettes, et aberration sphérique négative de – 0,11 µm.

Fig. 7-82 Implant AT-LISA® Toric 909M et 909MV (Zeiss).
(Reproduit avec l’aimable autorisation de Zeiss-Meditec.)
Implant monobloc en acrylique hydrophile 5 % (matériau Ryacryl®), il est destiné à l’injection dans le sac capsulaire par une incision de 2,2 mm.
Il est décliné en deux modèles : 588F (puissances supérieures à 25 D) et 638F (puissances inférieures ou égales à 25 D) (fig. 7-83). Ces deux modèles diffèrent par leur taille : pour le modèle 588F, la taille de l’implant est de 5,75 mm × 12 mm avec quatre zones réfractives annulaires ; pour le modèle 638F, la taille de l’implant est de 6,25 mm × 12 mm avec cinq zones annulaires. Chaque modèle est décliné avec une addition au choix de + 3 D ou + 4 D au niveau de l’implant. La toricité se situe sur la face antérieure.
La gamme de correction sphérique s’étend de + 14 D à + 32 D et, pour la correction d’astigmatisme, de + 1 D à + 6 D au niveau de l’implant par incrément de 0,5 D, ce qui correspond environ à une correction maximale de 4,3 D au niveau de la cornée.
Il présente une asphéricité neutre sur sa face antérieure.

Fig. 7-83 Implant M-flex® T (Rayner).
(Reproduit avec l’aimable autorisation de Rayner.)
Implant monobloc biconvexe en acrylique hydrophile à surface hydrophobe, il est destiné à l’implantation dans le sac capsulaire par 1,5 mm minimum. Le diamètre optique est de 6 mm, la longueur totale de 11 mm (fig. 7-84).
Il s’agit d’un implant original à deux zones optiques non concentriques avec un secteur de 160° inférieur dédié à la vision de près avec addition de + 3 D et un axe visuel libre pour la vision de loin. Sa face postérieure est asphérique neutre et torique.
La gamme de correction sphérique va de 0 à 36 D par incrément de 0,01 D, et la gamme de correction torique de + 0,25 D à + 12 D par pas de 0,01 D.

Fig. 7-84 Implant Lentis® Mplus® torique (Oculentis).
(Reproduit avec l’aimable autorisation d’Oculentis/Topcon.)
Le bilan préopératoire est d’abord celui d’un implant multifocal et doit comporter en plus l’évaluation la plus parfaite possible de l’astigmatisme à corriger et la commande de l’implant à l’aide des calculateurs en ligne.
Il s’agit d’un temps essentiel dans l’évaluation du patient. Elle ne doit pas être uniquement quantitative mais aussi qualitative, dans la mesure où certains astigmatismes, notamment les astigmatismes irréguliers, sont une contre-indication à la pose d’un implant multifocal torique.
La réfraction, qu’elle soit automatisée ou subjective, ne représente pas une méthode utilisable car seul doit être pris en compte l’astigmatisme cornéen préopératoire et non l’astigmatisme retrouvé en réfraction objective ou subjective qui, lui, représente l’astigmatisme total. L’astigmatisme total est l’addition de l’astigmatisme cornéen et de l’astigmatisme interne. Dans la majorité des cas l’astigmatisme interne est d’origine cristallinien.
Nous disposons de différents appareils pour l’évaluation préopératoire précise de l’astigmatisme cornéen.
Le kératomètre manuel mesure la puissance cornéenne entre deux points distants de trois millimètres (la taille de cette zone dépend de l’importance de la prolaticité cornéenne et peut aller de 2,8 à 3,2 mm). Il présume que la cornée entre ces deux points est sphérique. Il ne mesure pas la zone centrale mais il l’extrapole. Il est capable de mettre en évidence certaines irrégularités cornéennes sans jamais pouvoir les mesurer.
Plusieurs appareils sont capables d’évaluer le rayon de courbure de la cornée antérieure.
Il présente des similitudes avec le kératomètre manuel, avec mesure de quatre points sur un diamètre allant de 2,8 à 3,7 mm en fonction de la prolaticité cornéenne ; il existe un scotome central nécessitant l’extrapolation des mesures. Il ne peut pas mettre en évidence d’irrégularités cornéennes, à moins d’être couplé à une observation de type Placido de la cornée qui pourra, dans certains cas, mettre en évidence une irrégularité des mires sans jamais pouvoir la quantifier.
Il présente l’avantage d’avoir six points de mesure sur un diamètre de 2,5 mm, ce qui représente une mesure plus proche du centre donc plus fiable.
Il présente l’avantage d’avoir trente-deux points de mesure sur deux cercles, le plus central présentant un diamètre de 1,65 mm, soit encore plus petit que celui du IOLMaster® ou des autres kératomètres.
Ils présentent l’avantage de réaliser à la fois une évaluation quantitative et qualitative de l’astigmatisme cornéen, contrairement aux kératomètres.
L’analyse quantitative se fait à partir de milliers de points mesurés. La zone aveugle centrale, variable selon les appareils, est en moyenne de 1,6 mm.
La donnée SimK renseignée par tous les topographes est calculée sur le cercle central de 3 mm de diamètre, comme avec un kératomètre classique, et ne tient pas compte des données plus centrales.
L’analyse qualitative de l’astigmatisme cornéen antérieur permet de s’assurer du caractère régulier et symétrique de l’astigmatisme, ce qui est un point important dans la prise en charge efficace d’un astigmatisme au cours d’une implantation multifocale torique. Elle permettra de détecter les astigmatismes très asymétriques et/ou irréguliers, qui sont une contre-indication à l’implantation multifocale.
On note que certains topographes (OPD-scan, Nidek, KR-1W Topcon, Atlas® Zeiss…) sont capables de réaliser une extrapolation mathématique de l’aberrométrie cornéenne à partir de la topographie. Ceci peut avoir un intérêt dans certains cas d’astigmatisme – où la coma et/ou le tilt prédomine(nt) sur le cylindre. Des aberrations optiques d’ordre élevé en quantité importante doivent nous faire réfléchir quant à l’opportunité d’une implantation multifocale. De plus, ce topographe peut être relié au logiciel IOL-Station afin de tenir compte des données topographiques et d’optimiser le choix de l’asphéricité de l’implant.
Les tomographes représentent un apport important dans l’évaluation de l’astigmatisme et ce pour deux raisons principales :
– absence de zone centrale aveugle avec mesure réelle de la kératométrie centrale sans extrapolation, due à la position périphérique de la caméra d’enregistrement ; il peut être intéressant de comparer la mesure de la puissance cornéenne centrale et de l’astigmatisme à l’intérieur des 3 mm centraux et de les comparer aux valeurs obtenues avec un kératomètre ou avec le SimK du topographe : toute différence significative témoigne d’un astigmatisme irrégulier et doit faire réévaluer notre indication éventuelle d’implant multifocal torique ;
– mesure de la puissance de la face postérieure de la cornée, qui ne représente pas en soi un intérêt particulier dans l’évaluation quantitative de l’astigmatisme chez la plupart des patients, mais qui peut être contributive dans la détection d’un éventuel kératocône fruste (contre-indication à la pose d’un implant multifocal) ou une éventuelle séquelle de traumatisme cornéen avec astigmatisme postérieur.
La station de travail TMS-5 (Tomey) représente l’association d’un topographe de type Placido à une analyse tomographique par Scheimpflug camera. Cet appareil peut être relié à un biomètre optique (OA 1000) avec transfert vers le logiciel Okulix® permettant de calculer la puissance des implants grâce au procédé de ray-tracing, évitant ainsi les sources d’erreurs potentielles dans certaines situations (antécédents de chirurgie réfractive, forts astigmatismes…) inhérentes aux formules empiriques habituellement utilisées.
Une fois la biométrie réalisée et une fois l’analyse de l’astigmatisme cornéen faite, il faudra utiliser un calculateur en ligne.
Le premier calculateur a été développé par STAAR dans les années quatre-vingt-dix.
Ce type de calculateur (fig. 7-85) permet non seulement de déterminer la puissance sphérocylindrique de l’implant mais aussi l’axe optimal où sera positionné le tore positif de l’implant en tenant compte des données kératométriques de l’astigmatisme cornéen et de l’astigmatisme présumé chirurgicalement induit selon le principe du cylindre croisé.
Certains calculateurs permettent une personnalisation plus grande que d’autres, permettant de choisir l’astigmatisme résiduel qu’on souhaite obtenir en fin d’intervention et même, chez certaines sociétés, de faire varier la puissance du tore de l’implant et de voir ses conséquences sur l’astigmatisme résiduel prévu et sur le résultat sphérique avec calcul de l’équivalent sphérique (Zeiss) (fig. 7-86).
Deux sources d’erreur peuvent émaner de l’utilisation de ces calculateurs en ligne :
– l’astigmatisme induit chirurgicalement au cours de l’intervention : il est important d’utiliser une technique chirurgicale la moins astigmatogène possible et la plus reproductible (micro-incision temporale) et d’évaluer sur un calculateur son propre astigmatisme moyen induit (Surgically-Induced Astigmatism Calculator sur le site du Dr Hill3 ) :
– le rapport entre l’astigmatisme cornéen et la toricité de l’implant : les calculateurs en ligne utilisables actuellement pour les implants multifocaux toriques disponibles utilisent une méthode d’approximation pour estimer ce rapport ; le ratio utilisé entre ces deux données est un ratio fixe qui va de 1,41 à 1,48 selon les sociétés ; ce ratio est en réalité influencé par la puissance de l’implant et, surtout, par l’ELP (Effective Lens Position).
La variation de l’ELP peut être très importante d’un œil à l’autre, notamment sur les yeux très courts ou dans le cadre de myopie importante, ce qui ne plaide pas pour l’utilisation d’une valeur moyenne d’estimation de l’ELP. L’utilisation d’un ratio fixe ne prendra pas en compte ce facteur et pourra être la source d’erreurs dans l’estimation de la puissance torique de l’implant. Ainsi, il sera préférable d’utiliser des formules théoriques (Haigis, Holladay 2, SRK/T – moins recommandée car utilisant la kératométrie) plutôt que les formules de régression (SRK II), car elles utilisent la mesure de la profondeur de chambre antérieure pour déterminer l’ELP dans le cas de la formule de Haigis et sept variables différentes dont la profondeur de chambre antérieure dans la formule de Holladay 2, permettant ainsi de s’affranchir de la notion de ratio fixe. En cas de fortes amétropies, Hoffer-Q sera recommandée pour le grand hypermétrope et Haigis chez le myope fort.

Fig. 7-85 Calculateur en ligne du laboratoire Alcon.

Fig. 7-86 Calculateur en ligne du laboratoire Zeiss permettant l’ajustement sphérocylindrique.
Le marquage de l’axe sur lequel seront positionnés les repères de l’implant torique au moment de la chirurgie sera réalisé en deux temps.
Une des sources d’imprécision est liée au phénomène de cyclotorsion. Il est donc essentiel, afin d’éviter la cyclorotation liée au passage de la position assise à la position couchée et/ou au passage de la vision binoculaire à la vision monoculaire de réaliser un marquage au bloc opératoire avant la chirurgie, dans des conditions parfaitement identiques à celles qui ont été utilisées pour les examens préopératoires de mesure de l’axe d’astigmatisme (kératométrie manuelle, automatique, topographie).
Nous réalisons un marquage cornéen après instillation d’oxybuprocaïne, sur 0° et 90 °, avant toute injection de drogues sédatives par l’anesthésiste, sur un patient assis, en vision binoculaire (fig. 7-87 et 7-88).
Il existe de nombreux instruments qui peuvent être utilisés pour réaliser ces marques de référence : simple crayon dermographique, marqueur multimarques, marqueur pendulaire, utilisation d’une lampe à fente, marqueur de Devgan (fig. 7-89 à 7-93).
Fig. 7-87 Instillation d’oxybuprocaïne collyre.
Fig. 7-88 Marquage sur patient assis en vision binoculaire du méridien horizontal et éventuellement vertical.
Fig. 7-89 Marquage au crayon dermographique.
Fig. 7-90 Marquage avec marqueur multimarques.
Fig. 7-91 Marquage au crayon dermographique à la lampe à fente.
Fig. 7-92 Marquage avec marqueur pendulaire.

Fig. 7-93 Marqueur de Devgan.
Sur le patient couché, au bloc opératoire, on marque le méridien sur lequel seront alignés les repères indiquant le tore de l’implant, selon les informations données par le calculateur.
On se servira comme référence du marquage précédemment réalisé sur le patient assis des méridiens horizontaux et verticaux, qui seront alignés sur les repères 0° et 90° d’un anneau gradué de type marqueur de Mendez®.
Il est possible dès à présent de s’affranchir de cette étape de marquage pré- et/ou peropératoire grâce à des solutions automatisées de repérage des axes.
Le système CALLISTO® (Zeiss) (fig. 7-94) permet l’alignement des implants toriques avec un processus peropératoire extrêmement simple réalisé essentiellement par le repérage sur l’écran de l’axe 0/180° préalablement marqué sur le patient assis, l’axe d’alignement idéal est présenté sur écran au chirurgien dans toute la phase de préalignement et d’alignement définitive par des lignes de couleurs ; le tracker très compétitif de cet appareil permet de suivre les mouvements de l’œil induits par les manœuvres chirurgicales intraoculaires, rendant l’adéquation entre l’axe cible et l’axe effectif optimale. Sa dernière évolution, qui sera prochainement commercialisée, permettra de réaliser une acquisition d’une image des vaisseaux conjonctivaux en même temps que la biométrie et permettra de bénéficier de l’intégration de l’image temps réel en direct dans le microscope opératoire.
Le système SG300 de SMI (fig. 7-95 à 7-97) permet également, après acquisition d’une image de l’œil sur un patient assis, le transfert des données par le biais d’un système de traitement de l’image projetée dans les oculaires du microscope grâce à l’adjonction d’un boîtier additionnel connectable sur la plupart des microscopes du marché.
Fig. 7-94 Présentation générale du CALLISTO® (Zeiss).
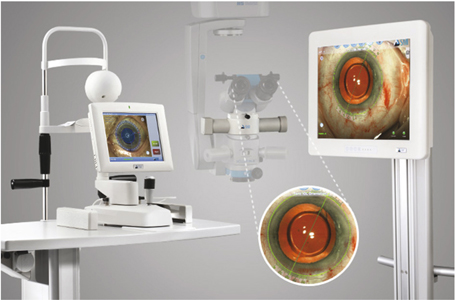
Fig. 7-95 Présentation de la plateforme SMI.
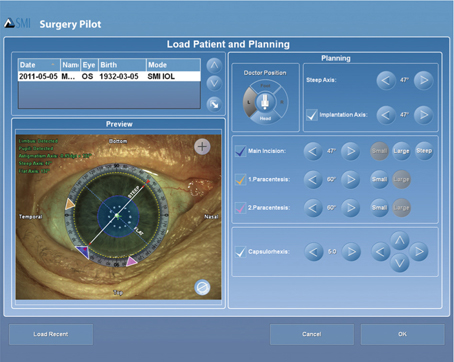
Fig. 7-96 Pilotage de la plateforme SG300 de SMI.

Fig. 7-97 Projection dans les oculaires de l’axe de positionnement de l’implant avec le SG300 de SMI.
Il nous semble essentiel, pour garantir la précision du résultat, de réaliser l’incision la moins astigmatogène possible et dont la quantité d’astigmatisme induit sera la plus reproductible possible. La micro-incision (incision de 2,2 mm et moins) réalisée en temporale permet de se rapprocher d’un astigmatisme induit très faible et reproductible [10].
Il est important, pour éviter tout effet de tilt préjudiciable en cas d’implant multifocal et pour éviter une rotation de l’implant torique, de réaliser un capsulorhexis rond, centré et de taille légèrement inférieure à celle de l’optique (fig. 7-98).
Fig. 7-98 Capsulorhexis rond et centré.
Afin de garantir la stabilité rotationnelle de l’implant, il sera nécessaire de nettoyer le produit viscoélastique sous l’implant (fig. 7-99) et de favoriser l’adhérence rapide de la capsule postérieure à la face postérieure de l’implant par la réalisation d’une pression douce sur l’optique.
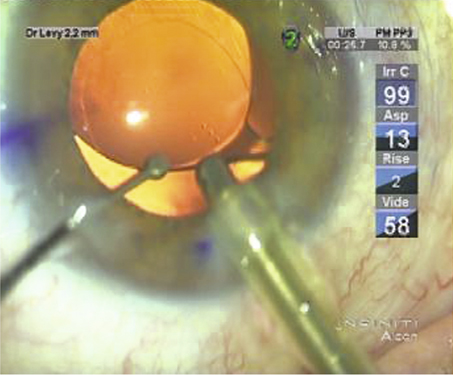
Fig. 7-99 Lavage bimanuel du produit viscoélastique en arrière de l’implant avant le positionnement définitif de l’implant.
L’ultime étape consiste en l’alignement définitif des repères sur l’implant matérialisant l’axe du cylindre sur l’implant avec les marques placées sur la cornée en début de chirurgie (fig. 7-100) ou son positionnement sur l’axe directement visualisé sur les plateformes de repérages automatisées.
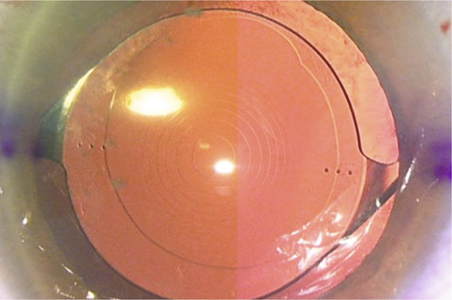
Fig. 7-100 Alignement du repère matérialisant le tore positif de l’implant sur la marque cornéenne.
Les implants multifocaux peuvent s’envisager dans le cadre d’une chirurgie de cataracte ou d’une chirurgie de presbytie par ablation du cristallin clair. Bien évidemment, tous les critères de sécurité en rapport avec la pose d’un implant torique et d’un implant multifocal doivent être respectés.
Sont candidats les patients présentant en préopératoire un astigmatisme cornéen et non subjectif, à condition qu’il s’agisse d’un astigmatisme régulier et symétrique et à condition que les mesures de cet astigmatisme soient reproductibles au cours des différents examens réalisés.
Seuls les modèles monofocaux toriques sont autorisés dans certains astigmatismes irréguliers (kératocône, greffe), si la mesure de la réfraction est accessible.
Il faut éviter les professions nécessitant une vision nocturne de grande qualité et les profils psychologiques hyperexigeants, revendicatifs, psychorigides.
Il ne faut pas envisager d’implant multifocal en cas de pathologie oculaire associée : glaucome mal contrôlé, rétinopathie diabétique, maculopathie…
En matière d’ablation de cristallin clair, les règles de sécurité communément admises sont : chez l’hypermétrope, de n’opérer qu’à partir de cinquante à cinquante-cinq ans, sauf cas exceptionnel ; chez le myope, du fait des risques accrus de décollement de rétine, de ne pas opérer avant soixante à soixante-cinq ans, à condition que le décollement postérieur du vitré soit réalisé et avec l’aval d’un rétinologue et la pratique de sécurité d’un OCT vérifiant l’intégrité maculaire. Enfin, l’indication chez l’emmétrope ne fait en rien l’unanimité et mérite d’être évaluée au cas par cas.
Il ne semble pas indispensable d’utiliser un implant multifocal torique et ce d’autant plus que, pour des valeurs aussi faibles d’astigmatisme cornéen, la reproductibilité au niveau de l’évaluation des axes est souvent assez faible. Dans ce cas peut être privilégiée, lorsque cela est possible, l’incision sur le méridien cambré, ayant pour intérêt de ne pas majorer voire d’éventuellement de diminuer l’astigmatisme cornéen préexistant.
En premier lieu, notons qu’une telle valeur de cylindre s’il est inverse ou oblique peut être bénéfique pour la vision de près du patient, en lui apportant quelque profondeur de champ, et pourra être avantageusement préservée – en particulier chez un patient myope. Ce n’est que lorsqu’il pénalise la vision en se plaçant dans un axe direct qu’il conviendra de le corriger.
Cependant, cette notion se vérifie surtout avec les monofocaux toriques, alors qu’un astigmatisme, quelle que soit sa forme, est délétère pour un implant multifocal.
Il faut dans ce cas essayer de réduire l’astigmatisme cornéen préopératoire. Le choix peut se faire alors entre les techniques d’incisions relaxantes cornéennes et les implants toriques.
Compte tenu du manque de prédictibilité des incisions relaxantes, alors qu’il est requis, face à cette faible amétropie, de viser une correction optimale, et compte tenu du fait que nous disposons d’implants multifocaux toriques corrigeant de tels degrés d’astigmatisme, il semble légitime de privilégier cette dernière option. Ce choix permettra d’améliorer le résultat réfractif et visuel sans avoir à modifier la technique chirurgicale de micro-incision cornéenne temporale.
Dans ce cas, l’indication d’un implant multifocal torique peut être systématiquement posée dans le but d’obtenir d’emblée, en une seule chirurgie, le meilleur résultat possible, qui plus est stable dans le temps et peu générateur d’aberrations optiques d’ordre élevé.
Si les implants multifocaux diffèrent selon leur principe optique – réfractifs : efficaces en vision de loin et intermédiaire, moins en vision de près, mais indépendants de la pupille ; diffractifs : plus performants en vision de près sans dégradation majeure de la vision de loin mais dépendants de la pupille et donc de la lumière environnante –, le fait d’ajouter à leur dessin une toricité vise dans tous les cas à optimiser les performances réfractives et, par là même, visuelles sans modifier les caractéristiques propres de la catégorie à laquelle ils appartiennent.
Les implants multifocaux toriques ayant été introduits récemment sur le marché, la littérature internationale n’est pas encore riche en résultats.
Nous disposons de deux communications orales : la première à l’ARVO 2010 [18], montrant une qualité de vision explorée par la MTF identique avec le ReSTOR® IQ + 3 et le ReSTOR® Toric SND1T [18] ; la seconde à la SAFIR 2011 [11], montrant des résultats comparables pour le ReSTOR® Toric et l’AT-LISA® 909M en vision de loin, en vision de près (avec une distance de 33 cm pour l’implant AT-LISA® et 40 cm pour l’implant ReSTOR® Toric), une meilleure vision intermédiaire pour l’implant ReSTOR® Toric et une indépendance globale au port d’une correction optique postopératoire identique pour les deux implants [11].
Deux articles récents ont montré avec l’implant AT-LISA® 909M une excellente récupération de la vision de loin et de près sans correction et une grande prédictibilité dans la correction de l’astigmatisme modéré à fort [1], avec des résultats encore plus prédictibles avec des incisions de taille inférieure à 2,2 mm [13].
Une communication orale de B. Cochener en 2011 à l’ASCRS a montré, pour une implantation bilatérale chez quatorze patients avec un astigmatisme moyen de 3,1 D (1 à 6,5 D), une indépendance totale au port de correction optique de loin et de près chez tous les patients, une indépendance partielle dans la vision intermédiaire, une bonne qualité de vision et une rotation moyenne de l’implant inférieure à 7° [2].
Un article récent évaluant l’implant M-flex® T sur trente-cinq yeux de vingt-cinq patients, a montré une réduction significative de l’astigmatisme et une augmentation significative de l’indépendance postopératoire au port d’une correction optique. La rotation postopératoire semble un peu plus importante qu’avec les autres implants, avec 91 % des patients à ± 10°, et une variation certaine dans la correction de l’astigmatisme avec persistance d’un astigmatisme résiduel significatif dans certains cas, surtout chez les patients ayant un astigmatisme préopératoire de 4 D ou plus [5].
Les résultats publiés par P.-J. Pisella (Ocular Surgery News SuperSite, février 2011) sur treize yeux de huit patients ont montré une bonne prédictibilité réfractive avec, notamment, une réduction significative de l’astigmatisme moyen de 1,89 D en préopératoire à 0,47 D en postopératoire, une rotation moyenne de 4,4° ; ceux publiés à l’ASCRS 2011 par les mêmes auteurs ont montré une bonne prédictibilité et une stabilité réfractive à six mois ainsi qu’une bonne acuité visuelle en vision de près et en vision intermédiaire [14].
La prévalence de l’astigmatisme est difficile à apprécier avec précision, étant dépendante de nombreux facteurs, notamment ethniques et liés à l’âge. Des études récentes montrent néanmoins une incidence élevée dans la population, justifiant ainsi l’usage régulier d’implants toriques. Sur une population étudiée de 11 624 patients âgés de huit à soixante-dix ans, 47,4 % présentaient un astigmatisme supérieur ou égal à 0,75 D sur un œil au moins et 24,1 % sur les deux yeux [23]. De plus, deux études récentes montrent la présence d’un astigmatisme supérieur ou égal à 1 D au moment de la chirurgie du cristallin chez près de 30 % des patients opérés [7].
La gestion de l’astigmatisme est un point essentiel dans le cadre d’une implantation multifocale pour laquelle une précision absolue dans le résultat sphérocylindrique postopératoire est impérative. L’impact de la persistance d’un astigmatisme résiduel sur l’acuité visuelle non corrigée est bien connu en vision de loin comme de près, en particulier lorsqu’il est supérieur ou égal à 1 D [8, 22].
Dans cette approche, la prise en compte d’astigmatismes même modérés (0,50 D à 1,25 D) par implants toriques s’avère tout à fait intéressante. La correction de faibles astigmatismes par la pose d’un implant torique améliore l’acuité visuelle non corrigée d’une à deux lignes sur l’échelle logMAR [6]. Ainsi, dans la perspective de la pose d’un implant multifocal, les techniques de micro-incision permettent d’envisager la gestion de tout astigmatisme supérieur ou égal à 0,50 D, d’où l’intérêt de recourir chaque fois que nécessaire à des implants de faible toricité.
Plus l’astigmatisme sera de faible amplitude, plus la reproductibilité des mesures kératométriques sera mauvaise. Il faut se méfier de tous les problèmes de surface oculaire, notamment ceux en relation avec un œil sec, qui peuvent entraîner un biais dans l’évaluation préopératoire de l’astigmatisme cornéen.
Le cumul des erreurs en cas de marquage et d’alignement manuel non assisté peut s’avérer préjudiciable. Nuijts a récemment montré [15] que, si on compare les différentes étapes du marquage (marquage sur patient assis et marquage avec anneau de Mendez sur patient couché) et de l’alignement manuel de l’implant comparé à l’utilisation de l’appareil automatisé SG300 de SMI, l’erreur cumulée moyenne est de 4,9° ± 2,1° en mesure manuelle avec un maximum de 10° possible pour chaque étape – une erreur de 10° correspond à une diminution d’efficacité d’environ 30 % de l’implant torique.
Les premiers implants toriques, dans les années quatre-vingt-dix, ont souvent montré une mauvaise stabilité du fait de l’inadaptation entre la taille de l’implant et celle du sac, responsable de rotations postopératoires pouvant atteindre 25° [17]. L’utilisation de nos jours de plateformes très stables (matériaux et géométries), telles que celles précédemment décrites, permet de minimiser la rotation postopératoire de la plupart des implants utilisés. De nombreuses études ont été publiées, avec des résultats qui montrent une rotation moyenne très faible allant de moins de 1° [21] jusqu’à moins de 4°, aussi bien sur des plateformes acryliques hydrophobes qu’hydrophiles [3, 5, 12].
La réalisation d’un capsulorhexis centré et de taille adaptée à celle de l’optique ainsi que l’aspiration du produit viscoélastique sous l’optique sont des étapes importantes pour minimiser cette rotation.
Le futur des aides à l’alignement sera l’utilisation d’une solution globale intégrant une biométrie avec acquisition simultanée d’images des vaisseaux conjonctivaux principaux, transfert des données du biomètre vers un ordinateur qui collecte les données biométriques et les calculs d’implants.
Les données d’informations pertinentes concernant les axes de références sont alors projetées dans le binoculaire du microscope (cf. fig. 7-97 et fig. 7-101), visibles directement par le chirurgien, éventuellement en trois dimensions. Les différentes données peuvent être personnalisées, en taille, couleur et positionnement, le chirurgien pouvant choisir d’avoir ses données sur son œil dominant ou sur son œil dominé, celles-ci apparaissant ou disparaissant à volonté, permettant la réalisation sans perturbation visuelle de la chirurgie.
Pour exemple, l’évolution de la plateforme Zeiss « Solution globale » propose désormais une projection dans le microscope du marquage manuel du méridien horizontal (commercialisée depuis octobre 2011) et cette solution globale intégrant la photographie de l’iris et la projection dans le microscope est rentrée en phase d’essai clinique en automne 2011 et doit être tout prochainement commercialisée.
L’Orange® (Wavetec Vision) est un aberromètre peropératoire qui permet de mesurer la réfraction peropératoire fondée sur la mesure du front d’onde et de recommander l’axe idéal du placement de l’implant torique. Il pourra être utilisé en association avec les systèmes automatisés de repérage des axes, de façon à éviter l’imprécision relative liée au marquage manuel.
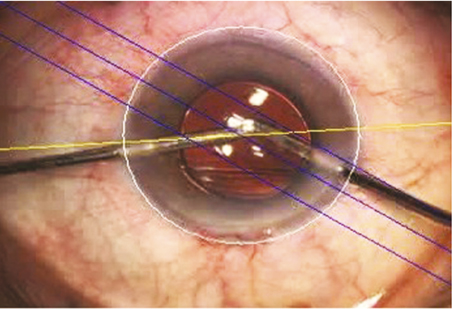
Fig. 7-101 Projection de l’axe d’implantation dans les oculaires du microscope avec le système Zeiss.
L’utilisation des lasers femtoseconde dans la chirurgie de la cataracte permettra certainement d’améliorer les résultats après implants multifocaux toriques, du fait de la meilleure qualité et de la meilleure reproductibilité des capsulorhexis, notamment en ce qui concerne leur taille et leur centrage, ainsi qu’en assurant une incision parfaitement localisée et non astigmatogène.
L’avenir permettra certainement d’utiliser les propriétés des implants photoajustables (cf. chapitre 9), afin d’obtenir encore plus de précision dans le cadre de la multifocalité torique.


[1] Alió J.L., Pinero D.P., Tomas J. et al. Vector analysis of astigmatic changes after cataract surgery with implantation of a new toric multifocal intraocular lens J Cataract Refract Surg, 2011 ; 37 : 1217-29.
[2] Bathany D., Cochener B. Predictability and stability of multifocal diffractive toric IOLs for correction of presbyopia combined with astigmatism. Communication orale. ASCRS 2011, San Diego.
[3] Chang D.F. Comparative rotational stability of single-piece open-loop acrylic and plate-haptic silicone toric intraocular lenses J Cataract Refract Surg, 2008 ; 34 : 1842-7.
[4] Chang D.F. Early rotational stability of the longer Staar toric intraocular lens; fifty consecutive cases. J Cataract Refract Surg, 2003 ; 29 : 935-40.
[5] Entabi M., Harman F., Lee N. et al. Injectable 1-Piece hydrophilic acrylic toric intraocular lens for cataract surgery: Efficacity and stability. J Cataract Refract Surg, 2011 ; 37 : 235-40.
[6] Ernest P., Potvin R. Effects of preoperative corneal astigmatism orientation on results with a low-cylinder-power toric intraocular lens. J Cataract Refract Surg, 2011 ; 37 : 727-32.
[7] Ferrer-Blasco T., Montes-Mico R., Peixoto-de-Matos S. et al. Prevalence of corneal astigmatism before cataract surgery. J Cataract Refract Surg, 2009 ; 35 : 70-75.
[8] Hayashi K., Manabe S., Yoshida M. et al. Effect of astigmatism on visual acuity with a diffractive multifocal intraocular lens. J Cataract Refract Surg, 2010 ; 36 : 1323-9.
[9] Hoffmann P.C., Hütz W. Analysis of biometry and prevalence data for corneal astigmatism in 23239 eyes. J Cataract Refract Surg, 2010 ; 36 : 1479-85.
[10] Kohnen T., Dick B., Jacobi K.W. Comparison of the induced astigmatism after temporal clear corneal tunnel incisions of different sizes. J Cataract Refract Surg, 1995 ; 21 : 417-24.
[11] Levy P. Multifocalité et astigmatisme : Évaluation des implants Acrilisa Torique et Restor torique. Communication, SAFIR 2011.
[12] Mendicute J., Irigoyen C., Aramberri J. et al. Foldable toric intraocular lens for astigmatism correction in cataract patients. J Cataract Refract Surg, 2008 ; 34 : 601-7.
[13] Mojzis P., Pinero D.P., Studeny P. et al. Comparative analysis of clinical outcomes obtained with a new diffractive multifocal toric intraocular lens implanted through two types of corneal incision. J Refract Surg, 2011 ; 27 : 648-57.
[14] Nochez Y., Debois A., Salah S., Pisella P.-J. Visual and refractive outcomes following implantation of innovative Premium multifocal toric IOL after cataract surgery. Communication orale. ASCRS 2011, San Diego.
[15] Visser N., Nuijts R.M. SG300 for Toric Lens Implantation. CRSToday Europe, april 2011.
[16] Pisella P.-J. Communication orale. ESCRS 2011, Istanbul.
[17] Ruhswurm I., Scholz U., Zehetmayer M. et al. Astigmatism correction with a foldable toric intraocular lens in cataract patients. J Cataract Refract Surg, 2000 ; 26 : 1022-7.
[18] Schwiegerling J. Image quality analysis for an aspheric toric apodized diffractive intraocular lens using modulation transfer function testing. Communication orale. ARVO 2011.
[19] Shah G.D., Praveen M.R., Vasavada A.R. et al. Software-based assessment of postoperative rotation of toric intraocular lens. J Cataract Refract Surg, 2009 ; 35 : 413-8.
[21] Wehner W. Microincision intraocular lens with plate haptic design. Evaluation of rotational stability and centering of a microincision intraocular lens with plate haptic design in 12-19 months of follow-up. Ophthalmologe, 2007 ; 104 : 393-4.
[22] Weinand F., Jung A., Stein A. et al. Rotational stability of a single-piece hydrophobic acrylic intraocular lens: new method for high-precision rotation control. J Cataract Refract Surg, 2007 ; 33 : 800-3.
[23] Wolffsohn J.S., Bhogal G., Shah S. Effect of uncorrected astigmatism on vision. J Cataract Refract Surg, 2011 ; 37 : 454-60.
[24] Young G., Sulley A., Hunt C. Prevalence of astigmatism in relation to soft contact lens fitting. Eye Contact Lens, 2011 ; 37 : 20-5.
L. Lesueur
Lors d’une chirurgie de cataracte, l’ablation du cristallin entraîne la perte de l’accommodation quel que soit l’âge du patient. Depuis la fin des années quatre-vingt-dix, l’implantation monofocale dans la chirurgie de la cataracte chez l’enfant est pratiquée selon un consensus bien établi. Il faut réaliser qu’en ophtalmopédiatrie, les progrès technologiques dont bénéficie la chirurgie chez l’adulte sont utilisés après un recul relativement conséquent, nécessaire à la sécurité et la fiabilité dans le temps chez l’enfant. Si les implants multifocaux de première génération ont été utilisés chez l’adulte depuis les années quatre-vingt-dix, les premiers cas chez l’enfant ont été publiés dans les années deux mille. En effet, n’est-il pas intéressant d’utiliser les implants multifocaux chez l’enfant atteint de cataracte dans le but de corriger la presbytie induite par la chirurgie et de supprimer le port de lunettes avec verre bifocal ou verre progressif ? Les implants multifocaux de dernière génération apportent un réel progrès chez l’adulte et commencent à être utilisés chez l’enfant, comme le montrent les récentes publications. Mais les indications et les techniques chirurgicales sont plus complexes chez l’enfant : en fonction de l’atteinte unilatérale ou bilatérale, en fonction du biomatériau, en fonction de l’âge et de la stabilité réfractive lors de la chirurgie. C’est toute une problématique qui est discutée à l’heure actuelle.
En premier lieu, l’examen complet orthoptique et oculaire avec analyse de la réfraction, du segment antérieur (cornée, angle iridocornéen, iris), du type de cataracte, de la tension oculaire et du fond d’œil permettra d’éliminer les contre-indications à l’implantation multifocale.
Les principaux critères d’exclusion sont les anomalies cornéennes, les amétropies fortes myopiques et cylindriques, les anisométropies fortes, les glaucomes, les microphtalmies, les déformations pupillaires, les rétinopathies, les anomalies neuro-ophtalmologiques et les inflammations oculaires.
De façon idéale, la mesure de la longueur axiale sera réalisée avec un biomètre non-contact afin d’optimiser la précision millimétrique. Les kératométries seront données soit par le réfractomètre automatique, soit par le biomètre non-contact, soit par le topographe. Une topographie d’élévation permettra d’analyser les aberrations cornéennes, les astigmatismes et d’éliminer les contre-indications sur des cornées pathologiques. La réfraction sous cycloplégique sera systématique sur les deux yeux. En pratique, ces examens seront réalisés sans problème chez l’enfant dès l’âge de six ans. Chez les plus jeunes, un examen sous anesthésie générale permettra de réaliser une biométrie aux ultrasons, la réfraction et les kératométries seront réalisés avec un réfractomètre automatique portable et l’examen oculaire avec le microscope opératoire et la biomicroscopie indirecte.
Toutes ces données permettront le calcul de la puissance de l’implant. La formule SRK/T sera le plus souvent utilisée sans modifications après l’âge de six ans (car la croissance axiale est déjà bien avancée) en gardant une légère hypermétropie de 0,50 D à 1 D, ou les formule de Holladay pour les hypermétropes. Dans les plus jeunes âges, il faudra réaliser une sous-correction du calcul adaptée en fonction de l’âge de l’enfant lors de la chirurgie, afin de prévenir la myopisation liée à la croissance de la longueur axiale [7].
En ophtalmopédiatrie, le biomatériau de choix est à ce jour, pour son recul, l’acrylique hydrophobe à bords carrés pour lutter contre l’opacification capsulaire postérieure [3]. Le design trois-pièces ou monobloc est une question d’habitude chirurgicale, l’important étant de préférer un implant multifocal avec angulation surtout si on conserve la capsule postérieure en peropératoire.
L’optique de 6 mm sera diffractive multifocale et torique (si l’astigmatisme préopératoire est supérieur à 1 D) (fig. 7-102 et 7-103). S’il n’y a pas de discussion sur le filtre UV, le filtre à lumière bleue n’est pas encore unanime en utilisation chez l’enfant, en raison des effets secondaires sur la modification de perception des couleurs et ses conséquences neurologiques [2].
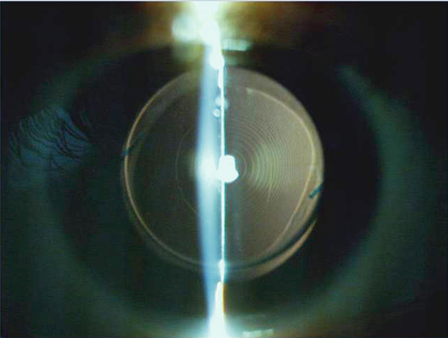
Fig. 7-102 Implant Tecnis® Multifocal (AMO), trois-pièces.
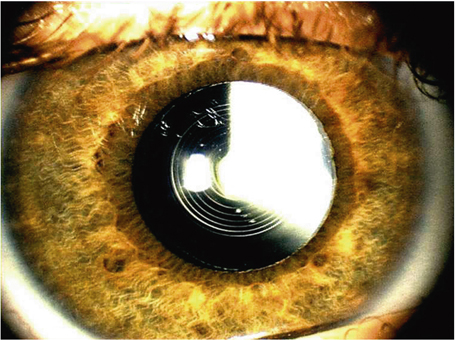
Fig. 7-103 Implant AcrySof® ReSTOR® (Alcon), monobloc.
Cette technique courante chez l’adulte (phacoémulsification coaxiale) est applicable chez l’enfant en moyenne après l’âge de six ans, sauf cas particuliers. L’important est de juger l’enfant capable de supporter une capsulotomie au laser YAG éventuellement dans l’année qui suit la chirurgie. Classiquement, l’incision cornéenne tunnélisée sera de 2,2 ou 2,4 mm. La réalisation du capsulorhexis antérieur de 5,5 mm sera plus délicate chez l’enfant car la capsule antérieure est très élastique et ce geste nécessite un apprentissage certain. Il sera plus précis en utilisant les visqueux de haut poids moléculaire. Le plus souvent, après hydrodissection et hydrodélinéation, les ultrasons seront peu utilisés car la majorité des cataractes chez l’enfant sont molles et l’exérèse du cristallin sera réalisée par hydroaspiration. Il est très important de ne laisser aucune masse résiduelle et de faire un pelage intercapsulaire très soigneux pour limiter la prolifération des perles d’Elschnig secondaires, qui nécessiteront une seconde intervention.
Ensuite, l’implant multifocal sera injecté et placé entre les deux feuillets capsulaires antérieur et postérieur, parfaitement centré. Après l’aspiration du visqueux, la pupille sera mise en myosis et l’incision sera suturée si elle n’est pas jugée étanche — la cornée est élastique chez l’enfant.
De règle, le traitement postopératoire comprendra collyres antibiotiques, anti-inflammatoires stéroïdiens et non stéroïdiens pendant trois semaines et une corticothérapie par voie générale de 1 mg/kg par jour pendant quinze jours associé à une antibiothérapie per os pendant dix jours.
Enfin, si nécessaire, le traitement de l’amblyopie sera commencé par occlusion adaptée ainsi que la correction optique résiduelle monofocale si besoin.
Chez les enfants plus jeunes en dessous de l’âge de six ans, pour lesquels un laser YAG secondaire est inenvisageable, il sera nécessaire de compléter la phacoémulsification classique décrite ci-dessus par la réalisation d’un capsulorhexis postérieur de 5 mm associée à une vitrectomie antérieure centrale au vitréotome en prenant soin de ne pas hydrater le vitré.
L’implantation est dans ce cas plus délicate, afin de bien positionner l’implant multifocal entre les deux feuillets capsulaires. Il sera nécessaire de vérifier l’absence de vitré en chambre antérieure en fin d’intervention (vidéo 7-23).
Les suites opératoires ainsi que le traitement local et général sont identiques.
Dans les cas de cataractes unilatérales précoces ou tardives et de cataractes bilatérales tardives (après six ans), l’implantation primaire de l’implant multifocal est systématique. Mais une implantation secondaire doit être discutée dans les cas de cataractes bilatérales précoces qui peuvent supporter une correction optique d’aphake sur les deux yeux et développer leur vision binoculaire. En effet, le calcul d’implant sera plus juste après l’âge de six ans et les résultats réfractifs n’en seront que meilleurs dans le futur. En ce sens, il faudra laisser en place un support capsulaire afin de poser un implant multifocal trois-pièces dans le sulcus avant l’entrée en école primaire.
Il existe à ce jour peu d’études chez l’enfant.
Jacobi et al. ont montré en 2001, avec au moins un an de suivi sur une série de trente-cinq yeux chez vingt-six enfants (âgés de deux à quatorze ans), les résultats des yeux implantés avec l’implant multifocal SA40N en silicone [4] :
– augmentation significative (p = 0,001) de la meilleure acuité visuelle de loin corrigée avec, dans 71 % des yeux, une acuité visuelle à 20/40 (0,5) et, dans 31 % des cas, une acuité visuelle de 20/25 (0,8) ou plus ;
– indépendance aux lunettes modérée, avec 22 % des enfants devant porter une correction optique en vision de près, 44 % en vision de loin et 33 % des enfants ne portant plus de correction optique ;
– existence d’une vision stéréoscopique augmentée de façon significative (p = 0,01) ;
– seize yeux (46 %) qui ont présenté une opacification dans l’aire pupillaire, dont dix ont été réopérés ; une ablation de membrane fibrineuse a été réalisée sur quatre yeux et un recentrage chirurgical de l’implant a été réalisé sur six yeux.
Cristobal et al., en 2010, ont publié les résultats de cinq patients âgés de quatre à six ans opérés de cataracte unilatérale avec mise en place d’un implant multifocal diffractif AcrySof® ReSTOR® SND3 acrylique hydrophobe avec un suivi de vingt et un mois [1]. Les résultats visuels ont retrouvé en moyenne une acuité visuelle de loin non corrigée de 0,45 logMAR (0,3) et une meilleure acuité visuelle de loin corrigée de 0,3 logMAR (0,5), avec 20/32 (0,6) chez trois enfants, 20/50 (0,4) chez un enfant et 20/63 (0,3) chez un enfant. La meilleure acuité visuelle de près corrigée était de 0,1 log MAR avec Jaeger 1 pour deux yeux, Jaeger 2 pour un œil, Jaeger 3 pour un œil et Jaeger 4 pour un œil. La vision stéréoscopique avec fusion (TNO test) était présente chez quatre patients. Aucun enfant ne s’est plaint de halos et/ou d’éblouissement. Aucune réopération n’a été nécessaire et aucun décentrement n’a été observé.
Enfin, nous avons démarré une étude multicentrique au sein de la SAFIR, publiée à l’ESCRS 2010 (Paris), incluant à ce jour quarante et un yeux de trente-cinq enfants âges de onze mois à quinze ans opérés de cataracte congénitale ou iatrogénique principalement unilatérale. Les implants multifocaux en acrylique hydrophobe utilisés ont été les AcrySof® ReSTOR® SN60AD3, SN6AD3, SN6AD1, ReSTOR® Torique, AMO Tecnis® ZMA00, AMO NXG1 et Acri.LISA® 909M et torique. Une vitrectomie antérieure centrale avec capsulorhexis postérieur a été réalisée systématiquement avant l’âge de cinq ou six ans pour prévenir la cataracte secondaire.
Nos résultats montrent à ce jour, avec un suivi moyen postopératoire de douze mois, une augmentation significative (p < 0,5) de la meilleure acuité visuelle de loin corrigée (0,31 logMAR ; 0,5) et de la meilleure acuité visuelle de loin non corrigée (0,43 logMAR ; 0,4) postopératoires (0,67 logMAR ; 0,2 en préopératoire) et également une augmentation significative (p < 0,5) de la vision de près corrigée (0,29 logMAR ; Jaeger 5) et non corrigée (0,46 logMAR ; Jaeger 7) par rapport au préopératoire (0,61 logMAR ; Jaeger 9) (fig. 7-104). L’indépendance au port de lunettes a été notée dans 48 % des cas tous groupes confondus (fig. 7-105).
Si on compare les résultats en fonction de la technique chirurgicale (phacoémulsification simple versus phacoémulsification et vitrectomie), ce qui correspond à deux tranches d’âge moyen différentes lors de la chirurgie (huit ans et demi versus quatre ans et demi), nous trouvons :
– de meilleurs résultats visuels dans le groupe « phacoémulsification simple » des enfants plus âgés (moins amblyopes en préopératoire) (fig. 7-104) ;
– une indépendance aux lunettes dans 70 % des cas dans le groupe « phacoémulsification simple » contre 21 % dans le groupe « phacoémulsification et vitrectomie » (les plus jeunes portent une correction optique calculée en fonction de la myopisation secondaire et pour rééduquer l’amblyopie) (fig. 7-105) ;
– une vision binoculaire plus fréquente (50 % des cas) (fig. 7-105) dans le groupe « phacoémulsification et vitrectomie » contre 37 % des cas dans le groupe « phacoémulsification simple » (probablement en rapport avec l’opacification capsulaire postérieure secondaire).
Par ailleurs, nous n’avons pas noté de différences significatives dans ces résultats en fonction du type d’implant multifocal posé.
Enfin, une capsulotomie au laser YAG (fig. 7-106) a été réalisée dans 33 % des cas dans le groupe « phacoémulsification simple » et dans aucun cas dans le groupe « phacoémulsification et vitrectomie ». Néanmoins deux réinterventions pour aspiration de perles d’Elschnig et membrane inflammatoire ont été réalisées dans le groupe « phacoémulsification et vitrectomie ».
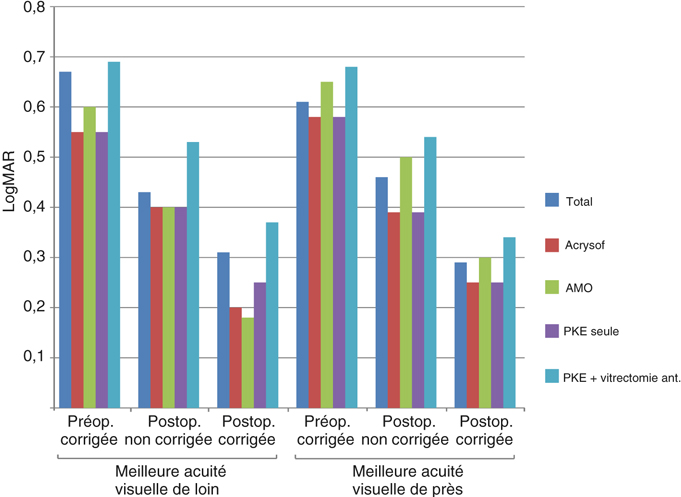
Fig. 7-104 Étude SAFIR : résultats visuels.
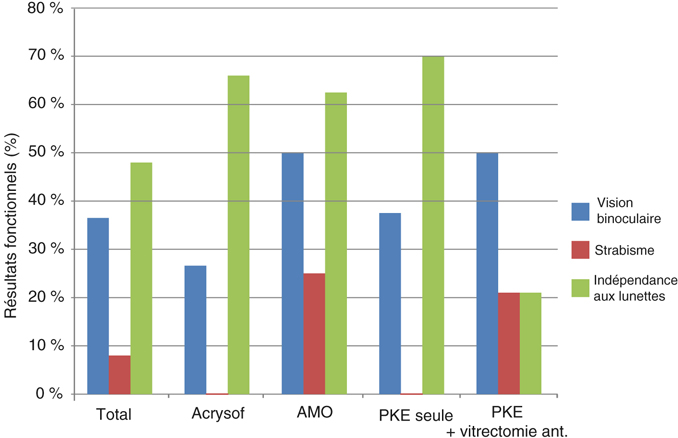
Fig. 7-105 Étude SAFIR : résultats fonctionnels.
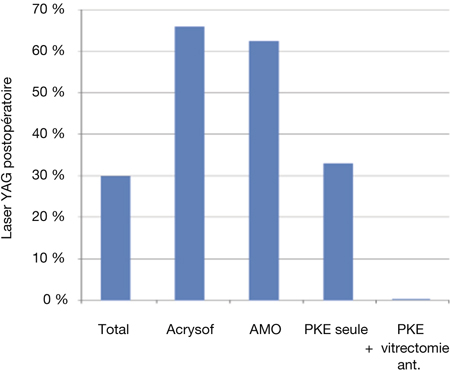
Fig. 7-106 Étude SAFIR : laser YAG postopératoire.
Nous voyons à travers ces résultats que la multifocalité chez l’enfant permet d’éviter le port d’une correction optique additionnelle avec sécurité chez les enfants opérés tardivement de leur cataracte avec, dans 70 % des cas, une indépendance aux lunettes, principalement dans les cas de cataracte unilatérale (ayant bénéficié d’une phacoexcérèse simple).
Les limites concernent les enfants opérés au plus jeune âge et en bilatéral en raison de l’évolution réfractive qui est encore difficile à prévoir à ce jour à travers les études [5] – néanmoins, une chirurgie réfractive monofocale sera possible lors de la stabilisation réfractive à l’âge adulte. Par ailleurs, les effets secondaires des implants multifocaux entraînent une baisse de sensibilité aux contrastes [6] et, pour les implants multifocaux avec filtre en lumière bleue, des perturbations de la perception des couleurs et du rythme nycthéméral.
Les études à long terme préciseront les effets positifs et négatifs des implants multifocaux de dernière génération chez l’enfant, afin d’en préciser avec sécurité les indications.

[1] Cristobal J.A., Remon L., Del Buey M.A. et al. Multifocal intraocular lenses for unilateral cataract in children. J Cataract Refract Surg, 2010 ; 36 : 2035-40.
[2] Haiwei Wang M.A., Jun Wang M.D., Wenying Fan M.A. et al. Comparison of photochromic, yellow, and clear intraocular lenses in human and mesopic lighting conditions. J Cataract Refract Surg, 2010 ; 36 : 2080-6.
[3] Hug D. Intraocular lens use in challenging pediatric cases. Curr opin Ophthalmol, 2010 ; 21 : 345-9.
[4] Jacobi P.C., Dietlein T.S., Konen W. Multifocal intraocular lens implantation in pediatric cataract surgery. Ophtalmology, 2001 ; 108 : 1375-80.
[5] Lu Y., Ji Y.H., Luo Y. et al. Visual results and complications of primary intraocular lens implantation in infants aged 6 to 12 months. Graefes Arch Clin Exp Ophthalmol, 2010 ; 248 : 681-6.
[6] Vingolo E.M., Grenga P., Lacobelli L., Grenga R. Visual acuity and contrast sensitivity: AcrySof ReSTOR apodized diffractive versus AcrySof SA60AT monofocal intraocular lenses. J Cataract Refract Surg, 2007 ; 33 : 1244-7.
[7] Wilson Jr M.E., Trivedi R.H. Eye growth after pediatric cataract surgery. Am J Ophthalmol, 2004 ; 138 : 1039-40.

