P.-J. Pisella
Le principe de la monovision est assez simple, proposant une méthode de correction de la presbytie par la correction d’un œil pour la vision de loin et de l’autre pour la vision de près. Cette méthode peut être appliquée à la correction par lentilles de contact ou par chirurgie réfractive, cornéenne ou implantatoire.
La monovision représente une méthode couramment utilisée et bien ressentie par le sujet dans la majorité des cas, en particulier chez les patients myopes. Son succès peut cependant être limité par trois principaux facteurs : l’altération de la vision stéréoscopique, la dominance oculaire et l’obtention d’une bonne vision intermédiaire.
Sur le plan pratique, il est communément admis que la correction optique sera adaptée pour la vision de loin sur l’œil dominant quel que soit le mode de correction, par lentilles de contact, chirurgie cornéenne photoablative ou chez le pseudophake[7, 20, 27].
La notion de dominance oculaire, nécessaire dans la recherche du succès de la monovision, a fait l’objet depuis plus de cinquante ans d’expériences et de recherches diverses tant elle semble difficile à caractériser de façon uniforme. Ainsi, depuis la première expérience datant de 1949 où le sujet devait viser un objet en pointant son index pendant que l’examinateur vérifiait quel œil était prioritairement sélectionné, d’autres méthodes furent successivement appliquées[1, 5]. Walls, en 1951, estima que la dominance visée n’était en vérité pas une dominance oculaire mais le reflet de la latéralité de la dominance directionnelle dans la vision monoculaire [25]. En réalité, il n’y aurait pas une dominance oculaire simple et unique mais plusieurs composantes, notamment une composante motrice — correspondant à la dominance de visée — et une composante sensorielle (ou composante directionnelle) fondée sur la rivalité rétinienne [19]. Pour d’autres auteurs, la dominance de visée serait à la fois composante de la dominance sensorielle et la dominance motrice ; ce qui pourrait se résumer de façon un peu simpliste : « La dominance de visée existe quand la dominance motrice rencontre la dominance sensorielle. » Ainsi, la dominance de visée est celle qui nécessite l’attention visuelle d’une seule fovéa, résultant non seulement de considérations motrices (saccades plus courtes ou plus rapides pour l’œil dominant) mais aussi sensorielles lorsque les deux yeux sont mis en situation de rivalité binoculaire, rompant la vision bifovéolaire.
L’œil dominant en visée est celui capable de réprimer son image physiologique diplopante, ce qui suggère bien l’existence d’une forme sensorielle de dominance oculaire. En fait, la dominance oculaire devient nécessaire dès lors que la visée ou le geste sont associés à la fonction visuelle : il s’agit de vaincre la rivalité rétinienne entre les deux yeux lors de certaines activités (tir à l’arc, par exemple).
Le résultat des différents tests utilisés pour caractériser la dominance oculaire peut varier lorsque le sujet regarde à des endroits différents de son champ visuel et même à différents moments. La dominance oculaire est un concept plastique, susceptible d’une grande adaptabilité [3]. Elle est également inégale d’un individu à l’autre et il semble, d’après des observations chez des sujets anisométropes soit naturellement soit induits par lentille de contact, que moins elle est marquée, meilleure est l’adaptation à la monovision.
Sur le plan pratique, aucun test de visée n’ayant pu faire la preuve de sa supériorité, ni surtout du caractère fiable et définitif de son information, le choix actuel se porte sur le test du flou préférentiel, réalisé en interposant une addition de + 1,25 D à + 1,50 D alternativement devant chacun des deux yeux et en demandant au sujet devant lequel sa vision binoculaire paraît la plus claire [15].
Les indications de la monovision sont simples et peuvent être résumées de la façon suivante : une motivation du patient à ne pas porter de lunettes en postopératoire clairement exprimée, notamment en chirurgie de la cataracte, et une non-indication d’implant multifocal, soit par le patient, soit par le chirurgien.
L’analyse de la littérature retrouve peu d’études comparant les deux choix d’implantation, la randomisation étant impossible, notamment en raison du surcoût engendré par l’implant multifocal [29]. De même, la réfraction initiale du patient ne semble pas non plus déterminante, sauf la présence d’un astigmatisme associé. Ainsi, dans une étude publiée en 2002 portant sur deux groupes de patients opérés soit de cataracte soit de cristallin clair, l’équivalent sphérique préopératoire était respectivement de + 6,0 D à – 9,5 D dans le groupe « monofocal » et + 8,0 D à – 14 D dans le groupe « multifocal » sans différence significative [7].
Le choix de la monovision par rapport à l’implantation multifocale est également fonction des activités et besoins du patient (conduite nocturne), de sa crainte éventuelle des phénomènes de halos, notamment avec les optiques diffractives bifocales, de son besoin en vision intermédiaire et bien sûr du choix économique, l’implantation monofocale en monovision étant neutre de ce point de vue. Il faut également ajouter la capacité du sujet à comprendre les explications concernant la monovision.
Le pourcentage de succès de la monovision en termes de satisfaction des patients est voisin de 80 % sur les différentes séries publiées[4, 5, 29].
En termes d’acuité visuelle binoculaire, les résultats publiés retrouvent des acuités de loin sans correction supérieures à 7/10 dans 70 % à 80 % des cas, avec 10 % à 30 % des patients ayant 10/10[7, 27]. Il faut noter dans ces séries une anisométropie moyenne entre les deux yeux voisine de 2 D, avec une tendance à la diminution : de – 2,75 D il y a une dizaine d’années à – 1,50 D dans les séries plus récentes, voire 1 D [4]. En vision de près, les acuités retrouvées sont de P2 dans 80 % des cas avec, parfois, P3 dans 10 % restants. Dans son étude comparative entre deux séries implantées en multifocale (AcrySof® ReSTOR® SN60D3, Alcon, Fort Worth, États-Unis) et en monofocale/monovision (AcrySof® SN60WF, Alcon), Zhang et al. retrouvent d’ailleurs des résultats similaires, comparables dans les deux groupes [29].
En termes d’indépendance vis-à-vis des lunettes, une amélioration très significative est retrouvée dans les deux groupes pour lire un journal, jouer aux cartes, utiliser un ordinateur et conduire.
En ce qui concerne la dominance oculaire, si, dans la majorité des études, les auteurs privilégient la vision de loin sur l’œil dominant — testé le plus souvent par la méthode de visée —, Finkelman et al. rapportent un très bon score de satisfaction (9,54 de moyenne sur une échelle de 10 avec des écarts de 8 à 10) sans test préalable de la dominance mais en visant une myopisation « faible » de l’œil prévu en vision de près (moins de 1,50 D) [4].
En fait, il semble que le pourcentage de succès de la monovision repose sur l’existence d’une dominance modérée et possiblement alternante d’un œil à l’autre ainsi que sur la capacité entre les deux yeux à supprimer l’image floue. À l’inverse, une forte dominance de visée est difficile à maintenir en monovision et peut donc être considérée comme un facteur de risque d’échec. Il semble utile de maintenir un test de visée en préopératoire moins pour déterminer le côté dominant avec certitude que pour évaluer la capacité du sujet à tolérer le flou de façon alternative [10].
De façon plus surprenante, plusieurs études retrouvent également une réduction de la vision stéréoscopique, mais le plus souvent modérée et de façon non significative[4, 27].
Enfin, lorsqu’elle est étudiée, la monovision ne semble pas atteindre la sensibilité aux contrastes [4], contrairement à l’implantation multifocale.
Les limites de la monovision découlent directement de son principe et, comme précédemment vu, de la sélection du patient et du choix réfractif final postopératoire.
Sur le plan de la performance visuelle, une bonne vision intermédiaire, devenue précieuse dans la vie actuelle, sera difficile à obtenir sans compromettre soit une bonne vision de loin soit une bonne vision de près, même si l’utilisation d’une « addition » faible (inférieure à + 2,00 D) sur l’œil destiné à la vision de près permet d’obtenir un résultat convenable.
La perte de vision stéréoscopique est également classique dans les limites de la monovision ; elle doit cependant être nuancée et est souvent proportionnelle à l’addition désirée et à la baisse d’acuité (de loin) qui en découle. Ceci a été mis en évidence aussi bien en adaptation en lentilles de contact [9] qu’en implantation pseudophake [4].
Enfin, la dominance oculaire, souvent soupçonnée dans les cas d’échec, doit être comprise et recherchée moins comme un facteur de détermination absolue — et donc de choix obligatoire d’œil dominant de loin et non dominant de près — que comme un facteur de risque d’échec si cette dominance apparaît trop marquée et non plastique. Un test de dominance de visée semble donc toujours utile en préopératoire afin de renseigner cette notion, examen idéalement confirmé par un test en lentilles de contact permettant de vérifier la tolérance potentielle de la monovision.
L’avènement des techniques d’investigation des aberrations optiques a redéfini l’« erreur réfractive » en pratique clinique. Ainsi, les aberromètres à usage clinique, après avoir accompagné l’essor de la chirurgie réfractive cornéenne, facilitent l’accès de l’ophtalmologiste à l’évaluation des aberrations d’ordre supérieur, c’est-à-dire celles qui existent dans un système optique au-delà des anomalies axiles et de l’astigmatisme régulier, tous deux qualifiés d’aberrations d’ordre inférieur.
Les aberrations d’un système optique correspondent à des déformations imprimées à un front d’onde plan qui traverse ce système.
La compréhension de ces aberrations et leur diagnostic trouvent également une application en chirurgie cristallinienne avec la notion d’optique asphérique, de qualité de vision et d’adéquation entre la cornée d’une part et le cristallin ou l’implant intraoculaire d’autre part.
Les aberrations optiques d’ordre supérieur sont relativement faibles et sont dominées par les aberrations de troisième ordre (coma verticale et horizontale, trefoil oblique et horizontal) et par l’aberration sphérique (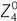 ). C’est cette dernière qui retiendra notre attention dans la mesure où elle est corrélée à la qualité de vision en particulier nocturne et, par chance, reste actuellement la seule à pouvoir être corrigée ou tout au moins modifiée par l’utilisation d’une lentille intraoculaire, en étant susceptible d’influer sur la distance de vision ainsi que sur la vision fonctionnelle.
). C’est cette dernière qui retiendra notre attention dans la mesure où elle est corrélée à la qualité de vision en particulier nocturne et, par chance, reste actuellement la seule à pouvoir être corrigée ou tout au moins modifiée par l’utilisation d’une lentille intraoculaire, en étant susceptible d’influer sur la distance de vision ainsi que sur la vision fonctionnelle.
L’aberration sphérique est une aberration de quatrième ordre engendrée par une surface optique à travers laquelle tous les rayons lumineux ne convergent pas en un seul et même point focal. Ainsi, à travers une lentille sphérique, les rayons périphériques convergent de façon plus importante que les rayons centraux ou para-axiaux (fig. 8-1). Cette focalisation en avant des rayons périphériques correspond à l’aberration sphérique. Il s’agit d’un déphasage du front d’onde, mesuré en micromètres. On comprend bien sûr le rôle capital joué par la pupille dans le système optique de l’œil humain.
Il ne faut pas confondre l’« asphéricité », qui est une variable géométrique, et l’« aberration sphérique », variable optique.
La valeur de l’aberration sphérique totale de l’œil peut être simplifiée comme étant la résultante de celle de la cornée d’une part et de l’optique interne d’autre part. Ainsi, même s’il ne s’agit pas d’une formule arithmétique parfaite, les polynômes de Zernike étant des transformés de Fourier, il est clairement démontré un mécanisme de compensation des aberrations entre cornée et cristallin pour l’astigmatisme, la coma horizontale et l’aberration sphérique [13].
La cornée humaine normale, naturellement prolate, c’est-à-dire plus bombée au centre qu’en périphérie, présente une valeur d’asphéricité dénommée facteur Q (pour quotient d’asphéricité) négative, en moyenne autour de – 0,26. Le tableau 8-I donne les valeurs du facteur Q de différents types de cornée d’après Holladay [11]. Il faut noter que la traduction de la variable géométrique (facteur Q) en aberration sphérique (coefficient de Zernike) est à l’origine de la confusion fréquente faite entre les deux (cf. chapitre 7) : si le facteur Q d’une cornée normale est Q = – 0,26, la valeur de l’aberration sphérique (AS) générée sera AS = + 0,27 µm.
Ainsi, chez un sujet jeune d’une vingtaine d’années par exemple, la valeur de l’aberration sphérique de l’œil entier est voisine de zéro, synonyme de qualité de vision optimale, en raison d’une compensation quasi totale de la valeur positive cornéenne par la valeur négative d’environ – 0,27 µm du cristallin. Cette compensation n’est cependant pas immuable au cours de la vie : la valeur de l’aberration sphérique du cristallin augmente avec le vieillissement ; c’est ce que les Anglo-Saxons dénomment le presbyopic shift[6, 8]. Ainsi, de – 0,27 µm à dix-neuf ans, l’aberration sphérique cristallinienne devient nulle vers quarante ans et positive à environ + 0,13 µm à soixante ans. La valeur de la cornée restant, elle, stable tout au long de la vie, l’aberration sphérique totale du globe oculaire s’accroît avec l’âge avec, en corollaire, une diminution de la qualité de vision. Des phénomènes de halos et de flou visuel peuvent alors apparaître ou s’accentuer, en particulier en ambiance mésopique, lorsque la pupille s’ouvre davantage.
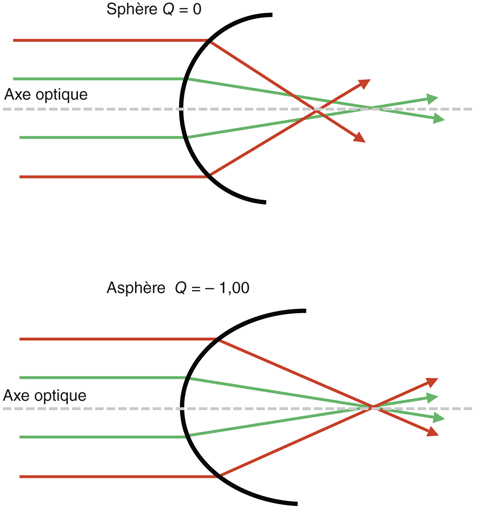
Fig. 8-1 Asphéricité et aberration sphérique.
Dans le cas d’une surface sphérique (Q = 0), il y a défocalisation des rayons périphériques en avant : c’est l’aberration sphérique, AS > 0. Dans le cas d’une surface asphérique (Q = – 1) : AS = 0.
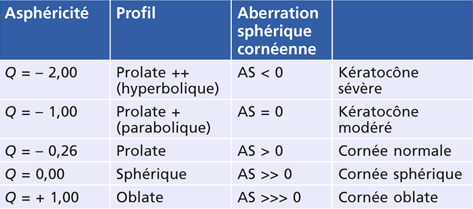
Tableau 8-I Valeurs du quotient d’asphéricité Q de la cornée humaine (d’après Holladay, 2002 [11]).
De ces différentes notions découle l’apparition d’implants intraoculaires destinés à la chirurgie de la cataracte dits asphériques, c’est-à-dire mimant la valeur négative du cristallin jeune. Le premier implant asphérique a été élaboré sur le montant moyen d’asphéricité cornéenne, soit – 0,27 µm (Tecnis® IOL, AMO, États-Unis), afin de retrouver la vision d’un œil de vingt ans lors de l’opération de la cataracte. Les études évaluant cet implant ont retrouvé une amélioration de la sensibilité aux contrastes d’environ 40 % dans des conditions photopiques et mésopiques, une diminution significative des halos et même une amélioration comparative du temps de réaction en simulation de conduite nocturne de l’ordre d’une demi-seconde [13]. De même, dans une série personnelle, l’amélioration de la qualité de vision par rapport à une série de patients opérés avec le même implant mais sphérique a été confirmée en même temps que l’abaissement de la valeur de l’aberration sphérique totale de l’œil dans le groupe implanté avec l’implant asphérique [2].
Depuis la commercialisation de ce premier modèle au début des années deux mille, la majorité des compagnies ont évolué vers l’implant asphérique, qui représente aujourd’hui l’implant de référence sur le marché français en 2011. Des variantes sont cependant proposées, en particulier sur la valeur d’aberration sphérique utilisée, allant de – 0,27 µm à une valeur nulle d’aberration sphérique. Les raisons principales de ces choix tiennent à un double constat : même si la valeur moyenne de l’aberration sphérique cornéenne est connue, toutes les cornées, normales ou préalablement opérées, n’ont pas systématiquement une aberration sphérique de + 0,27 µm. Dans une série personnelle, environ 60 % des patients examinés en préopératoire de chirurgie de la cataracte présentaient une valeur voisine de + 0,27 µm ; les autres se répartissaient sur des valeurs supérieures ou inférieures (fig. 8-2) [16]. Cette notion est importante, car elle permet de comprendre qu’il n’existe pas de valeur « idéale » d’asphéricité d’un implant, celle-ci étant dépendante, entre autres, de la valeur de la cornée du patient, alors qu’il n’existe pas à cette heure d’asphéricité d’implant personnalisable pour chaque cornée. Nous avons également pu vérifier cette hypothèse sur deux séries de patients opérés avec le même implant sur le plan du design, mais disponible en trois modèles d’asphéricité possible, négative, nulle et positive. Les tests de qualité de vision, notamment par aberrométrie double passage et par sensibilité aux contrastes, ont été réalisés [17]. L’enseignement tiré de cette étude est double : d’une part, les valeurs totales d’aberration sphérique prédites par le choix de l’implant en fonction de la valeur cornéenne retrouvée ont effectivement été vérifiées cliniquement ; d’autre part, les paramètres de qualité de vision sont significativement améliorés dans le groupe « cornée/implant appariés » avec une valeur finale d’aberration sphérique résiduelle la plus proche possible de zéro. En termes d’acuité visuelle, les résultats font état d’une excellente vision de loin sans correction, l’implant étant par ailleurs monofocal et l’emmétropie recherchée.
Mais cette qualité de vision « optimisée » est-elle réellement bénéfique pour le patient en termes de confort visuel ? Sur le plan de la performance optique, en particulier en ambiance mésopique, incontestablement ; mais cette valeur résiduelle la plus faible possible d’aberration sphérique totale s’accompagne également d’une diminution de la profondeur de champ et, donc, de la capacité de l’œil à voir un objet en vision rapprochée. De la même façon, peut-on exploiter cette optimisation d’aberration sphérique finale prédictible pour conserver ou créer de la profondeur de champ et envisager ainsi une approche dans la prise en charge du patient presbyte ?
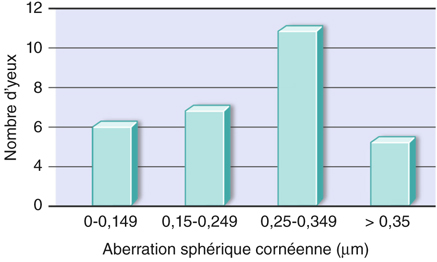
Fig. 8-2 Répartition des aberrations sphériques cornéennes dans une population de patients opérés de la cataracte.
On peut définir la profondeur de champ comme étant la variation de la distance de l’image d’un système optique pouvant être tolérée sans entraîner de manque significatif de netteté au niveau du foyer [24]. À cette définition optique peut s’ajouter une définition plus physiologique, la profondeur de champ pouvant être considérée comme une tolérance neurosensorielle de perception pour des erreurs minimes de focalisation (fig. 8-3). Il existe un certain nombre de facteurs qui influencent la profondeur de champ de l’œil humain. On note ainsi des facteurs environnementaux, comme la luminance ou le contraste, et des facteurs internes comme l’acuité visuelle, la taille de la pupille ou l’âge. Les troubles de la réfraction et la présence d’aberrations font partie des seconds. Certains de ces facteurs ont pour effet de diminuer la profondeur de champ, comme la luminance, le contraste ou l’ouverture pupillaire ; d’autres, comme l’accommodation ou la présence d’aberrations d’ordre élevées, sont susceptibles de l’augmenter [26]. C’est précisément l’utilisation de certaines aberrations d’ordre supérieur, telles que l’aberration sphérique (quatrième ordre), comme facteur de profondeur de champ qui est discutée ici au titre de méthode de prise en charge de patients presbytes. Ainsi, récemment, une équipe australienne a étudié expérimentalement l’influence de l’aberration sphérique primaire (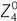 ) et secondaire (
) et secondaire (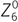 ) sur la profondeur de champ [28]. L’étude, conduite sur des sujets jeunes non presbytes mais après cycloplégie, utilisait un appareil d’optique adaptative, c’est-à-dire susceptible de simuler et de modifier les aberrations d’ordre supérieur d’un sujet regardant une cible visuelle. Les auteurs étudiaient la profondeur de champ d’un sujet en maintenant une qualité d’image rétinienne équivalente à une acuité de 5/10, compatible avec une activité normale en vision de loin. L’augmentation de 0,6 µm de
) sur la profondeur de champ [28]. L’étude, conduite sur des sujets jeunes non presbytes mais après cycloplégie, utilisait un appareil d’optique adaptative, c’est-à-dire susceptible de simuler et de modifier les aberrations d’ordre supérieur d’un sujet regardant une cible visuelle. Les auteurs étudiaient la profondeur de champ d’un sujet en maintenant une qualité d’image rétinienne équivalente à une acuité de 5/10, compatible avec une activité normale en vision de loin. L’augmentation de 0,6 µm de 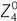 entraînait une augmentation de 0,80 D de profondeur de champ ; 0,25 µm induit de
entraînait une augmentation de 0,80 D de profondeur de champ ; 0,25 µm induit de 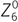 entraînait une augmentation de 0,87 D de profondeur de champ. La combinaison des deux aberrations permettait d’obtenir des niveaux similaires de profondeur de champ avec des augmentations moindres d’aberrations. Au total, sur les six sujets testés, la moyenne de la profondeur de champ mesurée avec acuité visuelle résiduelle « acceptable » était d’environ 2,6 ± 0,5 D, ce qui apparaît comme un résultat intéressant. Cette capacité à lire de façon défocalisée est donc susceptible d’être utile au sujet presbyte par un mécanisme passif, très différent d’une accommodation ou même de l’utilisation d’une bifocalité ou multifocalité vraie. Dans une précédente étude, Rocha et al., utilisant une méthodologie similaire, avaient également démontré un gain d’environ 2 D sur la profondeur de champ après induction d’aberration sphérique de 0,6 µm (en valeur positive ou négative), contrastant avec l’augmentation modeste lors d’induction de coma ou trefoil [22].
entraînait une augmentation de 0,87 D de profondeur de champ. La combinaison des deux aberrations permettait d’obtenir des niveaux similaires de profondeur de champ avec des augmentations moindres d’aberrations. Au total, sur les six sujets testés, la moyenne de la profondeur de champ mesurée avec acuité visuelle résiduelle « acceptable » était d’environ 2,6 ± 0,5 D, ce qui apparaît comme un résultat intéressant. Cette capacité à lire de façon défocalisée est donc susceptible d’être utile au sujet presbyte par un mécanisme passif, très différent d’une accommodation ou même de l’utilisation d’une bifocalité ou multifocalité vraie. Dans une précédente étude, Rocha et al., utilisant une méthodologie similaire, avaient également démontré un gain d’environ 2 D sur la profondeur de champ après induction d’aberration sphérique de 0,6 µm (en valeur positive ou négative), contrastant avec l’augmentation modeste lors d’induction de coma ou trefoil [22].
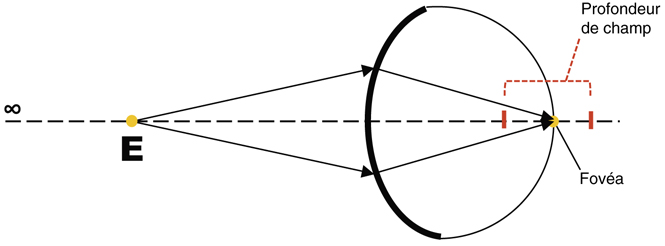
Fig. 8-3 Représentation schématique de la profondeur de champ.
Les études cliniques sur des patients opérés de cataracte étudiant la relation entre aberrations d’ordre supérieur et profondeur de champ sont peu nombreuses, mais on retrouve des études comparatives sur l’utilisation d’implants asphérique ou sphérique. Santhiago et al. rapportent les résultats retrouvés sur une série de patients implantés avec l’implant Akreos® (Bausch & Lomb, Rochester, États-Unis) dans sa version AO (asphérique, AS = 0) ou sa version Fit (sphérique, AS > 0) [23]. Si l’aberration sphérique finale est significativement plus basse dans le groupe AO quelle que soit la taille de la pupille, les auteurs ne mettent pas en évidence de différence significative en vision de loin, près et intermédiaire avec le port de la correction de loin, c’est-à-dire en termes de profondeur de champ. Marcos et al., en 2005, retrouvaient également une amélioration de la qualité de vision dans une étude comparant un implant asphérique (Tecnis® Z9000, AMO, États-Unis) et AcrySof® sphérique (Alcon, Fort Worth, États-Unis), mais au détriment de la tolérance à la défocalisation dans le groupe asphérique, c’est-à-dire de la profondeur de champ, de l’ordre d’1,5 D entre les deux groupes [14]. Une autre étude datant de 2007 menée par Rocha et al. tire les mêmes conclusions sur la moindre capacité à lire de près en portant une correction de loin dans un groupe de patients implantés avec la version asphérique (IQ) de l’implant AcrySof® (Alcon laboratoire, États-Unis) comparé au même implant sphérique (AT) et à un autre implant sphérique (Sensar® AR40, AMO laboratoires, États-Unis). La diminution de l’aberration sphérique finale semblant être corrélée à une dégradation de la profondeur de champ [21].
Ces différentes études ont démontré le lien existant entre profondeur de champ et aberration sphérique. Si la qualité de vision gagne à ce que l’aberration sphérique finale soit la plus proche de zéro, il peut paraître utile, en termes de confort de vision, de laisser une certaine valeur résiduelle d’aberration sphérique, elle-même corrélée à un certain degré de profondeur de champ, donc de vision de près. Une étude a été menée sur des patients implantés par implant asphérique choisi en fonction de l’aberration sphérique cornéenne, la profondeur de champ et la qualité de vision étant les paramètres évalués. Les résultats statistiques retrouvent une valeur résiduelle finale de 0,07 µm d’aberration sphérique comme étant le meilleur compromis entre qualité de vision et profondeur de champ conservées [18].
Dans le cadre d’une prise en charge du patient presbyte, la mise en place d’un implant monofocal à visée emmétropisante mais dont l’aberration sphérique permettrait de cibler une aberration sphérique finale non nulle pourrait représenter une alternative à la monovision. Ainsi, la vision binoculaire resterait parfaitement conservée mais le patient pourrait garder une certaine capacité en vision de près. Il semble que, pour obtenir un résultat fonctionnel intéressant, cette technique soit définie sur une implantation bilatérale, l’œil dominant recevant un implant visant une aberration sphérique finale proche de zéro afin de rechercher la meilleure qualité de vision, l’œil dominé étant implanté avec un implant sphérique afin de garder une aberration sphérique finale non nulle.
Les limites de ce type d’implantation sont d’abord fonctionnelles, avec un résultat en vision de près qui ne peut égaler une véritable monovision ou même une implantation multifocale ; de plus, elle ne peut s’adresser qu’à des patients désireux de garder une autonomie en vision de près mais sans indépendance vis-à-vis des lunettes pour une lecture poursuivie. Elle peut être recommandée à des patients ne désirant pas d’implantation multifocale ou non-demandeurs, ainsi qu’à ceux qui professionnellement ou par choix ne veulent pas ou ne supportent pas la monovision (testée préalablement par lentilles de contact).
Enfin, la réalisation de cette asphéricité programmée nécessite, d’une part, l’utilisation d’un matériel d’investigation en consultation incluant un aberromètre et un topographe cornéen susceptible de fournir les aberrations cornéennes préopératoires, d’autre part, la réalisation obligatoire d’une micro-incision chirurgicale, seule garante de la neutralité opératoire sur ces mêmes aberrations cornéennes [17] et, enfin, l’utilisation d’implants à choix d’asphéricité possible et acceptant le passage en micro-incision. Ces différentes contraintes rendent encore cette technique confidentielle et en cours d’évaluation en 2012.


[1] Charnwood L. Observations on ocular dominance. Optician, 1949 ; 118 : 85-96.
[2] Denoyer A., Le Lez M.-L., Majzoub S., Pisella P.-J. Quality of vision after cataract surgery after Technis Z9000 intraocular lens implantation: effect on contrast sensitivity and wavefront aberration improvments on the quality of daily vision. J Cataract Refract Surg, 2007 ; 33 : 210-6.
[3] Evans B.J.W. Monovision: a review. Ophthal Physiol Opt, 2007 ; 27 : 417-39.
[4] Finkelman Y., Ng, J.Q., Barrett G. Patient satisfaction and visual function after pseudophakic monovision. J Cat Refract Surg, 2009 ; 35 : 998-1002.
[5] Giles G.H. The practice of Orthoptics. Hammond and Co, London, 1949.
[6] Glasser A., Campbell M.C. Presbyopia and the optical changes in the human crystalline lens with age. Vision Res, 1998 ; 38 : 209-29.
[7] Greenbaum S. Monovision pseudophakia. J Cataract Refract Surg, 2002 ; 28 : 1439-43.
[8] Guirao A., Gonzalez C., Redondo M. et al. Average optical performance of the human eye as a function of age in a normal population. Invest Ophthalmol Vis Sci, 1999 ; 40 : 203-13.
[9] Gutkowski M., Cassin B. Stereopsis and monovision in the contact lens management of presbyopia. Binoc Vis Strabismus Q, 1991 ; 6 : 31-6.
[10] Handa T., Mukuno K., Uozato H. et al. Ocular dominance and patient satisfaction after monovision induced by intraocular lens implantation. J Cataract Refract Surg, 2004 ; 30 : 769-74.
[11] Holladay J.T. Corneal topography using the Holladay diagnostic summary. J Cataract Refract Surg, 1997 ; 23 : 209-21.
[12] Holladay J.T., Piers P.A., Koranyi G. et al. A new intraocular lens design to reduce spherical aberration of pseudophakic eyes. J Refract Surg, 2002 ; 18 : 683-91.
[13] Kelly J.E., Mihashi T., Howland H.C. Compensation of corneal horizontal/vertical astigmatism, lateral coma, and spherical aberration by internal optics of the eye. J Vision, 2004 ; 4 : 262-71.
[14] Marcos S., Barbero S., Jimenez-Alfaro I. Optical quality and depth-of-field of eyes implanted with spherical and aspheric lenses. J Refract Surg, 2005 ; 21 : 223-35.
[15] Meyler J. Presbyopia. In : Contact Lens Practice. N. Efron (ed.). Butterworth-Heinemann, Oxford, 2010 : 252-65.
[16] Nochez Y., Favard A., Majzoub S., Pisella P.-J. Measurement of corneal aberrations for customisation of intraocular lens asphericity: impact on quality of vision after micro-incision cataract surgery. Br J Ophthalmol, 2010 ; 94 : 440-4.
[17] Nochez Y., Majzoub S., Pisella P.-J. Corneal aberration integrity after micro incision surgery: prerequisite conditions for total ocular aberrations prediction. Br J Ophthalmol, 2010 ; 94 : 661-3.
[18] Nochez Y., Majzoub S., Pisella P.-J. Effect of residual ocular spherical aberration on objective and subjective quality of vision in pseudophakic eyes. J Cataract Refract Surg, 2011 ; 37 : 1076-81.
[19] Ogle K. Ocular dominance and binocular retinal rivalty. In : The eye. H. Davson (ed.). Academic Press, New York, 1962 : 409-17.
[20] Papas E., Young G., Hearn K. Monovision vs soft diffractive bifocal contact lenses: a crossover study. Internat Contact Lens Clin, 1990 ; 17 : 181-7.
[21] Rocha K.M., Soriano E.S., Chamon W. et al. Spherical aberration and depth of focus in eyes implanted with aspheric and spherical intraocular lenses: a prospective randomized study. Ophthalmology, 2007 ; 114 : 2050-4.
[22] Rocha K.M., Vabre L., Chateau N., Krueger R.R. Expanding depth of focus by modifying higher-order aberrations induced by an adaptive optics visual simulator. J Cataract Refract Surg, 2009 ; 35 : 1885-92.
[23] Santhiago M.R., Netto M.V., Barreto J. et al. Wavefront analysis, contrast sensitivity and depth of focus after cataract surgery with aspherical intraocular lens implantation. Am J Ophthalmol, 2010 ; 149 : 383-9.
[24] Schapero M., Cline D., Hofstetter H.W. (eds). Dictionary of visual science. 2nd edition. Chilton Book Company, Radnor, Pennsylvania, 1968 : 192.
[25] Walls G.L. A theory of ocular dominance. Arch Ophthalmol, 1951 ; 45 : 387-412.
[26] Wang B., Ciuffreda K.J. Depth-of-focus of the human eye: theory and clinical implications. Surv Ophthalmol, 2006 ; 51 : 75-85.
[27] Wright K., Guemes A., Kapadia M.S., Wilson S.E. Binocular function and patient satisfaction after monovision induced by myopic photorefractive keratectomy. J Cataract Refract Surg, 1999 ; 25 : 177-82.
[28] Yi F., Iskander D.R., Collins M. Depth of focus and visual acuity with primary and secondary spherical aberration. Vision Research, 2011 ; 51 : 1648-58.
[29] Zhang F., Sugar A., Jacobsen G., Collins M. Visual function and patient satisfaction: comparison between bilateral diffractive multifocal intraocular lenses and monovision pseudophakia. J Cat Refract Surg, 2011 ; 37 : 44.

