M. Puech, M. Streho
Le calcul d’implant après chirurgie réfractive cornéenne reste un élément en cours d’amélioration avec, parfois, quelques surprises réfractives qui peuvent pousser soit à un geste réfractif cornéen complémentaire soit à un changement d’implant, pour les cas les plus éloignés de la réfraction souhaitée en préopératoire.
Les techniques de chirurgie réfractives sont diverses ainsi que le degré d’amétropie traitée. Cette variabilité des situations réfractives et des techniques employées explique en grande partie les résultats, parfois dispersés, des techniques de calcul d’implant lorsqu’on utilise des formules de régression fondées sur un échantillon de patients dont la situation réfractive ne correspond pas au patient qui est actuellement en cours de bilan pour une intervention de cataracte. Les études couramment publiées tendent à réaliser des séries plus ou moins homogènes de patients opérés par telle ou telle technique. Les premières publications ont rapporté une nette tendance à l’hypermétropisation des patients après chirurgie de la cataracte sur des yeux déjà opérés de myopie par kératotomie radiaire [9, 12, 14, 16]. Le succès du LASIK avec microkératome puis par laser femtoseconde a popularisé les interventions de chirurgie réfractive, avec un nombre croissant de ces patients qui arrivent à l’âge de l’opération de la cataracte.
Les méthodes habituelles de calcul d’implant sont régulièrement prises en défaut sur ces yeux dont la cornée a été remaniée [5]. De nombreuses solutions alternatives sont proposées, soit en se fondant sur les données préopératoires du patient, soit en utilisant des formules d’appréciation de la réfraction par des algorithmes plus ou moins sophistiqués. Malgré de nombreuses propositions, le calcul d’implant après chirurgie réfractive se heurte à un problème de mesure et non un problème de calcul [6].
Dans le cas d’un calcul d’implant classique, les deux mesures principales destinées à activer les formules de calcul sont la kératométrie et la longueur axiale (cf. chapitre précédent). La plupart des formules habituelles reposent sur ces deux mesures et sur la constante A pour déterminer, par calcul, la position d’un implant donné dans l’œil opéré. Chacun de ces trois éléments impacte la réfraction postopératoire avec une importance relative sur les erreurs de calcul par rapport à la réfraction souhaitée. Olsen a pu quantifier cette incidence respective pour la chirurgie classique de cataracte : 8 % des erreurs réfractives peuvent être imputées à la kératométrie, 54 % à la longueur axiale et 38 % à l’estimation de la véritable position de l’implant [15].
L’arrivée des biomètres optiques, avec une très nette réduction de l’écart type sur les mesures de longueur axiale, tend à réduire la proportion d’erreurs de calcul liées à la mesure de longueur axiale [19].
D’un autre côté, les procédures de chirurgie réfractive cornéenne majorent l’imprécision de mesure sur la kératométrie. La modification de l’état réfractif des cornées opérées retentit directement sur l’appréciation de la position de l’implant, dans la mesure où de nombreuses formules de calcul utilisent la kératométrie pour apprécier cette position de l’implant. Les progrès en matière de fiabilité des calculs se feront dans la direction d’une meilleure mesure de la puissance cornéenne centrale et dans la meilleure détermination de la position de l’implant, non pas de façon statistique mais de façon personnalisée pour un patient donné.
Les différentes techniques de chirurgie réfractive ont des conséquences diverses sur le calcul d’implant.
Les premiers patients opérés de kératotomie radiaire ont fourni les premières constatations d’erreurs réfractives après opération de cataracte sur des cornées remaniées [9, 12, 13]. La tendance constatée a été dans le sens d’une hypermétropisation postopératoire de la cataracte [5, 14].
Deux éléments peuvent provoquer cette erreur [8] :
– la kératométrie sur les 3 mm centraux par les kératomètres classiques ne rend pas compte de l’aplatissement cornéen central produit par la technique de chirurgie réfractive ;
– la mesure sur la zone des 3 mm centraux se fait sur une zone de plus grande cambrure cornéenne, ce qui tend à mesurer une puissance cornéenne plus élevée qu’elle ne l’est en réalité au centre de la cornée.
L’apport de la topographie cornéenne est d’identifier les variations de courbure de la cornée de façon beaucoup plus complète que les kératomètres. Les changements de rayons de courbure apparaissent entre le centre de la cornée et la région des 3 mm centraux mais aussi de façon circulaire au niveau des 3 mm ou 4 mm centraux, avec des puissances cornéennes assez variables en fonction du secteur horaire considéré (fig. 15-1). La topographie permet ainsi de mieux apprécier l’aspect de régularité ou d’irrégularité de la cornée, mais la puissance cornéenne véritablement utile pour le calcul d’implant n’est pas clairement identifiée. Il est possible d’utiliser pour le calcul l’équivalent de la kératométrie, la moyenne des mesures sur les 3 mm centraux ou sur les 4 mm centraux avec, parfois, des variations de ces paramètres en fonction de l’appareil utilisé.
Plusieurs éléments entrent en ligne de compte pour expliquer l’hypermétropisation postopératoire :
– la mauvaise appréciation de la puissance de l’implant (par absence de mesure de la puissance cornéenne centrale) ;
– la mauvaise appréciation de la position de l’implant, très souvent dépendante dans les formules de calcul classiques de la courbure cornéenne antérieure.
De façon pratique, face à une hypermétropisation postopératoire après chirurgie de la cataracte chez un patient opéré de kératotomie radiaire, une partie de cette hypermétropisation régresse, car elle peut être liée à une réapparition d’œdème dans les cicatrices de kératotomie radiaire – pouvant induire jusqu’à + 3 D. Cet élément est d’autant plus présent que les incisions radiaires sont très transparentes, alors que les incisions fibrosées, plus blanchâtres, seront moins sensibles à cette fluctuation postopératoire. Un contrôle évolutif de l’hypermétropie peut être réalisé en postopératoire immédiat avant de décider d’un changement d’implant ou d’un complément de traitement réfractif (pas avant, au minimum, un mois après le geste).
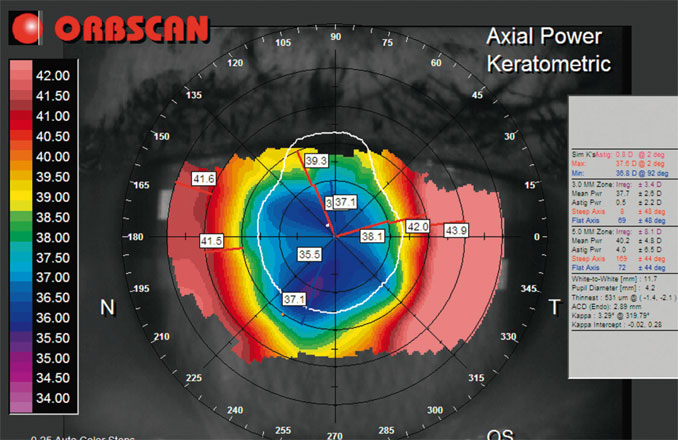
Fig. 15-1 Aspect de topographie cornéenne après chirurgie par kératotomie radiaire.
Les rayons de courbure sont très fluctuants, notamment sur la zone des 3 mm centraux, avec une importante différence entre le centre de la cornéen et la périphérie de l’apex cornéen.
La conséquence d’une intervention par LASIK myopique est de réduire la puissance cornéenne centrale par un amincissement du stroma cornéen, entraînant un amincissement cornéen global au centre et un aplatissement de la courbure cornéenne antérieure. La mesure de la puissance cornéenne sur les 3 mm centraux est ici aussi un mauvais reflet de la puissance cornéenne centrale, avec pour conséquence une hypermétropisation moins marquée qu’en kératotomie radiaire mais souvent constatée [4, 17, 18, 20].
La topographie cornéenne permet de mieux apprécier le centrage du traitement, la largeur de la zone traitée et les changements de courbure produits par le geste réfractif (fig. 15-2).
Dans ce cas, l’erreur de mesure est attribuée à la perte de parallélisme des deux faces de la cornée. Cet élément influe sur l’indice de réfraction de la cornée, arbitrairement choisi par Javal à 1,3375, reliant une cornée de 45,0 D à un rayon de courbure de 7,5 mm [11]. Cette valeur de l’indice de réfraction fait l’objet de controverses, avec des indices proposés de 1,3315 par Gullstrand et 1,33 par la plupart de fabricants de topographes cornéens [7].
La controverse est liée au principe même de cet indice qui est censé représenter, par une seule valeur, la réunion de deux dioptres principaux de la cornée : le dioptre antérieur entre l’air et la cornée et le dioptre postérieur entre la cornée et l’humeur aqueuse. Cette simplification est liée à la théorie optique de la lentille fine qui, en optique physique, tend à transformer plusieurs dioptres, de rapport constant, en un équivalent de lentille fine unique, de façon à schématiser les calculs physiques. À l’opposé, l’étude dite de la lentille épaisse prend en compte les véritables particularités d’un ensemble de dioptres, avec la connaissance des différents indices de réfraction et des distances respectives entre les dioptres ; cette théorie dite de la lentille épaisse commence à être réintroduite par quelques auteurs pour tenter d’améliorer la fiabilité de nos calculs dans les situations complexes après chirurgie réfractive, en appréciant mieux le rôle joué par la face antérieure de la cornée de façon indépendante de la face postérieure et sans passer par des approximations statistiques.
Une autre particularité du calcul d’implant après chirurgie par LASIK est liée à une erreur d’appréciation de la position de l’implant [10]. Cette appréciation est réalisée par les formules classiques en se fondant sur la kératométrie mesurée au kératomètre. En cas de procédure myopique, la perte de parallélisme de la cornée au centre entraîne une différence assez nette entre les rayons de courbure de la face antérieure de la cornéen et de la face postérieure. Fonder l’estimation de la position de l’implant sur la seule kératométrie antérieure revient à estimer la puissance de l’implant sur une cornée anormalement plate par rapport à la forme du segment antérieur.
Ces deux erreurs se cumulant, la réfraction postopératoire est souvent décalée dans le sens d’une hypermétropisation postopératoire [5].
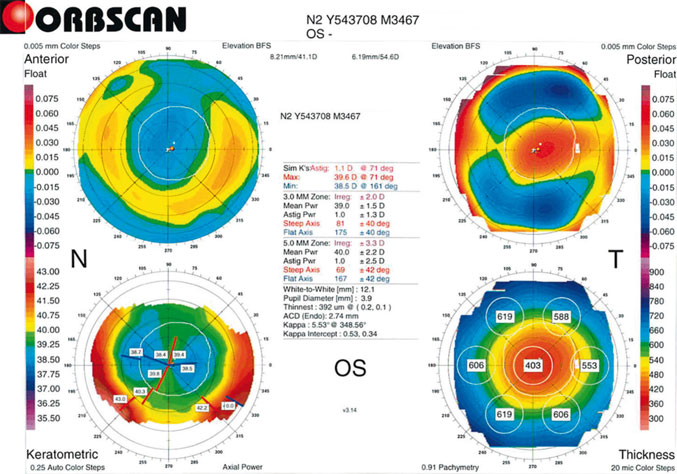
Fig. 15-2 Topographie cornéenne sur LASIK myopique.
Le centrage du traitement est très bien analysé par les topographes cornéens, qui peuvent aussi montrer l’aplatissement cornéen central par rapport à la périphérie de l’apex.
Les procédures de LASIK hypermétropique tendent à produire une majoration de la courbure cornéenne centrale, le plus souvent par amincissement cornéen autour de l’apex [3, 4, 16, 21]. La kératométrie réalisée sur les 3 mm centraux se fait sur une zone de cornée moins cambrée que la cornée centrale. La topographie cornéenne montre les modifications de courbures, qui sont souvent moins importantes qu’en LASIK myopique (fig. 15-3).
Dans cette configuration de traitement, la perte de parallélisme de la cornée est moins marquée au centre, mais la déconnexion du rayon de courbure mesuré par rapport à l’anatomie du segment antérieur de ce patient hypermétrope entraîne aussi une mauvaise appréciation de la position de l’implant. La réfraction postopératoire est souvent décalée dans le sens d’une myopisation [3].
Cette myopisation non souhaitée est cependant mieux tolérée que l’hypermétropisation d’un myope.
Les patients hypermétropes traités par chirurgie réfractive sont, à l’heure actuelle, moins nombreux que les anciens myopes, mais les procédures se multipliant, l’amélioration du calcul d’implant dans cette situation s’impose.
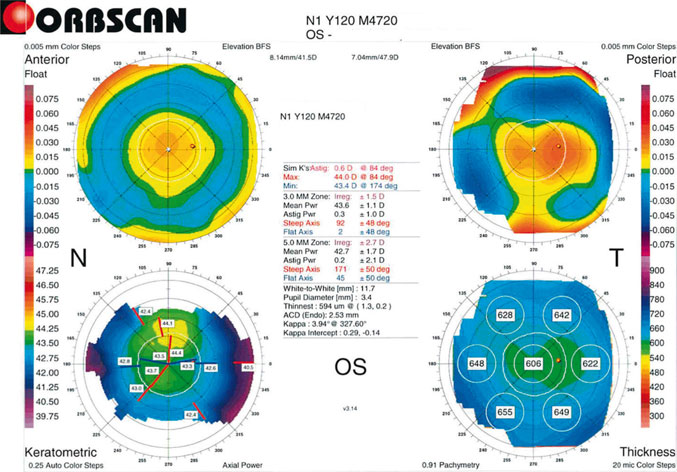
Fig. 15-3 Topographie cornéenne en cas de LASIK hypermétropique.
Les variations de courbure de la cornée sont moins marquées qu’en cas de LASIK myopique, mais les mesures réalisées à 3 mm ne sont pas un reflet exact de la puissance cornéenne centrale.
Les procédures de presbyLASIK ont pour objectif de produire une multifocalité cornéenne susceptible de compenser la perte d’accommodation du cristallin [1, 2]. Les techniques sont diverses et les résultats variables en fonction du traitement appliqué. La faible standardisation et le peu de patients opérés étant en âge de se faire opérer de cataracte ne permettent pas de dégager des séries suffisantes pour guider le calcul d’implant de façon efficace. Quelques éléments peuvent cependant être pris en considération à partir des techniques appliquées aux emmétropes ou aux hypermétropes.
Dans le cas du presbyLASIK, le degré de multifocalité obtenu par la procédure réfractive sera à considérer comme une compensation utile après l’opération de cataracte. Si la chirurgie cornéenne a atteint son but de transformer la cornée en cornée multifocale, cet avantage sera appréciable avec un implant monofocal, à condition d’obtenir l’emmétropie de loin. En cas d’échec du résultat multifocal, la question d’un implant multifocal pourra se poser, avec des indications qui doivent tenir compte des aberrations cornéennes présentes sur ces yeux opérés.
La plus grande difficulté du calcul d’implant après presbyLASIK est d’apprécier la puissance cornéenne sur des cornées qui présentent souvent des variations de puissance assez rapides sur des petites zones adjacentes, très mal analysées par les kératomètres. La topographie cornéenne apporte une bonne visualisation des variations de courbure, mais les valeurs absolues à retenir pour le calcul d’implant ne sont pas encore très codifiées (fig. 15-4). Une des voies peut être de multiplier les points de mesures sur une zone plus centrales, comme le fait l’appareil Lenstar® (Haag-Streit) en proposant trente-deux mesures sur deux cercles concentriques de 1,7 mm et 2,1 mm (fig. 15-5). Les techniques plus récentes d’appréciation de la véritable puissance cornéenne centrale par ray-tracing ou OCT seront probablement d’une grande aide.
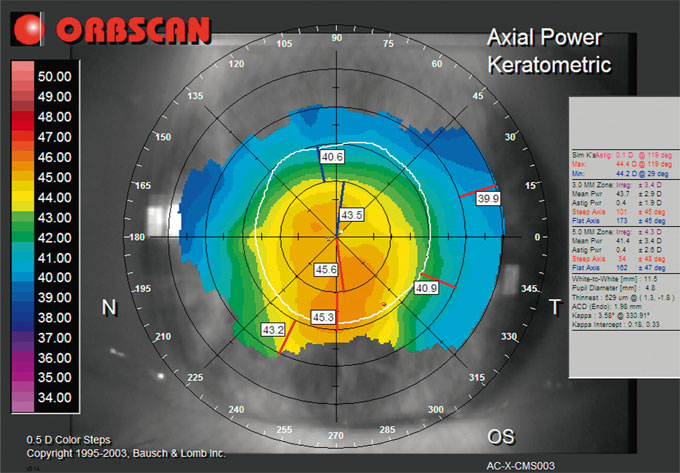
Fig. 15-4 Topographie cornéenne en cas de presbyLASIK.
L’importante variabilité des rayons de courbure au niveau de l’apex et en inférieur de l’apex est bien individualisée par les topographes cornéens, mais la valeur à retenir pour le calcul d’implant n’est pas clairement définie.
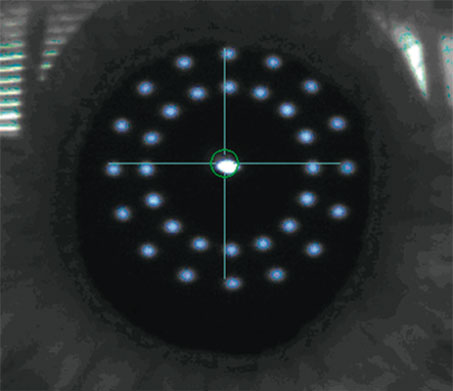
Fig. 15-5 Aspect de mesure de kératométrie avec l’appareil Lenstar® (Haag-Streit).
Ces mesures sont prises sur deux cercles concentriques de chacun seize points de mesure, améliorant nettement l’appréciation de la puissance cornéenne sur un diamètre plus proche que les 3 mm centraux.
La particularité du calcul d’implant après mise en place d’un implant phake est liée à la prise de mesure de la longueur axiale [5, 16].
L’interposition du matériau de l’implant en avant du cristallin naturel, soit en chambre antérieure soit en chambre postérieure, entraîne une traversée de ce matériau par le faisceau ultrasonore de biométrie ou par le faisceau laser des appareils d’interférométrie.
En biométrie ultrasonore, cette interposition entraîne une importante accélération des ultrasons dans le matériau, avec des vitesses de conduction que les appareils habituels ne peuvent pas identifier par des surbrillances spécifiques. En outre, le matériau de l’implant génère des artefacts de répétition, comme pour tous les corps étrangers intraoculaires, qui empêchent une bonne reconnaissance du pic rétinien.
La mesure de longueur axiale dans cette situation est très peu précise, voire impossible, par échographie en mode A, en particulier pour les implants en PMMA qui entraînent le plus d’artefacts.
La solution de l’échographie en mode B permet à la fois d’identifier la face antérieure de l’implant et la face postérieure du cristallin naturel mais aussi la position du pic rétinien (fig. 15-6). Dans cette situation, l’absence de marqueurs spécifiques pour l’implant peut être compensée en positionnant la surbrillance prévue pour la face avant du cristallin sur la face antérieure de l’implant, et la surbrillance de la face postérieure du cristallin sur la véritable position de la cristalloïde postérieure. Par cette méthode, une moyenne des vitesses de conduction des ultrasons est réalisée, ce qui permet de limiter les erreurs.
Les appareils par interférométrie ont l’avantage d’une moindre différence de vitesse de conduction entre les différents milieux intraoculaires et le matériau de l’implant, ce qui rend la mesure plus précise qu’en mode ultrasonore. Il est cependant préférable, pour les appareils qui ne disposent pas d’un mode « implant phake », de comparer les mesures en mode phake et pseudophaque. La limite de mesure de ces appareils est représentée par le pourcentage d’absence de réponse en cas de cataracte dense avec interposition de l’implant, ce qui implique une mesure en mode ultrasonore avec ses aléas.
Dans cette situation d’implant phaque, il semble nécessaire d’anticiper le problème du calcul d’implant par deux étapes préventives :
– au moment de l’opération réfractive avec mise en place de l’implant phaque, un calcul d’implant complet peut être réalisé, de façon à archiver ou faire archiver ce document dans l’attente de l’opération de la cataracte ; le calcul de l’implant phaque ne nécessitant pas toujours un recours à la longueur axiale, il sera nécessaire de réaliser un calcul standard à archiver ;
– en absence de calcul d’implant avant la chirurgie par implant phaque, une autre précaution intermédiaire peut être prise : un calcul d’implant en mode interférométrique, tant que le cristallin n’est pas opacifié ; dans cette situation, la mesure de longueur axiale en mode interférométrique reste en effet très fiable.
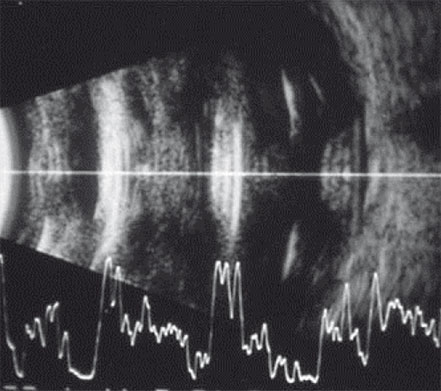
Fig. 15-6 Échographie en mode B d’un patient porteur d’un implant phaque en PMMA.
L’échographie B permet d’identifier l’implant, le cristallin et la rétine. Il subsiste cependant une impossibilité de mesure précise par absence de surbrillances spécifiques à l’implant dans lequel la vitesse de conduction des ultrasons est nettement accélérée par rapport à l’humeur aqueuse.


[1] Alió J.L., Chaubard J.-J., Caliz A. et al. Correction of presbyopia by technovision central multifocal LASIK (presbyLASIK). J Refract Surg, 2006 ; 22 : 453-60.
[2] Alió J.L., Amparo F., Ortiz D., Moreno L. Corneal multifocality with excimer laser for presbyopia correction. Curr Opin Ophthalmol, 2009 ; 20 : 264-71.
[3] Awwad S.T., Kelley P.S., Bowman R.W. et al. Corneal refractive power estimation and intraocular lens calculation after hyperopic LASIK. Ophthalmology, 2009 ; 116 : 393-400 e1.
[4] Feiz V., Mannis M.J., Garcia-Ferrer F. et al. Intraocular lens power calculation after laser in situ keratomileusis for myopia and hyperopia: a standardized approach. Cornea, 2001 ; 20 : 792-7.
[5] Gimbel H., Sun R., Kaye G.B. Refractive error in cataract surgery after previous refractive surgery. J Cataract Refract Surg, 2000 ; 26 : 142-4.
[6] Gobbi P.G., Carones F., Brancato R. Keratometric index, videokeratography, and refractive surgery. J Cataract Refract Surg, 1998 ; 24 : 202-11.
[7] Gullstrand A. Die Dioptrik des Auges. Handbuch der physiologischen Optik. Vol. 1. Helmholtz H. (ed.). L. Voss, Hamburg, Leipzig, 1909.
[8] Hanna K.D., Jouve F.E., Waring G.O. 3rd. Preliminary computer simulation of the effects of radial keratotomy. Arch Ophthalmol, 1989 ; 107 : 911-8.
[9] Hoffer K.J. Intraocular lens power calculation for eyes after refractive keratotomy. J Refract Surg, 1995 ; 11 : 490-3.
[10] Holladay J.T., Praeger T.C., Chandler T.Y., Musgrove K.H. A three-part system for refining intraocular lens power calculations. J Cataract Refract Surg, 1988 ; 14 : 17-24.
[11] Javal E. Mémoires d’ophtalmométrie. Librairie de l’Académie de Médecine, Paris, 1891.
[12] Koch D.D., Liu J.F., Hyde L.L. et al. Refractive complications of cataract surgery after radial keratotomy. Am J Ophthalmol, 1989 ; 108 : 676-82.
[13] Lyle W.A., Jin G.J. Intraocular lens power prediction in patients who undergo cataract surgery following previous radial keratotomy. Arch Ophthalmol, 1997 ; 115 : 457-61.
[14] Markovits A.S. Extracapsular cataract extraction with posterior chamber intraocular lens implantation in a postradial keratotomy patient. Arch Ophthalmol, 1986 ; 104 : 329-31.
[15] Olsen T. Sources of error in intraocular lens power calculation. J Cataract Refract Surg, 1992 ; 18 : 125-9.
[16] Puech M., Saragoussi J.-J. Chirurgie de la cataracte après chirurgie réfractive. Deuxième partie : le problème du calcul d’implant. J Fr Ophtalmol, 2000 ; 23 : 67-72.
[17] Savini G., Hoffer K.J., Carbonelli M., Barboni P. Intraocular lens power calculation after myopic excimer laser surgery: clinical comparison of published methods. J Cataract Refract Surg, 2010 ; 36 : 1455-65.
[18] Shammas H.J., Shammas M.C., Garabet A. et al. Correcting the corneal power measurements for intraocular lens power calculations after myopic laser in situ keratomileusis. Am J Ophthalmol, 2003 ; 136 : 426-32.
[19] Shammas H.J., Chan S. Precision of biometry, keratometry, and refractive measurements with a partial coherence interferometry-keratometry device. J Cataract Refract Surg, 2010 ; 36 : 1474-8.
[20] Speicher L. Intra-ocular lens calculation status after corneal refractive surgery. Curr Opin Ophthalmol, 2001 ; 12 : 17-29.
[21] Wang L., Booth M.A., Koch D.D. Comparison of intraocular lens power calculation methods in eyes that have undergone LASIK. Ophthalmology, 2004 ; 111 : 1825-31.

