A. Abenhaim, B. Cochener
B. Cochener
Le traitement de la presbytie impose, plus que dans n’importe quel autre chapitre de la chirurgie réfractive, une attention redoublée concernant l’information et l’examen clinique du patient candidat à l’opération. Il sera en effet nécessaire d’ajouter aux explications sur le processus de la perte d’accommodation et des limites des solutions chirurgicales disponibles, un examen complet oculaire, afin de dépister d’éventuels désordres pouvant guider la stratégie du choix thérapeutique, voire contre-indiquer le projet chirurgical ou le différer après traitement spécifique des anomalies détectées sur un œil ayant amorcé son vieillissement [25].
L’examen à la lampe à fente accompagnera l’évaluation des mesures réfractives, d’acuités visuelles (abordées aux sections II et III de ce chapitre) ainsi que de qualité de vision (sensibilité aux contrastes, à l’éblouissement, aberrométrie, questionnaire de qualité de vie). En cas de port de lentilles de contact, il sera donc réalisé après au moins huit jours de retrait de ces dernières.
Peut-on rappeler que cornée et cristallin représentent les deux structures nobles de la chirurgie réfractive, puisqu’elles constituent les deux dioptres optiques principaux : avec deux tiers du pouvoir optique de l’œil attribué à la cornée et le tiers restant revenant au cristallin. Aussi sera-t-il crucial de se focaliser sur l’examen de ces deux éléments, avant de décider de la chirurgie à conduire.
Au cœur de la photoablation, cette fenêtre transparente avasculaire se doit d’être vérifiée dans son épaisseur, sa régularité, sa résistance viscoélastique et son intégrité anatomique, en particulier lorsqu’un LASIK sera envisagé chez un presbyte débutant.
L’examen en lampe à fente recherchera toute opacité, trace de cicatrice infectieuse ou traumatique ainsi que toute lésion évocatrice de dystrophie (microkystes sous-épithéliaux, irrégularités de surface en « empreinte digitale » en faveur d’une dégénérescence épithéliale, source d’érosions récurrentes avec ou sans kératalgies récidivantes) ou encore aspect en gouttes ou opacités postérieures révélatrices d’un endothélium anormal. La région du limbe fera l’objet d’une attention particulière, surtout en cas de port prolongé de lentilles, de terrain d’allergie ou de rosacée responsables de l’apparition de néovaisseaux, d’un panus, d’infiltrats immunitaires pouvant gêner la découpe du volet et favoriser une inflammation postopératoire. De même, l’examen des conjonctives bulbaires et tarsales recherchera hyperémie, papilles, follicules, télangiectasies, irrégularités, cicatrices et/ou meibomite, attestant de ces mêmes situations pathologiques (cf. infra « Surface oculaire »). Cet examen soigneux exigera de travailler en fente large, fine et rétro-illumination.
La vidéotopographie (spéculaire de Placido et/ou d’élévation) viendra compléter l’observation en lampe à fente en apportant des informations sur la présence d’un éventuel astigmatisme, en quantifiant sa régularité et sa symétrie et en le confrontant à l’astigmatisme total mesuré en réfraction afin de définir la part cornéenne et la part interne de celui-ci (crucial en matière d’implantation torique) (fig. 21-1). La topographie d’élévation renseignera également sur l’asphéricité cornéenne, soit par la mesure directe du facteur Q, soit indirectement par la mesure des aberrations sphériques, ainsi que sur la carte pachymétrique — servant de premier critère de sélection en photoablation, en exigeant un seuil d’au moins 500 µm. En postopératoire, elle permettra de mesurer l’effet morphologique de la chirurgie, en particulier dans le centrage d’une procédure cornéenne, dans l’astigmatisme et les aberrations induites [9].
La mesure de l’épaisseur cornéenne peut être également obtenue classiquement par échographie ultrasonore. Plus récemment et plus aisément, elle est déterminée par exploration Scheimpflug et par tomographie par cohérence optique du segment antérieur (OCT), procurant une image sagittale de l’œil avec, pour les plateformes de dernière génération, une capacité à haute définition d’accéder à des mesures des différentes couches cornéennes, telles qu’un volet LASIK. Ces outils sont par ailleurs utiles à la détermination des dimensions intraoculaires requises pour l’approche en particulier de l’implantation phaque ou de l’évaluation dynamique des implants accommodatifs (sachant que seuls les ultrasons franchissent la barrière pigmentée de l’iris) [8, 22].
La dimension sécuritaire d’une chirurgie sur la cornée est donnée par la microscopie spéculaire, qui vérifiera l’intégrité morphologique et densitométrique de l’endothélium (fig. 21-2). La microscopie confocale permettra d’ajouter à l’endothélium l’évaluation de toutes les couches de la cornée : ce niveau de précision pourra présenter un intérêt dans l’étude de la réponse tissulaire autour d’un inlay intracornéen, par exemple [12, 60].
La dernière propriété de la cornée à explorer est représentée par sa biomécanique, admise aujourd’hui comme fondamentale dans la chirurgie photoablative. À défaut de pouvoir mesurer la vraie élasticité cornéenne, celle de la viscoélasticité est devenue d’usage courant grâce à l’appareil ORA® (Ocular Resistance Analyser, laboratoire EBC). Elle consiste en une tonométrie dynamique et suggère de s’alerter si la résistance cornéenne (CRF, proportionnelle à la pachymétrie) est inférieure à 8 et l’hystérésie (CH, mesure de la visocélasticité) est inférieure à 10 [54] (fig. 21-3).
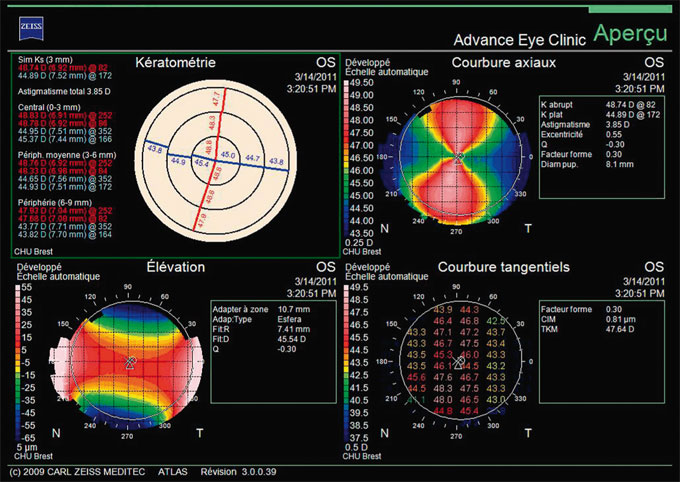
Fig. 21-1 Vidéotopographie spéculaire (Placido) : astigmatisme cornéen régulier, symétrique.
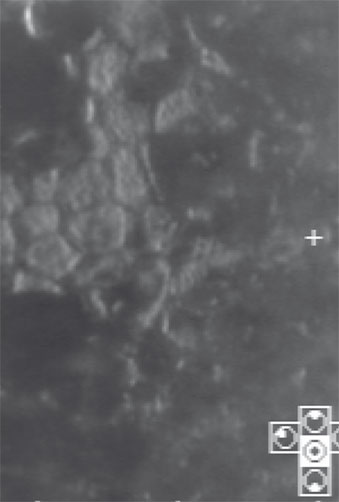
Fig. 21-2 Microscopie spéculaire : dystrophie endothéliale (cornea guttata).
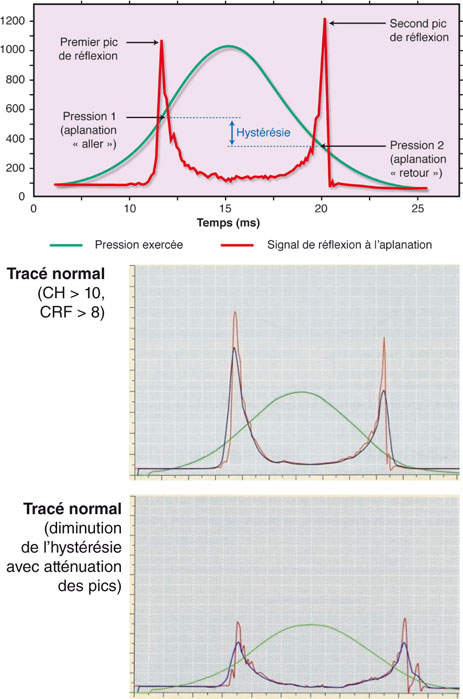
Fig. 21-3 ORA® : analyse de la viscoélasticité cornéenne.
Son observation est cruciale en chirurgie réfractive, surtout dans le domaine de la presbytie, car c’est sa transparence qui va conditionner le choix thérapeutique, quant à décider d’une chirurgie cornéenne ou intraoculaire. L’évaluation de sa transparence est devenue cruciale à l’heure où se pose la question de définir si la phacoexérèse est indiquée dans un but purement réfractif ou dans le cadre d’une chirurgie de la cataracte vraie [45]. En dehors de l’acuité visuelle qui représente à cette heure le seul critère officiel de diagnostic de la cataracte, avec un seuil de 5/10, il paraît important d’introduire d’autres paramètres que sont la gradation de l’opalescence cristallinienne et la quantification de sa densité. La cataracte devrait ainsi se caractériser comme une altération optique et/ou anatomique du cristallin conduisant à un retentissement sur la vision qualitative et/ou objective [13]. La transparence du cristallin est officiellement établie selon la classification LOCS III internationale qui tient compte de la localisation (centrale, périphérique, nucléaire, corticale, capsulaire et/ou sous-capsulaire) et de l’intensité de l’opacification [34, 51]. D’autres outils de type Scheimpflug camera (Pentacam®, Oculus) (fig. 21-4) et aberromètre OQAS proposent également une mesure de densitométrie du cristallin[5, 6, 35]. Leur intégration dans l’arsenal des outils diagnostiques devrait permettre d’apporter une confirmation du vieillissement cristallinien en cas d’altération de la qualité de vision perçue par le patient et objectivée par un questionnaire de vie (cf. chapitres 23et 24).
Il paraît ainsi important d’affiner la définition de la cataracte à partir de ces nouveaux critères, afin de dépasser la seule valeur d’acuité visuelle et de détecter les signes de modifications du cristallin liés au temps qui passe. Ceux-ci peuvent parfois exister dès à partir de cinquante-cinq ans, compte tenu des conditions actuelles de vie exigeantes en performances visuelles et des implants réfractifs disponibles capables de combiner un retrait de la cataracte et un retrait de lunettes.
Cette différence entre échange réfractif du cristallin et chirurgie de la cataracte réfractive est importante à établir, car il en découle des conditions de prise en charge différentes.
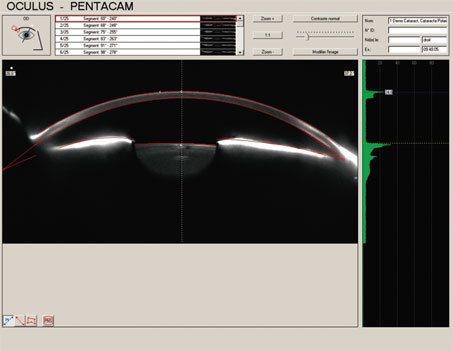
Fig. 21-4 Image Scheimpflug (Pentacam®, Oculus) : mesure de la densitométrie cristallinienne.
L’étude de l’anatomie et des dimensions intraoculaires revêt son intérêt dans la vérification de la conformation normale des angles, en particulier chez le grand hypermétrope, et surtout dans l’évaluation des mouvements d’un implant accommodatif et des structures anatomiques de voisinage au cours de la dynamique d’accommodation.
La pupillométrie est un paramètre d’importance en chirurgie réfractive, surtout en matière de chirurgie de la presbytie car la qualité de la dilatation d’une pupille conditionne la vision qualitative en favorisant la survenue de halos, d’éblouissements en cas de grande pupille mésopique, dépassant 7 mm, et rentrant ainsi en conflit avec des berges d’ablation ou l’équateur d’un implant intraoculaire. Plus spécifiquement, en matière de correction de la presbytie reposant sur un concept multifocal, la réactivité pupillaire joue un rôle crucial, puisque les performances visuelles reposent sur une dilatation pupillaire adaptée à la zone optique sélectionnée pour une distance de vision donnée : myosis en vision de près, diamètre intermédiaire en vision de loin photopique et mydriase en condition scotopique. Cette dépendance de la pupille et, par là même, des conditions d’éclairage ambiant doit être impérativement expliquée aux patients avant l’opération.
La mesure objective de cette réaction pupillaire ne peut à cette heure hélas qu’être approchée de façon statique en mesurant les diamètres de la pupille en conditions de pleine luminosité et d’obscurité (Colvard®, Procyon®). En revanche, il n’existe pas de plateforme disponible capable de renseigner non seulement sur les dimensions extrêmes de la pupille mais également sur la quantification du temps nécessaire à la pupille pour passer de l’état contracté à dilaté.
À l’heure de la quête de la perfection en matière de chirurgie réfractive en termes de rapidité de récupération, de performances visuelles optimisées et de confort ressenti du patient, il apparaît que la source actuelle de complications communes est relative à l’altération de la surface oculaire. Celle-ci est souvent sous-estimée car elle n’est que rarement explorée en préopératoire en l’absence de symptômes d’alerte. Or elle est inductrice d’une comorbidité significative pouvant atteindre, selon des estimations globales (sans essai contrôlé), 50 % des cataractes opérées et 30 % des LASIK de tous types.
Les maladies de la surface oculaire (Ocular Surface Diseases, OSD) constituent une entité regroupant : l’œil sec (primitif ou volontiers secondaire induit par lentilles de contact, ménopause, médications), les paupières opérées et les blépharites — dans laquelle la rosacée joue un rôle important, surtout dans la population des candidats à la chirurgie de la presbytie — et, enfin, l’allergie oculaire. Plus spécifiquement, la sécheresse oculaire se définit comme une maladie multifactorielle touchant le système lacrymal et la surface oculaire, donnant lieu à une symptomatologie d’inconfort, de perturbation visuelle et d’instabilité du film lacrymal avec un risque potentiel de dommage de la surface. L’inflammation, de découverte récente, y est de règle associée et est mise en évidence en particulier par une augmentation de l’osmolarité. Si le processus devient durable, la dérégulation de la surface oculaire peut se chroniciser [32].
L’intégrité de la surface oculaire conditionne le succès de toute chirurgie réfractive, qu’elle soit cornéenne ou intraoculaire [42]. À cette heure, en effet, l’œil sec représente la plus commune complication de la photoablation de surface et surtout du LASIK, qui a même conduit à la description d’une entité spécifique baptisée LINE (pour LASIK-Induced Neurotrophic Epitheliopathy) décrite par Ambrosio et Wilson [4]. Parmi les mécanismes en cause et ceci quel que soit le modèle de laser utilisé, il faut évoquer les changements de la forme de la cornée perturbant la dynamique lacrymale, entraînant une dessiccation de la surface oculaire et altérant la distribution du film lacrymal en relation avec la paupière supérieure. Par ailleurs, une blépharite peut prédisposer à l’infection et à l’inflammation (notamment de l’interface d’un LASIK) ; une épithéliopathie peut induire un œil sec, une kératite ponctuée superficielle, des kératalgies récidivantes, voire être responsable d’une fragilité de surface peropératoire (faisant le lit d’une invasion épithéliale sous le volet ou d’une kératite lamellaire diffuse : « SOS syndrome ») et d’un retard de cicatrisation postopératoire. L’allergie sera cause d’irritation chronique, d’inflammation, de sécheresse, pouvant même compromettre la transparence cornéenne.
Y a-t-il une différence entre LASIK et ablation de surface (photokératectomie réfractive) ? Le maintien d’un épithélium intègre devrait permettre une plus rapide réhabilitation, avec moins de douleur et de réponse cicatricielle, avec de plus une stabilité accélérée. Cependant, la présence d’un volet à charnière responsable d’une trans-section d’un large nombre de fibres sensorielles afférentes (innervées par le V et le système sympathique) lors de la découpe lamellaire, impacte l’intégrité fonctionnelle de la glande lacrymale [19]. Au total, le LASIK est plus souvent pourvoyeur de sécheresse oculaire que l’ablation de surface [47, 48, 53]. L’hypothèse actuelle concernant la sécheresse induite par le LASIK repose sur la combinaison d’un facteur neurotrophique et inflammatoire. En effet, sur le plan physiopathologique, l’interruption des fibres nerveuses par la découpe du capot entraîne une diminution de l’influence de la régulation neurotrophique sur les cellules épithéliales — avec diminution de la sécrétion des modulateurs trophiques qui régulent le métabolisme et la viabilité cellulaire —, une baisse du taux de clignement, de la production basale et du réflexe des larmes [52]. En parallèle, comme précédemment souligné, les changements de forme de la cornée induits par la correction laser de l’amétropie provoquent une modification de la distribution du film lacrymal, de l’interaction entre surface oculaire et paupière supérieure, une augmentation de l’évaporation lacrymale et du risque de dépôt ferrique. Un possible dommage des cellules souches limbiques sous l’effet de l’anneau de succion a été évoqué mais ne joue probablement qu’un rôle minime. Au total, la diminution de cette activité lacrymale est constante mais ne dure en règle générale que quelques mois ; ce n’est qu’en cas d’altération préopératoire de la surface oculaire que l’altération sera responsable d’un trouble chronique du mécanisme de réparation.
La boucle de régulation faisant intervenir les facteurs de croissance et donc de médiation nerveuse est perturbée par la section des nerfs cornéens qui induit en particulier une baisse significative des trois principales protéines de la réparation : lactoferrine, IgA (lipocaline lacrymale), lysozyme. Il existe une influence de la profondeur de découpe, en faveur des capots fins concernant l’influence sur l’action neurogénique car la majorité des fibres nerveuses sont concentrées sur deux tiers de la profondeur cornéenne [44]. De ce fait, les capots fins seraient source d’une meilleure récupération de la sensibilité cornéenne et de la réparation de la surface oculaire. La notion d’un volet à charnière supérieure sectionnant les fibres nasales et temporales plus délétère qu’une charnière nasale ne coupant que le versant temporal est aujourd’hui controversée par la démonstration, en microscopie confocale notamment, d’une répartition des terminaisons nerveuses égale sur les quatre quadrants [39]. Les derniers affinements apportés au dessin du capot associent outre la diminution d’épaisseur à 100 µm, l’élargissement de la charnière et des conformations inversées des berges, le tout contribuant à une architecture nouvelle du capot pouvant diminuer l’incidence de la sécheresse oculaire postopératoire [7, 24, 37]. À noter cependant que ce risque augmente avec la pratique d’un capot de grand diamètre (supérieur à 9 mm-9,5 mm) nécessaire au traitement de l’hypermétropie et de la presbytie, en raison d’une découpe se rapprochant du limbe. Celui-ci est doté d’une capacité de réactivité cellulaire, immunitaire et inflammatoire supérieure au centre de la cornée.
L’inflammation dans cette physiopathologie de l’altération de la surface oculaire après chirurgie de la cornée joue un rôle important dans la diminution de la fonction lacrymale, avec une augmentation de l’osmolarité et du taux de cytokines pro-inflammatoires (par les cellules limbiques épithéliales) et des enzymes de dégradation de la matrice. L’inflammation peut directement altérer les cellules épithéliales, prolonger le dommage des nerfs cornéens et abîmer la glande lacrymale, conduisant à une dégradation de la surface oculaire.
Dans le même registre sont à ranger les chirurgies par mise en place de lenticules intrastromaux qui, de la même façon, impliquent un volet ou une tunnélisation cornéenne ainsi qu’un changement de la courbure cornéenne variable selon le concept.
La population candidate à la chirurgie intraoculaire de la presbytie est sans nul doute la plus volontiers concernée [38]. En effet, il s’agit de patients de règle de plus de cinquante-cinq ans, présentant des changements hormonaux, palpébraux (blépharites, rosacée avec meibomite), preneurs de médications, voire porteurs de maladies systémiques favorisant la sécheresse, telles qu’un diabète[11, 31]. Il sera important de dépister et de traiter au préalable à l’opération de phaoexérèse, car la chirurgie pourra exacerber ces conditions prédisposantes par l’incision avec section nerveuse (certes minimisée par la pratique de mini-incision). L’opération sera souvent accompagnée d’une sécheresse transitoire dont il faudra informer le patient. En vérité, ce symptôme est devenu la plainte dominante, même si le plus souvent minime et non durable, car il est le seul persistant compte tenu de l’inflammation minimisée par les petites incisions et la récupération visuelle optimisée par des implants performants, emmétropisants, associés à une opération sans suture [58, 59].
La pathologie de la surface oculaire est une préoccupation récente de la chirurgie réfractive ; son incidence apparaît grandissante depuis qu’elle est recherchée. Ainsi, selon Waltz (communication orale), elle serait estimée à un patient sur six opérés, tandis que dans l’étude PHACO (Prospective Health Assessment of cataract Patient’s Ocular Surface study) incluant neuf centres américains (cent quatre-vingt-quinze yeux), 15 % des yeux présenteraient une sécheresse préopératoire (avec un test à la fluorescéine plus significativement perturbé que le BUT ou que le Schirmer), 56 % seraient porteurs de blépharites [26].
Les implications en cas de syndromes secs non diagnostiqués et non traités avant la chirurgie ne sont pas négligeables, car topographie, aberrométrie et kératométrie s’en trouvent modifiées, ce qui expose à une possible perte de la précision de calcul des puissances d’implants, de la mesure de l’axe et du degré d’astigmatisme — autant de paramètres cruciaux en matière d’implantation torique.
Ces suites opératoires embarrassantes, qui peuvent aliéner la vie d’un patient, soulignent l’importance de dépister les troubles de la surface oculaire avant la chirurgie, non pour forcément la contre-indiquer mais pour la traiter au préalable à l’opération afin d’en garantir le résultat attendu, au prix parfois d’un maintien prolongé du traitement lubrifiant au décours du geste. Il pourra être justifié de préférer une approche en surface plutôt qu’en LASIK en cas de syndrome sec préopératoire significatif, car le LASIK en est plus pourvoyeur que la photokératectomie réfractive.
Un questionnaire de vie en premier lieu détectera et quantifiera les signes d’alerte, tels que photophobie, kératalgies nocturnes, sensations de corps étranger, fluctuations visuelles, sans oublier, surtout chez la population vieillissante concernée par la presbytie, l’enquête sur l’existence d’une maladie générale de type arthritique ou immunitaire [50] et la prise de médications pouvant induire une sécheresse secondaire (diurétiques, anticholinergiques, antidépresseurs [23], antihistaminiques…). En plus des anomalies cornéennes évoquées plus haut, se concentrant en particulier sur la recherche des anomalies de l’épithélium et de sa membrane basale, l’examen à la lampe à fente explorera également le limbe et les conjonctives (dépistant hyperémie, papilles, follicules de l’allergie) (fig. 21-5). Paupières et visage seront examinés soigneusement afin de dépister une conformation anatomique défavorable au maintien d’une intégrité du film lacrymal (ectropion, entropion…) ou une meibomite (fig. 21-6) éventuellement associée à une rosacée de la face, ou à un masque du lupus associé à un syndrome sec.
La séquence conventionnelle des tests d’évaluation de la surface oculaire peut être ici rappelée, explorant successivement les différentes couches du film lacrymal : la phase aqueuse fait appel au test de Schirmer (sans anesthésiant), la couche de mucine est testée par le temps de rupture du film lacrymal (BUT, Break-Up Time) et par le vert de lissamine (détectant les zones de défect de mucine), enfin la phase lipidique est évaluée avant tout par l’examen des paupières.
Sur le plan fonctionnel, la stabilité lacrymale est reflétée par le BUT mais également par la continuité des mires du vidéokératoscope (du vidéotopographe) ou encore par les fluctuations de l’aberromètre. D’autres outils plus sophistiqués l’évaluent : le tearscope et l’interférométrie des larmes. La production des larmes est approchée par le ménisque lacrymal le long de la paupière inférieure (en cas de dysfonctionnement meibomien, de blépharite) et par le test de Schirmer (sauf en cas d’insensibilité sur un œil sec chronique). Le test à la fluorescéine serait positif dans 2 % à 6 % des cas après le LASIK, révélateur d’une kératite ponctuée superficielle (fig. 21-7) ; on étudiera dans le test au vert de lissamine le marquage en cornée et en conjonctive reflétant l’altération de la couche de mucine.
Cependant, il faut souligner qu’il n’existe qu’une pauvre corrélation entre la clinique et les résultats des explorations : ainsi, 20 % à 50 % des patients selon les auteurs se plaindraient de sécheresse après LASIK, signifiant que la majorité ne présentent pas d’anomalie des tests associés. De nouveaux biomarqueurs et outils d’imagerie ont été récemment mis à disposition pour une évaluation plus précise et prometteuse de la surface oculaire.
L’osmolarité lacrymale peut être mesurée par le Tearlab® (Medeuronet), qui l’obtient par capillarité à partir d’un échantillon de larmes (d’au moins 50 nl). Il détecte un défect aqueux ou par excès d’évaporation. La valeur seuil d’osmolarité est de 308 mOsm/l, au-dessus de laquelle le diagnostic d’œil sec est retenu (fig. 21-08). C’est un instrument qui semble utile potentiellement pour le dépistage d’une altération de la surface en préopératoire et pour la comparaison de traitements lubrifiants réparateurs [57].
Le retentissement visuel occasionné par une altération de la surface oculaire est un volet tout récemment abordé grâce à l’aberrométrie, qui constitue l’outil novateur de la quantification de la qualité de vision. En effet, avant qu’une baisse objective de l’acuité visuelle ne soit notée, existe une dégradation de la qualité de vision sous la forme d’une labilité des images aberrométriques, alors que l’OCT pourra parfois révéler une aire d’accumulation des larmes le long de la paupière inférieure. Mais, surtout, c’est l’exploration par OQAS (double pass retinal images), enregistrant la sensibilité aux contrastes et la mesure de la dispersion de la lumière (scatter light), qui sera la plus contributive : cet appareil permet de réaliser une évaluation non invasive de la dynamique du film lacrymal. Son principe de fonctionnement repose sur le passage de la lumière laser au travers des structures oculaire de la cornée à la rétine, puis réfléchie de la rétine vers la caméra CDD. Le film lacrymal représente le premier milieu : il retentit sur l’image s’il est inhomogène, contaminé de débris ou s’il existe des variations locales d’épaisseur ; il peut alors en découler une augmentation des aberrations optiques d’ordre supérieur et de la dispersion de la lumière (scatter light) dans la surface antérieure, affectant la dispersion globale de la lumière au travers du système optique global. Il existe différentes sources de scatter light physiologique : cornéennes (chirurgies, haze, dystrophies…), cristalliniennes (cataracte…) et vitréennes (hyalite…) [30, 41]. Les résultats s’expriment en sensibilité aux contrastes sous la forme du MTF (Modulation Transfert Function), qui correspond au ratio Contraste de l’image/Contraste de la source objet. La seconde valeur fournie par l’OQAS est l’indice objectif de diffusion, intitulé OSI (Optical Scatter Index), qui évalue la diffusion intraoculaire, comparant la quantité de lumière à la périphérie par rapport à celle du centre : plus la diffusion est importante, plus l’indice est élevé. Ainsi, chez le sujet jeune, l’OSI attendu est inférieur à 5, alors qu’il augmentera en cas de cataracte. La mesure se fait à partir d’une série de quarante images consécutives, ne prenant pas plus de 0,5 s, sur un patient évitant de cligner. Elle se réalise sous faibles conditions de lumière ambiante, afin de travailler avec un diamètre pupillaire optimal dans le but d’augmenter la sensibilité de la méthode. Une étude a été conduite par A. Benito (communication ASCRS 2011) montrant une élévation de l’intensité de l’OSI dans le temps comparable du test du BUT entre yeux normaux et ceux atteints de syndrome sec modéré. Ainsi, l’OQAS permettrait une détection précoce et un suivi du film lacrymal des patients présentant une altération du film lacrymal (fig. 21-9).
Parmi les nouvelles plateformes de prise en charge de la surface oculaire, il faut mentionner le Lipiview®-Lipiflow® (TearScience), qui a bénéficié de l’agrément FDA et a reçu le marquage CE. Cet équipement permet à la fois un diagnostic de dysfonctionnement meibomien et en propose un traitement, sachant que 65 % des causes de syndrome sec sont relatives à un excès d’évaporation dont l’étiologie principale est la meibomite par obstruction des glandes (fig. 21-10). La première étape est représentée par un trépied diagnostique, analysant par un questionnaire « SPEED » la symptomatologie, puis évaluant par un examen en lampe à fente la fonction des glandes de Meibomius (MGE, Meibomian Glands Evaluator) et, enfin, analysant la qualité du film lacrymal par le Lipiview®. Cette dernière phase est établie sur l’évaluation de l’épaisseur de la couche lipidique, la répartition sur la surface oculaire et l’analyse du clignement. La seconde étape est donc thérapeutique et vise à relancer la fonction des glandes de Meibomius dans le but d’arrêter l’évaporation et permettre la lubrification : ce traitement recourt à une coque (à usage unique) appliquée sur chaque œil fonctionnant par pulsation thermique (Lipiflow®) [29]. La chaleur est appliquée directement aux glandes de Meibomius à travers la conjonctive palpébrale des paupières supérieures et inférieures. Une pression graduée et pulsée est appliquée sur la partie externe des paupières, visant à soulager simultanément l’obstruction des glandes meibomiennes supérieures et inférieures. Le bénéfice apporté serait durable pour une période d’environ six mois, selon la sévérité de la pathologie initiale.
Notons que cet arsenal de nouveaux traitements décrits pose le problème de leur coût, en raison de l’absence de remboursement.
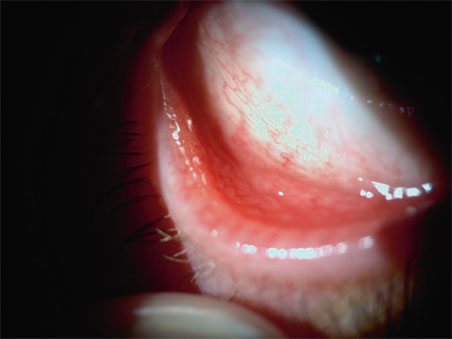
Fig. 21-5 Conjonctivite allergique.
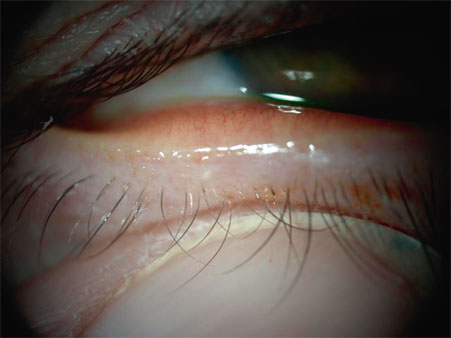
Fig. 21-6 Dysfonctionnement meibomien (meibomite dans le cadre d’une rosacée oculaire débutante).
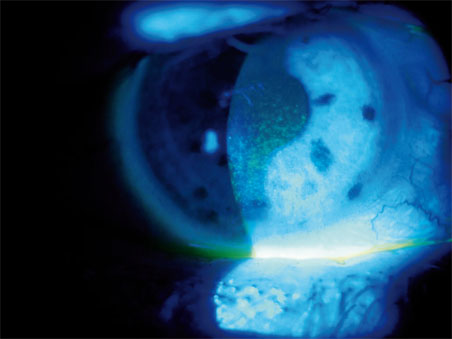
Fig. 21-7 Marquage à la fluorescéine : kératite ponctuée superficielle (syndrome sec modéré).
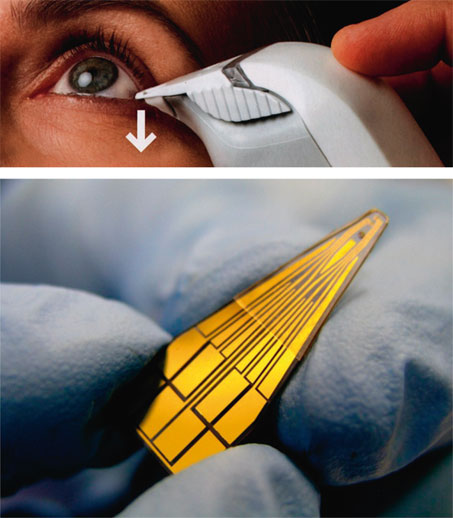
Fig. 21-8 TearLab® (Medeuronet) : mesure de l’osmolarité lacrymale par capillarité.
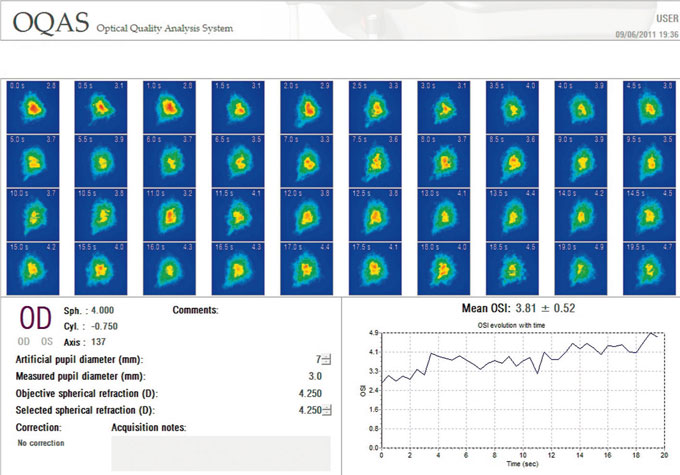
Fig. 21-9 OQAS. Mesure de la dispersion (scatter) de la lumière dans les milieux oculaires.
Mesure du MTF : contrastes ; OSI, Objective Scatter Index, > 5 : cataracte.
Fig. 21-10 Lipiview®, Lipiflow® (Tearscience). Plateforme de diagnostic et de traitement du dysfonctionnement meibomien.
En premier lieu, il faudra préparer la surface oculaire en préopératoire en proposant systématiquement des substituts de larmes (de préférence sans conservateurs) pour un à trois mois chez tous les patients, voire au long cours chez ceux présentant un syndrome sec [15]. Il existe depuis peu un regain d’intérêt pour le recours aux bouchons méatiques — qui peuvent être transitoires — en accompagnement du LASIK chez les sujets prédisposés, voire de façon systématique. Les patients présentant une blépharite devront conduire des soins d’hygiène des paupières, sous forme de massage et toilette aux compresses imprégnées d’eau bouillie tiédie, pouvant si nécessaire être renforcés d’une cure de cyclines et aidés d’un masque ou de lunettes chauffantes à chambre humide (Blephasteam®, Théa). De façon exceptionnelle, le traitement par stéroïdes pourra calmer une inflammation de la surface, ce qui invitera à différer le geste jusqu’à vérification de la normalisation de la surface à distance du traitement, de même en cas de recours à de la ciclosporine à concentration de 0,05 % (Restasis®) à but anti-inflammatoire et lubrifiant, que le libre accès aux États-Unis rend plus systématiquement prescrite [14, 56]. Certains praticiens seront enfin adeptes de la micronutrition et prescriront une supplémentation combinant oméga 3, vitamines B12, C, E, et minéraux (zinc) dans un équilibre des dosages spécifiquement élaboré pour la sécheresse oculaire.
En deuxième étape, il conviendra de protéger la surface oculaire pendant la chirurgie. Il est important de préserver la cornée et la conjonctive du traumatisme chirurgical, par exemple par un arrosage fréquent ou même par une application d’un visqueux dispersif, apportant agent trophique et optimisant la visualisation des milieux de façon prolongée.
Il conviendra ensuite de réhabiliter la surface oculaire en postopératoire. Ceci se fera par le contrôle de la surface oculaire et par le maintien si nécessaire d’un traitement lubrifiant prolongé, avec la même hiérarchie que celle décrite en préopératoire. Une sensibilisation et une éducation du patient seront requises sur l’intérêt du traitement au long cours, ce qui n’est pas toujours bien accepté par un patient qui vit ce traitement local comme une contrainte et la gêne induite par la sécheresse comme une complication de la chirurgie [43].
La place de la rétine dans le débat sur les indications de la chirurgie réfractive demeure un grand sujet de controverse. Dans le domaine de la chirurgie de la presbytie, qui concerne des patients d’âge mûr ayant déjà amorcé le processus de vieillissement oculaire, la question de la rétine se pose en termes de dépistage d’altération méconnue et de conduite à tenir en cas de survenue d’un décollement de rétine, de lésions maculaires ou du nerf optique.
La mise en place d’un anneau de succion en cas de procédure LASIK expose à une fragilisation de la rétine avec de rares cas d’hémorragies maculaires et d’exceptionnels décollements de rétine rapportées[1, 2, 18, 33, 40, 49, 55]. Plus à risque encore, la rupture de la barrière cristallinienne en cas de phacoexérèse à but réfractif expose à une augmentation du risque de décollement de rétine secondaire, d’autant plus qu’il n’existe encore qu’un détachement partiel du vitré. Son incidence est difficile à établir car il n’existe pas dans la littérature de données scientifiques chiffrant précisément le risque de cette complication en cas de chirurgie du cristallin clair — globalement estimé à 0,3 % dans le cas de la phacoémulsification, se multipliant par 2 à 10 en cas de myopie modérée et forte ? C’est pourquoi l’examen du fond d’œil, incluant l’exploration de la macula, complétée si doute ou si œil à risque d’une OCT, apparaît fondamental à proposer en cas de chirurgie intraoculaire pseudophaque [3, 28].
À cette heure, il est certain que toute rétinopathie (diabétique, hypertensive), toute maladie dégénérative (maculopathie liée à l’âge ou à la myopie forte) ou inflammatoire (uvéite, choriorétinite) de l’œil constitue une contre-indication à l’implantation multifocale. Celle-ci d’une part ne pourrait être optimisée dans ses résultats en raison d’une moindre capacité de la rétine altérée à faire le recueil de l’ensemble du signal lumineux et à assurer avec les aires corticales le tri de l’image la plus nette à chaque distance de vision ; d’autre part, une optique multifocale peut représenter une gêne à la visualisation parfaite du fond d’œil requis dans le suivi des maladies rétiniennes. En vérité, plus que la périphérie correctement accessible à l’examen en présence d’un implant multifocal, c’est la mise au point sur la macula qui peut s’avérer délicate. La difficulté cependant dépend du type d’implant (diffractif plus à problème que réfractif) et du nombre de zones de multifocalité.
Par ailleurs, la question aujourd’hui communément posée est celle du devenir de l’œil opéré porteur d’un tel implant se compliquant à distance d’une lésion rétinienne [10, 20]. S’il n’existe pas encore dans la littérature de cas décrits, des témoignages sur des œdèmes maculaires (voire des trous maculaires) (fig. 21-11) et des décollements de rétine secondaires à la phacoexérèse ont été rapportés (J. Gambrelle, SAFIR 2012) [27, 46]. Il est probable qu’il ne sera pas nécessaire de retirer un implant multifocal ni en cas de décollement, ni en cas de maculopathie car, dans ce cas, la dégradation visuelle sera certainement si notable qu’aucun bénéfice ne sera escompté d’un remplacement par un modèle monofocal — tout comme un patient porteur d’une DMLA conserve communément ses verres progressifs. Comme déjà souligné précédemment, la chirurgie du décollement de rétine ne se heurte pas à des difficultés majeures ; seule la chirurgie maculaire est plus délicate. Il est à rappeler que les complications rétiniennes sont favorisées par une rupture du sac capsulaire, imposant de recourir à un implant au dessin adapté pour le sulcus voire à un monofocal en cas de stabilité insuffisante [36]. La survenue d’un œdème maculaire sera source d’une perte de capacité visuelle surtout en vision de près. Son traitement ne sera pas spécifique et fera se succéder anti-inflammatoire non stéroïdien, inhibiteur de l’anhydrase carbonique, voire injection intravitréenne de cortisone pour obtenir, dans bon nombre de cas, une réversibilité des lésions avec récupération visuelle. Parfois, une membrane épirétinienne s’organisera et le praticien se heurtera à la difficulté de visualiser la macula pour un abord chirurgical.
Fig. 21-11 Œdème maculaire cystoïde après implantation pseudophaque multifocal en OCT (rupture capsulaire peropératoire, implant multifocal trois pièces dans le sulcus).
La mesure de la tension oculaire doit systématiquement faire partie du bilan préopératoire car il est important de consigner cette mesure à titre de référence pour le suivi du patient — d’autant que la chirurgie de la presbytie concerne des patients en âge de révélation du glaucome à angle fermé. La vigilance sera d’autant plus renforcée que le patient décrira un terrain de glaucome familial. Avant tout, la mesure de la tension oculaire (en particulier pratiquée par aplanation) sera confrontée à la mesure de la pachymétrie, car il existe une relation entre ces deux grandeurs, conduisant à une mesure de tension intraoculaire d’autant plus importante que l’épaisseur de la cornée est grande (supérieure à 580 µm) ; il s’agira ainsi d’écarter les sous-estimations en cas de cornée fine et les surestimations en cas de cornée épaisse [16, 17, 21]. En cas d’alerte sur une valeur aux limites de la normale (supérieure à 16 mm Hg) et/ou d’examen de la papille montrant une coloration, une excavation, un anneau neurorétinien subnormaux, un champ visuel de dépistage (bleu-jaune), la réalisation d’une courbe de tension et des explorations morphologiques de la papille seront recommandées (OCT, tomographe rétinien de Heidelberg…) à la recherche des signes précurseurs d’un glaucome. Dans ce cas, une chirurgie réfractive serait, au moins au stade de découverte et jusqu’à période d’équilibration, contre-indiquée.
Est-ce ce que cela signifie qu’un patient soigné pour hypertonie ne peut bénéficier d’une chirurgie réfractive ? La réponse à cette question est à aborder avec prudence et il conviendra d’attendre au moins deux ans de traitement, d’absence d’évolution démontrée et de normalité complète des explorations paracliniques pour s’autoriser à proposer une opération à but fonctionnel.
Ce sont les procédures photoablatives au laser à excimères qui posent le problème le plus important en raison de l’affinement cornéen qu’elles engendrent. Cependant, en matière de presbyLASIK, à moins que les modifications d’asphéricité soient combinées à une correction d’une myopie, les changements induits ne sont que peu significatifs quant au retentissement sur la mesure de tension oculaire. En revanche, en cas de myopie traitée, il faudra considérer qu’un facteur correctif devra être apporté afin d’écarter le risque de sous-estimation (environ 2 mmHg à ajouter à la valeur recueillie si correction de – 4 D).
En matière de chirurgie intraoculaire, il est par ailleurs admis que le vieillissement du cristallin entraîne, outre une perte de la transparence, une augmentation du volume du cristallin refoulant les structures de voisinage et, ainsi, majorant le risque d’augmentation de la pression intraoculaire, ce qui peut être significatif sur un œil hypermétropique dont l’angle se trouvera réduit. Le retrait du cristallin revêt alors un caractère salvateur, permettant une diminution bénéfique des valeurs de tension. Si le nerf optique est intègre, la mise en place d’un implant réfractif pourra alors être discutée.


[1] Al-Rashaed S., Al-Halafi A.M. Retinal detachment after laser in situ keratomileusis. Middle East Afr J Ophthalmol, 2011 ; 18 : 224-7.
[2] Al-Rashaed S., Abboud E., Al-Dhibi H. Bilateral retinal detachment after laser in situ keratomileusis. Ophthalmic Surg Lasers Imaging, 2009 ; 40 : 180-4.
[3] Alió J.L., Ruiz-Moreno J.M., Shabayek M.H. et al. The risk of retinal detachment in high myopia after small incision coaxial phacoemulsification. Am J Ophthalmol, 2007 ; 144 : 93-8.
[4] Ambrósio R. Jr, Tervo T., Wilson S.E. LASIK-associated dry eye and neurotrophic epitheliopathy: pathophysiology and strategies for prevention and treatment. J Refract Surg, 2008 ; 24 : 396-407.
[5] Artal P., Benito A., Pérez G.M. et al. An objective scatter index based on double-pass retinal images of a point source to classify cataracts. PLoS One, 2011 ; 6 : e16823.
[6] Babizhayev M.A., Minasyan H., Richer S.P. Cataract halos: a driving hazard in aging populations Implication of the Halometer DG test for assessment of intraocular light scatter. Appl Ergon, 2009 ; 40 : 545-53.
[7] Barequet I.S., Hirsh A., Levinger S. Effect of thin femtosecond LASIK flaps on corneal sensitivity and tear function. J Refract Surg, 2008 ; 24 : 897-902.
[8] Beutelspacher S.C., Serbecic N., Scheuerle A.F. Assessment of central corneal thickness using OCT, ultrasound, optical low coherence reflectometry and Scheimpflug pachymetry. Eur J Ophthalmol, 2011 ; 21 : 132-7.
[9] Bühren J., Nagy L., Yoon G. et al. The effect of the asphericity of myopic laser ablation profiles on the induction of wavefront aberrations. Invest Ophthalmol Vis Sci, 2010 ; 51 : 2805-12.
[10] Cagini C., Fiore T., Iaccheri B. et al. Macular thickness measured by optical coherence tomography in a healthy population before and after uncomplicated cataract phacoemulsification surgery. Curr Eye Res, 2009 ; 34 : 1036-41.
[11] Cho Y.K., Kim M.S. Dry eye after cataract surgery and associated intraoperative risk factors. Korean J Ophthalmol, 2009 ; 23 : 65-73.
[12] Cruzat A., Pavan-Langston D., Hamrah P. In vivo confocal microscopy of corneal nerves: analysis and clinical correlation. Semin Ophthalmol, 2010 ; 25 : 171-7.
[13] Donaldson P.J., Chee K.S., Lim J.C., Webb K.F. Regulation of lens volume: implications for lens transparency. Exp Eye Res, 2009 ; 88 : 144-50.
[14] Donnenfeld E.D., Solomon R., Roberts C.W. et al. Cyclosporine 0.05 % to improve visual outcomes after multifocal intraocular lens implantation. J Cataract Refract Surg, 2010 ; 36 : 1095-100.
[15] Durrie D., Stahl J. A randomized clinical evaluation of the safety of Systane Lubricant Eye Drops for the relief of dry eye symptoms following LASIK refractive surgery. Clin Ophthalmol, 2008 ; 2 : 973-9.
[16] El Danasoury M.A., El Maghraby A., Coorpender S.J. Change in intraocular pressure in myopic eyes measured with contact and non-contact tonometers after laser in situ keratomileusis. J Refract Surg, 2001 ; 17 : 97-104.
[17] Emara B., Probst L.E., Tingey D.P. et al. Correlation of intraocular pressure and central corneal thickness in normal myopic eyes and after laser in situ keratomileusis. J Cataract Refract Surg, 1998 ; 24 : 1320-5.
[18] Faghihi H., Jalali K.H., Amini A. et al. Rhegmatogenous retinal detachment after LASIK for myopia. J Refract Surg, 2006 ; 22 : 448-52.
[19] Foulks G.N. Tear dysfunction from lacrimal gland to LASIK. Ocul Surf, 2010 ; 8 : 99.
[20] Fragkiskou S., Papadaki T., Minos E. et al. Lamellar retinal hole formation following routine cataract surgery. Semin Ophthalmol, 2009 ; 24 : 239-40.
[21] Garzozi H.J., Chung H.S., Lang Y. et al. Intraocular pressure and photorefractive keratectomy: a comparison of three different tonometers. Cornea, 2001 ; 20 : 33-6.
[22] Gavrilov J.C., Gaujoux T., Sellam M. et al. Occurrence of posterior vitreous detachment after femtosecond laser in situ keratomileusis: Ultrasound evaluation. J Cataract Refract Surg, 2011 ; 37 : 1300-4.
[23] Ghaffariyeh A., Chamacham T. Tricyclic antidepressants: potential therapeutic alternatives for treatment of dry eye symptoms after LASIK. J Refract Surg, 2008 ; 24 : 770-1.
[24] Golas L., Manche E.E. Dry eye after laser in situ keratomileusis with femtosecond laser and mechanical keratome. J Cataract Refract Surg, 2011 ; 37 : 1476-80.
[25] Goldberg D.F. Preoperative evaluation of patients before cataract and refractive surgery. Int Ophthalmol Clin, 2011 ; 51 : 97-107.
[26] Hardten D.R. Dry eye disease in patients after cataract surgery. Cornea, 2008 ; 27 : 855.
[27] Haug S.J., Bhisitkul R.B. Risk factors for retinal detachment following cataract surgery. Curr Opin Ophthalmol, 2012 ; 23 : 7-11.
[28] Knez N., Šiško K., Pahor D. Influence of cataract surgery on macular thickness – a 3-month follow-up. J Int Med Res, 2011 ; 39 : 1113-21.
[29] Lane S., DuBiner H.B., Epstein R.J. et al. A new system, the LipiFlow, for the treatment of meibomian gland dysfunction (MGD). Cornea, 2012, January 4th, published ahead-of-print.
[30] Lapid-Gortzak R., Van der Meulen I., Van der Linden J.W. et al. Straylight measurements before and after removal of epithelial ingrowth. J Cataract Refract Surg, 2009 ; 35 : 1829-32.
[31] Liu X., Gu Y.S., Xu Y.S. Changes of tear film and tear secretion after hacoemulsification in diabetic patients. J Zhejiang Univ Sci B, 2008 ; 9 : 324-8.
[32] Liu X., Yi C. Analysis of the reasons for not undergoing laser corneal refractive surgery in 611 patients. Cell Biochem Biophys, 2011 ; 61 : 711-4.
[33] Lois N., Wong D. Pseudophakic retinal detachment. Surv Ophthalmol, 2003 ; 48 : 467-87.
[34] Magalhães F.P., Costa E.F., Cariello A.J. et al. Comparative analysis of the nuclear lens opalescence by the Lens Opacities Classification System III with nuclear density values provided by Oculus Pentacam: a cross-section study using Pentacam Nucleus Staging software. Arq Bras Oftalmol, 2011 ; 74 : 110-3.
[35] Martínez-Roda J.A., Vilaseca M., Ondategui J.C. et al. Optical quality and intraocular scattering in a healthy young population. Clin Exp Optom, 2011 ; 94 : 223-9.
[36] Mearza A.A., Ramanathan S., Bidgood P., Horgan S. Visual outcome in cataract surgery complicated by vitreous loss in a district general hospital. Int Ophthalmol, 2009 ; 29 : 157-60.
[37] Mian S.I., Li A.Y., Dutta S. et al. Dry eyes and corneal sensation after laser in situ keratomileusis with femtosecond laser flap creation Effect of hinge position, hinge angle, and flap thickness. J Cataract Refract Surg, 2009 ; 35 : 2092-8.
[38] Movahedan A., Djalilian A.R. Cataract surgery in the face of ocular surface disease. Curr Opin Ophthalmol, 2012 ; 23 : 68-72.
[39] Nettune G.R., Pflugfelder S.C. Post-LASIK tear dysfunction and dysesthesia. Ocul Surf, 2010 ; 8 : 135-45.
[40] Neuhann I.M., Neuhann T.F., Heimann H. et al. Retinal detachment after phacoemulsification in high myopia: analysis of 2356 cases. J Cataract Refract Surg, 2008 ; 34 : 1644-57.
[41] Ondategui J.C., Vilaseca M., Arjona M. et al. Optical quality after myopic photorefractive keratectomy and laser in situ keratomileusis: Comparison using a double-pass system. J Cataract Refract Surg, 2012 ; 38 : 16-27.
[42] Quinto G.G., Camacho W., Behrens A. Postrefractive surgery dry eye. Curr Opin Ophthalmol, 2008 ; 19 : 335-41.
[43] Rosenfeld S.I. Evaluation and management of post-LASIK dry eye syndrome. Int Ophthalmol Clin, 2010 ; 50 : 191-9.
[44] Sánchez-Navés J., Furfaro L., Piro O., Balle S. Impact and permanence of LASIK-induced structural changes in the cornea on pneumotonometric measurements: contributions of flap cutting and stromal ablation. J Glaucoma, 2008 ; 17 : 611-8.
[45] Sharma K.K., Santhoshkumar P. Lens aging: effects of crystallins. Biochim Biophys Acta, 2009 ; 1790 : 1095-108.
[46] Sheu S.J., Ger L.P., Ho W.L. Late increased risk of retinal detachment after cataract extraction. Am J Ophthalmol, 2010 ; 149 : 113-9.
[47] Shtein R.M. Post-LASIK dry eye. Expert Rev Ophthalmol, 2011 ; 6 : 575-82.
[48] Sullivan B.D., Whitmer D., Nichols K.K. et al. An objective approach to dry eye disease severity. Invest Ophthalmol Vis Sci, 2010 ; 51 : 6125-30.
[49] Suzuki C.R., Farah M.E. Retinal peripheral changes after laser in situ keratomileusis in patients with high myopia. Can J Ophthalmol, 2004 ; 39 : 69-73.
[50] Tam P.M., Young A.L., Lam P.T. Sjogren syndrome and dry eye: the impact of corneal refractive surgery. Cornea, 2010 ; 29 : 1072.
[51] Tan A.C., Wang J.J., Lamoureux E.L. et al. Cataract prevalence varies substantially with assessment systems: comparison of clinical and photographic grading in a population-based study. Ophthalmic Epidemiol, 2011 ; 18 : 164-70.
[52] Toda I., Yoshida A., Sakai C. et al. Visual performance after reduced blinking in eyes with soft contact lenses or after LASIK. J Refract Surg, 2009 ; 25 : 69-73.
[53] Toda I. LASIK and the ocular surface. Cornea, 2008 ; 27 : S70-6.
[54] Touboul D., Roberts C., Kérautret J. et al. Correlations between corneal hysteresis, intraocular pressure, and corneal central pachymetry. J Cataract Refract Surg, 2008 ; 34 : 616-22.
[55] Tsai C.Y., Chang T.J., Kuo L.L. et al. Visual outcomes and associated risk factors of cataract surgeries in highly myopic Taiwanese. Ophthalmologica, 2008 ; 222 : 130-5.
[56] Utine C.A., Stern M., Akpek E.K. Clinical review: topical ophthalmic use of cyclosporin A. Ocul Immunol Inflamm, 2010 ; 18 : 352-61.
[57] Versura P., Profazio V., Campos E.C. Performance of tear osmolarity compared to previous diagnostic tests for dry eye diseases. Curr Eye Res, 2010 ; 35 : 553-64.
[58] Woodward M.A., Randleman J.B., Stulting R.D. Dissatisfaction after multifocal intraocular lens implantation. J Cataract Refract Surg, 2009 ; 35 : 992-7.
[59] Yamaguchi T., Negishi K., Tsubota K. Functional visual acuity measurement in cataract and intraocular lens implantation. Curr Opin Ophthalmol, 2011 ; 22 : 31-6.
[60] Yokogawa H., Kobayashi A., Tagawa K., Sugiyama K. In vivo laser confocal microscopic analysis of corneal K-structures after keratorefractive surgery (LASIK and epi-LASIK). Ophthalmic Surg Lasers Imaging, 2010 ; 41 : 494-8.
A. Abenhaim
La mesure de la réfraction après l’interrogatoire du patient est la première étape de tout examen ophtalmologique. Outre son importance diagnostique, la qualité de sa réalisation va contribuer à construire la relation de confiance indispensable à toute décision et guide le geste thérapeutique.
La détermination de la réfraction se déroule selon trois étapes successives :
– mesure de l’acuité visuelle brute ;
– mesure objective de la réfraction ;
– détermination subjective de la réfraction.
L’examen démarre par la mesure de l’acuité visuelle sans correction. En l’absence de toute pathologie, cette première mesure va donner un indice du trouble de la réfraction. Le tableau 21-I indique les différentes situations selon l’acuité de loin et de près [10]. Il est également important de noter ces mesures dans le cadre d’une chirurgie réfractive, cela permettra de les confronter aux résultats postopératoires.

Tableau 21-I Première indication à partir de l’acuité visuelle brute chez le presbyte.
Le terme de réfraction objective désigne toutes les méthodes permettant de déterminer la réfraction totale d’un œil sans faire appel à la participation subjective du patient. Historiquement, la réfraction était déterminée par la skiascopie, aidée de la kératométrie. La réfraction objective actuelle fait appel à l’usage routinier des kératoréfractomètres automatiques.
Les réfractomètres opèrent selon le principe de l’ophtalmoscopie indirecte. Ils déduisent directement l’amétropie du patient (fig. 21-12). Les réfractomètres projettent une image test sur la rétine et analysent par un second dispositif optique cette image. Le faisceau incident passe par la périphérie de la pupille et le faisceau réfléchi par le centre. Tous ces appareils utilisent une lumière infrarouge (880 nm), ce qui évite l’éblouissement du patient. La mise au point de l’image test réfléchie sur la rétine est effectuée par un système optoélectronique, l’image est saisie par un capteur électronique [8]. Les données recueillies sont traitées par un logiciel de calcul qui déduit l’amétropie.
Les réfractomètres automatiques peuvent opérer selon différents principes optiques : skiascopie, diaphragme de Schneider, netteté de l’image rétinienne, recoupement de l’image, mesure de la diminution de l’image, et celui de prismes rotatifs. Chaque fabriquant a choisi un des principes cités.
Les mesures sont effectuées selon tous les méridiens de l’œil et le temps de la mesure est de 0,05 à 0,5 seconde.
L’efficacité des différents systèmes optiques ou électroniques est comparable. C’est essentiellement le logiciel de calcul de conversion de la valeur de la lumière infrarouge en lumière visible qui fait la qualité de la mesure donnée par l’appareil.
L’appareil donne la valeur de la réfraction avec amétropie sphérocylindrique et la kératométrie sur les deux axes.
Ces appareils ont simplifié la mesure de la réfraction objective de nos patients. Néanmoins, ils gardent une certaine marge d’erreur liée à l’imperfection relative des logiciels de calcul. Les erreurs en sur- ou sous-correction de la sphère sont possibles et dépendent du logiciel de calcul de l’appareil. L’astigmatisme est souvent surévalué. La fixation n’est jamais tout à fait stable et, même avec une fixation brouillée ou reportée à l’infini, il persiste toujours une composante accommodative qui peut surestimer la myopie ou sous-estimer une hypermétropie. Enfin, la mesure perd de sa fiabilité sur cornée opérée.
L’examen est fait en trois mesures en rafale. L’appareil donne :
– une moyenne de la correction théorique sphérocylindrique ;
– la valeur kératométrique ;
– avec un indice de fiabilité de la mesure.
En règle générale, la valeur de la sphère est surestimée chez le myope, variable chez l’hypermétrope en fonction de l’âge et de l’état de fatigue du patient ; pour le cylindre, l’axe est souvent proche de celui mesuré, à 5° à 10° près, la puissance mesurée est souvent surestimée de 0,25 D à 0,75 D [2, 3]. En vérité, en l’absence de cycloplégie, s’ajoute à l’erreur machine le spasme accommodatif, qui peut conduire chez un patient non encore presbyte jusqu’à des valeurs de 3 D de myopie induite (surestimant le patient myope et sous-estimant l’hypermétrope).
Malgré ces limites indiscutables, les réfractomètres ont permis de standardiser la mesure de la réfraction objective. Ils sont devenus le point de départ de toute réfraction subjective. L’utilisation régulière du même appareil et la confrontation avec la réfraction subjective obtenue permettent à l’examinateur de se faire sa propre opinion de son appareil.
Fig. 21-12 Réfractokératomètre automatique.
En chirurgie réfractive, l’évaluation objective est complétée par d’autres appareils : les aberromètres et les topographes.
Les topographes cornéens étudient la surface de la cornée et ses rayons de courbure. Le calcul de la kératométrie n’est effectué que sur la cornée antérieure pour les topographes conventionnels de Placido.
L’aberromètre, à la différence du kératomètre automatique, projette le test sur la macula, déterminant l’astigmatisme total du système optique global. Les valeurs d’astigmatisme servent ici plus à la prescription de lunettes ou de base à la formule de la photoablation au laser à excimères.
La technique du front d’onde offre un moyen unique de mesurer et de corriger les imperfections propres à chacun(e) de manière à atteindre un niveau de précision supérieur à celui qu’autorisent les lentilles ou lunettes ; l’aberromètre peut être ainsi considéré comme un super-réfractomètre, sachant que la mesure de la sphère et du cylindre correspond à l’évaluation des aberrations d’ordre faible. Le traitement met en œuvre une analyse détaillée des performances de l’œil, analyse obtenue par une technique numérique d’optique adaptative qui avait été mise au point pour réduire les distorsions des télescopes les plus puissants. Désormais, grâce à elle, le chirurgien peut identifier, mesurer et corriger les imperfections d’un œil avec une approximation vingt-cinq fois supérieure à celle que permet le verre correcteur (lunettes ou lentilles de contact). L’aberromètre détecte chaque rayon lumineux quittant l’œil et dresse une carte de la manière dont cela se produit ; cette analyse très fine permet de mettre en valeur les imperfections (les aberrations) du système visuel de l’œil étudié.
Il existe deux types de topographes, les spéculaires (plus anciens) et les topographes d’élévation (plus récents).
Les topographes spéculaires utilisent des systèmes de mires (de Placido) projetées et calculent les courbures cornéennes qu’ils présentent avec différentes couleurs (zones plates en bleu et zones cambrées en orange et rouge). Ces techniques, qui détectent les principales anomalies de la cornée, ont l’inconvénient de n’étudier que la face antérieure de la cornée. Il n’y a pas de données concernant l’épaisseur et la face postérieure. C’est pourquoi d’autres méthodes ont été mises au point : la topographie d’élévation.
Cette technique d’élévation permet d’étudier la cornée par rapport à une sphère de référence (best-fit sphere). Les points les plus hauts sont représentés par des couleurs chaudes (rouge et orangé) et les points bas par des couleurs en bleu. Si le point est situé au niveau de la sphère de référence, la couleur est verte. Les topographes modernes sont donc des vidéokératographes avec lesquels les détails de la cornée sont obtenus à l’aide d’une coupole composée d’anneaux lumineux concentriques projetés sur celle-ci (principe du disque de Placido) avec, en parallèle, passage sur toute la surface de la cornée d’une double fente lumineuse. Une caméra CCD capte et enregistre la réflexion de ces anneaux par la cornée. L’image obtenue est analysée par l’ordinateur de l’appareil et le logiciel permet de visualiser, d’analyser et de comparer différentes cartes topographiques [11] — sachant qu’une machine ne peut être comparée à une autre et que seules des images exprimées en même échelle et réalisées à des temps différents par un appareil donné peuvent être comparées.
La topographie détermine précisément l’astigmatisme, sa symétrie et son axe.
L’usage extensif du réfractomètre automatique, contrôlé par un ordinateur couplé, a permis de raccourcir le temps d’examen de la réfraction et d’éviter les erreurs de transcription de la mesure sur le dossier.
Néanmoins, seule la qualité de l’évaluation subjective conduite par un praticien attentif à ce temps essentiel du bilan ophtalmologique permettra d’avoir des mesures fiables. Il faudrait se garder d’ajuster une lunette en prescrivant la formule sphérocylindrique obtenue par le réfractomètre automatique.
La réfraction subjective est la composante essentielle de l’évaluation de l’acuité visuelle du patient.
Le but de la réfraction est d’obtenir la compensation par des moyens subjectifs pour placer, à l’aide d’une correction optique, le remotum à l’infini pour chaque œil [4].
Conduite de l’examen subjectif :
– corriger d’abord aussi bien que possible l’amétropie sphérique en trouvant la sphère la plus convexe donnant l’acuité visuelle maximale ;
– corriger ensuite l’astigmatisme en introduisant un cylindre selon la méthode de Jackson puis en précisant par essais successifs l’axe précis puis la puissance appropriée du cylindre ;
– une fois l’astigmatisme corrigé, il reste à ajuster avec précision la correction finale de l’amétropie sphérique.
Il existe différentes méthodes et techniques de réfraction, chaque examinateur choisit celle qu’il maîtrise le mieux.
De règle, la séquence à proposer démarre par la réfraction subjective, suivie de la réfraction cycloplégique — dont on ne pourra s’affranchir que si la perte d’accommodation est complète, au-delà de soixante ans — et affinée par la réfraction manifeste, servant de référence pour le patient et de guide dans la stratégie chirurgicale.
La règle de Swaine permet d’estimer la réfraction sphérique ou l’équivalent sphérique en fonction de l’acuité visuelle brute d’un œil myope ou ayant été myopisé.
Inversement, en connaissant la valeur de la défocalisation myopisante, il est possible de calculer l’acuité visuelle théorique attendue. Cette règle s’exprime sous la forme (tableau 21-II) [10] :
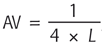 , où L est la puissance de la lentille de débrouillage.
, où L est la puissance de la lentille de débrouillage.
Son expression mathématique est :
– Swaine direct : AV = 0,25/Pa ou Pa = 0,25/AV (avec Pa, puissance de l’amétropie) ;
– Swaine inverse : Pa + 1,25 = Sb ou Pa = Sb – 1,25 (avec Sb, sphère de brouillage).
Pour amener l’acuité de 10 à 2/10, on brouille la Pa en rajoutant un verre de + 1,25, le patient est alors myope de – 1,25.
Hormis les cas idéaux, la règle de Swaine est une excellente règle qui permet de faire une hypothèse :
– chez le myope, elle permet :
– d’apprécier l’accommodation (la mesure au réfractomètre automatique est délicate chez le très fort myope) par le Swaine direct ;
– de trouver s’il existe ou non une surcorrection de lunettes par le Swaine direct ;
– d’estimer à 0,25 D à 0,50 D près la myopie, même s’il existe un astigmatisme, quels que soient la valeur et l’axe (grâce au réfractomètre automatique) ;
– de vérifier l’hypothèse de départ par le Swaine indirect ;
– chez l’hypermétrope, elle permet :
– de trouver la sphère de départ pour la méthode du brouillard par le Swaine inverse ;
– de borner la limite supérieure de l’hypermétropie subjective, par le Swaine inverse.
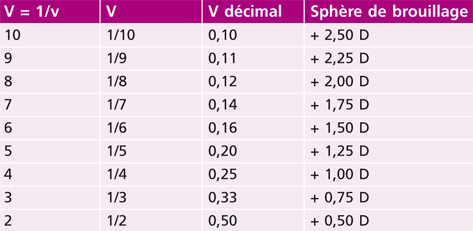
Tableau 21-II Acuité visuelle et sphère de brouillage.
Cette méthode a pour but de lever un spasme accommodatif éventuel. Elle consiste à myopiser un sujet au moyen d’une addition de lentilles convexes pour l’obliger à relâcher son accommodation
– chez l’hypermétrope : après détermination de la sphère permettant une acuité visuelle maximale, on ajoute + 2,50 D ; on réduit progressivement par paliers de 0,25 D la surcorrection jusqu’à atteindre l’acuité visuelle maximale ;
– chez le myope : on retranche 2,50 D à la valeur apparente de la myopie ; on reprend l’examen en augmentant par paliers de 0,25 D la correction jusqu’à avoir de nouveau l’acuité visuelle maximale.
Méthode :
– brouiller la sphère qu’on veut mettre au point ; cette sphère peut être celle estimée par Swaine direct ou avec le réfracteur automatique ;
– comment brouiller ? par la méthode statistique :
– Sphère de brouillage = Sphère estimée + SAE ;
– où SAE (sphère d’accommodation estimée pour l’âge) = 0,75 D à 1 D chez le presbyte ;
– cette méthode n’est cependant pas toujours suffisante pour faire céder un spasme accommodatif, ni pour trouver une hypermétropie latente ; lorsqu’un doute persiste, il ne faut pas hésiter à réaliser une réfractométrie sous collyre cycloplégique [7].
Le test duochrome rouge/vert (fig. 21-13) est utilisé en réfraction subjective pour affiner la correction optique. Il s’agit de la mise au point et/ou de la vérification de la sphère en monoculaire ou en binoculaire. Ce test est fondé sur l’aberration chromatique de l’œil : chez l’emmétrope, le foyer du jaune est sur la rétine, celui du vert en avant et celui du rouge en arrière.
Méthode :
– brouiller la sphère qu’on désire mettre au point ou vérifier de + 0,50 à + 1,00 ; cette sphère peut être estimée par le Swaine direct, trouvée par le réfracteur automatique ou mise au point par le brouillard ;
– le patient fixe les signes sur le tableau rouge/vert et il doit juger sur quel fond les caractères lui paraissent plus noirs, contrastés ;
– débrouiller la sphère par paliers de 0,25 D jusqu’à égalité dans le rouge et le vert ;
– si l’égalité ne peut être obtenue, laisser le myope dans le rouge et l’hypermétrope dans le vert [1].

Fig. 21-13 Test Rouge/Vert.
Il s’agit de placer devant la correction trouvée un face-à-main ou un verre de + 0,25 D et – 0,25 D :
– celui de + 0,25 D doit faire chuter l’acuité ; sinon, on ajoute + 0,25 D à la sphère ;
– celui de – 0,25 D doit donner une acuité identique, sinon ajouter – 0,25 D à la sphère.
Ajouter jusqu’à ce que + 0,25 D fasse chuter ou – 0,25 D soit pareil.
Le patient doit voir aussi net les traits horizontaux que verticaux. On place le cylindre de Jackson de puissance 0,50 en avant sur la monture (en statique), l’axe des négatifs à 90° dans la monture — la focale verticale doit alors être sur la rétine et donc vue nette :
– si les traits verticaux sont plus nets, ajouter – 0,25 D ;
– si les traits verticaux sont identiques aux horizontaux, c’est la bonne sphère ;
– si les traits horizontaux sont plus nets, ajouter + 0,50 D pour brouiller.
Ces tests servent donc à vérifier la sphère donnant l’acuité visuelle maximale. Une fois cela réalisé, nous poursuivons la réfraction subjective par l’étude de l’astigmatisme avec son axe et sa puissance [1, 7].
Le cylindre croisé de Jackson (CXJ) est une lentille d’une puissance sphérique de – 0,25 D et cylindrique de + 0,50 D. Elle permet de mettre au point l’astigmatisme, l’axe puis la puissance sans modifier l’équilibre dioptrique car son équivalent sphérique est nul.
L’axe du manche du CXJ permet la mise au point de l’axe de l’astigmatisme. L’axe des signes gravés sur la lentille permet la mise au point de la puissance de l’astigmatisme (fig. 21-14). Ainsi, les deux faces présentées alternativement permettent de déterminer l’axe puis la puissance.
La réfractométrie moderne suppose l’utilisation d’autoréfractomètres, il est à noter cependant que l’astigmatisme donné correspond à la valeur maximale à ne pas dépasser car modifié par l’accommodation. Concernant l’axe, il n’est pas toujours précis, mais il n’est pas loin de l’axe du cylindre subjectif.
Il existe une phraséologie à respecter :
– à la question : « Les lettres sont moins floues pour vous du côté 1, du côté 2, ou pareil ? », la réponse souhaitée est : « C’est pareil. » ;
– si on ne peut obtenir cette réponse d’emblée, il faut aller jusqu’au bout de la méthode d’encadrement des 20°.
La mise au point de l’astigmatisme se fait toujours après la mise au point de la sphère et cela sur la ligne d’acuité la plus haute obtenue lors de la mise au point de la sphère. On commence toujours par la mise au point de l’axe par l’encadrement des 20° ; la classique méthode des 5° ne sera utilisée que pour les très forts astigmatismes, le tout avec un CXJ de 0,25 D pour l’axe et la puissance — l’utilisation du CXJ de 0,50 D modifie la puissance du cylindre : on l’utilisera pour les amblyopies ou pour des astigmatismes de 0,25 associés à des spasmes accommodatifs.
Fig. 21-14 Cylindre croisé de Jackson.
– Comment manipuler le CXJ :
– superposer l’axe du cylindre (axe donné par le réfractomètre automatique) et l’axe du manche du CXJ ;
– repérer le signe « – » du CXJ situé du côté de l’étiquette du verre cylindrique ;
– poser dès le début la question au patient ;
– faire pivoter le CXJ autour de l’axe de l’astigmatisme ;
– repérer le signe « – » situé côté inscription ;
– poser la question ;
– modifier l’axe du verre cylindrique en fonction de la réponse du patient.
– La mise au point de l’axe se fait en trois étapes :
– première étape, comportant les sept manipulations : superposer l’axe du CXJ et celui du verre cylindrique ; si le patient voit aussi net ou aussi flou, c’est le bon axe ;
– si le patient voit mieux l’axe négatif à gauche par rapport à l’axe du verre cylindrique, alors tourner l’axe du verre cylindrique vers la gauche de 20° (encadrement choisi 110°-90°) ;
– placer l’axe du CXJ dans l’axe du verre cylindrique : idem, tourner de 10° si c’est dans le sens inverse.
– Manipulation du CXJ :
– superposer l’axe d’un signe du CXJ et l’axe du verre cylindrique ;
– question : « Vous voyez mieux en position 1 ou 2 ? » ;
– modifier la puissance du cylindre en fonction de la réponse du patient ;
– puis, on répète cette manipulation jusqu’à ce que les deux positions soient aussi nettes.
– L’axe du verre cylindrique a été précédemment mis au point et ne sera plus modifié. L’axe des signes « – » et « + » du CXJ, lui, sera toujours parallèle. Trois réponses sont possibles :
– « Pareil » ;
– « Mieux avec le – » : ajouter – 0,25 D ;
– « Mieux avec le + » : ajouter + 0,25 D.
Note : afin de conserver l’équilibre duochrome (rouge/vert), à chaque fois qu’on fait varier la puissance du cylindre de 0,50 en positif ou en négatif, nous ferons varier la puissance de la sphère en – 0,25 D ou en + 0,25 D. Donc, pour une variation du cylindre de – 0,50 D, on rajoute + 0,25 D à la sphère au palier.
Si le patient hésite entre deux puissances cylindriques, il faut conserver la puissance la plus faible.
Il existe deux autres méthodes qui vérifient l’existence ou non d’un faible astigmatisme, il s’agit de la méthode de Freeman et du trou sténopéique.
Cet examen permet d’équilibrer les deux yeux sur le plan accommodatif et en puissance dioptrique. On recherchera l’isoacuité et on donnera le confort à l’œil dominant en vision de loin. Pour cela, il peut être pratiqué au choix trois tests polarisés pour la mise au point de la sphère :
– le test rouge/vert polarisé : la méthode est la même que pour le test rouge/vert simple mais avec des lunettes polarisées ; le patient voit de son œil droit le haut du test et de son œil gauche le bas du test. Dans le meilleur des cas, on réalise l’équilibre dioptrique, sinon on laisse l’amétrope dans sa couleur ;
– le test de balance ou d’équilibre bi-oculaire : comparer et égaliser dans le flou l’acuité visuelle de chaque œil et trouver l’œil dominant ;
– la croix de Jackson (avec prismes dissociants) : le test est identique à celui en monoculaire mais, ici, les deux yeux sont dissociés par des prismes ; sur l’œil droit, un prisme de 3 D base inférieure et sur l’œil gauche un prisme de 3 D base supérieure, la réponse idéale étant les traits verticaux sont identiques aux traits horizontaux pour chaque œil.
Cet examen permet de donner le confort de vue et d’adapter la correction optique aux problèmes du déséquilibre phorique. L’affinement de la sphère au palier va se faire en binoculaire avec les tests de débrouillage, croix de Jackson, test rouge/vert simple et faces vérificatrices ± 0,25 D. Ces tests sont identiques à ceux pratiqués en monoculaire décrits plus haut.
L’examen de la phorie est réalisé à travers quatre principaux tests (cf. chapitre 22) :
– le test de Schober (avec lunettes rouge/verte), qui vérifie la vision simultanée et quantifie la déviation en cas d’hétérophorie en vision de loin (fig. 21-15) ;
– le test de Worth (avec filtre rouge/vert), nous renseigne sur la dominance oculaire ou la neutralisation (fig. 21-16) ;
– le test à coïncidence (verticale et horizontale), qui explore la vision simultanée, la correspondance rétinienne normale ou anormale, l’hétérophorie en vision de loin et l’anéisoconie (test de Morizet) (fig. 21-17) ;
– l’examen orthoptique sous écran reste le dépistage du vrai déséquilibre oculomoteur [5].

Fig. 21-15 Test de Schober.
Fig. 21-16 Test de Worth.
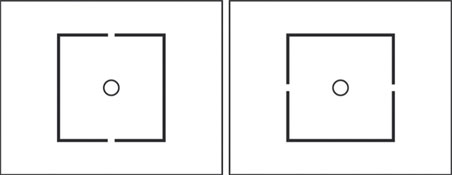
Fig. 21-17 Test à coïncidence vertical et horizontal.

La cycloplégie demeure incontournable dans l’examen de la réfraction du patient, des premiers mois de vie et jusqu’à la presbytie. Seule l’étude de la réfraction subjective sous cycloplégie permet de déterminer avec précision la réfraction de l’œil examiné, c’est-à-dire la correction optique qui l’emmétropise et permet de focaliser parfaitement l’image de l’objet en vision de loin sur la rétine.
Elle est obtenue ponctuellement avec un cycloplégique de référence (atropine, cyclopentolate commercialisé sous le nom de Skiacol®) et est censée supprimer le tonus ciliaire de base. En réalité, l’efficacité cycloplégique ne sera pas la même chez tous les sujets, en particulier en fonction des perturbations accommodatives induites par l’amétropie initiale ou les troubles moteurs.
Après instillation du collyre selon le protocole en vigueur, une mesure objective à l’autoréfractomètre est réalisée. Là encore, les valeurs données par l’appareil montrent quelques variations liées essentiellement à la fixation du patient.
Il s’agit de faire lire le patient tandis qu’on interpose devant l’œil examiné la correction optique indiquée par l’autoréfractomètre, en ajustant cette correction pour obtenir l’acuité visuelle la plus élevée. Le niveau d’acuité visuelle est fonction de la netteté de l’image rétinienne, qui dépend de la compensation exacte de l’amétropie.
Ceci détermine la réfraction la plus précise, à 0,25 D près, de l’œil examiné, c’est-à-dire la correction optique qui emmétropise l’œil.
La technique de réfraction reste identique à celle décrite dans la réfraction subjective.
La réfraction « manifeste », décrite par les Anglo-Saxons, correspond à l’état de repos d’un œil non cycloplégié, sans sollicitation accommodative. Elle peut être obtenue soit de loin par une fixation à 6 mètres soit de près par la fixation d’un spot éblouissant, dont l’effet en pénombre serait anti-accommodatif. Le problème est qu’il est difficile d’affirmer que le tonus ciliaire de base est parfaitement déterminé.
Ainsi, à distance de la mesure sous cycloplégie, sera réalisée une réfraction manifeste.
La méthode s’apparente à celle décrite pour la réfraction subjective. Sa particularité est de partir de la réfraction obtenue en cycloplégie comme valeur de base et de nuancer le cylindre, afin d’en confirmer la dépendance — en particulier chez les sujets auparavant corrigés en équivalent sphérique — et en définir l’axe et l’amplitude optimale. Puis est ajustée la sphère (par méthode du brouillard) pour définir la sphère minimale permettant d’obtenir l’acuité visuelle optimale (en rouge = vert).
Cette réfraction manifeste est une valeur précieuse puisque :
– c’est elle qui fonde la programmation d’un traitement conventionnel ;
– elle autorise le passage à un traitement assisté par aberrométrie ou par topographie que si elle est en corrélation avec les mesures de réfraction obtenue par ces plateformes de mesures pouvant guider la photoablation.
Chez le presbyte, la détermination de l’addition nécessaire pour pallier la perte de l’accommodation est relativement simple. Néanmoins, la détermination précise de la meilleure addition est déterminante pour le confort du patient. Il existe plusieurs méthodes pour déterminer l’addition exacte.
Tout d’abord, on détermine la distance de lecture pour chaque patient. On utilise classiquement la distance morphologique déterminée par Harmon qui sépare la pointe du coude à l’index replié sur le pouce. En règle générale (mais avec un défaut de standardisation), on travaille à 40 cm, cette distance procure le meilleur compromis confort et effort d’accommodation-convergence.
Avant de détailler les différentes méthodes de détermination de l’addition nécessaire, il est important de comprendre le rôle de cette addition sur la profondeur du champ de vision du presbyte corrigé. Les limites du parcours en vision de près restitué sont déterminées par l’amplitude de l’accommodation restante et par la puissance de l’addition.
Pour une presbytie donnée, la prescription d’une addition trop forte réduira le champ de vision dans la profondeur pour des verres unifocaux et également dans le sens de la largeur pour des verres multifocaux.
Différentes méthodes permettent de déterminer l’addition.
Le tableau 21-III résume les correspondances entre âge et addition. Fondées sur des méthodes statistiques, elles ne tiennent pas compte des variations individuelles et n’ont qu’un intérêt indicatif.

Tableau 21-III Addition en fonction de l’âge du sujet.
Le sujet presbyte muni de sa seule correction de loin sous-accommode, il va donc préférer le texte noir sur fond vert. Il suffit d’ajouter progressivement une addition devant les deux yeux par palier de + 0,25 D jusqu’à ce que le patient lise aussi bien dans le rouge et dans le vert. En cas d’impossibilité d’obtenir une égalité parfaite, il est préférable pour éviter une surcorrection de prescrire la dernière sphère qui permet de voir dans le vert.
Cette méthode est à éviter chez le sujet âgé où la modification de la couleur du cristallin perturbe la vision des couleurs.
Chez le patient porteur de sa correction de loin, on rajoute des cylindres croisés de Jackson ± 0,50 D avec axe du cylindre négatif à 90°. Le patient sous-accommodant va voir plus nettement des lignes horizontales. On rajoute progressivement des sphères convexes par palier de + 0,25 D jusqu’à ce qu’il voie mieux les lignes verticales du test et on prescrit la valeur d’addition donnant la meilleure égalité entre les deux lignes (tableau 21-IV [10], fig. 21-18).

Tableau 21-IV Réponses aux tests du sujet muni de son addition habituelle.
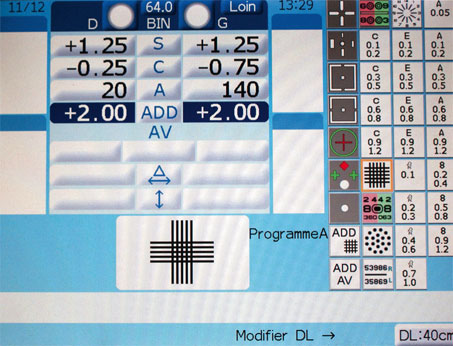
Fig. 21-18 Interface du réfracteur automatique. Ici, test de la croix de Jackson en vision de près à 40 cm.
On propose des additions croissantes par palier de + 0,25 jusqu’à ce que le patient puisse lire les plus petits caractères. Cette méthode comporte un risque élevé de surcorrection.
Le principe est de déterminer l’amplitude d’accommodation résiduelle à l’aide du test de lecture et d’en déduire l’addition.
La mesure se fait avec un test mobile ou un test fixe :
– avec un test mobile, on rapproche le texte jusqu’à ce que le patient ne puisse plus lire et on mesure la distance convertie en mètres ; puis, en partant presque du nez, on recule le test jusqu’à ce que le patient arrive à lire : l’amplitude d’accommodation est l’inverse de la moyenne de ces distances exprimées en mètres ;
– avec un test fixe placé à 40 cm, on demande au patient de fixer le Parinaud 2 et on ajoute des verres positifs devant la correction de loin, par quart de dioptrie, jusqu’à ce qu’il puisse deviner le texte (addition minimale) : l’amplitude maximale du patient est égale à 2,5 D diminuées de la puissance de l’addition minimale.
Pour calculer l’addition confortable, on rajoute à l’addition minimale soit la moitié (Sheard) soit les 2/3 (Percival) de l’amplitude d’accommodation résiduelle ou, plus simplement, une dioptrie — c’est la méthode dite de l’addition minimale [1].
Dans un premier temps, on détermine le calcul de l’addition minimale comme expliqué dans le paragraphe précédent (test fixe et verres convexes) et on rajoute 1 D pour obtenir l’addition permettant d’avoir une lecture confortable. Cette méthode est simple, éprouvée, la plus facilement reproductible. Le principe est de redonner au patient une accommodation apparente de 3,5 D.



[1] Beaubert E., Pariguet F., Taboulot S. Manuel de l’opticien. Maloine, Paris, 2005.
[2] Corbe C., Menu J.-P., Chaine G. Traité d’optique physiologique et clinique. Douin, Paris, 1993.
[3] Darras C. Éléments et réflexions d’optique physiologique. Era, Nantes, 1995.
[4] Duke-Elder S., Abrams D. Subjective verification of the refraction. In : Duke-Elder S. (ed.). System of Ophthalmology. Tome V. Kimpton, London, 1970.
[5] Hugonnier R., Hugonnier S. Strabismes. Masson, Paris, 1970 : 368-86.
[6] Landolt E. The refraction and accommodation of the eye and their anomalies. Pentland, Edinbourg, 1886.
[7] Malet F. Les lentilles de contact. Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 2009 : 201-17.
[8] Péchereau A. Réfractométrie automatique. Influence de la cycloplégie sur l’équivalent sphérique. Ophtalmologie, 1993 ; 93 : 309-12.
[9] Risse J.-F. et al. Exploration de la fonction visuelle. Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 1999.
[10] Roth A., Gomez A., Péchereau A. La réfraction de l’œil : du diagnostic à l’équipement optique. Elsevier, Paris, 2007.
[11] Saragoussi J.-J., Arné J.-L., Colin J., Montard M. Chirurgie réfractive. Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 2001.
A. Abenhaim
L’acuité visuelle repose sur le pouvoir de discrimination de l’individu : il s’agit tout simplement de la capacité de voir distinctement un objet. Ce test est incontournable et doit démarrer tout examen de la vue. En effet, sa mesure est le premier outil diagnostique d’un défaut visuel. Quantitativement, l’acuité visuelle s’exprime par l’inverse de l’angle minimum de résolution (AMR, ou MAR en anglais) exprimé en minute d’arc en fraction de Snellen [1, 10].
On distingue différents types d’acuités visuelles en fonction de la nature de la cible :
– le minimum visible est la capacité de distinguer un point ou une ligne unique de taille variable ;
– le minimum séparable est la capacité à distinguer deux points ou lignes parallèles séparées par un certain angle :
– la première échelle fut proposée par Landolt en 1874 sous la forme d’un anneau brisé ; la brisure de l’anneau peut prendre huit positions différentes ;
– il existe également le « E » de Snellen ou plus simplement le « E » de Raskin ;
– pour tous ces symboles, l’épaisseur du trait ainsi que toutes les ouvertures correspondent à un cinquième de la hauteur de la lettre (fig. 21-19) ;
– l’acuité visuelle morphoscopique, la plus couramment utilisée, fait intervenir des mécanismes de reconnaissance de forme : lettres, chiffres, dessins. Elle vient rajouter au pouvoir de résolution de l’individu un traitement de l’information visuelle par le cortex cérébral. On appelle cette mesure le minimum reconnaissable [4,5].
L’acuité visuelle dépend directement de l’angle minimum de résolution (AMR). C’est l’angle sous lequel le plus petit détail permettant la reconnaissance du plus petit symbole est lu. Ce détail est appelé élément discriminant [6]. L’acuité visuelle et l’angle minimum de résolution sont liés par la formule qui détermine le pouvoir de résolution (fig. 21-20) :

Fig. 21-19 Le « C » de Landolt, le « E » de Snellen et le « E » de Raskin.
(Source : site de la SNOF, 2000.)
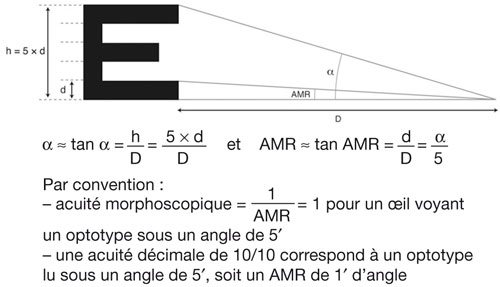
Fig. 21-20 Expression de l’angle minimum de résolution (ARM).
D, distance entre le sujet et le tableau d’acuité ; h, hauteur de l’optotype ; d, taille du plus petit détail permettant la reconnaissance de l’optotype.
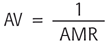
Le système de notation français inclut l’acuité sous forme de fraction de 10. Une acuité visuelle de 10/10 correspond à un angle minimum de résolution d’une minute d’angle.
Il existe des lettres plus faciles à lire que d’autres :
– faciles : « L », « T », « U », « V » ;
– difficiles : « S », « G », « H », « B » ;
– confusion : « F », « P », « R », « K », « X », « V », « T », « Y », « N », « M », « H » « O ».
L’acuité visuelle est meilleure avec des caractères séparés qu’avec des caractères groupés [13].
Des variations brutales d’acuité d’une ligne à l’autre peuvent perturber la performance du sujet. Les échelles logarithmiques à progression constante sont les meilleures.
La luminance de l’échelle doit être au minimum de 120 cd/m2 et la luminance du cabinet de consultation ne doit pas dépasser celle du fond de plus de 25 %.
Le contraste doit être au minimum de 80 %.
Pour la vision de loin, il a été démontré qu’une distance de lecture de 3 à 4 mètres augmente l’acuité visuelle. Si la pièce est trop petite, il faut utiliser le système à deux miroirs pour augmenter la distance.
L’acuité visuelle doit être mesurée au-delà de 3 mètres en vision de loin et pas à moins de 33 cm en vision de près, afin d’éviter une réponse accommodative ne correspondant pas à la vision de loin et pouvant donc modifier les capacités réelles du sujet.
Un diamètre pupillaire de 2 mm donne la vision optimale.
Il y a baisse de l’acuité avec l’âge.
En fonction de l’amétropie et de son type de correction (lunettes ou lentilles), l’image de l’échelle peut être agrandie (forte correction d’hypermétropie) ou diminuée (myopie).
D’autres facteurs comme le temps de présentation, la sommation binoculaire, les micromouvements oculaires peuvent influencer la mesure. Enfin, les facteurs psychologiques propres à chaque patient peuvent influencer la performance : fatigue, stress, etc.
Il est à noter que la mesure de l’acuité visuelle sous collyre cycloplégique reste indispensable car elle est censée supprimer le tonus ciliaire de base. En réalité, l’efficacité cycloplégique ne sera pas la même pour tous les sujets, en particulier en fonction des perturbations accommodatives induites par l’amétropie initiale ou les troubles moteurs. Cette acuité visuelle « brute » n’a de sens qu’en pratique de réfraction, afin de déterminer l’acuité visuelle maximale avec la meilleure correction sphérocylindrique (base de la réfraction manifeste).
L’échelle décimale est l’échelle la plus répandue en France. Elle propose une mesure par croissance de numérateur de la fraction : 1/10, 2/10… 8/10, 9/10, 10/10. La mesure respecte la règle de l’inverse de l’angle minimum de résolution [7]. Cette notation est indépendante de la distance d’examen.
La caractéristique de cette échelle est sa précision dans les fortes acuités : le nombre des lignes entre les acuités de 2 minutes d’arc (5/10) et d’une minute d’arc (10/10) est le même qu’entre 2 minutes d’arc (5/10) et 10 minutes d’arc (1/10). Ainsi, par sa progression, cette échelle est d’une faible précision dans les basses acuités visuelles [11].
Par ailleurs, aucun des paramètres suivants n’est maîtrisé : interactions du contour, lisibilité aléatoire des lettres, nombres différents de lettres par ligne, mémorisation [9].
Malgré ses handicaps, cette échelle est finalement la plus utilisée en pratique clinique pour évaluer la vision des presbytes à équiper en verres, lentilles ou dans le cadre de la chirurgie réfractive.
Cette échelle utilise une progression arithmétique du dénominateur. Le dénominateur diminue d’une unité d’une ligne à l’autre 1/10, 1/9… 1/3,1/2, 1/1.
Cette échelle est plus précise pour les faibles acuités. En revanche, elle est inutilisable en pratique car trop imprécise pour les acuités élevées.
Cette échelle combine l’échelle décimale et l’échelle aux inverses :
– 1/10, 1/9, 1/8… 1/3 (~ 3/10) ;
– puis 4/10, 5/10 jusque 14/10.
Elle cumule l’avantage des deux échelles précédentes et devient donc plus précise. Elle est présente dans de nombreux projecteurs de test. Cependant, on peut lui reprocher de ne pas avoir une progression régulière d’une ligne à l’autre, de ne pas contrôler le nombre de lettres par ligne, ni l’interaction de contour ou la mémorisation.
Les échelles logarithmiques ont été conçues pour maîtriser au mieux les facteurs de notation de l’acuité visuelle [2, 8]. Les échelles permettent des mesures plus précises d’acuité visuelle comparées aux échelles décrites précédemment. Ces types d’échelles sont les seules pour lesquelles la progression de l’efficience d’une ligne à l’autre est constante [15] : ces échelles ont une progression géométrique de la taille des lettres d’un facteur de 1,26 (26 %) ; ce pas de 1,26 traduit en unité logarithmique permet d’avoir une progression constante en chaque ligne lue de 0,1 unité log.
La notation logMAR utilise le logarithme de l’angle minimum de résolution (AMR ou MAR en anglais). On peut facilement convertir l’acuité chiffrée en unité log en acuité exprimée en dixièmes. Dans notre pratique courante, les acuités sont mesurées en dixièmes. Les acuités utilisées dans les communications spécifiques sont exprimées en logMAR. Il est impératif d’apprendre à convertir dans les deux sens les valeurs d’acuité visuelle :
– pour passer de la rotation logMAR à la décimale : AV = 10– (unité log) ;
– pour passer de l’acuité décimale en unité logMAR, on utilise le logarithme en base 10 de la valeur de l’acuité décimale : si AV = 1/10 = 0,1, log10(0,1) = – 1 en unité logMAR.
Pour éviter les calculs, on peut consulter la table de concordance entre notation décimale et notation logarithmique (tableau 21-V).
Ces échelles logarithmiques tiennent compte d’un certain nombre de facteurs de variation de l’acuité visuelle pour augmenter la précision de la mesure, en particulier :
– nombre de lettres par ligne : il existe le même nombre de lettres pour chaque ligne (cinq), contrairement aux échelles décimales où il y a plus de lettres aux acuités élevées par rapport aux lignes de basse acuité ;
– lisibilité des lettres : on sait que certaines lettres sont plus difficiles à lire que d’autres ; les échelles logarithmiques utilisent trois lettres de lisibilité facile et deux lettres de lisibilité difficile ;
– interaction du contour : pour éviter au maximum les phénomènes d’interaction de contour, les échelles sont construites en respectant :
– l’espace entre deux lettres d’une même ligne est égal à la largeur des lettres de cette ligne ;
– l’espace entre deux lignes est au moins égal à la hauteur de la plus petite de ces deux lignes.
Les principales échelles logarithmiques sont les échelles de : Bailey-Lowie, ETDRS, Guillon-Pollin, Paliaga et Péchereau (fig. 21-21).
L’échelle ETDRS (Early Treatment Retinopathy Study) qui constitue la référence internationale, ne sert pas stricto sensu et d’un point de vue formel à mesurer l’acuité visuelle, mais à déterminer un score : elle permet ainsi de comparer l’évolution de l’acuité visuelle de façon très précise. Elle a donc un grand intérêt dans toutes les pathologies évolutives de l’acuité visuelle.
En pratique clinique, nous utilisons l’échelle numérique, mais il faut en connaître les limites. Les tableaux 21-VI et 21-VII [7, 14] illustrent les variations d’efficience visuelle entre deux niveaux contigus d’acuité visuelle dans une échelle décimale et dans une échelle à progression logarithmique. La progression décimale n’est pas régulière, contrairement à la progression logarithmique. En postopératoire de chirurgie réfractive, on peut observer des patients tristes de n’avoir récupéré que 9/10, alors qu’en pratique la différence avec l’acuité de 10/10 est minime.
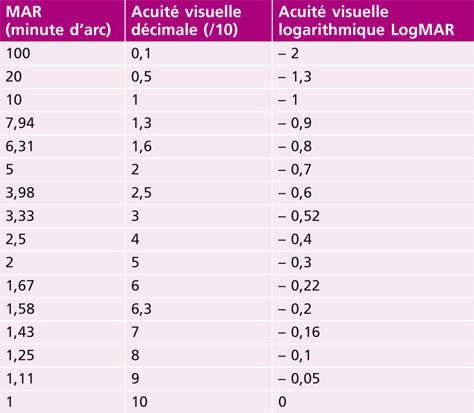
Tableau 21-V Concordances entre la notation décimale (Monoyer) et la notation logarithmique.

Fig. 21-21 Échelle logarithmique du Pr Pécherau.
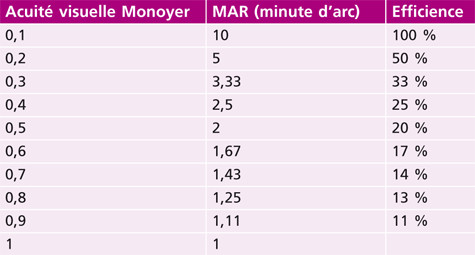
Tableau 21-VI Pourcentage de variation de l’efficience visuelle entre deux lignes d’optotypes en notation décimale (Monoyer).
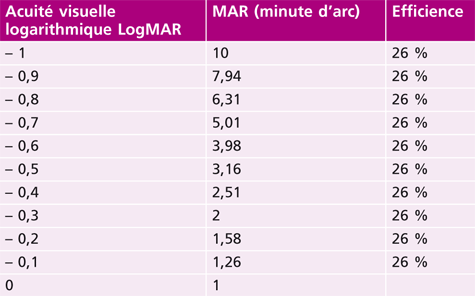
Tableau 21-VII Pourcentage de variation de l’efficience visuelle entre deux lignes d’optotypes en notation logarithmique.
Deux types d’échelle sont les plus utilisés en France : l’échelle de Parinaud pour les adultes et l’échelle de Rossano-Weiss [11] pour les enfants ou les illettrés.
Parinaud a réduit les caractères de 20 % (4 minutes et non 5 minutes d’angle pour l’échelle équivalente de loin). Cette réduction est justifiée par l’influence sur l’acuité visuelle de l’accommodation et du retentissement pupillaire lors de la lecture. De plus, le fait de lire rend l’interprétation des optotypes plus facile.
La distance de lecture est un point essentiel. En effet, la taille apparente du texte lu dépend de sa taille réelle et de la distance de lecture.
Les conditions d’éclairage du texte imposent une lumière directionnelle sur le texte.
Sur le plan théorique, une mesure à l’aide d’un Parinaud ne permet pas de déterminer une acuité visuelle précise en vision de près [3]. La mesure de l’acuité visuelle demande le contrôle de nombreux paramètres qui sont ignorés par le test de Parinaud.
Le test de Parinaud est composé d’un certain nombre de textes de taille décroissante d’une certaine complexité. Cependant, un texte ne peut être considéré comme une mesure précise de l’acuité : les lettres ne sont pas de la même taille (majuscules et minuscules) ; la typographie ne respecte pas celle des échelles d’acuité dont le trait fait un cinquième de la taille totale de la lettre ; le test fait intervenir la lecture et donc les capacités cognitives du patient.
Malgré toutes ces critiques, cette mesure est celle que nous utilisons en pratique clinique. Elle permet de valider une prescription dans une activité de vision de près et de la comparer aux mesures antérieures.
Le tableau des équivalences (tableau 21-VIII) [14] permet de comparer les mesures en vision de près aux mesures décimales et logarithmiques.
Les articles internationaux utilisent l’échelle américaine de Jaeger dont les équivalences sont rappelées au tableau 21-IX.
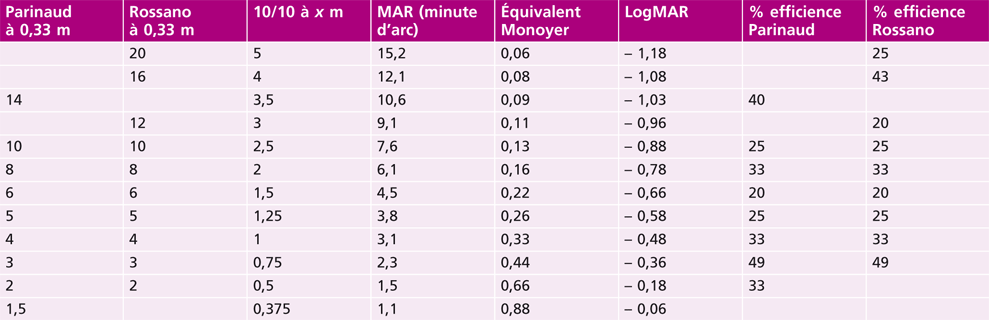
Tableau 21-VIII Concordances entre la notation de près (Parinaud et Rossano- Weiss), la notation décimale et la notation logarithmique, et variation de l’efficience visuelle entre deux lignes d’optotypes.

Tableau 21-IX Équivalences entre échelle de Parinaud et échelle de Jaeger.
L’utilisation croissante des ordinateurs et des interfaces numériques ont rendu l’analyse de la vision intermédiaire indispensable.
L’interprétation des résultats de certaines chirurgies de la presbytie (presbyLASIK, implants multifocaux) rend nécessaire l’établissement d’échelles de vision intermédiaire. Certains laboratoires ont mis au point des échelles de vision intermédiaire pour évaluer leurs produits (fig. 21-22). Néanmoins, la mise au point d’une échelle normalisée de vision intermédiaire paraît, en 2012, indispensable à l’exercice actuel de l’ophtalmologie.
Le cahier des charges de la conception d’une telle échelle implique un choix d’optotypes répondant aux critères de Landolt, de progression logarithmique, avec un dispositif physique permettant de calibrer les distances de lecture. La distance à considérer dans les études comparatives en matière de chirurgie de la presbytie est comprise entre 50 cm et 80 cm (valeur moyenne : 70 cm).

Fig. 21-22 Échelle de vision intermédiaire (80 cm).
(Laboratoire Bausch & Lomb.)


[1] Arden G.B. Le standard de mesure de l’acuité visuelle. J Fr Ophtalmol, 1988 ; 11, 779-92.
[2] Avital L., Zalonghi X., Sander M.S. et al. Comparaison d’une planche d’acuité visuelle de loin logarithmique et de la planche de loin Rossano-Weiss. J Fr Orthoptique, 1999.
[3] Beaubert E., Pariguet F., Taboulot S. Manuel de l’opticien. Maloine, Paris, 2005.
[4] Corbe C., Menu J.-P., Chaine G. Traité d’optique physiologique et clinique. Douin, Paris, 1993.
[5] Darras C. Éléments et réflexions d’optique physiologique. Era, Nantes, 1995.
[6] Donders F.C. On the anomalies of accommodation and refraction of the eye, with a premilinary essay on physiological dioptrics (translated from the author’s manuscript by William Daniel Morre). The New Sydenham Society, London, 1864.
[7] Dufier J.-L. Échelle décimale de Monoyer. J Fr Ophtalmol, 1988 ; 11 : 793.
[8] Ferris F.L., Kassoff A., Bresnick G.H. et al. New visual acuity charts for clinical research. Am J Ophtalmol, 1982 ; 94 : 91-6.
[9] Jayle G.E., Aubert L., Camo R. L’intérêt clinique du rapport acuité visuelle mésopique sur acuité visuelle photopique. Bull Soc Ophtalmol Fr, 1958 ; 7-8 : 1-5.
[10] Lewis F.P. Five minutes angle as general formula for recording visual acuity. JAMA, 1929 ; 93 : 972.
[11] Monoyer F. Échelle typographique pour la détermination de l’acuité visuelle. (Acad. des Sciences, Comptes rendus, 1875, vol. 80, 113). Gaz Méd Paris, 1875 ; XXI : 258.
[12] Pigassou-Albouy R. Les optotypes pour enfants. Ann d’Oculist, 1974 ; 207 : 803-10.
[13] Risse J.-F. et al. Exploration de la fonction visuelle. Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 1999 : 99-121.
[14] Roth A., Gomez A., Péchereau A. La réfraction de l’œil : du diagnostic à l’équipement optique. Elsevier, Paris, 2007.
[15] Zalhonghi X., Sander M.S. Validation théorique d’une planche logarithmique d’acuité visuelle de loin pour enfant. J Fr Orthoptique, 1999.

