M. Assouline1
De nombreuses méthodes ont été proposées pour compenser chirurgicalement la presbytie en agissant sur le cristallin, la cornée ou la sclère (tableau 23-I) [10-12, 14].
La mise au point de dispositifs ou de procédés si variés traduit l’importance des efforts de recherche et développement actuels et témoigne des enjeux économiques projetés (un milliard et demi de sujets presbytes soit 23 % de la population dans le monde).
En l’absence de restauration vraie de la mécanique accommodative, les approches palliatives (monovision, multifocalité, effet sténopéique), satisfaisantes sur le plan de l’acuité quantitative, imposent néanmoins des contraintes de qualité de vision qui ont été progressivement optimisées pour en généraliser l’adoption.
Il existe trois niveaux d’intégration qui participent de façon intriquée à l’expérience visuelle du sujet opéré :
– niveau optique « objectif » ;
– niveau sensoriel « subjectif » ;
– niveau fonctionnel « relationnel » : efficacité visuelle relationnelle ou aptitude à interagir avec l’environnement, du fait de l’intégration neurosensorielle (par exemple, vestibulaire) et cognitive supérieure de l’information transmise par les deux yeux.
Ceci explique que, pour une qualité optique fixée (par exemple, celle d’un implant multifocal usiné), les résultats fonctionnels puissent être différents selon les sujets et varier chez un même sujet au cours du temps du fait d’une neuroadaptation.
L’évaluation clinique de la qualité de vision est actuellement surtout fondée sur l’analyse de la qualité optique de l’œil mais devrait progressivement intégrer les niveaux sensoriel et relationnel.
Cinq grands principes optiques sont utilisés pour la compensation chirurgicale de la presbytie et, malgré une efficacité fonctionnelle quantitative similaire, les résultats en sont parfois très différents en termes de qualité de vision :
1. la monovision (ou bascule) répartit les tâches visuelles de près et de loin entre les deux yeux : l’œil dominant (ou directeur ou fixateur) est corrigé pour la vision de loin et l’autre œil (non dominant ou dominé) pour la vision de près (à 33 cm) ou la vision intermédiaire (à 50 cm-60 cm) ;
2. la multifocalité partage la lumière incidente qui pénètre par la pupille entre foyer de près et foyer de loin de façon stricte (bifocalité) ou transitionnelle (multifocalité vraie, permettant une vision intermédiaire utile) ; cette approche est employée sous deux formes principales :
– les chirurgies cornéennes multifocales (presbyLASIK ou autres) ;
– les implants intraoculaires multifocaux (cristallins artificiels réfractifs ou diffractifs) ;
3. l’effet sténopéique augmente la profondeur de champ en éliminant par exclusion spatiale lors du passage au travers d’une pupille d’entrée étroite les rayons lumineux correspondant à la partie défocalisée de l’image : cette approche est mise en œuvre uniquement dans l’implant intrastromal cornéen KAMRA® (ex-Acufocus®), récemment mis sur le marché français ;
4. la « pseudo-accommodation » d’un cristallin artificiel accommodatif chez le sujet pseudophake résulte d’une variation de sa puissance optique apparente du fait de la modification de sa position ou de sa forme au cours de l’accommodation résiduelle du muscle ciliaire, qui s’accompagne d’une « poussée » antérieure du vitré et d’une relaxation capsulaire ; en théorie, cette méthode visant à reproduire l’accommodation naturelle préserverait la qualité de vision ;
5. la restauration de l’accommodation proprement dite fait l’objet de deux approches distinctes :
– modification du cadre scléral de l’action du muscle ciliaire (expansion sclérale ou lift scléral supraciliaire) ; l’efficacité clinique et l’innocuité de ces méthodes à long terme sont encore débattues ; ces méthodes sont pour l’heure abandonnées et ne sont pas abordées dans ce chapitre [20, 98] ;
– modification des caractéristiques mécaniques du cristallin naturel devenu presbyte (thermoplastie de la capsule, incisions épinucléaires au laser femtoseconde) : il s’agit d’approches purement expérimentales à ce jour, dont les essais cliniques semblent imminents, mais qui sortent du cadre de ce chapitre.
Les objectifs du chapitre sont de tenter d’apporter des éléments de réponse actualisés aux six questions essentielles suivantes :
– Qu’est-ce que la qualité de vision ?
– Qu’est-ce que la qualité optique de l’œil ?
– Comment évaluer les résultats d’une compensation chirurgicale de la presbytie ?
– Quel est l’impact spécifique de chaque approche chirurgicale de la compensation de la presbytie sur la qualité de vision ?
– Qu’est-ce que la neuroadaptation et quel est son rôle dans la qualité de vision après compensation chirurgicale de la presbytie ?
– Comment améliorer la qualité de vision des patients opérés en cas d’échec ?
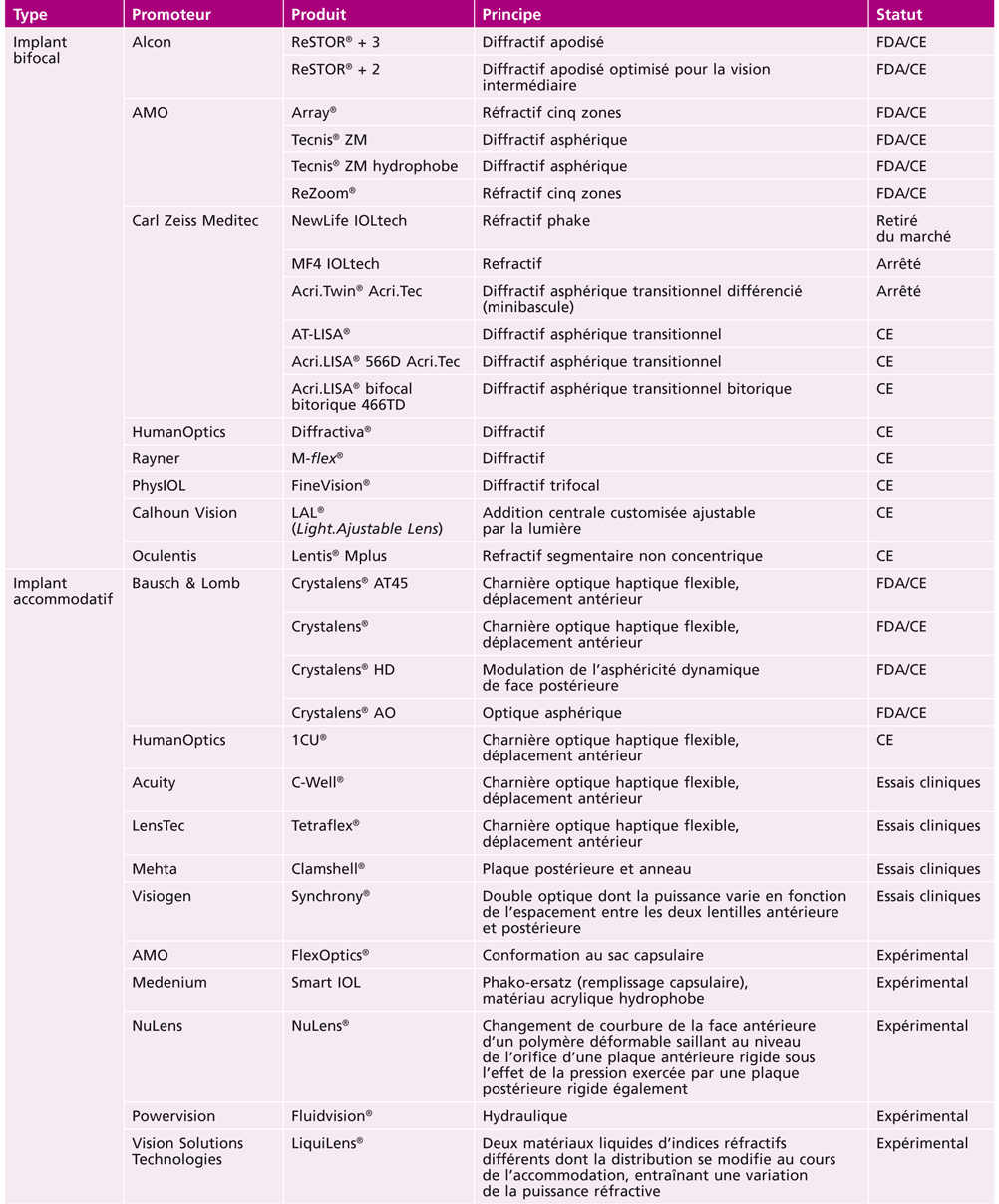
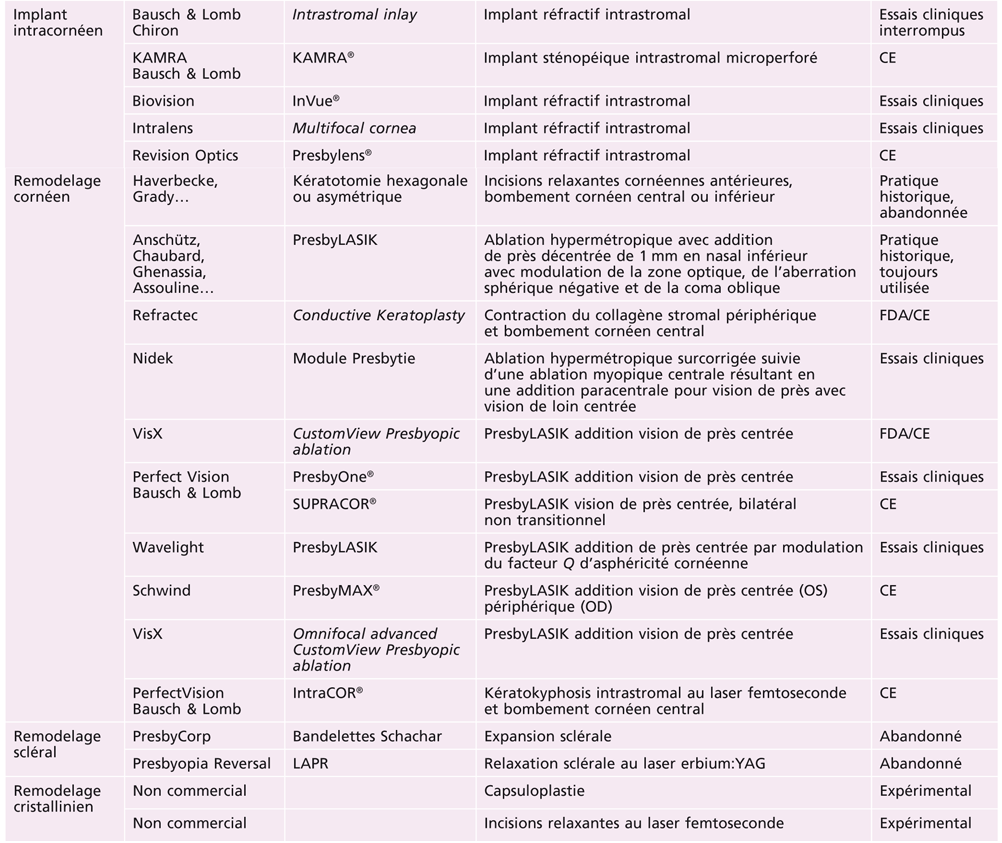
Tableau 23-I Méthodes de chirurgie de la presbytie.
L’aptitude visuelle au quotidien met en jeu des capacités variées faisant intervenir deux modes visuels principaux :
– le mode « focal », dédié à la reconnaissance des objets, principalement fondé sur les hautes fréquences spatiales, sur la vision centrale (pouvoir séparateur, amplitude accommodative), nécessitant une bonne qualité optique et une bonne attention (intégration corticale ventrale) ;
– le mode « ambiant », dédié à l’orientation spatiale (posture, locomotion, stabilisation du regard, exploration inconsciente de l’environnement), fondé sur les basses fréquences spatiales, la vision périphérique (binocularité, champ visuel), relativement indépendant de la qualité optique de l’œil et semi-conscient (intégration corticale dorsale).
Un bon exemple de la coexistence de ces deux modes au quotidien est celui de la pratique de la lecture en marchant.
Par analogie avec un senseur opto-électronique, la résolution de l’œil peut en théorie être définie selon quatre composantes :
– résolution « temporelle » (intervalle minimal de perception) ;
– résolution « spatiale » (pouvoir séparateur) ;
– résolution « radiométrique » (niveaux de gris perçus) ;
– résolution « spectrale » (spectre des longueurs d’onde perçues).
Résolutions temporelle, spatiale, radiométrique et spectrale sont antagonistes et ne peuvent être optimisées toutes à la fois pour un senseur donné. Le système visuel humain représente un compromis évolutif, lié à la différenciation optique et sensorielle, adapté à l’activité de l’homme, souvent différent de celui observé dans d’autres espèces animales.
Le pouvoir séparateur de l’œil, capacité à distinguer deux points proches, fait intervenir la qualité optique de l’œil et la densité des photorécepteurs rétiniens ; il représente le fondement de la mesure de l’acuité visuelle — assimilée par défaut à la « quantité de vision » par opposition aux autres aptitudes visuelles souvent regroupées improprement sous la notion diffuse de « qualité de vision ».
La densité des récepteurs rétiniens est en effet la base anatomique de la discrimination de deux points très proches par échantillonnage. La projection d’un optotype « E » de Snellen à 10/10 (donc sous un angle de 5 minutes d’arc environ) occupe sur la rétine une matrice d’environ 10 × 20 cônes photorécepteurs. Selon le théorème de Nyquist, l’acuité maximale théorique serait dans ce cas d’environ 20 à 40/10 (fig. 23-1) ; en pratique, cette acuité maximale théorique est limitée par les phénomènes de diffraction à pupille étroite et de façon croissante par les aberrations optiques d’ordre supérieur quand le diamètre pupillaire augmente (fig. 23-1).
Le pouvoir séparateur est testé en clinique par la mesure classique de l’acuité visuelle morphoscopique statique sous fort contraste de loin et de près, mais différents éléments en affectent les résultats (taille et forme du test, temps de présentation, état adaptatif, contraste, mobilité de l’optotype ou de l’observateur…). La pertinence de l’acuité visuelle est donc souvent limitée pour apprécier la qualité de vision et l’aptitude visuelle en conditions de vie réelle.
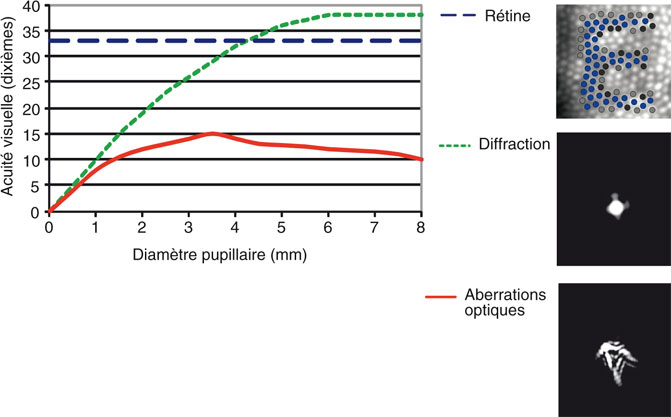
Fig. 23-1 Limite de la vision.
Acuité visuelle théorique en fonction du diamètre de la pupille et de la diffraction, des aberrations optiques d’ordre supérieur, de l’échantillonnage par les photorécepteurs rétiniens.
La vision humaine repose avant tout sur la perception des contrastes, c’est-à-dire la différenciation du niveau d’intensité lumineuse de deux plages adjacentes. L’agencement particulier des cellules photoréceptrices et de l’intégration intrarétinienne ou dans les voies visuelles favorise l’analyse des plages d’intensités lumineuses différentes alternées (réseaux sinusoïdaux), dont l’espacement (période) détermine la fréquence spatiale de l’objet observé, tandis que la différence d’intensité lumineuse (amplitude) forme le contraste (fig. 23-2).
Par analogie avec les sons, l’œil humain peut percevoir environ dix « octaves », correspondant au doublement de la fréquence spatiale. Tout objet ou toute scène peuvent être décomposés en une « somme » de réseaux sinusoïdaux de contraste « superposés » dans l’espace observé. Ce mécanisme intervient par exemple dans la reconnaissance rapide des expressions du visage — une aptitude neurophysiologique importante dans l’espèce humaine, qui serait perturbée dans la schizophrénie [89].
La courbe décrivant la fonction de sensibilité aux contrastes traduit la capacité optique et neurale de chaque individu à percevoir différents niveaux de contraste (de 0 % à 100 %) pour différentes fréquences spatiales (de 0,1 à 60 cycles par degré). L’acuité morphoscopique classique n’étudie que les moyennes et hautes fréquences spatiales sous contraste maximum. Cependant, un certain nombre d’aptitudes visuelles (perception du mouvement, vision nocturne, reconnaissance des visages) impliquent également les faibles contrastes et les basses fréquences spatiales.
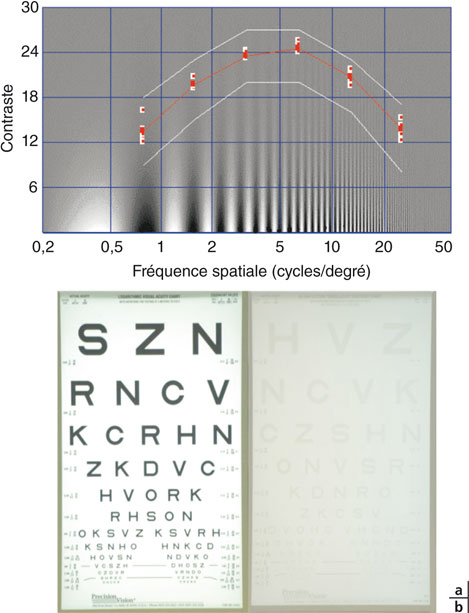
Fig. 23-2 Sensibilité aux contrastes.
a. Mesure complète. b. Acuité (logMAR) à 90 % et 10 % de contraste.
L’œil humain jeune peut modifier sa focalisation de l’infini à 7 cm en 350 ms. Cette accommodation de 12 D environ décroît avec l’âge, jusqu’à environ 1,5 D vers soixante ans.
L’amplitude d’accommodation moyenne dans la population peut être approchée par la formule d’Hofstetter (« 18,5 D diminués du tiers de l’âge en années »), mais elle se révèle très variable, notamment plus importante chez le myope que l’hypermétrope.
Il est donc nécessaire pour chaque sujet de mesurer directement la courbe de défocalisation décrivant l’amplitude accommodative. Cette fonction permet également de comparer efficacement le bénéfice des chirurgies de compensation de la presbytie (cf. infra, fig. 23-22).
Dans la vie réelle l’accommodation est également affectée par différents facteurs (psychiques, pharmacologiques) et, plus rarement, par le contexte visuel.
L’effet de Mandelbaum décrit la tendance à accommoder de près dans des conditions de mauvaise visibilité (myopisation liée au pare-brise sale, au mauvais temps, au brouillard, etc.). Cette focalisation spontanée à une distance d’environ 0,9 mètre, variable selon les sujets, est liée à la relaxation ciliaire du fait de l’absence de stimulus précis de focalisation (« dark focus » ou focalisation sur « champ vide »). Ce problème est majoré par l’effet sténopéique d’une pupille étroite. Ses conséquences visuelles sont variables selon les individus mais peuvent entraîner des conséquences sérieuses, comme par exemple la désorientation spatiale des pilotes aériens (retenue comme la cause probable de l’accident fatal de J.F. Kennedy Jr en 1999 [150]).
Les anomalies de l’amplitude d’accommodation et de sa relation avec les vergences (rapport AC/A et CA/A) sortent du cadre de ce chapitre mais elles jouent un rôle important dans les problèmes de confort et de fatigabilité visuelle [119].
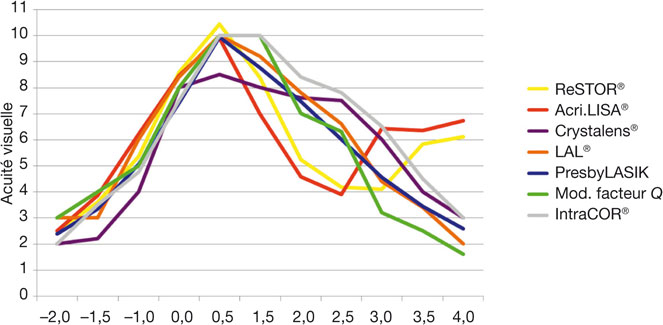
Fig. 23-22 Courbes de défocalisation pour différentes méthodes de compensation chirurgicale de la presbytie.
De très nombreuses fonctions visuelles peuvent être isolées plus spécifiquement.
En pratique, les examens qui permettent de les explorer sont réalisés plutôt dans un contexte de recherche clinique ou de sélection professionnelle qu’en routine clinique :
– vision spatiale et binoculaire :
– perception statique du relief [55] ;
– perception dynamique de la profondeur, du relief, de la distance [156] ;
– perception de la vitesse ou de l’accélération des objets en mouvements [143] ;
– seuils de détection dans le champ visuel [123] ;
– effet de la sommation binoculaire sur la performance visuelle (synergie) ;
– tolérance à la rivalité rétinienne [70] ;
– vision dynamique :
– acuité dynamique (cible mobile ou avec observateur en mouvement) [31, 149, 165] ;
– test de stabilisation du regard (gaze stabilisation test) ;
– temps de perception d’un test [139] ;
– vision des couleurs [119] ;
– résistance à l’éblouissement [6, 9] :
– vision nocturne et en conditions limites de contrastes :
– confort visuel :
– vision relationnelle pour l’accomplissement des tâches complexes :
– vision posturale : efficacité visuelle et retentissement postural et moteur, statique ou dynamique, de l’information visuelle [32, 59, 151].
L’acuité stéréoscopique peut être mesurée par les tests à disparité fixe (Titmus, Randot) ou à seuil de disparité (Howard-Dolman), ce dernier semblant plus précis [55].
L’acuité visuelle dynamique (sur test mobile ou avec observateur en mouvement) semble présenter un intérêt clinique particulier. L’acuité visuelle dynamique horizontale, verticale ou circulaire décroît en fonction de divers paramètres (vélocité angulaire du test, basse luminance du test…). L’acuité visuelle dynamique est notamment réduite par le myosis et améliorée par l’augmentation de la taille pupillaire [149].
De tous les tests visuels pratiqués en recherche clinique, l’acuité visuelle dynamique semble la mesure la mieux corrélée aux performances individuelles dans la réalisation de tâches complexes (conduite, pilotage, chasse). Il existe par exemple une corrélation rétrospective très poussée entre l’acuité visuelle dynamique et l’historique d’accidents de la route chez les conducteurs privés ou professionnels [31]. L’acuité visuelle dynamique des athlètes de haut niveau est également supérieure à la moyenne, alors que l’acuité statique n’est pas significativement différente [165].
Dans une autre étude portant sur des jeunes pilotes automobiles, l’acuité statique, la stabilisation du regard et l’acuité visuelle dynamique n’étaient pas statistiquement différents mais le temps de perception d’un test (PTT) était significativement meilleur [139].
La perte d’acuité visuelle sous déviation angulaire ou « acuité directionnelle », décrite sous le terme d’effet Campbell [27], traduit l’effet du décentrement d’une pupille d’entrée étroite artificielle par rapport à la pupille naturelle. Cette perte de pouvoir séparateur de l’œil dans les fréquences spatiales basses et intermédiaires pour les rayons excentrés (d’un facteur 3 à 8) semble être la conséquence d’une combinaison d’aberrations transverses chromatiques et monochromatiques [7]. D’un intérêt purement théorique jusqu’ici, l’effet Campbell devrait retrouver une certaine importance clinique avec la mise en œuvre de méthodes réfractives fondées sur une partition spatiale de la pupille (photoablation multifocale excentrée, implant intrastromal sténopéique, implant pseudophake avec addition bifocale asphérique excentrée).
La qualité de vision ne se caractérise pas seulement par la somme des aptitudes visuelles d’un patient mais également par l’absence subjective d’effets visuels indésirables. La « transparence de l’œil » [118] exprime l’idée simple et élégante qu’un œil sain doté d’une bonne qualité de vision n’entre tout simplement pas dans le champ de conscience habituel de l’individu.
La typologie clinique complexe des effets visuels indésirables subjectifs rapportés par les patients après chirurgie de la presbytie correspond le plus souvent à des problèmes bien identifiables, corrélés à des perturbations caractéristiques des analyses paracliniques objectives.
Le vocabulaire très varié des plaintes subjectives (halos, éblouissement, double image, images fantômes, image « baveuse », fluctuations visuelles diurnes et nocturnes, etc.) peut donc être le plus souvent traduit sous forme d’un diagnostic précis (tableau 23-II).
La qualité de vision fait donc référence à l’expérience visuelle subjective du sujet, qui combine l’effet :
– des propriétés optiques de l’œil ;
– de la capacité sensorielle rétinienne ;
– de l’intégration du message visuel par les voies optiques et le cortex occipital ;
– de la réponse corticale complexe (cognitive, posturale, vestibulaire, motrice ou émotionnelle) à ce message visuel.
L’ensemble conditionne l’efficacité pratique des fonctions visuelles :
– pouvoir séparateur de l’œil ;
– sensibilité au contraste spatial ;
– amplitude accommodative ;
– aptitudes visuelles spécifiques ;
– absence d’effets visuels indésirables.
L’appréciation de la qualité de vision ne peut donc être systématiquement exhaustive et doit faire appel, en fonction des besoins, à des méthodes multiples et complémentaires, parfois quantitatives et objectives, parmi lesquelles l’analyse de la qualité optique de l’œil occupe actuellement une place de choix.
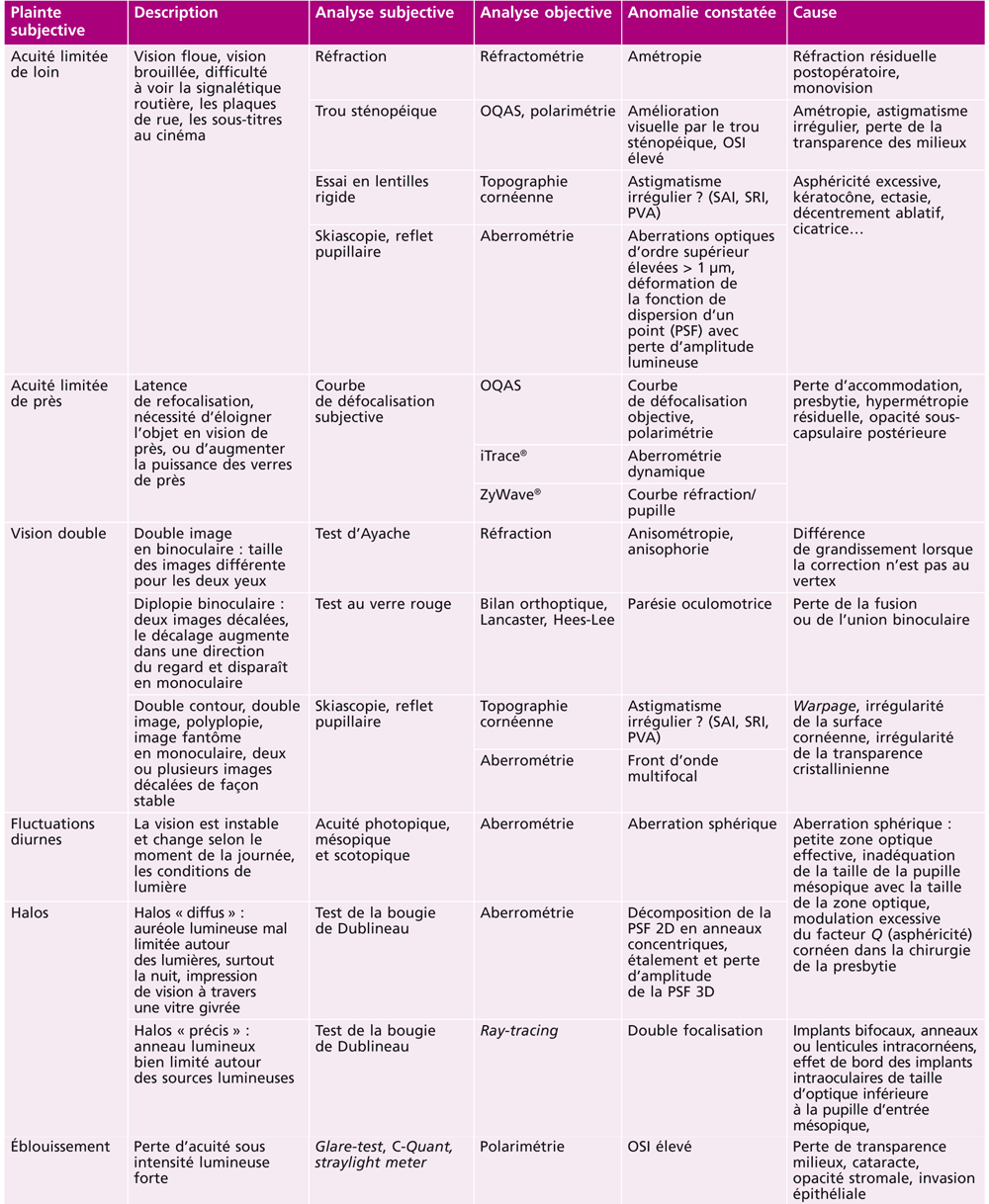
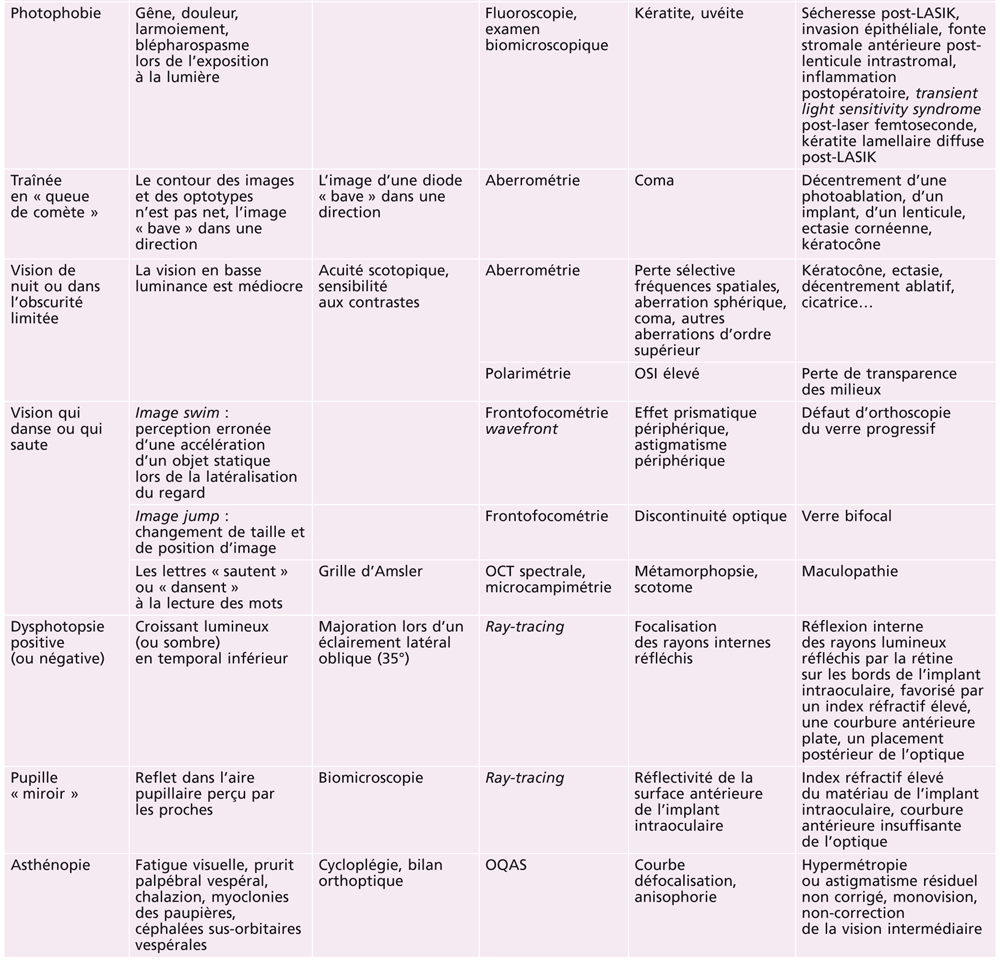
Tableau 23-II Plaintes subjectives, analyse subjective et objective, causes des symptômes rapportés après compensation de la presbytie.

La qualité optique d’un système, en particulier du système oculaire, traduit sa capacité à transmettre le contraste des objets observés. La relation entre le pourcentage de transmission du contraste et la fréquence spatiale de l’objet observé définit les « fonctions de transfert de modulation » (MTF, Modulation Transfer Functions) (fig. 23-3). Les MTF expriment donc le ratio entre le contraste de l’image rétinienne et le contraste original de l’objet observé et suffisent en pratique à caractériser la performance optique du système (un œil humain, un télescope ou un microscope optique, par exemple).
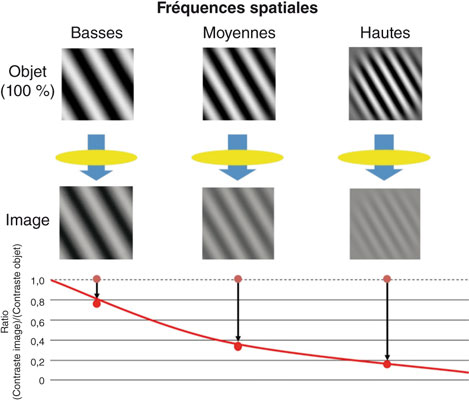
Fig. 23-3 Fonction de transfert de modulation (MTF, Modulation Transfer Function).
Elle représente la capacité d’un système optique à transmettre le contraste des objets.
Les imperfections optiques de l’œil dégradent sa performance du fait de phénomènes de diffraction, à pupille étroite, ainsi que d’aberrations optiques d’ordre inférieur (amétropie) ou supérieur (aberration sphérique et coma, notamment) lorsque la pupille devient plus large [13].
Ces imperfections entraînent une perte de focalisation des rayons lumineux pénétrant par la pupille d’entrée optique — projection virtuelle de la pupille anatomique « vue », c’est-à-dire grandie, par le dioptre cornéen. Certains de ces « rayons » ou, en tout cas, une proportion de l’énergie lumineuse incidente ne parviennent pas à la fovéa et l’image perçue est partiellement défocalisée (fig. 23-4).
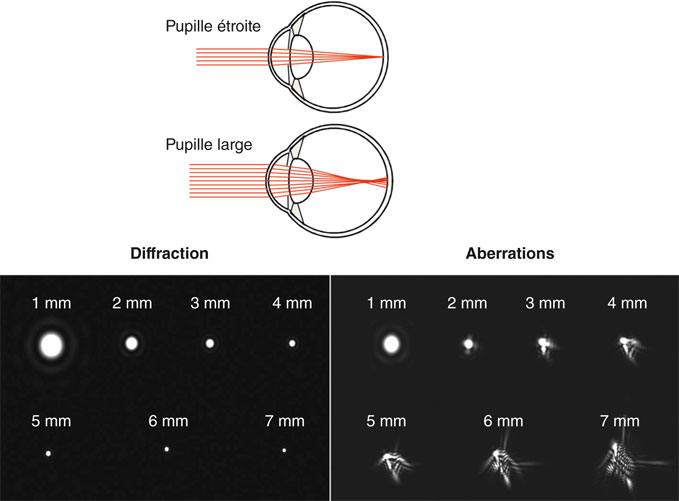
Fig. 23-4 Diffraction et aberrations en fonction de la taille de la pupille.
(Documents de A. Roorda.)
L’effet de Stiles-Crawfordt stipule que :
– tous les rayons lumineux passant par la pupille d’entrée contribuent à la formation de l’image fovéolaire ;
– les rayons périphériques ont cependant une efficacité réduite (seulement 20 % pour ceux passant par le diamètre 8 mm).
Ceci serait lié à l’angle d’incidence au niveau des photorécepteurs, dont la structure allongée parallèlement à l’axe visuel joue le rôle d’un filtre d’apodisation, contribuant à la réduction des halos de diffraction. Il est important de noter que la pupille d’entrée effective dépend de plusieurs paramètres (topographie réfractive cornéenne, distance des éléments optiques de l’œil par rapport aux points nodaux).
Les phénomènes de diffraction sont liés à l’interférence de la propagation du front d’onde avec les bords de la pupille d’entrée lorsque celle-ci devient trop étroite (inférieure à 1 mm pour l’œil humain, f:22 pour un objectif photographique). Ce phénomène peut être assimilé aux modifications de direction et d’amplitude subies par la houle (train de vagues) à l’entrée d’un port. La fonction de dispersion (ou d’étalement) d’un point (PSF) montre dans ce cas une disposition concentrique caractéristique (disque d’Airy), qui donne une idée de la gêne visuelle subie par les patients traités par myotiques (fig. 23-4).
Le rapport de Strehl (Strehl Ratio, SR), ratio entre les MTF d’un système optique et celles d’un système uniquement limité par la diffraction, quantifie le rôle des aberrations optiques, dans la qualité optique de ce système, indépendamment des problèmes de diffraction.
Les aberrations optiques de l’œil peuvent être appréhendées par l’analyse des distorsions du front d’onde. Le front d’onde (wavefront) matérialise la direction des rayons lumineux formant l’image d’un objet comme étant la surface virtuelle réunissant les surfaces « élémentaires » individuelles perpendiculaires à chacun de ces rayons lumineux. Pour un objet situé à l’infini, les rayons lumineux pénétrant la pupille d’entrée sont parallèles entre eux. L’union des surfaces perpendiculaires à chacun de ces rayons lumineux est une surface plane, perpendiculaire à la direction de propagation des rayons parallèles entre eux. Ce front d’onde plan traduit l’absence d’aberration optique dans le milieu de propagation (l’air) (fig. 23-5). En cas d’aberrations optiques, les rayons lumineux ne sont plus parallèles et le front d’onde présente des distorsions caractéristiques du système optique traversé.
Une analyse mathématique de cette déformation du front d’onde au moyen de différents outils (décomposition polynomiale de Zernike ou transformées de Fourier) permet de quantifier de façon simple le niveau de déformation « global » sous forme d’un écart quadratique moyen tridimensionnel (analogue à l’écart type par rapport à la moyenne dans un système à deux dimensions pour une distribution statistique), nommé Root Mean Square (RMS, en micromètres). Une interprétation mathématique de ces données du front d’onde permet de dériver des notions utiles pour la compréhension et la quantification de la qualité optique de l’œil.
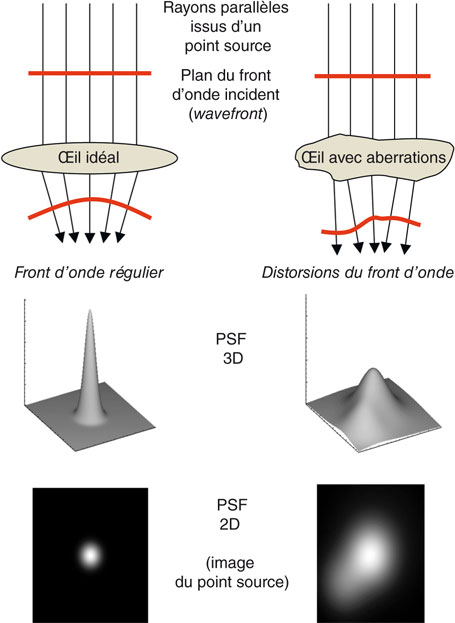
Fig. 23-5 Principe de l’aberrométrie du front d’onde.
PSF, Point Spread Function (fonction de dispersion d’un point, tri- ou bidimensionnelle).
La fonction de dispersion d’un point (PSF, Point Spread Function) est l’« image » virtuelle d’un point lumineux vu à l’infini dégradée par l’œil du sujet, extrapolée à partir des données du front d’onde (fig. 23-5).
Il est très simple de faire une autoévaluation subjective des variations de sa propre PSF en examinant une diode lumineuse à distance sous différentes conditions d’éclairement (puisque l’effet des aberrations optiques d’ordre supérieur augmente avec le diamètre de la pupille).
Elle peut être représentée en deux dimensions sous forme d’une tache dont l’augmentation de la taille (défocalisation), la déformation (par exemple en « queue de comète » dans le cas d’une aberration de type coma associée à un décentrement optique), la perte d’intensité ou d’homogénéité lumineuse traduisent la dégradation de la qualité optique.
En trois dimensions, la PSF se présente sous forme d’un pic dont l’élargissement de la base (augmentation des aberrations optiques) et la réduction de la hauteur (réduction de l’amplitude de l’intensité lumineuse) quantifient de même l’importance de la perte de qualité optique de l’œil.
Les coefficients de Zernike (en micromètres) permettent de mesurer les parts respectives et les directions des différentes aberrations optiques élémentaires d’ordre inférieur (tilt, myopie, astigmatisme, hypermétropie) ou d’ordre supérieur (aberration sphérique positive ou négative, coma, trefoil…) (fig. 23-6c). La décomposition polynomiale de Zernike consiste schématiquement à représenter toute déformation complexe du front d’onde par la « somme » de soixante-quatre déformations (aberrations) élémentaires, classées par « ordres » et par types de symétries (fig. 23-6d).
Un autre mode de décomposition, par les transformées de Fourier, permet d’augmenter la précision des coefficients au-delà du cinquième ordre, moins importants en pratique clinique.
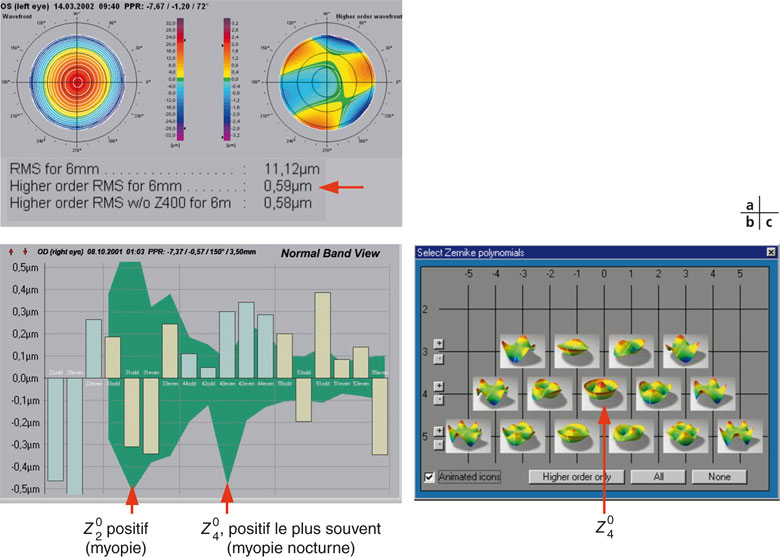
Fig. 23-6 Décomposition polynomiale de Zernike du front d’onde.
a. Examen aberrométrique. À gauche : front d’onde total. À droite : front d’onde des aberrations d’ordre supérieur. En bas : valeur des RMS.
b. Décomposition polynomiale et coeffi cients de Zernike. c. Formes élémentaires de Zernike.
Les aberrations optiques d’ordre supérieur les plus importantes en pratique pour l’œil humain sont :
– l’aberration sphérique, qui induit une déformation du front d’onde en « sombrero », caractérise la différence de puissance optique réfractive entre le centre et la périphérie du système (fig. 23-7) :
– par exemple, une cornée opérée de myopie (asphéricité de type oblate du fait d’un aplatissement central relativement à la périphérie) présente une aberration sphérique positive ; celle-ci peut parfois retarder l’effet de la presbytie [8] ;
– une cornée opérée d’hypermétropie, prolate, présente une aberration sphérique négative, d’autant plus importante que la zone optique est étroite (cornée hyperprolate, dotée d’une asphéricité importante, avec un facteur Q par exemple compris entre – 0,4 et – 1,0) (cf. infra, fig. 23-12a) ; dans certaines conditions, l’aberration sphérique négative permet d’induire une augmentation de la profondeur de champ afin de compenser la presbytie ;
– la coma, qui induit une déformation asymétrique du front d’onde en doubles cupules inversées adjacentes, caractérise le décentrement optique du système ; elle est responsable d’une dégradation de la fonction de dispersion d’un point en « queue de comète » (cf. infra, fig. 23-12e à g) ; dans certaines conditions, la coma permet d’induire un certain degré de bifocalité, afin de compenser la presbytie.
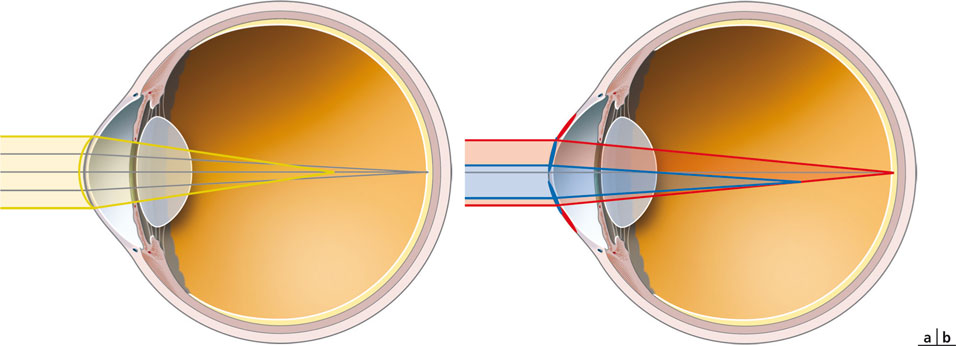
Fig. 23-7 Aberration sphérique.
a. Aberration sphérique positive après chirurgie ablative myopique. La cornée préopératoire (jaune) est aplatie au centre en postopératoire (gris). En postopératoire, les rayons centraux sont focalisés sur la rétine, tandis que les rayons périphériques subissent l’effet de la myopie périphérique résiduelle induisant une défocalisation d’une partie de l’image. b. Aberration sphérique négative après chirurgie ablative de la presbytie. L’ablation hypermétropique (rouge) corrige la vision de loin en augmentant la courbure centrale de la cornée. L’ablation paracentrale décentrée complémentaire, centrée sur la pupille de près en myosis (bleu), augmente la courbure centrale au niveau d’une zone plus étroite et défocalise les rayons lumineux passant par cette zone « hyperprolate » (myopisation focale).
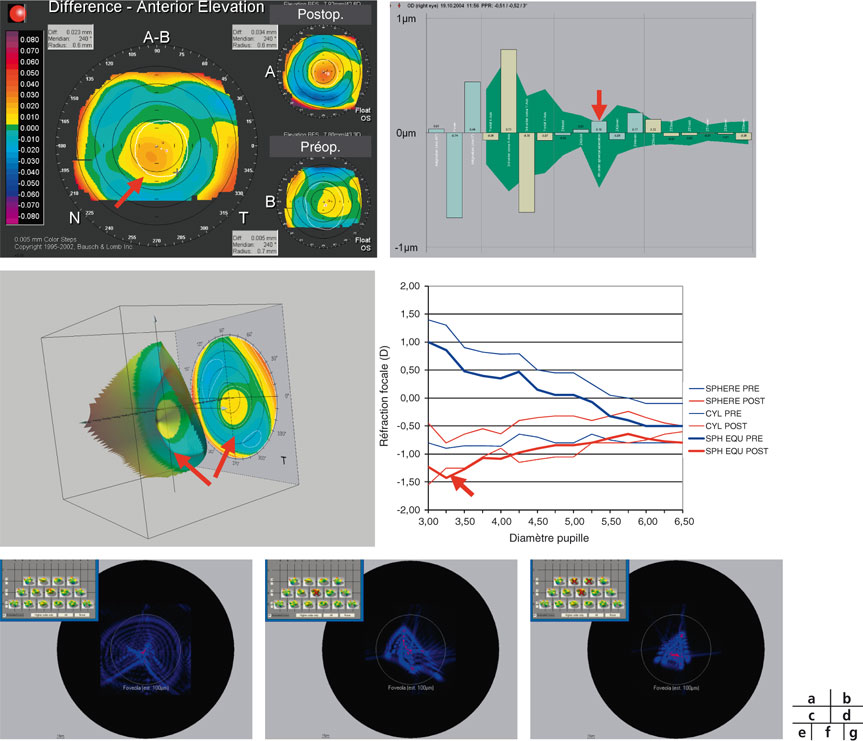
Fig. 23-12 Résultats d’un presbyLASIK.
a. Cornée asphérique hyperprolate (addition + 1,7 D, zone optique de 3,0 mm). b. Aberration sphérique négative. c. Front d’onde multifocal tridimensionnel et bidimensionnel. d. Myopisation centrale de la courbe aberrométrique réfraction/pupille. e. PSF (Point Spread Function) globale. f. PSF sans l’aberration sphérique. g. PSF sans l’aberration sphérique ni la coma.
Les caractéristiques du front d’onde permettent également de calculer d’autres paramètres :
– les fonctions de transfert de modulation (MTF) ;
– les images simulées d’optotype ou d’objets plus complexes « vues » par le sujet, par une technique mathématique de convolution d’image (produit de la FDP par les coordonnées de l’objet) ;
– l’acuité visuelle potentielle sous fort ou faible contraste (cf. infra, fig. 23-13).
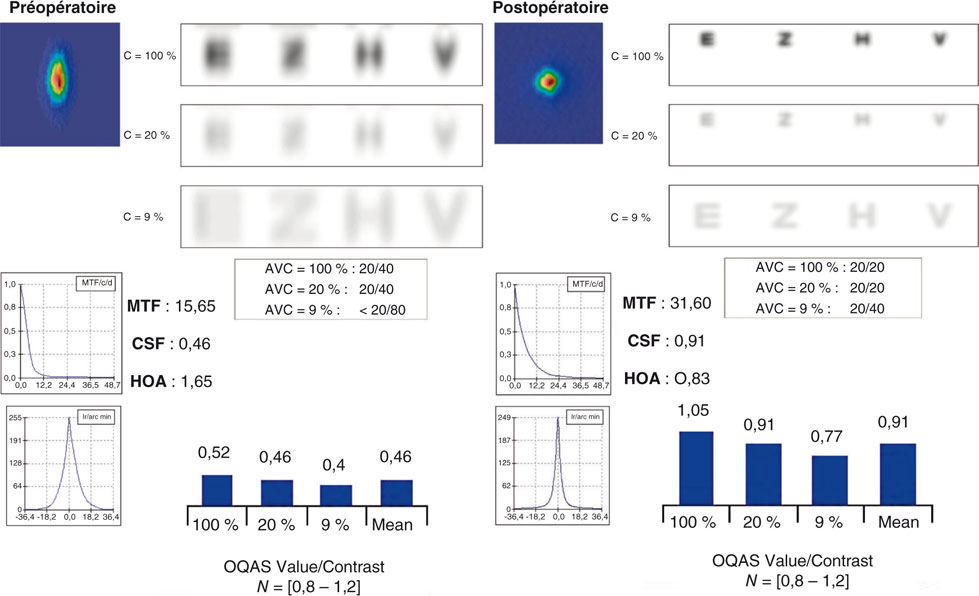
Fig. 23-13 Résultats d’un presbyLASIK en termes de vision des contrastes.
Calcul des MTF, sensibilité aux contrastes et convolution d’optotypes à partir de la PSF.
MTF, Modulation Transfer Functions ; CSF, Contrast Sensitivity Function ; HOA, High Order Aberrations ; PSF, Point Spread Function.
Les aberrations optiques et la diffraction ne sont pas les seules sources de dégradation de la qualité optique de l’œil. Les phénomènes d’absorption, de diffusion et, surtout, de dispersion antérograde de la lumière (anterior forward scatter ou straylight) liés à la perte de transparence des milieux intraoculaire (haze post-photoablation, interface LASIK, cataracte, opacification capsulaire postérieure) atténuent la cohérence et l’intensité des rayons lumineux.
L’éblouissement (glare) est la perte de contraste ou d’acuité résultant de cette dispersion antérograde de la lumière (fig. 23-8).
Des méthodes subjectives anciennes (acuité sous éblouissement) ont fait place à des approches semiquantitatives subjectives (straylight meter) ou objectives (polarimétrie) pour quantifier cet effet visuel indésirable parfois invalidant.

Fig. 23-8 Qualité de vision en conduite de nuit en fonction du diamètre de la zone optique d’une photoablation myopique.
L’éblouissement (glare) et la perception de halos lumineux autour des lumières, augmentent du fait de la disparité entre une zone de traite traitement optique étroite et une pupille large. Ces effets visuels indésirables dépendent également de la dispersion antérograde de la lumière lors de la traversée des milieux oculaires (anterior forward scattering).
L’évaluation de la qualité optique de l’œil au moyen de la kératométrie et de l’acuité morphoscopique sous fort contraste repose sur des modèles optiques simplifiés de l’œil (par exemple, l’œil réduit de Donders ou le modèle de Gullstrand) selon une conception purement axiale de la réfraction. Cette approche clinique n’est pertinente que dans le cas d’un œil optiquement « sphérocylindrique » pur, ne présentant que des aberrations optiques d’ordre inférieur (myopie, hypermétropie, astigmatisme régulier).
Cependant, dans la majorité des cas normaux et plus encore en cas de pathologie (kératocône, cicatrice cornéenne) ou de chirurgie réfractive cornéenne ou intraoculaire, il existe des aberrations optiques d’ordre supérieur, dont l’impact sur la qualité optique de l’œil peut être négatif (dégradation de la qualité optique de l’œil et de la qualité de vision scotopique, par exemple) ou parfois bénéfique (aberrations optiques d’ordre supérieur défocalisantes permettant d’augmenter la profondeur de champ et de compenser la presbytie, par exemple).
L’analyse de la qualité optique de l’œil a bénéficié depuis vingt ans, sous l’impulsion clinique de l’essor de la chirurgie réfractive cornéenne, de plusieurs révolutions technologiques et conceptuelles : la topographie cornéenne, le ray-tracing, la pupillométrie, l’aberrométrie du front d’onde, la polarimétrie, l’optique adaptative.
La kératométrie a été remplacée par la topographie cornéenne, mieux à même d’analyser les variations régionales de la courbure et de la forme de la cornée opérée, afin d’en déduire les conséquences optiques sur la vision.
Les modèles les plus récents de topographes cornéens d’élévation se sont affranchis du système vidéokératoscopique de Placido, trop dépendant de la qualité du film lacrymal et de la symétrie rotationnelle « normale » de la cornée, et restituent une modélisation géométrique plus fidèle des faces antérieure et postérieure de la cornée, dont peuvent être inférées les cartes topographiques de puissance réfractive antérieure, postérieure et globale (cf. infra, fig. 23-12a), ainsi que des indices numériques ou cartographiques de « qualité optique » [13].
Des algorithmes sophistiqués, empiriques ou théoriques, offrent des possibilités d’analyse prédictive d’acuité visuelle potentielle, de ray-tracing et de modélisation du front d’onde cornéen ou des fonctions de transfert de modulation (MTF).
Grâce à la simulation numérique fondée sur les données de courbure topographique cornéenne, les modèles d’optique axiale (œil réduit de Donders) ont évolué vers des modèles plus complexes de ray-tracing, prenant en compte l’ensemble des rayons lumineux incidents et l’effet optique des surfaces secondaires (face postérieure de la cornée, cristallin).
Ces modèles, disponibles commercialement (par exemple, logiciel Zemax®), sont adaptés à l’analyse prédictive des interactions optiques complexes de l’œil, notamment pour l’optimisation des profils ablatifs [86, 112] et le dessin des implants intraoculaires utilisés en chirurgie de la presbytie [74].
La taille de la pupille adaptée à l’obscurité (pupille mésopique et scotopique) détermine le niveau et le retentissement optique et donc visuel des aberrations optiques. Cette mesure est donc très importante en chirurgie ablative de la myopie, afin de préserver la qualité de vision nocturne compromise par l’aberration sphérique positive induite. Dans la chirurgie multifocale cornéenne de compensation de la presbytie, la connaissance de la pupille photopique et mésopique joue un rôle également important :
– la pupille photopique subit en effet une partition spatiale afin de répartir l’énergie lumineuse entre les foyers de loin et de près : cette distribution est d’autant plus efficace que la pupille disponible est plus large ; certaines modalités thérapeutiques, implant ajustable à la lumière avec addition asphérique centrée (LAL®-CNA) par exemple, sont contre-indiquées en cas de pupille photopique inférieure à 3,0 mm ;
– la pupille mésopique détermine le niveau de fluctuation visuelle diurne lié à la différence de réfraction en fonction de la variation du diamètre pupillaire du fait de l’asphéricité cornéenne et de l’aberration sphérique négative induite.
Les technologies de pupillométrie statique ou dynamique mises en œuvre dans la chirurgie de la presbytie sont très variées et sont de plus en plus souvent intégrées aux instrumentations de topographie cornéenne, d’aberrométrie ou de photoablation.
Les techniques binoculaires ou non occultantes sont plus fiables, car elles évitent la mydriase réactionnelle à l’occlusion de l’œil adelphe [138].
La pupillométrie permet notamment de :
– référencer la réfraction et l’aberrométrie du front d’onde en fonction d’un diamètre pupillaire donné ;
– détecter les patients à pupille photopique large (bons candidats à une technique multifocale) ou étroite (bons candidats à la monovision) ;
– détecter les patients à pupille mésopique large, présentant un risque majoré de fluctuation visuelle, de halos et d’éblouissement au décours d’une chirurgie multifocale ou induisant une forte asphéricité cornéenne du fait d’une correction importante ;
– réaliser l’enregistrement d’une référence irienne pour la reconnaissance du patient, de l’œil opéré, de l’axe visuel, afin d’améliorer la sécurité des traitements et l’alignement des profils ablatifs ou des implantations.
L’aberrométrie du front d’onde, adaptée des techniques de contrôle de qualité en optique astronomique, a surtout ouvert la voie d’une quantification objective directe de la qualité optique de l’œil, permettant une évaluation indirecte reproductible de la qualité de vision (à capacité sensorielle et cognitive constante).
L’aberrométrie du front d’onde de l’œil consiste à mesurer la déviation des rayons lumineux induite par leur passage dans les milieux oculaires (cf. supra, fig. 23-5). Il existe de nombreux aberromètres disponibles en clinique, dont les performances ont été comparées [131].
L’utilisation clinique de l’aberrométrie permet d’établir une correspondance objective relativement fiable avec les plaintes subjectives des patients, selon l’aspect du front d’onde et la quantification des aberrations optiques d’ordre supérieur (tableau 23-II). Il est très important de noter que le résultat de l’aberrométrie du front d’onde dépend du diamètre pupillaire de mesure : tous les aberromètres intègrent donc des fonctions de pupillométrie plus ou moins sophistiquées.
Une méthode manuelle, dite psychophysique (fondée sur les réponses du sujet examiné), très peu utilisée, consiste à mesurer la déviation angulaire de l’image d’un point source entrant par différents points de la pupille en réalignant cette image avec celle d’une croix de fixation passant par un point fixe de la pupille. Cette méthode permet notamment de mesurer les variations du front d’onde au cours de l’accommodation [71].
Une autre méthode inspirée de la skiascopie focale, la réfractométrie spatiale (OPD-scan, Nidek) permet d’obtenir une carte topographique de la réfraction oculaire et d’en déduire le front d’onde, ainsi que les MTF. Cette méthode, couplée à une topographie cornéenne de type Placido coaxiale, donne une représentation graphique pratique des aberrations optiques d’origine cornéenne, comparée aux aberrations globales de l’œil.
Dans l’aberromètre de Hartmann-Shack (« out-going optics »), le plus couramment utilisé en ophtalmologie, une grille de rayons monochromatiques parallèles entre eux est projetée sur la rétine au moyen d’une grille composée de quelques dizaines de lenticules (fig. 23-9a).
Dans le cas d’un œil dépourvu d’aberrations optiques, les rayons lumineux sont déviés par les dioptres oculaires et convergent parfaitement sur la fovéa. Lorsque ces rayons sont réfléchis par la rétine, ils suivent un chemin inverse et, à la sortie de la pupille d’entrée, se distribuent à nouveau de façon parfaitement parallèle. Un capteur capable d’analyser ces rayons à leur sortie détermine que leur disposition est conforme à la « grille » régulière de départ, ce qui permet de conclure à l’absence d’aberrations optiques oculaires.
En cas d’aberrations optiques, certains rayons se dispersent et ne parviennent pas à la fovéa. Après réflexion par la rétine et sortie par la pupille d’entrée, le même capteur déterminera que les rayons émergents ne sont pas parallèles et que la grille des « centroïdes » matérialisant la position de chacun des rayons réfléchis présente des distorsions par rapport à la grille projetée. Ces distorsions permettent de calculer la déformation du front d’onde, qui peut être représentée en deux ou en trois dimensions et qui traduit graphiquement la présence d’aberrations optiques dans l’œil analysé. Certains modèles récents sont également couplés à une topographie cornéenne de type Placido coaxiale (Topcon KW1).
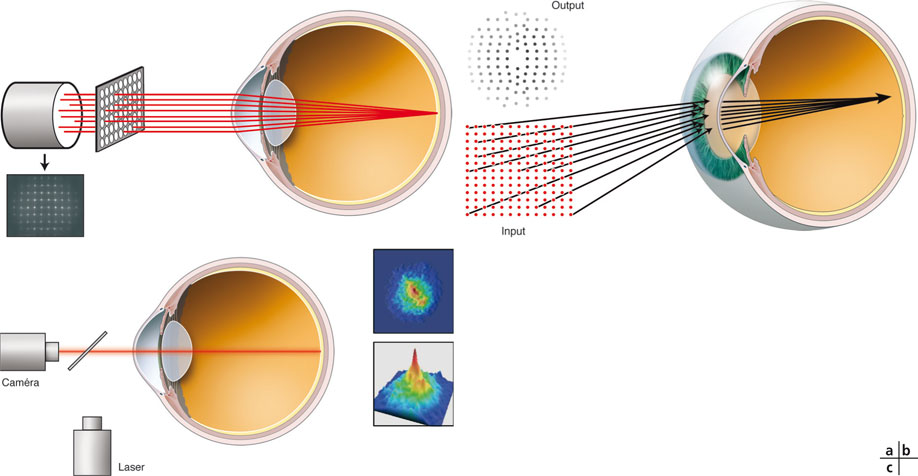
Fig. 23-9 Aberromètres.
a. Hartmann- Shak. b. Tscherning. c. Dual-pass OQAS.
Dans l’aberromètre de Tscherning, un rayon monochromatique balaie l’aire maculaire en reproduisant une grille. Un capteur synchrone de ce balayage analyse directement en temps réel la position du reflet rétinien de ce rayon entrant (« in-going optics ») (fig. 23-9b). Ce système présente quelques avantages, notamment l’augmentation de la plage dynamique d’analyse — indépendante de la réfraction ou de l’importance des aberrations, car les centroïdes trop « proches » ne risquent pas d’être confondus — et la possibilité d’une analyse en temps réel permettant de faire varier l’accommodation du sujet au moyen d’un stimulus réfractif ou visuel, plus adaptée à l’examen du presbyte.
L’aberromètre OQAS® (« dual-pass optics ») (Visiometrics) utilise un capteur particulièrement sensible pour analyser directement l’image du reflet rétinien d’un faisceau monochromatique infrarouge projeté sur la fovéa et calculer la distorsion spatiale du point lumineux projeté (fonction de dispersion d’un point, PSF), qui intègre sa dégradation « à l’aller » et « au retour » au travers des milieux intraoculaires (fig. 23-9c).
L’aberrométrie permet en outre une mesure objective de l’accommodation selon trois modalités [159-161].
L’aberrométrie de Tscherning en temps réel au cours d’efforts accommodatifs effectués par stimulation visuelle simultanée de l’œil adelphe permet de comparer les fronts d’onde successifs et d’en déduire les modifications de la réfraction et des aberrations d’ordre supérieur défocalisantes. Cette méthode est disponible commercialement (iTrace®, Tracey) (cf. infra, fig. 23-14).
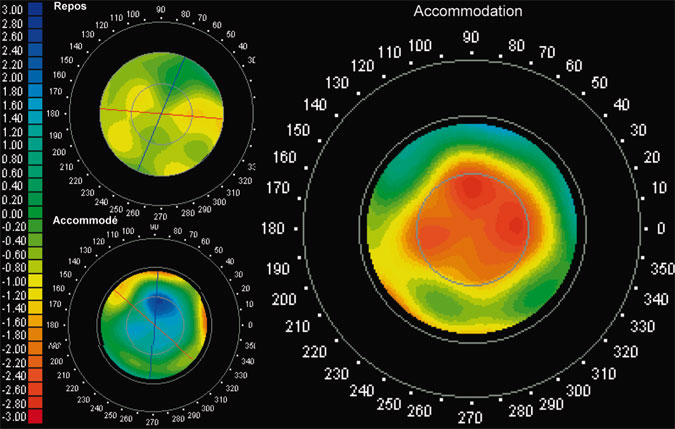
Fig. 23-14 Aberrométrie dynamique d’un implant accommodatif (en vision de près) par l’aberromètre-t opographe iTrace®.
L’aberromètre OQAS II® permet également une évaluation objective de l’accommodation. Lorsque nous avons évalué cet instrument en 2005, nous avons suggéré aux concepteurs d’ajouter sur le chemin optique de l’appareil la possibilité d’interposer un système de variation de la puissance optique sur l’axe de fixation du patient, simulant l’addition de verres correcteurs analogues à ceux que nous utilisons pour mesurer la courbe de défocalisation subjective. Ce perfectionnement, introduit sur la version OQAS II, permet à présent de réaliser une courbe de défocalisation objective, à laquelle est associée une simulation de la vision d’un optotype de Snellen par convolution d’images à partir des MTF mesurées (cf. fig. 23-11 et 23-13, et également la figure 9-5, au chapitre 9, représentant un cas clinique d’implantation LAL® avec traitement CNA). Cependant, le faisceau infrarouge utilisé ne permet pas à l’instrument de tenir compte de la pseudo-accommodation induite par les implants réfractifs ou diffractifs.
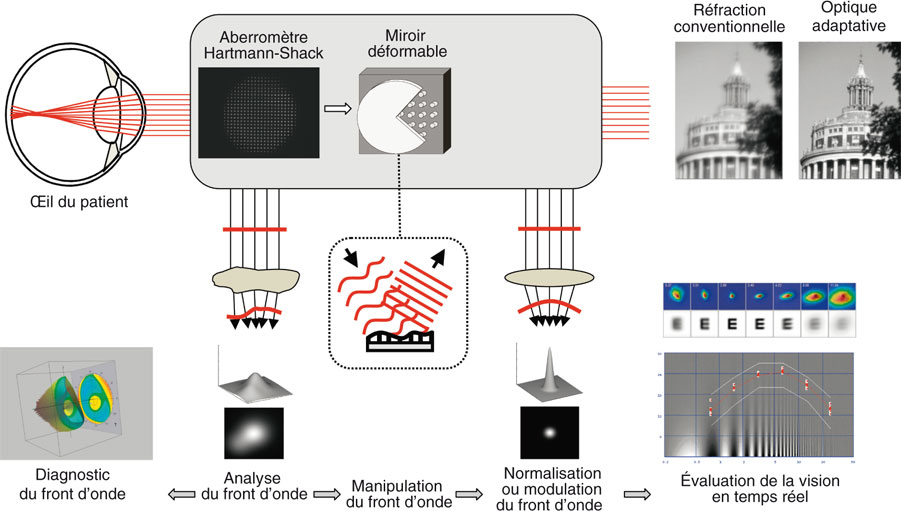
Fig. 23-11 Principe de l’optique adaptative.
À droite, la tour de l’université de Rochester (NY, États- Unis) vue à 800 m avec ou sans optique adaptative (images de D. Williams, Center for Visual Science).
L’aberrométrie dynamique, utilisée pour l’instant en recherche clinique, permet de mesurer le front d’onde au cours d’efforts accommodatifs. Des mesures de type Hartmann-Shack répétées à 7 Hz (environ deux cents mesures sur trente secondes) sont comparées pour les principales aberrations [45].
La diffusion antérograde de la lumière (anterior forward scatter, ou straylight) contribue à l’éblouissement et à la perte de contraste ou d’acuité visuelle. De nombreux dispositifs ont été mis au point pour quantifier l’effet de l’éblouissement ou la perte de résistance à l’éblouissement de façon subjective [9, 88, 152] ou, plus récemment, objective [95, 102].
Une méthode classique, le Brightness Acuity Tester (BAT, Mentor), mesure l’acuité sous éblouissement, le patient regardant au travers d’une petite coupole lumineuse [147]. Une méthode plus récente est fondée sur la comparaison subjective psychophysique de stimuli générés par ordinateur. Cette méthode semi-quantitative (straylight meter de Van den Berg, ou C-Quant®, Optikon) nécessite une bonne coopération [88, 152].
Cependant, la seule méthode réellement objective actuelle est fondée sur la polarimétrie. L’incorporation d’un polarimètre dans l’aberromètre OQAS II permet de quantifier indirectement mais objectivement la proportion de lumière dispersée (ocular scattering) au cours du passage des rayons lumineux dans les milieux intraoculaires, par comparaison de l’image de la fonction de dispersion (PSF) d’un point avant et après polarisation au moyen de deux filtres polarisant linéaires (l’un sur le trajet de l’illumination, l’autre sur le trajet de l’enregistrement). La conjonction de deux filtres polarisants croisés associés à un filtre de phase agit comme un filtre d’exclusion spatiale, éliminant les rayons trop éloignés de l’axe visuel [95]. Cette instrumentation génère un indice corrélé à la transparence des milieux (OSI, Optical Scatter Index). Une dégradation de cette transparence (cataracte, opacité de l’interface LASIK, haze sous-épithélial) augmente l’OSI (fig. 23-10). Dans une étude portant sur cent soixante-dix-huit yeux « normaux » de cent quatre-vingt-deux volontaires sains jeunes (acuité logMAR supérieure ou égale à 0,0, sensibilité aux contrastes normale), la valeur moyenne normale de référence de l’OSI a été évaluée à 0,38 ± 0,19. La combinaison de la mesure des MTF fournie de façon simultanée par l’aberrométrie à la mesure de la sensibilité aux contrastes globale (neurale et optique) permet de déduire les fonctions de sensibilité au contraste neurales dans une population normale de référence [102].
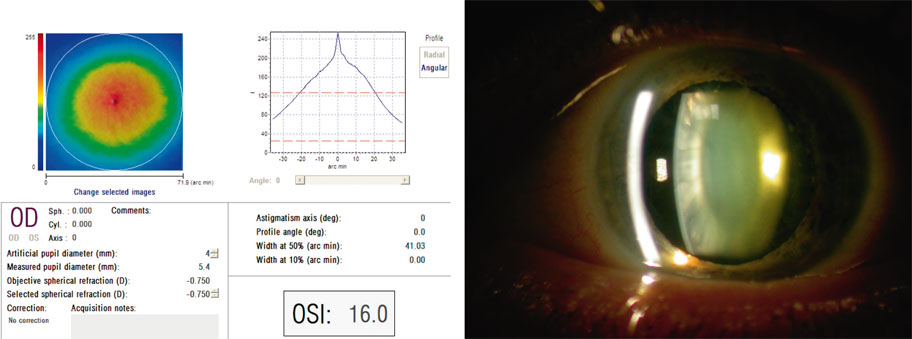
Fig. 23-10 Polarimétrie OQAS dans une cataracte nucléaire débutante.
La valeur de l’indice OSI (16) est considérablement supérieure à la normale (1), malgré une acuité visuelle normale.
L’optique adaptative, technique plus récente et moins diffusée, permet de préciser le lien entre la qualité optique de l’œil et la perception visuelle subjective du sujet, en modulant en temps réel les aberrations optiques lors de l’évaluation visuelle du sujet au moyen d’un miroir déformable (ou d’un élément cristal liquide) [99] motorisé, asservi à un aberromètre, également introduit dans le chemin optique visuel du patient (fig. 23-11).
L’optique adaptative a permis de confirmer notamment que :
– la correction des aberrations optiques d’ordre supérieur améliorait la qualité de vision subjective ;
– l’introduction en temps réel d’aberrations optiques d’ordre supérieur (coma, trefoil, aberration sphérique) permet de moduler la profondeur de champ ; notamment, l’induction d’une aberration sphérique négative produit une modification de la position du centre de focalisation d’environ 2,6 D par micromètre d’aberration, ce qui recoupe très exactement des protocoles empiriques actuels de presbyLASIK [129] ; ceci permettrait de guider la chirurgie ablative de la presbytie en précisant pour chaque individu la relation optimale entre asphéricité préopératoire et aberration sphérique induite en fonction de la dynamique pupillaire et de la tolérance subjective (brevet AMO, US patent 7513620) ;
– l’introduction d’aberration sphérique négative réduit la latence accommodative du sujet, tandis que l’aberration sphérique positive ou la coma l’augmentent [58].
L’évaluation subjective est nécessaire mais parfois trompeuse.
L’acuité visuelle peut être mesurée avec les échelles habituelles (Parinaud, Jaeger) ou, de façon plus standardisée, au moyen de l’échelle du Minnesota (Minnesota Reading Chart) permettant la détermination de la taille minimale critique de caractères (CPS, Critical Print Size ; CPS normale : 0,20 logMAR), de l’acuité de lecture internationale logMAR (normale : 0,05 logMAR) et de la vitesse de lecture [66, 67].
Les études de concordance entre les divers optotypes et méthodologies de mesure suggèrent que la mesure de l’acuité de lecture logMAR avec optotypes en lettres majuscules est l’évaluation la plus pertinente [65].
La simple détermination de l’acuité (avec ou sans correction, de près et de loin) ne suffit pas à caractériser avec précision le succès d’une technique chirurgicale de compensation de la presbytie. Il existe en effet de nombreux facteurs de confusion qui affectent l’appréciation du bénéfice apparent d’une chirurgie en termes d’acuité, d’indépendance par rapport à une correction optique de près ou de qualité de vision :
– effet d’apprentissage et de motivation (plus le sujet pratique un test visuel donné, plus les résultats s’améliorent) [83] ;
– effet placebo ;
– effet sténopéique (la vision de près non corrigée est inversement corrélée au diamètre de la pupille) ;
– variation de la luminance du test (les résultats visuels s’améliorent lors que les tests sont présentés sous fort éclairement ; par exemple, l’échelle de Parinaud rétroéclairée) ;
– temps de présentation du test.
Par ailleurs, de bons résultats réfractifs ne doivent pas masquer une dégradation de la qualité de vision (sensibilité aux contrastes, effets visuels indésirables photiques de types halos, éblouissements) [115].
D’autres tests fonctionnels doivent donc être mis en œuvre :
– mesure de l’acuité en vision intermédiaire (à 50-65 cm) ;
– mesure de l’acuité de près avec la meilleure correction de loin ;
– détermination du punctum proximum et du punctum remotum ;
– amplitude accommodative sous ambiance lumineuse constante et à diamètre pupillaire constant ;
– courbe de défocalisation (acuité de loin avec addition successive de verres correcteurs concaves croissants sur la meilleure correction de loin, de – 0,50 D à 4,0 D par paliers de 0,50) [62, 65] ;
– vitesse de lecture de près [43, 44, 76, 77] ;
– courbe de sensibilité aux contrastes ou acuité sous faible contraste (10 %) (cf. supra, fig. 23-2) ;
– questionnaires de qualité de vision normalisés.
La mesure de l’amplitude d’accommodation résiduelle du sujet presbyte s’avère difficile et peu fiable en routine. L’évaluation subjective est perturbée par de nombreux facteurs (taille de la pupille, illumination du test, temps de présentation, profondeur de champs statique réfractive, effet d’apprentissage). L’évaluation objective par la skiascopie est également très dépendante des conditions du test et de l’expérience de l’observateur. L’évaluation objective par l’aberrométrie dynamique du front d’onde, utilisée en recherche clinique (cf. infra, fig. 23-14), n’est pas intégrée en routine clinique et, surtout, ne permet pas pour l’instant de quantifier la pseudo-accommodation des implants diffractifs avec précision.
C’est donc la mesure de courbe de défocalisation subjective qui demeure actuellement la meilleure approche, permettant d’évaluer de façon assez rapide l’amplitude d’accommodation dans les conditions d’examen habituelles (cf. infra, fig. 23-22). Pour plus de fiabilité, il est nécessaire d’introduire un effet de randomisation (soit de la taille des optotypes, soit de la puissance des verres d’addition), afin d’éviter de proposer au sujet une progression trop linéaire de la difficulté de lecture [65].
La mesure quantitative de la vitesse de lecture de près bénéficie de technique informatisée (par exemple, le Salzburg Reading Desk, fondée sur l’échelle de lecture logarithmique de Radner) [41]. Les vitesses de lecture sont relativement constantes chez les sujets normaux, environ 150 ± 20 mots par minute (mpm) ou 350 ± 50 caractères par minute (cpm) pour les fontes larges, mais elles diminuent de façon variable pour les fontes plus petites. La moyenne des distances de lecture spontanée est 49,74 ± 4,43 cm.
Les questionnaires de qualité de vision autoadministrés, tels que ceux du National Eye Institute (NEI-RQL-42 ou NEI-VFQ-25), possèdent un degré relativement élevé de reproductibilité et de cohérence interne, à condition d’être développés et validés avec rigueur [24, 46, 90, 136]. Les questionnaires les plus performants sont capables de discriminer les différentes pathologies oculaires affectant la qualité de vision. Ces questionnaires sont surtout corrélés de façon étroite à l’acuité visuelle de près et à la sensibilité aux contrastes, ce qui en fait des outils utiles pour l’évaluation des résultats de la chirurgie de la presbytie. Cependant, les modèles mathématiques montrent que les critères d’autoévaluation n’expliquent que moins de la moitié de la variance des résultats, ce qui suggère l’influence significative d’autres facteurs, comme par exemple l’attitude psychologique du sujet par rapport à sa pathologie ou son intervention [30].
Les questionnaires de qualité de vie (cf. chapitre 24) posent des problèmes similaires [46, 94, 136] mais permettent de discriminer le bénéfice fonctionnel de différentes options chirurgicales, par exemple en termes de conduite nocturne [2-4].
L’évaluation objective de l’effet chirurgical est indispensable pour comprendre le mécanisme réel de l’effet visuel observé et mesurer objectivement le bénéfice qualitatif et quantitatif apporté par l’intervention, de façon indépendante du sujet et de l’observateur.
Les principaux tests employés sont :
– la topographie cornéenne pour mesurer l’asphéricité ;
– les méthodes spécifiques de réfractométrie spatiale ;
– l’aberrométrie du front d’onde, pour quantifier :
– la qualité optique initiale et finale de l’œil opéré ;
– les aberrations optiques défocalisantes (aberration sphérique, coma) ;
– la pseudo-accommodation liée à ces aberrations ;
– l’accommodation résiduelle (variation de la puissance optique de l’œil liée à la variation des aberrations d’ordres inférieur et supérieur au cours de l’effort accommodatif volontaire ou induit) ;
– les techniques d’imageries (échographie de haute fréquence, OCT du segment antérieur), sensibilisées par des épreuves pharmacologiques (cycloplégie) ou la fixation de l’œil adelphe, qui confirment l’éventuel mouvement antérieur d’un implant accommodatif.
Les figures 23-12 et 23-13 résument l’ensemble des informations fournies par la topographie d’élévation et l’aberrométrie dans un cas de presbyLASIK.
La topographie cornéenne objective l’augmentation d’élévation antérieure corrélée à la puissance optique de la cornée et, notamment, l’asphéricité qui contribue à la multifocalité réfractive. La cornée hyperprolate (plus cambrée au centre que la normale) induit par exemple une « myopie localisée » dans la zone centrale compensatrice de la presbytie.
L’aberrométrie conventionnelle (fig. 23-12a) indique la qualité optique globale résultant de la chirurgie — distorsion du front d’onde (RMS, en micromètres), image d’un point vu à l’infini par l’œil du sujet (fonction de dispersion d’un point) — et la « topographie » de la réfraction dans la pupille d’entrée. La fonction de dispersion d’un point (PSF) permet de visualiser directement la contribution de chaque type d’aberration à la perte de qualité optique de l’œil (fig. 23-12e à g). L’aberromètre permet également la quantification des aberrations optiques d’ordre supérieur défocalisantes (aberration sphérique négative : « myopie centrale » ; coma : bifocalité).
Certains aberromètres (ZyWave®, Bausch & Lomb) extrapolent la courbe de réfraction (sphère, cylindre, axe) en fonction du diamètre de la pupille, notamment la réfraction simulée en fonction du diamètre pupillaire (fig. 23-12d).
L’aberromètre dual-pass OQAS détermine les fonctions de transfert de modulation (MTF) caractéristiques de la qualité optique de l’œil opéré et simule l’acuité potentielle du sujet en fonction du contraste (fig. 23-13).
L’aberromètre-topographe Tracey mesure simultanément la topographie cornéenne et l’aberrométrie dynamique (iTrace®) au cours de l’accommodation, car une cible de fixation externe variable peut être visualisée en continu par le sujet [91] (fig. 23-14).
Compte tenu de ces notions, l’évaluation pré- et postopératoire ou comparative des méthodes de compensation chirurgicale de la presbytie devrait comprendre idéalement :
– une évaluation fonctionnelle subjective, comportant :
– la mesure de l’acuité de lecture logMAR avec optotypes en lettres majuscules à 33 cm et à 65 cm ;
– la détermination de la vitesse de lecture maximale pour les fontes standards au moyen d’un texte aléatoire ou d’un logiciel adapté ;
– la mesure de la taille minimale critique de caractère permettant le maintien de la vitesse de lecture maximale (CPS) ;
– la détermination de la courbe d’accommodation subjective (avec randomisation de la présentation des optotype ou des verres d’addition) ;
– la mesure de l’acuité sous faible contraste (10 %) ou la courbe de sensibilité aux contrastes ;
– un questionnaire de qualité de vision et d’indépendance par rapport à une correction optique, validé scientifiquement ;
– une évaluation anatomique et optique objective, incluant :
– la mesure de l’asphéricité de la cornée par la topographie d’élévation ;
– la caractérisation quantitative des aberrations optiques d’ordre supérieur défocalisantes par l’aberrométrie du front d’onde ;
– une courbe de défocalisation objective aberrométrique ;
– l’évaluation simultanée de la pupillométrie photopique et scotopique.
Le choix des méthodes et de leur éventuelle combinaison vise à optimiser pour chaque patient l’efficacité de la vision non corrigée dans deux ou plus des cinq domaines fonctionnels correspondant aux distances courantes :
– vision rapprochée (couture, épilation, modélisme) ;
– vision de près (lecture, écriture, bricolage) ;
– vision intermédiaire (écran informatique, menu au restaurant, titres de journaux, expositions) ;
– vision de loin (conduite en ville, télévision, cinéma) ;
– vision à grande distance (indications routières, noms de rue, sortie et correspondances de métro, sous-titres au cinéma, chasse, golf).
L’évaluation préopératoire du mode de vie, des besoins et des habitudes visuelles du sujet doit être suffisamment précise (travail sur écran, conduite de nuit, types de documents et distance de lecture préférée, intensité des tâches visuelles). Il est important à ce stade de cerner les attentes du patient, documentées au besoin par un questionnaire spécifiquement ciblé (cf. chapitre 20), et de lever l’ambiguïté éventuelle que poserait une attente trop irréaliste :
– exigence d’une vision parfaite à toute distance sans aucune correction ;
– impératif d’un travail intensif de près et en vision intermédiaire sans aucune correction optique ;
– aptitude professionnelle en conditions limites d’éclairement.
Les principes, les risques et les bénéfices de ces méthodes doivent être soigneusement exposés aux candidats. De nombreux patients peuvent bénéficier de l’une ou l’autre des méthodes. Le chirurgien doit être attentif aux critères de sélection de la technique la plus appropriée car, le plus souvent, c’est à lui que le patient laissera la décision.
La méthode la plus simple et la plus ancienne de compensation chirurgicale de la presbytie consiste à favoriser la vision de loin sans correction sur un œil dit « dominant » (en général l’œil droit chez un droitier) et la vision de près sans correction sur l’autre œil, dit « non dominant ».
Cette dominance oculaire existe chez la très grande majorité des sujets et correspond souvent à l’œil directeur, ce qui explique qu’on vise (photographie, tir à la carabine, tir à l’arc) toujours avec le même œil. Le cerveau est capable de sélectionner spontanément l’image la plus importante des deux images de loin et de près qui sont perçues par la rétine en fonction du contexte cognitif.
Cette monovision, ou « bascule », est appliquée depuis de très nombreuses années notamment pour les lentilles de contact, la chirurgie de la cataracte, les implants phakes et la chirurgie cornéenne au laser (LASIK, photokératectomie réfractive).
Toutes les méthodes de chirurgie réfractive permettant d’induire une myopie peuvent être appliquées à la monovision.
La monovision est en compétition dans chaque indication avec une approche multifocale de la compensation chirurgicale de la presbytie.
Les avantages et les limites classiques de la monovision ont été caractérisés dans de nombreuses études scientifiques, souvent de façon comparative avec l’approche multifocale.
La monovision corrige efficacement la vision de loin et la vision intermédiaire ou de près. Les résultats visuels des études de monovision sont relativement homogènes.
La tolérance d’une minimonovision ou micromonovision obtenue par LASIK semble excellente [125]. Chez les sujets hypermétropes presbytes traités, 95 % des patients ont une acuité de 10/10 et P5, et 81 % ont P2 [126]. Avec une anisométropie de – 1,25 D, 96 % des patients pseudophakes ont 6/10 ou plus et 92 % P4 ou mieux [56]. Dans une étude comparative chez le pseudophake, l’indépendance en lunettes était obtenue dans 80 % des cas en monovision, 65 % avec des implants multifocaux et 15 % avec des implants monofocaux symétriques [57]. Le niveau d’acuité visuelle non corrigée de près dépend directement du niveau d’anisométropie choisi [57].
Cette approche est facile à mettre en œuvre, prédictible et sûre. Elle est peu coûteuse par rapport aux systèmes multifocaux [61]. En outre, une éventuelle correction complémentaire est plus facile à mettre en œuvre : une simple correction complémentaire par retouche, lunettes ou lentilles pour la vision de loin et/ou de près et intermédiaire permet de compenser très efficacement l’éventuelle insuffisance d’efficacité visuelle dans les circonstances particulières (conduite de nuit, travail de très près, vision intermédiaire). En revanche, la prescription de verres progressifs est pénalisée par l’anisométropie et l’anisophorie éventuelle qui en résulte.
Fondée sur des approches classiques et robustes, la monovision évite les aléas à court terme et long terme des systèmes multifocaux plus sophistiqués mais moins éprouvés. Le choix et la maîtrise de la technique chirurgicale sont cependant importants : par exemple, le LASIK permet d’obtenir des résultats de monovision chez l’emmétrope plus prédictible, plus stable et avec moins d’astigmatisme induit que la kératoplastie conductive dans une étude comparative, alors que, pour le public américain, ces méthodes ont été longtemps présentées comme similaires [18].
Elle n’est pas contre-indiquée par les facteurs de risque de pathologie neurosensorielle (qui limiteraient l’efficacité de la multifocalité).
Celle-ci est stable quelle que soit la lumière environnante. Les effets visuels indésirables persistants (halos, éblouissement, diplopie) sont absents. La sensibilité aux contrastes semble normale en monovision avec, notamment, une bonne sommation binoculaire entre 1 et 6 cycles par degré [77] ; le niveau de sensibilité aux contrastes est cependant légèrement réduit en vision scotopique pour un niveau plus élevé d’anisométropie [57] ; en micromonovision LASIK chez l’hypermétrope presbyte, la sensibilité aux contrastes est même améliorée de façon significative à 3 et 6 cycles par degré et inchangée à 12 et 18 cycles par degré [126].
L’aptitude à la lecture semble meilleure en monovision qu’avec les lentilles multifocales, tant pour l’acuité de près (0,05 ± 0,12 logMAR contre 0,19 ± 0,11 logMAR) qu’en taille critique de fonte d’impression. En revanche, la vitesse de lecture n’était pas statistiquement différente dans cette étude (environ 350 caractères par minutes) [76].
Chez le pseudophake, 97,3 % des patients évalués avec le test VF-7 s’estiment satisfaits ou très satisfaits d’une monovision avec anisométropie de 2 D [100]. Ce taux, relativement homogène dans les séries publiées, est supérieur à celui des systèmes multifocaux [19, 25, 85]. La satisfaction est d’autant plus grande que le patient est plus âgé (64 % avant soixante ans, 87 % entre soixante et soixante-dix ans, 94 % après soixante-dix ans) [77].
Dans une étude portant sur quatre-vingt-deux cas ayant un taux de satisfaction de 97,6 %, le taux de retouche de l’œil non dominant était de 7 % et celui de l’œil dominant de 21 %, ce qui souligne l’importance de l’obtention de l’emmétropie pour le succès de la monovision [124].
Le succès de la monovision obtenue par LASIK myopique peut également être apprécié par le taux de retouche pour annulation de la monovision (correction complémentaire de l’œil non dominant pour la vision de loin). Dans l’étude précédente, aucun patient ayant bénéficié d’un essai préalable de monovision en lentilles de contact n’a souhaité une annulation de sa monovision, alors que deux cas sur trente et un ont demandé cette « annulation » en l’absence d’essai préalable de lentilles [124]. Dans une autre série beaucoup plus large (24 463 cas de LASIK opérés de 2002 à 2008, tous âges confondus), la monovision avait été réalisée dans 1,55 % des cas soit trois cent quatre-vingts cas. Sur ces trois cent quatre-vingts cas, seuls seize patients (4,21 %) ont demandé une correction chirurgicale de la monovision pour rétablir l’égalité réfractive entre les deux yeux [142].
Les inconvénients de la monovision sont modérés mais finalement assez mal répertoriés dans la littérature. Les principaux problèmes rencontrés sont :
– altération du sens stéréoscopique ;
– réduction du champ visuel ;
– perte de la sommation binoculaire ;
– rivalité rétinienne ;
– retentissement moteur et postural ;
– altération de la performance visuelle pour les tâches complexes ;
– limite de l’acuité réglementaire de l’œil corrigé en vision de près ;
– stress binoculaire ;
– difficulté d’identification ou de choix de l’œil dominant ;
– perte de la fonctionnalité en cas limitation ou de réduction oculaire unilatérale de la vision ;
– difficulté de l’obtention de l’emmétropie effective sur l’œil dominant ;
– insuffisance de couverture des trois domaines de la vision (problème de la « troisième focale ») ;
– nécessité d’une neuroadaptation.
Il est utile de réfuter deux idées fausses : « Le seul inconvénient de la monovision est la dégradation du sens stéréoscopique permettant la perception du relief et de la profondeur » ; « Sans vision binoculaire, il n’y a pas de perception de la profondeur ou du relief ».
En fait, au-delà de quelques mètres, les indices monoculaires (flou, ombre propre, ombre portée, variations du contour, texture) sont plus importants que les indices binoculaires pour la vision du relief, de la profondeur et des distances. Ces notions sont directement utilisées dans la recherche sur la vision robotisée, pour laquelle la « stéréovision » par caméras multiples est en compétition avec le traitement statique ou dynamique de l’image produite par une source unique (J.-L. Baril, université de Bourgogne).
La mesure de la stéréoscopie est fondée sur des tests cliniques simples mais peu standardisés et peu reproductibles, ce qui induit des discordances de résultats entre les tests, notamment du fait de la persistance d’indices visuels monoculaires (faux positifs) variables selon de type de test (Titmus, Randot, préscolaire) [53].
Le niveau optimal d’anisométropie permettant une performance visuelle suffisante au prix d’une perte acceptable de la stéréoscopie a été évalué par de nombreux auteurs (fig. 23-15). Une anisométropie de 1 D réduit la stéréoacuité de 79 secondes d’arc à 100, tandis qu’une anisométropie de 2 D réduit à 158 secondes d’arc. La proportion de patients ayant à la fois une vision de près supérieure à 5/10 et de loin supérieure à 8/10 était plus grande avec 1,50 D qu’avec 1 D ou 2 D d’anisométropie [65]. Pour 2 D d’anisométropie, la stéréoacuité mesurée au test de Titmus était de 197 secondes d’arc dans une autre étude [101].
Après six mois d’adaptation à la monovision, la stéréoacuité moyenne de près (Randot) et de loin (Worth 4 points) reste pénalisée par l’absence de fusion fovéolaire, autour de 100 secondes d’arc pour une anisométropie de 1,5 D ou moins et 150 secondes d’arc pour une anisométropie plus importante, contre 40 secondes d’arc pour les sujets contrôles [52].
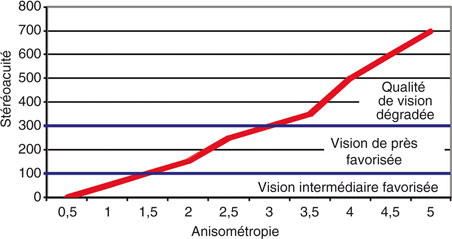
Fig. 23-15 Anisométropie (en dioptries) et stéréoacuité (en secondes d’arc).
Le champ visuel monoculaire statique est d’environ 145°. Le champ visuel binoculaire statique est de 190°. Dans l’intersection des deux champs visuels monoculaires, le champ visuel binoculaire permet la vision du relief.
Le champ visuel binoculaire a été comparé entre implants multifocaux et monovision (– 1,5 D à – 1,0 D). Le score d’efficacité d’Easterman et le temps moyen du test n’étaient pas différents et tous les patients étaient aptes au test de conduite britannique. Cependant, l’incidence des points « non vus », notamment ceux situés en bordure du champ binoculaire vrai, dans le champ visuel monoculaire de l’œil dominant corrigé de loin (65 % des cas), était plus élevée dans le groupe monovision (33 % contre 0 %), ce qui indiquerait une pénalisation du champ visuel de près [145].
La sommation binoculaire induit une synergie cognitive qui permet, par l’usage simultané des deux yeux, d’améliorer significativement :
– l’acuité visuelle ;
– le seuil de détection de la lumière ;
– la détection des objets au sein d’un environnement (objets « camouflés ») ;
– la qualité de vision subjective ;
– la performance visuelle ;
– la perception de l’espace ;
– la coordination œil-main ;
– la lecture confortable et efficace.
Ceci est lié :
– à un meilleur rapport sensibilité/détectabilité des stimuli visuels (plus petits, moins lumineux, plus rapides) à l’intérieur du champ visuel binoculaire ;
– à une meilleure stratégie d’utilisation du regard (champ visuel dynamique).
Ces éléments sont cependant peu quantifiables et leur altération est parfois remarquablement compensée en monovision.
La rivalité rétinienne survient lorsque les deux yeux tentent de percevoir simultanément deux « objets » différents indépendants l’un de l’autre. Le plus souvent, l’œil dominant surmonte l’œil dominé dans ce conflit perceptif et entraîne parfois une perte de l’information visuelle importante ou signifiante. Ceci a été proposé pour quantifier la dominance sensorielle en clinique [70].
Un exemple classique de rivalité rétinienne est fourni par le problème des affichages virtuels « tête haute » en aéronautique (pilotage des hélicoptères AH-64, par exemple) ou dans certains modèles d’automobile grand public.
L’impact de la monovision sur les problèmes de rivalité rétinienne est encore mal connu.
Le retentissement postural de la fixation monoculaire de loin, étudié sur plateforme de posturographie dynamique informatisée, ne semble pas influencé par la dominance oculaire [59].
L’impact de la monovision sur l’aptitude à la marche en terrain irrégulier a été analysé dans plusieurs études. Ont été notamment observés :
– un ralentissement de la vitesse de marche, suggérant une augmentation inconsciente des précautions prises ;
– une réduction de l’espace de franchissement des marches (distance horizontale orteil-nez de marche) ;
– une augmentation de 33 % de la variabilité de la distance verticale entre les orteils et le nez de marche.
Ces données suggèrent une possible augmentation du risque de heurter les obstacles et l’importance d’un apprentissage adapté pour réduire les conséquences somato-sensorielle de la monovision [32].
Une autre étude souligne l’importance de la défocalisation monoculaire chez le sujet âgé dans la perte de précision de l’appréciation de la hauteur d’une marche [151].
La compensation de la perte du sens stéréoscopique, même minime, fait appel à des fonctions visuelles complexes, susceptibles de s’altérer avec l’âge. Ainsi, une étude montre une majoration du risque de chute chez les sujets âgés en cas de monovision récente [151].
La comparaison des mouvements oculaires et céphaliques chez des sujets équipés de diverses corrections de la presbytie lors d’un test de conduite automobile vidéo montre des différences significatives. Les lunettes progressives (V2) et bifocales (DF) induisent des mouvements oculaires plus longs que les lentilles multifocales ou en monovision. Les mouvements de la tête sont également plus importants avec les lunettes simples, progressives ou bifocales. La reconnaissance des véhicules cibles et le temps de freinage n’étaient pas statistiquement différents. L’identification des indications du tableau de bord était moins précise dans le secteur inférieur gauche, quel que soit le mode de correction [33, 34].
La performance visuelle en conduite, notamment de nuit, peut être affectée par la monovision.
Les différentes corrections de la presbytie par verres simples, verres progressifs, lentilles multifocales et lentilles en monovision, ont été comparées à court terme chez le sujet non habitué, pendant des périodes successives randomisées. La détection et l’évitement des risques routiers de faible contraste, l’identification des signaux routiers, la lecture des panneaux de rue, le temps de conduite pour un trajet déterminé, la capacité à rester dans sa ligne, la réponse aux indications du tableau de bord et les mouvements oculaires (durée de la fixation et nombre de fixations) ont été quantifiées. La lecture des plaques de rue était moins rapide avec la monovision et les lentilles multifocales. La vitesse de conduite était plus lente et la durée de fixation était plus longue avec les lentilles multifocales qu’avec les verres progressifs. Les verres simples de loin étaient associés à plus d’erreur en vision de près, avec des durées de fixations plus longues [35]. Dans une autre étude de la perception subjective des difficultés de conduite, les sujets porteurs de lentilles de contact multifocales rapportaient plus de problèmes de halos et d’éblouissement, les porteurs de verres bifocaux plus de problèmes d’adaptation à la distance, et les porteurs de verres progressifs plus de problèmes de distorsion de leur vision périphérique [33, 34].
Il apparaît donc que chaque mode de correction présente des avantages et des inconvénients spécifiques.
L’impact de la monovision sur l’aptitude d’un sujet à interagir de façon performante avec son environnement a été débattu de façon exhaustive à l’occasion d’un accident aéronautique, celui du vol Delta 554 (19 octobre 1996, trois blessés légers sur soixante-trois passagers et membres d’équipage). Dans des conditions météorologiques particulièrement difficiles, un appareil McDonnell-Douglas MD-88 a heurté le sol à l’atterrissage. Les conclusions de la National Transportation Safety Board ont imputé l’accident au fait que l’équipement du pilote en lentilles de contact en monovision avait compromis sa capacité à apprécier la position de l’avion par rapport à la piste d’atterrissage, dans un contexte d’illusion optique créé par l’approche au-dessus de l’eau, la défaillance de la signalisation au sol, la pluie et le brouillard, et la défaillance de l’altimètre du copilote [109, 150]. Pourtant la correction réfractive en monovision des pilotes a été proposée très tôt [97]. Par ailleurs, l’analyse de la NTSB a été contredite par de nombreux experts [21], notamment sur le principe que la perception de la profondeur et du relief n’est liée à la vision stéréoscopique que jusqu’à quinze mètres de distance environ.
La limite réglementaire doit parfois être atteinte :
– pour le permis et la conduite automobile ;
– pour le pilotage aérien ;
– dans les professions de sécurité ;
– pour l’aptitude à certains métiers spécifiques.
En l’absence de monovision, l’effet de la correction myopique au vertex par LASIK bilatéral sur la vision binoculaire semble négligeable et transitoire. Notamment, chez le sujet orthotropique en préopératoire, le rapport AC/A mesuré par la méthode des gradients se réduit d’un à trois mois en postopératoire et retourne à la normale entre trois et neuf mois après l’intervention [119].
Le stress binoculaire induit par la monovision est lié à plusieurs facteurs :
– images rétiniennes non similaires (aniséiconie par anisométropie) ;
– problèmes de convergence ;
– conflit entre accommodation et convergence.
Ses conséquences fonctionnelles sont le plus souvent bénignes mais parfois plus gênantes (céphalées, douleurs orbitaires, fatigabilité).
Chez des sujets prédisposés, la monovision s’accompagne d’un risque modéré de décompensation d’un strabisme latent, qu’il est prudent de dépister par un essai contactologique préalable [87].
En cas de presbytie avancée, la différence nécessaire entre les deux yeux peut induire une fatigue oculaire, souvent modérée, notamment en fin de journée et en cas de travail intensif.
La performance visuelle de la monovision dans le travail, étudiée en comparaison avec d’autres méthodes (verres de près, bifocaux, lentilles de contact multifocales) semble légèrement réduite et s’accompagne d’une fatigue dans l’utilisation prolongée des écrans informatiques [79, 81].
Ceci traduit parfois une erreur dans le choix de l’œil directeur ou une discordance entre œil directeur/dominant/préféré. Il est donc utile de tester l’hypothèse de la monovision en lentilles pendant quinze jours au moins, en conditions visuelles réalistes (éviter les périodes de congés). En cas de problème, il est toujours utile de tenter l’inversion de côté.
La dominance est la supériorité d’un œil sur l’autre dans le regard (œil directeur), la fixation préférentielle, les fonctions sensorielles (par exemple, l’acuité visuelle) ou la persistance en cas de rivalité oculaire. Les bases neuroanatomiques et la signification fonctionnelle de la dominance sensorielle oculaire ne sont pas élucidées, malgré l’importance clinique pratique de ces notions en contactologie, en chirurgie et dans le traitement des problèmes fonctionnels binoculaires.
Une étude récente a analysé la concordance de la dominance sensorielle oculaire entre les trois principales fonctions visuelles (acuité de résolution, sensibilité aux contrastes et sensibilité à l’alignement) et confirme l’absence de corrélation stable entre ces trois types de dominance sensorielle pour un individu donné [146]. Une autre étude comparant neuf méthodes pour déterminer la dominance motrice et sensorielle de sujets emmétropes, ayant une acuité et une stéréoacuité normale, a retrouvé dans un pourcentage significatif de cas des résultats ambigus ou discordants. Les meilleurs tests étaient ceux utilisant un carton perforé et le test au kaléidoscope [140].
Il n’y a donc pas de bonne corrélation entre l’œil directeur et l’œil sensoriel dominant.
Une méthode quantitative de détermination de la dominance sensorielle a été proposée. Une cible de rivalité binoculaire est projetée sur la rétine de chaque œil du sujet à l’aide de deux rétinomètres. Le sujet rapporte la visibilité exclusive d’une des deux cibles monoculaire et la durée de cette visibilité exclusive est notée. La différence de durée entre l’œil dominant et l’œil non dominant est une appréciation quantitative de la dominance sensorielle. Ce test peut être appliqué à des patients porteurs d’une cataracte [69].
Des tests plus simples utilisés en routine permettent en principe d’identifier l’œil directeur et l’œil dominant.
L’œil directeur peut être déterminé par le test du cylindre ou du carton perforé.
On demande au patient de regarder spontanément avec les deux yeux au travers d’un cylindre de papier (une feuille A4 roulée dans le sens de la longueur, par exemple) tenue à deux mains à 30 cm du visage, une cible éloignée (lettre optotype 1/10 ou diode à plus de 3 mètres). Lorsque l’examinateur cache un œil après l’autre (avec la main, par exemple) le sujet prend conscience qu’il « vise » avec un œil seulement alors qu’il pensait voir avec les deux yeux. Cette réalisation du phénomène de neutralisation est également importante pour introduire le concept de monovision et en faciliter l’acceptation.
L’œil dominant sensoriel est identifié par l’addition alternée d’une sphère de + 0,75 D sur la meilleure correction en vision de loin. Le sujet examiné exprime en général de façon univoque sa préférence pour un côté, ce qui indique la configuration la moins pénalisante pour la vision binoculaire. D’autres méthodes de suppression interoculaire ont été proposées [162].
La relativité de cette dominance sensorielle explique sans doute le succès de la monovision inversée (correction de loin sur l’œil non dominant). Dans une série de cent quarante-quatre cas de LASIK consécutifs, 88 % des patients corrigés en monovision et 100 % des patients corrigés en monovision inversée se déclaraient satisfaits de l’intervention [80].
L’emmétropisation effective de l’œil dominant est cruciale pour le succès de la monovision. Elle est plus ou moins difficile à obtenir, en fonction de l’amétropie préopératoire et de la technique chirurgicale. Les progrès acquis en ultraLASIK (découpe au laser femtoseconde, eye tracker multidimensionnel, reconnaissance irienne, nomogrammes avancés) favorisent une meilleure prédictibilité des résultats, en règle supérieurs 95 % des cas à moins d’une demi-dioptrie de l’objectif réfractif. Ce n’est pas encore le cas avec les implants phakes ou pseudophakes, pour lesquels les taux sont autour de 60 % à 80 %. Les progrès de la biométrie et la précision apportée par les implants toriques ou les implants ajustables par la lumière devraient améliorer la prédictibilité et donc l’efficacité de la monovision (fig. 23-16).
Dans une série de référence, 7 % des patients choisissent de corriger l’œil sous-corrigé, mais 28 % choisissent de faire une retouche sur l’œil dominant [26]. Dans une étude portant sur quatre-vingt-deux cas, ayant un taux de satisfaction de 97,6 %, le taux de retouche de l’œil non dominant était de 7 % et celui de l’œil dominant de 21 %, soulignant l’importance de l’obtention de l’emmétropie pour le succès de la monovision [124].
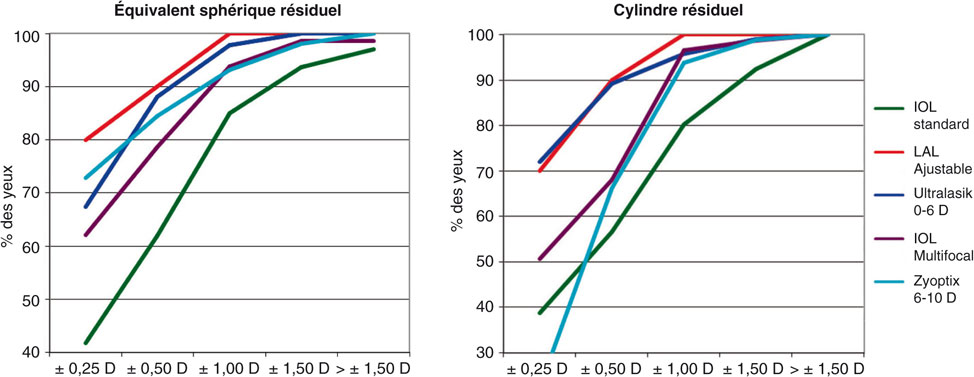
Fig. 23-16 Obtention de l’emmétropie effective.
Précision réfractive (% d’yeux opérés à 0,25 D, 0,5 D, 1,0 D et 1,5 D de l’objectif réfractif) pour l’équivalent sphérique et le cylindre après chirurgie par implant standard (incision 1,8 mm à 3,2 mm), implant diffractif multifocal (incision 1,8 mm à 2,2 mm) ou implant ajustable (incision 3,2 mm) comparée à celle de deux techniques de LASIK (conventionnel ou guidée par l’aberrométrie et l’eyetracker rotationnel).
UltraLASIK : n = 266 ; Zyoptix : n = 234 ; implants standards : n = 4 435 ; implants multifocaux : n = 145 ; LAL ajustable : n = 10.
La monovision crée seulement deux distances de vision nettes (loin et près), alors que la vision normale nécessite de couvrir trois à cinq domaines de vision distincts (très près, près, intermédiaire, loin et très loin). C’est souvent dans le domaine de la vision intermédiaire (écran d’ordinateur, partition musicale, exposition d’art) que se manifeste la limite de la monovision.
Pour pallier ce problème, le principe de monovision peut être décliné selon différents niveaux d’asymétrie entre les deux yeux en fonction des besoins exprimés par le sujet (tableau 23-III).
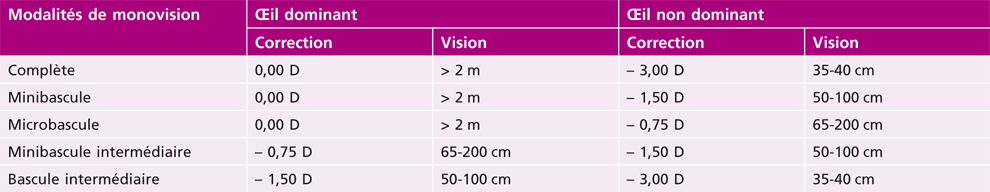
Tableau 23-III Monovision : niveaux d’asymétrie entre les deux yeux en fonction des besoins exprimés par le sujet.
Le traitement du flux constant d’information visuelle par le cerveau permet normalement (chez le sujet non presbyte), grâce à l’accommodation, de focaliser instantanément et inconsciemment sur l’objet de notre attention cognitive, qui est alors vu « net », alors que les autres objets pourtant présents dans notre champ de vision sont « flous ». Notre cerveau peut alors concentrer son analyse sur l’objet vu « net ».
En monovision, le sujet doit apprendre à faire le tri de l’influx d’informations visuelles en provenance des deux yeux en fonction de la distance focale de l’objet qui est le sujet de son attention. Chez certains sujets, ce processus est automatique de façon quasi immédiate. Cependant, pour la majorité des patients, le temps d’adaptation est en général d’une à deux semaines [81]. Un petit groupe de patients ne parvient jamais à s’adapter [79], ce qui incite à tester cette approche par la simulation du résultat en lentilles de contact pendant une période suffisante, avant d’en retenir l’indication en chirurgie réfractive (tableau 23-IV).
Il est probable que l’exploration en imagerie par résonance magnétique (IRM) fonctionnelle permettra de mieux comprendre la réponse corticale dans ce processus de neuroadaptation.

Tableau 23-IV Comment améliorer les résultats de la monovision ?
L’évaluation de la qualité de vision après compensation chirurgicale multifocale de la presbytie doit être envisagée de façon comparative avec l’alternative optique offerte par le port de lunettes. L’impact des verres bi- ou multifocaux sur la qualité de vision est donc important à connaître.
L’utilisation de verres bifocaux ou trifocaux entraîne un saut brutal (jump) de taille et de position d’image lors du passage de la ligne de vue sur la zone de séparation (ledge) des segments optiques de puissance et d’effet prismatique différents. Il existe à ce niveau une bande de non-focalisation (scotome). Les verres bifocaux pénalisent également la vision intermédiaire non corrigée. Ces inconvénients expliquent qu’actuellement moins de 20 % des presbytes préfèrent les bifocaux aux verres progressifs récents.
Depuis leur mise au point il y a plus de cinquante ans [39], les verres multifocaux progressifs se sont constamment améliorés pour compenser les limitations optiques intrinsèques du concept, notamment grâce à l’introduction de surfaces asphériques « libres » optimisées mathématiquement [106] (cf. chapitre 3). Les inconvénients visuels des verres multifocaux demeurent cependant assez nombreux.
Lors de la progression de la puissance optique de la zone stabilisée de loin vers la zone stabilisée de près, le long d’un « couloir d’addition », géométriquement matérialisé par le méridien « ombilic » de la surface, on observe latéralement une augmentation rapide de l’astigmatisme de la surface périphérique du fait d’une zone de transition (blend zone) entre les deux surfaces sphériques différentes. Cette perte d’orthoscopie induit des distorsions et un flou visuel en vision latérale (par exemple, dans un rétroviseur de voiture). Le théorème de Minkwitz indique que cet astigmatisme indésirable est, à une distance donnée de l’ombilic, environ égal au double de la variation d’addition sur la hauteur équivalente. L’astigmatisme latéral indésirable et l’étroitesse du champ de vision qui en résulte sont donc d’autant plus marqués que l’addition est élevée et que le couloir d’addition est « court » (faible hauteur de verre).
L’optimisation mathématique des surfaces, notamment des gradients de puissance astigmatisme/addition, permise par les outils de calcul intensifs et les nouvelles méthodes d’usinage peut être arbitrée :
– soit en faveur de la largeur du champ de vision nette de loin et de près (au prix de distorsions périphériques plus importantes), permettant une vision statique plus confortable (gradient élevé) ;
– soit au bénéfice d’une réduction des distorsions périphériques, favorisant une meilleure dynamique du regard au détriment du champ de lecture, de ce fait plus réduit (gradient faible).
L’astigmatisme périphérique indésirable est le plus souvent oblique, ce qui entraîne, du fait de la différence de grandissement, une déformation partielle (skew distorsion) de l’image perçue dans cet axe. Le bord rectiligne d’une grille peut de ce fait être perçu comme incliné ou incurvé.
L’amélioration de l’orthoscopie du verre passe par la réduction ou la verticalisation de l’astigmatisme indésirable des zones de transition, mais demeure intrinsèquement limitée par les contraintes mathématiques de géométrie des surfaces.
Lorsque les verres progressifs sont symétriques horizontalement sur les deux yeux, des différences de puissance, d’effet prismatique et de grandissement apparaissent en convergence et contribuent à une rupture de la vision binoculaire. Cet effet peut être minimisé par la rotation nasale du méridien ombilic (asymétrie droite/gauche du design), afin d’optimiser le champ de vision binoculaire de près, au prix cependant d’une augmentation de l’astigmatisme indésirable dans la région nasale.
Une longueur de couloir d’addition plus élevée nécessite des ajustements posturaux ou de direction du regard plus importants (environ 2° de rotation pour chaque millimètre de longueur en plus) et une moindre accessibilité spontanée à la zone de vision de près. En revanche, la plage dynamique disponible pour la vision intermédiaire est plus confortable que pour un couloir d’addition court.
Le gradient prismatique de la périphérie des verres progressifs induit également une distorsion de la perception des mouvements. La variation de prisme et de grandissement lors de la latéralisation du regard entraîne une impression erronée d’accélération des objets statiques. Cette impression d’objet mouvant (image swim) perturbe l’intégration du message visuel par le système vestibulaire, essentielle pour l’équilibre et la stabilisation de l’image lors des mouvements. Ceci peut être la cause d’une sensation de vertige ou de mal de transports.
Le concept de verre progressif impose pour le sujet une impossibilité de regarder de près en haut du verre (par exemple, pour lire le titre d’un ouvrage dans un rayonnage) ou de loin en bas du verre (par exemple, pour descendre un escalier). La nécessité d’un ajustement postural (inclinaison de la tête compensatrice) implique un apprentissage parfois peu évident pour certains porteurs. Cette limitation significative ne peut être surmontée que par une correction multifocale solidaire des mouvements de l’œil et indépendante de la direction du regard, au vertex (lentilles de contact, chirurgie cornéenne) ou intraoculaire.
Les verres sales ou dont la surface est dégradée, notamment du fait du caractère très hydrophobe des traitements antireflet, génèrent par dispersion antérograde des rayons lumineux des halos comparables ou plus importants que ceux perçus avec les lentilles de contact ou avec des corrections réfractives chirurgicales [6].
Dans les espèces possédant un œil de type « caméra photographique », l’aberration chromatique (différence de focalisation des longueurs d’onde colorées) entraîne une défocalisation d’autant plus importante que la profondeur de champ est faible. Ce problème est compensé chez la majorité des vertébrés par une optique physiologiquement multifocale concentrique — « hypermétropie » centrale et « myopie » périphérique chez les prédateurs pour favoriser l’acuité de loin, et l’inverse chez les proies pour favoriser le champ visuel périphérique. Chez certaines espèces, la pupille en fente verticale ou horizontale permet de garder le bénéfice de cette optique multifocale concentrique afin d’éviter l’exclusion de la partie périphérique de l’optique physiologique lors du myosis. Dans d’autres espèces, la constriction d’une pupille circulaire contribuerait à limiter la perte de profondeur de champ (pseudo-accommodation) du fait de l’effet sténopéique induit [93].
Chez l’homme, l’aberrométrie montre effectivement qu’il existe à l’état normal une multifocalité :
– statique, par modulation des aberrations optiques d’ordre inférieur (myopisation croissante en fonction du diamètre de la pupille d’entrée, augmentation de l’astigmatisme) ;
– dynamique, par modulation des aberrations d’ordre supérieur (diminution de l’aberration sphérique positive, augmentation de l’aberration sphérique négative, augmentation de la coma) au cours de l’accommodation physiologique [91].
Cette multifocalité « spontanée » ou « latente » s’étend également aux sujets pseudophakes, ce qui explique la pseudo-accommodation constatée depuis longtemps avec les implants pseudophakes monofocaux [110, 127].
La profondeur de champ dépend de l’acuité visuelle, du diamètre de la pupille, du niveau d’illumination et de la taille du test, conditions dont la standardisation est essentielle pour juger de l’efficacité d’une méthode chirurgicale de la compensation de la presbytie. Pour des yeux pseudophakes monofocaux, la profondeur de champ pour une pupille de 3 mm est d’environ 1,12 D pour une acuité de 10/10, 0,62 D pour 15/10 et 0,47 D pour 20/10 [141].
L’aberration sphérique des implants monofocaux contribue à cette augmentation de la profondeur de champ. Cette « pseudo-multifocalité » serait réduite par les nouveaux modèles neutres ou asphériques compensant l’asphéricité naturelle de la cornée. La comparaison des implants AcrySof® SN60AT (standard) et AcrySof® IQ (asphérique) montre par exemple que la réduction de l’aberration sphérique induite et de l’aberration sphérique totale postopératoire réduit la profondeur de champ et, en particulier, la meilleure acuité en vision de près et en vision intermédiaire avec la correction de loin [128].
Si l’absence d’aberration sphérique conditionne des MTF optimales, une aberration sphérique résiduelle de 0,07 µm à 0,10 µm offrirait le meilleur compromis en termes de profondeur de champ [111].
Le principe général des corrections multifocales cornéennes ou intraoculaires est de défocaliser la lumière incidente pénétrant dans l’œil par la pupille d’entrée (projection virtuelle « réfractive inverse » de la pupille au vertex cornéen) pour partager ou redistribuer l’intensité lumineuse simultanément sur le foyer de loin et sur le foyer de près (et éventuellement sur un foyer intermédiaire).
La multifocalité, contrairement à la monovision, corrige donc à la fois la vision de loin et de près et, parfois, la vision intermédiaire sur chaque œil. Il existe donc une vision simultanée de deux images de netteté différente selon la distance à laquelle « regarde » le sujet. Le cerveau sélectionne l’image la plus appropriée en fonction du contexte ; la suppression incomplète de l’image défocalisée est responsable d’un « halo » ou d’une double « image fantôme », ce qui nécessite une neutralisation par le biais d’un apprentissage (neuroadaptation spontanée).
Les corrections multifocales chirurgicales sont de deux types :
– la « multifocalité séparatrice » (ou discontinue ou discrète), fondée :
– soit sur la juxtaposition concentrique d’éléments optiques de puissances différentes (optique réfractive multifocale) ;
– soit sur une optique de type Fresnel (optique diffractive multifocale) ;
– la « multifocalité transitionnelle » (ou continue), fondée sur une optique asphérique modulant les aberrations optiques d’ordre supérieur défocalisantes (aberration sphérique négative et/ou coma), ce qui représente une inversion de la multifocalité physiologique par exemple par majoration de l’asphéricité naturelle de la cornée (modulation du facteur Q).
La dynamique pupillaire (variation du diamètre et de la position de la pupille en fonction de l’éclairement, de l’état accommodatif ou d’autres stimuli) joue un rôle important dans l’exclusion spatiale de tout ou partie de l’optique multifocale chirurgicale.
Il est important de centrer le système et de calculer précisément la répartition des surfaces réfractives (anneaux concentriques alternés pour la vision de loin et la vision de près), afin de garantir une distribution adéquate de la lumière entrante sur les deux foyers quel que soit le diamètre pupillaire.
En principe, elle est indépendante du diamètre pupillaire et du centrage — les propriétés optiques sont les mêmes sur toute la surface de l’optique. Il peut être néanmoins intéressant d’aménager la distribution spatiale des zones diffractives, par exemple pour favoriser la vision de loin à pupille dilatée, afin de tenir compte du myosis accommodatif (apodisation de l’implant ReSTOR® d’Alcon) ou pour réduire l’aberration sphérique (implants Tecnis®, Acri.LISA®, Rayner ou Diffractiva®, par exemple).
Dans une photoablation multifocale de type presbyLASIK, par exemple, la prise en compte du déplacement inféro-nasal de la pupille lors du réflexe accommodation-convergence-myosis peut conduire à préférer un léger décentrement de la zone d’addition dans cette direction, afin d’optimiser l’adéquation de la pupille à la zone cornéenne de plus grande puissance en vision de près (fig. 23-17).

Fig. 23-17 PresbyLASIK. Centrage de la zone d’addition asphérique sur la pupille de près.
Il existe plusieurs implants multifocaux (bifocaux en réalité, sauf exception) disponibles sur le marché européen. Ces implants sont soit réfractifs soit, le plus souvent actuellement, diffractifs (fig. 23-18). Les caractéristiques des principaux implants sont abordées dans le chapitre 7.
La chirurgie du cristallin avec implants multifocaux diffractifs ou réfractifs induit une bifocalité discontinue :
– les implants réfractifs sont constitués de plusieurs zones de puissances réfractives différentes (en général deux puissances, pour la vision de loin et de près) :
– dans les modèles conventionnels, la disposition des zones est concentrique (symétrie rotationnelle) et le nombre de zones et leur diamètre annulaire dépendent d’un schéma de distribution de la lumière sur les foyers de près et de loin aussi indépendants que possible du diamètre de la pupille ;
– dans un modèle plus récent, un deuxième segment asphérique est ajouté sur l’optique principe, créant une zone d’addition inférieure sans symétrie rotationnelle (Lentis® Mplus, Oculentis), reprenant le principe général du presbyLASIK décentré [3, 48, 104] ;
– les implants diffractifs utilisent la diffraction de la lumière (séparation de la lumière en deux faisceaux) obtenue par la création d’un relief apparenté aux optiques de Fresnel sur l’une des surfaces de l’optique de l’implant ; cet effet est moins dépendant du diamètre de la pupille et du centrage correct de l’optique que pour les optiques multifocales réfractives ; trois perfectionnements récents ont été introduits pour optimiser la distribution relative de l’énergie lumineuse :
– l’asphéricité compense l’aberration sphérique de la cornée (positive, neutre ou négative) et vise à améliorer la qualité optique de la périphérie de l’implant, sa profondeur de champ et la distribution de l’énergie lors de la mydriase : les premiers essais (Tecnis® Multifocal) ont démontré une amélioration de la sensibilité aux contrastes des patients ; avec un autre modèle (ReSTOR® asphérique), l’acuité de près était améliorée mais la sensibilité aux contrastes et la perception de halos n’étaient pas différentes [42] ;
– l’apodisation implique une décroissance progressive de la hauteur des marches diffractives vers la périphérie pour augmenter l’énergie lumineuse disponible en vision de loin lors de la dilatation de la pupille (ReSTOR®) ;
– l’utilisation appropriée de l’énergie des harmoniques de focalisation permet, par une sélection des foyers de loin et de près adaptée, de générer un troisième foyer de focalisation utile pour la vision intermédiaire (FineVision®, PhysIOL).
Dans les deux cas, réfractif ou diffractif, le sujet implanté perçoit deux images simultanées dont l’une est beaucoup moins nette en fonction de la distance. Cette deuxième image « fantôme » doit être neutralisée par l’intégration visuelle corticale (neuroadaptation).
Cette double image ne perturbe pas l’acuité stéréoscopique [55].
L’importance de l’addition conditionne la courbe de défocalisation et la profondeur de champ. Une addition moins importante permet de mieux corriger la vision intermédiaire.
L’évaluation sur banc optique (MTF et résolution sur cible calibrée) permet également de juger des performances respectives de ces implants. Dans une étude récente, les implants ReSTOR® asphérique et Acri.LISA® avaient les meilleures performances par rapport aux implants Tecnis®, ReSTOR® non asphérique et ReZoom® (le moins performant de la série) (fig. 23-19) [103].
Les techniques de ray-tracing permettent de modéliser la répartition de l’intensité lumineuse sur les différents foyers d’un axe de défocalisation et de juger des performances « multifocales » de chaque implant. En effet, l’optimisation théorique des optiques doit tenir compte de la mise en situation réelle dans l’œil. Par exemple, l’effet de l’apodisation de l’optique serait neutralisé ou antagonisé par l’aberration sphérique de l’œil, laquelle augmente également avec la taille de la pupille. Ainsi, les modèles de ray-tracing récents suggèrent que, contrairement à ce qui était attendu, l’énergie lumineuse sur l’image de loin serait en définitive réduite par l’apodisation à pupille dilatée, à moins d’introduire une certaine aberration sphérique dans l’optique de l’implant [154].
L’analyse clinique de la qualité optique de l’œil après aberrométrie dual-pass OQAS après implantation de lentilles multifocales apodisées, retrouve par ailleurs un effet limitant de la puissance de l’implant sur la fonction de dispersion d’un point (PSF), sur les MTF, ainsi que sur les performances visuelles de loin et de près [108].
Un implant plus récent, l’implant ajustable par la lumière LAL® (Calhoun Vision), permet de créer en postopératoire, en modifiant les propriétés optiques de l’implant intraoculaire in situ au moyen d’un rayon UV, une zone d’addition centrale dont la puissance, la taille et l’asphéricité peuvent être ajustées en fonction de la demande du patient et des paramètres individuels (pupillométrie). Les avantages de ce procédé CNA (Customized Near Add) sont les suivants :
– correction emmétropisante ajustable secondairement, afin de garantir une vision de loin non corrigée satisfaisante ;
– centrage de l’addition sur l’axe visuel du patient ;
– ajustement en plus ou en moins de l’addition asphérique à la demande ;
– réversibilité de l’addition multifocale asphérique.
La figure 9-5, au chapitre 9 consacré à l’implant LAL® (Calhoun), démontre l’efficacité remarquable de ce procédé tant en termes de courbe de défocalisation que sur le plan de la qualité optique finale de l’œil opéré.
Les résultats des implants cristalliniens multifocaux ont fait l’objet d’une méta-analyse récente de vingt publications portant sur l’acuité non corrigée de loin et de près et l’indépendance par rapport au port des lunettes. Les implants diffractifs donnent globalement de meilleurs résultats que les réfractifs classiques et il n’y a pas de différence significative entre les implants pour la perception de halos [37, 38]. Ces résultats dépendent étroitement de la qualité de mise en œuvre de ce concept pour chaque patient (tableau 23-V). Les nouveaux implants diffractifs améliorent de façon importante l’efficacité clinique par rapport aux systèmes plus anciens (implant diffractif 3M, implant asphérique Domilens, implant réfractif Array®). Le compromis entre une excellente vision de près (P2 dans plus de 95 % des cas) et une vision de loin plus performante est satisfaisant : plus de 90 % des patients inclus dans les études cliniques ont une acuité sans correction de loin supérieure à 5/10.
Dans une étude comparant l’implantation bilatérale de quatre implants d’un même fabricant (AMO) monofocaux, multifocaux réfractifs classiques et optimisés et multifocaux diffractifs (AR40, Array®, ReZoom® et Tecnis® Multifocal), les courbes de défocalisation à – 3,00 D, la sensibilité aux contrastes à 3 cycles par degré et la qualité de vision (VF-7) et l’absence d’effets visuels indésirables (halos) étaient meilleures avec les modèles diffractifs qu’avec les modèles réfractifs. L’indépendance en lunettes était de 20 %, 43 %, 53 % et 87,5 % respectivement pour les implants AR40, Array®, ReZoom® et Tecnis® Multifocal [36].
Dans une autre étude, la vitesse de lecture quantifiée avec le Salzburg Reading Desk, était meilleure pour les modèles diffractifs (ReSTOR®, AT-LISA®), que pour le modèle réfractif (ReZoom®) [2].
Cependant, une autre étude comparant l’implant diffractif Tecnis® à l’implant réfractif Array® retrouve une sensibilité aux contrastes meilleure en vision intermédiaire pour l’implant réfractif, argument en faveur d’un panachage (mix & match) des types d’implants chez un même patient [64]. La vision intermédiaire — permettant notamment le travail sur écran informatique à 50 cm de distance — peut également bénéficier d’un modèle trifocal (FineVision®, PhysIOL).
Le concept d’implant multifocal réfractif à addition segmentée inférieure (Lentis® Mplus, Oculentis) semble prometteur. Les résultats à court terme témoignent d’une excellente qualité de vision, tant en termes de vitesse de lecture [104] que de sensibilité aux contrastes [3]. Curieusement, et de façon superposable à ce qui avait été observé en presbyLASIK décentré, cet implant induit un certain degré de coma, mais les patients ne rapportent pas plus d’effets visuels indésirables (halos, éblouissement) qu’un groupe contrôle monofocal [3].
L’analyse des causes d’insatisfaction après implantation multifocale chez quarante-neuf patients (soixante-seize yeux) retrouve une vision « trouble » (95 %) ou des phénomènes photiques indésirables (halos, éblouissement) (39 %). Les trois principales causes identifiées étaient l’amétropie résiduelle, l’opacification capsulaire postérieure et une pupille mésopique trop grande. Dans cette étude, 85 % des yeux ont bénéficié d’un traitement efficace par correction optique, chirurgie réfractive ou capsulotomie au laser YAG, et seuls 4 % ont eu besoin d’un échange d’implant [41].
La perception de halos (le plus souvent non gênants), les éblouissements et les difficultés en vision scotopiques (conduite de nuit) s’améliorent de façon assez significative avec le temps (neuroadaptation). Il ne semble pas exister de corrélation exacte entre l’évaluation de la dispersion antérograde de la lumière et la perception de halos pour les différents concepts d’optique multifocale. Dans une étude très récente, le dessin multifocal réfractif entraînait moins de dispersion (mesurée par le straylight meter) mais les patients percevaient plus de halos qu’avec les dessins diffractifs ou asphérique segmentés (Lentis® Mplus) [48]. La perception de ces halos avec l’implant réfractif est étroitement corrélée avec un défaut de centrage de l’implant lié à une discordance entre l’axe visuel et le centre pupillaire (angle kappa) [120].
La perception de dysphotopsies résulte de phénomènes de projection et de réflexion interne favorisés par l’index réfractif élevé du matériau. Habituellement perçues sous forme d’arcs de cercle avec les implants monofocaux, ces dysphotopsies peuvent prendre la forme d’anneaux concentriques avec les implants diffractifs apodisés de fort index réfractifs. Ce type d’implant peut également générer des anomalies concentriques au niveau de l’imagerie de la rétine par SLO [96].
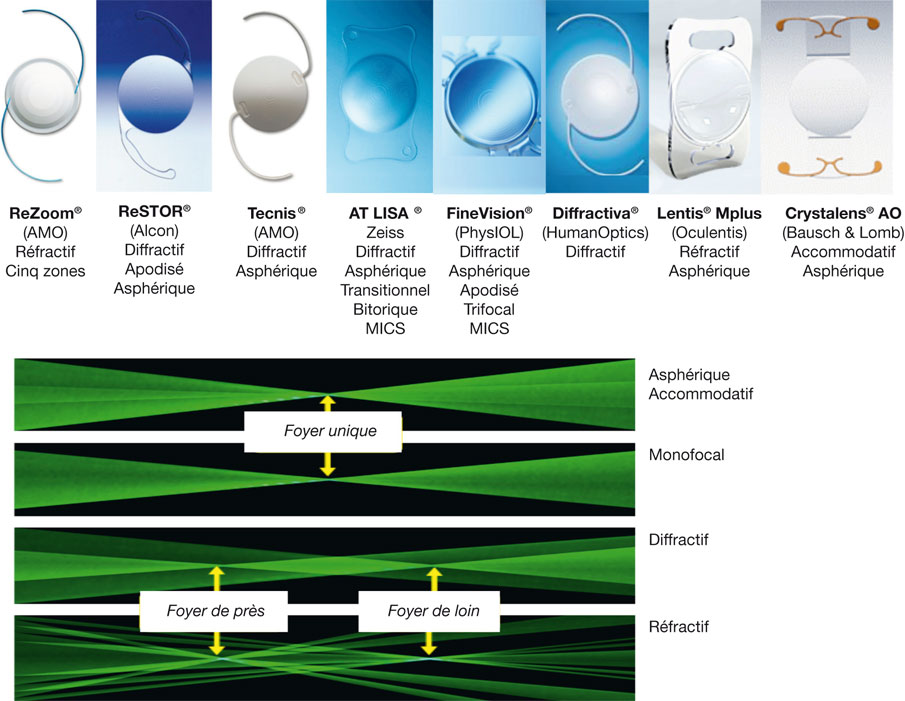
Fig. 23-18 Implants pour la presbytie et répartition de la lumière.
(Implants : selon données des laboratoires ; schémas : document d’Edwin Sarver, Carbondale, Illinois.)
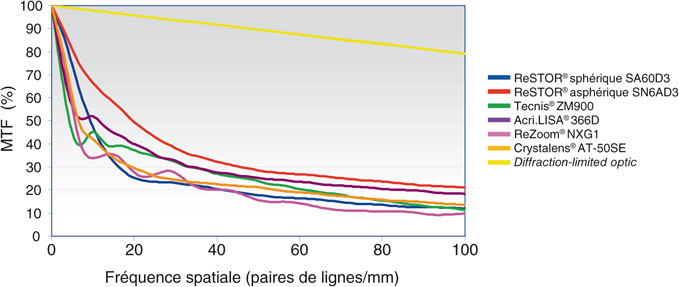
Fig. 23-19 MTF (Modulation Transfer Functions) de différents implants multifocaux.
(Données de W.A. Maxwell, ASCRS 2008.)

Tableau 23-V Comment améliorer les résultats cliniques des implants multifocaux ?
Dans le presbyLASIK, un principe différent est mis en œuvre car la nature du tissu cornéen ne permet pas la réalisation de surfaces réfractives discontinues : la multifocalité est de type transitionnel.
La photoablation permet de manipuler les aberrations optiques d’ordre supérieur défocalisantes (aberration sphérique) ou bifocalisantes (coma). Ces deux anomalies peuvent être combinées (aberration sphérique décentrée).
Le presbyLASIK entraîne donc une défocalisation « continue » très différente de celle obtenue avec les implants pseudophakes bifocaux.
La transition entre les zones optiques de loin et de près est progressive et fait intervenir en outre un mécanisme de sélection pupillaire du fait du réflexe physiologique d’accommodation-convergence-myosis.
Plusieurs profils de photoablation ont été proposés depuis une dizaine d’années (fig. 23-20) [1, 15-17, 23, 28, 29, 78, 113, 148, 155].
Il existe à présent plusieurs versions commerciales du presbyLASIK selon les constructeurs de lasers à excimères (cf. chapitre 5) :
– Nidek (Module Presbytie) : ablation hypermétropique surcorrigée suivie d’une ablation myopique centrale résultant en une addition paracentrale pour vision de près avec vision de loin centrée (algorithme PAC) ;
– VISX (CustomView Presbyopic Ablation) : presbyLASIK avec addition vision de près centrée guidée par aberrométrie ;
– Bausch & Lomb, TechnoVision :
– PresbyOne® : presbyLASIK avec addition vision de près centrée ;
– SUPRACOR® : addition de près centrée non transitionnelle ;
– Wavelight® : presbyLASIK avec addition de près centrée par modulation du facteur Q d’asphéricité cornéenne ;
– Schwind (PresbyMAX®) : presbyLASIK avec addition vision de près centrée (OS) et périphérique (OD) ;
– Zeiss-Meditec (Laser Blended Vision®) : addition de près centrée asymétrique sur les deux yeux.
Plus récemment, une tendance à la personnalisation de ce profil ablatif a été observée. On peut anticiper trois modes de personnalisation, éventuellement combinés dans l’avenir pour chaque patient, en fonction des objectifs réfractifs souhaités et de l’optimisation de la fonction optique de l’œil en vision de loin, vision intermédiaire et vision de près.
– guidé par la topographie ou le facteur d’asphéricité cornéenne Q : normalement autour de – 0,25, idéalement – 0,8 à – 1,0 (hyperprolate) pour la compensation multifocale de la presbytie ;
– guidé par l’aberrométrie ou l’aberration sphérique : normalement autour de 0,2 RMS, idéalement – 0,50 RMS pour la compensation multifocale de la presbytie ;
– guidé par la dynamique pupillaire : taille et position en fonction de l’état accommodatif et de la luminosité.
Par exemple, pour les patients présentant un décentrement temporal important de la pupille, une ablation centrée sur la pupille génère moins de coma qu’une ablation centrée au vertex dans le traitement de l’hypermétropie par LASIK [144].
De même, il paraît prudent d’exclure du presbyLASIK centré les patients dont la pupille photopique paraît trop étroite (inférieure à 3,0 mm), du fait du risque de pénalisation de la vision de loin par l’addition centrale, ou alors de viser une correction unilatérale ou utilisant un profil non transitionnel (SUPRACOR®, IntraCOR®).
Les résultats du presbyLASIK dans sa forme actuelle dépendent donc de la méthode employée et de l’expérience de l’opérateur (courbe d’apprentissage significative).
Nous avons rapporté les résultats de notre expérience du presbyLASIK « décentré » comparé à ceux des implants multifocaux. Le profil de presbyLASIK que nous pratiquons depuis 2001, selon le schéma original proposé par Charles Ghenassia, module les aberrations optiques d’ordre supérieur défocalisantes à deux niveaux :
– le bombement central de la cornée crée une aberration sphérique négative, ce qui signifie que la cornée centrale devient plus puissante que la cornée paracentrale, comme si on induisait une myopie confinée aux 3 mm centraux ; il en résulte une augmentation de la profondeur de champ ; cet effet peut être différencié entre les deux yeux (protocole asymétrique) en fonction de la dominance ;
– cette aberration sphérique négative peut être décentrée très légèrement par rapport à la pupille mydriatique utilisée en vision de loin (notamment de nuit) pour mieux correspondre au centre de la pupille myotique utilisée en vision de près [22] ; ce décentrement induit une faible coma oblique, qui se traduit en pratique par une bifocalité de la pupille d’entrée, dont les trois quarts supéro-temporaux favoriseront la vision de loin tandis que le quart inféro-nasal sera plus efficace pour la vision de près, en accord avec la dynamique pupillaire accommodative. En effet, la taille et la position de la pupille varient en fonction de la distance de vision : de loin, la pupille est légèrement dilatée et centrée ; de près, la pupille est plus étroite et légèrement décentrée vers le bas et le nez (de 0,2 mm à 0,7 mm), pour correspondre à la convergence des yeux lors de la vision de près [54, 158].
L’augmentation de courbure localisée au centre de la cornée se traduit clairement en topographie d’élévation ou de puissance totale par rapport à un LASIK hypermétropique monofocal (fig. 23-21).
L’aberrométrie ZyWave® et l’aberrométrie dual-pass OQAS (cf. supra, fig. 23-10) montrent l’induction d’une aberration sphérique négative décentrée avec coma modérée. Cependant, la fonction de dispersion d’un point (PSF) et la simulation de la sensibilité au contraste et des fonctions de transfert de modulation (MTF) confirment que la qualité optique de l’œil peut être globalement préservée par cette manipulation des aberrations optiques d’ordre supérieur [1]. L’aberrométrie ZyWave® permet également de mesurer la réfraction simulée en fonction du diamètre de la pupille. Par rapport à l’état préopératoire moyen (sur quarante-deux yeux opérés), le presbyLASIK a réduit l’hypermétropie centrale et la myopie périphérique et induit une myopie modérée localisée aux 3 mm centraux de la cornée (cf. supra, fig. 23-12d).
Nous avons comparé les résultats du presbyLASIK à ceux des implants multifocaux. La comparaison des courbes de défocalisation dans une série de quarante-deux yeux opérés de presbyLASIK multifocal avec une série appariée d’yeux traités par implants multifocaux montre que le presbyLASIK induit un effet multifocal préservant la vision intermédiaire, alors que les implants bifocaux (ReSTOR® et Acri.LISA®) donnent des courbes bimodales plus efficaces pour la vision de près et de loin (fig. 23-22).
L’étude de la sensibilité aux contrastes en vision de loin montre avec les deux méthodes une diminution d’une à trois lignes au cours des trois premiers mois, qui s’améliore par la suite jusqu’à deux ans.
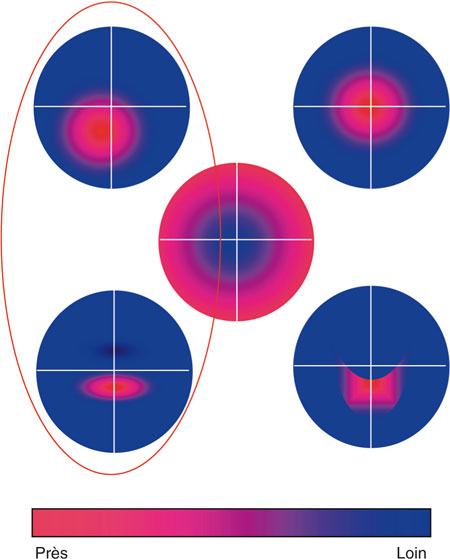
Fig. 23-20 Profils ablatifs pour la modulation multifocale du front d’onde.
(Document de G. Youssefi, Bausch & Lomb.)
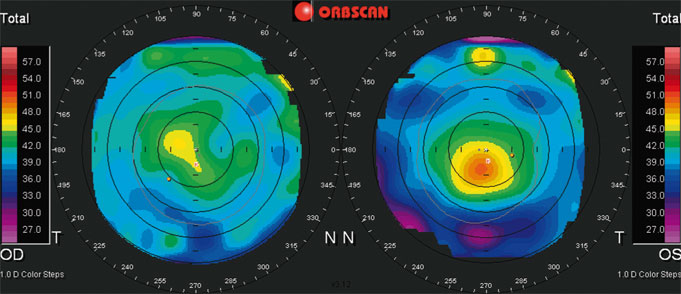
Fig. 23-21 Topographie d’élévation. Puissance réfractive totale, LASIK hypermétropique (OD) et presbyLASIK (OS).
Cette technique n’offre pas à cette heure assez de recul pour permettre d’analyser la qualité de vision qu’elle induit. Outre l’inlay à effet sténopéique (KAMRA®, cf. infra), les inlays intrastromaux développés à ce jour pour la compensation de la presbytie obéissent à deux principes :
– implant réfractif agissant sur la courbure de la cornée antérieure, type PresbyLens® (ReVision Optics) ;
– implant réfractif agissant sur l’indice de réfraction intrastromal, type Permavision®.
Ces implants se heurtent toujours aux problèmes de mise en œuvre technologiques (implants ultraminces), chirurgicales (technique opératoire délicate, notamment pour le centrage et la stabilisation) et de tolérance intrastromale à long terme (interférence avec le métabolisme cornéen) (cf. chapitre 10).
La kératoplastie conductive utilise une sonde d’hyperfréquence (350 kHz) permettant de porter les fibres de collagène cornéen à 65 °C à 500 µm de profondeur, afin de contracter le collagène stromal paracentral et augmenter la courbure cornéenne centrale [72]. Il s’agit d’une méthode efficace, stable et peu invasive. La technique « light touch » permet de minimiser le risque d’astigmatisme irrégulier induit. Une série de huit points de contraction disposés en couronne permet de cambrer le centre de la cornée et de corriger jusqu’à 2,25 D d’hypermétropie. Pour la presbytie un protocole standardisé est proposé :
– correction de + 1,00 à + 1,7 : seize spots sur deux anneaux de 6 et 7 mm ;
– correction de + 1,75 à + 2,25 : vingt-quatre spots sur trois anneaux de 6, 7 et 8 mm.
Les résultats de l’étude FDA [105] (cent quatre-vingt-neuf yeux de cent cinquante patients) montrent qu’à vingt-quatre mois, aucun œil n’a perdu plus de deux lignes d’acuité, tous les yeux ont plus de 5/10 (86 % stables), aucun œil n’a d’augmentation du cylindre supérieure à 2 D, 91 % étaient à moins de 1 D de l’objectif réfractif (et 51 % à moins de 0,50 D), 71 % des yeux ont P3 ou mieux (et 51 % P2 ou mieux), 87 % des patients ont déclaré une amélioration de leur qualité de vision, 94 % avaient une perception du relief bonne ou excellente, 79 % étaient satisfaits de l’intervention. Les meilleurs résultats sont obtenus pour les hypermétropies de moins de 0,75 D, avec un astigmatisme inférieur à 0,75 D. La pachymétrie doit être supérieure à 550 µm sur la zone des 6 mm.
Cette méthode a été approuvée récemment en tant que « correction temporaire de la presbytie » par la FDA américaine mais, malgré plusieurs tentatives commerciales, n’a pas été encore adoptée de façon significative en France.
Le traitement intrastromal au laser femtoseconde Femtec® (Technolas Perfect Vision, Bausch & Lomb) est une des innovations les plus prometteuses de ces dernières années. Les résultats de l’étude de la sensibilité aux contrastes avant et après intervention montraient l’absence de différence significative sous fort contraste (85 cd/m²) et une tendance à l’amélioration de la sensibilité aux contrastes (non significative) dans les basses et hautes fréquences spatiales sous faible contraste (3 cd/m²) en postopératoire [132].
Les problèmes actuels posés par cette méthode (cf. chapitre 6) sont :
– la limitation des indications opératoires aux cas présentant une hypermétropie inférieure à 0,75 D sans astigmatisme significatif ;
– l’inconstance des résultats liée à la non-découpe complète occasionnelle des anneaux intrastromaux ;
– la stabilité des résultats qui n’a pas encore été confirmée à long terme ;
– l’absence de méthodologie précise pour les reprises en cas d’insuffisance de résultat ou de décentrement.
Ces résultats ont été confirmés par d’autres études à court terme [73].
Cette technique ne peut être employée après ou avant LASIK, en raison du risque d’ectasie centrale induite [133].
Cependant, le rapport bénéfice sur risque de cette intervention paraît suffisamment favorable (absence d’effet secondaire ou de complication sérieuse) pour la proposer en première intention dans l’indication proposée (cf. infra, fig. 23-24).
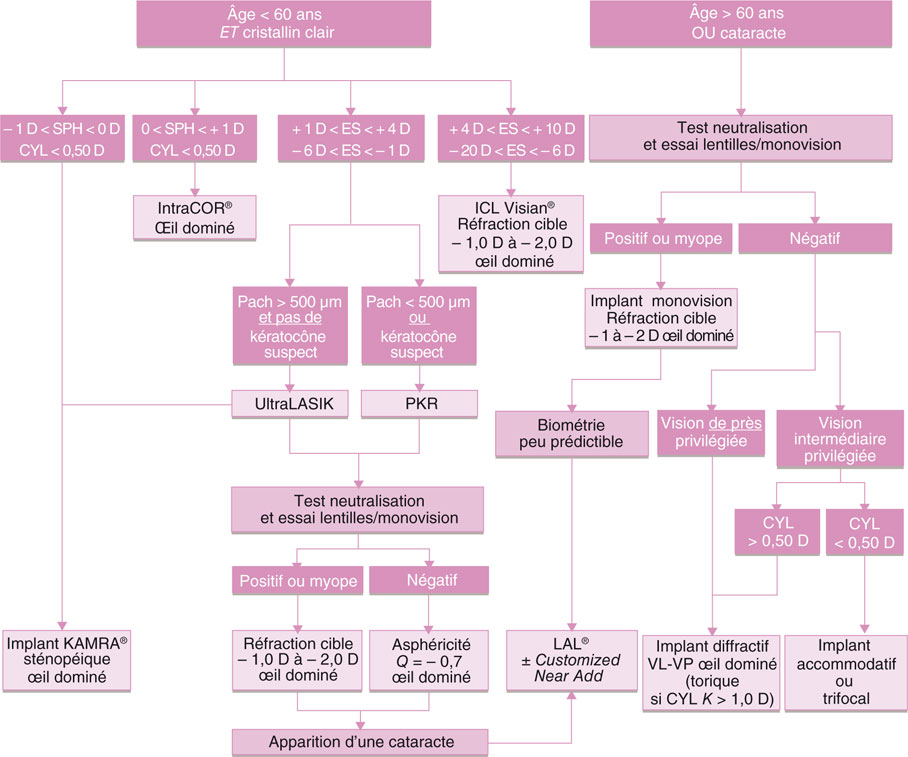
Fig. 23-24 Choix de la méthode.
L’effet sténopéique, mis en œuvre exclusivement dans l’implant intracornéen KAMRA® (anciennement Acufocus®, Bausch & Lomb), agit sur la profondeur de champ par exclusion spatiale des rayons lumineux défocalisés. Il s’agit d’un inlay microperforé biocompatible, implanté entre 250 µm (série pilote) et 400 µm sous la surface épithéliale après découpe d’un volet lamellaire ou création d’une poche de dissection. L’ouverture centrale de 1,5 mm de diamètre doit être parfaitement centrée sur l’axe visuel au moyen d’un système d’imagerie peropératoire dédié (cf. chapitre 10). L’effet sténopéique qui en résulte améliore considérablement la profondeur de champ de la vision du sujet presbyte sans pénaliser la vision de loin. L’évaluation optique objective (amplitude d’accommodation simulée par aberrométrie OQAS) confirme l’augmentation de la profondeur de champ.
Sur le plan fonctionnel, les premiers résultats sont très prometteurs, notamment en termes de vitesse de lecture [45, 163]. Il n’existe cependant pas de données précises permettant de comparer la qualité de vision obtenue avec cet implant par rapport aux autres approches. En théorie, l’utilisation de l’effet sténopéique présente, selon nous, plusieurs limitations qui pourraient en affecter les résultats en termes de qualité de vision :
– réduction de l’acuité dynamique du fait de l’effet sténopéique ;
– difficulté dans l’utilisation de l’accommodation résiduelle (effet de Mandelbaum) ;
– diminution importante de l’acuité en cas de décentrement de l’implant (effet de Campbell) [7].
Sur le plan anatomique, les problèmes métaboliques liés à l’implantation intrastromale (limitation du flux de nutriments d’origine aqueuse à destination du stroma antérieur et de l’épithélium) pourraient théoriquement être source d’extrusion ou de nécrose aseptique antérieure.
Les implants accommodatifs peuvent se répartir selon leur mécanisme d’action en deux groupes (cf. chapitre 12) :
– implant à déplacement antérieur favorisé par un bras de levier entre optique et haptiques :
– simple optique (AT45, Crystalens® 5.0, HD, AO, Tetraflex®, C-Well®, FlexOptics®) ;
– double optique (Synchrony®, implant de Sarfarazi, Mehta Clamshell®) ;
– implants à changement de courbure favorisé par l’utilisation d’un matériau plus ou moins « fluide » (FluidVision®, NuLens®, LiquiLens®, SmartIOL ou phako-ersatz).
Concernant le modèle à optique simple le plus largement diffusé, Crystalens®, il a connu des perfectionnements (versions HD et AO) (cf. supra, fig. 23-18) proposés respectivement en 2009 et 2010 par Bausch & Lomb Eyeonics. Ces modèles reprennent le dessin du Crystalens® 5.0 avec une modification de l’asphéricité et de la courbure centrale de la face postérieure de l’implant destinée à favoriser la vision de près indépendamment du déplacement antérieur de l’optique (augmentation de l’énergie lumineuse au centre lors de la voussure antérieure de l’optique, ou arching). Cette modification favoriserait la profondeur de champ mais au détriment de la qualité optique (testée sur banc optique) en vision de loin [84].
Les implants accommodatifs présentent des avantages théoriques certains par rapport aux implants diffractifs ou réfractifs multifocaux :
– transmission de 100 % de la lumière à toutes les distances (cf. supra, fig. 23-13) ;
– meilleure qualité optique globale en termes de fonctions de transfert de modulation (MTF), malgré la discordance des études présentées par les différents laboratoires ;
– absence de halos ou d’éblouissements induits (pour des pupilles normales) ;
– vision intermédiaire de meilleure qualité ;
– absence de neuroadaptation (pas de tri sélectif de l’image fovéolaire en fonction du contexte visuel).
Les résultats initiaux des implants accommodatifs AT45 (Crystalens®) et 1CU® (HumanOptics) ont toutefois été inégaux et limités dans le temps. Par exemple, dans une étude comparant quatre-vingt-sept yeux de quarante-cinq patients, le presbyLASIK et l’implant multifocal Acri.LISA® donnaient de meilleurs résultats que l’implant accommodatif AT45 [113]. Cependant, les implants accommodatifs améliorent la vision de près non corrigée par rapport aux implants monofocaux classiques. Une étude comparative sur soixante yeux a montré une meilleure performance « accommodative » initiale que celle obtenue avec les implants monofocaux en termes d’addition requise pour la meilleure acuité de près, d’acuité de près avec la correction de loin et de déplacement antérieur de l’implant lors de l’accommodation [100]. Les acuités de près avec correction de loin pour les implants accommodatifs Tetraflex® et 1CU® sont également meilleures que celles obtenues avec un implant non accommodatif de référence type AcrySof®.
Les résultats à sept ans de l’implant accommodatif de deuxième génération Crystalens® AT45 [40] semblent indiquer une persistance de l’effet fonctionnel très correcte (67 % des yeux lisent P2 sans correction ou mieux).
L’implant accommodatif de quatrième génération Crystalens® HD, approuvé par la FDA, obtient des résultats cliniques très prometteurs par rapport aux modèles précédents et aux implants bifocaux diffractifs ou réfractifs classiques (100 % P3 ou mieux, 80 % P2 ou mieux, 55 % P1,5 ou mieux). Dans l’étude FDA du Cristalens® HD, la sensibilité aux contrastes était améliorée par rapport aux modèles multifocaux ou aux modèles antérieurs.
Dans une étude récente portant sur l’implant Tetraflex®, 100 % des yeux avaient au moins 1 D d’accommodation à six mois et 96 % des cas bilatéraux avaient 2 D d’accommodation à ce stade ; 89,3 % avaient une acuité de près avec la correction de loin supérieure à 5/10 [135].
Notre connaissance des aspects non optiques (non réfractifs) de la vision qui interfèrent avec les résultats de la chirurgie de compensation de la presbytie (ou de toute autre forme de correction de la presbytie, par exemple par des verres progressifs) reste très limitée. La littérature scientifique fait défaut dans ce domaine, et cette section ne reflète que notre analyse personnelle de ce sujet, appelé sans doute à se développer dans l’avenir, conformément à ce qui a été observé dans les autres champs de la neurologie sensorielle ou motrice.
Il semble utile de distinguer cinq niveaux de neuroadaptation potentiels différents (ou étages d’intégration) associés à l’expérience visuelle :
– niveau neurosensoriel, faisant intervenir les capacités intrinsèques de la rétine et des voies optiques précorticales dans le traitement de l’information issue de l’image projetée sur la fovéa : cette adaptation de « niveau bas » calibre le message visuel pour en faciliter le codage ultérieur et améliorer les fonctions de discrimination autour du niveau d’adaptation ;
– niveau oculomoteur, traduisant la réponse oculomotrice extrinsèque et intrinsèque à la perception visuelle : si l’adaptation à la lumière est simple à comprendre, les réponses motrices facilitant l’exploration visuelle (stratégie du regard, saccades de réalignement) sont plus complexes ;
– niveau psychophysique, mettant en jeu les caractéristiques du traitement de l’information visuelle propres au cortex occipital ;
– niveau associatif, faisant référence à l’utilisation vestibulaire, somesthésique ou motrice de l’information visuelle pour adapter la réponse posturale, locomotrice (coordination œil-main) ou la direction et la stabilisation du regard, ainsi que la perception de l’espace ambiant et de la position du corps relativement à cet espace ;
– niveau cognitif, dans lequel l’expérience visuelle antérieure du sujet sert de référentiel pour l’analyse contextuelle du message visuel, au travers de l’activation des aires corticales et sous-corticales associées à la mémoire visuelle, intellectuelle, émotionnelle ou culturelle à cette information visuelle.
Le processus de neuroadaptation peut être très rapide, sur une fraction de seconde, par exemple pour l’adaptation à l’obscurité (étage neurosensoriel et oculomoteur intrinsèque), ou très lent, sur plusieurs mois, en relation avec la neuroplasticité qui repose sur l’altération à long terme des connexions anatomiques ou des propriétés synaptiques en relation avec l’activité neuronales ou secondaires à des mécanismes lésionnels : des axones et des dendrites peuvent croître ou se rétracter, des synapses s’établir ou disparaître (étages corticaux psychophysique et cognitif).
Le concept de neuroadaptation explique sans doute plusieurs aspects cliniques actuels de la chirurgie de compensation de la presbytie :
– la vision subjective observée, notamment le gain de profondeur de champ (pseudo-accommodation cornéenne), induite par les aberrations défocalisantes est meilleure que ne le prédirait la correspondance avec l’équivalent dioptrique en termes de défocalisation axiale ;
– l’amélioration de la sensibilité aux contrastes survient en moyenne six mois après l’implantation de lentilles intraoculaires multifocales ;
– l’amélioration de la sensibilité au contraste est observée après implantation multifocale du second œil.
La notion de « fonction de transfert neural » (NTF) viendrait donc compléter celle de « fonction de transfert de modulation optique » (MTF) pour expliquer la variabilité des fonctions de sensibilité aux contrastes du système visuel pris dans son ensemble.
L’organisation du système visuel permet à deux images rétiniennes disparates de se combiner pour former une image unique comportant une information sur le relief et la profondeur de l’objet ou de la scène observée.
La correction optique ou chirurgicale de la presbytie (différente pour l’instant de la restauration de l’accommodation) introduit une complexité supplémentaire dans cette intégration du message visuel et crée, notamment, la possibilité d’une rivalité bi-oculaire (monovision) ou intraoculaire (multifocalité). La neuroadaptation susceptible de contribuer à minimiser ou optimiser ces rivalités visuelles a été peu étudiée dans le domaine de la vision mais a fait l’objet d’importants travaux dans les autres domaines de la neurologie sensorielle (audition, par exemple) [114]. Il serait ainsi très utile de pouvoir tirer parti des caractéristiques individuelles du système visuel pour :
– définir les critères préopératoires susceptibles d’affecter le choix et le pronostic fonctionnel d’une technique particulière ;
– améliorer l’acceptabilité et l’efficacité des méthodes mises en œuvre en les ajustant aux possibilités de neuroadaptation spécifiques de chaque individu ;
– améliorer la perception des résultats obtenus par la mise en œuvre de méthodes d’entraînement neuroadaptatif.
Il existe un débat scientifique actuel sur la possibilité d’améliorer les fonctions de transfert neural (NTF) au moyen de méthodes d’apprentissage perceptuel (« perceptual learning ») fondé sur l’entraînement neuroadaptatif [134, 164].
Sur le plan clinique, plusieurs études montrent une amélioration rapide et persistante à long terme des performances visuelles élémentaires (champ visuel, sensibilité au contraste spatiale et temporelle, orientation) par l’apprentissage perceptif. Par exemple, trente minutes d’adaptation à une défocalisation de + 2 D améliorent de façon significative la sensibilité aux contrastes avec cette pénalisation, de façon distincte d’un simple effet d’apprentissage [122]. Ces données suggèrent la persistance d’une plasticité cérébrale à l’âge adulte, capable de favoriser l’acquisition d’aptitudes visuelles nouvelles. L’apprentissage perceptif sous-entend une réorganisation du processus visuel cérébral, utilisant des informations sensorielles acquises pendant la réalisation de tâches visuelles prédéterminées.
Les études récentes suggèrent que cet apprentissage est restreint et que son efficacité ne peut être facilement « transférée » pour un stimulus différent, une autre localisation du champ visuel ou l’autre œil non entraîné [117]. Cependant certains types de stimuli (patch de Gabor avec masque latéral et autoajustements individualisés) permettraient la généralisation du fruit d’un entraînement restreint à la vision complexe. Sur le plan conceptuel, ceci ouvre différentes perspectives cliniques inédites (neuro-réhabilitation, renforcement mémoriel, amélioration des performances visuelles) sans que les bases anatomophysiologiques en soient encore connues.
L’apprentissage perceptif pourrait améliorer la qualité de vision au moyen de systèmes de discrimination de l’orientation ou d’exercices utilisant les représentations de Gabor (fig. 23-23).
Dans l’image multifocale perçue par la rétine, la deuxième image défocalisée réduit le contraste de la première image focalisée, et ce problème est majoré par la persistance d’une amétropie de loin ou d’un astigmatisme. L’intégration neurosensorielle rétinienne et perceptive corticale filtre le message visuel pour éliminer la deuxième image, par un processus probablement plus sophistiqué que le simple ajustement du contraste de l’image — par analogie avec le traitement d’une image digitale —, qui fait intervenir l’interprétation contextuelle des éléments d’information contenus dans l’image aux fins de rehaussement ou de neutralisation sélective. L’apprentissage perceptif renforce cette capacité d’extraction de l’information visuelle adéquate. Le programme RevitalVision®, disponible sur Internet, utilise les patchs de Gabor au cours de sessions d’entraînement successives. Les résultats du sujet sont analysés et le programme est ajusté pour augmenter la fréquence de présentation des stimuli ayant spécifiquement amélioré les réponses perceptives lors de la session suivante. Des modules spéciaux (vision des contrastes, vision de près) sont disponibles. Des essais cliniques informels, conduits dans le cadre commercial de la société NeuroVision®, reprise par le groupe RevitalVision®, suggèrent que ces méthodes déjà appliquées et approuvées par la FDA au traitement de l’amblyopie fonctionnelle de l’adulte aux États-Unis, apporteraient un bénéfice visuel, notamment en termes de sensibilité aux contrastes, dans le contexte de la faible myopie, de la presbytie débutante [117] et de l’amélioration des résultats fonctionnels après chirurgie réfractive [92], notamment après implantation d’implants multifocaux.
Selon les premiers évaluateurs de la méthode, les patients implantés avec l’implant accommodatif Crystalens® bénéficient plutôt des modules « Acuité visuelle » et « Post-chirurgie réfractive » que du module « Vision des contrastes ». En moyenne, toutes indications confondues, sur plusieurs milliers de cas, les patients gagneraient deux lignes d’acuité visuelle et 100 % de sensibilité aux contrastes ; ces résultats sont stables dans le temps (source : www.revitalvision.com).
Par ailleurs, chez les patients implantés avec des lentilles multifocales, les halos et les éblouissements sont réduits.
Dans une étude (non publiée) conduite par Richard L. Lindström et Marlane Brown sur dix patients insatisfaits de leurs résultats avec les implants Crystalens® ou ReZoom®, l’amélioration moyenne était de 1,8 ligne d’acuité de près (0,8 à 3 lignes) à partir d’une dizaine de séances de vingt à trente minutes. Dans une étude comparative prospective non randomisée portant sur dix-sept sujets myopes et vingt et un presbytes, une amélioration moyenne de l’acuité non corrigée de loin et de près de 2,2 logMAR a été observée, ainsi qu’une amélioration de la sensibilité aux contrastes [47].
La potentialisation de l’apprentissage perceptif par la manipulation des aberrations optiques a été confirmée par une étude de sujets myopes équipés en lentilles spécifiques induisant une aberration sphérique négative de 0,10 µm, montrant une amélioration des distances et des vitesses accommodatives [5].
Une étude récente a également examiné l’impact de l’apprentissage perceptif sur le bénéfice d’une correction des aberrations optiques d’ordre supérieure par optique adaptative. L’acuité rétinienne de six sujets a été mesurée par SLO (Scanning Laser Ophthalmoscope) avant et après correction des aberrations optiques d’ordre supérieur par optique adaptative. Après une semaine d’apprentissage perceptif, le bénéfice de la correction par optique était toujours perçu de façon immédiate. Ces résultats suggèrent que l’effet des aberrations optiques sur la qualité de vision n’est pas habituellement compensé par des mécanismes neurosensoriels [130].
Des études contrôlées et randomisées sont nécessaires pour confirmer la validité de ces résultats et notamment la supériorité de cette approche sur le simple effet d’apprentissage spontané.
La neuroadaptation semble être une nouvelle frontière pour la monovision et la multifocalité qui, malgré l’optimisation des solutions techniques, impliquent un défi inédit en termes de plasticité cérébrale pour une proportion de plus en plus restreinte mais réelle des patients opérés.
Les exercices de neuroadaptation permettront sans doute une acclimatation visuelle plus efficace et plus rapide ainsi que, peut-être, la détection des patients les moins aptes à bénéficier de mécanismes de neuroadaptation spontanée, qui seraient des candidats moins favorables à la multifocalité.

Fig. 23-23 Apprentissage perceptif à l’aide des patchs de Gabor.
Le patch de Gabor est une figure élémentaire de réseau sinusoïdal de contraste spécifique capable d’activer efficacement les champs récepteurs corticaux visuels dont elle reproduit la topographie. La technique de stimulation par masquage latéral consiste à présenter l’image de Gabor cible, flanquée de deux images de Gabor alignées latéralement. On présente au patient de façon randomisée et brève deux images d’écran, dont l’une ne contient pas la cible. Le patient identifie quel écran contient l’image de Gabor cible. Un retour audio permet de corriger les erreurs. Cette tâche visuelle est répétée jusqu’à l’obtention d’un niveau de résolution correspondant au seuil visuel du patient.
Le choix raisonné d’une méthode particulière dépend de notre capacité à corréler les critères optiques ou fonctionnels de succès (cf. supra « Évaluation des résultats ») d’une chirurgie compensatrice de la presbytie aux variables indépendantes, évaluées avant l’intervention (âge, amétropie, kératométrie, asphéricité, pupillométrie, aptitude de neuroadaptation…) pour prédire le succès d’une indication spécifique pour un individu donné.
La comparaison séquentielle de la qualité de vision avec lentilles de contact de même modèle multifocales ou monofocales en monovision, souligne de façon claire les avantages et insuffisance respective des approches en monovision et en multifocalité [66]. Dans cette étude, les auteurs ont observé :
– une meilleure acuité de loin et de près en monovision ;
– une acuité intermédiaire, une sensibilité aux contrastes, une vitesse de lecture, et une taille critique de fonte d’impression (CPS) comparables pour monovision et multifocalité ;
– une meilleure stéréoacuité et une meilleure profondeur de champ de près avec les lentilles multifocales ;
– une dégradation de la sensibilité aux contrastes et de l’acuité de loin pour la lentille multifocale comportant une addition plus élevée.
La monovision reste une approche simple, efficace et sûre pour la compensation de la presbytie, qui mérite d’être envisagée pour tous les patients presbytes, dans l’arbre décisionnel chirurgical (fig. 23-24).
Les problèmes posés par la monovision sont en général bénins, transitoires et peuvent être surmontés facilement par :
– un examen de l’équilibre binoculaire préopératoire ;
– un encadrement attentif des attentes préopératoires et perceptions postopératoires (parfois plusieurs mois) du sujet ;
– une simulation en lentille de contact pendant un temps suffisant (au moins deux semaines).
Les critères de choix de la monovision liés au patient ont été résumés dans une revue récente de la littérature. Les femmes ont une meilleure acceptation de la monovision, de même que les patients n’ayant pas une préférence de latéralisation trop marquée — laquelle induit des difficultés de neutralisation. La monovision est plus fréquemment appliquée chez les myopes mais les hypermétropes ne la tolèrent pas moins bien [51].
Les facteurs prédictifs favorables sont résumés dans le tableau 23-VI.
La taille de la pupille influence le niveau de tolérance et de performance de la monovision. Dans un modèle dérivé du modèle optique de Liou-Brennan, prenant en compte dans un système centré l’asphéricité de la cornée, le diamètre de la pupille, l’effet de Stiles-Crawford, un implant intraoculaire et l’aberration chromatique, une simulation des fonctions de transfert de modulation par ray-tracing (Zemax®) a déterminé qu’une réduction du diamètre de la pupille et une augmentation de la myopie résiduelle contribuaient à optimiser l’acuité de près. Pour une pupille de 2,5 mm et une myopie de – 1,50 D sur l’œil dominant, l’acuité à 40 cm était de 20/23 (0,06 logMAR). L’indication et le choix du niveau de monovision peuvent donc être ajustés en fonction de la pupille photopique de près [82].
Le maintien de la sommation binoculaire (évaluée par sensibilité aux contrastes) au cours de l’introduction d’une addition positive sur l’œil non dominant semble un bon facteur prédictif de la tolérance à la monovision [68].
Il existe enfin quelques rares indications médicales de la monovision :
– compensation de certaines diplopies verticales habituellement corrigées par prismes [75, 107] ;
– correction des ésotropies accommodatives avec un rapport AC/A élevé, chez les sujets jeunes, en lieu et place d’une correction bifocale ou multifocale [50] ;
– la correction en monovision (myopie résiduelle de 2 D sur l’œil non dominant) a été proposée pour ralentir l’évolution de la myopie axiale chez l’enfant d’âge scolaire : les résultats d’une étude sur trente mois indiqueraient un ralentissement statistiquement significatif de la progression de la myopie de 0,36 D par an par rapport à l’œil dominant corrigé complètement, un ralentissement de l’allongement axial du globe de 0,13 mm par an, mais un retour de ces paramètres au niveau de ceux de l’œil dominant en neuf à dix-huit mois à l’arrêt de la sous-correction de l’œil non dominant [63, 116].

Tableau 23-VI Éléments prédictifs.
Les facteurs prédictifs favorables à la multifocalité sont résumés dans le tableau 23-VI. Les facteurs psychologiques favorisant l’intolérance à la monovision sont également en faveur du choix de la multifocalité. Ainsi, les hommes « introvertis » (par opposition à « extravertis ») seraient moins enclins à accepter la monovision. Les femmes ayant du mal à percevoir un motif visuel sur un fond visuellement structuré ont également plus de difficultés en monovision [49].
Les problèmes d’intégration vestibulaires périphériques (maladie de Ménière) seraient un facteur de risque d’intolérance aux implants multifocaux [60].
La qualité de vision postopératoire s’améliore spontanément dans la grande majorité des cas avec le temps. Des facteurs multiples contribuent à cette amélioration :
– progression de la qualité optique de l’interface cornéenne après presbyLASIK entre trois et six mois, se traduisant par une normalisation de la sensibilité aux contrastes et de la polarimétrie ;
– régularisation de la surface cornéenne par remodelage épithélial et stromal, lié à la réponse cicatricielle après kératochirurgie ;
– atténuation de la réaction inflammatoire postopératoire après implantation ;
– amélioration de la sécheresse postopératoire par régénération des nerfs cornéens à six mois ;
– neuroadaptation à la multifocalité ou à la monovision.
En cas d’échec de ces mécanismes ou de la neuroadaptation, le patient est demandeur de solutions permettant d’améliorer la qualité de vision finale postopératoire.
Il est nécessaire à ce stade de vérifier que la gêne fonctionnelle subjective est bien en rapport avec les données objectives de l’analyse de la qualité optique de l’œil et ne correspond pas à une attente irréaliste du patient, trop peu ou mal informé en préopératoire des contraintes visuelles associées au compromis optique nécessaire (monovision, multifocalité ou effet sténopéique). Un effort pédagogique supplémentaire est parfois très utile pour défendre le résultat obtenu lorsque celui-ci paraît conforme à ce qui était attendu et pour éviter ainsi au patient les complications potentielles d’une retouche chirurgicale. Dans le cas de la monovision, il est par exemple exceptionnel qu’au terme d’un délai de six à douze mois, une anisométropie de moins de 1,5 D soit mal supportée, lorsque l’emmétropie de l’œil dominant est obtenue. Dans la multifocalité cornéenne, il est également très rare qu’une aberration sphérique inférieure à 1 µm (témoignant d’une asphéricité de l’ordre de Q = – 0,8, par exemple), éventuellement associée à une coma modérée inférieure à 0,4 µm, soit la cause d’une gêne fonctionnelle insurmontable persistante.
Après avoir exclu une éventuelle pathologie intercurrente (cataracte, pathologie neurosensorielle), des essais contactologiques simples permettent de s’assurer de la réalité du problème optique et de la motivation du patient en vue d’une éventuelle retouche chirurgicale.
Les lentilles souples silico-hydrogel, éventuellement jetables, permettent de tester la correction sphérocylindrique optimale d’une amétropie résiduelle ou d’une anisométropie mal tolérée. Les lentilles rigides perméables au gaz apportent une idée précise du rôle d’une éventuelle asphéricité ou d’un astigmatisme irrégulier cornéens dans la dégradation de la qualité de vision.
En définitive, les indications de retouches chirurgicales sont dictées le plus souvent par une limitation persistante de la meilleure acuité visuelle non corrigée si la solution est simple et dénuée de risque excessif ou de la meilleure acuité corrigée dans le cas contraire. L’indication sera d’autant plus acceptable qu’il existe des effets visuels indésirables associés gênants ou invalidants concordant avec l’analyse objective. Ces solutions chirurgicales sont très variées : on peut retenir essentiellement les méthodes rappelées dans le tableau 23-VII.
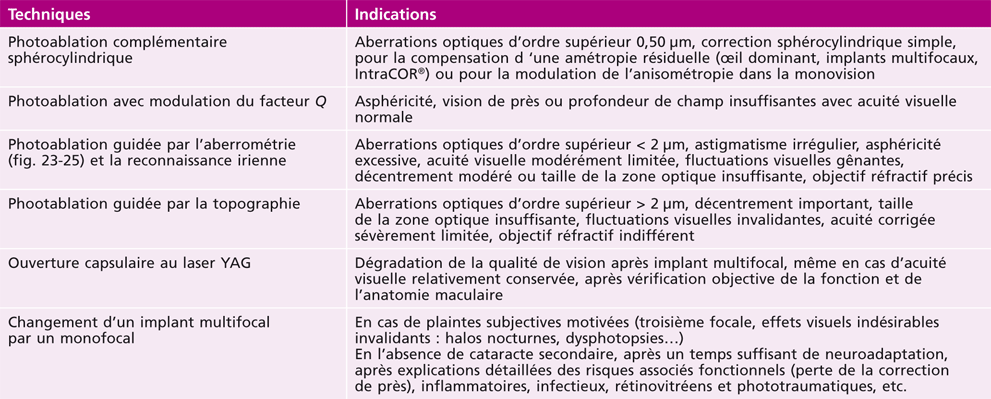
Tableau 23-VII Indications à une retouche chirurgicale.
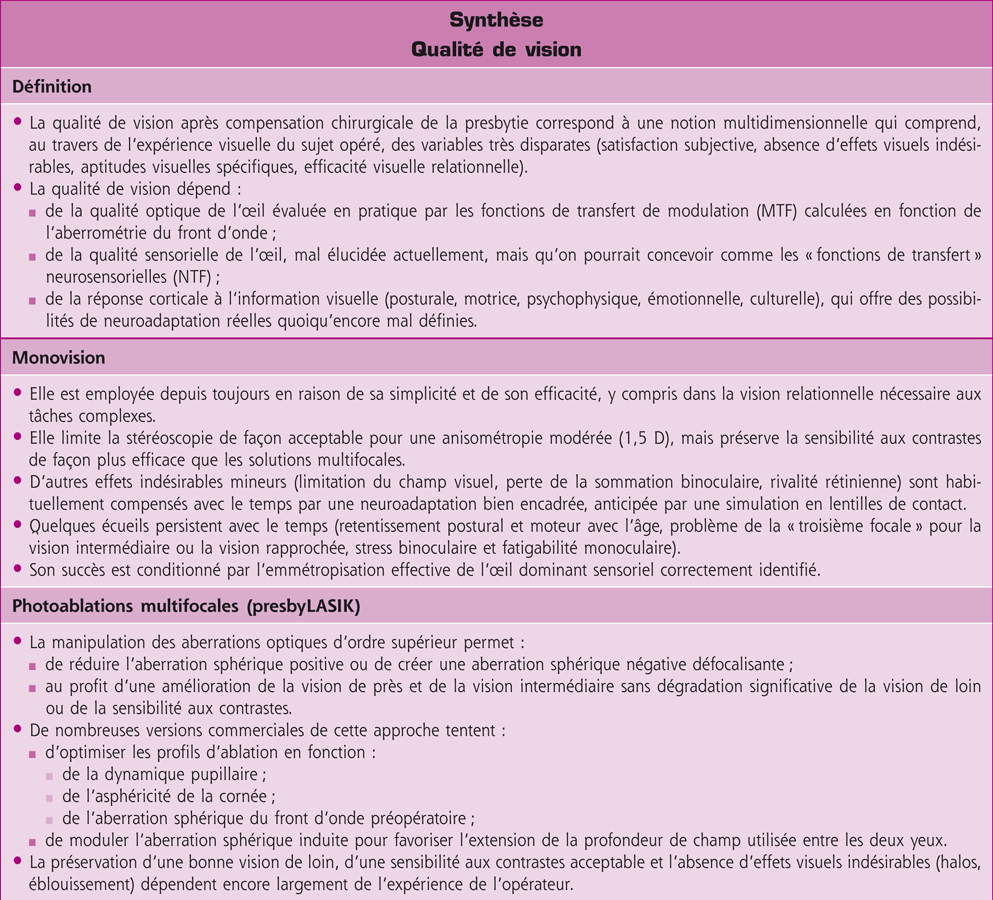
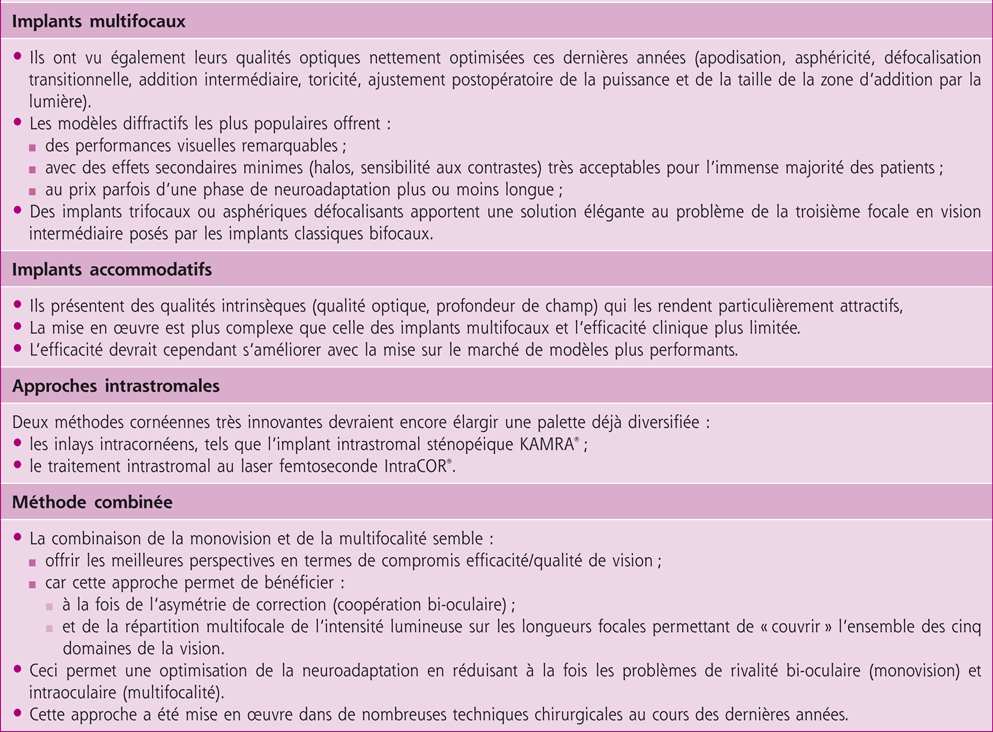
[1] Alió J.L., Chaubard J.-J., Caliz A. et al. Correction of presbyopia by technovision central multifocal LASIK (presbyLASIK). J Refract Surg, 2006 ; 22 : 453-60.
[2] Alió J.L., Grabner G., Plaza-Puche A.B. et al. Postoperative bilateral reading performance with 4 intraocular lens models: six-month results. J Cataract Refract Surg, 2011 ; 37 : 842-52.
[3] Alió J.L., Pinero D.P., Plaza-Puche A.B., Chan M.J. Visual outcomes and optical performance of a monofocal intraocular lens and a new-generation multifocal intraocular lens. J Cataract Refract Surg, 2011 ; 37 : 241-50.
[4] Alió J.L., Plaza-Puche A.B., Pinero D.P. et al. Quality of life evaluation after implantation of 2 multifocal intraocular lens models and a monofocal model. J Cataract Refract Surg, 2011 ; 37 : 638-48.
[5] Allen P.M., Radhakrishnan H., Rae S. et al. Aberration control and vision training as an effective means of improving accommodation in individuals with myopia. Invest Ophthalmol Vis Sci, 2009 ; 50 : 5120-9.
[6] Allen R.J., Saleh G.M., Litwin A.S. et al. Glare and halo with refractive correction. Clin Exp Optom, 2008 ; 91 : 156-60.
[7] Artal P., Marcos S., Iglesias I., Green D.G. Optical modulation transfert and contrast sensitivity with small decentered pupil in the human eye. Vision Res, 1996 ; 36 : 3575-86.
[8] Artola A., Patel S., Schimchak P. et al. Evidence for delayed presbyopia after photorefractive keratectomy for myopia. Ophthalmology, 2006 ; 113 : 741.e1.
[9] Aslam T.M., Haider D., Murray I.J. Principles of disability glare measurement: an ophthalmological perspective. Acta Ophthalmol Scand, 2007 ; 85 : 354-60.
[10] Assouline M. Compensation chirurgicale de la presbytie (2e partie). Ophtalmologies, 2007 ; 1 : 128.
[11] Assouline M. Chirurgie de la presbytie. In : Chirurgie réfractive. Saragoussi J.-J., Arné J.-L., Colin J., Montard M. Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 2001.
[12] Assouline M. Compensation chirurgicale de la presbytie : les différentes techniques en 2007. Ophtalmologies, 2007 ; 1 : 58-9.
[13] Assouline M. Nouvelles analyses optiques de l’œil. In : Chirurgie réfractive. Saragoussi J.-J., Arné J.-L., Colin J., Montard M. Rapport de la Société Française d’Ophtalmologie. Masson, Paris, 2001.
[14] Assouline M. Perspectives chirurgicales dans le traitement de la presbytie. Réflexions Ophtalmologiques, 1998 ; 21 : 17-29.
[15] Assouline M. Lasik monovision ou presbylasik multifocal : principes optiques. Ophtalmologies, 2007 ; 1 : 64-8.
[16] Assouline M. My presbyLasik technique. CRSToday Europe, 2007 ; 2 : 53-4.
[17] Assouline M., Girard C., Guedj T. Compensation chirurgicale de la presbytie par le PresbyLasik. Réflexions Ophtalmologiques, 2007 ; Suppl. : 76-83.
[18] Ayoubi M.G., Leccisotti A., Goodall E.A. et al. Femtosecond laser in situ keratomileusis versus conductive keratoplasty to obtain monovision in patients with emmetropic presbyopia. J Cataract Refract Surg, 2010 ; 36 : 997-1002.
[19] Back A., Grant T., Hine N. Comparative visual performance of three presbyopic contact lens corrections. Optom Vis Sci, 1992 ; 69 : 474-80.
[20] Baikoff G., Assouline M. Les techniques sclérales : restaurer l’accommodation ? Ophtalmologies, 2007 ; 1 : 135.
[21] Baron R. Guest editorial. The crash of Delta flight 554: Was monovision contact lens use the cause? http://www.airlinesafety.com/editorials/Delta554.htm
[22] Bauerberg J.M. Centered vs. inferior off-center ablation to correct hyperopia and presbyopia. J Refract Surg, 1999 ; 15 : 66-9.
[23] Becker K.A., Jaksche A., Holz F.G. [PresbyLASIK: Treatment approaches with the excimer laser.] Ophthalmologe, 2006 ; 103 : 667-72.
[24] Berdeaux G., Meunier J., Arnould B., Viala-Danten M. Measuring benefits and patients’ satisfaction when glasses are not needed after cataract and presbyopia surgery: scoring and psychometric validation of the Freedom from Glasses Value Scale (FGVS). BMC Ophthalmol, 2010 ; 10 : 15.
[25] Boerner C.F., Thrasher B.H. Results of monovision correction in bilateral pseudophakia. Am Intraocular Implant Soc J, 1982 ; 10 : 49-50.
[26] Braun E.H., Lee J., Steinert R.F. Monovision in LASIK. Ophthalmology, 2008 ; 115 : 1196-202.
[27] Campbell F.W., Kulikowski J.J., Levinson J. The effect of orientation on the visual resolution of gratings. J Physiol, 1966 ; 187 : 427-36.
[28] Cantu R., Rosales M.A., Tepichin E. et al. Objective quality of vision in presbyopic and non-presbyopic patients after pseudoaccommodative advanced surface ablation. J Refract Surg, 2005 ; 21 : S603-5.
[29] Cantu R., Rosales M.A., Tepichin E. et al. Advanced surface ablation for presbyopia using the Nidek EC-5000 laser. J Refract Surg, 2004 ; 20 : S711-3.
[30] Carta A., Braccio L., Belpoliti M. et al. Self-assessment of the quality of vision: association of questionnaire score with objective clinical tests. Curr Eye Res, 1998 ; 17 : 506-11.
[31] CBASSE (Commission on Behavioral and Social Sciences and Education). Emergent techniques for assessment of visual performance. National Academy Press, Washington DC, 1985.
[32] Chapman G.J., Vale A., Buckley J. et al. Adaptive gait changes in long-term wearers of contact lens monovision correction. Ophthalmic Physiol Opt, 2010 ; 30 : 281-8.
[33] Chu B.S., Wood J.M., Collins M.J. Effect of presbyopic vision corrections on perceptions of driving difficulty. Eye Contact Lens, 2009 ; 35 : 133-43.
[34] Chu B.S., Wood J.M., Collins M.J. Influence of presbyopic corrections on driving-related eye and head movements. Optom Vis Sci, 2009 ; 86 : E1267-75.
[35] Chu B.S., Wood J.M., Collins M.J. The effect of presbyopic vision corrections on nighttime driving performance. Invest Ophthalmol Vis Sci, 2010 ; 51 : 4861-6.
[36] Cillino S., Casuccio A., Di Pace F. et al. One-year outcomes with new-generation multifocal intraocular lenses. Ophthalmology, 2008 ; 115 : 1508-16.
[37] Cochener B., Fernandez-Vega L., Alfonso J.-F. et al. Spectacle independence and subjective satisfaction of ReSTOR multifocal intraocular lens after cataract or presbyopia surgery in two European countries. Clin Ophthalmol, 2010 ; 4 : 81-9.
[38] Cochener B., Lafuma A., Khoshnood B. et al. Comparison of outcomes with multifocal intraocular lenses: a meta-analysis. Clin Ophthalmol, 2011 ; 5 : 45-56.
[39] Cretin-Maitenaz B. Multifocal lens having a locally variable power. US Patent 2,869,422. 1959.
[40] Cumming J.S., Dell S.J., Colvard D.M. et al. Clinical evaluation of the Crystalens AT-45 accommodating intraocular lens: results of the U.S. Food and Drug Administration clinical trial. J Cataract Refract Surg, 2006 ; 32 : 812-25.
[41] De Vries N.E., Webers C.A., Touwslager W.R. et al. Dissatisfaction after implantation of multifocal intraocular lenses. J Cataract Refract Surg, 2011 ; 37 : 859-65.
[42] De Vries N.E., Webers C.A., Verbakel F. et al. Visual outcome and patient satisfaction after multifocal intraocular lens implantation: aspheric versus spherical design. J Cataract Refract Surg, 2010 ; 36 : 1897-904.
[43] Dexl A.K., Schlogel H., Wolfbauer M., Grabner G. Device for improving quantification of reading acuity and reading speed. J Refract Surg, 2010 ; 26 : 682-8.
[44] Dexl A.K., Seyeddain O., Riha W. et al. Reading performance after implantation of a small-aperture corneal inlay for the surgical correction of presbyopia: Two-year follow-up. J Cataract Refract Surg, 2011 ; 37 : 525-31.
[45] Dick H.B., Kaiser S. [Dynamic aberrometry during accommodation of phakic eyes and eyes with potentially accommodative intraocular lenses.] Ophthalmologe, 2002 ; 11 : 825-34.
[46] Djadi-Prat J., Saragoussi J.-J., Lebuisson D.A. et al. Qualité de vie après Lasik : partie I. Validation de la traduction française de l’échelle NEI-RQL-42. J Fr Ophtalmol, 2011 ; 34 : 143-56.
[47] Durrie D., McMinn P.S. Computer-based primary visual cortex training for treatment of low myopia and early presbyopia. Trans Am Ophthalmol Soc, 2007 ; 105 : 132-8.
[48] Ehmer A., Rabsilber T.M., Mannsfeld A. et al. [Influence of different multifocal intraocular lens concepts on retinal stray light parameters.] Ophthalmologe, 2011 ; 108 : 952-6.
[49] Erickson D.B., Erickson P. Psychological factors and sex differences inacceptance of monovision. Percept Mot Skills, 2000 ; 91 : 1113-9.
[50] Eustis H.S., Mungan N.K. Monovision for treatment of accommodative esotropia with a high AC/A ratio. J AAPOS, 1999 ; 3 : 87-90.
[51] Farid M., Steinert R.F. Patient selection for monovision laser refractive surgery. Curr Opin Ophthalmol, 2009 ; 20 : 251-4.
[52] Fawcett S.L., Herman W.K., Alfieri C.D. et al. Stereoacuity and foveal fusion in adults with long-standing surgical monovision. J AAPOS, 2001 ; 5 : 342-7.
[53] Fawcett S.L. An evaluation of the agreement between contour-based circles and random dot-based near stereoacuity tests. J AAPOS, 2005 ; 9 : 572-8.
[54] Fay A.M., Trokel S.L., Myers J.A. Pupil diameter and the principal ray. J Cataract Refract Surg, 1992 ; 18 : 348-51.
[55] Ferrer-Blasco T., Madrid-Costa D., Garcia-Lozaro S. et al. Stereopsis in bilaterally multifocal pseudophakic patients. Graefes Arch Clin Exp Ophthalmol, 2011 ; 249 : 245-51.
[56] Finkelman Y.M., Ng J.Q., Barrett G.D. Patient satisfaction and visual function after pseudophakic monovision. J Cataract Refract Surg, 2009 ; 35 : 998-1002.
[57] Franchini A., Caporossi O., Franchini I. Pseudophakic monovision vs bilateral multifocal IOLs implantation: clinical results. ASCRS, 2010.
[58] Gambra E., Sawides L., Dorronsoro C., Marcos S. Accommodative lag and fluctuations when optical aberrations are manipulated. J Vis, 2009 ; 9 : 4.1-15.
[59] Gandelman-Marton R., Arlazoroff A., Dvir Z. Ocular dominance and balance performance in healthy adults. Gait Posture, 2010 ; 31 : 394-6.
[60] Gatzioufas Z., Osvald A., Schroeder A.C. et al. A serious refractive multifocal intraocular lens complication in Meniere’s disease. Optom Vis Sci, 2010 ; 87 : 448-9.
[61] Greenbaum S. Cost-benefit analysis of multifocal IOLs versus monovision pseudophakia. J Cataract Refract Surg, 2009 ; 35 : 614.
[62] Guedj T., Girard C., Assouline M. Évaluation fonctionnelle : un point clé de la chirurgie de la presbytie. Ophtalmologies, 2007 ; 1 : 61-3.
[63] Guggenheim J.A., To C.H. Monovision slows myopia progression. Br J Ophthalmol, 2005 ; 89 : 1076-7.
[64] Gunenc U., Celik L. Long-term experience with mixing and matching refractive array and diffractive CeeOn multifocal intraocular lenses. J Refract Surg, 2008 ; 24 : 233-42.
[65] Gupta N., Naroo S.A., Wolffsohn J.S. Is randomisation necessary for measuring defocus curves in pre-presbyopes? Cont Lens Anterior Eye, 2007 ; 30 : 119-24.
[66] Gupta N., Naroo S.A., Wolffsohn J.S. Visual comparison of multifocal contact lens to monovision. Optom Vis Sci, 2009 ; 86 : E98-105.
[67] Gupta N., Wolffsohn J.S., Naroo S.A. Comparison of near visual acuity and reading metrics in presbyopia correction. J Cataract Refract Surg, 2009 ; 35 : 1401-9.
[68] Handa T., Shimizu K., Mukuno K. et al. Effects of ocular dominance on binocular summation after monocular reading adds. J Cataract Refract Surg, 2005 ; 31 : 1588-92.
[69] Handa T., Uozato H., Higa R. et al. Quantitative measurement of ocular dominance using binocular rivalry induced by retinometers. J Cataract Refract Surg, 2006 ; 32 : 831-6.
[70] Hayashi K., Yoshida M., Manabe S.I., Hayashi H. Optimal amount of anisometropia for pseudophakic monovision. J Refract Surg, 2010 : 27 : 1-7.
[71] He J.C., Marcos S., Webb R.H., Burns S.A. Measurement of the wave-front aberration of the eye by a fast psychophysical procedure. J Opt Soc Am A, 1998 ; 15 : 2449-55.
[72] Hersh P. Optics of conductive keratoplasty: implications for presbyopia management. Trans Am Ophthalmol Soc, 2005 ; 103 : 412-56.
[73] Holzer M.P., Mannsfeld A., Ehmer A., Auffarth G.U. Early outcomes of INTRACOR femtosecond laser treatment for presbyopia. J Refract Surg, 2009 ; 25 : 855-61.
[74] Illueca C., Alió J.L., Mas D. et al. Pseudoaccommodation and visual acuity with Technovision presbyLASIK and a theoretical simulated Array multifocal intraocular lens. J Refract Surg, 2008 ; 24 : 344-9.
[75] Ing E. Monovision therapy in patients with presbyopia and binocular diplopia. Arch Ophthalmol, 1997 ; 115 : 1086.
[76] Ito M., Shimizu K., Amano R., Handa T. Assessment of visual performance in pseudophakic monovision. J Cataract Refract Surg, 2009 ; 35 : 710-4.
[77] Ito M., Shimizu K. Reading ability with pseudophakic monovision and with refractive multifocal intraocular lenses: comparative study. J Cataract Refract Surg, 2009 ; 35 : 1501-4.
[78] Jackson W.B., Tuan K.M., Mintsioulis G. Aspheric wavefront-guided LASIK to treat hyperopic presbyopia: 12-month results with the VISX platform. J Refract Surg, 2011 ; 27 : 519-29.
[79] Jain S., Arora I., Azar D.T. Success of monovision in presbyopes: Review of the literature and potential applications to refractive surgery. Surv Ophthalmol, 1996 ; 40 : 491-9.
[80] Jain S., Ou R., Azar D.T. Monovision outcomes in presbyopic individuals after refractive surgery. Ophthalmology, 2001 ; 108 : 1430-3.
[81] Josephson J.E., Caffery B. Monovision vs. aspheric bifocal contact lenses: A crossover study. J Am Optom Assoc, 1987 ; 58 : 652-4.
[82] Kawamorita T., Uozato H., Handa T. et al. Effect of pupil size on visual acuity in a laboratory model of pseudophakic monovision. J Refract Surg, 2010 ; 26 : 378-80.
[83] Kaymak H., Fahle M., Ott G., Mester U. Intraindividual comparison of the effect of training on visual performance with ReSTOR and Tecnis diffractive multifocal IOLs. J Refract Surg, 2008 ; 24 : 287-93.
[84] Kim M.J., Zheleznyak L., Macrae S. et al. Objective evaluation of through-focus optical performance of presbyopia-correcting intraocular lenses using an optical bench system. J Cataract Refract Surg, 2011 ; 37 : 1305-12.
[85] Kirschen D.G., Hung C.C., Nakano T.R. Comparison of suppression, stereoacuity, and interocular differences in visual acuity in monovision and acuvue bifocal contact lenses. Optom Vis Sci, 1999 ; 76 : 832-7.
[86] Koller T., Seiler T. Four corneal presbyopia corrections: simulations of optical consequences on retinal image quality. J Cataract Refract Surg, 2006 ; 32 : 2118-23.
[87] Kowal L., Battu R., Kushner B. Refractive surgery and strabismus. Clin Exp Ophthalmol, 2005 ; 33 : 90-6.
[88] Lapid-Gortzak R., Van der Linden J.W., Van der Meulen I. et al. Straylight measurements in laser in situ keratomileusis and laser-assisted subepithelial keratectomy for myopia. J Cataract Refract Surg, 2010 ; 36 : 465-71.
[89] Lee J., Gosselin F., Wynn J.K., Green M.F. How do schizophrenia patients use visual information to decode facial emotion? Schizophr Bull, 2010 ; 10 : 1093.
[90] Lévy P., Elies D., Dithmer O. et al. Development of a new subjective questionnaire: the Freedom from Glasses Value Scale (FGVS). J Refract Surg, 2010 ; 26 : 438-46.
[91] Li Y.J., Choi J.A., Kim H. et al. Changes in ocular wavefront aberrations and retinal image quality with objective accommodation. J Cataract Refract Surg, 2011 ; 37 : 835-41.
[92] Lim K.L., Fam H.B. NeuroVision treatment for low myopia following LASIK regression. J Refract Surg, 2006 ; 22 : 406-8.
[93] Lind O.E., Kelber A., Kröger R.H. Multifocal optical systems and pupil dynamics in birds. J Exp Biol, 2008 ; 211 : 2752-8.
[94] Luo B.P., Brown G.C., Luo S.C., Brown M.M. The quality of life associated with presbyopia. Am J Ophthalmol, 2008 ; 145 : 618-22.
[95] Luque S.O., Bueno J.M., Diaz-Douton F. et al. A new clinical instrument to objectively measure intraocular scatter. Invest Ophthalmol Vis Sci, 2005 ; 46 : E-Abstract, 4327.
[96] Luttrull J.K., Dougherty P.J., Zhao H., Mainster M.A. Concentric ring scanning laser ophthalmoscope artifacts and dysphotopsia in diffractive multifocal pseudophakia. Ophthalmic Surg Lasers Imaging, 2010 ; 41.
[97] Maguen E., Nesburn A.B., Salz J.J. Bilateral photorefractive keratectomy with intentional unilateral undercorrection in an aircraft pilot. J Cataract Refract Surg, 1997 ; 23 : 294-6.
[98] Malecaze F.J., Gazagne C.S., Tarroux M.C., Gorrand J.M. Scleral expansion bands for presbyopia. Ophthalmology, 2001 ; 108 : 2165-71.
[99] Manzanera S., Prieto P.M., Ayala D.B. et al. Liquid crystal Adaptive Optics Visual Simulator: Application to testing and design of ophthalmic optical elements. Optics Express, 2007 ; 15 : 24-161.
[100] Marchini G., Mora P., Pedrotti E. et al. Functional assessment of two different accommodative intraocular lenses compared with a monofocal intraocular lens. Ophthalmology, 2007 ; 114 : 2038-43.
[101] Marques F.F., Sato R.M., Chiacchio B.B. et al. Evaluation of visual performance and patient satisfaction with pseudophakic monovision technique. Arq Bras Oftalmol, 2009 ; 72 : 164-8.
[102] Martinez-Roda J.A., Vilaseca M., Ondategui J.C. et al. Optical quality and intraocular scattering in a healthy young population. Clin Exp Optom, 2011 ; 94 : 223-9.
[103] Maxwell W.A., Lane S.S., Zhou F. Performance of presbyopia-correcting intraocular lenses in distance optical bench tests. J Cataract Refract Surg, 2009 ; 35 : 166-71.
[104] McAlinden C., Moore J.E. Multifocal intraocular lens with a surface-embedded near section: Short-term clinical outcomes. J Cataract Refract Surg, 2011 ; 37 : 441-5.
[105] McDonald M., Durrie D., Asbell P. et al. Treatment of presbyopia with conductive keratoplasty. Six-month results of the 1-year United States FDA clinical trial. Cornea, 2004 ; 23 : 661-8.
[106] Meister D.J., Fisher S.W. Progress in the spectacle correction of presbyopia. Part 1: Design and development of progressive lenses. Clin Exp Optom, 2008 ; 91 : 240-50.
[107] Migneco M.K. Alleviating vertical diplopia through contact lenses without the use of prism. Eye Contact Lens, 2008 ; 34 : 297-8.
[108] Moreno L.J., Pinero D.P., Alió J.L. et al. Double-pass system analysis of the visual outcomes and optical performance of an apodized diffractive multifocal intraocular lens. J Cataract Refract Surg, 2010 ; 36 : 2048-55.
[109] Nakagawara V.B., Veronneau S.J. Monovision contact lens use in the aviation environment: a report of a contact lens-related aircraft accident(1). Am J Ophthalmol, 2000 ; 130 : 542-3.
[110] Nakazawa M., Ohtsuki K. Apparent accommodation in pseudophakic eyes after implantation of posterior chamber intraocular lenses. Am J Ophthalmol, 1983 ; 96 : 435-8.
[111] Nochez Y., Majzoub S., Pisella P.-J. Effect of residual ocular spherical aberration on objective and subjective quality of vision in pseudophakic eyes. J Cataract Refract Surg, 2011 ; 37 : 1076-81.
[112] Ortiz D., Alió J.L., Illueca C. et al. Optical analysis of presbyLASIK treatment by a light propagation algorithm. J Refract Surg, 2007 ; 23 : 39-44.
[113] Patel S., Alió J.L., Feinbaum C. Comparison of Acri.Smart multifocal IOL, crystalens AT-45 accommodative IOL, and Technovision presbyLASIK for correcting presbyopia. J Refract Surg, 2008 ; 24 : 294-9.
[114] Pepin S.M. Neuroadaptation of presbyopia-correcting intraocular lenses. Curr Opin Ophthalmol, 2008 ; 19 : 10-2.
[115] Pepose J.S. Maximizing satisfaction with presbyopia-correcting intraocular lenses: the missing links. Am J Ophthalmol, 2008 ; 146 : 641-8.
[116] Phillips J.R. Monovision slows juvenile myopia progression unilaterally. Br J Ophthalmol, 2005 ; 89 : 1196-200.
[117] Polat U. Making perceptual learning practical to improve visual functions. Vision Res, 2009 ; 49 : 2566-73.
[118] Pouliquen Y. La transparence de l’œil. Odile Jacob, Paris, 2011.
[119] Prakash G., Choudhary V., Sharma N., Titiyal J.S. Change in the accommodative convergence per unit of accommodation ratio after bilateral laser in situ keratomileusis for myopia in orthotropic patients: prospective evaluation. J Cataract Refract Surg, 2007 ; 33 : 2054-6.
[120] Prakash G., Prakash D.R., Agarwal A. et al. Predictive factor and kappa angle analysis for visual satisfactions in patients with multifocal IOL implantation. Eye (Lond), 2011 ; 25 : 1187-93.
[121] Rabin J., Gooch J., Ivan D. Rapid quantification of color vision: the cone contrast test. Invest Ophthalmol Vis Sci, 2011 ; 52 : 816-20.
[122] Rajeev N., Metha A. Enhanced contrast sensitivity confirms active compensation in blur adaptation. Invest Ophthalmol Vis Sci, 2010 ; 51 : 1242-6.
[123] Raphael S., Macleod D.I. Mesopic luminance assessed with minimum motion photometry. J Vis, 2011 ; 11 . 14.
[124] Reilly C.D., Lee W.B., Alvarenga L. et al. Surgical monovision and monovision reversal in LASIK. Cornea, 2006 ; 25 : 136-8.
[125] Reinstein D.Z., Archer T.J., Gobbe M. LASIK for myopic astigmatism and presbyopia using non-linear aspheric micro-monovision with the Carl Zeiss Meditec MEL 80 platform. J Refract Surg, 2011 ; 27 : 23-37.
[126] Reinstein D.Z., Couch D.G., Archer T.J. LASIK for hyperopic astigmatism and presbyopia using micro-monovision with the Carl Zeiss Meditec MEL80 platform. J Refract Surg, 2009 ; 25 : 37-58.
[127] Risse J.-F., Girardon P., Boissonnot M. L’accommodation apparente de l’œil aphaque corrigé par cristallin artificiel. Bull Soc Ophtalmol Fr, 1989 ; 89 : 1039-44.
[128] Rocha K.M., Soriano E.S., Chamon W. et al. Spherical aberration and depth of focus in eyes implanted with aspheric and spherical intraocular lenses: a prospective randomized study. Ophthalmology, 2007 ; 11 : 2050-4.
[129] Rocha K.M., Vabre L., Château N., Krueger R.K. Expanding depth of focus by modifying higher-order aberrations induced by an adaptive optics visual simulator. J Cataract Refract Surg, 2009 ; 35 : 1885-92.
[130] Rossi E.A., Roorda A. Is visual resolution after adaptive optics correction susceptible to perceptual learning? J Vis, 2010 ; 1 : 11.
[131] Rozema J.J., Van Dyck D.E.M., Tassignon M.-J. Clinical comparison of 6 aberrometers. Part 1: technical specifications. J Cataract Refract Surg, 2005 ; 31 : 1114-27.
[132] Ruiz L.A., Cepeda L.M., Fuentes V.C. Intrastromal correction of presbyopia using a femtosecond lasersystem. J Refract Surg, 2009 ; 25 : 847-54.
[133] Saad A., Grise-Dulac A., Gatinel D. Bilateral loss in the quality of vision associated with anterior corneal protrusion after hyperopic LASIK followed by intrastromal femtolaser-assisted incisions. J Cataract Refract Surg, 2010 ; 36 : 1994-8.
[134] Sagi D. Perceptual learning in vision research. Vision Res, 2011 ; 51 : 1552-66.
[135] Sanders D.R., Sanders M.L. Visual performance results after Tetraflex accommodating intraocular lens implantation. Ophthalmology, 2007 ; 9 : 1679-84.
[136] Saragoussi J.-J., Djadi-Prat J., Lebuisson D.A. et al. Qualité de vie après LASIK : partie II. Qualité de vie et satisfaction d’une population de patients opérée par LASIK. J Fr Ophtalmol, 2011 ; 34 : 294-302.
[137] Schallhorn S., Tanzer D., Sanders D.R. et al. Night driving simulation in a randomized prospective comparison of Visian toric implantable collamer lens and conventional PRK for moderate to high myopic astigmatism. J Refract Surg, 2010 ; 26 : 321-6.
[138] Scheffel M., Kuehne C., Kohnen T. Comparison of monocular and binocular infrared pupillometers under mesopic lighting conditions. J Cataract Refract Surg, 2010 ; 36 : 625-30.
[139] Schneiders A.G., John Sullivan S., Rathbone E.J. et al. Visual acuity in young elite motorsport athletes: a preliminary report. Phys Ther Sport, 2010 ; 11 : 47-9.
[140] Seijas O., Gomez de Liaso P., Gomez de Liaso R. et al. Ocular dominance diagnosis and its influence in monovision. Am J Ophthalmol, 2007 ; 144 : 209-16.
[141] Sergienko N.M., Kondratenko Y.N., Tutchenko N.N. Depth of focus in pseudophakic eyes. Graefes Arch Clin Exp Ophthalmol, 2008 ; 11 : 1623-7.
[142] Shah C.R., Purba M.K., Dardzhikova A. et al. Experience with patient satisfaction with monovision targeted in PRK and LASIK. ASCRS San Francisco, 2009.
[143] Shimizu K., Ito M. Dissatisfaction after bilateral multifocal intraocular lens implantation: an electrophysiology study. J Refract Surg, 2011 ; 27 : 309-12.
[144] Soler V., Benito A., Soler P. et al. A Randomized comparison of pupil-centered vs vertex-centered ablation in LASIK correction of hyperopia. Am J Ophthalmol, 2011 ; 152 : 591-9.
[145] Stanojcic N., Wilkins M., Bunce C., Ionides A. Visual fields in patients with multifocal intraocular lens implants and monovision: an exploratory study. Eye(Lond), 2010 ; 24 : 1645-51.
[146] Suttle C., Alexander J., Liu M. et al. Sensory ocular dominance based on resolution acuity, contrast sensitivity and alignment sensitivity. Clin Exp Optom, 2009 ; 92 : 2-8.
[147] Tan J.C., Spalton D.J., Arden G.B. Comparison of methods to assess visual impairment from glare and light scattering with posterior capsule opacification. J Cataract Refract Surg, 1998 ; 24 : 1626-31.
[148] Telandro A. Pseudo-accommodative cornea: a new concept for correction of presbyopia. J Refract Surg, 2004 ; 20 : S714-7.
[149] Ueda T., Nawa Y., Okamoto M., Hara Y. Effect of pupil size on dynamic visual acuity. Percept Mot Skills, 2007 ; 104 : 267-72.
[150] US National Transport Safety Board Report NYC99MA178 & US National Transportation Safety Board Report AAR-97/03.
[151] Vale A., Buckley J.G., Elliott D.B. Gait alterations negotiating a raised surface induced by monocular blur. Optom Vis Sci, 2008 ; 85 : 1128-34.
[152] Van Bree M.C., Van Verre H.P., Devreese M.T. et al. Straylight values after refractive surgery: screening for ocular fitness in demanding professions. Ophthalmology, 2011 ; 118 : 945-53.
[153] Van Mierlo C.M., Brenner E., Smeets J.B. Better performance with two eyes than with one in stereo-blind subjects’ judgments of motion in depth. Vision Res, 2011 ; 51 : 1249-53.
[154] Vega F., Alba-Bueno F., Millan M.S. Energy distribution between distance and near images in apodized diffractive multifocal intraocular lenses. Invest Ophthalmol Vis Sci, 2011 ; 52 : 5695-701.
[155] Vinciguerra P., Nizzola G.M., Nizzola F. et al. Zonal photorefractive keratectomy for presbyopia. J Refract Surg, 1998 ; 14 : S218-21.
[156] Vlaskamp B.N., Yoon G., Banks M.S. Human stereopsis is not limited by the optics of the well-focused eye. J Neurosci, 2011 ; 31 : 9814-8.
[157] Vola J.-L., Cornu L., Carruel C. et al. L’âge et les acuités visuelles photopiques et mésopiques. J Fr Ophtalmol, 1983 ; 6 : 473-9.
[158] Walsh G. The effect of mydriasis on the pupillary centration of the human eye. Ophthalmic Physiol Opt, 1988 ; 8 : 178-82.
[159] Win-Hall D.M., Glasser A. Objective accommodation measurements in prepresbyopic eyes using an autorefractor and an aberrometer. J Cataract Refract Surg, 2008 ; 34 : 774-84.
[160] Win-Hall D.M., Ostrin L.A., Kasthurirangan S., Glasser A. Objective accommodation measurement with the Grand Seiko and Hartinger coincidence refractometer. Optom Vis Sci, 2007 ; 84 : 879-87.
[161] Wold J.E., Hu A., Chen S., Glasser A. Subjective and objective measurement of human accommodative amplitude. J Cataract Refract Surg, 2003 ; 29 : 1878-88.
[162] Yang E., Blake R., McDonald J.E. 2nd. A new interocular suppression technique for measuring sensory eye dominance. Invest Ophthalmol Vis Sci, 2010 ; 51 : 588-93.
[163] Yilmaz O.F., Alagoz N., Pekel G. et al. Intracorneal inlay to correct presbyopia: Long-term results. J Cataract Refract Surg, 2011 ; 37 : 1275-81.
[164] Zalevsky Z., Ben Yaish S., Zlotnik A. et al. Cortical adaptation and visual enhancement. Opt Lett, 2010 ; 35 : 3066-8.
[165] Zimmerman A.B., Lust K.L., Bullimore M.A. Visual acuity and contrast sensitivity testing for sports vision. Eye Contact Lens, 2011 ; 37 : 153-9.
- Chapitre 23
Qualité de vision après compensation chirurgicale de la presbytie

