M. Puech, M. Streho
L’objectif du traitement de la presbytie au moment de l’opération de la cataracte demande une plus grande précision du calcul d’implant pour tirer le meilleur parti des implants multifocaux ou accommodatifs.
Pour les patients déjà opérés de chirurgie réfractive, le souhait de traiter aussi la presbytie au moment de l’opération de la cataracte représente un objectif de plus en plus fréquent mais avec un taux de réponse imparfaite qui reste trop élevé.
Les différentes méthodes énumérées précédemment (cf. chapitre 16) représentent une liste non exhaustive des techniques de calcul d’implant proposées en cas de chirurgie de la cataracte après chirurgie réfractive [9]. La multiplicité des solutions proposées montre que la véritable réponse n’est pas encore été trouvée pour s’approcher de l’emmétropie de façon fiable [13].
Les méthodes de calcul fondées sur l’histoire réfractive du patient se heurtent au caractère incomplet ou erroné des données. Les méthodes reposant sur les mesures avant l’opération de la cataracte sont limitées en précision par la modification des rapports entre les différents dioptres oculaires. Cette perte de cohérence physique limite l’utilisation de l’optique gaussienne, qui reste la base de nombreuses formules de calcul.
Les deux écueils des formules actuelles résident dans deux raccourcis principaux :
– la simplification des différents dioptres oculaires dans la théorie de la lentille fine par rapport au modèle de la lentille épaisse ;
– l’utilisation, dans les formules optiques, du seul faisceau incident centré, alors que le système oculaire utilise tout le diamètre pupillaire pour transmettre les images jusqu’à la rétine.
La plupart des formules de calcul utilisent les bases de l’optique gaussienne, dénommée aussi optique para-axiale, sous deux déclinaisons : la théorie de la lentille fine et la théorie de la lentille épaisse.
Les lois de l’optique physique utilisées par la plupart de nos formules actuelles reposent sur la théorie dite de la lentille fine décrite par Gauss (fig. 17-1) : cette théorie optique transforme un ensemble de dioptres cohérents en une seule lentille qui, théoriquement, n’a pas d’épaisseur.
Par exemple, la cornée qui est constituée de différents dioptres est ramenée à une seule lentille théorique, ce qui permet d’en déterminer la puissance totale. En réalité, les faisceaux lumineux qui traversent la cornée traversent au moins trois dioptres différents : le dioptre entre l’air et le film lacrymal, le dioptre entre le film lacrymal et l’épithélium, le dioptre entre l’endothélium et l’humeur aqueuse. Ces trois dioptres sont régis par les lois de l’optique classique dépendant des rayons de courbure et des différences indices de réfraction.
Cette simplification de l’optique géométrique s’appuie sur la connaissance des caractéristiques de chaque élément intraoculaire en lui affectant des propriétés dites standards, par exemple :
– la distance entre les deux dioptres principaux de la cornée est de l’ordre de 520 µm et ces deux dioptres sont assimilés à une lame à face parallèle ;
– cette simplification permet de transformer un ensemble de dioptres complexes en une seule lentille fine dont l’indice de réfraction a été établi, par calcul, à 1,3375 ;
– cette valeur correspond à un choix, parfois contesté par d’autres calculs d’optique géométrique, aboutissant à des valeurs de l’indice global de la cornée de 1,33.
En cas de chirurgie réfractive ablative, la cornée est amincie par le geste réfractif et, en cas de chirurgie myopique, les deux faces de la cornée ne peuvent plus être assimilées à une lame à face parallèle. L’indice de réfraction unique schématisant l’ensemble de la cornée devient une valeur erronée.
Le cristallin naturel est lui aussi assimilé à une lentille fine dont la puissance représente, en fait, le dioptre entre l’humeur aqueuse et la face antérieure du cristallin puis le dioptre entre la face postérieure du cristallin et l’humeur vitrée. Le recours au modèle de la lentille fine appliqué au cristallin a abouti à la notion d’ELP (Effective Lens Position, position véritable de l’implant) : cette valeur ne représente cependant qu’une valeur algébrique abstraite qui décrit la distance entre le plan principal de la cornée et le plan principal du cristallin en appliquant le modèle de l’optique gaussienne. Cette valeur calculée de façon mathématique par les algorithmes de Gauss ne correspond pas véritablement à la distance qu’on peut mesurer entre la cornée et l’implant mis en place.
Ces différentes simplifications peuvent être acceptables pour des yeux proches des modèles qui ont servi à l’élaboration du modèle oculaire par la théorie de la lentille fine. Lorsque les paramètres entre les différents dioptres s’éloignent du modèle idéal, les règles d’application de ce modèle sont prises en défaut. Cela est le cas pour les yeux qui s’éloignent de l’emmétropie comme en cas de myopie ou d’hypermétropie forte. Cela peut aussi être rencontré en cas de discordance entre la taille du segment antérieur et la longueur du globe oculaire ou bien en cas de position du cristallin plus en avant ou plus en arrière par rapport au modèle.
Les principales formules actuelles de calcul d’implant reposent sur ce modèle de la lentille fine, ce qui explique, en partie, les variations de réfraction par rapport à la réfraction souhaitée.
Une des voies pour rendre plus fiables les calculs pourra faire appel au modèle de physique optique dénommé modèle de la lentille épaisse.
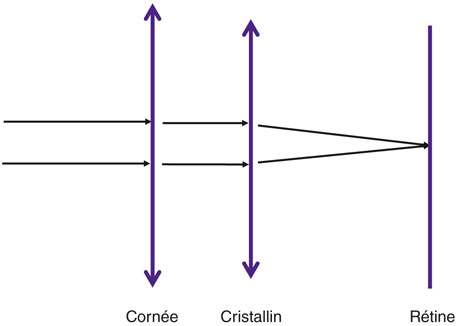
Fig. 17-1 Modèle de la lentille fine.
La cornée et le cristallin sont simplifiés pour correspondre chacun à une seule lentille fondée sur des modèles standards en épaisseur et en indice de réfraction.
Ce modèle de physique optique fait appel à la connaissance plus précise des relations entre les différents dioptres traversés par le faisceau lumineux (fig. 17-2) [10]. Pour appliquer ce modèle, il est nécessaire de connaître les rayons de courbure des dioptres intraoculaires, leur espacement et les indices de réfraction des différents milieux traversés.
Les appareils de mesure actuels permettent, soit par biométrie ultrasonore soit par interférométrie (comme avec l’appareil Lenstar® de Haag-Streit), de déterminer les épaisseurs de la cornée et du cristallin. Les topographes modernes (comme l’appareil Pentacam® de Oculus) et, plus récemment, quelques appareils OCT (comme l’appareil RTVue® de Optovue) permettent aussi de mesurer les rayons de courbure des faces antérieure et postérieure de la cornée.
Pour appliquer ce modèle à l’utilisation d’un implant cristallinien, il est aussi nécessaire de connaître les rayons de courbure de l’implant et son épaisseur centrale. Ces éléments sont disponibles auprès du fabricant mais peuvent varier en fonction de la puissance de l’implant, ce qui limite, à l’heure actuelle, l’utilisation de cette méthode en pratique courante.
Un des éléments critiques, comme avec les formules de calcul actuelles, est la détermination de la position de l’implant, qui aura un impact important dans la puissance finale de tout le système optique de l’œil [11].
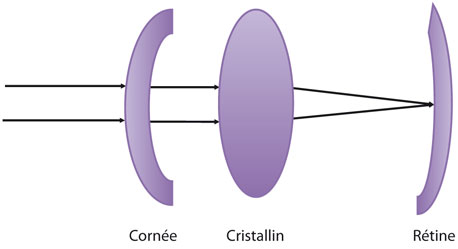
Fig. 17-2 Modèle de la lentille épaisse.
La cornée et le cristallin sont analysés comme une succession de différents dioptres en respectant l’espacement entre les différents dioptres et le véritable indice de réfraction à l’intérieur des différents milieux traversés par le faisceau lumineux.
Qu’on utilise le modèle de la lentille fine ou celui de la lentille épaisse, les lois de l’optique géométrique gaussienne ont pour postulat que les lentilles traversées réalisent un système centré et s’appliquent à un faisceau lumineux fin, lui-même centré sur les lentilles.
En réalité, dans un œil humain, les différents dioptres ne sont pas parfaitement centrés et le faisceau lumineux incident correspond à un large faisceau dépendant du diamètre pupillaire.
De plus, les caractéristiques de ce faisceau incident varient en fonction de son degré d’excentricité par rapport à l’axe visuel : l’angle d’incidence du faisceau au centre de la cornée est un angle proche des 90°, alors que les rayons plus périphériques auront un angle d’incidence différent à cause de la courbure cornéenne.
Les phénomènes de réflexion et de diffraction du faisceau incident sont eux aussi différents lorsqu’on s’éloigne de l’apex cornéen.
De plus, pour un patient opéré de chirurgie réfractive cornéenne, la perturbation du faisceau incident par les modifications des rayons de courbure mais aussi par les modifications de réflectivité et de diffraction à l’intérieur de la cornée plus ou moins remaniée entraîne une perte de fiabilité des différents modèles optiques classiques.
Les analyses aberrométriques et par ray-tracing [7] apportent une possibilité d’analyse du comportement d’un faisceau incident sur tout le diamètre pupillaire, ce qui permet de s’approcher ainsi de la réalité optique des yeux de nos patients en incluant les aberrations de tout le système optique du globe oculaire. Les améliorations liées au calcul d’implant pourront bénéficier de la meilleure connaissance de cette façon d’analyser les caractéristiques de chaque globe oculaire.
En conservant le modèle actuel de la lentille fine, quelques tentatives sont déjà ébauchées pour réduire l’imprécision dans la détermination de la puissance cornéenne, notamment dans la détermination de la puissance du dioptre cornéen antérieur [2, 19]. Ces solutions s’appuient sur la détermination du rayon de courbure antérieur en se fondant sur le rayon de courbure postérieur à partir des mesures par les topographes cornéens [8, 23], par les appareils reposant sur le principe de la Scheimpflug camera [18] et, plus récemment, sur les appareils OCT [4]. Ces tentatives sont réunies sous le terme de puissance cornéenne totale (total corneal power ou net corneal power dans les publications anglo-saxonnes) [3].
Le premier appareil commercialisé ayant donné un accès aux rayons de courbure de la face postérieure de la cornée a été l’appareil Orbscan® (Bausch & Lomb) [20] avec ses mires de Placido complétées par une fente lumineuse balayant la cornée par un faisceau incident vertical.
L’arrivée de l’appareil Pentacam® (Oculus) a permis d’améliorer la mesure des rayons de courbure de la face postérieure de la cornée en utilisant un faisceau lumineux rotatif, sur le principe de la Scheimpflug camera.
Des travaux plus récents réalisés par OCT focalisée sur la cornée permettent de recalculer les rayons de courbure de la cornée avec une précision nettement supérieure aux deux systèmes précédents [21, 22]. Le faisceau OCT étant peu perturbé par les différentes pertes de réflectivité intracornéenne, le calcul des rayons de courbure antérieur et postérieur de la cornée est possible sur des cornées normales mais aussi sur des cornées opérées de chirurgie réfractive avec une très haute précision dans la mesure d’épaisseur cornéenne. Ces travaux sont en cours d’évaluation mais laissent entrevoir une bonne fiabilité pour la détermination de la puissance cornéenne à l’apex et sur la zone des 3 mm ou 4 mm centraux. Ces mesures, allant dans le sens d’une meilleure précision et d’une meilleure connaissance des dioptres cornéens, pourront aussi être utilisées avec le modèle de calcul de la lentille épaisse.
L’application de ce modèle utilise la connaissance précise de la position des différents dioptres qui forment l’ensemble du système oculaire et aussi des rayons de courbure et des indices de réfraction.
Pour la cornée, il est nécessaire de connaître le rayon de courbure de la face antérieure et celui de la face postérieure, de connaître les indices de réfraction de l’air, de la cornéen et de l’humeur aqueuse. Les progrès actuels en matière de mesure des paramètres de la cornée vont permettre le recours à cette méthode avec, par exemple, les mesures des rayons de courbure antérieur et postérieur et de la pachymétrie par Scheimpflug camera ou par OCT. L’indice de réfraction du tissu cornéen fait encore l’objet de quelques discussions pour les yeux qui n’ont pas été opérés de chirurgie réfractive, avec une valeur fixée à 1,3365 [5]. Pour les yeux déjà opérés, cet indice restera une approximation dépendant de la qualité de la cicatrisation intracornéenne ; diverses approches ont été tentées pour adapter cet indice à la quantité de tissu photoablaté [6].
Pour le cristallin, les mesures des rayons de courbure antérieur et postérieur ne sont pas accessibles en pratique courante et l’indice de réfraction peut aussi varier en fonction de la densité et de la répartition des opacités intracristalliniennes. Une des approches de fiabilisation de cette méthode est d’utiliser le modèle du globe pseudophaque [14, 16] avec mesure directe de la position de l’implant. Cet implant étant connu, ses rayons de courbure antérieur et postérieur ainsi que son indice de réfraction peuvent être intégrés dans la formule.
Avec le modèle de la lentille épaisse dans le cas d’un globe pseudophaque, les erreurs d’appréciation de la réfraction finale ne viennent que des éléments requis, non réalisés, comme un décentrement de l’implant ou un tilt de l’optique de l’implant.
Dans le modèle de la lentille épaisse, la position de l’implant est directement liée à la mesure de la profondeur de la chambre antérieure pseudophaque et de l’épaisseur de l’implant au centre. Ces mesures sont disponibles avec les appareils ultrasonores en mode A ou en mode B, mais l’arrivée d’appareils infrarouge comme le Lenstar® (Haag-Streit) rend cette approche plus précise.
Une étude réalisée par Olsen montre la possibilité de comparer la position de l’implant mesurée par Lenstar® en postopératoire à la position de la cristalloïde antérieure et postérieure mesurée avant l’intervention.
Cette approche permettra d’inclure une base de données liée à tel ou tel implant pour mieux apprécier la position de l’implant en fonction de l’épaisseur cristallinienne.
La formule d’Olsen intègre cette théorie de la lentille épaisse avec utilisation de la profondeur de chambre antérieure et de l’épaisseur cristallinienne [12].
Les limites du modèle de la lentille épaisse peuvent être liées à deux éléments :
– ce modèle est applicable aux systèmes optiques centrés, ce qui n’est pas toujours le cas par exemple face à un tilt ou un décentrement de l’implant ;
– les lois de propagation de la lumière avec le modèle de la lentille épaisse ne sont applicables que pour les rayons lumineux cheminant sur l’axe visuel ou les rayons proches de l’axe visuel (système para-axial).
Pour étudier plus finement les phénomènes complexes de diffraction et réflexion d’un faisceau lumineux traversant la cornée sur tout le diamètre pupillaire et tout le système optique de l’œil, des approches plus récentes, faisant appel à l’aberrométrie et au ray-tracing, ouvrent quelques perspectives applicables au calcul d’implant, notamment en cas de perturbation de la réflectivité de la cornée après chirurgie réfractive.
Toutes les formules de calcul d’implant actuelles utilisent les lois de l’optique gaussienne, c’est-à-dire para-axiale, s’appliquant à des systèmes optiques centrés et à des faisceaux incidents ne faisant qu’un petit angle par rapport à l’axe visuel. La méthode du ray-tracing est une méthode de calcul du comportement d’un faisceau très fin passant par l’axe visuel mais aussi par les différents points de la zone pupillaire, avec des angles différents par rapport au faisceau passant strictement sur l’axe visuel (fig. 17-3) [15]. Le faisceau incident est réfracté et diffracté par les différentes surfaces selon les lois de Snell et toutes ces trajectoires sont analysées grâce aux bases de l’aberrométrie.
L’avantage de ce système est de tenir compte des aberrations optiques liées aux différents dioptres.
Quelques rares logiciels qui utilisant le ray-tracing [1, 17] sont disponibles, comme le logiciel OKULIX®. Les premières approches de cette méthode retrouvent des résultats comparables aux autres formules pour des longueurs axiales proches de la normale. Les différences de puissances d’implant emmétropisantes sont plus importantes pour les globes plus courts ou plus longs que la moyenne.
Les premiers résultats de cette méthode montrent une légère supériorité du ray-tracing en cas de calcul d’implant normal notamment pour les yeux hors norme, mais elle est également attendue pour les yeux opérés de chirurgie réfractive. À l’heure actuelle, les publications sont très rares et sur des séries trop petites, ne permettant pas de confirmer cette hypothèse. Néanmoins, la possibilité d’associer l’important recul acquis en matière d’aberrométrie dans les cas de chirurgie réfractive permet d’envisager une adaptation rapide de cette analyse appliquée au calcul d’implant notamment après chirurgie réfractive.
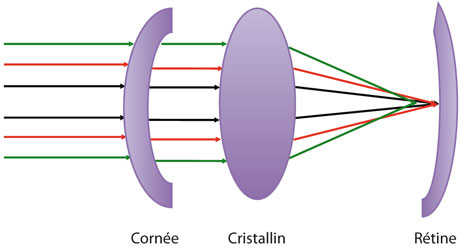
Fig. 17-3 Modèle du ray-tracing.
Les faisceaux incidents et réfléchis sont analysés séparément en fonction de leur éloignement par rapport à l’axe visuel. Contrairement au modèle gaussien para-axial, la technique du ray-tracing permet d’analyser séparément les faisceaux lumineux sur toute la zone d’ouverture de la pupille avec, par exemple, des focalisations différentes en fonction de l’éloignement par rapport à l’axe visuel (prise en compte de l’aberration sphérique) : les rayons rouges sont focalisés sur la rétine comme les rayons para-axiaux mais les rayons verts plus périphériques sont focalisés en avant de la rétine.
Malgré les méthodes les plus évoluées et les mesures de plus en plus précises des différents paramètres géométriques et optiques, le calcul d’implant après chirurgie réfractive cornéenne reste un exercice difficile. Les méthodes proposées tendent à réduire l’écart entre la réfraction souhaitée en préopératoire et la réfraction réellement obtenue en postopératoire. Cet objectif est souvent atteint par la plupart des méthodes proposées à l’heure actuelle, mais avec des résultats souvent plus performants sur les séries qui ont servi de base à l’élaboration des différentes méthodes. Lors du passage à des études prospectives, l’écart type se majore en fonction des différentes situations de chirurgie réfractive rencontrées.
Le recours à l’histoire réfractive du patient reste souvent un repère appréciable avant le choix définitif de l’implant. Cependant, en cas d’absence de données suffisantes, il semble utile de se référer à une méthode empirique qui garde son intérêt et semble pouvoir le garder pour quelque temps. Il s’agit de la méthode de calcul fondée sur la kératométrie mesurée au moment du bilan de cataracte, réduite de 1 D en cas de chirurgie réfractive myopique et majorée de 1 D en cas de chirurgie hypermétropique.
La réalisation de cette méthode a été décrite pour compenser l’erreur de mesure en cas de chirurgie cornéenne myopique. La puissance cornéenne mesurée par les kératomètres étant trop importante, car mesurée sur les 3 mm centraux, la valeur retenue pour le calcul de l’implant est estimée par le K mesuré – 1 D.
En pratique, compte tenu des différents appareils à notre disposition pour réaliser la kératométrie, il est possible de comparer les mesures obtenues par le kératomètre, le biomètre à infrarouge et la topographie cornéenne : le K le plus faible pourra alors être retenu puis réduit de 1 D pour limiter l’erreur de mesure. Cette méthode semble marcher de façon satisfaisante avec la formule SRK/T mais, pour limiter le risque de mauvaise appréciation de la position de l’implant, il est nécessaire de viser une amétropie de – 1,50 D pour s’approcher de l’emmétropie postopératoire. Cette méthode ne relève que de constatations non publiées et sera à adapter en fonction de l’importance de la chirurgie cornéenne réalisée.
En cas de chirurgie réfractive hypermétropique, ce raisonnement pourra être appliqué en majorant la kératométrie d’environ 1 D.

[1] Einighammer J., Oltrup T., Bende T., Jean B. Calculating intraocular lens geometry by real ray tracing. J Refract Surg, 2007 ; 23 : 393-404.
[2] Gobbi P.G., Carones F., Brancato R. Keratometric index, videokeratography, and refractive surgery. J Cataract Refract Surg, 1998 ; 24 : 202-11.
[3] Hamed A.M., Wang L., Misra M., Koch D.D. A comparative analysis of five methods of determining corneal refractive power in eyes that have undergone myopic laser in situ keratomileusis. Ophthalmology, 2002 ; 109 : 651-8.
[4] Huang D., Swanson E.A., Lin C.-P. et al. Optical coherence tomography. Science, 1991 ; 254 : 1178-81.
[5] Huang D., Tang M., Shekhar R. Mathematical model of corneal surface smoothing after laser refractive surgery. Am J Ophthalmol, 2003 ; 135 : 267-78.
[6] Jarade E.F., Abi Nader F.C., Tabbara K.F. Intraocular lens power calculation following LASIK: determination of the new effective index of refraction. J Refract Surg, 2006 ; 22 : 75-80.
[7] Jin H., Rabsilber T., Ehmer A. et al. Comparison of ray-tracing method and thin-lens formula in intraocular lens power calculations. J Cataract Refract Surg, 2009 ; 35 : 650-62.
[8] Leyland M. Validation of Orbscan II posterior corneal curvature measurement for intraocular lens power calculation. Eye, 2004 ; 18 : 357-60.
[9] Lteif Y., Gatinel D. Calcul de la puissance de l’implant intraoculaire après chirurgie réfractive cornéenne. J Fr Ophtalmol, 2008 ; 31 : 326-34.
[10] Norrby S. Using the lens haptic plane concept and thick-lens ray tracing to calculate intraocular lens power. J Cataract Refract Surg, 2004 ; 30 : 1000-5.
[11] Olsen T. Prediction of the effective postoperative (intraocular lens) anterior chamber depth. J Cataract Refract Surg, 2006 ; 32 : 419-24.
[12] Olsen T. Use of fellow eye data in the calculation of intraocular lens power for the second eye. Ophthalmology, 2011 ; 118 : 1710-5.
[13] Preussner P.R., Olsen T., Hoffmann P., Findl O. Intraocular lens calculation accuracy limits in normal eyes. J Cataract Refract Surg, 2008 ; 34 : 802-8.
[14] Preussner P.R., Wahl J. [Consistent numerical calculation of optics of the pseudophakic eye.] Ophthalmologe, 2000 ; 97 : 126-41.
[15] Preussner P.R., Wahl J., Lahdo H. et al. Ray tracing for intraocular lens calculation. J Cataract Refract Surg, 2002 ; 28 : 1412-9.
[16] Preussner P.R., Wahl J., Weitzel D. et al. Predicting postoperative intraocular lens position and refraction. J Cataract Refract Surg, 2004 ; 30 : 2077-83.
[17] Rabsilber T.M., Reuland A.J., Holzer M.P., Auffarth G.U. Intraocular lens power calculation using ray tracing following excimer laser surgery. Eye (Lond), 2007 ; 21 : 697-701.
[18] Savini G., Barboni P., Carbonelli M., Hoffer K.J. Accuracy of a dual Scheimpflug analyzer and a corneal topography system for intraocular lens power calculation in unoperated eyes. J Cataract Refract Surg, 2011 ; 37 : 72-6.
[19] Sónego-Krone S., López-Moreno G., Beaujon-Balbi O.V. et al. A direct method to measure the power of the central cornea after myopic laser in situ keratomileusis. Arch Ophthalmol, 2004 ; 122 : 159-66.
[20] Srivannaboon S., Reinstein D.Z., Sutton H.F.S., Holland S.P. Accuracy of Orbscan total optical power maps in detecting refractive change after myopic laser in situ keratomileusis. J Cataract Refract Surg, 1999 ; 25 : 1596-9.
[21] Tang, M. An intraocular lens power calculation formula based on optical coherence tomography: a pilot study. J Refract Surg, 2010 ; 26 : 430-7.
[22] Tang M. Intraocular lens power calculation based on Fourier-domain optical coherence tomography. Invest Ophthalmol Vis Sci, 2010 ; 51 : e-Abstract 5692.
[23] Twa M.D., Roberts C., Mahmoud A.M., Chang J.S. Jr. Response of the posterior corneal surface to laser in situ keratomileusis for myopia. J Cataract Refract Surg, 2005 ; 31 : 61-71.

