Œdèmes maculaires – historique
J.-A. Bernard
L’œdème maculaire n’a été reconnu que récemment, avec l’ère moderne. Les anciens ne disposaient que de globes d’autopsie et la notion même d’œdème maculaire était totalement absente de leurs préoccupations cliniques. L’histoire de cet œdème n’a trouvé sa place qu’avec la possibilité d’examiner la rétine in vivo. Or, l’examen du fond d’œil (FO) ne fut réalisable qu’avec l’invention de l’ophtalmoscope, dont les premiers exemplaires n’apparurent qu’à la deuxième moitié du xixe siècle [1, 2]. Et encore, ce fut seulement 100 ans plus tard, à la fin de la Deuxième Guerre mondiale, à partir de 1945, que grâce aux progrès de la biomicroscopie du FO, débuta réellement l’analyse méthodique du FO. Cependant, l’évaluation précise de celui-ci et son dépistage à un stade initial sont restés ardus jusqu’à l’apparition, depuis à peine 20 ans, de méthodes d’imagerie complètement nouvelles. L’« histoire d’eau » de la macula a été rythmée par les avancées technologiques qui ont permis de prouver l’existence de l’œdème maculaire, de le quantifier, de suivre avec précision les résultats du traitement, etc. Dans ce théâtre où s’agitent les multiples acteurs qui font la vie et, malheureusement aussi, la souffrance maculaire, la technologie est effectivement devenue reine, mais le décideur opérationnel reste, encore et toujours, le médecin.
« Il (elle) a les chevilles qui gonflent ! »
Historiquement, le « gonflement œdémateux systémique » a été reconnu très tôt par nos ancêtres médecins (Hippocrate, Avicenne, etc.), lorsque l’œdème frappe des zones décollables, telles la région périorbitaire, ou les membres inférieurs. C’est au niveau des jambes, dans la région prétibiale, qu’a été décrit le signe du godet : persistance en creux de l’empreinte de la pression du doigt du clinicien qui, localement, a repoussé l’œdème, par déplétion mécanique d’une zone de l’espace extracellulaire. L’œdème peut se généraliser et entraîner un épanchement pleural ou péritonéal, voire péricardique, quand les tissus œdémateux, saturés d’eau, ne peuvent plus éponger le trop-plein de liquide et que se forment des cavités qui sont autant de « réservoirs » néoformés dans des espaces latents préexistants. Au maximum se constitue une anasarque, où le liquide occupe tous les espaces possibles de l’organisme. Dans la rétine, il se forme des logettes « cystoïdes », ainsi dénommées parce que ce sont de faux kystes, sans paroi propre. Très caractéristiques de l’œdème maculaire, ceux-ci sont l’équivalent rétinien des « réservoirs » qui peuvent se former au cours d’un œdème systémique. L’excès d’« eau » entre les cellules a été très vite reconnu comme le responsable du gonflement d’un organe ou d’un tissu. Le passage de l’eau du secteur plasmatique vers le secteur interstitiel dépend schématiquement de trois facteurs :
pression hydrostatique transcapillaire, augmentée en cas d’obstacle veineux ;
pression osmotique liée aux protéines (pression oncotique) qui tend à retenir l’eau dans le secteur plasmatique ;
perméabilité capillaire aux protéines sous l’influence de substances vasoactives.
Ces manifestations sont en effet le témoin de l’inflation de l’espace « interstitiel » ou « secteur extracellulaire ». C’est le classique « œdème tissulaire », qu’on retrouve dans la région maculaire, mais avec la particularité morphologique imprimée par sa structure propre et par la pression intraoculaire. Quant à l’inflation intracellulaire par déséquilibre ionique, « œdème cellulaire », elle est exceptionnellement caractérisée en clinique ophtalmologique et ce type d’œdème ne sera pas envisagé dans notre promenade historique. Nous ne retiendrons pas non plus, dans ce cadre, l’« œdème » rétinien intracellulaire ischémique aigu par occlusion de l’artère centrale de la rétine ou d’une de ses branches, entraînant un arrêt axoplasmique dans le territoire correspondant, ni les décollements séreux, notamment sous-rétiniens, qui représentent une autre entité, quoique volontiers associée. Au passage, remarquons que l’œdème « tissulaire » a conduit à envisager les membranes séparant les différents compartiments : cellules, tissus, organes. C’est au niveau des membranes que se situent les barrières où peut s’activer un transport actif, assuré par un épithélium à son contact, volontiers gros consommateur d’énergie.
L’histoire de la pathologie rétinienne n’a donc commencé qu’au milieu du xixe siècle, avec l’accès au fond d’œil (FO) grâce à l’ophtalmoscopie. Le premier à avoir vu un FO in vivo et à décrire un appareillage permettant cet examen fut probablement le physiologiste tchèque Jan Evangelista Purkinje, en 1823 (fig. 1-1). Mais la monographie qu’il publia à ce sujet était en latin, confinée à l’auditoire de l’Université de Breslau, en Prusse (ville redevenue polonaise en 1945, sous sa dénomination antérieure de Wroclaw), et ne fut jamais diffusée dans les autres universités européennes. Purkinje fut plus heureux avec le phénomène qu’il décrivit en 1825 et auquel fut donné son nom !
L’inventeur britannique Charles Babbage dessina, lui aussi, un ophtalmoscope vers 1847, et en proposa le prototype à un éminent ophtalmologiste, Thomas Wharton Jones. Ce dernier était myope et ne vit rien de net dans l’instrument : le projet fut abandonné… Finalement, c’est à Hermann von Helmholtz (fig. 1-2) que fut reconnue la paternité de l’ophtalmoscope, non seulement parce qu’il en construisit un modèle qui fonctionnait, mais aussi parce qu’il fit la démonstration de son « miroir oculaire » (Augenspiegel), en 1850, à la société de physique de Berlin et le publia en 1851 [3]. Le dispositif permettait une ophtalmoscopie directe. Très vite, l’appareil bénéficia d’un véritable engouement (fig. 1-3). Tout le monde voulut cet instrument : Albrecht Von Graefe à Berlin, William Bowman à Londres, Louis-Auguste Desmarres à Paris (fig. 1-4) [4]. Rekoss, micromécanicien de Königsberg, eut l’excellente idée d’ajouter un disque tournant comportant une gamme de lentilles correctrices parmi lesquelles on trouvait celle qui permettait de s’adapter à l’amétropie de l’œil examiné (ainsi qu’éventuellement à celle de l’examinateur !). Les premiers signes d’œdème du pôle postérieur de l’œil furent dès lors décrits et reproduits ou, plus exactement, les manifestations qui peuvent l’accompagner, tels les exsudats.
L’amélioration de l’ophtalmoscope prit du temps et se fit soit selon le principe de l’ophtalmoscopie directe, représentée, comme on vient de le voir, par des systèmes sur le modèle Helmholtz, soit selon le principe de l’ophtalmoscopie indirecte, dont le premier exemple d’appareil fut celui de Ruete, très rapidement apparu après celui de Helmholtz, puisque décrit en 1852, à peine un an plus tard. Mais il était d’un montage compliqué et il ne connut pas de réelle diffusion. Du reste, il fut immédiatement modifié et amélioré par Helmholtz qui proposa de l’utiliser en tenant tout simplement un miroir dans une main et une loupe dans l’autre, système aujourd’hui encore utilisé, en se servant habituellement d’une palette de Morax. Bien entendu, la bougie est, depuis longtemps remplacée par une source lumineuse électrique (Dennet, 1885). Eduard Von Jaeger créa à son tour un ophtalmoscope à partir des appareils d’Helmholtz et de Ruete, et dessina un des tout premiers atlas d’images du FO normal et pathologique (fig. 1-5). Il était passionné de dessins, demandant parfois à ses patients de revenir 20 fois, leur faisant subir des séances d’observation pouvant durer jusqu’à 3 heures [5] !
Giraud-Teulon fut, lui aussi, un génial précurseur. Son ophtalmoscope (1861) était le premier à permettre une vision binoculaire, stéréoscopique, de grande clarté, d’un champ étendu de la rétine (fig. 1-6). Cet ophtalmoscope est l’ancêtre de l’appareil de Schepens et il aurait été d’un apport clinique majeur pour l’examen de la périphérie du FO et du décollement de la rétine si sa diffusion n’avait été limitée par des réglages difficiles, notamment de l’écart interpupillaire, par l’image renversée mal maîtrisée au début en binoculaire, et surtout par l’absence, à cette époque, de toute forme de chirurgie de la rétine, laquelle reste la principale indication de cette méthode d’examen du FO. En outre, si l’ophtalmoscope binoculaire permettait de disposer d’une vue panoramique du pôle postérieur de l’œil, il ne donnait pas une image suffisamment agrandie de la macula.
Il reste cependant très instructif de rappeler les étapes qui ont marqué le développement de l’ophtalmoscope de « Schepens », car la réflexion technologique a été présente tout au long du processus de recherche et de réalisation de ce remarquable ophtalmoscope. Or, Charles Schepens (1912–2006) avait fait des études de mathématiques avant celles de médecine, ces dernières imposées par la tradition familiale (et sociale !) de l’époque, où les garçons devenaient « docteurs » et les filles infirmières. Sa double compétence, à la fois médicale et scientifique, mathématique, a fait qu’il avait, dès la fin de ses études de médecine, déjà saisi les potentialités d’un développement moderne de l’ophtalmoscope de Giraud-Teulon. Mais c’était juste avant 1940 et l’occupation brutale de son pays, la Belgique, par les forces nazies. La guerre interrompit donc ses projets dans l’immédiat, et ce n’est que fin 1943 qu’il put reprendre ses recherches, alors que lui et sa famille étaient réfugiés à Londres. Aidé par une bourse du Moorfields Eye Hospital, Schepens entreprit de développer un prototype d’ophtalmoscope binoculaire indirect, réunissant sur un casque la source lumineuse et le système optique, libérant ainsi une main et permettant, de façon courante, l’observation stéréoscopique du FO. Le prototype de l’ophtalmoscope avait été construit à partir de matériaux, à l’époque d’importance stratégique, exclusivement réservés à l’effort de guerre (verre à qualité optique, cuivre, laiton, aluminium, etc.), si bien que, pour disposer de quoi construire son ophtalmoscope, Schepens prit l’initiative de récupérer les éléments nécessaires parmi les débris éparpillés dans les rues de Londres après les bombardements allemands… Un des premiers exemplaires, ainsi fabriqué de pièces et de morceaux, est exposé à la Smithsonian Institution of Washington (musée américain de l’histoire des progrès technologiques). Dès la fin du conflit, en 1945, Schepens publia les caractéristiques de son ophtalmoscope à la Société belge d’ophtalmologie, ce qui conduisit l’Académie américaine d’ophtalmologie à l’inviter en 1946 à Chicago pour donner une conférence sur son appareil. L’année suivante, en 1947, Schepens fit le choix de s’installer avec sa famille aux États-Unis, à Boston. Il y fonda un département qui devint le premier centre privé dévolu aux maladies de l’œil, et où diverses améliorations du « casque de Schepens » furent développées. Mais, plus que les maladies maculaires, c’était le décollement de la rétine qui intéressait essentiellement les ophtalmologistes de la Retina Foundation de Boston.
Le développement d’une ophtalmoscopie biomicroscopique directe binoculaire, permettant un examen stéréoscopique et de bonne taille du pôle postérieur, fut principalement l’œuvre d’un autre génie, Hans Goldmann. Établi en Suisse, il fut le concepteur, en collaboration avec l’entreprise Haag-Streit, de la première lampe à fente (LAF) moderne, la Haag-Streit-Slitlamp 320®, en 1933. La LAF Haag-Streit Slitlamp 900®, devenue le « gold standard », apparut plus tard, en 1958. Mais, dès 1938, Goldmann avait théorisé et conçu les verres de contact pour l’examen du pôle postérieur du FO (verre central) et celui à trois miroirs (communément appelé verre de Goldmann) pour la périphérie de la rétine et la gonioscopie. Grâce à ces verres, il fut désormais facile de réaliser de façon routinière la biomicroscopie directe binoculaire dans de bonnes conditions. Là aussi, cependant, il fallut attendre la fin de la guerre pour qu’à partir de 1945 le verre de Goldmann connaisse une réelle diffusion et que la mise en évidence de l’œdème maculaire, vu en stéréoscopie, devienne indiscutable. L’amélioration de la biomicroscopie du fond d’œil se poursuivit par l’apparition sur le marché de plusieurs autres fabricants de LAF performantes, rapidement munies de systèmes enregistreurs photographiques, puis vidéo. Parallèlement, de nouvelles lentilles d’examen, et notamment des lentilles non contact, type lentilles de Volk en ophtalmoscopie indirecte, se sont considérablement développées ces dernières années et sont devenues la principale méthode non invasive d’examen en routine du FO, sur le patient assis devant la LAF.
Ces méthodes ophtalmoscopiques modernes ont été à la source de progrès majeurs dans la compréhension et la classification des œdèmes maculaires (forme diffuse ou focale). Il fut clairement établi que la prédisposition de la macula à se gonfler de liquide est le fait de plusieurs facteurs :
forte activité métabolique, dont la souffrance est rapide, se traduisant immédiatement par un déséquilibre des échanges ;
trajet latéral des fibres de Henlé, dont la dilacération est facilitée par l’épaisseur de la couche plexiforme externe, périfovéolaire, où les fibres sont faiblement liées entre elles ;
espace extracellulaire de dimensions limitées, isolé entre deux barrières hématorétiniennes (BHR), interne faite des capillaires rétiniens, externe faite de l’épithélium pigmentaire.
Comme pour la cornée ou le cristallin, l’espace extracellulaire rétinien est relativement déshydraté par rapport à l’espace extracellulaire du reste de l’organisme : c’est une condition nécessaire à la transparence d’un tissu. Cet espace « restreint » tolère mal une inflation hydrique, et cette particularité structurelle, « pauvre » en eau, contribue à la constitution de logettes cystoïdes, seule façon pour la rétine d’accumuler l’« eau » en surplus. Avec les moyens biomicroscopiques modernes, l’œdème maculaire est facilement visible (fig. 1-7). Sa structure « cystoïde » était connue et décrite depuis longtemps : E. Fuchs (1901), W.P.C. Zeeman (1911), A. Vogt (1918), P. Bailliart (1934), A. Bangerter (1945). La structure anatomopathologique de l’œdème cystoïde maculaire fut rapidement décrite et précisée. Mais en 1952, le traité d’Ophtalmologie clinique de Paul Bonnet qui faisait alors référence évoquait à peine l’œdème maculaire. Cependant, le remarquable rapport de la Société française d’ophtalmologie (SFO) de l’année 1957 : Biomicroscopie du corps vitré et du fond de l’œil, par A. Busacca, H. Goldmann et S. Schiff-Wertheimer [6], commence à évoquer les différentes formes de l’œdème de la macula telles qu’elles étaient alors connues. S. Schiff-Wertheimer rappelle les aspects notamment évolutifs de cet « œdème kystique » [6, p. 324-325], tandis que, dans les planches couleurs du même ouvrage (fig. 1-8), Busacca montre un œdème cystoïde dans une occlusion d’une branche veineuse rétinienne (OBVR). Dans l’étude Early treatment diabetic retinopathy study (ETDRS) qui a débuté en 1985, l’œdème est retenu comme présent lorsqu’il est « cliniquement significatif » (épaississement de la rétine au sein des 500 µm centraux ; présence d’exsudats lipidiques ; épaississement rétinien central de la taille d’un disque papillaire). La collecte des données du FO a été souvent réalisée aux États-Unis par les images fournies par la rétinographie, en paires stéréoscopiques, mais nous verrons l’apport décisif des méthodes d’imagerie les plus récentes.

Fig. 1-1 Jan Evangelista Purkinje.

Fig. 1-2 Hermann von Helmholtz.

Fig. 1-3 Ophtalmoscope type Helmholtz, ayant appartenu à Von Graefe.
(Source : William Holland Wilmer Ophthalmology Collection/National Museum of Health & Medicine, Washington, DC. © NMHM. Reproduction autorisée.)

Fig. 1-4 Une des toutes premières description de l’« œdème rétinien » par Louis Auguste Desmarres dans son traité Maladie des yeux (1858, p. 466) [4].
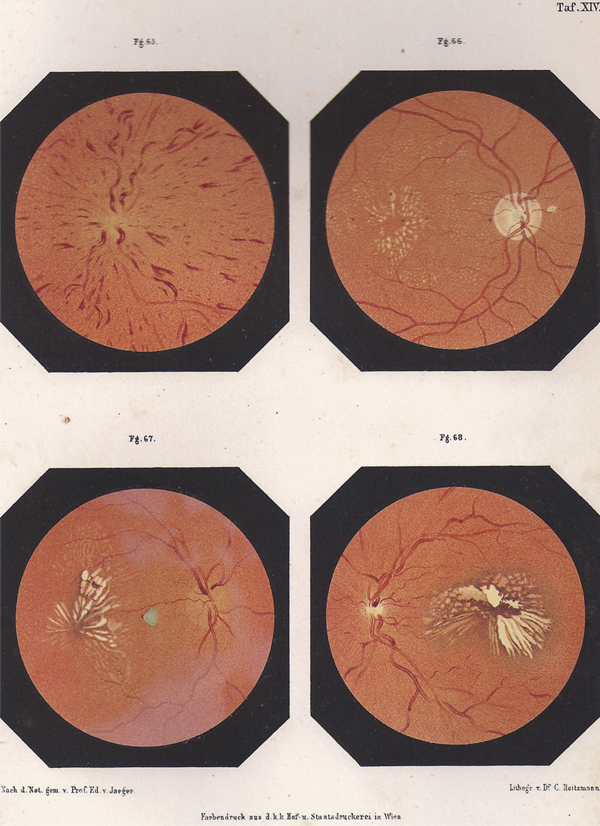
Fig. 1-5 Planche de dessins d’Eduard Von Jaeger, tiré de son atlas Ophthalmoskopischer. Hand Atlas (1869), figurant une occlusion de la veine centrale de la rétine et différents aspects d’œdème.

Fig. 1-6 Appareil de Giraud-Teulon.
(Source : Soubrane G. Les DMLAs. Rapport de la Société Française d’Ophtalmologie. Paris : Elsevier Masson ; 2007. Reproduction autorisée.)
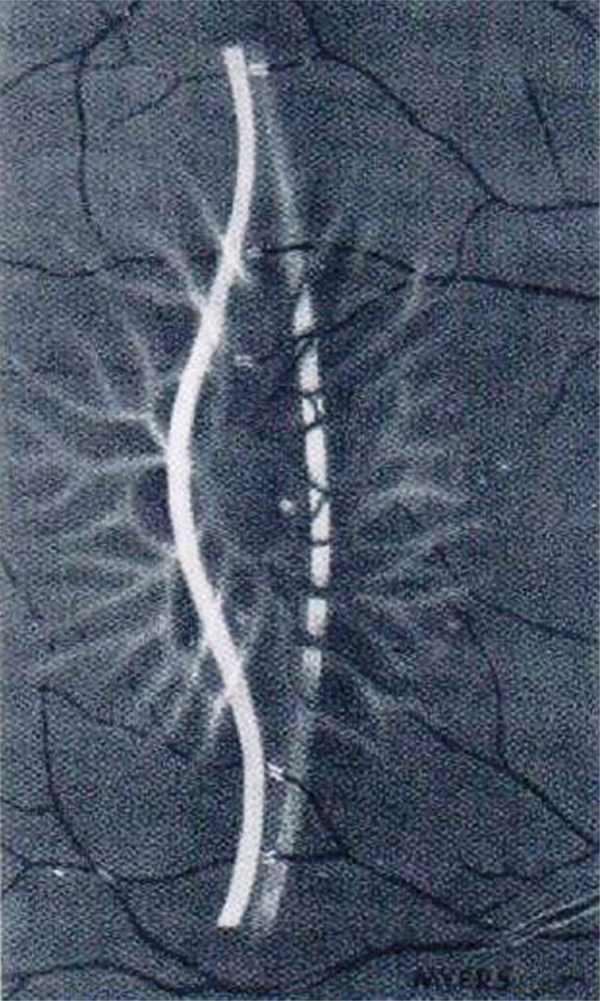
Fig. 1-7 Œdème biomicr¢oscopique.
(Source : Rapport annuel du Bulletin des Sociétés d’Ophtalmologie de France, 1972. Reproduction autorisée.)
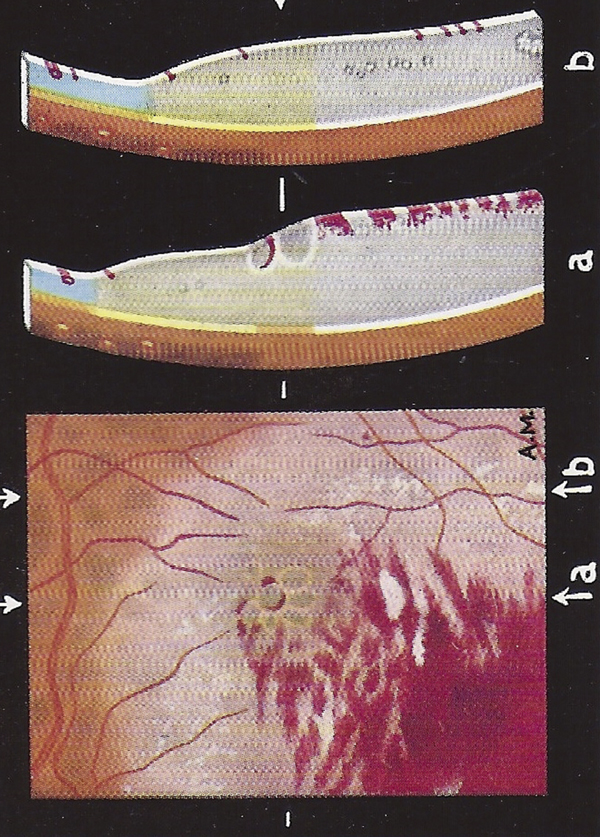
Fig. 1-8 Dessin d’un œdème maculaire compliquant une thrombose d’une branche de la veine temporale inférieure.
(Source : Busacca A et al. [6], planche XXIIII, fig. 5. Reproduction autorisée.)
La naissance de l’angiographie, il y a un peu plus d’un demi-siècle, a marqué le début de l’ère de l’imagerie de la rétine, et spécialement de la macula. Les circonstances de la géniale découverte de l’angiographie sont véritablement romanesques [7, 8] et sont un modèle de « sérendipité » (terme désignant une découverte accidentelle, à la suite d’un concours de circonstances fortuit, souvent dans le cadre d’une recherche concernant un tout autre sujet).
La fluorescéine, découverte et synthétisée en 1871, fut employée au xxe siècle, dans leurs travaux de recherche, par divers grands noms de l’ophtalmologie (notamment Paul Ehrlich et Erich Seidel en Allemagne, Albert Franceschetti et Hans Goldmann en Suisse, Edward Maumenee aux États-Unis). Mais l’idée n’était pas encore venue d’étudier, grâce à la fluorescéine, les vaisseaux du FO et encore moins les altérations pathologiques du tissu rétinien. Chose surprenante, ce sont deux étudiants en médecine, Harold Novotny et David Alvis, travaillant dans un laboratoire de pneumologie d’Indianapolis (États-Unis), qui inventèrent l’angiographie fluorescéinique de la rétine ! Leur mission de recherche « pneumologique » était d’étudier, sur les vaisseaux du FO, les effets du niveau de saturation du sang en oxygène. Ils bricolèrent une caméra Zeiss, lui ajoutèrent des filtres adaptés à la longueur d’onde d’excitation et à celle de l’émission en fluorescence, installèrent un flash rustique et réalisèrent (novembre 1959) la première angiographie de la rétine. Leur découverte, publiée non sans peine dans la revue Circulation, certes prestigieuse, mais pour un lectorat non ophtalmologique, se répandit d’abord lentement [9]. Elle retrouva cependant un nouvel élan à Miami (États-Unis) où un technicien photographe de haut niveau, le dénommé Johnny Justice, qui devint fameux dans le milieu angiographique de la rétine, contribua au développement de la technologie. Parallèlement, un grand découvreur de talents et d’idées nouvelles, Edward Norton, chef de service du Bascom Palmer Eye Institute (BPEI) et directeur du département d’ophtalmologie à l’Université de Miami pendant 33 ans, de 1958 à 1991, s’intéressa à son tour à la fluorescéine. Peu de temps après, Johnny Justice, avec cette fois la position de chef-photographe, rejoignit à son tour ce centre à la renommée mondiale. Les progrès incessants de la technologie achevèrent de convaincre Ed Norton et son jeune assistant, un certain Donald Gass (fig. 1-9), du considérable potentiel de l’angiographie.
À partir de 1965, le groupe de Miami publia des articles princeps qui démontrèrent définitivement l’intérêt de l’angiographie à la fluorescéine, spécialement dans l’œdème maculaire où il constitue notamment le syndrome d’Irvine-Gass [10], décrit après intervention compliquée de la cataracte. En même temps, apparurent les premiers lasers à usage ophtalmologique et leur utilisation devint courante dès les années 1970. L’angiographie mettant en évidence les altérations vasculaires (essentiellement dans le cadre de la rétinopathie diabétique), le laser permettant de les traiter, les deux méthodologies se stimulèrent l’une l’autre dans une amélioration technique permanente avec une diffusion dans le monde entier.
En 1970 parut aux États-Unis le Stereoscopic atlas of macular diseases, chef-d’œuvre de J.D.M. Gass, devenu la bible dans le domaine des maladies de la macula, et plusieurs fois réédité. En France, parut en 1972 le rapport du Bulletin des Sociétés d’Ophtalmologie de France (BSOF) sur Les maculopathies œdémateuses, ouvrage magistral (suivi de nombreux autres) (fig. 1-10) de G. Coscas et al. (fig. 1-11). Avec l’apport de l’angiographie en fluorescence, la physiopathologie était beaucoup mieux expliquée : rôle des capillaires maculaires dont la paroi laissait diffuser le contenu des vaisseaux, mais aussi rôle de la nature des protéines du liquide occupant les logettes, ajoutant à la diffusion (leakage) l’effet d’accumulation par l’avidité des protéines anormalement présentes dans les logettes, vis-à-vis du colorant (pooling). L’œdème maculaire cystoïde (OMC) y était décrit, les différentes étiologies précisées (syndrome d’Irvine-Gass de l’opéré de la cataracte ; OMC des uvéites ; OMC des rétinopathies pigmentaires ; rétinopathie diabétique ; occlusions veineuses rétiniennes, rétinopathie des radiations, etc.). Dans le rapport 1976 de la SFO (de M. Bonnet et P. François), La macula, Mireille Bonnet a précisé à nouveau la sémiologie de ce tableau.
L’immense intérêt de l’angiographie en fluorescence a été de permettre l’analyse de la dynamique circulatoire des vaisseaux du FO, de la perméabilité des barrières hémato-oculaires (paroi des vaisseaux rétiniens, épithélium pigmentaire). La compréhension de ces barrières a été une étape essentielle dans l’interprétation de l’angiographie et pour la détermination du choix thérapeutique. À partir de ces années 1970, de nombreux travaux sont parus sur l’œdème maculaire. Les œdèmes focaux où la source rétinienne de la « fuite » est une anomalie microvasculaire (typiquement au cours d’une rétinopathie diabétique) sont l’objet d’un consensus pour le traitement laser. En revanche, l’accord est moins unanime pour les traitements en grille des œdèmes diffus, même avec les grilles hypodosées des nouveaux lasers MicroPulse™. Néanmoins, dans le diabète toujours, les conclusions de l’étude ETDRS restaient en faveur de la photocoagulation au laser.
Parallèlement aux raffinements du traitement au laser, le traitement médical s’est lui aussi considérablement modifié avec la délivrance des molécules pharmaceutiques directement au contact de la cible par les injections intravitréennes. Celles-ci ont une assez longue histoire d’utilisation et ont été d’abord employées dans les cas d’endophtalmie, notamment postopératoires, afin d’apporter une dose massive d’antibiotiques à l’intérieur de l’œil infecté. L’usage des injections intravitréennes a ensuite été relancé pour le ganciclovir, au début des années 1990, dans le traitement des rétinites à cytomégalovirus du sida. De la même façon, le premier implant intravitréen à action prolongée a été approuvé en 1996 par la Food and Drug Administration (FDA) pour le ganciclovir. Ces injections intravitréennes, réalisées dans le cadre dramatique des endophtalmies ou du sida, ont ouvert la voie à d’autres molécules pour d’autres pathologies, selon ce même mode d’administration, désormais devenu routinier, et notamment pour les œdèmes maculaires persistants et menaçant la vision. Ainsi, on a injecté de l’acétonide de triamcinolone (accord de la FDA en 2005 pour l’implant de corticoïdes Rétisert® dans les uvéites, en 2009 dans les œdèmes maculaires consécutifs à une occlusion de branche veineuse de la rétine), puis a été approuvée l’utilisation d’autres implants corticoïdes, contenant de nouvelles molécules (Ozurdex®, Illuvien®, etc.), et aussi des anti-VEGF (vascular endothelial cell growth factor), dans la foulée des extensions de leurs indications en dehors de la dégénérescence maculaire liée à l’âge (DMLA).
Parallèlement à ces avancées thérapeutiques, l’angiographie s’est enrichie par l’arrivée de nouvelles méthodes :
vert d’indocyanine, utilisable en clinique courante à partir des années 1990, grâce aux capteurs numériques et à l’amélioration des filtres, qui ont permis de contourner la difficulté liée au faible rendement lumineux de ce colorant ;
développement des rétinographes à balayage laser confocal ;
autofluorescence, particulièrement intéressante dans l’analyse de l’évolution de la DMLA atrophique ainsi que dans les dystrophies de la rétine.
Mais ces progrès ont été moins contributifs dans l’analyse de l’œdème maculaire. Pour celui-ci, comme pour bien d’autres pathologies, l’arrivée de l’OCT (optical coherence tomography) a marqué la deuxième révolution en imagerie de la rétine – chronologiquement, après celle de l’angiographie. C’est dans les années 1990 que cette nouvelle méthode d’exploration a été conçue, puis mise à la disposition des cliniciens.
James G Fujimoto, professeur au Department of Electrical Engineering and Computer Science au Massachusetts Institute of Technology (MIT), fut un de ceux qui réalisèrent les premiers appareils d’OCT. David Huang, Eric A. Swanson, Carmen Puliafito et al. ont été, en 1991, à l’origine du premier article [11], publié dans la prestigieuse revue Science, montrant la coupe optique d’une rétine en OCT. Fin 1996, a été commercialisé le premier appareil d’OCT, disponible sur le marché. Depuis, les améliorations et les progrès ne cessent de se pousser l’un derrière l’autre. Outre la définition obtenue par les OCT Spectral Domain™ récents, devenue proche de la perfection, l’appareil peut fournir, en temps réel, l’épaisseur de la rétine, les modifications de la structure, les logettes cystoïdes, la survie des photorécepteurs par la ligne des photorécepteurs, l’image MultiColor™, l’autofluorescence, etc. D’autres développements sont proposés : OCT en face, OCT-angiographie, à elle seule nouvelle révolution puisque permettant, pour quelques secondes d’examen en plus, une angiographie très précise, et sans injection de colorant ! L’essor de l’OCT date d’à peine plus de 20 ans, mais il a déjà révolutionné le diagnostic, le pronostic et la décision thérapeutique.
Illustrant l’accélération de l’histoire, on peut, avec Carmen Puliafito [12], distinguer quatre périodes dans la courte et déjà riche vie de l’OCT :
1992 à 1995, fabrication du prototype et mise en évidence de ses possibilités ;
1995 à 2000, premiers appareils commerciaux, mais de qualité insuffisante ;
2000 à 2005, les appareils proposés parviennent à un bon niveau de qualité, tandis que se banalisent les traitements par injections intravitréennes de corticoïdes et d’anti-VEGF ;
à partir de 2005, les OCT Spectral Domain™ ont apporté vitesse d’acquisition, précision des images et possibilités supplémentaires (OCT en face, OCT-angiographie) qui ouvrent de nouveaux horizons encore dans la compréhension des œdèmes maculaires.
Les implants-réservoirs, les développements de l’OCT, bientôt peut-être les nanoparticules sont probablement en train d’écrire l’histoire actuelle de l’œdème maculaire. On ne connaît cet œdème si particulier que depuis 50 ans environ. Nous avons appris beaucoup de choses, mais il nous en reste encore beaucoup à apprendre !

Fig. 1-9 J.D.M. Gass.
(Source : Soubrane G. Les DMLAs. Rapport de la Société Française d’Ophtalmologie. Paris : Elsevier Masson ; 2007. Reproduction autorisée.)

Fig. 1-10 Couverture du Rapport annuel du Bulletin des Sociétés d’Ophtalmologie de France, 1972.
(Reproduction autorisée.)

Fig. 1-11 Gabriel Coscas.
(Reproduction autorisée.)
[1] Soubrane G, Coscas G. In : Soubrane G. Les DMLAs. Rapport de la Société Française d’Ophtalmologie (SFO). Paris : Elsevier Masson ; 2007. p. 7-9.
[2] Franceschetti A. Notions historiques. In : Pournaras C. Pathologies vasculaires oculaires. Rapport de la Société Française d’Ophtalmologie (SFO). Paris : Elsevier Masson ; 2008. p. 1-5.
[3] Helmhotz H. Beschreibung eines Augen-Spiegels zur Untersuchung der Netzhaut in lebenden Augen. Berlin ; Forstner ; 1851. p. 1.
[4] Desmarres LA. Maladies des yeux. Vol. 3. Paris : Germer Baillière ; 1858.
[5] Keeler R, Singh AD, Dua HS. A master mastering the ophthalmoscope : Eduard von Jaeger. Br J Ophthalmol 2013 ; 97 : 387-8.
[6] Busacca A, Goldmann H, Schiff-Wertheimer S. Biomicroscopie du corps vitré et du fond d’œil. Rapport de la Société Française d’Ophtalmologie (SFO). Paris : Masson ; 1957.
[7] Marmor MF, Ravin JG. Fluorescein angiography, insight and serendipity a half century ago. Arch Ophthalmol 2011 ; 129(7) : 943-8.
[8] Bernard JA. Les 50 ans de l’angiographie. Info-SFO. Le Petit Journal de la SFO. 118e congrès SFO ; 2012.
[9] Novotny HR, Alvis DL. A method of photographing fluorescence in circulating blood in the human retina. Circulation 1961 ; 24 : 82-6.
[10] Gass JDM, Norton WD. Cystoid macular edema and papilledema following cataract extraction : a fluorescein fundoscopic and angiographic study. Arch Ophthalmol 1966 ; 76 : 646-61.
[11] Huang D, Swanson EA, Lin CP, et al. Optical coherence tomography. Science 1991 ; 254 : 1178-81.
[12] CA Puliafito. OCT Angiography : the next era of OCT technology emerges. Ophthalmic Surg Lasers Imaging Retina 2014 ; 45 : 360.