Œdème maculaire diabétique
Coordonné par P. Massin
C. Delcourt, M.-N. Delyfer
➤ L’intensification de la prise en charge des facteurs de risque systémiques a permis de réduire significativement la prévalence et l’incidence de l’œdème maculaire diabétique dans les pays industrialisés. Dans ces pays, la prévalence de l’œdème maculaire cliniquement significatif est de l’ordre de 3 %.
➤ La prévalence de l’œdème maculaire diabétique est plus élevée dans les populations d’origine africaine, vivant dans les pays industrialisés, et latino-américaine.
➤ Les principaux facteurs de risque de l’œdème maculaire diabétique sont la durée du diabète, le mauvais contrôle du diabète et de la tension artérielle.
La rétinopathie diabétique est l’une des principales causes de cécité dans le monde, tout particulièrement chez les adultes en âge de travailler. Les deux principales formes de rétinopathie diabétique menaçant la vision sont l’œdème maculaire diabétique (OMD) et la rétinopathie diabétique sévère (incluant la rétinopathie proliférante). L’OMD représente à lui seul la première cause de cécité chez les sujets de moins de 50 ans [1]. Malgré l’augmentation constante de la prévalence du diabète au niveau mondial, les connaissances épidémiologiques concernant la fréquence et les facteurs de risque de l’OMD restent limitées, même si le nombre d’études épidémiologiques dans ce domaine a nettement augmenté depuis une quinzaine d’années.
Les premières études épidémiologiques ont principalement été conduites dans des populations d’origine européenne, au sein des pays industrialisés (États-Unis, Europe, Australie). Nous présentons dans le tableau 8-1 les principales études menées depuis le début des années 1990. Il existe quelques études antérieures, mais la méthodologie pour la classification de l’OMD, ainsi que pour la prise en charge du diabète, les rend peu comparables aux études ultérieures et nous ne les avons pas incluses dans ce tableau. Nous nous sommes ainsi concentrés sur les études portant sur des échantillons représentatifs des diabétiques (issus de la population générale ou d’échantillons représentatifs de médecins traitant le diabète) ayant utilisé un diagnostic photographique de l’OMD, ce qui constitue la méthode de référence pour la classification de l’OMD. La plupart des études existantes ont utilisé la classification de l’Early Treatment for Diabetic Retinopathy Study (ETDRS) ou des méthodes qui en sont dérivées. Certaines études distinguent l’œdème maculaire (OM ; généralement défini sur les clichés en couleurs par la présence d’exsudats ou de traces de photocoagulation focale) de l’œdème maculaire cliniquement significatif (OMCS ; si l’œdème maculaire est présent dans les 500 μ centraux). On peut noter que la plupart des études concernent moins de 500 sujets, seule une étude porte sur plus de 1 000 sujets.
Chez les diabétiques d’origine européenne, la prévalence de l’OMCS était d’environ 5 % dans les années 1990, ce qui était inférieur aux prévalences rapportées dans les années 1980 (environ 10 % dans la Wisconsin Epidemiologic Study of Diabetic Retinopathy [14]). Elle a clairement baissé depuis l’an 2000, se situant autour de 3 % (entre 1,0 et 3,9 % selon les études). Cette baisse de la prévalence de l’OMD depuis l’an 2000 a été confirmée dans une analyse groupant 35 études portant sur plus de 22 000 participants [15]. Les taux de prévalence apparaissent assez homogènes dans les différents pays industrialisés, qu’il s’agisse des États-Unis, des pays européens ou de l’Australie. Cette baisse de la prévalence de l’OMD dans les pays industrialisés est très probablement à mettre en rapport avec une meilleure prise en charge du diabète, notamment suite à la publication, dans les années 1990, d’études d’intervention ayant montré le bénéfice de l’intensification du contrôle glycémique, tensionnel et lipidique. De nouveaux appareils et médicaments, ainsi que des programmes de dépistage et d’éducation thérapeutique ont ainsi permis une nette amélioration de ces paramètres dans la population diabétique, se traduisant notamment par une réduction de la prévalence de l’OMD et de la rétinopathie diabétique.
La situation apparaît beaucoup plus préoccupante dans les autres groupes ethniques, qu’il s’agisse de minorités ethniques de pays développés ou d’autres continents (tableau 8-2). La grande majorité des études dans ces groupes ethniques ont été conduites après 2000, motivées par la forte augmentation de la prévalence du diabète dans ces populations. Ainsi, aux États-Unis, les diabétiques d’origine africaine présentent des prévalences de l’OMD nettement plus élevées (8 à 11 %) que les diabétiques d’origine européenne (2 à 3 %) [11, 12]. Une prévalence élevée de l’OMD a également été rapportée chez les Antillais de la Barbade [16]. En revanche, il n’existe aucune donnée fiable concernant la prévalence de l’OMD en Afrique. Les diabétiques d’origine latino-américaine semblent également présenter de fortes prévalences d’OMD, qu’ils vivent aux États-Unis (5 à 10 %) [11, 12, 17, 18], ou au Mexique où une prévalence de 19,9 % a été rapportée [25]. La prévalence de l’OMD apparaît également élevée dans une étude chez les aborigènes australiens [23]. Dans les populations asiatiques, la prévalence de l’OMD est de l’ordre de 3 à 5 % dans la majorité des études, qu’il s’agisse de populations vivant dans leur pays d’origine (Chine, Inde, Singapour) [19–21, 26] ou aux États-Unis [11]. La prévalence apparaît plus faible dans une étude réalisée en Corée du Sud (1,6 % pour l’OMCS), rejoignant celle des diabétiques d’origine européenne [24].
Les quelques études ayant estimé l’incidence de l’OMD montrent des résultats similaires : incidence plus faible après l’an 2000 et plus élevée chez les Latino-Américains que chez les diabétiques d’origine européenne (tableau 8-3).
Ces différences de prévalences de l’OMD entre groupes ethniques ont probablement des origines multiples [34]. Ainsi, la prise en charge du diabète est très probablement de moins bonne qualité dans les pays à revenus faible et moyen que dans les pays à haut revenu. Dans ces derniers, les minorités ethniques représentent en général des groupes de population défavorisés, ayant un moins bon accès aux soins. Mais ces différences semblent persister après ajustement sur la qualité de la prise en charge (notamment contrôle glycémique et tensionnel), suggérant que d’autres facteurs pourraient intervenir [34]. Ainsi, des différences génétiques et épigénétiques pourraient également expliquer une plus grande susceptibilité de certains diabétiques à développer une rétinopathie et notamment un OM.
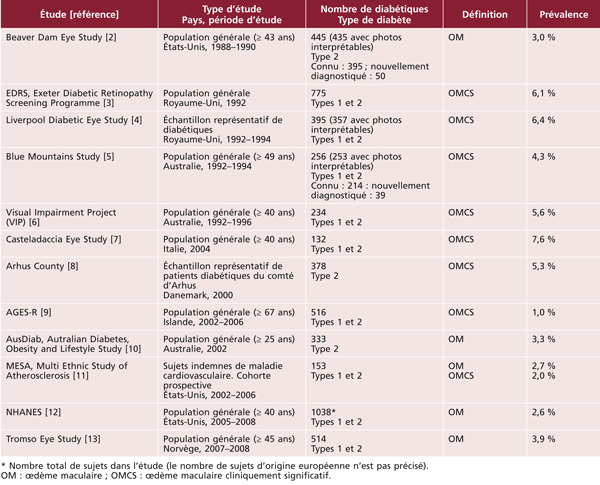
Tableau 8-1 Prévalence de l’œdème maculaire diabétique chez les personnes d’origine européenne (études en population, diagnostic photographique).
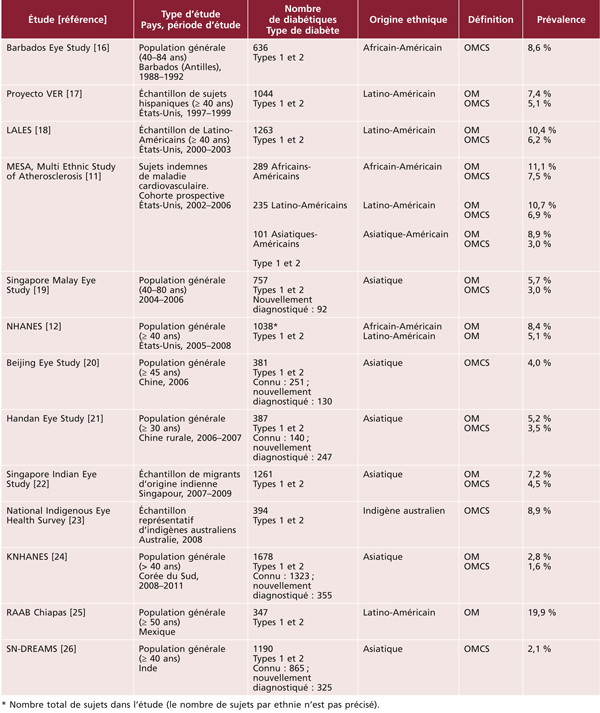
Tableau 8-2 Prévalence de l’œdème maculaire diabétique chez les personnes d’autres origines (études en population, diagnostic photographique).
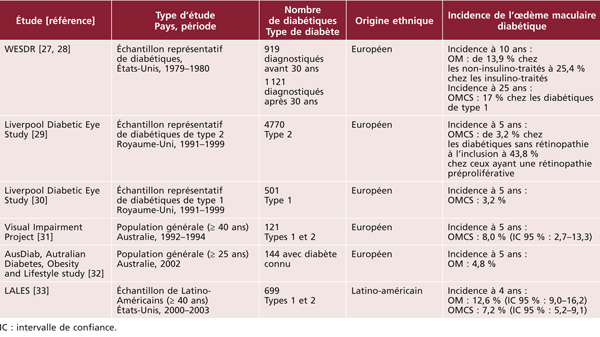
Tableau 8-3 Incidence de l’œdème maculaire diabétique.
Les facteurs de risque majeurs de l’OMD sont le type et la durée d’évolution du diabète, la qualité du contrôle glycémique et l’hypertension artérielle et la sévérité de la rétinopathie diabétique (tableau 8-4). Ainsi, la prévalence et l’incidence de l’OMD sont plus élevées chez les diabétiques de type 1 et chez les diabétiques insulino-traités [15, 27]. Le risque d’OMD est multiplié par plus de 4 après 20 ans de diabète, ainsi que pour des valeurs d’HbA1c supérieures à 9 % par rapport aux valeurs inférieures ou égales à 7 % [15]. Ce risque est multiplié par 2 chez les diabétiques hypertendus [15]. Le rôle central du contrôle glycémique et tensionnel a été confirmé dès les années 1990 par de grandes études d’intervention comme le Diabetes Control and Complications Trial (DCCT) aux États-Unis et la United Kingdom Prospective Diabetes Study (UKPDS). Ces facteurs étant également prédominants pour la rétinopathie diabétique, il existe un lien fort entre la survenue d’un OM et la sévérité de la rétinopathie [29].
La dyslipidémie (notamment une élévation du cholestérol plasmatique) est également associée à une augmentation du risque d’OMD, dans des proportions plus modestes (multiplication par 1,5 environ) [15]. Un essai randomisé a montré une diminution de 31 % du risque de traitement par laser pour OM chez les patients traités par fénofibrate par rapport à un placebo [35]. Deux études de moins grande envergure ont également montré un effet protecteur des statines qui reste à préciser [36].
Ces facteurs systémiques font l’objet d’une prise en charge intensive (contrôle régulier, adaptation des traitements antidiabétiques, anti-hypertensifs et hypolipémiants) afin de normaliser le mieux possible ces paramètres. Cette prise en charge intensive, aujourd’hui répandue, est très probablement responsable de la baisse de prévalence de l’OMD dans les pays industrialisés ces 20 dernières années.
De nombreux autres facteurs de risque généraux ont été étudiés, tels que la néphropathie, l’anémie, les apnées du sommeil, les glitazones et la grossesse. Ces facteurs de risque restent discutés, car les résultats des études sont parfois discordants [36]. La néphropathie diabétique est une complication microvasculaire bien connue chez les diabétiques. Elle se caractérise par une diminution de la filtration glomérulaire et une micro-albuminurie. L’hypoprotidémie induite est responsable d’une diminution de la pression oncotique qui favorise les œdèmes tissulaires. Plusieurs études ont ainsi montré une association positive entre micro-albuminurie et OMD, indépendamment des facteurs de risque communs à ces complications (notamment durée du diabète, contrôle glycémique, tension artérielle), mais d’autres à l’inverse ne retrouvent pas cette association qui reste donc discutée. Le traitement par hémodialyse a également été avancé comme pouvant influencer l’épaisseur rétinienne en OCT, mais là encore, les résultats sont divergents selon les études [36].
L’anémie a également été évoquée comme pouvant influencer la survenue de l’OMD. Elle est souvent associée à l’hypertension artérielle et à la néphropathie diabétique et, à ce titre, rarement considérée comme un potentiel facteur de risque indépendant d’OMD. Une étude indienne prospective, conduite sur deux années, a cependant démontré une association positive entre anémie et OMD. Ce résultat semble corroboré par l’effet bénéfique de l’érythropoïétine sur l’OMD dans de petites séries de cas [36].
Les apnées du sommeil semblent très fréquemment associées à l’OMD. En effet, quelques études ont rapporté que presque 50 % des patients présentant un OMD font des apnées du sommeil [36]. Elles pourraient aggraver l’OMD en causant une hypoxie, une hypercapnie (augmentation du dioxyde de carbone dans le sang), ainsi qu’une hypertension. Cependant, seule une étude interventionnelle, ayant inclus peu de patients, a montré une amélioration modérée de l’acuité visuelle mais pas de l’OM.
La prescription de glitazones semblerait favoriser l’apparition de l’OMD chez certains patients mais là encore, toutes les études ne convergent pas vers les mêmes résultats [36].
La progression de la rétinopathie diabétique au cours de la grossesse est bien connue ; l’aggravation du risque d’OMD a été moins étudiée mais semble associée à la survenue d’une hypertension gravidique [36].
Enfin, d’autres facteurs de risque généraux ont également été avancés tels que la consommation d’alcool, l’obésité, l’hypothyroïdie, l’inflammation, la dysfonction endothéliale ou, plus récemment, la déficience en vitamine D. Toutefois, les résultats des études concernant ces potentiels facteurs de risque sont partiellement incohérents et aucun d’entre eux n’a un rôle vraiment démontré aujourd’hui dans la pathogénie de l’OMD.
Un facteur de risque d’OMD non systémique reste essentiel à considérer : il s’agit de la survenue ou de l’aggravation d’un OMD dans les suites d’une chirurgie oculaire, notamment de la cataracte [37]. Les patients diabétiques présentent de manière très fréquente un épaississement maculaire significatif dans les suites de chirurgie de la cataracte, pouvant être associé à une perte de vision significative à 1 mois avec récupération incomplète à 3 mois postopératoires. Cette situation semble d’autant plus marquée que la durée d’évolution du diabète est importante (> 10 ans) et qu’il existe une insulino-dépendance.
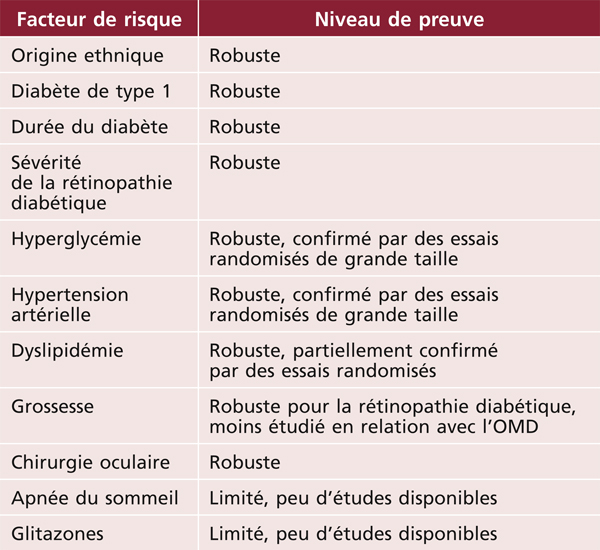
Tableau 8-4 Facteurs de risque de l’œdème maculaire diabétique.
Les progrès effectués dans la prise en charge du diabète au cours des 20 dernières années (notamment traitement intensif de l’hyperglycémie et de l’hypertension) ont permis une diminution de la prévalence de l’OMD chez les diabétiques d’origine européenne. La situation apparaît beaucoup plus préoccupante, notamment chez les minorités d’origine africaine et latino-américaine des pays développés. Les diabétiques asiatiques pourraient également avoir un risque d’OMD légèrement supérieur à celui des diabétiques d’origine européenne. Au total, le nombre de cas d’OMD est certainement amené à augmenter dans les prochaines années, en raison de l’augmentation de la prévalence du diabète, notamment dans les populations non européennes.
On peut regretter que les études épidémiologiques actuelles ne prennent pas encore en compte le diagnostic de l’OMD par tomographie à cohérence optique. En effet, cette technique d’imagerie a révolutionné le diagnostic et le traitement de l’OMD. Sa prise en compte dans les études épidémiologiques pourrait conduire à une révision non négligeable des estimations des taux de prévalence de l’OMD.
[1] Ciulla TA, Amador AG, Zinman B. Diabetic retinopathy and diabetic macular edema : pathophysiology, screening, and novel therapies. Diabetes Care 2003 ; 26 : 2653-64.
[2] Klein R, Klein BE, Moss SE, Linton KL. The Beaver Dam Eye Study. Retinopathy in adults with newly discovered and previously diagnosed diabetes mellitus. Ophthalmology 1992 ; 99 : 58-62.
[3] Ling R, Ramsewak V, Taylor D, Jacob J. Longitudinal study of a cohort of people with diabetes screened by the Exeter Diabetic Retinopathy Screening Programme. Eye 2002 ; 16 : 140-5.
[4] Broadbent DM, Scott JA, Vora JP, Harding SP. Prevalence of diabetic eye disease in an inner city population : the Liverpool Diabetic Eye Study. Eye (Lond) 1999 ; 13 (Pt 2) : 160-5.
[5] Mitchell P, Smith W, Wang JJ, Attebo K. Prevalence of diabetic retinopathy in an older community. The Blue Mountains Eye Study. Ophthalmology 1998 ; 105 : 406-11.
[6] McKay R, McCarty CA, Taylor HR. Diabetic retinopathy in Victoria, Australia : the Visual Impairment Project. Br J Ophthalmol 2000 ; 84 : 865-70.
[7] Giuffre G, Lodato G, Dardanoni G. Prevalence and risk factors of diabetic retinopathy in adult and elderly subjects : The Casteldaccia Eye Study. Graefes Arch Clin Exp Ophthalmol 2004 ; 242 : 535-40.
[8] Hove MN, Kristensen JK, Lauritzen T, Bek T. The prevalence of retinopathy in an unselected population of type 2 diabetes patients from Arhus County, Denmark. Acta Ophthalmol Scand 2004 ; 82 : 443-8.
[9] Gunnlaugsdottir E, Halldorsdottir S, Klein R, et al. Retinopathy in old persons with and without diabetes mellitus : the Age, Gene/Environment Susceptibility--Reykjavik Study (AGES-R). Diabetologia 2012 ; 55 : 671-80.
[10] Tapp RJ, Shaw JE, Harper CA, et al. The prevalence of and factors associated with diabetic retinopathy in the Australian population. Diabetes Care 2003 ; 26 : 1731-7.
[11] Wong TY, Klein R, Islam FM, et al. Diabetic retinopathy in a multi-ethnic cohort in the United States. Am J Ophthalmol 2006 ; 141 : 446-55.
[12] Varma R, Bressler NM, Doan QV, et al. Prevalence of and risk factors for diabetic macular edema in the United States. JAMA Ophthalmol 2014 ; 132 : 1334-40.
[13] Bertelsen G, Peto T, Lindekleiv H, et al. Tromso eye study : prevalence and risk factors of diabetic retinopathy. Acta Ophthalmol 2013 ; 91 : 716-21.
[14] Klein R, Klein BE, Moss SE, et al. The Wisconsin epidemiologic study of diabetic retinopathy. IV. Diabetic macular edema. Ophthalmology 1984 ; 91 : 1464-74.
[15] Yau JW, Rogers SL, Kawasaki R, et al. Global prevalence and major risk factors of diabetic retinopathy. Diabetes Care 2012 ; 35 : 556-64.
[16] Leske MC, Wu SY, Hyman L, et al. Diabetic retinopathy in a black population : the Barbados Eye Study. Ophthalmology 1999 ; 106 : 1893-9.
[17] West SK, Klein R, Rodriguez J, et al. Diabetes and diabetic retinopathy in a Mexican-American population : Proyecto VER. Diabetes Care 2001 ; 24 : 1204-9.
[18] Varma R, Macias GL, Torres M, et al. Biologic risk factors associated with diabetic retinopathy : the Los Angeles Latino Eye Study. Ophthalmology 2007 ; 114 : 1332-40.
[19] Wong TY, Cheung N, Tay WT, et al. Prevalence and risk factors for diabetic retinopathy : the Singapore Malay Eye Study. Ophthalmology 2008 ; 115 : 1869-75.
[20] Xie XW, Xu L, Wang YX, Jonas JB. Prevalence and associated factors of diabetic retinopathy. The Beijing Eye Study 2006. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 1519-26.
[21] Wang FH, Liang YB, Zhang F, et al. Prevalence of diabetic retinopathy in rural China : the Handan Eye Study. Ophthalmology 2009 ; 116 : 461-7.
[22] Zheng Y, Lamoureux EL, Lavanya R, et al. Prevalence and risk factors of diabetic retinopathy in migrant Indians in an urbanized society in Asia : the Singapore Indian eye study. Ophthalmology 2012 ; 119 : 2119-24.
[23] Xie J, Arnold AL, Keeffe J, et al. Prevalence of self-reported diabetes and diabetic retinopathy in indigenous Australians : the National Indigenous Eye Health Survey. Clin Experiment Ophthalmol 2011 ; 39 : 487-93.
[24] Jee D, Lee WK, Kang S. Prevalence and risk factors for diabetic retinopathy : the Korea National Health and Nutrition Examination Survey 2008-2011. Invest Ophthalmol Vis Sci 2013 ; 54 : 6827-33.
[25] Polack S, Yorston D, Lopez-Ramos A, et al. Rapid assessment of avoidable blindness and diabetic retinopathy in Chiapas, Mexico. Ophthalmology 2012 ; 119 : 1033-40.
[26] Raman R, Ganesan S, Pal SS, et al. Prevalence and risk factors for diabetic retinopathy in rural India. Sankara Nethralaya Diabetic Retinopathy Epidemiology and Molecular Genetic Study III (SN-DREAMS III), report no 2. BMJ Open Diabetes Res Care 2014 ; 2 : e000005.
[27] Klein R, Klein BE, Moss SE, Cruickshanks KJ. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. XV. The long-term incidence of macular edema. Ophthalmology 1995 ; 102 : 7-16.
[28] Klein R, Knudtson MD, Lee KE, et al. The Wisconsin Epidemiologic Study of Diabetic Retinopathy XXIII : the twenty-five-year incidence of macular edema in persons with type 1 diabetes. Ophthalmology 2009 ; 116 : 497-503.
[29] Younis N, Broadbent DM, Vora JP, Harding SP. Incidence of sight-threatening retinopathy in patients with type 2 diabetes in the Liverpool Diabetic Eye Study : a cohort study. Lancet 2003 ; 361 : 195-200.
[30] Younis N, Broadbent DM, Harding SP, Vora JP. Incidence of sight-threatening retinopathy in Type 1 diabetes in a systematic screening programme. Diabet Med 2003 ; 20 : 758-65.
[31] McCarty DJ, Fu CL, Harper CA, et al. Five-year incidence of diabetic retinopathy in the Melbourne Visual Impairment Project. Clin Experiment Ophthalmol 2003 ; 31 : 397-402.
[32] Tapp RJ, Tikellis G, Wong TY, et al. Longitudinal association of glucose metabolism with retinopathy : results from the Australian Diabetes Obesity and Lifestyle (AusDiab) study. Diabetes Care 2008 ; 31 : 1349-54.
[33] Varma R, Choudhury F, Klein R, et al. Four-year incidence and progression of diabetic retinopathy and macular edema : the Los Angeles Latino Eye Study. Am J Ophthalmol 2010 ; 149 : 752-61.e1-3.
[34] Sivaprasad S, Gupta B, Crosby-Nwaobi R, Evans J. Prevalence of diabetic retinopathy in various ethnic groups : a worldwide perspective. Surv Ophthalmol 2012 ; 57 : 347-70.
[35] Keech AC, Mitchell P, Summanen PA, et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study) : a randomised controlled trial. Lancet 2007 ; 370 : 1687-97.
[36] Diep TM, Tsui I. Risk factors associated with diabetic macular edema. Diabetes Res Clin Pract 2013 ; 100 : 298-305.
[37] Kim SJ, Equi R, Bressler NM. Analysis of macular edema after cataract surgery in patients with diabetes using optical coherence tomography. Ophthalmology 2007 ; 114 : 881-9.
P. Massin, J.-A. Pournaras
➤ La pathogénie de l’OMD est complexe et fait intervenir de nombreux mécanismes intriqués.
➤ La rupture de la barrière hémato-rétinienne (BHR) interne est le principal mécanisme à l’origine de l’OMD. Elle est due à la fois à une altération des systèmes de jonction situés entre les cellules endothéliales rétiniennes, sous l’effet du vascular endothelial growth factor (VEGF) et de diverses cytokines inflammatoires, et à une augmentation du transport transcellulaire à travers les cellules endothéliales rétiniennes sous l’effet du VEGF.
➤ Il existe également une altération des mécanismes de déshydratation de la rétine par les cellules gliales de Müller et par l’épithélium pigmentaire.
➤ L’intégrité anatomique et fonctionnelle du complexe neurovasculaire est indispensable au bon fonctionnement de la BHR interne ; l’atteinte neuronale (apoptose des cellules ganglionnaires) et l’activation précoce des cellules gliales observées au cours du diabète affectent le bon fonctionnement de la BHR interne.
➤ Conformément à la loi de Starling, tout facteur systémique induisant une augmentation de la pression hydrostatique ou une diminution de la pression oncotique est susceptible d’aggraver l’OMD.
➤ Les anomalies du vitré observées au cours du diabète peuvent aggraver l’OMD.
La pathogénie de l’OMD est complexe et fait intervenir de multiples mécanismes intriqués. L’hyperglycémie chronique est le principal facteur à l’origine de l’OMD. En situation d’hyperglycémie chronique, quatre voies biochimiques principales sont activées :
-
la cascade des polyols ;
-
la voie des produits avancés de la glycation ;
-
la voie de la protéine kinase C ;
Ces voies augmentent le stress oxydatif, l’inflammation, l’hypoxie et la dysfonction vasculaire. Il en résulte l’activation de différents facteurs de croissance et cytokines, tels que le vascular endothelial growth factor (VEGF), les angiopoïétines, le tumor necrosis factor (TNF), les interleukines (IL), les métalloprotéinases matricielles (MMP) qui contribuent à la rupture de la barrière hémato-rétinienne (BHR) interne et à l’OMD.
La rupture de la BHR interne est le mécanisme principal à l’origine de l’OMD. Son bon fonctionnement repose sur l’intégrité structurelle et fonctionnelle des différents éléments qui la composent, mais dépend aussi des interactions dynamiques entre cellules endothéliales, cellules gliales et tissu neuronal au sein du complexe neurovasculaire.
À cause de sa complexité et du manque de modèle animal adéquat, la physiopathologie du développement et des complications de l’OMD est incomplètement élucidée.
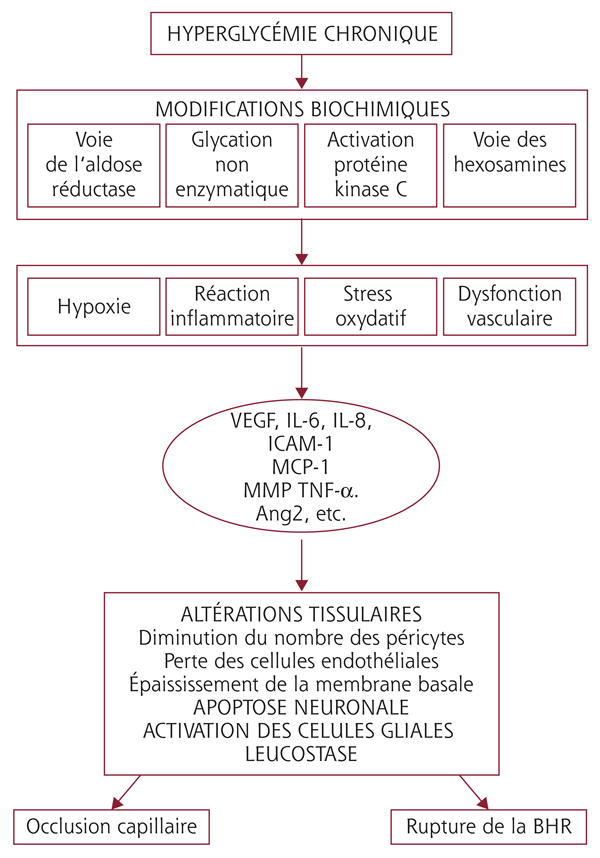
Fig. 8-1 Physiopathologie de l’œdème maculaire du diabétique.
Au cours du diabète, l’hyperglycémie chronique entraîne l’activation de différentes voies biochimiques à l’origine d’un stress oxydatif, d’une réaction inflammatoire, d’une augmentation de l’hypoxie tissulaire et d’une dysfonction endothéliale. Il en résulte la production de VEGF et de différentes cytokines. Cette sécrétion est à l’origine de lésions tissulaires, d’une leucostase accrue, d’une apoptose neuronale et d’une activation des cellules gliales de la rétine. Il en résulte l’occlusion des capillaires rétiniens, et la rupture de la barrière hématorétinienne.
Il n’y a pas de modèle animal d’OMD. Les modèles in vitro utilisent des cultures de cellules d’origine bovine ou humaine, la perméabilité étant étudiée en mesurant la résistance électrique transendothéliale ou le transport de fluorescein isothiocyanate (FITC)-dextran à travers ces couches cellulaires [2].
In vivo, les modèles les plus utilisés pour étudier la perméabilité capillaire rétinienne sont les souris ou les rats rendus diabétiques par injection de streptozotocine. Ils développent des signes précoces de rétinopathie diabétique avec une rupture précoce de la BHR interne, dès la première semaine après l’induction du diabète. La perméabilité est mesurée par le passage de colorant bleu d’Evans, ou de FITC-dextran, après sacrifice des animaux [3]. La souris Akita, spontanément diabétique, a également été utilisée pour l’étude de la rupture de la BHR [4].
Il n’existe en revanche aucun modèle in vivo d’OMD, développant un épaississement maculaire que l’on pourrait mesurer par tomographie à cohérence optique (optical coherence tomography [OCT]) permettant d’évaluer l’effet des traitements contre l’OMD.
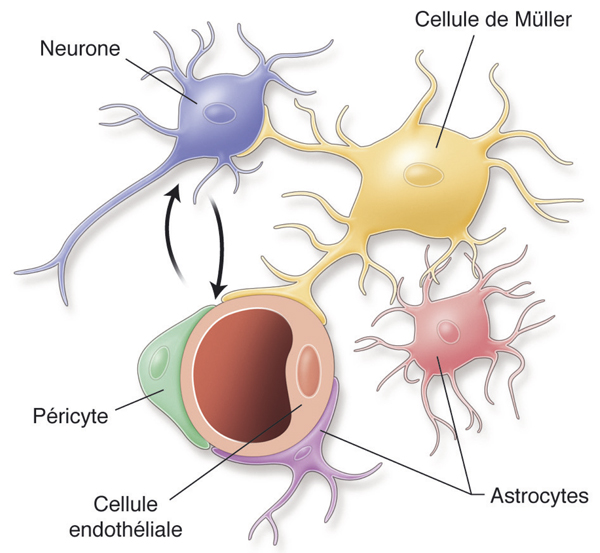
La BHR interne contrôle les échanges de métabolites et de déchets entre la lumière des capillaires et des vaisseaux rétiniens, et la neurorétine. Elle est principalement constituée par les systèmes de jonction serrée entre les cellules endothéliales adjacentes. Ces jonctions sont composées d’un agrégat complexe de protéines, à la fois transmembranaires et intracellulaires : occludine, protéines zonula occludens (ZO), cadhérine, etc. (voir chapitre 4.2). Les péricytes et les cellules gliales rétiniennes (pied des cellules gliales de Müller et des astrocytes) jouent également un rôle important dans le maintien de la BHR interne [5].
L’altération de la BHR interne survient précocement au cours du diabète, avant même l’apparition de signes cliniques de rétinopathie diabétique (RD). Elle est caractérisée par une perte de péricytes, un épaississement de la membrane basale des capillaires rétiniens et une diminution du nombre des cellules endothéliales [6, 7]. Ces lésions tissulaires sont la conséquence des différentes modifications biochimiques induites par l’hyperglycémie chronique (fig. 8-1). Il en résulte une hyperperméabilité diffuse qui contribue à l’aggravation de la RD. Les mécanismes responsables de cette hyperperméabilité sont multiples.
Au cours du diabète, le passage de flux des capillaires rétiniens vers le tissu rétinien se fait principalement par passage paracellulaire à travers les systèmes de jonction altérés. En effet, au cours du diabète expérimental, une désorganisation des complexes protéiques a été observée au niveau des systèmes de jonction des cellules endothéliales rétiniennes avec une diminution du taux d’occludines et de cadhérines, entraînant une augmentation de la perméabilité rétinienne [8, 9].
Cette hyperperméabilité rétinienne résulte, en grande partie, de l’action du VEGF sur les protéines des jonctions serrées des cellules endothéliales rétiniennes (voir chapitre 4.6) [10]. Une augmentation de l’expression du VEGF dans la rétine est un changement précoce, observé dans le modèle de diabète expérimental [11]. Elle résulte de l’ischémie tissulaire locale, secondaire aux occlusions microvasculaires, mais aussi de l’effet d’un grand nombre de médiateurs inflammatoires.
Plusieurs arguments plaident en faveur du rôle du VEGF dans la rupture de la BHR interne. Dès sa découverte, celui-ci a été reconnu comme un puissant facteur d’hyperperméabilité vasculaire [12]. Des taux élevés de VEGF ont été retrouvés dans le vitré de patients atteints d’OMD [13]. Il a été montré, in vivo et in vitro, que l’augmentation du VEGF entraînait une phosphorylation rapide de l’occludine et de la protéine ZO-1, in vivo et in vitro [10, 14]. Il existe une corrélation entre l’augmentation du VEGF-A et l’augmentation de la perméabilité rétinienne, ainsi que de la diminution de la concentration en protéine ZO-1 dans le vitré de patients diabétiques [2].
Toutefois, d’autres facteurs sont impliqués dans la rupture de la BHR interne, tels que les cytokines inflammatoires. En effet, au cours du diabète, il existe un état inflammatoire chronique [15]. Des taux élevés de cytokines inflammatoires ont été retrouvés dans le vitré ou l’humeur aqueuse de patients atteints d’OMD [16–18], notamment d’IL-6, IL-8 et de chemokine ligand 2 (CCL2), aussi connu comme monocyte chemotactic protein 1 (MCP-1) (voir chapitre 4.6). Une leucostase accrue (adhésion de leucocytes à la paroi endothéliale des capillaires rétiniens) est observée dès les stades très précoces de la RD [19, 20]. Elle jouerait un rôle majeur dans la rupture de la BHR interne. L’adhésion des leucocytes à la paroi des capillaires rétiniens est secondaire à l’expression accrue de molécules inflammatoires d’adhésion, notamment d’intercellular adhesion molecule 1 (ICAM-1) à la surface des cellules endothéliales. Il s’ensuit un recrutement important de monocytes dans la rétine, induit par l’augmentation de CCL2 (voir chapitre 4.6) [21]. Dans la rétine, les monocytes activés se différencient en macrophages, qui secrètent VEGF et cytokines inflammatoires : angiopoïétine 2 (Ang2), TNF-α, IL, MMP-2 et MMP-9. Celles-ci, à leur tour, agissent sur la BHR interne et créent ainsi un cercle vicieux aggravant l’OM.
L’hypoxie joue également un rôle dans la rupture de la BHR par l’intermédiaire de l’hypoxia-inducible factor 1 (HIF-1), principal régulateur de l’homéostasie en oxygène ; ce facteur joue également un rôle dans la stimulation de l’angiogenèse, pour améliorer l’oxygénation tissulaire, et aussi dans la survie neuronale [22].
La perte des péricytes, observée précocement au cours de la RD, concourt à la rupture de la BHR interne [23]. En effet, les péricytes jouent un rôle important dans la stabilisation des capillaires rétiniens, ils secrètent le transforming growth factor β (TGF-β), qui inhibe la prolifération des cellules endothéliales [23] . La perte des péricytes résulterait de la diminution des taux de platelet-derived growth factor β (PDGF-β) [24], mais aussi de la migration des péricytes sous l’effet de l’Ang2, dont des taux élevés ont été retrouvés dans le vitré de patients diabétiques [25].
Enfin, la diminution d’épaisseur du glycocalyx des cellules endothéliales au cours du diabète, ainsi que l’épaississement de la membrane basale des cellules endothéliales favoriseraient également l’augmentation de la perméabilité vasculaire [26, 27].

Fig. 8-2 Voies de passage du flux des capillaires rétiniens vers le tissu rétinien.
Le passage de flux des capillaires de la rétine vers le tissu rétinien se fait principalement par passage paracellulaire à travers les systèmes de jonction altérés sous l’effet du VEGF et de différentes cytokines inflammatoires. Il se fait aussi par passage transcellulaire de vésicules de cavéoline, sous l’effet du VEGF. La protéine PLVAP (plasmalemma vesicle-associated protein) jouerait un rôle clé dans la régulation de la perméabilité vasculaire induite par le VEGF.
L’augmentation de la perméabilité rétinienne résulterait également de l’augmentation du transport transcellulaire à travers la cellule endothéliale, par transcytose de vésicules de cavéoline, sous l’effet du VEGF (fig. 8-2) [28]. Celle-ci permet de transporter des protéines de grande taille, avec un haut pouvoir osmotique, du pôle apical de la cellule vers son pôle basal. Une protéine a été identifiée comme favorisant le passage transcellulaire : la protéine plasmalemna vesicle associated protein (PLVAP) qui n’est exprimée, au niveau de la cellule endothéliale rétinienne, qu’en cas de rupture de la BHR interne. Son activité est associée à l’expression du VEGF : il semble que PLVAP joue un rôle clé dans la régulation de la perméabilité transcellulaire induite par le VEGF [29, 30].
De récents travaux suggèrent qu’une altération du complexe neurovasculaire de la rétine interviendrait précocement dans la pathogénie de l’OM [31]. Le complexe neurovasculaire est constitué des neurones, des cellules gliales – incluant astrocytes, cellules gliales de Müller (CGM) et microglie –, des cellules endothéliales et des péricytes (fig. 8-3). Cette organisation est caractérisée par un contact physique intime et des interactions fonctionnelles entre ses différents composants. Ainsi, astrocytes, CGM, et péricytes coopèrent pour constituer les différents composants de la BHR interne permettant le maintien de son étanchéité (voir chapitre 4.1). L’intégrité anatomique et fonctionnelle de ce complexe est donc indispensable au bon fonctionnement de cette barrière.
Or, si la RD a été longtemps considérée comme une pathologie primitivement microvasculaire, il est maintenant admis qu’il existe une atteinte neuronale (apoptose des cellules ganglionnaires) et une activation précoce des cellules gliales de la rétine, notamment des cellules de Müller, qui affectent le bon fonctionnement de la BHR interne au cours de la RD [31–33]. La chronologie des événements n’est néanmoins pas claire, et il existe deux hypothèses : rupture initiale de la BHR interne entraînant une modification de la composition des liquides extracellulaires source d’atteinte neuronale ou, a contrario, apoptose neuronale initiale induite par l’hyperglycémie chronique, à l’origine de la rupture de la BHR interne [5].
Dans les conditions normales, l’eau qui s’accumule dans le tissu rétinien est éliminée en permanence par l’épithélium pigmentaire (EP) qui déshydrate l’espace sous-rétinien et par les CGM qui déshydratent la rétine interne (fig. 8-4 ; voir chapitre 4.4) [34]. Les CGM permettent l’élimination aqueuse du milieu interstitiel vers les vaisseaux sanguins et le vitré. L’absorption et l’élimination des fluides par les CGM sont assurées par des canaux aqueux aquaporines 4 (AQP4) et potassiques Kir4.1
Le développement d’un OM résulte d’un déséquilibre entre le flux de liquide entrant dans le parenchyme rétinien à travers les parois des vaisseaux devenus perméables, et l’insuffisance de résorption par l’EP et les CGM. En cas d’OM, l’accumulation de fluide s’effectue généralement dans l’espace extracellulaire, comme cela est suggéré par la fuite de fluorescéine durant l’angiographie, mais il existerait également une accumulation de liquide intracellulaire, au sein des cellules de Müller (voir chapitre 2) [35, 36].
En effet, les mécanismes de résorption semblent être altérés au cours du diabète. Il existerait une délocalisation des canaux aqueux et potassiques des CGM, ne permettant plus l’élimination d’eau et de potassium intracellulaire vers les vaisseaux rétiniens et le vitré, et entraînant leur ballonisation [34].
Il existerait également une altération de la BHR externe au cours du diabète [37]. L’élimination des liquides par l’EP fait intervenir des aquaporines et des pompes Na+/K+ ; or, une modification de l’expression de ces deux éléments a été décrite au cours du diabète [38]. Il existerait également une diminution de l’occludine dans les cellules de l’EPR et dans la membrane limitante externe (MLE) [39].
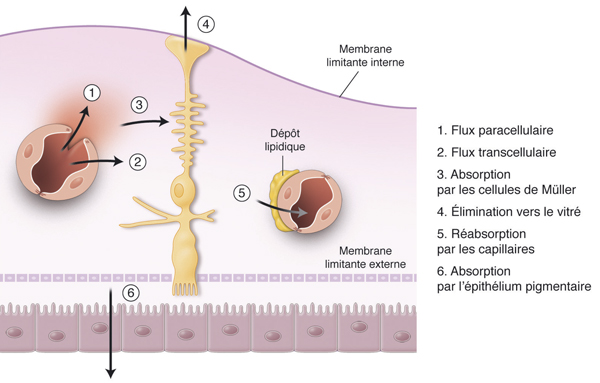
Fig. 8-4 Mécanismes de déshydratation de la rétine.
Dans les conditions normales, l’eau qui s’accumule dans le tissu rétinien est éliminée en permanence par l’épithélium pigmentaire (6), qui déshydrate l’espace sous-rétinien, et par les cellules de Müller qui déshydratent la rétine interne. Ces dernières permettent l’élimination aqueuse du milieu interstitiel vers les vaisseaux sanguins (5) et le vitré (4).
• Facteurs systémiques :
■ hypertension artérielle ;
■ facteurs à l’origine d’une surcharge volémique (insuffisance rénale, insuffisance cardiaque, hypo-albuminémie) ;
■ apnée du sommeil.
• Facteurs mécaniques :
■ traction vitréomaculaire ;
■ membrane épirétinienne.
Lors de l’ouverture de la BHR, les lois de Starling influencent le mouvement net de l’eau et des solutés en dehors des capillaires menant à la formation de l’OM (voir fig. 9-5). Les lois de Starling établissent que le mouvement net du fluide hors des capillaires est déterminé par l’addition des pressions hydrostatique et oncotique (pression prédominante intraluminale hydrostatique et oncotique). C’est pourquoi l’accumulation de l’eau et des solutés dans la rétine peut être conditionnée par le changement soit de la première (du fait d’une augmentation de la pression artérielle par exemple) soit de la seconde (du fait d’une modification du contenu protéique). De ce fait, les facteurs systémiques induisant soit une augmentation de la pression hydrostatique – comme l’hypertension ou la surcharge de fluide intravasculaire (insuffisance cardiaque ou rénale) –, soit une diminution de la pression oncotique (hypo-albuminémie) pourraient aggraver l’OMD et doivent être traitées activement.
Plusieurs observations indiquent que le vitré pourrait jouer un rôle dans la pathogénie de l’OMD. Hikichi et al. ont observé une résolution spontanée de l’OMD, fréquente en cas de décollement postérieur du vitré complet [40]. Des taux élevés de produits précoces et avancés de la glycation ont été mesurés dans le vitré de patients diabétiques par rapport aux patients indemnes [41]. Ces altérations pourraient favoriser la liquéfaction et la déstabilisation du vitré. De plus, l’adhésion vitréorétinienne demeure souvent forte malgré la liquéfaction du gel [42]. La déstabilisation du cortex central, associée à l’attachement persistant du cortex vitréen à la rétine, peut causer une traction sur la macula et contribuer au développement de l’OM. Un tel mécanisme est évident dans le cas d’OMD avec hyaloïde postérieure tendue et épaisse, pour laquelle la vitrectomie a démontré son efficacité [43]. La traction mécanique par une membrane épirétinienne peut également aggraver l’œdème et être relâchée par une exérèse chirurgicale. Enfin, le cortex vitréen postérieur constitue un réservoir dans lequel peuvent s’accumuler facteurs de croissance et cytokines inflammatoires au contact de la rétine, exacerbant l’OMD.
À cause de sa complexité et du manque de modèle animal adéquat, de grandes interrogations demeurent sur la physiopathologie du développement et des complications de l’OMD. Alors que le contrôle des facteurs de risque systémiques semble crucial pour prévenir son aggravation, le traitement est actuellement basé principalement sur l’utilisation d’agents pharmacologiques incluant les anti-VEGF et les stéroïdes associés à la photocoagulation. La meilleure compréhension des mécanismes complexes, impliqués dans la pathogenèse de l’OMD, pourra à l’avenir nous donner de nouvelles cibles thérapeutiques.
[1] Zhang X, Zeng H, Bao S, et al. Diabetic macular edema : new concepts in patho-physiology and treatment. Cell Biosci 2014 ; 4 : 27.
[2] Deissler HL, Deissler H, Lang GK, Lang GE. VEGF but not PlGF disturbs the barrier of retinal endothelial cells. Exp Eye Res 2013 ; 115 : 162-71.
[3] Tang L, Lee CA, Yunpeng D, et al. My D88 pathways in leukocytes affect the retina in diabetes. PLoS One 2013 ; 8 : e68871.
[4] Barber AJ, Antonetti DA, Kern TS, et al. The Ins2Akita mouse as a model of early retinal complications in diabetes. Invest Ophthalmol Vis Sci 2005 ; 46 : 2210-8.
[5] Das A, McGuire PG, Rangasamy S. Diabetic Macular edema : pathophysiology and novel therapeutic targets. Ophthalmology 2015 ; 122 : 1375-94.
[6] Hammes HP, Feng, Y, Pfister, F, Brownlee M. Diabetic retinopathy : targeting vasoregression. Diabetes 2011 ; 60 : 9-16.
[7] Lorenzi, M, Gerhardinger, C. Early cellular and molecular changes induced by diabetes in the retina. Diabetologia 2001 ; 44 : 791-804.
[8] Antonetti DA, Barber AJ, Khin S, et al. Vascular permeability in experimental diabetes is associated with reduced endothelial occludin content : vascular endothelial growth factor decreases occludin in retinal endothelial cells. Penn State Retina Research Group. Diabetes 1998 ; 47 : 1953-9.
[9] Barber AJ, Antonetti DA, Gardner TW. Altered expression of retinal occludin and glial fibrillary acidic protein in experimental diabetes. The Penn State Retina Research Group. Invest Ophthalmol Vis Sci 2000 ; 41 : 3561-8.
[10] Antonetti DA, Barber AJ, Hollinger LA, et al. Vascular endothelial growth factor induces rapid phosphorylation of tight junction proteins occludin and zonula occluden 1. A potential mechanism for vascular permeability in diabetic retinopathy and tumors. J Biol Chem 1999 ; 274 : 23463-7.
[11] Lu M, Kuroki M, Amano S, et al. Advanced glycation end products increase retinal vascular endothelial growth factor expression. J Clin Invest 1998 ; 101 : 1219-24.
[12] Senger DR, Galli SJ, Dvorak AM, et al. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science 1983 ; 219 : 983-5.
[13] Funatsu H, Yamashita H, Ikeda T, et al. Vitreous levels of interleukin-6 and vascular endothelial growth factor are related to diabetic macular edema. Ophthalmology 2003 ; 110 : 1690-6.
[14] Muthusamy A, Lin CM, Shanmugam S, et al. Ischemia-reperfusion injury induces occludin phosphorylation/ubiquitination and retinal vascular permeability in a VEGFR-2-dependentmanner. J Cereb Blood Flow Metab 2014 ; 34 : 522-31.
[15] Adamis AP. Is diabetic retinopathy an inflammatory disease ? Br J Ophthalmol 2002 ; 83 : 363-5.
[16] Funatsu H, Noma H, Mimura T, et al. Association of vitreous inflammatory factors with diabetic macular edema. Ophthalmology 2009 ; 116 : 73-9.
[17] Lee WJ, Kang MH, Seong M, Cho HY. Comparison of aqueous concentrations of angiogenic and inflammatory cytokines in diabetic macular oedema and macular oedema due to branch retinal vein occlusion. Br J Ophthalmol 2012 ; 96 : 1426-30.
[18] Yoshimura T, Sonoda KH, Sugahara M, et al. Comprehensive analysis of inflammatory immune mediators in vitreoretinal diseases. PLoS One 2009 ; 4 : e8158.
[19] Leal EC, Manivannan A, Hosoya K, et al. Inducible nitric oxide synthase isoform is a key mediator of leukostasis and blood-retinal barrier breakdown in diabetic retinopathy. Invest Ophthalmol Vis Sci 2007 ; 48 : 5257-65.
[20] Joussen AM, Murata T, Tsujikawa A, et al. Leukocyte-mediated endothelial cell injury and death in the diabetic retina. Am J Pathol 2001 ; 158 : 147-52.
[21] Rangasamy S, McGuire PG, Franco Nitta C, et al. Chemokine mediated monocyte trafficking into the retina : role of inflammation in alteration of the blood-retinal barrier in diabetic retinopathy. PLoS One 2014 ; 9 : e108508.
[22] Choi YK, Kim JH, Kim WJ, et al. AKAP12 regulates human blooderetinal barrier formation by downregulation of hypoxia-inducible factor-1alpha. J Neurosci 2007 ; 27 : 4472-81.
[23] Frank RN. Etiologic mechanisms in diabetic retinopathy. In : Ryan SJ. Ed. Retina. Volume II. Philadelphia, PA : Elsevier Mosby ; 2006, p. 1241-70.
[24] Enge M, Bjarnegard M, Gerhardt H, et al. Endothelium-specific platelet-derived growth factor-B ablation mimics diabetic retinopathy. EMBO J 2002 ; 21 : 4307-16.
[25] Pfister F, Feng Y, Vom HF, et al. Pericyte migration : a novel mechanism of pericyte loss in experimental diabetic retinopathy. Diabetes 2008 ; 57 : 2495-502.
[26] Nieuwdorp M, van Haeften TW, Gouverneur MC, et al. Loss of endothelial glycocalyx during acute hyperglycemia coincides with endothelial dysfunction and coagulation activation in vivo. Diabetes 2006 ; 55 : 480-6.
[27] Das A, Frank RN, Zhang NL, et al. Increases in collagen type IV and laminin in galactose-induced retinal capillary basement membrane thickening e prevention by an aldose reductase inhibitor. Exp Eye Res 1990 ; 50 : 269-80.
[28] Nag S, Kapadia A, Stewart DJ. Review : molecular pathogenesis of blood-brain barrier breakdown in acute brain injury. Neuropathol Appl Neurobiol 2011 ; 37 : 3-23.
[29] Wisniewska-Kruk J, Klaassen I, Vogels IM, et al. Molecular analysis of blood-retinal barrier loss in the Akimba mouse, a model of advanced diabetic retinopathy. Exp Eye Res 2014 ; 122 : 123-31.
[30] Klaassen I, Van Noorden CJ, Schlingemann RO. Molecular basis of the inner blood-retinal barrier and its breakdown in diabetic macular edema and other pathological conditions. Progress in Retinal and Eye Research 2013 ; 34 : 19-48.
[31] Antonetti DA, Klein R, Gardner TW. Diabetic retinopathy. N Engl J Med 2012 ; 366 : 1227-39.
[32] Antonetti DA, Barber AJ, Bronson SK, et al. ; JDRF Diabetic Retinopathy Center Group. Diabetic retinopathy : seeing beyond glucose-induced microvascular disease. Diabetes 2006 ; 55 : 2401-11.
[33] Rungger-Brandle E, Dosso AA, Leuenberger PM. Glial reactivity, an early feature of diabetic retinopathy. Invest Ophthalmol Vis Sci 2000 ; 41 : 1971-80.
[34] Bringmann A, Pannicke T, Grosche J, et al. Müller cells in the healthy and diseased retina. Prog Retin Eye Res 2006 ; 25 : 397-424.
[35] Fine BS, Brucker AJ. Macular edema and cystoid macular edema. Am J Ophthalmol 1981 ; 92 : 466-81.
[36] Yanoff M, Fine BS, Brucker AJ, Eagle RC. Pathology of human cystoid macular edema. Surv Ophthalmol 1984 ; 28 (suppl) : 505-11.
[37] Xu HZ, Le YZ. Significance of outer blood-retina barrier breakdown in diabetes and ischemia. Invest Ophthalmol Vis Sci 2011 ; 52 : 2160-4.
[38] Omri S, Omri B, Savoldelli M, et al. The outer limiting membrane (OLM) revisited : clinical implications. Clin Ophthalmol 2010 ; 4 : 183-95.
[39] Hollborn M, Dukic-Stefanovic S, Pannicke T, et al. Expression of aquaporins in the retina of diabetic rats. Curr Eye Res 2011 ; 36 : 850-6.
[40] Hikichi T, Fujio N, Akiba J, et al. Association between the short-term natural history of diabetic macular edema and the vitreomacular relationship in type II diabetes mellitus. Ophthalmology 1997 ; 104 : 473-8.
[41] Sebag J. Anatomy and pathology of the vitreo-retinal interface. Eye 1992 ; 6 (Pt 6) : 541-52.
[42] Takahashi M, Trempe CL, Maguire K, McMeel JW. Vitreoretinal relationship in diabetic retinopathy. A biomicroscopic evaluation. Arch Ophthalmol 1981 ; 99 : 241-5.
[43] Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomy for diabetic macular traction and edema associated with posterior hyaloidal traction. Ophthalmology 1992 ; 99 : 753-9.
P. Massin, K. Angioi-Duprez
➤ L’OMD est défini par la constatation d’un épaississement rétinien et/ou d’exsudats lipidiques au pôle postérieur.
➤ Son diagnostic clinique repose sur l’examen biomicroscopique et la tomographie par cohérence optique (optical coherence tomography [OCT]).
➤ La photographie du fond d’œil est le complément indispensable à l’examen biomicroscopique du fond d’œil.
➤ Elle permet d’évaluer avec précision la sévérité de la rétinopathie diabétique associée à l’OMD.
L’OMD est défini par un épaississement de la rétine maculaire, lié à une accumulation de liquide dans la rétine. Son diagnostic clinique repose sur la constatation de cet épaississement rétinien en biomicroscopie et/ou sur la présence d’exsudats lipidiques dans la région maculaire.
L’épaississement rétinien est plus ou moins visible à l’examen clinique, selon l’importance de l’œdème. Il peut être localisé à une partie de la macula, souvent associé dans ce cas à des exsudats circinés (fig. 8-5) ou plus diffus. Il est parfois possible de visualiser des logettes intrarétiniennes maculaires (fig. 8-6), on parle alors d’œdème maculaire cystoïde (OMC). Lorsqu’il est modéré, l’épaississement peut être difficile à diagnostiquer : on peut s’aider de verres de contact, tels que la partie centrale du verre de Goldmann et surtout de verres comme le Centralis Direct® (Volk) ou des lentilles non-contact de 60, 78, ou 90 dioptries, en utilisant une fente fine. L’estimation biomicroscopique de l’épaisseur rétinienne est subjective et l’examen clinique permet seulement de diagnostiquer des épaississements supérieurs à 1,6 fois la normale [1]. L’OCT est indispensable pour confirmer l’œdème, en objectivant l’épaississement rétinien (voir plus loin chapitre 8.4). Outre le diagnostic d’œdème, l’OCT permet de le quantifier et de définir sa localisation avec précision en analysant les zones rétiniennes épaissies. Le retentissement fonctionnel de cet épaississement rétinien se traduit par une baisse d’acuité visuelle, variable selon sa localisation et son importance, et par des métamorphopsies plus ou moins marquées.
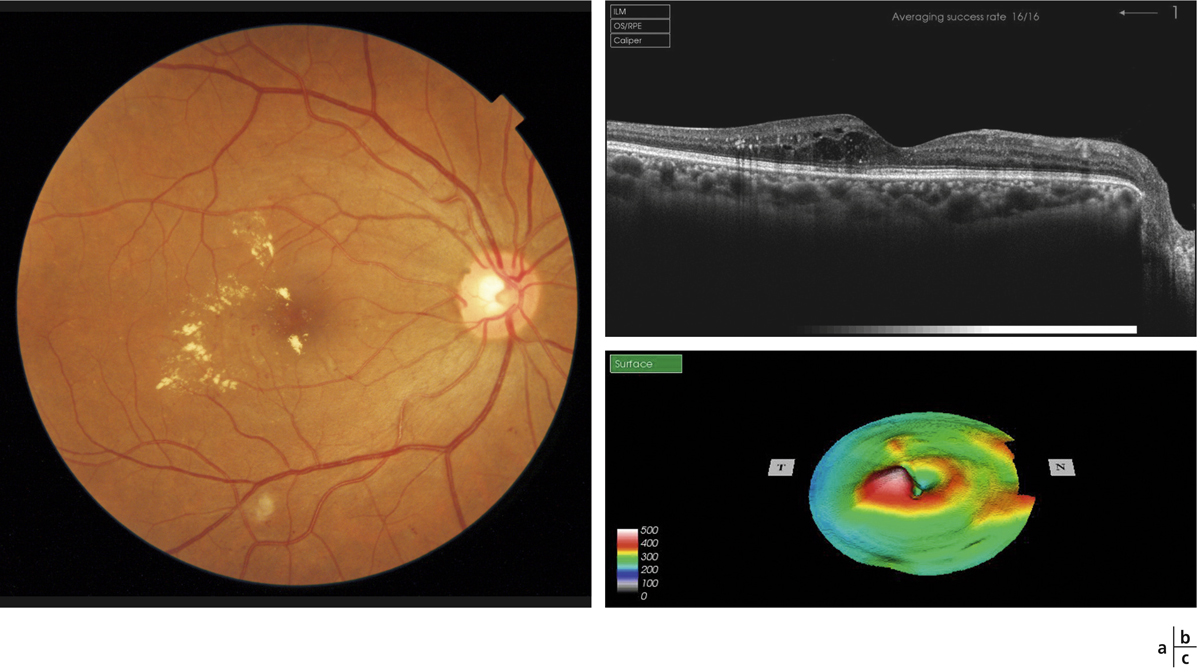
Fig. 8-5 Exsudats circinés.
a. Photographie en couleurs. Les exsudats sont organisés en couronne autour des micro-anévrismes dont ils sont issus. Ils précipitent à la périphérie de la zone œdématiée. b. Coupe OCT passant par la zone œdématiée : on observe des kystes intrarétiniens prédominant dans la couche plexiforme externe et les exsudats apparaissent sous forme de lésions hyper-réflectives. On observe également des points hyper-réflectifs dans les logettes d’œdème. c. L’œdème s’étend à proximité du centre de la fovéa, sans atteindre le centre.
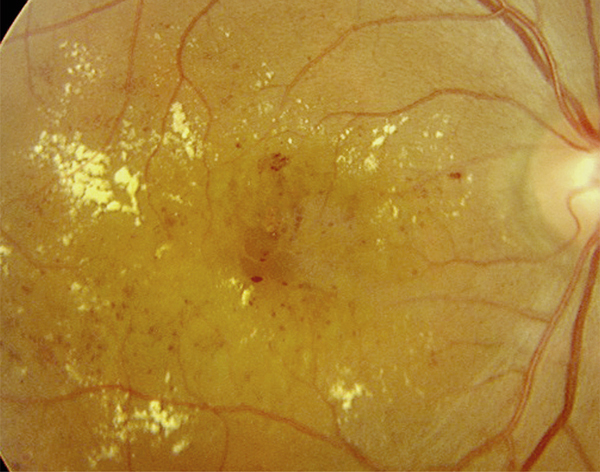
Fig. 8-6 Œdème maculaire cystoïde.
Les kystes d’œdème sont bien visibles sur la photographie en couleurs. Ils s’accompagnent de très nombreux exsudats, micro-anévrismes et d’hémorragies rétiniennes ponctiformes.
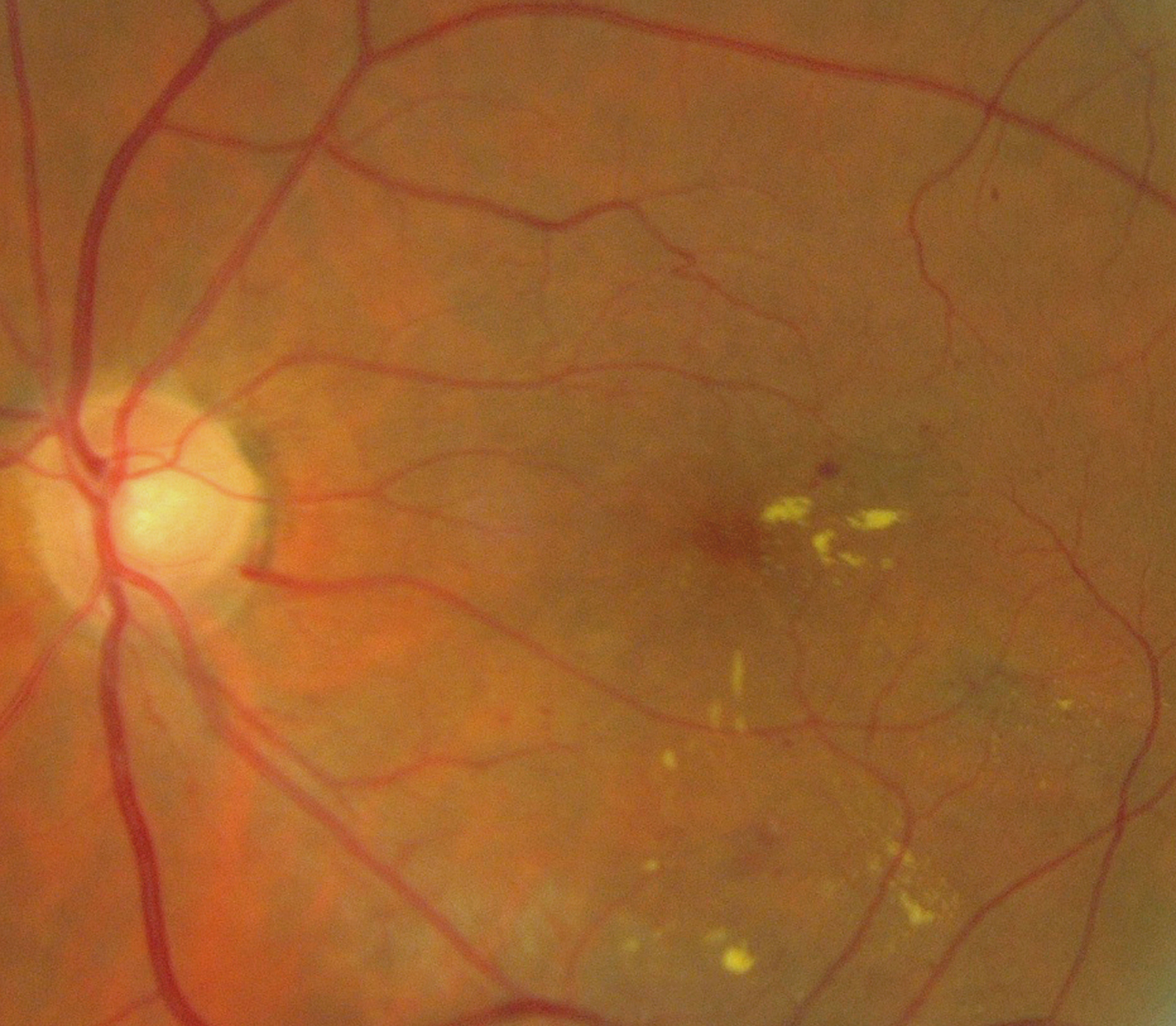
Les exsudats lipidiques sont fréquemment rencontrés dans le cadre de l’OMD. Ils sont visibles sous forme de dépôts jaunâtres, intra- ou sous-rétiniens, autour ou au sein même de la macula (fig. 8-5 et eFig. 8-1 ). Ils prennent fréquemment une disposition en « couronne » (exsudats circinés) autour des anomalies microvasculaires dont ils sont issus (micro-anévrismes et anomalies microvasculaires intrarétiniennes [AMIR]) : dans ce cas, ils sont localisés en bordure de la zone d’épaississement rétinien (œdème souvent appelé « focal » ; fig. 8-5). Ils peuvent également prendre une disposition radiaire stellaire, caractéristique de la région centrale, du fait de l’anatomie des fibres de Henlé (fig. 8-7). Les exsudats intrarétiniens, situés dans la région maculaire, n’entraînent probablement pas, à eux seuls, de baisse visuelle, c’est l’œdème rétinien qui les accompagne qui en est responsable.
). Ils prennent fréquemment une disposition en « couronne » (exsudats circinés) autour des anomalies microvasculaires dont ils sont issus (micro-anévrismes et anomalies microvasculaires intrarétiniennes [AMIR]) : dans ce cas, ils sont localisés en bordure de la zone d’épaississement rétinien (œdème souvent appelé « focal » ; fig. 8-5). Ils peuvent également prendre une disposition radiaire stellaire, caractéristique de la région centrale, du fait de l’anatomie des fibres de Henlé (fig. 8-7). Les exsudats intrarétiniens, situés dans la région maculaire, n’entraînent probablement pas, à eux seuls, de baisse visuelle, c’est l’œdème rétinien qui les accompagne qui en est responsable.
Lorsqu’il existe une exsudation massive et chronique, les exsudats s’organisent et réalisent une plaque d’exsudation sous-maculaire et sont alors souvent associés à une destruction des photorécepteurs et une baisse de la vue irréversible (fig. 8-8).
Les exsudats correspondent à une accumulation de dépôts lipidiques dans la rétine témoignant d’une diffusion anormale de constituants plasmatiques par rupture de la BHR interne, au niveau des micro-anévrismes et des AMIR. En effet, leur paroi laisse diffuser non seulement du sérum, mais aussi des substances de gros poids moléculaire telles que les lipoprotéines qui seront à l’origine des exsudats. Toutefois, si les composants de faible poids moléculaire peuvent être réabsorbés par les capillaires sains et/ou l’épithélium pigmentaire, les lipoprotéines sont trop volumineuses et s’accumulent à la jonction de la rétine œdématiée et de la rétine saine. Elles précipitent dans les couches plexiformes externe et interne de la rétine formant les exsudats « durs » ou « lipidiques ». Ceux-ci seront résorbés par phagocytose des macrophages. Les exsudats sont donc des témoins indirects des phénomènes de résorption au sein de la rétine (fig. 8-9 et eFig. 8-2 ).
).
En l’absence de traitement, l’évolution spontanée conduit plutôt à une augmentation en nombre et en volume des exsudats, sauf en cas d’occlusion spontanée des micro-anévrismes responsables de l’extravasation liquidienne. Le traitement des anomalies vasculaires responsables de l’exsudation aboutit à leur résorption progressive qui est souvent lente sur plusieurs mois ; les exsudats disparaissent par phagocytose des macrophages. Lorsqu’il existe une plaque exsudative sous-maculaire, il est possible de la faire disparaître par photocoagulation des lésions causales mais le plus souvent, soit une fibrose sous-maculaire, soit une atrophie localisée de l’épithélium pigmentaire demeurera. Une augmentation transitoire des exsudats peut s’observer dans les semaines qui suivent une photocoagulation focale au laser ou surtout des injections intravitréennes de corticoïdes. En effet, il se produit alors une résorption rapide de la composante liquidienne de l’œdème et les lipoprotéines précipitent sous forme d’exsudats (fig. 8-9).

eFig. 8-1 Œdème focal localisé.

Fig. 8-7 Exsudats à disposition radiaire.
OM sévère, associé à de nombreux exsudats en couronne. Les exsudats centraux ont une disposition radiaire due à leur précipitation dans la couche des fibres de Henlé.
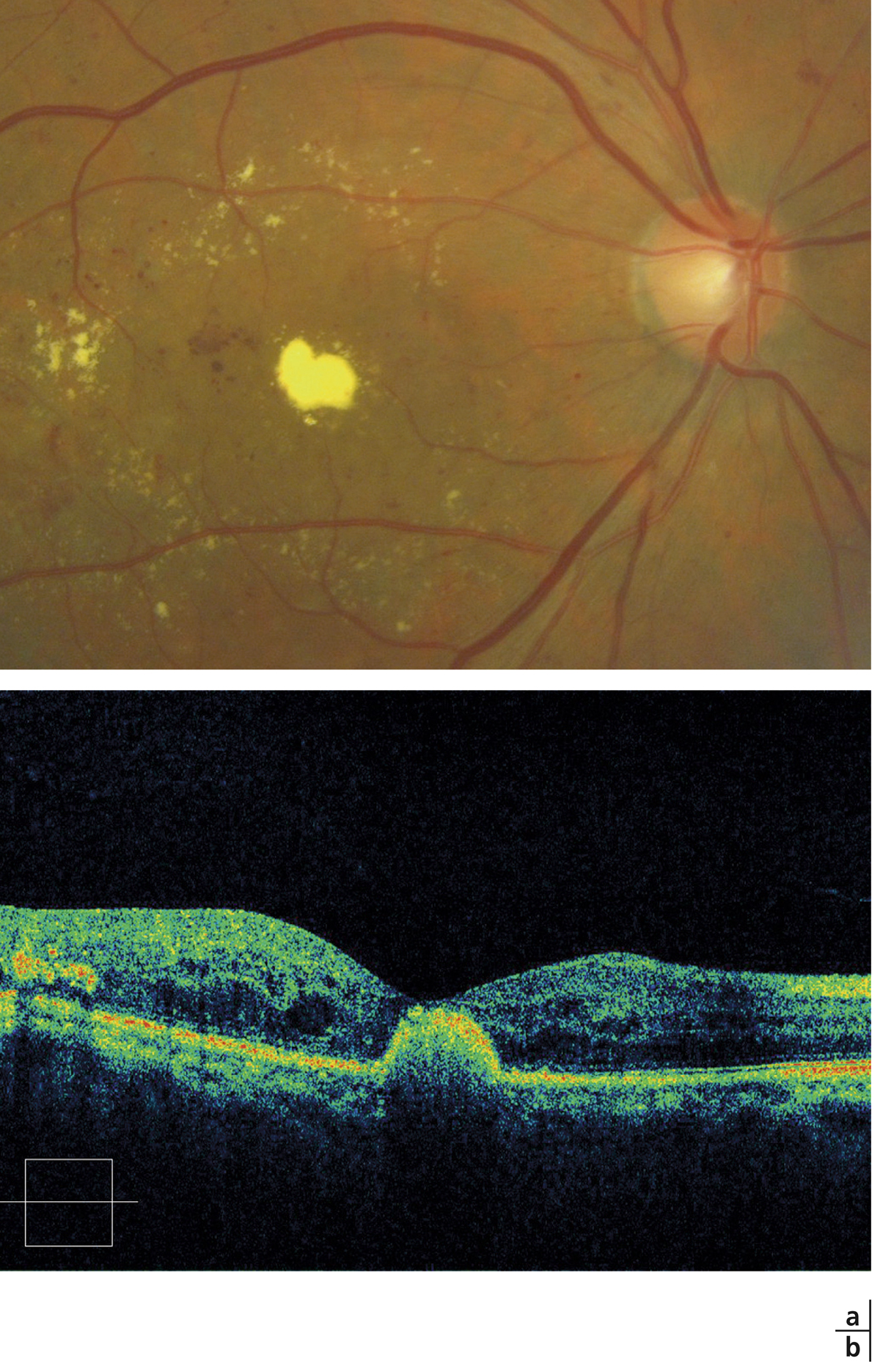
Fig. 8-8 Placard exsudatif sous-fovéolaire.
a. Photographie en couleurs : placard exsudatif centromaculaire associé à des exsudats en couronne autour de la fovéa. b. La coupe OCT montre que les exsudats centraux forment une lésion sous-rétinienne hyper-réflective. La rétine en regard est atrophique. Le pronostic fonctionnel est péjoratif.
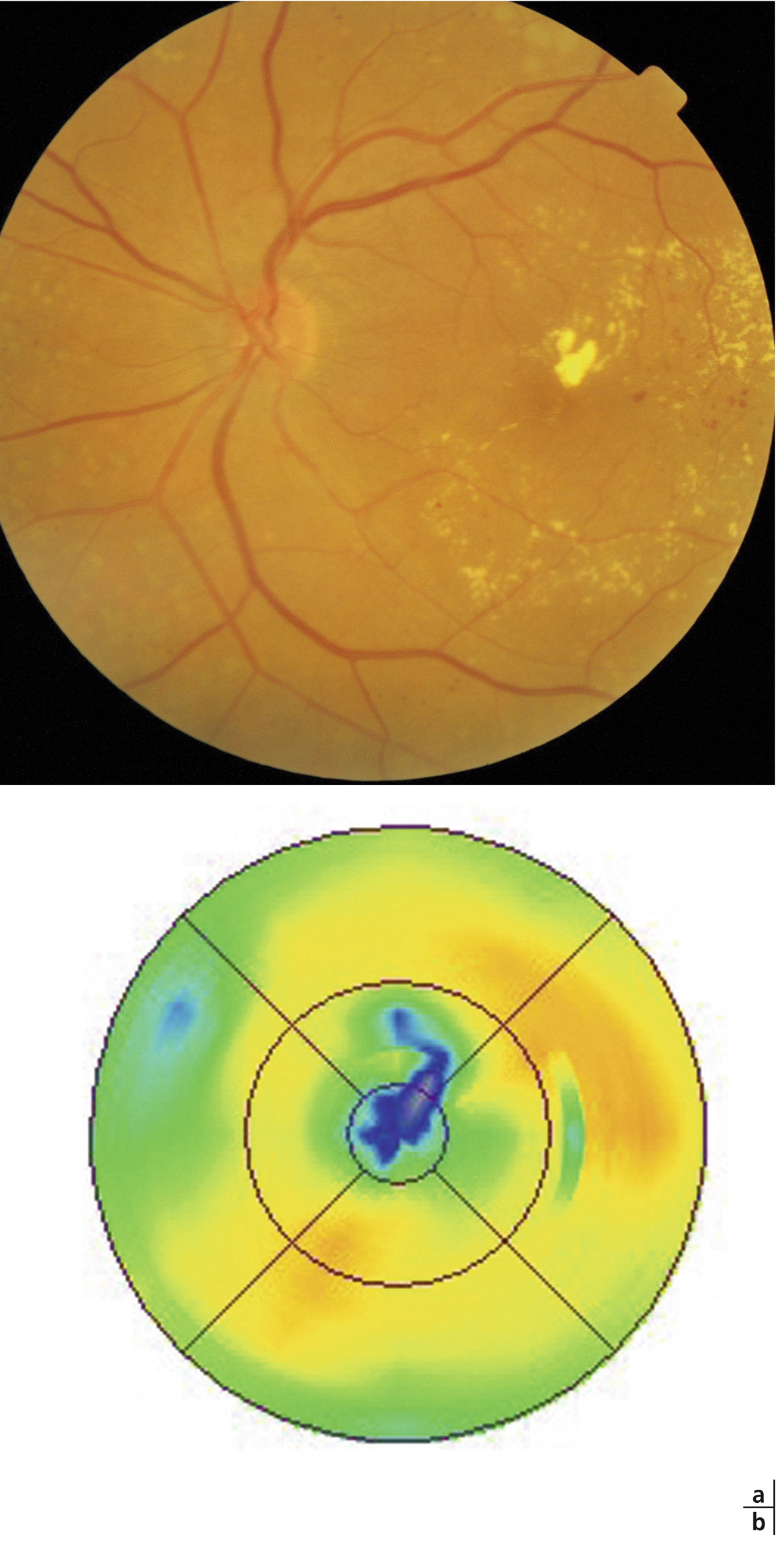
Fig. 8-9 Exsudation secondaire à la résorption d’un œdème maculaire.
a. Photographie en couleurs : 2 semaines après une injection intravitréenne de corticoïdes, des exsudats sont apparus dans la macula. b. La cartographie objective la disparition de l’OM. Il s’agit d’exsudats de résorption qui ont précipité lors de la réabsorption de l’œdème.
eFig. 8-2 Œdème maculaire focal associé à un faible épaississement rétinien.
L’examen du fond d’œil va permettre de mettre en évidence un certain nombre d’éléments sémiologiques caractéristiques de la rétinopathie diabétique (RD), faisant partie de l’OM ou associés à celui-ci :
-
les micro-anévrismes sont les premiers signes ophtalmoscopiques de la RD et sont toujours présents en cas d’OMD. Ils correspondent à de petites lésions arrondies rouges, de diamètre variable pouvant aller de 10 à 100 μ (fig. 8-5 à 8-7). Leur nombre est souvent sous-estimé cliniquement, par rapport à l’examen angiographique qui en met souvent beaucoup plus en évidence. Dans la majorité des cas, leur nombre augmente avec le temps mais certains peuvent s’occlure spontanément et disparaître ; on constate ainsi un certain degré de turn-over des micro-anévrismes. Leur paroi peut rester imperméable comme celle des capillaires rétiniens normaux ou devenir perméable, du fait des altérations cellulaires pariétales, aboutissant à un œdème localisé que l’on qualifie alors de focal. Cette zone d’œdème peut être bordée d’exsudats et l’on parlera alors de formation circinée (fig. 8-5) ;
-
des micro-hémorragies sont également souvent présentes dans la région maculaire chez les patients porteurs d’OMD. On distingue plusieurs types d’hémorragies :
-
des hémorragies punctiformes, lésions arrondies rouges, de petite taille (moins de 200 μ), bien limitées, parfois difficiles à différencier des micro-anévrismes (fig. 8-6),
-
des hémorragies en taches, de plus grand diamètre, volontiers irrégulières, situées plus profondément dans la rétine (voir fig. 8-12),
-
des hémorragies en flammèches superficielles situées au niveau des fibres optiques, souvent en rapport avec l’existence d’une hypertension artérielle associée au diabète (fig. 8-10). Les hémorragies disparaissent spontanément et sont des témoins de la maladie vasculaire sous-jacente ;
-
-
des nodules cotonneux peuvent être présents chez certains patients au niveau du pôle postérieur (fig. 8-11). Ils peuvent exister dans un tableau d’OMD sans toutefois faire partie intégrante de la sémiologie de l’œdème. Ils apparaissent sous forme d’une petite zone blanchâtre avec un épaississement localisé des fibres optiques. Ils correspondent à un œdème localisé des fibres optiques et sont le témoin d’une occlusion des artérioles précapillaires du pôle postérieur. Une localisation péripapillaire des nodules cotonneux doit faire évoquer une rétinopathie hypertensive associée (fig. 8-10 ; voir plus loin chapitre 8.8) ;
-
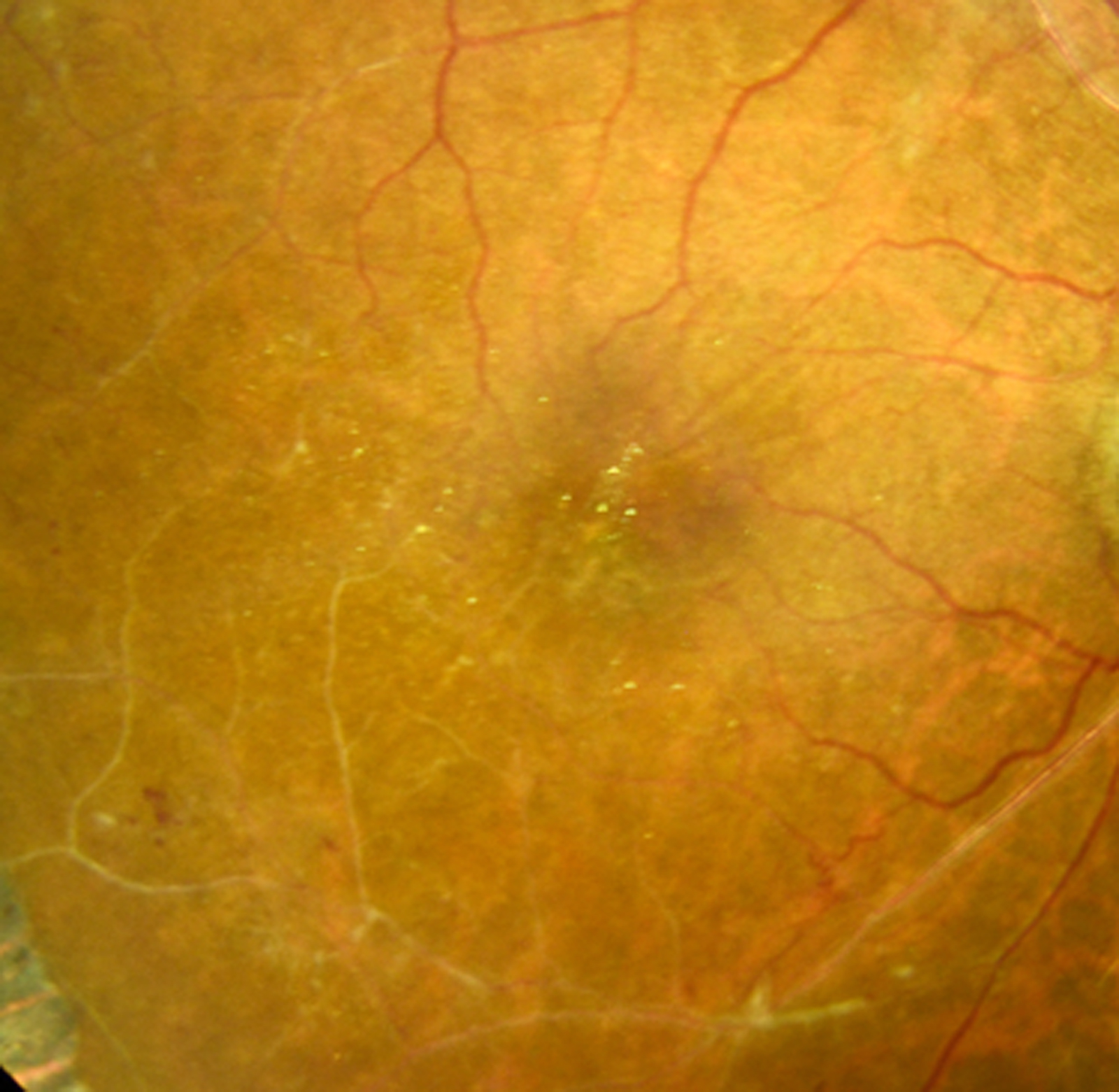
toutes les anomalies vasculaires liées à la RD peuvent aussi être présentes au pôle postérieur et dans la région maculaire : anomalies veineuses, tortuosités ou boucles, anomalies microvasculaires intrarétiniennes, modifications capillaires avec dilatation, néovaisseaux prérétiniens et/ou prépapillaires. Des occlusions capillaires peuvent survenir durant l’évolution de la RD, parallèlement à leur hyperperméabilité génératrice de l’œdème. Cette raréfaction capillaire au sein de l’aire maculaire se traduit en angiographie par un aspect irrégulier de la maille capillaire maculaire et de la zone avasculaire centrale qui s’élargit progressivement. On parle de maculopathie ischémique (eFig. 8-3
 ) lorsqu’il existe une occlusion étendue des capillaires de la région maculaire avec un doublement du diamètre de la zone avasculaire centrale en angiographie. Elle peut être suspectée à l’examen biomicroscopique devant la constatation au pôle postérieur de vaisseaux artériolaires occlus, blancs et/ou la présence d’hémorragies rétiniennes en taches, profondes. Il est très important de la prendre en compte, car elle est souvent associée à un pronostic fonctionnel réservé.
) lorsqu’il existe une occlusion étendue des capillaires de la région maculaire avec un doublement du diamètre de la zone avasculaire centrale en angiographie. Elle peut être suspectée à l’examen biomicroscopique devant la constatation au pôle postérieur de vaisseaux artériolaires occlus, blancs et/ou la présence d’hémorragies rétiniennes en taches, profondes. Il est très important de la prendre en compte, car elle est souvent associée à un pronostic fonctionnel réservé.
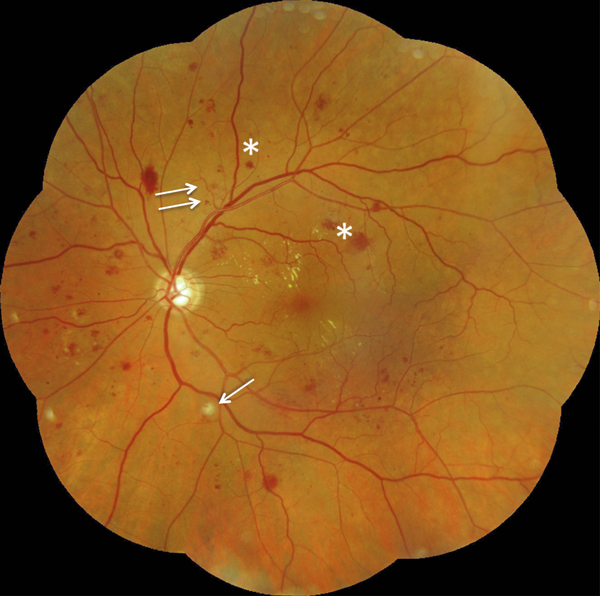
Fig. 8-12 Rétinopathie diabétique non proliférante sévère.
Photographie en couleurs panoramique de la macula. On observe deux zones d’OM focal, à distance du centre de la macula, entourées d’exsudats. L’OM est associé à de nombreux micro-anévrismes et hémorragies rétiniennes ponctiformes, mais aussi à : des hémorragies en taches (*), un nodule cotonneux (flèche), des AMIR (double flèche) et une dilatation veineuse. La photographie objective l’ischémie rétinienne sévère qui se manifeste surtout par de nombreuses hémorragies en taches dans les quatre quadrants de la périphérie rétinienne.
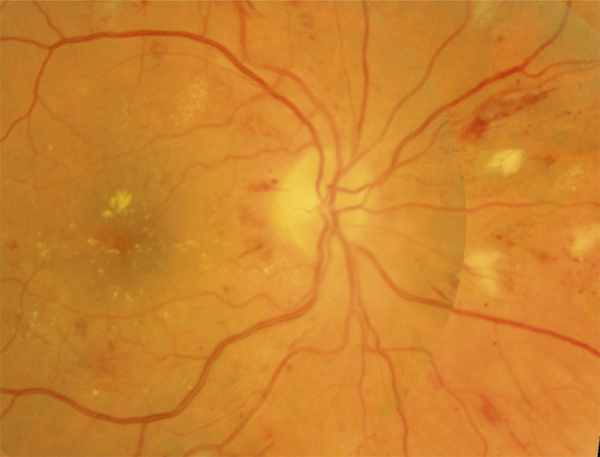
Fig. 8-10 Rétinopathie hypertensive.
L’OM est associé à des hémorragies en flammèches péripapillaires et à des nodules cotonneux témoignant d’une rétinopathie hypertensive associée à la rétinopathie diabétique.

Fig. 8-11 Nodules cotonneux.
On observe sur la photographie en couleurs une zone d’œdème focal modéré temporomaculaire, associé à quelques nodules cotonneux.
eFig. 8-3 Ischémie maculaire.
Un examen attentif du segment antérieur est toujours réalisé avant dilatation pupillaire à la recherche d’une rubéose irienne.
L’examen biomicroscopique, réalisé ensuite après dilatation pupillaire maximale, permet d’évaluer la sévérité de la RD associée à l’OM. Il est réalisé à l’aide de lentilles sans contact type Superfield® (Volk), ou lentilles non-contact de 60, 78 ou 90 dioptries. Il évalue la présence et le nombre des lésions de la RD en moyenne périphérie rétinienne, cette évaluation étant considérablement facilitée par la réalisation systématique des photographies. L’examen biomicroscopique permet aussi d’examiner l’extrême périphérie rétinienne, non accessible sur les photographies en couleurs standard, révélant parfois des lésions rétiniennes dont la présence pourrait témoigner de la sévérité de la RD [2].
L’examen biomicroscopique apprécie enfin l’état du vitré. Il recherche : un décollement complet du vitré attesté par la présence d’un anneau de Weiss ; la présence d’adhérences vitréomaculaires, d’une hyaloïde postérieure épaissie ou d’une membrane épimaculaire qui seront analysées plus finement par l’OCT.
La photographie du fond d’œil est le complément indispensable à l’examen biomicroscopique du fond d’œil. Elle est plus sensible que l’examen biomicroscopique du fond d’œil pour détecter et quantifier les signes de RD.
Un OM peut être suspecté devant la présence d’exsudats au pôle postérieur ou de logettes cystoïdes. Lors des premières études cliniques, la présence et la sévérité de l’OM étaient appréciées sur des photographies stéréoscopiques du pôle postérieur. Elles sont avantageusement remplacées actuellement par l’examen par OCT.
Un panoramique photographique complet du fond d’œil est indispensable, comprenant une photographie du pôle postérieur et huit clichés de la périphérie rétinienne, réalisés après dilatation pupillaire (fig. 8-12). La photographie du fond d’œil permet de visualiser les différents signes de la RD et de quantifier l’ischémie rétinienne périphérique. La gravité de cette dernière est estimée par le nombre et la sévérité de signes cliniques aisément reconnaissables sur les photographies du fond d’œil tels que :
-
les hémorragies intrarétiniennes « en taches » (fig. 8-12) ;
-
les anomalies veineuses à type de dilatation veineuse irrégulière « en chapelet » ou de boucles veineuses (fig. 8-13) ;
-
les AMIR (fig. 8-13) ;
-
les néovaisseaux prérétiniens ou prépapillaires (fig. 8-14).
L’examen par photographies du fond d’œil permet ainsi de quantifier la sévérité de la RD selon la classification rappelée au tableau 8-5 [3].
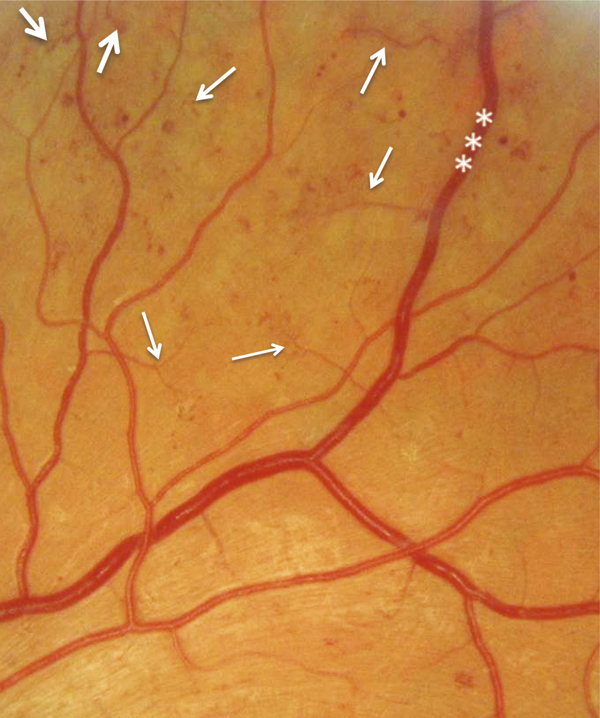
Fig. 8-13 Ischémie rétinienne périphérique sévère.
On observe de nombreux AMIR (flèches) et des anomalies veineuses en chapelet (*) associées à de nombreux micro-anévrismes et hémorragies rétiniennes.
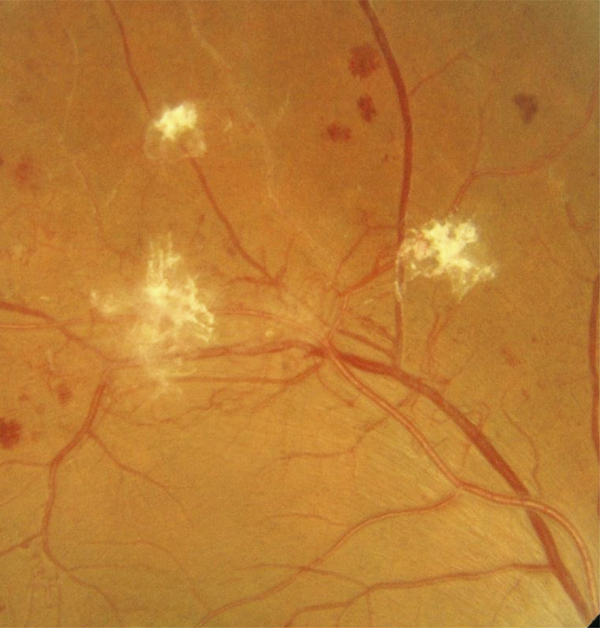
Fig. 8-14 Néovaisseaux prérétiniens.
Les néovaisseaux prérétiniens associés à une lame de fibrose prérétinienne sont bien visibles. Ils se sont développés à la limite postérieure des zones d’ischémie rétinienne, au niveau desquelles on observe les vaisseaux artériels déshabités et quelques hémorragies rétiniennes en taches.
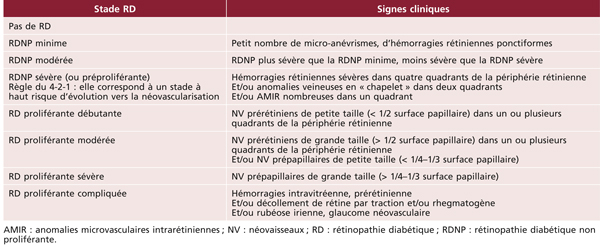
Tableau 8-5 Classification de la RD.
[1] Shahidi M, Ogura Y, Blair NP, et al. Retinal thickness analysis for quantitative assessment of diabetic macular edema. Arch Ophthalmol 1991 ; 109 : 1115-9.
[2] Silva PS, Dela Cruz AJ, Ledesma MG, et al. Diabetic retinopathy severity and peripheral lesions are associated with nonperfusion on ultrawide field angiography. Ophthalmology 2015 ; 122 : 2465-72.
[3] Wilkinson CP, Ferris III FL, Klein RE, et al. representing the Global Retinopathy Project Group. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales. Ophthalmology 2003 ; 110 : 1677-82.
J. Leid
Bien que non pathognomoniques, on retrouve avec une fréquence particulière certains types de dyschromatopsies acquises (DA) dans les œdèmes maculaires du diabète.
Il est très fréquent que l’OM débute dans la rétinopathie diabétique par de petites logettes périfovéolaires. Dans ce cas, les patients qui présentaient le plus souvent déjà une DA de type III voient s’y superposer une DA d’axe rouge-vert le plus souvent de type I, c’est la pseudoprotanomalie. Elle marque un tournant dans la rétinopathie diabétique.
Les œdèmes chroniques évoluant vers une atrophie maculaire relative étendue provoquent, à terme, des DA à type d’achromatopsie acquise caractérisées par des axes scotopiques au Panel D15.
Ce type de DA se rencontre aussi dans les rétinopathies œdémateuses asséchées et stabilisées, anciennement traitées par des photocoagulations laser en grilles périfovéolaires étendues.
On retiendra surtout l’extraordinaire labilité de la vision des couleurs tout au long des traitements par injection intravitréenne d’anti-VEGF. La vision des couleurs marque le plus souvent parfaitement l’évolution de l’œdème avec, éventuellement, un aspect prédictif du devenir au long cours de la pathologie. La vision des couleurs se révèle un adjuvant précieux pour juger du protocole à poursuivre chez ces patients et de l’espacement des injections. L’apparition d’un axe scotopique durable semble notamment préfigurer une stabilisation, au moins à moyen terme, par atrophie relative compatible toutefois avec une acuité visuelle correcte.
Monsieur MR, né en 1942, diabétique depuis 1963, a vu son acuité de l’œil gauche chuter de 5/10 à 2/10 rapidement en 2013–2014, en raison d’un OM. Il présentait une rétinopathie non proliférante modérée avec quelques micro-anévrismes et avait eu en 2003 un traitement focal paramaculaire. L’ensemble donnait une DA de type III tritan. Trois injections intravitréennes (IVT) ont permis un affaissement progressif de l’OM avec remontée de l’acuité et passage à un axe scotopique signant une stabilisation par atrophie et autorisant un espacement des IVT (fig. 8-15).
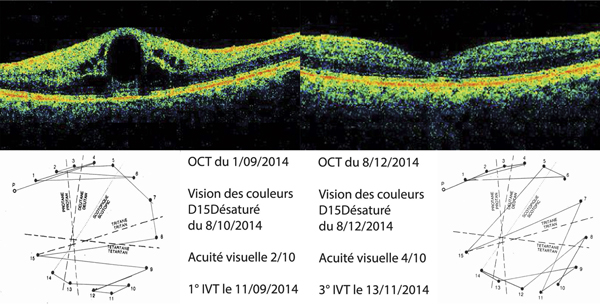
Fig. 8-15 Œdème maculaire diabétique. Évolution de l’OCT après trois IVT.
Affaissement de la macula et parallèlement passage d’une DA de type III à une achromatopsie acquise (Panel 15D).
Monsieur JZ, né en 1944, diabétique depuis 1953, porteur d’une rétinopathie diabétique ancienne très sévère bilatérale exsudative et proliférative, a eu plusieurs hémorragies intravitréennes bilatérales ayant nécessité des vitrectomies. Le patient, pseudophake bilatéral avec un diabète très instable, passe de 7/10 à 2/10 sur son œil droit entre 2011 et 2013 avec un important œdème maculaire. Une première IVT de ranibizumab, réalisée est suivie de huit IVT en 1 an. Le patient retrouve 5/10 malgré une rechute temporaire. Au départ, on note une DA de type III sévère sans axe rouge-vert avec passage transitoire vers un axe scotopique lors de la rechute puis vers une pseudoprotanomalie avec l’amélioration (fig. 8-16).

Fig. 8-16 Œdème maculaire diabétique. Évolution de l’OCT après huit IVT.
Affaissement de l’œdème et passage d’une DA de type III à une pseudoprotanomalie.
P. Massin, S. Dumas, A. Erginay
➤ L’angiographie à la fluorescéine permet une analyse fine des modifications des capillaires rétiniens liées au diabète (micro-angiopathie diabétique).
➤ On peut distinguer trois stades de micro-angiopathie : un stade infraclinique, un stade de micro-angiopathie débutante et la maculopathie diabétique (ou micro-angiopathie sévère).
➤ La micro-angiopathie débutante associe occlusions capillaires, micro-anévrismes, hémorragies ponctuées superficielles et diffusions.
➤ La maculopathie diabétique (ou micro-angiopathie diabétique sévère) est caractérisée par la présence d’occlusions capillaires et de diffusions sévères, à l’origine d’une ischémie rétinienne maculaire (maculopathie ischémique) ou d’un OM menaçant la vision.
➤ Une diffusion de fluorescéine sans épaississement rétinien n’est pas un œdème.
➤ L’œdème peut être affirmé devant la constatation de logettes cystoïdes sur les clichés tardifs de l’angiographie.
➤ L’angiographie à la fluorescéine est avant tout un outil de bilan de l’OMD puisque le diagnostic de l’OM repose sur la constatation d’un épaississement maculaire en OCT. L’angiographie permet de préciser l’origine des diffusions et de préciser le degré d’occlusion des capillaires maculaires associée à l’œdème, facteur de pronostic fonctionnel important.
L’angiographie à la fluorescéine (AF) a été pendant longtemps le seul examen de diagnostic et d’évaluation de la sévérité de la RD. Elle a été remplacée en partie par les photographies du fond d’œil, moins invasives, pour l’évaluation de l’ischémie rétinienne périphérique (voir plus haut chapitre 8.3), mais elle garde encore toute sa place dans l’évaluation de la perfusion maculaire. En effet, elle a été pendant longtemps le seul examen permettant une analyse fine des modifications des capillaires rétiniens liées au diabète, notamment au niveau de la macula. Il est néanmoins possible qu’elle soit supplantée prochainement par l’angio-OCT (voir plus loin et voir chapitre 5.2).
L’angiographie permet de suivre avec précision l’histoire naturelle de la micro-angiopathie diabétique. On peut distinguer schématiquement trois stades : un stade infraclinique, un stade de micro-angiopathie débutante et la maculopathie diabétique (ou micro-angiopathie sévère).
Les premiers signes de la micro-angiopathie diabétique surviennent au niveau du pôle postérieur, principalement de la maille capillaire périfovéolaire. L’angiographie à la fluorescéine permet de mettre en évidence ces anomalies des capillaires rétiniens liées au diabète, avant que n’apparaissent les premiers signes ophtalmoscopiques de la RD. La micro-angiopathie diabétique se manifeste précocement par une dilatation des capillaires rétiniens, parfois associée à des diffusions de fluorescéine, notamment au niveau du pôle postérieur. Ces diffusions sont habituellement transitoires et peuvent se manifester lors de la rééquilibration glycémique de début de diabète [1]. Toutefois, si l’angiographie est intéressante à ce stade au plan physiopathogénique, elle n’a pas d’intérêt clinique, ces anomalies initiales n’ayant pas de retentissement sur la vision, ni de valeur pronostique de l’évolution future de la RD.
Lorsqu’elle s’aggrave, la micro-angiopathie diabétique se manifeste par l’association de plusieurs lésions : occlusions capillaires, micro-anévrismes, hémorragies ponctuées superficielles et diffusions (fig. 8-17 à 8-19). Initialement peu nombreuses, elles vont augmenter progressivement avec l’aggravation de la micro-angiopathie. Si ces lésions sont caractéristiques de la micro-angiopathie diabétique, elles ne sont pas spécifiques et peuvent être retrouvées dans d’autres étiologies (hypertension artérielle, occlusion veineuse, rétinopathie radique, etc.). Des nodules cotonneux peuvent être également présents.
Les occlusions capillaires apparaissent volontiers au sein de l’arcade anastomotique périfovéolaire, donnant un aspect irrégulier à la zone avasculaire centrale, et entraînant un agrandissement des espaces intercapillaires maculaires (fig. 8-18 et 8-19). L’extension des zones d’occlusion capillaire résulte en un agrandissement progressif de la zone avasculaire centrale (ZAC).
Les micro-anévrismes se développent habituellement au bord d’un micro-territoire de non-perfusion capillaire (fig. 8-18 et 8-19). Ils constitueraient une réponse proliférative à une hypoxie localisée. Ils prédominent au pôle postérieur. En AF, ils apparaissent sous forme de lésions punctiformes hyperfluorescentes, à bords nets, dont la fluorescence est maximale au temps artérioveineux. Ils apparaissent souvent plus nombreux en angiographie qu’à l’examen du fond d’œil. La paroi du micro-anévrisme peut être imperméable à la fluorescéine ou au contraire la laisser diffuser aux temps tardifs de l’angiographie.
Le micro-anévrisme est parfois difficile à distinguer en ophtalmoscopie d’une hémorragie rétinienne ponctiforme. L’angiographie permet cette distinction, le micro-anévrisme apparaissant hyperfluorescent, alors que l’hémorragie rétinienne reste sombre. Néanmoins, cette distinction n’a pas d’importance clinique, puisque c’est le nombre global de micro-anévrismes et d’hémorragies rétiniennes qui est le principal marqueur de la sévérité de la rétinopathie diabétique.
Les micro-anévrismes peuvent s’occlure spontanément, mais sont souvent alors remplacés par d’autres micro-anévrismes. L’augmentation progressive du nombre des micro-anévrismes est un bon indice de progression de la RD [2]. Par ailleurs, la vitesse du turn-over des micro-anévrismes au pôle postérieur serait un critère prédictif d’évolution vers la maculopathie [3].
Le nodule cotonneux apparaît en angiographie sous forme d’une zone hypofluorescente, à la fois par masquage, lié à l’opacification blanche des axones par le matériel axoplasmique, et par non-perfusion capillaire secondaire à l’occlusion d’une artériole précapillaire (fig. 8-20). Aux temps tardifs de l’angiographie, l’aspect est variable : lorsque le nodule cotonneux est récent, il y a peu de coloration tardive ; lorsqu’il est plus ancien, il y a souvent dilatation des capillaires de voisinage avec coloration tardive par les bords.
Les diffusions de fluorescéine traduisent la rupture de la BHR interne et la perméabilité anormale qui en résulte. Elles sont visibles sur les clichés tardifs de l’angiographie (fig. 8-19 et 8-21). Ces diffusions peuvent provenir d’anomalies localisées (on peut les appeler alors focales) comme les micro-anévrismes ou, à un stade plus évolué, d’AMIR ou être plus étendues, mal définies, à partir de la paroi des capillaires rétiniens devenus perméables. Ces diffusions angiographiques ne sont pas synonymes d’œdème (fig. 8-21). En effet, l’état d’hydratation de la rétine est la résultante de phénomènes dynamiques très actifs : tant que les fluides qui diffusent dans la rétine sont réabsorbés efficacement, grâce aux mécanismes de déshydratation (épithélium pigmentaire, cellules de Müller), il n’y a pas d’accumulation de liquide dans le tissu rétinien et donc, pas d’œdème. C’est seulement lorsqu’apparaissent des logettes cystoïdes en angiographie (voir ci-dessous) que l’on peut parler d’œdème.
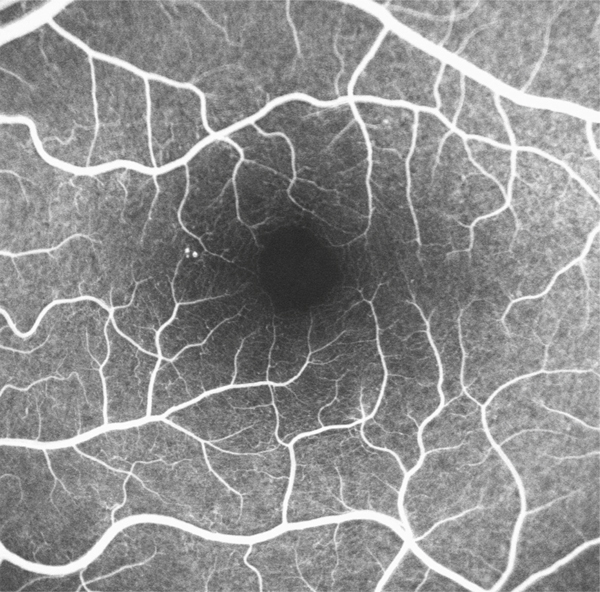
Fig. 8-17 Micro-angiopathie diabétique débutante, fort grossissement sur la maille capillaire.
On note une dilatation des capillaires maculaires et une petite irrégularité du contour de la zone avasculaire centrale (ZAC).
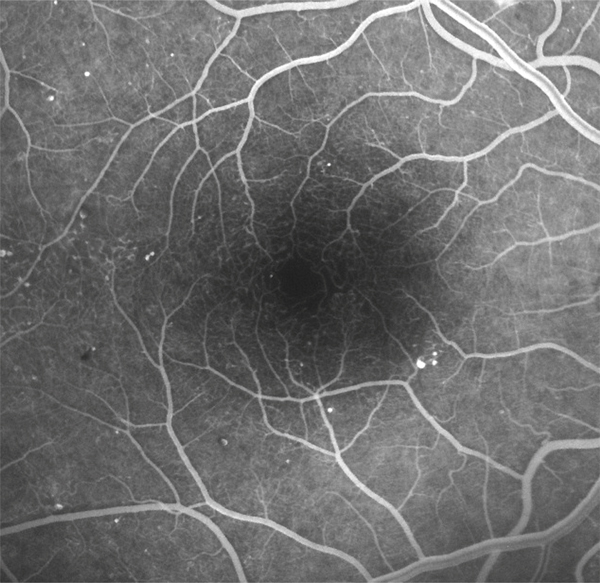
Fig. 8-18 Micro-angiopathie diabétique à un stade plus évolué.
Les occlusions capillaires sont à l’origine d’une irrégularité des contours de la ZAC et d’une augmentation des espaces intercapillaires, mais la surface de la ZAC garde un diamètre normal. L’acuité visuelle est normale. On note quelques micro-anévrismes ainsi que des AMIR en temporal du pôle postérieur.
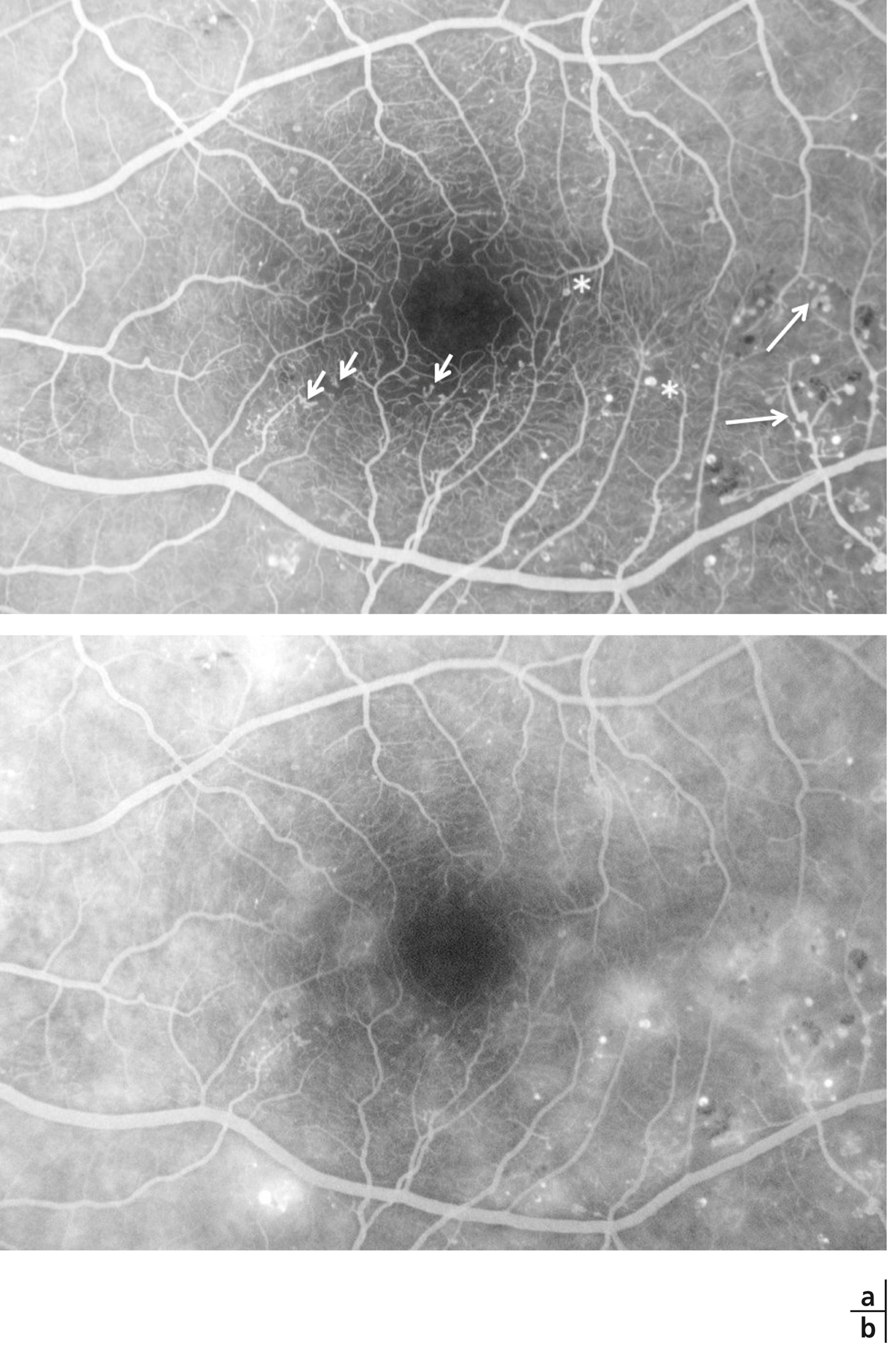
Fig. 8-19 Micro-angiopathie diabétique associée à des AMIR.
Pôle postérieur (a). Au temps artérioveineux, il existe une dilatation importante des capillaires maculaires, associée à une petite irrégularité du contour de la ZAC et une augmentation des espaces intercapillaires. Les micro-anévrismes (*) et les AMIR (flèches) se sont développés sur les bords des zones de non-perfusion capillaire. Il existe des territoires de non-perfusion en temporal du pôle postérieur, bordés également d’AMIR (flèches). Au temps tardif, il existe des diffusions de fluorescéine à partir des micro-anévrismes, des AMIR et, à un moindre degré, des capillaires dilatés (b).
(Clichés du Dr G. Quentel.)
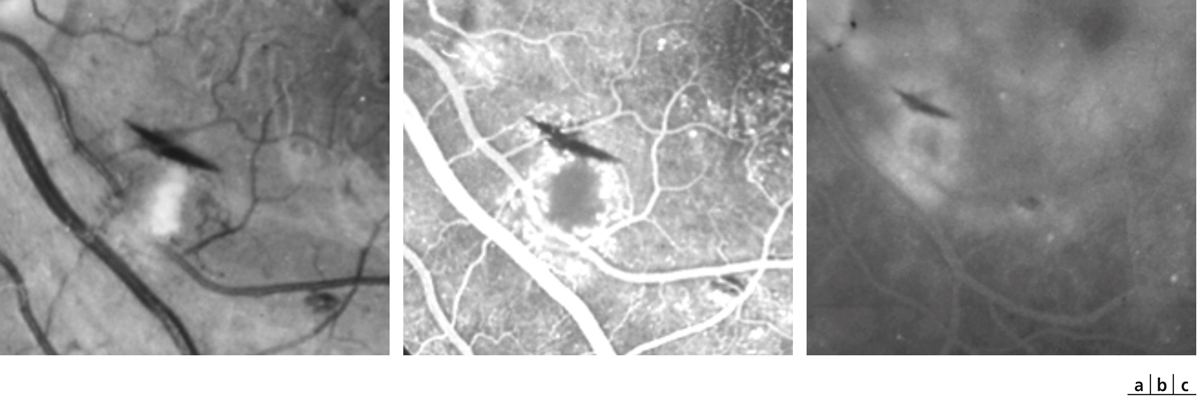
Fig. 8-20 Nodule cotonneux.
a. Cliché anérythre. Le nodule cotonneux a un aspect blanc, duveteux. Son axe est perpendiculaire au faisceau des fibres optiques. On note un déficit arciforme correspondant aux fibres optiques atrophiques. Le nodule cotonneux est associé à une hémorragie en flammèche. b. Temps artérioveineux de l’angiographie. Il existe une hypofluorescence par masquage par le matériel axoplasmique, mais aussi par non-perfusion dans le territoire du nodule cotonneux (occlusion d’une artériole). Les capillaires sur les bords du nodule cotonneux sont dilatés et irréguliers et il existe une prolifération d’AMIR. c. Temps tardif. Diffusion de fluorescéine à partir des capillaires dilatés et des AMIR.
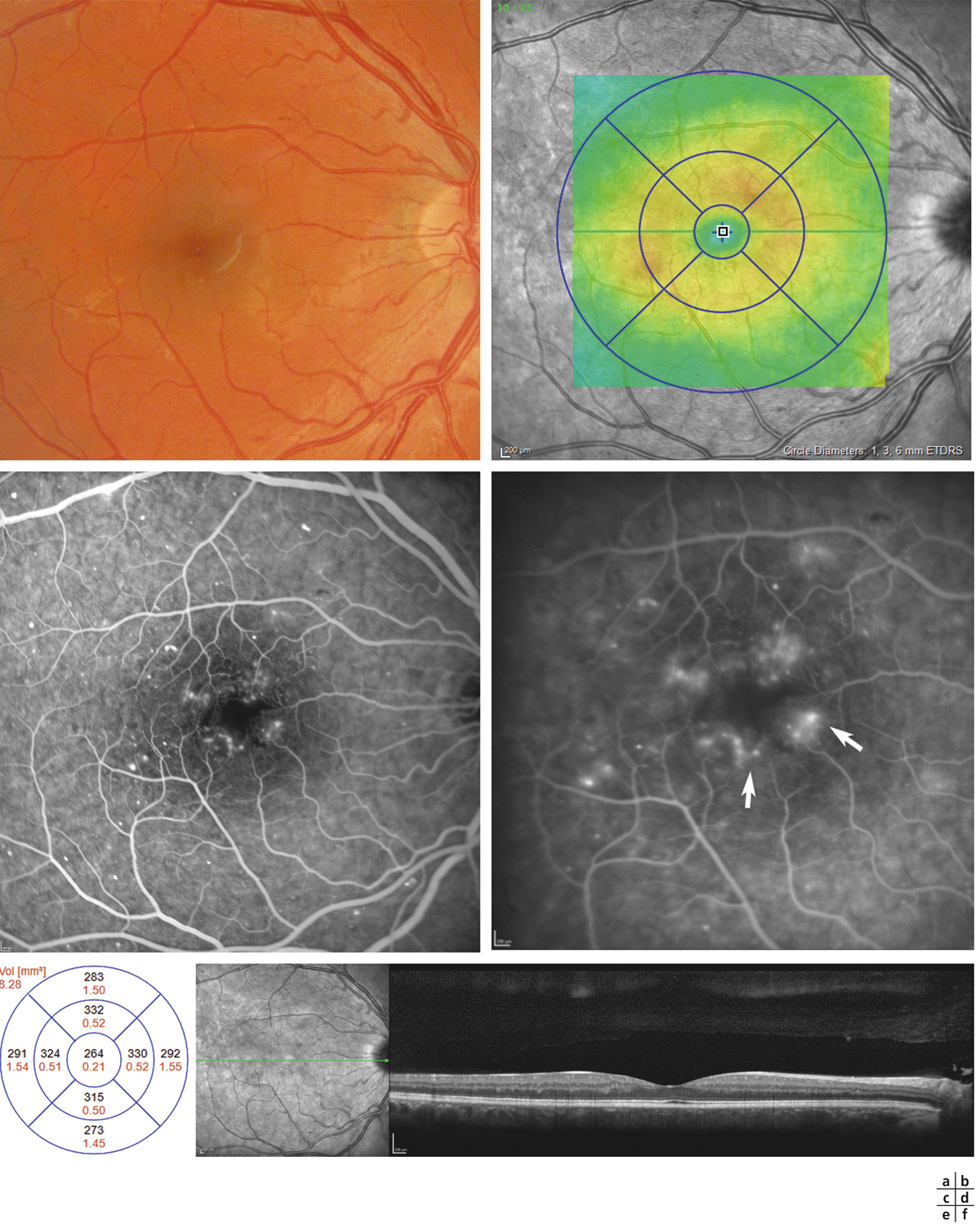
Fig. 8-21 Diffusion de fluorescéine sans œdème maculaire.
Le fond d’œil ne montre aucun signe d’OM, pas d’exsudat ni d’épaississement central visible (a). Le mapping a un aspect normal (b). On note pourtant une diffusion angiographique (d, flèches) au cours de la séquence (c, temps précoce ; d, temps tardif). L’épaisseur centrale est normale à 264 μ (e) ; le profil maculaire est également normal (f).
On parle de maculopathie diabétique lorsque les occlusions capillaires et diffusions sont sévères et à l’origine d’une ischémie rétinienne maculaire ou d’un OM menaçant la vision.
L’ischémie maculaire est la résultante d’une occlusion étendue des capillaires maculaires. On parle de maculopathie ischémique lorsque la ZAC est agrandie avec un diamètre horizontal supérieur à plus de deux fois son diamètre normal, soit 2 fois 500 μm (fig. 8-22 à 8-24 et voir fig. 5-54). Bresnick a montré que la vision ne commençait à s’altérer que lorsque le diamètre de la zone avasculaire centrale était supérieur à 1000 μm [4].
Des proliférations d’AMIR sur les bords de la zone avasculaire centrale peuvent s’observer (fig. 8-22 et 8-23) ; celles-ci ne doivent pas être confondues avec des micro-anévrismes. Ce sont des anomalies vasculaires, de petit calibre, de forme irrégulière, prenant un aspect en « bourgeons » ou en « tortillons ». En angiographie, elles apparaissent sous forme d’un bourgeonnement vasculaire se développant à partir de la paroi d’une veinule, au sein d’un territoire de non-perfusion capillaire, voire artériolaire. Leur paroi laisse diffuser modérément ou non la fluorescéine. Elles constituent une réponse néovasculaire à l’ischémie locale.
D’autres lésions témoignant de la souffrance ischémique de la rétine peuvent siéger au pôle postérieur, telles que des hémorragies en taches, de plus grande taille et plus profondes que les hémorragies ponctiformes (fig. 8-24), des anomalies veineuses en chapelet. Celles-ci, appelées également veines moniliformes, représentent des segments de veinules ou de veines rétiniennes dilatées associées à des zones de rétrécissement veineux. Elles sont bien visibles en ophtalmoscopie et représentent des signes indirects d’ischémie rétinienne. En angiographie, leur paroi est souvent hyperfluorescente.
Le développement de néovaisseaux prérétiniens dans la région maculaire est rare, mais possible. L’angiographie permet de détecter des néovaisseaux débutants qui pourraient échapper à l’examen du fond d’œil (fig. 8-23). Ils sont en général situés à proximité ou au bord postérieur des territoires de non-perfusion. Ils s’imprègnent dès le temps veineux précoce de l’angiographie et laissent diffuser le colorant de façon intense. Lorsque les néovaisseaux sont plus évolués, ils se composent de vaisseaux afférents et efférents et d’une frange de prolifération faite de néocapillaires. Ils sont habituellement en dérivation sur une veine ou une veinule. L’angiographie pourra aider à différencier les néovaisseaux prérétiniens débutants des AMIR qui restent intrarétiniennes et diffusent peu, mais ils sont souvent considérés comme étant des néovaisseaux intrarétiniens. L’angiographie peut également aider à diagnostiquer des néovaisseaux prépapillaires débutants qui se manifestent par une diffusion prépapillaire.
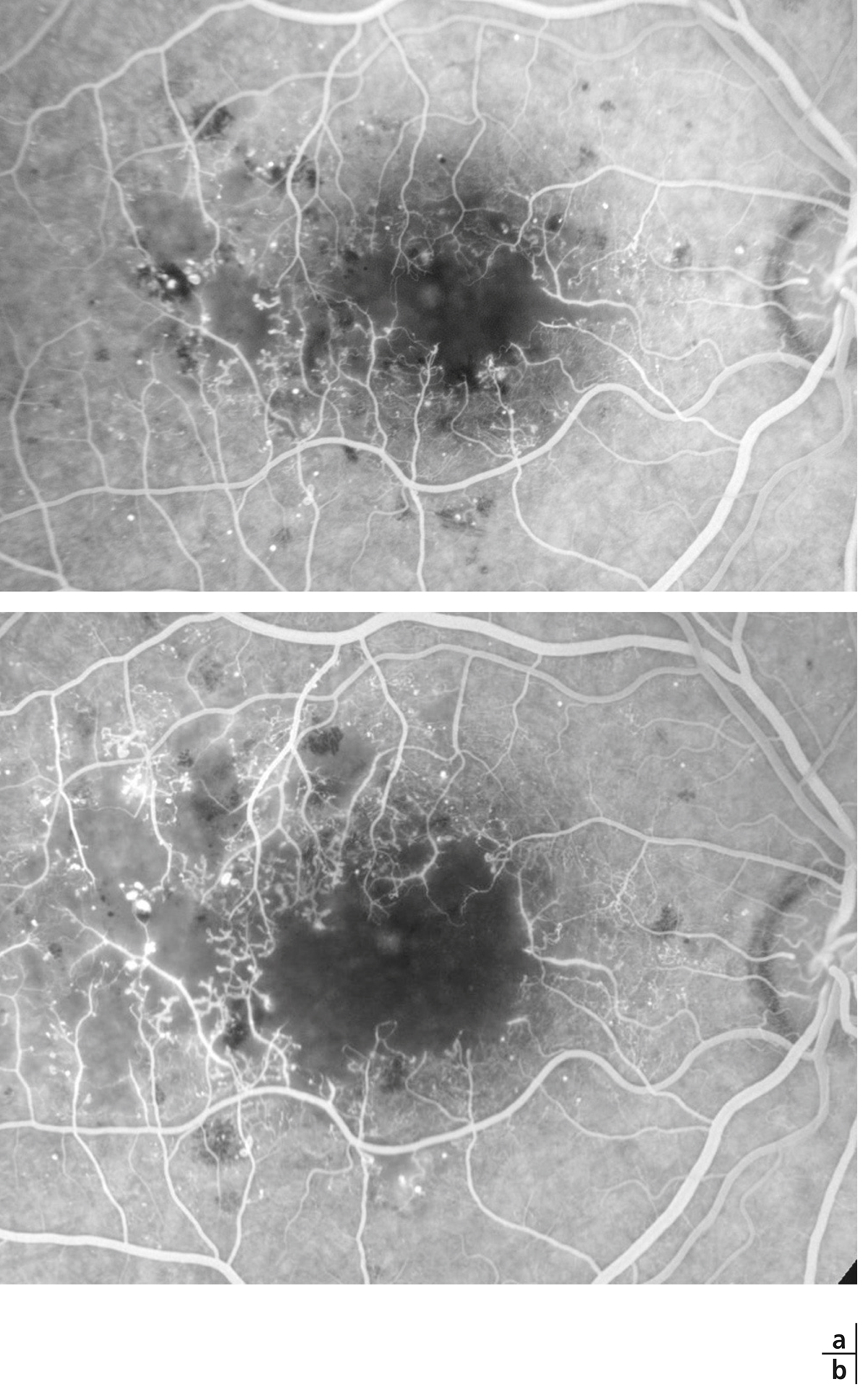
Fig. 8-22 Maculopathie ischémique. Évolution sur 2 ans.
a. Territoires de non-perfusion capillaire étendus, à l’origine d’un élargissement important de la zone avasculaire centrale. Le contour normal de la ZAC n’est plus discernable. On note de nombreuses proliférations d’AMIR au pourtour des territoires de non-perfusion. b. 2 ans plus tard, la maculopathie ischémique s’est aggravée avec une extension des zones de non-perfusion, notamment en temporal de la macula. L’acuité visuelle s’est effondrée.
(Clichés du Dr G. Quentel.)
Fig. 8-23 Maculopathie ischémique au cours d’une rétinopathie diabétique proliférante.
On note un agrandissement de la ZAC, la présence de nombreux micro-anévrismes et AMIR au pôle postérieur. Il existe une hyperfluorescence en temporal du pôle postérieur, correspondant à un néovaisseau prérétinien débutant.
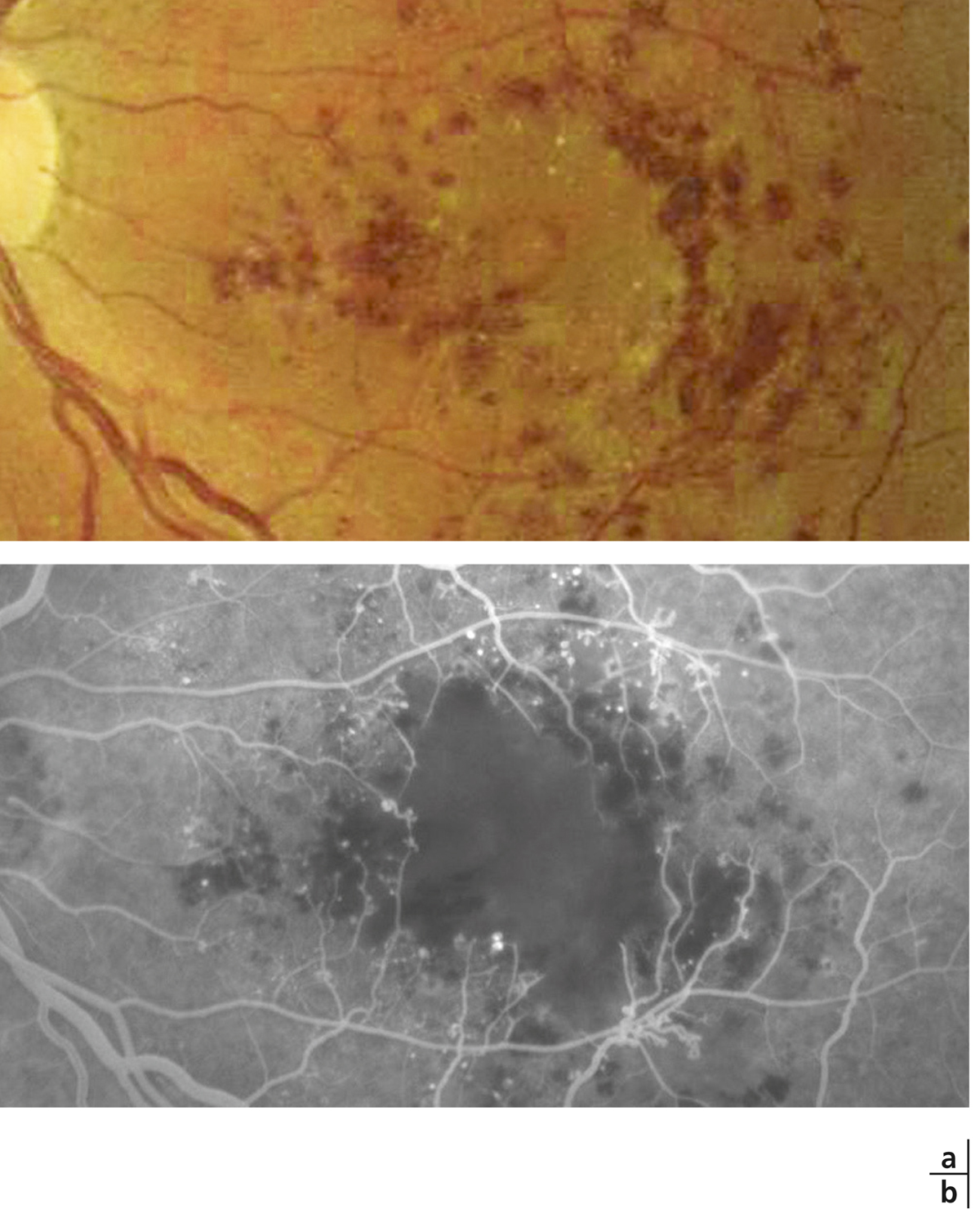
Fig. 8-24 Infarcissement hémorragique de la macula.
a. Cliché en couleurs. La maculopathie ischémique est suspectée dès l’examen clinique, devant la présence de nombreuses hémorragies profondes, en taches, dans la région maculaire. b. L’angiographie confirme la maculopathie ischémique majeure.
L’OM est avant tout défini par un épaississement de la rétine maculaire, diagnostiqué au mieux par l’OCT. Il est en général, dans la maculopathie diabétique, secondaire à une rupture de la BHR interne, et l’angiographie est utile pour identifier l’origine des diffusions de fluorescéine.
Celles-ci peuvent être focales à partir d’un ou de plusieurs micro-anévrismes ou AMIR. On peut parler à ce stade d’OM focal. Il est le plus souvent associé à des exsudats organisés en « couronne » autour des micro-anévrismes dont ils sont issus (qualifiés alors de circinés), mais les exsudats peuvent être absents (fig. 8-25 à 8-27). Cet œdème peut être minime, modéré ou sévère selon sa localisation par rapport au centre de la macula (voir plus loin chapitre 8.7). L’angiographie, qui permet de visualiser et localiser les micro-anévrismes à l’origine des diffusions, aidera à la décision thérapeutique. En effet, lorsque les micro-anévrismes à l’origine de l’OM modéré sont situés à plus de 1000 μ du centre de la macula, un traitement par laser peut être proposé ; en revanche, lorsque les micro-anévrismes sont plus proches, notamment au niveau de la maille capillaire fovéolaire, le laser doit être proscrit.
Les diffusions de fluorescéine peuvent provenir de la paroi des capillaires rétiniens et toucher tout le lit capillaire maculaire. Dans ce cas, il existe une hyperfluorescence diffuse du pôle postérieur ; en l’absence de logettes cystoïdes, on ne pourra parler d’œdème qu’en cas d’épaississement rétinien associé. En revanche, la visualisation de logettes cystoïdes, aux temps tardifs de l’angiographie, permet d’affirmer l’œdème (fig. 8-28 et 8-29) puisque ces logettes témoignent de l’accumulation de liquide dans le tissu rétinien. La présence d’une logette fovéolaire centrale est un élément de gravité. Les logettes peuvent réaliser une image en « pétales de fleur » (fig. 8-28) ou en « nids d’abeilles » (fig. 8-26 et 8-29) selon la localisation des kystes intrarétiniens. Les logettes centrales peuvent être diagnostiquées dès les temps précoces de l’angiographie par l’effet fenêtre que produit le refoulement du pigment jaune par ces logettes (voir chapitre 5.2).
Parfois, l’épaississement rétinien maculaire diagnostiqué en OCT ne s’accompagne que de discrètes diffusions de fluorescéine. Cela peut être le cas des OMD tractionnels : l’absence de diffusion aux temps tardifs confirme alors le rôle majeur de la composante tractionnelle aux dépens de la composante microvasculaire dans la genèse de l’œdème, et aide à poser l’indication d’une vitrectomie (fig. 8-30).
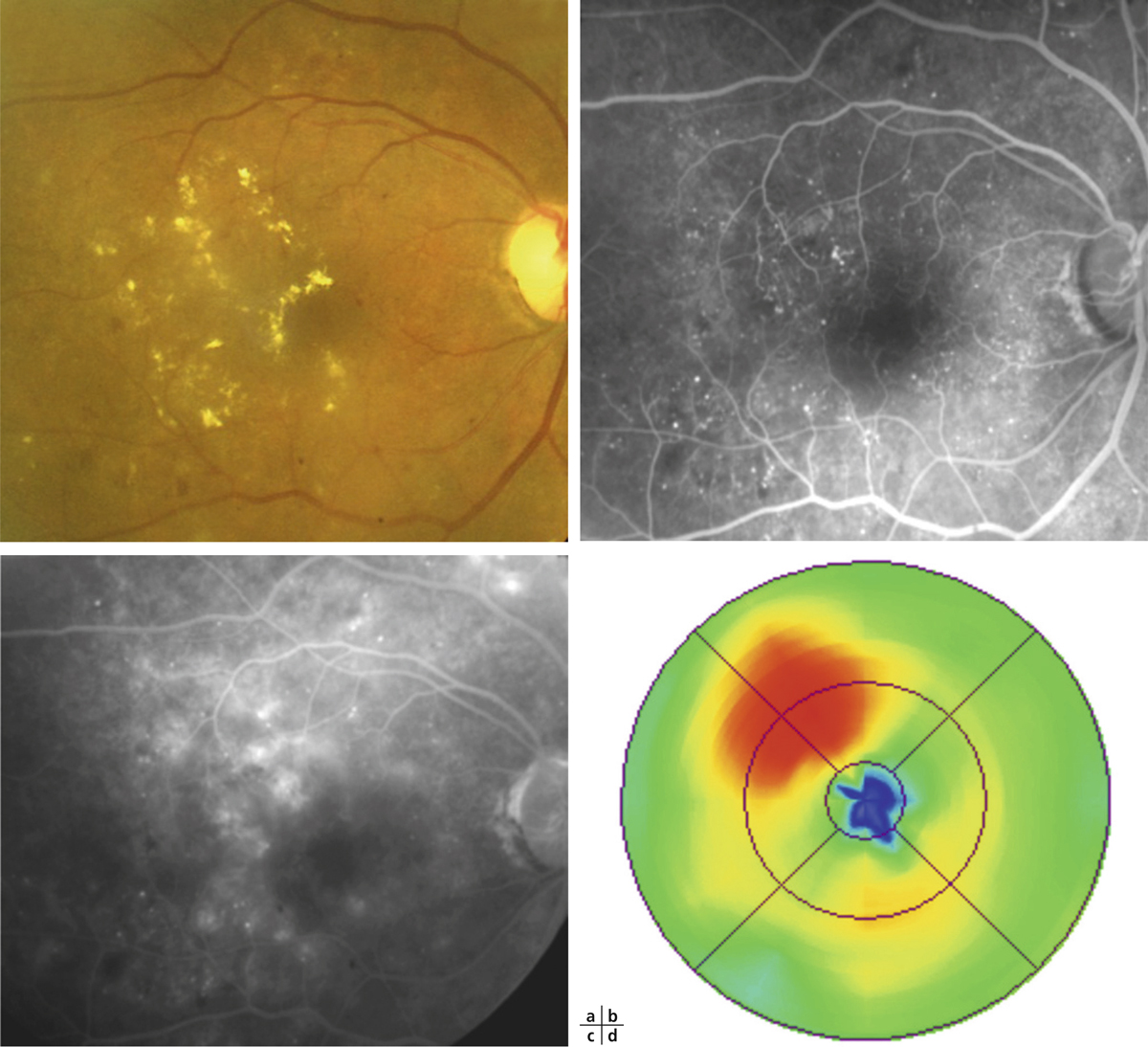
Fig. 8-25 Œdème maculaire focal modéré.
a. Cliché en couleurs. Exsudats circinés temporomaculaires n’atteignant pas le centre de la macula. L’acuité visuelle est de 10/10. b. Temps artérioveineux. c. Temps tardif. L’angiographie objective les micro-anévrismes dont les exsudats sont issus et les diffusions à partir de ces micro-anévrismes. d. La cartographie OCT objective l’épaississement maculaire en regard des exsudats circinés, permettant d’affirmer et de localiser l’OM. Celui-ci est modéré car il n’atteint pas la zone centrale de la macula, mais la menace. Il existe donc une indication à un traitement par laser focal.
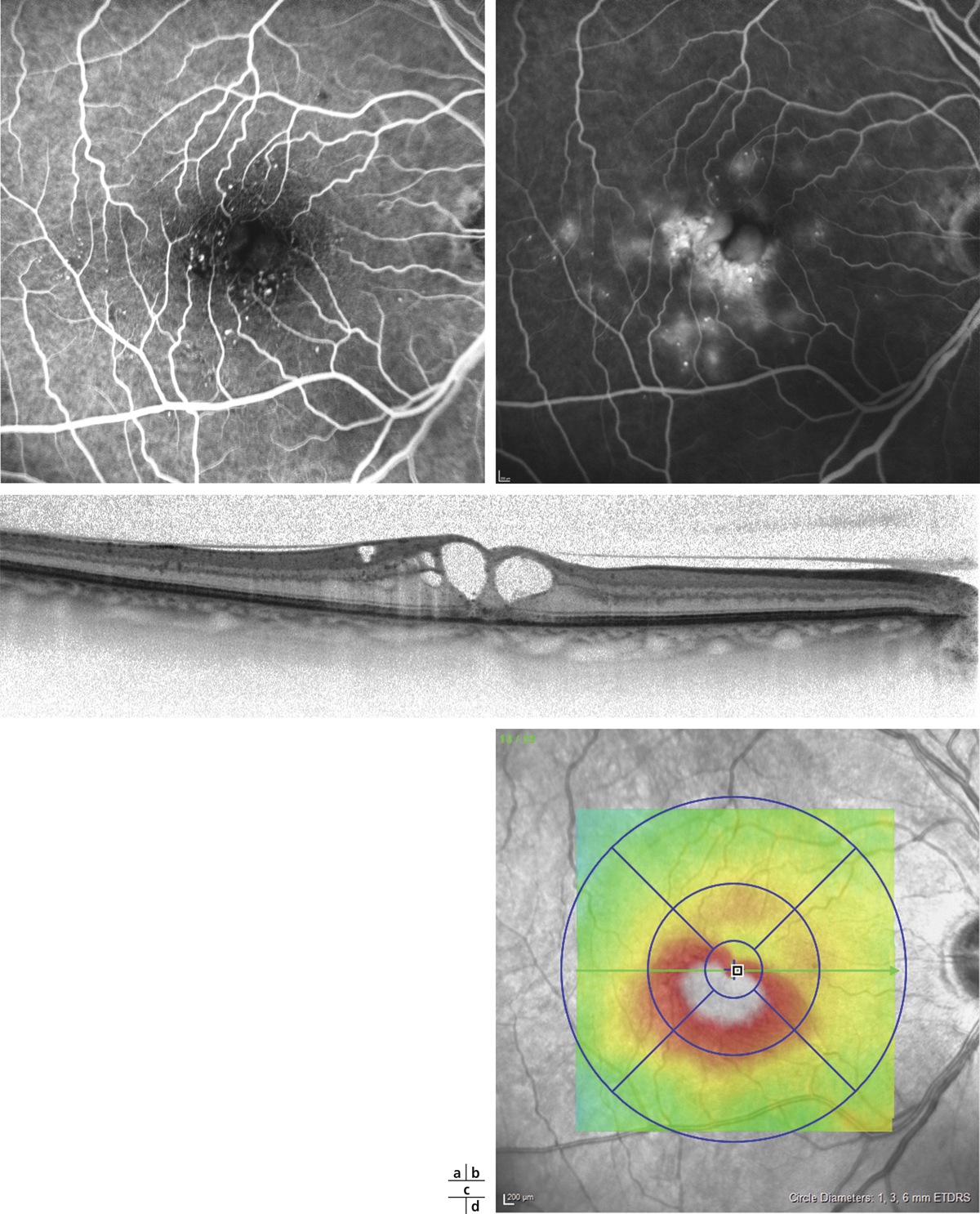
Fig. 8-28 Œdème maculaire cystoïde en « pétales de fleur ».
a. Angiographie au temps artérioveineux : rupture de la maille capillaire périfovéolaire, micro-territoires d’occlusions capillaires, bordés de nombreux micro-anévrismes juxtafovéolaires. On observe une hyperfluorescence par effet fenêtre en regard des logettes centrales, liée au refoulement du pigment jaune maculaire. b. Cliché tardif de l’angiographie : diffusions à partir des micro-anévrismes et remplissage de logettes cystoïdes en pétales de fleur, qui semblent localisées au niveau des zones d’occlusion capillaire, et de deux logettes centrales de grande taille. c. Coupe OCT horizontale. Les deux logettes centrales sont bien visibles ainsi que des logettes de plus petite taille dans les couches nucléaire interne, plexiforme externe et dans la couche des cellules ganglionnaires. Interruption centrale localisée de l’ellipsoïde et de la limitante externe. Présence d’un décollement périfovéolaire du vitré. d. Cartographie maculaire objectivant l’épaississement maculaire central.
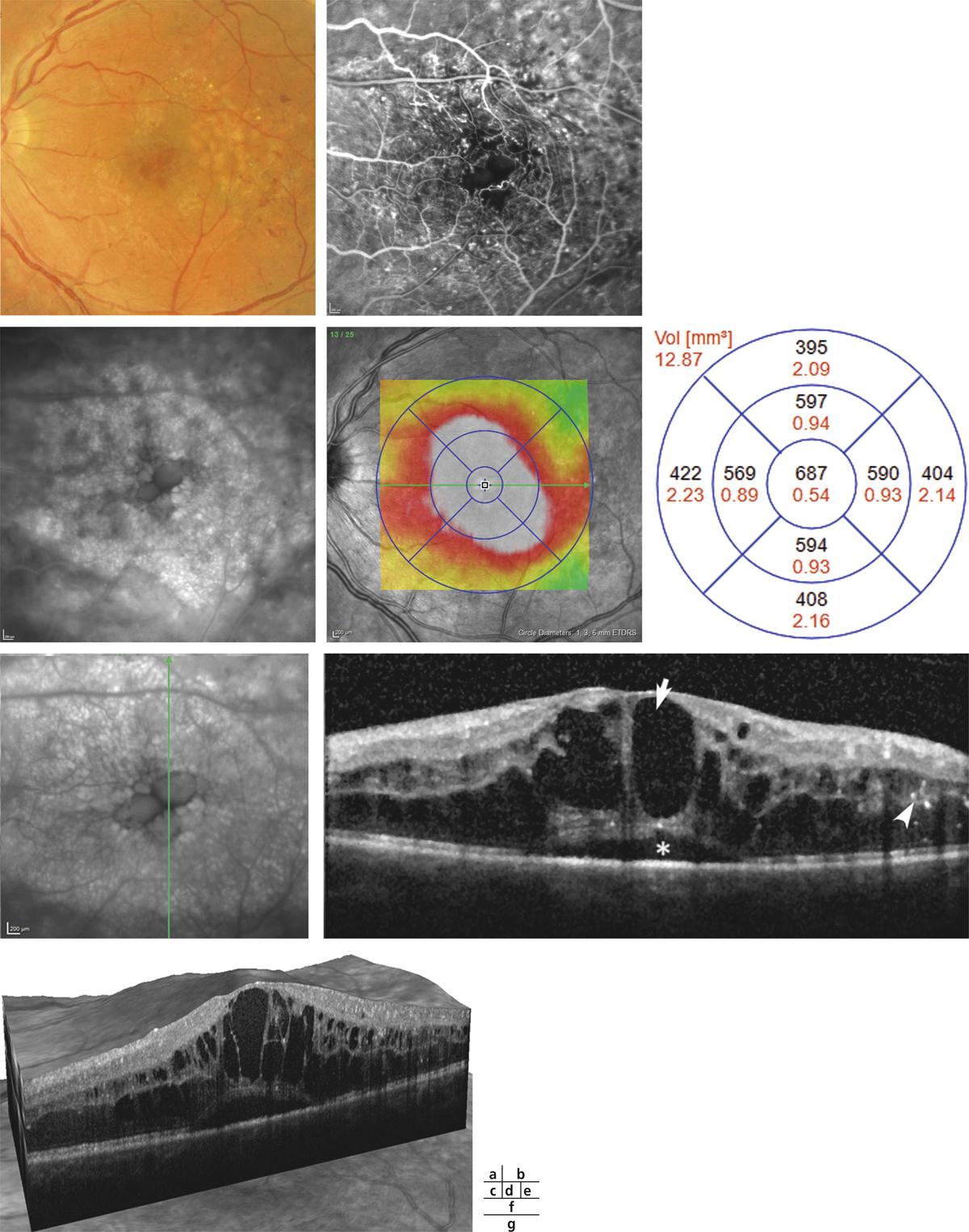
Fig. 8-29 Œdème maculaire diabétique sévère en nids d’abeilles.
a. Au fond d’œil, il n’y a ni exsudat, ni hémorragie. On devine les logettes cystiques centrales. b. Au temps artérioveineux de l’angiographie à la fluorescéine, on note une raréfaction capillaire centromaculaire avec une zone avasculaire centrale élargie, de nombreux micro-territoires non perfusés au pôle postérieur et de nombreuses AMIR. c. Les larges logettes centrales sont bien visibles sur le cliché infrarouge. d, e. La cartographie maculaire objective l’épaississement maculaire central et le quantifie. f, g. Sur la coupe OCT, on note un épaississement important de la rétine maculaire, des logettes optiquement vides (flèche), surtout présentes dans les couches nucléaire interne et plexiforme externe. Cet aspect optiquement « vide » est souvent associé à un remplissage intense de colorant en angiographie. On note également un décollement séreux rétinien (astérisque) et des points hyper-réflectifs (tête de flèche).
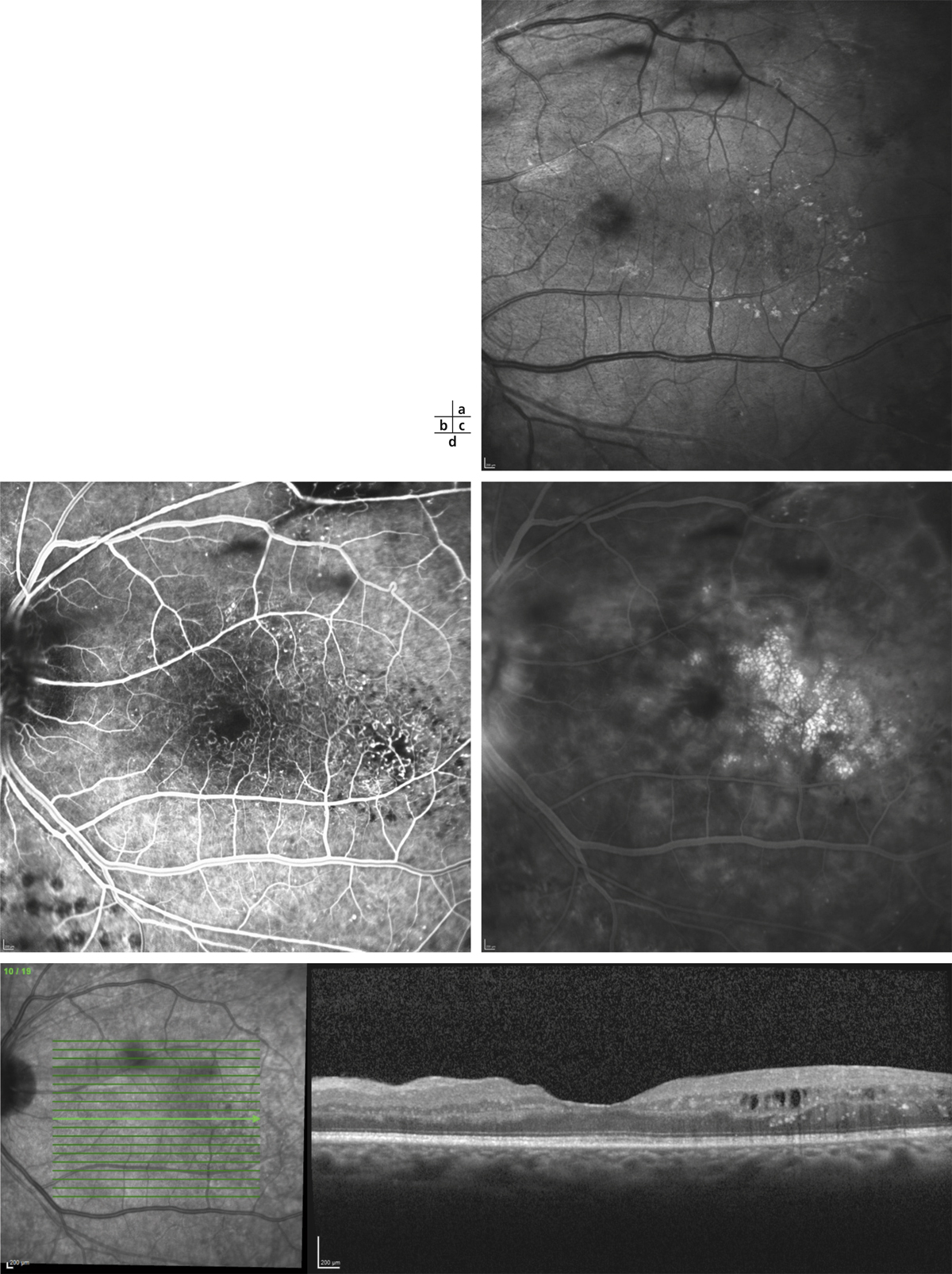
Fig. 8-26 Œdème maculaire modéré microkystique.
a. Cliché monochromatique vert. Exsudats circinés temporomaculaires. b. Au temps artérioveineux de l’angiographie, on observe la présence de nombreux micro-anévrismes au pôle postérieur, une rupture de la maille capillaire périfovéolaire et des AMIR, situées au centre de la circinée, en temporal du pôle postérieur. c. OM microkystique en nids d’abeilles en temporal du pôle postérieur. d. La coupe OCT horizontale montre les kystes intrarétiniens au sein de la couche nucléaire interne, associés aux exsudats. L’épaisseur centromaculaire est normale, l’OMD est modéré.

Fig. 8-30 Œdème maculaire tractionnel.
a. Cliché en couleurs. Aspect brillant à la surface de la rétine évoquant une hyaloïde postérieure épaissie. b. Temps artérioveineux de l’angiographie. Assez nombreux micro-anévrismes au pôle postérieur. c. Temps tardif de l’angiographie. Diffusion minime. d, e. Les coupes OCT objectivent l’épaississement maculaire, associé à une traction vitréomaculaire. La hyaloïde postérieure est épaissie et partiellement décollée de la macula sur laquelle elle exerce une traction. Il existe par ailleurs une membrane épirétinienne.
L’angiographie à la fluorescéine est avant tout un outil de bilan de l’OMD, puisque le diagnostic de l’OM repose sur la constatation d’un épaississement maculaire en OCT.
Elle permet de préciser :
-
l’origine des diffusions (focales ou diffuses) et la localisation des anomalies microvasculaires dont elles sont issues (micro-anévrismes, AMIR) ;
-
le degré d’occlusion des capillaires maculaires associée à l’œdème. En effet, l’association d’une ischémie maculaire à l’œdème est un facteur de mauvais pronostic fonctionnel.
L’angiographie permet en outre d’apprécier la sévérité de la non-perfusion rétinienne périphérique associée à l’œdème, même si la classification de la rétinopathie diabétique est avant tout basée sur l’analyse des photographies en couleurs du fond d’œil. Les angiographies dites « grand champ » sont susceptibles d’améliorer la qualité de l’analyse de la périphérie rétinienne (voir chapitre 5.2).
L’angiographie de l’iris peut être utile pour diagnostiquer une rubéose débutante : la rubéose irienne se manifeste par une diffusion de fluorescéine à partir des néovaisseaux, alors que les vaisseaux iriens normaux ne diffusent pas (eFig. 8-4 ).
).
Enfin, l’angiographie est indispensable en cas de baisse visuelle inexpliquée pour diagnostiquer toute autre pathologie maculaire associée à l’œdème telle qu’une néovascularisation choroïdienne, une épithéliopathie rétinienne diffuse, etc.
eFig. 8-4 Rubéose irienne.
[1] Koenig F, Bandello F. Les stades initiaux de la rétinopathie diabétique. In : Symposium International sur la rétinopathie diabétique. Revue Chibret d’Ophtalmologie 1984 ; p. 137-47.
[2] Klein R, Meuer SM, Moss SE, Klein BE. Retinal microaneurysm counts and 10-year progression of diabetic retinopathy. Arch Ophthalmol 1995 ; 113 : 1386-91.
[3] Cunha-Vaz J. Phenotypes and biomarkers of diabetic retinopathy. Personalized medicine for diabetic retinopathy : the Weisenfeld award. Invest Ophthalmol Vis Sci 2014 ; 55 : 5412-9.
[4] Bresnick GH, Condit R, Syrjala S, et al. Abnormalities of the foveolar avascular zone in diabetic retinopathy. Arch Ophthalmol 1984 ; 102 : 1286-93.
D. Gaucher, A. Erginay, M. Nardin
➤ L’OCT a un rôle central dans la prise en charge de l’OMD. Il en permet le diagnostic et le suivi. Grâce à l’analyse des structures intrarétiniennes et de la jonction vitréomaculaire, il peut mettre en évidence des éléments pathogéniques (tractionnels par exemple) et donne des indications sur le pronostic fonctionnel de l’OMD.
➤ L’OM est défini par un épaississement de la rétine maculaire qui se manifeste sous la forme d’une augmentation de l’hyporéflectivité des couches externes de la rétine. Il peut s’y associer des exsudats, des logettes cystoïdes ainsi qu’un décollement séreux rétinien (DSR).
➤ Le DSR, souvent associé à l’OMD, n’a pas de valeur pronostique fonctionnelle péjorative.
➤ Le décollement périfovéolaire de la hyaloïde postérieure ne doit pas être confondu avec une traction vitréomaculaire. Dans le premier cas, la hyaloïde postérieure est fine, non tendue et a un aspect biconvexe, de part et d’autre de son attache fovéolaire. Dans le second cas, la hyaloïde postérieure est épaissie, hyper-réflective et tendue.
➤ L’OCT permet de mettre en évidence plusieurs lésions qui seraient des indicateurs de mauvais pronostic fonctionnel : exsudats rétrofovéolaires, points hyper-réflectifs, amincissement de la rétine interne, ruptures de la couche ellipsoïde et/ou de la membrane limitante externe.
L’OM est défini comme un épaississement rétinien dû principalement à l’accumulation de fluide dans l’espace extracellulaire du tissu rétinien, suite à une rupture de la BHR (principalement interne). La définition clinique classique de l’OMD date des études de l’ETDRS dans les années 1990 [1, 2] et repose sur l’analyse des photographies stéréoscopiques du fond d’œil. L’OCT a permis une mesure objective de l’œdème.
On considère classiquement que l’épaisseur rétinienne est anormale lorsqu’elle est supérieure à la normale de + 2 écarts types. Ces valeurs « normales » varient avec chaque type d’OCT (voir chapitre 5.2). En pratique clinique, on peut considérer qu’une rétine est épaissie lorsque l’épaisseur centromaculaire (1 000 μ centraux de la grille ETDRS) est supérieure à 250 μ pour le time-domain–optical coherence tomography (TD-OCT) [3] et environ 300–350 μ pour le spectral-domain optical coherence tomography (SD-OCT) [4].
L’épaississement rétinien central n’est pas le seul critère : la présence d’espaces hyporéflectifs intrarétiniens, de liquide sous-rétinien, la perte de la dépression fovéolaire sont d’autres critères tomographiques associés aux OM. Ces signes ont une importance clinique, surtout en absence d’épaississement rétinien visible au fond d’œil. En effet, Bressler et le Diabetic Retinopathy Clinical Research Network (DRCRnet) ont montré qu’un épaississement rétinien mesuré entre 225 et 299 μ (souvent dû à la présence de micrologettes intrarétiniennes) en TD-OCT, évoluait dans 25 à 50 % des cas vers un OMD significatif à 2 ans [5].
L’intérêt majeur de l’OCT dans la rétinopathie diabétique (RD) est le diagnostic et le suivi de l’évolution de l’OMD. Les SD-OCT ont permis, en plus de la mesure objective de l’épaisseur rétinienne, une analyse fine des différentes structures intrarétiniennes possiblement atteintes au cours de l’OMD. Ils permettent également une analyse précise de la jonction vitréomaculaire souvent pathologique chez le patient diabétique.
Le premier signe de la RD est les micro-anévrismes correspondant à une ectasie de 10 à 100 μm développée à partir de la paroi d’un capillaire rétinien. Ils siègent le plus souvent au niveau du pôle postérieur. Les diffusions à partir des micro-anévrismes peuvent être à l’origine d’un OM.
En SD-OCT, les micro-anévrismes sont caractérisés par :
-
leur position au sein des couches rétiniennes : dans 80 % des cas, ils se situent dans la nucléaire interne (fig. 8-31 et 8-32) [6] ;
-
la présence plus ou moins marquée d’un anneau hyper-réflectif appelé ring sign ou structure capsulaire qui, en cas d’absence, permet une diffusion plus importante du colorant en angiographie (fig. 8-33) [7] ;
-
la présence éventuelle d’une logette cystoïde attenante et de « spots » hyper-réflectifs, tous deux significativement associés à une diffusion angiographique [7].

Fig. 8-31 Micro-anévrisme.
Le micro-anévrisme vu sur le fond d’œil (a, flèche) est en partie responsable de l’OM visualisé en cartographie maculaire (b). Sur la coupe OCT, il est localisé dans la couche nucléaire interne. C’est une structure hyper-réflective (astérisque) associée à un cône d’ombre postérieur (flèche) (c).
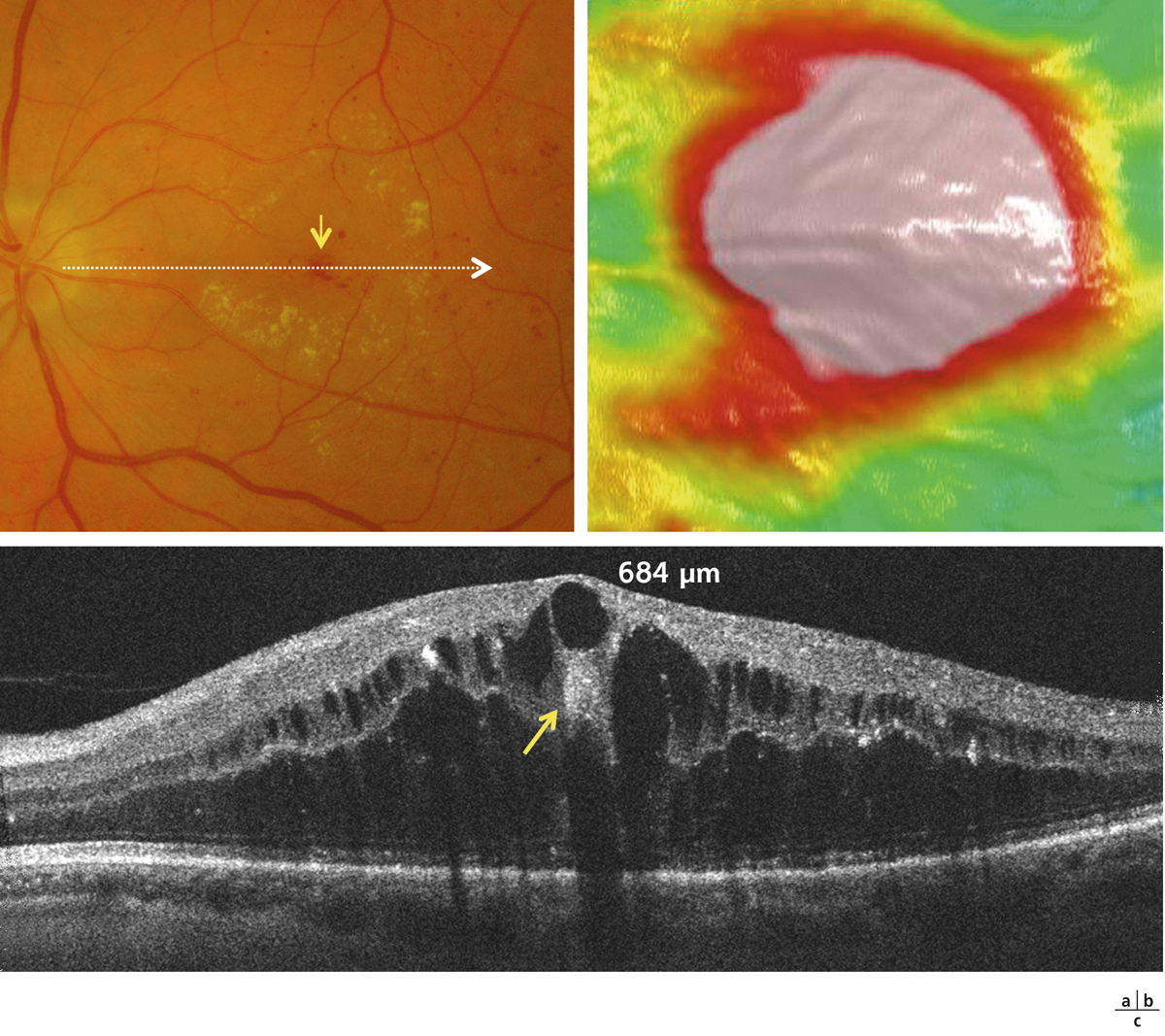
Fig. 8-32 Œdème maculaire sévère, associé à un macro-anévrisme.
a. Cliché en couleurs : OM sévère central entouré d’une couronne d’exsudats. On note des hémorragies rétiniennes centrales, ainsi qu’un macro-anévrisme. b. La cartographie maculaire objective l’épaississement maculaire central et étendu. c. Sur la coupe OCT, le macro-anévrisme est bien visible au sein de l’œdème (flèche), il est hyper-réflectif et associé à un cône d’ombre.
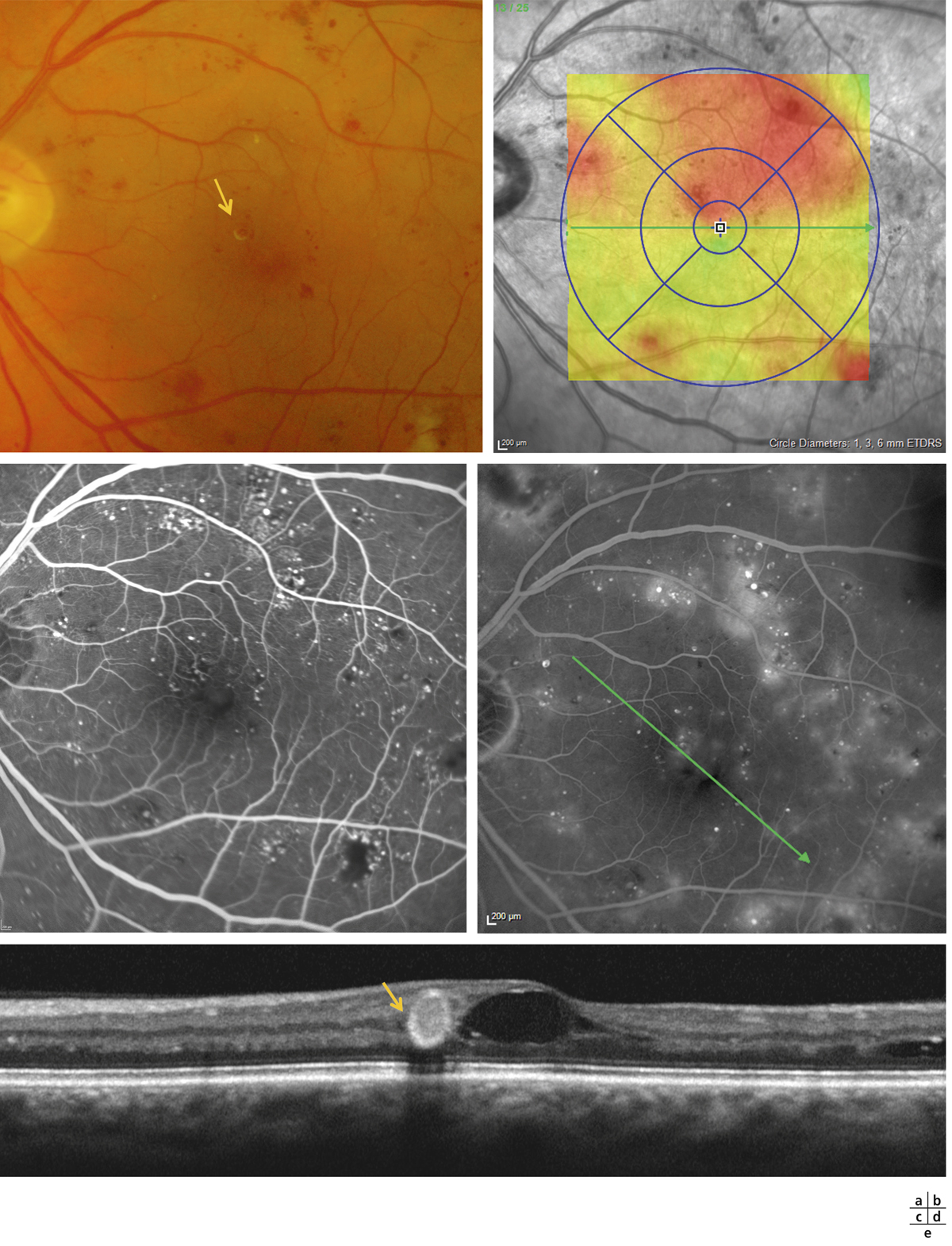
Fig. 8-33 Micro-anévrisme entouré d’un anneau hyper-réflectif (ring sign).
a. Cliché en couleurs. On voit au centre de la macula un macro-anévrisme qui semble encapsulé (flèche). b. La cartographie maculaire objective un OM modéré. c, d. Ce macro-anévrisme est peu visible en angiographie au temps artérioveineux (c) et diffuse peu au temps tardif (d). e. Sur la coupe OCT, le macro-anévrisme apparaît hyper-réflectif, de très grande taille. Il est entouré d’un anneau hyper-réflectif (ring sign) et semble « encapsulé » (flèche).
L’OM se définit à l’OCT par un épaississement de la rétine maculaire. Cet épaississement se manifeste sous la forme d’une augmentation de l’hyporéflectivité des couches externes de la rétine traduisant l’accumulation de liquide au sein de la rétine. Il peut s’y associer des exsudats, des logettes cystoïdes ainsi qu’un DSR. L’œdème est souvent associé en OCT à des points hyper-réflectifs présents dans toute l’épaisseur rétinienne. Ils sont appelés en anglais hyper reflective foci et ont été décrits et étudiés depuis peu.
Les logettes cystoïdes sont des cavités kystiques hyporéflectives intrarétiniennes, optiquement vides, siégeant principalement au niveau des couches nucléaires internes (inner nuclear layer [INL]) ou plexiformes externes (outer plexiform layer [OPL]) de la rétine. Il a été décrit une association entre la couche contenant les logettes et l’aspect angiographique de l’OM : un aspect en « rayons de miel » ou « nids d’abeilles » correspondrait à des logettes dans l’INL (voir fig. 8-29), alors que les logettes de l’OPL donneraient plutôt un aspect pétaloïde (voir fig. 8-28) [8]. En pratique clinique ces corrélations ont peu d’importance car la présence d’une logette centrale, fovéolaire est un élément de gravité.
Au niveau angiographique, les niveaux de fluorescence ne diffèrent pas significativement entre les yeux avec et sans logettes cystoïdes [9] ; en revanche, en SD-OCT, on note souvent des logettes cystoïdes dont le contenu n’est pas optiquement vide mais hyper-réflectif ou hétérogène. Cet aspect est corrélé à un faible remplissage de ces logettes en angiographie et à la présence de micro-anévrismes (fig. 8-34) [10].
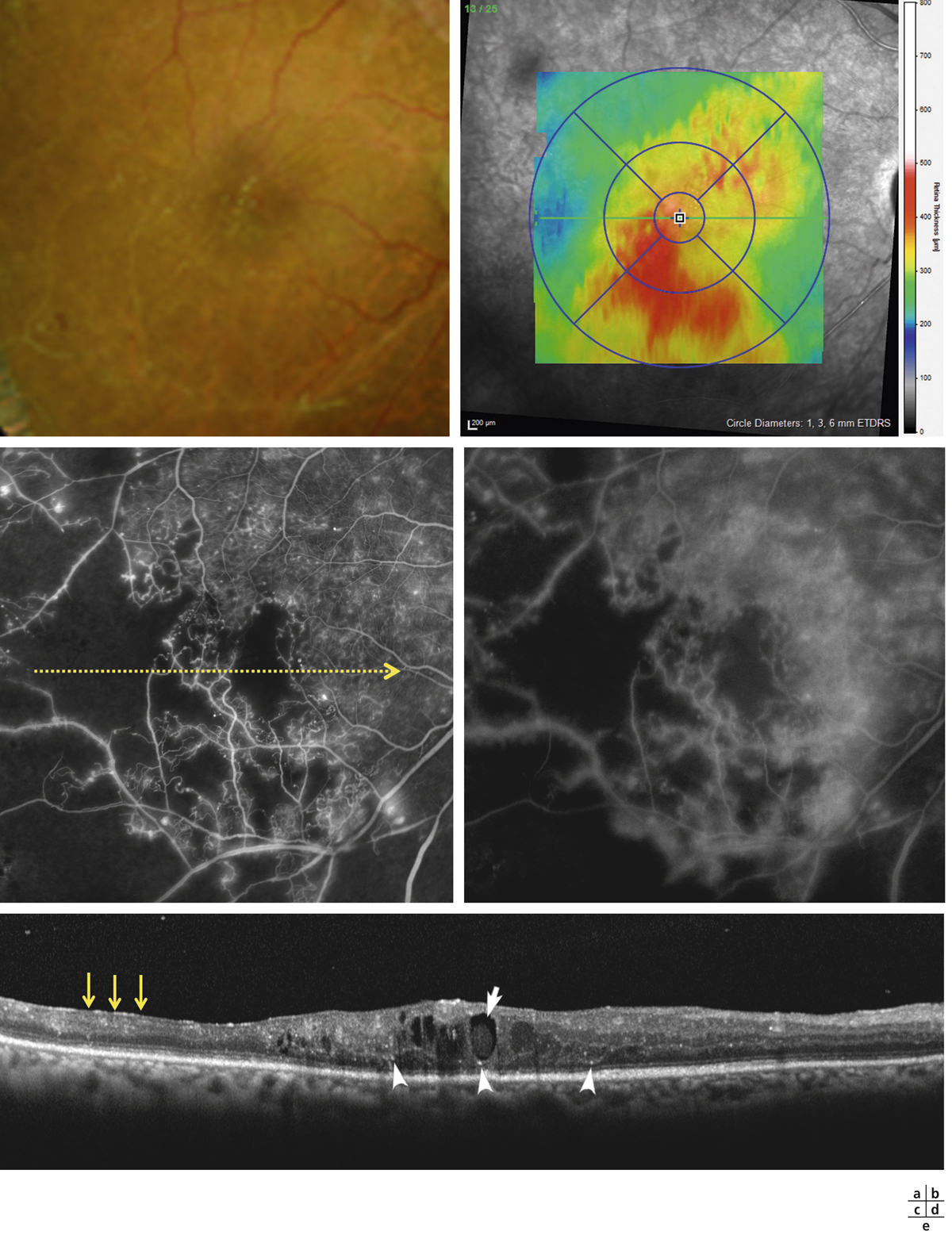
Fig. 8-34 Œdème maculaire ischémique.
Les vaisseaux de l’arcade temporale inférieure sont déshabités sur le cliché en couleurs (a). L’épaississement rétinien sur la cartographie est modéré (b), le cliché angiographique montre une disparition du lit capillaire en temporal et un élargissement de la zone avasculaire centrale signant une ischémie sévère (c). Sur la coupe OCT horizontale passant par la fovéola (e), on note des logettes cystoïdes contenant du matériel hyper-réflectif (e, flèche blanche) : cet aspect est souvent associé à une absence de remplissage de fluorescéine en angiographie comme dans cet exemple (d). On note également la présence de points hyper-réflectifs surtout dans la couche des noyaux des photorécepteurs (têtes de flèche). L’origine de ces points est discutée, ils sont de mauvais pronostic et associés à une rupture de la limitante externe et/ou des photorécepteurs. La rétine interne est amincie dans la zone de rétine ischémique (flèches jaunes).
Un DSR est associé à l’OMD dans environ 15 % des cas. Le DSR apparaît comme un espace optiquement vide, le plus souvent hyporéflectif, de forme ogivale, situé entre l’épithélium pigmentaire et les couches externes de la rétine (fig. 8-29 et 8-35).
La hauteur du DSR n’est pas corrélée avec l’épaississement rétinien qu’il précède parfois (fig. 8-35) [11]. Le DSR n’a pas de valeur pronostique péjorative au plan fonctionnel et ne semble pas toujours lié à la gravité de l’OM [11]. En revanche, les œdèmes très sévères (épais et avec des espaces cystoïdes) sont volontiers associés à un DSR.
L’origine du DSR reste discutée. Elle peut être parfois tractionnelle. Toutefois des études sur la corrélation entre le niveau de fluorescence de la rétine et l’épaisseur rétinienne suggèrent que c’est l’hyperperméabilité vasculaire périfovéolaire qui contribue le plus à la pathogenèse du DSR dans l’œdème maculaire [9]. Un dysfonctionnement de l’épithélium pigmentaire contribue probablement également à la genèse des DSR au cours de la rétinopathie diabétique (voir chapitre 4.3) [12].
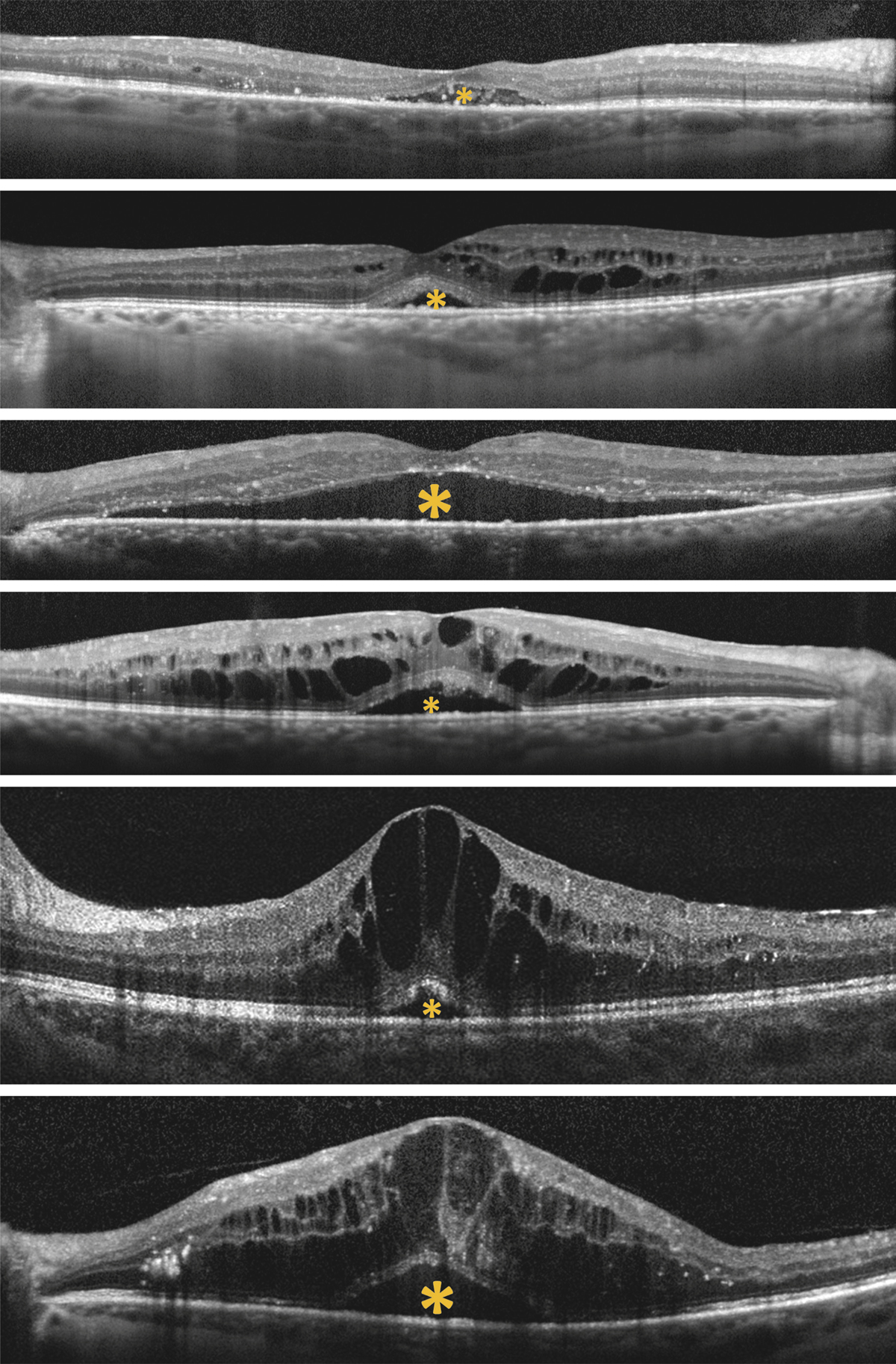
Fig. 8-35 Décollement séreux rétinien (DSR).
Il n’y a aucune corrélation entre la taille du DSR (*) et l’importance de l’épaississement rétinien sus-jacent.
Les exsudats correspondent à une accumulation de lipoprotéines, liée à leur extravasation à travers la paroi altérée des micro-anévrismes ou des AMIR.
Au niveau maculaire, les exsudats prennent une disposition radiaire, car ils s’accumulent dans la couche des fibres de Henlé (ayant elles-mêmes une disposition radiaire).
En SD-OCT, les exsudats apparaissent sous la forme de lésions intrarétiniennes arrondies hyper-réflectives masquant la réflectivité du complexe épithélium pigmentaire–choriocapillaire sous-jacent (fig. 8-36 et 8-37) [13]. Il en résulte un défect dans la ligne de profil postérieur de la rétine. Localisés le plus souvent dans les couches plexiformes, ils peuvent également s’accumuler sous la rétine ou au sein des logettes cystoïdes. Ils sont, dans la majorité des cas, associés à un épaississement rétinien témoignant de l’œdème. Lorsqu’il n’existe pas d’épaississement rétinien, l’exsudat est alors témoin d’un OM résorbé (voir fig. 8-9 et eFig. 8-2) [13]. En l’absence de traitement, les exsudats peuvent s’accumuler sous la rétine, réalisant un placard exsudatif, et s’associent alors à une désorganisation des couches internes et externes de la rétine (fig. 8-37c et d).
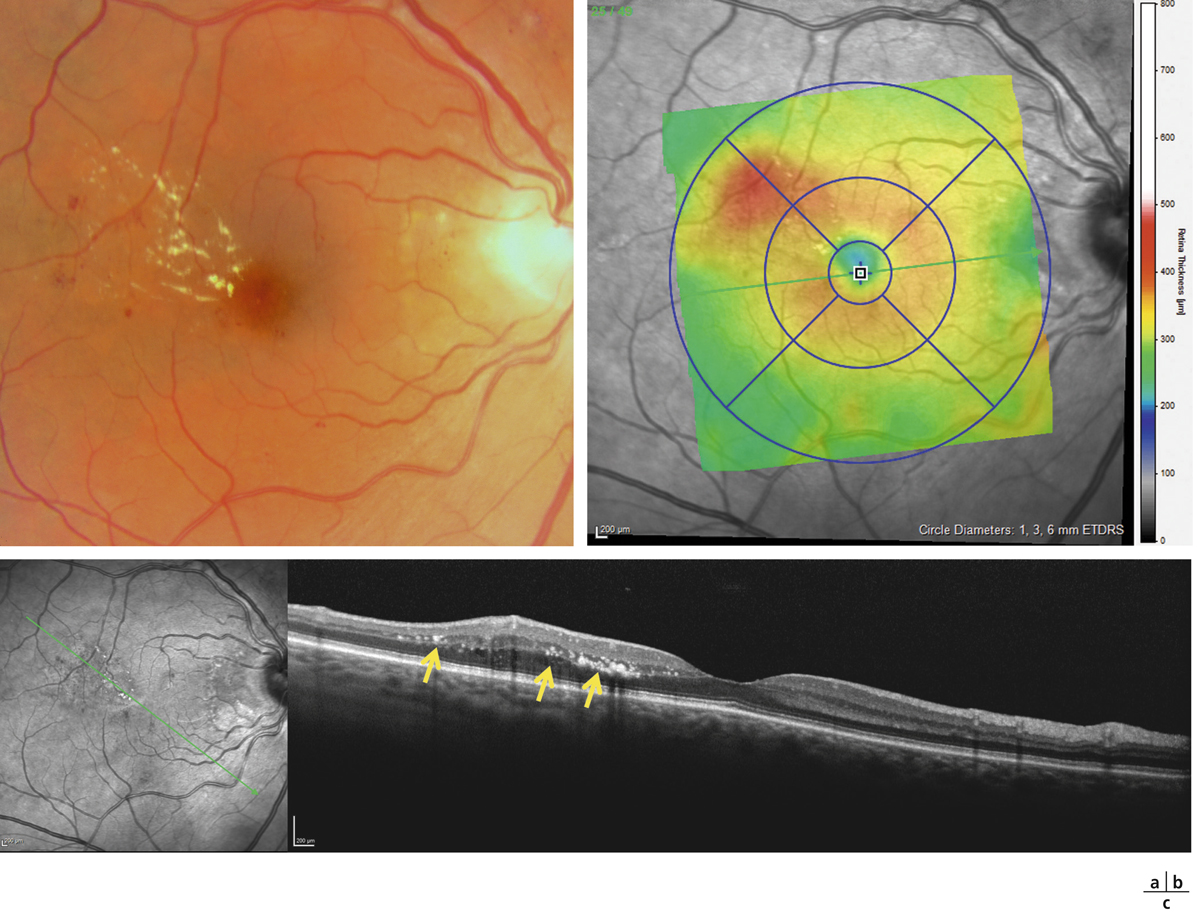
Fig. 8-36 Œdème maculaire modéré.
a. Sur le cliché en couleurs, on note une couronne d’exsudats centrée par des micro-anévrismes, en temporal supérieur de la fovéa. b. La cartographie objective l’épaississement maculaire modéré, n’atteignant pas le centre de la macula. c. Localisés dans la couche plexiforme externe, les exsudats apparaissent sous forme de lésions hyper-réflectives associées à un cône d’ombre sous-jacent (flèches).
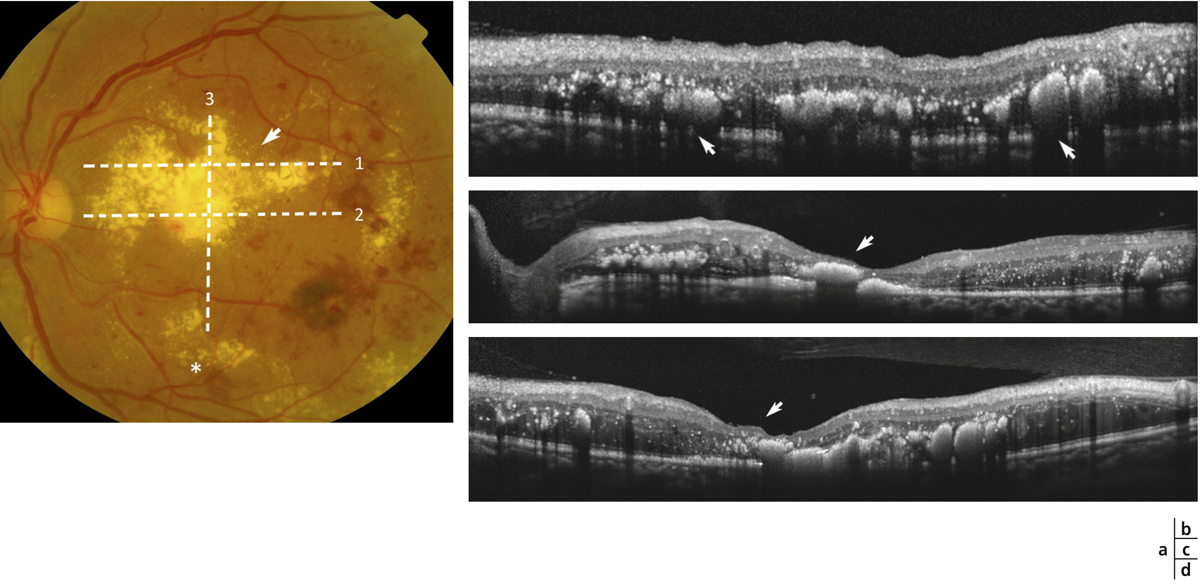
Fig. 8-37 Exsudats lipidiques.
Au fond d’œil, les exsudats forment des petites lésions blanc-jaune, brillantes de quelques microns de diamètre (a, astérisque). Les exsudats peuvent comme dans cet exemple s’accumuler au niveau maculaire en formant des grandes plages blanches appelées aussi « placard exsudatif » (a, flèche). Les coupes OCT passant par ces lésions (b : coupe 1, c : coupe 2, d : coupe 3) montrent bien l’aspect des exsudats lipidiques. Ils sont situés dans les couches plexiformes externes, sont arrondis et très hyper-réflectifs (b). Cette réflexion intense crée un cône d’ombre postérieur important qui masque l’épithélium pigmentaire et la choroïde (b, flèches). Les exsudats peuvent s’accumuler dans les fibres de Henlé au niveau centromaculaire (c, flèche) et en sous-rétinien (d, flèche). Dans ces cas, une atrophie rétinienne est souvent associée (c et d).
Des points hyper-réflectifs ont été décrits en 2009 par Bolz et al. [14]. Ils peuvent siéger dans toute l’épaisseur de la rétine, dans les DSR ou dans les logettes cystoïdes (fig. 8-38). Leur signification n’est pas claire. Il pourrait s’agir, pour Bolz et al., de macrophages chargés de lipides, précurseurs de la formation des exsudats lipidiques. Pour d’autres, ils pourraient être un marqueur d’activité microgliale [15] ou être corrélés à des ruptures de la limitante externe et de la zone ellipsoïde, précédant la dégénérescence des photorécepteurs [16, 17]. Leur présence dans les OMD, ou dans le DSR des OMD, serait associée à un mauvais pronostic fonctionnel [13, 18].
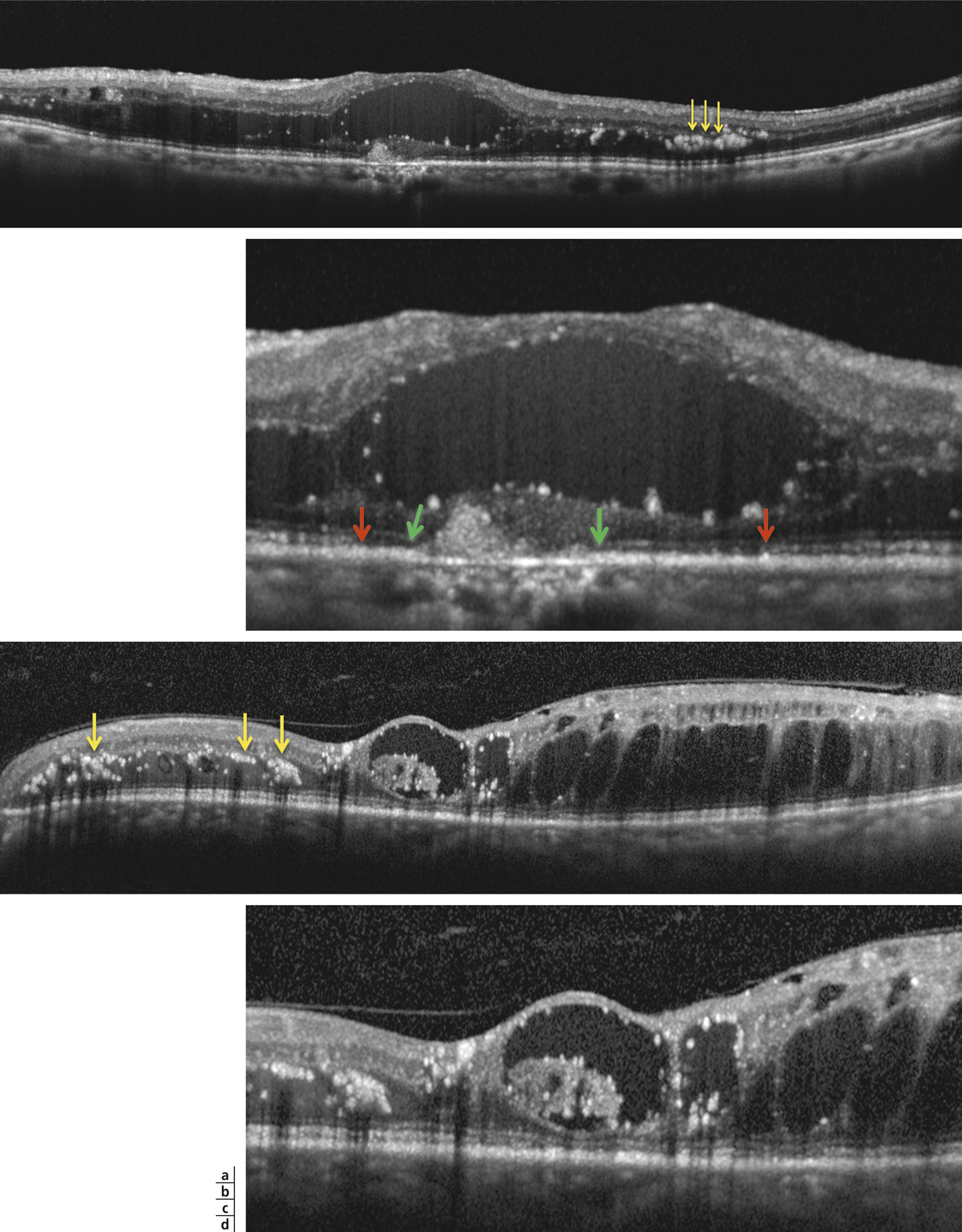
Fig. 8-38 Points hyper-réflectifs. Deux cas d’œdème maculaire diabétique comportant de nombreux points hyper-réflectifs.
Dans le premier cas (a, b : fort grossissement), les points hyper-réflectifs tapissent les contours de la logette centrale ; ils sont à différencier des exsudats de plus grande taille (flèches jaunes) localisés dans la plexiforme externe. Dans le deuxième cas (c, d), ils sont associés à du matériel au sein de la logette centrale. En a et b, on note l’interruption centrale de l’ellipsoïde (flèches rouges) et de la membrane limitante externe (flèches vertes).
L’hyperglycémie chronique chez les patients diabétiques est responsable de nombreuse modifications biochimiques au sein du vitré. Le SD-OCT est un moyen performant d’analyse de la jonction vitréomaculaire.
Le décollement postérieur du vitré est plus précoce et plus fréquent chez les patients diabétiques que dans la population générale [12]. La hyaloïde postérieure apparaît fine et peu réflective, non tendue (fig. 8-28 et 8-39a). Elle prend un aspect biconvexe en avant, de part et d’autre de son attache fovéolaire. L’influence du décollement périfovéolaire du vitré sur l’OMD reste discutée mais nous avons montré qu’il était plus fréquent si un OMD était présent [19]. Un vitréoschisis, se traduisant par un dédoublement de la hyaloïde postérieure, est parfois observé.
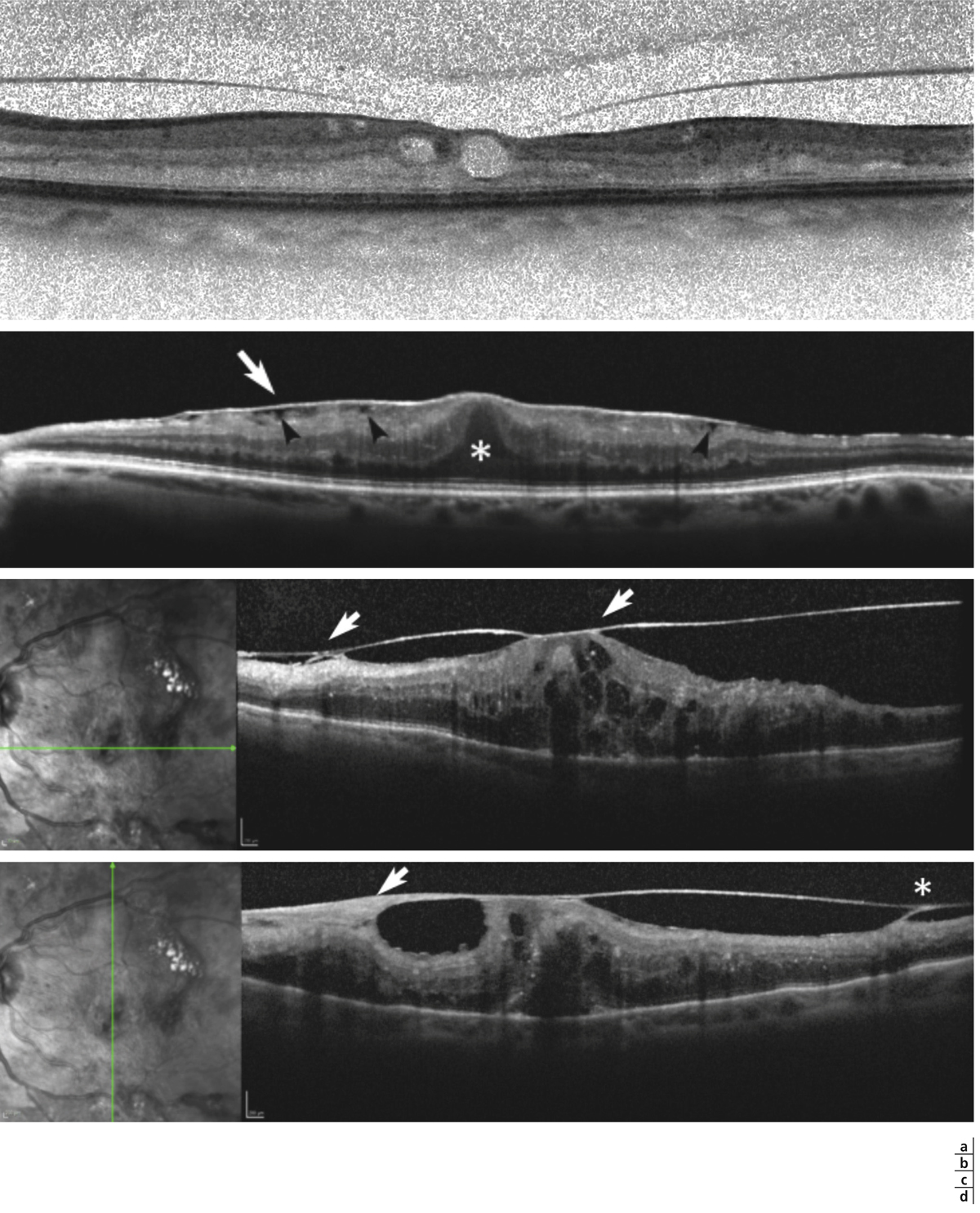
Fig. 8-39 Œdème maculaire diabétique et jonction vitréomaculaire.
a. OMD associé à un décollement périfovéolaire du vitré. La hyaloïde postérieure apparaît fine et peu réflective, non tendue. Elle prend un aspect biconvexe en avant de part et d’autre de son attache fovéolaire. b. OM dû à une membrane épimaculaire. La membrane apparaît comme une ligne hyper-réflective tendue à la surface de la rétine (flèche blanche), responsable de contractions tangentielles, de la perte de l’entonnoir fovéolaire (astérisque) et de plis rétiniens superficiels visibles indirectement par des espaces hyporéflectifs entre la rétine externe et la membrane (têtes de flèche). Malgré la perte de la dépression fovéolaire, la fovéola reste repérable par l’hyporéflectivité des fibres de Henlé qui s’étend jusqu’à la limitante interne (astérisque). c, d. OM tractionnel. La hyaloïde postérieure est épaissie, tendue. Les coupes OCT horizontale (c) et verticale (d) montrent les attaches vitréorétiniennes (flèches). On distingue aussi une membrane épirétinienne qui se réfléchit sur la hyaloïde postérieure (d, astérisque). La rétine fovéolaire est altérée, on voit des kystes intrarétiniens au niveau des zones d’attache vitréenne. Le fait que la rétine soit épaissie au niveau des zones d’attache et non ailleurs signe le mécanisme tractionnel de l’œdème.
Le syndrome de traction vitréomaculaire se présente sous la forme d’un décollement partiel du vitré périphérique, avec persistance d’une attache de la hyaloïde postérieure au niveau de la région maculaire. Une membrane épimaculaire fait souvent l’interface entre la hyaloïde postérieure adhérente et la limitante interne [20].
En OCT, la hyaloïde postérieure apparaît épaissie et hyper-réflective, « trop bien visible » avec persistance de zones d’attaches vitréorétiniennes centrofovéolaires. En regard de la traction, le tissu rétinien est souvent désorganisé avec un œdème rétinien kystique sous forme d’une ou de plusieurs grandes cavités hyporéflectives fovéolaires (fig. 8-39c et d) [21]. Il est difficile chez ces patients diabétiques présentant un œdème maculaire d’identifier l’origine précise des logettes : traction vitréomaculaire ou rupture de la BHR interne, les deux mécanismes étant le plus souvent associés. Dans ces cas, l’absence de diffusion en angiographie plaide en faveur d’une origine plutôt tractionnelle (voir fig. 8-30). Enfin, dans les formes plus sévères, la traction vitréomaculaire peut entraîner un décollement maculaire tractionnel.
Les membranes épirétiniennes sont plus fréquentes chez les patients diabétiques que dans la population générale ; le vitré est moins souvent décollé que dans les membranes idiopathiques. En OCT, la membrane épimaculaire apparaît comme une ligne hyper-réflective tendue à la surface de la rétine, responsable de contractions tangentielles, de la perte de l’entonnoir fovéolaire et de plis rétiniens superficiels (fig. 8-39b). En cas d’OMD, il peut être également difficile de savoir quelle est la part de responsabilité de la membrane dans la genèse de l’OMD.
En cas de rétinopathie diabétique proliférante, l’OCT visualise les néovaisseaux situés en avant du plan rétinien, dans le cortex vitréen postérieur. Situées principalement au niveau du pôle postérieur, ces proliférations fibrovasculaires peuvent engendrer des phénomènes tractionnels en se rétractant (eFig. 8-5 ).
).
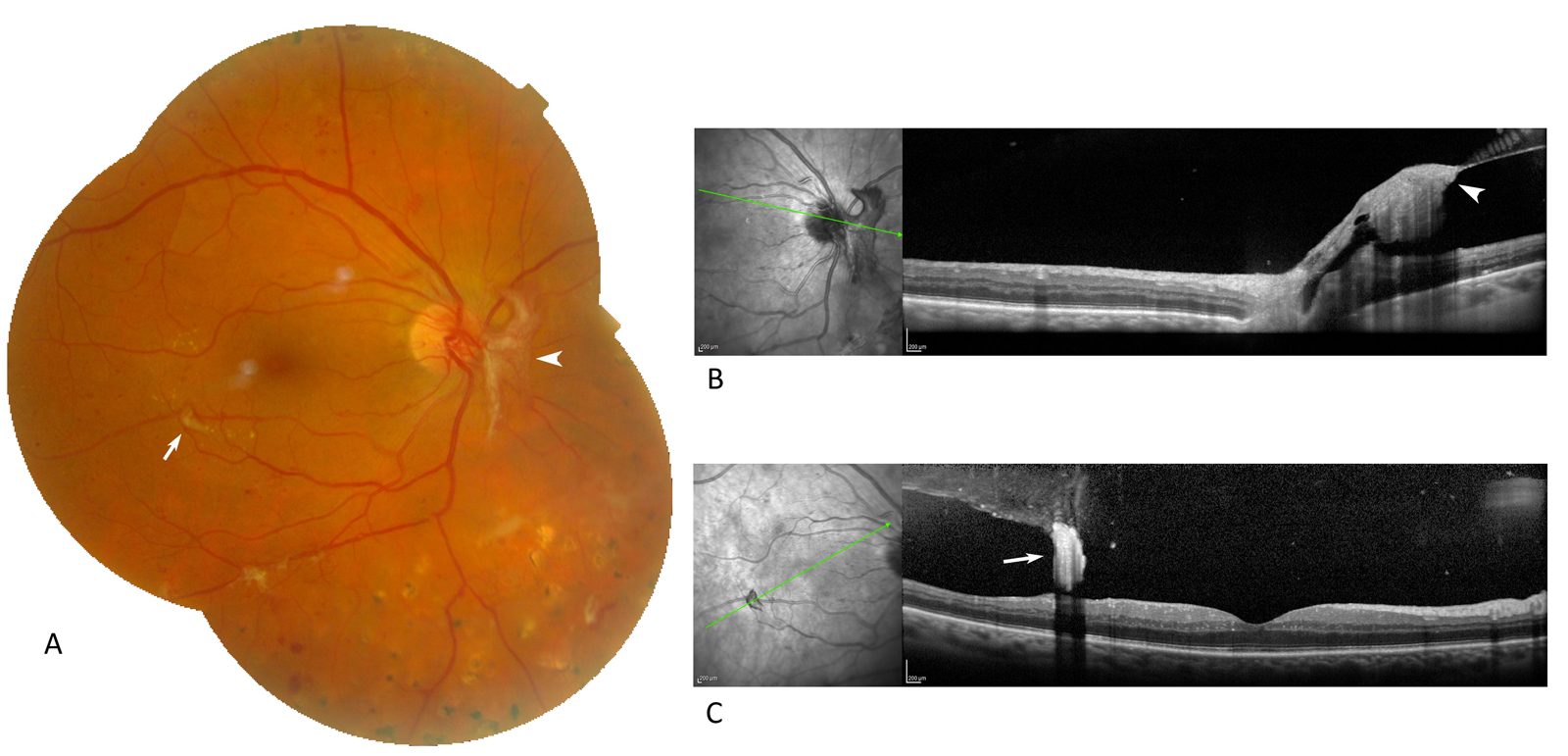
eFig. 8-5 Néovaisseaux prérétiniens.
Un amincissement de la couche des cellules ganglionnaires est observé en cas de maculopathie ischémique, associée ou non à un OMD (fig. 8-34) [22]. Une diminution de l’épaisseur des couches des cellules ganglionnaires a aussi été observée après résolution de l’OMD (voir fig. 8-46) [23]. Dans ces deux cas de figure, la perte tissulaire semble corrélée à l’acuité visuelle.
Le degré de désorganisation architecturale de la rétine interne (disorganisation of retinal inner layers [DRIL]) serait également prédictif de l’acuité visuelle [24].
Enfin, en cas d’OMD, le ratio de la quantité de tissu rétinien central résiduel par rapport à la quantité de fluide serait également un facteur de pronostic visuel (fig. 8-40) [25].
À l’inverse, un épaississement focal des couches internes de la rétine peut être observé en cas de nodule cotonneux. Celui-ci correspond à une accumulation protéique liée à une interruption du flux axoplasmique consécutif à une ischémie aiguë focale des fibres par occlusion d’une artériole rétinienne précapillaire. Les nodules cotonneux sont transitoires et régressent en quelques semaines à quelques mois. Leur évolution en OCT comporte deux phases [26] :
-
lors de leur apparition et pendant plusieurs semaines, ils sont visualisés par une hyper-réflectivité des couches internes et notamment celles des fibres optiques, la rétine interne étant légèrement épaissie. Il existe une hyporéflectivité postérieure par masquage (eFig. 8-6
 ) ;
) ; -
dans un second temps et après résolution ophtalmoscopique (à 9 semaines en moyenne), il y a un amincissement global de la rétine dans la zone concernée par rapport à la rétine saine adjacente, visible sur le mapping OCT.

Fig. 8-46 Épaississement maculaire.
a. Diffus intéressant toute la région maculaire sans mise en évidence d’une traction vitréenne localisée. b. Localisé et plutôt central avec une nette hyperéchogénicité correspondant à un OMC.
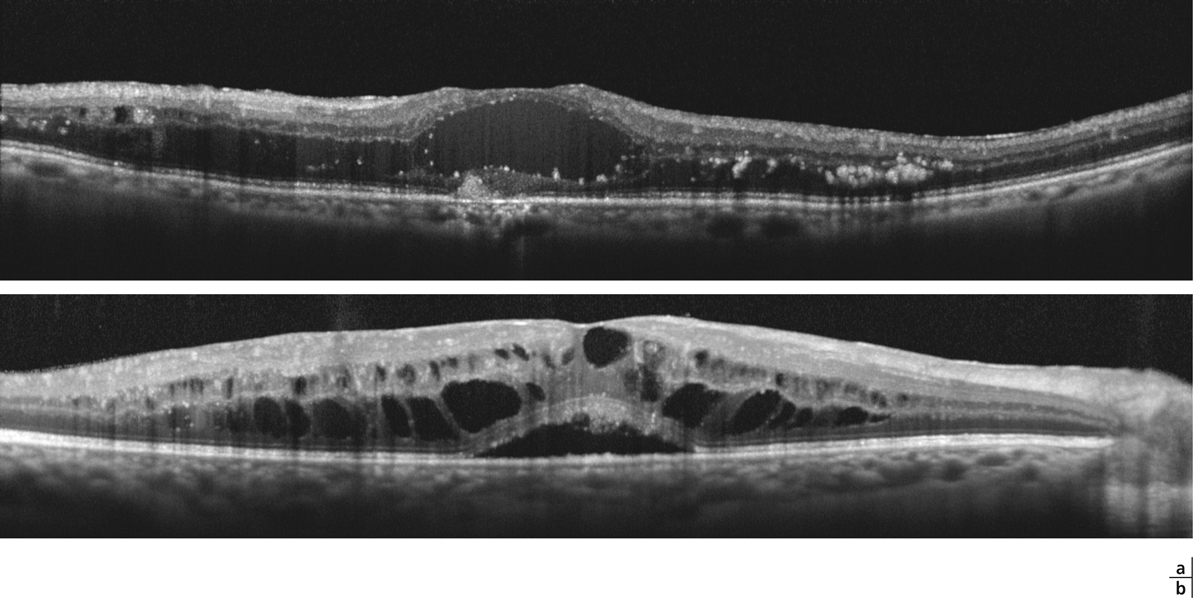
Fig. 8-40 Ratio tissu rétinien/fluide.
Ces deux OMD ont une épaisseur centromaculaire relativement identique. Toutefois, si l’on compare dans l’un et l’autre cas la quantité de tissu rétinien hyper-réflectif par rapport à la quantité de fluide hyporéflectif, le ratio tissu/fluide est plus élevé dans le cas b que dans le cas a. On peut en déduire qu’après résolution de l’OMD, l’acuité visuelle sera probablement meilleure dans le cas b que dans le cas a.
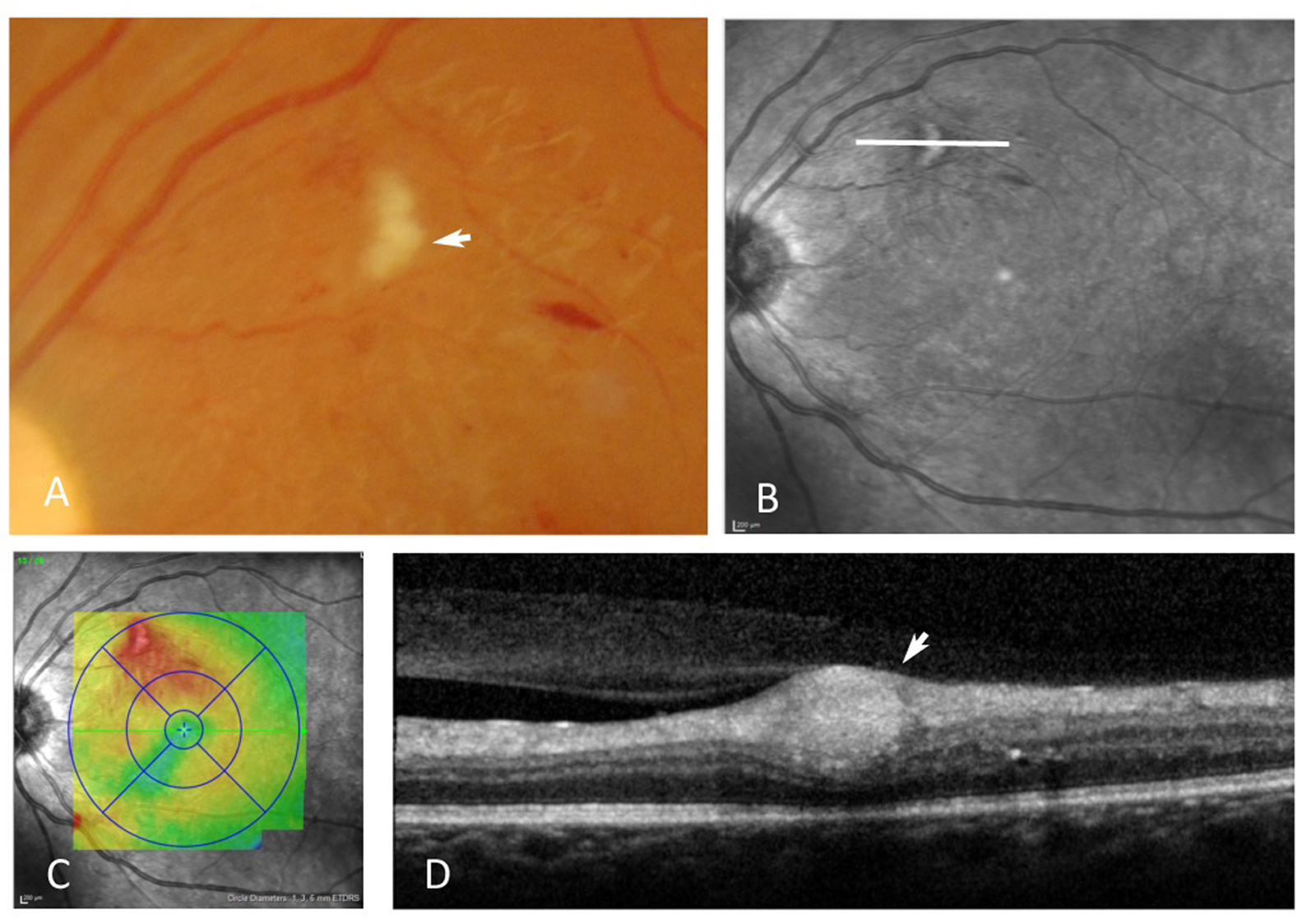
eFig. 8-6 Nodule cotonneux.
Il semble désormais admis que l’absence d’intégrité de la ligne inner and outer segment junction (IS–OS) ou ellipsoïde (fig. 8-41) soit corrélée à une dysfonction des photorécepteurs et de l’épithélium pigmentaire. Des observations dans la rétinite pigmentaire ont montré la corrélation de l’atteinte de la ligne ellipsoïde avec la fonction visuelle et l’autofluorescence de l’épithélium pigmentaire [17]. La corrélation entre l’acuité visuelle et celle de la ligne ellipsoïde a été montrée également dans l’OMD [27].
La rupture de la ligne hyper-réflective correspondant à la membrane limitante externe (MLE) serait également associée à une mauvaise récupération visuelle après résolution de l’OMD [28]. La continuité de la MLE comme celle de la ligne ellipsoïde refléteraient donc toutes deux l’intégrité des photorécepteurs (voir fig. 8-34).
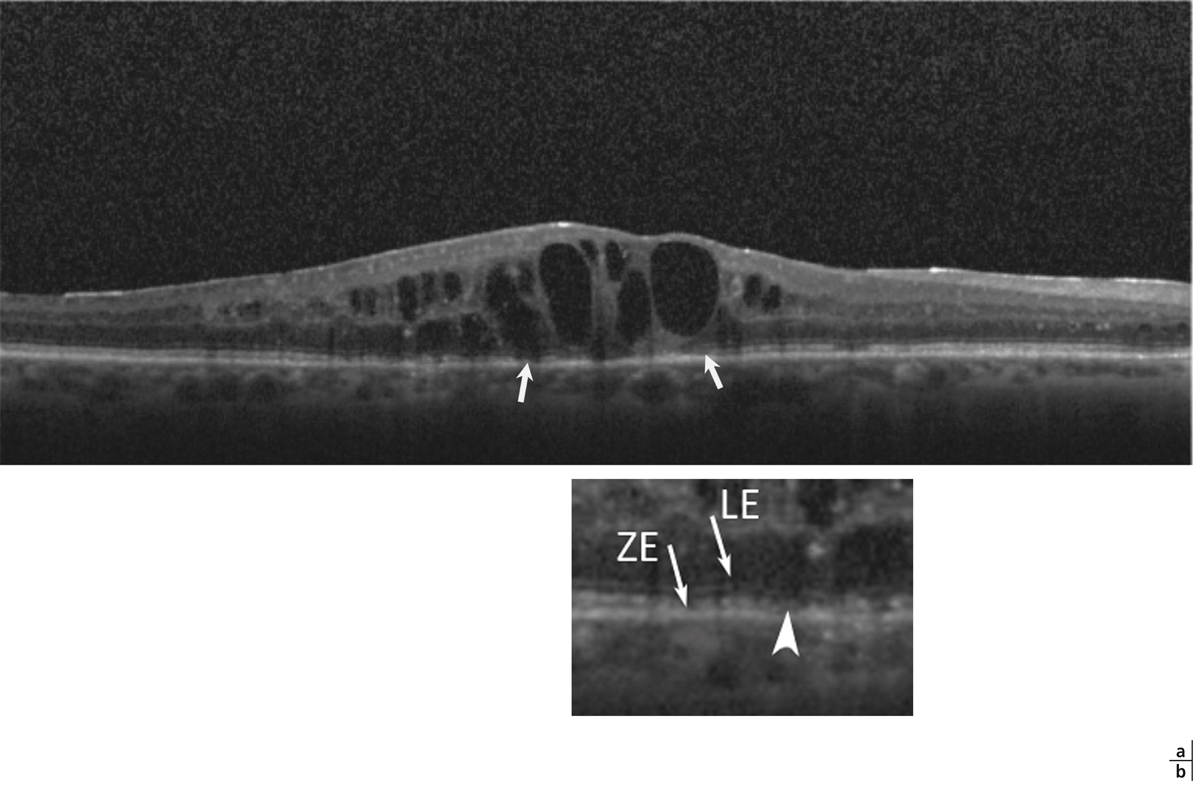
Fig. 8-41 Exemple d’œdème maculaire diabétique avec rupture de la ligne ellipsoïde.
On note une disparition complète de la zone ellipsoïde (ZE) et de la limitante externe (LE) sur une grande partie centrofovéolaire du profil maculaire OCT (a, entre les flèches). On note à fort grossissement des interruptions focales des deux lignes hyper-réflectives à proximité de leur disparition (b, tête de flèche).
Plusieurs classifications tomographiques de l’OMD ont été proposées, mais il n’y a, à ce jour, aucune classification reconnue et validée de l’OMD basée sur l’OCT.
En 1999, Otani et al. ont décrit trois types d’OMD grâce à l’OCT : l’épaississement en « éponge » de la rétine, l’œdème cystoïde et l’OMD avec DSR [29]. En 2004, Kwang et al., comparant les aspects tomographique et angiographique de l’OMD, ont décrit quatre stades d’OMD. Le stade 1 est un épaississement rétinien sans hyporéflectivité des couches rétiniennes, le stade 2 est un épaississement avec une hyporéflectivité marquée des couches externes, le stade 3 est un OMD avec DSR ; le stade 3 est sous-divisé en deux stades selon l’existence ou non d’une traction : le stade 3A ne montre pas de traction vitréenne visible, et le stade 3B est associé à une traction visible [30].
Après l’apparition des OCT de deuxième génération, Kim et al. ont repris en 2006 cette classification : les stades décrits ci-dessus peuvent coexister. Ils distinguent : épaississement non cystoïde, épaississement cystoïde, traction vitréenne, DSR [31]. Malgré ces diverses tentatives de systématisation de la description OCT des OMD, la littérature reprend peu ces classifications qui sont purement descriptives et elles restent peu utilisées en pratique courante.
Récemment, Bolz et al. ont proposé une classification de l’OMD basée sur l’OCT et l’angiographie en fluorescence (tableau 8-6) [32]. C’est le protocole SAVE, dans lequel quatre critères sont évalués : la présence d’un décollement séreux rétinien (S), l’étendue de l’OMD mesurée par le nombre de quadrants de la grille de l’ETDRS présentant un épaississement rétinien (A), la présence d’une anomalie de l’interface vitréomaculaire (V), et l’étiologie de l’OMD (E). Quatre types « étiologiques » sont décrits : selon la source des diffusions (type 1 : focal ou type 2 : non focal), selon la présence d’une ischémie rétinienne (type 3) et d’une atrophie centrale (type 4). Ces quatre types d’OM peuvent coexister dans un même œil. Une bonne corrélation interobservateur a été retrouvée pour l’ensemble de ces critères, sauf pour l’évaluation de l’interface vitréorétinien. Le degré d’atrophie dans le type 4 a été mesuré par l’index d’intégrité tissulaire, défini par le ratio liquide intra- et sous-rétinien versus tissu résiduel dans la région maculaire centrale, et une bonne corrélation a été retrouvée entre l’acuité visuelle et cet index d’intégrité tissulaire. Une étude de plus grande ampleur est nécessaire pour valider cette classification [33].
Tableau 8-6 Score SAVE.
[1] ETDRS study group. Early photocoagulation for diabetic retinopathy. ETDRS report number 9. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology 1991 ; 98 : 766-85.
[2] ETDRS study group. Grading diabetic retinopathy from stereoscopic color fundus photographs--an extension of the modified Airlie House classification. ETDRS report number 10. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology 1991 ; 98 : 786-806.
[3] Chan A, Duker JS, Ko TH, et al. Normal macular thickness measurements in healthy eyes using Stratus optical coherence tomography. Arch Ophthalmol 2006 ; 124 : 193-8.
[4] Giani A, Cigada M, Choudhry N, et al. Reproducibility of retinal thickness measurements on normal and pathologic eyes by different optical coherence tomography instruments. Am J Ophthalmol 2010 ; 150 : 815-24.
[5] Diabetic Retinopathy Clinical Research Network, Bressler NM, Miller KM, Beck RW, Bressler SB, Glassman AR, et al. Observational study of subclinical diabetic macular edema. Eye (Lond) 2012 ; 26 : 833-40.
[6] Horii T, Murakami T, Nishijima K, et al. Optical coherence tomographic characteristics of microaneurysms in diabetic retinopathy. Am J Ophthalmol 2010 ; 150 : 840-8.
[7] Ito H, Horii T, Nishijima K, et al. Association between fluorescein leakage and optical coherence tomographic characteristics of microaneurysms in diabetic retinopathy. Retina 2013 ; 33 : 732-9.
[8] Otani T, Kishi S. Correlation between optical coherence tomography and fluorescein angiography findings in diabetic macular edema. Ophthalmology 2007 ; 114 : 104-7.
[9] Murakami T, Uji A, Ogino K, et al. Association between perifoveal hyperfluorescence and serous retinal detachment in diabetic macular edema. Ophthalmology 2013 ; 120 : 2596-603.
[10] Horii T, Murakami T, Nishijima K, et al. Relationship between fluorescein pooling and optical coherence tomographic reflectivity of cystoid spaces in diabetic macular edema. Ophthalmology 2012 ; 119 : 1047-55.
[11] Gaucher D, Sebah C, Erginay A, et al. Optical coherence tomography features during the evolution of serous retinal detachment in patients with diabetic macular edema. Am J Ophthalmol 2008 ; 145 : 289-96.
[12] Foos RY, Kreiger AE, Forsythe AB, Zakka KA. Posterior vitreous detachment in diabetic subjects. Ophthalmology 1980 ; 87 : 122-8.
[13] Ota M, Nishijima K, Sakamoto A, et al. Optical coherence tomographic evaluation of foveal hard exudates in patients with diabetic maculopathy accompanying macular detachment. Ophthalmology 2010 ; 117 : 1996-2002.
[14] Bolz M, Schmidt-Erfurth U, Deak G, et al. Optical coherence tomographic hyperreflective foci : a morphologic sign of lipid extravasation in diabetic macular edema. Ophthalmology 2009 ; 116 : 914-20.
[15] Vujosevic S, Bini S, Midena G, et al. Hyperreflective intraretinal spots in diabetics without and with nonproliferative diabetic retinopathy : an in vivostudy using spectral domain OCT. J Diabetes Res 2013 ; 2013 : 491835.
[16] Baumuller S, Issa PC, Scholl HPN, et al. Outer retinal hyperreflective spots on spectral domain optical coherence tomography in macular telangiectasia type 2. Ophthalmology 2010 ; 117 : 2162-68.
[17] Murakami T, Akimoto M, Ooto S, et al. Association between abnormal autofluorescence and photoreceptor disorganization in retinitis pigmentosa. Am J Ophthalmol 2008 ; 145 : 687-94.
[18] Nishijima K, Murakami T, Hirashima T, et al. Hyperreflective foci in outer retina predictive of photoreceptor damage and poor vision after vitrectomy for diabetic macular edema. Retina 2014 ; 34 : 732-40.
[19] Gaucher D, Tadayoni R, Erginay A, et al. Optical coherence tomography assessment of the vitreoretinal relationship in diabetic macular edema. Am J Ophthalmol 2005 ; 139 : 807-13.
[20] Hikichi T, Yoshida A, Trempe CL. Course of vitreomacular traction syndrome. Am J Ophthalmol 1995 ; 119 : 55-61.
[21] Ghazi NG, Ciralsky JB, Shah SM, et al. Optical coherence tomography findings in persistent diabetic macular edema : the vitreomacular interface. Am J Ophthalmol 2007 ; 144 : 747-54.
[22] Byeon SH, Chu YK, Lee H, et al. Foveal ganglion cell layer damage in ischemic diabetic maculopathy : correlation of optical coherence tomographic and anatomic changes. Ophthalmology 2009 ; 116 : 1949-59.
[23] Bonnin S, Tadayoni R, Erginay A, et al. Correlation between ganglion cell layer thinning and poor visual function after resolution of diabetic macular edema. Invest Ophthalmol Vis Sci 2015 ; 56 : 978-82.
[24] Radwan SH, Soliman AZ, Tokarev J, et al. Association of disorganization of retinal inner layers with vision after resolution of center-involved diabetic macular edema. JAMA Ophthalmol 2015 ; 133 : 820-5.
[25] Pelosini L, Hull CC, Boyce JF, et al. Optical coherence tomography may be used to predict visual acuity in patients with macular edema. Invest Ophthalmol Vis Sci 2011 ; 52 : 2741-8.
[26] Ioannides A, Georgakarakos ND, Elaroud I, Andreou P. Isolated cotton-wool spots of unknown etiology : management and sequential spectral domain optical coherence tomography documentation. Clin Ophthalmol 2011 ; 5 : 1431-3.
[27] Forooghian F, Stetson PF, Meyer SA, et al. Relationship between photoreceptor outer segment length and visual acuity in diabetic macular edema. Retina 2010 ; 30 : 63-70.
[28] Shin HJ, Lee SH, Chung H, Kim HC. Association between photoreceptor integrity and visual outcome in diabetic macular edema. Graefes Arch Clin Exp Ophthalmol 2012 ; 250 : 61-70.
[29] Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999 ; 127 : 688-93.
[30] Kang SW, Park CY, Ham DI. The correlation between fluorescein angiographic and optical coherence tomographic features in clinically significant diabetic macular edema. Am J Ophthalmol 2004 ; 137 : 313-22.
[31] Kim BY, Smith SD, Kaiser PK. Optical coherence tomographic patterns of diabetic macular edema. Am J Ophthalmol 2006 ; 142 : 405-12.
[32] Bolz M, Lammer J, Deak G, et al. SAVE : a grading protocol for clinically significant diabetic macular oedema based on optical coherence tomography and fluorescein angiography. Br J Ophthalmol 2014 ; 98 : 1612-7.
[33] Bolz M, et al., Communication orale. Annual Meeting of the Association for Research in Vision and Ophthalmology (ARVO) 2015.
A. Couturier
➤ Les micro-anévrismes détectés en OCT-angiographie (OCTA) sont moins nombreux qu’en angiographie en fluorescéine ; ils prédominent dans le réseau capillaire profond.
➤ En revanche, les zones de non-perfusion capillaire sont mieux analysables et quantifiables en OCTA qu’en angiographie en fluorescéine.
➤ En cas d’OM, les kystes maculaires apparaissent en OCTA sous forme d’espaces hyporéflectifs dépourvus de capillaires ; ceux-ci réapparaissent partiellement lorsque l’OM se résorbe.
L’OCT-angiographie (OCTA), ou angio-OCT, est une nouvelle technique d’imagerie permettant une visualisation en face de la vascularisation rétinienne sans injection de colorant. L’OCTA permet une analyse précise des deux plexus capillaires rétiniens, tandis que ceux-ci apparaissent superposés sur une angiographie à la fluorescéine. Ainsi, chez le sujet normal, l’OCTA a permis de préciser l’architecture des plexus capillaires superficiel et profond [1]. En cas d’OM, l’OCTA permet de rechercher des anomalies capillaires spécifiques et d’analyser précisément les rapports entre les logettes et les plexus capillaires.
La rétinopathie diabétique (RD) est principalement caractérisée au niveau maculaire par l’apparition de zones de non-perfusion capillaire, la formation de micro-anévrismes et la rupture de la BHR. Plusieurs études de la microvascularisation maculaire en angiographie à la fluorescéine ont montré un élargissement des zones intercapillaires dans la RD. Cependant, la capacité de cette imagerie à détecter les anomalies de la maille capillaire reste limitée en raison de la superposition des deux lits capillaires et des phénomènes de diffusion du colorant.
Récemment, l’OCTA a permis une analyse tridimensionnelle non invasive de la microcirculation rétinienne au niveau maculaire. L’OCTA permet en effet la séparation des deux lits capillaires superficiel et profond, ce dernier étant peu visible sur l’angiographie à la fluorescéine.
Chez les patients présentant une RD, l’OCTA permet de visualiser les caractéristiques cliniques de la maladie, décrites au fond d’œil et en angiographie à la fluorescéine, telles que les micro-anévrismes, les AMIR), les néovaisseaux prérétiniens ainsi que les zones de non-perfusion capillaire (fig. 8-42) [2]. L’OCTA permet également la détection d’altérations spécifiques dans les deux lits capillaires.
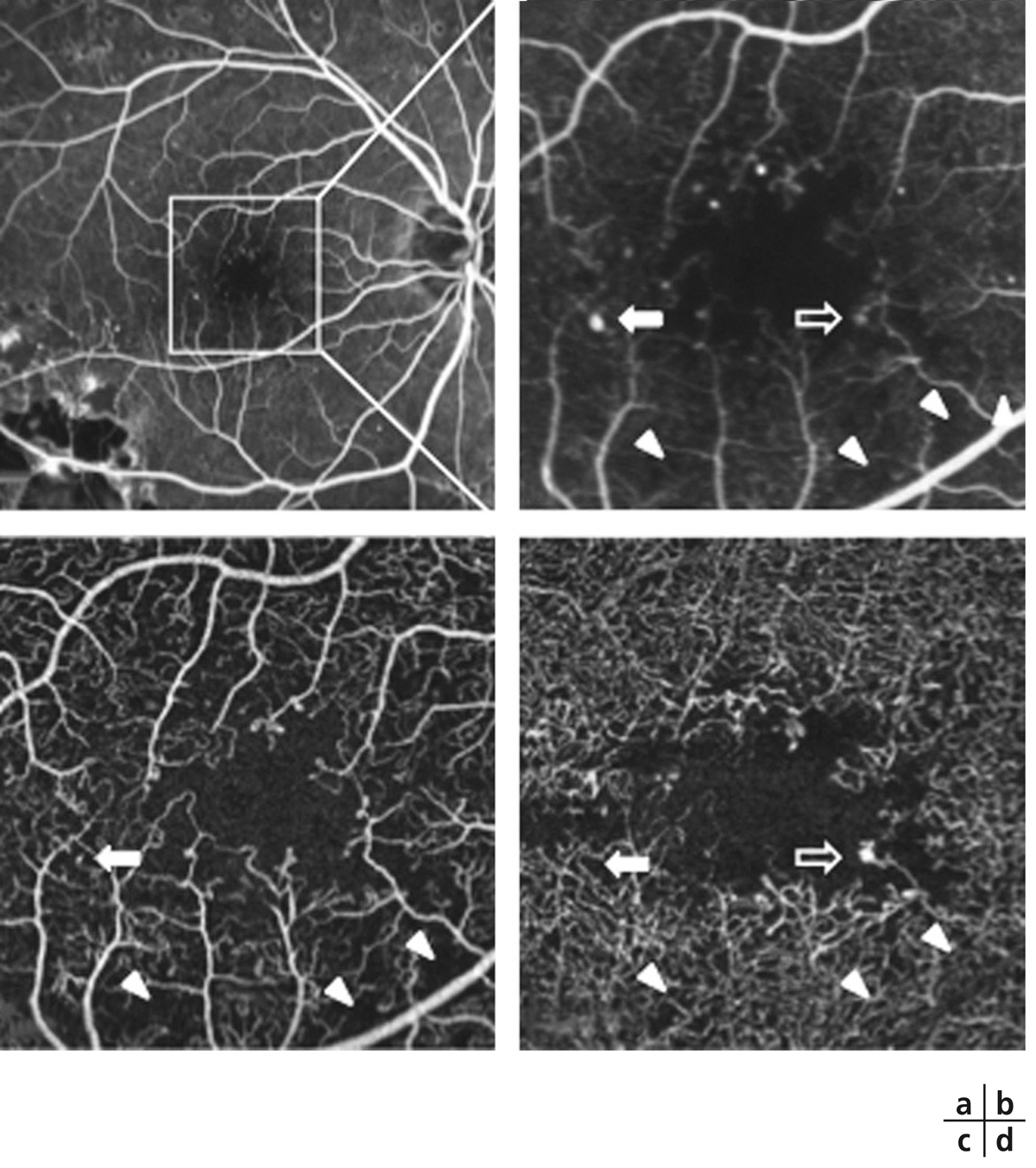
Fig. 8-42 Angiographie à la fluorescéine (a, b) et OCTA (c, d) d’une rétinopathie diabétique non proliférante sévère traitée par photocoagulation panrétinienne.
Un carré de 3 × 3 mm a été délimité sur l’angiographie à la fluorescéine (AF) (a) et correspond à la taille de l’angiogramme en OCTA. Un micro-anévrisme (flèche pleine) détecté sur l’AF (b) n’est pas visualisé en OCTA ni dans le plexus superficiel (c), ni dans le plexus profond (d). Certains micro-anévrismes sont parfois mieux identifiés sur l’OCTA que sur l’AF (b, d : flèche creuse). Les zones de non-perfusion capillaire sont bien visibles en OCTA (b, c, d : têtes de flèche).
De nombreux micro-anévrismes sont détectés en OCTA sous forme de dilatations capillaires rondes ou ovalaires. Cependant, la comparaison avec le nombre de micro-anévrismes détectés en angiographie à la fluorescéine montre que seuls 60 % environ des micro-anévrismes sont visibles en OCTA, indépendamment de leur taille (eFig. 8-7 ) [3]. Cela peut être éventuellement expliqué par un flux sanguin très lent dans certains micro-anévrismes, sous le seuil de détection de l’OCTA qui est d’environ 0,3 mm/sec. Une autre hypothèse serait que certains micro-anévrismes ne contiennent que du plasma et pas de cellules circulantes et ne seraient donc pas détectés par l’OCTA.
) [3]. Cela peut être éventuellement expliqué par un flux sanguin très lent dans certains micro-anévrismes, sous le seuil de détection de l’OCTA qui est d’environ 0,3 mm/sec. Une autre hypothèse serait que certains micro-anévrismes ne contiennent que du plasma et pas de cellules circulantes et ne seraient donc pas détectés par l’OCTA.
En OCTA, le nombre de micro-anévrismes détectés est plus important dans le lit capillaire profond que dans le lit superficiel, suggérant que les micro-anévrismes se développent principalement dans le réseau capillaire profond, comme retrouvé par les études histologiques [4]. La présence de micro-anévrismes est un signe précoce et un indicateur important de progression de la RD comme l’atteste la classification actuelle de la RD basée en partie sur leur nombre. L’absence de détection de certains micro-anévrismes par l’OCTA pourrait donc représenter un inconvénient pour l’analyse de la RD.
Par ailleurs, les micro-anévrismes sont des signes indirects d’ischémie rétinienne et se développent principalement au bord de zones de non-perfusion. Ces zones de non-perfusion sont, au contraire, mieux analysées en OCTA qu’en angiographie à la fluorescéine. En effet, il a été montré que chez des sujets sains, l’angiographie à la fluorescéine ne permettait d’obtenir une bonne image du réseau capillaire que dans 30 % des cas : la densité capillaire ainsi observée n’était que de 50 % de celle retrouvée histologiquement sur des yeux de cadavres de donneurs sains du même âge [5]. En revanche, l’OCTA permet une analyse précise des zones de non-perfusion grâce à l’absence de superposition des deux lits capillaires et des phénomènes de diffusion. Ainsi, des mesures quantitatives de zones de non-perfusion capillaire ou de densité capillaire seraient plus précises en OCTA.
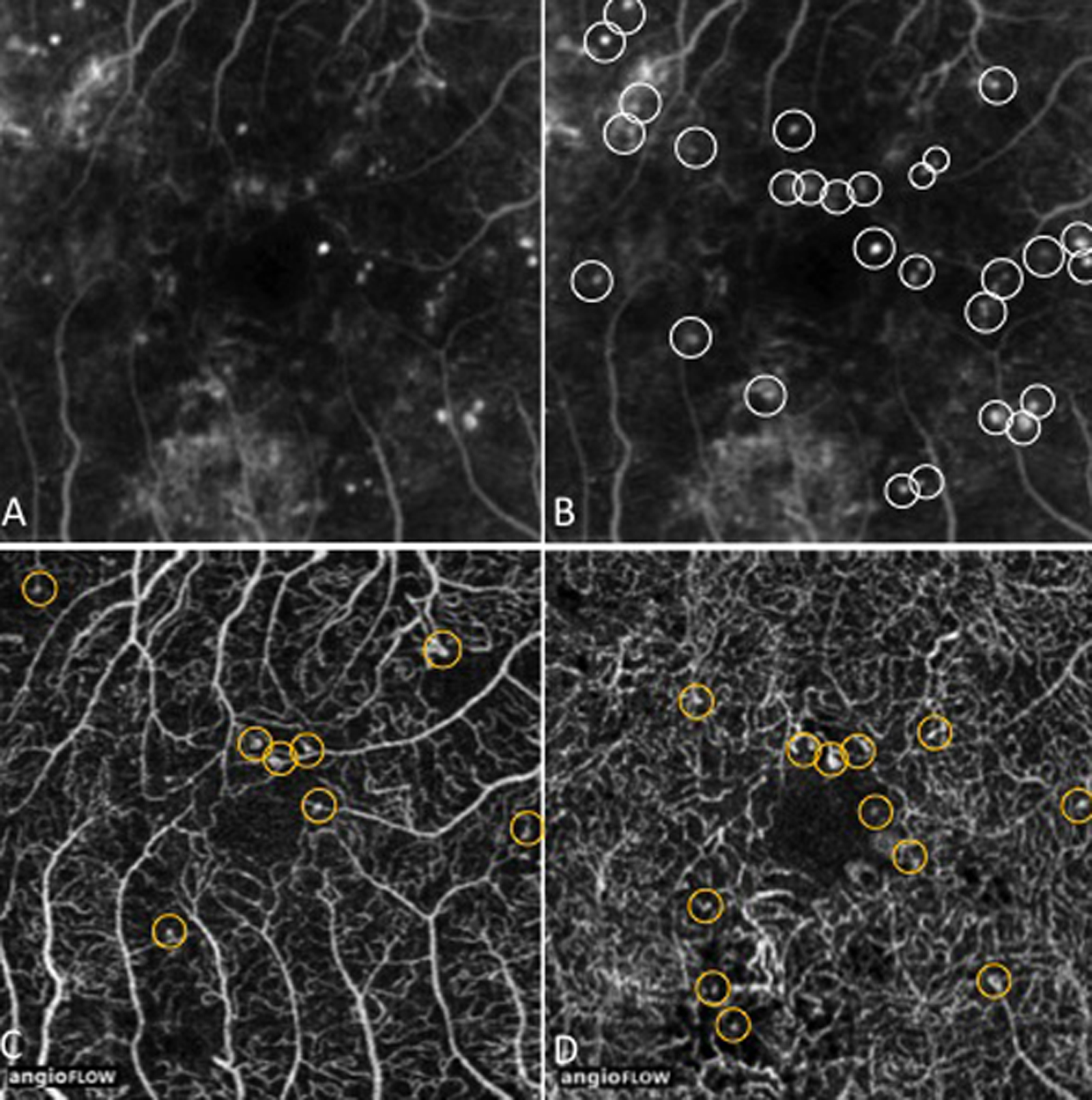
eFig. 8-7 Angiographie à la fluorescéine et OCTA d’une rétinopathie diabétique non proliférante sévère.
À l’inverse des micro-anévrismes, les AMIR sont toujours bien visibles en OCTA, certainement en raison d’une circulation sanguine plus rapide au niveau de ces anomalies intrarétiniennes qui se développent également au bord de zones de non-perfusion (eFig. 8-8 ) [2]. Ces anomalies semblent se développer préférentiellement aux dépens du réseau capillaire superficiel mais, en raison d’artefacts de projection, ils peuvent également être visualisés dans la couche du plexus capillaire profond. De la même façon, les néovaisseaux prérétiniens et prépapillaires sont bien visibles en OCTA et peuvent maintenant être quantifiés grâce aux nouveaux logiciels de mesures de surface, permettant ainsi d’évaluer précisément la réponse à un traitement [2].
) [2]. Ces anomalies semblent se développer préférentiellement aux dépens du réseau capillaire superficiel mais, en raison d’artefacts de projection, ils peuvent également être visualisés dans la couche du plexus capillaire profond. De la même façon, les néovaisseaux prérétiniens et prépapillaires sont bien visibles en OCTA et peuvent maintenant être quantifiés grâce aux nouveaux logiciels de mesures de surface, permettant ainsi d’évaluer précisément la réponse à un traitement [2].
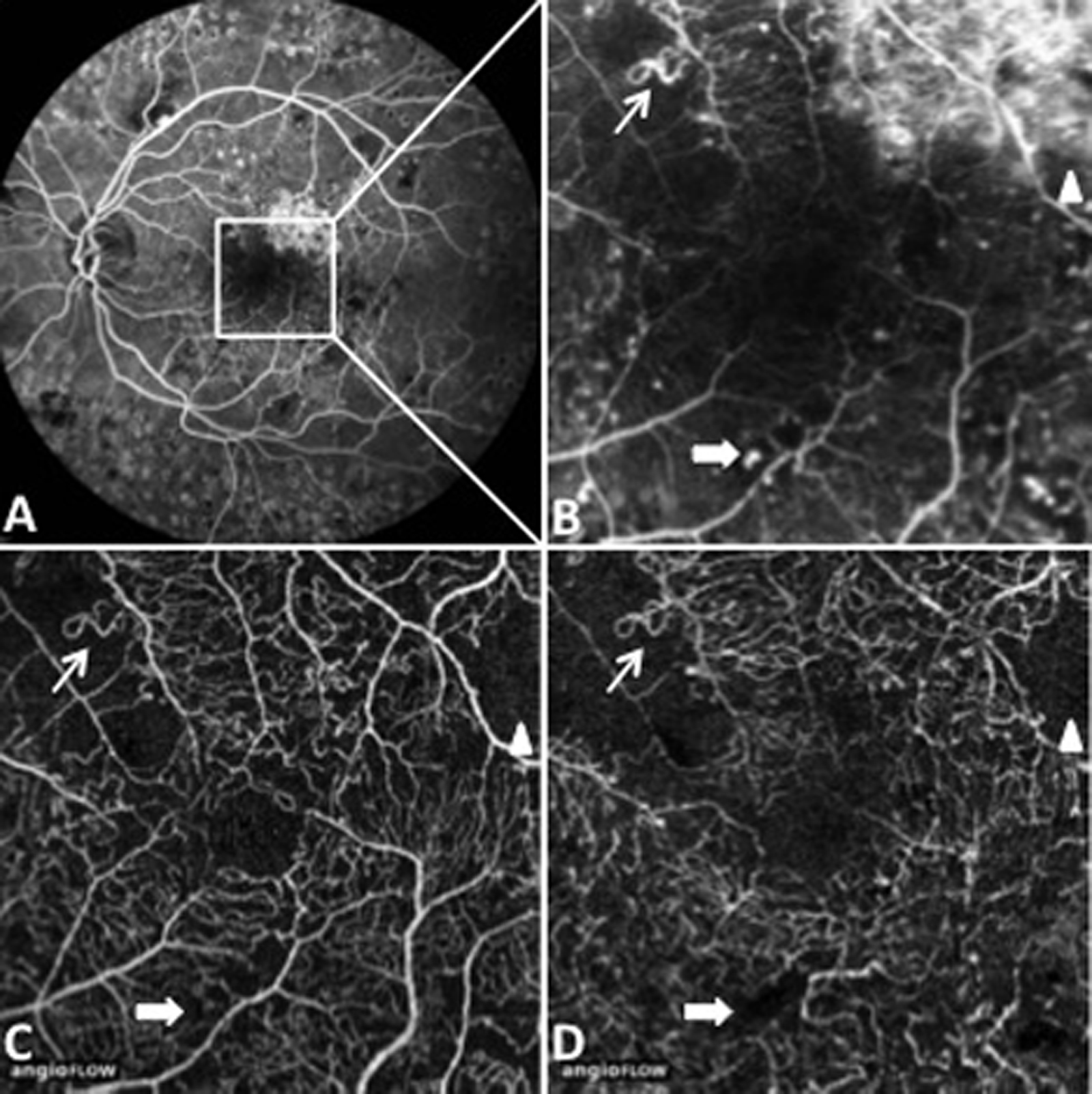
eFig. 8-8 Angiographie à la fluorescéine et OCTA d’une rétinopathie diabétique proliférante traitée par photocoagulation panrétinienne.
L’OCTA retrouve une modification des deux réseaux capillaires dès les stades précoces de RD. L’atteinte du lit capillaire superficiel semble différer du lit profond : dans le lit capillaire superficiel, la RD entraîne une raréfaction des capillaires avec présence de zones de non-perfusion (fig. 8-43). La visualisation et la délimitation de ces zones non perfusées du lit superficiel sont excellentes en cas de bonne fixation du patient et semblent plus précises qu’en angiographie à la fluorescéine. Cependant, l’OCTA ne permet actuellement qu’une visualisation limitée de l’aire maculaire, de 8 × 8 mm maximum sans détection possible de l’ensemble des zones ischémiques rétiniennes. Celle-ci nécessite la réalisation d’images avec excentration de la fixation puis reconstruction.
Dans le lit capillaire profond, les zones de non-perfusion capillaire ne sont présentes que dans un tiers des cas environ et il existe une désorganisation de l’architecture du réseau capillaire [3]. En effet, comparé à un sujet normal qui présente en OCTA une architecture régulière du plexus profond organisé en vortex capillaires, le sujet diabétique présente une désorganisation du réseau profond avec des vortex capillaires difficilement identifiés (fig. 8-43). La sévérité des atteintes des deux lits capillaires en OCTA semble corrélée au stade de la RD définie sur les rétinophotographies.
La ZAC est également bien visualisée et délimitée en OCTA. Les études concernant la mesure de la taille de la ZAC en angiographie à la fluorescéine pour grader les RD n’ont pas permis de retrouver une valeur pronostique significative de cette mesure [6]. Cependant la mesure de la ZAC semble plus précise au niveau du réseau capillaire superficiel en OCTA qu’en angiographie à la fluorescéine. Ainsi, des études récentes ont montré que la ZAC est élargie de façon significative et asymétrique chez les patients diabétiques comparés aux sujets sains en OCTA, et ce de façon proportionnelle à la sévérité de la rétinopathie diabétique [7, 8].
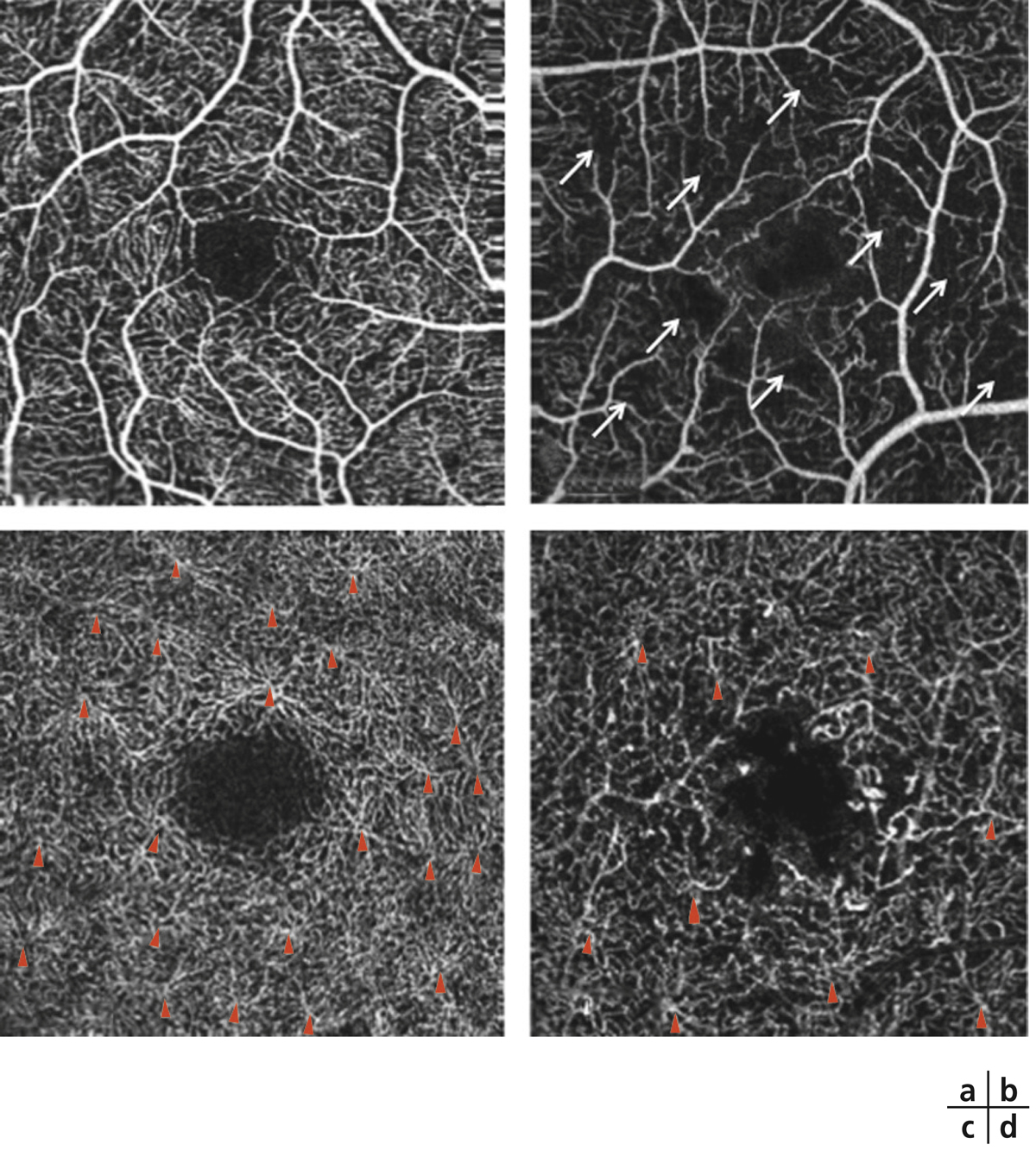
Fig. 8-43 OCT-angiographie d’un sujet présentant une rétinopathie diabétique non proliférante sévère (b, d) comparée à un sujet sain (a, c).
Le plexus capillaire superficiel (b) présente une raréfaction capillaire avec de nombreuses zones de non-perfusion (flèches blanches), tandis que le plexus profond (d) présente une désorganisation avec disparition de l’organisation normale en vortex capillaires (vortex identifiés par les têtes de flèche rouges).
En cas d’OM, les kystes maculaires sont visualisés en OCTA sous forme d’espaces hyporéflectifs dépourvus de capillaires (fig. 8-44). L’absence de capillaires au sein des logettes d’OM pourrait être expliquée par un déplacement des capillaires en périphérie des kystes ou par le développement préférentiel de l’œdème dans des zones de non-perfusion capillaire préexistantes. Le suivi en OCTA de patients traités pour un OM diabétique montre que l’assèchement des logettes d’OM s’accompagne d’une réapparition partielle des capillaires dans les zones de kystes. Des kystes hyper-réflectifs, visibles aussi sur les coupes B-scan d’OCT, peuvent également apparaître et semblent correspondre à un tissu fibroglial cicatriciel (fig. 8-45). À l’avenir, le suivi à long terme en OCTA de patients traités pour un OM diabétique pourrait éventuellement permettre d’apporter des éléments nouveaux sur les anomalies capillaires associées à l’œdème.
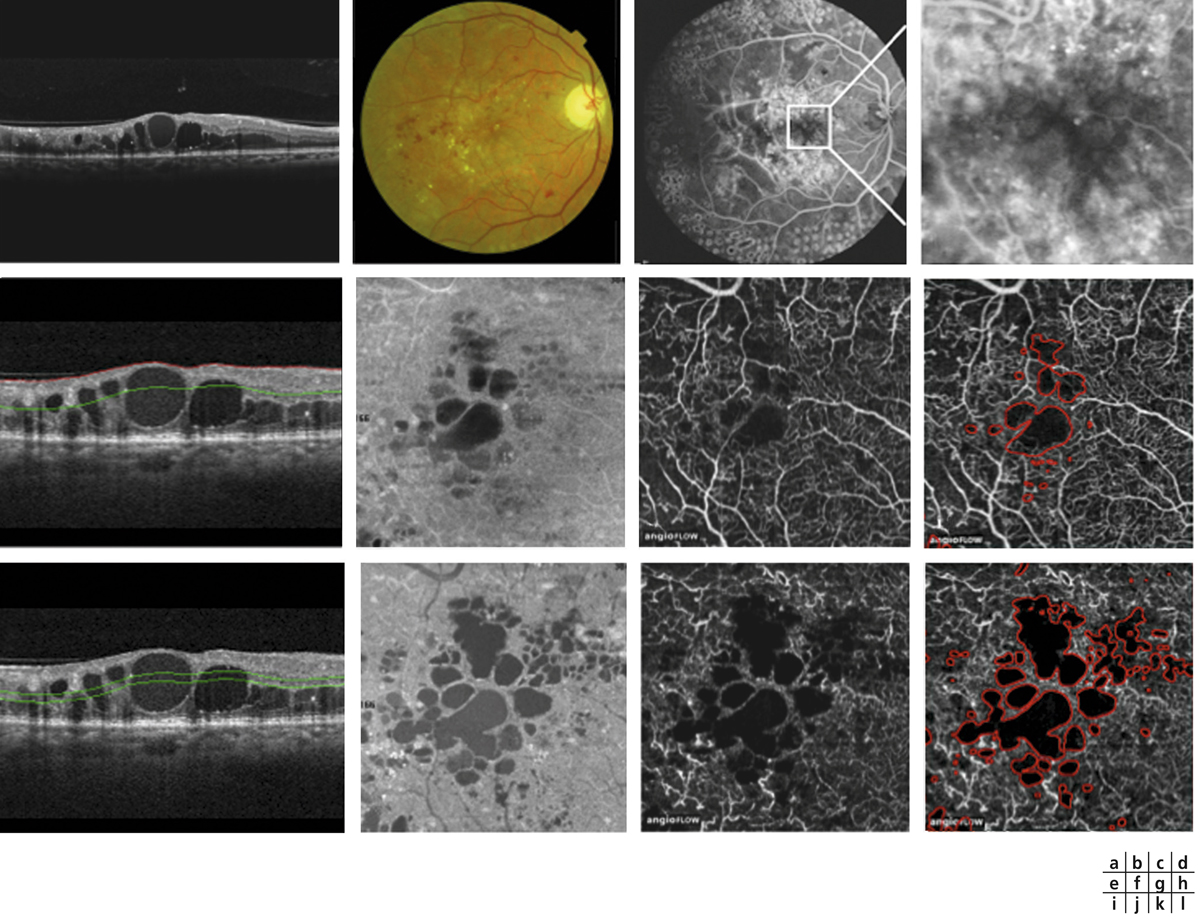
Fig. 8-44 Imagerie d’un patient présentant une rétinopathie diabétique non proliférante sévère traitée par photocoagulation panrétinienne associée à un œdème maculaire sévère non traité.
L’OMC sévère est diagnostiqué sur les coupes d’OCT B-scan (a, e, i) et les signes de rétinopathie sont visibles sur la rétinophotographie en couleurs (b) et l’angiographie à la fluorescéine (AF) (c, d) : agrandissement d’une zone de 3 × 3 mm de la région maculaire. L’AF retrouve la persistance de zones de non-perfusion et des diffusions au pôle postérieur. L’OCTA détecte les logettes d’œdème au niveau des deux plexus capillaires superficiel (g) et profond (k). Elles sont également bien visibles sur les clichés « en face » (f, j) de l’OCTA. La délimitation de l’œdème (en rouge) à partir de ces clichés « en face » et leur superposition sur l’angiogramme (h, l) confirment l’absence de capillaires au sein des logettes.
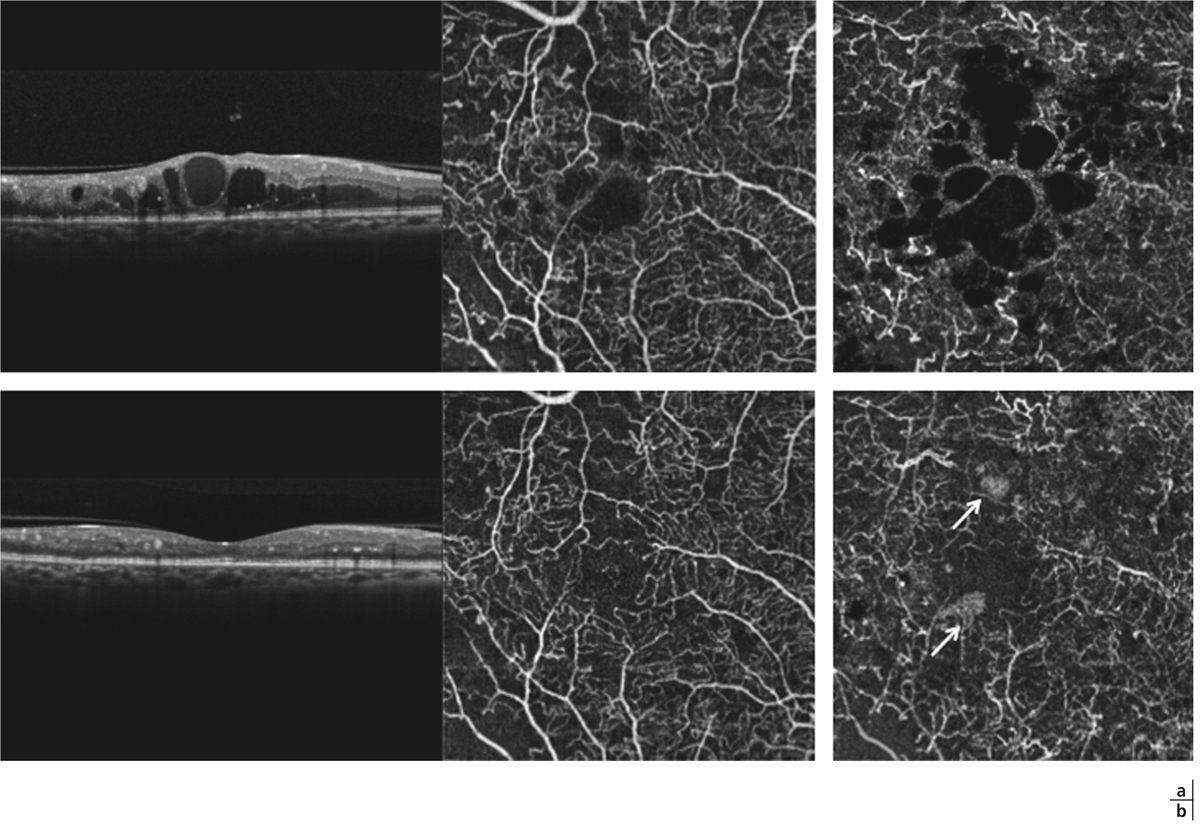
Fig. 8-45 Évolution d’un œdème maculaire diabétique sévère après traitement par trois injections intravitréennes d’anti-VEGF en OCTA (même patient qu’à la figure 8-44).
a. Avant traitement, les logettes d’œdème sont bien visibles sur la coupe B-scan d’OCT et sur les angiogrammes, principalement au niveau du plexus capillaire profond. L’OCTA détecte également des plages de non-perfusion au niveau du plexus capillaire superficiel, tandis qu’il existe une désorganisation importante du plexus capillaire profond. b. 1 mois après la 3e injection d’anti-VEGF, l’OCT B-scan objective l’assèchement de l’œdème. Des anomalies capillaires persistent dans les anciennes zones d’œdème au niveau des plexus superficiel et profond. Des images de kystes hyper-réflectifs (flèches) sont visibles dans le plexus profond et pourraient correspondre à du tissu fibroglial cicatriciel.
L’OCTA apporte aujourd’hui une visualisation précise de l’architecture capillaire dans les pathologies rétiniennes maculaires, constituant un outil diagnostique et de suivi supplémentaire. Il pourrait également permettre d’apporter des éléments nouveaux dans la compréhension de certaines pathologies rétiniennes telles que l’OM.
L’OM peut en effet être visualisé et analysé de façon précise en OCTA. Les logettes apparaissent sous forme d’espaces hyporéflectifs dépourvus de capillaires, quelle que soit l’origine de l’œdème, mais les anomalies capillaires éventuellement associées semblent différer.
[1] Spaide RF, Klancnik JM, Cooney MJ. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomography angiography. JAMA Ophthalmol 2015 ; 133 : 45-50.
[2] Ishibazawa A, Nagaoka T, Takahashi A, et al. Optical coherence tomography angiography in diabetic retinopathy : a prospective pilot study. Am J Ophthalmol 2015 ; 160 : 35-44.
[3] Couturier A, Mané V, Bonnin S, et al. Capillary plexus anomalies in diabetic retinopathy on optical coherence tomography angiography. Retina 2015 ; 35 : 2384-91.
[4] Moore J, Bagley S, Ireland G, et al. Three dimensional analysis of microaneurysms in the human diabetic retina. J Anat 1999 ; 194 : 89-100.
[5] Mendis KR, Balaratnasingam C, Yu P, et al. Correlation of histologic and clinical images to determine the diagnostic value of fluorescein angiography for studying retinal capillary detail. Invest Ophthalmol Vis Sci 2010 ; 51 : 5864-9.
[6] Ahmad Fadzil M, Ngah NF, George TM, et al. Analysis of foveal avascular zone in colour fundus images for grading of diabetic retinopathy severity. Conf Proc IEEE Eng Med Biol Soc 2010 ; 2010 : 5632-5.
[7] Freiberg FJ, Pfau M, Wons J, et al. Optical coherence tomography angiography of the foveal avascular zone in diabetic retinopathy. Graefes Arch Clin Exp Ophthalmol 2015 Sep 4.
[8] Di G, Weihong Y, Xiao Z, et al. A morphological study of the foveal avascular zone in patients with diabetes mellitus using optical coherence tomography angiography. Graefes Arch Clin Exp Ophthalmol 2015 Sep 7.
M. Puech
➤ L’échographie permet d’analyser l’état rétinien et l’interface vitréomaculaire en cas de cataracte dense ou d’hémorragie du vitré.
➤ En cas d’hémorragie du vitré, elle permet d’identifier le plus souvent la cause et le point de départ de l’hémorragie ; elle permet d’effectuer un suivi évolutif dans l’attente de la résorption spontanée de l’hémorragie.
➤ L’échographie permet d’analyser précisément les tractions vitréorétiniennes au cours de la rétinopathie diabétique proliférante.
Le recours à l’échographie, lors de rétinopathie diabétique (RD), peut être très utile en cas de perte de transparence des milieux qui limite l’analyse de la rétine maculaire et périphérique. En cas de cataracte dense, l’examen échographique est utile chez un patient diabétique pour apprécier l’état rétinien et maculaire. En cas d’hémorragie intravitréenne, l’examen échographique permet le plus souvent d’identifier la cause et le point de départ de l’hémorragie, en réalisant un bilan vitréorétinien complet et en appréciant l’état maculaire.
L’échographie peut également identifier les différentes formes d’épaississement maculaire lié au diabète. L’analyse des relations vitréorétiniennes détecte soit la présence d’un décollement postérieur du vitré, soit la présence d’une organisation vitréenne avec mise en évidence de brides intravitréennes produisant des tractions maculaires dont le stade le plus évolué est un décollement rétinien tractionnel maculaire ou périphérique.
L’examen échographique prend donc toute sa place dans l’ensemble des systèmes d’imagerie dédiés à l’épaississement maculaire du diabète, notamment en cas de perte de transparence des milieux [1].
Lors de l’examen échographique, que ce soit derrière une cataracte dense ou une hémorragie intravitréenne, la très bonne pénétration du faisceau ultrasonore permet d’apprécier, dans toutes les circonstances, l’état de la région maculaire [2]. Cette analyse est nettement améliorée par l’utilisation des sondes de 20 MHz qui majorent la résolution en gardant une bonne pénétration au travers des opacités des milieux [3]. L’examen peut ainsi mettre en évidence :
-
un épaississement diffus intéressant toute la région maculaire avec souvent absence de décollement postérieur du vitré (DPV) (fig. 8-46a). Cet épaississement est apprécié sur les coupes maculaires horizontales et verticales ;
-
un épaississement maculaire plus localisé avec quelques zones hyperéchogènes pouvant correspondre à des logettes d’OMC (fig. 8-46b) ;
-
un important épaississement d’aspect hématique et d’échogénicité légèrement hétérogène, pouvant correspondre à une importante réaction hémorragique, intra- ou sous-rétinienne (fig. 8-47).
Fig. 8-47 Bombement maculaire hémorragique, d’aspect hétérogène, rentrant dans le cadre d’une importante hémorragie rétinienne maculaire associée à une hémorragie vitréenne assez dense
L’examen échographique permet d’apprécier la présence ou non d’un DPV au niveau de la région maculaire [4]. Le plus souvent, en cas de RD modérée, le DPV se produit de façon physiologique, avec une hyaloïde postérieure qui reste fine et mobile en regard de la rétine maculaire. Lors des stades plus avancés de RD, la hyaloïde postérieure peut être épaissie, en gardant certaines adhérences sur la macula, au niveau des vaisseaux temporaux ou directement sur la papille. Ces différents types d’adhérence peuvent parfois constituer un support de développement d’une néovascularisation prérétinienne pouvant entraîner des hémorragies intravitréennes importantes (fig. 8-48) [5].
L’exploration ultrasonore peut parfois identifier des hémorragies intravitréennes, plus ou moins associées à une organisation en travées et en brides intravitréennes, mais il peut aussi exister des hémorragies rétro-hyaloïdiennes reconnaissables par leur aspect plus homogène (fig. 8-49). Ces tractions peuvent provenir de brides intravitréennes avec parfois un effet de traction sur les vaisseaux rétiniens. Il peut aussi s’agir de la hyaloïde postérieure, en partie décollée qui garde certaines adhérences plus marquées tant dans la région maculaire qu’en périphérie [6]. Dans les stades les plus évolués avec une hyaloïde postérieure épaissie et décollée, le diagnostic différentiel avec un décollement de rétine est parfois difficile.
Les tractions vitréorétiniennes denses peuvent enfin aboutir à un aspect de décollement de rétine tractionnel. Ces derniers peuvent intéresser la région maculaire avec un aspect localisé (fig. 8-50a) mais sont parfois périphériques : certaines brides intravitréennes partent de la papille ou du pôle postérieur et se dirigent en périphérie pour donner des décollements dits « en toile de tente » (fig. 8-50b) [7]. La rétine décollée est alors assez épaissie et peu mobile.
Le rôle de l’échographie en cas de rétinopathie diabétique est de réaliser un bilan anatomique en complément du bilan de fond d’œil avec la possibilité, notamment en cas d’hémorragie vitréenne, d’identifier la cause de l’hémorragie, de pratiquer un état des lieux et, si nécessaire, d’effectuer un suivi évolutif dans l’attente de la résorption souvent spontanée de l’hémorragie [8]. En cas d’hémorragie plus dense ou persistante, l’échographie interviendra pour étayer les choix thérapeutiques et pour guider les décisions chirurgicales notamment en cas de décollement de rétine associé.
Fig. 8-48 Coupe échographique d’un néovaisseau prérétinien, développé sur une bride vitréenne au niveau des vaisseaux temporaux
Fig. 8-49 Hémorragie intravitréenne avec décollement postérieur du vitré et hémorragie rétro-hyaloïdienne donnant des échos diffus plus homogènes que dans le gel vitréen.
Fig. 8-50 Décollement de rétine tractionnel.
a. Décollement de rétine de la région maculaire par traction vitréenne qui se dirige vers la périphérie rétinienne. b. Traction vitréenne entraînant un décollement de rétine périphérique « en toile de tente » assez caractéristique d’un décollement tractionnel du diabétique.
[1] Coleman DJ, Silverman RH, Chabi A, et al. High-resolution ultrasonic imaging of the posterior segment. Ophthalmology 2004 ; 111 : 1344-51.
[2] Salz DA, Witkin AJ. Imaging in diabetic retinopathy. Middle East Afr J Ophthalmol 2015 ; 22 : 145-50.
[3] Hewick SA, Fairhead AC, Culy JC, Atta HR. A comparison of 10 MHz and 20 MHz ultrasound probes in imaging the eye and orbit. Br J Ophthalmol 2004 ; 88 : 551-5.
[4] Zvornicanin J, Jusufovic V, Cabric E, et al. Significance of ultrasonography in evaluation of vitreo-retinal pathologies. Med Arch 2012 ; 66 : 318-20.
[5] Lindgren G, Lindblom B. Causes of vitreous hemorrhage. Curr Opin Ophthalmol 1996 ; 7 : 13-9.
[6] Colangelo L, Mancini A, Lobefalo L, et al. Echobiometry of the ocular layers at the posterior pole. Ophthalmologica 1998 ; 212 Suppl 1 : 27-9.
[7] Jerneld B, Algvere P, Singh G. An ultrasonographic study of diabetic vitreo-retinal disease with low visual acuity. Acta Ophthalmol 1980 ; 58 : 193-201.
[8] Capeans C, Santos L, Touriño R, et al. Ocular echography in the prognosis of vitreous haemorrhage in type II diabetes mellitus. Int Ophthalmol 1998 ; 21 : 269-75.
A. Lecleire-Collet
➤ L’OMD est associé à une baisse d’acuité visuelle variable.
➤ En l’absence de traitement, l’OMD entraîne une dégradation lente et progressive de l’acuité visuelle. Ainsi, une diminution modérée de l’acuité visuelle est généralement observée au bout d’un an, et cette perte d’acuité visuelle s’aggrave avec la durée du suivi sans traitement.
➤ Une amélioration spontanée de l’OMD peut survenir, soulignant l’absence d’urgence à traiter un OMD.
➤ Des fluctuations spontanées diurnes et à moyen terme de l’OMD sont habituelles ; elles doivent être prises en compte pour l’évaluation des traitements de l’OMD.
Peu d’études ont évalué le devenir des OMD non traités, car la photocoagulation maculaire a été utilisée avec efficacité dans l’OMD dès les années 1980. Les injections intravitréennes de corticoïdes et d’anti-VEGF se sont ensuite imposées dans la prise en charge de cette pathologie. Cependant, il est intéressant de connaître l’évolution naturelle de l’OMD, notamment les formes sans baisse d’acuité visuelle importante, afin d’en informer les patients et de garder un esprit critique sur les résultats des nouveaux traitements.
Des informations concernant l’évolution naturelle, sans traitement, de l’OMD nous ont été apportées par certaines études cliniques observationnelles et les bras « contrôles » de grandes études randomisées, réalisées principalement avant ou au début de l’utilisation de ces traitements. Un point à souligner est la difficulté à recueillir des informations concernant l’évolution de l’équilibre glycémique et tensionnel des patients dans ces études.
L’OMD présente également des fluctuations spontanées à court terme, mises en évidence récemment grâce à l’OCT. Elles doivent être connues pour mieux interpréter l’efficacité des traitements de l’OMD.
Une étude a évalué, de façon rétrospective, l’évolution spontanée de 31 yeux (24 patients) présentant un OMD non traité, suivis pendant plus de 3 ans (suivi moyen : 4 ans, intervalle : 3–8,5 ans) sans traitement [1]. L’évolution de l’OM a été appréciée uniquement sur l’angiographie en fluorescence, l’OCT n’étant à cette date pas disponible. Il s’agissait d’yeux adelphes, d’yeux traités ou bien d’yeux présentant une acuité visuelle supérieure à 0,5. Les caractéristiques des yeux étaient les suivantes : logette cystoïde centrale présente dans 45 % des yeux, exsudats maculaires présents dans 25 % des yeux (8 yeux). Dans la majorité des cas, l’acuité visuelle est restée stable, passant en moyenne de 0,60 à 0,55. Vingt-neuf pour cent des yeux ont présenté une perte d’acuité visuelle de 2 lignes ou plus à 3 ans. Une amélioration spontanée de l’acuité visuelle de 2 lignes ou plus a été notée dans 19,5 % des cas. Les acuités visuelles initiale et finale étaient sensiblement plus faibles chez les patients présentant une logette angiographique centrale. Cette étude a souligné la possible fluctuation spontanée de l’OMD angiographique, puisque 51,5 % des yeux ont présenté au cours du suivi de leur OMD angiographique soit une disparition spontanée suivie d’une réapparition, soit l’inverse.
En ce qui concerne les exsudats : en l’absence de traitement, ils deviennent plus nombreux et volumineux et s’accumulent dans la région maculaire. Dans les cas les plus graves, les exsudats réalisent des placards exsudatifs sous-maculaires, associés à une désorganisation du tissu rétinien et à un mauvais pronostic visuel. Cependant, les exsudats peuvent disparaître spontanément, lorsque les anomalies causales dont ils sont issus (par exemple, les micro-anévrismes) s’occluent spontanément. La résorption des exsudats (phagocytose par les macrophages) est lente (la durée peut atteindre plusieurs mois). Toutefois, les récidives sont fréquentes [2].
Cette étude avait pour but d’évaluer l’efficacité du laser maculaire pour traiter l’OMD. Dans celle-ci, plus de 2 000 yeux présentant une rétinopathie diabétique non proliférante associée à un OM (défini par un épaississement rétinien situé à moins de 1 diamètre papillaire du centre de la macula) et une acuité visuelle supérieure ou égale à 2/10 ont été randomisés, soit pour un traitement par laser de l’OM, soit pour une surveillance sans traitement (1 490 yeux). Le critère principal de l’étude était le pourcentage d’yeux présentant une baisse d’acuité visuelle de 3 lignes ou plus à 3 ans. Dans le groupe de patients non traités, l’acuité visuelle s’est dégradée (perte de plus de 3 lignes ETDRS) au bout de 3 ans dans 24 % des yeux (tableau 8-7), soit environ le double des patients traités par laser.
Davis et al. [4] ont calculé la baisse d’acuité visuelle mensuelle liée à un OM sévère. Dans l’étude randomisée évaluant l’efficacité de la ruboxistaurine (PKC-DRS2), ils ont montré que les yeux du groupe placebo présentant un OM sévère perdaient 0,63 lettre ETDRS par mois (0,67 en ajustant sur les données cliniques à l’inclusion), correspondant à 23 lettres sur 36 mois. Ce résultat était comparable aux 20 lettres perdues des yeux contrôles sur une période de 23 à 36 mois rapportées dans l’étude de l’ETDRS [5]. Il faut noter que les yeux qui avaient antérieurement été traités par photocoagulation maculaire perdaient 2,1 lettres de moins en moyenne que ceux non traités.
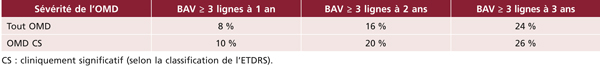
Tableau 8-7 Étude ETDRS, report no 1 : évolution du groupe contrôle (non traité), à 1, 2 et 3 ans.
Les nouveaux traitements de l’OMD (ranibizumab, implant de dexaméthasone, implant de fluocinolone) ont été évalués dans de grandes études randomisées. Certaines d’entre elles ont comparé l’efficacité du traitement évalué à un groupe contrôle traité par placebo (le plus souvent injections intra-oculaires simulées). Ces groupes contrôles ne décrivent qu’imparfaitement l’histoire naturelle de l’OMD, car la plupart des yeux inclus dans ces bras contrôles avaient déjà reçu des traitements par laser, voire même des injections mais ils apportent néanmoins des résultats intéressants sur l’évolution des yeux non traités.
-
Étude RESOLVE [6] : cette étude (151 patients) d’une durée de 1 an a comparé les injections mensuelles de ranibizumab (deux dosages différents) au placebo (injections simulées ; 49 patients) chez des patients présentant un OMD. Dans cette étude, moins de 20 % des patients inclus dans le groupe placebo ont bénéficié d’un traitement par laser maculaire plus de 6 mois avant le début de l’étude et environ un tiers des patients dans le groupe placebo a reçu un traitement par laser maculaire durant l’étude du fait d’une évolution défavorable.
-
Études RISE AND RIDE [7] : cette étude a comparé deux groupes de patients traités par ranibizumab à un groupe contrôle. Le groupe contrôle a été traité par des injections mensuelles simulées pendant 2 ans. Dans cette étude, près de 75 % des patients du groupe contrôle avaient été traités antérieurement pour leur OMD et près de 25 % de ces patients ont bénéficié d’un laser maculaire durant l’étude.
-
Étude MEAD [8] : il s’agit d’une étude comparant deux groupes de patients traités par implant de dexaméthasone à un groupe contrôle, avec un suivi de 3 ans. Près de 75 % des patients du groupe contrôle avaient bénéficié d’un traitement de leur OMD avant leur inclusion. Les patients du groupe contrôle ayant une évolution défavorable nécessitant un traitement de secours ont été exclus de l’étude. Ainsi, les patients du groupe contrôle décrits dans cette étude représentent des patients avec une évolution spontanée de leur OM très favorable.
-
Études FAME [9] : ces études, faites chez des patients présentant un OMD réfractaire, ont comparé un groupe traité par une injection unique d’un implant d’acétonide de fluocinolone à un groupe contrôle, avec un suivi de 3 ans. Tous les patients du groupe contrôle avaient été traités par laser maculaire avant l’inclusion. Soixante pour cent des patients du groupe contrôle ont bénéficié d’un traitement par laser maculaire, et 35 % d’un autre traitement (injections intravitréennes, etc.) durant l’étude. À la différence de l’étude MEAD, les patients du groupe contrôle ayant reçu un traitement de secours n’ont pas été exclus de l’étude.
Il faut également rappeler que nous n’avons malheureusement que peu ou pas de données concernant l’évolution des facteurs systémiques (pression artérielle, HbA1C, etc.) dans les études que nous décrivons ici.
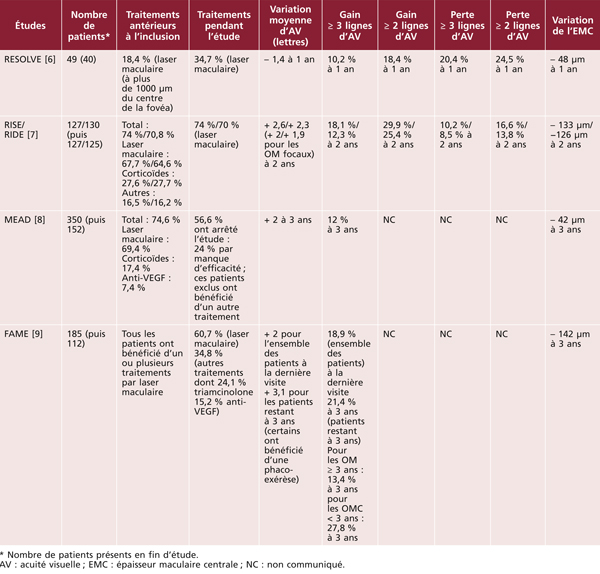
Tableau 8-8 Évolution des groupes contrôles dans les études interventionnelles.
Depuis l’avènement de l’OCT, il est possible d’étudier de façon fine et objective l’évolution spontanée de l’épaisseur maculaire rétinienne des OMD. Plusieurs études ont ainsi mis en évidence des variations diurnes de l’épaisseur maculaire, ainsi que des fluctuations spontanées sur le moyen terme (fig. 8-51 à 8-53 et eFig. 8-9 à 8-11 ).
).
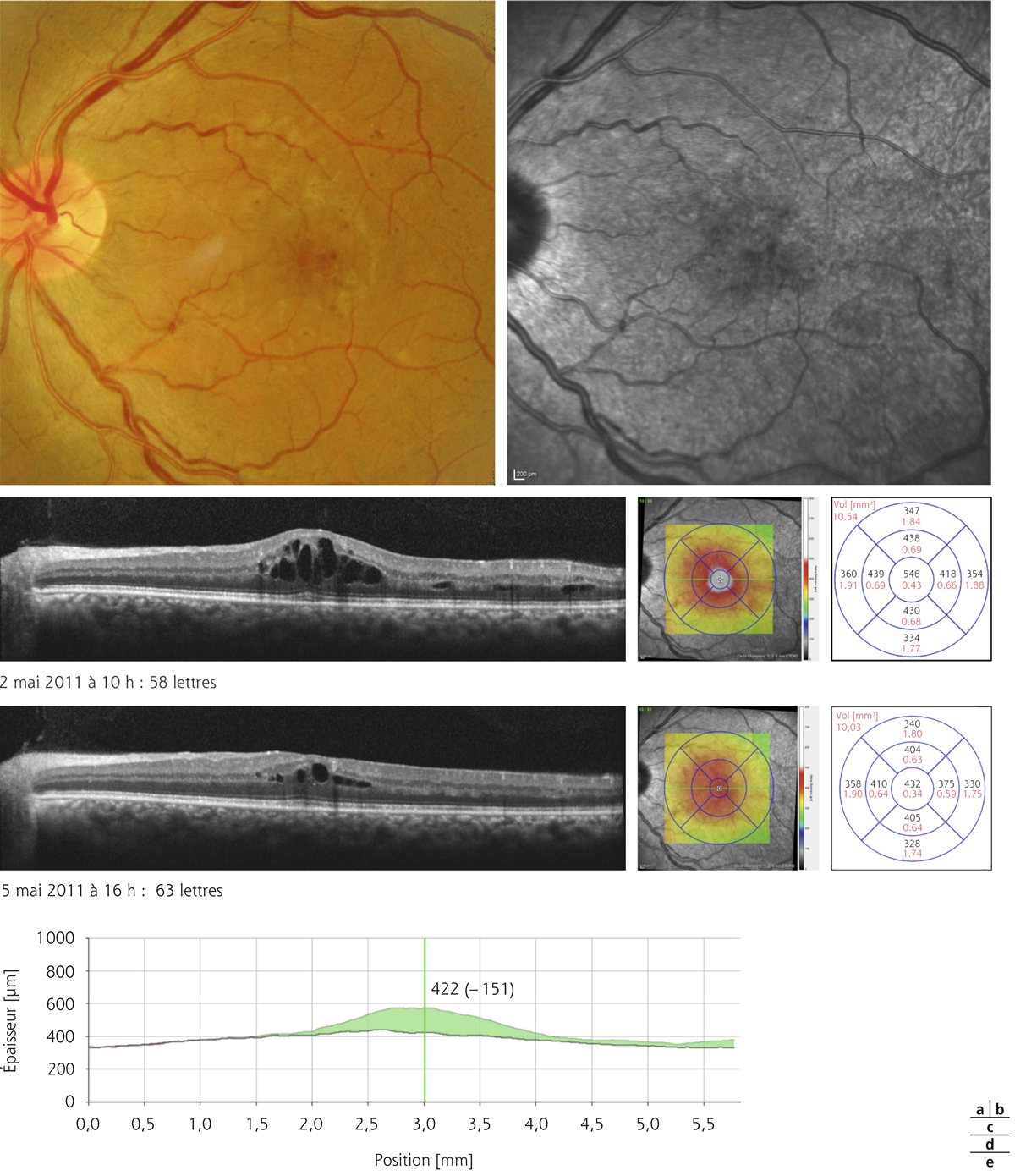
Fig. 8-51 Variations à court terme de l’épaisseur maculaire chez un patient présentant un OMD.
a, b. Clichés en couleurs et anérythre : OMD central associé à des micro-anévrismes. c. OCT réalisé le 2 mai 2011 à 10 h : l’acuité visuelle est de 58 lettres, l’OCT objective un OM cystoïde sévère avec de nombreuses logettes centrales, l’épaisseur maculaire centrale est de 546 μm. d. OCT réalisé 3 jours plus tard, le 5 mai 2011 à 16 h : l’acuité visuelle a augmenté de 5 lettres (63 lettres), l’épaisseur maculaire a diminué spontanément à 432 μm. e. Différentiel d’épaisseur maculaire entre les deux examens (−151 μm).
(Source : service d’ophtalmologie, hôpital Lariboisière.)
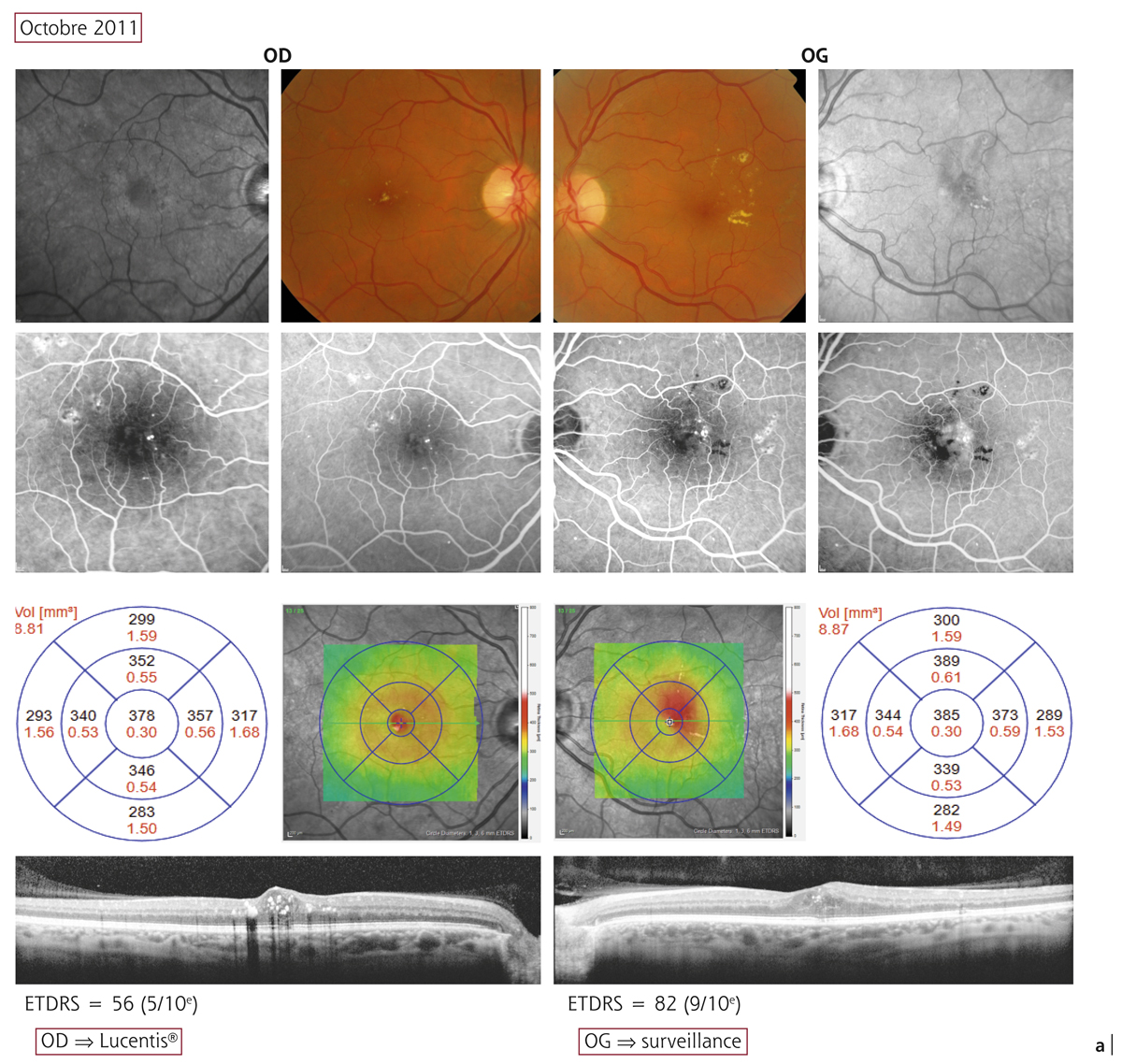
Fig. 8-53 Évolution spontanée d’un œdème maculaire non traité chez un patient diabétique de type 2.
Patient âgé de 57 ans, diabétique de type 2, insulino-traité et hypertendu. Hémoglobine glyquée (HbA1c) : 7,3 %, pression artérielle : 149/70. a. Il présente un OMD bilatéral, l’acuité visuelle de l’œil droit (OD) est de 0,5 (56 lettres ETDRS) et celle de l’œil gauche (OG) de 0,9 (82 lettres ETDRS). L’œil droit est traité par ranibizumab et une surveillance est proposée pour l’œil gauche.
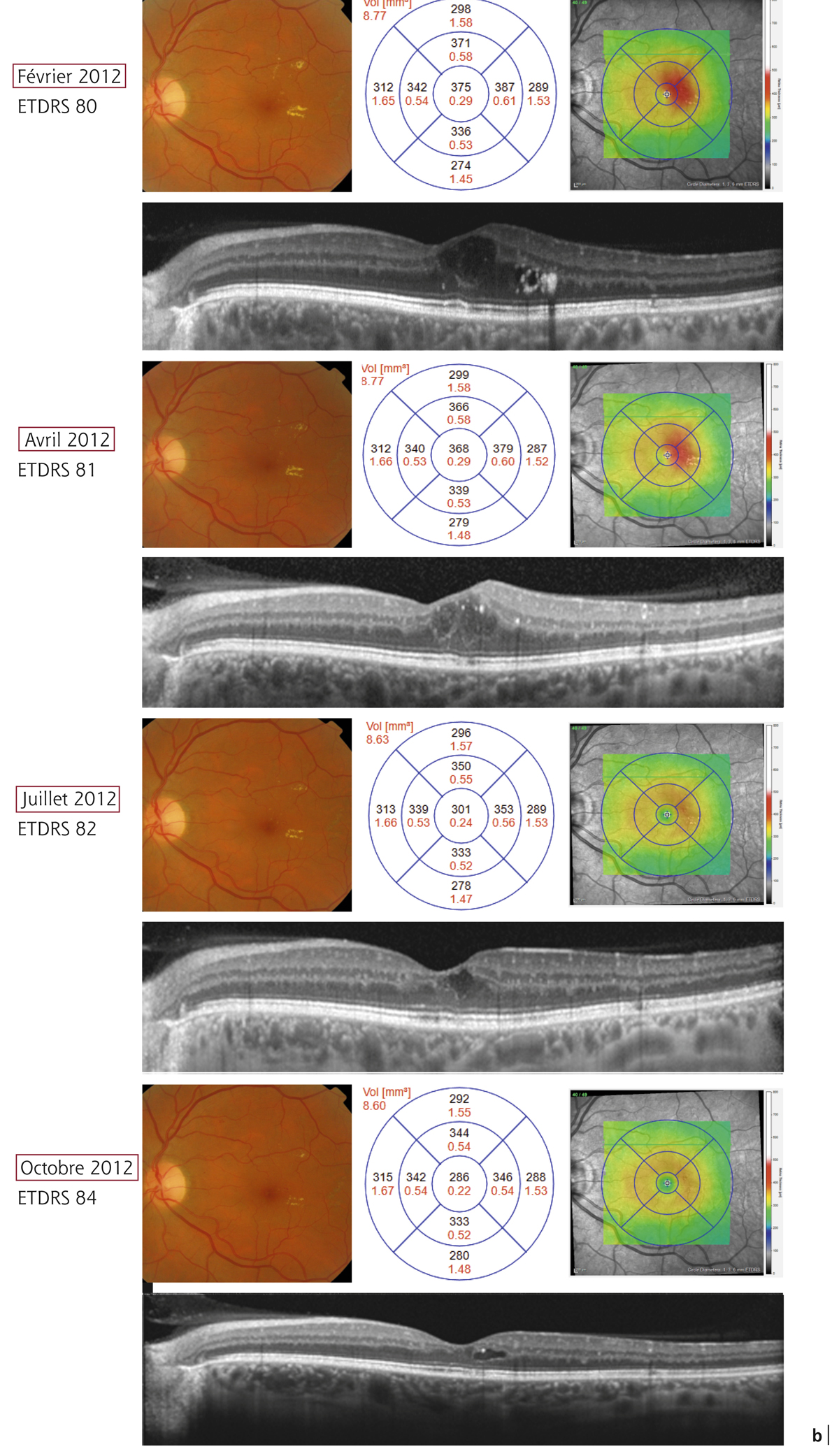
Fig. 8-53 Évolution spontanée d’un œdème maculaire non traité chez un patient diabétique de type 2. (suite)
b. Évolution spontanée de l’œil gauche. Entre février et octobre 2012, l’acuité visuelle reste stable. L’épaisseur maculaire centrale fluctue, pour revenir en octobre à une valeur normale, avec une quasi-disparition de l’OM.
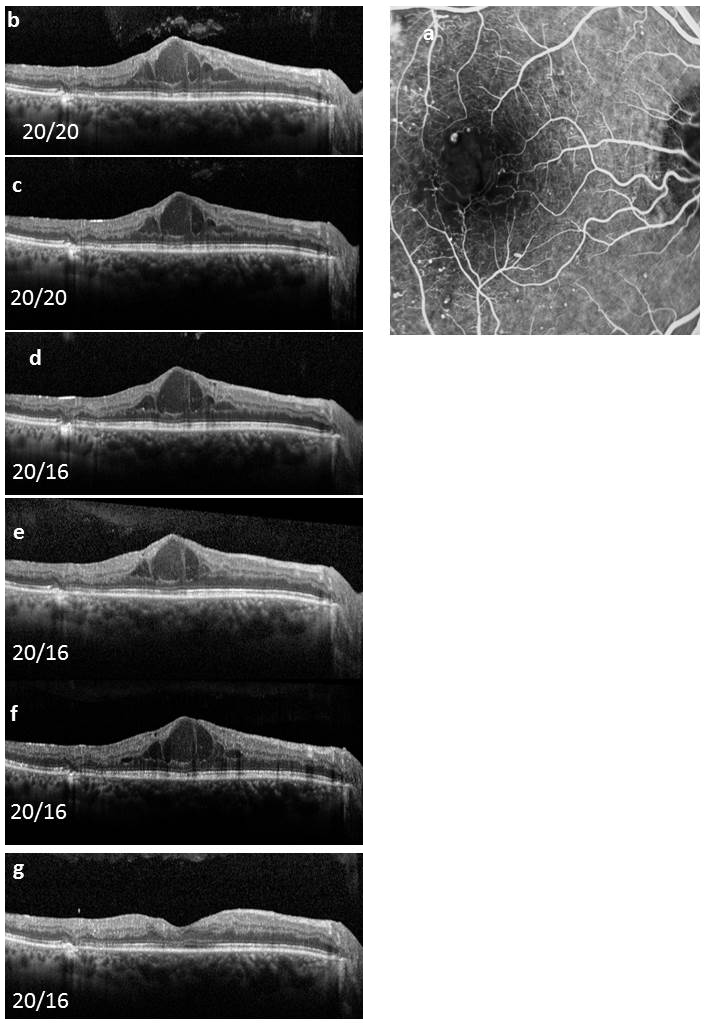
eFig. 8-9 Évolution spontanée (suivi pendant 20 mois) d’un œdème maculaire non traité chez un patient diabétique de type 1, déjà traité par panphotocoagulation rétinienne.
eFig. 8-10 Évolution spontanée (suivi pendant 3 ans) d’un œdème maculaire focal minime non traité chez un patient diabétique de type 2.
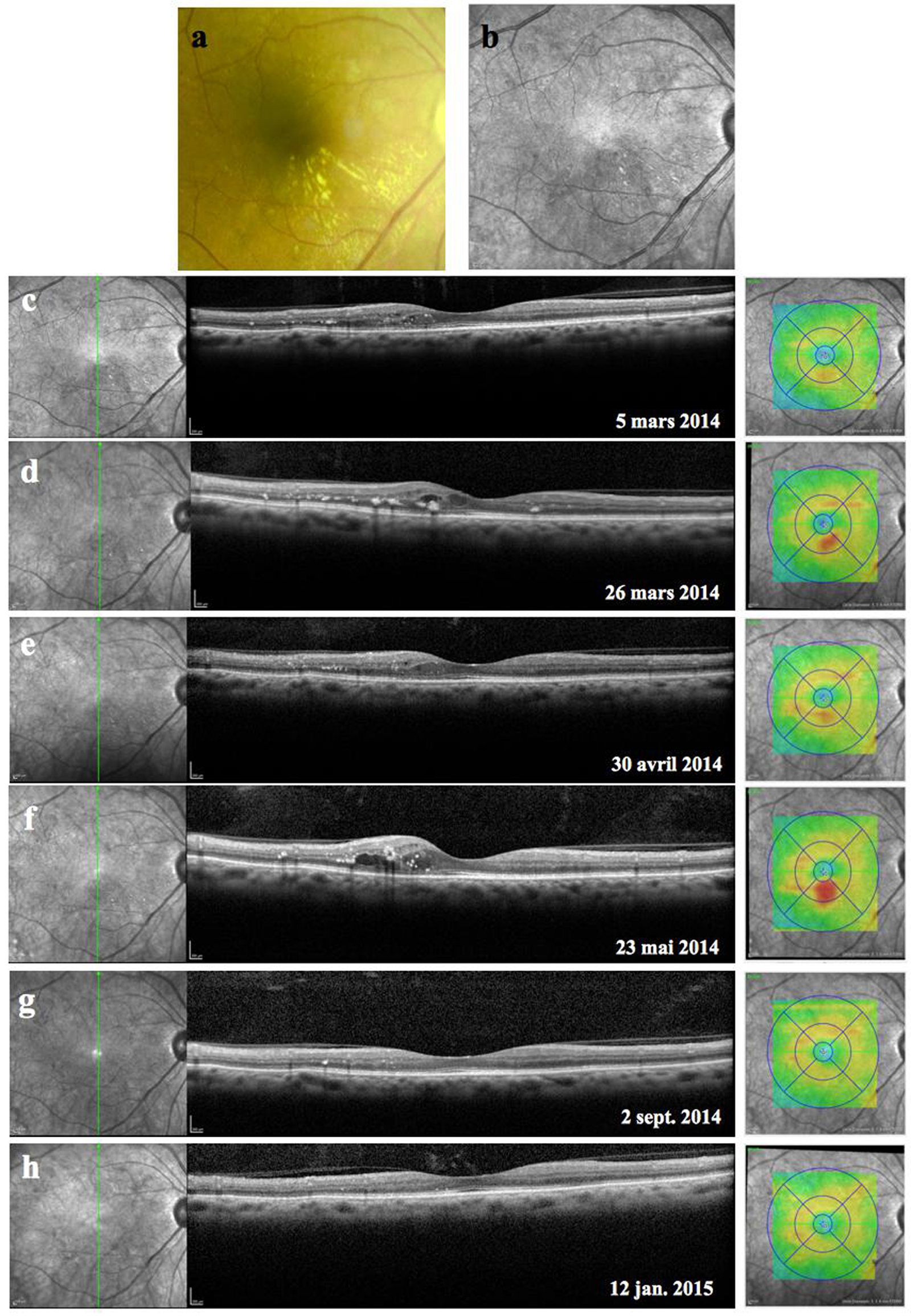
eFig. 8-11 Évolution spontanée d’un œdème maculaire focal modéré non traité chez un patient diabétique de type 2.
Franck et al. [10] ont montré des variations significatives de l’OMD au cours de la journée, avec une épaisseur maculaire plus importante le matin et diminuant au cours de la journée chez quatre des dix patients étudiés. Le même résultat a été retrouvé sur l’ensemble des neuf patients étudiés pour Polito et al. [11] avec une épaisseur fovéolaire initiale supérieure ou égale à 300 μm et une diminution d’épaisseur de 6,1 %, 15,2 % et 21 % au cours de la journée. Danis et al. [12] ont retrouvé également cette diminution moyenne de l’épaisseur maculaire durant la journée (diminution de l’épaisseur maculaire centrale moyenne de 6 %, soit 13 μm). Toutefois, seuls 3 % des 156 yeux étudiés présentaient une diminution importante de l’épaisseur maculaire centrale (variation d’au moins 25 % ou 50 μm). Dans une autre étude de Polito et al. [13], la diminution de l’épaisseur maculaire au cours de la journée était présente pour les dix patients étudiés, et plus marquée dans le groupe de patients restés en position debout toute la journée (diminution de 20,6 %) par rapport au groupe de patients restés en position couchée toute la journée depuis la veille (diminution de 6,2 %).
Ces résultats sont en faveur d’un rôle de la posture corporelle et de la pression hydrostatique dans les variations et la physiopathogénie de l’OMD. Larsen et al. [14] ont montré une augmentation moyenne de l’épaisseur maculaire durant la nuit chez 12 patients présentant un OMD, l’épaisseur étant moins importante au coucher (316 μm ± 72) qu’au réveil (336 μm ± 81), malgré une position allongée maintenue. Cette augmentation restait significative après ajustement pour l’effet de la pression artérielle. Elle s’accompagnait d’une baisse d’acuité visuelle et son importance était liée aux modifications de la pression artérielle durant la nuit.
Ces résultats suggèrent qu’une régulation déficiente de la pression des capillaires rétiniens augmente l’œdème. L’augmentation de l’OM durant la nuit pourrait être liée à une variation posturale de la pression veineuse et à l’augmentation du métabolisme rétinien dans le noir.
Des variations sur le long cours ont été mises en évidence dans plusieurs études.
Dans l’étude de Massin et al. [15] (évaluant la triamcinolone dans l’OMD), neuf des douze yeux (75 %) non traités adelphes présentaient une variation supérieure ou égale à 11 % de l’épaisseur maculaire centrale au moins une fois sur 3 mois par comparaison à leur épaisseur maculaire centrale médiane (avec une épaisseur maculaire centrale médiane à l’inclusion de 463 μm ± 82). Une autre étude de Toda et al. [16] a montré que cinq des neuf yeux (55 %) avec un OMD non traité ont présenté une variation significative de leur épaisseur maculaire centrale sur 3 mois (avec une épaisseur maculaire centrale médiane de 328 μm ± 235).
Enfin, plus récemment, l’étude de Dupas et al. [17] a confirmé ces données, avec un nombre de patients plus important. Dans cette étude, 23 patients présentant un OMD ont été suivis toutes les 2 semaines pendant 3 mois. À la visite initiale, une mesure ambulatoire de la pression artérielle pendant 24 heures a été réalisée, ainsi que cinq mesures de l’épaisseur maculaire centrale en OCT durant la journée. Durant le suivi, une mesure quotidienne et simultanée de la pression artérielle et de l’épaisseur maculaire centrale a été effectuée. Au moins une modification de l’épaisseur maculaire centrale supérieure à 11 % par rapport à la valeur médiane (= variation significative) a été observée durant le suivi chez près de la moitié des patients. L’épaisseur maculaire centrale a diminué pendant la journée et augmenté pendant la nuit mais ici de manière non significative. Les patients ayant les épaisseurs maculaires centrales les plus hautes avaient les niveaux de pression pulsée les plus élevés (corrélation positive significative).
Les facteurs de variation de l’OMD mis en évidence dans l’ensemble des études sont les suivants :
-
l’heure de la journée [10–14] : l’heure de la mesure devrait ainsi être prise en considération dans l’interprétation des modifications de l’épaisseur maculaire ;
-
la pression artérielle, la pression pulsée, les variations de la pression artérielle (fig. 8-52) [14, 17] ;
-
l’hypoglycémie : l’étude de Feldman et al. [18] a montré que les patients qui ne présentaient pas de variation diurne de leur OMD, avaient plus d’événements hypoglycémiques que les autres. À noter que les événements hypoglycémiques entraînent une augmentation de la pression artérielle [19].
Ainsi, ces facteurs de variation devraient être pris en compte lors de l’évaluation de l’efficacité d’un traitement de l’OMD.
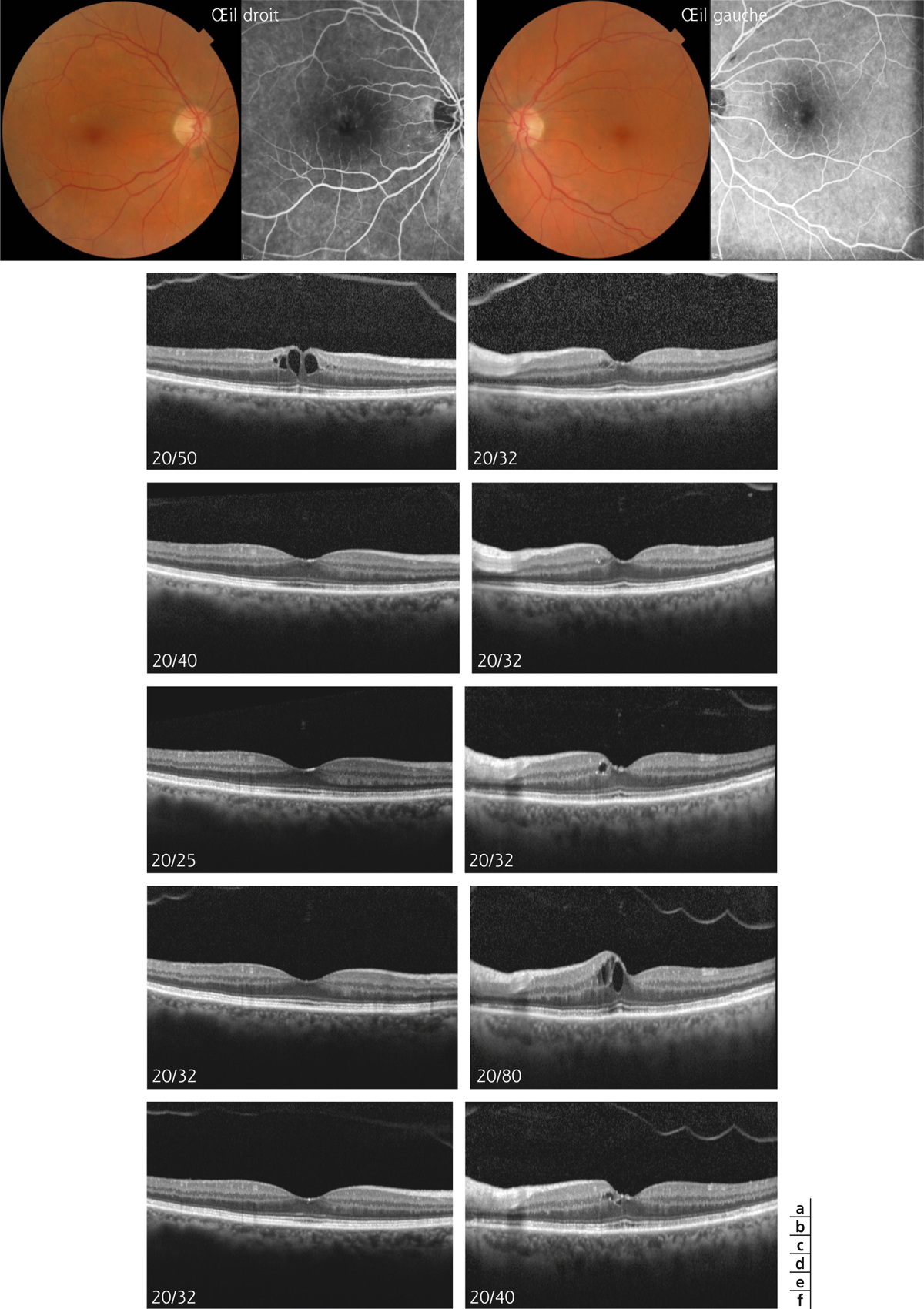
Fig. 8-52 Évolution spontanée (suivi pendant 18 mois) d’un œdème maculaire non traité chez une patiente diabétique de type 2 présentant des variations glycémique et tensionnelle.
a. Clichés en couleurs et angiographies rétiniennes. b à f. Coupes en OCT réalisées à 4 et 6 mois d’intervalle. L’hémoglobine glyquée et la pression artérielle s’améliorent dans un premier temps puis s’altèrent de nouveau. À noter l’asymétrie d’évolution entre les deux yeux.
[1] Massin-Korobelnik P, Gaudric A, Coscas G. Spontaneous evolution and photocoagulation of diabetic cystoid macular edema. Graefes Arch Clin Exp Ophthalmol 1994 ; 232 : 279-89.
[2] Massin P, Erginay A, Rétinopathie diabétique. Issy-les-Moulineaux : Elsevier ; 2010, 145 p.
[3] Early Treatment Diabetic Retinopathy Study research group. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985 ; 103 : 1796-806.
[4] Davis MD, Sheetz MJ, Aiello LP, et al. Effect of ruboxistaurin on the visual acuity decline associated with long-standing diabetic macular edema. Invest Ophthalmol Vis Sci 2009 ; 50 : 1-4.
[5] Gangnon RE, Davis MD, Hubbard LD, et al. A severity scale for diabetic macular edema developed from ETDRS data. Invest Ophthalmol Vis Sci 2008 ; 49 : 5041-7.
[6] Massin P, Bandello F, Garweg JG, et al. Safety and efficacy of ranibizumab in diabetic macular edema (RESOLVE Study) : a 12-month, randomized, controlled, double-masked, multicenter phase II study. Diabetes Care 2010 ; 33 : 2399-405.
[7] Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema : results from 2 phase III randomizedtrials : RISE and RIDE. Ophthalmology 2012 ; 119 : 789-801.
[8] Boyer DS, Yoon YH, Belfort R Jr, et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology 2014 ; 121 : 1904-14.
[9] Campochiaro PA, Brown DM, Pearson A, et al. Sustained delivery fluocinolone acetonide vitreous inserts provide benefit for at least 3 years in patients with diabetic macular edema. Ophthalmology 2012 ; 119 : 2125-32.
[10] Frank RN, Schulz L, Abe K, Iezzi R. Temporal variation in diabetic macular edema measured by optical coherence tomography. Ophthalmology 2004 ; 111 : 211-7.
[11] Polito A, Del Borrello M, Polini G, et al. Diurnal variation in clinically significant diabetic macular edema measured by the Stratus OCT. Retina 2006 ; 26 : 14-20.
[12] Danis RP, Glassman AR, Aiello LP, et al. Diurnal variation in retinal thickening measurement by optical coherence tomography in center-involved diabetic macular edema. Arch Ophthalmol 2006 ; 124 : 1701-7.
[13] Polito A, Polini G, Chiodini RG, et al. Effect of posture on the diurnal variation in clinically significant diabetic macular edema. Invest Ophthalmol Vis Sci 2007 ; 48 : 3318-23.
[14] Larsen M, Wang M, Sander B. Overnight thickness variation in diabetic macular edema. Invest Ophthalmol Vis Sci 2005 ; 46 : 2313-6.
[15] Massin P, Audren F, Haouchine B, et al. Intravitreal triamcinolone acetonide for diabetic diffuse macular edema : preliminary results of a prospective controlled trial. Ophthalmology 2004 ; 111 : 218-24.
[16] Toda J, Fukushima H, Kato S. Injection of triamcinolone acetonide into the posterior sub-tenon capsule for treatment of diabetic macular edema. Retina 2007 ; 27 : 764-9.
[17] Dupas B, Feldman-Billard S, Bui Quoc E, et al. Influence of pulse pressure and spontaneous variations of macular thickness inpatients with diabetic macular oedema. Acta Ophthalmol 2014 ; 92 : 372-6.
[18] Feldman-Billard S, Dupas B, Sedira N, et al. Hypoglycaemia is associated with the absence of a decrease in diurnal macular thickness in patients with diabetic macular oedema. Diabetes Metab 2013 ; 39 : 169-73.
[19] Feldman-Billard S, Massin P, Meas T, et al. Hypoglycemia induced blood pressure elevation in patients with diabetes. Arch Intern Med 2010 ; 170 : 829-31.
B. Dupas
➤ Dans l’OMD, l’accumulation de liquide n’est pas le seul facteur à l’origine de l’altération de la vision.
➤ La perte primitive des cellules neuronales et gliales engendrée par l’hyperglycémie chronique joue un rôle dans la fonction visuelle du patient avec OMD.
➤ La durée d’évolution de l’OM, ainsi que celle du diabète, et le déséquilibre des facteurs systémiques sont les principaux facteurs conditionnant la viabilité du tissu rétinien résiduel, et donc la récupération visuelle potentielle.
➤ De nouveaux facteurs morphologiques d’imagerie (notamment en OCT-angiographie) comme la superficie des zones de non-perfusion capillaire maculaire, associés à l’analyse des couches rétiniennes semblent prometteurs pour appréhender le pronostic visuel, en association aux facteurs cliniques.
Traiter un OMD aujourd’hui, c’est, au-delà de la prescription et de la réalisation d’injections intravitréennes (IVT), pouvoir se prononcer sur l’avenir visuel d’un patient. À la différence de la majorité des OM secondaires à des étiologies oculaires locales, l’OMD reflète avant tout les complications sévères d’une affection systémique. Au travers de ce sous-chapitre, nous tenterons de définir les caractéristiques anatomiques et les facteurs prédictifs influençant la récupération visuelle chez les patients diabétiques atteints d’OMD. Il est néanmoins important de dissocier réponses anatomique et fonctionnelle au traitement : si la réduction de l’épaississement maculaire est un prérequis à l’amélioration de l’acuité visuelle, ce n’est pas le seul déterminant de l’acuité visuelle finale (encadré 8-2
• Facteurs influençant la réponse anatomique :
■ âge jeune, type de diabète ;
■ équilibre des facteurs systémiques (diabète, hypertension artérielle) ;
■ existence d’une traction maculaire (traction vitréomaculaire ou membrane épirétinienne) ;
■ épaisseur maculaire initiale.
• Facteurs de mauvais pronostic fonctionnel :
■ longue durée de l’OMD ;
■ rétinopathie diabétique sévère ;
■ acuité visuelle initiale basse ;
■ ischémie maculaire ;
■ placard exsudatif sous-fovéolaire ;
■ ratio tissu rétinien/fluide faible ;
■ disorganisation of retinal inner layers (DRIL) ;
■ amincissement des couches internes de la rétine ;
■ rupture de l’ellipsoïde ou de la membrane limitante externe.
).
Pour interpréter l’efficacité d’une thérapeutique dans l’OMD, il faut tenir compte des fluctuations spontanées de l’OMD, journalières ou à moyen terme (pouvant atteindre jusqu’à 20 % de l’épaisseur maculaire) et potentiellement en rapport avec la variation de facteurs systémiques comme la pression artérielle [1].
Ces facteurs sont importants à colliger car différents cas de figure peuvent se présenter : un OMD survenant chez un jeune patient diabétique de type 1, avec rétinopathie décompensée par une rééquilibration glycémique rapide, ou chez une femme enceinte sera plus aisé à traiter (et parfois spontanément résolutif) [2], qu’un OMD chez un diabétique de type 2, plus âgé avec comorbidités associées (fig. 8-54). L’âge jeune est par ailleurs un facteur favorisant la récupération visuelle chez les patients avec OMD traités par ranibizumab [3].
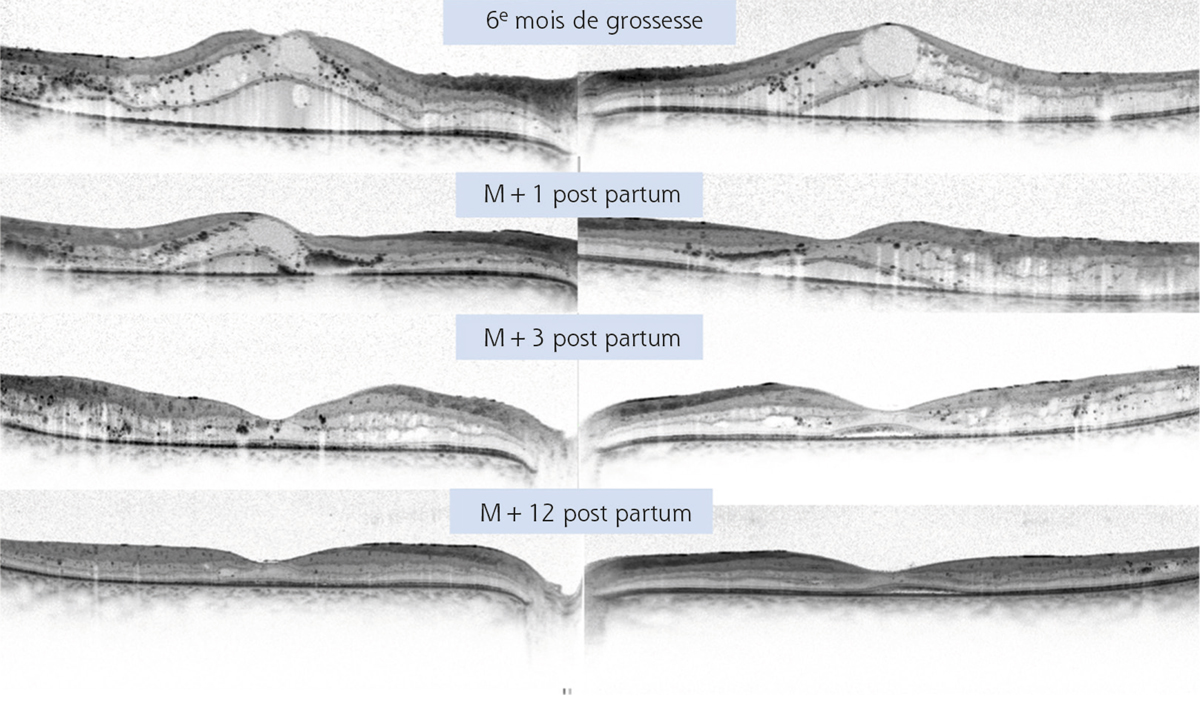
Fig. 8-54 Régression spontanée d’un œdème maculaire chez une patiente diabétique de type 1 âgée de 25 ans, iconographiée par SD-OCT.
Patiente enceinte de 6 mois : OM bilatéral associé à un volumineux décollement séreux rétinien (DSR). Acuité visuelle : 1/10 P14. Une surveillance simple est effectuée. Post-partum M+1 : régression partielle du DSR, persistance d’un œdème intrarétinien. Post-partum M+3 : régression quasi totale du DSR et normalisation de l’épaississement rétinien central. Post-partum M+12 : normalisation de l’épaisseur rétinienne dans toute l’aire maculaire, persistance d’un très discret DSR de l’œil gauche et de quelques logettes intrarétiniennes de l’œil droit. Acuité visuelle : 9/10 P2 aux deux yeux.
La durée d’évolution est également un facteur primordial, car elle conditionne probablement la fonctionnalité des cellules rétiniennes neuronales et gliales résiduelles, et donc les capacités de récupération visuelle. Elle est cependant difficile à déterminer, le début de la maculopathie étant insidieux et les patients ne consultant le plus souvent qu’en cas de baisse visuelle déjà avérée. Une durée d’évolution courte de l’OMD est corrélée à un meilleur pronostic visuel après IVT de ranibizumab [3]. Les patients des groupes témoins traités à retardement dans les grands essais cliniques ont une acuité visuelle finale n’atteignant pas celle des yeux traités d’emblée [4, 5]. Toutefois, il faut toujours initier un traitement, même en cas d’acuité visuelle basse (entre 1/20 et 2/10), ne serait-ce que pour préserver la fonction visuelle résiduelle. L’étude FAME a par ailleurs montré que les OMD chroniques de plus de 3 ans pouvaient bénéficier d’un gain d’acuité visuelle significatif après traitement par acétonide de fluocinolone [6].
Cet équilibre constitue un facteur de réponse aux anti-VEGF [7]. En effet, dans une étude rétrospective évaluant le bénéfice du traitement par ranibizumab, les patients avec une hémoglobine glyquée (HbA1c) inférieure à 7 % montraient des améliorations, fonctionnelle et anatomique, supérieures à celles des patients avec une HbA1c plus élevée, sans cependant réduire le nombre d’IVT sur 6 mois. Toutefois, dans les analyses post hoc réalisées sur les patients des études RISE and RIDE, le gain d’acuité visuelle après IVT d’anti-VEGF n’était pas influencé par l’équilibre glycémique [8]. Cette discordance pourrait s’expliquer par le fait que, dans ces grandes études de cohorte, l’HbA1c moyenne est meilleure que celle des patients « de la vraie vie », l’influence des facteurs systémiques étant alors moins prégnante. Par ailleurs, le type de traitement (insuline ou antidiabétiques oraux) ne semble pas influencer la réponse aux anti-VEGF [9].
Même si aucune donnée n’a été publiée sur l’influence de la pression artérielle sur la réponse au traitement par anti-VEGF, il semble nécessaire d’optimiser l’équilibre tensionnel afin d’éviter la survenue d’une rétinopathie hypertensive associée et de limiter l’aggravation de la maculopathie.
Le développement d’une imagerie de très haute résolution (SD-OCT et OCT-angiographie) a permis – et permettra – d’identifier des caractéristiques morphologiques corrélées au degré de récupération visuelle.
Ces anomalies sont un facteur de moins bon pronostic, essentiellement lorsqu’il existe une composante tractionnelle évidente de la hyaloïde postérieure ou d’une membrane épirétinienne associée à la rupture de la BHR [10]. Il est toutefois difficile d’évaluer la responsabilité de la composante tractionnelle dans l’OMD ; la réalisation d’injections intravitréennes « tests » permet alors d’évaluer la possibilité de diminution, partielle ou totale, de l’épaississement rétinien, et par conséquent de poser une indication opératoire complémentaire si nécessaire (fig. 8-55).
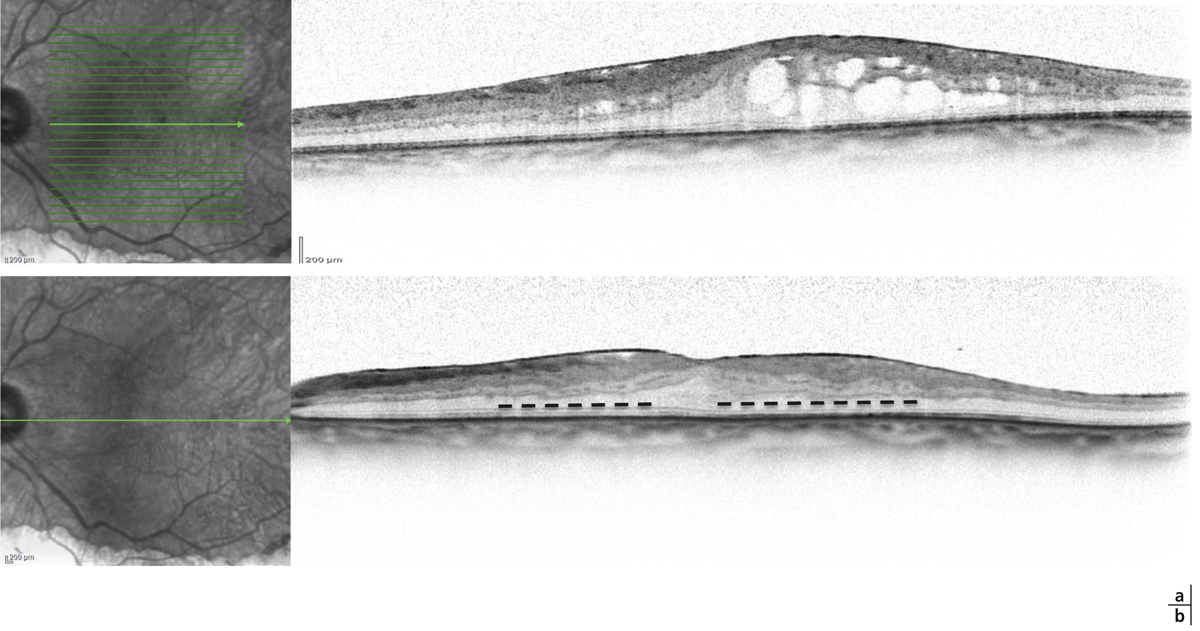
Fig. 8-55 Régression d’un œdème maculaire diabétique associé à une membrane épirétinienne chez un patient de 57 ans, diabétique de type 2, après injection intravitréenne.
a. Coupe horizontale d’OCT révélant un OM prédominant en temporomaculaire et associé à une membrane épirétinienne. Acuité visuelle 2/10. b. Aspect 1 mois après une injection intravitrénne d’un implant de dexaméthasone : les logettes d’œdème ont totalement disparu, l’épaisseur maculaire s’est pratiquement normalisée. Acuité visuelle 5/10. Noter la membrane épirétinienne et les remaniements de l’architecture rétinienne interne (en pointillé) pouvant expliquer la récupération visuelle incomplète.
La visibilité en OCT de certaines structures – comme la membrane limitante externe et la ligne d’interdigitation (IS–OS) – a fait l’objet de nombreuses études et semble corrélée au pronostic visuel [11]. Cependant, les anomalies de signal en OCT, correspondant aux différentes structures rétiniennes, peuvent être modifiées par de nombreux phénomènes en cas d’œdème rétinien et il est difficile de les évaluer de manière fiable ; il semble donc raisonnable d’interpréter ces critères avec prudence. C’est finalement une fois la rétine asséchée que l’évaluation de l’architecture rétinienne est la plus aisée à appréhender. La présence d’exsudats rétrofovéolaires est de mauvais pronostic [12], alors que la présence d’un décollement séreux rétinien (identifié dans 8 à 20 % des cas) n’influence pas le pronostic visuel [13]. Les cicatrices de laser juxtafovéolaires, par l’atrophie qu’elles induisent et leur potentiel évolutif, représentent également un facteur de mauvais pronostic de récupération visuelle [14].
La quantité du tissu rétinien central interne est également un facteur conditionnant le pronostic visuel. Différentes techniques intéressantes ont été décrites, notamment en utilisant des images OCT « en face » et en quantifiant le nombre de « piliers » cellulaires traversant les kystes (voir plus haut fig. 8-40) [15]. Le degré de désorganisation architecturale de la rétine interne (disorganisation of retinal inner layers [DRIL]) serait également prédictif de l’acuité visuelle [16]. Le degré d’occlusion des capillaires périfovéolaires et, à un stade ultime, l’ischémie maculaire sont des facteurs de mauvais pronostic visuel [17, 18]. Il est à noter que l’utilisation d’anti-VEGF de manière itérative ne semble pas aggraver l’ischémie maculaire préexistante [19]. Ils pourraient au contraire limiter les phénomènes micro-occlusifs localisés au pôle postérieur [20]. L’OCT-angiographie semble permettre par ailleurs d’évaluer, rapidement et aisément, l’étendue des occlusions du réseau capillaire. Elle pourrait constituer un moyen plus fiable que l’angiographie à la fluorescéine pour définir les territoires de non-perfusion (fig. 8-56).
L’épaisseur des couches des cellules ganglionnaires est diminuée après résolution de l’OMD et la perte tissulaire semble corrélée au degré d’acuité visuelle (fig. 8-57) [21]. Le patient diabétique présente une neurodégénérescence rétinienne avec une apoptose des cellules neurogliales dès les stades précoces de la maladie [22], parfois même sans rétinopathie cliniquement décelable au fond d’œil. La neuropathie diabétique se définirait d’ailleurs pour certains comme une perte neurogliale initiale entraînant une perte du couplage neurovasculaire ayant pour corollaire une atteinte vasculaire secondaire [23].
Enfin, une équipe a récemment corrélé le degré de non-perfusion capillaire à des altérations de la rétine externe sous-jacente, visibles en OCT, soulignant ainsi le rôle du plexus capillaire profond dans l’oxygénation de la rétine externe [24].
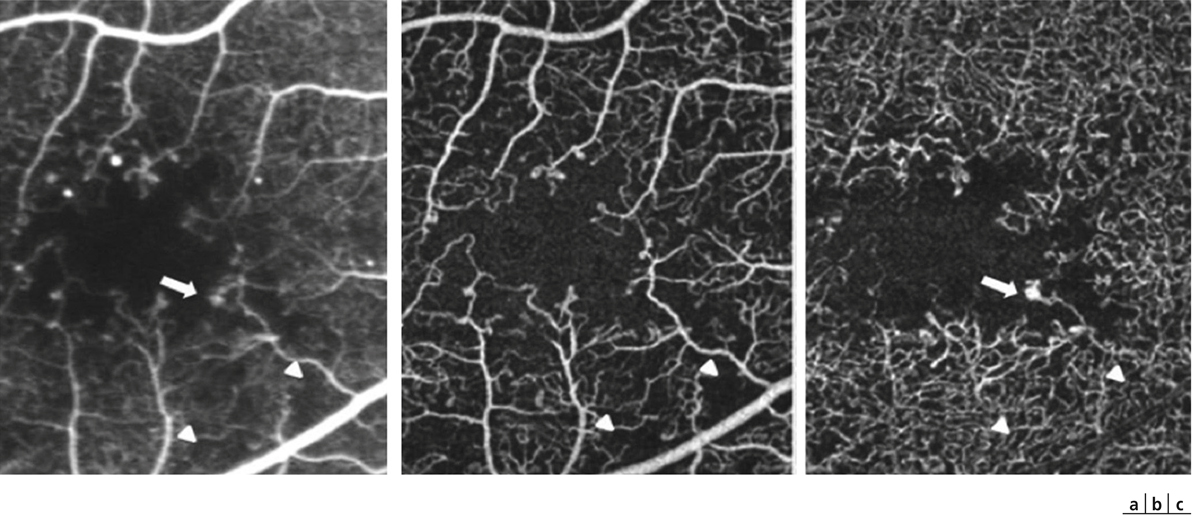
Fig. 8-56 Réseau capillaire périfovéolaire d’un patient avec maculopathie diabétique sans œdème rétinien, imagé en angiographie à la fluorescéine (a) et en OCT-angiographie (b, c).
a. L’angiographie à la fluorescéine révèle des zones de non-perfusion capillaire (têtes de flèche) associées à des micro-anévrismes (flèche). b. Angiographie-OCT permettant de visualiser le réseau capillaire superficiel en s’affranchissant des phénomènes de diffusion. Meilleure visualisation des zones de non-perfusion (têtes de flèche). c. Angiographie-OCT du réseau capillaire profond avec micro-anévrisme (flèche) et remaniement du lit capillaire (têtes de flèche).
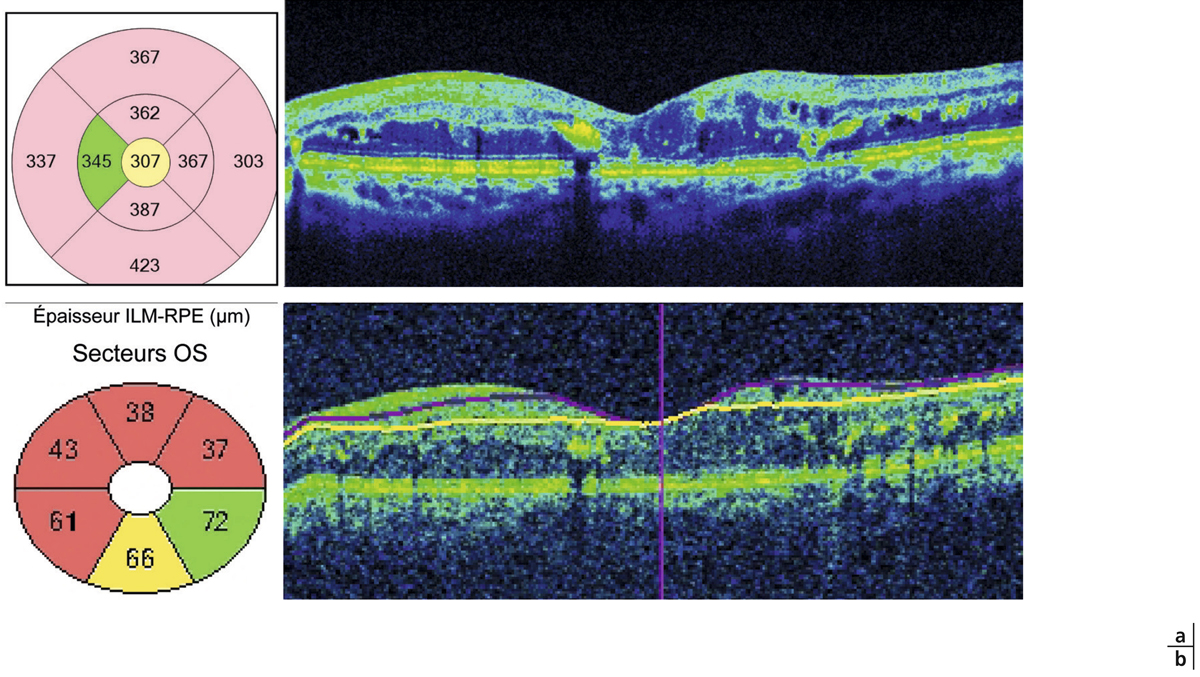
Fig. 8-57 Cartographies OCT d’un œdème maculaire diabétique résorbé après injections intravitréennes.
a. Cartographie d’épaisseur maculaire (de l’épithélium pigmentaire à la membrane limitante interne) dans les neuf secteurs principaux. L’épaisseur rétinienne est subnormale malgré la présence d’exsudats et de kystes rétiniens résiduels. b. Cartographie de l’épaisseur du complexe des cellules ganglionnaires (délimité par les lignes violettes et jaune), révélant une nette diminution des épaisseurs dans la plupart des secteurs rétiniens. Acuité visuelle 3/10.
Plus l’épaisseur rétinienne initiale est élevée, plus la réduction d’épaisseur maculaire est importante, mais moins grandes sont les chances d’obtenir une épaisseur maculaire normale. L’étude du DRCRnet utilisant le ranibizumab associé ou non au laser [5] a retrouvé 20 % de mauvais répondeurs anatomiques (c’est-à-dire avec une diminution inférieure à 20 % de l’épaisseur maculaire initiale à la visite finale à 12 mois) et 7 % de non-répondeurs anatomiques (avec une diminution inférieure à 10 %). Les patients avec une acuité visuelle inférieure à 2/10 après 2 ans de traitement par ranibizumab présentaient par ailleurs dans 50 % des cas une persistance de liquide intrarétinien.
Plus la rétinopathie est sévère, moins bons sont les résultats visuels après injections de ranibizumab [10]. Le rôle direct de l’ischémie périphérique dans l’entretien de l’OM est encore débattu ; il est à noter qu’une étude a trouvé une association entre la présence d’une ischémie périphérique en angiographie grand champ et la présence, mais non la sévérité, d’un OMD [25].
La classification de l’OM a évolué ces dernières années et la distinction entre « focal » et « diffus » tend à disparaître dans les nouvelles propositions de classification [26]. Certains OMD s’associent toutefois à de volumineux micro-anévrismes, équivalents à des « macro-anévrismes » développés aux dépens du lit capillaire, et responsables d’une exsudation majeure. Ces derniers peuvent être accessibles à une photocoagulation directe au laser qui permet, dans certains cas, une rémission complète avec normalisation de l’épaisseur maculaire et résorption des exsudats. Ces cas pourraient représenter une catégorie à part qu’il semble utile d’identifier (voir chapitre 8.10). Par ailleurs, la vitesse du turn-over des micro-anévrismes au pôle postérieur refléterait un critère prédictif d’évolution vers la maculopathie [27] et un marqueur de réponse aux anti-VEGF [28].
Si la pharmacodynamique des molécules injectées dans la cavité vitréenne est modifiée en cas de vitrectomie, la réponse fonctionnelle observée après IVT semble identique chez les yeux vitrectomisés ou non vitrectomisés, notamment en cas d’utilisation d’un implant de dexaméthasone [29]. Dans une analyse post hoc du protocole I, dans lequel ont été inclus 25 yeux vitrectomisés, les résultats du traitement par ranibizumab ne semblent pas différents des résultats obtenus dans les yeux non vitrectomisés [30].
L’acuité visuelle initiale conditionne le niveau d’acuité visuelle final. Si le gain d’acuité visuelle est plus faible en cas d’acuité visuelle initiale élevée – et plus élevé en cas d’acuité visuelle initiale basse –, l’acuité visuelle finale sera toujours meilleure si la fonction visuelle initiale n’est pas trop altérée. Elle est le reflet de la viabilité cellulaire. Il paraît désormais évident qu’il ne faut pas attendre une détérioration visuelle trop importante pour obtenir de bons résultats visuels après traitement par injections intravitréennes ; s’il n’existe, bien entendu, aucun caractère d’urgence à traiter un OMD, un traitement précoce semble permettre à long terme de préserver une meilleure fonction visuelle. Une étude du DRCRnet est d’ailleurs en cours afin d’évaluer l’éventuel bénéfice de l’instauration d’un traitement précoce par anti-VEGF chez des sujets avec une acuité visuelle supérieure à 8/10. Les résultats du protocole T vont dans ce sens [31] : dans cette étude, plus de 50 % des patients présentaient une acuité visuelle initiale supérieure à 5/10, et les résultats visuels finaux obtenus dans ce groupe de patients sont bien meilleurs que ceux obtenus chez les patients dont l’acuité visuelle initiale était inférieure à 5/10.
Les résultats récents de ce protocole soulèvent aussi la question de l’efficacité des différents anti-VEGF disponibles actuellement en France [31]. Si le ranibizumab 0,3 mg administré en pro renata (PRN) donne des résultats équivalents à ceux de l’aflibercept administré en régime fixe (en termes de gain d’acuité visuelle à 12 mois) chez les sujets avec acuité visuelle initiale supérieure à 4/10, il semble en revanche moins efficace, à cette dose, pour des acuités visuelles inférieures à 4/10. Cependant il semble difficile d’extrapoler sur l’efficacité respective des deux molécules en France et en Europe, où le dosage réglementaire de ranibizumab est de 0,5 mg.
Si la mesure de l’acuité visuelle sur l’échelle ETDRS est à l’heure actuelle le seul critère fonctionnel admis et utilisé pour évaluer l’efficacité des thérapeutiques dans les grands essais cliniques, elle n’est que modérément corrélée à l’épaisseur maculaire et ne reflète pas toujours la perception du déficit visuel ressenti par le patient. Il semble donc intéressant de mettre en perspective d’autres aspects de la fonction visuelle chez les patients atteints d’OMD, comme la localisation du point de fixation et la sensibilité rétinienne. La micropérimétrie permet, de façon simple et rapide, de définir ces deux paramètres [32]. La stabilité de la fixation semble plus fortement corrélée à l’acuité visuelle que son caractère central ou paracentral [33]. Chez les patients diabétiques avec antécédents de traitement par laser maculaire et cicatrices parafovéales, la capacité de la rétine à adopter un nouveau point de fixation paraît importante à évaluer (fig. 8-58). Certains auteurs évoquent même la possibilité d’utiliser les résultats micropérimétriques comme analyse prédictive de la fonction visuelle chez le patient avec OMD [34].

Fig. 8-58 Résultats micropérimétriques avant et après résorption partielle d’un œdème maculaire diabétique.
a, b. Cartographies et coupes OCT avant (a) et après (b) traitement, objectivant une nette diminution de l’épaisseur maculaire. c. Image en micropérimétrie des nuages de points localisant la zone préférentielle de la fixation. Les points bleu clair correspondent à la fixation avant traitement (en phase d’œdème). Les points bleu foncé correspondent à la fixation après traitement, après régression partielle de l’œdème. Avant traitement, la zone de fixation est très étendue et excentrée. Après traitement, la zone de fixation est plus réduite et recentrée sur la fovéa.
L’adjonction du laser aux injections intravitréennes ne semble pas représenter un facteur prédictif péjoratif sur l’acuité visuelle, notamment s’il est réalisé de façon différée, après au moins 6 mois de traitement intravitréen [5]. Il sera alors focalisé sur les zones d’épaississement rétinien résiduel et tentera de cibler les anomalies micro-anévrismales diffusant et persistant malgré un traitement pas anti-VEGF ou corticoïdes.
Le nombre d’IVT n’est malheureusement pas prédictible. Des analyses post hoc réalisées sur les patients de l’étude RESTORE [4] révèlent qu’environ 25 % des patients bons répondeurs (c’est-à-dire avec un gain d’acuité visuelle supérieur à 15 lettres) ont reçu six IVT ou moins, durant les 12 premiers mois de traitement. Cependant, aucun facteur prédictif de cette bonne réponse n’a pu à l’heure actuelle être identifié, si ce n’est la réponse initiale au traitement. En effet, les résultats d’une analyse post hoc du protocole I (traitement de l’OMD par ranibizumab) ont été récemment rapportés et indiquent que la réponse fonctionnelle obtenue après trois injections de ranibizumab est très fortement prédictive de l’acuité visuelle finale [35].
Des analyses post hoc réalisées sur la phase d’extension à 5 ans des patients des études RISE and RIDE [36] révèlent que 25 % des patients n’ont reçu aucune injection de ranibizumab durant les 4e et 5e années de suivi. Ces patients présentaient une durée d’évolution de leur OMD plus courte, des valeurs d’acuité visuelle initiales plus élevées, une épaisseur maculaire initiale moindre et un stade de rétinopathie associée moins sévère.
Les patients jeunes avec une durée d’évolution du diabète moindre, un OM récent naïf, une acuité visuelle peu abaissée, et une épaisseur maculaire initiale modérée ont potentiellement un meilleur pronostic visuel. L’enjeu actuel réside donc dans le dépistage précoce de la maculopathie afin de traiter plus tôt les patients. Les anomalies de l’interface vitréorétinienne et les remaniements de la rétine, interne et externe, contribuent à limiter la récupération visuelle. Les nouvelles techniques d’imagerie sont prometteuses et permettront probablement de définir, via l’analyse sémiologique fine de l’anatomie maculaire, d’autres facteurs prédictifs plus précis.
[1] Dupas B, Feldman-Billard S, Bui Quoc E, et al. Influence of pulse pressure and spontaneous variations of macular thickness in patients with diabetic macular oedema. Acta Ophthalmol 2014 ; 92 : 372-6.
[2] Gaucher D, Fortunato P, Lecleire-Collet A, et al. Spontaneous resolution of macular edema after panretinal photocoagulation in florid proliferative diabetic retinopathy. Retina 2009 ; 29 : 1282-8.
[3] Bressler SB, Qin H, Beck RW, et al. Factors associated with changes in visual acuity and central subfield thickness at 1 year after treatment for diabetic macular edema with ranibizumab. Arch Ophthalmol 2012 ; 130 : 1153-61.
[4] Schmidt-Erfurth U, Lang GE, Holz FG, et al. Three-year outcomes of individualized ranibizumab treatment in patients with diabetic macular edema : the RESTORE extension study. Ophthalmology 2014 ; 121 : 1045-53.
[5] Elman MJ, Ayala A, Bressler NM, et al. Intravitreal ranibizumab for diabetic macular edema with prompt versus deferred laser treatment: 5-year randomized trial results. Ophthalmology 2015 ; 122 : 375-81.
[6] Campochiaro PA, Brown DM, Pearson A, et al. Sustained delivery fluocinolone acetonide vitreous inserts provide benefit for at least 3 years in patients with diabetic macular edema. Ophthalmology 2012 ; 119 : 2125-32.
[7] Matsuda S, Tam T, Singh RP, et al. The impact of metabolic parameters on clinical response to VEGF inhibitors for diabetic macular edema. J Diabetes Complications 2014 ; 28 : 166-70.
[8] Bansal AS, Khurana RN, Wieland MR, et al. Influence of glycosylated hemoglobin on the efficacy of ranibizumab for diabetic macular edema : a post hoc analysis of the RISE/RIDE trials. Ophthalmology 2015 ; 122 : 1573-9.
[9] Matsuda S, Tam T, Singh RP, et al. Impact of insulin treatment in diabetic macular edema therapy in type 2 diabetes. Can J Diabetes 2015 ; 39 : 73-7.
[10] Bressler SB, Qin H, Beck RW, et al. Factors associated with changes in visual acuity and central subfield thickness at 1 year after treatment for diabetic macular edema with ranibizumab. Arch Ophthalmol 2012 ; 130 : 1153-61.
[11] Maheshwary AS, Oster SF, Yuson RMS, et al. The association between percent disruption of the photoreceptor inner segment-outer segment junction and visual acuity in diabetic macular edema. Am J Ophthalmol 2010 ; 150 : 63-7.
[12] Vujosevic S, Pilotto E, Bottega E, et al. Retinal fixation impairment in diabetic macular edema. Retina Phila 2008 ; 28 : 1443-50.
[13] Gaucher D, Sebah C, Erginay A, et al. Optical coherence tomography features during the evolution of serous retinal detachment in patients with diabetic macular edema. Am J Ophthalmol 2008 ; 145 : 289-96.
[14] Channa R, Sophie R, Khwaja AA, et al. Factors affecting visual outcomes in patients with diabetic macular edema treated with ranibizumab. Eye 2014 ; 28 : 269-78.
[15] Pelosini L, Hull CC, Boyce JF, et al. Optical coherence tomography may be used to predict visual acuity in patients with macular edema. Invest Ophthalmol Vis Sci 2011 ; 52 : 2741-8.
[16] Radwan SH, Soliman AZ, Tokarev J, et al. Association of disorganization of retinal inner layers with vision after resolution of center-involved diabetic macular edema. JAMA Ophthalmol 2015 ; 133 : 820-5.
[17] Sim DA, Keane PA, Zarranz-Ventura J, et al. The effects of macular ischemia on visual acuity in diabetic retinopathy. Invest Ophthalmol Vis Sci 2013 ; 54 : 2353-60.
[18] Bresnick GH, De Venecia G, Myers FL, et al. Retinal ischemia in diabetic retinopathy. Arch Ophthalmol 1975 ; 93 : 1300-10.
[19] Manousaridis K, Talks J. Macular ischaemia : a contraindication for anti-VEGF treatment in retinal vascular disease ? Br J Ophthalmol 2012 ; 96 : 179-84.
[20] Campochiaro PA, Wykoff CC, Shapiro H, et al. Neutralization of vascular endothelial growth factor slows progression of retinal nonperfusion in patients with diabetic macular edema. Ophthalmology 2014 ; 121 : 1783-9.
[21] Bonnin S, Tadayoni R, Erginay A, et al. Correlation between ganglion cell layer thinning and poor visual function after resolution of diabetic macular edema. Invest Ophthalmol Vis Sci 2015 ; 56 : 978-82.
[22] Van Dijk HW, Verbraak FD, Kok PHB, et al. Early neurodegeneration in the retina of type 2 diabetic patients. Invest Ophthalmol Vis Sci 2012 ; 53 : 2715-9.
[23] Jackson GR, Scott IU, Quillen DA, et al. Inner retinal visual dysfunction is a sensitive marker of non-proliferative diabetic retinopathy. Br J Ophthalmol 2012 ; 96 : 699-703.
[24] Scarinci F, Jampol LM, Linsenmeier RA, Fawzi AA. Association of diabetic macular nonperfusion with outer retinal disruption on optical coherence tomography. JAMA Ophthalmol 2015 ; 133 : 1036-44.
[25] Wessel MM, Nair N, Aaker GD et al. Peripheral ischaemia as evaluated by ultra-widefield fluorescein angiography is associated with diabetic macular edema. Br J Ophthalmol 2012 ; 96 : 694-8.
[26] Bolz M, Lammer J, Deak G, et al. SAVE : a grading protocol for clinically significant diabetic macular oedema based on optical coherence tomography and fluorescein angiography. Br J Ophthalmol 2014 ; 98 : 1612-7.
[27] Cunha-Vaz J. Phenotypes and biomarkers of diabetic retinopathy. Personalized medicine for diabetic retinopathy : the Weisenfeld award. Invest Ophthalmol Vis Sci 2014 ; 55 : 5412-9.
[28] Leicht SF, Kernt M, Neubauer A, et al. Microaneurysm turnover in diabetic retinopathy assessed by automated RetmarkerDR image analysis--potential role as biomarker of response to ranibizumab treatment. Ophthalmol J Int 2014 ; 231 : 198-203.
[29] Boyer DS, Faber D, Patel SS, et al. Dexamethasone intravitreal implant for treatment of diabetic macular edema in vitrectomized patients. Retina 2011 ; 31 : 915-23.
[30] Bressler SB, Melia A, Glassman A, et al. Ranibizuman plus prompt or deferred laser for diabetic macular edema in eyes with vitrectomy before anti-vascular endothelial growth factor therapy. Retina 2015 ; 35 : 2516-28.
[31] Diabetic Retinopathy Clinical Research Network, Wells JA, Glassman AR, et al. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med 2015 ; 372 : 1193-203.
[32] Morales MU, Saker S, Mehta RL, et al. Preferred retinal locus profile during prolonged fixation attempts. Can J Ophthalmol 2013 ; 48 : 368-74.
[33] Carpineto P, Ciancaglini M, Di Antonio L, et al. Fundus microperimetry patterns of fixation in type 2 diabetic patients with diffuse macular edema. Retina 2007 ; 27 : 21-9.
[34] Midena E, Vujosevic S. Microperimetry in diabetic retinopathy. Saudi J Ophthalmol 2011 ; 25 : 131-5.
[35] Dugel P. Communication orale. Congrès de l’American Academy of Ophthalmology, Las Vegas 2015.
[36] Wykoff C. Open label extension of the RISE/RIDE trials. Congrès de l’American Academy of Ophthalmology, 2014, communication orale.
P. Massin
➤ La classification de l’OM a pour but d’établir des stades de gravité et donc de pronostic fonctionnel différents.
➤ Il n’y a pas de consensus international sur les définitions d’OMD focal et diffus et les études cliniques n’ont pas permis de démontrer la valeur pronostique de cette classification qui est globalement abandonnée.
➤ L’épaississement maculaire ne suffit pas à décrire la sévérité d’un OM et la valeur pronostique de la plupart des anomalies rétiniennes décrites en OCT n’ayant pas été validée à ce jour, il n’est pas possible de les intégrer dans une classification.
➤ La classification moderne de la maculopathie diabétique reprend la classification internationale de l’American Academy of Ophthalmology basée sur la localisation de l’œdème, à laquelle ont été ajoutés des signes dont la valeur pronostique péjorative a été démontrée.
L’OMD, et plus généralement la maculopathie diabétique, n’est qu’un des aspects de la rétinopathie diabétique (RD) et il s’observe aussi bien dans les formes de RD proliférante que non proliférante. La maculopathie diabétique nécessite donc une classification particulière, à côté de celle de la RD, elle-même basée sur la sévérité de l’ischémie rétinienne périphérique et le risque visuel qui en découle.
La classification d’une pathologie a pour but d’établir des stades de gravité et donc de pronostic différents dans l’évolution de cette pathologie, auxquels correspondent des délais de surveillance et des indications thérapeutiques différents. La gravité d’un OMD est liée au risque visuel représenté par cet OM, et les différents stades d’une classification représentent habituellement des stades exposant à un risque croissant de perte visuelle ; on peut également intégrer dans cette classification une forme d’OMD relevant d’un mécanisme pathogénique particulier et nécessitant une thérapeutique particulière (OM tractionnel par exemple). Par ailleurs, pour être reconnues, ces classifications nécessitent théoriquement d’avoir été validées par de larges études prospectives, démontrant la valeur pronostique de chacun des stades qu’elles décrivent.
Les classifications d’une pathologie sont largement dépendantes des outils de diagnostic disponibles, c’est pourquoi les premières classifications de l’OMD étaient essentiellement basées sur la description des signes observés à l’examen du fond d’œil [1–5].
L’angiographie en fluorescence (AF) a ensuite permis d’objectiver les occlusions des capillaires rétiniens, la rupture de la BHR interne et les diffusions qui en résultent. Des classifications basées sur l’AF et le type de diffusion à l’origine de l’OMD ont été alors exposées. Bresnick a ainsi proposé, en 1983, une classification de la maculopathie diabétique, basée sur l’AF, distinguant la maculopathie ischémique, les œdèmes maculaires focal et diffus [6]. L’œdème maculaire focal est secondaire à des diffusions localisées à partir de micro-anévrismes et d’AMIR ; les exsudats sont fréquents, souvent organisés en couronne (exsudats circinés) L’OM diffus est caractérisé par une dilatation étendue du lit capillaire maculaire et une diffusion généralisée, se compliquant fréquemment d’OMC. Enfin, la maculopathie ischémique est définie par une occlusion étendue des capillaires maculaires. Cette classification angiographique a été largement utilisée et faisait partie de la classification de la maculopathie diabétique proposée par l’Association de langue française pour l’étude du diabète et des maladies métaboliques (ALFEDIAM) en 1996 [7]. Toutefois, cette classification angiographique de l’OMD est controversée : il n’y a pas de consensus international sur les définitions d’OMD focal et diffus [8] et les études cliniques n’ont pas permis de démontrer la valeur pronostique de cette classification, globalement abandonnée.
L’ETDRS a apporté sa propre définition de l’œdème maculaire : il s’agit de tout épaississement rétinien, localisé à moins d’un diamètre papillaire du centre de la macula, détectable à l’examen biomicroscopique du fond d’œil ou sur des clichés stéréoscopiques du fond d’œil et associé ou non à des exsudats [9]. Sa sévérité dépend de la localisation de l’œdème par rapport au centre de la macula. L’ETDRS Study Group a proposé une classification de l’OMD qui a été validée par la large étude de l’ETDRS (report n° 1), évaluant l’efficacité du laser pour l’OMD. C’est encore aujourd’hui la classification de référence.
La grille de l’ETDRS est utilisée pour évaluer la distance de l’œdème par rapport au centre de la macula (fig. 8-59) : il s’agit d’une grille constituée de trois cercles concentriques, ayant des diamètres respectifs de 1 000, 3 000 et 6 000 μm.
L’ETDRS a défini le stade d’« œdème maculaire cliniquement significatif » (OMCS ; clinically significant macular edema [CSME]) qui est un stade de gravité pour lequel il faut envisager un traitement, car il expose à un haut risque de perte visuelle. Il correspond à un œdème menaçant ou atteignant le centre de la macula. Sa définition, complexe, regroupe trois situations :
-
épaississement rétinien et/ou exsudats lipidiques atteignant le centre de la macula ;
-
épaississement rétinien et/ou exsudats situés à moins de 500 μ du centre de la macula mais ne l’atteignant pas ;
-
épaississement rétinien d’un diamètre papillaire ou plus, situé, au moins en partie, à moins d’un diamètre papillaire mais à plus de 500 μ du centre de la macula.
L’inconvénient de cette classification est qu’elle ne tient pas compte du degré d’ischémie maculaire. De plus, elle est trop complexe pour la pratique clinique quotidienne. C’est pourquoi, une classification simplifiée de l’ETDRS a été proposée en 2003, la classification internationale de l’American Academy of Ophthalmology (AAO) [10].
Dans cette classification dérivée de celle de l’ETDRS, le niveau de gravité de l’OMD repose sur la distance entre l’épaississement rétinien et/ou les exsudats secs et le centre de la macula, et le risque visuel qui en découle (tableau 8-9). L’OM est classé en minime, modéré ou sévère, selon sa localisation par rapport au centre de la macula. Plus l’œdème est proche du centre, plus la menace visuelle est grande. Les exsudats secs peuvent être les témoins d’un OM résorbé ou d’un OM encore présent. Il faut noter que cette classification, comme la classification de l’ETDRS, ne prend pas en compte le degré d’ischémie maculaire.
Fig. 8-59 Grille d’évaluation ETDRS de l’œdème maculaire.
Le disque central à limites pleines a un diamètre de 1 000 μm. Le disque intermédiaire et le disque périphérique, chacun divisé en quatre quadrants, ont un rayon respectivement de 1 500 et 3 000 μm.

Tableau 8-9 Classification de l’œdème maculaire selon la classification internationale de la Société américaine d’ophtalmologie (2003).
L’OCT est devenue maintenant un outil de diagnostic de l’OM utilisé en routine. Elle permet de quantifier l’épaississement rétinien maculaire de façon précise et reproductible, et d’analyser un nombre croissant d’anomalies intrarétiniennes (voir chapitre 8.4). Toutefois, l’absence de parallélisme entre l’acuité visuelle et l’épaisseur maculaire n’autorise pas une classification de l’OMD basée seulement sur l’épaisseur maculaire [11].
Kim et al. ont proposé une classification de l’OMD selon son aspect en OCT, distinguant OMC, épaississement rétinien diffus, décollement séreux rétinien, traction vitréomaculaire et décollement de rétine tractionnel [12]. Ces aspects sont toutefois souvent associés et ne décrivent pas forcément des stades de gravité croissante. Avec l’augmentation de la résolution des OCT de nouvelle génération, de nouvelles anomalies intrarétiniennes sont décrites mais la valeur pronostique de ces anomalies n’étant pas encore clairement élucidée, il n’est pas encore possible de les intégrer dans une classification (voir chapitres 8.4 et 8.6).
Récemment, Bolz et al. ont proposé une classification de l’OMD basée sur l’OCT et l’angiographie en fluorescence. C’est le protocole SAVE décrit dans le chapitre 8.4. Une étude de grande ampleur est nécessaire pour valider cette classification [13].
On peut néanmoins proposer à ce jour, une classification « moderne » de l’OMD, à partir de la classification internationale de l’AAO, en y adjoignant les signes reconnus comme étant associés à un pronostic fonctionnel péjoratif (tableau 8-10). Cette classification a été validée par la Fédération France Macula (FFM), le Club francophone des spécialistes de la rétine (CFSR) et par la Société française d’ophtalmologie [14]. À noter qu’il s’agit d’une classification provisoire, amenée à évoluer dans le futur, lorsque la valeur pronostique des différents signes observés en OCT, mais aussi de l’ensemble des informations apportées par l’imagerie multimodale, sera établie.
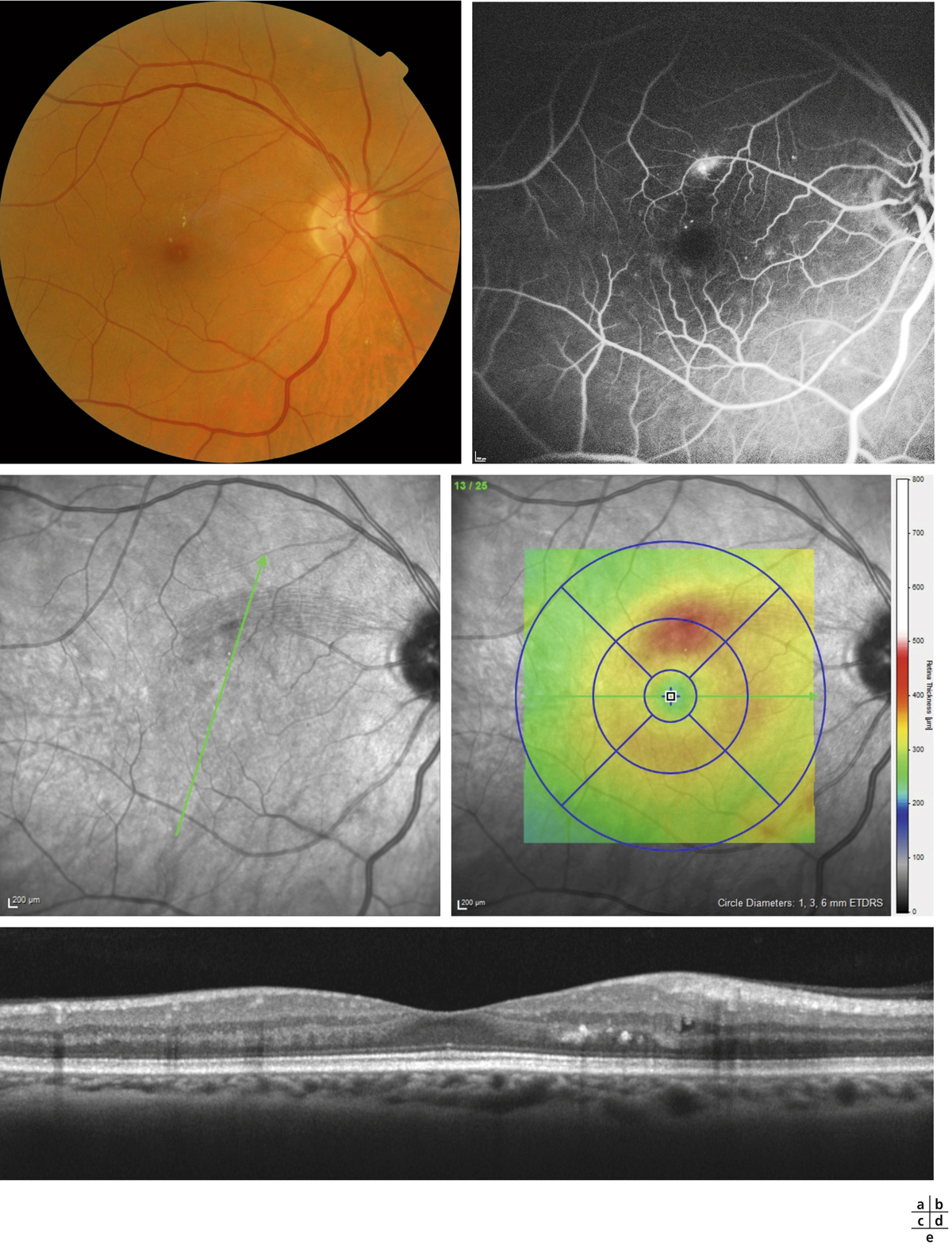
Fig. 8-60 Œdème maculaire minime.
a. Cliché en couleurs : quelques exsudats sus-fovéolaires. b. L’angiographie objective un micro-anévrisme sus-fovéolaire dont les parois laissent diffuser la fluorescéine. c. La flèche verte indique la direction de la coupe OCT. d. La cartographie maculaire objective un épaississement à distance du centre de la macula. e. Sur la coupe OCT passant par l’œdème, on distingue les exsudats hyper-réflectifs, associés à un épaississement modéré. La menace visuelle est minime, il n’y a pas d’indication à un traitement par laser.
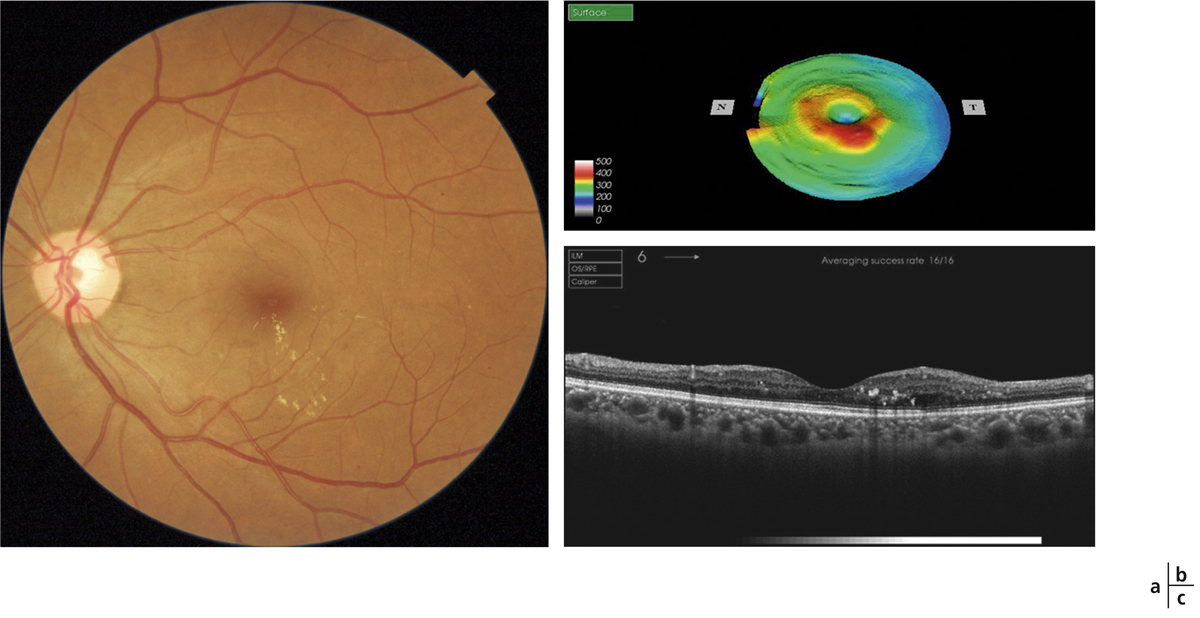
Fig. 8-61 Œdème maculaire modéré.
a. Cliché en couleurs : on observe une couronne d’exsudats dont l’extrémité est très proche du centre de la macula. b. La cartographie maculaire de l’œil gauche objective une zone d’épaississement maculaire en regard de la couronne d’exsudats, à proximité du centre de la macula. L’OMD est modéré. c. La coupe OCT passant par la zone œdémateuse objective l’épaississement rétinien extrafovéolaire associé aux exsudats hyper-réflectifs.

Fig. 8-62 Œdème maculaire modéré à sévère.
a. Cliché en couleurs : micro-anévrismes et hémorragies rétiniennes assez nombreuses au pôle postérieur. b. Le cliché tardif de l’angiographie objective des diffusions à partir des micro-anévrismes. c. La flèche verte indique la direction de la coupe OCT en e. d. La cartographie maculaire objective une zone d’épaississement maculaire à distance du centre de la macula. L’œdème semble peu sévère. e. Sur la coupe OCT, on observe une zone d’épaississement rétinien en temporal de la fovéa, mais il existe également quelques microkystes intrarétiniens centraux qui font la sévérité de cet œdème.
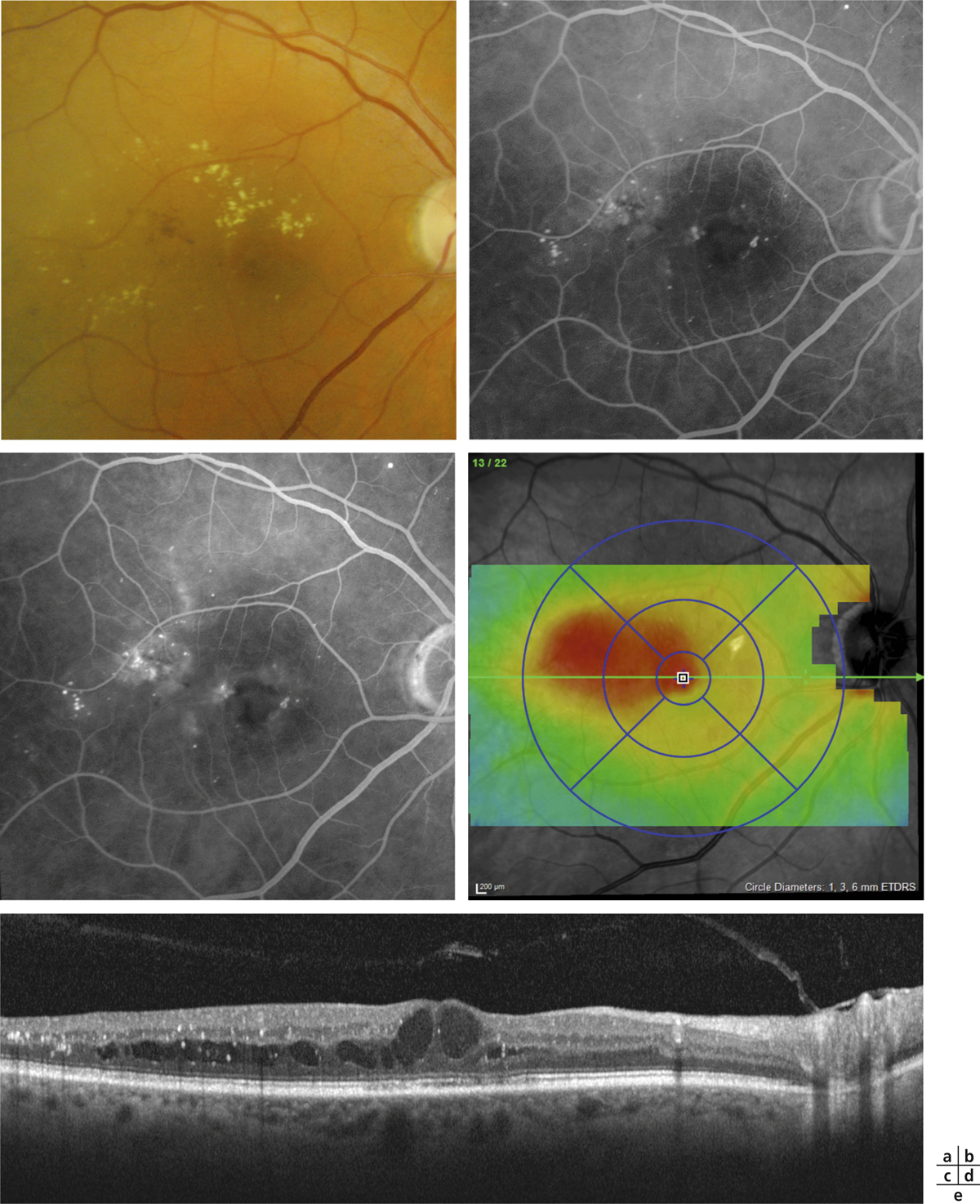
Fig. 8-63 Œdème maculaire sévère.
a. Cliché en couleurs : couronne d’exsudats associée à des micro-anévrismes en temporal de la fovéa. b, c. Sur l’angiographie, on observe des diffusions à partir des micro-anévrismes, dont certains sont localisés sur la maille capillaire périfovéolaire, et le remplissage d’une logette centrale. d. La cartographie maculaire objective un épaississement maculaire prédominant en temporal de la fovéa et atteignant le centre de la macula. e. Sur la coupe OCT horizontale, on observe des kystes intrarétiniens, prédominant dans la couche plexiforme externe, et deux logettes centrales. La hyaloïde postérieure est décollée du pôle postérieur mais encore attachée à la papille.
eFig. 8-12 Œdèmes maculaires diabétiques minime et modéré chez un même patient.
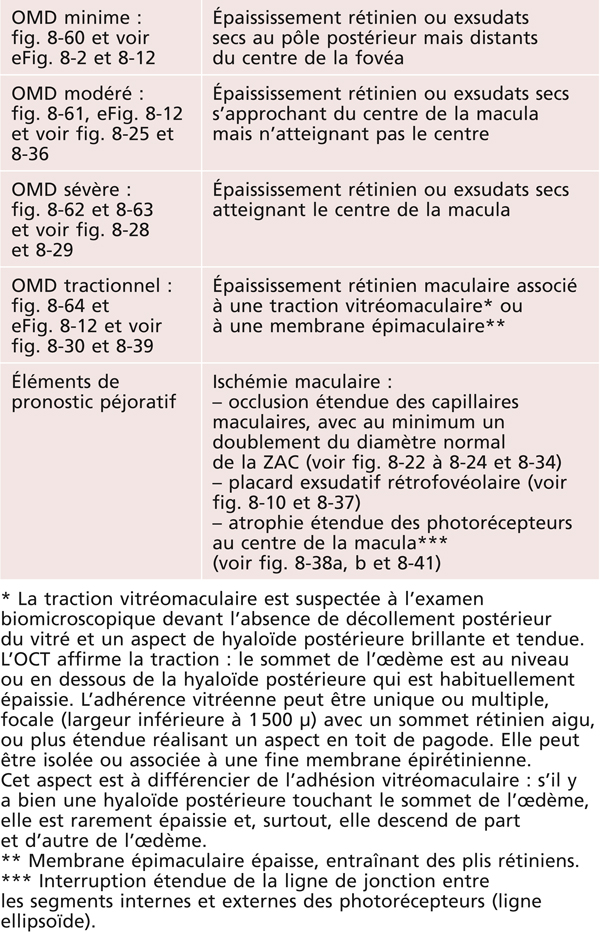
Tableau 8-10 Classification moderne de l’OMD.
[1] Lee P, McMeel JW, Schepens CL, Fields RA. A new classification of diabetic retinopathy. Am J Ophthalmol 1966 ; 62 : 207.
[2] Oakley N, Hill DW, Joplin GF, et al. Diabetic retinopathy, the assessment of severity and progress by comparison with a set of standard fundus photographs. Diabetologica 1967 ; 3 : 402.
[3] Kohner EM. The evolution and natural history of diabetic retinopathy. Int Opthalmol Clin 1978 ; 18 : 1-16.
[4] Sigelman J. Diabetic macular edema in juvenile- and adult-onset diabetes. Am J Opthalmol 1980 ; 90 : 287-96.
[5] Klein R, Klein BEK, Magli YL, et al. An alternative method of grading diabetic retinopathy. Ophthalmology 1986 ; 93 : 1183-7.
[6] Bresnick GH. Diabetic maculopathy. A critical review highlighting diffuse macular edema. Ophthalmology 1983 ; 90 : 1301-17.
[7] Massin P, Angioi-Duprez K, Bacin F, et al. Recommandations de l’ALFEDIAM pour le dépistage et la surveillance de la rétinopathie diabétique. Diabet Metab 1996 ; 22 : 203-9.
[8] Browning DJ, Altaweel MM, Bressler NM, et al.; Diabetic Retinopathy Clinical Research Network. Diabetic macular edema : what is focal and what is diffuse ? Am J Ophthalmol 2008 ; 146 : 649-55, 655.e1-6.
[9] Early Treatment Diabetic Retinopathy Study Research Group. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study Report number 1. Arch Opthalmol 1985 ; 103 : 1796-806.
[10] Wilkinson CP, et al. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales. Ophthalmology 2003 ; 110 : 1677-82.
[11] Virgili G, Menchini F, Murro V, et al. Optical coherence tomography (OCT) for detection of macular oedema in patients with diabetic retinopathy. Cochrane Database Syst Rev 2011 ; (7) : CD008081.
[12] Kim BY, Smith SD, Kaiser PK. Optical coherence tomographic patterns of diabetic macular edema. Am J Ophthalmol 2006 ; 142 : 405-12.
[13] Bolz M, Lammer J, Deak G, et al. SAVE : a grading protocol for clinically significant diabetic macular oedema based on optical coherence tomography and fluorescein angiography. Br J Ophthalmol 2014 ; 98 : 1612-7.
[14] Massin P, Baillif S, Creuzot C, et al. Œdème maculaire diabétique : diagnostic et bilan préthérapeutique. J Fr Ophtalmol 2015 ; 38 : e187-9.
A. Lecleire-Collet
➤ L’apparition d’un OMD pendant la grossesse survient le plus souvent parallèlement à l’aggravation de la rétinopathie diabétique.
➤ Habituellement, il disparaît spontanément après l’accouchement. Il est de règle de ne pas traiter l’OM pendant la grossesse.
➤ La présence d’un OM ne doit en aucun cas faire surseoir à la réalisation d’une photocoagulation panrétinienne en cas de rétinopathie diabétique non proliférante sévère ou plus grave survenant au cours de la grossesse.
L’OM chez les femmes enceintes diabétiques présente des spécificités cliniques et évolutives que nous allons détailler ci-dessous. Cet intertitre ne concerne que les patientes présentant un diabète avant la grossesse (et non celles présentant un diabète uniquement gestationnel qui ne développeront pas de rétinopathie diabétique).
La grossesse est une période à risque d’aggravation de la rétinopathie diabétique. Environ un quart des patientes présente une aggravation de leur rétinopathie diabétique pendant la grossesse [1]. Les mécanismes d’aggravation, non complètement élucidés, impliqueraient une augmentation du taux d’insulin-like growth factor 1 (IGF-1), secondaire à l’augmentation des hormones de croissance, et une augmentation du flux sanguin pendant la grossesse [2, 3].
La survenue d’un OMD pendant la grossesse est peu fréquente et généralement concomitante d’une aggravation importante de la rétinopathie diabétique, évoluant vers une forme proliférante. Selon Sinclair et al. [4], dans une étude publiée en 1984, la proportion de femmes diabétiques développant un OM sévère associé à une rétinopathie diabétique non proliférante sévère ou proliférante durant la grossesse représenterait à peu près 6 % des femmes enceintes diabétiques, 10 % des femmes enceintes diabétiques avec une rétinopathie en début de grossesse et 60 % des femmes enceintes diabétiques avec une rétinopathie diabétique proliférante durant la grossesse. Toutefois, il est possible que ses chiffres soient inférieurs actuellement.
Les facteurs de risque de progression de la rétinopathie diabétique (et donc d’apparition ou d’aggravation d’un OM) sont les suivants : diabète déséquilibré et équilibration rapide de la glycémie en début de grossesse (en général dû à l’absence de programmation de la grossesse), ancienneté du diabète, sévérité de la rétinopathie initiale et hypertension artérielle. Le risque d’aggravation de la rétinopathie diabétique est maximal en fin de deuxième trimestre.
Peu de données sont présentes dans la littérature. Sinclair et al. [4] ont rapporté les cas de sept jeunes femmes avec un diabète de type 1 ancien, n’ayant pas de rétinopathie diabétique ou seulement une rétinopathie diabétique minime en début de grossesse qui ont développé un OM sévère associé à une rétinopathie diabétique non proliférante sévère ou proliférante durant leur grossesse. L’OM était associé à une non-perfusion capillaire maculaire selon les auteurs, et le plus souvent une protéinurie et une hypertension artérielle. L’OM a entraîné une perte moyenne de 6 lignes ETDRS et l’acuité visuelle des yeux atteints était comprise entre 20/30 et 20/400. Bien que la néovascularisation ait été contrôlée par la photocoagulation panrétinienne, l’OM a continué à s’aggraver jusqu’à l’accouchement dans tous les cas et a souvent été aggravé transitoirement par la photocoagulation panrétinienne. Après l’accouchement, l’OM s’est amélioré chez toutes les jeunes femmes et l’acuité visuelle a augmenté en moyenne de 3 lignes ETDRS, bien que cinq yeux aient conservé des acuités visuelles inférieures à 20/60 (sans traitement).
Des recommandations pour le suivi ophtalmologique des femmes enceintes diabétiques ont été établies, en fonction du stade de rétinopathie diabétique en début de grossesse [5].
En cas de rétinopathie diabétique non proliférante sévère ou plus grave survenant au cours de la grossesse, il faut réaliser immédiatement et rapidement une photocoagulation panrétinienne (sauf éventuellement en toute fin de grossesse), même s’il existe un œdème maculaire.
L’amélioration en post-partum d’un OMD survenu pendant la grossesse est la règle (fig. 8-65 ; eFig. 8-13 et eCas clinique 8.1
et eCas clinique 8.1 ). Il ne faut donc pas traiter l’OMD pendant la grossesse et patienter jusqu’au post-partum. Dans les cas de persistance de l’OM en post-partum, avec une amélioration progressive et une acuité visuelle peu abaissée, on pourra attendre quelques mois supplémentaires avant d’envisager alors un traitement. En cas d’OM persistant en post-partum sans tendance à l’amélioration, la prise en charge sera habituelle (injections d’anti-VEGF, etc.). L’allaitement sera alors plutôt déconseillé [6].
). Il ne faut donc pas traiter l’OMD pendant la grossesse et patienter jusqu’au post-partum. Dans les cas de persistance de l’OM en post-partum, avec une amélioration progressive et une acuité visuelle peu abaissée, on pourra attendre quelques mois supplémentaires avant d’envisager alors un traitement. En cas d’OM persistant en post-partum sans tendance à l’amélioration, la prise en charge sera habituelle (injections d’anti-VEGF, etc.). L’allaitement sera alors plutôt déconseillé [6].
Rappelons que les anti-VEGF sont contre-indiqués pendant la grossesse, le VEGF ayant un rôle déterminant dans le développement vasculaire et neuronal du fœtus. Les corticoïdes utilisés en injections intravitréennes n’ont pas été testés chez la femme enceinte et même si le passage systémique est en théorie faible, leur utilisation est à déconseiller [6].
Dans les cas graves d’OM tractionnel ou de décollement tractionnel maculaire, dus à des proliférations fibrovasculaires atteignant le pôle postérieur, une intervention chirurgicale peut être proposée pendant la grossesse, à discuter au cas par cas (début ou fin de grossesse, état de l’œil adelphe, etc.).
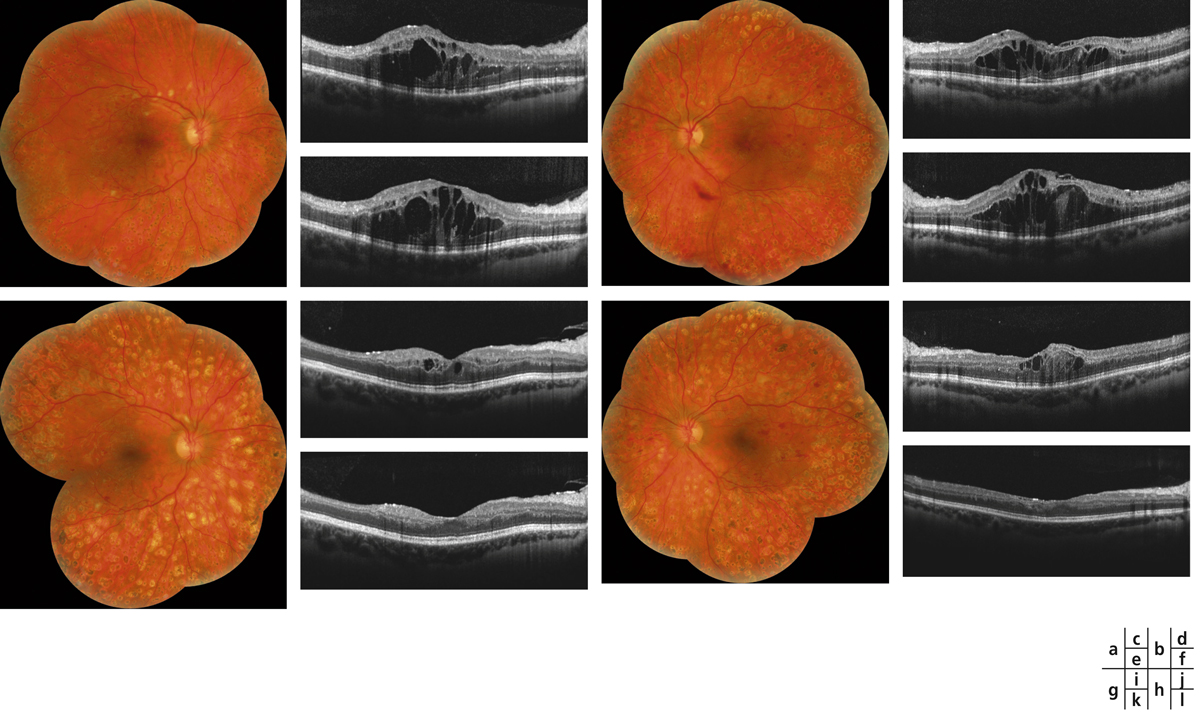
Fig. 8-65 Patiente diabétique de type 1, avec un diabète mal équilibré, enceinte de 3 mois, présentant une rétinopathie diabétique proliférante sévère à droite (a), une rétinopathie diabétique proliférante compliquée à gauche (b) et un œdème maculaire bilatéral à 3 mois (c, d) et 6 mois (e, f) de grossesse.
La photocoagulation rétinienne est poursuivie en urgence (g, h). Diminution progressive de l’OM en post-partum : à 3 mois post-partum (i, j) ; à 6 mois post-partum (k, l).
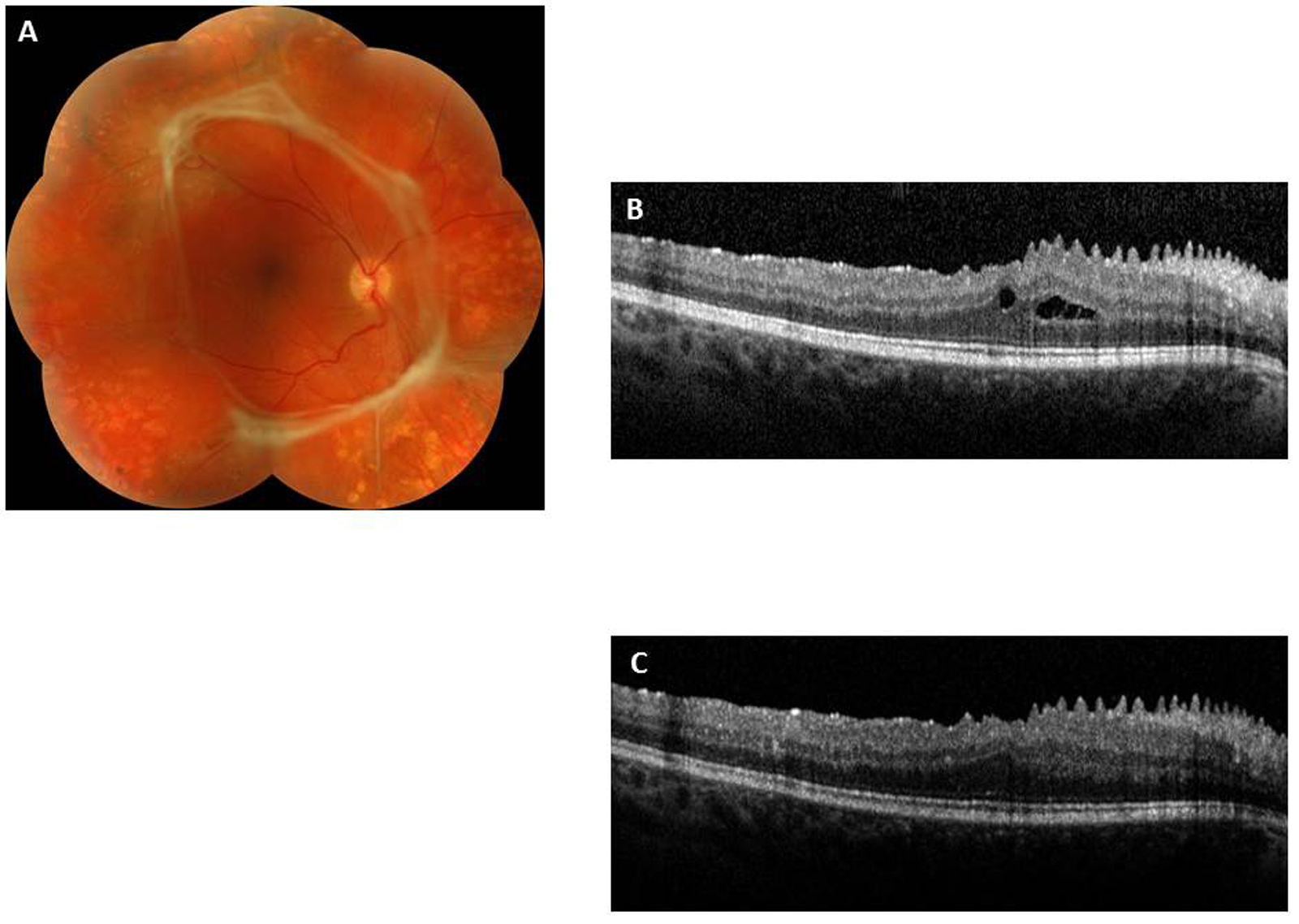
eFig. 8-13 Patiente diabétique de type 1, avec un diabète ancien mal équilibré, enceinte de 3 mois, présentant une rétinopathie diabétique proliférante sévère en cours de photocoagulation rétinienne en urgence.
eCas clinique 8-1 Évolution d’un œdème maculaire diabétique pendant la grossesse.
L’apparition d’un OMD pendant la grossesse survient le plus souvent parallèlement à l’aggravation de la rétinopathie diabétique (évolution vers les formes non proliférantes sévères et proliférantes).
L’OM s’améliore habituellement après l’accouchement, disparaissant le plus souvent. Il est ainsi recommandé de ne pas traiter l’OM pendant la grossesse, d’autant que les principales thérapeutiques sont contre-indiquées (injections intravitréennes d’anti-VEGF et, dans une moindre mesure, de corticoïdes). La présence d’un OM ne doit en aucun cas surseoir à la réalisation d’une panphotocoagulation en cas de rétinopathie diabétique non proliférante sévère ou plus grave survenant au cours de la grossesse.
[1] Chew EY, Mills JL, Metzger BE, et al. Metabolic control and progression of retinopathy. The Diabetes in Early Pregnancy Study. National Institute of Child Health and Human Development Diabetes in Early Pregnancy Study. Diabetes Care 1995 ; 18 : 631-7.
[2] Ringholm L, Vestgaard M, Laugesen CS, et al. Pregnancy-induced increase in circulating IGF-I is associated with progression of diabetic retinopathy in women with type 1 diabetes. Growth Horm IGF Res 2011 ; 21 : 25-30.
[3] Loukovaara S, Harju M, Kaaja R, et al. Retinal capillary blood flow in diabetic and nondiabetic women during pregnancy and postpartum period. Invest Ophthalmol Vis Sci 2003 ; 44 : 1486-91.
[4] Sinclair SH, Nesler C, Foxman B, et al. Macular edema and pregnancy in insulin-dependent diabetes. Am J Ophthalmol 1984 ; 97 : 154-67.
[5] Massin P, Ben Mehidi A, Paques M, et al. Management of diabetic complications during pregnancy using diabetic retinopathy as an example. Diabetes Metab 2001 ; 27 : S48-52.
[6] Dupas B, Massin P, Averous K. Rétine. Médecine Sciences Publications ; 2012, 277 p.
A. Giocanti-Aurégan
➤ La chirurgie de la cataracte chez les patients diabétiques apporte un bénéfice fonctionnel significatif à condition que la rétinopathie diabétique (RD) et l’OMD soient évalués et contrôlés avant chirurgie.
➤ En cas d’OMD préopératoire, le traitement de l’OMD avant chirurgie de la cataracte sera privilégié et la chirurgie pratiquée après disparition de l’œdème maculaire.
➤ L’équilibre glycémique et tensionnel doit idéalement être obtenu avant phacoémulsification (PKE).
➤ Chez les patients diabétiques, un traitement peropératoire peut être proposé en association à la chirurgie de la cataracte si le patient présente un OMD préopératoire traité ou en cours de traitement.
➤ L’association de collyres anti-inflammatoires non stéroïdiens (AINS) à la dexaméthasone en postopératoire semble diminuer l’apparition d’un OMD.
➤ Chez les patients diabétiques n’ayant pas d’OMD préopératoire, une IVT d’anti-VEGF ou de corticoïdes « préventive » n’est pas recommandée systématiquement ; des études sont nécessaires afin d’apporter la preuve de l’intérêt de cette démarche.
Le patient diabétique développe une cataracte environ 20 ans plus tôt qu’un patient non diabétique. Les facteurs de risque d’opacification cristallinienne précoce en cas de diabète sont : la sévérité de la RD, le traitement par insulinothérapie, l’âge ainsi que l’existence d’une protéinurie [1]. L’OM peut survenir au décours d’une chirurgie de la cataracte chez un patient diabétique.
La physiopathogénie de l’OM postopératoire apparaît multifactorielle. Les facteurs étiologiques suspectés incluent l’inflammation, les mécanismes de traction vitréenne et l’hypotonie [2, 3]. Parmi ceux-ci, le mécanisme principal semble être une inflammation du segment antérieur induite par la chirurgie résultant en une libération de médiateurs inflammatoires endogènes. Ces médiateurs tels que prostaglandines, cytokines et autres facteurs diffusent à travers le vitré vers la rétine, augmentent la perméabilité vasculaire et altèrent les capillaires périfovéolaires, résultant en une accumulation de fluide intrarétinien.
La baisse d’acuité visuelle est le principal symptôme de l’œdème maculaire cystoïde (OMC) postopératoire. Elle débute généralement entre 4 et 12 semaines après chirurgie, atteignant un pic d’incidence autour de 4 à 6 semaines postopératoires. Les patients peuvent également souffrir de métamorphopsies, scotome central et réduction de la sensibilité aux contrastes. L’examen de la réfraction peut montrer une hypermétropisation. L’OCT retrouve la perte de la dépression fovéolaire ainsi qu’un épaississement maculaire, associé à la présence de kystes intrarétiniens. Certains éléments cliniques résumés dans le tableau 8-11 permettent de différencier chez un patient diabétique, un OM du pseudophaque (ou syndrome d’Irvine-Gass) d’un OMD présent en postopératoire (fig. 8-66 et 8-67). Ces deux formes d’œdème sont néanmoins souvent associées chez le patient diabétique, d’autant que le syndrome d’Irvine-Gass survient plus fréquemment en cas d’œdème diabétique préopératoire (fig. 8-68).
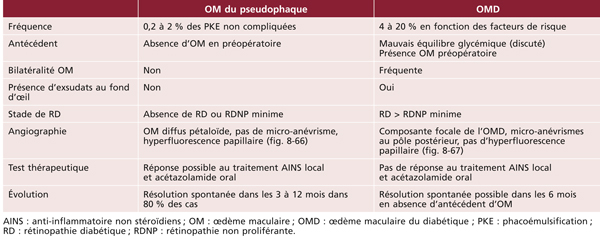
Tableau 8-11 Éléments cliniques d’orientation vers un OM du pseudophaque (syndrome d’Irvine-Gass) ou vers un OMD en cas d’OM après PKE.
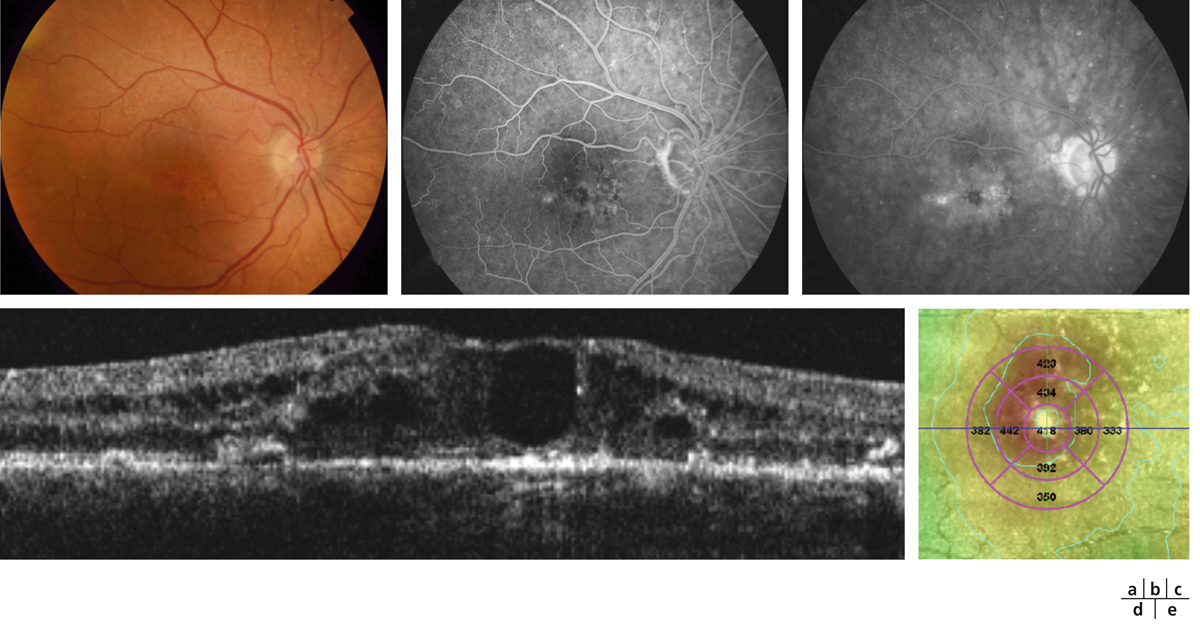
Fig. 8-66 Œdème maculaire cystoïde survenant 3 semaines après phacoémulsification.
a. Rétinographie en couleurs de l’œil droit d’un patient sans rétinopathie diabétique, présentant par ailleurs des migrations pigmentaires au pôle postérieur. Pas d’exsudat visible. b. Temps artérioveineux de l’angiographie à la fluorescéine laissant apparaître l’effet masque en rapport avec les migrations pigmentaires. Pas de micro-anévrisme visible. c. Temps tardif : diffusion de fluorescéine avec aspect pétaloïde au pôle postérieur en rapport avec le remplissage des logettes d’œdème maculaire cystoïde. Hyperfluorescence papillaire tardive. d. OCT : œdème maculaire cystoïde. e. Cartographie maculaire : œdème maculaire central avec épaisseur rétinienne centrale à 418 μm.
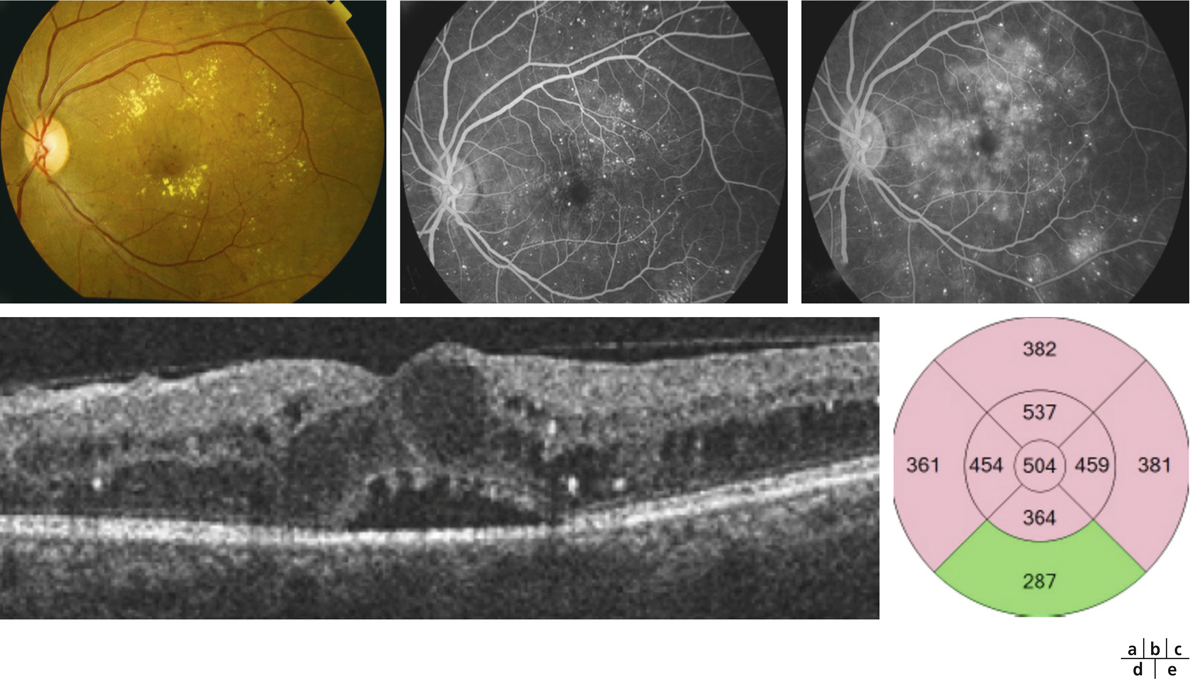
Fig. 8-67 Œdème maculaire diabétique postopératoire diagnostiqué lors du contrôle 4 semaines après phacoémulsification.
a. Rétinographie en couleurs de l’œil gauche objectivant une couronne d’exsudats au pôle postérieur associée à des hémorragies. La rétinopathie diabétique est non proliférante modérée. b. Temps précoce de l’angiographie à la fluorescéine laissant apparaître de nombreux micro-anévrismes au pôle postérieur. c. Temps tardif : diffusion de fluorescéine à partir des micro-anévrismes périmaculaires. Pas d’hyperfluorescence papillaire tardive. d. OCT maculaire : OM cystoïde associé à la présence d’un décollement séreux rétinien. Présence de nombreux points hyper-réflectifs. e. Cartographie maculaire : OM central avec épaisseur rétinienne centrale à 504 μm.
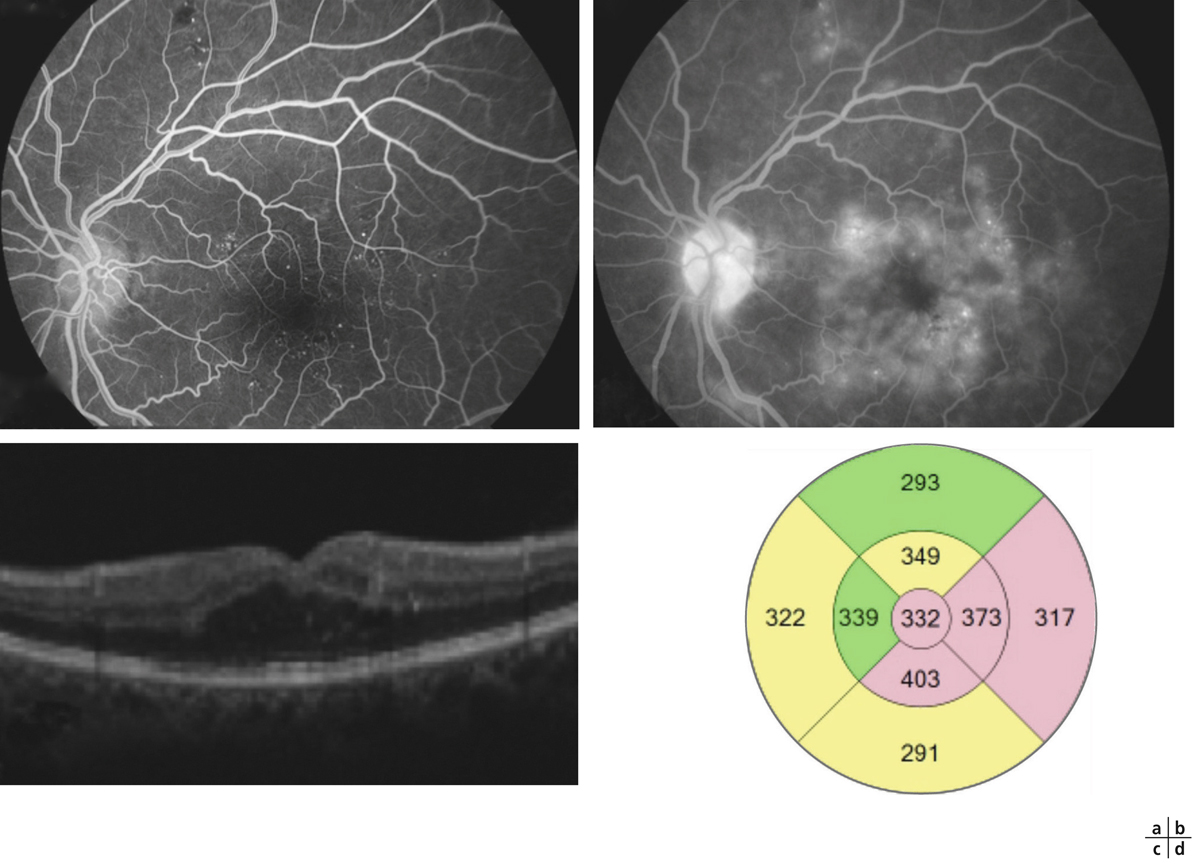
Fig. 8-68 Œdème maculaire cystoïde postopératoire chez un patient diabétique.
Dans ce cas, les deux phénomènes sont probablement intriqués (OM du pseudophaque et OMD). a. Temps précoce de l’angiographie à la fluorescéine. Présence de micro-anévrismes au pôle postérieur. b. Temps tardif de l’angiographie. OM mixte comportant une composante diffuse centrale avec fuite de fluorescéine d’aspect pétaloïde, ainsi qu’une composante focale, avec diffusion à partir des micro-anévrismes. Hyperfluorescence papillaire tardive. c. OCT : œdème maculaire cystoïde. d. Cartographie maculaire : OM central avec épaisseur rétinienne centrale à 332 μm.
La progression de l’OMD après extraction du cristallin peut limiter les bénéfices visuels postopératoires de la chirurgie de la cataracte [4]. Les études cliniques, et notamment l’ETDRS, retrouvent 10 à 12 % d’OMD postopératoires en cas d’antécédent d’OMD, même si l’OCT préopératoire ne montre pas d’épaississement maculaire [5]. Les yeux ayant un antécédent d’OMD préopératoire, n’ayant jamais nécessité de traitement, ont une fréquence d’OMD postopératoires de 4 %. Ce taux passe à 20 % si les yeux ont un antécédent de traitement préopératoire de l’OMD.
Le résultat visuel après PKE chez le patient diabétique est meilleur comparativement aux études plus anciennes et l’incidence des complications reportées est faible [6–8]. Ces bons résultats pourraient être expliqués par une meilleure gestion de la RD préopératoire, l’amélioration des techniques chirurgicales (permettant une réduction de la durée opératoire et des complications associées) et une meilleure gestion des facteurs systémiques tels que la glycémie ou l’hypertension artérielle. L’acuité visuelle est toutefois significativement inférieure chez les patients diabétiques versus non diabétiques à 6 semaines postopératoires sans différence significative d’épaisseur rétinienne centrale (ERC). Une acuité visuelle supérieure ou égale à 20/40 est obtenue pour 62 % [9] à 89 % [6] des yeux opérés.
La progression de l’OMD après extraction du cristallin peut limiter les bénéfices visuels postopératoires de la chirurgie de la cataracte. Le taux d’OM suivant la chirurgie de la cataracte varie entre 4 et 70 % en fonction de la méthode utilisée pour mettre en évidence l’œdème (angiographie, biomicroscopie ou OCT), de la technique chirurgicale et de l’existence de comorbidités telles que la présence d’une uvéite. Kwon et al. [10] ont étudié 104 patients diabétiques opérés de cataracte et retrouvaient une prévalence de l’OMD de 18 %. Parmi les cas d’OMD, 63 % survenaient au cours du 1er mois postopératoire et 68 % étaient spontanément résolutifs au cours des 6 mois postopératoires. Un antécédent de photocoagulation focale préopératoire était retrouvé comme un facteur protecteur d’œdème mais uniquement au cours des 2 mois suivant la chirurgie.
Dowler et al. [8] ont étudié 32 patients diabétiques opérés de cataracte et retrouvaient un OMCS au moment de la chirurgie comme un facteur péjoratif, avec une tendance à perdurer au cours de la première année postopératoire sans résolution spontanée. La présence d’un OM avant chirurgie de la cataracte est un facteur de risque important d’OM persistant en postopératoire [8]. Le stade de la RD semble également être un facteur de risque de développement d’OMD postopératoire. En effet, Kim et al. [11] ne retrouvent pas de variation de l’ERC en postopératoire chez des patients atteints de RD non proliférante minime ou en cas d’absence de RD, alors que l’ERC augmente en cas de RD non proliférante modérée à sévère.
Les facteurs de risque d’une faible récupération visuelle après chirurgie de la cataracte seraient la durée du diabète, le stade de la RD en préopératoire et la présence d’un OM préopératoire [12]. L’identification et la prise en charge des facteurs de risque avant PKE, tels qu’une RD active et/ou un déséquilibre glycémique, sont indispensables chez les patients diabétiques. Il semble également désormais préférable de tout mettre en œuvre pour traiter l’OMD avant la chirurgie de la cataracte.
Le principal facteur de risque d’OMCS semble être l’existence d’un antécédent d’OM. Il serait donc intéressant dans ce cas précis de discuter un éventuel traitement préventif de la récidive de l’OM postopératoire en combinant la chirurgie à un agent pharmacologique intravitréen traitant l’œdème (anti-VEGF, corticoïdes). Compte tenu du taux de développement et de progression de l’OMD après chirurgie de la cataracte, de multiples études cliniques ont été réalisées afin d’évaluer l’effet de traitements (tableau 8-12) combinés à la chirurgie de la cataracte [13–16].
Tableau 8-12 Principales études évaluant l’intérêt d’un traitement combiné avec la chirurgie de la cataracte (PKE) chez le patient diabétique sur l’acuité visuelle et l’épaisseur rétinienne centrale postopératoire.
L’inflammation, par le biais des prostaglandines qui augmentent la perméabilité des capillaires périmaculaires, joue sans doute un rôle majeur dans le développement de l’OM. Les traitements par AINS par le blocage de la production de prostaglandines semblent intéressants en instillation avant et après PKE. L’utilisation d’AINS [17] en association à un traitement par dexaméthasone, versus dexaméthasone seule, semble réduire également le développement d’un OM après PKE. Les prostaglandines synthétiques utilisées dans le traitement du glaucome augmentent la perméabilité capillaire rétinienne par effet pro-inflammatoire, en particulier chez les patients à haut risque d’OMC [18]. Une fenêtre thérapeutique peut être décidée à l’appréciation du chirurgien en fonction du risque d’OM postopératoire chez le patient diabétique.
Chez 293 patients diabétiques sans OMD central au moment de la chirurgie, Baker et al. ont rapporté un taux de 20 % d’OMD postopératoires, 16 semaines après chirurgie s’il existait un antécédent d’OMD préopératoire contre 4 % dans le cas contraire (p 0,001) [5]. Une étude menée par Kim et al. en 2008 [4] portant sur des patients diabétiques (n = 50), ou aux antécédents d’uvéite (n = 30) ou sains (n = 50) sans OM préopératoire, retrouvait un taux global de 14 % d’OM, 1 mois après chirurgie de la cataracte non compliquée. Par ailleurs, le risque de développer un OMD postopératoire est supérieur en cas de RD présente en préopératoire comparativement aux patients sans RD. Ce risque est également supérieur en cas d’hypertension artérielle, de néphropathie diabétique et d’hyperlipidémie. Par ailleurs, la plupart de ces études suggèrent une évolution bénigne possible des OMD apparaissant après chirurgie de la cataracte. Un traitement à court terme en postopératoire ne semble donc pas nécessaire et peut être retardé après une absence de résolution spontanée 6 mois après chirurgie de la cataracte [12].
La PKE peut s’avérer plus périlleuse chez un patient diabétique, du fait d’une mauvaise dilatation pupillaire présente dans 25 % des cas. Une plus forte incidence de complications postopératoires est reportée telles que les uvéites antérieures fibrineuses, l’opacification capsulaire postérieure, la néovascularisation du segment antérieur, une accélération de la progression de la RD et un OM. Avant de programmer une PKE, il est souhaitable de stabiliser la RD par photocoagulation panrétinienne (PPR) quand cela est indiqué. Le rapport no 25 de l’ETDRS [19] montre que les yeux ayant bénéficié d’une PPR préopératoire ont de meilleurs résultats comparativement aux yeux dont la PPR est différée. L’effet de la chirurgie sur la progression de la RD est un sujet très controversé. En effet, le taux de progression de la RD après chirurgie de la cataracte dépend d’un grand nombre de variables telles que le stade de RD préopératoire, la durée d’évolution du diabète, l’équilibre glycémique et la technique chirurgicale. Les résultats des études sont contradictoires : certaines études concluent à une absence de progression de la RD [20] et sont contredites par d’autres qui retrouvent des taux de progression allant jusqu’à de 28,2 %, versus 13,8 % en absence de chirurgie (odds ratio [OR] : 2,65) à 1 an [21]. Les facteurs de progression de la RD après PKE sont la présence d’un OM préopératoire, une dysfonction rénale, l’existence d’une RD initiale préopératoire et une expérience limitée de l’opérateur [7]. Par ailleurs, les patients dont la RD progresse au cours du suivi, sont plus sujets à développer un OMD. Dans tous les cas, une évaluation de la RD et son traitement par PPR préopératoire si nécessaire, et si la phacosclérose le permet, sont recommandés. En postopératoire, une période de suivi rapproché de la RD pendant 6 mois est raisonnable. Dans tous les cas, le pronostic fonctionnel de la chirurgie de la cataracte semble en rapport avec l’existence d’un OMD dont l’apparition semble liée à la progression de la RD.
Les particularités de la gestion du patient diabétique en cas de chirurgie de la cataracte sont résumées dans la figure 8-69 et dans le eCas clinique 8.2 .
.
Fig. 8-69 Gestion de la chirurgie de la cataracte chez un patient diabétique.
AINS : anti-inflammatoire non stéroïdien ; IVT : injection intravitréenne ; OCT : optical coherence tomography ; OMD : œdème maculaire diabétique ; PG : prostaglandines ; PPR : photocoagulation panrétinienne ; RD : rétinopathie diabétique ; RDNP : rétinopathie diabétique non proliférante ; VEGF : vascular endothelial growth factor.
eCas clinique 8-2 Traitement d’un œdème maculaire diabétique en vue de la chirurgie de la cataracte
[1] Klein BE, Klein R, Moss SE. Incidence of cataract surgery in the Wisconsin Epidemiologic Study of Diabetic Retinopathy. Am J Ophthalmol 1995 ; 119 : 295-300.
[2] Reese AB, Jones IS, Cooper WC. Macular changes secondary to vitreous traction. Trans Am Ophthalmol Soc 1966 ; 64 : 123-34.
[3] Wolter JR. The histopathology of cystoid macular edema. Albrecht Von Graefes Arch Clin Exp Ophthalmol 1981 ; 216 : 85-101.
[4] Kim SJ, Belair ML, Bressler NM, et al. A method of reporting macular edema after cataract surgery using optical coherence tomography. Retina 2008 ; 28 : 870-6.
[5] Baker CW, Almukhtar T, Bressler NM, et al. (Diabetic Retinopathy Clinical Research Network Authors/Writing Committee.) Macular edema after cataract surgery in eyes without preoperative central-involved diabetic macular edema. JAMA Ophthalmol 2013 ; 131 : 870-9.
[6] Henricsson M, Heijl A, Janzon L. Diabetic retinopathy before and after cataract surgery. Br J Ophthalmol 1996 ; 80 : 789-93.
[7] Mittra RA, Borrillo JL, Dev S, et al. Retinopathy progression and visual outcomes after phacoemulsification in patients with diabetes mellitus. Arch Ophthalmol 2000 ; 118 : 912-7.
[8] Dowler JG, Sehmi KS, Hykin PG, et al. The natural history of macular edema after cataract surgery in diabetes. Ophthalmology 1999 ; 106 : 663-8.
[9] Early Treatment Diabetic Retinopathy Study research group. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985 ; 103 : 1796-806.
[10] Kwon SI, Hwang DJ, Seo JY, et al. Evaluation of changes of macular thickness in diabetic retinopathy after cataract surgery. Korean J Ophthalmol 2011 ; 25 : 238-42.
[11] Kim SJ, Equi R, Bressler NM. Analysis of macular edema after cataract surgery in patients with diabetes using optical coherence tomography. Ophthalmology 2007 ; 114 : 881-9.
[12] Haddad NMN, Sun JK, Abujaber S, et al. Cataract surgery and its complications in diabetic patients. Semin Ophthalmol 2014 ; 29 : 329-37.
[13] Takamura Y, Kubo E, Akagi Y. Analysis of the effect of intravitreal bevacizumab injection on diabetic macular edema after cataract surgery. Ophthalmology 2009 ; 116 : 1151-7.
[14] Chae JB, Joe SG, Yang SJ, et al. Effect of combined cataract surgery and ranibizumab injection in postoperative macular edema in nonproliferative diabetic retinopathy. Retina 2014 ; 34 : 149-56.
[15] Kim Sy, Yang J, Lee YC, et al. Effect of a single intraoperative sub-Tenon injection of triamcinolone acetonide on the progression of diabetic retinopathy and visual outcomes after cataract surgery. J Cataract Refract Surg 2008 ; 34 : 823-6.
[16] Boyer DS, Yoon YH, Belfort R, et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology 2014 ; 121 : 1904-14.
[17] Elsawy MF, Badawi N, Khairy HA. Prophylactic postoperative ketorolac improves outcomes in diabetic patients assigned for cataract surgery. Clin Ophthalmol 2013 ; 7 : 1245-9.
[18] Aptel F, Denis P. Retina and glaucoma : therapeutic considerations. J Fr Ophtalmol 2008 ; 31 : 2S61-4.
[19] Chew EY, Benson WE, Remaley NA, et al. Results after lens extraction in patients with diabetic retinopathy : early treatment diabetic retinopathy study report number 25. Arch Ophthalmol 1999 ; 117 : 1600-6.
[20] Squirrell D, Bhola R, Bush J, et al. A prospective, case controlled study of the natural history of diabetic retinopathy and maculopathy after uncomplicated phacoemulsification cataract surgery in patients with type 2 diabetes. Br J Ophthalmol 2002 ; 86 : 565-71.
[21] Hong T, Mitchell P, De Loryn T, et al. Development and progression of diabetic retinopathy 12 months after phacoemulsification cataract surgery. Ophthalmology 2009 ; 116 : 1510-4.
F. Fajnkuchen
➤ En l’absence d’OM préexistant, la PPR induit habituellement un épaississement rétinien modéré, avec peu de retentissement, et le plus souvent transitoire.
➤ En l’absence d’OM préexistant, un trouble visuel qui s’installe en cours de PPR régresse spontanément en 3 à 4 mois dans plus de 80 % des cas.
➤ En cas d’OM associé, le risque de majoration de l’OM après PPR incite à différer sa réalisation de quelques semaines lorsqu’elle n’est pas urgente (RD préproliférante ou proliférante minime) afin de contrôler l’OM au préalable.
➤ En cas d’indication urgente de PPR, l’injection intravitréenne conjointe d’agents pharmacologiques est indiquée en présence d’un OM associé.
La photocoagulation panrétinienne (PPR) est le traitement de référence des patients présentant une RD proliférante comme l’ont montré les travaux de la Diabetic Retinopathy Study [1] et de l’Early Treatment Diabetic Retinopathy Study [2, 3]. La PPR peut induire l’apparition (ou la majoration) d’un OM et/ou d’un décollement séreux rétinien. Dans la publication initiale de l’ETDRS, réalisée avant l’ère de l’OCT, 18 % des patients traités par PPR ont présenté un OM, diagnostiqué sur des clichés du fond d’œil, 4 mois après la réalisation du traitement [2]. Cet effet secondaire bien connu fait, cependant, l’objet d’une littérature peu abondante [4]. Nous allons aborder deux situations cliniques différentes : la réalisation d’une PPR chez un patient sans œdème et la réalisation d’une PPR chez un patient présentant conjointement un OM. Enfin, nous discuterons de la place des traitements pharmacologiques (IVT d’anti-VEGF et corticoïdes) dans cette indication.
La présence d’un épaississement rétinien dans les suites d’une PPR est un effet secondaire habituel. Différents mécanismes physiopathologiques ont été évoqués où pourrait notamment intervenir une augmentation des concentrations vitréennes d’un certain nombre de cytokines pro-inflammatoires, et notamment l’IL-6, libérés par la rétine, à la suite des impacts de laser [5].
Cependant, l’augmentation de l’épaisseur rétinienne ne s’associe pas nécessairement à des troubles visuels. Shimura et al. ont ainsi observé chez une série de patients ayant une ERC moyenne avant traitement inférieure à 200 μm, une élévation moyenne de l’ERC à plus de 200 μm après traitement. Cette augmentation est le plus souvent modérée et transitoire et cet épaississement rétinien n’a perturbé la fonction visuelle que dans 8 à 11 % des cas [6]. De la même manière, Lee et al. ont noté une augmentation moyenne de 20 μm de l’ERC dans les suites d’une PPR. Cette augmentation a été observée dès le premier mois et a persisté à 1 an sans effets délétères sur l’acuité visuelle [7]. Soman et al. ont rapporté les résultats d’une série de 76 yeux traités par PPR en l’absence d’OM concomitant [8]. Sur l’ensemble des patients, une baisse d’acuité visuelle statistiquement significative a été observée à 1 semaine et 1 mois, mais ce trouble visuel ne persistait au 3e mois que chez 18,4 % des patients. Au cours du suivi, une augmentation de l’ERC de l’ordre de 40 μm, apparaissant dès la première semaine, a été notée. Un décollement séreux rétinien a été constaté dans 10,5 % des cas. Il convient de noter dans cette étude que les patients bénéficiaient d’une PPR en quatre séances, espacées seulement d’une semaine, ce qui peut expliquer l’impact visuel plus prononcé dans cette série.
Au total, en l’absence d’OM préexistant, une augmentation de l’ERC discrète (20 à 40 μm) est habituelle. Elle a un impact absent ou limité en intensité et en durée sur l’acuité visuelle (eFig. 8-14 ). Moins de 20 % des patients ont un trouble visuel qui persiste au-delà de 3 à 4 mois.
). Moins de 20 % des patients ont un trouble visuel qui persiste au-delà de 3 à 4 mois.
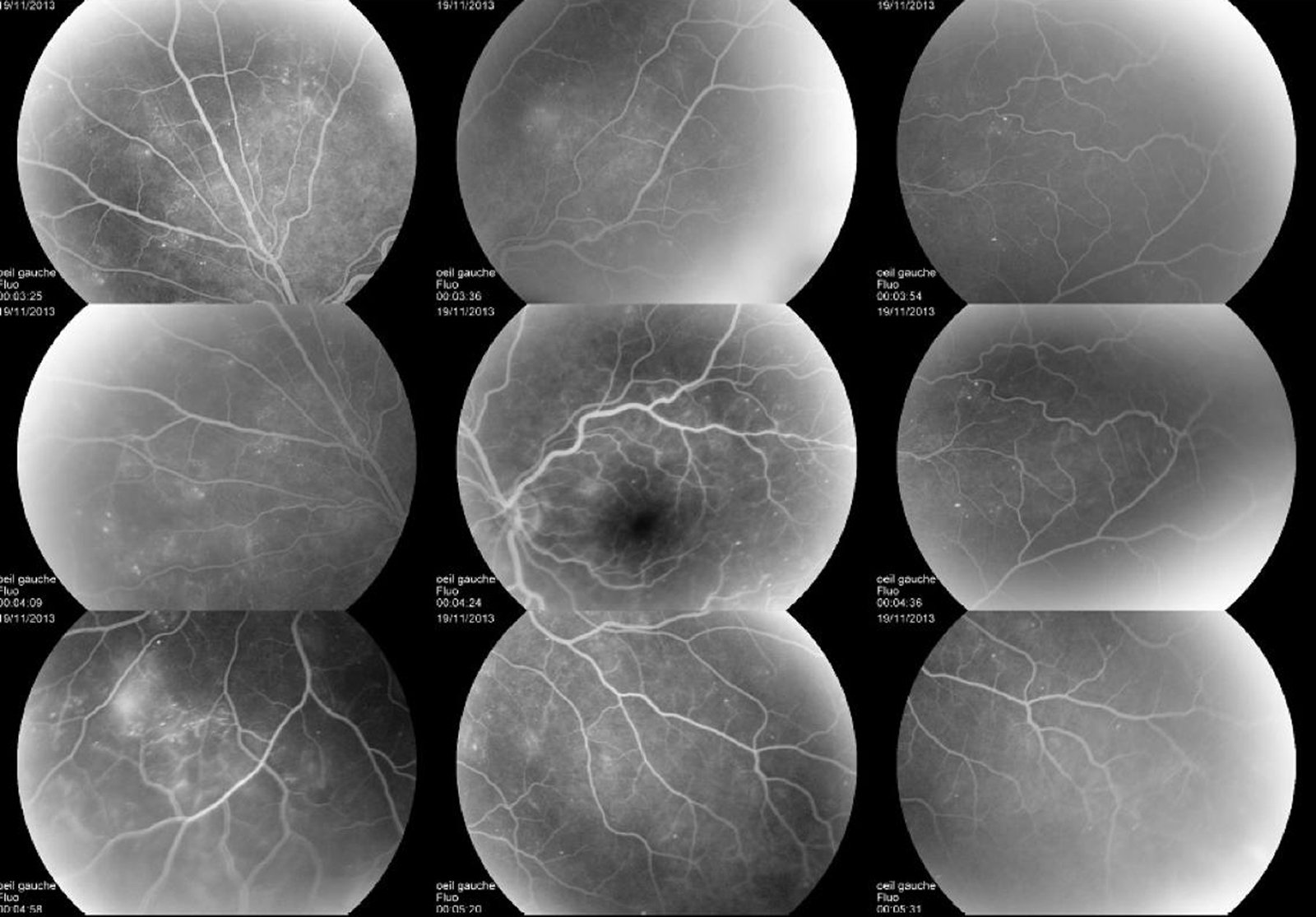
eFig. 8-14 Œdème maculaire infraclinique après PPR.
Cette prévention repose actuellement sur différents axes : identifier les patients à risque d’OMD post-PPR, fractionner la réalisation d’une PPR en plusieurs séances, diminuer l’énergie totale délivrée.
Très peu d’études ont cherché à identifier les facteurs de risque d’OM post-PPR. Parmi les facteurs retrouvés, il existe :
-
des facteurs généraux, témoins le plus souvent d’un mauvais équilibre des facteurs de risque systémiques : hypertension artérielle, dyslipidémie, néphropathie diabétique, cardiopathie, pathologie occlusive carotidienne, anémie ;
-
des facteurs locaux : patients opérés de cataracte, antécédents d’uvéite [6, 8]. Parmi les facteurs associés à un plus grand risque d’OM post-PPR, citons aussi une plus grande épaisseur rétinienne avant laser, au niveau des cercles concentriques interne et externe du mapping OCT [2]. De façon assez surprenante, aucune étude, à notre connaissance, n’a cherché à évaluer si un antécédent d’OM était un facteur de risque d’OM post-laser. Il faut cependant signaler que, dans une étude de Shimura et al., les auteurs soulignent que chez des patients ayant une épaisseur fovéolaire normale mais une épaisseur parafovéolaire augmentée, le risque de voir apparaître après PPR des œdèmes, plus importants et plus prolongés, est augmenté [9]. Cela souligne l’importance de rechercher un OM, même minime, avant d’entreprendre une PPR.
Un certain nombre d’études plaident en faveur d’un fractionnement en plusieurs séances de la PPR afin de se prémunir contre l’apparition d’un OMD. Ainsi dans une étude de Shimura et al., les patients ayant une séance de laser toutes les semaines ont une augmentation de l’ERC plus importante et plus persistante que les patients ayant un traitement toutes les 2 semaines [6]. À 16 semaines, dans le groupe des patients traités toutes les 2 semaines, l’ERC se normalisait, alors qu’elle restait élevée dans le groupe des patients traités toutes les semaines. Dans cette série, l’ERC maximale était observée 1 semaine après la fin de la PPR. De même, Lee et al. retrouvaient une absence de retentissement sur la vision d’un rythme de laser bimensuel [7]. Lorsque la PPR était réalisée toutes les semaines, l’ERC ne se normalisait pas entre deux sessions entraînant un effet cumulatif du laser, à l’origine d’un OM plus important et persistant. De ce fait, au regard du risque d’OM, il conviendrait, dans la mesure du possible, de ne pas réaliser, chez les patients sans antécédents d’OMD, de séances à moins de 2 semaines d’intervalle.
Cependant, la nécessité de fractionner le laser n’est pas retrouvée dans toutes les études. Ainsi une étude du DRCRnet avait montré qu’il n’y avait pas plus d’œdème lorsque l’on réalisait une PPR en une séance versus une PPR en quatre séances [10]. Toutefois, il convient de préciser que la technique de PPR utilisée dans cette étude ne correspond pas du tout à notre pratique en France, puisque dans l’étude du DRCRnet, la PPR complète en une seule séance délivrait au total un peu plus de 1200 impacts. La pratique française de PPR nous amène à délivrer plus de 2000 impacts, c’est pourquoi, avec les lasers conventionnels, il semble prudent, de délivrer ces impacts en plusieurs séances.
Du fait de la diminution du temps de chaque impact, les lasers multispots type laser PASCAL® permettent une diminution globale de l’énergie délivrée au cours d’une PPR. Cette diminution d’énergie pourrait contribuer à diminuer le risque d’OM post-PPR, comme le suggère une étude de Muqit et al. montrant qu’avec le laser PASCAL®, la diminution de l’énergie délivrée, via la réduction de la durée de chaque impact, avait un effet préventif sur l’OMD plus marqué que le fractionnement des séances [11].
Comme on l’a vu ci-dessus, l’OM étant spontanément régressif dans plus de 80 % des cas, il convient d’attendre au moins 3 à 4 mois avant d’envisager son traitement. Au-delà de cette période, il est raisonnable d’envisager un recours aux agents pharmacologiques par voie intravitréenne, même si le rythme d’injections n’a pas à ce jour fait l’objet d’études spécifiques dans cette indication.
Les patients avec un OM préexistant sont 2 fois plus à risque de perdre 2 lignes d’acuité visuelle, 6 semaines après le traitement et 3 fois plus à risque d’atteindre une acuité visuelle de 20/200, par rapport aux patients sans OM (eFig. 8-15 ) [12].
) [12].
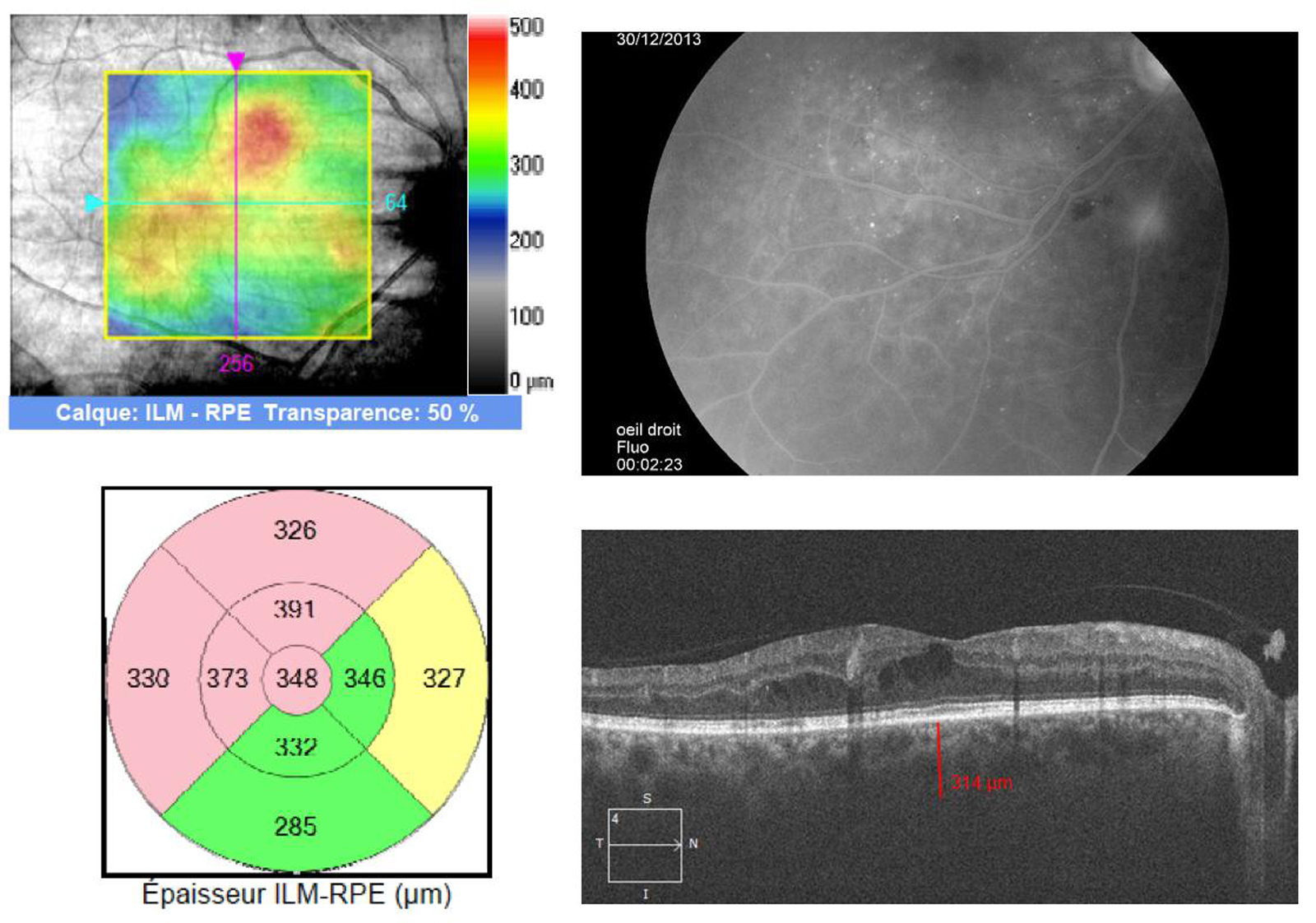
eFig. 8-15 Aggravation transitoire d’un œdème maculaire au cours de la PPR.
Les règles de prévention précédemment exposées en matière de fractionnement et de diminution de l’énergie délivrée s’appliquent également dans ce cadre.
Dans l’idéal, il faudrait pouvoir contrôler l’OM avant d’entreprendre le laser, en différant sa réalisation, quand la PPR n’est pas urgente. On traite alors dans un premier temps l’OM central par des agents pharmacologiques et, lorsque l’œdème est contrôlé, on peut débuter la PPR (eFig. 8-16 ).
).
Dans un certain nombre de cas, soit parce que la PPR est urgente, soit pour des raisons pratiques, il n’est pas possible de différer la réalisation de la PPR. Avant l’ère des anti-VEGF, il était recommandé de traiter conjointement lors de la première séance de PPR, l’œdème maculaire par une photocoagulation en grid/focal associé à une première session de PPR. L’avènement des agents pharmacologiques fait que le laser maculaire n’est plus réalisé en première intention et de nombreuses études ont montré l’intérêt des corticoïdes et des anti-VEGF en injections intravitréennes pour limiter l’effet délétère de la PPR sur l’OM.
En 2011, le DRCRnet a rapporté les résultats d’une étude portant sur 354 yeux nécessitant une PPR et présentant simultanément un OMD [13]. Les patients ont été divisés en trois groupes : un premier recevant une IVT de ranibizumab d’emblée et à 4 semaines, un deuxième groupe bénéficiant d’une IVT de triamcinolone à l’inclusion et un troisième groupe ayant une injection simulée. Trois à 10 jours après l’inclusion, les patients ont eu une PPR, débutée soit le jour même, soit le lendemain. À la 14e semaine, les patients qui n’ont pas eu de traitement par IVT ont eu une baisse d’acuité visuelle moyenne de 4 lettres contre un gain de 1 à 2 lettres dans les autres groupes. De plus, 23 % des patients perdaient plus de 10 lettres en l’absence d’injection contre moins de 10 % avec IVT, du fait d’une majoration de l’OMD.
En 2015, Ferraz et al. ont rapporté les résultats d’une série de 60 patients avec OMD ayant bénéficié d’un traitement soit par ranibizumab comme adjuvant de la PPR (30 patients) soit sans ranibizumab (30 patients) [14]. À 6 mois, les patients ayant un traitement conjoint avaient un gain visuel de 3,6 lettres contre une perte de 4,4 lettres dans le groupe contrôle. De nombreuses autres séries ont confirmé l’intérêt des agents pharmacologiques en prévention de la majoration de l’OMD [15–17].
Récemment, ont été rapportés les résultats du protocole S, étude randomisée évaluant l’intérêt d’un traitement par injections mensuelles de ranibizumab par rapport à la PPR chez des patients présentant une RD proliférante, associée ou non à un OMD [18]. Cette étude de non-infériorité a inclus 394 yeux de 305 patients. Ces yeux ont été traités soit par PPR (réalisée en une à trois séances), soit par injections mensuelles de ranibizumab. À noter que les yeux présentant un OM à l’inclusion pouvaient être traités par ranibizumab dans les deux groupes. Le critère principal d’évaluation était la modification d’acuité visuelle à 2 ans. Les résultats de cette étude ont montré que le traitement par injections de ranibizumab n’était pas inférieur à 2 ans à la PPR. Les résultats visuels étaient meilleurs dans le groupe traité par ranibizumab avec parallèlement moins d’yeux nécessitant une vitrectomie ou ayant un déficit du champ visuel. Toutefois, ce résultat a été obtenu, dans le groupe traité par ranibizumab, au prix d’un suivi mensuel, d’un nombre médian de 10 injections en 2 ans en l’absence d’OM initial, s’élevant à 14 injections s’il existait un OM initial. Enfin, le bénéfice visuel obtenu dans les deux groupes semble avoir avant tout été lié au traitement systématique de l’OM par ranibizumab. Au terme de cette étude, il ne paraît pas raisonnable de remplacer la PPR par des injections mensuelles de ranibizumab chez les patients présentant une RD proliférante, ne serait-ce qu’au vu de la nécessité d’un suivi mensuel et du rapport coût–efficacité. Cette étude démontre toutefois l’intérêt des injections de ranibizumab en traitement adjuvant de la PPR chez des patients présentant un OMD et une RD proliférante.
Les RD florides, associées à un OMD, sont développées ci-après.
eFig. 8-16 Traitement par anti-VEGF d’un œdème maculaire avant PPR.
[1] Preliminary report on effects of photocoagulation therapy. The Diabetic Retinopathy Study Research Group. Am J Ophthalmol 1976 ; 81 : 383-96.
[2] Early photocoagulation for diabetic retinopathy. ETDRS report number 9. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology 1991 ; 98 : 766-85.
[3] Chew EY, Ferris FL, Csaky KG, et al. The long-term effects of laser photocoagulation treatment in patients with diabetic retinopathy: the early treatment diabetic retinopathy follow-up study. Ophthalmology 2003 ; 110 : 1683-9.
[4] Diabetic Retinopathy Clinical Research Network, Googe J, Brucker AJ, Bressler NM, et al. Randomized trial evaluating short-term effects of intravitreal ranibizumab or triamcinolone acetonide on macular edema after focal/grid laser for diabetic macular edema in eyes also receiving panretinal photocoagulation. Retina 2011 ; 31 : 1009-27.
[5] Shimura M, Yasuda K, Nakazawa T, et al. Panretinal photocoagulation induces pro-inflammatory cytokines and macular thickening in high-risk proliferative diabetic retinopathy. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 1617-24.
[6] Shimura M, Yasuda K, Nakazawa T, et al. Quantifying alterations of macular thickness before and after panretinal photocoagulation in patients with severe diabetic retinopathy and good vision. Ophthalmology 2003 ; 110 : 2386-94.
[7] Lee SB, Yun YJ, Kim SH, Kim JY. Changes in macular thickness after panretinal photocoagulation in patients with severe diabetic retinopathy and no macular edema. Retina 2010 ; 30 : 756-60.
[8] Soman M, Ganekal S, Nair U, Nair K. Effect of panretinal photocoagulation on macular morphology and thickness in eyes with proliferative diabetic retinopathy without clinically significant macular edema. Clin Ophthalmol Auckl NZ 2012 ; 6 : 2013-7.
[9] Shimura M, Yasuda K, Nakazawa T, Tamai M. Visual dysfunction after panretinal photocoagulation in patients with severe diabetic retinopathy and good vision. Am J Ophthalmol 2005 ; 140 : 8-15.
[10] Diabetic Retinopathy Clinical Research Network, Brucker AJ, Qin H, Antoszyk AN, et al. Observational study of the development of diabetic macular edema following panretinal (scatter) photocoagulation given in 1 or 4 sittings. Arch Ophthalmol 2009 ; 127 : 132-40.
[11] Muqit MMK, Marcellino GR, Henson DB, et al. Single-session vs multiple-session pattern scanning laser panretinal photocoagulation in proliferative diabetic retinopathy : The Manchester Pascal Study. Arch Ophthalmol 2010 ; 128 : 525-33.
[12] Mendrinos E, Pournaras CJ. Photocoagulation panrétinienne. Pathologies vasculaires oculaires. Issy-les-Moulineaux : Masson ; 2008, p. 409-18.
[13] Diabetic Retinopathy Clinical Research Network, Googe J, Brucker AJ, Bressler NM, et al. Randomized trial evaluating short-term effects of intravitreal ranibizumab or triamcinolone acetonide on macular edema after focal/grid laser for diabetic macular edema in eyes also receiving panretinal photocoagulation. Retina 2011 ; 31 : 1009-27.
[14] Ferraz DA, Vasquez LM, Preti RC, et al. A randomized controlled trial of panretinal photocoagulation with and without intravitreal ranibizumab in treatment-naive eyes with non-high-risk proliferative diabetic retinopathy. Retina 2015 ; 35 : 280-7.
[15] Zacks DN, Johnson MW. Combined intravitreal injection of triamcinolone acetonide and panretinal photocoagulation for concomitant diabetic macular edema and proliferative diabetic retinopathy. Retina 2005 ; 25 : 135-40.
[16] Zein WM, Noureddin BN, Jurdi FA, et al. Panretinal photocoagulation and intravitreal triamcinolone acetonide for the management of proliferative diabetic retinopathy with macular edema. Retina 2006 ; 26 : 137-42.
[17] Cho WB, Moon JW, Kim HC. Intravitreal triamcinolone and bevacizumab as adjunctive treatments to panretinal photocoagulation in diabetic retinopathy. Br J Ophthalmol 2010 ; 94 : 85.
[18] Writing Committee for the Diabetic Retinopathy Clinical Research Network, Gross JG, Glassman AR, Jampol LM, et al. Panretinal Photocoagulation vs intravitreous ranibizumab for proliferative diabetic retinopathy : a randomized clinical trial. JAMA 2015 Nov ; 314 : 2137-46.
M. Nardin, D. Gaucher
➤ La rétinopathie diabétique floride (RDF) est rare, mais extrêmement sévère et souvent cécitante. Elle survient chez le jeune diabétique de type 1.
➤ Elle constitue une véritable urgence thérapeutique.
➤ Toute forme de RDF non proliférante sévère ou proliférante doit être traitée en urgence par PPR.
➤ La présence d’un OM ne doit pas retarder la mise en route de la PPR ; celle-ci peut permettre la disparition spontanée de l’OM.
➤ En cas de baisse visuelle sévère, les anti-VEGF sont le traitement de choix de l’OMD.
La rétinopathie diabétique floride (RDF) est une forme rare (environ 1 % des rétinopathies diabétiques proliférantes) [1–3] mais grave de RD proliférante, potentiellement cécitante. Initialement décrite par Kohner qui la qualifiait de « rapid, bloody, and blinding » [1], elle se caractérise par le terrain sur lequel elle survient et par sa rapidité d’évolution.
Typiquement, la RDF atteint le sujet jeune de moins de 40 ans, diabétique de type 1, dont le diabète est mal équilibré (HbA1C > 10 %) évoluant depuis plusieurs années (en règle supérieure à 5 ans). Ce dernier est souvent multicompliqué (néphropathie, neuropathie, hypertension artérielle). La RDF affecte préférentiellement les jeunes femmes (dans 66 à 80 % des cas selon les séries) [3, 4]. Cette rétinopathie survient spontanément ou peut être déclenchée par une rééquilibration glycémique rapide et/ou une grossesse.
La RDF se caractérise par une évolution très rapide. Elle évolue typiquement en moins de 6 mois d’une RD non proliférante minime à modérée à une RD proliférante sévère très évolutive. Exceptionnellement, elle peut même survenir chez des jeunes patientes sans rétinopathie connue (fig. 8-70 et eFig. 8-17 ). Le pronostic des RDF est très grave avec un risque élevé d’évolution vers la cécité par décollement de rétine tractionnel et/ou glaucome néovasculaire (entre 15 et 70 % selon les publications) [4–6].
). Le pronostic des RDF est très grave avec un risque élevé d’évolution vers la cécité par décollement de rétine tractionnel et/ou glaucome néovasculaire (entre 15 et 70 % selon les publications) [4–6].
Cliniquement, la RDF se présente au fond d’œil sous forme d’une RD non proliférante sévère ou d’une RD proliférante bilatérale. Les zones d’ischémie sont marquées par la présence de nombreuses hémorragies rétiniennes, d’AMIR et d’anomalies veineuses moniliformes, parfois spectaculaires. Au stade de RD proliférante, il existe des proliférations exubérantes de néovaisseaux associées à une prolifération fibreuse importante et rétractile, évoluant parfois malgré la PPR. Ces voiles néovasculaires très étendus ont un fort potentiel d’hémorragies et de rétraction (eFig. 8-18 ). Il s’y associe très souvent un OM étendu à l’origine d’une baisse visuelle d’intensité variable.
). Il s’y associe très souvent un OM étendu à l’origine d’une baisse visuelle d’intensité variable.
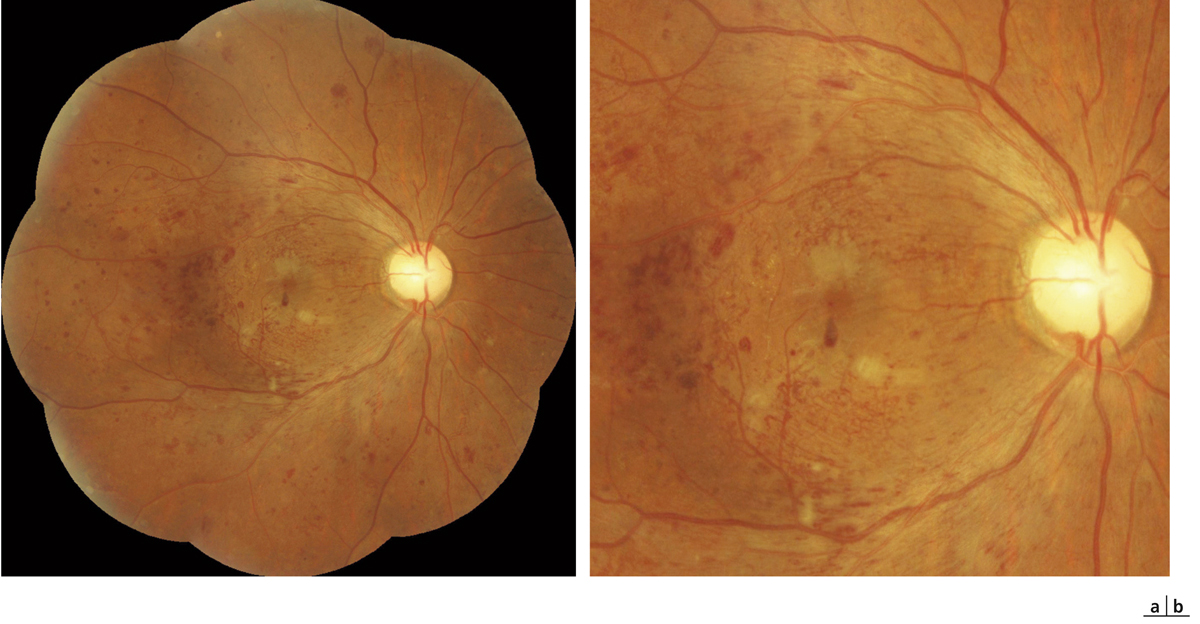
Fig. 8-70 Aspect de rétinopathie diabétique floride chez une jeune femme de 20 ans.
Cette jeune femme, diabétique de type 1 depuis l’enfance, n’avait pas de RD connue. Elle se présente d’emblée avec une RD non proliférante sévère, marquée par l’existence de nombreuses hémorragies rétiniennes et d’AMIR sévères dans les quatre quadrants de la périphérie rétinienne (a). Ces AMIR nombreuses sont particulièrement bien visibles sur le cliché du pôle postérieur (b). C’est une urgence thérapeutique, la PPR doit être débutée sans tarder.

eFig. 8-17 Exemple d’évolution dramatique de la rétinopathie diabétique floride chez une jeune femme de 23 ans.
eFig. 8-18 Photographie du fond d’œil d’une rétinopathie diabétique floride.
La RDF est une urgence ophtalmologique. Son traitement repose sur une prise en charge intensive de ces patients peu compliants avec réalisation immédiate et rapide d’une PPR. Celle-ci peut être associée à une vitrectomie précoce si une hémorragie du vitré survient gênant la réalisation de la PPR ou si des proliférations fibrovasculaires continuent à se développer en dépit de la PPR [5, 6]. Seul un traitement précoce et intensif peut permettre d’améliorer le pronostic de ces formes très graves de RD.
La présence d’un OMD ne doit pas retarder la mise en route de la PPR. En effet, en cas d’OM associé à une RD non proliférante sévère ou à une RD proliférante, l’ETDRS recommande de traiter en priorité l’OMD avant de réaliser la PPR, pour éviter l’aggravation de l’OM par la PPR. Cette règle est vraie dans la majorité des cas mais ne s’applique pas aux RDF [7]. Dans cette situation, l’OM semble principalement dû à la grande quantité de facteurs de croissance présents dans le corps vitré, tel le VEGF, secrétés par les territoires rétiniens ischémiques. Aiello et al. ont montré que la PPR s’accompagnait d’une diminution du taux de VEGF [8]. La PPR, dans le cadre des RDF, peut donc entraîner une diminution du taux de VEGF, permettant ainsi de restaurer la BHR interne, améliorant la perméabilité capillaire et réduisant ainsi l’OM (fig. 8-71 et 8-72).
Nous l’avons constaté dans une étude rétrospective portant sur dix patients (17 yeux) atteints de RDF et d’OM sévère : la seule PPR menée rapidement a permis, dans tous les cas, une amélioration de l’OM et de l’acuité visuelle, sans aucun traitement spécifique de l’OMD [9].
Le schéma thérapeutique suivant peut être proposé :
-
si l’OMD est associé à une baisse d’acuité visuelle minime ou modérée, aucun traitement spécifique de cet OM n’est requis. La PPR doit être conduite rapidement et de façon extensive. Les lasers multispots ont tout leur intérêt dans ces formes particulières de RD proliférante. Une vitrectomie précoce sera proposée si des complications de la néovascularisation surviennent empêchant la réalisation de la PPR (eFig. 8-19
 ) ;
) ; -
si l’OMD est associé à une baisse de la vue significative, des IVT seront proposées au patient (fig. 8-73). Les anti-VEGF seront utilisés en première intention. Il faudra au préalable s’assurer que la patiente n’est pas enceinte et vérifier qu’il n’existe pas de vastes voiles fibrovasculaires situés à proximité du pôle postérieur. Ces derniers risqueraient en effet, en se rétractant, de provoquer un décollement de rétine tractionnel. Les IVT de corticoïdes sont à éviter chez ces patients jeunes en raison du risque d’hypertonie oculaire et de cataracte induite.

Fig. 8-71 Disparition spontanée d’un œdème maculaire diabétique associé à une rétinopathie floride.
De larges proliférations néovasculaires sont visibles en prépapillaire sur l’angiographie à la fluorescéine (a). L’OCT montre un OMD avec un épaississement central de plus de 500 μ (b). Trois mois plus tard après réalisation de la PPR, l’œdème n’a plus que 300 μ d’épaisseur (c). Six mois plus tard, l’œdème a disparu sans aucun traitement spécifique (d).
(Source : Gaucher D, Fortunato P, Lecleire Collet A, et al. Spontaneous resolution of macular edema after panretinal photocoagulation in florid proliferative diabetic retinopathy. Retina 2009 ; 29 : 1282-8. Reproduction autorisée.)
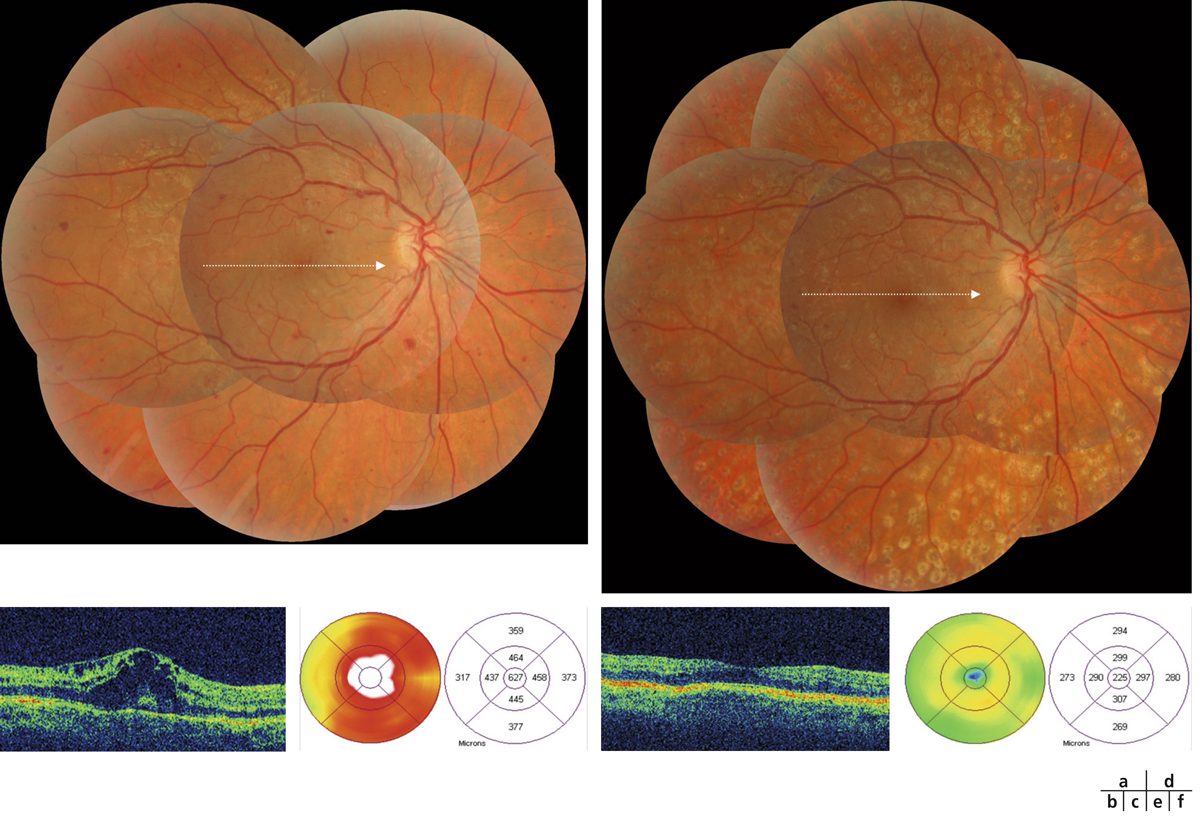
Fig. 8-72 Disparition spontanée de l’œdème maculaire diabétique grâce à la photocoagulation panrétinienne.
a. Il s’agit d’une jeune femme âgée de 22 ans, diabétique de type 1, se présentant avec une baisse d’acuité visuelle modérée (AV : 0,6), survenant 3 mois après une rééquilibration glycémique rapide. Elle n’avait pas de RD connue. L’examen du fond d’œil (a) et l’OCT (b, c) objectivent une RD non proliférante sévère associée à un OM responsable de la baisse visuelle. Une PPR est entreprise rapidement sans traitement spécifique de l’OM. b. Trois mois plus tard, l’acuité visuelle est remontée à 10/10, la PPR est complète (d) et l’OM a spontanément disparu (e, f).
(Source : Massin P, Erginay A. Rétinopathie diabétique. Coll. Atlas en Ophtalmologie. Issy-les-Moulineaux : Elsevier Masson ; 2010. Reproduction autorisée.)

eFig. 8-19 Exemple d’un œil atteint de rétinopathie diabétique floride.
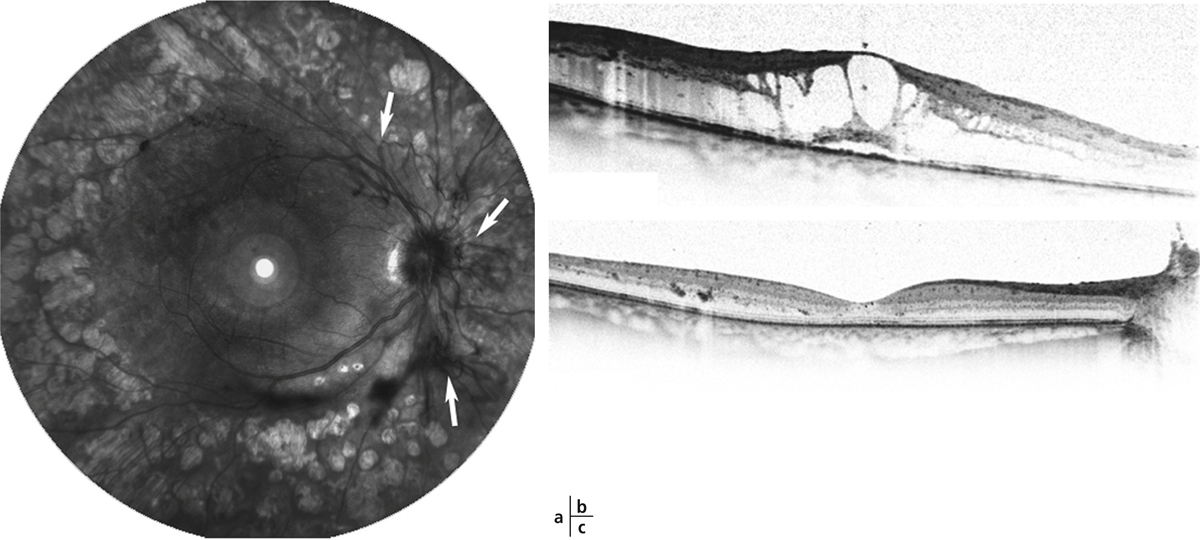
Fig. 8-73 Patiente traitée par laser (a) pour une rétinopathie diabétique floride.
Le laser a permis une stabilisation de la rétinopathie, on remarque la prolifération péripapillaire (a, flèches). Un OM était associé à la rétinopathie (b). L’œdème n’a pas régressé spontanément et a dû être traité, avec succès dans ce cas, par plusieurs injections d’anti-VEGF (c).
[1] Kohner EM, Hamilton AM, Joplin GF, Fraser TR. Florid diabetic retinopathy and its response to treatment by photocoagulation or pituitary ablation. Diabetes1976 ; 25 : 104-10.
[2] Ben Mehidi A, Massin P, Guyot-Argenton C, et al. Diabetic retinopathy in children and adolescents. Diabetes Metab 2003 ; 29 : 300-6.
[3] Massin P, Erginay A. Rétinopathie dabétique. 2nde éd. Issy-les-Moulineaux : Elsevier Masson ; 2010, 145 p.
[4] Lattanzio R, Brancato R, Bandello FM, et al. Florid diabetic retinopathy (FDR) : a long-term follow-up study. Graefes Arch Clin Exp Ophthalmol 2001 ; 239 : 182-7.
[5] Favard C, Guyot-Argenton C, Assouline M, et al. Full panretinal photocoagulation and early vitrectomy improve prognosis of florid diabetic retinopathy. Ophthalmology 1996 ; 103 : 561-74.
[6] Couturier C, Dupas B, Guyomard JL, Massin P. Etude surgical outcomes of florid diabetic retinopathy treated with antivascular endothelial growth factor. Retina 2014 ; 34 : 1952-9.
[7] Early photocoagulation for diabetic retinopathy. ETDRS report number 9. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology 1991 ; 98 : 766-85.
[8] Aiello LP, Avery RL, Arrigg PG, et al. Vascular endothelial growth factor in ocular fluid of patients with diabetic retinopathy and other retinal disorders. N Engl J Med 1994 ; 331 : 1480-7.
[9] Gaucher D, Fortunato P, Lecleire Collet A, et al. Spontaneous resolution of macular edema after panretinal photocoagulation in florid proliferative diabetic retinopathy. Retina 2009 ; 29 : 1282-8.
P. Massin
➤ L’hypertension artérielle (HTA) est fréquente chez le patient diabétique de type 2.
➤ Des signes de rétinopathie hypertensive sont fréquemment associés à la RD en cas d’HTA insuffisamment équilibrée.
➤ Un déséquilibre de la tension artérielle doit être recherché et corrigé chez tout patient diabétique de type 2 présentant un OMD.
➤ La néphropathie diabétique est un facteur aggravant l’OMD. En cas d’insuffisance rénale terminale, la dialyse peut améliorer l’OMD.
L’hypertension artérielle (HTA) est deux fois plus fréquente chez les diabétiques de type 2 que dans la population générale : 40 % des diabétiques de type 2 sont hypertendus à l’âge de 45 ans et 60 % après 75 ans [1]. Elle peut être majorée par une apnée du sommeil, avec une disparition de la baisse pressionnelle nocturne physiologique. L’HTA du patient diabétique est fréquemment difficile à équilibrer. La rétinopathie hypertensive est rare dans la population non diabétique et survient en cas d’HTA élevée. Chez les patients diabétiques, l’expérience clinique suggère une plus grande susceptibilité à l’hypertension artérielle, des signes de rétinopathie hypertensive surajoutés à la rétinopathie diabétique apparaissant dans des cas d’HTA modérée [2]. Ce phénomène est fréquent chez les diabétiques de type 2.
Les signes de rétinopathie hypertensive peuvent être difficiles à reconnaître, car ils sont intriqués avec ceux de la RD. Néanmoins, de nombreuses hémorragies rétiniennes en « flammèches », des nodules cotonneux péripapillaires, associés à un épaississement maculaire diffus et à une exsudation, doivent faire évoquer la possibilité d’une rétinopathie hypertensive associée (fig. 8-74, eFig. 8-20 et voir fig. 8-10). Les artères ont un calibre réduit et il existe des signes d’artériolosclérose. Enfin, l’OCT révèle souvent un décollement séreux rétinien associé. Dans ce cas, il est urgent d’équilibrer la pression artérielle avant d’envisager tout autre traitement de l’OM. Le déséquilibre tensionnel, s’il n’est pas évident, doit être recherché par des mesures répétées, voire par un enregistrement ambulatoire sur 24 heures de la pression artérielle. Dans la majorité des cas, la baisse pressionnelle permet une diminution de l’OM et une amélioration de l’acuité visuelle (fig. 8-74).
et voir fig. 8-10). Les artères ont un calibre réduit et il existe des signes d’artériolosclérose. Enfin, l’OCT révèle souvent un décollement séreux rétinien associé. Dans ce cas, il est urgent d’équilibrer la pression artérielle avant d’envisager tout autre traitement de l’OM. Le déséquilibre tensionnel, s’il n’est pas évident, doit être recherché par des mesures répétées, voire par un enregistrement ambulatoire sur 24 heures de la pression artérielle. Dans la majorité des cas, la baisse pressionnelle permet une diminution de l’OM et une amélioration de l’acuité visuelle (fig. 8-74).

Fig. 8-74 Évolution d’une rétinopathie hypertensive aggravant une rétinopathie diabétique.
a, b. Panoramiques en couleurs d’un patient diabétique de type 2 âgé de 45 ans. Il existe une RD non proliférante modérée majorée par une rétinopathie hypertensive. Celle-ci se manifeste par de nombreuses hémorragies péripapillaires en flammèches, des nodules cotonneux bilatéraux et un OM. La tension artérielle est de 170–90 mmHg. c, d. L’OCT objective l’OM marqué par un épaississement rétinien, l’existence de kystes intrarétiniens et la présence d’un décollement séreux rétinien bilatéral. e. Cartographie maculaire du même patient. L’acuité visuelle est de 0,2 à droite et 0,3 à gauche.

Fig. 8-74 Évolution d’une rétinopathie hypertensive aggravant une rétinopathie diabétique. (suite)
f, g. Panoramiques en couleurs 2 mois après la mise en route du traitement hypotenseur. Les signes de rétinopathie hypertensive ont nettement diminué, des exsudats de résorption sont apparus au pôle postérieur, organisés pour certains en étoile maculaire. h, i. L’OCT objective la régression de l’OM dans les deux yeux. j. La cartographie maculaire objective la diminution de l’épaississement maculaire. L’acuité visuelle est remontée à 0,4 dans les deux yeux.
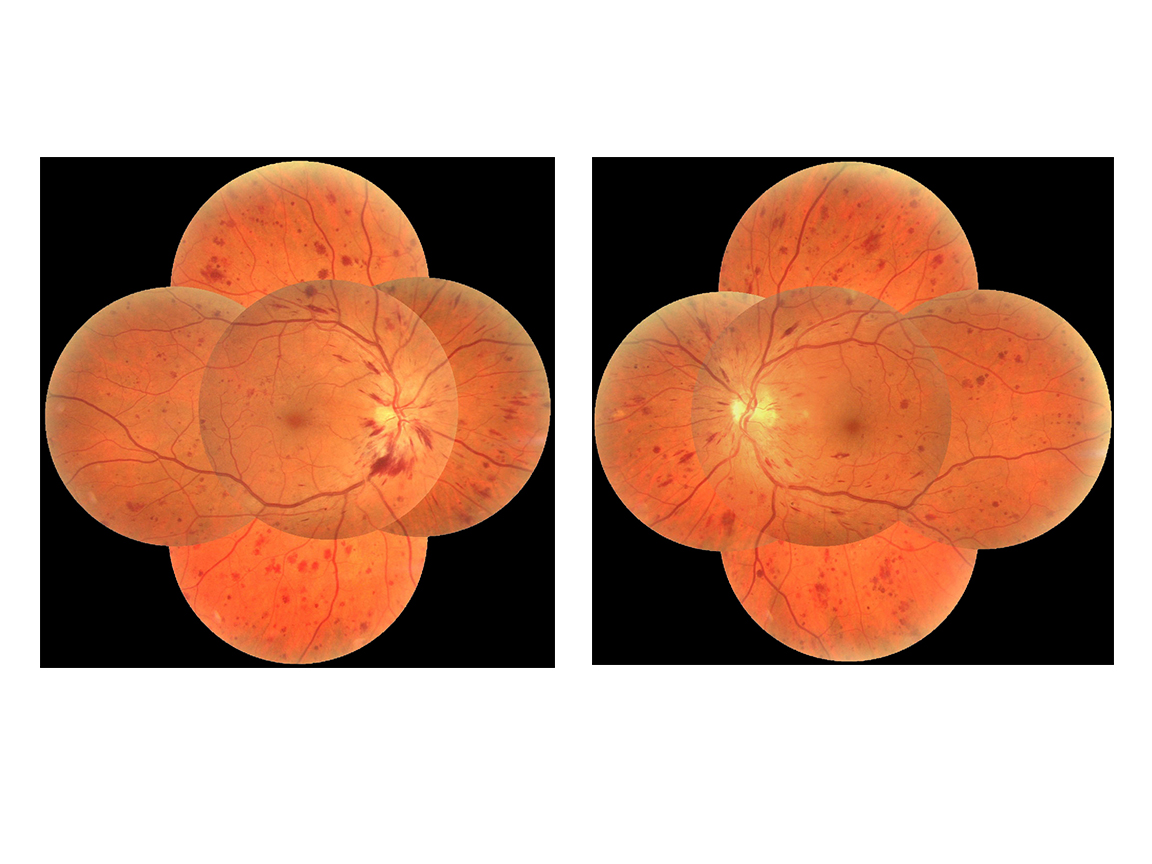
eFig. 8-20 Rétinopathie hypertensive compliquant une rétinopathie diabétique non proliférante sévère.
La néphropathie diabétique est une complication microvasculaire fréquemment associée à la RD. Elle se caractérise par une diminution de la filtration glomérulaire et une microalbuminurie. L’hypoprotidémie induite est responsable d’une diminution de la pression oncotique qui favorise les œdèmes tissulaires. L’insuffisance rénale, dont le diabète est une cause fréquente, s’associe à une surcharge volémique et fréquemment une hypertension artérielle. Ces deux facteurs, par l’augmentation de la pression hydrostatique qu’ils induisent, sont également susceptibles d’aggraver l’OM lorsque la BHR interne est rompue. Dans l’étude de Romero et al, explorant le lien entre micro-angiopathie rénale et OM, la sévérité de la dysfonction rénale était corrélée à la survenue d’un OMD [3]. Une amélioration partielle d’un OMD après traitement par furosémide a été décrite chez un patient diabétique ayant un syndrome néphrotique [4]. Knudsen et al. ont montré une corrélation entre la mesure de l’épaisseur maculaire en OCT et l’importance du taux d’excrétion d’albumine urinaire chez des patients diabétiques de type 2 atteints d’OMD [5, 6]. Enfin, la dialyse rénale est susceptible d’améliorer rapidement un OM chez des patients en insuffisance rénale terminale (fig. 8-75).
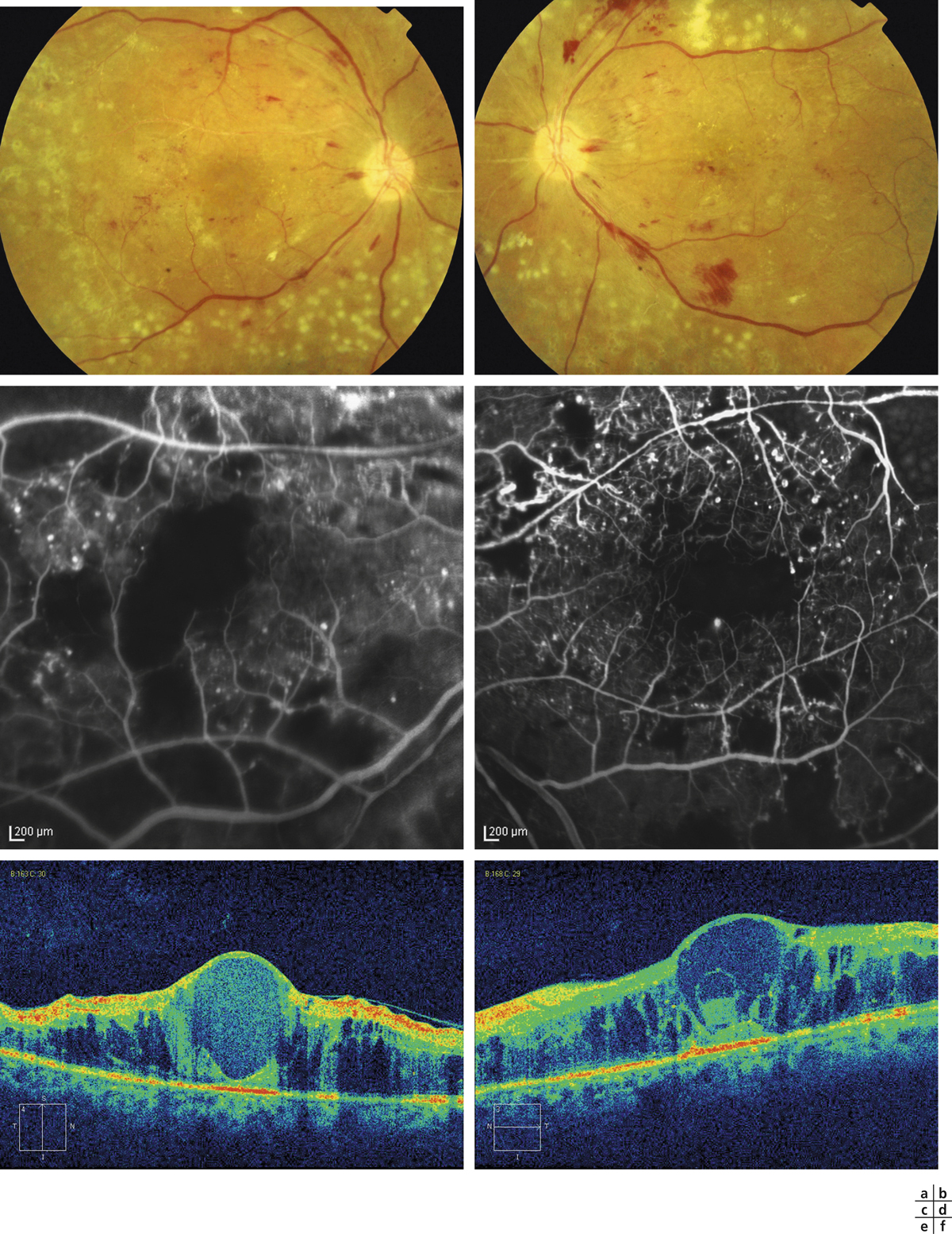
Fig. 8-75 Évolution d’un œdème maculaire après dialyse.
a, b. Patient diabétique âge de 47 ans, présentant une insuffisance terminale. Les photographies en couleurs montrent une rétinopathie diabétique qui a été traitée par PPR. Il existe quelques hémorragies rétiniennes en flammèche liées à une HTA insuffisamment contrôlée. On note au pôle postérieur des vaisseaux artériels déshabités, notamment à l’œil droit, témoignant d’une ischémie maculaire. c, d. L’angiographie en fluorescence confirme l’ischémie maculaire, plus marquée au niveau de l’œil droit. De nombreux AMIR sont présentes dans le pôle postérieur de l’œil gauche. e, f. L’OCT objective un important OM bilatéral avec une volumineuse logette centrale.
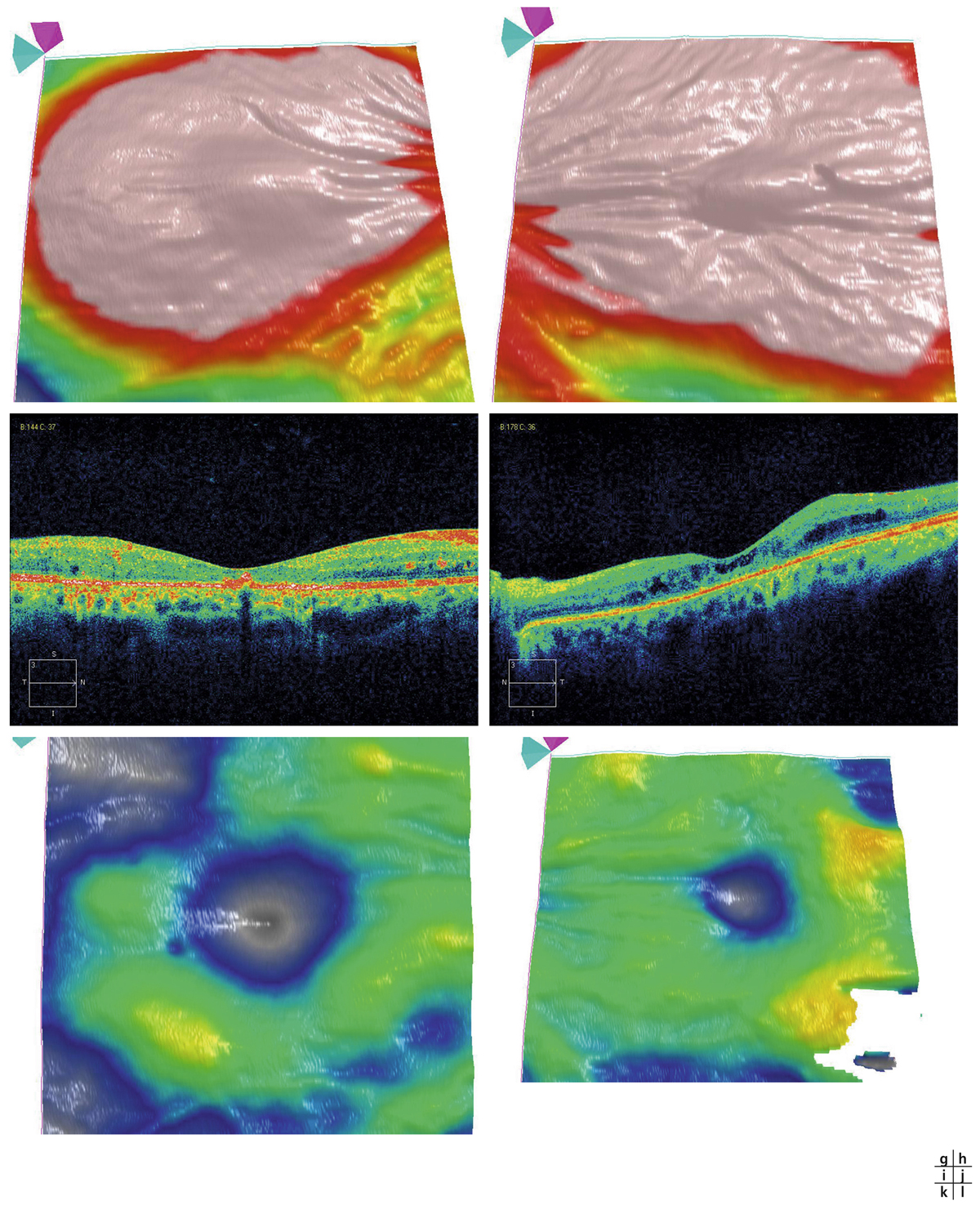
Fig. 8-75 Évolution d’un œdème maculaire après dialyse.
g, h. Cartographie maculaire de ce patient. L’acuité visuelle est de 0,05 à l’œil droit et de 0,2 à l’œil gauche. i, j. Deux mois après mise sous dialyse, l’OM a complètement régressé à l’œil droit, il ne persiste que quelques kystes intrarétiniens au niveau de l’œil gauche. k, l. La cartographie maculaire objective la réduction de l’épaisseur maculaire avec désormais un certain degré d’atrophie maculaire. L’acuité visuelle de l’œil droit ne s’est pas améliorée, l’acuité visuelle de l’œil gauche est de 0,3.
[1] Hypertension in Diabetes Study group. HDS. I. Prevalence of hypertension in newly presenting type 2 diabetic patients and the association with risk factors for cardiovascular and diabetic complications. J Hypertens 1993 ; 11 : 309-17.
[2] Bresnick GH. Diabetic maculopathy. A critical review highlighting diffuse macular edema. Ophthalmology 1983 ; 90 : 1301-17.
[3] Romero P, Baget M, Mendez I, et al. Diabetic macular edema and its relationship to renal microangiopathy : a sample of Type I diabetes mellitus patients in a 15-year follow-up study. J Diabetes Complications 2007 ; 21 : 172-80.
[4] Ciardella AP. Partial resolution of diabetic macular oedema after systemic treatment with furosemide. Br J Ophthalmol 2004 ; 88 : 1224-5.
[5] Koo NK, Jin HC, Kim KS, Kim YC. Relationship between the morphology of diabetic macular edema and renal dysfunction in diabetes. Korean J Ophthalmol 2013 ; 27 : 98-102.
[6] Knudsen ST, Bek T, Poulsen PL, et al. Macular edema reflects generalized vascular hyperpermeability in type 2 diabetic patients with retinopathy. Diabetes Care 2002 ; 25 : 2328-34.
P. Massin
➤ Le maternally inherited diabetes and deafness (MIDD) est une forme rare de diabète coségréguant avec une mutation ponctuelle de l’ADN mitochondrial.
➤ Il associe un diabète de transmission maternelle, une surdité de perception progressive et une dystrophie maculaire rétinienne, présente chez environ 80 % des patients caucasiens atteints de MIDD.
➤ La dystrophie maculaire est caractérisée par la présence de dépôts pigmentés sous-rétiniens, disposés en réseau dans la région maculaire et autour de la papille, associés à des altérations atrophiques de l’épithélium pigmentaire au niveau du pôle postérieur.
➤ Cette dystrophie est associée dans la majorité des cas à un bon pronostic visuel ; elle évolue rarement vers une forme atrophique majeure.
➤ La rétinopathie diabétique est peu fréquente lorsqu’une dystrophie maculaire existe chez les patients atteints de MIDD.
Une forme particulière de maculopathie diabétique est la dystrophie maculaire du maternally inherited diabetes and deafness (MIDD). Ce diabète est secondaire à des anomalies du génome mitochondrial. Il est lié à une mutation ponctuelle par substitution AG en position 3243 de l’ADN mitochondrial (ADNmt), codant l’ARN de transfert de la leucine ARNt-Leu(UUR). Il associe un diabète de transmission maternelle, une surdité de perception progressive et une dystrophie maculaire rétinienne [1, 2].
Cette même mutation peut co-ségréguer avec un syndrome appelé MELAS (acronyme d’encéphalomyopathie mitochondriale, acidose lactique, pseudo-accidents vasculaires cérébraux) [3]. La forte variabilité inter- et intra-individuelle d’hétéroplasmie mitochondriale (c’est-à-dire du pourcentage de mitochondries mutées dans chaque organe) conduit à un très large spectre de manifestations cliniques et de sévérité de la maladie chez les individus d’une même famille porteurs de la même mutation [4]. Des atteintes cardiaques, musculaires, gastro-intestinales et rénales peuvent être associées au MIDD ou au syndrome de MELAS, notamment un ptosis.
Parmi l’ensemble des patients atteints de diabète, la fréquence du diabète mitochondrial par mutation 3243 est variable [2, 5–7]. Dans des cohortes de diabétiques non insulino-dépendants non sélectionnés selon l’existence d’antécédents maternels de diabète ou d’une surdité, la prévalence est plus élevée chez les diabétiques d’Asie, chinois et surtout japonais (0,9 à 5,9 %) que chez les diabétiques caucasiens (0,13 à 0,42 %). Dès lors que l’on sélectionne les patients selon leur phénotype (surdité) ou un antécédent de diabète maternel, la prévalence est plus élevée, comprise entre 0,45 et 10 % pour les populations caucasiennes et entre 4,6 et 21 % pour les populations japonaises.
Le diabète a une présentation clinique particulière. Il s’agit dans la majorité des cas d’un diabète non insulino-dépendant, caractérisé par un âge de début précoce (environ 35 ans, avec des extrêmes de 12 à 67 ans), un indice de masse corporelle normal ou bas, et des antécédents maternels de diabète chez 70 à 80 % des patients [2].
Une surdité bilatérale neurosensorielle est le deuxième élément du syndrome MIDD, présente dans 90 % des cas [2]. Elle est précoce, de sévérité variable et des antécédents maternels de surdité sont présents dans plus de 60 % des cas.
La fréquence de la dystrophie maculaire réticulée est variable selon les séries. Nous l’avons retrouvée chez 86 % des patients d’une série de 54 patients atteints de MIDD et Smith et al. l’ont retrouvée chez 77 % de leurs patients [2, 8, 9]. En revanche, la dystrophie maculaire semble rare chez les Japonais, suggérant une susceptibilité ethnique. En effet, cette dystrophie n’a été rapportée dans aucune des séries japonaises réalisées avant 2000 [10, 11]. Et en 2003, Suzuki et al. l’ont soigneusement recherchée et ne l’ont retrouvée que chez 13,4 % d’une série de 113 patients [5].
La dystrophie maculaire réticulée (ou pattern dystrophy des Anglo-Saxons) a été identifiée en 1995 [12] à partir de deux familles, puis décrite et analysée plus en détail [8]. Elle est caractérisée par la présence de dépôts pigmentés sous-rétiniens, disposés en réseau dans la région maculaire et autour de la papille, associés à des altérations atrophiques de l’épithélium pigmentaire au niveau du pôle postérieur. L’acuité visuelle est normale dans la majorité des cas ainsi que l’éléctrorétinogramme. Cette dystrophie maculaire est évolutive.
Les premiers dépôts sous-rétiniens semblent apparaître entre 20 et 30 ans puis s’étendent progressivement en réseau. Au bout de nombreuses années d’évolution, des zones périmaculaires d’atrophie de l’épithélium pigmentaire et de la choriocapillaire peuvent se développer. Elles atteignent rarement le centre de la macula, entraînant alors une chute de l’acuité visuelle. Nous avons proposé une classification en quatre stades évolutifs de cette dystrophie maculaire, précisée ultérieurement par de Laat et al., basée sur l’ophtalmoscopie, complétée par l’imagerie multimodale (autofluorescence, OCT et angiographie à la fluorescéine) [8, 13].
Le stade 1 est caractérisé par de discrètes altérations de l’épithélium pigmentaire au pôle postérieur, au mieux détectées par l’autofluorescence (fig. 8-76). Il s’y ajoute au stade 2 des dépôts pigmentés localisés, s’organisant en couronne périfovéale et autour de la papille (fig. 8-77). Le stade 3 est caractérisé par l’apparition de zones d’atrophie choriorétinienne extrafovéales, et le stade 4 par une atrophie choriorétinienne étendue au pôle (fig. 8-78). Ce dernier stade s’accompagne d’une baisse de l’acuité visuelle importante.
Il existe une très grande variabilité dans l’évolution clinique de la dystrophie qui peut rester, dans certains cas, bénigne tout au long de la vie du patient diabétique.
Cette dystrophie n’est pas spécifique de la mutation 3243, puisqu’elle a été retrouvée associée à une large délétion de l’ADN mitochondrial [14].
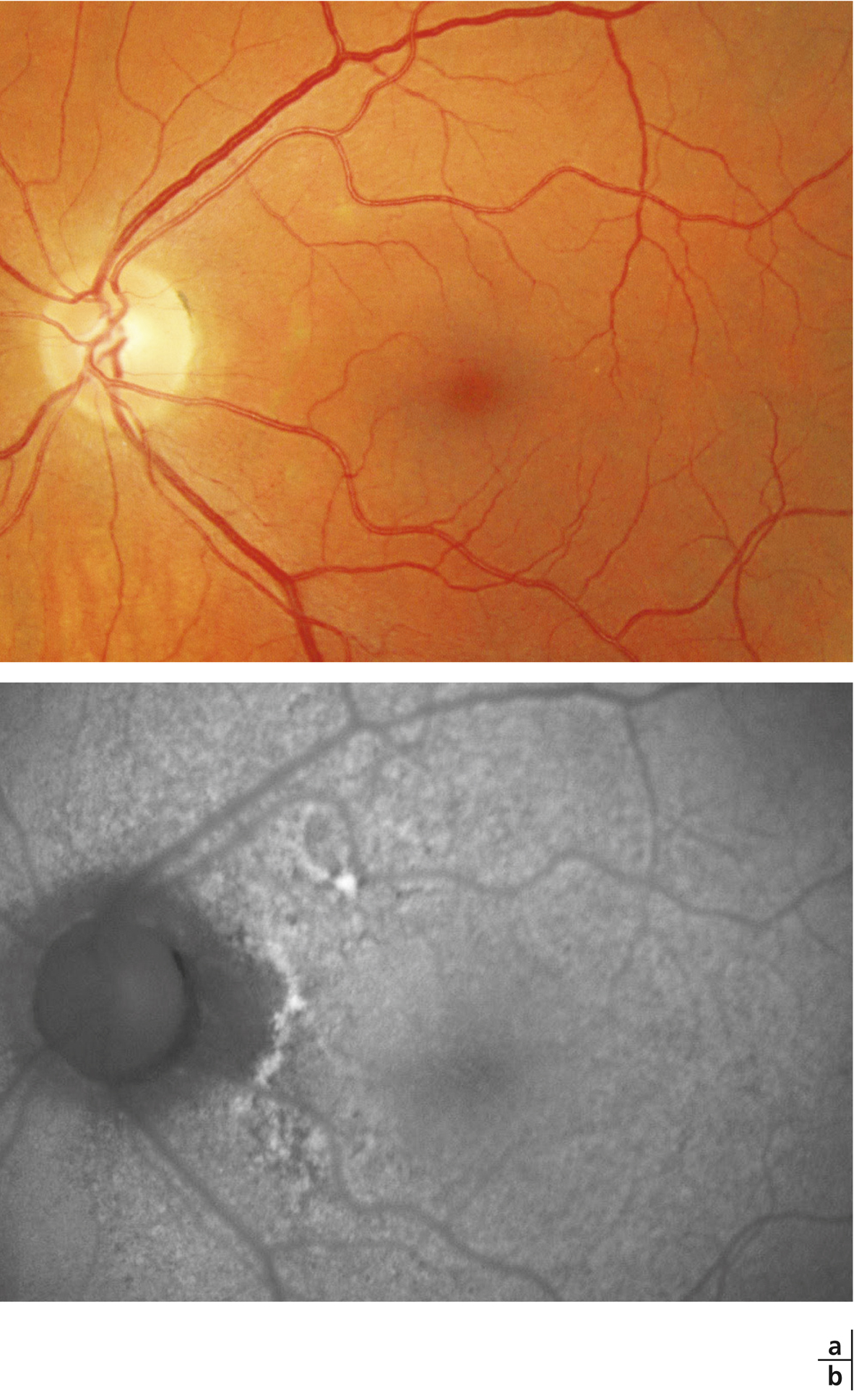
Fig. 8-76 Dystrophie maculaire débutante (stade 1/2).
Patient âgé de 30 ans, dont la mère est atteinte de MIDD. Il souffre lui-même d’un diabète et d’une discrète hypo-acousie. Son acuité visuelle est normale. a. Cliché en couleurs : le fond d’œil paraît normal. b. Le cliché en autofluorescence révèle une fluorescence inhomogène du pôle postérieur associée à des zones d’hyperautofluorescence réticulée le long de la papille témoignant d’une dystrophie maculaire débutante.
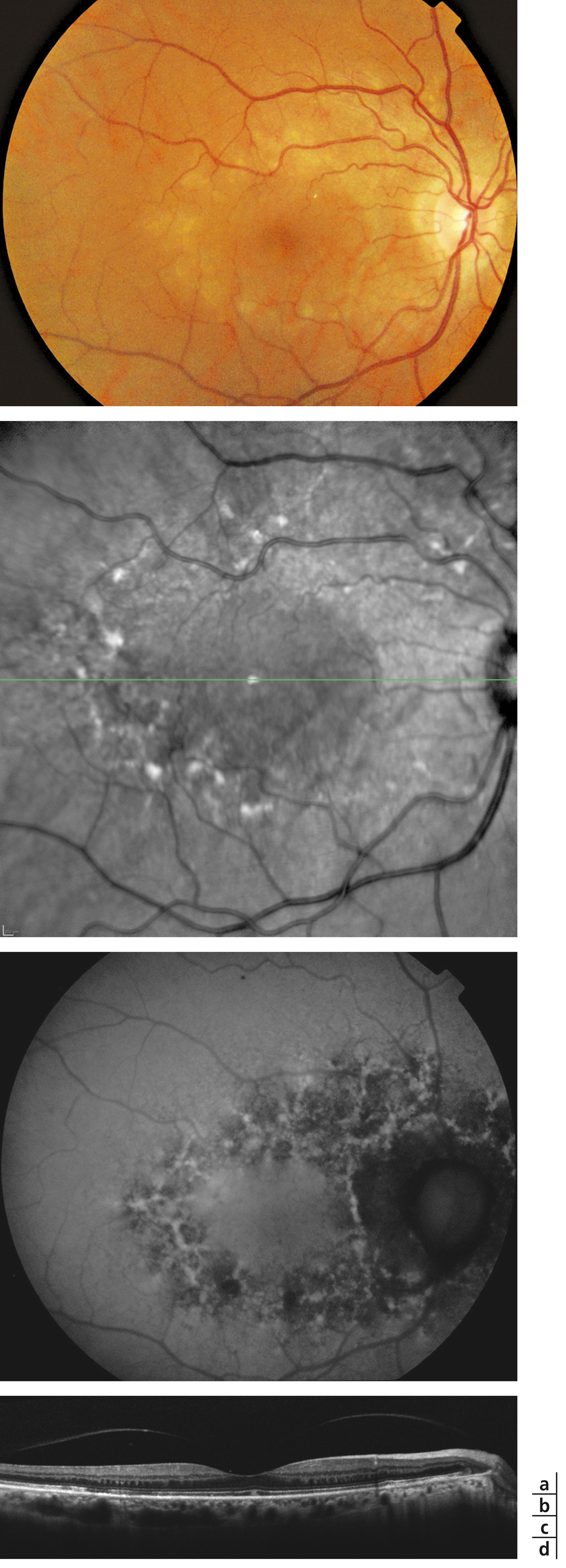
Fig. 8-77 Dystrophie maculaire réticulée (stade 2).
a. Cliché en couleurs : altérations pigmentaires organisées en couronne périfovéolaire. b. Cliché anérythre : aspect de dépôts blanchâtres sous-rétiniens en couronne périfovéolaire. c. Cliché en autofluorescence : la dystrophie semble plus étendue que sur les précédents clichés. On observe une hyperautofluorescence réticulée au niveau des lésions pigmentées observées sur la photographie en couleurs associée à une diminution de l’autofluorescence au niveau des zones plus atrophiques, localisées autour de la fovéa mais aussi autour de la papille. d. Coupe OCT : on observe des zones localisées d’hyporéflectivité de la rétine externe, principalement au niveau de l’ellipsoïde et des segments externes des photorécepteurs, correspondant aux zones d’atrophie.

Fig. 8-78 Dystrophie maculaire au stade atrophique (stade 4).
a, b. Clichés en couleurs et en lumière bleue. Vastes plages d’atrophie choriorétinienne du pôle postérieur, atteignant la fovéa. c. Cliché en autofluorescence : vastes zones sombres d’atrophie de l’épithélium pigmentaire, dans la macula et autour de la papille, bordées d’altérations irrégulières de l’autofluorescence. d. Coupe OCT montrant l’atrophie majeure des couches externes de la rétine. L’acuité visuelle est effondrée.
Nous avons montré que la rétinopathie diabétique était moins fréquente en cas de dystrophie maculaire. En effet, dans notre série, la fréquence de la rétinopathie diabétique était 5 fois plus faible chez les patients atteints de MIDD que dans un groupe de patients atteints de diabète « commun », appariés selon le type de diabète, le traitement, la durée d’évolution et l’HbA1c (8 % versus 40 %) [15]. La seule différence entre les groupes était une fréquence plus faible d’HTA chez les patients atteints de MIDD. Le rôle protecteur de la dystrophie maculaire réticulée, par l’intermédiaire de la diminution des besoins énergétiques de la rétine, est vraisemblable. Une preuve indirecte est apportée par les résultats de la série japonaise [5]. La prévalence de la dystrophie maculaire réticulée y est faible (13,4 %), alors que la rétinopathie diabétique est fréquemment observée (55 % des cas, avec 20 % de formes préproliférantes et proliférantes).
Contrastant avec la rareté de la rétinopathie diabétique, une fréquence plus élevée d’insuffisance rénale a été notée chez les patients atteints de MIDD, et ce en dépit de la faible fréquence d’HTA associée. Cette prévalence élevée des atteintes rénales dans le MIDD pourrait être expliquée par une néphropathie mitochondriale spécifique.
[1] Reardon W, Ross RJ, Sweeney MG, et al. Diabetes mellitus associated with a pathogenic point mutation in mitochondrial DNA. Lancet 1992 ; 340 : 1376-9.
[2] Guillausseau PJ, Massin P, Dubois-LaForgue D, et al. Maternally inherited diabetes and deafness : a multicenter study. Ann Intern Med 2001 ; 134 : 721-8.
[3] Rummelt V, Folberg R, Ionasescu V, et al. Ocular pathology of MELAS syndrome with mitochondrial DNA 3243 point mutation. Ophthalmology 1993 ; 100 : 1757-66.
[4] Laloi-Michelin M, Meas T, Ambonville C, et al. ; Mitochondrial Diabetes French Study Group. The clinical variability of maternally inherited diabetes and deafness is associated with the degree of heteroplasmy in blood leukocytes. J Clin Endocrinol Metab 2009 ; 94 : 3025-30.
[5] Suzuki S, Oka Y, Kadowaki H, et al. Clinical features of diabetes mellitus with the mitochondrial DNA 3243 (A-G) mutation in Japanese : maternal inheritance and complications. Diab Res Clin Pract 2003 ; 59 : 207-17.
[6] Vionnet N, Passa P, Froguel P. Prevalence of mitochondrial gene mutations in families with diabetes mellitus. Lancet 1993 ; 342 : 1429-30.
[7] Paquis-Flucklinger V, Vialettes B, Vague P, et al. Importance of searching for mtDNA defects in patients with diabetes and hearing defects. Diabetologia 1998 ; 41 : 740-4.
[8] Massin P, Virally-Monod M, Vialettes B, et al. Prevalence of macular pattern dystrophy in maternally inherited diabetes and deafness. Ophthalmology 1999 ; 106 : 1821-7.
[9] Smith PR, Bain SC, Good PA, et al. Pigmentary retinal dystrophy and the syndrome of maternally inherited diabetes and deafness caused by the mitochondrial DNA 3243 tRNA(Leu) A to G mutation. Ophthalmology 1999 ; 106 : 1101-8.
[10] Suzuki Y, Iizuka T, Kobayashi T, et al. Diabetes mellitus associated with the 3243 mitochondrial tRNA(Leu)(UUR) mutation : insulin secretion and sensitivity. Metabolism 1997 ; 46 : 1019-23.
[11] Kishimoto M, Hashiramoto M, Araki S, et al. Diabetes mellitus carrying a mutation in the mitochondrial tRNA(Leu(UUR)) gene. Diabetologia 1995 ; 38 : 193-200.
[12] Massin P, Guillausseau PJ, Vialettes B, et al. Macular pattern dystrophy associated with a mutation of mitochondrial DNA. Am J Ophthalmol 1995 ; 120 : 247-8.
[13] De Laat P, Smeitink JA, Janssen MC, et al. Mitochondrial retinal dystrophy associated with the m.3243A>G mutation. Ophthalmology 2013 ; 120 : 2684-96.
[14] Souied EH, Salès MJ, Soubrane G, et al. Macular dystrophy, diabetes, and deafness associated with a large mitochondrial DNA deletion. Am J Ophthalmol 1998 ; 125 : 100-3.
[15] Massin P, Dubois-Laforgue D, Meas T, et al. ; GEDIAM (Mitochondrial Diabetes French Study Group). Retinal and renal complications in patients with a mutation of mitochondrial DNA at position 3,243 (maternally inherited diabetes and deafness). A case-control study. Diabetologia 2008 ; 51 : 1664-70.
S. Baillif
➤ Une hémoglobine glyquée inférieure à 7 % est préconisée chez les patients diabétiques afin de réduire l’apparition de l’OMD.
➤ La tension artérielle systolique cible conseillée est inférieure à 140 mmHg.
➤ Les mesures hygiéno-diététiques sont à associer à une alimentation équilibrée, une activité sportive adaptée et l’arrêt du tabac.
➤ Les dyslipidémies sont à équilibrer préférentiellement avec la prescription d’un fibrate.
Le traitement des facteurs généraux est primordial dans la prise en charge de la maculopathie diabétique œdémateuse. En effet, très tôt, preuve a été faite de l’effet délétère des mauvais contrôles glycémique et tensionnel sur l’évolution de l’OM secondaire à la rétinopathie diabétique. D’autres facteurs, tel que l’équilibre lipidique, sont aussi à considérer.
De nombreuses études cliniques de grande envergure ont confirmé la relation étroite existant entre équilibre glycémique et complications rétiniennes chez le patient diabétique. Le Diabetes Control And Complications Trial (DCCT) a montré que la sévérité ainsi que la durée de l’hyperglycémie étaient des facteurs majeurs de progression des complications microvasculaires rétiniennes mais aussi rénales et neurologiques chez les patients diabétiques insulino-dépendants [1]. Ainsi, une diminution de 10 % de l’hémoglobine glyquée (de 8 à 7,2 % par exemple) permet une chute de près de 45 % du risque de progression de la rétinopathie diabétique. Plus l’hémoglobine glyquée est élevée, et ce de façon durable, plus le risque de complications est élevé [1]. L’étude note aussi qu’il n’y a malheureusement pas de seuil d’hémoglobine glyquée au-dessous duquel le risque de progression s’annule [1]. La United Kingdom Prospective Diabetes Study (UKPDS) a trouvé des résultats similaires chez les patients diabétiques non insulino-dépendants [2]. La survenue ainsi que la progression de l’OMD sont directement corrélées à la sévérité et à la durée de l’hyperglycémie [3–5]. À travers toutes les études cliniques publiées, la valeur de l’hyperglycémie est considérée comme le facteur de risque de développement et de progression de l’OM le plus robuste [6]. Ainsi, une augmentation de 1 % du taux de l’hémoglobine glyquée est associée à une augmentation de 22 % de l’incidence de l’OM sur une période de suivi de 21 ans chez les diabétiques de type 1 [6]. L’équilibre glycémique a un retentissement direct sur l’acuité visuelle des patients diabétiques. Une augmentation de 1 % du taux de l’hémoglobine glyquée est associée à une augmentation de 28 % de la survenue d’une mauvaise acuité visuelle (définie comme inférieure à 5/10) sur une période de suivi de 25 ans [7]. La mauvaise acuité visuelle est fortement corrélée à la sévérité de la rétinopathie diabétique et à la présence d’un OM [7].
L’équilibre glycémique doit donc être une priorité dans le traitement des patients diabétiques. Il semble qu’un contrôle intensif de la glycémie soit à favoriser. Ainsi, la DCCT montre qu’un traitement intensif des patients diabétiques de type 1 (plus de trois injections quotidiennes d’insuline) permet une réduction de 46 % de l’incidence de l’OM au bout de 6,5 ans et de 58 % au bout de 4 années supplémentaires (étude EDIC) par rapport au groupe recevant un traitement conventionnel (une à deux injections d’insuline quotidiennes) [3]. Sur 20 ans d’étude, un groupe de patients diabétiques de type 1 traités, pour 93,4 % d’entre eux, de manière intensive présentera moins de complications rétiniennes et de baisse d’acuité visuelle que le groupe de patients dont seuls 23,3 % des membres seront traités de manière intensive : le premier groupe présentera 10 % de rétinopathie diabétique proliférante versus 36 % dans le second groupe. De même, le risque de menace visuelle sera de 18 % contre 43 % [8]. Le rapport Cochrane de 2014 confirme la supériorité d’un contrôle glycémique intensif versus un traitement conventionnel sur toutes les complications microvasculaires du patient diabétique [9]. Le risque de développer une rétinopathie diabétique serait de 6,2 % en cas de contrôle strict versus 23,2 % en cas de traitement conventionnel (p < 0,00001). Le bénéfice d’un contrôle précoce et strict de la glycémie serait aussi bénéfique au long cours, alors que le contrôle glycémique devient moins strict : l’étude EDIC a montré que 10 ans après la fin d’un suivi glycémique attentif et sévère, les patients présentaient encore une réduction du risque de progression de leur rétinopathie de 53 % [10]. La persistance de l’effet bénéfique initial est appelée phénomène de « mémoire métabolique ». Celui-ci est attribué à des modifications, par acétylation ou méthylation, des histones, protéines régulant la condensation puis la transcription de l’ADN. Ainsi une corrélation entre hémoglobine glyquée et acétylation du complexe histone H3 lysine-9 a été décrite [11].
L’équilibre glycémique strict permet donc de retarder ou d’arrêter la progression de la rétinopathie diabétique mais n’améliore cependant pas une rétinopathie diabétique existante [12]. Seules des modifications rétiniennes très précoces (telle que la diffusion de fluorescéine dans le vitré mesurée par fluorométrie) peuvent être réversibles en cas d’équilibre métabolique strict [12].
Il est toutefois à noter qu’un contrôle glycémique sévère peut être dommageable. Ainsi, le DCCT rapporte, lors d’un suivi de patients diabétiques de type 1 durant 6,5 ans, la survenue dans 65 % des cas d’au moins un épisode hypoglycémique sévère (c’est-à-dire requérant une assistance médicale) dans le groupe traité intensivement versus 35 % des cas dans le groupe disposant d’un traitement conventionnel [13]. Ainsi le taux d’hypoglycémie sévère serait de 61,2 pour 100 patients par an dans le groupe intensif versus 18,7 pour 100 patients par an dans le groupe conventionnel, soit un risque relatif de 3,28. Il semblerait que le risque d’hypoglycémie sévère soit surtout présent dans le groupe de patients présentant une hémoglobine glyquée inférieure à 9 % avant l’équilibration glycémique [9]. Une des conséquences des hypoglycémies et de l’amélioration trop rapide de la glycémie est l’aggravation de la rétinopathie et de la maculopathie diabétiques [14]. Celle-ci serait liée à une augmentation de l’expression de IGF-1 [12]. Il semble cependant que l’aggravation initiale de la rétinopathie ne compromette pas les résultats à long terme. Ainsi, un contrôle métabolique intensif réduirait la progression de la rétinopathie diabétique à 2 ans dans 23,2 % des cas versus 38,7 % des cas avec contrôle traditionnel (p 0,0001), et ce malgré une aggravation initiale [12].
Obtenir un meilleur équilibre glycémique passe, chez le diabétique de type 1, par l’intensification du traitement médicamenteux avec de meilleurs résultats lors de l’utilisation d’une pompe à insuline ou de plus de trois injections d’insuline par jour [8]. Le contrôle glycémique est aussi plus efficace quand des mesures d’éducation du patient, avec vérification fréquente des glycémies, sont associées. Plus récemment, la greffe d’îlots pancréatiques semble donner de bons résultats, permettant une sécrétion pérenne du peptide C, une réduction de la glycémie et de l’hémoglobine glyquée ainsi qu’une diminution des épisodes hypoglycémiques [15]. La transplantation d’îlots pancréatiques permettrait aussi de limiter la progression de la rétinopathie diabétique.
Les associations scientifiques américaines et européennes contre le diabète ont émis des recommandations en 2009 [16]. Une hémoglobine glyquée inférieure à 7 % est recherchée. Le traitement initial repose, chez les diabétiques de type 2, sur la modification des comportements (alimentation, activité sportive, arrêt du tabac) associé à de la metformine. En cas de résultat insuffisant, des antidiabétiques oraux sont associés ou un traitement par insuline est instauré [16].
L’hypertension artérielle (HTA) est très souvent associée au diabète. L’incidence de l’HTA est trois fois plus élevée chez les sujets diabétiques de type 2 que chez les sujets contrôles [12]. Du fait du retentissement de l’HTA sur la microcirculation, une aggravation de la rétinopathie diabétique est attendue en cas de mauvais contrôle pressionnel concomitant. Il a en effet été démontré que la tension artérielle augmente la pression de perfusion ainsi que la production de monoxyde d’azote dans les vaisseaux rétiniens des sujets diabétiques, conduisant à une dysfonction de l’endothélium vasculaire et à une disparition des péricytes [16, 17].
L’UKPDS a étudié la relation entre la pression artérielle et la survenue d’une baisse d’acuité visuelle [18]. Ainsi, au bout de 9 ans de suivi, les patients diabétiques de type 2 ayant un contrôle strict de leur tension artérielle (défini par une tension artérielle inférieure à 150–85 mmHg) ont présenté une réduction de 47 % du risque de perte d’acuité visuelle de plus de 3 lignes ETDRS par rapport aux patients ayant un contrôle pressionnel moins strict (défini par une tension artérielle inférieure à 180–105 mmHg). Plus récemment, l’UKPDS confirme ces résultats avec une moindre dégradation de la fonction visuelle dans le groupe ayant un meilleur contrôle de la tension artérielle [19]. Cette différence s’explique par la moindre survenue d’un OM [19]. En effet, de nombreuses études retrouvent une relation directe entre les valeurs de la tension artérielle et l’incidence de l’OMD [4, 6]. Cependant il semble qu’il y ait un effet seuil avec une absence de bénéfice supplémentaire quand la pression artérielle cible est trop basse. Ainsi, dans l’étude ACCORD, aucune différence en termes de progression de la rétinopathie diabétique n’était observée entre le groupe de patients diabétiques dont la pression artérielle systolique était au-dessous de 120 mmHg et ceux au-dessous de 140 mmHg [20].
Pour certains auteurs, les tensions artérielles systolique et diastolique sont des facteurs de risque d’évolution vers l’apparition d’une rétinopathie diabétique [21, 22]. Cette association serait linéaire avec une augmentation du risque d’évolution vers la rétinopathie de 3 à 20 % par augmentation de 10 mmHg de la pression artérielle systolique et de 2 à 30 % en cas d’augmentation de 10 mmHg de la pression artérielle diastolique [22]. Pour d’autres auteurs, l’existence d’une hypertension artérielle n’est pas, en elle-même, un facteur de risque de survenue d’OM chez les diabétiques de type 2 et c’est d’avantage l’hypertension artérielle diastolique (supérieure à 90 mmHg) qui serait délétère [23]. D’autres encore observent que la pression artérielle systolique est le facteur de risque à considérer avec, chez des patients diabétiques de type 1, un risque accru d’OM en cas de tension artérielle systolique supérieure à 160 mmHg [6].
Le contrôle de la tension artérielle doit être permanent. En effet, l’effet positif d’un contrôle strict de la tension artérielle sur la progression des altérations microvasculaires, aboutissant à la rétinopathie ou la maculopathie diabétiques, s’estompe rapidement après arrêt du traitement anti-hypertenseur [24]. Ainsi, dès la deuxième année après la fin de l’étude, plus aucune différence n’était observée entre un groupe de patients dont la tension artérielle était limitée, durant 4 ans, à 150–85 mmHg et ceux dont la tension artérielle était limitée à 180–105 mmHg sur cette même période [24].
Actuellement, aucun traitement hypotenseur n’a pu démontrer définitivement sa supériorité dans la prévention ou la limitation de la progression de la rétinopathie diabétique [25]. Cependant, il semble que les hypotenseurs bloquant le système rénine–angiotensine soient plus efficaces dans cette indication [26]. En effet, l’intérêt de cette classe thérapeutique a été évoqué avec la découverte d’un système rénine–angiotensine dans l’œil dont l’activité est augmentée en cas de rétinopathie diabétique [12]. De nombreuses études ont évalué l’effet de ces thérapeutiques dans la rétinopathie diabétique mais il est parfois difficile d’attribuer l’amélioration obtenue à la baisse tensionnelle ou à la classe thérapeutique en elle-même. Ainsi, le lisinopril, dans l’étude EURODIAB, n’a pas démontré d’effet sur « l’incidence » de la rétinopathie diabétique mais a entraîné une réduction significative de la « progression » de la rétinopathie diabétique [27]. Ce bénéfice était aussi observé chez des patients diabétiques de type 1 normo-tendus [27]. Le candésartan, étudié chez des patients diabétiques de type 1 et 2, a permis une réduction de l’incidence de la rétinopathie diabétique de 18 % (p = 0,0508) mais pas d’action sur la progression de la rétinopathie [28]. Dans l’étude RASS, la progression de la rétinopathie diabétique a été observée dans 38 % des cas dans le groupe placebo versus 25 % dans le groupe traité par énalapril (p = 0,02) et 21 % dans le groupe traité par losartan (p = 0,008) [29].
La tension artérielle doit être contrôlée chez tout patient diabétique. Le Royaume-Uni conseille aux patients diabétiques d’avoir une tension artérielle inférieure à 140–80 mmHg. L’American Diabetes Association ainsi que le National Health Institute américain considèrent qu’une tension artérielle inférieure à 130–80 mmHg est préférable pour les patients diabétiques [30]. Il semble que les traitements anti-hypertenseurs agissant sur le système rénine–angiotensine, tels que les inhibiteurs de l’enzyme de conversion de l’angiotensine (lisinopril, énalapril) ou les antagonistes du récepteur de l’angiotensine II (candésartan, losartan), présentent une efficacité supérieure aux autres hypotenseurs dans le cadre de la rétinopathie diabétique.
Le rôle des lipides dans la survenue et la progression de la rétinopathie ou maculopathie diabétiques est moins évident que ne le sont ceux de l’hyperglycémie ou de l’hypertension artérielle [31]. Les études donnent parfois des résultats discordants. L’hypertriglycéridémie est associée à un risque supérieur de progression de la rétinopathie diabétique chez les sujets diabétiques de type 1 (risque relatif [RR] = 2,30) [32]. Le DCCT retrouve une association statistiquement significative entre l’incidence de l’OM et les taux sériques de low density lipids (LDL) ou du rapport cholestérol total/high density lipoprotein (HDL) chez des sujets diabétiques de type 1 [33]. Dans cette étude, l’impact de l’hypertriglycéridémie ou de l’hypo-HDL n’est plus significatif après ajustement avec l’âge, le sexe, le tabac ou l’ancienneté du diabète. Plus récemment, aucune relation n’a été retrouvée, chez des sujets diabétiques de type 1, entre les taux sériques de cholestérol total ou de LDL [34]. Dans l’étude ADVANCE, aucune relation n’a été retrouvée entre de basses valeurs de HDL sérique et la survenue de complications microvasculaires rétiniennes chez des patients diabétiques de type 2 [35]. Cependant les auteurs concluent que, du fait du retentissement rénal et cardiovasculaire majeur des dyslipidémies chez le patient diabétique, un traitement hypolipémiant est nécessaire [30].
Les statines permettent de réduire les taux sériques de cholestérol LDL. Leur efficacité dans la réduction des accidents macrovasculaires chez le patient diabétique a été démontrée. Au niveau ophtalmologique, l’atorvastatine a permis une réduction de l’OM chez des patients diabétiques de type 2 avec une réduction significative de l’incidence des exsudats durs [36]. Cette association n’est pas retrouvée par Klein et al. avec une absence de corrélation entre les traitements par statines et l’incidence des complications microvasculaires rétiniennes [34].
Les récepteurs activés par les proliférateurs des peroxysomes (peroxisome proliferator-activated receptor [PPAR]) sont des récepteurs régulant des gènes impliqués dans le métabolisme glycémique et lipidique. Ils interviennent dans la sensibilité cellulaire à l’insuline et l’homéostasie lipidique [37]. La rosiglitazone ou la pioglitazone, appartenant à la famille des thiazolidendiones, sont des agonistes des PPAR-γ. Ils sont prescrits en monothérapie ou en association avec les antidiabétiques oraux ou l’insuline chez les diabétiques de type 2. Cependant, leur utilisation est actuellement débattue du fait de leurs effets secondaires. Une association entre cancer de la vessie et prescription de pioglitazone au long cours a été suspectée [38]. L’utilisation de la rosiglitazone a été restreinte du fait d’une potentielle augmentation du risque d’infarctus du myocarde. Enfin, les thiazolidendiones, déjà connus pour occasionner des œdèmes des membres inférieurs, pourraient générer des OM ou pérenniser des OM préexistants [39]. Cependant, cet effet serait transitoire avec disparition de l’OM et amélioration de l’acuité visuelle lors de l’arrêt du traitement par glitazone [40]. D’autres auteurs ne retrouvent pas de facteurs de risque maculaires liés à cette utilisation [41]. Actuellement, la question des thiazolidendiones dans l’OM reste en suspens.
Les fibrates sont aussi des agonistes de la PPAR-γ mais leur action principale est le contrôle lipidique. L’action des fibrates sur la microcirculation rétinienne est encore mal connue. Différentes hypothèses sont avancées telles que l’inhibition de la voie du VEGF, la prévention de l’apoptose des cellules endothéliales vasculaires, ou des propriétés anti-inflammatoires et anti-oxydantes [12]. L’étude Fenofibrate Intervention And Event Lowering In Diabetes (FIELD) a démontré un effet bénéfique des fénofibrates, chez les sujets diabétiques de type 2, dans la réduction des complications microvasculaires rétiniennes [42]. Une diminution de l’incidence de l’OM ainsi que de la nécessité d’un traitement maculaire par laser a été observée dans cette population [42]. L’effet des fénofibrates semble être indépendant de la glycémie, de la tension artérielle et du contrôle lipidique initial [25]. L’étude ACCORD confirme l’effet bénéfique des fénofibrates chez les diabétiques de type 2 avec 6,5 % de progression de la rétinopathie diabétique chez les patients traités versus 10,2 % chez ceux recevant un placebo [43]. Plus récemment, l’étude MacuFen n’a pas retrouvé de différence en termes de volume maculaire et d’épaisseur maculaire chez des patients diabétiques ayant un OM traité quotidiennement par acide fénofibrique ou placebo [44]. Cependant, les auteurs estiment que la puissance de leur étude est insuffisante pour permettre la détection d’une différence entre les deux groupes.
Le contrôle du métabolisme lipidique chez le sujet diabétique est nécessaire, surtout en vue de réduire les complications macrovasculaires. Le premier traitement prescrit est en général une statine [45]. Les complications microvasculaires rétiniennes sont limitées surtout grâce à l’utilisation des fénofibrates dont le mécanisme d’action serait indépendant de l’effet antilipidique [45]. Le Royaume-Uni préconise un taux de cholestérol total inférieur à 4 mmol/L et un taux de LDL inférieur à 2 mmol/L. L’American Diabetes Association préconise un taux de LDL inférieur à 100 mg/dL, une triglycéridémie inférieure à 150 mg/dL et un taux de HDL supérieur à 40 mg/dL chez l’homme et 50 mg/dL chez la femme.
La consommation de tabac est un facteur de risque cardiovasculaire bien connu. C’est aussi un facteur de risque de survenue d’un OM chez les patients diabétiques de type 2 [46] et de type 1 [47]. Chez le patient diabétique de type 1, le tabac est associé à un risque accru de progression de la rétinopathie diabétique.
La protéine kinase C (PKC) joue un rôle dans le développement et la progression des complications microvasculaires diabétiques. Elle induit, dans les modèles animaux, une augmentation de la perméabilité vasculaire rétinienne ainsi qu’une néovascularisation rétinienne. L’activation de la PKC est responsable d’une déphosphorylation du récepteur β du PDGF conduisant à une apoptose péricytaire et à une augmentation des capillaires acellulaires. La PKC provoque une phosphorylation des occludines composant les jonctions serrées des cellules endothéliales vasculaires aboutissant à leur désassemblage et à une augmentation de la perméabilité vasculaire. L’expression de la PKC est stimulée par le VEGF ainsi que par l’hyperglycémie. L’inhibition de tous les isoformes de la PKC est létale du fait de l’importance de cette enzyme dans le fonctionnement cellulaire rénal et cardiaque. Une inhibition sélective permet d’en diminuer les effets secondaires.
La ruboxistaurine ou RBX (LY333531, Lilly Research Laboratories, Indianapolis, États-Unis) est un inhibiteur sélectif de l’isoforme β de la PKC. Elle est administrée per os de façon quotidienne. La RBX a été étudiée dans l’OMD. Deux études de phase 3 randomisées, en double insu contre placebo (PKC-DRS et PKC-DRS2), ont tout d’abord montré que l’administration de RBX à 32 mg/jour permettait une réduction de près de 50 % de la survenue d’une baisse d’acuité visuelle chez les patients diabétiques (9,1 % dans le groupe placebo versus 5,5 % dans le groupe RBX). La réduction de ce risque était évidente dans le groupe des patients présentant un OMD [48]. Des diminutions de la progression de l’OM et de la fréquence des lasers maculaires étaient aussi notées dans les groupes traités par RBX. L’étude PKC-DMES, évaluant la RBX versus placebo chez des patients diabétiques présentant un OM situé à plus de 300 μm de la fovéa, a conclu à une possible diminution de la baisse d’acuité visuelle liée à l’évolution de l’OMD dans le groupe RBX [49]. Deux nouvelles études ont été publiées en 2013 : MBDL et MBCU [50]. Ces études de phase 3, randomisées en double insu, ont comparé durant 3 ans, les résultats visuels de patients ayant un OMD, traités quotidiennement par placebo ou par 32 mg de RBX. Les résultats de ces deux études regroupant 1 028 patients ont montré qu’une baisse d’acuité visuelle de plus de 15 lettres persistant plus de 6 mois survenait dans 4,4 % des cas dans le groupe placebo versus 2,3 % dans le groupe RBX (p = 0,069). Aucune différence entre les deux groupes n’a été notée quant aux critères anatomiques (épaisseur maculaire en OCT, présence de logettes fovéolaires, nécessité d’un laser maculaire). Du fait des résultats plus mitigés des dernières études cliniques, l’efficacité de la RBX dans les rétinopathie et maculopathie diabétiques reste très incertaine.
De nouvelles stratégies sont en cours d’exploration dans le traitement de l’OMD [51]. Les cibles sont variées et découlent de la physiopathologie des complications rétiniennes diabétiques. Ainsi, sont évaluées, du point de vue systémique [51] :
-
les inhibiteurs de l’angiopoïétine 2 : les angiopoïétines sont des facteurs de croissance se fixant sur les récepteurs tyrosine kinase Tie-2 des cellules endothéliales et régulant la vasculogenèse. Une augmentation de l’angiopoïétine 2, présente chez les modèles animaux diabétiques, est responsable d’une augmentation de la perméabilité vasculaire rétinienne. Des études de phase 2 sont en cours dans l’OMD avec un inhibiteur de l’angiopoïétine 2 s’administrant par voie sous-cutanée ;
-
des inhibiteurs des chimiokines MCP-1, administrés par voie orale, sont aussi en cours d’étude de phase 2. Le principe de ce traitement est d’inhiber l’altération des BHR en limitant le chimiotactisme leucocytaire et leur extravasation tissulaire rétinienne ;
-
le danazol, stéroïde ayant des propriétés androgéniques et anabolisantes fait l’objet d’études de phase 2 dans l’OMDS. Son administration orale permettrait de réduire la perméabilité vasculaire en agissant au niveau des jonctions cellulaires serrées ;
-
la minocycline, tétracycline de seconde génération, est aussi testée dans ce domaine du fait de ses propriétés anti-inflammatoires permettant de réduire l’activation de la microglie et la sécrétion secondaire de cytokines.
Les facteurs systémiques sont à considérer et à équilibrer en cas d’OMD. Le contrôle de la glycémie ainsi que celui de la tension artérielle, dans les limites requises par les sociétés savantes, sont indispensables dans le but de maîtriser la progression de la rétinopathie ou de la maculopathie diabétiques. Chez les patients diabétiques présentant une dyslipidémie, un traitement par fénofibrate est conseillé [52]. Un contrôle glycémique, tensionnel ou lipidique, trop strict (HbA1c inférieure à 6 % et tension artérielle systolique inférieure à 120 mmHg par exemple) ne présenterait pas de bénéfices supplémentaires en termes de développement et de progression de la maculopathie œdémateuse ou en termes d’acuité visuelle [52].
[1] The relationship of glycemic exposure (HbA1C) to the risk of development and progression of retinopathy in the Diabetes Control and Complications Trial. Diabetes 1995 ; 44 : 968-83.
[2] UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998 ; 352 : 837-53.
[3] Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group. Retinopathy and nephropathy in patients with type 1 diabetes four years after a trial of intensive therapy. N Engl J Med 2000 ; 342 : 381-9.
[4] Aroca PR, Salvat M, Fernández J, Méndez I. Risk factors for diffuse and focal macular edema. J Diabetes Complications 2004 ; 18 : 211-5.
[5] Klein R, Knudtson MD, Lee KE, et al. The Wisconsin Epidemiologic Study of Diabetic Retinopathy : XXII the twenty-five-year progression of retinopathy in persons with type 1 diabetes. Ophthalmology 2008 ; 115 : 1859-68.
[6] Klein R, Knudtson MD, Lee KE, et al. The Wisconsin Epidemiologic Study of Diabetic Retinopathy XXIII : the twenty-five-year incidence of macular edema in persons with type 1 diabetes. Ophthalmology 2009 ; 116 : 497-503.
[7] Klein R, Lee KE, Gangnon RE, Klein BE. The 25-year incidence of visual impairment in type 1 diabetes mellitus the wisconsin epidemiologic study of diabetic retinopathy. Ophthalmology 2010 ; 117 : 63-70.
[8] LeCaire TJ, Palta M, Klein R, et al. Assessing progress in retinopathy outcomes in type 1 diabetes : comparing findings from the Wisconsin Diabetes Registry Study and the Wisconsin Epidemiologic Study of Diabetic Retinopathy. Diabetes Care 2013 ; 36 : 631-7.
[9] Fullerton B, Jeitler K, Seitz M, et al. Intensive glucose control versus conventional glucose control for type 1 diabetes mellitus. Cochrane Database Syst Rev 2014 ; 2 : CD009122.
[10] White NH, Sun W, Cleary PA, et al. ; Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group. Prolonged effect of intensive therapy on the risk of retinopathy complications in patients with type 1 diabetes mellitus : 10 years after the Diabetes Control and Complications Trial. Arch Ophthalmol 2008 ; 126 : 1707-15.
[11] Miao F, Chen Z, Genuth S, et al. Evaluating the role of epigenetic histone modifications in the metabolic memory if type diabetes. Diabetes 2014 ; 63 : 1748-62.
[12] Lingam G, Wong TY. Systemic médical management of diabetic retinopathy. Middle East Afr J Ophthalmol 2013 ; 20 : 301-8.
[13] Hypoglycemia in the Diabetes Control and Complications Trial. The Diabetes Control and Complications Trial Research Group. Diabetes 1997 ; 46 : 271-86.
[14] Davis MD, Beck RW, Home PD, et al. Early retinopathy progression in four randomized trials comparing insulin glargine and NPH [corrected] insulin. Exp Clin Endocrinol Diabetes 2007 ; 115 : 240-3.
[15] Warnock GL, Thompson DM, Meloche RM, et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation 2008 ; 86 : 1762-6.
[16] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes : a consensus algorithm for the initiation and adjustment of therapy : a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009 ; 32 : 193-203.
[17] Haefliger IO, Meyer P, Flammer J, Lusher TF. The vascular endothelium as a regulator of the ocular circulating : a new concept in ophthalmology ? Survey of Ophthalmology 1994 ; 39 : 123-32.
[18] UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes : UKPDS 38. BMJ 1998 ; 317 : 703-13.
[19] Matthews DR, Stratton IM, Aldington SJ, et al. ; UK Prospective Diabetes Study Group. Risks of progression of retinopathy and vision loss related to tight blood pressure control in type 2 diabetes mellitus : UKPDS 69. Arch Ophthalmol 2004 ; 122 : 1631-40.
[20] Ismail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes : an analysis of the ACCORD randomised trial. Lancet 2010 ; 376 : 419-30.
[21] Gupta A, Raman R, Kulothungan V, Sharma T. Association of systemic and ocular risk factors with neurosensory retinal detachment in diabetic macular edema : a case-control study. BMC Ophthalmol 2014 ; 9 : 14-47.
[22] Gallego PH, Craig ME, Hing S, Donaghue KC. Role of blood pressure in development of early retinopathy in adolescents with type 1 diabetes : prospective cohort study. BMJ 2008 ; 337 : a918.
[23] Bhagat N, Grigorian RA, Tutela A, Zarbin MA. Diabetic macular edema : pathogenesis and treatment. Surv Ophthalmol 2009 ; 54 : 1-32.
[24] Holman RR, Paul SK, Bethel MA, et al. Long term follow-up after tight control of blood pressure in type 2 diabetes. N Engl J Med 2008 ; 359 : 1565-76.
[25] Ockrim Z, Yorston D. Managing diabetic retinopathy. BMJ 2010 ; 341 : c5400.
[26] Marin Garcia PJ, Marin-Castaño ME. Angiotensin II-related hypertension and eye diseases. World J Cardiol 2014 ; 6 : 968-84.
[27] Chaturvedi N, Sjolie AK, Stephenson JM, et al. Effect of lisinopril on progression of retinopathy in normotensive people with type 1 diabetes. The EUCLID Study Group. Lancet 1998 ; 351 : 28-31.
[28] Sjølie AK, Klein R, Porta M, et al. Effect of candesartan on progression and regression of retinopathy in type 2 diabetes (DIRECT-Protect 2) : a randomised placebo-controlled trial. Lancet 2008 ; 372 : 1385-93.
[29] Mauer M, Zinman B, Gardiner R, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med 2009 ; 361 : 40-51.
[30] Kiire CA, Porta M, Chong V. Medical management for the prevention and treatment of diabetic macular edema. Surv Ophthalmol 2013 ; 58 : 459-65.
[31] Lim LS, Wong TY. Lipids and diabetic retinopathy. Expert Opin Biol Ther 2012 ; 12 : 93-105.
[32] Hadjadj S, Duly-Bouhanick B, Bekherraz A, et al. Serum triglycerides are predictive factor for the development and the progression of complications in patients with type 1 diabetes. Diabetes Metab 2004 ; 30 : 43-51.
[33] Miljanovic B, Glynn RJ, Nathan DM, et al. A prospective study of serum lipids and risk of diabetic macular edema in type 1 diabetes. Diabetes 2004 ; 53 : 2883-92.
[34] Klein BE, Myers CE, Howard KP, Klein R. Serum lipids and proliferative diabetic retinopathy and macular edema in persons with long-term type 1 diabetes mellitus : The Wisconsin Epidemiologic Study of Diabetic Retinopathy. JAMA Ophthalmol 2015 ; 133 : 503-10.
[35] Morton J, Zoungas S, Li Q, et al. Low HDL cholesterol and the risk of diabetic nephropathy and retinopathy : results of the ADVANCE study. Diabetes Care 2012 ; 35 : 2201-6.
[36] Gupta A, Gupta V, Thapar S, Bhansali A. Lipid-lowering drug atorvastatin as an adjunct in the management of diabetic macular edema. Am J Ophthalmol 2004 ; 137 : 675-82.
[37] Escher P, Wahli W. Peroxisome proliferator-activated receptors : insight into multiple cellular functions. Mutat Res 2000 ; 448 : 121-38.
[38] Azar S, El-Mollayess GM, Al Shaar L, et al. Impact of thiazolidinediones on macular thickness and volume in diabetic eyes. Can J Ophthalmol 2013 ; 48 : 312-6.
[39] Idris I, Warren G, Donnelly R. Association between thiazolidinedione treatment and risk of macular edema among patients with type 2 diabetes. Arch Intern Med 2012 ; 172 : 1005-11.
[40] Ryan EH Jr, Han DP, Ramsay RC, et al. Diabetic macular edema associated with glitazone use. Retina 2006 ; 26 : 562-70.
[41] Tatti P, ArrigoniF, LongobardiA, et al. Retrospective analysis of rosiglitazone and macular oedema in patients with type 2 diabetes mellitus. Clin Drug Investig 2008 ; 28 : 327-32.
[42] Keech AC, Mitchell P, Summanen PA, et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study) : a randomised controlled trial. Lancet 2007 ; 370 : 1687-97.
[43] The ACCORD Study Group ; ACCORD Eye Study Group. Chew EY, Ambrosius WT, Davis MD, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes. N Engl J Med 2010 ; 363 : 233-44.
[44] Massin P, Peto T, Ansquer JC, Aubonnet P, MacuFEN Study Investigators FT. Effects of fenofibric acid on diabetic macular edema : the MacuFen study. Ophthalmic Epidemiol 2014 ; 21 : 307-17.
[45] Valensi P, Picard S. Lipids, lipid-lowering therapy and diabètes complications. Diabetes Metab 2011 ; 37 : 15-24.
[46] Kamoi K, Takeda K, Hashimoto K, et al. Identifying risk factors for clinically significant diabetic macula edema in patients with type 2 diabetes mellitus. Curr Diabetes Rev 2013 ; 9 : 209-17.
[47] Kramer CK, de Azevedo MJ, da Costa Rodrigues T, et al. Smoking habit is associated with diabetic macular edema in Type 1 diabetes mellitus patients. J Diabetes Complications 2008 ; 22 : 430.
[48] The PKC-DRS2 Study Group. The effect of ruboxistaurin on visual loss in patients with diabetic retinopathy. Ophthalmology 2006 ; 113 : 2221-30.
[49] PKC-DMES Study Group. Effect of ruboxistaurin in patients with diabetic macular edema : thirty-month results of the randomized PKC-DMES clinical trial. Arch Ophthalmol 2007 ; 125 : 318-24.
[50] Sheetz MJ, Aiello LP, Davis MD, et al. MBDL and MBCU Study Groups. The effect of the oral PKC β inhibitor ruboxistaurin on vision loss in two phase 3 studies. Invest Ophthalmol Vis Sci 2013 ; 54 : 1750-7.
[51] Das A, McGuire PG, Rangasamy S. Diabetic macular edema : pathophysiology and novel therapeutic targets. Ophthalmology 2015 ; 122 : 1375-94.
[52] Chew E, Davis MD, Danis R, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes : the Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology 2014 ; 121 : 2443-51.
F. Fajnkuchen
➤ Les indications de laser ont considérablement évolué au cours de ces dernières années.
➤ Le laser reste le traitement de première intention des œdèmes focaux extracentraux, cliniquement significatifs, c’est-à-dire constituant une menace pour la fonction visuelle.
➤ Le laser n’est plus le traitement de première intention des OM touchant le centre.
➤ En cas d’OMD central, le laser est un traitement qui doit être différé et mis en œuvre pour traiter l’œdème résiduel persistant après un traitement par injections intravitréennes.
➤ À chaque fois qu’un traitement par laser est instauré, il convient toujours de se prémunir des effets secondaires de ce type de traitement (au premier rang desquels vient l’élargissement des cicatrices) en utilisant des paramètres de traitement peu agressifs et en veillant à ne pas appliquer d’impacts au sein d’une zone dite « sanctuaire » de 1 diamètre papillaire centrée sur la fovéa.
La photocoagulation au laser, à la suite des travaux de l’ETDRS [1], a été pendant plusieurs décennies le traitement de référence des patients présentant un OM cliniquement significatif. Toutefois, avec l’avènement des nouveaux traitements pharmacologiques (anti-VEGF et corticoïdes), la prise en charge des patients ayant un OMD a considérablement évolué. Les traitements pharmacologiques sont devenus le traitement de première intention des OM centraux. Il n’en reste pas moins que la photocoagulation laser reste le traitement de référence des OM extracentraux, et qu’elle pourrait présenter, dans certaines situations, un intérêt en association avec les traitements pharmacologiques dans les OM centraux. Récemment de nouveaux lasers ont été introduits : laser PASCAL®, laser micropulse, laser NAVILAS®. Dans cette synthèse, nous rappelons les indications et résultats du laser dans l’OMD et faisons le point sur les nouveaux lasers.
Le mécanisme d’action par lequel le laser est efficace sur l’OMD est incomplètement élucidé. La réduction de l’œdème par la réalisation d’un grid maculaire, sans traitement focal des micro-anévrismes, semble confirmer que les voies d’action du laser sont multiples et que la photocoagulation a un effet direct sur la rétine indépendant de l’effet médié par l’occlusion des lésions microvasculaires.
Différents facteurs pourraient intervenir dans cette efficacité : l’occlusion des micro-anévrismes à l’origine des diffusions, l’autorégulation des débits vasculaires rétiniens conséquence d’une destruction d’une partie des tissus rétiniens par la photocoagulation, l’amélioration de l’oxygénation rétinienne après laser, l’apparition de modifications biochimiques au sein de l’épithélium pigmentaire favorisant la résolution de l’œdème, etc. [2, 3].
Le traitement est réalisé sous anesthésie topique et fait appel à un verre contact. Il implique une étape minutieuse de repérage des lésions à traiter, en s’aidant des données de l’imagerie, permettant de sélectionner les lésions microvasculaires et les zones d’épaississement de la rétine à traiter.
On utilise le plus souvent une longueur d’onde verte, soit à partir de laser argon vert traditionnel (514 nm), soit le plus souvent actuellement avec un laser YAG (yttrium aluminium garnet) doublé (532 nm).
Deux stratégies de traitement peuvent être mises en œuvre au cours d’une photocoagulation, et elles sont souvent associées l’une à l’autre :
-
soit traiter directement les zones de fuite : micro-anévrismes et AMIR, c’est l’objet du laser focal. Cette occlusion est un processus lent, s’installant le plus souvent en plusieurs semaines ou mois ;
-
soit un traitement diffus de la zone d’épaississement rétinien, sans cibler les lésions microvasculaires qui diffusent : c’est la photocoagulation en grid.
Les protocoles de traitement par laser initialement proposés par l’ETDRS avaient un potentiel destructeur trop élevé, si bien que par la suite des traitements plus conservateurs ont été introduits : l’ETDRS modifié (mETDRS) et le mild macular grid (MMG) laser (tableau 8-13).
En pratique, le protocole mETDRS traite, au sein d’un œdème, les zones d’épaississement de la rétine (traitement en grid) et les micro-anévrismes (traitement focal), tandis que la méthode MMG réalise un grid plus diffus et plus espacé sur l’ensemble de la macula, sans traiter les micro-anévrismes (pas de traitement focal). Une étude a comparé, dans l’OM central, les deux techniques et a montré que le mETDRS est plus efficace sur le plan anatomique que le MMG, mais sans différence sur l’acuité visuelle [4].
Actuellement, compte tenu de l’existence de traitements pharmacologiques pour traiter les OMD centraux, et de l’effet potentiellement délétère pour la fonction visuelle de faire des impacts à proximité de la fovéa, de nombreux spécialistes recommandent de ne pas faire de laser au sein d’une zone d’un diamètre papillaire centré sur la fovéa.
Deux questions font l’objet de débats : faut-il guider le traitement par l’angiographie à la fluorescéine (AF) ou par l’OCT ? Et faut-il traiter focalement les micro-anévrismes ou peut-on se contenter de ne réaliser qu’une photocoagulation en grid sur les zones d’œdème ?
Dans une étude parue en 2011, Gallego-Pinazo et al. n’ont pas trouvé de différence significative en termes d’amélioration de l’acuité visuelle et de réduction de l’épaisseur rétinienne centrale selon que le traitement soit guidé par l’AF ou l’OCT [5]. Toutefois, une étude récente suggère que le nombre d’impacts réalisés est moins important lorsque l’on guide le traitement par AF plutôt que par OCT [6].
Faut-il traiter les micro-anévrismes ? L’occlusion des micro-anévrismes n’est pas toujours aisée : ils sont de petite taille, pas toujours faciles à repérer au fond d’œil et leur ciblage peut-être difficile surtout si le patient bouge. Au total, avec le laser conventionnel, le taux d’occlusion des micro-anévrismes n’est que de 70 %. De plus, de nombreux auteurs soulignent que l’application de photocoagulation en quinconce pourrait à elle seule apporter un résultat suffisant sur l’œdème. Cependant, d’autres auteurs considèrent qu’il existe un certain nombre d’avantages à photocoaguler directement les micro-anévrismes. Une plus grande efficacité anatomique pourrait être observée après occlusion des micro-anévrismes, ainsi qu’une diminution du besoin en retraitement [7]. Dans ce cas, l’utilisation d’un laser jaune avec une meilleure absorption par l’hémoglobine pourrait être préférable.
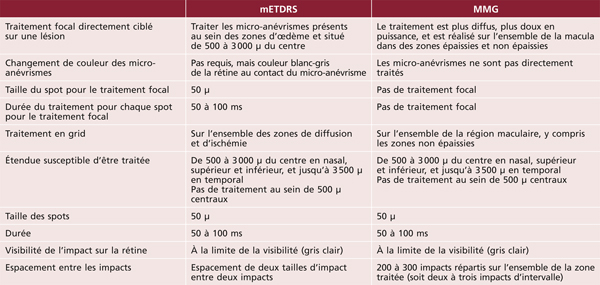
Tableau 8-13 Technique des traitements mETDRS et mild macular grid (MMG).
Malgré les évolutions de la technique, la photocoagulation reste une technique invasive. Un des effets secondaires les plus fréquents de la photocoagulation est la tendance à l’élargissement des cicatrices avec le temps (fig. 8-79). Ces cicatrices peuvent devenir coalescentes et menacer la fonction visuelle lorsque les impacts sont trop proches du centre. Il en résulte différents effets secondaires visuels : scotomes centraux et paracentraux, baisse de la vision centrale, troubles de la vision de la couleur, diminution de la sensibilité aux contrastes. Schatz et al. rapportent, dans une série de patients avec un OMD traité par laser, qu’un élargissement des cicatrices atteignant la région centrale survient dans 11 cas sur 2013 et est à l’origine de baisse de la vision centrale [8]. Maeshima et al. constatent un élargissement moyen de 12,7 % par an des cicatrices de laser au pôle postérieur. La présence de ces complications a poussé à utiliser des paramètres de traitement moins agressifs (mETDRS, laser infraliminaires, etc.) [9].
D’autres effets secondaires sont moins fréquents comme une fibrose sous-rétinienne et le développement de néovaisseaux sous-rétiniens sur les cicatrices de photocoagulation. En effet, si les impacts atteignent la membrane de Bruch, ils peuvent favoriser la survenue de membrane néovasculaire d’origine choroïdienne, développée sur la cicatrice de photocoagulation. Ces complications sont favorisées par l’utilisation d’impacts de petites dimensions avec des puissances élevées. Des impacts fovéolaires accidentels sont également possibles ; l’étape de repérage des zones à traiter doit donc être méticuleuse pour éviter ce type de complications.
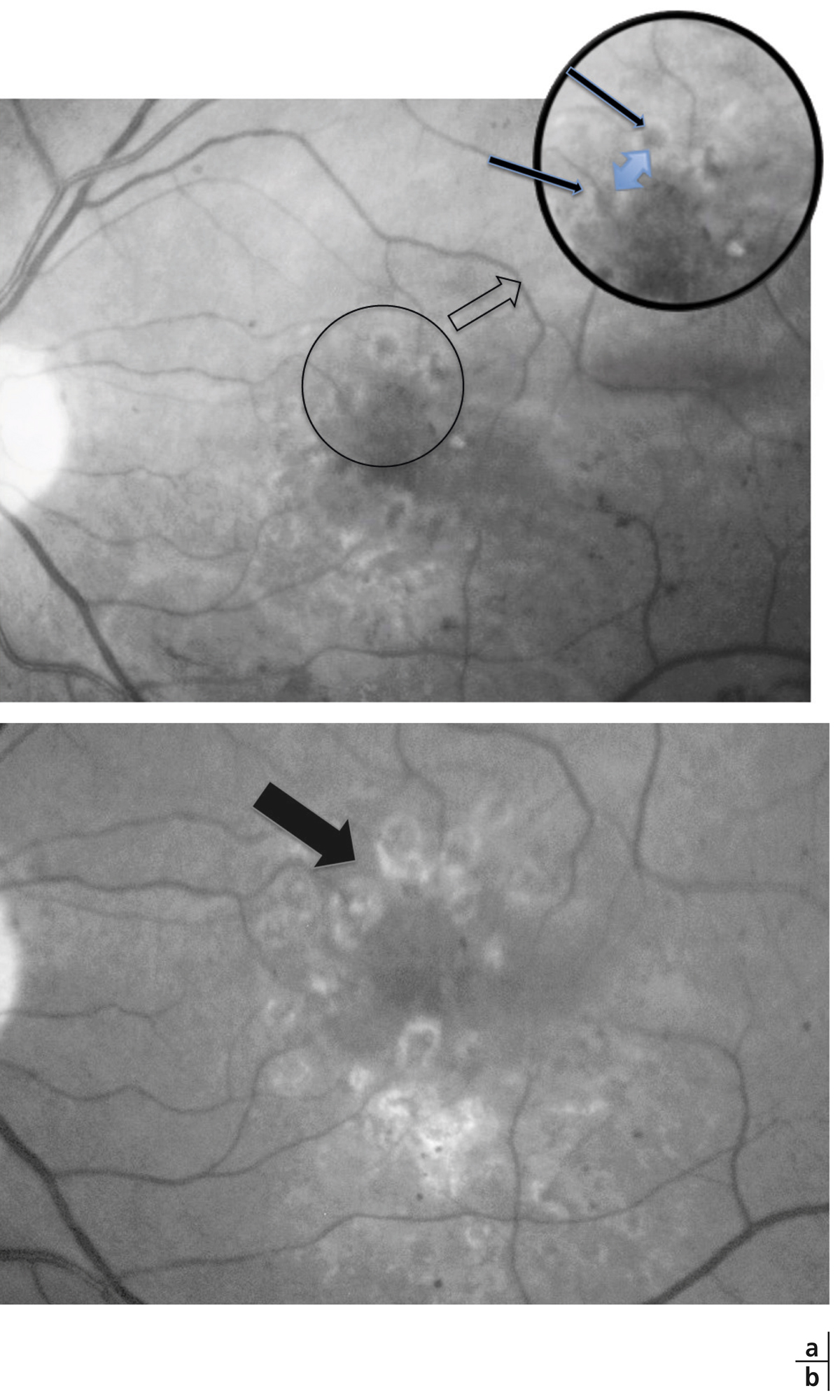
Fig. 8-79 Photocoagulation maculaire.
a. Impacts fortement dosés, de trop grand diamètre et insuffisamment espacés (intervalle d’un impact entre deux impacts, image agrandie, flèche bleue). b. Sur le contrôle, 9 mois après le précédent cliché, on constate une extension des cicatrices qui ont tendance à devenir jointives.
Le laser reste le traitement de première intention de tout OM focal extracentral, menaçant la fonction visuelle, c’est-à-dire répondant à la définition d’un OM cliniquement significatif tel que caractérisé par le groupe de l’ETDRS, et ce quel que soit le niveau d’acuité visuelle. Cet œdème focal, extracentral, se présente de façon stéréotypée sous la forme d’une zone d’épaississement rétinien entourée d’une couronne d’exsudats, centrée par des micro-anévrismes à l’origine des phénomènes de diffusion (fig. 8-80).
L’ETDRS est la première étude à avoir suggéré l’intérêt de ce traitement dans l’OM focal extracentral [1]. Les recommandations de l’ETDRS restent appropriées et il n’y a pas, à ce jour, de nouvelles recommandations pour traiter l’OM non central [10], même s’il convient d’utiliser des paramètres de traitement moins intenses (mETDRS) que ceux utilisés dans les protocoles initiaux.
En 2009, une étude du DRCRnet a confirmé que le laser (avec la technique mETDRS) restait le traitement de première intention dans ce type d’œdème, permettant de maintenir les patients à un bon niveau d’acuité visuelle (supérieur à 20/25 dans 75 % des cas 1 an après le traitement) [11].
Le traitement de l’OM extracentral associe un traitement focal à un traitement en grid. Les impacts sont placés de façon focale sur les anomalies microvasculaires (AMIR et micro-anévrismes). On applique en général un à trois impacts sur chacune de ces anomalies avec une puissance juste au-dessus du seuil de visibilité, entraînant un aspect gris autour du micro-anévrisme (il n’est pas nécessaire de blanchir la lésion). À ce traitement focal est associé un traitement en grid, avec impacts disposés en quinconce sur l’ensemble de la zone épaissie. Compte tenu du risque sur la fonction visuelle de réaliser des impacts trop proches du centre et de la disponibilité récente d’agents pharmacologiques pour traiter les OM centraux, il convient de ne pas réaliser d’impact au sein d’une zone dite « sanctuaire », correspondant à un territoire d’un diamètre papillaire centré sur la fovéa (fig. 8-81).
L’efficacité du traitement est jugée 4 mois après le laser ; l’OCT permet alors de vérifier la réussite du traitement et les clichés en autofluorescence permettent de vérifier que les impacts de laser ont été bien positionnés (eFig. 8-21 ). En cas de traitement incomplet, il est légitime de renouveler le traitement. Une à deux séances espacées de 4 mois suffisent dans la très grande majorité des cas à traiter l’œdème. Le résultat est favorable dans 80 à 100 % des cas, mais une récidive de l’œdème focal n’est pas exceptionnelle.
). En cas de traitement incomplet, il est légitime de renouveler le traitement. Une à deux séances espacées de 4 mois suffisent dans la très grande majorité des cas à traiter l’œdème. Le résultat est favorable dans 80 à 100 % des cas, mais une récidive de l’œdème focal n’est pas exceptionnelle.
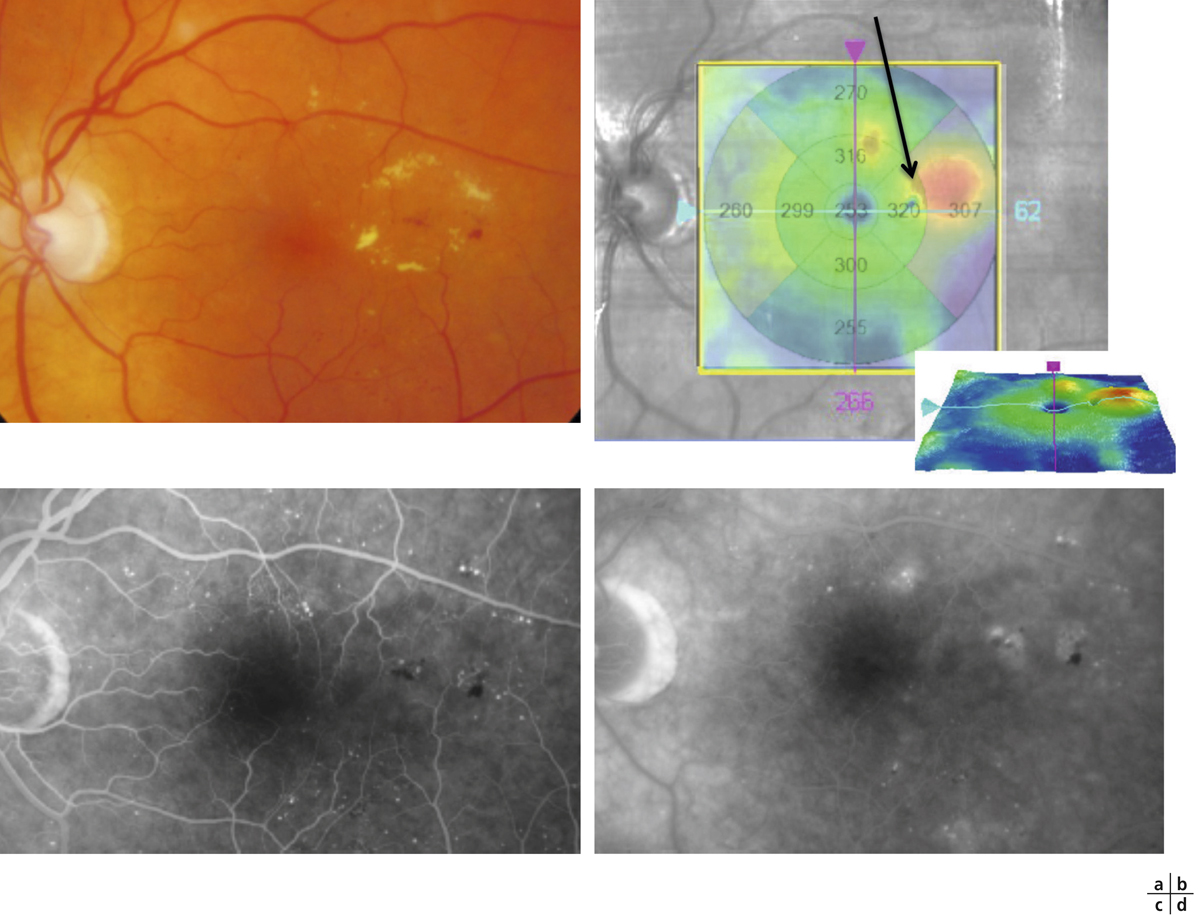
Fig. 8-80 Zone d’œdème focal extracentral avec exsudats et micro-anévrismes (a).
L’OCT montre l’épaississement maculaire et la cartographie confirme qu’une partie de l’œdème siège à moins de 1500 μm du centre (œdème présent en partie au sein du cercle concentrique interne de la cartographie : flèche noire) (b). L’angiographie confirme la présence de micro-anévrismes qui diffusent (c et d).
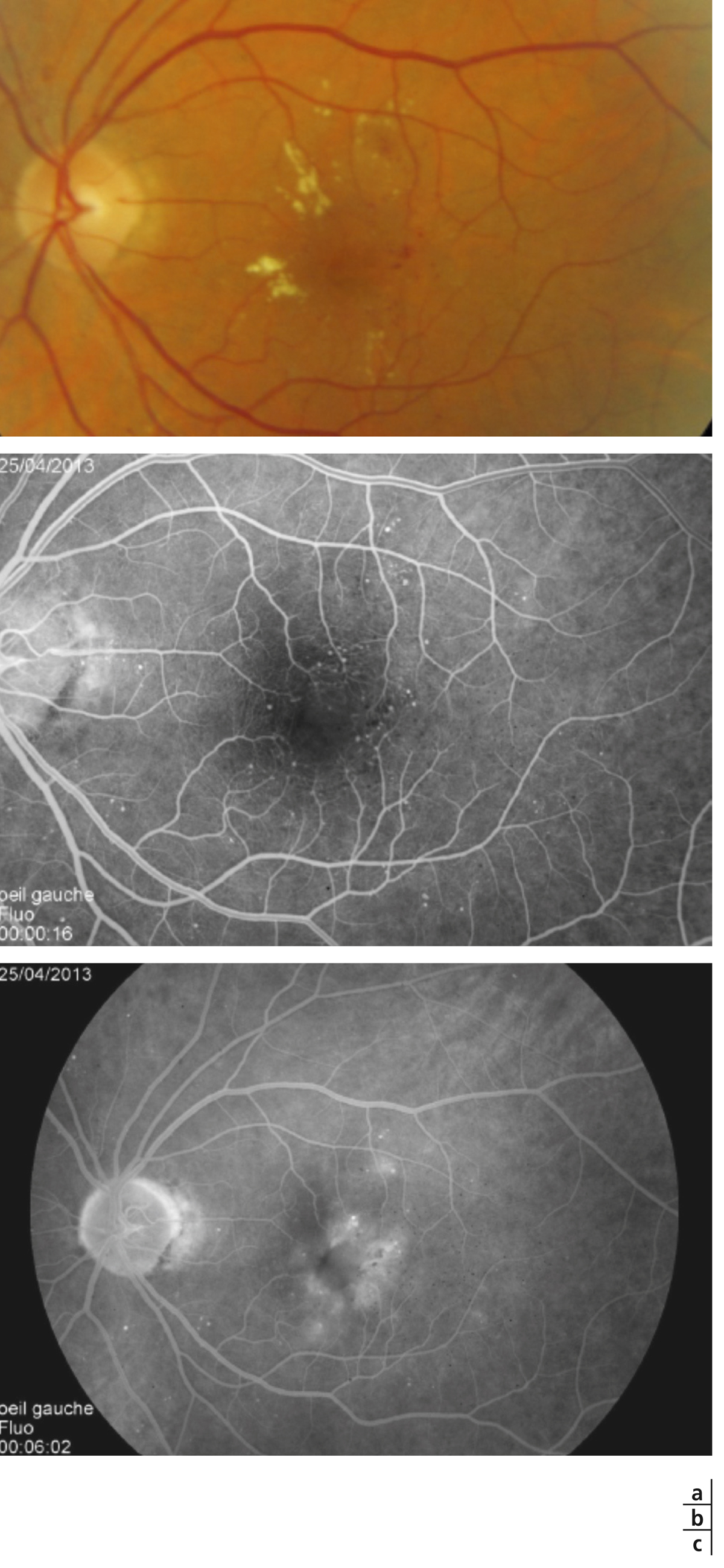
Fig. 8-81 Œdème maculaire avec exsudats.
Cliché couleur (a). Exsudats disposés en couronne autour de la fovéa. L’angiographie montre la présence de micro-anévrismes à l’origine des phénomènes de diffusion (b et c). Les micro-anévrismes siègent au sein de la zone sanctuaire d’un diamètre papillaire centré sur la fovéa. Ils ne sont pas accessibles au traitement laser.

eFig. 8-21 Œdème focal.
L’arrivée des traitements pharmacologiques a totalement modifié nos indications en matière de traitement de l’OM central.
Les études ont successivement montré que :
-
même si le laser pouvait, dans un nombre non négligeable de cas, améliorer l’acuité visuelle des patients traités, ce bénéfice visuel s’installait lentement ;
-
sur le plan anatomique et fonctionnel, en cas d’OMD central, les résultats obtenus avec le laser étaient inférieurs à ceux observés après IVT ;
-
il n’y avait pas de bénéfice sur le plan visuel à associer, en première intention, laser conventionnel et IVT, et les résultats obtenus étaient même inférieurs à ceux observés avec des IVT en monothérapie.
Au total, en cas d’OMD central, il convient de réaliser en première intention des IVT en monothérapie. Le laser ne doit être réalisé que secondairement et uniquement en cas de persistance, après 6 mois de traitement par IVT, de zones résiduelles d’œdème. Le laser peut être alors réalisé sur ces zones d’épaississement rétinien persistant.
L’ETDRS, étude qui date maintenant de près de 30 ans, a été la première étude prospective à avoir démontré la pertinence d’un traitement par laser dans la prise en charge de l’OMD [1]. Cette étude a montré que la photocoagulation focale et en grid était efficace pour réduire la fréquence des baisses d’acuité visuelle sévères : après 3 ans de suivi, 12 % des patients du groupe traité avaient une baisse d’acuité visuelle supérieure à 3 lignes, versus 24 % dans le groupe contrôle, soit une diminution du risque de 50 %. À la suite de cette étude, il était largement admis que le laser permettait d’éviter une perte d’acuité visuelle importante mais que les gains d’acuité visuelle étaient rares : seuls 17 % des patients ont présenté un gain d’acuité visuelle au terme du suivi et 3 % ont présenté un gain de plus de 3 lignes. Cependant, l’étude avait tendance à minimiser le potentiel de gain d’acuité visuelle, car la majorité des patients avait un niveau d’acuité visuelle élevé à l’inclusion et ne pouvait donc pas, par nature, avoir un gain important (effet plafond).
En 2008 est publiée la plus large cohorte de patients traités par laser depuis l’ETDRS [12, 13]. Les conclusions de cette étude, réalisée par le DRCRnet, ont montré, et probablement pour différentes raisons (critères d’inclusions différents, meilleure prise en charge des facteurs systémiques, modification des paramètres de traitement, etc.), que les résultats du laser sont meilleurs que ce que l’on pensait depuis l’ETDRS. En effet, dans cette étude, le gain d’acuité visuelle moyen à 3 ans est voisin de 5 lettres et à 2 ans, 32 % des patients ont un gain d’AV supérieur à 10 lettres. Cette étude montre que l’efficacité du laser sur l’acuité visuelle s’installe lentement (18 % des patients ont un gain d’acuité visuelle supérieur ou égal à 10 lettres à 4 mois, 32 % à 2 ans et 44 % à 3 ans) ; après 1 an de traitement, on ne constate souvent pas de gain d’acuité visuelle mais plutôt une stabilisation.
En 2010, une autre étude menée par le réseau DRCRnet a confirmé les données de 2008. En cas d’OMD impliquant le centre, un gain moyen de 3 lettres est constaté chez les patients traités par laser après 2 ans de suivi et 36 % des patients ont au moins un gain de 10 lettres [14, 15]. Les gains d’acuité visuelle chez les patients traités par laser ne sont donc pas exceptionnels, mais ils s’installent lentement.
En cas d’OM central traité par laser, le risque de baisse d’acuité visuelle à 3 ans reste cependant élevé, voisin de 15 %. Depuis qu’un meilleur contrôle de la glycémie et de la tension artérielle est devenu la base de la prise en charge d’un patient diabétique, le devenir visuel des patients s’est amélioré. Toutefois, les études récentes du DRCRnet soulignent que même avec un contrôle strict de la glycémie et de la tension artérielle, entre 12 et 13 % des patients avec atteinte fovéolaire et bénéficiant d’un traitement focal/grid perdent 10 lettres ETDRS ou plus après 2 à 3 ans de suivi.
Au final, des gains d’acuité visuelle sont communs après traitement par laser, mais ils s’installent lentement (sur 2 à 3 ans). Le traitement ne prévient pas, dans une proportion non négligeable de cas, la baisse importante de l’acuité visuelle.
Tableau 8-14 Résultats visuels des groupes de patients traités par laser dans les principales études randomisées évaluant des traitements de l’OM.
Les constatations concernant l’évolution des patients présentant un OMD central traités par laser ont ensuite été confirmées par les études comparant les anti-VEGF et le laser dans cette indication. Toutes ces études confirment que d’une part, le gain d’acuité visuelle après laser s’installe lentement et d’autre part, au terme d’une année de suivi, les résultats du laser sont en retrait par rapport aux évolutions sous anti-VEGF. Une récente méta-analyse a fait le point sur cette problématique [16].
Concernant les études ayant évalué le ranibizumab (RBZ) :
-
dans l’étude READ-2, les patients ayant eu un traitement par laser, éventuellement répété au 3e mois, ont une variation de leur acuité visuelle de −0,43 lettre au terme de 6 mois de suivi et aucun patient n’a un gain supérieur à 15 lettres versus + 7,24 lettres et 22 % dans le groupe RBZ [17] ;
-
dans l’étude RESTORE, à 1 an, les résultats en termes d’acuité visuelle sont en faveur du RBZ puisque le gain d’acuité visuelle moyen obtenu avec ce dernier est de + 6,1 lettres versus + 0,8 lettre dans le groupe laser. En ce qui concerne les gains supérieurs ou égaux à 15 lettres, ils sont observés dans 22,6 % dans le groupe RBZ versus 8,2 % dans le groupe laser. De plus, le gain d’acuité visuelle dans le groupe RBZ s’installe rapidement dès les premiers mois, contrairement au laser [18] ;
-
des constatations identiques sont retrouvées dans l’étude BOLT comparant laser et bévacizumab (BVZ) et dans les études VIVID/VISTA comparant laser et aflibercept (AFB) [19]. Dans l’étude BOLT, on constate une variation de l’acuité visuelle de −0,5 lettre à 2 ans dans le groupe laser (versus + 8,6 dans le groupe BVZ) ; 49 % des patients gagnent plus de 10 lettres et 100 % perdent moins de 15 lettres dans le groupe sous anti-VEGF contre 7 % et 86 % dans le groupe laser. Dans les études VIVID/VISTA, on observe également à 1 an que le laser fait moins bien que l’AFB, avec un gain sous laser compris entre 0,2 et 1,2 lettre contre un gain compris entre 10,5 et 12,5 dans les groupes sous AFB [19].
Enfin des études portant sur le RBZ et l’AFB comparés au laser ont montré des résultats inférieurs, en termes de sensibilité aux contrastes, du laser par rapport aux deux anti-VEGF [20, 21].
Au total, en cas d’OMD central, toutes les études confirment la supériorité du traitement par anti-VEGF en première intention par rapport au traitement par laser. Toutefois, en cas d’OM atteignant la région centrale, dû principalement à des diffusions à partir de micro-anévrismes accessibles au laser, le traitement par laser peut être efficace, mais son effet est lent et retardé (fig. 8-82).
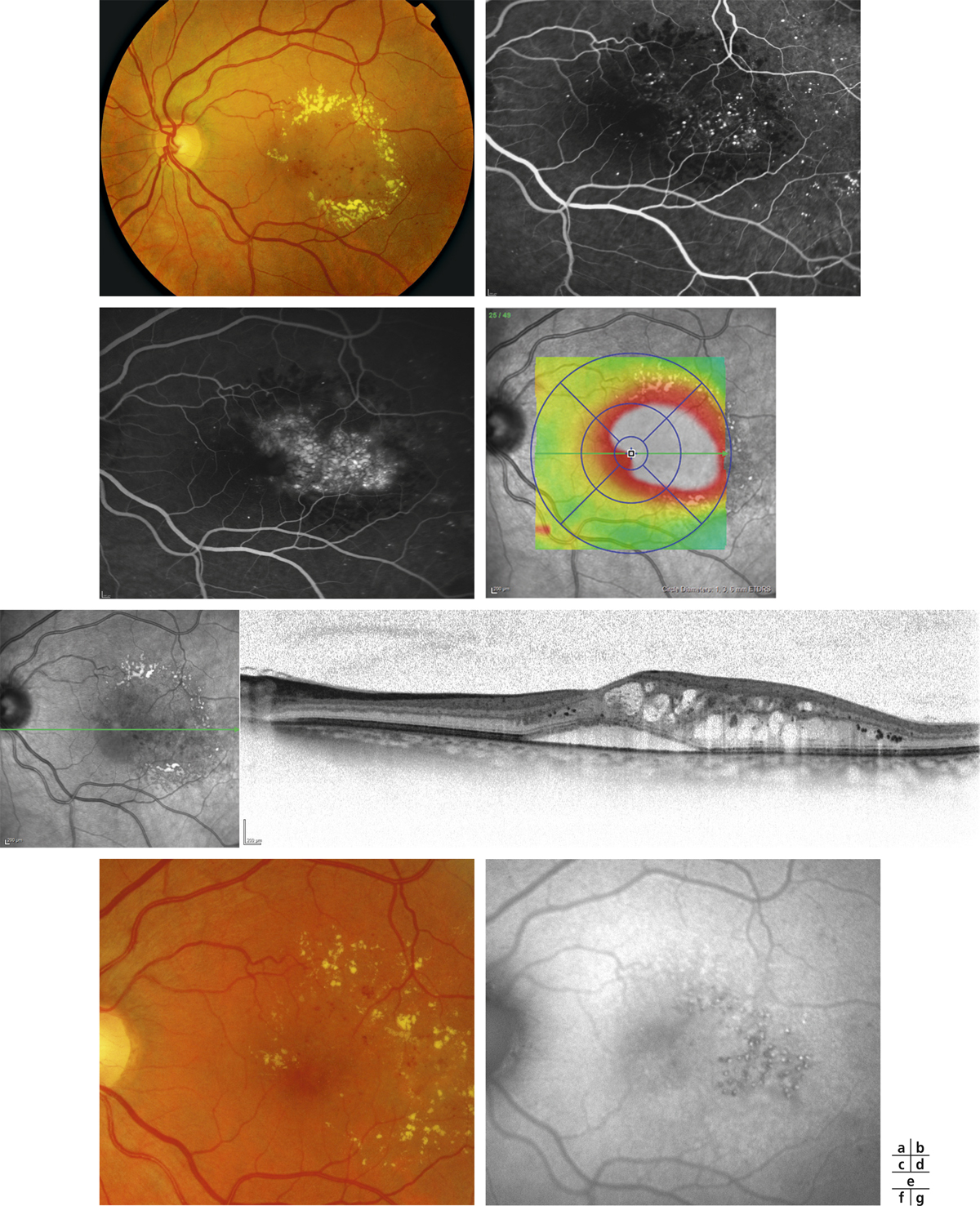
Fig. 8-82 Traitement par laser d’un œdème maculaire diabétique sévère, secondaire à des diffusions focales.
a. Cliché en couleurs : œdème à prédominance temporomaculaire, entouré d’une couronne d’exsudats lipidiques. L’acuité visuelle est de 0,6 Parinaud 3. b. Cliché artérioveineux de l’angiographie montrant les nombreux micro-anévrismes localisés en temporal de la macula, principaux responsables de l’œdème. c. Cliché tardif de l’angiographie : OM microkystique en nids d’abeilles à prédominance temporomaculaire. d. Cartographie maculaire montrant l’épaississement maculaire touchant la région centrale. e. Coupe OCT horizontale : épaississement rétinien prédominant en temporal du pôle postérieur, associé à de nombreux kystes intrarétiniens, dont un kyste central, et à un décollement séreux rétinien. f. Six mois après le traitement par laser : les exsudats se sont en partie résorbés. L’acuité visuelle s’est améliorée à 0,7 Parinaud 2. g. Cliché en autofluorescence objectivant les cicatrices de laser. Le laser a été appliqué à plus de 700 μ du centre de la macula, les micro-anévrismes plus proches du centre n’ont pas été traités.
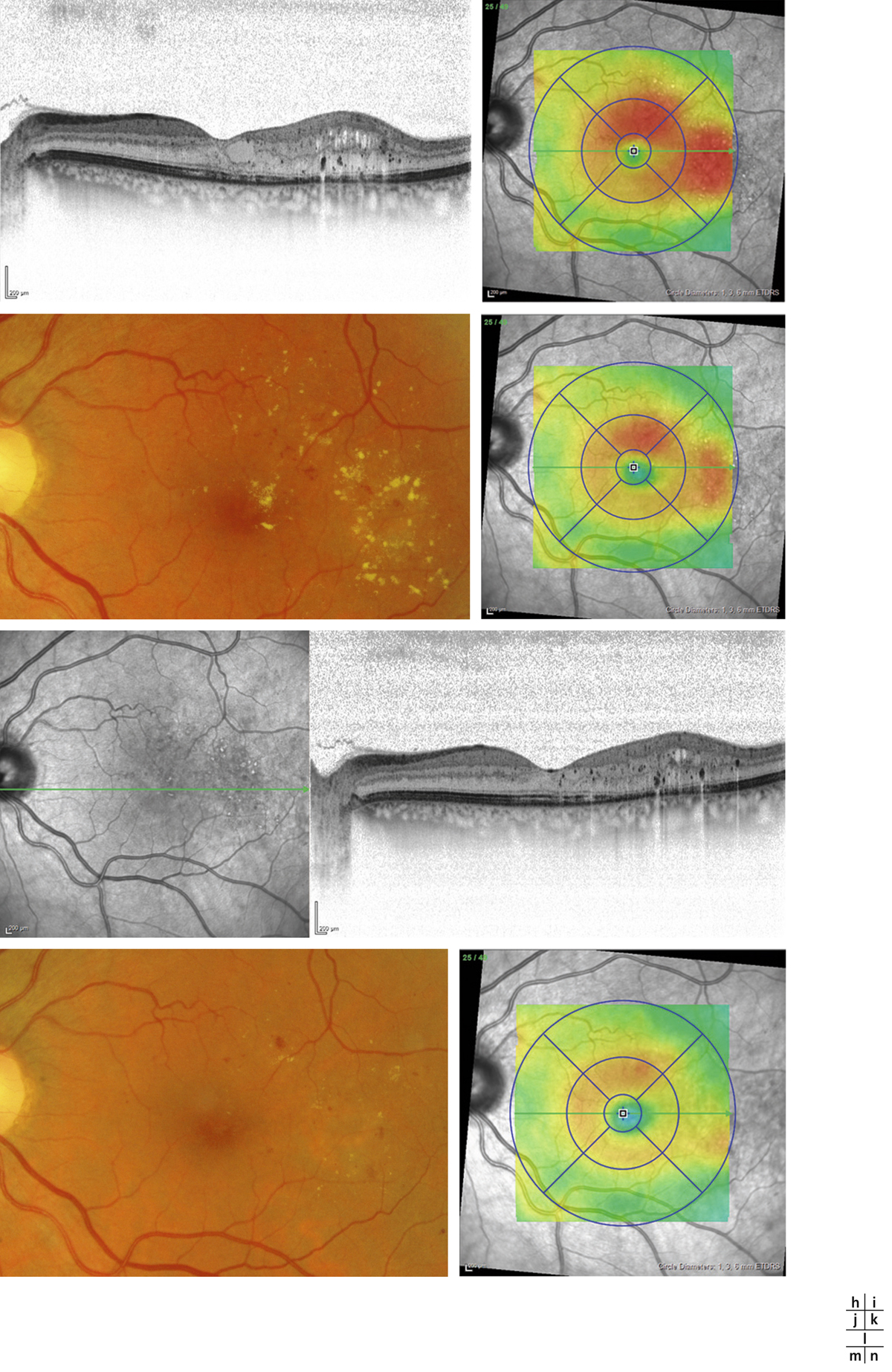
Fig. 8-82 Traitement par laser d’un œdème maculaire diabétique sévère, secondaire à des diffusions focales. (suite)
h. On observe sur la coupe OCT une réduction de l’épaississement maculaire et une disparition du décollement séreux rétinien. Il persiste des kystes d’œdème intrarétinien. i. La cartographie maculaire montre une réduction majeure de l’épaississement rétinien. j. Quatre mois plus tard, le nombre des exsudats a encore diminué. k. La cartographie maculaire objective la poursuite de la réduction d’épaississement maculaire. l. Sur la coupe OCT, il ne persiste plus que quelques kystes intrarétiniens. m. Photographie couleur. Six mois plus tard, les exsudats ont complètement disparu. n. La cartographie maculaire montre une quasi-normalisation de l’épaisseur maculaire et du profil fovéolaire.
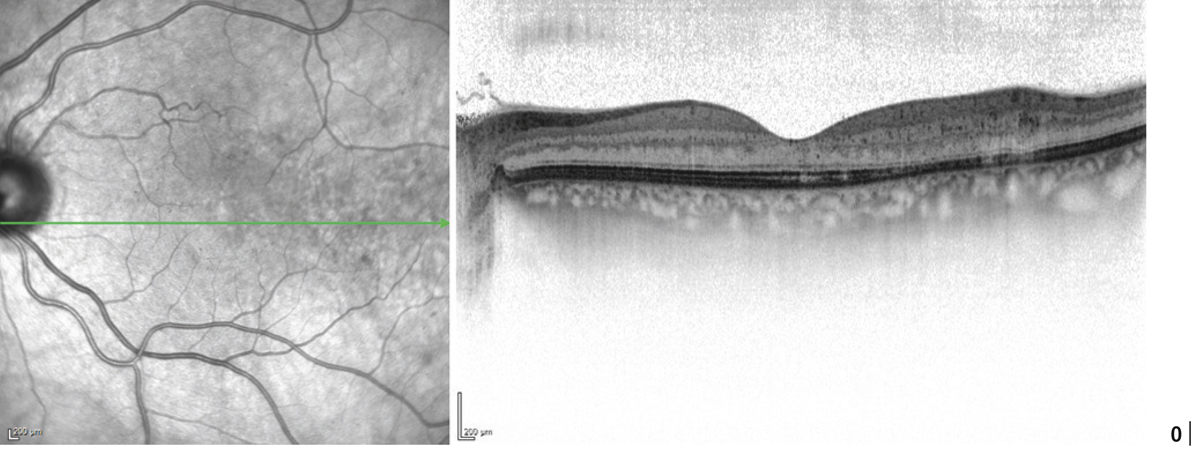
Fig. 8-82 Traitement par laser d’un œdème maculaire diabétique sévère, secondaire à des diffusions focales. (suite)
(Clichés du Dr P. Massin.)
Le mécanisme d’action mis en jeu au cours du laser étant différent de celui des IVT d’un anti-VEGF ou d’un stéroïde, il a semblé très vite pertinent d’évaluer l’intérêt d’un traitement combiné injection–laser maculaire. Cette association thérapeutique permet-elle d’augmenter l’efficacité thérapeutique par rapport à une monothérapie, ou permet-elle de diminuer le nombre d’IVT ? Plusieurs études ont évalué cette association.
L’étude RESTORE est la première à avoir comparé RBZ en monothérapie versus RBZ + laser. Cette association n’apporte pas de bénéfice ni en termes d’acuité visuelle, ni en termes anatomiques. Les acuités visuelles sont même meilleures dans le groupe monothérapie que dans le groupe combiné avec des niveaux de gain d’acuité visuelle respectifs (en lettres ETDRS) de + 6,1 versus + 5,9 à 1 an, de + 7,9 versus + 6,7 à 2 ans, et de +8,0 versus + 6,7 à 3 ans. De même, les épaisseurs rétiniennes centrales sont voisines tout au long du suivi avec par exemple à 1 an une réduction de l’épaisseur rétinienne centrale de −118 μ en cas de monothérapie et de −128 μ en cas de traitement combiné [18, 22, 23].
On constate toutefois une discrète diminution du nombre d’IVT nécessaires au cours des 2e et 3e années, avec 6,8 IVT en 2 ans dans le groupe monothérapie, versus 6 IVT dans le groupe traitement combiné.
De la même manière, une étude avec un effectif plus limité (trois groupes de 42 patients), l’étude READ-2 n’observe pas de bénéfice visuel à un traitement combiné IVT–laser et cela, quel que soit le moment de l’évaluation sur une période de 3 ans. Ainsi au terme de 2 ans de suivi le gain d’acuité visuelle est de + 7,7 lettres dans le groupe monothérapie, versus 6,8 lettres dans le groupe traitement combiné. Après 3 ans de suivi, on note un peu plus d’IVT dans le groupe monothérapie que dans le groupe combiné mais cette différence n’est pas statistiquement significative au cours de la troisième année [24, 25].
En 2007, Lam et al. ont évalué l’intérêt d’un traitement séquentiel corticoïdes (triamcinolone) suivi, 1 mois après, d’une photocoagulation maculaire par rapport à un traitement par injection en monothérapie de corticoïdes. À nouveau, le traitement combiné n’apporte pas de bénéfice visuel par rapport à un traitement par monothérapie. Il semble toutefois prolonger l’effet anatomique asséchant du corticoïde. En effet, à 17 semaines, il existait une différence significative de variation de l’épaisseur rétinienne centrale entre traitement combiné et monothérapie. Cette différence n’était plus constatée au 6e mois [26].
Au total, associer IVT et laser en première intention n’apporte aucun bénéfice visuel supplémentaire par rapport aux IVT en monothérapie.
Le protocole I du DRCRnet a eu pour but de déterminer l’intérêt d’associer du laser à des IVT de RBZ. Deux groupes de patients traités par RBZ ont été comparés : dans le premier groupe, les patients avaient obligatoirement du laser effectué à l’initiation du traitement (groupe IVT + laser immédiat) ; dans le second groupe, les patients pouvaient avoir du laser mais pas avant la 24e semaine (groupe IVT + laser différé) [14]. Les résultats à 5 ans ont été récemment publiés et montrent que la réalisation de laser immédiat n’est pas bénéfique en termes d’acuité visuelle, voire même délétère, par rapport à la réalisation d’un traitement différé (différence de 2,6 lettres entre les deux groupes) [27]. Au terme de 5 ans de suivi, 56 % des patients n’ont pas eu besoin de laser complémentaire. Tout au long du suivi, sur les 5 ans, le niveau d’acuité visuelle était meilleure dans le groupe IVT + laser différé que dans le groupe laser immédiat. La différence entre les deux groupes était d’autant plus élevée que l’acuité visuelle initiale était inférieure à 4/10. De même, il n’y a pas eu de bénéfice à un traitement laser immédiat sur l’épaisseur rétinienne centrale. Le seul bénéfice retrouvé dans cette étude, à l’adjonction d’un traitement immédiat, a été de permettre de diminuer le nombre d’IVT avec un nombre médian inférieur de 4 IVT retrouvé dans le traitement laser immédiat.
Les auteurs attribuent la différence d’acuité visuelle entre les deux groupes au fait que soit les patients dans le groupe IVT + laser différé ont eu plus d’IVT en 5 ans (17 versus 13), soit le laser, effectué de façon systématique à l’initiation du traitement, pourrait avoir entraîné des dégâts maculaires à l’origine d’altérations de la fonction visuelle.
Au total, la réalisation d’un traitement combiné associant laser et IVT, avec réalisation du laser dès l’initiation du traitement, n’apporte aucun bénéfice fonctionnel ou anatomique. Cela ne signifie pas pour autant qu’il ne faut plus réaliser de laser en cas d’OM initialement central. Il doit être effectué après 6 mois de traitement par IVT, lorsque persistent, à ce stade, des zones d’épaississement rétinien, et sous réserve que les impacts à effectuer soient réalisés en dehors d’une zone d’un diamètre papillaire centrée sur la macula.
Le laser PASCAL® (PAttern SCAnning Laser) est un laser récent, émettant des pulses de 532 nm et permettant de délivrer des impacts multiples appliqués en un seul coup de pédale. Il s’agit d’un modèle de laser semi-automatique à balayage. Un des intérêts majeurs de ce type de laser est de pouvoir minimiser le temps de délivrance de l’impact. Les impacts sont courts réduisant ainsi les effets thermiques nocifs. Les impacts peuvent être distribués sous forme de pulses de 10 ms à 1 000 ms, avec des intervalles de 10 ms. Cette diminution de la durée des impacts entraîne une diffusion thermique moindre (avec moins d’extension des cicatrices) et une sensation douloureuse moindre par rapport au laser conventionnel.
Il existe quelques données dans la littérature sur l’utilisation du laser PASCAL® dans le traitement focal ou en grid de l’OMD. Souvent, les impacts sont délivrés sous forme d’un spot unique et non pas avec le pattern spécifique destiné, en théorie, à la réalisation d’un grid. Les études se sont surtout intéressées à confirmer que des impacts appliqués à la limite de la visibilité étaient efficaces pour réduire l’OMD. Une étude récente a montré que des impacts de 100 μ avec des durées de 10 ms permettaient d’avoir un effet sur la rétine [28]. Cet effet est confirmé par la visualisation au fond d’œil des impacts, partiellement visibles dans l’heure qui suit leur réalisation, et par les clichés en autofluorescence. De même, une modification de la réflectivité rétinienne est observée en OCT au niveau des zones d’impact du laser. L’hyperautofluorescence des lésions s’accentue avec le temps. Les examens d’imagerie semblent confirmer que l’effet du laser reste cantonné à la zone où a eu lieu l’impact, avec peu de diffusion en profondeur et latéralité de la brûlure induite. Cela tend à réduire l’œdème induit par le laser et à limiter les phénomènes d’élargissement des impacts ce qui, au final, minimise la cicatrice induite. En termes d’efficacité, le laser PASCAL®, est efficace, au moins à court terme, pour réduire l’OMD [29].
La réalisation d’un traitement maculaire n’est pas toujours aisée. Pour le traitement focal, les impacts doivent être placés sur les micro-anévrismes repérés en imagerie et la concordance n’est pas toujours évidente, notamment si les milieux ne sont pas transparents ou si le patient bouge. Récemment, un nouveau système laser non contact a été développé, le système NAVILAS®. Il s’agit d’un système de laser (laser à 532 nm émettant des impacts monospot ou multispot) couplé à un eyetracker qui est intégré à un système d’acquisition d’images (cliché en couleurs, anérythre, infrarouge et angiographie à la fluorescéine).
Le laser est appliqué sur la rétine directement à partir des images acquises par l’appareil à l’aide d’une caméra (et non pas d’une lampe à fente), la délivrance des impacts se fait de façon non-contact (il n’y a pas de verre posé sur l’œil) mais à partir des données que l’on voit sur l’écran. La présence d’un eyetracker permet de compenser les mouvements du patient et autorise un traitement délivré avec plus de précision.
Les premiers résultats avec ce laser ont été publiés en 2011 et ont inclus 86 yeux présentant un OMD. Les auteurs retrouvent une plus grande précision de traitement puisque les micro-anévrismes repérés ont pu être ciblés dans 92 % des cas contre seulement 72 % avec un laser traditionnel [30].
Ce système pourrait contribuer à diminuer le nombre de traitements par laser (à 8 mois, le taux de retraitement est de 18 % pour le NAVILAS® versus 31 % pour le laser conventionnel) [7]. Il permettrait peut-être même de diminuer le besoin en IVT : une étude récente comparant IVT et NAVILAS® versus IVT en monothérapie a montré qu’après 3 IVT initiales de RNB, le groupe de patients ayant eu un traitement combiné a eu besoin de 0,88 IVT supplémentaire au terme de la première année versus 3,8 IVT dans le groupe IVT sans NAVILAS® [31].
Dans les faits, un plus grand nombre d’études est indispensable pour confirmer ces éléments et surtout pour apprécier sa facilité d’utilisation en pratique.
À la différence des lasers conventionnels émettant un faisceau laser en continu, les lasers micropulse (le plus souvent laser diode infrarouge à 810 nm) délivrent des durées de pulses courtes (de l’ordre de la milliseconde ou de la microseconde), regroupées dans une enveloppe de tir. Ce mode de délivrance permet de limiter les dégâts thermiques au sein de la rétine et confine, pour l’essentiel, l’effet du laser à l’épithélium pigmentaire. Les impacts ainsi créés sont en dessous du seul de visibilité et n’induisent pas de blanchiment de la rétine tout en limitant les effets secondaires liés au laser. Le mécanisme exact par lequel ce type de laser agit est incomplètement élucidé : l’effet serait essentiellement médié par l’épithélium pigmentaire.
De nombreuses études, dont une méta-analyse réalisée à partir de quatre études, ont suggéré que ce type de laser était aussi efficace que le laser conventionnel avec un meilleur profil de tolérance locale (puisque ce type de laser limite les lésions rétiniennes induites) [32]. Cependant, il convient de rappeler que le laser micropulse a encore une diffusion assez limitée, probablement lié au fait que :
-
il est difficile de mettre en œuvre un traitement pour lequel on ne sait pas si l’énergie délivrée est suffisante en raison de l’absence d’effet ophtalmoscopiquement visible au moment de la délivrance ;
-
il n’y a pas, encore, de consensus sur l’irradiance nécessaire à la mise en œuvre de ce type de traitement [2].
B. Dupas
Comme dans les occlusions de branche veineuse rétiniennes [35], des macro-anévrismes capillaires peuvent se développer dans l’OMD chronique et aboutir à des œdèmes parfois réfractaires. Ils sont le plus souvent entourés de nombreux exsudats lipidiques, qui font suspecter leur présence. Ils peuvent être visibles au fond d’œil sous la forme d’une lésion rouge/rosée, entourée d’une coque blanchâtre, leur diamètre étant souvent supérieur à 150 µm. La détection de ces macro-anévrismes peut se faire sur l’OCT en examinant soigneusement toutes les coupes du cube, mais c’est l’angiographie notamment en indocyanine green (ICG) qui permet de visualiser au mieux ces anomalies macro-anévrismales (fig. 8-83a, b et c). À noter que ces lésions, si elles sont très bien visualisées en OCT « en face », ne sont que rarement bien visualisables en OCT-angiographie, du fait des probables turbulences ou ralentissements du flux sanguin à leur niveau (eFig. 8-22 ).
).
La détection systématique et le traitement par photocoagulation ciblée sur ces anomalies permettent souvent, lorsque ces dernières sont accessibles au laser, de faire régresser l’OMD totalement ou partiellement, un traitement adjuvant par IVT pouvant être nécessaire. La technique de photocoagulation consiste à repérer précisément la lésion et à délivrer des impacts d’une durée d’au moins 30 ms sur la lésion pour obtenir son blanchiment. Un contrôle par OCT permet de vérifier si le contenu de la lésion devient hyper-réflectif, indiquant que le traitement a été efficace. Quelques semaines seulement peuvent être nécessaires pour obtenir une diminution de l’épaisseur maculaire, les exsudats disparaissant quant à eux en plusieurs mois (fig. 8-83d). Des séances de photocoagulation complémentaires peuvent être nécessaires si l’anévrisme est toujours perméable en angiographie.
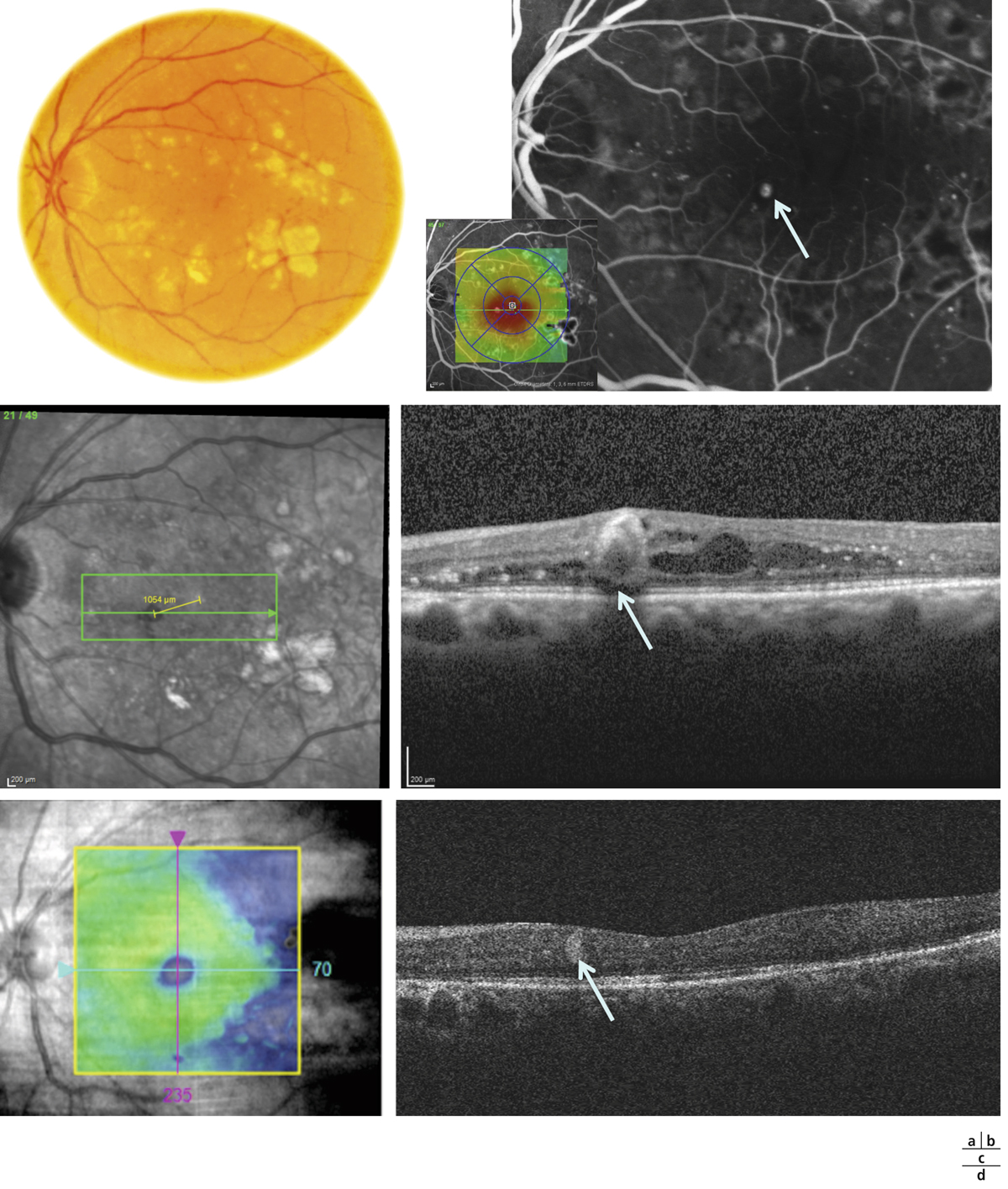
Fig. 8-83 Patient résistant à un traitement par anti-VEGF.
a. Cliché en couleurs montrant une couronne d’exsudats associée à des séquelles de laser maculaire. b. L’angiographie à la fluorescéine permet de bien visualiser le macro-anévrisme (flèche) qui est situé au centre de la couronne d’exsudats. c. OCT montrant l’anévrisme situé à 1 000 µm de la fovéa (caliper), formé d’une « coque » hyper-réflective avec contenu hyporéflectif (flèche), et associé à un épaississement rétinien. d. 3 mois après photocoagulation au laser : normalisation de l’épaisseur maculaire, l’anévrisme est toujours visible mais son contenu est hyper-réflectif (flèche), témoignant de la thrombose.
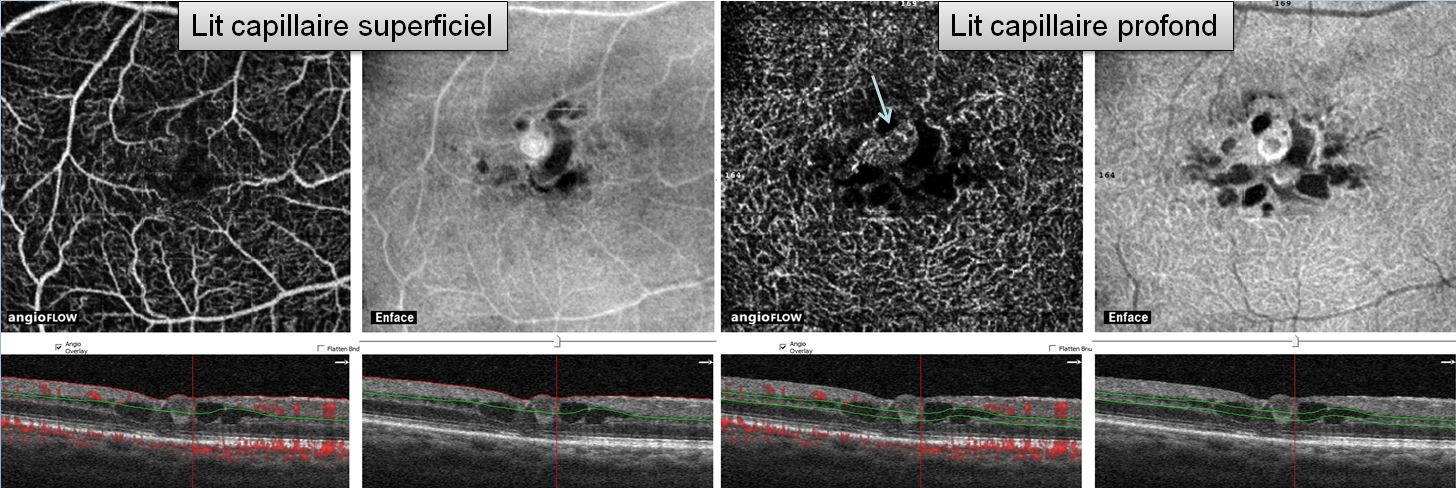
eFig. 8-22 À gauche : macro-anévrisme bien visible sur l’image « en face » mais non visible sur l’angiogramme du lit capillaire superficiel. À droite : macro-anévrisme bien visible sur l’image « en face » et très légèrement visible sur l’angiogramme du lit capillaire profond.
[1] Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Arch Ophthalmol 1985 ; 103 : 1796-806.
[2] Romero-Aroca P, Reyes-Torres J, Baget-Bernaldiz M, Blasco-Suñe C. Laser treatment for diabetic macular edema in the 21st century. Curr Diabetes Rev 2014 ; 10 : 100-12.
[3] Park YG, Kim EY, Roh YJ. Laser-based strategies to treat diabetic macular edema : history and new promising therapies. J Ophthalmol 2014 ; 2014 : 769213.
[4] Writing Committee for the Diabetic Retinopathy Clinical Research Network, Fong DS, Strauber SF, Aiello LP, et al. Comparison of the modified Early Treatment Diabetic Retinopathy Study and mild macular grid laser photocoagulation strategies for diabetic macular edema. Arch Ophthalmol 2007 ; 125 : 469-80.
[5] Gallego-Pinazo R, Suelves-Cogollos AM, Dolz-Marco R, et al. Macular laser photocoagulation guided by spectral-domain optical coherence tomography versus fluorescein angiography for diabetic macular edema. Clin Ophthalmol Auckl NZ 2011 ; 5 : 613-7.
[6] Kozak I, El-Emam SY, Cheng L, et al. Fluorescein angiography versus optical coherence tomography-guided planning for macular laser photocoagulation in diabetic macular edema. Retina 2014 ; 34 : 1600-5.
[7] Neubauer AS, Langer J, Liegl R, et al. Navigated macular laser decreases retreatment rate for diabetic macular edema : a comparison with conventional macular laser. Clin Ophthalmol Auckl NZ 2013 ; 7 : 121-8.
[8] Schatz H, Madeira D, McDonald HR, Johnson RN. Progressive enlargement of laser scars following grid laser photocoagulation for diffuse diabetic macular edema. Arch Ophthalmol 1991 ; 109 : 1549-51.
[9] Maeshima K, Utsugi-Sutoh N, Otani T, Kishi S. Progressive enlargement of scattered photocoagulation scars in diabetic retinopathy. Retina 2004 ; 24 : 507-11.
[10] Bandello F, Cunha-Vaz J, Chong NV, et al. New approaches for the treatment of diabetic macular oedema : recommendations by an expert panel. Eye 2012 ; 26 : 485-93.
[11] Scott IU, Danis RP, Bressler SB, et al. Effect of focal/grid photocoagulation on visual acuity and retinal thickening in eyes with non-center-involved diabetic macular edema. Retina 2009 ; 29 : 613-7.
[12] Diabetic Retinopathy Clinical Research Network. A randomized trial comparing intravitreal triamcinolone acetonide and focal/grid photocoagulation for diabetic macular edema. Ophthalmology 2008 ; 115 : 1447-9, 1449.e1-10.
[13] Diabetic Retinopathy Clinical Research Network, Beck RW, Edwards AR, Aiello LP, et al. Three-year follow-up of a randomized trial comparing focal/grid photocoagulation and intravitreal triamcinolone for diabetic macular edema. Arch Ophthalmol 2009 ; 127 : 245-51.
[14] Diabetic Retinopathy Clinical Research Network, Elman MJ, Aiello LP, Beck RW, et al. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2010 ; 117 : 1064-77.e35.
[15] Elman MJ, Bressler NM, Qin H, et al. Expanded 2-year follow-up of ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2011 ; 118 : 609-14.
[16] Chen G, Li W, Tzekov R, et al. Ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema : a meta-analysis of randomized controlled trials. PloS One 2014 ; 9 : e115797.
[17] Nguyen QD, Shah SM, Heier JS, et al. Primary End Point (six months) results of the ranibizumab for edema of the macula in diabetes (READ-2) study. Ophthalmology 2009 ; 116 : 2175-81.e1.
[18] Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study : ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011 ; 118 : 615-25.
[19] Korobelnik JF, Do DV, Schmidt-Erfurth U, et al. Intravitreal aflibercept for diabetic macular edema. Ophthalmology 2014 ; 121 : 2247-54.
[20] Comyn O, Sivaprasad S, Peto T, et al. A randomized trial to assess functional and structural effects of ranibizumab versus laser in diabetic macular edema (the LUCIDATE study). Am J Ophthalmol 2014 ; 157 : 960-70.
[21] Gonzalez VH, Boyer DS, Schmidt-Erfurth U, et al. Microperimetric assessment of retinal sensitivity in eyes with diabetic macular edema from a phase 2 study of intravitreal aflibercept. Retina 2015 ; 35 : 687-94.
[22] Lang GE, Berta A, Eldem BM, et al. Two-year safety and efficacy of ranibizumab 0.5 mg in diabetic macular edema: interim analysis of the RESTORE extension study. Ophthalmology 2013 ; 120 : 2004-12.
[23] Schmidt-Erfurth U, Lang GE, Holz FG, et al. Three-year outcomes of individualized ranibizumab treatment in patients with diabetic macular edema : the RESTORE extension study. Ophthalmology 2014 ; 121 : 1045-53.
[24] Nguyen QD, Shah SM, Khwaja AA, et al. Two-year outcomes of the ranibizumab for edema of the macula in diabetes (READ-2) study. Ophthalmology 2010 ; 117 : 2146-51.
[25] Do DV, Nguyen QD, Khwaja AA, et al. Ranibizumab for edema of the macula in diabetes study : 3-year outcomes and the need for prolonged frequent treatment. JAMA Ophthalmol 2013 ; 131 : 139-45.
[26] Lam DSC, Chan CKM, Mohamed S, et al. Intravitreal triamcinolone plus sequential grid laser versus triamcinolone or laser alone for treating diabetic macular edema : six-month outcomes. Ophthalmology 2007 ; 114 : 2162-7.
[27] Elman MJ, Ayala A, Bressler NM, et al. Intravitreal Ranibizumab for diabetic macular edema with prompt versus deferred laser treatment : 5-year randomized trial results. Ophthalmology 2015 ; 122 : 375-81.
[28] Muqit MMK, Gray JCB, Marcellino GR, et al. Barely visible 10-millisecond pascal laser photocoagulation for diabetic macular edema: observations of clinical effect and burn localization. Am J Ophthalmol 2010 ; 149 : 979-86.e2.
[29] Jain A, Collen J, Kaines A, et al. Short-duration focal pattern grid macular photocoagulation for diabetic macular edema : four-month outcomes. Retina 2010 ; 30 : 1622-6.
[30] Kozak I, Oster SF, Cortes MA, et al. Clinical evaluation and treatment accuracy in diabetic macular edema using navigated laser photocoagulator NAVILAS. Ophthalmology 2011 ; 118 : 1119-24.
[31] Liegl R, Langer J, Seidensticker F, et al. Comparative evaluation of combined navigated laser photocoagulation and intravitreal ranibizumab in the treatment of diabetic macular edema. PloS One 2014 ; 9 : e113981.
[32] Sivaprasad S, Dorin G. Subthreshold diode laser micropulse photocoagulation for the treatment of diabetic macular edema. Expert Rev Med Devices 2012 ; 9 : 189-97.
[33] Brown DM, Schmidt-Erfurth U, Do DV, et al. Intravitreal aflibercept for diabetic macular edema : 100-week results from the VISTA and VIVID Studies. Ophthalmology 2015 ; 122 : 2044-52.
[34] Ishibashi T, Li X, Koh A, et al. ; REVEAL Study Group. The REVEAL Study : ranibizumab monotherapy or combined with laser versus laser monotherapy in Asian patients with diabetic macular edema. Ophthalmology 2015 ; 122 : 1402-15.
[35] Bourhis A, Girmens JF, Boni S, et al. Imaging of macroaneurysms occurring during retinal vein occlusion and diabetic retinopathy by indocyanine green angiography and high resolution optical coherence tomography. Graefes Arch Clin Exp Ophthalmol 2010 ; 248 : 161-6.
J. Conrath
➤ Les traitements par IVT d’acétonide de triamcinolone, d’implant de dexaméthasone et d’acétonide de fluocinolone sont efficaces pour traiter l’OMD.
➤ Leur effet bénéfique est limité par leurs effets secondaires.
➤ Le taux d’effets secondaires varie selon le corticoïde utilisé : il est plus élevé avec la triamcinolone et l’acétonide de fluocinolone qu’avec la dexaméthasone.
➤ Avec l’apparition de l’implant de dexaméthasone, l’acétonide de triamcinolone n’est plus indiqué pour traiter l’OMD.
➤ La durée de l’efficacité de l’implant de dexaméthasone est de l’ordre de 3 à 4 mois.
➤ L’implant de dexaméthasone est indiqué dans l’OMD associé à une baisse visuelle, de première intention chez les patients pseudophaques et chez les patients pour lesquels un traitement non corticoïde ne convient pas, et de deuxième intention chez les patients insuffisamment répondeurs à un traitement non corticoïde.
➤ L’implant d’acétonide de fluocinolone aurait un effet thérapeutique d’une durée de 2 à 3 ans. Il est indiqué en cas d’OMD chronique lorsque la réponse aux autres traitements disponibles est insuffisante.
La pathogénie de l’OMD est complexe et fait intervenir de nombreux facteurs (voir plus haut chapitre 8.2) [1], notamment des facteurs de croissance vasculaire (le VEGF-A principalement) et d’autres facteurs, pro-inflammatoires (IL-6, ICAM, TNF-α) [2]. Le mécanisme d’action des corticoïdes dans l’OMD est multifactoriel ; les corticoïdes permettent de stabiliser la BHR interne grâce à leurs propriétés anti-inflammatoire, anti-apoptotique, anti-œdémateuse et anti-angiogénique [3]. Par ailleurs, les corticoïdes administrés par voie intravitréenne possèdent des propriétés neuroprotectrices anti-apoptotiques [4] et protègent la rétine de l’agression de la lumière dans un modèle de rétinite pigmentaire [5].
Monin et al. ont, en 1994, rapporté le premier cas d’OMD traité par corticostéroïdes [6] : il s’agissait d’un traitement par voie orale à fortes doses (1 mg/kg) avec surveillance en milieu hospitalier, et évaluation de l’œdème et du décollement séreux rétinien par examen du fond d’œil au verre à 3 miroirs. Un traitement par photocoagulation au laser avait été effectué, une fois le décollement séreux réappliqué. Un gain visuel de 2 à 4 lignes a été rapporté. Le risque de décompensation du diabète étant élevé, ce traitement est resté confidentiel. Afin de minimiser le risque de décompensation systémique, d’autres voies d’administration ont été ensuite explorées.
La voie intravitréenne présente des avantages théoriques très intéressants par rapport à l’administration systémique de corticostéroïdes, permettant la délivrance d’une dose faible mais efficace de traitement directement en regard du site de l’œdème, sans risque de décompensation du diabète en raison d’un passage systémique très faible (voir chapitre 6.3). Trois molécules sont actuellement utilisées en IVT (fig. 8-84). Leur activité anti-inflammatoire diffère (tableau 8-15). Il a cependant fallu s’affranchir de leur demi-vie courte, de l’ordre de 2 à 3 heures pour la triamcinolone, la dexaméthasone et le fluocinolone [7]. Cela a été obtenu soit à partir de la dissolution lente du principe actif qui est cristallisé (cas de la triamcinolone), soit par le relargage progressif du principe actif qui est libéré à partir d’une matrice biodégradable (cas de la dexaméthasone), soit depuis un petit tube en polyimide, matériau non biodégradable, utilisé pour fabriquer les haptiques de certains implants cristalliniens (cas de la fluocinolone).

Fig. 8-84 Structures moléculaires de l’acétonide de fluocinolone, de l’acétonide de triamcinolone et de la dexaméthasone.

Tableau 8-15 Puissance relative des différents corticostéroïdes.
Jonas a publié le premier cas de traitement d’un OMD par IVT de triamcinolone chez un patient ayant un œdème réfractaire aux autres traitements [8]. Un gain visuel a été rapporté (amélioration de 1 à 4/10e), mais avec un pic d’hypertonie à 30 mmHg. Au début des années 2000, de nombreuses études sur l’utilisation de la triamcinolone par voie intravitréenne dans toutes les indications d’OM, quelle qu’en soit l’étiologie, ont été publiées. Des études de dose ont été réalisées dans des cas d’OMD réfractaire : la dose de 4 mg n’a pas montré d’efficacité supérieure à celle de 2 mg dans une étude randomisée prospective contrôlée [9]. Cependant elle reste la dose la plus souvent utilisée (elle correspond à 0,1 mL de la préparation commerciale habituelle non diluée). L’utilisation de la mesure de l’épaisseur maculaire centrale par OCT constitue une excellente approximation de la pharmacocinétique de la triamcinolone. Celle-ci a une demi-vie estimée à 15,4 jours et une durée maximale d’effet de 140 jours [10]. Dans la première étude prospective randomisée publiée, portant sur 15 patients souffrant d’un OMD bilatéral, un œil étant traité et l’autre servant de témoin, Massin et al. ont montré, à 4 et à 12 semaines après injection, une réduction significative de l’épaississement maculaire central des yeux traités par triamcinolone par rapport aux yeux témoins [11]. En revanche, à 6 mois, il n’y avait plus de différence d’épaisseur entre les deux groupes en raison de la récidive de l’œdème (eFig. 8-23 ). À aucun moment n’a été observée une amélioration significative de l’acuité visuelle, probablement du fait qu’ont été inclus dans cette étude des œdèmes anciens ayant un potentiel visuel limité.
). À aucun moment n’a été observée une amélioration significative de l’acuité visuelle, probablement du fait qu’ont été inclus dans cette étude des œdèmes anciens ayant un potentiel visuel limité.
En Australie, l’équipe de Gillies a réalisé une étude randomisée chez des patients ayant un OMD réfractaire au traitement par laser, comparant une IVT de triamcinolone et une injection sous-conjonctivale de sérum physiologique [12]. Les patients pouvaient être retraités tous les 6 mois en cas de baisse d’acuité visuelle supérieure ou égale à 5 lettres, ou si l’épaisseur maculaire centrale était supérieure à 250 μm en TD-OCT. En cas d’inefficacité à 6 mois, le patient pouvait être retraité par laser. Un gain de 5 lettres ou plus a été observé chez 56 % des patients traités par triamcinolone versus 26 % des témoins (p = 0,006) avec une moyenne de 2,6 injections réalisées sur 2 ans. La diminution de l’épaisseur maculaire centrale était plus importante dans le groupe traité que dans le groupe contrôle (p = 0,009) (tableau 8-16).
Le DRCRnet a réalisé une étude prospective randomisée sur 2 ans portant sur 840 yeux de 693 patients répartis en trois groupes : un groupe était traité par injection intravitréenne (IVT) de 4 mg de triamcinolone, un deuxième par une IVT de 1 mg de triamcinolone et le troisième par laser maculaire [13]. À 4 mois, le groupe 4 mg a présenté les meilleurs résultats visuels mais cette supériorité n’existait plus à 12 mois. À 24 mois, l’acuité visuelle moyenne était significativement meilleure dans le groupe laser. Le nombre moyen d’injections sur 24 mois était de 3,1 dans le groupe 4 mg, 3,5 dans le groupe 1 mg et 2,9 séances ont été réalisées dans le groupe laser. Les résultats visuels différaient de ceux de l’étude de Gillies. Les différences dans les critères d’inclusion et les protocoles thérapeutiques peuvent expliquer ces résultats discordants. En revanche, le traitement par 4 mg de triamcinolone semblait très efficace chez les patients ayant l’acuité visuelle la plus basse à l’inclusion (de 20/200 à 20/320) puisque chez ces patients, un gain de 10 lettres ou plus à 2 ans a été observé dans 77 % des yeux traités par 4 mg de triamcinolone versus 46 % pour les yeux traités par 1 mg et 42 % des yeux traités par laser.
Les effets secondaires de l’IVT de triamcinolone comprennent l’apparition d’une cataracte (avec dans l’étude du DRCRnet des taux de chirurgie de la cataracte à 2 ans de 51 % dans le groupe 4 mg, 23 % dans le groupe 1 mg et 13 % dans le groupe laser [13]) et d’hypertonie oculaire (tableau 8-16). Le risque d’endophtalmie reste anecdotique et le taux ne semblait pas supérieur à celui observé lors d’IVT d’autres molécules. En outre, le passage de cristaux de triamcinolone en chambre antérieure chez le pseudophaque ou l’aphaque peut simuler une endophtalmie (fig. 8-85).
La voie sous-ténonienne a été utilisée de manière épisodique dans les années 2000 pour traiter l’OMD [17–19]. Cardillo et al., comparant l’administration de 4 mg de triamcinolone par voie intravitréenne et 40 mg par injection sous-ténonienne postérieure, ont montré une efficacité supérieure de la voie intravitréenne avec une tolérance identique des deux voies d’administration [17]. En revanche, lorsque l’acuité visuelle au départ est bonne (20/25) et l’épaississement maculaire central modéré (328 μm en moyenne), l’injection sous-ténonienne antérieure de 20 mg ou postérieure de 40 mg n’apportait pas de bénéfice visuel, et pouvait avoir des effets secondaires tels qu’un ptosis ou une hypertonie oculaire [18]. Enfin, cette voie d’administration de la cortisone était susceptible de décompenser un diabète puisque le passage systémique n’est pas négligeable [20].
En France, la triamcinolone n’a pas l’autorisation de mise sur le marché (AMM) pour une utilisation intravitréenne et, de ce fait, est de moins en moins utilisée puisque d’autres médications, avec moins d’effets secondaires, ont obtenu l’AMM et le remboursement pour le traitement intravitréen de l’OMD.
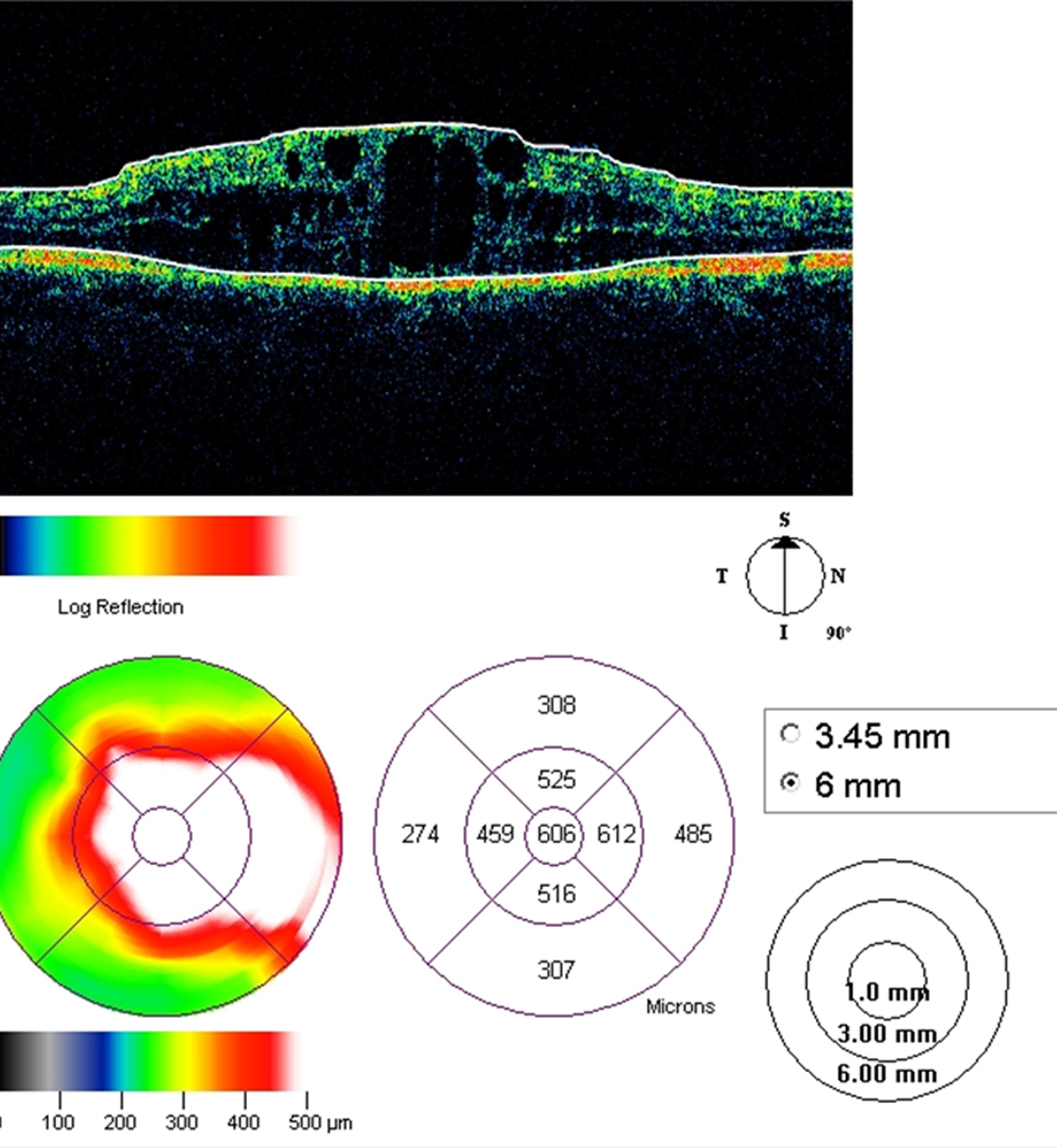
eFig. 8-23 Œdème maculaire diabétique traité par triamcinolone.
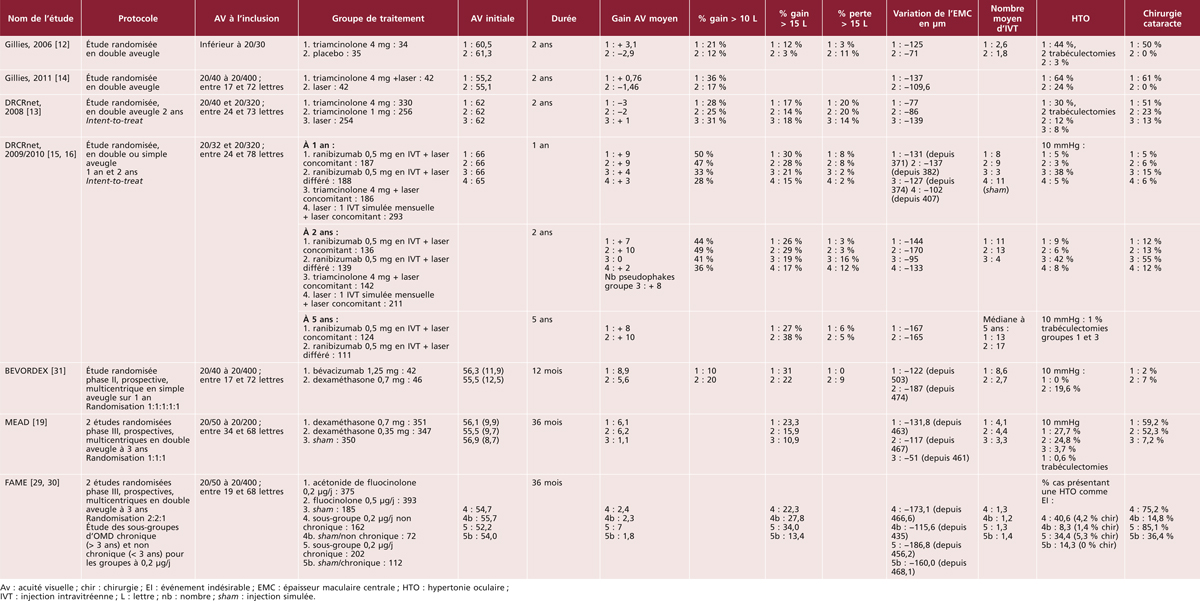
Tableau 8-16 Résumé des études randomisées ayant évalué l’efficacité du traitement par corticoïdes pour l’OMD.
Fig. 8-85 Pseudo-hypopion 2 jours après injection intravitréenne de triamcinolone.
L’œil est pseudophaque. Il est indolore.
L’implant de dexaméthasone à relargage progressif qui porte le nom d’Ozurdex® (Allergan), est composé d’un mélange de polymères d’acide polylactique et polyglycolique dont l’érosion spontanée libère progressivement la dexaméthasone (voir chapitre 6.3). Il a obtenu l’AMM pour le traitement des OM secondaires aux uvéites postérieures non infectieuses, aux occlusions veineuses rétiniennes et au diabète. Il est composé d’un bâtonnet qui mesure 6 mm de long (fig. 8-86a et b) et est injecté dans le vitré à la pars plana grâce à un dispositif « applicateur » (fig. 8-86c) doté d’une une aiguille creuse 22 G.
L’étude Macular Edema Assessment of implantable Dexamethasone in Diabetes (MEAD) a comparé deux doses de dexaméthasone à 350 μg et 700 μg contre placebo, de façon prospective et randomisée, en double insu [21]. Les trois bras comportaient respectivement 347, 351 et 350 patients pour un total de 1048 patients (un œil inclus par patient), suivis pendant 3 ans. L’acuité visuelle, à l’inclusion, était comprise entre 20/50 et 20/200 (l’acuité visuelle moyenne était de 56,2 lettres soit environ 20/80) et l’ancienneté de l’œdème était en moyenne de 24,9 mois. Soixante-six pour cent des yeux inclus avaient été traités préalablement par laser, 17,9 % par IVT de corticoïdes, 8,6 par IVT d’anti-VEGF, et 27,8 % n’avaient reçu aucun traitement. Un intervalle minimal de 6 mois entre deux injections était requis et une réinjection était indiquée si l’épaisseur maculaire centrale était supérieure à 175 μm en OCT Stratus® (Zeiss). Aucun traitement de secours n’était autorisé. Le critère d’évaluation principal était le pourcentage de patients présentant un doublement de l’acuité visuelle (+ 15 lettres ETDRS) à 3 ans. Ainsi, 22,2 % des patients du groupe 700 μg, 18,4 % du groupe 350 μg et 12 % du groupe placebo (p 0,001) ont atteint ce critère. Les courbes d’évolution de l’acuité visuelle ont montré une amélioration rapide de l’acuité visuelle dans les groupes traités par dexaméthasone, puis une diminution de l’acuité visuelle moyenne jusqu’au 24e mois du fait du développement d’une cataracte avec une remontée secondaire au fur et à mesure que les patients phaques se faisaient opérer de la cataracte (fig. 8-87). L’analyse de la courbe des patients initialement pseudophaques (n = 86 traités par 700 μg, n = 88 traités par 350 μg) a montré une amélioration initiale de l’acuité visuelle puis une stabilité de celle-ci tout au long des 3 ans de suivi (fig. 8-88 et 8-89). La réduction de l’épaisseur maculaire centrale était significativement plus importante dans les yeux des deux groupes traités par dexaméthasone par rapport à celle des yeux traités par placebo (−111,6 μm, −107,9 μm et −41,9 μm dans les groupes 700 μg, 350 μg et placebo respectivement, avec p 0,001). La sous-analyse réalisée chez les patients phaques a montré un effet « protecteur » de la dexaméthasone vis-à-vis de la survenue d’un syndrome d’Irvine-Gass après chirurgie de la cataracte : il n’y a pas eu d’augmentation de l’épaisseur maculaire après la chirurgie dans les deux groupes traités par dexaméthasone, alors qu’une augmentation de celle-ci a été notée dans le groupe placebo (p ≤ 0,003).
Les effets secondaires comprenaient l’apparition ou l’aggravation d’une cataracte préexistante, observée chez 67,9 %, 64,1 % et 20,4 % des patients phaques dans les groupes 700 μg, 350 μg et placebo respectivement. Une chirurgie de la cataracte a été réalisée chez 59,2 %, 52,3 % et 7,2 % d’entre eux respectivement. Une hypertonie oculaire a été observée chez 36 % des patients traités par 700 μg de dexaméthasone (32 % 25 mmHg, 6,6 % 35 mmHg) et 41,5 % des patients ont reçu un traitement hypotonisant. Seul un patient, dans chaque groupe traité par dexaméthasone, a nécessité une trabéculectomie (0,3 %). Le nombre moyen de traitements a été de cinq injections sur 3 ans dans le groupe 700 μg parmi les patients arrivés à la fin de l’étude (64,1 % des patients initialement inclus). En effet, seuls 57,9 % des patients inclus dans l’étude l’ont terminée, principalement du fait de l’interdiction de tout traitement de secours (laser ou autre IVT) au cours de l’étude. Une bonne proportion de patients a donc été sortie de l’étude.
D’autres publications ont montré l’efficacité de l’implant de dexaméthasone dans l’OMD [22, 23]. Une étude multicentrique rétrospective française [23] réalisée chez 74 patients (74 yeux) traités par implant de dexaméthasone a montré, avec un recul moyen de 9,8 mois, une amélioration moyenne de l’acuité visuelle de 7 lettres ETDRS, entre 2 et 4 mois après injection, et une diminution de l’épaisseur maculaire centrale de 239 μm au 2e mois. Les patients ont reçu 1,2 injection en moyenne pendant la période de suivi. Les facteurs prédictifs d’une bonne réponse au traitement étaient une épaisseur maculaire initiale inférieure à 500 μm et un œdème naïf de tout traitement. Vingt-sept pour cent des patients ont eu un gain de 3 lignes ou plus à 6 mois après injection et le délai de réinjection moyen a été de 5,4 mois. Une hypertonie oculaire a été retrouvée dans 13,4 % des yeux.
L’utilisation de l’implant de dexaméthasone paraît particulièrement adaptée aux yeux vitrectomisés, car il permet un relargage progressif du principe actif : ainsi, dans l’étude Champlain [24], 55 yeux vitrectomisés ont été traités par implant de dexaméthasone ; une amélioration de + 6 et + 3 lettres, avec une diminution de l’épaisseur maculaire centrale de 156 μm et 39 μm, ont été observées à 8 et 26 semaines après injection. Une étude rétrospective espagnole, comparant les résultats d’une injection de dexaméthasone dans 24 yeux vitrectomisés et 34 yeux non vitrectomisés, n’a pas retrouvé de différence statistiquement significative en termes d’amélioration de l’acuité visuelle ou de réduction de l’épaisseur maculaire entre les deux groupes [25].
L’implant de dexaméthasone est indiqué dans l’OMD associé à une baisse visuelle, chez trois groupes de patients :
-
de première intention :
-
chez les patients pseudophaques,
-
chez les patients pour lesquels un traitement non corticoïde ne convient pas ;
-
de deuxième intention, chez les patients insuffisamment répondeurs à un traitement non corticoïde.
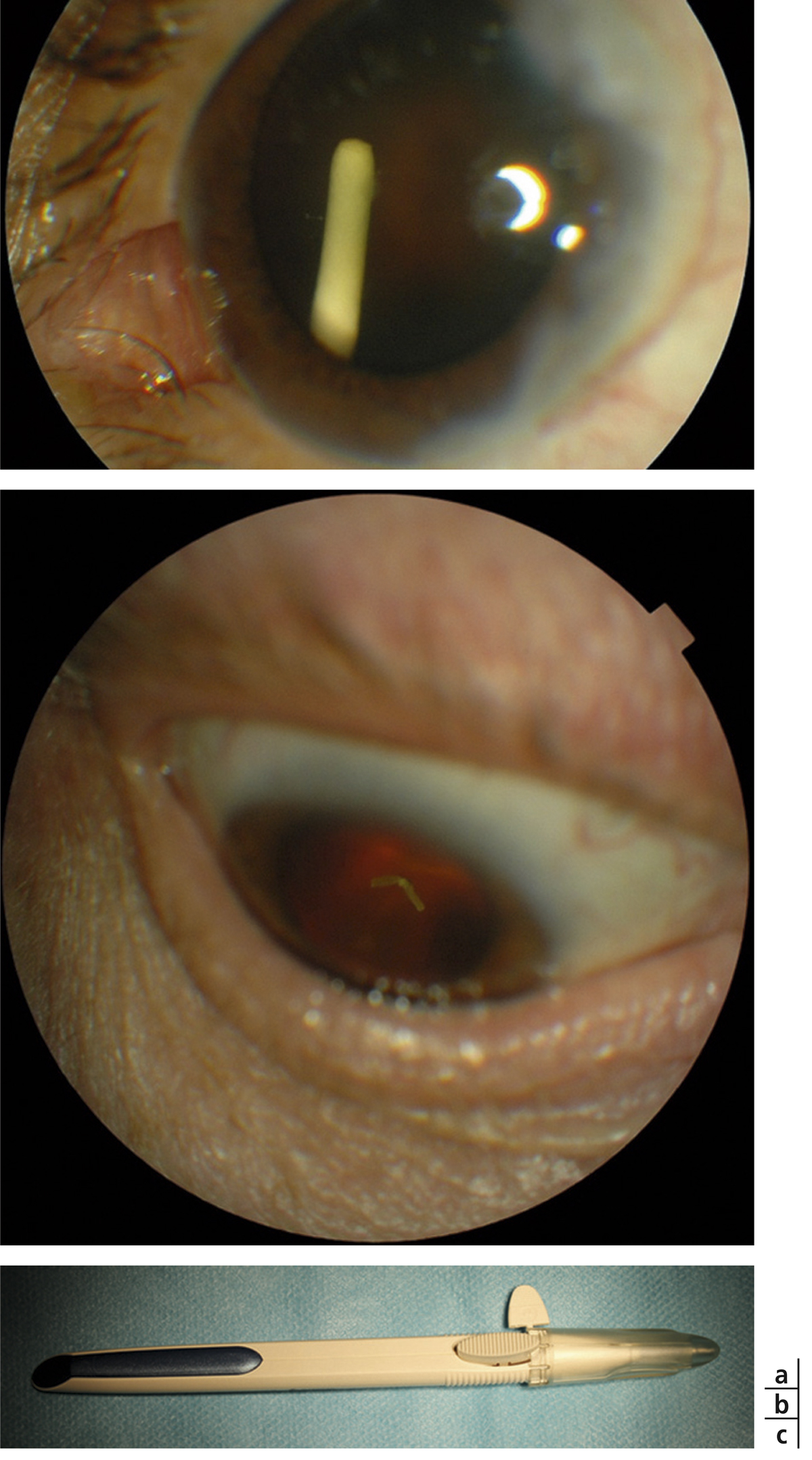
Fig. 8-86 Visualisation d’un implant d’Ozurdex® dans la cavité vitréenne.
a. Implant d’Ozurdex® en position vitréenne antérieure. b. Implant d’Ozurdex® 4 mois après injection. c. Applicateur de l’implant de dexaméthasone (Ozurdex®).
(Figures a et b : remerciements au Dr V. Donnadieu.)
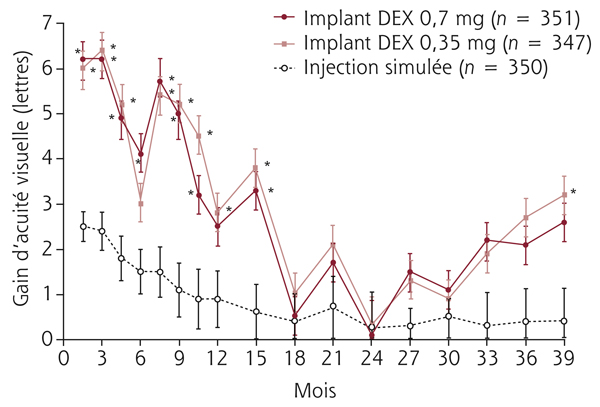
Fig. 8-87 Évolution de l’acuité visuelle après injection de l’implant de dexaméthasone chez l’ensemble des patients.
(D’après Boyer DS, Yoon YH, Belfort RJ, et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology 2014 ; 121 : 1904-14.)
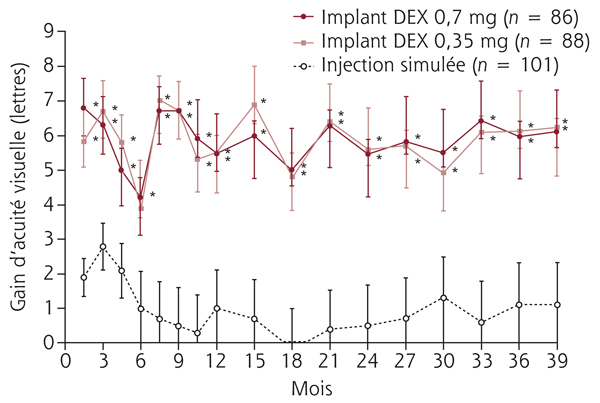
Fig. 8-88 Évolution de l’acuité visuelle après injection de l’implant de dexaméthasone chez les patients pseudophaques.
(D’après Boyer DS, Yoon YH, Belfort RJ, et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology 2014 ; 121 : 1904-14.)
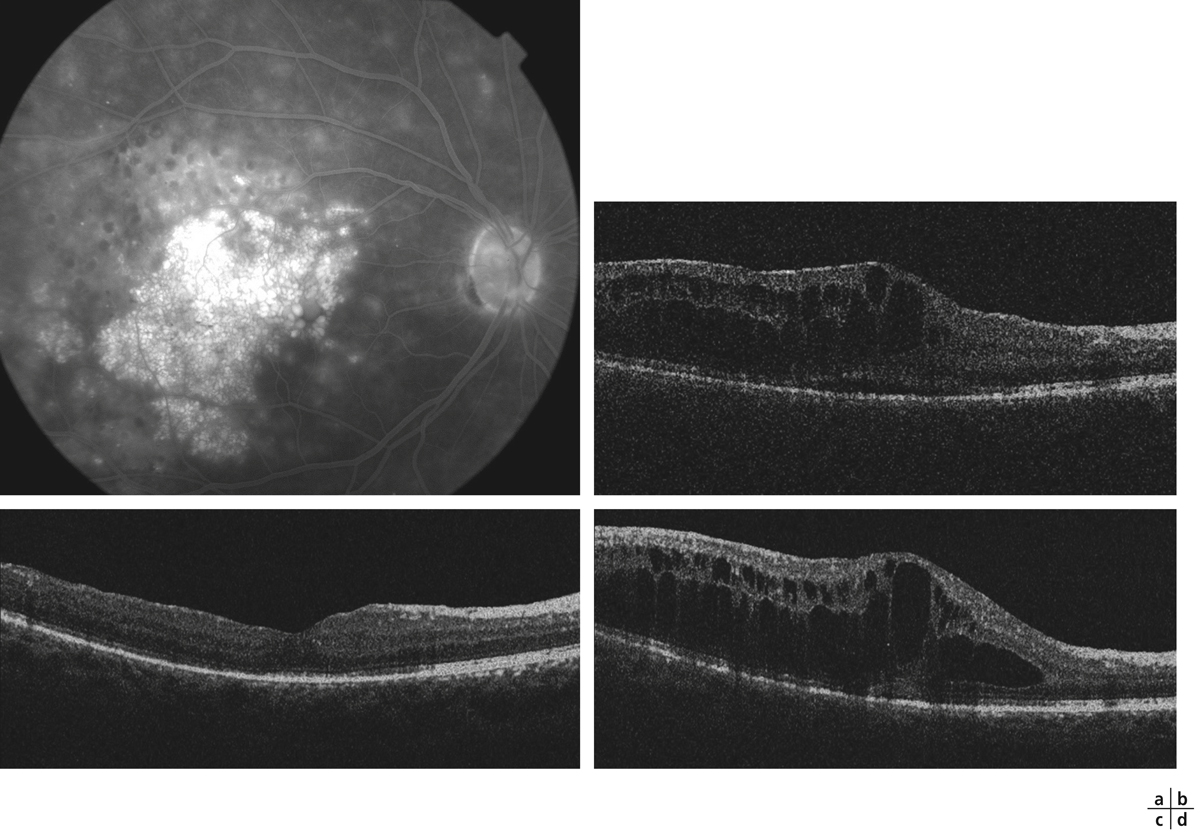
Fig. 8-89 Traitement d’un œdème maculaire diabétique réfractaire par injection intravitréenne d’Ozurdex®.
L’œdème maculaire a été traité sans succès par grid laser, injections de triamcinolone, bévacizumab et vitrectomie. Une injection intra-oculaire d’Ozurdex® est réalisée. a, b. Angiographie à la fluorescéine, cliché veineux tardif (a) et OCT (b) avant l’injection. c. OCT à 2 mois après l’injection : l’œdème maculaire a totalement régressé. d. Récidive de l’OM 6 mois après l’injection d’Ozurdex®.
L’acétonide de fluocinolone a initialement été utilisé sous forme d’un dispositif suturable (Retisert®, Bausch Lomb, États-Unis) relarguant 0,59 μg/jour de produit actif. Son efficacité pour traiter l’OMD a été évaluée dans une étude comparant 127 yeux implantés avec 69 yeux témoins : une amélioration de l’acuité visuelle de + 15 lettres a été observée chez 31,8 % des patients implantés à 2 ans versus 9,3 % dans le groupe témoin (p = 0,0016). Toutefois, cette différence n’était plus significative à 3 ans (31,1 % versus 20,0 %, p = 0,1566) [26]. Un taux très élevé de complications (33,8 % de chirurgie filtrante et 91 % de phacoexérèse) a disqualifié ce traitement.
Le dispositif injectable sans incision/suture sclérale connu sous le nom d’Iluvien® (Alimera, États-Unis), est actuellement commercialisé dans plusieurs pays d’Europe et il a reçu une AMM en France pour l’OMD. Il s’agit d’un petit tube en polyimide (3,5 mm de long × 0,37 mm de diamètre, fig. 8-90), non résorbable, injectable par un dispositif 25 G ; celui-ci avait initialement soit deux extrémités du tube ouvertes, relarguant 0,5 μg/jour de fluocinolone, soit une seule ouverture relarguant 0,2 μg/jour (modèle retenu pour la commercialisation). L’étude préliminaire Fluocinolone Acetonide in huMan aqueOUS (FAMOUS) a dosé l’acétonide de fluocinolone dans l’humeur aqueuse après injection intravitréenne du dispositif chez 37 patients en comparant les doses de 0,2 μg/jour et 0,5 μg/jour [27] : un relargage progressif et continu d’acétonide de fluocinolone a été observé avec des concentrations supérieures à 2 ng/mL pendant 3 mois puis variant de 1,0 à 0,5 ng/L à 12 mois. Cet implant aurait ainsi un effet thérapeutique pendant 2 à 3 ans [28].
Les études Fluocinolone Acetonide for diabetic Macular Edema (FAME) A et B, prospectives, randomisées, multicentriques en double insu et contre placebo ont évalué l’effet de l’acétonide de fluocinolone sur l’OMD [29, 30]. Dans cette étude, les patients ont été randomisés en trois groupes : ils ont été traités soit par injection simulée (n = 185), soit par injection de l’implant dosé à 0,2 μg/jour (n = 375) ou à 0,5 μg/jour (n = 393). Une amélioration de l’acuité visuelle de plus de 15 lettres à 3 ans a été observée chez 28,7 % des patients traités par 0,2 μg versus 27,8 % des patients traités par 0,5 μg et 18,9 % des patients du groupe contrôle (p 0,001). Une meilleure efficacité a été observée chez les patients présentant un OMD chronique (dont la durée était supérieure à 3 ans) [30]. Trente-huit pour cent des patients traités par 0,2 μg ont nécessité un traitement hypotonisant et 4,8 % une chirurgie filtrante. Le taux de chirurgie de la cataracte a été de 80,3 % à 3 ans dans ce groupe.
En conclusion, le dispositif injectable d’acétonide de fluocinolone reste une option thérapeutique intéressante dans l’OMD chronique, résistant aux autres traitements, notamment aux anti-VEGF et au laser. L’Iluvien® a obtenu l’AMM pour l’OMD en France mais n’est pas encore remboursé.
Fig. 8-90 Schéma d’un implant de fluocinolone.
Lors de son injection à la pars plana (a), dans la cavité vitréenne, version 0,2 μg/jour, ouvert sur un seul côté (b, au milieu, modèle actuellement commercialisé) et version 0,5 μg/jour, ouvert sur les deux côtés du tube (c).
Le DRCRnet a publié de nombreux articles comparant le ranibizumab à la triamcinolone, associés à un traitement par laser ou laser seul. Il en ressort une supériorité du ranibizumab en monothérapie ou associé au laser sur la triamcinolone ou le laser seul. En revanche, chez les patients initialement pseudophaques, la triamcinolone associée au laser est aussi efficace que le ranibizumab en monothérapie ou associé au laser (+ 8 lettres d’acuité visuelle en moyenne pour les trois groupes) [15].
L’implant de dexaméthasone a été comparé au bévacizumab dans une étude randomisée de Gillies et al. [31]. Quatre-vingt-huit yeux de 61 patients ont été traités soit par une injection de dexaméthasone toutes les 16 semaines, soit par une injection de bévacizumab toutes les 4 semaines, en pro renata (PRN), avec un suivi de 12 mois. Une amélioration de l’acuité visuelle de + 10 lettres ETDRS a été observée chez 40 % des yeux traités par bévacizumab versus 41 % des yeux traités par dexaméthasone (non significatif) ; le gain moyen a été de + 8,9 lettres (bévacizumab) versus + 5,6 lettres (dexaméthasone). Une baisse de 10 lettres a été observée chez 11 % des patients traités par dexaméthasone (principalement en raison du développement d’une cataracte) mais chez aucun patient traité par bévacizumab. Le nombre moyen d’injections a été de 8,6 (de 4 à 13) dans le groupe bévacizumab et 2,7 (de 1 à 4) dans le groupe dexaméthasone à 12 mois. La réduction de l’épaississement maculaire a été plus importante dans le groupe dexaméthasone (−187 μm en moyenne) versus bévacizumab (−122 μm en moyenne) (p = 0,015). Douze yeux du groupe traité par dexaméthasone ont présenté une hypertonie supérieure à 25 mmHg.
L’étude Maggiore [32], dont le promoteur est le laboratoire Allergan, a comparé le ranibizumab à l’implant de dexaméthasone, pour traiter l’OMD. Les patients étaient traités soit par trois injections mensuelles de ranibizumab puis PRN, soit par un implant de dexaméthasone au début de l’étude et aux 5e et 10e mois. Il s’agit d’une étude de non-infériorité. Le critère d’évaluation principal était le gain moyen d’acuité visuelle entre 0 et 12 mois. Les premiers résultats de l’étude ont démontré la non-infériorité du traitement par implant de dexaméthasone par rapport au ranibizumab, avec un gain moyen de 7,6 lettres pour le ranibizumab versus 4,6 lettres pour l’implant de dexaméthasone. Ce résultat a été obtenu avec un nombre moyen de 8,7 injections pour le ranibizumab et 2,85 pour l’implant de dexaméthasone.
Les corticoïdes ont prouvé leur efficacité pour traiter l’OMD. L’amélioration visuelle qu’ils induisent initialement est toutefois limitée ultérieurement par le développement d’une cataracte. Ils trouvent donc leur meilleure indication chez le patient pseudophaque ; chez le patient phaque, la chirurgie de la cataracte devra être envisagée dès que le développement de celle-ci fait perdre le bénéfice visuel induit par le traitement corticoïde. L’association du traitement par implant de dexaméthasone à la chirurgie de la cataracte permettra de limiter le risque d’aggravation postopératoire de l’OMD.
Le choix entre anti-VEGF et corticoïdes pour traiter l’OMD fera intervenir non seulement des critères oculaires (caractère phaque du patient, pseudophaque, aphaque, présence ou non d’un glaucome ou d’une hypertonie oculaire) mais aussi systémiques (antécédent récent de pathologie cardiovasculaire ou cérébrovasculaire aiguë) et de terrain (âge, facilité de déplacement du patient, éloignement, possibilité de suivi régulier, etc.). On préférera ainsi utiliser un anti-VEGF chez un jeune phaque, chez un glaucomateux ou hypertone oculaire avec bithérapie ou plus, chez un aphaque avec risque de passage d’un implant de corticoïde en chambre antérieure. On préférera un corticoïde retard chez le pseudophaque, chez la personne âgée se déplaçant avec difficulté, chez le patient avec des antécédents cardiovasculaires récents. Le choix sera plus libre chez le patient de plus de 50 ans sans antécédents particuliers. Les figures 8-94 et 8-95 (dans le chapitre 8.11) proposent un algorithme thérapeutique de l’OMD.
[1] Romero-Aroca P. Targeting the pathophysiology of diabetic macular edema. Diabetes Care 2010 ; 33 : 2484-5.
[2] Catier A, Tadayoni R, Erginay A, et al. Œdème maculaire. Encycl Méd Chir (Elsevier, Paris). 21-245-A-30. 2004.
[3] Golan S, Loewenstein A. Steroids and the management of macular edema. Ophthalmologica 2010 : 224 Suppl : 31-40.
[4] Wenzel A, Grimm C, Seeliger MW, et al. Prevention of photoreceptor apoptosis by activation of the glucocorticoid receptor. Invest Ophthalmol Vis Sci 2001 ; 42 : 1653-9.
[5] Glybina IV, Kennedy A, Ashton P, et al. Photoreceptor neuroprotection in RCS rats via low-dose intravitreal sustained-delivery of fluocinolone acetonide. Invest Ophthalmol Vis Sci 2009 ; 50 : 4847-57.
[6] Monin C, Lepvrier-Guibal N, Guillot de Suduiraut C, et al. Treatment of diabetic macular edema with neuroepithelium detachment combining high-dose corticotherapy and photocoagulation. J Fr Ophtalmol 1994 ; 17 : 585-90.
[7] Edelman JL. Differentiating intraocular glucocorticoids. Ophthalmologica 2010 ; 224 Suppl : 25-30.
[8] Jonas JB, Sofker A. Intraocular injection of crystalline cortisone as adjunctive treatment of diabetic macular edema. Am J Ophthalmol 2001 ; 132 : 425-7.
[9] Audren F, Lecleire-Collet A, Erginay A, et al. Intravitreal triamcinolone acetonide for diffuse diabetic macular edema : phase 2 trial comparing 4 mg vs 2 mg. Am J Ophthalmol 2006 ; 142 : 794-9.
[10] Audren F, Tod M, Massin P, et al. Pharmacokinetic-pharmacodynamic modeling of the effect of triamcinolone acetonide on central macular thickness in patients with diabetic macular edema. Invest Ophthalmol Vis Sci 2004 ; 45 : 3435-41.
[11] Massin P, Audren F, Haouchine B, et al. Intravitreal triamcinolone acetonide for diabetic diffuse macular edema : preliminary results of a prospective controlled trial. Ophthalmology 2004 ; 111 : 215-8.
[12] Gillies MC, Sutter FKP, Simpson JM, et al. Intravitreal triamcinolone for refractory diabetic macular edema : two-year results of a double-masked, placebo-controlled, randomized clinical trial. Ophthalmology 2006 ; 113 : 1533-8.
[13] DRCRnet. A randomized trial comparing intravitreal triamcinolone acetonide and focal/grid photocoagulation for diabetic macular edema. Ophthalmology 2008 ; 115 : 1447-9, 1449.e1-10.
[14] Gillies MC, McAllister IL, Zhu M, et al. Intravitreal triamcinolone prior to laser treatment of diabetic macular edema : 24-month results of a randomized controlled trial. Ophthalmology 2011 ; 118 : 866-72.
[15] Diabetic Retinopathy Clinical Research Network, Elman MJ, Aiello LP, Beck RW, et al. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2010 ; 117 : 1064-77.e35.
[16] Elman MJ, Bressler NM, Qin H, et al. Expanded 2-year follow-up of ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2011 ; 118 : 609-14.
[17] Cellini M, Pazzaglia A, Zamparini E, et al. Intravitreal vs. subtenon triamcinolone acetonide for the treatment of diabetic cystoid macular edema. BMC Ophthalmol 2008 ; 8 : 5.
[18] Cardillo JA, Melo LA Jr, Costa RA, et al. Comparison of intravitreal versus posterior sub-Tenon’s capsule injection of triamcinolone acetonide for diffuse diabetic macular edema. Ophthalmology 2005 ; 112 : 1557-63.
[19] Chew E, Strauber S, Beck R, et al. Randomized trial of peribulbar triamcinolone acetonide with and without focal photocoagulation for mild diabetic macular edema : a pilot study. Ophthalmology 2007 ; 114 : 1190-6.
[20] Feldman-Billard S, Du Pasquier-Fediaevsky L, Héron E. Hyperglycemia after repeated periocular dexamethasone injections in patients with diabetes. Ophthalmology 2006 ; 113 : 1720-3.
[21] Boyer DS, Yoon YH, Belfort RJ, et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology 2014 ; 121 : 1904-14.
[22] Pacella E, Vestri AR, Muscella R, et al. Preliminary results of an intravitreal dexamethasone implant (Ozurdex®) in patients with persistent diabetic macular edema. Clin Ophthalmol 2013 ; 7 : 1423-8.
[23] Guigou S, Hajjar C, Parrat E, et al. Multicenter Ozurdex® assessment for diabetic macular edema : MOZART study. J Fr Ophtalmo. 2014 ; 37 : 480-5.
[24] Boyer DS, Faber D, Gupta S, et al. Dexamethasone intravitreal implant for treatment of diabetic macular edema in vitrectomized patients. Retina 2011 ; 31 : 915-23.
[25] Medeiros MD, Alkabes M, Navarro R, et al. Dexamethasone intravitreal implant in vitrectomized versus nonvitrectomized eyes for treatment of patients with persistent diabetic macular edema. J Ocul Pharmacol Ther 2014 ; 30 : 709-16.
[26] Schwartz SG, Flynn HW Jr. Fluocinolone acetonide implantable device for diabetic retinopathy. Curr Pharm Biotechnol 2011 ; 12 : 347-51. Review.
[27] Pearson PA, Comstock TL, Ip M, et al. Fluocinolone acetonide intravitreal implant for diabetic macular edema : a 3-year multicenter, randomized, controlled clinical trial. Ophthalmology 2011 ; 118 : 1580-7.
[28] Campochiaro PA, Nguyen QD, Hafiz G, et al. Aqueous levels of fluocinolone acetonide after administration of fluocinolone acetonide inserts or fluocinolone acetonide implants. Ophthalmology 2013 ; 120 : 583-7.
[29] Campochiaro PA, Brown DM, Pearson A, et al. ; FAMEStudy Group. Sustained delivery fluocinolone acetonide vitreous inserts provide benefit for at least 3 years in patients with diabetic macular edema. Ophthalmology 2012 ; 119 : 2125-32.
[30] Cunha-Vaz J, Ashton P, Iezzi R, et al. Sustained delivery fluocinolone acetonide vitreous implants : long-term benefit in patients with chronic diabetic macular edema. Ophthalmology 2014 ; 121 : 1892-903.
[31] Gillies MC, Lim LL, Campain A, et al. A randomized clinical trial of intravitreal bevacizumab versus intravitreal dexamethasone for diabetic macular edema : the BEVORDEX study. Ophthalmology 2014 ; 121 : 2473-81.
[32] Maggiore Study. Safety and efficacy study of Ozurdex® compared to Lucentis® in patients with diabetic macular edema. 2015. En ligne : https://www.clinicaltrials.gov/ct2/show/NCT01427751
L. Kodjikian, D. Bellocq
➤ Les anti-VEGF sont efficaces pour améliorer l’acuité visuelle et réduire l’épaississement maculaire en cas d’OMD.
➤ Quarante à 60 % des yeux traités par anti-VEGF gagnent 2 lignes d’acuité visuelle ou plus, et 25 à 30 % gagnent 3 lignes d’acuité visuelle ou plus.
➤ Les yeux traités par anti-VEGF perdent deux à trois fois moins d’acuité visuelle que ceux traités par laser.
➤ Pour obtenir ces gains visuels, le traitement initial doit être intensif avec un nombre moyen d’injections compris entre sept et neuf durant la première année de traitement.
➤ Un trop grand retard à la mise en route du traitement conduit à une moindre amélioration de l’acuité visuelle.
➤ Si le traitement initial a été intensif durant la première année, le nombre d’injections pour maintenir le gain visuel diminue au cours des années de suivi.
➤ Une bonne tolérance oculaire et systémique est observée avec les anti-VEGF.
Les facteurs de croissance de l’endothélium vasculaire ou vascular endothelial growth factors (VEGF) sont impliqués dans la physiopathogénie de l’OMD. Les molécules inhibant ce facteur croissance, administrées par IVT, ont été les premières à obtenir leur AMM pour le traitement de l’OMD associé à une baisse d’acuité visuelle significative. En 2012, un anti-VEGF, le ranibizumab (Lucentis®) obtient une AMM, suivi en 2015 par un VEGF-trap, l’aflibercept (Eyléa®). Un autre anti-VEGF est utilisé hors AMM dans certains pays : le bévacizumab (Avastin®). Le pegaptanib (Macugen®) n’a jamais obtenu d’AMM dans cette indication, malgré la publication de quelques études.
Le ranibizumab est le premier anti-VEGF à avoir obtenu l’AMM européenne et américaine pour le traitement de la baisse d’acuité visuelle par OMD. Son efficacité a été démontrée dans plusieurs études prospectives randomisées et contrôlées, notamment les études READ-2 [1, 2], RESOLVE [3], RESTORE [4], du DRCRnet (étude indépendante) [5–8] et RISE and RIDE [9]. Le tableau 8-17 résume les principales caractéristiques des études majeures. Le ranibizumab a permis une amélioration significative de l’acuité visuelle de plus de 5 lettres chez environ trois quarts des patients, amélioration persistante dans le temps, au prix d’une diminution significative du nombre d’IVT dès la deuxième année de traitement. Dans l’étude READ-2 [1, 2], le ranibizumab (0,5 mg) en monothérapie a été comparé au laser en monothérapie et à la combinaison ranibizumab plus laser. À 6 mois, l’acuité visuelle s’était améliorée significativement dans le groupe ranibizumab en monothérapie comparé au groupe laser en monothérapie ou ranibizumab plus laser. L’ajout du laser au ranibizumab n’apportait aucun bénéfice fonctionnel. L’étude REVEAL [10], réalisée uniquement en Asie, a retrouvé les mêmes résultats. Dans l’étude RESTORE [4], qui incluait 345 patients, les trois groupes de traitement étaient identiques à ceux de l’étude READ-2. Le schéma d’administration consistait en une phase d’induction avec 3 IVT mensuelles suivies d’une phase de suivi mensuelle (avec injection à la demande ou PRN). À 1 an, le ranibizumab a permis une amélioration significative de la meilleure acuité visuelle de + 6,1 lettres en monothérapie et + 5,9 lettres en combinaison avec le laser en comparaison au laser en monothérapie (+ 0,8 lettre). La réduction de l’épaississement rétinien était deux fois plus importante avec le ranibizumab qu’avec le laser en monothérapie. Une méta-analyse récente a montré que d’une part, le ranibizumab 0,5 mg en monothérapie était supérieur au laser en monothérapie du point de vue du gain d’acuité visuelle (pas de différence significative du point de vue de la réduction de l’épaisseur rétinienne) et d’autre part, la combinaison photocoagulation au laser + traitement par ranibizumab 0,5 mg ne montrait aucune supériorité par rapport au traitement par ranibizumab en monothérapie [11].
L’étude indépendante, dite protocole I du DRCRnet [5–8], comprenait initialement quatre bras de traitement : ranibizumab 0,5 mg et laser concomitant, ranibizumab 0,5 mg et laser différé à 6 mois, triamcinolone et laser concomitant et enfin IVT simulées et laser concomitant. La supériorité du ranibizumab en monothérapie et de l’association ranibizumab + laser a été démontrée face au laser en monothérapie à 1 an avec un gain moyen de + 9 lettres dans les deux groupes ranibizumab (nombre moyen d’IVT entre 8 et 9) versus + 3 lettres dans le groupe laser en monothérapie, et à 2 ans avec un gain de + 7 à 8 lettres (nombre moyen d’IVT la deuxième année de 2 à 3) versus + 3 lettres à nouveau pour le laser en monothérapie. À 3 ans, les résultats fonctionnels dans le groupe ranibizumab et laser concomitant était inférieur à 2,9 lettres (9,7 versus 6,8 lettres, p = 0,02) par comparaison avec le groupe ranibizumab et laser différé. Le nombre moyen d’IVT la troisième année de traitement a continué à diminuer et était en moyenne de 1 à 2 IVT. À 5 ans, cette différence n’était plus statistiquement significative avec, pour les yeux traités par ranibizumab et laser concomitant, un gain d’acuité visuelle inférieur de 2,6 lettres en moyenne (+ 7,2 lettres versus + 9,8 lettres à 5 ans, p = 0,09) à ceux traités par ranibizumab et laser différé d’au moins 6 mois (à noter que la grande majorité de ce groupe de patients n’a pas reçu de traitement par laser). En revanche, les patients ayant bénéficié de l’adjonction d’un traitement laser concomitant ont, à 5 ans, reçu moins d’IVT (médiane de la différence de 4 IVT). La quatrième année, 54 % des patients avec laser concomitant et 45 % des patients avec laser différé n’ont reçu aucune injection, ces pourcentages étant respectivement de 62 % et 52 % la cinquième année. Au final, le niveau d’acuité visuelle s’est maintenu sur 5 ans dans les deux groupes de patients traités par ranibizumab avec un besoin décroissant d’injections.
Les études RISE (n = 377) and RIDE (n = 382) ont comparé deux doses de ranibizumab en monothérapie (0,3 et 0,5 mg) en injections mensuelles pendant 24 mois à des injections simulées (sham), la photocoagulation laser maculaire étant autorisée dans les trois groupes selon des critères bien précis [9]. Les deux groupes de patients traités par ranibizumab ont obtenu un gain moyen de 11 à 12 lettres à 24 mois, sans différence entre les deux doses. Ce gain était significativement supérieur à celui obtenu dans le groupe sham (moins de 3 lettres). De plus, les deux groupes de patients traités par ranibizumab ont eu significativement moins de procédures de laser maculaire (en moyenne 1,8 et 1,6 procédures sur 24 mois dans le groupe sham versus 0,3 et 0,8 dans les deux groupes ranibizumab). Ces études ont permis aussi de montrer que, même si le traitement de l’OMD n’est pas une urgence absolue, il se doit quand même d’être entrepris dès que possible s’il est indiqué. En effet, un retard ou délai à l’initiation du traitement par ranibizumab s’accompagnait d’une moindre amélioration de l’acuité visuelle. Dans les études, RISE and RIDE, l’instauration d’un traitement par ranibizumab 2 ans après l’inclusion (chez les patients initialement non traités par anti-VEGF) a certes permis une amélioration de l’acuité visuelle, mais sans jamais atteindre le niveau de vision des patients traités d’emblée par ranibizumab [12]. Cette même conclusion est d’ailleurs obtenue dans l’étude RESTORE pour les patients traités initialement par laser et qui ont pu bénéficier du ranibizumab au terme de la première année [13].
L’étude RETAIN a, quant à elle, évalué un schéma thérapeutique « treat and extend » (allongement progressivement croissant des intervalles d’injection en cas de bonne réponse thérapeutique), après l’obtention de la phase de stabilisation de l’acuité visuelle [14]. Ce schéma thérapeutique a été comparé à un schéma PRN, avec des résultats fonctionnels comparables. Enfin, l’étude prospective non contrôlée RELIGHT, comportant un seul bras, a montré, qu’un suivi bimensuel à partir du sixième mois, après une phase initiale de 3 IVT mensuelles et PRN mensuel jusqu’au sixième mois, permettait de maintenir, à 18 mois, le gain visuel acquis à 6 mois [15].
Du point de vue de la tolérance (tableau 8-17), dans toutes les études avec le ranibizumab, aucun sur-risque de mortalité ou d’accidents thrombo-emboliques artériels (cardiovasculaires ou cérébraux) n’a été rapporté avec le ranibizumab en comparaison au laser ou placebo [16]. On peut seulement noter une augmentation de l’incidence de l’hypertonie oculaire dans les groupes traités par ranibizumab dans les études RESOLVE, RISE and RIDE mais pas RESTORE.
Le ranibizumab (Lucentis®, Novartis, Bâle, Suisse) a obtenu l’AMM européenne le 21 novembre 2012, révisée le 4 septembre 2014 pour le traitement chez l’adulte de l’OMD atteignant la région centrale associée à une baisse de l’acuité visuelle significative (inférieure ou égale à 5/10e en France selon les recommandations de la Haute autorité de santé [HAS]). Le service médical rendu (SMR) est important et l’amélioration du service médical rendu mineure (ASMR IV) selon la commission de transparence de la HAS. C’est un traitement de première intention chez les patients avec prise en charge du diabète optimisée. Le traitement est initié avec une injection par mois jusqu’à ce que l’acuité visuelle maximale soit atteinte et/ou jusqu’à l’absence de signe d’activité de la maladie. L’objectif est d’obtenir l’acuité visuelle maximale ainsi que la réduction maximale de l’épaississement rétinien maculaire, ce qui sous-entend une absence de modifications fonctionnelle et anatomique lors de trois évaluations mensuelles successives. Les intervalles de suivi et de traitement, déterminés par le médecin, sont ensuite basés sur l’activité de la maladie, évaluée par la mesure de l’acuité visuelle et/ou des critères anatomiques (OCT ou angiographie). Deux stratégies sont possibles : soit un suivi mensuel (PRN), et reprise des injections en cas de diminution de l’acuité visuelle et/ou augmentation de l’épaisseur maculaire, soit une stratégie de type « treat and extend » comprenant des injections fixes réalisées à des intervalles croissants et une reprise des injections plus fréquentes en cas de récidive de l’OMD. Le traitement par ranibizumab devra être interrompu devant l’absence d’amélioration fonctionnelle et/ou anatomique après la phase d’induction. Des facteurs prédictifs de l’efficacité du ranibizumab ont été étudiés et sont rapportés dans le tableau 8-18 [17–20]. Ils sont importants à connaître pour la prise en charge pronostique de la maladie et l’information au patient. Récemment, les résultats d’une analyse post hoc du protocole I du DRCRnet ont été rapportés et indiquent que la réponse fonctionnelle obtenue après trois injections de ranibizumab est très fortement prédictive de l’acuité visuelle finale [21].
Aux États-Unis, le ranibizumab a obtenu début 2015 une extension de son AMM, afin de traiter la rétinopathie diabétique associée à l’OMD. Cette extension a été obtenue grâce aux études RISE and RIDE notamment [17, 22]. Le ranibizumab en injections mensuelles a non seulement permis de ralentir la progression de la rétinopathie diabétique périphérique mais aussi, et surtout, d’améliorer la rétinopathie diabétique. Le retard à l’instauration du ranibizumab réduisait cet effet bénéfique. Le groupe d’étude américain indépendant DRCRnet a réalisé une étude, appelée protocole S, afin de comparer l’efficacité de la PPR « immédiate » aux injections de ranibizumab associées à une PPR « différée » au cours de la rétinopathie diabétique proliférante (voir plus haut chapitre 8.8) ; il a ainsi montré que le traitement par injections de ranibizumab n’était pas inférieur, à 2 ans, à la PPR [23].
Tableau 8-17 Principales séries évaluant la prise en charge de l’OMD par IVT d’anti-VEGF.
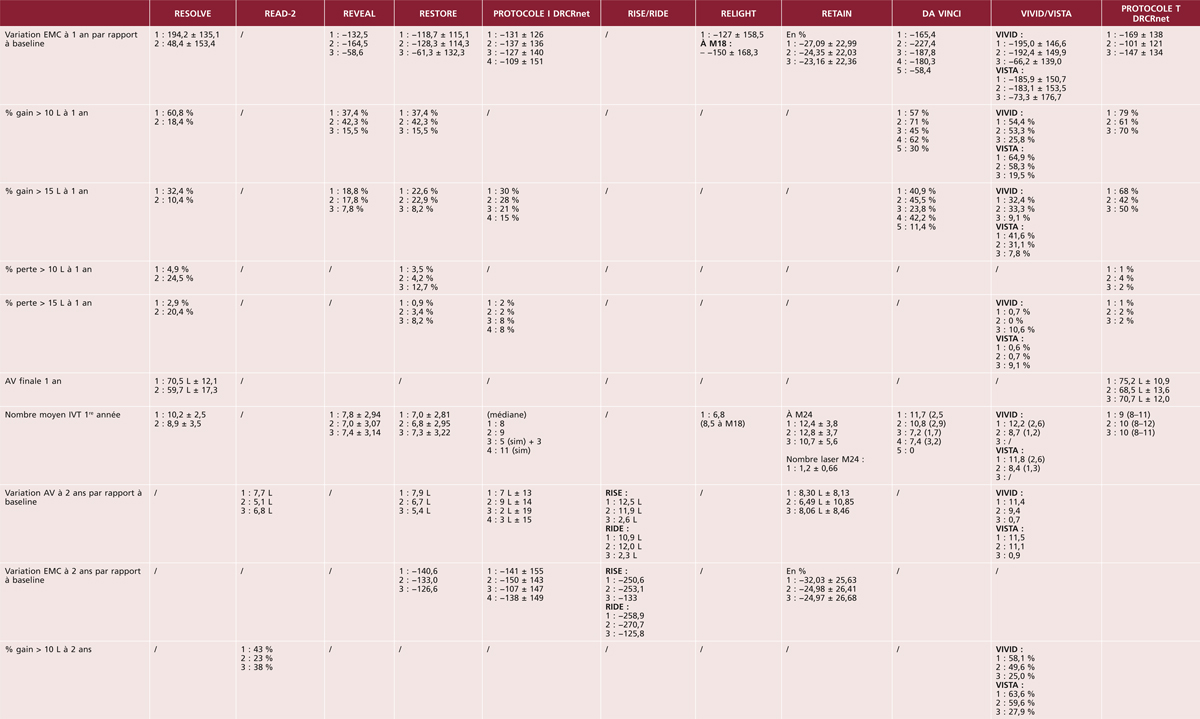
Tableau 8-17 Suite.
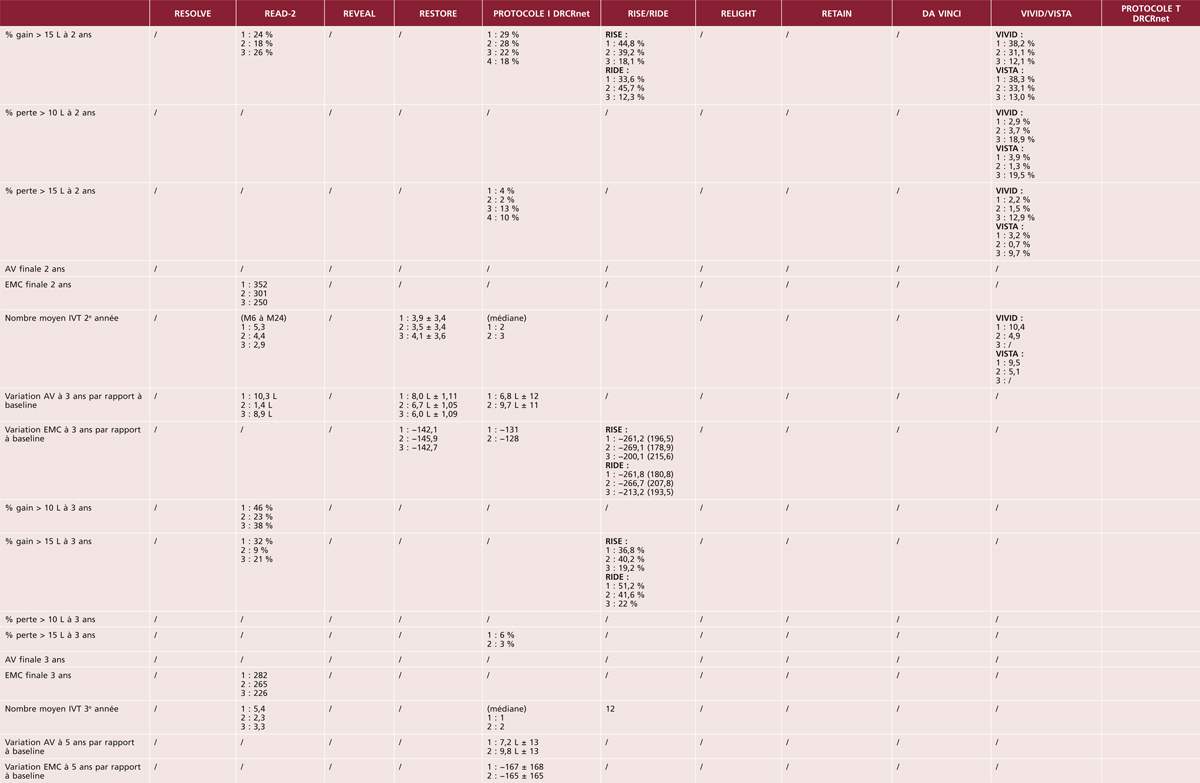
Tableau 8-17 Suite.

Tableau 8-17 Suite.

Tableau 8-18 Facteurs prédictifs rapportés dans les études thérapeutiques sur l’œdème maculaire diabétique.
L’efficacité de l’aflibercept dans le traitement de l’OMD a été d’abord démontrée dans l’étude de phase II DA VINCI (tableau 8-17) [24]. Celle-ci comparait quatre schémas de traitement par aflibercept – 0,5 mg Q4 (c’est-à-dire mensuel), 2 mg Q4, 2 mg Q8 (c’est-à-dire bimestriel) après 3 IVT mensuelles, 2 mg PRN après 3 IVT mensuelles – au laser. À 6 et 12 mois, l’aflibercept était supérieur au laser pour le gain visuel et la réduction de l’épaississement rétinien central sans qu’aucune différence statistique n’ait été rapportée dans les quatre bras de traitement par aflibercept. Les études de phase III VIVID et VISTA qui ont suivi ont permis l’obtention de l’AMM [25]. Dans ces études, deux schémas thérapeutiques avec l’aflibercept (2 mg Q4 ou 2 mg Q8 après une phase d’induction de 5 IVT mensuelles) ont été comparés au traitement par laser : les deux groupes de patients traités par aflibercept ont eu une amélioration rapide de l’acuité visuelle avec un gain moyen de 11 à 12 lettres à 1 an, significativement supérieur au gain obtenu avec le laser (0 à 1 lettre). Ce résultat et cette différence avec le laser se sont maintenus au cours de la deuxième année [26]. Des résultats similaires ont été obtenus anatomiquement sur la réduction de l’épaississement maculaire, avec là aussi une supériorité clinique et statistique de l’aflibercept par rapport au laser. En revanche, aucune différence n’a été observée entre les deux schémas thérapeutiques d’aflibercept. De plus, aucun sur-risque d’effet indésirable systémique n’a été noté. À 2 ans, l’effet indésirable grave le plus fréquemment rapporté était la cataracte.
L’aflibercept (Eyléa®, Bayer, Leverkusen, Allemagne) a ainsi obtenu le 18 mars 2015 une AMM (et son remboursement en France fin août 2015) chez l’adulte, dans le traitement de l’OMD atteignant la région centrale associé à une baisse de l’acuité visuelle significative (inférieure ou égale à 5/10e en France selon les recommandations de la HAS). Le SMR est important et l’ASMR mineure (IV). Il s’agit d’un traitement de première intention chez les patients avec prise en charge du diabète optimisée. La dose recommandée est de 2 mg d’aflibercept. À l’instauration du traitement, le schéma d’AMM est fixe : Eyléa® est injectée une fois par mois pendant 5 mois consécutifs, puis tous les 2 mois. Il n’est pas nécessaire de réaliser des visites de suivi entre les injections durant la première année. Il est recommandé néanmoins de s’assurer d’une réponse fonctionnelle et/ou anatomique au traitement après 3 à quatre injections. Ultérieurement, il peut être utile, en fonction du contexte clinique, de réaliser, un bilan fonctionnel et morphologique supplémentaire entre les injections. Si aucun gain visuel ou anatomique n’est observé après la phase d’induction, le traitement par Eyléa® sera interrompu, et un traitement utilisant une autre molécule pourra être entrepris. Après les 12 premiers mois de traitement, l’intervalle entre deux injections peut être prolongé en fonction des résultats visuels et anatomiques.
Aux États-Unis, l’aflibercept a obtenu début 2015, quelques semaines après le ranibizumab, une extension de son AMM, afin de traiter la rétinopathie diabétique associée à l’OMD. Cette extension a été obtenue grâce aux études VIVID et VISTA notamment [25, 26]. L’aflibercept a non seulement permis de ralentir la progression de la rétinopathie diabétique périphérique mais aussi, et surtout, d’améliorer la rétinopathie diabétique.
Le bévacizumab (Avastin®) a été examiné dans près d’une dizaine d’études randomisées et contrôlées. Néanmoins, il n’a toujours pas d’AMM en ophtalmologie et reste interdit d’utilisation en France (la recommandation temporaire d’utilisation [RTU] du bévacizumab en France n’ayant été accordé le 1er septembre 2015 que dans l’indication DMLA exsudative). Les études sur le bévacizumab dans l’OMD l’ont comparé à la triamcinolone [27] pour la plupart et ne présentent donc pas d’intérêt dans la pratique quotidienne française. L’étude BEVORDEX a comparé le bévacizumab à l’implant de dexaméthasone [28]. Ses résultats sortent du cadre de ce chapitre (l’étude BEVOREX est toutefois traitée dans le tableau 8-16). L’étude BOLT a comparé le bévacizumab 1,25 mg au laser [27, 29] et a démontré, à 2 ans, la supériorité fonctionnelle du bévacizumab. Une autre étude comparant le bévacizumab à l’association bévacizumab + traitement laser unique n’a logiquement retrouvé aucune différence [30]. Enfin l’étude de Lam et al. a comparé deux doses de bévacizumab (1,25 mg et 2,5 mg) dans l’OMD diffus uniquement. À 6 mois, après 3 IVT mensuelles et 3 mois sans traitement, un gain d’acuité visuelle a été montré, sans différence entre les deux groupes [31].
Les études ayant comparé les anti-VEGF entre eux dans l’OMD sont rares. Trois peuvent être citées [32–34] et une dernière plus particulièrement analysée [35].
Une étude a examiné l’effet du bévacizumab et du ranibizumab chez 29 patients ayant reçu les deux produits à au moins 6 mois d’intervalle [32]. Cette faible méthodologie et le nombre limité de patients discréditent à eux seuls les résultats. L’étude BRDME est en cours et seul son protocole a fait l’objet d’une publication récente pour l’instant [33]. Elle comparera le bévacizumab et le ranibizumab aussi bien du point de vue efficacité que du point de vue médico-économique. La troisième publication est la première étude prospective randomisée qui a comparé le bévacizumab et le ranibizumab dans l’OMD [34]. Elle a étudié seulement 63 yeux de 48 patients qui ont reçu des IVT soit de 1,5 mg de bévacizumab soit de 0,5 mg de ranibizumab. Le laser de secours était autorisé dès le 3e mois. Les deux produits ont permis une amélioration visuelle et anatomique à 1 an. Les patients traités par ranibizumab ont nécessité moins d’IVT en moyenne (7,67 versus 9,84), ont plus rapidement présenté une amélioration de leur acuité visuelle et ont, à certaines visites (notamment celle du 2e mois), présenté un gain d’acuité visuelle supérieur.
La quatrième publication, très récente, est la seule ayant comparé les deux anti-VEGF (ranibizumab et bévacizumab) et le VEGF-trap (aflibercept) dans l’OMD [35]. Le DRCRnet a comparé, de façon indépendante financièrement, l’efficacité du ranibizumab 0,3 mg (posologie américaine et non européenne), de l’aflibercept 2 mg et du bévacizumab 1,25 mg, administrés selon un même schéma thérapeutique (critères de re-traitement propres au DRCRnet mais exigeants). Il s’agit du protocole T, étude prospective, randomisée, multicentrique (n = 89 centres), américaine, en mono-insu (plus de la moitié des patients dans chaque groupe a nécessité un traitement bilatéral et il y a donc eu une levée de « l’aveugle »). Dans l’analyse globale de la population de l’étude, une efficacité cliniquement équivalente a été obtenue pour les trois traitements. En revanche, des différences d’efficacité ont été observées en fonction de l’acuité visuelle : lorsque l’acuité visuelle initiale était égale ou supérieure à 20/40, l’efficacité des trois traitements était identique, avec une médiane de 9 IVT pour aflibercept versus 10 IVT pour les deux autres molécules. En revanche, lorsque l’acuité visuelle initiale était inférieure ou égale à 0,5 (68 lettres ou 20/50) – ce qui correspond d’une part à une sous-analyse planifiée avant la réalisation de l’étude (c’est-à-dire sous-analyse non post hoc) et d’autre part au critère HAS de remboursement –, l’aflibercept était alors statistiquement et cliniquement plus efficace que le ranibizumab à la dose de 0,3 mg ou que le bévacizumab (gain visuel de + 19, + 14 et + 12 lettres respectivement à 1 an, avec une médiane de 10, 10 et 11 IVT respectivement). Il y a eu aussi moins de séances laser complémentaires à partir de la 24e semaine pour l’aflibercept par rapport au bévacizumab seulement.
Du point de vue de l’efficacité anatomique, l’aflibercept était dans l’analyse globale de la population plus efficace statistiquement que les deux autres, la différence étant vraiment majeure par rapport au bévacizumab (réduction de 169, 147 et 101 μ respectivement à 1 an). Du point de vue de la tolérance, aucune différence statistique n’a été notée à 1 an entre les trois molécules pour les effets indésirables cardiovasculaires au sens de la définition classique (c’est-à-dire décès d’origine cardiovasculaire, accident vasculaire cérébral, infarctus du myocarde) de l’Antiplatelet Trialists’ Collaboration (APTC) [36].
La question en suspens pour l’Europe où seul le ranibizumab 0,5 mg est autorisé est la suivante : est-ce que les résultats auraient pu être meilleurs avec le ranibizumab 0,5 mg avec un schéma de traitement PRN au lieu de 0,3 mg PRN et ainsi effacer la différence avec l’aflibercept ? Il est en tout cas intéressant de noter dans le rapport de la commission de transparence de la HAS du 18 mars 2015 que :
-
d’une part, une méta-analyse de comparaison indirecte aflibercept–ranibizumab selon la méthode de Bucher (quatre études pivotales) et selon la méthode bayésienne (dix études hétérogènes) retrouve une différence identique à celle du protocole T (gain de 4,7 lettres de plus avec l’aflibercept par rapport au ranibizumab) [37] ;
-
d’autre part, « les résultats du protocole T doivent être interprétés avec prudence dans la mesure où l’aflibercept n’était pas administré selon le schéma posologique recommandé par l’AMM et où le ranibizumab n’était pas utilisé à la dose validée par l’AMM en Europe (0,3 mg au lieu de 0,5 mg), etc. [et que] au vu des données disponibles, aucun impact n’est attendu de la spécialité Eyléa® par rapport à Lucentis® en termes d’amélioration de l’acuité visuelle et de la qualité de vie des patients traités » (commission de la trasnparence, 2015).
[1] Nguyen QD, Shah SM, Heier JS, et al. Primary end point (six months) results of the ranibizumab for edema of the mAcula in diabetes (READ-2) study. Ophthalmology 2009 ; 116 : 2175-81.
[2] Nguyen QD, Shah SM, Khwaja AA, et al. Two-year outcomes of the ranibizumab for edema of the macula in diabetes (READ-2) study. Ophthalmology 2010 ; 117 : 2146-51.
[3] Massin P, Bandello F, Garweg JG, et al. Safety and efficacy of ranibizumab in diabetic macular edema (RESOLVE Study) : a 12-month, randomized, controlled, double-masked, multicenter phase II study. Diabetes Care 2010 ; 33 : 2399-405.
[4] Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study : ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011 ; 118 : 615-25.
[5] Diabetic Retinopathy Clinical Research Network, Elman MJ, Aiello LP, Beck RW, et al. Randomized trial evaluating ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2010 ; 117 : 1064-77.e35.
[6] Elman MJ, Bressler NM, Qin H, et al. Expanded 2-year follow-up of ranibizumab plus prompt or deferred laser or triamcinolone plus prompt laser for diabetic macular edema. Ophthalmology 2011 ; 118 : 609-14.
[7] Diabetic Retinopathy Clinical Research Network, Elman MJ, Qin H, Aiello LP, et al. Intravitreal ranibizumab for diabetic macular edema with prompt versus deferred laser treatment : three-year randomized trial results. Ophthalmology 2012 ; 119 : 2312-8. Erratum in : Ophthalmology 2014 ; 121 : 805.
[8] Elman MJ, Ayala A, Bressler NM, et al. Intravitreal ranibizumab for diabetic macular edema with prompt versus deferred laser treatment : 5-year randomized trial results. Ophthalmology 2015 ; 122 : 375-81.
[9] Nguyen QD, Brown DM, Marcus DM, et al, RISE and RIDE Research Group. Ranibizumab for diabetic macular edema: results from 2 phase III randomized trials : RISE and RIDE. Ophthalmology 2012 ; 119 : 789-801.
[10] Ishibashi T, Li X, Koh A, et al., REVEAL study group. Ranibizumab monotherapy or combined with laser versus laser monotherapy in Asian patients with diabetic macular edema. Ophthalmology 2015 ; 122 : 1402-14.
[11] Ford JA, Lois N, Royle P, et al. Current treatments in diabetic macular oedema : systematic review and meta-analysis. BMJ Open 2013 ; 3 : pii : e002269.
[12] Brown DM, Nguyen QD, Marcus DM, et al., RIDE and RISE Research Group. Long-term outcomes of ranibizumab therapy for diabetic macular edema : the 36-month results from two phase III trials : RISE and RIDE. Ophthalmology 2013 ; 120 : 2013-22.
[13] Schmidt-Erfurth U, Lang GE, et al. ; RESTORE Extension Study Group. Three-year outcomes of individualized ranibizumab treatment in patients with diabetic macular edema : the RESTORE extension study. Ophthalmology 2014 ; 121 : 1045-53.
[14] Prünte C, Fajnkuchen F, Mahmood S, et al. ; the RETAIN Study Group. Ranibizumab 0.5 mg treat-and-extend regimen for diabetic macular oedema : the RETAIN study. Br J Ophthalmol 2015. pii : bjophthalmol-2015-307249.
[15] Pearce I, Banerjee S, Burton BJ, et al. ; RELIGHT Study Group. Ranibizumab 0.5 mg for diabetic macular edema with bimonthly monitoring after a phase of initial treatment : 18-month, multicenter, phase IIIB RELIGHT Study. Ophthalmology 2015 ; 122 : 1811-9.
[16] Yanagida Y, Ueta T. Systemic safety of ranibizumab for diabetic macular edema : meta-analysis of randomized trials. Retina 2014 ; 34 : 629-35.
[17] Ip MS, Domalpally A, Sun JK, Ehrlich JS. Long-term effects of therapy with ranibizumab on diabetic retinopathy severity and baseline risk factors for worsening retinopathy. Ophthalmology 2015 ; 122 : 367-74.
[18] Sophie R, Lu N, Campochiaro PA. Campochiaro. Predictors of functional and anatomic outcomes in patients with diabetic macular edema treated with ranibizumab. Ophthalmology 2015 ; 122 : 395-401.
[19] Bressler SB, Qin H, Beck RW, et al. ; Diabetic Retinopathy Clinical Research Network. Factors associated with changes in visual acuity and central subfield thickness at 1 year after treatment for diabetic macular edema with ranibizumab. Arch Ophthalmol 2012 ; 130 : 53-61.
[20] Channa R, Sophie R, Khwaja AA, et al. ; the READ-2 Study Group 2. Factors affecting visual outcomes in patients with diabetic macular edema treated with ranibizumab. Eye 2014 ; 28 : 69-78.
[21] Dugel P. Communication orale. Congrès de l’American Academy of Ophthalmology, Las Vegas 2015.
[22] Ip MS, Domalpally A, Hopkins JJ, et al. Long-term effects of ranibizumab on diabetic retinopathy severity and progression. Arch Ophthalmol 2012 ; 130 : 1145-52.
[23] Writing Committee for the Diabetic Retinopathy Clinical Research Network, Gross JG, Glassman AR, Jampol LM, et al. Panretinal photocoagulation vs intravitreous ranibizumab for proliferative diabetic retinopathy : a randomized clinical trial. JAMA 2015 ; 314 : 2137-46.
[24] Do DV, Nguyen QD, Boyer D, et al. One-year outcomes of the DA VINCI Study of VEGF Trap-Eye in eyes with diabetic macular edema. Ophthalmology 2012 ; 119 : 1658-65.
[25] Korobelnik JF, Do DV, Schmidt-Erfurth U, et al. Intravitreal aflibercept for diabetic macular edema. Ophthalmology 2014 ; 121 : 2247-54.
[26] Brown DM, Schmidt-Erfurth U, Do DV, et al. Intravitreal aflibercept for diabetic macular edema : 100-week results from the VISTA and VIVID Studies. Ophthalmology 2015 ; 122 : 2044-52.
[27] Michaelides M, Fraser-Bell S, Hamilton R, et al. Macular perfusion determined by fundus fluorescein angiography at the 4-month time point in a prospective randomized trial of intravitreal bevacizumab or laser therapy in the management of diabetic macular edema (Bolt Study) : report 1. Retina 2010 ; 30 : 781-6.
[28] Gillies MC, Lim LL, Campain A, et al. A randomized clinical trial of intravitreal bevacizumab versus intravitreal dexamethasone for diabetic macular edema : the BEVORDEX study. Ophthalmology 2014 ; 121 : 2473-81.
[29] Michaelides M, Kaines A, Hamilton RD, et al. A prospective randomized trial of intravitreal bevacizumab or laser therapy in the management of diabetic macular edema (BOLT study) 12-month data : report 2. Ophthalmology 2010 ; 117 : 1078-86.
[30] Faghihi H, Esfahani MR, Harandi ZA, et al. Intravitreal bevacizumab vs. combination of intravitreal bevacizumab plus macular photocoagulation in clinically significant diabetic macular edema : 6 months results of a randomized clinical trial. Iranian J Ophthalmol 2010 ; 22 : 21-6.
[31] Lam DS, Lai TY, Lee VY, et al. Efficacy of 1.25 MG versus 2.5 MG intravitreal bevacizumab for diabetic macular edema : six-month results of a randomized controlled trial. Retina 2009 ; 29 : 292-9.
[32] Ozturk BT, Kerimoglu H, Bozkurt B, Okudan S. Comparison of intravitreal bevacizumab and ranibizumab treatment for diabetic macular edema. J Ocul Pharmacol Ther 2011 ; 27 : 373-7.
[33] Schauwvlieghe AM, Dijkman G, Hooymans JM, et al. Comparing the effectiveness and costs of bevacizumab to ranibizumab in patients with diabetic macular edema: a randomized clinical trial (the BRDME study). BMC Ophthalmol 2015 ; 15 : 71.
[34] Nepomuceno AB, Takaki E, Paes de Almeida FP, et al. A prospective randomized trial of intravitreal bevacizumab versus ranibizumab for the management of diabetic macular edema. Am J Ophthalmol 2013 ; 156 : 502-10.
[35] Diabetic Retinopathy Clinical Research Network, Wells JA, Glassman AR, Ayala AR, et al. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med 2015 ; 372 : 1193-203.
[36] Antiplatelet Trialists’ Collaboration. Collaborative overview of randomized trials of antiplatelet therapy : I : prevention of death, myocardial infarction, and stroke. BMJ 1994 ; 308 : 81-106.
[37] Korobelnik JF, Kleijnen J, Lang SH, et al. Systematic review and mixed treatment comparison of intravitreal aflibercept with other therapies for diabetic macular edema (DME). BMC Ophthalmol 2015 ; 15 : 52.
Y. Lemer
➤ L’OMD tractionnel, c’est-à-dire associé à une traction vitréomaculaire, est la seule forme clinique pour laquelle la chirurgie est indiquée de première intention.
➤ L’OMD tractionnel est défini par une caractéristique anatomique précise : le sommet de l’œdème en OCT est au niveau ou en dessous de la hyaloïde postérieure partiellement décollée.
➤ L’OMD tractionnel doit être distingué de l’OMD associé à un décollement périfovéolaire de la hyaloïde postérieure : celui-ci n’est pas un œdème tractionnel. Si la hyaloïde postérieure touche le sommet de l’œdème, elle est rarement épaissie et, surtout, elle descend de part et d’autre de l’œdème.
➤ Le bénéfice de la vitrectomie en cas d’OMD non tractionnel n’est pas démontré.
C’est au début des années 1980 qu’ont été publiées les premières études suggérant un lien entre vitré et OM, initialement dans les occlusions veineuses puis dans le diabète [1]. Des études animales réalisées chez le chat ont montré que la diffusion vers la rétine de différentes molécules, et en particulier de l’oxygène, était considérablement augmentée après vitrectomie en comparaison avec des yeux non opérés. Cliniquement, une moindre fréquence de l’OMD était observée chez des patients présentant un décollement postérieur du vitré (DPV) complet par rapport à ceux n’ayant pas de DPV [2]. Dans les yeux présentant un œdème sans DPV, l’œdème disparaissait spontanément dans 55 % des yeux lorsque le DPV se constituait, alors qu’une guérison spontanée n’était observée que dans 20 % des cas lorsque le vitré restait attaché [3].
En 1992, est publiée la première étude montrant l’intérêt [4] de la vitrectomie chez 10 patients diabétiques présentant un OM associé à une hyaloïde postérieure tendue et brillante ; une amélioration anatomique et fonctionnelle était observée dans 9 cas. Ces résultats ont été confirmés par plusieurs autres études [5, 6], dont celle parue 1 an plus tard, réalisée chez 22 patients : à la suite de la vitrectomie, une amélioration visuelle était observée chez 19 patients, une diminution des diffusions angiographiques chez 10 patients et une disparition complète de l’OMD chez 12 patients. Neuf ans plus tard [7], l’OCT permettait d’objectiver dans ces cas l’existence d’une hyaloïde postérieure tendue, incomplètement décollée de la macula, réalisant un aspect dit « en toit de pagode », caractéristique des œdèmes appelés, de ce fait, tractionnels.
En 1996, les premiers résultats de la vitrectomie pour OM diffus, indiquée non pas pour une traction mais pour une simple absence de décollement postérieur du vitré (DPV), ont donné des résultats surprenants [8] : dans 57 des 58 yeux, une disparition de l’OM était observée et associée à un gain significatif de l’acuité visuelle. Cette amélioration fonctionnelle était confirmée par l’angiographie chez 35 des 36 yeux suivis pendant 12 mois.
En 2001 [9], une autre étude a présenté les résultats de la vitrectomie, séparant les 30 yeux de 29 patients en quatre groupes selon la présence ou non d’un DPV et l’existence ou non d’une membrane épirétinienne. Grâce à l’OCT, il était possible d’obtenir des valeurs chiffrées de l’épaisseur de la rétine maculaire. La conclusion était que, dans tous les groupes, la vitrectomie provoquait une diminution significative de l’épaisseur maculaire et une augmentation significative de l’acuité visuelle moyenne.
Depuis, les publications se sont multipliées, la plupart décrivant des résultats positifs au moins anatomiques et parfois visuels, sans qu’aucune preuve définitive de l’efficacité ne puisse être donnée en l’absence de technique standardisée et du fait de l’association fréquente de la vitrectomie à une photocoagulation ou une injection intravitréenne de cortisone ou d’anti-VEGF.
La composante tractionnelle est la seule indication pour laquelle il a été largement démontré que la vitrectomie avec ablation de la hyaloïde postérieure pouvait être efficace, tant du point de vue anatomique que fonctionnel, avec des résultats durables. Cependant, il est fondamental de bien identifier l’aspect en OCT afin de porter des indications claires et comparer les résultats des différentes études.
L’OMD associé à une traction vitréomaculaire est la seule forme clinique pour laquelle la chirurgie est indiquée de première intention. Cette forme d’OM est rare [10] : elle concernerait moins de 5 % des œdèmes. Elle est définie par une caractéristique anatomique précise [11] : le sommet de l’œdème en OCT est au niveau ou en dessous de la hyaloïde postérieure partiellement décollée (voir plus haut fig. 8-31, 8-39c et d, et 8-64). Cette hyaloïde peut être normale ou épaissie, ce dernier cas correspondant à la description clinique initiale de Lewis et al. [4]. L’adhérence vitréenne peut être unique ou multiple, focale avec un sommet rétinien aigu ou plus étendue, réalisant un aspect en toit de pagode. Elle peut être isolée ou associée à une fine membrane épirétinienne qui se prolonge de la surface rétinienne à la face postérieure de la hyaloïde non décollée, expliquant peut-être la persistance de l’attache vitréenne.
Cette forme d’OMD tractionnel est à distinguer de l’OMD associé à un décollement périfovéolaire de la hyaloïde postérieure. Celui-ci n’est pas un œdème tractionnel même s’il y est souvent associé dans la littérature, notamment anglo-saxonne, expliquant la confusion qui règne dans les indications et les résultats de la vitrectomie. Si la hyaloïde postérieure touche bien le sommet de l’œdème, elle est rarement épaissie et surtout, elle descend de part et d’autre de l’œdème (voir plus haut fig. 8-27e et 8-28c). Il n’y a donc probablement pas de réelle traction et l’amalgamer avec l’OMD tractionnel, comme cela est souvent le cas dans les publications, est source de confusion et de biais dans les résultats.
L’indication de vitrectomie doit être portée devant toute baisse d’acuité visuelle significative due à un OM associé à une traction vitréenne. Ce diagnostic peut être clinique dans les formes caractéristiques avec la constatation au fond d’œil d’une logette ou d’un épaississement maculaire, sans décollement postérieur du vitré et d’une hyaloïde postérieure brillante et tendue (voir plus haut fig. 8-22). Ce phénomène ne peut être vu que de façon dynamique en faisant varier l’incidence de la lentille d’examen. Ces formes se rencontrent volontiers dans les rétinopathies diabétiques proliférantes qui ont été inactivées par une photocoagulation panrétinienne. On peut également retrouver des tractions authentiques sans épaississement de la hyaloïde postérieure. Si on peut parfois suspecter le diagnostic, seul l’OCT permet de le confirmer en retrouvant l’aspect caractéristique précédemment décrit. Il n’est pas nécessaire d’essayer de traiter l’OM par photocoagulation ou injections intravitréennes dans ces cas.
Une alternative à la vitrectomie pourrait être la vitréolyse enzymatique mais avec probablement des résultats médiocres : même en l’absence de membrane épirétinienne associée, qui est presque une contre-indication à son utilisation, l’expérience clinique montre qu’en cas d’OMD tractionnel, l’adhérence vitréorétinienne est particulièrement forte et difficile à lever pendant la chirurgie.
La technique chirurgicale est bien codifiée : elle consiste en la réalisation d’une vitrectomie dont le but principal est de séparer la hyaloïde postérieure de son attache maculaire. Tous les autres gestes possibles ont été décrits (pelage de la limitante interne, injection finale d’anti-VEGF, de cortisone, etc.), mais le seul point important est de bien voir cette hyaloïde postérieure. Lorsqu’elle est épaissie, elle est souvent brillante, tendue. Il faut pratiquer une ouverture dans une zone où elle est séparée de la rétine et on parvient dès lors à la retirer complètement. L’adhérence maculaire est habituellement forte ou du moins le sommet de l’œdème fragile et il faut être prudent pour éviter de transformer le kyste fovéolaire en trou lamellaire. Quand la hyaloïde postérieure n’est pas épaissie, la technique est la même que celle utilisée en cas de traction vitréomaculaire idiopathique en commençant par soulever la hyaloïde postérieure au niveau de la papille puis en la retirant de l’aire maculaire prudemment en raison de l’attache fovéolaire. Parfois, la hyaloïde postérieure est moins visible et on doit s’aider soit de cristaux de triamcinolone, soit de colorants spécifiques mais cette éventualité est rare dans cette indication. En cas de membrane épirétinienne associée se réfléchissant sur la face postérieure de la hyaloïde postérieure, elle devra être enlevée en bloc avec celle-ci.
Les résultats de la vitrectomie sont assez concordants dans les différentes études qui ont individualisé cette entité, lorsque les images OCT confirment les critères d’inclusion des patients en montrant une vraie traction répondant aux critères de définition (c’est-à-dire le sommet de l’œdème ne doit pas être plus haut que la hyaloïde postérieure) [12–14]. Dans ces cas, l’amélioration anatomique constatée sur l’épaisseur centrale de la rétine est de 80 %, l’amélioration visuelle étant le plus souvent parallèle (fig. 8-91). C’est le cas dans les premières études et jusque dans les années 2004 environ [4–6]. Les études postérieures, qu’elles soient prospectives ou rétrospectives, semblent avoir moins respecté ces critères d’inclusion stricts et souvent, l’indication chirurgicale est portée devant un œdème simplement associé à un vitré non décollé et on retrouve dans ces cas des taux de succès beaucoup plus variables, par exemple de 28 à 49 % dans l’étude pourtant prospective du DRCRnet [15]. Cette étude de référence est en fait plus proche de la vie réelle que d’une étude prospective contrôlée, le diagnostic de « traction » étant laissé à l’appréciation du chirurgien du fait de l’absence de lecture centralisée des OCT préopératoires. Par ailleurs, si la vitrectomie avait comme but essentiel de retirer la hyaloïde postérieure, elle était associée à un pelage de membrane épirétinienne dans 61 % des cas, une ablation de la membrane limitante interne dans 54 % des cas, une photocoagulation panrétinienne peropératoire dans 40 % des cas et une injection intravitréenne de triamcinolone en fin d’intervention dans 60 % des cas, etc.
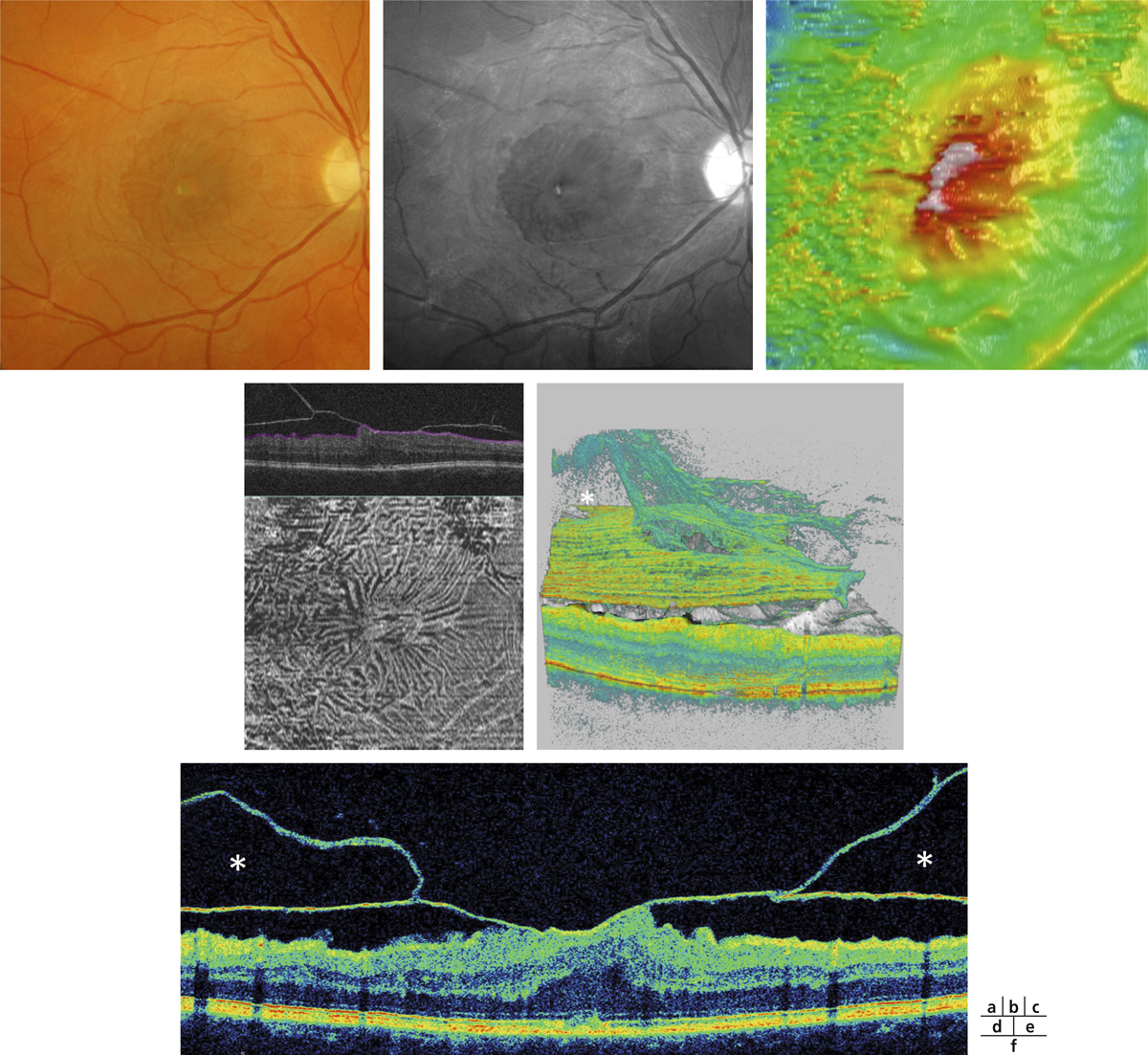
Fig. 8-64 Œdème maculaire tractionnel.
a, b. Clichés en couleurs et en lumière bleue. On observe un aspect brillant du pôle postérieur. c. La cartographie maculaire montre un épaississement modéré, associé à une irrégularité de surface. d. Sur l’OCT « en face », on voit clairement le plissement de la rétine multidirectionnel. e. Le montage en 3 dimensions montre la traction vitréomaculaire avec un dédoublement de la hyaloïde postérieure (astérisque). f. Sur la coupe OCT, la hyaloïde postérieure est épaissie, hyper-réflective, tendue, partiellement décollée, et reste attachée au centre de la macula sur laquelle elle exerce une traction. Il existe un vitréoschisis (astérisque) au niveau de la hyaloïde postérieure qui est dédoublée.
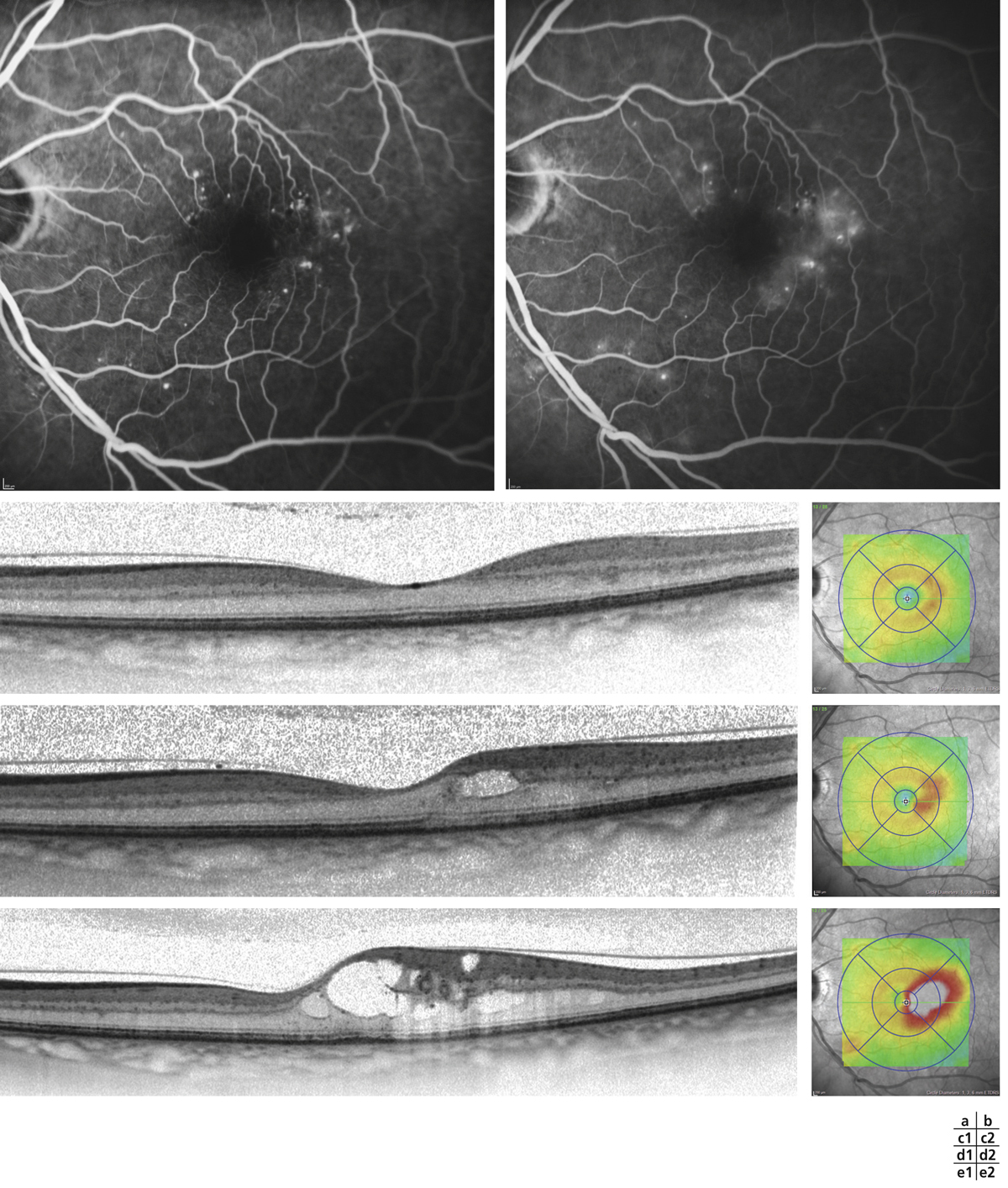
Fig. 8-27 Évolution naturelle d’un œdème maculaire diabétique.
a, b. Angiographie initiale : temps précoce (a). Il existe des micro-anévrismes dans la région maculaire, prédominant en temporal de la fovéa ; le cliché tardif (b) objective des diffusions à partir de ces micro-anévrismes. c. Coupe OCT horizontale contemporaine de l’angiographie : il n’y a pas d’OM, si ce n’est en c2 (cartographie maculaire) une épaisseur temporomaculaire dans les limites de la normale. d. Coupe OCT réalisée 3 mois plus tard, un kyste intrarétinien est apparu dans la couche plexiforme externe. L’épaisseur centromaculaire est normale, l’OM est modéré (d2 : cartographie maculaire). e. Coupe OCT réalisée 3 mois plus tard, l’OM s’est aggravé et est devenu sévère. Les kystes intrarétiniens se sont étendus dans la plexifome externe, il existe une petite logette centrale, deux micro-anévrismes sont bien visibles sur la coupe OCT. Cartographie maculaire (e2) correspondant à une augmentation de l’épaisseur maculaire en temporal supérieur.
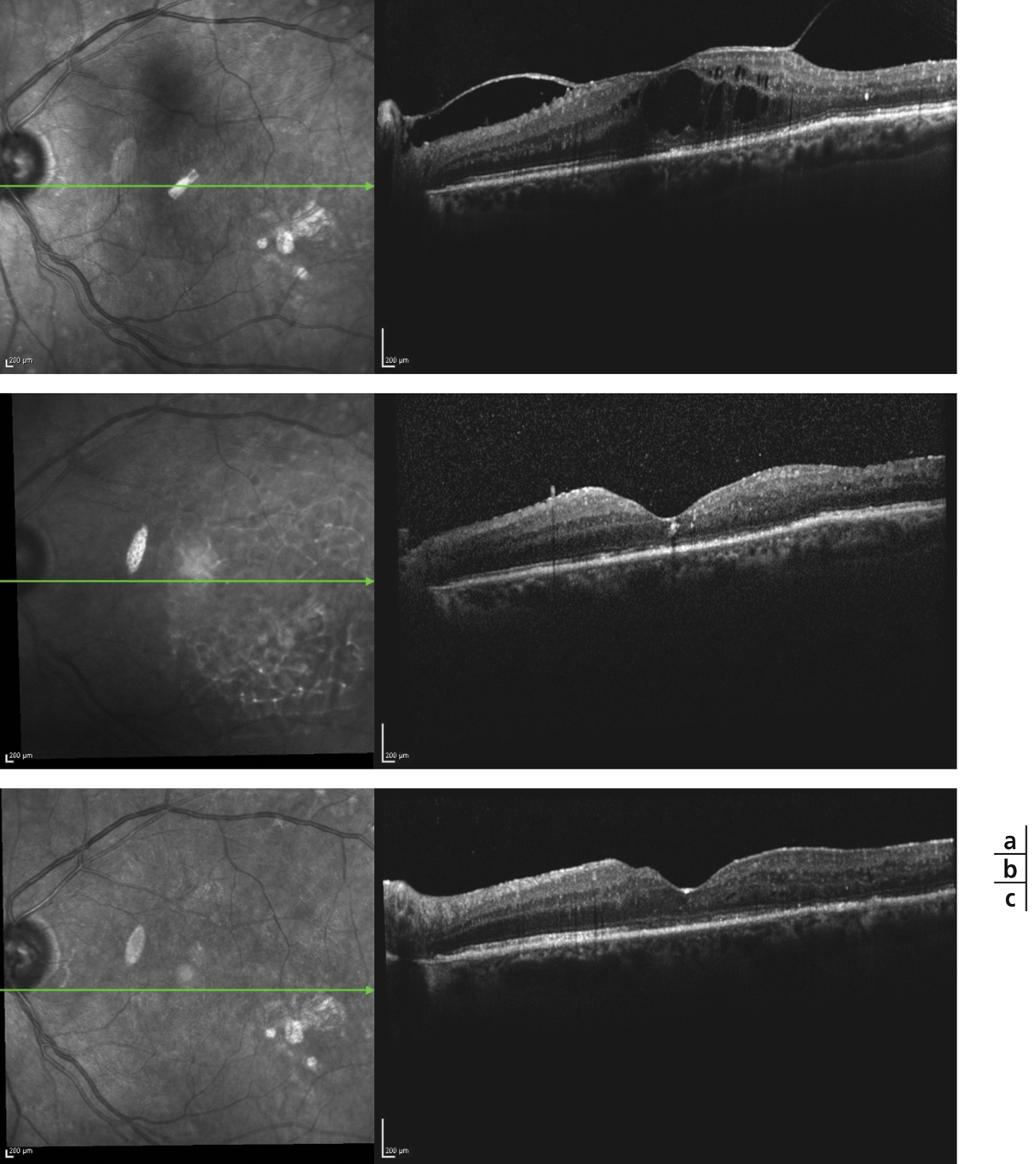
Fig. 8-91 Résultat de la vitrectomie dans un cas d’œdème maculaire diabétique tractionnel.
a. Aspect d’OMD tractionnel chez une patiente pseudophaque. La hyaloïde est épaissie et remonte au-dessus du sommet de l’œdème. L’adhérence est large. L’acuité visuelle est de 20/200. b. Six mois après la vitrectomie, l’OM a disparu. La vision est remontée à 20/40. c. Quatre ans plus tard, la situation est stable, l’œdème n’a pas récidivé, l’acuité visuelle est de 20/50.
Cette situation concerne tous les œdèmes du diabétique non associés à un aspect typique de traction vitréomaculaire tel qu’il a été décrit précédemment, avec ou sans DPV, avec ou sans membrane épirétinienne associée. Les études publiées sur le sujet sont nombreuses [9, 12], mais le plus souvent non concluantes. Les indications de vitrectomie sont variables (soit de première intention, soit après échec des autres traitements) : la vitrectomie est parfois le seul geste, sinon elle est souvent associée à une dissection de la membrane limitante interne, mais aussi à une injection finale de cortisone ou d’anti-VEGF, à une photocoagulation panrétinienne ou focale sur des micro-anévrismes ; les données de ces études sont le plus souvent rétrospectives. Dans ces études, les suivis sont habituellement limités à 6 mois, elles ne tiennent pas compte du statut cristallinien et s’intéressent plus aux résultats anatomiques que fonctionnels. Le niveau d’équilibre du diabète et de la pression artérielle n’est jamais précisé. La seule constante de ces études est la présentation de résultats positifs qui ne peuvent qu’interpeller le lecteur.
La plupart des études de grande taille ont été réalisées avant l’utilisation maintenant quasiment généralisée des anti-VEGF de première intention. Les indications étaient essentiellement portées sur des œdèmes réfractaires à une photocoagulation focale ou en grille avec des résultats habituellement bons quant à l’épaisseur maculaire centrale en OCT et décevants en termes de gain d’acuité visuelle. La présence d’un DPV ou non, le pelage ou non d’une membrane épirétinienne ne semblaient pas modifier ces résultats [9, 12]. La seule question semblait être l’intérêt du pelage associé de la membrane limitante interne (MLI) [13, 14]. Pour certains, en cas de vitréoschisis, il semblait être le seul moyen d’être sûr d’avoir enlevé complètement les résidus corticaux à la surface de la rétine. Pour d’autres, cette dissection aurait également un rôle de levée des barrières entre la rétine et la cavité vitréenne, permettant une meilleure oxygénation rétinienne à partir de la cavité vitréenne et une élimination des cytokines et du VEGF de la rétine vers le vitré. Cette hypothèse semble confirmée par une étude, sur un petit nombre de cas, rapportée par Gandorfer et al. [13] qui retrouvaient une amélioration de l’œdème résistant à une vitrectomie préalable et réopéré avec ablation de la limitante interne laissée lors de la première intervention. Dans une étude publiée en 2007 [16], la comparaison de la vitrectomie avec pelage de la limitante interne et de la photocoagulation en grille sur deux groupes de 12 patients n’ayant pas eu de traitement de l’œdème depuis au moins 6 mois montrait une supériorité de la vitrectomie en termes de diminution de l’épaisseur maculaire, mais aucune différence significative en termes d’acuité visuelle finale. Le suivi de cette étude était de 6 mois. Cette étude a été confirmée par une autre étude [17], publiée l’année suivante. Figueroa et al. [18] en 2008 publiaient une étude prospective sur trois groupes de patients : le groupe 1 (11 patients aux antécédents de glaucome) et le groupe 2 (11 patients randomisés) bénéficiaient d’une vitrectomie avec pelage de la MLI, le groupe 3 (20 patients randomisés) était traité par vitrectomie avec pelage de la MLI et injection en fin d’intervention de triamcinolone. À l’issu de 18 mois de suivi, aucune différence n’a été retrouvée entre les groupes même si la réduction de l’épaisseur rétinienne était initialement plus rapide dans le groupe recevant de la triamcinolone. À 1 an, il n’y avait plus de différence en termes d’épaisseur maculaire et aucune amélioration visuelle significative n’avait été observée au cours du suivi. Dans une étude récente [19], comparant rétrospectivement deux groupes de patients vitrectomisés avec pelage de la MLI, pour œdème soit tractionnel soit non tractionnel, Bonnin et al. ne retrouvaient pas de différence à 3 ans entre les deux groupes en termes de gain d’acuité visuelle et de réduction d’épaisseur maculaire centrale. Ces résultats rejoignent une ancienne étude de Yamamoto et al. réalisée en 2001 [9] qui retrouvait un effet identique de la vitrectomie dans les quatre groupes de patients étudiés : sans DPV et sans membrane épirétinienne (MER), sans DPV et avec MER, avec DPV et avec MER et avec DPV sans MER associée. Plus récemment, une étude comparative intra-individuelle portant sur 120 yeux de 60 patients [20], opérés pour œdème diffus sans traction, sans DPV ni MER et suivis 5 ans (tous les patients phaques étaient opérés dans le même temps du cristallin) ne retrouvait aucune différence de résultats visuels entre les yeux avec et sans pelage de la MLI. Cette étude, débutée en 1999, ne comportait pas de mesure de l’épaisseur maculaire en OCT.
La seule étude comparative de la vitrectomie et pelage de la MLI avec les anti-VEGF (bévacizumab) et la photocoagulation a été publiée récemment par Romano et al. [21]. Elle est malheureusement rétrospective avec des critères de choix du traitement peu clairs. Elle montre que seul le traitement par IVT donne une amélioration visuelle, alors que la vitrectomie avec pelage de la MLI est le meilleur moyen de provoquer une réduction de l’épaisseur maculaire centrale, éventuellement même une évolution vers l’atrophie centrale. Une hypothèse pour expliquer cette évolution serait le traumatisme des cellules de Müller lors du pelage.
Il est néanmoins parfois légitime de s’interroger sur l’intérêt d’une vitrectomie en cas de membrane épirétinienne associée à l’OMD. C’est un cas de figure fréquent, la membrane épirétinienne étant souvent associée à un décollement du vitré incomplet. Dans ces cas, il est difficile d’évaluer le rôle joué par la membrane dans la pathogénie de l’OMD et l’importance de la rétraction tangentielle due à la membrane. Les résultats des études sus-citées ne plaident pas en faveur d’une vitrectomie systématique. Toutefois, une vitrectomie peut être proposée dans certains cas de membrane épirétinienne épaisse, entraînant des plis rétiniens et une rétraction importante du pôle postérieur (voir plus haut chapitre 8.7) [22]. Dans les autres cas, lorsque la membrane est plus fine, la vitrectomie ne sera proposée qu’en cas d’échec des autres traitements disponibles.
Le tableau 8-19 résume les études ayant évalué les résultats de la vitrectomie pour un OM non tractionnel, avec un suivi d’au moins 12 mois. Il semble que la vitrectomie puisse avoir un rôle pour diminuer l’épaississement maculaire, surtout en cas d’épaisseur initiale importante, supérieure à 400 μ. La question est de savoir s’il s’agit d’un retour à une épaisseur normale ou, avec le temps, d’une évolution vers l’atrophie. L’acuité visuelle s’améliore seulement si elle est très basse en préopératoire et il n’y a pas de parallélisme entre l’épaisseur maculaire et l’acuité visuelle finale. Il n’y aurait ainsi pas d’intérêt à proposer une vitrectomie pour les œdèmes modérés avec une acuité visuelle peu altérée.
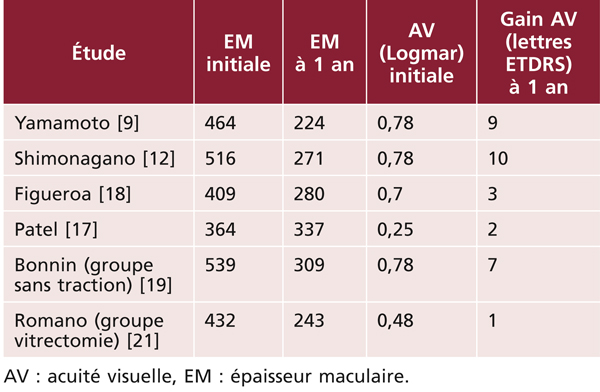
Tableau 8-19 Comparaison des différentes études ayant évalué l’effet de la vitrectomie pour les œdèmes diabétiques non tractionnels.
Les résultats à attendre de la vitrectomie pour OM ne semblent pas clairs en l’absence d’étude prospective randomisée, impossible à réaliser de nos jours en raison de la complexité et des coûts des procédures à mettre en œuvre. Il semble certain que la chirurgie reste le traitement de choix des œdèmes tractionnels (associés à une traction vitréomaculaire), peut-être même en première intention quand les critères diagnostiques définis cliniquement et sur l’OCT sont réunis avec une traction vitréenne focale ou peu étendue mais en tout cas isolée, sans MER associée. Dans ces cas, une simple ablation de la hyaloïde postérieure sans pelage additionnel de la MLI est suffisante, ce dernier geste pouvant être source d’atrophie maculaire ultérieure.
Pour les cas d’œdèmes sans traction, aucun consensus n’est réuni avec des résultats discordants selon les études. On peut proposer la vitrectomie après échec des autres traitements disponibles avec parfois de bonnes surprises anatomiques (fig. 8-92, 8-93 et eFig. 8-24 ), plus rarement fonctionnelles. La durée des résultats est variable avec cependant une récidive fréquente de l’œdème avec le temps.
), plus rarement fonctionnelles. La durée des résultats est variable avec cependant une récidive fréquente de l’œdème avec le temps.
Nous citerons pour finir les conclusions d’une méta-analyse de 2014 [23] : « Il y a peu de preuve en faveur d’une intervention chirurgicale pour œdème maculaire diabétique en l’absence de membrane épirétinienne ou de traction vitréomaculaire. Bien que l’effet de la vitrectomie semble supérieur à celui du laser sur la structure de la rétine à 6 mois, il n’y a plus de bénéfice prouvé à 12 mois. De plus, il n’y a aucune preuve suggérant une supériorité de la vitrectomie sur le laser en termes de résultats visuels. »
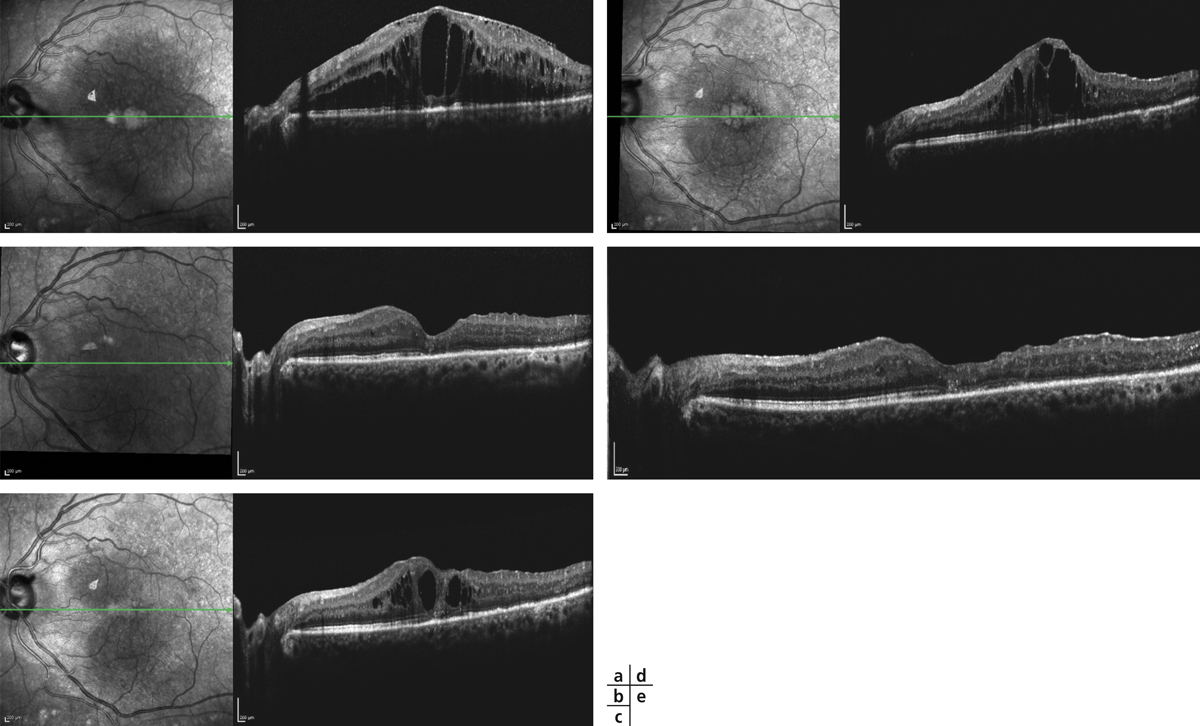
Fig. 8-92 Résultat de la vitrectomie dans un cas d’œdème maculaire diabétique non tractionnel.
a. Aspect d’OMD sans traction vitréenne chez une patiente monophtalme et pseudophaque présentant une hypertonie majeure après injection de triamcinolone. L’épaississement maculaire est considérable, associé à une membrane épirétinienne. Le vitré n’est pas décollé. L’acuité visuelle préopératoire est de 20/100. b. Aspect postopératoire, 2 mois après vitrectomie et pelage de la MLI. L’épaisseur maculaire s’est quasiment normalisée, l’acuité visuelle est de 20/40. Il existe une interruption centrale de l’ellipsoïde. c. Six mois après la vitrectomie, l’œdème commence à récidiver mais l’acuité visuelle reste inchangée à 20/40. d. Aggravation de la récidive de l’OM avec baisse d’acuité visuelle à 20/63. e. OCT de la même patiente après huit injections intravitréennes d’anti-VEGF réalisées toutes les 6 semaines. L’épaississement rétinien s’est réduit et l’acuité visuelle s’est améliorée à 20/32.
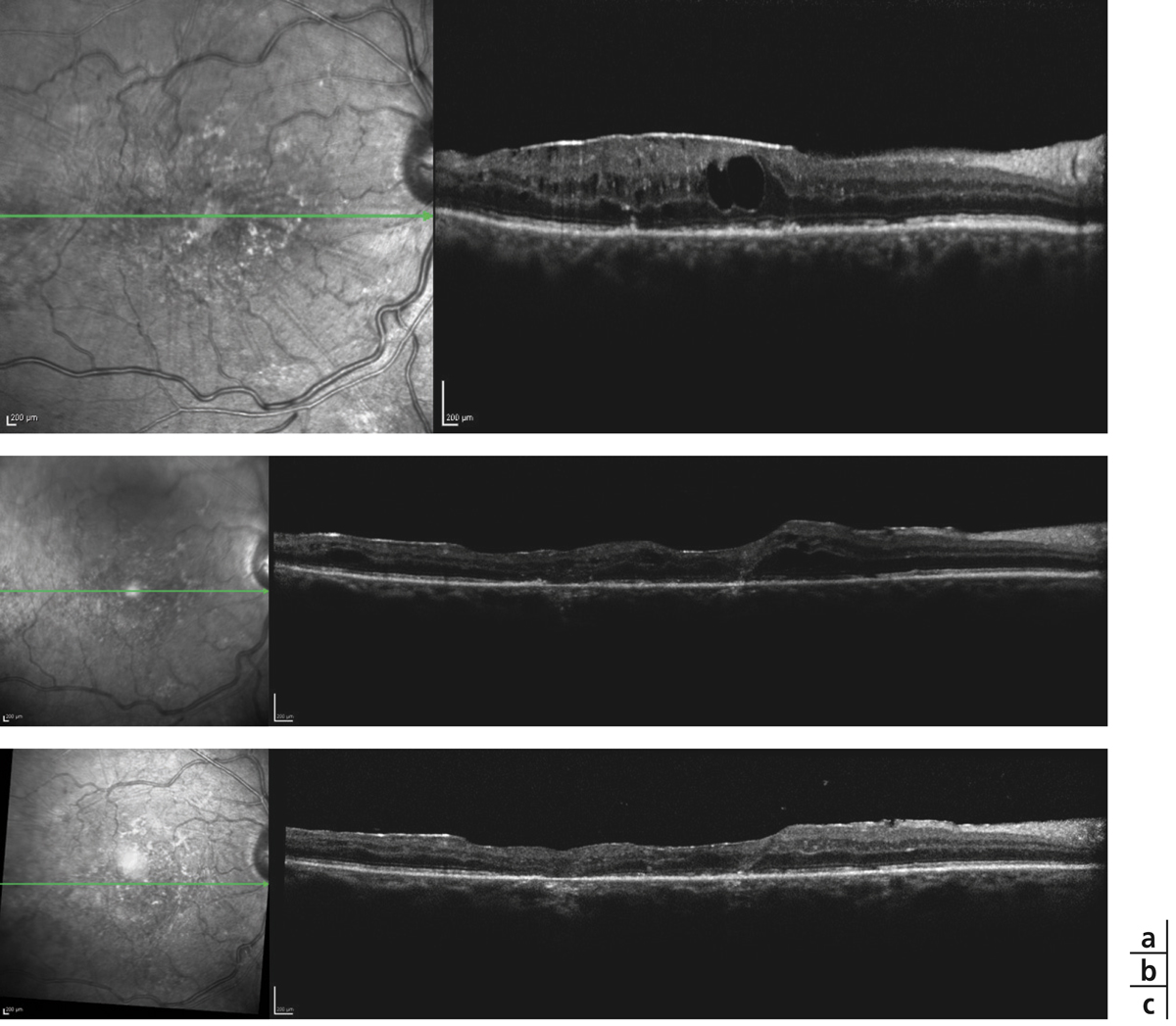
Fig. 8-93 Œdème maculaire diabétique associé à une membrane épirétinienne.
a. Aspect préopératoire. Il existe une fine membrane épirétinienne associée à l’œdème, responsable d’un plissement rétinien. L’acuité visuelle est de 20/200. b. Aspect 5 mois après vitrectomie, pelage de la MER, ablation de la MLI et injection de triamcinolone : il reste quelques kystes rétiniens. L’acuité visuelle est de 20/40. c. Même patient, 2 ans après la vitrectomie. L’amincissement rétinien confine à l’atrophie. L’acuité visuelle est inchangée à 20/40.
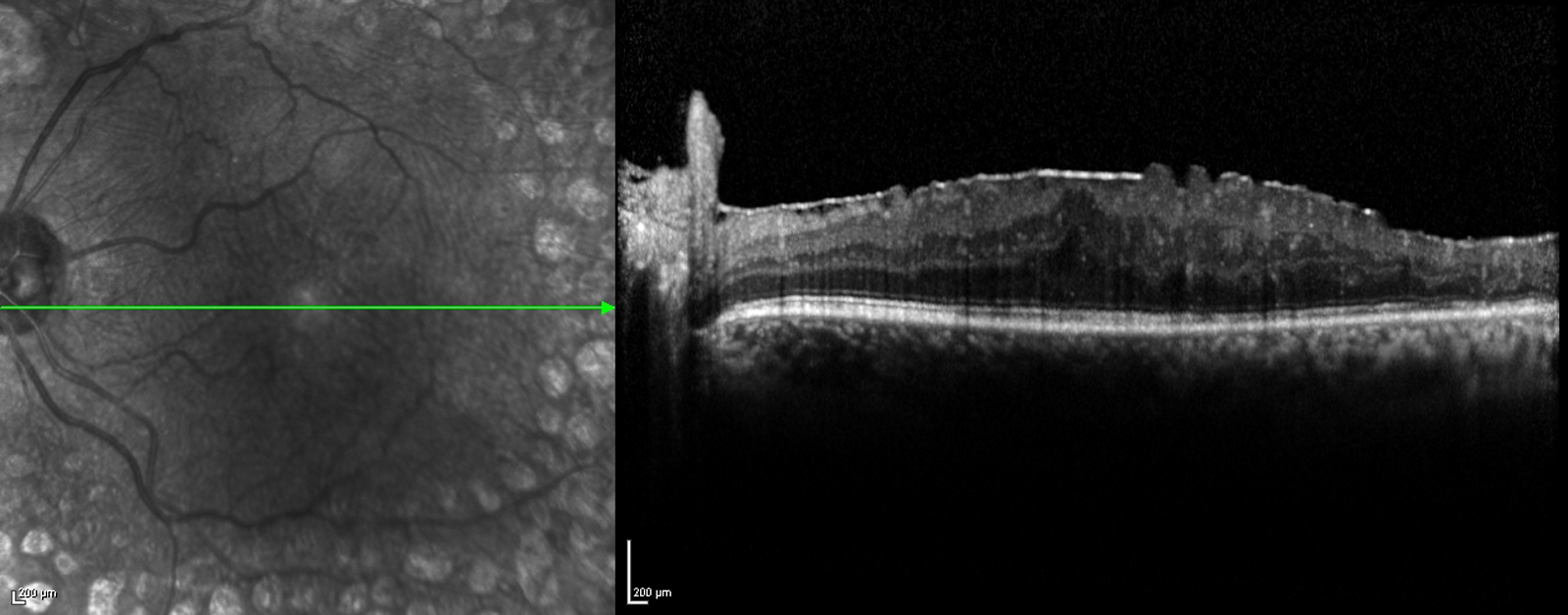
eFig. 8-24 Vitrectomie pour œdème maculaire diabétique en alternative au traitement par anti-VEGF.
[1] Stefansson E, Landers M, Wolbarsht M. Increased ret inal oxygen supply following pan retinal photocoagula tion and vitrectomy and lensectomy. Trans Am Ophthal mol Soc 1981 ; 129 : 308-21.
[2] Nasrallah FP, Jalkh AE, Coppenolle FV, et al. The role of the vitreous in diabetic macular edema. Ophthalmology 1988 ; 95 : 1335-9.
[3] Yamaguchi Y, Otani T, Kishi S. Resolution of diabetic cystoid macular edema associated with spontaneous vitreofoveal separation. Am J Ophthalmol 2003 ; 135 : 116-8.
[4] Lewis H, Abrams GW, Blumenkranz MS, Camp RV. Vitrectomy for diabetic macular traction and edema associated with posterior hyaloidal traction. Ophthalmology 1992 ; 99 : 753-9.
[5] Van Effenterre G, Guyot Argenton CL, Guiberteau B, et al. Œdèmes maculaires induits par la contraction de la hyaloïde postérieure. J Fr Ophtalmol 1993 ; 16 : 602-10.
[6] Harbour W, Smiddy WE, Flynn HW Jr, Rubsamen PE. Vitrectomy for diabetic macular edema associated with posterior hyaloid thickening and contraction. Am J Ophthalmol 1996 ; 121 : 405-13.
[7] Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001 ; 131 : 44-9.
[8] Tachi N, Ogino N. Vitrectomy for diffuse macular edema in cases of diabetic retinopathy. Am J Ophthalmol 1996 ; 122 : 258-60.
[9] Yamamoto T, Akabane N, Takeuchi S. Vitrectomy for diabetic macular edema : the role of posterior vitreous detachment and epimacular membrane. Am J Ophthalmol 2001 ; 132 : 369-77.
[10] Thomas D, Bunce C, Moorman C, Laidlaw DAH. A randomized controlled feasibility trial of vitrectomy versus laser for diabetic macular edema ? Br J Ophthal Mol 2005 ; 89 : 81-6.
[11] Massin P, Duguid G, Erginay A, et al. Optical coherence tomography for evaluating diabetic macular edema before and after vitrectomy. Am J Ophthalmol 2003 ; 135 : 169-77.
[12] Shimonagano Y, Makiuchi R, Miyazaki M, et al. Results of visual acuity and foveal thickness in diabetic macular edema after vitrectomy. Jpn J Ophthalmol 2007 ; 51 : 204-9.
[13] Gandorfer A, Messmer EM, Ulbig MW, Kampik A. Resolution of diabetic macular edema after surgical removal of the posterior hyaloid and the inner limiting membrane. Retina 2000 ; 20 : 126-33.
[14] Asami T, Terasaki H, Kachi S, et al. Ultrastructure of internal limiting membrane removed during plasmin assisted vitrectomy from eyes with diabetic macular edema. Ophthalmology 2004 ; 111 : 231-7.
[15] Diabetic Retinopathy Clinical Research Network. Vitrectomy for diabetic macular edema and vitreo macular traction. Ophthalmology 2010 ; 117 : 1087-93.
[16] Kumar A, Sinha S, Azad R, et al. Comparative evaluation of vitrectomy and dye enhanced ILM peel with grid laser in diffuse diabetic macular edema. Graefe’s Arch Clin Exp Ophthalmol 2006 ; 245 : 360-8.
[17] Patel JI, Hykin PG, Schadt M, et al. Diabetic macular oedema : pilot randomised trial of parts plana vitrectomy vs. macular argon photocoagulation ? Eye 2006 ; 20 : 873-81.
[18] Figueroa MS, Contreras I, Noval S. Surgical and ana tomical outcomes of pars plana vitrectomy for diffuse nontractional diabetic macular edema. Retina 2008 ; 28 : 420-6.
[19] Bonnin S, Sandali O, Bonnel S, et al. Vitrectomy with internal limiting membrane peeling for tractional and nontractional diabetic macular edema : long-term results of a comparative study. Retina 2014 ; 35 : 921-8.
[20] Kumagai K, Hangai M, Ogino N, Larson E. Effect of internal limiting membrane peeling on long term visual outcomes for diabetic macular edema. Retina 2015 ; 35 : 1422-8.
[21] Romano MR, Romano V, Vallejo-Garcia JL, et al. Macular hypotrophy after internal limiting membrane removal for diabetic macular edema. Retina 2014 ; 34 : 1182-9.
[22] Sitbon A, Dupas B, Chahed S, et al. Efficacité de la vitrectomie dans l’œdème maculaire diabétique associé à une membrane épimaculaire. J Fr Ophtalmol 2013 ; 36 : 830-5.
[23] Simunovic MP, Hunyor AP, Ho IV. Vitrectomy for diabetic macular edema : a systematic review and meta-analysis. Can J Ophthalmol 2014 ; 49 : 188-95.
P. Massin
➤ L’OMD n’est pas une entité unique.
➤ Il résulte de plusieurs mécanismes pathogéniques qui peuvent être associés (rupture de la BHR, altération des mécanismes de déshydratation de la rétine : voir chapitre 8.2). Il peut être aussi aggravé par des facteurs systémiques (HTA) ou oculaires (traction vitréomaculaire).
➤ Il existe donc plusieurs formes cliniques de l’OMD et il est important avant d’entreprendre son traitement de connaître sa nature. Cette démarche aidera à faire le choix thérapeutique le mieux adapté.
Le bilan préthérapeutique a pour but de phénotyper l’OMD mais également le patient. En effet, l’OMD s’inscrit dans une pathologie systémique dont il est l’une des complications et il est donc essentiel de recueillir l’ensemble des données concernant le diabète et les facteurs de risque associés (HTA, dyslipidémie, etc.). Une collaboration interdisciplinaire avec le diabétologue, le médecin généraliste, le cardiologue, etc. est donc un préalable indispensable à la bonne prise en charge d’un OMD.
L’interrogatoire doit recueillir les données cliniques concernant le patient diabétique et l’OMD (fig. 8-94). L’examen clinique comprend une mesure de la meilleure acuité visuelle corrigée pour évaluer le retentissement fonctionnel, un examen biomicroscopique complet du segment antérieur sans oublier de rechercher une éventuelle rubéose irienne, une mesure de la pression intra-oculaire et un examen biomicroscopique du segment postérieur, qui doit préciser l’état du vitré et la sévérité de la rétinopathie diabétique (RD) associée.
Les examens complémentaires comprennent :
-
l’OCT : elle permet d’affirmer le diagnostic d’œdème, d’objectiver l’épaississement maculaire, de le localiser et de le quantifier ; elle permet en outre l’analyse des modifications des structures intrarétiniennes associées à l’OMD et de l’interface vitréomaculaire. Elle objective ainsi la présence de facteurs prédictifs péjoratifs pour l’acuité visuelle (atrophie étendue des photorécepteurs ou amincissement de la rétine interne, par exemple) ;
-
les photographies en couleurs du fond d’œil du pôle postérieur et de la périphérie rétinienne : elles permettent de voir les lésions rétiniennes avec une plus grande sensibilité que l’examen du fond d’œil et permettent de quantifier la sévérité de la RD associée à l’OMD ;
-
l’angiographie à la fluorescéine : elle précise les sources des diffusions à l’origine de l’OMD, ainsi que la sévérité des occlusions capillaires maculaires associées à l’OMD, facteur pronostic important.
Au terme de ces examens, il sera possible de préciser le type de l’OMD et sa sévérité selon la classification de l’OMD exposée au chapitre 8.7 [1], son retentissement fonctionnel et parfois de se prononcer sur l’avenir visuel du patient en fonction des facteurs pronostiques recueillis pendant le bilan. Celui-ci pourra, dans certains cas, identifier un facteur aggravant majeur dont le seul traitement peut suffire à faire régresser l’OMD (HTA très déséquilibrée, traction vitréomaculaire, etc.).
Il sera ensuite nécessaire de faire la synthèse des facteurs influençant la décision thérapeutique (fig. 8-94).
L’heure du début du traitement dépend essentiellement de l’acuité visuelle.
En l’absence de baisse de l’acuité visuelle :
-
l’équilibre des facteurs systémiques est toujours indispensable ;
-
le seul traitement à envisager est celui d’éventuelles fuites focales accessibles au traitement par laser. Il sera débuté sans tarder lorsqu’existe une menace visuelle, notamment en cas d’OM modéré ou sévère ;
-
sinon, une surveillance est recommandée (pas d’indication préventive aux IVT en l’absence de données complémentaires du fait du risque d’endophtalmie et de la possible amélioration spontanée de l’OMD).
S’il existe une baisse de l’acuité visuelle significative due à un œdème maculaire sévère :
-
lorsqu’il existe un grand déséquilibre des facteurs systémiques « inaugural », sans prise en charge antérieure, on peut attendre 2 à 3 mois avant d’instaurer un traitement par IVT, l’équilibration des facteurs systémiques pouvant permettre d’améliorer l’OMD ;
-
sinon, même s’il n’y a pas d’urgence à traiter, il est recommandé de ne pas trop attendre, un trop grand retard à la mise en route du traitement par injections étant délétère. Au vu des données récemment publiées, notamment du protocole T [2], il paraît légitime de débuter le traitement par injections dès que l’acuité visuelle chute à 7/10 Parinaud 3 ou moins. Le traitement de première intention consiste dans la majorité des cas à réaliser des IVT d’anti-VEGF ou de corticoïdes.
Le traitement par laser est indiqué de première intention :
-
en cas d’OM modéré, n’atteignant pas la région centrale ;
-
et éventuellement en cas d’OM sévère atteignant la région centrale, lorsqu’il existe des diffusions à partir de micro-anévrismes accessibles au traitement par laser et que l’acuité visuelle est normale.
Le traitement sera réalisé avec une intensité modérée et à distance prudente du centre de la macula. Seules les lésions (notamment les micro-anévrismes) situées à plus de 750 à 1000 μ du centre de la macula seront traitées. L’application d’impacts de laser plus proches du centre de la macula n’est pas recommandée (voir plus haut chapitre 8.10).
En dehors de ces circonstances, le traitement par laser n’est indiqué qu’en deuxième intention, comme éventuel complément du traitement par IVT sur des zones d’épaississement périfovéales résiduelles.
Les IVT sont proposées comme traitement de première intention dans la grande majorité des cas d’OMD sévère responsable d’une baisse d’acuité visuelle.
Trois traitements peuvent être proposés en première intention : le ranibizumab, l’aflibercept ou l’implant de dexaméthasone.
Le traitement par injections mensuelles d’anti-VEGF (ranibizumab ou aflibercept) sera proposé de première intention :
-
d’autant plus qu’il existe une ischémie rétinienne périphérique sévère et, a fortiori, une rubéose irienne ;
-
en l’absence de contre-indications aux anti-VEGF : antécédents cardiovasculaires récents (infarctus du myocarde, accident vasculaire cérébral datant de moins de 3 mois), grossesse ;
-
mais à condition qu’un suivi mensuel soit possible, indispensable au cours de la première année ;
-
en cas de contre-indications à l’implant de dexaméthasone.
Le choix entre les deux anti-VEGF disponibles, ranibizumab ou aflibercept, sera laissé à la libre appréciation des ophtalmologistes prescripteurs, aucune donnée n’étant disponible sur la comparaison en face à face entre les deux traitements aux doses commercialisées en Europe.
Le traitement par IVT de l’implant de dexaméthasone pourra être proposé de première intention, conformément à l’AMM :
-
chez le patient pseudophaque ;
-
chez le patient phaque, pour lequel un traitement non corticoïde ne convient pas, particulièrement lorsqu’un suivi mensuel n’est pas possible (difficultés de déplacement, patient peu compliant, ou ne souhaitant pas venir tous les mois), ou lorsqu’il existe des contre-indications au traitement par anti-VEGF (voir ci-dessus). S’il s’agit d’un sujet jeune, dont le cristallin est clair, il devra être prévenu du risque de cataracte lié à l’utilisation des corticoïdes ;
-
ce traitement est contre-indiqué en cas de glaucome évolué ou non équilibré. Il est habituel de ne pas l’utiliser chez des glaucomateux traités par bithérapie, d’aphaquie, en présence d’un implant à fixation irienne, ou d’une iridectomie périphérique de grande taille et en cas d’antécédents infectieux oculaires (herpès, toxoplasmose, etc.).
Le schéma thérapeutique de ces traitements est proposé dans les encadrés 8-3 à 8-6
Indication dans l’OMD sévère associé à une baisse visuelle.
Traitement en 3 PHASES, conduit à la fois en fonction de l’acuité visuelle et de l’OCT :
• phase I, induction : 3 IVT mensuelles :
■ bilan AV + OCT dans les 15 jours suivant la troisième injection,
■ permet de juger si le patient est répondeur au traitement,
■ patient REPONDEUR : gain AV ≥ 5 lettres ou réduction de l’EMC ≥ 10 % ;
• phase II, traitement intensif :
■ si le patient est répondeur, poursuivre les injections mensuelles jusqu’à STABILISATION de l’acuité visuelle ET de l’épaisseur maculaire,
■ STABILISATION : Δ AV < 5 lettres et Δ EMC < 10 % au cours de 3 évaluations successives ;
• phase III, éviter la récidive :
■ soit suivi mensuel (PRN) et reprise des injections en cas de diminution de l’acuité visuelle et/ou augmentation de l’épaisseur maculaire,
■ soit stratégie « treat and extend » comprenant des injections réalisées avec des intervalles croissants mais un délai raccourci en cas de récidive de l’OMD.
Si aucun gain d’acuité visuelle et aucune réduction de l’épaisseur maculaire ne sont observés après la phase d’induction, le traitement par ranibizumab sera interrompu, et un traitement utilisant une autre molécule pourra être entrepris.
Δ AV : varitation d’acuité visuelle ; Δ EMC : variation épaisseur maculaire centrale.
Indication dans l’OMD sévère associé à une baisse visuelle.
• Traitement réalisé selon le schéma fixe de l’AMM : injection 1 fois/mois pendant 5 mois consécutifs suivi d’une injection tous les 2 mois.
• Il est recommandé néanmoins de s’assurer d’une réponse fonctionnelle et/ou anatomique au traitement après 3 à 4 injections.
• Si aucun gain d’acuité visuelle et aucune réduction de l’épaisseur maculaire ne sont observés après la phase d’induction, le traitement par aflibercept sera interrompu et un traitement utilisant une autre molécule pourra être entrepris.
• Après les 12 premiers mois de traitement par aflibercept, l’intervalle entre 2 injections peut être élargi en fonction des résultats visuels et anatomiques.
• À la suite de la publication du protocole T, il paraît légitime d’utiliser aussi un protocole PRN basé sur l’acuité visuelle et l’OCT, comprenant des injections mensuelles jusqu’à stabilisation de l’acuité visuelle et de l’EMC (STABILITÉ : Δ AV < 5 lettres et Δ EMC < 10 % au cours de 3 évaluations successives).
Δ AV : varitation d’acuité visuelle ; Δ EMC : variation épaisseur maculaire centrale.
Indication dans l’OMD sévère associé à une baisse visuelle.
• Après la première injection, visites de contrôle à 1, 2 et 4 mois comprenant mesure de la pression intra-oculaire, de l’acuité visuelle et OCT.
• En cas d’hypertonie oculaire > 21 mmHg à l’initiation du traitement, un contrôle supplémentaire est recommandé dans les 15 jours suivant l’injection, uniquement après la première injection.
• Lors de la deuxième injection, en l’absence d’hypertonie constatée lors de la première injection, un seul contrôle pressionnel entre 1 et 2 mois post-injection est recommandé.
• Lors des injections ultérieures, la visite de 4 mois post-injection permet d’évaluer la pérennité de l’action de la molécule afin de définir la nécessité de réinjection.
• Si aucun gain d’acuité visuelle et aucune réduction de l’épaisseur maculaire ne sont observés après la première injection, ou si une hypertonie oculaire sévère non contrôlable survient, le traitement par dexaméthasone sera interrompu et un traitement utilisant une autre molécule pourra être entrepris.
• Visites de contrôle à 1, 2 et 4 mois comprenant mesure de la pression intra-oculaire, de l’acuité visuelle et OCT.
• En cas d’hypertonie oculaire > 21 mmHg à l’initiation du traitement, un contrôle supplémentaire est recommandé au 7e jour.
• Le contrôle de la pression oculaire sera poursuivi ultérieurement tous les 3 mois, car l’apparition de l’hypertonie peut être retardée.
.
Tel qu’indiqué ci-dessus, un traitement pas laser pourra être proposé, comme éventuel complément du traitement par IVT sur des zones d’épaississement périfovéales résiduelles, en respectant les précautions déjà énoncées.
Une vitrectomie peut être proposée en cas d’OMD tractionnel, c’est-à-dire s’il existe une traction vitréomaculaire évidente en OCT ou une membrane épimaculaire épaisse en cas d’OM sévère responsable d’une baisse visuelle.
S’il existe un doute sur l’existence d’une traction, une vitrectomie pourra être proposée devant l’échec des traitements par IVT.
En cas d’inefficacité du traitement intravitréen initial, un changement de traitement par une des autres molécules pourra être réalisé, en respectant les contre-indications respectives.
Enfin, le traitement par implant d’acétonide de fluocinolone (Iluvien®) pourra être proposé aux patients insuffisamment répondeurs aux traitements par anti-VEGF. S’agissant d’un traitement de longue durée, il paraît logique de le proposer aux patients pour lesquels une efficacité des corticoïdes intravitréens de plus courte durée a déjà été démontrée et n’ayant pas présenté d’hypertonie oculaire sévère lors des précédents traitements par corticoïdes. Son absence de remboursement actuelle limite son utilisation.
-
Grossesse : comme indiqué dans le chapitre 8.8, il est recommandé de ne pas traiter l’OMD pendant la grossesse, celui-ci disparaissant après l’accouchement dans la majorité des cas. Les traitements par anti-VEGF doivent être évités pendant la grossesse et les corticoïdes sont peu recommandés, les patientes étant jeunes et phaques dans la majorité des cas.
-
Rétinopathie diabétique floride et OMD : comme indiqué dans le chapitre 8.8, si l’acuité visuelle est normale ou modérément diminuée, la PPR à elle seule peut permettre une disparition de l’OMD, même si l’injection d’anti-VEGF permet de réaliser plus lentement, et donc avec moins de risque, la PPR. Si l’acuité visuelle est sévèrement réduite, le traitement par IVT d’anti-VEGF sera associé à la PPR, en étant vigilant sur le risque de rétraction d’une éventuelle fibrose.
-
La chirurgie de la cataracte peut aggraver un OMD préexistant (voir chapitre 8.8). En cas d’OMD préexistant atteignant la région centrale, un traitement par IVT d’anti-VEGF ou par implant de dexaméthasone sera entrepris avant la chirurgie et poursuivi en postopératoire. En cas d’apparition d’un OMD après la chirurgie, le traitement de choix est l’implant de dexaméthasone en l’absence de contre-indications, du fait de la composante inflammatoire.
[1] Massin P, Baillif S, Creuzot C, et al. Œdème maculaire diabétique : diagnostic et bilan préthérapeutique. J Fr Ophtalmol 2015 ; 38 : e187-9.
[2] Diabetic Retinopathy Clinical Research Network, Wells JA, Glassman AR, Ayala AR, et al. Aflibercept, bevacizumab, or ranibizumab for diabetic macular edema. N Engl J Med 2015 ; 372 : 1193-203.
[3] Massin P, Baillif S, Creuzot C, et al. Fiche d’information aux médecins : traitement de l’œdème maculaire diabétique. J Fr Ophtalmol 2015 ; 38 : e191-7.