Œdème maculaire postopératoire (dont syndrome d’Irvine-Gass)
Coordonné par M. Weber
T. Zhou, C. Chiquet
➤ On parle de syndrome d’Irvine-Gass lorsqu’un œdème maculaire (OM) fait suite à une chirurgie de la cataracte et on parle d’OM postopératoire quand il fait suite aux autres chirurgies.
➤ La prévalence d’un syndrome d’Irvine-Gass varie selon les critères OCT, angiographique ou clinique retenus.
➤ La prévalence d’un syndrome d’Irvine-Gass est nettement augmentée en cas de rupture capsulaire ou de chirurgie sur terrain diabétique, uvéitique ou d’antécédent d’occlusion veineuse.
➤ La prévalence d’un œdème maculaire postopératoire après chirurgie vitréorétinienne est supérieure à 5 % (avec des chiffres variant selon le type de chirurgie et le terrain).
➤ La physiopathogénie d’un OM postopératoire, d’une cataracte ou d’une autre chirurgie est multifactorielle : inflammatoire, mécanique et/ou phototoxique.
L’œdème maculaire (OM) postopératoire, plus connu sous le nom de « syndrome d’Irvine-Gass » dans les suites de la première description par Irvine en 1953 et démontré angiographiquement par Gass et Norton en 1966 [1, 2], est une cause de baisse d’acuité visuelle après chirurgie ophtalmologique, principalement après chirurgie de la cataracte. Cet OM apparaît généralement entre le 1er et le 6e mois après la chirurgie et peut persister plus de 3 mois. L’OM peut être aigu (apparition durant les 4 premiers mois postopératoires), retardé (après les 4 mois) ou chronique (durée d’évolution supérieure à 6 mois).
Sa définition est variable en fonction de la méthodologie utilisée pour sa détection :
l’OM cliniquement significatif est un OM directement visible à l’ophtalmoscopie qui s’accompagne d’un retentissement fonctionnel important (logMAR < 0,3, Snellen < 20/40 ou Monoyer < 5/10). La chronicité de l’OM cliniquement significatif est définie par une durée supérieure ou égale à 6 mois ;
l’OM cystoïde défini à l’angiographie à la fluorescéine est typiquement décrit comme une hyperfluorescence en pétales de fleur aux temps tardifs, avec fuite capillaire périfovéolaire ;
l’OM a été plus récemment défini grâce à la tomographie par cohérence optique (optical coherence tomography [OCT]) avec des définitions variables en fonction des études :
augmentation de plus de 30 % de l’épaisseur maculaire centrale (EMC) par rapport aux valeurs préopératoires,
EMC supérieure à 200 µm au niveau de la fovéa en spectral-domain optical coherence tomography (SD-OCT),
augmentation de l’EMC dépassant la valeur préopératoire + 3 déviations standard (DS) pour une population donnée et/ou présence de kyste associée à une augmentation de l’EMC [3].
La prévalence des OM postopératoires est donc très variable en fonction des critères diagnostiques. La prévalence est toujours plus importante dans la période périopératoire précoce.
L’OM cliniquement significatif diagnostiqué par simple examen biomicroscopique du fond d’œil est relativement peu fréquent avec une incidence variant de 0,2 à 2 % comparativement aux OM diagnostiqués par des techniques d’imagerie [4].
En angiographie et les jours suivant la chirurgie de cataracte, plus de 50 % des patients présenteraient un OM non cliniquement significatif, 8 % un OM cliniquement significatif et seulement 1 à 3 % de ces OM persisteraient [5]. Ainsi, 12 mois après chirurgie de la cataracte, 3 % des patients présentent un OM en angiographie [6].
Les études utilisant l’OCT comme moyen diagnostique rapportent une prévalence plus importante de l’ordre de 3 à 7 % dans la première année postopératoire, en absence de facteurs prédisposants (tableau 11-1) [5–10].
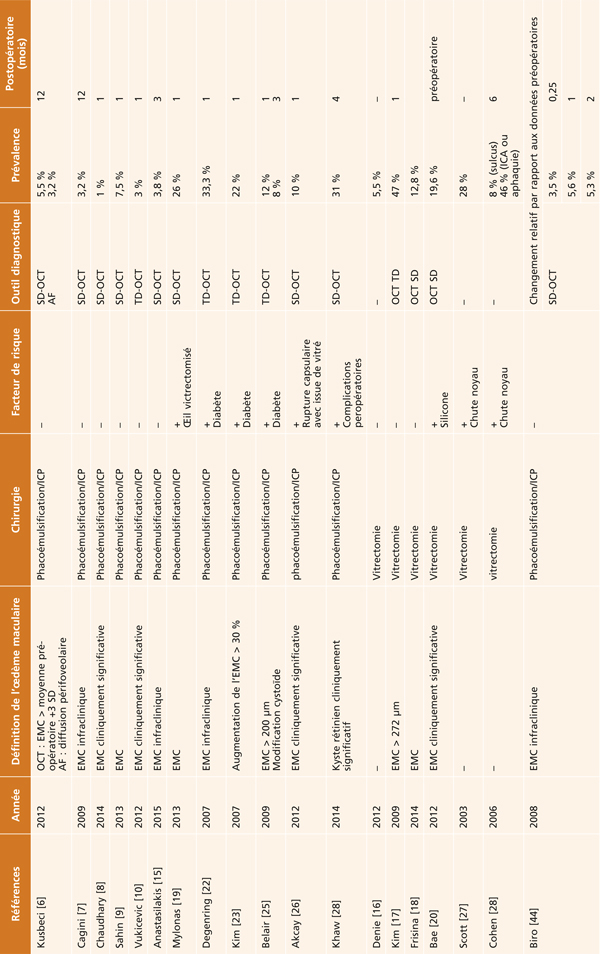
Tableau 11-1 Épidémiologie de l’œdème maculaire post-chirurgical.
La chirurgie de cataracte, sans complication et sans facteur de risque, peut se compliquer d’un OM postopératoire. L’évolution des techniques opératoires a permis de diminuer ce risque, passant de 6 à 23 % pour les extractions intracapsulaires avec implant à support irien [5, 11] à 6 % pour les implantations en chambre antérieure [12], puis 1,2 à 2,3 % pour les extractions extracapsulaires et implantations intracapsulaires [5, 11]. La diminution de taille des incisions et l’utilisation de la phacoémulsification ont réduit ces complications jusqu’à 1 % [8], la prévalence globale des études les plus récentes variant entre 0,1 et 2,3 % [13, 14].
Le temps opératoire et l’énergie utilisée lors de la phacoémulsification sont corrélés également à la prévalence des OM cliniquement non significatifs en OCT [15].
L’OM survient avec une prévalence de 5 % chez les patients vitrectomisés pour des corps flottants [16]. Toutes chirurgies vitréorétiniennes confondues, une étude prospective sur 100 patients a retrouvé une incidence de 47 % d’OM en OCT 1 mois après la chirurgie [17].
Dans une étude rétrospective en SD-OCT, l’incidence d’OM sur 1 an est de 12,8 % après chirurgie de membranes épirétiniennes (MER), avec une prévalence augmentée pour les chirurgies combinées phaco-vitrectomie [18] (10 % pour la vitrectomie seule versus 15 % en cas de chirurgie combinée) [18]. Les patients opérés de MER avec pelage de limitante interne développent un OM dans 26 % des cas après chirurgie de cataracte sans complication [19]. L’utilisation d’huile de silicone peut également être associée à la survenue d’œdème maculaire cystoïde ou OMC (19 %) [20], le risque augmentant avec la durée du tamponnement.
Les facteurs de risque sont le diabète (prévalence de 3 à 33 % chez les diabétiques versus 1,7 % chez les non-diabétiques) [21–23], la rétinopathie diabétique avec un risque augmentant avec la sévérité de celle-ci [24], l’uvéite intermédiaire ou postérieure (incidence de 12 % et 8 % à 1 et 3 mois, respectivement), d’autant plus que l’inflammation est mal contrôlée durant les 3 premiers mois avant la chirurgie [25].
Les complications peropératoires, comme la rupture capsulaire avec issue de vitré (prévalence d’OM de 10 %) [26] ou la chute de noyau cristallinien (29 %) [27], augmentent la prévalence de l’OM postopératoire. Toutes complications confondues (rupture capsulaire, issue de vitré, désinsertion zonulaire, chute de noyau), la prévalence de l’OM en SD-OCT est estimée à 31 % [28]. La technique d’implantation semble également jouer un rôle, car l’incidence d’OMC est de 8 % pour les implants placés dans le sulcus contre 46 % des yeux restant aphaques ou bénéficiant d’une implantation à fixation irienne [29].
L’effet favorisant des collyres de prostaglandine est discuté. Ceux-ci en effet auraient un effet favorisant l’apparition d’OM en postopératoire chez les patients pseudophaques ou aphaques, avec résolution de l’OM à l’arrêt du collyre [30–32].
La physiopathogénie de l’œdème maculaire postopératoire est multifactorielle.
À un stade précoce, les modifications histologiques au niveau de la rétine au cours des OM sont liées à une rupture de la barrière hémato-rétinienne interne ou BHRi (altération des jonctions serrées des cellules endothéliales et dégénérescence avec œdème des cellules de Müller) et externe ou BHRe (altération des jonctions serrées des cellules de l’épithélium pigmentaire) avec accumulation de liquide dans l’espace extracellulaire [33]. Il se forme alors des kystes entre les couches plexiforme externe et nucléaire interne avec possible coalescence des espaces cystoïdes pour former de larges kystes intrarétiniens [34].
Il existe également une hypertrophie et/ou hyperplasie de l’épithélium pigmentaire.
Des cellules gliales peuvent migrer à la surface interne de la rétine et aboutir à la formation d’une MER.
La macula est une zone prédisposée au développement d’OM du fait de la direction latérale des fibre de Henlé allant du centre fovéolaire vers la région périfovéolaire, du potentiel de réservoir d’accumulation de fluide extracellulaire au niveau de la couche plexiforme externe, et de la zone avasculaire centrale entraînant une zone de fragilité entre la choroïde et la circulation rétinienne, avec diminution du pouvoir de résorption liquidienne [33].
De nombreux médiateurs pro-inflammatoires comme les prostaglandines, des cytokines (l’interleukine 1ß ou IL-1ß, IL-6, et le monocyte chemoattractant protein-1 [MCP-1] [35]) et d’autres médiateurs de l’inflammation (sérotonine, bradykinine, histamine, substance P) joueraient un rôle essentiel dans la genèse des OM postopératoires. Les prostaglandines, principal médiateur en cause, sont des métabolites de l’acide arachidonique, obtenus à partir de phospholipides membranaires par action de la phospholipases A2 (sécrétées en réponse à une agression tissulaire). D’autres substances pro-inflammatoires sont également libérées : le platelet-activating factor (PAF) et les leucotriènes [36]. D’autres cytokines comme le vascular endothelial growth factor (VEGF) et l’insulin-like growth factor-1 (IGF-1), médiateurs secrétés par des tissus ischémiques, sont également suspectées de participer à la genèse de l’OM post-chirurgical. Ces médiateurs seraient libérés par le tissu irien lésé lors des manipulations intra-oculaires au moment de la chirurgie de la cataracte (le rôle protecteur de la capsule postérieure ayant déjà été décrit dans la littérature) [37].
La quantification de cette inflammation a d’ailleurs été réalisée après chirurgie de cataracte à l’aide du tyndallomètre laser (résultat bien corrélé à la concentration en protéines dans l’humeur aqueuse, indirectement liée à une atteinte de la barrière hémato-aqueuse) [38].
Ces molécules pro-inflammatoires augmenteraient donc la perméabilité au liquide extracellulaire en rompant tout d’abord la barrière hémato-aqueuse, puis diffuseraient à travers le vitré jusqu’à la rétine ouvrant les jonctions serrées intercellulaires des cellules endothéliales et de l’épithélium pigmentaire (rupture de la BHRi et de la BHRe) [31]. L’efficacité des anti-inflammatoires non stéroïdiens en prévention primaire soutient cette hypothèse [39].
La présence de fibres vitréennes au niveau des cellules de Müller évoque le rôle d’une traction vitréomaculaire au cours des chirurgies, notamment en cas de rupture capsulaire avec issue ou incarcération de vitré. Les modifications vitréennes entraîneraient des tractions maculaires avec décompensation des cellules de Müller. L’issue de vitré augmente le risque d’apparition d’OMC [40]. Dans une série de cas rétrospectifs d’OMC chronique, des tractions rétiniennes extrafovéolaires ont été retrouvées en SD-OCT [41]. La vitrectomie a été proposée pour lever ces adhérences vitréomaculaires [42].
Les phototraumatismes de l’épithélium pigmentaire peuvent causer une rupture de la BHRe et ainsi engendrer un OM. Deux mécanismes sont avancés : des lésions thermiques par absorption de la lumière par l’épithélium pigmentaire (EP) pendant la chirurgie et/ou des lésions photochimiques causées par la lumière du microscope opératoire. La phototoxicité du rayonnement ultraviolet (UV) serait en partie liée à l’ablation du cristallin protecteur, entraînant une formation de radicaux libres et de prostaglandines. Cette hypothèse est controversée, l’utilisation de filtre anti-UV sur le microscope opératoire [43] ne semblant pas protéger de la survenue d’un OM postopératoire.
L’évolution spontanée des OM postopératoires est dans la majorité des cas favorable puisqu’environ 90 % régressent spontanément en quelques mois avec une amélioration de l’acuité visuelle. La plupart des patients présentant un OM non cliniquement significatif passent donc inaperçus [44]. Cependant dans 1 à 3 % des cas, l’OMC peut persister [45], l’augmentation des kystes intrarétiniens pouvant aboutir à la création de trou lamellaire ou de trou maculaire. L’altération des photorécepteurs par l’œdème chronique peut aboutir à une baisse de l’acuité visuelle irréversible. Malgré la résorption spontanée ou traitée, ces cas peuvent passer à un état de chronicité, alternant les phases de rémissions et les phases de récidives œdémateuses [4].
[1] Gass JD, Norton EW. Cystoid macular edema and papilledema following cataract extraction. A fluorescein fundoscopic and angiographic study. Arch Ophthalmol 1966 ; 76 : 646-61.
[2] Irvine SR. A newly defined vitreous syndrome following cataract surgery. Am J Ophthalmol 1953 ; 36 : 599-619.
[3] Jittpoonkuson T, Garcia PM, Rosen RB. Correlation between fluorescein angiography and spectral-domain optical coherence tomography in the diagnosis of cystoid macular edema. Br J Ophthalmol 2010 ; 94 : 1197-200.
[4] Lobo C. Pseudophakic cystoid macular edema. Ophthalmologica 2012 ; 227 : 61-7.
[5] Stark WJ Jr., Maumenee AE, Fagadau W, et al. Cystoid macular edema in pseudophakia. Surv Ophthalmol 1984 ; 28 Suppl : 442-51.
[6] Kusbeci T, Eryigit L, Yavas G, Inan UU. Evaluation of cystoid macular edema using optical coherence tomography and fundus fluorescein angiography after uncomplicated phacoemulsification surgery. Curr Eye Res 2012 ; 37 : 327-33.
[7] Cagini C, Fiore T, Iaccheri B, et al. Macular thickness measured by optical coherence tomography in a healthy population before and after uncomplicated cataract phacoemulsification surgery. Curr Eye Res 2009 ; 34 : 1036-41.
[8] Chaudhary C, Bahadhur H, Gupta N. Study of cystoid macular edema by optical coherent tomography following uneventful cataract surgery. Int Ophthalmol 2015 ; 35 : 685-91.
[9] Sahin M, Cingu AK, Gozum N. Evaluation of cystoid macular edema using optical coherence tomography and fundus autofluorescence after uncomplicated phacoemulsification surgery. J Ophthalmol 2013 ; 2013 : 376013.
[10] Vukicevic M, Gin T, Al-Qureshi S. Prevalence of optical coherence tomography-diagnosed postoperative cystoid macular oedema in patients following uncomplicated phaco-emulsification cataract surgery. Clin Experiment Ophthalmol 2012 ; 40 : 282-7.
[11] Stark WJ, Maumenee AE, Dangel ME, et al. Intraocular lenses. Experience at the Wilmer Institute. Ophthalmology 1982 ; 89 : 104-8.
[12] Moses L. Complications of rigid anterior chamber implants. Ophthalmology 1984 ; 91 : 819-25.
[13] Zur D, Fischer N, Tufail A, et al. Postsurgical cystoid macular edema. Eur J Ophthalmol 2011 ; 21 Suppl 6 : S62-8.
[14] Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg 2007 ; 33 : 1550-8.
[15] Anastasilakis K, Mourgela A, Symeonidis C, et al. Macular edema after uncomplicated cataract surgery : a role for phacoemulsification energy and vitreoretinal interface status ? Eur J Ophthalmol 2015 ; 25 : 192-7.
[16] de Nie KF, Crama N, Tilanus MA, et al. Pars plana vitrectomy for disturbing primary vitreous floaters : clinical outcome and patient satisfaction. Graefes Arch Clin Exp Ophthalmol 2013 ; 251 : 1373-82.
[17] Kim SJ, Martin DF, Hubbard GB 3rd, et al. Incidence of postvitrectomy macular edema using optical coherence tomography. Ophthalmology 2009 ; 116 : 1531-7.
[18] Frisina R, Pinackatt SJ, Sartore M, et al. Cystoid macular edema after pars plana vitrectomy for idiopathic epiretinal membrane. Graefes Arch Clin Exp Ophthalmol 2015 ; 553 : 47-56.
[19] Mylonas G, Sacu S, Deak G, et al. Macular edema following cataract surgery in eyes with previous 23-gauge vitrectomy and peeling of the internal limiting membrane. Am J Ophthalmol 2013 ; 155 : 253-9.
[20] Bae SH, Hwang JS, Yu HG. Comparative analysis of macular microstructure by spectral-domain optical coherence tomography before and after silicone oil removal. Retina 2012 ; 32 : 1874-83.
[21] Schmier JK, Halpern MT, Covert DW, Matthews GP. Evaluation of costs for cystoid macular edema among patients after cataract surgery. Retina 2007 ; 27 : 621-8.
[22] Degenring RF, Vey S, Kamppeter B, et al. Effect of uncomplicated phacoemulsification on the central retina in diabetic and non-diabetic subjects. Graefes Arch Clin Exp Ophthalmol 2007 ; 245 : 18-23.
[23] Kim SJ, Equi R, Bressler NM. Analysis of macular edema after cataract surgery in patients with diabetes using optical coherence tomography. Ophthalmology 2007 ; 114 : 881-9.
[24] Samanta A, Kumar P, Machhua S, et al. Incidence of cystoid macular oedema in diabetic patients after phacoemulsification and free radical link to its pathogenesis. Br J Ophthalmol 2014 ; 98 : 1266-72.
[25] Belair ML, Kim SJ, Thorne JE, et al. Incidence of cystoid macular edema after cataract surgery in patients with and without uveitis using optical coherence tomography. Am J Ophthalmol 2009 ; 148 : 128-35.
[26] Akcay BI, Bozkurt TK, Guney E, et al. Quantitative analysis of macular thickness following uneventful and complicated cataract surgery. Clin Ophthalmol 2012 ; 6 : 1507-11.
[27] Scott IU, Flynn HW Jr., Smiddy WE, et al. Clinical features and outcomes of pars plana vitrectomy in patients with retained lens fragments. Ophthalmology 2003 ; 110 : 1567-72.
[28] Khaw KW, Lam HH, Khang TF, et al. Spectral-domain optical coherence tomography evaluation of postoperative cystoid macular oedema following phacoemulsification with intraoperative complication. BMC Ophthalmol 2014 ; 14 : 16.
[29] Cohen SM, Davis A, Cukrowski C. Cystoid macular edema after pars plana vitrectomy for retained lens fragments. J Cataract Refract Surg 2006 ; 32 : 1521-6.
[30] Schumer RA, Camras CB, Mandahl AK. Latanoprost and cystoid macular edema : is there a causal relation ? Curr Opin Ophthalmol 2000 ; 11 : 94-100.
[31] Miyake K, Ibaraki N. Prostaglandins and cystoid macular edema. Surv Ophthalmol 2002 ; 47 Suppl 1 : S203-18.
[32] Warwar RE, Bullock JD, Ballal D. Cystoid macular edema and anterior uveitis associated with latanoprost use. Experience and incidence in a retrospective review of 94 patients. Ophthalmology 1998 ; 105 : 263-8.
[33] Coscas G, Cunha-Vaz J, Soubrane G. Macular edema : definition and basic concepts. Dev Ophthalmol 2010 ; 47 : 1-9.
[34] Sigler EJ. Microcysts in the inner nuclear layer, a nonspecific SD-OCT sign of cystoid macular edema. Invest Ophthalmol Vis Sci 2014 ; 55 : 3282-4.
[35] Chu L, Wang B, Xu B, Dong N. Aqueous cytokines as predictors of macular edema in non-diabetic patients following uncomplicated phacoemulsification cataract surgery. Mol Vis 2013 ; 19 : 2418-25.
[36] Kent D, Vinores SA, Campochiaro PA. Macular oedema : the role of soluble mediators. Br J Ophthalmol 2000 ; 84 : 542-5.
[37] Kraff MC, Sanders DR, Jampol LM, Lieberman HL. Effect of primary capsulotomy with extracapsular surgery on the incidence of pseudophakic cystoid macular edema. Am J Ophthalmol 1984 ; 98 : 166-70.
[38] Ersoy L, Caramoy A, Ristau T, et al. Aqueous flare is increased in patients with clinically significant cystoid macular oedema after cataract surgery. Br J Ophthalmol 2013 ; 97 : 862-5.
[39] Almeida DR, Johnson D, Hollands H, et al. Effect of prophylactic nonsteroidal antiinflammatory drugs on cystoid macular edema assessed using optical coherence tomography quantification of total macular volume after cataract surgery. J Cataract Refract Surg 2008 ; 34 : 64-9.
[40] Sebag J, Balazs EA. Pathogenesis of cystoid macular edema : an anatomic consideration of vitreoretinal adhesions. Surv Ophthalmol 1984 ; 28 Suppl : 493-8.
[41] Martinez MR, Ophir A. Pseudophakic cystoid macular edema associated with extrafoveal vitreoretinal traction. Open Ophthalmol J 2011 ; 5 : 35-41.
[42] Pendergast SD, Margherio RR, Williams GA, Cox MS Jr. Vitrectomy for chronic pseudophakic cystoid macular edema. Am J Ophthalmol 1999 ; 128 : 317-23.
[43] Jampol LM, Kraff MC, Sanders DR, et al. Near-UV radiation from the operating microscope and pseudophakic cystoid macular edema. Arch Ophthalmol 1985 ; 103 : 28-30.
[44] Biro Z, Balla Z, Kovacs B. Change of foveal and perifoveal thickness measured by OCT after phacoemulsification and IOL implantation. Eye (Lond) 2008 ; 22 : 8-12.
[45] Milch FA, Yannuzzi LA. Medical and surgical treatment of aphakic cystoid macular edema. Int Ophthalmol Clin 1987 ; 27 : 205-17.
B. Wolff, F. De Bats, M. Mauget-Faÿsse
➤ La traduction clinique d’un OM postopératoire clinique est une baisse d’acuité visuelle touchant en premier lieu la vision de près, puis la vision de loin avec une baisse modérée de celle-ci.
➤ Le diagnostic repose principalement sur l’OCT qui précisera le phénotype de l’œdème (épaississement, œdème intrarétinien, logettes, décollement séreux rétinien) et l’épaississement rétinien en cartographie maculaire.
➤ L’angiographie à la fluorescéine n’est pas indispensable au diagnostic mais doit être réalisée pour éliminer une étiologie éventuellement uvéitique à l’OM, notamment en cas de résistance à un traitement classique par acétazolamide et collyres (anti-inflammatoire non stéroïdien [AINS] ± anti-inflammatoire stéroïdien [AIS]).
Le diagnostic du syndrome d’Irvine-Gass doit être évoqué devant tout tableau de récupération fonctionnelle imparfaite dans les suites d’une chirurgie endo-oculaire [1, 2]. Une irritation de l’œil associée à un certain degré de photophobie est parfois ressentie par les patients. La mesure de l’acuité visuelle permet d’objectiver l’atteinte fonctionnelle, celle-ci impacte d’abord la vision de près ; la baisse d’acuité visuelle de loin est le plus souvent modérée. L’examen du segment antérieur peut montrer une discrète hyperhémie conjonctivale associée parfois à un cercle périkératique. Un effet Tyndall (en général coté à moins de 2+) peut être visualisé en chambre antérieure. Des éléments cliniques, évoquant une complication peropératoire parfois passée inaperçue, peuvent être observés. Une rupture capsulaire avec issue de vitré, une désinsertion zonulaire, un défaut de positionnement de l’implant de chambre postérieure, une incarcération irienne dans la kératotomie, etc. devront ainsi être toujours recherchés. L’examen du fond d’œil peut montrer une discrète hyalite cellulaire associée à un épaississement de la macula et une hyperhémie de la papille. Les examens complémentaires sont souvent essentiels pour confirmer l’OM.
L’OCT Spectral-domain (SD-OCT) peut être considéré aujourd’hui comme l’examen clé pour le diagnostic de l’OM postopératoire (fig. 11-1). Il permet d’objectiver les logettes d’œdème intrarétiniennes, associées inconstamment à un décollement séreux rétinien (DSR). Une cartographie de la macula permet de quantifier l’œdème. L’OCT « en face », passant par la couche plexiforme externe et la couche nucléaire interne, montre l’étendue et la localisation précise des logettes d’œdème (fig. 11-2). Par ailleurs, l’examen de la couche ellipsoïde est très utile pour objectiver une éventuelle atteinte des photorécepteurs (zone d’interruption de l’ellipsoïde).
L’OCT–angiographie est réalisé dans le cas d’un OM aigu inflammatoire survenant en postopératoire (syndrome d’Irvine-Gass) chez un sujet non diabétique. L’aspect initial de l’œdème ne diffère pas significativement de l’aspect des OM compliquant les pathologies vasculaires rétiniennes. Il apparaît également sous forme de logettes hyporéflectives dépourvues de capillaires sur les différents niveaux de segmentation. La guérison de l’OM, dans les mois qui suivent l’intervention, semble dans ce cas s’accompagner d’une restitution de l’anatomie normale des capillaires contrairement aux OM d’autres étiologies (fig. 11-3).
L’autofluorescence peut montrer une atténuation de l’hypo-autofluorescence fovéolaire avec visualisation des logettes cystoïdes centrales iso-autofluorescentes (fig. 11-4).
L’angiographie à la fluorescéine conserve son indication pour le diagnostic étiologique de l’œdème (fig. 11-5 et 11-6). Elle montre dans tous les cas une rupture la barrière hémato-rétinienne plus ou moins étendue au niveau du pôle postérieur. Il existe, par ailleurs, une hyperfluorescence papillaire aux temps tardifs de l’angiographie. L’examen de la périphérie rétinienne permet d’éliminer une vascularite ou des territoires d’occlusion capillaire témoignant d’une autre étiologie (vasculaire ou inflammatoire). L’angiographie au vert d’indocyanine n’est pas indispensable au diagnostic mais permet d’éliminer toute autre cause d’œdème maculaire (néovascularisation choroïdienne, choroïdite inflammatoire, etc.).
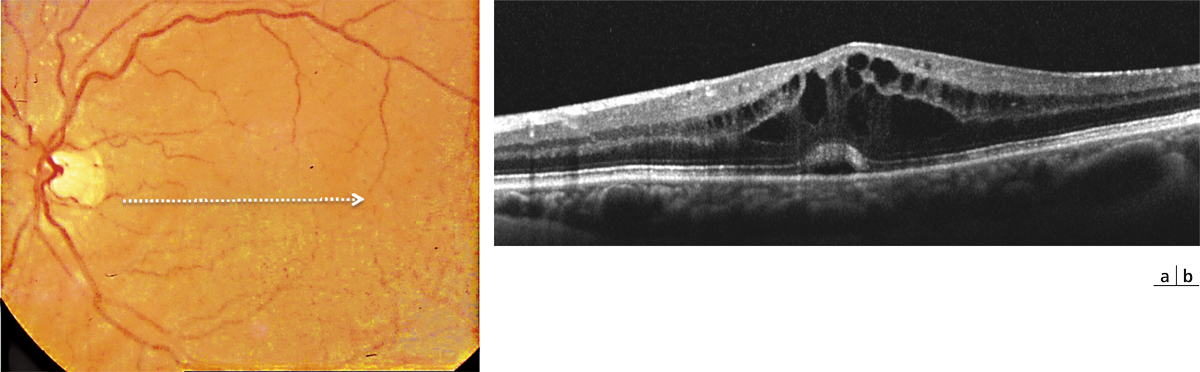
Fig. 11-1 Fond d’œil et SD-OCT d’un patient de 70 ans présentant une baisse visuelle à 6 semaines postopératoires.
Le cliché en couleurs (a) ne montre pas d’anomalies particulières. Le SD-OCT (b) objective l’œdème maculaire avec des logettes cystoïdes et un discret soulèvement séreux rétinien rétrofovéolaire.
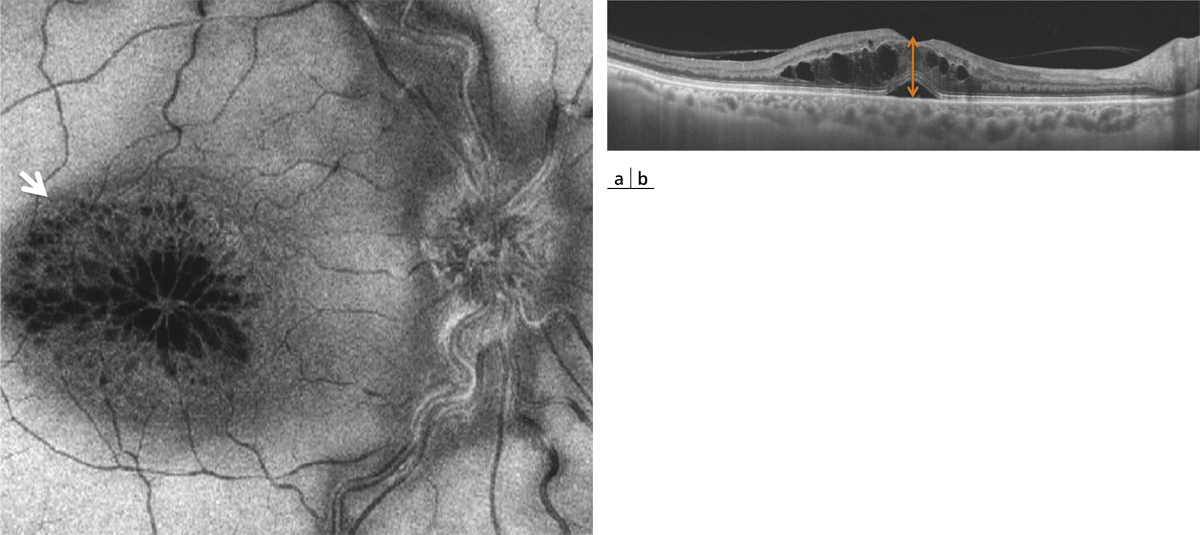
Fig. 11-2 OCT « en face » (a) passant par la couche plexiforme externe, réalisé chez un patient présentant un syndrome d’Irvine-Gass.
L’étendue des logettes d’œdème avec une disposition en nids d’abeilles est bien visualisée (flèche). L’OCT B-scan correspondant (b) permet d’évaluer l’épaississement rétinien (flèche).
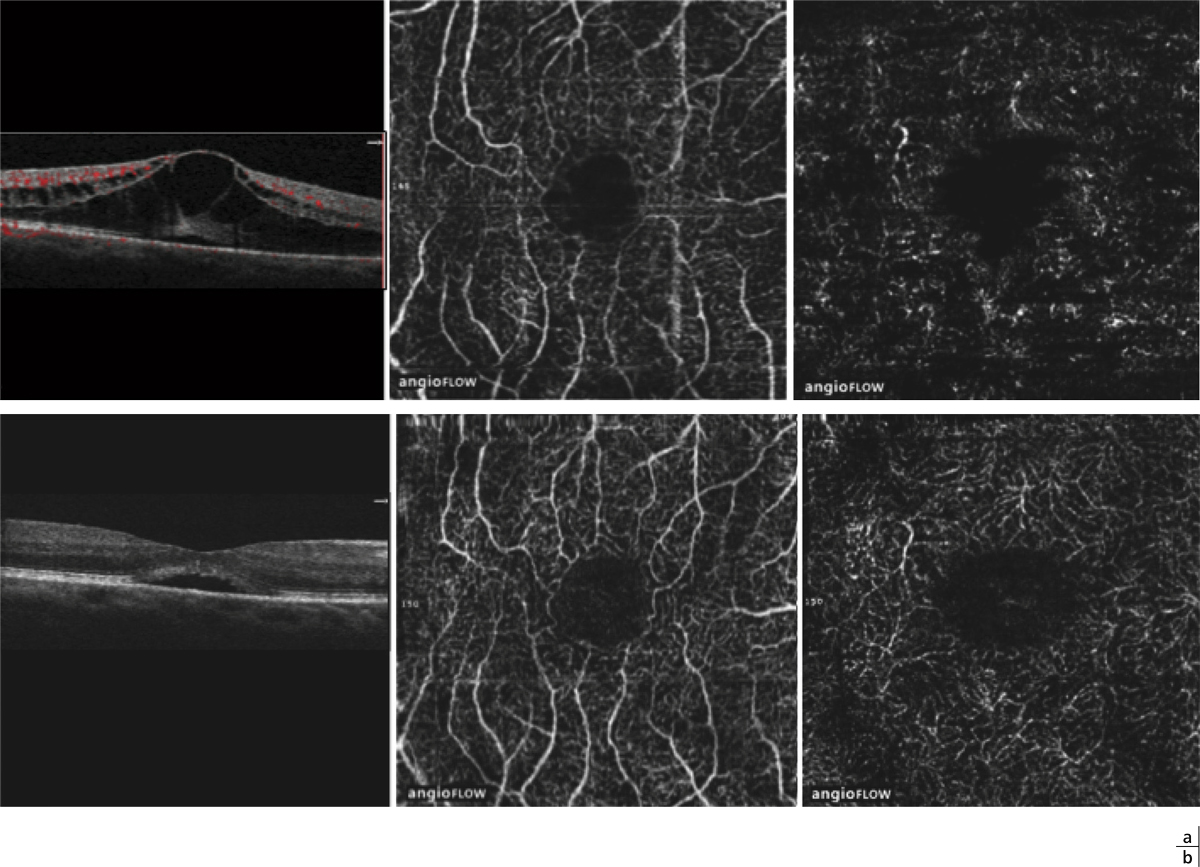
Fig. 11-3 OCT–angiographie d’un œdème maculaire inflammatoire postopératoire survenu 1 mois après une chirurgie de cataracte non compliquée.
a. Initialement, les logettes sont visualisées par des espaces hyporéflectifs dépourvus de capillaires au centre de la macula. Le plexus capillaire superficiel semble d’aspect normal, tandis que le plexus capillaire profond est moins bien identifié. b. Trois mois après traitement local, les logettes d’œdème se sont asséchées, mais il persiste un décollement séreux rétinien. L’architecture des plexus capillaires superficiel et profond semble quasiment normalisée.
(Remerciements au Dr Aude Couturier.)
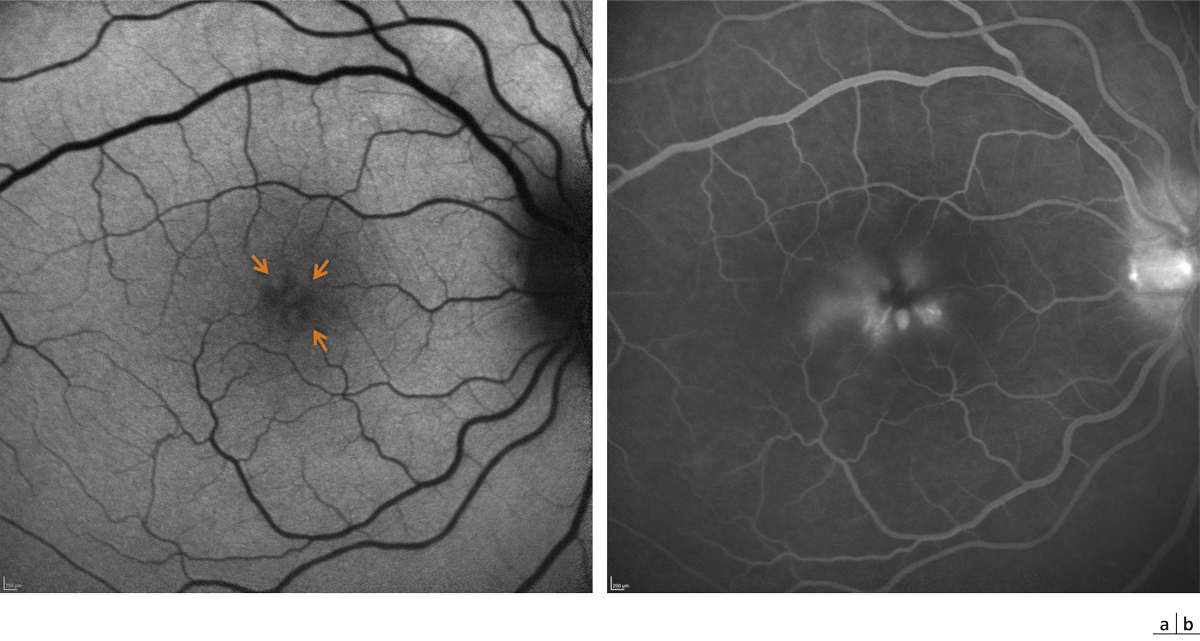
Fig. 11-4 Syndrome d’Irvine-Gass.
Cliché en autofluorescence (a) permettant la visualisation des logettes cystoïdes centrales iso-autofluorescentes (flèches). L’angiographie à la fluorescéine correspondante (b) objective plus clairement l’œdème cystoïde et la rupture de la barrière hémato-rétinienne.
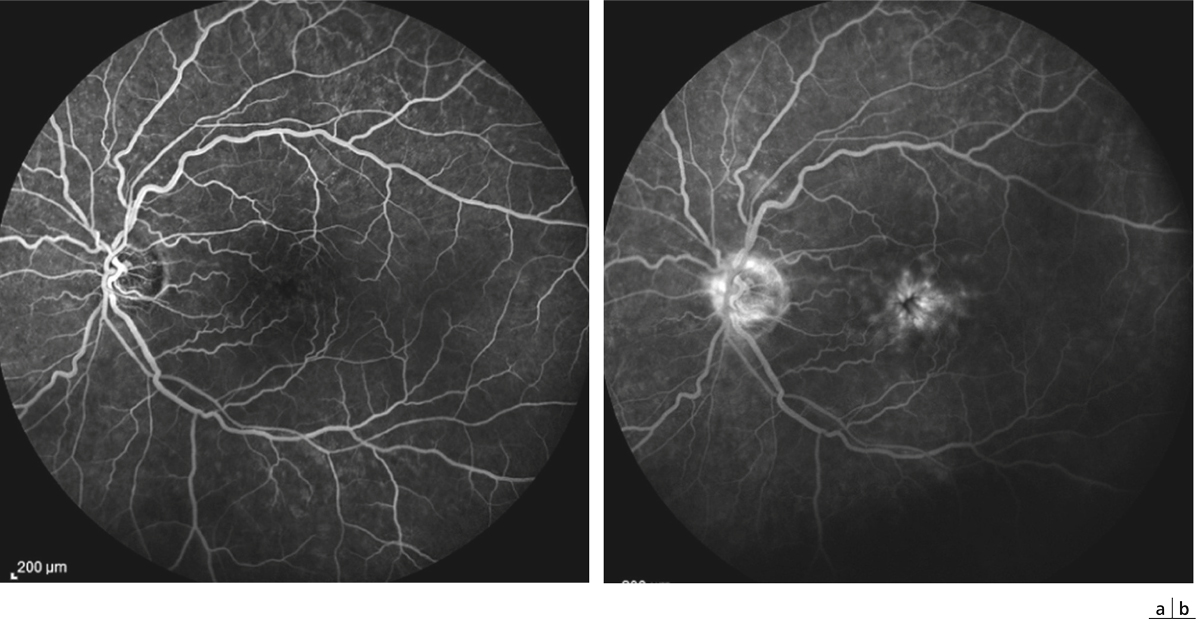
Fig. 11-5 Angiographie à la fluorescéine chez le patient de la figure 11-1.
Cliché précoce (a) puis cliché tardif (b) montrant l’hyperfluorescence papillaire associée à une diffusion de colorant par rupture de la barrière hémato-rétinienne aux temps tardifs de l’examen.
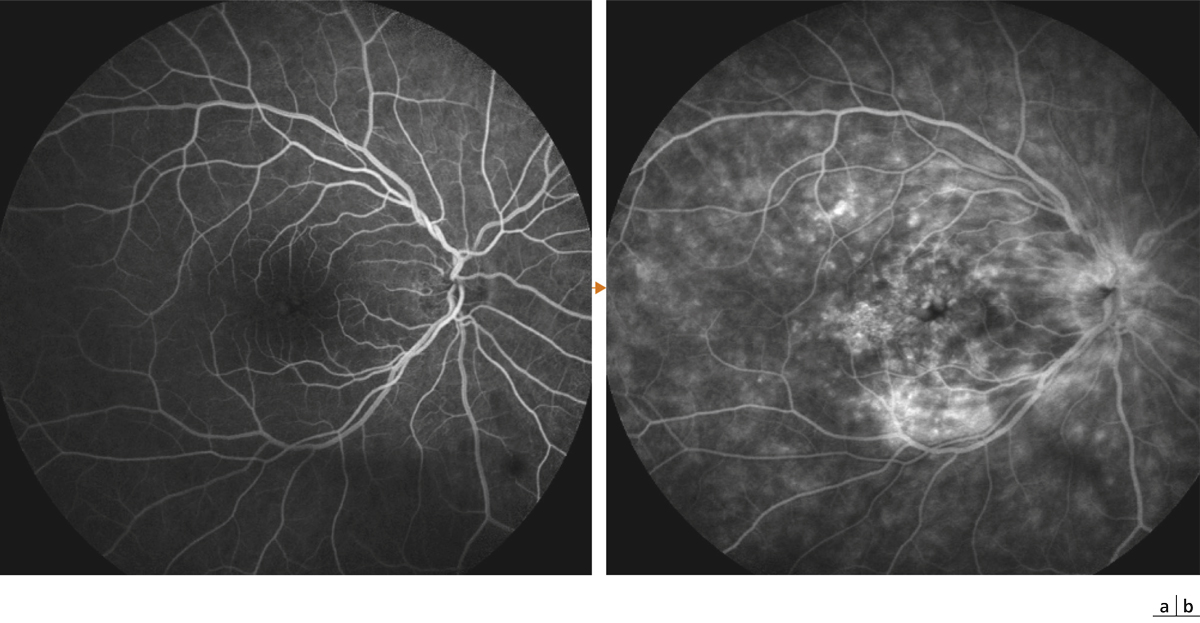
Fig. 11-6 Angiographie à la fluorescéine chez un patient présentant un syndrome d’Irvine-Gass.
Temps artérioveineux (a) puis tardif (b) : l’angiographie objective l’hyperfluorescence papillaire associée à une diffusion majeure de colorant par rupture de la barrière hémato-rétinienne aux temps tardifs de l’examen.
Le suivi du syndrome d’Irvine-Gass se fera sur deux versants : fonctionnel et anatomique.
La mesure de l’acuité visuelle permettra d’évaluer la réponse fonctionnelle au traitement. L’examen du segment antérieur montrera une disparition de l’hyperhémie conjonctivale et d’un éventuel effet Tyndall en chambre antérieure.
L’examen en SD-OCT permettra d’objectiver la résorption de l’œdème ou sa réapparition à l’arrêt ou à la décroissance du traitement (fig. 11-7).
L’angiographie à la fluorescéine ou au vert d’indocyanine ne sera indiquée qu’en cas de non-réponse aux différents traitements. Il faudra, dans cette situation, refaire l’ensemble du bilan d’imagerie pour éliminer avec certitude une autre étiologie à l’origine de l’œdème maculaire.
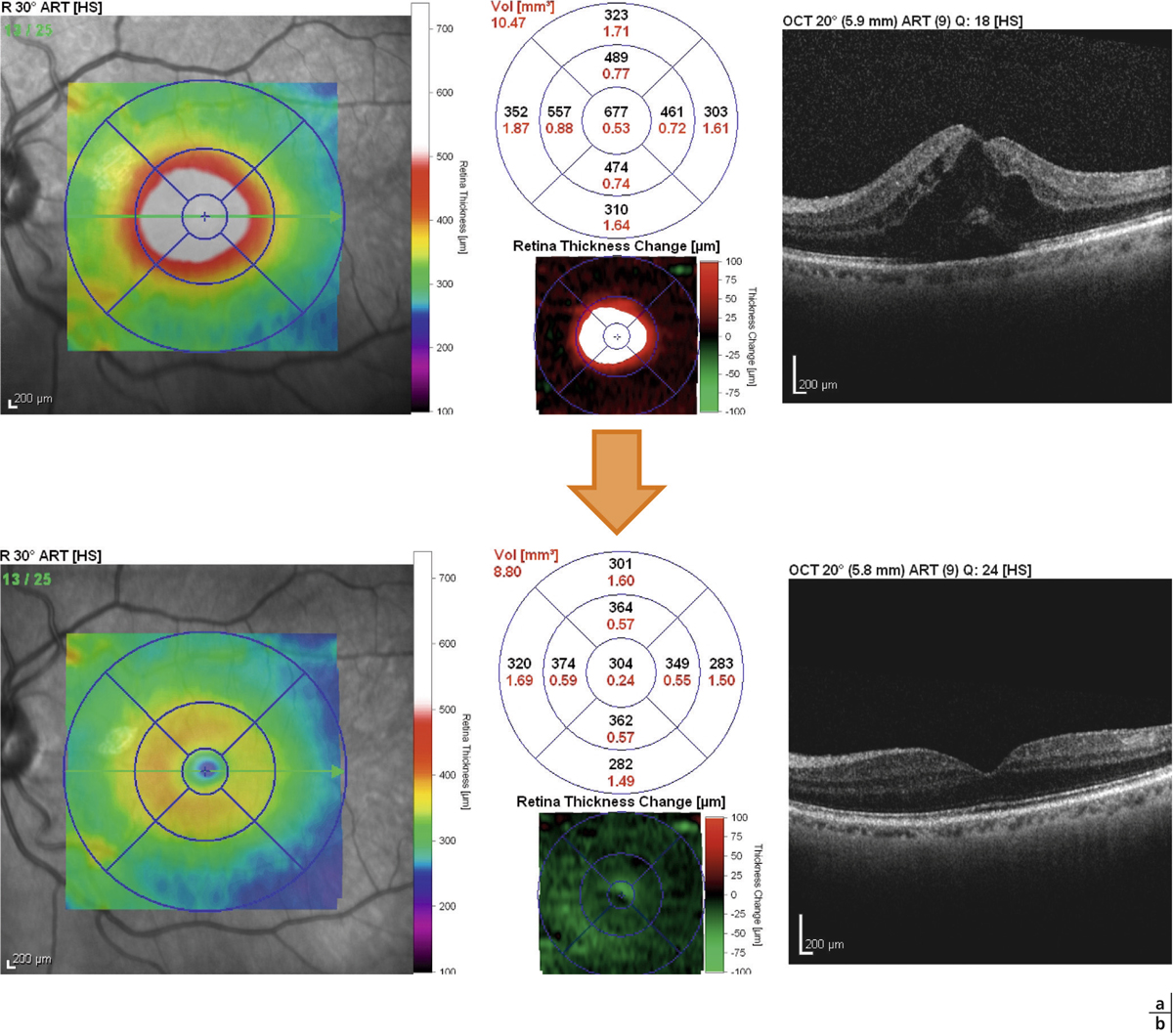
Fig. 11-7 Cartographie maculaire en SD-OCT avant traitement (a) et 3 mois après implantation d’Ozurdex® (b) objectivant la disparition de l’œdème maculaire.
[1] Flach AJ. The incidence, pathogenesis and treatment of cystoid macular edema following cataract surgery. Trans Am Ophthalmol Soc 1998 ; 96 : 557-634.
[2] Yonekawa Y, Kim IK. Pseudophakic cystoid macular edema. Curr Opin Ophthalmol 2012 ; 23 : 26-32.
T.-J. Wolfenberger
➤ La prévention d’un OM postopératoire repose sur les collyres anti-inflammatoires non stéroïdiens (AINS) : plusieurs méta-analyses confirment la supériorité des collyres AINS sur les collyres stéroïdiens, sans préciser si certains AINS sont plus efficaces que d’autres dans cette prévention.
➤ Compte tenu de la prévalence accentuée de ces OM en cas de rupure capsulaire ou chez le diabétique ou après chirurgie vitréorétinienne, ce traitement préventif par collyre AINS prend encore plus d’importance et doit être prolongé au-delà du premier mois.
➤ D’autres stratégies préventives d’OM postopératoire notamment chez le diabétique, en complément des collyres AINS, seront proposées dans un avenir proche.
➤ Le traitement curatif d’un OM postopératoire repose sur des stratégies en cascade pour la plupart sans autorisation de mise sur le marché mais avec des arguments cliniques assez solides d’efficacité : 1re ligne de traitement, acétazolamide per os + collyre AINS (± anti-inflammatoire stéroïdiens [AIS]) ; 2e ligne de traitement, injection péri-oculaire ou intravitréenne de stéroïde ; 3e ligne de traitement : injection intravitréenne anti-VEGF ou sous-cutanée d’anti-TNF-α ou d’IFN-α2a ou chirurgie (avec pelage de la membrane limitante interne).
L’œdème maculaire cystoïde postopératoire est la conséquence terminale d’une rupture de la barrière hémato-rétinienne en lien avec des processus inflammatoires per- et postopératoires [1]. Sa prise en charge thérapeutique a évolué au cours de ces quatre dernières décennies avec l’avènement de nouveaux médicaments et approches chirurgicales rendant son traitement de plus en plus efficace [2].
La découverte de l’OM remonte au milieu du xixe siècle [3], cependant la première description de l’OM postopératoire n’a été rapportée qu’en 1950 par un ophtalmologiste autrichien Karl Hruby. Il a été le premier à l’indiquer après chirurgie de la cataracte [4]. Trois ans plus tard, Irvine a exposé l’incarcération vitréenne dans la cicatrice cornéenne dans sa publication fondatrice des œdèmes maculaires secondaires à des chirurgies cristalliniennes intra- ou extracapsulaires [5]. Gass a décrit pour sa part, pour la première fois en 1966, l’aspect pétaloïde en angiographie à la fluorescéine de l’œdème maculaire secondaire à une chirurgie de la cataracte [6].
La rupture de la barrière hémato-rétinienne (BHR) induite par l’inflammation post-chirurgicale à l’origine de la rétention de fluide et de protéines au niveau de la rétine maculaire est à l’origine de l’OM postopératoire. Deux facteurs, le transforming growth factor β (TGF-β) et le vascular endothelial growth factor (VEGF), induisent des modifications de la perméabilité, notamment des espaces paracellulaires, et les cellules de l’épithélium pigmenté de la rétine deviennent susceptibles à des cytokines inflammatoires comme les molécules d’adhésion intercellulaires. Ces différents facteurs interagissent de façon synergique dans la cascade qui conduit à la rupture de l’intégrité de la BHR et semblent impliqués dans l’OM postopératoire [7, 8]. L’inflammation intra-oculaire post-chirurgicale semble plus influencer la BHRe que la BHRi. L’implication secondaire de la BHRi peut néanmoins survenir [7]. Le dysfonctionnement de la BHR peut se normaliser spontanément si le stimulus inflammatoire postopératoire est de courte durée. Cependant si l’inflammation persiste, une diffusion de fluide, focale ou diffuse dans les espaces extracellulaires de la rétine, se produit. Dans les cas sévères, l’œdème maculaire évolue vers l’apparition de logettes cystoïdes et/ou un décollement séreux rétinien [9].
L’œdème maculaire secondaire à une chirurgie de la cataracte est la cause la plus fréquente de baisse d’acuité visuelle dans la phase postopératoire [10] avec un œdème maculaire cliniquement significatif ou OMCS (associé à une baisse visuelle) présent chez 1 à 2 % des patients [1]. Un OM infraclinique visible en angiofluorographie est plus fréquent et est rapporté chez environ 20 % des patients opérés de cataracte [11, 12]. Néanmoins ces pourcentages sont sans doute aujourd’hui surestimés au regard des progrès de la chirurgie de la cataracte et notamment avec l’avènement de la phacoémulsification comme gold standard de la chirurgie cristalinienne. L’incidence de l’OM angiographique, 6 semaines après chirurgie par rétinopexie pneumatique et chirurgie par cryo-indentation, est rapportée chez respectivement 11 % et 29 % des patients [13].
La prévention de l’OM postopératoire demeure une préoccupation depuis plusieurs décennies. Les premières études sur le sujet ont été conduites en utilisant à la fois les AINS et les stéroïdes [14]. Une méta-analyse des résultats d’études randomisées suggère que les AINS seuls sont bénéfiques comme traitement médical prophylactique de l’OM secondaire à une chirurgie de la cataracte [15], ce que d’autres études ont confirmé par la suite [16, 17]. Une méta-analyse plus récente confirme la supériorité des AINS seuls sur les collyres stéroïdiens dans la prévention de l’OM postopératoire de la cataracte, sans préciser si les AINS sont tous équivalents dans cette prévention [18]. Si tous les AINS en collyre sont prescrits pour prévenir un OM postopératoire, seuls le flurbiprofène et le népafénac (chez le diabétique) ont une autorisation de mise sur le marché (AMM) dans la prévention du syndrome d’Irvine-Gass. Des études récentes ont qualifié le népafénac comme un agent prometteur pour la prophylaxie de l’OM angiographique permettant une récupération visuelle plus rapide [19–21]. De la même façon, le bronfénac a démontré son efficacité dans la prévention de l’OM postopératoire en supprimant l’inflammation de chambre antérieure et l’épaississement rétinien [22]. Différentes études démontrent une supériorité du traitement par collyre AINS lorsque celui-ci est démarré 24 à 36 heures avant la chirurgie.
D’autres auteurs se sont par ailleurs intéressés à l’effet des injections péri-oculaires de stéroïdes en fin de phacoémulsification. Une injection sous-ténonienne de 40 mg d’acétonide de triamcinolone a démontré une efficacité, en termes de contrôle de l’inflammation post-chirurgie non compliquée de la cataracte et de tolérance, équivalentes à l’instillation de collyre de prednisolone à 1 % [23] ; ces résultats ont été confirmés par une étude plus récente où une injection sous conjonctivale périopératoire d’acétate de bétaméthasone a démontré une efficacité comparable à des collyres stéroïdiens postopératoires pour prévenir l’inflammation et l’OM post-chirurgie de la cataracte [24, 25].
Concernant les patients porteurs d’un OM diabétique, deux études ont porté sur un traitement concomitant par anti-VEGF seul [26] ou combiné à de la triamcinolone au moment de la chirurgie de la cataracte [27]. Ce traitement anti-VEGF, seul ou combiné, permet de prévenir l’augmentation de l’épaisseur maculaire mais plus encore, de réduire l’épaississement maculaire lié à la maculopathie diabétique préopératoire.
Chez des patients diabétiques avec rétinopathie diabétique mais sans OM, des études préliminaires non randomisées semblent indiquer un intérêt à administrer un anti-VEGF pour diminuer le risque d’OM postopératoire de la chirurgie de la cataracte (3,7 % versus 25,9 %) [28, 29], mais ces données préliminaires nécessitent confirmation par des études prospectives randomisées.
Une étude prospective randomisée contre placebo a retrouvé une augmentation significative de l’acuité visuelle après chirurgie vitréorétinienne (vitrectomie pour hémorragie intravitréenne, chirurgie de membrane épirétinienne et chirurgie de trous maculaires) dans le groupe traité par une combinaison collyres AIS + AINS par rapport au groupe AIS + placebo [30].
Le traitement de l’OM postopératoire nécessite une approche systématique et graduelle pour prévenir une perte visuelle irréversible [3]. La première ligne de traitement inclut les collyres AINS, les inhibiteurs de l’anhydrase carbonique per os et les corticostéroïdes en collyre. La deuxième ligne de traitement s’appuie sur des injections locales de stéroïdes et la troisième ligne de traitement sur les injections intravitréennes d’anti-VEGF [31] ou les immunomodulateurs [32], voire la chirurgie.
L’action des AINS est basée sur l’inhibition de la cyclo-oxygénase qui inhibe la production de prostaglandines, produits de dégradation de l’acide arachidonique [33]. Certains AINS peuvent aussi avoir un effet sur d’autres médiateurs. Le diclofénac, par exemple, inhibe la formation de leucotriènes qui amplifient l’infiltration cellulaire durant la réaction inflammatoire [34]. Les AINS sont aussi impliqués dans le mouvement transmembranaire du chlorure, avec pour conséquence des flux à travers l’épithélium pigmentaire rétinien. Les AINS topiques sont ainsi devenus un traitement clé de la prise en charge postopératoire et inflammatoire de l’œdème maculaire cystoïde (OMC) inflammatoire [35] et leur efficacité clinique a été montrée dans différentes études [36–39].
Deux études en double insu, contre placebo, sans utilisation de corticoïdes, ont montré que le kétorolac 0,5 % en solution ophtalmique, instillé pendant 3 mois, améliore la vision de certains patients présentant un OMC après chirurgie de la cataracte [40, 41]. Une méta-analyse des résultats d’essais contrôlés randomisés a confirmé que les AINS sont bénéfiques comme traitement médical pour les OM chroniques du pseudophake [15], même si une analyse récente a conclu que cet effet est discutable [18]. D’autres auteurs ont montré que le népafénac était un AINS potentiellement utilisable en prophylaxie mais aussi pour le traitement topique curatif de l’OM du pseudophake [42].
Les effets secondaires les plus fréquents consécutifs à l’instillation d’AINS topiques comprennent des brûlures passagères, des picotements et une hyperhémie conjonctivale. Les complications moins fréquentes comprennent les kératites ponctuées superficielles, les ulcérations cornéennes épithéliales, la fonte cornéenne, un retard de cicatrisation et, de façon plus rare, une kératolyse infiltrante et ulcérante [33].
Le traitement médical de l’OMC avec les inhibiteurs de l’anhydrase carbonique (IAC) a été proposé pour la première fois par Cox et Bird en 1988 dans une étude comprenant 41 patients avec des OMC d’étiologies variées [43]. Les IAC peuvent moduler la polarité de l’anhydrase carbonique au niveau de l’épithélium pigmentaire rétinien et par voie de conséquence le flux liquidien de la rétine vers la choroïde [44–46].
L’efficacité à long terme des IAC dans l’OMC des uvéites et des pseudophakes a été rapportée par Schilling et al. dans une cohorte de 41 yeux avec un suivi moyen de 3,1 ans. Un taux d’efficacité de 50 % a été observé dans le groupe uvéite au prix d’une récidive à l’arrêt du traitement chez la moitié des patients. Les sujets restants ont eu besoin de maintenir une dose de 125 à 500 mg par jour pendant une durée moyenne de 2,3 ans [47]. D’autres cas cliniques ont rapporté une efficacité curative des IAC dans le traitement des OM post-chirurgie rétinienne [48, 49]. Certains patients présentant un OMC ayant répondu de façon efficace à l’acétazolamide n’ont pu continuer le traitement en raison d’effets secondaires tels que des nausées, des malaises et des paresthésies des bras et des jambes [46]. La dose initiale habituelle est de 2 fois 250 mg/jour per os et peut être adaptée en fonction des effets cliniques et des effets secondaires. En cas d’administration au long cours des IAC, une surveillance de la fonction rénale devra être réalisée et une supplémentation potassique est recommandée pour pallier une perte potassique urinaire. Il apparaît que certaines personnes développent une tachyphylaxie aux IAC avec pour conséquence une diminution de l’efficacité du traitement après quelque temps [50]. Les raisons de cette tachyphylaxie ne sont pas totalement élucidées mais pourraient être liées à la présence d’anticorps sériques anti-anhydrase carbonique [51].
Les corticostéroïdes inhibent la lipo-oxygénase mais ont aussi une multitude d’autres effets anti-inflammatoires en agissant, notamment, sur l’interleukine 1 et en rétrocontrôlant l’expression du gène VEGF, entraînant une réduction de la perméabilité vasculaire par le biais de différents mécanismes [52]. L’action synergique des stéroïdes associés aux AINS a été démontrée dans le traitement des réactions inflammatoires post-chirurgie de la cataracte dans les années 1990 [53]. Après chirurgie moderne de la cataracte (petite incision, peu d’ultrasons), cette action synergique demeure d’actualité pour des chirurgies de cataracte sur terrains diabétiques ou uvéitiques ; à l’inverse, pour les chirurgies de cataracte liée à l’âge isolée, il n’y a pas de supériorité des stéroïdes sur les AINS ni d’effet synergique pour ce qui est de la réaction inflammatoire post-chirurgicale. Les corticoïdes peuvent aussi être utilisés en association avec les IAC [46] qui augmenteraient la résorption de fluide à travers l’épithélium pigmentaire rétinien [44, 46]. Les corticostéroïdes peuvent être administrés en topique, par injection péri-oculaire ou intravitréenne, per os ou par voie parentérale.
Les corticostéroïdes topiques peuvent pénétrer l’épithélium cornéen et atteindre la chambre antérieure. Des complications potentielles de l’utilisation des stéroïdes topiques comprennent une augmentation de la pression intra-oculaire avec glaucome, des cataractes sous-capsulaires postérieures, une exacerbation des infections et des récurrences de kératites herpétiques [54].
Les corticostéroïdes peuvent être administrés sous forme d’injections locales péri-oculaires, ce qui permet de déposer une dose importante de médicament offrant ainsi une libération plus durable et une diminution des effets secondaires systémiques. L’injection peut se faire par voie sous-conjonctivale (0,3 à 0,4 mL) ou par voie sous-ténonienne (1 mL) d’un corticoïde à libération prolongée tel que l’acétonide de triamcinolone. Le choix de l’une ou l’autre des voies péri-oculaires est possible et efficace ; il n’y a pas de données comparatives randomisées entre ces deux voies d’administration. Dans le cas de l’injection sous-ténonienne, il est important que l’injection du médicament ait lieu dans l’espace sous-ténonien le plus postérieur possible. Les effets secondaires de ces voies péri-oculaires comprennent une augmentation de la pression intra-oculaire et la formation de cataracte. Le risque d’augmentation de pression intra-oculaire temporaire après injection sous-conjonctivale ou sous-ténonienne de triamcinolone est de l’ordre de 30 %, mais la plupart des ces hypertonies est contrôlée par un traitement antiglaucomateux local [55]. Seuls 1 % des patients sont à risque de nécessiter une chirurgie antiglaucomateuse.
Plusieurs études ont rapporté des résultats positifs dans le traitement de l’œdème inflammatoire grâce aux injections intravitréennes (IVT) de stéroïdes [56]. Des effets secondaires potentiels des IVT regroupent le glaucome, la cataracte et l’endophtalmie. L’implant de polymère biodégradable permettant une libération prolongée de dexaméthasone (Ozurdex®) a montré que les patients atteints d’OMC (associé au diabète, aux occlusions veineuses rétiniennes, aux uvéites et en post-chirurgie de cataracte) ont eu une amélioration significative de leur acuité visuelle après avoir été implantés [56]. Ce traitement combine la facilité d’une injection intravitréenne à travers la pars plana, avec une action prolongée allant jusqu’à 3 à 6 mois. L’efficacité et la sécurité de ce nouveau dispositif d’administration ont été étudiées dans l’OMC post-phacoémulsification réfractaire au traitement conventionnel [57] : l’épaisseur maculaire moyenne et la meilleure acuité visuelle corrigée moyenne étaient améliorées après 1 mois de traitement par implant de dexaméthasone, et ce pendant les 6 premiers mois du traitement. D’autres études ont montré des résultats similaires et l’implant de dexaméthasone apparaît comme une alternative thérapeutique efficace et sûre dans le traitement de l’œdème maculaire post-chirurgical, notamment le syndrome d’Irvine-Gass, en première ou deuxième ligne, à la place des injections péri-oculaires de stéroïdes [58–60]. Les implants de dexaméthasone ont non seulement été utilisés avec efficacité pour des OMC post-chirurgie de cataracte, mais aussi pour des OM réfractaires apparaissant après chirurgie combinée de phacoémulsification et vitrectomie pour membrane épirétinienne [61–63]. Un sous-groupe de patients diabétiques avec un OMC postopératoire a également été étudié et l’implant de dexaméthasone apparaît être d’une efficacité équivalente dans la prévention des OMC que ce soit en postopératoire ou dans la prise en charge de l’OM diabétique [64, 65].
Les corticoïdes systémiques peuvent aussi être utilisés dans le traitement des OMC postopératoires et inflammatoires, éventuellement en première intention pour des cas bilatéraux ou pédiatriques, ou pour des cas résistants aux autres traitements [66]. Des doses initiales importantes afin de contrôler le processus inflammatoire, suivies d’une décroissance progressive afin d’éviter les récidives, sont souvent nécessaires. Des effets secondaires sont fréquemment rencontrés lors de l’administration de corticoïdes systémiques avec notamment des ulcères gastriques, une ostéoporose, un déséquilibre glycémique, une hypertension artérielle, un syndrome cushingoïde et une insuffisance corticotrope. En raison de ces effets secondaires, les corticoïdes oraux ne sont pas utilisés en première ou deuxième intention et doivent être employés avec précaution après une consultation auprès d’un interniste.
Les agents anti-VEGF se sont récemment imposés comme une option thérapeutique prometteuse dans le traitement des OM [67]. Les anti-VEGF inhibent le facteur de croissance vasculaire endothélial, ce qui est non seulement crucial dans le contrôle de la néovascularisation mais aussi dans la réduction de la perméabilité de la BHR [67]. Une étude plus récente a évalué l’efficacité et la sécurité à court terme des injections intravitréennes de bévacizumab pour le traitement des OMC inflammatoires secondaires. Une injection unique intravitréenne de bévacizumab était bien tolérée et associée à une amélioration à court terme de l’acuité visuelle et une diminution de l’épaisseur rétinienne en OCT chez une proportion importante de patients réfractaires à un traitement conventionnel [68]. Des controverses existent cependant concernant la place exacte des anti-VEGF dans le traitement des OMC postopératoires. Deux études ont posé la problématique de l’injection intravitréenne de bévacizumab dans les OMC postopératoires avec des résultats discordants. Certains auteurs rapportent une amélioration significative de l’acuité visuelle et une diminution de l’épaisseur maculaire [69–71], alors que d’autres auteurs ne trouvent pas d’amélioration [72]. Il est aussi possible d’utiliser des corticoïdes et des anti-VEGF en association pour le traitement des OMC postopératoires après chirurgie de cataracte, en particulier chez les patients diabétiques avec bonne réponse thérapeutique [73]. Les anti-VEGF ne sont de ce fait pas un traitement de première ou de deuxième intention compte tenu des autres traitements à notre disposition et de la brièveté d’effet de ces traitements.
Le rôle de la chirurgie vitréenne dans les œdèmes maculaires postopératoires est de plus en plus clairement défini depuis de nombreuses années [74, 75]. Le traitement chirurgical postopératoire des OMC est indiqué dans deux situations cliniques précises :
le syndrome de traction vitréomaculaire qui correspond à une situation classique décrite par Irvine ;
après chirurgie de cataracte compliquée avec rupture capsulaire et chute de fragments cristalliniens.
Dans le premier scenario, l’étude Vitrectomy-Aphakic-Cystoid Macular Edema, une étude multicentrique et prospective de patients ayant un OMC chronique avec aphakie, a montré une amélioration de l’acuité visuelle secondaire à la vitrectomie [76, 77]. Dans une étude portant sur 24 yeux avec un OMC chronique du pseudophake ne répondant pas au traitement médical, Harbour et al. ont réalisé une vitrectomie avec libération des adhérences vitréennes : l’acuité visuelle s’est améliorée chez tous les patients et 71 % d’entre eux ont montré une récupération visuelle postopératoire supérieure ou égale à 3 lignes. Les résultats visuels postopératoires de cette étude n’étaient pas influencés par la durée d’évolution de l’OMC ou l’acuité visuelle préopératoire [78].
D’autres études ont également rapporté une diminution de l’inflammation postopératoire et de l’OMC après vitrectomie pour fragments cristalliniens intravitréens [79, 80] . Une méta-analyse récente a confirmé le fait qu’une vitrectomie, effectuée le jour même, tend à diminuer l’incidence de l’OMC en comparaison à une chirurgie retardée [81]. Une vitrectomie a aussi été réalisée chez des patients sans adhérence vitréenne postérieure en cas de résistance à un traitement médical avec de bons résultats [82]. Les théories expliquant le bénéfice de la vitrectomie dans ces cas comprennent une amélioration temporaire de l’oxygénation de la rétine interne lors du geste, le retrait d’un certain nombre de facteurs de croissance de la cavité vitréenne qui entretiennent l’OM et la possibilité d’utiliser des thérapies pharmacologiques intravitréennes adjuvantes dans le même temps chirurgical, tels que la triamcinolone [83] ou l’implant de dexaméthasone (fig. 11-8). Le pelage de la membrane limitante interne pourrait aussi être indiqué dans ces cas pour améliorer l’OM postopératoire chronique [84], mais aucune étude randomisée n’a, à ce jour, confirmé ou infirmé cela.
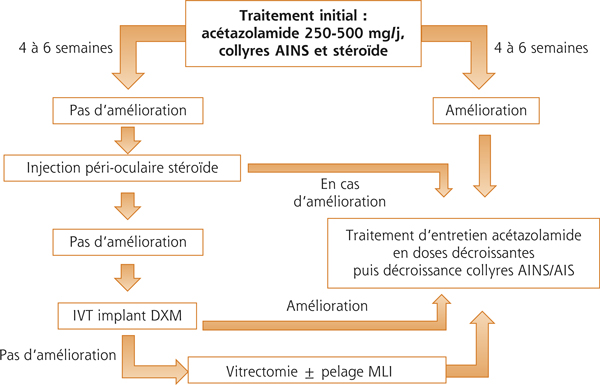
Fig. 11-8 Diagramme décrivant l’algorithme thérapeutique pour un œdème maculaire cystoïde postopératoire non tractionnel.
La dose d’attaque comprend acétazolamide (2 fois 250 mg/j per os), corticoïdes et AINS topiques. En l’absence d’amélioration à 3 semaines, il est effectué une injection sous-ténonienne de triamcinolone. Si le traitement initial est efficace, la posologie peut être diminuée lentement. En cas de non-réponse, une IVT d’Ozurdex® ou d’anti-VEGF peut être réalisée. Une vitrectomie avec éventuellement pelage de la membrane limitante interne peut être réalisée dans les cas récalcitrants. DXM : dexaméthasone ; IVT : injection intravitréenne ; MLI : membrane limitante interne.
La prise en charge des OMC postopératoires peut suivre un algorithme (fig. 11-8) qui propose l’utilisation des AINS ± des stéroïdes en collyres 3 à 4 fois par jour. Dans la majorité des cas, ceux-ci peuvent être associés à un traitement systémique par inhibiteurs de l’anhydrase carbonique tel que l’acétazolamide 250 à 500 mg/jour. Dans la majorité des cas, ces traitements de première intention permettent de faire disparaître l’OM. Dans le cas contraire, une injection sous-conjonctivale ou sous-ténonienne de triamcinolone peut être réalisée avec arrêt des collyres cortisonés. La poursuite des AINS et de l’acétazolamide à dose réduite (125–250 mg/jour) pourra être envisagée en parallèle de ce traitement corticoïde en fonction des évolutions objective et subjective.
Par cette approche, plus de 50 % des OMC postopératoires et inflammatoires répondent favorablement (fig. 11-9). Dans les cas réfractaires, d’autres alternatives tels que les IVT d’anti-VEGF, les implants de corticoïdes (dexaméthasone) (fig. 11-10) et la vitrectomie peuvent être pris en considération (fig. 11-11). Enfin, des données d’efficacité de traitement par IFN-α2a pour des OM postopératoires réfractaires à tout traitement ont été rapportées (fig. 11-12) [85].
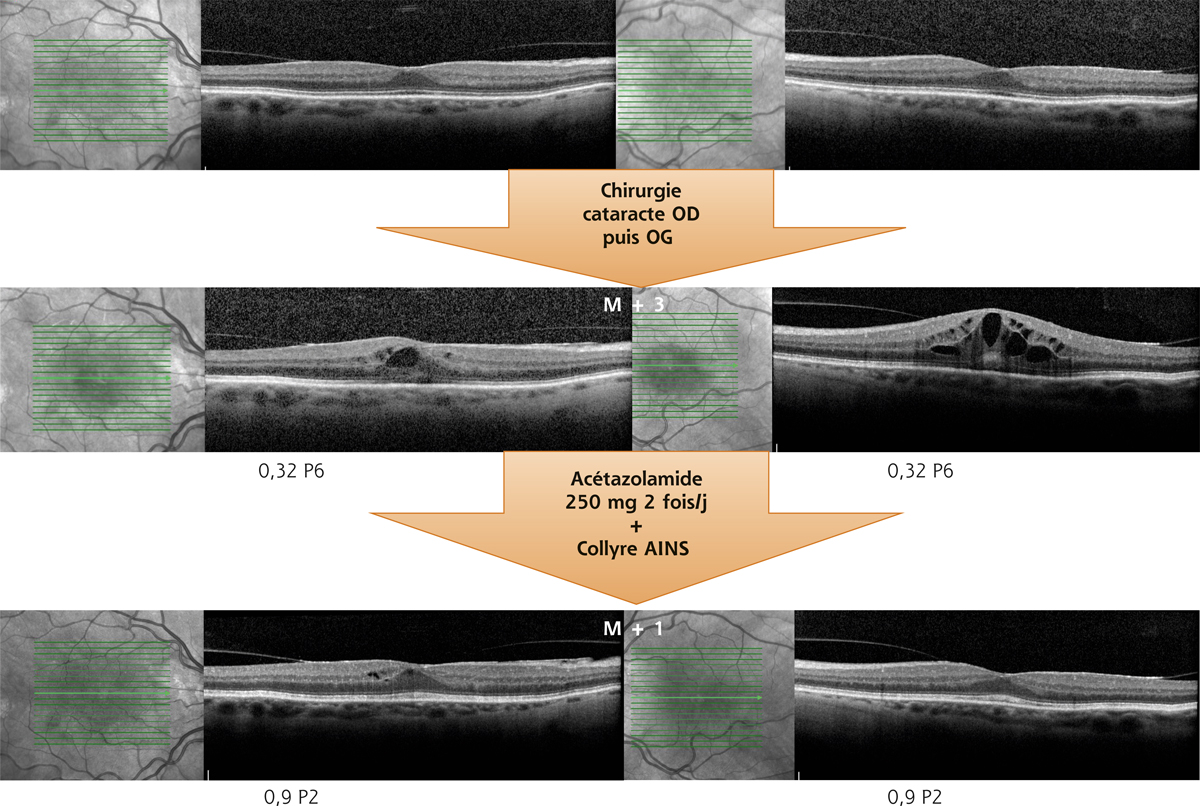
Fig. 11-9 Syndrome d’Irvine-Gass Irvine-Gass avant et 4 semaines après traitement par acétazolamide (2 fois 250 mg/j) et collyre AINS (4 fois/j).
P2 et P6 : Parinaud.
(Remerciements au Dr Michel Weber.)
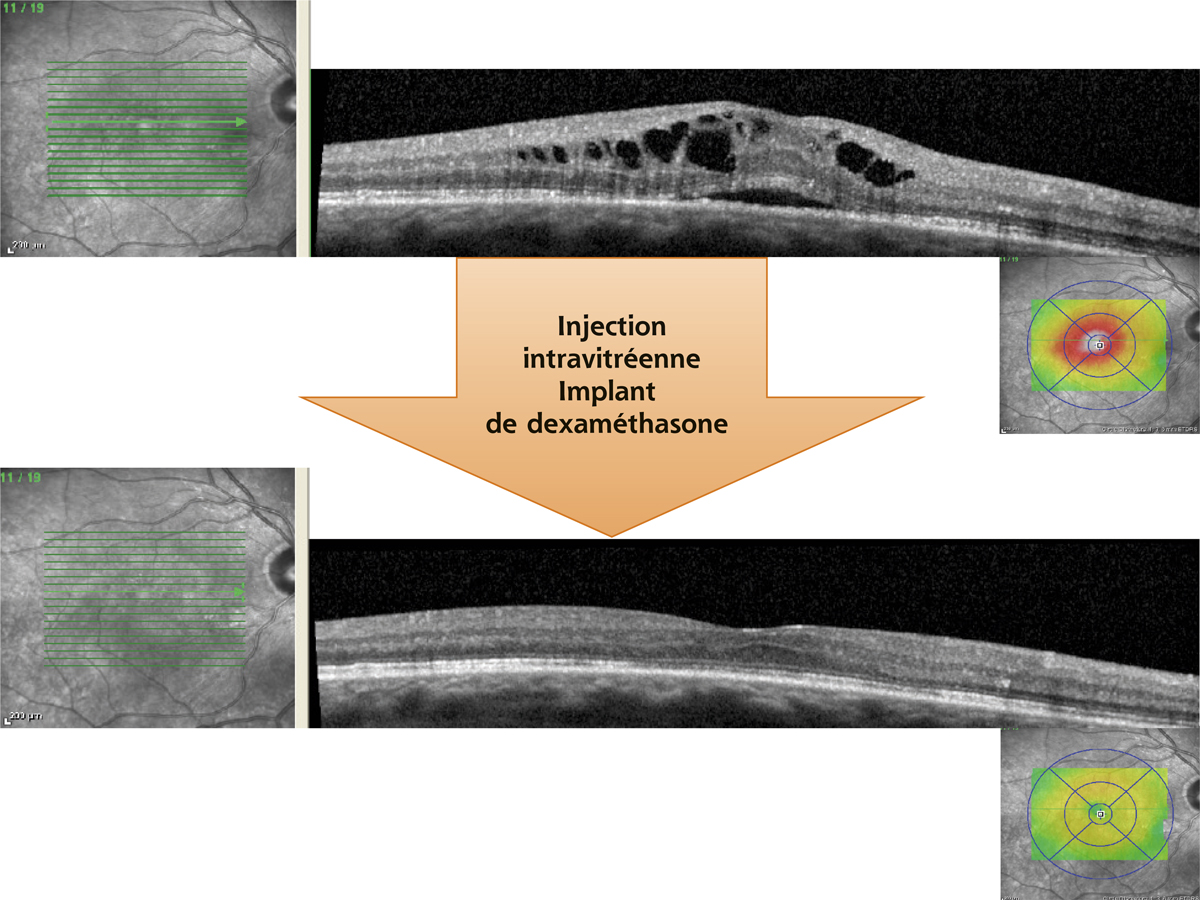
Fig. 11-10 Syndrome d’Irvine-Gass réfractaire au traitement de première intention (acétazolamide + collyre AINS + AIS) traité par IVT d’un implant de dexaméthasone.
(Remerciements au Dr Michel Weber.)
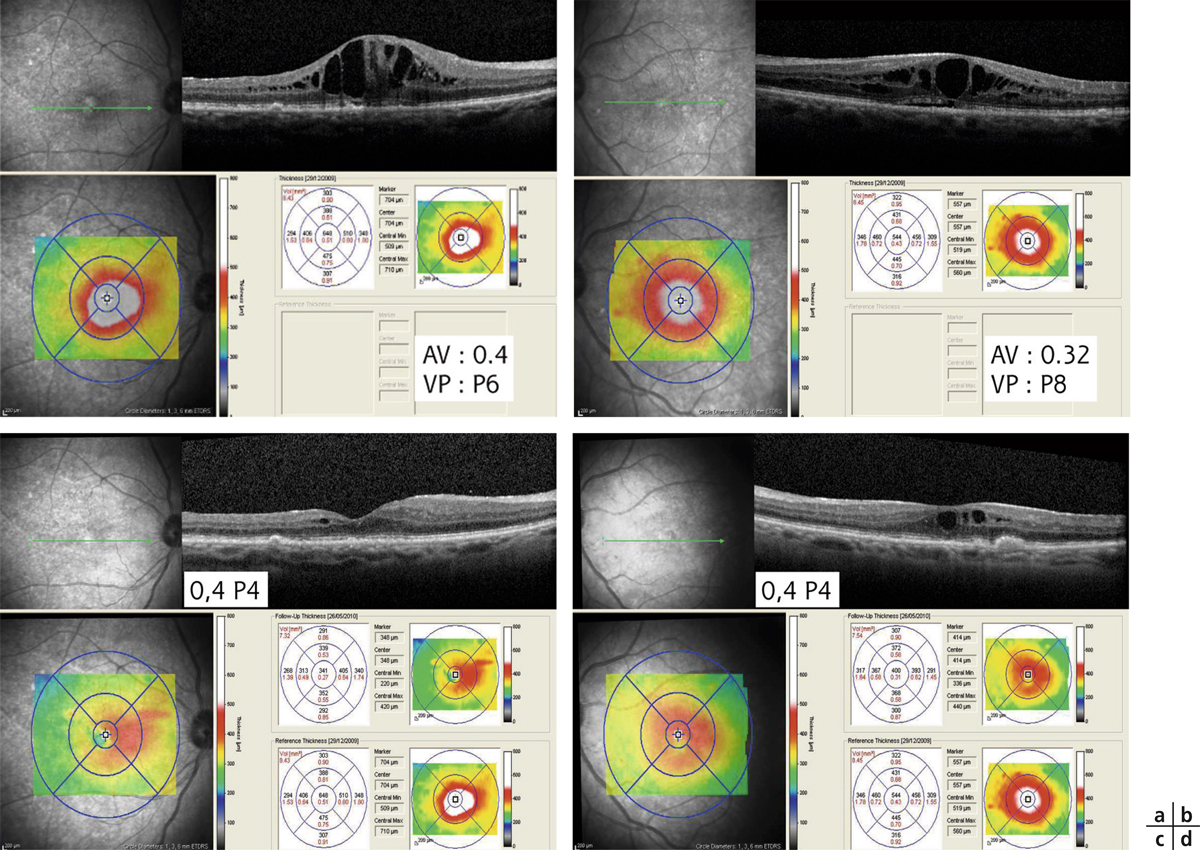
Fig. 11-11 Femme de 65 ans, opérée de la cataracte des deux yeux en 2008, qui a développé un syndrome d’Irvine-Gass bilatéral postopératoire.
Ce syndrome d’Irvine-Gass a été réfractaire aux traitements successifs suivants : acétazolamide + collyres AIS et AINS ; injection péri-oculaire de stéroïde ; vitrectomie + pelage MLI + IVT triamcinolone ODG ; nouvelle IVT triamcinolone ODG. Il a finalement été traité par injection sous-cutanée d’IFN-α2a, 3 MUI, 3 fois/semaine.
OCT OD (a) et OG (b) avant traitement par IFN-α2a. OCT OD (c) et OG (d) 1 mois après d’un traitement par IFN-α2a. P : Parinaud.
(Remerciements au Dr M. Weber.)
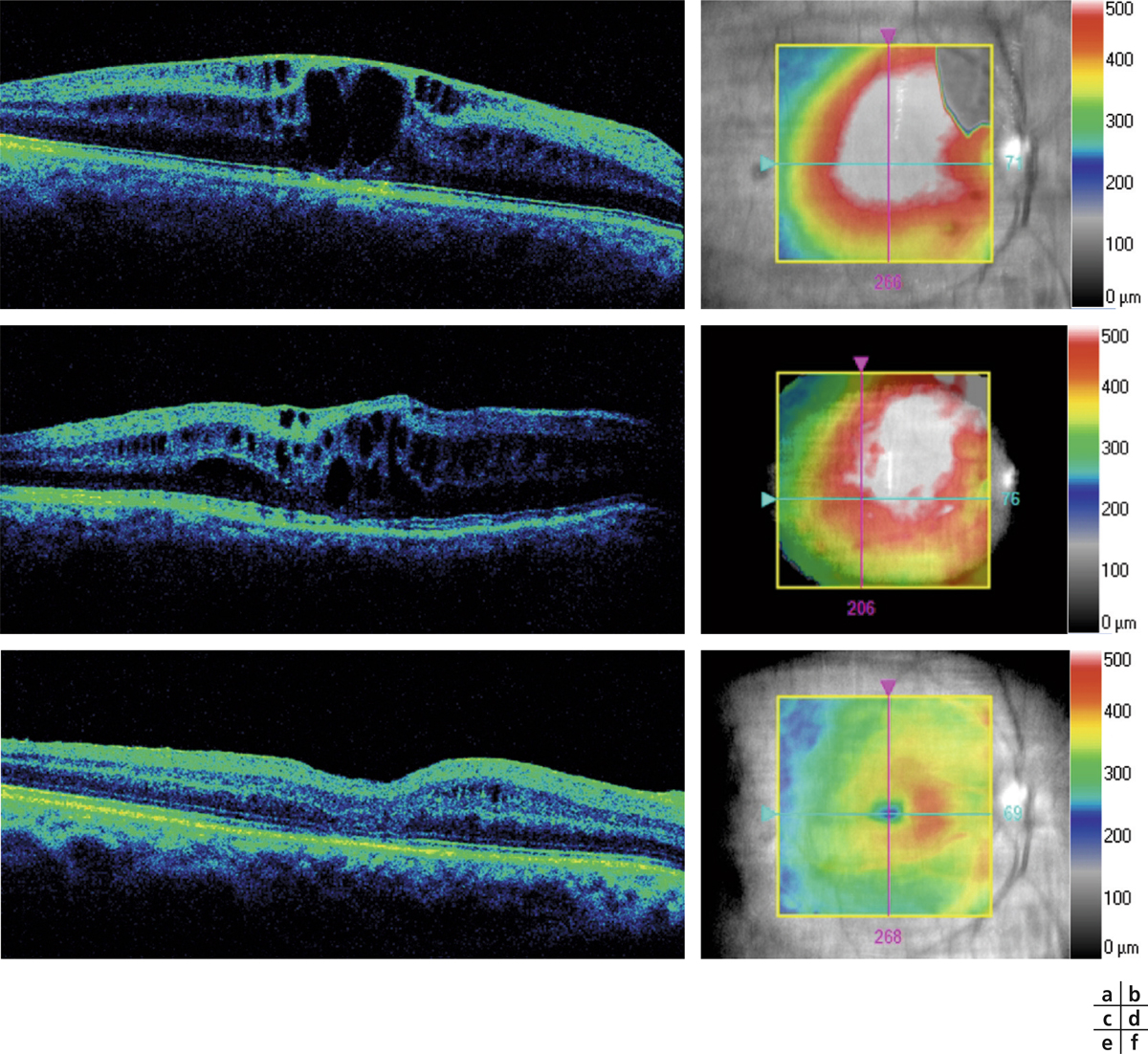
Fig. 11-12 Patient de 29 ans ayant développé un œdème maculaire chronique du pseudophake après greffe de cornée pour kératocône et phakoémulsification ultérieure.
Malgré un traitement médical complet associant des collyres AINS, des IVT d’anti-VEGF et d’Ozurdex®, l’œdème maculaire ne répond pas et l’épaisseur maculaire centrale atteint 557 µ, l’acuité visuelle est réduite à 0,05 (a, b). Après une vitrectomie par la pars plana, pelage d’une membrane épirétinienne et injection d’Ozurdex®, l’OMC commence à décroître, passant à 467 µ à J1 postopératoire (c, d), et la fovéa récupère un profil quasi physiologique avec une épaisseur maculaire centrale à 297 µ à 21 jours postopératoires (e, f). La vision est remontée à 0,32.
[1] Ray S, D’Amico DJ. Pseudophakic cystoid macular edema. Semin Ophthalmol 2002 ; 17 : 167-80.
[2] Guo S, Patel S, Baumrind B, et al. Management of pseudophakic cystoid macular edema. Surv Ophthalmol 2015 ; 60 : 123-37.
[3] Wolfensberger TJ. The historical discovery of macular edema. Doc Ophthalmol 1999 ; 97 : 207-16.
[4] Hruby K. Spaltlampenmikroskopie des hinteren Augenabschnittes. Wien-Innsbruck : Urban und Schwarzenberg ; 1950.
[5] Irvine SR. A newly defined vitreous syndrome following cataract surgery. Am J Ophthalmol 1953 ; 36 : 499-619.
[6] Gass JD, Norton EW. Cystoid macular edema and papilledema following cataract extraction. A fluorescein fundoscopic and angiographic study. Arch Ophthalmol 1966 ; 76 : 646-61.
[7] Kent D, Vinores SA, Campochiaro PA. Macular oedema : the role of soluble mediators. Br J Ophthalmol 2000 ; 84 : 542-5.
[8] Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg 2007 ; 33 : 1550-8.
[9] Wolfensberger T. Makulaödem In : Kampik A, Ed. Augenärztliche Differentialdiagnose. Stuttgart : Thieme ; 2000, p. 238-57.
[10] Rossetti L, Autelitano A. Cystoid macular edema following cataract surgery. Curr Opin Ophthalmol 2000 ; 11 : 65-72.
[11] Wright PL, Wilkinson CP, Balyeat HD, et al. Angiographic cystoid macular edema after posterior chamber lens implantation. Arch Ophthalmol 1988 ; 106 : 740-4.
[12] Ursell PG, Spalton DJ, Whitcup SM, Nussenblatt RB. Cystoid macular edema after phacoemulsification : relationship to blood-aqueous barrier damage and visual acuity. J Cataract Refract Surg 1999 ; 25 : 1492-7.
[13] Tunc M, Lahey JM, Kearney JJ, et al. Cystoid macular oedema following pneumatic retinopexy vs scleral buckling. Eye 2007 ; 21 : 831-4.
[14] Flach AJ, Stegman RC, Graham J, Kruger LP. Prophylaxis of aphakic cystoid macular edema without corticosteroids. A paired-comparison, placebo-controlled double-masked study. Ophthalmology 1990 ; 97 : 1253-8.
[15] Rossetti L, Chaudhuri J, Dickersin K. Medical prophylaxis and treatment of cystoid macular edema after cataract surgery. The results of a meta-analysis. Ophthalmology 1998 ; 105 : 397-405.
[16] Almeida DR, Johnson D, Hollands H, et al. Effect of prophylactic nonsteroidal antiinflammatory drugs on cystoid macular edema assessed using optical coherence tomography quantification of total macular volume after cataract surgery. J Cataract Refract Surg 2008 ; 34 : 64-9.
[17] Yilmaz T, Cordero-Coma M, Gallagher MJ. Ketorolac therapy for the prevention of acute pseudophakic cystoid macular edema : a systematic review. Eye (Lond) 2012 ; 26 : 252-8.
[18] Kessel L, Tendal B, Jørgensen KJ, et al. Post-cataract prevention of inflammation and macular edema by steroid and nonsteroidal anti-inflammatory eye drops : a systematic review. Ophthalmology. 2014 ; 121 : 1915-24.
[19] Myiake K, Ota I, Miyake G, et al. Nepafenac 0.1 % versus fluorometholone 0.1 % for preventing cystoid macular edema after cataract surgery. J Cataract Refract Surg 2011 ; 37 : 1581-8.
[20] Almeida DR, Khan Z, Xing L, et al. Prophylactic nepafenac and ketorolac versus placebo in preventing postoperative macular edema after uneventful phacoemulsification. J Cataract Refract Surg 2012 ; 38 : 1537-43.
[21] Singh R, Alpern L, Jaffe GJ, et al. Evaluation of nepafenac in prevention of macular edema following cataract surgery in patients with diabetic retinopathy. Clin Ophthalmol 2012 ; 6 : 1259-69.
[22] Endo N, Kato S, Haruyama K, et al. Efficacy of bromfenac sodium ophthalmic solution in preventing cystoid macular oedema after cataract surgery in patients with diabetes. Acta Ophthalmol 2010 : 88 : 896-900.
[23] Paganelli F, Cardillo JA, Melo LA Jr, et al. ; Brazilian Ocular Pharmacology and Pharmaceutical Technology Research Group. A single intraoperative sub-Tenon’s capsule triamcinolone acetonide injection for the treatment of post-cataract surgery inflammation. Ophthalmology 2004 ; 111 : 2102-8.
[24] Dieleman M, Wubbels RJ, van Kooten-Noordzij M, de Waard PW. Single perioperative subconjunctival steroid depot versus postoperative steroid eyedrops to prevent intraocular inflammation and macular edema after cataract surgery. J Cataract Refract Surg 2011 ; 37 : 1589-97.
[25] Negi AK, Browning AC, Vernon SA. Single perioperative triamcinolone injection versus standard postoperative steroid drops after uneventful phacoemulsification surgery : Randomized controlled trial. J Cataract Refract Surg 2006 ; 32 : 468-74.
[26] Takamura Y, Kubo E, Akagi Y. Analysis of the effect of intravitreal bevacizumab injection on diabetic macular edema after cataract surgery. Ophthalmology 2009 ; 116 : 1151-7.
[27] Akinci A, Muftuoglu O, Altinsoy A, Ozkilic E. Phacoemulsification with intravitreal bevacizumab and triamcinolone acetonide injection in diabetic patients with clinically significant macular edema and cataract. Retina 2011 ; 31 : 755-8.
[28] Udaondo P, Garcia-Pous M, Garcia-Delpech S, et al. Prophylaxis of macular edema with intravitreal ranibizumab in patients with diabetic retinopathy after cataract surgery: a pilot study. J Ophthalmol 2011 ; 2011 : 159436
[29] Chae JB, Joe SG, Yang SJ, et al. Effect of combined cataract surgery and ranibizumab injection in postoperative macular edema in nonproliferative diabetic retinopathy. Retina 2014 ; 34 : 149-56.
[30] Kim SJ, Lo WR, Hubbard B, et al. Topical ketorolac in vitreoretinal surgery. Arch Ophthalmol 2008 ; 126 : 1203-8.
[31] Arevalo JF, Maia M, Garcia-Aramis RA, et al. Intravitreal bevacizumab for refractory pseudophakic cystoid macular edema: the Pan-American Collaborative Retina Study Group results. Ophthalmology 2009 ; 116 : 1481-7.
[32] Wu L, Arevalo JF, Hernandez-Bogantes E, Roca JA. Intravitreal infliximab for refractory pseudophakic cystoid macular edema : results of the Pan-American Collaborative Retina Study Group. Int Ophthalmol 2012 ; 32 : 235-43.
[33] Colin J. The role of NSAIDs in the management of postoperative ophthalmic inflammation. Drugs 2007 ; 67 : 1291-308.
[34] Ku EC, Lee W, Kothari HV, Scholer DW. Effect of diclofenac sodium on the arachidonic acid cascade. Am J Med 1986 ; 80 : 18-23.
[35] Wolfensberger TJ, Herbort CP. Treatment of cystoid macular edema with non-steroidal anti-inflammatory drugs and corticosteroids. Doc Ophthalmol 1999 ; 97 : 381-6.
[36] Nelson ML, Martidis A. Managing cystoid macular edema after cataract surgery. Curr Opin Ophthalmol 2003 ; 14 : 39-43.
[37] Sivaprasad S, Bunce C, Patel N. Non-steroidal anti-inflammatory agents for treating cystoid macular oedema following cataract surgery. Cochrane Database Syst Rev 2005 : CD004239.
[38] Sivaprasad S, Bunce C, Crosby-Nwaobi R. Non-steroidal anti-inflammatory agents for treating cystoid macular oedema following cataract surgery. Cochrane Database Syst Rev 2012 ; 2 : CD004239.
[39] Rojas B, Zafirakis P, Christen W, et al. Medical treatment of macular edema in patients with uveitis. Doc Ophthalmol 1999 ; 97 : 399-407.
[40] Flach AJ, Dolan BJ, Irvine AR. Effectiveness of ketorolac tromethamine 0.5 % ophthalmic solution for chronic aphakic and pseudophakic cystoid macular edema. Am J Ophthalmol 1987 ; 103 : 479-86.
[41] Flach AJ, Jampol LM, Weinberg D, et al. Improvement in visual acuity in chronic aphakic and pseudophakic cystoid macular edema after treatment with topical 0.5 % ketorolac tromethamine. Am J Ophthalmol 1991 ; 112 : 514-9.
[42] Zaczek A, Artzen D, Laurell CG, et al. Nepafenac 0.1 % plus dexamethasone 0.1 % versus dexamethasone alone : effect on macular swelling after cataract surgery. J Cataract Refract Surg 2014 ; 40 : 1498-505.
[43] Cox SN, Hay E, Bird AC. Treatment of chronic macular edema with acetazolamide. Arch Ophthalmol 1988 ; 106 : 1190-5.
[44] Wolfensberger TJ, Chiang RK, Takeuchi A, Marmor MF. Inhibition of membrane-bound carbonic anhydrase enhances subretinal fluid absorption and retinal adhesiveness. Graefes Arch Clin Exp Ophthalmol 2000 ; 238 : 76-80.
[45] Wolfensberger TJ, Mahieu I, Jarvis-Evans J, et al. Membrane-bound carbonic anhydrase in human retinal pigment epithelium. Invest Ophthalmol Vis Sci 1994 ; 35 : 3401-7.
[46] Wolfensberger TJ. The role of carbonic anhydrase inhibitors in the management of macular edema. Doc Ophthalmol 1999 ; 97 : 387-97.
[47] Schilling H, Heiligenhaus A, Laube T, et al. Long-term effect of acetazolamide treatment of patients with uveitic chronic cystoid macular edema is limited by persisting inflammation. Retina 2005 ; 25 : 182-8.
[48] Marmor MF. Hypothesis concerning carbonic anhydrase treatment of cystoid macular edema : example with epiretinal membrane. Arch Ophthalmol 1990 ; 108 : 1524-5.
[49] Weene LE. Cystoid macular edema after scleral buckling responsive to acetazolamide. Ann Ophthalmol 1992 ; 24 : 423-4.
[50] Fishman GA, Glenn AM, Gilbert LD. Rebound of macular edema with continued use of methazolamide in patients with retinitis pigmentosa. Arch Ophthalmol 1993 ; 111 : 1640-6.
[51] Wolfensberger TJ, Aptsiauri N, Godley B, et al. Antiretinal antibodies associated with cystoid macular edema. Klin Monatsbl Augenheilkd 2000 ; 216 : 283-5.
[52] Edelman JL, Lutz D, Castro MR. Corticosteroids inhibit VEGF-induced vascular leakage in a rabbit model of blood-retinal and blood-aqueous barrier breakdown. Exp Eye Res 2005 ; 80 : 249-58.
[53] Othenin-Girard P, Borruat X, Bovey E, et al. Diclofenac-dexamethasone combination in treatment of postoperative inflammation : prospective double-blind study. Klin Monatsbl Augenheilkd 1992 ; 200 : 362-6.
[54] Ciulla TA, Walker JD, Fong DS, Criswell MH. Corticosteroids in posterior segment disease : an update on new delivery systems and new indications. Curr Opin Ophthalmol 2004 ; 15 : 211-20.
[55] Lafranco Dafflon M, Tran VT, Guex-Crosier Y, Herbort CP. Posterior sub-Tenon’s steroid injections for the treatment of posterior ocular inflammation : indications, efficacy and side effects. Graefes Arch Clin Exp Ophthalmol 1999 ; 237 : 289-95.
[56] Cunningham MA, Edelman JL, Kaushal S. Intravitreal steroids for macular edema : the past, the present, and the future. Surv Ophthalmol 2008 ; 53 : 139-49.
[57] Dutra Medeiros M, Navarro R, Garcia-Arumí J, et al. Dexamethasone intravitreal implant for treatment of patients with recalcitrant macular edema resulting from Irvine-Gass syndrome. Invest Ophthalmol Vis Sci 2013 ; 54 : 3320-4.
[58] Bellocq D, Korobelnik JF, Burillon C, et al. Effectiveness and safety of dexamethasone implants for post-surgical macular oedema including Irvine-Gass syndrome : the EPISODIC study. Br J Ophthalmol 2015 ; 99 : 979-83.
[59] Furino C, Boscia F, Recchimurzo N, et al. Intravitreal dexamethasone implant for refractory macular edema following uncopmlicated phacoemulsification. Eur J Ophthalmol 2014 ; 24 : 387-91.
[60] Sze AM, Luk FA, Yip TP, et al. Use of intravitreal dexamethasone implant in patients with cataract and macular edema undergoing phacoemulsification. Eur J Ophthalmol 2015 ; 25 : 168-72.
[61] Furino C, Boscia F, Recchimurzo N, et al. Intravitreal dexamethasone implant for refractory macular edema secondary to vitrectomy for macular pucker. Retina 2014 ; 34 : 1612-6.
[62] Frisina R, Pinackatt SJ, Sartore M, et al. Cystoid macular edema after pars plana vitrectomy for idiopathic epiretinal membrane. Graefes Arch Clin Exp Ophthalmol 2015 ; 253 : 47-56.
[63] Romano V, Angi M, Scotti F, et al. Inflammation and macular oedema after pars plana vitrectomy. Mediators Inflamm 2013 ; article ID 971758.
[64] Dang Y, Mu Y, Li L, et al. Comparison of dexamethasone intravitreal implant and intravitreal triamcinolone acetonide for the treatment of pseudophakic cystoid macular edema in diabetic patients. Drug Des Devel Ther 2014 ; 8 : 1441-9.
[65] Khurana RN, Palmer JD, Porco TC, Wieland MR. Dexamethasone intravitreal implant for pseudophakic cystoid macular edema in patients with diabetes. Ophthalmic Surg Lasers Imaging Retina 2015 ; 46 : 56-61.
[66] Sijssens KM, Los LI, Rothova A, et al. Long-term ocular complications in aphakic versus pseudophakic eyes of children with juvenile idiopathic arthritis-associated uveitis. Br J Ophthalmol 2010 ; 94 : 1145-9.
[67] Mason JO 3rd, Albert MA Jr., Vail R. Intravitreal bevacizumab (Avastin) for refractory pseudophakic cystoid macular edema. Retina 2006 ; 26 : 356-7.
[68] Cordero Coma M, Sobrin L, Onal S, et al. Intravitreal bevacizumab for treatment of uveitic macular edema. Ophthalmology 2007 ; 114 : 1574-1579e1.
[69] Arevalo JF, Garcia-Amaris RA, Roca JA, et al. Primary intravitreal bevacizumab for the management of pseudophakic cystoid macular edema : pilot study of the Pan-American Collaborative Retina Study Group. J Cataract Refract Surg 2007 ; 33 : 2098-105.
[70] Arevalo JF, Maia M, Garcia-Amaris RA, et al. ; Pan-American Collaborative Retina Study Group. Intravitreal bevacizumab for refractory pseudophakic cystoid macular edema : the Pan-American Collaborative Retina Study Group results. Ophthalmology 2009 ; 116 : 1481-7.
[71] Barone A, Russo V, Prascina F, Delle Noci N. Short-term safety and efficacy of intravitreal bevacizumab for pseudophakic cystoid macular edema. Retina 2009 ; 29 : 33-7.
[72] Spitzer MS, Ziemssen F, Yoeruek E, et al. Efficacy of intravitreal bevacizumab in treating postoperative pseudophakic cystoid macular edema. J Cataract Refract Surg 2008 ; 34 : 70-5.
[73] Akinci A, Muftuoglu O, Altınsoy A, et al. Phacoemulsification with intravitreal bevacizumab and triamcinolone acetonide injection in diabetic patients with clinically significant macular edema and cataract. Retina 2011 ; 31 : 755-8.
[74] Aylward GW. The place of vitreoretinal surgery in the treatment of macular oedema. Doc Ophthalmol 1999 ; 97 : 433-8.
[75] Radetzky S, Walter P, Fauser S, et al. Visual outcome of patients with macular edema after pars plana vitrectomy and indocyanine green-assisted peeling of the internal limiting membrane. Graefes Arch Clin Exp Ophthalmol 2004 ; 242 : 273-8.
[76] Fung WE. The national, prospective, randomized vitrectomy study for chronic aphakic cystoid macular edema. Progress report and comparison between the control and nonrandomized groups. Surv Ophthalmol 1984 ; 28 Suppl : 569-75.
[77] Fung WE. Vitrectomy for chronic aphakic cystoid macular edema. Results of a national, collaborative, prospective, randomized investigation. Ophthalmology 1985 ; 92 : 1102-11.
[78] Harbour JW, Smiddy WE, Rubsamen PE, et al. Pars plana vitrectomy for chronic pseudophakic cystoid macular edema. Am J Ophthalmol 1995 ; 120 : 302-7.
[79] Margherio RR, Margherio AR, Pendergast SD, et al. Vitrectomy for retained lens fragments after phacoemulsification. Ophthalmology 1997 ; 104 : 1426-32.
[80] Rossetti A, Doro D. Retained intravitreal lens fragments after phacoemulsification : complications and visual outcome in vitrectomized and nonvitrectomized eyes. J Cataract Refract Surg 2002 ; 28 : 310-5.
[81] Vanner EA, Stewart MW. Vitrectomy timing for retained lens fragments after surgery for age-related cataracts : a systematic review and meta-analysis. Am J Ophthalmol 2011 Sep ; 152 : 345-57.
[82] Pendergast SD, Margherio RR, Williams GA, Cox MS Jr. Vitrectomy for chronic pseudophakic cystoid macular edema. Am J Ophthalmol 1999 ; 128 : 317-23.
[83] Konstantinidis L, Berguiga M, Beknazar E, Wolfensberger TJ. Anatomic and functional outcome after 23-gauge vitrectomy, peeling, and intravitreal triamcinolone for idiopathic macular epiretinal membrane. Retina 2009 ; 29 : 1119-27.
[84] Peyman GA, Canakis C, Livir-Rallatos C, et al. The effect of internal limiting membrane peeling on chronic recalcitrant pseudophakic cystoid macular edema : a report of two cases. Am J Ophthalmol 2002 ; 133 : 571-2.
[85] Deuter CM, Gelisken F, Stubiger N, et al. Successful treatment of chronic psudophakic macular edema (Irvine-Gass syndrome) with interferon alpha : a report of three cases. Ocul Immunol Inflamm 2011 ; 19 : 216-8.
M. Weber
➤ Les anti-inflammatoires non stéroïdiens (AINS) constituent le principal traitement à visées préventive et curative de l’œdème maculaire (OM) postopératoire.
➤ L’analyse des facteurs de risque présentés par le patient définit la place des AINS dans la prescription encadrant le geste chirurgical.
➤ Les stéroïdes locaux, locorégionaux et parfois systémiques peuvent constituer un traitement intéressant en association aux AINS dans le traitement des OM postopératoires.
Les OM postopératoires, décrits depuis 1950, peuvent survenir après chirurgie de la cataracte, prenant alors le nom de syndrome d’Irvine-Gass, ou après n’importe quelle autre chirurgie endoculaire. Leur reconnaissance a été grandement facilitée par l’OCT.
L’évolution des techniques chirurgicales au cours de ces dernières décennies s’est traduite par des gestes de moins en moins traumatisants et, par voie de conséquence, des inflammations postopératoires de plus en plus limitées.
La diminution du risque d’OM postopératoire avec baisse d’acuité visuelle est la conséquence directe de ces progrès chirurgicaux, notamment après chirurgie non compliquée d’une cataracte liée à l’âge isolée (1 à 2 %). Pour autant, ce risque faible ne doit pas minimiser les bénéfices des collyres AINS dans la prévention de ces OM. Il ne doit pas d’avantage masquer le risque d’environ 10 % d’OM postopératoire après chirurgie de cataracte chez un patient diabétique ou après chirurgie d’un décollement de rétine. Dans de telles circonstances, il est souhaitable de réaliser un traitement préventif par AINS en complément du traitement par stéroïdes et cela pendant une durée d’au moins 2 à 3 mois. Une telle attitude, validée pour la prévention de l’OM chez le diabétique après chirurgie de la cataracte, se doit probablement d’être appliquée à la chirurgie vitréorétinienne même si elle n’est pas encore validée par la littérature.
Il est par ailleurs essentiel de reconnaître et traiter un OM diabétique, vasculaire ou inflammatoire avant toute chirurgie endoculaire pour éviter sa pérennisation ou son aggravation après chirurgie.
Il est fort probable qu’un traitement préventif d’un OM postopératoire, chez un patient porteur d’une rétinopathie diabétique mais sans œdème maculaire diabétique, par IVT (que ce soit par anti-VEGF ou une autre modalité thérapeutique) devienne un jour une recommandation de pratique courante, dès lors qu’il aura été validé par un essai randomisé de haut niveau de preuve scientifique.
Le traitement préventif dépendra de la chirurgie et surtout du terrain (fig. 11-13) :
dans le cas d’une chirurgie de la cataracte liée à l’âge isolée sans atteinte ou antécédent d’une maladie oculaire ou générale à répercussion oculaire : les collyres AINS sont la référence, initiés si possible 48 heures avant la chirurgie et poursuivis pendant 15 jours à 4 semaines. Les corticoïdes, bien que largement prescrits, ne sont pas utiles, car ils ne sont pas supérieurs aux AINS pour diminuer l’inflammation postopératoire et sont nettement inférieurs aux AINS pour prévenir un syndrome d’Irvine-Gass. Ce traitement par AINS seul, pourtant préconisé dès 1995 par une conférence de consensus de la Société française d’ophtalmologie (SFO) sur la chirurgie de la cataracte, n’est toujours pas le traitement de référence en France. La Société danoise d’ophtalmologie vient d’avaliser ce traitement par AINS seul dans ses recommandations. Il y a fort à parier que d’autres sociétés savantes suivront la même démarche, compte tenu des données scientifiques de haut de niveau de preuve abondant dans ce choix ;
dans le cas d’une chirurgie de la cataracte survenant chez un sujet jeune, chez un patient diabétique ou sur un œil porteur (ou aux antécédents) d’uvéite, de sclérite ou d’occlusion veineuse, le traitement reste basé sur une association de collyres stéroïdiens et AINS parfois associés à une reprise (ou à un renforcement) d’un traitement stéroïdien systémique notamment chez le patient avec uvéite ou sclérite active ou ancienne. Chez le patient diabétique, compte tenu d’un risque élevé de syndrome d’Irvine-Gass (environ 10 %), il est recommandé de poursuivre le traitement AINS pendant 2 à 3 mois ;
dans le cas de la chirurgie rétinienne (chirurgie maculaire ou chirurgie de décollement de rétine), il n’y a aucune préconisation particulière. Un traitement par collyre stéroïdien (associé à une antibiothérapie pendant 7 jours) est habituellement prescrit pendant 1 mois. Bien qu’aucun AINS n’ait d’AMM dans cette indication, des éléments cliniques plaident en faveur de leur usage à côté des stéroïdes.
Le traitement curatif d’un œdème postopératoire, quelle que soit la chirurgie concernée, pourra reposer sur l’algorithme de traitement proposé dans la figure 11-14.
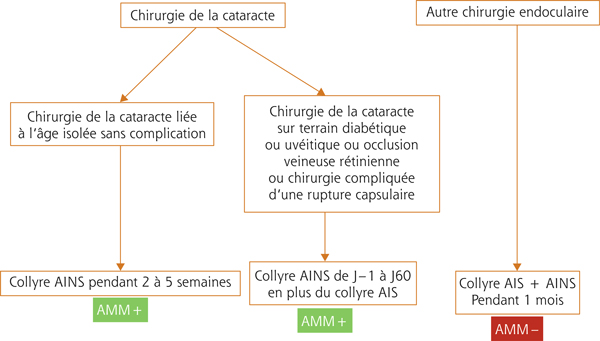
Fig. 11-13 Traitement préventif d’un œdème maculaire postopératoire.
Si tous les collyres AINS ont démontré un bénéfice dans la prévention d’un syndrome d’Irvine-Gass, seuls deux collyres ont une AMM dans cette indication : le flurbiprofène (chirurgie de la cataracte : 6 fois/j pendant 5 semaines) et le népafénac (chirurgie de la cataracte chez le diabétique : 3 fois/j de J–1 à J60).
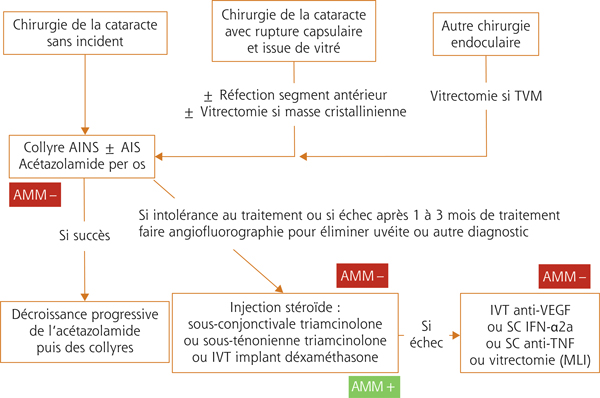
Fig. 11-14 Traitement curatif d’un œdème maculaire postopératoire.
IFN : interféron ; IVT : injection intravitréenne ; MLI : membrane limitante interne ; SC : sous-cutané ; TVM : traction vitréomaculaire.