Œdème maculaire des occlusions veineuses
Coordonné par A. Glacet-Bernard
J.-F. Girmens
➤ Selon les études, la prévalence des occlusions veineuses rétiniennes (OVR) est comprise entre 0,3 et 1,6 %. Une méta-analyse récente retrouve une prévalence des OVR de 5,20 pour 1000 (4,42 pour 1000 pour les occlusions d’une branche veineuse rétinienne [OBVR] et 0,80 pour 1000 pour les occlusions de la veine centrale de la rétine [OVCR]). On peut estimer que les OVR concernent près de 308 000 Français.
➤ L’incidence (annuelle) est estimée à 1,2 pour 1000 pour les OBVR, 0,4 pour 1000 pour les OVCR, soit environ 33 000 et 10 000 nouveaux cas annuels d’OBVR et OVCR (respectivement) en France. Environ 30 % des patients atteints d’OVR seraient susceptibles de développer un œdème maculaire (OM) responsable de baisse d’acuité visuelle.
➤ Prévalence et incidence augmentent avec l’âge, mais toutes les études ne retrouvent pas de différence selon le sexe.
➤ Le risque de bilatéralisation est compris entre 7 et 15 % des cas.
➤ Si les différentes études épidémiologiques concordent pour l’association des OVR avec hypertension artérielle et hypertonie oculaire ou glaucome, d’autres facteurs de risque potentiels ont été retrouvés (diabète, syndrome d’apnées du sommeil, hyperhomocystéinémie, thrombophilie, hyperviscosité, etc.).
Les occlusions veineuses rétiniennes (OVR) constituent la deuxième cause de pathologie vasculaire rétinienne après la rétinopathie diabétique. Pourtant, nous ne disposons que de peu de renseignements sur leur épidémiologie [1]. Les OVR se divisent en trois types : les occlusions de la veine centrale de la rétine (OVCR), les occlusions de branche veineuse rétinienne (OBVR) et les hémi-occlusions ou occlusions hémisphériques (OVHR).
Les données épidémiologiques concernant les OVR sont différentes selon que l’on s’intéresse à la population générale ou au recrutement en centre hospitalier. En effet, certaines pouvant passer inaperçues, les OVR sont en fait plus fréquentes en population générale qu’au cours d’une consultation d’ophtalmologie, qui plus est dans des centres spécialisés. En outre, la répartition des formes diffère également, puisque, contrairement aux effectifs de consultation, où se retrouvent principalement des patients symptomatiques (et parfois les plus graves d’entre eux), les OBVR, plus souvent asymptomatiques, sont plus fréquentes que les OVCR.
Six études épidémiologiques [2–7] se sont intéressées à la prévalence des occlusions veineuses rétiniennes, retrouvant des taux variant de 0,3 % [4] à 1,6 % [2].
Cette grande variabilité de prévalence entre les études publiées peut s’expliquer par le petit nombre d’occlusions dans chaque étude, des différences méthodologiques (notamment le moyen diagnostique utilisé : fond d’œil, rétinophotographie, etc.), ainsi que de possibles différences ethniques dans la distribution des facteurs de risque (trois études s’intéressaient à la population caucasienne [2–4], et c’est seulement récemment qu’ont émergé des données concernant d’autres populations ethniques – comme les populations asiatiques [5, 7] ou hispaniques [6], etc. – bien qu’il ne semble pas exister de différence).
Par ailleurs, il est intéressant de noter que la définition des OVR peut varier d’une étude à l’autre, et que tous les stades étaient le plus souvent inclus (de la forme « aiguë », avec hémorragies et dilatations veineuses, aux formes séquellaires avec présence de circulation collatérale). Parmi eux, un certain nombre (non défini) ne présentait donc probablement pas de symptômes.
Enfin, certaines études ne différencient pas les types d’OVR, notamment occlusion de veine centrale (OVCR) et occlusion de branche (OBVR), pourtant importants à distinguer puisqu’ils ne partagent pas exactement les mêmes facteurs de risque, pronostics et traitements [8].
Une méta-analyse récente [1] a combiné les données de 15 études de population internationales afin de mieux estimer la prévalence des occlusions veineuses rétiniennes.
Les auteurs ont ainsi sélectionné les études de population comportant des rétinophotographies permettant de diagnostiquer une occlusion veineuse rétinienne, et dont les investigateurs ont accepté de fournir les données nécessaires (même en l’absence de publication antérieure) ; il s’agissait principalement d’études :
américaines : Atherosclerosis Risk in Communities Study, Beaver Dam Eye Study, Cardiovascular Health Study (CHS), Los Angeles Latino Eye Study, Multi-Ethnic Study of Atherosclerosis (MESA), Arizona Project on Vision, Evaluation, Research ;
européennes : EUREYE, Rotterdam Eye Study ;
asiatiques : Beijing Eye Study, Funagata Study, Handan Eye Study, Hisayama Study, Shihpai Eye Study, Singapore Malay Eye Study from Asia ;
australienne : Blue Mountains Eye Study.
Les critères retenus pour comptabiliser une OVR étaient précis. Ainsi, une OVCR était définie par l’association d’un œdème rétinien, d’un œdème papillaire, d’hémorragies rétiniennes disséminées, et de dilatation veineuse. L’OVCR était qualifiée d’ancienne si un engainement veineux ou la présence d’anastomoses papillaires étaient constatés. Une OBVR était définie par la présence des mêmes signes dans un secteur rétinien correspondant au territoire de drainage de la veine occluse.
Ainsi, à partir de la population des 15 études retenues (68 751 sujets), la prévalence, standardisée pour l’âge et le sexe, est de 3,77 pour 1000 (intervalle de confiance ou IC : 3,08–4,46) pour les OBVR et 0,65 pour 1000 (IC : 0,49–0,80) pour les OVCR. Les taux de prévalence étaient très différents selon les études, variant pour les OVCR de 0,04 (CHS) à 1,59 pour 1000 (Blue Mountains Eye Study), et de 0,26 (CHS) à 9,32 (Hisayama) pour les OBVR.
En limitant l’analyse aux études qui prenaient en compte plus de deux champs aux deux yeux, soit 49 869 participants, le taux de prévalence est augmenté : 4,42 (IC : 3,65–5,19) pour les OBVR, 0,80 (IC : 0,61–0,99) pour les OVCR et 5,20 (IC : 4,40–5,99) pour toute OVR (pour 1000 adultes).
En utilisant ces taux de prévalence, et en les rapportant à la population mondiale, les auteurs concluent que 16,4 millions (IC : 13,9–18,9) d’adultes sont atteints d’OVR, dont 2,5 millions (IC : 1,9–3,1) souffrent d’une OVCR, et 13,9 millions (IC : 11,5–16,4) sont atteints d’OBVR. De la même manière, en extrapolant ces chiffres à la population française au 1er janvier 2015, on peut estimer que les OVR concernent près de 308 000 Français, dont 252 101 atteints d’OBVR et 55 597 atteints d’OVCR.
Tandis que la prévalence des OVR augmente avec l’âge, la méta-analyse ne retrouve pas de différence de prévalence entre les sexes, contrairement à ce que rapportaient certaines autres études [2, 9–12].
L’étude Beaver Dam nous renseigne sur l’incidence des OVR, avec des chiffres à 5 et 15 ans quasi comparables [3, 13]. Ainsi, suivant une population initialement âgée de 43 à 84 ans, l’incidence d’OBVR à 5 ans est de 0,6 % (1,8 % à 15 ans), celle des OVCR de 0,2 % (0,5 % à 15 ans).
Des chiffres comparables sont rapportés par l’étude australienne Blue Mountains, chez des patients initialement âgés de plus de 49 ans, avec à 10 ans une incidence de 1,2 % pour les OBVR et 0,4 % pour les OVCR [14].
En tentant d’extrapoler ces données à la structure de la population française (au 1er janvier 2015), on peut considérer que l’incidence des OBVR est de l’ordre de 33 000 nouveaux cas annuels, contre 10 000 nouveaux cas annuels d’OVCR.
L’incidence des OVR augmente avec l’âge, avec un maximum dans la tranche d’âge 65–74 ans, ce qui correspond aux moyennes d’âge observées dans d’autres études [9–11, 15]. Par contre, il ne semble là encore pas exister de différence d’incidence selon le sexe.
La bilatéralisation est peu fréquente, observée dans 7 à 15 % des cas, avec un délai moyen d’atteinte du second œil de 19 mois [9, 16]. Dans la Central Vein Occlusion Study, ce risque est évalué à 0,9 % par an [9], plus important pour Hayreh : 7,7 % à 2 ans, 12 % à 4 ans [17].
Dans la Beaver Dam Eye Study, 17 cas incidents d’œdème maculaire ont été observés parmi 61 yeux atteints d’OBVR, 7 cas chez 18 yeux atteints d’OVCR [13], soit une incidence de l’œdème maculaire de 28 % (OBVR) à 39 % (OVCR). D’après l’incidence de l’OVR estimée plus haut, environ 13 500 patients développeraient donc un œdème maculaire (OM) secondaire à une OVR chaque année en France (9500 OBVR et 4000 OVCR).
Une étude canadienne [18] s’intéressant aux patients avec baisse d’acuité visuelle due à un OM secondaire à une OVR, retrouve une incidence plus élevée, avec 73 cas identifiés (53 OBVR et 20 OVCR) parmi 47 166 patients de 40 ans et plus sur une durée de 2 ans, soit une incidence annuelle de baisse d’acuité visuelle par OM de 0,056 % (IC 95 % : 0,011–0,072) pour les OBVR et 0,021 % (IC 95 % : 0,008–0,081) pour les OVCR. En rapportant ces chiffres à la population française (33 989 854 Français de plus de 40 ans au 1er janvier 2015), cela représenterait 26 000 nouveaux cas d’OM secondaire à une OVR en France chaque année.
Les enquêtes épidémiologiques portant sur les OVR se divisent en deux catégories selon leur recrutement : les enquêtes épidémiologiques (dépistage des OVR dans la population générale) et les enquêtes cas-témoins (à partir de cas diagnostiqués en consultation). Les premières sont théoriquement plus objectives pour appréhender l’existence d’une association à un ou plusieurs facteurs de risque, mais ne portent généralement que sur peu de patients en raison de la relative rareté de la maladie. D’un autre côté, les enquêtes cas-témoins regroupent beaucoup plus de patients, mais sont dès le départ biaisées vers les formes graves et les sujets jeunes, car ce sont ces cas qui sont le plus susceptibles d’être dirigés vers des centres spécialisés.
Dans ce type d’études, la qualité des groupes témoins et la prise en compte des facteurs confondants est essentielle. Par exemple, l’hypertension artérielle (HTA) et le glaucome sont tous deux associés à une élévation de l’homocystéine sanguine ou au syndrome d’apnées du sommeil. Il faut donc, si on veut évaluer l’existence d’une liaison directe entre un facteur et une OVR, faire une analyse multivariée. Il faut retenir également que toute enquête épidémiologique ne peut établir avec certitude de relation de cause à effet, mais seulement suggérer des relations pathogéniques qui nécessitent d’autres études ciblées pour être validées. De plus, dans une étude donnée, la multiplicité des facteurs considérés augmente le risque d’y retrouver une association fortuite. Enfin, il faut savoir interpréter les chiffres obtenus. Le risque relatif est le paramètre qui exprime le mieux la relation clinique pouvant exister entre un facteur de risque et une maladie. On considère souvent qu’un risque relatif doit idéalement être supérieur à 2 pour être cliniquement significatif. En d’autres termes, statistiquement significatif ne veut pas toujours dire cliniquement significatif.
Les différentes études épidémiologiques mettent toutes en évidence une association significative à l’hypertension artérielle et au glaucome.
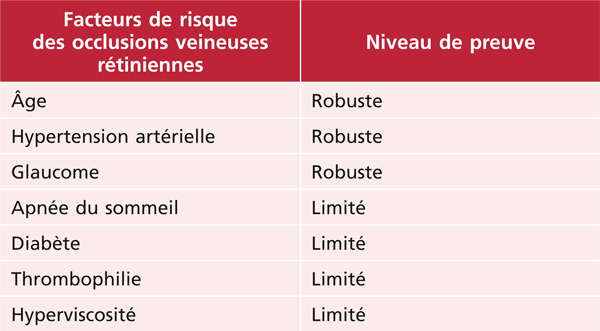
Tableau 9-1 Facteurs de risque des OVR et leur niveau de preuve.
L’hypertension artérielle, retrouvée en moyenne chez 50 à 60 % des patients, est le principal facteur de risque d’OVR, toutes formes confondues [2, 4, 11, 12, 19], avec un risque relatif compris entre 2 (IC 95 % : 1,2–3,3) [2] et 3,9 (IC 95 % : 2,1–7,2) [19].
Le rôle des apnées du sommeil dans la survenue des OVR est controversé. Son association fréquente chez les patients présentant une OVR a été récemment retrouvée dans plusieurs études [20, 21]. L’hypoxie et l’hypercapnie chroniques, responsables de modifications hématologiques (augmentation du taux des facteurs de la coagulation, hyperagrégation plaquettaire, diminution de l’activité fibrinolytique, altération de l’endothélium vasculaire), pourraient favoriser un état d’hypercoagulabilité.
Il n’est pas clairement établi que le diabète soit un facteur de risque d’OVR en général ou d’OBVR [2, 6, 13, 19, 22]. Seules trois études retrouvent une association avec les OVCR [12, 13, 23]. Par contre, le diabète est clairement un facteur aggravant [24, 25].
L’hyperhomocystéinémie plasmatique peut être due à une anomalie enzymatique d’ordre génétique (déficit en méthyltétrahydrofolate réductase ou MTHFR) ou bien à un déficit (nutritionnel ou acquis) en l’un des cofacteurs vitaminiques comme les folates ou la vitamine B12. L’hyperhomocystéinémie est un facteur de risque cardiovasculaire reconnu, son taux plasmatique augmente après la phase aiguë des accidents cardiovasculaires et des syndromes coronaires. Son rôle au cours des OVR est controversé, certaines études retrouvant une association, d’autres niant celle-ci (ces divergences sont en grande partie dues à l’absence de prise en compte de la tension artérielle et de l’âge, qui majorent l’homocystéinémie). Une méta-analyse récente portant sur 42 études cas-témoins a réévalué les rapports entre homocystéinémie, déficit génétique en MTHFR et OVR [26] : le niveau plasmatique d’homocystéine semble significativement plus élevé chez les patients atteints d’OVR. Une augmentation de 1 µmol/L est associée avec une augmentation du risque d’OVR d’un facteur 1,4. Par contre, elle n’a pas retrouvé pas d’association entre mutation C677T du gène de la MTHFR et OVR.
L’association entre glaucome/hypertonie et OVR est rapportée par de nombreuses études [2, 12, 19, 27]. Ainsi, glaucome et/ou hypertonie oculaire sont retrouvés dans respectivement environ 10 % et 20 % des OVCR, ce qui est significativement plus fréquent que dans la population générale [12, 28]. Une analyse plus approfondie montre qu’en fait cette relation concerne essentiellement les OVCR [29]. De plus, il faut distinguer le rôle de la pression intra-oculaire (PIO) de celui de l’excavation papillaire : une PIO élevée est associée à l’OVCR, mais pas l’excavation papillaire [28]. En revanche, l’excavation papillaire est associée à une forme particulière d’OBVR, le site de l’occlusion étant situé au sein même de l’excavation [30]. Enfin, certaines formes d’OVCR avec bas débit rétinien (« blanc périveinulaire ») sont aggravées par une hypertonie oculaire.
Plus d’une centaine d’études ont tenté de déterminer l’implication d’un ou plusieurs facteurs de risque thrombotique dans la physiopathologie des OVR. Les anomalies de l’hémostase retrouvées chez ces patients sont variables, souvent absentes et dans l’ensemble ne semblent pas jouer un rôle prépondérant. In fine, la présence d’une anomalie ne signifie pas qu’elle soit à l’origine de la maladie, et encore moins qu’il soit utile de la traiter, d’où les limites inhérentes à une telle approche [31].
Cette mutation est retrouvée chez environ 5 % des sujets sains. En regroupant les études publiées, on retrouve une prévalence moyenne de la mutation de 8 % chez les patients avec OVR, nettement inférieure à celle observée dans la maladie thrombo-embolique veineuse qui est d’environ 20 %. De l’avis général, il n’est pas intéressant de rechercher de façon systématique une résistance à la protéine C chez les patients ayant une OVR [32–34]. Tout au plus, il a été suggéré que cette anomalie puisse jouer un rôle plus important dans les OVR du sujet jeune et/ou sans autre facteur de risque [35, 36].
Aucune relation entre déficits en protéine C, protéine S, antithrombine III ou mutation G20210A du gène de la prothrombine (facteur II) et OVR n’a été formellement mis en évidence [37–39].
Plusieurs études sont en faveur de l’existence d’anomalies de la fibrinolyse chez les patients avec OVR [40, 41] : élévation des taux d’inhibiteur de l’activateur du plasminogène-1 (PAI-1) et de la lipoprotéine (a) [Lp(a)]. Du fait de son analogie de structure avec le plasminogène, la Lp(a) se comporte en effet comme un inhibiteur de la fibrinolyse.
Les relations entre syndrome des antiphospholipides et OVR sont confuses. Cela est lié notamment à l’absence de standardisation des méthodes de mesure des anticorps antiphospholipides et à la présence fréquente d’anticoagulants circulants dans la population générale (jusqu’à 10 % avec certaines méthodes et dans certaines populations). D’une façon générale, la découverte d’un syndrome des antiphospholipides à l’occasion d’une OVR est rare, et il n’est pas justifié a priori de réaliser systématiquement une telle recherche [34, 42].
Plusieurs études ont suggéré l’existence d’anomalies hémorhéologiques, principalement une augmentation de la viscosité sanguine et plasmatique, chez les patients avec OVR. Il convient cependant d’être prudent sur leur interprétation, car il n’y a pas, à l’heure actuelle, de test standardisé pour mesurer la viscosité sanguine [16, 43].
Des travaux récents ont par ailleurs mis en évidence que chez des patients atteints d’OVR, l’expression accrue de phosphatidylsérine à la surface des globules rouges pourrait être responsable d’une augmentation de l’adhérence des globules rouges à l’endothélium vasculaire et participer, au moins en partie, à la constitution de l’occlusion [44].
Dans la littérature, seulement trois familles d’OVR regroupant sept sujets ont été décrites. Notre équipe a recensé, depuis 2005, 34 familles avec deux cas ou plus d’OVR (dont neuf avec trois cas au moins), soit un total de 85 patients, la grande majorité des cas étant des OVCR ou des OVHR [45]. Ces cas familiaux se caractérisent par une bilatéralité fréquente (15,3 % dans notre série) et un âge de survenue plus jeune chez les descendants des sujets atteints (possible phénomène d’anticipation génétique). L’analyse génétique est en cours.
Des OVCR apparemment sans signes inflammatoires oculaires manifestes ont été associées à une sarcoïdose. Dans certains cas, l’OVR peut être en rapport avec une maladie générale, essentiellement les hémopathies (myélomes et leucémies).
Des OVR sous traitement par interféron alpha ou au cours de l’infection par le virus de l’immunodéficience humaine (VIH) ont été également rapportées, sans que la relation de cause à effet soit toujours bien établie.
Le traitement substitutif hormonal aurait plutôt un effet protecteur [23, 27]. Le rôle éventuel de la pilule anticonceptionnelle est mal documenté.
D’exceptionnels cas d’OVCR au cours des thrombophlébites cérébrales et au cours des malformations artérioveineuses ont été rapportés.
[1] Rogers S, McIntosh RL, Cheung N, et al. The prevalence of retinal vein occlusion : pooled data from population studies from the United States, Europe, Asia, and Australia. Ophthalmology 2010 ; 117 : 313-9.e1.
[2] Mitchell P, Smith W, Chang A. Prevalence and associations of retinal vein occlusion in Australia. The Blue Mountains Eye Study. Arch Ophthalmol 1996 ; 114 : 1243-7.
[3] Klein R, Klein BE, Moss SE, Meuer SM. The epidemiology of retinal vein occlusion : the Beaver Dam Eye Study. Trans Am Ophthalmol Soc 2000 ; 98 : 133-41 ; discussion 141-3.
[4] Wong TY, Larsen EKM, Klein R, et al. Cardiovascular risk factors for retinal vein occlusion and arteriolar emboli : the Atherosclerosis Risk in Communities & Cardiovascular Health studies. Ophthalmology 2005 ; 112 : 540-7.
[5] Liu W, Xu L, Jonas JB. Vein occlusion in Chinese subjects. Ophthalmology 2007 ; 114 : 1795-6.
[6] Cheung N, Klein R, Wang JJ, et al. Traditional and novel cardiovascular risk factors for retinal vein occlusion : the multi-ethnic study of atherosclerosis. Invest Ophthalmol Vis Sci 2008 ; 49 : 4297-302.
[7] Lim LL, Cheung N, Wang JJ, et al. Prevalence and risk factors of retinal vein occlusion in an Asian population. Br J Ophthalmol 2008 ; 92 : 1316-9.
[8] Hayreh SS. Prevalent misconceptions about acute retinal vascular occlusive disorders. Prog Retin Eye Res 2005 ; 24 : 493-519.
[9] Natural history and clinical management of central retinal vein occlusion. The Central Vein Occlusion Study Group. Arch Ophthalmol 1997 ; 115 : 486-91.
[10] Hayreh SS, Zimmerman B, McCarthy MJ, Podhajsky P. Systemic diseases associated with various types of retinal vein occlusion. Am J Ophthalmol 2001 ; 131 : 61-77.
[11] Weger M, Renner W, Steinbrugger I, et al. Role of thrombophilic gene polymorphisms in branch retinal vein occlusion. Ophthalmology 2005 ; 112 : 1910-5.
[12] Sperduto RD, Hiller R, Chew E, et al. Risk factors for hemiretinal vein occlusion : comparison with risk factors for central and branch retinal vein occlusion : the eye disease case-control study. Ophthalmology 1998 ; 105 : 765-71.
[13] Klein R, Moss SE, Meuer SM, Klein BEK. The 15-year cumulative incidence of retinal vein occlusion : the Beaver Dam Eye Study. Arch Ophthalmol 2008 ; 126 : 513-8.
[14] Cugati S, Wang JJ, Rochtchina E, Mitchell P. Ten-year incidence of retinal vein occlusion in an older population : the Blue Mountains Eye Study. Arch Ophthalmol 2006 ; 124 : 726-32.
[15] Beaumont PE, Kang HK. Clinical characteristics of retinal venous occlusions occurring at different sites. Br J Ophthalmol 2002 ; 86 : 572-80.
[16] Glacet-Bernard A, Coscas G, Chabanel A, et al. Prognostic factors for retinal vein occlusion : prospective study of 175 cases. Ophthalmology 1996 ; 103 : 551-60.
[17] Hayreh SS, Zimmerman MB, Podhajsky P. Incidence of various types of retinal vein occlusion and their recurrence and demographic characteristics. Am J Ophthalmol 1994 ; 117 : 429-41.
[18] Petrella RJ, Blouin J, Davies B, Barbeau M. Incidence and characteristics of patients with visual impairment due to macular edema secondary to retinal vein occlusion in a representative canadian cohort. J Ophthalmol 2012 ; 2012 : e723169.
[19] Rath EZ, Frank RN, Shin DH, Kim C. Risk factors for retinal vein occlusions. A case-control study. Ophthalmology 1992 ; 99 : 509-14.
[20] Glacet-Bernard A, Leroux les Jardins G, Lasry S, et al. Obstructive sleep apnea among patients with retinal vein occlusion. Arch Ophthalmol 2010 ; 128 : 1533-8.
[21] Chou KT, Huang CC, Tsai DC, et al. Sleep apnea and risk of retinal vein occlusion : a nationwide population-based study of Taiwanese. Am J Ophthalmol 2012 ; 154 : 200-5.e1.
[22] Yasuda M, Kiyohara Y, Arakawa S, et al. Prevalence and systemic risk factors for retinal vein occlusion in a general Japanese population : the Hisayama study. Invest Ophthalmol Vis Sci 2010 ; 51 : 3205-9.
[23] Eye Disease Case-Control Study Group. Risk factors for central retinal vein occlusion. Arch Ophthalmol 1996 ; 114 : 545-544.
[24] Mansour AM, Walsh JB, Goldberger S, Henkind P. Role of diabetes mellitus on the natural history of central retinal vein occlusion. Ophthalmologica 1992 ; 204 : 57-62.
[25] Swart J, Reichert-Thoen JW, Suttorp-Schulten MS, et al. Diabetes mellitus : a risk factor affecting visual outcome in branch retinal vein occlusion. Eur J Ophthalmol 2003 ; 13 : 648-52.
[26] Li D, Zhou M, Peng X, Sun H. Homocysteine, methylenetetrahydrofolate reductase C677T polymorphism, and risk of retinal vein occlusion : an updated meta-analysis. BMC Ophthalmol 2014 ; 14 : 147.
[27] Koizumi H, Ferrara DC, Bruè C, Spaide RF. Central retinal vein occlusion case-control study. Am J Ophthalmol 2007 ; 144 : 858-63.
[28] Hayreh SS, Zimmerman MB, Beri M, Podhajsky P. Intraocular pressure abnormalities associated with central and hemicentral retinal vein occlusion. Ophthalmology 2004 ; 111 : 133-41.
[29] Beaumont PE, Kang HK. Cup-to-disc ratio, intraocular pressure, and primary open-angle glaucoma in retinal venous occlusion. Ophthalmology 2002 ; 109 : 282-6.
[30] Beaumont P, Goldberg I, Hollows FC. Optic cup vein occlusion ; description of a new entity. Trans Ophthalmol Soc N Z 1976 ; 28 : 115-7.
[31] Hayreh SS, Zimmerman MB, Podhajsky P. Hematologic abnormalities associated with various types of retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol 2002 ; 240 : 180-96.
[32] Linna T, Ylikorkala A, Kontula K, et al. Prevalence of factor V Leiden in young adults with retinal vein occlusion. Thromb Haemost 1997 ; 77 : 214-6.
[33] Johnson TM, El-Defrawy S, Hodge WG, et al. Prevalence of factor V Leiden and activated protein C resistance in central retinal vein occlusion. Retina 2001 ; 21 : 161-6.
[34] Janssen MCH, den Heijer M, Cruysberg JRM, et al. Retinal vein occlusion : a form of venous thrombosis or a complication of atherosclerosis ? A meta-analysis of thrombophilic factors. Thromb Haemost 2005 ; 93 : 1021-6.
[35] Arsène S, Delahousse B, Regina S, et al. Increased prevalence of factor V Leiden in patients with retinal vein occlusion and under 60 years of age. Thromb Haemost 2005 ; 94 : 101-6.
[36] Rehak M, Rehak J, Müller M, et al. The prevalence of activated protein C (APC) resistance and factor V Leiden is significantly higher in patients with retinal vein occlusion without general risk factors. Case-control study and meta-analysis. Thromb Haemost 2008 ; 99 : 925-9.
[37] Ciardella AP, Yannuzzi LA, Freund KB, et al. Factor V Leiden, activated protein C resistance, and retinal vein occlusion. Retina 1998 ; 18 : 308-15.
[38] Williamson TH, Rumley A, Lowe GD. Blood viscosity, coagulation, and activated protein C resistance in central retinal vein occlusion : a population controlled study. Br J Ophthalmol 1996 ; 80 : 203-8.
[39] Albisinni R, Coppola A, Loffredo M, et al. Retinal vein occlusion and inherited conditions predisposing to thrombophilia. Thromb Haemost 1998 ; 80 : 702-3.
[40] Marcucci R, Bertini L, Giusti B, et al. Thrombophilic risk factors in patients with central retinal vein occlusion. Thromb Haemost 2001 ; 86 : 772-6.
[41] Turello M, Pasca S, Daminato R, et al. Retinal vein occlusion : evaluation of “classic” and “emerging” risk factors and treatment. J Thromb Thrombolysis 2010 ; 29 : 459-64.
[42] Glacet-Bernard A, Bayani N, Chretien P, et al. Antiphospholipid antibodies in retinal vascular occlusions. A prospective study of 75 patients. Arch Ophthalmol 1994 ; 112 : 790-5.
[43] Arend O, Remky A, Jung F, et al. Role of rheologic factors in patients with acute central retinal vein occlusion. Ophthalmology 1996 ; 103 : 80-6.
[44] Wautier MP, Héron E, Picot J, et al. Red blood cell phosphatidylserine exposure is responsible for increased erythrocyte adhesion to endothelium in central retinal vein occlusion. J Thromb Haemost JTH 2011 ; 9 : 1049-55.
[45] Girmens J, Scheer S, Héron E, Sahel JA, et al. Familial central retinal vein occlusion. Eye 2008 ; 22 : 308-10.
A. Pierru, J.-F. Girmens, M. Paques
➤ La principale cause de baisse d’acuité visuelle au cours des OVR est l’œdème maculaire, dû soit à une rupture de la barrière hémato-rétinienne, soit à un œdème ischémique intracellulaire. Plusieurs facteurs semblent jouer un rôle dans sa survenue, le vascular endothelial growth factor (VEGF) ayant un rôle prédominant.
➤ À la phase aiguë, l’œdème maculaire est dépendant des conditions circulatoires, dont la pression intra-oculaire et la pression artérielle. À terme, une endothéliopathie sévère peut aboutir à une chronicisation de l’œdème. Un œdème maculaire peut également survenir par propagation d’un œdème papillaire. En cas d’obstruction veineuse prolongée, une circulation collatérale peut apparaître, parfois associée à des macro-anévrismes.
Les OVCR sont secondaires à un ralentissement du flux veineux au niveau du nerf optique [1]. La nature et la localisation exacte de cet obstacle ne sont pas connues. Certaines études post mortem rapportent la présence d’un thrombus dans la veine centrale en regard de la lame criblée ou immédiatement en arrière de celle-ci [2]. Cependant, ces études anatomopathologiques portent le plus souvent sur des formes anciennes, entraînant un biais de recrutement. Ainsi, le thrombus retrouvé pourrait être secondaire à l’occlusion, et non à l’origine de la maladie [3]. Nous ne disposons pas à l’heure actuelle de moyen d’imagerie suffisamment performant pour analyser le flux au sein des vaisseaux centraux de la rétine.
En ce qui concerne les OBVR, la conception classique de leur pathogénie attribue un rôle causal à la compression de la veine par une artère artérioscléreuse. Une autre hypothèse consiste en une modification progressive du trajet de l’artère, qui entraîne avec elle la veine par l’intermédiaire de l’adventice commune, la veine déformée finissant par s’obstruer [4]. Récemment, l’imagerie par optique adaptative a suggéré que la sténose veineuse dans les croisements artérioveineux n’était pas liée à un contact direct avec la veine (fig. 9-1) [5]. Ceci ouvre une hypothèse intéressante, celle du rôle de facteurs diffusibles relargués par l’artère dans la survenue des lésions veineuses. Le rôle de la rhéologie sanguine, de la pression artérielle, de l’apnée du sommeil est débattu [6, 7]. Ces facteurs pourraient jouer un rôle chez certains patients.
Le terme d’obstruction est sans doute plus approprié pour décrire ce qui se passe au cours d’une OVR, l’obstacle veineux n’étant pas complet le plus souvent. D’une manière générale, l’OVR va provoquer dans le réseau veineux d’amont une augmentation de la pression veineuse, responsable d’une dilatation et d’une tortuosité veineuse ainsi que d’un ralentissement du flux sanguin. Ce ralentissement est la conséquence logique du fait qu’il n’y a qu’une seule voie de sortie pour le flux sanguin rétinien, qui n’est que faiblement compensé par les connexions entre territoires veineux. Ceci a pour effet une distorsion des fibres optiques qui sont au voisinage des veines (éventuellement responsable de l’apparition de nodules cotonneux) et un aspect caractéristique du remplissage veineux en angiographie dynamique, appelé « flux veinulaire pulsatile ». Cette pulsatilité veineuse est due à la transmission du pouls artériel à travers les capillaires et les veinules post-capillaires [8].
L’obstacle veineux peut se constituer de manière rapide voire brutale. Dans ce dernier cas, un véritable syndrome de bas débit rétinien peut être au premier plan du tableau clinique, se manifestant par un aspect caractéristique d’opacification de la rétine périveinulaire [9, 10] du fait de l’ischémie neuronale (fig. 9-2). Le ralentissement circulatoire entraîne aussi une désaturation du sang veineux : les veines peuvent apparaître alors plus sombres que du côté opposé.
Une autre manifestation d’un bas débit initial peut être une occlusion d’une artère ciliorétinienne. Le territoire ciliorétinien est plus affecté par le bas débit global que le territoire des artères rétiniennes, peut-être en raison d’une pression moindre régnant dans les artères ciliaires, mais ce point est controversé [11]. Le ralentissement circulatoire peut aller jusqu’à un véritable aspect d’occlusion de l’artère centrale de la rétine (forme souvent appelée « occlusion combinée de l’artère et de la veine centrale de la rétine ») (fig. 9-3).
Lorsque l’obstruction veineuse se constitue progressivement, le tableau est sensiblement différent. En effet, une occlusion se constituant progressivement laisse du temps au réseau circulatoire et à la rétine pour s’adapter. Les signes cliniques liés à l’œdème maculaire dominent le tableau clinique.
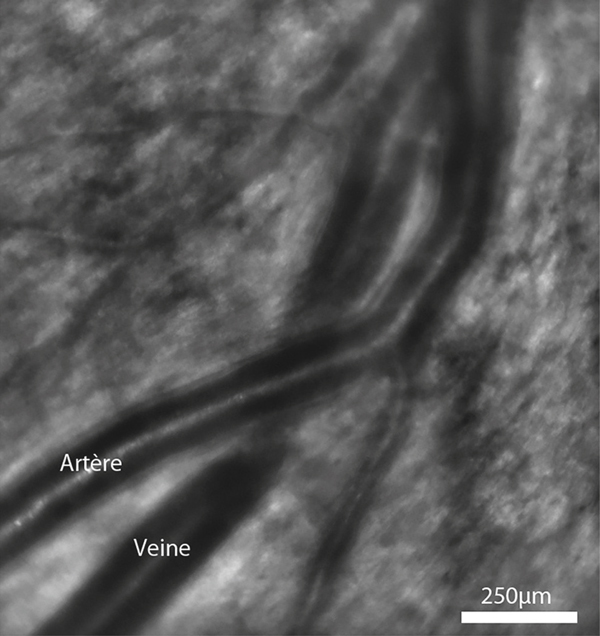
Fig. 9-1 Croisement artérioveineux vu en optique adaptative.
Noter que le rétrécissement veineux est présent au-delà de la zone de superposition artérioveineuse, suggérant que d’autres facteurs que la compression artérielle entrent en jeu.
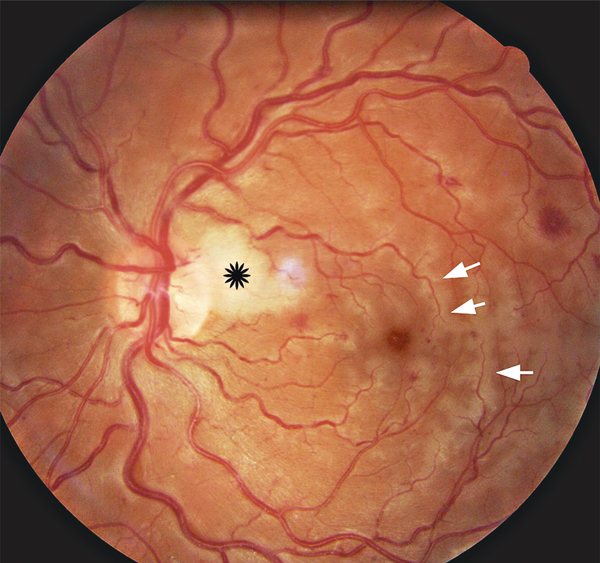
Fig. 9-2 OVCR avec blanc périveinulaire (flèches).
L’étoile indique une occlusion ciliorétinienne.
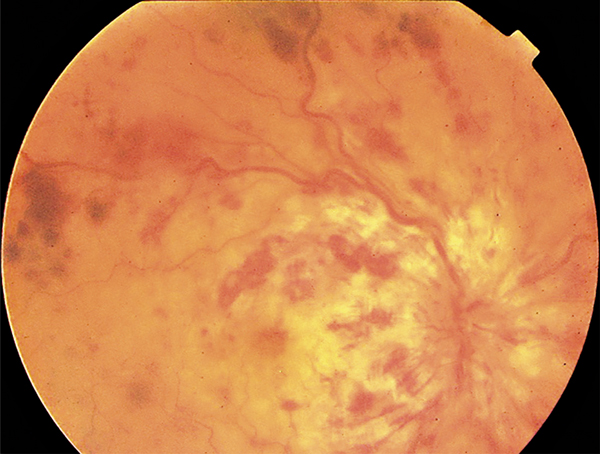
Fig. 9-3 Occlusion combinée de l’artère et de la veine centrale de la rétine.
Noter l’aspect blanc de la macula.
La principale cause de baisse visuelle au cours des OVR est l’œdème maculaire, défini par l’augmentation de l’épaisseur rétinienne maculaire. Elle est due soit à la rupture de la barrière hémato-rétinienne (BHR) interne (cas le plus fréquent), soit à un œdème ischémique intracellulaire. Les deux mécanismes peuvent être associés de façon variable. La rupture de la BHR aboutit à une exsudation plus ou moins importante de protéines et de lipides plasmatiques.
La pathogénie de l’œdème maculaire des occlusions veineuses (OMV) reste incomplètement élucidée [12]. L’OMV est caractérisé par un remodelage microvasculaire important avec une pression veineuse élevée, à l’origine d’une perturbation profonde de la structure et de la physiologie microvasculaire. Les parois veineuses s’épaississent et les capillaires perdent des cellules endothéliales et des péricytes. En parallèle, la pression veineuse élevée stimule un processus de collatéralisation, c’est-à-dire la transformation de capillaires en veines. Enfin, des micro-anévrismes peuvent également apparaître. Par analogie avec ce qui est admis pour l’œdème maculaire diabétique, il est probable que ceci est associé à :
une perte de l’autorégulation du flux sanguin rétinien ;
l’augmentation de la synthèse de facteur tel le VEGF ;
des altérations des jonctions serrées entre les cellules endothéliales.
La dysfonction de la BHR interne est sans doute l’élément central de l’OM dans les occlusions veineuses. Le VEGF est en effet connu pour sa capacité à induire une rupture de la BHR en ouvrant les jonctions serrées des cellules endothéliales (du fait de son action sur l’adhérence et l’expression des occludines des VE-cadhérines via des récepteurs membranaires VEGF-R1 et 2). Cette ouverture peut être suffisamment importante pour entraîner le passage de globules rouges, d’où la présence des hémorragies (fig. 9-4). Ces logettes hémorragiques sont très spécifiques des OMV. Dans l’OMV, le rôle prédominant du VEGF est suggéré par l’effet clinique important de son inhibition spécifique.
Cependant, d’autres facteurs jouent un rôle. Les fluctuations à court terme de l’œdème maculaire peuvent ainsi être en rapport avec les variations de la pression de perfusion oculaire, comme en rend compte la loi de Starling [13]. Le fluide transcapillaire comporte trois processus : diffusion, filtration et pinocytose. Diffusion et pinocytoses dépendent essentiellement des propriétés des cellules endothéliales (présence de canaux cellulaires, de vésicules de pinocytose, etc.). L’équation de Starling reflète le mécanisme de la filtration à travers les membranes capillaires (fig. 9-5). À partir de la pression hydrodynamique et de la pression oncotique de chaque côté de la BHR, cette loi modélise la résultante en termes de pression transcapillaire. À pression intra-oculaire égale, le flux à travers la barrière dépend donc de la pression artérielle. Cette loi met aussi l’accent sur l’effet de la présence de protéines dans le milieu extracellulaire qui va engendrer une pression oncotique tendant à augmenter le flux transcapillaire, mais aussi sur le fait que la pression interstitielle (= la pression intra-oculaire) va tendre à s’opposer à ce passage transvasculaire. Il faut donc se souvenir que ce flux dépend aussi de la pression intra-oculaire ; selon la loi de Starling, si la pression intra-oculaire baisse, alors le flux à travers les capillaires, et donc l’œdème maculaire, augmente.
Dans la rétine, le fluide extracellulaire, échappé des capillaires, peut diffuser dans la rétine parfois sur de longues distances. La propagation « horizontale » du liquide passe probablement par la couche nucléaire externe et/ou par l’espace sous-rétinien. Un œdème papillaire peut ainsi se propager jusqu’à la macula (fig. 9-6). Ce fluide peut s’accumuler localement dans les logettes, le plus souvent situées dans les couches plexiformes. Ces accumulations sont cependant transitoires, le liquide pouvant ensuite s’échapper vers le vitré, être réabsorbé par d’autres vaisseaux ou par l’épithélium pigmentaire. En effet, l’angiographie à la fluorescéine montre qu’en quelques minutes le fluide extravasé disparaît. L’œdème maculaire par rupture de la BHR est donc un phénomène dynamique, caractérisé par un flux constant de plasma des capillaires vers l’épithélium pigmentaire et vers le vitré.
Un phénomène bien connu mais encore mal expliqué est l’accumulation préférentielle du liquide extracellulaire, quelle que soit son origine, dans la macula et plus particulièrement sous la fovéa. Il est en effet fréquent de constater qu’une lésion distale, n’entraînant que peu d’épaississement rétinien, est associée à une petite bulle de décollement séreux rétinien fovéolaire (fig. 9-7). Ce décollement fovéolaire pourrait être dû à une moindre adhésion des cônes à l’épithélium pigmentaire par rapport aux bâtonnets. Ce phénomène est sans doute à mettre en rapport avec la constatation fréquente d’une prolifération pigmentaire sous-fovéolaire dans les séquelles d’OMV (fig. 9-8). Enfin, dans les cas d’altération localisée mais sévère de la barrière, des lipoprotéines de haut poids moléculaire peuvent s’accumuler sous la forme d’exsudats secs (fig. 9-9). Ces exsudats secs ont une dynamique d’évolution plus lente que celle du fluide extracelllulaire ; ils mettent plus de temps à se mettre en place et disparaissent plus lentement après traitement.
De manière spécifique à l’OMV, l’ischémie par bas débit engendrée par le ralentissement circulatoire joue sans doute aussi un rôle important, celle-ci pouvant augmenter la synthèse du VEGF. Par analogie avec ce qui se passe au cours de l’œdème maculaire diabétique, il est possible que d’autres facteurs jouent un rôle, comme l’inflammation, la perte des péricytes, la dysfonction gliale, la leukostase, voire le vitré. Ces différents facteurs sont certainement à l’œuvre lors de la survenue d’une OVR chez un sujet diabétique. Il est d’ailleurs fréquent de voir une véritable rétinopathie diabétique se déclencher à l’occasion d’une OVR. Cependant, le rôle propre de ces facteurs dans l’OVR reste mal connu. Ceci est dû notamment à l’absence de modèle animal pertinent d’OVR.
Certains OMV récents sont rapidement réversibles. D’autres vont malgré cela persister, témoignant probablement d’une endothéliopathie sévère. En effet, après une phase initiale très dépendante de la loi de Starling, et donc de la pression régnant dans les capillaires, peut survenir une incompétence endothéliale rendant l’œdème maculaire indépendant des conditions circulatoires. Par exemple, l’occlusion veineuse peut aboutir à une mort cellulaire endothéliale, qui entraîne probablement une rupture localisée de la barrière, celle-ci étant indépendante du VEGF. À terme, les cellules de l’épithélium pigmentaire et/ou les cellules de Müller peuvent dégénérer, provoquant des séquelles visuelles irréversibles.
Il ne faut pas confondre l’épaississement rétinien dû à un œdème de celui dû à une ischémie neuronale ; ce dernier est lié à un œdème intracellulaire (fig. 9-10), différent de l’œdème par rupture de la BHR qui entraîne un œdème extracellulaire.
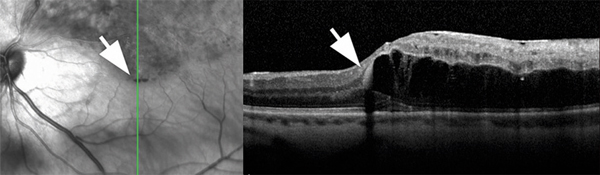
Fig. 9-4 Œdème maculaire secondaire à une OVCR (à gauche, imagerie infrarouge ; à droite, OCT) avec logettes présentant un niveau hémorragique (flèches).
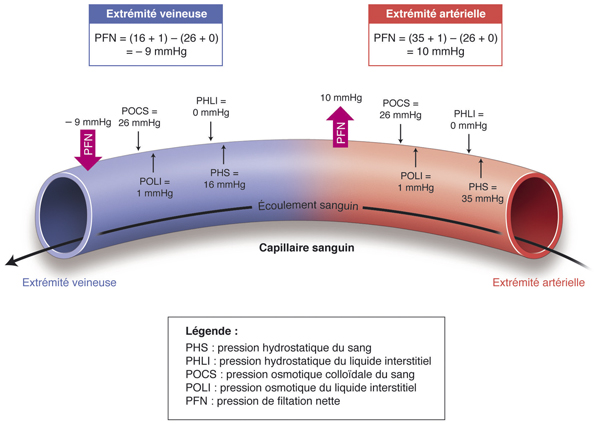
Fig. 9-5 Schéma figurant la dynamique des échanges capillaires selon la loi de Starling.
La pression hydrostatique du sang a tendance à pousser le liquide hors des capillaires (filtration), tandis que la pression osmotique colloïdale du sang a tendance à attirer le liquide dans les capillaires (réabsorption). Au pôle artériel des capillaires : la force résultante permet de faire sortir par diffusion l’eau, les gaz et les nutriments du plasma vers le liquide interstitiel. Au pôle veineux des capillaires : la force résultante permet de rappeler l’eau et les déchets métaboliques dans le plasma. Toute augmentation de la pression hydrostatique ou diminution de la pression osmotique plasmatique résulte en une augmentation des diffusions et à un œdème tissulaire.
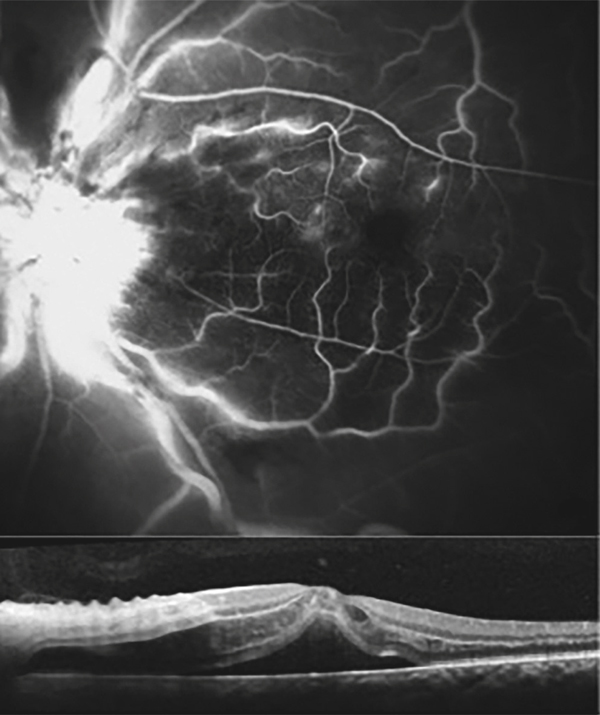
Fig. 9-6 Occlusion de la veine centrale.
Angiographie à la fluorescéine : diffusion papillaire sans diffusion maculaire. Coupe SD-OCT horizontale : œdème maculaire asymétrique prédominant en nasal, en rapport avec la propagation de l’œdème papillaire vers la macula ainsi qu’avec un œdème ischémique dû à une occlusion ciliorétinienne.
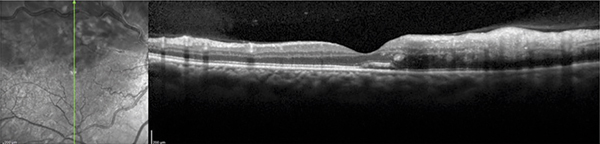
Fig. 9-7 Coupe SD-OCT horizontale : décollement séreux rétinien fovéolaire.
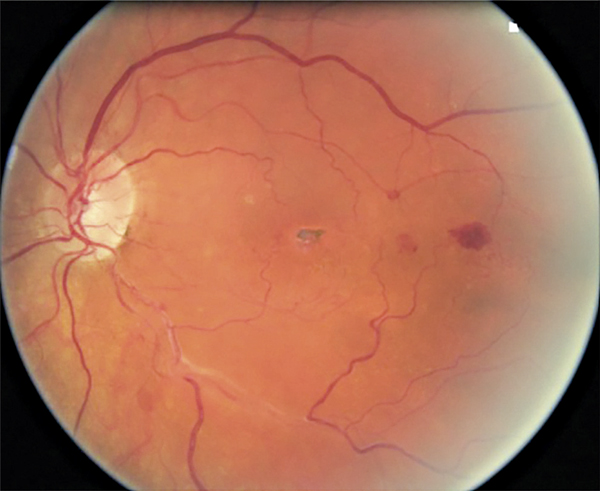
Fig. 9-8 Rétinographie couleur : prolifération pigmentaire sous-fovéolaire séquellaire d’un œdème maculaire post-occlusion de branche veineuse rétinienne.
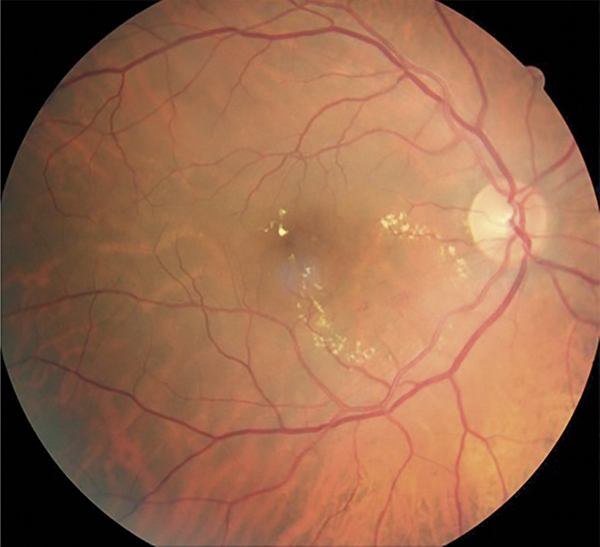
Fig. 9-9 Rétinophotographie couleur : exsudats secs maculaires liés à l’accumulation de lipoprotéines de haut poids moléculaire.
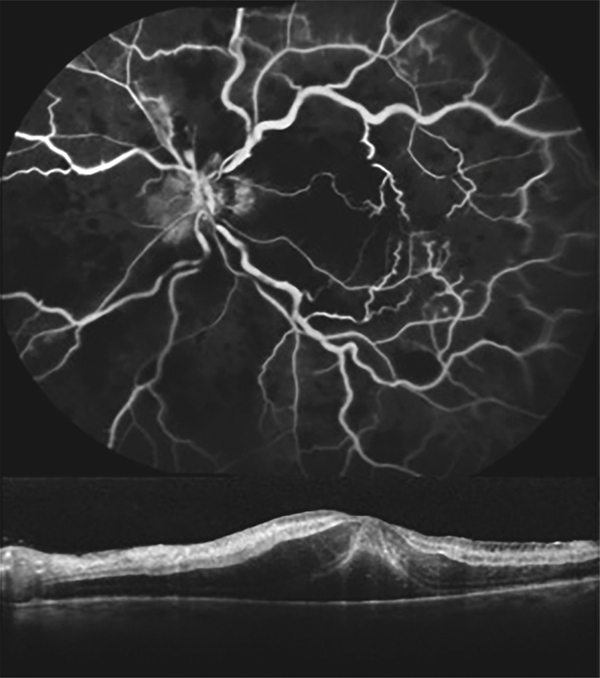
Fig. 9-10 Occlusion de la veine centrale de la rétine avec non-perfusion étendue et épaississement rétinien dû à l’œdème ischémique neuronal.
Il n’y a pas de rupture évidente de la barrière décelable en angiographie à la fluorescéine.
Si l’obstacle veineux persiste suffisamment longtemps, une circulation collatérale peut apparaître. Ce phénomène est distinct de l’angiogenèse en ce sens qu’il ne crée pas un nouveau trajet vasculaire, mais élargit un trajet vasculaire préexistant. La collatéralisation veineuse est très spécifique voire pathognomonique de l’occlusion veineuse rétinienne, à ne pas confondre avec la présence dans certaines formes de rétinopathie diabétique de boucles veineuses. Cette collatéralisation peut être accompagnée d’une dilatation localisée sous la forme d’un macro-anévrisme ; ce dernier peut à lui seul être responsable d’un œdème maculaire. Ce macro-anévrisme peut être unique, multiple ; dans ce dernier cas, les macro-anévrismes peuvent être éventuellement regroupés en grappes. Ils sont le plus souvent situés sur le trajet d’une circulation collatérale et entourés d’une zone d’occlusion capillaire. Ils sont au mieux détectés par l’angiographie au vert d’indocyanine (indocyanine green [ICG]) [14] ; la tomographie par cohérence optique (optical coherence tomography [OCT]) et l’examen du fond d’œil sont également contributifs (fig. 9-11). Ce dernier peut orienter la recherche d’un macro-anévrisme par la présence d’exsudats secs, très évocateurs.
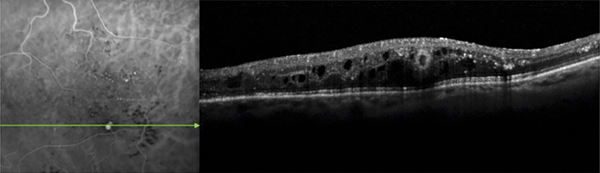
Fig. 9-11 Angiographie au vert d’indocyanine et coupe SD-OCT horizontale visualisant un macro-anévrisme responsable d’un œdème maculaire.
[1] Michelson G, Harazny J. Increased vascular resistance for venous outflow in central retinal vein occlusion. Ophthalmology 1997 ; 104 : 659-63.
[2] Green WR, Chan CC, Hutchins GM, Terry JM. Central retinal vein occlusion : a prospective histopathologic study of 29 eyes in 28 cases. Retina 1981 ; 1 : 27-55.
[3] Williamson TH. Central retinal vein occlusion : what’s the story ? Br J Ophthalmol 1997 ; 81 : 698-704.
[4] Weinberg D, Dodwell DG, Fern SA. Anatomy of arteriovenous crossings in branch retinal vein occlusion. Am J Ophthalmol 1990 ; 109 : 298-302.
[5] Paques M, Brolly A, Benesty J, et al. Venous nicking without arteriovenous contact : the role of the arteriolar microenvironment in arteriovenous nickings. JAMA Ophthalmol 2015 ; 133 : 947-50.
[6] Glacet-Bernard A, Chabanel A, Lelong F, et al. Elevated erythrocyte aggregation in patients with central retinal vein occlusion and without conventional risk factors. Ophthalmology 1994 ; 101 : 1483-7.
[7] Glacet-Bernard A, Leroux les Jardins G, Lasry S, et al. Obstructive sleep apnea among patients with retinal vein occlusion. Arch Ophthalmol 2010 ; 128 : 1533-8.
[8] Paques M, Garmyn V, Catier A, et al. Analysis of retinal and choroidal circulation during central retinal vein occlusion using indocyanine green videoangiography. Arch Ophthalmol 2001 ; 119 : 1781-7.
[9] Paques M, Gaudric A. Perivenular macular whitening during acute central retinal vein occlusion. Arch Ophthalmol 2003 ; 121 : 1488-91.
[10] Browning DJ. Patchy ischemic retinal whitening in acute central retinal vein occlusion. Ophthalmology 2002 ;109 : 2154-9.
[11] McLeod D. Central retinal vein occlusion with cilioretinal infarction from branch flow exclusion and choroidal arterial steal. Retina 2009 ; 29 : 1381-95.
[12] Zhang X, Zeng H, Bao S, et al. Diabetic macular edema: new concepts in patho-physiology and treatment. Cell Biosci 2014 ; 4 : 27.
[13] Paques M, Massin P, Sahel JA, et al. Circadian fluctuations of macular edema in patients with morning vision blurring: correlation with arterial pressure and effect of light deprivation. Invest Ophthalmol Vis Sci 2005 ; 46 : 4707-11.
[14] Bourhis A, Girmens JF, Boni S, et al. Imaging of macroaneurysms occurring during retinal vein occlusion and diabetic retinopathy by indocyanine green angiography and high resolution optical coherence tomography. Graefes Arch Clin Exp Ophthalmol 2010 ; 248 : 161-6.
A. Glacet-Bernard
➤ L’OMV est un signe quasiment constant au cours des OVR et représente un élément majeur de leur pronostic.
➤ On distingue l’œdème extracellulaire, le plus fréquent, caractérisé par l’accumulation de fluide dans des logettes cystoïdes, et l’œdème intracellulaire, plus rare, secondaire à une atteinte artérielle associée, donnant un blanchiment de la rétine ischémique.
➤ L’œdème maculaire peut régresser spontanément dans les formes favorables (20 à 25 % des cas), mais il peut à l’inverse donner des complications irréversibles de l’architecture maculaire lorsqu’il devient chronique. Son traitement doit donc intervenir avant que des lésions irréversibles ne compliquent son évolution.
➤ Par ailleurs, il est intimement intriqué à la composante ischémique de l’occlusion veineuse. C’est un œdème VEGF-dépendant qui est la conséquence de la souffrance hypoxique de la rétine suite à l’occlusion veineuse ; les OVR ischémiques donnent paradoxalement les œdèmes maculaires les plus volumineux. L’association à une maculopathie ischémique conditionne sa prise en charge.
L’œdème maculaire est un signe quasi constant des occlusions veineuses et il s’accompagne d’un cortège de signes cliniques évocateurs qui facilitent généralement son diagnostic [1–3]. Néanmoins, son expression clinique varie considérablement au cours de l’évolution de l’affection, ce qui peut amener à discuter des diagnostics différentiels dans les formes anciennes ou atypiques.
Sur le plan clinique, les OVR sont caractérisées par une grande variabilité de leur symptomatologie et de leurs modalités évolutives, mais on peut définir un ensemble de signes cliniques schématiquement communs à toutes les formes cliniques, même si chaque signe peut se présenter avec une intensité variable.
L’occlusion veineuse survient dans la grande majorité des cas chez une personne âgée de plus de 50 ans qui présente un ou plusieurs facteurs de risque vasculaire. Le mode d’installation des troubles visuels est le plus souvent progressif. Le plus souvent, environ dans les trois quarts des cas, le trouble visuel apparaît le matin au réveil, ce qui laisse supposer le rôle de facteurs nocturnes dans le déclenchement de l’OVR [4]. La baisse d’acuité visuelle est au départ modérée : elle se manifeste par un brouillard visuel prédominant le matin, compatible avec une vision relativement conservée. Ce symptôme est lié le plus souvent à l’œdème maculaire secondaire à l’occlusion veineuse (OMV) qui est connu pour prédominer le matin (sous l’effet de la régulation nycthémérale incluant en particulier des modifications de la tension artérielle et intra-oculaire) et régresser partiellement dans la journée [5].
Le flou visuel peut régresser spontanément, mais dans la plupart des cas, il s’accentue progressivement au cours des premières semaines pour conduire à une baisse franche de l’acuité visuelle, plus ou moins sévère. Parfois, le trouble visuel est méconnu du patient qui ne constate son problème oculaire qu’au moment d’une poussée évolutive donnant une baisse significative de sa vision ou devant des complications tardives.
Plus rarement, la baisse de la vision est brutale, réduisant d’emblée la vision à compter les doigts. Cette baisse visuelle sévère fait suspecter une occlusion de la veine centrale de la rétine (OVCR) ischémique d’emblée de pronostic très sévère, particulièrement exposée au risque de glaucome néovasculaire (fig. 9-12). Une acuité visuelle basse inférieure à 1/10 fait suspecter que le patient est à risque de complication néovasculaire, d’autant plus s’il existe des facteurs de risque vasculaire, au premier plan desquels le diabète, et des territoires non perfusés en angiographie (en l’absence de photocoagulation panrétinienne). Heureusement, d’autres situations peuvent conduire à une baisse visuelle rapide et majeure, mais ne partagent pas avec les formes ischémiques le risque redoutable de néovascularisation du segment antérieur :
forme associée à une occlusion d’une artère ciliorétinienne (fig. 9-13) ;
forme avec vasoconstriction artérielle excessive mais transitoire, donnant un blanchiment fugace du fond d’œil (fig. 9-14) ;
ischémie maculaire isolée, hémorragie maculaire dense (fig. 9-15) ;
hémorragie intravitréenne ou rétro-hyaloïdienne (fig. 9-16).
Si l’acuité visuelle est un élément simple et important qui peut orienter le diagnostic de la forme clinique et de la sévérité, elle doit être complétée par les autres examens cliniques et paracliniques, au premier rang desquels l’angiographie à la fluorescéine, pour préciser le diagnostic.
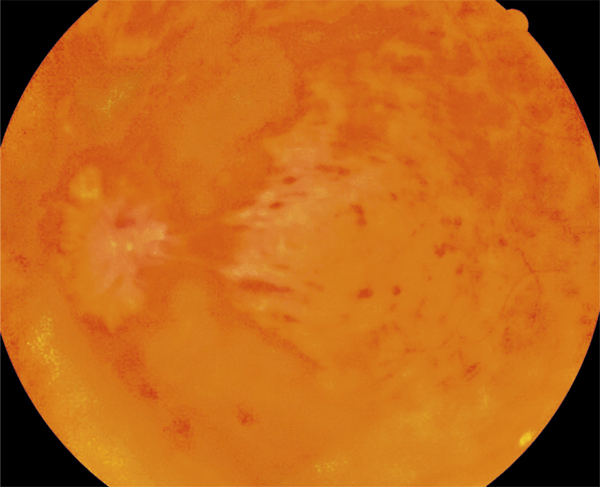
Fig. 9-12 OVCR ischémique d’emblée chez une femme de 60 ans (acuité visuelle inférieure à 20/400).
Les hémorragies rétiniennes sont profuses, prédominant autour de la papille ; la rétine apparaît pâle en dehors des flaques hémorragiques.
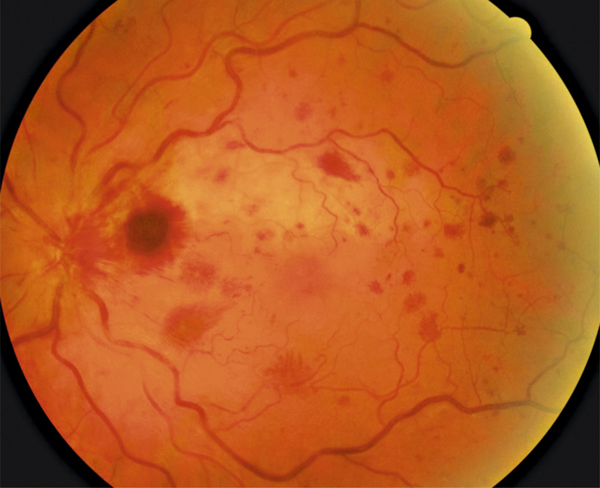
Fig. 9-13 OVCR associée à une occlusion d’une artère ciliorétinienne.
En plus du tableau typique associant dilatation et tortuosité veineuse, hémorragies rétiniennes dans les quatre quadrants et œdème de la papille, le territoire de l’artère ciliorétinienne se distingue par sa couleur blanche (ischémie rétinienne due à l’occlusion artériolaire). Une hémorragie ronde masque l’origine de l’artère ciliorétinienne sur le bord de la papille.
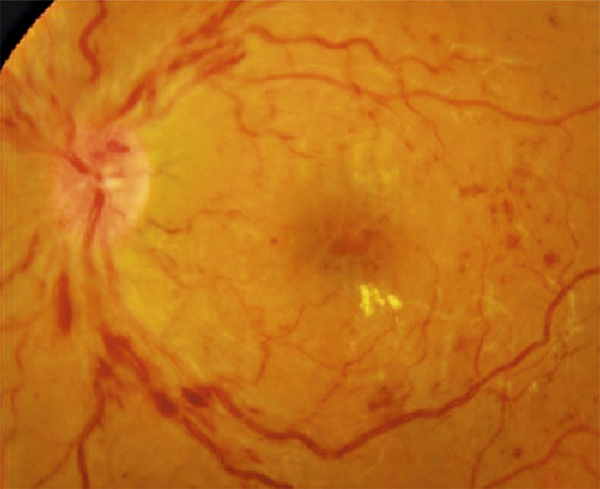
Fig. 9-14 OVCR avec blanc périveinulaire, témoignant d’un ralentissement circulatoire intense avec hypoxie rétinienne, parfois transitoire et de bon pronostic.
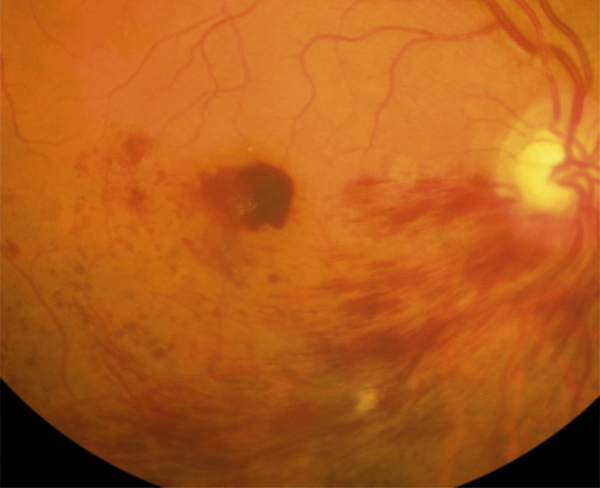
Fig. 9-15 Hémorragie maculaire dense, cause de baisse d’acuité visuelle d’emblée, compliquant une occlusion veineuse inférieure par ailleurs de bon pronostic.
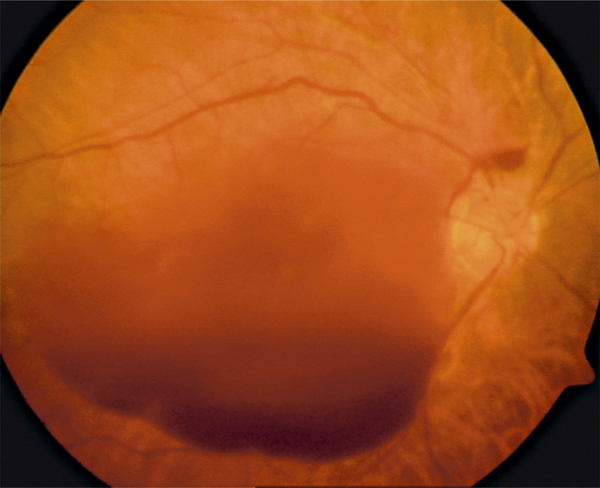
Fig. 9-16 Hémorragie rétro-hyaloïdienne compliquant une OBV ancienne avec bouquet de néovaisseaux prérétiniens supérieurs.
Même s’il est généralement normal, l’examen biomicroscopique du segment antérieur doit toujours être réalisé avec beaucoup d’attention. Lorsqu’une forme ischémique d’OVCR est suspectée notamment chez les patients à risque (voir plus haut), il faut rechercher minutieusement les premiers signes de rubéose irienne avant la dilatation pupillaire : dilatation de la collerette irienne [6] ; apparition de néovaisseaux au sphincter, devant le stroma irien et/ou dans l’angle camérulaire en gonioscopie ; synéchies irido-cristalliniennes.
La mesure de la tension oculaire des deux yeux est indispensable, et retrouve dans presque un tiers des cas un glaucome chronique ou une hypertonie sous-jacente, en sachant que la tension oculaire est habituellement diminuée à la phase aiguë dans l’œil atteint de l’occlusion. Beaucoup plus rarement, elle retrouvera une élévation du tonus en rapport avec un glaucome néovasculaire, complication qui survient généralement au troisième mois d’évolution des formes ischémiques ou après l’arrêt des injections d’anti-VEGF ou de corticoïdes.
L’examen du fond d’œil permet souvent de diagnostiquer l’OMV face à la tétrade sémiologique caractéristique décrite par Coscas dans le premier rapport sur les occlusions veineuses [1] : l’œdème rétinien est associé à des dilatations et tortuosités veineuses, des hémorragies rétiniennes et parfois des nodules cotonneux (fig. 9-17).
L’œdème rétinien est quasiment constant et lié à la rupture de la barrière hémato-rétinienne interne sous l’effet de la sécrétion de VEGF. Il consiste en une infiltration extracellulaire de fluide s’accumulant préférentiellement dans la couche de Henlé (plexiforme externe), puis dans toutes les couches de la rétine. Dans la région maculaire, l’œdème prend rapidement un aspect cystoïde aboutissant à l’image classique en pétale de fleur, bien visible en angiographie à la fluorescéine mais aussi actuellement sur l’OCT « en face » (fig. 9-18). Les hémorragies intrarétiniennes peuvent parfois être collectées dans les logettes d’œdème maculaire cystoïde et sédimenter dans ce milieu liquidien, donnant un niveau horizontal bien reconnaissable « en nid de pigeon » qui confirme le diagnostic d’œdème maculaire cystoïde dès l’examen clinique (fig. 9-19).
À côté de cet œdème extracellulaire, conséquence de l’extravasation du contenu sanguin en réponse à l’hyperpression veineuse et à la sécrétion de VEGF, il existe parfois un œdème intracellulaire lorsqu’il existe une participation artérielle, se manifestant par un blanchiment de la rétine ischémique. Il peut s’agir d’une occlusion artérielle ciliorétinienne associée à l’OVR ou d’une vasoconstriction artérielle réactionnelle à une OVCR donnant un blanchiment rétinien fugace prédominant dans la zone périveineuse (voir fig. 9-13 et 9-14) [7, 8]. Si le blanchiment de la rétine est fugace, l’atteinte des couches superficielles et moyennes de la rétine (des fibres optiques à la nucléaire interne) est observable à long terme sur les coupes de spectral-domain optical coherence tomography ou SD-OCT (voir chapitre 9-3).
Dans les OVCR, l’œdème papillaire est constant. Il peut être très marqué et donner l’aspect caractéristique de « papillo-phlébite », assez fréquent chez les sujets jeunes et souvent de bon pronostic (fig. 9-20).
Les dilatations veineuses et les tortuosités accentuées sont le résultat d’une distension pariétale des veines, déformables, sous l’effet de l’hyperpression veineuse liée à l’obstacle à la circulation sanguine. Elles pourraient donc être un marqueur de l’intensité du ralentissement circulatoire. De même, le caractère sombre des veines dilatées pourrait correspondre au caractère désaturé du sang témoignant de l’hypoxie, corrélée au ralentissement circulatoire. À l’opposé, la normalisation du calibre veineux, spontanée ou sous l’effet d’un traitement, semble être de bon pronostic.
Les hémorragies rétiniennes reflètent la sévérité de l’OVR. Les hémorragies de la phase aiguë sont superficielles en flammèches, disposées le long des fibres optiques. Elles prédominent au pôle postérieur, autour de la papille, et sont habituellement associées à des hémorragies ponctuées, disséminées au pôle postérieur jusqu’en périphérie (voir fig. 9-17). Elles témoignent de l’hyperpression veineuse et de la rupture de la barrière hémato-rétinienne interne. Avec le temps, ces hémorragies se résorbent progressivement et perdent leur caractère en flammèches, tout en restant superficielles. Dans les formes ischémiques, on peut observer des hémorragies profondes en flaques, délimitées par les trajets vasculaires (fig. 9-21).
Une hémorragie peut aussi être observée dans la cavité vitréenne. Au stade aigu, il est fréquent d’observer une suffusion hémorragique dans le vitré, prédominant devant le pôle postérieur et à la partie inférieure du vitré (fig. 9-22). Ces hémorragies précoces ne sont pas le signe d’une complication néovasculaire mais témoignent de l’importance de l’hyperpression veineuse. À un stade plus tardif de l’évolution, une hémorragie intravitréenne doit faire systématiquement rechercher une néovascularisation prépapillaire ou prérétinienne, assez fréquente au décours des occlusions de branche veineuse rétinienne (voir fig. 9-16). Ces hémorragies sont parfois collectées dans l’espace rétro-hyaloïdien, donnant aussi un aspect typique en « nid de pigeon ».
Les nodules cotonneux correspondent au gonflement des fibres optiques par accumulation de matériel axoplasmique. Ils témoignent classiquement de l’occlusion d’une artériole précapillaire, résultant en un petit territoire ischémique. Souvent, cet accident ischémique focal conduit à la dégénérescence des fibres optiques concernées par l’occlusion artériolaire, ce qui donnera après quelques semaines un déficit fasciculaire bien visible sur le cliché en lumière bleue, d’où la gravité des nodules cotonneux inter-papillo-maculaires (fig. 9-23). Parfois, le nodule cotonneux n’a aucune connotation ischémique : la souffrance des fibres optiques peut être d’origine uniquement mécanique, lorsque le trajet des fibres optiques est contraint et déformé par les tortuosités très marquées des veines rétiniennes. Ces nodules cotonneux sont donc le long des gros troncs veineux (voir fig. 9-17).
L’examen du fond d’œil peut aussi déceler d’autres anomalies : modification du calibre artériel en rapport avec l’artériosclérose, signes de croisement, exsudats lipidiques, excavation glaucomateuse de la papille, et parfois séquelles d’occlusion veineuse controlatérale (engainements secs, boucles prépapillaires, circulation de shunt).
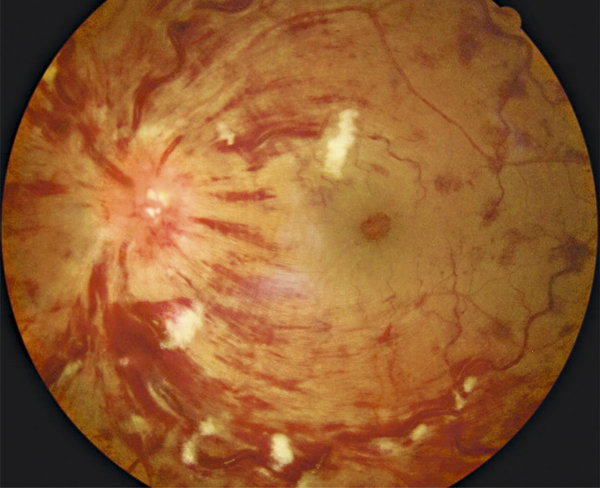
Fig. 9-17 OVCR typique associant les quatre signes cardinaux décrits par le Pr Coscas (hémorragies, œdème, dilatation et tortuosités veineuses, nodules cotonneux).
Les nodules cotonneux sont d’origine ischémique (blanc intense dans la zone inter-papillo-maculaire) ou mécanique (moins intenses le long des courbures de la veine temporale inférieure).
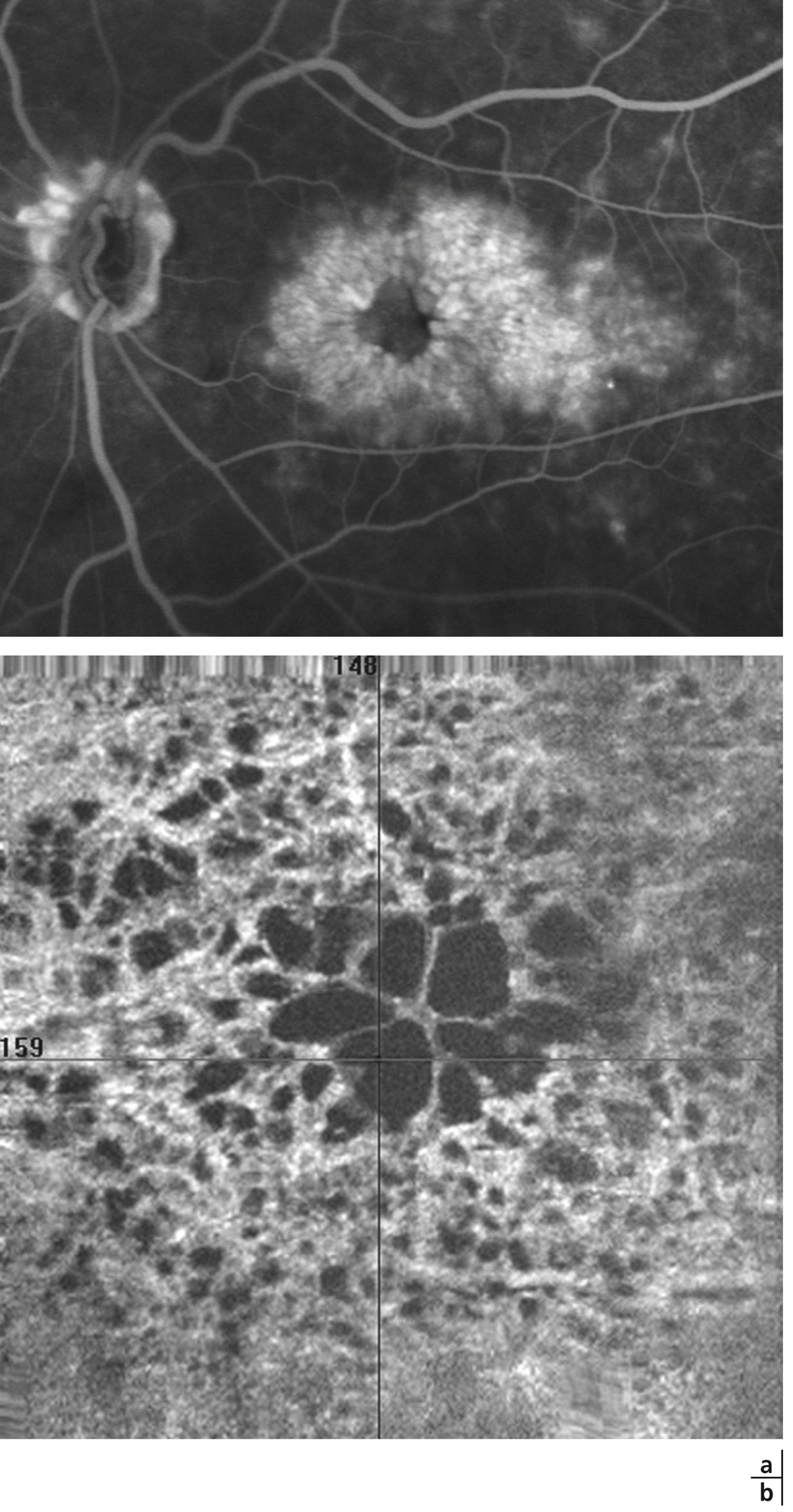
Fig. 9-18 Aspect d’OMV en pétale de fleur visualisé sur le temps tardif de l’angiographie à la fluorescéine (a) et sur l’OCT « en face » dans une OVCR (b).
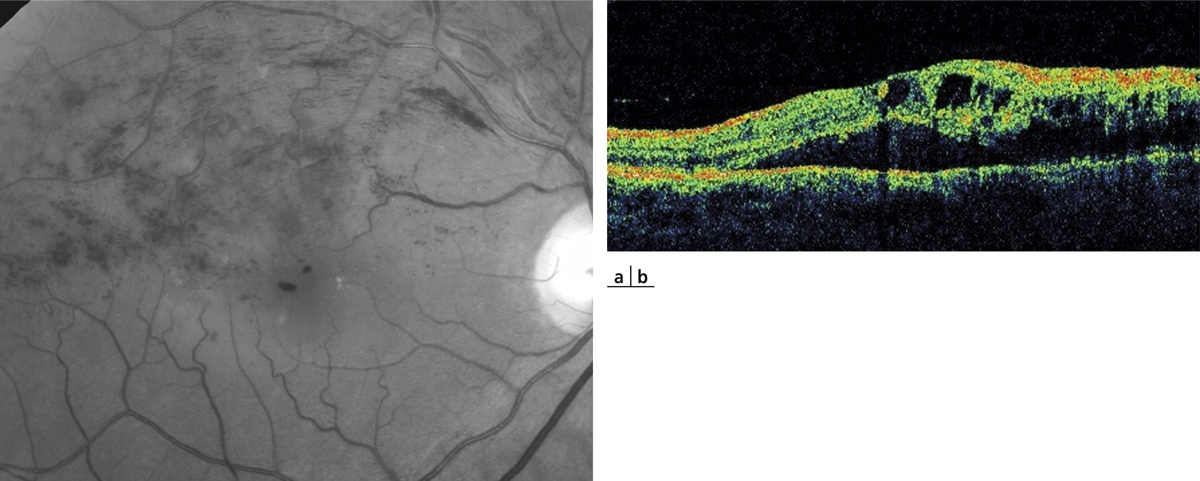
Fig. 9-19 Hémorragie rétinienne collectée dans une logette donnant un aspect en nid de pigeon (a). L’OCT (b) retrouve une hyperréflectivité déclive sur cette coupe verticale, correspondant au sang dans la logette.
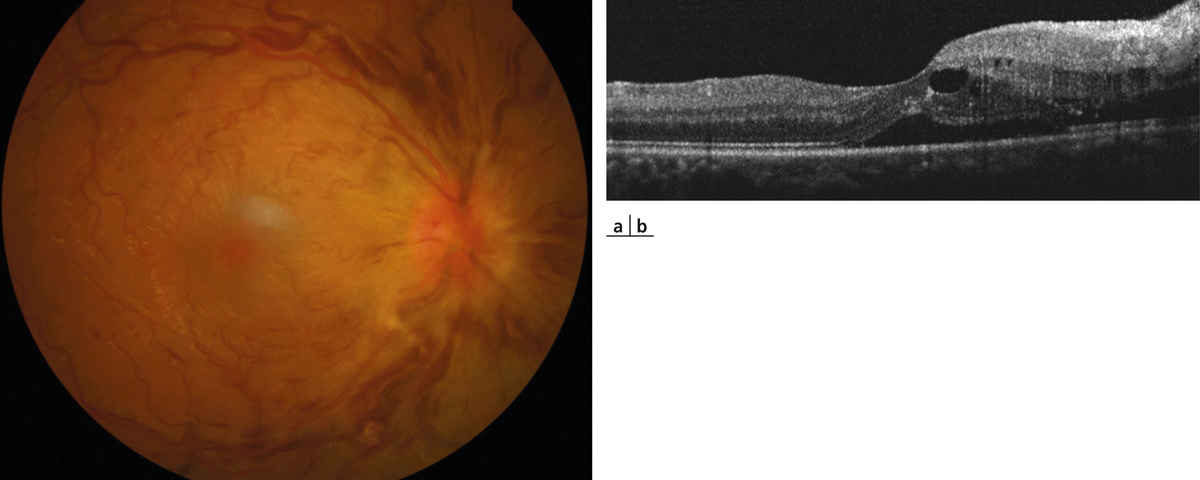
Fig. 9-20 Tableau de papillo-phlébite chez un patient jeune.
Forme d’OVCR avec prédominance des signes à la papille. L’œdème papillaire est majeur et les hémorragies sont peu nombreuses (a). Sur la coupe OCT (b), le soulèvement maculaire et l’OMV semblent principalement alimentés par l’œdème papillaire.

Fig. 9-21 Hémorragies profondes en flaque dans une OVCR ischémique.
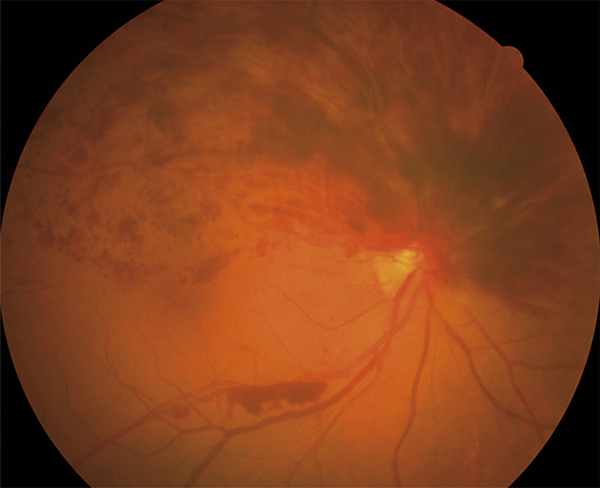
Fig. 9-22 Occlusion veineuse hémicentrale.
Le site de l’occlusion est, comme pour l’OVCR, au niveau de la lame criblée. Les hémorragies ne concernent qu’une hémirétine, mais elles prennent naissance à la papille. Contrairement aux OBV, un quadrant nasal est concerné par l’occlusion. À noter une suffusion hémorragique dans le vitré donnant une petite collection hématique rétro-hyaloïdienne en nid de pigeon.
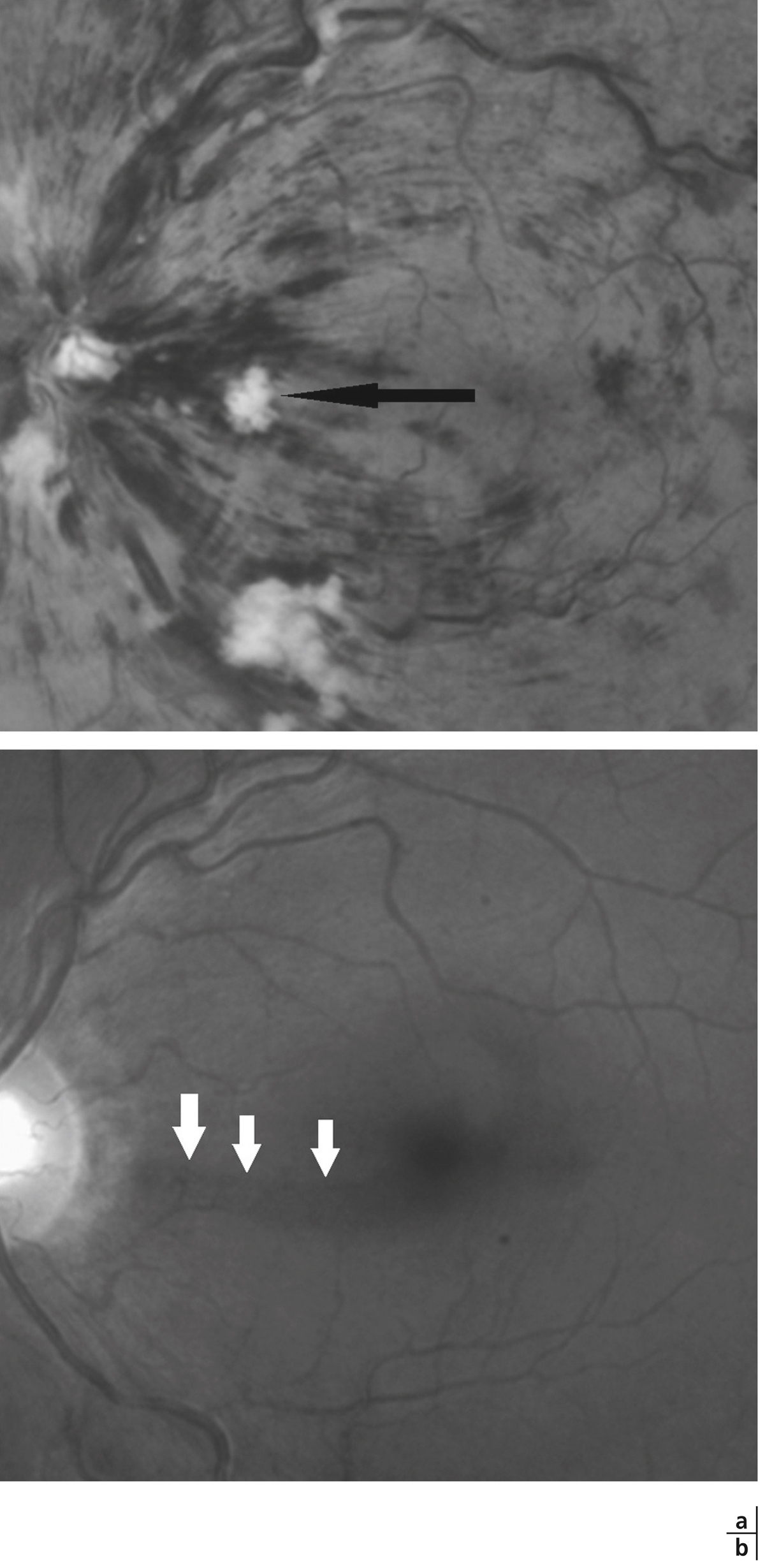
Fig. 9-23 Nodule cotonneux inter-papillo-maculaire (a : flèche noire) évoluant vers un déficit arciforme des fibres optiques bien visible en lumière bleue (b : flèches blanches).
Si toutes les occlusions veineuses rétiniennes présentent des points communs évidents, en partageant la même symptomatologie et les mêmes facteurs de risque, il existe des différences importantes entre occlusion du tronc de la veine centrale de la rétine et occlusion de branche veineuse rétinienne, tant sur leur terrain de prédilection, les particularités évolutives et le pronostic (tableau 9-2). Les occlusions veineuses hémicentrales (OVHC) partagent les caractéristiques des OVCR en ce qui concerne le risque de néovascularisation du segment antérieur (car le territoire non perfusé peut être étendu), et celles des OBVR en ce qui concerne le pronostic visuel, l’évolution et le traitement de l’OMV puisqu’une partie de l’arcade capillaire anastomotique périfovéolaire est épargnée.
Selon les récentes études épidémiologiques, les OBVR sont très nettement les plus nombreuses, d’autant plus qu’elles peuvent être sous-évaluées, en particulier dans des études rétrospectives basées sur des rétinophotographies.
L’OVCR correspond à l’atteinte de l’ensemble des veines rétiniennes suite à l’obstruction du tronc veineux central au niveau ou juste en arrière de la lame criblée. Les signes cliniques sont donc présents dans les quatre quadrants rétiniens (voir fig. 9-17) [9]. Comme la circulation rétinienne est « terminale », les perturbations circulatoires peuvent avoir un retentissement majeur sur l’oxygénation de la rétine, exposant aux complications les plus sévères comme le glaucome néovasculaire (GNV) [10]. Heureusement, elle ne correspond qu’à un quart environ des occlusions veineuses.
L’OVHC partage de nombreux points communs avec l’OVCR, car le site de l’occlusion est également au niveau de la lame criblée [11]. L’OVHC peut être observée lorsqu’existe une dualité du tronc de la veine centrale (un hémitronc supérieur et un hémitronc inférieur). Cette anomalie congénitale est observée dans environ 20 % des cas. Il n’est pas rare d’observer le passage d’une OVCR vers une OVHC lorsque la circulation sanguine s’améliore dans l’un des deux troncs (voir fig. 9-22), ou à l’inverse qu’une OVHC se transforme en véritable OVCR (fig. 9-24). Ces OVHC peuvent être prises pour des occlusions de branche si l’examen ou le cliché n’analyse pas la rétine en nasal de la papille.
Contrairement aux OVCR et aux OVHC, c’est presque toujours au niveau d’un croisement artérioveineux que se produit l’occlusion de branche veineuse (fig. 9-25). Du fait de l’atteinte partielle du réseau capillaire périfovéolaire, les conséquences sur la vision centrale sont limitées et moindres que dans les OVCR, donnant un meilleur pronostic visuel final [12, 13]. De plus, certaines occlusions de branches nasales peuvent être totalement asymptomatiques. Comme dans l’OVHC, l’OMV est asymétrique. Lorsqu’il est important, il déborde sur la rétine non atteinte par l’occlusion et peut exercer une action délétère à long terme sur la vision centrale. C’est pourquoi, avant l’ère des traitements anti-œdémateux, les OBV ischémiques étaient connues pour avoir un meilleur pronostic visuel que les OBV œdémateuses [14].
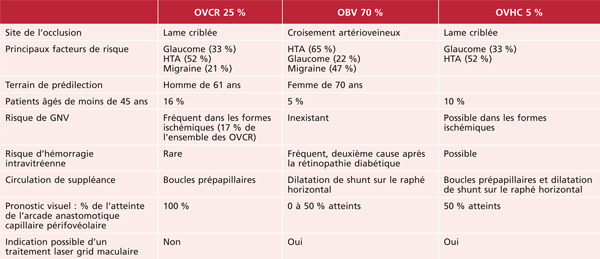
Tableau 9-2 Principales caractéristiques des OVR selon leur topographie (OVCR, OBV et OVHC).
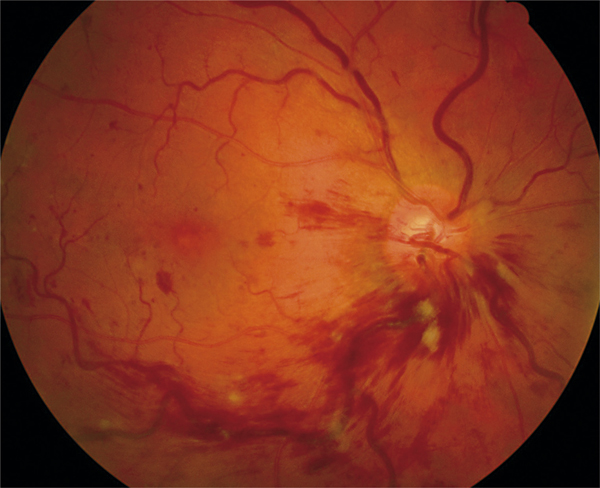
Fig. 9-24 Occlusion veineuse hémicentrale inférieure se transformant en OVCR.
On observe une augmentation de calibre des veines supérieures associées à de petites hémorragies dans les quadrants supérieurs.
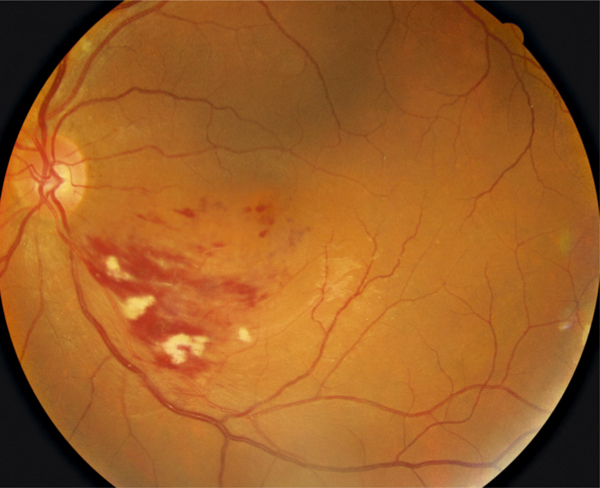
Fig. 9-25 Occlusion de branche veineuse, le site de l’occlusion étant au niveau d’un croisement artérioveineux.
Il n’existe pas de classification de l’OMV et c’est la classification des OVR qui prime, distinguant les formes bien perfusées (ou non ischémiques ou œdémateuses) des formes ischémiques (ou non perfusées) [3, 15, 16]. L’œdème maculaire est très fréquent au cours des OVR, de l’ordre de 95 % des cas, à la fois dans les formes perfusées et dans les formes non perfusées. Paradoxalement, l’œdème maculaire des formes ischémiques est plus marqué et volumineux que celui des formes bien perfusées, ce qui est expliqué par le fait que l’œdème des OVR est VEGF-dépendant, donc plus marqué en cas d’ischémie rétinienne périphérique associée [17].
Les formes bien perfusées sont compatibles avec une vision relativement conservée et c’est parmi elles que se trouvent les évolutions spontanément favorables. Elles correspondent à environ 80 % des OVCR à leur début et seulement à 40 % après 1 an de suivi, en raison de la « conversion » de nombreuses OVR en forme ischémique au cours des premiers mois d’évolution, d’où la nécessité d’une surveillance très régulière au cours de la première année.
L’ischémie maculaire n’est pas prise en compte spécifiquement dans la classification, or elle constitue un élément majeur du pronostic visuel. C’est l’angiographie à la fluorescéine et maintenant l’angio-OCT qui la mettent en évidence. Elle est généralement observée dans les formes non perfusées, mais elle peut parfois être presque isolée, sans territoires de non-perfusion étendus en périphérie rétinienne, n’exposant donc pas au risque de néovascularisation. Dans les OVCR, en présence d’ischémie maculaire, le traitement symptomatique de l’OMV n’apporte pas le bénéfice visuel attendu et est généralement interrompu rapidement (fig. 9-26). Comme évoqué plus haut, dans les OBV, une ischémie maculaire partielle n’est au contraire pas un élément de mauvais pronostic visuel, au contraire [14].
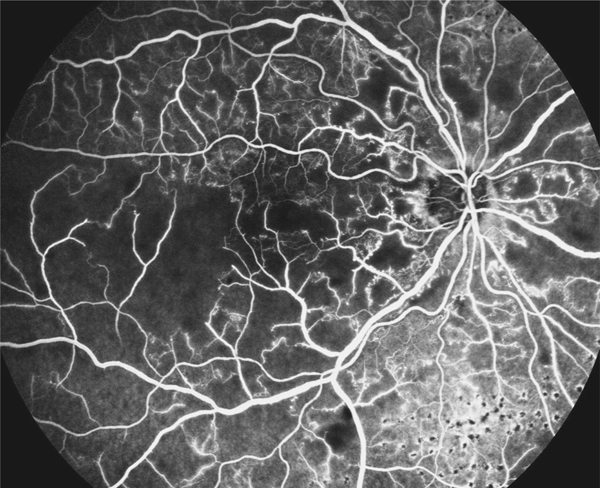
Fig. 9-26 OVCR ischémique avec disparition de nombreux vaisseaux de petit et moyen calibres au pôle postérieur et en périphérie, avec de nombreux aspect en arbre mort.
L’acuité visuelle est effondrée dans ce cas de maculopathie ischémique (inférieure à 20/400).
L’œdème maculaire, observé au stade initial dans presque tous les cas, ne régresse généralement pas aussi rapidement que les hémorragies rétiniennes ; il peut même s’intensifier dans un premier temps et devenir le symptôme prédominant après 3 à 4 mois, donnant la forme caractéristique de « l’œdème maculaire persistant ». Le diagnostic de cet œdème maculaire persistant est facilité maintenant par l’OCT. Cet œdème persistant concerne environ 50 % des OVCR bien perfusées et représente la principale cause d’absence de récupération visuelle. La Central Vein Occlusion Study (CVOS) a observé l’évolution spontanée de cet OMV des formes bien perfusées [3, 18] : il peut régresser spontanément et donner une lente amélioration de la vision dans 9 % des yeux à 1 an, 20 % à 2 ans et 24 % à 3 ans.
Le développement de circulations de suppléance peut être associé à une évolution favorable. Ces modifications vasculaires sont progressives et font partie du remodelage vasculaire observé au décours des OVR et permettant parfois leur diagnostic rétrospectif. Dans les OVCR et les OVHC, il s’agit de boucles prépapillaires (fig. 9-27). Dans les OBV et les OVHC, il s’agit souvent d’une dilatation des veinules et des capillaires au niveau du raphé horizontal (fig. 9-28) qui permettent un drainage du sang vers la veine opposée (supérieure s’il s’agit d’une OBV inférieure et inversement). On peut observer également des vaisseaux de shunt, capillaires dilatés faisant un « pontage » de part et d’autre du site de l’occlusion.
Schématiquement, les formes initialement bien perfusées ont trois modalités évolutives qui peuvent se combiner : la récupération complète ou quasi complète des symptômes qui survient dans 25 % des cas ; la persistance d’un œdème maculaire responsable de baisse visuelle séquellaire dans 50 % des cas ; l’apparition d’ischémie rétinienne plus ou moins étendue dans 54 % des cas, dont 26 % de cas évoluant en forme ischémique sévère.
Toute la complexité de la prise en charge de l’œdème maculaire réside dans la contradiction entre l’attente d’une récupération spontanée possible et le risque de dégradation de la fonction maculaire liée à la persistance de l’œdème, sans sous-estimer les complications éventuelles, bien que rares, des traitements invasifs.
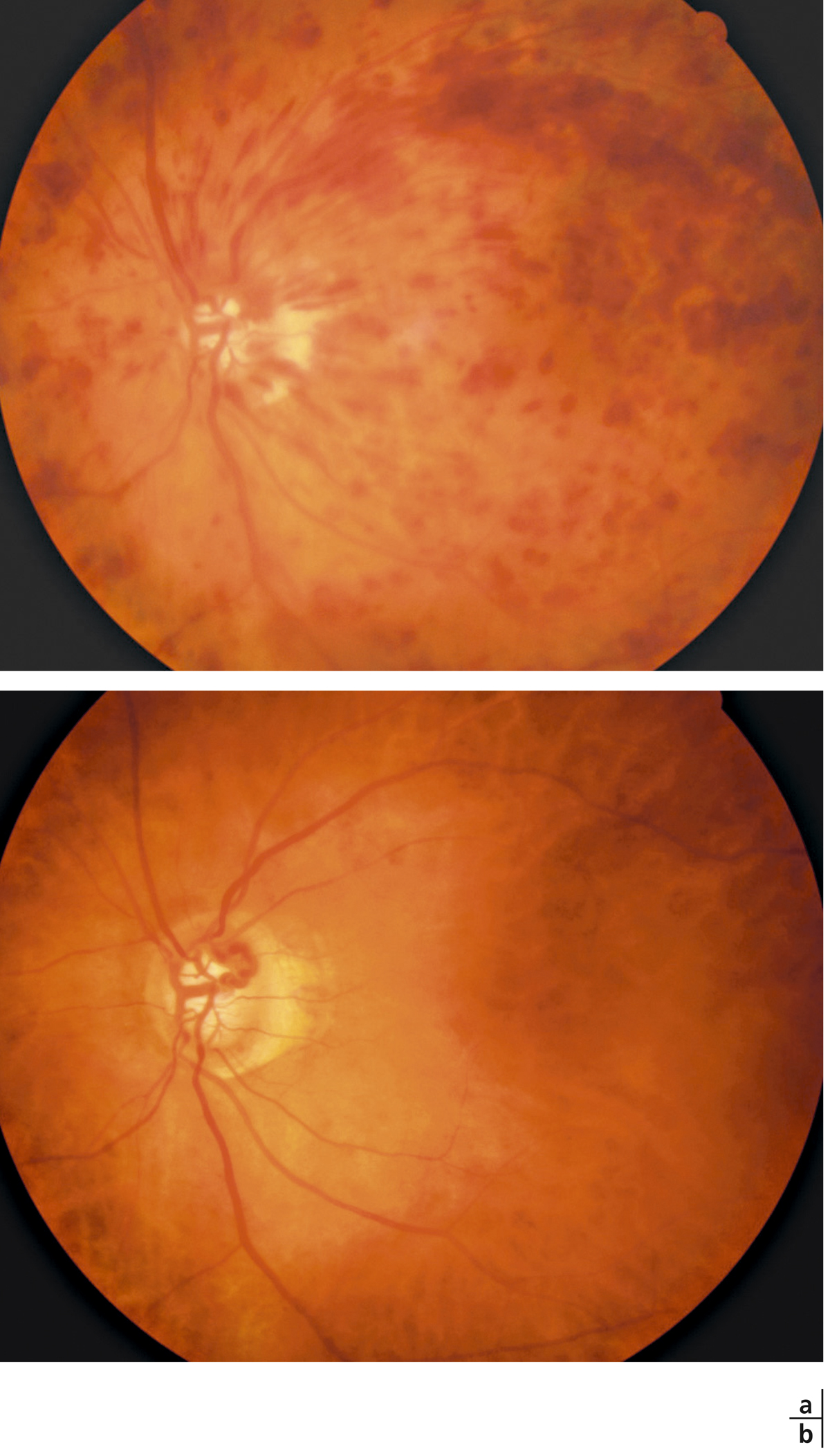
Fig. 9-27 Évolution spontanément favorable d’une OVCR chez une femme de 72 ans.
Rétinophotographie au stade initial (20/100 : a) et 6 mois après (b) où des boucles prépapillaires sont bien visibles.
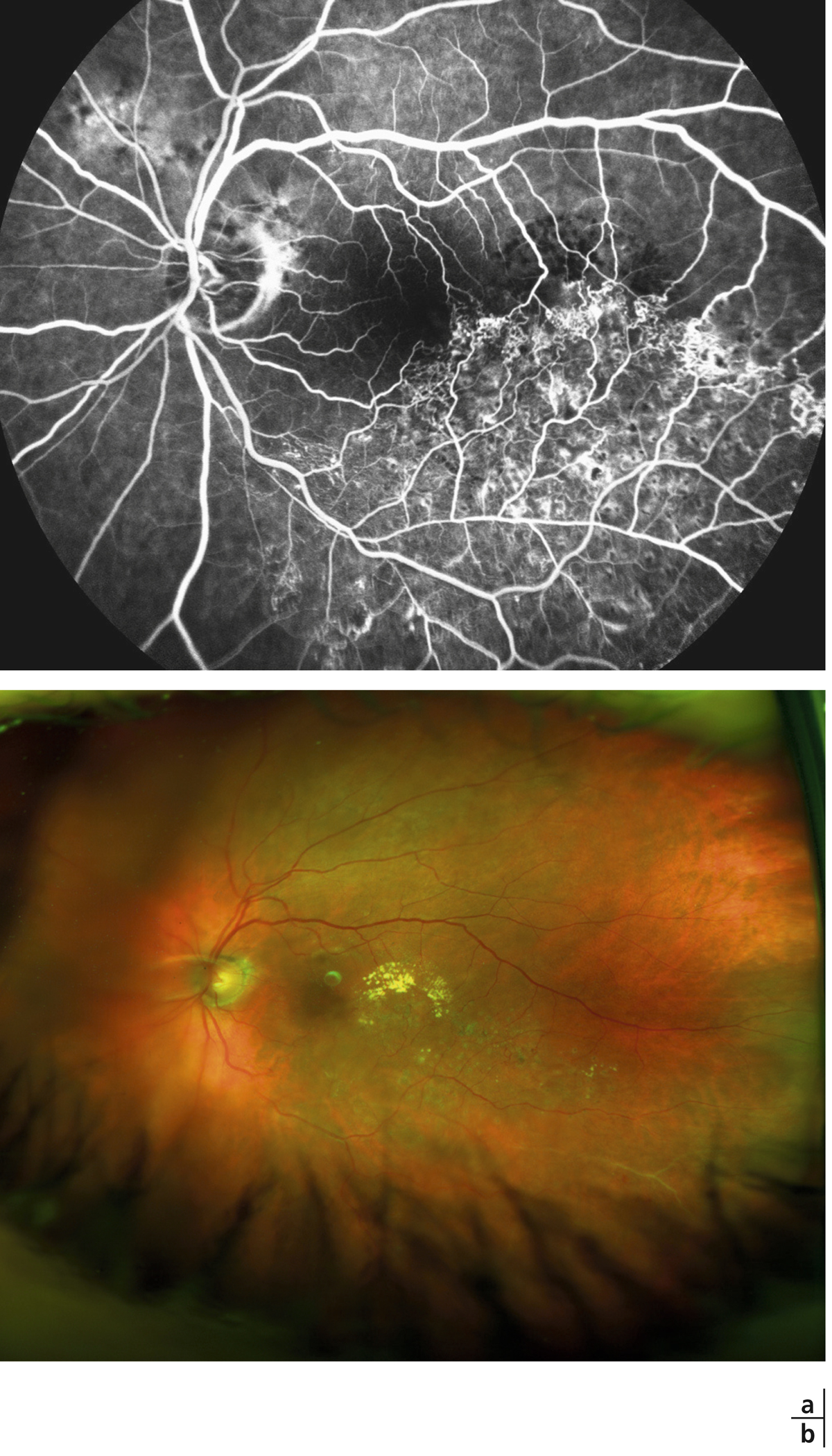
Fig. 9-28 Circulation de suppléance au cours d’une OBV temporale inférieure.
On distingue bien la dilatation des capillaires en bordure du territoire occlus, en particulier sur le raphé horizontal (a). Ces dilatations sont responsables d’œdème et d’exsudats sur la rétinophotographie ultra-grand champ Optos® (b).
Le plus souvent, la chronicité de l’œdème aboutit à la dégradation lente et irréversible de l’architecture maculaire. Les logettes d’œdème maculaire cystoïde tendent à confluer et à envahir toutes les couches de la rétine. À un stade extrême, les différentes couches rétiniennes ne peuvent plus être distinguées entre des cavités pseudo-kystiques qui envahissent la rétine. Lorsque ces lésions s’accentuent et s’étendent, elles deviennent facilement visibles à l’examen du fond d’œil sous forme d’amas pigmentaires rétro-fovéaux parfois associés à des plages dépigmentées. Au stade final, une large zone d’atrophie de l’épithélium pigmentaire remplace la zone occupée précédemment par l’œdème (fig. 9-29) ; ces modifications se font sans changement de la vision du patient qui reste limitée le plus souvent à un scotome central [9].
Parfois, l’œdème maculaire persistant peut conduire à d’autres complications : rupture de la paroi interne d’une logette centrale avec constitution d’un trou maculaire lamellaire (fig. 9-30), trou maculaire complet, fibrose sous-rétinienne, développement d’une membrane épimaculaire, dont l’indication chirurgicale doit être posée en tenant compte du contexte.
Le soulèvement rétinien exsudatif est une complication peu fréquente des OVHR et des OBVR, et plus rare dans les OVCR [19, 20]. Il survient dans les formes mixtes où des segments de capillaires dilatés avoisinent de petits territoires de non-perfusion. Cliniquement, le soulèvement de la rétine neurosensorielle maculaire est souvent légèrement excentré sous forme de bulle fixe, entourée d’une couronne plus ou moins dense d’exsudats lipidiques. À la surface de cette bulle, les anomalies du lit vasculaire sont évidentes, avec des zones de dilatations et de nombreux micro-anévrismes pouvant évoquer une maladie de Coats (fig. 9-31).
En conclusion, l’OMV est un signe quasiment constant et représente un élément majeur du pronostic des OVR. Son traitement doit intervenir avant que des lésions irréversibles ne compliquent son évolution. Par ailleurs, il est intimement intriqué à la composante ischémique de l’occlusion veineuse du fait des conséquences de la maculopathie ischémique sur la fonction maculaire d’une part et de l’influence de l’ischémie périphérique qui agit directement sur cet œdème VEGF-dépendant d’autre part.
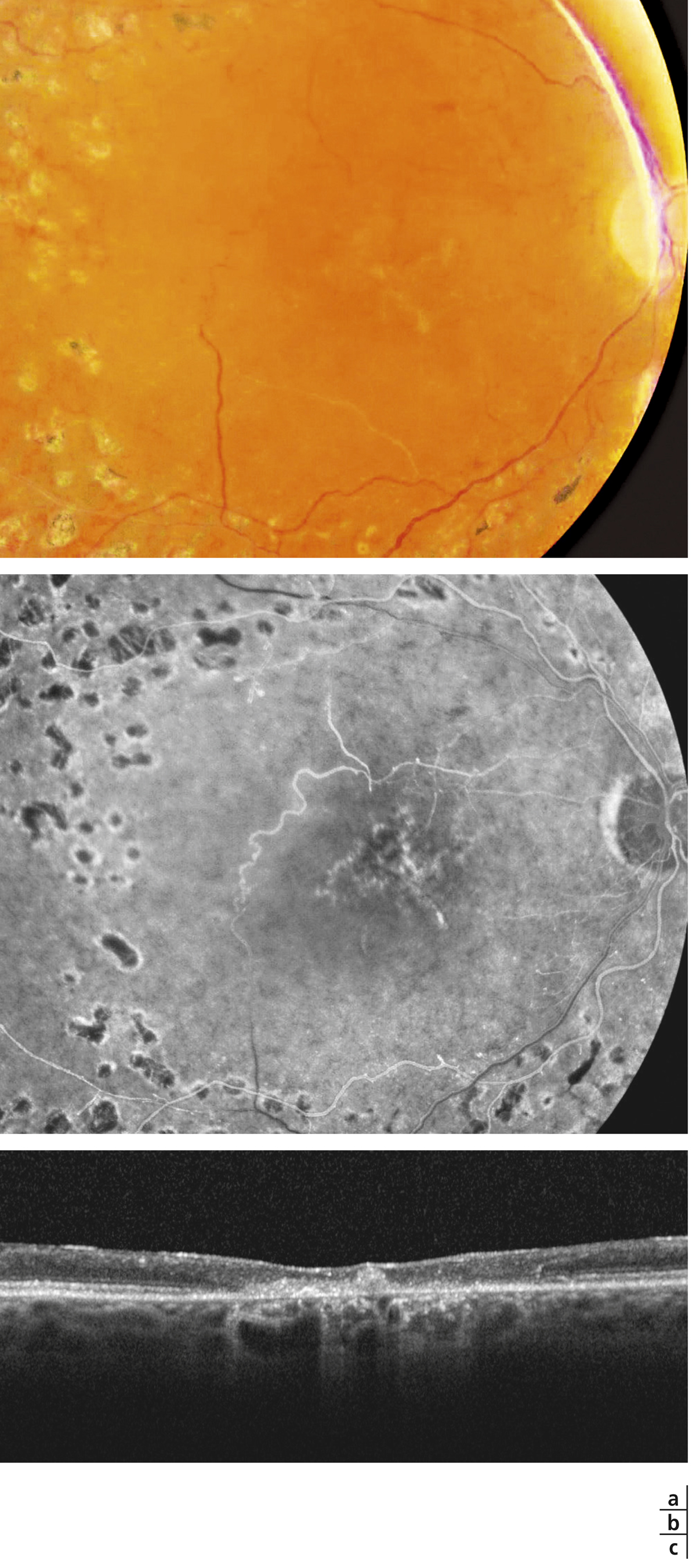
Fig. 9-29 Évolution tardive d’un OMV au cours d’une OVCR ischémique.
Des remaniements pigmentaires spontanés sont visibles sur la rétinophotographie et l’angiographie (a, b). Sur l’OCT, la rétine est atrophique et son architecture est totalement remaniée (c).
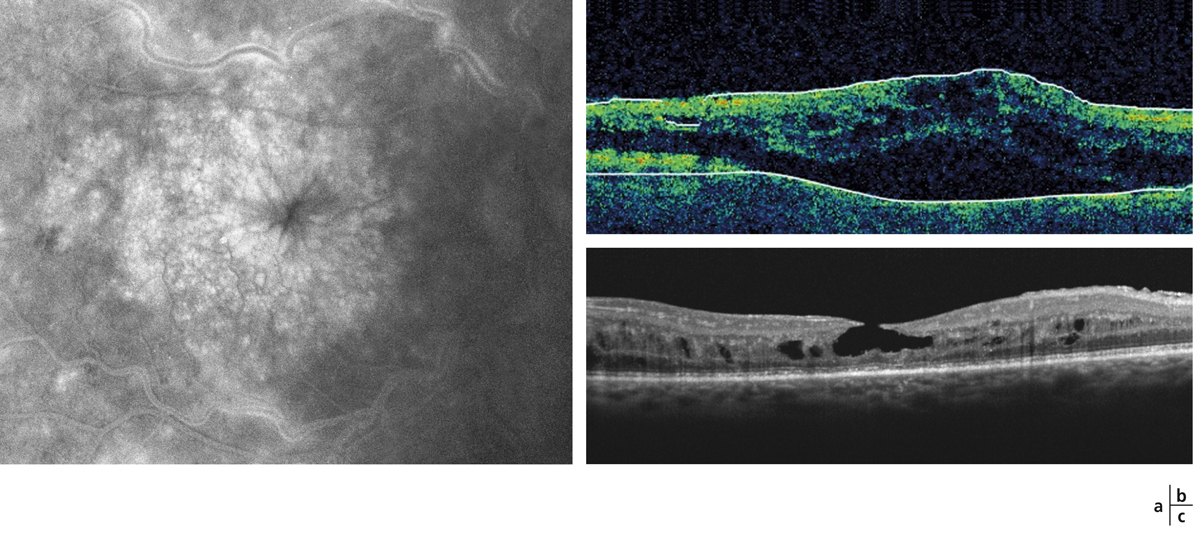
Fig. 9-30 Trou lamellaire (c) survenue plusieurs années après une OVCR compliquée d’OMV persistant (a, b).
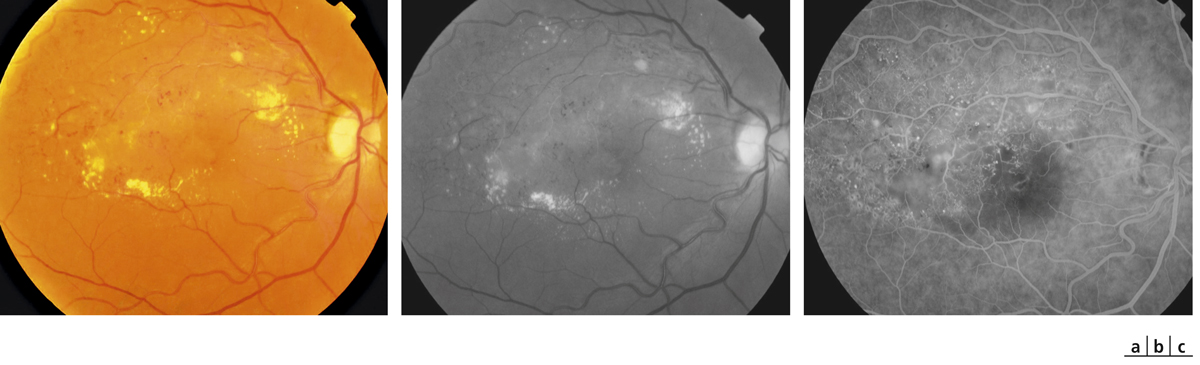
Fig. 9-31 Décollement exsudatif compliquant une OBV de type mixte.
Une couronne d’exsudats lipidiques est bien visible sur le cliché couleur (a), les dilatations micro-anévrismales sont facilement visualisées sur le cliché vert (b) et sur l’angiographie (c).
[1] Coscas G, Dhermy P. Occlusions veineuses rétiniennes. Rapport de la Société française d’ophtalmologie. Paris : Masson ; 1978.
[2] Glacet-Bernard A, Coscas G, Paques M, Pournaras CJ. Occlusions veineuses rétiniennes. Rapport annuel des Sociétés d’ophtalmologie de France. Paris : Lamy ; 2011, 324 p.
[3] Natural history and clinical management of central retinal vein occlusion. The Central Vein Occlusion Study Group. Arch Ophthalmol 1997 ; 115 : 486-91.
[4] Glacet-Bernard A, les Jardins GL, Lasry S, et al. Obstructive sleep apnea among patients with retinal vein occlusion. Arch Ophthalmol 2010 ; 128 : 1533-8.
[5] Paques M, Massin P, Sahel JA, et al. Circadian fluctuations of macular edema in patients with morning vision blurring : correlation with arterial pressure and effect of light deprivation. Invest Ophthalmol Vis Sci 2005 ; 46 : 4707-11.
[6] Paques M, Girmens JF, Riviere E, Sahel J. Dilation of the minor arterial circle of the iris preceding rubeosis iridis during retinal vein occlusion. Am J Ophthalmol 2004 ; 138 : 1083-6.
[7] Browning DJ. Patchy ischemic retinal whitening in acute central retinal vein occlusion. Ophthalmology 2002 ; 109 : 2154-9.
[8] Paques M, Gaudric A. Perivenular macular whitening during acute central retinal vein occlusion. Arch Ophthalmol 2003 ; 121 : 1488-91.
[9] Hayreh SS, Zimmerman MB. Fundus changes in central retinal vein occlusion. Retina 2015 ; 35 : 29-42.
[10] Hayreh SS, Podhajsky PA, Zimmerman MB. Natural history of visual outcome in central retinal vein occlusion. Ophthalmology 2011 ; 118 : 119-133.e1-2.
[11] Hayreh SS, Hayreh MS. Hemi-central retinal vein occlusion. Pathogenesis, clinical features, and natural history. Arch Ophthalmol 1980 ; 98 : 1600-9.
[12] Hayreh SS, Zimmerman MB. Fundus changes in branch retinal vein occlusion. Retina 2015 ; 35 : 1016-27.
[13] Hayreh SS, Podhajsky PA, Zimmerman MB. Branch retinal artery occlusion : natural history of visual outcome. Ophthalmology 2009 ; 116 : 1188-94.e1-4.
[14] Finkelstein D. Ischemic macular edema. Recognition and favorable natural history in branch vein occlusion. Arch Ophthalmol 1992 ; 110 : 1427-34.
[15] Hayreh SS. Classification of central retinal vein occlusion. Ophthalmology 1983 ; 90 : 458-74.
[16] Glacet-Bernard A, Coscas G, Chabanel A, et al. Prognostic factors for retinal vein occlusion : prospective study of 175 cases. Ophthalmology 1996 ; 103 : 551-60.
[17] Martinet V, Guigui B, Glacet-Bernard A, et al. Macular edema in retinal vein occlusion: correlation study between optical coherence tomography, fluorescein angiography and visual acuity. Int Ophthalmol 2012 ; 32 : 369-77.
[18] Evaluation of grid pattern photocoagulation for macular edema in central vein occlusion. The Central Vein Occlusion Study Group M report. Ophthalmology 1995 ; 102 : 1425-33.
[19] Weinberg D, Jampol LM, Schatz H, Brady KD. Exudative retinal detachment following central and hemicentral retinal vein occlusions. Arch Ophthalmol 1990 ; 108 : 271-5.
[20] Ravalico G, Battaglia Parodi M. Exudative retinal detachment subsequent to retinal vein occlusion. Ophthalmologica 1992 ; 205 : 77-82.
J. Leid
Les dyschromatopsies acquises (DA) rencontrées dans les œdèmes maculaires des thromboses veineuses ont peu de particularité si ce n’est leur habituelle gravité liée à l’importance de ces œdèmes et leur difficulté de diagnostic précis étant donné la faiblesse fréquente de l’acuité visuelle. On retiendra l’intérêt des tests saturés (Panel D15 standard) pour mieux différencier les composantes de ces DA majeures peu lisibles aux tests désaturés.
C’est cependant surtout l’évolution des DA chez les malades traités par injection intravitréenne (IVT) d’anti-VEGF qui a retenu notre attention. Tout comme pour les œdèmes diabétiques traités de la même façon, on observe une grande variabilité des DA au fur et à mesure des injections avec une réactivité très rapide de la vision des couleurs.
Contrairement au diabète, on trouve moins souvent des axes rouge-vert associés aux axes bleu-jaune de type III. Ces derniers prédominent largement. Par contre l’amélioration clinique et anatomique de ces œdèmes traités par IVT et leur stabilisation se traduit volontiers par l’apparition d’axes scotopiques qui semblent signer la bonne maîtrise de l’œdème, au moins à moyen terme, le recul étant insuffisant pour se prononcer sur un futur plus lointain.
Ce mode d’évolution des DA chez les patients œdémateux traités par anti-VEGF, qu’ils soient diabétiques ou porteurs de thromboses veineuses, est à prendre en considération dans la compréhension des mécanismes d’action de ces traitements. Il préfigure probablement une amélioration dont le prix à payer est une forme d’atrophie partielle de certaines cellules rétiniennes.
À titre d’exemple voici le cas de Monsieur R.S., né en 1943, porteur d’une thrombose veineuse séquellaire, ancienne et non datée. Le diagnostic d’œdème maculaire post-thrombose a été porté lors d’un bilan pour glaucome sévère méconnu et cataracte chez ce patient qui savait que l’acuité de cet œil gauche était moins bonne depuis longtemps mais ne s’en préoccupait pas (fig. 9-32). La chirurgie de la cataracte clôturée par une IVT de ranibizumab a transformé la situation, permettant de récupérer 8/10 avec une restitution du profil fovéolaire au prix de deux injections seulement. La vision des couleurs qui était peu altérée antérieurement en dépit de l’œdème et d’une acuité de 6/10 a évolué vers une DA de type III puis vers un axe scotopique avec 8/10 malgré une atrophie rétinienne partielle (fig. 9-33).
Ainsi l’étude de la vision des couleurs mérite-t-elle d’entrer dans les critères décisionnels pour les éventuelles réinjections.
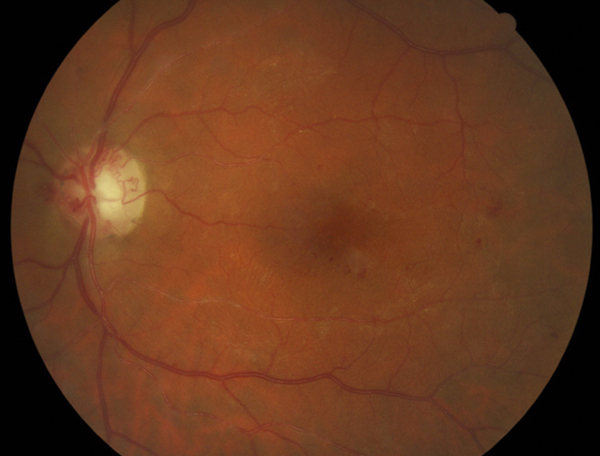
Fig. 9-32 Aspect du pôle postérieur en rétinographie.
On remarquera les shunts sur la papille, les engainements artériels et les micro-hémorragies temporomaculaires.
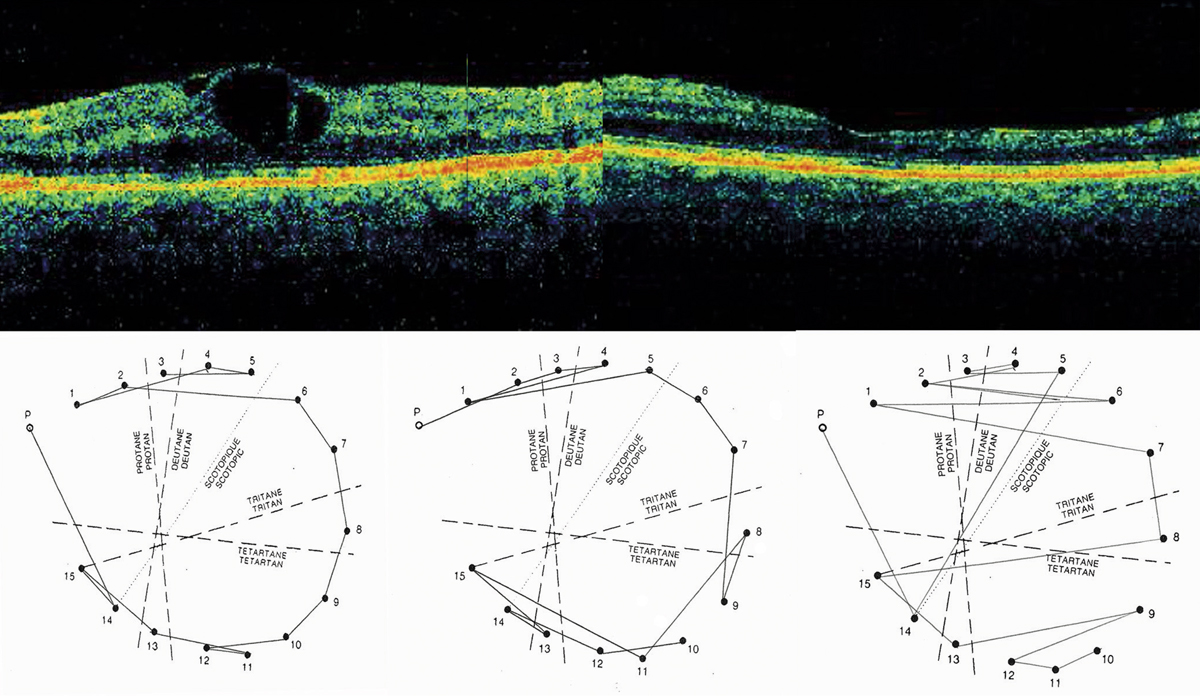
Fig. 9-33 Traitement par anti-VEGF.
Évolution favorable de l’OCT mais avec diminution de l’épaisseur rétinienne. Parallèlement le D15 désaturé passe d’une DA très modérée malgré l’œdème à un axe tritan et scotopique une fois l’œdème stabilisé.
A. Glacet-Bernard
➤ À l’heure des nouvelles explorations non invasives, l’angiographie à la fluorescéine reste le seul examen qui visualise directement les vaisseaux rétiniens de la macula jusqu’à la périphérie de la rétine et analyse la dynamique du remplissage des vaisseaux par la fluorescéine.
➤ De nouveaux angiographes à ultra-grand champ rationalisent l’examen en permettant l’exploration de la périphérie rétinienne jusqu’à 102 ou 200° en un seul cliché.
➤ Avec ces nouveaux appareils à ultra-grand champ, les territoires de non-perfusion rétinienne sont mieux visualisés. L’ischémie rétinienne est détectée beaucoup plus souvent avec ces nouvelles explorations qu’avec les angiographes classiques, et une corrélation entre la surface de non-perfusion, l’acuité visuelle et l’œdème maculaire a pu être démontrée. De nombreuses études sont en cours et ces nouvelles explorations peuvent changer la prise en charge des occlusions veineuses.
À l’heure où de nouvelles explorations dites « non invasives » sont devenues indispensables pour l’évaluation des pathologies de la rétine, l’angiographie à la fluorescéine, qui a connu ses heures de gloire dans les années 1970 [1, 2], reste un examen essentiel pour analyser et suivre toutes les pathologies vasculaires rétiniennes et, en particulier, les OVR. C’est le seul examen qui visualise directement les vaisseaux rétiniens de la macula jusqu’à la périphérie de la rétine, analyse la dynamique du remplissage des vaisseaux par la fluorescéine, met en évidence les conséquences de l’occlusion vasculaire sur le lit capillaire maculaire et périphérique et, à plus long terme, objective le remodelage vasculaire ainsi que les circulations de suppléance. L’angiographie constitue donc le « gold standard » pour poser le diagnostic précis d’occlusion veineuse basé sur le retard de remplissage veineux, apprécier le pronostic en mesurant la surface des territoires de non-perfusion et surveiller l’évolution de la perfusion rétinienne [3].
L’angiographie reste une technique d’actualité avec le développement de nouveaux appareils à ultra-grand champ d’exploration, qui rationalise l’examen et amène à redéfinir de nouveaux paramètres comme l’index ischémique.
Le cliché en couleur apporte immédiatement des informations importantes sur la topographie, l’abondance et le type des hémorragies, la turgescence et les tortuosités des veines rétiniennes et le caractère foncé, désaturé du sang veineux (fig. 9-34a). Il faut préférer un grand champ (50–60°) prenant à la fois la papille et la macula pour bien différencier par exemple les OBV des formes hémicentrales. Si la rétinophotographie couleur permet de faire souvent le diagnostic, il ne faut pas négliger l’apport des rétinophotographies monochromatiques.
Le cliché en lumière verte (anérythre ou red free) apportera un contraste maximum pour l’analyse des vaisseaux et des hémorragies (couleur complémentaire du vert, fig. 9-34b). Il est aussi utile pour mettre en évidence, par contraste, les aspects fugaces de blanc périveinulaire.
Le cliché en lumière bleue (ou blue reflectance) analyse particulièrement, grâce à ses courtes longueurs d’onde, les modifications de la surface rétinienne et du pigment xanthophylle : logettes d’œdème maculaire cystoïde, nodules cotonneux, aspect de blanc périveinulaire, développement d’une membrane épirétinienne, déficit dans la couche des fibres optiques, paroi fibrosée d’un macro-anévrisme, etc. (fig. 9-34c).
Le cliché en lumière rouge, comme le cliché en infrarouge (fig. 9-34d-f), donne une bonne visualisation du pigment. C’est également le cas du cliché en autofluorescence qui donne des informations sur l’épithélium pigmentaire. Il permet de repérer facilement les cicatrices de laser qui apparaissent hypo-autofluorescentes, de même que les plages d’atrophie maculaire au stade ultime de l’OMV.
Fig. 9-34 Occlusion de la veine centrale.
Clichés couleur en lumière blanche (a) et monochromatiques : vert ou anérythre (b), bleue (c), rouge (d), infrarouge (e) et en autofluorescence (f). Le temps artériel (g) et le retour veineux laminaire (h) permettent de calculer le temps de transit artérioveineux. Au temps tardif (i), les logettes d’OMV sont bien visibles, associées à une coloration de la paroi des gros troncs veineux du pôle postérieur.
L’angiographie objective le retard du remplissage veineux, dès le stade initial de la maladie. La gêne à la circulation de retour entraîne une dilatation veineuse et un ralentissement du flux sanguin, particulièrement bien analysable en vidéo-angiographie [4]. Un retard artériel modéré accompagne souvent le retard veineux. Celui-ci est quantifié par la mesure du temps de transit artérioveineux, défini comme la différence entre le temps de début du remplissage artériel et le temps veineux laminaire où le colorant commence à dessiner les contours de la lumière veineuse sous forme de deux rails parallèles (fig. 9-34g et h). Un temps de transit artérioveineux normal est inférieur à 5 secondes.
Dans les formes d’OVCR associée à une occlusion d’une artère ciliorétinienne, le ralentissement majeur du remplissage artériel dans le secteur ciliorétinien est décelable au tout début du remplissage vasculaire, à ne pas manquer sur les temps précoces de l’angiographie (fig. 9-35). L’origine de l’artère ciliorétinienne est bien visible sur le bord de la papille à partir duquel elle part en hameçon [5]. Dans d’autres situations [6], le remplissage artériel peut être ralenti de manière transitoire mais extrême, comme c’est le cas des formes avec blanc périveinulaire [6, 7]. Une pulsatilité du remplissage veineux peut aussi être observée à ce stade, témoignant de l’élévation de la pression veineuse.
Aux temps tardifs, une imprégnation de la paroi des gros troncs veineux du pôle postérieur est souvent visible, sans phénomène de diffusion. Cette coloration des parois veineuses témoigne de la souffrance pariétale secondaire à la distension des vaisseaux et se distingue d’une vascularite par son aspect global, homogène et non segmentaire.
La capillaropathie œdémateuse est observée quand l’ensemble du lit capillaire rétinien et des veinules est dilaté avec présence d’une diffusion de colorant aux temps tardifs. La papille est également hyperhémiée et œdémateuse dans les OVCR (fig. 9-34i). La coloration des logettes aux temps tardifs est caractéristique de l’OMV.
La capillaropathie ischémique se définit par la présence de territoires, plus ou moins étendus, de non-perfusion du lit capillaire. Au pôle postérieur, la rupture de l’arcade anastomotique périfovéolaire est particulièrement bien identifiable à l’examen angiographique avec un champ compris entre 30 et 60°. En périphérie, l’arbre artériel paraît grêle et irrégulier, avec parfois un aspect en « arbre mort », avec des spicules hérissant les artérioles et montrant l’interruption brutale de la circulation sanguine (fig. 9-36). Une hyperfluorescence des parois vasculaires avec phénomène de diffusion plus ou moins intense peut être visible en périphérie rétinienne et évoque une souffrance hypoxique de la rétine au stade aigu, alors que les territoires de non-perfusion ne sont pas (encore) visibles (fig. 9-37) [8]. Lorsque ces diffusions sont importantes, elles gênent l’examen du lit capillaire qui peut paraître par contraste anormalement sombre, et faire poser à tort un diagnostic d’ischémie rétinienne.
Généralement, l’ischémie rétinienne commence par l’extrême périphérie (fig. 9-38) et progresse vers le centre, avec typiquement un triangle temporal à sommet postérieur (en raison du trajet plus long des vaisseaux temporaux). Il est donc indispensable de réaliser des clichés périphériques avec quatre à huit champs. Toutefois, l’ischémie n’est pas seulement périphérique mais peut concerner aussi la macula, avec rupture de l’arcade et élargissement plus ou moins grand de la zone avasculaire centrale. C’est la maculopathie ischémique, de pronostic sévère, atteignant préférentiellement les patients âgés et hypertendus.
En fait, l’angiographie montre que l’un des deux mécanismes, œdème ou ischémie, peut être prédominant, mais qu’ils sont presque toujours associés et intriqués et se modifient au cours de l’évolution et sous l’effet des traitements.
Fig. 9-35 OVCR associée à une occlusion artérielle ciliorétinienne.
Sur les clichés verts (a), le territoire de l’artère ciliorétinienne apparaît blanchâtre, ischémique, avec une macula partiellement rouge cerise. Le temps très précoce de l’angiographie met en évidence l’artère ciliorétinienne qui démarre en hameçon sur le bord temporal de la papille (b : flèche).
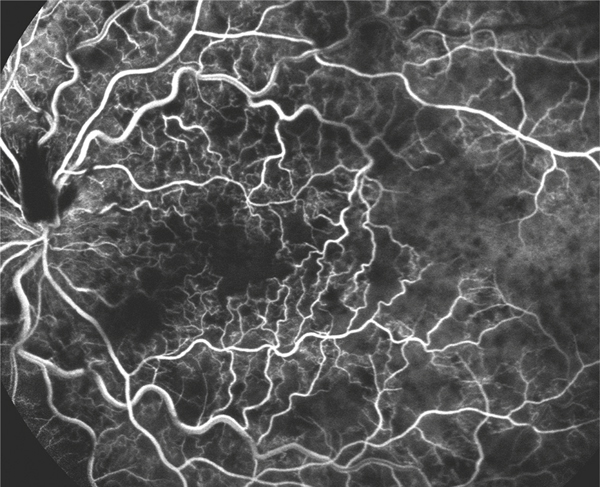
Fig. 9-36 Forme ischémique sévère.
Désertification du lit capillaire, retard circulatoire majeur, aspects en arbre mort.
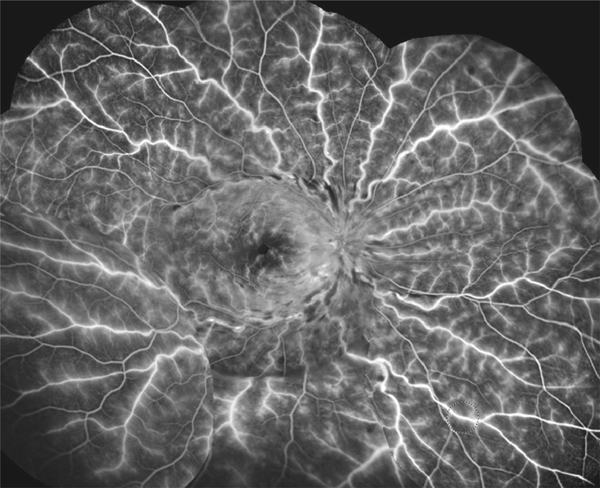
Fig. 9-37 Phénomène de diffusion important au cours d’une OVCR récente concernant tous les vaisseaux jusqu’en périphérie.
Il n’existe pas à ce stade de territoire de non-perfusion.
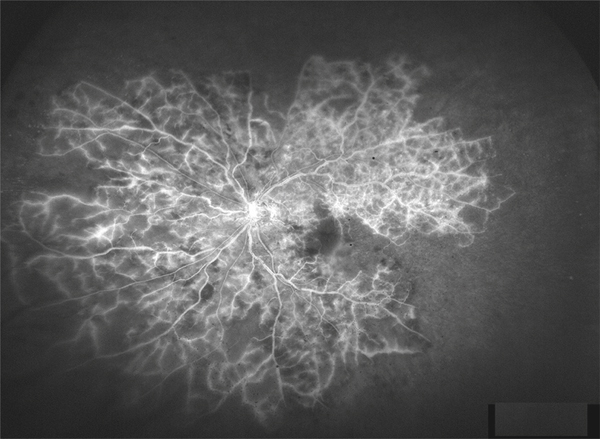
Fig. 9-38 Conversion d’une OVCR ; l’ischémie apparaît souvent en temporal.
(Source : image Optos® de la collection du Pr John Conrath.)
Une circulation collatérale ou de suppléance plus ou moins efficace se met en place progressivement, donnant une dilatation de certains rameaux capillaires de pontages ou de shunts veinoveineux. Dans les OBV, ces anastomoses « haut–bas » sont bien visibles sur le raphé horizontal et de part et d’autre du site de l’occlusion où des vaisseaux de pontage peuvent apparaître (voir fig. 9-28) [9].
Dans les OVCR, des boucles veineuses prépapillaires peuvent se développer après quelques semaines ou mois et peuvent permettre parfois un diagnostic rétrospectif (voir fig. 9-27). Des dilatations micro- ou macro-anévrismales peuvent apparaître, souvent associées aux territoires de non-perfusion du lit capillaire. Ces circulations de suppléance et ces micro-anévrismes peuvent être responsables d’un œdème maculaire persistant.
Après plusieurs mois, la macula peut être le siège de remaniements accentués de l’épithélium pigmentaire, sous forme d’une plage centrale hyperfluorescente, par effet fenêtre, sans diffusion, avec parfois quelques amas de pigment (voir fig. 9-29). La survenue d’une néovascularisation prérétinienne ou prépapillaire est facilement mise en évidence par l’angiographie, car les néovaisseaux sont responsables d’une diffusion précoce et abondante de colorant.
Si le choix est possible, préférer un large champ englobant la papille et la macula ; les angiographes classiques offrent un champ de 30 à 60°, à préférer au grossissement sur la région maculaire donné par les scannings laser ophtalmoscopes qui ont un champ de 10 ou 30°, donnant une bonne image de la maille capillaire périfovéolaire mais supprimant les informations de remplissage vasculaire à la papille et l’examen de la périphérie rétinienne.
Au cours de l’exploration des OVR, les premières secondes du remplissage des vaisseaux rétiniens (et aussi choroïdiens) apportent des informations très utiles, et il est très important de connaître le temps artériel et le temps veineux laminaire pour apprécier la dynamique du remplissage vasculaire. Cette dynamique du remplissage vasculaire rétinien est observée au mieux au niveau de la papille. L’enregistrement en vidéo-angiographie de ces premières secondes de l’angiographie, obtenu avec de nombreux appareils actuellement, peut apporter une meilleure évaluation et objectiver le caractère pulsatile du remplissage veineux.
En plus des habituels clichés précoces et tardifs centrés sur la macula, visant à étudier respectivement la maille capillaire périfovéolaire et les phénomènes de diffusion et de coloration des logettes d’OM, les clichés périphériques sont indispensables à une bonne évaluation angiographique de toute OVR ; les huit champs périphériques sont utiles même si la méthodologie de certaines études internationales ne demande que cinq champs avec un angiographe de 45° [10]. Ils renseignent sur d’éventuels territoires non perfusés qui commencent généralement par les zones périphériques. Ces clichés doivent être réalisés assez tôt juste après la phase de remplissage artérioveineux et être confrontés avec des clichés tardifs, où les diffusions d’une néovascularisation prérétinienne à la bordure des territoires non perfusés seront plus faciles à repérer. Une image composite (ou montage) peut être obtenue pour assembler le champ central et les champs périphériques sur la même vue (fig. 9-39).
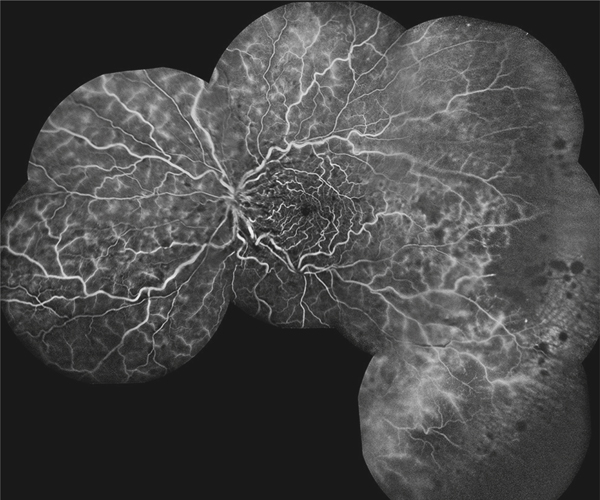
Fig. 9-39 Montage (image composite) créé de manière semi-automatique à partir d’une angiographie classique de champ 55°, superposant un champ central et huit champs périphériques.
L’angiographie avec un « grand champ » peut se révéler particulièrement utile pour l’examen de la périphérie, comme la lentille grand angle du scanning laser ophtalmoloscope (Spectralis®, Heidelberg, Allemagne) donnant un champ de 102°, ou encore l’ultra-grand champ allant jusqu’à 200°, soit environ 82 % de la totalité de la rétine en un seul cliché (Optos® Optomap panoramic P200Tx, Dunfermline, Écosse) [11]. En étendant les limites d’exploration jusqu’à la périphérie rétinienne, ces techniques permettent une amélioration de la détection des zones ischémiques (fig. 9-40 et 9-41). La surface analysée a été calculée et serait multipliée par 2,8 par rapport à l’exploration classique avec cinq champs qui donne globalement après montage un champ d’exploration de 75° [12].
Prasad a démontré pour la première fois que l’exploration de l’extrême périphérie rétinienne dans les OBV et les OVHC par angiographie ultra-grand champ (Optos® PLC, Dunfermline, Écosse) permettait de retrouver des territoires non perfusés en avant de l’équateur, avec une corrélation entre la présence d’une non-perfusion non traitée par photocoagulation et la présence d’un OMV (p = 0,007) et de néovascularisations (p = 0,033) [8].
Spaide a observé la présence de territoires non perfusés dans toutes les OVCR étudiées de manière rétrospective, même celles qui auraient été classées en forme bien perfusée selon les critères de la Central Vein Occlusion Study ou CVOS (moins de 10 surfaces papillaires soit 25,4 mm2) [13]. Toutes les OVCR étudiées étaient en cours de traitement par ranibizumab. Dans les formes bien perfusées au sens de la CVOS, la surface moyenne d’ischémie était de 277 mm2, alors qu’elle était de 369 mm2 dans les formes ischémiques de la CVOS (sur les 1108 mm2 que représente la rétine), cette différence n’était cependant pas statistiquement significative. La surface de non-perfusion était inversement corrélée à l’acuité visuelle (p = 0,013).
L’exploration plus complète de la périphérie rétinienne rend plus précise l’évaluation de l’index ischémique, proposé en 1982 par Magargal [14]. Le rapport de la surface de rétine non perfusée sur la surface totale mesurée sur Optos® donne le pourcentage d’ischémie rétinienne qui permet d’apprécier la sévérité de l’OVR et le risque de néovascularisation. Singer a montré qu’un index ischémique plus élevé était corrélé à un OMV plus volumineux, une moins bonne acuité visuelle et un risque de récidive de l’OMV après traitement [15]. Le suivi de l’évolution montrait parfois une régression de la surface des territoires non perfusés en périphérie. Dans les OVCR, Tsui a montré que le risque de néovascularisation survient avec un index ischémique mesuré sur Optos® de 45 % [16], ce qui reste assez proche finalement de celui de 50 % proposé il y a 30 ans par Magargal avec les systèmes d’angiographie classiques.
Cependant, l’utilisation de ces appareils peut avoir des limites. Si dans les OBV, les territoires ischémiques sont facilement identifiés en comparaison au lit capillaire sain adjacent, il n’en est pas de même pour les OVCR, où des phénomènes de diffusion à partir des parois vasculaires peuvent gêner l’interprétation de la perfusion de la rétine périphérique. L’élargissement du champ d’examen diminue en partie la définition de lit capillaire maculaire qui devient moins clairement analysable, cependant l’examen de la macula reste néanmoins possible [16]. La distorsion de la périphérie rétinienne qui est aplanie donc élargie pour être représentée sur un planisphère demande un traitement d’image supplémentaire pour être convertie en surface rétinienne [13, 17]. Avec l’angiographe ultra-grand champ (Optos®), seule une image à la fin de la phase de remplissage artérioveineux est prise, ce qui ne permet pas d’analyser la dynamique des temps précoces du remplissage vasculaire.
En conclusion, l’angiographie reste le meilleur moyen d’analyser les désordres liés aux OVR, en apportant des informations sur l’atteinte de la dynamique circulatoire, le retentissement sur le lit capillaire, le remodelage du lit vasculaire et la formation d’une circulation collatérale. Avec les nouveaux appareils permettant l’analyse en ultra-grand champ allant jusqu’à 200°, l’analyse de la périphérie rétinienne est plus complète et plus précise. Le lien entre OMV et non-perfusion rétinienne périphérique est retrouvé, confirmant le caractère VEGF-dépendant de cette pathologie. Ces nouvelles techniques d’imagerie sont l’objet de nombreuses études en cours, qui vont peut-être modifier la prise en charge des OVR dans le futur [18].
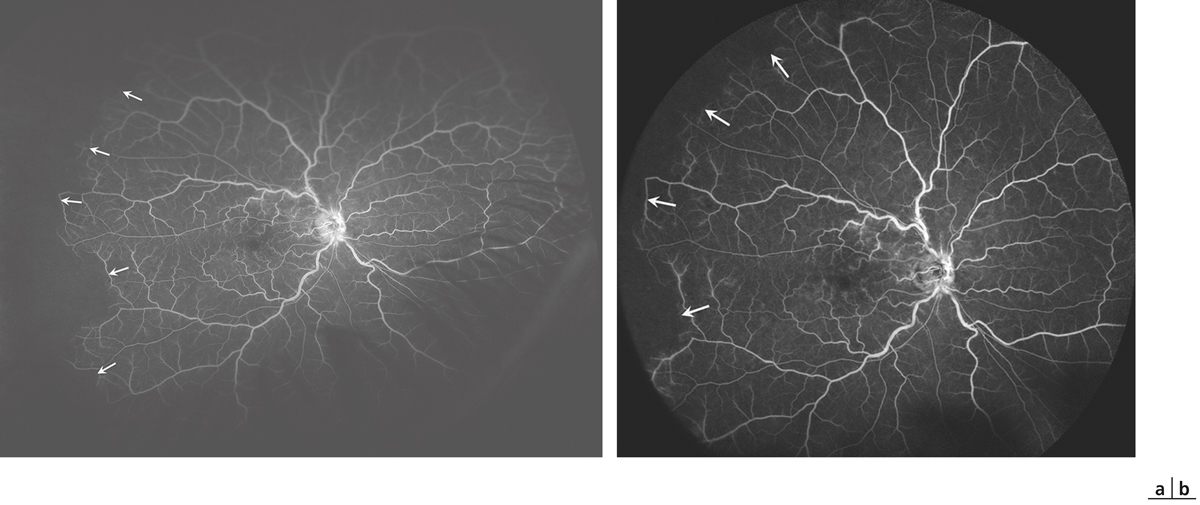
Fig. 9-40 Angiographie en ultra-grand champ d’une OVCR à l’aide d’Optos® explorant jusqu’à 200° (a) et du Spectralis® avec la lentille de 102° (b).
On distingue bien une couronne non perfusée en extrême périphérie (délimitée par les flèches).
(Source : images de la collection du Pr Carl Arndt.)
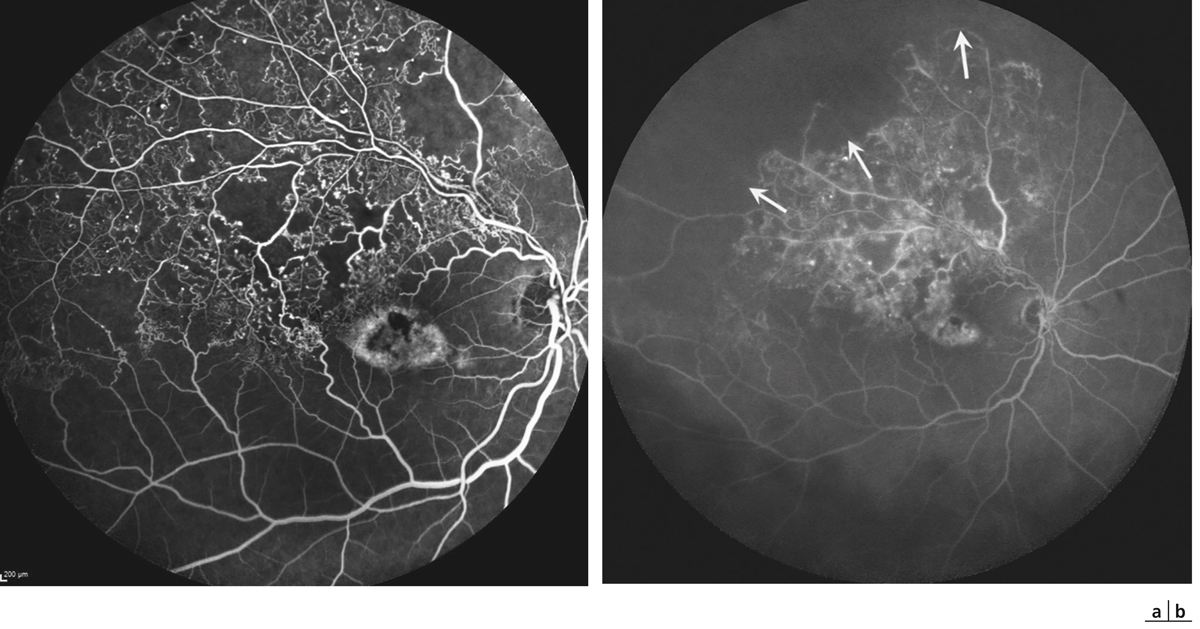
Fig. 9-41 Comparaison d’un champ classique de 55° et d’un ultra-grand champ de 102° dans une OBV.
Une zone d’ischémie intense sans aucun vaisseau est mise en évidence en extrême périphérie (délimitée par les flèches), non vue par le champ d’exploration classique.
[1] Laatikainen L, Kohner EM. Fluorescein angiography and its prognostic significance in central retinal vein occlusion. Br J Ophthalmol 1976 ; 60 : 411-8.
[2] Coscas G, Dhermy P. Occlusions veineuses rétiniennes. Rapport de la Société française d’ophtalmologie. Paris : Masson ; 1978.
[3] Glacet-Bernard A, Coscas G, Paques M, Pournaras CJ. Occlusions veineuses rétiniennes. Rapport annuel des Sociétés d’ophtalmologie de France. Lamy ; 2011, 324 p.
[4] Paques M, Naoun K, Garmyn V, et al. Conséquences circulatoires des occlusions veineuses rétiniennes : intérêt de l’angiographie dynamique. J Fr Ophtalmol 2002 ; 25 : 898-902.
[5] Glacet-Bernard A, Gaudric A, Touboul C, Coscas G. Occlusion de la veine centrale de la rétine avec occlusion d’une artère cilio-rétinienne. À propos de 7 cas. J Fr Ophtalmol 1987 ; 10 : 269-77.
[6] Browning DJ. Patchy ischemic retinal whitening in acute central retinal vein occlusion. Ophthalmology 2002 ; 109 : 2154-9.
[7] Paques M, Gaudric A. Perivenular macular whitening during acute central retinal vein occlusion. Arch Ophthalmol 2003 ; 121 : 1488-91.
[8] Prasad PS, Oliver SC, Coffee RE, et al. Ultra wide-field angiographic characteristics of branch retinal and hemicentral retinal vein occlusion. Ophthalmology 2010 ; 117 : 780-4.
[9] Jaulim A, Ahmed B, Khanam T, Chatziralli IP. Branch retinal vein occlusion : epidemiology, pathogenesis, risk factors, clinical features, diagnosis, and complications. An update of the literature. Retina 2013 ; 33 : 901-10.
[10] Central vein occlusion study of photocoagulation therapy. Baseline findings. Central Vein Occlusion Study Group. Online J Curr Clin Trials 1993 ; Doc No 95 : [6021 words ; 6081 paragraphs].
[11] Witmer MT, Parlitsis G, Patel S, Kiss S. Comparison of ultra-widefield fluorescein angiography with the Heidelberg Spectralis((R)) noncontact ultra-widefield module versus the Optos® Optomap®. Clin Ophthalmol 2013 ; 7 : 389-94.
[12] Parlitsis GJ, Aaker GD, Wessel MM, et al. Ultra-widefield angiography improves the detection and classification of retinal vascular occlusions. Invest Ophthalmol Vis Sci (ARVO) 2010 : abstract#287.
[13] Spaide RF. Peripheral areas of nonperfusion in treated central retinal vein occlusion as imaged by wide-field fluorescein angiography. Retina 2011 ; 31 : 829-37.
[14] Magargal LE, Donoso LA, Sanborn GE. Retinal ischemia and risk of neovascularization following central retinal vein obstruction. Ophthalmology 1982 ; 89 : 1241-5.
[15] Singer M, Tan CS, Bell D, Sadda SR. Area of peripheral retinal nonperfusion and treatment response in branch and central retinal vein occlusion. Retina 2014 ; 34 : 1736-42.
[16] Tsui I, Franco-Cardenas V, Hubschman JP, et al. Ultra wide field fluorescein angiography can detect macular pathology in central retinal vein occlusion. Ophthalmic Surg Lasers Imaging 2012 ; 43 : 257-62.
[17] Sagong M, van Hemert J, Olmos de Koo LC, et al. Assessment of accuracy and precision of quantification of ultra-widefield images. Ophthalmology 2015 ; 122 : 864-6.
[18] Patel M, Kiss S. Ultra-wide-field fluorescein angiography in retinal disease. Curr Opin Ophthalmol 2014 ; 25 : 213-20.
S. Nghiem-Buffet
➤ L’OCT est devenu un examen incontournable dans le diagnostic, la description, la quantification et le suivi de l’OM des OVR.
➤ S’il n’apporte généralement pas d’aide au diagnostic de l’occlusion veineuse proprement dit, certains signes comme l’épaississement électif de la couche de Henlé sont pathognomoniques d’un stade très précoce d’OVR.
➤ Certains signes peuvent orienter vers une atteinte artérielle associée qui peut influencer le pronostic : hyperreflectivité de la couche nucléaire interne ou encore de la limitante moyenne.
➤ Sur le long terme, l’OCT aide à détecter des lésions qui peuvent influencer le pronostic visuel : altération de la zone ellipsoïde, remaniement de l’épithélium pigmentaire, atrophie rétinienne, développement d’une membrane épimaculaire, etc.
La tomographie en cohérence optique (OCT) est devenue un examen incontournable dans le diagnostic et le suivi des occlusions veineuses rétiniennes (OVR). Cette technique d’examen non invasive permet d’apprécier les différentes microstructures tissulaires de la rétine et de mesurer l’épaisseur rétinienne [1]. Les OVR sont marquées par un ralentissement circulatoire bien visible à l’angiographie à la fluorescéine et l’OCT va apprécier les retentissements de ce trouble hémodynamique sur la rétine centrale en visualisant l’exsudation et l’œdème rétinien mais aussi les conséquences de la non-perfusion et de l’ischémie rétinienne.
Le spectral-domain optical coherence tomography (SD-OCT) s’est largement développé ces dernières années apportant une amélioration de la résolution des images et de leur qualité. Les mesures de l’épaisseur rétinienne deviennent plus précises et reproductibles permettant une meilleure quantification pour un suivi évolutif plus fiable, particulièrement utile dans l’évaluation des traitements des OVR.
L’œdème maculaire (OM) correspond à une accumulation de fluide dans la rétine centrale entraînant un épaississement rétinien (fig. 9-42). Cette accumulation de fluide peut être intracellulaire ou extracellulaire et est souvent associée à une accumulation de fluide sous la rétine entraînant un décollement séreux rétinien (DSR) [2].
Dans les formes débutantes, on observe initialement un épaississement de la rétine externe au niveau de la couche nucléaire externe et qui précède la formation des logettes cystoïdes (fig. 9-43). Cette atteinte initiale des couches externes de la rétine semble être caractéristique du stade aigu des OVR [3]. Cette localisation s’expliquerait par le retentissement initial de l’hyperpression veineuse sur le réseau vasculaire profond, au niveau des veinules post-capillaires situées dans la plexiforme externe. L’œdème va ensuite rapidement s’étendre à toute l’épaisseur de la rétine gagnant les couches internes de la rétine (fig. 9-44 et 9-45). Très rapidement, des logettes cystoïdes de petite taille apparaissent (micrologettes des formes précoces).
Au niveau anatomopathologique, l’œdème des OVR se constitue dans la couche des fibres de Henlé qui correspond à la couche plexiforme externe et en OCT à une partie de la couche nucléaire externe [4]. Le caractère distensif de la couche des fibres de Henlé qui sont particulièrement longues dans la zone centromaculaire explique probablement la localisation préférentielle du fluide dans cette partie de la rétine centrale.
L’œdème maculaire cystoïde (OMC) est ainsi caractérisé par un épaississement rétinien dans lequel s’accumulent des espaces arrondis optiquement vides (logettes ou pseudo-kystes), à contenu liquidien, hyporéflectifs en OCT. Les logettes cystoïdes prédominent dans la région fovéale où elles peuvent être d’emblée de grosse taille, séparées par les piliers des cellules de Müller [5]. Adjacentes à la fovéa, et au fur et à mesure de l’évolution de l’OVR, de plus petites logettes sont souvent vues dans les couches nucléaire interne et plexiforme externe. Dans la région extrafovéolaire, de petites logettes cystoïdes peuvent être présentes dans toutes les autres couches de la rétine, comme la couche des fibres nerveuses, la couche des cellules ganglionnaires, la couche plexiforme interne et la couche nucléaire externe [5]. Avec le temps, les grosses logettes cystoïdes centrales peuvent fusionner par effondrement des piliers des cellules de Müller. L’OCT en face permet de réaliser des coupes coronales qui montrent l’extension en surface des logettes de l’OMC (fig. 9-46).
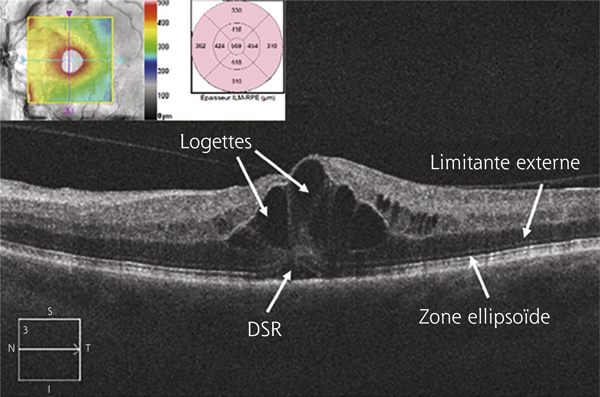
Fig. 9-42 Œdème maculaire cystoïde en SD-OCT.
Œdème maculaire cystoïde dans une occlusion de la veine centrale de la rétine récente. Coupe horizontale montrant les grosses logettes centrales et les micrologettes paracentrales. Le décollement séreux est de petite taille. La limitante externe et la zone ellipsoïde semblent intègres.
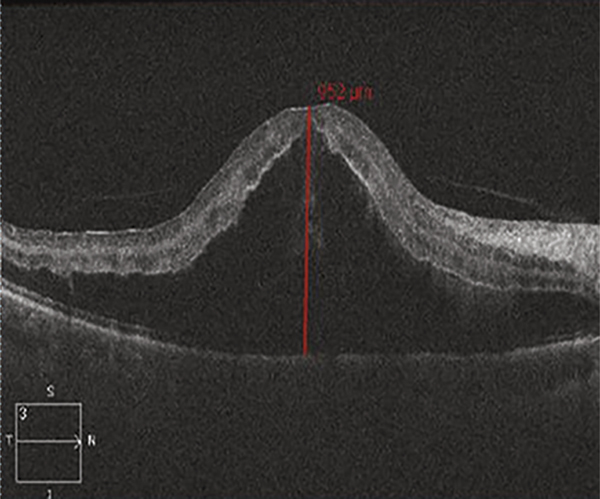
Fig. 9-43 Œdème maculaire dans une forme précoce et sévère d’occlusion de la veine centrale de la rétine.
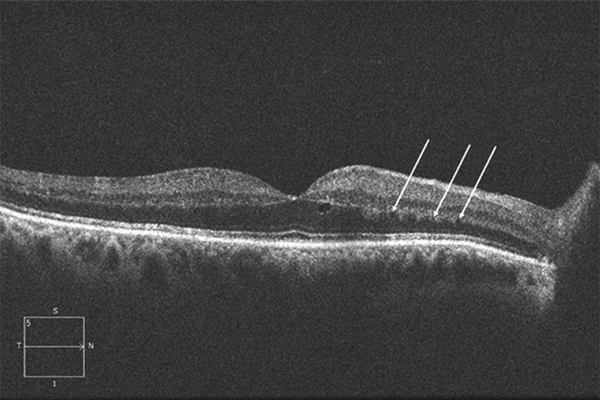
Fig. 9-44 Forme débutante d’œdème maculaire dans une occlusion de la veine centrale de la rétine récente avec micrologettes au niveau de la couche plexiforme externe (flèches).
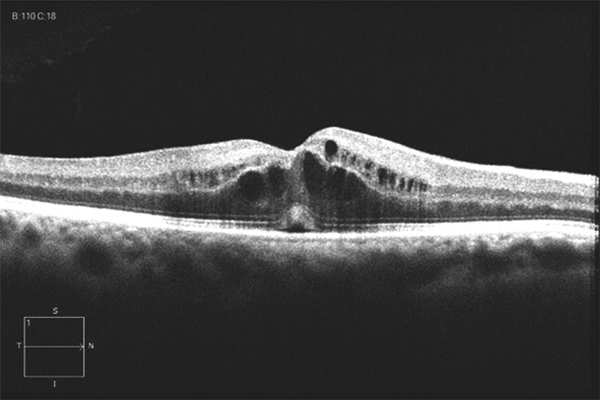
Fig. 9-45 Patient de la figure 9-44 après 3 semaines d’évolution : extension progressive des logettes à l’ensemble de la rétine et apparition d’un microdécollement séreux rétinien.
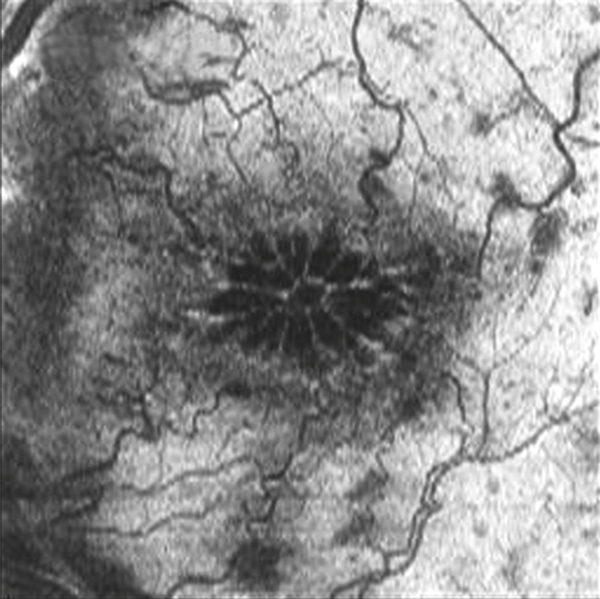
Fig. 9-46 Œdème maculaire cystoïde en OCT « en face ».
Le DSR est très souvent associé à l’OM des OVR. Il correspond à une accumulation de fluide sous la rétine. Sur l’OCT, le DSR apparaît comme un espace hyporéflectif rétrofovéolaire, situé entre la rétine neurosensorielle et l’épithélium pigmenté (voir fig. 9-42). Il est souvent présent dans les formes initiales des OVR et est alors localisé, de petite taille et souvent triangulaire (voir fig. 9-45). Dans les formes plus sévères, l’OMC peut être plus marqué et le DSR devient plus volumineux et s’étend à l’ensemble de la région fovéolaire (fig. 9-47).
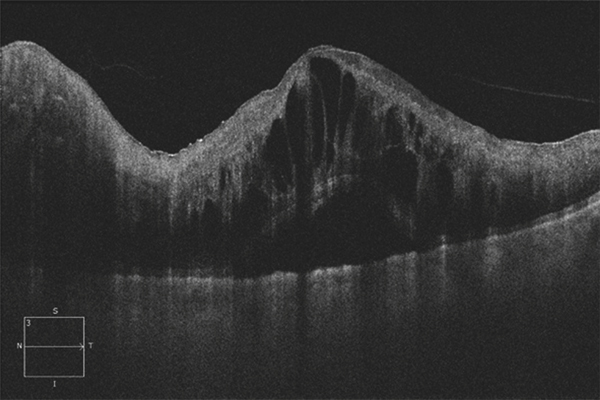
Fig. 9-47 Occlusion de la veine centrale de la rétine avec œdème maculaire important et décollement séreux rétinien étendu.
L’amélioration de la définition du SD-OCT permet de mieux visualiser les couches profondes de la rétine neurosensorielle et d’analyser la qualité des photorécepteurs même en présence d’un OM s’il n’est pas trop important. L’analyse de la membrane limitante externe et de la ligne de jonction des segments externes et internes des photorécepteurs (IS/OS ou zone ellipsoïde) apporte un facteur pronostique à l’OM de l’OVR (voir fig. 9-42). Ainsi, l’intégrité de ces lignes en SD-OCT est un élément de bon pronostic des OVR. En revanche, le pronostic est plus sombre lorsque sont observées des interruptions de ces lignes dans leur partie rétrofovéolaire au SD-OCT [6–9]. Lorsque l’œdème est important, il peut être difficile d’apprécier l’intégrité de ces structures même en SD-OCT. Dans ces conditions, c’est l’assèchement de la rétine (le plus souvent par l’effet des traitements), qui va permettre de les visualiser (fig. 9-48).
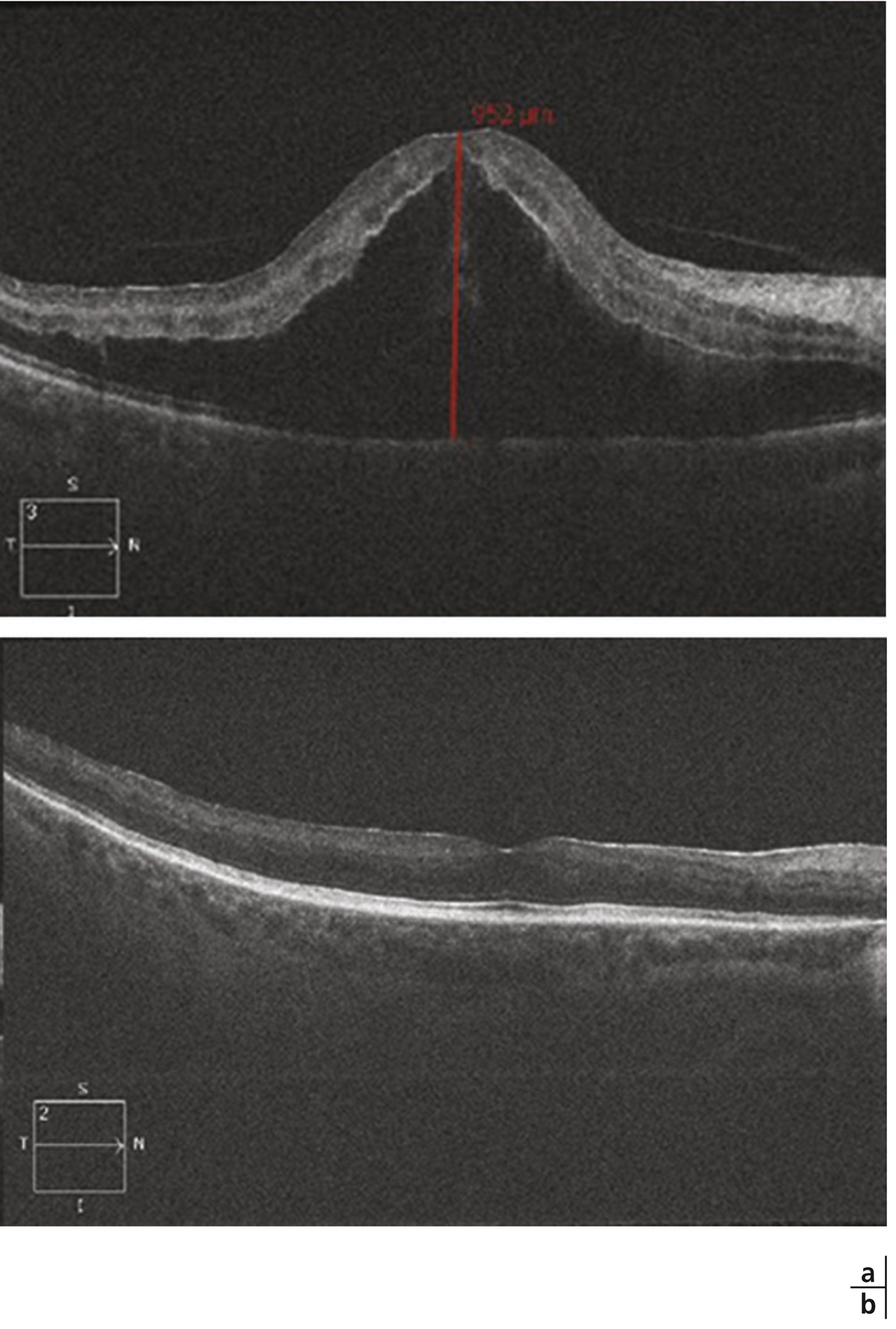
Fig. 9-48 Occlusion de la veine centrale de la rétine avec important œdème maculaire.
Coupe OCT. a. Avant traitement, la limitante externe et la zone ellipsoïde ne sont pas visibles sur l’OCT en raison de l’épaississement rétinien mesuré à 952 µm. b. Après traitement, l’assèchement de la rétine permet d’apprécier la conservation de la limitante externe et de la zone ellipsoïde.
De petits points hyperréflectifs sont souvent visibles grâce aux SD-OCT. Ils peuvent être présents dès la phase aiguë de l’OVR. Ils sont très fins, adjacents aux espaces cystoïdes et à l’accumulation du fluide, mais peuvent être aussi disséminés dans toutes les couches de la rétine atteignant aussi les couches internes.
Ces petits points hyperréflectifs correspondraient à des cellules inflammatoires, cellules microgliales et macrophages, activées par l’inflammation liée à la rupture de la barrière hémato-rétinienne [10]. Ils disparaissent après traitement de l’œdème maculaire. Leur réapparition précoce traduit le début de la récidive (fig. 9-49).
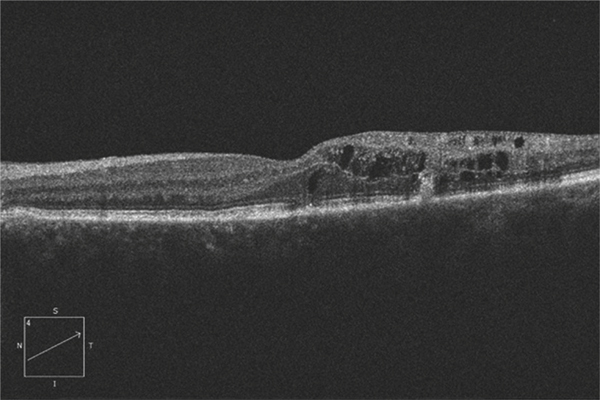
Fig. 9-49 Apparition de petits points hyperréflectifs associés à quelques micrologettes traduisant le début de la récidive de l’œdème maculaire dans une occlusion de la branche de veine rétinienne.
Les nodules cotonneux sont fréquents dans les OVR. En SD-OCT, ils apparaissent comme des zones très hyperréflectives au niveau de la rétine interne qui est épaissie (fig. 9-50). Dans les formes très ischémiques d’OVCR, les nodules cotonneux sont très nombreux et regroupés autour de la papille.
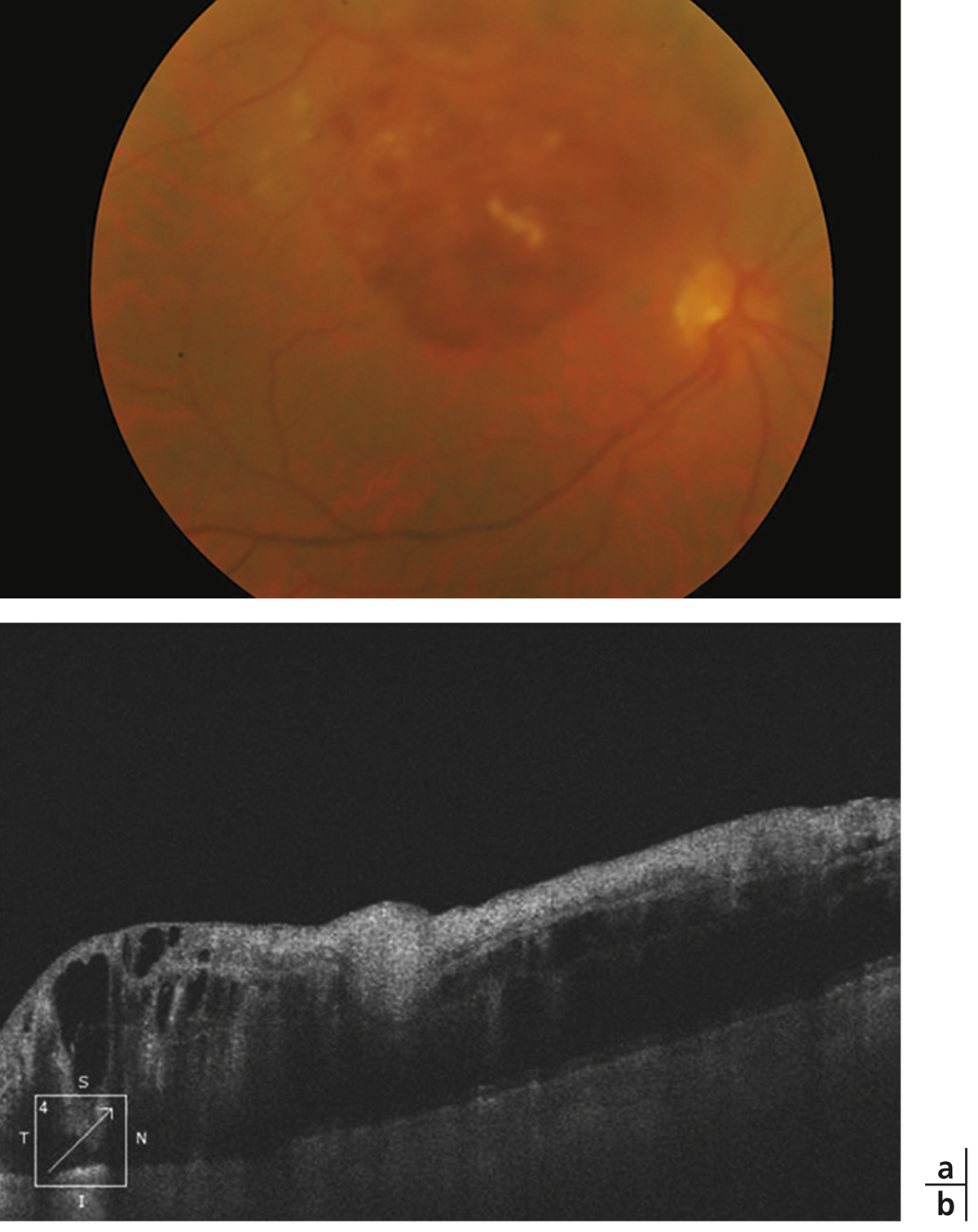
Fig. 9-50 Nodules cotonneux et hémorragies rétiniennes.
a. Occlusion de branche veineuse rétinienne avec présence d’un gros nodule cotonneux sus-maculaire au sein d’hémorragies rétiniennes. b. Coupe SD-OCT passant par le nodule cotonneux correspondant à la zone très hyperréflective centrale arrondie au niveau de la rétine interne épaissie. Les hémorragies rétiniennes sont visibles de part et d’autre du nodule cotonneux comme des zones hyperréflectives au niveau des couches internes de la rétine.
Les hémorragies rétiniennes sont visibles en SD-OCT comme des zones hyperréflectives (fig. 9-50). Elles peuvent être difficiles à voir lorsqu’elles sont très superficielles comme les hémorragies en flammèches. Lorsqu’il existe un important infarcissement hémorragique, l’épaississement de la rétine s’accompagne d’une hyperréflectivité interne correspondant à la part superficielle de l’hémorragie, rapidement relayée par une hyporéflectivité par interruption du signal.
Des exsudats lipidiques sont visibles comme de petites zones hyperréflectives à contours nets prédominant dans les couches externes de la rétine (fig. 9-51). Ils apparaissent lorsque l’œdème devient chronique ou lorsqu’il se résorbe.
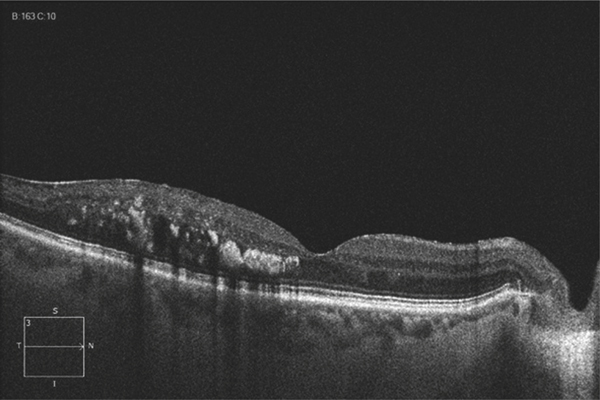
Fig. 9-51 Exsudats lipidiques dans une OBVR en SD-OCT.
Les exsudats sont visibles comme de petites zones hyperréflectives dans les couches externes de la rétine situées ici en temporal de la fovéa.
L’interface vitréorétinienne doit toujours être analysée à la recherche de tractions vitréorétiniennes ou d’une membrane épimaculaire fréquemment observée au cours de l’évolution des OVR.
Dans certaines formes d’occlusions de la veine centrale de la rétine (OVCR), il existe un ralentissement circulatoire artériel majeur responsable d’une ischémie de la rétine interne. Cette ischémie est le plus souvent transitoire et fonctionnelle, car le lit capillaire reste perfusé. Elle se traduit par un aspect blanchâtre de la rétine au pôle postérieur selon une topographie suivant l’arbre veineux donnant un aspect de « blanc périveinulaire ». Les signes d’OVCR sont peu marqués : peu d’hémorragies, discrètes dilatations des veines rétiniennes. L’angiographie à la fluorescéine montre le retard du remplissage artériel. En SD-OCT, la rétine peut être épaissie. On observe une hyperréflectivité des couches de la rétine interne correspondant à l’œdème ischémique de celle-ci (fig. 9-52) [11]. L’hyperréflectivité de la nucléaire interne semble être un signe spécifique d’ischémie du plexus rétinien capillaire intermédiaire et profond. La rétine moyenne, qui regroupe la couche nucléaire interne et la plexiforme externe, semble être une zone de « partage des eaux » qui la rend plus vulnérable à l’ischémie du plexus capillaire profond. Cette maculopathie moyenne aiguë paracentrale récemment nommée paracentral acute middle maculopathy (PAMM) a été décrite dans d’autres atteintes rétiniennes vasculaires (occlusion artérielle rétinienne ou ciliorétinienne, rétinopathie diabétique, drépanocytose, syndrome de Purtscher, etc.) [12, 13]. Dans les OVR, l’hyperréflectivité de la nucléaire interne correspond donc à une atteinte artérielle associée. L’évolution spontanée de ces formes d’OVCR est le plus souvent favorable avec un faible risque d’évolution vers un OM ou vers une forme non perfusée, même si de petits territoires de non-perfusion peuvent persister. Une atrophie maculaire peut être séquellaire de l’ischémie rétinienne prolongée et peut alors être responsable d’une baisse visuelle importante.
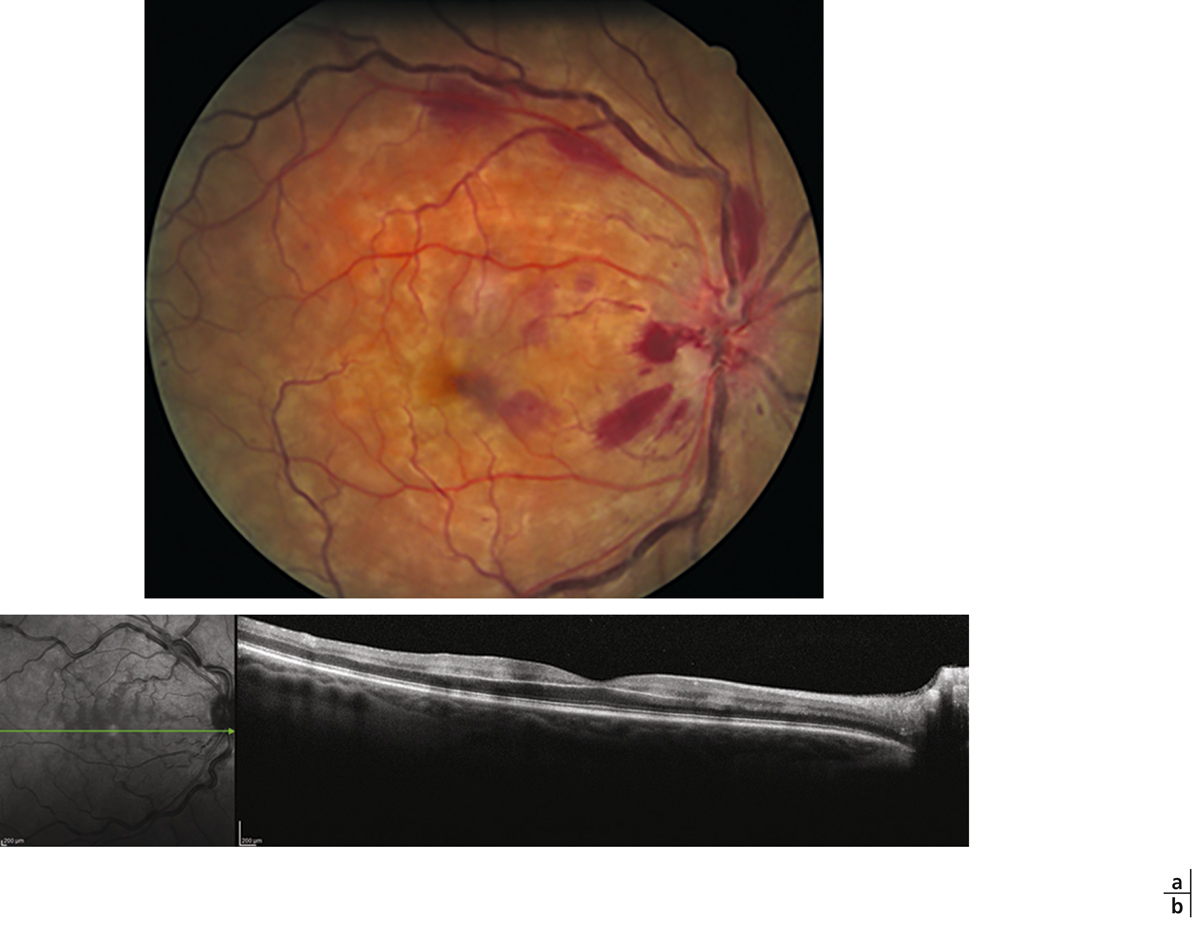
Fig. 9-52 Occlusion de la veine centrale avec blanc périveinulaire.
a. Cliché couleur : aspect blanchâtre de la rétine au pôle postérieur avec quelques hémorragies rétiniennes, dilatation modérée des veines rétiniennes et œdème papillaire. b. Sur la coupe en SD-OCT, on observe des zones d’hyperréflectivité au niveau de la couche nucléaire interne traduisant l’ischémie rétinienne, caractéristiques de la maculopathie moyenne paracentrale aiguë (PAMM).
Source : clichés dus à l’obligeance du Pr Michel Paques.
Certaines OVCR peuvent s’accompagner d’une occlusion de l’artère ciliorétinienne. Cette occlusion survient dans le contexte d’une baisse généralisée du débit sanguin rétinien secondaire à l’occlusion veineuse. En SD-OCT, coexistent un œdème diffus de la rétine et un œdème ischémique de la rétine localisée au territoire de l’artère ciliorétinienne occluse (fig. 9-53), avec en particulier l’opacification de la couche nucléaire interne (PAMM).
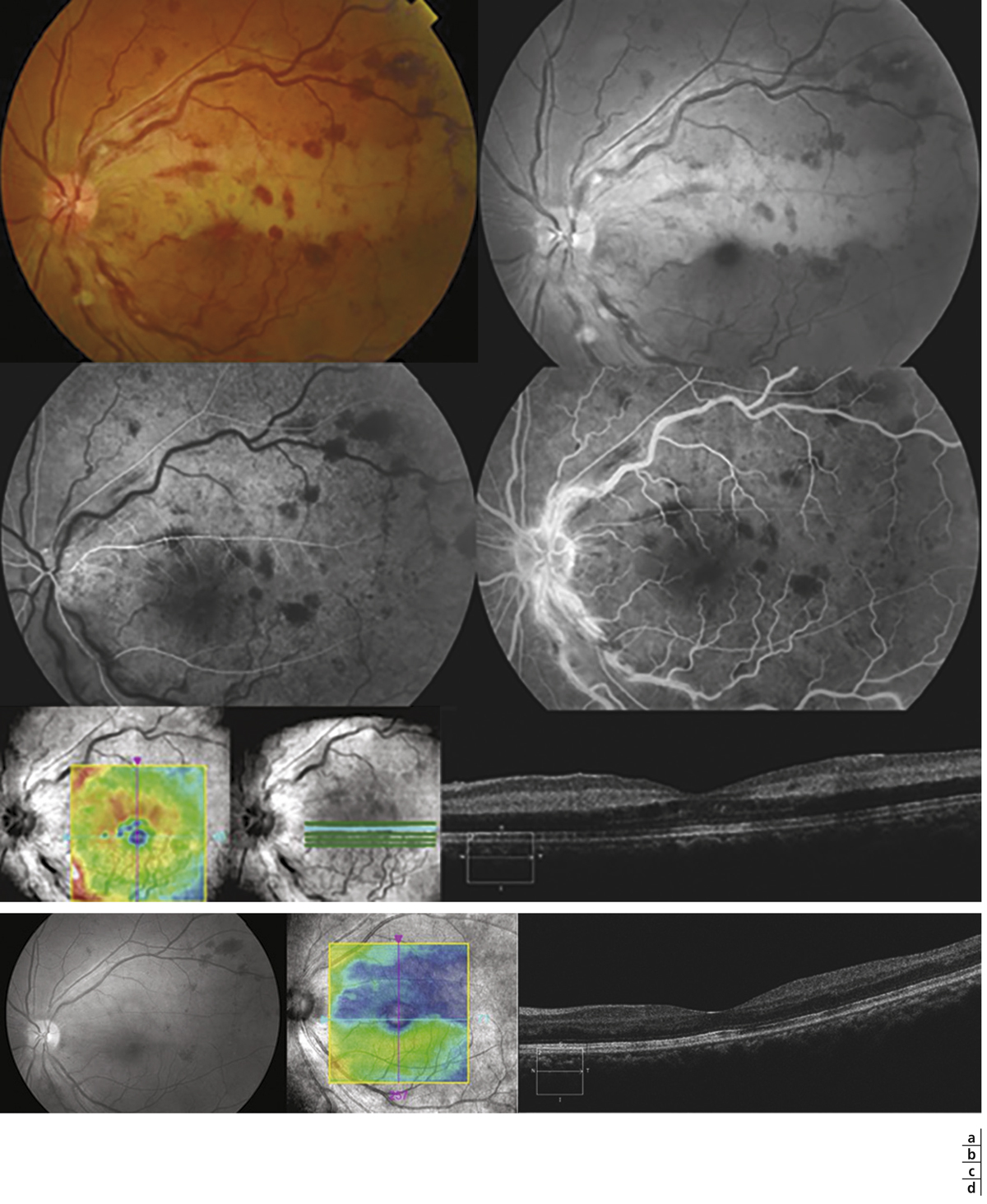
Fig. 9-53 Occlusion de la veine centrale de la rétine avec occlusion d’une artère ciliorétinienne.
a. Clichés couleur et vert avec dilatation des veines rétiniennes, rares hémorragies rétiniennes et territoire d’ischémie rétinienne correspondant à l’occlusion réactionnelle d’une artère ciliorétinienne. b. Angiographie à la fluorescéine avec clichés précoces et tardifs. c. SD-OCT coupe et cartographie montrant l’œdème rétinien ischémique dans le territoire de l’artère ciliorétinienne occluse. Les coupes de SD-OCT montrent également une hyperréflectivité de la couche nucléaire interne témoignant de l’ischémie de la rétine moyenne (PAMM). d. Trois mois plus tard, normalisation du fond d’œil avec évolution vers l’atrophie de la rétine dans le territoire de la ciliorétinienne.
Dans les formes d’OVCR les plus sévères marquées par une non-perfusion majeure, l’œdème maculaire est en général très important, ce qui corrobore le caractère VEGF-dépendant de l’œdème (fig. 9-54a et b). L’épaisseur fovéolaire (épaisseur rétinienne centrale sans le DSR) apparaît ainsi comme un élément pronostic. Sur une série de 53 yeux atteints d’OVCR, l’épaisseur fovéolaire mesurée supérieure à 700 µm était accompagnée d’une ischémie rétinienne périphérique dans 69 % des cas et l’acuité visuelle finale était inférieure ou égale à 20/200 chez 75 % de ces patients [3].
Ko et al. ont également démontré une corrélation entre l’opacification d’une ligne située dans la plexiforme externe qu’ils désignent comme la limitante moyenne (fig. 9-54c) et une acuité visuelle basse dans une série de 50 OVCR ; ces cas correspondaient souvent à des formes ischémiques. L’opacification transitoire de cette ligne, généralement observée au cours du premier mois, serait le témoin d’une ischémie maculaire aiguë [14].
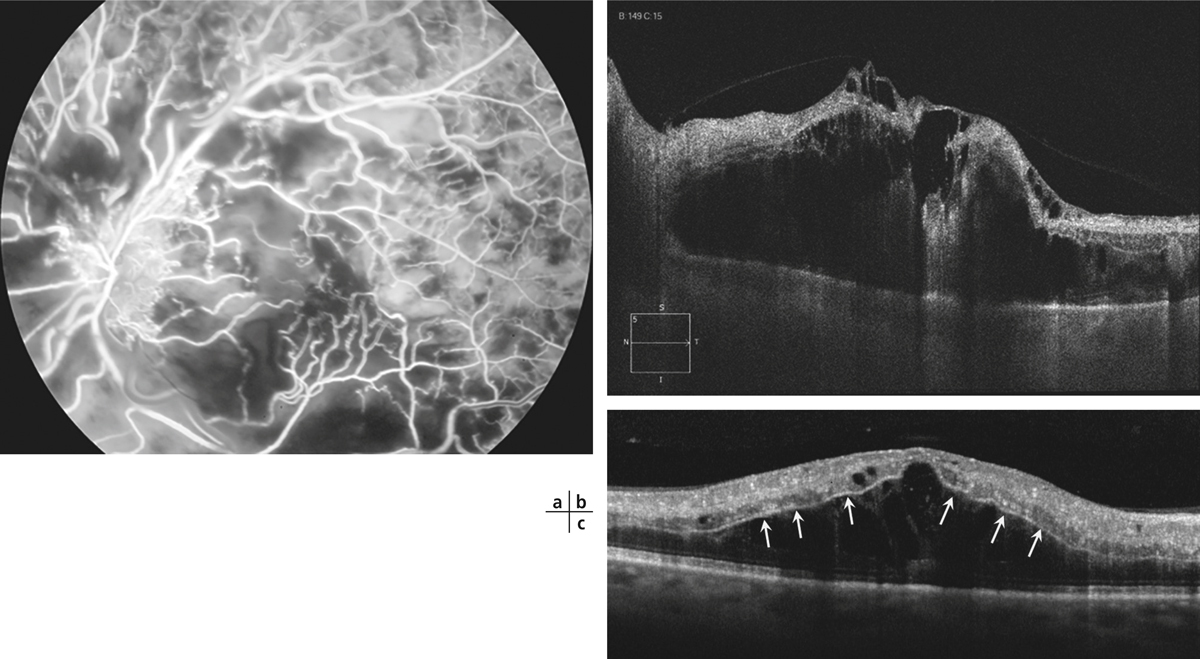
Fig. 9-54 Occlusion de la veine centrale de la rétine mal perfusée (ischémique).
a. Angiographie à la fluorescéine montrant la non-perfusion presque totale du lit capillaire. b. Œdème maculaire majeur en SD-OCT du même patient. c. Chez un autre patient, hyperréflectivité de la limitante moyenne (flèches), signe transitoire témoignant d’une souffrance ischémique maculaire aiguë selon Ko [12].
(Remerciements au Dr Agnès Glacet-Bernard.)
Dans les premiers temps, l’OM des OVCR peut être réversible et s’accompagner d’une récupération visuelle ad integrum. Lorsqu’il devient chronique, il va entraîner des dommages structurels irréversibles aboutissant à la désorganisation de l’architecture de la rétine et à la destruction des photorécepteurs. On observe ainsi une dégénérescence kystique de la macula (fig. 9-55a et b). Dans les formes les plus tardives, on peut observer une pigmentation rétrofovéolaire correspondant à une prolifération pigmentaire sous-maculaire. L’évolution peut se faire vers une atrophie de la rétine maculaire avec diminution de l’épaisseur rétinienne. Parfois, la rétine reste épaissie avec présence de pseudo-logettes hyporéflectives correspondant à des lacunes dégénératives par perte et mort cellulaires (fig. 9-55c).
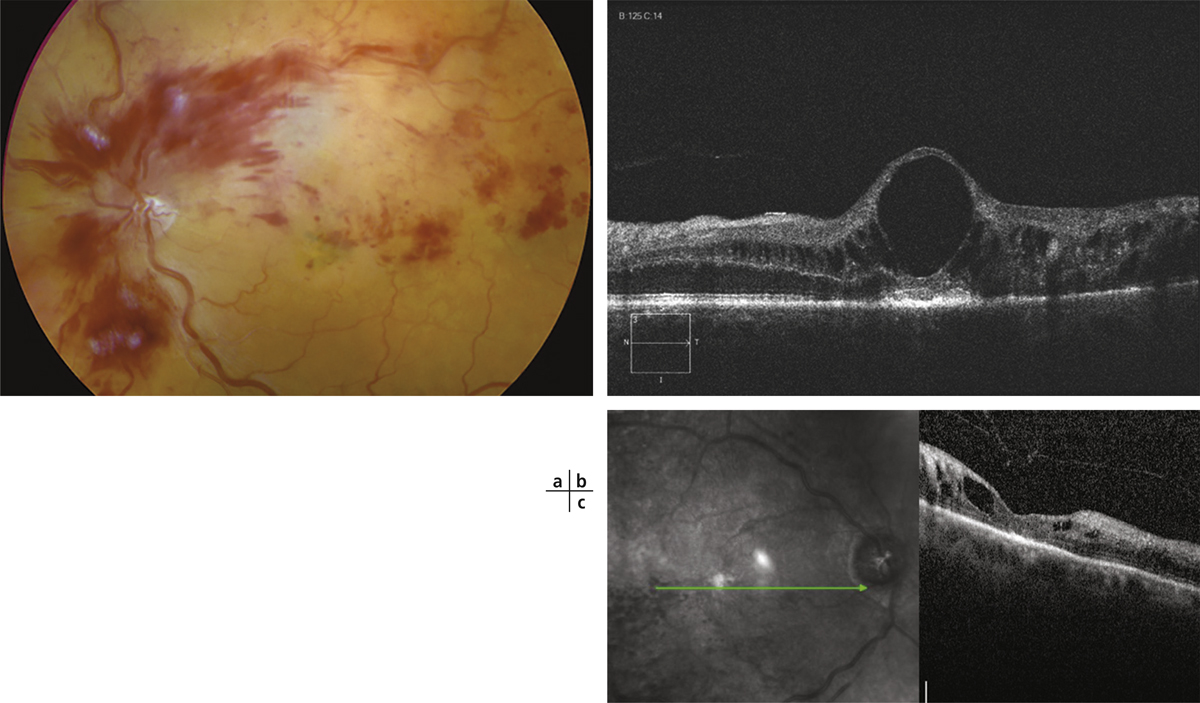
Fig. 9-55 Formes anciennes d’occlusion de la veine centrale de la rétine.
a. Cliché couleur montrant une pigmentation fovéolaire. b. SD-OCT montrant la dégénérescence kystique de la rétine avec un dépôt pigmenté hyperréflectif rétrofovéolaire. c. SD-OCT montrant un œdème maculaire chronique avec lacunes dégénératives par perte et mort cellulaires dans une occlusion de veine centrale de la rétine ancienne.
La description de l’OM des OBVR est très proche de celle des OVCR. C’est la topographie de l’œdème qui diffère en fonction du territoire de la veine rétinienne occluse.
L’œdème rétinien est localisé dans le territoire concerné par l’occlusion veineuse et peut parfois dépasser cette zone (fig. 9-56). À la phase chronique, de gros micro-anévrismes peuvent se développer sur les bordures de non-perfusion capillaire ou sur les anastomoses veinoveineuses dans le territoire de la branche veineuse occluse. Ces gros micro-anévrismes sont responsables d’une exsudation chronique qui se traduit souvent par des couronnes d’exsudats circinés. En SD-OCT, les micro-anévrismes peuvent parfois être visibles sous la forme de petites lésions arrondies hyperréflectives à contenu hyporéflectif au sein de l’œdème rétinien (fig. 9-57). L’angiographie à la fluorescéine et au vert d’indocyanine permet de mieux localiser ces ectasies vasculaires pour pouvoir guider le traitement par photocoagulation directe au laser thermique (fig. 9-58).
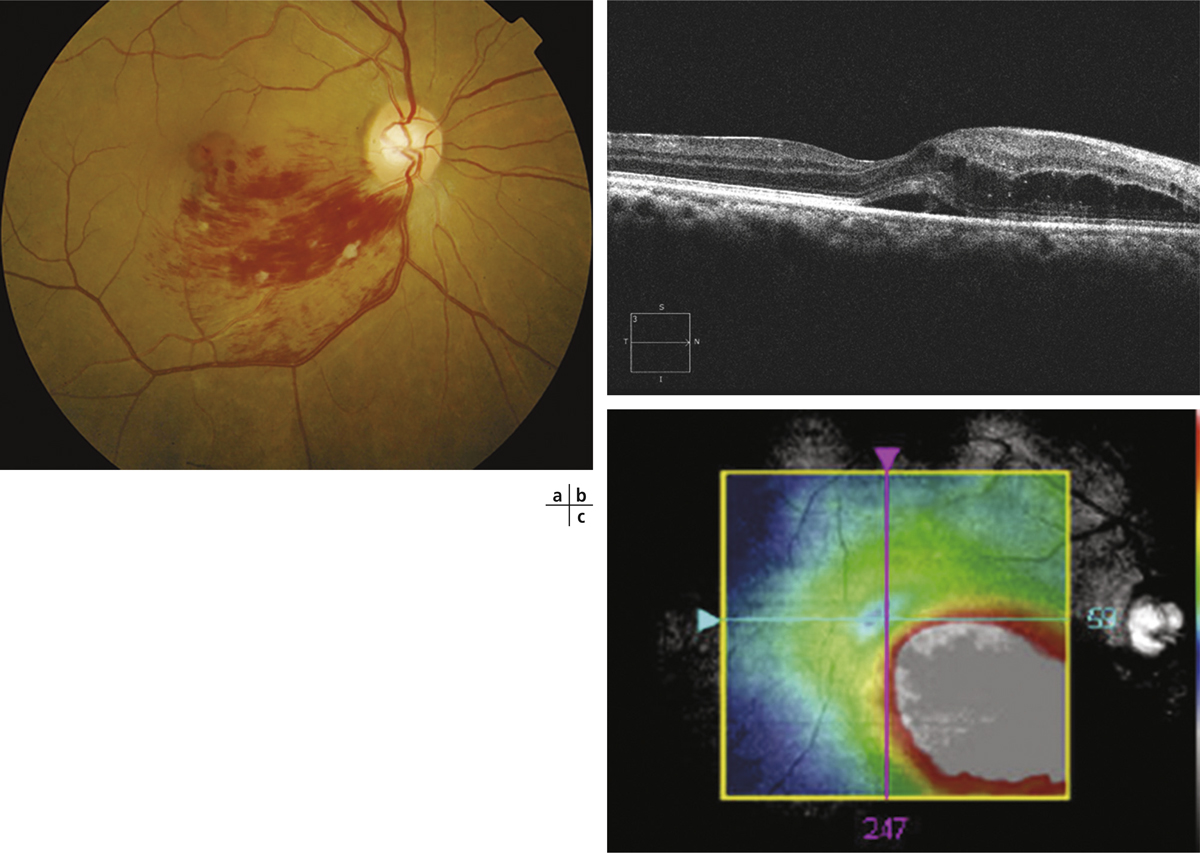
Fig. 9-56 Occlusion de branche veineuse rétinienne.
a. Cliché couleur montrant les hémorragies en flammèches, quelques nodules cotonneux dans le territoire de la branche veineuse rétinienne occluse. b. Coupe en SD-OCT montrant l’épaississement cystoïde de la rétine nasale avec un décollement séreux rétinien. c. Cartographie SD-OCT montrant la topographie de l’œdème maculaire.
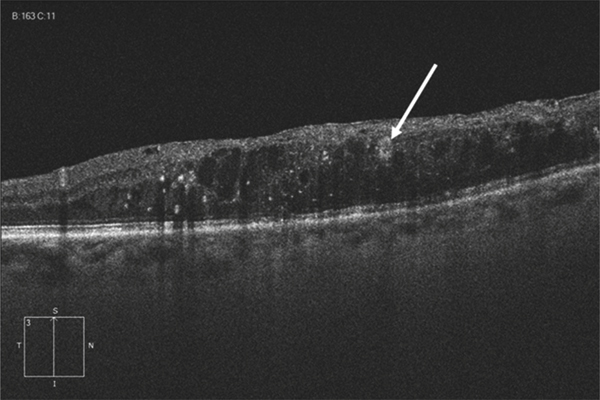
Fig. 9-57 Micro-anévrisme (flèche) en SD-OCT dans une occlusion de branche veineuse chronique.
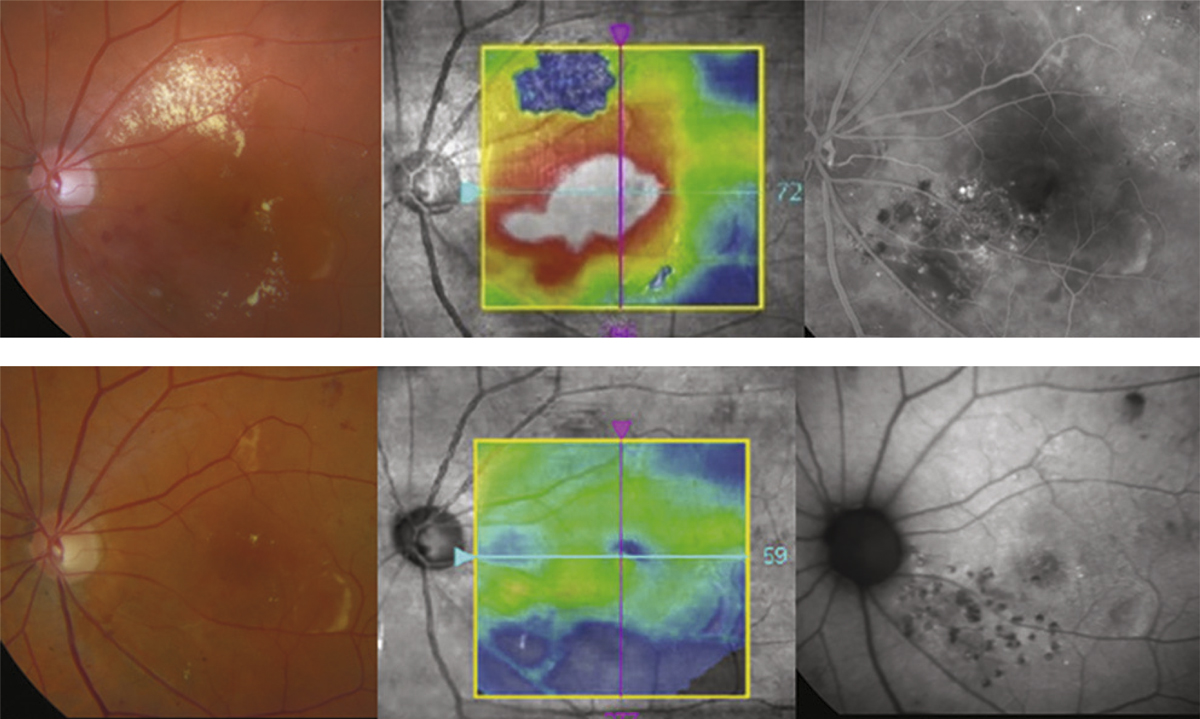
Fig. 9-58 Micro-anévrismes compliquant des circulations de suppléance dans une occlusion de branche veineuse rétinienne chronique.
a. Exsudation chronique lipidique à partir de micro-anévrismes compliquant une occlusion de branche veineuse rétinienne ancienne (cliché couleur, cartographie SD-OCT, angiographie à la fluorescéine). b. Après traitement par laser des micro-anévrismes, disparition de l’œdème maculaire (cliché couleur, cartographie SD-OCT, cliché en autofluorescence).
Les mesures automatiques de l’épaisseur rétinienne sont plus précises avec l’utilisation des SD-OCT. Elles permettent d’avoir une évaluation quantitative de l’épaisseur maculaire particulièrement utile pour le suivi et l’évolution sous traitement des OVR. L’OM est parfois trop important pour que les repérages automatiques puissent s’appliquer correctement. Les valeurs ne sont alors pas fiables et il faut réaliser des mesures manuelles à l’aide de clippers ou en déplaçant les lignes de repères.
Le suivi évolutif des OM par SD-OCT est particulièrement utile depuis l’utilisation des traitements injectables anti-VEGF et corticoïdes (fig. 9-59). Après la première injection intravitréenne, le SD-OCT va apprécier la réponse au traitement utilisé et une fois l’œdème asséché, il pourra évaluer l’intégrité de la ligne des photorécepteurs et de la limitante externe (voir fig. 9-48) [5]. Par la suite, le SD-OCT détectera les récidives de l’OM par la ré-augmentation de l’épaisseur rétinienne, la réapparition des petits points hyperréflectifs, des logettes cystoïdes et du DSR et pourra ainsi aider à la décision de retraitement [15].
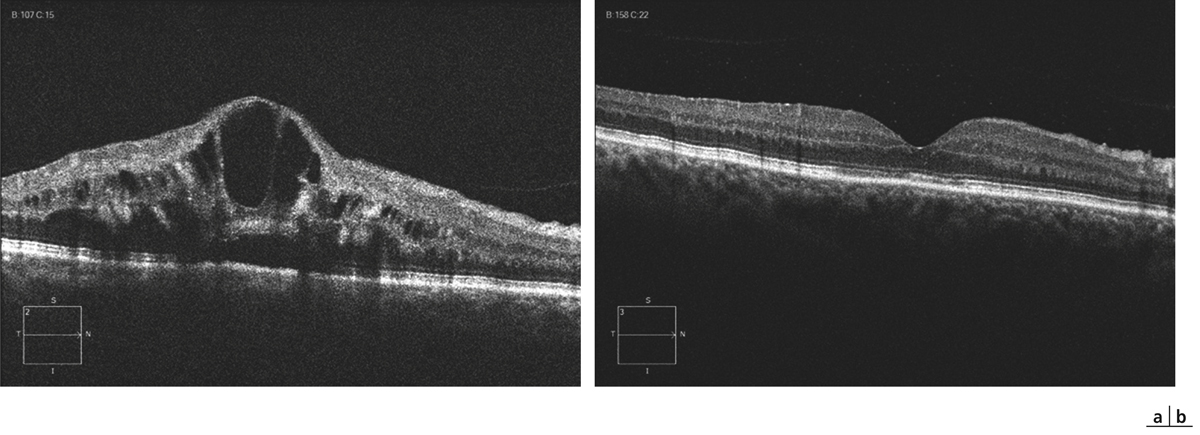
Fig. 9-59 Suivi évolutif de l’œdème maculaire d’une occlusion de la veine centrale de la rétine.
a. Avant traitement. b. Après traitement par injection intravitréenne d’anti-VEGF.
Le développement de l’OCT puis du SD-OCT toujours plus performant, plus rapide et plus fiable, a permis d’améliorer considérablement l’examen de la rétine maculaire. L’OCT est devenu un examen incontournable dans le diagnostic, la description, la quantification de l’OM des OVR. L’amélioration des mesures de l’épaisseur maculaire centrale a rendu cet examen indispensable pour l’évaluation des traitements et le suivi évolutif.
[1] Glacet-Bernard A, Coscas G, Pournaras CJ. Occlusions veineuses rétiniennes. Bull Soc Ophtalmol Fr, Rapport annuel. Éditions L-Groupe Ciel ; 2011, 324 p.
[2] Coscas G, Cunha-Vaz J, Soubrane G. Macular edema : definition and basic concepts. Dev Ophthalmol 2010 ; 47 : 1-9.
[3] Martinet V, Guigui B, Glacet-Bernard A, et al. Macular edema in central retinal vein occlusion : correlation between optical coherence tomography, angiography and visual acuity. Int Ophthalmol 2012 ; 32 : 369-77.
[4] Lujan BJ, Roorda A, Knighton RW, Carroll J. Revealing Henle’s fiber layer using spectral domain optical coherence tomography. Invest Ophthalmol Vis Sci 2011 ; 52 : 1486-92.
[5] Yamaike N, Tsujikawa A, Ota M, et al. Three-dimensional imaging of cystoid macular edema in retinal vein occlusion. Ophthalmology 2008 ; 115 : 355-62.
[6] Ota M, Tsujikawa A, Kita M, et al. Integrity of foveal photoreceptor layer in central retinal vein occlusion. Retina 2008 ; 28 : 1502-8.
[7] Ota M, Tsujikawa A, Murakami T, et al. Foveal photoreceptor layer in eyes with persistent cystoid macular edema associated with branch retinal vein occlusion. Am J Ophthalmol 2008 ; 145 : 273-80.
[8] Shin HJ, Chung H, Kim HC. Association between integrity of foveal photoreceptor layer and visual outcome in retinal vein occlusion. Acta Ophthalmol 2011 ; 89 : 35-40.
[9] Wolf-Schnurrbusch UE, Ghanem R, Rothenbuehler SP, et al. Predictors of short-term visual outcome after anti-VEGF therapy of macular edema due to central retinal vein occlusion. Invest Ophthalmol Vis Sci 2011 ; 52 : 3334-7.
[10] Coscas G, Coscas F, Zucchiatti I, et al. SD-OCT pattern of retinal venous occlusion with cystoid macular edema treated with Ozurdex®. Eur J Ophthalmol 2011 ; 21 : 631-6.
[11] Sarda V, Nakashima K, Wolff B, et al. Topography of patchy retinal whitening during acute perfused retinal vein occlusion by optical coherence tomography and adaptive optics fundus imaging. Eur J Ophthalmol 2011 ; 21 : 653-6.
[12] Sarraf D, Rahimy E, Fawzi AA, et al. Paracentral acute middle maculopathy, a new variant of acute macular neuroretinopathy associated with retinal capillary ischemia. JAMA Ophthalmol 2013 ; 131 : 1275-87.
[13] Chen X, Rahimy E, Sergott RC, et al. Spectrum of retinal vascular diseases associated with paracentral acute middle maculopathy. Am J Ophthalmol 2015 ; 160 : 26-34.
[14] Ko J, Kwon OW, Byeon SH. Optical coherence tomography predicts visual outcome in acute central retinal vein occlusion. Retina 2014 ; 34 : 1132-41.
[15] Gerding H, Monés J, Tadayoni R, et al. Ranibizumab in retinal vein occlusion : treatment recommendations by an expert panel. Br J Ophthalmol 2015 ; 99 : 297-304.
A. Glacet-Bernard, F. Coscas, A. Mière, A. Sellam
➤ L’angio-OCT est une avancée très récente et très prometteuse qui permet de visualiser avec une grande précision les vaisseaux sanguins, sans injection de colorant. Dans les OVR, il existe une atteinte du lit capillaire rétinien superficiel et une atteinte plus marquée du lit capillaire profond, où les zones de non-perfusion sont plus nombreuses, de même que les logettes cystoïdes d’œdème maculaire.
➤ L’angio-OCT n’analysant qu’une plage limitée dans les 10 degrés centraux, cet examen ne détrône pas l’angiographie à la fluorescéine qui est actuellement la seule à visualiser la perfusion de la rétine périphérique, indispensable dans la prise en charge des OVR.
L’angio-OCT est une avancée très récente et très prometteuse dans les moyens d’exploration des pathologies vasculaires du segment postérieur de l’œil (rétine, papille, choroïde) qui permet, sans injection de colorant, de visualiser avec une grande précision les vaisseaux sanguins (voir chapitre 5) [1].
Les images d’angio-OCT (voir fig. 9-60 et 9-61) fournissent des informations sur le flux détecté sur les sections en C-scan (OCT « en face »). Une segmentation automatique ou manuelle permet de visualiser le C-scan et l’angio-OCT correspondants à différentes profondeurs (tous les 30 µm ou par rapport à un plan de référence, la limitante interne ou membrane de Bruch). La précision de cette segmentation des couches tissulaires est cruciale pour obtenir des images OCT-A fiables.
L’angio-OCT permet donc l’analyse séparée du lit capillaire profond et du lit capillaire superficiel, alors que l’angiographie à la fluorescéine ne visualise pas de façon différentielle les deux lits capillaires car les couches rétiniennes sont superposées. Cependant, l’analyse est concentrée sur une zone très limitée (3 × 3 mm ou 6 × 6 mm).
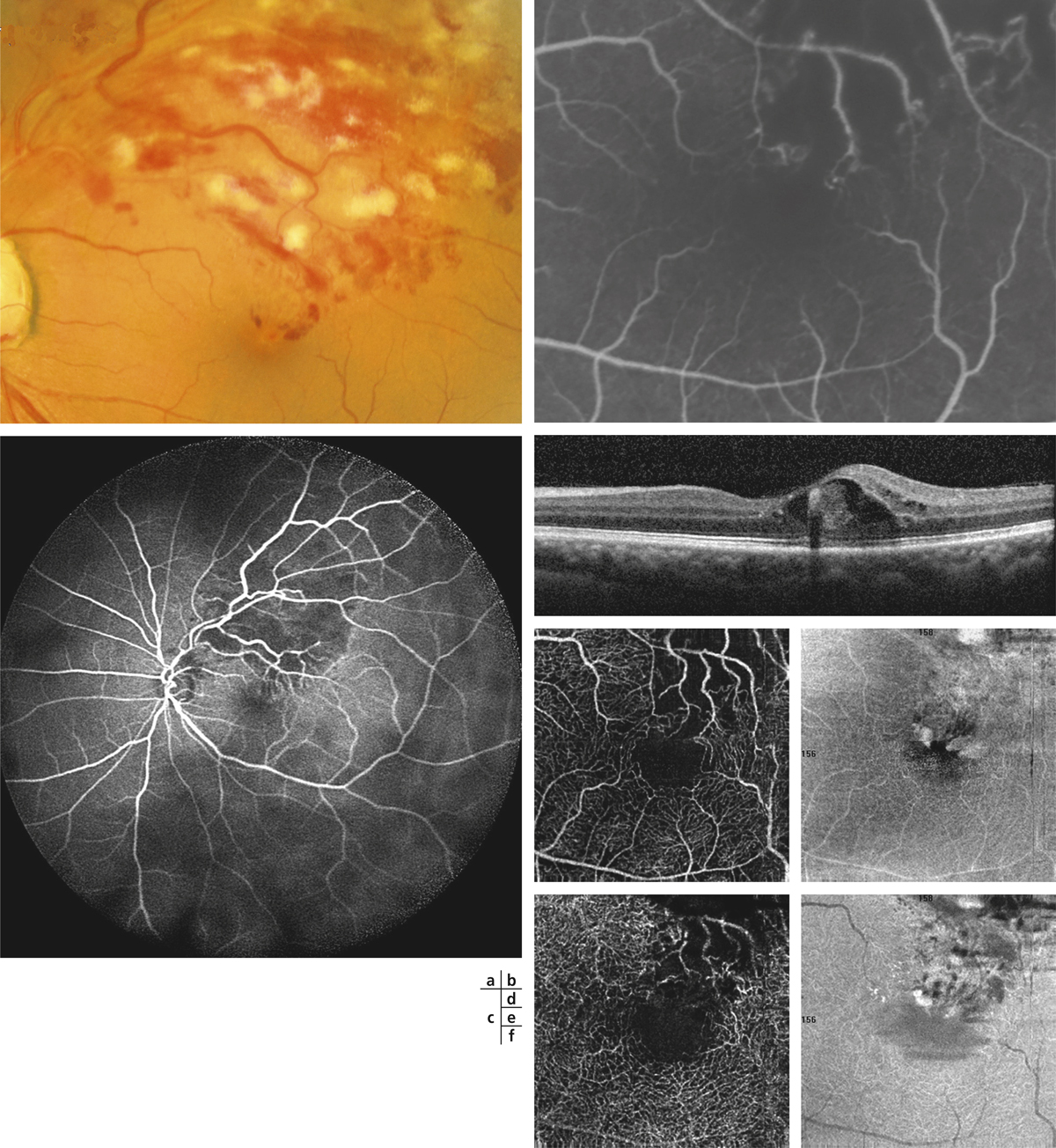
Fig. 9-60 OBV temporale supérieure ischémique chez une femme de 58 ans (acuité visuelle de 20/25).
Le cliché couleur (a) montre la présence d’hémorragies profondes et de nodules cotonneux dans le territoire de l’occlusion. Le temps précoce de l’AF (b) montre une interruption de l’arcade anastomotique périfovéale temporale supérieure. Un cliché en ultra-grand champ (c) montre l’étendue de la zone de non-perfusion en temporal supérieur. Le SD-OCT (B-scan) retrouve un OM modéré (d). L’angio-OCT au niveau du lit capillaire superficiel (e) retrouve une rupture de la maille périfovéale en continuité avec la zone non perfusée temporale supérieure. Au niveau du lit capillaire profond, les ruptures de la maille capillaire sont plus nombreuses et on distingue également de petites logettes cystoïdes noires (f).
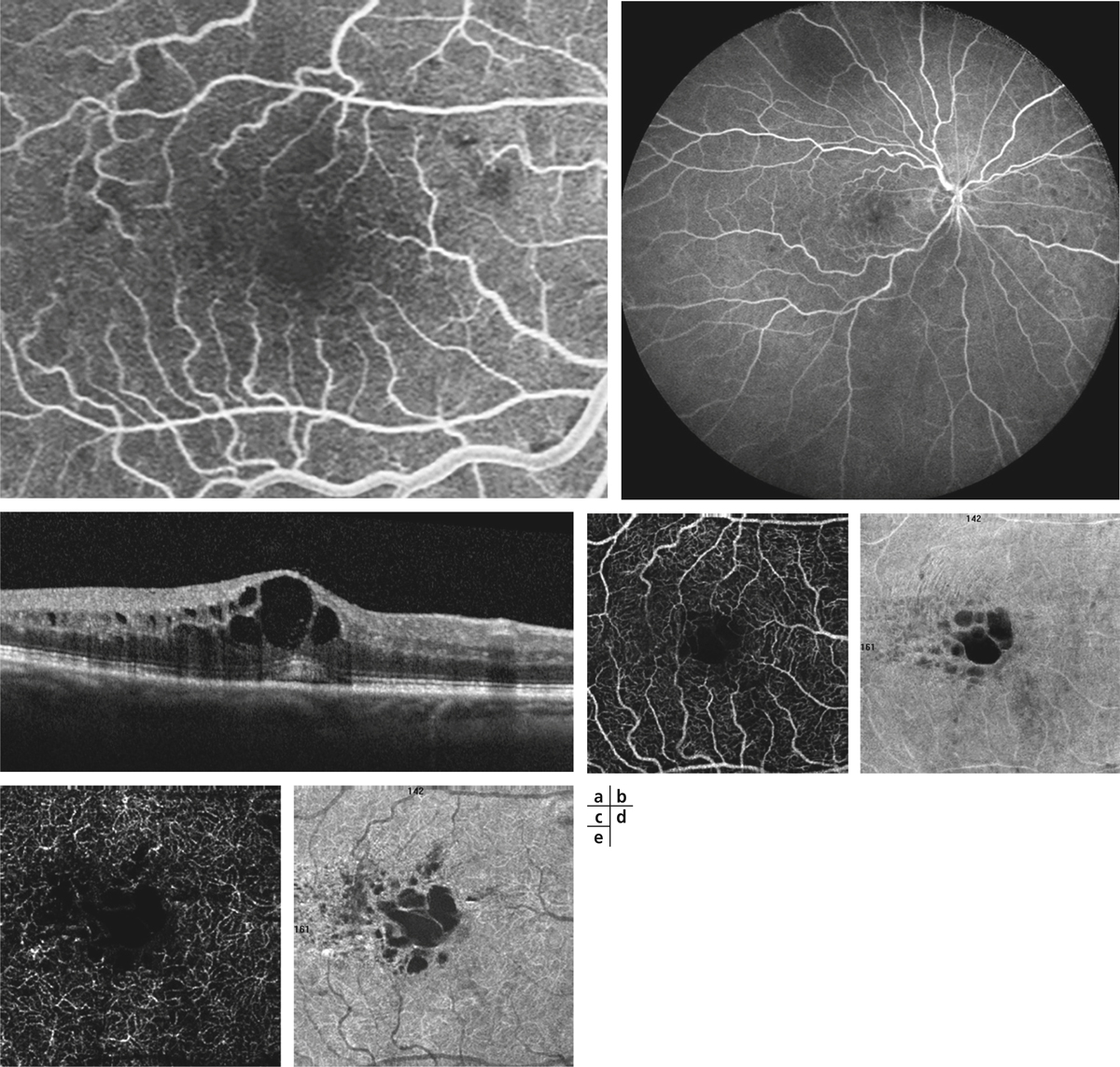
Fig. 9-61 OVCR bien perfusée chez un homme de 86 ans (acuité visuelle de 20/64).
En angiographie à la fluorescéine, le cliché agrandi sur la maille capillaire montre une arcade périfovéale plus ou moins bien définie qui semble globalement intacte (a) ; il n’existe pas de territoire de non-perfusion périphérique sur le cliché ultra-grand champ de 102° (b). Le SD-OCT (B-scan) retrouve un OM cystoïde avec de grosses logettes centrales et un soulèvement fovéolaire débutant (c). L’angio-OCT au niveau du lit capillaire superficiel (d) retrouve une maille périfovéale quasiment intacte. Au niveau du lit capillaire profond, les logettes cystoïdes sont plus larges et plus nombreuses (e).
Peu de publications à ce jour rapportent les résultats de l’analyse en angio-OCT au cours des OVR. Kuehlewein et al. rapportent le cas d’un patient atteint d’OBV examiné à l’aide du swept-source OCT microangiography [2]. Les vaisseaux rétiniens, y compris les capillaires, étaient visualisés dans leurs différentes couches et en 3D.
Une seconde étude, rapportée au congrès de la Société française d’ophtalmologie en 2015 et sous presse [3], a analysé l’aspect en angio-OCT d’un groupe de 54 patients consécutifs présentant une OVR (29 OVCR et 25 OBV). L’aspect du lit capillaire rétinien superficiel (LCS) et du lit capillaire profond (LCP) a été comparé aux signes connus de l’angiographie à la fluorescéine (AF) et du SD-OCT (fig. 9-60 et 9-61).
La visibilité de l’arcade anastomotique périfovéale était retrouvée dans 100 % des cas en angio-OCT et seulement dans 80,7 % en AF (p = 0,001).
Les ruptures de l’arcade anastomotique périfovéale étaient présentes dans 90,9 % des cas en angio-OCT dans le lit capillaire superficiel versus 70,5 % en AF (p = 0,002). En effet, la visualisation des capillaires périfovéolaires a été parfois rendue difficile en AF dans certaines circonstances : absence de temps précoce, diffusion abondante et précoce de colorant, trouble des milieux (cataracte), volumineux œdème nécessitant un changement de mise au point.
D’une manière générale, l’atteinte du lit capillaire profond était plus marquée que l’atteinte du lit capillaire superficiel, avec des logettes cystoïdes plus nombreuses et volumineuses, et des zones de non-perfusion également plus nombreuses.
L’angio-OCT a été le moyen le plus performant pour détecter un œdème maculaire comparé au SD-OCT et à l’AF. En effet, des logettes cystoïdes étaient observées en angio-OCT dans 80 % des cas dans les deux lits capillaires superficiel et profond, dans 66,7 % des cas en AF et dans 75,5 % des cas en SD-OCT.
Une corrélation a été retrouvée entre la rupture de l’arcade périfovéale et l’ischémie rétinienne périphérique (p = 0,013). En l’absence de rupture de l’arcade anastomotique dans le lit capillaire superficiel, il n’a jamais été observé d’ischémie périphérique ; cela concernait 7,5 % des patients. En cas de rupture de l’arcade, une ischémie périphérique a été observée dans deux tiers des cas. Si ces données sont confirmées, l’angio-OCT pourrait aider à sélectionner les cas pour lesquels l’AF n’est pas nécessaire. D’autres corrélations étaient retrouvées entre la présence d’une ischémie rétinienne périphérique en AF et angio-OCT : dilatation et rupture de la maille capillaire dans le lit profond (p = 0,016) et présence de zones noires non perfusées dans le lit capillaire profond (p = 0,038).
L’angio-OCT, examen non invasif d’acquisition très rapide, peut devenir un examen de dépistage et d’évaluation de l’œdème et de l’ischémie maculaire des OVR. Il pourra permettre de suivre avec une très grande précision à la fois l’œdème maculaire et l’architecture des lits capillaires maculaires superficiel et profond. Toutefois, l’analyse est limitée aux 10 degrés centraux.
Cette technique très prometteuse pourrait remplacer avantageusement le SD-OCT simple. L’angiographie à la fluorescéine reste pour l’instant indispensable pour analyser la perfusion de la périphérie rétinienne.
[1] Spaide RF, Klancnik JM Jr., Cooney MJ. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomography angiography. JAMA Ophthalmol 2015 ; 133 : 45-50.
[2] Kuehlewein L, An L, Durbin MK, Sadda SR. Imaging areas of retinal nonperfusion in ischemic branch retinal vein occlusion with swept-source OCT microangiography. Ophthalmic Surg Lasers Imaging Retina 2015 ; 46 : 249-52.
[3] Coscas F, Glacet-Bernard A, Miere A, et al. OCT-Angiography in retinal vein occlusion : evaluation of superficial and deep capillary plexa. Am J Ophthalmol 2015, (à paraître).
J.-F. Girmens
➤ L’évolution des occlusions veineuses rétiniennes est souvent imprévisible.
➤ À côté des facteurs liés à la pathologie elle-même (acuité visuelle initiale, perfusion capillaire, épaisseur maculaire, forme clinique) ou au terrain sur lequel elle survient (âge, sexe, pathologies associées), le délai d’instauration du traitement de l’œdème maculaire semble également pouvoir influencer l’acuité visuelle finale, au moins à court et moyen terme.
➤ Il faut rappeler que les anti-VEGF ne font que retarder l’apparition des complications néovasculaires, sans en diminuer le risque.
L’évolution des OVR est souvent imprévisible, allant de la récupération complète à la perte de vision (voire du globe oculaire). À côté de l’histoire naturelle de la maladie, la mise à disposition de nouveaux traitements de l’œdème maculaire pose la question de leur rôle dans la modification de ce pronostic (récupération visuelle, complications néovasculaires). L’œdème maculaire étant la principale cause de baisse d’acuité visuelle lors des OVR, le pronostic de l’œdème maculaire des OVR recoupe celui des OVR en général, entravé par la possibilité de conversion ischémique.
Dans la Central Vein Occlusion Study (CVOS), le niveau initial d’acuité visuelle était un élément prédictif de l’acuité visuelle et du risque de néovascularisation à 3 ans [1]. Ainsi, lorsque l’acuité visuelle initiale est supérieure à 5/10, elle reste bonne (> 5/10) dans 65 % des cas, et risque de chuter à moins de 1/10 dans seulement 10 % des cas, avec 7 % de risque de néovascularisation à 3 ans. Inversement, lorsque l’acuité visuelle initiale est inférieure à 1/10, elle reste à ce niveau dans la grande majorité des cas (79 %), avec un risque important de rubéose irienne (44 %). Par contre, l’évolution des patients avec acuité visuelle « intermédiaire » (entre 1 et 5/10) est partagée entre maintien (44 %), perte (37 %) ou gain de vision (19 %), et un risque de rubéose irienne de 15 %.
L’angiographie à la fluorescéine est considérée comme l’examen de choix dans la détermination du pronostic dès le stade initial, en classant les occlusions en formes « perfusées » ou « non perfusées » selon l’étendue des zones de non-perfusion capillaire. Outre d’être difficile initialement (masquage par hémorragies abondantes, qualité insuffisante de l’angiographie) [2], le seuil à partir duquel est définie une forme « non perfusée » varie d’un auteur à l’autre (de 10 à 75 DP). Ne reposant que sur une surface de rétine analysée peu étendue, l’arrivée d’angiographes « ultra-grands champs » devrait probablement remettre en cause cette classification. Récemment a été proposé de calculer un « index ischémique » (ischemic index ou ISI), en faisant le rapport de la surface de rétine non perfusée sur la surface totale de rétine analysée : un ISI supérieur à 45 % semble indiquer un risque élevé de néovascularisation [3].
L’étendue de la non-perfusion périphérique semble également influencer la réponse au traitement par anti-VEGF de l’œdème maculaire : ainsi, alors que les patients avec un ISI supérieur à 10 % ont initialement une épaisseur rétinienne plus importante et une acuité visuelle plus basse, ils vont d’avantage bénéficier du traitement par anti-VEGF, avec réduction plus importante de l’œdème maculaire et gain d’acuité visuelle plus important [4].
En attendant l’avènement des « angio-OCT », l’angiographie traditionnelle reste utile pour apprécier la perfusion maculaire, dont l’altération entrave évidemment le pronostic visuel après traitement de l’œdème.
L’OCT est l’examen sur lequel repose la surveillance de l’œdème maculaire et de son traitement. La corrélation entre épaisseur maculaire mesurée en OCT et acuité visuelle donne des résultats discordants, notamment en raison de l’atrophie maculaire des formes ischémiques qui contredit la corrélation inverse attendue entre épaisseur maculaire et acuité visuelle [5]. Cependant, il semble bien exister une épaisseur initiale au-delà de laquelle le pronostic visuel est réservé : une épaisseur rétinienne centrale (en dehors de l’éventuel DSR sous-jacent) supérieure à 700 µm semble compromettre la récupération visuelle [6], probablement du fait qu’elle correspond à des formes avec ischémie maculaire [7].
Lorsqu’elle est visible (parfois masquée par un œdème trop important), la continuité de la zone ellipsoïde (anciennement jonction segments externes–segments internes des photorécepteurs) est un élément de bon pronostic [8].
Certaines OVCR se présentent sous la forme d’une baisse brutale et profonde de la vision, contrastant avec des anomalies souvent minimes à l’examen du fond d’œil. Ce sont les cas où il faut rechercher des signes d’opacification de la rétine périveinulaire, liée à une ischémie aiguë de la rétine par bas débit [9, 10] : l’analyse des clichés en lumière bleue ou mieux l’OCT peuvent être utiles pour mettre en évidence cet aspect. L’intérêt de reconnaître cette présentation tient au fait que ces patients présentent une évolution particulière, en général spontanément favorable. Les risques essentiels de cette forme sont une atrophie maculaire et un œdème papillaire (éventuellement diffusant à la macula).
Ces formes peuvent être associées à l’occlusion d’une artère ciliorétinienne. Elle est alors souvent au premier plan du tableau clinique, sous la forme d’une plage de rétine blanche centrée par une artère [11], pouvant même égarer le diagnostic. C’est la constatation de quelques fines hémorragies périveineuses périphériques, d’une dilatation veineuse modérée (intérêt de la comparaison avec l’autre œil) et éventuellement d’une opacification périveineuse (intérêt de l’OCT à haute résolution) en dehors du territoire atteint par l’occlusion ciliorétinienne qui redresse le diagnostic.
L’apparition de boucles prépapillaires ou collatérales autour d’un croisement artérioveineux est traditionnellement associée à un bon pronostic. Si leur présence témoigne d’anastomoses opticociliaires en cas d’OVCR, leur absence n’est pas forcément de mauvais pronostic, puisque, outre de se développer lentement, les anastomoses peuvent également se développer en arrière de la papille : les auteurs ayant étudié ce paramètre donnent donc des résultats discordants [12–14]. Par ailleurs, notons que les tentatives de création d’anastomoses (par laser ou neurotomie radiaire) ne semblent pas réellement efficaces.
De nombreuses études s’accordent sur le mauvais pronostic des OVR avec l’âge et le sexe masculin [12, 15, 16].
Même en l’absence de rétinopathie diabétique, les formes graves d’OVR sont plus fréquentes chez les patients diabétiques, avec augmentation du risque de conversion vers une forme ischémique [16], et ce d’autant plus que le diabète est déséquilibré [17].
Les élévations de l’hématocrite, de la lipidémie, de la viscosité sanguine et du fibrinogène semblent des facteurs de mauvais pronostic [12].
Comme pour tout œdème maculaire [18], le statut du vitré semble influencer l’évolution des OVR et de leur œdème maculaire. Ainsi, un décollement postérieur du vitré prévient non seulement la survenue de néovascularisations prérétiniennes ou prépapillaires [19], mais aussi le risque d’œdème maculaire persistant [20–22].
S’il est probable que les traitements de l’œdème maculaire améliorent le pronostic visuel au long cours des OVR (certainement pour les OVCR, peut-être moins évident pour les OBVR), la date du début du traitement reste posée. Si on se rappelle que les patients inclus dans les essais thérapeutiques avaient une durée d’évolution de l’œdème maculaire comprise entre 1,5 et 5,5 mois en moyenne lors du début du traitement, il ne semble pas urgent de débuter le traitement de l’œdème maculaire. À l’inverse cependant, il est probablement délétère de le différer de plusieurs mois : ainsi, hormis dans l’essai BRAVO (ranibizumab pour l’OM des OBVR [23]), les groupes « témoins », traités avec 6 mois à 1 an de retard, s’ils bénéficient toujours du traitement, ne rattrapent pas totalement les patients traités 6 mois à 1 an plus tôt [24]. Une analyse post hoc de l’essai GENEVA [25] indique que chaque mois supplémentaire de retard est associé à une diminution de la probabilité d’atteindre une amélioration cliniquement significative de l’acuité visuelle, dans la population de patients inclus.
Par ailleurs, il convient de garder à l’esprit que le traitement anti-VEGF ne diminue pas le risque de complications néovasculaires, mais ne fait que retarder leur apparition [26].
[1] Natural history and clinical management of central retinal vein occlusion. The Central Vein Occlusion Study Group. Arch Ophthalmol 1997 ; 115 : 486-91.
[2] Hayreh SS, Klugman MR, Beri M, et al. Differentiation of ischemic from non-ischemic central retinal vein occlusion during the early acute phase. Graefes Arch Clin Exp Ophthalmol 1990 ; 228 : 201-17.
[3] Tsui I, Kaines A, Havunjian MA, et al. Ischemic index and neovascularization in central retinal vein occlusion. Retina 2011 ; 31 : 105-10.
[4] Singer M, Tan CS, Bell D, Sadda SR. Area of peripheral retinal nonperfusion and treatment response in branch and central retinal vein occlusion. Retina 2014 ; 34 : 1736-42.
[5] Ota M, Tsujikawa A, Murakami T, et al. Foveal photoreceptor layer in eyes with persistent cystoid macular edema associated with branch retinal vein occlusion. Am J Ophthalmol 2008 ; 145 : 273-80.
[6] Martinet V, Guigui B, Glacet-Bernard A, et al. Macular edema in central retinal vein occlusion : correlation between optical coherence tomography, angiography and visual acuity. Int Ophthalmol 2012 ; 32 : 369-77.
[7] Shroff D, Mehta DK, Arora R, et al. Natural history of macular status in recent-onset branch retinal vein occlusion : an optical coherence tomography study. Int Ophthalmol 2008 ; 28 : 261-8.
[8] Ota M, Tsujikawa A, Kita M, et al. Integrity of foveal photoreceptor layer in central retinal vein occlusion. Retina 2008 ; 28 : 1502-8.
[9] Paques M, Gaudric A. Perivenular macular whitening during acute central retinal vein occlusion. Arch Ophthalmol 2003 ; 121 : 1488-91.
[10] Browning DJ. Patchy ischemic retinal whitening in acute central retinal vein occlusion. Ophthalmology 2002 ; 109 : 2154-9.
[11] Glacet-Bernard A, Gaudric A, Touboul C, Coscas G. Occlusion of the central retinal vein with occlusion of a cilioretinal artery : a propos of 7 cases. J Fr Ophtalmol 1987 ; 10 : 269-77.
[12] Glacet-Bernard A, Coscas G, Chabanel A, et al. Prognostic factors for retinal vein occlusion : prospective study of 175 cases. Ophthalmology 1996 ; 103 : 551-60.
[13] Giuffrè G, Palumbo C, Randazzo-Papa G. Optociliary veins and central retinal vein occlusion. Br J Ophthalmol 1993 ; 77 : 774-7.
[14] Fuller JJ, Mason JO, White MF, et al. Retinochoroidal collateral veins protect against anterior segment neovascularization after central retinal vein occlusion. Arch Ophthalmol 2003 ; 121 : 332-6.
[15] Chaine G, Tolub O, Français C, Coscas G. Éléments de pronostic défavorable des occlusions de la veine centrale de la rétine de type oedémateux. Bull Mém Société Fr Ophtalmol 1985 ; 96 : 403-6.
[16] Keenan JM, Dodson PM, Kritzinger EE. Are there medical conditions specifically underlying the development of rubeosis in central retinal vein occlusion ? Eye 1993 ; 7 : 407-10.
[17] Paques M, Champion E, Sedira N, et al. Diabetes as a risk factor for post-CRVO neovascularisation. Eur J Ophthalmol 2010 ; 20 : 631-2.
[18] Schepens CL, Avila MP, Jalkh AE, Trempe CL. Role of the vitreous in cystoid macular edema. Surv Ophthalmol 1984 ; 28 Suppl : 499-504.
[19] Akiba J, Kado M, Kakehashi A, Trempe CL. Role of the vitreous in posterior segment neovascularization in central retinal vein occlusion. Ophthalmic Surg 1991 ; 22 : 498-502.
[20] Hikichi T, Konno S, Trempe CL. Role of the vitreous in central retinal vein occlusion. Retina 1995 ; 15 : 29-33.
[21] Takahashi MK, Hikichi T, Akiba J, et al. Role of the vitreous and macular edema in branch retinal vein occlusion. Ophthalmic Surg Lasers 1997 ; 28 : 294-9.
[22] Kado M, Jalkh AE, Yoshida A, et al. Vitreous changes and macular edema in central retinal vein occlusion. Ophthalmic Surg 1990 ; 21 : 544-9.
[23] Heier JS, Campochiaro PA, Yau L, et al. Ranibizumab for macular edema due to retinal vein occlusions : long-term follow-up in the HORIZON trial. Ophthalmology 2012 ; 119 : 802-9.
[24] Thach AB, Yau L, Hoang C, Tuomi L. Time to clinically significant visual acuity gains after ranibizumab treatment for retinal vein occlusion : BRAVO and CRUISE trials. Ophthalmology 2014 ; 121 : 1059-66.
[25] Yeh WS, Haller JA, Lanzetta P, et al. Effect of the duration of macular edema on clinical outcomes in retinal vein occlusion treated with dexamethasone intravitreal implant. Ophthalmology 2012 ; 119 : 1190-8.
[26] Brown DM, Wykoff CC, Wong TP, et al. Ranibizumab in preproliferative (ischemic) central retinal vein occlusion : the Rubeosis Anti-VEGF (RAVE) trial. Retina 2014 ; 34 : 1728-35.
M. Gallice, C. Chiquet
➤ L’utilisation de stéroïdes dans l’occlusion veineuse rétinienne permet de réduire l’œdème maculaire et d’améliorer l’acuité visuelle. Le gain d’acuité visuelle moyen est alors de 4 à 8 lettres pour l’OVCR et d’environ 9 lettres pour l’OBVR.
➤ Le pic d’efficacité est à 2 mois après injection intravitréenne d’un implant de 700 µg de dexaméthasone.
➤ Les principales complications des corticostéroïdes sont la cataracte, l’hypertonie oculaire ou le glaucome cortisonique.
➤ Le pic d’hypertonie intra-oculaire survient 1 à 2 mois après l’injection.
➤ L’hypertonie cortisonique est favorisée par la myopie forte et un glaucome préexistant.
L’œdème maculaire persistant est une cause fréquente de mauvaise récupération visuelle dans 60 % des cas après occlusion veineuse rétinienne non ischémique [1]. Environ 17 % des patients présentent une bonne récupération fonctionnelle spontanée dans les 2 mois suivant l’occlusion veineuse (acuité visuelle de 10/10 et épaisseur rétinienne centrale inférieure ou égale à 250 µm) [2] et 5 à 10 % des formes non perfusées présentent un œdème maculaire cliniquement significatif initial [3, 4]. En France, le traitement par injection intravitréenne d’un implant de 700 µg de dexaméthasone à libération prolongée (DEX) a reçu en 2011 l’autorisation de mise sur le marché comme traitement de première intention de l’œdème maculaire post-occlusion veineuse rétinienne.
Les grandes études évaluant l’effet des stéroïdes (tableau 9-3) incluaient plus fréquemment des patients atteints d’œdème maculaire (OMV) compliquant une OBVR qu’une OVCR. En moyenne, l’OMV évoluait depuis plus de 5 mois et mesurait plus de 500 µm. Dans l’étude GENEVA, le critère de traitement par implant DEX était un OMV cliniquement significatif (acuité visuelle entre 1/10 et 4/10 ou épaisseur rétinienne centrale > 300 µm) dans les suites d’une occlusion veineuse rétinienne évoluant depuis 6 semaines à 9 mois (OVCR) ou 12 mois (OBVR). Les données sur les traitements pris antérieurement au traitement par corticoïdes dans l’étude GENEVA ne semblent pas disponibles. Querques et al. [5] et Chiquet et al. [6] ont inclus les patients naïfs de traitement avec des résultats sur le gain d’acuité visuelle à 3 mois similaires à ceux de GENEVA. Une étude a sélectionné des patients non répondeurs au bévacizumab (n = 18), principalement atteints d’OVCR [7]. L’injection de DEX permettait une réduction moyenne de l’épaisseur maculaire centrale sur l’OCT de 146 µm et une augmentation moyenne de l’acuité visuelle de 0,26 logMAR.
Tableau 9-3 Résultats anatomiques et fonctionnels des principales études sur l’implant de dexaméthasone (Ozurdex®) dans l’OM des occlusions veineuses rétiniennes.
Six mois après une injection intravitréenne de DEX 700 µg, 21 à 38 % [8–10] des patients ont un gain de plus de 15 lettres d’acuité visuelle. Inversement, 6 à 11 % [2] perdent 15 lettres d’acuité visuelle. Au cours de 12 mois de suivi après injection d’un implant intravitréen de DEX 700 µg, 10 [11] à 29 % [12] des patients perdent 5 lettres d’acuité visuelle.
Deux mois après l’injection, le gain moyen est de 4 à 9 lettres. L’effet fonctionnel de l’injection intravitréenne de DEX 700 µg est maximal à 2 mois [13].
La sensibilité rétinienne mesurée en électrorétinographie multifocale est bien corrélée aux modifications d’épaisseur des rétines interne et externe [14].
L’épaisseur maculaire centrale est inférieure à 250 µm dans 65 % des cas, 1 à 5 mois après l’injection intravitréenne de DEX. La diminution moyenne de l’œdème maculaire varie de 134 à 267 µm, 6 mois après l’injection. Le maximum d’efficacité est atteint à 2 mois (– 330 µm en moyenne).
À 6 mois, 21 à 31 % des patients ont un gain de plus de 15 lettres d’acuité visuelle. Inversement, 6 à 11 % perdent 15 lettres d’acuité visuelle [2, 8].
À 6 mois, la diminution moyenne de l’épaisseur maculaire centrale est de 183 µm. Deux tiers des patients ont une épaisseur maculaire centrale inférieure à 250 µm, 5 à 20 semaines après l’injection.
Les études évaluant l’efficacité de l’implant intravitréen de DEX 700 µg à 12 mois ont suivi un protocole pro renata (PRN), à la demande, avec un minimum de 3 mois entre deux injections. Les patients bénéficiaient d’une nouvelle injection si l’acuité visuelle inférieure était à 84 lettres ou si l’épaisseur rétinienne centrale dépassait 250 à 300 µm (selon les études). Le nombre moyen d’injection variait de 1,9 à 3,2 injections par œil sur 1 an. Vingt-trois pour cent des patients avaient besoin de plus de trois injections au cours de la période. En moyenne, 5 mois séparaient deux injections [2].
Au cours d’un traitement de type PRN, le gain moyen d’acuité visuelle est de 11 lettres pour les OVCR et 6 lettres pour les OBVR, avec une diminution moyenne de l’épaisseur maculaire centrale de 80 µm [12]. Dans l’étude GENEVA, l’amélioration d’acuité visuelle se maintient à 12 mois : les patients ayant initialement bénéficié d’un traitement par implant de DEX 700 µg ont un gain supplémentaire d’acuité visuelle de 2,5 lettres à 12 mois contre une perte de 1 lettre à 12 mois dans le groupe placebo [2, 15].
Il existe une récidive (définie comme une diminution de l’épaisseur maculaire suivie d’une augmentation de plus de 30 %) de l’œdème maculaire dans 56 % des cas et un effet rebond (défini comme une augmentation de plus de 110 % de l’épaisseur maculaire centrale comparativement à l’épaisseur initiale) dans 13 % des cas [6, 16]. L’effet rebond survient en moyenne 18 semaines après l’injection de l’implant DEX.
Les caractéristiques des patients inclus dans l’étude randomisée SCORE étaient semblables à celles incluses dans les études évaluant l’implant intravitréen DEX. Ils présentaient un œdème maculaire post-occlusion de la veine centrale de la rétine non ischémique évoluant en moyenne depuis 4,3 mois [17].
À 1 an, 27 % et 26 % de patients traités par injection intravitréenne de triamcinolone acétonide 1 mg et 4 mg respectivement ont gagné 15 lettres d’acuité visuelle ; significativement plus que dans le groupe non traité (7 % des patients). L’épaisseur maculaire centrale était diminuée de – 196 µm (– 390 à – 62), – 261 µm (– 407 à – 79) dans le groupe 1 mg et 4 mg de triamcinolone acétonide contre – 277 µm (– 418 à – 40) dans le groupe non traité.
Le gain d’acuité visuelle était durable à 2 ans (31 % et 26 % dans le groupe 1 mg et 4 mg contre 9 % dans le groupe non traité), bien que le nombre de perdus de vue soit important (45 % de perdus de vue à 2 ans). Soixante-dix-sept pour cent et 57 % de patients ont été retraités, respectivement dans le groupe 1 mg et le groupe 4 mg, à 4 mois. Les patients étaient retraités tous les 4 mois s’ils étaient répondeurs : gain d’au moins 5 lettres ETDRS (Early Treatment Diabetic Retinopathy Study) d’acuité visuelle avec acuité visuelle ≤ 20/25 ou diminution de l’épaisseur rétinienne centrale ≥ 50 µm mais épaisseur maculaire centrale > 225 µm. Ainsi les patients ont reçu en moyenne deux injections (IC 95 % : 1,8–2,1) dans la première année de traitement.
Le traitement par injection intravitréenne de triamcinolone acétonide 1 mg et 4 mg a été comparé à la photocoagulation laser en grille dans l’étude SCORE [18]. Bien qu’il n’y ait pas de différence significative sur le résultat anatomique et fonctionnel à 1 an, le résultat était significativement meilleur dans le groupe traité par photocoagulation au laser à 4 ans.
Les patients ont reçu en moyenne deux injections intravitréennes dans la première année de traitement contre 1,5 séance de laser.
Par ordre de fréquence (tableau 9-4), la cataracte cortico-induite est l’effet indésirable le plus fréquemment retrouvé chez les patients traités par corticostéroïdes pour l’œdème maculaire compliquant les occlusions veineuses. Dans l’étude GENEVA, l’incidence de la cataracte après injection intravitréenne de DEX 0,7 mg était de 7,6 % après une injection, et 29,6 % après deux injections. Six mois après la seconde injection d’un implant DEX 0,7 mg ou 0,35 mg, neuf patients (3,1 % des patients phaques) ont été opérés de cataracte dans l’étude GENEVA. Les données actuellement publiées (pour les occlusions veineuses rétiniennes) ont un recul d’un an.
Le risque de glaucome cortico-induit augmente avec l’exposition aux stéroïdes : après deux injections d’implant intravitréen DEX 700 µg, 15 à 33 % des patients ont une élévation de PIO de plus de 10 mmHg contre 13 % 6 mois après une seule injection [2, 10]. Le pic d’hypertonie oculaire survient entre 1 mois [9] et 2 mois [8] après injection. Quatre [8] à 25 % [9] des patients ont présenté une hypertonie oculaire transitoire, majoritairement résolue sous traitement topique. Un à 3 % ont présenté une hypertonie réfractaire nécessitant le recours à un traitement laser ou chirurgical.
En cas d’hypertonie oculaire ou de glaucome préexistant, 20 % des patients ont présenté une hypertonie oculaire à 3 mois contre 8 % chez les patients indemnes de problèmes tensionnels oculaires [9]. Ces données sont compatibles avec le fait qu’hypertonie oculaire et glaucome préexistant sont des facteurs de risque connus d’hypertonie cortisonique [19].
Aucun cas d’endophtalmie (infectieuse ou stérile) n’a été rapporté dans les grandes études (n = 1285). Dans la pratique courante, plusieurs cas de déplacement de l’implant de dexaméthasone en chambre antérieure [20] ont été décrits notamment chez les patients avec implant de chambre antérieure.
Une hémorragie sous-conjonctivale a été rapportée chez 14,1 % des patients [9].
L’ischémie rétinienne n’a pas été étudiée dans les études de forte puissance. Des cas cliniques ont montré que l’ischémie rétinienne [21] peut survenir 3 à 4 mois après l’injection de l’implant DEX.
Tableau 9-4 Complications des corticostéroïdes (DEX) utilisés pour le traitement de l’OM après occlusion veineuse rétinienne.
La survenue d’une hypertonie cortisonique était significativement associée au traitement par injection intravitréenne de triamcinolone (TA) et a justifié la mise en route d’un traitement hypotonisant local chez 35 % (OVCR) à 41 % (OBVR) des patients traités par 4 mg de TA, chez 7 % (OBVR) à 20 % (OVCR) dans le groupe traité à 1 mg, et 2 à 8 % dans le groupe non traité [17, 18, 22]. Quatre patients dans le groupe traité par 4 mg de TA (deux OVCR et deux OBVR) et deux patients dans le groupe traité par 1 mg TA (OVCR) ont eu recours à une chirurgie filtrante au cours du suivi. Ces taux élevés avaient fait proposer à certains un test thérapeutique avec instillation de collyre à la dexamethasone afin de détecter les patients à risque.
Une chirurgie de la cataracte était significativement plus souvent pratiquée dans le groupe traité par TA 4 mg (4 yeux OVCR, 35 yeux OBVR) que dans le groupe traité par 1 mg (0 œil OVCR, 8 yeux OBVR) ou non traité [19].
Aucun cas d’endophtalmie infectieuse n’a été rapporté dans les études SCORE.
[1] Rehak J, Rehak M. Branch retinal vein occlusion : pathogenesis, visual prognosis, and treatment modalities. Curr Eye Res 2008 ; 33 : 111-31.
[2] Haller JA, Bandello F, Belfort R Jr, et al. Dexamethasone intravitreal implant in patients with macular edema related to branch or central retinal vein occlusion twelve-month study results. Ophthalmology 2011 ; 118 : 2453-60.
[3] Finkelstein D. Ischemic macular edema. Recognition and favorable natural history in branch vein occlusion. Arch Ophthalmol 1992 ; 110 : 1427-34.
[4] Hayreh SS, Podhajsky PA, Zimmerman MB. Natural history of visual outcome in central retinal vein occlusion. Ophthalmology 2011 ; 118: 119-133.e1-2.
[5] Querques L, Querques G, Lattanzio R, et al. Repeated intravitreal dexamethasone implant (Ozurdex®) for retinal vein occlusion. Ophthalmologica 2013 ; 229 : 21-5.
[6] Chiquet C, Dupuy C, Bron A, et al. Intravitreal dexamethasone implant versus anti-VEGF injection for treatment-naive patients with retinal vein occlusion and macular edema: a 12-month follow-up study. Graefes Arch Clin Exp Ophthalmol 2015 (à paraître).
[7] Sharareh B, Gallemore R, Taban M, et al. Recalcitrant macular edema after intravitreal bevacizumab is responsive to an intravitreal dexamethasone implant in retinal vein occlusion. Retina 2013 ; 33 : 1227-31.
[8] Haller JA, Bandello F, Belfort R Jr, et al. Randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with macular edema due to retinal vein occlusion. Ophthalmology 2010 ; 117 : 1134-46.e3.
[9] Matonti F, Meyer F, Guigou S, et al. Ozurdex in the management of the macular edema following retinal vein occlusion in clinical practice. Acta Ophthalmol 2013 ; 91 : e584-586.
[10] Capone A Jr., Singer MA, Dodwell DG, et al. Efficacy and safety of two or more dexamethasone intravitreal implant injections for treatment of macular edema related to retinal vein occlusion (Shasta study). Retina 2014 ; 34 : 342-51.
[11] Maggio E, Polito A, Guerriero M, Pertile G. Intravitreal dexamethasone implant for macular edema secondary to retinal vein occlusion : 12-month follow-up and prognostic factors. Ophthalmologica 2014 ; 232 : 207-15.
[12] Joshi L, Yaganti S, Gemenetzi M, et al. Dexamethasone implants in retinal vein occlusion: 12-month clinical effectiveness using repeat injections as-needed. Br J Ophthalmol 2013 ; 97 : 1040-4.
[13] Veritti D, Macor S, Lanzetta P. Early effects of dexamethasone implant on macular morphology and visual function in patients with macular edema secondary to retinal vein occlusion. Ophthalmologica 2014 ; 232 : 144-8.
[14] Querques G, Lattanzio R, Querques L, et al. Impact of intravitreal dexamethasone implant (Ozurdex) on macular morphology and function. Retina 2014 ; 34 : 330-41.
[15] Yeh WS, Haller JA, Lanzetta P, et al. Effect of the duration of macular edema on clinical outcomes in retinal vein occlusion treated with dexamethasone intravitreal implant. Ophthalmology 2012 ; 119 : 1190-8.
[16] Parodi MB, Iacono P, De Benedetto U, et al. Rebound effect after intravitreal dexamethasone implant for the treatment of macular edema secondary to central retinal vein occlusion. J Ocul Pharmacol Ther 2012 ; 28 : 566-8.
[17] Ip MS, Scott IU, VanVeldhuisen PC, et al. ; SCORE Study Research Group. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with observation to treat vision loss associated with macular edema secondary to central retinal vein occlusion: the Standard Care vs Corticosteroid for Retinal Vein Occlusion (SCORE) study report 5. Arch Ophthalmol 2009 ; 127 : 1101-440.
[18] Scott IU, Ip MS, VanVeldhuisen PC, Oden NL, et al. ; SCORE Study Research Group. A randomized trial comparing the efficacy and safety of intravitreal triamcinolone with standard care to treat vision loss associated with macular Edema secondary to branch retinal vein occlusion : the Standard Care vs Corticosteroid for Retinal Vein Occlusion (SCORE) study report 6. Arch Ophthalmol 2009 ; 127 : 1115-28. Erratum in : Arch Ophthalmol 2009 ; 127 : 1655.
[19] Jones R 3rd, Rhee DJ. Corticosteroid-induced ocular hypertension and glaucoma : a brief review and update of the literature. Curr Opin Ophthalmol 2006 ; 17 : 163-167.
[20] Pardo-Lopez D, Frances-Munoz E, Gallego-Pinazo R, Diaz-Llopis M. Anterior chamber migration of dexametasone intravitreal implant (Ozurdex®). Graefes Arch Clin Exp Ophthalmol 2012 ; 250 : 1703-4.
[21] Semeraro F, Russo A, Danzi P, Costagliola C. Central retinal vein occlusion treated with Ozurdex® : a case report and review of literature. J Ocul Pharmacol Ther 2013 ; 29 : 84-7.
[22] Aref AA, Scott IU, Oden NL, Ip MS, et al. ; SCORE Study Investigator Group. Incidence, risk factors, and timing of elevated intraocular pressure after intravitreal triamcinolone acetonide injection for macular edema secondary to retinal vein occlusion : SCORE Study Report 15. JAMA Ophthalmol 2015 ; 133 : 1022-9.
[23] Kuppermann BD, Blumenkranz MS, Haller JA, et al. Randomized controlled study of an intravitreous dexamethasone drug delivery system in patients with persistent macular edema. Arch Ophthalmol 2007 ; 125 : 309-17.
M.-B. Rougier
➤ L’utilisation des anti-VEGF dans le traitement de l’OMV a considérablement amélioré le pronostic visuel des patients.
➤ Tous les anti-VEGF testés dans les OVR (pegaptanib sodium, bévacizumab, ranibizumab, aflibercept) ont démontré une efficacité, mais seuls les deux derniers ont actuellement l’autorisation de mise sur le marché (AMM) pour le traitement des OVR.
➤ En plus de l’action anti-œdémateuse, les anti-VEGF ont une action anti-angiogénique parfois utile pour prévenir la néovascularisation irienne ou rétinienne, et ils pourraient parfois limiter l’extension des zones de non-perfusion dans les OVR.
➤ Si le schéma thérapeutique testé dans les études princeps était le PRN (à la demande), le suivi en « treat and extend » semble apporter de bons résultats dans les OMV récidivants.
Depuis les premiers travaux sur le macaque, puis sur l’homme [1, 2] montrant une activation du VEGF au cours de l’ischémie rétinienne, il a été montré également que le taux de VEGF était corrélé à la sévérité d’une OVR (OVR), qu’elle soit compliquée d’œdème maculaire ou de néovaisseaux [3, 4]. Ces découvertes sur la pathogénie des OVR et le rôle joué par le VEGF d’une part, et le développement de l’utilisation des anti-VEGF par injection intravitréenne dans la dégénérescence maculaire liée à l’âge (DMLA) d’autre part, ont permis d’élargir la palette des traitements de l’œdème maculaire des occlusions veineuses (OMV). Les molécules concernées sont le pegaptanib (Macugen®, Pfizer), le bévacizumab (Avastin®, Roche), le ranibizumab (Lucentis®, Novartis) et l’aflibercept (Eylea®, Bayer).
Le pegaptanib est un aptamère qui fixe uniquement le VEGF165, une isoforme du VEGF A.
Le bévacizumab est un anticorps monoclonal humanisé qui fixe toutes les isoformes du VEGF A, mais avec une affinité particulière pour le VEGF165. Il agit aussi sur la sécrétion du pigment epithelium derived factor (PEDF).
Le ranibizumab est un fragment d’anticorps monoclonal humanisé recombinant fixant toutes les isoformes du VEGF A. Il possède une fraction Fc qui raccourcit son passage dans la circulation systémique et accélère son élimination.
L’aflibercept est une protéine de fusion recombinante composée des fragments des domaines extracellulaires des récepteurs du VEGF 1 et 2 humains, fusionnés au fragment Fc de l’IgG1 humaine. Il se lie au VEGF A et au placental growth factor (PlGF).
Il a été clairement démontré que dans l’OVR existe une stimulation de la sécrétion du VEGF. Celle-ci est le fait de mécanismes inflammatoires dus aux lésions de l’endothélium vasculaire d’une part, et de l’hypoxie d’autre part [5 pour revue]. Le VEGF est un facteur pro-angiogénique qui contribue à la survenue de l’OMV et de la néovascularisation rétinienne.
Le VEGF induit une augmentation de la perméabilité vasculaire à l’origine d’une rupture de la barrière hémato-rétinienne et de l’OMV. Les injections d’anti-VEGF permettent la restauration de cette barrière avec un effet direct sur l’OMV.
Au cours des OVR, il n’est pas rare de constater la transformation d’une rétine initialement perfusée en rétine ischémique. Le mécanisme de transformation étant inconnu, il a été supposé qu’il s’agissait d’une aggravation de l’occlusion. Aussi certains ont pensé que les injections répétées d’un bloqueur du VEGF allaient entraîner une majoration des zones de non-perfusion. Les travaux de Campochiaro [6] ont permis de montrer que, au contraire, les injections d’anti-VEGF (ranibizumab dans ce cas précis) permettaient non seulement une diminution de l’incidence de l’ischémie rétinienne par rapport aux sujets non traités, mais aussi une réduction des surfaces non perfusées.
Le pegaptanib a été la première molécule testée dans l’OVCR. Il s’agissait d’une étude de phase 2 en double aveugle, versus placebo sur une durée de 6 mois [7]. Les patients traités recevaient 0,3 mg ou 1 mg de pegaptanib. L’OMV diminuait de façon significative dans les groupes traités par rapport au groupe placebo, et l’acuité visuelle augmentait en moyenne de 7,1 et 9,9 lettres dans les groupes traités contre 3,0 dans le groupe placebo. Malgré ces résultats, l’arrivée du bévacizumab et du ranibizumab a totalement éclipsé le pegaptanib de l’éventail thérapeutique de l’OMV.
Le bévacizumab a également été évalué dans une étude prospective randomisée en double insu versus placebo [8] : 60 patients présentant un OMV recevaient toutes les 6 semaines 1,25 mg de bévacizumab ou un placebo pendant les 6 premiers mois. À l’issue de ces 6 mois, tous les patients recevaient l’anti-VEGF toutes les 6 semaines jusqu’à 12 mois. À 1 an, le gain moyen d’acuité visuelle était de 16 lettres dans le groupe bévacizumab/bévacizumab contre 4,6 lettres dans le groupe placebo/bévacizumab.
L’efficacité du ranibizumab a été démontrée grâce à l’étude CRUISE, une étude multicentrique, randomisée, en double aveugle sur 392 yeux [9]. Les 6 premiers mois, les patients étaient randomisés dans trois groupes : 0,3 mg ou 0,5 mg de ranibizumab mensuel et un groupe placebo. Les 6 mois suivants le groupe contrôle était traité, comme les deux autres, avec du ranibizumab selon un mode PRN. À 6 moi, l’amélioration de l’acuité visuelle était respectivement de 12,7 et 14,9 lettres dans chaque groupe traité, et de 0,8 lettre dans le groupe placebo. À 1 an, l’amélioration moyenne de l’acuité visuelle était de 13,9 lettres dans les deux groupes traités contre 7,3 lettres dans le groupe placebo/ranibizumab. À 6 mois, environ 47 % des yeux dans les groupes traités gagnaient au moins 15 lettres contre 17 % dans le groupe placebo. À 1 an, la proportion reste la même pour les groupes traités, et elle passe à 33 % dans le groupe placebo/ranibizumab. Notons que lors du passage du traitement mensuel au traitement PRN, on constate une baisse d’acuité visuelle et la question s’est posée de savoir si en poursuivant le traitement mensuel pendant 1 an, l’acuité visuelle finale pouvait être meilleure.
Deux autres études ont été réalisées pour étudier le devenir à long terme des OMV traités par ranibizumab. L’étude HORIZON [10] a recruté 304 patients ayant complété l’étude CRUISE pour une année supplémentaire. Cette étude était ouverte, avec un seul bras, tous les patients recevant du ranibizumab. Les patients étaient revus au moins tous les 3 mois, et injectés si nécessaire. À 2 ans, 44 % des OVCR présentaient une disparition de l’OMV et parmi ceux-là, 78 % gagnaient au moins 15 lettres (64 % d’acuité visuelle ≥ 20/40). En revanche, les 56 % restants ont nécessité six injections la deuxième année et seuls 33 % ont gagné au moins 15 lettres (28 % d’acuité visuelle ≥ 20/40).
L’étude RETAIN [11] a prolongé l’étude HORIZON pour deux années supplémentaires, mais seulement sur 32 patients. À 4 ans, seuls 44 % (14 patients) avaient une disparition de l’OMV, et parmi ceux-là, 64 % avaient une acuité visuelle égale ou supérieure à 20/40, et 71 % avaient eu leur dernière injection 2 ans auparavant. Seuls 27,8 % des patients avec OMV persistant avaient une acuité visuelle égale ou supérieure à 20/40. Cela signifie également que même avec une bonne récupération visuelle, certains nécessitent encore des injections de ranibizumab tout au long des quatre années.
Enfin l’étude SHORE a évalué le ranibizumab mensuel versus PRN entre les mois 7 et 15 pour les patients ayant obtenu une stabilisation de l’OMV après les sept premières injections mensuelles [12]. Cette étude montre qu’une fois la stabilisation obtenue, le PRN est aussi efficace que les injections mensuelles en termes d’acuité visuelle.
L’aflibercept a fait l’objet de deux études randomisées, multicentriques et en double aveugle versus placebo : COPERNICUS et GALILEO [13, 14]. Il s’agissait d’études sur 12 mois au cours desquelles tous les patients recevaient une injection d’aflibercept par mois les 6 premiers mois ou un placebo. Ensuite, dans COPERNICUS, les patients recevaient de l’aflibercept en PRN, et les patients du groupe contrôle pouvaient également être traités par aflibercept. Dans GALILEO, les patients restaient dans leur groupe d’origine, aflibercept ou placebo, mais avec la possibilité de recours au laser pour traiter les néovaisseaux rétiniens à tout moment de l’étude.
Dans COPERNICUS, 55,3 % des patients gagnaient au moins 15 lettres contre 30,1 % dans le groupe contrôle à 12 mois. Mais à 2 ans [15], l’acuité visuelle obtenue au 12e mois ne s’est pas maintenue pas dans le groupe aflibercept. Il est possible que le critère d’inclusion permettant d’inclure des patients ayant un OMV depuis 9 mois, c’est-à-dire relativement ancien, ait joué un rôle. L’espacement des contrôles tous les 3 mois pendant la deuxième année (comme dans HORIZON) peut aussi expliquer la baisse visuelle. Enfin le groupe contrôle n’a jamais rattrapé le bénéfice visuel obtenu chez les patients traités d’emblée par aflibercept.
Dans GALILEO, à 1 an, 60 % des patients traités avaient amélioré leur acuité visuelle d’au moins 15 lettres, contre 32 % dans le groupe placebo, et la réduction d’épaisseur maculaire était respectivement de 423 µm et 219 µm dans les deux groupes. Ces résultats se maintiennent à 18 mois [16].
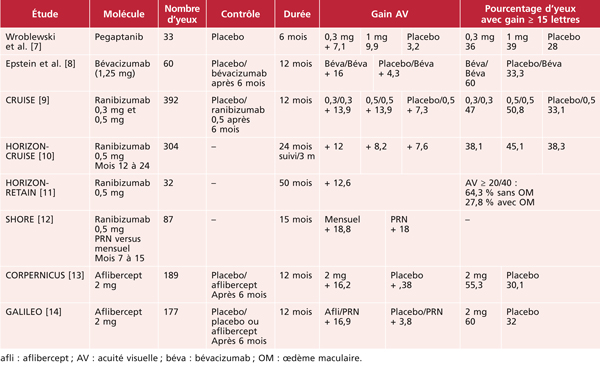
Tableau 9-5 Études concernant les anti-VEGF pour les occlusions de la veine centrale de la rétine.
Une petite étude sur 20 sujets a étudié le pegaptanib dans les OBVR et a montré des résultats encourageants sur l’acuité visuelle et l’épaisseur maculaire [17]. Mais ces résultats n’ont pas été confirmés par des études plus larges.
L’efficacité du bévacizumab a été étudiée dans de nombreuses études, et de façon précoce dans l’utilisation des anti-VEGF. L’une des plus récentes, ouverte, sur 2 ans et avec un seul bras [18], montre un bénéfice réel des injections sur une série de 105 patients, et avec un nombre moyen d’injections très faible : 3,8 ± 1,5 injections sur les 2 ans. Russo et al. [19] ont également comparé le bévacizumab au traitement laser en grid sur 12 mois. Le gain d’acuité visuelle était de 15,5 lettres dans le groupe bévacizumab contre 10 lettres dans le groupe laser.
Le ranibizumab a été initialement évalué dans l’étude pivot BRAVO [20], étude multicentrique, randomisée et en double insu chez 397 patients sur 1 an. Les sujets étaient assignés dans trois groupes : 0,3 mg ou 0,5 mg de ranibizumab mensuel et un groupe placebo pour les 6 premiers mois. Les 6 mois suivants, tous les patients étaient sous 0,5 mg de ranibizumab en PRN. À partir du 3e mois, un traitement de recours par laser en grid était autorisé dans les trois groupes. À 6 mois, le gain d’acuité visuelle était de 16,6 lettres (0,3 mg) et 18,3 lettres (0,5 mg) contre 7,3 lettres dans le groupe contrôle. Le pourcentage de patients améliorant leur acuité visuelle d’au moins 15 lettres était respectivement de 55 % et 61 % dans les groupes traités, contre 28,8 % dans le groupe placebo. À 1 an, l’amélioration était de 16,4 lettres (0,3 mg) et 18,3 lettres (0,5 mg) contre 12,1 lettres dans le groupe placebo/0,5 mg ranibizumab. Le pourcentage de patients améliorant leur acuité visuelle d’au moins 15 lettres était respectivement de 56 % (0,3 mg) et 60,3 % (0,5 mg) contre 43,9 % dans le groupe placebo/0,5 mg ranibizumab. Comme dans l’étude CRUISE, les patients traités présentaient une baisse d’acuité visuelle lors du passage du traitement mensuel en PRN. Une étude HORIZON pour les OBVR a été réalisée selon le même schéma que pour les OVCR [10]. À 2 ans, la moitié des patients avait une disparition de l’OMV avec une acuité visuelle égale ou supérieure à 20/40 dans 80 % des cas. L’autre moitié a nécessité une moyenne de trois injections dans l’année, mais là encore 80 % avaient une acuité visuelle égale ou supérieure à 20/40, probablement grâce à l’association à un traitement laser.
Une étude RETAIN a également été menée, sur 34 patients [11]. À 4 ans, 50 % des patients avaient une résolution de l’OMV, résolution obtenue dès la deuxième année pour 76 % d’entre eux, et 80 % avaient une acuité visuelle égale ou supérieure à 20/40.
Comme dans les OVCR, l’étude SHORE a montré l’absence de différence entre les traitements mensuels et PRN après stabilisation obtenue à partir du 7e mois.
L’aflibercept a fait l’objet de l’étude VIBRANT, randomisée en double insu (aflibercept tous les mois versus laser en grid) sur 6 mois chez 183 patients [21] : 52,7 % des patients dans le groupe aflibercept avaient amélioré leur acuité visuelle d’au moins 15 lettres contre 26,7 % dans le groupe laser, et en moyenne le gain était respectivement de 17 et 6,9 lettres.
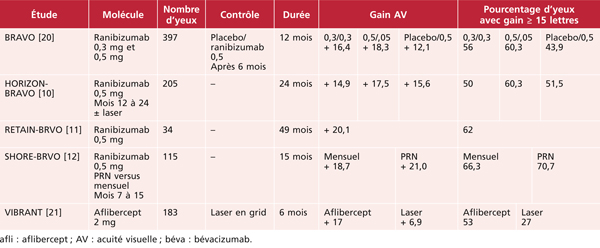
Tableau 9-6 Études concernant les anti-VEGF pour les occlusions de branche veineuse rétinienne.
Au moment où nous rédigeons ce texte, seuls le ranibizumab et l’afliberceptt ont l’AMM pour le traitement de l’OMV dans les OVCR et OBVR pour le premier, et uniquement dans l’OVCR pour le second.
Même si des recommandations strictes concernant l’utilisation des anti-VEGF dans l’OMV ne sont pas établies, il n’en demeure pas moins qu’un consensus s’est fait autour de quelques règles :
un OMV doit être traité le plus tôt possible. Toutes les études ont bien montré que les patients du groupe contrôle ne rattrapaient jamais à 1 an l’acuité visuelle de ceux des groupes traités. Il ne faut donc plus attendre 3 ou 6 mois l’éventuelle résolution spontanée d’un OMV avant de traiter. Néanmoins, pour les OVR modérées, il est possible d’attendre quelques semaines après survenue de l’OMV pour vérifier quelle est la tendance évolutive et ne pas traiter une forme d’évolution spontanément favorable [22] ;
le traitement initial comprend généralement des injections mensuelles (généralement trois) jusqu’à la résolution de l’OMV ou jusqu’à l’absence d’amélioration après deux ou trois injections. Dans ce cas, il faut modifier la molécule ou la classe thérapeutique ;
après la phase de traitement initial, les deux schémas classiques, PRN (à la demande) ou « treat and extend » peuvent être utilisés. Cette deuxième phase de traitement peut être proposée d’emblée après la phase initiale ou bien seulement en cas de récidive de l’OMV après la première série d’IVT. Dans le cas d’un suivi en « treat and extend », les intervalles entre chaque injection seront augmentés très graduellement, en général de 1 à 2 semaines à chaque fois selon la rapidité de réapparition de l’OMV. Dès la réapparition des signes d’OMV, il faudra raccourcir l’intervalle en conséquence. Il n’y a à ce jour qu’une étude rétrospective évaluant la méthode du « treat and extend » dans le traitement de l’OBVR avec le bévacizumab, montrant une efficacité égale au PRN avec une diminution du nombre de visites annuelles et du coût médical [23] ;
les résultats qui montrent, après les 6 mois de traitement mensuel, l’équivalence entre poursuite des injections mensuelles et PRN rappellent la nécessité d’un contrôle mensuel. En effet, les études CRUISE, HORIZON et COPERNICUS montrent qu’un suivi tous les 3 mois n’est pas suffisant. Ce n’est qu’à partir de la deuxième année que l’on peut, en cas de stabilité, ne voir les patients que tous les 3 mois ;
environ la moitié des patients nécessitent des injections d’anti-VEGF au long cours en raison de la persistance ou de la récurrence d’un OMV. Campochiaro [6] a bien montré que les injections répétées d’anti-VEGF ne majoraient pas les zones de non-perfusion rétiniennes, mais il est cependant indispensable de rechercher en angiographie et de traiter au laser les zones ischémiques qui sont à l’origine non seulement des néovaisseaux, mais aussi de la production de VEGF et ainsi de la persistance de l’OMV ;
dans le cas d’OBVR, une association de ranibizumab et de laser en grid est possible, le même jour éventuellement, mais il faudra commencer par l’injection de ranibizumab.
L’utilisation des anti-VEGF dans le traitement de l’OMV a considérablement amélioré le pronostic visuel des patients. Même si les schémas thérapeutiques ne suivent pas actuellement des recommandations strictes, notamment en ce qui concerne le choix de la molécule en première intention, la prise en charge précoce est actuellement admise par tous.
[1] Pe’er J, Folberg R, Itin A, et al. Vascular endothelial growth factor upregulation in human central retinal vein occlusion. Ophthalmology 1998 ; 105 : 412-6.
[2] Shima DT, Gougos A, Miller JW, et al. Cloning and mRNA expression of vascular endothelial growth factor in ischemic retinas of Macaca fascicularis. Invest Ophthalmol Vis Sci 1996 ; 37 : 1334-40.
[3] Noma H, Funatsu H, Mimura T, et al. Role of soluble vascular endothelial growth factor receptor-2 in macular edema with central retinal vein occlusion. Br J Ophthalmol 2011 ; 95 : 788-92.
[4] Boyd Sr, Zachary I, Chakravarthy U, et al. Correlation of increased vascular endothelial growth factor with neovascularization and permeability in ischemic central vein occlusion. Arch 2002 ; 120 : 1644-50.
[5] Ehlers JP, Fekrat S. Retinal Vein Occlusion : beyond the acute event. Surv Ophthalmol 2011 ; 56 : 281-99.
[6] Campochiaro PA, Bhisitkul RB, Shapiro H, Rubio RG. Vascular endothelial growth factor promotes progressive retinal nonperfusion in patients with retinal vein occlusion. Ophthalmology 2013 ; 120 : 795-802.
[7] Wroblewski JJ, Wells JA 3rd, Adamis AP, et al. Pegaptanib sodium for macular edema secondary to central retinal vein occlusion. Arch Ophthalmol 2009 ; 127 : 374-80.
[8] Epstein DL, Algvere PV, Von Wendt G, et al. Benefit from bevacizumab for macular edema in central retinal vein occlusion: twelve month results of a prospective, randomized study. Ophthalmology 2012 ; 119 : 2587-91.
[9] Brown DM, Campochiaro PA, Singh RP, et al. Ranibizumab for macular edema following central retinal vein occlusion: six-month primary end point results of a phase III study. Ophthalmology 2010 ; 117 : 1124-33.
[10] Heier JS, Campochiaro PA, Yau L, et al. Ranibizumab for macular edema due to retinal vein occlusion : long-term follow-up in the HORIZON trial. Ophthalmology 2012 ; 119 : 802-9.
[11] Campochiaro PA, Sophie R, Pearlman J, et al. Long-term outcomes in patients with retinal vein occlusion treated with ranibizumab : the RETAIN study. Ophthalmology 2014 ; 121 : 209-19.
[12] Campochiaro PA, Wykoff CC, Singer M, et al. Monthly versus as-needed ranibizumab injections in patients with retinal vein occlusion : the SHORE study. Ophthalmology 2014 ; 121 : 2432-42.
[13] Brown DM, Heier JS, Clark WL, et al. Intravitreal aflibercept injection for macular edema secondary to central retinal vein occlusion : 1-year results from the phase 3 COPERNICUS study. Am J Ophthalmol 2013 ; 155 : 429-37.
[14] Korobelnik JF, Holz FG, Roider J, et al. Intravitreal Aflibercept injection for macular edema resulting from central retinal vein occlusion : one-year results of the phase 3 GALILEO study. Ophthalmology 2014 ; 121 : 202-8.
[15] Heier JS, Clark WL, Boyer DS, et al. Intravitreal aflibercept injection for macular edema due to central retinal vein occlusion: two-year results from the COPERNICUS study. Ophthalmology 2014 ; 121 : 1414-20.
[16] Ogura Y, Roider J, Korobelnik JF, et al. Intravitreal aflibercept for macular edema secondary to central retinal vein occlusion : 18-month results of the phase 3 GALILEO study. Am J Ophthalmol 2014 ; 158 : 1032-8.
[17] Wroblewski JJ, Wells JA 3rd, Gonzales CR. Pegaptanib sodium for macular edema secondary to branch retinal vein occlusion. Am J Ophthalmol 2010 ; 149 : 147-54.
[18] Hikichi T, Higuchi M, Matsushita T, et al. Two-year outcomes of intravitreal bevacizumab therapy for macular edema secondary to branch retinal vein occlusion. Br J Ophthalmol 2014 ; 98 : 195-9.
[19] Russo V, Barone A, Conte E, et al. Bevacizumab compared with macular laser grid photocoagulation for cystoid macular edema in branch retinal vein occlusion. Retina 2009 ; 29 : 511-5.
[20] Campochiaro PA, Heier JS, Feiner L, et al. Ranibizumab for macular edema following branch retinal vein occlusion : six-month primary end point results of a phase III study. Ophthalmology 2010 ; 117 : 1102-12.
[21] Campochiaro PA, Clark WL, Boyer DS, et al. Intravitreal aflibercept for macular edema following branch retinal vein occlusion : the 24-week results of the VIBRANT study. Ophthalmology 2015 ; 122 : 538-44.
[22] Girmens JF, Glacet-Bernard A, Korjikian L, et al. Prise en charge de l’œdème maculaire secondaire à une occlusion veineuse rétinienne. J Fr Ophtalmol 2015 ; 38 : 253-63.
[23] Rush Rb, Simunovic MP, Aragon AV 2nd, Ysasaga JE. Treat and extend intravitreal bevacizumab for branch retinal vein occlusion. Ophthalmic Surg Lasers Imaging Retina 2014 ; 45 : 212-6.
K. Angioi-Duprez, F. Tréchot, J.-B. Conart
➤ Le traitement de l’œdème maculaire lié aux OVR a évolué depuis les premières études de référence.
➤ Pour les OBV, la grille maculaire a longtemps été la référence. Les injections d’anti-VEGF semblent actuellement apporter une meilleure amélioration visuelle mais les résultats avec un suivi plus long de 2 à 3 ans sont nécessaires avant de conclure définitivement.
➤ Pour les OVCR, il n’y a pas d’indication de traitement par grille maculaire. Les traitements par injections d’anti-VEGF ou de corticoïdes sont les traitements de première intention.
➤ Le traitement par laser focal peut être proposé pour des anomalies de type dilatations anévrismales de grande taille survenant au long cours.
➤ Dans les OBV comme dans les OVCR, la récidive de l’OMV doit faire rechercher des territoires de non-perfusion en périphérie rétinienne, dont le traitement au laser pourrait peut-être être bénéfique pour l’évolution de l’œdème.
La prise en charge de l’œdème maculaire (OM) lié à une occlusion de branche veineuse rétinienne a bénéficié des résultats de l’étude Branch Vein Occlusion Study (BVOS). Cette étude avait pour but d’analyser le rôle du laser dans la prévention de la néovascularisation et de l’hémorragie vitréenne et dans l’amélioration de l’acuité visuelle dans le cadre de l’œdème maculaire [1, 2]. Les résultats de cette étude ont montré une amélioration de l’acuité visuelle chez les patients traités par photocoagulation en grille (ou grid) maculaire. Un traitement par laser est donc indiqué devant un œdème persistant au moins 3 mois après le début d’une OBVR, et après résorption des hémorragies maculaires, quand l’acuité visuelle est inférieure à 5/10. Le traitement par grille est devenu et reste le traitement de référence de l’œdème maculaire des OBVR. Son mode d’action est mal connu et plusieurs hypothèses ont été avancées, telles une amélioration de l’oxygénation rétinienne, une amélioration de la résorption du liquide intrarétinien vers la choroïde [3, 4].
Les modalités de réalisation du traitement sont les suivantes (tableau 9-7) : les impacts doivent être de petite taille (100 µ de diamètre), d’une faible durée (0,10 s) et d’une faible intensité pour éviter un surdosage et une destruction de toutes les couches de la rétine et la perception par le patient de microscotomes dans son champ de vision central. Il convient de respecter un espace d’au moins 100 µ entre les impacts pour éviter l’apparition de zones atrophiques liées à l’élargissement des cicatrices des impacts, elles aussi génératrices de scotomes potentiellement gênants pour les patients. Comme dans tous les cas de photocoagulation du pôle postérieur, il est prudent de rester à distance de la fovéola et de respecter une zone centrale d’environ un diamètre papillaire (fig. 9-62). À ce titre, il faut être très prudent avec l’utilisation des procédures automatisées des lasers multispot. L’autofluorescence est un bon moyen pour localiser les impacts une fois ceux-ci réalisés car ils doivent rester à la limite du visible à l’examen simple du fond d’œil. De plus, il faut toujours garder à l’esprit le risque de survenue d’une néovascularisation choroïdienne qui peut survenir secondairement à un traitement par laser et ceci en particulier chez les personnes âgées [5].
Malgré un traitement bien conduit, les récidives de l’œdème ne sont pas rares et un nouveau traitement aboutit inévitablement à plus de cicatrices. Certains auteurs proposent la réalisation d’un traitement à faible dose (subthreshold micropulse photocoagulation) qui semble permettre d’obtenir un contrôle de l’œdème maculaire en limitant le risque de séquelles anatomiques [6, 7]. Les résultats des premières études de ce type de traitement semblent montrer des résultats anatomiques et fonctionnels intéressants mais doivent être confirmés par de plus grandes séries et un suivi prolongé. De même, leurs résultats doivent être comparés à ceux des injections intravitréennes.
En effet, l’apparition des traitements par injections intravitréennes de corticoïdes et d’anti-VEGF a considérablement modifié la prise en charge de cette pathologie ; les résultats au long cours détermineront les traitements de référence et des modalités de passage de l’un à l’autre traitement ou des associations permettant d’optimiser les résultats fonctionnels [8–13]. Deux études ont comparé frontalement l’efficacité du laser en grille maculaire et des anti-VEGF dans le traitement de l’œdème maculaire des OBVR, l’étude BRIGHTER (laser versus ranibizumab) et l’étude VIBRANT (laser versus aflibercept) [14, 15]. Ces deux études concluent à une meilleure efficacité des injections intravitréennes d’anti-VEGF en termes d’acuité visuelle, mais leur recul est encore limité, de l’ordre de 6 mois. Par conséquent, il faudra attendre les résultats sur des durées plus longues avant de conclure définitivement à la supériorité des anti-VEGF.
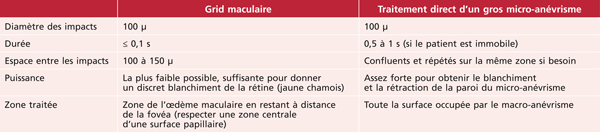
Tableau 9-7 Caractéristiques de la photocoagulation au laser dans les OBVR.
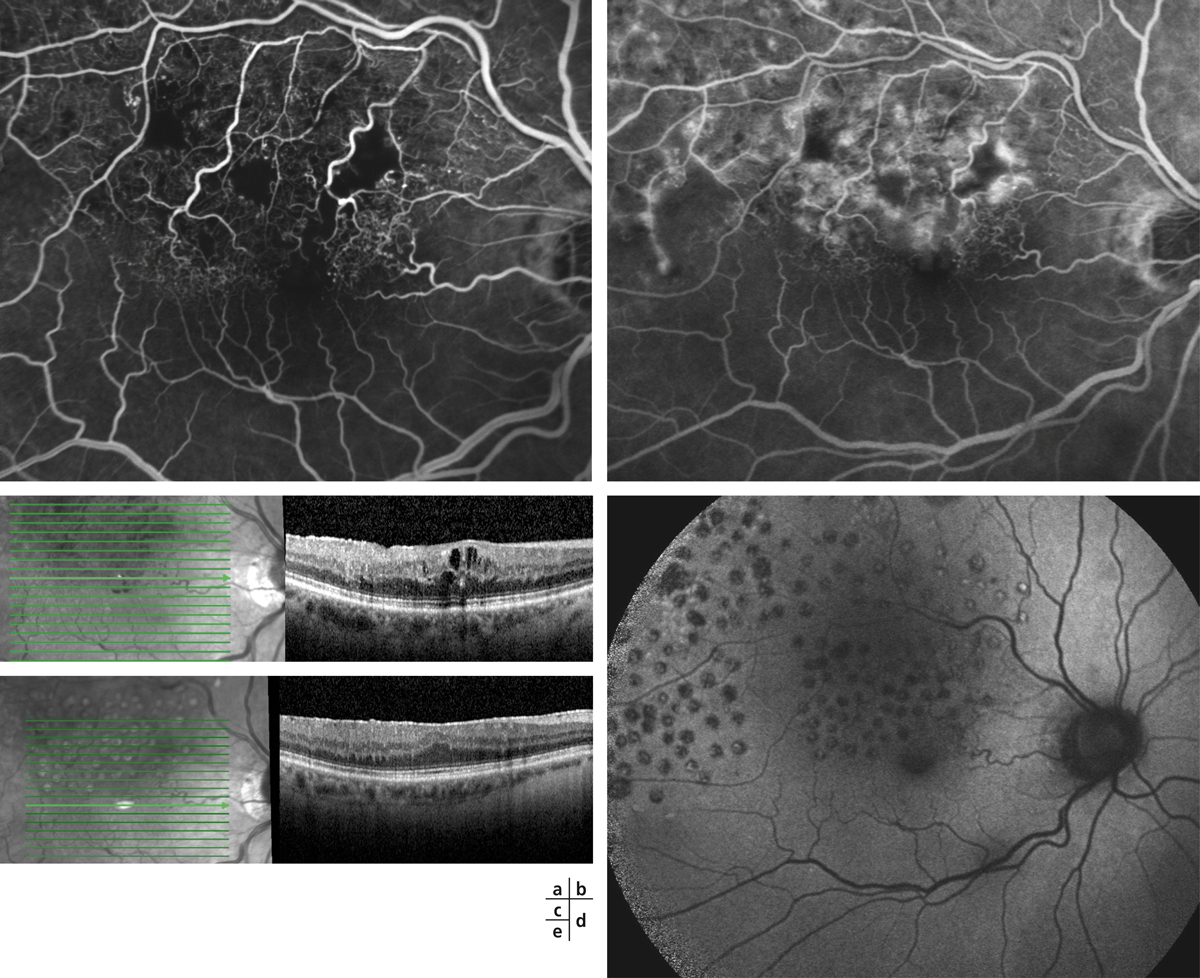
Fig. 9-62 OBVR mixte chez un homme de 62 ans.
Après une première injection d’Ozurdex® et le traitement de la périphérie rétinienne non perfusée, une récidive de l’OMV apparaît et fait chuter l’acuité visuelle de 8/10-P2 à 5/10-P3. L’angiographie à la fluorescéine montre au temps précoce (a) la présence de petits territoires de non-perfusion au pôle postérieur. La diffusion de colorant remplissant les logettes cystoïdes est bien visible aux temps tardifs (b). Sur l’OCT (c), des petites logettes sont réapparues dans la partie supérieure de la macula, avec augmentation de l’épaisseur centrale à 365 µ. Un traitement en grid maculaire est réalisé devant cette récidive de l’OMV combinée à une deuxième injection d’Ozurdex® ; le laser a lieu 2 mois après la deuxième injection ; les impacts sont de petite taille (100 µ), espacés, recouvrant la zone de diffusion sans empiéter dans les 1 000 µ centraux (d). Quatre mois après le traitement au laser, l’OMV a régressé ; une fine membrane épirétinienne est visible (e).
(Remerciements au Dr Agnès Glacet-Bernard.)
Dans les années 1990, l’efficacité du traitement par laser dans la rétinopathie diabétique et les OBVR ont incité à la mise en œuvre d’études dans le cadre des OVCR [16]. Certaines études révélaient que le traitement par grille maculaire en cas d’OM avait montré une régression au moins partielle de l’œdème, mais assez peu de résultats sur le plan de l’amélioration de l’acuité visuelle. Certains facteurs de meilleurs résultats avaient été identifiés, une acuité visuelle supérieure ou égale à 1/10, le jeune âge, l’absence d’ischémie maculaire et de remaniements pigmentaires centromaculaires. La CVOS avait pour but de rechercher non seulement l’intérêt d’une photocoagulation panrétinienne (PPR) préventive dans les formes ischémiques mais aussi l’intérêt d’un traitement par une grille maculaire en cas d’œdème maculaire persistant après une OVCR [17]. Même si de meilleures réponses au traitement ont été observées chez les patients de moins de 60 ans, les conclusions de cette étude n’ont pas permis de mettre en évidence un intérêt fonctionnel à ce traitement, contrairement au cas des œdèmes des OBVR. C’est la raison pour laquelle il n’a pas été recommandé dans le cas des OVCR. De plus, depuis quelques années, l’avènement des traitements par injections intravitréennes de corticoïdes ou d’anti-VEGF ont considérablement modifié la prise en charge de ces œdèmes maculaires [18] et il ne persiste pas d’indication de traitement pas grille maculaire sauf dans des formes très particulières.
Il existe certaines formes cliniques atypiques d’œdème maculaire, liées au remodelage vasculaire qui survient à moyen et long terme après à une OBVR ou plus rarement une OVCR.
Dans certains cas, il peut exister des dilatations capillaires micro-anévrismales dont la taille peut atteindre celle d’un macro-anévrisme, mieux identifiées sur les clichés d’angiographie au vert d’indocyanine, en comparaison à l’angiographie à la fluorescéine ou à l’OCT (fig. 9-63, voir aussi fig. 9-31). Lorsque la diffusion est importante, un traitement par laser sélectif des lésions de type macro-anévrisme est recommandé. Le but du traitement est l’occlusion du macro-anévrisme. Pour cela, il faut envisager de petits impacts de 100 µ de diamètre, de durée plus longue (0,1 à 0,5 s si le patient est bien immobile) à une puissance suffisante pour observer une modification de la coloration de la lésion (souvent, la paroi du macro-anévrisme blanchit et se rétracte, puissance de 100 à 200 mW). Si la photocoagulation directe n’est pas possible en raison de la proximité de la zone fovéolaire, il peut être utile d’y associer une grille dans la zone adjacente. Le résultat est différé et un contrôle doit être effectué 3 à 4 mois après le traitement, permettant non seulement d’évaluer son efficacité en vérifiant la réduction de l’œdème mais aussi de contrôler qu’il n’existe pas de nouvelles lésions [19, 20].
Chez certains patients, il peut exister un œdème maculaire ancien associé à une réaction exsudative majeure autour de l’œdème. Ces patients pourraient alors bénéficier d’un traitement par laser focal en grille des territoires œdémateux, associé éventuellement au traitement direct de dilatations micro-anévrismales. Comme dans le cas précédent, un contrôle différé de plusieurs mois sera réalisé car la régression de l’œdème et des exsudats est très lente.
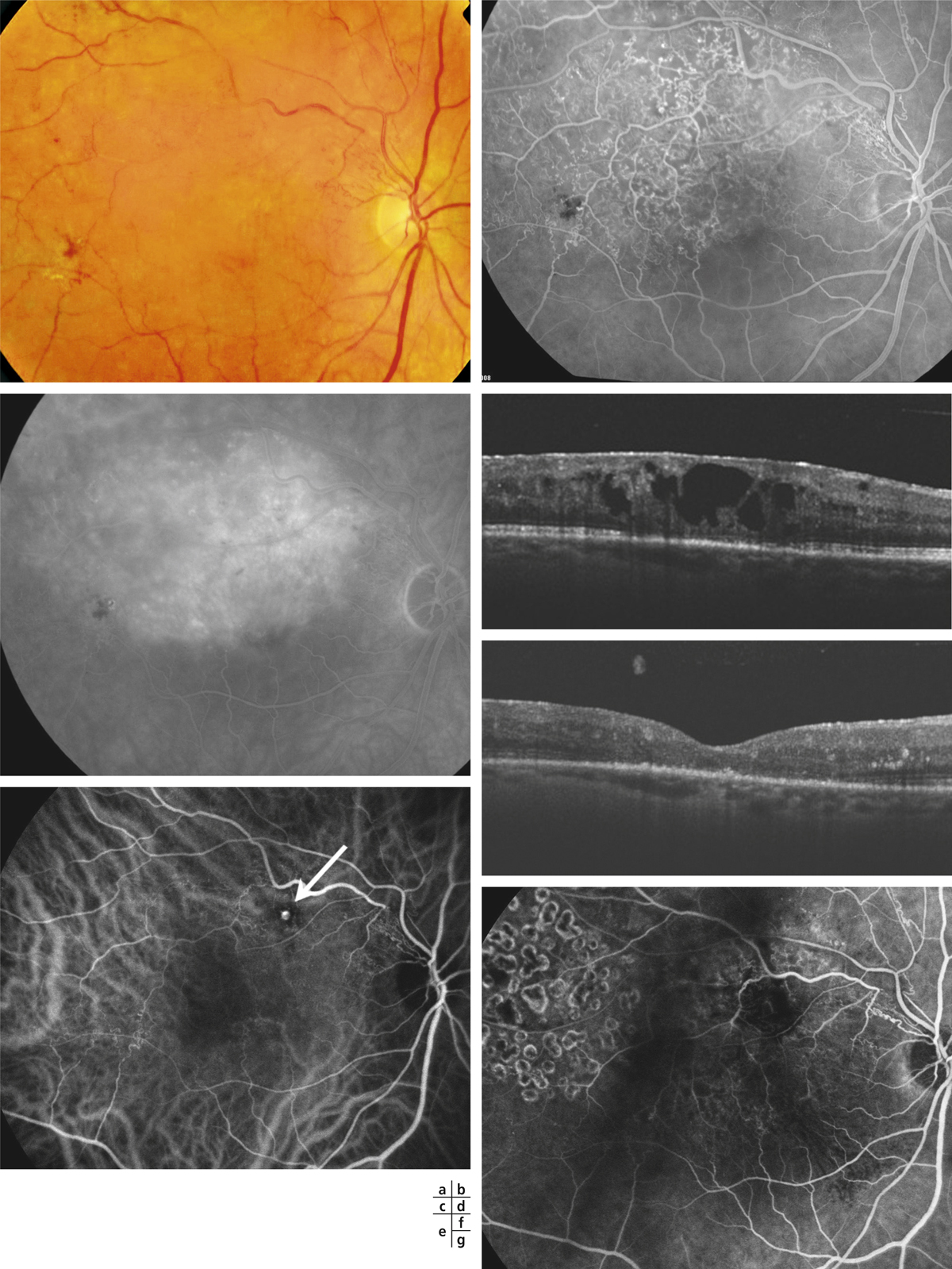
Fig. 9-63 OMV persistant 18 mois après l’apparition d’une OBV chez une femme de 73 ans.
Sur le cliché couleur (a), les hémorragies ont presque totalement disparu sauf dans la région du raphé horizontal (circulation de suppléance). L’angiographie à la fluorescéine (b, c) retrouve une raréfaction des capillaires avec diffusion abondante de colorant, responsable de l’augmentation d’épaisseur de la macula sur l’OCT (d). L’angiographie au vert d’Infracyanine® permet d’identifier une dilatation macro-anévrismale (flèche) au sein de la zone de diffusion (e). Après traitement direct du macro-anévrisme combiné au traitement de la périphérie rétinienne ischémique, l’OMV a disparu sur l’OCT (f) et sur l’angiographie ; une cicatrice hypofluorescente remplace le macro-anévrisme (g).
(Remerciements au Dr Agnès Glacet-Bernard et au Dr Alain Zourdani.)
Certains auteurs ont par ailleurs proposé la réalisation d’une photocoagulation panrétinienne comme traitement adjuvant de l’OM. En effet, la rétine ischémique produit du VEGF qui favorise l’apparition et la persistance de l’œdème. Par conséquent, sa destruction par la photocoagulation au laser permettrait de favoriser la régression de l’œdème. L’étude de Spaide en 2013 portant sur dix patients atteints d’OVCR a comparé la fréquence des injections de ranibizumab pendant 6 mois avant et 6 mois après photocoagulation des territoires ischémiques périphériques [21]. Aucune différence significative en termes d’acuité visuelle et de nombre d’injections n’a été mise en évidence (même s’il existait une tendance à moins d’injections dans le groupe traité aussi par laser). Par contre, l’étude de Rehaket et al. publiée en 2014 qui comparait deux groupes de patients atteints d’OVCR (un groupe ranibizumab seul versus un groupe ranibizumab plus laser périphérique) a montré une amélioration de l’acuité visuelle chez les patients qui ont bénéficié d’une photocoagulation des territoires de non-perfusion, mais la différence n’était pas statistiquement significative [22]. Ces deux études comportent de très petits effectifs, et une étude plus large serait nécessaire pour établir de manière plus claire le rôle du traitement au laser de la périphérie rétinienne dans l’évolution de l’OMV.
[1] Branch Vein Occlusion Study Group. Argon laser scatter photocoagulation for prevention of neovascularization and vitreous hemorrhage in branch vein occlusion. A randomized clinical trial. Arch Ophthalmol 1986 ; 104 : 34-41.
[2] Branch Vein Occlusion Study Group. Argon laser scatter photocoagulation for macular edema in branch vein occlusion. Am J Ophthalmol 1984 : 98 : 271-82.
[3] Arnasson A, Stefansson E. Laser treatment and the mechamism of edema reduction in branch vein occlusion. InvestOphthalmol Vis Sci 2000 ; 41 : 877-9.
[4] Pournaras CJ, Tsacopoulos M, Strommer K, et al. Scatter photocoagulation restores tissue hypoxia in experimental vasoproliferativemicroangiopathy in miniature pigs. Ophthalmology 1990 ; 97 : 1329-33.
[5] Glacet-Bernard A, Coscas G. Traitement par photocoagulation au laser. In : Glacet-Bernard A, Coscas G, Pournaras CJ. Occlusions veineuses rétiniennes. Rapport du Bulletin des Sociétés d’ophtalmologie de France ; 2011, p. 251-66.
[6] Battaglia Parodi M, Iacono P, Bandello F. Subthreshold grid laser versus intravitreal bevacizumab as second-line therapy for macular edema in branch retinal occlusion recurring after conventional grid laser treatment. Graefes Arch Clin Exp Ophthalmol 2015 ; 253 : 1647-51.
[7] Inagaki K, Ohkoshi K, Ohde S, et al. Subthreshold micropulse photocoagulation for persistent macular edema secondary to branch retinal vein occlusion including best-corrected visual acuity greater than 20/40. J Ophthalmol 2014 ; 2014 : 251257.
[8] Salinas-Alamán A, Zarranz-Ventura J, Caire González-Jauregui JM, et al. Intravitreal bevacizumab associated with grid laser photocoagulation in macular edema secondary to branch retinal vein occlusion. Eur J Ophthalmol 2011 ; 21 : 4-9.
[9] Donati S, Barosi P, Bianchi M, et al. Combined intravitreal bevacizumab and grid laser photocoagulation for macular edema secondary to branch retinal vein occlusion. Eur J Ophthalmol 2012 ; 22 : 607-14.
[10] Leitritz MA, Gelisken F, Ziemssen F, et al. Grid laser photocoagulation for macular oedema due to branch retinal vein occlusion in the age of bevacizumab ? Results of a prospective study with crossover design. Br J Ophthalmol 2013 ; 97 : 215-9.
[11] Azad SV, Salman A, Mahajan D, et al. Comparative evaluation between ranibizumab combined with laser and bevacizumab combined with laser versus laser alone for macular oedema secondary to branch retinal vein occlusion. Middle East Afr J Ophthalmol 2014 ; 21 : 296-301.
[12] Tan MH, McAllister IL, Gillies ME, et al. Randomized controlled trial of intravitreal ranibizumab versus standard grid laser for macular edema following branch retinal vein occlusion. Am J Ophthalmol 2014 ; 157 : 237-47.
[13] Pichi F, Specchia C, Vitale L, et al. Combination therapy with dexamethasone intravitreal implant and macular grid laser in patients with branch retinal vein occlusion. Am J Ophthalmol 2014 ; 157 : 607-15.
[14] Campochiaro PA, Clark WL, Boyer DS, et al. Intravitreal aflibercept for macular edema following branch retinal vein occlusion : the 24-week results of the VIBRANT study. Ophthalmology 2015 ; 122 : 538-44.
[15] Gerding H, Boscia F, Mones JM, et al. Ranibizumab ± adjunctive laser vs laser in patients with visual impairment due to macular edema secondary to branch retinal vein occlusion (BRVO) : sesign and baseline characteristics of the BRIGHTER study. Poster. IOVS 2014 ; 55 : 607.
[16] Hayrey SS, Klugman MR, Podhajsky P, et al. Argon laser photocoagulation in ischemic central vein occlusion. A ten-year study. Graefes Arch Clin Exp Ophthalmol 1983 ; 228 : 236-9.
[17] The central Vein Occlusion Study Group. A randomized clinical trial of early panretinal photocoagulation in ischemic central vein occlusion. Ophthalmology 1995 ; 102 : 1434-44.
[18] Shah NJ, Shah UN. Long-term effect of early intervention with single intravitreal injection of bevacizumab followed by panretinal and macular grid photocoagulation in central retinal vein occlusion (CRVO) with macular edema : a pilot study. Eye (Lond) 2011 ; 25 : 239-44.
[19] BattagliaParodi M, Blondel E, Ravalico G. Capillary microaneurysms in central vein occlusion. Ophthalmologica 1995 ; 209 : 248-50.
[20] Bourhis A, Girmens JF, Boni S, et al. Imaging of macroaneurysm occuring during retinal vein occlusion and diabetic retinopathy by indocyanine green angiography and high resolution optical coherence tomography. Graefes Arch Clin Exp Ophthalmol 2010 ; 248 : 161-6.
[21] Spaide RF. Prospective study of peripheral panretinal photocoagulation of areas of nonperfusion in central retinal vein occlusion. Retina 2013 ; 33 : 56-62.
[22] Rehak M, Tilgner E, Franke A, et al. Early peripheral laser photocoagulation of nonperfused retina improves vision in patients with central retinal vein occlusion (results of a proof of concept study). Graefes Arch Clin Exp Ophthalmol 2014 ; 252 : 745-52.
A. Glacet-Bernard
➤ Il n’existe pas de consensus sur les indications des traitements médicaux dans les OVR, et peu d’études contrôlées sont disponibles.
➤ Parmi ces traitements étiologiques, les correcteurs rhéologiques et surtout l’hémodilution ont démontré des résultats positifs dans les OVR au cours d’études prospectives randomisées.
➤ En améliorant globalement le pronostic de l’OVR, l’œdème maculaire est aussi diminué par ces traitements, et le recours à un traitement symptomatique de l’œdème est moins souvent nécessaire.
➤ Cependant, les récentes modifications des indications des hydroxyéthylamidons mettent un frein à la pratique de l’hémodilution selon ses protocoles habituels dans les OVR.
Les traitements à visée vasculaire sont encore appelés traitements étiologiques, car ils visent à traiter le ralentissement circulatoire et restaurer les conditions d’un débit sanguin rétinien plus proche de la normale pour limiter les effets de l’occlusion veineuse et en particulier l’œdème maculaire (OMV). Ces derniers englobent les traitements médicaux incluant l’hémodilution et les approches chirurgicales de décompression vasculaires (voir plus loin « Chirurgie dans l’œdème maculaire des occlusions veineuses rétiniennes »).
Peu d’études ont été consacrées à étudier les traitements à visée vasculaire dans les OVR. En ce qui concerne les anti-agrégants plaquettaires et les anticoagulants, aucune étude n’a démontré une efficacité de ces traitements dans les OVR [1–3] ; à l’inverse, Hayreh a récemment montré que les patients prenant ces traitements au cours d’une OVR avaient un moins bon pronostic visuel, possiblement en raison d’un risque accru d’hémorragies, connues pour leur effet délétère sur la vision [4].
Les fibrinolytiques avaient montré une certaine efficacité, mais leur utilisation n’est pas recommandée dans les OVR en raison du risque vital par hémorragie massive chez des personnes souvent âgées ayant un terrain cardiovasculaire [5–7].
Les correcteurs rhéologiques (troxérutine et pentoxifylline) ont une place à part, car ils sont les seuls à avoir montré des résultats positifs dans les études randomisées [8–10]. Toutefois, le caractère monocentrique des études et l’absence de confirmation par des études de plus grande ampleur expliquent sans doute l’absence de consensus sur ces traitements. En 1994, l’étude randomisée et contrôlée en double insu sur la troxérutine avait montré que les patients traités par 7 g/jour pendant 4 mois avaient moins d’œdème maculaire à la fin du suivi que les patients du groupe placebo ; on observait également dans le groupe traité une meilleure acuité visuelle et moins de conversion en forme ischémique [8].
En dehors des traitements à visée vasculaire, et avant l’ère des injections intravitréennes, la corticothérapie par voie générale a longtemps été proposée dans certaines formes ayant une composante œdémateuse marquée, ou parfois en cas d’œdème maculaire persistant. Ce traitement avait montré une efficacité sur la résorption de l’OMV et sur l’acuité visuelle mais il existait un effet rebond à l’arrêt du traitement. De plus, l’administration prolongée de corticoïdes chez des patients âgés ayant un terrain vasculaire était délétère sur le plan vasculaire. Un consensus s’est ainsi formé pour ne pas recommander ce traitement dans les OVR, à l’exception de certaines formes survenant chez des sujets jeunes au lit vasculaire sain quand une origine inflammatoire pouvait être suspectée [7]. La possibilité d’une corticothérapie locale par injection de l’implant de dexaméthasone a totalement remplacé cette prescription par voie générale.
Ce traitement étiologique permet, en diminuant de manière drastique la viscosité sanguine, d’accélérer le débit circulatoire dans les vaisseaux rétiniens et de rompre le cercle vicieux de la stase présente lors de la plupart des OVR [9, 11–15]. Ce traitement est appliqué à la phase aiguë des OVR, et la précocité du traitement a été démontrée comme étant un facteur pronostique important [16]. Seul Peduzzi avait proposé en 1985 d’appliquer ce traitement plusieurs mois après le début de l’OVR en cas d’OMV persistant [17], attitude qui n’a pas été suivie par la majorité des auteurs.
Néanmoins, des études récentes sur l’hémodilution se sont intéressées à l’effet sur l’OMV, en comparant l’hémodilution par soustraction de sang total ou par érythrocytaphérèse au traitement symptomatique de l’OMV par anti-VEGF [18, 19].
L’étude RAVO est une étude allemande prospective, randomisée, multicentrique, concernant 58 patients présentant une OVCR récente (moins de 8 semaines). Elle comparait un groupe de patients traités par hémodilution isovolémique (technique manuelle de soustraction de sang total) et un deuxième groupe traité conjointement par hémodilution et trois injections mensuelles de ranibizumab [18]. À partir du 3e mois, les deux groupes pouvaient recevoir un traitement par IVT de ranibizumab à la demande (PRN). Les résultats à 1 an étaient identiques dans les deux groupes en termes d’acuité visuelle et d’épaisseur maculaire. Le nombre d’IVT était moins important dans le groupe hémodilution seule et 30 % des patients de ce groupe n’ont eu besoin d’aucune IVT.
L’étude CHIC-3 est une étude française prospective, randomisée, multicentrique portant sur 44 patients présentant une OVCR récente (moins de 1 mois) et comparant trois groupes de traitement : hémodilution seule (technique automatisée par érythrocytaphérèse), IVT de ranibizumab (trois IVT mensuelles suivies d’un PRN), et les deux traitements combinés [19]. À 1 et 2 mois, l’acuité visuelle et l’épaisseur maculaire étaient rapidement améliorées de manière significative dans les deux groupes traités par ranibizumab, mais après un suivi de 6 mois, il n’existait pas de différence significative sur ces critères entre les trois groupes. Le groupe ayant reçu les deux traitements avait des résultats légèrement supérieurs au groupe hémodilution seule mais sans différence significative. Dans les deux groupes traités par IVT, certains effets secondaires observés pouvaient avoir un lien avec le traitement : une cataracte iatrogène, une suspicion d’accident vasculaire cérébral, un cas de rubéose irienne à l’arrêt des IVT, deux hémorragies intravitréennes.
Ces deux études convergent sur le fait que la prise en charge précoce par hémodilution ou IVT de ranibizumab donne le même résultat final, avec une diminution du nombre d’IVT et de leurs complications potentielles en cas de traitement par hémodilution. De plus, ces études montrent qu’il n’y a pas de perte de chance à démarrer le traitement par IVT d’anti-VEGF après une période de 1 à 2 mois.
Le traitement par hémodilution garde donc une place de choix lorsque le patient est vu à un stade très précoce, notamment chez les hommes jeunes qui correspondant au sous-groupe de patients les plus améliorés par cette modalité thérapeutique et en dehors des contre-indications classiques (diabète, pathologie cardiorespiratoire mal équilibrée, etc.). Cependant, les récentes modifications des indications des hydroxyéthylamidons depuis 2014 complexifient et limitent la pratique de l’hémodilution selon ses protocoles habituels dans les OVR.
[1] Quinlan PM, Elman MJ, Bhatt AK, et al. The natural course of central retinal vein occlusion. Am J Ophthalmol 1990 ; 110 : 118-23.
[2] Ducos de Lahitte G, Quintyn JC, Leparmentier A, Mathis A. Occlusions veineuses rétiniennes survenant chez des patients traités par anticoagulants et/ou antiagrégants plaquettaires. À propos de 5 cas. J Fr Ophtalmol 2007 ; 30 : 145-49.
[3] Browning DJ, Fraser CM. Retinal vein occlusions in patients taking warfarin. Ophthalmology 2004 ; 111 : 1196-200.
[4] Hayreh SS, Podhajsky PA, Zimmerman MB. Central and hemicentral retinal vein occlusion: role of anti-platelet aggregation agents and anticoagulants. Ophthalmology 2011 ; 118 : 1603-11.
[5] Hattenbach LO, Friedrich Arndt C, Lerche R, et al. Retinal vein occlusion and low-dose fibrinolytic therapy (R.O.L.F.) : a prospective, randomized, controlled multicenter study of low-dose recombinant tissue plasminogen activator versus hemodilution in retinal vein occlusion. Retina 2009 ; 29 : 932-40.
[6] Coscas G, Soubrane G. Anticoagulants et fibrinolytiques (urokinase) dans les occlusions veineuses rétiniennes : résultats initiaux d’une étude randomisée. Bull Soc Ophtalmol Fr 1978 ; 78 : 737-42.
[7] Kohner EM, Laatikainen L, Oughton J. The management of central retinal vein occlusion. Ophthalmology 1983 ; 90 : 484-7.
[8] Glacet-Bernard A, Coscas G, Chabanel A, et al. A randomized, double-masked study on the treatment of retinal vein occlusion with troxerutin. Am J Ophthalmol 1994 ; 118 : 421-9.
[9] Wolf S, Arend O, Bertram B, et al. Hemodilution therapy in central retinal vein occlusion. One-year results of a prospective randomized study. Graefes Arch Clin Exp Ophthalmol 1994 ; 232 : 33-9.
[10] De Sanctis MT, Cesarone MR, Belcaro G, et al. Treatment of retinal vein thrombosis with pentoxifylline : a controlled, randomized trial. Angiology 2002 ; 53 Suppl 1 : S35-8.
[11] Wiederholt M, Leonhardt H, Schmid-Schonbein H, Hager H. Treatment of central retinal venous and arterial occlusion by isovolemic hemodilution. Klin Monatsbl Augenheilkd 1980 ; 177 : 157-64.
[12] Hansen LL, Wiek J, Wiederholt M. A randomised prospective study of treatment of non-ischaemic central retinal vein occlusion by isovolaemic haemodilution. Br J Ophthalmol 1989 ; 73 : 895-9.
[13] Chen HC, Wiek J, Gupta A, et al. Effect of isovolaemic haemodilution on visual outcome in branch retinal vein occlusion. Br J Ophthalmol 1998 ; 82 : 162-7.
[14] Glacet-Bernard A, Atassi M, Fardeau C, et al. Hemodilution therapy using automated erythrocytapheresis in central retinal vein occlusion: results of a multicenter randomized controlled study. Graefes Arch Clin Exp Ophthalmol 2011 ; 249 : 505-12.
[15] Chiquet C, Tonini M, Drillat P, et al. Choroidal blood flow after isovolemic hemodilution in an eye with retinal vein occlusion and the contralateral healthy eye. Retina 2010 ; 30 : 275-80.
[16] Dhalluin JF, Glacet-Bernard A, Lelong F, et al. Traitement par hémodilution isovolémique des occlusions de la veine centrale de la rétine récentes. Ophtalmologie 1998 ; 12 : 442-5.
[17] Peduzzi M, Debbia A, Stacca R, et al. Central retinal vein occlusion, effect of isovolemic hemodilution as an adjunctive therapy. In : Brancato R, Coscas G, Lumbroso B. Eds. Retinal diseases 2. Amsterdam : Kugler and Ghedini ; 1987, p. 89-96.
[18] Kreutzer TC, Wolf A, Dirisamer M, et al. Intravitreal ranibizumab versus isovolemic hemodilution in the treatment of macular edema secondary to central retinal vein occlusion : twelve-month results of a prospective, randomized, multicenter trial. Ophthalmologica 2015 ; 233 : 8-17.
[19] Graber M, Glacet-Bernard A, Massamba N, et al. Prise en charge précoce des occlusions de la veine centrale de la rétine par ranibizumab et/ou hémodilution. J Fr Ophtalmol 2015, sous presse.
F. Becquet
➤ Plusieurs approches chirurgicales ont été proposées dans le traitement des OMV.
➤ Les techniques visant à lever l’obstacle à la circulation veineuse (adventicectomie, neurotomie optique radiaire ou thrombolyse intravasculaire) ont été abandonnées.
➤ La vitrectomie (associée ou non au pelage de la limitante interne) garde une indication dans le traitement de l’OMV. Elle serait d’efficacité plus durable que les traitements pharmacologiques, mais aucune étude prospective multicentrique randomisée n’a confirmé, à ce jour, cette impression.
En 1988, Osterloh et Charles [1] ont été les premiers à offrir une alternative thérapeutique chirurgicale à la photocoagulation en proposant une décompression dans l’occlusion de branche veineuse rétinienne (OBVR) responsable d’un œdème maculaire (OM) persistant. Progressivement, de nombreuses procédures chirurgicales ont été préconisées dans les occlusions veineuses rétiniennes (OVR), particulièrement au début des années 2000, juste avant l’avènement des injections intravitréennes (IVT) de corticoïdes et d’anti-VEGF qui ont relégué au second plan la chirurgie dans cette indication.
L’idée de réduire l’OM en ôtant le vitré est née à la suite des travaux de Nasrallah [2] et Hikishi [3] montrant une relation entre l’aspect incomplet du décollement postérieur du vitré (DPV) et la présence d’un œdème maculaire. Ce sont des équipes japonaises qui ont publié les premières des résultats favorables du traitement de l’OM des OVR (OMV) par vitrectomie et détachement de la hyaloïde postérieure. Les meilleurs résultats postopératoires étaient obtenus lorsque la durée d’évolution était plus courte (moins de 12 mois) et quand l’acuité visuelle préopératoire était la meilleure [4, 5]. Par la suite, de nombreuses publications, généralement rétrospectives et sans groupe contrôle, sont venues confirmer l’amélioration de l’OMV après vitrectomie associée fréquemment au décollement du vitré et au pelage de la limitante interne (LI) (fig. 9-64) [6–8]. Une amélioration fonctionnelle (2/10e en moyenne) accompagne habituellement la régression de l’OMV, mais pas toujours. À long terme, l’effet positif de la chirurgie est rapporté dans plusieurs études [6, 8], avec une efficacité sur l’acuité visuelle et sur l’épaisseur maculaire pendant plus de 5 ans [6].
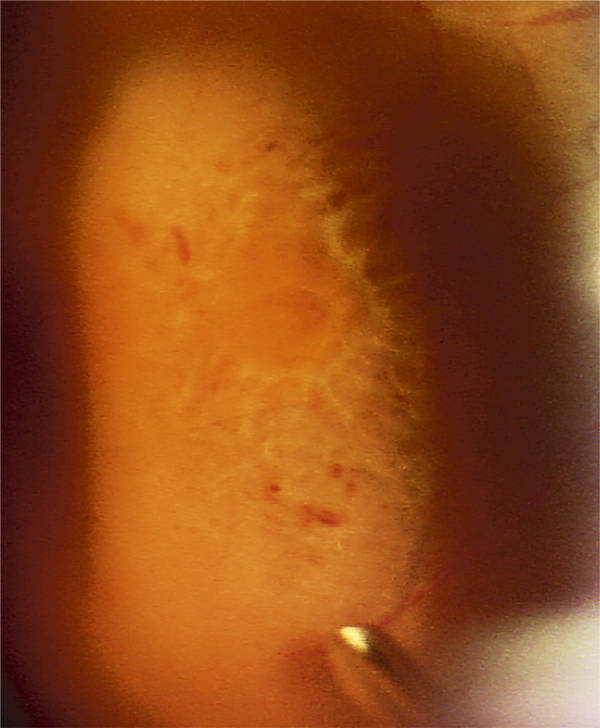
Fig. 9-64 Vue peropératoire en vitrectomie 2 voies à la lampe à fente d’un pelage de la limitante interne pour un œdème maculaire chronique secondaire à une OVCR.
Les mécanismes invoqués pour expliquer l’effet positif de la vitrectomie sont de trois ordres : rôle mécanique du décollement de la hyaloïde postérieure, amélioration de l’oxygénation de la rétine, et suppression de facteurs présents dans la cavité vitréenne et pouvant induire angiogenèse et inflammation. Pour certains auteurs, la hyaloïde postérieure serait particulièrement épaissie et adhérente à la rétine maculaire. Son ablation libérerait la rétine et ses vaisseaux d’un carcan et favoriserait la résorption de l’OM. Ainsi, les patients qui bénéficient le plus de la vitrectomie sont ceux qui au départ n’ont pas de DPV [3, 9]. La vitrectomie avec pelage de la hyaloïde postérieure et des tissus épirétiniens éventuels (membrane épimaculaire et/ou limitante interne pathologique) permettrait une meilleure diffusion de l’oxygène à la rétine maculaire, à partir du segment antérieur et éventuellement des zones de rétine bien vascularisées adjacentes [10]. L’élévation de la tension en oxygène dans la rétine interne provoquerait une vasoconstriction artériolaire diminuant la pression hydrostatique dans les capillaires et les veinules, permettant ainsi la résorption de l’OMV. Enfin, la vitrectomie permettrait de réduire le taux de VEGF intravitréen [11], taux qui semble être corrélé avec le pronostic visuel et avec les modifications éventuelles de l’OMV après la vitrectomie [12].
L’action positive de la vitrectomie semble durable et différente de celle des IVT [6]. La combinaison de cette chirurgie avec les IVT de stéroïdes pourrait permettre une action plus rapide et plus durable sur la résorption de l’OMV [8]. Néanmoins, même avec ce traitement combiné, la récidive de l’OM est fréquente (59 % dans l’étude de Tsujikawa et al. [13]) et l’effet bénéfique à long terme de cette association thérapeutique reste à prouver. De plus, il faut garder à l’esprit que la vitrectomie va modifier définitivement la pharmacocinétique des molécules injectées en intravitréen, réduisant leur demi-vie dans la cavité vitréenne et éventuellement leur efficacité.
L’ablation de la LI maculaire semble améliorer les résultats anatomiques et fonctionnels de la vitrectomie dans toutes les formes d’œdèmes [14]. Dès 1984, Sebag a suggéré que la traction par les fibres vitréennes sur les cellules de Müller rétiniennes prédisposait à l’OMC [15]. On sait que le pelage de la LI entraîne des lésions minimes des pieds des cellules de Müller et que ces lésions pourraient être à l’origine d’une gliose radiaire transrétinienne s’opposant à l’installation ou à la rechute de l’OM, en renforçant la cohésion des différentes couches cellulaires rétiniennes et en rétablissant l’homéostasie cellulaire rétinienne [16]. Le pelage de la LI pourrait aussi agir en facilitant la diffusion du sang et des liquides extracellulaires de la rétine vers la cavité vitréenne.
La plupart des études récentes sur la vitrectomie dans l’OM incluent systématiquement le pelage de la LI. Il semble que ce geste apporte un bénéfice supplémentaire dans la diminution postopératoire de l’OM [6, 8, 17, 18] et que contrairement aux IVT, cette régression soit stable dans le temps (fig. 9-65) [19, 20]. Le pelage de la LI maculaire seul donnerait aussi les mêmes résultats, associé ou non à l’adventicectomie dans les OBVR [21]. Néanmoins, les études comparant les résultats de la vitrectomie avec ou sans pelage de la LI ne retrouvent pas de différence significative entre les deux groupes [7]. En fait, actuellement, l’argument principal en défaveur de la vitrectomie associée au pelage de la LI dans les OVR est l’absence d’étude comparative, multicentrique et randomisée, malgré l’accumulation de nombreuses et grandes séries rétrospectives en sa faveur.
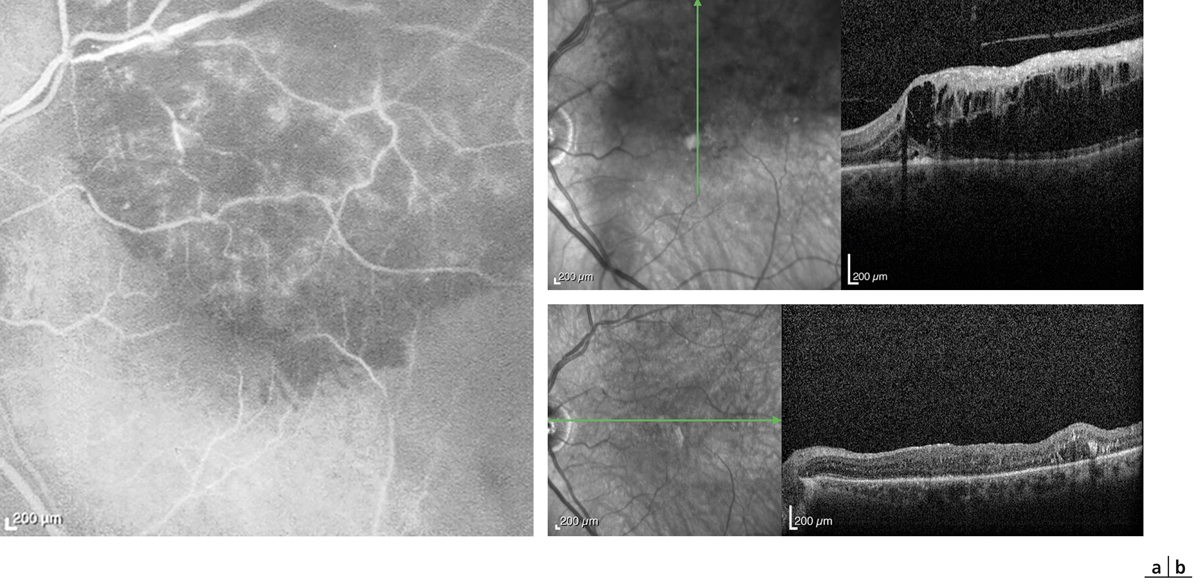
Fig. 9-65 OBVR hémorragique de l’œil gauche avec œdème maculaire récidivant de 750 µ (acuité visuelle de 2,5/10e, P6) après deux IVT d’Ozurdex®.
Aspect angiographique à 2 mois (a) et rétinographique à 10 mois (b). Une vitrectomie avec pelage de la limitante interne a été réalisée à 11 mois. À 1 an postopératoire, sur le cliché monochromatique vert et sur l’OCT (c), les hémorragies rétiniennes et l’œdème maculaire ont disparu, sans aucune récidive de l’œdème maculaire, entraînant une amélioration de l’acuité visuelle à 5/10, P3.
L’apparition d’un syndrome de l’interface vitréorétinienne–membrane épirétinienne (MER) ou traction vitréomaculaire (TVM) est diagnostiquée beaucoup plus facilement depuis la surveillance régulière de l’OM par OCT. Il n’est donc pas rare actuellement de retrouver au cours de ce suivi la survenue d’une MER – de la fibrose prémaculaire simple à la prolifération fibrovasculaire (fig. 9-66) – ou d’une TVM venant compromettre le pronostic visuel d’une OVR bien perfusée [22]. Bien que ces syndromes de l’interface soient une complication classique de l’OM chronique, certains auteurs suspectent le rôle favorisant des IVT d’anti-VEGF [23] ou de corticoïdes [24] dans leur survenue.
En l’absence d’étude mettant en évidence le rôle néfaste des MER et TVM dans l’OM chronique des OVR et l’intérêt d’une chirurgie d’ablation dans ces cas, par analogie avec l’efficacité de la chirurgie dans l’OM du diabétique dont la composante tractionnelle aggrave l’œdème, on pourra proposer une chirurgie de pelage en présence d’un syndrome de l’interface patent dans les OM non ischémiques.
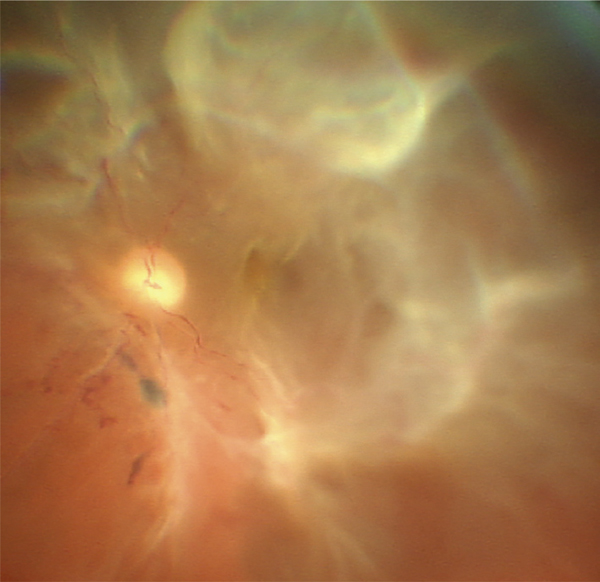
Fig. 9-66 Vue peropératoire en vitrectomie 3 voies (système grand champ) d’un décollement de rétine tractionnel par prolifération fibrovasculaire secondaire à une OVCR ischémique.
La survenue d’une hémorragie intravitréenne (HIV) signe la présence d’une néovascularisation du segment postérieur et donc une forme ischémique de l’OVR. Dans ces cas, la composante œdémateuse associée passe au second plan et la chirurgie sera nécessaire en cas d’HIV dense pour permettre un nettoyage de la cavité vitréenne, un décollement complet du cortex vitréen postérieur, une ablation des néovaisseaux prérétiniens et la réalisation peropératoire d’une endophotocoagulation au laser des territoires ischémiques.
Les modifications pariétales artérioveineuses en cas d’HTA ou de sénescence, ainsi que le rétrécissement de la paroi veineuse par l’adventice commune fibrosée, représentent le mécanisme physiopathogénique le plus fréquent de l’OBVR. Habituellement, l’OBVR survient au niveau des croisements artérioveineux [25], particulièrement quand l’artère passe au-dessus de la veine. Pour les OBVR prenant leur origine à un croisement artérioveineux, une section de la gaine commune a été proposée pour libérer la veinule rétinienne et l’artériole rétinienne du tissu adventitiel commun entourant ce croisement artérioveineux (fig. 9-67) [26]. Le rétablissement de la circulation veineuse après chirurgie a été retrouvé dans les études initiales : reperfusion capillaire à l’angiographie ; amélioration du drainage veineux dans le réseau affecté ; restauration partielle de la perfusion rétinienne normale dans la branche affectée avec amélioration du flux sanguin [27]. Pourtant, dans d’autres études, la reperfusion était souvent inconstante et aléatoire, voire inexistante [28].
Concernant l’efficacité chirurgicale, l’analyse et la comparaison entre les études effectuées sont rendues délicates en raison des différences et des variations entre les méthodes, et de l’absence de groupe contrôle. Concernant la régression de l’OM, chez les patients traités par vitrectomie et adventicectomie, seuls les patients n’ayant pas au départ de DPV ont eu une récupération visuelle notable, ce qui laisse penser que le pelage de la hyaloïde postérieure a eu un rôle prépondérant [9]. Cette hypothèse semble confirmée par d’autres études rapportant que les résultats de l’adventicectomie étaient en tout point comparables à ceux de la vitrectomie seule avec ablation de la hyaloïde postérieure associée [21] ou non [29] à l’ablation de la LI. Un auteur signalait le bénéfice supplémentaire obtenu avec le pelage de la LI [18]. Sur le plan fonctionnel, si une majorité d’études non comparatives ou comparatives non randomisées [26] ont rapporté une amélioration significative de l’acuité visuelle, d’autres auteurs n’ont pas retrouvé d’amélioration de l’acuité visuelle [30]. Du fait des complications potentielles liées à la vitrectomie elle-même (cataracte, déchirure rétinienne, décollement de rétine, etc.) ou à l’adventicectomie (lacération vasculaire avec hémorragie rétinienne ou intravitréenne, déchirure rétinienne postérieure, etc.), et en l’absence d’étude prospective randomisée, ces résultats contradictoires ne permettent pas de recommander l’adventicectomie dans la prise en charge des OBVR. D’ailleurs, en pratique, cette technique est actuellement abandonnée.
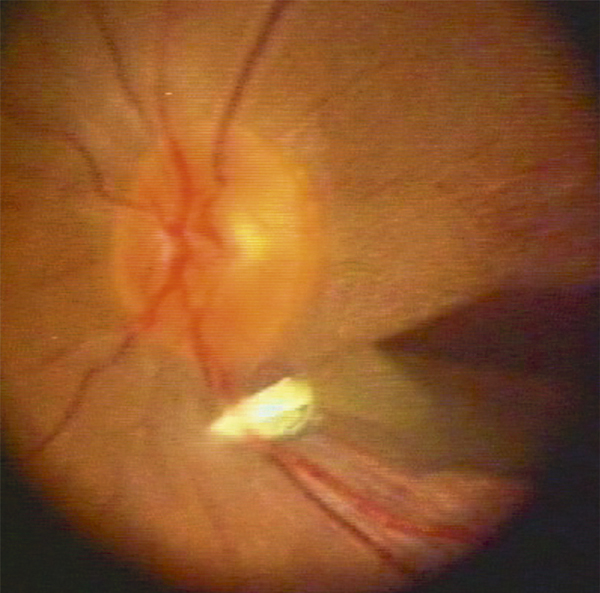
Fig. 9-67 Vue peropératoire en vitrectomie 2 voies à la lampe à fente de l’incision de l’adventice commune entre l’artère et la veine rétinienne, et de la séparation artérioveineuse.
Le relâchement de la compression vasculaire au niveau de la lame criblée a été proposé pour améliorer le retour veineux dans les yeux atteints d’OVCR. Opremcak a proposé le premier en 2001 une technique consistant à sectionner la lame criblée et l’anneau scléral adjacent par voie endoculaire : la neurotomie optique radiaire (NOR) [31]. Après une vitrectomie standard, est effectuée une section radiaire à la micro-lame sur le bord nasal du nerf optique visant à éviter au maximum les lésions des fibres optiques, particulièrement celles du faisceau interpapillomaculaire (fig. 9-68). Ce geste permettrait de relaxer théoriquement l’anneau scléral, augmentant ainsi le flux veineux et permettant au thrombus de se dégager.
Au cours des premières études pilotes [31, 32], une amélioration anatomique et clinique, objectivant en particulier une diminution significative de l’OM a été observée (fig. 9-69). Dans une importante étude non randomisée portant sur 117 patients consécutifs opérés par NOR [33], une amélioration anatomique et clinique confirmée par angiographie a été retrouvée dans la très grande majorité des cas (95 %) et l’acuité visuelle s’est améliorée de 2,5 lignes en moyenne dans 71 % des cas. À part une néovascularisation du segment antérieur constatée chez 6 % des patients, aucune complication sérieuse liée à la procédure chirurgicale n’a été signalée. Dans une deuxième étude de la même équipe portant sur 63 patients consécutifs, l’ajout à la procédure de vitrectomie + NOR d’une IVT de 4 mg de triamcinolone n’a pas apporté de bénéfice aux résultats de la première étude [34]. Une autre étude multicentrique non randomisée retrouve une amélioration après NOR, particulièrement en cas de développement d’anastomose rétino-opticociliaire [35]. Cet effet favorable serait dû pour certains à l’amélioration de la circulation rétinienne par le biais d’anastomoses opticociliaires et/ou rétinochoroïdiennes (fig. 9-69d) apparaissant parfois au site de la neurotomie, tandis que d’autres pensent que la vitrectomie seule est responsable de cette amélioration, voire simplement l’évolution naturelle de la maladie.
Ainsi, le fondement théorique proposé pour cette chirurgie demeure controversé : pour certains, une décompression significative de la veine centrale de la rétine par une seule incision localisée de l’anneau scléral et d’une partie de la lame criblée adjacente est peu probable ; pour d’autres, le site d’occlusion peut se situer en arrière de la lame criblée dont la libération ne modifierait donc pas l’occlusion. En l’absence de confirmation d’une amélioration significative du flux sanguin rétinien par vidéo-angiographie [36] ou d’une décompression constatée en anatomopathologie [37] et de résultats d’une étude randomisée contrôlée, il n’existe, pour l’instant, pas de preuves suffisantes pour recommander la NOR dans le traitement chirurgical de l’OVCR, d’autant que les complications de cette technique peuvent être sérieuses parfois (déficits de champ visuel, perforation de l’artère centrale de la rétine, décollement de rétine à partir du site de l’incision, occlusion de l’artère centrale de la rétine).
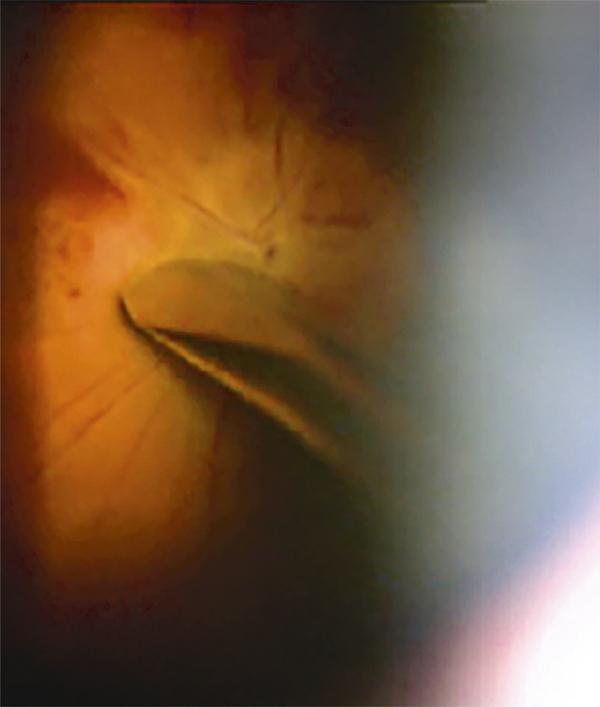
Fig. 9-68 Vue peropératoire en vitrectomie 2 voies à la lampe à fente d’une neurotomie optique radiaire.
Une lancette calibrée à 20 gauges incise la partie nasale du nerf optique de manière parallèle aux fibres optiques en évitant les vaisseaux rétiniens.
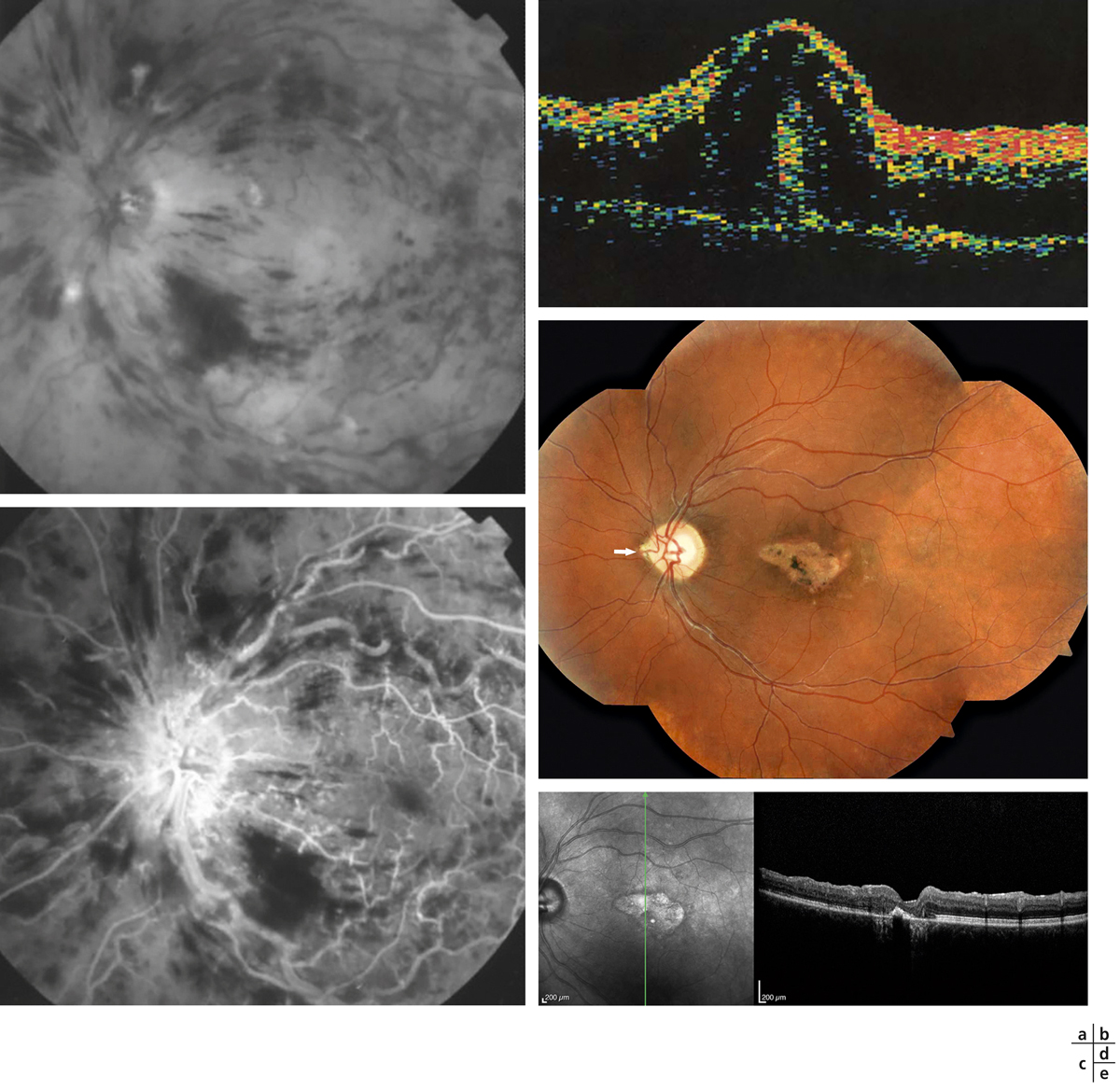
Fig. 9-69 Patient ayant présenté une baisse d’acuité visuelle (1/10e, P16) par OVCR de l’œil gauche en avril 2002.
le cliché anérythre (a) pris après 1 mois et demi d’évolution met en évidence la présence de nodules cotonneux péripapillaires associés à des hémorragies rétiniennes en flammèches et profondes dispersées dans les quatre quadrants, et un œdème maculaire marqué confirmé par l’OCT (b). L’angiogramme à 32 s (c) objective un œdème rétinien de l’ensemble du pôle postérieur et l’absence de signe d’ischémie rétinienne patente. Une vitrectomie avec NOR a été réalisée fin juin 2002 avec une amélioration anatomique à 6 mois et fonctionnelle (1,5/10, P8) à 1 an. Après 12 ans d’évolution, l’acuité visuelle est à 2,5/10, P8 avec une atrophie maculaire et le développement d’une anastomose rétinochoroïdienne (flèche blanche) plongeant dans le trajet de l’incision du nerf optique (d). L’OCT confirme l’atrophie maculaire avec disparition focale des photorécepteurs (e).
Cette autre technique chirurgicale consiste en une vitrectomie combinée avec une injection d’activateur de plasminogène (rt-PA) dans la veine rétinienne. Le but est ici, par une action thrombolytique ciblée, de dissoudre le thrombus déjà formé au niveau du site de l’occlusion. Après la réalisation d’une vitrectomie, la canulation d’une branche veineuse s’effectue à l’aide d’une canule d’un diamètre inférieur à 100 µ avant d’envisager l’injection endovasculaire de rt-PA. Les études expérimentales chez l’animal ont montré une efficacité de cette technique dans la reperméabilisation veineuse [38]. Néanmoins, chez l’homme, même si l’étude de l’équipe promotrice de la technique rapporte des résultats intéressants [39], une autre étude pilote n’a pas retrouvé de corrélation entre une lyse réussie et une amélioration visuelle. De même, l’analyse angiographique pré- et postopératoire n’a pas objectivé de modifications circulatoires significatives [40].
L’injection intravitréenne de fibrinolytiques a été tentée dans le but d’éviter les complications systémiques de la fibrinolyse. Des études prospectives, randomisées et contrôlées ont été réalisées avec des résultats suggérant une supériorité pour les IVT très précoces (dans les 3 jours après le début de l’OVR) [41, 42]. Mais des études expérimentales ultérieures ont mis en évidence l’inefficacité des IVT de rt-PA dans un modèle d’OVR et la majoration dose-dépendante de la toxicité rétinienne du rt-PA en présence d’une OVCR [43].
En fait, l’évolution naturelle du thrombus, qui s’organise rapidement en tissu conjonctif vasculaire, ne plaide pas en faveur de l’efficacité de ces techniques de reperméabilisation. Ainsi transformé, et quelle que soit la voie d’administration envisagée, le thrombus ne peut pas être dissous par des agents thrombolytiques au moment où est constatée cliniquement l’OVR chez la majorité des patients. Ainsi, qu’elle soit intravitréenne ou intravasculaire rétinienne, la thrombolyse n’a pas actuellement démontré son efficacité dans le traitement des OVR.
De nombreuses approches chirurgicales ont été tentées pour traiter les OVR, particulièrement avant l’apparition des IVT d’anti-VEGF ou de corticoïdes. Si l’adventicectomie, la neurotomie optique radiaire ou la thrombolyse intravasculaire ont été abandonnées, la vitrectomie est encore indiquée, particulièrement en cas d’œdème maculaire réfractaire lié à la présence d’une membrane épirétinienne ou d’adhérences vitréomaculaires, d’hémorragie intravitréenne ou de décollement de rétine tractionnel. Dans le traitement de l’OMV, c’est surtout l’absence d’étude multicentrique comparative et randomisée qui ne permet pas actuellement de conclure formellement à l’efficacité de la vitrectomie (associée ou non, selon les écoles, au pelage de la limitante interne). Pourtant, une majorité des nombreuses et importantes séries rétrospectives publiées indiquent des résultats anatomiques et fonctionnels bénéfiques. En comparaison aux traitements par IVT d’anti-VEGF ou de corticoïdes, la vitrectomie semble diminuer la récidive de l’OM en ayant une action anti-œdémateuse plus durable.
[1] Osterloh MD, Charles S. Surgical decompression of branch retinal vein occlusion. Arch Ophthalmol 1988 ; 106 : 1469-71.
[2] Nasrallah FP, Jalkh AE, Van Coppenolle F, et al. The role of the vitreous in diabetic macular edema. Ophthalmology 1988 ; 95 : 1335-9.
[3] Hikichi T, Konno S, Trempe CL. Role of the vitreous in central retinal vein occlusion. Retina 1995 ; 15 : 29-33.
[4] Tachi N, Hashimoto Y, Ogino N. Vitrectomy for macular edema combined with retinal vein occlusion. Doc Ophthalmol 1999 ; 97 : 465-9.
[5] Saika S, Tanaka T, Miyamoto T, et al. Surgical posterior vitreous detachment combined with gas/air tamponade for treating macular edema associated with branch retinal vein occlusion : retinal tomography and visual outcome. Graefes Arch Clin Exp Ophthalmol 2001 ; 239 : 729-32.
[6] Park DH, Kim IT. Long-term effects of vitrectomy and internal limiting membrane peeling for macular edema secondary central retinal vein occlusion and hemiretinal vein occlusion. Retina 2010 ; 30 : 117-24.
[7] Arai M, Yamamoto S, Mitamura Y, et al. Efficacy of vitrectomy and internal limiting membrane removal for macular edema associated with branch retinal vein occlusion. Ophthalmologica 2009 ; 223 : 172-6.
[8] Nkeme J, Glacet-Bernard A, Gnikpingo K, et al. Traitement chirurgical de l’œdème maculaire persistant des occlusions veineuses rétiniennes. J Fr Ophtalmol 2006 ; 29 : 808-14.
[9] Charbonnel J, Glacet-Bernard A, Korobelnik JF, et al. Management of branch retinal vein occlusion with vitrectomy and arteriovenous adventitial sheathotomy, the possible role of surgical posterior vitreous detachment. Graefes Arch Clin Exp Ophthalmol 2004 ; 242 : 223-8.
[10] Stefansson E, Novack RL, Hatchell DL. Vitrectomy prevents retinal hypoxia in branch retinal vein occlusion. Invest Ophthalmol Vis Sci 1990 ; 31 : 284-9.
[11] Noma H, Funatsu H, Mimura T, et al. Changes of vascular endothelial growth factor after vitrectomy for macular edema secondary to retinal vein occlusion. Eur J Ophthalmol 2008 ; 18 : 1017-9.
[12] Noma H, Funatsu H, Mimura T, et al. Visual acuity and foveal thickness after vitrectomy for macular edema. Ophthalmologica 2010 ; 224 : 367-73.
[13] Tsujikawa A, Fujihara M, Iwawaki T, et al. Triamcinolone acetonide with vitrectomy for treatment of macular edema associated with branch retinal vein occlusion. Retina 2005 ; 25 : 861-7.
[14] Kuhn F, Kiss G, Mester V, et al. Vitrectomy with internal limiting membrane removal for clinically significant macular oedema. Graefes Arch Clin Exp Ophthalmol 2004 ; 242 : 402-8.
[15] Sebag J, Balazs EA. Pathogenesis of cystoid macular edema : an anatomic consideration of vitreoretinal adhesions. Surv Ophthalmol 1984 ; 28(suppl) : 493-8.
[16] Ducournau D, Ducournau Y. A closer look at the ILM. Retinal Physician 2008 ; July/August (suppl).
[17] Raszewska-Steglinska M, Gozdek P, Cisiecki S, et al. Pars plana vitrectomy with ILM peeling for macular edema secondary to retinal vein occlusion. Eur J Ophthalmol 2009 ; 19 : 1055-62.
[18] Mester U, Dillinger P. Vitrectomy with arteriovenous decompression and internal limiting membrane dissection in branch retinal vein occlusion. Retina 2002 ; 22 : 740-6.
[19] Yunoki T, Mitarai K, Yanagisawa S, et al. Effects of vitrectomy on recurrent macular edema due to branch retinal vein occlusion after intravitreal injection of bevacizumab. J Ophthalmol 2013 : 415974.
[20] Macular Edema study. Congrès de l’EVRS 2012. En ligne : http://www.evrs.eu/me-study-connect
[21] Becquet F, Le Rouic JF, Zanlonghi X, et al. Efficacité du traitement chirurgical de l’œdème maculaire chronique secondaire à une occlusion de branche veineuse rétinienne. J Fr Ophtalmol 2003 ; 26 : 570-6.
[22] Hayreh SS, Podhajsky PA, Zimmerman MB. Natural history of visual outcome in central vein retinal occlusion. Ophthalmology 2011 ; 118 : 119-33.e1-2.
[23] Marticorena J, Romano MR, Heimann H, et al. Intravitreal bevacizumab for retinal vein occlusion and early growth of epiretinal membrane : a possible secondary effect ? Br J Ophthalmol 2011 ; 95 : 391-5.
[24] Bakri SJ, Omar AF. Evolution of vitreomacular traction following the use of the dexamethasone intravitreal implant (Ozurdex) in the treatment of macular edema secondary to central retinal vein occlusion. J Ocul Pharmacol Ther 2012 ; 28 : 547-9.
[25] Staurenghi G, Lonati C, Aschero M, Orzalesi H. Arteriovenous crossing as a risk factor in branch retinal vein occlusion. Am J Ophthalmol 1994 ; 117 : 211-3.
[26] Korobelnik JF. Adventicectomie. In : Glacet-Bernard A. Occlusions veineuses rétiniennes. Bull Soc Opht Fr, rapport annuel. Marseille : Lamy ; 2011.
[27] Kube T, Feltgen N, Pache M, et al. Angiographic findings in arteriovenous dissection (sheathotomy) for decompression of branch retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol 2005 ; 243 : 334-8.
[28] Avci R, Inan UU, Kaderli B. Evaluation of arteriovenous crossing sheathotomy for decompression of branch retinal vein occlusion. Eye 2006 ; 22 : 120-7.
[29] Figueroa MS, Torres R, Alvarez MT. Comparative study of vitrectomy with and without vein decompression for branch retinal vein occlusion : a pilot study. Eur J Ophthalmol 2004 ; 14 : 40-7.
[30] Oh IK, Kim S, Oh J, et al. Long-term visual outcome of arteriovenous adventitial sheathotomy on branch retinal vein occlusion induced macular edema. Korean J Ophthalmol 2008 ; 22 : 1-5.
[31] Opremcak EM, Bruce RA, Lomeo MD, et al. Radial optic neurotomy for central retinal vein occlusion : a retrospective pilot study of 11 consecutive cases. Retina 2001 ; 21 : 408-15.
[32] Le Rouic JF, Becquet F, Zanlonghi X, et al. Traitement des occlusions sévères de la veine centrale de la rétine par neurotomie optique radiaire. Résultats préliminaires. J Fr Ophtalmol 2003 ; 26 : 577-85.
[33] Opremcak EM, Rehmar AJ, Ridenour CD, et al. Radial optic neurotomy for central retinal vein occlusion : 117 consecutive cases. Retina 2006 ; 26 : 297-305.
[34] Opremcak EM, Rehmar AJ, Ridenour CD, et al. Radial optic neurotomy with adjunctive intraocular triamcinolone for central retinal vein occlusion : 63 consecutive cases. Retina 2006 ; 26 : 306-13.
[35] Hasselbach HC, Ruefer F, Feltgen N, et al. Treatment of central retinal vein occlusion by radial optic neurotomy in 107 cases. Graefes Arch Clin Exp Ophthalmol 2007 ; 245 : 1145-56.
[36] Horio N, Horiguchi M. Retinal blood flow and macular edema after radial optic neurotomy for central retinal vein occlusion. Am J Ophthalmol 2006, 141 : 31-4.
[37] Vogel A, Holz FG, Loeffler KU. Histopathologic findings after radial optic neurotomy in central retinal vein occlusion. Am J Ophthalmol 2006 ; 141 : 203-5.
[38] Tameesh MK, Lakhanpal RR, Fujii GY, et al. Retinal vein cannulation with prolonged infusion of tissue plasminogen activator (t-PA) for the treatment of experimental retinal vein occlusion in dogs. Am J Ophthalmol 2004 ; 138 : 829-39.
[39] Weiss JN, Bynoe LA. Injection of tissue plasminogen activator into a branch retinal vein in eyes with central retinal vein occlusion. Ophthalmology 2001 ; 108 : 2249-57.
[40] Feltgen N, Junker B, Agostini H, et al. Retinal endovascular lysis in ischemic central retinal vein occlusion. One year results of a pilot study. Ophthalmology 2007 ; 114 : 716-23.
[41] Glacet-Bernard A, Kuhn D, Vine AK, et al. Treatment of recent onset central retinal vein occlusion with intravitreal tissue plasminogen activator : a pilot study. Br J Ophthalmol 2000 ; 84 : 609-13.
[42] Ghazi NG, Nourredine B, Haddad RS, et al. Intravitreal tissue plasminogen activator in the management of central retinal vein occlusion. Retina 2003 ; 23 : 780-4.
[43] Yamamoto T, Kamei M, Kunavisarut P, et al. Increased retinal toxicity of intravitreal tissue plasminogen activator in a central retinal vein occlusion model. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 509-14.
S. Nghiem-Buffet, A. Glacet-Bernard
La prise en charge de l’œdème maculaire (OMV) des occlusions veineuses rétiniennes (OVR) s’est considérablement modifiée depuis l’introduction des injections intravitréennes (IVT) de corticoïdes et d’anti-VEGF [1, 2]. Actuellement, le traitement de l’OMV repose sur ces IVT aussi bien pour les occlusions de la veine centrale de la rétine (OVCR) que pour les occlusions de branche veineuse rétinienne (OBVR). Ces deux entités sont différentes mais les algorithmes thérapeutiques de l’OMV sont finalement proches en dehors du délai de prise en charge, des indications de laser et d’hémodilution (fig. 9-70 et 9-71).
Néanmoins, le traitement de l’œdème maculaire ne résume pas la prise en charge des OVR. La photocoagulation au laser garde sa place dans le traitement de l’ischémie et de la prévention de la néovascularisation, le traitement de l’œdème des OBVR et le traitement des gros micro-anévrismes compliquant les OBVR chroniques et il peut être associé aux IVT lorsque les récidives de l’OM des OBVR sont trop fréquentes (voir plus haut « Traitement par photocoagulation au laser »). Un traitement par hémodilution peut être envisagé pour certains patients vus précocement et en l’absence de contre-indication (patients jeunes sans antécédents cardiovasculaires importants, voir plus haut « Traitements à visée vasculaire – hémodilution ») [3].
Plusieurs publications récentes proposent des recommandations de traitement des OVR formulées par des groupes d’experts à partir d’analyses bibliographiques et confirment la place prédominante des IVT [4–6]. Seules les molécules ayant une indication remboursée en France dans l’OM des OVR (AMM) seront discutées dans cet algorithme thérapeutique du traitement de l’œdème maculaire.
Fig. 9-70 Algorithme thérapeutique des OBVR.
AV : acuité visuelle ; FO : fond d’œil ; IVT : injections intravitréennes ; OBVR : occlusion de branche veineuse rétinienne ; OCT : tomographie en cohérence optique ; OMV : œdème maculaire secondaire à l’occlusion veineuse rétinienne ; TO : tension oculaire.
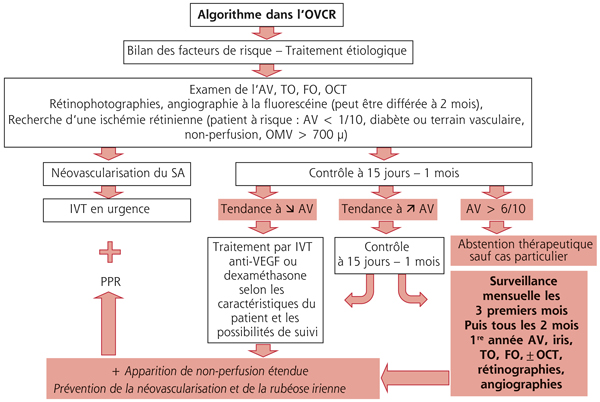
Fig. 9-71 Algorithme thérapeutique des OVCR.
AV : acuité visuelle ; FO : fond d’œil ; IVT : injections intravitréennes ; OCT : tomographie en cohérence optique ; OMV : œdème maculaire secondaire à l’occlusion veineuse rétinienne ; OVCR : occlusion de la veine centrale de la rétine ; PPR : photocoagulation panrétinienne ; SA : segment antérieur ; TO : tension oculaire.
Si le patient consulte immédiatement après l’apparition des symptômes, il semble raisonnable d’attendre environ 1 mois pour avoir une idée de l’évolution spontanée avant la mise en place d’un traitement actif (37 % d’évolution spontanée favorable à 3 ans pour les OBV d’après la Branch Vein Occlusion Study (BVOS) et 16 % à 6 mois pour les OVCR) [7, 8]. Ce temps peut être mis à profit pour tenter un traitement étiologique (équilibration des facteurs de risque vasculaire, traitement d’une apnée du sommeil, indication d’une hémodilution selon le cas, etc.).
Après cette période d’observation de 1 mois, dès que l’acuité visuelle initiale est inférieure à 6/10, un traitement sera généralement proposé dans les OVCR. Pour les OBVR de pronostic moins sombre, c’est l’importance de la baisse d’acuité visuelle qui va déterminer la rapidité de mise en place du traitement, une fois écoulée la période d’observation de 1 mois. Si l’acuité visuelle est inférieure à 3/10, ce traitement sera débuté rapidement. Entre 3 et 6/10, le traitement peut être différé, mais il est recommandé de l’instaurer avant 3 mois d’évolution pour permettre une récupération rapide et maximale [9].
Nous disposons au moment de la rédaction de ce texte de trois molécules de deux classes thérapeutiques différentes ayant reçu l’AMM et le remboursement pour le traitement de l’OM des OVCR : le ranibizumab et l’aflibercept de la famille des anti-VEGF, et l’implant de dexaméthasone de la famille des corticoïdes.
Le ranibizumab et l’aflibercept ont des AMM qui préconisent un régime de traitement différent de celui des études randomisées BRAVO, CRUISE, COPERNICUS et GALILEO [10–19]. Pour le ranibizumab, la nouvelle AMM du 5/09/2014 est très souple. Elle recommande de pratiquer une injection mensuelle de ranibizumab 0,5 mg jusqu’à ce que l’acuité visuelle (AV) maximale soit atteinte et stable et/ou jusqu’à l’absence de signes d’activité de la maladie. Les retraitements seront ensuite administrés en fonction de l’évolution de la maladie appréciée par mesure de l’AV et/ou sur les critères anatomiques. Cette nouvelle AMM est destinée à l’ensemble des indications remboursées du ranibizumab (traitement de la dégénérescence maculaire liée à l’âge néovasculaire, prise en charge des baisses d’AV liées à l’œdème maculaire diabétique et des occlusions de veines rétiniennes, traitement des néovaisseaux choroïdiens secondaire à la myopie forte). Le schéma thérapeutique de la précédente AMM du ranibizumab pour les OVR reste valable car il a été étudié par l’étude BRIGHTER avec des résultats favorables. Après trois injections minimum et l’obtention d’un plateau de 2 mois avec AV maximale atteignable, les injections sont suspendues. Elles sont proposées si l’acuité visuelle baisse à nouveau. L’introduction de retraitements possibles sur critères anatomiques dans la nouvelle AMM permet de pouvoir traiter aussi les patients sur récidive significative de l’OM dépistée à l’OCT, celle-ci pouvant précéder la baisse d’AV.
L’AMM de l’aflibercept est, elle aussi, assez flexible. Elle recommande d’injecter mensuellement 2 mg d’aflibercept jusqu’à l’obtention de résultats visuels et anatomiques stables au cours de trois évaluations mensuelles consécutives. La nécessité de poursuivre le traitement doit ensuite être réévaluée. Si nécessaire, le traitement peut être poursuivi avec une augmentation progressive de l’intervalle entre deux injections afin de maintenir les réponses anatomique et fonctionnelle.
La flexibilité de ces deux AMM laisse donc le choix d’une surveillance mensuelle avec un traitement en fonction des besoins (PRN), ou d’un allongement progressif de l’intervalle de contrôle et d’injection (« treat and extend »), décidé par l’ophtalmologiste pour un patient donné.
Il n’existe pas à ce jour d’étude randomisée comparant le ranibizumab et l’aflibercept dans le traitement de l’OM des OVR et les études de phase III concernant les deux molécules ne sont pas comparables, même si les résultats semblent globalement très similaires. Il n’existe pas non plus d’étude randomisée comparant les régimes de traitement PRN et « treat and extend ». Le choix d’un anti-VEGF se décidera donc en fonction de l’expérience de l’ophtalmologiste par rapport à l’un ou l’autre traitement. La bonne tolérance du ranibizumab déjà largement utilisé dans cette indication peut être un argument d’utilisation en première intention pour certains ; néanmoins la tolérance de l’aflibercept semble tout à fait identique à celle du ranibizumab dans les études cliniques et autorise son utilisation en première intention. La disponibilité d’un deuxième anti-VEGF peut représenter une alternative thérapeutique utile en cas de réponse insuffisante à un premier traitement anti-VEGF [20].
L’implant de dexaméthasone a une durée d’action théorique de 6 mois, qui se révèle en pratique être plus courte. Les réinjections sont effectuées en moyenne tous les 4 à 5 mois. En, effet, l’implant de dexaméthasone a une efficacité maximale au 2e mois qui va ensuite diminuer à partir du 3e mois avec une baisse d’AV [21, 22]. Dans l’AMM, il est précisé qu’une « administration ultérieure peut être envisagée chez les patients qui présentent une réponse au traitement suivi d’une perte d’acuité visuelle et qui, selon l’avis de leur médecin, pourraient bénéficier d’un nouveau traitement, sans être exposés à un risque significatif ». Il est également mentionné que les données concernant une « administration répétée dans un délai inférieur à 6 mois sont très limitées ». Il est probable qu’à la parution de ce rapport, les résultats des études de phase IIIb analysant le traitement avec réinjections à 5 mois seront disponibles en permettant une meilleure connaissance.
Le choix du traitement de l’OMV se confronte aux avantages et aux inconvénients de chaque molécule. Les anti-VEGF sont très efficaces avec une excellente tolérance mais doivent être injectés très souvent. Les corticoïdes nécessitent moins d’injections mais ils exposent aux risques d’hypertonie et de cataracte.
Le choix entre corticoïdes et anti-VEGF repose avant tout sur le profil du patient, l’absence de contre-indication au traitement mais aussi sur sa mobilité et sa disponibilité. Les patients pseudo-phakes ou avec des antécédents cardiovasculaires récents seront plutôt traités par corticoïdes, alors que les patients glaucomateux, jeunes ou à risque élevé de survenue de rubéose, le seront plutôt par anti-VEGF. Les possibilités de suivi sont également un paramètre important du choix thérapeutique. En cas d’impossibilité de suivi mensuel, les corticoïdes seront proposés mais il ne faudra pas négliger une surveillance très régulière les premiers mois à la recherche d’une complication néovasculaire.
Quel que soit le traitement choisi, il sera toujours possible de changer de molécule selon les difficultés de suivi ou la survenue de complications. Les anti-VEGF peuvent permettre de pallier le développement d’une hypertonie cortisonique et l’implant de dexaméthasone peut permettre d’espacer le suivi et les injections en cas de chronicisation ou de difficultés de suivi sous anti-VEGF.
Le laser thermique reste un complément utile dans les OBVR devenues chroniques après plusieurs mois d’évolution (> 6 mois) et en cas d’AV inférieure à 5/10 [7]. Il peut être proposé en cas de suivi difficile ou pour tenter un sevrage des IVT. Le laser garde une excellente indication dans le traitement des gros micro-anévrismes car il peut traiter définitivement l’OMV.
La surveillance des patients doit se faire selon plusieurs axes : la tolérance des traitements, leur efficacité et l’évolution de la pathologie.
La tolérance des traitements concerne essentiellement l’implant de dexaméthasone avec un risque connu d’hypertonie oculaire (dans l’étude GENEVA, une hypertonie de 25 mmHg ou plus a été observée chez 16 % des patients, et un tonus de 35 mmHg ou plus chez 3 % des patients, au 2e mois après l’IVT donc au pic d’efficacité de l’implant) [21]. Pour les anti-VEGF, les élévations de pression intra-oculaire (PIO) sont moins fréquentes mais restent possibles (17 % d’hypertonie oculaire dans l’étude GALILEO pour l’aflibercept) [18]. La mesure de la PIO est donc nécessaire dans le suivi de l’implant de dexaméthasone et doit être faite au moins aux 1er et 2e mois après l’injection. Après la première injection, si la PIO est restée normale, le risque d’hypertonie est faible (10 % supplémentaires à la deuxième IVT) [22].
La survenue d’une cataracte cortico-induite est une autre complication possible de l’implant de dexaméthasone avec l’apparition et l’augmentation des opacités cristalliniennes à 1 an chez 29,8 % des patients dans GENEVA après deux implants [22]. Il faudra dépister la survenue de cette cataracte après le deuxième implant, car elle peut être responsable d’une moins bonne récupération visuelle.
L’efficacité des traitements est évaluée sur les gains d’acuité visuelle et sur la diminution de l’OM.
Avec l’implant de dexaméthasone, l’efficacité est maximale à 2 mois. En principe, on propose un suivi mensuel après le premier implant (efficacité à 1 mois, efficacité maximale à 2 mois, dépistage des récidives à 3 et 4 mois). Après le deuxième implant, le suivi peut être allégé en l’absence de survenue d’événements indésirables avec des examens à 2 et 4 mois, puis tous les mois pour le diagnostic précoce des récidives.
Avec les anti-VEGF, les injections sont mensuelles jusqu’à ce que l’acuité visuelle maximale soit atteinte avec stabilisation visuelle lors de trois évaluations consécutives (phase d’induction). Par la suite, les patients sont suivis tous les mois avec réinjections en fonction des besoins (PRN). Si l’AV baisse en raison de la récidive de l’OMV, les injections mensuelles sont réinstaurées jusqu’à ce l’AV soit à nouveau stable lors de trois évaluations consécutives. Si l’OCT révèle clairement des signes de récidive d’OM avant la baisse visuelle, le traitement peut être réinstauré lorsqu’a été identifiée, pour un patient donné, une corrélation entre dégradation anatomique et de la fonction visuelle (la réapparition de l’OM précédant souvent la baisse d’AV).
Une autre modalité thérapeutique de type « treat and extend » peut être envisagée pour les anti-VEGF après la phase d’induction mais son bénéfice n’a pas encore été démontré.
Le traitement est alors poursuivi avec une augmentation progressive de l’intervalle entre deux injections afin de maintenir les réponses anatomique et fonctionnelle. Ce protocole thérapeutique peut être intéressant pour diminuer le nombre de visites et essayer de déterminer, pour certains cas, un intervalle de récidive propre qui pourrait ensuite permettre d’installer des retraitements programmés. Il permet également d’éviter les rechutes régulières de l’OMV que l’on peut observer dans le suivi PRN et qui pourraient avoir un effet délétère à moyen et long terme.
En l’absence d’amélioration après trois injections d’anti-VEGF ou d’un implant de dexaméthasone, la poursuite du même traitement n’est pas recommandée. En revanche, un changement de traitement peut être proposé en cas de persistance de l’OMV et si l’angiographie en fluorescence a permis d’éliminer une ischémie maculaire majeure qui compromettrait toute chance de récupération visuelle.
Ce sont essentiellement les complications de la non-perfusion qui vont être recherchées dans le suivi de l’évolution de la maladie. Pour les OVCR, c’est le dépistage de la rubéose irienne et d’une hypertonie oculaire par glaucome néovasculaire qui reste l’élément essentiel de la surveillance. Ce risque est plus fréquent dans les quatre premiers mois de l’OVCR mais persiste tout au long de l’évolution de la maladie. Sous anti-VEGF, le risque de rubéose est très diminué mais il faudra être très vigilant à l’arrêt du traitement, puisqu’une néovascularisation du segment antérieur peut survenir jusqu’à 48 mois chez la moitié des patients ayant une OVCR ischémique traitée par anti-VEGF [23]. Les corticoïdes quant à eux protégeant moins du risque de rubéose, la surveillance de l’iris reste indispensable sous ce traitement. Quel que soit le traitement (anti-VEGF ou corticoïdes), les signes habituels d’ischémie au fond d’œil comme les hémorragies ne sont plus visibles. L’angiographie à la fluorescéine peut être alors très utile en montrant l’étendue des territoires de non-perfusion. En cas de survenue d’une rubéose, la photocoagulation panrétinienne (PPR) est indiquée en urgence sous couverture anti-VEGF qui permet de refroidir le tableau clinique en stoppant la prolifération néovasculaire, évitant ainsi la fermeture de l’angle irido-cornéen. La PPR est en général recommandée en cas de conversion ischémique sévère ou de forme non perfusée d’emblée. Certains auteurs ne la préconisent cependant pas dans les formes ischémiques sans néovascularisation compte tenu des résultats de la Central Vein Occlusion Study (CVOS) qui n’avait pas montré le bénéfice d’une PPR allégée à titre préventif dans les formes avec ischémie débutante [24]. Dans ce cas de figure, la surveillance de l’iris est primordiale car la PPR doit être débutée dès l’apparition de signes précoces de rubéose. Néanmoins, la rapidité fulgurante de la néovascularisation et le caractère irréversible de la perte visuelle secondaire au glaucome néovasculaire, même traité par anti-VEGF, conduisent la plupart des auteurs à débuter la PPR dans les OVCR ischémiques sans attendre le début de rubéose irienne.
Pour les OBVR, la non-perfusion étendue peut aboutir à la formation de néovaisseaux prérétiniens et d’hémorragie intravitréenne. L’angiographie à la fluorescéine permet d’identifier les territoires non perfusés et les néovaisseaux, puis de proposer une photocoagulation au laser des territoires de non-perfusion.
Au final, la surveillance de la tolérance et de l’efficacité des traitements et l’évolution de la pathologie nécessitent un suivi rapproché au moins la première année. Une visite mensuelle quel que soit le traitement sera au mieux réalisée pendant les 6 à 9 premiers mois. Un espacement des visites sera ensuite envisagé. Une fois la phase chronique installée, le suivi peut être adapté au délai de récidive dans la mesure où celui-ci a été identifié (pouvant aller jusqu’à 4 mois) tout en continuant de dépister la survenue des complications.
Les IVT de corticoïdes et d’anti-VEGF ont considérablement modifié la prise en charge de l’OM des OVR. Ils sont devenus le traitement de première intention de cette affection même s’ils n’en sont qu’un traitement symptomatique. Le choix du traitement se confronte aux avantages et aux inconvénients de chaque molécule. L’excellente tolérance des anti-VEGF est contrebalancée par le nombre élevé d’injections nécessaires. À l’inverse, l’effet plus prolongé des corticoïdes est contrebalancé par la survenue possible d’hypertonie et de cataracte. Le choix entre corticoïdes et anti-VEGF repose avant tout sur le profil du patient, l’absence de contre-indication au traitement mais aussi sur sa mobilité et sa disponibilité. Enfin, la possibilité de passer d’un traitement à un autre permet d’adapter au mieux la prise en charge en fonction de l’évolution de la maladie et de la disponibilité du patient.
Si ces nouveaux traitements ont permis d’améliorer le pronostic visuel des patients, les résultats à long terme sont encore mal connus avec un passage possible vers la chronicité de l’OMV dans près de la moitié des cas à 4 ans [25]. Enfin, la recherche d’une conversion ischémique et d’une néovascularisation du segment antérieur reste indispensable dans le suivi des OVCR, même à long terme, pour éviter la survenue d’un glaucome néovasculaire par la réalisation d’une PPR.
[1] Glacet-Bernard A, Coscas G, Pournaras CJ. Occlusions veineuses rétiniennes. Bull Soc Ophtalmol Fr, Rapport annuel. Éditions L-Groupe Ciel ; novembre 2011, 324 p.
[2] Alain Gaudric. Pathologies vasculaires du fond d’œil. Paris : Lavoisier ; 2012, 280 p.
[3] Glacet-Bernard A, Atassi M, Fardeau C, et al. Hemodilution therapy using automated erythrocytapheresis in central retinal vein occlusion: results of a multicenter randomized controlled study. Graefes Arch Clin Exp Ophthalmol 2011 ; 249 : 505-12.
[4] Girmens JF, Glacet-Bernard A, Kodjikian L, et al. Management of macular edema secondary to retinal vein occlusion. J Fr Ophtalmol 2015 ; 38 : 253-63.
[5] Gerding H, Monés J, Tadayoni R, et al. Ranibizumab in retinal vein occlusion : treatment recommendations by an expert panel. Br J Ophthalmol 2015 ; 99 : 297-304.
[6] Yeh S, Kim SJ, Ho AC, et al. Therapies for Macular edema associated with central retinal vein occlusion: a report by the American Academy of Ophthalmology. Ophthalmology 2015 ; 122 : 769-78.
[7] The Branch Vein Occlusion Study Group. Argon laser photocoagulation for macular edema in branch retinal occlusion. Am J Ophthalmol 1984 ; 98 : 271-82.
[8] The Central Vein Occlusion Study Group. Evaluation of grid pattern photocoagulation for macular edema in central retinal vein occlusion : the Central Vein Occlusion Study Group M Report. Ophthalmology 1995 ; 102 : 1425-33.
[9] Heier JS, Campochiaro PA, Yau L, et al. Ranibizumab for macular edema due to retinal vein occlusions. Long-term follow-up in the HORIZON trial. Ophthalmology 2012 ; 119 : 802-9.
[10] Campochiaro PA, Clark WL, Boyer DS, et al. Intravitreal aflibercept for macular edema following branch retinal vein occlusion : the 24-week results of the VIBRANT Study. Ophthalmology 2015 ; 122 : 538-44.
[11] Campochiaro PA, Heier JS, Feiner L, et al. ; BRAVO Investigators. Ranibizumab for macular edema following branch retinal vein occlusion : six-month primary end point results of a phase III study. Ophthalmology 2010 ; 117 : 1102-12.
[12] Brown DM, Campochiaro PA, Bhisitkul RB, et al. Sustained benefits from ranibizumab for macular edema following branch retinal vein occlusion. 12-Month outcomes of a phase III study. Ophthalmology 2011 ; 118 : 1594-602.
[13] Brown DM, Campochiaro PA, Singh RP, et al. ; CRUISE Investigators. Ranibizumab for macular edema following central retinal vein occlusion : six-month primary end point results of a phase III study. Ophthalmology 2010 ; 117 : 1124-33.
[14] Campochiaro PA, Brown DM, Awh CC, et al. Sustained benefits from ranibizumab for macular edema following central retinal vein occlusion. 12-Month outcomes of a phase III study. Ophthalmology 2011 ; 118 : 2041-9.
[15] Brown DM, Heier JS, Clark WL, et al. Intravitreal aflibercept injection for macular edema secondary to central retinal vein occlusion : 1-year results from the phase 3 COPERNICUS study. Am J Ophthalmol 2013 ; 155 : 429-37.
[16] Heier JS, Clark WL, Boyer DS, et al. Intravitreal aflibercept injection for macular edema due to central retinal vein occlusion : two-year results from the COPERNICUS study. Ophthalmology 2014 ; 121 : 1414-20.
[17] Holz FG, Roider J, Ogura Y, et al. VEGF Trap-Eye for macular oedema secondary to central retinal vein occlusion : 6-month results of the phase III GALILEO study. Br J Ophthalmol 2013 ; 97 : 278-84.
[18] Korobelnik JF, Holz FG, Roider J, et al. ; GALILEO Study Group. Intravitreal Aflibercept injection for macular edema resulting from central retinal vein occlusion : one-year results of the phase 3 GALILEO study. Ophthalmology 2014 ; 121 : 202-8.
[19] Ogura Y, Roider J, Korobelnik JF, et al. ; GALILEO Study Group. Intravitreal aflibercept for macular edema secondary to central retinal vein occlusion : 18-month results of the phase 3 GALILEO study. Am J Ophthalmol 2014 ; 158 : 1032-8.
[20] Eadie JA, Ip MS, Kulkarni AD. Response to aflibercept as secondary therapy in patients with persistent retinal edema due to central retinal vein occlusion initially treated with bevacizumab or ranibizumab. Retina 2014 ; 34 : 2439-43.
[21] Haller JA, Bandello F, Belfort R Jr, et al. ; OZURDEX GENEVA Study Group. Randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with macular edema due to retinal vein occlusion. Ophthalmology 2010 ; 117 : 1134-46.
[22] Haller JA, Bandello F, Belfort R Jr, et al. ; Ozurdex GENEVA Study Group. Dexamethasone intravitreal implant in patients with macular edema related to branch or central retinal vein occlusion twelve-month study results. Ophthalmology 2011 ; 118 : 2453-60.
[23] Brown DM, Wykoff CC, Wong TP, et al. ; RAVE Study Group. Ranibizumab in preproliferative (ischemic) central retinal vein occlusion: the rubeosis anti-VEGF (RAVE) trial. Retina 2014 ; 34(9) : 1728-35.
[24] The Central Vein Occlusion Study Group. A randomized clinical trial of early panretinal photocoagulation for ischemic central vein occlusion. The Central Vein Occlusion Study Group N report. Ophthalmology 1995 ; 102 : 1434-44.
[25] Campochiaro PA, Sophie R, Pearlman J, et al. ; RETAIN Study Group. Long-term outcomes in patients with retinal vein occlusion treated with ranibizumab: the RETAIN Study. Ophthalmology 2013 ; 121 : 209-19.
A. Glacet-Bernard
L’œdème des occlusions veineuses rétiniennes (OMV) résulte principalement de la rupture de la barrière hémato-rétinienne interne, due à la sécrétion de VEGF engendrée par le ralentissement circulatoire. Cet œdème VEGF-dépendant est extracellulaire et se manifeste initialement au niveau des couches profondes de la rétine (couche des fibres de Henlé dans la plexiforme externe) ; le fluide s’accumule dans des logettes cystoïdes qui se répartissent rapidement dans toutes les couches de la rétine. Ces lésions peuvent être totalement réversibles dans les formes favorables ou sous traitement.
Il existe parfois un œdème intracellulaire résultant d’une atteinte artérielle associée (occlusion artérielle ciliorétinienne, forme avec retard circulatoire majeur dans l’artère centrale de la rétine) qui se manifeste cliniquement par un blanchiment de la rétine et sur l’OCT par une atteinte des couches internes et moyennes de la rétine (opacification de la couche nucléaire interne comme dans le syndrome paracentral acute middle maculopathy, diminution de l’épaisseur des couches des fibres optiques–cellules ganglionnaires–nucléaire interne, hyperréflectivité de la limitante moyenne). Ces lésions sont irréversibles et peuvent permettre un diagnostic rétrospectif.
L’OMV bénéficie des avancées en matière d’exploration grâce à l’angio-OCT, qui permet d’évaluer, de manière non invasive, à la fois l’œdème et la perfusion du lit capillaire, et aux nouveaux angiographes ultra-grand champ qui analysent mieux la perfusion de la rétine périphérique.
Les nouveaux traitements symptomatiques de l’OMV ont révolutionné le pronostic et la prise en charge des OVR. L’implant de dexaméthasone puis les anti-VEGF ont démontré une excellente efficacité sur la régression de l’OMV et la récupération visuelle. Certaines formes restent malheureusement non améliorées principalement lorsqu’une ischémie maculaire existe.
Par ailleurs, le traitement et la surveillance de l’OMV ne résument pas la prise en charge d’une occlusion veineuse rétinienne. L’évaluation du contexte étiologique et la surveillance de la perfusion rétinienne restent indispensables pour éviter les complications les plus sévères (comme le glaucome néovasculaire qui n’est pas prévenu mais seulement retardé par les IVT). Le traitement au laser des zones ischémiques peut également améliorer le pronostic de cet OMV VEGF-dépendant.