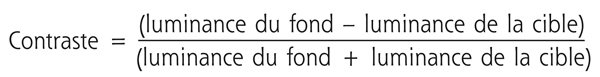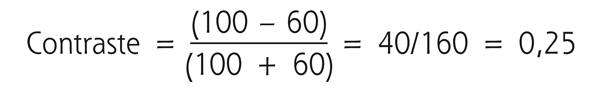Diagnostic clinique et explorations complémentaires
Coordonné par C. Creuzot-Garcher
F. Becquet
➤ En cas d’œdème maculaire, métamorphopsies avec micropsie, scotome central relatif et dyschromatopsie sont les symptômes les plus fréquemment associés à la baisse visuelle.
➤ L’âge du patient, le caractère uni- ou bilatéral des symptômes, la vitesse d’installation et le degré d’altération de la fonction visuelle permettent de guider la recherche étiologique.
La baisse d’acuité visuelle et les métamorphopsies constituent le classique syndrome maculaire. Pour guider la recherche étiologique, en plus de l’âge du patient, trois éléments sont essentiels à rechercher à l’interrogatoire en présence d’une altération de la vision due à un œdème maculaire : le caractère uni- ou bilatéral de l’atteinte ; la vitesse de progression de l’altération visuelle ; les symptômes associés. Ce sont ces derniers qui seront étudiés plus spécifiquement dans ce chapitre, la baisse d’acuité visuelle étant abordée plus bas et dans le chapitre 4.9.
Il semble que les patients soient plus ou moins sensibles à la mauvaise vision d’un seul œil selon qu’il s’agisse ou non de leur œil directeur ou selon qu’ils possèdent ou non une bonne vision binoculaire. Ainsi, tant que le patient n’a pas été examiné, le caractère monoculaire de l’atteinte est souvent méconnu. L’apparition brutale ou rapide de l’atteinte oriente plutôt vers une origine ischémique – œdème maculaire (OM) des occlusions veineuses rétiniennes (OVR) –, alors qu’une évolution sur plusieurs jours ou semaines est plus fréquemment liée à une inflammation. Néanmoins, il existe en matière d’OM des chevauchements entre le mode évolutif de ces différents mécanismes (OM du diabétique par exemple), c’est pourquoi l’anamnèse a une valeur d’orientation mais ne peut à elle seule affirmer une étiologie.
Les métamorphopsies sont caractérisées par la perception de déformations des lignes et des objets dans le champ visuel central. Elles sont plus ou moins sévères et peuvent parfois entraîner une gêne disproportionnée à la lecture de près et être invalidantes malgré une relative conservation de l’acuité visuelle de loin. En fait, elles sont particulièrement ressenties et d’autant plus pénibles que l’acuité visuelle est encore bonne. En pratique courante, l’examen des métamorphopsies repose sur l’interrogatoire et des tests relativement subjectifs comme la lecture de près, qui va fournir des informations précises sur le degré de la gêne induite, et l’examen à la grille d’Amsler qui donne également une idée assez précise du degré des déformations et de l’étendue de la zone déformée par rapport au point de fixation [1, 2]. Différentes techniques ont été développées pour mesurer de façon objective les métamorphopsies [3–5] mais elles ne sont pas utilisées en pratique courante. Ainsi, la périmétrie par hyperacuité préférentielle (PHP), plus sensible que le test d’Amsler, pourrait améliorer la détection précoce des métamorphopsies accompagnant un œdème maculaire récidivant ou une poussée de dégénérescence maculaire liée à l’âge (DMLA) exsudative dans les populations à risque [6].
Les métamorphopsies peuvent s’associer à des modifications de la taille des images qui sont ressenties plus petites en cas de micropsie ou, plus rarement, plus grandes en cas de macropsie. En cas de micropsie accompagnant des métamorphopsies, celles-ci se situent quasiment toujours autour du point de fixation avec les lignes verticales et horizontales incurvées vers l’intérieur (fig. 5-1a). C’est le contraire qui se produit en cas de macropsie (fig. 5-1b) [7]. La micropsie et la macropsie d’origine rétinienne sont dues au déplacement des photorécepteurs. Lorsqu’ils sont dissociés ou éloignés les uns des autres, en cas d’œdème maculaire par exemple, l’image sur la rétine d’un objet donné stimulera un plus petit nombre de photorécepteurs et le cortex visuel interprétera cela comme une image plus petite. Si les photorécepteurs sont plus rapprochés les uns des autres comme dans le cas d’une contraction de la rétine maculaire par une membrane épirétinienne, le même objet stimulera un plus grand nombre de photorécepteurs et sera interprété comme plus grand [1, 7]. Ainsi, en présence d’un œdème maculaire, c’est la micropsie qui sera prédominante par rapport aux métamorphopsies.
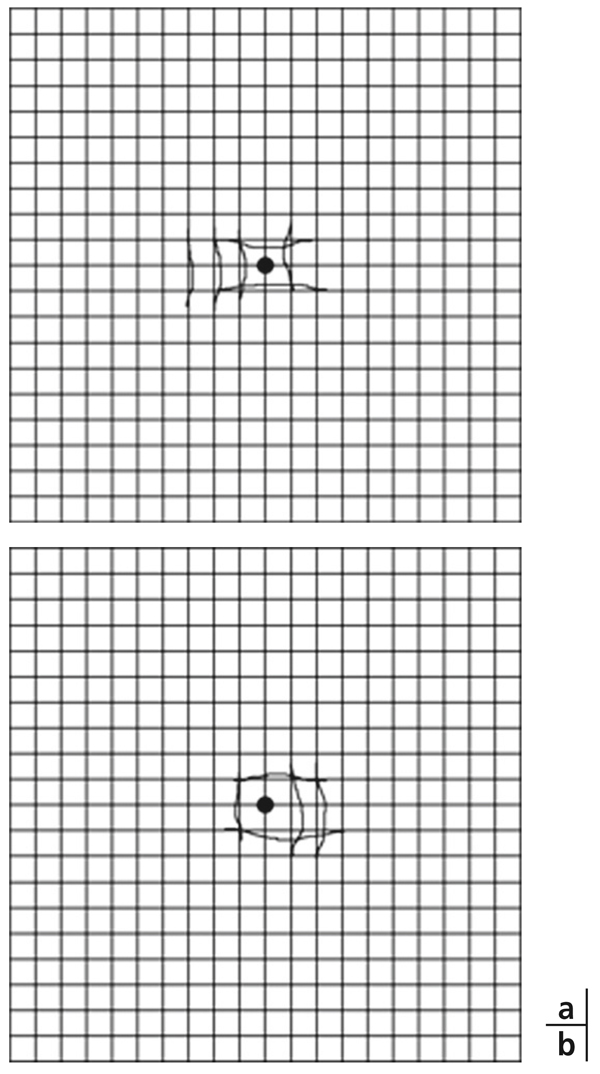
Fig. 5-1 Grille d’Amsler objectivant des métamorphopsies centrales : avec micropsie chez un patient atteint d’œdème maculaire débutant (a) ; avec macropsie chez un patient présentant une membrane épirétinienne (b).
Le scotome central relatif correspond à une sensation d’opacité plus ou moins dense et étendue qui se projette dans le champ de vision central du patient. Ce scotome relatif s’accompagne fréquemment de métamorphopsies qui peuvent, avec une grande variation de combinaisons, se situer dans l’aire du scotome, le circonscrire, ou au contraire être indépendantes. Une tache grise ou colorée, relativement large, fixe, et au travers de laquelle les détails sont atténués, assombris ou flous, s’accompagnant d’une baisse d’acuité visuelle et éventuellement de métamorphopsies, oriente avant tout vers une maculopathie débutante [8]. La survenue rapide du scotome relatif avec un retentissement visuel marqué est plus volontiers la marque d’un OM survenant dans le cadre d’un syndrome d’Irvine-Gass. Un OM accompagnant une occlusion de branche veineuse rétinienne donnera plutôt un scotome en secteur ou paracentral. L’étendue du scotome peut être documentée qualitativement avec une grille d’Amsler [1, 2] en gardant à l’esprit le caractère approximatif de cette évaluation lié à l’instabilité de la fixation et au processus cortical de complétion [9]. Le symptôme scotome relatif est, contrairement aux métamorphopsies, plutôt en rapport avec une infiltration œdémateuse des couches plus superficielles de la rétine dont la vascularisation est assurée par la circulation rétinienne. Bien entendu, habituellement, l’OM infiltre toute l’épaisseur rétinienne, ce qui fait que le patient présente un scotome et des métamorphopsies simultanément. Enfin, si l’OM se chronicise, une désorganisation du tissu rétinien avec mort cellulaire, en particulier au niveau de la couche des photorécepteurs, conduira à une atrophie transformant le scotome central relatif en scotome absolu. La micropérimétrie constitue un outil d’exploration intéressant permettant de quantifier ces scotomes de même que la qualité de la fixation (voir plus loin dans ce chapitre le paragraphe « Micropérimétrie »).
Une maculopathie œdémateuse entraîne une perturbation de la discrimination du sens chromatique qui est parallèle à la baisse d’acuité visuelle. Une anomalie de la vision colorée sera perçue par le patient surtout si elle est franchement asymétrique (pathologie unilatérale) et de survenue rapide. Comme la plupart des maculopathies, l’OM s’accompagne d’une dyschromatopsie, pas toujours évidente pour le patient car variable en fonction de la maladie causale, dans laquelle dominent les confusions d’axe bleu-jaune (dyschromatopsie acquise ou DA de type III). Il est très important d’utiliser des tests désaturés (Panel D15 désaturé de Lanthony par exemple) pour mettre en évidence une DA débutante, quelle que soit son origine (maladie rétinienne ou pathologie du nerf optique). Une atteinte d’axe rouge-vert de type I associée (touchant les cônes centraux et à différencier d’un DA d’axe rouge-vert de type II présent dans la plupart des neuropathies optiques) est présente la plupart du temps, mais elle passe inaperçue car elle est noyée dans l’importante atteinte bleu-jaune. Sa recherche dans le diabète peut permettre de faire le diagnostic différentiel entre une maculopathie débutante et une neuropathie optique. Sur le plan clinique, en ce qui concerne les maculopathies œdémateuses, il est important de retenir les deux principes suivants :
-
en cas de fixation centrale, le déficit sera une DA de type III (d’axe bleu-jaune), tandis qu’une fixation excentrée entraînera un déficit variable qui sera l’expression de la vision colorée de la nouvelle aire de fixation ;
-
une diminution de la sensibilité au rouge (DA de type I) suggère une altération des couches externes de la rétine [10]. Ainsi, à un stade cicatriciel d’une maculopathie œdémateuse, après la disparition de l’axe bleu-jaune, la persistance d’un petit axe rouge-vert signe une lésion définitive des cônes centraux [11].
La photophobie est une sensation oculaire désagréable occasionnée par l’exposition à une lumière d’intensité normale. Elle peut être indolore, et dans ce cas est apparentée à l’éblouissement, ou douloureuse. L’existence d’un OM peut engendrer une photophobie qui s’avère douloureuse, essentiellement lorsqu’il s’agit d’un OM inflammatoire accompagnant une uvéite.
Bien que rare, une diplopie monoculaire peut être occasionnée par un œdème maculaire cystoïde.
[1] Amsler M. Earliest symptoms of diseases of the macula. Brit J Ophthalmol 1953 ; 37 : 521-37.
[2] Yannuzzi LA. A modified Amsler grid. Ophthalmology 1982 ; 89 : 157-9.
[3] Goberville M, Guez JE, Le Gargasson JF. Quantification of metamorphopsia using a scanning laser ophthalmoscope. Vis Res 1995 ; 35 suppl : S137.
[4] Arndt CF, Séguinet S, Debruyne P, et al. Évaluation quantitative des métamorphopsies dans la pathologie maculaire. J Fr Ophtalmol 2000 ; 23 : 679-82.
[5] Kroyer K, Christensen U, Larsen M, et al. Quantification of metamorphopsia in patients with macular hole. Invest Ophthalmol Vis Sci 2008 ; 49 : 3741-6.
[6] Simunovic MP. Metamorphopsia and its quantification. Retina 2015 ; 35 : 1285-91.
[7] Frisen L. Metamorphopsia and dysmetropsia. Clinical test of vision. New York : Raven Press ; 1990, p. 10-42.
[8] Coscas G. Maculopathies œdémateuses. Bull Soc Opht Fr. Rapport annuel 1972, p. 84-5.
[9] Safran AB, Landis T. Plasticity in the adult visual cortex : implications for the diagnosis of visual field defects and visual rehabilitation. Curr Opin Ophthalmol 1996 ; 7 : 53-64.
[10] Pinckers A, Tilanus MAD. Colour vision in macula gliosis, cysts, holes and oedema : an approach to depth localization. In : Cavonius CR. Ed. Colour vision deficiencies XIII. Doc Ophthalmol Proc Series 1997 ; 59 : 193-203.
[11] Leid J, Lanthony P, Roth A, et al. Les dyschromatopsies. Bull Soc Opht Fr. Rapport annuel 2001. Marseille : Lamy ; 2001.
V. Gualino, C. Dubois-Roussel
➤ L’acuité visuelle (AV) est l’élément principal permettant d’évaluer le retentissement d’une atteinte maculaire et l’efficacité d’une thérapeutique.
➤ L’AV doit être évaluée avec la meilleure correction possible.
➤ La réduction de l’AV n’est pas constante entre 2 lignes d’AV mesurée en échelle décimale.
➤ Les échelles d’AV décimale manquent de précision dans les AV basses.
➤ Les échelles logarithmiques sont conçues de manière à ce que le gain entre chaque ligne soit le reflet d’une même progression.
➤ Toutes les échelles de mesures de l’AV comportent une certaine variabilité.
➤ Il existe des conversions possibles entre ces différentes échelles.
La mesure de l’acuité visuelle (AV) est un élément clé de l’examen ophtalmologique. Bien que subjective, elle rentre en compte dans de nombreuses prises en charge thérapeutiques. Dans ces situations, l’AV doit toujours être évaluée avec la meilleure correction optique après avoir fait une réfraction.
L’AV mesurée en ophtalmologie correspond au pouvoir séparateur. Il ne s’agit pas de percevoir la présence d’un objet (minimum visible) mais de distinguer deux objets très proches l’un de l’autre. C’est le plus petit écart permettant de voir 2 points distincts. L’angle formé par les 2 points et l’œil est appelé angle minimum de résolution ou minimum angle of resolution (MAR des Anglo-Saxons).
L’AV décimale (exprimée en dixièmes en France) est égale à l’inverse de la valeur de l’angle MAR exprimé en minutes d’arc : AV = 1/MAR.
En 1862, Hermann Snellen (1834–1908), ophtalmologiste néerlandais, développe les premières échelles standardisées pour l’évaluation de l’AV : une AV de 20/20 (6/6) correspondant à la capacité de discerner un optotype s’étendant sur 5 minutes d’angle à une distance de 20 pieds (6 mètres). Il donna son nom à l’échelle de Snellen largement utilisée aujourd’hui en pratique clinique (fig. 5-2). Les échelles employées en France en pratique de ville sont proches de l’échelle de Snellen, il s’agit principalement de l’échelle de Monoyer (fig. 5-3). Ce sont des échelles décimales qui notent en fonction de l’inverse du MAR.
La réduction de l’AV n’est pas constante entre 2 lignes d’acuité décimale. Plus on progresse de dixième en dixième avec une échelle classique d’AV de progression décimale, plus le gain entre chaque ligne se réduit. Ces échelles à progression géométrique manquent donc de précision pour l’évaluation des AV basses entraînant une variabilité dans les mesures.
La majorité des échelles de Snellen ont une progression géométrique [1]. Elles comprennent des lignes avec un nombre de lettres et une difficulté variables.
Pour pallier ce défaut, les échelles d’AV logarithmiques sont conçues de manière à ce que le gain entre chaque ligne soit le reflet d’une même progression en termes de MAR. Grâce aux propriétés des logarithmes, entre chaque écart de 0,1 logMAR, le pourcentage de réduction ou d’augmentation du MAR est identique (fig. 5-4).

Fig. 5-2 Échelle actuelle de Snellen couramment utilisée dans les pays anglo-saxons.

Fig. 5-3 Échelle de Monoyer couramment utilisée en France.
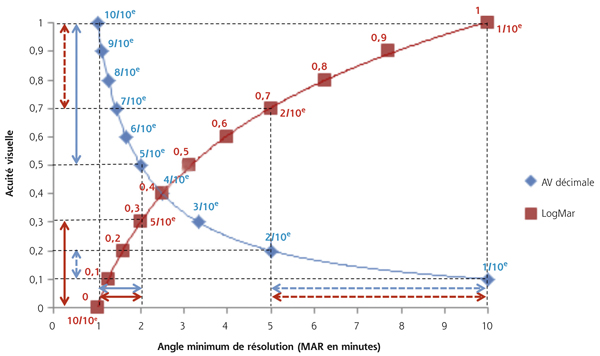
Fig. 5-4 Différence de progression d’une échelle décimale et logarithmique.
(Source : d’après Touzeau et al. Analyses statistiques de l’acuité visuelle. Encycl Méd Chir [Elsevier, Paris]. Ophtalmologie, 21-030-A-12. 2009.)
L’échelle ETDRS (fig. 5-5) est la plus connue des échelles visuelles logarithmiques et est reconnue comme le gold standard en recherche clinique. Dans l’échelle ETDRS, un gain de 3 lignes correspond toujours à un doublement de l’AV. L’échelle ETDRS permet de mesurer l’AV à la lettre près. Ses conditions de réalisation standardisées permettent en théorie de maîtriser certains facteurs influençant la mesure de l’acuité :
-
lisibilité des lettres : chaque ligne comporte 5 lettres. La tâche visuelle doit être de même difficulté pour chaque ligne lue. Seules les 10 « lettres de Sloan » (V, H, O, Z, C, N, K, R, S, D) sont utilisées et associées pour former des combinaisons de difficulté équivalente ;
-
mémorisation : il existe trois planches différentes pour éviter que le patient ne mémorise pas les lettres (ETDRS) : planche R pour la réfraction, planche 1 pour l’œil droit et planche 2 pour l’œil gauche ;
-
interaction de contour : l’espace entre les lettres d’une même ligne est égal à la largeur des lettres de cette ligne. L’espace entre 2 lignes est au moins égal à la hauteur de la plus petite de ces 2 lignes ;
-
la luminance : les mesures sont à réaliser dans une pièce sombre (< 161 lux). Deux tubes lumineux de 20 W recouverts d’un cache métallique rétro-éclairent les plaques.

Fig. 5-5 Échelle ETDRS.
Il est capital de pouvoir différencier une simple variabilité de mesure d’une amélioration ou d’une aggravation clinique liée à l’évolution de la maladie ou à son traitement. Pour certains auteurs, les conditions de réalisation standardisées de l’échelle ETDRS permettent de garantir une bonne reproductibilité de l’examen avec une variabilité non significative (< 5 lettres) entre les examinateurs [2, 3]. Cependant ces études avaient toutes pour objectif principal de montrer la reproductibilité de l’évaluation par l’échelle ETDRS et les conditions de réalisation étaient reproduites de manière très stricte. En pratique clinique et sur des grandes séries de patients, il est parfois difficile de reproduire exactement les mêmes conditions d’un examen à l’autre. De plus certains facteurs comme le diamètre pupillaire, la transparence des milieux, ou des facteurs psychologiques restent incontrôlables.
Pour de larges séries de mesure d’AV et un intervalle de confiance à 95 %, l’incertitude de répétabilité varie de 0,07 logMAR (3,5 lettres) [4] à 0,16 logMAR (8 lettres) [5] chez des sujets sains. Chez des patients présentant une baisse d’AV, cette incertitude peut varier de 0,15 logMAR (7,5 lettres) [6] à 0,2 logMAR (10 à 15 lettres) [7] selon les études.
Patel et al. ont retrouvé dans une étude portant sur 90 patients atteints de dégénérescence maculaire non exsudative (drusen, atrophie géographique ou cicatrice fibreuse rétrofovéolaire), sans signe d’activité sur les examens morphologiques (OCT, angiographie), un coefficient de répétabilité de 12 lettres en moyenne : 9 lettres pour les DMLA débutantes (petits et moyens drusen) et jusqu’à 17 lettres pour les DMLA sévères. Trente et un pour cent des patients qui avaient une DMLA stable ont eu une variation d’acuité visuelle supérieure à 5 lettres entre deux examens réalisés à 1 semaine d’intervalle (11 % d’entre eux avaient une moins bonne AV et 20 % avaient une meilleure AV). Cette variabilité était encore plus importante dans le sous-groupe des cicatrices fibreuses rétrofovéolaires ayant des AV basses (25 à 35 lettres) [8].
Sun et al., dans une étude portant sur 209 yeux atteints de rétinopathie diabétique à des stades variables, ont montré que l’utilisation d’un trou sténopéique sous-estimait l’AV d’au moins 2 lignes dans 25 % des cas et qu’elle augmentait de 5 lettres la variabilité entre deux examens en comparaison avec une réfraction classique [9].
Dans cette même étude, l’AV ETDRS mesurée avec les données du réfracteur automatique n’était pas significativement différente de celle mesurée après réfraction manuelle [9], la réfraction donnait une correction plus convexe de 0,25 dioptrie (D) en moyenne. Cependant, il est capital que l’AV soit mesurée avec une réfraction optimale. En effet, une étude a montré qu’une différence de correction sphérique de 0,50 D et 1 D induit une variabilité de respectivement 18 et 25 lettres ETDRS [10].
Le passage d’une méthode de mesure à l’autre peut également être problématique. Ainsi, Kaiser, dans une étude incluant des patients atteints de pathologies rétiniennes diverses (œdème maculaire diabétique, DMLA, membrane épimaculaire), a montré que l’échelle ETDRS surestimait l’AV de 6,5 lettres en moyenne par rapport à l’échelle de Snellen convertie en logMAR. Cette différence était d’autant plus importante que l’AV était basse [11]. Falkenstein et al. ont retrouvé eux aussi une différence en faveur de l’échelle ETDRS de 2 lignes (10 lettres) quand l’AV était comprise entre 1 et 5/10. En dessous de 1/10, la différence en faveur de l’ETDRS atteignait 4 lignes, et au-dessus de 6/10, la différence entre les deux échelles était de moins de 1 ligne [12].
Toutefois, toutes les études ne retrouvent pas cette différence entre l’échelle de Snellen et l’ETDRS. Lim et al. ont comparé les échelles ETDRS et Snellen sur 40 yeux de 40 patients en pratique courante et n’ont pas retrouvé de différence statistiquement significative sur l’AV moyenne entre les échelles (0,42 logMAR pour l’échelle ETDRS et 0,41 logMAR pour la Snellen) [13]. Avec un intervalle de confiance à 95 %, l’incertitude de répétabilité variait de ± 0,14 logMAR pour l’échelle ETDRS à ± 0,18 logMAR pour l’échelle de Snellen. La différence entre les deux échelles n’était que de 0,04 logMar soit 2 lettres ETDRS pour la variabilité des mesures. En revanche, la différence de temps nécessaire à la mesure de l’AV a montré que l’échelle ETDRS prenait presque deux fois plus de temps. Les auteurs en concluaient qu’il était difficile d’imposer l’échelle ETDRS en pratique courante [13].
Du fait de cette variabilité des mesures d’AV, plus importante avec une échelle de Snellen mais aussi présente avec l’échelle ETDRS, certains auteurs suggèrent qu’il faudrait fixer le seuil de variation significative d’AV ETDRS à 10 lettres et non à 5 lettres avant de conclure à une aggravation de la maladie ou à une amélioration sous traitement [8, 14], et ce d’autant plus que l’AV initiale est basse [15].
On note d’ailleurs que dans les études où le gain d’AV est classé comme une variable qualitative, les auteurs présentent les résultats en termes de pourcentage de patients ayant présenté un gain supérieur ou égal à 2 ou 3 lignes (10 ou 15 lettres). Ce type de présentation très fréquent est plus parlant pour le clinicien et le patient mais présente certains inconvénients :
-
des erreurs de classement car la variabilité de mesure décrite plus haut peut conduire à classer le patient dans le mauvais groupe si son acuité est proche du seuil choisi ;
-
une perte d’information, car un patient gagnant 15 lettres aura le même poids statistique qu’un patient gagnant 45 lettres en raison d’un effet plafond : un patient présentant une très bonne acuité visuelle avant traitement ne pourra pas améliorer sa vision de 15 lettres même s’il atteint 10/10.
Pour certains auteurs, l’étude de la moyenne de variation d’acuité visuelle qui apporte le plus d’informations et souffre également de moins de variabilités de mesure devrait être utilisée comme critère de jugement principal [15].
En France, l’acuité visuelle est mesurée en dixièmes. Dans d’autres pays, les unités sont différentes mais donnent des notions très voisines (tableau 5-1).
L’échelle communément utilisée en France pour l’AV de près est l’échelle de Parinaud. D’autres échelles de près sont disponibles (tableau 5-2).
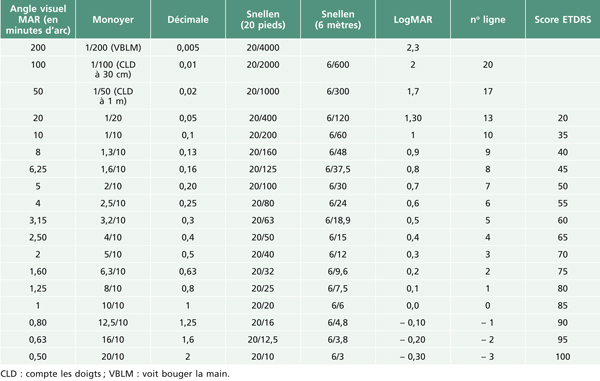
Tableau 5-1 Équivalence des différentes échelles de mesure d’acuité visuelle de loin.
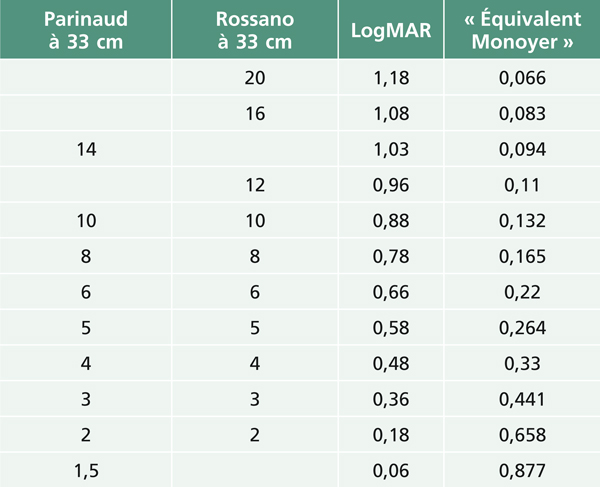
Tableau 5-2 Équivalence des différentes échelles de mesure d’acuité visuelle de près.
[1] Williams MA, Moutray TN, Jackson AJ. Uniformity of visual acuity measures in published studies. Invest Opthalmol Vis Sci 2008 ; 49 : 4321-7.
[2] Arditi A, Cagenello R. On the statistical reliability of letter-chart visual acuity measurements. Invest Opthalmol Vis Sci 1993 ; 34 : 120-9.
[3] Klein R, Klein BE, Moss SE, DeMets D. Inter-observer variation in refraction and visual acuity measurement using a standardized protocol. Ophthalmology 1983 ; 90 : 1357-9.
[4] Elliott DB, Sheridan M. The use of accurate visual acuity measurements in clinical anti-cataract formulation trials. Ophthalmic Physiol Opt 1988 ; 8 : 397-401.
[5] Raasch TW, Bailey IL, Bullimore MA. Repeatability of visual acuity measurement. Optometry and vision science : official publication of the American Academy of Optometry 1998 ; 75 : 342-8.
[6] Camparini M, Cassinari P, Ferrigno L, Macaluso C. ETDRS-fast : implementing psychophysical adaptive methods to standardized visual acuity measurement with ETDRS charts. Invest Opthalmol Vis Sci 2001 ; 42 : 1226-31.
[7] Kiser AK, Mladenovich D, Eshraghi F, et al. Reliability and consistency of visual acuity and contrast sensitivity measures in advanced eye disease. Optom Vis Sci 2005 ; 82 : 946-54.
[8] Patel PJ, Chen FK, Rubin GS, Tufail A. Intersession repeatability of visual acuity scores in age-related macular degeneration. Invest Opthalmol Vis Sci 2008 ; 49 : 4347-52.
[9] Sun JK, Aiello LP, Cavallerano JD, et al. Visual acuity testing using autorefraction or pinhole occluder compared with a manual protocol refraction in individuals with diabetes. Ophthalmology 2011 ; 118 : 537-42.
[10] Rosser DA, Murdoch IE, Cousens SN. The effect of optical defocus on the test-retest variability of visual acuity measurements. Invest Opthalmol Vis Sci 2004 ; 45 : 1076-9.
[11] Kaiser PK. Prospective evaluation of visual acuity assessment : a comparison of snellen versus ETDRS charts in clinical practice (An AOS Thesis). Trans Am Ophthalmol Soc 2009 ; 107 : 311-24.
[12] Falkenstein IA, Cochran DE, Azen SP, et al. Comparison of visual acuity in macular degeneration patients measured with snellen and early treatment diabetic retinopathy study charts. Ophthalmology 2008 ; 115 : 319-23.
[13] Lim LA, Frost NA, Powell RJ, Hewson P. Comparison of the ETDRS logMAR, ‘compact reduced logMar’and Snellen charts in routine clinical practice. Eye 2010 ; 24 : 673-7.
[14] Rosser DA, Cousens SN, Murdoch IE, et al. How sensitive to clinical change are ETDRS logMAR visual acuity measurements ? Invest Opthalmol Vis Sci 2003 ; 44 : 3278-81.
[15] Beck RW, Maguire MG, Bressler NM, et al. Visual acuity as an outcome measure in clinical trials of retinal diseases. Ophthalmology 2007 ; 114 : 1804-9.
C. Meillon
➤ La prise en compte de la qualité de vie des patients dans les études est devenue un critère indispensable pour évaluer un traitement.
➤ Le NEI VFQ-25 est le test psychométrique le plus souvent utilisé dans les études évaluant des traitements pour la DMLA ou les OM diabétiques ou des occlusions veineuses. Il permet une évaluation subjective de la fonction visuelle ainsi que l’influence des problèmes de vision sur les activités de la vie.
L’œdème maculaire (OM) est une affection le plus souvent chronique se traduisant cliniquement par une modification de la vision centrale. Selon la pathologie en cause dans la formation de l’œdème, la vision périphérique reste globalement conservée, mais la perte de l’acuité peut être sévère et suffisante pour entraîner un handicap visuel non négligeable sur la qualité de vie (QDV) des patients. Dans ce contexte, l’Organisation mondiale de la santé (OMS) a défini en 1994 la QDV comme « la perception qu’a un individu de sa place dans l’existence, dans le contexte de la culture et du système de valeurs dans lesquels il vit, en relation avec ses objectifs, ses attentes, ses normes et ses inquiétudes. Il s’agit d’un large champ conceptuel, englobant de manière complexe la santé physique de la personne, son état psychologique, son niveau d’indépendance, ses relations sociales, ses croyances personnelles et sa relation avec les spécificités de son environnement ».
Les relations entre l’ophtalmologie clinique et la QDV restent complexes (fig. 5-6), si la QDV en relation avec la vision n’est qu’une composante de la QDV liée à la santé, celle-ci n’en est pas moins fondamentale surtout chez les patients souffrant d’OM. Devant l’importance d’incorporer la QDV en pratique médicale et en prenant en compte l’augmentation de la prévalence de l’OM dans la population générale, il devient impératif de comprendre et de mesurer l’impact de l’OM sur la QDV des patients en pratique ophtalmologique de routine et dans le domaine de la recherche. Les traditionnelles mesures cliniques utilisées en ophtalmologie comme l’acuité visuelle, le champ visuel ou la vision des couleurs et des contrastes peuvent ainsi se révéler insuffisantes pour investiguer les nombreux aspects de la QDV de ces patients. La prise en compte de tous les aspects d’une pathologie ophtalmologique, incluant le retentissements psychologiques ou sur l’activité quotidienne et le bien-être en rapport avec la fonction visuelle, pourrait être un paramètre aussi important que la mesure seule de l’AV [1]. Les traitements itératifs, nécessitant des visites et examens fréquents mais également une sensation d’incertitude quant aux échéances à venir, participent également au retentissement de la pathologie. La pathologie impacte donc le patient tant par son retentissement direct sur sa vision que par les contraintes imposées par le traitement. Enfin, dans le domaine de la basse vision, la prise en compte de la QDV encourage le développement des aides visuelles et autres dispositifs pour soutenir les patients dans les actions de la vie quotidienne en fournissant une évaluation objective de leurs besoins ainsi que des bénéfices des dispositifs mis en place.
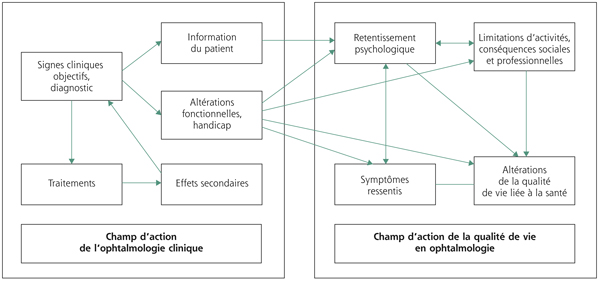
Fig. 5-6 Diagramme schématique des relations entre ophtalmologie clinique et qualité de vie.
Les instruments génériques ont été développés afin de pouvoir servir d’indicateurs sur l’état de santé et sur la qualité de vie, en se rendant indépendants de la pathologie étudiée, de son degré de sévérité, du traitement et du profil des patients (âge, sexe, origine ethnique, etc.). Ces échelles, dont les plus connues et utilisées sont le SIP et le SF-36 par exemple, sont parmi les plus anciennes et ont su faire preuve de leur fiabilité dans de nombreux domaines de la médecine.

Tableau 5-3 Les différentes échelles de qualité de vie génériques et spécifiques à l’ophtalmologie.
De nombreuses échelles de mesure de la QDV existent actuellement en ophtalmologie. Nous ne citerons que les plus connues.
Le NEI-VFQ-25 est le test psychométrique le plus souvent utilisé dans les études concernant la DMLA (29 %) [2]. C’est un questionnaire qui permet une évaluation subjective de la fonction visuelle ainsi que l’influence des problèmes de vision sur les activités de la vie. Elle est une version courte du NEI-VFQ-51 élaboré dans les années 1990 [3]. Il se compose de 25 items représentant 11 dimensions en rapport avec la vision auxquelles s’ajoute une dimension concernant l’état de santé général (tableau 5-4). De nombreuses études ont déjà validé et rapporté les résultats de l’utilisation du NEI-VFQ sur des patients atteints de DMLA, diabète, glaucome, uvéite ou OVCR [4, 5].
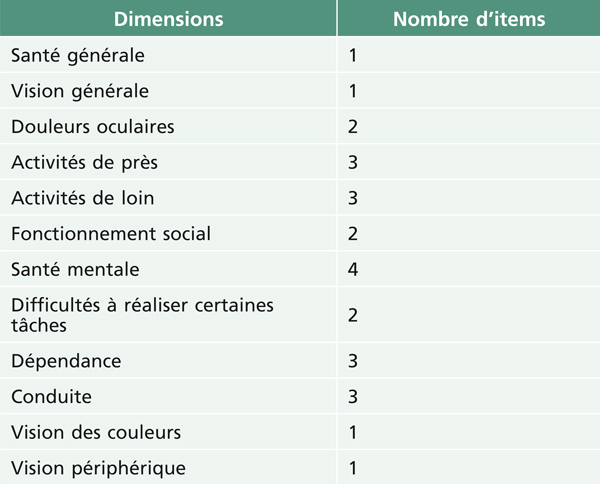
Tableau 5-4 Les 12 dimensions explorées dans le NEI-VFQ-25 et le nombre d’items correspondants.
Le MacDQoL prend en compte l’impact de l’affection maculaire sur des aspects de la vie ayant une connotation plus personnelle sur l’individu et sa QDV. Plusieurs études ont montré sa fiabilité et sa pertinence dans la DMLA [6]. Il reste aujourd’hui le test le plus spécifique en ce qui concerne les pathologies maculaires.
L’œdème maculaire du diabétique (OMD) est l’une des complications de la rétinopathie diabétique (RD), il reste la cause majeure de déficience visuelle et de cécité chez ces patients [7, 8]. La Wisconsin Epidemiologic Study of Diabetic Retinopathy (WESDR) rapporte que 20 % des diabétiques de type 1 et 25 % des diabétiques de type 2 développeront un OM [9]. Le retentissement sur la QDV est souvent majeur. Il en résulte des sentiments de frustration, d’incompréhension, de baisse de l’estime de soi, mais aussi une sensation d’isolement social pouvant aller jusqu’à la dépression [10]. Le score du NEI-VFQ-25 chez les diabétiques de type 2 souffrant d’OM serait assez proche de ceux souffrant de DMLA mais nettement plus faible par rapport aux diabétiques de type 1 ayant une RD ou aux pathologies comme le glaucome ou la cataracte [11]. Les anti-VEGFs ont prouvé leur efficacité en termes de gain d’AV mais aussi en termes d’amélioration de la QDV en comparaison des traitements par laser focal ou en l’absence de traitement. Les résultats des études RESTORE, RIDE et RISE ont toutes démontré une amélioration significative du score du NEI-VFQ-25 après 1 et 2 ans chez des patients atteints d’OMD avec un traitement par ranibizumab [1, 12].
Concernant les occlusions veineuses rétiniennes (OVR) qui ont une prévalence de 1,6 % dans la Blue Mountain Study, l’OM reste la principale cause de baisse d’AV. Les OVR sont associées à une baisse de la QDV évaluée par le NEI-VFQ-25 par rapport à des sujets sains [13]. Les traitements de l’OM par anti-VEGF ou corticostéroïdes ont montré une augmentation du score du NEI-VFQ-25 par rapport à des patients traités par placebo.
Enfin, dans les autres causes d’OM dans les pathologies comme la DMLA exsudative, les uvéites ou le syndrome d’Irvine-Gass, il faut souligner que la QDV est là aussi fortement modifiée avec une diminution des différents scores [14]. L’avènement des nouvelles thérapies par injection intravitréenne d’anti-VEGF ou de corticostéroïdes a également permis d’améliorer le pronostic en termes d’AV mais aussi de QDV [15].
La formation d’un OM dans les diverses pathologies comme le diabète, les OVR ou la DMLA marque un tournant pour le patient en termes de retentissement sur son acuité visuelle.
L’altération des fonctions visuelles induite par l’OM, non seulement par la dégradation de la fonction sensorielle mais aussi par le retentissement psychologique qu’elle induit, conduit à une restriction des activités du patient, pouvant altérer sa vie sociale et professionnelle, et par là même, dégrader très nettement sa QDV, dans son acceptation la plus globale. La prise en compte de la QDV des patients dans les études est devenue un critère indispensable pour évaluer un traitement. Les divers scores de QDV spécifiques à l’ophtalmologie comme le NEI-VFQ-25 sont devenus des critères essentiels associés à l’évaluation de l’AV. Ils s’inscrivent dans une nouvelle vision de prise en charge des patients, plus globale et fondée sur le retentissement de la maladie sur le patient dans sa vie de tous les jours.
[1] Bressler NM, Varma R, Suner IJ, et al. Vision-related function after ranibizumab treatment for diabetic macular edema: results from RIDE and RISE. Ophthalmology 2014 ; 121 : 2461-72.
[2] Finger RP, Fleckenstein M, Holz FG, Scholl HP. Quality of life in age-related macular degeneration: a review of available vision-specific psychometric tools. Qual Life Res 2008 ; 17 : 559-574.
[3] Mangione CM, Lee PP, Pitts J, et al. Psychometric properties of the National Eye Institute Visual Function Questionnaire (NEI-VFQ). NEI-VFQ Field Test Investigators. Arch Ophthalmol 1998 ; 116 : 1496-504.
[4] Clemons TE, Chew EY, Bressler SB, McBee W, Age-Related Eye Disease Study Research Group. National Eye Institute Visual Function Questionnaire in the Age-Related Eye Disease Study (AREDS) : AREDS Report No. 10. Arch Ophthalmol 2003 ; 121 : 211-7.
[5] Klein R, Moss SE, Klein BE, et al. The NEI-VFQ-25 in people with long-term type 1 diabetes mellitus : the Wisconsin Epidemiologic Study of Diabetic Retinopathy. Arch Ophthalmol 2001 ; 119 : 733-40.
[6] Mitchell J, Wolffsohn J, Woodcock A, et al. The MacDQoL individualized measure of the impact of macular degeneration on quality of life: reliability and responsiveness. Am J Ophthalmol 2008 ; 146 : 447-54.
[7] Moss SE, Klein R, Klein BE. Ten-year incidence of visual loss in a diabetic population. Ophthalmology 1994 ; 101 : 1061-70.
[8] Ciulla TA, Amador AG, Zinman B. Diabetic retinopathy and diabetic macular edema : pathophysiology, screening, and novel therapies. Diabetes Care 2003 ; 26 : 2653-64.
[9] Klein R, Klein BE, Moss SE, Cruickshanks KJ. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. XV. The long-term incidence of macular edema. Ophthalmology 1995 ; 102 : 7-16.
[10] Fenwick EK, Pesudovs K, Khadka J, et al. The impact of diabetic retinopathy on quality of life : qualitative findings from an item bank development project. Qual Life Res 2012 ; 21 : 1771-82.
[11] Hariprasad SM, Mieler WF, Grassi M, et al. Vision-related quality of life in patients with diabetic macular oedema. Br J Ophthalmol 2008 ; 92 : 89-92.
[12] Mitchell P, Bandello F, Schmidt-Erfurth U, et al. The RESTORE study : ranibizumab monotherapy or combined with laser versus laser monotherapy for diabetic macular edema. Ophthalmology 2011 ; 118 : 615-25.
[13] Awdeh RM, Elsing SH, Deramo VA, et al. Vision-related quality of life in persons with unilateral branch retinal vein occlusion using the 25-item National Eye Institute Visual Function Questionnaire. Br J Ophthalmol 2010 ; 94 : 319-23.
[14] Yuzawa M, Fujita K, Tanaka E, Wang EC. Assessing quality of life in the treatment of patients with age-related macular degeneration: clinical research findings and recommendations for clinical practice. Clin Ophthalmol 2013 ; 7 : 1325-32.
[15] Lightman S, Belfort R Jr., Naik RK, et al. Vision-related functioning outcomes of dexamethasone intravitreal implant in noninfectious intermediate or posterior uveitis. Invest Ophthalmol Vis Sci 2013 ; 54 : 4864-70.
V. Gualino, A. Erginay
➤ L’examen clinique par lentille, le plus souvent non contact, est généralement la première étape d’une exploration de la macula chez un patient se plaignant de baisse de vision.
➤ Cet examen permet de détecter les logettes caractéristiques de l’œdème mais surtout les signes rétiniens associés qui orienteront les examens complémentaires.
➤ Les lentilles de 60 et 78 D sont bien adaptées à l’examen maculaire.
L’examen clinique pour la recherche d’un œdème maculaire consiste en la réalisation d’un fond d’œil au biomicroscope, après dilatation pupillaire, de préférence avec un verre de contact. Il permet la visualisation d’un épaississement rétinien dans la région maculaire.
L’examen biomicroscopique permet une analyse stéréoscopique de la macula et la visualisation directe d’un épaississement rétinien s’il est présent. On réglera le biomicroscope pour avoir une fente fine, légèrement décalée (fig. 5-7). La visualisation de logettes intrarétiniennes est caractéristique d’un œdème maculaire cystoïde (fig. 5-8). Ces logettes peuvent être de tailles différentes, prenant l’aspect caractéristique en nid d’abeilles, en général plus larges vers le centre de la fovéola et de plus petite taille vers la périphérie de l’œdème. L’analyse du fond d’œil reste toutefois subjective, à la différence de mesures objectives de l’OCT par exemple, et dépendante de multiples facteurs comme l’expérience de l’examinateur.
Fig. 5-7 Visualisation d’un œdème maculaire au biomicroscope en fente fine avec une lentille contact.
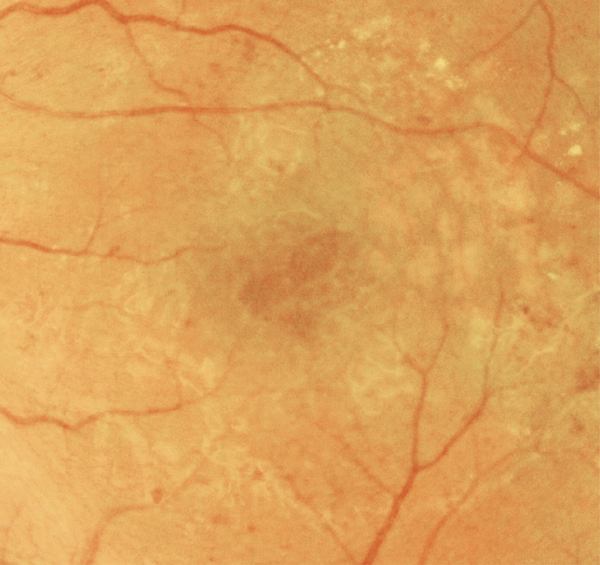
Fig. 5-8 Œdème maculaire cystoïde avec aspect en nid d’abeilles des logettes.
Ces lentilles offrent une excellente vision du pôle postérieur, avec un bon relief. Elles permettent d’analyser la macula plus précisément sans être gêné par les clignements de paupières. La qualité des images ainsi que la stéréoscopie sont meilleures qu’avec une lentille non contact et l’image est plus stable. Elles nécessitent d’instiller une goutte d’anesthésiant local ainsi que d’utiliser un gel de contact. Certains patients peuvent mal les supporter ou faire un malaise vagal. On peut utiliser le verre central du verre à trois miroirs de Goldman. Il existe de multiples verres directs ou indirects dédiés à l’analyse de la macula.
Brown et al. ont montré en 2004 une mauvaise corrélation (69 %) entre le diagnostic d’œdème maculaire au biomicroscope avec lentille de contact versus le diagnostic de référence par OCT 3 time-domain. Les discordances les plus fréquentes étaient retrouvées quand l’épaisseur maculaire était comprise entre 200 et 300 μm. Lorsque ces valeurs étaient soustraites de l’analyse, le taux de corrélation augmentait à 85 % [1]. L’examen clinique reste donc relativement sensible soit en l’absence d’œdème maculaire, soit quand l’œdème maculaire est supérieur à 300 μm en OCT.
Les lentilles non contact permettent de réaliser une ophtalmoscopie indirecte. Le principe de la vision indirecte permet d’avoir un grand champ tout en inversant l’image. Plus la puissance de la lentille est faible en dioptrie, plus l’image est magnifiée avec bonne sensation de relief mais avec un champ de vision plus faible. On privilégiera une lentille 60 D ou 78 D pour l’analyse de la macula, ces lentilles permettent une bonne magnification au prix d’un champ de vision réduit de l’ordre de 75°. L’utilisation de lentilles non contact diminuerait de 10 % la sensibilité du diagnostic d’œdème maculaire par rapport à l’utilisation de lentilles contact [2].
En fonction de l’étiologie de l’œdème maculaire, des anomalies rétiniennes peuvent être associées :
-
on recherchera des arguments pour un œdème maculaire diabétique (fig. 5-9) : micro-anévrismes, micro-hémorragies, couronnes d’exsudats généralement disposés autour des anomalies microvasculaires (AMIR et micro-anévrismes) ;
-
une traction vitréorétinienne (fig. 5-10).
L’analyse de la périphérie rétinienne, parfois délicate avec les examens complémentaires, reste essentielle dans l’examen clinique qui garde ainsi tout son intérêt.
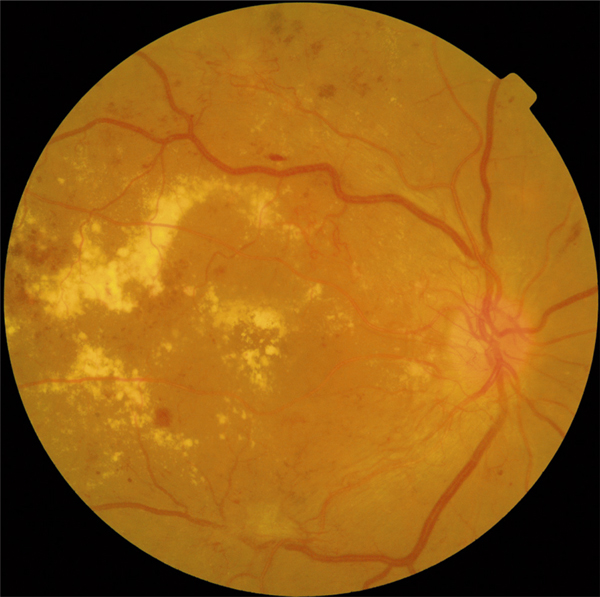
Fig. 5-9 Œdème maculaire diabétique mixte avec néovaisseaux prépapillaires.
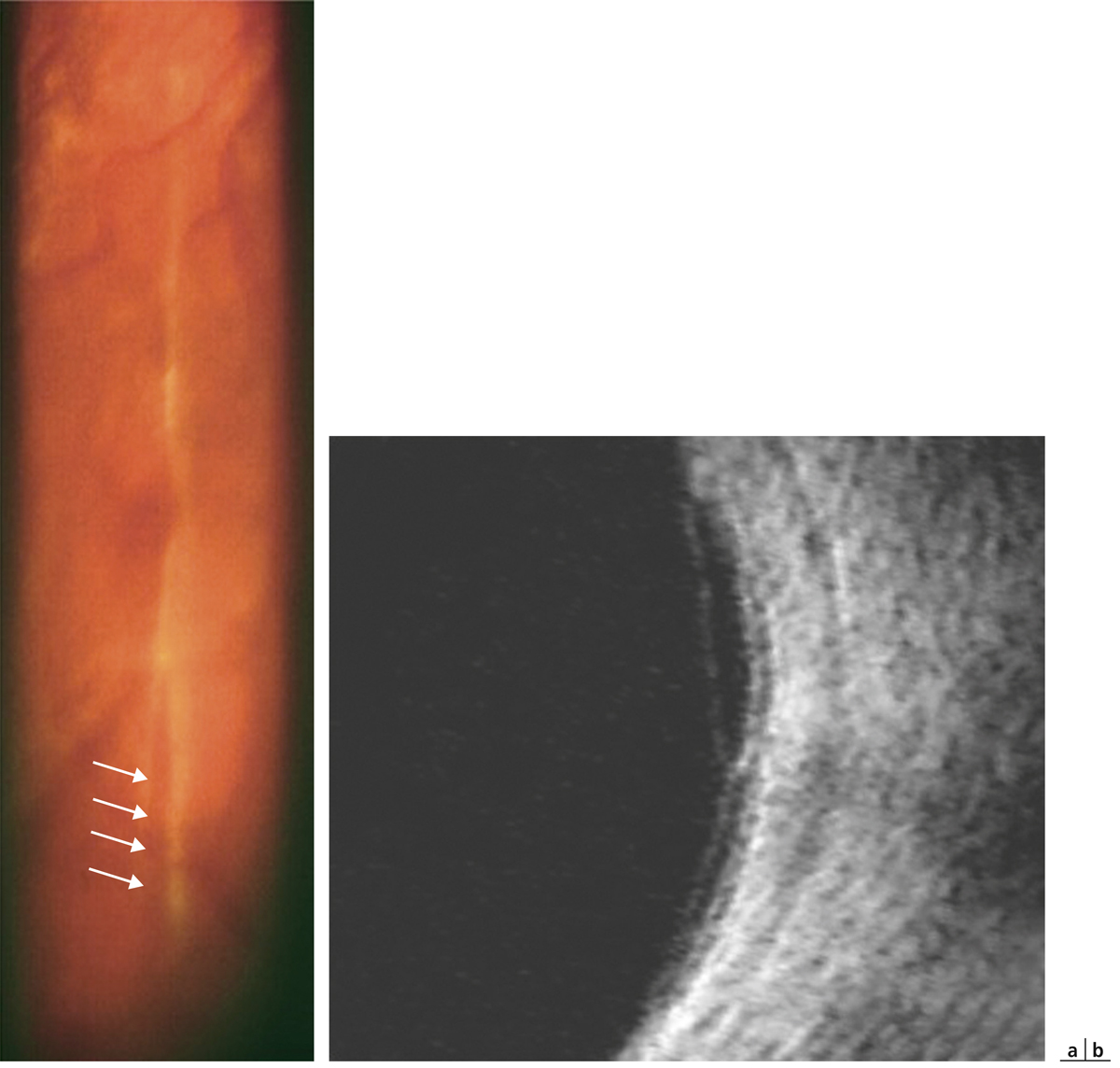
Fig. 5-10 Traction vitréorétinienne en biomicroscopie (a) et en échographie (b).
Depuis la généralisation de l’OCT et des rétinographes en couleurs, l’examen clinique passe souvent au deuxième plan dans l’analyse d’un œdème maculaire. Il garde pourtant tout son intérêt pour rechercher des complications associées à l’œdème maculaire, pouvant participer à une baisse d’acuité visuelle ou à la physiopathologie de cet œdème.
On recherchera plus précisément :
-
un syndrome sec avec une kératite superficielle, surtout chez les patients diabétiques ;
-
une inflammation (tyndall) a minima orientant vers une cause inflammatoire de l’œdème ;
-
une rubéose irienne ;
-
une cataracte participant à la baisse d’acuité visuelle ;
-
des séquelles de chirurgie de cataracte avec complications : rupture capsulaire, vitré en chambre antérieure, lésions iriennes ;
-
un implant mal centré ou une opacification capsulaire postérieure.
[1] Brown JC, Solomon SD, Bressler SB, et al. Detection of diabetic foveal edema : contact lens biomicroscopy compared with optical coherence tomography. Arch Ophthalmol 2004 ; 122 : 330-5.
[2] Brun SC, Bressler SB, Maguire MG, et al. A comparison of fundus biomicroscopy and 90 diopter lens examination in the detection of diabetic clinically significant macular edema [ARVO abstract]. Invest Ophthalmol Vis Sci 1993 ; 34 : 718.
J. Leid
➤ L’étude de la vision des couleurs est un excellent marqueur de la fonction des cônes maculaires souvent plus sensible que l’acuité visuelle.
➤ Il existe deux grands types de dyschromatopsies : celles héréditaires regroupant les daltonismes et les achromatopsies et celles acquises rassemblant les affections rétiniennes altérant les cônes et les dysfonctionnements des voies optiques rétrobulbaires.
➤ Les dyschromatopsies acquises (DA) sont soit d’axe rouge-vert dites de types I et II, soit bleu-jaune dite de type III majoritaires dans les œdèmes maculaires.
➤ Les DA sont détectées par les tests pigmentaires désaturés.
La perception colorée n’est possible chez l’homme que du fait de l’existence des cônes.
Ces cellules réceptrices de la lumière sont peu nombreuses en comparaison des bâtonnets (environ 20 fois moins), elles sont réparties sur toute la rétine mais avec une très forte densité dans la région maculaire. Elles sont responsables à la fois de l’acuité visuelle fine et de la vision des couleurs. On peut ainsi logiquement s’attendre à une corrélation entre ces deux fonctions en cas de pathologie maculaire et donc en cas d’œdème, mais ce n’est en fait pas toujours le cas, la vision des couleurs étant plus sensible que l’acuité visuelle.
L’étude de la vision des couleurs est un excellent marqueur de la fonction des cônes maculaires. Nous disposons aujourd’hui de techniques d’imagerie d’une grande finesse permettant d’apprécier l’anatomie de la rétine centrale, mais ne nous renseignant pas directement sur la fonction visuelle. Celle-ci doit être évaluée par d’autres méthodes dont l’ensemble reflète la qualité de notre vision et, plus que l’anatomie, c’est bien cela que les ophtalmologistes s’efforcent de préserver !
Les atouts principaux de cette exploration sont sa simplicité et la précocité de son altération en cas de pathologie maculaire, constituant ainsi un signal d’alarme efficace.
Il existe deux grands types de dyschromatopsies suivant qu’elles sont héréditaires et alors immuables et possédant des caractères colorimétriques parfaitement définis, ou acquises, variables et complexes.
Le premier groupe résulte d’une modification constitutionnelle des photopigments des cônes ou d’un défaut de transduction ; il regroupe essentiellement les daltonismes et les achromatopsies. Le second est partie constituante de l’atteinte fonctionnelle visuelle, qu’elle soit due à une affection rétinienne altérant les cônes ou à un dysfonctionnement des voies optiques rétrobulbaires affectant alors le fonctionnement des canaux colorés antagonistes rouge-vert et bleu-jaune à l’origine de la perception colorée.
Les DA sont caractérisées par leur complexité liée à leur physiopathologie. L’atteinte des trois types de cônes et des deux canaux antagonistes colorés, même si elle est inhomogène, sera toujours présente à terme. La classification des DA proposée par Verriest en 1964 [1] et toujours valide est donc plus descriptive que physiologique. Elle se base sur la prépondérance des axes de confusion colorée dans une dyschromatopsie donnée. On retient une DA rouge-vert de type I (fig. 5-11a), une rouge-vert de type II (fig. 5-11b) et une bleu-jaune dite de type III (fig. 5-11c). Lorsque la DA est sévère et que l’ensemble des mécanismes est touché de façon significative, on parle de dyschromatopsie sans axe qui est en fait une achromatopsie acquise. Plus finement, en réalité, il existe également des DA sans axe qui diffèrent des précédentes, car elles résultent de l’association d’une DA de type III à une DA de type I ou II sans pour autant prendre les caractéristiques colorimétriques d’une achromatopsie.
Les DA de type III étant de loin les plus fréquentes, on peut, pour affiner leur qualification, les scinder artificiellement en DA d’axe tritan et tétartan en fonction de l’emplacement dominant des axes de confusions.
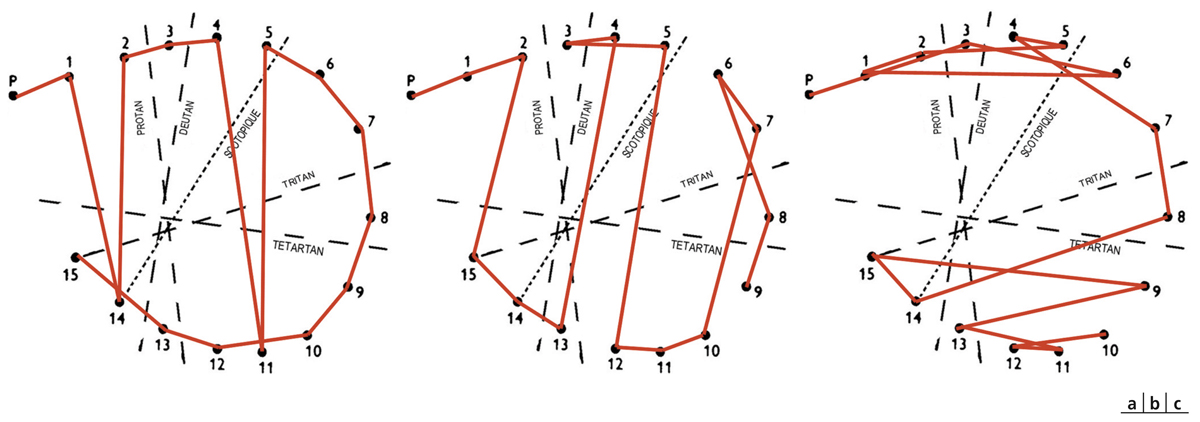
Fig. 5-11 Dyschromatopsie acquise d’axe rouge-vert.
Types I (a), II (b) et III (c), Panel D15 désaturé.
Toutes les DA entraînent une perte rapide de la sensibilité à la saturation. Les couleurs sont perçues par les patients comme « délavées ». Ce caractère crucial impose d’utiliser des tests pigmentaires désaturés pour en faire au plus tôt le diagnostic. Les planches pseudo-isochromatiques ne sont en pratique d’aucun secours. Les anomaloscopes sont d’une rareté extrême en France mais sont pourtant d’une grande utilité à la condition de tester l’ensemble du spectre par la méthode des deux équations colorées de Roth [2] : équation de Rayleigh pour évaluer les moyennes et longues longueurs d’onde (ainsi que pour éliminer une dyschromatopsie héréditaire) et équation de Moreland pour tester les courtes longueurs d’onde sachant que cette région est la plus souvent et la plus précocement atteinte dans les DA.
Les tests de prédilection sont cependant les tests d’assortiment (de pions colorés) désaturés, en premier lieu le test de Panel D15 désaturé de Lanthony (fig. 5-12) qui est simple, rapide et performant à la condition d’être administré dans de bonnes conditions d’éclairement, de préférence à l’aide de lampes fluorescentes ou fluocompactes de bon indice de rendu des couleurs et de température de couleur suffisante [3].
Si la DA est très intense on pourra y associer un test saturé tel le test 15 Hue de Farnsworth, moins sensible, permettant d’affiner le diagnostic lorsque le test désaturé est trop anarchique.
Les tests seront toujours dispensés en monoculaire, car les DA sont différentes d’un œil à l’autre.

Fig. 5-12 Panel D15 désaturé de Lanthony sous une lampe de McBeth.
On ne peut imaginer qu’une maladie rétinienne n’atteigne qu’un seul type de cône. Dans le cadre des œdèmes maculaires qui touchent par définition plus spécifiquement la rétine centrale, il faut distinguer les rétinopathies essentiellement fovéales des pathologies intéressant plus globalement l’ensemble de la macula. Les cônes S qui sont les moins nombreux (environ 10 % des cônes) sont situés essentiellement dans l’aire fovéale. Ils sont d’une grande fragilité, sensibles à toute perturbation du fonctionnement rétinien et notamment l’œdème. On ne s’étonnera donc pas de retrouver des DA de type III dans les œdèmes maculaires dès les stades les plus précoces de ces pathologies.
Le cheminement nerveux postérieur aux cônes S est spécifique et constitue la voie K qui ne représente que 1 % des fibres du nerf optique. Elle permet l’antagonisme entre les courtes longueurs d’onde et les longueurs d’onde moyennes et longues véhiculées par les voies M et P. L’atteinte de la voie K aboutit à des confusions d’axe bleu-jaune [4].
Il ne faut pas oublier cependant que la zone fovéolaire ne comporte que des cônes M et L. En conséquence, si une pathologie intéresse de façon prépondérante cette zone, il faut s’attendre à retrouver une dyschromatopsie d’axe rouge-vert. Les récentes techniques d’optique adaptative ont toutefois permis de constater que la répartition des différents types de cônes était très différente d’un sujet à l’autre [5], ce qui pourrait expliquer la relative variabilité des dyschromatopsies observées selon les patients pour des pathologies maculaires paraissant similaires.
Ce sont de loin les plus fréquentes. En fait, elles sont toujours présentes, isolées ou associées, si l’on met tout en œuvre pour les retrouver. Elles peuvent être très précoces alors que le fond d’œil voire même la tomographie par cohérence optique (optical coherence tomography [OCT]) ne montre encore aucune anomalie et doivent être recherchées à titre de dépistage et de signal d’alarme. À l’opposé, elles peuvent constituer une séquelle définitive, parfois isolée, après guérison anatomique d’un œdème maculaire. Leur intensité est très variable suivant la forme anatomique de l’œdème allant de quelques inversions à un axe tritan franc en passant par des axes tétartan qui demeurent les plus fréquents.
Suivant l’étiologie de l’œdème, on pourra retrouver une DA d’axe rouge-vert. Le plus souvent elle s’associe à une DA de type III qui la précède. Dans ce cas, elle est le plus souvent de type I signant classiquement une atteinte des cônes centraux (fig. 5-13). Cette forme de dyschromatopsie est connue depuis très longtemps sous le vocable de pseudo-protanomalie que Jaeger considérait déjà en 1951 comme pathognomonique des maladies accompagnées d’un œdème maculaire [6]. On peut plus rarement trouver des DA de type II qui sont plutôt l’apanage des atteintes post-rétiniennes, mais qui, en fait, peuvent aussi coexister avec une DA de type III. L’apparition soudaine d’une DA d’axe rouge-vert dans une pathologie rétinienne accompagnée d’une DA de type III est le plus souvent un signe de gravité dont il faut tenir compte, car il traduit la souffrance des récepteurs maculaires même si l’anatomie n’a pas varié [7]. Si l’OCT reste inchangé, la survenue d’une DA d’axe rouge-vert impose une réévaluation de la conduite diagnostique et thérapeutique.
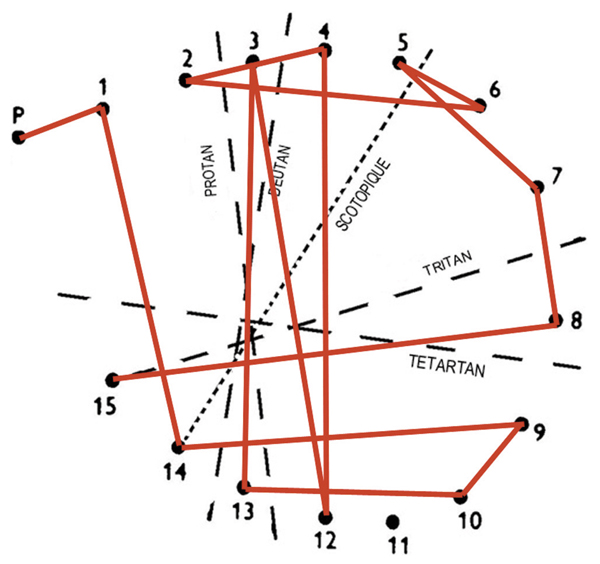
Fig. 5-13 Association d’une DA de type I avec une DA de type III au Panel D15 désaturé.
Elles recoupent soit la simple association d’une DA de type III intense avec une DA de type I ou II, soit une véritable achromatopsie acquise. Dans le premier cas, l’usage de tests saturés permettra de préciser le diagnostic devant un schéma de Lanthony anarchique (dit « sans axe » ou type IV de Verriest). Ce type de déficit peut résulter d’une altération des cônes S très sensibles à l’œdème associée à une atteinte des cônes centraux dont le pronostic est sérieux mais pas forcément dramatique si la situation ne perdure pas. Dans le second cas par contre, un axe de type scotopique sera mis en évidence attestant d’une atteinte profonde de tous les mécanismes colorés dont la signification est péjorative (fig. 5-14). Ces déficiences sont le plus souvent définitives. Elles signent une altération fonctionnelle profonde même si l’anatomie maculaire est réhabilitée.
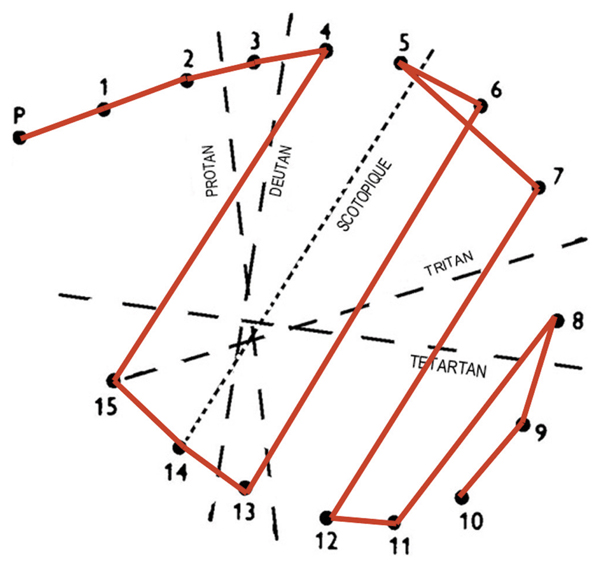
Fig. 5-14 Achromatopsie acquise : axe scotopique au Panel D15 désaturé.
[1] Verriest G. Les déficiences acquises de la discrimination chromatique. Mém Acad Royale Méd Belg 1964 ; IV, 5 : 34-327.
[2] Roth A, Lanthony P. Techniques d’exploration de la vision des couleurs. In : Risse JF. Exploration de la fonction visuelle. Rapport Soc Fr Ophtalmol. Paris : Masson ; 1999, p. 129-51.
[3] Leid J. Les dyschromatopsies. Rapport Soc Fr Ophtalmol. Marseille : Lamy ; 2001, 301 p.
[4] Rigaudière F. Comment voit-on en couleur ? In : Leid J. Spécial vision des couleurs. Propos Biopharma 2008 ; suppl. no 32 : 3-7.
[5] Hofer H, Carroll J, Neitz J, et al. Organization of the human trichromatic cone mosaic. J Neurosci 2005 ; 9 : 669-79.
[6] Jaeger W, Nover A. Strungen des Lichtsinn und Farbensinn bei Chorioretinis centralis serosa. Graefes Arch Ophthalmol 1951 ; 152 : 111-20.
[7] Pinckers A, Tilanus MAD. Colour vision in macular gliosis, cysts, holes and oedema : an approach to depth localization. In : Cavonius CR. Ed. Colour Vision Deficiencies XIII. Doc Ophthalmol Proc Series 59. Dordrecht : Kluwer ; 1997, p. 193-204.
Y. Kauffmann
➤ Le contraste est défini par la différence de luminance d’une cible par rapport à la luminance globale de son fond.
➤ La sensibilité au contraste est altérée de façon précoce et reproductible dans la plupart des pathologies ophtalmologiques.
➤ Dans l’œdème maculaire, l’atteinte de la sensibilité au contraste est plus constante et précoce que celle de l’acuité visuelle.
➤ La perte de sensibilité peut ne concerner que les hautes fréquences spatiales.
➤ La perte de sensibilité au contraste est bien corrélée à l’importance de l’impact fonctionnel.
Depuis longtemps, l’acuité visuelle joue un rôle prépondérant en ophtalmologie. Sa mesure, bien que simple et rapide, ne permet toutefois pas une exploration exhaustive de la fonction visuelle. En effet, la mesure du minimum séparable en situation de contraste maximal n’est pas nécessairement représentative du niveau de performance visuelle dans la vie courante. À titre d’exemple, il peut sembler plus utile de discerner un chat gris faisant irruption sur la route au crépuscule que d’identifier une puce noire sur une feuille blanche fortement éclairée à 5 m de distance. L’évaluation de la perception des contrastes se révèle ainsi être un paramètre important pour comprendre les difficultés visuelles rapportées par un patient, quand bien même il aurait une bonne acuité visuelle.
La comparaison de l’intensité lumineuse d’un objet à celle d’un endroit adjacent (contraste spatial) ou d’un moment précédent (contraste temporel) est une fonction fondamentale du système visuel. Les champs récepteurs des neurones du cortex occipital forment des groupes cellulaires neurorétiniens indépendants et sensibles spécifiquement à une fréquence spatiale donnée. Ils constituent un système de filtrage de l’information visuelle selon la forme, l’orientation et la taille des objets présentés [1]. Un premier traitement rétinien au niveau de la couche des cellules bipolaires et ganglionnaires, puis un second traitement cortical permettent l’optimisation de la vision des contrastes. Ce système multicanaux permet de comprendre l’intérêt d’une évaluation de la sensibilité au contraste pour une plage étendue de fréquences spatiales. En d’autres termes, vision des contrastes et acuité visuelle sont interdépendantes [1–3].
Le contraste est défini par la différence de luminance d’une cible par rapport à la luminance globale de son fond. Son calcul repose sur la formule de Michelson [4] :
Il s’agit d’une valeur sans unité comprise entre 0 et 1. La sensibilité au contraste correspond à l’inverse du seuil de perception du sujet. Cette sensibilité est ainsi d’autant plus élevée que le contraste détecté est plus faible. Par exemple, le contraste d’une cible de 60 candela/m2 projetée sur un fond de 100 candelas/m2 est calculé de la façon suivante :
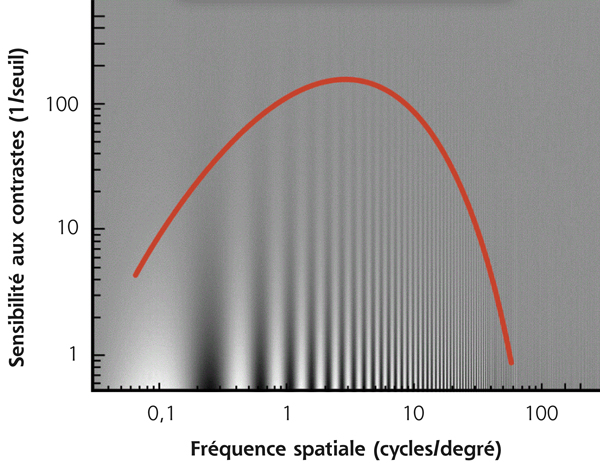
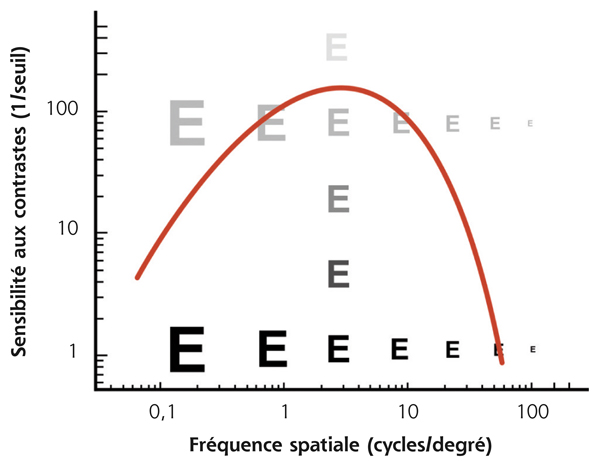
Si ce contraste correspond au seuil de perception du sujet pour une fréquence spatiale donnée, sa sensibilité au contraste serait de 1/0,25, soit 4. Les réseaux d’ondes sinusoïdaux (fig. 5-15) permettent d’illustrer la relation entre acuité visuelle et sensibilité au contraste. Ils font apparaître la courbe de sensibilité, aussi appelée fonction de sensibilité au contraste (fig. 5-16) [1, 3, 5]. Cette dernière prend une forme en cloche avec un maximum de sensibilité aux fréquences spatiales situées entre 3 et 6 cycles/degré. Ce pic permet un meilleur discernement des visages et des objets de la vie courante. Entre 18 et 24 cycles/degré (acuité visuelle ≥ 10/10), la sensibilité au contraste est déjà significativement diminuée et l’œil humain ne peut pas percevoir des fréquences spatiales supérieures à 60 cycles/degré [3].
Un sujet sain discerne en moyenne un contraste de 1 % correspondant à une sensibilité de 100 pour une fréquence spatiale de 3 à 6 cycles/degré. La sensibilité au contraste est influencée par le niveau d’éclairage global de la scène présentée (fig. 5-17) et diminue du centre vers la périphérie du champ visuel [1, 6]. Il existe également une diminution progressive de cette sensibilité avec l’âge [7].
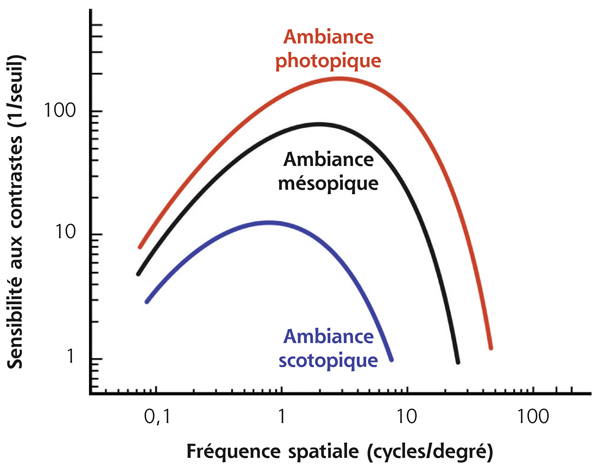
Fig. 5-17 Influence de l’ambiance lumineuse sur la sensibilité au contraste.
Vision fade, terne, délavée et éblouissements sont autant de plaintes pouvant faire suspecter un trouble de la vision des contrastes, même en l’absence de baisse d’acuité visuelle. Contrairement à la mesure du minimum séparable, les tests explorant la sensibilité au contraste se révèlent souvent plus longs et laborieux et, de ce fait, ne sont que rarement réalisés dans la pratique quotidienne. En effet, afin d’explorer le seuil de sensibilité pour différentes fréquences spatiales, la plupart d’entre eux évaluent la perception de nuances de gris pour différents niveaux d’acuité visuelle. Quelques exemples sont présentés ci-dessous.
Le seuil de sensibilité au contraste peut être évalué grâce à des barres grises alternantes dont le contraste est défini par leur différence de luminance. La largeur des barres définit la fréquence spatiale étudiée et leur périodicité permet d’évaluer le contraste temporel. Ces tests sont surtout utilisés dans le cadre de travaux de recherche fondamentale ou clinique.
Le test de Pelli et Robson (fig. 5-18) est réalisé à une distance de 1 m sous un éclairage standardisé (80 à 120 candelas/m2). Il évalue la sensibilité au contraste pour une fréquence spatiale unique (6 cycles/min) [8]. Le test de Serret comporte plusieurs échelles d’acuité visuelle complètes présentées pour huit niveaux de contraste différents [9]. Le Vision Contrast Test System (fig. 5-19) évalue une plage de cinq fréquences spatiales pour neuf niveaux de contraste. L’examen est réalisé sous une luminance de 140 candelas/m2 à une distance de 45 cm. Il est demandé au patient de déterminer l’orientation de 45 réseaux sinusoïdaux [3].
L’évaluation de la sensibilité au contraste permet de détecter de façon précoce et reproductible les atteintes fonctionnelles des pathologies ophtalmologiques (fig. 5-20). Erreurs réfractives, atteintes cornéennes, opacifications cristalliniennes débutantes, maculopathies ou amblyopies légères atteignent la sensibilité au contraste pour les hautes fréquences spatiales [1, 10, 11]. À l’inverse, les basses fréquences spatiales sont amputées dans les atteintes du nerf optique [1]. Une perte de sensibilité à une plage étendue de fréquences spatiales peut être retrouvée en cas de cataracte, de neuropathie glaucomateuse ou d’amblyopie modérée à sévère [1, 11].
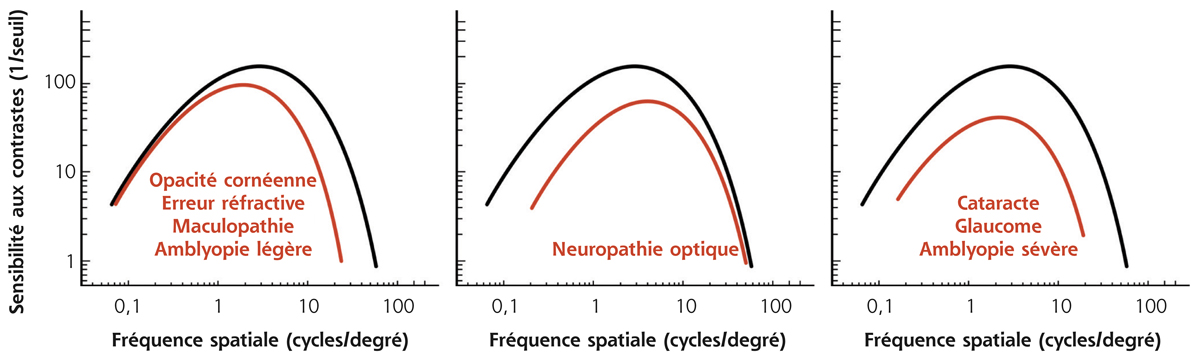
Fig. 5-20 Retentissement des pathologies ophtalmologiques sur la sensibilité au contraste.
La diminution de la sensibilité au contraste et les éblouissements font partie du syndrome maculaire au même titre que la baisse d’acuité visuelle, les métamorphopsies, le scotome et la dyschromatopsie. En cas d’œdème maculaire, indépendamment de son étiologie, l’atteinte de la sensibilité au contraste est beaucoup plus constante et précoce que celle de l’acuité visuelle [1, 3, 12]. Cette atteinte concerne plus spécifiquement les hautes fréquences spatiales, au-delà de 6 cycles/degré (fig. 5-21) [12]. Dans les œdèmes liés aux occlusions veineuses rétiniennes ou à la dégénérescence maculaire liée à l’âge (DMLA) exsudative, le lien entre l’épaisseur rétinienne et la perception des contrastes semble plus fort que pour l’acuité visuelle [13, 14]. De plus, pour l’œdème maculaire diabétique, il a été démontré que l’impact fonctionnel, notamment sur la vitesse de lecture, est bien mieux corrélé à l’importance de la perte de sensibilité au contraste qu’aux autres indicateurs de la fonction visuelle [15]. Une amélioration significative de ce paramètre peut être attendue après traitement de l’œdème, bien qu’il semble que la récupération de la sensibilité au contraste soit plus lente que la restitution anatomique [12–14, 16].
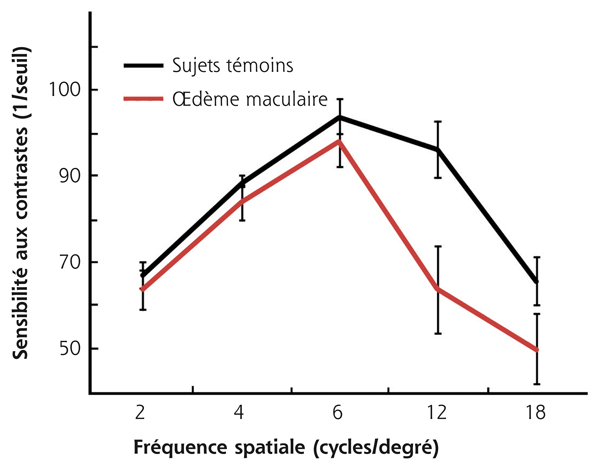
Fig. 5-21 Retentissement de l’œdème maculaire sur la sensibilité au contraste d’après Valentincic et al. [12].
L’atteinte de la sensibilité au contraste constitue un signe précoce et cliniquement pertinent à ne pas oublier pour l’évaluation du retentissement fonctionnel et pour le suivi des œdèmes maculaires. La perte de sensibilité peut ne concerner que les hautes fréquences spatiales, ce qui confirme l’intérêt de l’exploration de la perception des contrastes sur une plage étendue de fréquences spatiales.
[1] Corbé C, Sensibilité au contraste. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie, 2002, 8 p.
[2] Campbell FW, Maffei L. Contrast and spatial frequency. Sci Am 1974 ; 231 : 106-14.
[3] Ginsburg AP. Contrast sensitivity and functional vision. Int Ophthalmol Clin 2003 ; 43 : 5-15.
[4] Michelson A, Studies in Optics. University of Chicago Press ; 1927, 176 p.
[5] Adler FH, Levin L, Nilsson S, et al. Adler’s Physiology of the Eye. 11th edition. Saunders-Elsevier ; 2011, 820 p.
[6] Baldwin AS, Meese TS, Baker DH. The attenuation surface for contrast sensitivity has the form of a witch’s hat within the central visual field. J Vis 2012 ; 12 : 1-17.
[7] Nio YK, Jansonius NM, Fidler V, et al. Age-related changes of defocus-specific contrast sensitivity in healthy subjects. Ophthalmic Physiol Opt 2000 ; 20 : 323-34.
[8] Elliott DB, Sanderson K, Conkey A. The reliability of the Pelli-Robson contrast sensitivity chart. Ophthalmic Physiol Opt 1990 ; 10 : 21-4.
[9] Clenet M. Le test de Serret. Revue Francophone d’Orthopsie 2011 ; 4 : 177-8.
[10] Hazel CA, Petre KL, Armstrong RA, et al. Visual function and subjective quality of life compared in subjects with acquired macular disease. Invest Ophthalmol Vis Sci 2000 ; 41 : 1309-15.
[11] Lasa MS, Datiles MB 3rd, Podgor MJ, et al. Contrast and glare sensitivity. Association with the type and severity of the cataract. Ophthalmology 1992 ; 99 : 1045-9.
[12] Valentincic NV, Berendschot TT, Hawlina M, et al. Effect of tinted optical filters on visual acuity and contrast sensitivity in patients with inflammatory cystoid macular edema. Retina 2007 ; 27 : 483-9.
[13] Keane PA, Patel PJ, Ouyang Y, et al. Effects of retinal morphology on contrast sensitivity and reading ability in neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci 2010 ; 51 : 5431-7.
[14] Preti RC, Ramirez LM, Pimentel SL, et al. Single intravitreal bevacizumab injection effects on contrast sensitivity in macular edema from branch retinal vein occlusion. Arq Bras Oftalmol 2012 ; 75 : 29-32.
[15] Pearce E, Sivaprasad S, Chong NV. Factors affecting reading speed in patients with diabetic macular edema treated with laser photocoagulation. PLoS One 2014 ; 9 : e105696.
[16] Ginsburg AP, Cheetham JK, DeGryse RE, et al. Effects of flurbiprofen and indomethacin on acute cystoid macular edema after cataract surgery : functional vision and contrast sensitivity. J Cataract Refract Surg 1995 ; 21 : 82-92.
P. Koehrer
➤ La micropérimétrie est une exploration fonctionnelle permettant de mesurer la sensibilité rétinienne sur des zones prédéterminées de la rétine centrale, indépendamment de la fixation, grâce à des systèmes d’eyetracking.
➤ Elle permet d’établir des corrélations anatomofonctionnelles dans les pathologies rétiniennes médicales et chirurgicales et de mieux approcher la perception visuelle des patients.
La quantification du champ visuel est un élément indispensable pour obtenir un examen ophtalmologique complet. L’évaluation clinique de la fonction maculaire par la mesure de l’acuité visuelle est insuffisante puisqu’elle reflète uniquement la sensibilité fovéolaire, et non celle de la rétine paracentrale, pourtant utile à la plupart des activités, dont la lecture. Par ailleurs, la mesure de l’acuité visuelle ne permet pas de rendre compte de la présence de microscotomes influençant le confort visuel. L’étude du champ visuel central en périmétrie statique automatisée est souvent prise en défaut dans les pathologies maculaires puisqu’elle suppose une fixation stable et centrée sur la fovéa. La micropérimétrie mesure la sensibilité rétinienne centrale et paracentrale en la corrélant au fond d’œil testé et à ses éventuelles altérations anatomiques. Elle nécessite un contrôle continu du fond d’œil au cours de l’examen. Cet examen permet en outre de localiser le point de fixation sur la macula, d’étudier sa stabilité et son éventuelle excentricité. Le terme de micropérimétrie, également appelée en anglais fundus correlated perimetry, ne réfère donc pas à la taille des stimuli, équivalents à ceux de la périmétrie de Goldmann, ni à l’étendue du champ visuel étudié pouvant atteindre jusqu’à 20°, mais à la capacité de mettre en relation structure et fonction.
La première plate-forme de micropérimétrie est le scanning laser ophthalmoscopy (SLO 101®, Rodenstock, Ottobrun, Allemagne) qui utilise deux sources laser, l’une hélium–néon (632,8 nm) pour l’illumination de fond et la projection des stimuli, l’autre infrarouge en confocal (780 nm) pour l’acquisition de l’image rétinienne. Le champ maximal d’étude est de 33 × 21°. La correction des mouvements oculaires est réalisée manuellement au cours de l’examen en l’absence d’eyetracker. Cette plate-forme n’est désormais plus disponible à la vente [1].
La deuxième plate-forme de micropérimétrie est le micro perimeter 1 (MP1®, Nidek Instruments Inc., Padova, Italie), différent d’un SLO, où l’image du fond d’œil est acquise par une caméra infrarouge et la micropérimétrie réalisée à l’aide d’un écran à cristaux liquides. Un eyetracker compense les mouvements oculaires toutes les 40 ms au cours de l’examen, permettant de positionner les stimuli sur une localisation prédéfinie de la rétine. Dans la plupart des études, la périmétrie est réalisée avec un stimulus Goldmann III et une stratégie 4-2-1 après une adaptation à l’obscurité de 5 minutes. L’examen dure en moyenne 10 minutes. L’acquisition d’une photographie en couleurs du fond d’œil superposée aux résultats de micropérimétrie est possible. Une fonction de suivi automatique permet, au cours d’examens successifs, de mesurer l’évolution de la sensibilité de localisations rétiniennes, indépendamment des modifications de la fixation. En outre, le logiciel autorise la superposition des résultats sur des images issues d’autres appareils tels le Heidelberg Retina Angiograph® (HRA®, Heidelberg Engineering, Heidelberg, Allemagne) et propose des tests spécifiques de fixation et de lecture [1, 2]. Enfin, Deak et al. ont réussi à mettre en corrélation la photographie en couleurs du fond d’œil avec les résultats micropérimétriques et le spectral-domain optical coherence tomography (SD-OCT) maculaire Cirrus® (Zeiss Meditec, Dublin, CA, États-Unis) grâce au logiciel Research Browser 3.0® (Zeiss Meditec, Dublin, CA, États-Unis) [3].
Une plate-forme plus récente, OPKO/OTI® (Miami, FL, États-Unis), combine le SD-OCT/SLO et un micropérimètre doté d’un eyetracker. Cette dernière plate-forme a pour avantage de fournir une image SLO du fond d’œil en haute définition en continu au cours de l’examen, permettant un eyetracking précis fondé sur des points de repère vasculaires. Par ailleurs, le focus et la répétition du test au niveau de certains points sont complètement automatisés, au contraire du MP1®.
La dernière plate-forme est le système MAIA® (Centervue, Padova, Italie) combinant une image SLO du fond d’œil avec une périmétrie statique et un eyetraker 25 Hz. À ce jour, peu d’études rapportent son utilisation. Les premiers résultats indiquent une bonne reproductibilité des mesures chez des sujets sains [4].
Les résultats obtenus avec les différentes plates-formes de micropérimétrie ne sont pas directement comparables entre eux [5]. Sabates et al. ont établi des valeurs normatives en micropérimétrie OPKO/OTI® en mesurant la sensibilité rétinienne chez 169 patients entre 21 et 85 ans, ayant une acuité visuelle d’au moins 20/25 et indemnes de toute pathologie ophtalmologique ou générale. L’examen était réalisé après dilatation pupillaire (tropicamide 1 % et phénylnéphrine 2,5 %) comme dans les études cliniques. L’examen était réalisé avec un polar pattern 3, c’est-à-dire par 28 points répartis sur trois cercles centrés sur la fovéa de 0,7, 2 et 3,4 mm de diamètre respectivement. La sensibilité rétinienne moyenne était de 17,9 ± 1,2 dB et la sensibilité fovéolaire moyenne était de 19,7 ± 0,7 dB. Il n’y avait pas de différence significative entre les classes d’âge, excepté chez les patients de plus de 70 ans, en rapport avec l’opacification cristallinienne [6].
La micropérimétrie a permis de mettre en évidence des altérations fonctionnelles maculaires à des stades infracliniques de maculopathie, en montrant une diminution significative de la sensibilité maculaire chez des patients diabétiques asymptomatiques sans rétinopathie ni maculopathie par rapport à des témoins [7]. Récemment, ces résultats ont été corroborés chez des patients diabétiques asymptomatiques sans maculopathie mais présentant une rétinopathie non proliférante par rapport à des témoins diabétiques sans rétinopathie [8].
Lors de maculopathies patentes, plusieurs études ont montré des corrélations entre la sensibilité rétinienne et l’acuité visuelle chez des patients présentant un œdème maculaire cliniquement significatif (OMCS) [9, 10]. Par ailleurs, Vujosevic et al. ont montré, dans les OMCS, une corrélation inverse entre l’épaisseur rétinienne en OCT et la sensibilité rétinienne dans les 6000 μm centraux, avec une diminution de 0,83 dB à chaque fois que l’épaisseur rétinienne augmente de 10 % par rapport à sa valeur normale [10] ; ces résultats ont été confirmés par Hatef et al. [11]. En corrélant micropérimétrie (MP1®) et SD-OCT maculaire, Deak et al. ont montré que les lésions d’apparition tardive (kystes de la couche nucléaire externe ≥ 200 μm et décollement séreux rétinien) entraînaient une plus grande baisse de sensibilité rétinienne par rapport aux lésions précoces (kystes de la couche nucléaire interne) [3]. La corrélation avec l’angiographie à la fluorescéine a permis de mettre en évidence des microscotomes absolus en regard des zones de non-perfusion capillaire [12]. Au cours des OMCS, la corrélation avec le cliché en autofluorescence a montré une altération plus importante de la sensibilité rétinienne en regard des zones d’hyper-autofluorescence, traduisant la présence d’un œdème maculaire cystoïde (OMC) dans 90 % des cas. L’hyper-autofluorescence pourrait être liée à l’accumulation de lipofuscine dans la microglie activée (stress oxydatif) ou au déplacement du pigment maculaire par les kystes entraînant un effet fenêtre vers l’épithélium pigmentaire [13]. L’étude de la fixation au cours des OMCS donne des résultats contradictoires, certains auteurs rapportant une fixation majoritairement excentrée et instable [14, 15], au contraire d’autres [11, 16]. La principale raison semble être une durée d’évolution non comparable des œdèmes maculaires (OM) entre les différentes études. Le seul facteur anatomique identifié influençant la fixation est la présence d’exsudats secs centraux [17].
La micropérimétrie a été utilisée au cours du traitement des OM dans la LUCIDATE Study comparant l’efficacité du ranibizumab intravitréen à celle du grid maculaire et montrant un gain de sensibilité plus important dans le groupe traité par anti-vascular endothelial growth factor (anti-VEGF) [18]. L’utilisation de la micropérimétrie associée à des corrélations en SD-OCT, dans les différents secteurs maculaires au cours du suivi sous ranibizumab, a permis de mettre en évidence des fortes corrélations entre la résorption des kystes des couches nucléaires externe (≥ 200 μm) et interne et le gain de sensibilité rétinienne [19]. Lors du traitement par acétonide de triamcinolone, il a été mis en évidence une amélioration significative de la fixation et de la sensibilité maculaire lors des trois premiers mois [20].
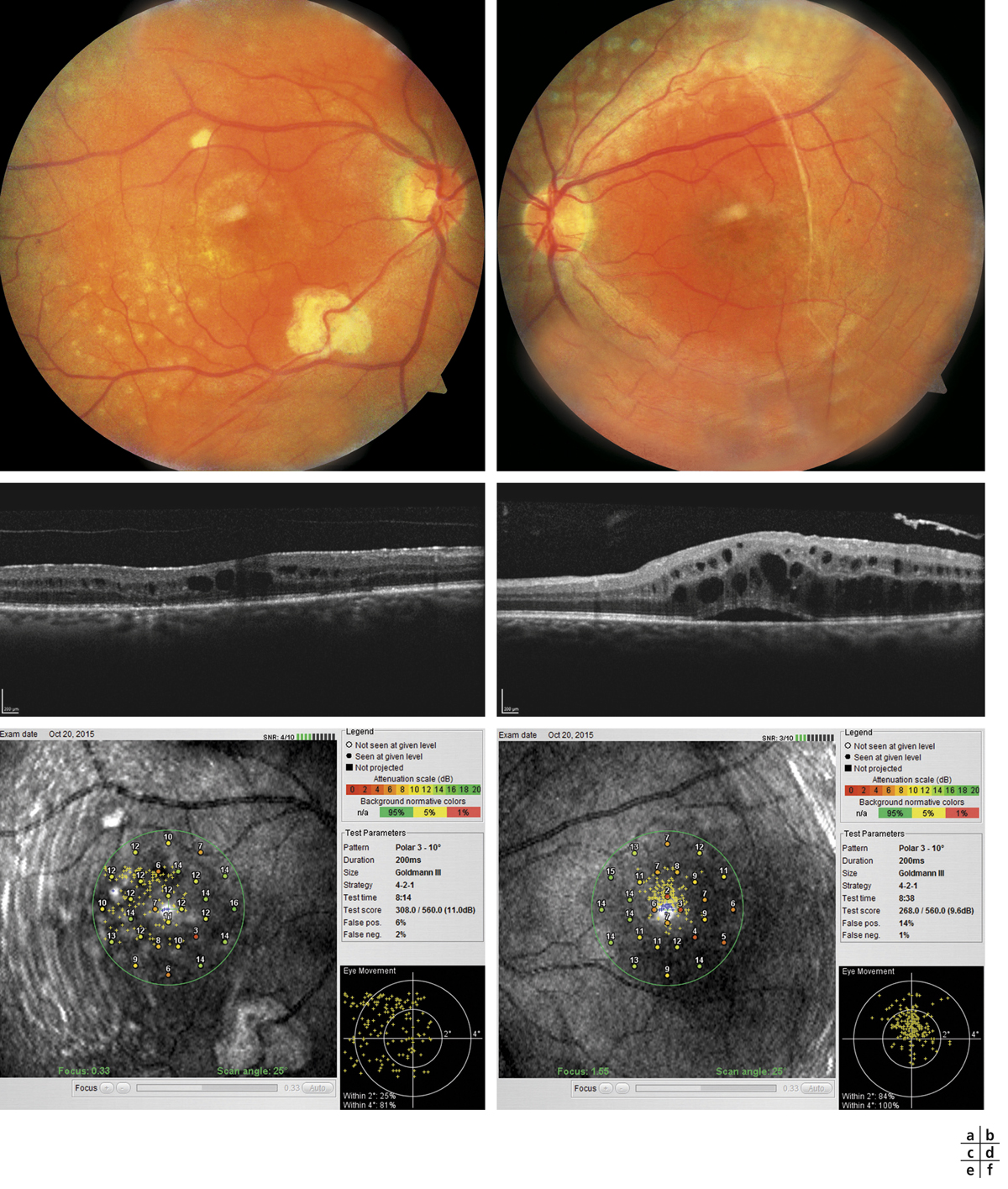
Fig. 5-22 Micropérimétrie d’un patient diabétique présentant un OM chronique bilatéral.
Patient de 78 ans pseudophaque. Clichés en couleurs OD (a) et OG (b). Examen par SD-OCT OD (c) et OG (d). Relevés micropérimétriques OPKO/OTI® des 10° centraux OD (e) et OG (f). Du côté droit, on note une baisse diffuse de la sensibilité rétinienne associée à une fixation très instable. Du côté gauche, on note une récidive récente de l’œdème maculaire en temporal affectant la fovéa. La fixation est plus stable, la sensibilité rétinienne est préservée en région interpapillomaculaire non affectée par l’œdème.
Plusieurs études ont montré des corrélations entre la sensibilité rétinienne en micropérimétrie, l’épaisseur rétinienne et le volume rétinien en OCT au cours des occlusions de la veine centrale de la rétine (OVCR) [21] et des occlusions de branche veineuse rétinienne (OBVR) [22]. Toutefois, au cours des OBVR, la corrélation entre sensibilité rétinienne et épaisseur rétinienne dans les différents secteurs maculaires était plus forte que celle entre acuité visuelle (AV) et épaisseur rétinienne moyenne [22].
L’intérêt de la micropérimétrie dans les essais thérapeutiques a été montré par Kriechbaum, qui, au cours du traitement de l’œdème maculaire des occlusions veineuses rétiniennes (OVR) par bévacizumab, a rapporté une diminution significative de la taille des scotomes absolus de 21,4 ± 21 % du champ visuel testé (12° centraux) à 6,4 ± 11 % à 6 mois, mais aussi une augmentation significative de la sensibilité rétinienne au cours des 12 mois de suivi [23]. La taille, le nombre des scotomes et la sensibilité rétinienne moyenne étaient corrélés à l’épaisseur maculaire centrale et moyenne mais aussi à l’AV. D’autres études ont rapporté des résultats anatomofonctionnels comparables avec le ranibizumab [24] et les corticostéroïdes : acétonide de triamcinolone [25, 26] et Ozurdex® [27]. L’utilisation de la micropérimétrie dans le suivi après implantation d’Ozurdex® a permis de montrer la récidive précoce infraclinique de l’œdème maculaire, avec une diminution de la sensibilité rétinienne moyenne des 10° centraux (40 points) dès le 3e mois, contrastant avec un gain de sensibilité rétinienne moyenne centrale (8 points), d’AV et de vitesse de lecture conservés jusqu’au 4e mois, et traduisant une détérioration périphérique de la barrière hémato-rétinienne interne avant d’être centrale [27]. Récemment, Querques et al. ont confirmé ces résultats ; ils ont montré de plus des corrélations négatives entre la sensibilité rétinienne et l’épaisseur des couches externes et internes de la rétine, suggérant ainsi la nécessité d’un retraitement avant 6 mois afin d’éviter l’apparition de lésions irréversibles [28]. Certaines séries n’ont pas mis en évidence de corrélation entre le gain d’AV, de sensibilité rétinienne et les paramètres morphologiques en OCT [29]. L’explication la plus probable est la durée importante d’évolution des œdèmes maculaires avant traitement dans ces études.
La micropérimétrie est une exploration évaluant la fonction maculaire globale des patients, permettant d’approcher ainsi, de façon objective, la perception visuelle de ces derniers. La corrélation de plus en plus fine des résultats de la micropérimétrie avec des explorations anatomiques leur ajoute une dimension fonctionnelle indispensable à la compréhension des pathologies rétiniennes médicales et chirurgicales.
[1] Rohrschneider K, Bultmann S, Springer C. Use of fundus perimetry (microperimetry) to quantify macular sensitivity. Prog Retin Eye Res 2008 ; 27 : 536-48.
[2] Springer C, Bultmann S, Volcker HE, Rohrschneider K. Fundus perimetry with the Micro Perimeter 1 in normal individuals : comparison with conventional threshold perimetry. Ophthalmology 2005 ; 112 : 848-54.
[3] Deak GG, Bolz M, Ritter M, et al. A systematic correlation between morphology and functional alterations in diabetic macular edema. Invest Ophthalmol Vis Sci 2010 ; 51 : 6710-4.
[4] Molina-Martin A, Pinero DP, Perez-Cambrodi RJ. Reliability and intersession agreement of microperimetric and fixation measurements obtained with a new microperimeter in normal eyes. Curr Eye Res 2015 ; 1-10.
[5] Rohrschneider K, Springer C, Bultmann S, Volcker HE. Microperimetry--comparison between the micro perimeter 1 and scanning laser ophthalmoscope--fundus perimetry. Am J Ophthalmol 2005 ; 139 : 125-34.
[6] Sabates FN, Vincent RD, Koulen P, et al. Normative data set identifying properties of the macula across age groups : integration of visual function and retinal structure with microperimetry and spectral-domain optical coherence tomography. Retina 2011 ; 31 : 1294-302.
[7] Nittala MG, Gella L, Raman R, Sharma T. Measuring retinal sensitivity with the microperimeter in patients with diabetes. Retina 2012 ; 32 ; 1302-9.
[8] De Benedetto U, Querques G, Lattanzio R, et al. Macular dysfunction is common in both type 1 and type 2 diabetic patients without macular edema. Retina 2014 ; 34 : 2171-7.
[9] Okada K, Yamamoto S, Mizunoya S, et al. Correlation of retinal sensitivity measured with fundus-related microperimetry to visual acuity and retinal thickness in eyes with diabetic macular edema. Eye (Lond) 2006 ; 20 : 805-9.
[10] Vujosevic S, Midena E, Pilotto E, et al. Diabetic macular edema : correlation between microperimetry and optical coherence tomography findings. Invest Ophthalmol Vis Sci 2006 ; 47 : 3044-51.
[11] Hatef E, Colantuoni E, Wang J, et al. The relationship between macular sensitivity and retinal thickness in eyes with diabetic macular edema. Am J Ophthalmol 2011 ; 152 : 400-5.e2.
[12] Unoki N, Nishijima K, Sakamoto A, et al. Retinal sensitivity loss and structural disturbance in areas of capillary nonperfusion of eyes with diabetic retinopathy. Am J Ophthalmol 2007 ; 144 : 755-60.
[13] Vujosevic S, Casciano M, Pilotto E, et al. Diabetic macular edema : fundus autofluorescence and functional correlations. Invest Ophthalmol Vis Sci 2011 ; 52 : 442-8.
[14] Carpineto P, Ciancaglini M, Di Antonio L, et al. Fundus microperimetry patterns of fixation in type 2 diabetic patients with diffuse macular edema. Retina 2007 ; 27 : 21-9.
[15] Kube T, Schmidt S, Toonen F, et al. Fixation stability and macular light sensitivity in patients with diabetic maculopathy : a microperimetric study with a scanning laser ophthalmoscope. Ophthalmologica 2005 ; 219 : 16-20.
[16] Vujosevic S, Pilotto E, Bottega E, et al. Retinal fixation impairment in diabetic macular edema. Retina 2008 ; 28 : 1443-50.
[17] Midena E, Vujosevic S. Microperimetry in diabetic retinopathy. Saudi J Ophthalmol 2011 ; 25 : 131-5.
[18] Comyn O, Sivaprasad S, Peto T, et al. A randomized trial to assess functional and structural effects of ranibizumab versus laser in diabetic macular edema (the LUCIDATE study). Am J Ophthalmol 2014 ; 157 : 960-70.
[19] Reznicek L, Cserhati S, Seidensticker F, et al. Functional and morphological changes in diabetic macular edema over the course of anti-vascular endothelial growth factor treatment. Acta Ophthalmol 2013 ; 91 : e529-536.
[20] Grenga P, Lupo S, Domanico D, Vingolo EM. Efficacy of intravitreal triamcinolone acetonide in long standing diabetic macular edema: a microperimetry and optical coherence tomography study. Retina 2008 ; 28 : 1270-5.
[21] Noma H, Mimura T, Shimada K. Retinal function and morphology in central retinal vein occlusion with macular edema. Curr Eye Res 2013 ; 38 : 143-9.
[22] Noma H, Funatsu H, Mimura T, et al. Functional-morphologic correlates in patients with branch retinal vein occlusion and macular edema. Retina 2011 ; 31 : 2102-8.
[23] Kriechbaum K, Prager F, Geitzenauer W, et al. Association of retinal sensitivity and morphology during antiangiogenic treatment of retinal vein occlusion over one year. Ophthalmology 2009 ; 116 : 2415-21.
[24] Mylonas G, Sacu S, Dunavoelgyi R, et al. Response of retinal sensitivity to ranibizumab treatment of macular edema after acute branch retinal vein occlusion. Retina 2013 ; 33 : 1220-6.
[25] Noma H, Mimura T. Macular sensitivity and morphology after intravitreal injection of triamcinolone acetonide for macular edema secondary to central retinal vein occlusion. Clin Ophthalmol 2012 ; 6 : 1901-6.
[26] Senturk F, Ozdemir H, Karacorlu M, et al. Retinal sensitivity improvement after intravitreal triamcinolone acetonide injection for macular edema secondary to branch retinal vein occlusion. Indian J Ophthalmol 2013 ; 61 : 3-7.
[27] Winterhalter S, Vom Brocke GA, Klamann MK, et al. Monthly microperimetry (MP1) measurement of macular sensitivity after dexamethasone implantation (Ozurdex) in retinal vein occlusions. Graefes Arch Clin Exp Ophthalmol 2015 ; 253 : 1873-82.
[28] Querques G, Lattanzio R, Querques L, et al. Impact of intravitreal dexamethasone implant (Ozurdex) on macular morphology and function. Retina 2014 ; 34 : 330-41.
[29] Winterhalter S, Lux A, Maier AK, et al. Microperimetry as a routine diagnostic test in the follow-up of retinal vein occlusion ? Graefes Arch Clin Exp Ophthalmol 2012 ; 250 : 175-83.
I. Audo
➤ L’électrophysiologie visuelle est une méthode d’évaluation objective de la fonction visuelle, qui nécessite une bonne fixation du patient.
➤ Les protocoles standards ont été définis par l’International Society for Clinical Electrophysiology of Vision (ISCEV).
➤ Toute réponse altérée aux potentiels évoqués visuels (PEV) damiers doit être complétée par un test de fonction maculaire.
➤ L’électrorétinogramme (ERG) permet de tester essentiellement la fonction rétinienne périphérique.
➤ Le pattern ERG fournit des informations sur la fonction maculaire ainsi que sur celle des cellules ganglionnaires issues de la macula.
➤ L’électro-oculogramme (EOG) reflète la fonction globale du couple épithélium pigmenté rétinien–photorécepteurs de façon indissociable.
L’électrophysiologie visuelle repose sur l’enregistrement d’une réponse visuelle à une stimulation lumineuse. Il s’agit d’une méthode d’évaluation objective de la fonction visuelle, à condition que le sujet testé fixe correctement la stimulation, par opposition aux tests psychophysiques (acuité visuelle, périmétrie, vision des couleurs et des contrastes) qui nécessitent la participation active du sujet. Dans ce sens, l’électrophysiologie prend toute sa place dans l’exploration d’une baisse d’acuité visuelle inexpliquée et notamment dans le diagnostic différentiel d’une baisse d’acuité visuelle non organique.
De plus, l’électrophysiologie est un outil essentiel pour préciser le diagnostic de certaines pathologies et permet d’apporter des éléments pronostiques, en complément d’autres examens paracliniques, dans le cas de neuropathies optiques, de maculopathies ou d’atteintes rétiniennes globales ; elle a cependant un intérêt limité dans l’œdème maculaire. En revanche, l’électrophysiologie prend toute sa place dans le cadre de protocoles de recherche du fait des indicateurs objectifs qu’elle fournit, ou comme outil de diagnostic différentiel d’autres lésions kystiques maculaires rentrant notamment dans le cadre de dystrophies rétiniennes (voir chapitre 14.4).
Dans un souci d’uniformisation et de reproductibilité, la Société internationale d’électrophysiologie (International Society for Clinical Electrophysiology of Vision [ISCEV]) a établi depuis les années 1980 des protocoles standard, révisés tous les 4 ans, définissant les conditions et réponses minimums pour un diagnostic précis. Tout enregistrement devra donc inclure au moins l’enregistrement des réponses selon ces standards.
Les potentiels évoqués visuels (PEV) permettent d’évaluer l’ensemble des voies visuelles, de la partie antérieure de l’œil jusqu’au cortex visuel. Ils sont réalisés selon des conditions précises (encadré 5-1
• Réalisation sans dilatation pupillaire, en monoculaire.
• Stimulations présentées devant le patient de façon soit structurée (échiquier fait de damiers noir et blanc alternants dont la taille varie – tailles de 60, 30 et 15 minutes d’arc, voire 7 minutes d’arc), soit par flashes.
• Électrodes de recueil du signal posées de part et d’autre des deux hémisphères au niveau du cortex occipital.
). La projection de la stimulation par damiers, en particulier, se fait au niveau maculaire et nécessite une bonne correction optique, une transparence des milieux et un fonctionnement maculaire normal pour la genèse correcte du signal au niveau du cortex visuel. On conçoit donc que toute anomalie sur l’axe visuel peut modifier les réponses. De même, toute atteinte de la fonction maculaire, et notamment la présence d’un œdème maculaire, modifiera la réponse des PEV de façon non spécifique. Ainsi, toute réponse altérée aux PEV damiers devra être complétée par un test de fonction maculaire – ERG damiers (voir ci-dessous) ou ERG multifocal (voir plus loin) – qui permettra, en cas de baisse d’acuité visuelle non expliquée par un trouble réfractif ou des milieux, de distinguer une atteinte maculaire d’une dysfonction du nerf optique ou des voies rétrochiasmatiques. De plus, en fonction de la taille des damiers, les stimulations vont solliciter différemment la résolution maculaire. Ainsi, en cas de lésions fovéolaires comme un trou maculaire, les réponses aux damiers de petite définition (15 minutes d’angle voire 7 minutes d’arc) seront altérées plus sélectivement que les réponses aux damiers 60 minutes d’arc [2]. Il n’existe cependant pas d’étude récente de corrélation entre la taille de la lésion maculaire, documentée par les nouvelles techniques d’imagerie rétinienne haute résolution, et les altérations des réponses aux PEV en fonction de la taille des damiers testés. Les réponses aux flashs sont en revanche plus grossières et peu modifiées par une altération sélective de la fonction maculaire.
Fig. 5-23 Potentiels évoqués visuels par damiers.
Réponses normales issues de l’œil droit (OD, tracés du haut) et de l’œil gauche (OG, tracés du bas) après stimulation par les damiers de taille 60′, 30′, 15′ et 7′. On note l’aspect bien structuré des réponses, sans asymétrie franche entre les deux hémisphères et entre les deux yeux avec une onde P100 de temps de culmination normal (compris entre 100 et 115 ms).
Cet examen permet de tester la fonction rétinienne globale avec une contribution de l’aire maculaire négligeable. Il répond à des conditions de réalisation précises (encadré 5-2
• Dilatation pupillaire, en binoculaire, à l’aide d’une électrode de recueil cornéenne.
• Stimulations par flashs achromatiques générés par une coupole.
• Début de l’examen après au moins 20 minutes d’adaptation à l’obscurité totale.
• Aucune illumination rétinienne préalable (imagerie rétinienne) dans la journée.
• Enregistrement de six réponses différentes [3], quatre dans les conditions d’adaptation à l’obscurité (scotopiques) et deux après adaptation à un fond lumineux de 30 cd/m2 pendant au moins 10 minutes (photopiques) :
1. réponse scotopique à un flash de 0,01 cd.s/m2 (dark adapted 0.01 ERG) ;
2. réponse scotopique à un flash de 3 cd.s/m2 (dark adapted 3.0 ERG) ;
3. réponse scotopique à un flash de 10 cd.s/m2 (Dark adapted 10.0 ERG) ;
4. potentiels oscillatoires, en réponse à un flash de 3 cd.s/m2 en modifiant la bande passante de recueil du signal (dark adapted 3.0 oscilatory potentials) ;
5. réponse photopique à un flash de 3 cd.s/m2 (light adapted 3.0 ERG) ;
6. réponse photopique à un flash de 3 cd.s/m2 avec une fréquence de 30 Hz (light adapted 30 Hz).
). Il teste essentiellement la fonction rétinienne périphérique et n’est donc pas un test pour juger de la fonction maculaire [4]. Ainsi, il ne sera pas ou peu modifié en cas d’œdème restreint à la macula, mais peut être indiqué dans le diagnostic de rétinopathie associant kystes maculaires et atteinte rétinienne périphérique. En particulier, il prend toute sa place en cas de suspicion de dystrophie rétinienne (voir chapitre 14.4) et documente séparément la fonction des bâtonnets par rapport à celle des cônes, et celle de la rétine externe par rapport à celle de la rétine interne.
Fig. 5-24 ERG champ total selon les recommandations standard de l’ISCEV.
Quatre réponses sont enregistrées : après 20 minutes d’adaptation à l’obscurité (DA : dark adapted) ; en réponse à un flash de 0,01 cd.s/m2 (DA 0.01 ERG) ; en réponse au flash standard de 3 cd.s/m2 (DA 3.0 ERG, avec un deuxième enregistrement avec la même intensité du flash mais en modifiant la bande passante de recueil du signal pour analyse des potentiels oscillatoires ou OP) ; en réponse à un flash de 10 cd.s/m2 (DA 10.0 ERG). Après 10 minutes d’adaptation à la lumière (LA : light adaptation), deux réponses sont enregistrées après stimulation par le flash standard de 3 cd.s/m2 présenté à une fréquence de 30 Hz (LA 3.0 Flicker) et à une fréquence de 0,2/s (LA 3.0 ERG).
Cet examen fournit des informations sur la fonction maculaire ainsi que sur la fonction des cellules ganglionnaires en provenance de la macula. Il s’enregistre comme l’ERG global mais sans dilatation pupillaire, avec une réfraction optimale et en monoculaire en cas de strabisme. La stimulation consiste en un échiquier noir et blanc, alternant, identique à celui employé pour enregistrer les PEV damiers. La réponse générée consiste en une déflection négative inconstante (N35), puis une déflection positive P50 suivie d’un déflection négative N95 (fig. 5-25). La N95 a son origine dans les cellules ganglionnaires. La P50 a son origine pour 70 % au niveau des cellules ganglionnaires et pour 30 % une origine plus proximale, au niveau des photorécepteurs maculaires. Le pattern ERG (PERG) est donc une méthode de choix pour distinguer une atteinte des photorécepteurs maculaires (altération de la P50 et proportionnellement de la N95) d’une atteinte primitive des fibres ganglionnaires (ex. : atrophie optique dominante), avec conservation de la P50 (toutefois diminuée en amplitude et de temps de culmination raccourci) concomitante à une disparition de la N95. La plupart des maculopathies entraînent une diminution d’amplitude mais une conservation du temps de culmination de la P50. En revanche, un signe relativement spécifique d’œdème maculaire, également retrouvé en cas de choriorétinite séreuse centrale, est l’allongement du temps de culmination de la P50 [6]. Cependant, contrairement à l’ERG multifocal, le PERG documente la fonction maculaire globale mais ne fournit pas une cartographie de l’électrogenèse maculaire.
Fig. 5-25 ERG damiers ou pattern ERG.
Cet examen reflète la fonction globale du couple épithélium pigmenté rétinien (EPR)–photorécepteurs (essentiellement bâtonnets) : la fonction des deux types cellulaires par l’électro-oculogramme (EOG) n’étant pas dissociable, devant tout EOG anormal il faut enregistrer l’ERG global avant de conclure à une altération isolée de la fonction de l’EPR. De même, si un ERG est altéré avec une dysfonction des bâtonnets, l’EOG sera aussi altéré du fait de cette dernière. L’EOG tire son principe du fait que, grâce aux pompes ioniques de l’épithélium et des échanges avec les photorécepteurs, l’œil est un dipôle dont la valeur va varier entre l’obscurité et la lumière (encadré 5-3
• Dilatation pupillaire.
• Électrodes cutanées placées au niveau des canthi internes et externes avec un stimulateur sous la forme d’une coupole.
• Patient placé dans l’obscurité et instruit à faire des saccades régulières en suivant une cible placée dans la coupole puis le fond de celle-ci est illuminée.
). Le rapport d’Arden est mesuré en pourcentage entre la valeur la plus haute à la lumière et la valeur la plus basse à l’obscurité (en général supérieure à 120 à 150 % selon les laboratoires). Les indications de l’EOG sont très limitées et restreintes actuellement aux suspicions de maladie de Best, au syndrome d’AZOOR (acute zonular outer retinopathy) ou au suivi des corps étrangers métalliques intra-oculaires. Ainsi, concernant les rétinopathies associées à des kystes maculaires, l’EOG est indiqué essentiellement en cas de suspicion de bestrophinopathie (voir chapitre 14.4).
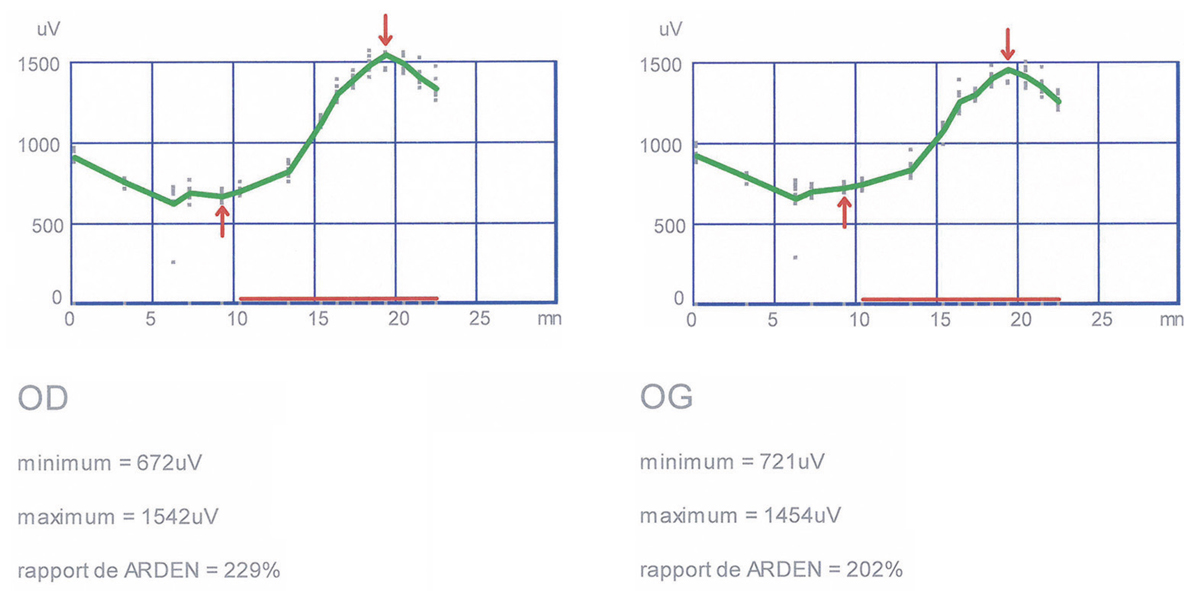
Fig. 5-26 EOG.
[1] Odom JV, Bach M, Brigell M, et al. ISCEV standard for clinical visual evoked potentials (2009 update). Doc Ophthalmol 2010 ; 120 : 111-9.
[2] Kato M, Nakagami T, Watanabe I. Visual evoked potentials in macular hole. Doc Ophthalmol 1991 ; 76 : 341-9.
[3] McCulloch DL, Marmor MF, Brigell MG, et al. ISCEV Standard for full-field clinical electroretinography (2015 update). Doc Ophthalmol 2015 ; 130 : 1-12.
[4] Holopigian K, Seiple W, Lorenzo M, Carr R. A comparison of photopic and scotopic electroretinographic changes in early diabetic retinopathy. Investigative Ophthalmology & Visual Science 1992 ; 33 : 2773-80.
[5] Bach M, Brigell MG, Hawlina M, et al. ISCEV standard for clinical pattern electroretinography (PERG) : 2012 update. Doc Ophthalmol 2013 ; 126 : 1-7.
[6] Eckstein MB, Spalton DJ, Holder G. Visual loss from central serous retinopathy in systemic lupus erythematosus. British J Ophthalmol 1993 ; 77 : 607-9.
[7] Marmor MF, Brigell MG, McCulloch DL, et al. ; International Society for Clinical Electrophysiology of Vision. ISCEV standard for clinical electro-oculography (2010 update). Doc Ophthalmol 2011 ; 122 : 1-7.
I. Meunier, S. Majzoub
➤ L’électrorétinogramme multifocal (ERGmf) permet une cartographie sélective et objective de la fonction des cônes des dix degrés maculaires.
➤ Cet examen teste majoritairement la réponse locale de la rétine interne de la zone maculaire.
➤ Un mauvais fonctionnement des cônes se traduit par une diminution des amplitudes et/ou une augmentation des latences dans la zone atteinte.
➤ Dans les œdèmes maculaires, la diminution du pic fovéolaire est fonction de la baisse d’acuité visuelle et de la durée de l’œdème.
➤ L’ERGmf montre une atteinte précoce chez les patients diabétiques avant même l’apparition des signes de rétinopathie.
➤ L’ERGmf a été détrôné par le couple SD-OCT–champ visuel dans l’œdème maculaire.
Développé par Sutter et Tran en 1991, l’électrorétinogramme multifocal (ERGmf) est le seul examen avec le pattern ERG qui permet une cartographie sélective et objective de la fonction des cônes de cinq régions concentriques centrales des dix degrés maculaires, alors que l’ERG champ total peut être normal et que le champ visuel reste un examen subjectif.
L’ERGmf a pris une place importante dans le bilan fonctionnel des baisses d’acuité visuelle à fond d’œil normal. Il permet de différencier une maculopathie dite occulte d’une neuropathie optique quand il existe un scotome central ou centro-cæcal avec un ERG flash normal et des PEV damiers altérés. Il est nécessaire dans le dépistage de lésions maculaires infracliniques, en particulier dans la surveillance des antipaludéens de synthèse. Il trouve aussi un intérêt dans les baisses d’acuité visuelle dites non organiques ou psychogènes, avec un ERG et des PEV damiers normaux, afin de prouver l’absence de maculopathie occulte sous-jacente. À l’inverse, quelle peut être la place de l’ERGmf quand la macula est altérée, notamment dans la rétinopathie diabétique ou dans les occlusions veineuses rétiniennes compliquées ou non d’un œdème maculaire ?
Selon les critères de l’ISCEV (2008), le patient doit être dilaté, porter la correction (équivalent sphérique de la correction optimale + 3) et avoir une fixation stable. Ainsi, il est difficilement réalisable avant l’âge de 8 ans et en cas de troubles des fonctions supérieures. L’examen est réalisé en ambiance photopique, après une adaptation d’au moins 10 minutes à la lumière. La stimulation et l’enregistrement se font en monoculaire. Un verre convexe de forte puissance (+ 12) est placé devant l’œil non stimulé afin de pénaliser la vision sans désadapter l’œil à la lumière. Ce n’est que si le patient a des difficultés de fixation qu’on devra occulter cet œil. Les scotomes centraux rendent la fixation difficile. Il faut faire fixer en binoculaire ou demander au patient de regarder droit devant et le lui rappeler régulièrement. Ce dernier point est à retenir dans les cas de rétinopathie diabétique ou d’occlusions veineuses.
Le signal généré par les stimulations hexagonales ou petit ERG focal est composé d’une première onde négative N1 qui correspond à l’hyperpolarisation des cellules bipolaires « OFF » et l’hyperpolarisation des cônes. Elle est suivie d’une onde positive P1 : probable retour à l’état de base des cellules bipolaires « OFF » et la dépolarisation des cellules bipolaires « ON » des cônes. Enfin, la courbe se termine par une onde négative N2 dont l’origine est mal connue. Cet examen teste donc majoritairement la réponse locale de la rétine interne de la zone maculaire (fonctionnement des cônes maculaires et des cellules bipolaires « ON » et « OFF » auxquelles ils sont reliés) (fig. 5-27).
Au-delà des réponses élémentaires, on peut présenter les réponses (classiquement l’onde P1) en fonction de leur degré d’excentricité par des anneaux, des quadrants, un code couleur ou comme un relevé du champ visuel (fig. 5-28 et 5-29). Ce codage permet de normaliser les mesures du patient à celles d’un sujet normal et d’âge comparable puisque le vieillissement s’accompagne d’une diminution des amplitudes. Ainsi, les valeurs normales apparaissent en vert, les valeurs anormales en rouge et les valeurs limites (borderline) ou subnormales en rose. Une carte « 3D » présente les mêmes résultats mais en relief, ce qui permet une visualisation plus conviviale et évidente (fig. 5-29).
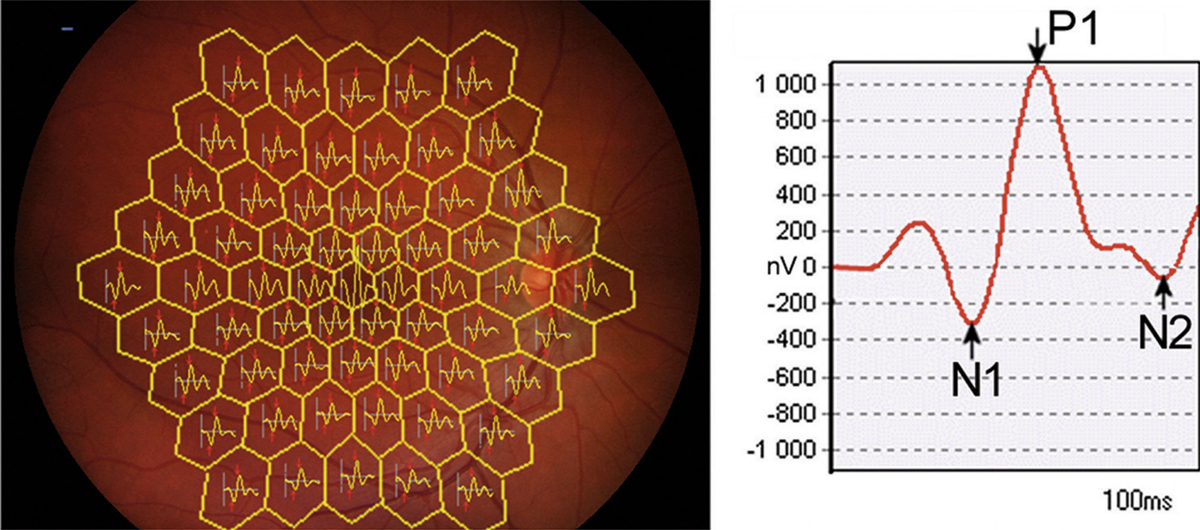
Fig. 5-27 Représentation des ERG élémentaires sur le fond d’œil (40° sur 50°) et schéma de l’ERGmf élémentaire normal.
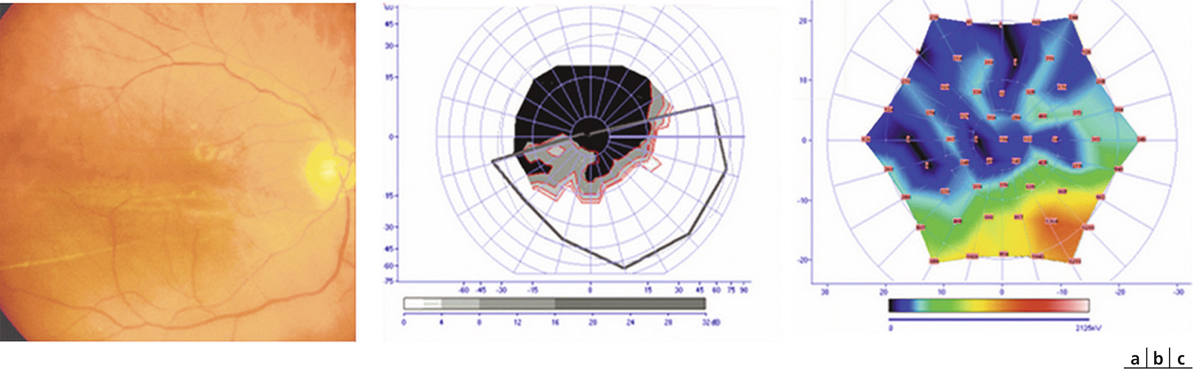
Fig. 5-28 Décollement de rétine inférieur.
a. Rétinophotographie. b. Champ visuel. c. ERGmf. Les résultats se présentent comme un champ visuel : le décollement de rétine inférieur est représenté par un déficit profond supérieur.
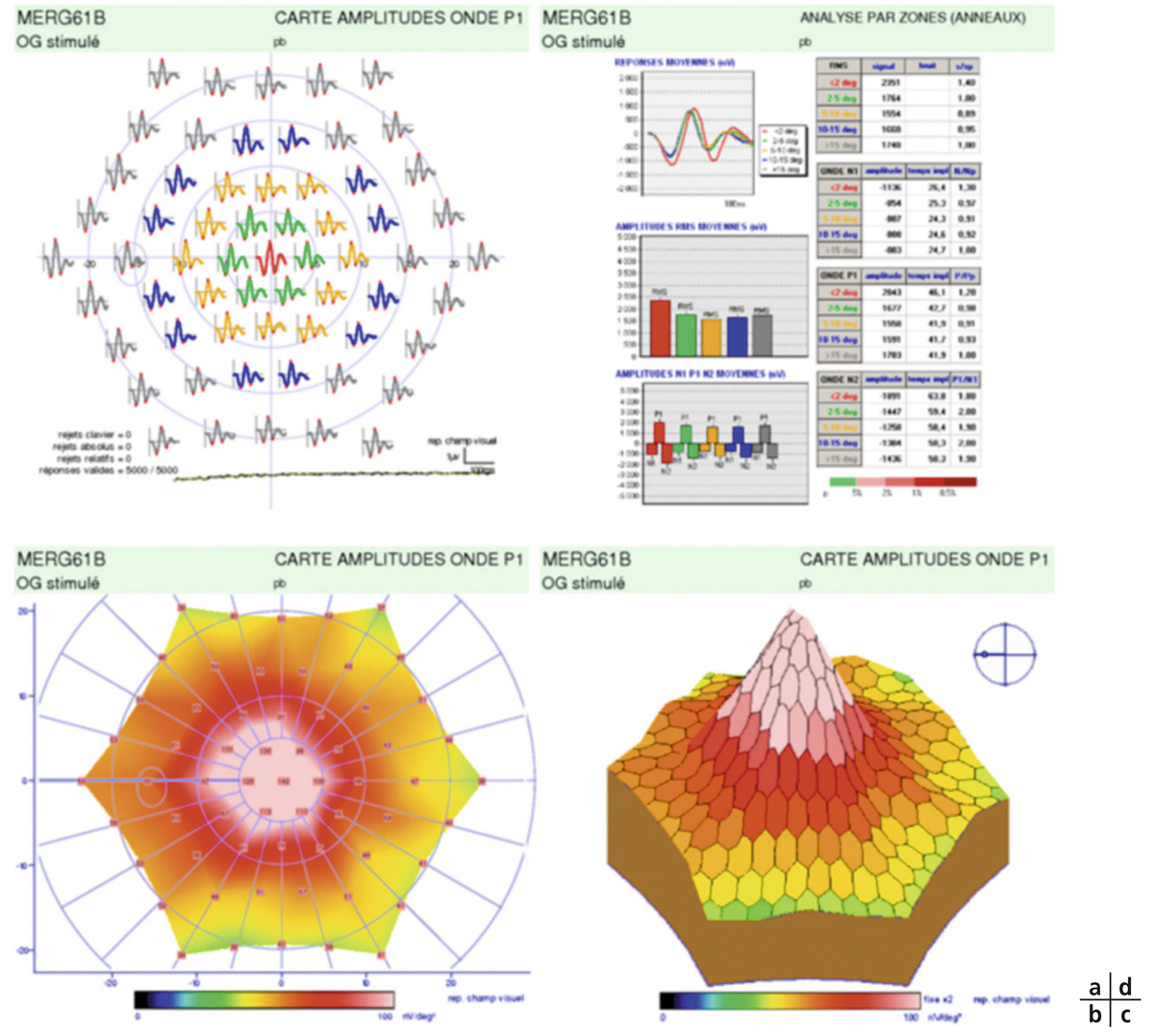
Fig. 5-29 Différents modes de représentation de l’ERGmf.
Ces données globales font l’objet d’une analyse par zone. Il s’agit soit d’anneaux concentriques (analyse par anneaux : a et d), soit par quadrants en 2D (b) ou en 3D (c). Des histogrammes avec un code couleur et des tableaux donnent l’ensemble des valeurs des amplitudes et des temps implicites moyens de chacune des ondes N1, P1 et N2 (d).
Un mauvais fonctionnement des cônes, même localisé, se traduit par une diminution des amplitudes et/ou une augmentation des latences dans la zone atteinte (fig. 5-29 à 5-33). Dans les œdèmes maculaires, la diminution du pic fovéolaire est fonction de la baisse d’acuité visuelle et de la durée de l’œdème et donc de la perte des cônes. Il y a également une diminution des amplitudes des anneaux périfovéolaires corrélée à la sensibilité rétinienne, c’est-à-dire à la surface et à l’intensité du déficit du champ visuel (fig. 5-30). Cette corrélation entre le déficit campimétrique et l’ERGmf est vérifiée dans les pathologies avec atteinte des couches externes de la rétine, ce qui n’est pas le cas dans les neuropathies.
L’ERGmf (comme le champ visuel) donne une carte précise, objective et reproductible (sous réserve de la coopération du patient et de la stabilité de la fixation) des zones maculaires altérées et préservées et peut orienter vers une cause notamment à la phase séquellaire où le fond d’œil peut sembler normal (atteinte d’un secteur dans les séquelles d’occlusion de branche). Malgré cela, l’ERGmf a peu de rôle dans le diagnostic ou dans le suivi des œdèmes maculaires car il a été détrôné par le SD-OCT. Cette technique d’imagerie reproductible et non invasive donne une évaluation précise de l’architecture maculaire avec les calculs :
-
des épaisseurs de la rétine et de leurs variations portant sur les différentes couches (atteinte rétine interne versus atteinte rétine externe) ;
-
de la perte de fonction, telle la perte des photorécepteurs par l’analyse de la couche nucléaire externe, de la ligne ellipsoïde et de la ligne épithélium pigmentaire–membrane de Bruch.
L’ERGmf garde une place dans les protocoles de recherche ou de thérapie de l’œdème maculaire en complément du SD-OCT et du champ visuel central subjectif.
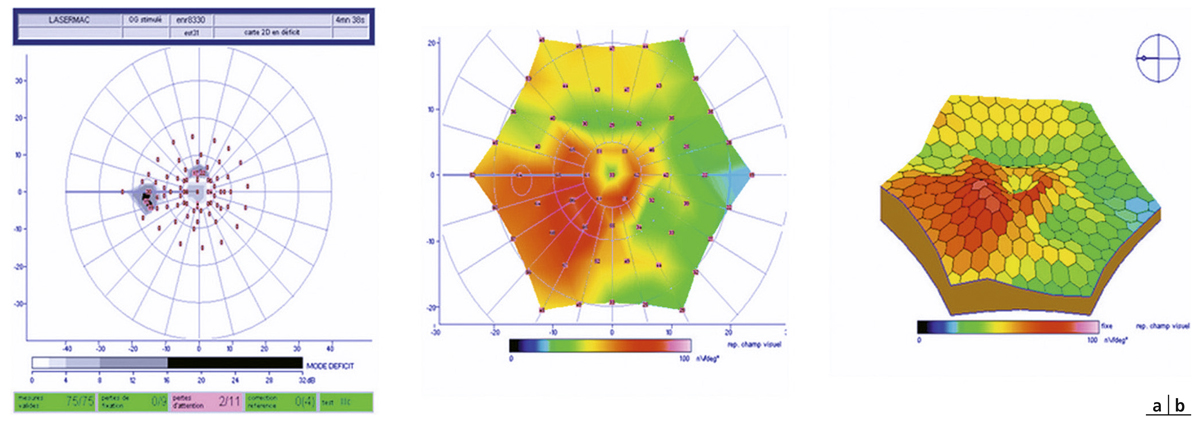
Fig. 5-30 Séquelle d’occlusion de branche veineuse rétinienne.
a. Champ visuel. b. ERGmf. Le déficit central localisé est superposable dans les deux méthodes.
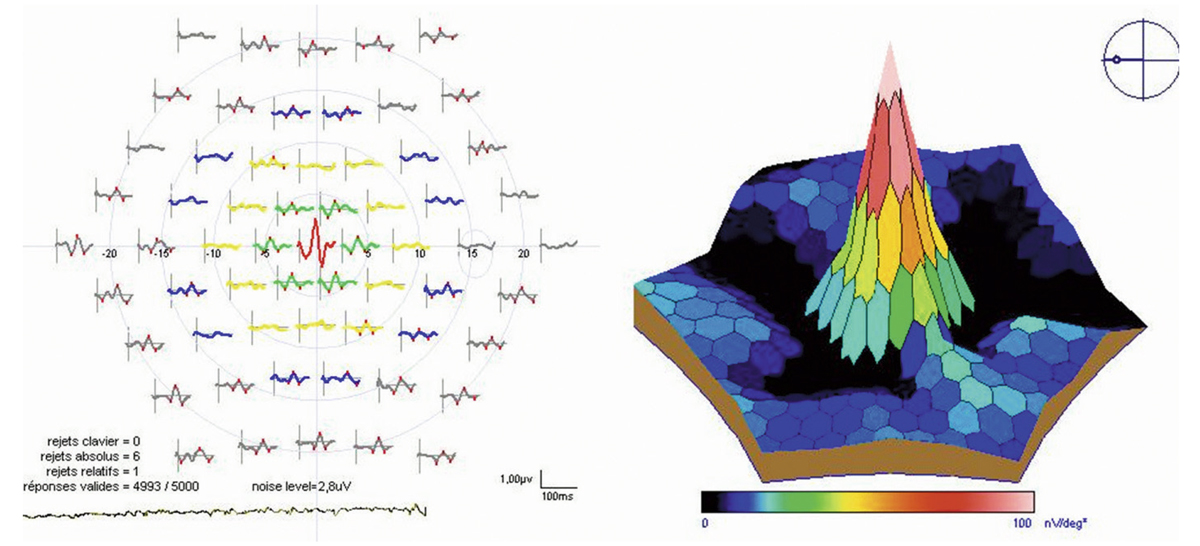
Fig. 5-31 Déficit paracentral avec préservation du pic fovéolaire dans une rétinopathie pigmentaire.
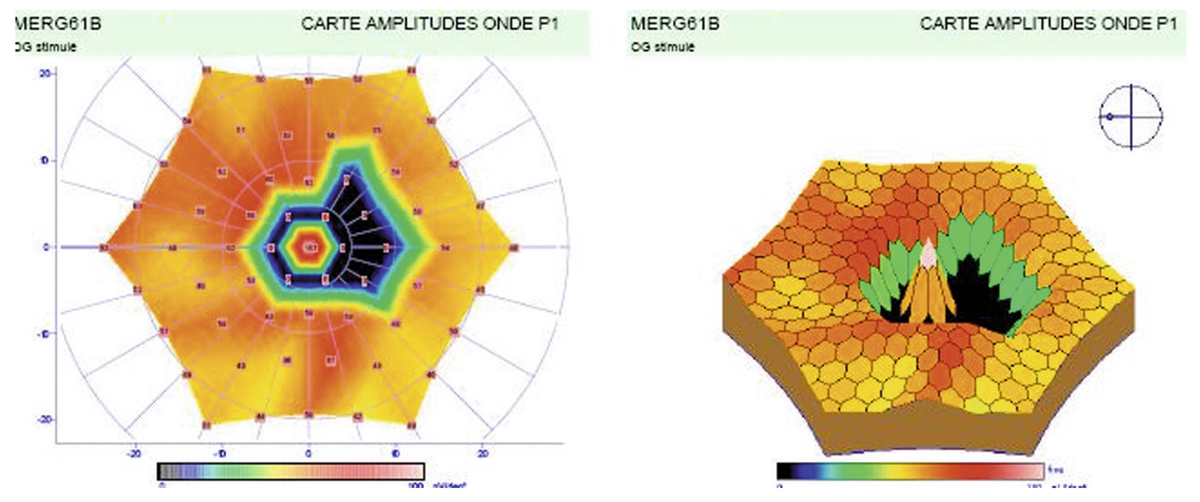
Fig. 5-32 Déficit péricentral d’une intoxication aux antipaludéens de synthèse.
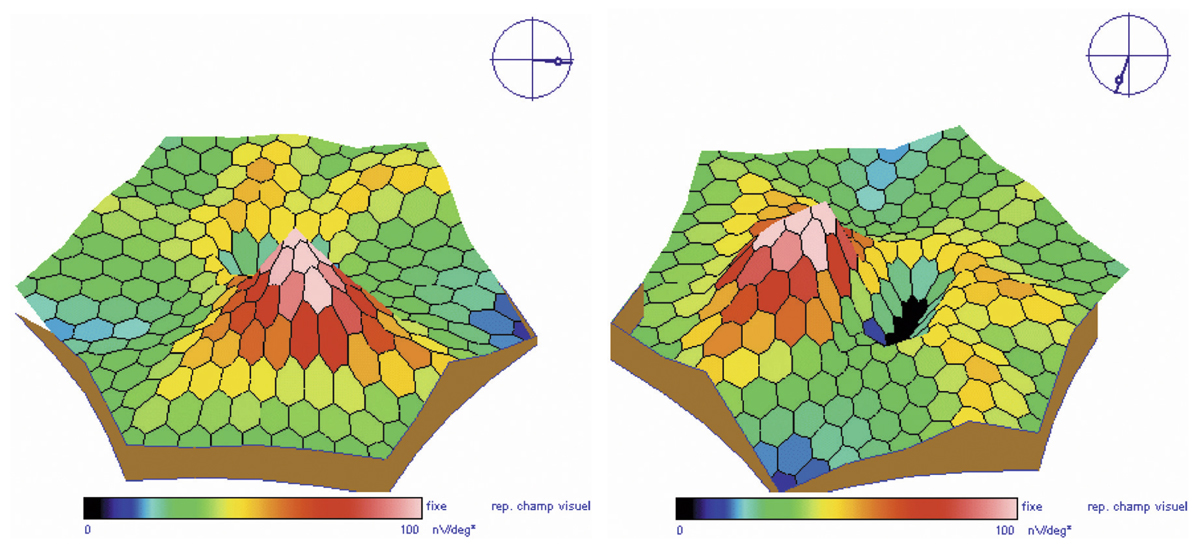
Fig. 5-33 ERGmf.
Dans la cartographie en 3D, il est important de noter que la zone en arrière du pic fovéolaire n’est visible que si on opère une rotation de la représentation 3D grâce aux flèches horizontales du pavé numérique du clavier. Dans cet exemple, le pic fovéolaire masquait le déficit qui est devenu visible grâce à la rotation de la carte 3D.
L’ERGmf est un outil pronostique de la rétinopathie diabétique [1–8]. Il est démontré que les temps séparant la stimulation des différents pics, notamment le pic de l’onde P1, sont précocement augmentés chez les patients diabétiques avant même l’apparition de signes de rétinopathie. Une augmentation d’une unité du taux de l’HbA1c s’accompagne d’une augmentation de 80 % du nombre d’hexagones anormaux. Ces altérations aux stades infracliniques peuvent être une mesure fiable et reproductible pour le calcul du risque de progression vers une rétinopathie diabétique après l’équilibre diabétique.
Il faut tenir compte dans ces évaluations que toute hyperglycémie au moment de la réalisation de l’ERGmf peut à l’inverse diminuer les temps de réponse [4] ; ceci serait lié à l’accélération du métabolisme de la rétine par l’hyperglycémie.
À l’aire du SD-OCT, les indications de l’ERGmf restent limitées dans les occlusions veineuses. Cet examen permet de cartographier sur les 103 hexagones étudiés les zones altérées caractérisées par une diminution de l’amplitude des réponses et une augmentation des temps de latence des ondes P1. L’atteinte est d’autant plus sévère qu’il y a une ischémie maculaire. L’intérêt est là encore dans la recherche clinique et dans l’évaluation des réponses aux traitements [9–13]. Par contre, l’ERGmf peut avoir un intérêt à distance de l’épisode occlusif lorsque la macula est normale mais que le patient reste symptomatique avec une baisse de l’acuité visuelle ou un scotome central. Cependant, le champ visuel et le SD-OCT restent là encore les examens de référence.
En conclusion, l’ERG multifocal a été détrôné par le couple SD-OCT–champ visuel dans l’œdème maculaire, les occlusions veineuses et la maculopathie diabétique. Il reste indiqué dans des protocoles de recherche clinique en complément du SD-OCT et du champ visuel.
[1] Palmowski AM, Sutter EE, Bearse MA, et al. Mapping of retinal function in diabetic retinopathy using the multifocal electroretinogramm. Invest Ophthalmol Vis Sci 1997 ; 38 : 2586-96.
[2] Greenstein VC, Holipigian K, Hood DC, et al. The nature and extent of retinal dysfunction associated with diabetic macular edema. Invest Ophthalmol Vis Sci 2000 ; 41 : 3643-54.
[3] Fortune B, Schneck ME, Adams A. Multifocal electroretinogram delays reveal local retinal dysfunction in early diabetic retinopathy. Invest Ophthalmol Vis Sci 1999 ; 40 : 2638-51.
[4] Klemp K, Larsen M, Sander B, et al. Effect of short-term hyperglycemia on multifocal electroretinogram in diabetic patients without retinoapthy. Invest Ophthalmol Vis Sci 2004 ; 45 : 3812-9.
[5] Ng JS, Bearse MA, Schneck ME, et al. Local diabetic retinopathy prediction by multifocal ERG Delays over 3 years. Invest Ophthalmol Vis Sci 2008 ; 49 : 1622-8.
[6] Lakhani E, Wright T, Abdolell M, et al. Multifocal ERG defects associated with insufficient long-term glycemic control in adolescents with type 1 diabetes. Invest Ophthalmol Vis Sci 2010 ; 51 : 5297-303.
[7] Harrison WE, Bearse MA, Ng JS, et al. Multifocal electroretinograms predict onset of diabetic retinopathy in adult patients with diabetes. Invest Ophthalmol Vis Sci 2011 ; 52 : 772-7.
[8] Greenstein VC, Chen H, Hood DC, et al. Retinal function in diabetic macular edema after focal laser photocoagulation. Invest Ophthalmol Vis Sci 2000 ; 41 : 3655-64.
[9] Dolan FM, Parks S, Keating D, et al. Multifocal electroretinographic features of central retinal vein occlusion. Invest Ophthalmol Vis Sci 2003 ; 44 : 4954-9.
[10] Abdel-Kader M, El-Dessouky WM. Multifocal electroretinogram in retinal vein occlusion. Saudi J Ophthalmol 2010 ; 24 : 125-32.
[11] Hvarfner C, Andreasson S, Larsson J, et al. Multifocal electroretinogram in branch retinal vein occlusion. Am J Ophthalmol 2003 ; 136 : 1163-5.
[12] Park S, Cho IH, Park TK, et al. Extrafoveal changes following intravitreal bevacizumab injections for macular edema secondary to branch retinal vein occlusion: a mfERG and OCT study. Doc Ophthalmol 2013 ; 126 : 137-48.
[13] Querques G, Lattanzio R, Querques L, et al. Impact of intravitreal dexamethasone implant (Ozurdex) on macular morphology and function. Retina 2014 ; 34 : 330-41.
C. Arndt
➤ On distingue deux classes d’imageurs : les imageries en photographie numérique (contact ou non-contact) et les imageries par balayage laser.
➤ Une rétinographie non mydriatique permet d’obtenir des clichés en couleurs de 30 ou 45°.
➤ Trois types de clichés monochromatiques peuvent être obtenus par l’application de filtres numériques à partir de l’image en couleurs.
➤ La prise de deux clichés de 45°, l’un centré sur la macula et l’autre sur la papille, représente actuellement la référence en termes de dépistage de la rétinopathie diabétique.
➤ La Retcam® réalise des clichés large champ (120°).
➤ L’analyse des rétinographies permet de définir le stade de rétinopathie diabétique.
La généralisation progressive des images rétiniennes numérisées a profondément modifié la pratique de l’ophtalmologie. Deux grandes classes d’imageurs peuvent être distinguées :
-
les imageries en photographie numérique (contact ou non-contact) ;
-
les imageries par balayage laser.
Un rétinographe classique mydriatique permet d’obtenir quatre types d’images :
-
les clichés en couleurs réalisés sans filtre en utilisant la lumière blanche (fig. 5-34a) ;
-
le cliché en lumière verte ou anérythre (550 nm) améliorant la visualisation des vaisseaux et des hémorragies (fig. 5-34b) ;
-
le cliché en rouge (630 nm) utile pour les lésions situées en arrière de l’épithélium pigmentaire dont les lésions mélaniques et les pigmentations (fig. 5-34c) ;
-
le cliché en lumière bleue (490 nm) visualisant le pigment xanthophylle et les fibres ganglionnaires (fig. 5-34d). La qualité de l’image est diminuée en cas de troubles de milieux.
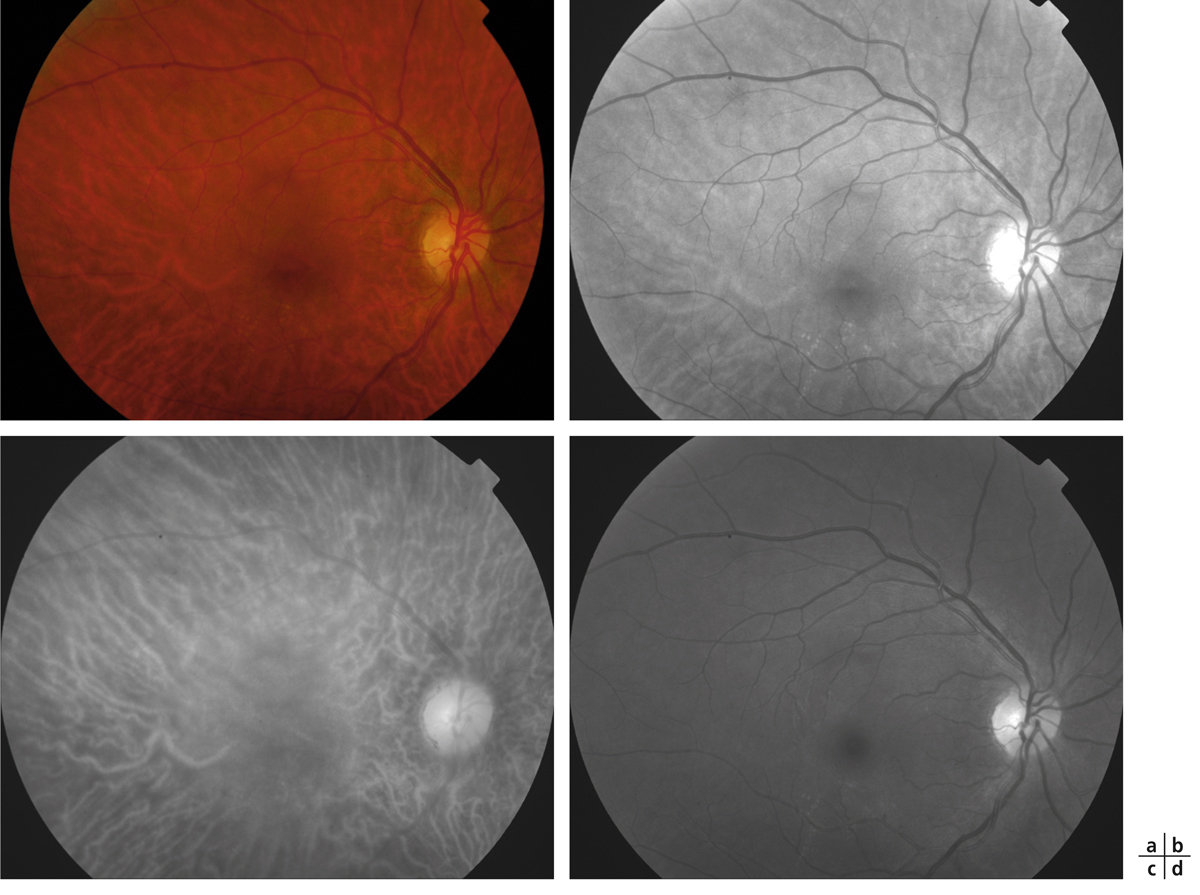
Fig. 5-34 Images obtenues par rétinographe classique.
a. Clichés en couleurs sans filtre en utilisant la lumière blanche. b. Cliché en lumière verte ou anérythre (550 nm) permettant d’améliorer la visualisation des vaisseaux et des hémorragies. c. Cliché en rouge (630 nm) très utile pour les lésions situées en arrière de l’épithélium pigmentaire. d. Cliché en lumière bleue (490 nm) utile pour bien visualiser le pigment xanthophylle et les fibres ganglionnaires.
Le patient est installé devant l’objectif, l’appareil est reculé et positionné afin de placer la lueur pupillaire au centre de l’image, puis l’appareil est rapproché du patient pour obtenir la totalité de l’image du fond d’œil, avec mise au point sur les vaisseaux rétiniens. Les clichés du pôle postérieur sont complétés dans l’idéal par quatre clichés dans les positions cardinales (en temporal supérieur, temporal inférieur, nasal supérieur et nasal inférieur).
L’intérêt des rétinographies mydriatiques réside dans la qualité des images obtenues. Dans la prise d’image des rétinographes mydriatiques, la dilatation pupillaire est obligatoire. Une mauvaise dilatation rend les clichés plus difficiles à analyser. Elle implique également un apprentissage initial de la part de l’opérateur. En cas de mauvais centrage, les micro-hémorragies du pôle postérieur et les lésions de la périphérie rétinienne ne seront pas visualisées. Toutefois, chez l’enfant, la prise d’image est dépendante de sa collaboration, compliquée parfois du fait de la position inconfortable sur la mentonnière.
Une rétinographie non mydriatique permet d’obtenir des clichés en couleurs de 30 ou 45°. Les trois types de clichés monochromatiques peuvent être obtenus par l’application de filtres numériques à partir de l’image en couleurs.
Une visualisation plus large du fond d’œil est également possible grâce au module panoramique qui permet ensuite par recalage de réaliser des montages. La prise de deux clichés de 45°, l’un centré sur la macula et l’autre sur la papille, représente actuellement la référence en termes de dépistage de la rétinopathie diabétique [1].
Le patient est installé devant l’objectif, des balises de repérage sur un écran de contrôle guident l’opérateur pour la prise d’image. La mise au point est effectuée sur les structures du fond d’œil (vaisseaux) sur l’écran de contrôle.
Du fait de la facilité d’apprentissage et de la possibilité de réaliser des clichés sans mydriase, la prise d’image est simple. La manipulation est typiquement destinée à des professionnels paramédicaux non spécialisés dans la prise d’image. La technique présente les mêmes inconvénients que la méthode précédente chez l’enfant.
La Retcam® (Massie Lab, Pleasanton, Californie, États-Unis) est une caméra digitale contact portable qui réalise des clichés large champ (120°) avec accès à l’extrême périphérie même en cas de trouble des milieux.
L’appareil est principalement destiné à l’examen des enfants [2], particulièrement pour le dépistage de la rétinopathie des prématurés. La prise d’image se fait avec une caméra portable reliée au système d’acquisition par un câble.
La prise d’image est facilitée chez les enfants prématurés par la caméra compacte qui permet de réaliser l’imagerie à proximité de la couveuse. Toutefois, la qualité de l’image limite l’utilisation du système pour d’autres applications (fig. 5-35).
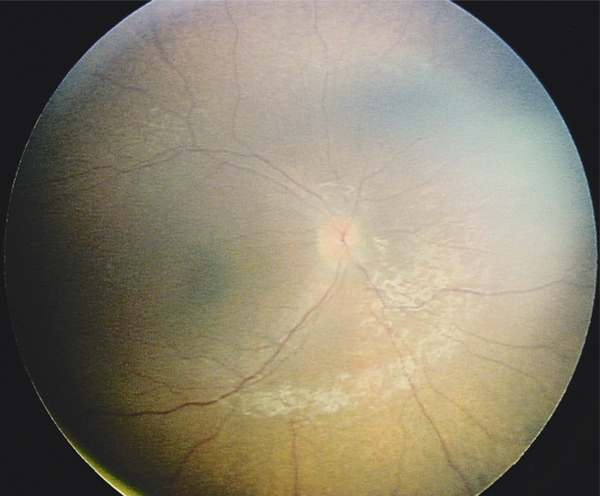
Fig. 5-35 Cliché pris en Retcam® permettant des clichés large champ (120°) avec une qualité d’image acceptable dans le cadre de dépistage ou de suivi.
Le Heidelberg Retinal Angiograph® (HRA®, Heidelberg Engineering, Heidelberg, Allemagne) permet d’obtenir des clichés en infrarouge, avec filtre vert ou des clichés en autofluorescence mais pas de clichés en couleurs, car ceux-ci sont faits de couleurs virtuelles. La grande résolution des images est due à différents paramètres. La mise au point sélective sur les structures à analyser dans un plan frontal est possible par le mode confocal. L’ophtalmoscopie à balayage laser (scanning laser ophthalmoscopy [SLO]) couplée au système de recalage permet de compenser les mouvements des yeux pour recaler plusieurs images successives (eyetracking). Les différents clichés recalés peuvent être moyennés entre eux, ce qui permet d’augmenter la qualité de l’image obtenue [3]. Une lentille grand champ permet l’accès à la périphérie du fond d’œil (55° et 100°) même en cas de faible dilatation pupillaire.
Optomap® (Optos PLC, Dunfermline, Écosse) est un système de visualisation digital du fond d’œil non-contact et non mydriatique utilisant le principe du SLO. Deux clichés monochromatiques à très large champ (200°) sont obtenus en un temps très court (0,25 s) à partir de deux lasers émettant dans le vert (532 nm) et le rouge (633 nm). Ces lasers (fig. 5-36) sont projetés sur la rétine par l’intermédiaire d’un miroir elliptique expliquant l’étendue de la surface rétinienne explorée. La lumière réfléchie est ensuite soumise à un séparateur de faisceau qui permet l’analyse dissociée de ses deux composantes verte et rouge et l’obtention directe de deux clichés monochromatiques. Un cliché en fausses couleurs (fig. 5-37) est reconstitué à partir de l’image obtenue à partir des deux faisceaux laser rouge et vert. Il en résulte que les structures les plus internes comme les opacités vitréennes ou des zones de rétine soulevées (fig. 5-38) apparaissent en vert. Ce type de cliché permet d’explorer près de 80 % de la surface rétinienne en une seule image (fig. 5-39).
Fig. 5-36 Principe de recueil des images de l’Optomap®.
Système SLO permettant d’obtenir des clichés monochromatiques à très large champ (200°) à partir de deux lasers émettant dans le vert (532 nm) et le rouge (633 nm).
Fig. 5-37 Cliché normal basé sur un aspect de « fausses couleurs » reconstituées à partir des images recueillies par les deux faisceaux laser rouge et vert (Optomap®).
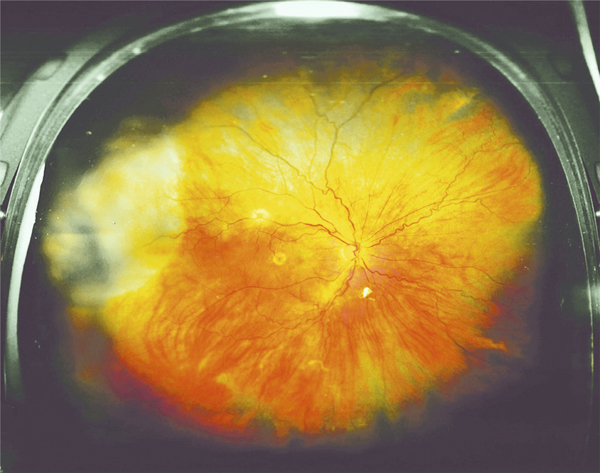
Fig. 5-38 Aspect de zone soulevée lors d’un décollement de rétine temporal supérieur qui apparaît en vert (Optomap®).
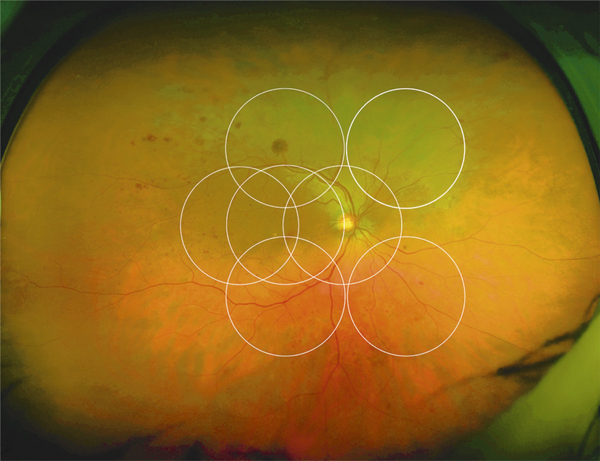
Fig. 5-39 Montage permettant de comparer les surfaces couvertes par des clichés définis par les neuf champs ETDRS et la visualisation offerte par les clichés à très grand champ.
L’analyse du cliché en couleurs se concentre en premier lieu sur l’aspect du reflet fovéolaire normal ou pathologique. L’analyse de la coloration de la papille et de l’anneau neurorétinien reste d’interprétation délicate. L’examen de la moyenne périphérie sur le cliché central peut faire rechercher des lésions plus franches en périphérie par la réalisation de clichés complémentaires.
Le développement des systèmes de numérisation des images du fond d’œil permet de constituer une photothèque conséquente de patients pour la documentation de la présence ou de l’absence d’une pathologie rétinienne avec parfois même des implications médico-légales.
L’accès immédiat à la lecture de l’image a contribué au développement de l’utilisation de l’image rétinienne en complément voire en remplacement de la biomicroscopie clinique. Dans les situations où l’examen clinique est difficile (faible dilatation pupillaire, impossibilité d’une immobilisation prolongée au-delà de quelques secondes comme le nystagmus), l’image photographique peut permettre un diagnostic des pathologies du pôle postérieur plus précis que celui de l’examen du fond d’œil [4]. Les lésions jaunes, les pigments et les hémorragies (sauf de petite taille) sont particulièrement bien visualisées. La supériorité du rendement diagnostique de la lecture d’images rétinophotographiques par rapport à l’examen du fond d’œil a été démontrée pour le dépistage de la rétinopathie diabétique [5]. Elle permet de répertorier la répartition des exsudats et guider la photocoagulation focale surtout quand ils sont disposés en couronnes multiples (fig. 5-40). En ophtalmopédiatrie, l’utilisation des images numériques évite souvent l’examen sous anesthésie générale.
Fig. 5-40 La photographie en couleurs constitue le gold standard pour imager les lésions présentes lors d’une rétinopathie diabétique. Elle visualise également les exsudats et guide la photocoagulation focale.
Depuis le développement de la tomographie en cohérence optique, le rôle essentiel des clichés monochromatiques est maintenant celui d’une documentation « topographique » par exemple de plis rétiniens en monochromatique vert, de l’extension d’une membrane, de l’intégrité du pigment xanthophylle (fig. 5-41) et de perte de fibres ganglionnaires sur le cliché monochromatique bleu ou d’une lésion choroïdienne sur le cliché monochromatique rouge.
Fig. 5-41 Cliché en monochormatique vert permettant de bien préciser l’extension d’une membrane et l’intégrité du pigment xanthophylle.
[1] Massin P, et al. OPHDIAT : a telemedical network screening system for diabetic retinopathy in the Ile-de-France. Diabetes Metab 2008 ; 34 : 227-34.
[2] Silva RA, et al. Stanford University Network for Diagnosis of Retinopathy of Prematurity (SUNDROP) : 18-month experience with telemedicine screening. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 129-36.
[3] Bellmann C, et al. Fundus autofluorescence imaging compared with different confocal scanning laser ophthalmoscopes. Br J Ophthalmol 2003 ; 87 : 1381-6.
[4] Khandhadia S, et al. Use of Optomap for retinal screening within an eye casualty setting. Br J Ophthalmol 2009 ; 93 : 52-5.
[5] Lin DY, Blumenkranz MS, Brothers RJ, Grosvenor DM. The sensitivity and specificity of single-field non mydriatic monochromatic digital fundus photography with remote image interpretation for diabetic retinopathy screening : a comparison with ophthalmoscopy and standardized mydriatic color photography. Am J Ophthalmol 2002 ; 134 : 204-13.
M.-B. Rougier
➤ La technique la plus répandue d’autofluorescence (AF) est obtenue avec une lumière bleue de longueur d’onde courte (entre 480 et 500 nm) qui excite la lipofuscine.
➤ La macula apparaît noire, car le pigment maculaire absorbe la lumière bleue incidente.
➤ L’aspect pétaloïde de l’hyper-autofluorescence observé en AF se calque sur les images tardives d’œdème maculaire cystoïde (OMC) en angiographie.
➤ L’AF donne une information pronostique lors du traitement d’un OMC, car elle est fortement corrélée aux altérations de la rétine externe.
➤ Dans l’AF en proche infrarouge, la mélanine est excitée, la macula est donc spontanément hyper-autofluorescente. La présence d’un œdème se traduit par une hypo-autofluorescence.
L’imagerie en autofluorescence (AF) repose sur les propriétés de fluorescence émise par la rétine lorsqu’elle est excitée par une lumière incidente. Selon la longueur d’onde de cette lumière incidente, certains composants de la rétine seront ou non excités. La technique la plus répandue est l’AF obtenue avec une lumière bleue de longueur d’onde courte (entre 480 et 500 nm selon les machines) qui excite la lipofuscine (produit de dégradation des photorécepteurs qui s’accumule dans l’épithélium pigmentaire). Des longueurs d’onde plus grandes, émettant dans le vert, excitent également la lipofuscine. Les images sont superposables à celles obtenues en bleu, mais la qualité est un peu moins bonne et, surtout, la sensibilité dans les œdèmes maculaires très faible [1, 2]. Rappelons que dans une AF normale, la macula apparaît noire, car le pigment maculaire (lutéine et zéaxanthine) de couleur jaune absorbe la lumière bleue incidente en totalité. Enfin, il est possible d’obtenir une AF en utilisant le proche infrarouge (800 nm). Dans ce cas, c’est la mélanine qui est excitée et l’interprétation des images est différente des précédentes.
Quand la longueur d’onde n’est pas précisée, il s’agit en général d’une AF en bleu.
Sans se substituer à l’angiographie, l’intérêt majeur de cette technique d’imagerie consiste en sa totale innocuité d’une part et sa rapidité d’acquisition d’autre part. De plus, son utilisation dans la détection de l’œdème maculaire cystoïde est logique. En effet, le pigment maculaire est localisé essentiellement dans les fibres de Henlé (couche plexiforme externe) ainsi que dans les couches nucléaires interne et externe. Et comme les kystes d’œdème sont localisés dans la couche nucléaire interne et la plexiforme externe, on comprend que la présence des kystes puisse déplacer le pigment maculaire, modifiant l’hypo-autofluorescence naturelle de la macula.
C’est pourquoi dans les cas d’OMC, il est possible de mettre en évidence des images en AF parfaitement superposables aux temps tardifs de l’angiographie à la fluorescéine. Mc Bain et al. [3], dans une étude portant sur l’OMC, ont montré que, comparée à l’angiographie, l’AF avait une sensibilité de 81 % et une spécificité de 69 %.
En revanche, une augmentation d’épaisseur maculaire sans kystes, comme un décollement séreux rétinien, n’aura pas de traduction en AF.
C’est l’OMC du diabétique qui a été le plus étudié en AF. On décrit trois types d’images différents [4] :
-
un aspect pétaloïde de l’hyper-autofluorescence qui se calque sur les images tardives d’OMC en angiographie (fig. 5-42a et b) ;
-
des spots d’hyper-autofluorescence sporadiques dans la région maculaire ;
-
une hypo-autofluorescence irrégulière correspondant souvent à la présence d’exsudats (fig. 5-42c).
Les deux derniers types d’aspects s’accompagnent souvent d’une altération de la rétine externe, visible à l’OCT, alors que dans le premier type les modifications sont liées au déplacement du pigment maculaire par les kystes d’œdème.
Outre la facilité d’acquisition et l’innocuité, l’AF, en association avec le SD-OCT, constitue un élément prédictif de récupération visuelle après traitement d’un OMC [5]. Il existe en effet une forte corrélation entre l’intensité du signal hyper-autofluorescent en AF et l’épaisseur maculaire ou les altérations de la rétine externe.
Dans le cadre des œdèmes maculaires accompagnant une uvéite, l’AF peut être moins contributive en raison du trouble des milieux transparents qui altère la qualité de l’image. Cependant l’OMC inflammatoire s’accompagne également d’une augmentation de l’hyper-autofluorescence maculaire, mais sans prendre systématiquement l’aspect pétaloïde [6].
Concernant l’AF en proche infrarouge, peu d’études ont été réalisées. Comme c’est la mélanine qui est excitée, la fluorescence est maximale au niveau fovéolaire. Ainsi, la présence d’un œdème se traduit par une hypo-autofluorescence. Dans le cadre des œdèmes maculaires du diabétique, deux types d’images ont été décrits : en mosaïque (dans lequel on retrouve des patches hyper- et hypo-autofluorescents) et pétaloïde (autofluorescence normale mais répartie en pétales) [7]. Ces modifications supposent que l’épithélium pigmentaire est modifié en cas d’œdème maculaire. L’utilisation de l’AF en infrarouge en routine clinique ne paraît pas d’actualité.
En conclusion, on retiendra que l’AF permet d’obtenir des images très superposables aux temps tardifs de l’angiographie dans l’OMC, et qu’elle est fortement corrélée aux altérations de la rétine externe et donc au pronostic visuel. En revanche, dans les autres types d’œdèmes maculaires, l’AF est nettement moins démonstrative. Enfin, les images d’AF obtenues avec une lumière de plus grande longueur d’onde s’avèrent peu fiables (verte) ou peu utiles (rouge).
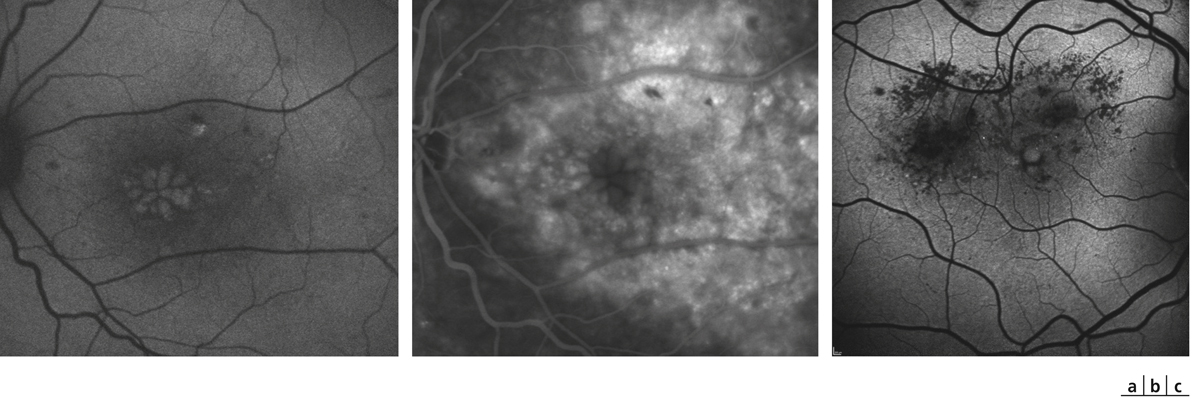
Fig. 5-42 Œdème maculaire cystoïde chez un diabétique.
a, b. L’aspect pétaloïde en autofluorescence (a) se superpose au cliché tardif de l’angiographie à la fluorescéine (b). c. Chez un autre patient, on retrouve trois spots arrondis périmaculaires hyper-autofluorescents correspondant à des kystes d’œdème maculaire. Les spots hypo-autofluorescents correspondent à des exsudats qui sont disposés en deux couronnes circinées.
[1] Bessho K, Gomi F, Harino S, et al. Macular autofluorescence in eyes with cytoid macula edema detected with 488 nm-excitation but not with 580nm-excitation. Graefes Clin Exp Arch Ophthalmol 2009 ; 247 : 729-34.
[2] Rezniczk L, Dabov S, Haritoglou C, et al. Green-light fundus autofluorescence in diabetic macular edema. Int J Ophthalmol 2013 ; 6 : 75-80.
[3] Mc Bain VA, Forrester JV, Lois N. Fundus autofluorescence in the diagnosis of cystoid macular edema. Br J Ophthalmol 2008 ; 92 : 946-9.
[4] Shen Y, Xu X, Liu K. Fundus autofluorescence characteristics in patients with diabetic macular edema. Chin Med J 2014 ; 127 : 1423-8.
[5] Chung H, Park B, Shin HJ, Kim HC. Correlation of fundus autofluorescence with spectral domain optical coherence tomography and vision in diabetic macular edema. Ophthalmology 2012 ; 119 : 1056-65.
[6] Roesel M, Henschel A, Heinz C, et al. Fundus autofluorescence and spectral domain optical coherence tomography in uveitic macular edema. Graefes Clin Exp Arch Ophthalmol 2009 ; 247 : 1685-9.
[7] Yoshitake S, Murakami T, Horii T, et al. Qualitative and quantitative characteristics of near-infrared autofluorescence in diabetic macular edema. Ophthalmology 2014 ; 121 : 1036-44.
G. Quentel, C. Creuzot-Garcher
➤ L’angiographie constitue un examen clé pour apprécier la dynamique vasculaire de la rétine et de la choroïde.
➤ Le diagnostic d’œdème maculaire est maintenant fait avant tout grâce à l’OCT. Toutefois, l’identification de zones de non-perfusion ou d’un aspect de diffusion contribuera tant au diagnostic de la pathologie causale qu’au choix thérapeutique devant l’apparition d’un œdème maculaire.
➤ L’angiographie permet de détecter une atteinte ischémique maculaire.
➤ L’angiographie en fluorescence tient ainsi une place de choix au sein de l’imagerie multimodale.
➤ Les angiographes grand champ permettent d’améliorer la qualité de la recherche des zones d’ischémie périphérique souvent mise en défaut par les angiographes conventionnels.
Introduite en 1959, l’angiographie en fluorescence a été, jusqu’au début des années 2000, l’examen fondamental et incontournable pour l’évaluation des maladies de la rétine. Le progrès technologique et notamment l’avènement de l’OCT ont apporté d’autres méthodes d’évaluation qui ont diminué la place de cet examen, encore néanmoins très utile et largement pratiqué [1].
L’angiographie à la fluorescéine permet de mettre en évidence la circulation et la diffusion d’un traceur injecté par voie intraveineuse. La circulation de ce traceur (qui se fait rapidement en une dizaine de secondes) visualise la morphologie du lit vasculaire et la dynamique de la circulation. La diffusion de ce traceur (qui est beaucoup plus lente et se compte en minutes) met en évidence les altérations de la barrière hémato-rétinienne. Le traceur utilisé est un colorant, le sel sodique de fluorescéine (fluorescéinate de sodium). Lorsqu’elle est stimulée par une radiation lumineuse bleue autour de 450 nm, la fluorescéine en solution émet une lumière de fluorescence jaune autour de 520 nm. Grâce à un jeu de filtre adapté, il est possible de photographier cette lumière de fluorescence de façon très sélective. La fluorescéine est une petite molécule pharmacologiquement inactive qui diffuse librement à travers les parois de la choriocapillaire et la membrane de Bruch, mais qui est retenue par les jonctions étanches des cellules endothéliales des vaisseaux rétiniens normaux (barrière hémato-rétinienne interne) et par les jonctions des cellules de l’épithélium pigmentaire (barrière hémato-rétinienne externe). Alors que les jonctions serrées des cellules endothéliales rétiniennes constituent une barrière étanche, les vaisseaux de la choroïde laissent passer le colorant qui imprégnera les espaces extravasculaires de la choroïde. Les jonctions serrées des cellules de l’épithélium pigmentaire (EP) constituent un obstacle au passage du colorant qui ne peut donc accéder à la rétine neurosensorielle si l’EP est intact. Pour Cunha-Vaz, le rôle de ces barrières est la clé de l’interprétation de l’angiographie en fluorescence [2].
L’angiographie permet l’analyse de la morphologie du lit vasculaire rétinien (calibre, régularité et distribution) et de la dynamique circulatoire tant sur les gros vaisseaux artériels et veineux que sur le lit capillaire, notamment dans les régions maculaire et papillaire ; cette analyse se fait sur les temps précoces de l’examen et permet de mettre en évidence des anomalies de la dynamique du remplissage choroïdien qui apparaît sous forme de lobules. Il est important que les prises de vue débutent précocement avant l’arrivée du colorant et soient réalisées à une cadence rapide d’environ une image par seconde afin de permettre cette analyse. On distingue plusieurs phases au cours de l’examen : une phase choroïdienne, une phase artérielle, une phase capillaire veineuse et tardive. L’examen permet ainsi de mesurer sur le plan dynamique :
-
le temps choroïdien : phase très précoce de visualisation du colorant dans la choroïde, alimentée par les artères ciliaires courtes. On peut noter à ce stade une éventuelle artère ciliorétinienne, présente chez 15 % des patients ;
-
la phase artérielle : elle suit la précédente d’une seconde environ, liée à l’arrivée du colorant par l’artère centrale de la rétine. Le temps « bras–rétine » est défini par le temps entre le début de l’injection et l’apparition du colorant au niveau rétinien, normalement de l’ordre de 10 à 15 secondes. Celui-ci peut être influencé par l’état vasculaire systémique du patient, par la qualité de la voie veineuse utilisée ainsi que le volume injecté. Il est donc très variable (fig. 5-43 et 5-44) ;
-
les temps de remplissage artériel et veineux : on distingue, dans un premier temps, la phase artérioveineuse précoce pendant laquelle sont colorées les artères, les artérioles et les veines, et, dans un second temps, la phase tardive où les veines s’imprègnent également. Le temps de transit artérioveineux (défini comme la différence entre le temps de début du remplissage artériel et le temps veineux laminaire) est normalement inférieur à 5 secondes (fig. 5-45).
L’analyse des capillaires rétiniens est un des apports principaux de l’examen avec la mise en évidence des zones de non-perfusion, de l’arcade anastomotique périfovéolaire et de la zone avasculaire centrale (ZAC) dont le diamètre normal mesure environ 400 μ (fig. 5-46c). La diffusion du colorant n’est souvent mise en évidence que sur les temps les plus tardifs de l’examen (fig. 5-47). Il est souvent utile de prolonger l’examen au-delà de 5 minutes, voire jusqu’à 10 ou même 30 minutes pour mettre en évidence des diffusions minimes. Les diffusions s’analysent selon leur topographie, leur répartition et leurs morphologies et suivant leur évolutivité sur des examens successifs [3, 4].
L’examen nécessitant une injection intraveineuse, il est indispensable d’obtenir du patient un consentement éclairé après explication des modalités et des risques de l’examen ; la tolérance est bonne mais il existe des allergies qui peuvent aller jusqu’à un choc anaphylactique grave, voire mortel. Ce risque évalué à 1 pour 200 000 injections [5] a contribué à faire diminuer les indications de cet examen. Compte tenu de ce risque, il est indispensable de peser l’indication et de réaliser l’examen dans un environnement où il est possible de faire face à un accident d’intolérance.
Fig. 5-43 Temps artériel au cours d’une séquence angiographique normale : les artères sont imprégnées à partir de l’artère centrale de la rétine.
Fig. 5-44 Artère ciliorétinienne : au temps artériel de l’angiographie, on observe une artère ciliorétinienne chez une patiente souffrant d’une occlusion veineuse.
Fig. 5-45 Temps artérioveineux au cours d’une séquence angiographique normale : visualisation du courant veineux laminaire.
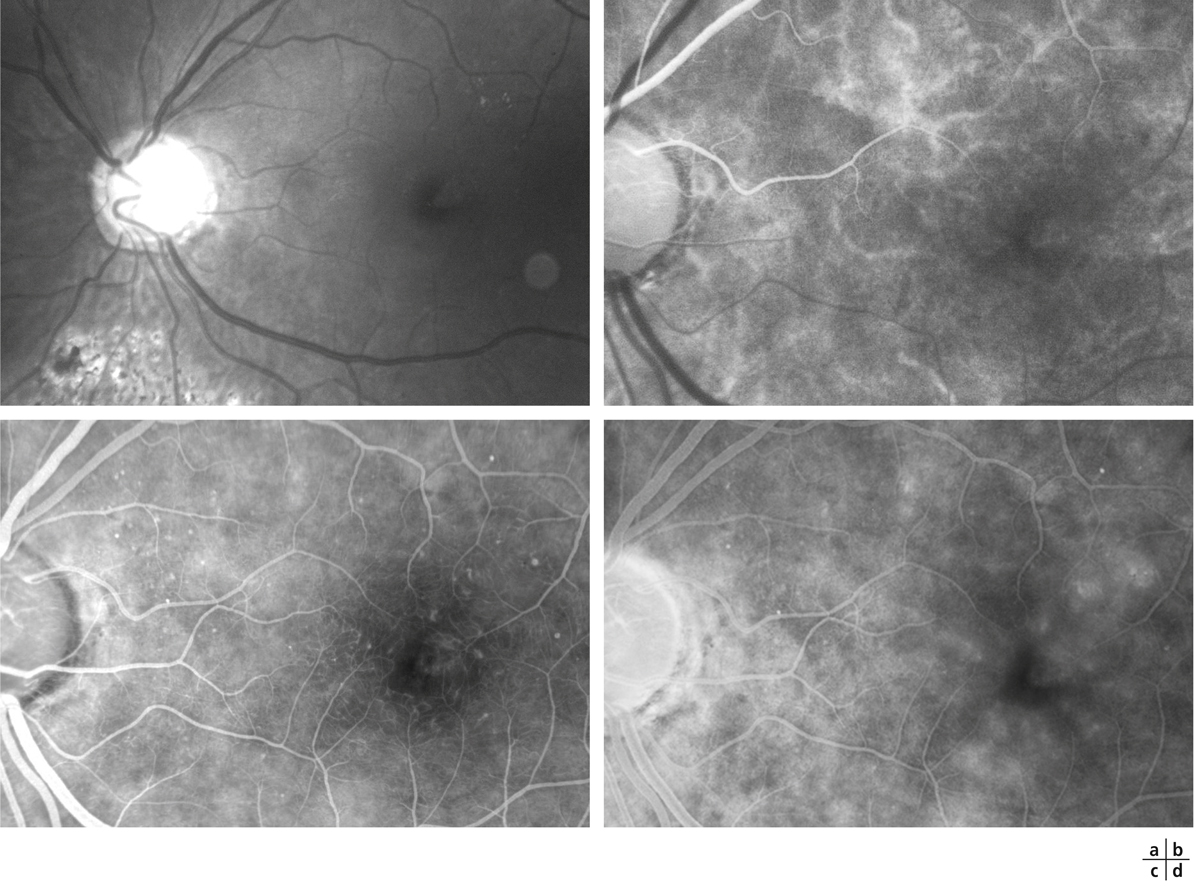
Fig. 5-46 Analyse de la ZAC et OMC chez un patient diabétique.
a. Cliché en lumière bleue : refoulement du pigment jaune central par une logette centrale. b. Temps précoce : hyperfluorescence au niveau de la logette centrale par effet fenêtre dû au refoulement du pigment jaune par la logette. c. Temps capillaire : dilatation du lit capillaire, micro-anévrismes disséminés, effet fenêtre central. d. Temps tardifs : diffusions péricentrales ; coloration de la logette cystoïde centrale.
Fig. 5-47 Diffusions au temps tardif de l’angiographie et OMC.
L’angiographie va identifier différentes anomalies d’augmentation ou de diminution du profil de fluorescence normale. Les signes recherchés s’appuieront sur l’identification :
-
d’un effet masque lié à un blocage de la fluorescence normale ;
-
des défauts de remplissage marqués par une hypofluorescence ;
-
d’un effet fenêtre où la fluorescence est anormalement visible à travers un épithélium pigmentaire déficient ;
-
une diffusion où la fluorescence va augmenter progressivement de taille au cours de la séquence angiographique ;
-
un remplissage d’une cavité par le colorant ;
-
un marquage tissulaire par le colorant.
Pour Staurenghi [6], l’angiographie a un intérêt majeur pour la recherche de l’étiologie d’un œdème maculaire ; en fait, la place de l’angiographie se conçoit en association avec d’autres examens : photographies en couleurs du fond d’œil, rétinographies monochromatiques, angiographie infrarouge au vert d’indocyanine, OCT. On a vu apparaître, dès 2011, les prémices du concept d’imagerie multimodale : chaque examen apporte sa part d’information permettant de construire un diagnostic raisonné. On rappelle que l’ischémie rétinienne, évaluée dans une rétinopathie diabétique, repose sur l’analyse des photographies en couleurs du fond d’œil. Toutefois, l’angiographie peut faciliter l’analyse d’une anomalie vasculaire, et trancher entre le diagnostic d’une anomalie microvasculaire intrarétinienne (AMIR) ou celui d’un néovaisseau (fig. 5-48).
L’état des barrières et la qualité de l’état vasculaire vont déterminer les caractéristiques observées en angiographie en fluorescence (tableau 5-5) :
-
barrière hémato-rétinienne interne qui, si elle est altérée, entraîne une diffusion du colorant hors des vaisseaux de gros diamètre lors d’un vascularite ou à partir des capillaires dans les capillaropathies inflammatoires (fig. 5-49 et 5-50 ; voir chapitre 10.4) ;
-
barrière hémato-rétinienne externe dont l’altération entraîne une diffusion, plus ou moins bien caractérisée selon la localisation de la lésion, par rapport à l’épithélium pigmentaire. Cette hyperfluorescence est mal caractérisée avec des limites mal définies comme on le voit dans les néovaisseaux occultes dits de type 1. On remarque d’ailleurs que la caractérisation des néovaisseaux repose encore actuellement sur des critères angiographiques (voir chapitre 12.1) ;
-
remplissage anomal lié à un décollement de l’épithélium pigmentaire (DEP) et sa nature, séreuse ou pas, permettant alors de distinguer les DEP fibrovasculaire des formes drusénoïdes (fig. 5-51 ; voir chapitre 12.1) ;
-
identification d’obstacle à la visualisation d’une fluorescence « normale » de la choroïde ou de la rétine dit également « effet masque » (tumeur, hémorragie, etc. ; fig. 5-52) ou, a contrario, visualisation d’une fluorescence anormale par l’absence de l’effet écran joué par l’épithélium pigmentaire dit également « effet fenêtre » (dans les atrophies de l’épithélium pigmentaire par ex. ; fig. 5-53). À noter que le pigment jaune maculaire crée une absorption de la lumière bleue d’excitation, ce qui entraîne dans l’angiographie normale une hypofluorescence de la région centromaculaire encore accentuée par la présence des pigments mélaniques plus abondants au niveau de la macula. L’altération du pigment jaune central, notamment lorsqu’il existe une logette cystoïde centrale, va se traduire par une augmentation de la stimulation de la fluorescence centrale avec visibilité d’une image arrondie dès le temps précoce de l’examen (voir fig. 5-46) ;
-
zones de non-perfusion : représentées par des territoires sombres, non vascularisés ; les capillaires rétiniens sont absents, voire les vaisseaux artériels de plus gros calibre (fig. 5-54 et 5-55). Un champ limité de 30 et 60° est particulièrement adapté à l’analyse de l’arcade anastomotique périfovéolaire et à l’identification de sa rupture. Les occlusions capillaires centrales entraînent un élargissement progressif de la ZAC avec, au maximum, l’apparition d’une maculopathie ischémique de mauvais pronostic. Les territoires de non-perfusion s’accompagnent fréquemment de dilatations des capillaires rétiniens de voisinage, ainsi que de micro-anévrismes se développant aux pourtours des zones de non-perfusion (fig. 5-56 et 5-57). Ces zones de non-perfusion peuvent aussi impliquer les vaisseaux choroïdiens, entraînant alors de larges territoires d’hypofluorescence à bords nets ;
-
zones de diffusion : la diffusion du colorant est définie par l’augmentation de la taille et de l’intensité de la fluorescence dans le temps, avec des limites floues aux temps tardifs. Elle est à distinguer de la simple imprégnation qui n’évoluera pas dans le temps. Elle est particulièrement bien visible au niveau des néovaisseaux responsables d’une diffusion précoce et abondante de colorant. On peut également noter une hyperfluorescence des parois vasculaires, aux stades précoces des occlusions veineuses. Une diffusion de colorant tardive au niveau des capillaires dilatés traduit la rupture de la barrière hémato-rétinienne interne. Elle n’est néanmoins pas synonyme d’œdème, les diffusions de fluide étant le plus souvent compensées par les mécanismes de réabsorption des fluides très actifs dans la rétine.
On distingue habituellement deux formes angiographiques d’œdème maculaire, cystoïde et non cystoïde [7]. Les données fournies par les images sont essentiellement qualitatives :
-
l’œdème maculaire non cystoïde se caractérise par une hyperfluorescence anormale diffuse et progressivement croissante avec accumulation du colorant au cours de l’examen ; cette hyperfluorescence est attribuée à une hyperperméabilité anormale du lit capillaire. Les limites de la zone de diffusion peuvent être imprécises. On parlera néanmoins d’œdème seulement si ces diffusions s’accompagnent d’un épaississement rétinien en biomicroscopie et/ou en OCT (fig. 5-58) ;
-
l’œdème maculaire cystoïde associe une dilation du lit capillaire, visible dès le temps précoce, et une diffusion progressivement croissante du colorant qui s’accumule pour former une image en « rayons de miel » ou en « pétales de fleur » avec une disposition radiaire (voir fig. 5-47 et 5-59) ; cette image est attribuée à la coloration du liquide qui se trouve dans les logettes cystoïdes de la couche plexiforme externe de la rétine [8]. Cependant, les logettes peuvent s’étendre vers d’autres couches de la rétine avec une variabilité liée à l’étiologie [9]. La taille des logettes doit être prise en considération, les logettes de grande taille caractérisant la dégénérescence cystoïde ayant un caractère péjoratif. L’image angiographique de l’œdème peut être visible dès la 2e minute après l’injection, mais souvent elle ne devient bien visible que vers la 5e minute, et parfois même plus tardivement.
En pratique, les clichés tardifs doivent être réalisés 5 minutes après l’injection. La plupart des protocoles de recherche clinique imposent même des clichés stéréoscopiques réalisés à la 10e minute.
L’étendue de la zone de diffusion n’est pas corrélée avec l’atteinte de l’acuité visuelle. Le caractère plus ou moins central de la zone œdémateuse est la caractéristique la plus importante. L’atteinte ischémique du lit capillaire et de l’épithélium pigmentaire joue également un rôle important : sémiologiquement l’atteinte de l’épithélium pigmentaire se caractérise par une hyperfluorescence d’apparition précoce qui n’augmente pas aux temps tardifs ; l’analyse fine des temps précoces de l’examen en comparaison avec les images tardives revêt donc une grande importance pour caractériser l’atteinte de l’épithélium pigmentaire (EP).
Fig. 5-48 Diffusion à partir d’un néovaisseau prérétinien.
Si les rétinophotographies en couleurs peuvent permettre de reconnaître un néovaisseau prérétinien, la diffusion intense de colorant facilite son identification : ici, un néovaisseau prérétinien et des micro-anévrismes et AMIR surviennent dans un contexte de rétinopathie diabétique proliférante minime.
Tableau 5-5 Principaux signes retrouvés en angiographie et mécanismes.
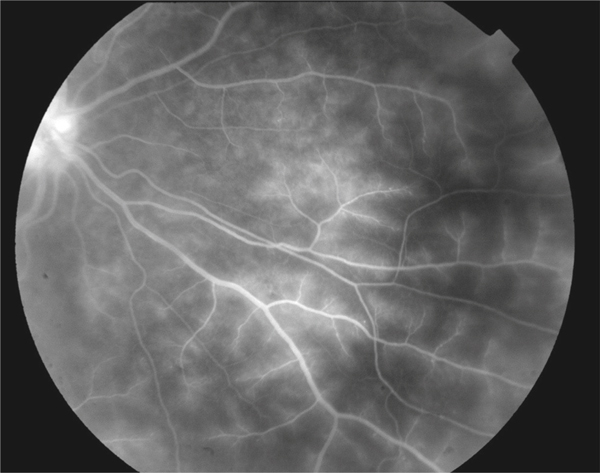
Fig. 5-49 Vascularite au cours d’une maladie de Behçet : diffusion de colorant à partir des vaisseaux de moyen et petit calibre.
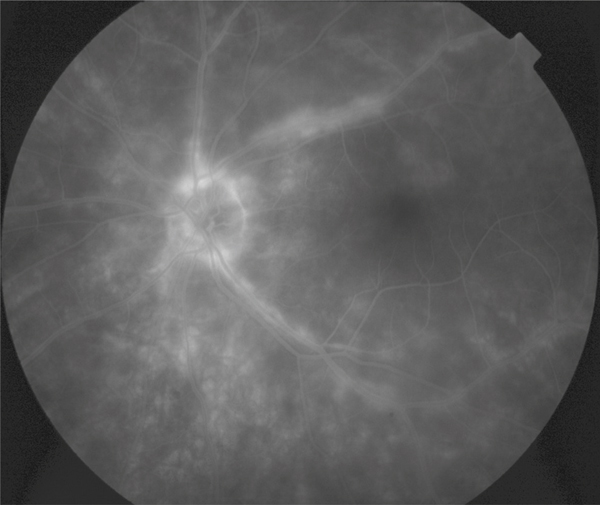
Fig. 5-50 Vascularite au cours d’une sarcoïdose : imprégnation de la paroi des veines et diffusion, œdème rétinien.
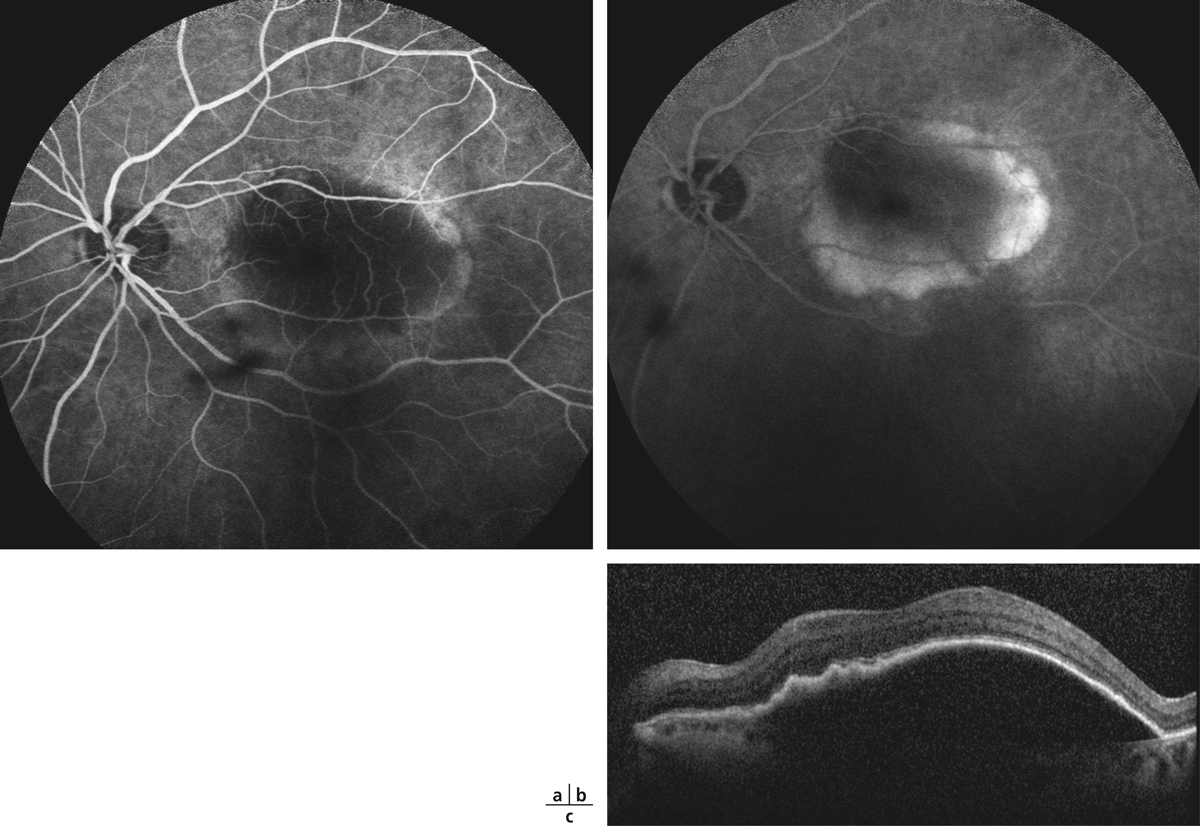
Fig. 5-51 Décollement de l’épithéium pigmentaire (DEP).
a. Effet masque exercé par le DEP qui « cache » la fluorescence sous-jacente. b. Remplissage du DEP au temps tardif de l’angiographie. c. Aspect de l’OCT correspondant.
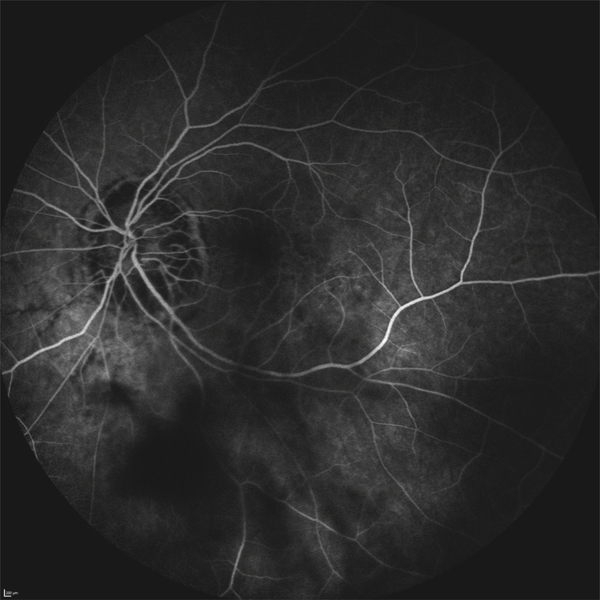
Fig. 5-52 Corps flottants chez un myope fort.
Ils constituent parfois un véritable masquage de la fluorescence sous-jacente.
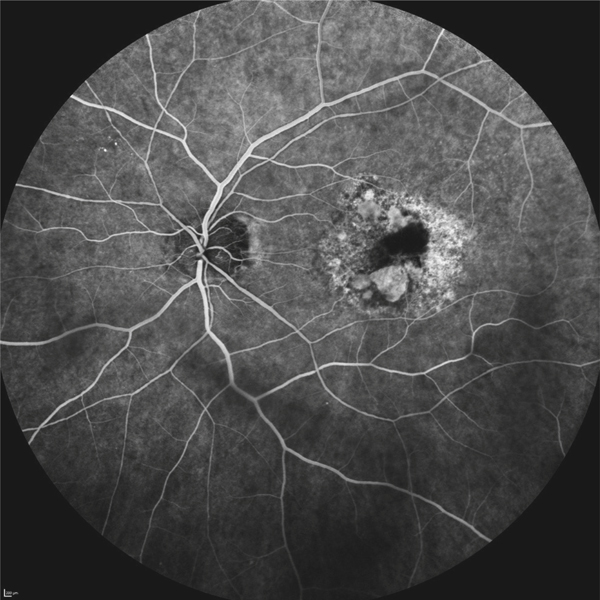
Fig. 5-53 Atrophie de l’épithélium pigmentaire dans une dégénérescence maculaire : elle provoque un « effet fenêtre » avec visualisation anormale de la fluorescence de fond.
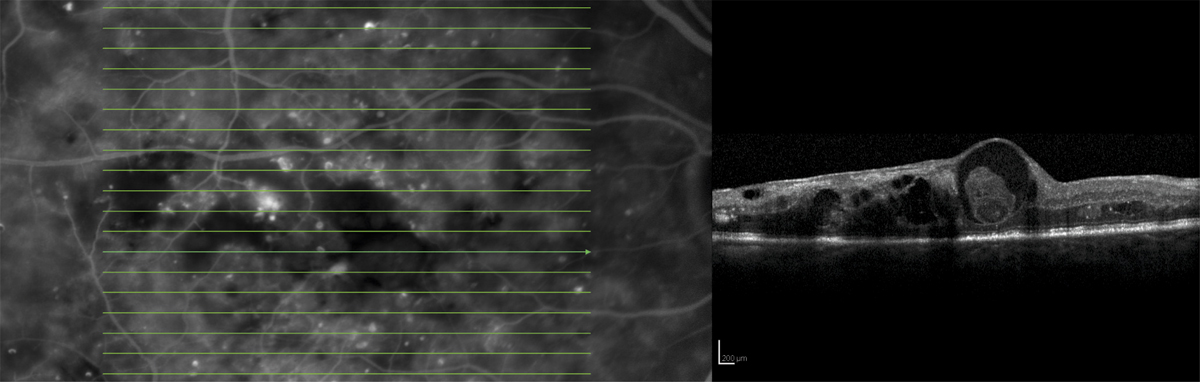
Fig. 5-54 Ischémie maculaire associée à un œdème intrarétinien.
L’angiographie constitue l’examen de choix pour identifier une ischémie maculaire responsable d’une mauvaise récupération visuelle lors du traitement d’un œdème maculaire.

Fig. 5-55 Temps artérioveineux de l’angiographie chez un patient diabétique qui a bénéficié d’une photocoagulation panrétinienne.
On observe de très nombreux micro-anévrismes et AMIR, notamment temporomaculaires, des occlusions capillaires responsables d’une augmentation importante de la taille de la ZAC (maculopathie ischémique). Le refoulement du pigment jaune par les logettes d’œdème permet de visualiser celles-ci dès le temps artérioveineux de l’angiographie par « effet fenêtre ».
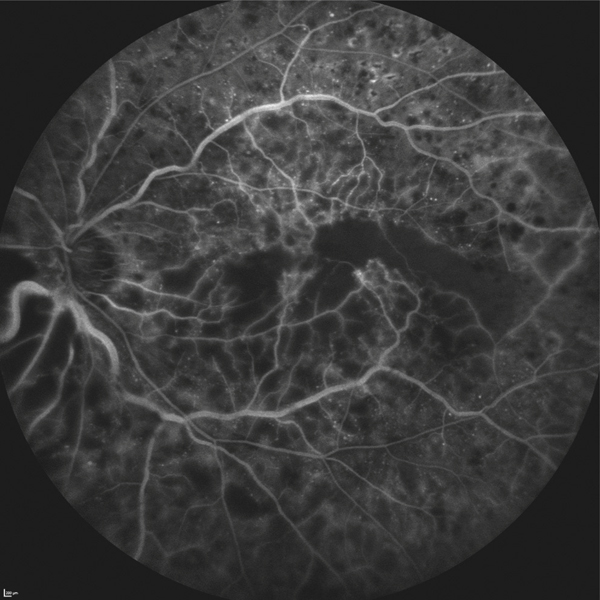
Fig. 5-56 Occlusion de la veine centrale de la rétine.
Vastes territoires de non-perfusion centrale et périphérique. Ces zones de non-perfusion sont associées à une diffusion du colorant à partir des veines.
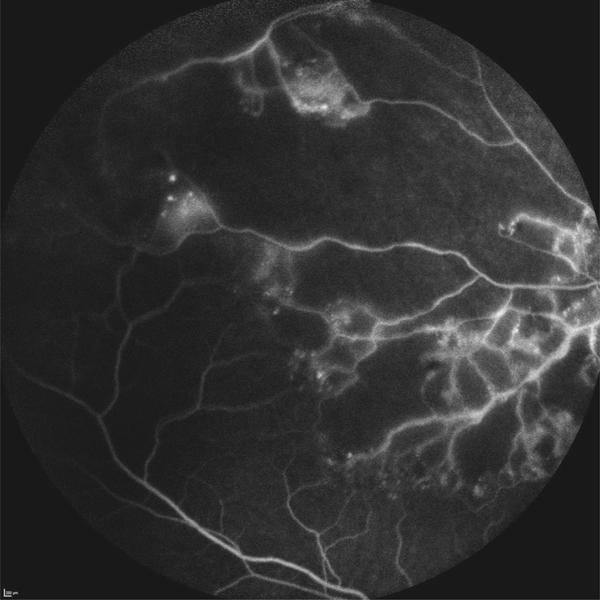
Fig. 5-57 Occlusion de la veine centrale de la rétine.
Vastes zones de non-perfusion périphériques bordées par des micro-anévrismes et des AMIR au temps intermédiaire de l’angiographie.
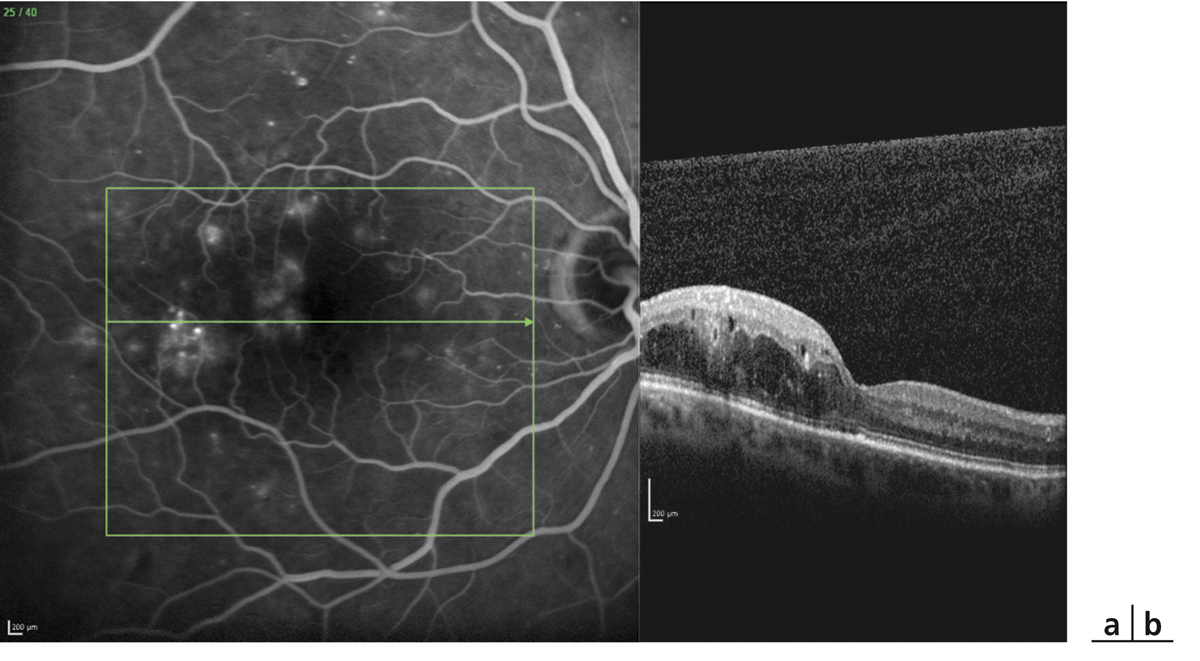
Fig. 5-58 Œdème maculaire diabétique sévère juxtafovéolaire.
a. L’angiographie objective les sources de diffusion à partir des micro-anévrismes. b. L’OCT objective l’épaississement temporomaculaire atteignant le centre de la macula.
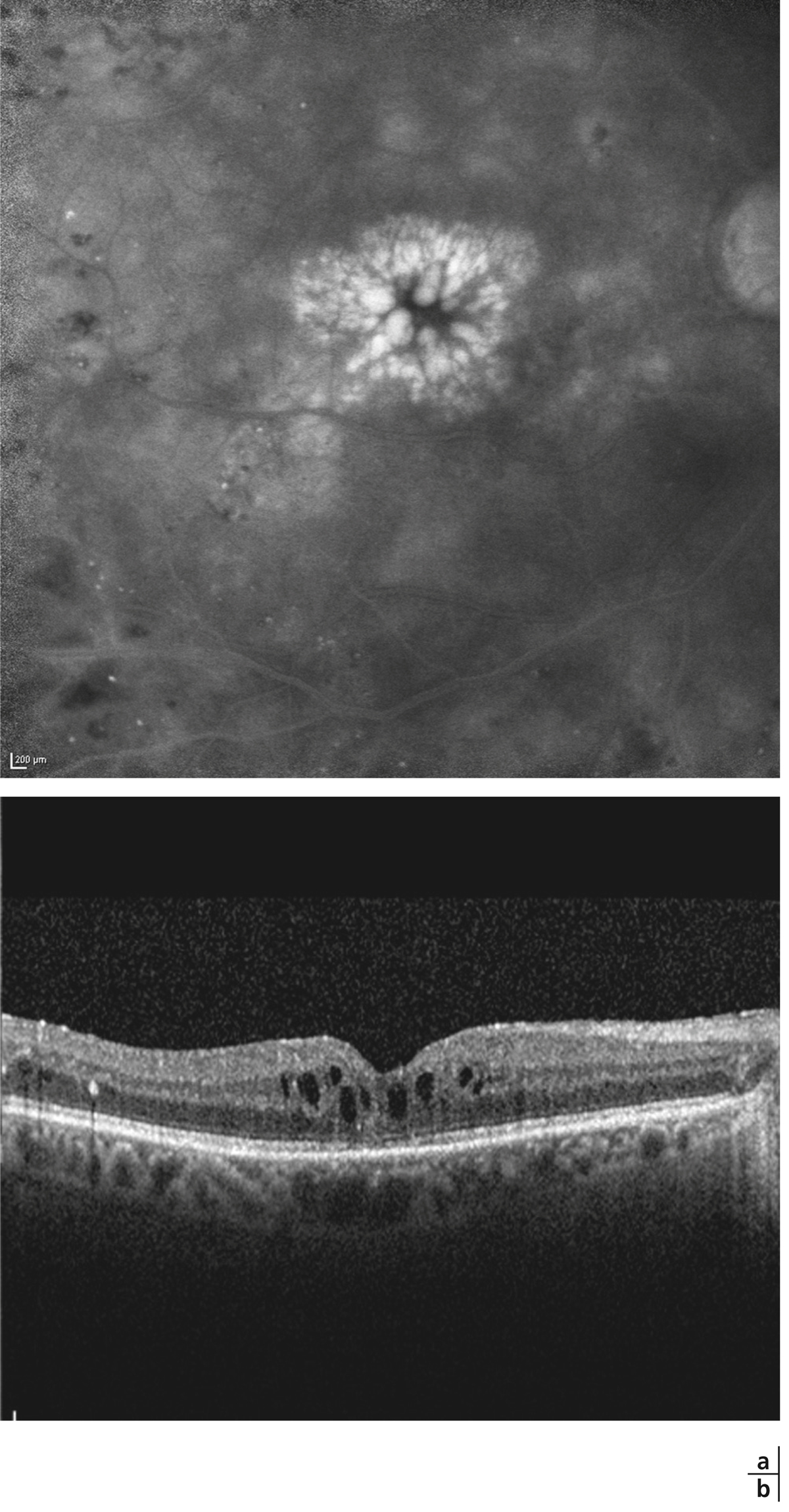
Fig. 5-59 Œdème maculaire cystoïde.
a. Remplissage des logettes par le colorant. b. OCT correspondant avec logettes bien visibles au niveau de la plexiforme externe.
Lors de l’analyse de l’image angiographique, les signes associés apportent des éléments étiologiques.
L’existence de micro-anévrismes est très évocatrice de diabète, mais n’en est pas spécifique ; le décompte et le turn-over des micro-anévrismes ont été utilisés comme méthode d’évaluation quantitative de la rétinopathie diabétique [10]. L’œdème focal est le plus souvent associé à des exsudats et des micro-anévrismes, plus ou moins volumineux, regroupés en amas, éventuellement associés a des pertes localisées de capillaires.
L’intérêt essentiel de l’angiographie n’est pas d’établir l’existence d’un œdème maculaire : l’OCT permet une évaluation aisée, facilement acceptée par le patient, sans risque d’intolérance. En revanche, l’angiographie reste l’examen incontournable pour apprécier la qualité de la perfusion maculaire, élément important de pronostic (voir fig. 5-46). L’agrandissement de la ZAC est associé à un pronostic visuel médiocre [11]. Toutefois, il est possible que prochainement, l’évaluation de la perfusion se fasse essentiellement par l’angio-OCT. La méthode, à l’heure où nous écrivons, n’est pas encore généralisée, mais elle permet une analyse de la perfusion sur les différentes couches de capillaires maculaires, ce que l’angiographie à la fluorescéine ne permet pas ; on peut donc prévoir une généralisation des examens d’angio-OCT dans l’évaluation de la perfusion, en particulier de la région maculaire (voir chapitre 8.4).
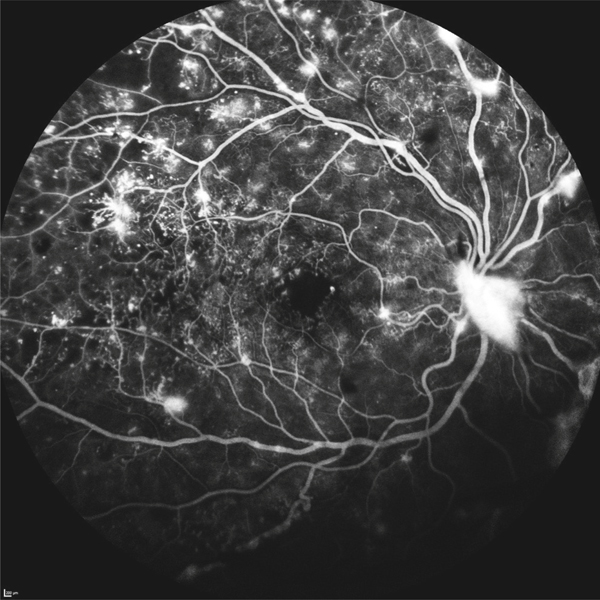
Fig. 5-60 Rétinopathie diabétique proliférante sévère.
Nombreux néovaisseaux prérétiniens et néovaisseaux prépapillaires de grande taille à l’origine d’une diffusion intense de fluorescéine. On observe de nombreux territoires de non-perfusion, notamment en temporal du pôle postérieur, bordés d’AMIR, et une irrégularité du calibre des veines, témoignant d’une ischémie rétinienne sévère. Il existe une rupture de la maille capillaire anastomotique, avec un agrandissement de la ZAC.
L’angiographie en fluorescence permet d’analyser la morphologie du lit capillaire maculaire et périphérique à la recherche de zones de non-perfusion, elle visualise la morphologie des gros vaisseaux mais surtout elle est le seul examen qui permet d’analyser la dynamique de la circulation rétinienne : temps « bras–rétine », temps de retour veineux, temps de remplissage veineux, analyse du courant laminaire, perturbation hémodynamique avec rupture du courant laminaire au niveau d’un croisement, analyse des circulations anastomotiques et des suppléances. L’œdème maculaire est lié à la zone d’atteinte du lit capillaire qui dépend du siège de l’occlusion vasculaire. L’angiographie permet aussi d’évaluer la dilatation vasculaire et les diffusions sur la papille (voir chapitre 9.4).
L’angiographie est un élément caractéristique de l’affection [12]. On observe souvent une dilatation des capillaires périfovéolaires sur les temps précoces de l’examen ; la diffusion du colorant peut être précoce et abondante aboutissant à la coloration de logettes en pétales de fleur ; il s y associe habituellement des diffusions sur la papille (fig. 5-61 et voir fig. 5-44 ; voir chapitre 11.2).
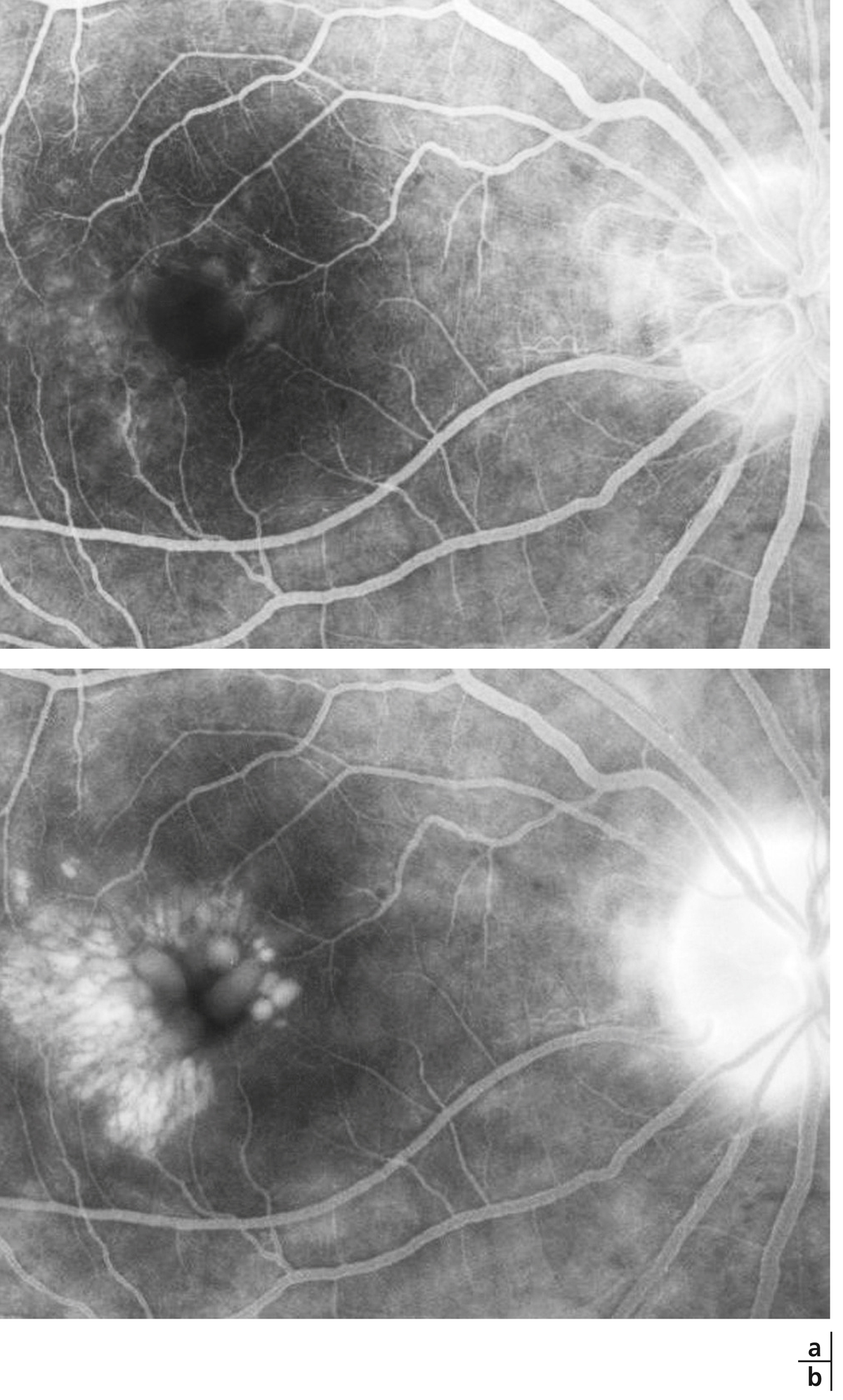
Fig. 5-61 Syndrome d’Irvine-Gass.
Patient de 65 ans. a. 8 semaines après chirurgie de la cataracte ; temps précoce, 22 secondes après injection : dilatation des capillaires périfovéolaires avec diffusion précoce ; dilatation des capillaires épipapillaires. b. Temps tardif, 5 minutes après injection : œdème cystoïde avec logette centrale, hyperfluorescence papillaire.
Des signes de vasculites rétiniennes sont associés aux diffusions tardives qui identifient l’œdème maculaire. Les vasculites rétiniennes sont caractérisées par la coloration localisée des parois veineuses siégeant le plus souvent en moyenne périphérie. L’examen permet aussi de mettre en évidence des occlusions vasculaires avec des images en « épingle à cheveux » ainsi que des zones de non-perfusion ; il est aussi possible de reconnaître des néovaisseaux prérétiniens ou prépapillaires (voir chapitre 10.4).
Lorsqu’il existe un œdème rétinien, l’aspect angiographique n’apporte pas d’élément spécifique, ce sont les clichés en lumière monochromatique, notamment en lumière bleue, qui apporteront des éléments diagnostiques dans le bilan photographique (voir chapitre 13.2).
L’aspect angiographique est le plus souvent caractéristique associant des dilatations du lit capillaire prédominant souvent dans la région temporomaculaire et des diffusions progressives du colorant pouvant prendre un aspect cystoïde ; l’examen angiographique recherchera des anomalies localisées de la périphérie rétinienne permettant de classer la forme clinique (fig. 5-62 ; voir chapitre 14.5).
Fig. 5-62 Télangiectasies maculaires de type 1 avec œdème maculaire.
a. Temps précoce. a. Diffusion du colorant à partir des télangiectasies.
L’angiographie en fluorescence est un examen indispensable dans l’évaluation de la DMLA ; son intérêt essentiel est la mise en évidence des néovaisseaux choroïdiens et des anomalies associées, notamment les décollements de l’épithélium pigmentaire. La généralisation de la pratique de l’OCT fait que l’angiographie n’est plus la seule et unique méthode d’évaluation dans la DMLA (voir chapitre 12.1).
Les angiographies dites « grand champ » ou « ultra-grand champ » améliorent la qualité de l’analyse de la périphérie rétinienne sur un champ de 102° avec la lentille grand angle du SLO (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne) ou de 200° avec le système Optomap panoramic P200Tx® (Optos, Écosse) [13]. Ces appareils permettront probablement de mieux caractériser l’ischémie rétinienne périphérique, jusque-là limitée à l’analyse faite par un examen par montage, autorisant un champ de visualisation de 75° (fig. 5-63) [14].
Fig. 5-63 Imagerie grand champ Optos® : rétinopathie diabétique proliférante.
La non-perfusion périphérique est bien visible, jusqu’en extrême périphérie, notamment au niveau de la rétine nasale.
[1] Cohen SY, Weber M, Oubraham H, et al. Imaging in retina units : changes observed during the last 12 years. Eur J Ophthalmol 2014 ; 24 : 216-20.
[2] Cunha-Vaz JG, Travassos A. Breakdown of the blood retinal barriers and cystoid macular edema. Surv Ophthalmol 1984 ; 28 : 485-92.
[3] Kohner EM, Hendkind P. Correlation of fluorescein angiogram and retinal digest in diabetic retinopathy. Am J Ophthalmol 1970 ; 69 : 403-14.
[4] Coscas G, Dhermy P. Occlusions veineuses rétiniennes. Rapport Société française d’ophtalmologie. Paris : Masson ; 1978, 484 p.
[5] Yannuzzi LA, Rohrer KJ, Tinder LJ, et al. Fluorescein angiography complications. Surv Ophthalmology 1986 ; 93 : 611-7.
[6] Staurenghi G, Invernizzi A, et al. Angiographie à la fluorescéine. In : Coscas G. Œdèmes maculaires. Aspect cliniques et thérapeutiques. Paris : Springer-Verlag France ; 2011, p. 27-43.
[7] Richard G, Soubrane G, Yannuzzi LA, Fluorescein and ICG angiography. 2nd ed. NewYork : Thieme ; 1998, p. 15-6.
[8] Guyer D, Yannuzzi LA, Chang S, et al. Retina-vitreous-Macula. 1st ed. Philadelphia : Saunders ; 1999, p. 240-4.
[9] Johnson MW. Etiology and treatment of macular edema. Am J Ophthalmol 2009 ; 147 : 11-21.
[10] Baudoin C, Lay B, Klein J. Automatic detection of microaneurysms in diabetic fluorescein angiography. Rev Epidémiol Sante Publique 1983 ; 32 : 254-61.
[11] Antonetti DA, Lieth E, Barber AJ, Gardner TW. Molecular mechanisms of vascular permeability in diabetic retinopathy. Semin Ophthalmol 1999 ; 14 : 240-8.
[12] Gass JDM, Norton EW. Fluorescein studies of patients with macular edema and papilledema following cataract extraction. Trans Am Ophthalmol Soc 1996 ; 64 : 232-49.
[13] Witmer MT, Parlitsis G, Patel S, Kiss S. Comparison of ultra-widefield fluorescein angiography with the Heidelberg Spectralis® noncontact ultra-widefield module versus the Optos® Optomap®. Clin Ophthalmol 2013 ; 7 : 389-94.
[14] Parlitsis GJ, Aaker GD, Wessel MM, et al. Ultra-widefield angiography improves the detection and classification of retinal vascular occlusions. Invest Ophthalmol Vis Sci 2010 ; abstract 287.
G. Querques, V. Capuano, O. Semoun, E.H. Souied
➤ L’angiographie au vert d’indocyanine (angio-ICG) permet de s’affranchir de l’obstacle que constitue l’épithélium pigmentaire.
➤ Ses principales indications sont chez les sujets jeunes, la choriorétinopathie séreuse centrale (CRSC), la myopie forte et les maladies inflammatoires ; et chez les sujets âgés, la DMLA et les tumeurs choroïdiennes.
➤ L’imagerie multimodale est utile pour diagnostiquer une DMLA devant l’apparition d’un œdème maculaire chez un sujet âgé.
➤ Le vert d’indocyanine a permis de définir la classification des néovaisseaux dans la DMLA.
Le vert d’indocyanine ou indocyanine green (ICG) est un colorant qui présente des propriétés physico-chimiques particulières. Il s’agit d’une molécule à la fois hydrophile et hydrophobe. En raison de ses propriétés et de son spectre d’absorption et d’émission, l’ICG est devenu incontournable comme outil d’imagerie de la vascularisation choroïdienne depuis plus de 30 ans.
L’interprétation de cette imagerie repose en partie sur l’analyse fine de l’intensité de la fluorescence émise et de son évolution au cours de la séquence angiographique.
On distingue schématiquement trois temps successifs après l’injection de ce colorant :
-
le temps précoce (période s’étendant du moment de l’injection du colorant et jusqu’à 5 minutes) qui visualise le remplissage des artères choroïdiennes, suivi par les temps artérioveineux choroïdiens ;
-
le temps intermédiaire (entre 5 et 15 minutes après l’injection) : on peut observer dans certaines conditions pathologiques un remplissage dit « retardé » de structures vasculaires choroïdiennes ou au contraire une absence de fluorescence ;
-
le temps tardif (jusqu’à environ 1 heure après l’injection) : c’est la phase d’inversion de contraste, car la papille qui était hyperfluorescente jusque-là va apparaît noire. Dans des conditions pathologiques précises, le colorant peut imprégner certaines structures choroïdiennes.
Les clichés d’angio-ICG peuvent être réalisés par des rétinographes classiques ou en mode confocal à l’aide du SLO (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne). Dans ce dernier cas, cette acquisition peut se faire avec des objectifs capturant les 30° (fig. 5-64a, 5-65a à c, 5-66a à c et 5.67a à c), 55° (fig. 5-68a) ou 102° (fig. 5-68b et c, et fig. 5-69).
En France, l’ICG est proposé par les firmes pharmaceutiques, sous différents noms de spécialités. Depuis 2003, une formule sans iode a reçu l’autorisation de mise sur le marché. Ses indications sont :
-
chez les sujets jeunes : la choriorétinopathie séreuse centrale (CRSC), la myopie forte et les maladies inflammatoires ;
-
chez les personnes plus âgées : essentiellement la DMLA et ses formes frontières comme la vasculopathie polypoïdale idiopathique (VPI) et les tumeurs choroïdiennes [1–3].
Le tableau 5-6 montre les principaux signes ICG en fonction des étiologies.
Fig. 5-64 Stries angioïdes chez un sujet jeune.
Angiographie ICG (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne, objectif 30°) d’un sujet jeune ayant une complication néovasculaire associée aux stries angioïdes. On observe une hyperfluorescence de cette lésion dès les temps intermédiaires (a). En OCT, des kystes intrarétiniens de grande taille sont visibles (b).
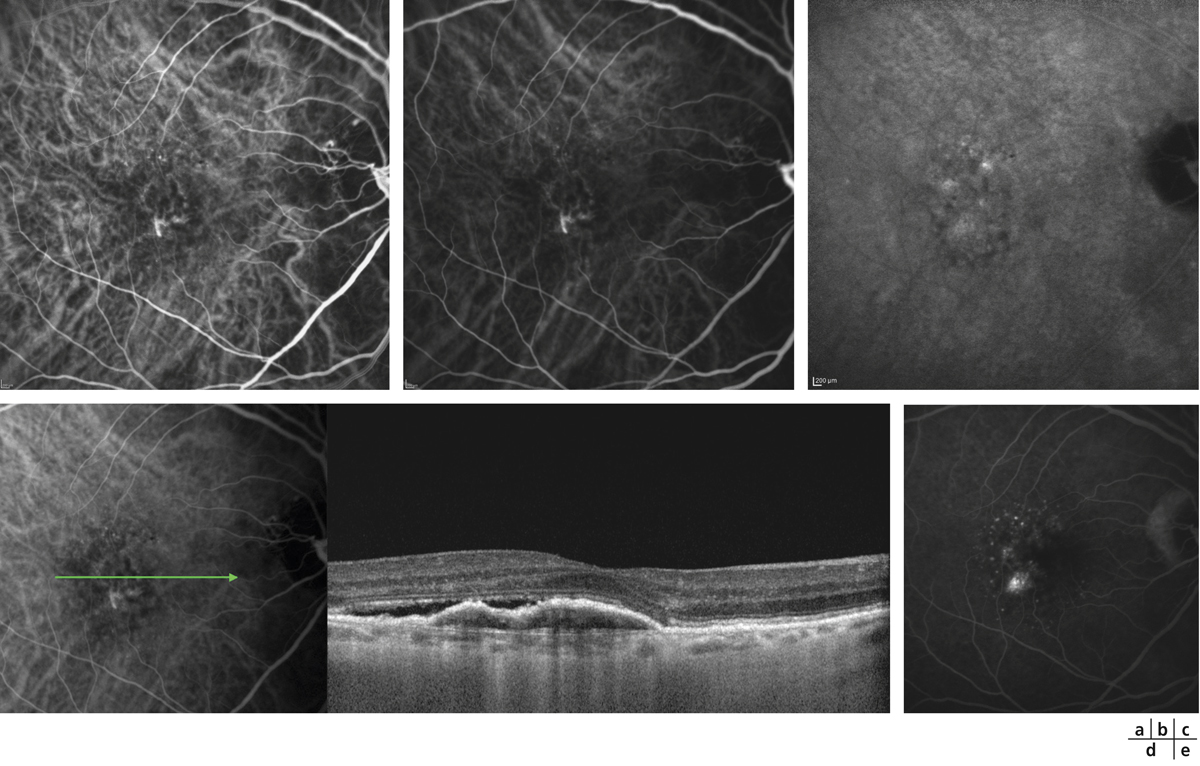
Fig. 5-65 Néovaisseaux occultes chez un sujet âgé.
Angiographie ICG (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne, objectif 30°) chez un sujet âgé ayant des néovaisseaux occultes (type 1). On observe une lésion hyperfluorescente aux temps précoces (a) et intermédiaires (b), suivie par une imprégnation aux temps tardifs (c). L’OCT confirme le caractère exsudatif par la présence d’une DSR (d). À noter l’aspect en pin points de l’angiographie à la fluorescéine (e).
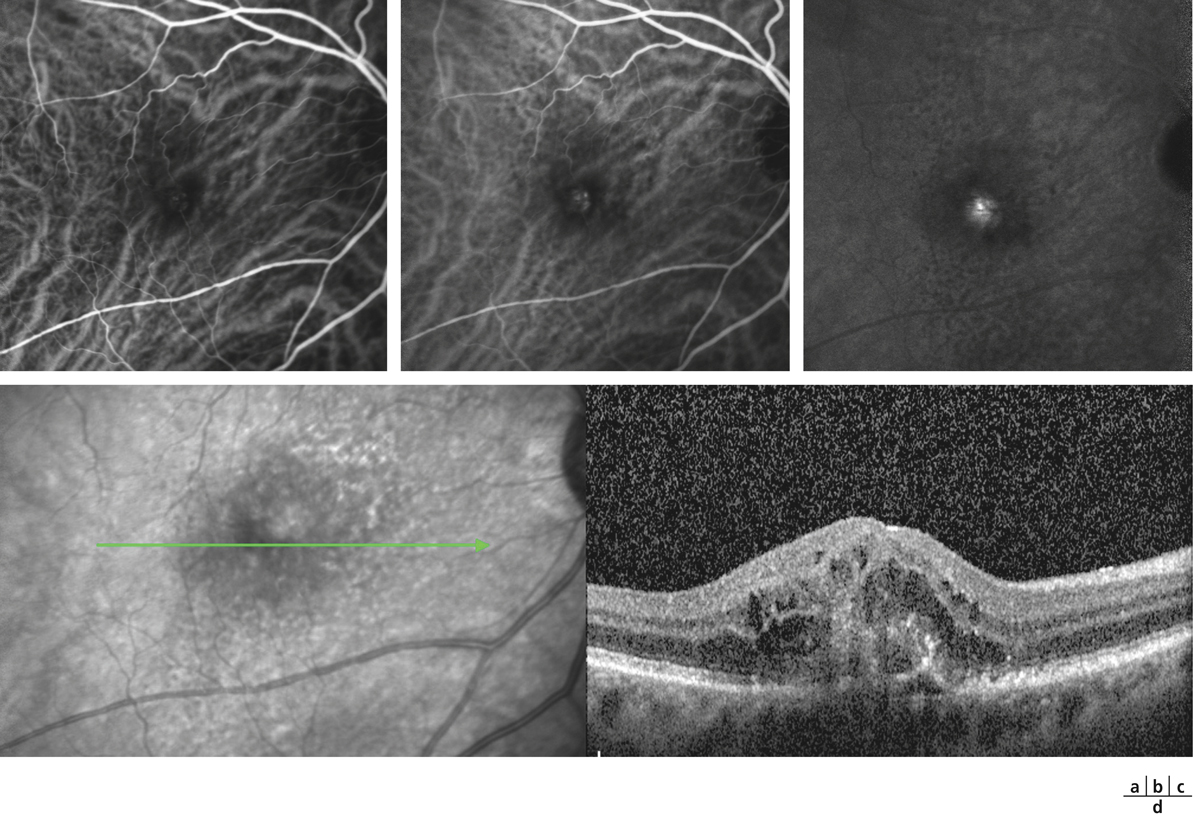
Fig. 5-66 Anastomose choriorétinienne chez un sujet âgé.
Angiographie ICG (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne, objectif 30°) chez un sujet présentant une anastomose choriorétinienne (type 3). Temps précoce (a). Une hyperfluorescence focale est visible dès les temps intermédiaires (b) et aux temps tardifs (c). L’OCT confirme le caractère exsudatif avec un kissing sign (d).
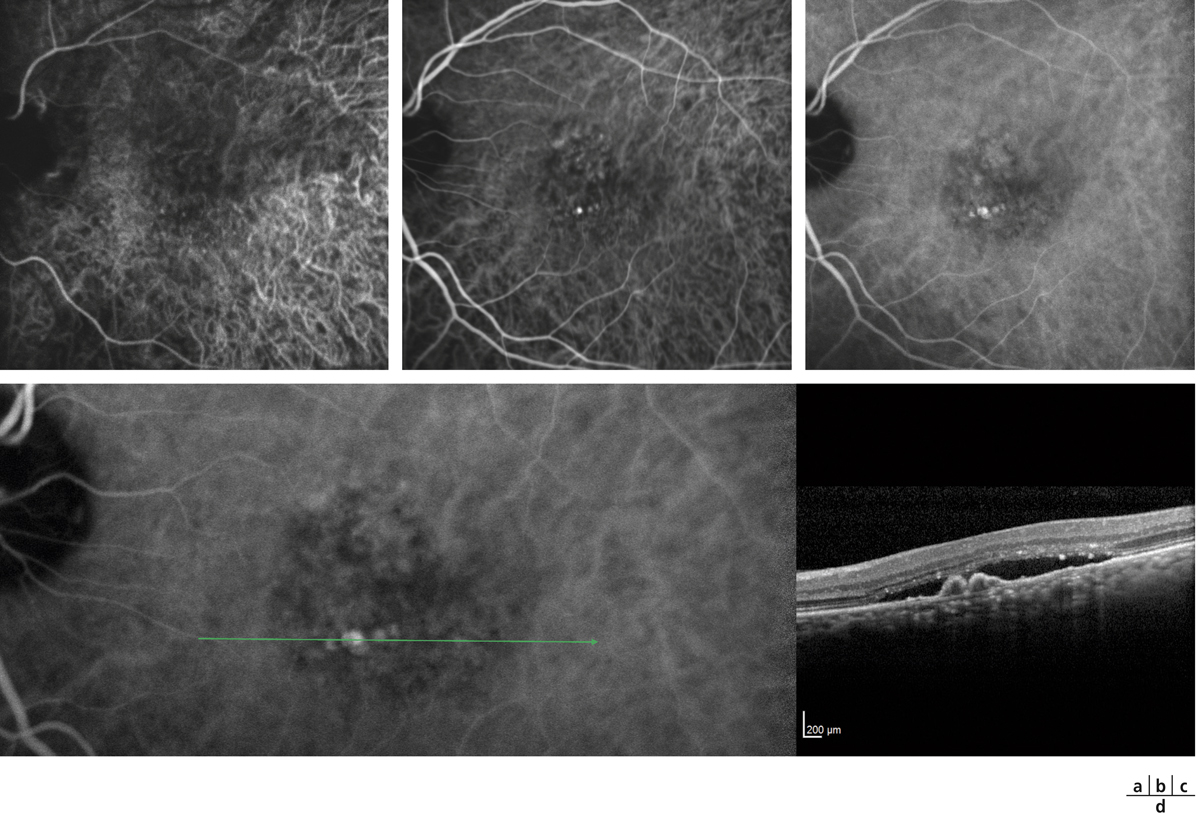
Fig. 5-67 Vasculopathie polypoïdale idiopathique chez un sujet âgé.
Angiographie ICG (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne) d’un sujet âgé ayant une vasculopathie polypoïdale idiopathique (a). En ICG, on note des hyperfluorescences « polypoïdales » à partir des temps intermédiaires (b, c). En OCT, on observe typiquement des décollements de l’EP parfois associés à un DSR de moyenne et grande taille (d).
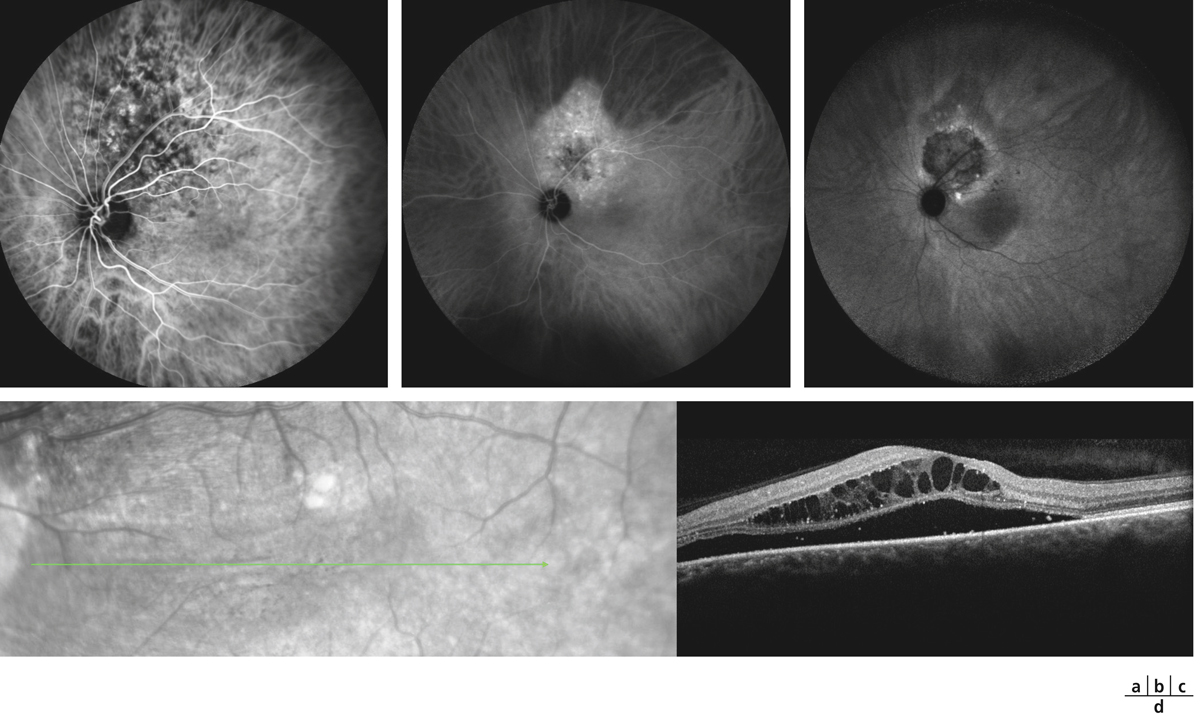
Fig. 5-68 Hémangiome choroïdien.
Angiographie ICG (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne) d’un patient atteint d’un hémangiome choroïdien. Aspect de remplissage progressif (a, objectif 55°) jusqu’au temps intermédiaire (b, objectif 102°) suivi par une hypofluorescence aux temps tardifs (c, objectif 102°) liée au wash-out pathognomonique de la lésion. En OCT, on observe des kystes intrarétiniens volumineux et un décollement séreux de la rétine (d).
Fig. 5-69 Imagerie ultra-grand champ chez un sujet normal.
Angiographie ICG avec un objectif sans contact « ultra-grand champ » 102° (Spectralis®, Heidelberg Engineering, Heidelberg, Allemagne). Ce module offre un grand champ sur une seule image, sans phénomène de distorsion même dans la zone périphérique rétinienne. Cet objectif permet de détecter et surveiller les modifications périphériques comme dans les vasculites ou des zones de non-perfusion. Ici, on observe les veines vortiqueuses chez un sujet normal (temps précoce) dans les quatre quadrants.
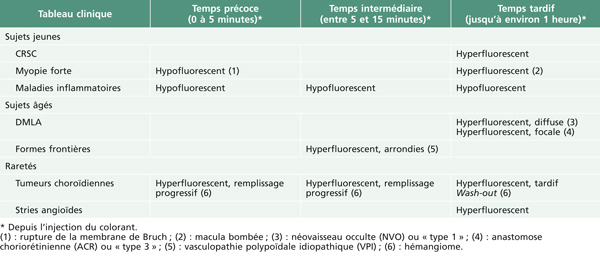
Tableau 5-6 Principaux signes ICG en fonction des étiologies.
La CRSC est une maladie qui peut se présenter sous la forme d’un œdème maculaire (OM) aigu avec décollement séreux rétinien (DSR). Elle peut parfois être associée à une hyperperméabilité des vaisseaux choroïdiens ainsi qu’à un épaississement choroïdien.
L’angiographie à la fluorescéine peut parfois montrer un ou plusieurs points de fuite. Le diagnostic est orienté par la présence de zones d’hyperfluorescence (et donc d’hyperperméabilité des vaisseaux choroïdiens) à l’ICG aux temps tardifs.
La myopie forte est la cause la plus fréquente de néovaisseaux chez les sujets jeunes. Il s’agit de structures pré-épithéliales sans signe à l’ICG. L’ICG est surtout intéressante pour le diagnostic de rupture de la membrane de Bruch matérialisée par une hyperfluorescence aux temps précoces. Ces zones de « fragilité » sont à haut risque de complication néovasculaire et nécessitent une surveillance rapprochée.
Parfois associée au syndrome de dysversion papillaire ou aux staphylomes myopiques, la « macula bombée » (dome-shaped macula) peut donner un OM et un DSR. L’ICG montre des zones d’hyperfluorescence similaires à celles observées dans les CRSC.
La recherche de foyers inflammatoires actifs ou de leurs séquelles est une excellente indication d’ICG. Les zones hypofluorescentes visibles sont liées à des anomalies de la séquence de remplissage des différentes couches choroïdiennes. L’analyse des caractéristiques de ces lésions (taille, topographie, modifications dans le temps, bilatéralisation) permet d’écarter certains diagnostics différentiels, tels que ceux liés à une non-perfusion choroïdienne (classiquement l’acute multifocal placoid pigment epitheliopathy [AMPPE]) ou bien associés à des infiltrations parfois granulomateuses (voir chapitre 10).
Les stries angioïdes avec ruptures de la membrane de Bruch associées à des calcifications sont une cause plus rare d’OM. Ces lésions sont hyperfluorescentes aux temps tardifs en ICG (voir fig. 5-64).
L’orientation diagnostique devant un OM chez un sujet plus âgé est plus complexe et nécessite plusieurs étapes. Les données de l’examen clinique et des différents examens complémentaires (angiographie à la fluorescéine, OCT et ICG) sont utiles. L’ICG peut constituer une aide précieuse. La priorité sera de savoir s’il s’agit d’une DMLA et d’en préciser la forme clinique.
Signalons que la classification des différents types de DMLA est établie sur la base des caractéristiques de l’hyperfluorescence aux temps tardifs de l’ICG : lorsqu’elle prend la forme d’une plaque tardive, on parle de néovaisseaux occultes (NVO) ou de « type 1 » (voir fig. 5-65), ce qui n’est pas le cas des néovaisseaux visibles (NVV) ou de « type 2 », même s’il existe des formes « mixtes ». Toutefois, un grand nombre d’études suggèrent que les résultats anatomiques, en termes de résorption d’OM, de taux de récidive et d’acuité visuelle finale sont similaires dans ces deux formes de néovaisseaux après traitement par anti-VEGF (voir fig. 5-65d, 5-66d et 5-67d). Cela explique en partie le moindre recours à l’ICG en pratique clinique quotidienne.
Le type 3, décrit initialement par Kuhn et al. [4] en 1995, correspond aux « anastomoses choriorétiniennes », caractérisées par leur aspect typique aux temps tardifs de l’ICG. Plusieurs explications physiopathologiques se sont succédé [5], mais l’hypothèse de Gass [6] en accord avec Freund [7] est celle de néovaisseaux d’origine choroïdienne s’étendant vers la neurorétine à la faveur d’une érosion de l’EP. Ces néovaisseaux de « type 3 » sont caractérisés par une hyperfluorescence focale en ICG à partir des temps intermédiaires (voir fig. 5-66).
Récemment, la description de néovaisseaux à développement intrarétinien débutant par une lésion hyper-réflective de la rétine externe en OCT, adhérente à un DEP sous-jacent, confirmé par l’angiographie à la fluorescéine et l’ICG a fait conclure à une origine simultanée du néovaisseau dans la rétine et « intradrusénoïde » après érosion de l’EP permettant la communication entre les deux secteurs [8].
Il existe également des OM compliquant une des « formes frontières » de DMLA, la vasculopathie polypoïdale idiopathique (VPI). Si certains aspects en OCT sont très évocateurs de VPI, l’ICG demeure néanmoins actuellement l’examen de référence pour mettre en évidence les dilatations polypoïdales. Ces dernières sont visibles à partir des temps intermédiaires sous la forme de zones hyperfluorescentes arrondies ou « polypes ». Typiquement, ces polypes sont localisés au voisinage de la papille, de façon non exclusive. Ils correspondent à des décollements de l’EP, parfois associés à des décollements séro-sanguins du neuro-épithélium, de moyenne ou de grande taille (voir fig. 5-67). Ils peuvent se compliquer d’hémorragies intra- ou sous-rétiniennes avec une acuité visuelle résiduelle souvent mauvaise. Tout comme dans les cas de CRSC auxquelles les polypes peuvent s’associer, les zones à traiter par la photodynamic therapy (PDT) sont déterminées par l’ICG [9].
Un OM peut être parfois lié à la présence d’une tumeur choroïdienne bénigne (hémangiome localisé) ou maligne (métastase tumorale, mélanome achrome). Le diagnostic de cette tumeur est fondé sur les résultats de l’examen du fond d’œil et des examens complémentaires (angiographie à la fluorescéine, ICG et échographie en B-scan). L’ICG garde son utilité pour confirmer un diagnostic d’hémangiome. On observe alors un remplissage progressif de la lésion jusqu’aux temps intermédiaires, suivi par un wash-out tardif avec une hypofluorescence pathognomonique de cette lésion (voir fig. 5-68).
[1] Desmettre T, Clerc B, Massol J, et al. Analysis of 379 drug prescriptions at a call Center 15. Presse Med 2011 ; 40 : e279-85.
[2] Cohen SY, Dubois L, Quentel G, Gaudric A. Is indocyanine green angiography still relevant ? Retina 2011 ; 31 : 209-21.
[3] Yannuzzi LA. Indocyanine green angiography : a perspective on use in the clinical setting. Am J Ophthalmol 2011 ; 151 : 745-51.e1.
[4] Kuhn D, Meunier I, Soubrane G, Coscas G. Imaging of chorioretinal anastomoses in vascularized retinal pigment epithelium detachments. Arch Ophthalmol 1995 ; 113 : 1392-8.
[5] Yannuzzi LA, Negrao S, Iida T, et al. Retinal angiomatous proliferation in age-related macular degeneration. Retina 2001 ; 21 : 416-34.
[6] Gass JD, Agarwal A, Lavina AM, Tawansy KA. Focal inner retinal hemorrhages in patients with drusen : an early sign of occult choroidal neovascularization and chorioretinal anastomosis. Retina 2003 ; 23 : 741-51.
[7] Freund KB, Ho IV, Barbazetto IA, et al. Type 3 neovascularization: the expanded spectrum of retinal angiomatous proliferation. Retina 2008 ; 28 : 201-11.
[8] Querques G, Souied EH, Freund KB. Multimodal imaging of early stage 1 type 3 neovascularization with simultaneous eye-tracked spectral-domain optical coherence tomography and high-speed real-time angiography. Retina 2013 ; 33 : 1881-7.
[9] Koh A, Lee WK, Chen LJ, et al. EVEREST study : efficacy and safety of verteporfin photodynamic therapy in combination with ranibizumab or alone versus ranibizumab monotherapy in patients with symptomatic macular polypoidal choroidal vasculopathy. Retina 2012 ; 32 : 1453-64.
M. Puech
➤ L’examen échographique apporte des éléments intéressants d’analyse de l’état vitréorétinien en cas de trouble des milieux.
➤ Cette imagerie explore la périphérie rétinienne et donne des informations sur l’état de l’interface vitréomaculaire et la présence d’un décollement postérieur du vitré.
➤ L’analyse de l’épaisseur et de l’échostructure de la paroi maculaire peut être intéressante quand l’OCT est mis en défaut.
➤ Le bilan des conséquences rétiniennes est très utile dans un contexte d’hémorragie intravitréenne non compliquée.
L’exploration échographique du globe oculaire en cas d’œdème maculaire prend toute sa place en cas de trouble des milieux ou de mauvais accès à la périphérie rétinienne.
Lorsque l’exploration du fond d’œil par les moyens optiques classiques (verres d’examen) ou les moyens d’imagerie par procédés optiques (OCT, rétinographie, etc.) ne permet pas de visualiser la région maculaire, l’échographie, grâce à sa capacité à traverser toutes les opacités oculaires, permet une imagerie en coupe avec une très bonne visualisation de l’épaisseur maculaire et des relations vitréorétiniennes. Les indications les plus courantes sont l’exploration de la macula derrière une hémorragie vitréenne ou l’analyse maculaire avant une intervention pour cataracte dense.
Parfois le recours à l’échographie peut être utile, même en cas de visualisation de la macula par les moyens optiques, dans le but d’analyser les relations vitréomaculaires.
L’utilisation de sondes de fréquences différentes permet d’allier une bonne pénétration des ultrasons à travers les tissus en augmentant la résolution lorsque la fréquence est plus élevée. Les sondes classiques d’exploration du pôle postérieur sont des sondes de 10 MHz focalisées à 22 ou 23 mm de façon à obtenir une meilleure résolution sur la région maculaire.
Les sondes de plus haute fréquence ont été d’abord développées par Charles Pavlin [1] avec des applications pour le segment antérieur. Le développement de sondes de 20 MHz focalisées sur le pôle postérieur [2, 3] a permis d’augmenter très nettement la résolution d’observation de la paroi postérieure notamment en cas d’épaississement maculaire (fig. 5-70).
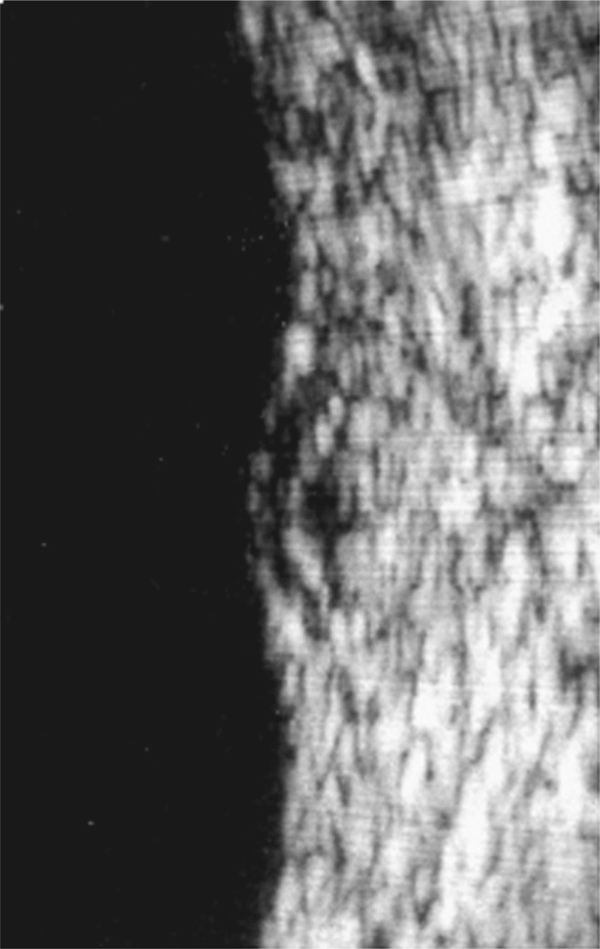
Fig. 5-70 Coupe maculaire verticale avec une sonde de 20 MHz d’un œdème maculaire associé à un décollement de l’épithélium pigmenté.
L’exploration du pôle postérieur par échographie commence par une exploration complète du segment postérieur en recoupant les informations données par les coupes dites « en champs » et par les coupes méridiennes. Après une exploration complète de la périphérie du globe, les coupes destinées à l’examen de la région maculaire peuvent aussi être des coupes complémentaires orthogonales à axe vertical puis horizontal :
-
les coupes verticales balayent le pôle postérieur de haut en bas avec inclinaison de la sonde de façon à passer alternativement sur la papille, puis en inter-papillo-maculaire, puis sur la région maculaire ; ce mouvement de va-et-vient se fait à gain élevé pour mieux visualiser les relations vitréorétiniennes, puis à gain plus faible pour mieux apprécier les détails de la paroi et notamment caractériser la présence d’un œdème maculaire soit diffus, soit avec présence de kystes intrarétiniens ;
-
les coupes horizontales ont l’avantage de pouvoir imager, sur une même coupe, la région maculaire et la papille donnant ainsi une image plus facilement parlante pour le suivi ultérieur.
L’exploration échographique, en cas d’œdème maculaire, peut apporter des informations précieuses sur deux éléments importants : les relations vitréomaculaires et l’analyse de l’épaisseur et de l’échostructure de la paroi maculaire.
L’apport de l’échographie pour analyser la rétine en cas d’œdème maculaire peut être utile pour juger des possibles interactions du vitré et de ses tractions sur la rétine centrale ou péricentrale mais aussi au niveau des vaisseaux temporaux [4].
L’échographie permet de diagnostiquer la présence ou l’absence du décollement postérieur du vitré : ce diagnostic est fait par visualisation de la hyaloïde postérieure qui apparaît comme une fine membrane moyennement échogène, mais qui peut être suivie jusqu’à son adhérence en périphérie rétinienne (fig. 5-71a). Cette hyaloïde postérieure est aussi caractérisée par sa dynamique lente au moment de la mobilisation du regard du patient en cours d’examen.
La présence ou l’absence d’un décollement vitréen en regard du pôle postérieur peuvent être observées en échographie de façon plus complète qu’en OCT dont la fenêtre de visualisation est réduite en antéropostérieur et en latéral.
L’échographie peut montrer un aspect d’anneaux prépapillaire flottant dans la cavité vitréenne signant le décollement du vitré au niveau de la papille mais qui s’accompagne le plus souvent du détachement vitréomaculaire.
L’absence de décollement vitréen au niveau maculaire est parfois plus difficile à affirmer en OCT et en échographie ; dans ces cas, l’analyse échographique de la périphérie permet d’identifier la hyaloïde postérieure décollée et de la suivre jusqu’au pôle postérieur.
Lorsque le vitré reste adhérent à la région maculaire, il peut s’agir d’une adhérence physiologique sans signe de traction maculaire, mais l’échographie permet aussi d’identifier la présence de brides de vitré dont l’adhérence maculaire entraîne des phénomènes mécaniques de traction soit tangentielle (fig. 5-71b), soit antéropostérieure.
Cette analyse est souvent utile en cas d’œdème maculaire dans le cadre d’une rétinopathie diabétique, d’une occlusion veineuse ou d’une membrane épirétinienne.
L’évolution des tractions vitréorétiniennes peut se compliquer de décollement de rétine tractionnel (fig. 5-72).
Fig. 5-71 Décollement postérieur du vitré avec hyaloïde postérieure se rattachant à la périphérie rétinienne (a) et aspect de traction vitréomaculaire tangentielle derrière une hémorragie intravitréenne (b).
Fig. 5-72 Traction vitréenne avec aspect de décollement de rétine tractionnel dit en « toile de tente » dans le cadre d’une rétinopathie diabétique.
L’échographie permet une image en coupe de la région maculaire avec la possibilité d’analyser le profil maculaire en incluant la visualisation d’un épaississement maculaire diffus ou localisé, plus ou moins associé à des logettes (fig. 5-73). Le rôle de l’échographie sera surtout un rôle diagnostique avec mise en évidence d’un épaississement maculaire [5] derrière des opacités des milieux. L’examen par OCT, lorsque la transparence des milieux le permet, reste un outil plus précis pour l’analyse sémiologique fine. Ainsi, un œdème maculaire cystoïde peut être identifié derrière une hyalite grâce à l’échographie de 20 MHz avec visualisation des logettes intrarétiniennes (fig. 5-74) ou derrière une cataracte dense en association à une membrane épirétinienne avec épaississement maculaire diffus (fig. 5-75).
L’échographie apporte un élément de bilan anatomique en cas de perte de transparence des milieux [6] avec la possibilité de révéler un œdème maculaire diffus ou localisé plus ou moins associé à des signes plus complexes. L’examen échographique pourra soit pousser à une décision thérapeutique urgente (par exemple en cas de découverte d’un décollement rétinien [7]), soit s’inscrire dans une démarche de surveillance évolutive (par exemple dans le suivi de résorption des hémorragies vitréennes).
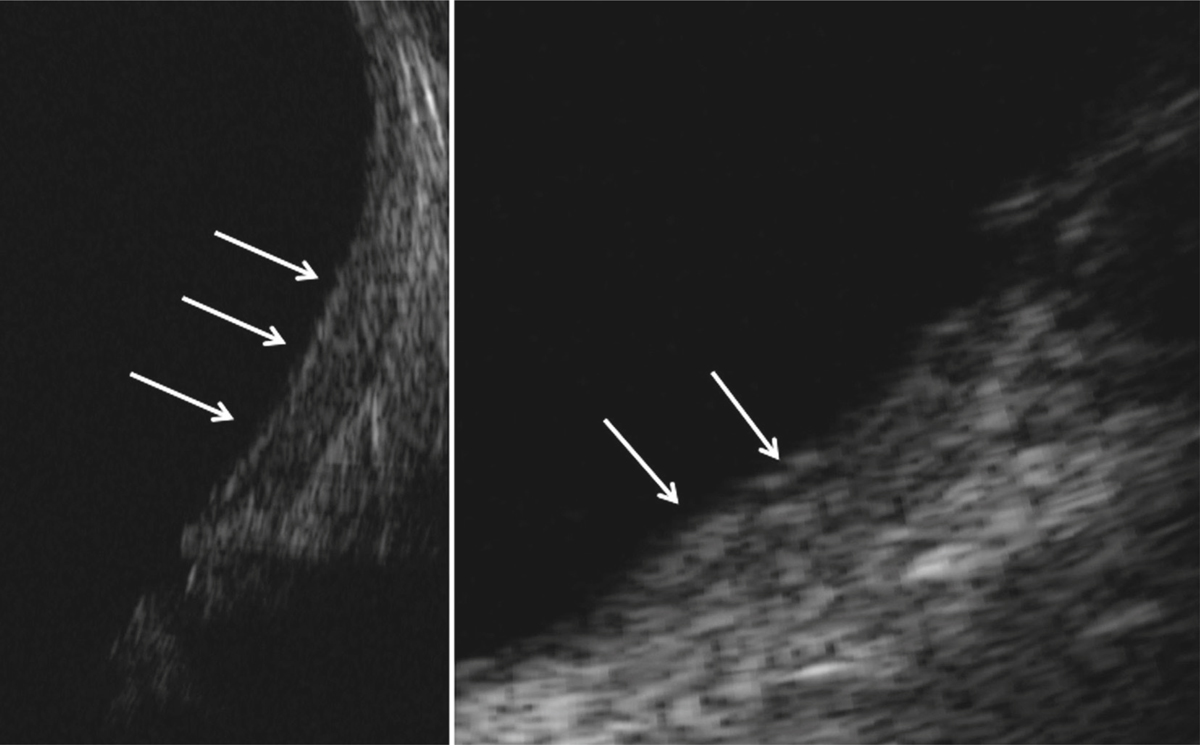
Fig. 5-73 Coupe maculaire en échographie de 10 MHz avec œdème maculaire diffus donnant un épaississement modéré (à gauche) et une zone d’épaississement assez échogène plus localisé avec OMC (à droite).
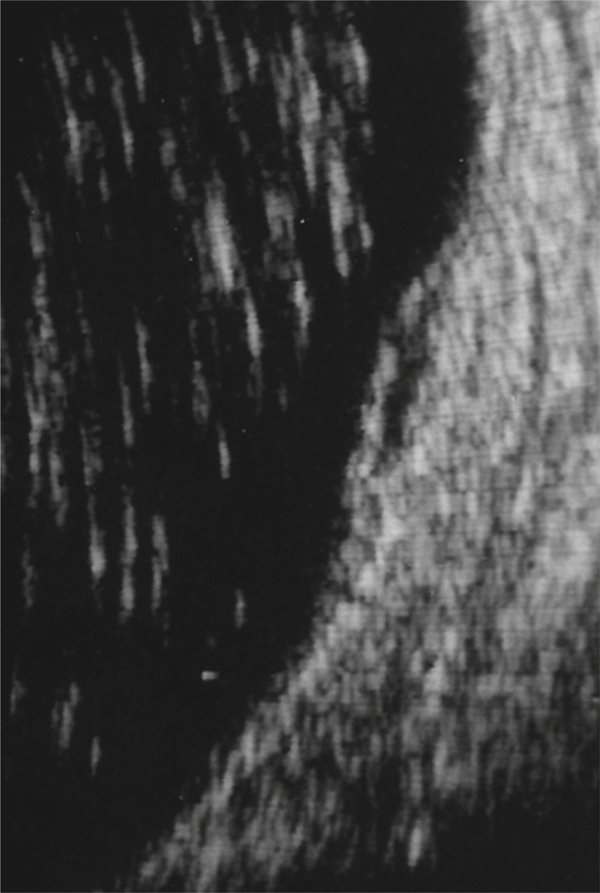
Fig. 5-74 Image en coupe avec une sonde de 20 MHz mettant en évidence l’épaississement maculaire avec présence de logettes d’OMC.
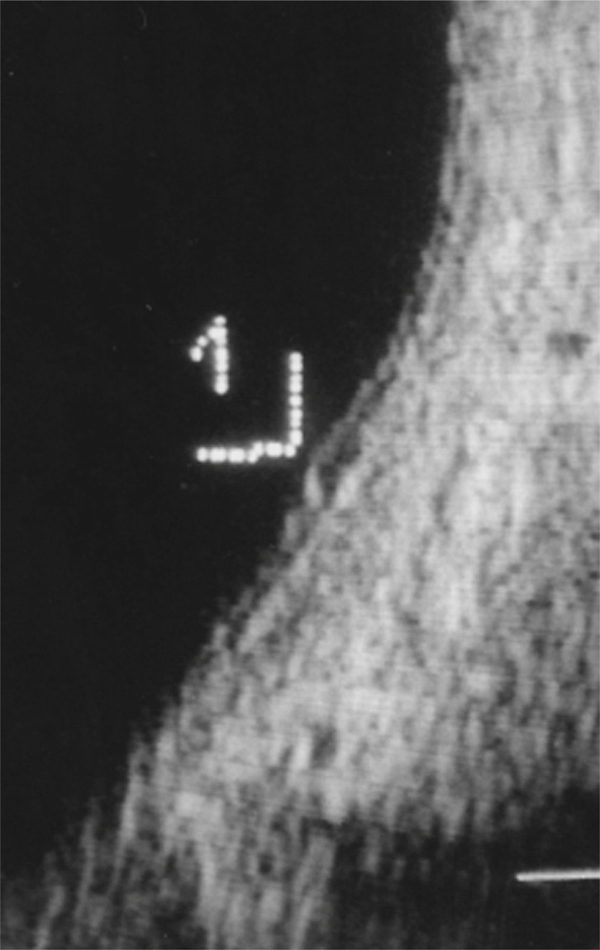
Fig. 5-75 Coupe maculaire en sonde de 20 MHz avec présence d’un « dédoublement maculaire » par présence d’une membrane épimaculaire et œdème rétinien diffus.
[1] Pavlin CJ, Harasiewicz K, Sherar MD, Foster FS. Clinical use of ultrasound biomicroscopy. Ophthalmology 1991 ; 98 : 287-95.
[2] Hewick SA, Fairhead AC, Culy JC, Atta HR. A comparison of 10 MHz and 20 MHz ultrasound probes in imaging the eye and orbit. Br J Ophthalmol 2004 ; 88 : 551-5.
[3] Coleman DJ, Silverman RH, Chabi A, et al. High-resolution ultrasonic imaging of the posterior segment. Ophthalmology 2004 ; 111 : 1344-51.
[4] Zvornicanin J, Jusufovic V, Cabric E, et al. Significance of ultrasonography in evaluation of vitreo-retinal pathologies. Med Arch 2012 ; 66 : 318-20.
[5] Colangelo L, Mancini A, Lobefalo L, et al. Echobiometry of the ocular layers at the posterior pole. Ophthalmologica 1998 ; 212 : 27-9.
[6] Lindgren G, Lindblom B. Causes of vitreous hemorrhage. Curr Opin Ophthalmol 1996 ; 7 : 13-9.
[7] Capeans C, Santos L, Touriño R, et al. Ocular echography in the prognosis of vitreous haemorrhage in type II diabetes mellitus. Int Ophthalmol 1997 ; 21 : 269-75.
A. Erginay, D. Gaucher
➤ La tomograpgie en cohérence optique (optical coherence tomography [OCT]) permet d’obtenir des images de haute résolution de la rétine.
➤ Le spectral-domain optical coherence tomography (SD-OCT) permet une meilleure visualisation des modifications intra- et extrarétiniennes et de l’interface rétinovitréenne.
➤ Le SD-OCT permet de redéfinir la terminologie en se rapprochant des connaissances histologiques et analyse particulièrement bien l’interface vitréomaculaire.
➤ Le module enhanced depth imaging–optical coherence tomography (EDI-OCT) permet la visualisation et la mesure des couches choroïdiennes.
➤ Le swept-source OCT a une vitesse d’acquisition supérieure aux SD-OCT mais une résolution inférieure.
➤ L’analyse de l’OCT permet de caractériser l’œdème par la mesure de l’épaississement rétinien, la perte de la dépression fovéolaire, la présence de logettes kystiques ou d’un décollement séreux rétinien, et ce de façon évolutive.
➤ Les valeurs normales de l’épaisseur maculaire sont différentes d’un appareil à l’autre, car les lignes de référence de mesure de l’épaisseur maculaire varient selon les appareils.
➤ Avant la réalisation d’une cartographie maculaire, il faut s’assurer de l’absence d’artefacts induite par la mesure automatique.
La tomographie en cohérence optique (optical coherence tomography [OCT]) est une technique d’imagerie rétinienne non invasive qui permet d’obtenir in vivo des images de haute résolution, en coupe antéropostérieure, des microstructures de la rétine et de l’interface vitréorétinienne. La technique a été décrite pour la première fois en 1991 [1]. La première génération d’OCT (OCT 1 ou System 2000®, Humphrey Instruments, Inc.) a été commercialisée en 1996. Les deuxième et troisième générations ont suivi, 3 et 6 ans plus tard (OCT 2 en 1999 et Stratus OCT 3000®, Carl Zeiss, Meditec, Allemagne en 2002). Le fonctionnement de cette première génération d’OCT, dit time-domain optical coherence tomography (TD-OCT), ressemble à une échographie réalisée non pas avec des ultrasons, mais avec un faisceau laser produit par une interférométrie à basse cohérence. Dans ce système, une lumière, produite par une diode superluminescente, est divisée en deux faisceaux par un miroir semi-réfléchissant : le faisceau de référence et le faisceau d’examen. Le premier faisceau a un trajet connu : il se réfléchit sur un miroir mobile. Le deuxième, dirigé vers l’œil, se réfléchit sur la rétine. Les deux faisceaux réfléchis arrivent simultanément sur un détecteur et créent un signal d’interférence dont l’amplitude peut être mesurée (fig. 5-76). Le déplacement mécanique du miroir mobile d’arrière en avant permet d’obtenir une distance de parcours équivalente pour les deux signaux qui peuvent entrer en résonance et créer une interférence. L’analyse de cette interférence permet de déterminer la réflectivité des couches rétiniennes en un point, au cours d’une acquisition de type A-scan : plus le signal rétinien réfléchi est important, plus l’interférence au signal de référence sera importante. La multiplication des A-scans permet d’obtenir un profil de réflectivité maculaire sur une distance déterminée. L’image obtenue s’apparente alors à une coupe histologique mais ne doit pas y être assimilée, car la réflectivité des couches rétiniennes dépend de nombreux facteurs (biréfringence, dispersion, réflexion et focalisation du signal). Ainsi, toute anomalie de composition ou de morphologie d’une structure rétinienne peut se traduire par un changement de sa réflectivité. La vitesse d’acquisition est d’environ 250 à 400 A-scans par seconde. Une coupe antéropostérieur ou B-scan est constituée par différentes séquences d’A-scan (100 en OCT 1 et 2 et 512 en Stratus®). La résolution du Stratus® est de l’ordre de 7 à 10 μm et varie de façon inversement proportionnelle à la taille des coupes.
En 2006, une nouvelle génération d’appareil utilisant un spectromètre à la place de l’interféromètre, dit spectral-domain optical coherence tomography (SD-OCT) ou « Fourier domain », est arrivée sur le marché. Grâce à l’utilisation d’un spectromètre, le signal cible est décomposé en une multitude de longueurs d’onde. Un calcul mathématique (décomposée de Fourrier) permet pour chaque onde d’obtenir la localisation du point réflecteur (grâce à la période de l’onde) et sa réflectivité (grâce à l’amplitude de l’onde). Ce système permet donc de localiser et caractériser la réflectivité d’un grand nombre de signaux réfléchis sur la rétine, sans mouvement d’un miroir de référence (fig. 5-77). Cela permet une augmentation de la vitesse d’acquisition des images de 25 000 à 75 000 A-scans/seconde, et donne une excellente qualité de l’image en diminuant les artefacts dus aux mouvements de l’œil. La résolution longitudinale de ces appareils se situe entre 4 et 6 μm. Grâce à l’amélioration de la résolution et de la vitesse d’acquisition, le SD-OCT permet une meilleure visualisation des modifications intra- et extrarétiniennes (limitante interne, cavités cystoïdes, exsudats lipidiques, jonction de segments externes–internes des photorécepteurs, épithélium pigmentaire, décollement fovéolaire) et de l’interface rétinovitréenne (limitante externe, hyaloïde, séparation vitréomaculaire, membrane épimaculaire, traction vitréomaculaire). Il permet également la multiplication du nombre de coupes et une reconstruction 3 D (50 à 256 coupes étagées). Les différentes lésions du fond d’œil sont repérées plus précisément. La mesure de l’épaisseur et la cartographie maculaire sont plus précises et sans interpolation.
Le SD-OCT donne des images en coupe de la macula avec un tel détail qu’il a été nécessaire de revisiter la nomenclature des termes utilisés, à la lumière des comparaisons entre l’OCT et les connaissances histologiques. Une des notions nouvelles de cette nomenclature porte sur ce qui était appelé la ligne de jonction des articles externes et internes des photos récepteurs (inner and outer segment junction line). Cette ligne hyper-réflective très visible appartient en fait totalement à l’article interne des photorécepteurs. Sa visibilité est due à la réfringence d’un amas de mitochondries appelé « ellipsoïde ». Le nouveau terme proposé est donc « zone ellipsoïde ». La zone d’interdigitation correspond à la zone où l’extrémité des articles externes des photorécepteurs se mêle aux villosités apicales des cellules de l’épithélium pigmentaire (fig. 5-78).
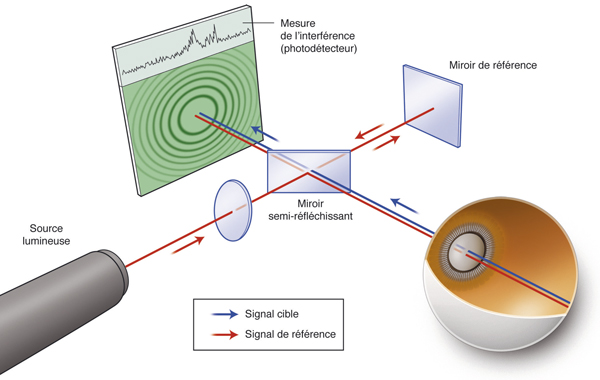
Fig. 5-76 Schéma du fonctionnement des TD-OCT.
La mobilité du miroir permet de créer des interférences entre un signal de référence et le signal venant de la rétine. Ces interférences permettent de calculer la réflectivité du tissu rétinien.
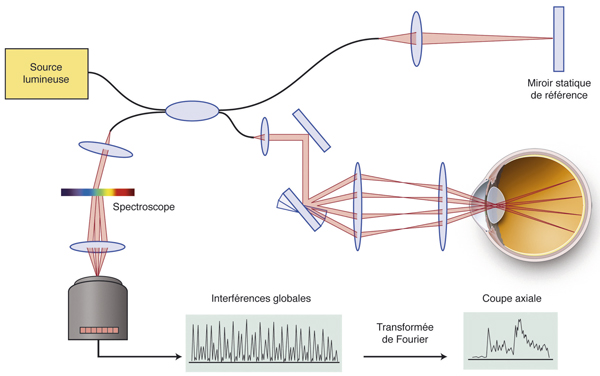
Fig. 5-77 Schéma de fonctionnement du SD-OCT.
Le miroir de référence n’est plus mobile, le signal issu de la rétine passe par un spectromètre, ce qui améliore la rapidité d’acquisition des données.
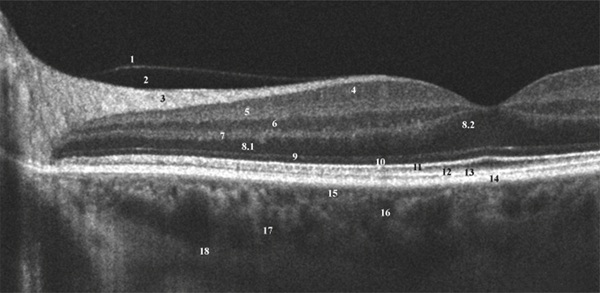
Fig. 5-78 Segmentation des couches rétiniennes de la macula d’un œil normal.
1 : cortex vitréen postérieur ; 2 : espace prérétinien ; 3 : couche des fibres optiques ; 4 : couche des cellules ganglionnaires ; 5 : couche plexiforme interne ; 6 : couche nucléaire interne ; 7 : couche plexiforme externe ; 8.1 : couche nucléaire externe ; 8.2 : couche des fibres de Henlé ; 9 : membrane limitante externe ; 10 : zone myoïde ; 11 : zone ellispoïde ; 12 : segments externes des photorécepteurs ; 13 : zone d’interdigitation ; 14 : complexe EP/membrane de Bruch ; 15 : choriocapillaire ; 16 : couche de Sattler ; 17 : couche de Haller ; 18 : jonction choroïdo-sclérale.
Les SD-OCT actuels offrent aussi d’autres outils d’imageries. L’OCT peut permettre de combiner de multiples procédés d’imagerie comme des clichés en couleurs, en autofluorescence, en angiographie à la fluorescéine ou au vert d’indocyanine. Les nouveaux modules optiques permettent l’examen en OCT du segment antérieur ou en ultra-grand champ. Les développements de logiciels et d’algorithmes offrent de nouvelles fonctions telles que l’EDI-OCT ou l’OCT « en face ».
Le module enhanced depth imaging–optical coherence tomography (EDI-OCT) a été développé pour améliorer la netteté de l’image en profondeur constituant une sorte de « mise au point » plus postérieure de l’OCT [2]. Elle permet la visualisation et la mesure des couches choroïdiennes. Actuellement, la plupart des machines sur le marché proposent ce module. Dans les œdèmes maculaires importants, ce module peut être utile car il permet une meilleure évaluation de l’état de l’épithélium pigmentaire et de la jonction segments externes–segments internes des photorécepteurs ou zone ellipsoïde (fig. 5-79). De plus, dans des maladies œdémateuses ou pseudo-œdémateuses comme dans la CRSC, la choroïde peut être anormale.
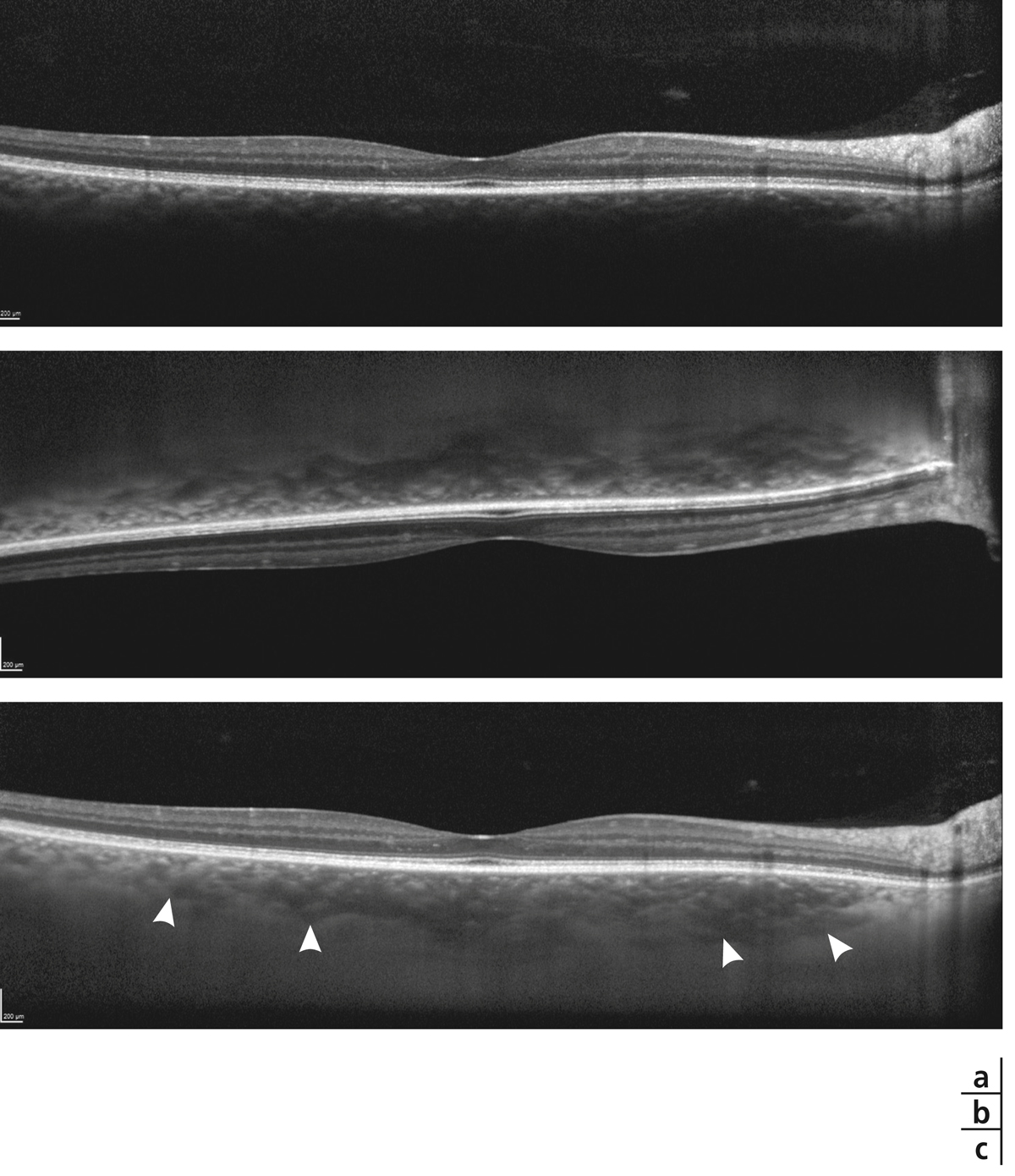
Fig. 5-79 Examen en mode EDI.
a. Coupe sans EDI d’un œil normal. b. Image inversée sans EDI obtenue en avançant l’OCT vers le patient. La choroïde est mieux visible. c. Image en mode EDI. La choroïde est bien visible et bien différenciée de la sclère (flèches).
Dans certains cas avec l’EDI-OCT, l’image de la surface interne de la rétine et de l’interface vitréorétinienne pourrait être moins bonne que celle de la choroïde. La technique du Combined depth imaging–optical coherence tomography (CDI-OCT) permet d’analyser l’ensemble de la rétine sur la même image. Il consiste à réaliser l’examen lors du moyennage, d’abord en mode normal, puis l’autre moitié en mode EDI (fig. 5-80).
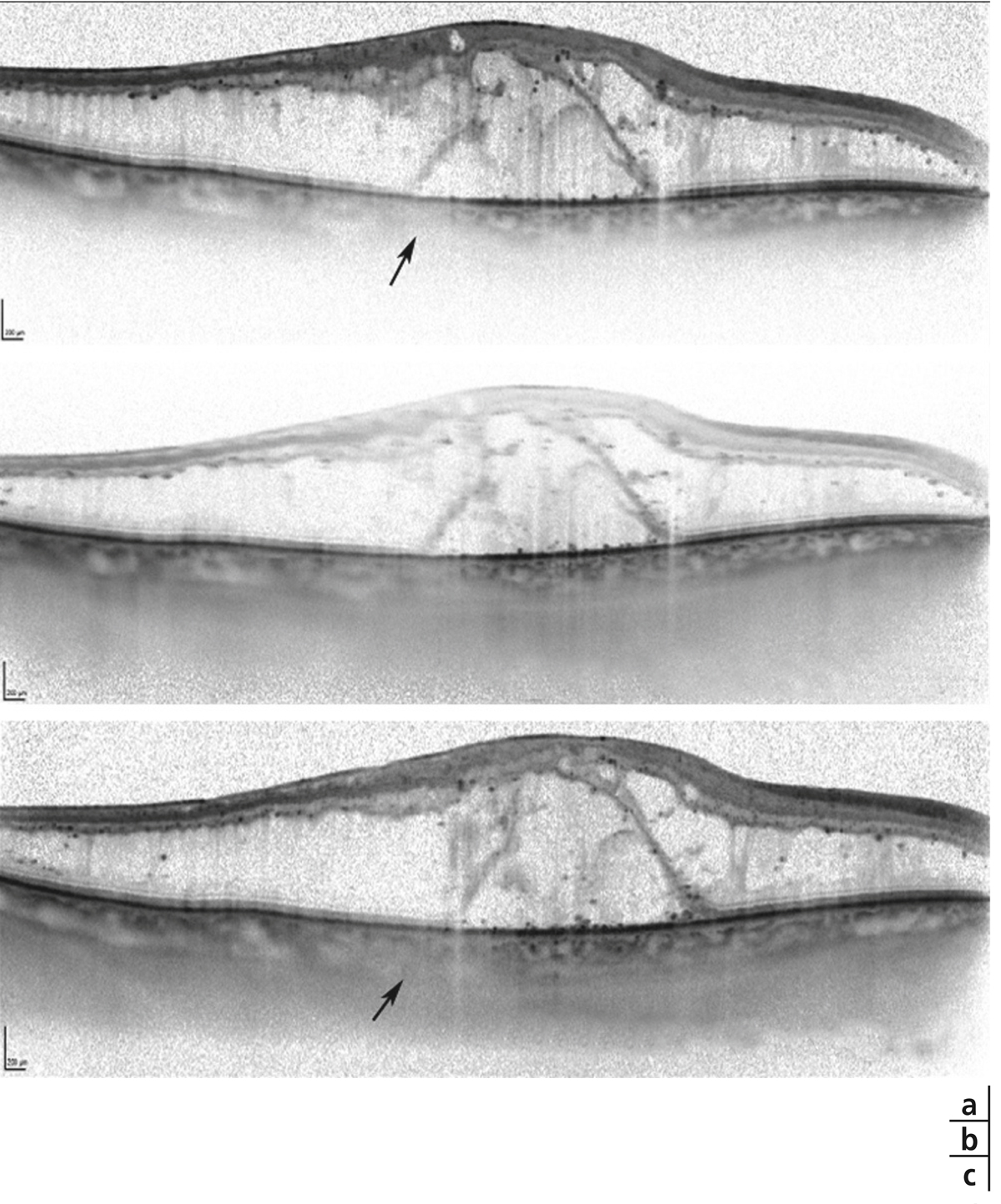
Fig. 5-80 Différences de visualisation des structures rétinochoroïdiennes selon la modalité d’acquisition des images en SD-OCT.
a. En acquisition standard, la rétine interne est bien contrastée mais les limites de la choroïde (flèche) et la ligne ellipsoïde sont peu précises par manque de contraste. b. En mode EDI, les couches internes sont plus contrastées et mieux visualisées mais les couches externes sont alors moins contrastées. c. On peut améliorer encore la qualité de la coupe maculaire en réalisant une acquisition combinée standard puis EDI sans arrêter la sommation. Le contraste est meilleur sur l’ensemble des couches rétiniennes, la limite de la choroïde est mieux vue (flèche).
L’OCT « en face » (voir aussi plus loin dans ce chapitre « OCT “en face” ») est une nouvelle approche d’imagerie en 3D. Grâce à une segmentation des couches rétiniennes, il permet d’obtenir des images transverses (C-scans ou frontales) de la rétine. Un algorithme de traitement d’images permet de mettre en évidence des néovaisseaux, des lésions vasculaires, des mailles fovéolaires anormales, de préciser l’extension de certaines lésions, etc. (fig. 5-81 et 5-82).
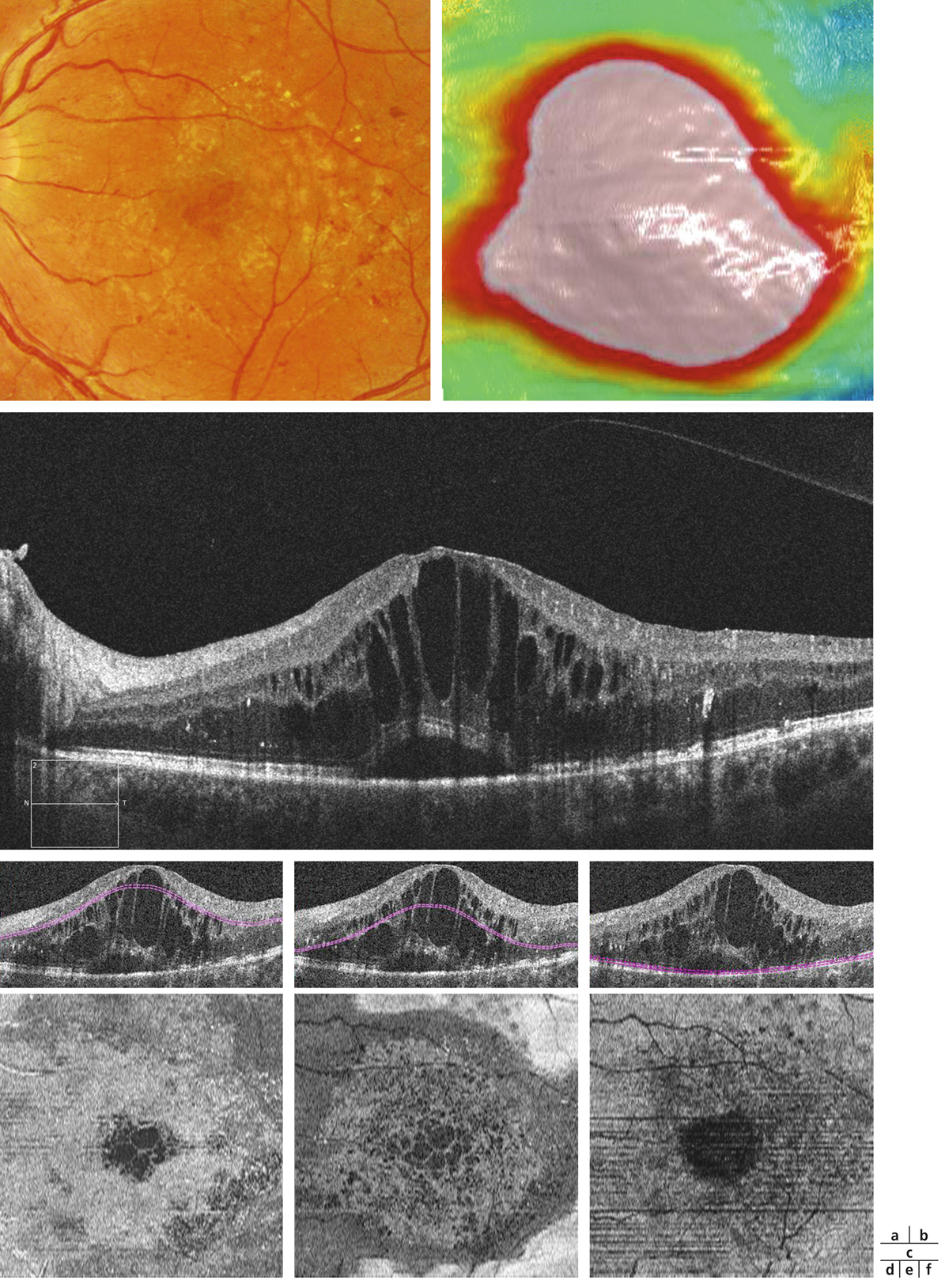
Fig. 5-81 Œdème maculaire diabétique vu en OCT « en face ».
a. Sur le cliché en couleurs du pôle postérieur de l’OG, on voit quelques rares hémorragies, des cicatrices de laser extrafovéolaires sans exsudats. b. La cartographie en 3D montre un OM sévère et saillant. c. La coupe maculaire de 9 mm montre un OMC, un décollement postérieur du vitré et un décollement séreux rétinien. d. La segmentation au niveau de la couche plexiforme interne montre bien les grosses logettes centrales. e. La segmentation au niveau de la couche plexiforme externe permet de voir de nombreux petits kystes qui recouvrent toute la surface maculaire. f. Enfin, la segmentation au niveau de la couche ellipsoïde permet de voir l’étendue du décollement séreux rétinien.
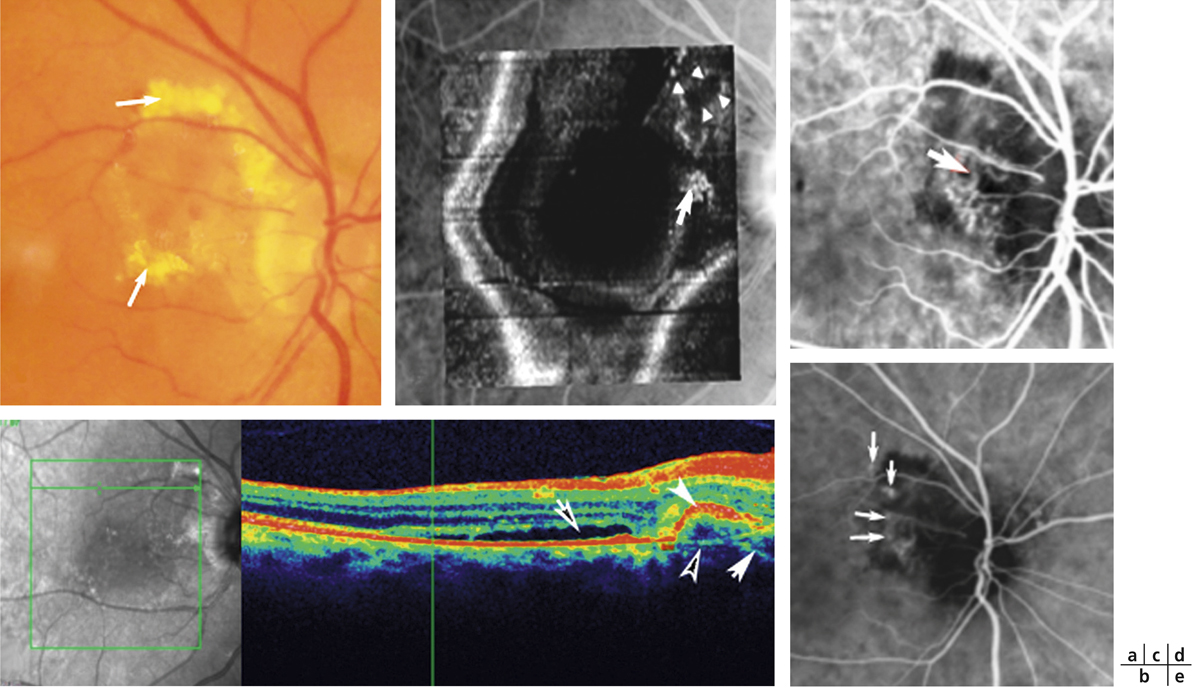
Fig. 5-82 Œdème maculaire associé à une vasculopathie polypoïdale.
a. On note une zone d’exsudation sur la photographie en couleurs du FO. b. L’OCT montre à ce niveau un décollement de l’épithélium pigmentaire (tête de flèche pleine) et un décollement séreux rétinien (flèche vide). On voit la membrane de Bruch tendue (tête de flèche pleine) et probablement le réseau vasculaire anastomotique (flèche pleine). c. L’OCT en face permet de confronter les données axiales et frontales : on visualise le décollement de l’épithélium pigmentaire (têtes de flèche) et également le réseau vasculaire anastomotique associé (flèche). L’ICG montre bien le réseau anastomotique (d) et les polypes (e).
Une nouvelle technologie angiographie-OCT (angio-OCT) ou OCT-angiographie a vu le jour depuis 2012 [3]. Elle est fondée sur la différence de signal entre les structures en mouvement et les structure statiques. L’angio-OCT est commercialisée depuis 2014 (Angiovue®, Optovue Inc., Fremont, États-Unis). Cette technique permet la visualisation du réseau vasculaire rétinien et choroïdien sans injection de produit de contraste [4]. L’angio-OCT permet la visualisation des micro-anévrismes [2], mais ces derniers paraissent moins nombreux que sur l’angiographie à la fluorescéine. Des études comparatives sont nécessaires pour déterminer la place de ce nouvel examen dans la pratique quotidienne. L’angio-OCT pourrait également avoir un intérêt dans le diagnostic des ischémies maculaires et des néovaisseaux prérétiniens également bien visibles grâce à cette technique (fig. 5-83).
Fig. 5-83 Maille capillaire périfovéolaire superficielle, profonde et couche choriocapilaire à l’examen en angio-OCT (Optovue®) d’un œil normal (a) et d’un œil de patient présentant une rétinopathie diabétique (b).
On note une nette raréfaction des capillaires et des AMIR chez le patient diabétique.
Le swept-source OCT (également appelé frequency domain-OCT [FD-OCT]) combine les avantages du SD-OCT et du TD-OCT. Il utilise une source variable en longueur d’onde et l’enregistrement du signal se fait avec un photodétecteur. L’avantage de cette technique est sa vitesse inégalée d’acquisition par rapport au SD-OCT (certains swept-source Fourier domain mode locking [FDML] atteignent jusqu’à 370 000 scans/secondes) mais la résolution axiale est cependant moins bonne que sur les prototypes SD-OCT.
Un modèle de FD-OCT, Topcon 3D OCT® (Topcon Europe, Capelle aan Den IJssel, Pays-Bas) a été commercialisé récemment. L’utilisation d’une plus longue longueur d’onde (1050 nm versus 840 nm) permet une meilleure visualisation des structures rétiniennes externes et choroïdiennes masquées par l’EP. La grande vitesse de balayage (100 000 A-scans/seconde contre 50 000 à 70 000 A-scans/seconde) accélère l’acquisition de B-scans, permettant ainsi d’obtenir un plus grand nombre de scans parfois grand champ (12 mm versus 6–9 mm avec SD-OCT classique). La visualisation du corps vitré paraît plus précise, mais semble être en rapport avec une meilleure sommation des images par un plus grand nombre de coupes (certaines machines en SD-OCT à 70 000 scans/secondes arrivent au même résultat). La longueur d’onde permet certes une plus grande pénétration tissulaire du laser, mais l’utilisation d’une sommation des images est cependant indispensable pour faciliter la visualisation de la choroïde. Les limites de la choroïde sont plus précises, ce qui facilite les mesures d’épaisseur (fig. 5-84). Un logiciel permettant de réaliser des cartographies de l’épaisseur choroïdienne a également été développé.
Fig. 5-84 OMD et swept-source OCT.
La choroïde et la sclère sont bien visibles malgré l’effet de masquage de la rétine épaissie (flèches).
L’OCT permet d’apprécier l’architecture rétinienne. Pour beaucoup, l’œdème est par définition lié à une exsudation intra- ou sous-rétinienne, extracellulaire et parfois intracellulaire. L’analyse des coupes OCT a permis de définir des critères anatomiques liés à l’œdème et à l’exsudation : l’épaississement rétinien, la perte de la dépression fovéolaire, la présence de logettes kystiques ou d’un décollement séreux rétinien sont des marqueurs de l’œdème maculaire (fig. 5-85). L’analyse fine permet de déterminer des facteurs de mauvais pronostic, comme l’atteinte de la ligne ellipsoïde, et bien souvent la cause de l’œdème : des néovaisseaux choroïdiens, une choroïde épaissie dans la CRSC, une traction vitréomaculaire, une fossette colobomateuse, etc.
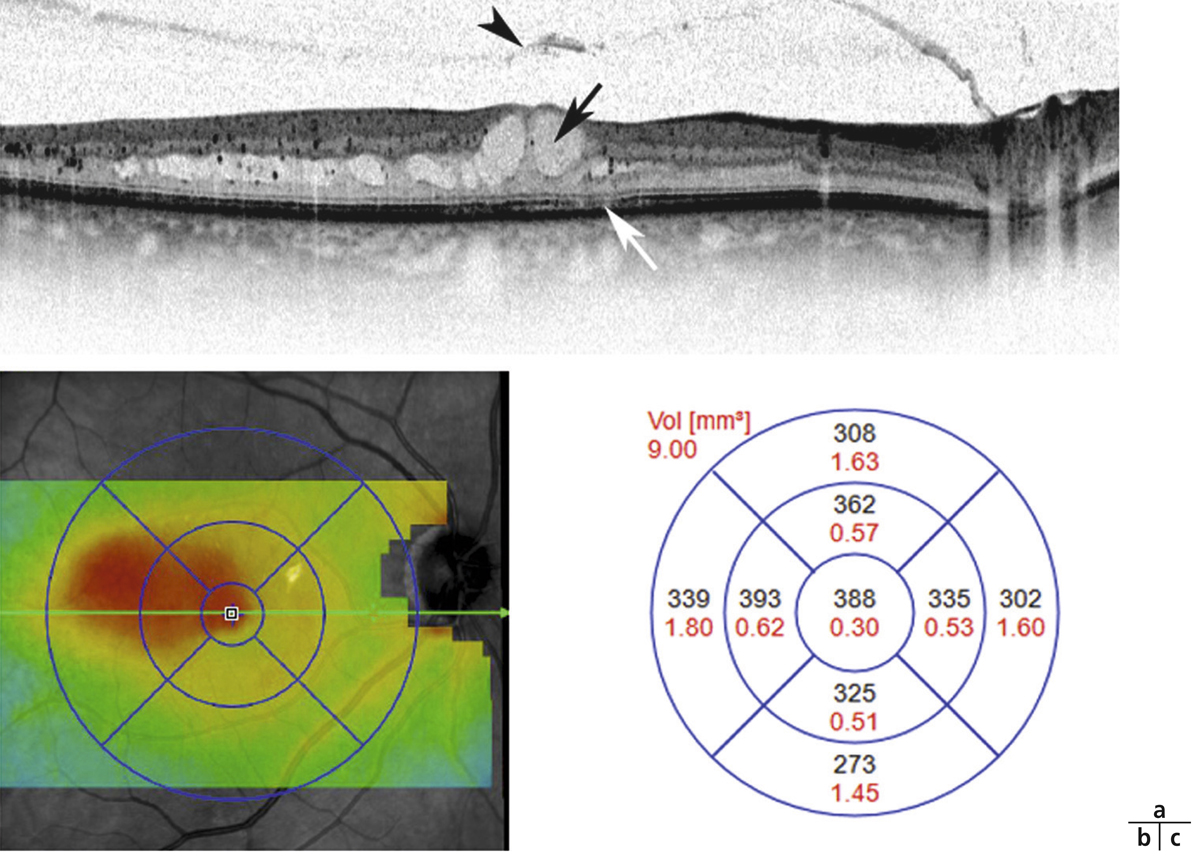
Fig. 5-85 OCT typique d’un œdème maculaire.
a. Sur le profil maculaire, on peut noter la présence de logettes kystiques (flèche noire), une hyaloïde postérieure épaissie (tête de flèche) mais sans traction vitréorétinienne évidente. Il existe une perte de la dépression fovéolaire qui suggère un épaississement rétinien central. L’hypodensité des fibres de Henlé et la disparition des couches internes hyper-réflectives signent la zone fovéolaire (flèche noire). Enfin, on note une diminution de la réflectivité de la ligne ellipsoïde (flèche blanche) qui n’est pas due à une structure hyper-réflective sus-jacente. b, c. L’épaississement rétinien est confirmé par les cartographies maculaires.
L’interface vitréomaculaire est particulièrement bien analysable en OCT. La hyaloïde postérieure est visible en OCT sous la forme d’une ligne fine hyper-réflective en avant de la rétine. L’OCT est une aide importante pour déterminer la présence d’un décollement partiel du vitré : la hyaloïde postérieure n’est pas visible en OCT si le vitré n’est pas décollé, car elle est totalement adhérente à la rétine et se confond avec l’hyper-réflectivité de la rétine interne. Elle n’est pas non plus visible en cas de décollement postérieur du vitré (DPV) complet. La profondeur de champ de l’OCT est d’environ 2 mm et elle n’est pas suffisante pour visualiser une hyaloïde totalement détachée de la rétine. Cette caractéristique va être modifiée par l’apparition des OCT grand champ et surtout les swept-source OCT qui ont une résolution axiale et transversale améliorée et une profondeur de champs de 5 à 6 mm. Enfin, les anomalies d’attache vitréorétinienne sont parfaitement observables en OCT et peuvent être associées à des œdèmes maculaires (voir chapitre 13.3).
L’OCT permet d’obtenir des mesures de l’épaisseur rétinienne, en particulier au niveau de la macula. Cet examen permet une analyse quantitative de l’OM en étudiant les modifications structurelles intrarétiniennes et l’interface vitréofovéolaire grâce à une image bidimensionnelle. La mesure de l’épaisseur maculaire est effectuée avec un logiciel de cartographie maculaire ou mapping. Depuis l’avènement des SD-OCT, les cartographies sont calculées à partir des balayages 3D. Sur chacune des coupes, l’épaisseur rétinienne est calculée au niveau de tous les points régulièrement espacés. L’OM sur la cartographie maculaire est représenté de deux façons différentes qui donnent des renseignements complémentaires : la cartographie en couleurs et la cartographie des épaisseurs rétiniennes moyennes. La cartographie en couleurs donne une représentation topographique de l’épaisseur rétinienne calculée à partir des valeurs mesurées sur chacune des coupes, si bien que les valeurs situées entre deux coupes sont extrapolées par le logiciel et non pas mesurées. Sur cette représentation, les couleurs chaudes montrent les zones d’épaississement rétinien et les couleurs froides les zones d’épaisseur normale (fig. 5-86).
La seconde représentation donne une moyenne de l’épaisseur rétinienne dans les différents secteurs de la grille d’évaluation de l’œdème maculaire de l’Early Treatment Diabetic Retinopathy Study (ETDRS), elle-même constituée de trois cercles concentriques de 1000, 3000 et 6000 μm de diamètre, centrés sur le point de fixation. La macula est ainsi divisée en neuf territoires différents dans chacun desquels figure l’épaisseur rétinienne moyenne. Cette épaisseur rétinienne moyenne sectorielle est calculée à partir des mesures ponctuelles réalisées le long des lignes de coupe (fig. 5-87). La valeur du point central est une donnée importante, car elle représente l’épaisseur rétinienne fovéolaire et serait probablement la valeur la mieux corrélée à l’acuité visuelle. Ces mesures représentent un progrès majeur dans la prise en charge de l’OM. La reproductibilité des mesures d’épaisseur rétinienne par réalisation d’une cartographie est bonne à condition de réaliser des coupes passant toutes par la fovéa. Or, en cas d’OM, la dépression fovéolaire a souvent disparu. Le repère le plus fiable est alors l’image du dôme hyporéflectif intrarétinien correspondant aux fibres de Henlé.
Les SD-OCT permettent une répartition plus homogène des points mesurés sur toute la région maculaire par rapport au TD-OCT. L’emplacement et les paramètres d’une ligne de coupe peuvent être gardés en mémoire et reproduits lors d’un examen ultérieur chez un même patient, permettant ainsi un examen comparatif aisé et reproductible. Il est possible d’afficher la cartographie selon une grille d’ETDRS mais aussi en damier.
L’apparition des nouveaux modèles d’OCT sur le marché a créé un vrai problème de normalisation des valeurs normales de l’épaisseur maculaire qui sont différentes d’un appareil à l’autre. Ceci est lié au fait que les lignes de référence de mesure de l’épaisseur maculaire varient selon les appareils. Ainsi, sur le Stratus®, la ligne de référence postérieure correspondait à la ligne de jonction des segments internes et externes des photorécepteurs. Sur le Cirrus®, cette ligne est plus postérieure, au niveau de l’épithélium pigmentaire, et sur le Spectralis®, elle est localisée au niveau de la membrane de Bruch. Pour les autres SD-OCT, elle est plus antérieure. Ces différences impliquent que les épaisseurs maculaires sont différentes d’un appareil à l’autre et qu’il est préférable de garder toujours le même appareil pour suivre l’évolution d’un OM. Les valeurs normatives pour chaque appareil seront utilisées pour définir l’épaississement rétinien débutant du patient. Ainsi, on considérera que la rétine est épaissie lorsque l’épaisseur rétinienne est supérieure à l’épaisseur rétinienne normale ± 2 déviations standard (tableau 5-7).
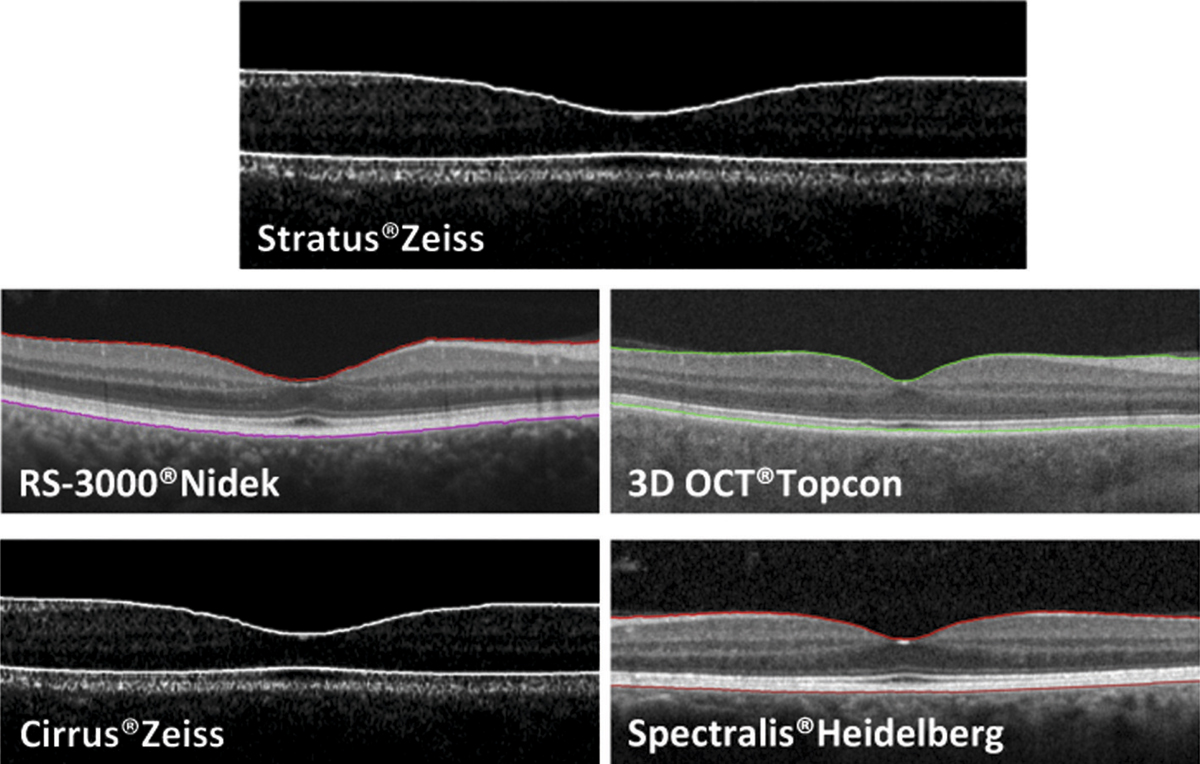
Fig. 5-86 Coupe de macula normale avec différents OCT.
Les lignes de référence pour la mesure de l’épaisseur maculaire sont différentes selon les OCT. Sur l’OCT Stratus®, la ligne de référence postérieure est localisée à la jonction des segments internes et externes des photorécepteurs. Sur le Cirrus®, cette ligne est plus postérieure, au niveau de l’épithélium pigmentaire, et sur le Spectralis®, elle est localisée au niveau de la membrane de Bruch. Pour les autres SD-OCT, elle est plus antérieure.
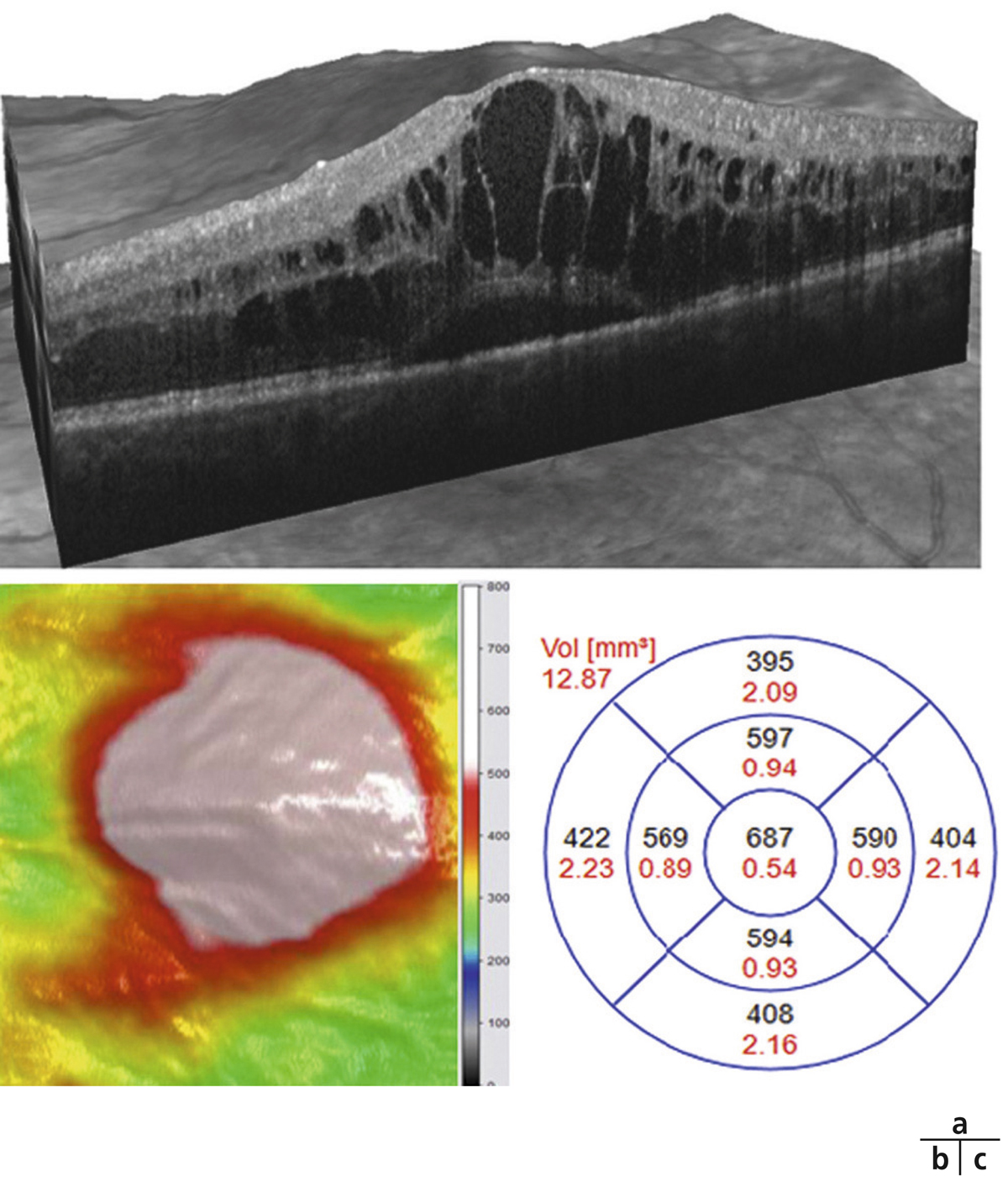
Fig. 5-87 a-c. Diverses représentations OCT d’un œdème maculaire.
À part le scan du profil maculaire, les SD-OCT sont capables d’utiliser les différentes mesures pour recréer une représentation 3D de l’œdème (a), une cartographie en couleurs de l’épaisseur rétinienne où les couleurs chaudes correspondent aux zones épaissies (b) et une cartographie des épaisseurs et des volumes rétiniens selon la « grille » ETDRS (c).
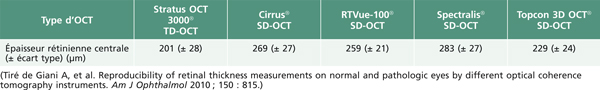
Tableau 5-7 Valeurs moyennes de l’épaisseur centrale maculaire normale mesurée avec différentes machines OCT.
Il existe une excellente reproductibilité de la mesure de l’épaisseur maculaire avec les SD-OCT. La reproductibilité de la mesure de l’épaisseur maculaire est encore meilleure pour les SD-OCT ayant la fonction de eyetracking qui permet d’obtenir des mesures extrêmement reproductibles de l’épaisseur maculaire, avec un coefficient de variation très faible de l’ordre de 8 μm [5].
L’amélioration de la vitesse d’acquisition des SD-OCT a diminué les artefacts liés aux micromouvements oculaires, mais les artefacts en rapport avec certaines structures intrarétiniennes demeurent inchangés. Ainsi, les exsudats lipidiques intrarétiniens apparaissent comme des structures hyper-réflectives masquant la réflectivité du complexe épithélium pigmentaire–choriocapillaire sous-jacent. Il en résulte un défect dans la ligne de profil postérieur de la rétine. Le logiciel de mesure de l’épaisseur rétinienne corrige automatiquement cette anomalie par interpolation linéaire, cependant, si les exsudats sont de grande taille, la correction par interpolation linéaire ne fonctionne pas, et la mesure de l’épaisseur rétinienne peut être alors erronée.
Plus rarement, la hyaloïde postérieure peut avoir une réflectivité anormalement élevée, le logiciel positionnant alors la ligne de profil antérieure sur cette hyaloïde au lieu de reconnaître la surface rétinienne, ce qui conduit à une surestimation de l’épaisseur rétinienne (fig. 5-88 et 5-89). En cas de trouble des milieux, la baisse importante du signal rend impossible l’utilisation de la mesure automatique.
Dans toutes ces situations, avant la réalisation d’une cartographie maculaire, il convient d’analyser au préalable les coupes en mode retinal thickness, afin de s’assurer que la mesure automatique n’a pas introduit d’artefacts. En cas d’erreur importante, cette mesure peut être effectuée manuellement en positionnant des index sur les limites externes et internes de la rétine.
Il existe plusieurs modalités de cartographie maculaire selon la génération et les modèles, mais les cartographies obtenues à partir de scans parallèles et horizontaux semblent devenir le standard actuellement en pratique clinique, les autres types d’acquisition étant moins systématiques (fig. 5-90). Les comparaisons récentes entre différents SD-OCT utilisaient d’ailleurs ce type de mapping (cube pour le Cirrus® et le volume de 49 lignes high speed de 20° × 20° pour le Spectralis®). Une marge d’erreur inférieure à 20 % est présente en cas de changement de machine entre deux mappings. Sur une même machine, la reproductibilité donne une marge d’erreur de moins de 10 %. Pour définir ces marges d’erreur, on peut utiliser une mesure standardisée rapportée à la mesure du Stratus®. Des équations pour convertir une mesure sur un SD-OCT (c’est-à-dire RTVue®, Cirrus® et Spectralis®) en mesure « standardisée Stratus® » ont été publiées [6, 7]. Par exemple, les valeurs de l’épaisseur centrale mesurée sur le RTVue® peuvent être converties en valeur « Stratus® » selon cette formule : Stratus® = −43,55 + 0,98 × RTVue®.
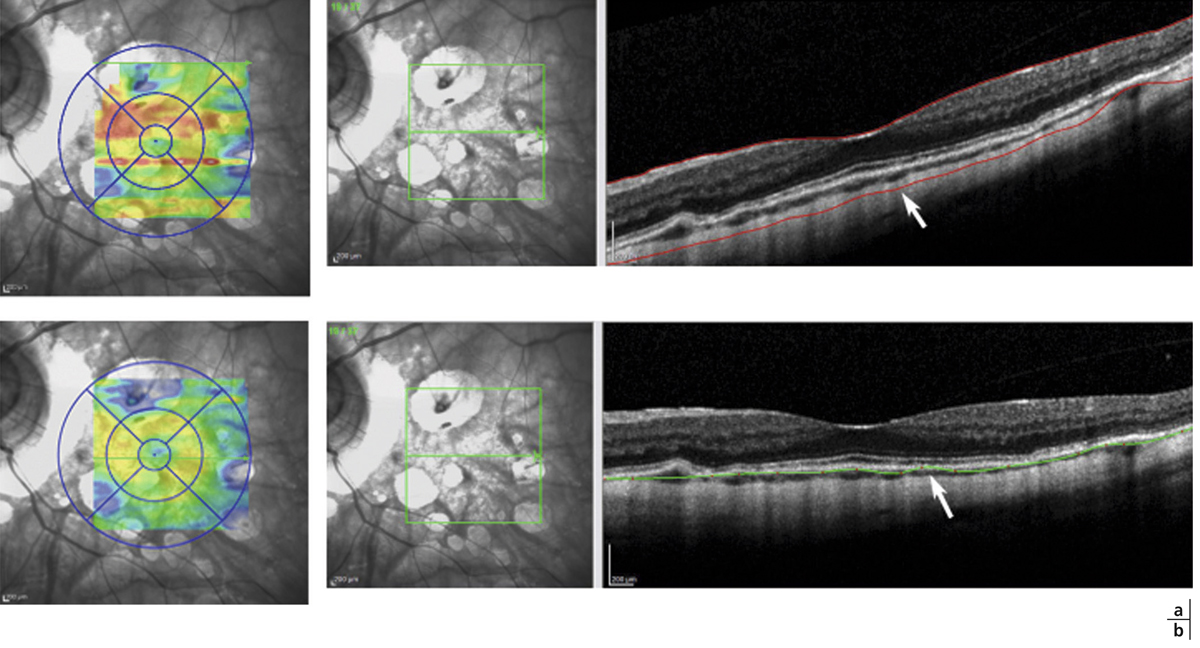
Fig. 5-88 Exemple d’artefact suggérant injustement la présence d’un œdème maculaire sur un œil myope fort.
La cartographie en couleurs montre un épaississement central à 300 μ (a, à gauche). La vérification des lignes de segmentation montre que la membrane de Bruch a été mal repérée et que la ligne se situe dans la choroïde (a, à droite). Une fois les lignes de segmentation postérieures corrigées (b, à droite), la cartographie en couleurs redevient normale, il n’y a pas d’œdème maculaire (b, à gauche).
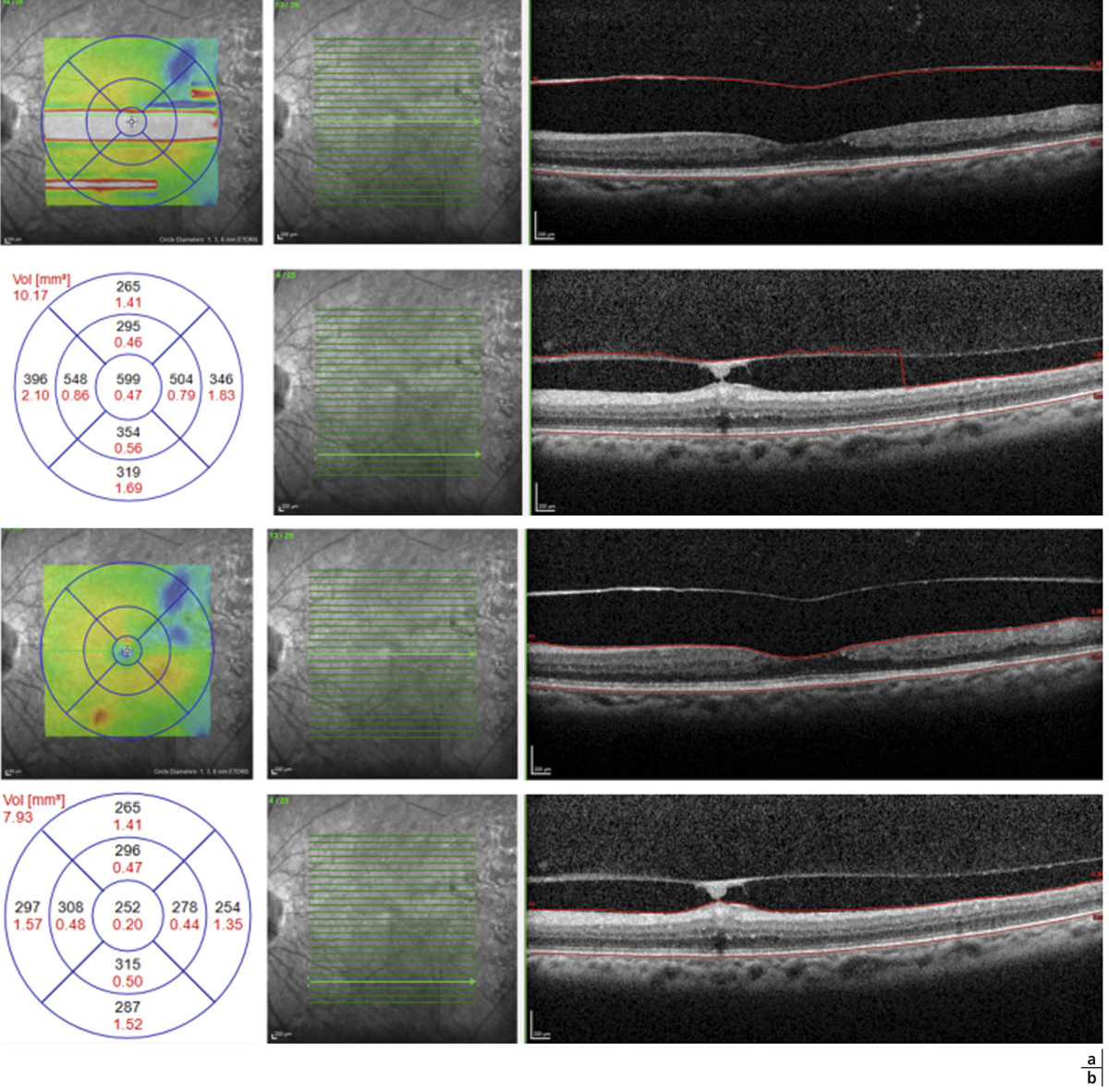
Fig. 5-89 Autres exemples d’artefacts.
a. L’hyper-réflectivité de la hyaloïde postérieure épaissie et partiellement décollée de la rétine est perçue par le logiciel comme la membrane limitante interne et fausse la cartographie et les mesures d’épaisseur rétinienne. b. Après correction manuelle des artefacts, la cartographie est modifiée : l’épaisseur maculaire est passée de 599 à 252 μm.
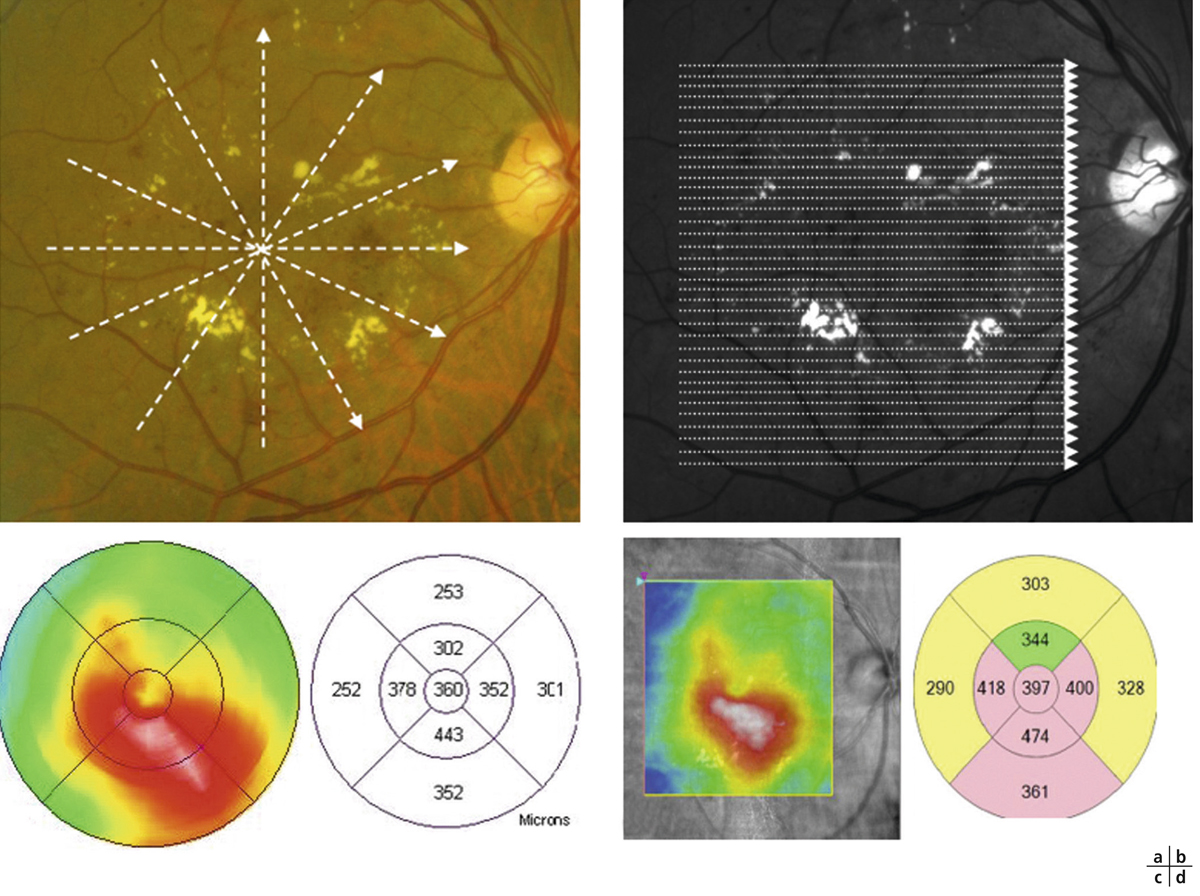
Fig. 5-90 Deux modes différents d’acquisition du mapping de l’OCT.
Les scans peuvent être disposés de façon radiaire, centrés par le point de fixation (a). Ce type d’acquisition était le seul possible sur le TD-OCT. Les SD-OCT offrent plus de possibilités, mais les lignes horizontales plus ou moins espacées sur une aire carrée de la macula sont devenues le mode d’acquisition standard (b). Pour un même œdème, deux OCT différents peuvent donner des résultats d’épaisseur très différents en fonction de leur système de segmentation. Les mappings des TD-OCT (c) mesurent des valeurs d’environ 50 μ inférieures à celle des SD-OCT (d) correspondant à l’épaisseur de l’épithélium pigmentaire non pris en compte sur les TD-OCT.
L’OCT permet de diagnostiquer et de suivre dans le temps un œdème maculaire. Il permet souvent de déterminer également l’origine de l’œdème et les nouvelles fonctionnalités de l’OCT laissent entrevoir la possibilité de mieux observer les anomalies vasculaires associées à l’œdème, ainsi que les anomalies de l’attache vitréomaculaire.
[1] Huang D, Swanson EA, Lin CP, et al. Optical coherence tomography. Science 1991 ; 254 : 1178-81.
[2] Spaide RF, Koizumi H, Pozzoni MC. Enhanced depth imaging spectral-domain optical coherence tomography. Am J Ophthalmol 2008 ; 146 : 496-500.
[3] Motaghiannezam SM, Koos D, Fraser SE. Differential phase-contrast, swept-source optical coherence tomography at 1060 nm for in vivo human retinal and choroidal vasculature visualization. J Biomed Opt 2012 ; 17 : 026011.
[4] Huang Y, Zhang Q, Thorell MR, et al. Swept-source OCT angiography of the retinal vasculature using intensity differentiation-based optical microangiography algorithms. Ophthalmic Surg Lasers Imaging Retina 2014 ; 45 : 382-9.
[5] Sohn EH, Chen JJ, Lee K, et al. Reproducibility of diabetic macular edema estimates from SD-OCT is affected by the choice of image analysis algorithm. Invest Ophthalmol Vis Sci 2013 ; 54 : 4184-8.
[6] Diabetic Retinopathy Clinical Research Network Writing Committee, Bressler SB, Edwards AR, Chalam KV, et al. Reproducibility of spectral-domain optical coherence tomography retinal thickness measurements and conversion to equivalent time-domain metrics in diabetic macular edema. JAMA Ophthalmol 2014 ; 132 : 1113-22.
[7] Bressler SB, Edwards AR, Andreoli CM, et al. Reproducibility of Optovue RTVue optical coherence tomography retinal thickness measurements and conversion to equivalent Zeiss Stratus metrics in diabetic macular edema. Transl Vis Sci Technol 2015 ; 4 : 5.
F. De Bats, B. Wolff B, M. Mauget-Faÿsse
➤ L’OCT « en face » permet d’analyser la rétine couche par couche en s’adaptant à la concavité postérieure du globe oculaire.
➤ L’OCT « en face » est toujours interprété en complément des coupes en B-scan afin de situer la couche rétinienne analysée.
➤ L’OCT « en face » permet de caractériser la forme et l’évolution des logettes de l’œdème.
Les nouvelles technologies d’OCT C-scan ou « en face » nous permettent d’acquérir et d’analyser la rétine couche par couche en s’adaptant à la concavité postérieure du globe oculaire. Cette acquisition dérive de l’analyse de la rétine en trois dimensions reconstruite à partir d’un cube dense constitué de coupes B-scan dans les plans horizontaux et verticaux (fig. 5-91). L’OCT « en face » est toujours interprété en complément des coupes en B-scan afin de situer précisément la couche rétinienne analysée. Sans le B-scan associé, aucune analyse correcte de l’OCT « en face » n’est possible [1]. Cette visualisation de la rétine dans un plan frontal permet une analyse cartographique du pôle postérieur. Dans la pathologie œdémateuse maculaire, l’OCT « en face » permet d’évaluer l’extension, la forme et l’évolution des logettes de l’œdème (fig. 5-92). L’OCT nécessite des milieux clairs et une coopération du patient pour obtenir des images de bonne qualité. La résolution de l’image finale en « en face » est conditionnée par la technologie OCT utilisée pour obtenir les B-scans initiaux. En effet, il existe deux technologies différentes en OCT : le spectral domain et le swept-source qui utilisent des longueurs d’onde différentes. La technologie swept-source dont la vitesse d’acquisition des images est très rapide utilise une longueur d’onde de 1 050 nm permettant une qualité uniforme des coupes selon la profondeur. Les reconstructions « en face » de la choroïde pourront être à haute résolution parfois aux dépens des détails intrarétiniens mieux visualisés en spectral domain. Toutes ces technologies sont en plein essor et permettront d’obtenir dans un avenir proche des images excellentes avec un plus grand champ d’acquisition, ce qui reste pour l’instant un point faible, puisque l’on ne peut analyser en « en face » que le pôle postérieur. En utilisant l’appareil Spectralis® (Heidelberg Engineering, Heidelberg, Allemagne), la rétine pourra être visualisée au travers de 496 coupes en profondeur. Les coupes en « en face » sont reconstruites à partir d’un cube maculaire de 197 sections transverses sur une surface maculaire centrale de seulement 5,79 × 5,79 mm2. D’autres appareils, par exemple les OCT RTVue XR Avanti® d’Optovue et DRI OCT-1 Atlantis® swept source de Topcon permettent un plus grand champ d’analyse de 40° du pôle postérieur [2]. Très récemment, une nouvelle technologie a émergé à partir de l’OCT « en face », il s’agit de l’angio-OCT. Elle repose sur le principe de la décorrélation qui consiste à répéter plusieurs acquisitions OCT sur une surface donnée à des temps successifs et à ne faire ressortir que les motifs différents [3]. Le signal obtenu correspond à un changement à l’intérieur d’un vaisseau et donc à un flux sanguin. Ainsi, une visualisation de la vascularisation rétinienne est possible sans colorant (fig. 5-93). Ces nouvelles imageries apparaissent excessivement prometteuses et vont probablement remplacer à plus ou moins long terme les examens d’angiographies utilisés actuellement.
Fig. 5-91 Les coupes en OCT C-scan sont issues de la reconstruction 3D à partir des B-scan initiaux.
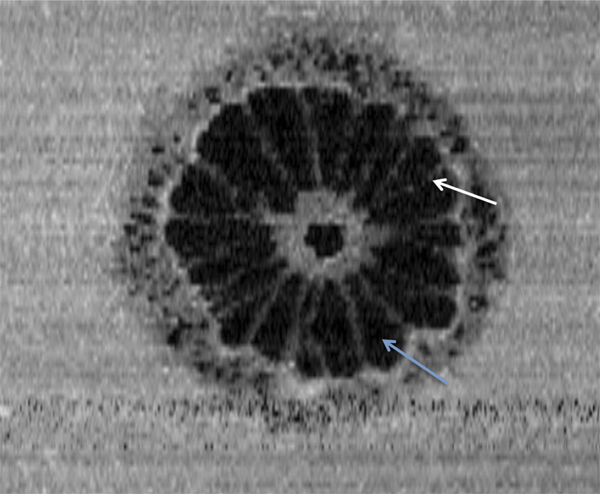
Fig. 5-92 Coupe en OCT C-scan au niveau de la couche plexiforme externe montrant la répartition des logettes œdémateuses hyporéflectives intrarétiniennes (flèche bleue) délimitées par les fibres de Henlé (flèche blanche) hyperréflectives.
(Source : communication de B. Lumbroso et F. Behar-Cohen, second Congrès international d’OCT « en face » et d’angiographie OCT, Rome 13-14 décembre 2014.)
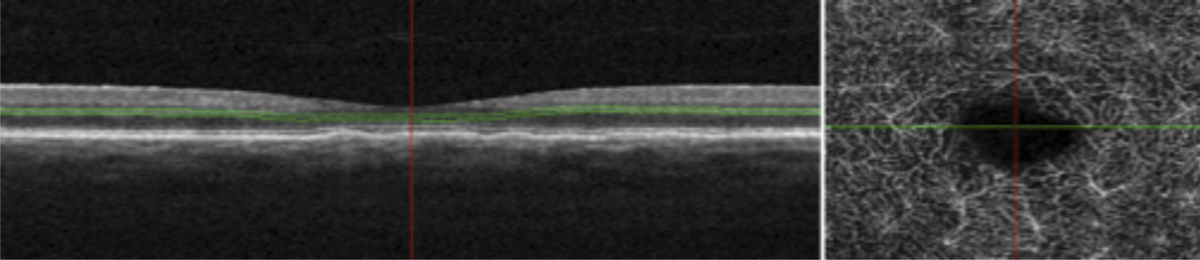
Fig. 5-93 Angio-OCT montrant le réseau capillaire intrarétinien reconstruit sans injection de colorant.
(Source : images des docteurs Bruno Lumbroso et Marco Rispoli.)
[1] Wolff B, Basdekidou C, Vasseur V, et al. Retinal inner nuclear layer microcystic changes in optic nerve atrophy : a novel spectral-domain OCT finding. Retina 2013 ; 33 : 2133-8.
[2] Alasil T, Ferrara D, Adhi M, et al. En face imaging of the choroid in polypoidal choroidal vasculopathy using swept-source optical coherence tomography. Am J Ophthalmol 2015 ; 159 : 634-43.
[3] Matsunaga D, Yi J, Puliafito CA, Kashani AH. OCT angiography in healthy human subjects. Ophthalmic Surg Lasers Imaging Retina 2014 ; 45 : 510-5.
F. Coscas, A. Miere, G. Coscas, A. Glacet-Bernard
➤ L’angio-OCT permet de visualiser les vaisseaux rétiniens maculaires sans injection intraveineuse de colorant.
➤ L’angio-OCT visualise le mouvement du flux sanguin.
➤ Les variations en termes d’hypo- ou d’hyperdensité reflètent la vitesse du débit capillaire sur une fenêtre d’acquisition centrale.
➤ L’angio-OCT est effectué selon un plan de référence variable suivant les appareils.
➤ La réalisation d’un B-scan est nécessaire pour évaluer le positionnement de ce plan de référence.
L’OCT [1] bénéficie d’une nouvelle avancée : l’angio-OCT, qui permet de visualiser les vaisseaux rétiniens maculaires sans injection intraveineuse de colorant. Ce procédé a été développé et présenté par D. Huang et G. Fujimoto [2] à la suite de nombreux travaux sur les techniques de Doppler, décorrélation d’amplitude et spectrum amplitude decorrelation [2–6].
L’angio-OCT visualise le mouvement du flux sanguin et apprécie ses variations en termes d’hypo- ou d’hyperdensité selon la vitesse du débit dans les vaisseaux rétiniens maculaires sur une petite fenêtre d’acquisition centrale, allant de 2 × 2 mm à 8 × 8 mm. Les premiers travaux ont testé le flux sanguin de la tête du nerf optique [7, 8] et l’aspect des néovaisseaux dans la DMLA [9] matérialisant l’hypersignal de certains néovaisseaux choroïdiens pré-épithéliaux. Une première analyse de l’architecture microvasculaire de la choriocapillaire [10] et dans les télangiectasies de type 2 montrait des dilatations du plexus capillaire profond [11].
L’OCT conventionnel SD-OCT (B-scan) avait permis de matérialiser la réaction exsudative et l’interface vitréomaculaire [12]. Le mode OCT « en face » a initialement été utilisé pour détecter le trajet hyper-réflectif des néovaisseaux choroïdiens (NVC) au sein d’un décollement de l’épithélium pigmentaire [13] ; il est actuellement utilisé en C-scan de référence pour l’angio-OCT.
Les équipements actuellement disponibles utilisent des algorithmes différents. Le split-spectrum amplitude-decorrelation angiography (SSADA) est l’un des algorithmes créés pour visualiser le flux sanguin dans les vaisseaux rétiniens, avec le full spectrum amplitude-decorrelation angiography et le pixel average [2]. Le cube 3D obtenu est utilisé pour calculer la décorrélation du signal d’amplitude, ce qui permet de visualiser le flux sanguin. Cette technologie est utilisée par l’AngioVue® (Optovue Inc., Californie, États-Unis). L’AngioVue® se sert d’une fenêtre d’acquisition de 3 × 3 mm, il est nécessaire de faire neuf acquisitions différentes pour couvrir l’aire maculaire. L’acquisition se fait dans les deux axes et permet d’obtenir une image bidimensionnelle « en face » et frontale (C-scan), ainsi qu’une image tridimensionnelle d’angio-OCT côte à côte. La lecture se fait à l’aide de la segmentation automatique de deux sections dans les couches internes (plexus capillaire superficiel dans membrane limitante interne–cellules ganglionnaires, profond dans plexiforme interne– plexiforme externe), et de deux sections dans les couches externes (rétine externe et choriocapillaire), avec toujours la possibilité de régler l’épaisseur de la section sur l’OCT antéropostérieur (B-scan). Le plan de référence peut aussi être ajusté en rentrant des valeurs numériques de distance et d’épaisseur par rapport à un plan choisi. Trois lits capillaires superficiel, profond et radiaire sont ainsi décrits : le plexus capillaire superficiel se situe entre la membrane limitante interne et le bord externe de la couche des cellules ganglionnaires ; le plexus capillaire profond s’étend entre le bord externe de la plexiforme interne (PI) jusqu’au milieu de la plexiforme externe (PE) [14]. L’angio-OCT est systématiquement associé à un OCT B scan (fig. 5-94).
L’algorithme de full spectrum amplitude-decorrelation angiography est développé sur les systèmes les plus complets de Heidelberg avec le Spectralis® OCT2 Angiography (Heidelberg Engineering, Heidelberg, Allemagne) avec une sommation de 25 images en eyetracking. Les figures 5-94 et 5-95 permettent de comparer l’aspect en angiographie à la fluorescéine (AF), en SD-OCT B-scan, en angio-OCT B-scan ainsi que la superposition de l’angio-OCT sur l’AF. L’analyse en angio-OCT et en OCT « en face » se fait à partir de B-scan angio-OCT. La localisation précise des différents éléments, sur cinq sections de coupes prédéfinies et deux plans de références (limitante interne et membrane de Bruch), donne une analyse très précise en angio-OCT. Ces segmentations automatiques sont très précises dans les couches internes, permettant la section automatique des cellules ganglionnaires (CG), de la nucléaire interne (NI), de la PE et de la membrane limitante interne (MLI) à la PE. L’OCT B-scan et l’angio-OCT B-scan sont associés à l’angio-OCT, permettant de bien localiser les vaisseaux dans l’épaisseur rétinienne et réalisant une cartographie détaillée du réseau capillaire rétinien au niveau de la microfenêtre d’acquisition (eFig. 5-1 et fig. 5-96).
et fig. 5-96).
Les limites de l’angio-OCT sont la difficulté de la réalisation en cas de trouble des milieux, la petite fenêtre d’acquisition et les artefacts de projection. C’est néanmoins le premier examen d’imagerie qui permet une analyse fine des lits capillaires profond et superficiel.
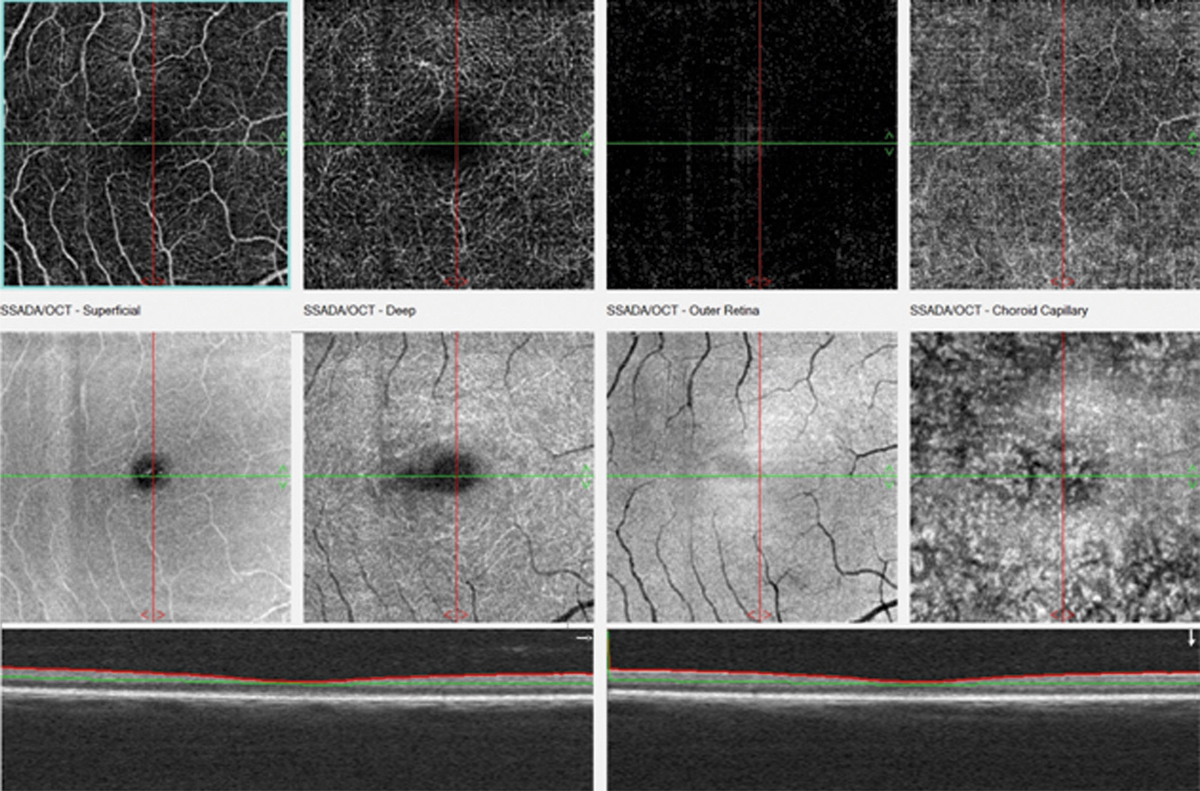
Fig. 5-94 Angio-OCT AngioVue® d’un sujet normal, montrant de gauche à droite la segmentation automatique des couches superficielles vers les couches profondes : plan du plexus capillaire superficiel (MLI–CG), plan de plexus capillaire profond (PI–PE), plan plus profond au niveau de la rétine externe et un dernier plan au niveau de la choriocapillaire.
Fig. 5-95 Sujet sain, angio-OCT B (Spectralis® OCT2).
Les capillaires apparaissent sous l’aspect de points hyper-réflectifs (à l’inverse de l’OCT B où les vaisseaux sont hypo-réflectifs). Les capillaires du plexus superficiel (PCS) apparaissent sous l’aspect de points hyper-réflectifs au niveau des couches ganglionnaires (flèche jaune). Le plexus capillaire profond (PCP) est clairement visible sous forme de points hyper-réflectifs au niveau de la plexiforme interne et nucléaire interne (flèche verte). Le SD-OCT B-scan et le Mapping sont réalisés dans le même temps d’examen sur le même appareil pouvant permettre un suivi en eyetracking. La double ligne rouge de repères sur l’angio-OCT B-scan représente la segmentation automatique choisie, ici sur MLI d’épaisseur 30 μm.
eFig. 5-1 Imagerie multimodale d’un œdème maculaire lié à une occlusion de la veine centrale de la rétine.
Fig. 5-96 Sujet sain, angio-OCT normal (Spectralis® OCT2).
a. Lit capillaire superficiel avec meilleure visibilité de l’arcade anastomotique et de l’agencement des capillaires superficiels. b. Le plan est situé à 45 μ sous la limitante interne. c. Visualisation détaillée du lit capillaire profond au niveau de la nucléaire interne (morphologie, architecture, densité et maillage). d. Le plan est situé à 110 μ sous la limitante interne.
L’angio-OCT, sans injection de colorant, permet d’avoir des informations plus précises dans les 10° centraux sur la présence et l’étendue de l’ischémie maculaire, sur les logettes maculaires très bien visibles car non masquées par la diffusion du colorant qui accompagne l’œdème maculaire en angiographie. L’imagerie multimodale de différentes causes d’OM illustre bien ce que chaque technique apporte au bilan diagnostique (fig. 5-97 et 5-98 et eFig. 5-2 à eFig. 5-11 ) [15].
) [15].
Fig. 5-97 Œdème maculaire lié à une OVCR.
a. Angiographie à la fluorescéine (AF) au temps précoce (27 s) montrant l’état (ruptures, dilatations, ectasies) de l’arcade anastomotique périfovéolaire. b. Aux temps tardifs, coloration et diffusion de l’OMC central et paracentral. c. Tomographie en cohérence optique (SD-OCT de 100 sommations d’images) montrant les volumineuses logettes centrales de l’OM.
Fig. 5-98 Angio-OCT du même patient (Spectralis® OCT2).
a. Réseau capillaire superficiel en angio-OCT 5 × 15°. b. La coupe est située au niveau des cellules ganglionnaires à 60 μm de la MLI : logettes cystoïdes hypodenses noires ; ruptures de l’arcade anastomotique avec raréfaction du lit capillaire superficiel ; maillage peu dense ; désorganisation des capillaires dont certains sont dilatés et discrètement hyperdenses et zones à faible signal, hypodenses, grisâtres, sans capillaire, correspondant à des zones hypoperfusées. c. Réseau capillaire profond. d. La coupe est située au niveau de la nucléaire interne à 90 μm de la MLI : excellente visibilité des logettes cystoïdes plus nombreuses, de leur localisation et de leur étendue ; désorganisation du lit capillaire profond notamment en temporal où les capillaires sont dilatés, anarchiques et raréfiés. e. Réseau capillaire plus profond. f. La coupe est située au niveau de la nucléaire interne à 140 μm de la MLI montrant de très nombreuses logettes cystoïdes de petite taille.
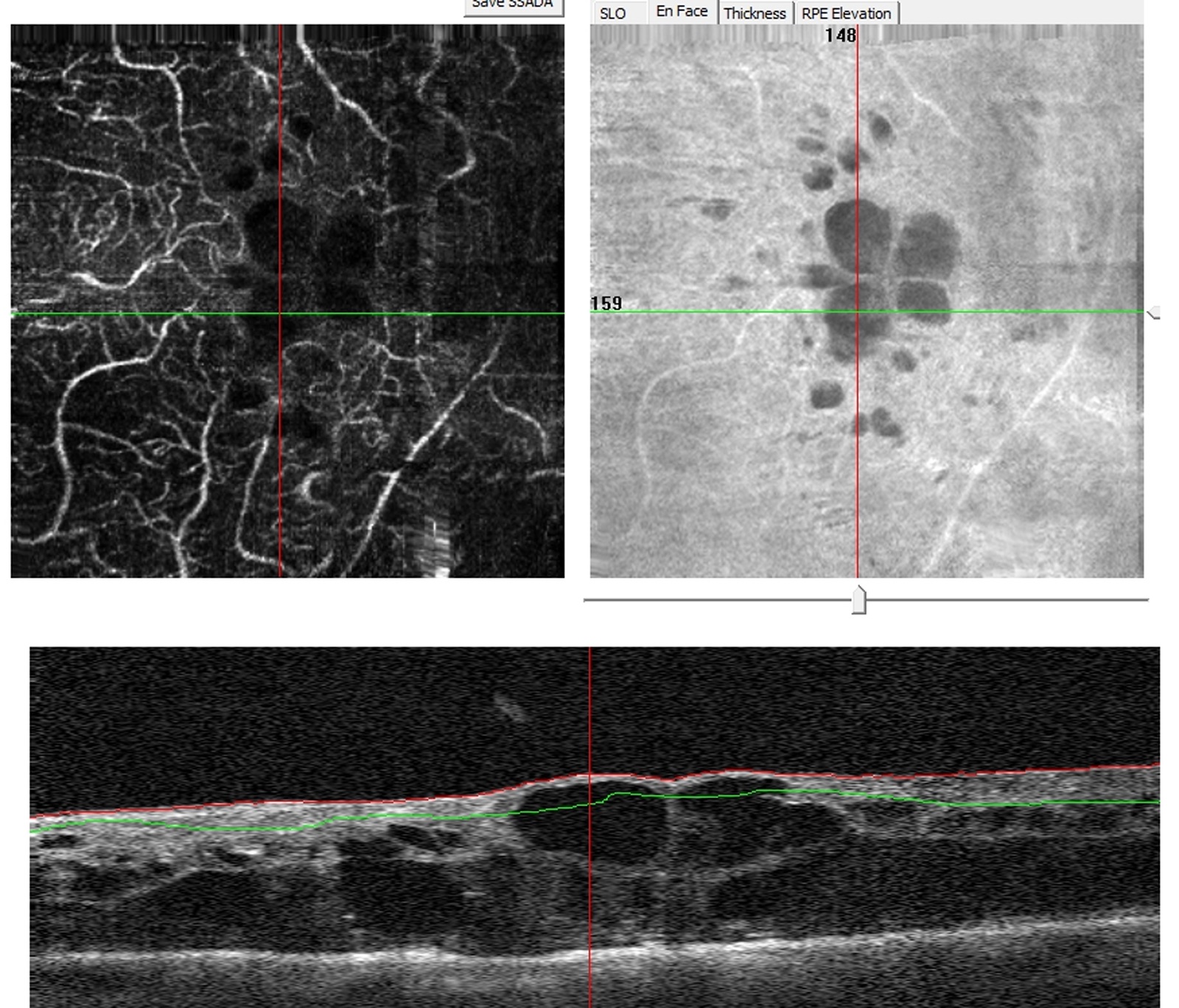
eFig. 5-2 Angio-OCT AngioVue® du même patient.
eFig. 5-3 Imagerie multimodale d’un œdème maculaire lié à une occlusion d’une branche veineuse temporale inférieure en angiographie à la fluorescéine, OCT B-scan.
eFig. 5-4 Angio-OCT AngioVue® de la même patiente.
eFig. 5-5 Imagerie multimodale d’une occlusion hémicentrale inférieure avec angiographie à la fluorescéine et SD-OCT.
eFig. 5-6 Angio-OCT AngioVue® du même patient.
eFig. 5-7 Imagerie multimodale chez un patient diabétique.
eFig. 5-8 Angio-OCT AngioVue®.
[1] Huang D, Swanson EA, Lin CP, et al. Optical coherence tomography. Science 1991 ; 254 : 1178-81.
[2] Jia Y, Tan O, Tokayer J, et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Opt Express 2012 ; 20 : 4710-25.
[3] Riva CE. Basic principles of laser Doppler flowmetry and application to the ocular circulation. Int Ophthalmol 2001 ; 23 : 183-9.
[4] White B, Pierce M, Nassif N, et al. In vivodynamic human retinal blood flow imaging using ultra-high-speed spectral domain optical coherence tomography. Opt Express 2003 ; 11 : 3490-7.
[5] Baumann B, Potsaid B, Kraus MF, et al. Total retinal blood flow measurement with ultrahigh speed swept source/Fourier domain OCT. Biomed Opt Express 2011 ; 2 : 1539-52.
[6] Tokayer J, Jia Y, Dhalla AH, Huang D. Blood flow velocity quantification using split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Biomed Opt Express 2013 ; 10 : 1909-24.
[7] Jia Y, Morrison JC, Tokayer J, et al. Quantitative OCT angiography of optic nerve head blood. Biomed Opt Express 2012 ; 3 : 3127-37.
[8] Kusuhara S, Matsumiya W, Imai H, et al. Evaluating dissociated optic nerve fiber layer appearance using en Face layer imaging produced by optical coherencetomography. Ophthalmologica 2014 ; 232 : 170-8.
[9] Jia Y, Bailey ST, Wilson DJ, et al. Quantitative optical coherence tomography angiography of choroidal neovascularization in age-related macular degeneration. Ophthalmology 2014 ; 121 : 1435-44.
[10] Choi W, Mohler KJ, Potsaid B, et al. Choriocapillaris and choroidal microvasculature imaging with ultrahigh speed OCT angiography. PLoS One 2013 ; 8 : e81499.
[11] Spaide RF, Klancnik JM Jr, Cooney MJ. Retinal vascular layers in macular telangiectasia type 2 imaged by optical coherence tomographic angiography. JAMA Ophthalmol 2015 ; 133 : 66-73.
[12] Gaucher D, Saleh M, Sauer A, et al. Macular edema without fluorescein leakeage. J Fr Ophtalmol 2009 ; 32 : 314-9.
[13] Coscas F, Coscas G, Querques G, et al. En Face enhanced depth imaging optical coherence tomography of fibrovascularpigment epithelium detachment. Invest Ophthalmol Vis Sci 2012 ; 53 : 4147-51.
[14] Spaide RF, Klancnik JM Jr, Cooney MJ. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomography angiography. JAMA Ophthalmol 2015 ; 133 : 45-50.
[15] Campochiaro PA, Wykoff CC, Shapiro H, et al. Neutralization of vascular endothelial growth factor slows progression of retinal nonperfusion in patients with diabetic macular edema. Ophthalmology 2014 ; 121 : 1783-9.
M. Saleh, M. Paques
➤ L’optique adaptative (OA) améliore les performances d’un système optique en corrigeant les aberrations optiques qu’il produit.
➤ L’OA permet d’accéder à une imagerie à très haute résolution des photorécepteurs, des vaisseaux rétiniens et des fibres nerveuses rétiniennes.
➤ La réflectivité de la jonction des segments externes et internes des photorécepteurs permet de les identifier de même que leur sensibilité préférentielle à une incidence particulière de la lumière.
➤ La densité, l’espacement intercellulaire et la régularité de la mosaïque des photorécepteurs sont les principales données étudiées en OA.
L’optique adaptative (OA) est une technologie qui a pour but d’améliorer les performances d’un système optique en corrigeant les aberrations optiques produites par ce dernier. Appliquée à l’œil humain, elle permet des avancées spectaculaires en imagerie rétinienne et l’observation à très haute résolution de diverses structures oculaires comme les photorécepteurs, les vaisseaux rétiniens et les fibres nerveuses rétiniennes. Son utilisation, encore au stade d’expérimentation clinique, laisse entrevoir un diagnostic plus précoce de certaines maladies rétiniennes ainsi qu’un suivi et une évaluation des traitements plus efficaces.
L’idée de corriger les aberrations optiques dans le but de rendre une image plus nette a initialement germé dans le domaine de l’astronomie [1]. Son application à l’ophtalmologie date, quant à elle, d’une quinzaine d’années. La détection automatisée du front d’ondes à l’aide de capteurs de type Shack-Hartmann est une étape importante dans l’émergence de cette technologie. C’est en 1996, à l’université de Rochester, que l’équipe de David Williams a imagé pour la première fois les photorécepteurs humains à l’aide d’un prototype d’OA couplé à un scanning laser ophthalmoscopy (SLO) [2]. La technologie s’est par la suite rapidement améliorée avec l’intégration de l’analyse en temps réel. L’OA a ensuite été associée à différentes modalités d’imagerie existantes, comme le SLO, une caméra flash et l’OCT [3–5]. Appliquée à l’œdème maculaire, l’OA est informative à plusieurs titres.
La visualisation des cônes par l’OA est rendue possible par la réflectivité de certaines structures cellulaires présentes à la jonction des segments externes et internes des photorécepteurs où se concentrent les mitochondries. L’effet Stiles-Crawford, qui correspond à une sensibilité préférentielle des photorécepteurs à une incidence particulière de la lumière (celle correspondant à l’orientation du cône), est ainsi exploité [6]. En plus de la densité et de l’espacement intercellulaire, l’OA fournit de précieuses informations sur la régularité de la mosaïque des photorécepteurs, nécessaire à une bonne fonction visuelle [7]. Une baisse modérée de la densité de cônes parafovéolaires a ainsi été mise en évidence chez les patients diabétiques de type 1 [8]. Dans une série de patients présentant une choriorétinite séreuse centrale résolutive, Ooto et al. ont montré une diminution de la densité de cônes associée à une désorganisation de la mosaïque cellulaire, anomalies qui étaient corrélées à la baisse de l’acuité visuelle [9]. La même approche peut être envisagée dans l’œdème maculaire, l’évaluation de la perte de photorécepteurs pouvant avoir une valeur pronostique (fig. 5-99).
Fig. 5-99 Patient présentant une choriorétinite séreuse centrale résolutive à l’œil droit.
Les couches rétiniennes externes paraissent hyporéflectives à l’OCT. L’optique adaptative retrouve une perte relative de la densité de cônes parafovéolaires comparée à l’œil adelphe sain.
En focalisant l’OA sur les couches internes de la rétine, il est possible d’obtenir des images « en face » (coronales) de l’œdème maculaire. Des logettes de différentes tailles peuvent être ainsi visualisées. Ces images sont à rapprocher des reconstructions obtenues par OCT « en face » (C-scan). Les images d’OA par illumination semblent ainsi correspondre à une image frontale d’une tranche rétinienne ou slab (fig. 5-100).
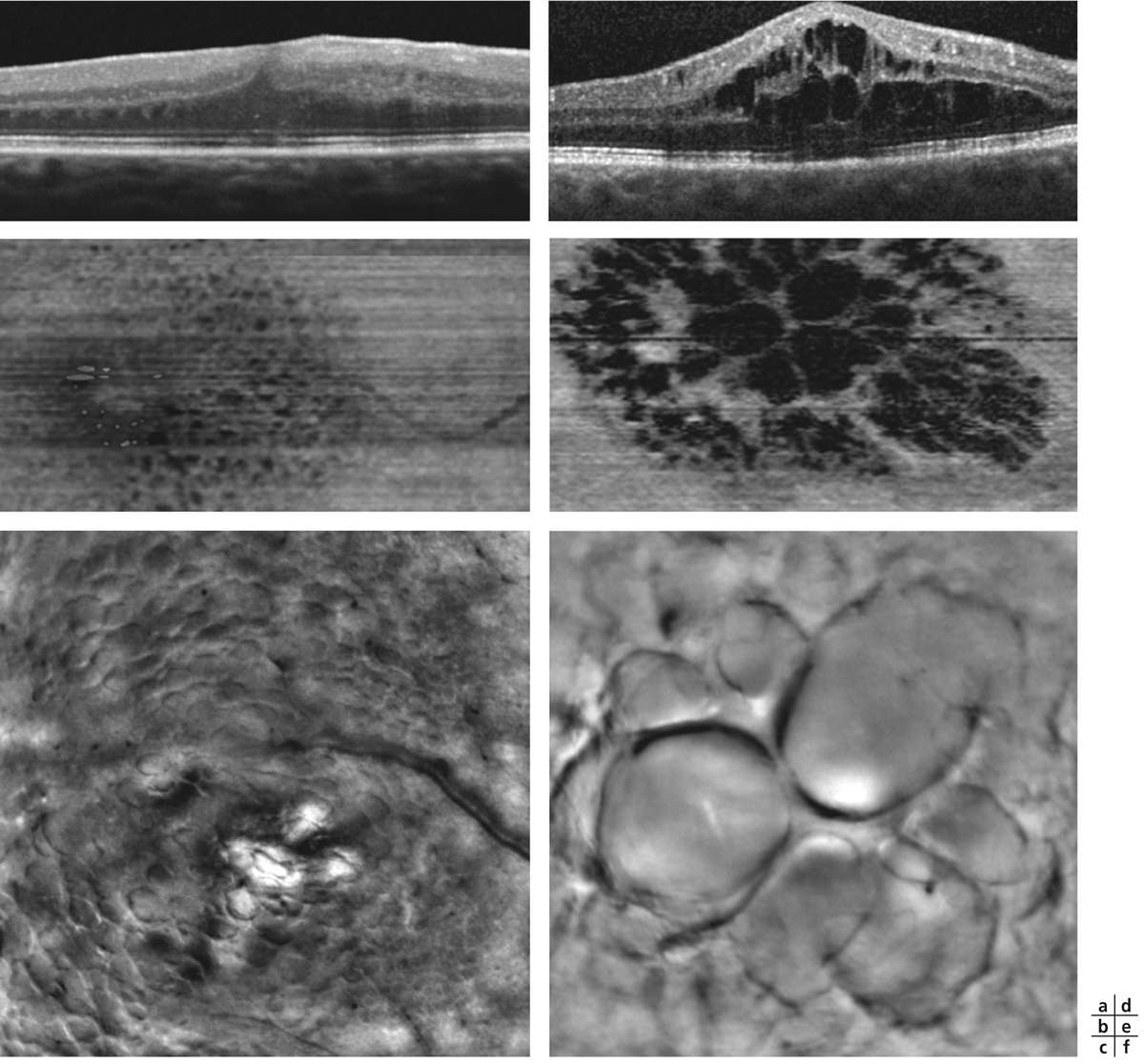
Fig. 5-100 Confrontation des images par SD-OCT (a, d), OCT « en face » (b, e) et optique adaptative (c, f).
a-c. Patient opéré d’une vitrectomie avec pelage d’une membrane épimaculaire. Persistance d’un épaississement maculaire diffus (B-scan) (a). L’OCT « en face » met en évidence la présence de petites logettes dans la couche plexiforme externe (b). L’optique adaptative retrouve des kystes rétiniens de petite taille (c). d-f. Œdème maculaire cystoïde chez un patient diabétique (d). Les logettes de différentes tailles sont visualisées en OCT « en face » (e) et en optique adaptative (f).
L’OA permet une visualisation des exsudats avec une résolution inégalée (fig. 5-101). Il en ressort ainsi que les exsudats associés à l’œdème maculaire du diabétique (OMD) sont constitués de l’agglomération de sphères de taille relativement homogène d’un diamètre d’environ 30 μm. Les études histologiques ont mis en évidence la nature protéique et lipidique des exsudats durs associés à la rétinopathie diabétique [10]. Constitués d’une matrice fibreuse, ils accueillent de nombreuses cellules qu’elles soient des macrophages ou des cellules pigmentées. Ces images en OA sont également très évocatrices des « foci » décrits en OCT. Ces lésions élémentaires hyper-réflectives se forment dans toutes les couches de la rétine à partir du mur des micro-anévrismes ; elles pourraient correspondre à l’extravasation de l’apoprotéine B qui s’agrège progressivement jusqu’à former les exsudats durs principalement localisés dans la couche plexiforme externe ; l’augmentation de la pression osmotique qui en résulte participerait à l’apparition de l’œdème maculaire. Ces lésions hyper-réflectives seraient quasi pathognomoniques de l’OMD (fig. 5-101 et 5-102) [11].
Il est également possible que les foci eux-mêmes soient constitués de l’agglomérat de matériel de dimension encore plus réduite comme le laissent supposer les premières images d’OA (fig. 5-103). Une comparaison anatomoclinique serait précieuse pour confirmer cette hypothèse. Par conséquent, l’OA pourrait aider à mieux connaître l’histoire naturelle des exsudats rétiniens survenant dans un contexte d’OMD et pourrait aider à évaluer les différentes thérapeutiques proposées (chirurgie, photocoagulation, traitement hypolipémiant général).
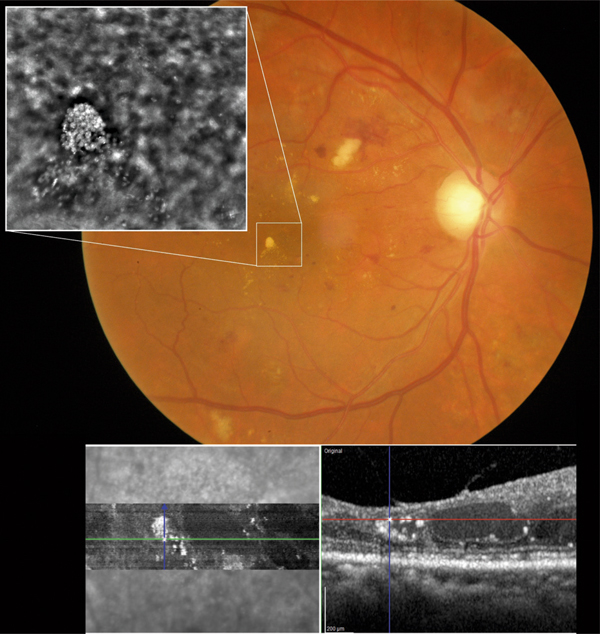
Fig. 5-101 Imagerie multimodale d’exsudats maculaires chez un patient diabétique.
La reconstruction « en face » confirme que l’image obtenue en optique adaptative correspond à l’agrégation de « foci » visualisés à l’OCT.

Fig. 5-102 Suivi sur 6 mois de l’exsudat. La désagrégation de ce dernier est visualisée grâce à l’OA.
Fig. 5-103 Les exsudats (flèche du haut) semblent constitués de « foci » (flèche du milieu), et les « foci » eux-mêmes semblent constitués de plus petits éléments de quelques microns (flèche du bas).
L’OA permet également d’imager les vaisseaux rétiniens, en particulier leurs parois et d’évaluer le flux sanguin [12]. Il est ainsi possible, dans le diabète, de détecter précocement l’apparition de subtiles modifications vasculaires comme les micro-anévrismes et les micro-hémorragies avec ou sans recours à un colorant [13]. Récemment, il a également été montré qu’avec une analyse informatique adaptée, il était possible de quantifier la raréfaction de la trame capillaire parafovéolaire qui survient dans le diabète avec une précision supérieure à celle de l’angiofluorographie classique [13]. L’OA offre une plus grande sensibilité à la détection des vascularites que l’angiographie ou la rétinographie [14]. Dans les occlusions veineuses rétiniennes, l’OA permet une étude des croisements artérioveineux ainsi qu’une détection sensible de l’opacification périveinulaire [15].
[1] Tyson R. Principles of adaptive optics. CRC Press ; 2010.
[2] Liang J, Williams DR, Miller DT. Supernormal vision and high-resolution retinal imaging through adaptive optics. J Opt Soc Am A Opt Image Sci Vis 1997 ; 14 : 2884-92.
[3] Hermann B, Fernández E, Unterhuber A, et al. Adaptive-optics ultrahigh-resolution optical coherence tomography. Optics Letters 200 ; 29 : 2142-4.
[4] Roorda A, Romero-Borja F, Donnelly III W, et al. Adaptive optics scanning laser ophthalmoscopy. Optics Express 2002 ; 10 : 405-12.
[5] Viard C, Nakashima K, Lamory B, et al. Imaging microscopic structures in pathological retinas using a flood-illumination adaptive optics retinal camera. Proc. SPIE in BiOS 2011 ; 7885 : 788509.
[6] Stiles W, Crawford B. The luminous efficiency of rays entering the eye pupil at different points. Proceedings of the Royal Society of London, Series B 1933 ; 778 : 428-50.
[7] Bidaut Garnier M, Flores M, Debellemanière G, et al. Reliability of cone counts using an adaptive optics retinal camera. Clinical & Experimental Ophthalmology 2014 ; 42 : 833-40.
[8] Lombardo M, Parravano M, Lombardo G, et al. Adaptive optics imaging of parafoveal cones in type 1 diabetes. Retina 2014 ; 34 : 546-57.
[9] Ooto S, Hangai M, Sakamoto A, et al. High-resolution imaging of resolved central serous chorioretinopathy using adaptive optics scanning laser ophthalmoscopy. Ophthalmology 2010 ; 117 : 1800-19.e1-2.
[10] Takagi H, Otani A, Kiryu J, Ogura Y. New surgical approach for removing massive foveal hard exudates in diabetic macular edema. Ophthalmology 1999 ; 106 : 249-256 ; discussion 256-7.
[11] Bolz M, Schmidt-Erfurth U, Deak G, et al., Diabetic Retinopathy Research Group Vienna. Optical coherence tomographic hyperreflective foci : a morphologic sign of lipid extravasation in diabetic macular edema. Ophthalmology 2009 ; 116 : 914-20.
[12] Zhong Z, Song H, Chui TYP, et al. Noninvasive measurements and analysis of blood velocity profiles in human retinal vessels. Investigative Ophthalmology & Visual Science 2011 ; 52 : 4151-7.
[13] Tam J, Dhamdhere KP, Tiruveedhula P, et al. Disruption of the retinal parafoveal capillary network in type 2 diabetes before the onset of diabetic retinopathy. Investigative Ophthalmology & Visual Science 2011 ; 52 : 9257-66.
[14] Errera MH, Coisy S, Fardeau C, et al. Retinal vasculitis imaging by adaptive optics. Ophthalmology 2014 ; 121 : 1311-2.e2.
[15] Sarda V, Nakashima K, Wolff B, et al. Topography of patchy retinal whitening during acute perfused retinal vein occlusion by optical coherence tomography and adaptive optics fundus imaging. European Journal of Ophthalmology 2010 ; 21 : 653-6.
G. Seidel, L. Schmetterer1
➤ Les systèmes d’imagerie actuels sont restreints quant à la capacité de localiser précisément une rupture de la barrière hémato-rétinienne.
➤ L’identification précoce de l’ischémie et l’inflammation est essentielle pour tenter de limiter la fibrose.
➤ L’avènement du contrast-enhanced OCT associé à des nanoparticules pourrait définir l’imagerie moléculaire de demain.
➤ Ces approches modernes avec une visualisation 3D des détails anatomiques et fonctionnels ouvriront la voie à des applications thérapeutiques.
Alors que l’ophtalmologie a dû patienter presque un siècle entre la réalisation du premier fond d’œil par Helmholz en 1851 et l’apparition des premières rétinophotographies dans les années 1940, l’innovation en imagerie rétinienne a quant à elle présenté une accélération fulgurante dans les dernières décennies. L’avènement de l’échographie oculaire, de l’angiographie à la fluorescéine à la fin des années 1950, puis les clichés en autofluorescence en 1968 et la tomographie en cohérence optique (OCT) en 1991 ont représenté des innovations révolutionnaires. Ces techniques constituent des outils indissociables de la pratique quotidienne moderne en ophtalmologie que ce soit pour le dépistage, le diagnostic et le suivi des pathologies rétiniennes (fig. 5-104).
Ces dernières années, l’intérêt s’est indiscutablement porté sur l’OCT. L’augmentation du nombre de publications portant sur l’OCT dans la littérature ophtalmologique témoigne de cet engouement. Le nombre de publications augmente chaque année passant de 79 publications annuelles en 2000 à 2699 en 2014 (fig. 5-105).
Désormais, les parutions scientifiques portant sur l’OCT sont deux fois plus nombreuses que celles portant sur l’angiographie, la rétinophotographie et l’autofluorescence réunies (fig. 5-106). Au même titre que son impact scientifique, l’impact de l’OCT en clinique courante a été majeur et s’est rapidement démocratisé. Contrairement aux rétinophotographies, dont la mise en œuvre clinique a été retardée par l’existence de nombreux artefacts et la nécessité d’un temps d’exposition de 10 minutes, l’OCT a été aisément adopté par la communauté ophtalmologique.
Grâce en partie au développement des traitements anti-VEGF et de l’intérêt commercial croissant, l’OCT a bénéficié de nombreux progrès technologiques d’imagerie en termes de résolution et de vitesse d’acquisition, de sorte que nous pouvons à présent étudier des images du pôle postérieur dont les détails anatomiques sont sans précédent. L’impressionnante résolution structurelle de l’OCT, parmi les multiples points forts de cette technique, a poussé certains ophtalmologistes à négliger les outils diagnostics traditionnels. Ces outils classiques gardent une valeur diagnostique sans pareil. Cet écueil doit donc être évité à tout prix.
Fig. 5-104 Histoire de l’imagerie rétinienne.
En 1851, le premier fond d’œil est réalisé par Helmholtz. Trente-cinq ans plus tard, le premier cliché rétinophotographique en noir et blanc est attribué à Howe, Jackmann et Webster. Dans les années 1940, la première rétinophotographie en couleurs est présentée par Bedell aux réunions de l’American Academy of Ophthalmology and Otholaryngeology. En 1956, Mundt et Hughes présentent une nouvelle technique diagnostique : l’échographie oculaire dans l’American Journal of Ophthalmology. En 1959, Flocks et Chao réalisent la première angiographie à la fluorescéine chez des chats, puis l’année suivante, Novotny et Alvis la pratiquent chez l’homme. En 1968, Machemer décrit une « pseudo-fluorescence » dans ses expériences sur le décollement de la rétine chez les singes. Huang publie quant à lui sur la technique de l’OCT.
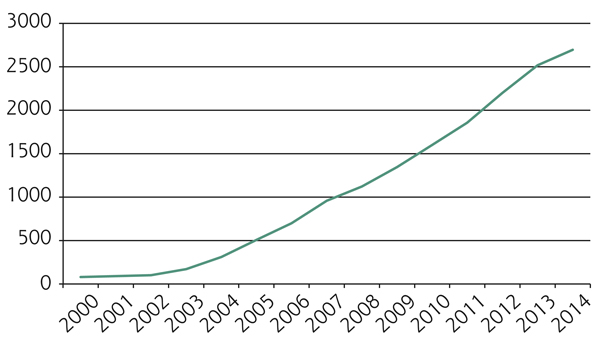
Fig. 5-105 Publications concernant la tomographie par cohérence optique de 2000 à 2014.
Recherches en ligne sur le site Internet PubMed consultées le 20 avril 2015 et rapportées à une année.
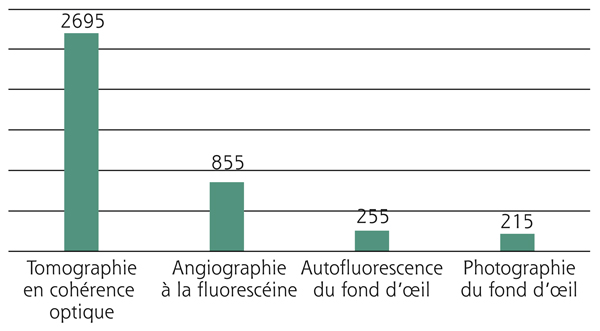
Fig. 5-106 Publications concernant l’imagerie rétinienne en 2014.
Recherches en ligne sur le site Internet PubMed consultées le 20 avril 2015.
Actuellement, les principales modalités d’exploration du pôle postérieur sont : la rétinographie en couleurs, l’échographie, l’angiographie à la fluorescéine et au vert d’indocyanine, les clichés en autofluorescence, l’OCT.
La rétinographie en couleurs est obtenue grâce à la réflexion, par les tissus intra-oculaires, d’un flash en lumière blanche. En fonction de la résolution du capteur, évaluée à l’échelle du micromètre, une gamme d’amplitude est obtenue. En plus des clichés en lumière blanche qui utilisent l’ensemble du spectre visible, les clichés monochromatiques peuvent améliorer le contraste entre des structures présentant différentes caractéristiques d’absorption et différentes localisations en profondeur. La localisation exacte en termes de profondeur sur les rétinographie demeure impossible ce qui en fait un inconvénient majeur pour la visualisation et la quantification de l’œdème maculaire cystoïde.
L’échographie est obtenue grâce à la réflexion d’ondes d’ultrasons sur les tissus oculaires. Les échographes ophtalmologiques fonctionnent avec une fréquence de 10 ou 20 MHz pour l’imagerie du pôle postérieur. La résolution augmente dès lors qu’on utilise des fréquences croissantes, en revanche les hautes fréquences diminuent la profondeur de pénétration. L’application de l’échographie dans l’imagerie de la rétine est donc limitée à des lésions qui ne sont pas accessibles à la biomicroscopie, comme les troubles sévères des milieux, les lésions opaques, les pathologies choroïdiennes et les lésions orbitaires.
L’angiographie à la fluorescéine et l’angiographie infrarouge au vert d’indocyanine permettent, en temps réel, d’étudier la distribution de colorants fluorescents dans l’œil. Elles permettent ainsi, à la fois, l’évaluation dynamique de la circulation sanguine dans les vaisseaux et l’évaluation de l’intégrité de la barrière hémato-rétinienne en mettant en évidence une diffusion. Il s’agit de la seule méthode commercialisée pour caractériser la perméabilité vasculaire. Cependant, cette technique ne quantifie pas l’intensité de la diffusion et n’évalue pas précisément la profondeur des structures étudiées.
Les clichés en autofluorescence mettent en évidence la répartition anatomique des fluorophores au niveau du pôle postérieur. La principale source de cette fluorescence est un produit dérivé de la vitamine A appelé lipofuscine, qui lui-même est composé d’au moins dix fluorophores différents. En tant que tel, le profil de fluorescence sert de témoin de l’activité métabolique au niveau de l’interface photorécepteurs–épithélium pigmentaire. Au même titre que pour l’angiographie, l’autofluorescence manque de précision pour quantifier le niveau de fluorescence émise. De plus, la profondeur des structures dont est issue la fluorescence doit être déduite par le clinicien à partir d’indices indirects. Ainsi, la comparaison interindividuelle et intra-individuelle, à l’exception des altérations du profil de fluorescence, est limitée.
L’OCT mesure la réflectivité des tissus par interférométrie. L’OCT fournit des images en volume avec une résolution axiale pouvant aller jusqu’à 1 μm. Les systèmes modernes, équipés de la technologie type swept-source ou enhanced depth imaging (EDI), permettent une visualisation détaillée de la rétine et de la choroïde en une coupe. Une limitation de l’OCT est sa résolution transversale, qui au mieux peut atteindre 10 μm. Ceci peut être amélioré à l’échelle du micron via l’optique adaptative, qui à son tour limite le champ de l’imagerie à quelques degrés. Cependant, le principal point faible de l’OCT est le manque d’information fonctionnelle. Le développement récent des premiers appareils d’angio-OCT donne l’espoir d’une visualisation fonctionnelle et anatomique.
La définition de l’œdème maculaire est l’accumulation de liquide extracellulaire dans la rétine secondaire à une rupture de la barrière hémato-rétinienne [1]. Ce liquide provient à quelques exceptions près, comme les fossettes colobomateuses, de vaisseaux choroïdiens ou rétiniens. En fonction de l’étiologie et l’importance de l’exsudat, les stratégies thérapeutiques varient de manière significative. Ainsi, l’objectif principal de l’imagerie de l’œdème maculaire est de quantifier l’excès de fluide et de localiser avec précision l’origine de la diffusion. Une localisation exacte dans les plans axial et transversal est nécessaire.
La localisation tridimensionnelle est sans nul doute l’apanage de l’OCT. En revanche, actuellement les informations sur la perméabilité vasculaire ne peuvent être obtenues que par l’angiographie à la fluorescéine. Cependant la localisation exacte des points de fuite en angiographie rencontre de nombreux problèmes. Tout d’abord, les éléments spontanément hyperfluorescents et les fuites intenses peuvent créer un effet masque. De plus, l’évaluation de la profondeur des structures est délicate en angiographie.
En plus de caractériser la fuite afin d’utiliser notre arsenal thérapeutique au mieux, certains souhaitent s’attaquer au problème sous-jacent. De nombreuses pathologies, telles que la DMLA, la maculopathie diabétique, les uvéites, et l’occlusion veineuse sont à l’origine d’exsudations qui provoquent à terme un œdème maculaire cystoïde. Ces processus pathologiques reposent souvent sur un certain degré d’inflammation, d’ischémie ou une combinaison des deux. Quant bien même de nombreux mécanismes pathologiques sont en jeu, il n’en demeure pas moins qu’a terme le résultat est irrémédiablement identique : la fibrose [2]. Parce que le stade définitif de fibrose est beaucoup plus difficile à traiter et que la récupération visuelle est souvent incomplète, l’identification de la pathologie avant l’avènement de changements structurels importants est cruciale.
Bon nombre des processus de l’inflammation fonctionnent à une échelle cellulaire ou moléculaire, ils demeurent donc difficiles à observer in vivo. L’identification des cellules inflammatoires à l’OCT est en cours d’étude. Des points hyper-réflectifs dans la chambre antérieure, le corps vitré et la rétine peuvent être vus chez des patients présentant une uvéite (fig. 5-107). Compte tenu de leur association avec l’activité inflammatoire, il est raisonnable de supposer que ces points représentent des cellules inflammatoires. Au niveau de la rétine, leur véritable nature et leur activité inflammatoire potentielle restent controversées [3, 4]. Malheureusement, les seuls autres signes cliniques pouvant précéder les modifications structurelles sont des éléments non spécifiques tels que la rupture de la barrière hémato-rétinienne en angiographie ou l’accumulation de lipofuscine en autofluorescence.
Le second facteur physiopathologique majeur dans l’œdème maculaire cystoïde est l’ischémie. Étant donné que l’ischémie est définie comme un apport sanguin insuffisant, son étude nécessite la visualisation du flux sanguin.
En ce qui concerne l’exploration de l’ischémie rétinienne le gold standard est sans conteste l’angiographie à la fluorescéine. À partir du moment ou l’ischémie entraîne des modifications structurelles, d’autres méthodes d’imagerie peuvent fournir des informations précieuses. On peut ainsi observer une ligne hyper-réflective située au niveau de la partie interne de la couche plexiforme externe sur coupe OCT (fig. 5-108). Cette ligne hyper-réflective peut être observée dans les occlusions de veines et d’artères rétiniennes et est un marqueur pronostique péjoratif [5]. Cependant, elle n’est pas toujours facilement identifiable et habituellement elle demeure transitoire. A contrario, dans d’autres pathologies où la composante hypoxique est marquée au niveau des couches plus profondes de la rétine, comme la rétinopathie diabétique, cette ligne hyper-réflective n’est pas retrouvée. Par conséquent, les œdèmes maculaires ischémiques et non ischémiques ont un aspect identique en OCT (fig. 5-109).
En résumé, les systèmes d’imagerie actuels sont restreints quant à la capacité de localiser précisément une rupture de la barrière hémato-rétinienne. De plus, ils sont limités dans l’étude de la composante fondamentale sur laquelle repose la physiopathologie de l’œdème maculaire cystoïde. La technique d’imagerie idéale doit combiner l’anatomie et l’évaluation fonctionnelle avec une haute résolution axiale et transversale. Enfin, elle doit associer une bonne pénétration des tissus, y compris de la rétine et de la choroïde, et une vision grand champ.
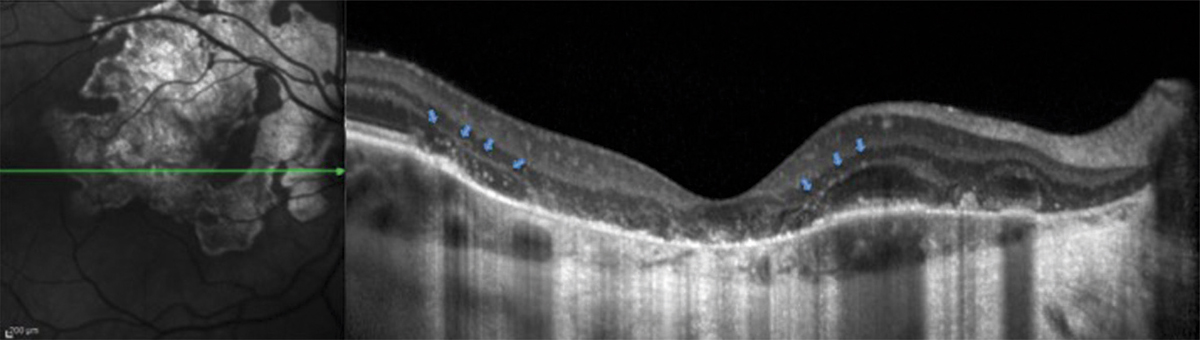
Fig. 5-107 Processus inflammatoire sur l’OCT.
Autofluorescence et OCT d’un patient présentant une choroïdite serpigineuse. Au niveau des zones inflammatoires actives de la lésion atrophique, des points hyper-réflectifs peuvent être remarqués (flèches).
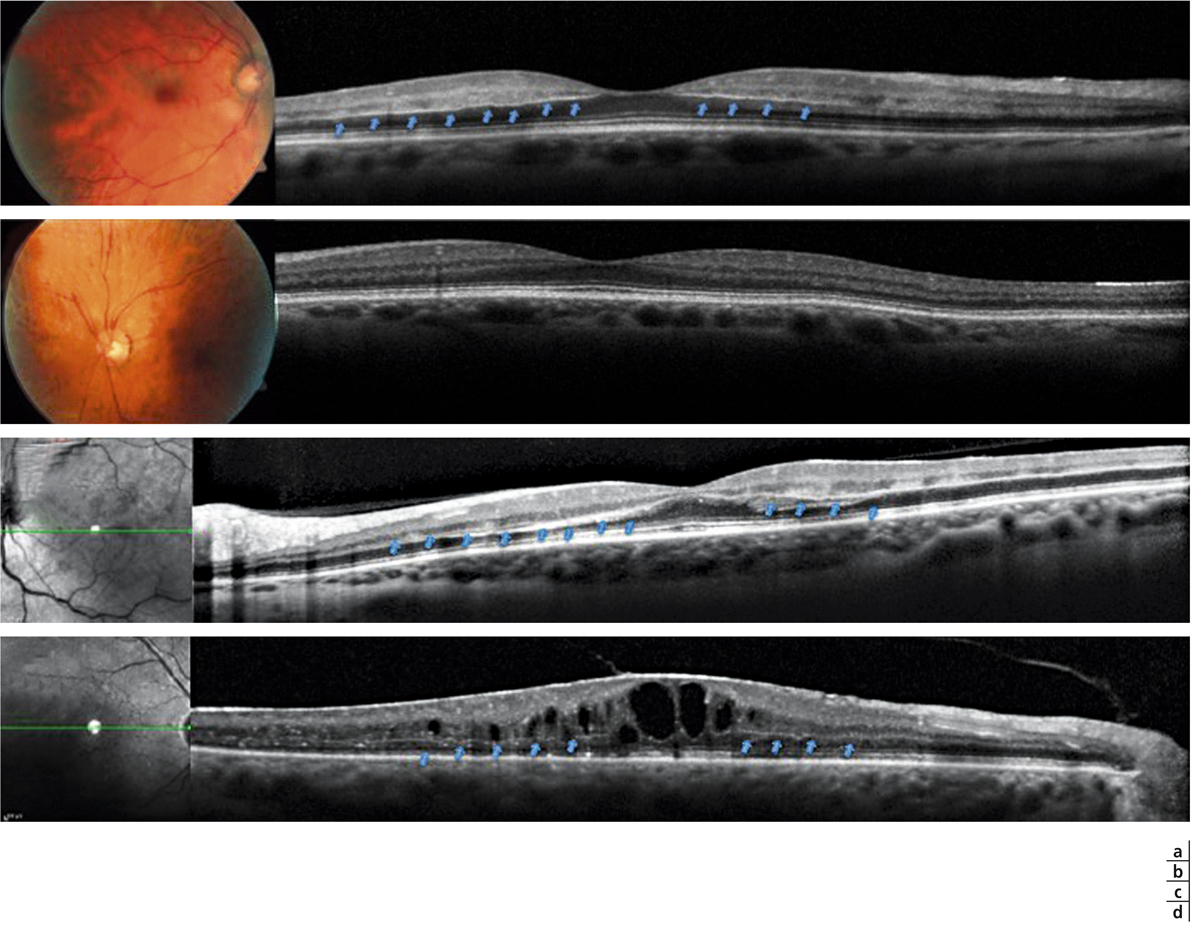
Fig. 5-108 Ischémie rétinienne en OCT.
Ligne hyper-réflective située au niveau de la partie interne de la couche plexiforme externe (flèches) chez un patient présentant une occlusion de l’artère centrale de la rétine (a) par rapport à l’œil controlatéral sain (b). Même aspect dans un œil présentant une occlusion de la veine centrale de la rétine sans œdème (c) et compliquée d’un œdème (d).
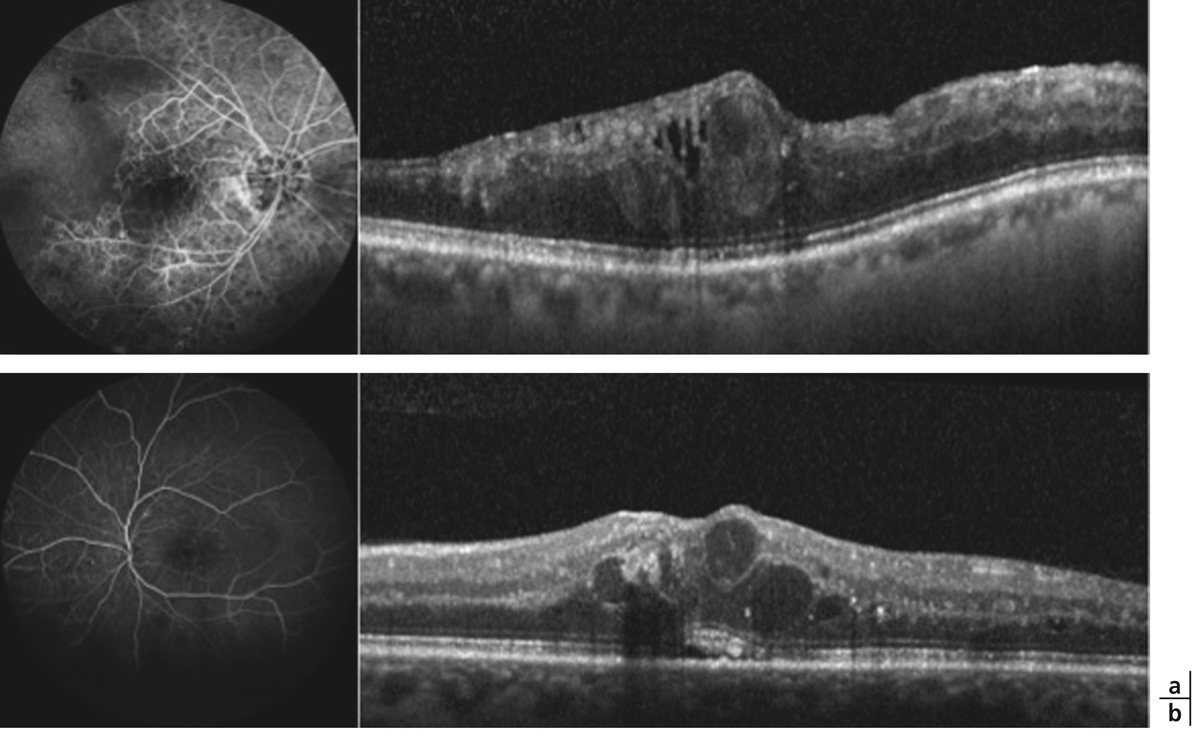
Fig. 5-109 Œdème maculaire ischémique et non ischémique en OCT.
Œdème maculaire cystoïde ischémique (a) et œdème maculaire non ischémique (b). Les œdèmes maculaires ischémiques et non ischémiques ont un aspect identique en OCT.
« Predicting the future is generally an invitation to look foolish. »
Steven Pinker
L’angiographie conventionnelle ne permet pas de véritable étude tridimensionnelle, car sa résolution en profondeur est faible. Un grand espoir repose donc sur l’amélioration de l’OCT conventionnel avec intégration d’une dimension fonctionnelle. Un pas dans cette direction est le développement de l’angio-OCT et le Doppler-OCT. Les systèmes d’angio-OCT reposent sur la détection de signal de décorrélation. Étant donné que les érythrocytes sont en mouvement dans la lumière vasculaire, leurs propriétés de réflexion à un point donné changent avec le temps. Des scanners successifs d’un même point peuvent donc permettre d’appréhender ces modifications. Sur une coupe OCT 3D, la visualisation d’éléments en mouvement en opposition aux structures statiques permet d’obtenir une carte tridimentionnelle de la vascularisation rétinienne et choroïdienne (fig. 5-110). Plusieurs approches fondées sur les données d’amplitude et de phase ont été réalisées et un système commercial est déjà disponible avec d’autres à venir. L’angio-OCT a déjà permis d’améliorer la compréhension des mécanismes vasculaires dans les télangiectasies maculaires de type 2 [6] et une meilleure caractérisation de la néovascularisation choroïdienne. Son intérêt clinique devra être confirmé dans le futur et de nombreuses améliorations peuvent être apportées. Les systèmes actuels doivent réduire leur résolution axiale de 15 μm, un sacrifice pour obtenir une vitesse de balayage suffisante [7].
Alors que l’angio-OCT estime la rhéologie rétinochoroïdienne en extrapolant le degré de décorrélation, ce qui peut sembler imprécis et ne fonctionnant que pour une gamme étroite de vitesse, le Doppler-OCT peut quant à lui quantifier le volume du flux sanguin. Il détecte le déphasage de particules permettant ainsi de mesurer la vitesse absolue d’écoulement du sang (fig. 5-111). De cette façon, le flux sanguin rétinien total a été mesuré avec une bonne corrélation entre le flux artériel et veineux indiquant des résultats valides [8]. En revanche, le Doppler-OCT nécessite des logiciels de traitement d’algorithmes très techniques ne pouvant pas être intégrés dans les dispositifs classiques d’angiographie [9].
Ces deux techniques possèdent un grand potentiel clinique et quelques améliorations permettront de dépasser les écueils évoqués. Cependant, ces techniques sont confrontées à une contrainte inhérente à leur fonctionnement : le mouvement. En effet pour être étudiées, les particules doivent avoir une certaine taille et une certaine vitesse. Par conséquent, l’étude d’une barrière hémato-rétinienne défectueuse doit reposer sur une nouvelle approche.
La technologie la plus prometteuse est le contrast-enhanced OCT dans laquelle des nanoparticules servent d’agents de contraste. Ces agents se présentent sous deux formes, passive et active. Les agents « passifs » dont le potentiel est le plus élevé sont des nanoparticules d’or. Définies par le rapport entre leur longueur (généralement autour de 20 nm) et leur diamètre, ces particules peuvent être réglées pour absorber la lumière à différentes longueurs d’onde. Dès lors que l’absorption est maximale dans la gamme des rayons émis par l’OCT, ces agents créent un contraste élevé au sein des tissus de la rétine. En pratique, si des nanoparticules d’or se retrouvaient dans le flux sanguin, il serait possible d’attester de l’intégrité de l’endothélium vasculaire et de l’ensemble du réseau vasculaire rétinien de manière dynamique en OCT. En outre, après le couplage des nanoparticules d’or à des anticorps ou des récepteurs solubles, il serait possible de réaliser des marquages spécifiques de composants tissulaires. Les nanoparticules marquées ont déjà été utilisées avec succès pour cibler intercellular adhesion molecule 1 (ICAM-1), une protéine transmembranaire hautement exprimée dans les tumeurs et les pathologies inflammatoires. Ce marquage a été réalisé dans un modèle de souris dans l’arthrite rhumatismale et pour détecter des séquences d’acide ribonucléique messager (ARNm) aberrantes dans des cellules tumorales humaines [10, 11]. Les agents de contraste « actifs » émettent un signal qui n’est habituellement pas détecté par les OCT. Ce signal repose sur des réactions photo-acoustiques et photothermiques, ce qui signifie l’émission par l’agent de contraste d’ondes sonores ou de chaleur en réponse à l’absorption de la lumière [12, 13]. Un inconvénient de cette technique est qu’un équipement supplémentaire est nécessaire, tandis que pour les agents dits passifs, il est possible de les intégrer aux OCT actuels. Le contrast-enhanced OCT est une voie de recherche non seulement pour l’imagerie, mais aussi en termes de thérapeutique. Néanmoins, les questions de biocompatibilité doivent être résolues et un long chemin nous sépare de l’application clinique en ophtalmologie. L’avènement du contrast-enhanced OCT associé à des nanoparticules pourrait définir l’imagerie moléculaire de demain avec une visualisation 3D des détails anatomiques et fonctionnels.
Fig. 5-110 Angio-OCT visualisation 3D de la vascularisation rétinienne et choroïdienne.
Angio-OCT (a), cliché du fond d’œil (b) coupe OCT selon la ligne blanche représentée en a. Les traits vert et rouge indiquent la profondeur des coupes d’angio-OCT, dont les résultats sont combinés et présentés en c. Angio-OCT avec un code couleur indiquant la profondeur des structures (c) : I et II illustrent les vaisseaux choroïdiens de grand et petit calibres, respectivement vert et bleu. La vascularisation superficielle rétinienne est visible sur la même coupe en rouge.
(Source : Blatter C, et al. Ultrahigh-speed non-invasive widefield angiography. J Biomed Opt 2012 ; 17 : 070505. Reproduction autorisée.)
Fig. 5-111 Doppler-OCT. Coupes réalisées en périphérie de la tête du nerf optique.
Chaque ligne représentée sur la rétinophotographie correspond à une coupe de Doppler-OCT.
(Source : Doblhoff-Dier V, et al. Measurement of the total retinal blood flow using dual beam Fourier-domain Doppler optical coherence tomography with orthogonal detection planes. Biomed Opt Express 2014 ; 5 : 630-42. Reproduction autorisée.)
[1] Klaassen I, Van Noorden CJ, Schlingemann RO. Molecular basis of the inner blood-retinal barrier and its breakdown in diabetic macular edema and other pathological conditions. Prog Retin Eye Res 2013 ; 34 : 19-48.
[2] Friedlander M. Fibrosis and diseases of the eye. J Clin Invest 2007 ; 117 : 576-86.
[3] Rose-Nussbaumer J, Li Y, Lin P, et al. Aqueous cell differentiation in anterior uveitis using fourier-domain optical coherence tomography. Invest Ophthalmol Vis Sci 2015 ; 56 : 1430-6.
[4] Saito M, Barbazetto IA, Spaide RF. Intravitreal cellular infiltrate imaged as punctate spots by spectral-domain optical coherence tomography in eyes with posterior segment inflammatory disease. Retina 2013 ; 33 : 559-65.
[5] Ko J, Kwon OW, Byeon SH. Optical coherence tomography predicts visual outcome in acute central retinal vein occlusion. Retina 2014 ; 34 : 1132-41.
[6] Spaide RF, Klancnik JM Jr., Cooney MJ. Retinal vascular layers in macular telangiectasia type 2 imaged by optical coherence tomographic angiography. JAMA Ophthalmol 2015 ; 133 : 66-73.
[7] Jia Y, Bailey ST, Hwang TS, et al. Quantitative optical coherence tomography angiography of vascular abnormalities in the living human eye. Proc Natl Acad Sci USA 2015 ; 112 : E2395-402.
[8] Doblhoff-Dier V, Schmetterer L, Vilser W, et al. Measurement of the total retinal blood flow using dual beam Fourier-domain Doppler optical coherence tomography with orthogonal detection planes. Biomed Opt Express 2014 ; 5 : 630-42.
[9] Leitgeb RA, Werkmeister RM, Blatter C, Schmetterer L. Doppler optical coherence tomography. Prog Retin Eye Res 2014 ; 41 : 26-43.
[10] Shao X, Zhang H, Rajian JR, et al. 125I-labeled gold nanorods for targeted imaging of inflammation. ACS Nano 2011 ; 5 : 8967-73.
[11] Kronig M, Walter M, Drendel V, et al. Cell type specific gene expression analysis of prostate needle biopsies resolves tumor tissue heterogeneity. Oncotarget 2015 ; 6 : 1302-14.
[12] Zhang EZ, Povazay B, Laufer J, et al. Multimodal photoacoustic and optical coherence tomography scanner using an all optical detection scheme for 3D morphological skin imaging. Biomed Opt Express 2011 ; 2 : 2202-15.
[13] Tucker-Schwartz JM, Meyer TA, Patil CA, et al. In vivo photothermal optical coherence tomography of gold nanorod contrast agents. Biomed Opt Express 2012 ; 3 : 2881-95.
A.-C. Bertaux
➤ L’évaluation médico-économique (EME) aide les décideurs à comparer et prioriser les stratégies de santé afin de garantir la qualité des soins tout en optimisant les ressources.
➤ L’EME permet de comparer des stratégies de santé entre elles pour en évaluer l’efficience (rapport coût–efficacité clinique).
➤ Les méthodes d’EME les plus utilisées sont les études coût–utilité (quality-adjusted life year [QALY]) et coût–efficacité.
L’évaluation médico-économique est un outil d’aide à la décision s’inscrivant dans un contexte de ressources limitées, permettant de prioriser les stratégies de santé afin de garantir la qualité des soins et d’optimiser l’allocation des ressources. Elle permet de comparer des stratégies diagnostiques, thérapeutiques ou de dépistage de manière à en évaluer l’efficience, c’est-à-dire le rapport entre les coûts et les résultats en termes d’efficacité clinique pour le patient (années de vie gagnées, qualité de vie, etc.). Il ne s’agit donc pas d’un seul calcul de coûts, mais de mesurer les différentiels de coûts et de résultats entre une stratégie évaluée et une stratégie qualifiée de référence.
En règle générale, le questionnement médico-économique se pose :
-
lors de l’introduction d’une technologie de santé nouvelle qui remet en cause la stratégie jusqu’alors considérée comme la stratégie de référence ;
-
lorsqu’on veut comparer des stratégies réalisées en routine pour lesquelles il n’existe pas de consensus et qui sont à l’origine de coûts différents (hospitalisation, traitement, suivi, etc.). Un exemple en est donné dans le tableau 5-8 dans le cas de l’œdème maculaire.
Les données médico-économiques peuvent ensuite être utilisées par les institutions nationales pour déterminer les tarifs des actes et produits de santé, c’est notamment l’objet du programme de recherche médico-economique (PRME), appel d’offres de la Direction générale de l’offre de soins.
On distingue plusieurs types d’études médico-économiques selon le critère de résultat utilisé, les études coût–utilité et coût–efficacité sont les principales méthodes. L’encadré 5-4
L’objectif de l’étude était de comparer l’intérêt médico-économique des différents traitements dans trois pathologies : l’œdème maculaire, l’occlusion de la branche veineuse rétinienne et l’occlusion de la veine centrale de la rétine.
• Pour l’œdème maculaire, les traitements comparés sont le laser, les anti-VEGF (ranibizumab, bévacizumab et pegaptanib), les corticoïdes (implant de dexaméthasone et injections intravitréennes de triamcinolone) et la chirurgie (vitrectomie).
• Dans l’occlusion de la branche veineuse rétinienne, les traitements comparés sont le laser, les anti-VEGF (ranibizumab, bévacizumab et pegaptanib) et les corticoïdes (implant de dexaméthasone et injections intravitréennes de triamcinolone).
• Dans l’occlusion de la veine centrale de la rétine, les stratégies comparées sont les anti-VEGF (ranibizumab, bévacizumab et pegaptanib) et les corticoïdes (implant de dexaméthasone et injections intravitréennes de triamcinolone).
Un modèle a permis de représenter chaque stratégie thérapeutique et les coûts associés sur une durée de traitement d’une année. Les données du modèle sont issues d’une revue de la littérature qui a recensé les essais cliniques de bonne qualité (randomisés, contrôlés avec une période de suivi) réalisés dans chacune des pathologies étudiées.
Deux études ont été réalisées :
• une analyse coût–efficacité, avec pour critère d’efficacité les lignes de vision. Le rapport entre les coûts de chaque stratégie et le critère d’efficacité a permis de calculer un ratio coût–efficacité différentiel en termes de coût par ligne de vision sauvée ;
• une analyse coût–utilité, dans le cadre de laquelle un coefficient de qualité de vie pondéré par les années de vie a été associé à chaque état de santé. Le rapport entre les coûts et l’utilité de chacune des stratégies a conduit au calcul d’un ratio en termes de coût par année de vie gagnée ajustée sur la qualité de vie (les QALY).
Dans la prise en charge de l’œdème maculaire, les coûts à 1 an varient de 1326 dollars pour le traitement par laser à 21 487 dollars pour le traitement par ranibizumab. Dans les deux études, la stratégie la plus efficiente, c’est-à-dire celle pour laquelle on gagne en efficacité/utilité pour un coût moins important, est le traitement par bévacizumab.
Dans la prise en charge de l’occlusion de la branche veineuse rétinienne, les coûts à 1 an varient de 1583 dollars pour les injections intravitréennes de triamcinolone à 28 685 dollars pour le traitement par ranibizumab. De la même manière que dans l’œdème maculaire, la stratégie la plus efficiente est le traitement par bévacizumab.
Dans la prise en charge de l’occlusion de la veine centrale de la rétine, les coûts pour une année de traitement varient de 1536 dollars pour les injections intravitréennes de triamcinolone à 21 464 dollars pour le ranibizumab. La stratégie la plus efficiente devient dans ce cas celle des injections intravitréennes de triamcinolone.
propose un exemple d’étude médico-économiques [1].
Les études coût–utilité ont pour critère de résultat les QALY (quality-adjusted life year), approche qualitative qui va consister à pondérer chaque année de vie gagnée par un critère entre 0 et 1 correspondant à la qualité de vie associée à un état de santé (0 équivalent au décès, 1 à la pleine santé). Il s’agit de l’analyse de référence en évaluation médico-économique. Elle est transposable et permet ainsi de comparer les résultats des évaluations médico-économiques entre elles et ainsi d’aider à prioriser les stratégies de santé.
Les études coût–efficacité reposent sur un critère d’efficacité clinique, de préférence final (les années de vie gagnées) qui peut néanmoins s’adapter au contexte clinique (cas de cécité par exemple).
L’évaluation médico-économique peut s’appuyer sur un essai clinique ou sur un modèle. La modélisation pallie l’absence de données issues d’essais cliniques intégrant l’ensemble des stratégies de prise en charge et des critères de mesure des résultats. Elle consiste à représenter schématiquement les stratégies de santé et permet d’étudier les résultats sur une période de suivi plus importante que dans le cadre d’un essai (horizon vie entière par exemple, incluant les conséquences à long terme des stratégies). Elle s’appuie sur l’agrégation de données issues de la littérature (méta-analyses ou essais cliniques) ou sur des bases de données de type registre.
Lorsque l’évaluation médico-économique est fondée sur un essai clinique, idéalement un essai randomisé contrôlé, le critère de résultat est évalué dans le cadre de l’essai. Les coûts à recueillir sont essentiellement les données de consommation de soins hospitaliers et ambulatoires ainsi que le coût de la procédure évaluée. Le recueil des coûts peut alors prendre plusieurs formes, selon le degré de précision requis et le point de vue de l’étude :
-
estimation du coût réel de la stratégie par le biais d’un recueil de type microcosting afin de valoriser de la manière la plus fine possible le coût de la prise en charge (recueil du temps dédié par chaque catégorie de personnel à la stratégie, coût des consommables, des médicaments, etc.) ;
-
recours aux bases de données hospitalières (programme de médicalisation des systèmes d’information [PMSI]) ou de l’assurance maladie (sous condition d’accès), aux nomenclatures de l’assurance maladie (tarification à l’activité [T2A], classification commune des actes médicaux [CCAM], etc.) ;
-
recours à la comptabilité analytique (direction financière).
[1] Smiddy WE. Economic consideration of macular edema therapies. Ophthalmology 2011 ; 118 : 1827-33.
Tableau 5-8 Comparaison des différentes modalités d’évaluation médico-économiques dans différentes causes d’œdème maculaire selon Smiddy [1].