Qu’est-ce qu’un œdème maculaire ?
C. Creuzot-Garcher, P. Massin
La définition de l’œdème maculaire (OM) a connu de profondes évolutions au fil des années tant en raison de l’amélioration des techniques d’exploration que de l’avancée dans la compréhension des mécanismes physiopathologiques impliqués dans son apparition (fig. 3-1). D’un simple épaississement rétinien maculaire constaté à l’ophtalmoscopie, l’OM a évolué vers un concept plus complexe, commun à de nombreuses pathologies, et dont la pathogénie implique de multiples mécanismes.
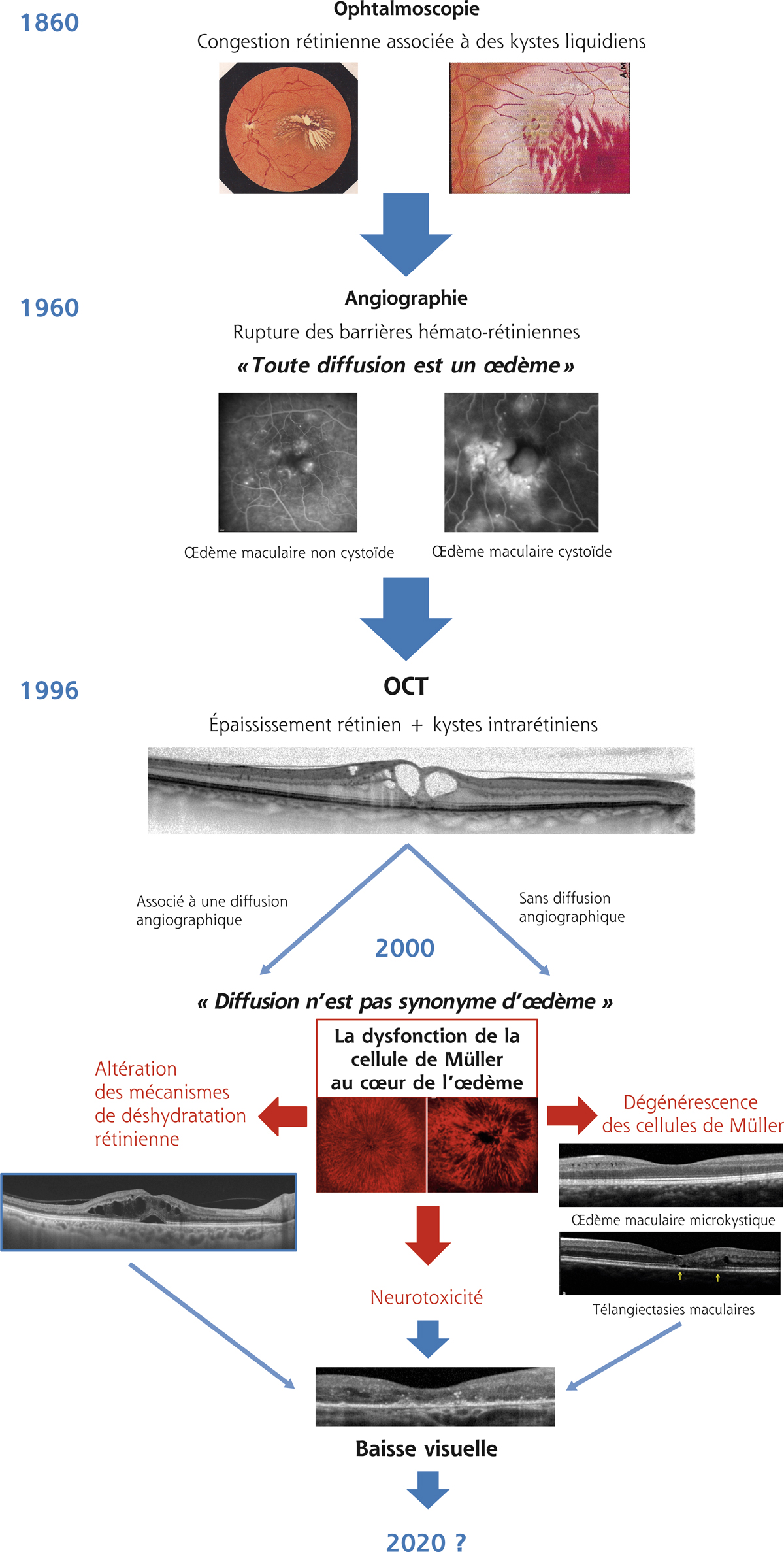
Fig. 3-1 Évolution de la définition de l’œdème maculaire au fil de l’acquisition des connaissances grâce à l’imagerie ou à la recherche fondamentale.
Le concept d’œdème maculaire est né avec les premiers ophtalmoscopes qui permettaient pour la première fois d’accéder à l’examen du fond d’œil. La description par Louis Auguste Desmarres de l’aspect d’œdème rétinien comme un aspect de « convexité des vaisseaux de la rétine » en 1858 est le premier pas dans la longue histoire de l’OM. Il introduisait, par la description de troubles de la circulation dans la « membrane rétinienne », la notion de congestion et de rétention liquidienne dans la rétine, assez vite complétée par la notion de kystes intrarétiniens. L’affection rétinienne était qualifiée d’œdème par analogie avec ce qui était constaté au niveau des tissus périphériques extra-oculaires. L’apparition de la vision stéréoscopique autorisa une troisième dimension permettant d’amener le concept d’« épaississement rétinien » qui reste encore le primum movens associé à l’OM, et de bien décrire l’aspect d’« œdème maculaire kystique » pouvant compliquer une occlusion veineuse, ou un diabète. Au terme de cette première période, l’OM était donc défini par un épaississement de la rétine, associé à des kystes intrarétiniens liquidiens.
L’angiographie à la fluorescéine a permis une avancée majeure dans notre connaissance de l’OM et de la compréhension de la pathogénie de l’OM. En visualisant la diffusion de la fluorescéine à partir des vaisseaux, elle a confirmé la notion de fuite à partir des vaisseaux rétiniens, et à un moindre degré choroïdiens. Cette diffusion du colorant, en dehors des vaisseaux ou à travers des jonctions de l’épithélium pigmentaire défaillantes, a permis de construire les notions de « rupture des barrières hémato-rétiniennes » (BHR), au risque de voir souvent confondre diffusion angiographique et OM. Le remplissage des logettes cystoïdes par la fluorescéine confirmait l’accumulation de liquide dans les kystes intrarétiniens, l’aspect pétaloïde étant expliqué par la disposition des fibres de Henlé entre lesquelles les kystes se formaient. Ces logettes étaient identifiées comme synonymes de gravité et de chronicité, mais l’explication des conséquences fonctionnelles restait encore imparfaite. Les anomalies observées par ailleurs (vascularite, ischémie, œdème papillaire) ont fait l’âge d’or de l’analyse sémiologique de l’angiographie. Les auteurs peinaient toutefois à définir des caractéristiques angiographiques pathognomoniques de telle ou telle étiologie car le point commun aux signes observés était souvent la rupture des BHR, non spécifique.
L’angiographie à la fluorescéine confortait le concept d’OM en tant que rétention intrarétinienne de liquide, mais soulevait néanmoins quelques interrogations : l’absence de parallélisme entre l’importance des diffusions (qui restaient difficiles à quantifier) et l’acuité visuelle, et l’absence de diffusion angiographique dans certains épaississements maculaires laissaient entrevoir une pathogénie de l’OM plus complexe qu’une simple rupture des barrières.
L’apparition de la tomographie à cohérence optique (optical coherence tomography [OCT]) a constitué probablement l’un des bouleversements les plus importants de l’histoire de l’ophtalmologie depuis l’angiographie, et de celle de l’OM en particulier. La précision obtenue avec successivement les OCT time domain puis spectral domain a enfin permis une évaluation tant quantitative que qualitative de l’épaississement rétinien. L’épaississement maculaire peut être précisément mesuré, même s’il devient alors évident qu’il n’est pas nécessairement synonyme de rupture de la BHR, ouvrant alors le vaste champ des aspects de « faux œdèmes maculaires » ou des aspects à la limite de l’œdème.
En effet, la confrontation de l’angiographie et de l’OCT a permis de confirmer que, dans bon nombre de cas, existait une corrélation entre les diffusions de fluorescéine observées en angiographie et l’importance de l’épaississement rétinien, et entre les logettes cystoïdes angiographiques et les kystes intrarétiniens en OCT. Mais l’observation de diffusion de fluorescéine, sans épaississement rétinien associé, mettait en lumière l’importance des mécanismes de déshydratation de la rétine, non observables en angiographie, et capables de compenser initialement la rupture des BHR. La définition de l’OM s’en trouvait modifiée, toute diffusion de fluorescéine, traduisant une rupture de la BHR interne, ne signifiant plus œdème.
À l’inverse, l’observation d’un épaississement maculaire et/ou de kystes intrarétiniens sans diffusion en angiographie suggérait qu’un épaississement maculaire ou la présence de logettes intrarétiniennes n’étaient pas synonymes d’accumulation liquidienne. Ainsi, il apparaissait que d’autres mécanismes que la rupture des BHR pouvaient être impliqués dans la genèse de l’épaississement maculaire, telle la traction dans les schisis rétiniens, et que les kystes intrarétiniens pouvaient être dus à une dégénérescence rétinienne, en particulier celle des cellules de Müller, comme dans les télangiectasies de type II ou les OM microkystiques.
Au vu des apports de l’OCT dans la visualisation objective de l’épaississement maculaire et des altérations des structures intrarétiniennes associées, on peut être surpris qu’aucune classification OCT de l’OM ne se soit réellement imposée, d’autant que l’épaississement maculaire est très souvent un critère essentiel d’évaluation d’efficacité clinique dans les études consacrées à l’OM. Une faible corrélation entre l’épaisseur maculaire et l’acuité visuelle a souvent été rapportée, soulignant bien que nombre d’autres acteurs que l’épaississement maculaire sont impliqués dans la baisse visuelle due à l’OM. L’analyse de plus en plus précise des structures intrarétiniennes grâce à la résolution croissante des nouvelles générations d’OCT permet d’appréhender le lien entre l’intégrité de ces structures et l’acuité visuelle. On peut raisonnablement penser que, à terme, le raffinement des analyses de l’OCT nous permettra de mieux prédire les capacités de récupération d’un patient donné à un temps donné en fonction des signes observés et des facteurs de mauvais pronostic identifiés.
On constate sur ce bref voyage dans l’histoire de l’œdème, au fil de l’amélioration des techniques d’imagerie, que la confrontation des différents examens est souvent essentielle à la pertinence du diagnostic clinique et à l’interprétation des signes observés. Les dernières années ont vu se développer le concept d’imagerie multimodale, indispensable à la compréhension de ce qui est observé et de son retentissement. L’OCT s’est imposé comme outil de référence dans la prise en charge de l’OM, l’angiographie gardant toutefois tout son intérêt pour définir précisément des zones de fuites ou détecter une ischémie maculaire. En effet, l’OCT ne met en évidence que les conséquences tissulaires de l’œdème et n’analyse pas réellement la composante vasculaire de celui-ci. Cette situation sera probablement en partie résolue avec l’angio-OCT qui permet l’identification des réseaux superficiels et profonds de la maille capillaire maculaire. Mais l’angio-OCT ne supplantera pas l’angiographie, car le contenu vasculaire qu’il montre n’est détecté que s’il est en mouvement.
Les progrès de l’imagerie ont grandement contribué à la compréhension du fonctionnement des BHR. La distinction entre œdèmes intra- et extracellulaires et le rôle clé joué par les cellules gliales de Müller ont été grandement renseignés par les données issues de la recherche fondamentale venant confirmer les hypothèses physiopathologiques. Les cellules gliales sont alors passées d’un simple statut de cellules de soutien à des acteurs essentiels dans la genèse et la régulation des phénomènes exsudatifs, angiogéniques et inflammatoires. La distinction entre œdèmes intra- et extracellulaire permet de mieux appréhender les phénomènes œdémateux sans diffusion. Ainsi, peuvent se combiner l’œdème intracellulaire, sans altération des BHR avec gonflement des cellules de Müller, et œdème extracellulaire, secondaire à une rupture des BHR interne et/ou externe. S’intriquent parfois la pression hydrostatique et la pression osmotique des différents secteurs, notamment dans l’OM diabétique ou les occlusions veineuses.
L’ensemble des ces mécanismes initiaux va s’accompagner d’une sécrétion de médiateurs inflammatoires réactionnels à la pathologie, mais également nécessaires à la réparation des altérations tissulaires et de la BHR. Les cellules rétiniennes, gliales en particulier, deviennent alors souvent les acteurs de leur propre attaque. Les dégâts observés au niveau des photorécepteurs sont donc aussi la résultante de l’effet délétère de tous ces mécanismes de défense. À cette atteinte des cellules de la rétine externe s’ajoute parfois celle des cellules neuronales dont les lésions définitives peuvent perdurer alors que l’œdème a disparu.
La plupart des études cliniques retiennent la mesure de l’acuité visuelle comme critère d’efficacité des thérapeutiques. Ce critère, qui semble logique puisque reflétant directement l’impact de la maladie pour le patient, cache mal ses faiblesses : une reproductibilité discutable, un reflet très imparfait du ressenti du patient (prenant mal en compte la sensibilité aux contrastes, les scotomes ou la vision des couleurs), aboutissant in fine à une représentation très quantitative d’une variable éminemment qualitative. L’apparition de techniques comme la micropérimétrie apportera probablement une évaluation plus qualitative de la fonction maculaire. On perçoit bien la nécessité de disposer d’outils fiables d’évaluation fonctionnelle en complément de la simple mesure de l’acuité visuelle. La prise en compte des données de qualité de vie semble également nécessaire dans notre choix des options thérapeutiques : une molécule qui s’accompagne d’une amélioration (ou du maintien) de l’acuité visuelle de l’ordre de 2 à 3 lettres après 2 ans d’injections mensuelles se doit nécessairement d’être confrontée à cette dimension, tant l’impact individuel (pour le patient) mais également sociétal est important.
Le caractère inexorable de la perte de vision chez un patient présentant un OM chronique en raison des conséquences sur la rétine externe a toutefois modifié nos pratiques : pour limiter la pérennité des événements biologiques délétères associés à l’œdème, on le traite plus précocement dans les occlusions veineuses, on prévient davantage l’OM du diabétique lors des traitements par photocoagulation panrétinienne, voire on envisage de limiter le laser pour préserver la fonction visuelle. On évolue enfin vers un concept plus proche de la meilleure acuité visuelle finale possible et pas simplement celui du meilleur gain visuel. La définition de véritables biomarqueurs d’imagerie devrait nous permettre de tendre vers une optimisation et une personnalisation des traitements de l’OM dont l’histoire n’est encore écrite que pour ses premiers chapitres.