F. Aptel
La pression qui règne à l’intérieur de l’œil résulte de l’équilibre s’établissant entre le contenu du globe (cristallin, vitré, uvée et humeur aqueuse) et son contenant (coque cornéosclérale).
L’humeur aqueuse étant essentiellement le seul élément du contenu de l’œil dont le volume peut varier rapidement, la pression intra-oculaire est en grande partie le fruit de l’équilibre s’établissant entre la sécrétion et l’élimination de l’humeur aqueuse.
L’humeur aqueuse est sécrétée dans la chambre postérieure par l’épithélium ciliaire, circule ensuite autour du cristallin et entre le cristallin et l’iris, puis en chambre antérieure, et est finalement éliminée en dehors de l’œil.
L’élimination de l’humeur aqueuse en dehors de l’œil se fait majoritairement par voie trabéculaire et, de façon accessoire mais néanmoins significative, au travers des tissus du stroma irien et de la base du corps ciliaire jusqu’à l’espace suprachoroïdien, constituant une voie d’élimination accessoire appelée voie uvéosclérale.
Le débit de la sécrétion aqueuse ainsi que la perméabilité du trabéculum et de la voie uvéosclérale sont régulés par des mécanismes multiples et complexes qui constituent des cibles d’action des médicaments utilisés pour abaisser la pression intra-oculaire.
La pression qui règne à l’intérieur de l’œil résulte de l’équilibre s’établissant entre le contenu du globe (cristallin, vitré, uvée et humeur aqueuse) et son contenant (coque cornéosclérale). Parmi ces différents éléments, l’humeur aqueuse (HA) est essentiellement la seule sujette à variations, et la pression intra-oculaire (PIO) est donc en grande partie le fruit de l’équilibre s’établissant entre la sécrétion et l’élimination de l’HA. Celle-ci est sécrétée dans la chambre postérieure par l’épithélium ciliaire qui recouvre les procès ciliaires, disposés de façon circulaire en arrière de l’iris. Elle chemine ensuite autour du cristallin et entre le cristallin et l’iris, puis en chambre antérieure et est finalement éliminée en dehors de l’œil. Cette élimination se fait majoritairement par voie trabéculaire et, de façon accessoire mais néanmoins significative, au travers des tissus du stroma irien et de la base du corps ciliaire jusqu’à l’espace suprachoroïdien (voie uvéosclérale). Le trabéculum, qui est situé à la jonction entre l’iris et la cornée (angle iridocornéen – AIC), est donc responsable de la majeure partie de l’évacuation de l’HA ; il joue schématiquement le rôle d’un filtre. Il est constitué de mailles de collagène séparées d’espaces vides qui permettent la filtration de l’HA. Celle-ci est ensuite collectée au niveau d’un canal circulaire qui épouse la circonférence de l’œil en arrière de la cornée (le canal de Schlemm) et qui s’abouche ensuite dans de nombreuses petites veines aqueuses, permettant ainsi le retour de l’HA dans la circulation sanguine générale (fig. 7-1).
La circulation de l’HA à l’intérieur de l’œil a différentes fonctions majeures. L’équilibre s’établissant entre la production et l’élimination permet de générer une PIO nécessaire au développement de l’œil lors de la vie embryonnaire, puis au maintien des structures oculaires en état de distension permanente tout au long de la vie. L’HA, milieu transparent et incolore d’indice de réfraction proche de 1,33, constitue un élément fondamental du système optique formé par l’œil, permettant la propagation des rayons lumineux dans l’œil et leur réfraction aux interfaces cornée-chambre antérieure et chambre antérieure-cristallin. Le flux permanent d’HA apporte différents substrats métaboliques ainsi que de l’oxygène dissous au cristallin, à l’endothélium cornéen et au trabéculum, qui sont des structures avasculaires, puis permet l’élimination des déchets issus du métabolisme. L’HA est également un vecteur permettant la circulation de différents composants intervenants dans les communications paracrines et les réponses immunitaires à l’intérieur de l’œil.
Le développement du corps ciliaire, ainsi que de la choroïde et de l’iris, est essentiellement réalisé à partir de la fin du 3e mois de la vie embryonnaire [11]. Le corps ciliaire, comme l’iris avec lequel il partage une origine embryologique et une organisation très voisine, a une double origine mésodermique et ectodermique.
Le corps ciliaire apparaît à la fin du 3e mois par la formation d’un plissement de la partie postérieure de la cupule optique, première ébauche des procès ciliaires. Ces plissements vont donner l’épithélium ciliaire avec ses deux assises cellulaires et, progressivement, se différencier en procès ciliaires, pars plana et ora serrata (5e mois).
La formation du mésenchyme oculaire est réalisée en trois phases. Une première vague de cellules issues de la crête neurale va migrer entre la surface de l’ectoderme et le cristallin pour donner l’endothélium cornéen et trabéculaire. Une deuxième vague de cellules issues de la crête neurale va migrer entre l’épithélium cornéen primitif et l’endothélium, pour former les kératocytes et le stroma cornéen. La troisième vague va se localiser entre le cristallin et l’endothélium cornéen pour se transformer plus tard en stroma irien et muscles ciliaires. Les muscles ciliaires s’individualisent à partir du mésoderme au 5e mois. La conception admise depuis Allen Brian et Bradley est celle d’un clivage progressif entre stroma irien et endothélium cornéen, plus ou moins complet pouvant alors expliquer les malformations embryologiques de l’AIC telles que l’embryotoxon ou le syndrome d’Axenfeld. La vascularisation de la choroïde, du corps ciliaire et de l’iris est également essentiellement d’origine mésodermique. Des vaisseaux pénètrent le stroma irien à partir d’un anneau irien externe (grand cercle vasculaire de l’iris). Par la suite, des artères ciliaires longues postérieures ayant atteint le corps ciliaire s’anastomosent avec les vaisseaux annulaires, formant ainsi le futur cercle artériel majeur de l’iris (ou grand cercle artériel de l’iris), origine de la vascularisation des procès ciliaires (tableau 7-1).

Tableau 7-1 Origines ectodermiques et mésodermiques du corps ciliaire et de l’iris.
Le corps ciliaire est une structure annulaire située en arrière de l’iris (voir fig. 7-1 et fig. 7-2, fig. 7-3, fig. 7-4) [54]. Le corps ciliaire, schématiquement triangulaire à la coupe, présente une face antérieure, une face postérieure et une face externe. La face antérieure représente le site d’insertion de l’iris latéralement, et délimite en arrière et en dedans le sulcus ciliaire. La face postérieure est le site d’insertion des procès ciliaires, responsables de la sécrétion de l’HA. La face postérieure se poursuit en arrière par une partie plissée (pars plicata) puis lisse (pars plana), et se termine à l’ora serata par la choroïde recouverte des différentes couches de la rétine périphérique. Enfin, la face externe adhère à la face interne de la sclère située en arrière du limbe cornéoscléral, créant ainsi un espace virtuel appelé espace supraciliaire. La longueur antéro-postérieure du corps ciliaire varie de 4,6 à 5,2 mm en nasal et de 5,6 à 6,3 mm en temporal [51]. La pars plana représente environ 75 % de la longueur totale du corps ciliaire, et la partie plissée les 25 % restants, expliquant ainsi le site d’abord chirurgical choisi lors de la réalisation des chirurgies du segment postérieur (vitrectomie, etc.) (3,5 à 4 mm en arrière du limbe). Le corps ciliaire est essentiellement composé d’une base musculaire, sur laquelle s’insèrent des digitations conjonctivovasculaires appelées procès ciliaires qui sont recouvertes d’un double épithélium ciliaire. Le corps ciliaire est assez abondement innervé par le système nerveux autonome.
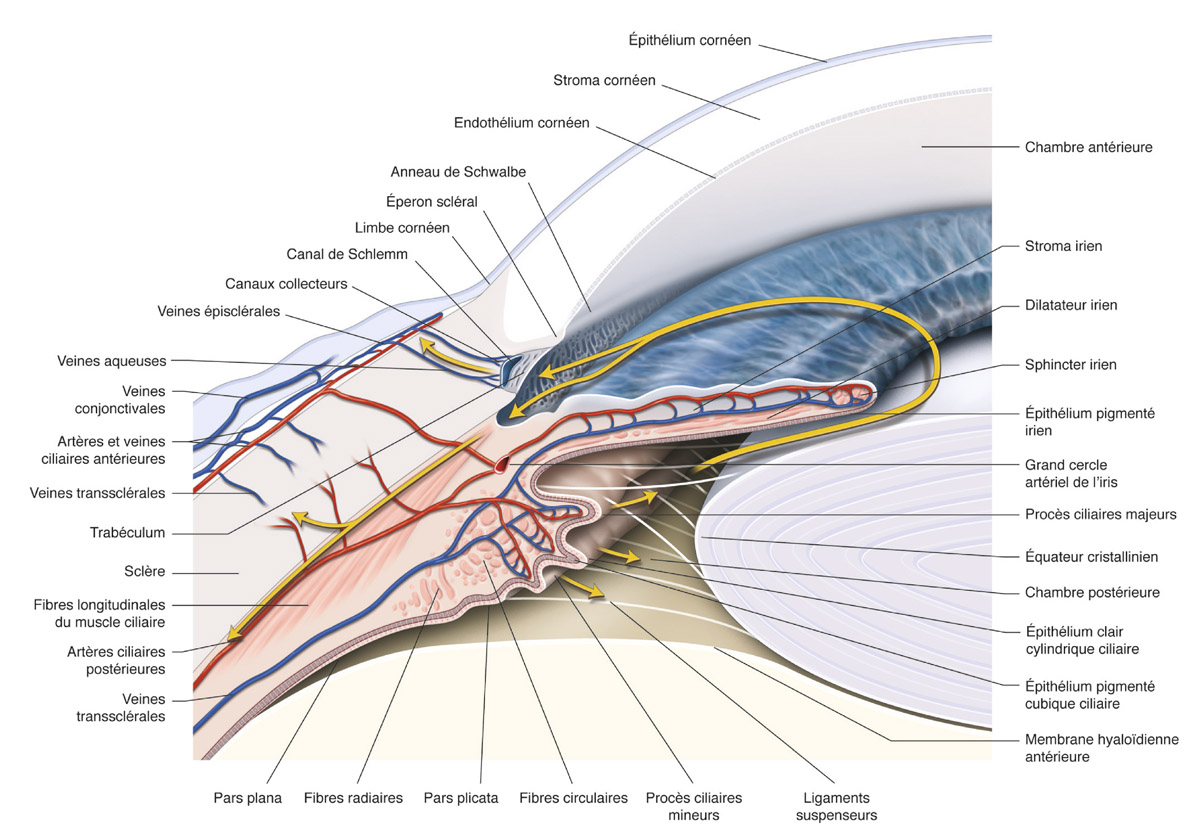
Fig. 7-1 Représentation schématique de la circulation de l’HA dans le segment antérieur de l’œil.
L’HA est sécrétée dans la chambre postérieure, remplit la chambre postérieure, passe par la pupille vers la chambre antérieure, circule en chambre antérieure sous l’influence du flux permanent ainsi que des mouvements de convection liés au gradient de température entre la cornée (température plus basse, mouvement descendant) et l’iris (température plus élevée, mouvement ascendant), puis quitte l’œil par les voies trabéculaire ou uvéosclérale, avant de rejoindre la circulation veineuse générale.

Fig. 7-2 Coupes histologiques dans un plan coronal d’un corps ciliaire de lapin (microscopie optique, coloration HES, obj. × 40, × 80, × 120, × 300).
En haut, de dehors en dedans : conjonctive et capsule de Tenon (1), sclère (2), espace supraciliaire (3), muscles cilaires (4), procès ciliaires (5), chambre postérieure (6). En bas : axe conjonctivovasculaire (1) (noter les capillaires tortueux), cellules pigmentées cubiques (2) et cellules claires cylindriques (3), chambre postérieure (4).

Fig. 7-3 Face postérieure d’un corps ciliaire de lapin (microscopie électronique à balayage, × 28, × 200, × 1 000, × 3 500).
En haut : pupille (1), face postérieure de l’iris (2), procès ciliaire (3), pars plicata (4). En bas : épithélium ciliaire.

Fig. 7-4 a, b. Vascularisation du corps ciliaire : représentation schématique de la vascularisation (a. vue de face ; b. vue de profil).

Fig. 7-4 c, d. Microscopie électronique à balayage après injection intravasculaire de résine et corrosion des tissus chez un lapin (× 20 et × 25).
La base du corps ciliaire, c’est-à-dire sa partie charnue, est essentiellement constituée de divers faisceaux musculaires, responsables notamment de l’accommodation. On distingue des fibres musculaires longitudinales, s’insérant sur l’éperon scléral, parfois nommées muscle de Brücke-Wallace, et des fibres musculaires circulaires parfois nommées muscle de Rouget-Müller. Les fibres longitudinales fixent le corps ciliaire sur la paroi de l’œil, au niveau de l’éperon scléral. Les fibres musculaires se dirigent ensuite en arrière et en dehors, se terminant dans la choroïde ou dans l’espace suprachoroïdien, au niveau de l’équateur du globe. Les fibres circulaires constituent la portion antérieure et interne du corps ciliaire et sont parallèles au limbe. La contraction de ces fibres circulaires permet de varier le diamètre du corps ciliaire et participe ainsi au processus d’accommodation. Les coupes histologiques montrent fréquemment chez l’homme la présence également de fibres obliques intermédiaires entre les deux contingents musculaires cités ci-dessus.
La formation de l’HA a lieu principalement au niveau des procès ciliaires, au nombre de 60 à 80 chez l’homme et composés d’un axe conjonctivovasculaire recouvert d’un épithélium bistratifié. Chaque procès ciliaire est centré sur une artériole, branche du grand cercle artériel de l’iris. Cette artériole se divise en deux ou trois rameaux qui donnent de nombreux capillaires fenêtrés auxquels fait suite un système veineux de retour qui gagne les vortiqueuses. L’endothélium et la membrane basale de ces vaisseaux sont fins, entourés de peu de péricytes, et relativement perméables aux liquides et molécules de petite et même de grande taille. Cette armature vasculaire centrale est au sein d’un stroma conjonctif axial qui sépare les vaisseaux de l’épithélium ciliaire. Le stroma est constitué de substance fondamentale (mucopolysaccharides, glycosaminoglycanes), de fibres de collagène essentiellement de type 3, d’élastine et de cellules conjonctivales (fibroblastes) [62]. Des éléments figurés du sang ou des cellules dérivées sont parfois retrouvés, témoignant de la perméabilité importante de l’endothélium capillaire, de la membrane basale de l’endothélium et des tissus conjonctifs voisins. L’épithélium ciliaire comporte deux couches cellulaires réunies par leur face apicale : une couche externe de cellules cubiques, fortement pigmentées, en regard du stroma des procès ciliaires dont elles sont séparées par une membrane basale, la limitante externe, et une couche interne de cellules cylindriques, non pigmentées, à noyau ovale et cytoplasme contenant de nombreux organites (appareil de Golgi, réticulum endoplasmique, mitochondries), en regard de la chambre postérieure dont elles sont séparées par la limitante interne. La membrane limitante interne, qui sépare ainsi l’épithélium ciliaire de la chambre postérieure, est constituée de glycoprotéines telles que les collagènes de types 1, 3 et 4, ainsi que de laminines [76]. D’autres protéines telles que la vimentine ou des canaux aqueux de type aquaporines 1 et 4 sont également exprimés au niveau de l’épithélium ciliaire non pigmenté [36, 134].
Les cellules de l’épithélium ciliaire non pigmenté sont unies entre elles par des complexes jonctionnels particulièrement développés sur leur membrane cytoplasmique apicale et latérale [93]. Des jonctions adhérentes, les desmosomes, assurent la cohésion mécanique des cellules entre elles. Des jonctions serrées imperméables, les zonulae occludentes (tight junctions) sont présentes seulement entre les cellules non pigmentées : elles assurent la cohésion cellulaire mais constituent surtout un système étanche qui, avec les membranes plasmiques des cellules, empêche la diffusion libre des substances de poids moléculaire moyen ou élevé entre le stroma ciliaire et la chambre postérieure (barrière hémato-aqueuse du corps ciliaire). Des jonctions communicantes (gap junctions) permettent le passage des petites molécules et des ions d’une cellule à l’autre, participant ainsi au système d’échange intercellulaire, et sont retrouvées entre les cellules pigmentées, entre les cellules non pigmentées, et entre les cellules pigmentées et non pigmentées. Il est à noter que des microvillosités des membranes plasmatiques apicales de deux couches cellulaires sont retrouvées en microscopie électronique, augmentant ainsi la surface de contact entre ces deux assises cellulaires.
La vascularisation de la région du corps ciliaire est de type anastomotique, issue notamment des artères ciliaires postérieures et des artères ciliaires antérieures, provenant toutes essentiellement ou exclusivement de l’artère ophtalmique [53, 66].
Les différents muscles de l’orbite reçoivent plusieurs artères, essentiellement mais pas exclusivement originaires de l’artère ophtalmique, qui abordent le muscle en arrière et le parcourent d’arrière en avant. Ces artères musculaires, elles-mêmes partiellement anastomosées entre elles, vont former à la partie antérieure des muscles les artères ciliaires antérieures (un à deux par muscle droit) qui perforent la sclère quelques millimètres en arrière du limbe. Les artères ciliaires antérieures sont essentiellement destinées à constituer le grand cercle artériel de l’iris lors de leur anastomose avec les artères ciliaires longues postérieures, mais fournissent également de petites branches vascularisant directement le corps ciliaire ou l’iris, ainsi que des branches récurrentes participant à la vascularisation de la choriocapillaire.
Les artères ciliaires longues postérieures sont généralement deux, mais leur nombre peut varier d’une à quatre. L’artère ciliaire longue latérale, relativement fixe, naît de l’artère ophtalmique, de sa partie latéro-optique ou optique. Elle suit la face latérale du nerf optique jusqu’au globe oculaire où elle perfore la sclère, environ 4 mm en dehors de la papille. Elle est en général de plus grand diamètre que son homologue médiale. L’artère ciliaire longue médiale naît de la partie latéro-optique, optique ou médio-optique de l’artère ophtalmique, parfois de l’artère musculaire inférieure. Elle va longer la face médiale du nerf optique jusqu’à la papille puis traverser la sclère. Chaque artère ciliaire longue chemine alors d’arrière en avant dans l’espace suprachoroïdien sur les méridiens de 3 heures et 9 heures, pour aller former le grand cercle artériel de l’iris.
L’anastomose des artères ciliaires antérieures et longues postérieures forme le grand cercle artériel de l’iris, situé dans la base du corps ciliaire juste en arrière de la racine de l’iris. Des études réalisées chez l’homme et chez des primates non humains semblent montrer que la contribution des artères ciliaires longues postérieures est prédominante. Chaque procès ciliaire est généralement vascularisé par deux artérioles ciliaires issues du grand cercle artériel, une antérieure et une postérieure. Les veines ciliaires se drainent essentiellement dans des veines situées à la jonction de la sclère et du corps ciliaire, se dirigeant ensuite postérieurement pour s’aboucher dans le lacis veineux de la choroïde. Une partie du drainage est également réalisée par des veinules qui perforent la sclère et se poursuivent par des veines épisclérales et conjonctivales.
Des terminaisons nerveuses du système sympathique et du système parasympathique innervent le corps ciliaire [101]. Les fibres du système sympathique proviennent du ganglion cervical supérieur et se terminent essentiellement au voisinage immédiat des vaisseaux ciliaires. En l’absence d’innervation de l’épithélium ciliaire, il est supposé que les neurotransmetteurs catécholaminergiques atteignent les récepteurs correspondants de l’épithélium ciliaire par cette voie. La stimulation du système sympathique augmente la sécrétion ciliaire (voir plus loin « Régulation de la formation de l’humeur aqueuse »). Les fibres du système parasympapthique proviennent du noyau d’Edinger-Westphal et se terminent essentiellement dans les muscles ciliaires. L’acétylcholine produite par la stimulation du système parasympathique stimule les récepteurs cholinergiques des fibres musculaires. La contraction du muscle ciliaire augmentera ainsi l’élimination d’HA, à la fois par voie trabéculaire et uvéosclérale.
La composition de l’HA diffère de celle du plasma du fait de deux caractéristiques physiologiques du segment antérieur de l’œil :
l’existence d’une barrière anatomique et fonctionnelle entre le sang et l’HA (barrière hémato-aqueuse, essentiellement constituée par l’endothélium des vaisseaux iriens et par les systèmes jonctionnels et la membrane plasmatique des cellules non pigmentées de l’épithélium irien) s’opposant au passage des molécules de grande taille ;
l’existence de systèmes de transport actif de petits composés organiques ou ioniques au niveau de l’épithélium ciliaire [12, 65]. L’HA, transparente, est ainsi très riche en eau, dépourvue d’éléments figurés, pauvre en protéines et concentrée en certains nutriments et vitamines comme l’acide ascorbique [62]. Les caractéristiques physicochimiques principales de l’HA sont résumées dans le tableau 7-2. Il est à noter que la composition de l’HA dépend des mécanismes mis en jeu lors de sa formation mais aussi des échanges avec les tissus qu’elle baigne : corps ciliaire, iris, cristallin, cornée, constituants de l’angle iridocornéen. De ce fait, l’HA de la chambre postérieure est sensiblement différente de l’HA de la chambre antérieure.
Schématiquement, l’HA est légèrement hypertonique, acide ; comparée au plasma, elle présente un excès majeur en acide ascorbique, un excès modeste en acide lactique et en ion chlore, ainsi qu’un déficit modeste en sodium, bicarbonate, dioxyde de carbone et glucose.
L’acide ascorbique possède des propriétés antioxydantes et peut aider à protéger les structures du segment antérieur des dommages potentiels des ultraviolets [94]. Les mammifères nocturnes ont ainsi des concentrations d’acide ascorbique dans l’HA environ 35 fois plus faibles que les mammifères diurnes, tel l’homme [64]. L’endothélium cornéen consomme pour son métabolisme du glucose et de l’oxygène, et rejette de l’acide lactique et du dioxyde de carbone [43]. Le cristallin consomme pour son métabolisme du glucose, des acides aminés et du potassium, et rejette de l’acide lactique et de l’acide pyruvique [35]. La composition de l’HA des patients phakes et des patients pseudo-phakes ne diffère cependant pas significativement. Des échanges de glucose et d’acides aminés entre l’HA et le vitré ont également été mis en évidence.
Différents composants possédant des activités procoagulantes ou fibrinolytiques ont été retrouvés dans l’HA [60]. Plusieurs hormones pouvant agir selon un mode paracrine ont également été identifiées dans l’HA : catécholamine, norépinéphrine, oxyde nitrique, etc. [32]. Enfin, il semble que l’épithélium ciliaire produise différents médiateurs qui agissent sur les cellules endothéliales trabéculaires pour réguler les fonctions de synthèse et de remodelage de la matrice extracellulaire, ainsi que les fonctions de contractilité et d’adhésion de ces cellules [32, 107]. L’hypothèse d’une régulation de l’évacuation de l’HA par voie trabéculaire et voie uvéosclérale par l’intermédiaire de molécules produites par l’épithélium ciliaire sous l’influence de différents stimuli et de l’innervation autonome, et cheminant ensuite dans le flux d’HA, a ainsi été émise.

Tableau 7-2 Caractéristiques physicochimiques de l’HA.
L’HA est essentiellement sécrétée par la portion antérieure du corps ciliaire, c’est-à-dire par l’épithélium ciliaire bordant les cryptes, les parties latérales et les crêtes formées par les procès ciliaires principaux. Cette portion du corps ciliaire présente en effet, en microscopie électronique, des digitations nombreuses entre les deux assises cellulaires, un réticulum endoplasmique granuleux et des mitochondries abondants dans le cytoplasme des cellules non pigmentées, de nombreuses fenestrations de l’endothélium des capillaires ciliaires, et de nombreuses jonctions communicantes entre les deux assises cellulaires, témoignant probablement de son caractère fonctionnel (sécrétant). A contrario, les procès ciliaires mineurs (postérieurs) et surtout la partie plus postérieure de la pars plicata semblent être peu ou pas fonctionnels.
Les capillaires du stroma ciliaire sont fenêtrés, ce qui permet des échanges rapides et relativement libres des solutés entre le sang et le stroma ciliaire : l’eau et les substances plasmatiques sortent des capillaires ciliaires, envahissent le stroma et peuvent pénétrer dans les espaces intercellulaires, entre les cellules pigmentées, jusqu’aux jonctions serrées des cellules non pigmentées. Leur filtration dépend des forces s’exerçant de part et d’autre de la paroi capillaire. Elle est donc directement liée à la pression hydrostatique du capillaire, celle du tissu stromal, la pression osmotique du capillaire et la pression osmotique du tissu stromal, selon la loi de Starling :
F = C × (Phc – Pht) + (Posmt – Posmc)
où F est le flux d’HA, C la constante, Phc la pression hydrostatique capillaire, Pht la pression hydrostatique tissulaire, Posmt la pression osmotique tissulaire et Posmc la pression osmotique capillaire.
Au niveau de l’épithélium ciliaire, plusieurs mécanismes vont permettre aux éléments sanguins, présents dans le stroma et les espaces intercellulaires, de traverser les membranes cellulaires, franchissant ainsi la barrière hémato-aqueuse pour produire l’HA dans la chambre postérieure. Certains sont passifs, ne demandant aucune énergie d’origine métabolique, tandis que d’autres sont actifs. La diffusion est un mécanisme passif tendant à équilibrer les concentrations de certaines substances essentiellement liposolubles de part et d’autre d’une membrane semi-perméable. L’ultrafiltration, qui intéresse essentiellement l’eau et les substances hydrosolubles, fait également partie des mécanismes passifs, bien qu’elle nécessite une force orientant le sens de traversée de la membrane. Les mécanismes actifs requièrent, en revanche, une énergie métabolique, fournie par des systèmes enzymatiques (pompes énergie-dépendantes hydrolysant des molécules d’adénosine triphosphate), pour pouvoir transférer à travers la barrière certaines substances spécifiques, en s’opposant éventuellement à un gradient de concentration.
La diffusion simple est la diffusion passive d’éléments au travers de la membrane plasmique dans le sens des concentrations fortes vers les concentrations faibles, jusqu’à équilibre des concentrations de part et d’autre de la membrane. La diffusion libre est un phénomène physique passif. Ce type de passage n’est possible que si la molécule est « soluble » dans la membrane phospholipidique, c’est-à-dire qu’elle peut traverser directement la bicouche de phospholipides. La molécule doit donc être hydrophobe (apolaire) ou, si elle est hydrophile (polaire), être suffisamment petite. Quelques substances hydrosolubles traversent également la membrane plasmique, sous le seul effet du gradient de concentration, probablement au travers de « pores » situés dans sa partie protéinique. La diffusion simple est caractérisée par une absence de saturation, une vitesse de diffusion dépendante de la différence de concentration (gradient de concentration, ou électrochimique pour des ions) mais aussi de la taille de la protéine et de la température, une absence de spécificité (ce gradient de concentration n’est pas régulé), et une certaine lenteur car les molécules doivent se dissoudre dans la double couche de phospholipides avant de passer de l’autre côté de la membrane. Ce mécanisme est lent par rapport à la diffusion facilitée.
Certaines substances, comme le glucose, la plupart des acides aminés et l’acide ascorbique, traversent la membrane plasmique de façon beaucoup plus rapide que des substances de même famille, de poids moléculaire voisin mais de structure différente. Pour ces substances, la vitesse de traversée de la membrane augmente avec leur concentration plasmatique jusqu’à un certain seuil au-delà duquel elle se stabilise. Ces constatations sont en faveur de la mise en jeu d’un transporteur membranaire de nature protéique, qui se lie transitoirement à la substance lors de son passage transmembranaire pour la déposer de l’autre côté de la membrane : ce mécanisme est appelé diffusion facilitée. La saturation du transporteur pour des concentrations trop élevées de la substance explique la limitation de la vitesse de son passage. Ce mode de transport est donc spécifique, rapide et régulé, les protéines de canal ayant la capacité de se fermer. Il ne consomme pas d’énergie et ne peut donc pas s’opposer à un gradient de concentration.
Elle décrit la séparation de molécules biologiques ou de particules contenues dans un liquide en fonction de leur taille moléculaire, par le passage de ce liquide à travers des membranes sélectives pourvues des pores dont le diamètre assure la sélection. L’ultrafiltration au niveau ciliaire est rendue possible par la constitution même de la barrière hémato-aqueuse, filtre constitué d’une couche cellulaire continue unie par des jonctions serrées et possédant des pores au niveau de la lame basale d’un diamètre de l’ordre de 10 à 20 nm. L’ultrafiltration nécessite cependant une force pour amener les molécules à franchir le filtre. Cette force est fournie par le gradient de pression existant de part et d’autre du filtre ; elle dépend essentiellement de la pression hydrostatique qui provient des capillaires et s’applique du stroma vers la chambre postérieure diminuée de la PIO et de la pression osmotique engendrée par les substances en solution présentes dans le stroma, qui s’exercent toutes deux en sens inverse ; la pression osmotique est due principalement aux protéines (pression oncotique) dont la concentration dans le stroma est élevée compte tenu de leur libre passage à travers les capillaires fenêtrés. L’ultrafiltration explique la pauvreté de l’HA en protéines qui sont retenues par le filtre dans les conditions normales et, au contraire, l’augmentation de la concentration protéique en cas de rupture de la barrière hémato-aqueuse, à l’origine de l’effet Tyndall observé en biomicroscopie.
La part de l’ultrafiltration dans la formation de l’HA est mineure, réalisant environ 10 à 15 % de la production totale en conditions physiologiques. En effet, les différences de pression hydrostatique et oncotique de part et d’autre de l’épithélium ciliaire sont à l’origine d’une force résultante faible vers la chambre postérieure, qui ne permet pas une production significative d’HA. Certains auteurs ont même supposé que dans les conditions physiologiques habituelles, les gradients de pression hydrostatique et oncotique aboutissaient au contraire à une réabsorption permanente d’une fraction de l’HA sécrétée par les mécanismes actifs [17].
Le transport actif implique le transfert d’une molécule contre un gradient de concentration. Il y a donc nécessité de fournir de l’énergie car ce transport n’est pas spontané. Il est considéré comme primaire si l’énergie provient de l’hydrolyse d’un nucléotide triphosphate ou secondaire lorsque l’énergie provient du gradient électrochimique d’un autre élément que celui transporté (on parle alors de couplage).
La sécrétion active d’HA est essentiellement fondée sur un transport actif de certains ions du plasma jusque dans la chambre postérieure contre un gradient de concentration. Elle aboutit ainsi à une concentration plus élevée de ces ions, d’où une osmolarité plus importante de l’HA que celle du plasma, avec ensuite un appel osmotique d’eau (diffusion de molécules d’eau au travers d’une membrane semi-perméable du compartiment dont la concentration en produits dissous est la plus faible – ici le plasma – vers le compartiment dont la concentration en produits dissous est la plus élevée – la chambre postérieure) (fig. 7-5).

Fig. 7-5 Mécanismes jonctionnels et enzymatiques des transports ioniques et liquidiens au travers de l’épithélium ciliaire. 1 : Cellules claires ; 2 : Cellules pigmentées ; 3 : Lame basale ; 4 : Stroma (tissu conjonctif lâche) ; 5 : Sang (plasma)

Fig. 7-5 Mécanismes jonctionnels et enzymatiques des transports ioniques et liquidiens au travers de l’épithélium ciliaire. (suite)
Les différents ions diffusent assez librement du plasma vers le stroma des procès ciliaires, par l’intermédiaire des capillaires fenêtrés. La lame basale des cellules pigmentées semble également être relativement perméable aux différents ions. Au niveau de la membrane plasmatique basale et latérale des cellules pigmentées, différents canaux et transporteurs protéiques permettent le passage des ions sodium dans le cytosol des cellules pigmentées. Les antiports Na+/H+ et Cl–/HCO3– permettent le passage d’un ion sodium en échange d’un proton, et d’un ion chlore en échange d’un ion bicarbonate, respectivement. Le cotransporteur Na-K-2Cl permet le passage simultané d’ions sodium, potassium et chlore de façon à équilibrer les charges. Le rôle du passage d’ions chlore est probablement aussi important que celui du transport d’ions sodium. Ainsi, chez des lapins, il a été montré que des agonistes de récepteurs à l’adénosine A3 augmentaient simultanément le passage d’ions chlore et la PIO, et qu’a contrario, des antagonistes de ces récepteurs diminuaient simultanément le passage d’ions chlore et la PIO. Chez des bovins, il a été montré qu’un dérivé de l’acide disulfonique (4,4′-diisothiocyanatostilbene-2,2′-disulfonic acid – DIDS) inhibiteur de l’antiport Cl–/HCO3– et de canaux chlore, ainsi qu’un dérivé de l’acide benzoïque inhibiteur des canaux chlore de l’épithélium non pigmenté diminuaient respectivement de 55 et 25 % la production d’HA. De même, chez des bovins, le bumétanide (inhibiteur du cotransporteur Na-K-2Cl) et le furosémide (inhibiteur de transporteurs anioniques) réduisaient respectivement de 35 et 45 % la production d’HA. Enfin, différentes catécholamines telles que l’épinéphrine, la norépinéphrine et la dopamine qui stimulent le cotransporteur Na-K-2Cl augmentent la production d’HA.
Différentes isoenzymes de l’anhydrase carbonique (2, 4 et 12) sont présentes en abondance au niveau de la face intracellulaire de la membrane plasmatique basale et latérale des cellules pigmentées. Cette enzyme favorise la transformation du CO2 et de l’H2O en HCO3– et H+, et fournit donc des protons et ions bicarbonate nécessaires au passage des ions sodium et chlore.
Un échange serait permis par un antiport Na+/H+ aux pôles apicaux des cellules non pigmentées (gap junction), la production d’ions H+ étant catalysée par l’anhydrase carbonique. Un ion sodium pénétrerait dans la cellule non pigmentée en échange d’un ion H+. Différents canaux chlore transmembranaires permettraient aux ions chlore de passer des cellules pigmentées aux cellules non pigmentées. L’enzyme anhydrase carbonique peut être inhibée médicalement (inhibiteurs de l’anhydrase carbonique).
L’enzyme Na+/K+-ATPase présente essentiellement à la face intracellulaire de la membrane plasmatique basale des cellules pigmentées, en transformant l’ATP (adénosine triphosphate) en ADP (adénosine diphosphate), fournit l’énergie nécessaire pour le transfert du sodium vers la chambre postérieure [20]. La Na+/K+-ATPase pompe les ions Na+ situés à l’intérieur des cellules non pigmentées et les rejette hors du pôle basal de ces cellules ; en même temps, elle mobilise les ions K+ de l’HA et permet leur passage intracellulaire. La pompe sodium-potassium transporte plus d’ions Na+ que d’ions K+ (trois ions Na+ sont échangés avec deux ions K+) [82]. La diffusion d’ions chlore des cellules non pigmentées vers la chambre postérieure par des canaux chlore transmembranaires permet de maintenir l’électroneutralité. L’inhibition de l’enzyme Na+/K+-ATPase par un glycoside cardiotonique (par exemple l’ouabaïne) ou par le vanadate diminue la production d’HA et la PIO chez l’homme et chez l’animal, confirmant que le transport actif du potassium du plasma vers la chambre postérieure est le mécanisme prédominant de sécrétion de l’HA [13, 14, 20].
L’augmentation de concentration des ions Na+ dans les espaces intercellulaires en aval des jonctions serrées et dans les invaginations membranaires du pôle basal des cellules non pigmentées crée un environnement hyperosmotique et, par conséquent, un appel d’eau à partir de l’intérieur des cellules. La diffusion de l’eau est facilitée par des protéines transmembranaires de type aquaporine, présentes aussi bien au niveau des cellules pigmentées et non pigmentées.
Un résumé des différents facteurs et situations pouvant aboutir à une diminution de la production d’HA est présenté dans le tableau 7-3.

Tableau 7-3 Facteurs pouvant aboutir à une réduction de la sécrétion aqueuse.
Des études fondées sur la mesure de décroissance dans le temps de la concentration d’un traceur ou d’un colorant injecté en chambre antérieure ont estimé qu’environ 1 à 1,5 % du volume de la chambre antérieure était renouvelé chaque minute [16, 42, 78]. La demi-vie d’un colorant hydrosoluble et de petit poids moléculaire, donc éliminé librement par les voies d’évacuation de l’HA, est ainsi d’environ 2 à 3 heures. Une étude fondée sur la technique de fluorophotométrie, qui consiste à faire pénétrer par voie transcornéenne de la fluorescéine en chambre antérieure puis à étudier grâce à la fluorescence émise la décroissance de sa concentration dans le temps, a ainsi retrouvé chez 519 sujets sains un débit de sécrétion aqueuse de 3,0 ± 0,8 µL/min entre 8 heures et midi. La distribution de ce paramètre dans la population était de type gaussien, avec 95 % des valeurs comprises entre 1,5 et 4,5 µL/min [22].
Il existe un rythme nycthéméral de la sécrétion d’HA, avec un débit plus important en période diurne et plus faible en période nocturne. Ainsi, dans l’étude mentionnée ci-dessus, le débit estimé par fluorophotométrie diminuait à 2,7 ± 0,6 µL/min entre 14 heures et 18 heures (490 sujets) et à 1,3 ± 0,4 µL/min la nuit entre minuit et 6 heures [22]. Les mécanismes exacts aboutissant au caractère nycthéméral de la sécrétion de l’HA ne sont pas exactement connus. Il semble néanmoins que l’activité diurne du système sympathique soit le déterminant majeur de ces variations. Ainsi, les antagonistes des récepteurs bêta-adrénergiques (bêtabloquants) ont peu ou pas d’effet sur la sécrétion aqueuse la nuit. A contrario, certains agonistes non sélectifs des récepteurs adrénergiques, tels que l’épinéphrine, augmentent nettement la sécrétion aqueuse lorsqu’ils sont administrés la nuit mais ont peu d’effet en période diurne. Une étude a par exemple mis en évidence une augmentation de 47 % de la sécrétion aqueuse après administration topique d’épinéphrine la nuit, mais de seulement 19 % après instillation de ce même agent le jour. Des résultats comparables, mais avec des écarts plus faibles, sont retrouvés après instillation de norépinéphrine.
L’innervation sympathique du corps ciliaire provient de la chaîne sympathique cervicale et parvient à l’œil par les nerfs ciliaires. Elle est présente dans les vaisseaux sanguins uvéaux, la base et le stroma des procès ciliaires. L’épithélium ciliaire possède de nombreux récepteurs aux médiateurs du système sympathique, mais ces récepteurs ne sont a priori pas en contact avec des fibres nerveuses du système sympathique. Certains auteurs ont émis l’hypothèse que la stimulation des nerfs du système sympathique innervant l’œil pouvait, par l’intermédiaire des récepteurs situés dans les artérioles et capillaires ciliaires, aboutir à une libération sanguine de médiateurs qui gagneraient ensuite l’épithélium ciliaire après avoir traversé les capillaires fenêtrés et le stroma ciliaire (action paracrine). Ainsi, la stimulation des chaînes sympathiques cervicales augmente la sécrétion aqueuse chez le singe, mais de façon modeste. D’autres auteurs ont suggéré que l’action du système sympathique sur l’épithélium ciliaire était essentiellement réalisée par des catécholamines produites par la glande surrénale et transportées par voie humorale (action endocrine).
Les effets des agonistes et antagonistes adrénergiques sont clairement établis. Les agonistes non sélectifs tels que l’épinéphrine (α1 et α2, β1 et β2) stimulent la sécrétion aqueuse lorsqu’ils sont administrés ponctuellement. Une administration à plus long terme peut en revanche réduire la sécrétion aqueuse, probablement par stimulation préférentielle des récepteurs α [80, 81]. Les agonistes bêta-sélectifs (isoprotérénol, terbutaline, salbutamol) stimulent la production d’HA chez le singe sous anesthésie générale et chez l’homme durant le sommeil [19, 45]. Chez l’homme éveillé, les agonistes β n’ont en revanche pas d’effet sur la sécrétion d’HA [111].
On peut donc supposer que la formation d’HA est à un niveau basal la nuit, non stimulée, alors qu’elle augmente durant le jour par activation des récepteurs bêta secondaire à une augmentation d’activité du système nerveux sympathique et/ou à une augmentation de la concentration des catécholamines circulantes. La stimulation des récepteurs bêta-adrénergiques augmente la production intracellulaire d’AMP cyclique, aboutissant à une augmentation de l’hydrolyse de l’adénosine triphosphate en adénosine diphosphate, augmentant notamment l’activité de l’enzyme Na+/K+-ATPase de la membrane plasmatique des cellules non pigmentées de l’épithélium ciliaire, et donc l’excrétion de sodium en chambre postérieure et la formation d’HA [31, 106]. Les antagonistes non sélectifs bêta 1 et 2 (timolol, lévobunolol, métipranolol) diminuent la sécrétion aqueuse le jour mais pas la nuit [31, 34, 106]. Les antagonistes sélectifs bêta 1 (bétaxolol) ont le même effet [23, 126].
Les agonistes et antagonistes α1 ont peu d’effet sur la formation d’HA [68, 69]. Les agonistes sélectifs α2 (clonidine, apraclonidine, brimonidine) réduisent, en revanche, la formation d’HA [46]. Certaines études ont néanmoins montré qu’une administration prolongée de brimonidine semblait en fait avoir plus d’effet sur l’augmentation de l’élimination de l’HA par voie uvéosclérale que sur la diminution de la sécrétion aqueuse.
L’innervation parasympathique de l’œil provient essentiellement du noyau d’Edinger-Westphal en suivant le trajet du nerf oculomoteur commun jusqu’au ganglion ciliaire où les fibres font relais, avant d’emprunter les nerfs ciliaires. Un second contingent de fibres parasympathiques emprunte le trajet du nerf facial pour parvenir, avec ce dernier, au ganglion ptérygopalatin où elles font relais avant de se diriger vers l’œil. Si la stimulation des fibres parasympathiques, véhiculées par la IIIe paire et se dirigeant vers l’œil, ou la stimulation des récepteurs du système parasympathique par des agonistes administrés par voie topique entraîne des modifications de l’élimination de l’HA par contraction des fibres musculaires ciliaires s’insérant sur l’éperon scléral, l’effet du système parasympathique sur la sécrétion aqueuse n’est pas précisément connu, même s’il semble être de toute façon mineur. Des lésions de la voie parasympathique empruntant le nerf facial et le ganglion ptérygopalatin diminuent, en revanche, la PIO chez les sujets sains comme chez les patients glaucomateux, la stimulation expérimentale ayant l’effet contraire chez les singes. L’élévation de la sécrétion aqueuse qui peut être rencontrée lors de la stimulation du système parasympathique peut être liée à la vasodilatation induite et à l’augmentation secondaire du flux sanguin à destinée choroïdienne, irienne et ciliaire. Les effets des agonistes muscariniques (substances qui reproduisent les effets de la stimulation postganglionnaire du parasympathique) sur la formation d’HA sont contradictoires avec des études rapportant la diminution de production, l’absence d’effet ou l’augmentation de production.
L’existence de récepteurs sérotoninergiques de type 5-HT1A et 5-HT2A dans le corps ciliaire et l’épithélium ciliaire a été rapportée. Ainsi, la kétansérine, antagoniste des récepteurs 5-HT2A de la sérotonine mais aussi des récepteurs α-adrénergiques, diminue la sécrétion aqueuse chez le lapin, le chat et le singe [24]. Des agonistes des récepteurs 5-HT1A, tels le flesinoxan ou la 8-OH-DPAT, diminuent également la sécrétion aqueuse [34, 26, 27].
L’ibopamine, agoniste des récepteurs dopaminergiques et adrénergiques, augmente la sécrétion aqueuse. Son effet sur la PIO peut en revanche être paradoxal, des études ayant montré un effet hypotonisant de cet agent, alors qu’un autre travail a retrouvé une élévation pressionnelle [8, 77]. Chez le lapin, une étude a montré que la perfusion intraveineuse de faibles doses de dopamine augmentait le flux sanguin ciliaire et la sécrétion aqueuse, mais diminuait la PIO, et que la perfusion intraveineuse de doses plus importantes de dopamine diminuait le flux sanguin ciliaire, la sécrétion aqueuse et la PIO [95].
Un composant du cannabis, le Δ-9-tétrahydrocannabinol (THC), réduit la sécrétion aqueuse lorsqu’il est inhalé ou administré par voie sanguine [89]. Bien que cet agent soit une substance très liposoluble, son administration par voie topique produit en revanche peu ou pas d’effet sur la PIO chez l’homme [49]. Des études ont montré l’existence de récepteurs CB1 au THC dans les procès ciliaires humains et animaux. Un agoniste des récepteurs CB1, le WIN-55-212, diminue la sécrétion aqueuse et la PIO de singes sains et glaucomateux, sans augmenter l’élimination de l’HA par voie trabéculaire ou uvéosclérale [28].
La PIO est le fruit de l’équilibre s’établissant entre la sécrétion et l’élimination de l’HA L’élévation de la PIO au-dessus des limites statistiques de la normale rencontrée chez certains sujets, et parfois compliquée d’une neuropathie optique glaucomateuse, est essentiellement liée à une diminution de l’évacuation de l’HA. La majorité des études montre que la sécrétion aqueuse n’est pas augmentée chez des sujets présentant une hypertonie oculaire ou atteints de glaucome primitif à angle ouvert. Une étude a ainsi retrouvé chez 20 sujets glaucomateux une sécrétion aqueuse non significativement différente de celle de 20 sujets sains en période diurne, mais légèrement plus élevée en période nocturne [15]. Une étude similaire n’a pas retrouvé de différences de sécrétion aqueuse chez des sujets atteints de glaucome à pression normale et des sujets sains, aussi bien en période diurne (2,58 ± 0,78 µL/min chez les sujets sains versus 2,48 ± 0,61 µL/min chez les sujets glaucomateux) qu’en période nocturne (0,98 ± 0,22 µL/min chez les sujets sains versus 1,24 ± 0,45 µL/min chez les sujets glaucomateux) [67]. Il est donc probable que des différences de variation nycthémérale de l’excrétion aqueuse expliquent les différences de rythme nycthéméral de la PIO des sujets sains et des sujets glaucomateux.
L’élimination de l’HA en dehors de l’œil se fait majoritairement par voie trabéculaire, et de façon accessoire mais néanmoins significative au travers des tissus du stroma irien et de la base du corps ciliaire jusqu’à l’espace suprachoroïdien (voie uvéosclérale). Le trabéculum, qui est situé à la jonction entre l’iris et la cornée (angle iridocornéen), et donc responsable de la majeure partie de l’évacuation de l’HA, joue schématiquement le rôle d’un filtre. Il est constitué de mailles de collagène séparées d’espaces vides qui permettent la filtration de l’HA. Celle-ci est ensuite collectée au niveau d’un canal circulaire qui épouse la circonférence de l’œil en arrière de la cornée (le canal de Schlemm) et qui s’abouche ensuite dans de nombreuses petites veines aqueuses, permettant ainsi le retour de l’HA dans la circulation sanguine générale. La voie trabéculaire est responsable de 70 à 90 % de l’évacuation de l’HA, sa part augmentant avec l’âge du fait du déclin de l’importance de la voie uvéosclérale [121].
La voie uvéosclérale consiste en le passage de l’HA au travers du stroma irien au niveau de la racine de l’iris, dont la face antérieure est dépourvue d’épithélium, puis son passage au travers des faisceaux musculaires du corps ciliaire jusqu’aux espaces supraciliaire et suprachoroïdien. De là, elle traverse la sclère directement, ou en empruntant les espaces périvasculaires, voies de pénétration des vaisseaux sanguins et des nerfs. Hors de l’œil, dans le tissu orbitaire, l’HA est en partie réabsorbée par les vaisseaux sanguins orbitaires et en partie drainée via les vaisseaux lymphatiques de la conjonctive. La voie uvéosclérale est responsable de 10 à 30 % de l’élimination de l’HA, sa part relative diminuant avec l’âge [121].
Le trabéculum a la forme d’une bande triangulaire à sommet antérieur et situé dans le prolongement de l’endothélio-Descemet cornéen, parallèle au limbe sclérocornéen, qui tapisse l’angle iridocornéen sur la totalité de sa circonférence. Histologiquement, le trabéculum est un tissu conjonctif lacunaire, composé d’un empilement de lamelles entourées de cellules endothéliales, réalisant ainsi un filtre pluristratifié situé en avant du mur interne du canal de Schlemm, formant des espaces intertrabéculaires de plus en plus minces en approchant de la lumière canalaire. Triangulaire à la coupe, on décrit macroscopiquement trois faces [92] :
la face antéro-externe, entre l’anneau de Schwalbe et l’éperon scléral, en contact intime avec le mur interne du canal de Schlemm, et mesurant environ 1 mm de large ;
la face postéro-externe, depuis l’éperon scléral jusqu’à la racine de l’iris, qui tapisse le sommet de l’angle et la paroi postéro-interne ;
la face interne, de l’anneau de Schwalbe jusqu’à la racine de l’iris, directement au contact de l’HA dans la chambre antérieure, large de 1,5 mm environ.
De la chambre antérieure jusqu’au canal de Schlemm, on distingue successivement trois portions au trabéculum : le trabéculum uvéal, le trabéculum cornéoscléral et le trabéculum cribriforme ou juxtacanaliculaire.
Il joint l’anneau de Schwalbe, en avant, au corps ciliaire et à la face antérieure de la racine de l’iris en arrière. Il est constitué de deux à quatre couches de piliers d’un diamètre de 5 à 12 µm, constitués d’un axe de fibres de collagène et d’élastine parallèles à la surface du limbe cornéoscléral. Ces piliers sont entourés d’une membrane basale sur laquelle reposent les cellules endothéliales trabéculaires, fibroblastes différenciés, appelées également cellules trabéculaires ou trabéculocytes. L’agencement de ces piliers laisse des espaces et des orifices larges (25 à 75 µm) qui n’offrent pas de résistance réelle au passage de l’HA.
Il est formé de lamelles conjonctives superposées et percées d’orifices ovalaires de taille progressivement décroissante (2 à 12 µm de diamètre), tendues de l’anneau de Schwalbe à l’éperon scléral. Sa section est de forme triangulaire, les lamelles devenant de plus en plus nombreuses au fur et à mesure qu’on s’approche de l’éperon. Chaque lamelle, de 5 µm d’épaisseur environ, est composée de quatre couches successives. Un tissu conjonctif constitué notamment de fibres de collagène (types 1 et 3) et d’élastine constitue la partie la plus interne. Une couche essentiellement composée d’élastine entoure ensuite cet axe conjonctif. Une couche de substance fondamentale sépare ensuite la couche de fibres d’élastine de la membrane basale de l’endothélium trabéculaire. Les cellules endothéliales trabéculaires forment une monocouche continue. Elles sont jointes par des jonctions communicantes (gap junction) ainsi que par des desmosomes qui assurent la stabilité de cette structure sans s’opposer au passage de l’HA. Le cystosquelette de ces cellules semble être notablement développé. L’examen en microscopie électronique des cellules montre la présence de filaments intracytoplasmiques d’actine d’environ 6 nm de diamètre probablement impliqués dans les phénomènes de contraction cellulaire, de mobilité cellulaire, de phagocytose, de pinocytose et d’adhésion cellulaire. On retrouve également des filaments intracytoplasmiques de vimentine et de desmine d’environ 10 nm de diamètre, également probablement impliqués dans les phénomènes de contraction et de mobilité cellulaire.
La forte densité des fibres dans les lamelles, la largeur des espaces interlamellaires (de 2 à 6 µm) et l’agencement décalé des orifices d’une lamelle à l’autre ne semblent cependant pas être des obstacles à l’élimination de l’HA.
Également appelé trabéculaire cribriforme ou parfois trabéculum endothélial, il constitue la partie la plus externe du trabéculum, situé entre la paroi interne du canal de Schlemm et le trabéculum cornéoscléral, et comprend deux à cinq couches de cellules endothéliales (cellules trabéculaires) réparties au sein d’une substance fondamentale. Les cellules endothéliales présentent de très longs prolongements cytoplasmiques réunissant les cellules entre elles. Ces prolongements contiennent des éléments du cytosquelette cellulaire. Parmi eux, les microfilaments d’actine constituent une armature contractile maintenant la membrane plasmique des cellules et servant de support au barrage que réalise la substance fondamentale extracellulaire. Ces microfilaments interviennent également par leur qualité contractile dans la phagocytose. La matrice extracellulaire (substance fondamentale) est composée de fibres collagène de type 3 essentiellement, synthétisées au niveau des ribosomes des cellules trabéculaires, de fibres d’élastine qui assurent avec le collagène la forme et l’élasticité du tissu extracellulaire, de fibronectine et de laminine responsables de l’adhérence des cellules à leur substrat, enfin de glycosaminoglycanes ou mucopolysaccharides. Synthétisées au niveau de l’appareil de Golgi des cellules trabéculaires, les glycosaminoglycanes sont excrétés des cellules pour former la substance extracellulaire. Hors de la cellule, les glycosaminoglycanes n’existent pas sous forme libre mais liées aux protéines, notamment au collagène, pour former des protéoglycanes qui possèdent une structure poly-anionique. Les sites anioniques sont liés à des molécules d’eau et sont donc à l’origine de l’hydratation de ces macromolécules. Celle-ci tend à réduire la taille des espaces intratrabéculaires et constitue ainsi une gêne à l’élimination de l’HA. Cette hydratation est sous la dépendance d’enzymes lysosomiales intracellulaires qui, par hydrolyse, dépolymérisent les macromolécules, diminuant ainsi le nombre de leurs sites anioniques, leur hydratation et ainsi leur résistance à l’écoulement de l’HA.
De structure vasculaire, le canal de Schlemm chemine dans la partie postérieure de la gouttière sclérale, parallèlement au limbe, et est directement en contact avec le trabéculum cribriforme. Il a une forme annulaire et circulaire. Sa lumière, le plus souvent unique, peut se dédoubler et varie de 200 à 400 µm. Ses deux parois, interne et externe, sont constituées de cellules endothéliales. Les cellules endothéliales de la paroi interne sont en continuité avec le trabéculum juxtacanaliculaire et constituent le mur interne du canal de Schlemm, dernière structure à être traversée avant que l’HA ne soit collectée dans la lumière canalaire. L’endothélium est d’épaisseur irrégulière du fait de la taille des noyaux cellulaires, de la présence de vacuoles géantes intracytoplasmiques et d’expansions cytoplasmiques en doigts de gant faisant saillies dans la lumière du canal. L’examen montre également la présence d’un cytosquelette assez abondant essentiellement composé de filaments d’actine. Les cellules, séparées d’espaces de 15 à 20 nm, sont jointes par différents complexes jonctionnels. La présence de jonctions serrées (zonula occludens) a été rapportée. Des pores et vacuoles de 0,5 à 2 µm de diamètre réalisent des ouvertures de la paroi interne du canal de Schlemm. Le nombre de vacuoles et de pores semble diminuer avec l’âge.
La paroi externe du canal de Schlemm, également composée d’une monocouche continue de cellules endothéliales, donne ensuite naissance à des canaux collecteurs efférents. Leur nombre varie entre 25 et 35. Plus nombreux du côté nasal que du côté temporal, ils s’anastomosent en un plexus veineux intrascléral profond, puis épiscléral, pour se drainer dans les plexus veineux extra-oculaires. Faisant également partie des vaisseaux efférents du canal de Schlemm, les veines aqueuses sont une voie plus directe reliant le canal de Schlemm aux veines épisclérales.
Les voies non trabéculaires d’élimination de l’HA, également dites non conventionnelles, ont été décrites assez récemment et sont moins précisément connues et comprises que la voie trabéculaire. Deux voies non conventionnelles sont mises en évidence : la voie uvéosclérale, consistant au passage d’HA à travers la racine de l’iris puis le muscle ciliaire jusqu’aux espaces suprachoroïdiens, et la voie irienne consistant en un passage probablement très modeste d’HA à travers le stroma irien jusque dans les veines iriennes.
L’absence de barrière épithéliale à la face antérieure de l’iris permet à l’HA d’entrer dans le stroma irien – tissu conjonctif lâche – puis de cheminer en son sein jusqu’aux faisceaux musculaires ciliaires. L’HA gagne ainsi les espaces supraciliaire et suprachoroïdien. De là, elle traverse la sclère directement ou en empruntant les espaces périvasculaires, voies de pénétration des vaisseaux sanguins et des nerfs. Hors de l’œil, dans le tissu orbitaire, l’HA est en partie réabsorbée par les vaisseaux sanguins orbitaires et en partie drainée via les vaisseaux lymphatiques de la conjonctive.
Des études ont montré, en l’absence de rupture de la barrière hémato-aqueuse, la possibilité de passage direct de traceurs de la chambre antérieure jusque dans la lumière des veines de l’iris [92]. La contribution de ce mécanisme n’est pas précisément connue, mais semble mineure en conditions physiologiques.
Les tissus des voies d’élimination de l’HA opposent de façon physiologique une certaine résistance au passage de l’HA. Du fait de la sécrétion permanente de l’HA qui est relativement indépendante de la PIO, et du fait du caractère peu distensible de la paroi cornéosclérale de l’œil, la PIO s’élève – augmentant ainsi l’évacuation de l’HA en dehors de l’œil – jusqu’à atteindre un niveau qui permet d’égaliser la production et l’évacuation de l’HA. Lorsque la résistance au passage de l’HA au travers des tissus est augmentée, ce niveau d’équilibre ou état stable est déplacé jusqu’à un autre état d’équilibre atteint avec une PIO plus élevée.
L’anatomie oculaire normale offre peu de résistance à la circulation de l’HA de son site de production (chambre postérieure) jusqu’à son site d’élimination (angle iridocornéen). De ce fait, les gradients de pression à l’intérieur de l’œil sont en conditions physiologiques négligeables, et la PIO peut ainsi être modélisée grâce aux principes de la mécanique des fluides.
Soient Fa le débit d’HA produit par sécrétion active et Fu le débit d’HA produit par ultrafiltration. La production totale Ft est égale à :
Ft = Fa + Fu (µL/min)
Soient Etrab le débit d’HA éliminé par voie trabéculaire et Eu le débit d’HA éliminé par voie uvéoscérale. L’élimination totale Et est égale à :
Et = Etrab + Eu (µL/min)
Soient Rtrab la résistance opposée au débit d’HA par le trabéculum et Ru la résistance opposée au débit d’HA par la voie uvéosclérale. Soient Ctrab et Cu la facilité à l’écoulement (inverse de la résistance 1/R) offerte par le trabéculum et la voie uvéosclérale. La facilité totale Ct est égale à :
Ct = Ctrab + Cu (µL/min/mmHg)
À l’état d’équilibre (pression constante), la production est égale à l’élimination :
Qt = Et = Etrab + Eu (µL/min)
L’évacuation par voie uvéosclérale est relativement indépendante de la PIO Pi et est donc toujours égale à Eu.
L’évacuation par voie trabéculaire est dépendante de la différence de pression entre la PIO Pi et la pression régnant à l’extérieur du globe (pression veineuse épisclérale, Pe), et est donc fonction de la différence de pression Pi-Pe et de la résistance Rtrab :
Etrab = (Pi – Pe)/Rtrab = (Pi – Pe) × Ctrab
De ce fait, à l’état stable :
Qt = Et = Etrab + Eu = Ctrab × (Pi – Pe) + Eu
Ou
Pi = Pe + (Qt – Eu)/Ctrab
En conditions normales :
la pression veineuse épisclérale Pe est de 8 à 9 mmHg [110, 113],
le débit total d’HA produite Qt est d’environ 2,5 µL/min [23, 57],
le débit éliminé par voie uvéosclérale est d’environ 1,6 µL/min chez un adulte jeune et de 1,1 µL/min chez un adulte âgé [121],
la capacité d’élimination du trabéculum Ctrab est d’environ 0,20 µL/min/mmHg chez un sujet sain [121],
donnant une PIO Pi d’environ 13 mmHg chez un sujet jeune et 16 mmHg chez un sujet âgé.
La relative indépendance du débit éliminé par voie uvéosclérale et de la PIO n’est pas parfaitement expliquée. Elle pourrait découler de la nature et de l’organisation des tissus et compartiments traversés par l’HA éliminée par voie uvéosclérale. L’HA éliminée par cette voie gagne les espaces suprachoroïdiens. La pression régnant dans les espaces suprachoroïdiens est inférieure à la PIO, mais serait néanmoins proportionnelle à la PIO – plus élevée lorsque la PIO est plus élevée, et vice versa, éventuellement du fait du caractère distensible de la choroïde – de telle sorte que le gradient de pression entre la chambre antérieure et les espaces suprachoroïdiens serait constant. Le gradient de pression constant induirait ainsi un débit constant d’HA éliminé par voie uvéosclérale. Il faut néanmoins préciser que certaines études, réalisées en conditions physiologiques aussi bien que non physiologiques telles qu’après l’administration topique d’analogues de prostaglandines, ont retrouvé une certaine relation entre le débit uvéoscléral et la PIO [63, 85]. Enfin, lorsque la PIO est nettement abaissée, la diminution de la pression dans les espaces suprachoroïdiens peut aboutir à une disparition du gradient de pression entre les espaces suprachoroïdiens et l’orbite, aboutissant à une diminution du flux d’HA entre les espaces suprachoroïdiens et les espaces péri-oculaires. Ce mécanisme pourrait expliquer la survenue de soulèvements choroïdiens dans les situations d’hypotonie majeure (post-chirurgicales, etc.), par accumulation dans cet espace des fluides ayant traversé la racine de l’iris et le muscle ciliaire (tableau 7-4).
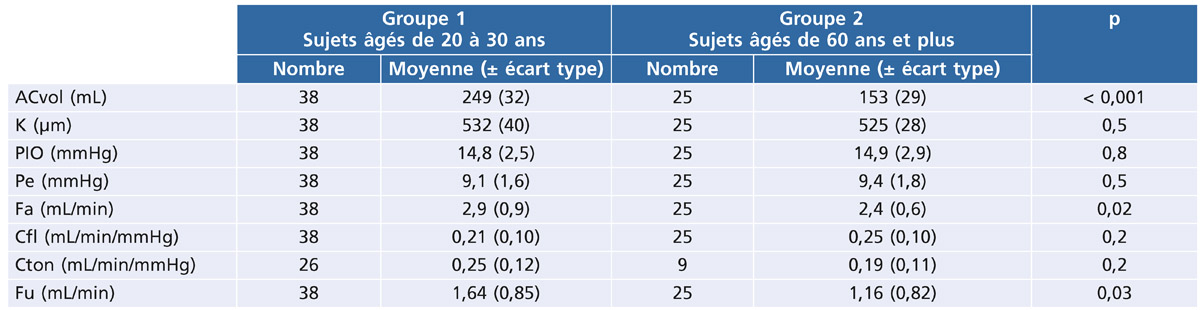
Tableau 7-4 Variations de la production et de l’élimination de l’HA avec l’âge chez des sujets sains.
La plupart de la résistance opposée à l’écoulement de l’HA par voie trabéculaire semble provenir du mur interne du canal de Schlemm et des structures les plus externes du trabéculum juxtacanaliculaire. Ainsi, une excision expérimentale du trabéculum réalisée ab interno sur un œil humain canulé réduit de 75 % la résistance à l’évacuation de l’HA pour des pressions intra-oculaires physiologiques [48]. Pour des pressions intra-oculaires basses (7 mmHg), la réduction n’est que de 50 % [100]. La résistance résiduelle à l’écoulement semble provenir essentiellement du trajet intrascléral des voies d’évacuation. Une étude similaire réalisée chez des singes a retrouvé que 60 à 65 % de la résistance à l’écoulement provenaient du trabéculum et du mur interne du canal de Schlemm, 25 % de la moitié interne de la sclère, et 15 % de la moitié externe de la sclère [87].
La largeur des espaces interlamellaires du trabéculum uvéal puis du trabéculum cornéoscléral (de 75 à 5 µm) semble permettre un passage assez facile de l’HA. Les mécanismes cellulaires et moléculaires du passage de l’HA au travers du trabéculum juxtacanaliculaire et surtout au travers de la monocouche de cellules endothéliales constituant le mur interne du canal de Schlemm ne sont pas parfaitement connus. La théorie actuellement la plus admise présente le passage d’HA au travers de la monocouche de cellules endothéliales comme étant majoritairement due à un passage transcellulaire passif dépendant du gradient de pression de part et d’autre de cette couche de cellules [56]. Ce processus, qui pourrait être décrit comme un phénomène de pinocyctose passif, résulterait de l’invagination de la membrane plasmique aboutissant à capturer des gouttelettes d’HA dans des vésicules intracytoplasmiques, vésicules qui seraient ensuite redirigées vers la membrane plasmatique opposée, puis fusionnées avec celle-ci de façon à libérer l’HA dans la lumière du canal de Schlemm. Ce phénomène étant partiellement passif, et non spécifique, la quantité d’HA qui entre dans la cellule dans des vésicules est directement proportionnelle au gradient de pression de part et d’autre de la cellule. L’existence en microscopie électronique de vacuoles géantes et de pores d’un diamètre de 0,5 à 2 µm au niveau de l’endothélium du canal de Schlemm semble corroborer cette théorie [40]. Des études ont montré la présence de traceurs injectés en chambre antérieure dans ces vacuoles [122]. La concentration des traceurs semble même pouvoir être plus élevée dans les vacuoles que dans les tissus extracellulaires adjacents, suggérant l’existence de mécanismes actifs de régulation du passage de l’HA. Des études ont montré une augmentation du nombre et de la taille de ces vacuoles lorsque la PIO est augmentée [115, 125].
D’autres auteurs ont suggéré l’existence d’une voie paracellulaire de passage de l’HA. La perfusion de ferritine dans la chambre antérieure de singes permet ainsi de mettre en évidence la présence de ce traceur entre les membranes plasmatiques de cellules adjacentes [38]. Le traceur semble s’accumuler à distance des jonctions serrées joignant ces membranes, suggérant l’existence de zones intercellulaires plus lâches, réalisant ainsi l’équivalent de petits canaux mettant en communication le trabéculum juxtacanaliculaire et la lumière du canal de Schlemm. Ce passage paracellulaire paraît en outre proportionnel à la PIO.
Des études ayant réalisé l’injection de traceurs en chambre antérieure (billes de latex fluorescentes, traceurs radioactifs, etc.) ont confirmé que l’HA pouvait traverser le stroma de la racine de l’iris et les espaces interstitiels du muscle ciliaire pour rejoindre les espaces suprachoroïdiens [3]. Les traceurs semblent ensuite rejoindre les tissus épiscléraux en suivant le trajet des perforations sclérales permettant le passage des vaisseaux ou nerfs, ou même en traversant directement les lamelles de collagène de la sclère. Des études réalisées chez le singe ont montré l’existence d’un gradient de pression d’environ 4 mmHg entre la PIO et la pression régnant dans les espaces suprachoroïdiens [37]. Il a été supposé que ce gradient de pression était le mécanisme principal du passage d’HA par voie uvéosclérale. Il semble relativement inchangé lors des variations de PIO.
La composition biochimique et l’organisation structurale des tissus interstitiels du muscle ciliaire semblent jouer un rôle important dans la perméabilité de cette structure à l’HA. La matrice extracellulaire du muscle ciliaire est essentiellement composée de collagène de types 1, 3 et 4, de fibronectine et de laminine [130]. Un changement de l’équilibre entre la biosynthèse et la biodégradation de ces différentes molécules peut modifier la perméabilité du corps ciliaire à l’HA, l’importance du flux uvéoscléral et de ce fait la PIO. Les différentes circonstances pouvant modifier l’évacuation de l’HA par voie uvéosclérale sont discutées dans le paragraphe suivant.
L’administration topique ou intracamérulaire d’épinéphrine (agoniste α1, α2, β1 et β2) augmente la capacité d’évacuation d’HA par voie trabéculaire [9]. Les mécanismes d’action ne sont pas précisément connus. Chez le singe, cet effet persiste après l’ablation chirurgicale de l’iris et des muscles ciliaires, suggérant que l’action pharmacologique est réalisée directement sur les cellules endothéliales ou la matrice extracellulaire du trabéculum, mais pas par l’intermédiaire des muscles ciliaires. L’administration topique d’agonistes des récepteurs bêta augmente également la capacité d’évacuation d’HA par voie trabéculaire [58]. Des études ont montré que des cellules endothéliales trabéculaires ou des cellules endothéliales du canal de Schlemm cultivées ex vivo sur une membrane poreuse se contractaient et se séparaient lors de l’ajout d’isoprotérénol ou d’épinéphrine dans le milieu de culture, augmentant le passage endothélial d’HA [127]. Cet effet semble être médié par des récepteurs bêta 2 de la membrane plasmatique des cellules endothéliales du trabéculum et du canal de Schlemm, couplés à des protéines G situées sur la face interne de la membrane plasmatique, dont l’activation aboutit par une cascade de réactions intracytoplasmiques à l’activation de l’enzyme adénylate cyclase et ainsi à la production d’AMP cyclique. Cet effet est bloqué par le timolol, mais pas par le bétaxolol, suggérant l’absence de récepteurs β1 dans le trabéculum des primates [2, 97].
D’autres études ont également démontré que l’administration topique ou intracamérulaire d’agonistes adrénergiques (épinéphrine, norépinéphrine et isoprotérénol) augmentait la concentration d’AMP cyclique dans l’HA, et que l’injection d’AMP cyclique en chambre antérieure diminuait la PIO [109].
Des études ont montré que l’administration d’indométacine ou d’antagonistes aux récepteurs à l’adénosine A1 inhibait l’effet de l’administration d’AMP cyclique, suggérant que cette dernière pouvait agir non seulement par contraction des cellules endothéliales trabéculaires, mais également en induisant la production de prostaglandines ou en activant les récepteurs à l’adénosine [33].
Les agonistes adrénergiques peuvent faciliter la disruption des filaments intracytoplasmiques d’actine, modifiant ainsi la forme des cellules endothéliales trabéculaires, altérant l’adhésion de ces cellules à la matrice extracellulaire et également l’adhésion des cellules endothéliales les unes aux autres [132]. Ainsi, la cytochalasine (inhibiteur de la polymérisation des molécules d’actine) potentialise l’effet de l’épinéphrine sur la capacité d’évacuation de l’HA, alors que la phalloïdine (inhibiteur de la dépolymérisation des molécules d’actine) inhibe ce même effet [96, 98]. L’épinéphrine inhibe également les mitoses et l’activité de phagocytose des cellules endothéliales trabéculaires in vivo.
La stimulation des récepteurs bêta-adrénergiques du muscle ciliaire aboutit à un relâchement des fibres musculaires et à une augmentation du flux uvéoscléral [124]. A contrario, les antagonistes des récepteurs bêta-adrénergiques (bêtabloquants) ne semblent pas diminuer le flux uvéoscléral lorsqu’ils sont administrés seuls [106]. Les bêtabloquants peuvent en revanche inhiber l’effet de l’épinéphrine sur le flux uvéoscléral. Les agonistes des récepteurs α2 peuvent également influer sur la voie uvéosclérale. Des études ont ainsi montré, chez l’homme, que la brimonidine augmentait le flux uvéoscléral alors que l’apraclonidine tendait plutôt à le diminuer [120]. Il a même été suggéré que l’effet à court terme de la brimonidine sur la PIO était essentiellement lié à la réduction de la sécrétion aqueuse, mais que l’effet à long terme était majoritairement lié à l’augmentation du flux uvéoscléral [118].
Du fait de l’insertion de l’extrémité antérieure du muscle ciliaire sur l’éperon scléral et sur le trabéculum cribiforme, l’état du muscle ciliaire exerce une influence sur la configuration du trabéculum. Quand le muscle ciliaire se contracte, le trabéculum est étiré, entraînant un élargissement des espaces entre les lamelles du trabéculum. De même, la traction exercée sur les fibrilles élastiques du trabéculum cribriforme dont certaines adhèrent aux cellules endothéliales du mur interne du canal de Schlemm pourrait augmenter le diamètre de celui-ci. Ainsi, l’accommodation, la stimulation électrique de la IIIe paire crânienne et l’administration topique ou systémique d’agonistes adrénergiques augmentent l’élimination de l’HA par voie trabéculaire, alors que les agonistes cholinergiques (atropine, etc.) la diminuent [7, 8]. Après désinsertion chirurgicale de l’iris et des muscles ciliaires, l’effet de la pilocarpine sur l’évacuation trabéculaire de l’HA disparaît, suggérant que l’effet est uniquement dû à son action sur les muscles ciliaires, sans action pharmacologique directe sur le trabéculum [59].
De façon intéressante, des études ont mis en évidence la présence de mécanorécepteurs dans les tissus conjonctifs de l’éperon scléral et des tissus voisins [114]. Ces récepteurs sensibles à l’étirement ou à la déformation des tissus et connectés à des fibres nerveuses du système parasympathique pourraient ainsi conférer au trabéculum une certaine aptitude à autoréguler l’évacuation de l’HA et ainsi la PIO.
La contraction des muscles ciliaires induite par la pilocarpine réduit la taille des espaces entre les fibres musculaires, diminuant l’élimination aqueuse par voie uvéosclérale [59, 114]. Cet effet est néanmoins mineur, et négligeable comparé à l’augmentation de l’élimination par voie trabéculaire, expliquant l’effet global sur la PIO. A contrario, la relaxation induite par l’atropine augmente la taille des espaces entre les fibres musculaires [59].
Les cellules endothéliales du trabéculum et du canal de Schlemm possèdent un cytosquelette essentiellement fait de microfilaments d’actine. Ces derniers sont formés par polymérisation de monomères d’actine G. Il existe un équilibre permanent entre polymérisation et dépolymérisation des microfilaments d’actine. Ces microfilaments intracytoplasmiques d’actine sont reliés entre eux par différentes protéines, notamment des protéines contractiles telles que la myosine de type 2. Le glissement d’une unité de myosine (chaîne légère) par rapport à une autre entraîne une traction des filaments d’actine, aboutissant à une contraction des cellules endothéliales. La formation de chaînes légères de myosine et leur liaison aux filaments d’actine sont régulées par différentes protéines kinases (enzymes catalysant une réaction de phosphorylation), notamment les protéines kinases Rho (ROCK : Rho-associated protein kinase) 1 et 2, enzymes sous la dépendance d’une enzyme de type GTP-ase (consommant de l’énergie par hydrolyse de guanosine triphosphate), et qui en phosphorylant les chaînes légères de myosine permettent leur liaison covalente aux filaments d’actine. De ce fait, les enzymes Rho kinases jouent un rôle majeur dans la régulation du cytosquelette actinique, et ainsi dans les fonctions de contraction et de déplacement cellulaire. Les microfilaments d’actine sont reliés à la membrane plasmatique par un complexe formé de nombreuses protéines intracellulaires, transmembranaires et extracellulaires, appelé plaque d’adhésion. Les intégrines sont les principales protéines transmembranaires de la plaque d’adhésion, dont l’une des extrémités interagit avec des protéines de la matrice extracellulaire situées à l’extérieur de la cellule et l’autre avec des constituants intracellulaires, notamment les microfilaments d’actine.
Globalement, les agents qui dégradent le cytosquelette, les protéines contractiles, les jonctions intercellulaires et la matrice extracellulaire augmentent la perméabilité du trabéculum à l’HA. Ces agents entraînent probablement un élargissement des espaces intercellulaires, permettant le passage de l’HA. La plupart des éléments du cytosquelette et des protéines contractiles cités ci-dessus peuvent constituer des cibles pour des agents destinés à augmenter la perméabilité du trabéculum (fig. 7-6) :
les cytochalasines, qui inhibent la polymérisation des monomères d’actine G constituant les microfilaments d’actine, telles que la latrunculine, qui se lie aux monomères et empêche leur polymérisation. Ainsi, l’administration topique ou intracamérulaire de latrunculine augmente de 60 à 70 % la capacité d’élimination d’HA du trabéculum [39]. Chez des singes, l’administration topique de latrunculine réduit la PIO [86]. Histologiquement, l’administration de latrunculine entraîne un élargissement des espaces séparant le trabéculum cribiforme et le mur interne du canal de Schlemm, et un élargissement des espaces séparant les cellules endothéliales du mur interne [102] ;
les agents inhibant la formation des chaînes légères de myosine, ou la liaison de ces molécules aux filaments d’actine. L’agent H7, inhibiteur non sélectif des protéines kinases, augmente la perméabilité du trabéculum et diminue la PIO après administration topique [72]. L’agent Y-27632, inhibiteur sélectif des protéines Rho kinases, diminue également la PIO en augmentant la perméabilité du trabéculum [55]. Histologiquement, ces agents aboutissent à une augmentation de la taille des espaces libres entre les lamelles du trabéculum, à un élargissement de la lumière du canal de Schlemm et, parfois, à un clivage entre le trabéculum cribiforme et le mur interne du canal de Schlemm [74] ;
les protéines modulant la liaison actine-myosine, telles que la caldesmone, protéine aboutissant à un découplage des chaînes légères de myosine des unités d’actine. En utilisant un vecteur viral (adénovirus), certains auteurs ont réussi à intégrer dans le génome des cellules endothéliales trabéculaires un double brin d’ADN permettant l’expression de caldesmone ou d’une enzyme de type transférase C3 ayant le même effet [50, 73] ;
les agents entraînant une disruption du réseau de microtubules. Les microtubules, constitués d’un assemblage de monomères de tubuline, ne permettent pas directement la contraction des cellules, mais servent au transport intracellulaire de nombreux éléments (vésicules contenant des protéines ou des ARNm) qui interviennent dans de nombreuses fonctions cellulaires telles que la formation du cytosquelette d’actine [117]. Les agents inhibant la polymérisation des monomères de tubuline (acide étacrynique, colchicine, vinblastine, etc.) augmentent ainsi la perméabilité du trabéculum à l’HA [47, 83].
La composition biochimique et l’organisation structurale de la matrice extracellulaire composant les lamelles trabéculaires et entourée d’un manchon de cellules endothéliales trabéculaires jouent également un rôle majeur dans la perméabilité du trabéculum à l’HA (voir plus loin « Corticostéroïdes et trabéculum »). Ainsi, différents agents dégradant les glycosaminoglycanes ou les protéoglycanes (hyaluronidase, alphachymotrypsine, collagénases, facteurs de croissance inducteurs de métalloprotéinases tels que le TGF-β, agonistes des récepteurs à l’adénosine, etc.) administrés dans la chambre antérieure ou par voie topique augmentent le flux d’HA éliminé par voie trabéculaire, chez l’animal ou chez l’homme [10, 18, 21].
La composition biochimique et l’organisation structurale de la matrice extracellulaire entourant les fibres musculaires du muscle ciliaire jouent un rôle majeur dans la perméabilité de cette structure à l’HA. La matrice extracellulaire du muscle ciliaire est essentiellement composée de collagène de types 1, 3 et 4, de fibronectine et de laminine [130]. Une modification de l’équilibre entre la biosynthèse et la biodégradation de ces différentes molécules peut modifier la perméabilité du corps ciliaire à l’HA, l’importance du flux uvéoscléral et de ce fait la PIO. Les prostaglandines, métabolites de l’acide arachidonique obtenus par action de phospholipases sur les phospholipides membranaires, sont fortement impliquées dans la régulation de la composition de la matrice extracellulaire des tissus du segment antérieur de l’œil. Les prostaglandines de type PGF2α, ainsi que les analogues de prostaglandines agonistes des récepteurs aux PGF2α, multiplient d’un facteur deux à trois le débit d’HA éliminée par voie uvéoscléral [44]. Cette augmentation majeure du débit uvéoscléral entraîne une diminution secondaire du débit trabéculaire.
Nombre d’études ont montré de très nombreux effets des PGF2α ou de leurs analogues sur les différents tissus oculaires. L’effet hypotenseur semble néanmoins être essentiellement dû à un remodelage de la matrice extracellulaire de la racine de l’iris, du muscle ciliaire et de la portion antérieure de la sclère. Au niveau du stroma irien et du muscle ciliaire, ces agents entraînent une augmentation de l’expression de différentes métalloprotéinases (MMP-1, -2 et -3), associée à une diminution de la composition en collagène de types 1, 2, 3 et 4, en fibronectine et en laminine [70, 103]. Histologiquement, ces agents augmentent la taille des espaces entre les fibres musculaires, entraînent une réorganisation de ces espaces avec une uniformisation de leurs orientations et l’apparition des structures bordées par des cellules endothéliales et comparables à des structures de drainage lymphatique [71, 133]. Au niveau de la sclère, ces agents induisent également une augmentation de l’expression de différentes métalloprotéinases (MMP-1, -2 et -3), associée à un remodelage de la composition et de l’organisation structurale des lamelles de collagène qui forment la sclère [131]. Différentes études ont montré une augmentation de la perméabilité de la sclère à différents traceurs (dextrans, albumine, etc.) [61].
Les sous-types de récepteurs aux prostaglandines responsables des effets des prostaglandines PGF2α et de leurs analogues sur la voie uvéosclérale ne sont pas exactement connus. Les récepteurs EP1, EP2, EP3 et FP semblent être impliqués, à des degrés divers en fonction de l’espèce considérée et des agents agonistes utilisés [5, 108]. L’administration d’agents stimulant simultanément plusieurs de ces récepteurs semble être plus efficace pour augmenter le flux uvéoscléral et diminuer la PIO que la stimulation isolée d’un seul de ces récepteurs.

Fig. 7-6 Représentation schématique des jonctions matrice extracellulaire-plaque d’adhésion-cytosquelette et des sites d’action potentiels d’agents destinés à inhiber les fonctions de contractilité et de mobilité cellulaire.
CML : chaîne légère de myosine.
Les cellules endothéliales du trabéculum et du canal de Schlemm possèdent des récepteurs aux glucocorticoïdes. En conditions physiologiques, les glucocorticoïdes – produits notamment par l’épithélium ciliaire – semblent participer à la régulation de la perméabilité du trabéculum, de la sécrétion d’HA et de ce fait de la PIO [128]. Ainsi, le cortisol active l’enzyme Na+/K+-ATPase de la membrane plasmatique des cellules ciliaires non pigmentées, et augmente la production d’HA [90, 91]. Par ailleurs, l’exposition prolongée à des glucocorticoïdes administrés par voie topique ou systémique peut aboutir à une augmentation de la PIO essentiellement ou exclusivement liée à une augmentation de la résistance du trabéculum à l’écoulement de l’HA. Les modifications métaboliques, biochimiques, cellulaires et tissulaires induites par les corticostéroïdes sont nombreuses, et leurs responsabilités respectives dans l’élévation pressionnelle ne sont pas précisément connues.
Les corticostéroïdes, notamment la dexaméthasone, provoquent une augmentation du volume de la matrice extracellulaire trabéculaire et une diminution de la taille des espaces permettant l’écoulement de l’HA [99]. Les mécanismes aboutissant à une augmentation de volume de la matrice extracellulaire sont nombreux et complexes. In vivo, l’exposition à la dexaméthasone de cellules endothéliales trabéculaires diminue la production de prostaglandines, réduit l’activité de phagocytose de ces cellules, la production de protéases diverses et l’activité protéolytique de ces cellules, la production d’enzymes lysosomiales destinées à hydrolyser les protéoglycanes et ainsi l’hydratation de la matrice extracellulaire, et modifie l’expression de nombreux gènes, pouvant aboutir à une augmentation de la synthèse de différents composants de la matrice extracellulaire tels que le collagène, la laminine et la fibronectine [112, 129]. Il existe probablement un équilibre permanent entre la synthèse, le remodelage et la dégradation de la matrice extracellulaire réalisés par les cellules endothéliales trabéculaires. Les glucocorticoïdes participent physiologiquement à la régulation de cet équilibre. L’exposition à des quantités excessives de certains corticoïdes déplace cet équilibre vers un excès de synthèse et une réduction de la dégradation de la matrice extracellulaire. L’effet contraire est probablement possible, l’administration de certains glucocorticoïdes tel l’acétate d’anécortave diminuant la PIO [88].
Au niveau de la membrane plasmatique des cellules endothéliales, l’exposition à la dexaméthasone augmente le nombre de jonctions serrées et diminue le nombre de jonctions communicantes, diminuant possiblement la perméabilité des couches les plus externes du trabéculum et du mur interne du canal de Schlemm [84, 123]. L’exposition à certains glucocorticoïdes modifie également l’aspect du cytosquelette, augmentant la densité du réseau de microfilaments d’actine, accroît le volume des cellules trabéculaires et du noyau de ces cellules, modifie la quantité et l’organisation de l’appareil de Golgi et du réticulum endoplasmique lisse et granuleux [29, 30].
L’exposition aux glucocorticoïdes des cellules endothéliales trabéculaires augmente l’expression d’un gène (MYOC, anciennement dénommé TIGR pour trabeculum meshwork induced glucocorticoid receptor) situé sur le chromosome 1 et aboutissant à la production d’une protéine, la myocilline [41]. La myocilline est retrouvée dans les cellules et dans la matrice extracellulaire de nombreux tissus oculaires. Son rôle dans la régulation de la perméabilité du trabéculum et dans la diminution de celle-ci en cas d’augmentation de sa synthèse n’est pas précisément connu [41].
Les modifications structurales et fonctionnelles des voies d’évacuation de l’HA observées chez les patients hypertones et glaucomateux sont nombreuses. Leurs responsabilités respectives dans l’élévation de la PIO ne sont pas parfaitement identifiées. L’hypothèse qu’une augmentation de la résistance à l’écoulement de l’HA au niveau du trabéculum juxtacanaliculaire et du mur interne du canal de Schlemm joue un rôle prépondérant est souvent évoquée. L’examen des rares travaux ayant réalisé une étude quantitative complète de la production et de l’élimination de l’HA chez des sujets hypertones et/ou glaucomateux montre en fait une responsabilité assez partagée entre la voie conventionnelle et de la voie uvéosclérale dans l’élévation pressionnelle [119]. Il est à noter que le flux d’HA éliminé par voie trabéculaire décline de façon physiologique au cours de la vie, diminuant d’environ 30 % chez un adulte jeune à 10 % chez un adulte de plus de 60 ans la part respective de cette voie dans l’élimination totale [119] (voir tableau 7-4 et tableau 7-5).
Une liste non exhaustive des modifications rapportées chez les patients hypertones et/ou glaucomateux est présentée dans le tableau 7-6 [1, 4, 25, 52, 75, 79, 104, 105, 116].

Tableau 7-5 Production et élimination de l’HA chez des sujets sains et hypertones.

Tableau 7-6 Modifications morphologiques et histologiques observées en cas d’hypertonie oculaire ou de glaucome primitif à angle ouvert.
Retenir
L’humeur aqueuse est sécrétée par le double épithélium ciliaire recouvrant les procès ciliaires.
Différents mécanismes participent à la formation de l’humeur aqueuse : ultrafiltration, diffusion passive, diffusion facilitée et sécrétion active.
Le débit de la sécrétion aqueuse est d’environ 2 à 3 µL/min, plus important en période diurne et plus faible en période nocturne.
Les antagonistes des récepteurs bêta-adrénergiques (bêtabloquants), inhibiteurs de l’anhydrase carbonique, agonistes des récepteurs α2-adrénergiques (brimonidine, apraclonidine) et agents hyperosmotiques (mannitol) diminuent la sécrétion aqueuse.
L’excrétion aqueuse est essentiellement réalisée par voie trabéculaire, et accessoirement par voie uvéosclérale.
La voie trabéculaire est responsable de 70 à 90 % de l’excrétion aqueuse, et la voie uvéosclérale de 10 à 30 %, sa part relative diminuant avec l’âge.
Les analogues de prostaglandines et prostamides augmentent fortement l’excrétion aqueuse par voie uvéosclérale.
[1] Ainsworth JR, Lee WR. Effects of age and rapid high-pressure fixation on the morphology of Schlemm’s canal. Invest Ophthalmol Vis Sci. 1990 ; 31 : 745-50.
[2] Allen RC, Epstein DL. Additive effect of betaxolol and epinephrine in primary open angle glaucoma. Arch Ophthalmol. 1986 ; 104 : 1178-84.
[3] Alm A, Nilsson SF. Uveoscleral outflow – a review. Exp Eye Res. 2009 ; 88 : 760-8.
[4] Alvarado J, Murphy C, Polansky J, Juster R. Age-related changes in trabecular meshwork cellularity. Invest Ophthalmol Vis Sci. 1981 ; 21 : 714-27.
[5] Anthony TL, Pierce KL, Stamer WD, Regan JW. Prostaglandin F2 alpha receptors in the human trabecular meshwork. Invest Ophthalmol Vis Sci. 1998 ; 39 : 315-21.
[6] Armaly MF, Burian HM. Changes in the tonogram during accommodation. AMA Arch Ophthalmol. 1958 ; 60 : 60-9.
[7] Armaly MF. Studies on intraocular effects of the orbital parasympathetics. II. Effect on intraocular pressure. AMA Arch Ophthalmol. 1959 ; 62 : 117-24.
[8] Azevedo H, Ciarniello MG, Rosignoli MT, et al. Effects of ibopamine eye drops on intraocular pressure and aqueous humor flow in healthy volunteers and patients with open-angle glaucoma. Eur J Ophthalmol. 2003 ; 13 : 370-6.
[9] Ballintine EJ, Garner LL. Improvement of the co-efficient of outflow in glaucomatous eyes. Prolonged local treatment with epinephrine. Arch Ophthalmol. 1961 ; 66 : 314-7.
[10] Barany EH, Scotchbrook S. Influence of testicular hyaluronidase on the resistance to flow through the angle of the anterior chamber. Acta Physiol Scand. 1954 ; 30 : 240-8.
[11] Barishak YR. Embryology of the eye and its adenxa. 2nd ed. Bâle (Suisse), Karger, 2001.
[12] Becker B. Chemical composition of human aqueous humor : effects of acetazolamide. AMA Arch Ophthalmol. 1957 ; 57 : 793-800.
[13] Becker B. Ouabain and aqueous humor dynamics in the rabbit eye. Invest Ophthalmol. 1963 ; 2 : 325-31.
[14] Becker B. Vanadate and aqueous humor dynamics. Proctor Lecture. Invest Ophthalmol Vis Sci. 1980 ; 19 : 1156-65.
[15] Beneyto Martin P, Fernández Vila PC, Pérez Martinez TM, Aliseda Peréz D. A fluorophotometric study on the aqueous humor dynamics in primary open angle glaucoma. Int Ophthalmol. 1992 ; 16 : 311-4.
[16] Bill A. Aqueous humor dynamics in monkeys (Macaca irus and Cercopithecus ethiops). Exp Eye Res. 1971 ; 11 : 195-206.
[17] Bill A. Blood circulation and fluid dynamics in the eyes. Physiol Rev. 1975 ; 55 : 383-417.
[18] Bill A. Effects of Na2 EDTA and alpha-chymotrypsin on aqueous humor outflow conductance in monkey eyes. Ups J Med Sci. 1980 ; 85 : 311-9.
[19] Bill A. Effects of norepinephrine, isoproterenol and sympathetic stimulation on aqueous humour dynamics in vervet monkeys. Exp Eye Res. 1970 ; 10 : 31-46.
[20] Bonting SL, Becker B. Studies on sodium-potassium activated adenosinetriphosphatase XIV. Inhibition of enzyme activity and aqueous humor flow in the rabbit eye after intravitreal injection of ouabain. Invest Ophthalmol. 1964 ; 3 : 523-33.
[21] Bradley JM, Vranka J, Colvis CM, et al. Effect of matrix metalloproteinases activity on outflow in perfused human organ culture. Invest Ophthalmol Vis Sci. 1998 ; 39 : 2649-58.
[22] Brubaker RF. Clinical measurements of aqueous dynamics : implications for addressing glaucoma. In : Civan MM (Ed.). The eye’s aquous humor, from secretion to glaucoma. New York, Academic Press, 1998 : 234-84.
[23] Brubaker RF. Flow of aqueous humor in humans [The Friedenwald Lecture]. Invest Ophthalmol Vis Sci. 1991 ; 32 : 31-45.
[24] Chang FW, Burke JA, Potter DE. Mechanism of the ocular hypotensive action of ketanserin. J Ocul Pharmacol. 1985 ; 1 : 137-47.
[25] Chapman SA, Bonshek RE, Stoddart RW, et al. Glycans of the trabecular meshwork in primary open angle glaucoma. Br J Ophthalmol. 1996 ; 80 : 435-44.
[26] Chidlow G, Cupido A, Melena J, Osborne NN. Flesinoxan, a 5-HT1A receptor agonist/alpha 1-adrenoceptor antagonist, lowers intraocular pressure in NZW rabbits. Curr Eye Res. 2001 ; 23 : 144-53.
[27] Chidlow G, Nash MS, De Santis LM, Osborne NN. The 5-HT (1A)Receptor agonist 8-OH-DPAT lowers intraocular pressure in normotensive NZW rabbits. Exp Eye Res. 1999 ; 69 : 587-93.
[28] Chien FY, Wang RF, Mittag TW, Podos SM. Effect of WIN 55212-2, a cannabinoid receptor agonist, on aqueous humor dynamics in monkeys. Arch Ophthalmol. 2003 ; 121 : 87-90.
[29] Clark AF, Brotchie D, Read AT, et al. Dexamethasone alters F-actin architecture and promotes cross-linked actin network formation in human trabecular meshwork tissue. Cell Motil Cytoskeleton. 2005 ; 60 : 83-95.
[30] Clark AF, Miggans ST, Wilson K, et al. Cytoskeletal changes in cultured human glaucoma trabecular meshwork cells. J Glaucoma. 1995 ; 4 : 183-8.
[31] Coakes RL, Brubaker RF. The mechanism of timolol in lowering intraocular pressure. In the normal eye. Arch Ophthalmol. 1978 ; 96 : 2045-8.
[32] Coca-Prados M, Escribano J. New perspectives in aqueous humor secretion and in glaucoma : the ciliary body as a multifactorial neuroendocrine gland. Prog Retin Eye Res. 2007 ; 26 : 239-62.
[33] Crawford KS, Gange SJ, Gabelt BT, et al. Indomethacin and epinephrine effects on outflow facility and cyclic adenosine monophosphate formation in monkeys. Invest Ophthalmol Vis Sci. 1996 ; 37 : 1348-59.
[34] Dailey RA, Brubaker RF, Bourne WM. The effects of timolol maleate and acetazolamide on the rate of aqueous formation in normal human subjects. Am J Ophthalmol. 1982 ; 93 : 232-7.
[35] De Berardinis E, Tieri O, Iuglio N, et al. The composition of the aqueous humor of man in aphakia. Acta Opthalmol. 1966 ; 44 : 64-68.
[36] Eichhorn M, Flugel C, Lutjen-Drecoll E. Regional differences in the distribution of cyctoskeletal filaments in the human and bovine ciliary epithelium. Graefes Arch Clin Exp Ophthalmol. 1992 ; 230 : 385-90.
[37] Emi K, Pederson JE, Toris CB. Hydrostatic pressure of suprachoroidal space. Invest Ophthalmol Vis Sci. 1989 ; 30 : 233-8.
[38] Epstein DL, Rohen JW. Morphology of the trabecular meshwork and inner-wall endothelium after cationized ferritin perfusion in the monkey eye. Invest Ophthalmol Vis Sci. 1991 ; 32 : 160-71.
[39] Ethier CR, Read AT, Chan DW. Effects of latrunculin-B on outflow facility and trabecular meshwork structure in human eyes. Invest Ophthalmol Vis Sci. 2006 ; 47 : 1991-8.
[40] Ethier CR. The inner wall of Schlemm’s canal. Exp Eye Res. 2002 ; 74 : 161-72.
[41] Fingert JH, Stone EM, Sheffield VC, Alward WL. Myocilin glaucoma. Surv Ophthalmol. 2002 ; 47 : 547-61.
[42] Freddo TF. Shifting the paradigm of the blood-aqueous barrier. Exp Eye Res. 2001 ; 3 : 581-92.
[43] Gabelt BT, Kaufman PL. Aqueous humor hydrodynamics. In : Kaufman P, Alm A (Eds). Adler’s physiology of the eye. 10th ed. St. Louis, Mosby, 2003 : 237-89.
[44] Gabelt BT, Kaufman PL. Prostaglandin F2 alpha increases uveoscleral outflow in the cynomolgus monkey. Exp Eye Res. 1989 ; 49 : 389-402.
[45] Gharagozloo NZ, Larson RS, Kullerstrand W, et al. Terbutaline stimulates aqueous humor flow in humans during sleep. Arch Ophthalmol. 1988 ; 106 : 1218-20.
[46] Gharagozloo NZ, Relf SJ, Brubaker RF. Aqueous flow is reduced by the alpha- adrenergic agonist, apraclonidine hydrochloride (ALO 2145). Ophthalmologica. 1988 ; 95 : 1217-20.
[47] Gills JP, Roberts BC, Epstein DL. Microtubule disruption leads to cellular contraction in human trabecular meshwork cells. Invest Ophthalmol Vis Sci. 1998 ; 39 : 653-8.
[48] Grant WM. Experimental aqueous perfusion in enucleated human eyes. Arch Ophthalmol. 1963 ; 69 : 783-801.
[49] Green K, Roth M. Ocular effects of topical administration of delta 9-tetrahydrocannabinol in man. Arch Ophthalmol. 1982 ; 100 : 265-7.
[50] Grosheva I, Vittitow JL, Goichberg P, et al. Caldesmon effects on the actin cytoskeleton and cell adhesion in cultured HTM cells. Exp Eye Res. 2006 ; 82 : 945-58.
[51] Hairston RJ, Maguire AM, Vitale S, et al. Morphometric analysis of pars plana development in humans. Retina. 1997 ; 17 : 135-8.
[52] Hann CR, Springett MJ, Wang X, Johnson DH. Ultrastructural localization of collagen IV, fibronectin, and laminin in the trabecular meshwork of normal and glaucomatous eyes. Ophthalmic Res. 2001 ; 33 : 314-24.
[53] Hayreh SS The ophthalmic artery : branches. Br J Ophthalmol. 1962 ; 46 : 212-47.
[54] Hogan M, Alvarado JA, Weddell JE. Histology of the human eye. Philadelphia, WB Saunders, 1971.
[55] Honjo M, Tanihara H, Inatani M, et al. Effects of rho-associated protein kinase inhibitor Y-27632 on intraocular pressure and outflow facility. Invest Ophthalmol Vis Sci. 2001 ; 42 : 137-44.
[56] Inomata H, Bill A, Smelser GK. Aqueous humor pathways through the trabecular meshwork and into Schlemm’s canal in the cynomolgus monkey (Macaca irus). An electron microscopic study. Am J Ophthalmol. 1972 ; 73 : 760-89.
[57] Jones RF, Maurice DM. New methods of measuring the rate of aqueous flow in man with fluorescein. Exp Eye Res. 1966 ; 5 : 208-20.
[58] Kaufman PL, Bárány EH. Adrenergic drug effects on aqueous outflow facility following ciliary muscle retrodisplacement in the cynomolgus monkey. Invest Ophthalmol Vis Sci. 1981 ; 20 : 644-51.
[59] Kaufman PL, Gabelt BT. Cholinergic mechanisms and aqueous humor dynamics. In : Drance SM et al. (eds). Pharmacology of glaucoma. Baltimore, Williams & Wilkins, 1992 : 64.
[60] Khodadoust AA, Stark WJ, Bell WR. Coagulation properties of intraocular humors and cerebrospinal fluid. Invest Ophtalmol Vis Sci. 1983 ; 24 : 1616-9.
[61] Kim JW, Lindsey JD, Wang N, Weinreb RN. Increased human scleral permeability with prostaglandin exposure. Invest Ophthalmol Vis Sci. 2001 ; 42 : 1514-21.
[62] Kitada S, Shapourifar-Tehrani S, Smyth RJ, et al. Characterization of human and rabbit pigmented and nonpigmented ciliary body epithelium. Curr Eye Res. 1991 ; 10 : 409-15.
[63] Kleinstein RN, Fatt I. Pressure dependency of transcleral flow. Exp Eye Res. 1977 ; 24 : 335-40.
[64] Koskela TK, Reiss GR, Brubaker RF, Ellefson RD. Is the high concentration of ascorbic acid in the an adaptation to intense solar radiation ? Invest Ophtalmol Vis Sci. 1989 ; 30 : 2265-7.
[65] Krause U, Raunio V. Proteins of the normal human aqueous humor. Ophthalmologica. 1969 ; 159 : 178-85.
[66] Lang J, Kageyama I The ophthalmic artery and its branches, measurements and clinical importance. Surg Radiol Anat. 1990 ; 12 : 83-90.
[67] Larsson LI, Rettig ES, Brubaker RF. Aqueous flow in open-angle glaucoma. Arch Ophthalmol. 1995 ; 113 : 283-6.
[68] Lee DA, Brubaker RF, Nagataki S. Acute effect of thymoxamine on aqueous humor formation in the epinephrine-treated normal eye as measured by fluorophotometry. Invest Ophthalmol Vis Sci. 1983 ; 24 : 165-8.
[69] Lee DA, Brubaker RF. Effect of phenylephrine on aqueous humor flow. Curr Eye Res. 1982-1983 ; 2 : 89-92
[70] Lindsey JD, Kashiwagi K, Boyle D, et al. Prostaglandins increase proMMP-1 and proMMP-3 secretion by human ciliary smooth muscle cells. Curr Eye Res. 1996 ; 15 : 869-75.
[71] Lindsey JD, Kashiwagi K, Kashiwagi F, Weinreb RN. Prostaglandin action on ciliary smooth muscle extracellular matrix metabolism : implications for uveoscleral outflow. Surv Ophthalmol. 1997 ; 41 (Suppl. 2) : S53-9.
[72] Liu X, Cai S, Glasser A, et al. Effect of H-7 on cultured human trabecular meshwork cells. Mol Vis. 2001 ; 7 : 145-53.
[73] Liu X, Hu Y, Filla MS, et al. The effect of C3 transgene expression on actin and cellular adhesions in cultured human trabecular meshwork cells and on outflow facility in organ cultured monkey eyes. Mol Vis. 2005 ; 11 : 1112-21.
[74] Lu Z, Overby DR, Scott PA, et al. The mechanism of increasing outflow facility by rho-kinase inhibition with Y-27632 in bovine eyes. Exp Eye Res. 2008 ; 86 : 271-81.
[75] Lütjen-Drecoll E. Morphological changes in glaucomatous eyes and the role of TGFbeta2 for the pathogenesis of the disease. Exp Eye Res. 2005 ; 81 : 1-4.
[76] Marshall GE, Konstas AG, Abraham S, et al. Extracellular matrix in aged human ciliary body : an immunoelectron microscope study. Invest Ophthalmol Vis Sci. 1992 ; 33 : 2546-60.
[77] McLaren JW, Herman DC, Brubaker RF, et al. Effect of ibopamine on aqueous humor production in normotensive humans. Invest Ophthalmol Vis Sci. 2003 ; 44 : 4853-8.
[78] McLaren JW. Measurement of aqueous humor flow. Exp eye Res. 2009 ; 88 : 641-7.
[79] McMenamin PG, Lee WR, Aitken DA. Age-related changes in the human outflow apparatus. Ophthalmology. 1986 ; 93 : 194-209.
[80] Neufeld AH, Chavis RM, Sears ML. Cyclic-AMP in the aqueous humor : the effects of repeated topical epinephrine administration and sympathetic denervation. Exp Eye Res. 1973 ; 16 : 265-72.
[81] Neufeld AH, Sears ML. Cyclic-AMP in ocular tissues of the rabbit, monkey, and human. Invest Ophthalmol. 1974 ; 13 : 475-7.
[82] Nilsson SF. Studies on ocular blood flow and aqueous humor dynamics. Effects of VIP and PHI related to the effects of facial nerve stimulation. Acta Univ Uppsala. 1986 ; 43 : 1-38.
[83] O’Brien ET, Lee RE, Epstein DL. Ethacrynic acid disrupts steady state microtubules in vitro. Curr Eye Res. 1996 ; 15 : 985-90.
[84] O’Brien ET, Perkins SL, Roberts BC, Epstein DL. Dexamethasone inhibits trabecular cell retraction. Exp Eye Res. 1996 ; 62 : 675-88.
[85] Pederson JE, Gaasterland DE, MacLellan HM. Uveoscleral aqueous outflow in the rhesus monkey : importance of uveal reabsorption. Invest Ophthalmol Vis Sci. 1977 ; 16 : 1008-7.
[86] Peterson JA, Tian B, Bershadsky AD, et al. Latrunculin-A increases outflow facility in the monkey. Invest Ophthalmol Vis Sci. 1999 ; 40 : 931-41.
[87] Peterson WS, Jocson VL, Sears ML. Resistance to aqueous outflow in the rhesus monkey eye. Am J Ophthalmol. 1971 ; 72 : 445-51.
[88] Prata TS, Tavares IM, Mello PA, et al. Hypotensive effect of juxtascleral administration of anecortave acetate in different types of glaucoma. J Glaucoma. 2010 ; 19 : 488-92.
[89] Purnell WD, Gregg JM. Delta (9)-tetrahydrocannabinol, euphoria and intraocular pressure in man. Ann Ophthalmol. 1975 ; 7 : 921-3.
[90] Rauz S, Cheung CM, Wood PJ, et al. Inhibition of 11beta-hydroxysteroid dehydrogenase type 1 lowers intraocular pressure in patients with ocular hypertension. QJM. 2003 ; 96 : 481-90.
[91] Rauz S, Walker EA, Shackleton CH, et al. Expression and putative role of 11 beta-hydroxysteroid dehydrogenase isozymes within the human eye. Invest Ophthalmol Vis Sci. 2001 ; 42 : 2037-42.
[92] Raviola G, Butler JM. Unidirectional transport mechanism of horseradish peroxidase in the vessels of the iris. Invest Ophthalmol Vis Sci. 1984 ; 25 : 827-36.
[93] Raviola G, Raviola E. Intercellular junctions in the ciliary epithelium. Invest Ophthalmol Vis Sci. 1978 ; 17 : 958-81.
[94] Reddy VN, Giblin FJ, Lin LR, Chakrapani B. The effect of aqueous humor ascorbate on ultraviolet-B-induced DNA damage in lens epithelium. Invest Ophtalmol Vis Sci. 1998 ; 39 : 344-50.
[95] Reitsamer HA, Kiel JW. Effects of dopamine on ciliary blood flow, aqueous production, and intraocular pressure in rabbits. Invest Ophthalmol Vis Sci. 2002 ; 43 : 2697-703.
[96] Robinson JC, Kaufman PL. Cytochalasin B potentiates epinephrine’s outflow facility-increasing effect. Invest Ophthalmol Vis Sci. 1991 ; 32 : 1614-8.
[97] Robinson JC, Kaufman PL. Effects and interactions of epinephrine, norepinephrine, timolol, and betaxolol on outflow facility in the cynomolgus monkey. Am J Ophthalmol. 1990 ; 109 : 189-94.
[98] Robinson JC, Kaufman PL. Phalloidin inhibits epinephrine’s and cytochalasin B’s facilitation of aqueous outflow. Arch Ophthalmol. 1994 ; 112 : 1610-3.
[99] Rohen JW, Linnér E, Witmer R. Electron microscopic studies on the trabecular meshwork in two cases of corticosteroid-glaucoma. Exp Eye Res. 1973 ; 17 : 19-31.
[100] Rosenquist R, Epstein D, Melamed S, et al. Outflow resistance of enucleated human eyes at two different perfusion pressures and different extents of trabeculotomy. Curr Eye Res. 1989 ; 8 : 1233-40.
[101] Ruskell GL The distribution of autonomic post ganglionic nerve fibres to the lacrimal gland in monkeys. J Anat. 1971 ; 109 : 229-42.
[102] Sabanay I, Tian B, Gabelt BT, et al. Latrunculin B effects on trabecular meshwork and corneal endothelial morphology in monkeys. Exp Eye Res. 2006 ; 82 : 236-46.
[103] Sagara T, Gaton DD, Lindsey JD, et al. Topical prostaglandin F2alpha treatment reduces collagen types I, III, and IV in the monkey uveoscleral outflow pathway. Arch Ophthalmol. 1999 ; 117 : 794-801.
[104] Sampaolesi R, Argento C. Scanning electron microscopy of the trabecular meshwork in normal and glucomatous eyes. Invest Ophthalmol Vis Sci. 1977 ; 16 : 302-14.
[105] Samuelson D, Streit A. Microanatomy of the anterior uveoscleral outflow pathway in normal and primary open-angle glaucomatous dogs. Vet Ophthalmol. 2012 ; 15 (Suppl. 1) : 47-53.
[106] Schenker HI, Yablonski ME, Podos SM, Linder L. Fluorophotometric study of epinephrine and timolol in human subjects. Arch Ophthalmol. 1981 ; 99 : 1212-6.
[107] Schlotzer-Schrehardt U, Lommatzsch J, Kuchle M, et al. Matrix metalloproteinases and their inhibitors in aqueous humor of patients with exfoliation syndrome/glaucoma and primary open-angle glaucoma. Invest Ophtalmol Vis Sci. 2003 ; 44 : 1117-25.
[108] Schlötzer-Schrehardt U, Zenkel M, Nüsing RM. Expression and localization of FP and EP prostanoid receptor subtypes in human ocular tissues. Invest Ophthalmol Vis Sci. 2002 ; 43 : 1475-87.
[109] Sears ML, Neufeld AH. Editorial : Adrenergic modulation of the outflow of aqueous humor. Invest Ophthalmol. 1975 ; 14 : 83-6.
[110] Selbach JM, Posielek K, Steuhl KP, Kremmer S. Episcleral venous pressure in untreated primary open-angle and normal-tension glaucoma. Ophthalmologica. 2005 ; 219 : 357-61.
[111] Shahidullah M, Yap M, To CH. Cyclic GMP, sodium nitroprusside and sodium azide reduce aqueous humour formation in the isolated arterially perfused pig eye. Br J Pharmacol. 2005 ; 145 : 84-92
[112] Shirato S, Murphy CG, Bloom E, et al. Kinetics of phagocytosis in trabecular meshwork cells. Flow cytometry and morphometry. Invest Ophthalmol Vis Sci. 1989 ; 30 : 2499-511.
[113] Sultan M, Blondeau P. Episcleral venous pressure in younger and older subjects in the sitting and supine positions. J Glaucoma. 2003 ; 12 : 370-3.
[114] Tamm ER, Flügel C, Stefani FH, Lütjen-Drecoll E. Nerve endings with structural characteristics of mechanoreceptors in the human scleral spur. Invest Ophthalmol Vis Sci. 1994 ; 35 : 1157-66.
[115] Tarkkanen A, Niemi M. Enzyme histochemistry of the angle of the anterior chamber of the human eye. Acta Ophthalmol (Copenh). 1967 ; 45 : 93-9.
[116] Tektas OY, Lütjen-Drecoll E. Structural changes of the trabecular meshwork in different kinds of glaucoma. Exp Eye Res. 2009 ; 88 : 769-75.
[117] Tian B, Geiger B, Epstein DL, Kaufman PL. Cytoskeletal involvement in the regulation of aqueous humor outflow. Invest Ophthalmol Vis Sci. 2000 ; 41 : 619-23.
[118] Toris CB, Camras CB, Yablonski ME. Acute versus chronic effects of brimonidine on aqueous humor dynamics in ocular hypertensive patients. Am J Ophthalmol. 1999 ; 128 : 8-14.
[119] Toris CB, Camras CB, Yablonski ME. Aqueous humor dynamics in ocular hypertensive patients. J Glaucoma. 2002 ; 11 : 253-8.
[120] Toris CB, Tafoya ME, Camras CB, Yablonski ME. Effects of apraclonidine on aqueous humor dynamics in human eyes. Ophthalmology. 1995 ; 102 : 456-61.
[121] Toris CB, Yablonski ME, Wang YL, Camras CB. Aqueous humor hynamics in the aging human eye. Am J Ophthalmol. 1999 ; 127 : 407-12.
[122] Tripathi RC. Mechanism of the aqueous outflow across the trabecular wall of Schlemm’s canal. Exp Eye Res. 1971 ; 11 : 116-21.
[123] Underwood JL, Murphy CG, Chen J, et al. Glucocorticoids regulate transendothelial fluid flow resistance and formation of intercellular junctions. Am J Physiol. 1999 ; 277 : C330-42.
[124] Van Alphen GW, Robinette SL, Macri FJ. Drug effects on ciliary muscle and choroid preparations in vitro. Arch Ophthalmol. 1962 ; 68 : 81-93.
[125] Vegget T. Ultrastructure of normal human trabecular endothelium. Acta Ophthalmol (Copenh). 1963 ; 41 : 193-9.
[126] Vuori ML, Kaila T, Iisalo E, Saari KM. Concentrations and antagonist activity of topically applied betaxolol in aqueous humour. Acta Ophthalmol (Copenh). 1993 ; 71 : 677-81.
[127] Wax MB, Molinoff PB, Alvarado J, Polansky J. Characterization of beta-adrenergic receptors in cultured human trabecular cells and in human trabecular meshwork. Invest Ophthalmol Vis Sci. 1989 ; 30 : 51-7.
[128] Weinreb RN, Bloom E, Baxter JD, et al. Detection of glucocorticoid receptors in cultured human trabecular cells. Invest Ophthalmol Vis Sci. 1981 ; 21 : 403-7.
[129] Weinreb RN, Mitchell MD, Polansky JR. Prostaglandin production by human trabecular cells : in vitro inhibition by dexamethasone. Invest Ophthalmol Vis Sci. 1983 ; 24 : 1541-5.
[130] Weinreb RN, Toris CB, Gabelt BT, et al. Effects of prostaglandins on the aqueous humor outflow pathways. Surv Ophthalmol. 2002 ; 47 (Suppl. 1) : S53-64.
[131] Weinreb RN. Enhancement of scleral macromolecular permeability with prostaglandins. Trans Am Ophthalmol Soc. 2001 ; 99 : 319-43.
[132] Wiederholt M. Direct involvement of trabecular meshwork in the regulation of aqueous humor outflow. Curr Opin Ophthalmol. 1998 ; 9 : 46-9.
[133] Yücel YH, Johnston MG, Ly T, et al. Identification of lymphatics in the ciliary body of the human eye : a novel “uveolymphatic” outflow pathway. Exp Eye Res. 2009 ; 89 : 810-9.
[134] Zhang D, Vetriel L, Verkman AS. Aquaporin deletion in mice reduces intraocular pressure and aqueous fluid production. J Gen Physiol. 2002 ; 119 : 561-9.

