J.-P. Renard, A.F. Marill
Une prise en charge optimale du glaucome primitif à angle ouvert (GPAO) doit considérer plusieurs spécificités liées aux particularités cliniques de l’affection, au terrain propre à chaque patient ainsi qu’aux conditions que doit remplir le médecin.
À côté des critères cliniques décisionnels dans la prise en charge, le stade de la neuropathie ainsi que son impact dans la vie quotidienne – mieux connu dès les stades précoces – sont des facteurs importants à évaluer.
Toutes les informations données concernant l’affection dès le stade de l’annonce du diagnostic et au cours du suivi doivent faire l’objet d’une traçabilité et d’une notification dans le dossier pour des raisons médicolégales.
Les variations de la perception de l’affection par le patient, différentes en fonction de l’âge, ont montré leur influence dans les modalités et les résultats de la prise en charge.
La qualité de l’information délivrée ainsi qu’une bonne maîtrise par le médecin des changements de comportements sont devenues essentielles dans la prise en charge individuelle adaptée à chaque étape du suivi.
Au-delà des modalités de la prise en charge classique des affections chroniques, avec leurs spécificités, la prise en charge du GPAO doit s’adapter en fonction de trois grands types de facteur dont il faut toujours tenir compte tout au long de la prise en charge :
des facteurs spécifiques à l’affection : modalités évolutives variables d’un patient à l’autre ; retentissement structural et fonctionnel irréversible dépendant de nombreux paramètres et du stade de la neuropathie optique ;
des facteurs propres à chaque patient, avec plusieurs niveaux de compréhension, d’acceptation et d’implication active de la part du patient, variables avec son âge, et source d’importantes conséquences sur sa qualité de vie et sur l’observance du suivi ;
des facteurs liés au médecin. La qualité de l’information délivrée et celle de la relation de confiance établie conditionnent une prise en charge optimale et adaptée.
La prise en charge adaptée, au-delà de son importance clinique et éthique évidente, prend aussi une importance médicolégale qu’il faut hélas souligner. Cette prise en charge de la neuropathie glaucomateuse peut être source de litiges heureusement rares qui concernent la contestation de conduites diagnostiques de glaucomes découverts à des stades avancés ou des mises en cause de prise en charge et de surveillance inadaptées.
Dans ses rapports annuels, par exemple pour l’année 2009 [12], le Sou Médical indique huit déclarations (sept dossiers) mettant en cause la conduite diagnostique de glaucomes découverts à des stades avancés, dont trois glaucomes à pression normale, ainsi que cinq déclarations contestant la prise en charge, la surveillance et le traitement du glaucome. En 2012, une relative stabilité a été notée par rapport aux années précédentes, avec six déclarations de ce type [12].
Principal facteur de risque de la neuropathie optique glaucomateuse, nous avons vu l’importance de la recherche et du contrôle d’une pression intra-oculaire (PIO) cible propre à chaque patient. La PIO avant traitement, le stade clinique de la neuropathie, la vitesse de progression, l’espérance de vie du patient ainsi que les autres facteurs de risque associés sont autant de facteurs à considérer dans cette démarche. Cette PIO cible doit être évaluée lors de chaque visite, ajustée en fonction des déficits en retenant les possibilités de « PIO idéale », de « PIO acceptable » et de « PIO limite » en fonction du contexte clinique individuel. Le médecin traitant dispose ainsi d’une certaine amplitude de manœuvre en fonction du rapport bénéfice/risque dans la détermination de la PIO optimale (voir chapitre 17-II paragraphe « Pressions cibles dans le glaucome »).
Le dépistage systématique des facteurs de risque de progression du GPAO reste une préoccupation constante dans le cadre d’une prise en charge vigilante. Il s’attache à rechercher tout nouveau facteur susceptible d’apparaître à chaque instant, en particulier la survenue de facteurs responsables d’une progression possible et qui peuvent être contrôlés, comme les facteurs vasculaires et systémiques, ou certains facteurs liés au mode de vie (voir chapitre 10-V).
La conception classique du GPAO en tant qu’affection chronique d’évolution lentement progressive n’est plus aussi tranchée. Elle a cédé la place à celle d’une affection neurodégénérative au potentiel évolutif variable avec les formes cliniques de « progresseur rapide » et de « progresseur lent » qu’il faut savoir dépister et reconnaître pour une prise en charge clinique et thérapeutique adaptée (fig. 19-1). S’y ajoute la notion de succession possible de phases de progression de différents types, au cours de l’histoire de la maladie, qui imposent un suivi vigilant (voir chapitre 11-II).
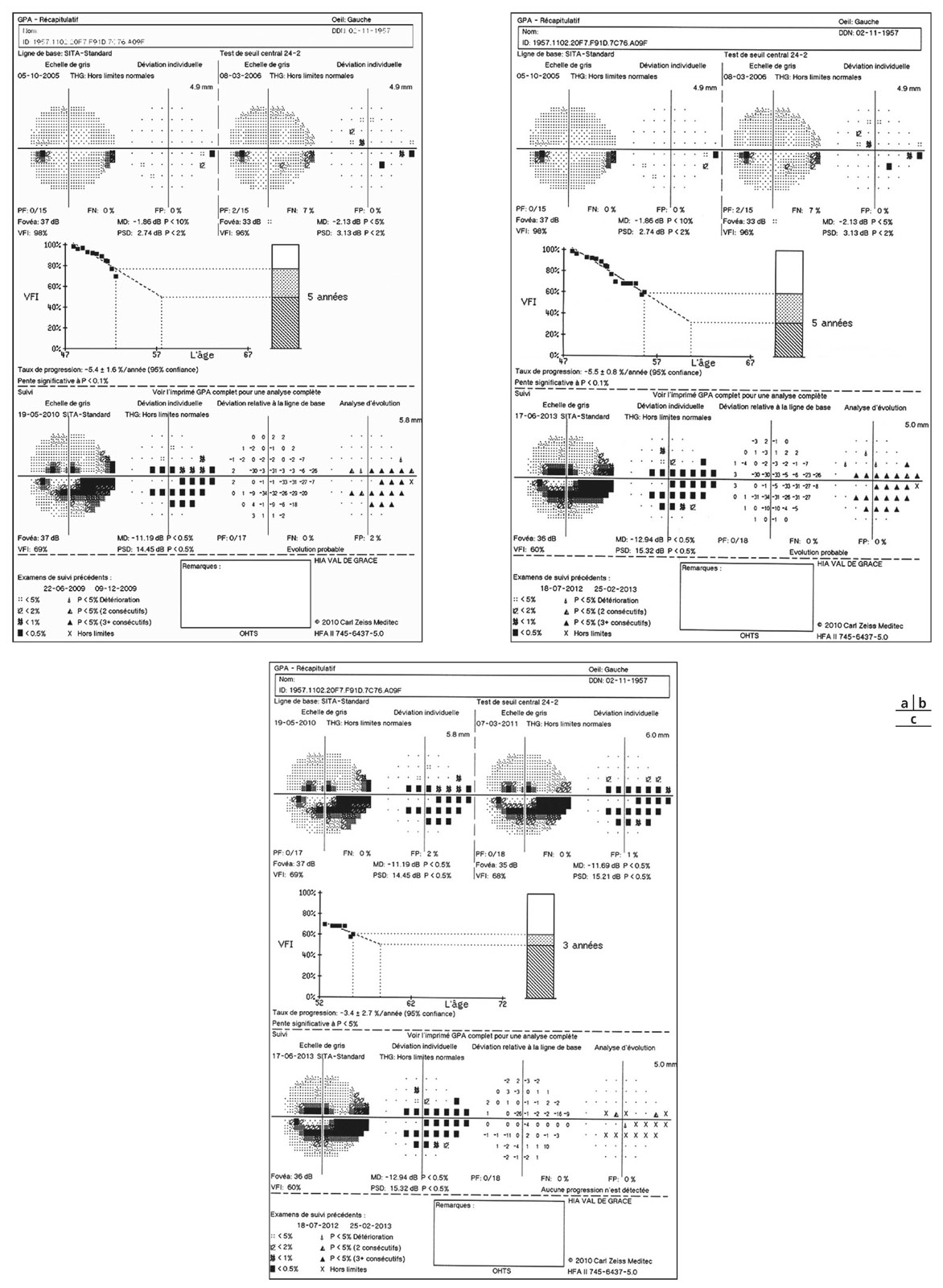
Fig. 19-1 a. Détection d’une progression rapide malgré une PIO cible atteinte avec un traitement médical maximal raisonnable chez un patient atteint de GPAO. b. Après trabéculoplastie au laser SLT, amélioration de la courbe de progression. c. Le taux de progression plus stable évalué après cette nouvelle étape thérapeutique confirme une prise en charge adaptée
La prise en charge doit être également adaptée en fonction du stade clinique du GPAO.
Au moment du diagnostic, quel que soit le stade clinique, la nécessité d’un nombre suffisant d’examens d’évaluation de l’atteinte structurale et fonctionnelle pour établir une bonne base de données initiales de référence est essentielle.
Au stade de GPAO débutant, l’analyse de l’atteinte structurale et fonctionnelle et de leur progression doit se faire avec tous les moyens paracliniques disponibles jusqu’à un stade avancé de la neuropathie. Si l’on considère classiquement la nécessité d’une atteinte sévère du champ visuel pour observer un retentissement sur les activités de la vie quotidienne, les atteintes modérées semblent avoir un impact plus précoce et plus fréquent que ce que l’on pensait [8]. Les patients rapportent des plaintes visuelles précoces (éblouissement nocturne, difficultés d’adaptation à la lumière ou à l’obscurité, vision floue) qu’ils attribuent au glaucome et qui traduisent en fait l’atteinte de la sensibilité aux contrastes. Ces difficultés rapportées sont identiques, que le déficit soit débutant ou modéré [10, 16]. L’analyse monoculaire du champ visuel en pratique clinique peut sous-estimer le retentissement binoculaire de déficits modérés, en particulier en cas de localisations paracentrales. Ce retentissement visuel doit être recherché à l’interrogatoire car il peut être un élément décisionnel dans l’adaptation de la prise en charge. La classique monothérapie initiale doit savoir céder rapidement la place à une association fixe, de préférence, bien tolérée et de même posologie au stade modéré ou en cas de progression rapide.
Au stade de GPAO évolué, quand les techniques d’analyse de l’atteinte structurale – notamment l’évaluation de la couche des fibres nerveuses rétiniennes péripapillaires en OCT-SD – ont atteint leurs limites et lorsque celles de l’évaluation de la progression de l’atteinte fonctionnelle sont difficiles, l’étude du complexe maculaire cellulaire ganglionnaire en OCT-SD a démontré son intérêt dans le suivi de ces patients.
La mesure de la qualité de vie définie par l’Organisation mondiale de la santé, comme la perception subjective de bien-être et de plénitude [25], est importante dans la prise en charge du patient glaucomateux (voir chapitre 17-III).
Les différents questionnaires développés pour son évaluation manquent de spécificité ou n’ont pas démontré leur facilité d’emploi en pratique clinique courante. Les résultats des différentes études, dont ceux rapportés avec le questionnaire français Glau-Qol 36, ont toutefois permis de montrer les principales dimensions caractéristiques à considérer dans le GPAO [2, 3, 22] et qui se résument en sept items : l’anxiété, l’image de soi, le psychisme, les contraintes, la prise en charge, la vie quotidienne et la conduite.
L’étude française réalisée il y a quelques années avec la version Glau-Qol 17 du questionnaire chez 756 sujets regroupant tous les stades cliniques, allant de l’hypertension-intra-oculaire (HTO) non traitée au glaucome évolué, rapporte des données intéressantes à considérer dans la prise en charge.
Quel que soit le stade de l’HTO et du glaucome, l’anxiété et l’image de soi sont les dimensions les plus altérées, et ce sans corrélation avec la sévérité du glaucome. Leur perturbation importante dès le stade d’HTO non traitée, sans être plus affectée aux stades plus évolués, souligne l’impact de l’affection dès son annonce.
Une autre étape est marquée lors de l’instauration d’un traitement avec un retentissement au niveau de trois autres dimensions, dont l’altération augmente avec les stades évolutifs de la neuropathie : les contraintes liées au traitement, le psychisme avec le sentiment de fragilité (voire dépression) et la prise en charge avec une baisse de confiance du patient dans la qualité de celle-ci.
C’est à partir du stade de glaucome modéré avec une altération plus marquée du CV, que les autres dimensions concernant la conduite automobile (accidents, conduite dans l’obscurité, sur de longues distances…) et la vie quotidienne (difficultés de lecture, mouvements de poursuites et saccades oculaires, chutes…) sont de plus en plus perturbées avec la progression de l’atteinte fonctionnelle [11, 24, 27] (fig. 19-2 et 19-3).
Ces résultats confirmés par de nombreuses études montrent que l’impact du GPAO dans la vie quotidienne du patient doit être recherché et considéré afin de contrôler au mieux certaines dimensions comme l’anxiété, l’image de soi, un état psychique parfois dépressif, et d’accéder à une prise en charge adaptée [1, 7, 8, 17, 20, 23].
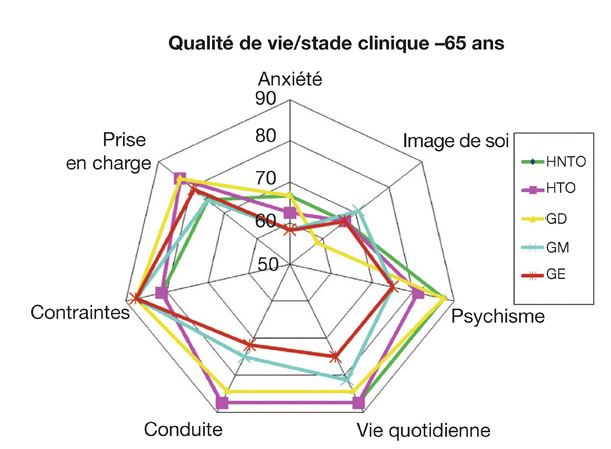
Fig. 19-2 Scores de qualité de vie par dimension pour la population de moins de 65 ans. HNTO : HTO non traitée ; HTO : hypertension intra-oculaire ; GD : glaucome débutant ; GM : glaucome modéré ; GE : glaucome évolué. (D’après Zanlonghi X, 2003 [27].)
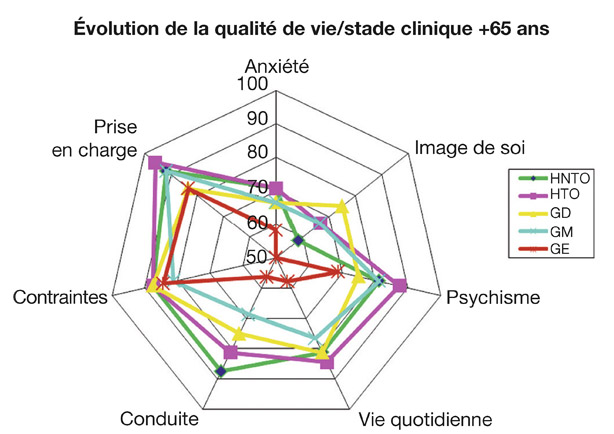
Fig. 19-3 Scores de qualité de vie par dimension pour la population de plus de 65 ans. HNTO : HTO non traitée ; HTO : hypertension intra-oculaire ; GD : glaucome débutant ; GM : glaucome modéré ; GE : glaucome évolué. (D’après Zanlonghi X, 2003 [27].)
C’est un facteur important dans la prise en charge thérapeutique du GPAO.
Le sujet jeune nécessite une attention particulière sur trois points essentiels :
la détermination de la PIO cible à atteindre. La préservation maximale du capital fonctionnel passe par un schéma thérapeutique plus rigoureux qui s’attachera à la recherche et au maintien constant d’une PIO cible plus basse pour un contrôle optimal du GPAO avec un recours fréquent aux associations fixes à une instillation quotidienne ;
le caractère pauci symptomatique du GPAO et l’hyperactivité socioprofessionnelle du sujet jeune ne facilitent pas l’acceptation ni la compréhension initiale de la neuropathie et de ses conséquences. Une information éclairée et souvent réitérée dans un climat de confiance prend toute sa valeur et son importance. Dès le stade initial d’HTO et de glaucome débutant, le défaut de confiance dans la prise en charge par le médecin est fréquent, conduisant à un suivi irrégulier des contrôles cliniques et des recommandations, avec un sentiment de manque d’information concernant l’affection et le traitement (voir fig. 19-2) ;
l’observance du traitement souvent insuffisante et dissimulée pour les mêmes raisons chez le sujet jeune doit être évaluée avec vigilance (voir chapitre 17-II). La prise en charge favorise la motivation par les associations fixes en mono-instillation quotidienne avec un passage rapide au traitement physique et chirurgical.
Le sujet plus âgé est souvent déjà traité pour d’autres affections et la prise en charge du GPAO doit s’adapter au contexte de ces traitements multiples avec au,-delà des préoccupations de compatibilité, celles de la tolérance.
L’adhérence au traitement est en général meilleure mais sa tolérance, en particulier au niveau de la surface oculaire, proportionnelle à l’ancienneté et au nombre de traitements locaux, vient souvent perturber sa bonne observance. La prise en charge doit alors s’adapter et bénéficie dans ces situations cliniques des nouvelles formulations des collyres sans conservateur, ainsi que des associations fixes et des nouveaux traitements physiques dont les indications dans la stratégie thérapeutique sont devenues plus précoces.
Si le sentiment de confiance dans la « prise en charge » est peu altéré avec peu de remise en question chez les patients de plus de 65 ans, l’impact sur la vie quotidienne (lecture, poursuites oculaires, aide aux déplacements, etc.) est bien plus important que chez le sujet plus jeune dès le stade de glaucome modéré. Il s’accentue avec la progression du glaucome (voir fig. 19-3). Au stade de glaucome sévère, la vie quotidienne, le bien-être psychique et la conduite sont très altérés [27]. Si les chutes et les accidents plus fréquents relèvent d’étiologies multifactorielles, les altérations de la fonction visuelle sont bien reconnues comme la principale cause de chutes chez les personnes âgées.
Enfin les troubles cognitifs, retrouvés chez 20 % des patients âgés atteints de GPAO (m environ 70 ans), doivent être pris en considération pour adapter la prise en charge de ces patients avec souvent l’aide de l’entourage [26].
Dès la prescription du traitement, les effets secondaires potentiels des collyres doivent être expliqués au patient. Ils sont recherchés à chaque visite de contrôle afin d’assurer la meilleure observance. Les schémas thérapeutiques doivent être simplifiés au maximum (intérêt d’une monothérapie, d’unidoses sans conservateur, d’associations fixes, etc.) pour une prise en charge la plus bénéfique possible [18, 21].
L’association d’un type particulier de personnalité A ou B au GPAO a été évaluée. Le comportement de type A, avec une conduite caractérisée par un sentiment permanent d’urgence, d’hyperactivité, d’hyper-investissement professionnel et de nervosité facile, est retrouvé chez 64 % des patients et associé à des altérations du champ visuel [5]. Le comportement de type B, plus détendu, plus coopératif, avec un rythme plus régulier et moins dans la précipitation globale, est moins fréquemment observé.
Une information claire, concise et la plus complète possible, en s’assurant de sa bonne compréhension, marque le début d’une prise en charge correcte. Elle passe par la mise en pratique de moyens adaptés aux temps essentiels que sont l’annonce du diagnostic et chaque stade évolutif au cours du suivi.
L’annonce du GPAO, comme celle de toute maladie chronique, demeure pour le patient un moment difficile susceptible d’altérer son mode de vie et celui de son entourage. À la phase initiale, l’impact sur la fonction visuelle et sa vie quotidienne sont plus une source d’inquiétude que le niveau de la PIO ou le degré d’atteinte du champ visuel. Dans l’étude CIGTS (Collaborative Initial Glaucoma Treatment Study), 50 % des patients lors de l’inclusion redoutaient le glaucome en raison du risque de cécité [15]. L’annonce doit être prudente, la plus neutre possible, en s’adaptant au mieux à la personnalité et au profil psychologique du patient qui vont moduler la perception, la compréhension et l’acceptation de l’information (voir chapitre 17-III).
L’annonce de l’affection, ses modalités et, dans la mesure du possible, son contenu doivent faire l’objet d’une traçabilité dans le dossier du patient. Tous les compléments d’informations, ainsi que ceux donnés à la demande du patient, délivrés lors des visites de contrôles, seront également notifiés dans le dossier. On s’assurera dans la mesure du possible de la bonne compréhension de l’information délivrée. On pourra noter également, par exemple, que la consultation du site de la Société française du glaucome a été conseillée en complément d’information.
La qualité de la communication et de la relation individuelle établie avec le patient est parmi les garants d’une bonne prise en charge.
Au cours d’une enquête réalisée chez 4 310 patients atteints de GPAO, 28 % indiquent avoir changé d’ophtalmologiste depuis l’annonce du diagnostic, dans 60 % des cas en raison d’une communication jugée insuffisante et de mauvaise qualité avec leur médecin [9].
Au cours des visites de suivi, la relation avec le patient doit s’adapter à ses attentes et à ses demandes.
Dans le cadre de la prise en charge, les patients soulignent précisément dans leurs attentes : l’importance de la communication, les qualités professionnelles, la réduction des craintes et de l’anxiété, ainsi que la délivrance de nouvelles informations concernant l’affection [4].
Une bonne prise en charge doit donc s’attacher à contrôler au mieux des facteurs plus spécifiques :
périodicité et régularité des consultations de trois à six mois, parfois inférieure ;
information renouvelée à chacun des contrôles ;
attente avant chaque consultation (jusqu’à 2 heures) ressentie comme une contrainte supplémentaire rapportée par les patients ;
délais de rendez-vous ;
annulations et reports de rendez-vous programmés [13].
Une prise en charge optimale passe par la recherche à l’interrogatoire des symptômes et des difficultés dans les tâches de la vie quotidienne, déjà présents au stade de glaucome débutant.
Une bonne compréhension de la gêne visuelle ressentie et exprimée par les patients selon le stade du glaucome est nécessaire. Aux stades précoce et modéré, les patients ressentent une gêne visuelle à type d’éblouissement ou de difficulté d’adaptation à la lumière et à l’obscurité. À un stade avancé, un tiers des patients décrivent un début de gêne aux déplacements autonomes en milieu extérieur. Au stade évolué, les perceptions visuelles sont plus celles de brouillard ou de flou visuel avec une perte progressive de la perception des détails.
L’évaluation de la perception visuelle dans les glaucomes sévères, chez 52 patients âgés de 52 à 82 ans, par une analyse d’analogies de perceptions visuelles avec six modèles photographiques de différentes scènes de la vie courante, rapporte :
aucun symptôme visuel ressenti chez 26 % des sujets avec une atteinte du champ visuel (MD ≥ – 8 dB) ;
la présence de brouillard visuel, de taches floues dans le champ de vision (MD ≥ – 18 dB) ;
des « manques » localisés (MD ≥ – 15 dB) [6].
Une prise en charge optimale et adaptée du GPAO implique en outre l’organisation et l’acceptation par le patient des contrôles réguliers, ainsi que la programmation ordonnée des bilans d’évaluation paraclinique et des prescriptions.
Les modèles « transthéoriques » de changements de comportement dans le domaine de la santé, mis au point et décrits par Prochaska et Di Clemente pour améliorer la prise en charge d’une dépendance (tabagique, alcoolique, etc.), représentent une aide à la décision destinée aux sujets non motivés, résistants ou non disposés à une prise en charge adaptée [19]. Progressivement généralisés à tous les contextes de soins au long cours, ils peuvent s’appliquer dans le cadre de la prise en charge adaptée du GPAO et se caractérisent par une succession de changements de comportement qui impliquent une progression par étapes. Le but est d’identifier les différents stades de changement afin de comprendre la motivation et le comportement du patient pour adapter l’information à chaque étape (fig. 19-4).
Les cinq stades à reconnaître pour adapter la prise en charge sont :
la « préréflexion » (ou précontemplation) ;
la « réflexion » (ou contemplation) ;
la préparation ;
l’action ;
la consolidation.
Le premier stade de « préréflexion » correspond à un désintérêt total envers la maladie et le traitement vis-à-vis desquels le patient ne se sent pas concerné et n’envisage aucune action. Ce déni de l’affection nécessite une recherche des lacunes de compréhension pour lesquelles l’information devra s’adapter.
Le deuxième stade dit de « réflexion », ou encore d’« intention », se caractérise par une ambivalence souvent exprimée dans les termes « oui… mais… » que l’on pourrait alors plutôt dénommer dans notre société de stade de « contestation… syndicaliste » ! Le patient envisage une action dans un certain avenir, mais exprime des doutes. Le rôle du médecin consiste à rompre cette ambivalence pour répondre et résoudre les difficultés évoquées d’acceptation de l’affection ainsi que de la nécessité du traitement et de contrôles réguliers (mode de vie, coût, etc.).
Au stade de « préparation », la décision de changer est prise par le patient, mais sans que ce changement de comportement soit réellement envisagé dans un futur immédiat. Il doit être encouragé.
Le stade d’« action » est celui auquel le patient s’engage à adopter un nouveau comportement qui doit être accompagné.
Le stade de « consolidation », ou d’« entretien », doit lui succéder. Capital pour ancrer l’adhérence du patient dans une prise en charge clinique et thérapeutique adaptée, il faut être conscient des variations inévitables à venir de la bonne compliance propre à chaque patient [14].
La connaissance de ces différents stades de changement de comportement, spécifiques aux affections chroniques, facilite la compréhension des variations d’attitudes parfois surprenantes des patients régulièrement suivis et permet, en fonction du contexte propre à chaque patient, d’adapter une prise en charge plus spécifique dans le cadre de la relation de confiance établie.
Ainsi la prise en charge adaptée du GPAO doit considérer les trois grandes entités représentées par l’affection, le patient et le praticien ; les facteurs spécifiques de chacun s’intriquent étroitement, en fonction de nombreux éléments avec une importance variable selon les différents stades de la neuropathie. Seule l’évaluation pertinente et vigilante de ces paramètres permet de mener à bien une prise en charge adaptée à chaque patient et à chaque stade de l’évolution
Retenir
Une bonne connaissance des facteurs spécifiques à l’affection, au patient et au médecin est nécessaire pour une prise en charge correcte du GPAO.
L’évaluation des principaux critères de surveillance doit être intégrée à la vitesse de progression variable et aux conséquences mieux connues de l’impact de l’annonce et du suivi de la neuropathie.
L’âge du patient joue un rôle important dans la conduite pratique clinique de la prise en charge. Le sujet jeune requiert une relation vigilante à l’acceptation et à la motivation du suivi clinique. Le sujet plus âgé doit bénéficier d’un accompagnement plus spécifique dans la vie quotidienne.
L’information la plus complète possible est devenue essentielle, ainsi que sa traçabilité dans le dossier du patient.
La connaissance des différents stades de changement de comportement spécifiques permet d’adapter la prise en charge dans le cadre du colloque singulier propre à chaque patient.
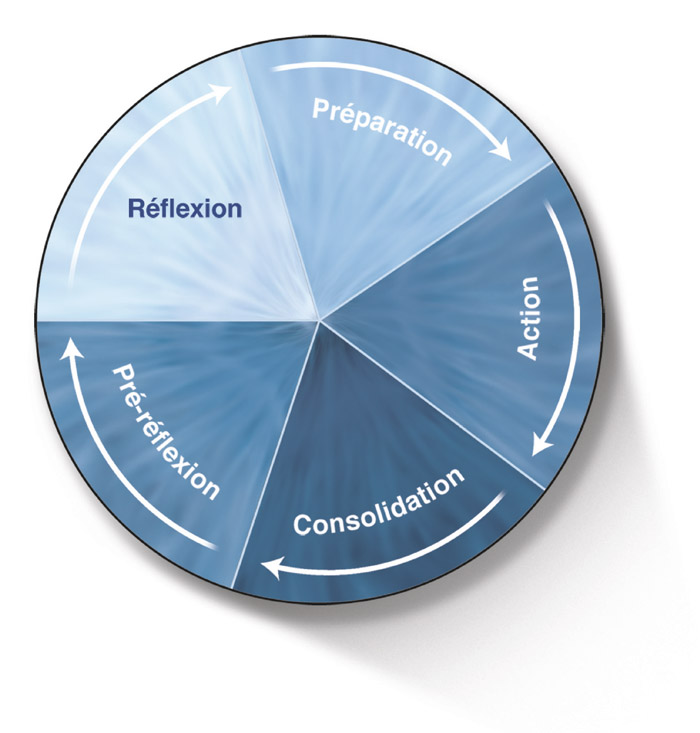
Fig. 19-4 Étapes du modèle « transthéorique » des changements de comportement pour une aide à la prise de décision. (D’après J.O. Prochaska.)
[1] Agorastos A, Skevas C, Matthaei M, et al. Depression, anxiety and disturb sleep in glaucoma. J Neuropsychiatry Clin Neurosci. 2013 ; 25 : 205-13.
[2] Baudouin C, Béchetoille A, Bron A, et al. [Relevance of quality of life and treatment compliance measurement in patients with chronic open-angle glaucoma]. J Fr Ophtalmol. 2000 ; 23 : 1057-64.
[3] Béchetoille A, Arnould B, Bron A, et al. Measurement of health-related quality of life with glaucoma : validation of the Glau-QoL 36-item questionnaire. Acta Ophthalmol (Copenh). 2008 ; 86 : 71-80.
[4] Bhargava JS, Bhan-Bhargava A, Foss AJE, et al. Views of glaucoma patients on provision of follow-up care, an assessment of patient prferences by conjoint analysis. Br J Ophthalmol. 2008 ; 92 : 1601-5.
[5] Bubella RM, Bubella DM, Cillino S. Type A behavior pattern : is it a risk factor for open-angle chronic glaucoma ? J Glaucoma. 2012 [Epub ahead of print].
[6] Crabb DP, Smith ND, Glen FC, et al. How does glaucoma look ? Patient perception of visual field loss. Ophthalmology. 2013 ; 120 : 1120-6.
[7] Glen FC, Crabb DP, Smith ND, et al. Do patients with glaucoma have difficulty recognizing faces ? Invest Ophthalmol Vis Sci. 2012 ; 53 : 3629-37.
[8] Goldberg I, Clement CI, Chiang TH, et al. Assessing quality of life in patients with glaucoma using the Glaucoma Quality of Life-15 (GQL-15) questionnaire. J Glaucoma. 2009 ; 18 : 6-12.
[9] Herndon LW, Brunner TM, Rollins JM The glaucoma research foundation patient survey : patient understanding of glaucoma and its treatment. Am J Ophthalmol. 2006 ; 141 : S22-S27.
[10] Janz NK, Wren PA, Lichter PR, et al. Quality of life in newly diagnosed glaucoma patients : The Collaborative Initial Glaucoma Treatment Study. Ophthalmology. 2001 ; 108 : 887-97 ; discussion : 898.
[11] Lamirel C, Milea D, Cochereau I, et al. Impaired saccadic eye movement in primary open-angle glaucoma. J Glaucoma. 2014 ; 23 : 23-32.
[12] Le risque des professions de santé en 2009 : Responsabilité civile professionnelle, décisions de justice, protection juridique. Revue Responsabilité (Éditions du GAMM, 10 cours du Triangle de l’Arche, TSA 40100 92919 La Défense Cedex), rapport, hors série, novembre 2010, 95 pages.
[13] Lee BW, Murakami Y, Duncan MT, et al. Patient- and system-related barriers to glaucoma follow-up in a county hospital population. Invest Ophthalmol Vis Sci. 2013 ; 54 : 6542-8.
[14] Lim MC, Watnik MR, Imson KR, et al. Adherence to glaucoma medication : the effect of interventions and association with personality type. J Glaucoma. 2013 ; 22 : 439-46.
[15] Musch DC, Lichter PR, Guire KE, et al. The Collaborative Initial Glaucoma Treatment Study : study design, methods, and baseline characteristics of enrolled patients. Ophthalmology. 1999 ; 106 : 653-62.
[16] Nelson P, Aspinall P, O’Brien C. Patients’ perception of visual impairment in glaucoma : a pilot study. Br J Ophthalmol. 1999 ; 83 : 546-52.
[17] Onakoya AO, Mbadugha CA, Aribaba OT, Ibidapo OO. Quality of life of primary open angle glaucoma patients in Lagos, Nigeria : clinical and sociodemographic correlates. J Glaucoma. 2012 ; 21 : 287-95.
[18] Park MH, Kang KD, Moon J. Korean Glaucoma Compliance Study Group. Noncompliance with glaucoma medication in Korean patients : a multicenter qualitative study. Jpn J Ophthalmol. 2013 ; 57 : 47-56.
[19] Prochaska JO. Decision making in the transtheorical model of behavior change. Med Decis Making. 2008 ; 28 : 845-4.
[20] Ramulu PY, West SK, Munoz B, et al. Glaucoma and reading speed : the Salisbury Eye Evaluation project. Arch Ophthalmol. 2009 ; 127 : 82-7.
[21] Renard JP, Giraud JM, Fenolland JR, May F. [Adherence to glaucoma therapy]. J Fr Ophtalmol. 2010 ; 33 : 291-5.
[22] Rouland JF, Denis P, Béchetoille A, et al. [Creating a specific quality-of-life questionnaire in patients with glaucoma : item generation]. J Fr Ophtalmol. 2002 ; 25 : 785-94.
[23] Skalicky S, Goldberg I. Depression and quality of life in patients with glaucoma : a cross-sectional analysis using the Geriatric Depression Scale-15, assessment of function related to vision, and the Glaucoma Quality of Life-15. J Glaucoma. 2008 ; 17 : 546-51.
[24] Smith ND, Crabb DP, Glen FC, et al. Eye movements in patients with glaucoma when viewing images of everyday scenes. Seeing Perceiving. 2012 ; 25 : 471-92.
[25] Study protocol for the World Health Organization project to develop a Quality of Life assessment instrument (WHOQOL). Qual Life Res Int J Qual Life Asp Treat Care Rehabil. 1993 ; 2 : 153-9.
[26] Yochim BP, Mueller AE, Kane KD, Kahook MY. Prevalence of cognitive impairment, depression, and anxiety symptoms among older adults with glaucoma. J Glaucoma. 2012 ; 21 : 250-4.
[27] Zanlonghi X, Arnould B, Bechetoille A, et al. Glaucome et qualité de vie. J Fr Ophtalmol. 2003 ; 26 (n° spécial 2) : S39-44.

