F. Aptel, C. Baudoin, P. Denis, P. Germain, P. Hamard, C. Lamirel, O. Laplace, A. Mermoud, E. Sellem, D. Sirbat, F. Valtot
E. Sellem
-
Les collyres bêtabloquants demeurent un traitement médical de première intention du GPAO et restent largement prescrits, seuls ou associés, malgré la prépondérance de certaines autres classes thérapeutiques.
-
Ils agissent en diminuant la sécrétion de l’humeur aqueuse, abaissant ainsi la PIO de 25 à près de 30 %.
-
Alors que leur tolérance locale est habituellement excellente, il convient de respecter les contre-indications systémiques.
Les collyres bêtabloquants (ou antagonistes β-adrénergiques) ont été les collyres antiglaucomateux les plus prescrits entre 1978 et la fin du xxe siècle. Ils demeurent un traitement reconnu de première intention de l’hypertension intra-oculaire (HTO) et du glaucome. De surcroît, le timolol est le dénominateur commun de toutes les combinaisons fixes actuellement disponibles.
Administré par voie intraveineuse et par voie orale, le propanolol démontra dès 1967 son efficacité pour abaisser la pression intra-oculaire (PIO) [19]. Disponible dans plusieurs pays dès 1978 (en France en 1979), le maléate de timolol demeura plusieurs années le seul collyre bêtabloquant utilisé en glaucomatologie. Suivirent d’autres molécules, en France : le métipranolol, puis le cartéolol, le bétaxolol, le béfunolol et le lévobunolol. Le béfunolol (Bentos®) a été retiré de la vente en 2003, et le métipranolol (Bétanol®) en 2011.
Éventuellement disponibles à différents dosages, dont plusieurs ont été supprimés, certaines de ces molécules ont régulièrement bénéficié de modifications galéniques (formes LP, formes sans conservateur, unidoses), permettant d’améliorer leur tolérance locale et/ou générale avec un rapport bénéfice/risque optimisé.
Le timolol est associé aux analogues des prostaglandines, ainsi qu’aux inhibiteurs de l’anhydrase carbonique et à la brimonidine, dans toutes les combinaisons fixes actuellement disponibles en France.
En 2013, les bêtabloquants ont été prescrits seuls ou en association non fixe dans 15,4 % versus 37,8 % pour les prostanoïdes, mais en réalité dans 44 % versus 54,8 % pour les prostanoïdes si l’on inclut leur présence dans les combinaisons fixes. Ce dernier pourcentage concernant les bêtabloquants reste remarquablement stable depuis plusieurs années : 42,6 % en 2008, 43,7 % en 2010, 44 % en 2011 comme donc en 2013 (source IMS Health).
Trois grands types de récepteurs adrénergiques ont été décrits dès la fin des années 1940 : les récepteurs α1 et α2, et les récepteurs β. Les récepteurs β peuvent eux-mêmes être individualisés en β1-, β2- et β3-récepteurs [7]. La stimulation des récepteurs :
-
β1 entraîne au niveau du cœur une accélération de la conduction et de la fréquence cardiaque ;
-
β2 entraîne une dilatation des bronches, ainsi qu’une vasodilatation coronaire et périphérique ;
-
β3 active la lipolyse dans les tissus adipeux.
Les catécholamines (adrénaline, noradrénaline) se combinent aux récepteurs β-adrénergiques membranaires pour stimuler, par l’intermédiaire de la protéine GS, l’enzyme adényl-cyclase également liée à la membrane cellulaire. Cette enzyme accélère dans la cellule la conversion de l’adénosine triphosphate (ATP) en adénosine monophosphate (cAMP), qui active elle-même la protéine kinase A (PKA). Par un mécanisme de phosphorylation de certaines protéines fonctionnelles, la PKA entraîne finalement l’effet biologique, qui dépend du type de cellule cible.
Concernant plus spécifiquement la formation de l’humeur aqueuse, la cascade biochimique déclenchée par l’activation de la PKA entraîne finalement une augmentation de l’activité de l’enzyme Na+/K+-ATPase de la membrane plasmatique des cellules non pigmentées (ou claires) de l’épithélium ciliaire et, in fine, l’excrétion de sodium dans la chambre postérieure et la formation d’humeur aqueuse par appel osmotique (voir chapitre 7, paragraphe « Mécanismes adrénergiques et cholinergiques »).
Les bêtabloquants, antagonistes, se fixent sur les récepteurs β-adrénergiques, empêchent ainsi leur stimulation par les catécholamines circulantes et suppriment ou atténuent donc cet effet biologique (fig. 16-1).
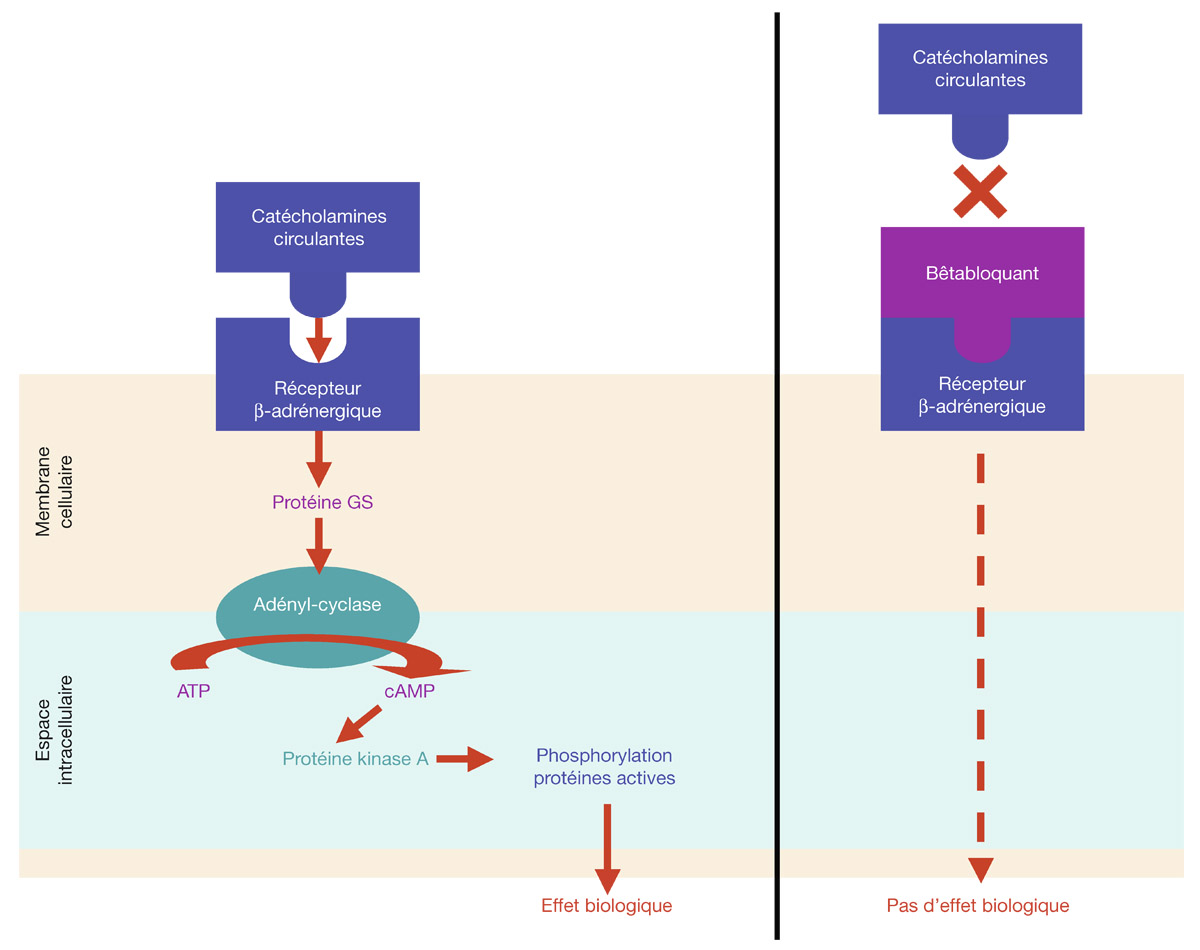
Fig. 16-1 Cascade biologique (à gauche) induite par la stimulation catécholaminergique d’un récepteur membranaire β-adrénergique, dont le déclenchement n’est plus possible lorsqu’une molécule β-bloquante se fixe sur ce récepteur (à droite).
Les récepteurs β1 et β2 (ainsi que des récepteurs α) cohabitent au niveau de la plupart des tissus oculaires, mais sont particulièrement nombreux au niveau du muscle ciliaire et des procès ciliaires, ainsi qu’au niveau des terminaisons nerveuses sympathiques oculaires.
Les collyres bêtabloquants agissent en diminuant de 35 à 45 % la sécrétion active de l’humeur aqueuse par les cellules claires de l’épithélium ciliaire [6], en empêchant – principalement au niveau des récepteurs β2-adrénergiques de ces cellules ciliaires – l’activation de l’enzyme adényl-cyclase membranaire par les catécholamines (adrénaline, noradrénaline) circulantes. Les études histologiques ont montré une modification morphologique de ces cellules après un traitement prolongé par le timolol [15]. Ce changement pourrait expliquer que les patients ayant arrêté les instillations du collyre ne présentent parfois pas de remontée pressionnelle avant 15 jours, en addition avec la persistance de la drogue dans les tissus oculaires [25].
Plus hypothétiques, d’autres mécanismes expliquant la diminution de la sécrétion aqueuse par les bêtabloquants ont été évoqués : diminution de la libération de noradrénaline par les terminaisons nerveuses sympathiques à proximité des cellules ciliaires ; action sur les récepteurs adrénergiques des artères ciliaires, entraînant une vasoconstriction et une diminution de l’ultrafiltration passive [18] ; interaction avec les récepteurs ciliaires de la sérotonine ; blocage des canaux calciques (pour le bétaxolol).
Le trabéculum ne participe pas aux modifications pressionnelles obtenues par les bêtabloquants, malgré sa richesse en récepteurs β.
Globalement, l’action hypotensive oculaire d’un collyre bêtabloquant débute 20 minutes environ après son instillation, et atteint un pic d’efficacité entre 2 à 4 heures. Cet effet peut se prolonger au-delà de 24 heures [33].
La réduction de la PIO est de l’ordre de 30 à 35 % dans les premiers jours. Elle diminue légèrement les semaines suivantes. L’efficacité sur l’abaissement pressionnel est sensiblement identique d’un bêtabloquant à l’autre, mais un peu plus faible avec le bétaxolol. La réaction hypotensive est quantitativement très différente d’un individu à l’autre, et un bêtabloquant faiblement dosé peut d’emblée fournir un abaissement pressionnel maximal.
Étant donné leur longue durée d’action, le rythme d’administration des bêtabloquants peut être limité chez certains patients à une instillation quotidienne, même sans vecteur permettant une « libération prolongée ». Dans ce cas, le collyre sera préférentiellement instillé le matin plutôt qu’en milieu de journée ou le soir, compte tenu de la baisse spontanée de la sécrétion ciliaire vespérale et nocturne.
En cas d’instillation unilatérale, le passage systémique entraîne habituellement un petit abaissement pressionnel au niveau de l’autre œil [10].
L’activité bêtabloquante est concentrée dans la forme lévogyre des molécules (elle est dix à cent fois plus faible dans la forme dextrogyre).
En dehors de l’effet proprement β-adrénolytique responsable de la baisse pressionnelle, trois propriétés pharmacologiques additionnelles au minimum différencient les bêtabloquants [21, 34].
Classiquement, lorsque les récepteurs β sont déjà occupés par un agent bêtabloquant (« antagoniste »), toute action sympathomimétique est inhibée et l’arrivée sur ces récepteurs d’un agent endogène β-agoniste (comme l’adrénaline) ne peut pas avoir d’effet stimulant. Certains bêtabloquants (cartéolol, béfunolol, pindolol) ont une action intermédiaire en occupant les récepteurs, mais aussi en provoquant une réponse sympathomimétique modérée. Ils restent toutefois des agents bêtabloquants à part entière, car ils s’opposent à l’action des β-stimulants endogènes. Ces agents bêtabloquants ont une activité dite « sympathomimétique intrinsèque » (ASI) et sont qualifiés d’« agonistes partiels ».
L’utilisation d’un bêtabloquant avec ASI dans la thérapeutique du glaucome pourrait présenter des avantages qui restent toutefois théoriques, et qui n’ont jamais été clairement démontrés en pratique clinique :
-
sur le plan local, le maintien d’une activité sympathomimétique respecterait la perfusion oculaire plus que ne le feraient les bêtabloquants sans ASI. Flammer et al. [8] avaient observé une amélioration de la sensibilité lumineuse différentielle sur des yeux glaucomateux traités par pindolol (β-bloquant avec ASI), alors que cet effet n’avait pas été retrouvé sur des yeux sous timolol ;
-
sur le plan général [29], il y aurait une moindre augmentation des résistances pulmonaires et une action moins bradycardisante.
Certains bêtabloquants peuvent s’opposer aux échanges ioniques transmembranaires, entraînant un effet anesthésique local. Cette « propriété » aurait pu représenter un danger potentiel pour la cornée avec un risque d’ulcération, mais aucun collyre bêtabloquant (à l’exception du bupranolol, non commercialisé en France) ne possède actuellement un effet stabilisant de membrane suffisamment important pour rendre son instillation source de risque.
La plupart des bêtabloquants agissent simultanément sur les récepteurs β1 et β2. Le blocage des β2-récepteurs peut entraîner, chez des sujets prédisposés, des complications bronchopulmonaires et une augmentation des résistances vasculaires périphériques (syndrome de Raynaud, diminution du débit sanguin coronaire, ischémie du nerf optique ?).
Le bétaxolol, produit a priori sans action bloquante β2, est capable d’abaisser la PIO de manière presque aussi importante que les autres produits, en diminuant donc le risque de complications liées au blocage β2. On parle de molécule β1-sélective ou encore cardiosélective. Le risque bronchopulmonaire n’est toutefois pas supprimé [11], car la cardiosélectivité du bétaxolol est dose-dépendante, disparaissant aux fortes concentrations.
Au niveau des procès ciliaires, les récepteurs β2 sont prédominants, et l’on pourrait s’attendre à une quasi inefficacité d’un collyre β1-sélectif. En réalité, la sélectivité du bétaxolol est largement débordée à cause de la concentration atteinte dans les procès ciliaires après une instillation locale, ce qui pourrait expliquer l’efficacité tonométrique de la molécule.
Les publications sur les différents collyres bêtabloquants sont extrêmement nombreuses. Nous ne présenterons ici que les points formellement acquis pour les quatre collyres bêtabloquants actuellement disponibles en France, par ordre chronologique de commercialisation.
Collyre bêtabloquant de référence, premier commercialisé et de loin le plus prescrit dans le monde, il s’agit d’un collyre bêtabloquant sans β1-sélectivité et sans ASI.
Le Timoptol® du laboratoire MSD-Chibret est disponible depuis 1979 en France en flacon multidose avec conservateurs, aux dosages de 0,25 et 0,50 % (un dosage de 0,10 % a été retiré). Un générique a vu le jour en 1996… à l’époque sans protestation ou questionnement, habituels aujourd’hui dès lors qu’une molécule passe dans le domaine publique.
Le timolol se présente sous plusieurs formes galéniques, dont beaucoup sont commercialisées en France :
-
formes sans conservateur en flacon multidoses, utilisant soit le système Abak™ délivrant son contenu à travers une membrane filtrante dont la porosité est suffisamment faible pour interdire toute contamination rétrograde du contenu (Timabak® 0,25 % et 0,50 %), soit avec le système Comod™ contenant une pompe empêchant l’air ambiant potentiellement contaminé d’entrer en contact avec la solution dans le flacon (Timocomod® 0,25 % et 0,50 %) ;
-
formes sans conservateur en unidose (Ophtim® 0,25 % et 0,50 %) ;
-
formes à libération prolongée (LP) avec conservateur en flacon multidoses, autorisant une seule instillation quotidienne. Deux véhicules différents sont utilisés avec le timolol pour augmenter le temps de présence à la surface du globe oculaire :
-
soit un polysaccharide anionique dérivé d’une gomme de gellane. En contact avec les cations du film lacrymal précornéen, le produit forme un gel permettant au principe actif de rester sur le globe durant une longue période (Timoptol® LP 0,25 % et 0,50 %),
-
soit un carbomère qui forme un film hydrophile permettant au timolol d’adhérer à la surface oculaire (Nyogel® LP). Ce véhicule autorise de surcroît l’utilisation d’une plus faible concentration (1 mg/g, soit 0,1 %) avec une efficacité équivalente aux solutions plus classiques à 0,50 % instillées deux fois par jour [24] ;
-
-
forme à libération prolongée sans conservateur en flacons unidoses, où le principe actif est également lié à un carbomère (Geltim® 0,10 %), et pour laquelle le bénéfice de l’absence de conservateur s’ajoute à tous les avantages qui viennent d’être présentés avec ce type de véhicule [5, 32].
Malgré un passage systémique beaucoup plus faible (avec une baisse de la concentration plasmatique qui peut atteindre 90 %), ces dernières formes ne permettent toutefois pas d’exclure les contre-indications absolues habituelles des bêtabloquants. Cependant, elles permettent une meilleure tolérance générale, et parfois la reprise de cette famille thérapeutique lorsqu’une forme non LP avait été retirée à cause de certains effets secondaires (perturbation de l’activité physique, par exemple).
Enfin, le timolol est à l’heure actuelle le dénominateur commun de toutes les combinaisons fixes disponibles en France : dorzolamide (Cosopt® et génériques), brinzolamide (Azarga®), brimonidine (Combigan®), latanoprost (Xalacom® et génériques), travoprost (Duotrav®), bimatoprost (Ganfort®). Il fut également combiné dans le même flacon avec la pilocarpine, mais ces préparations ne sont plus commercialisées (Timpilo® 2 % et 4 %, Pilobloq®).
Bêtabloquant non sélectif puissant, dont l’efficacité sur l’abaissement pressionnel est aussi bonne que celle du timolol, le cartéolol présente une forte action sympathomimétique intrinsèque, avec les avantages pharmacologiques potentiels – oculaires et généraux – de cette propriété. La tolérance locale est généralement excellente.
Les bêtabloquants peuvent intervenir sur les lipides sanguins, en diminuant le taux de HDL-cholestérol (le « bon » cholestérol) et en augmentant celui des triglycérides. De manière significative, le cartéolol diminue un peu moins le taux de HDL-cholestérol que le timolol [9]. Avec moins de bradycardie nocturne que le timolol [16], il pourrait également présenter un certain effet cardiomodulateur, augmentant la fréquence cardiaque lorsque celle-ci est inférieure à 70 pulsations par minute au repos, à la différence du timolol [12].
Disponible en flacon multidoses, deux instillations quotidiennes sont conseillées (Cartéol® 1 % et 2 %). Il est également commercialisé, avec les mêmes dosages et en unidose, sous une forme à libération prolongée permettant une seule instillation par jour (Cartéol® LP 1 % et 2 %). Le mécanisme de rétention à la surface oculaire, permettant cette couverture nycthémérale, est lié à son pouvoir muco-adhésif (et non à sa viscosité). Celui-ci est obtenu grâce à une galénique originale utilisant l’alginate, qui est un polysaccharide extrait des algues brunes.
En revanche, d’autres formulations ont été retirées du marché : Cartéol® 0,5 %, Cartéolol® 1 % et 2 % non LP en unidose, cartéolol dans un système Abak™ (Cartéabak®), cartéolol associé à la pilocarpine en combinaison fixe (Carpilo®).
Seul collyre β1-sélectif actuellement disponible, sans ASI, le bétaxolol diminue la fréquence des effets secondaires chez les asthmatiques et les insuffisants respiratoires par rapport aux collyres non β-sélectifs, mais les contre-indications absolues restent les mêmes qu’avec les autres bêtabloquants. Bien que son action soit « cardiosélective », le rythme cardiaque ne se ralentit pas significativement à l’effort. Les autres avantages potentiels d’un tel produit ont été présentés plus haut.
Plusieurs études indiquent que l’abaissement pressionnel est habituellement un peu moins important qu’avec les autres bêtabloquants [28, 31]. Une solution de bétaxolol à 0,50 %, toujours disponible, a initialement été commercialisée (Betoptic® 0,50 %). Elle entraîne fréquemment une irritation locale au moment de l’instillation [4], tout au moins les premières semaines de traitement. Le passage à une forme en suspension à 0,25 % (molécules de bétaxolol fixées sur des microparticules d’un polymère échangeur d’ions, la rendant bio-équivalente à la forme à 0,50 %) a permis une nette amélioration de la tolérance locale, tout en diminuant simultanément l’importance du passage systémique. Cette forme est disponible en flacon multidoses et en unidoses (Betoptic® 0,25 % suspension).
C’est un bêtabloquant non sélectif dépourvu d’ASI avec une demi-vie plus longue, grâce en particulier à sa métabolisation en dihydrolévobunolol. La chute pressionnelle obtenue peut se prolonger plus de 24 heures. Elle pourrait autoriser une seule instillation quotidienne [23], bien que l’AMM française conseille deux instillations par jour. Les effets secondaires locaux et généraux sont identiques à ceux du timolol. Il est disponible au seul dosage de 0,50 % (Betagan® 0,50 %), en flacon multidoses et en unidoses.
La méta-analyse de Van der Valk et al. [31] a comparé l’abaissement pressionnel obtenu par le timolol et le bétaxolol à celui des autres familles thérapeutiques (tableau 16-1). L’abaissement pressionnel, plus important pour le timolol que pour le bétaxolol, reste inférieur à 30 % pour les collyres bêtabloquants, alors qu’il peut dépasser ce pourcentage dans certaines études pour les prostaglandines. En faveur des bêtabloquants, cette étude indique de moins fortes fluctuations de la baisse pressionnelle obtenue entre l’acmé et le creux de leur efficacité tonométrique (tableau 16-2).
Une autre étude de Van der Valk et al. [30] ne montre aucune différence significative entre l’abaissement pressionnel immédiat obtenu par le timolol ou celui obtenu par le latanoprost lorsque la molécule est prescrite en première intention. Toutefois, il est aussi reconnu que cette efficacité des bêtabloquants a tendance à diminuer pour se stabiliser après quelques semaines de traitement. La possibilité d’une tachyphylaxie réelle est toutefois très contestée [3]. Quoi qu’il en soit, le remplacement par un autre collyre bêtabloquant ne relance que rarement la sensibilité pressionnelle aux instillations.
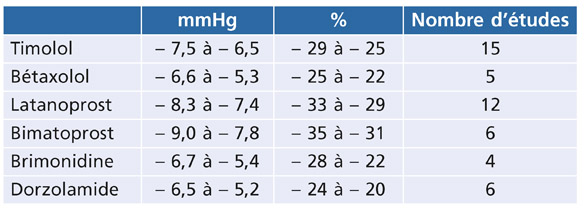
Tableau 16-1 Baisse pressionnelle obtenue par le timolol et le bétaxolol, exprimée en mmHg et en pourcentage, comparativement aux autres familles d’antiglaucomateux, au maximum de leur efficacité [31].
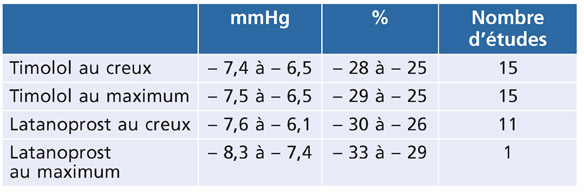
Tableau 16-2 Comparaison de la baisse pressionnelle obtenue par le timolol et le latanoprost, exprimée en mmHg et en pourcentage, au creux et au maximum de leur efficacité [31].
Les bêtabloquants sont, le plus souvent, parfaitement bien tolérés localement, ce qui explique leur large utilisation. Indolores à l’instillation, sans effet délétère cosmétique, pupillaire et accommodatif, ils sont exceptionnellement responsables de réaction allergique. La sensibilité cornéenne est souvent légèrement diminuée, même lorsque l’activité stabilisante de membrane est très faible. Il faudrait théoriquement en tenir compte chez les sujets présentant une affection cornéenne.
Une diminution de la sécrétion lacrymale est fréquente. Elle peut accélérer le passage d’une hypolacrymie sans irritation fonctionnelle vers une sémiologie de sécheresse oculaire patente, souvent mal supportée. L’irritation locale peut persister même après l’arrêt du traitement. Les porteurs de lentilles cornéennes doivent être prévenus et surveillés.
Le risque d’obstruction du conduit lacrymonasal par un traitement prolongé avec un collyre bêtabloquant a été rapporté [27].
Le passage systémique des bêtabloquants est assez faible, mais suffisant chez des sujets prédisposés pour entraîner des complications générales, parfois gravissimes et même mortelles [17]. Ces complications sont néanmoins rares, compte tenu de la fréquence de prescription de ces collyres. En outre, beaucoup sont controversées, car les effets secondaires rapportés sont fréquents de façon non iatrogénique dans la population générale (essoufflements, fatigue, dépression, etc.). Les formes galéniques permettant un moindre passage systémique sont naturellement indiquées dans ces cas discutables.
Les bêtabloquants sont responsables de bradycardies, voire d’arythmies ou de syncopes (d’évolution parfois fatale). Les blocs auriculoventriculaires de 2e et 3e degrés sont donc des contre-indications absolues à la prescription de tels produits. L’insuffisance cardiaque instable (ou en voie de décompensation) et les bradycardies sinusales sont des contre-indications relatives. Au moindre doute, voire systématiquement en le précisant sur l’ordonnance lors d’une première prescription, l’avis du cardiologue s’impose [14].
L’asthme avéré doit être considéré comme une contre-indication absolue (des états de mal asthmatiques mortels ont été signalés), même pour le bétaxolol malgré sa β1-sélectivité [26], car un stimulus très faible peut à lui seul provoquer une crise d’asthme. L’incidence bronchopulmonaire s’ajoutant aux effets cardiaques peut expliquer la diminution de l’endurance pendant les exercices physiques.
Les bêtabloquants peuvent être impliqués dans l’aggravation d’un syndrome de Raynaud, voire d’une artériopathie oblitérante, contre-indications relatives.
La diminution de la perfusion oculaire par les bêtabloquants est un sujet débattu [2, 20]. Des méthodes de mesure sophistiquées de la perfusion oculaire indiquent régulièrement des différences d’un bêtabloquant à l’autre, mais l’intérêt clinique n’en a pas été formellement établi. Elle a été évoquée par les partisans des bêtabloquants avec ASI et par ceux des β1-bloquants sélectifs. Cette hypothétique diminution pourrait être la conséquence d’une constriction des vaisseaux perfusant le globe oculaire, mais aussi d’une baisse de la pression artérielle diastolique comme systolique [22].
Elles sont nombreuses mais souvent difficiles à imputer directement au collyre [13] lorsque les effets décrits sont dose-dépendants : aggravation d’une myasthénie, diminution de la libido et impuissance, asthénie, troubles dépressifs, alopécie, difficultés à l’équilibration d’un diabète sucré par perturbations de la glycogénolyse, modification du profil lipidique avec une diminution du HDL-cholestérol et une augmentation des triglycérides, etc.
-
Asthme, bronchospasme
-
Insuffisance cardiaque décompensée
-
Blocs auriculoventriculaires 2e et 3e degrés
-
Bradycardie symptomatique (< 50 pulsations/min)
-
Syncopes de cause inconnue
Au même titre que les prostaglandines, les collyres bêtabloquants sont des molécules de première intention dans le traitement du GPAO. Leur prescription découle naturellement de l’absence de contre-indications, et il est essentiel de les rechercher par un interrogatoire minutieux et en sollicitant au moindre doute l’avis de l’interniste, du cardiologue et/ou du pneumologue. La mesure du pouls est un prérequis minimum ; celui-ci doit être régulièrement vérifié chez un patient traité à la recherche d’une bradycardie ou d’une arythmie. Ces molécules doivent plutôt être évitées chez les sportifs, qui peuvent se plaindre d’une réelle diminution de leurs performances lorsqu’ils instillent un collyre bêtabloquant.
Lorsque les patients sont déjà traités oralement par des bêtabloquants, l’administration topique concomitante est moins efficace, et il est légitime de préférer une autre famille thérapeutique en première intention pour abaisser la PIO. En revanche, sans contre-indication, l’habituelle excellente tolérance locale et l’absence d’effets cosmétiques (augmentation de la pigmentation irienne, cernes, duvet palpébral, hyperémie, etc.) peuvent représenter un avantage décisif des bêtabloquants lorsque le praticien hésite entre plusieurs familles thérapeutiques.
Le niveau pressionnel de départ, la pression cible que l’ophtalmologiste peut se fixer, la gravité du glaucome ou au contraire son absence sont également des paramètres essentiels de la décision thérapeutique. Une HTO « isolée » et un glaucome débutant avec une PIO modérément élevée incitent plutôt à prescrire un bêtabloquant en première intention. En revanche, un glaucome évolué et une forte PIO basale doivent viser une plus grande performance tonométrique selon le principe qu’alors « chaque mmHg compte », et la décision basculera plus volontiers du côté des prostaglandines, voire d’une combinaison – fixe ou non – d’emblée.
Les collyres bêtabloquants peuvent être associés à toutes les autres familles hypotensives oculaires, entraînant chaque fois un abaissement pressionnel supérieur à chacune des molécules prises isolément, et les combinaisons fixes disponibles en sont la preuve manifeste. Des travaux très récents indiquent que les inhibiteurs de la rho-kinase, hypotenseurs oculaires en cours d’évaluation clinique, pourraient toutefois diminuer la pénétration intra-oculaire des collyres bêtabloquants en augmentant leur élimination par la vascularisation conjonctivale [1], et donc perturber leur efficacité.
Retenir
-
Les collyres bêtabloquants, prescrits depuis la fin des années 1970, ont largement prouvé leur efficacité dans le traitement du GPAO.
-
De nombreuses formes galéniques ont été proposées pour améliorer leur tolérance locale et diminuer le passage systémique ainsi que la fréquence des instillations. Elles doivent désormais être prescrites en priorité.
-
Le timolol est le dénominateur commun de toutes les combinaisons fixes actuellement disponibles.
-
En l’absence de contre-indication absolue, leur prescription en première intention est légitime dans les hypertensions oculaires isolées, dans les glaucomes avérés peu évolués et peu évolutifs, et dans les cas où l’excès pressionnel est modéré.
[1] Arnold JJ, Hansen MS, Gorman GS, et al. The effect of Rho-associated kinase inhibition on the ocular penetration of timolol maleate. Invest Ophthalmol Vis Sci. 2013 ; 54 : 1118-26.
[2] Baxter GM, Williamson TH, McKillop G, Dutton GN. Color Doppler ultrasound of orbital and optic nerve blood flow : effects of posture and timolol 0,5 %. Invest Ophthalmol Vis Sci. 1992 ; 33 : 604-10.
[3] Bengtsson B, Heijl A. Lack of long-term drift in timolol’s effectiveness in patients with ocular hypertension. Invest Ophthalmol Vis Sci. 2001 ; 42 : 2839-42.
[4] Berry DP, Van Buskirk EM, Shields MB. Betaxolol and timolol : a comparison of efficacy and side effects. Arch Ophthalmol. 1984 ; 102 : 42-5.
[5] Bonnin N, Nezzar H, Dubray C, et al. Plasma levels and systemic safety of 0.1 % unpreserved timolol maleate gel, 0.5 % timolol aqueous solution and 0.5 % timolol maleate gel. J Fr Ophtalmol. 2012 ; 35 : 9-16.
[6] Coakes RL, Brubaker RS. The mechanism of timolol in lowering intraocular pressure. Arch Ophthalmol. 1978 ; 96 : 2045-48.
[7] Etienne R. Le système neurovégétatif de l’œil. In : Traitement médical et chirurgical des glaucomes. Marseille, Diffusion Générale de Librairie, 1977 : 35-43.
[8] Flammer J, Robert Y, Gloor B. Influence of pindolol and timolol treatment on the visual fields of glaucoma patients. J Ocul Pharmacol. 1986 ; 2 : 305-11.
[9] Freedman SF, Freedman NJ, Shileds MB, et al. Effects of ocular carteolol and timolol on plasma high-density lipoprotein cholesterol level. Am J Ophthalmol. 1993 ; 116 : 600-11.
[10] Glaucoma Laser Trial Research Group. The Glaucoma Laser Trial (GLT). IV. Contralateral effects of timolol on the intraocular pressure of eyes treated with ALT. Ophthalmic Surg. 1991 ; 22 : 234-40.
[11] Harris LS, Greenstein SH, Bloom AF. Respiratory difficulties with betaxolol. Am J Ophthalmol. 1986 ; 102 : 274-5.
[12] Kitazawa Y. Multicenter double-mind comparison of carteolol and timolol in primary open-angle glaucoma and ocular hypertension. Adv Ther. 1993 ; 10 : 95-131.
[13] Lama PJ. Systemic adverse effects of beta-adrenergic blockers : an evidence-based assessment. Am J Ophthalmol. 2002 ; 134 : 749-60.
[14] Le Jeunne C, Bringer L, Mondjee-Tahura Z, et al. Cardiovascular effects of eye drops containing timolol, carteolol, metipranolol, and betaxolol in elderly subjects. Therapie. 1989 ; 43 : 89-92.
[15] Lutjen-Drecoll E, Kaufman PL, Eichhorn M. Long-term timolol and epinephrine in monkeys : I. Functional morphology of the ciliary processes. Proc. Cambridge Ophthalmological Symposium. Trans Ophthalmol Soc UK. 1986 ; 105 : 180-95.
[16] Netland PA, Weiss HS, Stewart WC, et al. Cardiovascular effects of topical carteolol hydrochloride and timolol maleate in patients with ocular hypertension and primary open-angle glaucoma. Night Study Group. Am J Ophthalmol. 1997 ; 123 : 465-77.
[17] Netter P, Sirbat D, Trechot P. Les effets systémiques des collyres. Rapport annuel (A. Raspiller, coordinateur). Bull Soc Ophtalmol Fr. 1985 ; n° spécial : 225-75.
[18] Nyborg NC, Nielsen PJ. Beta-adrenergic receptors regulating vascular smooth muscle tone are only localized to the intraocular segment of the long posterior ciliary artery in bovine eye. Survey Ophthalmol. 1995 ; 39 : S66-S75.
[19] Phillips CI, Howitt G, Rowlands DL. Propanolol as ocular hypotensive agent. Br J Ophthalmol. 1967 ; 51 : 222-6.
[20] Pillunat L, Stodtmeister R. Effect of different antiglaucomatous drugs on ocular perfusion pressures. J Ocul Pharmacol. 1988 ; 4 : 231-2.
[21] Plane C. Les collyres bêtabloquants. In : Demailly P (ed.). Traitement actuel du glaucome primitif à angle ouvert. Rapport de la Société française d’ophtalmologie 1989. Paris, Masson, 1989 : 123-207.
[22] Quaranta L, Gandolfo F, Turano R, et al. Effects of topical hypotensive drugs on circadian IOP, blood pressure, and calculated diastolic ocular perfusion pressure in patients with glaucoma. Invest Ophthalmol Vis Sci. 2006 ; 47 : 2917-23.
[23] Rakofsky SI, Melamed S, Cohen JS, et al. A comparison of the ocular hypotensive effect of once daily and twice daily levobunolol treatment. Ophthalmology. 1989 ; 96 : 8-11.
[24] Rouland JF, Morel-Mandrino P, Elena PP, et al. Timolol 0.1 % gel (Nyogel 0.1 %) once daily versus conventional timolol 0.5 % solution twice daily : a comparison of efficacy and safety. Ophthalmologica. 2002 ; 216 : 449-54.
[25] Schlecht LP, Brubaker RF. The effects of withdrawal of timolol in chronically treated glaucoma patients. Ophthalmology. 1988 ; 95 : 1212-16.
[26] Schoene R, Abuan T, Ward RL, Beasley H. Effects of topical betaxolol, timolol and placebo on pulmonary function in asthmatic bronchitis. Am J Ophthalmol. 1984 ; 97 : 86-92.
[27] Seider N, Miller B, Beiran I. Topical glaucoma therapy as a risk factor for nasolacrimal duct obstruction. Am J Ophthalmol. 2008 ; 145 : 120-3.
[28] Stewart RH, Kimbrough RL, Ward RL. Betaxolol versus timolol : a 6-month double-blind comparison. Arch Ophthalmol. 1986 ; 104 : 46-8.
[29] Stewart WC. Carteolol, an ophthalmic β-adrenergic blocker with intrinsic sympathomimetic activity. J Glaucoma. 1994 ; 3 : 339-42.
[30] Van der Valk R, Webers CA, Hendrikse F, et al. Predicting intraocular pressure change before initiating therapy : timolol versus latanoprost. Acta Ophthalmol. 2008 ; 86 : 415-8.
[31] Van der Valk R, Webers CA, Schouten JS, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs. Ophthalmology. 2005 ; 112 : 1177-85.
[32] Volotinen M, Mäenpää J, Kautiainen H, et al. Ophthalmic timolol in a hydrogel vehicle leads to minor inter-individual variation in timolol concentration in aqueous humor. Eur J Pharm Sci. 2009 ; 36 : 292-6.
[33] Zimmermann TJ, Kaufman HE. Timolol : dose response and duration of action. Arch Ophthalmol. 1977 ; 95 : 605-7.
[34] Zimmermann TJ. Topical ophthalmic beta blockers : a comparative review. J Ocul Pharmacol. 1993 ; 9 : 373-84.
P. Denis
-
Les analogues des prostaglandines sont recommandés en premier choix pour la plupart des patients hypertones et glaucomateux, du fait de leur efficacité pressionnelle et de la posologie simplifiée.
-
Leur profil de tolérance générale est considéré comme bon, mais les effets indésirables locaux (en premier lieu l’hyperhémie conjonctivale) peuvent limiter leur utilisation à long terme.
Les analogues des prostaglandines (PG), parfois assimilés à la famille des hypotenseurs lipidiques, sont des métabolites de l’acide arachidonique (par l’intermédiaire de l’intervention d’une cyclo-oxygénase), acide gras poly-insaturé, lié aux phospholipides membranaires de la plupart des cellules de mammifères. Dans le traitement du glaucome, les PG représentent une option thérapeutique recommandée en première intention du fait de leur efficacité pressionnelle, de leur posologie simplifiée et de leur profil de tolérance systémique favorable. Les PG ont remplacé les bêtabloquants dans le cœur des ophtalmologistes pour ces raisons, même si ces derniers sont encore largement prescrits et qu’ils sont à la base de toutes les combinaisons fixes. Quatre analogues des prostaglandines sont actuellement disponibles sur le marché européen : le bimatoprost (Lumigan®), le latanoprost (Xalatan®), le travoprost (Travatan®) et le tafluprost (Taflotan®/Saflutan®). Le tafluprost n’est pas actuellement commercialisé en France, pour des raisons réglementaires. Le bimatoprost, molécule différente sur le plan structural, appartient à la famille des prostamides.
La pharmacologie clinique des prostaglandines se distingue par la mise en jeu de la voie uvéosclérale, dont l’activation conduit à une réduction de la pression intra-oculaire (PIO). Qualifiée arbitrairement d’accessoire, elle assure en fait une partie non négligeable de l’écoulement de l’humeur aqueuse et constitue une alternative à la voie trabéculaire classique.
L’élimination uvéosclérale concerne la fraction d’humeur aqueuse qui est éliminée de l’œil par les espaces intermusculaires du muscle ciliaire, par l’espace suprachoroïdien et à travers l’épaisseur du tissu scléral. Longtemps niée par les anatomistes, son existence fut démontrée en 1965 par Anders Bill grâce à des expériences de perfusion de la chambre antérieure par des traceurs radioactifs ou colorés. L’injection de dextran dans l’espace suprachoroïdien s’accompagnait d’une imprégnation secondaire des espaces périvasculaires de l’uvée antérieure puis de la sclère. Ce phénomène, différent de la simple diffusion, survenait également pour des traceurs de poids moléculaire différent. Ces constatations expérimentales amenèrent Bill à postuler pour une voie non conventionnelle d’élimination de l’humeur aqueuse. Cette voie accessoire trouve son substratum anatomique dans l’absence de barrière épithéliale entre la chambre antérieure et l’espace supraciliaire. Pour cette raison, le coefficient de drainage des substances hors de l’œil dépend principalement de la perméabilité du muscle ciliaire à ces substances. Vers l’arrière, les fibres longitudinales du muscle ciliaire s’orientent progressivement parallèlement à la paroi sclérale et se terminent dans le tissu conjonctif choroïdien. Les espaces intermusculaires forment un espace rempli de tissu conjonctif lâche estimé à 10 μL dans lequel peut s’immiscer l’humeur aqueuse. La sclère est un tissu fibreux dense formé de faisceaux de fibres collagènes entrecroisées mais qui présentent de nombreux orifices conjonctifs correspondant aux points de pénétration des vaisseaux et nerfs ciliaires. Ces orifices forment autant de possibilités de passage pour l’humeur aqueuse qui peut s’évacuer librement, étant donné que la pression qui règne dans la chambre antérieure est supérieure de quelques mmHg à celle s’exerçant dans l’espace suprachoroïdien.
Il a été initialement démontré que les PG étaient capables de reproduire certains éléments de la réaction inflammatoire oculaire, à savoir une hyperhémie conjonctivale, une vasodilatation irienne, un myosis, une augmentation de la concentration en protéines de l’humeur aqueuse et une élévation conséquente de la PIO. De plus faibles doses de prostaglandines (à des concentrations « infra-inflammatoires ») induisent une baisse pressionnelle prolongée, ce qui conduit à sélectionner dans la famille des PG plusieurs molécules candidates. Les effets des PG ont d’abord été démontrés avec les sels de trométhamine de PGF2α, malheureusement mal tolérés car responsables d’une forte hyperhémie conjonctivale [18]. La pénétration oculaire des dérivés phényl-substitués (17-phényl-PGF2α) est améliorée avec, pour corollaire, un effet notable sur la PIO.
Les PG entraînent un remodelage de la matrice extracellulaire du corps ciliaire et de la sclère, avec une modification de perméabilité de ces tissus et un élargissement des espaces musculaires ciliaires [25]. Cet effet passe par une collagénolyse touchant le collagène de types I et III, favorisée par l’augmentation de synthèse locale des métalloprotéinases [32]. Les altérations seraient également associées à un changement de forme du muscle ciliaire, avec redistribution géographique des molécules de vinculine et d’actine. La relaxation du muscle ciliaire serait responsable de la baisse précoce de la PIO permise par les PG. L’augmentation de l’écoulement trabéculaire de l’humeur aqueuse pourrait aussi être liée à la digestion protéolytique de la matrice extracellulaire.
-
Le latanoprost (Xalatan®, Pfizer et génériques) a été le premier analogue des PG mis sur le marché et est, pour cette raison, considéré comme le produit de référence dans la classe. À l’exception du bimatoprost, les PG sont des prodrogues sous forme d’esters qui subissent une transformation enzymatique dans la cornée, aboutissant à la formation de métabolites acides actifs, qui se lient spécifiquement aux récepteurs des prostaglandines F2 [36]. L’activation des récepteurs réduit la PIO par ouverture de la voie uvéosclérale, comme décrit précédemment. Le latanoprost (comme le travoprost – voir plus loin) est un ester phényl-substitué en position 17 de la PGF2α. Il est converti en acide libre lors de son passage au travers de l’épithélium cornéen par des hydrolases cornéennes. L’estérification moléculaire favorise sa liposolubilité et donc sa pénétration oculaire. Les formes acides libres des PG se fixent à leurs sites récepteurs PGF2 localisés dans le trabéculum et le muscle ciliaire. Sa formulation en unidose sans conservateur est maintenant disponible (Monoprost®, Théa).
-
Le bimatoprost (Lumigan®, Allergan) est, quant à lui, une prodrogue amide de la 17-phényl-PGF2α. Il est structuralement décrit comme une prostamide [9] et pourrait avoir un mécanisme d’action un peu différent, avec la mise en jeu complémentaire de la voie trabéculaire [27]. Cependant, ces données font l’objet de controverses et le bimatoprost est toutefois considéré par l’European Glaucoma Society comme un véritable analogue des PG [17]. Le bimatoprost présente également la particularité de disposer de deux concentrations, comme cela est le cas pour les collyres bêtabloquants : dosages à 0,03 % et à 0,01 %. La formulation du bimatoprost à 0,01 % (Lumigan® 0,1) est globalement aussi efficace sur la PIO que la formulation à 0,03 %, avec cependant un taux d’hyperhémie conjonctivale sensiblement inférieur, malgré l’augmentation significative de la concentration du chlorure de benzalkonium dans le bimatoprost à 0,01 % [23].
-
La formulation du travoprost (Travatan®, Alcon) a récemment fait l’objet d’une modification galénique où le chlorure de benzalkonium a été remplacé par un autre ammonium quaternaire, le Polyquad, moins toxique pour les cellules conjonctivales et épithéliales cornéennes aux concentrations utilisées.
-
Le tafluprost est commercialisé au Japon depuis plusieurs années au dosage de 0,0015 %, et est maintenant disponible dans plusieurs pays européens sous forme de monodoses à usage unique, sans conservateur. À ce titre, le tafluprost constitue un traitement adapté chez les patients présentant un syndrome sec oculaire ou une pathologie cornéenne épithéliale. Son efficacité est globalement comparable à celle du latanoprost [38], mais plusieurs études démontrent que la réduction pressionnelle permise par le tafluprost est inférieure à celle observée avec le latanoprost. En dehors de l’activation des récepteurs PGF2α, il pourrait aussi interagir avec les récepteurs PGE3.
La posologie journalière recommandée est une seule instillation quotidienne, généralement prescrite le soir, ce qui pourrait permettre de diminuer les pics matinaux de la PIO. En effet, l’action des PG sur la PIO débute environ deux heures après l’instillation et est maximale entre huit à douze heures après l’instillation [1]. Plusieurs études indiquent que l’augmentation de la posologie ne potentialise pas cet effet, et pourrait même le réduire. L’unoprostone à 0,12 et 0,15 % est la seule exception pour la fréquence d’instillation, puisqu’il doit être instillé deux fois par jour ; son effet sur la PIO est sensiblement plus faible que celui des autres PG [37], et il n’est pas commercialisé en France. Le maximum d’efficacité peut être atteint en trois à cinq semaines, du fait du remodelage tissulaire progressif du corps ciliaire. Certains patients pouvant être plus répondeurs à une molécule de cette classe par rapport à une autre, une substitution de traitement est possible après un premier essai préalable de quatre à six semaines. L’absence de réponse à une PG ne signifie pas que tous les analogues des PG sont nécessairement inactifs. Après une fenêtre thérapeutique, l’efficacité des PG s’estompe au bout d’un mois environ.
Le chlorure de benzalkonium est un ammonium quaternaire peu allergisant, mais dont la toxicité locale est bien reconnue. Des formulations de latanoprost ou de bimatoprost dénuées de conservateur sont actuellement en cours d’enregistrement réglementaire et devraient être mises sur le marché prochainement. L’absence de conservateurs dans les collyres de PG, ou leur remplacement par des composés moins agressifs, est un avantage majeur indiscutable sur le long terme, permettant d’atténuer la toxicité des conservateurs sur la surface oculaire [6]. Ces modifications galéniques ne s’accompagnent pas obligatoirement d’une incidence moindre des effets secondaires dans les essais cliniques, probablement parce que la toxicité des conservateurs est un phénomène retardé, se produisant à bas bruit et évoluant sur de nombreuses années [5]. En outre, si elle est souvent vécue comme iatrogène, l’hyperhémie conjonctivale n’est pas un signe témoignant directement de sa cytotoxicité sur la surface oculaire, mais plutôt comme un signe d’exposition aux PG. Malgré leurs effets toxiques, l’absence de conservateur dans un collyre ne s’accompagne pas toujours d’une amélioration de la tolérance locale immédiate, en particulier de l’hyperhémie conjonctivale [19].
EFFICACITÉ EN MONOTHÉRAPIE
Force est de constater que la quasi-totalité des essais cliniques choisissent la PIO comme principal critère d’évaluation d’efficacité d’un collyre antiglaucomateux, plutôt que les modifications structurales de la tête du nerf optique ou les altérations progressives du champ visuel. Bien que le glaucome soit d’abord une neuropathie optique, sa lenteur d’évolution rend difficile la réalisation d’études fondées sur les seules modifications papillaires ou du champ visuel.
Le nombre des études cliniques consacrées aux collyres de PG est considérable, et les publications sont parfois difficilement comparables, du fait de critères différents d’inclusion ou de méthodologie. Chaque PG, avant sa mise sur le marché, fait l’objet d’études de comparaison avec l’agent de référence dans sa classe, actuellement le maléate de timolol pour les bêtabloquants ou le latanoprost pour les analogues des PG. Ces études permettent de classer les molécules entre elles par des comparaisons directes ou indirectes. À ce titre, plusieurs méta-analyses sont disponibles et permettent d’évaluer l’efficacité et la tolérance des PG à grande échelle, sur un nombre conséquent de patients.
Une des premières méta-analyses a été réalisée par van der Valk et al. [40] en 2005. Une série de 27 articles publiés jusqu’en décembre 2003 servait de base de données, colligeant ainsi 28 essais cliniques randomisés chez des patients glaucomateux ou présentant une hypertonie oculaire isolée. Comparativement aux autres classes thérapeutiques, les PG apparaissent comme les plus efficaces sur la PIO, avec une réduction moyenne de 31-33 % au pic d’efficacité (effet maximal) et de 28-29 % au creux d’efficacité (effet minimal). Par comparaison, les pourcentages d’efficacité (par rapport à la PIO initiale) ne sont que de 27 et 26 % pour le timolol. Ces résultats consacrent ainsi la supériorité des PG sur les bêtabloquants, auparavant considérés comme les agents de référence du traitement du glaucome. Instillé chez des patients naïfs de tout traitement, le latanoprost permet une baisse de la PIO de 28 % lorsque la PIO initiale est inférieure à 24 mmHg, mais de 34 % lorsque celle-ci est supérieure à cette limite. Des PIO cibles inférieures à 18 mmHg sont obtenues chez environ 70 % des patients [14].
Dans le travail de van der Valk, aucune PG n’apparaît réellement supérieure, bien que le bimatoprost soit associé à la plus forte réduction de la PIO au pic d’efficacité (33 %). De même, dans une autre méta-analyse réalisée par Holmstrom et al. [20] et publiée la même année, la baisse moyenne de la PIO est respectivement de 26,7, 28,7 et de 30,3 % pour le latanoprost, le travoprost et le bimatoprost (22,2 % pour le timolol). Cette méta-analyse compare également la proportion de patients atteignant une PIO cible donnée, et le bimatoprost apparaît comme étant le plus efficace selon ce critère, pour toutes les cibles entre 13 et 20 mmHg. Il faut noter que la comparaison avec le travoprost n’est pas complète et que cette étude ne peut pas conclure formellement à la supériorité du bimatoprost sur le travoprost. La comparaison des deux PG au latanoprost démontre que la réduction de la PIO permise à la fois par le bimatoprost et le travoprost est en moyenne de 1 mmHg supérieure à celle observée avec le latanoprost (– 1,0 mmHg ; IC95 % : – 2,11 mmHg/+ 0,04 mmHg, p = 0,06 pour le bimatoprost ; et – 0,98 mmHg ; IC95 % : – 2,08 mmHg/+ 0,13 mmHg, p = 0,08 pour le travoprost) [15].
Les méta-analyses s’appliquent traditionnellement aux études où les comparaisons sont directes (« head-to-head »). Il est possible d’étendre les comparaisons entre des produits qui n’ont pas été directement mis en parallèle dans les études, par la technique de la méta-analyse par réseau. Ce stratagème permet d’extrapoler les différences entre deux médicaments, même s’ils n’ont pas été en concurrence directe dans les essais. En 2009, van der Valk a ainsi prolongé son travail princeps en réalisant des comparaisons non seulement directes, mais également indirectes par la technique des réseaux. Les conclusions sont assez similaires [39], et les PG demeurent les thérapeutiques antiglaucomateuses les plus puissantes dans la pharmacopée actuelle, justifiant ainsi leur indication en première ligne en Europe et dans la plupart des pays.
Un autre travail de méta-analyse sur les PG, incluant huit essais cliniques comparant le latanoprost, le travoprost et le bimatoprost, publiés jusqu’en juillet 2006, complète ces données en les étendant non seulement à la réduction moyenne de la PIO, mais également à la réduction de la PIO aux différentes heures de la journée [2]. Le bimatoprost à 0,03 % présente un léger avantage sur les deux autres PG, en termes de réduction de la PIO. La différence s’avère être statistiquement significative avec le latanoprost à tous les points testés de la courbe nycthémérale (8 h 00, 12 h 00, 16 h 00 et 20 h 00), mais seulement à certains points avec le travoprost. Il ne serait pas fondé d’extrapoler ces résultats au bimatoprost dosé à 0,01 %, qui n’a pas été étudié en méta-analyse. Le dosage à 0,01 % est globalement équivalent au dosage à 0,03 %, bien que ce dernier induise une baisse de PIO numériquement un peu plus forte. Les différences d’efficacité entre les PG sont relativement faibles, de l’ordre de 1 mmHg, de toute façon inférieures au seuil de 1,5 mmHg exigé par la plupart des autorités d’enregistrement réglementaire pour démontrer une différence pharmacologique statistique. Pour autant, ces différences doivent être considérées à l’aune des grandes études qui corrèlent le risque de progression du glaucome à la réduction de la PIO.
EFFICACITÉ EN ASSOCIATION
Si le traitement antiglaucomateux débute généralement par une monothérapie, un certain nombre de patients ne demeurent pas contrôlés après plusieurs années d’évolution par un seul traitement. Dans l’étude Ocular Hypertension Treatment Study (OHTS), près de 40 % des patients nécessitent au moins deux collyres pour suivre l’objectif d’une baisse – somme toute modeste – de 20 % de la PIO initiale [22]. De nombreuses études confirment que la monothérapie est, dans de nombreuses circonstances, insuffisante, obligeant à des changements ou des ajouts de collyre [41]. Schématiquement, une association médicamenteuse est recommandée par l’European Glaucoma Society si la PIO cible n’est pas atteinte par un seul traitement. Le choix peut se porter sur une association non fixe, mais la tendance actuelle du marché est de privilégier les combinaisons fixes, du fait de leurs avantages potentiels : simplification du traitement avec diminution du nombre d’instillations quotidiennes, absence de phénomène de « wash-out », diminution de l’apport en conservateurs par la diminution du nombre des instillations [13, 24]. Bien que les preuves irréfutables manquent, il est possible que les combinaisons fixes favorisent l’observance et l’adhérence thérapeutique [16], même si cette hypothèse n’a pas été spécifiquement démontrée. L’opinion des ophtalmologistes vis-à-vis des combinaisons fixes est favorable, et ils reconnaissent dans leur grande majorité qu’il s’agit d’une solution thérapeutique propre à améliorer la qualité de vie (96 %) et l’observance (98 %) [34].
La plupart des études indiquent que les combinaisons fixes à base de PG sont plus efficaces que les PG utilisées seules [4, 21, 26]. Les différences entre les combinaisons fixes et les PG peuvent être faibles à certaines heures de la journée, voire non significatives, du fait des variations nycthémérales de la PIO [7]. Pour certains, les combinaisons fixes de PG pourraient aboutir à un sous-dosage du timolol chez certains patients, du fait de la mono-instillation du bêtabloquant.
Plusieurs études plaident pour une efficacité pressionnelle grossièrement équivalente des trois combinaisons fixes à base de PG, avec un léger avantage pour la combinaison fixe bimatoprost-timolol par rapport aux deux autres (latanoprost-timolol et travoprost-timolol) [10, 11]. Quelques études ont comparé directement les deux associations de travoprost-timolol et de latanoprost-timolol. Il est retrouvé une efficacité équivalente mais avec une supériorité tonométrique à certains points de la courbe pour la combinaison travoprost-timolol [35]. Dans deux études observationnelles, l’avantage pour la combinaison travoprost-timolol est confirmé avec des baisses de PIO plus importantes [15] et un pourcentage de patients atteignant une PIO cible de moins de 18 mmHg bien supérieur (82 %) [33]. Une supériorité de l’association bimatoprost-timolol sur celle associant le latanoprost et le timolol est également démontrée [29].
La technique de méta-analyse par réseau a aussi été appliquée à la comparaison des trois combinaisons fixes de PG entre elles et pour évaluer leur additivité par rapport à leurs constituants [3]. Les résultats indiquent que les combinaisons sont toutes trois plus efficaces que les PG dont elles sont issues, que la combinaison bimatoprost-timolol est statistiquement plus efficace que les deux autres. Par ailleurs, l’incidence de l’hyperhémie conjonctivale est systématiquement inférieure avec une combinaison fixe qu’avec la PG correspondante. Ce phénomène est encore mal compris et l’hypothèse d’une exposition moindre au chlorure de benzalkonium, conservateur commun aux trois combinaisons fixes, n’est pas recevable car la posologie quotidienne reste inchangée. Une interaction avec le timolol serait possible, l’hypoesthésie cornéenne induite par le bêtabloquant pouvant être à l’origine de ce phénomène.
Les analogues des PG sont synergiques avec la plupart des autres médicaments antiglaucomateux : bêtabloquants, inhibiteurs de l’anhydrase carbonique par voie locale ou générale, agonistes α2-adrénergiques. Paradoxalement, la prescription conjointe avec la pilocarpine est aussi additive, alors que les myotiques induisent une fermeture de la voie uvéosclérale par contraction du muscle ciliaire.
Du fait de leurs faibles concentrations et de l’inactivation systémique rapide, le profil de tolérance systémique des PG est globalement bon, supérieur à celui des collyres adrénergiques. En dehors du risque exceptionnel d’acutisation d’une crise d’asthme (dyspnée et insuffisance respiratoire), les analogues des PG sont, chez l’adulte, bien tolérés.
Le principal effet indésirable lié à la prescription de collyres de PG est l’hyperhémie conjonctivales. La tolérance locale ne se résume pas à l’appréciation de l’hyperhémie conjonctivale, mais force est de contester qu’il s’agit du phénomène le plus visible, le plus fréquemment rapporté par les patients et dont les conséquences sur la poursuite du traitement sont les plus fortes. L’hyperhémie conjonctivale survient rapidement et s’atténue progressivement avec le temps, sans toutefois disparaître chez la majorité des patients. À proprement parler, il s’agit plus d’un signe d’imprégnation par les prostaglandines, témoignant de leur phylogénie inflammatoire, que d’une véritable conséquence d’une toxicité ou d’une allergie oculaire. L’hyperhémie est généralement isolée, sans réaction inflammatoire de la chambre antérieure. Elle n’est pas associée à d’autres phénomènes inflammatoires (myosis, phénomène de Tyndall de chambre antérieure). Comme cela a été dit auparavant, le risque de rougeur oculaire est volontiers plus marqué avec le bimatoprost à 0,3 %, et moindre avec le travoprost et le latanoprost. Le bimatoprost à 0,1 % entraîne sensiblement moins d’hyperhémie que le bimatoprost à 0,3 %. L’incidence de l’hyperhémie conjonctivale varie d’une étude à l’autre mais peut atteindre près de 40 % des patients. Il n’y a pas de différence entre le taux des arrêts thérapeutiques au bout de six mois de traitement par bimatoprost comparé au latanoprost [30] ou par bimatoprost comparé au travoprost [8], malgré le taux plus élevé d’hyperhémie conjonctivale sous bimatoprost. Ce taux ne reflète pas nécessairement l’adhérence, qui peut se manifester par des oublis passagers, des retards ou des irrégularités dans les horaires des instillations. Les analogues des PG atteignant leur pic d’efficacité 10 à 14 heures après administration, une instillation le soir au coucher est recommandée afin de réduire les symptômes liés à la vasodilatation conjonctivale. L’hyperhémie est modérée dans la plupart des cas, mais peut être responsable d’une interruption du traitement ou d’une observance tronquée.
Un autre effet indésirable propre à cette classe thérapeutique est la pigmentation de l’iris, qui résulte d’une augmentation du nombre de mélanosomes au sein des mélanocytes. La pigmentation de l’iris est considérée irréversible et corrélée au degré de pigmentation préalable de l’iris. Le risque carcinologique de mélanome oculaire est cependant écarté, car le changement de couleur de l’iris est lié à la production intracellulaire de mélanine, et les PG n’induisent pas de multiplication cellulaire. Avec le latanoprost, les iris bleus peuvent se pigmenter dans 10 à 20 % des cas lors des 18-24 premiers mois de traitement, tandis que près de 60 % des iris de couleur marron clair, bleu-vert ou bicolores peuvent présenter une pigmentation pendant la même période. Pour les autres PG, le risque d’hyperchromie irienne pourrait être indépendant de la couleur initiale de l’iris, avec une pigmentation assez identique quelle que soit sa couleur. Les effets à long terme de ces séquelles ne sont à ce jour pas connus, mais aucune donnée ne suggère de risque supplémentaire. D’autres effets indésirables rapportés lors de l’utilisation de PG topiques sont le risque d’hypertrichose (élongation et épaississement des cils), de trichiasis, de distichiasis, ainsi que d’une hyperpigmentation du tissu cutané palpébral et d’une hypertrichose péri-oculaire. Ces effets semblent réversibles à l’arrêt du traitement. L’hypertrichose représente en outre un effet cosmétique actuellement mis à profit par la commercialisation aux États-Unis d’un « mascara magique » à base de prostaglandines. Plus récemment ont été décrits des cas d’atrophie de la graisse orbitaire, responsable d’un certain degré d’énophtalmie [32]. Des aggravations et récidives de kératites herpétiques sous-jacentes, des œdèmes maculaires cystoïdes et des cas d’uvéites ont été rarement rapportés. Ces deux derniers effets secondaires décrits sont plus classiquement retrouvés chez des patients présentant des facteurs de risque d’œdème maculaire cystoïde (capsule cristallinienne rompue, rétinopathie diabétique œdémateuse, oblitération veineuse rétinienne) ou d’uvéite. Des phénomènes de Tyndall ont pu être observés chez des patients sans antécédents d’uvéite.
Même si les indications cliniques réglementaires concernent essentiellement le glaucome primitif à angle ouvert, les analogues des PG peuvent être prescrits dans de nombreuses indications, y compris lorsque l’angle est pathologique : glaucome pseudo-exfoliatif, pigmentaire, à pression normale. Chez l’enfant, le latanoprost est au moins aussi efficace que le timolol à 0,5 %, avec un profil de tolérance acceptable [28]. L’expérience avec le travoprost est plus marginale [42], et des cas d’élévation paradoxale de la PIO ont été décrits sous bimatoprost. La réduction de la PIO ne semble pas être affectée avec les trois PG en cas de fermeture de l’angle [12], même si la racine de l’iris est obstruée par une adhérence irienne étendue. Cette constatation illustre le fait que la voie uvéosclérale n’est pas anatomiquement systématisée et que l’humeur aqueuse peut parvenir à l’espace supraciliaire et suprachoroïdien même en présence d’une fermeture angulaire. En cas d’uvéite antérieure, en particulier d’origine herpétique, la prescription de PG, quoiqu’efficace, n’est pas recommandée du fait du risque de réactivation inflammatoire. Pour cette même raison, certains auteurs déconseillent l’emploi de PG durant la période postopératoire précoce de toute chirurgie de segment antérieur, même si cette attitude n’est pas partagée par tous. Chez la femme enceinte ou allaitant, les PG sont logiquement proscrits du fait du risque de contractions utérines et de menace d’accouchement prématuré.
Retenir
-
Les analogues des prostaglandines font actuellement partie des médicaments les plus efficaces pour abaisser la PIO.
-
Leur mode d’action original, leur efficacité pressionnelle, leur posologie simplifiée ainsi que leur tolérance systémique excellente leur confèrent un statut de médicaments de première intention.
-
Afin de préserver l’observance, il est nécessaire de vérifier au cas par cas la tolérance locale, moins optimale, et d’évaluer le retentissement de l’hyperhémie conjonctivale sur le suivi thérapeutique à long terme.
-
Une information adaptée doit être donnée aux patients avant mise sous traitement par les PG car certains de leurs effets indésirables sont irréversibles (allongement des cils, hyperpigmentation de l’iris).
[1] Alm A, Stjernschantz J. Effects on intraocular pressure and side effects of 0.005 % latanoprost applied once daily, evening or morning. A comparison with timolol. Scandinavian Latanoprost Study Group. Ophthalmology. 1995 ; 102 : 1743-52.
[2] Aptel F, Cucherat M, Denis P. Efficacy and tolerability of prostaglandin analogs : a meta-analysis of randomized controlled clinical trials. J Glaucoma. 2008 ; 17 : 667-73.
[3] Aptel F, Cucherat M, Denis P. Efficacy and tolerability of prostaglandin-timolol fixed combinations : a meta-analysis of randomized clinical trials. Eur J Ophthalmol. 2012 ; 22 : 5-18.
[4] Barnebey HS, Orengo-Nania S, Flowers BE, et al. The safety and efficacy of travoprost 0.004 %/timolol 0.5 % fixed combination ophthalmic solution. Am J Ophthalmol. 2005 ; 140 : 1-7.
[5] Baudouin C, Labbé A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res. 2010 ; 29 : 312-34.
[6] Baudouin C, Pisella PJ, Fillacier K, et al. Ocular surface inflammatory changes induced by topical antiglaucoma drugs : human and animal studies. Ophthalmology. 1999 ; 106 : 556-63.
[7] Brandt JD, Cantor LB, Katz LJ, et al. Bimatoprost/timolol fixed combination : a 3-month double-masked, randomized parallel comparison to its individual components in patients with glaucoma or ocular hypertension. J Glaucoma. 2008 ; 17 : 211-6.
[8] Cantor LB, Hoop J, Morgan L, et al. Intraocular pressure-lowering efficacy of bimatoprost 0.03 % and travoprost 0.004 % in patients with glaucoma or ocular hypertension. Br J Ophthalmol. 2006 ; 90 : 1370-3.
[9] Cantor LB. Bimatoprost : a member of a new class of agents, the prostamides, for glaucoma management. Expert Opin Investig Drugs. 2001 ; 10 : 721-31.
[10] Centofanti M, Oddone F, Gandolfi S, et al. Comparison of travoprost and bimatoprost plus timolol fixed combinations in open-angle glaucoma patients previously treated with latanoprost plus timolol fixed combination. Am J Ophthalmol. 2010 ; 150 : 575-80.
[11] Centofanti M, Oddone F, Vetrugno M, et al. Efficacy of the fixed combinations of bimatoprost or latanoprost plus timolol in patients uncontrolled with prostaglandin monotherapy : a multicenter, randomized, investigator-masked, clinical study. Eur J Ophthalmol. 2009 ; 19 : 66-71.
[12] Cheng JW, Cai JP, Li Y, Wei RL. A meta-analysis of topical prostaglandin analogs in the treatment of chronic angle-closure glaucoma. J Glaucoma. 2009 ; 18 : 652-7.
[13] Chrai SS, Makoid MC, Eriksen SP, Robinson JR. Drop size and initial dosing frequency problems of topically applied ophthalmic drugs. J Pharm Sci. 197 ; 63 : 333-8.
[14] Denis P, Baudouin C, Bron A, et al. First-line latanoprost therapy in ocular hypertension or open-angle glaucoma patients : a 3-month efficacy analysis stratified by initial intraocular pressure. BMC Ophthalmol. 2010 ; 10 : 4.
[15] Denis P, Lafuma A, Khoshnood B, et al. A meta-analysis of topical prostaglandin analogues intra-ocular pressure lowering in glaucoma therapy. Curr Med Res Opin. 2007 ; 23 : 601-8.
[16] Dunker S, Schmucker A, Maier H. Tolerability, quality of life, and persistency of use in patients with glaucoma who are switched to the fixed combination of latanoprost and timolol. Adv Ther. 2007 ; 24 : 376-86.
[17] European Glaucoma Society. Terminology and guidelines for glaucoma. 3rd Ed. Savona, Italy, Editrice Dogma, 2008.
[18] Giuffrè G. The effects of prostaglandin F2 alpha in the human eye. Graefes Arch Clin Exp Ophthalmol. 1985 ; 222 : 139-41.
[19] Hamacher T, Airaksinen J, Saarela V, et al. Efficacy and safety levels of preserved and preservative-free tafluprost are equivalent in patients with glaucoma or ocular hypertension : results from a pharmacodynamics analysis. Acta Ophthalmol. 2008 ; 242 (Suppl.) : 14-9.
[20] Holmstrom S, Buchholz P, Walt J, et al. Analytic review of bimatoprost, latanoprost and travoprost in primary open angle glaucoma. Curr Med Res Opin. 2005 ; 21 : 1875-83.
[21] Hommer A. A double-masked, randomized, parallel comparison of a fixed combination of bimatoprost 0.03 %/timolol 0.5 % with non-fixed combination use in patients with glaucoma or ocular hypertension. Eur J Ophthalmol. 2007 ; 17 : 53-62.
[22] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13.
[23] Katz LJ, Cohen JS, Batoosingh AL, et al. Twelve-month, randomized, controlled trial of bimatoprost 0.01 %, 0.0125 %, and 0.03 % in patients with glaucoma or ocular hypertension. Am J Ophthalmol. 2010 ; 149 : 661-71.
[24] Khouri AS, Realini T, Fechtner RD. Use of fixed-dose combination drugs for the treatment of glaucoma. Drugs Aging. 2007 ; 24 : 1007-16.
[25] Kim JW, Lindsey JD, Wang N, Weinreb RN. Increased human scleral permeability with prostaglandin exposure. Invest Ophthalmol Vis Sci. 2001 ; 42 : 1514-21.
[26] Konstas AG, Boboridis K, Tzetzi D, et al. Twenty-four-hour control with latanoprost-timolol-fixed combination therapy vs latanoprost therapy. Arch Ophthalmol. 2005 ; 123 : 898-902.
[27] Liang Y, Woodward DF, Guzman VM, et al. Identification and pharmacological characterization of the prostaglandin FP receptor and FP receptor variant complexes. Br J Pharmacol. 2008 ; 154 : 1079-93.
[28] Maeda-Chubachi T, Chi-Burris K, Simons BD, et al. Comparison of latanoprost and timolol in pediatric glaucoma : a phase 3, 12-week, randomized, double-masked multicenter study. Ophthalmology. 2011 ; 118 : 2014-21.
[29] Martinez A, Sanchez M. A comparison of the safety and intraocular pressure lowering of bimatoprost/timolol fixed combination versus latanoprost/timolol fixed combination in patients with open-angle glaucoma. Curr Med Res Opin. 2007 ; 23 : 1025-32.
[30] Noecker RS, Dirks MS, Choplin NT, et al. A six-month randomized clinical trial comparing the intraocular pressure-lowering efficacy of bimatoprost and latanoprost in patients with ocular hypertension or glaucoma. Am J Ophthalmol. 2003 ; 135 : 55-63.
[31] Ocklind A. Effect of latanoprost on the extracellular matrix of the ciliarymuscle. A study on cultured cells and tissue sections. Exp Eye Res. 1998 ; 67 : 179-91.
[32] Park J, Cho HK, Moon JI. Changes to upper eyelid orbital fat from use of topical bimatoprost, travoprost, and latanoprost. Jpn J Ophthalmol. 2011 ; 55 : 22-7.
[33] Rossi GC, Pasinetti GM, Bracchino M, et al. Switching from concomitant latanoprost 0.005 % and timolol 0.5 % to a fixed combination of travoprost 0.004 %/timolol 0.5 % in patients with primary open-angle glaucoma and ocular hypertension : a 6-month, multicenter, cohort study. Exper Opin Pharmacother. 2009 ; 10 : 1705-11.
[34] Stewart WC, Jenkins JN, Stewart JA. Survey assesses prostaglandin use. Rev Ophthalmol. 2005 ; 12 : article 844.
[35] Topouzis F, Melamed S, Danesh-Meyer H, et al. A 1-year study to compare the efficacy and safety of once-daily travoprost 0.004 %/timolol 0.5 % to once-daily latanoprost 0.005 %/timolol 0.5 % in patients with open-angle glaucoma or ocular hypertension. Eur J Ophthalmol. 2007 ; 17 : 183-90.
[36] Toris CB, Gabelt BT, Kaufman PL. Update on the mechanism of action of topical prostaglandins for intraocular pressure reduction. Surv Ophthalmol. 2008 ; 53 : S107-20.
[37] Toris CB, Zhan G, Camras CB. Increase in outflow facility with unoprostone treatment in ocular hypertensive patients. Arch Ophthalmol. 2004 ; 122 : 1782-7.
[38] Uusitalo H, Pillunat LE, Ropo A. Efficacy and safety of tafluprost 0.0015 % versus latanoprost 0.005 % eye drops in open-angle glaucoma and ocular hypertension : 24-month results of a randomized, double-masked phase III study. Acta Ophthalmol. 2010 ; 88 : 12-9.
[39] van der Valk R, Webers CA, Lumley T, et al. A network meta-analysis combined direct and indirect comparisons between glaucoma drugs to rank effectiveness in lowering intraocular pressure. J Clin Epidemiol. 2009 ; 62 : 1279-83.
[40] van der Valk R, Webers CA, Schouten JS, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs : a meta-analysis of randomized clinical trials. Ophthalmology. 2005 ; 112 : 1177-85.
[41] Watson PG, Barnett MF, Parker V, Haybittle J. A 7 year prospective comparative study of three topical beta blockers in the management of primary open angle glaucoma. Br J Ophthalmol. 2001 ; 85 : 962-8.
[42] Yanovitch TL, Enyedi LB, Schotthoeffer EO, Freedman SF. Travoprost in children : adverse effects and intraocular pressure response. J AAPOS. 2009 ; 13 : 91-3.
D. Sirbat
Le seul inhibiteur de l’anhydrase carbonique (IAC) utilisé par voie générale encore disponible pour traiter le glaucome primitif à angle ouvert (GPAO) est l’acétazolamide (Diamox®, Sanofi-Aventis). Ses effets secondaires généraux, qui pouvaient limiter sa prescription, ont été quasi supprimés par l’introduction de nouvelles molécules, le dorzolamide et le brinzolamide qui, présentés en collyre, associés ou non au timolol (Cosopt®, MSD-Chibret ; Azarga®, Alcon), confèrent une place de choix aux IAC dans l’arsenal antiglaucomateux.
Becker fut le premier, en 1954, à utiliser et démontrer chez des patients glaucomateux l’action hypotonisante de l’acétazolamide per os, chef de file des IAC qui comportent alors d’autres composés dont le méthazolamide, plus sélectif pour l’œil et sans effet rénal aux doses utilisées (< 4 mg/kg/24 h) [1]. Auparavant, en 1932, Meldrum et Broughton avaient découvert l’anhydrase carbonique (AC) dans les globules rouges de bovins, et la richesse de ces derniers en isoenzymes de type I (ACI) et de type II (ACII) sur les sept types d’isoenzymes (ACI à ACVII) de l’AC identifiés. Puis différentes études immunohistochimiques (Davenport, Bakker, Korhonen et Wistrand) ont retrouvé l’AC dans l’estomac (1939), le rein et l’œil (1941), puis l’épithélium ciliaire de l’œil (1951). En 1965, deux isoenzymes ACII et ACIV sont identifiées en forte concentration dans la partie apicale du cytoplasme (ACII) ou liées à la membrane latéro-basale jouxtant l’humeur aqueuse (ACIV) des cellules claires de l’épithélium ciliaire non pigmenté chez l’homme. L’ACIV, située sur le chromosome 17, a été séquencée et clonée. Ces deux enzymes agissent de concert et sont impliquées dans le transport de fluide et d’ions. Leur inhibition par les IAC explique leur action hypotonisante. L’AC est également présente dans l’endothélium cornéen, le cristallin, la rétine et les capillaires choroïdiens. En 1949 paraît la première publication de Friedenwald sur la théorie de la formation de l’humeur aqueuse, qui est un processus actif avec action probable de l’AC sur l’épithélium ciliaire. Barany et Kinsey confirment cette hypothèse de la nature sécrétoire de l’humeur aqueuse, fondée sur la découverte d’un grand excédent d’ions HCO3 dans la chambre postérieure par rapport au plasma et d’une concentration élevée d’ascorbate dans l’humeur aqueuse, ce qui conduit Wistrand à découvrir en 1951 l’AC dans l’épithélium ciliaire. Concomitamment, Roblin, chimiste chez Cyanamid, développe, à partir du sulfanilamide, des inhibiteurs puissants dont le chef de file est l’acétazolamide. Becker, outre la première utilisation d’un IAC chez l’homme, en précise de nombreuses bases physiologiques et pharmacologiques, à savoir que l’acétazolamide par voie systémique est le seul efficace, que l’administration sous-conjonctivale est inefficace et qu’il agit chez les animaux néphrectomisés, témoignant ainsi d’une action oculaire in situ, et non secondaire à ses effets généraux. De ce fait, les efforts pour développer une forme active sous forme topique d’IAC seront suspendue jusqu’en 1980, date à laquelle Maren [3] reprendra les recherches avec succès, pour aboutir en 1995 à la mise sur le marché du dorzolamide IAC topique (Trusopt®, MSD), puis quelques années plus tard du brinzolamide (Azopt®, Alcon), lesquels bénéficieront d’une formulation en association fixe avec le timolol 0,50 % (Cosopt®, MSD ; Azarga®, Alcon).
ANHYDRASE CARBONIQUE
L’AC est d’un poids moléculaire considérable (30 000). C’est une métallo-enzyme comportant de très nombreuses chaînes d’acides aminés unies à un ion zinc absolument essentiel à son activité. Son rôle est de catalyser la réaction réversible qui hydrate le CO2 et de créer le bicarbonate :
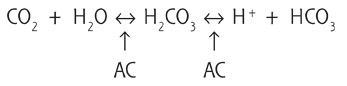
C’est cette réaction qui s’effectue très rapidement (10–6 s–1) qui est bloquée par les IAC, chez l’homme et chez les espèces animales. Ce sont les isoenzymes ACII et ACIV qui jouent le rôle majeur dans la sécrétion de l’humeur aqueuse chez l’homme, en maintenant un pH adéquat pour un transport actif optimal du sodium.
ACÉTAZOLAMIDE (DIAMOX®)
C’est un sulfamide aromatique hétérocyclique qui est maintenant le seul IAC par voie orale utilisé en France, sous forme de comprimés à 250 mg, et de lyophilisat à 500 mg réservé à la voie intraveineuse. Au niveau de l’œil, l’acétazolamide parvient à son site d’action ciliaire par voie systémique. En cas d’hypertension oculaire préalable, il provoque une chute rapide de la pression intra-oculaire (PIO) par action sur le corps ciliaire et élimination accélérée des bicarbonates et des autres électrolytes présents en concentration élevée dans les liquides intra-oculaires, et baisse de la pression osmotique des milieux liquidiens de l’œil. L’acétazolamide inhibe l’AC en se combinant par son radical aromatique –SO2NH2 à l’ion zinc de l’AC, et réduit la sécrétion aqueuse de 40 à 60 %. Sa durée d’action est de 6 heures et sa demi-vie plasmatique de 5 heures. Une inhibition de 98 % de l’activité de l’AC est nécessaire pour qu’une diminution de synthèse d’humeur aqueuse survienne. Per os, le produit est actif après 30 minutes. Compte tenu de la réduction de la sécrétion ciliaire durant le sommeil, démontrée par les travaux de Brubaker, de la baisse pressionnelle souhaitée pour atteindre la pression cible et de l’existence d’effets secondaires, il apparaît pertinent d’utiliser l’acétazolamide dans une perspective minimaliste, deux à trois fois par jour à la dose de 125 mg (un demi-comprimé), et même 80 mg (un tiers de comprimé) qui est le meilleur compromis entre l’effet et les inconvénients. À la dose thérapeutique qui est de 5 à 10 mg/kg/j (Friedlander) s’ajoute à l’effet oculaire une action rénale notable par inhibition de l’AC rénale, d’autant plus que le patient est âgé.
IAC PAR VOIE LOCALE
Les IAC par voie locale ont des effets généraux réduits et constituent une alternative intéressante. La recherche depuis 1954 de formulation d’IAC en collyre, pour pallier les effets secondaires de l’acétazolamide per os, a été longue et difficile en raison des problèmes de pénétration intra-oculaire et de tolérance locale. De très nombreux principes actifs ont été testés. Cette recherche, menée par Maren [3] et les laboratoires Merck-Sharp et Dohme, a abouti à la mise sur le marché du dorzolamide (Trusopt®) dans les vers 1995, suivi en 1998 par le brinzolamide (Azopt®, laboratoires Alcon).
Le dorzolamide (Trusopt®, collyre en solution à 20 mg/mL), maintenant génériqué, et le brinzolamide (Azopt®, collyre en suspension à 10 mg/mL) ont une action directe sur l’ACII et l’ACIV du corps ciliaire qu’ils inhibent, provoquant une baisse de la PIO (voir plus haut). Le dorzolamide appartient à la famille des sulfonamides thieno-thyopyran-2 et a la particularité d’être amphiphile, ce qui accroît sa pénétration cornéenne (sauf en cas d’œdème cornéen). Le dorzolamide à 2 % en solution inhibe 99,9 % de ACII et 95,5 % de ACIV. Instillé en solution à 2 % trois fois par jour, en monothérapie, le dorzolamide abaisse la PIO d’environ 20 à 24 % au pic d’efficacité [4] et son effet est comparable au bétaxolol (22-25 %), légèrement inférieur au timolol (25-29 %) et inférieur au latanoprost (29-33 %) et au bimatoprost (31-35 %). Son action débute une heure après l’instillation et dure huit heures. Le brinzolamide a une efficacité comparable, mais est administré deux fois par jour.
Les associations fixes des IAC locaux avec le timolol 0,50 % (Cosopt® et Azarga®), instillées deux fois par jour, entraînent une baisse additionnelle de 1,5 mmHg par rapport aux deux molécules instillées séparément, sans différence de tolérance. Dans une même méta-analyse sur cinq études européennes, Bron [2] démontre une efficacité équivalente du latanoprost à l’association timolol-dorzolamide. Le Cosopt® instillé deux fois par jour a été également comparé au Xalacom® (Shim) : la baisse de PIO est plus forte pour le Xalacom® (1 mmHg sur l’ensemble de la courbe diurne, et un peu plus à 16 heures), expliquée peut-être par l’administration de fait du dorzolamide contenu dans le Cosopt® deux fois par jour au lieu de trois en monothérapie. Les deux molécules, dorzolamide et brinzolamide, ont la même efficacité sur la PIO, aussi bien en monothérapie qu’en association, et au total un bon profil de tolérance et de sécurité.
IAC ADMINISTRÉS PAR VOIE GÉNÉRALE
Les effets secondaires de l’acétazolamide sont fréquents, nombreux, variables selon les individus, inhérents à ses propriétés pharmacologiques, et peuvent conduire à l’arrêt du traitement. La sphère visuelle échappe aux effets indésirables de l’acétazolamide : la transparence cornéenne et cristallinienne est conservée, et les fonctions de la rétine ne sont pas altérées. Les effets généraux indésirables mineurs s’atténuent dès les 2e et 3e mois de traitement. Le rôle de l’ophtalmologiste est crucial pour faire passer ce cap des trois mois au patient et pour l’aider à poursuivre le traitement en délivrant une information complète, loyale, mais apaisante. Les effets secondaires plus conséquents procèdent de l’effet rénal de l’IAC, dans le cadre des modifications urinaires, ioniques et sanguines qu’il induit : alcalinisation des urines avec perte de Na+, K+, HCO3–, et en corollaire une acidose métabolique plasmatique modérée. Cependant, une régulation de la composition urinaire, indépendante de l’AC, permet le retour à l’acidification normale des urines et rend possible la poursuite de l’utilisation de l’IAC en clinique. Beaucoup d’effets secondaires sont liés à l’hypokaliémie et à l’acidose métabolique modérée, tels des troubles mictionnels et gastro-intestinaux, associant de façon variable dysgueusie, « inconfort intestinal », diarrhée permanente, ou au contraire constipation, faiblesse musculaire, paresthésies des extrémités, somnolence, dans un contexte de perte de l’appétit. Des complications cardiaques sont possibles (perturbation de l’ECG, potentialisation de la digitaline). Bien que le rééquilibre potassique se rétablisse spontanément en quelques semaines, et d’autant plus vite que l’alimentation est équilibrée, il est recommandé de supplémenter le potassium soit en préconisant la prise d’aliments riches en potassium (bananes, oranges, amandes, chocolat, etc.), soit en prescrivant des sels de potassium (0,5 à 1,5 g/j) en sirop ou dragées à libération échelonnée (Kaléorid®, Diffu-K®), en dissociant l’heure de prise du potassium de celle du Diamox®, afin d’éviter de possibles ulcérations gastroduodénales. L’acidose métabolique peut entraîner des troubles de la libido dans un contexte d’asthénie générale, et peut être compensée par l’absorption d’une eau minérale fortement bicarbonatée telle l’eau de Vichy, qui aura également un effet favorable sur le risque de calculs urinaires. Ce dernier, lié à la diminution de l’excrétion urinaire des citrates, survient chez les patients aux antécédents de colique néphrétique.
Des réactions idiosyncrasiques du type myopie brutale et forte, hypoacousie et chute de cheveux sont classiques mais exceptionnelles. Une discrète hyperglycémie ou hyperuricémie peuvent être observées sans incidence de prescription chez les diabétiques bien équilibrés. On peut y rattacher les altérations sanguines immuno-allergo-toxiques, qui sont un risque inhérent à toute la famille des sulfamides. Elles sont très rares et s’expriment sous forme d’anémie aplastique, d’agranulocytopénie, voire d’agranulocytose. Le diagnostic est réalisé sur une numération-formule sanguine, et le patient confié à l’hématologue. Cette complication est imprévisible, mais il faut éviter de prescrire des IAC à des patients chez lesquels l’anamnèse révèle des antécédents familiaux et/ou personnels hématologiques. En cas de traitement prolongé, il sera nécessaire de surveiller l’ionogramme, la réserve alcaline, la glycémie, l’uricémie et l’hémogramme.
IAC ADMINISTRÉS PAR VOIE LOCALE
Ils présentent peu les effets des formulations systémiques. Les problèmes de tolérance sont essentiellement locaux, à type de conjonctivite allergique et de réaction palpébrale. La tolérance locale du dorzolamide est moins bonne que celle du brinzolamide sur quatre ans, avec 10 % de blépharoconjonctivites et 20 % d’hyperhémie conjonctivale. S’y associent parfois une dysgueusie, un trouble de la vision passager, des brûlures et parfois, rarement, a minima les symptômes présentés avec le Diamox®. Naturellement, les effets secondaires des collyres bêtabloquants se rajoutent à ces risques dans les combinaisons fixes.
CONTRE-INDICATIONS
Les contre-indications formelles sont l’insuffisance hépatique, les maladies pulmonaires chroniques obstructives sévères et la grossesse.
Les contre-indications relatives sont le diabète en cas d’usage prolongé et après discussion avec le diabétologue, les antécédents de lithiase rénale, les interférences médicamenteuses avec les diurétiques thiazidiques ou les corticoïdes, et les antécédents hématologiques personnels et familiaux.
Le traitement du glaucome à angle ouvert repose en première intention sur l’utilisation des prostaglandines et éventuellement des bêtabloquants. Les IAC (tout comme les agonistes adrénergiques-α2 spécifiques) sont utilisés en seconde intention en association variable selon les contre-indications et la tolérance lors d’insuffisance d’efficacité ou d’échec des premières molécules. Ils auraient également un effet vasodilatateur bénéfique sur les vaisseaux rétiniens et la tête du nerf optique. Il est important de vérifier régulièrement la qualité de vie des patients, garante d’une compliance et d’une persistance rigoureuses, et donc de l’efficacité du traitement. Le Diamox® par voie intraveineuse reste toujours irremplaçable pour faire baisser rapidement une PIO très élevée.
Retenir
Les progrès de la pharmacogalénique ont assuré le renouveau des inhibiteurs de l’anhydrase carbonique avec l’apparition, en sus du toujours efficace acétazolamide per os, du dorzolamide et du brinzolamide sous forme de collyre qui renforcent l’arsenal des antiglaucomateux de deuxième intention. Utilisés seuls ou en combinaison avec le timolol 0,5 %, sans action sur le système adrénergique, ils offrent un très bon profil de sécurité et de tolérance, gages d’une qualité de vie, d’observance et de persistance optimisées.
[1] Becker B. Diamox and the therapy of glaucoma. Am J Ophthalmol. 1954 ; 38 : 16.
[2] Bron A. Comparaison de l’effet du latanoprost en monothérapie et de l’association timolol-dorzolamide sur la baisse de la pression intraoculaire chez les patients ayant un glaucome à angle ouvert ou une hypertension oculaire. J Fr Ophtalmol. 2002 ; 25 : 604-8.
[3] Maren TH. The development of topical carbonic anhydrase inhibitors. J Glaucoma. 1995 ; 4 : 49-62.
[4] Van der Valk R, Webers CA, Schouten JS, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs. Ophthalmology. 2005 ; 112 : 1177-85.
D. Sirbat
La mise sur le marché de deux nouvelles molécules sympathomimétiques α2-sélectives, l’apraclonidine en 1995 (Iopidine® 0,5 %, collyre en solution, et Iopidine® 1 %, collyre en récipient unidose, laboratoires Alcon), puis la brimonidine en 1998 (Alphagan® 0,2 % collyre en solution, laboratoires Allergan), inaugure une nouvelle classe thérapeutique dans l’arsenal antiglaucomateux permettant de pallier les effets secondaires et les insuffisances d’action de l’adrénaline et de ses dérivés utilisés depuis 1954. L’Alphagan® bénéficie d’une présentation en combinaison fixe avec le timolol 0,5 %, (Combigan®, collyre en solution, laboratoire Allergan), qui accroît encore son efficacité.
L’adrénaline (ou épinéphrine) hormone produite par la médullosurrénale, est le chef de file des médications sympathomimétiques, et possède une action directe sur les récepteurs α et β. Découverte en 1903 (Pierre Brissot), utilisée en 1922 par Hambourger (Glaucosan®), elle n’a été réintroduite définitivement dans le traitement du glaucome à angle ouvert qu’en 1954, par Weeckers et Prijot, après l’introduction de la gonioscopie en 1940 et la démonstration en 1951, par Goldmann, de son action de diminution de l’humeur aqueuse [8]. Elle possède une action directe sur les deux sous-groupes α1 et α2 des récepteurs α situés au niveau de l’épithélium non pigmenté des procès ciliaires, des parois vasculaires, du trabéculum et du sphincter de l’iris. Ses effets secondaires locaux (mydriase, hyperhémie conjonctivale, réactions allergiques, œdèmes cystoïdes chez les patients aphakes, vasoconstriction des vaisseaux papillaires, etc.) et généraux (tachycardie, arythmies, extrasystoles, hypertension artérielle, accidents vasculaires cérébraux, etc.) ont encouragé la mise au point de nouveaux agents adrénergiques présentant des effets secondaires moindres [2, 3]. Plusieurs molécules ont ainsi été utilisées, tels des potentialisateurs adrénergiques (acide pivalique à l’origine de la première prodrogue, la dipivalyl-épinéphrine (Propine®, laboratoires Allergan) et des α-stimulants (noradrénaline, phényléphrine), pour aboutir à deux principes actifs sympathomimétiques spécifiques des récepteurs α2 : l’apraclonidine (Iopidine®) en 1995, puis en 1998 la brimonidine 0,2 % (Alphagan®) qui diminuent la pression intra-oculaire (PIO) en réduisant la sécrétion d’humeur aqueuse et en augmentant l’évacuation uvéosclérale. Les travaux de Mittag Mallorga, Lapalus, Sucobovich et Elena, réalisés à partir de 1984, ont permis de préciser que les récepteurs α1 sont post-synaptiques et situés dans les vaisseaux ciliaires, alors que les récepteurs α2 sont soit post-synaptiques dans les cellules épithéliales ciliaires non pigmentées, soit présynaptiques dans l’ensemble iris-corps ciliaire-trabéculum. Certains récepteurs α2 sont aussi retrouvés dans la rétine et impliqués dans la régulation dopaminergique. Enfin, les récepteurs α2 sont couplés négativement à l’adénylate cyclase, et les récepteurs α1 favorisent la mobilisation du calcium par l’intermédiaire du phophatidyl inositol.
APRACLONIDINE OU P-AMINOCLONIDINE (IOPIDINE® 0,5 % ET 1 %)
La clonidine, connue pour baisser la PIO (4 à 6 mg chez le sujet glaucomateux), induit également, par stimulation des récepteurs sympathomimétiques centraux, une baisse de la pression systolo-diastolique systémique, potentiellement délétère pour la vascularisation de la tête du nerf optique.
Une approche pharmacogalénique a entrepris de dissocier l’effet central de l’effet périphérique de la clonidine en utilisant des composés α2-adrénergiques ne franchissant pas la barrière hémato-encéphalique, et a abouti à la mise au point de l’apraclonidine.
L’apraclonidine stimule les récepteurs α2-adrénergiques pré- et post-synaptiques, et également les récepteurs α1-adrénergiques post-synaptiques. Sa faible lipophilie accroît sa pénétration par voie transconjonctivale et/ou transclérale plutôt que cornéenne, et sa structure polaire plus accusée que celle de la clonidine réduit son franchissement de la barrière hémato-encéphalique. Son action a été étudiée dans l’application retenue, à savoir la prévention des hypertensions intra-oculaires (HTO) survenant au décours des séances de laser dans les traitements du glaucome (iridotomie, trabéculoplastie, iridoplastie). L’apraclonidine chez l’homme diminue nettement le débit d’humeur aqueuse (– 35 %), sans effet déterminant sur les capacités d’écoulement trabéculaire uvéoscléral.
Au cours d’études pharmacologiques, l’apraclonidine 1 % instillée deux fois par jour chez le volontaire sain abaisse la PIO de 22 % à la 1re heure, jusqu’à 40 % à la 5e heure, baisse prolongée à 25 % à la 12e heure. Elle est ainsi plus efficace que les bêtabloquants, les inhibiteurs de l’anhydrase carbonique ou les substances osmotiques pour réduire l’intensité et la fréquence des pics hypertensifs post-laser, à la dose d’une goutte seule instillée une heure avant.
Bien que leur site d’action soit commun (épithélium ciliaire non pigmenté), l’association apraclonidine-bêtabloquants est synergique.
L’apraclonidine à 0,5 % est indiquée dans le traitement additionnel à court terme du glaucome chronique à angle ouvert (GPAO), chez les patients sous traitement maximal toléré pour induire une baisse de PIO additionnelle pour retarder le traitement laser ou chirurgical. Une tachyphylaxie réduit l’efficacité de l’apraclonidine 0,5 % et 1 % qui souvent n’excède pas un mois.
BRIMONIDINE 0,2 % (ALPHAGAN® 0,2 %, LABORATOIRE ALLERGAN)
La brimonidine est un α2-mimétique dont la structure est différente de l’apraclonidine, ce qui induit un profil d’action différent. Elle est mille fois plus sélective pour les récepteurs α2 qu’α1-adrénergiques, et vingt-huit fois plus α2-sélective que l’apraclonidine, ce qui engendre une action plus ciblée sur la PIO avec très peu d’effets secondaires liés à une action sur les récepteurs-α1 (rétraction de la paupière, vasoconstriction et mydriase). La baisse de PIO induite par la brimonidine au pic d’efficacité en monothérapie est d’environ 22 à 28 %, légèrement supérieure au dorzolamide (20 à 24 %) et au bétaxolol (22 à 25 %), légèrement inférieure au timolol (25 à 29 %) et inférieure au latanoprost (29 à 33 %) et au bimatoprost (31 à 35 %) [6].
L’association au timolol 0,5 % (Combigan®, laboratoire Allergan) accroît encore la baisse de PIO. D’autres études (T.K. Mundor) concluent à la supériorité de la brimonidine 0,2 % sur le bétaxolol 0,25 % en monothérapie en cas de glaucome ou d’HTO et à son aptitude à remplacer en toute sécurité d’autres traitements de glaucome (David A. Lee et Qi Cheng). En association avec d’autres antiglaucomateux, certains auteurs (Lee) rapportent à chaque fois une amplification de la baisse pressionnelle occasionnée par la brimonidine, quelle que soit la molécule substituée. Ainsi, cette baisse supplémentaire est de 12,44 % s’il s’agit du latanoprost et de 13,56 % en cas de bêtabloquant non sélectif. Cet effet pressionnel n’est pas univoque, mais propre à chaque principe actif substitué, et procède probablement d’actions différentes selon les propriétés pharmacodynamiques des molécules substituées, selon leurs sites d’action, leurs mécanismes d’action et la chronopharmacologie de leur administration. De surcroît, depuis plusieurs années a été découvert un effet neuroprotecteur de la brimonidine qui est toujours en cours d’évaluation, mais dont l’effet est confirmé chez l’animal [7, 9].
L’apraclonidine 0,5 % et 1 % (Iopidine® 0,5 % et 1 %), après instillation chez le lapin, atteint sa concentration maximale en deux heures, dans l’humeur aqueuse, l’iris, le corps ciliaire et le cristallin, avec une concentration la plus élevée dans la cornée, et la plus faible dans l’humeur vitrée. Sa demi-vie d’élimination dans l’humeur aqueuse est de deux heures, et inférieure à 1 ng/mL dans le plasma. Sa demi-vie est de 8 heures.
La brimonidine à 0,2 % (Alphagan®) a un taux de fixation aux protéines de 29 %. Elle se lie de façon réversible à la mélanine, sans toxicité dans le cadre d’une étude d’un an. Après administration, 75 % de la dose sont excrétés dans l’urine sous forme de métabolite en cinq jours. L’âge n’influe pas sur l’absorption et l’élimination systémiques du produit.
La brimonidine 0,2 % associée au timolol 0,5 % (Combigan®) conjugue les modalités pharmacocinétiques de la brimonidine (avec une élimination systémique due au métabolisme hépatique – cytochrome PH50 et aldéhyde oxydase) et celles du timolol (voir plus haut le paragraphe sur les bêtabloquants).
APRACLONIDINE
Ses effets secondaires sont essentiellement locaux, plus accentués avec le dosage à 1 %, et pour certains liés à son action α1-mimétique partielle tels un blanchissement conjonctival, un relèvement de la paupière, voire une mydriase. Des réactions allergiques locales ne sont pas rares, caractérisées par une hyperhémie, un prurit, une gêne ou un larmoiement, survenant dès les premiers jours et nécessitant l’arrêt du traitement dans 15 % des cas [1].
L’apraclonidine est contre-indiquée en cas de maladie cardiovasculaire sévère non contrôlée et doit être utilisée avec précaution en cas d’insuffisance vasculaire, de coronaropathie, de syndrome de Raynaud ou de maladie de Buerger (thromboangéite oblitérante). Les effets centraux sont rares, sous forme de troubles du rythme, bradycardie, hypotension orthostatique, sécheresse bouche-nez, dysgueusie, troubles digestifs, troubles du sommeil, asthénie, voire dépression [4].
BRIMONIDINE
Ses effets secondaires sont modérés comparés à l’apraclonidine. Ils consistent surtout en une sécheresse buccale avec dysgueusie et une asthénie avec somnolence dans 8,3 % des cas, sans modification de la tension artérielle. On observe toutefois des taux d’hyperhémie (12,5 %), de prurit oculaire (12,5 %) et d’allergie (4,2 %) supérieurs à ceux des bêtabloquants. Il ne faut pas l’associer aux IMAO ni aux antidépresseurs tricycliques qui inhibent son efficacité.
APRACLONIDINE
Elle existe en collyre à 0,5 % en solution et 1 % en unidose. L’indication du dosage à 0,5 % est le traitement du glaucome chronique en addition, à court terme (un mois), d’un traitement maximal toléré nécessitant une réduction supplémentaire de la PIO en vue de retarder un traitement laser ou chirurgical, à raison de trois instillations par jour. Dans la formulation à 1 % (Iopidine® 1 % en récipient unidose), l’apraclonidine permet de contrôler et/ou prévenir les pics pressionnels après traitement au laser argon ou Nd-YAG, au niveau du segment antérieur de l’œil (trabéculorétraction au laser argon ou trabéculoplastie sélective, iridotomie, capsulotomie, iridoplastie) [5]. L’administration une heure avant puis après traitement au laser réduit ces pics pressionnels.
BRIMONIDINE
Elle est indiquée dans le traitement du GPAO, instillée deux ou trois fois par jour, car elle ne présente pas de phénomènes de tachyphylaxie. Elle s’utilise en monothérapie chez les patients présentant une contre-indication aux bêtabloquants topiques, ou en association à d’autres antiglaucomateux si la pression cible n’est pas atteinte. Ses propriétés pharmacologiques, neuroprotectrices, établies chez l’animal, seraient d’un grand intérêt chez l’homme pour combattre les phénomènes d’apoptose au niveau du nerf optique.
Retenir
-
L’apraclonidine (Iopidine® 0,5 % et 1 %) et la brimonidine 0,2 % (Alphagan®), apparues respectivement en 1995 et 1998, consacrent le renouveau et la pérennité d’une nouvelle classe pharmacologique, les sympathomimétiques α2-sélectifs développés sous forme topique pour pallier les effets secondaires locaux et généraux délétères de l’adrénaline, chef de file du système sympathique.
-
La Iopidine® 1 % en unidose est utilisée en instillation d’une goutte une heure avant et après tout traitement antiglaucomateux au laser. En raison de tachyphylaxie et de problèmes de tolérance locale, la Iopidine® 0,5 % ne peut être indiquée qu’à des patients sous traitement maximal dans l’attente d’un traitement laser ou chirurgical proche.
-
La brimonidine 0,2 % (Alphagan® 0,2 %) est vingt-huit fois plus α2-sélective que l’apraclonidine, et mille fois plus α2 qu’α1-sélective. Dépourvue de tachyphylaxie et bien tolérée, elle est utilisée en traitement de deuxième intention dans la stratégie des traitements antiglaucomateux, en combinaison possible avec toutes les molécules. Dans ce cadre, son association au timolol 0,5 % (Combigan®) trouve tout son intérêt et offre un très bon profil de sécurité, ainsi que des perspectives de neuroprotection.
[1] Baudouin C. Allergic reaction to topical eyedrops. Curr Opin Allergy Clin Immunol. 2005 ; 5 : 459-63.
[2] Bechetoille A. Les collyres agonistes et antagonistes du système sympathique. In : Béchetoille A (Ed.). Les glaucomes. II. Paris, Japperenard, 1997 : 330-6.
[3] Etienne R. Médications sympathomimétiques. In : Traitement médical et chirurgical des glaucomes. Marseille, Diffusion Générale de Librairie, 1977 : 97-127.
[4] Netter P, Sirbat D, Trechot P. Les effets systémiques des collyres. Rapport annuel (A. Raspiller, coordinateur). Bull Soc Ophtalmol Fr. 1985 ; n° spécial : 225-75.
[5] Renard JP, May F, Rigal-Sastourne C, et al. Nouveaux traitements médicaux dans le glaucome. Nouvelles stratégies ? J Fr Ophtalmol. 2001 ; 24 : 1095-9.
[6] Van der Valk R, Webers CA, Schouten JS, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs. Ophtalmology. 2005 ; 112 : 1177-85.
[7] Vidal-Sanz M. Neuroprotectives effects of topical brimonidine. Neuroprotection Symposium at 7th Congress of the European Glaucoma Society, May 30th, 2004, Florence, Italy.
[8] Weekers R, DelmarcelleY, Gustin J. Treatment of ocular hypotension by adrenaline and diverse sympathico-mimetics amines. Am J Ophthalmol. 1955 ; 40 : 666-72.
[9] Woldemussie E, Ruiz G, Wijono M, et al. Neuroprotection of retinal ganglion cells by brimonidine in rats with laser-induced chronic ocular hypotension. Invest Ophthalmol Vis Sci. 2001 ; 42 : 2849-55.
E. Sellem
-
Le collyre à la pilocarpine est le seul parasympathomimétique encore disponible pour traiter le glaucome primitif à angle ouvert.
-
Alors qu’il fut l’un des antiglaucomateux les plus prescrits avant l’avènement des collyres bêtabloquants, ses effets secondaires limitent considérablement sa prescription à l’heure actuelle.
-
La pilocarpine conserve toutefois plusieurs indications légitimes.
Jusqu’à la fin des années 1970, les myotiques parasympathomimétiques ont été au centre du traitement médical antiglaucomateux. Le développement de nouvelles classes thérapeutiques (bêtabloquants, puis prostaglandines, inhibiteurs locaux de l’anhydrase carbonique et α-mimétiques) les a maintenant relégués nettement au second plan. De cette vaste famille, seule la pilocarpine reste encore disponible en France. En dépit habituellement d’une tolérance locale médiocre, celle-ci peut représenter une alternative médicale précieuse dans certaines circonstances cliniques.
La pilocarpine est un alcaloïde muscarinique extrait des feuilles d’un arbuste d’Amérique tropicale (Pilocarpus microphyllus ou jaborandi). Elle fut isolée en 1875 et d’abord utilisée comme agent sudorifique et dépuratif. Le spasme de l’accommodation et le myosis qu’elle provoquait ont conduit des ophtalmologistes allemands à étudier plus précisément ses effets locaux et à découvrir, dès 1877, qu’elle pouvait abaisser la pression intra-oculaire (PIO).
De nombreuses molécules parasympathomimétiques, directes ou indirectes [3], ont été proposées pour traiter le glaucome ou encore provoquer un myosis chirurgical, traiter la sécheresse oculaire ou réaliser des tests diagnostiques et des traitements en strabologie. Beaucoup ne sont plus disponibles, comme plusieurs propositions de combinaisons fixes aujourd’hui abandonnées après plusieurs années de commercialisation, ou des formes galéniques autorisant un moins grand nombre d’instillations.
Les parasympathomimétiques directs agissent, de la même façon que l’acétylcholine, sur les récepteurs muscariniques (subtype M3) au niveau des jonctions neuronales des chaînes parasympathiques post-ganglionnaires, et stimulent ainsi les organes auxquels l’axone est destiné (dont les fibres longitudinales du muscle ciliaire et le sphincter de l’iris, en ce qui concerne ce chapitre).
L’action hypotonisante oculaire des sympathomimétiques réside exclusivement en une diminution de la résistance à l’écoulement trabéculaire, alors qu’une éventuelle action sur la sécrétion aqueuse est très controversée. Les fibres longitudinales du muscle ciliaire s’insèrent fortement sur l’éperon scléral et, par son intermédiaire, à la partie postérieure du trabéculum cornéoscléral. La contraction du muscle ciliaire provoquée par la molécule parasympathomimétique entraîne une rotation postérieure de l’éperon scléral, qui exerce alors une traction mécanique rapide sur les mailles intertrabéculaires, entraînant leur ouverture « en éventail ». L’élargissement concomitant des espaces intertrabéculaires facilite l’écoulement de l’humeur aqueuse, permettant ainsi de réduire la PIO. Un effet direct sur l’activité biochimique des cellules trabéculaires pourrait contribuer également à la baisse pressionnelle. Cependant, lorsque le muscle ciliaire est désinséré de l’éperon scléral, les myotiques n’ont plus d’effets sur le trabéculum et la PIO [4]. A contrario, les myotiques réduisent l’évacuation uvéosclérale de l’humeur aqueuse [1], ce qui peut expliquer certaines hypertonies paradoxales lors de la prescription de pilocarpine chez un patient présentant un angle aux fonctions altérées (lors d’une récession traumatique de l’angle par exemple). Cela dit, la pilocarpine ne compromet pas l’efficacité des prostaglandines lorsque ces familles sont associées pour abaisser la PIO, avec au contraire un effet additif [6].
Sitôt excrétée à la terminaison axonale, l’acétylcholine voit ses effets annulés par l’intervention de la cholinestérase : les molécules anticholinestérasiques sont des parasympathomimétiques indirects.
La pilocarpine possède, comme la plupart des alcaloïdes, une bonne pénétration cornéenne du fait de son profil mixte hydrosoluble et liposoluble. Sa biodisponibilité dépend de facteurs locaux, en particulier de la teneur en mélanine des tissus uvéaux. En effet, le pigment mélanique est capable de fixer de façon non spécifique la drogue, et donc d’en modifier sa pharmacocinétique. Cette notion de susceptibilité individuelle nécessite de vérifier l’efficacité du plus faible dosage de pilocarpine avant d’augmenter la concentration du collyre. Elle explique aussi que le sujet mélanoderme puisse ne répondre parfois qu’à de fortes concentrations de pilocarpine, 4 % par exemple.
Après une instillation, le maximum de concentration de pilocarpine dans l’humeur aqueuse est atteint en 20 minutes, et persiste 4 heures. L’effet sur l’abaissement de la PIO est à son maximum 2 heures après l’instillation et persiste environ 8 heures. Cet abaissement est environ de 20 %, et est donc obtenu entre la 2e et la 8e heure suivant l’instillation [2]. Pour cette raison, quatre instillations quotidiennes devraient être recommandées pour assurer un abaissement pressionnel constant, bien qu’il ait été démontré que l’occlusion lacrymonasale permettait avec deux instillations par jour d’avoir la même efficacité sur le nycthémère [7].
Cela explique le développement de plusieurs formes galéniques, dont la majorité n’est pas disponible en France, qu’il s’agisse d’émulsions, de gels visqueux ou d’implants thérapeutiques solubles (Ocusert®), permettant une augmentation du temps de contact cornéen ou une libération constante et prolongée du principe actif (jusqu’à huit jours pour l’Ocusert®), ainsi qu’une réduction de ses effets latéraux.
À l’heure où cet ouvrage est écrit, la pilocarpine est le seul parasympathomimétique commercialisé en France pour traiter le glaucome. Elle est disponible en flacon sous forme de chlorhydrate de pilocarpine, sous trois concentrations différentes : 0,5 %, 1 % et 2 % (Isopto®-pilocarpine 0,5 %-1 %-2 % Alcon). Elle est également disponible en unidoses, seulement à destination hospitalière (Pilocarpine 1 % et 2 % Faure, par boîte de 100 unidoses, distribuée par le laboratoire Europhta).
D’autres agents cholinergiques peuvent, ou ont pu, être proposés en ophtalmologie :
-
l’acéclidine (Glaucostat®), cholinergique de synthèse, est aussi efficace que la pilocarpine, avec des effets secondaires moins prononcés. Pour des raisons essentiellement commerciales, elle n’est malheureusement plus disponible en France depuis 2003 ;
-
le chlorure d’acétylcholine (Miochol®), toujours accessible, permet d’obtenir un myosis rapide durant la chirurgie oculaire en injection intracamérulaire ;
-
le carbachol, synthétisé en 1932, est un myotique à longue durée d’action car il résiste à l’hydrolyse par les cholinestérases. Comme le chlorure d’acétylcholine, il peut être utilisé pour obtenir un myosis rapide en injection intracamérulaire durant la chirurgie (Miostat®), bien qu’il puisse être toxique vis-à-vis des cellules endothéliales cornéennes. Il fut longtemps disponible sous forme de collyre pour traiter le glaucome (Isoptocarbachol®), mais ses effets secondaires, beaucoup plus importants que ceux de la pilocarpine, ont limité son utilisation et il a été retiré de la pharmacopée française en 2003 ;
-
les agents anticholinestérasiques (ou parasympathomimétiques indirects), tel l’échothiopate iodide (Phospholine®), augmentent la concentration d’acétylcholine dans la fente synaptique. Ils ont une très longue durée d’action (deux instillations par semaine peuvent parfois suffire à abaisser la PIO !), mais leur utilisation au long cours entraîne une rigidité plastique de l’iris ainsi que la formation de kystes iriens. Ils peuvent être cataractogènes (opacités sous-capsulaires antérieures), et les effets indésirables locaux (myosis très serré) et surtout généraux (bradycardie, troubles digestifs, etc.) limitent l’utilisation de ces drogues dans la thérapeutique antiglaucomateuse. Leur commercialisation a progressivement été arrêtée en France, du dosage le plus fort au plus faible, où ils ne sont plus disponibles depuis 2002.
Les molécules parasympathomimétiques ont enfin pu être associées dans des combinaisons fixes, toutes retirées maintenant de la pharmacopée française : pilocarpine et néosynéphrine dans le but de diminuer le myosis (Néosyncarpine® retirée en 1997), acéclidine et adrénaline (Glaucadrine®, en 2003), pilocarpine et cartéolol (Carpilo®, en 2010), pilocarpine et timolol (Timpilo®, en 2005 ; Pilobloq®, en 2011).
Les effets généraux de la pilocarpine, aux concentrations actuellement disponibles, sont inexistants ou très controversés (hypersudation, hypersialorrhée, bradycardie, troubles digestifs, etc.). En réalité, les effets indésirables sont surtout locaux [8]. Ils sont liés :
-
à la contraction du sphincter irien (myosis, effet sténopéique, baisse de vision nocturne) ;
-
à la contraction du muscle ciliaire créant un spasme d’accommodation durant environ 2 heures avec une pseudo-myopie particulièrement marquée chez les sujets jeunes ou déjà myopes, parfois une céphalée frontale et/ou temporo-pariétale. L’ophtalmologiste doit connaître cet effet secondaire possible et en prévenir le patient lors de l’instillation d’un myotique avant une iridotomie. En cas de prescription au long cours, cet effet disparaît en quelques jours ;
-
à la stimulation de la glande lacrymale (larmoiement réflexe, irritation palpébrale).
L’effet cataractogène (opacités sous-capsulaires antérieures), observé autrefois avec les anticholinestérasiques, n’est pas habituellement retenu pour la pilocarpine.
Si la contraction ciliaire peut entraîner rapidement un décollement postérieur du vitré, toute prescription de pilocarpine nécessite surtout un examen soigneux et répété de la périphérie rétinienne du fait du risque de formation d’ouvertures rétiniennes et de décollement de rétine par traction vitréorétinienne induite [5]… bien que ce risque soit parfois contesté. La vigilance doit être d’autant plus importante que le sujet est myope, aphake ou qu’il présente des zones rétiniennes périphériques dégénératives.
Il peut être aussi utile de dilater épisodiquement la pupille pour éviter la formation de synéchies postérieures dues au myosis prolongé, en réalité exceptionnelles en dehors de réactions inflammatoires intra-oculaires. Ce myosis, après quelques mois, tend à devenir permanent, peu réductible médicalement, et gênera alors l’observation de la périphérie rétinienne précisément conseillée plus haut. Il perturbera également une chirurgie future de la cataracte. Le relevé du champ visuel en sera également affecté, avec une diminution diffuse de la sensibilité et une augmentation de la taille comme de la profondeur d’éventuels scotomes ; à cause de cela, il peut être nécessaire d’instiller une goutte de tropicamide pour cet examen à un patient sous pilocarpine afin d’obtenir un diamètre pupillaire d’au moins 3 mm.
Enfin, la contraction ciliaire entraîne un mouvement vers l’avant du diaphragme iridocristallinien et une diminution concomitante de la profondeur de la chambre antérieure (– 0,25 mm en moyenne). Celle-ci peut précipiter exceptionnellement un bloc pupillaire et une fermeture de l’angle iridocornéen. Cette dernière éventualité n’a toutefois été observée qu’avec de fortes concentrations de pilocarpine (4 % ou plus), qui ne sont plus commercialisées en France. En revanche, il est reconnu depuis longtemps que l’administration de pilocarpine, avant ou après une intervention filtrante, puisse précipiter la survenue d’un bloc ciliaire chez les rares sujets prédisposés à cette redoutable complication chirurgicale.
De fortes doses de pilocarpine peuvent avoir un effet tératogène chez l’animal, et la prescription de cette molécule doit donc être théoriquement évitée chez la femme enceinte, bien qu’aucune complication n’ait jamais été signalée.
L’importance des effets secondaires, la contrainte des pluri-instillations quotidiennes et l’émergence de collyres antiglaucomateux, dont la tolérance est bien meilleure, expliquent les rares prescriptions actuelles de la pilocarpine pour le traitement du glaucome primitif à angle ouvert (GPAO). La qualité de vie du glaucomateux, et donc l’observance médicamenteuse, peuvent naturellement en être affectées. Cependant, une bonne indication de la pilocarpine reste le glaucome chronique à angle ouvert survenant chez le sujet aphake ou pseudo-phake lorsque l’équilibre tonométrique n’a pas été obtenu avec toutes les autres familles thérapeutiques, et après avoir vérifié l’intégrité de la rétine périphérique. De nombreuses études ont montré l’effet additif apporté par la pilocarpine quelles que soient les autres molécules hypotensives prescrites de manière concomitante. Dans les formes de GPAO réfractaires les plus préoccupantes, la prescription de pilocarpine peut être utile pour espérer abaisser un peu plus la PIO, le rapport bénéfice/risque lui devenant alors favorable.
Enfin, certaines indications de la pilocarpine peuvent être ponctuelles : juste avant ou après une trabéculoplastie ou une iridoplastie périphérique afin de diminuer le risque de poussée pressionnelle ou de rendre un angle étroit plus accessible, également en préopératoire d’une chirurgie perforante pour diminuer le risque d’hernie irienne au moment de l’ouverture du globe.
Retenir
-
En raison de sa tolérance locale médiocre et du nombre quotidien d’instillations qu’elle impose, la pilocarpine n’est aujourd’hui prescrite que très rarement pour traiter le GPAO.
-
Lorsque les autres familles thérapeutiques ne sont pas assez efficaces, chez le pseudo-phake et l’aphake, elle demeure une bonne indication en raison de la moindre importance des effets secondaires.
-
L’intégrité de la rétine périphérique doit impérativement être vérifiée avant, puis régulièrement durant sa prescription.
[1] Crawford K, Kaufman PL. Pilocarpine antagonizes prostaglandin F2 alpha-induced ocular hypotension in monkeys. Evidence for enhancement of uveoscleral outflow by prostaglandin F2 alpha. Arch Ophthalmol. 1987 ; 105 : 1112-6.
[2] Drance SM, Bensted M, Schulzer M. Pilocarpine and intraocular pressure. Duration of effectiveness of 4 percent and 8 percent pilocarpine instillation. Arch Ophthalmol. 1974 ; 91 : 104-6.
[3] Etienne R. Médications parasympathomimétiques. In : Traitement médical et chirurgical des glaucomes. Marseille, Diffusion Générale de Librairie, 1977 : 45-79.
[4] Kaufman PL, Bárány EH. Loss of acute pilocarpine effect on outflow facility following surgical disinsertion and retrodisplacement of the ciliary muscle from the scleral spur in the cynomolgus monkey. Invest Ophthalmol. 1976 ; 15 : 793-807.
[5] Pape LG, Forbes M. Retinal detachment and miotic therapy. Am J Ophthalmol. 1978 ; 85 : 558-66.
[6] Toris CB, Zhan GL, Zhao J, et al. Potential mechanism for the additivity of pilocarpine and latanoprost. Am J Ophthalmol. 2001 ; 131 : 722-8.
[7] Zimmerman TJ, Sharir M, Nardin GF, Fuqua M. Therapeutic index of pilocarpine, carbachol, and timolol with nasolacrimal occlusion. Am J Ophthalmol. 1992 ; 114 : 1-7.
[8] Zimmerman TJ, Wheeler TM. Miotics : side effects and ways to avoid them. Ophthalmology. 1982 ; 89 : 76-80.
P. Denis
-
Toutes les combinaisons fixes en France associent actuellement le maléate de timolol à une molécule issue d’une autre famille thérapeutique (inhibiteur de l’anhydrase carbonique, agoniste α2-adrénergique ou analogue des prostaglandines).
-
À condition qu’elles soient aussi efficaces que leurs composants en association libre, les combinaisons fixes peuvent être préférées aux traitements dissociés car elles sont plus pratiques, réduisent l’exposition aux conservateurs et peuvent améliorer l’observance.
-
Il n’est pas démontré que les combinaisons fixes modifient l’évolution du glaucome différemment des traitements dissociés.
Il est de coutume de prescrire plusieurs collyres uniquement lorsqu’une monothérapie n’est plus suffisante pour contrôler la pression intra-oculaire (PIO) et pour atteindre, chez un patient donné, la PIO cible. Cette situation est plus fréquente qu’on ne le croit et concerne au moins un tiers de nos patients. En Europe, chez ces patients soumis à une multithérapie, deux tiers environ sont traités par une combinaison fixe. La multiplication des collyres perturbe la qualité de vie et peut jouer un rôle néfaste sur l’observance thérapeutique. Plusieurs études ont en effet démontré un lien entre le nombre de gouttes à instiller quotidiennement et le respect de la prescription, les patients suivant un traitement complexe étant les moins observants [19]. Le seuil qui conduit à une mauvaise observance est variable d’un sujet à l’autre, mais la plupart des patients ne suivent pas correctement leur prescription lorsque le nombre d’instillations est supérieur à trois gouttes par jour.
Les combinaisons fixes sont des préparations locales contenant plusieurs principes actifs dans le même flacon. Elles sont généralement plus efficaces que les monothérapies dont elles sont issues. Elles agissent en complémentarité lorsque les molécules qui la composent sont de familles différentes, agissant sur des cibles d’action variées (sécrétion/élimination de l’humeur aqueuse). Dans certains cas, la tolérance des combinaisons fixes est améliorée par rapport aux traitements dissociés, probablement du fait d’une réduction du nombre d’instillations quotidiennes. Le maléate de timolol, présent dans la majorité des combinaisons fixes, pourrait jouer un rôle positif dans la tolérance locale du principe actif qui lui est allié.
Les avantages des combinaisons fixes sont surtout pratiques. En mélangeant deux principes actifs dans le même flacon, elles évitent la dilution de la première goutte instillée par la seconde instillée trop rapidement lors de d’un traitement dissocié (effet de « washout »). La réduction mécanique du nombre de gouttes implique aussi une exposition moindre aux conservateurs dont on sait qu’ils sont agressifs à long terme pour la surface oculaire. Certaines spécialités sont déjà disponibles sans conservateur (Cosopt®) ou contiennent des conservateurs supposés moins cytotoxiques que le chlorure de benzalkonium (Polyquad dans le Duotrav®). Cet avantage galénique pourrait expliquer le fait que les combinaisons fixes ont généralement un profil de tolérance locale supérieur à celui des traitements dissociés.
Intuitivement, l’intérêt majeur des combinaisons fixes réside dans leur potentiel d’améliorer l’observance thérapeutique. Cependant, les preuves que le recours aux associations fixes permet cette amélioration sont paradoxalement assez peu nombreuses. Dans une étude observationnelle, les patients traités par une combinaison fixe présentaient une probabilité statistiquement plus forte de poursuivre leur traitement au-delà d’un mois, par rapport à ceux traités par deux, voire trois flacons de collyres différents [9]. Il est intéressant de noter que l’étude ne s’intéressait pas spécifiquement à l’impact des combinaisons fixes sur la persistance thérapeutique (une combinaison fixe étant considérée comme un seul traitement), mais simplement à celui du nombre de flacons utilisés quotidiennement par le patient.
Les recommandations officielles de l’European Glaucoma Society proposent – un peu timidement – le recours aux combinaisons fixes, en particulier lorsque « l’observance thérapeutique est susceptible d’être affectée par des traitements multiples et dissociés », soulignant aussi la diminution de l’exposition de la surface oculaire aux conservateurs.
Cependant, les combinaisons fixes ne doivent pas être considérées comme des traitements de première intention : il faut les réserver aux patients en échec de monothérapie. Si la prescription d’un collyre comprenant plusieurs médicaments peut apparaître séduisante, elle n’en comporte pas moins des inconvénients. Par définition, l’ajustement thérapeutique par l’adaptation de la posologie est impossible. Or, nous savons qu’un certain nombre de patients nécessite une posologie optimale pour qu’une baisse importante de la PIO survienne (deux instillations quotidiennes pour le timolol, trois pour le dorzolamide ou la brimonidine). Cet ajustement de la posologie est, par essence, impossible avec les combinaisons fixes, et il est alors nécessaire de préférer un traitement dissocié.
Le contrôle des effets indésirables est aussi plus complexe ; lors de la survenue d’une réaction inattendue, l’imputabilité à l’un ou l’autre des principes actifs formant la combinaison fixe est plus aléatoire et nécessite l’arrêt thérapeutique complet. Enfin, le recours à une combinaison fixe sans avoir, au préalable, testé individuellement chacun de ses composants peut ainsi théoriquement masquer l’inefficacité d’un des composants et conduire à traiter un patient pendant une longue période par un principe actif inefficace mais à risque d’effets indésirables.
La prescription d’une combinaison fixe sans discernement peut aboutir à une réduction forte et peu utile de la PIO et, surtout, à des effets indésirables locaux ou généraux. Même si cela ne fait pas l’objet d’un consensus académique, les combinaisons fixes peuvent être exceptionnellement proposées lorsqu’une exigence pressionnelle est forte, lorsqu’il existe une menace directe sur la vision centrale, ou quand l’observance thérapeutique risque d’être médiocre avec un traitement compliqué.
COMBINAISONS FIXES TIMOLOL-INHIBITEURS DE L’ANHYDRASE CARBONIQUE
Deux combinaisons fixes, associant le timolol et le dorzolamide (Cosopt®, MSD) ou le brinzolamide (Azarga®, Alcon), sont disponibles sur le marché européen et sont instillées deux fois par jour. L’association timolol-dorzolamide, qui existe sous forme sans conservateur, est plus efficace que ses composants [4] et équivalente à l’association libre [18]. Cela est également démontré pour l’association timolol-brinzolamide [11]. Le profil de tolérance des deux collyres est similaire, avec peut-être une tolérance locale améliorée pour cette dernière [2] (suspension au pH neutre). La comparaison de ces deux produits indique une égale efficacité pressionnelle [15], avec une incidence un peu moindre des effets indésirables locaux avec l’Azarga®, mais une dysgueusie plus fréquente.
COMBINAISON FIXES TIMOLOL-AGONISTES α2-ADRÉNERGIQUES
Seule l’association timolol-brimonidine (Combigan®, Allergan), prescrite deux fois par jour (trois en cas de besoin), est disponible en Europe et est globalement aussi efficace que le traitement dissocié à la même posologie. La brimonidine est une imidazoline hautement sélective des récepteurs α2-adrénergiques dont la structure chimique est proche de celle de la clonidine et de l’apraclonidine, mais significativement plus lipophile que ce dernier.
Les principaux effets indésirables rencontrés avec l’association sont ceux de ses composants ; les effets secondaires de la brimonidine sont principalement de nature systémique, liés au passage de la barrière hémato-encéphalique de la molécule : sécheresse buccale, fatigue et somnolence. Même si la fréquence cardiaque ou la pression artérielle sont peu perturbées, la prudence doit être de mise chez les patients présentant des antécédents cardiovasculaires sérieux. Le Combigan® ne doit pas être utilisé chez l’enfant du fait du risque de passage de la barrière hémato-encéphalique immature avec somnolence, dépression respiratoire, convulsions, voire apnée et coma. Ces effets indésirables graves surviennent 30 à 60 minutes après instillation, mais sont rapidement réversibles après action de la naloxone [14].
La brimonidine donne lieu à des réactions d’intolérance locale de nature allergique dont l’incidence est significative (5 % à trois mois, environ 12 % au bout d’un an). L’effet secondaire le plus souvent rapporté avec l’association timolol-brimonidine est logiquement l’allergie oculaire, mais à un taux moindre que celui observé avec la brimonidine en monothérapie. L’explication de ce phénomène n’est pas claire, mais le timolol diminue la sensibilité cornéenne et pourrait alors masquer les signes d’allergie. À trois mois, l’efficacité de l’association timolol-brimonidine est équivalente ou un peu supérieure à celle de l’association timolol-dorzolamide, avec une tolérance locale un peu meilleure : allergie pour la première, brûlures, picotements oculaires et goût amer pour la seconde [16]. Dans un modèle de surcharge hydrique, les deux associations ont le même effet sur la PIO circadienne [8]. En association avec une prostaglandine, elles se comportent aussi à peu près de la même façon, avec un gain pressionnel un peu plus marqué pour l’association timolol-brimonidine.
COMBINAISONS TIMOLOL-ANALOGUE DES PROSTAGLANDINES
Étant donné qu’ils sont largement prescrits en première intention, il n’est pas surprenant que les analogues des prostaglandines (PG) le soient également en seconde intention dans les combinaisons fixes. Le timolol peut être associé au latanoprost à 0,05 % (Xalacom®, Pfizer et laboratoires génériques), au travoprost à 0,004 % (Duotrav®, Alcon) ou au bimatoprost à 0,03 % (Ganfort®, Allergan), chacune des spécialités devant être instillée une seule fois par jour.
En association fixe, ces spécialités sont plus efficaces que les PG elles-mêmes [3, 10, 13]. À certaines heures de la journée, les différences entre les combinaisons fixes et les PG peuvent être faibles, voire non significatives, du fait des variations nycthémérales de la PIO [5]. Pour certains, les combinaisons fixes de PG pourraient aboutir à un sous-dosage du timolol chez certains patients, du fait de la mono-instillation quotidienne. En pratique, près de deux tiers des ophtalmologistes estiment que les combinaisons fixes sont un peu moins efficaces que les traitements dissociés [17]. Seule exception, le Xalacom® apparaît statistiquement moins efficace que le traitement dissocié lorsqu’il est prescrit le matin [6], mais la différence s’atténue pour devenir non significative lorsqu’il est instillé le soir [7]. Les différences constatées pourraient être liées à une fréquence d’instillation insuffisante ou un horaire inadapté, puisque le timolol est plus efficace lorsqu’il est administré le matin que le soir, et c’est l’inverse pour les PG. La suspicion envers l’efficacité de ces spécialités explique probablement qu’elles soient disponibles en Europe, en Australie, au Canada et au Japon, mais pas encore aux États-Unis.
Comparativement aux associations timolol-inhibiteur de l’anhydrase carbonique, les combinaisons fixes de PG semblent être un peu plus efficaces, avec un gain pressionnel supplémentaire de l’ordre de 1 mmHg lorsque le Xalacom® ou le Duotrav® sont comparés au Cosopt® [12, 20].
La technique de méta-analyse par réseau permet d’augmenter le nombre d’études analysées conjointement, et donc le nombre de patients évalués. Cette approche a été appliquée à une méta-analyse sur 20 études et plus de 4 000 patients, pour comparer les trois combinaisons fixes de PG entre elles, et évaluer leur additivité par rapport à leurs constituants [1]. Les résultats indiquent que les combinaisons sont toutes plus efficaces que les PG dont elles sont issues lorsque celles-ci sont prescrites en monothérapie, et que la combinaison bimatoprost-timolol est statistiquement plus efficace que les deux autres. Les différences observées sont certes faibles, mais significatives et maintenues à certaines heures de la journée. Par ailleurs, l’incidence de l’hyperhémie conjonctivale est systématiquement inférieure avec une combinaison fixe qu’avec la PG correspondante, ce qui confirme les constatations cliniques faites avec les autres associations fixes présentes sur le marché. Le timolol pourrait jouer, par son action stabilisante de membrane, un rôle anesthésique local, ou modifier les jonctions cellulaires étroites entre les cellules épithéliales, potentialiser la vacoconstriction entretenue par les catécholamines ou inhiber la libération locale d’oxyde nitrique.
AUTRES COMBINAISONS FIXES
Plusieurs combinaisons fixes allient la pilocarpine au timolol, au métipranolol ou au cartéolol, mais elles ne sont pas ou plus disponibles en France. L’association de la pilocarpine à un bêtabloquant pourrait être mise à profit chez le patient pseudo-phake, car le myosis induit a un effet sténopéique sur la vision et le risque de spasme d’accommodation n’existe plus.
À l’avenir, il est vraisemblable que nous disposerons de collyres délivrant plus de deux principes actifs, et la combinaison timolol-brimonidine-dorzolamide est déjà commercialisée au Mexique pour les glaucomes les plus réfractaires. Il vient d’être mis sur le marché américain une spécialité pharmaceutique excluant le timolol, mais à base de brimonidine-brinzolamide, dont l’efficacité s’apparente à celles de l’association libre (Simbriza®, Alcon) et qui peut donc être prescrite chez les patients présentant une contre-indication bronchopulmonaire ou cardiaque aux bêtabloquants.
Retenir
En pratique, les associations fixes répondent à des objectifs essentiels du traitement du glaucome :
-
simplification du traitement par réduction du nombre des instillations quotidiennes avec, pour corollaire, diminution de l’exposition de la surface oculaire aux conservateurs ;
-
efficacité supérieure aux monothérapies dont elles sont issues, et efficacité globalement comparable aux traitements dissociés ;
-
tolérance locale au moins identique (voire supérieure) aux associations non fixes ;
-
impact probablement positif sur l’observance thérapeutique à long terme, en particulier chez les patients présentant un handicap visuel sévère.
Il est cependant nécessaire de respecter les recommandations car les combinaisons fixes sont des traitements de seconde intention, destinés à renforcer la thérapeutique en cas d’insuffisance d’une monothérapie.
L’absence de discernement dans la prescription d’une combinaison fixe peut conduire à une réduction inutile de la PIO et expose à des effets indésirables locaux et/ou généraux.
Le choix de la combinaison fixe doit être adapté à l’objectif pressionnel et aux contraintes posologiques et de tolérance individuelle du patient.
[1] Aptel F, Cucherat M, Denis P. Efficacy and tolerability of prostaglandin-timolol fixed combinations : a meta-analysis of randomized clinical trials. Eur J Ophthalmol. 2012 ; 22 : 5-18.
[2] Auger GA, Raynor M, Longstaff S. Patient perspectives when switching from Cosopt™ (dorzolamide-timolol) to Azarga™ (brinzolamide-timolol) for glaucoma requiring multiple drug therapy. Clin Ophthalmol. 2012 ; 6 : 2059-62.
[3] Barnebey HS, Orengo-Nania S, Flowers BE, et al. The safety and efficacy of travoprost 0.004 %/timolol 0.5 % fixed combination ophthalmic solution. Am J Ophthalmol. 2005 ; 140 : 1-7.
[4] Boyle JE, Ghosh K, Gieser DK, Adamsons IA. A randomized trial comparing the dorzolamide-timolol combination given twice daily to monotherapy with timolol and dorzolamide. Dorzolamide-Timolol Study Group. Ophthalmology. 1998 ; 105 : 1945-51.
[5] Brandt JD, Cantor LB, Katz LJ, et al. Bimatoprost/timolol fixed combination : a 3-month double-masked, randomized parallel comparison to its individual components in patients with glaucoma or ocular hypertension. J Glaucoma. 2008 ; 17 : 211-6.
[6] Diestelhorst M, Larsson LI. A 12 week study comparing the fixed combination of latanoprost and timolol with the concomitant use of the individual components in patients with open angle glaucoma and ocular hypertension. Br J Ophthalmol. 2004 ; 88 : 199-203.
[7] Diestelhorst M, Larsson LI. A 12-week, randomized, double-masked, multicenter study of the fixed combination of latanoprost and timolol in the evening versus the individual components. Ophthalmology. 2006 ; 113 : 70-6.
[8] Hatanaka M, Grigera DE, Barbosa WL, et al. An eight-week, multicentric, randomized, interventional, open-label, phase 4, parallel comparison of the efficacy and tolerability of the fixed combination of timolol maleate 0.5 %/brimonidine tartrate 0.2 % versus fixed combination of timolol maleate 0.5 %/dorzolamide 2 % in patients with elevated intraocular pressure. J Glaucoma. 2008 ; 17 : 674-9.
[9] Higginbotham EJ, Hansen J, Davis EJ, et al. Glaucoma medication persistence with a fixed combination versus multiple bottles. Curr Med Res Opin. 2009 ; 25 : 2543-7.
[10] Hommer A. A double-masked, randomized, parallel comparison of a fixed combination of bimatoprost 0.03 %/timolol 0.5 % with non-fixed combination use in patients with glaucoma or ocular hypertension. Eur J Ophthalmol. 2007 ; 17 : 53-62.
[11] Kaback M, Scoper SV, Arzeno G, et al. Intraocular pressure-lowering efficacy of brinzolamide 1 %/timolol 0.5 % fixed combination compared with brinzolamide 1 % and timolol 0.5 %. Ophthalmology. 2008 ; 115 : 1728-34.
[12] Konstas AG, Kozobolis VP, Lallos N, et al. Daytime diurnal curve comparison between the fixed combinations of latanoprost 0.005 %/timolol maleate 0.5 % and dorzolamide 2 %/timolol maleate 0.5 %. Eye. 2004 ; 18 : 1264-9.
[13] Konstas AG, Boboridis K, Tzetzi D, et al. Twenty-four-hour control with latanoprost-timolol-fixed combination therapy vs latanoprost therapy. Arch Ophthalmol. 2005 ; 123 : 898-902.
[14] Lai Becker M, Huntington N, Woolf AD. Brimonidine tartrate poisoning in children : frequency, trends, and use of naloxone as an antidote. Pediatrics. 2009 ; 123 : e305-11.
[15] Manni G, Denis P, Chew P, et al. The safety and efficacy of brinzolamide 1 %/timolol 0.5 % fixed combination versus dorzolamide 2 %/timolol 0.5 % in patients with open-angle glaucoma or ocular hypertension. J Glaucoma. 2009 ; 18 : 293-300.
[16] Nixon DR, Yan DB, Chartrand JP, et al. Three-month, randomized, parallel-group comparison of brimonidine-timolol versus dorzolamide-timolol fixed-combination therapy. Curr Med Res Opin. 2009 ; 25 : 1645-53.
[17] Stewart WC, Konstas AG, Pfeiffer N. Patient and ophthalmologist attitudes concerning compliance and dosing in glaucoma treatment. J Ocul Pharmacol Ther. 2004 ; 20 : 461-9.
[18] Strohmaier K, Snyder E, DuBiner H, Adamsons IA. The efficacy and safety of the dorzolamide-timolol combination versus the concomitant administration of its components. Dorzolamide-Timolol Study Group. Ophthalmology. 1998 ; 105 : 1936-44.
[19] Taylor SA, Galbraith SM, Mills RP. Causes of non-compliance with drug regimens in glaucoma patients : a qualitative study. J Ocul Pharmacol Ther. 2002 ; 18 : 401-9.
[20] Teus MA, Miglior S, Laganovska G, et al. Efficacy and safety of travoprost/timolol vs dorzolamide/timolol in patients with open-angle glaucoma or ocular hypertension. Clin Ophthalmol. 2009 ; 3 : 629-36.
E. Sellem
Les premières tentatives de traitement au laser de l’hypertension oculaire (HTO), proposées au début des années 1970, avaient pour finalité la création de perforations (ou trabéculopunctures) au niveau du trabéculum. Les appareils utilisés étaient des lasers Q-switched ruby [5] ou des lasers à l’argon en mode continu [3]. Même si un abaissement pressionnel était obtenu durant quelques jours (par la réaction inflammatoire ?), il fallut rapidement admettre qu’une telle méthode n’avait aucune efficacité à court et à moyen termes, tout au moins avec les appareils disponibles à l’époque. Avec le laser Excimer, des microperforations ont toutefois pu être obtenues dès les années 1990 et ont fait l’objet de quelques publications, bien que ce type de trabéculotomie physique ne semble pas avoir bénéficié d’une large diffusion.
Le premier abaissement pressionnel durable obtenu avec un laser à l’argon a été rapporté en 1973 par Worthen chez le singe [8], donnant à la méthode le nom de trabéculotomie au laser. Ce fut tout le mérite de Wise et Witter dès 1976 [7] d’imaginer une autre conception de traitement utilisant l’énergie de ce laser et d’inaugurer, en quelque sorte, une nouvelle ère du traitement du glaucome primitif à angle ouvert (GPAO) en inventant la première trabéculoplastie efficace.
Quelques tentatives de trabéculoplastie avec le laser diode en mode continu ont été proposées dans les années 1990 [1, 2, 6], avec des résultats comparables à ceux obtenus avec l’argon sur le long terme, mais la faible diffusion de l’instrumentation, pourtant compacte et portable, a eu raison de cette méthode.
Finalement, la trabéculoplastie au laser à l’argon – qui fonctionne en mode continu – a fait pratiquement cavalier seul entre les années 1980 et 2000. Le développement de lasers micropulsés, dont le but est de produire un minimum d’altérations tissulaires grâce à des rafales d’impacts de très courte durée (de l’ordre de quelques nanosecondes), a pu être appliqué au traitement du trabéculum (fig. 16-2). La trabéculoplastie à l’argon est ainsi maintenant fortement concurrencée par la trabéculoplastie dite sélective ou SLT (selective laser trabeculoplasty), utilisant un laser YAG Q-switched, dont l’énergie endommage beaucoup moins les précieuses structures trabéculaires [4], avec des résultats globalement identiques et autorisant théoriquement la possibilité de retraitements sans danger. Des trabéculoplasties utilisant d’autres lasers micropulsés sont en cours d’évaluation et/ou restent peu diffusées : trabéculoplastie au laser titanium-sapphire (titanium-sapphire laser trabeculoplasty ou TLT) ou au laser diode micropulsé (micropulse diode laser trabeculoplasty ou MDLT) (fig. 16-3).
La pneumotrabéculoplastie, méthode originale et contestée, n’utilise pas le laser mais un mécanisme d’aspiration, ce qui justifie un paragraphe spécifique.
Les tentatives de trabéculotomie au laser Excimer et au laser Nd-YAG, abordées plus haut, sont présentées en fin de chapitre. La goniopuncture, ouverture de la membrane résiduelle trabéculo-descémétique éventuellement réalisée après une trabéculectomie externe non perforante, est traitée dans le chapitre spécifique consacré à cette technique chirurgicale.
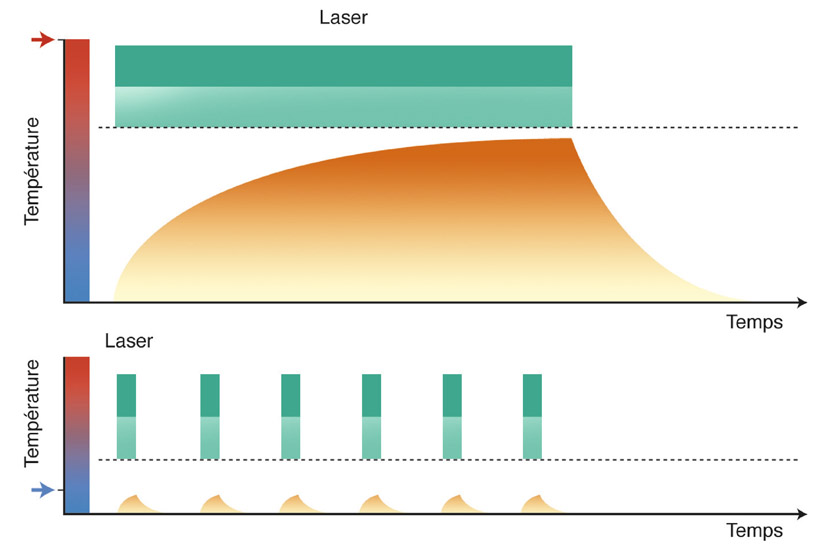
Fig. 16-2 En haut, accroissement de l’effet thermique provoqué par un laser fonctionnant en mode continu ; en bas, mode micropulsé avec chaque fois un retour à la température basale entre chaque impact, ne permettant donc théoriquement pas la création de lésions nécrotiques par coagulation.
Fig. 16-3 Longueurs d’onde et durée des impacts des différents lasers utilisés pour la trabéculoplastie. XeCl : chlorure de xénon.
[1] Brancato R, Carassa R, Trabucchi G. Diode laser compared with argon laser for trabeculoplasty. Am J Ophthalmol. 1991 ; 112 : 50-5.
[2] Chung PY, Schuman JS, Netland PA, et al. Five-year results of a randomized, prospective, clinical trial of diode vs argon laser trabeculoplasty for open-angle glaucoma. Am J Ophthalmol. 1998 ; 126 : 185-90.
[3] Hager H. Special microsurgical interventions. 2. First experiences with the argon laser apparatus 800 [in German]. Klin Monbl Augenheilkd. 1973 ; 162 : 437-50.
[4] Kramer TR, Noecker RJ. Comparison of the morphologic changes after selective laser trabeculoplasty and argon laser trabeculoplasty in human eye bank eyes. Ophthalmology. 2001 ; 108 : 773-9.
[5] Krasnov MM. Laser puncture of the anterior chamber angle in glaucoma (a preliminary report) [in Russian]. Vestn Oftalmol. 1972 ; 3 : 27-31.
[6] McHugh D, Marshall J, Ffytche TJ, et al. Diode laser trabeculoplasty (DLT) for primary open-angle glaucoma and ocular hypertension. Br J Ophthalmol. 1990 ; 74 : 743-7.
[7] Wise JB, Witter SL. Argon laser therapy for open-angle glaucoma. A pilot study. Arch Ophthalmol. 1979 ; 97 : 319-22.
[8] Worthen DM, Wickham MG. Laser trabeculotomy in monkeys. Invest Ophthalmol. 1973 ; 12 : 707-11.
TRABÉCULOPLASTIE AU LASER ARGON
E. Sellem
-
À court terme, l’efficacité de la trabéculoplastie sur l’abaissement pressionnel est globalement excellente dans le GPAO, permettant souvent un allégement thérapeutique médicamenteux.
-
Toutefois, cet effet se relâche souvent avec le temps.
-
Avec une procédure en deux temps séparés d’au moins un mois, les complications (essentiellement le risque d’une poussée pressionnelle) sont devenues très rares.
-
Un abaissement de la pression intra-oculaire (PIO) peut encore être obtenu lorsque cette dernière est inférieure à 20 mmHg.
-
Le retraitement à l’argon est peu efficace et potentiellement dangereux.
La première trabéculoplastie à l’argon (TLA), telle que nous la connaissons aujourd’hui, fut réalisée le 11 février 1976. Elle inaugura le travail de Wise et Witter aboutissant à la publication historique de 1979 [48]. Quarante et un globes phakes furent traités, en plaçant sur la totalité de la circonférence trabéculaire une centaine de petits impacts, courts mais puissants : à trois mois, 38 globes furent contrôlés avec une PIO inférieure à 21 mmHg, et ce succès persistait à un an chez 21 des 23 patients traités, avec souvent une réduction du traitement médicamenteux. Depuis ce travail princeps, des centaines de publications ont confirmé les bons résultats obtenus par Wise.
Mode d’action
Le trabéculum étant un anneau formé d’une compaction de lamelles présentant elles-mêmes une multitude d’espaces, Wise a imaginé augmenter la facilité d’écoulement en provoquant une contraction tissulaire qui rétrécirait l’anneau trabéculaire, et élargirait ainsi les pores adjacents. Ce raisonnement architectonique est admis : l’observation au microscope électronique des structures directement traitées a effectivement confirmé des modifications anatomiques de la trame trabéculaire avec une rétraction du collagène… mais aussi des nécroses cellulaires et des dépôts de matériel fibreux [22]. S’appuyant sur cette hypothèse, Haut et Moulin ont préféré, en France, parler de trabéculorétraction plutôt que de trabéculoplastie [15, 16].
Cependant, d’autres mécanismes participent à l’amélioration de l’humeur aqueuse. L’utilisation de techniques autoradiographiques, après incorporation de thymidine tritiée, a montré que la trabéculoplastie provoque une augmentation de la réplication de l’ADN au niveau des cellules trabéculaires adjacentes aux brûlures [4]. Les auteurs de ces travaux suggèrent qu’en augmentant le niveau de base des divisions cellulaires du trabéculum, la trabéculoplastie pourrait réactiver l’activité des cellules trabéculaires, ou plus précisément « sélectionner » les plus vigoureuses. Ces cellules sont précisément celles qui remplissent le rôle de phagocytose, de production de la matrice extracellulaire (dont les glycosaminoglycanes sont un constituant essentiel) et qui interviennent dans l’équilibre de la résistance à l’écoulement. Des études antérieures [42] avaient d’ailleurs démontré une modification de la structure des glycosaminoglycanes après trabéculoplastie.
Réalisation technique
Rappelons (voir fig. 16-2) que les lasers à l’argon utilisés en ophtalmologie ont un effet thermique, qu’ils fonctionnent en mode continu, qu’ils sont presque tous refroidis maintenant par air, et qu’ils travaillent dans des longueurs d’onde comprises entre 480 et 520 nm (bichromatique bleu-vert ou monochromatique vert).
Avant de réaliser la trabéculoplastie, l’opérateur aura naturellement pris soin d’examiner minutieusement l’angle iridocornéen pour vérifier son ouverture et en repérer les différentes structures. L’examen de la totalité de la circonférence est indispensable pour éviter en particulier de confondre les éventuels dépôts pigmentés du bas-fond camérulaire (en avant de l’anneau de Schwalbe) avec le trabéculum lui-même.
Préparation
Il ne paraît pas techniquement utile de resserrer médicalement la pupille pour la séance de photocoagulation. Au contraire, le myosis médicamenteux peut gêner dans certains cas la réalisation de la trabéculoplastie (la pilocarpine diminuant en effet la profondeur de la chambre antérieure). Cela dit, dans les formes de GPAO très évoluées, l’abaissement tonométrique obtenu temporairement avec le myotique peut constituer une protection supplémentaire au risque de poussée pressionnelle postopératoire.
Précisément, s’il y en a un, le traitement antiglaucomateux ne doit pas être suspendu pour la séance de laser. En particulier, les instillations d’un éventuel collyre aux prostaglandines peuvent sans risque ne pas être interrompues, malgré le caractère théoriquement pro-inflammatoire de cette famille thérapeutique.
Il est conseillé d’instiller une trentaine de minutes avant la séance de l’apraclonidine à 1 % afin de diminuer, là encore, le risque de poussée pressionnelle dans les heures suivant le traitement.
Installation
Une simple analgésie de contact (oxybuprocaïne) est suffisante avant de poser le verre nécessaire à la procédure.
De nombreux verres de contact permettent de réaliser une trabéculoplastie : certains non spécifiques (verre à trois miroirs de Goldmann) ; d’autres spécialement conçus afin d’élargir la vision des structures de l’angle, d’être ainsi très précis dans le placement des impacts, et d’obtenir des spots plus petits et plus chauds (verre CGAL de Roussel et Fankhauser, verre à trois miroirs de Ritch, etc.).
Technique opératoire
Localisation des impacts
Dès l’avènement de la trabéculoplastie, plusieurs localisations dans l’angle ont été proposées pour l’application des impacts de laser. Wise avait appliqué les impacts directement sur le trabéculum pigmenté. Toutefois, l’importance de la réaction inflammatoire et de la poussée pressionnelle secondaire risque d’être particulièrement marquée dans cette localisation qui, par ailleurs, photocoagule sur toute sa largeur la bande trabéculaire. En France, entre autres pour éviter cette altération tissulaire potentiellement délétère, Béchetoille et al. [2] ont décrit une technique très proche de la trabéculoplastie qu’il nomme goniorétraction, où les impacts sont dirigés sur la bande ciliaire, avec l’espoir que la cicatrice attire l’éperon scléral vers l’arrière et étire ainsi le trabéculum. La procédure, souvent douloureuse, nécessite naturellement que l’angle iridocornéen soit largement ouvert, et le risque d’hyphéma n’est pas négligeable.
Depuis, un consensus a été obtenu pour conseiller l’application des impacts à la jonction du trabéculum pigmenté et du trabéculum non pigmenté (fig. 16-4), la pigmentation assurant l’absorption de l’énergie du laser tout en ne lésant pas la totalité de la largeur trabéculaire fonctionnelle.
Paramètres
Ayant fait la preuve de leur efficacité, il est remarquable de constater que les paramètres proposés initialement par Wise n’ont pas été modifiés dans les travaux ultérieurs.
La taille du spot doit être la plus petite possible – elle est de 50 µm pour la grande majorité des appareils.
La durée de l’application est de 0,1 seconde. Elle peut passer à 0,2 seconde lorsque le trabéculum est peu pigmenté. Béchetoille préconise également, pour la goniorétraction, des durées de 0,2 seconde.
La puissance à utiliser est le paramètre le plus variable. Elle dépend directement de la réaction tissulaire, et peut varier d’un appareil à l’autre selon la qualité du calibrage. L’opérateur doit commencer avec une puissance assez faible, 0,5 W en règle générale. Cette puissance doit être progressivement augmentée jusqu’à obtenir une réaction tissulaire (fig. 16-5), et ne pas aller au-delà. Cette réaction n’est pas univoque et varie essentiellement selon la pigmentation trabéculaire : blanchiment, petite dispersion pigmentaire, bulle d’évaporation ou, plus rarement, discret mouvement tissulaire indiquant une rétraction localisée. Les variations d’intensité de cette pigmentation (plus importante dans la moitié inférieure de l’angle) peuvent obliger l’opérateur à moduler, d’un secteur à l’autre, la valeur de la puissance efficace biomicroscopiquement. Il est exceptionnel qu’elle doive être supérieure à 1,2 W.
Nombre d’impacts
De très nombreux travaux ont été consacrés à ce sujet, dont une synthèse a été faite et publiée par un comité d’experts de l’American Academy of Ophthalmology en 1996 [1]. Le placement de 50 impacts sur 180° de trabéculum est unanimement retenu par séance, soit approximativement huit impacts par heure de quadrant, soit encore un espacement de trois à quatre largeurs de zone photocoagulée entre chaque impact. Une densité plus forte, ou une plus grande portion de trabéculum traitée avec plus d’impacts, risque d’entraîner une réaction inflammatoire marquée et surtout une poussée pressionnelle postopératoire importante et potentiellement délétère [46]. Il est d’ailleurs régulièrement rappelé qu’une des meilleures façons d’obtenir une hypertension oculaire chez l’animal de laboratoire est de placer des impacts confluents de TLA sur la totalité de la circonférence trabéculaire [7].
Stratégie
D’emblée, une seule séance de 50 spots sur 180° permet souvent d’obtenir un abaissement tonométrique marqué [9]. Une seconde séance, traitant l’autre moitié circonférentielle avec encore une cinquantaine d’impacts, peut être proposée si le résultat de la première séance n’apparaît pas suffisant. Elle entraîne parfois une baisse supplémentaire de la PIO [10]… bien que l’efficacité maximale de la trabéculoplastie puisse être acquise dès la première séance [45]. En réalité, l’incertitude de cette efficacité maximale obtenue avec une seule séance, alliée à son relâchement plus rapide dans le temps à partir de la région non traitée, incite depuis longtemps la majorité des opérateurs à réaliser systématiquement le traitement de la totalité de la circonférence en deux séances [28].
La seconde séance est réalisée quatre à six semaines après la première (délai maximal d’apparition de l’efficacité du laser), mais à la condition qu’un abaissement pressionnel ait été noté après le premier traitement. Dans le cas contraire, il est inutile de compléter la trabéculoplastie, car la seconde séance sera forcément vouée à l’échec.
En pratique, il est important de prévenir le patient que la seconde séance n’aura certainement pas la même efficacité que la première. Si elle peut donc encore entraîner un abaissement pressionnel supplémentaire, sa justification sera essentiellement de « consolider » le bon résultat obtenu. Il est conseillé, parce que des erreurs ou des oublis sont toujours possibles sur les observations, parce qu’aussi la zone photocoagulée ne conserve rapidement aucune cicatrice biomicroscopiquement visible, de traiter avec la même chronologie tous les yeux (par exemple : 180° nasal à la première séance, et 180° temporal à la seconde).
Lorsque l’exposition trabéculaire est limitée par les reliefs de la base de l’iris, sur certaines zones ou sur la totalité de l’angle, il peut être utile de réaliser une iridorétraction périphérique (ou gonioplastie) avant la trabéculoplastie [30]. Ces impacts d’argon seront placés sur le bombé irien périphérique à l’aide d’un verre de contact : verre à iridotomie pour un tir direct ; verre de Goldmann ou à trabéculoplastie pour un tir indirect, qui permet d’évaluer immédiatement l’efficacité anatomique de la photocoagulation irienne. Les paramètres à utiliser ne sont pas les mêmes que ceux de la trabéculoplastie : 200 ou 250 µm, 0,2 seconde, et une puissance suffisante pour entraîner la rétraction irienne (en commençant à 300 mW).
Soins postopératoires
L’instillation d’une goutte d’apraclonidine à 1 % est conseillée à la fin de la procédure pour diminuer le risque de poussée pressionnelle. Précisément, le traitement du glaucome ne doit pas être interrompu dès la trabéculoplastie terminée. Il doit même être renforcé (collyre hypotonisant, acétazolamide per os) lorsque l’on craint qu’une poussée pressionnelle postopératoire soit préjudiciable à l’œil traité dans les glaucomes évolués. Un corticoïde local (fluorométholone, rimexolone, mais surtout dexaméthasone) est prescrit à titre systématique, durant quatre à sept jours, à la posologie de trois ou quatre instillations quotidiennes. L’efficacité des anti-inflammatoires non stéroïdiens a pu être contestée dans les suites immédiates du traitement [41]. Étienne conseillait de poser une vessie de glace sur l’œil traité les heures suivant la photocoagulation.
Lorsque c’est logistiquement possible, particulièrement dans les glaucomes sévères, la PIO du patient doit être surveillée les premières heures suivant la trabéculoplastie. Si les complications sont inexistantes ou insignifiantes, le patient est réexaminé à la 4e semaine. Même lorsque le résultat pressionnel paraît très vite satisfaisant, il faut savoir attendre ce délai avant de diminuer éventuellement le traitement médical antiglaucomateux. En effet, la réaction inflammatoire est parfois responsable, à elle seule, d’un abaissement de la PIO dont l’importance risque d’être transitoire.
Complications
De nombreuses complications ont été rapportées avec la TLA. Cela dit, les plus sévères d’entre elles ont été observées dans les premières années de la pratique de cette procédure et, avec le recul et l’expérience, l’ajustement des protocoles les ont rendues maintenant exceptionnelles.
Poussée pressionnelle
Provoquée par la libération de cellules inflammatoires et de débris dans la chambre antérieure et au niveau du trabéculum, c’est la complication la plus habituelle de la trabéculoplastie. Elle n’est qu’exceptionnellement délétère, mais il convient de la redouter dans certaines circonstances. Même temporaire, lorsque le glaucome est très évolué, elle risque d’aggraver les altérations périmétriques préexistantes et exceptionnellement de faire perdre le point de fixation [38] ; prolongée, elle peut imposer rapidement la réalisation d’une intervention filtrante chez des patients qui auraient été, de toute façon, des candidats à la chirurgie sans trabéculoplastie [46]. La survenue de cette poussée pressionnelle postopératoire ne semble toutefois pas hypothéquer le succès de la trabéculoplastie.
Plus de la moitié des globes ayant subi une trabéculoplastie vont présenter une augmentation postopératoire de la PIO, ne dépassant pas habituellement 5 mmHg et ne persistant pas au-delà de la 24e heure. Des poussées pressionnelles supérieures à 15 mmHg ont toutefois été signalées [38]. Et, dans quelques rares globes, cette élévation pressionnelle peut ne survenir que plusieurs jours après le traitement, ou peut parfois se prolonger au-delà du 15e jour.
Elle est d’autant plus fréquente et marquée que la trabéculoplastie a été quantitativement importante, justifiant la procédure de deux séances de 50 impacts plutôt qu’une seule de 100 impacts [46]. Le degré de pigmentation trabéculaire est, pour le groupe du Glaucoma Laser Trial [37], le premier facteur de risque de cette complication, bien que cet avis ne soit pas unanime [24]. Sans lien avec l’assertion précédente, l’incidence de cette complication est également plus forte lorsque les impacts sont placés plus postérieurement au niveau du trabéculum pigmenté [29]. Ce risque persiste aussi bien après la seconde séance [37], mais l’abaissement obtenu après la première séance entraîne mathématiquement une remontée temporaire de la PIO à un niveau moins élevé. L’âge, la réfraction et le niveau pressionnel au moment de la procédure n’ont pas été signalés comme étant des facteurs prédictifs de ce risque. Lorsqu’un œil a été traité, il est habituel que l’autre réagisse tonométriquement de la même façon à la trabéculoplastie.
Cette complication potentielle justifie, en particulier dans les glaucomes évolués, l’instillation pré- et postopératoire d’apraclonidine à 1 % [8]. La prescription de pilocarpine à 4 % (qui n’est pas disponible en France) et celle de brimonidine ont également été proposées à titre prophylactique, avec des résultats favorables, alors que l’instillation d’anti-inflammatoires, stéroïdiens ou non, n’a aucune influence sur ce risque.
Goniosynéchies
Leur incidence, selon les séries, varie de 15 à 50 % des yeux traités, et décroît incontestablement avec l’expérience de l’opérateur. Elles sont d’autant plus fréquentes que les impacts ont été placés postérieurement [39]. Ces goniosynéchies ne se forment qu’au niveau du point d’impact du laser et apparaissent presque immédiatement. Elles ont volontiers l’aspect de fines élevures ou de spicules de la base de l’iris, rejoignant la bande ciliaire ou l’éperon scléral. Elles prennent rarement l’apparence de véritables synéchies atteignant le niveau du trabéculum. Elles n’ont aucune incidence sur le gain pressionnel.
Inflammation du segment antérieur
Il est habituel, immédiatement après la trabéculoplastie, de constater de légers phénomènes inflammatoires au niveau du segment antérieur : irritation oculaire modérée, injection périlimbique et discret Tyndall de l’humeur aqueuse. Les patients se plaignent volontiers, durant quelques heures, de douleurs à la pression du globe. Une véritable iridocyclite est exceptionnelle. Quoi qu’il en soit, ces manifestations ne sont pas préjudiciables au pronostic ultérieur et sont très nettement atténuées par la prescription d un collyre corticoïde après la photocoagulation. L’éventuelle poussée pressionnelle postopératoire est indépendante de cette inflammation, celle-ci pouvant même participer temporairement à un abaissement de la PIO.
Autres complications
La survenue d’une hémorragie immédiate au point d’impact est rare et n’a aucune incidence fâcheuse, sinon celle de gêner parfois la poursuite immédiate du traitement. Cet hyphéma reste toujours modeste et peut être arrêté en appuyant quelques secondes assez fortement sur le verre de contact.
Les brûlures cornéennes sont exceptionnelles et imputables à de grossières fautes techniques.
Résultats
Résultats globaux
Plusieurs centaines de publications ont directement concerné les résultats de la TLA, dont le recul est maintenant de plus de trente ans. Les premiers travaux ont fait dire à Wilensky [47] que l’avènement de la trabéculoplastie représentait une « révolution tranquille » dans le traitement du glaucome à angle ouvert. Il convient de distinguer les résultats à court terme, habituellement excellents, de ceux à moyen et long termes qui ont pu décevoir… et faire considérer à certains la TLA comme un traitement provisoire ne pouvant finalement pas concurrencer la chirurgie.
Les séries concernées sont très inhomogènes, considérant différemment en particulier le moment de la trabéculoplastie (d’un traitement en première intention à la TLA comme alternative à la chirurgie), la définition du succès (importance de la baisse de la PIO, diminution du traitement médical, stabilisation du glaucome, échappement à la chirurgie) ou le type de GPAO. Le rapport de la SFO de 1989, confié à Philippe Demailly dix ans après la publication de Wise, présente une mise au point très complète de la TLA et de ses résultats [14]. Nous nous référerons également à deux importantes publications de synthèse, plus de 25 ans après l’avènement de la TLA : une revue de la collaboration Cochrane en 2007 [23] et le rapport de l’American Academy of Ophthalmology en 2011 [25]. À court terme, l’abaissement de la PIO obtenue par une TLA peut atteindre 30 %, avec des baisses de 6 à 13 mmHg. Les taux de succès vont de 65 à 97 % à six mois. L’indication chirurgicale est repoussée quatre fois sur cinq. L’importance du traitement médical est diminuée deux fois sur trois, et celui-ci peut être totalement supprimé dans 10 % des cas [9, 36, 38].
Ces bons résultats diminuent les années suivantes : la plupart des investigateurs indiquent une perte annuelle de succès de 6 à 10 % parmi les yeux ayant réagi favorablement la première année, pour arriver à un taux global de succès autour de 50 % à la 5e année [18, 32, 49]. Spaeth et Baez [33] indiquent que la TLA permet de repousser l’indication chirurgicale de cinq ans chez 35 % des patients qui présentaient un GPAO évolutif non contrôlé médicalement. Les séries à dix ans sont rares et souvent peu significatives en raison du petit nombre de sujets encore exploitables (perdus de vue ou décédés) : Wise [49] indique encore un taux de succès de 56 %, mais Moulin et Haut [17] tombent à 11 % avec une série encore importante de 127 yeux traités.
Facteurs influençant l’efficacité de la TLA
PIO de départ
La chute pressionnelle a d’autant plus de chances d’être importante que la PIO de départ est haute, pouvant atteindre 40 à 50 % lorsque la PIO dépasse 30 mmHg [38]. Si la PIO est inférieure à 20 mmHg avant la TLA, une baisse de 3 à 4 mmHg peut seulement s’observer, mais elle est parfois suffisante pour stabiliser le glaucome.
Âge
Les patients de moins de 40 ans réagissent moins bien à la TLA que leurs aînés. Si les taux de succès immédiat peuvent avoisiner 90 % chez les sujets de plus de 40 ans, ils tombent autour de 40 % pour les patients plus jeunes [38], ce qui doit inciter à leur proposer une solution chirurgicale plutôt qu’une TLA lorsque le traitement médical est dépassé. En revanche, dans le glaucome pigmentaire, de très beaux succès tonométriques peuvent être obtenus chez les sujets jeunes [20].
Ethnie
Une étude indique un moins bon résultat tonométrique chez les sujets mélanodermes (succès de 32 %) que chez les Caucasiens (65 %) à cinq ans [26]. Les autres travaux concernant l’influence de la race ne trouvent aucune différence significative entre les deux, ainsi que comparativement aux Japonais et aux Indiens.
Aphakie et pseudo-phakie
À la différence des yeux pseudo-phakes, les yeux aphakes répondent globalement moins favorablement à la TLA que les yeux phakes [38], mais l’aphakie ne doit pas forcément représenter une contre-indication à ce traitement car de bons résultats sont régulièrement signalés.
Myopie forte
La plupart des études publiées indiquent un grand nombre d’échecs la première année chez les patients myopes forts [5, 33]. Passé ce délai, les échecs seraient moins nombreux, voire très rares, puisque 70 % des yeux ayant subi une TLA bénéficieraient toujours d’un allégement thérapeutique [14].
Syndrome exfoliatif
Les globes présentant un syndrome exfoliatif ont habituellement une réponse favorable à la TLA très marquée, souvent plus que pour le GPAO, tout au moins à court terme [11, 40]. Cependant, ces succès s’épuisent globalement très vite à partir de la 1re année [21, 33]. La surveillance du glaucomateux ne doit donc pas se relâcher, mais la TLA peut représenter une alternative thérapeutique précieuse dans l’attente d’une phako-extraction chez ces patients souvent âgés, à qui pourrait être proposée quelques mois plus tard une chirurgie combinée.
Dispersion pigmentaire
Les meilleurs résultats de la TLA dans le glaucome pigmentaire concernent paradoxalement les sujets jeunes : à six ans, les sujets de moins de 40 ans ont un taux de succès de 72 %, contre 18 % chez les sujets de plus de 40 ans [20] ! Il est suggéré que la forte absorption de l’énergie par les pigments aggrave encore les altérations trabéculaires qui ont eu le temps de se constituer chez les sujets âgés, ou que les pigments s’y sont déplacés plus profondément (dans le trabéculum cornéoscléral et le mur interne du canal de Schlemm).
Glaucome à pression normale
Bien qu’une réduction substantielle de la PIO ne puisse pas être obtenue avec la TLA chez les sujets présentant un glaucome à pression normale (GPN), plusieurs travaux indiquent le rôle souvent bénéfique de cette procédure dans le traitement de ce type de glaucome [27, 31]. Cette opinion n’est toutefois pas unanime [44]. Par ailleurs, ces travaux déjà anciens mésestimaient le biais de la mesure de la PIO apporté par l’épaisseur de la cornée centrale, et il est vraisemblable qu’un certain nombre de ces GPN présentaient en réalité une PIO réelle plus élevée.
Retraitement au laser à l’argon
Plusieurs travaux ont évalué l’intérêt d’un retraitement pas le laser à l’argon lorsqu’une première TLA, initialement efficace, se relâchait [3, 12, 19]. Dans l’étude de Feldman et al. [6] avec un recul plus important, un succès est obtenu dans seulement 11 % des cas à 24 mois et 5 % à 48 mois, et une seconde trabéculoplastie faite moins d’un an après la première est chaque fois vouée à l’échec. Les résultats sont globalement plus mauvais et moins durables que le premier traitement, avec de surcroît des risques importants de poussées pressionnelles postopératoires marquées. Dans certaines circonstances toutefois (180° traités seulement lors de la première TLA, efficacité supérieure à deux ans, patients très âgés, syndrome pseudo-exfoliatif), un retraitement peut être envisagé avec prudence. En réalité, le développement de la trabéculoplastie sélective a pratiquement rendu caduque cette proposition thérapeutique (voir plus loin « Trabéculoplastie sélective au laser »).
Indications cliniques
Dans le schéma de la progression thérapeutique du GPAO, la TLA se situe légitimement entre le traitement médical tolérable et la chirurgie. Les premiers traitements au laser concernaient tous des patients candidats à la chirurgie, lorsque l’instillation des collyres ne pouvait être complétée et que le niveau tonométrique restait trop élevé pour espérer stabiliser le glaucome.
Assez rapidement toutefois, il a été suggéré que la TLA pouvait être proposée en première intention dans le traitement du GPAO, d’une part en raison de son efficacité et de sa relative innocuité, d’autre part dans le but de supprimer les contraintes des instillations, les effets latéraux et le risque d’inobservance du traitement médical. Le Glaucoma Laser Trial a randomisé en deux groupes des glaucomateux nouvellement diagnostiqués : l’un traité par un traitement médical, l’autre par une TLA [36]. Après un délai de deux ans, la baisse moyenne de la PIO était de 7 mmHg dans le premier groupe et de 9 mmHg dans le second groupe, dans lequel 44 % des patients restaient contrôlés sans traitement médical. Après sept ans, les résultats étaient encore en faveur du groupe traité initialement par une TLA, avec une réduction de la PIO plus importante de 1,2 mmHg, statistiquement significative [35]. Cela dit, à l’initialisation de cette étude, le traitement médical consistait seulement en la prescription de timolol, et les prostaglandines, comme les inhibiteurs locaux de l’anhydrase carbonique et les α2-mimétiques, n’étaient pas encore disponibles. Bien auparavant d’ailleurs, cette démarche thérapeutique avait été contestée [43], la TLA ne retardant que de quelques années l’instauration du traitement médical. Et lorsque les membres de l’American Glaucoma Society furent interrogés en 1993, seulement 2,3 % d’entre eux indiquaient proposer la TLA comme traitement initial du GPAO [28].
Quoi qu’il en soit, la trabéculoplastie (à l’argon ou autre) peut naturellement être proposée en complément du traitement médical, dont l’arsenal s’est donc fortement enrichi dès le milieu des années 1990. Elle le sera d’autant plus que le traitement médical est mal toléré, multiple, et/ou que l’observance est mauvaise ou douteuse, dans le but de le diminuer ou même de le supprimer.
Elle peut l’être aussi en association avec la réalisation d’une chirurgie filtrante. Lorsqu’une TLA est réalisée après une trabéculectomie, la préservation du champ visuel est plus efficace que le traitement médical après cinq ans [13] ; dans l’Advanced Glaucoma Intervention Study (AGIS), les patients afro-américains présentant un glaucome évolué répondaient mieux à la TLA suivie d’une trabéculectomie qu’à une trabéculectomie suivie d’une TLA, à l’inverse des Caucasiens, suggérant que la TLA pouvait être une meilleure approche thérapeutique initiale dans certaines populations spécifiques [34].
Retenir
Depuis le début des années 1980, la TLA a fait la preuve de son efficacité tonométrique et de sa relative innocuité lors d’une première réalisation. Elle peut être proposée d’emblée pour traiter le GPAO, mais plus souvent en complément du traitement médical, voire de la chirurgie. Maintenant largement concurrencée par la trabéculoplastie sélective, elle ne nécessite pas d’appareillage spécifique et reste une alternative thérapeutique essentielle pour ceux qui ne disposent que d’un laser à l’argon. En revanche, la répétition de ce traitement est potentiellement dangereuse et le plus souvent vouée à un échec rapide.
Fig. 16-4 Les différentes propositions de localisation des impacts pour la trabéculoplastie.
Fig. 16-5 Différentes réponses biomicroscopiques au traitement du trabéculum par le laser à l’argon.
[1] American Academy of Ophthalmology Committee on Ophthalmic Procedure Assessments. Laser trabeculoplasty for primary open-angle glaucoma. Ophthalmology. 1996 ; 103 : 1706-12.
[2] Béchetoille A, Jallet G, Leclair E, Ebran JM. La goniorétraction au laser à argon. J Fr Ophtalmol. 1985 ; 8 : 19-27.
[3] Brown SV, Thomas JV, Simmons RJ. Laser trabeculoplasty re-treatment. Am J Ophthalmol. 1985 ; 99 : 8-10.
[4] Bylsma SS, Samples JR, Acott TS, Van Buskirk EM. Trabecular cell division after argon laser trabeculoplasty. Arch Ophthalmol. 1988 ; 106 : 544-7.
[5] Coakes R. Laser trabeculoplasty. Br J Ophthalmol. 1992 ; 76 : 624-6.
[6] Feldman RM, Katz LJ, Spaeth GL, et al. Long-term efficacy of repeat argon laser trabeculoplasty. Ophthalmology. 1991 ; 98 : 1061-5.
[7] Gaasterland D, Kupfer C. Experimental glaucoma in the rhesus monkey. Invest Ophthalmol. 1974 ; 13 : 455-7.
[8] Holmwood PC, Chase RD, Krupin T, et al. Apraclonidine and argon laser trabeculoplasty. Am J Ophthalmol. 1992 ; 114 : 19-22.
[9] Horns DJ, Bellows AR, Hutchinson BT, Allen RC. Argon laser trabeculoplasty for open angle glaucoma. A retrospective study of 380 eyes. Trans Ophthalmol Soc UK. 1983 ; 103 : 288-96.
[10] Klein HZ, Shields MB, Ernest JT. Two-stage argon laser trabeculoplasty in open-angle glaucoma. Am J Ophthalmol. 1985 ; 99 : 392-5.
[11] Logan P, Burke E, Joyce PD, Eustace P. Laser trabeculoplasty in the pseudo-exfoliation syndrome. Trans Ophthalmol Soc UK. 1983 ; 103 : 586-7.
[12] Messner D, Siegel LI, Kass MA, et al. Repeat argon laser trabeculoplasty. Am J Ophthalmol. 1987 ; 103 : 113-5.
[13] Migdal C, Gregory W, Hitchings R. Long-term functional outcome after early surgery compared with laser and medicine in open-angle glaucoma. Ophthalmology. 1994 ; 101 : 1651-6 ; discussion : 1657.
[14] Moulin F, Demailly P, Valtot F. Le laser à l’argon. In : Demailly P (Ed.). Traitement actuel du glaucome primitif à angle ouvert. Rapport SFO 1989. Paris, Masson, 1989 : 231-78.
[15] Moulin F, Haut J, Abboud E. Trabeculoperforation ? Trabeculoretraction ? Trabeculoplasty ? Review of the various designations used for laser treatment in primary open-angle glaucoma. Ophthalmologica. 1985 ; 191 : 75-83
[16] Moulin F, Haut J. Résultat du traitement au laser à l’argon de 100 yeux atteints de glaucome à angle ouvert. J Fr Ophtalmol. 1983 ; 6 : 661-70.
[17] Moulin F, Haut J. Trabéculoplastie au laser argon. Résultats sur 10 ans. J Fr Ophtalmol. 1994 ; 17 : 93-8.
[18] Moulin F, Le Mer Y, Haut J. Five-year results of the first 159 consecutive phakic chronic open-angle glaucomas treated by argon laser trabeculoplasty. Ophthalmologica. 1991 ; 202 : 3-9.
[19] Richter CU, Shingleton BJ, Bellows AR, et al. Retreatment with argon laser trabeculoplasty. Ophthalmology. 1987 ; 94 : 1085-9.
[20] Ritch R, Liebmann J, Robin A, et al. Argon laser trabeculoplasty in pigmentary glaucoma. Ophthalmology. 1993 ; 100 : 909-13.
[21] Ritch R, Podos S. Laser trabeculoplasty in the exfoliation syndrome. Bull NY Acad Med. 1983 ; 59 : 339-44.
[22] Rodrigues MM, Spaeth GL, Donohoo P. Electron microscopy of argon laser therapy in phakic open-angle glaucoma. Ophthalmology. 1982 ; 89 : 198-210.
[23] Rolim de Moura CR, Paranhos A, Wormald R. Laser trabeculoplasty for open angle glaucoma. Cochrane Database Syst Rev (serial online). 2007 ; 4 : CD003919.
[24] Rouhiainen HJ, Teräsvirta ME, Tuovinen EJ. Laser power and postoperative intraocular pressure increase in argon laser trabeculoplasty. Arch Ophthalmol. 1987 ; 105 : 1352-4.
[25] Samples JR, Singh K, Lin SC, et al. Laser trabeculoplasty for open-angle glaucoma : a report by the american academy of ophthalmology. Ophthalmology. 2011 ; 118 : 2296-302.
[26] Schwartz AL, Love DC, Schwartz MA. Long-term follow-up of argon laser trabeculoplasty for uncontrolled open-angle glaucoma. Arch Ophthalmol. 1985 ; 103 : 1482-4.
[27] Schwartz AL, Perman KI, Whitten M. Argon laser trabeculoplasty in progressive low-tension glaucoma. Ann Ophthalmol. 1984 ; 16 : 560-2 et 566.
[28] Schwartz AL. Argon laser trabeculoplasty in glaucoma : what’s happening (survey results of American Glaucoma Society Members). J Glaucoma. 1993 ; 2 : 329-36.
[29] Schwartz LW, Spaeth GL, Traverso C, Greenidge KC. Variation of techniques on the results of argon laser trabeculoplasty. Ophthalmology. 1983 ; 90 : 781-4.
[30] Sellem E. Gonioplastie : indications et technique. Bull Soc Ophtalmol Fr. 1987 ; 87 : 85-90.
[31] Sharpe ED, Simmons RJ. Argon laser trabeculoplasty as a means of decreasing intraocular pressure from “normal” levels in glaucomatous eyes. Am J Ophthalmol. 1985 ; 99 : 704-7.
[32] Shingleton BJ, Richter CU, Bellows AR, et al. Long-term efficacy of argon laser trabeculoplasty. Ophthalmology. 1987 ; 94 : 1513-8.
[33] Spaeth GL, Baez KA. Argon laser trabeculoplasty controls one third of cases of progressive, uncontrolled, open angle glaucoma for 5 years. Arch Ophthalmol. 1992 ; 110 : 491-4.
[34] The Advanced Glaucoma Intervention Study (AGIS). 4. Comparison of treatment outcomes within race. Seven-year results. Ophthalmology. 1998 ; 105 : 1146-64.
[35] The Glaucoma Laser Trial (GLT) and Glaucoma Laser Trial Follow-up Study. 7. Results. Glaucoma Laser Trial Research Group. Am J Ophthalmol. 1995 ; 120 : 718-31.
[36] The Glaucoma Laser Trial (GLT). 2. Results of argon laser trabeculoplasty versus topical medicines. The Glaucoma Laser Trial Research Group. Ophthalmology. 1990 ; 97 : 1403-13.
[37] The Glaucoma Laser Trial. I. Acute effects of argon laser trabeculoplasty on intraocular pressure. Glaucoma Laser Trial Research Group. Arch Ophthalmol. 1989 ; 107 : 1135-42.
[38] Thomas JV, Simmons RJ, Belcher CD. Argon laser trabeculoplasty in the presurgical glaucoma patient. Ophthalmology. 1982 ; 89 : 187-97.
[39] Traverso CE, Greenidge KC, Spaeth GL. Formation of peripheral anterior synechiae following argon laser trabeculoplasty. A prospective study to determine relationship to position of laser burns. Arch Ophthalmol. 1984 ; 102 : 861-3.
[40] Tuulonen A, Airaksinen PJ. Laser trabeculoplasty I in simple and capsular glaucoma. Acta Ophthalmol (Copenh). 1983 ; 61 : 1009-15.
[41] Tuulonen A. The effect of topical indomethacin on acute pressure elevation of laser trabeculoplasty in capsular glaucoma. Acta Ophthalmol (Copenh). 1985 ; 63 : 245-9.
[42] Van Buskirk EM, Pond V, Rosenquist RC, Acott TS. Argon laser trabeculoplasty : studies of mechanism of action. Ophthalmology. 1984 ; 91 : 1005-10.
[43] Van Buskirk EM. The laser step in early glaucoma therapy. Am J Ophthalmol. 1991 15 ; 112 : 87-90.
[44] Watson PG, Allen ED, Graham CM, et al. Argon laser trabeculoplasty or trabeculectomy a prospective randomised block study. Trans Ophthalmol Soc UK. 1985 ; 104 : 55-61.
[45] Weinreb RN, Ruderman J, Juster R, Wilensky JT. Influence of the number of laser burns administered on the early results of argon laser trabeculoplasty. Am J Ophthalmol. 1983 ; 95 : 287-92.
[46] Weinreb RN, Ruderman J, Juster R, Zweig K. Immediate intraocular pressure response to argon laser trabeculoplasty. Am J Ophthalmol. 1983 ; 95 : 279-86.
[47] Wilensky JT. Editorial. Laser therapy for glaucoma : the quiet revolution. Ann Ophthalmol. 1981 ; 13 : 659.
[48] Wise JB, Witter SL. Argon laser therapy for open-angle glaucoma. A pilot study. Arch Ophthalmol. 1979 ; 97 : 319-22.
[49] Wise JB. Ten year results of laser trabeculoplasty. Does the laser avoid glaucoma surgery or merely defer it ? Eye (Lond). 1987 ; 1 : 45-50.
TRABÉCULOPLASTIE SÉLECTIVE AU LASER
P. Denis
-
La trabéculoplastie sélective au laser (SLT) est un traitement physique de l’angle iridocornéen qui s’effectue avec des impulsions très courtes et des niveaux d’énergie bien inférieurs à ceux utilisés dans la classique trabéculoplastie au laser à l’argon.
-
Le laser SLT utilise un laser vert impulsionnel de 3 nanosecondes, dont la fréquence Nd-YAG est doublée (532 nm), et cible plus particulièrement les cellules trabéculaires pigmentées chargées de chromophore.
-
Par ses effets pressionnels et sa relative innocuité, la SLT constitue une alternative thérapeutique dans le glaucome primitif à angle ouvert (GPAO).
La prise en charge du glaucome débute le plus souvent par le traitement médical, la chirurgie étant généralement réservée aux cas les plus évolués ou résistant à ce traitement médical. La trabéculoplastie au laser a, depuis son avènement, souvent été présentée comme une alternative à la chirurgie, en permettant d’éviter celle-ci. Elle permet d’abaisser significativement la pression intra-oculaire (PIO) et de simplifier le traitement médical en diminuant le nombre de collyres à instiller, et retarde effectivement l’heure de la chirurgie filtrante.
La trabéculoplastie est utilisée depuis près de 40 ans pour abaisser la PIO dans les glaucomes. Wise et Witter, dans leur publication princeps, avaient recours au laser à l’argon (pics principaux à 488 nm et 514 nm), d’où le terme générique et consacré de trabéculoplastie au laser à l’argon (TLA). Par la suite, d’autres lasers, utilisant différentes sources dont le krypton (647 ou 568 nm), la diode (810 nm), ou le Nd-YAG doublé de fréquence (532 nm) ont été choisis. La réponse biologique du trabéculum à l’exposition à la lumière dépend de la densité de l’énergie du faisceau laser, et non de la longueur d’onde utilisée. Développée par Latina à Boston en 1995 et approuvée par la Food and Drug Administration dès 2002, la SLT minimise les effets tissulaires tout en conservant un effet bénéfique sur la PIO. Le laser SLT, expérimenté depuis près d’une quinzaine d’années, a fait l’objet de plus d’une centaine de publications scientifiques, visant à confirmer ses indications cliniques, son efficacité et sa place dans le traitement du GPAO. Ces études démontrent que la trabéculoplastie au laser SLT est aussi efficace que la TLA, et qu’elle peut être avantageusement comparée à une monothérapie.
Mécanisme d’action
Le mécanisme d’action du laser SLT est encore mal connu. En 1983, Anderson et Parrish [3] observent qu’en jonglant avec certains paramètres d’un faisceau laser, il est possible d’irradier sélectivement les cellules pigmentées d’un tissu, en épargnant les cellules avoisinantes. Plus tard, Latina et Park [15] démontrent que des impacts d’un faisceau Nd-YAG déclenché, très courts (< 1 ms) stimulent spécifiquement les cellules trabéculaires pigmentées sans affecter les cellules dépourvues de mélanine. À une fréquence de 532 nm, l’absorption de l’énergie par un chromophore se fait en un temps inférieur au temps de relaxation thermique (temps requis pour dissiper l’énergie thermique reçue). De ce fait, la mélanine n’a donc pas le temps de restituer l’énergie sous forme de chaleur aux tissus environnants et le laser SLT peut ainsi cibler spécifiquement la mélanine présente dans une cellule. Les microbulles observées lors de la réalisation de la procédure témoigneraient de la vaporisation de l’eau contenue dans les cellules désintégrées à 150 °C [4].
La réduction de la PIO est ainsi liée à la stimulation des cellules trabéculaires pigmentées par l’énergie délivrée par le laser. Comme pour la TLA, l’effet mécanique d’étirement des fibres trabéculaires pourrait induire une augmentation de l’écoulement de l’humeur aqueuse, induisant la réduction de la PIO. Il est aussi possible que le laser SLT agisse par stimulation du métabolisme des cellules trabéculaires, celles-ci sécrétant des facteurs de croissance et des métalloprotéinases dont le rôle est d’augmenter l’élimination trabéculaire de l’humeur aqueuse.
Les lésions trabéculaires histologiques induites par le laser SLT ou à l’argon sont différentes et confortent l’hypothèse d’une action biologique du laser SLT sur le trabéculum. Alors que la TLA entraîne une destruction tissulaire importante, avec une désorganisation des piliers trabéculaires et une formation de cratères aux points d’impact du faisceau laser, la SLT n’induit que de très discrètes modifications de la surface du trabéculum, sans nécrose de coagulation (fig. 16-6).
Contrairement à la TLA, le ciblage spécifique des cellules endothéliales trabéculaires pigmentées se fait pratiquement sans effet thermique. Le respect de l’architecture du trabéculum pourrait expliquer que la trabéculoplastie au laser SLT conserve une efficacité clinique reproductible lors des retraitements. Le niveau d’énergie délivré par le laser SLT est bien plus faible que celui du laser à l’argon, de l’ordre de 1 %, ce qui pourrait aussi expliquer les différences histologiques. L’hypothèse d’une action biologique du laser SLT sur le trabéculum est confortée par les travaux d’Alvarado et al. [2] sur la perméabilité des cellules bordant le canal de Schlemm. Lorsque ces cellules sont mises en contact avec des cellules trabéculaires préalablement irradiées par le laser SLT, la perméabilité des cellules du canal de Schlemm est augmentée de façon majeure. Cet effet biologique est sans doute médié par la libération de cytokines (en particulier, interleukine-1α et β) ou de radicaux libres relargués localement par les cellules trabéculaires. Le trabéculum resterait anatomiquement intact, et ce sont les cytokines libérées dans le milieu local qui augmenteraient secondairement la perméabilité du trabéculum et du canal de Schlemm à l’humeur aqueuse.
Technique
Le laser SLT utilise un faisceau YAG de fréquence doublée de 532 nm, proche de celui du laser à l’argon, mais qui est délivré sous forme pulsée et non continue (mode impulsionnel). L’onde électromagnétique du laser induit une onde de choc qui favorise l’ionisation des atomes, nécessaire à la destruction cellulaire. Avec le laser SLT, seule l’énergie délivrée peut varier car les autres paramètres (durée de 3 ns et diamètre du spot de 400 µm) sont fixes. La seconde différence avec le laser argon réside dans la taille du spot, bien supérieure à celle de l’argon (seulement de 50 µm de diamètre pour l’argon). Cette taille de spot est adaptée à la zone traitée car elle recouvre facilement la largeur des structures angulaires, de l’anneau de Schwalbe à la partie antérieure de la bande ciliaire. Une particularité du faisceau est qu’il est vu flou, mais la mise au point optique doit être faite sur les éléments de l’angle. Dans ces conditions, l’attention du médecin doit se focaliser sur la visualisation du trabéculum et non sur la projection du faisceau de visée sur l’angle (fig. 16-7). Ainsi, l’énergie générée par le laser SLT est distribuée aussi plus équitablement aux différentes couches des mailles trabéculaires. Les paramètres utilisés permettent de réduire considérablement l’énergie délivrée, qui est de l’ordre de 0,7 à 1,5 millijoules (mJ) pour la SLT, soit près de cent fois moins que pour le laser à l’argon (tableau 16-3).
Le nombre de spots ne fait pas l’objet de consensus et les protocoles de traitement sont influencés par l’expérience de la TLA [17] : 50 impacts non jointifs sur l’hémi-circonférence angulaire, 100 impacts sur la circonférence en une ou deux séances espacées d’un mois, en fonction de l’objectif clinique ou de la réponse tonométrique. Comme pour la TLA, le niveau d’énergie initialement utilisé doit être faible et progressivement augmenté pour se situer au niveau juste inférieur à celui nécessaire pour obtenir une bulle de vaporisation. La détermination du niveau d’énergie peut ainsi varier d’une portion trabéculaire à l’autre, en fonction de sa pigmentation. Le patient doit être installé de façon confortable devant la lampe à fente. Le verre de gonioscopie doit être maintenu bien perpendiculaire à l’axe de l’œil. Si on veut « dérouler » l’angle si l’iris est bombé, il ne faut pas basculer le verre mais demander au patient d’orienter son regard en direction du miroir. Le choix du verre de gonioscopie est important car le grossissement optique conditionne la taille du spot ainsi que l’énergie délivrée au trabéculum. Plus le grossissement du spot est important, plus la taille du spot est petite. Avec le verre original de Latina, la taille du spot est de 400 μm, mais passe à 376 μm si on utilise un classique verre à trois miroirs de Goldmann et même à 268 μm avec le verre CGA d’Haag-Streit qui augmente la taille de l’image d’un facteur 1,5. De plus, un spot de petite taille réduit la surface traitée, ce qui peut rendre la focalisation sur le trabéculum plus difficile. La SLT est réalisée en une à deux séances espacées d’un mois, en appliquant 50 spots presque confluents sur chaque hémi-champ, sur 180° et 360°. Il est recommandé de débuter à 0,8 mJ et d’augmenter la puissance par paliers de 0,1 mJ. La puissance doit être diminuée de moitié au départ lorsque le trabéculum est très pigmenté. Il est judicieux de débuter le laser par l’hémi-circonférence inférieure car l’angle est physiologiquement plus large, ce qui améliore la visibilité des structures. À la surface du trabéculum, les impacts de laser SLT provoquent rarement une dispersion pigmentaire et exceptionnellement un blanchiment trabéculaire (signe de surdosage). En revanche, on observe très fréquemment des bulles de vaporisation à la surface du trabéculum, ressemblant à des « bulles de champagne ». Lorsque les bulles de microcavitation sont visibles, il est conseillé d’abaisser la puissance de 0,1 mJ, pour rester en dessous du seuil de cavitation tout au long de la procédure. Le principe décrit par les concepteurs et retenu est d’obtenir globalement ces microbulles sur 50 % de l’ensemble des impacts réalisés (vidéo 16-1).
Enfin, l’efficacité du laser SLT ne doit se juger qu’au bout de quelques semaines durant lesquelles le traitement antiglaucomateux antérieur est maintenu. Pour éviter une réaction inflammatoire de chambre antérieure, il ne faut pas oublier la prescription préalable d’un traitement anti-inflammatoire non stéroïdien pendant quelques jours et prévenir l’hypertonie oculaire précoce par un traitement adapté, en privilégiant les agonistes α2-adrénergiques, efficaces dans cette indication. La PIO sera mesurée régulièrement après la SLT. Un examen clinique incluant la mesure de la PIO doit être classiquement réalisé à une heure, à une à deux semaines, à six semaines et à trois mois après la trabéculoplastie, même si les visites précoces sont souvent omises, sauf complications inattendues. Une vigilance accrue doit cependant être respectée en cas de glaucome évolué, du fait du risque lié aux pics hypertoniques. Le traitement antiglaucomateux antérieur peut être allégé progressivement, en fonction de la réponse tonométrique obtenue et de la PIO cible choisie pour le patient.
Réglages du laser
-
Exposition : 3 ns (préréglé).
-
Taille du spot : 400 μm (préréglé).
-
100 impacts sur 360° en deux séances, 50 impacts en une séance (moitiés inférieure ou temporale).
Choix de la lentille
-
Lentille Latina SLT, V3M de Goldmann, verre CGA ou de Ritch.
Niveau d’énergie
-
Commencer à 0,8 mJ et augmenter la puissance suivant les besoins jusqu’à observation du point d’évaluation clinique (bulles de microcavitation).
-
Angles très fortement pigmentés : 0,4 à 0,6 mJ.
-
Angles légèrement pigmentés : 1,0 à 1,2 mJ.
-
Dispersion pigmentaire : 0,4 mJ (sur 90° d’angle).
Critère d’évaluation de traitement
-
Obtention de bulles de cavitation (« bulles de champagne »). Lorsqu’on obtient ces bulles de cavitation, il est nécessaire de réduire la puissance de 0,1 mJ. Une fois la puissance réduite, les bulles de cavitation ne seront donc plus visibles (le traitement est alors considéré comme infraliminaire). Étant donné que la pigmentation trabéculaire varie dans un même œil (notamment dans les zones inférieures et temporales), les réglages de puissance doivent être adaptés au moins pour chaque quadrant afin d’éviter un surdosage thérapeutique.
-
Un examen clinique incluant la mesure de la PIO doit être réalisé une heure, une à deux semaines, six semaines et trois mois après la trabéculoplastie. Le traitement antiglaucomateux antérieur peut être allégé progressivement, en fonction de la réponse tonométrique.
Résultats cliniques
Les premiers résultats de la SLT ont été publiés par Latina en 1998 chez des patients présentant un glaucome mal contrôlé par un traitement médical maximal [16]. Après une procédure réalisée sur une hémi-circonférence angulaire, la PIO est abaissée de 4,1 mmHg (16,3 %) à une semaine et de 4,6 mmHg (18,7 %) à la 26e semaine. Un pic pressionnel de plus de 5 mmHg est observé chez un quart de la population traitée. Dans un travail plus récent, une baisse de PIO de 3 mmHg est obtenue chez 79 % des patients et de 6 mmHg chez 40 % des patients six mois après une hémi-trabéculoplastie [7]. Pour certains, des traitements plus limités, intéressant un quart de la circonférence angulaire, sont aussi efficaces qu’un traitement de la moitié de l’angle [5]. La SLT permet d’alléger le traitement médical préalable chez plus de 80 % des patients après six mois de suivi, même si le sevrage thérapeutique est souvent partiel [9]. Le résultat n’est cependant pas totalement prévisible et la baisse de la PIO peut atteindre 6 à 8 mmHg, mais est souvent plus limitée (de l’ordre de 3-4 mmHg).
Comparaison TLA et SLT
Damji et al. [8] ont comparé, dans une étude réalisée en double insu, l’hémi-trabéculoplastie au laser à l’argon et au laser SLT. Au bout d’un an, la baisse de PIO permise par les deux techniques est équivalente, avec une réduction moyenne de 5,86 mmHg pour le SLT et de 6,0 mmHg pour le laser argon. Cette étude a des limites puisque le recours à la chirurgie et les traitements antiglaucomateux pouvaient être adaptés lors du suivi. D’autres travaux confirment l’équivalence des deux techniques, avec possiblement une inflammation moindre induite par le laser SLT [18].
Un certain nombre de patients ayant bénéficié d’une TLA présentent un échappement thérapeutique avec le temps, la PIO remontant progressivement à distance de la procédure. Ce phénomène s’observe aussi avec le laser SLT et plusieurs études confirment cette observation [13] : lorsque le critère du succès thérapeutique est défini par une baisse de PIO de 3 mmHg sans traitement additionnel, le pourcentage des patients atteignant cet objectif est de 68, 46 et 32 % respectivement après un, trois et cinq ans. Lorsque ce critère exige à la fois une baisse de PIO de 3 mmHg et de 20 % par rapport à la PIO initiale, ces pourcentages sont respectivement de 58, 38 et 31 % au décours de ces mêmes périodes. La fréquence des échappements thérapeutiques avec le temps est jugée similaire à celle observée avec le laser argon (eTableau 16-1).
Comparaison à un traitement médical
L’efficacité de la SLT a été comparée à celle du latanoprost, qui peut être considéré comme un traitement de référence [19]. Les deux traitements sont comparables avec une réduction de la PIO de l’ordre de 30 % au décours du suivi.
Efficacité en cas de pseudo-exfoliation capsulaire
Quelques études indiquent une efficacité identique que dans le GPAO [10] ; techniquement, la pigmentation trabéculaire souvent soutenue dans le glaucome pseudo-exfoliatif facilite la focalisation précise des impacts de SLT. La durée de la réponse tonométrique serait cependant plus courte avec un taux d’échec logiquement plus élevé qu’en cas de glaucome chronique.
Efficacité en fonction de la pigmentation trabéculaire
Le rôle du pigment angulaire sur l’efficacité de la trabéculoplastie au laser SLT est discuté ; pour certains, la présence d’une surcharge pigmentaire serait un facteur de succès de la procédure [6] mais cette observation n’est pas unanime. Il est classique de débuter avec une énergie réduite de moitié et d’ajuster le niveau d’énergie délivrée en cas de trabéculum très pigmenté, car le risque d’hypertonie irréductible nécessitant une chirurgie filtrante a été décrit [11]. Des niveaux d’énergie de l’ordre de 0,4 mJ peuvent être utilisés au départ, afin d’atteindre progressivement le seuil des bulles de microcavitation. En cas de glaucome pigmentaire, il est aussi conseillé de diminuer le nombre d’impacts (12 impacts sur 90°, 24 impacts sur 180°, 48 impacts sur 360°).
Efficacité après une TLA ou une chirurgie filtrante
Les rares études consacrées à cette éventualité indiquent que la SLT, lorsqu’elle est réalisée après une TLA, garde son efficacité et n’expose pas à un risque accru de complications inflammatoires ou hypertoniques. Il est possible de réaliser une trabéculoplastie sélective après une chirurgie filtrante antiglaucomateuse, et on recommande généralement (et empiriquement) de respecter un délai de trois mois entre les deux procédures.
Efficacité en fonction du niveau de la PIO initiale
L’étude Advanced Glaucoma Intervention Study (AGIS) a démontré qu’un niveau élevé de PIO avant une TLA est un facteur de pronostic péjoratif et nécessite alors un nombre plus important de collyres antiglaucomateux [1]. Après une SLT, la PIO est aussi d’autant plus diminuée que la PIO initiale est élevée [12]. Cette constatation est compatible avec l’idée que la plupart des traitements hypotonisants oculaires sont d’autant plus efficaces que la PIO est augmentée.
Efficacité du retraitement
Il est possible de retraiter le trabéculum au laser SLT, avec une conservation de l’efficacité sur la réduction de la PIO. En pratique, il est nécessaire d’attendre une période d’au moins un mois lorsque l’hémi-circonférence de 180° a été traitée pour effectuer un traitement complémentaire sur l’autre moitié angulaire. Si on veut répéter ensuite la procédure une seconde fois, il faut attendre au moins six mois pour envisager ce retraitement. Le protocole suivi sera alors identique, en débutant toujours par 180°. En revanche, la plupart des auteurs s’accordent sur le fait qu’une seconde trabéculoplastie ne sera pas efficace si le patient n’a pas réagi au traitement initial par laser SLT. Les résultats de la trabéculoplastie initiale conditionnent généralement ceux de la seconde trabéculoplastie. Enfin, nous ne disposons pas à ce jour de résultats d’études cliniques au-delà de deux procédures.
Complications – Effets indésirables
Les complications inflammatoires sont surtout précoces, doivent être connues et systématiquement prévenues par un traitement adapté. Un pic de pression de plus de 10 mmHg peut être observé dans 10 % des cas, apparaissant généralement dans les premières 24 heures suivant le traitement et disparaissant lors des 24 heures suivantes, éventuellement plus tardivement. Ce pic de pression est plus particulièrement observé lorsque l’énergie choisie est trop élevée. La technique expose également à d’autres complications inflammatoires locales dont la fréquence est faible : douleurs oculaires, réaction inflammatoire de chambre antérieure. Ces complications sont prévenues et traitées par la prescription systématique de collyres antiglaucomateux et anti-inflammatoires (eTableau 16-2).
-
Douleur et sensation de gêne (modérée ou absente).
-
Pic initial de PIO (qui peut être observé une heure après le traitement ; moins de 10 % des cas).
-
Vision légèrement brouillée, photophobie légère durant deux ou trois jours par réaction uvéale.
-
Réaction inflammatoire de chambre antérieure (myosis, rare Tyndall de chambre antérieure).
-
Rares goniosynéchies, n’engendrant pas de gêne trabéculaire à l’écoulement de l’humeur aqueuse.
Indications cliniques
Les indications thérapeutiques sont nombreuses et sont globalement celles de la TLA. La plupart des formes cliniques de glaucome sont accessibles, à condition que l’angle iridocornéen soit ouvert et le trabéculum visible en gonioscopie : GPAO, glaucomes pseudo-exfoliatif et pigmentaire, glaucome à pression normale. De manière générale, les résultats pressionnels sont plus importants lorsque la PIO initiale est élevée ; il est ainsi logique que la baisse de PIO soit de plus faible amplitude dans le glaucome à pression normale et que le pourcentage de non-répondeurs soit plus important. Les circonstances conduisant à proposer une trabéculoplastie sélective sont nombreuses : nécessité d’une PIO cible basse, échec du traitement médical ou mauvaise observance, effets indésirables liés aux collyres, difficultés physiques d’instillation, éventuellement après une chirurgie filtrante antérieure insuffisamment efficace. Lorsque l’angle est étroit, il est possible de proposer la trabéculoplastie après réalisation préalable d’une iridotomie ou d’une iridoplastie. En revanche, les glaucomes secondaires (congénital, inflammatoire, néovasculaire), ou lorsque le trabéculum n’est pas visible, ne constituent pas des indications de la trabéculoplastie sélective.
La TLA a, pour beaucoup, été considérée comme une alternative au traitement chirurgical, pour éviter une chirurgie filtrante difficile à réaliser ou mal acceptée par le patient. La SLT conserve logiquement cette indication et a redonné ses lettres de noblesse à ce traitement physique. Elle peut être aussi proposée en complément d’une chirurgie filtrante insuffisamment efficace.
Retenir
-
La trabéculoplastie sélective au laser SLT est incontestablement un traitement physique efficace du glaucome, avec un profil d’innocuité satisfaisant, les complications postopératoires étant de nature et de fréquence limitées.
-
La baisse de PIO est, en moyenne, de 20 à 30 % par rapport à la PIO initiale, ce qui place la trabéculoplastie assez favorablement par rapport à une monothérapie.
-
Dans la plupart des études, l’efficacité du laser SLT diminue progressivement avec le temps, et l’échappement thérapeutique touche un patient sur dix tous les ans, si on considère le seuil d’une réduction de PIO de 20 %.
-
La trabéculoplastie sélective peut être répétée, avec un résultat pressionnel assez comparable lors de la seconde session, et c’est sans doute la faible énergie délivrée par le laser SLT qui explique l’efficacité des retraitements.
-
Le protocole de préparation est comparable à celui employé par la trabéculoplastie au laser argon, et la prescription de collyres antiglaucomateux limite le risque de pics hypertoniques après la procédure.
-
De réalisation aisée et rapide, la SLT représente une alternative thérapeutique intéressante dans la prise en charge du glaucome.
Fig. 16-6 Effets histologiques comparés du laser à l’argon en haut et du laser SLT en bas, à faible et fort grossissement. (Avec l’aimable autorisation de TR Kramer et RJ Noecker [14] ; © ELLEX France.)
Fig. 16-7 Réalisation d’une SLT sur angle ouvert. Le spot, de grande taille, est vu flou, et il est important que les structures angulaires, en particulier le trabéculum, soient nettement observées durant toute la procédure.
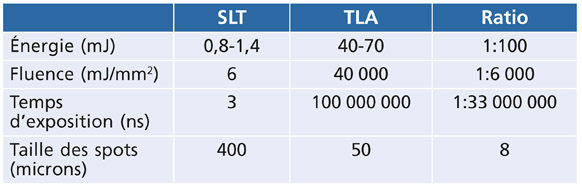
Tableau 16-3 Comparaisons des paramètres de la SLT et de la TLA.
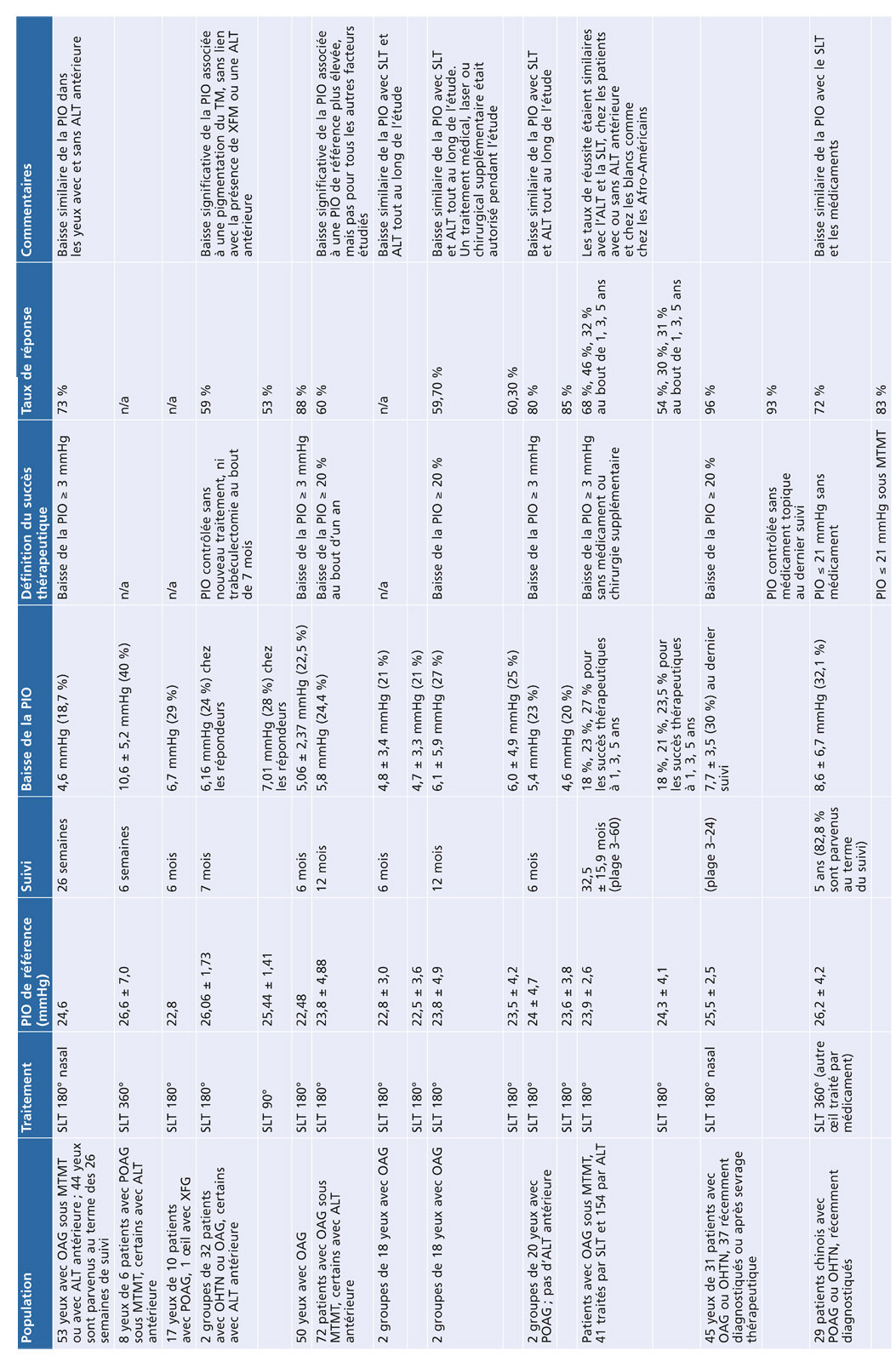
eTableau 16-1 Efficacité de la SLT signalés dans les différentes études. (Avec l’aimable autorisation des laboratoires Alcon.)
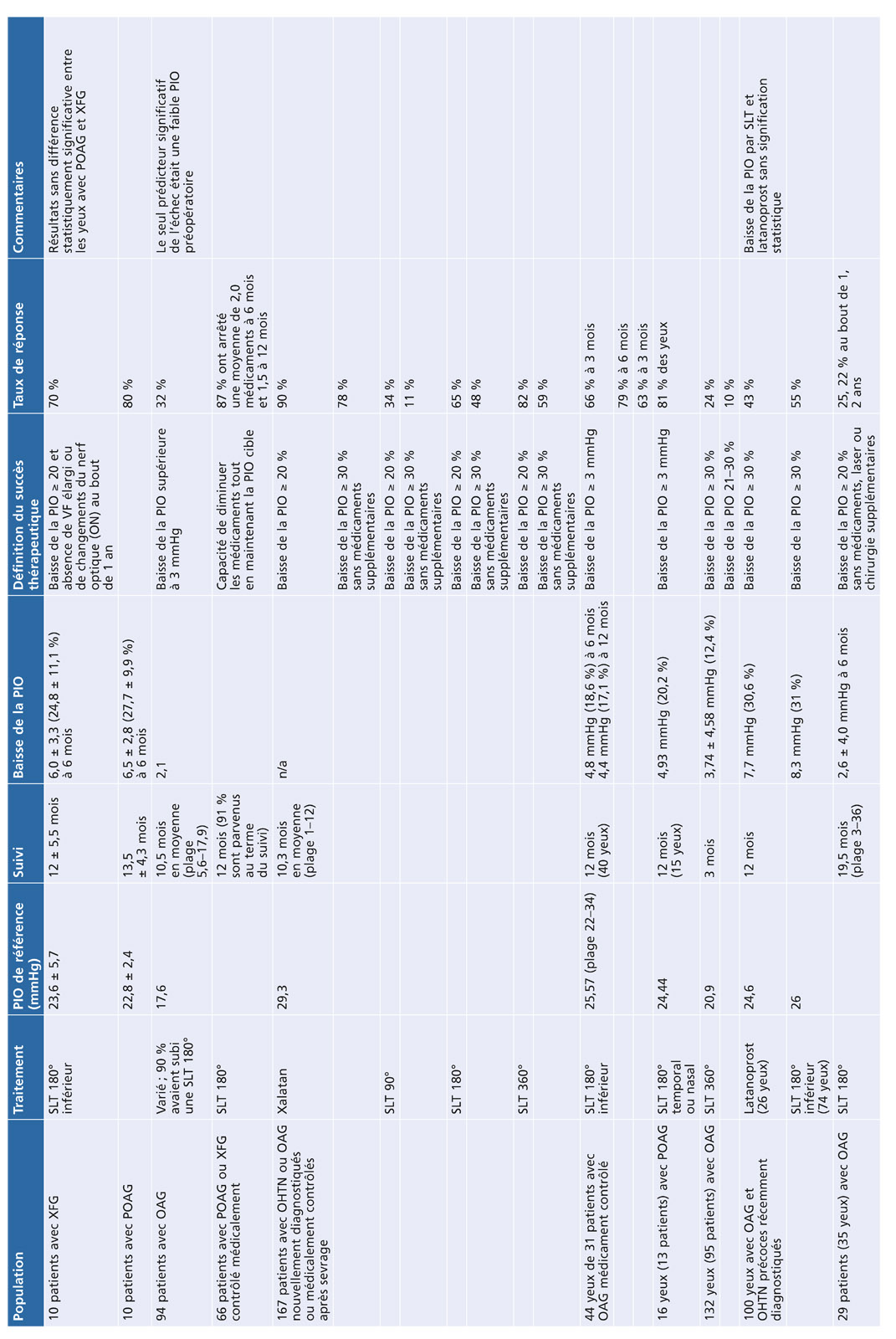
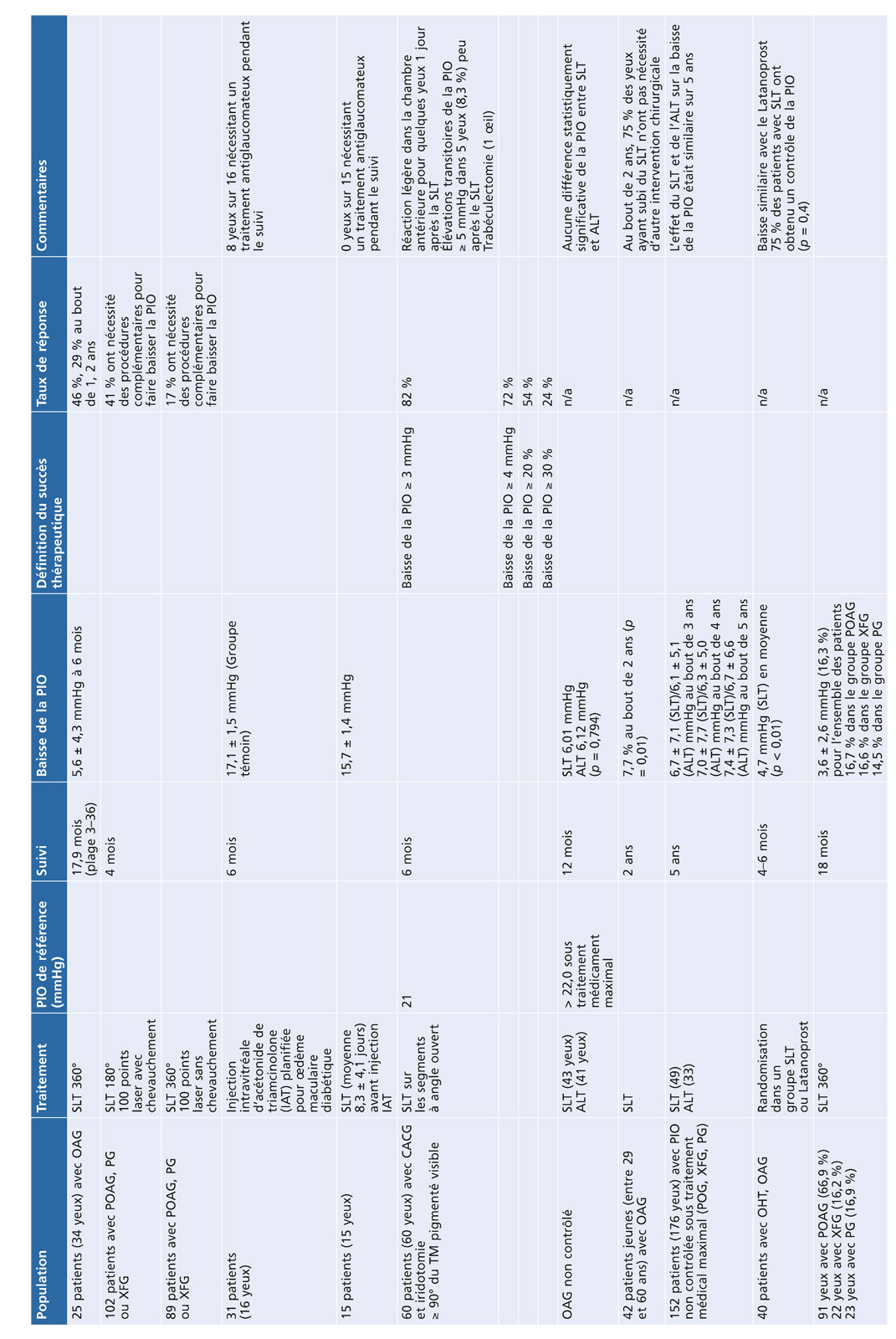
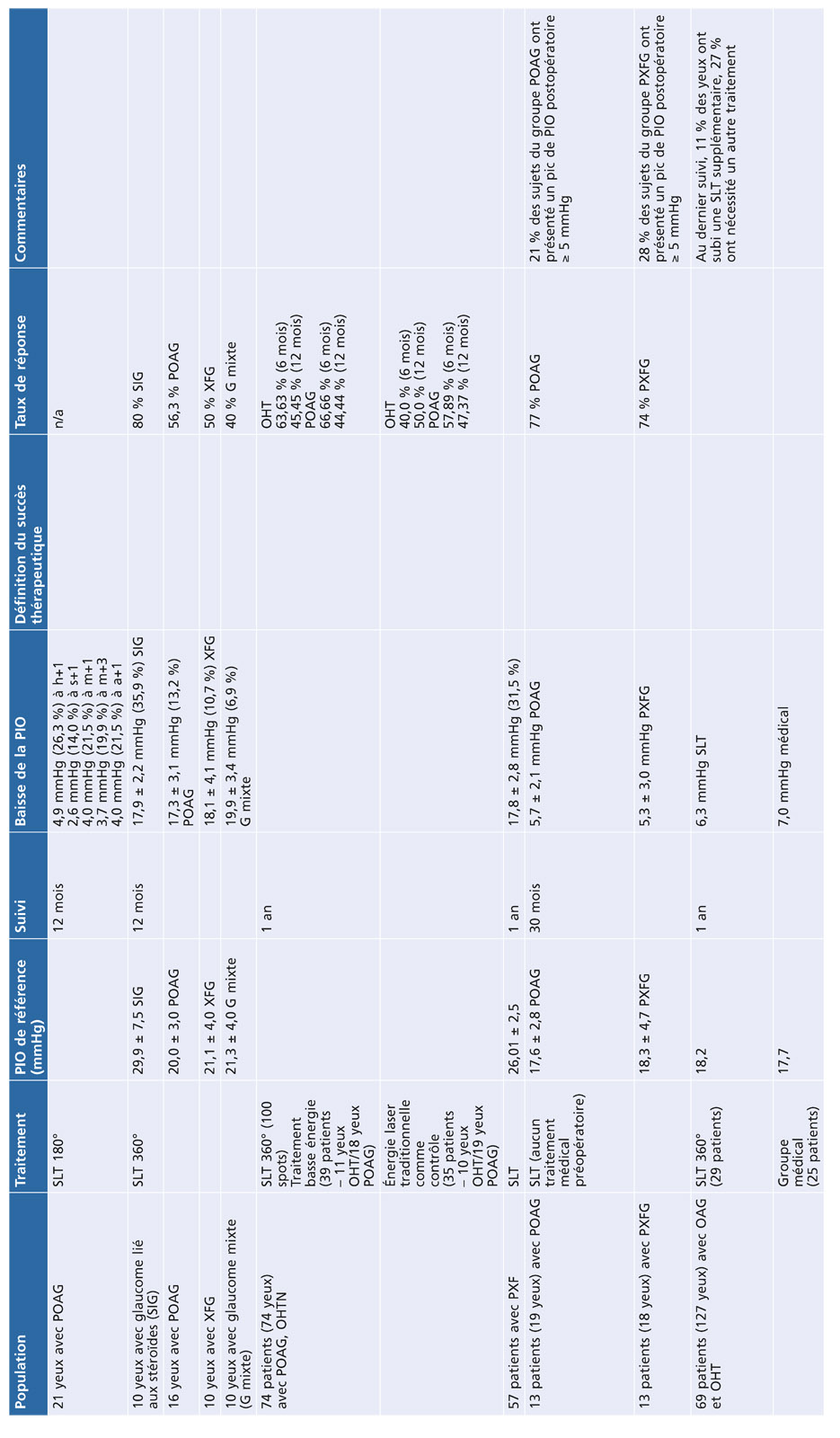
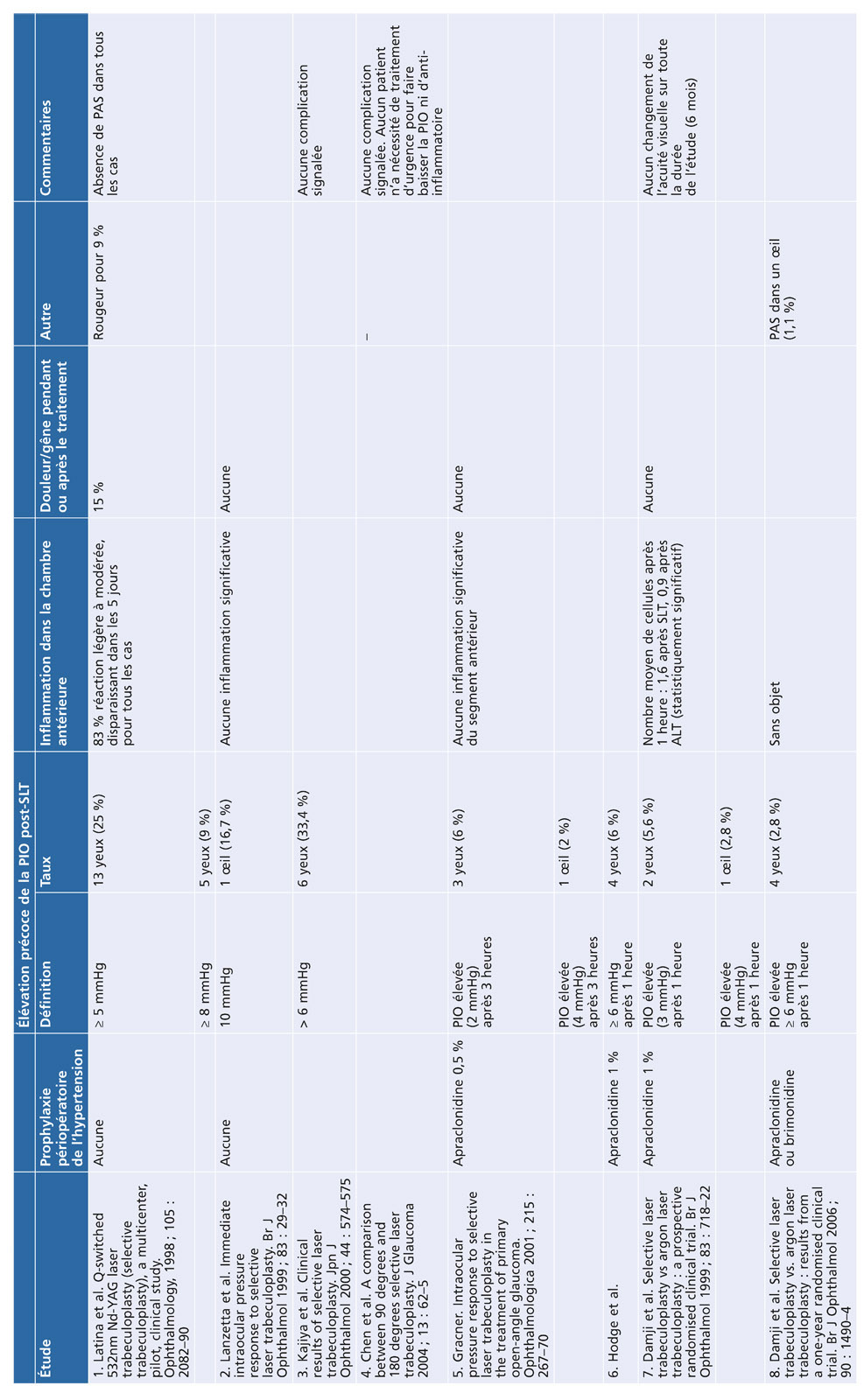
eTableau 16-2 Synthèse des effets indésirables au SLT signalés dans des études scientifiques. (Avec l’aimable autorisation des laboratoires Alcon.)
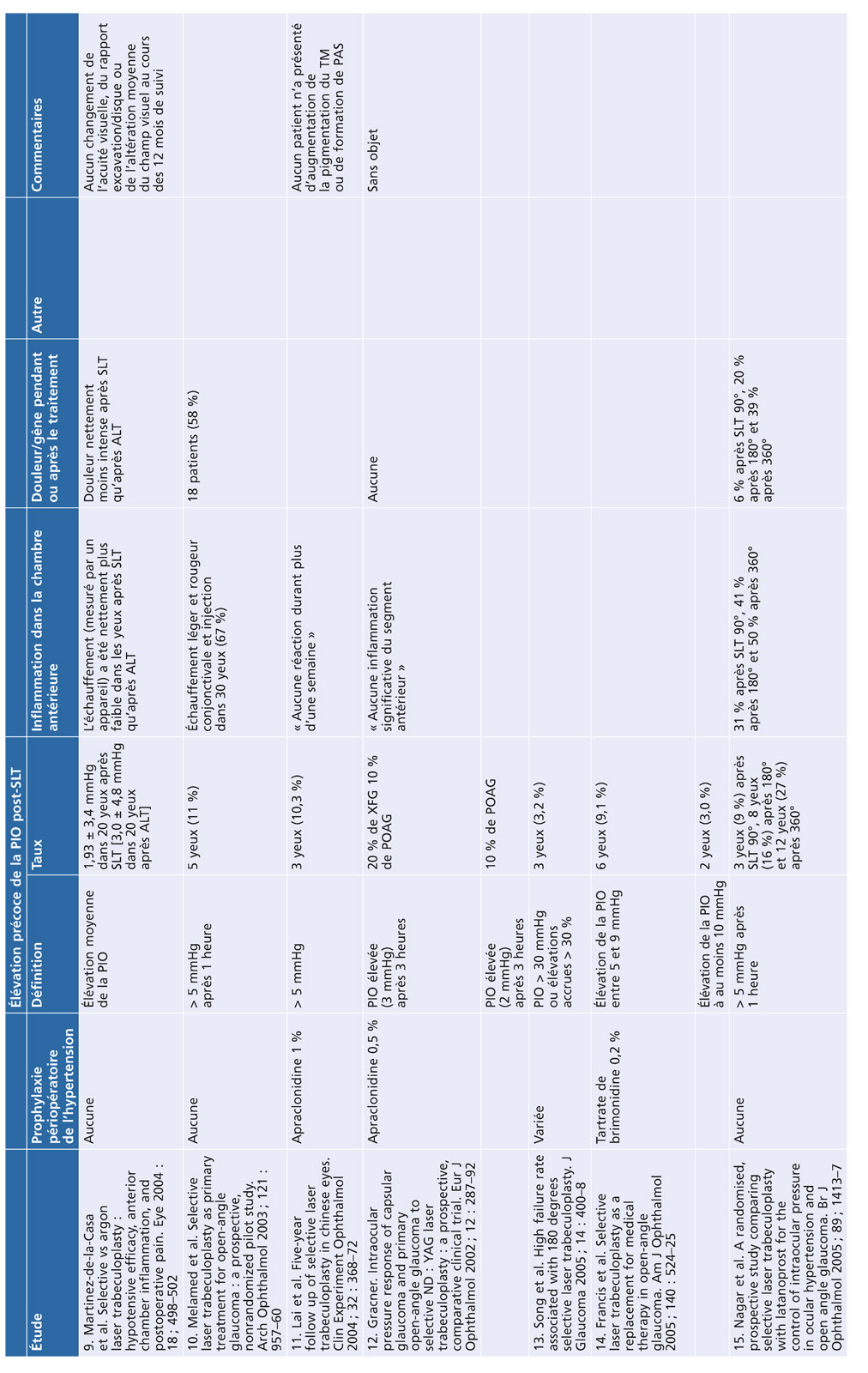
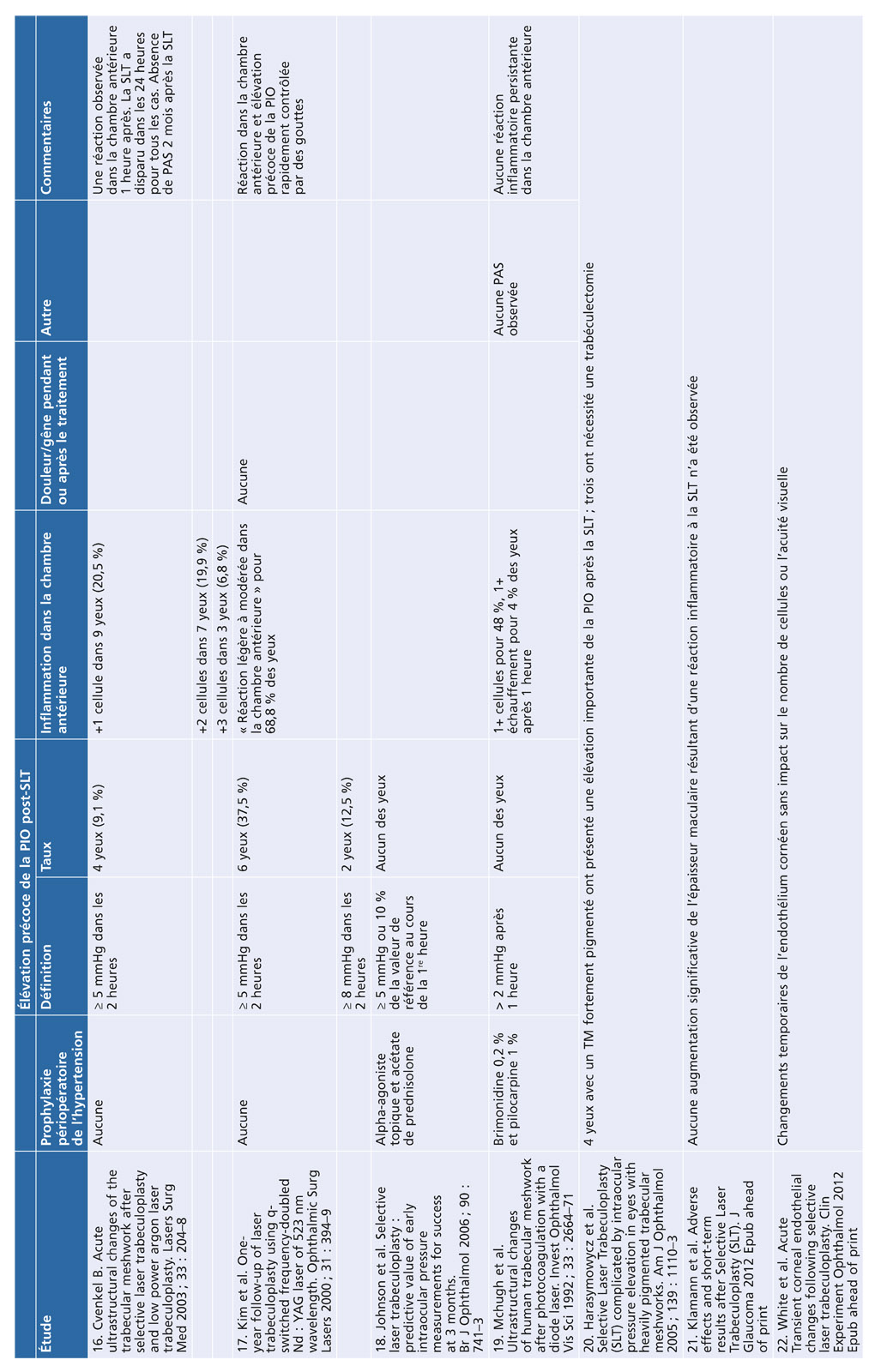

PAS : peripheral anterior synechiae (synéchies antérieures périphériques).
[1] AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS). 11. Risk factors for failure of trabeculectomy and argon laser trabeculoplasty. Ophthalmology. 2002 ; 134 : 481-982.
[2] Alvarado JA, Iguchi R, Martinez J, et al. Similar effects of selective laser trabeculoplasty and prostaglandin analogs on the permeability of cultured Schlemm canal cells. Am J Ophthalmol. 2010 ; 150 : 254-64.
[3] Anderson RR, Parrish JA. Selective photothermolysis : precise microsurgery by selective absorption of pulsed radiation. Science. 1983 ; 220 : 524-7.
[4] Brinkmann R, Huttmann G, Rogener J, et al. Origin of retinal pigment epithelium cell damage by pulsed laser irradiance in the nanosecond to microsecond time regimen. Lasers Surg Med. 2000 ; 27 : 451-64.
[5] Chen TC, Ang RT, Grosskreutz CL, et al. Brimonidine 0.2 % versus apraclonidine 0.5 % for prevention of intraocular pressure elevations after anterior segment laser surgery. Ophthalmology. 2001 ; 108 : 1033-8.
[6] Chen E, Golchin S, Blomdahl S. A comparison between 90 degrees and 180 degrees selective laser trabeculoplasty. J Glaucoma. 2004 ; 13 : 62-5.
[7] Cvenkel B. One-year follow-up of selective laser trabeculoplasty in open-angle glaucoma. Ophthalmologica. 2004 ; 218 : 20-5.
[8] Damji KF, Bovell AM, Hodge WG, et al. Selective laser trabeculoplasty vs. argon laser trabeculoplasty : results from a one-year randomised clinical trial. Br J Ophthalmol. 2006 ; 90 : 1490-4.
[9] Francis BA, Ianchulev T, Schofield JK, Minckler DS. Selective laser trabeculoplasty as a replacement for medical therapy in open-angle glaucoma. Am J Ophthalmol. 2005 ; 140 : 524-5.
[10] Gracner T. Intraocular pressure response of capsular glaucoma and primary open-angle glaucoma to selective Nd : YAG laser trabeculoplasty : a prospective, comparative clinical trial. Eur J Ophthalmol. 2002 ; 12 : 287-92.
[11] Harasymowycz PJ, Papamatheakis DG, Latina M, et al. Selective laser trabeculoplasty (SLT) complicated by intraocular pressure elevation in eyes with heavily pigmented trabecular meshworks. Am J Ophthalmol. 2005 ; 139 : 1110-3.
[12] Johnson PB, Katz LJ, Rhee DJ. Selective laser trabeculoplasty : predictive value of early intraocular pressure measurements for success at 3 months. Br J Ophthalmol. 2006 ; 90 : 741-3.
[13] Juzych MS, Chopra V, Banitt MR, et al. Comparison of long-term outcomes of selective laser trabeculoplasty versus argon laser trabeculoplasty in open-angle glaucoma. Ophthalmology. 2004 ; 111 : 1853-9.
[14] Kramer TR, Noecker RJ. Comparison of the morphologic changes after selective laser trabeculoplasty and argon laser trabeculoplasty in human eye bank eyes. Ophthalmology. 2001 ; 108 : 773-9.
[15] Latina MA, Park C. Selective targeting of trabecular meshwork cells : in vitro studies of pulsed and CW laser interactions. Exp Eye Res. 1995 ; 6 : 359-71.
[16] Latina MA, Sibayan SA, Shin DH, et al. Q-switched 532nm Nd-YAG laser trabeculoplasty (selective trabeculoplasty), a multicenter, pilot, clinical study. Ophthalmology. 1998 ; 105 : 2082-90.
[17] Lustgarten J, Podos SM, Ritch R, et al. Laser trabeculoplasty. A prospective study of treatment variables. Arch Ophthalmol. 1984 ; 102 : 517-9.
[18] Martinez-de-la-Casa JM, Garcia-Feijoo J, Castillo A, et al. Selective vs argon laser trabeculoplasty : hypotensive efficacy, anterior chamber inflammation, and postoperative pain. Eye. 2004 ; 18 : 498-502.
[19] McIlraith I, Strasfeld M, Colev G, Hutnik CM. Selective laser trabeculoplasty as initial and adjunctive treatment for open-angle glaucoma. J Glaucoma. 2006 ; 15 : 124-30.
AUTRES TRABÉCULOPLASTIES
E. Sellem
Laser titanium-sapphire
Le laser titanium-sapphire (TLT) est un laser pulsé, conçu (SOLX, Inc., Waltham, MA) dans le but de délivrer l’énergie au niveau des couches profondes du trabéculum, mais sans dénaturation thermique aussi bien au niveau des couches traversées qu’à celui des couches profondes (fig. 16-8).
Cette propriété est permise par l’utilisation simultanée d’une durée courte de l’impact (7 μs contre 100 000 μs avec le laser à l’argon) et d’une longueur d’onde (790 nm) permettant une pénétration tissulaire de l’énergie. Les spots ont une taille de 200 μm et le temps d’impact est de 7 µs. Les images ultrastructurales du trabéculum traité sont d’ailleurs similaires à celles présentées après trabéculoplastie sélective, c’est-à-dire indemnes d’altérations tissulaires visibles.
Un certain nombre d’études indiquent une baisse pressionnelle identique [3, 7] à celle de la trabéculoplastie au laser à l’argon à un an ; comparativement à la SLT, Holz et Lim [4] trouve identique, voire supérieure, l’efficacité tonométrique de la TLT à 6 mois et à 18 mois. D’autres auteurs sont moins enthousiastes : dans une série de 67 yeux traités de 44 patients présentant une PIO incomplètement contrôlée médicalement, avec un suivi moyen de 42 semaines, Ogunbowale [5] note une baisse de la PIO moyenne, passant de 23,1 à 20,0 mmHg, inférieure à celle obtenue par la SLT, et les poussées pressionnelles postopératoires sont fréquentes et parfois prolongées ; Garcia-Sanchez [2] a traité 33 yeux porteurs d’un GPAO, en plaçant 50 impacts sur les 180° inférieurs du trabéculum avec une réduction notée au 6e mois de 3,9 ± 4,7 mmHg.
Cela dit, à la différence de la SLT, l’énergie utilisée serait suffisamment forte pour permettre la réalisation d’iridotomies et d’iridoplasties, ainsi que l’ouverture contrôlée de microshunts en or, reliant la chambre antérieure aux espaces supraciliaires (procédé mis au point par la même firme et en cours d’évaluation).
Laser diode micropulsé
La même finalité d’épargne tissulaire a conduit à utiliser le laser diode micropulsé (MDLT) pour la réalisation des trabéculoplasties. La source d’énergie est la même que celle utilisée pour les traitements de la rétine ou du corps ciliaire (Iridex, Mountain View, CA). La longueur d’onde est proche de l’infrarouge à 810 nm, les spots ont une taille de 200 ou 300 µm, la durée d’application (pendant laquelle est délivrée chaque fois une rafale de 100 micropulsations de 0,6 mJ) est de 0,1 ou 0,2 s, et l’énergie utilisée se situe entre 1 et 2 W (tableau 16-4).
Peu de résultats ont été publiés dans la littérature, mais il semble que la MDLT ne soit que très modestement efficace à abaisser la PIO : Detry-Morel et al. [1], en comparant la MDLT avec la TLA, ne trouvent que 20 % de succès tonométriques à trois mois, avec une baisse de la PIO de 12,2 ± 11,9 % versus 21,8 ± 11,1 % ; Rantala et Välimäki [6] concluent même à l’inefficacité de la méthode après un suivi de 19 mois ! Dans les deux séries, les yeux traités n’ont pas eu de complications postopératoires significatives.
Laser PASCAL™
Le PAttern SCAnning Laser (PASCAL) est un laser de 532 nm semi-automatique qui permet de délivrer en une fois plusieurs impacts. Il est régulièrement utilisé par de nombreuses équipes dans le traitement des pathologies rétiniennes devant être photocoagulées.
Un programme a pu être appliqué à la réalisation de la trabéculoplastie, appelée ici pattern laser trabeculoplasty. À ce jour, une seule publication en fait état [8], utilisant des spots de 100 µm, une durée d’application de 5 ms (soit vingt fois moins que la TLA), et une puissance permettant une réaction tissulaire se situant entre 0,5 et 1 W. Soixante-six impacts espacés régulièrement sont appliqués chaque fois, à seize reprises, avec une rotation automatique entre chacune de ces reprises, la totalité du trabéculum étant donc traitée avec près de 1 100 impacts posés sur la totalité de la circonférence trabéculaire dans la même séance. Les auteurs indiquent que ce traitement guidé par l’ordinateur est rapide, précis, avec un traumatisme minimal, et qu’il a permis une réduction moyenne de 24 % de la PIO pour les 47 yeux traités avec un recul de six mois.
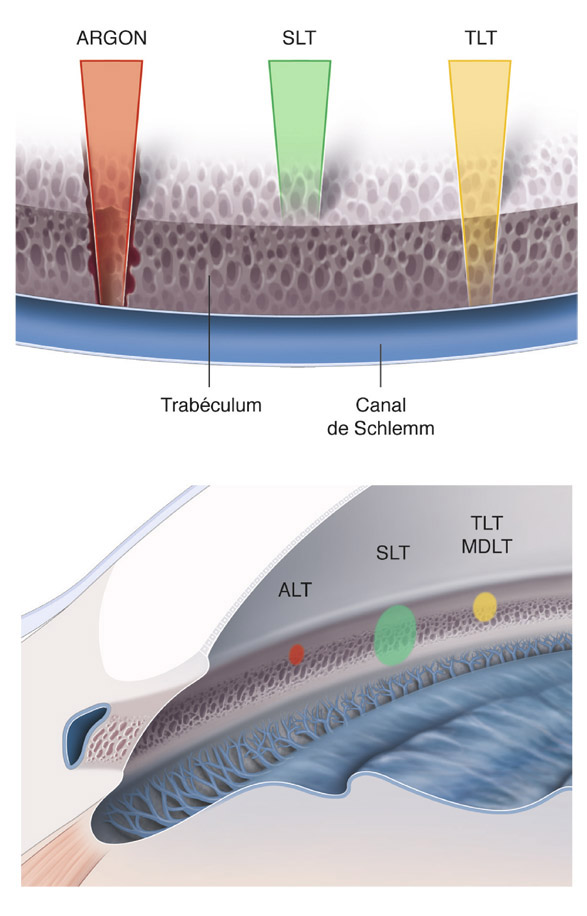
Fig. 16-8 Sites trabéculaires d’action respectifs des lasers à l’argon, sélectif et titanium-sapphire.
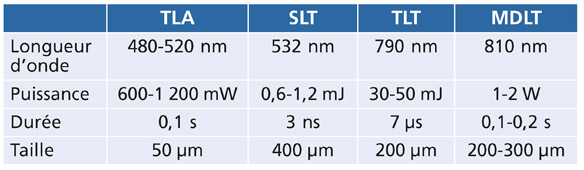
Tableau 16-4 Paramètres respectifs des lasers à l’argon (TLA), sélectifs (SLT), titanium-sapphire (TLT) et diode micropulsé (MDLT).
[1] Detry-Morel M, Muschart F, Pourjavan S. Micropulse diode laser (810 nm) versus argon laser trabeculoplasty in the treatment of open-angle glaucoma : comparative short-term safety and efficacy profile. Bull Soc Belge Ophtalmol. 2008 ; 308 : 21-8.
[2] Garcia-Sanchez J. Hypotensive efficacity and anterior chamber inflammation with titanium sapphire selective laser trabeculoplasty. ARVO 2007, poster #B955.
[3] Goldenfeld M, Melamed S, Simon G, Ben Simon GJ. Titanium : sapphire laser trabeculoplasty versus argon laser trabeculoplasty in patients with open-angle glaucoma. Ophthalmic Surg Lasers Imaging. 2009 ; 40 : 264-9.
[4] Holz HA, Lim MC. Glaucoma lasers : a review of the newer techniques. Curr Opin Ophthalmol. 2005 ; 16 : 89-93.
[5] Ogunbowale L, et al. Paradoxical intraocular pressure rise with titanium sapphire selective laser trabeculoplasty. ARVO 2007, poster #B954.
[6] Rantala E, Välimäki J. Micropulse diode laser trabeculoplasty – 180-degree treatment. Acta Ophthalmol. 2012 ; 90 : 441-4.
[7] Simon G, Lowery J, Clevenger J. Laser trabeculoplasty for reducing intraocular pressure with a titanium : sapphire laser. American Glaucoma Society, Annual Meeting 2006, Charleston, SC. Poster #22.
[8] Turati M, Gil-Carrasco F, Morales A, et al. Patterned laser trabeculoplasty. Ophthalmic Surg Lasers Imaging. 2010 ; 41 : 538-45.
E. Sellem
A vec les lasers disponibles au début des années 1970, les tentatives initiales de perforation trabéculaire jusqu’au canal de Schlemm (trabéculotomie), ou sclérale de pleine épaisseur (sclérostomie), furent toutes des échecs. Durant les trente dernières années, le développement des nouvelles technologies laser a toutefois suscité régulièrement des travaux avec ces mêmes prétentions anatomiques… dont il faut malheureusement admettre qu’une majorité n’a pas confirmé les espoirs que les auteurs pouvaient en attendre.
TRABÉCULOTOMIE AU LASER EXCIMER
La trabéculotomie ab interno au laser Excimer (ELT) a fait l’objet de rares publications relativement récentes. La sonde devant être au contact du trabéculum, sa réalisation ne peut se faire que par endoscopie. Après une incision limbique de 1,3 mm et une injection de produit viscoélastique, Wilmsmeyer et al. [8] introduisent la sonde dans la chambre antérieure et la traversent jusqu’au contact du trabéculum. La longueur d’onde du laser XeCl Excimer utilisé (AIDA, Munich) est de 308 nm, avec une énergie de 1,2 mJ, une durée d’impact de 60 ns, un taux de répétition de 20 Hz et une taille de spot de 200 µm. Dix impacts sont appliqués sur 90°, avec chaque fois un blanchiment de la zone traitée et une bulle d’évaporation. La survenue d’une petite hémorragie rétrograde témoigne de la perforation du canal de Schlemm. Deux groupes de patients ont été ainsi traités : 75 patients avec une ELT isolée, et 60 patients ayant bénéficié dans le même temps d’une phako-émulsification. Dans le premier groupe, la PIO passe de 24,1 ± 0,7 mmHg en préopératoire à 18,8 ± 0,4 mmHg à trois mois, et à 16,8 ± 1,0 mmHg à 24 mois, avec toutefois 28 % de retraitement en raison d’une baisse insuffisante de la PIO ; dans le second groupe, les chiffres sont respectivement de 22,4 ± 0,6 mmHg, 16,5 ± 0,4 mmHg et 12,8 ± 1,5 mmHg, avec 7 % de retraitement. Les suites postopératoires n’ont pas posé de problèmes particuliers.
Babighian et al. [1], plus récemment, utilisent le même appareil, avec un protocole sensiblement identique, plaçant huit spots espacés de 500 μm et une durée de pulsation un peu plus longue (80 ns). Quinze patients sont ainsi enrôlés, et comparés à 15 autres traités par SLT (50 impacts sur 180°). À 24 mois, la PIO diminue de 25,0 ± 1,9 mmHg à 17,6 ± 2,2 mmHg dans le premier groupe, et de 23,9 ± 0,9 mmHg à 19,1 ± 1,8 mmHg dans le groupe SLT, la différence n’étant pas statistiquement significative entre les deux groupes. Le contrôle gonioscopique à un mois montre la présence de microtrous ronds ou ovales entourés d’une hyperpigmentation, persistant tout au long du suivi, sans goniosynéchies.
Compte tenu de l’appareillage requis et de la nécessité d’un geste chirurgical, l’intérêt pratique d’une telle méthode pour traiter le GPAO apparaît toutefois très limité et son avenir n’est pas assuré.
TRABÉCULOTOMIE AU LASER ND-YAG
La goniopuncture, dont le but est d’ouvrir la membrane trabéculaire résiduelle après la réalisation d’une chirurgie filtrante non perforante, sera décrite plus loin dans « Chirurgie filtrante non perforante ».
Quelques travaux visant à réaliser une trabéculotomie avec le laser Nd-YAG soit in vitro, soit sur des animaux de laboratoire, soit plus exceptionnellement en clinique humaine, ont été publiés dans les années 1980 et 1990 [2, 5, 7]. L’énergie était délivrée soit en transcornéen avec un verre à gonioscopie, soit ab interno après introduction camérulaire d’une sonde. La plupart des résultats publiés étaient régulièrement satisfaisants sur l’augmentation de l’excrétion aqueuse et l’abaissement pressionnel… mais le recul et l’absence de publications récentes confirment l’abandon actuel de cette méthode.
SCLÉROSTOMIES AU LASER
Les tentatives de sclérostomie au laser se partagent là encore en méthodes ab interno et ab externo.
Des techniques ab interno ont été réalisées sur des yeux de lapin avec le laser Nd-YAG et le laser Excimer, publiées dans les années 1980, sans suites cliniquement pratiques. Une technique très originale, proposée par Latina et al. [4], consistait à imprégner de bleu de méthylène une zone très ciblée de la sclère par une technique électrique d’iontophorèse. Le colorant pénétrait ainsi toute l’épaisseur sclérale, jusqu’à ce qu’il soit visible en gonioscopie. La sclérostomie était ensuite réalisée à l’aide d’un laser hélium-néon pulsé émettant à 660 nm et délivrant un spot de 200 µm. L’énergie était augmentée jusqu’à la perforation sclérale. Les résultats initiaux, avec 75 % de succès lorsqu’une perforation complète était obtenue, tombaient malheureusement à 25 % après 15 mois.
Une technique ab externo utilisant le laser Holmium-YAG a été décrite au début des années 1990, avec un taux de succès de 76 % à trois mois et de 54 % à 12 mois dans la série d’Iwach et al. [3]. La sonde du laser était glissée sous la conjonctive jusqu’au limbe, après une ouverture chirurgicale de 1 mm réalisée à 12 mm en arrière de la cornée. Les impacts étaient alors appliqués, la sonde étant positionnée perpendiculairement au limbe. Une fois la perforation obtenue, attestée par l’observation du faisceau lumineux dans la chambre antérieure, la sonde était retirée et la conjonctive suturée.
Comme les techniques de trabéculotomie au laser, toutes ces méthodes paraissent avoir fait long feu, et la littérature du xxie siècle ne les mentionne plus. Toutefois, l’intérêt d’une telle approche thérapeutique pourrait être relancé grâce à l’extrême précision apportée par le laser femtoseconde, comme en attestent quelques travaux préliminaires [6].
[1] Babighian S, Caretti L, Tavolato M, et al. Excimer laser trabeculotomy vs 180 degrees selective laser trabeculoplasty in primary open-angle glaucoma. A 2-year randomized, controlled trial. Eye (Lond). 2010 ; 24 : 632-8.
[2] Dutton GN, Allan D, Cameron SA. Pulsed neodymium-YAG laser trabeculotomy : energy requirements and replicability. Br J Ophthalmol. 1989 ; 73 : 177-81.
[3] Iwach AG, Hoskins HD, Drake MV, Dickens CJ. Subconjunctival THC : YAG (“holmium”) laser thermal sclerostomy ab externo. A one-year report. Ophthalmology. 1993 ; 100 : 356-65 ; discussion : 365-6.
[4] Latina MA, Melamed S, March WF, et al. Gonioscopic ab interno laser sclerostomy. A pilot study in glaucoma patients. Ophthalmology. 1992 ; 99 : 1736-44.
[5] Palacz O, Sylwestrzak Z, Palacz A. Efficiency of Nd-YAG laser trabeculotomy in open-angle glaucoma [article en polonais]. Klin Oczna. 1994 ; 96 : 148-50.
[6] Sun H, Kurtz R, Juhasz T. Evaluation of human sclera after femtosecond laser ablation using two photon and confocal microscopy. J Biomed Opt. 2012 ; 17 : 081411 (1-5).
[7] Venkatesh S, Lee WR, Guthrie S, et al. An in vitro morphological study of Q-switched neodymium/YAG laser trabeculotomy. Br J Ophthalmol. 1986 ; 70 : 89-96.
[8] Wilmsmeyer S, Philippin H, Funk J. Excimer laser trabeculotomy : a new, minimally invasive procedure for patients with glaucoma. Graefes Arch Clin Exp Ophthalmol. 2006 ; 244 : 670-6.
C. Lamirel, I. Cochereau
-
La pneumotrabéculoplastie reproduit l’effet de l’anneau de succion du Lasik.
-
Le traitement est appliqué pendant une minute et répété une seconde fois à 5 minutes d’intervalle. Un retraitement est réalisé à une semaine d’intervalle, puis à trois mois ou en fonction de la remontée pressionnelle.
-
Les effets indésirables sont souvent mineurs à modérés, et transitoires : hyperhémie conjonctivale, hémorragie sous-conjonctivale, douleur ou un inconfort oculaire, flou visuel, larmoiement.
L’idée de la pneumotrabéculoplastie (PNT) est née à la suite de la constatation d’une baisse pressionnelle après chirurgies de Lasik. Si cette baisse est linéairement corrélée avec l’épaisseur cornéenne photo-ablatée, il y a un effet sur la pression intra-oculaire (PIO) même en l’absence de photo-ablation [6]. Différentes hypothèses ont été suggérées pour expliquer cet effet : artéfacts, modifications de la rigidité cornéenne, rupture de la membrane de Bowman, etc. Cependant, certains auteurs ont proposé que ce soit l’anneau de succion qui agisse sur la PIO, soit par effet mécanique direct sur le trabéculum, soit par la libération de médiateurs comme des métalloprotéases [1]. Pour faire baisser la PIO en reproduisant l’effet de succion du Lasik, ils ont conçu un anneau de succion connecté à une pompe à vide qui se positionne en regard du limbe cornéoscléral pour obtenir le maximum d’effet en regard du trabéculum.
TECHNIQUE
Le matériel comprend une unité centrale qui contient la pompe à vide, une tubulure et un anneau de succion à usage unique. L’emballage de cet anneau comporte un code-barres unique qui doit être scanné par l’unité centrale pour autoriser le traitement afin d’éviter la réutilisation d’un anneau de succion pour plusieurs patients. Cet anneau est ensuite connecté à la tubulure et celle-ci à l’unité centrale. La puissance d’aspiration est fixe (22 mmHg) et seule la durée du traitement doit être programmée sur l’unité centrale. Les recommandations sont une durée de traitement de 60 secondes. Le traitement est réalisé sur un patient en position allongée après anesthésie locale. L’anneau est posé à la surface de l’œil en regard du limbe en vérifiant qu’il ne déborde pas en cornée claire pour éviter une ulcération épithéliale cornéenne (fig. 16-9). La pompe à vide est alors déclenchée pendant la durée de traitement programmée. Il faut veiller à bien déplisser les culs-de-sac conjonctivaux supérieur et inférieur pour obtenir une étanchéité immédiate sans difficulté. La succion est contrôlée par la mesure de la dépression affichée sur la machine en mmHg, et le bruit de la pompe à vide se modifie lorsque l’étanchéité est obtenue. Une légère mydriase est parfois visible pendant le traitement. Ce dernier est appliqué deux fois à 5 minutes d’intervalle, et les deux yeux peuvent être traités dans le même temps.
Il est recommandé de réaliser deux traitements à une semaine d’intervalle, puis de retraiter à trois mois ou en fonction de la remontée pressionnelle. Le traitement post-PNT consiste en un antibiotique et un anti-inflammatoire non stéroïdien topiques pendant une semaine.
RÉSULTATS
Les résultats de cette technique sont essentiellement rapportés par des séries ou des études sans groupe témoin. Sur une série de 177 patients glaucomateux avec une PIO initiale moyenne de 23,4 mmHg, la PIO moyenne après traitement par PNT était de 17,1 mmHg avec un recul moyen de deux ans [1]. Lors d’une étude prospective ouverte sur 37 patients sans traitement concomitant, les deux yeux ont été traités par PNT avec un mois d’écart [2]. L’effet sur le premier œil était maximal le lendemain de la première séance de PNT, avec une baisse moyenne de 3,9 mmHg pour une PIO initiale de 24,7 mmHg alors que, à un mois, la PIO moyenne était de 23,8 mmHg sans différence significative par rapport à la PIO initiale. Sur le 2e œil, la baisse pressionnelle était maximale trois mois après le traitement de cet œil avec une baisse de 2,1 mmHg pour une PIO initiale de 23,6 mmHg. Une autre étude multicentrique ouverte a évalué la PNT chez 63 patients consécutifs ayant des PIO entre 20 et 25 mmHg lors de l’inclusion : l’œil avec la PIO la plus élevée était traité par PNT et l’œil avec la PIO la plus basse servait de contrôle [3]. Avec un mois de suivi, la PIO de l’œil traité par PNT diminuait de 22,2 à 18,9 mmHg, tandis que la PIO de l’œil non traité diminuait également de 20,7 à 18,9 mmHg. Jusqu’à six mois de recul, les PIO de l’œil traité et non traité n’étaient pas significativement différentes. Toutes ces études souffrent de biais méthodologiques et statistiques, en particulier de type « régression vers la moyenne » et, pour certaines, de conflits d’intérêts.
Seules deux études prospectives randomisées avec un groupe témoin ont été publiées [7, 8]. La première étude a comparé l’efficacité de la PNT par rapport à celle du latanoprost chez 36 patients ayant une PIO supérieure 20 mmHg malgré un traitement par timolol 0,5 %. Les PIO initiales des deux groupes étaient similaires : 23,4 mmHg pour le groupe PNT et 23,5 mmHg pour le groupe latanoprost. À un mois, la baisse pressionnelle était plus forte dans le groupe latanoprost (– 28 %) que dans le groupe PNT (– 19 %). Dans le groupe PNT, 61 % des patients avaient une baisse pressionnelle supérieure ou égale à 20 % à un mois, mais ils n’étaient plus que 33 % à trois mois et 6 % à six mois. Dans le groupe latanoprost, la proportion de patients avec une baisse pressionnelle supérieure ou égale à 20 % était de 94, 89 et 89 % respectivement à un, trois et six mois. Une seconde étude a comparé la PNT à la trabéculoplastie au laser argon (TLA) chez 32 patients non contrôlés par bithérapie (PIO > 20 mmHg) [7]. Les PIO initiales étaient comparables entre les deux groupes : 23,4 mmHg pour le groupe PNT, et 23,5 mmHg pour le groupe TLA. À un mois, la PIO était de 20,4 mmHg dans le groupe PNT et de 17,8 mmHg dans le groupe TLA. La proportion de patients avec une baisse pressionnelle supérieure ou égale à 20 % était de 31 % à un mois, de 6 % à trois mois et de 0 % à six mois dans le groupe PNT contre 81 % à un mois, 75 % à trois mois et 63 % à six mois dans le groupe TLA.
Ces résultats avec groupes témoins montrent que si la PNT permet de diminuer la PIO de – 13 % à – 19 % à un mois, cet effet est transitoire et disparaît entre trois et six mois chez la plupart des patients. Des retraitements par PNT sont possibles, mais il n’existe pas de données fiables sur leur efficacité.
COMPLICATIONS
Les effets secondaires les plus fréquents sont une hyperhémie conjonctivale, une hémorragie sous-conjonctivale, une douleur ou un inconfort oculaire, un flou visuel, un larmoiement.
Tous ces effets indésirables sont souvent mineurs à modérés, et transitoires [4]. Un cas d’abrasion cornéenne avec œdème, un cas d’hypertonie oculaire majeure à plus de 40 mmHg et un cas de décollement de rétine ont également été rapportés [3, 5]. La PNT ne semble pas aggraver les altérations glaucomateuses structurelles ou fonctionnelles dans les études publiées.
Retenir
La PNT permet de diminuer la PIO de – 13 % à – 19 % à un mois. Cet effet est transitoire et disparaît entre trois et six mois chez la plupart des patients.
Fig. 16-9 Positionnement de l’anneau de succion sur l’œil d’une patiente. Le traitement est en cours et on devine une mydriase.
[1] Avalos Urzùa G, Bores LD, Livecchi JT. Pneumatic trabeculoplasty. A new method to treat primary open-angle glaucoma and reduce the number of concomitant medications. Ann Ophthalomol. 2005 ; 37 : 37-46.
[2] Bucci MG, Centofanti M, Oddone F, et al. Pilot study to evaluate the efficacy and safety of pneumatic trabeculoplasty in glaucoma and ocular hypertension. Eur J Ophthalmol. 2005 ; 15 : 347-52.
[3] Fogagnolo P, Rossetti L, Marchini G, et al. The effect of pneumatic trabeculoplasty on intraocular pressure : the results of a 6-month, open-label, multicenter study. Eur J Ophthalmol. 2008 ; 18 : 922-8.
[4] Pesce G, Ahmetaj M, Alessio T, et al. Ocular adverse effects of the pneumatic trabeculoplasty in patients’ treatment with open angle glaucome. Acta Ophthalmologica. 2008 ; 86 : 0. doi : 10.1111.
[5] Pesce G, Macinagrossa G, Cantatore A, et al. Retinal detachment after pneumatic trabeculoplasty : a case report. Acta Ophthalmologica. 2010 ; 88 : 9. doi : 10.1111.
[6] Sellem E. Actualités des trabéculoplasties. J Fr Ophtalmol. 2008 ; 31 : 2S78-81.
[7] Uva MG, Longo A, Reibaldi M. Pneumatic trabeculoplasty versus argon laser trabeculoplasty in primary open-angle glaucoma. Ophthalmologica. 2010 ; 224 : 10-5.
[8] Uva MG, Longo A, Reibaldi M. Pneumatic trabeculoplasty vs latanoprost as adjunctive therapy to timolol in primary open-angle glaucoma or ocular hypertension. Graefes Arch Clin Exp Ophthalmol. 2009 ; 247 : 1103-9.
F. Aptel
-
Les procédures de cyclodestruction réduisent la pression intra-oculaire (PIO) par plusieurs mécanismes (destruction de l’épithélium pigmenté et non pigmenté réduisant la production d’humeur aqueuse, inflammation du corps ciliaire réduisant également la sécrétion ciliaire, filtration d’humeur aqueuse au travers de zones de sclère amincies, augmentation du flux uvéoscléral liée à des modifications tissulaires des muscles ciliaires et de la pars plana). La réduction de la production d’humeur aqueuse due à la coagulation de l’épithélium ciliaire est probablement le mécanisme prédominant.
-
La cyclophotocoagulation par voie trans-sclérale est à ce jour la méthode de référence parmi les différentes techniques de cyclodestruction, relativement aisée à réaliser, aussi efficace mais mieux tolérée que les méthodes plus anciennes (cyclocryothérapie, etc.).
-
Les procédures de cyclophotocoagulation (lasers diode ou Nd-YAG), souvent efficaces pour réduire la PIO, présentent néanmoins encore des effets secondaires potentiels sévères qui les réservent au traitement des glaucomes réfractaires aux méthodes chirurgicales conventionnelles, ne représentant pas une alternative pouvant être proposée en deuxième intention en cas d’insuffisance du traitement médical.
-
Le principal risque à court terme des méthodes actuelles de cyclodestruction est la survenue de pics d’hypertonie, nécessitant un traitement anti-inflammatoire conséquent et prolongé, et un maintien, voire un renforcement transitoire, du traitement hypotonisant préalable.
-
Le principal risque à long terme des méthodes actuelles de cyclodestruction est la survenue d’une hypotonie majeure (PIO < 5 mmHg) avec évolution vers la phtyse du globe oculaire, nécessitant un choix prudent des paramètres de tirs, notamment lors des procédures de retraitement.
-
Un nouveau dispositif de coagulation du corps ciliaire utilisant des ultrasons focalisés de haute intensité délivrés par des transducteurs miniaturisés semble permettre une réduction importante de la PIO, sans risque de survenue des complications habituellement rencontrées avec les méthodes classiques de cyclodestruction, et pourrait donc être proposé plus tôt dans la prise en charge des glaucomes.
La pression qui règne à l’intérieur de l’œil est le fruit d’un équilibre entre la production de l’humeur aqueuse au niveau du corps ciliaire et son élimination par les voies trabéculaire et uvéosclérale. Les traitements du glaucome peuvent donc agir selon deux mécanismes : la réduction de la production d’humeur aqueuse par la destruction partielle ou l’inhibition pharmacologique du corps ciliaire ou la facilitation de l’évacuation de l’humeur aqueuse en dehors de l’œil. La plupart des traitements chirurgicaux et lasers proposés en cas de glaucome visent à faciliter l’évacuation de l’humeur aqueuse en dehors de l’œil. Cette stratégie d’abaissement de la PIO est probablement plus justifiée en termes de physiologie et de physiopathologie, car l’élévation de la PIO généralement rencontrée dans les différentes formes de glaucome est très souvent due à une gêne à l’élimination de l’humeur aqueuse, la production n’étant pas augmentée ; par ailleurs, un débit minimal de sécrétion aqueuse doit être conservé, notamment afin de maintenir les structures oculaires en état de distension afin d’éviter l’évolution du globe vers l’atrophie, et également de permettre la nutrition de plusieurs structures qui dépendent exclusivement de l’oxygène, des nutriments et des minéraux dissous dans l’humeur aqueuse (cristallin, endothélium cornéen, etc.).
Une stratégie alternative peut être de diminuer la PIO en diminuant la production d’humeur aqueuse. La cyclodestruction consiste à détruire tout ou partie du corps ciliaire afin de réduire la production d’humeur aqueuse et d’abaisser la PIO. De nombreuses méthodes physiques sont utilisées ou ont été utilisées à cette fin, aboutissant essentiellement à une nécrose de coagulation du corps ciliaire consécutive à son échauffement (lasers, micro-ondes, ultrasons, diathermie) ou à sa congélation (cryothérapie). Les méthodes les plus anciennes (diathermie, cryothérapie, etc.) présentaient deux inconvénients majeurs qui les cantonnaient au traitement des glaucomes réfractaires atteignant des yeux peu ou non fonctionnels : elles étaient peu sélectives de l’organe à traiter, entraînant souvent des dommages des structures adjacentes, et elles induisaient une relation effet/dose très inconstante, empêchant de prévoir avec précision l’effet du traitement et aboutissant souvent à une hypotonie majeure puis à une phtyse du globe. Par la suite, le développement de sources et de fibres lasers (lasers diode et Nd-YAG), permettant d’échauffer le corps ciliaire en délivrant l’énergie d’une façon plus focalisée et sélective, a permis de réduire les risques de lésions de toutes les structures adjacentes et d’améliorer la prédictibilité du traitement. Les procédures de cyclodestruction par lasers diode ou Nd-YAG, souvent efficaces pour réduire la PIO, présentent néanmoins encore des effets secondaires potentiels qui les réservent au traitement des glaucomes réfractaires aux méthodes chirurgicales conventionnelles. Elles ne sont pas une alternative pouvant être proposée en deuxième intention en cas d’insuffisance du traitement médical.
Un dispositif de coagulation du corps ciliaire utilisant des ultrasons focalisés de haute intensité délivrés par des transducteurs miniaturisés a été développé ces dernières années afin d’éviter les effets secondaires de toutes les méthodes précédentes. Les premiers essais cliniques ont montré une très bonne tolérance de cette méthode, suggérant une utilisation possiblement plus précoce dans la stratégie thérapeutique que les méthodes précédentes, sans doute en alternative aux chirurgies filtrantes, ou même avant celles-ci.
La cyclodiathermie consistait à brûler le corps ciliaire à l’aide d’un courant électrique (tension de 40 mV environ). La cyclodiathermie non perforante (électrode au contact de la sclère) a été proposée par Weve en 1933 [56]. Ultérieurement, la technique a été modifiée par Vogt [53] qui a développé une électrode perforant la sclère et atteignant la base du corps ciliaire. L’électrode était placée 1,5 à 2,5 mm en arrière du limbe, avec des applications réparties en deux rangées de 180°. Les études histologiques montraient une nécrose de coagulation étendue des procès ciliaires et de la base du corps ciliaire, mais également de la pars plicata, de la pars plana et de la sclère adjacente [34]. Les lésions sclérales pouvaient aboutir à un amincissement de la sclère, voire à une perforation de celle-ci. Le risque était aussi que les lésions s’étendent de façon postérieure à la sclère et à la rétine, avec une dégénérescence nécrotique et microkystique de ces tissus. Cette technique a été progressivement abandonnée car les résultats pressionnels étaient médiocres et imprévisibles, et les complications trop importantes (inflammation majeure, hypertonie réactionnelle, baisse importante de l’acuité visuelle, hypotonie liée à l’écoulement liquidien au travers des sites scléraux fragilisés, évolution fréquente vers la phtyse du globe oculaire) [1]. L’incidence de la phtyse oculaire était d’environ 5 % des yeux traités après cyclodiathermie.
CYCLOCOAGULATION PAR MICRO-ONDES
L’utilisation d’un générateur de micro-ondes pour réaliser un échauffement puis une nécrose partielle du corps ciliaire a été étudiée dans les années 1990 aux États-Unis [18, 19]. Plusieurs impacts étaient réalisés de façon circonférentielle. Des études in vivo animales, puis réalisées sur des yeux destinés à être énucléés (fig. 16-10), ont montré une nécrose de coagulation relativement sélective de l’épithélium ciliaire, sans atteinte des structures adjacentes. Cette méthode est restée au stade expérimental, sans utilisation clinique ultérieure.
IRRADIATION BÊTA
Haik et al. [22] ont rapporté en 1948 l’utilisation d’un radio-élément émetteur de radiations bêta (radium), placé au contact de la sclère de façon à entourer le corps ciliaire, expérimentalement chez des lapins et sur un patient humain. Cette méthode ne semblait pas être parfaitement tolérée, aboutissant notamment à la formation de cataractes radio-induites, et n’a pas donné lieu à d’autres utilisations ou développements.
EXCISION CHIRURGICALE DU CORPS CILIAIRE
L’excision chirurgicale d’une portion du corps ciliaire, par voie interne ou par voie externe sous un volet scléral, a été rapportée dans plusieurs séries, notamment pour le traitement du glaucome de l’aphake réfractaire [43]. Les taux de succès semblaient être relativement élevés, mais la procédure chirurgicale était souvent longue et complexe, source de complications potentiellement graves et relativement fréquentes (issue de vitré, décollement de rétine, hémorragie expulsive).
Fig. 16-10 Application d’un générateur de micro-ondes en regard du corps ciliaire. (Source : Finger et al., 1995 [18]. Reproduit avec l’autorisation de BMJ Publishing Group Ltd.)
PRINCIPES ET MÉCANISMES D’ACTION
Introduite par Bietti en 1950, elle consiste à détruire les procès ciliaires en les gelant à l’aide d’une cryode en oxyde nitreux ou en carbone dioxyde de plus de 2,5 mm de diamètre, à une température de – 80 °C, ce qui permet un gel des procès ciliaires étendu sur 3 à 4 mm [7]. La congélation du corps ciliaire entraîne sa destruction par un double mécanisme. Le refroidissement des tissus aboutit à une déshydratation intracellulaire aiguë de l’épithélium qui se sépare du stroma, et un infarcissement hémorragique du stroma qui se nécrose, consécutif à l’interruption de la circulation capillaire. Cette nécrose ischémique transforme les procès ciliaires en un tissu fibreux dépourvu d’épithélium ciliaire fonctionnel [46].
PROTOCOLE
Le traitement est réalisé à l’aide d’une cryode en oxyde nitreux ou en carbone dioxyde de 2,5 à 4 mm [41]. Le bord antérieur de la cryode est placé à environ 1-1,5 mm du limbe. Une transillumination peut être utilisée pour aider au positionnement de la cryode [52]. Cette dernière doit être fermement appliquée contre la sclère, de façon à faciliter le refroidissement des tissus sous-jacents. Six à dix applications d’une durée d’environ 60 secondes sont appliquées sur 180° à 270° de la circonférence du corps ciliaire. Certains opérateurs suggéraient de ne pas réaliser des sessions de plus de six applications sur 180° de façon à limiter le risque de phtyse et de nécrose du segment antérieur. Une réaction inflammatoire importante et douloureuse est fréquente après cyclocryothérapie. L’administration à hautes doses et prolongée d’anti-inflammatoires stéroïdiens et de cycloplégiques est recommandée.
EFFICACITÉ ET TOLÉRANCE
Une étude américaine incluant 50 yeux présentant un glaucome néovasculaire rapporte un taux de succès (PIO < 26 mmHg) de 68 % lors du dernier suivi [30]. Dans une étude plus récente, Caprioli et al. [12] ont traité puis suivi, pendant une durée moyenne de 29 mois, 96 yeux atteints de glaucomes de l’aphake, de glaucomes néovasculaires et de glaucomes primitifs à angle ouvert. La PIO était inférieure à 21 mmHg chez 76 % des yeux atteints de glaucomes primitifs à angle ouvert, 68 % des yeux atteints de glaucomes de l’aphake et 55 % des yeux atteints de glaucomes néovasculaires.
Les complications de la cyclocryothérapie sont nombreuses et fréquentes. Un traitement de plus de 180° expose à une nécrose du segment antérieur et majore le risque de phtyse notamment dans les cas de glaucomes néovasculaires, postuvéitiques ou les glaucomes de l’aniride. Un placement trop antérieur de la sonde expose à des altérations iriennes ou cristalliniennes et risque d’altérer l’endothélium cornéen et les voies d’écoulement de l’humeur aqueuse en rétrécissant la lumière du canal de Schlemm, ce qui compromet le résultat pressionnel. Un placement trop postérieur de la sonde expose quant à lui à un risque de fibrose sous-rétinienne. Les complications sont essentiellement inflammatoires, responsables de douleurs, d’hypertonie réactionnelle, de baisse visuelle (30 à 70 %) et de phtyse (3 à 34 %) [6]. Elles sont plus fréquentes en cas de glaucomes néovasculaires. Du fait de la fréquence des complications, cette technique a maintenant été quasiment abandonnée.
PRINCIPES ET MÉCANISMES D’ACTION
L’utilisation des ultrasons de haute intensité (10 kW/cm2) pour coaguler le corps ciliaire a été étudiée vers la fin des années 1980 et le début des années 1990 [11, 15, 16, 35, 40, 45, 47-49]. Un avantage spécifique des ultrasons est que l’énergie peut être focalisée au travers de tissus non optiquement transparents, réduisant ainsi les risques d’absorption non désirée de l’énergie du faisceau ultrasonore, et donc les effets sur les tissus adjacents. De même, le dépôt d’énergie et l’élévation thermique au niveau des tissus traités ne dépendent pas de la pigmentation des tissus, qui peut varier grandement, surtout au niveau du corps ciliaire. À l’inverse des micro-ondes, les ultrasons sont peu absorbés par les tissus contenant beaucoup d’eau, tels que le vitré et l’humeur aqueuse, réduisant le risque d’échauffement de ces compartiments.
Le premier dispositif utilisant les ultrasons de haute intensité et permettant de coaguler le corps ciliaire a été développé dans les années 1980 par Lizzi (Riverside Research Institute, New York) et Coleman et ses collaborateurs (Cornell University Medical College, New York). Ces travaux ont abouti à la commercialisation d’un dispositif (Sonocare CST-100 Therapeutic Ultrasound System, Sonocare Inc., Ridgewood, New Jersey) qui fut l’un des premiers dispositifs thérapeutiques utilisant les ultrasons thérapeutiques autorisés par les autorités (Food and Drug Administration).
Le Sonocare comportait un module de commande électronique (générateur) et un transducteur situé à l’extrémité d’un bras articulé. Le transducteur était composé d’une zone focalisée destinée à générer le faisceau permettant l’échauffement des tissus au point focal, d’un transducteur diagnostique (A-scan) permettant de déterminer la distance (z) entre le point focal et la cible (corps ciliaire), et d’une fibre optique pour déterminer la position (x, y) à la surface de la sclère. Le transducteur destiné au traitement était une coupole composée de céramique PZT (titano-zirconate de plomb) de 1,46 mm d’épaisseur, avec une fréquence fondamentale de 1,5 MHz et une fréquence de travail de 4,5 MHz. Le transducteur utilisé pour les études animales avait un diamètre de 42 mm, une distance focale de 90 mm, et induisait une zone focale de 14,9 mm de longueur axiale et de 0,6 mm de longueur transverse [15]. Les durées de tirs variaient de 1 à 5 secondes, avec une fluence de 100 à 2 000 W/cm2 au point focal. Les études histologiques réalisées lors de différentes études animales retrouvaient des amincissements localisés de la sclère, avec une conjonctive intacte en regard des zones d’amincissement, et une interruption et une perte de l’épithélium ciliaire au voisinage des zones traitées. À moyen terme, les fibrilles de grand diamètre de la sclère normale étaient remplacées par un tissu cicatriciel composé de fibrilles de plus petits diamètres et produit par des fibroblastes [40]. Il a été supposé que ces lésions sclérales pouvaient être responsables d’un passage direct de l’humeur aqueuse au travers de la sclère amincie.
PROTOCOLE
Plusieurs études cliniques ont été réalisées avec le Sonocare [11, 16, 35, 40, 45, 47, 49]. Le transducteur utilisé pour les études humaines avait un diamètre de 80 mm, une distance focale de 90 mm, et induisait une zone focale de 3 mm de longueur axiale et de 0,4 mm de longueur transverse. Les durées de tirs variaient de 1 à 5 secondes, avec une fluence de 800 à 4 800 W/cm2 au point focal.
Un bain de couplage constitué de sérum physiologique tiède devait être mis en place en collant une feuille de plastique sur la peau du patient, autour de l’œil à traiter. À l’aide de la fibre optique et de la sonde d’imagerie, le bras articulé devait être positionné manuellement. La sonde devait être déplacée manuellement entre chaque impact, et la vérification du positionnement devait être répétée avant chaque nouvel impact.
RÉSULTATS
Maskin et al. [35] ont obtenu une réduction de 38,4 % de la PIO huit mois après cyclodestruction sur 158 yeux présentant un glaucome réfractaire. Avec le même appareil, Sterk et al. [47] ont obtenu une réduction de 42,2 % de la PIO trois à quatre mois après cyclodestruction sur 44 yeux atteints de glaucomes réfractaires. En utilisant le Sonocare pour traiter des bulles de filtration non fonctionnelles, Denis et Valtot [48] ont obtenu un contrôle pressionnel satisfaisant pour 75,2 % de 62 yeux trois mois après traitement. Le taux de succès était plus élevé pour les yeux phakes que pour les yeux aphakes ou pseudo-phakes (82 versus 68 %).
Du fait de la complexité et de la longueur de la procédure, l’utilisation du Sonocare a été progressivement abandonnée au milieu des années 1990. Par ailleurs, les complications de cette procédure étaient fréquentes. L’hypertonie réactionnelle était pratiquement constante et souvent majeure, imposant la prescription systématique d’un traitement hypotonisant par voie générale en postopératoire immédiat ainsi qu’une surveillance tensionnelle rigoureuse. Les lésions des structures voisines du corps ciliaire, notamment de la cornée, de la sclère et de la conjonctive, étaient fréquentes, probablement du fait de la difficulté de positionnement du transducteur, et se traduisaient par des ulcères de cornée, des brûlures ou des nécroses conjonctivales, des ectasies et des perforations sclérales [15, 16, 45]. D’autres complications telles qu’une inflammation chronique, le développement d’une cataracte et une baisse d’acuité visuelle étaient parfois décrites. Une revue des différentes études cliniques publiées montre des taux de complications variant de 9,5 à 43 % (baisse d’acuité visuelle), 9,5 à 22 % (uvéite chronique), 5 à 13 % (brûlures cornéosclérales) et 1,4 à 4 % (phtyse) [11, 16, 35, 45, 47-49].
La photocoagulation du corps ciliaire peut se faire soit par voie externe, trans-sclérale ou transpupillaire, soit par voie interne endoscopique, et à l’aide de différentes sources lasers (diode, argon, Nd-YAG).
PRINCIPES ET MÉCANISMES D’ACTION
Cyclophotocoagulation trans-sclérale
La photocoagulation trans-sclérale est une méthode non invasive car la photocoagulation des procès ciliaires est réalisée à l’aide de lasers dont l’énergie est transmise au corps ciliaire au travers des plans conjonctivoscléraux. Les lasers utilisés sont ceux émettant dans le proche infrarouge (laser Nd-YAG et laser semi-conducteur diode), car leur longueur d’onde est bien transmise par la sclère et bien absorbée par les mélanocytes du corps ciliaire.
Les lasers Nd-YAG délivrent un faisceau d’une longueur d’onde de 1 064 nm qui a l’avantage de traverser la sclère et la conjonctive en étant peu absorbé et peu diffusé (les phénomènes de diffusion, mécanisme prédominant de l’atténuation dans la sclère, sont inversement proportionnels au cube ou à la puissance quatre de la longueur d’onde d’une onde électromagnétique). L’énergie peut être délivrée de façon continue ou pulsée, et transmise par un système non contact (lampe à fente) ou contact (fibre optique). À ce jour, il semble néanmoins qu’aucun système de cyclophotocoagulation par laser Nd-YAG ne soit plus commercialisé en Europe.
Les lasers diode délivrent un faisceau d’une longueur d’onde de 800 à 850 nm, qui a l’inconvénient d’être plus diffusé par la sclère que les faisceaux issus de lasers Nd-YAG (longueur d’onde plus courte), mais l’avantage d’être plus absorbé par la mélanine (spectre d’absorption décroissant de 400 à 1 000 nm). Le principal dispositif permettant une coagulation du corps ciliaire par laser diode est le laser Oculight SLx (Iris Medical Instruments), délivrant un faisceau d’une longueur d’onde de 810 nm, en mode continu, avec une puissance maximale de 3,0 W et un temps de tir maximal de 9,9 secondes.
Plusieurs mécanismes sont proposés pour expliquer la réduction de PIO après cyclophotocoagulation, notamment une réduction de la production d’humeur aqueuse par destruction de l’épithélium ciliaire et/ou par réduction de la vascularisation ciliaire, et une augmentation de l’évacuation, par filtration au travers d’une sclère amincie et/ou par augmentation du flux aqueux uvéoscléral lié au remodelage et à la rétraction des tissus situés au voisinage de la jonction entre la sclère et la choroïde [10, 36, 38, 50]. Les études histologiques réalisées sur des yeux animaux ou humains traités par cyclophotocoagulation trans-sclérale montrent de façon quasiment constante une nécrose de coagulation des procès ciliaires, avec disparition du double épithélium ciliaire, parfois destruction de la lame basale de l’épithélium, distension de fibres de collagène du stroma et déplétion vasculaire du stroma pouvant aller jusqu’à une interruption complète de la vascularisation [36, 38, 50]. Certaines études, réalisées notamment après cyclophotocoagulation au laser diode, semblent également montrer un effet disruptif sur les tissus du corps ciliaire, avec un détachement important de l’épithélium ciliaire du reste du stroma qui semble lui, dans ce cas, être relativement préservé [25, 36]. Des études réalisées plusieurs mois après cyclophotocoagulation montrent une atrophie quasiment complète des procès ciliaires, une fibrose du stroma ciliaire et parfois une hyperplasie, voire une repousse, de l’épithélium ciliaire. Dans ce cas, il a été suggéré que le processus de régénération de l’épithélium résultait d’une recolonisation d’une membrane basale intact par des cellules provenant de régions non traitées ou de la base des cryptes ciliaires [36]. Le néo-épithélium ciliaire semble pouvoir être sécrétant.
Cyclophotocoagulation endoscopique
La photocoagulation endoscopique est une méthode invasive nécessitant l’ouverture du globe oculaire pour y introduire une fibre optique qui amène l’énergie laser au contact des procès ciliaires [20]. Un dispositif commercialisé associe de façon coaxiale une fibre optique reliée à un laser diode délivrant une puissance maximale de 1,2 W, une fibre optique reliée à une caméra vidéo et une fibre optique reliée à une source lumineuse (EndoOptiks Inc.). L’endoscope muni du guide lumineux est introduit dans la chambre postérieure afin de permettre une photocoagulation directe des procès ciliaires (distance focale d’environ 0,75 mm). Les lésions histologiques semblent relativement comparables à celles observées après cyclophotocoagulation trans-sclérale.
Cyclophotocoagulation transpupillaire
La photocoagulation directe des procès ciliaires au laser argon et par voie transpupillaire est possible dans d’exceptionnelles situations anatomiques telles que, par exemple, une aniridie ou une iridodialyse étendue [32]. Les études histologiques montrent également une nécrose de coagulation des procès ciliaires, mais sans atteinte des zones les plus externes du corps ciliaire [32].
PROTOCOLE
Cyclophotocoagulation trans-sclérale
Lors du traitement direct (laser Nd-YAG), le laser est monté sur la lampe à fente et le faisceau est défocalisé sur la sclère afin d’être focalisé 1,5 mm en profondeur au niveau du corps ciliaire (laser Nd-YAG Microruptor II de Lasag ; impacts de 5 J, 250 ms, répartis sur le corps ciliaire). Lors du traitement à l’aide d’un laser Nd-YAG muni d’une fibre optique, l’énergie laser chemine au travers d’une fibre optique qui vient prendre appui sur la sclère, environ 1,2 à 1,5 mm en arrière du limbe, en regard des procès ciliaires : laser Nd-YAG ; Crystal Focus Emerald (32 impacts : 7 W, 0,7 s) ; Microruptor III de Lasag (24 impacts : 10 W, 0,2 s).
Lors du traitement par voie trans-sclérale réalisée à l’aide d’un laser semi-conducteur à diode, l’énergie peut être délivrée à l’aide d’une fibre optique placée directement 1,2 à 1,5 mm en arrière du limbe, nécessitant un système de mesure (compas, réglettes, etc.), ou à l’aide d’une sonde dédiée dont la forme épouse la conjonctive en arrière du limbe, plaçant directement l’extrémité de la fibre optique 1,2 mm en arrière du limbe (fig. 16-11). Le traitement est généralement débuté avec une puissance de 1 750 à 2 000 mW et une durée de 2 secondes par tir. En cas d’audition d’un « pop », la puissance est diminuée par paliers de 250 mW jusqu’à la disparition de ce phénomène. En l’absence d’audition, la puissance est augmentée par paliers de 250 mW jusqu’à son audition, puis diminuée de 250 mW afin de se situer juste en dessous du seuil d’apparition. Il est néanmoins fréquent de ne pas pouvoir entendre ce phénomène témoignant probablement de l’effet disruptif du faisceau laser sur les tissus du corps ciliaire. Dans ce cas, il peut être recommandé de ne pas augmenter les paramètres de tir au-delà de 2 500 à 2 750 mW de puissance et trois secondes de tir, sauf sur des yeux très faiblement pigmentés. Il faut également signaler que certains opérateurs, préférant favoriser la coagulation des tissus et éviter l’effet disruptif, utilisent une faible puissance (1 250 à 1 500 mW) mais avec des durées de tir plus longues (environ 4 secondes).
La première séance de cyclophotocoagulation est classiquement réalisée en traitant 270 à 300° de la circonférence du corps ciliaire, par l’application de 15 à 20 tirs. Il est sans doute souhaitable d’éviter les méridiens de 3 et 9 heures, zones préférentielles de pénétration des artères ciliaires longues postérieures, afin de réduire le risque d’ischémie du segment antérieur. En cas de retraitement, il est conseillé de diminuer le nombre de tirs, afin de réduire le risque d’hypotonie, qui augmente à chaque séance supplémentaire.
Un traitement postopératoire anti-inflammatoire et cycloplégique prolongé doit être prescrit (par exemple, dexaméthasone collyre quatre à six fois par jour et atropine deux fois par jour pendant une durée minimale de un mois, éventuellement complété d’injections sous-conjonctivales). Il est préférable de poursuivre, voire renforcer, le traitement hypotonisant préopératoire, puis de le diminuer progressivement à distance lors de la baisse de la PIO.
Cyclophotocoagulation endoscopique
Elle peut être réalisée par un abord limbique. Après réalisation d’une incision de petite taille (sonde de 20 gauges, c’est-à-dire environ 0,81 mm), un produit viscoélastique est introduit en chambre antérieure puis en chambre postérieure de façon à déplacer en avant l’iris, permettant ensuite un abord direct des procès ciliaires sans contact de la sonde avec la face antérieure du cristallin si l’œil est phake. Si l’œil a été préalablement vitrectomisé ou si la procédure est précédée d’une vitrectomie, un abord par la pars plana est possible (3,5 à 4 mm en arrière du limbe).
Le dispositif est positionné de façon à voir les procès ciliaires (champ de vue de 70° permettant de voir cinq à huit procès). Un faisceau laser rouge de visée permet de visualiser la zone à traiter. La distance focale est de 0,75 mm. Le traitement est généralement débuté avec une puissance de 400 à 600 mW et une durée de 1,5 à 2 secondes par tir. En cas d’audition d’un « pop », la puissance est diminuée par paliers de 50 mW jusqu’à la disparition de ce phénomène. En l’absence d’audition, la puissance est augmentée par paliers de 50 mW jusqu’à son audition, puis diminuée de 50 mW afin de se situer juste en dessous du seuil d’apparition. Une incision d’abord permet le traitement de 120 à 180° de la circonférence, étendue généralement suffisante en première intention. Après la procédure, le produit viscoélastique doit être soigneusement retiré, afin de minimiser les risques de pics d’hypertonie après la procédure.
Cyclophotocoagulation transpupillaire
Le verre central du verre à trois miroirs de Goldmann peut être utilisé. Une taille de spot de 100 à 300 μm, une durée de tirs de 100 à 200 ms et une puissance élevée (500 à 1 000 mW) sont utilisées de façon à provoquer un blanchiment des procès ciliaires. Environ la moitié (180°) de la circonférence du corps ciliaire est traitée en première intention, avec environ trois à cinq spots par procès de façon à traiter toute la longueur de ceux-ci.
RÉSULTATS
Efficacité
Le résultat pressionnel est obtenu généralement entre une et quatre semaines après le traitement. Il est souvent nécessaire de pratiquer une ou plusieurs séances supplémentaires de laser pour obtenir un résultat pressionnel satisfaisant. La cyclophotocoagulation trans-sclérale au laser diode, qui est maintenant la technique la plus utilisée, permet des résultats satisfaisants en termes d’efficacité avec, dans souvent plus de deux tiers des cas, une PIO inférieure à 22 mmHg les premières années suivant le traitement (tableau 16-5). Les taux de succès à long terme (cinq ans ou plus) sont plus limités, souvent inférieurs à 50 %.
Tolérance
Les complications de la cyclophotocagulation sont moins fréquentes que celles des méthodes plus anciennes (diathermie, cryothérapie, etc.), mais restent suffisamment fréquentes pour limiter son utilisation au traitement des glaucomes réfractaires aux traitements chirurgicaux conventionnels (tableau 16-6). À court terme, la survenue de pics d’hypertonie est relativement fréquente (élévation de plus de 10 mmHg par rapport à la PIO préopératoire dans 10 à 20 % des cas). À long terme, la complication la plus fréquente est la baisse d’acuité visuelle (30 % des cas environ), liée soit au mauvais contrôle pressionnel (hypotonie ou hypertonie) et à la progression de la neuropathie optique, soit au développement d’une cataracte, d’un œdème maculaire cystoïde ou encore à une possible phototoxicité rétinienne du rayonnement laser. Les taux de pthyse sont de l’ordre de 0,5 à 7 % des cas, mais nettement plus fréquents en cas de retraitement ou sur les yeux multi-opérés.
Fig. 16-11 Sonde G probe destinée à la cyclophotocoagulation trans-sclérale, dont une extrémité épouse la forme du globe et l’autre est reliée à une fibre optique elle-même reliée à une source laser diode. (D’après Weinreb et al., 1998 [55].)
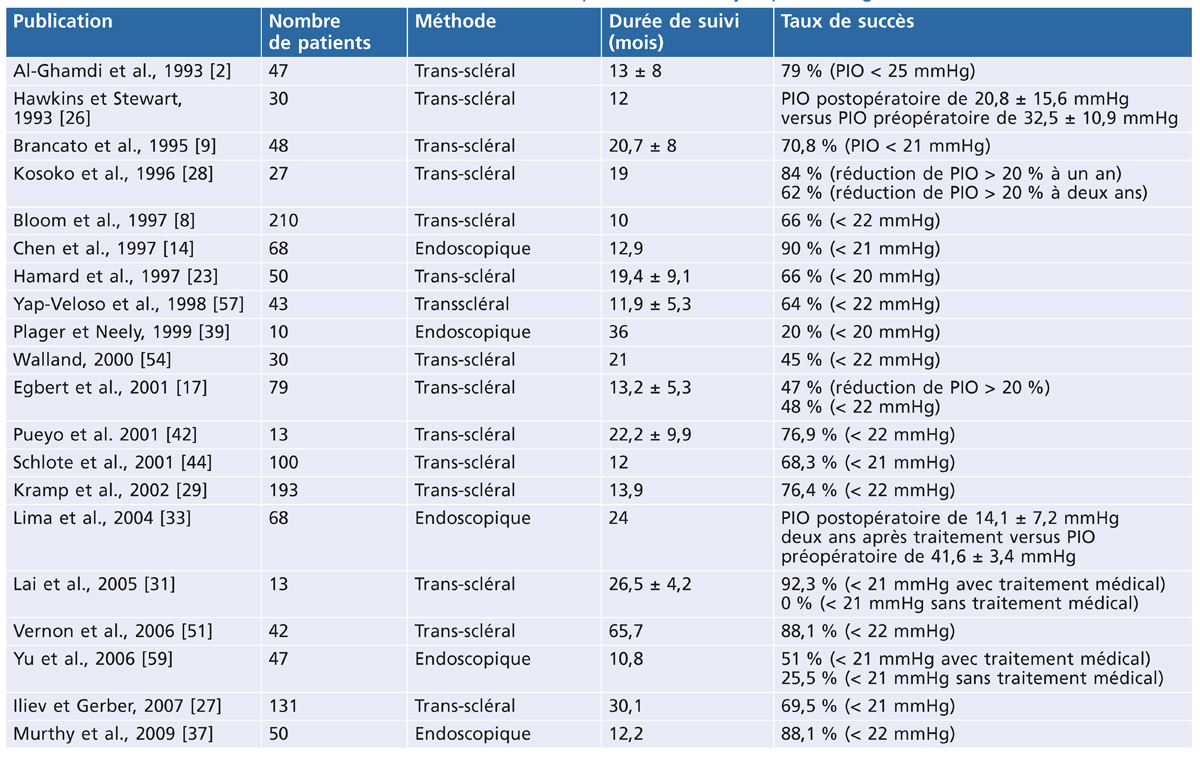
Tableau 16-5 Revue de la littérature : taux de succès des procédures de cyclophotocoagulation.
Tableau 16-6 Revue de la littérature : incidence des complications après cyclophotocoagulation.
PRINCIPES ET MÉCANISMES D’ACTIONS
Lorsque les ultrasons sont utilisés à forte puissance (environ 10 000 fois plus élevée dans le cas des ultrasons thérapeutiques que dans le cas de l’imagerie médicale) et lorsque le faisceau formé par les ultrasons est convergent, la concentration de l’énergie ultrasonore en un point focal de petite taille entraîne un échauffement important, rapide et très localisé, aboutissant généralement en une nécrose de coagulation des tissus au niveau du point focal. On parle d’ultrasons focalisés de haute intensité ou d’ultrasons thérapeutiques. La destruction des tissus est immédiate, précise et rapide. La zone à traiter est complètement coagulée, alors que toutes les structures voisines restent intactes. Le faisceau d’ultrasons traverse les tissus sans les léser, et de ce fait ce traitement peut être réalisé par voie externe, sans incision chirurgicale des tissus (traitement non invasif).
Un dispositif de coagulation du corps ciliaire utilisant des ultrasons focalisés de haute intensité délivrés par des transducteurs miniaturisés et travaillant à très haute fréquence a été développé ces dernières années afin d’éviter les effets secondaires de toutes les méthodes de cyclodestruction plus anciennes [3-5, 13]. Des simulations numériques réalisées à partir des caractéristiques anatomiques des yeux animaux et humains et des paramètres régissant l’interaction des ultrasons avec les tissus des différents constituants de l’œil ont permis d’établir que l’utilisation de six transducteurs travaillant à une fréquence élevée et disposés sur un berceau circulaire permettait de générer rapidement une élévation thermique importante, jusqu’à 80 °C, limitée au corps ciliaire [4, 13]. Un exemple de ces lésions obtenues dans un gel thermosensible transparent est représenté à la eFigure 16-1.
L’intérêt des ultrasons focalisés de haute intensité délivrés par des transducteurs miniaturisés intégrés dans un dispositif circulaire a ensuite été exhaustivement évalué in vivo sur des yeux de lapins. Ce modèle animal a été choisi du fait des similitudes anatomiques entre les yeux de lapins et les yeux humains, et également pour sa facilité d’utilisation. Une réduction significative et importante de la pression a été obtenue (parfois plus de 50 % de la PIO initiale) quatre semaines après traitement, en coagulant les parties intermédiaires et distales des procès ciliaires [4]. La réduction pressionnelle était significativement plus importante lorsque le corps ciliaire a été traité de façon circonférentielle en activant les six secteurs du dispositif. Après sacrifice des animaux, l’examen histologique montrait une nécrose de coagulation des parties intermédiaires et distales des procès ciliaires, avec perte de l’épithélium bistratifié et présence d’un œdème et d’une congestion vasculaire du stroma ciliaire. Ces lésions de nécrose de coagulation des procès ciliaires étaient réparties de façon circonférentielle lorsque tous les six secteurs ont été activés, et de façon segmentaire lorsque tous les secteurs n’ont pas été activés. La démarcation entre les zones traitées et non traitées était souvent très nette et abrupte, avec une distance inférieure à 0,1 mm. De même, la localisation des lésions était relativement constante, et 75 à 90 % de la longueur des procès ciliaires étaient coagulés chez tous les lapins traités (fig. 16-12). Ce caractère très localisé des lésions ainsi que la reproductibilité de positionnement des lésions expliquent probablement l’absence de lésion des tissus oculaires adjacents observée en histologie.
PROTOCOLE
Un cône de couplage, en forme de cône tronqué et fait de polymère, est placé directement au contact du globe oculaire, favorisant un positionnement adéquat et constant des transducteurs, aussi bien pour le centrage que pour la distance par rapport à la sclère. À la base du cône, une fine gouttière est connectée à un système d’aspiration. L’application d’une dépression légère (environ 70 mmHg) permet d’obtenir une aspiration douce de la conjonctive bulbaire, solidarisant ainsi le cône de couplage et l’œil à traiter. Après obtention du ventousage, l’anneau – composé d’un berceau de support sur lequel sont insérés les six transducteurs – est positionné dans le cône de couplage. La cavité ainsi créée est remplie avec du sérum physiologique. Les six volumes focaux des transducteurs sont centrés sur un cercle de 11, 12 ou 13 mm. Un examen ultrabiomicroscopique est réalisé avant le traitement afin de déterminer le modèle d’anneau permettant de cibler de façon optimale le corps ciliaire. L’anneau est connecté à un module de contrôle, avec une interface permettant à l’opérateur de programmer auparavant la procédure les différents paramètres d’exposition (nombre de secteurs à être activés, fréquence, puissance acoustique, durée d’exposition et temps de pause entre chaque secteur) (fig. 16-13 et 16-14).
Les paramètres suivants sont généralement utilisés : aspiration 70 mmHg, fréquence de travail 21 MHz, nombre de secteurs activés six, puissance acoustique 2,5 à 3 W, durée de tir de 3, 4 ou 6 secondes, et temps de repos entre chaque secteur 20 secondes [3, 5]. Après traitement, il est sans doute préférable d’administrer des anti-inflammatoires stéroïdiens et/ou non stéroïdiens pendant une durée de quatre semaines.
RÉSULTATS
Une première étude clinique pilote ayant pour objectifs principaux d’évaluer la faisabilité et la sécurité de cette nouvelle méthode de traitement, ainsi que d’évaluer non exhaustivement son efficacité de façon à pouvoir estimer la taille de l’échantillon nécessaire à une étude d’envergure ultérieure, a été conduite à partir de mars 2010 en France [3]. Aucune complication n’est survenue lors du traitement. Une réduction pressionnelle moyenne de 33,9 % a été obtenue à la dernière visite de suivi. Un succès chirurgical (défini par une réduction pressionnelle supérieure ou égale à 20 % associée à une PIO supérieure à 5 mmHg) a été obtenu chez 10 des 12 patients (83,3 %) lors de la dernière visite de suivi. Aucun patient n’a présenté de pic pressionnel ou d’élévation pressionnelle majeure lors des premiers temps du suivi (élévation de plus de 10 mmHg par rapport à la pression préopératoire lors des sept premiers jours de suivi). Les examens cliniques et échographiques réalisés aux différents temps du suivi n’ont jamais mis en évidence de signes majeurs d’inflammation ni de lésions des structures autres que le corps ciliaire, notamment pas de lésion du cristallin ou de la sclère (paroi du globe oculaire). Aucun œil traité n’a développé d’hypotonie majeure ou de phtyse, qui sont des complications classiques et sévères des méthodes actuelles de cyclodestruction.
Une étude multicentrique évaluant l’efficacité à long terme et la tolérance de cette procédure sur un effectif plus important de patients atteints de glaucomes moins évolués a été débutée en avril 2011. Cette étude est réalisée avec le même dispositif que celui utilisé lors de la première étude clinique pilote, mais avec une géométrie légèrement modifiée, permettant un élargissement des six zones focales. Aucune complication n’est survenue lors du traitement. Une réduction pressionnelle moyenne de 32,7 % a été obtenue à la dernière visite de suivi. Un succès chirurgical (défini par une réduction pressionnelle supérieure ou égale à 20 % associée à une PIO supérieure à 5 mmHg) a été obtenu chez 30 des 42 patients (71,4 %) lors de la dernière visite de suivi. Aucun patient n’a présenté de pic pressionnel ou d’élévation pressionnelle majeure lors des premiers temps du suivi (élévation de plus de 10 mmHg par rapport à la pression préopératoire lors des sept premiers jours de suivi). La tolérance était également excellente, et aucun œil traité n’a développé d’hypotonie majeure ou de phtyse.
Retenir
-
La cyclodestruction consiste à détruire une portion variable du corps ciliaire, afin de réduire la production d’humeur aqueuse et d’abaisser la PIO. De nombreuses méthodes physiques sont utilisées ou ont été utilisées à cette fin, aboutissant à une nécrose de coagulation du corps ciliaire consécutive à son échauffement (lasers, micro-ondes, ultrasons) ou à sa congélation (cryothérapie).
-
La cyclophotocoagulation trans-sclérale par laser diode est maintenant la méthode la plus utilisée, l’utilisation des autres étant marginale. Toutes ces méthodes ont deux inconvénients majeurs : elles sont peu ou pas sélectives de l’organe à traiter, entraînant souvent des dommages des structures adjacentes, et elles présentent une relation effet/dose très inconstante, empêchant de prévoir avec précision l’effet du traitement. De ce fait, ces méthodes sont efficaces mais parfois mal tolérées (réactions inflammatoires majeures, lésions d’autres structures que le corps ciliaire, notamment le cristallin, chute trop importante de la PIO), et sont actuellement réservées au traitement des glaucomes réfractaires aux méthodes chirurgicales conventionnelles, lorsqu’une ou plusieurs chirurgies filtrantes échouent à réduire suffisamment la PIO.
-
L’utilisation de techniques facilitant le positionnement du dispositif par rapport au corps ciliaire (sondes et fibres optiques adaptées à l’anatomie de la région limbique, transillumination, etc.) et le choix de paramètres de traitement prudents avec éventuellement réalisation de plusieurs séances successives permettent d’obtenir une tolérance acceptable de la cyclophotocoagulation trans-sclérale au laser diode.
-
Enfin, les différents essais cliniques évaluant l’efficacité à long terme et la tolérance des procédures de coagulation par ultrasons focalisés de haute intensité permettront de préciser la place de cette nouvelle méthode de traitement qui semble être beaucoup mieux tolérée que les méthodes précédentes (traitement des glaucomes réfractaires, alternative aux chirurgies filtrantes, etc.).

eFig. 16-1 Lésions obtenues dans un gel thermosensible.
Fig. 16-12 a. Micrographie montrant la transition nette entre une zone de corps ciliaire traitée (gauche du champ) et une zone non traitée (droite du champ). Noter l’intégrité de la sclère en regard des zones traitées. Grossissement × 10. Micrographies à forts grossissements montrant une nécrose de coagulation des procès ciliaires : disparition du double épithélium ciliaire et déplétion vasculaire du stroma (b) ; procès ciliaire non traité (c). Grossissement, × 40.
Fig. 16-13 Anneau avec les six transducteurs piézoélectriques (a). Positionnement et centrage du cône de couplage (b). Insertion de l’anneau sur le cône de couplage – la cavité est remplie avec du sérum physiologique (c). Contrôle de l’avancement de la procédure à l’aide du module de commande ; les six secteurs sont représentés sous forme de pictogrammes, en vert avant le tir, en rouge lorsque le tir à lieu ou a eu lieu (d).
Fig. 16-14 Simulation des zones focales induites par les sondes de traitement, sur un œil de petite taille (a, diamètre de 11 mm) et sur un œil de grande taille (b, diamètre 13 mm).
[1] Albaugh CH, Dunphy EB. Cyclodiathermy. Arch ophthalmol. 1942 ; 27 : 543-57.
[2] Al-Ghamdi S, Al-Obeidan S, Tomey KF, Al-Jadaan I. Transscleral neodymium : YAG laser cyclophotocoagulation for end-stage glaucoma, refractory glaucoma, and painful blind eyes. Ophthalmic Surg. 1993 ; 24 : 526-9.
[3] Aptel F, Charrel T, Lafon C, et al. Miniaturized high-intensity focused ultrasound device for the treatment of glaucoma : a clinical pilot study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8747-53.
[4] Aptel F, Charrel T, Palazzi X, et al. Histologic effects of a new device for high-intensity focused ultrasound cyclocoagulation. Invest Ophthalmol Vis Sci. 2010 ; 51 : 5092-8.
[5] Aptel F, Lafon C. Applications of therapeutic ultrasound in ophthalmology. Int J Hyperthermia. 2012 ; 28 : 405-18.
[6] Benson MT, Nelson ME. Cyclocryotherapy. A review of cases over a 10 years period. Br J Ophthalmol. 1990 ; 74 : 103-5.
[7] Bietti G. Surgical intervention on the ciliary body ; new trends for the relief of glaucoma. J Am Med Assoc. 1950 ; 142 : 889-97.
[8] Bloom PA, Tsai J C, Sharma K, et al. “Cyclodiode”. Trans-scleral diode laser cyclophotocoagulation in the treatment of advanced refractory glaucoma. Ophthalmology. 1997 ; 104 : 1508-19 ; discussion : 1519-20.
[9] Brancato R, Carassa RG, Bettin P, et al. Contact transscleral cyclophotocoagulation with diode laser in refractory glaucoma. Eur J Ophthalmol. 1995 ; 5 : 2-39.
[10] Brancato R, Leoni G, Trabucchi G, Cappellini A. Histopathology of continuous wave neodymium : yttrium aluminum garnet and diode laser contact transscleral lesions in rabbit ciliary body : a comparative study. Invest Ophthalmol Vis Sci. 1991 ; 32 : 1586-92.
[11] Burgess SE, Silverman RH, Coleman DJ, et al. Treatment of glaucoma with highintensity focused ultrasound. Ophthalmology. 1986 ; 93 : 831-8.
[12] Caprioli J, Strang SL, Spaeth GL, Poryzees EH. Cyclocryotherapy in the treatment of advanced glaucoma. Ophthalmology. 1985 ; 92 : 947-54.
[13] Charrel T, Aptel F, Birer A, et al. Development of a miniaturized HIFU device for glaucoma treatment with conformal coagulation of the ciliary bodies. Ultrasound Med Biol. 2011 ; 37 : 742-54.
[14] Chen J, Cohn RA, Lin SC, et al. Endoscopic photocoagulation of the ciliary body for treatment of refractory glaucomas. Am J Ophthalmol. 1997 ; 124 : 787-96.
[15] Coleman DJ, Lizzi FL, Driller J, et al. Therapeutic ultrasound in the treatment of glaucoma. I. Experimental model. Ophthalmology. 1985 ; 92 : 339-46.
[16] Coleman DJ, Lizzi FL, Driller J, et al. Therapeutic ultrasound in the treatment of glaucoma. II. Clinical applications. Ophthalmology. 1985 ; 92 : 347-53.
[17] Egbert PR, Fiadoyor S, Budenz DL, et al. Diode laser transscleral cyclophotocoagulation as a primary surgical treatment for primary open-angle glaucoma. Arch Ophthalmol. 2001 ; 119 : 345-50.
[18] Finger PT, Perry HD, Shakin JL, et al. Microwave cyclodestruction : evaluation on human eyes. Br J Ophthalmol. 1995 ; 79 : 678-82.
[19] Finger PT, Smith PD, Paglione RW, Perry HD. Transscleral microwave cyclodestruction. Invest Ophthalmol Vis Sci. 1990 ; 31 : 2151-5.
[20] Fleischman JA, Swartz M, Dixon JA. Argon laser endophotocoagulation. An intraoperative trans-pars plana technique. Arch Ophthalmol. 1981 ; 99 : 1610-2.
[21] Goldenberg-Cohen N, Bahar I, Ostashinski M, et al. Cyclocryotherapy versus transscleral diode laser cyclophotocoagulation for uncontrolled intraocular pressure. Ophthalmic Surg Lasers Imaging. 2005 ; 36 : 272-9.
[22] Haik GM, Breffeilh LA, Barber A. Beta irradiation as a possible therapeutic agent in glaucoma ; an experimental study with the report of a clinical case. Am J Ophthalmol. 1948 ; 31 : 945-52.
[23] Hamard P, Gayraud JM, Kopel J, et al. Treatment of refractory glaucomas by transscleral cyclophotocoagulation using semiconductor diode laser. Analysis of 50 patients followed-up over 19 months. J Fr Ophtalmol. 1997 ; 20 : 125-33.
[24] Hamard P, Hamard H. Traitement des glaucomes réfractaires. Encycl Méd Chir, Ophtalmologie, 2008, 21-280-B-50.
[25] Hampton C, Shields MB. Transscleral neodymium-YAG cyclophotocoagulation. A histologic study of human autopsy eyes. Arch Ophthalmol. 1988 ; 106 : 1121-3.
[26] Hawkins TA, Stewart WC. One-year results of semiconductor transscleral cyclophotocoagulation in patients with glaucoma. Arch Ophthalmol. 1993 ; 111 : 488-91.
[27] Iliev ME, Gerber S. Long-term outcome of trans-scleral diode laser cyclophotocoagulation in refractory glaucoma. Br J Ophthalmol. 2007 ; 91 : 1631-5.
[28] Kosoko O, Gaasterland DE, Pollack IP, Enger CL. Long-term outcome of initial ciliary ablation with contact diode laser transscleral cyclophotocoagulation for severe glaucoma. The Diode Laser Ciliary Ablation Study Group. Ophthalmology. 1996 ; 103 : 1294-302.
[29] Kramp K, Vick HP, Guthoff R. Transscleral diode laser contact cyclophotocoagulation in the treatment of different glaucomas, also as primary surgery. Graefes Arch Clin Exp Ophthalmol. 2002 ; 240 : 698-703.
[30] Krupin T, Mitchell KB, Becker B. Cyclocryotherapy in neovascular glaucoma. Am J Ophthalmol. 1978 ; 86 : 24-6.
[31] Lai JS, Tham CC, Chan JC, Lam DS. Diode laser transscleral cyclophotocoagulation as primary surgical treatment for medically uncontrolled chronic angle closure glaucoma : long-term clinical outcomes. J Glaucoma. 2005 ; 14 : 114-9.
[32] Lee PF, Pomerantzeff O. Transpupillary cyclophotocoagulation of rabbit eyes. An experimental approach to glaucoma surgery. Am J Ophthalmol. 1971 ; 71 : 911-20.
[33] Lima FE, Magacho L, Carvalho DM, et al. A prospective, comparative study between endoscopic cyclophotocoagulation and the Ahmed drainage implant in refractory glaucoma. J Glaucoma. 2004 ; 13 : 233-7.
[34] Lindner-Dominguez J. Histological findings on the rabbit ciliary body following cyclodiathermy and cryothermy. Ber Zusammenkunft Dtsch Ophthalmol Ges. 1972 ; 71 : 341-4.
[35] Maskin SL, Mandell AI, Smith JA, et al. Therapeutic ultrasound for refractory glaucoma : a threecenter study. Ophthalmic Surg. 1989 ; 20 : 186-92.
[36] McKelvie PA, Walland MJ. Pathology of cyclodiode laser : a series of nine enucleated eyes. Br J Ophthalmol. 2002 ; 86 : 381-6.
[37] Murthy GJ, Murthy PR, Murthy KR, et al. A study of the efficacy of endoscopic cyclophotocoagulation for the treatment of refractory glaucomas. Indian J Ophthalmol. 2009 ; 57 : 127-32.
[38] Pantcheva MB, Kahook MY, Schuman JS, et al Comparison of acute structural and histopathological changes of the porcine ciliary processes after endoscopic cyclophotocoagulation and transscleral cyclophotocoagulation. Clin Exp Ophthalmol. 2007 ; 35 : 270-4.
[39] Plager DA, Neely DE. Intermediate-term results of endoscopic diode laser cyclophotocoagulation for pediatric glaucoma. J Aapos. 1999 ; 3 : 131-137.
[40] Polack PJ, Iwamoto T, Silverman RH, et al. Histologic effects of contact ultrasound for the treatment of glaucoma. Invest Ophthalmol Vis Sci. 1991 ; 32 : 2136-42.
[41] Prost M. Cyclocryotherapy for glaucoma. Evaluation of techniques. Surv Ophthalmol. 1983 ; 28 : 93-100.
[42] Pueyo M, Honrubia FM, Sanchez A, Pablo LE. Ciliary ablation with diode laser. Long-term study. Arch Soc Esp Oftalmol. 2001 ; 76 : 165-8.
[43] Sautter H, Demeler U. Antiglaucomatous ciliary body excision. Am J Ophthalmol. 1984 ; 98 : 344-8.
[44] Schlote T, Derse M, Rassmann K, et al. Efficacy and safety of contact transscleral diode laser cyclophotocoagulation for advanced glaucoma. J Glaucoma. 2001 ; 10, 294-301.
[45] Silverman RH, Vogelsang B, Rondeau MJ, Coleman DJ. Therapeutic ultrasound for the treatment of glaucoma. Am J Ophthalmol. 1991 ; 111 : 327-37.
[46] Smith RS, Boyle E, Rudt LA. Cyclocryotherapy : a light and electron microscopic study. Arch Ophthalmol. 1977 ; 95 : 285-8.
[47] Sterk CC, vd Valk PH, van Hees CL, et al The effect of therapeutic ultrasound on the average of multiple intraocular pressures throughout the day in therapy-resistant glaucoma. Graefes Arch Clin Exp Ophthalmol. 1989 ; 227 : 36-8.
[48] Valtot F, Denis P. The treatment of failed trabecular surgery in glaucoma with ultrasound (Sonocare). Ophtalmologie. 1990 ; 4 : 142-4.
[49] Valtot F, Kopel J, Haut J. Treatment of glaucoma with high intensity focused ultrasound. Int Ophthalmol. 1989 ; 13 : 167-70.
[50] Van der Zypen E, England C, Fankhauser F, Kwasniewska S. The effect of transscleral laser cyclophotocoagulation on rabbit ciliary body vascularization. Graefes Arch Clin Exp Ophthalmol. 1989 ; 227 : 172-9.
[51] Vernon SA, Koppens JM, Menon GJ, Negi AK. Diode laser cycloablation in adult glaucoma : long-term results of a standard protocol and review of current literature. Clin Experiment Ophthalmol. 2006 ; 34 : 411-20.
[52] Vest E, Rong-Guang W, Raitta C. Transillumination guided cyclocryotherapy in the treatment of secondary glaucoma. Eur J Ophthalmol. 1992 ; 2 : 190-5.
[53] Vogt A. Versuche zur intraokularen Druckherabsetzung mittels Diathermieschadigung des corpus ciliare (Zyklodiatermiestichelung). Klin Monatsbl Augenheilkd. 1936 ; 97 : 672-7.
[54] Walland MJ. Diode laser cyclophotocoagulation : longer term follow up of a standardized treatment protocol. Clin Experiment Ophthalmol. 2000 ; 28 : 263-7.
[55] Weinreb RN, Mills RP. Glaucoma surgery : principles and techniques. 2nd ed. Ophthalmology monograph 4. San Francisco, American Academy of Ophthalmology, 1998 : 165.
[56] Weve H. Die Zyklodiatermie das corpus ciliare bei glaukom. Zentralbl Ophthalmol. 1933 ; 29 : 562-9.
[57] Yap-Veloso MI, Simmons RB, Echelman DA, et al. Intraocular pressure control after contact transscleral diode cyclophotocoagulation in eyes with intractable glaucoma. J Glaucoma. 1998 ; 7 : 319-28.
[58] Yildirim N, Yalvac IS, Sahin A, et al. A comparative study between diode laser cyclophotocoagulation and the Ahmed glaucoma valve implant in neovascular glaucoma : a long-term follow-up. J Glaucoma. 2009 ; 18 : 192-6.
[59] Yu MB, Huang SS, Ge J, et al. The clinical study of endoscopic cyclophotocoagulation on the management of refractory glaucoma. Zhonghua Yan Ke Za Zhi. 2006 ; 42 : 27-31.
F. Valtot
-
Les différentes étapes, depuis l’iridectomie de von Graefe jusqu’aux techniques micro-invasives.
-
Les techniques pour réduire les complications postopératoires (sclérectomie profonde non perforante, techniques micro-invasives, etc.).
-
Les techniques pour diminuer ou supprimer la cicatrisation épisclérale, source d’échecs chirurgicaux (antimitotiques, chirurgies ab interno, augmentation du flux uvéoscléral).
En Occident, le diagnostic de glaucome n’a été posé qu’au début du xviiie siècle. Les cliniciens, tel Woolhouse (1650-1743), oculiste itinérant exerçant sur les places publiques lors des foires, ou le célèbre chevalier Taylor qui sillonnait toute l’Europe en grand équipage autour de 1750, palpaient un œil toujours dur et leurs publications mettaient en cause le rôle dévastateur de la compression. Woolhouse tentait même de la supprimer en ponctionnant l’œil avec un trocart. L’effet était bénéfique, mais limité dans le temps !
En 1848-1849, Albrecht von Graefe, âgé de 20 ans, séjourne à Paris. Il y fréquente le service de Desmarres qui y réalise alors des paracentèses pour traiter les glaucomes. De retour à Berlin, il fait de même, mais est déçu par le côté trop temporaire de l’effet obtenu. Il avait observé que le fait de pratiquer une iridectomie en cas d’inflammation du segment antérieur diminuait notablement celle-ci, mais faisait également baisser la pression intra-oculaire (PIO) mesurée à la palpation, puisqu’il ne disposait pas encore de tonomètre. Il pensait que cela diminuait la sécrétion d’humeur aqueuse (HA). En juin 1856, il fit donc une iridectomie sectorielle sur l’œil d’une femme de 51 ans atteinte de « glaucome aigu », pour tenter de la soulager. Il la guérit. Il venait, sans le savoir, à 28 ans, de découvrir intuitivement le traitement du blocage pupillaire. Dès l’année suivante, il publiait son célèbre article sur le rôle curateur de l’iridectomie dans certains glaucomes, mais en reconnaissait aussi les limites, faisant bien la distinction entre glaucome aigu et glaucome chronique [1].
Von Graefe avait constaté que, dans 20 % des cas, la cicatrice de l’incision sclérale (pratiquée à la lance un peu en arrière du limbe) qui permettait de faire l’iridectomie ne se refermait pas. La conjonctive prenait un aspect cystoïde dû à la fuite sous-conjonctivale de l’HA. Par crainte des infections, incurables à l’époque, il luttait contre cette « filtration ». Cependant, ses collègues et lui-même notaient avec intérêt que l’HA, sous l’influence de la pression, s’échappait par l’incision et s’accumulait sous la conjonctive où elle se résorbait fort opportunément. Cette autorégulation de la pression oculaire après certaines iridectomies était la première chirurgie filtrante. Elle montrait le chemin, et les oculistes s’en sont inspirés pour traiter les glaucomes « chroniques » et sauver des millions d’yeux de la cécité.
En même temps les connaissances anatomiques progressaient depuis que Schlemm, en 1827, observant l’œil d’un pendu, eut découvert et cathétérisé avec une soie de porc le canal circulaire gorgé de sang qui allait porter son nom. Le rôle dévastateur de l’hypertension ne faisant plus aucun doute, il fallait localiser le siège de la résistance à l’écoulement. Les travaux nombreux sur l’homme menés entre 1858 et 1890 ont tous abouti à accuser l’angle iridocornéen. Dans toute l’Europe, les chirurgiens inventent alors des techniques permettant à l’HA de s’écouler sous la conjonctive. À Paris, en 1869, de Wecker pratique au limbe une « large plaie scléroticale ». Comme l’iris a naturellement tendance à s’y enclaver, l’iridectomie est systématique. Cependant d’autres chirurgiens, notamment en Angleterre, n’ont cure de l’enclavement de l’iris, pensant même qu’il a son utilité (Bader et Spencer Watson en 1876). En 1906, Holth a sensiblement la même idée : bloquer une incision de sclérotomie par un fragment d’iris servant de mèche. Ainsi naquit l’iridencleisis. Cette méthode efficace mais peu esthétique, très largement répandue, a été utilisée pendant plus de cent ans. Trois noms sont incontournables : l’ophtalmologiste militaire français Félix Lagrange qui décrivit en 1905 l’iridosclérectomie ; le major anglais Elliot qui, opérant sans aide aux Indes, inventa en 1909 un trépan qui lui permettait de réaliser plus facilement un orifice scléral calibré ; et, enfin, Foroni qui, en 1913, eut le premier l’idée d’un abord scléral ab externo, au couteau, pour pratiquer une iridosclérectomie. Cette technique se répandit largement en France [3], car elle était d’exécution facile et ne nécessitait pas une adresse chirurgicale exceptionnelle, tout en donnant une bonne filtration. Il faudra attendre 1958 pour que H. Scheie décrive une dernière variante de cette chirurgie [2], consistant à cautériser doucement les berges de la sclérectomie au fur et à mesure de son ouverture à la lame, rétractant ainsi les bords sans hémorragie et sans créer un trop gros orifice. Cependant, toutes les interventions décrites jusqu’à présent étaient « de pleine épaisseur », c’est-à-dire que l’HA passait directement de la chambre antérieure, via une ouverture sclérale limbique, sous la conjonctive. Celle-ci, qui n’est quelquefois réduite qu’à quelques couches de cellules épithéliales, représentait la seule barrière entre le milieu ambiant, plus ou moins septique, et la chambre antérieure. Les résultats tonométriques étaient souvent excellents, en partie grâce à la « porosité », pour ne pas dire les microperforations, de la conjonctive. Toutefois, les risques d’infection, d’hypotonie, de fuite, voire de rupture conjonctivale constituaient un danger permanent.
L’idée est donc née de « protéger » l’orifice sclérocornéen en taillant un volet scléral qui le recouvrirait. P. Sugar en 1961 décrit une intervention très proche de l’intervention actuelle, mais il l’abandonne. Constantin Coryllos publie en 1967, en grec – ce qui a forcément limité sa diffusion –, son article « L’ablation du trabéculum (trabéculectomie) comme intervention antiglaucomateuse ». Toute la « gloire » est revenue à l’anglais John Cairns qui l’a fait connaître. Il publie en 1968 une note préliminaire dans une revue américaine décrivant une nouvelle technique chirurgicale : la trabéculectomie. Sous un volet scléral, un segment de trabéculum et de canal de Schlemm sont excisés. L’idée était de rétablir le circuit normal de l’HA, l’obstacle trabéculaire étant levé, en lui permettant de regagner le canal de Schlemm par ses deux extrémités sectionnées sous le volet scléral remis en place et suturé. Il croyait s’affranchir ainsi de la filtration sous-conjonctivale. Les faits l’ont contredit, l’HA filtrant sous le volet, puis gagnant [1] l’espace sous-conjonctival au lieu d’emprunter le canal de Schlemm. Cette intervention bien codifiée, facile à réaliser, devint vite la référence, d’autant que l’utilisation systématique du microscope dès le début des années 1970, sous l’influence de J. Barraquer à Barcelone et d’H. Harms en Allemagne, ainsi que le progrès des aiguilles et sutures, ont permis d’améliorer la précision des gestes. Bien que tributaire de la filtration conjonctivale, la trabéculectomie a représenté un réel progrès en diminuant considérablement les complications de la chirurgie de pleine épaisseur, telles que l’hypotonie, les fuites et les infections. De plus, l’utilisation de produits visqueux, l’ouverture progressive des sutures dans les suites – qui permet d’ajuster la filtration « à la demande » – et les lentilles de grand diamètre appuyant sur le volet évitent une décompression trop rapide et l’hypotonie.
Dès les années 1975-1980, on constata que les PIO obtenues après trabéculectomie étaient supérieures et moins stables que celles obtenues par la chirurgie de pleine épaisseur [2]. L’efficacité de la trabéculectomie, comme celle de toutes les interventions fonctionnant grâce à la filtration sous-conjonctivale, peut diminuer ou s’arrêter à cause de la cicatrisation des tissus. Dès le début du xxe siècle et jusqu’à maintenant, toutes sortes de matériaux ont été utilisés pour empêcher la fermeture de la sclérostomie et « guider » l’HA sous la conjonctive. Ce fut une succession d’échecs car, dans l’immense majorité des cas, l’obstacle n’est ni dans la chambre antérieure ni au niveau de la sclère, mais il est dû à la cicatrisation des tissus épiscléraux situés à quelques millimètres du limbe. C’est là que la partie externe du drain ou du tube finit par être englobée dans le tissu cicatriciel. Pour éviter cet écueil, Molteno en 1969 eut l’idée d’évacuer l’HA beaucoup plus en arrière, grâce à un long tube plongeant dans la chambre antérieure et relié à un réservoir suturé à la sclère au niveau de l’équateur. Ce réservoir s’encapsule en quelques semaines et la filtration se fait alors dans les espaces péri-orbitaires. Toutes sortes de dispositifs valvés ou non ont été proposés, reliés à des réservoirs de forme et volume variables. Tous ont pour but de « délocaliser » la bulle conjonctivale vers l’équateur dans un espace plus vaste, calibré et encapsulé dans une zone moins sujette à la fibrose et à l’infection. Cette chirurgie, d’abord réservée aux glaucomes réfractaires, est actuellement proposée en première intention dans les pays anglo-saxons. L’intervention, relativement longue, requiert l’expertise d’un chirurgien expérimenté et un suivi rigoureux. De plus, le coût du dispositif n’est pas négligeable.
Après une intervention filtrante, le suivi attentif et un traitement anti-inflammatoire prolongé ne mettent pas complètement à l’abri d’une remontée presssionnelle. C’est pourquoi, pour diminuer la fibrose épisclérale, Heuer a proposé en 1984 d’injecter sous la conjonctive un antimétabolite, le 5-fluoro-uracile, qui inhibe la multiplication cellulaire des fibroblastes. La mitomycine C, autre antimétabolite, utilisé par Chen à partir de 1982, a un effet plus puissant et prolongé. L’application peropératoire « à l’éponge » de ces deux produits a rendu leur utilisation facile. Leur efficacité a entraîné leur usage de plus en plus large dès le début des années 1990, au point de devenir quasiment systématique, même en première intention, dans de nombreuses indications. L’effet tonométrique est indiscutable, mais les complications (hypotonie, perforation conjonctivale, nécrose sclérale, endophtalmie) risquent de mettre en danger la fonction visuelle même très longtemps après la chirurgie.
En 1962, à Moscou, Kraznov inventa la première intervention non perforante : la « sinusotomie ». Excisant la sclère au-dessus du canal de Schlemm ouvert, il obtenait une filtration sous-conjonctivale sans ouvrir la chambre antérieure. Cela supprimait quasiment toutes les complications de la chirurgie perforante (hyphéma, inflammation, athalamie, hypotonie). En se fondant sur ce principe, Koslov et Anisimova ont proposé en 1990 la sclérectomie profonde qui améliora les résultats. Dès 1993, nous l’avons pratiquée à l’hôpital Saint-Joseph en lui ajoutant un geste clé : la trabéculectomie externe, c’est-à-dire le pelage du mur interne du canal de Schlemm et du trabéculum cribriforme adjacent. Avec un recul de vingt ans, cette intervention a fait ses preuves avec des résultats tonométriques comparables à ceux de la trabéculectomie et très peu de complications. En particulier, avantage notable sur la trabéculectomie réputée cataractogène, elle n’induit pas de cataracte ni de baisse visuelle. Les progrès de la biomicroscopie ultrasonore (UBM) et de l’OCT ont permis de mieux montrer in vivo les chemins suivis par l’HA et leur évolution au fil des années. Cette intervention, conçue comme une chirurgie filtrante, fonctionne souvent à la longue sans filtration conjonctivale grâce à une bulle intrasclérale et un passage uvéoscléral de l’HA, comme l’ont montré A. Mermoud et P.-Y. Santiago (fig. 16-15).
Fig. 16-15 UBM (Artemis) 12 ans après sclérectomie profonde avec trabéculectomie externe. Pas de bulle conjonctivale, filtration intrasclérale et présence de liquide entre la sclère et le corps ciliaire ; PIO à 11 mmHg. (Cliché F. Valtot.)
La filtration conjonctivale est capricieuse et a tendance à diminuer avec le temps. L’utilisation des antimétabolites l’améliore, mais expose à d’autres difficultés. Trouver une autre voie pour exfiltrer l’HA est devenu le nouveau défi de la chirurgie du glaucome. Trois options sont actuellement proposées.
Puisque l’obstacle siège à leur niveau, il est logique de les inciser sur tout ou partie de leur circonférence, l’HA empruntant ensuite les émonctoires naturels supposés sains. C’est ce qu’a fait Barkan en 1936 au couteau, ab interno. Allen et Burian, puis Harms et Dannheim dans les années 1960, ont pratiqué des trabéculectomies ab externo. Après de très bons résultats, la tension remontait, surtout chez les adultes, à cause de la cicatrisation. De même, l’ouverture du canal de Schlemm au laser a donné des espoirs, mais l’effet n’a pas été durable. Actuellement, les drains iStent™, sorte de clous creux en titane, sont proposés pour faire communiquer le canal de Schlemm et la chambre antérieure. Loewen déclare que « les ophtalmologistes doivent apprendre à se servir de l’OCT haute résolution plus souvent, en particulier pour étudier avant l’intervention l’aspect du canal de Schlemm et savoir où se trouvent ses plus gros canaux collecteurs afin de placer judicieusement leurs stents, comme le font les cardiologues avec la coronarographie ». Le Trabectome™, dispositif associant un système de résection, thermo-cautérisation et aspiration, permet l’ablation totale du trabéculum et du mur interne du canal de Schlemm sur une partie de l’angle. Ces deux chirurgies se pratiquent sous gonioscopie, souvent lors d’une intervention de cataracte. Avec l’endophotocoagulation ciliaire, les Anglo-Saxons rangent ces interventions ab interno, sans manipulation de la conjonctive et de la sclère et sans sutures, sous le terme de minimally invasive glaucoma surgery (MIGS). Ces techniques, que certains voudraient pratiquer systématiquement, ont encore quelques imperfections : elles restent invasives puisqu’elles ouvrent l’œil, sont coûteuses et, si les résultats sont encourageants à un ou deux ans, ils peuvent devenir décevants par la suite, surtout quand l’intervention a été pratiquée au cours d’une phako-éxérèse qui, en soi, est hypotonisante.
En 1993, en Afrique du Sud, Stegmann, dans un contexte difficile (patients pauvres, suivi aléatoire), a mis au point la viscocanalostomie, chirurgie non perforante originale, puisque le volet scléral est suturé de façon étanche après la sclérectomie profonde afin qu’il n’y ait aucune filtration conjonctivale. Avant cette fermeture, du visqueux (qui aurait un effet fibrinolytique) est injecté par une canule dans les deux extrémités sectionnées du canal de Schlemm. Stegmann postule que cela dilate le canal et ses efférents, rétablissant leur rôle physiologique. La canaloplastie est la même intervention, associant le passage d’un cathéter dans les 360° de circonférence du canal. Il dilate le Schlemm et ses efférents en les emplissant de visqueux. Enfin, un fil est laissé en place et noué sous tension, tirant sur le mur interne du canal et le trabéculum. Ainsi s’expliqueraient l’amélioration de l’écoulement et la baisse pressionnelle. Grieshaber et Stegmann proposent aussi maintenant un implant dilatateur, le « canal expander », placé dans le canal de Schlemm ab externo. L’implant Hydrus™ métallique de 8 mm, lui, est engagé dans la lumière du canal de Schlemm sous gonioscopie. Il est censé agir en le maintenant dilaté et ouvert sur la chambre antérieure.
La cyclodialyse, connue depuis longtemps, a été abandonnée car elle donnait des résultats imprévisibles. Des implants suprachoroïdiens injectés depuis la chambre antérieure ou en trans-scléral sont proposés actuellement pour maîtriser l’excrétion uvéosclérale de l’HA. Les équipes pratiquant beaucoup de sclérectomies profondes avec trabéculectomie externe ont constaté que 50 à 70 % des patients normotones ont une filtration suprachoroïdienne spontanée bien visible à l’UBM, surtout cinq à dix ans après l’intervention. Parallèlement, la bulle visible macroscopiquement disparaît. D’autres équipes s’intéressent à de nouveaux acteurs dont le rôle était méconnu : Yucel et Gupta sur les lymphatiques découverts dans le corps ciliaire et la conjonctive (surtout supérieure et nasale) formant une voie uvéolymphatique ; Mastropasqua sur la sclère qui n’est pas une coque inerte, mais intervient dans la résorption de l’HA. L’excrétion trans-sclérale peut être augmentée jusqu’à cinq fois quand la voie trabéculaire est défaillante. Ce mécanisme, qui serait d’adaptation, est favorisé par les interventions amincissant la sclère (comme la sclérectomie). Certains, ayant eu l’idée d’y créer des tunnels au laser femtoseconde, annoncent des résultats prometteurs (Chai).
Quel que soit le rôle promis à ces nouvelles techniques, les progrès de l’UBM et des OCT ont été d’un grand apport dans la compréhension des voies de l’écoulement de l’HA avant et après la chirurgie, avec des incidences très bénéfiques sur les futures procédures.
Retenir
-
Les méthodes chirurgicales sont en constante évolution, mais aucune ne s’est encore imposée pour supprimer tout risque postopératoire et assurer un succès tonométrique définitif.
-
La trabéculectomie a révolutionné la chirurgie des glaucomes primitifs à angle ouvert, mais les suites postopératoires ont été nettement améliorées avec l’avènement de la chirurgie filtrante non perforante.
-
Les techniques micro-invasives (iStent™, Trabectome™, endophotocoagulation ciliaire) sont très prometteuses, mais restent en cours d’évaluation.
[1] Béchetoille A. Les glaucomes, vol. 1. Éditions Japperenard, 1997 : 1-18.
[2] Belcher D. Filtering operations-an overview. In : Glaucoma surgery. Mosby, 1992 : 17-35.
[3] Etienne R. Les glaucomes. Marseille, Diffusion générale de Librairie, 1969 : 538-604.
P. Hamard
-
La trabéculectomie est efficace pour abaisser durablement la pression intra-oculaire (PIO).
-
La préparation de la chirurgie et son suivi prolongé sont indispensables pour améliorer le pronostic fonctionnel de la trabéculectomie.
-
La complication la plus fréquente est la cataracte, la plus grave est l’endophtalmie tardive, favorisée par une bulle de filtration fragile.
-
Une surveillance à vie de tout opéré est impérative.
La trabéculectomie, popularisée par Cairns en 1968, destinée à abaisser la PIO, reste la chirurgie filtrante de première intention de référence car elle s’adresse à tous les types de glaucome, que l’angle iridocornéen (AIC) soit ouvert ou fermé.
Le mérite inégalé de la trabéculectomie est la bonne connaissance de la technique liée à 40 ans d’expérience clinique qui ont permis de mieux comprendre ses mécanismes d’action, d’évaluer son efficacité à long terme et de connaître l’incidence de ses complications dont certaines sont tardives.
L’intervention consiste, sous couvert d’un volet scléral de protection, en une sclérokératectomie – comprenant idéalement le trabéculum [32] – et permettant à l’humeur aqueuse (HA) de quitter la chambre antérieure vers les espaces sous-conjonctivaux. Si les voies de résorption de l’HA sont plurielles (veines aqueuses, espace supraciliaire, voies trans-sclérale et transconjonctivale), il s’avère que le pronostic fonctionnel de la trabéculectomie est conditionné par le développement d’une filtration sous-conjonctivale pérenne sous forme d’une bulle de filtration.
Si le principe de la technique est resté le même depuis sa description initiale, des variantes chirurgicales ont été proposées au fil des ans pour pérenniser la filtration et réduire l’incidence des complications liées à l’hypotonie prolongée, au développement de volumineuses bulles de filtration limbiques fragiles ou encore à une cicatrisation tissulaire excessive, complications pouvant compromettre le pronostic visuel et fonctionnel de la chirurgie [35].
La trabéculectomie est une technique efficace pour abaisser la PIO. Les complications concernent un patient sur deux mais sont souvent mineures et peuvent être prévenues ou limitées par une prise en charge rigoureuse avant, pendant et après l’intervention.
Si la complication la plus fréquente est la cataracte, celle qui nous préoccupe davantage est l’échec de la filtration par développement d’une cicatrice imperméable à l’HA. L’infection reste une complication exceptionnelle mais gravissime.
TECHNIQUE
Préparation de la chirurgie
Ce qu’il faut dire au patient
Il doit être prévenu des risques inhérents à cette chirurgie (explications orales, remise de la fiche SFO « Opération du glaucome chronique, chirurgie filtrante », eEncadré 16-1). Il doit comprendre que la préparation et le suivi sont indispensables au pronostic fonctionnel et que les suites seront chronophages. Il doit assimiler que l’intervention ne fait qu’abaisser la PIO pour limiter l’évolution du glaucome sans pouvoir le supprimer, et qu’elle ne peut en aucun cas améliorer l’acuité visuelle. La perte du point de fixation, complication dramatique et redoutée, doit être évoquée en cas de glaucome au stade terminal menaçant le point de fixation, même si cette complication reste exceptionnelle.
Il faut spécifier que le port de lentilles de contact peut devenir impossible après la chirurgie, que la paroi oculaire est fragilisée, que l’œil devient plus vulnérable aux traumatismes et aux infections, que tout larmoiement et toute conjonctivite doivent amener à consulter rapidement, et ce tout au long de la vie.
Préparation des tissus
Elle est insdipensable pour minimiser les risques d’inflammation et d’hémorragie qui compromettent la cicatrisation et donc le résultat.
-
Traitement de toute inflammation de surface oculaire ou des annexes.
-
Un mois avant l’intervention :
-
arrêt des collyres hypotonisants avec conservateur, voire relais par acétazolamide ;
-
instillation d’AINS non conservés ou de fluorométholone 1 %, quatre fois par jour [6].
-
-
Dix jours avant l’intervention avec accord du médecin anesthésiste : arrêt des anti-agrégants plaquettaires, des extraits de ginkgo biloba, des AINS généraux (relais par flurbiprofène avec arrêt la veille de l’intervention).
-
Quatre jours avant l’intervention avec accord du médecin anesthésiste : arrêt des anticoagulants et relais par HBPM avec arrêt la veille de l’intervention.
-
Le jour de l’intervention :
-
si HTO préopératoire, hypotoniser le globe oculaire : Diamox® IV (500 mg), mannitol 20 % IV, 250 ml à passer en 20 minutes avant l’heure de la chirurgie ;
-
instillation d’une goutte d’α2-agoniste juste avant l’intervention (vasoconstriction locale pour réduire les saignements).
-
Anesthésie
Le type d’anesthésie dépend de l’âge du patient, de son statut anesthésique et de ses possibilités de coopération, tout en respectant également les préférences du patient et de l’opérateur avec l’aval de l’anesthésiste. Quel que soit le type d’anesthésie, le patient sera installé en proclive de 10 à 20°, surtout s’il présente des facteurs de risque d’hémorragie choroïdienne (hypertension artérielle, myopie forte, obésité, aphakie, anticoagulants), et la pression artérielle sera soigneusement contrôlée durant l’intervention.
Anesthésie locale
C’est la technique de choix pour cette intervention souvent réalisée en ambulatoire. Deux impératifs sont à respecter :
-
obtenir une analgésie pour éviter une poussée choroïdienne et ses complications ;
-
ne pas comprimer le globe oculaire pour éviter l’élévation de la PIO qui risquerait d’aggraver un glaucome évolué.
L’anesthésie peut être topique (gouttes de tétracaïne ou gel de Xylocaïne®) ou sous-conjonctivale (lidocaïne), mais doit être accompagnée d’une bonne prémédication par benzodiazépine pour assurer l’anxiolyse et d’une sédation – pour l’amnésie et l’immobilité – associant un analgésique morphinique de faible durée d’action (fentanyl, sufentanil ou alfentanil) à un sédatif narcotique léger (propofol) en fonction des protocoles établis et validés par le chirurgien et l’anesthésiste. Les anesthésies locorégionales (caronculaires, sous-ténoniennes, péribulbaires ou rétrobulbaires), en injectant peu de produit et en réalisant une sédation au moment de l’injection, permettent une meilleure akinésie rendant la chirurgie souvent plus confortable.
Les anesthésies sous-ténoniennes et caronculaires, efficaces et peu invasives, seront privilégiées chez les patients ayant une fragilité sclérale : myopie forte, buphtalmie.
Anesthésie générale
Elle est généralement réservée aux sujets jeunes, pusillanimes ou peu coopérants.
Technique opératoire classique
On procédera à deux désinfections soigneuses de la peau péri-orbitaire et des culs-de-sac conjonctivaux à la Bétadine® diluée (ou Amukine® en cas d’allergie), chacune pendant deux minutes.
Exposition du site opératoire
Le site opératoire doit idéalement être recouvert par la paupière supérieure, éviter les zones de goniosynéchies, les vaisseaux épiscléraux et perforants et les zones cicatricielles. Un fil de traction cornéenne (soie 7/0) sur 12 heures ou 6 heures, ou limbique (3-9 heures), permettant de récliner le globe vers le bas, sera préféré à la prise du muscle droit supérieur (risque d’hématome).
Volet conjonctivoténonien
-
Volet conjontivoténonien à charnière au fornix (fig. 16-16a)
Les tissus conjontivoténoniens sont ouverts au limbe chirurgical, sur 5 à 10 mm, sans refends latéraux pour limiter la réaction cicatricielle et les risques de Seidel, en poursuivant la dissection 10-15 mm en arrière du limbe pour favoriser l’écoulement postérieur de l’HA (fig. 16-16b). Les manipulations tissulaires sont limitées, la dissection du volet scléral et le placement des sutures ajustables sont facilités.
-
Volet conjontivoténonien à charnière au limbe
Les tissus conjonctivoténoniens seront ouverts à 8 mm du limbe, séparément pour éviter de blesser le muscle droit supérieur, et sur 10 mm pour une bonne exposition. Cette ouverture limite le risque de Seidel en cas d’utilisation d’antimitotiques mais expose aux bulles de filtration limbiques volumineuses en favorisant le développement d’un anneau de fibrose postérieur [37].
En pratique, l’ouverture au limbe présente plus d’avantages que l’ouverture au fornix, sans différence sur le résultat tensionnel à terme [37], raison pour laquelle elle est préférée.
Volet scléral de protection
Son rôle est fondamental car il oppose la première résistance à l’écoulement aqueux. Les tissus épiscléraux doivent être au préalable scarifiés et la cautérisation doit être minimale pour limiter la fibrose épisclérale, la rétraction des tissus et préserver les vaisseaux intervenant dans le drainage futur de l’HA. Le volet scléral à charnière limbique est pré-incisé à la lame (ou au couteau 15°), puis disséqué à la lame ou au couteau Crescent (fig. 16-16c). Sa forme importe peu et sa taille, généralement de 3 × 3 mm, n’influe pas sur le contrôle tensionnel si la dissection des extrémités du volet s’arrête 1 mm en arrière du limbe chirurgical [3] pour favoriser l’écoulement postérieur de l’HA et limiter le risque d’encapsulation [20]. Son épaisseur doit être de la moitié de l’épaisseur sclérale : trop fin, il favorise l’hypotonie, trop épais il peut faire clapet et bloquer la filtration. Le prépositionnement des sutures sur le volet avant l’ouverture de la chambre antérieure facilite la fermeture rapide du volet scléral (fig. 16-16d).
Application d’antimitotiques
Si nécessaire, plusieurs petites éponges de Mérocel® imbibées d’antimitotique sont placées sur la sclère, à cheval sur le volet scléral et en arrière pour favoriser une bulle de filtration diffuse et postérieure (fig. 16-16e). Les éponges ne doivent pas toucher les berges du volet conjonctival. Après leur retrait, un rinçage prolongé au balanced salt solution (BSS) est nécessaire.
Ouverture de la chambre antérieure
Une paracentèse au couteau 15° réalisée en cornée claire permet de décomprimer doucement le globe oculaire en début d’intervention, d’injecter du BSS en chambre antérieure ou de placer un mainteneur de chambre antérieure pour adapter le serrage des sutures, d’évacuer les débris inflammatoires et sanguins, et de vérifier l’étanchéité du volet conjonctival en fin d’intervention.
Trabéculectomie proprement dite
Lorsque le limbe chirurgical est exposé (le repère visuel est la ligne blanc-bleu), la trabéculectomie proprement dite est réalisée par résection d’un bloc sclérolimbique qui comprend idéalement le trabéculum et le canal de Schlemm. Cette résection peut se faire à la lame (fig. 16-16fg), d’une largeur inférieure à celle du volet scléral, ou au punch :
-
la lame, généralement un couteau 15°, permet de réaliser trois incisions : l’une antérieure, parallèle au limbe, en avant de l’anneau de Schwalbe, et les deux autres perpendiculaires à la première et situées à ses extrémités (fig. 16-16f). Le bloc créé est pris entre les mors d’une pince à griffes, retourné pour repérer le trabéculum postérieur pigmenté, puis réséqué aux ciseaux de Vannas, juste en en avant de l’éperon scléral (fig. 16-16g). La taille de la trabéculectomie est variable, généralement de 1 × 1 mm. Sa largeur doit être inférieure à celle du volet scléral pour limiter l’écoulement aqueux limbique qui favorise le développement de volumineuses bulles de filtration antérieures [40] ;
-
le « punch » permet une résection tissulaire calibrée, de 0,5 ou 1 mm.
Iridectomie périphérique
Elle est indispensable pour éviter que l’iris ne s’incarcère dans la fistule. L’iris, pris dans les mors de la pince de Bonn, doit être sectionné aux ciseaux courbes de Vannas sur une largeur au moins équivalente à celle de la sclérectomie (fig. 16-16hi).
Fermeture du volet scléral de protection
Elle se fait à l’aide de points séparés au nylon 10/0, placés aux coins d’un volet carré ou à la pointe d’un volet triangulaire, et des sutures additionnelles (ajustables, points séparés ou relâchables) sont rajoutées jusqu’à ce que la fermeture du volet assure le maintien d’une chambre antérieure formée (suture étanche) sans que le volet soit hermétique (l’humeur aqueuse doit soudre au travers des berges du volet). L’injection de BSS en chambre antérieure permet d’ajuster le serrage des sutures (fig. 16-16jk). Les points séparés qui assurent l’étanchéité du volet seront numérotés sur le compte rendu opératoire, car ils seront lysés en premier en cas d’hypertonie en postopératoire. Les sutures ajustables (quadruple boucle simple mise à plat) pourront être desserrées à la lampe à fente et les sutures relâchables, qui passent en cornée claire, seront sectionnées (fig. 16-16k), ce qui s’avère nécessaire dans 50 % des cas [22].
Sutures conjonctivo-ténoniennes
Elles doivent assurer l’étanchéité parfaite du volet conjonctivoténonien, soit par points séparés soit par minisurjets (Vicryl 8/0 ou 10/0) à aiguille ronde en chargeant simultanément les plans conjonctivaux et ténoniens en cas d’ouverture au limbe (fig. 16-16l), mais séparément dans les ouvertures au fornix. Des sutures additionnelles conjonctivolimbiques en cas de volet à charnière limbique limiteront les risques de Seidel. Dans tous les cas, il faut vérifier en fin d’intervention que la bulle de filtration se soulève et est étanche en injectant du BSS en chambre antérieure (fig. 16-16m).
Un collyre ou une pommade, antibiotique et anti-inflammatoire, sont instillés en fin d’intervention ainsi qu’une goutte d’atropine 1 %, et l’œil est protégé par une coque qu’il faudra garder pour dormir la nuit jusqu’à la disparition des sutures (15 à 21 jours) (vidéo 16-2).
Variantes techniques
Trabéculectomie modifiée selon Pen Khaw [30]
Elle a pour but :
-
d’éviter les risques de bulle de filtration limbique volumineuse en disséquant un large volet scléral rectangulaire s’arrêtant à 1 mm du limbe chirurgical, et en appliquant des éponges imbibées de mitomycine C en arrière du volet et sur une large surface ;
-
de réduire les risques d’hypotonie précoce prolongée en réalisant une petite trabéculectomie et en plaçant des sutures ajustables (quadruple boucle à plat) ;
-
de limiter la réaction inflammatoire en plaçant un mainteneur de chambre antérieure qui évacue les débris inflammatoires.
Trabéculectomie après dissection d’un tunnel scléral [26]
Dérivée des techniques initiales de phaco-émulsification par voie sclérale, son but est de limiter la manipulation tissulaire, d’éviter une athalamie peropératoire et de réduire les Seidel limbiques. Elle consiste à réaliser une pochette sclérocornéenne de 2 mm sur 3 mm au couteau Crescent, sans réfends latéraux, et à ouvrir la chambre antérieure par une incision auto-étanche au couteau 3,2 mm, la résection cornéosclérale se faisant au punch introduit dans l’ouverture cornéenne, suivie d’une iridectomie périphérique.
Prise en charge après l’intervention
La surveillance postopératoire est fondamentale pour surveiller la cicatrisation tissulaire qui s’étend sur plusieurs mois, avec des étapes clés à connaître (voir encadré ci-après) et adapter le traitement en fonction, ce qui peut permettre de doubler, les taux de succès [12]. Le traitement anti- inflammatoire par corticothérapie locale sera prolongé et à doses dégressives jusqu’à l’obtention d’une bulle de filtration modérément soulevée, diffuse, étanche, à vascularisation diminuée (fig. 16-17) et microkystique (fig. 16-18).
Une antibiothérapie préventive est de rigueur la première semaine, ainsi que l’utilisation d’anti- inflammatoire non stéroïdien non conservés locaux en complément, pouvant permettre de renforcer le traitement anti-inflammatoire sans majorer le risque de cataracte et d’hypertonie induite par la corticothérapie locale.

Ordonnance type de sortie
Œil opéré
-
Rincer l’œil matin et soir avec du sérum physiologique avant d’instiller les gouttes.
-
Essuyer sans frotter avec des compresses stériles.
-
Instiller à 10 minutes d’intervalle les collyres suivants : collyre dexaméthasone + antibiotique : six fois par jour pendant huit jours relayé par un collyre à la dexaméthasone sans conservateur quatre fois par jour pendant un mois puis trois fois par jour pendant un mois.
-
Agents hydratants de la surface oculaire sans conservateur trois fois par jour deux mois si sensation de sable.
-
Pommade vitamine A le soir au coucher après les gouttes si sensation de sable.
Œil non opéré
-
Continuer le traitement habituel.
Précautions pendant un mois
-
Dormir avec la coque oculaire, ne pas dormir à plat ventre ni du côté opéré.
-
Pas de sport, pas de piscine, pas de maquillage.
-
Ne pas frotter l’œil, éviter de pencher la tête en avant et de porter des paquets lourds.
-
Douche à partir du cou, lavage du visage avec un gant à l’exception des yeux.
-
Laver les cheveux tête en arrière.
-
Consulter immédiatement en cas de douleur, de baisse visuelle brutale, de larmoiement ou de sécrétions anormales.
Visites de contrôle
Le patient doit être revu le lendemain de la chirurgie, à J8, J15, 1 mois, 2 mois, 3 mois, 6 mois, voire plus souvent selon l’évolution de la cicatrisation, en contrôlant à chaque visite l’acuité visuelle, la PIO, l’aspect de la bulle de filtration (étendue, volume, vascularisation, microkystes, étanchéité ++), l’aspect de la chambre antérieure et le fond d’œil. Le suivi se fera ensuite très régulièrement tous les six mois à vie, les complications de la chirurgie pouvant survenir plusieurs années après sa réalisation (notamment les perforations des bulles de filtration qui exposent au risque d’endophtalmie).
RÉSULTATS
Ils se conçoivent en termes de contrôle tensionnel, de maintien de la fonction visuelle et de complications éventuelles. Les taux de succès sont très variables selon les études (de 36 % à 98 % !) [34] car les critères de succès varient selon les études publiées.
Pour pallier cette difficulté d’interprétation des résultats dans les études à venir, la WGA (World Glaucoma Association) a édité en 2009 un consensus sur la définition du succès de la chirurgie du glaucome [15] qui dépend de la PIO cible :
-
PIO < 18 mmHg pour les glaucomes débutants ou baisse de 20 % de la PIO ;
-
PIO < 15 mmHg pour les glaucomes modérés ou baisse de 30 % de la PIO ;
-
PIO < 12 mmHg pour les glaucomes sévères évolués.
Il faut dans chaque cas préciser si ces succès sont complets (sans traitement médical d’appoint) ou relatifs (avec traitement médical d’appoint), et exclure des critères de succès les PIO inférieures à 6 mmHg et les yeux ayant accusé une perte d’acuité visuelle.
Il se dégage toutefois des nombreuses études concernant la trabéculectomie que les taux de succès tensionnel de la trabéculectomie sont élevés durant les deux premières années et qu’ils diminuent ensuite dans les trois années qui suivent pour rester relativement stables les années suivantes.
Stalmans et al. [38] rapportent sur une série de 53 yeux opérés selon la technique de Pen Khaw qu’à 15,7 mois, 100 % des yeux ont une PIO inférieure à 21 mmHg, 90,9 % une PIO inférieure à 18 mmHg et 61,4 % une PIO inférieure à 14 mmHg avec des taux de complications extrêmement réduits : 1,8 % d’athalamie, 1,5 % hypotonie dans les trois premières semaines, et 8,9 % de décollements choroïdiens.
Les résultats à moyen et long termes sont rapportés dans le tableau 16-7, Landers ayant publié les résultats des principales études à moyen terme [23].
L’étude de Jampel et al. [18], portant sur 797 yeux opérés de trabéculectomie, renseigne sur les résultats attendus à moyen terme (4 ans) en termes de pourcentage de réduction pressionnelle (ou PIO cible) (tableau 16-8). Les taux de succès sont plus importants avec l’utilisation de mitomycine C à plus forte concentration et pour les patients qui ont les PIO préopératoires les plus élevées. Les complications principales sont l’apparition ou l’aggravation d’une cataracte (55 %), une baisse visuelle de plus de trois lignes (21 %), une complication liée à la bulle de filtration (8 %) et des complications infectieuses (3,4 %). Les taux de réintervention (nouvelle trabéculectomie, implant de dérivation, cyclodestruction) pour contrôle pressionnel insuffisant sont de 13 %.
Les taux de succès et l’incidence des complications à cinq ans de la trabéculectomie sont équivalents avec la mitomycine C (0,2 mg/mL, 2 minutes) et le 5-fluoro-uracile (50 mg/mL, 5 minutes) utilisés en peropératoire d’après les résultats de l’étude randomisée de Palanca-Capistrano et al. [29] portant sur 103 sujets, avec des taux de succès relatifs (6 mmHg < PIO < 21 mmHg) de 66 % dans le groupe mitomycine C et 76 % dans le groupe 5-fluoro-uracile. La complication la plus fréquente dans cette étude est une fuite au niveau de la bulle de filtration dont l’incidence est de 4 % par an dans chaque groupe.
À plus long terme, les études sont moins nombreuses mais les taux de succès tendent à se stabiliser et restent intéressants, du moins avec un traitement d’appoint puisque 15 à 20 ans après la chirurgie, entre 42 et 90 % des patients ont une PIO encore contrôlée (PIO < 21 mmHg) [2, 23, 28, 42], les taux de succès complets étant bien sûr moindres et surtout très variables selon les études puisque chiffrés entre 1 % [42] et 60 % [23].
Des études qui ont comparé la trabéculectomie aux autres techniques chirurgicales se dégagent les grandes notions suivantes :
-
la trabéculectomie permet un abaissement tensionnel supérieur à celui de la sclérectomie profonde mais avec plus de complications selon une récente méta-analyse [21] ;
-
les taux de succès de la trabéculectomie à deux ans sont supérieurs à ceux de la trabéculectomie ab interno (76,1 % et 22,4 % respectivement) [19] ;
-
chez les patients pseudo-phakes ou ayant eu un échec de trabéculectomie, l’étude TVT (trabéculectomie versus tube), randomisée, multicentrique, comparant la trabéculectomie avec la mitomycine C aux implants de drainage, rapporte que si les deux techniques permettent un abaissement tensionnel équivalent, avec un taux de complications tardives similaire, la trabéculectomie + mitomycine C expose à davantage de complications précoces et à des taux d’échec plus importants que les implants de drainage dans ces indications [11].
COMPLICATIONS
Si l’incidence des complications de la trabéculectomie est de 50 % toutes causes confondues [10], elles sont le plus souvent mineures. Certaines, plus rares, peuvent compromettre le succès de la chirurgie, voire exceptionnellement engager le pronostic visuel.
Complications peropératoires
Elles sont peu fréquentes (12 % des cas selon l’étude CIGTS [17]), mais peuvent toutes compromettre le pronostic fonctionnel de la trabéculectomie : hématome musculaire lors de la prise en charge du muscle droit supérieur, déchirure de la conjonctive lors de la dissection (l’injection sous-conjonctivale de BSS permet de repérer les zones d’adhérence tissulaire éventuelles) ; un volet scléral trop fin peut se déchirer ou se perforer et, s’il n’est pas suturable, mieux vaut disséquer ailleurs un autre volet plus épais.
Hémorragie
Une hémorragie peut gêner le déroulement de l’intervention et favoriser une fibrose secondaire (en provenance de la conjonctive, du corps ciliaire, des extrémités sectionnées du canal de Schlemm, de l’incision cornéosclérale ou de l’iris avec risque d’un hyphéma qui est la complication la plus fréquente (24,6 %) [10]. Si le saignement ne cède pas spontanément ou après tamponnement par un produit viscoélastique, une cautérisation prudente est nécessaire. Un hyphéma important nécessite un lavage de chambre antérieure. Le traitement est surtout préventif : arrêt des médicaments interférant avec la coagulation avant l’intervention, dissection à distance des vaisseaux, cautérisation si nécessaire à bon escient.
Hernie de l’iris
Une hernie de l’iris, lors de l’ouverture de la chambre antérieure, peut être difficile à réintégrer. L’instillation de myotiques et le bon contrôle de la tension artérielle diminuent ce risque.
Iridectomie périphérique
Une iridectomie périphérique incomplète complétée secondairement à l’aide d’une pince à griffes expose au risque de lésion de la zonule, de la cristalloïde antérieure, voire de la hyaloïde antérieure avec issue de vitré. Si l’irrigation de BSS sous pression ne permet pas d’ouvrir le feuillet pigmenté résiduel, il est préférable de terminer l’iridectomie périphérique au laser secondairement.
Issue de vitré
L’issue de vitré est rare (0,5 % des cas) mais grave car elle expose à l’obstruction à court terme du site de trabéculectomie et à d’autres complications plus graves comme l’invasion épithéliale, le décollement de rétine, l’œdème maculaire, l’uvéite ou l’endophtalmie. Elle peut survenir si l’excision du bloc scléral est trop postérieure (yeux buphtalmes, myopes forts), lorsqu’une iridectomie périphérique est complétée avec une pince à griffes, si le cristallin est subluxé en regard de la zone de trabéculectomie ou chez l’aphake. Elle est favorisée par l’augmentation de la pression veineuse épisclérale et par l’appui du blépharostat sur le globe. Elle nécessite une vitrectomie antérieure et une surveillance postopératoire rapprochée.
Hémorragie suprachoroïdienne
Elle a une incidence rapportée de 0,73 % chez les glaucomateux, toutes interventions chirurgicales confondues. Les facteurs de risque sont ceux qui favorisent une poussée choroïdienne (obésité, hypertension artérielle, bronchopathie chronique obstructive, patient installé en déclive, pression sur le globe pendant l’intervention, décompression brutale oculaire, hypotonie brutale et/ou prolongée) sur un œil aux parois et/ou aux vaisseaux fragiles (myopes forts, buphtalmes, glaucomes évolués), ou sur les yeux vitrectomisés, aphakes, atteints du syndrome de Sturge-Weber (30 % de risque) ou chez les patients ayant des troubles de l’hémostase. Le tableau clinique associe un effacement brutal de la chambre antérieure, un durcissement du globe oculaire et l’expansion d’une masse noire au fond d’œil pouvant aboutir à l’expulsion du contenu oculaire dans un contexte douloureux malgré l’anesthésie. La fermeture du globe oculaire doit être la plus rapide possible en tentant de réintégrer l’uvée et en injectant en intraveineux des hypotonisants artériels (nicardipine, Loxen®) et oculaires [acétazolamide, mannitol 20 % (1 g/kg) en IV]. Le pronostic visuel à terme est incertain, mais meilleur si l’uvée n’a pas été expulsée, s’il n’y a pas d’hémorragie intravitréenne ni de décollement de rétine associé. L’indication secondaire du drainage chirurgical des hématomes associé à une vitrectomie-silicone sera discutée au cas par cas avec un rétinologue. La prévention est importante chez les patients à risque, notamment sous anticoagulants : installation du patient en proclive, contrôle de la tension artérielle et de la PIO avant l’intervention, décompression douce du globe par réalisation d’une paracentèse avant la trabéculectomie, utilisation d’un mainteneur de chambre antérieure ou injection de visqueux pour garder une PIO constante pendant l’intervention, préplacement de sutures sur le volet pour fermer rapidement et limiter la période d’hypotonie peropératoire, fermeture étanche du volet scléral.
Traumatisme cristallinien
C’est une complication rare mais pouvant survenir lors de la paracentèse au couteau 15°, lors de l’incision du bloc sclérocornéen ou au moment de l’iridectomie. L’irrigation excessive de la chambre antérieure lors de l’intervention peut alors accélérer dans les suites opératoires la formation d’une cataracte.
Complications postopératoires à court et moyen termes (moins de trois mois)
Les complications les plus fréquentes dans les jours qui suivent l’intervention sont l’hyphéma, l’hypotonie, l’hypothalamie, le Seidel conjonctival et le décollement choroïdien [10] ; d’autres complications, plus rares et parfois plus graves, peuvent survenir.
Baisse d’acuité visuelle
Si une modification de l’acuité visuelle est banale dans les semaines qui suivent l’intervention [altération de la surface oculaire par les fils de suture ou les traitements anti-inflammatoires locaux, trouble réfractif consécutif à la baisse de la PIO (astigmatisme si hypotonie, myopisation si hypothalamie, hypermétropisation si œdème maculaire d’hypotonie)], la baisse profonde de l’acuité visuelle (< 1/10), encore appelée « wipe out » par les Anglo-Saxons, est une complication redoutée quand on opère un glaucome très évolué avec atteinte périmétrique dans les 10° centraux, dont l’incidence publiée varie entre 0 et 7,7 %. Elle est liée à la survenue d’une complication – maculopathie d’hypotonie essentiellement, remontée tensionnelle oculaire ou réaction inflammatoire –, et est plus fréquente si la PIO préopératoire est élevée [24]. Sa prévention passe par une indication opératoire circonstanciée en cas de glaucome très évolué, par un contrôle strict de la PIO avant l’intervention, par une surveillance rapprochée dans les heures qui suivent la chirurgie pour détecter et traiter un pic hypertensif, et par la prise de toutes les précautions opératoires précitées pour limiter le risque d’hypotonie oculaire per- et postopératoire.
Phénomène de Seidel conjonctival
Il traduit l’absence d’étanchéité de la bulle de filtration du fait de sutures insuffisantes ou lâches, d’une perforation traumatique de la conjonctive peropératoire ou d’une fuite au niveau du point de passage d’un point. Il est plus fréquent avec une ouverture conjonctivale au limbe (11-30 %) qu’au fornix (0-11 %) [35], indépendamment de l’utilisation d’antimitotiques. Son traitement dépend de son importance et de la présence de complications associées.
-
Seidel minime non compliqué d’athalamie
Il est souvent rapidement résolutif sous couvert d’une antibiothérapie locale et d’une pommade cicatrisante, voire d’une lentille thérapeutique de large diamètre, la corticothérapie locale étant réduite mais maintenue pour traiter une cyclite susceptible d’entretenir l’hypotonie. Des collyres réduisant la production d’humeur aqueuse peuvent être utilisés sur un très court terme pour limiter le flux aqueux transconjonctival, tandis qu’une cycloplégie locale par atropine 1 % est indiquée si la chambre antérieure est étroite afin de retendre la zonule. La suture de la conjonctive sous asepsie stricte est toutefois le moyen le plus efficace de traiter le Seidel.
-
Seidel important et/ou compliqué d’athalamie
Il faut réintervenir chirurgicalement en reformant la chambre antérieure par injection de viscoélastique ou de gaz, et en resuturant la conjonctive.
Le traitement du Seidel conjonctival est essentiellement préventif et passe par une manipulation conjonctivale la plus atraumatique possible et la vérification en fin d’intervention de l’étanchéité du volet conjonctivoténonien.
Hémorragies
Les hémorragies postopératoires (sous-conjonctivales, hyphéma) sont fréquentes (6 à 25 % des cas) [10] et souvent résolutives spontanément sous corticothérapie locale renforcée pour limiter la fibrose tissulaire.
-
Hyphéma
En cas d’hyphéma sans hypertonie, des boissons abondantes et fréquentes facilitent sa résorption et l’instillation d’atropine limite la récidive du saignement irien en bloquant l’iris en mydriase. On conseillera au patient le repos et la surélévation de la tête du lit de 30 à 45°.
Si l’hyphéma est compliqué d’une hypertonie oculaire, la gonioscopie peut suffire à mobiliser un caillot sanguin bloquant l’orifice de la trabéculectomie, Un traitement hyponisant local, voire général, sera mis en route selon les valeurs de la PIO. Un lavage de chambre antérieure sera discuté si la PIO est supérieure à 35 mmHg et l’hyphéma majeur (risque d’hématocornée), et chez les patients drépanocytaires.
-
Hémorragie intravitréenne
Elle est rare, secondaire à un saignement irien ou ciliaire, et régresse souvent spontanément. Exceptionnellement, elle peut être massive et secondaire à un hématome choroïdien, dans un contexte d’hypertonie oculaire.
-
Hémorragies suprachoroïdiennes
Elles peuvent survenir dans les jours qui suivent l’intervention, chez les patients à risque, notamment sous anticoagulants, et sont favorisées par une manœuvre de Valsalva. La douleur est aiguë et brutale, l’acuité visuelle effondrée, la chambre antérieure réduite, la PIO normale ou élevée et l’hématome est visible au fond d’œil. Une hémorragie intravitréenne ou un décollement de rétine associés assombrissent le pronostic visuel. Le traitement médical associe des hypotonisants locaux et généraux, des cycloplégiques et des antalgiques. L’évacuation chirurgicale des hématomes est indiquée en cas de douleur importante, d’athalamie, de décollements choroïdiens hématiques massifs jointifs, généralement après une dizaine de jours d’observation, le temps que le caillot se liquéfie. Le pronostic visuel est réservé.
Hypotonie (PIO < 6 mmHg) avec chambre antérieure étroite
Elle traduit un excès d’évacuation de l’HA et/ou une diminution de production d’HA. L’hypotonie peut se compliquer d’un décollement choroïdien, d’un stop sécrétoire ciliaire, d’une inflammation, d’une cataracte, d’un œdème de cornée ou d’une hémorragie suprachoroïdienne. Le traitement associe dans tous les cas un cycloplégique, une corticothérapie locale et le repos. Les traitements spécifiques sont ceux de la cause.
-
Déhiscence conjonctivale avec phénomène de Seidel
C’est la cause la plus fréquente des hypotonies postopératoires. La bulle de filtration est souvent plate. Il faut suturer la déhiscence.
-
Excès de filtration au travers du volet scléral
La bulle de filtration est volumineuse et les décollements choroïdiens fréquents. L’excès de filtration est favorisé par un volet fin, des sutures insuffisantes ou lysées trop tôt dans les suites opératoires, et par l’utilisation de mitomycine C. Une lentille thérapeutique souple de grand diamètre (18 mm, par exemple Trabeculens®, laboratoire LCS) peut être utile quelques jours pour comprimer la bulle de filtration le temps que la chambre antérieure se reforme. Chez les sujets à risque d’hémorragie suprachoroïdienne, ou si l’hypotonie est compliquée d’athalamie menaçant la transparence de la cornée ou du cristallin, il faut réintervenir chirurgicalement, resuturer le volet scléral et reformer la chambre antérieure en injectant un produit viscoélastique.
Hypertonie oculaire avec chambre antérieure étroite
-
Blocage pupillaire
Il survient lorsque l’iridectomie est incomplète ou non fonctionnelle car obstruée et qu’il existe des synéchies postérieures. Il se traduit par un bombement irien périphérique. Il faut hypotoniser le globe oculaire médicalement et compléter ou réaliser très rapidement une iridectomie périphérique.
-
Hémorragie choroïdienne
Voir plus haut le paragraphe « Hémorragies ».
-
Glaucome malin
Représentant 2 % des complications de la chirurgie filtrante, il est surtout l’apanage des glaucomes par fermeture de l’angle ou des yeux hypermétropes. Typiquement, la chambre antérieure est effacée, l’iridectomie périphérique patente, et la PIO élevée mais parfois normale. L’échographie mode B peut objectiver des espaces hypo-échogènes dans la cavité vitréenne. Il faut s’assurer que l’iridectomie périphérique est complète, instiller de l’atropine, prescrire des agents hypotonisants locaux et généraux, voire des agents hyperosmotiques. En cas d’échec ou de récidive à l’arrêt de l’atropine, on peut tenter divers traitements successivement : rupture simultanée de la capsule et la hyaloïde antérieures au laser Nd-YAG chez le pseudo-phake ou l’aphake, hyaloïdectomie au laser au travers de l’iridectomie périphérique chez le phake, photocoaguler le corps ciliaire, retirer le vitré antérieur et une partie de la hyaloïde antérieure par vitrectomie à la pars plana, ou réaliser une vitrectomie complète avec iridectomie, zonulectomie en regard et lensectomie chez les phakes, cette intervention donnant les meilleurs succès tensionnels et le moindre taux de récidive [8].
Hypertonie oculaire avec chambre antérieure profonde
Elle témoigne d’un obstacle sur le trajet de l’évacuation de l’HA. Si l’obstacle est le plus souvent externe, la gonioscopie doit être systématique pour éliminer un obstacle interne empêchant le développement d’une bulle de filtration.
-
Obstacle interne
Dans les jours qui suivent la chirurgie, l’hypertonie oculaire peut être due à un résidu de produit viscoélastique en chambre antérieure, à l’obstruction du site de trabéculectomie par un caillot sanguin, un fragment d’iris, ou une bride de vitré à sectionner au laser Nd-YAG ou par des procès ciliaires à rétracter au laser à l’argon. La révision chirurgicale est parfois nécessaire.
La corticothérapie locale prolongée peut expliquer une hypertonie oculaire. Elle sera relayée par un traitement par AINS si la bulle de filtration est encore inflammatoire.
-
Obstacle externe (le plus fréquent)
Le diagnostic est porté sur l’aspect de la bulle de filtration et le traitement doit être rapide pour éviter l’installation d’adhérences tissulaires définitives. La période critique se situe entre la 1re et la 4e semaine, lorsque la réponse inflammatoire est maximale.
Sutures du volet scléral trop serrées
La bulle de filtration est plate et le site de trabéculectomie est libre en gonioscopie. Il faut agir avant que la fibrose conjonctivale et épisclérale ne symphyse le volet scléral (entre J8 et J10, plus tard si de la mitomycine C a été utilisée en peropératoire). La lyse des sutures se fait au laser à l’argon (50 μm, 1 W, 0,1 s) focalisé au travers du verre de Hoskins (fig. 16-19), une à une, en commençant par celles qui ont permis l’étanchéité du volet scléral et en vérifiant la PIO après chaque lyse pour éviter une hypotonie oculaire. Les sutures ajustables limitent ce risque puisque qu’elles sont desserrées en fonction du flux aqueux sortant.
Encapsulation de la bulle de filtration
Elle complique 15 % des trabéculectomies et survient surtout dans les 3 à 6 semaines qui suivent l’intervention. Elle est favorisée par l’utilisation prolongée de collyres locaux conservés, l’inflammation et/ou les hémorragies sous-conjonctivales. La bulle de filtration est soulevée en dôme, entourée d’un anneau de fibrose hypervascularisé (fig. 16-20). Il faut majorer la corticothérapie locale et effondrer les parois de la bulle de filtration à l’aiguille (needling) puis injecter une substance anticicatrisante en sous-conjonctival (SC) (5 mg de 5-fluoro-uracile, 0,01 mg de mitomycine C ou dexaméthasone 4 mg/mL). Le needling se fait à la lampe à fente ou au bloc opératoire selon les cas. L’anticicatrisant est injecté à côté de la bulle de filtration, puis on procède au needling à l’aide d’une aiguille 30G ou d’une lancette 23G introduites en SC, à 9 mm du limbe et dirigées vers la paroi de la bulle de filtration qu’elles perforent en plusieurs points. Le needling est réussi lorsque la bulle de filtration s’affaisse, que la conjonctive adjacente à se soulève, et que la PIO baisse. Des collyres corticoïdes et antibiotiques sont prescrits après le needling. Les complications peuvent être l’hémorragie sous-conjonctivale, l’hyphéma ou l’hypotonie (vidéo 16-3).
Fibrose de la bulle de filtration
Survenant souvent entre le 2e et 3e mois postopératoires, elle se traduit par une bulle de filtration plate et une hypertonie intra-oculaire. Il faut dilacérer la fibrose par injection SC de 0,1 mL de Xylocaïne® 1 % suivie par une injection de BSS tandis que l’aiguille progresse en direction du volet scléral, passant parfois sous le volet scléral pour libérer les adhérences. Un abaissement immédiat de la PIO à 10 mmHg témoigne de son succès Une injection SC de 5-fluoro-uracile ou de mitomycine C est réalisée ensuite à distance de la bulle de filtration. Les injections seront répétées si nécessaire et, en cas d’échec, on pourra réviser chirurgicalement le site opératoire (vidéo 16-4).
BF : bulle de filtration ; HTO : hypertension intra-oculaire.
Complications postopératoires à long terme (plus de trois mois)
Pouvant survenir plusieurs années après la trabéculectomie, elles nécessitent une surveillance à vie.
Déhiscence de la bulle de filtration
Elle survient sur des bulles de filtration aux parois fines et avasculaires, spontanément ou après un traumatisme (par exemple lentilles de contact) et est favorisée par l’utilisation de mitomycine C et de 5-fluoro-uracile (17,9 % de fuite à cinq ans avec la mitomycine C) [9, 25]. Elle se traduit par un Seidel conjonctival (fig. 16-21) découvert fortuitement ou au décours d’une complication – larmoiement, photophobie, baisse visuelle ou douleurs. Elle expose au risque d’hypotonie chronique compliquée, de baisse de l’acuité visuelle, d’inflammation ou d’infection.
Toute fuite, même minime, doit être traitée rapidement car aucune antibiothérapie prophylactique locale ne peut prévenir seule la survenue d’une complication infectieuse.
Si la fuite est minime et non compliquée le traitement peut être conservateur sous surveillance stricte : collyres diminuant la production d’HA sous couvert d’une antibiothérapie prophylactique locale, voire port d’une lentille de grand diamètre (Trabeculens®, 17,5 mm de diamètre), une à trois semaines. D’autres traitements conservateurs ont des résultats aléatoires : point de colle, injection de sang autologue, sutures compressives au Prolène sur la bulle de filtration, needling postérieur de la bulle de filtration pour réduire la pression dans cette dernière, recouvrement par une membrane amniotique [4].
La reprise chirurgicale reste le traitement de choix car les fuites récidivent souvent après traitement conservateur. Elle consiste à désépithélialiser la bulle de filtration ou la réséquer et à la recouvrir par du tissu sain selon trois techniques d’efficacité équivalente : greffe conjonctivale libre [36], lambeau conjonctivoténonien d’abaissement [5] ou de rotation [13]. Si le volet scléral est trop fin ou nécrosé, il faut le recouvrir par un volet scléral autologue. Les taux de succès (disparition du Seidel conjonctival et 6 < PIO < 21 mmHg ± traitement) sont de 80 à 86 % à 12 mois [13, 39] et restent de 44 % à 10 ans [31]. Cette reprise chirurgicale expose à l’hypertonie oculaire dans 20 à 40 % des cas [5, 13, 39], qui est cependant moins fréquente si la bulle de filtration a été désépithélialisée [27].
Hypotonie oculaire
Elle se définit comme une PIO inférieure à 6 mmHg et traduit une évacuation excessive ou une production insuffisante d’HA (voir plus haut l’encadré « Chambre antérieure étroite ou effacée après trabéculectomie : orientation diagnostique »). Elle peut être isolée ou compliquée d’une BAV par maculopathie d’hypotonie, troubles réfractifs liés à l’hypo- ou à l’athalamie, cataracte ou décollement choroïdien.
-
Bulle de filtration perforée
Voir plus haut « Déhiscence de la bulle de filtration ».
-
Bulle de filtration hyperfiltrante
Le traitement est conservateur en cas de gêne isolée, mais d’efficacité aléatoire, consistant à créer une réaction inflammatoire sur les bords de la bulle de filtration pour en réduire le volume, soit par cryothérapie, soit par photocoagulation au laser à l’argon ou au laser Nd-YAG. L’injection de sang autologue dans la bulle de filtration peut favoriser sa fibrose et réduire son volume, de même que son plaquage par des sutures compressives au nylon 10/0. En cas d’échec ou en cas de BAV, il faut réintervenir chirurgicalement : reformer la chambre antérieure par injection de visqueux ou de gaz, suturer le volet scléral ou le recouvrir d’un patch de sclère autologue, et remplacer la bulle de filtration par un lambeau conjonctivoténonien sain d’abaissement ou de rotation. La reprise chirurgicale peut se compliquer d’une remontée de la PIO.
-
Cyclodialyse
Liée au détachement des fibres musculaires ciliaires de l’éperon scléral si l’éperon a été sectionné en peropératoire, elle est visualisée en gonioscopie sous forme d’une fente, ou par UBM, plus facilement si la chambre antérieure est remplie de visqueux avant l’examen. L’instillation d’atropine entraîne une remontée de la PIO alors que les myotiques aggravent l’hypotonie. Si l’atropine 1 % trois fois par jour pendant un mois est inefficace, on peut tenter de fermer la fente selon différents procédés : photocoagulation au laser à l’argon, cryo-application transconjonctivale, suture du corps ciliaire, cryo-application ciliaire localisée, diathermie ciliochoroïdienne, vitrectomie, cryothérapie et tamponnement par gaz [16]. L’hypertonie est de règle dans les 15 jours qui suivent la fermeture de la fente, à traiter médicalement en excluant les myotiques.
-
Inflammation chronique
Une membrane cyclitique sur le corps ciliaire dans un contexte d’uvéite peut le rendre hyposécrétant. Sa résection peut être discutée si elle est visualisée.
-
Cause médicamenteuse
Le timolol ou l’acétazolamide repris après un échec d’une trabéculectomie peuvent entraîner une hypotonie compliquée de décollement choroïdien, expliquée par une hyper-réactivité de l’épithélium ciliaire [41].
Gêne fonctionnelle ou esthétique
Elle peut être liée à un ptosis, à une bulle de filtration exubérante entraînant une rétraction de la paupière supérieure, créant une sensation de corps étranger ou des douleurs par sècheresse oculaire pouvant aller jusqu’à un effet Dellen, ou au contraire un larmoiement. Le traitement est médical – agents lubrifiants et cicatrisants locaux – ou conservateur (voir plus haut « Bulle de filtration hyperfiltrante ») car la réfection de la bulle de filtration expose à une remontée de la PIO. Les excroissances de bulle de filtration sur la cornée peuvent générer un astigmatisme et leur résection ne compromet pas le fonctionnement de la bulle.
Baisse visuelle
-
Astigmatisme
Si un astigmatisme induit irrégulier est fréquent dans les suites opératoires non compliquées et régressif en 12 mois [14], certains astigmatismes ne sont pas régressifs : volet scléral trop fin suturé fortement, dellen cornéen, astigmatisme secondaire à une hypotonie.
-
Cataracte
C’est la complication la plus fréquente de la trabéculectomie à terme : 64 à 78 % des cas [1, 24]. Elle est favorisée par une athalamie, une réaction inflammatoire et par l’utilisation de mitomycine C en peropératoire. La fréquence de cette incidence doit faire poser l’indication d’une chirurgie combinée cataracte-glaucome chez les patients ayant déjà des opacités cristalliniennes.
-
Maculopathie d’hypotonie
Compliquant une hypotonie oculaire chronique, elle est plus fréquente chez les sujets de moins de 50 ans et chez les myopes, entraîne une BAV avec métamorphopsies et se traduit par la présence de fins plis choroïdiens maculaires. Le traitement de la cause permet de traiter l’hypotonie pour permettre une récupération visuelle parfois longue et incomplète, avec risque de métamorphopsies résiduelles.
Complications inflammatoires et infectieuses
Complications rares mais potentiellement gravissimes, pouvant survenir des années après la chirurgie, elles sont favorisées par une bulle de filtration aux parois fines et avasculaires, notamment après utilisation d’antimitotiques, et par les bulles de filtration qui fuient, l’inflammation puis l’infection étant favorisées par toutes les pathologies de la surface oculaire. Le traitement préventif est fondamental : il faut rechercher systématiquement à chaque consultation de suivi un Seidel conjonctival, enseigner au patient les signes qui doivent l’amener à consulter en urgence – larmoiement ou conjonctivite – et traiter toutes les pathologies inflammatoires et infectieuses des paupières chez les patients opérés de trabéculectomie.
Le traitement des inflammations de la bulle passe par le traitement de la pathologie de la surface oculaire associé à une corticothérapie et une antibiothérapie locales, en revoyant très régulièrement le patient pour ne pas méconnaître une infection débutante de la bulle de filtration (blébite).
La blébite se traduit par un abcès de la bulle de filtration, une inflammation conjonctivale (fig. 16-22) et du segment antérieur pouvant aller jusqu’à l’hypopion. Son incidence est de 3 % [18], moindre si la trabéculectomie a été réalisée sur des yeux vierges de traitement médical (1,5 % de risque à 9 ans selon l’étude CIGTS, portant sur 285 yeux) [43]. Le pronostic visuel dépend de la rapidité de la prise en charge, pour éviter une évolution vers l’endophtalmie. Le traitement associe des collyres « fortifiés » et une antibiothérapie par voie générale à large spectre après prélèvement conjonctival et de chambre antérieure avec protéine C-réactive en cas de réaction inflammatoire importante du segment antérieur. Les injections intravitréennes d’antibiotiques seront indiquées en l’absence d’amélioration clinique après 24 ou 48 heures de traitement ou en cas de BAV. Une corticothérapie locale sera débutée après 24 ou 48 heures d’amélioration clinique.
L’atteinte vitréenne témoigne d’une endophtalmie dont l’incidence varie entre 0,2 et 9,6 % [43]. Les facteurs de risque sont les bulles non recouvertes par la paupière supérieure, les bulles de filtration de localisation inférieure et les antimitotiques (2,5 % par an si mitomycine C versus 0,1 % par an). Les germes par ordre de fréquence sont les streptocoques, les bacilles à Gram négatif (Haemophilus influenzae), Staphylococcus epidermidis et S. aureus. La prise en charge est urgentissime avec ponction de chambre antérieure et/ou prélèvement vitréen dans les minutes qui suivent le diagnostic, et injections intravitréennes d’antibiotiques (vancomycine, amikacine) et de dexaméthasone d’emblée ou le lendemain, à répéter, associés à une antibiothérapie générale. La vitrectomie d’emblée, dans les cas où l’acuité visuelle est effondrée, pourrait améliorer le pronostic visuel mais n’est pas sans complications. Une fois l’infection traitée, si la bulle persiste et fuit, il faut la réséquer chirurgicalement. Dans tous les cas, ces complications peuvent compromettre le pronostic de la filtration.
Retenir
-
La trabéculectomie est une intervention filtrante perforante protégée par un volet scléral qui fait communiquer directement la chambre antérieure avec les espaces sous-conjonctivaux en ôtant tous les sites de résistance à l’écoulement aqueux pour abaisser la PIO.
-
La technique initiale décrite par Cairns a été modifiée pour améliorer le pronostic fonctionnel de la chirurgie et limiter l’incidence des complications (antimétabolites, sutures ajustables ou relâchables, technique favorisant un flux postérieur d’humeur aqueuse).
-
Les capacités de cicatrisation de la bulle de filtration conditionnent le succès de la chirurgie. Une préparation tissulaire et un suivi rigoureux sont indispensables au développement d’une bulle fonctionnelle.
-
La trabéculectomie est efficace pour abaisser durablement la PIO (à 13 mmHg dans 80 % des cas à 2 ans, avec 90 % de succès relatifs à 20 ans), l’abaissement tensionnel étant identique voire supérieur à celui de la sclérectomie profonde mais avec une incidence plus élevée de complications (50 %), souvent mineures et réversibles. Un patient sur quatre présentera une cicatrisation anormale de la bulle de filtration, et un sur deux une cataracte dans les suites de la trabéculectomie.
-
L’endophtalmie, rare mais gravissime, favorisée par les bulles de filtration fragiles, peut survenir très longtemps après la chirurgie.
-
Un suivi régulier à vie des patients opérés de trabéculectomie s’impose donc.


Fig. 16-16 Les différentes étapes de la trabéculectomie. a. Ouverture conjontivoténonienne au limbe. b. Ouverture des espaces sous-conjonctivoténoniens postérieurs. c. Dissection d’un volet scléral de mi-épaisseur. d. Préplacement des sutures au nylon sur le volet scléral. e. Application d’éponges imbibées de mitomycine C. f. Pré-incision sclérocornéenne à la lame 15° au limbe chirurgical.
Fig. 16-16 Les différentes étapes de la trabéculectomie. g. Résection du bloc sclérocornéen aux ciseaux de Vannas. h. Iridectomie périphérique aux ciseaux de Vannas. i. La fistule doit être plus petite que la largeur du volet scléral. j. Suture du volet scléral par plusieurs points auto-enfouis au nylon 10/0 sous contrôle du flux sortant par injection de BSS en chambre antérieure. k. Repose conjonctivoténonienne par plusieurs points au Vicryl 10/0 aiguille ronde. l. Vérification de l’étanchéité du volet conjonctivoténonien par injection de BSS en chambre antérieure qui remplit la future bulle de filtration.
Fig. 16-16 Les différentes étapes de la trabéculectomie. m. Suture relâchable passant en avant en cornée claire et en arrière en pont sur la partie antérieure du volet scléral, destinée à être sectionnée dans les suites opératoires au niveau de son extrémité antérieure.
Fig. 16-17 Bulle de filtration à un mois, diffuse, modérément soulevée, à vascularisation diminuée.
Fig. 16-18 Bulle de filtration présentant des microkystes en surface.
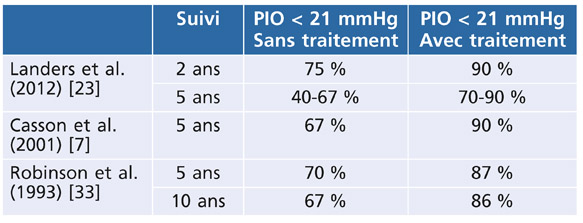
Tableau 16-7 Taux de succès de la trabéculectomie à moyen et long termes.
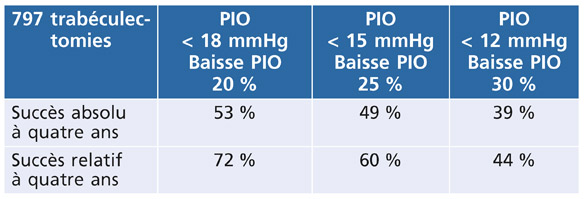
Tableau 16-8 Taux de succès à quatre ans de la trabéculectomie, exprimés en fonction de la PIO cible évalués chez 797 opérés [18].
Fig. 16-19 Verre de Hoskins permettant de lyser les sutures de nylon au laser à l’argon.
Fig. 16-20 Bulle de filtration encapsulée.
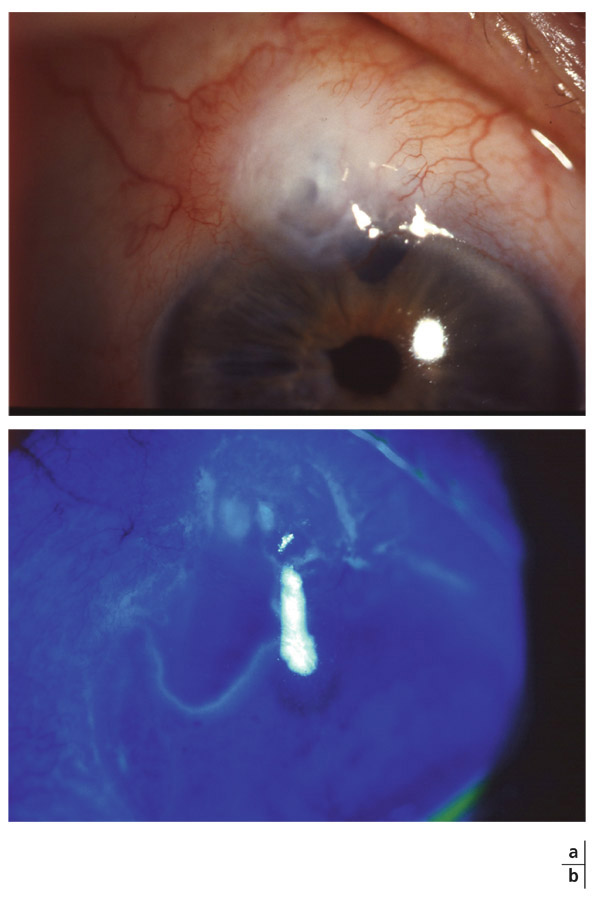
Fig. 16-21 Bulle de filtration avasculaire perforée (a) mise en évidence par le test à la fluorescéine (b).
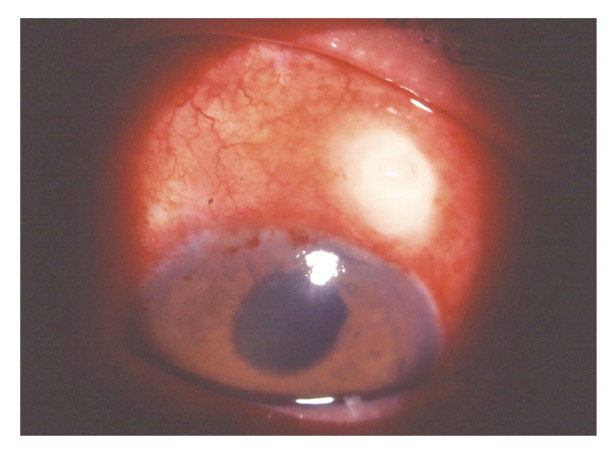
Fig. 16-22 Blébite.
[1] AGIS (Advanced Glaucoma Intervention Study) Investigators. The Advanced Glaucoma Intervention Study 8 : risk of cataract formation after trabeculectomy. Arch Ophthalmol. 2001 ; 119 : 1771-9.
[2] Bevin TH, Molteno AC, Herbison P. Otago Glaucoma Surgery Outcome Study : long-term results of 841 trabeculectomies. Clin Experiment Ophthalmol. 2008 ; 36 : 731-7.
[3] Birchall W, Bedggood A, Wells AP. Do scleral flap dimensions influence reliability of intraocular pressure control in experimental trabeculectomies. Eye. 2007 ; 21 : 402-7.
[4] Bochmann F, Azuara-Blanco A. Interventions for late trabeculectomy bleb leak. Cochrane Database Syst Rev. 2012 ; 9 : CD006769.
[5] Bresson-Dumont H, Lehoux A, Foucher J. Long term follow up of bleb reconstruction after glaucoma filtering surgery. J Fr Ophtalmol. 2009 ; 32 : 241-6.
[6] Breusegem C, Spielberg L, Van Ginderdeuren R, et al. Preoperative nonsteroidal anti-inflammatory drug or steroid and outcomes after trabeculectomy : a randomized controlled trial. Ophthalmology. 2010 ; 117 : 1324-30.
[7] Casson R, Rahman R, Salmon JF. Long term results and complications of trabeculectomy augmented with low dose mitomycine C in patients at risk for filtration failure. Br J Ophthalmol. 2001 ; 85 : 686-8.
[8] Debrouwere V, Stalmans P, Van Calster J, et al. Outcomes of different management options for malignant glaucoma : a retrospective study. Graefe’s Arch Clin Exp Ophthalmol. 2012 ; 250 : 131-41.
[9] DeBry PW, Perkins TW, Heatley G, et al. Incidence of late-onset bleb-related complications following trabeculectomy with mitomycin. Arch Ophthalmol. 2002 ; 120 : 297-300.
[10] Edmunds B, Thompson JR, Salmon JF, et al. The National Survey of Trabeculectomy. III. Early and late complications. Eye. 2002 ; 16 : 297-303.
[11] Gedde SJ, Singh K, Schiffman JC, et al. The Tube Versus Trabeculectomy Study : interpretation of results and application to clinical practice. Curr Opin Ophthalmol. 2012 ; 23 : 118-26.
[12] Grehn F. Surgery of primary open angle glaucoma. Klin Monbl Augenheilkd. 2008 ; 225 : 30-8.
[13] Hamard P, Tazartes M, Ayed T, et al. Pronostic fonctionnel des bulles fuyant recouvertes par un lambeau conjonctivoténonien d’abaissement. J Fr Ophtalmol. 2001 : 24 : 482-90.
[14] Hayashi K, Hayashi H, Oshika T, Hayashi F. Fourier analysis of irregular astigmatism after trabeculectomy. Ophthalmic Surg Lasers. 2000 ; 31 : 94-9.
[15] Heuer DK, Barton K, Grehn F, et al. Consensus on definition of success. In : Shaarawy T, Sherwood M, Grehn F (eds). Guidelines on design and reporting of glaucoma surgical trials : World Glaucoma Association. Amsterdam, Kugler Publications, 2009 : 15-24.
[16] Hoerauf H, Roider J, Laqua H. Treatment of traumatic cyclodialysis with vitrectomy, cryotherapy and gas tamponnade. J Cat Refract Surg. 1999 ; 25 : 1299-301.
[17] Jampel HD, Musch DC, Gillespie BW, et al. The Collaborative Initial Glaucoma Treatment Study Group. Perioperative complications of trabeculectomy in the Collaborative Initial Glaucoma Treatment Study (CIGTS). Am J Ophthalmol. 2005 ; 140 : 16-22.
[18] Jampel HD, Solus JF, Tracey PA, et al. Outcomes and bleb-related complications of trabeculectomy. Ophthalmology. 2012 ; 119 : 712-22.
[19] Jea SY, Francis BA, Vakili, G, et al. Ab interno trabeculectomy versus trabeculectomy for open-angle glaucoma. Ophthalmology. 2012 ; 119 : 36-42.
[20] Johns E, Clark J, Khaw PT. Recent advances in trabeculectomy technique. Curr Opin Ophthalmol. 2005 ; 16 : 107-13.
[21] Ke M, Guo J, Qian Z. Meta analysis of non-penetrating trabecular surgery versus trabeculectomy for the treatment of open angle glaucoma. J Huazhong Univ Sci Technolog Med Sci. 2011 ; 31 : 264-70.
[22] Klink T, Grehn F. Suture management after trabeculectomy. Ophthalmologe. 2009 ; 106 : 364-7.
[23] Landers J, Martin K, Sarkies N, et al. A twenty-year follow up study of trabeculectomy : risk factors and outcomes. Ophthalmology. 2012, 119 : 694-702.
[24] Law SK, Nguyen AM, Coleman AL, et al. Severe loss of central vision in patients with advanced glaucoma undergoing trabeculectomy. Arch Ophthalmol. 2007 ; 125 : 1044-50.
[25] Lin ZJ, Li Y, Cheng JW, Lu XH. Intraoperative mitomycin C versus intraoperative 5-fluorouracil for trabeculectomy : a systematic review and meta-analysis. J Ocul Pharmacol Ther. 2012 ; 28 : 166-73.
[26] Luntz MH, Schlossman A. Trabeculectomy : a modified surgical technique. J Cataract Refract Surg. 1994 ; 20 : 350-2.
[27] Melo AB, Razeghinejad MR, Palejwala N, et al. Surgical repair of leaking filtering blebs using two different techniques. J Ophthalmic Vis Res. 2012 ; 7 : 281-8.
[28] Molteno AC, Bosma NJ, Kittelson JM. Otago glaucoma surgery outcome study : long-term results of trabeculectomy – 1976 to 1995. Ophthalmology. 1999 ; 106 : 1742-50.
[29] Palanca-Capistrano AM, Hall J, Cantor LB, et al. Long-term outcomes of intraoperative 5-fluorouracil versus intraoperative mitomycin C in primary trabeculectomy surgery. Ophthalmology. 2009 ; 116 : 185-90.
[30] Pen Khaw PT. Enhanced trabeculectomy : the Moorfields Safer Surgery System. Dev Ophthalmol. 2012 ; 50 : 1-28.
[31] Radhakrishnan S, Quigley HA, Jampel HD, et al. Outcomes of surgical bleb revision for complications of trabeculectomy. Ophthalmology. 2009 ; 116 : 1713-8.
[32] Razeghinejad MR, Fudemberg SJ, Spaeth GL. The changing concept basis of trabeculectomy : a review of past and current surgical techniques. Surv Ophthalmol. 2012 ; 57 : 1-25.
[33] Robinson DI, Lertsumitkul S, Billson FA, et al. Long-term intraocular pressure control by trabeculectomy : a ten-year life table. Aust NZ J Ophthalmol. 1993 ; 21 : 79-85.
[34] Rotchford AP, King AJ. Moving the goal posts definitions of success after glaucoma surgery and their effect on reported outcome. Ophthalmology. 2010 ; 117 : 18-23.
[35] Sarwat S. Current variations in glaucoma surgery. Curr Opin Ophthalmol. 2012 ; 23 : 89-95.
[36] Schnyder CC, Sharaawy T, Ravinet E, et al. Free conjunctival autologous graft for bleb repair and bleb reduction after trabeculectomy and nonpenetrating filtering surgery. J Glaucoma. 2002 ; 11 : 10-6.
[37] Solus JF, Jampel HD, Tracey PA, et al. Comparison of limbus-based and fornix-based trabeculectomy : success, bleb-related complications, and bleb morphology. Ophthalmology. 2012 ; 119 : 703-11.
[38] Stalmans I, Gillis A, Lafaut AS, Zeyen T. Safe trabeculectomy technique : long term outcome. Br J Ophthalmol. 2006 ; 90 : 44-7.
[39] Tannenbaum DP, Hoffman D, Greaney MJ, Caprioli J. Outcomes of bleb excision and conjunctival advancement for leaking or hypotonous eyes after glaucoma filtering surgery. Br J Ophthalmol. 2004 ; 88 : 99-103.
[40] Tse KM, Lee HP, Shabana N, et al. Do shapes and dimensions of scleral flap and sclerostomy influence aqueous outflow in trabeculectomy ? A finite element simulation approach. Br J Ophthalmol. 2012 ; 96 : 432-7.
[41] Vela MA, Campbell DG. Hypotony and ciliochoroidal detachment following pharmacologic therapy in previously filtered patients. Ophthalmology. 1985 ; 92 : 50-7.
[42] Wilenski JT, Chen TC. Long term results of trabeculectomy in eyes that were initially successful. Tr Am Ophth Soc. 1996 ; 94 : 147-59.
[43] Zahid S, Musch DC, Niziol LM, Lichter PR. Collaborative Initial Glaucoma Treatment Study Group. Risk of endophthalmitis and other long-term complications of trabeculectomy in the Collaborative Initial Glaucoma Treatment Study (CIGTS). Am J Ophthalmol. 2013 ; 155 : 674-80.
E. Brasnu, P. Hamard, S. Roy, C. Baudouin
-
La chirurgie non pénétrante du glaucome est improprement appelée sclérectomie profonde, alors qu’elle nécessite une ablation du trabéculum externe pour être efficace et réalise donc une trabéculectomie externe.
-
Cette ablation du trabéculum externe, adjacent au canal de Schlemm, est un temps fondamental car c’est à ce niveau que se situe la résistance à l’écoulement de l’humeur aqueuse.
-
Une sécurité postopératoire incomparable découle directement de l’absence d’ouverture du trabéculum interne résiduel, mais une ouverture peropératoire ne pénalise pas toujours le résultat opératoire.
-
Le large taux d’échec des trabéculectomies, dû à la fibrose sous-conjonctivale, se retrouve bien évidemment après sclérectomie profonde non perforante et reste encore un écueil possible dans la chirurgie du glaucome.
PRINCIPES ET INTÉRÊTS DE LA CHIRURGIE FILTRANTE NON PERFORANTE
Généralités
La chirurgie filtrante du glaucome a pour but d’abaisser la pression intra-oculaire (PIO) afin de préserver au mieux le nerf optique. Jusqu’à présent, la trabéculectomie popularisée par John Cairns il y a plus de 40 ans est restée considérée comme la technique de référence.
Or cette technique, consistant à créer une communication directe entre la chambre antérieure et les espaces sous-conjonctivaux, expose à plusieurs complications postopératoires potentielles comme la filtration excessive ou l’hypotonie liées à l’ouverture de la chambre antérieure entraînant une décompensation oculaire brutale. Aussi de nouvelles techniques de chirurgie filtrante non perforante ont-elles été développées dans les années 1990, proposant une véritable chirurgie à globe fermé [32], la plus connue étant improprement appelée sclérectomie profonde [16]. Retirer la sclère pour atteindre le canal de Schlemm est bien entendu une condition nécessaire mais certainement insuffisante, et les sinusotomies naguère prônées aussi par l’école russe, consistant à réséquer une lamelle sclérale sus-jacente au canal de Schlemm et à externaliser le canal sur 120°, ont été abandonnées, faute d’efficacité à long terme [23]. L’objectif de la chirurgie non perforante est en effet d’abaisser la PIO en diminuant la résistance à l’humeur aqueuse (HA) qui est anormalement augmentée chez les patients glaucomateux, la majeure partie de l’obstacle trabéculaire étant très précisément située le long du mur interne du canal de Schlemm et au niveau du trabéculum adjacent. L’ablation de ce mur interne est donc le temps fondamental, le seul qui garantisse une efficacité à long terme en permettant une issue d’HA suffisante, à la fois pour normaliser la PIO et s’opposer à la redoutable cicatrisation conjonctivale.
Le concept de chirurgie filtrante non perforante a ainsi évolué au cours des 50 dernières années. C’est dans les années 1960 que Krasnov décrivit la sinusotomie (citée plus haut), première chirurgie non perforante rapidement abandonnée en raison de l’absence de résultats encourageants à long terme [23]. Par la suite, la technique de Krasnov fut complétée par l’ablation du mur interne du canal de Schlemm et du trabéculum juxtacanaliculaire avec la technique de « trabéculectomie ab externo » [10, 49, 53]. Fyodorov et Koslov, par la suite, décrivirent l’intervention improprement nommée sclérectomie profonde, consistant à réséquer, sous un volet scléral superficiel, un volet scléral profond, le mur externe du canal de Schlemm et la partie du stroma cornéen située derrière le trabéculum antérieur et la membrane de Descemet, réalisant à proprement parler une trabéculectomie externe non perforante. Cette intervention associe donc le concept de sclérectomie profonde et de trabéculectomie externe, technique de chirurgie non perforante actuellement la plus répandue [9, 12, 13, 16, 24, 25, 37]. Une autre technique de chirurgie filtrante non perforante a également vu le jour récemment, la viscocanalostomie. Décrite par Stegmann en 1999 [48], elle consiste à réaliser une sclérectomie profonde puis à injecter un produit viscoélastique dans le canal de Schlemm, au niveau de ses deux orifices, afin de favoriser l’évacuation de l’HA au niveau de ce canal rouvert par la dilatation, et de gagner les canaux efférents, mais sans procéder à l’ablation de la membrane trabéculaire externe (voir plus haut « Évolution des techniques »).
Le chirurgien du glaucome cherchant à se familiariser avec ces nouvelles techniques ne doit pas être effrayé par l’apparente diversité de procédures proposées ici ou là. Tous les chirurgiens qui ont commencé la chirurgie non pénétrante il y a déjà plusieurs années ont adapté, selon leurs habitudes et expériences, différentes variantes opératoires, à la fois pour la dissection du trabéculum et la prévention de l’échec postopératoire.
Comment la chirurgie non pénétrante fonctionne-t-elle ?
L’objectif principal de la chirurgie filtrante non pénétrante est de diminuer la résistance à l’évacuation de cette HA qui, dans le glaucome primitif à angle ouvert (GPAO), semble être localisée au niveau de la région juxtacanaliculaire et de l’endothélium du canal de Schlemm. La technique de trabéculectomie externe non perforante, plus couramment dénommée, à tort, sclérectomie profonde non perforante (SPNP), a ainsi été développée dans le but de lever l’obstacle à l’écoulement de l’HA, tout en empêchant une filtration excessive pourvoyeuse d’hypotonie [31, 39]. En pratique, la dénomination de SPNP s’explique par le fait que cette technique vise à aborder chirurgicalement les zones de résistance précédemment citées à partir de la surface externe de l’œil sans pénétrer à l’intérieur du globe ni perforer les structures les plus profondes.
Pour bien comprendre les principes de cette chirurgie qui débute par la réalisation d’un volet scléral superficiel, comme dans la trabéculectomie classique, il est capital d’identifier les voies d’écoulement d’HA qui vont être facilitées par les différentes étapes de cette chirurgie (fig. 16-23). La première est représentée par l’augmentation de la filtration uvéosclérale et trans-sclérale par l’amincissement de la sclère surplombant l’espace suprachoroïdien, cet amincissement étant obtenu après dissection du volet scléral profond (voir plus loins « Techniques »). Cela a été bien montré par la visualisation en UBM d’une voie supraciliaire hypo-échogène suggérant un passage de l’HA dans l’espace suprachoroïdien (augmentation de la filtration uvéosclérale), et par une hyporéflectivité de la sclère autour de la chambre de décompression, suggérant par ailleurs un écoulement trans-scléral de l’HA [29]. La deuxième étape fondamentale est réalisée après dissection du volet scléral profond (ou cavité sclérale) et résection de la paroi externe du canal de Schlemm permettant l’ouverture de celui-ci et l’exposition de sa paroi interne (fig. 16-24). Il s’agit de la trabéculectomie ab externo qui consiste en un pelage de la membrane trabéculaire externe (MTE) constituée d’une fine couche de tissus comprenant le mur interne du canal de Schlemm, le trabéculum cribriforme et une partie du trabéculum cornéoscléral [19, 49] (fig. 16-25). La troisième étape est la résection de la sclère antérieure au canal de Schlemm et la délamination de la membrane de Descemet adjacentes au trabéculum, permettant de libérer l’espace sus-jacent et de créer une nouvelle membrane fonctionnelle dénommée membrane trabéculodescemétique. Ainsi la chirurgie non perforante permet-elle à l’HA de s’écouler de la chambre antérieure à la cavité sclérale néoformée par trois voies : le trabéculum postérieur, dont la composante juxtacanaliculaire et endothéliale a été retirée, le trabéculum antérieur préservé mais rendu fonctionnel par l’ablation de la sclère sus-jacente, et la membrane trabéculodescemétique néoformée [31, 39]. Une fois dans la cavité sclérale, l’HA se résorberait par plusieurs mécanismes, le principal et le plus visible étant la bulle de filtration conjonctivale. Néanmoins il semblerait que la cavité sclérale en elle-même constitue une voie de résorption, des canaux de drainage trans-scléraux pouvant conduire l’HA de l’espace suprachoroïdien vers l’espace épiscléral [11]. De plus, l’espace sous-choroïdien est aussi probablement impliqué, une partie de l’HA pouvant être résorbée au travers de la sclère. Enfin, la réduction de la résistance du canal de Schlemm après trabéculectomie ab externo induit une augmentation du flux à l’intérieur du canal avec une percolation d’HA en regard des tissus réséqués qui peut alors plus facilement rejoindre les canaux collecteurs et les veines aqueuses [31, 39].
ASPECTS HISTOPATHOLOGIQUES
Si le site précis de la résistance à l’écoulement de l’HA chez les patients glaucomateux fait encore l’objet de controverses, il est généralement admis qu’elle se situe pour 75 % dans le trabéculum, particulièrement au niveau du mur interne du canal de Schlemm et dans les couches trabéculaires adjacentes au canal [27, 28], et pour 25 % au niveau du mur externe du canal de Schlemm et de la sclère qui l’entoure [38], le collapsus du canal pouvant également être impliqué dans l’hypertonie oculaire (HTO) [34]. La chirurgie filtrante non perforante consiste à ôter de façon sélective la partie du trabéculum opposant une résistance à l’écoulement, afin de faciliter l’écoulement de l’HA hors de la chambre antérieure de l’œil, sans ouverture de cette dernière, d’où le nom de chirurgie non perforante ou non pénétrante [32]. Hamard et al. [18, 19] ont analysé en microscopie confocale des MTE de patients glaucomateux prélevées au décours d’une chirurgie filtrante non perforante et de donneurs sains (prélèvement post-mortem sur des globes énucléés). Cette étude a montré que les MTE avaient une épaisseur moyenne de 29,5 ± 7,6 μm (de 12 à 50 μm) et qu’elles étaient constituées de trois couches tissulaires de compositions différentes (fig. 16-26) : le mur interne du canal de Schlemm, le trabéculum cribriforme et une partie du trabéculum cornéoscléral. Le mur interne du canal de Schlemm était caractérisé par la présence d’une monocouche de cellules situées dans le même plan confocal. Sous ce plan cellulaire, le trabéculum cribriforme a été identifié par la présence de cellules étoilées exprimant intensément la vimentine, l’épaisseur de ce plan étant concordante avec celle décrite précédemment en microscopie électronique [5, 44] (fig. 16-27). Les couches trabéculaires cornéosclérales ont été repérées grâce à l’organisation fibrillaire de la matrice extracellulaire correspondant aux lamelles trabéculaires recouvertes de cellules (fig. 16-28). Les résultats de cette étude suggèrent que la résistance à l’écoulement de l’HA se situe non seulement au niveau du trabéculum externe, mais également au niveau des couches trabéculaires plus internes, au niveau du trabéculum cornéoscléral. L’analyse en microscopie confocale de la MTE a également permis de démontrer que les MTE des patients glaucomateux présentaient un nombre très réduit de cellules trabéculaires par rapport aux sujets témoins, ce qui avait été décrit antérieurement par Alvarado et al. [1].
INDICATIONS ET CONTRE-INDICATIONS DE LA CHIRURGIE NON PERFORANTE
Les indications de la chirurgie non perforante sont les suivantes : le glaucome primitif à angle ouvert, le glaucome pseudo-exfoliatif, le glaucome pigmentaire, le glaucome du myope fort, le glaucome de l’aphake ou du pseudo-phake, le glaucome uvéitique à angle ouvert, le glaucome à pression normale et le glaucome cortisonique. En effet, comme cela a été détaillé précédemment, dans la plupart des glaucomes à angle ouvert, la résistance à l’évacuation de l’HA est principalement localisée au niveau de la région juxtacanaliculaire et de l’endothélium du canal de Schlemm. Aussi l’évacuation de l’HA peut-elle être améliorée de façon significative dans cette chirurgie qui consiste à pratiquer la résection des structures responsables de cette résistance [39, 40].
Dans le glaucome congénital ou juvénile, l’anatomie de l’iris, de l’angle iridocornéen, du trabéculum et de la cornée peut être modifiée et gêner la bonne réalisation de cette chirurgie. En effet, dans ces cas particuliers, malgré une dissection effective du volet scléral superficiel, du canal de Schlemm et l’ouverture de la fenêtre trabéculodescemétique, les conditions anatomiques peuvent rendre l’accès à la membrane trabéculaire externe difficile [14].
En revanche, les glaucomes à angle fermé, primitifs ou secondaires, et les glaucomes néovasculaires sont de très mauvaises indications, voire des contre-indications à la chirurgie non perforante. En effet, lorsque l’apposition iridotrabéculaire est étendue, elle forme un obstacle interne qui bloque le passage de l’HA jusqu’au trabéculum. C’est aussi le cas des néovaisseaux des glaucomes néovasculaires [40].
TECHNIQUES
Généralités
L’intervention peut être réalisée sous anesthésie locale, topique ou générale [35]. On privilégiera plutôt une anesthésie topique ou sous-ténonienne qui suffit le plus souvent à obtenir l’analgésie souhaitée, plutôt qu’une anesthésie péri- ou rétrobulbaire qui, par l’augmentation de volume dans le cône orbitaire, risque d’entraîner une augmentation de la PIO et d’entraver le libre mouvement de bascule du globe nécessaire à l’exposition de la région opérée. Si ce dernier mode d’anesthésie était choisi, le volume d’anesthésique injecté doit être limité au strict minimum, de l’ordre de 3 à 4 mL [41].
L’intervention consiste à disséquer, dans un premier temps, un volet conjonctivoténonien, au limbe ou au fornix (fig. 16-29). Ensuite, un volet scléral superficiel (d’un tiers d’épaisseur sclérale) de 5 × 5 mm environ est réalisé, à charnière antérieure cornéosclérale (fig. 16-30). Les spécificités de la chirurgie non perforante comprennent ensuite trois étapes : l’abord direct du canal de Schlemm avec ouverture du toit, l’extension vers l’avant en direction de la ligne de Schwalbe, de manière à réaliser une chambre de décompression suffisamment étendue, et enfin l’ablation du mur interne du canal de Schlemm avec pelage du fond de la gouttière du canal, point crucial de l’intervention correspondant à l’ablation sélective de la partie du trabéculum impliquée pour grande partie dans la résistance à l’écoulement de l’HA, en théorie le mur interne du canal de Schlemm et les couches trabéculaires adjacentes au canal (fig. 16-31 à 16-43).
Particularités et variantes techniques
L’abord initial au niveau de la conjonctive ou lors de la découpe du premier volet scléral ne pose pas de problème technique particulier par rapport à la trabéculectomie (fig. 16-29 à 16-31, 16-44 et 16-45). Ensuite, l’abord du canal de Schlemm peut s’effectuer par voie postérieure, lors de la découpe d’un volet profond, triangulaire, à base antérieure s’appuyant sur le toit du canal de Schlemm et à pointe postérieure. La découpe est préciliaire et doit être très profonde au ras du corps ciliaire, en ne laissant que quelques fibres sclérales (fig. 16-32 et 16-33). Lorsque l’on suit ce plan, la dissection arrive de manière naturelle en avant de l’éperon scléral sur le canal de Schlemm qui s’ouvre sans difficulté (fig. 16-34 et 16-35). Cependant, cet abord nécessite une gestion méticuleuse de la base sclérale en regard de l’anneau de Schwalbe, dans la mesure où les découpes exposent à plusieurs risques (fig. 16-36). Une découpe aux ciseaux laissant trop de sclère entraîne un risque d’ablation insuffisante avec une sclère se rabattant sur le toit du canal de Schlemm et conduisant à son obstruction, puis à sa fibrose. À l’inverse, une découpe cherchant à enlever trop de sclère au ras de l’anneau de Schwalbe expose à un risque important de perforation qui, si elle est étendue, peut obliger à transformer l’intervention en chirurgie perforante type trabéculectomie classique.
Il est également possible d’adopter un abord direct le long du canal de Schlemm en prédécoupant un rectangle scléral à cheval sur la localisation supposée du canal de Schlemm (fig. 16-46). Le coin postérieur droit peut servir de base pour une dissection étendue le long du canal de Schlemm. L’abord de celui-ci est en général assez simple, dans la mesure où il est possible de le repérer en tractant vers le haut la zone du canal, ce qui permet d’identifier en arrière une région sclérale nécessitant d’être coupée et en avant le trabéculum antérieur, dont les fibres blanches doivent également être sectionnées (fig. 16-47).
Le temps suivant consiste à étendre vers l’avant la dissection, en utilisant par exemple les mors de la pince de Bonn, ce qui permet de tirer vers l’avant et le haut le trabéculum antérieur et de le détacher ainsi de la membrane trabéculodescemétique sous-jacente. Le plan de clivage existe mais reste relativement étroit, dans la mesure où la sclère en regard du trabéculum antérieur est inextensible. Il est cependant possible de glisser une lame de couteau pour sectionner cette paroi sclérale antérieure, ce qui permet d’accéder à la région trabéculodescemétique et notamment à l’anneau de Schwalbe souvent bien visible sous l’aspect d’une fine ligne. Lorsque cette dissection est étendue vers l’avant, il est généralement possible d’observer une petite issue d’HA, ce qui pourrait permettre d’obtenir une filtration suffisante mais ne constitue pas un geste totalement satisfaisant pour le long terme.
Le troisième temps, fondamental, est celui de l’ablation du fond de la gouttière du canal de Schlemm correspondant à la membrane trabéculaire se présentant sous la forme d’une bande jaune chamois. Elle peut être sectionnée à l’aide des mors de la pince de Bonn ou de la pointe du couteau avant d’être pelée, permettant une issue d’HA qui peut désormais sourdre librement sans résistance (fig. 16-48) [12, 32].
La suite de l’intervention, lorsqu’on a obtenu cette dissection, est sans particularité, la suture du volet n’étant pas absolument indispensable. En revanche, la suture de la conjonctive doit être soigneuse par surjet ou par points séparés d’un fil résorbable avec des aiguilles non spatulées ne déchirant pas la conjonctive et évitant ainsi, dans de nombreux cas, une fuite postopératoire (fig. 16-49 et 16-50).
COMPLICATIONS ET SUIVI POSTOPÉRATOIRE
La sclérectomie profonde non pénétrante, dans la philosophie qui a conduit à son développement, vise par essence à réduire notablement le nombre et l’étendue des complications liées à la chirurgie du glaucome. Cependant, malgré une indication opératoire bien justifiée, une maîtrise des techniques et moyens chirurgicaux à notre disposition, des complications opératoires peuvent malgré tout survenir. Il est essentiel, pour le chirurgien, de bien les connaître, afin de pouvoir, en cours d’intervention, reconnaître les situations difficiles ou dangereuses, et faire face aux imprévus. Les suites opératoires peuvent aussi être grevées de plusieurs types de complication, qu’il est également capital de bien connaître afin d’y faire face dans les meilleurs délais et avec les meilleures chances thérapeutiques.
Les complications peuvent se produire durant l’intervention, dans la phase postopératoire précoce ou plus tardivement. Les complications typiques de la chirurgie non perforante sont la perforation de la membrane trabéculodescemétique, l’hypertension postopératoire nécessitant une goniopuncture, la fibrose de la bulle de filtration traitée par antimétabolites ou la formation d’une bulle polykystique réduite par un « needling » à l’aiguille. Les autres complications classiques se rencontrent également, comme dans toute chirurgie filtrante, et ne sont pas spécifiques ; seules les prévalences sont différentes, largement en faveur de la chirurgie non perforante [50].
Complications communes à la trabéculectomie et à la SPNP
Les complications communes à toutes les chirurgies filtrantes sont nombreuses : glaucome malin, hémorragies, signe de Seidel, hyphéma, chambre antérieure plate, inflammation intra-oculaire, décollement choroïdien, hypotonie, hypertonie, effet Dellen, infection de la bulle de filtration (blébite), cataracte, œdème maculaire, endophtalmie, rétinopathie de décompression, baisse de l’acuité visuelle, ectasie sclérale et, bien sûr, remontée pressionnelle liée à la fibrose conjonctivale postopératoire (voir plus haut « Trabéculectomie »). Néanmoins, grâce à l’absence d’ouverture de la chambre antérieure permettant une baisse moins brutale de la PIO, la survenue des complications fréquemment retrouvées dans la trabéculectomie classique est sensiblement amoindrie avec cette technique [6-8, 13, 22, 26, 33]. Dans l’étude de Mermoud et al. [33] comparant la SPNP à la trabéculectomie, le pourcentage total de complications était significativement inférieur dans le groupe SPNP, avec par exemple survenue d’une cataracte chez seulement deux patients opérés de cataracte dans le groupe SPNP versus cinq patients dans le groupe trabéculectomie (p < 0,05).
Complications spécifiques à la chirurgie non perforante
Complications peropératoires : perforation de la membrane trabéculodescemétique
La membrane trabéculodescemétique est une structure très fine et extrêmement fragile. Lors de sa dissection, des perforations peuvent parfois surgir dans sa portion la plus mince, correspondant d’un point de vue anatomique à la jonction du trabéculum antérieur et de la membrane de Descemet. Une perforation de cette membrane est malheureusement une complication fréquente lors de l’apprentissage de la technique chirurgicale non pénétrante. Dans l’étude de Karlen et al. [21], cette complication s’élevait aux alentours de 30 % dans les dix premières interventions pour diminuer ensuite à près de 3 % lors des cent opérations suivantes. L’attitude à adopter est variable en fonction du moment où elle se produit et de l’étendue de la perforation. Le plus souvent, la perforation est une micro-ouverture survenant en cours de dissection, notamment lors de l’extension antérieure. Si c’est le cas, il est important d’arrêter d’éponger pour ne pas vider la chambre antérieure, mais le principe de la chirurgie par trabéculectomie externe peut être maintenu. Dans ce cas néanmoins, il est préférable de suturer le volet scléral car la filtration est plus abondante qu’en cas de sclérectomie profonde non perforante réalisée sans incident. En cas de perforation plus étendue avec issue d’iris (fig. 16-51), il est souvent possible de maintenir le même type d’intervention chirurgicale avec ablation de la membrane trabéculaire, mais l’iris faisant bouchon au niveau de la perforation doit être sectionné, réalisant ainsi une iridectomie périphérique. Si l’ablation de la membrane trabéculaire peut être obtenue et si l’iris ne bouche qu’une petite partie de la zone de dissection, son ablation permet, sous couvert de myotiques intracamérulaires, de reconstituer une chambre antérieure correcte, d’éloigner l’iris et de maintenir une dissection acceptable. Là encore, la suture du volet scléral est indispensable, avec éventuellement la réalisation d’une paracentèse pour reformer une bonne chambre en fin d’intervention et éviter une athalamie, notamment chez le sujet phake ou en cas d’hypermétropie qui prédisposent à un effacement de chambre antérieure en postopératoire. L’intervention reste donc une chirurgie un peu plus délicate mais gardant les principes de dissection trabéculaire profonde et réalisant une microtrabéculectomie.
Enfin, en cas de perforation importante postérieure notamment le long de l’éperon scléral, en particulier en cas de remaniements traumatiques ou chirurgicaux antérieurs, qui peuvent modifier les structures anatomiques trabéculaires, il est nécessaire de convertir cette chirurgie en une trabéculectomie classique dont les suites seront souvent un peu plus délicates en raison de l’abord particulièrement postérieur de cette chirurgie. L’iridectomie périphérique est systématique, de même que la suture du volet scléral de manière assez étanche pour éviter une fuite excessive. La réalisation d’une paracentèse visant à reconstituer en fin d’intervention la chambre antérieure, injecter des myotiques et tester la bulle de filtration, comme dans une trabéculectomie classique, est tout à fait conseillée. Néanmoins, lorsque la perforation est importante, celle-ci transforme cette chirurgie non pénétrante en une chirurgie pénétrante qui, comme la trabéculectomie, peut provoquer les complications citées ci-dessus. Dans une série de 20 patients opérés de sclérectomie profonde avec perforation de la membrane trabéculodescemétique, Sanchez et al. [43] ont rapporté une incidence augmentée de complications postopératoires. Elles se manifestent sous la forme de chambre antérieure plate, hypotonie, décollement choroïdien, inflammation et hyphéma. Il faut toutefois noter que dans ces situations, le volet superficiel n’a pas été refermé de façon étanche. Or, en suturant correctement le volet scléral superficiel et en injectant éventuellement un produit viscoélastique en chambre antérieure et sous le volet scléral, les complications liées à l’hypotonie peuvent être évitées dans la plupart des cas.
Complications postopératoires
-
Rupture de la membrane trabéculodescemétique
Des ruptures de la membrane trabéculodescemétique peuvent survenir après traumatisme de l’œil, lorsque ce dernier subit des augmentations très brusques de pression. Il s’ensuit en général un prolapsus de l’iris au travers de la membrane trabéculodescemétique, avec une déformation de la zone pupillaire qui est ainsi attirée vers le site de filtration. Si la pression oculaire reste normale, aucun traitement additif n’est proposé. En revanche, si la pression augmente en raison du blocage de la filtration par une partie de l’iris périphérique enclavé dans la déchirure, il est nécessaire de lever ce blocage à l’aide d’une iridotomie périphérique au laser Nd-YAG. Si cette procédure ne suffit pas et que la pression reste trop élevée, il faut alors procéder à une révision chirurgicale.
-
Décollement de la membrane de Descemet
Le décollement de la membrane de Descemet est une complication postopératoire relativement rare de la chirurgie non pénétrante du glaucome. Lors de la sclérectomie profonde, le mécanisme est probablement lié au passage d’HA de l’espace intrascléral dans l’espace sous-descemétique, avec pour conséquence un œdème de cornée localisé. Du sang peut également être observé à l’intérieur du décollement.
-
Synéchies antérieures périphériques et incarcération irienne
Certaines conditions apparaissant lors de l’opération ou à la suite d’un traitement de goniopuncture par laser conduisent à un mouvement de la portion périphérique de l’iris qui peut adhérer à la membrane trabéculodescemétique perforée. Des synéchies périphériques antérieures se forment alors à la suite de microperforations peropératoires, avec un petit prolapsus de l’iris, ou d’un enclavement de l’iris qui est aspiré par le flux relativement important à travers la goniopuncture. Les brides d’adhésion peuvent être libérées par l’application d’impacts de laser Nd-YAG.
Goniopuncture
La goniopuncture est l’ouverture au laser de la membrane trabéculaire interne, partie du trabéculum laissée intacte lors de la réalisation de la sclérectomie profonde avec trabéculectomie externe dont elle est le complément postopératoire lorsque la pression oculaire remonte ou lorsque la pression cible que l’on cherchait à atteindre avec la chirurgie filtrante n’est pas atteinte. En pratique, elle est réalisée dans 40 à 50 % des cas de chirurgie filtrante non perforante, dans un délai moyen qui varie selon les publications entre 3 et 21 mois. Elle est couronnée de succès dans 68 à 94 % des cas [17, 25, 46, 51] (eCas clinique 16-1), avec un abaissement pressionnel de l’ordre de 30 à 50 %.
La goniopuncture est réalisée à l’aide du laser Nd-YAG monté sur la lampe à fente (mode free-running Q-switched), au travers d’un verre angulaire (CGA1 de LASAG) posé sur la cornée après instillation d’un anesthésique de contact, le verre permettant la focalisation du laser sur la zone à perforer. L’idéal est de tenter une perforation la plus éloignée possible de la racine de l’iris afin de limiter les risques d’incarcération irienne secondaire. Lorsque la sclérectomie profonde a été menée très antérieurement dans le stroma cornéen, la goniopuncture se fait au niveau de la membrane trabéculodescemétique. Deux à quinze impacts d’une puissance de 3,5 à 8 mJ sont généralement suffisants pour perforer la membrane trabéculaire interne résiduelle en un ou deux points (fig. 16-52 et 16-53). L’efficacité de la goniopuncture se juge en prenant la pression oculaire à l’aplanation une heure après la réalisation du laser où l’on doit constater un abaissement tensionnel significatif [51]. Dans les suites, l’instillation d’un anti-inflammatoire non stéroïdien est préconisée pendant quelques jours, parfois associée à l’instillation de pilocarpine le soir durant quelques semaines, notamment si l’angle iridocornéen est un peu étroit ou si la perforation est proche de la racine irienne, afin de limiter les risques d’incarcération. En effet, ce geste expose risque d’incarcération irienne dans l’orifice de goniopuncture qui peut se compliquer d’une remontée tensionnelle plus ou moins importante en fonction du degré d’engagement de l’iris dans le trabéculum [51], nécessitant un traitement spécifique (rétraction et/ou section de l’iris au laser, voire reprise chirurgicale) (eCas clinique 16-2 ; fig. 16-54 à 16-56).
Situation typique
Monsieur X, 65 ans, était suivi pour un glaucome primitif à angle ouvert bilatéral depuis 15 ans, traité par une trithérapie comportant une association fixe de timolol et dorzolamide et du latanoprost. Malgré ce traitement, la PIO (pression intra- oculaire) était de 25 mmHg dans l’œil droit et de 15 mmHg dans l’œil gauche pour des pachymétries respectives de 470 et 465 μm, et une progression du champ visuel a été objectivée sur l’œil droit. Une sclérectomie profonde non perforante a donc été réalisée à droite, avec des suites opératoires simples et une PIO postopératoire inférieure à 10 mmHg pendant 12 mois. Lors de la consultation de contrôle un an après la chirurgie, la PIO est néanmoins remontée à 22 mmHg sur l’œil droit, avec un site chirurgical libre en gonioscopie et une bulle de filtration plate non enkystée. Une goniopuncture au laser Nd- YAG a donc été effectuée, permettant une baisse prolongée de la PIO à 10 mmHg.
Situation piège
Madame Y, 55 ans, présentant un glaucome primitif à angle ouvert bilatéral, consulte 15 mois après la réalisation d’une sclérectomie profonde non perforante sur l’œil gauche suivie d’une goniopuncture effectuée un mois après la chirurgie. Malgré cela, trois mois plus tôt, devant une remontée pressionnelle à 25 mmHg, une association fixe de timolol-brimonidine a été réintroduite.
L’examen biomicroscopique met en évidence, sur l’œil gauche, une bulle de filtration plate et fibrosée, une PIO à 28 mmHg, une cornée claire et une chambre antérieure profonde, sans déformation irienne. Une gonioscopie est réalisée et retrouve une incarcération irienne limitée au site de goniopuncture. Une tentative d’iridorétraction au laser à l’argon est donc effectuée (impacts de 200 μm, 0,2 W et 0,2 s), ne permettant pas d’obtenir de baisse pressionnelle. Ce cas clinique souligne l’importance de l’examen gonioscopique dans le suivi des chirurgies non perforantes. En effet, dans ce cas précis, la remontée pressionnelle est liée à l’incarcération irienne au niveau du site de goniopuncture. Une iridorétraction réalisée plus précocement avant la survenue d’une fibrose conjonctivale aurait pu être couronnée de succès et éviter la réintroduction d’un traitement local qui lui- même favorise la survenue de la fibrose.
RÉSULTATS
À l’heure actuelle, de nombreuses études rétrospectives et prospectives ont montré l’efficacité de la chirurgie non perforante sur la réduction de la PIO à court, moyen et long termes, avec de faibles taux de complications et une récupération visuelle plus rapide qu’après une trabéculectomie classique [3, 4, 8, 9, 12, 17, 21, 25, 30, 43, 45, 46]. Dans l’étude suisse de Bissig et al. [4] sur 105 yeux de 105 patients et 10 ans de suivi, une PIO inférieure ou égale à 21 mmHg était obtenue chez 47,7 % des patients sans traitement et 89 % des patients avec traitement médical. Ainsi, la PIO moyenne à 10 ans était de 12,2 ± 4,7 mmHg pour une PIO initiale de 26,8 ± 7,7 mmHg, soit une baisse de 54 %. Le nombre de traitements hypotonisants passait de 2,3 ± 0,7 à 1,3 ± 1,1 (réduction de 43,5 %). Notons néanmoins que 24,5 % des patients bénéficièrent d’injections sous-conjonctivales de 5-fluoro-uracile, et 59,8 % d’une goniopuncture. Les résultats de cette étude étaient concordants avec ceux des autres études réalisées avec des durées de suivi plus courtes [3, 8, 9, 12, 17, 21, 25, 30, 43, 45, 46]. Concernant la comparaison avec la trabéculectomie classique, les résultats des différentes études rétrospectives et prospectives sont assez divergents, et concluent soit à une efficacité équivalente des deux techniques [8, 13, 33], soit à une supériorité de la trabéculectomie classique [6, 7, 22, 26]. Cela peut en partie s’expliquer par des méthodologies différentes, certaines études ne prenant par exemple pas en compte la réalisation d’une goniopuncture [7]. Néanmoins, toutes les études ont montré des taux de complications moindres après chirurgie non perforante (voir plus haut).
ADJUVANTS À LA CHIRURGIE : DRAINS ET IMPLANTS
Plusieurs dispositifs adjuvants implantés au cours de la chirurgie peuvent être proposés pour aider au maintien de l’espace scléral créé au cours de la sclérectomie profonde non perforante et assurer le succès au long cours de cette dernière (voir plus loin « Dispositifs et implants dans la SPNP »). Les implants de collagène furent les premiers à être utilisés, fabriqués à partir de collagène scléral d’origine porcine (Aquaflow®, Staar Surgical AG) [4]. De forme cylindrique (4,0 × 0,5 × 0,5 mm), l’Aquaflow® triple de volume lors de son hydratation par l’HA, puis est progressivement digéré sous l’action de collagénases et des métalloprotéases en six à neuf mois environ (eFig. 16-2 et 16-3) [46]. Un autre implant dégradable, le SK-gel® (laboratoires Corneal, France), de forme triangulaire, consiste en un maillage de hyaluronate de sodium biosynthétique qui par son caractère réticulé et ses propriétés physiques et rhéologiques, permet également d’assurer un large volume dans l’espace de filtration [15, 47, 52]. Un dispositif a été récemment développé, le Healaflow®, acide hyaluronique réticulé à résorption lente, destiné à préserver l’espace scléral et sous-conjonctival et à maintenir ainsi une filtration fonctionnelle après une chirurgie non pénétrante [42]. Des modèles d’implants non résorbables ont également été testés, destinés à demeurer dans l’espace de filtration, comme le T-Flux® dont les branches sont insérées dans les orifices du canal de Schlemm (laboratoires IOLtech) [2, 20, 36, 52] (eFig. 16-4 et 16-5).
Retenir
-
La chirurgie filtrante non perforante avec trabéculectomie externe est une chirurgie sûre permettant de contrôler la pression intra-oculaire de patients présentant un glaucome primitif à angle ouvert en minimisant les risques d’hypotonie.
-
L’ablation sélective du mur interne du canal de Schlemm et du trabéculum externe est l’étape fondamentale de la sclérectomie profonde non perforante.
-
La possibilité de réaliser une goniopuncture, ouverture au laser de la membrane trabéculaire interne dans les suites de la chirurgie, augmente le taux de succès de la chirurgie filtrante non perforante.
Fig. 16-23 Représentation histologique du trabéculum et du canal de Schlemm (coloration avec de la ferritine et du bleu de Prusse mettant en évidence le bon écoulement traditionnel à travers les différentes couches du trabéculum jusqu’au canal de Schlemm). (Source : A. Mermoud. Chirurgie des glaucomes. Rapport des sociétés d’ophtalmologie de France, 2005.)
Fig. 16-24 Sclérectomie profonde. La dissection du second volet scléral permet l’ouverture de la gouttière du canal de Schlemm au fond de laquelle se trouve la membrane trabéculaire externe à ôter.
Fig. 16-25 Ablation de la membrane trabéculaire externe située au fond de la gouttière du canal de Schlemm. La membrane ici apparaît transparente.
Fig. 16-26 Membrane trabéculaire externe d’un sujet normal en microscopie confocale. De la surface vers la profondeur : flèches noires : endothélium du canal de Schlemm (cytoplasme non fluorescent) ; flèches bleues : trabéculum cribriforme (expansions cytoplasmiques fluorescentes) ; flèches blanches : trabéculum cornéoscléral (cytoplasme peu fluorescent).
Fig. 16-27 Plan du trabéculum cribriforme. Cellules aux larges expansions cytoplasmiques (flèches) dispersées au sein d’une matrice sans organisation fibrillaire.
Fig. 16-28 Plan du trabéculum cornéscléral. Les cellules trabéculaires recouvrent les lamelles trabéculaires (organisation fibrillaire de la matrice extracellulaire dont les fibres élastiques apparaissent autofluorescentes).
Fig. 16-29 Ouverture conjonctivoténonienne au limbe sur 12 heures après mise en traction de la cornée par une soie 7/0.
Fig. 16-30 Dissection du volet scléral (un tiers d’épaisseur sclérale).
Fig. 16-31 Réalisation du volet scléral superficiel.
Fig. 16-32 Dissection du volet scléral profond (1).
Fig. 16-33 Dissection du volet scléral profond (2).
Fig. 16-34 Ouverture du canal de Schlemm situé en avant de l’éperon scléral.
Fig. 16-35 Ouverture de la gouttière du canal de Schlemm.
Fig. 16-36 Résection du volet scléral profond.
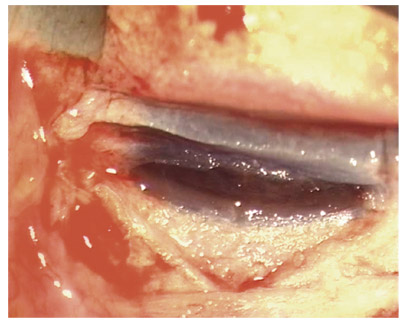
Fig. 16-37 Exposition du canal de Schlemm et de la membrane trabéculodescemétique.
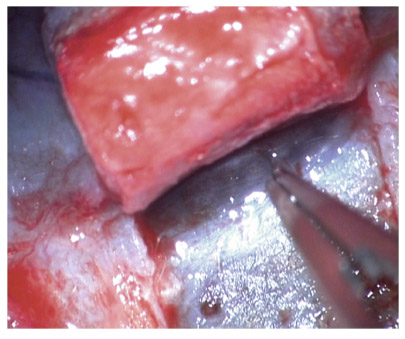
Fig. 16-38 Résection de la membrane trabéculaire externe (1).
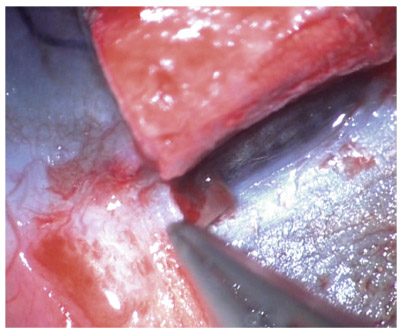
Fig. 16-39 Résection de la membrane trabéculaire externe (2).
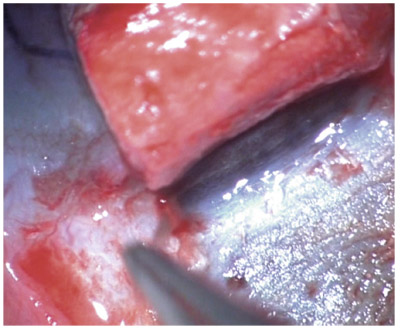
Fig. 16-40 Résection de la membrane trabéculaire externe (3).
Fig. 16-41 Repose du volet scléral superficiel à l’aide de deux points lâches au monofilament.
Fig. 16-42 Repose conjonctivoténonienne au limbe.
Fig. 16-43 Suture des plans conjonctivoténoniens à l’aide de sutures résorbables auto-enfouies.
Fig. 16-44 Découpe d’un volet scléral superficiel triangulaire à base antérieure au couteau jetable.
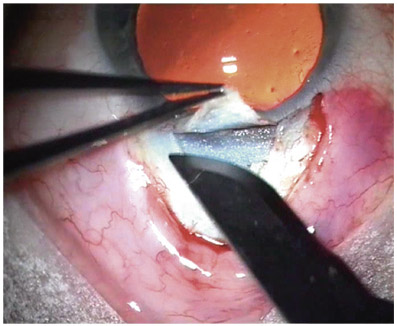
Fig. 16-45 Extension vers l’avant du volet permettant de repérer la jonction entre la sclère et la cornée et parfois même de découvrir quatre structures adjacentes : la sclère proprement dite, puis une zone plus grise correspondant au canal de Schlemm, puis, plus en avant, le trabéculum antérieur recouvert des fibres sclérales imperméables, et encore en avant la cornée proprement dite.
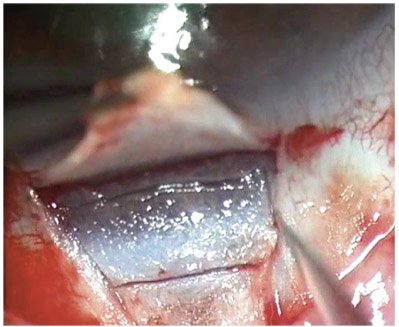
Fig. 16-46 Prédécoupe d’un volet scléral profond, ici réalisé le long du canal de Schlemm au couteau 15°.
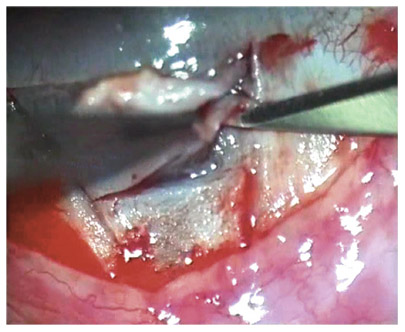
Fig. 16-47 Le coin postérieur droit en arrière de l’éperon scléral est utilisé pour repérer le canal de Schlemm que l’on identifie bien en soulevant ce volet profond. Le couteau de 15° permet de découper la sclère en arrière le long de l’éperon scléral et en avant le long du trabéculum antérieur.
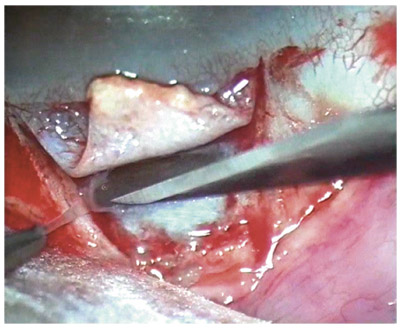
Fig. 16-48 Une fois que le toit du canal de Schlemm est retiré, il est possible d’aborder le fond de la gouttière correspondant au mur interne du canal de Schlemm et au trabéculum adjacent. Cette bande est retirée à l’aide de la pince et permet d’obtenir une zone de filtration étendue et efficace.
Fig. 16-49 Le volet scléral n’est pas suturé, mais une suture soigneuse de la conjonctive au limbe à l’aide d’une aiguille non spatulée permet d’obtenir l’étanchéité de la région conjonctivale et de la future bulle de filtration.
Fig. 16-50 Un deuxième point est mis en place et permet d’obtenir l’ébauche d’une bulle de filtration.

Fig. 16-51 Aspect gonioscopique postopératoire d’une macroperforation passée inaperçue en cours d’intervention. À noter l’iris attiré par la zone de trabéculectomie perforée.

Fig. 16-52 Aspect gonioscopique de la goniopuncture réalisée en avant des couches trabéculaires résiduelles.
Fig. 16-53 Ouverture en « fermeture éclair » de la membrane trabéculaire interne après goniopuncture réalisée trop précocement.
Fig. 16-54 Adossement de l’iris sur le site de sclérectomie après goniopuncture.
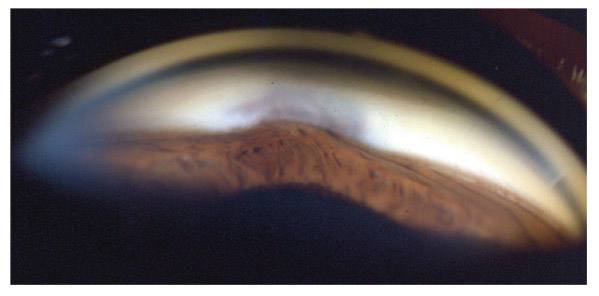
Fig. 16-55 Déformation pupillaire en poire vers le site de sclérectomie par incarcération irienne après goniopuncture.
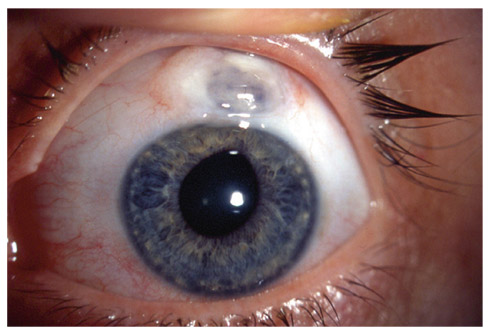
Fig. 16-56 Aspect gonioscopique de l’incarcération irienne dans le site de sclérectomie après goniopuncture.
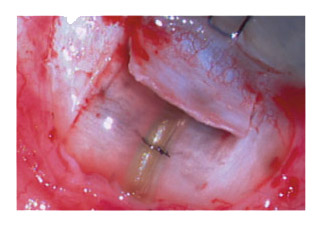
eFig. 16-2 Implant Aquaflow® (Staar Surgical AG) positionné sous le volet superficiel lors d’une chirurgie non perforante et suturé à la sclère à l’aide d’un point de monofilament 10-0.

eFig. 16-3 Coupe d’OCT de segment antérieur de type Spectralis® (Heidelberg Engineering, Dossenheim, Allemagne) montrant le positionnement d’un implant Aquaflow® (flèche) un mois après chirurgie non perforante. (Cliché : R. Tahiri.)
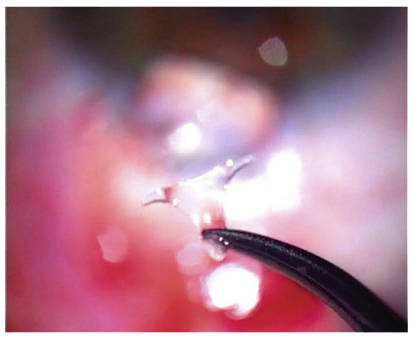
eFig. 16-4 Implant T-Flux® (laboratoires IOLtech) en acrylique hydrophile dont les branches sont insérées dans les orifices du canal de Schlemm.
eFig. 16-5 Mise en place d’un implant T-Flux® (laboratoires IOLtech). L’angulation des bras permet de plaquer les couches trabéculaires résiduelles tandis que le corps de l’implant est suturé au plan scléral superficiel par deux points lâches au monofilament 10-0 placés au coin du volet.
[1] Alvarado J, Murphy C, Juster R. Trabecular meshwork cellularity in primary open-angle glaucoma and nonglaucomatous normals. Ophthalmology. 1984 ; 91 : 564-79.
[2] Ates H, Uretmen O, Andac K, Azarsiz SS. Deep sclerectomy with a nonabsorbable implant (T-Flux) – preliminary results. Can J Ophthalmol. 2003 ; 38 : 482-8.
[3] Bas JM, Goethals MJ. Sclérectomie profonde non perforante, résultats préliminaires. Bull Soc Belge Ophtalmol. 1999 ; 272 : 55-9.
[4] Bissig A, Rivier D, Zaninetti M, et al. Ten years follow-up after deep sclerectomy with collagen implant. J Glaucoma. 2008 ; 17 : 680-6.
[5] Buller C, Johnson D. Segmental variability of the trabecular meshwork in normal and glaucomatous eyes. Invest Ophthalmol Vis Sci. 1994 ; 35 : 3841-51.
[6] Cheng JW, Ma XY, Wei RL. Efficacy of non-penetrating trabecular surgery for open angle glaucoma – a meta-analysis. Chin Med J (Engl). 2004 ; 117 : 1006-10.
[7] Chiselita D. Non-penetrating deep sclerectomy versus trabeculectomy in primary open-angle glaucoma surgery. Eye (Lond). 2001 ; 15 : 197-201.
[8] Cillino S, Di Pace F, Casuccio A, et al. Deep sclerectomy versus trabeculectomy with low-dosage mitomycin C – four-year follow-up. Ophthalmologica. 2008 ; 222 : 81-7.
[9] Dahan E, Drusedau MU. Nonpenetrating filtration surgery for glaucoma – control by surgery only. J Cataract Refract Surg. 2000 ; 26 : 695-701.
[10] de Laage de Meux P, Kantelip B. [Surgical anatomy of corneoscleral limbus]. Arch Ophtalmol (Paris). 1976 ; 36 : 39-50.
[11] Delarive T, Rossier A, Rossier S, et al. Aqueous dynamic and histological findings after deep sclerectomy with collagen implant in an animal model. Br J Ophthalmol. 2003 ; 87 : 1340-4.
[12] Demailly P, Lavat P, Kretz G, Jeanteur-Lunel MN. Non-penetrating deep sclerectomy (NPDS) with or without collagen device (CD) in primary open-angle glaucoma- middle-term retrospective study. Int Ophthalmol. 1996 ; 20 : 131-40.
[13] El Sayyad F, Helal M, El-Kholify H, et al. Nonpenetrating deep sclerectomy versus trabeculectomy in bilateral primary open-angle glaucoma. Ophthalmology. 2000 ; 107 : 1671-4.
[14] Feusier M, Roy S, Mermoud A. Deep sclerectomy combined with trabeculectomy in pediatric glaucoma. Ophthalmology. 2009 ; 116 : 30-8.
[15] Galassi F, Giambene B. Deep sclerectomy with SkGel implant – 5-year results. J Glaucoma. 2008 ; 17 : 52-6.
[16] Hamard P, Lachkar Y. La chirurgie filtrante non perforante : évolution du concept, réalisation, résultats. J Fr Ophtalmol. 2002 ; 25 : 527-36.
[17] Hamard P, Plaza L, Kopel J, et al. Sclérectomie profonde non perforante et glaucome à angle ouvert. Résultats à moyen terme des premiers patients opérés. J Fr Ophtalmol. 1999 ; 22 : 25-31.
[18] Hamard P, Sourdille P, Valtot F, Baudouin C. Apport de la microscopie confocale dans l’analyse de la membrane trabéculaire prélevée au cours de la chirurgie filtrante non perforante. J Fr Ophtalmol. 2001 ; 24 : 29-35.
[19] Hamard P, Valtot F, Sourdille P, et al. Confocal microscopic examination of trabecular meshwork removed during ab externo trabeculectomy. Br J Ophthalmol. 2002 ; 86 : 1046-52.
[20] Jungkim S, Gibran SK, Khan K, Murray A. External trabeculectomy with T-Flux implant. Eur J Ophthalmol. 2006 ; 16 : 416-21.
[21] Karlen ME, Sanchez E, Schnyder CC, et al. Deep sclerectomy with collagen implant – medium term results. Br J Ophthalmol. 1999 ; 83 : 6-11.
[22] Ke M, Guo J, Qian Z. Meta analysis of non-penetrating trabecular surgery versus trabeculectomy for the treatment of open angle glaucoma. J Huazhong Univ Sci Technolog Med Sci. 2011 ; 31 : 264-70.
[23] Krasnov MM. Externalization of Schlemm’s canal (sinusotomy) in glaucoma. Br J Ophthalmol. 1968 ; 52 : 157-61.
[24] Lachkar Y, Hamard P. Nonpenetrating filtering surgery. Curr Opin Ophthalmol. 2002 ; 13 : 110-5.
[25] Lachkar Y, Neverauskiene J, Jeanteur-Lunel MN, et al. Nonpenetrating deep sclerectomy – a 6-year retrospective study. Eur J Ophthalmol. 2004 ; 14 : 26-36.
[26] Luo RJ, Zhuo YH, Liu SR, et al. [Long-term effects of non-penetrating trabecular surgery versus trabeculectomy for treating glaucoma]. Zhonghua Yan Ke Za Zhi. 2010 ; 46 : 499-502.
[27] Maepea O, Bill A. The pressures in the episcleral veins, Schlemm’s canal and the trabecular meshwork in monkeys – effects of changes in intraocular pressure. Exp Eye Res. 1989 ; 49 : 645-63.
[28] Maepea O, Bill A. Pressures in the juxtacanalicular tissue and Schlemm’s canal in monkeys. Exp Eye Res. 1992 ; 54 : 879-83.
[29] Marchini G, Marraffa M, Brunelli C, et al. Ultrasound biomicroscopy and intraocular-pressure-lowering mechanisms of deep sclerectomy with reticulated hyaluronic acid implant. J Cataract Refract Surg. 2001 ; 27 : 507-17.
[30] Massy J, Gruber D, Muraine M, Brasseur G. Sclérectomie profonde non perforante : résultats à moyen terme. J Fr Ophtalmol. 1999 ; 22 : 292-8.
[31] Mermoud A, Roy S. Comment la chirurgie non pénétrante fonctionne-t-elle ? Chirurgie des glaucomes. Rapport annuel BSOF, 2005.
[32] Mermoud A, Schnyder CC. Nonpenetrating filtering surgery in glaucoma. Curr Opin Ophthalmol. 2000 ; 11 : 151-7.
[33] Mermoud A, Schnyder CC, Sickenberg M, et al. Comparison of deep sclerectomy with collagen implant and trabeculectomy in open-angle glaucoma. J Cataract Refract Surg. 1999 ; 25 : 323-31.
[34] Nesterov AP. Role of the blockade of Schlemm’s canal in pathogenesis of primary open-angle glaucoma. Am J Ophthalmol. 1970 ; 70 : 691-6.
[35] O’Donoghue E, Batterbury M, Lavy T. Effect on intraocular pressure of local anaesthesia in eyes undergoing intraocular surgery. Br J Ophthalmol. 1994 ; 78 : 605-7.
[36] Ravinet E, Bovey E, Mermoud A. T-Flux implant versus Healon GV in deep sclerectomy. J Glaucoma. 2004 ; 13 : 46-50.
[37] Razeghinejad MR, Fudemberg SJ, Spaeth GL. The changing conceptual basis of trabeculectomy – a review of past and current surgical techniques. Surv Ophthalmol. 2012 ; 57 : 1-25.
[38] Rosenquist R, Epstein D, Melamed S, et al. Outflow resistance of enucleated human eyes at two different perfusion pressures and different extents of trabeculotomy. Curr Eye Res. 1989 ; 8 : 1233-40.
[39] Roy S, Mermoud A. Comment la chirurgie non pénétrante fonctionne-t-elle ? J Fr Ophtalmol. 2006 ; 29 : 1167-74.
[40] Roy S, Mermoud A. Deep sclerectomy. Dev Ophthalmol. 2012 ; 50 : 29-36.
[41] Roy S, Mermoud A. La sclérectomie profonde non perforante : aspects techniques. J Fr Ophtalmol. 2006 ; 29 : 1160-6.
[42] Roy S, Thi HD, Feusier M, Mermoud A. Crosslinked sodium hyaluronate implant in deep sclerectomy for the surgical treatment of glaucoma. Eur J Ophthalmol. 2012 ; 22 : 70-6.
[43] Sanchez E, Schnyder CC, Mermoud A. [Comparative results of deep sclerectomy transformed to trabeculectomy and classical trabeculectomy]. Klin Monbl Augenheilkd. 1997 ; 210 : 261-4.
[44] Schlotzer-Schrehardt U, Naumann GO. Trabecular meshwork in pseudoexfoliation syndrome with and without open-angle glaucoma. A morphometric, ultrastructural study. Invest Ophthalmol Vis Sci. 1995 ; 36 : 1750-64.
[45] Shaarawy T, Karlen M, Schnyder C, et al. Five-year results of deep sclerectomy with collagen implant. J Cataract Refract Surg. 2001 ; 27 : 1770-8.
[46] Shaarawy T, Mansouri K, Schnyder C, et al. Long-term results of deep sclerectomy with collagen implant. J Cataract Refract Surg. 2004 ; 30 : 1225-31.
[47] Sourdille P, Santiago PY, Villain F, et al. Reticulated hyaluronic acid implant in nonperforating trabecular surgery. J Cataract Refract Surg. 1999 ; 25 : 332-9.
[48] Stegmann R, Pienaar A, Miller D. Viscocanalostomy for open-angle glaucoma in black African patients. J Cataract Refract Surg. 1999 ; 25 : 316-22.
[49] Tanihara H, Negi A, Akimoto M, et al. Surgical effects of trabeculotomy ab externo on adult eyes with primary open angle glaucoma and pseudoexfoliation syndrome. Arch Ophthalmol. 1993 ; 111 : 1653-61.
[50] Varga Z, Shaarawy T. Deep sclerectomy- safety and efficacy. Middle East Afr J Ophthalmol. 2009 ; 16 : 123-6.
[51] Vuori ML. Complications of Neodymium-YAG laser goniopuncture after deep sclerectomy. Acta Ophthalmol Scand. 2003 ; 81 : 573-6.
[52] Wiermann A, Zeitz O, Jochim E, et al. [A comparison between absorbable and non-resorbable scleral implants in deep sclerectomy (T-Flux and SK-Gel)]. Ophthalmologe. 2007 ; 104 : 409-14.
[53] Zimmerman TJ, Kooner KS, Ford VJ, et al. Trabeculectomy vs. nonpenetrating trabeculectomy – a retrospective study of two procedures in phakic patients with glaucoma. Ophthalmic Surg. 1984 ; 15 : 734-40.
F. Valtot
-
Une cicatrisation excessive est la cause essentielle des échecs de la chirurgie antiglaucomateuse.
-
5-Fluoro-uracile et mitomycine C sont les deux antimitotiques utilisés pour diminuer le risque de cicatrisation excessive.
-
Ils augmentent significativement le taux de succès pressionnel à court et long termes.
-
Cette efficacité doit être mise en balance avec le risque de complications parfois gravissimes et souvent retardées.
Le principe de la chirurgie filtrante est de permettre à l’humeur aqueuse (HA) de quitter la chambre antérieure, où il règne une surpression, pour s’écouler librement sous la conjonctive. Elle s’accumule puis se résorbe dans une zone appelée la bulle de filtration. On espère ainsi que va se réaliser un équilibre subtil entre la pression du liquide rejeté et la résistance des tissus épiscléraux à laquelle elle se heurte. Dans cet idéal, la pression intra-oculaire (PIO) va se « normaliser » et l’évolution de la maladie ralentir ou stopper.
CICATRISATION NORMALE ET PATHOLOGIQUE
Après la chirurgie, comme après toute plaie infligée au corps humain, une cascade de processus cicatriciels va débuter. Considérée comme très bénéfique partout ailleurs, la cicatrisation, qui a pour but de remettre les tissus dans leur état initial après une agression, devient l’ennemi mortel de la chirurgie filtrante du glaucome. Depuis de nombreuses années, il est bien connu que certains yeux sont plus susceptibles que d’autres de connaître un échec de leur chirurgie filtrante (yeux aphakes, pseudo-phakes, déjà opérés, yeux des sujets jeunes ou des mélanodermes, les yeux atteints d’uvéite ou de glaucome néovasculaire) [35], et même ceux qui ont reçu pendant des années des collyres conservés [4]. Pour le chirurgien, ces yeux sont dits « à risque » d’échec, car on sait que la cicatrisation y sera vigoureuse, c’est-à-dire que l’HA va se faire enfermer dans des cloisons conjonctives qui peuvent devenir étanches. Cependant, certains sujets n’ayant apparemment aucun facteur de risque d’échec vont développer une cicatrice hypertrophique. C’est au niveau de l’interface entre la conjonctive-capsule de Tenon d’une part, et de l’épisclère d’autre part, que se produit la cicatrisation dite « excessive » [22].
Cicatrisation normale
Les principaux acteurs de la cicatrisation sont les fibroblastes. Très vite après l’opération, ils se multiplient et migrent sur le site opératoire où ils sécrètent la matrice extracellulaire qui va se rétracter. Leur activité est modulée par les cellules et les substances contenues dans l’HA (cytokines et facteurs de croissance) [25] et d’autres cellules médiatrices de l’inflammation (lymphocytes et macrophages présents dans la conjonctive, la capsule de Tenon et le tissu épiscléral). Parallèlement, l’angiogenèse amène un tissu de granulation. Après une longue période de remodelage, les cellules inflammatoires et les fibroblastes en excès meurent par apoptose et tout revient apparemment à la normale. Apparemment… car il semble que des cellules spécifiques restent longtemps, voire toujours, en veille. Ces cellules à mémoire seraient capables de reprendre à tout moment le processus cicatriciel.
Cicatrisation excessive
La cause de la cicatrisation excessive n’est pas parfaitement connue. On ne sait si elle est due à la présence d’un trop grand nombre de fibroblastes, ou si ceux-ci sont trop actifs, ou actifs trop longtemps, sous l’influence des cellules inflammatoires présentes dans la conjonctive et des cellules et substances apportées par l’HA. On sait que l’HA des glaucomateux est particulièrement riche en facteurs de croissance. De nombreuses techniques chirurgicales et des traitements pharmacologiques ont été proposés pour maîtriser la cicatrisation excessive, sans efficacité notable.
Avènement des antimitotiques
C’est en 1981 que Chen [5] utilisa pour la première fois un antinéoplasique, la mitomycine C (MMC) en peropératoire sur le site d’une trabéculectomie pour diminuer la réaction cicatricielle. En 1983 [13], un autre antimétabolite, le 5-fluoro-uracile (5-FU), a commencé à être employé aux États-Unis en « complément » de la chirurgie filtrante, en injections postopératoires. Son utilisation s’est alors assez vite répandue. Ce n’est qu’en 1991 que Palmer [32] a introduit l’usage peropératoire de la MMC aux États-Unis. Grâce à l’utilisation de deux produits réservés jusque-là à l’oncologie, une nouvelle ère s’ouvrait pour la chirurgie du glaucome. L’utilisation des antimitotiques a considérablement amélioré les performances de la chirurgie en permettant d’obtenir, plus sûrement et pour plus longtemps, des chiffres de PIO mettant à l’abri d’une dégradation du nerf optique. Il faut noter que ces résultats se retrouvent non seulement sur les yeux à « risque », mais aussi sur les yeux vierges.
5-FLUORO-URACILE
Le 5-FU est utilisé depuis le début des années 1960 pour la chimiothérapie des cancers digestifs. Il a d’abord été employé en ophtalmologie pour inhiber la prolifération rétinovitréenne. Cet antimétabolite est un analogue fluoré de la pyrimidine.
Mode d’action
Il agit en inhibant la thymidylate synthétase ; il bloque ainsi la synthèse de l’ADN et empêche les divisions cellulaires. Au niveau de la capsule de Tenon et du tissu épiscléral, son mode d’action principal est l’inhibition de la prolifération des fibroblastes au début de la période postopératoire (une semaine chez le lapin) [23], ce qui freine la cicatrisation et contribue au maintien d’une bonne filtration [17]. S’y ajoute sans doute un effet toxique direct précoce. Le 5-FU, qui est également incorporé dans l’ARN, empêche aussi l’action de nombre d’enzymes intracellulaires.
Études cliniques et résultats
La plupart des études [13, 14, 33, 39] montrèrent en 1984 et dans les années qui suivirent des résultats spectaculaires : 65 à 92 % de succès sur des yeux à risque. Dans la Fluorouracil Filtering Surgery Study (FFSS) [37], étude prospective randomisée, il y avait deux groupes d’yeux aphakes, pseudo-phakes ou déjà opérés de glaucome. Tous ont eu une trabéculectomie, les uns avec 5-FU postopératoire, les autres sans. Dans le groupe 5-FU, les succès ont été de 73 % à un an, 51 % à trois ans et 49 % à cinq ans ; dans le groupe sans 5-FU, les succès n’étaient que de 50 % à un an, 26 % à trois ans et cinq ans [38]. Les résultats obtenus sur les yeux vierges de toute chirurgie dans une étude prospective randomisée [10] étaient encore meilleurs : 94 % versus 73 % de succès dans le groupe 5-FU avec un suivi de 20 mois.
Mode d’administration
Le protocole utilisé pour les traitements postopératoires comportait des injections sous-conjonctivales de 5-FU à la concentration de 50 mg/mL le plus souvent (certains opérateurs, dont ceux de la FFSS, ont préféré la concentration de 10 mg/mL), pratiquées à 180 ou 90° de la trabéculectomie. Dans la FFSS, deux injections par jour étaient faites la première semaine, puis une par jour la semaine suivante. Ces injections sont douloureuses. À ce rythme d’injections, les complications immédiates, surtout cornéennes (ulcères géants), étaient fréquentes, obligeant à une pause qui a permis de constater des résultats tonométriques voisins de ceux des injections deux fois moins fréquentes [26]. Peu à peu, sauf dans les cas sévères, le nombre total des injections a été réduit à cinq, voire trois [30]. Ces données ont conduit à supprimer, au début des années 1990, les injections, et à pratiquer une application peropératoire d’une éponge imbibée du produit dosé à 50 mg/mL pendant 5 minutes, imitant ainsi le protocole de la MMC décrit depuis peu. Cette application est devenue la procédure de référence. Les résultats tonométriques n’ont pas été affectés par cette nouvelle méthode, bien plus acceptée par les patients [29]. De plus, dans les cas difficiles, des injections postopératoires à la demande sont possibles.
Limites
Rothman et al. [34] ont montré qu’en pratique l’application de 5-FU n’augmente la filtration que pendant les trois premières années. Au-delà, la courbe de survie des yeux traités devient parallèle à celle des yeux non traités [36].
Complications
Les complications cornéennes, observées après les injections répétées en postopératoire, ont presque disparu depuis l’application peropératoire du produit. Les autres complications telles que l’hypotonie, les fuites sur les bulles et les endophtalmies sont, à trois et cinq ans, plus fréquentes qu’en cas de chirurgie sans antimétabolite [36, 40].
MITOMYCINE C
La MMC est un antibiotique isolé à partir de cultures de Streptomyces caespitosus. C’est un antinéoplasique cytostatique qui a un effet alkylant. La MMC entraîne l’inhibition de la synthèse de l’ADN. Son action étant indépendante de la phase de division cellulaire, elle ne se limite pas là, puisqu’elle inhibe aussi les mitoses et la synthèse de l’ARN et des protéines. L’inhibition de la prolifération cellulaire est totale. La MMC est employée en carcinologie pour traiter les cancers digestifs, du sein et de la vessie. Elle a été utilisée en ophtalmologie pour la première fois en 1962 après exérèse d’un ptérygion, pour en empêcher la récidive. Ainsi Chen [5] eut l’idée de l’utiliser en application directe sur la sclère avant une trabéculectomie pratiquée sur un glaucome réfractaire.
Mode d’action
Khaw, étudiant l’effet de l’application de MMC sur la sclère de lapin en peropératoire [23], constata l’inhibition de la prolifération fibroblastique ténonienne pendant plus de 36 jours (versus une semaine pour le 5-FU). Les fibroblastes existants meurent par apoptose. Cette action est, à temps égal (5 minutes), dépendante de la concentration de MMC appliquée : 100 % pour 0,4 mg/mL contre 60 % pour 0,2 mg/mL [23]. La MMC a aussi un effet délétère sur l’endothélium vasculaire conduisant à une raréfaction des vaisseaux au niveau de la conjonctive (aspect typique avasculaire des bulles) [1], de l’épisclère et du corps ciliaire. Il faut aussi noter qu’après application épisclérale pendant 5 minutes (ou injection sous-conjonctivale) de MMC, le produit pénètre très vite dans la sclère et la traverse. Les procès ciliaires sous-jacents sont profondément remaniés de façon durable et sans doute définitive, ce qui entraîne de facto une baisse pressionnelle proportionnelle à la surface imprégnée par le produit toxique. La pénétration tissulaire de la MMC est très rapide, mais elle demeure très longtemps sur place [24, 25]. Le rinçage est donc nécessaire après application, mais il n’est efficace qu’en surface. Il faut garder ces notions à l’esprit quand on traite des sclères minces (glaucomes congénitaux, myopes) ou que l’on applique l’éponge sous le volet scléral, accélérant ainsi la pénétration de la MMC au travers de la sclère.
La MMC est par ailleurs toxique pour le cristallin, et probablement pour les cellules rétiniennes. Derick et al. [8] ont montré l’effet dévastateur de la pénétration de la MMC dosée à 0,5 mg/mL dans la chambre antérieure : décompensation cornéenne, inflammation majeure, nécrose irienne et du corps ciliaire.
Études cliniques et résultats
Chen [5] fut le pionnier de cette pratique : il appliqua le premier la MMC entre la sclère et la conjonctive avant de tailler le volet scléral d’une trabéculectomie pratiquée sur des yeux atteints de glaucome réfractaire. Ses premiers résultats publiés en 1990 [6] sur 45 yeux donnaient 78 % de succès avec un recul de deux à trois ans. Les ophtalmologistes occidentaux, qui utilisaient le 5-FU en injection sous-conjonctivale depuis plusieurs années, ont alors eu deux nouvelles options à leur disposition : soit la MMC en application locale [32], soit le 5-FU en peropératoire, puisque l’efficacité de la méthode était démontrée. De nombreuses études comparant les résultats des deux produits ont conclu à l’efficacité des deux molécules mais, au fil des années (32 mois dans l’article de Katz et al. [21]), il devenait évident que le groupe 5-FU avait une PIO moyenne beaucoup plus élevée (16 mmHg) que le groupe MMC (9 mmHg).
Restait à déterminer quelle était la concentration du produit la plus appropriée et pendant combien de temps il fallait maintenir le contact avec les tissus oculaires. Palmer [32] en 1991 utilisait la MMC à 0,5 mg/mL pendant 5 minutes. Depuis, de très nombreux articles ont testé l’utilisation de MMC entre 0,2 et 0,5 mg/mL pendant des temps variables allant de 1 à 5 minutes, si bien que les comparaisons sont impossibles. On peut cependant conclure que plus la concentration est forte (0,5 mg/mL), plus la PIO obtenue est basse. En revanche, Khaw et Clarke [25] conseillent un temps d’application compris entre 1 et 3 minutes. Au-delà, ils pensent qu’on augmente le risque de complications sans majoration de l’effet tonométrique. Robin a trouvé une incidence plus marquée de cataracte quand l’exposition passait de 2 à 4 minutes. En 1997, Chen [7] comptait une grande majorité de chirurgiens utilisant la MMC à 0,4 mg/mL pendant 3 à 4 minutes. Comme pour le 5-FU, il semble qu’on ait utilisé au début des doses trop fortes pendant un temps trop long, source d’un excès de complications. En 2003, Beckers et al. [2] obtenaient 60 % de pressions inférieures à 15 mmHg avec cinq ans de recul, en ayant utilisé la MMC à 0,2 mg/mL pendant 3 minutes. En 2006 Fontana et al. [9], dans une étude rétrospective sur 292 yeux traités par de la MMC à 0,3 mg/mL pendant 1 à 3 minutes, trouvaient 80 % d’yeux ayant une pression inférieure à 12 mmHg à un an et 45 % à trois ans.
Mode d’administration
La MMC (comme le 5-FU) n’a pas d’autorisation officielle en France pour un usage ophtalmologique. Leur utilisation, cautionnée par des centaines de publications en France et à l’étranger depuis plus de 30 ans, est toutefois devenue courante dans la chirurgie du glaucome. Si le 5-FU est disponible directement au dosage habituel de 50 mg/mL, ce n’est pas le cas de la MMC… et le chirurgien ou son équipe doivent préparer le produit et le diluer pour obtenir la concentration choisie en fonction de chaque patient.
Protocole de P. Khaw
Initialement, l’éponge imbibée de MMC était appliquée entre la sclère et la conjonctive avant la taille du volet scléral. Au fil des années, des améliorations ont été proposées, notamment par P. Khaw et son équipe, afin de diminuer les complications de la chirurgie avec antimétabolites [25]. Il a mis au point une technique chirurgicale particulière de trabéculectomie associée à l’application de 5-FU ou de MMC peropératoire. Il privilégie le volet conjonctival incisé au limbe sur 8 mm (sans trait de refend) avec charnière au fornix. Il dissèque en arrière jusqu’au tendon du droit supérieur. Il taille un volet scléral le plus grand possible, sans inciser les bords latéraux jusqu’au limbe, afin que l’HA soit dirigée vers l’arrière. Il pousse ensuite sous la conjonctive six petites éponges faites d’un matériau ne se fragmentant pas pour ne pas perdre de microdébris in situ. Il les répartit autour de la trappe sur la plus large surface possible, et en glisse une sous le volet scléral. Il espère ainsi préparer une large zone de filtration diffuse, peu propice au développement d’une bulle kystique ou cernée par un bourrelet cicatriciel. L’éponge placée entre le volet et le plancher scléral a pour but d’éviter la cicatrisation intrasclérale, fréquemment retrouvée en cas de réintervention sur un échec antérieur. Il protège le bord incisé de la conjonctive de tout contact avec l’antimétabolite. Que ce soit avec le 5-FU ou la MMC, il laisse les éponges en place 3 minutes, puis rince avec au moins 20 mL de sérum. Quant à la MMC, s’il veut un effet plus fort, il n’augmente pas le temps mais la concentration du produit, passant de 0,2 à 0,5 mg/mL. Une sclérostomie de petite taille est pratiquée au punch. Puis le volet est suturé seulement sur les côtés par un mélange de sutures fixes et « ajustables en transconjonctival ». Ainsi l’HA ne peut s’échapper librement que vers l’arrière. L’utilisation d’un antimitotique aussi puissant que la MMC nécessite que le volet soit partiellement suturé afin d’éviter l’hypotonie postopératoire. En cas d’hypertonie, en revanche, les sutures peuvent être relâchées en transconjonctival (ou sectionnées au laser, selon d’autres auteurs). Khaw s’attache enfin à remettre la conjonctive en place par deux points latéraux de nylon 10/0 fixés à la cornée pour qu’il n’y ait aucune fuite. L’ensemble de ces précautions chirurgicales lui a permis de supprimer l’immense majorité des complications liées à cette chirurgie tout en maintenant ses avantages : pression finale comprise entre 10 et 15 mmHg et maintien de la fonction visuelle. Il a pu réduire la fréquence des bulles kystiques de 90 à 29 % ainsi que celle des blébites et des endophtalmies de 20 % à 0 % [25]. Il faut à tout prix éviter la pénétration des antimétabolites dans la chambre antérieure. En effet, le 5-FU a un pH de 9, et une très faible quantité de MMC entraîne, entre autres, des dommages endothéliaux irréversibles.
Complications
Du fait de ses propriétés, les complications liées à l’usage de la MMC sont plus nombreuses et plus sévères que celles associées à l’application du 5-FU. Il a fallu plusieurs années pour que les précautions préconisées par Khaw soient validées puis diffusées. Comme pour la chirurgie sans antimétabolite, ou celle accompagnée de 5-FU, la chirurgie avec MMC connaît trois complications principales : l’hypotonie (< 6 mmHg) accompagnée ou non de maculopathie, les fuites sur la bulle, et les infections (blébites ou endophtalmies). Ces complications sont souvent tardives, voire très tardives (plus de 10 ans), pas toujours connues des opérateurs et échappant aux statistiques. Ainsi plusieurs études semblent être en contradiction avec ce qui a été écrit plus haut, ne trouvant pas de corrélation entre le temps d’application ou la concentration de MMC et la fréquence ou la gravité des hypotonies. Cependant, le plus long recul rapporté n’était que de cinq ans [3]. En l’absence de fuite, la cause principale des hypotonies tardives est souvent la nécrose du volet scléral qui aboutit de fait à une chirurgie de pleine épaisseur. Les jeunes myopes y sont plus exposés. Le taux de fuites rapportées sur les bulles après MMC est variable (entre 1 et 27 %). Cependant, plusieurs articles se rejoignent sur le chiffre de 6 %. Les fuites sont plus rares (0,7 %), curieusement, après chirurgie combinée cataracte-glaucome [11]. Dans ce cas, la paroi des bulles est plus épaisse que celle des bulles fragiles, fines et avasculaires, typiques de la chirurgie avec MMC. Ces dernières ont d’ailleurs un risque de fuir et de s’infecter qui augmente avec le temps [15]. La MMC est un indéniable facteur de risque d’infection [18] d’une bulle de filtration : le taux de blébites est estimé à 6 % par an, et celui des endophtalmies entre 0,8 et 1,3 % [3]. Les patients doivent être avertis et surveillés à vie.
INDICATIONS EN PEROPÉRATOIRE
Malgré l’examen préopératoire et l’anamnèse, il est impossible de prévoir quelle sera la cicatrisation individuelle. Trois options sont possibles pour le chirurgien du glaucome :
-
n’utiliser aucun antimétabolite ;
-
appliquer du 5-FU (50 mg/mL) en peropératoire ;
-
appliquer de la MMC in situ à un dosage et pendant une durée à choisir en fonction du contexte.
Les résultats des études cliniques internationales rapportées ci-dessus et la liste des complications citées a permis de conclure que la MMC est plus active, et plus longtemps, sur les yeux à risque que le 5-FU, mais elle est censée engendrer plus de complications. La nette différence d’action constatée en laboratoire est moins évidente en clinique, surtout sur les yeux vierges [41]. Ainsi, l’étude de Palanca-Capistrano et al. [31] comparant les effets soit du 5-FU, soit de la MMC sur des trabéculectomies de première intention avec un recul de 19 à 82 mois ne montre aucune différence, ni sur les résultats pressionnels, ni sur les complications. En cas de première intervention, il est vraisemblable qu’un certain nombre de patients ne nécessite pas de traitement antimitotique (patients caucasiens, âgés, n’ayant jamais été opérés). Les ophtalmologistes américains préfèrent traiter tout le monde : 32 % avec le 5-FU et 68 % avec MMC [19]. Dans la même circonstance, l’European Glaucoma Society (EGS) conseille aucun traitement ou le 5-FU peropératoire et préfère une réponse graduée, sur mesure, pour chaque œil : 5-FU à 50 mg/mL ou MMC à 0,2 mg/mL pendant 2 à 3 minutes pour les risques « moyens », et la MMC 0,4 mg/mL 2 à 5 minutes pour les cas à haut risque [12].
INJECTIONS POSTOPÉRATOIRES
Cette prudence dans le dosage du traitement peropératoire n’interdit pas, si besoin, le recours aux injections postopératoires. Il est conseillé de surveiller l’aspect de la bulle à la recherche de signes d’échec (diminution de la surface soulevée, épaississement et vascularisation conjonctivale et, enfin, remontée pressionnelle) plutôt qu’attendre. La cicatrisation excessive doit être prévenue. Les injections sont ou non précédées d’un needling.
Injections de 5-FU
Khaw et Clarke [25] conseillent alors d’injecter 0,1 mL de 5-FU (50 mg/mL) sous la conjonctive « le plus près possible de la bulle, sans toutefois que le liquide puisse pénétrer la bulle ». Il conseille aussi de bien rincer le limbe pour protéger la cornée ou, mieux, d’injecter du Healon GV® en barrage au limbe, puis le 5-FU qui, ainsi, ne pourrait pas refluer. Broadway en 2004, associant un needling aux injections de 5-FU, obtenait 60 % de succès à 18 mois sur 101 yeux. Ces injections doivent souvent être renouvelées à la demande. Elles peuvent aussi être tentées en cas d’échec d’une chirurgie filtrante faite avec application de MMC.
Injections de MMC
De nombreux chirurgiens refusent de prendre le risque de la MMC (dont P. Khaw). D’autres, après avoir fait un needling pour reperméabiliser la cicatrice, suturent l’orifice conjonctival, puis font une application transconjonctivale de MMC [42]. Guterriez-Ortiz propose d’injecter 0,1 mL de MMC à 0,1 ou 0,2 mg/mL en sous-conjonctivale postérieure (8 mm) pour éviter la pénétration en chambre antérieure. Il obtient de bons résultats à condition que l’injection soit faite tôt après la chirurgie (3-4 mois).
LES ANTIMITOTIQUES DANS LES AUTRES INTERVENTIONS ANTIGLAUCOMATEUSES
Le 5-FU et la MMC sont utilisés dans les autres interventions filtrantes comme la sclérectomie, avec un protocole identique à celui de la trabéculectomie, L’application de 5-FU ou de MMC est très répandue lors de la pose de tubes ou valves. Il est difficile de savoir si cet usage est justifié. Les séries publiées sont trop petites ou faites sans groupe de contrôle. Les reculs sont limités et les résultats contradictoires [42]. Actuellement, la tendance est en faveur des injections de 5-FU si la tension remonte en postopératoire. Pour la chirurgie combinée cataracte-glaucome, là encore les avis sont partagés. Yoon et Singh [42] a cependant trouvé sur une étude de quatre ans un bénéfice pressionnel net quand la MMC est appliquée, particulièrement chez les sujets à risque. Il faut noter que les antimitotiques peuvent être totalement inefficaces chez certains sujets [28, 40] et que des résistances progressives à la MMC (et non au 5-FU) peuvent s’installer [16].
NOUVELLES ORIENTATIONS
Le 5-FU et la MMC sont utilisés depuis 30 ans pour ralentir la cicatrisation et n’ont pas eu de concurrents aussi efficaces et moins dangereux.
Mode de délivrance
Dès 1986-1988, Lee [27] avait imaginé, pour répondre à la cascade d’événements complexes qui se succèdent au cours de la cicatrisation, d’utiliser un implant en polymère biodégradable qui serait placé sous la conjonctive après une trabéculectomie. Comme il pensait qu’une seule molécule ne pouvait agir sur toutes les phases, cet implant était composé de plusieurs couches superposées qui se délitaient lentement en délivrant leurs différents agents, dont le 5-FU, et des stéroïdes. Depuis, plusieurs tentatives ont eu lieu avec des résultats mitigés. L’idée est d’améliorer l’efficacité en diminuant les doses de toxique et donc les effets secondaires. Le mode de délivrance des antimétabolites devrait bénéficier des nouvelles technologies (capsules biodégradables, gels, nanoparticules [28]), pour permettre une libération limitée en quantité et dans le temps au seul moment où elle est nécessaire.
Associations
Kahook [20] a publié en 2010 les résultats d’une étude pilote où un anti-facteur de croissance vasculaire endothelial (VEGF), le ranibizumab, était injecté dans le vitré et la MMC appliquée en peropératoire d’une trabéculectomie. Les premiers résultats à six mois et un an sont meilleurs qu’avec la MMC seule. De nouveaux antagonistes sont en cours d’évaluation, seuls et associés aux antimitotiques [28], pour obtenir une meilleure efficacité.
Retenir
-
Les risques d’échec de la chirurgie antiglaucomateuse doivent être systématiquement évalués en préopératoire, mais cette prise en compte ne suffit pas toujours à anticiper la réaction cicatricielle individuelle.
-
Ces facteurs de risque sont pour le GPAO : sujet jeune, mélanoderme, chirurgie oculaire antérieure, traitement antiglaucomateux prolongé.
-
La MMC est plus active, et beaucoup plus longtemps, que le 5-FU, mais entraîne plus de complications, parfois de nombreuses années après la chirurgie.
-
En peropératoire, le 5-FU s’utilise à la concentration de 50 mg/mL, appliquée 3 à 5 minutes, et la MMC de 0,2 à 0,5 mg/mL, appliquée 2 à 4 minutes. L’application se fait entre la conjonctive et la sclère, ou entre le volet et le plancher scléral, ou les deux.
-
En cas d’échec d’une chirurgie filtrante, les antimitotiques peuvent également être utilisés en injection sous-conjonctivale, avec ou sans needling, en utilisant de préférence le 5-FU (0,1 mL à 50 mg/mL) plutôt que la MMC (0,1 mL à 0,02 mg/mL).
-
Le 5-FU et la MMC ne doivent jamais pénétrer dans la chambre antérieure.
-
La cicatrice doit être surveillée à vie.
[1] Assalian A, Scroggs MW, Shields MB, et al. Histology of conjunctival vascular endothelium after filtering surgery with Mitomycin in rabbits. Can J Ophthalmol. 1996 ; 31 : 289-95.
[2] Beckers HJ, Kinders KC, Webers CA. Five-year results of trabeculectomy with mitomycin C. Graefe’s Arch Clin Exp Ophthalmol. 2003 ; 241 : 106-10.
[3] Bindlish R, Condon G, Schlosser JD, et al. Efficacy and safety of mitomycin C in primary trabeculectomy. Five-year follow-up. Ophthalmology. 2002 ; 109 : 1336-42.
[4] Broadway DC, Grierson I, O’Brien C, et al. Adverse effects of topical antiglaucoma medication : II. The outcome of filtration surgery. Arch Ophthalmol. 1994 ; 112 : 446-54.
[5] Chen CW. Enhanced intraocular pressure controlling effectiveness of trabeculectomy by local application of mitomycin C. Trans Asia-Pacific Acad Ophthalmo1. 1983 ; 9 : 172-77.
[6] Chen CW, Huang HT, Bair JS, et al. Trabeculectomy with simultaneous topical application of mitomycin C in refractory glaucomas. J Ocular Pharmacol. 1990 ; 6 : 175-82.
[7] Chen PP, Yamamoto T, Sawada A, et al. Use of antifibrosis agents and glaucoma drainage devices in the American and Japanese glaucoma societies. J Glaucoma. 1997 ; 6 : 192-96.
[8] Derick RJ, Pasquale L, Quigley HA, et al. Potential toxicity of mitomycin C. Arch Ophthalmol. 1991 ; 109 : 1635-39.
[9] Fontana H, Nouri-Mahdavi K, Lumba J, et al. Trabeculectomy with mitomycin C. Ophthalmology. 2006 ; 113 : 930-36.
[10] Goldenfeld M, Krupin, Ruderman JN, et al. 5-Fluorouracil in initial trabeculectomy : A prospective, randomized, multi-center study. Ophthalmology. 1994 ; 101 : 1024-29.
[11] Greenfield DS, Liebmann JM, Lee J, et al. Late-onset bleb leaks after glaucoma filtering surgery. Arch Ophthalmol. 1998 ; 116 : 443-47.
[12] Guide pour les glaucomes. 3e édition. European Glaucoma Society. 2008 : 154-56.
[13] Heuer DK, Parrish RK, Gressel MG, et al. 5-Fluoro-uracil and glaucoma filtering surgery : II. A pilot study. Ophthalmology. 1984 ; 91 : 385-93.
[14] Heuer DK, Parrish RK, Gressel MG. et al. 5-Fluoro-uracil and glaucoma filtering surgery : III. Intermediate follow-up of a pilot study. Ophthalmology. 1986 ; 93 : 1537-46.
[15] Hu CY, Matsuo H, Tomita G. Clinical characteristics and leakage of functioning blebs after trabeculectomy with Mitomycin C in primary glaucoma patients. Ophthalmolgy. 2003 ; 110 : 345-52.
[16] Hueber A, Esser JM, Kociok N, et al. Mitomycin C induces multidrug resistance in glaucoma surgery. Graefes Arch Clin Exp Ophthalmol. 2008 ; 246 : 297-304.
[17] Jampel HD. Effect of brief exposure to mitomycin-C on viability and proliferation of cultured human Tenon’s capsule fibroblasts. Ophthalmolgy. 1992 ; 99 : 1471-76.
[18] Jampel HD, Quigley HA, Kerrigan-Baumrind LA, et al. Risk factors for late-onset infection following glaucoma filtration surgery. Arch Ophthalmol. 2001 ; 119 : 1001-08.
[19] Joshi AB, Parrish RK, Feuer WF. 2002 Survey of the American Glaucoma Society : Practice preferences for glaucoma surgery and antifibrotic use. J Glaucoma. 2005 ; 14 : 72-74
[20] Kahook MY. Bleb morphology and vascularity after trabeculectomy with intravitreal Ranibizumab : a pilot study. Am J Ophthalmol. 2010 ; 150 : 399-403.
[21] Katz GJ, Higginbotham EJ, Lichter PR, et al. Mitomycin C versus 5-fluorouracil in high-risk glaucoma filtering surgery : extended follow-up. Ophthalmology. 1995 ; 102 : 1263-69.
[22] Khaw PT. Wound healing. In : Glaucoma surgery in open angle glaucoma. The Hague, The Netherlands, Kugler Publications, 2005 : 41-54.
[23] Khaw PT, Doyle JW, Sherwood MB, et al. Effects of intraoperative 5-fluorouracil or Mitomycin C on glaucoma filtration surgery in the rabbit. Ophthalmology. 1993 ; 100 : 367-72.
[24] Khaw PT, Sherwood MB, Mackay SLD. Five minute treatments with fluorouracil, floxuridine and mitomycin have long-term effects on human Tenon’s capsule fibroblasts. Arch Ophthalmol. 1992 ; 110 : 1150-54.
[25] Khaw PT, Clarke J. Antifibrotic agents in glaucoma surgery. In : Yanoff M, Duker JS (eds). Ophthalmology. London, Mosby, 2008.
[26] Kitazawa Y, Kawase K, Matsushita H, et al. Trabeculectomy with Mitomycin : a comparative study with 5-fluorouracil. Arch Ophthalmol. 1991 ; 109 : 1693-98.
[27] Lee DA. Pharmacologic modulation of wound healing following filtering surgery. In : Glaucoma surgery. Mosby, 1992 : 53-6.
[28] Lockwood A, Brocchini S, Khaw PT. New developments in the pharmacological modulation of wound healing after glaucoma surgery. Curr Opin Ophthalmol. 2013 ; 13 : 65-71.
[29] Mora JS, Nguyen N, Iwach AG, et al. Trabeculectomy with intraoperative sponge 5-fluorouracil. Ophthalmology. 1996 ; 103 : 963-70.
[30] Ophir A, Ticho U. A randomized study of trabeculectomy and subconjunctival administration of 5-fluorouracil in primary glaucomas. Arch Ophthalmol. 1992 ; 11 : 1072-75.
[31] Palanca-Capistrano AM, Hall J, Cantor LB, et al. Long term outcomes of intraoperative 5-fluorouracil versus intraoperative mitomycin C in primary trabeculectomy surgery. Ophthalmology. 2009 ; 116 : 185-90.
[32] Palmer SS. Mitomycin as adjunct chimiotherapy with trabeculectomy. Ophthalmology. 1991 ; 98 : 317-21.
[33] Rockwood EJ, Parrish RK, Heuer DK, et al. Glaucoma filtering surgery with 5-fluorouracil. Ophthalmology. 1987 ; 94 : 1071-8.
[34] Rothman RF, Liebmann JM, Ritch R. Low-dose 5-fluorouracil trabeculectomy as initial surgery in uncomplicated glaucoma : long term follow-up. Ophthalmology. 2000 ; 107 : 1184-90.
[35] Skuta GL, Parrish RK. Wound healing in glaucoma filtering surgery. Surv Ophthalmol. 1987 ; 32 : 149-70.
[36] Suzuki R, Dickens CJ, Iwach AG, et al. Long term follow-up of initially successful trabeculectomy with 5-fluorouracil injections. Ophthalmology. 2002 ; 109 : 1921-4.
[37] The Fluorouracil Filtering Surgery Study Group. Fluorouracil filtering surgery study one year follow-up. Am J Ophthalmol. 1989 ; 108 : 625-35.
[38] The Fluorouracil Filtering Surgery Study Group. Three-year follow-up of the Fluorouracil Filtering Surgery Study. Am J Ophthalmol. 1993 ; 115 : 82-92.
[39] Weinreb RN. Adjusting the dose of 5-fluorouracil after filtration surgery to minimize side effects. Ophthalmology. 1987 ; 94 : 564-70.
[40] Wong TT, Khaw PT, Aung T, et al. The Singapore 5-fluorouracil trabeculectomy study : effects on intraocular pressure control and disease progression at 3 years. Ophthalmology. 2009 ; 116 : 175-84.
[41] WuDunn D, Cantor LB, Palanca-Capistrano AM, et al. A prospective randomized trial comparing intraoperative 5-fluorouracil versus mitomycin C in primary trabeculectomy. Am J Ophthalmol. 2002 ; 134 : 521-8.
[42] Yoon PS, Singh K. Update on antifibrotic use in glaucoma surgery, including use in trabeculectomy and glaucoma drainage implants and combined cataract and glaucoma surgery. Curr Opin Ophthalmol. 2004 ; 15 : 141-6.
S. Roy, A. Mermoud
-
Plusieurs dispositifs peuvent être employés pour maintenir ouvert l’espace de filtration, afin de prévenir l’affaissement du volet scléral superficiel contre le plancher scléral.
-
Les implants utilisés dans la sclérectomie profonde non perforante (SPNP) peuvent être classés en deux groupes : les implants non résorbables et de nombreux implants résorbables.
RAPPEL ANATOMIQUE ET TECHNIQUE CHIRURGICALE
Afin de bien comprendre le rôle important joué par les implants et autres dispositifs utilisés lors de la chirurgie non perforante, il convient au préalable de rappeler brièvement ici les principes et structures anatomiques impliqués dans cette technique chirurgicale. Cette dernière vise à réduire de manière significative la résistance à l’écoulement de l’humeur aqueuse entre le site de production et les voies de drainages extra-oculaires, permettant ainsi de diminuer durablement la pression intra-oculaire [2, 7, 12]. L’humeur aqueuse est alors évacuée selon différentes routes de drainage qui sont (i) l’espace intrascléral, (ii) l’espace sous-conjonctival et (iii) l’espace suprachoroïdien. La création d’une cavité intrasclérale (sclérectomie profonde) lors de la dissection de la sclère permet de former un espace de filtration adéquat (fig. 16-57). Dans la phase postopératoire, de nouveaux vaisseaux de drainage vont se développer afin de contribuer à l’évacuation trans-sclérale de l’humeur aqueuse provenant de la diffusion à travers la membrane trabéculo-descemétique et la paroi interne du canal de Schlemm [5].
NÉCESSITÉ DES IMPLANTS DANS LA SPNP
Afin que l’humeur aqueuse émergeant de la membrane trabéculo-descemétique et du volet interne du canal de Schlemm et du trabéculum juxtacanaliculaire soit drainé en permanence au travers cet espace intrascléral, il est essentiel de s’assurer que la filtration ne soit pas compromise au long cours par une atteinte de la structure de cet espace. À cette fin, il est donc primordial de maintenir ouvert l’espace intrascléral dans lequel s’évacue l’humeur aqueuse avant sa réabsorption par les voies intrasclérales de drainage. Plusieurs dispositifs peuvent être employés pour maintenir ouvert cet espace, afin de prévenir l’affaissement du volet scléral superficiel contre le plancher scléral.
TYPES D’IMPLANT
Les implants utilisés dans la SPNP peuvent être groupés dans deux classes distinctes. La première comprend les implants et dispositifs non résorbables qui seront, par définition, présents en permanence dans l’espace intrascléral. La seconde inclut tous les implants dont la composition est résorbable au cours du temps et qui seront amenés à disparaître progressivement dans la période postopératoire.
Implants non résorbables
La classe des implants non résorbables comprend principalement le T-Flux® qui, comme son nom l’indique, présente la forme d’un T dont les branches latérales viennent s’enclaver dans les ouvertures du canal de Schlemm [1, 10] (eFig. 16-6). Le corps de l’implant comporte un orifice permettant de le suturer à la sclère profonde pour assurer son ancrage. Sa structure est constituée de Poly-Megma®, une substance synthétique acrylique fortement hydrophile, comparable au matériau utilisé pour confectionner les lentilles de contact souples hydrophiles acryliques.
Des essais cliniques ont été conduits chez l’animal et chez l’homme pour déterminer les propriétés biologiques et fonctionnelles d’implants non résorbables confectionnés en PMMA, dont la forme est en croix, à l’instar de la lettre X [4, 9] (eFig. 16-7). L’intérêt de ce type de matériau, qui a été largement utilisé dans la chirurgie de la cataracte et dont la biocompatibilité a été clairement démontrée, réside dans la libre forme qu’il est ainsi possible de donner à l’implant dans l’espace scléral de filtration, et dans l’excellente stabilité à long terme vis-à-vis de la tolérance biologique et des phénomènes de rejet ou de fibrose.
Récemment un nouvel implant en polymère acrylique (2-hydroxy-éthyl-méta-acrylate) a été développé afin de faciliter l’écoulement de l’humeur aqueuse au niveau de l’espace suprachoroïdien et intrascléral (communication personnelle). Il consiste en une petite plaque en forme de tétraèdre garnie de sillons formant des canaux permettant le drainage de l’humeur aqueuse (eFig. 16-8).
Implants résorbables
Les implants résorbables sont plus nombreux et nous présentons les types les plus courants sur le marché actuel. Historiquement, le premier dispositif utilisé avec succès dans la chirurgie non pénétrante est un implant cylindrique fabriqué à partir de collagène scléral d’origine porcine (Aquaflow®) (fig. 16-58) [6]. Le collagène est traité de façon à garantir sa pureté et sa neutralité biologique pour éviter d’induire des réactions inflammatoires ou de rejet. Sous sa forme sèche, après stérilisation aux rayons gamma, il mesure environ 4,0 × 0,5 × 0,5 mm (eFig. 16-9). L’implant triple de volume après hydratation complète, le contenu en eau s’élevant alors à plus de 99 % (eFig. 16-10). Dans la phase postopératoire et sous l’action de collagénases et de métalloprotéinases circulant dans l’humeur aqueuse, l’implant est progressivement digéré dans le lit scléral en l’espace de six à neuf mois environ.
L’acide hyaluronique est une glycosaminoglycane produite par la matrice extracellulaire que l’on trouve en grande quantité dans le corps. Il existe une forme sodique d’acide hyaluronique, le hyaluronate de sodium, qui est couramment utilisé dans la chirurgie du segment antérieur, en particulier pour ses propriétés viscoélastiques. En créant des ponts stables entre les branches des chaînes latérales de l’acide hyaluronique, il est ainsi possible d’agir durablement sur les propriétés physiques et rhéologiques de cette matière, afin d’augmenter sa stabilité en solution. Un gel peut ainsi être synthétisé et présente une très grande stabilité au cours du temps.
Ce gel n’est pas directement soluble dans l’eau, mais lorsqu’il est entouré d’eau, il accroît son état d’hydratation et augmente alors de volume, tout en étant thermostable.
Une forme particulière de gel a été développée et consiste en un maillage de hyaluronate de sodium biosynthétique moulé sous la forme d’un triangle équilatéral de 3,5 mm de côté pour une épaisseur de 500 μm ou d’un triangle isocèle de 4,5 mm par 3,0 mm pour la même épaisseur (SK-Gel®) (eFig. 16-11).
L’un des avantages de cette géométrie d’implant est qu’il n’est pas nécessaire de suturer l’implant au niveau de la sclère, contrairement à l’implant cylindrique de collagène, et qu’il occupe également un large volume dans l’espace de filtration, tout en permettant une bonne circulation de l’humeur aqueuse [8, 13].
De l’acide hyaluronique sous forme d’un agent viscoélastique (Healon GV®) est utilisé dans une variante de chirurgie non pénétrante, la viscocanalostomie, afin de dilater les ostia du canal de Schlemm et de garder ouvert l’espace intrascléral de filtration.
Récemment, un nouvel implant a été développé en utilisant des ressources de biotechnologie pour produire un acide hyaluronique fortement réticulé (Healaflow®). Cet implant doublement réticulé peut être facilement injecté sur le lit scléral, sous le volet scléral superficiel, afin de maintenir la structure de l’espace intrascléral de filtration [11] (fig. 16-59).
RÉSULTATS CLINIQUES
En utilisant un implant non résorbable T-Flux® dans la SPNP, le résultat après un suivi de 16 mois auprès de 25 patients mentionne un taux de succès complet (PIO < 21 mmHg sans médicament) de 39,1 % [1]. Un dispositif en PMMA a été implanté chez 30 patients avec un suivi de 30 mois. Le taux de succès est de 42 % pour maintenir la PIO inférieure à 21 mmHg sans traitement [9]. Dans une analyse de suivi de plus de 10 ans portant sur 105 patients opérés avec un implant cylindrique de collagène, le taux de succès complet est de 44,6 % afin de maintenir la pression intra-oculaire inférieure à 21 mmHg sans traitement [3]. Un travail de recherche a été mené, avec un suivi de cinq ans, sur 97 cas implantés avec l’implant SK-Gel® afin de déterminer le succès de cette technique. Le taux de succès complet est de 64,9 % [8]. Une recherche visait à comparer les deux classes d’implants non résorbables (T-Flux® avec 54 patients) et résorbables (SK-Gel® avec 18 patients). Pour le groupe d’implants T-Flux® 90,3 % des patients ont vu leur PIO être stabilisée en dessous de 18 mmHg alors que le groupe SK-Gel® atteignait 76,9 % [13]. Une autre étude a effectué le même type de comparaison entre les implants T-Flux® et Healon GV® avec un taux de succès de 63,6 % pour le premier groupe et 81,8 % pour le second [10]. Enfin, une publication récente incluant 55 patients bénéficiant de l’injection de Healaflow® a démontré un taux de succès complet à 12 mois de 70 % [11].
Retenir
-
La SPNP est une technique chirurgicale moderne qui a fait ses preuves pour diminuer de façon durable la pression intra-oculaire des patients glaucomateux.
-
Afin de développer pleinement son action, il est indispensable de bien respecter l’anatomie des structures opérées, en particulier l’espace intrascléral de filtration qui est un des lieux de drainage de l’humeur aqueuse.
-
Des implants de drainage soit permanents, soit résorbés, dans la phase postopératoire, sont placés dans cet espace afin d’en maintenir la stabilité dans le temps.
-
L’action biologique au niveau de la cicatrisation et de la prévention de la fibrose jouée par l’acide hyaluronique utilisé dans les implants résorbables contribue également aux résultats favorables de cette chirurgie.
Fig. 16-57 Image de biomicroscopie ultrasonore montrant la membrane trabéculo-descemétique et l’espace intrascléral de filtration.
eFig. 16-6 Implant T-Flux® en Poly-Megma®.
eFig. 16-7 Implant en croix en PMMA.

eFig. 16-8 Implant ESNOPER V2000 en 2-hydroxy-éthyl-méta-acrylate.
Fig. 16-58 Implant en collagène porcin Aquaflow® inséré dans la cavité intrasclérale et suturé par un fil de nylon sur le lit scléral.
eFig. 16-9 Implant en collagène porcin Aquaflow® sous forme sèche.

eFig. 16-10 Implant en collagène porcin Aquaflow® après hydratation.

eFig. 16-11 Implant en acide hyaluronique SK-Gel®.
Fig. 16-59 Implant en acide hyaluronique doublement réticulé Healaflow®.
[1] Ates H, Uretmen O, Andac K, et al. Deep sclerectomy with a nonabsorbable implant (T-Flux) : preliminary results. Can J Ophthalmol. 2003 ; 38 : 482-8.
[2] Bill A, Svedbergh B. Scanning electron microscopic studies of the trabecular meshwork and the canal of Schlemm’s : an attempt to localize the main resistance to outflow of aqueous humour in man. Acta Ophthalmol (Copenh). 1972 ; 50 : 295-320.
[3] Bissig A, Rivier D, Zaninetti M, et al. Ten years follow-up after deep sclerectomy with collagen implant. J Glaucoma. 2008 ; 17 : 680-6.
[4] Codreanu A, Tran HV, Wiaux C, et al. In vivo study comparing an X-shaped polymethylmethacrylate and a cylindrical collagen implant for deep sclerectomy. Clin Experiment Ophthalmol. 2011 ; 39 : 135-41.
[5] Delarive T, Rossier A, Rossier S, et al. Aqueous dynamic and histological findings after deep sclerectomy with collagen implant in an animal model. Br J Ophthalmol. 2003 ; 87 : 1340-4. Comment in : Br J Ophthalmol. 2003 ; 87 : 1310.
[6] Demailly P, Jeanteur-Lunel MN, Berkani M. Non penetrating deep sclerectomy associated with collagen implant device in primary open angle glaucoma : middle term retrospective study. J Fr Ophtamol. 1996 ; 19 : 659-66.
[7] Ethier CR, Kamm RD, Palaszewski BA, et al. Calculation of flow resistance in the juxtacanalicular meshwork. Invest Ophthalmol Vis Sci. 1986 ; 27 : 1741-50.
[8] Galassi F, Giambene B. Deep sclerectomy with SK-Gel implant : 5-year results. J Glaucoma. 2008 ; 17 : 52-6.
[9] Mansouri K, Shaarawy T, Wedrich A, Mermoud A. Comparing polymethylmethacrylate implant with collagen implant in deep sclerectomy : a randomized controlled trial. J Glaucoma. 2006 ; 15 : 264-70.
[10] Ravinet E, Bovey E, Mermoud A. T-Flux implant versus Healon GV in deep sclerectomy. J Glaucoma. 2004 ; 13 : 46-50.
[11] Roy S, Huyen DT, Feusier M, Mermoud A. Cross-linked sodium hyaluronate implant in deep sclerectomy for the surgical treatment of glaucoma. Eur J Ophthalmol. 2012 ; 22 : 70-6.
[12] Seiler T, Wollensak J. The resistance of the trabecular meshwork to aqueous humor outflow. Graefe’s Arch Clin Exp Ophthalmol. 1985 ; 223 : 88-91.
[13] Wiermann A, Zeitz O, Jochim E, et al. A comparison between absorbable and non-resorbable scleral implants in deep sclerectomy (T-Flux and SK-Gel). Ophthalmologe. 2007 ; 104 : 409-14.
O. Laplace
-
L’Ex-PRESS™, amélioré dans ses dernières versions, peut être mis en concurrence avec la trabéculectomie.
-
Les valves et drains existent en différentes tailles et matériaux, s’adaptant à tous les patients. Ils s’adressent aux patients en échec des traitements classiques après multiples chirurgies. Leur indication tend à s’étendre à des patients moins lourds.
-
La gestion des complications reste essentielle.
-
Les études prospectives récentes permettent de mieux comprendre leur devenir.
De nombreux dispositifs chirurgicaux sont disponibles et complètent les possibilités thérapeutiques du glaucome primitif à angle ouvert (GPAO). Certains offrent une alternative à la chirurgie filtrante classique avec pour objectifs de diminuer ses complications, comme l’Ex-PRESS™ ; d’autres, comme les valves et drains, sont l’apanage des glaucomes réfractaire (pour faciliter la compréhension du texte, nous appellerons « drains » les systèmes SANS valve et non tube afin d’éviter la confusion avec le tube distal siliconé inhérent de tous les dispositifs). Longtemps sous-employés, véhiculant parfois une mauvaise réputation (technique difficile, complications importantes), ces moyens thérapeutiques retrouvent une place importante dans la prise en charge des glaucomes. Certains vont jusqu’à les mettre en concurrence avec la trabéculectomie en première intention.
CARACTÉRISTIQUES
L’Ex-PRESS™ a connu plusieurs évolutions depuis sa création par Belkin et Glovinsdky. Fabriqué par Optonol Ltd. en Israël, le dernier modèle Ex-PRESS™ P de 50 μ est distribué depuis peu par Alcon. La technique proposée au départ consistait à placer le dispositif au limbe en le laissant directement sous la conjonctive. De nombreuses complications (hypotonie, migration du dispositif, etc.) ont imposé une révision de la technique et un remodelage du design, reconsidérant désormais plus favorablement cette alternative à la trabéculectomie. La longueur de l’Ex-PRESS™ est de 2,4 mm, et son extrémité interne est biseautée pour faciliter sa pose. Les orifices latéraux ont été supprimés pour éviter l’incarcération de l’iris et remplacés par un orifice unique sur le dôme supérieur. Le diamètre interne mesure 50 μm, et l’ensemble est préchargé sur un injecteur (fig. 16-60a). La version avec un tunnel interne de 200 μm, avec laquelle la plupart des études ont été réalisées, ne devrait plus être disponible au moment de la parution de cet ouvrage.
INDICATIONS, CONTRE-INDICATIONS ET TECHNIQUE OPÉRATOIRE
L’indication d’un Ex-PRESS™ se fera selon les mêmes critères que ceux d’une trabéculectomie, à quelques nuances près. Un angle très remanié et une chambre antérieure très étroite ne seront pas adaptés pour accueillir ce matériel, de même qu’un déficit en cellules endothéliales. Une aniridie, des antécédents d’uvéite ou un implant de chambre antérieure devront faire reconsidérer sa pose.
L’anesthésie topique simple peut être proposée après la phase d’apprentissage, le geste étant relativement rapide et peu traumatique. On pourra préférer une anesthésie sous-ténonienne en début d’intervention si nécessaire.
La technique recommandée débute comme celle d’une trabéculectomie, par la désinsertion de la conjonctive (limbe ou fornix) et la création d’un volet scléral de 40-50 % d’épaisseur. Il faut repérer le trabéculum avant la pénétration en avant de l’éperon scléral par une orientation parallèle à l’iris d’une aiguille 25G. Sous protection viscoélastique, l’injecteur dépose l’Ex-PRESS™ au travers du limbe qui s’y fixera par son éperon inférieur (fig. 16-60b). Le viscoélastique doit être injecté au regard du site de pénétration par une paracentèse cornéenne ou directement par une aiguille de 30G montée sur le tube du produit. Son volume ne devra pas excéder un tiers du volume de la chambre antérieure (pour éviter une hypertonie postopératoire et un lavage nécessaire peropératoire). Certains auteurs préfèrent la pose d’un terminal d’infusion en chambre antérieure au viscoélastique. Il n’est pas nécessaire de faire une iridectomie. Conjonctive et volet scléral sont suturés selon les habitudes du chirurgien.
Certains auteurs associent la mitomycine C à 0,05 % sous le volet scléral, d’autres l’utilisent à la concentration de 0,2 mg ou 0,4 mg/L en sous-conjonctivo-ténonien.
La gestion postopératoire ne comporte pas de particularité par rapport à la chirurgie filtrante classique. Anti-inflammatoires non stéroïdiens et corticoïdes seront instillés pendant plusieurs semaines, les fils du volet pourront être lysés au laser et les sutures ajustables retirées si besoin.
RÉSULTATS
Il existerait moins de complications et une récupération visuelle plus rapide avec l’Ex-PRESS™ P50 par rapport à la trabéculectomie (une semaine versus un mois postopératoire) avec moins de visites postopératoires (six versus huit). L’analyse comparative des bulles de filtration selon le Moorfields Bled Grading System ne montre pas de différence significative [12]. Le taux de révision de bulles est comparable.
L’étude prospective de Dahan et al. [8] a comparé les résultats de la pose d’un Ex-PRESS™ X200 sur un œil et d’une trabéculectomie sur l’œil adelphe chez 15 patients ayant un GPAO non contrôlé. À 30 mois, la PIO a évolué de 31,1 à 16,2 mmHg pour les yeux après trabéculectomie, et de 28,1 à 15,7 mmHg pour les yeux avec l’Ex-PRESS™. La pose d’Ex-PRESS™ exposait à moins de complications postopératoires (20 versus 33 %, essentiellement des chambres antérieures étroites et des hypotonies), et le taux de succès (PIO < 18 mmHg avec ou sans traitement) était statistiquement en faveur de ce groupe, 80 versus 40 % [8]. Il n’y aurait pas de différence significative sur le pronostic tensionnel entre une population mélanoderme et une population caucasienne [20]. De Jong et al. [9], dans une étude prospective randomisée sur 78 patients jamais opérés suivis sur cinq ans, ont retrouvé un taux de succès (PIO < 18 mmHg sans traitement associé) plus favorable en faveur du groupe Ex-PRESS™. À un, trois et cinq ans, les taux étaient de 86,8 %, 66,7 % et 59 % pour l’Ex-PRESS™ versus 61,5 %, 41 % et 46,2 % pour les trabéculectomies. L’apprentissage ne semble pas améliorer le résultat [21].

Fig. 16-60 Dispositif Ex-PRESS™.
Les valves et les drains sont des dispositifs filtrants composés d’un tube creux en silicone positionné le plus souvent en chambre antérieure, de 23G de diamètre externe ; il est également possible d’introduire ce tube dans la cavité vitréenne au travers d’une sclérotomie après traitement d’un problème vitréorétinien associé ou en cas de contre-indication absolue d’une pose en chambre antérieure. Le tube est relié à un plateau qui sera fixé au globe oculaire en arrière de la ligne virtuelle reliant l’origine des tendons des muscles droits. Les valves possèdent un système de résistance à l’évacuation de l’humeur aqueuse (HA) qui limite les hypotonies postopératoires. L’HA ne peut circuler que dans un sens avec une pression d’ouverture prédéfinie. Les dispositifs de type drain offrent un écoulement passif de l’HA sans aucune résistance. Il existe assez peu de modèles disponibles sur le marché.
LES DIFFÉRENTS MODÈLES
Drain de Molteno
Molteno fut le premier en 1973 à introduire le principe d’un drainage de l’HA vers un « réservoir » fixé au globe. Les modèles avec le plateau rond et des bords surélevés sont en polypropène. De conception néo-zélandaise, ce système se décline en deux versions : simple plateau (137 mm2) ou doubles plateaux (275 mm2, formes pour œil gauche et droit) réunis entre eux par un segment de silicone de 10 mm (Molteno Ophtalmic Limited, Dunedin, Nouvelle-Zélande). Dans chaque version, il existe la possibilité d’un « pressure rigde », triangle en relief disposé à l’entrée du tube au plateau. Il existe un plateau de 50 mm2 pour les microphtalmes. Une dernière génération, Molteno™ 3, tout en silicone, plus flexible et ovalaire, est disponible en 175 et 230 mm2 et devrait supplanter les versions antérieures.
Valve de Krupin
Théodore Krupin donna son nom à sa valve commercialisée en 1976 (Eagle Vision, Memphis, Tennessee, États-Unis), théoriquement capable de s’ouvrir pour une pression intra-oculaire (PIO) de 11 mmHg et de se refermer au-dessous des 9 mmHg grâce à des stries verticales et horizontales sur le tube. Son plateau est ovale en silastic pour une surface de 183 mm2. Très utilisé ces dernières décennies, sa distribution en France semble confidentielle.
Valve d’Ahmed
Marteen Ahmed introduit sa valve en 1993 (New World Medical, Rancho Cucamonga, Californie, États-Unis), conçue pour fonctionner à partir de 8 mmHg grâce à une double membrane en élastomère placée sur le bord proximal du réservoir, limitant ainsi les hypotonies postopératoires. Le plateau existe en deux matériaux : polypropylène pour les séries S ou en silicone pour les modèles FP. Deux tailles de plateau sont disponibles pour chaque série : 96 et 184 mm2 (S3, S2 et FP8, FP7). Il existe également un modèle double plateau dans chaque matériau, assurant une surface d’échange avec le complexe conjonctive-capsule de Tenon de 364 mm2. Des modèles spécifiques, destinés à l’introduction par la pars plana, se caractérisent par une portion se clippant à la sclère à l’endroit où le tube se courbe pour son entrée dans la cavité vitréenne.
Drain de Baerveldt
Il s’agit d’un système non valvé développé par George Baerveldt dès 1992. Deux tailles d’un plateau elliptique et fenêtré fabriqué en silicone imprégné de baryum (ce qui le rend radio-opaque) sont disponibles : 250 et 350 mm2, modèle BG 103-250 et 101-350 (Abbott Medical Optics, Abbott Park, Illinois, États-Unis). Le modèle BG pars plana 102-350 est destiné à l’implantation dans la cavité vitréenne.
PRINCIPES COMMUNS
Ces dispositifs chirurgicaux sont réservés en principe aux glaucomes réfractaires. Nous verrons que certains les recommandent au même titre que la trabéculectomie en première intention. Le type et la forme de matériel choisi dépendront de la taille de l’orbite et du nombre et du type de chirurgies réalisées antérieurement. En effet, on pourra préférer un plateau de petite taille adapté à de petites orbites et chez les forts hypermétropes. Des antécédents de chirurgies rétiniennes avec indentation ou de strabisme seront pris en compte pour définir l’emplacement du dispositif. Une chirurgie combinée sera souvent réalisée en présence d’une cataracte. Une affection cornéenne, des anomalies importantes du segment antérieur ou une conjonctive au limbe inexploitable feront discuter une vitrectomie associée à une implantation postérieure afin d’éviter l’extrusion secondaire du tube.
CHOIX DE LA TAILLE ET DE LA NATURE DU MATÉRIAU
En dehors de considérations anatomiques particulières, la question de la taille du plateau reste discutée. D’un point de vue théorique, l’efficacité d’un dispositif de drainage dépend de la réaction du tissu conjonctivoténonien à l’HA qui se répand au-dessus du plateau. La « filtration » se fera au travers de cette capsule fibreuse néoformée d’autant plus efficacement que celle-ci aura une faible épaisseur et une grande surface.
On doit aux travaux de l’Otago Glaucoma Surgery Outcome Study une meilleure compréhension du fonctionnement des bulles de filtration. La libération de l’HA (peu oxygénée et faible en protéines) dans l’espace vascularisé conjonctivoténonien va activer un processus cicatriciel initial (activation cellulaire fibroblastique, œdème, vasodilatation) et aboutir à la formation de néocollagène dans les trois à six premières semaines. Il en résulte une augmentation locale de la PIO au-delà de la pression capillaire induisant l’apoptose du contingent cellulaire et un remaniement des parois internes de la bulle : fragmentation et lyse du collagène. La paroi interne devient peu vasculaire et pauvre en cellules ; la diffusion de facteurs pro-apoptotiques vers les couches les plus externes vient freiner l’activation de la couche fibrovasculaire. Il existe alors un remodelage continu des deux faces de la capsule, avec une couche externe active et formatrice de collagène et une couche interne « apoptotique » et pauvre en cellules et vaisseaux constituée de collagène fragmenté [10]. D’autres facteurs extrinsèques ont été proposés, influençant la phase inflammatoire initiale et le pronostic, notamment le moment du shunt de l’HA. La pose d’un drain type Molteno en deux temps – mise en place du plateau suivie quelques semaines après de l’introduction du tube en chambre antérieure – donnerait des bulles de filtration moins épaisses (200 μm au lieu de 400 μm).
Thomson et son équipe [22] ne trouvent pas de différence d’efficacité entre un système à simple plateau versus double plateau, tandis qu’Heuer et al. [13] quelques années plus tôt donnaient des résultats en faveur de la valve de Molteno la plus grande, 71 % versus 46 % de PIO inférieure à 22 mmHg à deux ans. L’étude prospective de Britt et al. [3] trouve un meilleur contrôle pressionnel avec un plateau de 250 mm2 au lieu de 500 mm2 d’une valve de Baerveldt alors que, quelques années plus tôt, Lloyd et son équipe n’arrivaient pas à les départager [18]. L’augmentation de la taille des plateaux aurait un rôle positif jusqu’à un certain point où d’autres facteurs viendraient alors en limiter ses effets : sécrétions de TGF-β, forme du plateau, chirurgie, complications, etc.
La nature du matériau pourrait également jouer un rôle dans le pronostic : l’étude prospective d’Ishida et al. [14] montre un meilleur contrôle pressionnel avec la valve d’Ahmed fabriquée en silicone. Plusieurs travaux rétrospectifs vont également dans ce sens sur des résultats à un an [2].
TECHNIQUE CHIRURGICALE
Technique habituelle en un temps
La chirurgie, quel que soit le dispositif, se décompose en plusieurs temps similaires. Elle débute par la désinsertion de la conjonctive dans un quadrant où celle-ci garde un plan de clivage. Il faut en effet garantir une fermeture étanche sans traction de la conjonctive en fin d’intervention par-dessus le volet scléral protégeant le tube.
La sclère est mise à nu en arrière de la ligne d’insertion des droits, et les muscles droits sont exposés au crochet ou maintenu par une soie 3/0. Le plateau des dispositifs est préplacé dans le quadrant choisi avant sa suture, permettant de visualiser le positionnement du tube et de marquer sur la sclère les dimensions du volet scléral qui le recouvrira en fin d’intervention.
Après sa pose, le plateau est fixé par des fils non résorbables. Le dernier temps consiste à la pose de l’extrémité du tube en chambre antérieure au travers d’un microchenal réalisé avec une aiguille 23G. Le site d’insertion sera choisi après avoir relâché les fils de traction musculaires afin de trouver la « position primaire du tube », celle où il se dépose sans contrainte sur le globe. La sclérotomie transfixiante se fait dans un plan parallèle à celui de l’iris afin d’éviter tout contact avec la cornée, le cristallin ou l’iris en postopératoire. Le tube est inséré en chambre antérieure, laissé volontairement un peu long sous visqueux. Il sera ensuite coupé en plusieurs étapes en biseau jusqu’à trouver la taille idéale offrant le meilleur positionnement de son extrémité.
Le tube est recouvert par le patch scléral et la conjonctive suturée avec des fils résorbables 8/0 (fig. 16-61).
Pour la valve d’Ahmed, il faudra l’amorcer en injectant du BSS par une microcanule introduite à l’extrémité du tube. L’intérêt d’une résection ténonienne n’est pas démontré.
Intérêt des adjuvants à la chirurgie
Antimitotiques
Largement utilisés dans la chirurgie traditionnelle, les antimitotiques ne semblent pas modifier le pronostic des valves. Kurnaz et al. [16] n’ont pas retrouvé de différence de résultats entre un groupe avec une valve d’Ahmed et l’utilisation de la mitomycine C 0,5 mg pendant 3 minutes et un groupe sans antimitotique. L’étude prospective de Costa et al. [7] a comparé les résultats de valves d’Ahmed et l’utilisation de la mitomycine C à 0,5 mg/mL pendant 5 minutes à un groupe témoin (34 versus 26 patients). Après un an, il n’existe aucune différence entre les deux groupes. En 1997, Lee et al. [17] ne retrouvaient déjà pas, dans leur étude prospective comparative, d’amélioration des résultats avec des Molteno associées à la mitomycine C. Ces résultats ont été confirmés l’année suivante par Cantor et al. [5], après l’utilisation de mitomycine C 0,4 mg/mL lors de la pose de valve de Molteno double plateau. Al-Mobarak et al. [1], dans une étude rétrospective récente sur deux ans, ont même conclu à un effet défavorable de l’utilisation de la mitomycine C.
Corticoïdes
La prednisolone en postopératoire d’une implantation par un drain de Molteno ne modifie pas le pronostic de l’intervention [24].
Trucs et astuces
Taille
Sur des yeux de petite taille, il est préférable d’utiliser des valves ou drains avec des plateaux de petite surface pour rendre la chirurgie plus aisée et diminuer les risques de diplopie postopératoire. Il faut aussi prendre en compte le risque théorique de traumatisme du nerf optique par le bord postérieur du plateau lors des mouvements oculaires. Les 13 × 16 mm du plateau d’une valve d’Ahmed adulte (184 mm2) placé à 8-12 mm du limbe mettront son bord postérieur proche de quelques millimètres du nerf optique, notamment dans le cadran supéro-nasal. La proximité de muscle grand oblique expose au risque d’un pseudo-syndrome de Brown. Lorsque la conjonctive est inexploitable en supérieur, le quadrant inféro-nasal offre une alternative séduisante loin de l’oblique inférieur. L’inconvénient majeur est d’ordre esthétique avec la visibilité de la bulle et la déformation possible de la paupière inférieure.
Limiter l’hypotonie pour les dispositifs non valvés
Un point en croix serré obstruant totalement la lumière du tube est proposé avec du fil résorbable pour limiter l’hypotonie postopératoire avec les drains. Le traitement médical est poursuivi pendant les quatre semaines suivant la chirurgie, et la filtration se fera dès la lyse du point sur un site où la capsule est « préformée » autour du plateau. Des études histologiques ont montré une bulle moins épaisse lorsque l’HA filtre quelques semaines après la réaction inflammatoire chirurgicale initiale. La ligature peut être associée à une ouverture du tube par une incision fine et longitudinale aux couteaux 30 ou 40° en avant de la suture. Pendant trois à cinq semaines, il existera une filtration au limbe. On pourra préférer une suture partielle du tube, malheureusement difficile à calibrer.
Certains chirurgiens privilégient une chirurgie en deux temps : pose du dispositif puis, un mois plus tard, mise en place du tube en chambre antérieure et amorce de la filtration.
RÉSULTATS
Afin de limiter le biais lié à la fois aux différents types de glaucome inclus dans les études et la variété des dispositifs utilisés, l’accent sera donné sur les résultats des études prospectives.
Valve versus trabéculectomie
La TVT Study (tube versus trabeculectomy) a randomisé 212 patients atteints de GPAO non contrôlé en deux groupes, un groupe Baerveldt™ 350 et un groupe trabéculectomie + mitomycine C 0,4 mg/mL durant 4 minutes. À cinq ans, la PIO était de 14 ± 6,9 pour le drain versus 12,6 ± 5,9 mmHg pour la trabéculectomie, ce qui représente respectivement une diminution de 41 % et 49 % de la PIO par rapport à l’inclusion (p = NS). Si le taux de succès semble comparable, le taux d’échec (réduction de moins de 20 %, PIO > 21 ou < 5 mmHg, perte visuelle) est plus important dans le groupe trabéculectomie (46,9 versus 29,8 %). Les complications précoces ont été plus fréquentes dans le groupe trabéculectomie (37 versus 21 %), la différence étant essentiellement due au taux d’hyphémas, tandis que l’ajout de traitement médical sur les deux premières années était plus important dans le groupe drain [11]. Wilson et al. [25], quelques années plus tôt, avaient confronté les résultats d’une valve d’Ahmed à ceux de la trabéculectomie. La PIO était plus basse après une trabéculectomie pendant la première année, avant de se stabiliser au niveau de la valve ensuite. La probabilité de succès au-delà des 31 mois moyens de suivi était comparable dans les deux groupes (68,1 % des patients trabéculectomisés et 69,8 % avec une valve avaient une PIO < 21 mmHg et au moins 15 % de baisse).
Valve d’Ahmed versus Molteno simple plateau
Nassiri et al. [19] incluent 92 patients avec un suivi de deux ans, valve d’Ahmed modèle FP7 de 184 mm2 versus drain de Molteno simple 134 mm2. Le groupe Molteno diminue de façon plus importante la PIO par rapport à la base line : 49,7 versus 41,9 % pour la valve d’Ahmed. Les taux de complication était identiques.
Valve d’Ahmed versus Baerveldt
L’étude multicentrique de The Ahmed versus Baerveldt Study (AVB) débutée en 2005 a suivi 238 glaucomes réfractaires traités soit par une valve d’Ahmed FP7 (groupe A), soit par une valve de Baerveldt 350 (groupe B). La majorité des patients étaient atteints de GPAO ; néanmoins, de nombreux glaucomes secondaires (uvéitiques, néovasculaires, etc.) représentaient pratiquement la moitié des effectifs. Les résultats à un an montraient une PIO à 16,5 ± 5 mmHg dans le groupe A versus 13,6 ± 4,8 dans le groupe B qui présentait également plus de complications (54 versus 45 %) et de reprises chirurgicales (42 versus 26 %) [3, 6]. Le taux d’échec était plus important dans le groupe A : 43 versus 28 %, comprenant essentiellement des échecs du contrôle strict de la PIO supérieure à 18 mmHg ou moins de 20 % de gain. La nature des complications était identique dans les deux groupes : chambre antérieure étroite, décollements choroïdiens, œdème de cornée. Une prise en charge chirurgicale a été nécessaire pour 48 patients dans le groupe B (95 procédures), et pour 32 patients du groupe A (57 interventions). Il s’agissait de reformation de la chambre antérieure, de vitrectomie postérieure, de chirurgie de la cataracte ou de geste complémentaire sur le dispositif (révision ou fixation du tube).
L’Ahmed Baerveldt Comparison Study, débutée en octobre 2006 et qui présente une structure comparable à l’AVB (même valve comparée), a enrôlé 276 patients et considéré le taux d’échec (défini par une PIO > 21 ou < 5 mmHg ou baisse de moins de 20 %, ou nécessité d’une deuxième chirurgie glaucomateuse). La baisse de la PIO a été de 2 mmHg plus importante à toutes les visites suivant la première semaine en faveur du groupe Baerveldt, et le nombre de collyres diminué de façon plus significative [4]. Le taux de complications était plus important dans ce groupe, 58 versus 43 %, comme le taux de réinterventions, respectivement 13 % et 5 % (replacement du tube, suture conjonctivale, iridectomie périphérique sur chambre antérieure étroite, ablation du tube sur contact cornéen, etc.). Dans les deux groupes, l’acuité visuelle a diminué lors de la première année, de deux lignes de Snellen dans 30 % des cas.
Comparaison de différentes versions selon le modèle
L’utilisation des drains de Molteno double plateau semble plus efficace sur le plan pressionnel par rapport à un plateau simple à deux ans (71 versus 46 %), mais expose à des complications plus fréquentes et plus sévères : 8 % de décollements choroïdiens hémorragiques versus 0 %, 10 % de chambres antérieures plates versus 4 % [13]. Les glaucomes néovasculaires n’étaient pas représentés dans cette étude.
La comparaison des drains de Baerveldt 350 et 500 par Britt et al. [3], à la fin des années 1990, a trouvé à cinq ans un taux de succès respectif de 79 % et 66 % (PIO entre 6 et 21 mmHg, pas de chirurgie complémentaire, absence de complications majeures) [18]. Suivant les mêmes critères d’évaluation, Ishida en 2006 retrouve 82 % de succès à deux ans après la pose de valve d’Ahmed FP7 (plateau silicone) contre 56,7 % dans sa version polypropylène [14].
COMPLICATIONS
Complications précoces
La principale complication est l’hypotonie postopératoire et sa gestion. Le risque persiste jusqu’à l’obtention d’un tissu fibreux autour du plateau. Il est théoriquement plus important avec les drains par rapport aux systèmes valvés. Dans l’étude TVT, au moins 15 % des patients présentaient des effusions uvéales et/ou des chambres antérieures plates ou très étroites, avec un taux identique dans les deux groupes (Baerveldt et trabéculectomie) [11]. L’existence d’une filtration dans la région où le tube rentre en chambre antérieure doit être recherchée par la présence d’une bulle « limbique ». L’hypotonie aura plus de mal à se résoudre sur des yeux ayant déjà subi des chirurgies d’hyposécrétion de type cyclo-affaiblissement diode ou ultrasons. Une chirurgie en deux temps (insertion du tube en chambre antérieure quelques semaines suivant la mise en place du plateau) limiterait les hypotonies précoces, mais garde l’inconvénient d’une seconde procédure.
La gestion est la même que pour une trabéculectomie : cycloplégiques, injection de visqueux en chambre antérieure souvent fréquente en attendant la réaction fibreuse, ou plus spécifiquement suture en fil résorbable sur le tube. La prise en charge est plus précoce en cas de contact du tube avec l’endothélium (fig. 16-62).
La complication la plus redoutée est l’hémorragie suprachoroïdienne. Elle est décrite dans 3 % des cas après les valves, et reste redoutable sur le pronostic fonctionnel [11, 23]. Un décollement choroïdien est noté dans 10 à 15 % des cas [23]. Un drainage est toujours possible au cas par cas.
La remontée de la PIO entre trois à six semaines ne doit pas alerter de façon excessive, elle est due au processus cicatriciel avant le remodelage de la bulle. Il faudra éliminer les rares cas de glaucome malin, associant un aplatissement de la chambre antérieure et une hypertonie croissante.
Complications tardives
Atteinte cornéenne
Un des risques directs de la pose de matériel en chambre antérieure est la décompensation endothéliale. Knape et al. [15] ont pu constater la survie d’une greffe de cornée à cinq ans sur 28 yeux de patients ayant reçu un drain (Molteno ou Baerveldt) posé avant (dans 10 cas sur 28) ou après une greffe de cornée (les 18 cas restants). Le GPAO est contrôlé dans 71 % des cas à cinq ans (PIO < 18 mmHg avec ou sans traitement). La cornée est restée claire dans 96 % et 54 % des à un an et cinq ans. Cette étude ne montre pas de différence significative sur la survie de la greffe de cornée qu’elle soit faite avant ou après la gestion d’un GPAO par un drain.
Troubles de la mobilité
Ils dépendent de la taille et de la forme du plateau (simple ou double plateau), du site d’implantation et du volume de l’orbite. Ils sont de quelques poucents avec les valves d’Ahmed ou les drains de Molteno simple plateau à 6-8 % avec les drains de Baerveldt [11]. The Ahmed versus Baerveldt Study retrouve 6 % de diplopie avec une valve d’Ahmed contre 3 % dans l’autre groupe [6]. Une implantation proche des muscles obliques favorise les troubles de la mobilité postopératoires.
Autres complications
La baisse visuelle est souvent rapportée dans les études. Les causes sont autant inhérentes à la maladie qu’aux complications. Des complications liées aux tubes sont parfois rencontrées : obstruction de l’extrémité par des reliquats vitréens ou par du silicone ou de l’iris, mobilisation, érosion de la conjonctive en regard (fig. 16-63).
Fig. 16-61 a. Désinsertion de la conjonctive et traction du globe. b. Positionnement du plateau et repérage des dimensions du volet scléral. c. Réalisation du volet. d. Insertion d’une aiguille 23G parallèle au plan de l’iris en avant de l’éperon scléral. e. Insertion du tube en chambre antérieure. f. Suture du tube pour les drains au fil résorbable pour limiter la filtration postopératoire. L’intervention se termine par la suture du volet et de la conjonctive. g. Aspect du positionnement du tube en postopératoire en coupe OCT.
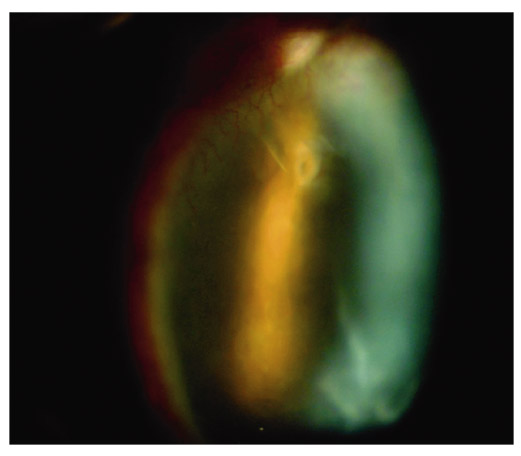
Fig. 16-62 Complication liée au tube en chambre antérieure : contact cornéen.
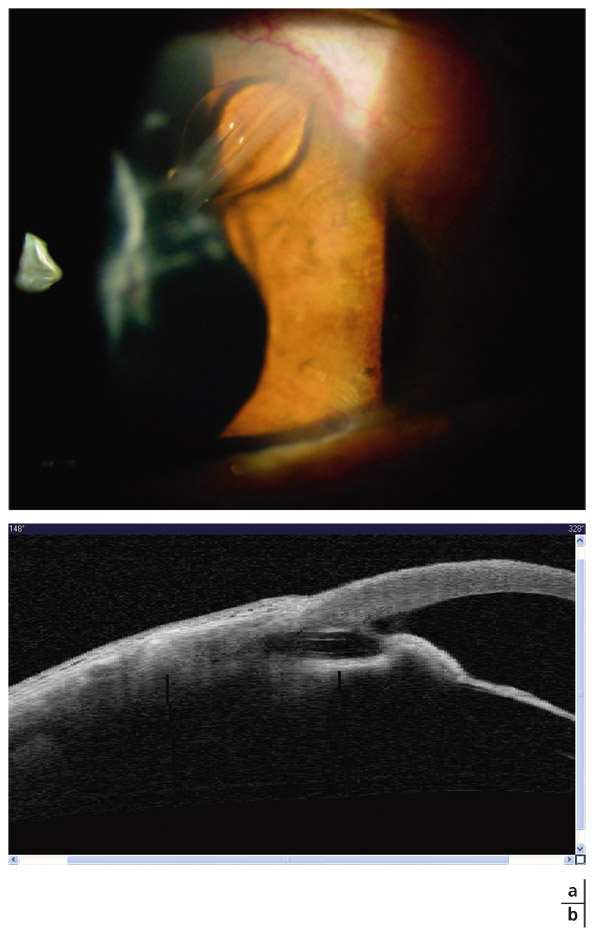
Fig. 16-63 a. Obstruction de l’extrémité du tube par silicone. b. Obstruction de l’extrémité du tube par l’iris.
Les dispositifs de drainage font partie de l’arsenal thérapeutique des glaucomes nécessitant une prise en charge chirurgicale, parfois comme unique recours à des solutions complexes (œil multi-opéré, pathologies associées) ou directement mis en concurrence avec la classique trabéculectomie (tubes et Ex-PRESS™). Proposés aux stades tardifs de la maladie sur des yeux fragilisés et complexes, les valves et tubes exposent à un taux d’échec et de complications qu’il faut savoir connaître et traiter. Les modifications régulières apportées aux dispositifs, la rigueur et la personnalisation de la chirurgie ont permis d’en améliorer le pronostic.
Retenir
-
Les valves et tubes permettent de faire face à des situations difficiles en limitant les complications par la rigueur de la prise en charge.
-
Le choix des tailles et versions permet de s’adapter à tous les patients et toutes les situations cliniques.
-
Le suivi est parfois émaillé de complications dont la plupart sont réversibles ou accessibles à un geste secondaire.
-
Le pronostic reste réservé en grande partie par la gravité de la maladie initiale.
-
L’indication essentielle reste celle des glaucomes réfractaires, mais tend à s’étendre.
-
Des chirurgies combinées sont possibles en cas de situations difficiles, mais avec un pronostic d’autant plus sombre que le passé des patients est lourd.
[1] Al-Mobarak F, Khan AO. Two-year survival of Ahmed valve implantation in the first 2 years of life with and without intraoperative mitomycin-C. Ophthalmology. 2009 ; 116 : 1862-5.
[2] Bis Brasil MV, Rockwood EJ, Smith SD. Comparison of silicone and polypropylene Ahmed Glaucoma Valve implants. J Glaucoma. 2007 ; 16 : 36-41.
[3] Britt MT, LaBree LD, Lloyd MA, et al. Randomized clinical trial of the 350-mm2 versus the 500-mm2 Baerveldt implant : longer term results – is bigger better ? Ophthalmology. 1999 ; 106 : 2312-8.
[4] Budenz DL, Barton K, Feuer WJ, et al. Ahmed Baerveldt Comparison Study Group. Treatment outcomes in the Ahmed Baerveldt Comparison Study after 1 year of follow-up. Ophthalmology. 2011 ; 118 : 443-52.
[5] Cantor L, Burgoyne J, Sanders S, et al. The effect of mitomycin C on Molteno implant surgery : a 1-year randomized, masked, retrospective study. J Glaucoma. 1998 ; 7 : 240-6.
[6] Christakis PG, Kalenak JW, Zurakowski D, et al. The Ahmed Versus Baerveldt study : one-year treatment outcomes. Ophthalmology. 2011 ; 118 : 2180-9.
[7] Costa VP, Azuara-Blanco A, Netland PA, et al. Efficacy and safety of adjunctive mitomycin C during Ahmed Glaucoma Valve implantation : a prospective randomized clinical trial. Ophthalmology. 2004 ; 111 : 1071-6.
[8] Dahan E, Ben Simon GJ, Lafuma A. Comparison of trabeculectomy and Ex-PRESS iplantation in fellow eyes of the same patient : a prospective, randomised study. Eye (Lond). 2012 ; 26 : 703-10.
[9] De Jong L, Lafuma A, Aguadé AS, Berdeaux G. Five-year extension of a clinical trial comparing the Ex-PRESS glaucoma filtration device and trabeculectomy in primary open-angle glaucoma. Clin Ophthalmol. 2011 ; 5 : 527-33.
[10] Dempster AG, Molteno AC, Bevin TH, Thompson AM. Otago glaucoma surgery outcome study : electron microscopy of capsules around Molteno implants. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8300-9.
[11] Gedde SJ, Gedde SJ, Singh K, et al. Tube Versus Trabeculectomy Study Group. The Tube Versus Trabeculectomy Study : interpretation of results and application to clinical practice. Curr Opin Ophthalmol. 2012 ; 23 : 118-26.
[12] Good TJ, Kahook MY. Assessment of bleb morphologic features and postoperative outcomes after Ex-PRESS drainage device implantation versus trabeculectomy. Am J Ophthalmol. 2011 ; 151 : 507-13.
[13] Heuer DK, Lloyd MA, Abrams DA, et al. Which is better ? One or two ? A randomized clinical trial of single-plate versus double-plate Molteno implantation for glaucomas in aphakia and pseudophakia. Ophthalmology. 1992 ; 99 : 1512-9.
[14] Ishida K, Netland PA, Costa VP, et al. Comparison of polypropylene and silicone Ahmed Glaucoma Valves. Ophthalmology. 2006 ; 113 : 1320-6.
[15] Knape RM, Szymarek TN, Tuli SS, et al. Five-year utcomes of eyes with glaucoma drainage device and penetrating keratoplasty. J Glaucoma. 2012 ; 21 : 608-14.
[16] Kurnaz E, Kubaloglu A, Yilmaz Y, et al. The effect of adjunctive Mitomycin C in Ahmed glaucoma valve implantation. Eur J Ophthalmol. 2005 ; 15 : 27-31.
[17] Lee D, Shin DH, Birt CM, et al. The effect of adjunctive mitomycin C in Molteno implant surgery. Ophthalmology. 1997 ; 104 : 2126-35.
[18] Lloyd MA, Baerveldt G, Fellenbaum PS, et al. Intermediate-term results of a randomized clinical trial of the 350- versus the 500-mm2 Baerveldt implant. Ophthalmology. 1994 ; 101 : 1456-63 ; discussion : 1463-4.
[19] Nassiri N, Kamali G, Rahnavardi M, et al. Ahmed glaucoma valve and single-plate Molteno implants in treatment of refractory glaucoma : a comparative study. Am J Ophthalmol. 2010 ; 149 : 893-902.
[20] Salim S, Du H, Boonyaleephan S, Wan J. Surgical outcomes of the Ex-PRESS glaucoma filtration device in African American and white glaucoma patients. Clin Ophthalmol. 2012 ; 6 : 955-62.
[21] Seider MI, Rofagha S, Lin SC, Stamper RL. Resident-performed Ex-PRESS shunt implantation versus trabeculectomy. J Glaucoma. 2012 ; 21 : 469-74.
[22] Thompson AM, Molteno AC, Bevin TH, Herbison P. Otago glaucoma surgery outcome study : comparative results for the 175-mm2 Molteno3 and double-plate molteno implants. JAMA Ophthalmol. 2013 ; 131 : 155-9.
[23] Tuli SS, WuDunn D, Ciulla TA, Cantor LB. Delayed suprachoroidal hemorrhage er glaucoma filtration procedures. Ophthalmology. 2001 ; 108 : 1808-11.
[24] Välimäki J, Airaksinen PJ, Tuulonen A, Risteli J. Postoperative systemic corticosteroid treatment and Molteno implant surgery : a randomized clinical trial. Acta Ophthalmol Scand. 1999 ; 77 : 50-6.
[25] Wilson MR, Mendis U, Paliwal A, Haynatzka V. Long-term follow-up of primary glaucoma surgery with Ahmed glaucoma valve implant versus trabeculectomy. Am J Ophthalmol. 2003 ; 136 : 464-70.
E. Brasnu, C. Baudouin
-
Les techniques de chirurgies filtrantes dites « ab interno » permettent d’obtenir une baisse de la pression intra-oculaire (PIO) par diminution de la résistance trabéculaire, la filtration de l’humeur aqueuse (HA) s’effectuant sans drainage trans-scléral dans l’espace sous-conjonctival.
-
Elles permettent théoriquement de s’affranchir du risque de fibrose postopératoire qui représente le principal facteur d’échec des chirurgies ab externo.
-
Il existe plusieurs techniques de chirurgies « ab interno », toutes nécessitant un abord chirurgical gonioscopique de l’angle iridocornéen.
Dans le glaucome primitif à angle ouvert (GPAO), l’obstacle à l’évacuation de l’HA se situe théoriquement au niveau du trabéculum. Ainsi, une incision ou un contournement du trabéculum permettant d’accéder directement au canal de Schlemm sont des alternatives intéressantes aux chirurgies filtrantes conventionnelles dites ab externo. En effet, ces techniques, appelées chirurgies filtrantes ab interno, permettent d’obtenir une baisse de la PIO par diminution de la résistance trabéculaire, avec une augmentation de la filtration d’HA qui s’effectue ici sans drainage dans l’espace sous-conjonctival. Elles permettent donc théoriquement de s’affranchir du risque de fibrose postopératoire qui représente le principal facteur d’échec des chirurgies ab externo. Plusieurs techniques chirurgicales ont été décrites, comme la trabéculotomie, le goniocurettage, la trabéculopuncture au laser, la trabéculotomie ab interno (Trabectome™, Neomedics Inc., Tustin, Californie, États-Unis) et les stents trabéculaires iStents™ (Glaukos Corporation, Laguna Hills, Californie, États-Unis), toutes nécessitant une voie d’abord gonioscopique [11]. Nous traiterons ici les deux dernières techniques citées, la trabéculotomie ab interno (Trabectome™) et les stents trabéculaires iStents™, celles-ci correspondant aux techniques les plus récentes dont la tolérance et l’efficacité ont été rapportées dans de nombreuses études [6, 12].
PRINCIPE ET INDICATIONS
Cette technique, utilisée depuis 2006, consiste à réaliser une électro-thermo-ablation du trabéculum et du mur interne du canal de Schlemm sur 60 à 120°, créant une communication directe entre la chambre antérieure et les canaux collecteurs, et court-circuitant ainsi la résistance trabéculaire à l’évacuation de l’HA [5]. Le système utilisé, dénommé Trabectome™, est constitué d’une pièce à main jetable de 19,5G connectée à une pompe péristaltique d’irrigation-aspiration, ainsi qu’à un générateur électrochirurgical à haute fréquence (550 kHz) (fig. 16-64). Cette technique, combinée ou non à l’extraction du cristallin, peut être proposée chez des patients présentant un glaucome à angle ouvert à cornée claire, rendant possible l’accès au trabéculum, et chez qui la PIO cible se situe autour de 15 à 17 mmHg. Elle peut particulièrement être intéressante dans des cas à fort risque d’hypotonie ou de complications conjonctivales (fibrose de la bulle de filtration). En revanche, elle est à éviter dans des cas de glaucomes sévères à PIO cible basse, dans les glaucomes à angle fermé ou néovasculaires, ou lorsque l’angle iridocornéen n’est pas accessible. Une autre contre-indication, relative celle-ci, est le cas des patients pour qui aucun traitement hypotonisant adjuvant ne peut être prescrit [6].
TECHNIQUE CHIRURGICALE
La pièce à main est introduite dans la chambre antérieure par une incision de 1,7 mm après injection de produit viscoélastique, puis dirigée sous contrôle gonioscopique direct vers l’angle iridocornéen en irrigation continue. L’extrémité de la pièce à main du Trabectome™ est ensuite introduite dans le canal de Schlemm, en avant de l’éperon scléral, dans le sens choisi par le chirurgien. En relâchant la pédale de contrôle, celui-ci active l’aspiration et l’électro-ablation, et procède ainsi à la résection du trabéculum sur 30 à 60°. L’instrument est ensuite retiré du canal de Schlemm, tourné à 180° et réintroduit afin de procéder à l’ablation du trabéculum sur 30 à 60° dans la direction opposée à la précédente. Le chirurgien procède ensuite à l’aspiration du produit viscoélastique et à l’irrigation de la chambre antérieure à l’aide de la pièce à main, avant d’assurer l’étanchéité de l’incision par irrigation des berges ou pose d’un point de suture cornéenne.
RÉSULTATS ET COMPLICATIONS
Les études histopathologiques réalisées sur des disques cornéoscléraux de donneurs ont montré une meilleure préservation des tissus adjacents avec le Trabectome™ comparé à la technique de goniotomie chirurgicale classique, avec une bonne précision dans la résection du trabéculum et du mur interne du canal de Schlemm [5]. L’avantage théorique de cette technique est d’ouvrir une large voie à l’évacuation de l’HA de la chambre antérieure au canal de Schlemm avec un faible risque de lésion mécanique ou thermique des structures adjacentes, la voie d’abord en cornée claire permettant par ailleurs d’éviter la formation d’une bulle de filtration et les complications qui y sont liées. Les inconvénients possibles sont la réduction du flux circonférentiel dans le canal de Schlemm, la possible fermeture secondaire de celui-ci, et une baisse de la PIO limitée par la pression veineuse épiscérale et la résistance du canal de Schlemm [6].
Minckler et al. [10] furent les premiers à rapporter les résultats du Trabectome™ en 2005, dans une étude pilote prospective sur 37 patients présentant un GPAO non contrôlé ayant déjà ou non bénéficié d’une chirurgie ou d’un laser. La baisse moyenne de PIO dans cette étude était de 40 %, passant de 28,2 ± 4,4 mmHg en préopératoire à 16,3 ± 2,0 mmHg en postopératoire à 12 mois. Dans cette étude était également rapportée une baisse du nombre de traitement hypotonisants, soit de 1,2 ± 0,6 à 0,4 ± 0,6. La complication la plus fréquente était l’hyphéma (59 % des patients à J+1), résolutif en 6,4 jours en moyenne. Quelques mois plus tard, les mêmes auteurs élargirent leur étude en incluant un total de 101 patients sur 30 mois, avec un succès global de 84 % (PIO ≤ 21 mmHg avec ou sans traitement) [9]. Dans cette étude, la PIO à 30 mois passait de 27,6 ± 7,2 mmHg à 16,3 ± 3,3 mmHg. Les complications postopératoires rapportées étaient des synéchies angulaires localisées (14 %), des défects cornéens épithéliaux (3 %) ou une hypertonie postopératoire précoce attribuée à un mauvais lavage du produit viscoélastique (5 %).
Dans une étude rétrospective, Vold et al. [17] étudièrent les effets d’une trabéculoplastie réalisée au préalable sur l’efficacité du Trabectome™, sur 1 345 patients présentant un GPAO, et conclurent que la trabéculoplastie n’influait pas de façon statistiquement significative le succès à long terme du Trabectome™. De plus, dans cette étude, le nombre de traitements adjuvants en postopératoire était plus faible dans le groupe sans trabéculoplastie préalable, suggérant que le laser augmentait au contraire le recours aux médications hypotonisantes en postopératoire [17]. Dans une étude plus récente, Jea et al. [8] ont également montré que le Trabectome™ n’influait pas le taux de succès d’une trabéculectomie ultérieure. Les mêmes auteurs ont par ailleurs comparé récemment la trabéculectomie ab interno réalisée avec le Trabectome™ à la trabéculectomie classique ab externo avec mitomycine dans une étude rétrospective chez 217 patients (115 patients dans le groupe Trabectome™ et 102 patients dans le groupe trabéculectomie) [7]. Dans cette étude, le taux de succès à deux ans était de 22,4 % après Trabectome™ versus 76,1 % après trabéculectomie (p < 0,001). À l’exception de l’hyphéma, le taux de complications était plus élevé dans le groupe trabéculectomie (p < 0,001). De plus, davantage de procédures additionnelles furent nécessaires dans ce même groupe.
Plusieurs auteurs ont également étudié l’efficacité du Trabectome™ associé à la chirurgie de la cataracte par phaco-émulsification (PKE). Francis et al. [4] ont ainsi étudié le taux de succès de cette technique de chirurgie combinée (Trabectome™ + PKE) chez 304 patients dans une étude prospective non comparative. Le taux de succès, défini par une baisse de la PIO initiale de 20 %, était de 78 % à 6 mois et 64 % à 12 mois dans cette étude. Les complications rapportées étaient un reflux sanguin peropératoire (238 cas), des lésions iriennes (4 cas) et une rupture capsulaire (2 cas). Dans deux autres études, Francis et al. ont comparé les résultats de la chirurgie combinée Trabectome™ + PKE à la chirurgie du cristallin seule (PKE) d’une part, et à la chirurgie combinée trabéculectomie + PKE d’autre part. Ils montrèrent que la PIO était significativement plus basse après chirurgie combinée Trabectome™ + PKE comparé au groupe PKE seule (baisse de la PIO de 25 % dans le groupe Trabectome™ + PKE versus une augmentation de la PIO de 5 % dans le groupe PKE seule à un an). En revanche, ils ne montrèrent pas de différence significative entre le succès de la chirurgie combinée du cristallin avec le Trabectome™ comparé à la chirurgie combinée avec la trabéculectomie classique à un an [6], avec en revanche plus de médications dans le groupe Trabectome™ + PKE. Enfin, dans une autre étude, Mosaed et son équipe ont également comparé les résultats du Trabectome™ seul versus Trabectome™ + PKE à 12 mois. Le taux de succès était de 64,9 % à 12 mois dans le groupe Trabectome™ versus 86,9 % dans le groupe Trabectome™ + PKE, suggérant une efficacité supérieure de la chirurgie combinée comparée à la technique du Trabectome™ seul [6].

Fig. 16-64 Composition du système Trabectome™ (Neomedics Inc., Tustin, Californie, États-Unis).
PRINCIPE ET INDICATIONS
L’iStent® ou « micro-bypass » trabéculaire est un système permettant de créer une ouverture permanente entre la chambre antérieure et la lumière du canal de Schlemm visant à court-circuiter le trabéculum et le mur interne du canal. Ce dispositif en titane non ferromagnétique en forme de tuba de plongée (fig. 16-65) a été conçu pour permettre son introduction et son maintien dans la lumière du canal de Schlemm (1 × 0,33 mm). Préchargé dans un injecteur stérile à usage unique et hépariné, il est disponible en deux orientations selon la latéralité de l’œil auquel il est destiné (œil droit ou œil gauche) [15].
Comme pour la technique du Trabectome™, l’iStent® ne peut être proposé qu’aux patients présentant un glaucome à angle ouvert avec une cornée claire permettant de visualiser le trabéculum. Combinées ou non à la chirurgie de la cataracte, ses indications et contre-indications sont en pratique les mêmes que pour le Trabectome™ (voir plus haut) [6].
TECHNIQUE CHIRURGICALE
L’iStent® est inséré par une incision auto-étanche de 3 mm sous anesthésie topique, après injection de produit viscoélastique et à l’aide d’un verre de gonioscopie directe. Si la pose est combinée avec une chirurgie du cristallin, le système est introduit par l’incision de phaco-émulsification après implantation de la lentille intra-oculaire dans le sac capsulaire.
L’extrémité distale du dispositif est ensuite dirigée vers le tiers supérieur du trabéculum avec un angle de 15°, puis le stent est délicatement inséré dans le canal de Schlemm à travers le trabéculum. L’iStent® peut alors être libéré par pression sur l’extrémité proximale de l’injecteur, puis l’injecteur et le produit viscoélastique sont retirés (fig. 16-66).
RÉSULTATS ET COMPLICATIONS
L’étude pilote initiale a été réalisée en 2007 par Spiegel et al. [15] sur six patients. Elle a montré une baisse de la PIO de 25 % ou plus sur quatre des six patients à un an. Par la suite, la tolérance et l’efficacité de ce dispositif furent évaluées par Buchacra et al. [1] dans une étude prospective sur un total de dix patients et une durée moyenne de suivi de 12,7 ± 4,6 mois. Dans cette étude, une baisse de la PIO de 27,3 % fut observée à 12 mois. Les complications les plus fréquemment retrouvées étaient : un hyphéma modéré (7 yeux), une élévation transitoire de la PIO supérieure ou égale à 30 mmHg (3 yeux) et un œdème cornéen (2 yeux). Aucune de ces complications n’eut de séquelle à long terme.
En 2008, Spiegel et al. [14] ont rapporté les résultats de l’iStent® combiné à l’extraction du cristallin par phaco-émulsification dans une étude multicentrique prospective non comparative portant sur 47 patients. La baisse de PIO moyenne obtenue dans cette étude était de 5,7 ± 3,8 mmHg à six mois. La seule complication rapportée (7 patients) était une occlusion du stent. Les résultats de cette même étude à 12 mois (42 patients), publiés en 2009 par les mêmes auteurs, ont montré une baisse moyenne de la PIO à un an de 21,4 % [16]. Une autre étude prospective plus récente (comparative et randomisée), a été publiée par Fea et al. [3], incluant 33 patients sur 15 mois. Vingt-et-un patients ont bénéficié d’une chirurgie de la cataracte seule, 12 d’une chirurgie combinée cataracte et iStent®. À 15 mois, la PIO moyenne était significativement plus basse dans le groupe combiné que dans le groupe cataracte seule (14,8 ± 1,2 mmHg versus 15,7 ± 1,1 mmHg respectivement, p = 0,031). Aucun effet secondaire n’a été rapporté dans cette étude [3]. Samuelson et al. [13] ont réalisé une étude multicentrique similaire sur 240 yeux. Dans cette étude, à 12 mois, une baisse de la PIO sans traitement supérieure ou égale à 20 % était obtenue pour 66 % des patients dans le groupe PKE + iStent® versus 48 % dans le groupe PKE seule. Ces résultats sont cohérents avec ceux de l’étude multicentrique plus récente de Craven et al. [2], où le nombre de patients avec une PIO inférieure ou égale à 21 mmHg sans traitement était significativement plus élevé dans le groupe PKE + iStent® que dans le groupe PKE seule (p = 0,036).

Fig. 16-65 iStent® (Glaukos Corporation, Laguna Hills, Californie, États-Unis).

Fig. 16-66 Vue gonioscopique montrant deux iStents® en place dans le canal de Schlemm.
Aujourd’hui, même si la trabéculectomie (perforante ou non) et à moindre échelle les valves ou drains restent la technique de référence dans la chirurgie du glaucome, des nouvelles techniques prometteuses, telles que le Trabectome™ ou l’iStent®, permettent aujourd’hui de baisser la PIO de façon efficace et peu risquée. Les données de la littérature citées plus haut nous autorisent aujourd’hui à proposer ces procédures chirurgicales ab interno à nos patients, en respectant bien sûr les indications et contre-indications de ces techniques.
Retenir
-
La trabéculotomie ab interno (Trabectome™) et les stents trabéculaires iStent® sont deux techniques récentes dont la tolérance et l’efficacité ont été rapportées dans de nombreuses études.
-
La trabéculotomie ab interno au Trabectome™ consiste à réaliser une électro-thermo-ablation du trabéculum et du mur interne du canal de Schlemm sur 60 à 120°, créant une communication directe entre la chambre antérieure et les canaux collecteurs.
-
L’iStent® ou « micro-bypass » trabéculaire est un dispositif en titane non ferromagnétique en forme de tuba de plongée qui permet de créer une ouverture permanente entre la chambre antérieure et la lumière du canal de Schlemm et de court-circuiter ainsi le trabéculum et le mur interne du canal.
-
Ces deux chirurgies peuvent être combinées à la chirurgie de la cataracte.
-
L’indication idéale concerne les patients présentant un glaucome à angle ouvert à cornée claire rendant possible l’accès au trabéculum, pour qui la PIO cible se situe autour de 15 à 17 mmHg.
[1] Buchacra O, Duch S, Milla E, Stirbu O. One-year analysis of the iStent trabecular microbypass in secondary glaucoma. Clin Ophthalmol. 2011 ; 5 : 321-6.
[2] Craven ER, Katz LJ, Wells JM, Giamporcaro JE. Cataract surgery with trabecular micro-bypass stent implantation in patients with mild-to-moderate open-angle glaucoma and cataract : two-year follow-up. J Cataract Refract Surg. 2012 ; 38 : 1339-45.
[3] Fea AM. Phacoemulsification versus phacoemulsification with micro-bypass stent implantation in primary open-angle glaucoma : randomized double-masked clinical trial. J Cataract Refract Surg. 2010 ; 36 : 407-12.
[4] Francis BA, Minckler D, Dustin L, et al. Combined cataract extraction and trabeculotomy by the internal approach for coexisting cataract and open-angle glaucoma : initial results. J Cataract Refract Surg. 2008 ; 34 : 1096-103.
[5] Francis BA, See RF, Rao NA, et al. Ab interno trabeculectomy : development of a novel device (Trabectome) and surgery for open-angle glaucoma. J Glaucoma. 2006 ; 15 : 68-73.
[6] Francis BA, Winarko J. Ab interno Schlemm’s canal surgery : trabectome and i-stent. Dev Ophthalmol. 2012 ; 50 : 125-36.
[7] Jea SY, Francis BA, Vakili G, et al. Ab interno trabeculectomy versus trabeculectomy for open-angle glaucoma. Ophthalmology. 2012 ; 119 : 36-42.
[8] Jea SY, Mosaed S, Vold SD, Rhee DJ. Effect of a failed trabectome on subsequent trabeculectomy. J Glaucoma. 2012 ; 21 : 71-5.
[9] Minckler D, Baerveldt G, Ramirez MA, et al. Clinical results with the Trabectome, a novel surgical device for treatment of open-angle glaucoma. Trans Am Ophthalmol Soc. 2006 ; 104 : 40-50.
[10] Minckler DS, Baerveldt G, Alfaro MR, Francis BA. Clinical results with the Trabectome for treatment of open-angle glaucoma. Ophthalmology. 2005 ; 112 : 962-7.
[11] Razeghinejad MR, Fudemberg SJ, Spaeth GL. The changing conceptual basis of trabeculectomy : a review of past and current surgical techniques. Surv Ophthalmol. 2012 ; 57 : 1-25.
[12] Saheb H, Ahmed II. Micro-invasive glaucoma surgery : current perspectives and future directions. Curr Opin Ophthalmol. 2012 ; 23 : 96-104.
[13] Samuelson TW, Katz LJ, Wells JM, et al. Randomized evaluation of the trabecular micro-bypass stent with phacoemulsification in patients with glaucoma and cataract. Ophthalmology. 2011 ; 118 : 459-67.
[14] Spiegel D, Garcia-Feijoo J, Garcia-Sanchez J, Lamielle H. Coexistent primary open-angle glaucoma and cataract : preliminary analysis of treatment by cataract surgery and the iStent trabecular micro-bypass stent. Adv Ther. 2008 ; 25 : 453-64.
[15] Spiegel D, Wetzel W, Haffner DS, Hill RA. Initial clinical experience with the trabecular micro-bypass stent in patients with glaucoma. Adv Ther. 2007 ; 24 : 161-70.
[16] Spiegel D, Wetzel W, Neuhann T, et al. Coexistent primary open-angle glaucoma and cataract : interim analysis of a trabecular micro-bypass stent and concurrent cataract surgery. Eur J Ophthalmol. 2009 ; 19 : 393-9.
[17] Vold SD, Dustin L. Impact of laser trabeculoplasty on Trabectome™ outcomes. Ophthalmic Surg Lasers Imaging. 2010 ; 41 : 443-51.
P. Germain
-
La séquence de réalisation des principales techniques de chirurgie combinée doit être bien connue.
-
Il faut savoir éviter les complications propres à cette chirurgie et connaître leurs particularités.
-
Le suivi postopératoire reste un temps primordial de la prise en charge chirurgicale de la cataracte et du glaucome.
Les techniques chirurgicales pour la prise en charge conjointe d’une cataracte et d’un glaucome primitif à angle ouvert (GPAO) varient d’un continent à l’autre. La chirurgie de référence dans les pays anglo-saxons reste la phacotrabéculectomie, le plus souvent avec adjonction d’antimitotiques. La phacosclérectomie s’est rapidement développée dans différents pays européens et est devenue, en France en particulier, une technique très représentée. La phacoviscocanalostomie est une technique également développée depuis une dizaine d’années. De nombreuses autres techniques voient le jour et en sont actuellement au stade d’évaluation : toutes combinent la réalisation d’une chirurgie moderne de la cataracte par micro-incision, avec mise en place d’un implant pliable de chambre postérieure dans le sac capsulaire, et d’une technique chirurgicale visant à améliorer le flux d’excrétion d’humeur aqueuse [24].
La chirurgie combinée nécessite la réalisation d’une hémostase sclérale au moment de la réalisation de la chirurgie du glaucome qui, même si elle est douce, est ressentie généralement de façon pénible par les patients. La manipulation conjonctivale est sensible, et les gestes sur l’iris sont douloureux. Aussi une anesthésie topique pure par collyre à base de tétracaïne n’est-elle pas recommandée. L’utilisation d’un gel à la lidocaïne 2 % est prônée par certains, mais se heurte à un problème d’agrément par les autorités de santé. Le meilleur confort est sans doute apporté par la réalisation d’une anesthésie sous-ténonienne ou péribulbaire. Dans ce cas, la compression doit être douce et la quantité de produit anesthésique injectée limitée.
La technique chirurgicale de phaco-exérèse qui doit être adoptée est celle maîtrisée par l’opérateur.
L’incision se fera en cornée claire temporale ou oblique afin de laisser une distance suffisante avec le site opératoire de la chirurgie filtrante qui est situé dans le quadrant supérieur.
La chirurgie de la cataracte du patient glaucomateux chronique est volontiers délicate. Il n’est pas rare d’être confronté à une pupille qui se dilate mal. C’est de moins en moins le cas d’un patient sous myotique au long cours, mais c’est une situation fréquente dans le glaucome exfoliatif. Des synéchies iridocristalliniennes plus ou moins étendues peuvent être observées chez un patient ayant bénéficié d’une iridotomie au laser. Une libération soigneuse de celles-ci à la spatule est le geste préalable à une éventuelle dilatation irienne. La bonne connaissance d’une ou de plusieurs techniques de dilatation peropératoire de la pupille est indispensable. Les anciennes iridectomies sectorielles secondairement suturées ou les multiples sphinctérotomies sont abandonnées pour des techniques compatibles avec la chirurgie de la cataracte par micro-incision. Il s’agit des dilatateurs à iris réalisant un streching pupillaire avec des modèles à deux ou trois branches, d’utilisation aisée (dilatateur de Beehler). Si le traumatisme irien semble important lors de la chirurgie, il est intéressant de noter que les lendemains sont souvent calmes avec des iris gardant même, de façon étonnante, un jeu pupillaire. D’autres dispositifs permettent un maintien peropératoire de la dilatation pupillaire. Il s’agit des rétracteurs iriens flexibles introduits par quatre micro-incisions cornéennes, crochetant la margelle irienne, puis étant rétractés pour conférer à la pupille une forme carrée. Cette technique peut être mise en œuvre en cas de syndrome d’iris flasque peropératoire, devenu plus fréquent avec la multiplication des patients sous α-antagonistes pour des pathologies prostatiques. L’anneau de Malyugin s’insère par un injecteur et se retire par la même incision que celle utilisée pour la pointe phaco. Il permet d’obtenir une ouverture large et circulaire avec un appui irien en huit points.
Le risque de zonulolyse plus ou moins étendue est majoré en présence d’un syndrome exfoliatif. Le chirurgien doit savoir repérer les situations à risque et connaître la technique de mise en place d’un anneau capsulaire.
Il s’agit donc d’une chirurgie de cataracte souvent délicate, demandant un temps opératoire prolongé, au cours d’une intervention qui sera par ailleurs plus longue puisque complétée de la chirurgie filtrante.
Le problème du choix de l’implant sera abordé dans le chapitre 20-II.
La prescription postopératoire comporte quelques particularités. La posologie et la durée du traitement anti-inflammatoire seront prolongées. La stabilité réfractive peut être plus longue à obtenir et la correction optique du patient sera retardée.
TECHNIQUES
La phacotrabéculectomie associe la réalisation d’une chirurgie de la cataracte et celle d’une chirurgie conventionnelle du glaucome. Les variantes techniques spécifiques à cette intervention sont représentées par le choix de la réalisation en un ou deux sites, et la possibilité de pratiquer une désinsertion limbique ou postérieure de la conjonctive.
DÉSINSERTION CONJONCTIVALE LIMBIQUE OU POSTÉRIEURE
Un fil tracteur transcornéen de Vicryl 7/0 est placé sur le méridien de 12 heures et permet une bonne exposition du quadrant supérieur. Une désinsertion conjonctivale limbique est réalisée aux microciseaux de Vannas. Elle limite la manipulation conjonctivale, mais expose davantage au phénomène de Seidel postopératoire. Elle ne devra pas être trop large (deux méridiens). Une suture soigneuse est indispensable en fin d’intervention, la bulle de filtration étant testée au BSS (balanced salt solution) pour bien vérifier son étanchéité. Selon les habitudes du chirurgien, une désinsertion postérieure est bien sûr envisageable. Le choix d’une désinsertion limbique ou postérieure n’influence pas le résultat pressionnel de la chirurgie [18].
Réalisation sur un ou deux sites
Au début du développement de la phaco-émulsification, il était fréquent de réaliser une incision tunnellisée sclérale. Ce tunnel scléral, ouvert dans sa partie antérieure en cornée claire, pouvait faire office de volet scléral et, facilitée par l’utilisation d’un « punch », la trabéculectomie proprement dite était réalisée. Depuis que les incisions de la phaco-émulsification se font en cornée claire, la réalisation d’une chirurgie sur deux sites séparés est devenue la règle. Les résultats pressionnels des études comparant ces deux variantes montrent pour certaines un avantage à réaliser la chirurgie en deux sites séparés, avec une baisse pressionnelle supplémentaire de 1 à 3 mmHg [2, 15, 27], alors que d’autres font état d’une baisse équivalente [3, 5]. Le taux d’échec de la chirurgie filtrante est noté dans une étude comme étant deux fois plus fréquent en cas de chirurgie sur un site [20]. La chirurgie sur deux sites a l’avantage de moins solliciter les tissus autour du site de trabéculectomie. Elle facilite la réalisation d’une éventuelle lyse au laser de suture sclérale dans le suivi postopératoire. La chirurgie en un seul site permet toutefois de limiter la perte cellulaire endothéliale [3, 20].
La séquence opératoire d’une chirurgie sur deux sites est dictée par la nécessité de réaliser le volet scléral sur un œil ferme. Ainsi, après avoir exposé le quadrant supérieur et désinséré la conjonctive, la sclère est libérée de tout résidu de tissu ténonien et épiscléral. Une hémostase sclérale douce est obtenue à la diathermie ou au thermocautère, puis le volet scléral est préparé au couteau 30° ou au couteau Crescent. Sa forme est variable selon les habitudes du chirurgien. Un antimitotique est alors éventuellement appliqué, puis rincé abondamment. L’exposition du globe est alors relâchée. L’intervention de la cataracte est menée dans son intégralité. La taille du rhexis ne doit pas être trop grande, ses bords devant recouvrir l’optique pour limiter le risque de capture de l’implant par l’iris en postopératoire. L’injection intracamérulaire de myotique peut être utile pour faciliter la réalisation ultérieure de l’iridectomie. Même en cas d’incision cornéenne étroite, il peut être sécurisant de placer une suture de monofilament 10/0 si l’on veut être certain d’avoir un globe suffisamment étanche pour autoriser, dans certains cas, un massage oculaire en postopératoire différé. La trabéculectomie proprement dite est alors réalisée. L’ostium scléral ne doit pas être trop grand et rester une bordure sclérale sur les côtés qui sera recouverte par le volet scléral. Une iridectomie basale est en règle générale pratiquée. Étant donné que l’iridectomie est source d’hyphéma et d’inflammation postopératoire, certains auteurs ont éliminé cette étape de leur pratique. L’efficacité pressionnelle est la même, mais avec plus d’hyphéma dans le groupe avec iridectomie, et un cas d’incarcération irienne dans le groupe sans iridectomie a été rapporté [16]. L’inflammation dans le groupe avec iridectomie est majorée, et une baisse pressionnelle supplémentaire est notée à un an dans le groupe sans iridectomie [6]. Les sutures sclérales sont placées et serrées afin de maintenir la profondeur de la chambre antérieure. La suture conjonctivale est réalisée au Vicryl 10/0, avec des brins laissés assez longs pour ne pas irriter la paupière supérieure. L’aiguille est non spatulée afin de limiter le risque de Seidel postopératoire. La filtration est testée par la reformation de la chambre antérieure au BSS. L’injection de céfuroxime en intracamérulaire termine l’intervention.
Certains chirurgiens préfèrent réaliser la chirurgie de la cataracte en premier, et pratiquer la trabéculectomie dans son intégralité dans un second temps.
Utilisation d’un antimitotique
Les habitudes anglo-saxonnes montrent que l’utilisation de la mitomycine C est quasi systématique lors de la réalisation d’une phacotrabéculectomie. Le taux de succès de la chirurgie filtrante est alors amélioré, non pas de façon globale mais seulement dans certains sous-groupes (patients mélanodermes, PIO > 20 mmHg, plus de deux collyres hypotonisants, trabéculectomie antérieure) [25]. Cependant, l’influence de cet antimitotique semble moins importante qu’en cas de réalisation d’une trabéculectomie seule [29]. De plus, l’indication de chirurgie combinée est généralement posée pour des glaucomes peu évolués, bien équilibrés, où la nécessité de l’adjonction d’un antimitotique peut être superflue. Les antimitotiques sont plutôt réservés aux cas de chirurgies filtrantes isolées, pour des GPAO plus évolués (voir chapitre 20-II).
Soins postopératoires
Le suivi d’une phacotrabéculectomie se rapproche plus du suivi d’une chirurgie filtrante que de celui d’une simple phaco-émulsification (fig. 16-67). La corticothérapie locale est intense et prolongée, dégressive sur six à huit semaines. Une lyse au laser d’une suture sclérale peut être nécessaire, mais ne doit pas avoir lieu trop précocement. Un massage oculaire doux peut être indiqué. Comme pour le suivi d’une trabéculectomie, les contrôles postopératoires doivent être rapprochés au cours du 1er mois, afin de mettre en œuvre à temps les moyens efficaces pour lutter contre un échec de la procédure filtrante.
RÉSULTATS
Pour juger l’efficacité pressionnelle de cette technique, il faut pouvoir la comparer d’une part avec la trabéculectomie réalisée seule, et d’autre part avec la phaco-exérèse réalisée seule. La phacotrabéculectomie autorise un moins bon contrôle tonométrique à long terme que la trabéculectomie seule, mais permet un abaissement pressionnel supplémentaire de 2 à 4 mmHg comparé à la chirurgie de cataracte seule [11].
COMPLICATIONS
Ce sont celles de la phaco-émulsification et celles de la trabéculectomie (fig. 16-68), auxquelles il faut rajouter certaines plus spécifiques. Ainsi il n’est pas rare d’observer des réactions inflammatoires très précoces, avec parfois constitution d’une membrane cyclitique. L’ouverture de la barrière hémato-aqueuse explique sans doute cette propension à l’inflammation. Cette dernière réagit généralement rapidement à la corticothérapie locale intensive. Une chambre antérieure étroite par hyperfiltration précoce peut entraîner une capture de l’optique de l’implant par l’iris.
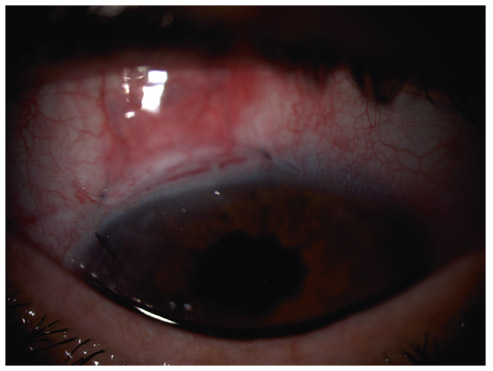
Fig. 16-67 Phacotrabéculectomie : aspect à J1.
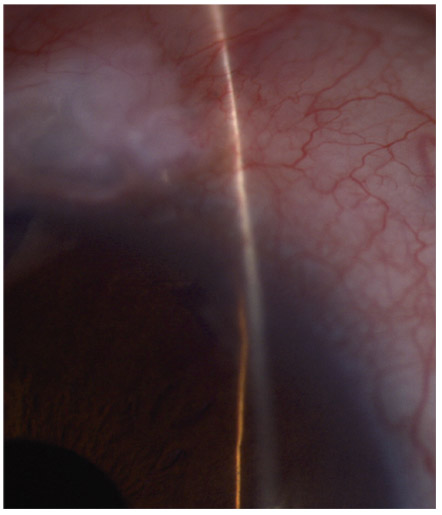
Fig. 16-68 Des adhérences iridocornéennes peuvent compliquer une hypothalamie précoce.
La sclérectomie profonde non perforante, développée depuis une vingtaine d’années, est une alternative à la trabéculectomie. Son principal avantage est d’augmenter le profil de sécurité de la chirurgie du glaucome. Cette technique permet un bon maintien de la profondeur de la chambre antérieure de l’œil, engendre peu de modifications réfractives cornéennes et, en conséquence, l’acuité visuelle reste stable en postopératoire immédiat. Avec tous ces avantages, il est apparu logique de proposer cette chirurgie en association avec la chirurgie de la cataracte.
TECHNIQUES
Les temps opératoires délicats de dissection sclérale de la sclérectomie profonde imposent de travailler sur un œil ferme. Le quadrant supérieur est exposé à l’aide d’un fil de Vicryl 7/0 transcornéen. La désinsertion conjonctivale limbique permet une large exposition sclérale, importante pour réaliser un volet scléral superficiel (un tiers d’épaisseur sclérale) de taille suffisante (5 mm × 5 mm). L’hémostase doit être douce et respecter les vaisseaux aqueux perforants. La dissection se fait en avant en cornée claire. La dissection du volet scléral profond est ensuite débutée, d’arrière en avant, jusqu’à l’éperon scléral qui est repéré par la structure tangentielle au limbe de ses fibres nacrées. Le canal de Schlemm situé juste en avant est simplement abordé.
L’exposition supérieure est relâchée et la phaco-émulsification est alors réalisée en totalité. Un lavage soigneux du produit visqueux en fin d’intervention est indispensable. En effet, sa persistance dans la chambre antérieure, en particulier dans l’angle iridocornéen, pourrait gêner l’appréciation du bon flux d’humeur d’aqueuse à travers la membrane trabéculaire restante lors de l’exérèse du trabéculum cribriforme. Une hydrosuture des berges de l’incision cornéenne est réalisée, une suture cornéenne n’étant pas indispensable.
Le quadrant supérieur est à nouveau exposé. Le canal de Schlemm s’ouvre facilement sous le couteau et la dissection sclérale est poursuivie en cornée claire. Le volet scléral profond est coupé aux microciseaux ou au couteau. Le pelage de la membrane trabéculaire est soigneusement réalisé à la pince.
À ce stade, de nombreuses variantes existent. Différents modèles d’implants de drainage placés dans le lit scléral sont disponibles. Certains sont suturés à la sclère. Ils permettent de garder un espace scléral ouvert et de limiter le risque de fibrose de cet espace intrascléral. D’autres procédés expérimentaux ont été testés. Certains utilisent un implant scléral autologue [19]. D’autres récupèrent la capsule antérieure lors de l’intervention de phaco-émulsification et l’utilisent comme implant scléral [22]. Le volet scléral superficiel est ensuite suturé ou non. En effet, certains chirurgiens préfèrent obtenir une filtration sous-conjonctivale. La suture sclérale n’est alors pas indispensable, et le volet scléral est simplement replacé sur le lit scléral. Dans ce cas, il faudra savoir analyser en postopératoire l’aspect de la bulle et savoir mettre en œuvre les moyens pour éviter une fibrose précoce. La bulle sous-conjonctivale obtenue est en général moins saillante et plus diffuse qu’avec la trabéculectomie. D’autres souhaitent au contraire s’affranchir de cette filtration sous-conjonctivale en suturant étroitement le volet scléral au monofilament de Nylon 10/0 (fig. 16-69, p. 596-597).
RÉSULTATS
Alors que la phacotrabéculectomie semble un peu moins efficace que la trabéculectomie seule, la phacosclérectomie permettrait un meilleur contrôle pressionnel à long terme que la sclérectomie profonde seule [7]. La phacosclérectomie et la phacotrabéculectomie présentent une efficacité quasi équivalente, mais avec moins de complications en faveur de la première technique [4]. Il y a cependant peu d’études comparatives, et de nombreux biais rendent les comparaisons difficiles (variantes techniques, utilisation d’antimitotiques, etc.). Enfin, cette technique, sans doute plus délicate à maîtriser, est probablement davantage opérateur-dépendante.
COMPLICATIONS
Le point fort de cette technique est bien sûr le faible taux de complications postopératoires. Au lendemain de l’intervention, la chambre antérieure est profonde, sans réaction inflammatoire (fig. 16-70). L’acuité visuelle est rapidement optimale. Les complications sont les mêmes que pour chaque technique individuellement. La survenue d’une microperforation est une complication de la technique, mais est en règle générale plus facile à gérer que lorsqu’elle survient lors d’une simple chirurgie du glaucome. En effet, la chambre antérieure est profonde après le temps opératoire cristallinien et l’iris reste généralement à distance de cette micro-ouverture. L’injection d’une petite quantité de produit visqueux dans la chambre antérieure en regard du site de sclérectomie peut être sécurisante. Il ne faut pas chercher à disséquer le plancher du canal de Schlemm avant l’étape cristallinienne car une microperforation, sous l’à-coup des flux de la phaco-émulsification, s’agrandirait immanquablement avec un risque de hernie irienne. La chambre antérieure ne doit pas être reformée sous trop de pression à la fin de la phaco-émulsification pour ne pas risquer d’avoir un bombement antérieur du canal de Schlemm. Cela rendrait le pelage du trabéculum cribriforme difficile, voire aboutirait à une perforation spontanée.
Une remontée pressionnelle postopératoire peut être jugulée par la réalisation d’une goniopuncture au laser YAG. Sur un œil pseudo-phake avec une chambre antérieure approfondie, le risque d’incarcération irienne post-laser est probablement moins élevé. En la réalisant de façon systématique à la 4e semaine, d’excellents résultats pressionnels ont pu être obtenus [31]. Le massage oculaire est contre-indiqué dans les suites de cette intervention, car il existe un risque de rupture de la membrane trabéculaire ou descemétique restante.
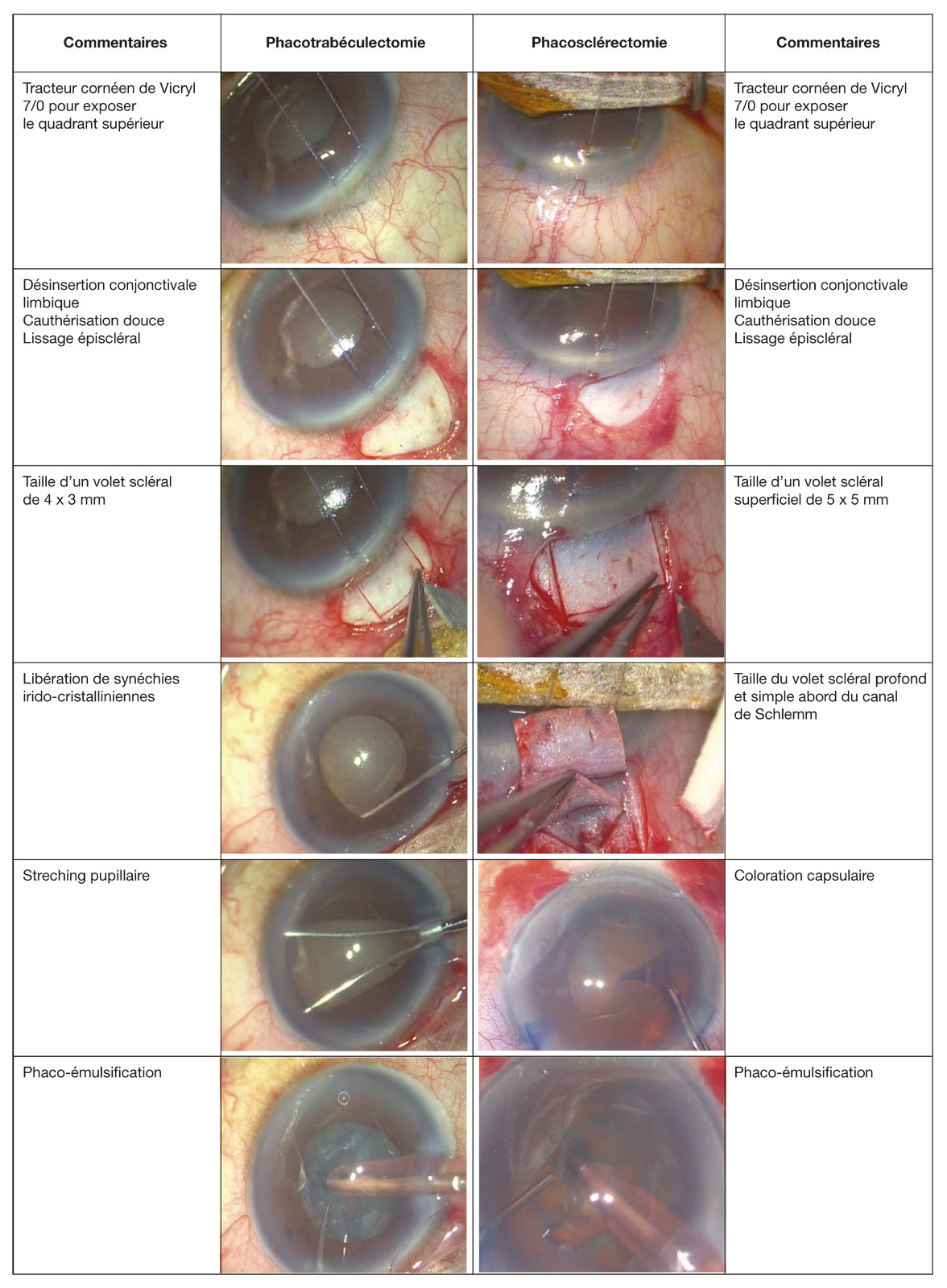
Fig. 16-69 Séquences chirurgicales des deux principales techniques de chirurgie combinée.
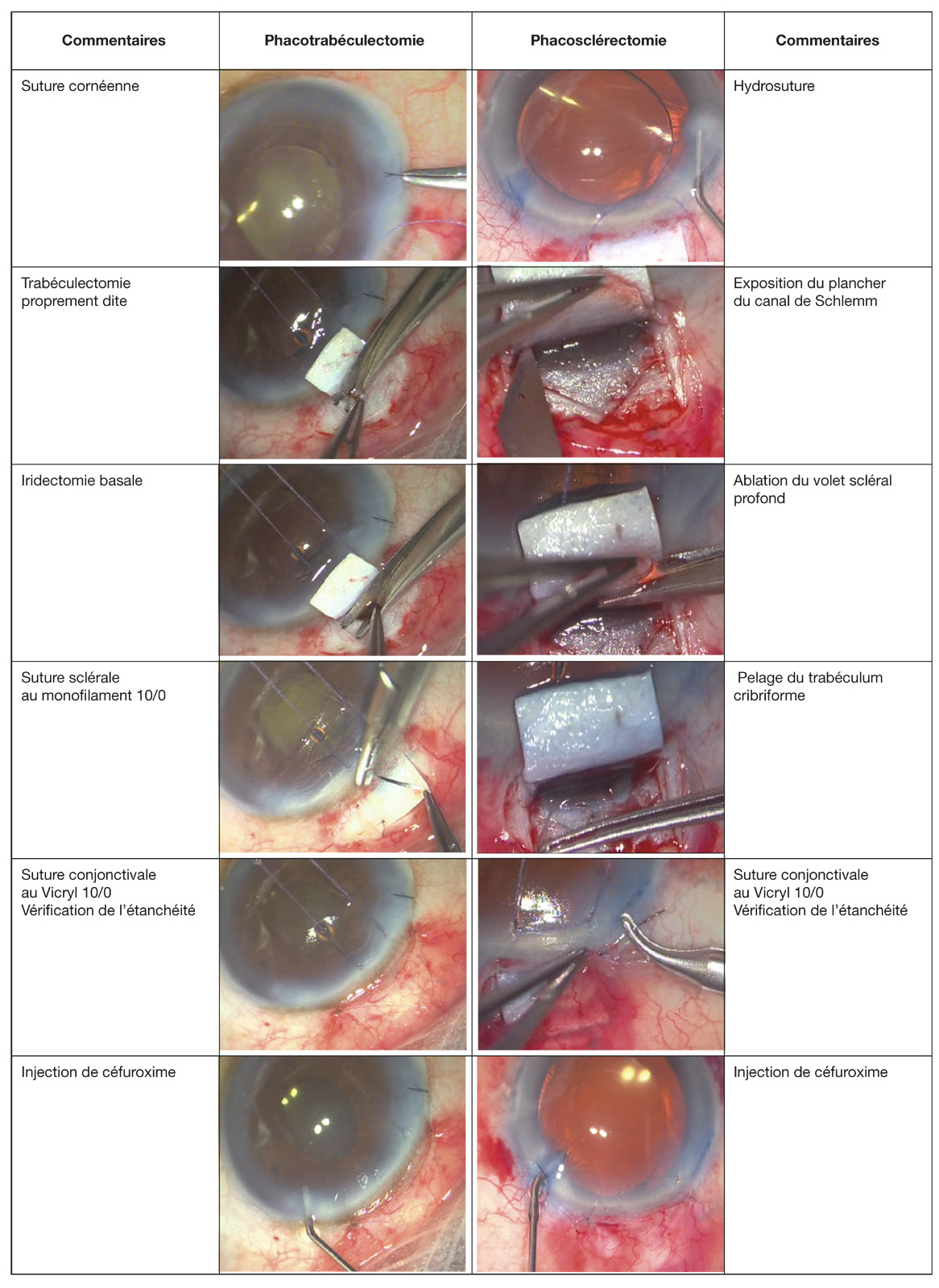
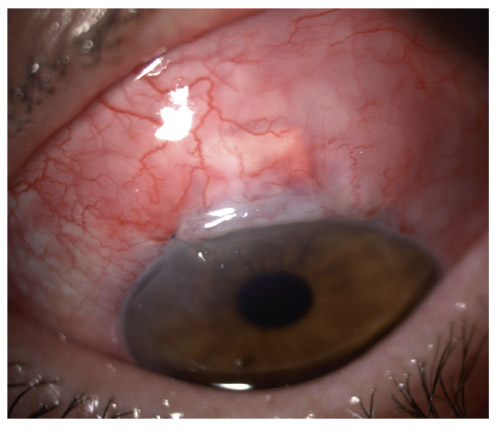
Fig. 16-70 Phacosclérectomie à J1.
TECHNIQUES
Ces deux techniques ont de nombreux points communs avec la phacosclérectomie. La séquence des gestes chirurgicaux est identique. Ces deux techniques visent à réouvrir ou élargir le canal de Schlemm pour lui rendre une physiologie d’excrétion normale. Ainsi, dans ces deux techniques, le choix est délibéré de ne pas avoir de filtration sous-conjonctivale. Dans la viscocanalostomie, un produit viscoélastique est injecté dans les ostia latéraux ouverts du canal de Schlemm. Le trabéculum juxtacanaliculaire est pelé ou non. Le volet scléral est ensuite fermement suturé. En ce qui concerne la canaloplastie, l’objectif est de cathétériser le canal de Schlemm sur 360° avec un microtube de 250 microns de diamètre permettant d’injecter un produit visqueux, et équipé d’une fibre optique dont l’extrémité lumineuse permet de repérer son parcours circonférentiel. Un fil de prolène est suturé à l’extrémité de la sonde lorsque celle-ci réapparaît au niveau de l’ostium scléral opposé. La sonde est alors retirée dans la direction opposée, et le fil de prolène suturé pour permettre une mise sous tension du canal (vidéo 16-5).
RÉSULTATS
Les résultats de la phacoviscocanalostomie semblent identiques à ceux de la phacotrabéculectomie avec mitomycine C sur une série prospective de 40 yeux suivis sur un an [17] (fig. 16-71) Cette technique est efficace et permet d’obtenir une baisse pressionnelle de 33 % sur un suivi de 12 à 90 mois. Le jeune âge et les valeurs pressionnelles élevées en préopératoires sont des facteurs de risque d’échec [30]. Le bénéfice apporté par le pelage du trabéculum juxtacanaliculaire réalisé dans 73 yeux sur 136 ayant bénéficié d’une phacoviscocanalostomie est analysé [21]. Si le résultat à long terme est identique, qu’un pelage trabéculaire ait été réalisé ou non, ce pelage permet d’éviter des pics pressionnels postopératoires précoces. Sur une série prospective multicentrique de 54 patients opérés de phacocanaloplastie, la PIO chute de 24,4 mmHg à 13,7 mmHg à un an [26].
COMPLICATIONS
Là encore, ce sont celles de la chirurgie de la cataracte et celles d’une technique chirurgicale du glaucome qui se veut sûre. Des pics pressionnels postopératoires, des perforations descemétiques ou des hyphémas peuvent être constatés, mais les complications graves sont évitées [17].
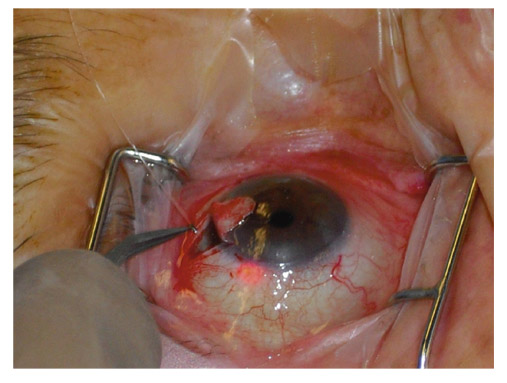
Fig. 16-71 Viscocanaloplastie. (Cliché : N. Collignon.)
Certaines techniques, peu invasives, sont développées afin de conduire l’humeur aqueuse de la chambre antérieure vers l’espace sous-scléral ou sous-conjonctival, ou directement dans la lumière du canal de Schlemm. Ces nouvelles techniques sont en cours d’évaluation par des équipes très spécialisées. D’autres techniques chirurgicales plus lourdes sont utilisées en cas de glaucomes réfractaires.
TECHNIQUES MINI-INVASIVES
Phaco-émulsification et implant Ex-PRESS™
Cet implant est un dispositif biocompatible de 3 mm de long, avec un diamètre externe de 400 microns, sans valve, en acier inoxydable et avec une lumière interne de 50 μm. Il a un plateau externe d’un côté et un petit éperon de l’autre qui, une fois introduit en chambre antérieure, évite son extrusion. Son implantation se faisait au début de son utilisation directement sous la conjonctive.
Sur une série de 35 yeux non contrôlés médicalement et ayant bénéficié d’une phaco-exérèse avec mise en place d’un Ex-PRESS™, la pression intra-oculaire chute de 19,3 mmHg en préopératoire à 13,3 mmHg en postopératoire. Les complications sont représentées par une érosion conjonctivale, une obstruction du tube et la nécessité d’une nouvelle chirurgie pour enlever le shunt dans près de 30 % des cas [23]. Ce risque de complication a conduit à modifier la technique d’implantation. Ce dispositif est actuellement introduit sous couverture d’un lambeau scléral [13].
Phaco-émulsification et implant iStent™
Ce minidispositif a été développé pour être implanté au cours de la chirurgie de la cataracte. Une fois celle-ci réalisée, un myotique est instillé en intracamérulaire. La chambre antérieure est remplie de produit viscoélastique. Sous contrôle gonioscopique à l’aide d’un verre, ce microtube en titane coudé à angle droit est inséré par son extrémité pointue directement dans le canal de Schlemm, créant une ouverture permanente entre la chambre antérieure et la lumière du canal. Cette approche interne permet donc d’éviter tout mécanisme de drainage scléral et sous-conjonctival, et de respecter un éventuel site ultérieur de chirurgie filtrante externe. Une étude prospective multicentrique avec un suivi de deux ans sur une population de 58 patients a été réalisée, et 42 patients ont pu être analysés à un an. Six patients avaient un stent mal positionné, mais gardaient un bon contrôle pressionnel ; sept stents apparaissaient bouchés, dont deux ont nécessité la réalisation d’une trabéculectomie [28]. Une étude récente non comparative relève la sécurité de cette technique et note un abaissement pressionnel modeste de 16,33 % à trois ans [1].
Phaco-émulsification et implant Eye-Pass®
Il s’agit d’un double tube en silicone dont l’extrémité distale est insérée en chambre antérieure, se séparant en deux tubes, chacun étant introduit dans la lumière du canal de Schlemm. Cette technique demande donc la préparation d’un volet scléral et l’abord classique du canal de Schlemm.
Sur 12 patients, deux ont présenté une perforation trabéculaire nécessitant la conversion en une trabéculotomie. Le succès tonométrique est variable, quatre patients gardant une pression à 18 mmHg à la fin du suivi [8].
TECHNIQUES AVEC MISE EN PLACE DE TUBES OU DE VALVES
En cas de risque important d’échec d’une trabéculectomie, ces techniques de drainage peuvent être associées à une chirurgie de la cataracte. Une étude rétrospective de 33 patients confirme un abaissement pressionnel avec l’utilisation de l’implant de Baerveldt, mais au prix de complications classiques avec ces techniques (effusion choroïdienne, inflammation, œdème maculaire cystoïde, œdème cornéen, etc.) [14].
La majorité de la résistance à l’écoulement de l’humeur aqueuse se situant au niveau du trabéculum juxtacanaliculaire, certaines techniques sont développées pour court-circuiter le trabéculum. Ainsi l’humeur aqueuse peut s’évacuer directement dans la lumière du canal de Schlemm.
UTILISATION DE LA PINCE
Cette technique consiste, après réalisation de la chirurgie de la cataracte, à enlever à l’aide d’une pince une portion du trabéculum (un quadrant) sous visualisation directe à l’aide d’un verre à gonioscopie. Sur une petite série prospective de 11 yeux, non contrôlés médicalement et déjà opérés de chirurgie antiglaucomateuse, l’abaissement pressionnel obtenue est important (39 %) [9].
UTILISATION DU TRABECTOME®
Cet appareil, approuvé aux États-Unis depuis 2004, consiste en une pièce à main comportant un électro-cauthère et un système d’irrigation-aspiration. Sous contrôle direct à l’aide d’un verre à gonioscopie, une portion du trabéculum et du mur interne du canal de Schlemm est excisée. Sur une série de 304 yeux, un abaissement pressionnel de 20 mmHg en préopératoire à 15,5 mmHg en postopératoire à un an est rapporté [10].
D’autres techniques ont été testées, telles que la réalisation d’une cyclophotocoagulation endoscopique en passant par l’incision cornéenne après la chirurgie de la cataracte [12].
La chirurgie de la cataracte peut déjà être couplée à l’utilisation d’un laser. La chirurgie non perforante du glaucome a pu bénéficier de l’apport d’une technologie erbium : YAG. Il est fort probable que ces nouvelles technologies soient un jour associées pour assurer une chirurgie combinée de nouvelle génération, sans doute plus facile à réaliser, avec des protocoles mieux définis.
Retenir
-
La chirurgie de la cataracte du patient glaucomateux est souvent plus difficile en raison de particularités anatomiques fréquemment rencontrées (synéchies iridocristalliniennes, mauvaise dilatation pupillaire, fragilité zonulaire, etc.).
-
Phacotrabéculectomie et phacosclérectomie sont les techniques les plus utilisées en France. Si la première est maîtrisée par davantage de chirurgiens, la seconde autorise des suites opératoires plus simples.
-
La séquence des gestes et les détails de leur réalisation dépendent des habitudes du chirurgien.
-
De nouvelles techniques sont en cours d’évaluation. Elles couplent la phaco-émulsification avec des techniques de drainage de l’humeur aqueuse peu invasive, ou avec la réalisation d’une trabéculectomie ab interno.
[1] Arriola-Villalobos P, Martínez-de-la-Casa JM, Díaz-Valle D, et al. Combined iStent trabecular micro-bypass stent implantation and phacoemulsification for coexistent open-angle glaucoma and cataract : a long-term study. Br J Ophthalmol. 2012 ; 96 : 645-9.
[2] Borggrefe J, Lieb W, Grehn F. A prospective randomized comparison of two techniques of combined cataract-glaucoma surgery. Graefe’s Arch Clin Exp Ophthalmol. 1999 ; 237 : 887-92.
[3] Buys YM, Chipman ML, Zack B, et al. Prospective randomized comparison of one-versus two-site phacotrabeculectomy : two year results. Ophthalmology. 2008 ; 115 : 1130-3.
[4] Cillino S, Pace FD, Casuccio A, et al. Deep sclerectomy versus punch trabeculectomy with or without phacoemulsification : a randomized clinical trial. J Glaucoma. 2004 ; 13 : 500-6.
[5] Cotran PR, Roh S, McGwin G. Randomized comparison of 1-Site and 2-Site phacotrabeculectomy with 3-year follow-up. Ophthalmology. 2008 ; 115 : 447-54.
[6] de Barros DS, Da Silva RS, Siam GA, et al. Should an iridectomy be routinely performed as a part of trabeculectomy ? Two surgeons’ clinical experience. Eye (Lond). 2009 ; 23 : 362-7.
[7] D’Eliseo D, Pastena B, Longanesi L, et al. Comparison of deep sclerectomy with implant and combined glaucoma surgery. Ophthalmologica. 2003 ; 217 : 208-11.
[8] Dietlein TS, Jordan JF, Schild A, et al. Combined cataract-glaucoma surgery using the intracanalicular Eyepass glaucoma implant : first clinical results of a prospective pilot study. J Cataract Refract Surg. 2008 ; 34 : 247-52.
[9] Ferrari E, Bandello F, Roman-Pognuz D, Menchini F. Combined clear corneal phacoemulsification and ab interno trabeculectomy : three-year case series. J Cataract Refract Surg. 2005 ; 31 : 1783-8.
[10] Francis BA, Minckler D, Dustin L, et al. Trabectome Study Group. Combined cataract extraction and trabeculotomy by the internal approach for coexisting cataract and open-angle glaucoma : initial results. J Cataract Refract Surg. 2008 ; 34 : 1096-103.
[11] Friedman DS, Jampel HD, Lubomski LH, et al. Surgical strategies for coexisting glaucoma and cataract. An evidence-based update. Ophthalmology. 2002 ; 109 : 1902-15.
[12] Gayton JL, Van Der Karr M, Sanders V. Combined cataract and glaucoma surgery : trabeculectomy versus endoscopic laser cycloablation. J Cataract Refract Surg. 1999 ; 25 : 1214-9.
[13] Gindroz F, Roy S, Mermoud A, Schnyder CC. Combined Ex-PRESS LR-50/IOL implantation in modified deep sclerectomy plus phacoemulsification for glaucoma associated with cataract. Eur J Ophthalmol. 2011 ; 21 : 12-9.
[14] Hoffman KB, Feldman RM, Budenz DL, et al. Combined cataract extraction and Baerveldt glaucoma drainage implant : indications and outcomes. Ophthalmology. 2002 ; 109 : 1916-20.
[15] Jampel HD, Friedman DS, Lubomski LH, et al. B. Effect of technique on intraocular pressure after combined cataract and glaucoma surgery. An evidence-based review. Ophthalmology. 2002 ; 109 : 2215-24.
[16] Kaplan-Messas A, Cohen Y, Blumenthal E, Avni I. Trabeculectomy and phaco-trabeculectomy with and without peripheral iridectomy. Eur J Ophthalmol. 2009 ; 19 : 231-4.
[17] Kobayashi H, Kobayashi K. Randomized comparison of the intraocular pressure-lowering effect of phacoviscocanalostomy and phacotrabeculectomy. Ophthalmology. 2007 ; 114 : 909-14.
[18] Lemon LC, Shin DH, Kim C, et al. Limbus-based vs fornix-based conjunctival flap in combined glaucoma and cataract surgery with adjunctive mitomycin C. Am J Ophthalmol. 1998 ; 125 : 340-5.
[19] Mousa AS. Preliminary evaluation of nonpenetrating deep sclerectomy with autologous scleral implant in open-angle glaucoma. Eye (Lond). 2007 ; 21 : 1234-8.
[20] Nassiri N, Nassiri N, Mohammadi B, Rahmani L. Comparison of 2 surgical techniques in phacotrabeculectomy : 1 site versus 2 sites. Eur J Ophthalmol. 2010 ; 20 : 316-26.
[21] Park M, Tanito M, Nishikawa M, et al. Combined viscocanalostomy and cataract surgery compared with cataract surgery in Japanese patients with glaucoma. J Glaucoma. 2004 ; 13 : 55-61.
[22] Rekas M, Rudowicz J, Lewczuk K, et al. Phacoemulsification-deep sclerectomy modified by trabeculum microperforations and implantation of lens anterior capsule as autologous scleral implant. Curr Med Res Opin. 2010 ; 26 : 2025-32.
[23] Rivier D, Roy S, Mermoud A. Ex-PRESS R-50 miniature glaucoma implant insertion under the conjunctiva combined with cataract extraction. J Cataract Refract Surg. 2007 ; 33 : 1946-52.
[24] Rosdahl JA, Chen TC. Combined cataract and glaucoma surgeries : traditional and new combinations. Int Ophthalmol Clin. 2010 ; 50 : 95-106.
[25] Shin DH, Ren J, Juzych MS, et al. Primary glaucoma triple procedure in patients with primary open-angle glaucoma : the effect of mitomycin C in patients with and without prognostic factors for filtration failure. Am J Ophthalmol. 1998 ; 125 : 346-52.
[26] Shingleton B, Tetz M, Korber N. Circumferential viscodilation and tensioning of Schlemm canal (canaloplasty) with temporal clear corneal phacoemulsification cataract surgery for open-angle glaucoma and visually significant cataract : one-year results. J Cataract Refract Surg. 2008 ; 34 : 433-40.
[27] Shingleton BJ, Price RS, O’Donoghue MW, et al. Comparison of 1-site versus 2-site phacotrabeculectomy. J Cataract Refract Surg. 2006 ; 32 : 799-802.
[28] Spiegel D, Wetzel W, Neuhann T, et al. Coexistent primary open-angle glaucoma and cataract : interim analysis of a trabecular micro-bypass stent and concurrent cataract surgery. Eur J Ophthalmol. 2009 ; 19 : 393-9.
[29] Wilkins M, Indar A, Wormald R. Intra-operative mitomycin C for glaucoma surgery. Cochrane Database Syst Rev. 2005 ; 4 : CD002897.
[30] Wishart MS, Shergill T, Porooshani H. Viscocanalostomy and phacoviscocanalostomy : long-term results. J Cataract Refract Surg. 2002 ; 28 : 745-51.
[31] Yuen NS. Early results of modified nonpenetrating deep sclerectomy and phacoemulsification in the treatment of open angle glaucoma and cataract. Eur J Ophthalmol. 2009 ; 19 : 72-9.
H. Bresson-Dumont
-
La physiopathogénie du glaucome est complexe et multifactorielle.
-
En plus du facteur pressionnel, primordial, des facteurs génétiques, vasculaires, dégénératifs, immunologiques et environnementaux ont été mis en évidence.
-
L’absence de méthode suffisamment fiable et reproductible, en pratique courante, pour mesurer le flux sanguin oculaire rend difficiles les études sur les thérapeutiques visant à améliorer la perfusion du nerf optique oculaire.
-
Les études sur la neuroprotection sont extrêmement difficiles à mettre en œuvre en raison de l’absence de modèle expérimental de glaucome primitif à angle ouvert (GPAO) s’aggravant malgré une pression intra-oculaire (PIO) normalisée, et de la durée nécessaire des investigations.
-
Il est nécessaire, en clinique courante, de mettre en évidence les autres facteurs de risque du GPAO, en particulier les facteurs vasculaires et environnementaux, pour éviter au maximum tout effet délétère sur la vascularisation du nerf optique.
Le traitement du glaucome est actuellement centré sur la diminution de la PIO [12]. Pourtant la physiopathogénie du glaucome est plus complexe et multifactorielle Actuellement grâce, entre autres, aux grandes études épidémiologiques prospectives, les facteurs de risque sont de plus en plus étudiés. Il s’agit des facteurs génétiques, vasculaires, dégénératifs, immunologiques et environnementaux, pour les plus connus. Le traitement moderne du glaucome doit donc désormais prendre en compte ces autres facteurs de risque, même si actuellement notre action reste encore limitée en pratique.
Le rôle de la baisse du flux sanguin oculaire (FSO) et des facteurs ischémiques n’est pas clairement défini dans la pathogénie du glaucome. Si, cliniquement, il semble exister une association entre le FSO et la progression du glaucome, la relation de cause à effet n’est pas encore précisément établie [5]. Le problème est qu’il n’existe, à l’heure actuelle, aucun examen fiable qui mesure tous les aspects du FSO et de sa régulation. La plupart des techniques ne sont d’ailleurs pas utilisables en pratique courante ; les études sont donc difficiles à mener, tant dans un but diagnostique que thérapeutique [37]. Pourtant, de nombreuses observations cliniques tendent à montrer que les troubles du FSO jouent un rôle dans le glaucome, et qu’il semble exister un intérêt majeur à rechercher les facteurs vasculaires, potentiellement péjoratifs sur l’évolution du glaucome.
Tous les facteurs qui diminuent la pression artérielle moyenne (hypotension artérielle, hypovolémie, variation tensionnelle importante, etc.) ou augmentent les résistances vasculaires (artériosclérose, hyperviscosité sanguine, vasospasme) peuvent avoir un impact négatif sur le flux sanguin oculaire. De la même façon, on comprend qu’une hypertension intra-oculaire (HTO) puisse aussi avoir un impact vasculaire, en diminuant le débit sanguin. Et, lorsque la PIO est normalisée, les autres facteurs vasculaires jouent alors un rôle plus prépondérant. Il faut donc, en fait, rechercher et traiter ces éléments dans toutes les formes de glaucome.
Les facteurs vasculaires du glaucome ont été décrits précédemment. Au vu des différentes études, il semblerait que la diminution de la pression de perfusion soit un facteur de risque de glaucome plus consistant que la tension artérielle [28], et que les épisodes d’hypotension artérielle, en particulier diastoliques, soient particulièrement délétères. Il ressort aussi de ces études que, dans certaines formes de glaucome, la dysrégulation vasculaire primitive joue un rôle majeur et est indépendante du niveau de l’HTO. La forme la plus reconnue est la forme vasospastique pour laquelle Flammer [20] a proposé un schéma thérapeutique particulier.
L’amélioration de la pression de perfusion locale passe surtout par la régulation de la tension artérielle. En effet, il n’existe actuellement pas encore de thérapeutique fiable qui améliore de façon significative et incontestable le FSO, même si de très nombreuses recherches sont en cours.
Les hypotensions artérielles, nocturnes ou diurnes, contribuent de façon majeure à diminuer la pression de perfusion oculaire. Il est donc nécessaire d’en faire le diagnostic par un monitoring ambulatoire de la tension artérielle. Très souvent, il s’agit d’un traitement antihypertenseur trop puissant. La régularisation de ces traitements est donc la principale étape, en collaboration avec le médecin généraliste ou le cardiologue, car leur prise en charge est délicate [23]. Il ne faut pas négliger les mesures hygiénodiététiques telles qu’un apport hydrique salé au repas du soir qui peut éviter les hypotensions nocturnes : eaux salées (eau de Vichy, San Pellegrino, etc.), jus de tomate, soupe salée, un régime salé contenant 1 à 5 g de sel par jour. L’hypotension artérielle orthostatique peut être évitée par le port de bas à varices et même la chirurgie de grosses varices.
Malheureusement, certaines molécules prescrites contre l’hypotension artérielle sont des vasoconstricteurs périphériques qui peuvent provoquer, au contraire, une diminution du FSO, comme les activateurs des récepteurs α-adrénergiques (dihydroergotamine, yohimbine) et les sympathomimétiques (heptaminol, midodrine, cafédrine, étiléfrine). Le médicament de référence contre l’hypotension artérielle, intervenant sur la volémie sanguine, non vasoconstricteur, reste la fludrocortisone par son action minéralocorticoïde qui favorise la fuite potassique et la rétention sodée. Sa prescription, restreinte, doit être débutée à la dose de 50 μg, par palier, jusqu’à la disparition des symptômes posturaux, en évitant l’apparition d’effets secondaires des corticoïdes (prise de poids). La dose de fludrocortisone de deux fois 0,1 mg par semaine semble recommandée dans le glaucome [24]. Le patient ne doit pas arrêter brusquement le traitement du fait du risque majeur d’insuffisance surrénale aiguë. Cependant, le traitement de l’hypotension doit absolument être mené en accord avec le médecin référent qui coordonnera les surveillances spécifiques.
L’administration systémique de substances vasodilatatrices a un effet sur la plupart des lits vasculaires, ce qui modifie la pression artérielle et les pressions de perfusion. Le flux sanguin choroïdien ne possède pas d’autorégulation : les effets résultent donc des modifications cardiovasculaires. Cependant, ces molécules n’auront que peu d’effet sur le FSO sauf si elles abaissent de façon importante la pression artérielle et, dans ce cas, entraîneraient plutôt une diminution du FSO.
Les études des effets des substances vasoactives sur le FSO sont très difficiles à mener. Il est aléatoire d’extrapoler à l’homme les résultats retrouvés ex vivo sur un organe pris isolément, ou les informations recueillies lors d’expérimentation chez l’animal. La transposition d’un effet observé chez un sujet sain à un patient glaucomateux reste donc hasardeuse. De nombreuses molécules ont pourtant été étudiées dans le but d’améliorer le FSO, au premier rang desquelles les hypotonisants topiques couramment utilisés dans le glaucome. Un effet bénéfique sur la vascularisation de la tête du nerf optique a souvent été retrouvé ; cependant, il est difficile de savoir si l’effet n’est pas dépendant, en réalité, de la baisse de la PIO. De plus, ces études ont des méthodologies très variées, ce qui rend difficile la comparaison des résultats. L’efficacité spécifique de ces molécules sur le FSO n’est donc pas encore prouvée.
Les études ont montré que les prostanoïdes induisent des modifications vasculaires au niveau du segment antérieur, mais aucune, parmi l’abondante littérature évaluant leur effet sur le flux sanguin du nerf optique et de la rétine, n’a apporté la preuve de leur efficacité sur le FSO, en dehors de l’effet bénéfique vasculaire de la réduction de la PIO.
Les bêtabloquants ont essentiellement des effets cardiovasculaires : ils ralentissent le cœur, réduisent ses besoins en oxygène et n’ont pas un effet hypotenseur sur la pression artérielle à proprement parler. Des centaines d’études ont analysé leurs effets vasculaires et surtout une éventuelle vasoconstriction. Il faut retenir, en fait, que le timolol aurait tendance à induire une vasoconstriction des vaisseaux uvéaux antérieurs, mais il n’existe pas de preuve d’une action sur les vaisseaux uvéaux postérieurs ou rétiniens. Le bétaxolol aurait un effet plutôt myorelaxant, en bloquant les canaux calciques, sans preuve formelle d’un intérêt sur la préservation du nerf optique chez les patients glaucomateux.
Parmi les sympathomimétiques α2-sélectifs, les effets sur la vascularisation sont très différents selon qu’il s’agit de l’apraclonidine ou de la brimonidine. La première est vasoconstrictrice, la seconde a une sélectivité α2 plus élevée, donc pas d’effet vasoconstricteur, tout en gardant l’effet hypotenseur important. Pour la brimonidine, les études sont contradictoires : certaines ont retrouvé une amélioration des paramètres du FSO après six mois d’instillation chez des glaucomes à pression élevée ou normale [64], alors que d’autres études ne montrent pas de modification significative après quatre à huit semaines d’utilisation [68].
L’effet des inhibiteurs de l’anhydrase carbonique (dorzolamide, brinzolamide, acétazolamide) sur le flux sanguin oculaire a largement été étudié ; on retrouve près d’une centaine d’études publiées dans la littérature. Leurs effets bénéfiques sur le flux sanguin oculaire ont largement été débattus, et les résultats sont parfois divergents selon que les études aient été effectuées chez des sujets sains, glaucomateux, à pression normale ou non, et selon les méthodes de mesures utilisées. Cependant, il semblerait que les résultats convergent vers le fait que ces molécules augmentent le flux sanguin et améliorent la régulation du FSO [76], de façon plus importante que ce que l’on pourrait en attendre avec une simple diminution de l’HTO. Une étude récente met en évidence un effet vasorelaxant des artères ciliaires par le biais d’une action indépendante sur l’oxyde nitrique et le tonus vasculaire de l’endothélium vasculaire [35].
De nombreuses molécules utilisées par voie systémique peuvent avoir un impact sur le FSO et sa régulation, mais aucune étude randomisée n’a démontré un effet bénéfique dans le glaucome. Les molécules les plus étudiées sont les inhibiteurs calciques, les inhibiteurs de conversion de l’angiotensine I, des récepteurs de l’angiotensine, de l’anhydrase carbonique et de la phosphodiesterase.
Les inhibiteurs calciques diminuent le taux intracellulaire de calcium par blocage des canaux calciques et induisent une relaxation des cellules musculaires lisses et une vasodilatation cérébrale, coronaire et périphérique. Les expérimentations ont montré une diminution de la contraction des cellules musculaires des artères ciliaires et une diminution de la sensibilité à l’endothéline-1. Quelques études ont montré une augmentation du FSO et une diminution des résistances vasculaires des artères ciliaires courtes postérieures chez le sujet sain et chez les patients glaucomateux [78]. Malheureusement, les inhibiteurs calciques induisent de nombreux effets secondaires, et leur mauvaise tolérance en limite l’usage en pratique courante.
Il existe deux types de substances inhibitrices du système rénine-angiotensine. L’angiotensine I est transformée en angiotensine II grâce à l’enzyme de conversion. L’angiotensine II possède une activité vasoconstrictrice, et il existe des récepteurs spécifiques au niveau des vaisseaux de la tête du nerf optique. Le tandolapril (inhibiteur de conversion de l’angiotensine) ou le losartan (un inhibiteur des récepteurs de l’angiotensine II) semblaient avoir un effet bénéfique sur les artères ciliaires courtes postérieures et le flux sanguin choroïdien, mais les résultats sont contradictoires in vivo et il n’a pas été retrouvé de rôle déterminant sur le FSO [75].
Un antagoniste de l’endothéline-1 (l’ambrisentan ou bosentan), puissant vasoconstricteur, aurait pu être intéressant dans le traitement médical du glaucome par trois mécanismes : il agit sur la contractilité du trabéculum et favorise la voie trabéculaire de l’élimination de l’humeur aqueuse ; il améliore le débit sanguin oculaire, indépendamment de la PIO, et augmente ainsi la survie des cellules ganglionnaires rétiniennes [65]. Cependant, les études in vivo n’ont pas confirmé sa réelle efficacité, ni son intérêt dans le glaucome.
Dans le but d’améliorer le FSO, certaines substances naturelles ont été évaluées, en particulier le ginkgo biloba et le magnésium.
Le ginkgo biloba semble avoir une activité sur les flux sanguins cérébral et périphérique, et induirait une augmentation de la vélocité leucocytaire dans l’artère ophtalmique [11]. Une étude randomisée contre placebo a évalué l’effet de 80 mg de ginkgo biloba deux fois par jour pendant quatre semaines et montrait une augmentation significative du FSO avec le ginkgo biloba, mesuré au HRF [51].
Le magnésium influe sur le métabolisme des autres ions, de l’acétylcholine et de l’oxyde nitrique et module l’action de nombreux enzymes. C’est un inhibiteur calcique naturel qui permet de limiter l’action vasoconstrictrice. Chez l’homme, une étude montre une amélioration du FSO périphérique, mais sans contrôle placebo [21].
Les facteurs de risque vasculaires généraux augmentant les résistances vasculaires agissent par le biais d’une réduction de calibre vasculaire (artériosclérose, hypertension artérielle, hyperlipidémie), ou par une augmentation de la viscosité sanguine.
L’artériosclérose, induite principalement par l’hypertension artérielle (HTA), l’hyperlipidémie, le tabac, le diabète et l’obésité, est au premier rang des causes de réduction du calibre vasculaire.
Les relations entre HTA et glaucome sont complexes. Il semblerait que l’HTA soit néfaste lorsqu’elle entraîne une angiosclérose chez les hypertendus de longue date, en raison de la rigidification des vaisseaux, du rétrécissement vasculaire et ainsi de la diminution chronique de la perfusion. Ce n’est pas à proprement parler l’augmentation de la tension artérielle qui est délétère, puisqu’elle peut, en fait, augmenter la pression de perfusion et contrecarrer l’HTO chez les jeunes au réseau vasculaire souple. C’est donc l’HTA chronique qu’il est important de prendre en charge pour préserver le réseau vasculaire, par des mesures hygiénodiététiques et des médicaments.
Le traitement des facteurs liés à l’artériosclérose doit être pris en charge par le médecin généraliste, en veillant toutefois à ne pas surdoser les antihypertenseurs qui risqueraient d’induire une hypotension artérielle, en particulier diastolique, et ainsi diminuer la pression de perfusion oculaire. Ces mesures permettent souvent un gain presssionnel de 4 mmHg et évitent les pics d’HTA supérieurs à 160 mmHg [45].
En conclusion, la prise en charge de tous les facteurs de risque vasculaires est nécessaire, car ils entraînent des lésions mécaniques sur le réseau vasculaire. Cette prise en charge est à déléguer aux médecins généralistes en la collaboration avec le cardiologue.
La viscosité sanguine est déterminée par le nombre d’éléments figurés du sang, le taux de protéines plasmatiques, la déformation et l’agrégation érythrocytaire. L’hyperviscosité conduit à un ralentissement circulatoire allant jusqu’à l’occlusion vasculaire. Les modifications de la viscosité sont le plus souvent liées à des hémopathies, qui ne sont pas rares dans la population âgée.
Le vasospasme est défini comme une constriction inappropriée ou une dilatation insuffisante au niveau de la microcirculation. Les principales manifestations cliniques sont les extrémités froides et une tendance à l’hypotension artérielle. Certains patients souffrent également de migraines. Ce syndrome vasospastique est, depuis plus de vingt ans, présenté comme un facteur de risque majeur de la maladie glaucomateuse [20]. Le glaucome vasospastique a été décrit dès 1998 par Broadway et Drance [4] et plus récemment par Flammer et Mozaffarieh [18]. La dysrégulation vasculaire perturbe l’autorégulation vasculaire locale lors des variations de FSO, et rend le nerf optique plus sensible à l’augmentation de la PIO et à une diminution de la pression sanguine systémique en induisant, entre autres, une hypotension artérielle et une pression de perfusion diastolique basse. La dysrégulation vasculaire primitive touche de façon préférentielle la femme jeune, mince et active. S’y associent des migraines, des extrémités froides avec éventuellement un syndrome de Raynaud, une sensation diminuée de la soif et des difficultés à l’endormissement. Ces formes de glaucome vasculaire sont moins dépendantes du niveau de PIO et sont souvent évolutives.
La recherche thérapeutique sur la dysrégulation vasculaire débute seulement [44]. Les inhibiteurs calciques, en diminuant l’effet vasoconstricteur du taux élevé d’endothéline-1, amélioreraient le champ visuel, certainement grâce à la vasodilatation induite. La dose recommandée de nifédipine serait de 5 à 10 mg/j en fonction des effets secondaires. Des études récentes préfèrent la nimodipine per os, qui serait plus efficace du fait de sa liposolubilité élevée et de sa capacité à traverser la barrière hémato-encéphalique [39].
Autre traitement évoqué, le magnésium est un antagoniste physiologique du calcium qui module la vascularisation induite par l’endothéline-1 et améliore la circulation périphérique chez les patients vasospastiques. La dose quotidienne de magnésium préconisée est de 125 mg/j. Ont été aussi proposés le ginkgo biloba, la lutte contre l’hypotension artérielle et la pratique régulière du sport.
La migraine et le phénomène de Raynaud sont intimement liés à la dysrégulation vasculaire. Le traitement de la migraine n’améliore en aucun cas le glaucome mais il peut, en revanche, être délétère pour la vascularisation oculaire si sont prescrits des vasoconstricteurs comme les dérivés de l’ergot de seigle ou les triptans. Ce sont de puissants vasoconstricteurs antagonistes spécifiques des récepteurs sérotoninergiques, qui ont une action agoniste sur les récepteurs α-adrénergiques et ainsi bloquent la vasodilatation, responsable de la migraine.
Il ne faut pas aussi négliger les mesures destinées à diminuer les crises vasomotrices : protection contre le froid, arrêt du tabac, diminution des médicaments déclencheurs.
Le syndrome d’apnées du sommeil (SAS) est un trouble du sommeil caractérisé par un arrêt du flux respiratoire (apnée) ou une diminution de ce flux (hypopnée), associés à des signes diurnes évocateurs d’une mauvaise qualité de sommeil. Il est diagnostiqué par un enregistrement polygraphique ventilatoire nocturne, la polysomnographie, qui mesure la saturation en oxymétrie percutanée et les répercussions cardiovasculaires avec la mesure de la fréquence cardiaque.
L’association GPAO-SAS a été décrite dès 1982 par Walsh et Montplaisir [80] et secondairement par Mojon et al. [42], entre autres. De nombreuses études ont confirmé que les patients atteints de GPAO ou de glaucome à pression normale (GPN) présentaient plus de SAS que dans la population générale [3] ; cependant, il ne semble pas exister plus de glaucomes dans la population de SAS. Il a été prouvé que le SAS diminuait le FSO [17] indépendamment des autres facteurs de risque vasculaires [42]. Il existe une corrélation entre la sévérité du SAS (en pour cent d’apnée-hyponée) et la PIO [32], et on retrouve une déstructuration du rythme nycthéméral de la PIO avec souvent une augmentation des valeurs nocturnes [54].
Il semble donc intéressant de rechercher un SAS systématiquement devant tout glaucome (à pression normale ou non), de la même façon que l’on recherche les facteurs de risque vasculaires, d’autant plus que le SAS est un facteur de risque qui peut être contrôlé avec la collaboration du médecin généraliste, du spécialiste ORL, voire dans certains cas du neurologue.
Les mesures hygiénodiététiques (perte de poids, arrêt de la consommation d’alcool, de tabac ou de sédatifs) ont une efficacité incomplète et transitoire, mais doivent toujours être mises en place. La réduction du poids est efficace tant dans les apnées modérées que dans les formes intermédiaires et sévères. Par ailleurs, pratiquer régulièrement une activité physique, veiller à des horaires réguliers de sommeil et privilégier un environnement optimal assurent un sommeil de meilleure qualité. Le tabagisme augmente l’inflammation des voies respiratoires supérieures, favorisant ainsi le ronflement et le SAS. La consommation d’alcool est associée à une exacerbation du nombre et de la durée des apnées, à une désaturation et à une fragmentation du sommeil. Les traitements positionnels visant à empêcher le décubitus dorsal au cours du sommeil ne sont efficaces que chez une petite fraction des patients.
Le maintien du calibre des voies aériennes peut être proposé afin d’éliminer le ronflement ou l’apnée du sommeil. Il existe un certain nombre de techniques qui agissent à des niveaux différents :
-
l’orthèse de propulsion mandibulaire portée durant le sommeil se fixe sur les dents et permet de projeter en avant la mâchoire inférieure de 80 % de la saillie maximale, pour mieux libérer le pharynx ;
-
les techniques chirurgicales maxillofaciales. En dehors de l’ablation des amygdales responsables d’apnées du sommeil chez l’enfant, la chirurgie maxillofaciale de l’adulte est lourde (uvulo-palato-pharyngoplastie, ostéotomie d’avancement maxillomandibulaire). Depuis les années 1980, on peut pratiquer au laser une réduction de la luette et de la partie distale du palais mou, sans excision totale du muscle de la luette ;
-
la stimulation électrique permet d’activer, à chaque inspiration pendant le sommeil, le nerf hypoglosse (nerf moteur de la langue), faisant ainsi avancer la langue et permettant un élargissement des voies aériennes supérieures ;
-
la ventilation en pression positive continue constitue le traitement de référence le plus efficace dans les SAS sévères. Elle maintient les voies aériennes supérieures ouvertes à tous les stades du cycle respiratoire en augmentant la pression d’air dans le pharynx, empêchant ainsi son collapsus pendant les temps inspiratoires et expiratoires (fig. 16-72). À long terme, l’efficacité dépend de l’observance. Les principaux bénéfices concernent l’amélioration de la vigilance diurne, mais certaines études font aussi état d’une réduction de la mortalité, du nombre d’accidents cardiaques et des accidents de la route. La ventilation en pression positive continue agit aussi sur la PIO. Chez des patients qui avaient des modifications de leur courbe nycthémérale de PIO, on peut observer une normalisation de leur profil [54]. Cependant, certaines études ont montré une augmentation de la PIO encore plus importante la nuit sous ventilation en pression positive continue [33]. Cette modification est probablement liée aux pressions positives de ventilation qui augmentent la pression intrathoracique. Le rôle bénéfique de cette ventilation sur le développement ou le contrôle de la progression de la neuropathie optique n’est donc pas formellement établi à ce jour.
Fig. 16-72 Patient équipé d’un appareil de ventilation en pression positive continue dans le traitement des apnées du sommeil.
Le glaucome est une maladie multifactorielle, neurodégénérative, d’évolution progressive, conduisant à une mort par apoptose (ou mort cellulaire programmée) des fibres axonales du nerf optique et des cellules ganglionnaires de la rétine. La neuroprotection se rapporte à tout traitement qui prévient, retarde ou inverse la mort cellulaire neuronale liée au processus d’apoptose résultant d’une lésion neuronale initiale [14]. La première action neuroprotectrice efficace est la diminution de la PIO. Toutefois, on estime qu’au moins 10 % des patients continuent à évoluer malgré une pression cible atteinte [79].
De nombreux modèles expérimentaux ont donc été développés pour la recherche de nouvelles thérapeutiques susceptibles d’agir sur cette apoptose. Malheureusement, les études qui testent la neuroprotection sont difficiles à mettre en œuvre d’un point de vue méthodologique et longues à réaliser. Les multiples essais in vivo n’ont pas montré de résultats significatifs, principalement du fait de la méthodologie et des biais de mesure [58] (voir chapitre 16-III).
Le tartrate de brimonidine (Alphagan®) [67] et la mémantine [16, 49] ont été largement étudiés comme agents luttant contre l’excitotoxicité dans le glaucome : ils sont décrits en détail dans le chapitre 16-III. Dans un avenir proche, de nouvelles recherches vont être mises en œuvre sur un nouvel agent, le bis(7)-tacrine, également antagoniste des récepteurs NMDA, qui semble être un neuroprotecteur plus puissant que la mémantine [16].
De nombreuses substances naturelles actuellement disponibles sont proposées pour leur une activité anti-oxydante et/ou neuroprotectrice. Ces substances font partie des compléments alimentaires largement distribués, mais il n’existe pas à ce jour d’effet bénéfique bien démontré suffisamment fondé sur les preuves. Leur utilisation est cependant envisagée en traitement d’appoint par certains auteurs [44]. Les plus fréquemment recommandés sont actuellement la citicoline, le ginkgo biloba, le magnésium et le coenzyme Q10. Toutefois, de nombreux anti-oxydants ont aussi été proposés comme le thé vert, le vin rouge, le curcumin et le pycnogénol (voir plus loin).
Son activité neuroprotectrice a été largement analysée en ophtalmologie et en neurologie. Il piégerait les radicaux libres oxygénés et les radicaux nitrés, bloquant toute la chaîne de peroxydation membranaire à l’origine de l’apoptose et de la mort cellulaire qui en découle. Son action antiradicalaire protégerait du stress oxydatif. Il préserverait aussi le métabolisme mitochondrial en agissant sur la phosphorylation oxydative, ce qui induirait une augmentation significative de la production d’ATP dans les cellules de l’œil, liée à une augmentation du métabolisme des cellules rétiniennes. Il stimulerait l’expression de neurotrophines du cerveau, et donc favoriserait la survie des cellules ganglionnaires. En s’opposant à la libération d’oxyde nitrique, il les protégerait de la toxicité du glutamate [1].
Des études récentes [36, 73] mais aussi plus anciennes [57] ont rapporté une amélioration de la fonction visuelle et une diminution de la progression du déficit périmétrique chez des patients supplémentés en ginkgo biloba.
La citicoline est étudiée depuis 1989 en ophtalmologie. Elle est utilisée chez l’homme depuis de nombreuses années dans les troubles cognitifs et les accidents vasculaires cérébraux, pour diminuer les séquelles neurologiques. C’est une substance endogène qui intervient dans la synthèse des phospholipides membranaires neuronaux. Dans les cellules ganglionnaires de la rétine, c’est un précurseur de la phosphatidylcholine et de la sphingomyéline. Elle a une action dans le maintien de l’intégrité des membranes. En cas d’écrasement du nerf optique, la perte de cellules ganglionnaires serait atténuée par la citicoline et l’expression de la protéine anti-apoptotique BCl2 serait augmentée [70]. En cas d’ischémie/reperfusion [50], la citicoline s’opposerait à la désorganisation des membranes des cellules ganglionnaires induite par les radicaux libres. De plus, en libérant la choline, elle agirait sur le métabolisme du glutathion, permettant d’engendrer une action antioxydante. Elle protégerait les tissus neuronaux de l’œdème induit par l’ischémie en activant une pompe Na+/K+-ATPase membranaire. Cinq essais cliniques européens de phase III ont rapporté un effet bénéfique sur les paramètres périmétriques et/ou électrophysiologiques de patients glaucomateux, après 60 jours de citicoline per os ou en intramusculaire. Cependant, il existe une régression du bénéfice après trois mois de wash-out. L’amélioration semblait stable après huit ans chez des patients qui continuaient le traitement, ce qui suggère un effet neuroprotecteur possible.
Dans le glaucome, l’apport en magnésium a été proposé il y a de nombreuses années pour ses effets vasculaires [19], en particulier en cas de vasospasme. Mais récemment, une étude a trouvé que le magnésium per os améliorerait le champ visuel dans le GPN, sans modification du débit sanguin oculaire [2]. Le sel de magnésium aurait une action neuroprotectrice en bloquant l’action des récepteurs NMDA cérébraux. Ces récepteurs sont activés en situation d’hypoxie cérébrale et permettent l’entrée du calcium dans les neurones, provoquant des lésions cellulaires. Le magnésium agirait en s’opposant à l’entrée du calcium dans les cellules musculaires lisses vasculaires, cet effet inhibiteur calcique étant sans retentissement sur la pression artérielle, et comme neuroprotecteur par réduction de l’expression de protéines apoptotiques, notamment la caspase-3 et le bax. Il posséderait en plus une action vasodilatatrice cérébrale qui permettrait de limiter l’ischémie tissulaire et l’apoptose secondaire à l’ischémie reperfusion et au vasospasme. La Rotterdam Study n’a cependant pas rapporté d’effet bénéfique de la supplémentation en magnésium dans le glaucome. Les études doivent donc être poursuivies.
Le coenzyme Q10 est un élément fondamental du métabolisme de la mitochondrie. Des études récentes ne lui ont pas seulement attribué une activité anti oxydante, mais aussi une activité spécifique anti apoptotique. Carlo Nucci [48] a montré qu’en instillation topique, le coenzyme Q10 réduisait la perte des cellules ganglionnaires de la rétine de rat, induite par une augmentation de la PIO. L’activité neuro protectrice a aussi été démontrée in vivo par Cordeiro [25] sur un modèle d’HTO chronique. Le coenzyme Q10 réduirait l’effet délétère de l’ischémie induite par l’hypertonie oculaire, en protégeant le métabolisme énergétique mitochondrial. L’accumulation extracellulaire de glutamate induite par l’ischémie serait contenue, limitant ainsi la mort par apoptose des cellules ganglionnaires rétiniennes.
Dans une revue de la littérature très complète, en 2010, Sena et al. [72] font le point sur les essais contrôlés randomisés des molécules systémiques ou topiques à visée neuroprotectrice. Le but de cette étude était d’examiner les preuves de l’efficacité de la neuroprotection dans le glaucome. Ont été étudiés les antagonistes de la NMDA tels que la mémantine, les α2-adrénergiques comme la brimonidine, des inhibiteurs des canaux calciques, des neurotrophines (BDNF), des antioxydants et certains antiradicaux libres, des extraits de ginkgo biloba et des inhibiteurs de l’oxyde nitrique synthétase. Malheureusement, aucune étude pertinente n’a été identifiée, et cette etude rétrospective conclut qu’il n’existe pas actuellement suffisamment de preuves pour affirmer que ces agents neuroprotecteurs soient réellement efficaces dans le traitement du glaucome.
De plus en plus d’études mettent en évidence l’importance du comportement individuel et de l’environnement dans la survenue et la progression du glaucome, et sont poursuivies dans ce sens [52]. Des essais cliniques randomisés doivent être menés, mais leur réalisation est difficile en raison de l’aspect polyfactoriel : l’interaction entre les différents facteurs est importante, rendant délicate l’extraction indéniable d’un seul paramètre.
La micronutrition, en ce qui concerne les glaucomes, est au stade de la réflexion et essaie de construire un rationnel à partir d’arguments scientifiques. Ces derniers tendent à prouver l’influence de certains nutriments sur le risque global de développer un glaucome. Ces constatations viendront naturellement influencer notre comportement alimentaire.
Une étude prospective américaine sur 10 ans [31] a mis en évidence des relations entre l’apport alimentaire en lipides et la prévalence du GPAO. Ren et al. [59] ont souligné que les patients atteints de GPAO avaient des teneurs plasmatiques et érythrocytaires réduites en certains acides gras poly-insaturés (AGPI) par rapport aux sujets témoins, en particulier pour certaines entités lipidiques, suggérant des modifications très subtiles du métabolisme lipidique dans le glaucome. La combinaison d’une déficience en oméga-3 et de pics pressionnels aggraverait le dysfonctionnement des cellules ganglionnaires rétiniennes [46]. Un régime combinant AGPI oméga-6 et oméga-3 semblait plus efficace qu’un régime non spécifique d’AGPI pour prévenir l’apparition d’un glaucome [69]. Cela a été confirmé par une grande étude observationnelle française qui suggère un effet protecteur des AGPI oméga-3, en particulier apportés par les noix [60]. L’intérêt d’un régime riche en AGPI oméga-3 et oméga-6 semble donc unanimement intéressant pour un patient glaucomateux [15].
Les études nous livrent d’autres conseils, en particulier sur la consommation de fruits et légumes sources de vitamines et d’antioxydants. Même si certains résultats sont contradictoires, ces études incitent donc à améliorer notre alimentation pour éviter la survenue ou l’aggravation d’un glaucome. Les conclusions convergent vers deux axes : augmenter l’apport en acides gras poly-insaturés qui peuvent influencer la concentration endogène de PGF2α et augmenter les apports en antioxydants. Il semble important de privilégier les apports en oméga-3 sans déstabiliser le rapport oméga-6/oméga-3 par la consommation de noix, huile de poisson gras, huile de tournesol, maïs, certaines viandes (riches en oméga-6), graines de lin et huile de soja. Pour l’apport en antioxydants, il faudrait privilégier les caroténoïdes présents dans la plupart des fruits (principalement les agrumes et les pêches) et des légumes (jaunes et verts, en particulier les légumes crucifères – chous vert, frisé, rouge, chou-fleur, -rave, choux de Bruxelles, rutabaga, navet, radis, cresson, roquette, raifort), ainsi que les apports en vitamines A, C, E, B1 et B2 (fig. 16-73) [22].

Fig. 16-73 De nombreuses études nous incitent à améliorer notre alimentation pour éviter la survenue ou l’aggravation d’un glaucome – augmenter les apports en AGPI (noix) et en antioxydants (caroténoïdes présents dans la plupart des fruits, tels que les agrumes et les pêches, et des légumes, notamment jaunes et verts, en particulier les légumes crucifères).
Nous venons de voir l’intérêt d’un régime riche en AGPI dans la prévention du glaucome, mais les oméga-3 semblent aussi avoir un rôle thérapeutique [6]. D’après Huang et al., les oméga-3 seraient bénéfiques pour le patient glaucomateux, car ils diminueraient la PIO, augmenteraient le flux sanguin oculaire et auraient une action neuroprotectrice. Nguyen et al. [47] ont démontré que des animaux supplémentés en oméga-3 auraient une PIO plus basse et des teneurs en DHA (acide docosahexaénoïque) plus élevées dans le corps ciliaire. La diminution de la PIO serait secondaire à une augmentation des flux uvéoscléral et trabéculaire de l’humeur aqueuse, grâce à des effets directs sur la relaxation des muscles ciliaires (par le biais des prostaglandines, qui sont des métabolites des acides gras oméga-3) et le remodelage de la matrice extracellulaire [71]. Il a été démontré que la consommation d’huile de foie de morue, qui contient de l’EPA (acide eicosapentaénoïque) et de DHA, peut réduire la PIO chez les animaux de laboratoire [40]. Outre l’effet hypotonisant, le potentiel vasculaire des omégas-3 semble intéressant [43].
Toutes ces études convergent donc vers l’intérêt thérapeutique d’une supplémentation en oméga-3 dans la prévention et le traitement du glaucome ; cependant, des études randomisées doivent être mises en œuvre pour confirmer ces hypothèses.
Certaines substances auraient un effet thérapeutique indépendant de la réduction de la PIO [30]. Mozaffarieh et Flammer [44] ont publié de nombreuses études suggérant l’effet thérapeutique d’aliments, soit par effet neuroprotecteur, soit par le biais d’une amélioration du FSO. Les composés flavonoïdes polyphénoliques tels que le thé vert, le vin rouge et le chocolat noir auraient ces propriétés antioxydantes. Les polyphénols (procyanidines) du vin rouge (contenus dans les pépins et la peau du raisin) exerceraient des effets vasoprotecteurs en inhibant la synthèse de l’endothéline-1. Les myrtilles (anthocyanosides) auraient un effet antioxydant intéressant en raison de leur structure chimique particulière.
Le ginkgo biloba contient plus de 60 principes actifs. Ses composants sont principalement des flavonoïdes et des terpénoïdes qui contiennent deux principes actifs principaux, l’EGb761 et le LI1370. De nombreuses études pharmacologiques, toxicologiques et cliniques ont prouvé l’efficacité de l’EGb761 sur le stress oxydatif au niveau de la mitochondrie, ce qui lui confère des propriétés antioxydantes [63]. Une action bénéfique sur le FSO a été décrite [9, 11]. Cette propriété neuroprotectrice a déjà été décrite plus haut.
Au vu de ces différentes études, le ginkgo biloba pourrait présenter un intérêt thérapeutique grâce à un effet bénéfique sur les différentes étapes impliquées dans le glaucome et être proposé comme traitement adjuvant, associé à une diminution de la PIO [13].
La vitamine A peut non seulement maintenir l’intégrité de la surface oculaire, mais également empêcher l’altération de l’épithélium oculaire provoquée par des médicaments antiglaucomateux [56] et améliorer la phototransduction rétinienne et la viabilité des cellules rétiniennes de l’épithélium pigmentaire. La supplémentation grâce des quantités modérées d’huile de foie de morue paraît relativement sûre, d’autant qu’elle permet l’apport conjugé en vitamine A et en AGPI oméga-3 ; elle semble donc être bénéfique pour le traitement de glaucome.
Il a été récemment rapporté que la découverte du GPAO se fait à des stades plus tardifs, avec des formes cliniques plus évoluées et plus rapidement progressives dans les classes sociales défavorisées (voir chapitre 8-V). Des études très récentes pointent la responsabilité potentielle de certains produits chimiques, comme les pesticides, dans la pathogénie de maladies neurodégénératives (maladies d’Alzheimer et de Parkinson) ainsi que dans le glaucome [60]. L’impact réel de l’utilisation massive des produits chimiques neurotrophiques dans notre environnement, depuis quelques dizaines d’années, ne sera probablement mis en évidence que progressivement. Ces constatations pousseront indéniablement à modifier le comportement et la prise en charge des patients glaucomateux.
Le rôle du tabac dans la pathogénie du glaucome reste controversé. Renard et al. [60] ont mis en évidence dans une étude épidémiologique récente que le tabagisme important (supérieur à 40 paquets-année) était un facteur de risque de glaucome, alors que l’étude américaine de Kang et al. [29] ne l’avait pas rapporté – mais pour un tabagisme plus faible. Quoi qu’il en soit, il est certain que le tabac a un rôle délétère par ses effets cardiovasculaires néfastes et comme source de stress oxydatif. Ces deux facteurs étant reconnus dans la pathogénie du glaucome, le bon sens commande qu’il est préférable pour un glaucomateux de ne pas fumer.
La consommation d’alcool et de marijuana a une action potentiellement hypotensive sur la PIO [8, 26]. Cependant, toutes les études soulignent le fait qu’il ne faut pas oublier que, pour ces deux substances, le rapport bénéfice/risque est mauvais et qu’il est pas justifié de les proposer comme traitement alternatif du glaucome.
Les différentes études n’ont pas montré de relation forte entre le surpoids et la survenue du GPAO. Une revue de la littérature récente a conclu que, même si des preuves existent quant à la relation entre une PIO plus élevée et l’obésité (définie par un indice de masse corporelle élevé), les résultats concernant la relation entre la neuropathie optique glaucomateuse et l’obésité sont contradictoires [7].
Aucune étude jusqu’alors n’a mis en évidence de relation directe entre la pratique sportive et le GPAO. En revanche, plusieurs ont montré l’effet hypotonisant de l’exercice physique [53] et son effet bénéfique sur le FSO, en particulier sur le flux sanguin rétinien et choroïdien [27, 62]. La pratique régulière du sport peut donc être recommandée, même si le mécanisme exact de l’effet bénéfique n’est pas encore complètement élucidé.
Flammer et Mozaffarieh [43] rapportent dans plusieurs études l’effet bénéfique de la pratique du sauna. Le choc thermique provoqué par la chaleur induirait des modifications cellulaires qui favoriseraient la régénération des cellules ganglionnaires [83]. Les auteurs préconisent la pratique régulière du sauna, en particulier chez les patients glaucomateux.
Il a été découvert que la pression intracrânienne (PIC) était inférieure chez les patients atteints de GPAO ou de GPN, par rapport à des sujets témoins non glaucomateux [84]. Dans la Beijing Intracranial and Intraocular Pressure Study, les auteurs ont retrouvé, à l’IRM, un espace sous-arachnoïdien étroit au niveau le partie orbitaire du nerf optique dans le GPN, suggérant une faible pression du liquide céphalorachidien [82]. Il existe donc probablement une relation entre PIO et PIC. Une diminution de la PIC pourrait entraîner une augmentation de la pression différentielle (PIO moins PIC) de part et d’autre de la lame criblée et favoriser une atteinte glaucomateuse. Des expérimentations sur le rat ont montré qu’une augmentation artificielle de la PIC pouvait induire une augmentation du gradient de pression au travers de la lame criblée, et ainsi une augmentation retardée de la PIO [66]. Toute molécule agissant sur la PIC pourrait donc induire des modifications non négligeables, comme l’acétazolamide per os ou le glycérol. De nombreuses études sont en cours pour préciser le rôle des rapports particuliers entre liquide céphalorachidien et nerf optique, afin de cerner toutes les implications thérapeutiques qui en découlent.
Lin et al. [38] rapportent l’intérêt du traitement de l’hypothyroïdie puisque le risque de développer un GPAO dans les cinq ans qui suivent le diagnostic est élevé, mais diminue de façon importante en cas de supplémentation hormonale. L’hypothyroïdie pourrait favoriser le dépôt de mucopolysaccharides dans le trabéculum et induire une élévation de la PIO en augmentant la résistance à l’écoulement de l’humeur aqueuse. Il est donc primordial d’équilibrer au mieux et au plus vite les hypothyroïdiens.
Aucune thérapeutique alternative (phytothérapie, ostéopathie, homéopathie, acupuncture, méditation, etc.), essentiellement destinée à améliorer le bien-être, n’a de support scientifique véritable. En revanche, en Asie, l’acupuncture est plus largement prônée comme un traitement adjuvant efficace.
De très nombreux articles chinois proposent l’acupuncture comme traitement du glaucome en association ou non aux traitements antiglaucomateux allopathiques. Certains tentent même de prouver l’efficacité de l’acupuncture – en particulier le traitement auriculaire – sur le FSO grâce à la mesure écho-Doppler de vaisseaux rétrobulbaires [77]. D’autres études rapportent une amélioration significative de la PIO et de l’acuité visuelle par rapport à l’état antérieur, mais l’effet reste temporaire, l’état initial étant recouvré après quatre semaines sans traitement [74]. Il n’existe pas de preuve de l’effet bénéfique au long cours.
Même si le traitement du glaucome est encore essentiellement axé sur la baisse de la PIO, de nombreuses études nous incitent désormais à nous pencher sur le traitement des autres facteurs de risque associés de la maladie glaucomateuse : les facteurs génétiques, vasculaires, dégénératifs, immunologiques et environnementaux. La prise en charge de certains de ces pans de la maladie est encore au stade de la recherche, comme l’immunothérapie ou la neuroprotection, mais il est déjà possible de s’intéresser aux paramètres vasculaires et environnementaux. La quête de ces facteurs vasculaires est un temps primordial dans la prise en charge des patients glaucomateux car, à l’aide des autres professionnels de santé comme les généralistes et les cardiologues, un certain nombre d’entre eux peut être contrôlé.
Le lecteur trouvera des informations complémentaires dans les références [10, 34, 41, 48, 55, 61, 81, 85-87].
Retenir
-
La prise en charge thérapeutique du glaucome est encore essentiellement fondée sur la réduction de la PIO, mais d’autres facteurs de risque peuvent être contrôlés.
-
Ce sont principalement les facteurs vasculaires et environnementaux qu’il est important de prendre en considération.
-
La recherche systématique des facteurs de risque vasculaires est un point clé de la prise en charge du patient glaucomateux : il faut préserver à tout prix la perfusion oculaire en évitant les hypotensions artérielles délétères et les vasoconstricteurs, et en luttant contre l’artériosclérose.
-
La réflexion sur les facteurs environnementaux débute seulement. Dans l’avenir, il faudra probablement intégrer dans la stratégie thérapeutique un certain degré d’hygiène de vie, en particulier alimentaire, et la lutte contre l’exposition aux produits chimiques neurotrophiques, comme les pesticides.
-
Encore au stade de la recherche scientifique, la vaccination et la neuroprotection vont probablement être développées dans les dix ans à venir.
[1] Ahlemeyer B, Krieglstein J. Neuroprotective effects of Ginkgo biloba extract. Cell Mol Life Sci. 2003 ; 60 : 1779-92.
[2] Aydin B, Onol M, Hondur A, et al. The effect of oral magnesium therapy on visual field and ocular blood flow in normotensive glaucoma. Eur J Ophthalmol. 2010 ; 20 : 131-5.
[3] Blumen Ohana E, Blumen MB, Bluwol E, et al. Primary open angle glaucoma and snoring : prevalence of OSAS. Eur Ann Otorhinolaryngol Head Neck Dis. 2010 ; 127 : 159-64.
[4] Broadway DC, Drance SM. Glaucoma and vasospasme. Br J Ophthalmol 1998 ; 82 : 855-6.
[5] Caprioli J, Coleman AL. Blood pressure, perfusion pressure, and glaucoma. Am J Ophthalmol. 2010 ; 149 : 704-12.
[6] Caramazza N, Damele M, Parente G, et al. Use of polyunsatured fatty acids in the treatment of glaucomatous optic neuropathy (GON). Ann Ottalmol Clin Ocul. 1999 ; 125 : 329-38.
[7] Cheung N, Wong TY. Obesity and eye diseases. Surv Ophthalmol. 2007 ; 52 : 180-95.
[8] Chien FY, Wang RF, Mittag TW, Podos SM. Effect of WIN 55212-2, a cannabinoid receptor agonist, on aqueous humor dynamics in monkeys. Arch Ophthalmol. 2003 ; 121 : 87-90.
[9] Choi WS, Choi CJ, Kim KS, et al. To compare the efficacy and safety of nifedipine sustained release with Ginkgo biloba extract to treat patients with primary Raynaud’s phenomenon in South Korea ; Korean Raynaud study (KOARA study). Clin Rheumatol. 2009 ; 28 : 553-9.
[10] Chua BE, Nguyen DQ, Qin Q, et al. Bleb vascularity following post-trabeculectomy subcojunctival bevacizumab : a pilot study. Clin Experiment Ophthalmol. 2012 ; 40 : 773-9.
[11] Chung HS, Harris A, Kristinsson JK, et al. Ginkgo biloba extract increases ocular blood flow velocity. J Ocul Pharmacol Ther. 1999 ; 15 : 233-40.
[12] Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol. 2008 ; 53 (Suppl. 1) : S3-10.
[13] Cybulska-Heinrich AK, Mozaffarieh M, Flammer J. Ginkgo biloba : an adjuvant therapy for progressive normal and high tension glaucoma. Mol Vis. 2012 ; 18 : 390-402.
[14] Danesh-Meyer HV. Neuroprotection in glaucoma : recent and future directions. Curr Opin Ophthalmol. 2011 ; 22 : 78-86.
[15] Ernst E. Effects of n-3 fatty acids on blood rheology. J Intern Med Suppl. 1989 ; 225 : 129-32.
[16] Fang JH, Wang XH, Xu ZR, Jiang FG. Neuroprotective effects of bis (7)-tacrine against glutamate-induced retinal ganglion cells damage. BMC Neurosci. 2010 ; 11 : 31.
[17] Faridi O, Park SC, Liebmann JM, Ritch R. Glaucoma and obstructive sleep apnoea syndrome. Clin Experiment Ophthalmol. 2012 ; 40 : 408-19.
[18] Flammer J, Mozaffarieh M. Autoregulation, a balancing act between supply and demand. Can J Ophthalmol. 2008 ; 43 : 317-21.
[19] Flammer J, Pache M, Resink T. Vasospasm, its role in the pathogenesis of diseases with particular reference to the eye. Prog Retin Eye Res. 2001 ; 20 : 319-49.
[20] Flammer J. The vascular concept of glaucoma. Surv Ophthalmol. 1994 ; 38 (Suppl.) : S3-6.
[21] Gaspar AZ, Gasser P, Flammer J. The influence of magnesium on visual field and peripheral vasopasm in glaucoma. Ophthalmologica. 1995 ; 209 : 11-3.
[22] Giaconi JA, Yu F, Stone KL, et al. Study of Osteoporotic Fractures Research Group. The association of consumption of fruits/vegetables with decreased risk of glaucoma among older African-American women in the study of osteoporotic fractures. Am J Ophthalmol. 2012 ; 154 : 635-44.
[23] Graham SL, Drance SM, Wijsman K, et al. Ambulatory blood pressure monitoring in glaucoma. The nocturnal dip. Ophthalmology. 1995 ; 102 : 61-9.
[24] Gugleta K, Orgül S, Stumpfig D, et al. Fludrocortisone in the treatment of systemic hypotension in primary open-angle glaucoma patients. Int Ophtalmol. 1999 ; 23 : 25-30.
[25] Guo L, Cordeiro MF. Assessment of neuroprotection in the retina with DARC. Prog Brain Res. 2008 ; 173 : 437-50.
[26] Harris A, Swartz D, Engen D, et al. Ocular hemodynamic effects of acute ethanol ingestion. Ophthalmic Res. 1996 ; 28 : 193-200.
[27] Hayashi N, Ikemura T, Someya N. Effects of dynamic exercise and its intensity on ocular blood flow in humans. Eur J Appl Physiol. 2011 ; 111 : 2601-6.
[28] Ishikawa M, Sawada Y, Sato N, Yoshitomi T. Risk factors for primary open-angle glaucoma in Japanese subjects attending community health screenings. Clin Ophthalmol. 2011 ; 5 : 1531-7.
[29] Kang JH, Pasquale LR, Rosner BA, et al. Prospective study of cigarette smoking and the risk of primary open-angle glaucoma. Arch Ophthalmol. 2003 ; 121 : 1762-8.
[30] Kang JH, Pasquale LR, Willett W, et al. Antioxidant intake and primary open-angle glaucoma : a prospective study. Am J Epidemiol. 2003 ; 158 : 337-46.
[31] Kang JH, Pasquale LR, Willett WC, et al. Dietary fat consumption and primary open-angle glaucoma. Am J Clin Nutr. 2004 ; 79 : 755-64.
[32] Karakucuk S, Goktas S, Aksu M, et al. Ocular blood flow in patients with obstructive sleep apnea syndrome (OSAS). Graefes Arch Clin Exp Ophthalmol. 2008 ; 246 : 129-34.
[33] Kiekens S, De Groot V, Coeckelbergh T, et al. Continuous Positive airway pressure therapy is associated with an increase in intraocular pressure in obstructive sleep apnea. Invest Ophthalmol Vis Sci. 2008 ; 49 : 934-40.
[34] Killer HE, Miller NR, Flammer J, et al. Cerebrospinal fluid exchange in the optic nerve in normal-tension glaucoma. Br J Ophthalmol. 2012 ; 96 : 544-8.
[35] Kringelholt S, U Simonsen, Bek T. Dorzolamide-induced relaxation of intraocular porcine ciliary arteries in vitro depends on nitric oxide and the vascular endothelium. Curr Eye Res. 2012 ; 37 : 1107-13.
[36] Lee J, Sohn SW, Kee C. Effect of Ginkgo biloba extract on visual field progression in normal tension glaucoma. J Glaucoma. 2013 ; 22 : 780-4.
[37] Leske MC. Ocular perfusion pressure and glaucoma : clinical trial and epidemiologic findings. Curr Opin Ophthalmol. 2009 ; 20 : 73-8.
[38] Lin HC, Kang JH, Jiang YD, Ho JD. Hypothyroidism and the risk of developing open-angle glaucoma : a five-year population-based follow-up study. Ophthalmology. 2010 ; 117 : 1960-6.
[39] Luksch A, Rainer G, Koyuncu D, et al. Effect of nimodipine on ocular blood flow and colour contrast sensitivity in patients with normal tension glaucoma. Br J Ophthalmol. 2005 ; 89 : 21-5.
[40] Mancino M, Ohia E, Kulkarni P. A comparative study between cod liver oil and liquid lard int on intraocular pressure on rabbits. Prostag Leukotr Ess. 1992 ; 45 : 239-43.
[41] Merritt JC, Crawford WJ, Alexander PC, et al. Effect of marihuana on intraocular and blood pressure in glaucoma. Ophthalmology. 1980 ; 87 : 222-8.
[42] Mojon DS, Hess CW, Goldblum D, et al. High prevalence of glaucoma in patients with sleep apnea syndrome. Ophthalmology. 1999 ; 106 : 1009-12.
[43] Mozaffarieh M, Flammer J. A novel perspective on natural therapeutic approaches in glaucoma therapy. Expert Opin Emerg Drugs. 2007 ; 12 : 195-8.
[44] Mozaffarieh M, Flammer J. New insights in the pathogenesis and treatment of normal tension glaucoma. Curr Opin Pharmacol. 2013 ; 13 : 43-9.
[45] Muntner P, Woodward M, Mann DM, et al. Comparison of the Framingham Heart Study hypertension model with blood pressure alone in the prediction of risk of hypertension : the Multi-Ethnic Study of Atherosclerosis. Hypertension. 2010 ; 55 : 1339-45.
[46] Nguyen CT, Vingrys AJ, Bui BV. Dietary ω-3 deficiency and IOP insult are additive risk factors for ganglion cell dysfunction. J Glaucoma. 2013 ; 22 : 269-77.
[47] Nguyen CT, Bui BV, Sinclair AJ, Vingrys AJ. Dietary omega 3 fatty acids decrease intraocular pressure with age by increasing aqueous outflow. Invest Ophthalmol Vis Sci. 2007 ; 48 : 756-62.
[48] Nucci C, Tartaglione R, Cerulli A, et al. Retinal damage caused by high intraocular pressure-induced transient ischemia is prevented by coenzyme Q10 in rat. Int Rev Neurobiol. 2007 ; 82 : 397-406.
[49] Osborne NN. Recent clinical findings with memantine should not mean that the idea of neuroprotection in glaucoma is abandoned. Acta Ophthalmol. 2009 ; 87 : 450-4.
[50] Parisi V, Coppola G, Centofanti M, et al. Evidence of the neuroprotective role of citicoline in glaucoma patients. Prog Brain Res. 2008 ; 173 : 541-54.
[51] Park JW, Kwon HJ, Chung WS, et al. Short-term effects of Ginkgo biloba extract on peripapillary retinal blood flow in normal tension glaucoma. Korean J Ophthalmol. 2011 ; 25 : 323-8.
[52] Pasquale LR, Willett WC, Rosner BA, Kang JH. Anthropometric measures and their relation to incident primary open-angle glaucoma. Ophthalmology. 2010 ; 117 : 1521-9.
[53] Passo MS, Goldberg L, Elliot DL, et al. Exercise training reduces intraocular pressure among subjects suspect of having glaucoma. Arch Ophthalmol. 1991 ; 109 : 1096-8.
[54] Pépin JL, Chiquet C, Tamisier R, et al. Frequent loss of nyctohemeral rhythm of intraocular pressure restored by nCPAP treatment in patients with severe apnea. Arch Ophthalmol. 2010 ; 128 : 1257-63.
[55] Portmann N, Gugleta K, Kochkorov A, et al. Choroidal blood flow response to isometric exercise in glaucoma patients and patients with ocular hypertension. Invest Ophthalmol Vis Sci. 2011 ; 52 : 7068-73.
[56] Qiu XD, Gong L, Chen MJ. Research on effects of vitamin A palmitate on repair of mechanical corneal epithelial defects and conjunctival goblet cells in rabbits. Chin J Ophthalmol. 2010 ; 46 : 151-60.
[57] Quaranta L, Bettelli S, Uva MG, et al. Effect of Ginkgo biloba extract on preexisting visual field damage in normal tension glaucoma. Ophthalmology. 2003 ; 110 : 359-62.
[58] Quigley HA. Clinical trials for glaucoma neuroprotection are not impossible. Curr Opin Ophthalmol. 2012 ; 23 : 144-54.
[59] Ren H, Magulike N, Ghebremeskel K, Crawford M. Primary open-angle glaucoma patients have reduced levels of blood docosahexaenoic and eicosapentaenoic acids. Prostaglandins Leukot Essent Fatty Acids. 2006 ; 74 : 157-63.
[60] Renard JP, Rouland JF, Bron A, et al. Nutritional, lifestyle and environmental factors in ocular hypertension and primary open-angle glaucoma : an exploratory case-control study. Acta Ophthalmol. 2013 ; 91 : 505-13.
[61] Rhee DJ, Spaeth GL, Myers JS. Prevalence of the use of complementary and alternative medicine for glaucoma. Ophthalmology. 2002 ; 109 : 438-43.
[62] Risner D, Ehrlich R, Kheradiya NS, et al. Effects of exercise on intraocular pressure and ocular blood flow : a review. J Glaucoma. 2009 ; 18 : 429-36.
[63] Ritch R. Complementary therapy for the treatment of glaucoma : a perspective. Ophthalmol Clin North Am. 2005 ; 18 : 597-609.
[64] Rosa RH, Hein TW, Yuan Z, et al. Brimonidine evokes heterogeneous vasomotor response of retinal arterioles : diminished nitric oxide-mediated vasodilation when size goes small. Am J Physiol Heart Circ Physiol. 2006 ; 291 : H231-8.
[65] Rosenthal R, Fromm M. Endothelin antagonism as an active principle for glaucoma therapy. Br J Pharmacol. 2011 ; 162 : 806-16.
[66] Samuels BC, Hammes NM, Johnson PL, et al. Dorsomedial/Perifornical hypothalamic stimulation increases intraocular pressure, intracranial pressure, and the translaminar pressure gradient Invest Ophthalmol Vis Sci. 2012 ; 53 : 7328-35.
[67] Saylor M, McLoon LK, Harrison AR, Lee MS. Experimental and clinical evidence for brimonidine as an optic nerve and retinal neuroprotective agent. An evidence-based review. Arch Ophthalmol. 2009 ; 127 : 402-6.
[68] Schmidt KG, Klingmüller V, Gouveia SM, et al. Short posterior ciliary artery, central retinal artery, and choroidal hemodynamics in brimonidine-treated primary open-angle glaucoma patients. Am J Ophthalmol. 2003 ; 136 : 1038-48.
[69] Schnebelen C, Pasquis B, Salinas-Navarro M, et al. A dietary combination of omega-3 and omega-6 polyunsaturated fatty acids is more efficient than single supplementations in the prevention of retinal damage induced by elevation of intraocular pressure in rats. Graefes Arch Clin Exp Ophthalmol. 2009 ; 247 : 1191-203.
[70] Schuettauf F, Rejdak R, Thaler S, et al. Citicoline and lithium rescue retinal ganglion cells following partial optic nerve crush in the rat. Exp Eye Res. 2006 ; 83 : 1128-34.
[71] Schwartz K, Budenz D. Current management of glaucoma. Curr Opin Ophthalmol. 2004 ; 15 : 119-26.
[72] Sena DF, Ramchand K, Lindsley K. Neuroprotection for treatment of glaucoma in adults. Cochrane Database Syst Rev. 2010 ; 2 : CD006539.
[73] Shim SH, Kim JM, Choi CY, et al. Ginkgo biloba extract and bilberry anthocyanins improve visual function in patients with normal tension glaucoma. J Med Food. 2012 ; 15 : 818-23.
[74] Son JS, Liu PL, Cheng NC. Intraocular pressure-lowering effect of auricular acupressure in patients with glaucoma : a prospective, single-blinded, randomized controlled trial. J Altern Complement Med. 2010 ; 16 : 1177-84.
[75] Spicher T, Orgül S, Gugleta K, et al. The effect of losartan potassium on choroidal hemodynamics in healthy subjects. J Glaucoma. 2002 ; 11 : 177-82.
[76] Stefánsson E, Pedersen DB, Jensen PK, et al. Optic nerve oxygenation. Prog Retin Eye Res. 2005 ; 24 : 307-32.
[77] Takayama S, Watanabe M, Kusuyama H, et al. Evaluation of the effects of acupuncture on blood flow in humans with ultrasound color Doppler imaging. Evid Based Complement Alternat Med. 2012 ; 2012 : 513638.
[78] Tomita K, Araie M, Tamaki Y, et al. Effects of nilvadipine, a calcium antagonist, on rabbit ocular circulation and optic nerve head circulation in NTG subjects. Invest Ophthalmol Vis Sci. 1999 ; 40 : 1144-51.
[79] Varma R, Peeples P, Walt JG, Bramley TJ. Disease progression and the need for neuroprotection in glaucoma management. Am J Manag Care. 2008 ; 14 (Suppl. 1) : S15-9.
[80] Walsh JT, Montplaisir J. Familial glaucoma with sleep apnoea : a new syndrome ? Thorax. 1982 ; 37 : 845-9.
[81] Wan MJ, Daniel S, Kassam F, et al. YM. Survey of complementary and alternative medicine use in glaucoma patients. J Glaucoma. 2012 ; 21 : 79-82.
[82] Wang N, Xie X, Yang D, et al. Orbital cerebrospinal fluid space in glaucoma : The Beijing Intracranial and Intraocular Pressure (iCOP) Study. Ophthalmology. 2012 ; 119 : 2065-73.
[83] Wax MB, Tezel G, Yang J, et al. Induced autoimmunity to heat shock proteins elicits glaucomatous loss of retinal ganglion cell neurons via activated T cell-derived Fas-ligand. J Neurosci. 2008 ; 28 : 12085-96.
[84] Wostyn P, De Groot V, Audenaert K, De Deyn PP. Are intracranial pressure fluctuations important in glaucoma ? Med Hypotheses. 2011 ; 77 : 598-600.
[85] Yip JL, Broadway DC, Luben R, et al. Physical activity and ocular perfusion pressure : the EPIC-Norfolk eye study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8186-92.
[86] Yücel YH, Gupta N, Zhang Q, et al. Memantine protects neurons from shrinkage in the lateral geniculate nucleus in experimental glaucoma. Arch Ophthalmol. 2006 ; 124 : 217-25.
[87] Yuki K, Murat D, Kimura I, et al. Reduced-serum vitamin C and increased uric acid levels in normal-tension glaucoma. Graefes Arch Clin Exp Ophthalmol. 2010 ; 248 : 243-8.
F. Aptel
Le traitement actuel du GPAO, quel qu’il soit, se limite à corriger un de ses facteurs de risque en réduisant la pression intra-oculaire (PIO). Pour ce qui est des traitements médicaux, la dernière évolution majeure reste l’avènement de la classe des analogues de prostaglandines, survenu maintenant il y a plus de quinze ans. Pour ce qui est des traitements chirurgicaux, les chirurgies filtrantes conventionnelles (trabéculectomie et sclérectomie profonde non perforante) restent de loin les procédures de choix, notamment en Europe. Si les pratiques thérapeutiques dans le domaine du glaucome n’ont pas profondément changé ces dernières années, il faut néanmoins noter qu’elles ont progressivement évolué. De nouvelles formulations sans conservateur ou utilisant d’autres conservateurs que le chlorure de benzalkonium ont été développées et sont disponibles pour la classe des bêtabloquants et des analogues de prostaglandines. De nouvelles combinaisons fixes, associant plusieurs principes actifs dans un même flacon, ont également été développées, certaines utilisant de façon similaire une formulation sans conservateur ou d’autres conservateurs que le chlorure de benzalkonium. Les trabéculoplasties réalisées à l’aide de lasers pulsés remplacent progressivement les procédures réalisées à l’aide de lasers à émission continue. Enfin, pour ce qui est des traitements chirurgicaux, de nouvelles techniques chirurgicales ou de nouveaux dispositifs souvent implantables ont été développés de façon à faciliter l’évacuation de l’humeur aqueuse (HA) en dehors de l’œil sans passer par l’intermédiaire d’une filtration transconjonctivale, à utiliser d’autres mécanismes d’action (voie suprachoroïdienne, voie trans-sclérale), et ainsi éviter les complications de bulles de filtration (infection, fuite d’HA, fibrose).
De nombreux travaux expérimentaux, précliniques ou aux stades initiaux du développement clinique, présentés ces dernières années laissent augurer des évolutions importantes des méthodes actuelles de traitement ou l’apparition de méthodes radicalement nouvelles prochainement. Ce chapitre se propose de présenter un bref panorama des médicaments et technologies nouveaux ou émergents.
Les quatre classes thérapeutiques communément utilisées pour le traitement du GPAO – analogues de prostaglandines, bêtabloquants, α2-agonistes et inhibiteurs de l’anhydrase carbonique – agissent soit en diminuant la production d’HA, soit en favorisant son élimination par voie uvéosclérale. Aucune de ces classes thérapeutiques n’agit principalement sur l’élimination de l’HA par voie trabéculaire, alors que celle-ci est largement majoritaire – responsable d’environ 80 à 90 % des capacités totales d’élimination de l’œil – et est généralement responsable de l’élévation de la PIO rencontrée en cas de glaucome. L’absence de telles classes thérapeutiques agissant sur l’élimination par voie trabéculaire peut probablement s’expliquer par la complexité des mécanismes cellulaires et biochimiques impliqués dans la régulation des différentes fonctions du trabéculum, qui restaient jusqu’à récemment majoritairement inconnus, empêchant l’identification de cibles accessibles à une thérapeutique pharmacologique. Les différentes recherches conduites ces dix dernières années permettent de mieux appréhender l’organisation du trabéculum et les différentes structures et voies moléculaires impliquées dans la régulation de ces fonctions qui peuvent aboutir à une élévation de la PIO lorsqu’elles sont perturbées.
Deux éléments principaux déterminant les capacités de filtration du trabéculum peuvent constituer des cibles de nouvelles thérapies : l’activité contractile des protéines du cytosquelette des cellules trabéculaires d’une part, et l’organisation structurelle et le volume de la matrice extracellulaire (MEC) d’autre part. Deux nouvelles classes thérapeutiques sont ainsi constituées, les inhibiteurs des protéines rho-kinases, agissant par remodelage du cytosquelette actinique des cellules trabéculaires, et les agonistes des enzymes métalloprotéinases, agissant par remodelage de la MEC (voir chapitre 7). Les premiers résultats d’études cliniques humaines réalisées chez des volontaires sains ou chez des patients glaucomateux ont été présentés ou publiés récemment, et donnent un premier aperçu de l’intérêt et de la place potentielle de ces nouvelles classes thérapeutiques.
Une étude de phase 1 réalisée chez des sujets sains a évalué l’effet pressionnel et la tolérance de différentes concentrations de l’inhibiteur des rho-kinases K-115 instillées une ou deux fois par jour [29]. La baisse pressionnelle variait de – 3,4 à – 4,3 mmHg versus – 1,6 mmHg avec un placebo. Le principal effet secondaire, présenté par plus de la moitié des sujets traités, était une hyperhémie modérée et transitoire, généralement résolutive en moins de 30 minutes.
Une étude contrôlée randomisée de phase 2 a été réalisée chez 210 patients hypertones ou glaucomateux, recevant soit du K-115 (0,1 %, 0,2 % ou 0,4 %) deux fois par jour, soit un placebo [28]. Après deux mois de suivi, des réductions pressionnelles modestes étaient obtenues, variant de – 11,7 % à – 19,1 % dans les yeux traités par K-115 versus – 8,2 % à – 10,8 % dans les yeux traités par placebo. Une hyperhémie transitoire et proportionnelle à la dose était également observée. Des équipes américaines ont récemment publié des résultats obtenus avec l’inhibiteur des rho-kinases AR-12286 [33] : 89 sujets hypertones ont été randomisés et ont reçu un traitement par AR-12286 (trois dosages possibles) ou un placebo, une fois par jour pendant sept jours, puis deux fois par jour pendant sept jours, puis trois fois par jour pendant sept jours. La baisse pressionnelle maximale était obtenue avec le dosage maximal à la dose de deux fois par jour (– 6,8 mmHg ; – 28 %). L’effet secondaire le plus fréquent était une hyperhémie conjonctivale transitoire.
Plusieurs essais cliniques de phase 3 vont débuter et devraient donc très possiblement aboutir à l’utilisation d’inhibiteurs des protéines rho-kinases en pratique courante.
Un laboratoire américain (Inotek Pharmaceuticals, Lexington, MA) évalue actuellement dans une étude multicentrique randomisée contrôlée de phase 2 l’efficacité et la tolérance d’un agoniste des métalloprotéinases (agoniste des récepteurs adénosine-1 INO-8875). Les résultats ne sont pas encore disponibles [15].
L’augmentation de la concentration intracellulaire de calcium augmente la production d’endothéline-1 (ET-1), aboutissant à une augmentation de l’activité contractile des cellules endothéliales trabéculaires et, ainsi, à une diminution de la taille des espaces interlamellaires et de la perméabilité du trabéculum à l’HA. Les inhibiteurs calciques – agissant au niveau des canaux calciques voltage-dépendants en freinant l’entrée normale d’ions calcium au niveau des cellules musculaires – administrés par voie topique peuvent augmenter la perméabilité du trabéculum et diminuer la PIO [31]. La réduction pressionnelle permise semble néanmoins modeste [20]. Plusieurs études de phase 2 sont actuellement réalisées pour évaluer l’intérêt de cette famille de molécules.
L’oxyde nitrique est un radical produit par l’enzyme oxyde nitrique synthase et dont une des actions est d’induire une relaxation des fibres musculaires lisses. Son effet sur le muscle ciliaire tend ainsi à augmenter l’évacuation de l’HA par voie uvéosclérale, mais à diminuer son élimination par voie trabéculaire. Un composé inhibiteur de l’oxyde nitrique synthase – le diéthyldithiocarbamate – peut être utilisé par voie topique pour diminuer la PIO [6, 16]. Un laboratoire travaille également au développement d’un analogue des prostaglandines F2α donneur d’oxyde nitrique (BOL-303259-X). Une étude de phase 2 aurait montré une plus grande aptitude à réduire la PIO que le latanoprost (données non publiées à ce jour). Une étude de phase 3 doit être débutée, laissant augurer une possible mise sur le marché dans les années à venir.
La thérapie génique est une stratégie thérapeutique qui consiste à faire pénétrer des gènes dans les cellules ou les tissus d’un individu afin de les intégrer dans le génome. Elle permet ainsi de remplacer ou de complémenter un allèle mutant défectif par un allèle fonctionnel ou de surexprimer une protéine dont l’activité aurait un impact thérapeutique. Des études expérimentales et animales ont ainsi montré que de telles stratégies pouvaient être utilisées pour augmenter la production intracamérulaire de protéines telles que la caldesmone, des inhibiteurs des protéines rho-kinases ou des métalloprotéinases [13, 19, 27]. L’expression de ces protéines semble pouvoir être prolongée dans le temps et permettrait d’augmenter la perméabilité du trabéculum à l’HA.
Plusieurs études ont montré qu’il était possible d’isoler des cellules trabéculaires humaines afin de les mettre en culture, puis ensuite de les réinjecter en chambre antérieure. Ces cellules se localisent alors au niveau des lamelles du trabéculum, et semblent ensuite acquérir les fonctions normales des cellules trabéculaires humaines (phagocytose de macroparticules, régulation de la composition et de la quantité de la MEC, etc.) [10, 11]. Il est de ce fait possible d’imaginer la réalisation d’une auto- ou allogreffe consistant en l’injection intracamérulaire de cellules trabéculaires activées et fonctionnelles, ou même l’administration intracamérulaire ou topique d’agents pharmacologiques qui activeraient in situ les fonctions ou la réplication des cellules endothéliales trabéculaires.
La voie d’administration topique actuellement utilisée avec tous les traitements antiglaucomateux présente un certain nombre d’inconvénients. D’une part, elle expose inutilement la surface oculaire aux principes actifs, excipients et conservateurs, alors que les cibles d’action des principes actifs sont toutes situées à l’intérieur de l’œil. Cette exposition de la surface oculaire est source de nombreux et fréquents effets secondaires (hyperhémie conjonctivale, sensation de brûlure, irritation, démangeaisons, etc.) et aboutit par effet toxique à différents dommages de la surface oculaire aux conséquences multiples (sécheresse oculaire, fibrose conjonctivale grevant le pronostic d’une éventuelle chirurgie filtrante ultérieure, etc.). Tous ces éléments combinés tendent à diminuer l’observance thérapeutique des patients glaucomateux. D’autre part, la complexité de la voie d’administration topique (nécessité de pouvoir instiller la goutte de façon adaptée) et du schéma thérapeutique des collyres administrés par voie topique (souvent plusieurs instillations par jour) semble également être un facteur de mauvaise observance.
Certaines classes thérapeutiques ou formulations galéniques ont été développées pour permettre, entre autres, de diminuer le nombre de collyres utilisés, la fréquence d’instillation, la concentration en conservateurs, donc pour favoriser une meilleure observance thérapeutique. L’utilisation d’analogues de prostaglandines ou de bêtabloquants à libération prolongée permet ainsi de réduire la fréquence d’administration à une instillation journalière, et celle de combinaisons fixes le nombre de collyres instillés et la quantité totale de conservateurs administrés.
Ces dernières années, d’assez nombreuses équipes ou laboratoires ont travaillé à l’élaboration de nouvelles formulations de principes actifs déjà existant permettant de réduire la fréquence d’instillation à moins d’une instillation par jour. Différentes stratégies sont étudiées. On peut distinguer les produits destinés à être placés à la surface du globe – sous forme de dispositifs tels qu’une lentille ou un bouchon lacrymal imprégnés d’un principe actif, ou sous forme de particules contenant un principe actif et ayant un temps de rémanence prolongé – des produits destinés à être injectés par voie sous-conjonctivale, intracamérulaire ou intravitréenne.
Différents matériaux (film d’acide polylactique-polyglycolique, surfactant à base de polyoxyéthylène) ou molécules (vitamine E, etc.) peuvent être associés à des agents thérapeutiques (analogues des prostaglandines, bêtabloquants) au sein d’une lentille souple, et permettent ainsi chez l’animal d’obtenir une concentration intracamérulaire efficace pendant quatre semaines ou plus [34]. L’administration topique ou sous-conjonctivale de particules muco-adhésives ou de liposomes contenant un agent thérapeutique rend également possible une concentration intracamérulaire efficace pendant quelques jours à une semaine, sans signe histologique ou clinique de mauvaise tolérance chez l’animal [34, 12].
Chez l’homme, différents laboratoires évaluent actuellement dans des essais cliniques de phase 2 des dispositifs à libération contrôlée de latanoprost (implant intravitréen biodégradable), de brimonidine (implant intravitréen biodégradable) et de bimatoprost (implant intracamérulaire biodégradable). Ces différents implants permettraient une libération de principes actifs suffisante avec un effet thérapeutique pendant une durée de trois mois.
La cyclocoagulation par ultrasons (ultrasonic circular cyclocoagulation) est une nouvelle méthode de coagulation du corps ciliaire permettant d’éviter les complications rencontrées avec les méthodes habituelles ; elle est présentée de façon exhaustive dans le chapitre 16-I [3, 4, 8].
Les deux techniques chirurgicales les plus couramment utilisées en Europe sont la trabéculectomie et la sclérectomie profonde non perforante. Ces procédures facilitent l’évacuation de l’HA en dehors de l’œil par l’intermédiaire d’une perforation de pleine épaisseur ou au contraire incomplète de la paroi de l’œil, aboutissant au passage de l’HA de la chambre antérieure ou du canal de Schlemm vers les espaces sous-conjonctivaux.
En alternative à ces techniques dites de chirurgies filtrantes ont été développées ces dernières années des procédures visant à permettre une évacuation de l’HA en dehors de l’œil non tributaire d’une filtration transconjonctivale (voie suprachoroïdienne, voie trans-sclérale, etc.), de façon à éviter toutes les complications liées à la présence d’une bulle de filtration. Ces techniques nouvelles sont nommées chirurgies mini-invasives du glaucome (minimally invasive glaucoma surgery ou MIGS) ou chirurgies indépendantes de la conjonctive (conjunctival independent glaucoma surgery). Les chirurgies mini-invasives peuvent être classées en procédures réalisées ab externo, telles que la pose du drain Express™ (Alcon) ou la procédure de canaloplastie (iScience Interventional), ou réalisées ab interno, telles que le drain iStent™ (Glaukos), la trabéculotomie par le dispositif Trabectome™ (NeoMedix), les drains suprachoroïdiens Cy Pass™ (Transcend Medical), Goldshunt™ (Solx) ou Starflo™ (iStar), ou l’endocyclophotocoagulation (Endo Optiks) [5, 14, 21-24, 26]. Les nouvelles chirurgies mini-invasives réalisées ab externo sont comparables à la sclérectomie profonde en termes d’aptitude à réduire la PIO et de tolérance : leur utilisation est donc souvent limitée par le coût des dispositifs. Les nouvelles chirurgies mini-invasives réalisées ab interno présentent souvent une aptitude à réduire la PIO modeste et inférieure à celle des chirurgies filtrantes conventionnelles, et sont de ce fait essentiellement réalisées en association à une procédure de chirurgie de la cataracte chez des patients présentant des glaucomes peu évolués.
La neuroprotection a pour but de protéger le nerf optique en ralentissant ou en stoppant l’apoptose des cellules ganglionnaires rétiniennes par d’autres méthodes que la réduction de la PIO. De nombreux agents neuroprotecteurs ont été identifiés in vitro, et un certain nombre d’entre eux ont prouvé leur efficacité pour prévenir ou ralentir le développement de maladies neurodégénératives telles que les maladies d’Alzheimer et de Parkinson. L’utilisation d’une molécule neuroprotectrice pour le traitement du glaucome se heurte néanmoins à certains obstacles. Un récepteur cellulaire à la molécule doit être présent au niveau des neurones ou des tissus de soutien de la rétine. Une voie d’administration simple, permettant une bonne biodisponibilité du principe actif au niveau du segment postérieur de l’œil et du nerf optique, doit exister. L’interaction de la molécule avec ses récepteurs cellulaires doit engendrer une cascade de réactions aboutissant à protéger les cellules ganglionnaires rétiniennes de l’apoptose. Enfin, l’efficacité clinique de cet agent pharmacologique doit être déterminée dans un ou plusieurs essais cliniques randomisés prospectifs qui doivent s’affranchir de nombreux biais méthodologiques – variations de la PIO, comorbidités associées, etc. – pour pouvoir démontrer une efficacité réelle.
Plusieurs composés ont fait preuve d’un effet neuroprotecteur dans des études expérimentales ou précliniques (inhibiteur non compétitif du récepteur NMDA au glutamate, inhibiteurs calciques, α-agonistes, inhibiteurs de la nitrite oxyde synthase, etc.). Seuls un inhibiteur non compétitif du récepteur NMDA au glutamate et des inhibiteurs calciques ont été évalués dans des études cliniques. La mémantine, qui est un inhibiteur non compétitif du récepteur NMDA au glutamate, n’a pas montré d’effet significatif pour ralentir la progression des déficits périmétriques dans un large essai clinique de phase 3 qui la comparait à un placebo. Les inhibiteurs calciques ont été évalués dans de petites séries présentant de nombreux biais méthodologiques (petits effectifs, pas de calcul du nombre de sujets nécessaires, pas de randomisation, etc.), empêchant d’en tirer des conclusions valables [17].
L’étude Low Pressure Glaucoma Treatment Study a comparé l’effet sur la progression des déficits périmétriques du timolol et de la brimonidine administrés par voie topique [18]. Malgré une réduction pressionnelle comparable, le risque de progression était presque quatre fois plus faible dans le groupe des patients traités par brimonidine, suggérant un possible effet neuroprotecteur associé. Un dispositif permettant l’injection intravitréenne d’un implant à relargage prolongé de brimonidine (polymère biodégradable) est actuellement évalué dans un essai clinique de phase 2, et pourrait donc être utilisé en pratique courante dans les années à venir.
Des études expérimentales ou animales ont démontré qu’il était possible d’utiliser des vecteurs viraux ou non viraux pour intégrer, dans le génome de différentes cellules de l’œil (cellules ganglionnaires rétiniennes, cellules de la glie, cellules rétiniennes, etc.), des allèles permettant ensuite à ces mêmes cellules de produire des protéines qui peuvent avoir un effet neuroprotecteur (brain-derived neurotrophic factor, inhibiteurs des protéines caspases, ciliary-derived neurotrophic factor, neurotrophines anti-apoptotiques, érythropoïétine, etc.) [1, 7, 32]. Il faut néanmoins noter qu’à ce jour aucune étude clinique n’a évalué l’efficacité et la sécurité de telles méthodes chez l’homme.
Des études expérimentales et animales ont montré qu’il était possible d’injecter à l’intérieur de l’œil (injection intravitréenne) ou autour de l’œil (injection sous-ténonienne, injection à proximité du nerf optique) des cellules souches (nerveuses, gliales, etc.) qui peuvent participer à la restauration de différents tissus oculaires, soit en s’intégrant directement à ces tissus et en se différenciant ensuite, soit en produisant des facteurs de croissance qui agissent sur les cellules restantes [32]. De façon similaire, aucune étude clinique n’a, à ce jour, évalué l’efficacité et la sécurité de telles méthodes chez l’homme.
Plusieurs laboratoires ou sociétés ont développé des prothèses rétiniennes, consistant en un système de capteurs multiples qui détectent la lumière et envoient ensuite un signal électrique vers des électrodes insérées dans le nerf optique, mais qui nécessitent la présence d’un nerf optique fonctionnel, et ne peuvent donc être proposées qu’aux patients atteints de cécité profonde d’origine rétinienne (retinis pigmentosa, etc.). Ces prothèses ont été évaluées dans quelques séries de patients publiées [9]. Plusieurs laboratoires travaillent également au développement de systèmes comportant des électrodes implantées ou stimulant directement le cortex cérébral visuel (Utah Electrode Arrays, etc.), qui permettraient donc de s’affranchir du nerf optique, et pourraient être ainsi proposés aux patients atteints de cécité profonde par destruction du nerf optique (glaucome, neuropathie optique héréditaire) [25, 30]. Ces équipements nécessitent cependant des procédures chirurgicales lourdes et ne permettent que des résultats actuellement modestes (perception d’une ambiance lumineuse, perception du déplacement d’objet de grande taille, etc.). Les progrès des micro- et nanotechnologies d’une part, et de l’imagerie fonctionnelle cérébrale d’autre part, augurent néanmoins de progrès dans ce domaine.
Différents arguments laissent penser que la lame criblée peut être le site anatomique de différents événements pouvant aboutir à l’apoptose des cellules ganglionnaires rétiniennes. La lame criblée est composée de différentes lamelles de tissu conjonctif et d’élastine, empilées les unes sur les autres, et perforées d’environ 200 à 300 pores destinés au passage des cellules ganglionnaires rétiniennes. Des astrocytes constituent le tissu de soutien des cellules ganglionnaires rétiniennes lors de leur passage dans ces pores, les séparant des tissus conjonctifs des lamelles de la lame criblée, et les séparant entre elles. La lame criblée permet donc le passage de différents éléments nerveux et vasculaires, son anatomie et ses propriétés biomécaniques étant destinées à préserver ces éléments du gradient de pression existant entre l’intérieur du globe oculaire et les espaces sous-arachnoïdiens. Il a donc été suggéré que des modifications de l’anatomie et/ou des propriétés biomécaniques (compressibilité, déformabilité, élasticité, perméabilité, etc.) de la lame criblée et de la sclère située au voisinage de celle-ci pouvaient, lors de variations de la PIO ou du gradient de pression translaminaire, entraîner un étirement, une compression, un cisaillement ou une torsion des axones des cellules ganglionnaires, et initier l’engagement de ces cellules sur la voie de l’apoptose cellulaire. La possibilité de modifier les propriétés biomécaniques de la sclère et de la lame criblée de façon à modifier la réponse de la lame criblée et de différentes structures papillaires et péripapillaires à des variations de pression a été évoquée, mais non démontrée à ce jour [2].
Retenir
De nouveaux agents thérapeutiques ou de nouvelles technologies sont actuellement développés et évalués dans des études expérimentales, précliniques ou cliniques de phase 1 ou 2. L’examen des preuves scientifiques disponibles à ce jour peut suggérer que les médicaments ou technologies qui arriveront le plus probablement en pratique courante dans les années à venir seront :
-
les nouvelles classes thérapeutiques agissant sur le trabéculum (inhibiteurs des protéines rho-kinases, agonistes des enzymes métalloprotéinases, etc.) ;
-
les nouvelles formes galéniques et nouvelles voies d’administration permettant un traitement à action prolongée sans administration topique de collyres (implants intracamérulaires ou intravitréens d’analogues de prostaglandines ou d’α-agonistes) ;
-
les analogues des prostaglandines donneurs d’oxyde nitrique ;
-
les nouvelles formulations galéniques permettant une action plus prolongée des traitements topiques existants (particules mucoadhésives, liposomes, etc.).
[1] Alqawlaq S, Huzil JT, Ivanova MV, Foldvari M. Challenges in neuroprotective nanomedicine development : progress towards noninvasive gene therapy of glaucoma. Nanomedicine (Lond). 2012 ; 7 : 1067-83.
[2] Anisimova S, Anisimov S, Tchigovanina N, Arutyunyan L. Surgical neuroprotection by changing the biomechanical properties of sclera in the perineural area in glaucoma. EGS 2012.
[3] Aptel F, Charrel T, Lafon C, et al. Miniaturized high-intensity focused ultrasound device in patients with glaucoma : a clinical pilot study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8747-53.
[4] Aptel F, Charrel T, Palazzi X, et al. Histologic effects of a new device for high-intensity focused ultrasound cyclocoagulation. Invest Ophthalmol Vis Sci. 2010 ; 51 : 5092-8.
[5] Ayyala RS, Chaudhry AL, Okogbaa CB, et al. Comparison of surgical outcomes between canaloplasty and trabeculectomy at 12 months’ follow-up. Ophthalmology. 2011 ; 118 : 2427-33.
[6] Borghi V, Bastia E, Guzzetta M, et al. A novel nitric oxide releasing prostaglandin analog, NCX 125, reduces intraocular pressure in rabbit, dog, and primate models of glaucoma. J Ocul Pharmacol Ther. 2010 ; 26 : 125-32.
[7] Borrás T. Advances in glaucoma treatment and management : gene therapy. Invest Ophthalmol Vis Sci. 2012 ; 53 : 2506-10.
[8] Charrel T, Aptel F, Birer A, et al. Development of a miniaturized HIFU device for glaucoma treatment with conformal coagulation of the ciliary bodies. Ultrasound Med Biol. 2011 ; 37 : 742-54.
[9] da Cruz L, Coley BF, Dorn J, et al. Argus II Study Group. The Argus II epiretinal prosthesis system allows letter and word reading and long-term function in patients with profound vision loss. Br J Ophthalmol. 2013 ; 97 : 632-6.
[10] Du Y, Roh DS, Mann MM, et al. Multipotent stem cells from trabecular meshwork become phagocytic TM cells. Invest Ophthalmol Vis Sci. 2012 ; 53 : 1566-75.
[11] Du Y, Yun H, Yang E, Schuman JS. Stem cells from trabecular meshwork home to TM tissue in vivo. Invest Ophthalmol Vis Sci. 2013 ; 54 : 1450-9.
[12] Fedorchak M, Wingard J, Medina C, et al. Rationally designed, controlled-release glaucoma treatments achieve one month of iop reduction with a single dose. ARVO 2012.
[13] Gabelt BT, Hu Y, Vittitow JL, et al. Caldesmon transgene expression disrupts focal adhesions in HTM cells and increases outflow facility in organ-cultured human and monkey anterior segments. Exp Eye Res. 2006 ; 82 : 935-44.
[14] Haller JA. Transvitreal endocyclophotocoagulation. Trans Am Ophthalmol Soc. 1996 ; 94 : 589-676.
[16] Ito Y, Nagai N, Shimomura Y. Reduction in intraocular pressure by the instillation of eye drops containing disulfiram included with 2-hydroxypropyl-β-cyclodextrin in rabbit. Biol Pharm Bull. 2010 ; 33 : 1574-8.
[17] Koseki N, Araie M, Tomidokoro A, et al. A placebo-controlled 3-year study of a calcium blocker on visual field and ocular circulation in glaucoma with low-normal pressure. Ophthalmology. 2008 ; 115 : 2049-57.
[18] Krupin T, Liebmann JM, Greenfield DS, et al. Low-Pressure Glaucoma Study Group. A randomized trial of brimonidine versus timolol in preserving visual function : results from the Low-Pressure Glaucoma Treatment Study. Am J Ophthalmol. 2011 ; 151 : 671-81.
[19] Liu X, Hu Y, Filla MS, et al. The effects of C3 transgene expression on actin and cellular adhesions in cultured human trabecular meshwork cells and on outflow facility in organ cultured monkey eyes. Mol Vis. 2005 ; 11 : 1112-21.
[20] Mansouri K, Silva SE, Shaarawy T. Efficacy and tolerability of topical 0.05 % flunarizine in patients with open-angle glaucoma or ocular hypertension-a pilot study. J Glaucoma. 2011 ; 20 : 519-22.
[21] Maris PJ, Ishida K, Netland PA. Comparison of trabeculectomy with Ex-PRESS miniature glaucoma device implanted under scleral flap. J Glaucoma. 2007 ; 16 : 14-9.
[22] Melamed S, Ben Simon GJ, Goldenfeld M, Simon G. Efficacy and safety of gold micro shunt implantation to the supraciliary space in patients with glaucoma : a pilot study. Arch Ophthalmol. 2009 ; 127 : 264-9.
[23] Minckler DS, Baerveldt G, Alfaro MR, et al. Clinical results with the Trabectome for treatment of open-angle glaucoma. Ophthalmology. 2005 ; 112 : 962-7.
[24] Minckler DS, Vedula SS, Li TJ, et al. Aqueous shunts for glaucoma. Cochrane Database Syst Rev. 2006 ; 2 : CD004918.
[25] Mohammadi HM, Ghafar-Zadeh E, Sawan M. An image processing approach for blind mobility facilitated through visual intracortical stimulation. Artif Organs. 2012 ; 36 : 616-28.
[26] Samuelson TW, Katz LJ, Wells JM, et al. US iStent Study Group. Randomized evaluation of the trabecular micro-bypass stent with phacoemulsification in patients with glaucoma and cataract. Ophthalmology. 2011 ; 118 : 459-67.
[27] Spiga MG, Borras T. Development of a gene therapy virus with a glucocorticoid-inducible MMP1 for the treatment of steroid glaucoma. Invest Ophthalmol Vis Sci. 2010 ; 51 : 3029-41.
[28] Tanihara H, Inoue T, Yamamoto T, et al. K-115 Clinical Study Group. Phase 2 randomized clinical study of a rho kinase inhibitor, K-115, in primary open-angle glaucoma and ocular hypertension. Am J Ophthalmol. 2013 ; 156 : 731-6.
[29] Tanihara H, Inoue T, Yamamoto T, et al. K-115 Clinical Study Group. Phase 1 Clinical Trials of a Selective Rho Kinase Inhibitor, K-115. JAMA Ophthalmol. 2013 ; 131 : 1288-95.
[30] Troyk P, Bak M, Berg J, et al. A model for intracortical visual prosthesis research. Artif Organs. 2003 ; 27 : 1005-15.
[31] Wang RF, Gagliuso DJ, Podos SM. Effect of flunarizine, a calcium channel blocker, on intraocular pressure and aqueous humor dynamics in monkeys. J Glaucoma. 2008 ; 17 : 73-8.
[32] Wert KJ, Skeie JM, Davis RJ, et al. Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye. J Vis Exp. 2012 ; 69 : 4286.
[33] Williams RD, Novack GD, van Haarlem T, Kopczynski C. AR-12286 Phase 2A Study Group. Ocular hypotensive effect of the Rho kinase inhibitor AR-12286 in patients with glaucoma and ocular hypertension. Am J Ophthalmol. 2011 ; 152 : 834-41.
[34] Xu Q, Kambhampati SP, Kannan RM. Nanotechnology approaches for ocular drug delivery. Middle East Afr J Ophthalmol. 2013 ; 20 : 26-37.
- Chapitre 16
Moyens thérapeutiques- I - Abaisser la PIO
- Traitements médicaux
- Prostaglandines et prostamides
- Inhibiteurs de l’anhydrase carbonique
- Alpha-mimétiques
- Parasympathomimétiques
- Combinaisons fixes
- Traitements physiques
- Traitements physiques agissant sur la sécrétion aqueuse – Cyclodestructions
- Traitements chirurgicaux
- Chirurgies filtrantes
- Valves et drains
- Chirurgies filtrantes ab interno
- Chirurgies combinées cataracte-glaucome
- II - Contrôle des facteurs non pressionnels
- III - Perspectives thérapeutiques
- I - Abaisser la PIO

