O. Laplace, E. Sellem
E. Sellem
En dehors de la prise en charge de certains facteurs de risque, lorsqu’ils sont identifiés et accessibles à un traitement spécifique, le traitement du GPAO – et de l’hypertension intra-oculaire (HTO) lorsque la décision a été prise de la traiter – impose dans tous les cas la baisse de la pression intra-oculaire (PIO). Celle-ci passe classiquement par une première étape, celle de la prescription médicamenteuse, qui pourra parfois être suffisante tout au long de la vie du patient. Elle impose une réflexion sur le choix du traitement de première intention et, en cas d’inefficacité, sur son remplacement éventuel par une autre molécule. Les traitements ultérieurs et leurs modalités de prescription doivent être bien maîtrisés (combinaisons fixes et instillations séparées). Dans cette réflexion, trois types de paramètres sont à considérer :
-
ceux liés à la molécule (efficacité pressionnelle et tolérance) ;
-
ceux liés au patient (âge, mode de vie, observance, etc.) ;
-
ceux liés à la neuropathie elle-même (stade évolutif au moment du diagnostic, vitesse de progression).
Toutes ces considérations ont été développées dans les chapitres précédents.
En cas d’inefficacité du traitement médical, un traitement physique puis chirurgical doit lui succéder (fig. 18-1). De nouvelles modalités de prise en charge sont suggérées depuis quelques années. Elles peuvent bousculer cette chronologie conventionnelle grâce précisément aux progrès des traitements physiques et aux performances des récentes propositions chirurgicales, et ainsi être proposées plus précocement dans un certain nombre de situations cliniques du GPAO (PIO cible très basse, mauvaise observance, problèmes de surface oculaire, refus des conservateurs, etc.).
Tout au long du suivi de la neuropathie glaucomateuse, qui peut s’étaler sur des décennies, et en tout cas jusqu’au décès du patient, l’attention du prescripteur doit se porter aussi sur les facteurs de risque qui peuvent apparaître à tout moment de la vie du glaucomateux, et expliquer une aggravation imprévue de la maladie malgré un contrôle tonométrique satisfaisant et une observance correcte. Ces facteurs de risque et leur prise en charge ont largement été évoqués dans les chapitres 8-III, 8-IV (paragraphe « Facteurs de risque non héréditaires ») et 17-II, et ils ne seront pas développés dans ce chapitre, dévolu à l’abaissement de la PIO.
Bien entendu, la vigilance de l’ophtalmologiste ne doit pas se focaliser sur le glaucome, et l’intervention d’une pathologie oculaire concomitante peut également aggraver la situation fonctionnelle de son patient : cataracte, dégénérescence maculaire liée à l’âge, aggravation d’une atrophie choriorétinienne myopique, etc.
En matière de GPAO, il est devenu rare que la PIO demeure élevée malgré la mise en œuvre de toutes les tentatives thérapeutiques conventionnelles. Se pose alors le problème de ce qu’il convient d’appeler un « glaucome réfractaire », plus habituel dans les formes secondaires ou congénitales.
Enfin, dans les formes agoniques, la perte physiologique des cellules ganglionnaires avec l’âge est régulièrement responsable d’une poursuite de la détérioration périmétrique contre laquelle le prescripteur est impuissant. Comme il est difficile d’évaluer la part de ce processus en cas d’aggravation, la recherche d’une PIO cible la plus basse possible doit être modulée en fonction du rapport contraintes/bénéfice ; mais cet objectif partagé avec le patient depuis le début du traitement demeure capital, et l’accompagnement reste le point essentiel de notre prise en charge
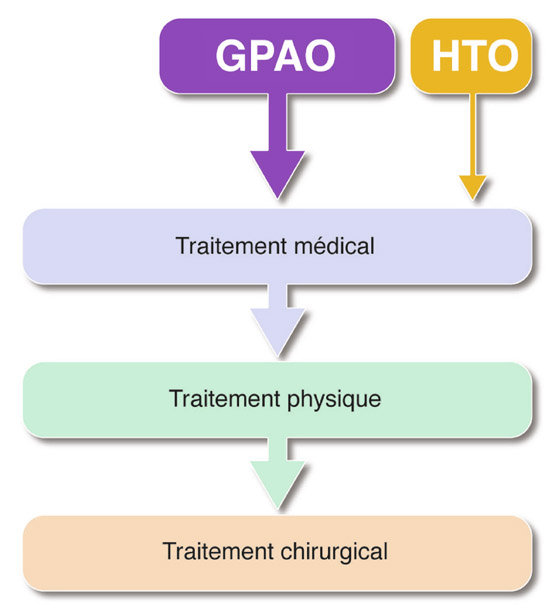
Fig. 18-1 Progression thérapeutique classique du GPAO (et de l’HTO lorsque la décision a été prise de la traiter).
E. Sellem
-
L’ophtalmologiste doit s’assurer de l’instillation correcte d’un collyre, au besoin en prenant le temps de la vérifier de visu et de l’expliquer.
-
L’occlusion des points lacrymaux après l’instillation diminue les risques d’effets systémiques.
-
Respecter, sans excès, l’intervalle des instillations lorsque plusieurs collyres sont prescrits au même moment de la journée.
-
Le choix du traitement de première intention se fait habituellement entre un collyre bêtabloquant et un collyre aux analogues des prostaglandines.
-
Les combinaisons fixes permettent un allégement de ces instillations et peuvent être rapidement prescrites, parfois d’emblée lorsque l’exigence pressionnelle est forte.
-
Au-delà de trois molécules instillées, l’abaissement pressionnel est insignifiant, au risque de multiplier les effets secondaires.
Lorsque l’examen clinique confirme la présence d’un glaucome avéré, l’abaissement pressionnel est impératif. À l’exception de l’European Glaucoma Prevention Study [11] – où les patients n’étaient traités que par du dorzolamide et dont les conclusions sont contestables (baisse de 19 % de la PIO dans le groupe placebo !) –, les grandes études prospectives comparatives de glaucomateux traités versus non traités (Early Manifest Glaucoma Trial [7], Collaborative Normal Tension Glaucoma Study [16]) ont confirmé le rôle bénéfique du traitement de la PIO dans l’évolution du GPAO. Celui-ci débute classiquement par l’instauration d’un traitement médical [6] (fig. 18-2). L’ophtalmologiste dispose d’un vaste choix : les familles thérapeutiques sont nombreuses et, dans chacune d’elles, plusieurs molécules sont disponibles (voir chapitre 16-I, paragraphe « Traitements médicaux »).
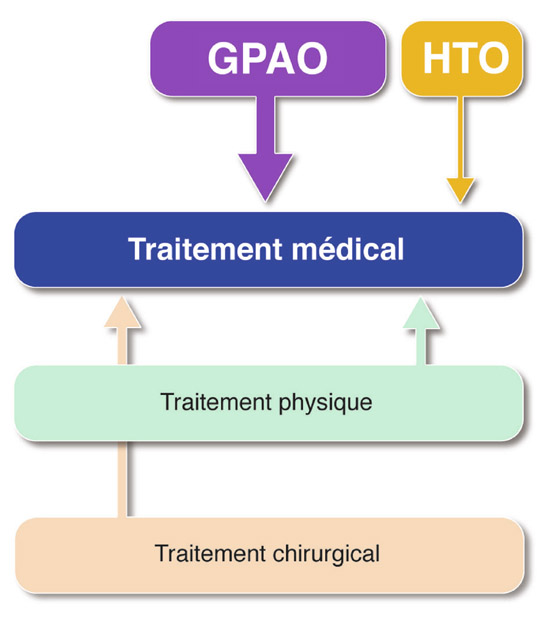
Fig. 18-2 La place du traitement médical dans le GPAO.
Il est impératif, chaque fois qu’un collyre est prescrit, de s’assurer que la technique d’instillation du collyre est correcte, afin que le principe actif puisse atteindre les cibles oculaires. Des fiches d’informations peuvent être remises au patient, ainsi que l’adresse de sites Internet indiquant la (ou les) technique(s) d’instillation. Il peut être utile de vérifier au cours de la consultation comment le patient « met ses gouttes », en lui demandant d’instiller par exemple un collyre mouillant devant le médecin, pour éventuellement le corriger. Procédant ainsi, une étude française avait montré que la qualité des instillations était globalement mauvaise : dans 20 % des cas, les gouttes étaient instillées en dehors de l’œil et, dans 20 % des cas également, le patient mettait l’embout en contact avec l’œil ; la médiocre qualité d’instillation des collyres était d’ailleurs corrélée à l’importance des atteintes du champ visuel [2]. Des appareillages d’aide à l’administration topique, malheureusement le plus souvent adaptés à certains flacons spécifiques, ont pu être proposés au patient pour faciliter l’instillation [15].
Le passage systémique représente plus de 80 % de la dose totale administrée. En évitant le globe, il emprunte à partir des voies lacrymales les plexus vasculaires périsacculaires pour rejoindre directement le cœur droit. À la différence des produits administrés per os, la molécule instillée échappe dès lors au phénomène du premier passage hépatique, sans donc subir de catabolisme avant d’être redistribuée dans l’organisme. Ainsi, l’administration oculaire aboutit à la présence dans le sang d’une quantité de produit actif loin d’être négligeable, susceptible d’atteindre les récepteurs bronchiques, cardiaques, artériels, cérébraux, etc., ainsi d’ailleurs que l’autre œil.
Afin de diminuer le drainage lacrymal du principe actif, et ses effets latéraux systémiques, il faut apprendre au patient à occlure par un doigt les points lacrymaux en appuyant 1 à 2 minutes sur le canthus interne après l’instillation, ou sinon à fermer fortement les yeux pendant la même durée [17]. Par ailleurs, en pratiquant ainsi, la biodisponibilité du principe actif dans l’œil peut être augmentée jusqu’à 35 % [3].
Il est une règle excessive, régulièrement inscrite dans les monographies et conseillée par les pharmaciens, indiquant de respecter un intervalle (ou wash-out) idéal de 15 minutes entre deux instillations. Elle risque de perturber inutilement la vie des patients, et de favoriser une observance médiocre chez ceux qui sont peu vigilants. En réalité, ce wash-out peut être réduit à 5 minutes : comme l’a montré un travail déjà ancien [4], il ne reste plus dans le film lacrymal que 45 % du premier collyre instillé après 30 secondes, que 17 % après 2 minutes, etc., et le principe actif n’est plus retrouvé après 5 minutes précisément.
En cas de plurithérapie au même moment de la journée, lorsque qu’un des collyres est sous une forme à libération prolongée (LP), celui-ci doit être instillé en dernier. En dehors de cette règle de bon sens, l’ordre des instillations n’a pas d’importance (eFig. 18-1).

eFig. 18-1 Ordonnance type pour un traitement associant une combinaison fixe instillée deux fois par jour et un collyre instillé le soir.
Cette expression de traitement initial peut se confondre avec le traitement dit de première intention, c’est-à-dire approuvé comme tel par l’organisme officiel de contrôle. En France, il s’agit des analogues des prostaglandines (PG) et des collyres bêtabloquants, bien que, dans les autorisations de mise sur le marché, la pilocarpine reste également considérée comme un traitement de première intention. Les avantages et les inconvénients de chacune de ces familles ont été largement présentés dans les chapitres respectifs (voir chapitre 16-I, paragraphe « Traitements médicaux ») ; ils ne seront repris que brièvement.
Les données les plus récentes de l’industrie pharmaceutique confirment une croissance continue de la prescription des PG en monothérapie, en France et dans les grands pays européens, qui a dépassé le double de celle des collyres bêtabloquants en monothérapie (voir chapitre 22). Les avantages de cette classe thérapeutique peuvent être résumés comme suit :
-
efficacité la plus importante sur la baisse pressionnelle (qui peut dépasser 30 %) de tous les collyres hypotonisants ;
-
une seule instillation quotidienne ;
-
persistance de l’efficacité durant la nuit (à la différence des bêtabloquants) ;
-
excellente tolérance systémique.
Plusieurs inconvénients peuvent toutefois limiter leur prescription :
-
sur le plan local, les effets latéraux sont essentiellement cosmétiques (injection conjonctivale, pigmentation irienne et palpébrale, allongement des cils, cernes, hirsutisme péri-orbitaire). La présence de conservateurs jusqu’en 2013 pouvait représenter dans certains cas un frein à leur prescription ; elle ne doit plus l’être avec la mise à disposition de PG en monodoses. Les uvéites ne constituent une précaution d’emploi à l’utilisation des PG qu’en cas d’antécédents ou d’épisodes aigus. L’arrêt des PG avant chirurgie oculaire n’est plus conseillé, mais ceux-ci doivent être interrompus en cas de rupture capsulaire et évités de préférence chez l’aphake en raison du risque faible d’œdème maculaire cystoïde. Enfin, les PG doivent être utilisés avec précaution chez les patients ayant des antécédents herpétiques oculaires, et arrêtés en cas de poussée ;
-
sur le plan général, être prudent théoriquement en cas d’asthme sévère et en cas de grossesse (voir chapitre 20-VIII).
En faveur des collyres bêtabloquants, l’excellente tolérance locale habituelle est l’argument essentiel pour le prescripteur. Les formes à libération prolongée (LP) autorisant une seule instillation quotidienne, les faibles dosages ainsi que les nombreuses formes disponibles sans conservateurs peuvent également être des avantages à prendre en compte au moment du choix. En revanche, les contre-indications générales doivent être impérativement respectées : asthme, bronchopneumopathies chroniques obstructives, blocs auriculoventriculaires de deuxième et troisième degrés non appareillés, syncopes d’étiologie indéterminée. Les sportifs se plaignent régulièrement d’une diminution de leurs performances lorsqu’ils sont sous bêtabloquants, et cette plainte doit être prise en compte. Cependant, l’avènement des formes LP avec une efficacité pressionnelle identique, mais des concentrations plasmatiques réduites de 90 %, a fait nettement diminuer ces effets secondaires et a pu souvent permettre la reprise d’une activité physique sportive chez les sujets jeunes. Il a été démontré que les autres effets secondaires potentiels (dépression, cauchemars, fatigue, troubles de la libido, etc.) ne sont en fait pas plus fréquents que chez les sujets de même âge non traités [9].
Naturellement, ce choix est d’abord guidé par l’existence de contre-indications, plus fréquentes avec les bêtabloquants qu’avec les PG. Dans les autres cas, certaines circonstances seront déterminantes pour préférer une famille thérapeutique à une autre [5] :
-
en faveur des bêtabloquants : différentiel moins important avec la pression cible déterminée (baisse de 25 % environ avec le timolol), HTO modérée, effets cosmétiques potentiels des PG refusés par le patient, traitement unilatéral (un œil ayant été par exemple opéré) en raison précisément de ces inconvénients esthétiques. L’écart de coût, autrefois très favorable aux bêtabloquants, est actuellement en train de se resserrer en France, en particulier depuis que le latanoprost est disponible sous forme générique (voir plus loin l’encadré « Les médicaments génériques dans le glaucome »). Il est toutefois un argument important dans certains pays ;
-
en faveur des PG : exigence d’une forte baisse de la PIO, glaucome à pression normale (où l’abaissement de la PIO est plus difficile à obtenir avec les bêtabloquants, par ailleurs théoriquement vasoconstricteurs dans une pathologie où la perfusion oculaire peut être perturbée), sécheresse oculaire (aggravée par les bêtabloquants).
Il arrive rarement que soient simultanément contre-indiqués PG et bêtabloquants. La prescription de collyres dits officiellement de deuxième intention peut alors se justifier, et devenir en revanche un traitement de « premier choix ». Il s’agit essentiellement, pour ne pas dire exclusivement, des inhibiteurs locaux de l’anhydrase carbonique (IAC) ou de la brimonidine. L’apraclonidine entraîne souvent une conjonctivite folliculaire ; son efficacité diminue en quelques jours ou semaines (tachyphylaxie), et sa prescription ne peut donc être envisagée sur le long cours, mais seulement dans l’attente d’une autre solution thérapeutique (laser ou chirurgie). La pilocarpine est très mal tolérée chez le sujet phake, et trois instillations quotidiennes sont nécessaires pour couvrir le nycthémère : elle ne doit plus jamais être indiquée en première intention. La prescription per os d’acétazolamide ne peut être envisagée qu’exceptionnellement chez des patients ne supportant aucun collyre mais, en fonction de la situation clinique, le recours à une trabéculoplastie ou à la chirurgie aura généralement été proposé.
En l’absence de contre-indications de chacune des molécules, les combinaisons fixes associant particulièrement PG et bêtabloquants sont légitimes comme premier choix thérapeutique en cas d’exigence pressionnelle forte, d’autant qu’elles sont souvent mieux tolérées localement que la molécule PG prescrite isolément. En cas de contre-indication aux collyres bêtabloquants, l’association fixe brinzolamide–brimonidine (Simbriza® Novartis-Alcon, dont la commercialisation est prévue en 2015) pourra également être proposée comme traitement de première intention.
Un contrôle doit être fait après 2 ou 3 semaines de traitement, délai nécessaire et suffisant pour laisser s’installer l’action du médicament dans le temps et évaluer la tolérance du patient à son traitement. Celle-ci peut en effet s’améliorer après quelques jours (c’est le cas de l’injection conjonctivale avec les PG), ou au contraire s’aggraver.
Plusieurs circonstances peuvent conduire plus ou moins rapidement à remplacer ou à compléter le premier traitement médical prescrit, soit parce qu’il est mal toléré, soit parce que la pression cible n’est pas atteinte, soit à plus long terme parce que le GPAO s’aggrave, quel que soit d’ailleurs l’abaissement pressionnel atteint.
Dans la famille des PG, il faut rappeler que le bimatoprost est un peu plus efficace sur la baisse pressionnelle que le latanoprost et le travoprost [1] ; pour les bêtabloquants, le bétaxolol est moins puissant que les autres bêtabloquants. Un changement à l’intérieur de la même famille peut donc être tenté dans certaines circonstances, plus pour espérer un abaissement pressionnel supplémentaire qu’une meilleure tolérance. En réalité, il est plus logique de passer à une autre famille thérapeutique, et de remplacer un collyre bêtabloquant par une PG plutôt que l’inverse, bien qu’un petit pourcentage de patients ne soit pas répondeur aux PG.
Dans l’Ocular Hypertension Treatment Study (OHTS), 40 % des patients nécessitaient un traitement complémentaire après cinq années [8]. Dans la Collaborative Initial Glaucoma Treatment Study [10], une bithérapie était nécessaire dans 75 % des cas après 2 ans pour atteindre la pression cible.
Naturellement, deux molécules ayant la même cible pharmacologique ne peuvent pas être combinées entre elles, mais l’association de deux principes actifs agissant simultanément sur la sécrétion aqueuse (bêtabloquants et IAC) ou la voie uvéosclérale (alphamimétiques et PG) peut potentialiser leur action respective. Et, en effet, toutes les combinaisons ont un effet additif, toutefois plus limité ou nul lorsqu’une PG est associée à la pilocarpine.
Les combinaisons fixes, lorsqu’elles existent, doivent être préférées à l’instillation séparée des deux principes actifs, avec les avantages suivants (voir chapitre 16-I, paragraphe « Combinaisons fixes ») :
-
non-infériorité sur la baisse pressionnelle par rapport à des instillations dissociées ;
-
moins de contraintes d’instillation et, en particulier, pas de période de wash-out à respecter ;
-
moins d’exposition aux conservateurs ;
-
meilleure tolérance habituellement de la molécule autre que le bêtabloquant ;
-
amélioration de l’observance.
Toutefois, concernant les combinaisons fixes associant PG et bêtabloquants, il faut souligner que le collyre bêtabloquant n’est instillé qu’une fois par jour, alors qu’il n’entre pas dans une formulation galénique LP. De surcroît, la chronobiologie s’en trouve perturbée, puisque la PG est plus active le soir et le bêtabloquant plus actif le matin. La plus grande puissance de la PG commande de conseiller l’instillation de la combinaison fixe plutôt en fin de journée. Ou encore, à la condition que le patient soit compliant, un traitement dissocié peut être conseillé pour respecter cette chronobiologie, avec une instillation d’un collyre bêtabloquant LP le matin et de PG le soir. Ce problème ne se pose pas pour les autres combinaisons nécessitant deux instillations quotidiennes.
Neuf pour cent des patients de l’étude OHTS nécessitaient une trithérapie après cinq années [8]. Les guidelines de l’European Glaucoma Society (EGS) dans leur 3e édition indiquent que « chez la plupart des patients, il n’est pas recommandé d’utiliser plus de deux collyres séparés ou de rajouter plus d’un collyre simple à une combinaison fixe » [6]. Effectivement, la mise à disposition des combinaisons fixes a considérablement simplifié la plurithérapie en diminuant le nombre d’instillations quotidiennes, par exemple trois si l’on associe une combinaison IAC–bêtabloquant ou brimonidine–bêtabloquant à une PG.
Il a été suggéré également d’associer des combinaisons fixes [13], par exemple une association bêtabloquant–brimonidine le matin et une association bêtabloquant–PG le soir, réduisant le traitement à deux instillations quotidiennes tout en respectant la chronobiologie du collyre bêtabloquant.
En réalité, avec la multiplication des propositions galéniques, des milliers de combinaisons sont maintenant possibles. Toutefois, au-delà de trois molécules instillées dans l’œil, le bénéfice pressionnel est habituellement faible ou nul, et les effets secondaires deviennent réellement importants : la probabilité cumulée d’efficacité et de tolérance d’une quatrième molécule est de 31 % à 6 mois, tombant à 14 % à un an [12]. Cependant, il est parfois surprenant d’observer certaines plurithérapies remarquablement bien tolérées par des patients parfaitement compliants ! La notion classique de « traitement maximal tolérable » est donc individuelle et ne peut pas être définie de manière univoque.
La prescription d’acétazolamide per os devient exceptionnelle pour traiter le GPAO. Elle peut être rendue nécessaire chez des patients multiopérés, pour compléter le traitement local et atteindre la pression cible. Il semble toutefois que l’association d’acétazolamide avec un collyre IAC ne renforce pas la baisse pressionnelle [14].
Les progrès des traitements physiques et chirurgicaux permettent heureusement, dans la grande majorité des cas, d’alléger l’importance du traitement médical ou de le supprimer, en cas d’insuffisance thérapeutique, de mauvaise observance ou d’intolérance. La survenue d’une cataracte peut permettre également, par la réalisation d’une chirurgie combinée, la suppression des collyres.
J.-P. Nordmann
Les médicaments génériques font partie intégrante de l’arsenal thérapeutique dans la plupart des spécialités. Ils deviennent disponibles après que 20 ans se sont écoulés à partir des premières études d’une molécule au sein d’un laboratoire. Si le temps de développement entre la mise au point de la molécule et la commercialisation a été court, le laboratoire aura une longue période d’exclusivité. Dans le cas contraire, cette période pourra être beaucoup plus réduite. Le coût d’un générique est en général de 50 % du produit princeps.
Dans le glaucome, il existe depuis quelques années des génériques, essentiellement de bêtabloquants, d’inhibiteurs de l’anhydrase carbonique et plus récemment d’α2-agonistes. Depuis le 1er janvier 2012, les génériques de prostaglandines sont disponibles. Seul le latanoprost est à ce jour concerné (Xalatan®), ainsi que la combinaison fixe latanoprost–timolol (Xalacom®).
On entend par spécialité générique d’une autre spécialité (Code de la santé publique, article L. 601-6, 1996) une spécialité :
-
qui a la même composition quantitative et qualitative en principe(s) actif(s) ;
-
qui a la même forme pharmaceutique ;
-
dont la bioéquivalence a été démontrée par des études appropriées de biodisponibilité ;
-
et qui est inscrite sur le Répertoire officiel des génériques.
Aucune étude clinique chez l’homme n’est faite pour vérifier l’efficacité ou la tolérance du générique. Les études de bioéquivalence sont faites sous forme de dosage du principe actif dans le plasma de sujets sains. En ce qui concerne les collyres, il n’y a pas en pratique de mesure de concentration du principe actif, car celui-ci ne passe que faiblement dans le sang. On se contente alors de mesurer la concentration du principe actif dans le flacon, une différence de 10 % par rapport au princeps étant acceptée [2].
En principe, ce qui n’est pas le principe actif peut être différent. En revanche, le conservateur ne peut pas être modifié et il en découle qu’une formulation sans conservateur ne peut pas être remplacée par un générique avec conservateur.
Outre le principe actif et le conservateur, un collyre comprend de nombreux composants ayant des rôles spécifiques, en particulier des agents adjuvants : ajustant la tonicité ou l’osmolalité (chlorure de sodium, chlorure de potassium, sels tampons, dextrose ou mannitol), ajustant le pH (acide borique, dérivés phosphatés, acide acétique/acétate de sodium, acide citrique/citrate de sodium), ajustant la viscosité (carboxyméthylcellulose et méthylcellulose), ajustant la solubilité (chlorure de benzalkonium, en dehors de son rôle de conservateur), ajustant la stabilité (EDTA disodique, etc.). L’ensemble de ces adjuvants est responsable de la tolérance du collyre. Ils ne sont pas évalués à nouveau dans un générique. En simplifiant la situation, il est raisonnable de considérer que le principe actif est responsable de l’efficacité d’un collyre et les agents adjuvants de sa tolérance.
Quelques travaux ont comparé génériques de latanoprost et Xalatan®. Une étude faite en Europe avec un générique a montré une équivalence d’efficacité et de tolérance [1]. D’autres études en Inde ont, au contraire, mis en évidence une efficacité réduite des génériques d’environ un tiers [4]. Cette baisse d’efficacité était liée à une mauvaise stabilité du principe actif. Les génériques entraînent parfois une kératite superficielle peu grave [5]. Le flacon lui-même peut être source de différences d’efficacité ; par exemple, avec un générique de timolol LP, le volume d’une goutte était réduit de 25 % en raison de la taille de l’orifice du flacon [3].
Depuis 1999, la loi de financement de la Sécurité sociale a consacré aux pharmaciens d’officine le droit de substitution des médicaments princeps par des génériques. Cependant, si le médecin précise à la main le terme « non substituable » sur son ordonnance, le pharmacien doit délivrer le traitement d’origine. Depuis juillet 2013, la règle « tiers payant contre générique » s’applique, ce qui veut dire que les patients souhaitant le produit princeps sont obligés d’avancer le supplément qui leur est remboursé secondairement par la Sécurité sociale.
Les ophtalmologistes doivent accompagner la prescription des génériques de façon générale pour des raisons de coût de la santé. Il faut en parler au patient, car un générique est d’autant mieux accepté qu’il est proposé par le médecin et non pas par le pharmacien.
Il apparaît fondamental d’apprécier l’efficacité et la tolérance de tout nouveau générique. De cette tolérance découlent aussi l’observance et la persistance du traitement, ce qui, en conséquence, induit des variations d’efficacité. Cela permettra de prendre en compte ces éléments pour adapter au mieux une thérapeutique qui est toujours de longue durée dans le glaucome.
[1] Allaire C, Dietrich A, Allmeier H, et al. Latanoprost 0.005 % test formulation is as effective as Xalatan® inpatients with ocular hypertension and primary open-angle glaucoma. Eur J Ophthalmol. 2012 ; 22 : 19-27.
[2] Chambers WA. Ophthalmic generics-are they really the same ? Ophthalmology. 2012 ; 119 : 1095-6.
[3] Mammo ZN, Flanagan JG, James DF, Trope GE. Generic versus brand-name North. American topical glaucoma drops. Can J Ophthalmol. 2012 ; 47 : 55-61.
[4] Narayanaswamy A, Neog A, Baskaran M, et al. A randomized, crossover, open label pilot study to evaluate the efficacy and safety of Xalatan in comparison with generic Latanoprost (Latoprost) in subjects with primary open angle glaucoma or ocular hypertension. Indian J Ophthalmol. 2007 ; 55 : 127-31.
[5] Takada Y, Okada Y, Fujita N, Saika S. A patient with corneal epithelial disorder that developed after administration of a latanoprost generic, but not a brand-name drug, eye drop. Case Rep Ophthalmol Med. 2012 ; 2012 : 536746.
Retenir
-
Le choix du collyre de première intention découle des contre-indications, et dépend du niveau pressionnel de départ, du stade évolutif du GPAO et des effets secondaires connus redoutés chez certains patients.
-
Il peut d’emblée s’agir d’une combinaison fixe.
-
En cas d’insuffisance thérapeutique, la première molécule peut être remplacée par une autre famille thérapeutique, ou associée à celle-ci.
-
Au-delà d’une bithérapie, l’adjonction d’un troisième principe actif est facilitée par l’association à une combinaison fixe, limitant le nombre d’instillation.
-
Le « traitement médical maximal » dépend de l’adhérence et de la tolérance au traitement, très variables d’un individu à l’autre.
-
Un traitement physique ou chirurgical doit être rapidement proposé dès lors qu’un patient réagit mal au traitement médical, que ce soit à cause de la faible efficacité pressionnelle ou de la mauvaise tolérance.
[1] Aptel F, Cucherat M, Denis P. Efficacy and tolerability of prostaglandin analogs : a meta-analysis of randomized controlled clinical trials. J Glaucoma 2008 ; 17 : 667-73.
[2] Aptel F, Masset H, Burillon C, et al. The influence of disease severity on quality of eye-drop administration in patients with glaucoma or ocular hypertension. Br J Ophthalmol. 2009 ; 93 : 700-1.
[3] Aritürk N, Oge I, Erkan D, et al. The effects of nasolacrimal canal blockage on topical medications for glaucoma. Acta Ophthalmol Scand. 1996 ; 74 : 411-3.
[4] Chrai SS, Makoid MC, Eriksen SP, Robinson JR. Drop size and initial dosing frequency problems of topically applied ophthalmic drugs. J Pharm Sci 1974 ; 63 : 333-8.
[5] Denis P. Bêta-bloquants ou prostaglandines : quel est le meilleur choix ? J Fr Ophtalmol 2009 ; 32 : 206-11.
[6] European Glaucoma Society. Terminology and guidelines for glaucoma, 3rd Ed. Savona, It : Dogma 2008.
[7] Heijl A, Leske MC, Bengtsson B, et al. Reduction of intraocular pressure and glaucoma progression : results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 ; 120 : 1268-79.
[8] Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 701-13.
[9] Lama PJ. Systemic adverse effects of beta-adrenergic blockers : an evidence-based assessment. Am J Ophthalmol. 2002 ; 134 : 749-60.
[10] Lichter PR, Musch DC, Gillespie BW, et al ; CIGTS Study Group. Interim clinical outcomes in the Collaborative Initial Glaucoma Treatment Study comparing initial treatment randomized to medications or surgery. Ophthalmology. 2001 ; 108 : 1943-53.
[11] Miglior S, Zeyen T, Pfeiffer N, et al ; European Glaucoma Prevention Study (EGPS) Group. Results of the European Glaucoma Prevention Study. Ophthalmology. 2005 ; 112 : 366-75.
[12] Neelakantan A, Vaishnav HD, Iyer SA, Sherwood MB. Is addition of a third or fourth antiglaucoma médication effective ? J Glaucoma. 2004 ; 13 : 130-6.
[13] Nordmann JP. Peut-on associer les associations fixes médicamenteuses ? J Fr Ophtalmol. 2009 ; 32 : 212-6.
[14] Rosenberg LF, Krupin T, Tang LQ, et al. Combination of systemic acetazolamide and topical dorzolamide in reducing intraocular pressure and aqueous humor formation. Ophthalmology. 1998 ; 105 : 88-92 ; discussion 92-3.
[15] Salyani A, Birt C. Evaluation of an eye drop guide to aid self-administration by patients experienced with topical use of glaucoma medication. Can J Ophthalmol. 2005 ; 40 : 170-4.
[16] The Collaborative Normal-Tension Glaucoma Study (CNTGS). Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Collaborative Normal-Tension Glaucoma Study Group. Am J Ophthalmol. 1998 ; 126 : 487-97.
[17] Zimmerman TJ, Kooner KS, Kandarakis AS, et al. Improving the therapeutic index of topically applied ocular drugs. Arch Ophthalmol. 1984 ; 102 : 551-3.
E. Sellem
-
La trabéculoplastie est maintenant proposée plus précocement dans le traitement du GPAO.
-
Toutefois, son efficacité est souvent limitée dans le temps et, pour le laser SLT, le nombre de retraitements ne peut être illimité.
-
Dans l’arsenal thérapeutique, la place de la cyclocoagulation par ultrasons focalisés de haute intensité doit encore être évaluée.
-
Une iridotomie voire une iridorétraction périphérique s’imposent parfois lorsque l’angle iridocornéen devient plus étroit avec les années.
Lors de l’avènement de la trabéculoplastie à l’argon, au début des années 1980, cette thérapeutique physique fut d’abord considérée comme une alternative chirurgicale, alors que les collyres antiglaucomateux disponibles étaient peu nombreux. Et, pendant les premières années de son existence, il a paru outrancier de proposer la trabéculoplastie comme thérapeutique initiale du GPAO [7]. Après des années de recul, d’observation des résultats à moyen et long termes, et aussi des complications qui s’avérèrent exceptionnellement graves et persistantes, les indications de la trabéculoplastie dans le GPAO devinrent plus précoces, incluant éventuellement sa réalisation en première intention. Avec la trabéculoplastie sélective (SLT) plus récente, encore moins traumatisante histologiquement que la trabéculoplastie à l’argon (TLA), ces indications se sont encore élargies.
Les premiers résultats encourageants obtenus par la cyclocoagulation par ultrasons focalisés de haute intensité laissent espérer que cette technique d’abaissement de la PIO pourra incorporer bientôt la liste des traitements conventionnels du GPAO.
La surveillance gonioscopique du GPAO révèle parfois une évolution vers une forme chronique par fermeture de l’angle, imposant la réalisation d’une iridotomie au laser.
Les résultats pressionnels de la TLA et du laser SLT sont globalement identiques à court et moyen termes, avec une baisse pressionnelle de 20 à 30 % en moyenne, pour environ 70 à 90 % d’yeux répondeurs (voir chapitre 16-I, paragraphe « Trabéculoplasties au laser »). Le relâchement plus précoce de l’efficacité du laser SLT, parfois contesté, est compensé par la possibilité d’un retraitement sans danger, à la différence de la TLA. Cela dit, si ce retraitement peut être envisagé au moins à deux reprises, on sait aussi que l’efficacité de chaque nouvelle séance risque d’être moins forte et moins durable que la précédente [3].
La trabéculoplastie peut se concevoir pour reculer le moment où les instillations de collyres hypotonisants deviendront éventuellement indispensables, avec différents arguments qui peuvent d’ailleurs s’additionner :
-
le patient risque d’être peu compliant ;
-
il faut lui épargner cette contrainte et les possibles effets latéraux dans un souci d’amélioration de sa qualité de vie ;
-
il est prudent d’épargner les tissus oculaires de l’effet délétère des conservateurs ou des principes actifs.
Plusieurs études prospectives ont comparé l’efficacité de la trabéculoplastie à celle du traitement médical en première intention. Publiée en 1995, l’étude Glaucoma Laser Trial (GLT) avait montré que la TLA initiale abaissait plus la PIO que la prescription initiale de timolol sur le long terme (6 à 9 ans selon les patients) [2]. Mais cette étude est déjà ancienne ; la trabéculoplastie était faite au laser à l’argon et le traitement médical initial ne comportait donc que du timolol, moins puissant que les analogues des prostaglandines (PG) pour abaisser la pression intra-oculaire (PIO). Deux travaux plus récents ont comparé en première intention le laser SLT au latanoprost [4, 5] : pour les deux études (avec un suivi de 6 mois pour l’une, de 12 mois pour l’autre), l’abaissement de la PIO a été similaire dans les deux groupes ; l’étude à 6 mois a montré toutefois de moins fortes fluctuations de la PIO dans le groupe initialement traité par le latanoprost. Il est donc acceptable de proposer dans certaines circonstances, dès le diagnostic de glaucome, la réalisation d’une trabéculoplastie. Celle-ci, dont on sait l’échappement fréquent avec les années, ne doit pas faire relâcher la vigilance du médecin… ou laisser le patient s’imaginer que sa maladie est guérie et qu’il n’aura jamais besoin d’un complément thérapeutique ultérieur.
La proposition d’une trabéculoplastie comme traitement initial de l’hypertension intra-oculaire et même du glaucome prépérimétrique est plus critiquable, précisément à cause de la probable diminution de son efficacité dans le temps, pour des situations cliniques dont l’évolution péjorative n’est pas assurée. Si la décision d’abaisser la PIO est prise, le traitement médical est alors plus adapté que le traitement physique, avec la préoccupation de ne pas « tirer des cartouches » inutilement.
Cette indication reste probablement la plus légitime (fig. 18-3), compte tenu de l’efficacité actuelle des collyres hypotenseurs, de leur tolérance globalement très acceptable et de leur exceptionnel échappement. La réalisation d’une trabéculoplastie est pleinement justifiée après un traitement médical précoce, uni- ou bimoléculaire, lorsque la pression cible n’est pas atteinte, que le glaucome progresse, ou encore lorsque le praticien souhaite épargner à son patient la contrainte d’un traitement plus lourd et potentiellement plus mal toléré.
De la même façon, à tout moment du suivi, une trabéculoplastie se justifie devant l’efficacité incomplète du traitement médical sur la baisse de la PIO et/ou la progression du glaucome, la survenue parfois retardée d’effets secondaires provoqués par les collyres, des difficultés physiques ou logistiques (disparition d’un tiers aidant) d’instillation, ou une mauvaise observance. Elle peut permettre la réduction du traitement médical, voire sa suppression, mais avec le souci constant pour le praticien d’une efficacité potentiellement limitée dans le temps.
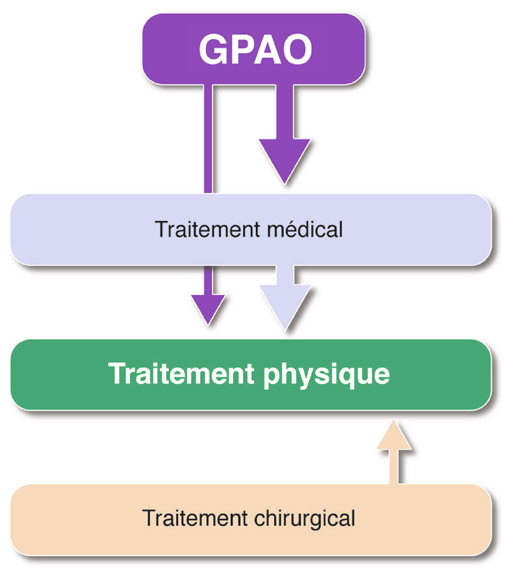
Fig. 18-3 La place du traitement physique dans le GPAO.
La chirurgie filtrante est grevée d’un taux d’échecs non négligeable, augmentant au fur et à mesure de l’éloignement de l’intervention. Ces échecs, partiels à cause d’un faible débit ou complets, s’ils ne justifient pas toujours une reprise chirurgicale, imposent la reprise des autres thérapeutiques abaissant la PIO. Parmi celles-ci, la trabéculoplastie a toute sa place, au même titre que les traitements médicaux, à condition naturellement de ne pas avoir déjà été faite avant la chirurgie, a fortiori si elle avait été réalisée à plusieurs reprises.
De nombreux travaux ont montré l’équivalence pressionnelle de ces deux techniques [6]. Des avantages plaident en faveur du laser SLT, en dehors des arguments histologiques (voir chapitre 16-I, paragraphe « Trabéculoplastie sélective au laser ») : moindre inflammation postopératoire, et retraitement plus souvent efficace et moins délétère. Cela dit, le laser à l’argon est plus répandu que le laser SLT, avec un recul de plus de 30 ans confirmant son innocuité à long terme quasi constante, et il ne doit pas être proposé avec réticence si l’accès au laser SLT n’est pas possible. En revanche, en cas d’échappement avec le laser à l’argon, il est impératif de proposer un retraitement avec le laser SLT qui a démontré son efficacité dans ces situations cliniques.
Parmi toutes les techniques de cyclodestruction, lorsque la situation clinique n’est heureusement pas celle d’un « glaucome réfractaire », seule la cyclocoagulation par ultrasons focalisés de haute intensité (high-intensity focused ultrasound [HIFU]) pourrait être envisagée dans le traitement précoce du GPAO en raison des résultats encourageants des premières études cliniques (voir chapitre 16-I, paragraphe « Traitements physiques agissant sur la sécrétion aqueuse – Cyclodestructions ») [1]. Lorsque les études multicentriques auront confirmé cette efficacité et son innocuité, il est probable que son indication concurrencera – par exemple – celle de la trabéculoplastie. La nomenclature doit encore être adaptée au coût de la procédure.
L’augmentation physiologique du volume du cristallin avec les années peut transformer un GPAO en glaucome mixte par blocage pupillaire concomitant fermant l’angle iridocornéen, le plus souvent incomplètement et par intermittence. La gonioscopie régulièrement pratiquée doit permettre d’évoquer cette possibilité évolutive, particulièrement en cas d’aggravation rapide de la neuropathie. Il est alors impératif de réaliser une iridotomie qui, si elle n’est pas faite trop tardivement, doit rouvrir l’angle complètement.
Dans le cas contraire, l’examinateur doit évaluer la présence ou non de goniosynéchies, au mieux par une gonioscopie dynamique par indentation, éventuellement complétée d’une imagerie du segment antérieur. S’il s’agit d’un accolement simple, provoqué par un syndrome iris-plateau ou des kystes iridociliaires venant compliquer le GPAO, une iridorétraction périphérique au laser à l’argon est souvent efficace pour obtenir à nouveau l’ouverture de l’angle (voir chapitre 13-II).
Retenir
-
Si l’insuffisance, l’intolérance ou l’inobservance du traitement médical sont des indications légitimes pour réaliser une trabéculoplastie, il peut être justifié de proposer celle-ci en première intention dans certaines circonstances.
-
L’avantage majeur qu’a le laser SLT sur le laser à l’argon est la possibilité de retraitements.
-
La cyclocoagulation par ultrasons focalisés de haute intensité est une technique prometteuse d’abaissement de la PIO, mais elle doit encore être validée pour bien situer sa place dans l’arsenal thérapeutique précoce du GPAO.
-
La surveillance gonioscopique peut repérer parfois l’évolution vers une fermeture progressive de l’angle, qui imposera alors la réalisation d’une iridotomie, voire d’une iridorétraction périphérique.
[1] Aptel F, Charrel T, Lafon C, et al. Miniaturized high-intensity focused ultrasound device for the treatment of glaucoma : a clinical pilot study. Invest Ophthalmol Vis Sci. 2011 ; 52 : 8747-53.
[2] Glaucoma Laser Trial Research Group. The Glaucoma Laser Trial (GLT) and Glaucoma Laser Trial Follow-up Study : 7. Results. Am J Ophthalmol. 1995 ; 120 : 718-31.
[3] Juzych MS, Chopra V, Banitt MR, et al. Comparison of long-term outcomes of selective laser trabeculoplasty versus argon laser trabeculoplasty in open-angle glaucoma. Ophthalmology. 2004 ; 111 : 1853-9.
[4] McIlraith I, Strasfeld M, Colev G, Hutnik CM. Selective laser trabeculoplasty as initial and adjunctive treatment for open angle glaucoma. J Glaucoma. 2006 ; 15 : 124-30.
[5] Nagar M, Luhishi E, Shah N. Intraocular pressure control and fluctuation : the effect of treatment with selective laser trabeculoplasty. Br J Ophthalmol. 2009 ; 93 : 497-501.
[6] Samples JR, Singh K, Lin SC, et al. Laser trabeculoplasty for open-angle glaucoma : a report by the American Academy of Ophthalmology. Ophthalmology. 2011 ; 118 : 2296-302.
[7] Van Buskirk EM. The laser step in early glaucoma therapy. Am J Ophthalmol. 1991 ; 15 (112) : 87-90.
E. Sellem
-
Des arguments sérieux peuvent justifier qu’une chirurgie filtrante soit proposée en première intention, ou très rapidement, dès le diagnostic de GPAO.
-
Habituellement, la chirurgie intervient après l’échec des traitements médicaux et physiques.
-
En Europe, le choix de la première technique chirurgicale se porte essentiellement sur la trabéculectomie ou sur la chirurgie non pénétrante.
-
La présence d’une cataracte au stade opératoire fait discuter l’intérêt d’une chirurgie combinée.
Dans le schéma thérapeutique classique du GPAO, la réalisation d’une chirurgie filtrante, perforante ou non perforante, se place en dernière position après le traitement médical et le traitement physique (fig. 18-4). Toutefois, des arguments justifient qu’elle puisse être faite d’emblée, sinon très rapidement après une brève période de traitement médical. Par ailleurs, même chez un patient bien équilibré avec le traitement médical (éventuellement complété d’une trabéculoplastie), il est souvent légitime de proposer d’intervenir chirurgicalement sur la pression intra-oculaire (PIO) à l’occasion d’une phaco-exérèse, ne serait-ce que pour espérer libérer le patient de la contrainte des instillations.
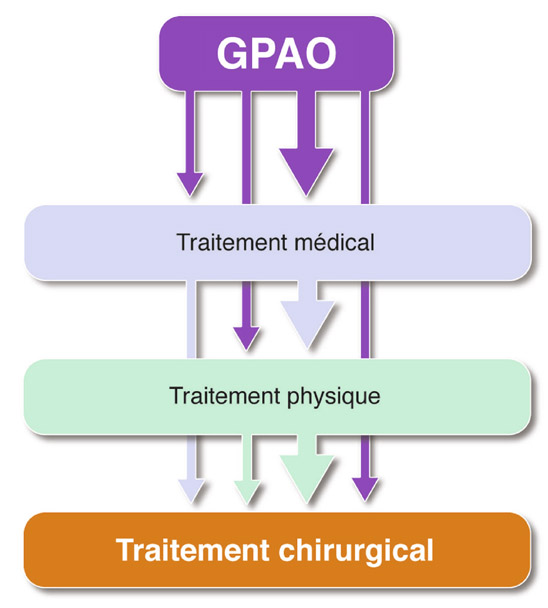
Fig. 18-4 La place de la chirurgie dans le GPAO.
Dans une étude prospective, l’équipe anglaise de Migdal, en 1994, avait rapporté l’intérêt d’une chirurgie proposée dès le diagnostic du GPAO, seule thérapeutique initiale permettant de stabiliser la neuropathie glaucomateuse, ce que ne pouvaient faire ni le traitement médical, ni la trabéculoplastie à l’argon après cinq années de recul [5]. De nombreux arguments peuvent effectivement justifier à tous les stades du GPAO de proposer d’emblée, ou très précocement, une sanction chirurgicale :
-
contrainte des instillations ;
-
risque de mauvaise observance ;
-
effet secondaire des collyres ou de l’acétazolamide ;
-
agression tissulaire par le principe actif, les conservateurs et/ou les adjuvants ;
-
risque d’échappement thérapeutique, comme cela est régulièrement signalé pour la trabéculoplastie qui, même efficace, ne permet pas toujours de supprimer le traitement médical ;
-
coût, grâce à la suppression des traitements médicaux et à la diminution de la fréquence des contrôles.
Par ailleurs, le développement de la chirurgie non perforante apporte des raisons supplémentaires de considérer favorablement cette approche thérapeutique d’une chirurgie de première intention, en raison du calme postopératoire, du faible taux de complications et de résultats pressionnels souvent considérés équivalents à ceux de la trabéculectomie conventionnelle.
Enfin, il est des situations où la perspective d’un règlement chirurgical paraît s’imposer dès le diagnostic de GPAO, lorsque certaines circonstances s’additionnent : sujets jeunes, glaucome évolué, PIO très forte, facteurs de risque multiples (myopie forte, antécédents familiaux de glaucomes graves, etc.). Les avantages et les inconvénients doivent être bien expliqués au patient, après éventuellement un court traitement médical lui prouvant alors les limites des autres moyens thérapeutiques.
À l’occasion d’une visite pour une cataracte au stade chirurgical, la découverte d’un GPAO modéré ou évolué doit également inciter l’opérateur à proposer une chirurgie combinée, avec l’instauration d’un traitement médical dans l’attente de l’intervention.
Les patients inclus dans l’étude anglaise de 1994 [5], et traités médicalement, ne pouvaient pas bénéficier des molécules et des formulations galéniques particulièrement efficaces disponibles actuellement. Il est vraisemblable qu’une étude faite aujourd’hui, comparant la chirurgie aux autres moyens éventuellement combinés, n’aboutirait pas à des résultats aussi tranchés.
Ainsi, dans l’Advanced Glaucoma Intervention Study (AGIS), les 591 patients inclus présentaient un glaucome modéré ou évolué non stabilisé avec le traitement médical, et rejoignaient soit un groupe traité par trabéculoplastie, soit un groupe traité par trabéculectomie. Les résultats de cette vaste étude, abondamment publiée, sont globalement en faveur de la chirurgie filtrante après échec du traitement médical quant à la progression du glaucome sur le long terme, mais avec une probabilité de présenter une cataracte significativement augmentée, jusqu’à 78 % dans certains sous-groupes à 5 ans [1-3]. Avec ce risque cataractogène connu de la trabéculectomie, qui n’existe pas avec la trabéculoplastie et qui est improbable avec la chirurgie non perforante, l’opérateur doit se rappeler qu’une phaco-exérèse sur des yeux présentant une bulle de filtration fonctionnelle risque d’augmenter l’échec de la chirurgie filtrante en postopératoire [4].
Les indications conventionnelles de la chirurgie doivent être finalement, le plus souvent, celles de la trabéculoplastie… lorsque celle-ci a été faite, et éventuellement réitérée, sans succès : PIO cible non atteinte, progression du glaucome, inobservance, effets secondaires insupportables des traitements médicaux, etc. Il est aussi des conditions oculaires où l’inefficacité d’une trabéculoplastie paraît d’emblée très probable (myopie forte, aphakie, sujets de moins de 30 ans), et la réalisation d’un traitement physique ne doit pas alors retarder l’heure obligatoire de la chirurgie.
En Europe, le choix se fait entre trabéculectomie et chirurgie filtrante non pénétrante (sclérectomie profonde, viscocanalostomie, canaloplastie). Les drains et les valves sont proposés plutôt au stade du glaucome réfractaire (voir chapitre 18-V), à la différence des États-Unis où ceux-ci sont volontiers posés en première intention [7]. Dans les deux techniques communément réalisées en Europe, un antimitotique (voir chapitre 16-I, paragraphe « Antimitotiques ») peut être associé au geste chirurgical en cas de risque d’échec (sujet mélanoderme, sujet jeune, aphakie, seconde intervention filtrante). Pour la chirurgie non pénétrante, des adjuvants (Aquaflow®, T-Flux®, etc.) peuvent encore compléter la procédure chirurgicale dans le but d’assurer un plus grand succès au long cours de la chirurgie (voir chapitre 16-I, paragraphe « Dispositifs et implants dans la sclérectomie profonde non perforante »).
Le calme des suites opératoires et la rareté des complications plaident en faveur de la chirurgie non pénétrante. En revanche, les difficultés de réalisation exigent un apprentissage de la part de l’opérateur, et les résultats à long terme apparaissent, dans plusieurs publications, un peu moins favorables qu’avec la trabéculectomie (voir chapitre 16-I, paragraphe « Chirurgie filtrante non perforante »).
Lorsqu’une cataracte doit être opérée sur un œil porteur d’un GPAO, la réalisation d’une chirurgie combinée est une option légitime (voir chapitre 16-I, paragraphe « Chirurgies combinées cataracte-glaucome »). La seule phaco-exérèse entraîne habituellement une chute de quelques mmHg, dont la persistance n’est pas assurée, mais qui peut justifier qu’une chirurgie filtrante n’y soit pas associée dans des formes de glaucome modéré et bien contrôlé médicalement. Dans le cas où les deux chirurgies s’imposent, surtout pour les glaucomes évolués, le problème n’est pas encore résolu de savoir s’il faut dissocier de quelques semaines les deux chirurgies ou les réaliser dans le même temps opératoire (voir chapitre 20-II) [6]. Certains opérateurs proposent, pour la chirurgie combinée, l’utilisation plus ou moins systématique d’antimitotiques, d’adjuvants ou de drains et valves. Précisément, les techniques que les Anglo-Saxons appellent « chirurgie mini-invasive du glaucome » concernent volontiers la chirurgie combinée où s’associent, à la phaco-exérèse, une endocyclophotocoagulation, la pose d’un drain ab interno (i-Stent®, etc.), ou la réalisation d’une trabéculotomie par le Trabectome®.
Quelle que soit la technique chirurgicale réalisée, avec ou sans phaco-exérèse, la qualité de la surveillance postopératoire est primordiale, et d’elle dépend souvent le succès ou l’échec de l’intervention (voir chapitre 16-I, paragraphe « Traitements chirurgicaux »). Des techniques ab externo sont parfois utiles lorsque la filtration s’installe difficilement pendant la période postopératoire précoce (needling de la bulle, section des points scléraux, injection sous-conjonctivale d’antimitotiques) (voir vidéo 16-3). Même en cas de succès pressionnel sur le moyen et le long terme, le patient doit être surveillé tout le restant de sa vie.
En cas d’échec partiel ou complet de la chirurgie, selon l’âge du patient et le stade évolutif de la maladie, une nouvelle chirurgie filtrante peut s’imposer sur un autre site, avec généralement l’utilisation systématique d’antimitotiques peropératoires. Parfois, la reprise d’un traitement médical et/ou la réalisation d’une trabéculoplastie (si elle n’avait pas été faite auparavant) peuvent suffire à stabiliser ou freiner significativement la progression du glaucome.
Retenir
-
Une chirurgie filtrante de première intention s’impose souvent en cas de glaucome découvert à un stade tardif, de surcroît chez un sujet jeune avec une PIO très élevée. Par ailleurs, des arguments solides plaident pour la chirurgie précoce même dans les glaucomes peu évolués.
-
Sur le long terme, la chirurgie filtrante est plus efficace que la trabéculoplastie, mais avec un risque cataractogène plus important pour la trabéculectomie.
-
En cas d’échec chirurgical, une deuxième chirurgie peut s’imposer en fonction de l’âge du patient et du stade évolutif du GPAO.
-
Même en cas de succès à long terme, la surveillance à vie du patient est impérative.
[1] AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS) : 6. The advanced glaucoma intervention study, 6 : effect of cataract on visual field and visual acuity. Arch Ophthalmol. 2000 ; 118 : 1639-52.
[2] AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS) : 7. The relationship between control of intraocular pressure and visual field deterioration. Am J Ophthalmol. 2000 ; 130 : 429-40.
[3] AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS) : 13. Comparison of treatment outcomes within race : 10-year results. Ophthalmology. 2004 ; 111 : 651-64.
[4] Chen PP, Weaver YK, Budenz DL, et al. 2nd Trabeculectomy function after cataract extraction. Ophthalmology. 1998 ; 105 : 1928-35.
[5] Migdal C, Gregory W, Hitchings R. Long-term functional outcome after early surgery compared with laser and medicine in open-angle glaucoma. Ophthalmology. 1994 ; 101 : 1651-6 ; discussion 1657.
[6] Peponis VG, Chalkiadakis SE, Katzakis MC, Parikakis EA. The effect of phacoemulsification on late bleb failure or intraocular pressure in patients with glaucoma : a systematic review. Clin Ophthalmol. 2012 ; 6 : 1045-9.
[7] Tran DH, Souza C, Ang MJ, Loman J, et al. Comparison of long-term surgical success of Ahmed Valve implant versus trabeculectomy in open-angle glaucoma. Br J Ophthalmol. 2009 ; 93 : 1504-9.
O. Laplace
-
Les techniques d’affaiblissement du corps ciliaire au laser sont efficaces pour traiter les glaucomes réfractaires déjà opérés par trabéculectomie ou par valve.
-
Il n’existe pas de consensus pour un protocole de traitement optimal tant avec le laser transscléral qu’avec les voies endoscopiques.
-
La voie endoscopique (endo-cyclo-photocoagulation ou endoscopic cyclophotocoagulation [ECP]) devrait s’imposer comme le traitement de référence de la cyclodestruction. Les suites au long cours sont en faveur de l’ECP.
-
Le nombre de traitement et l’intensité par cession conditionnent le risque de phtyse.
-
Les valves sont une alternative de choix dans le traitement de ces patients.
Les glaucomes réfractaires sont définis classiquement comme des glaucomes non contrôlés, sous traitement médical maximal toléré, et ayant eu au moins une intervention chirurgicale filtrante. Il s’agit de patients atteints de GPAO difficile à contrôler, avec un passé souvent complexe, rythmé par plusieurs procédures et des échecs. Le pronostic visuel est parfois engagé à court terme.
Il n’existe pas de consensus sur la prise en charge, mais différentes possibilités que le chirurgien saura partager en fonction de son expérience. Le risque opératoire devra être évalué et précisé au patient.
Il est très difficile de comparer les différentes possibilités thérapeutiques entre elles et de conseiller un choix préférentiel de façon systématique. En effet, la majorité des études sont rétrospectives, avec des effectifs limités, des critères de succès d’exigences diverses, et souvent des formes cliniques différentes de glaucome (uvéitiques, traumatiques, néovasculaires, etc.) au pronostic variable. Néanmoins, la prise en charge des glaucomes réfractaires est soumise à certaines constantes :
-
d’ordre clinique d’une part, en fonction de la situation propre à chaque patient (acuité visuelle restante, antécédents chirurgicaux, possibilité de suivi, etc.) ;
-
et d’ordre plus technique d’autre part : matériel accessible (diode, etc.), choix du matériau et de sa taille (valves, drains, etc.).
Devant ces situations cliniques à un stade thérapeutique évolué, il faut toujours penser aux possibilités limitées de renouveler le traitement choisi chez ces patients dont les antécédents sont lourds. Il faudra tenter, dans la mesure du possible, de programmer un enchaînement thérapeutique permettant d’autres alternatives en cas de nouvel échec. Les moyens thérapeutiques disponibles regroupent : les systèmes de drainage, les techniques d’affaiblissement du corps ciliaire par laser diode externe ou interne et, plus récemment, par ultrasons. La cyclocryoapplication semble aujourd’hui abandonnée.
La pose d’un système de drainage doit être envisagée de préférence si la fonction visuelle est encore satisfaisante avec une acuité visuelle chiffrable, et chez le sujet jeune, après une analyse systématique de différentes données.
Les antécédents chirurgicaux sont soigneusement répertoriés.
La taille de l’orbite doit être évaluée et confrontée à celle du globe oculaire. Une orbite de taille moyenne avec un œil microphtalme est plus adaptée à ce type de prothèse qu’une orbite large avec un globe oculaire volumineux de longueur axiale > 28 mm. La taille de l’implant ainsi que celle de la bulle kystique de filtration parfois exubérante doivent être prises en compte (fig. 18-5). Dans certains cas, le bilan est complété par une échographie oculaire en mode B (analyse du globe pour les myopies fortes) et/ou un scanner pour mieux évaluer la cavité orbitaire et l’espace entre le globe et l’orbite.
La position des plateaux sera adaptée en fonction des situations cliniques. Après une chirurgie de strabisme ou de décollement de rétine avec indentation, on préférera le quadrant temporal supérieur au quadrant nasal supérieur. L’implantation inférieure est toujours une solution de repli. En cas d’indentation sclérale, elle peut être sectionnée de part et d’autre des muscles droits, et le plateau est fixé avec précaution en avant du lit de l’éponge (scléromalacie du lit scléral indenté). Tous les dispositifs à double plateau sont à éviter dans une telle situation. On s’orientera sur des plateaux moins larges : Ahmed FP7™, Modèle 3™ ou Molteno™ simple plateau. On évitera le tube de Baerveldt™ dont les ailes sont largement déployées sous les muscles droits en temps normal, excepté si les deux extrémités latérales sont sectionnées pour ne garder que le centre du dispositif.
En présence d’un implant de chambre antérieure, une implantation postérieure doit être envisagée. Celui-ci pourra être changé pendant la procédure avec la pose d’implant postérieur clipsé à l’iris, limitant les risques de perte des cellules endothéliales en cas d’athalamie. Une vitrectomie 23 G transconjonctivale est nécessaire. Seul le site où sera placé le plateau est secondairement disséqué. L’objectif est d’épargner la plus grande zone conjonctivale possible pour permettre soit des recouvrements secondaires du tube ou plateau si nécessaire, soit la possibilité d’un lambeau vascularisé pour une éventuelle reprise dans un autre secteur oculaire plus fragile (ancien site de trabéculectomie avec bulle avasculaire par exemple). On utilisera des versions spécifiques de valves ou de tubes postérieures (Baerveldt™ Pars Plana BG 102-350, Ahmed™ PS2 ou PC7) ou les dispositifs classiques en fixant le tube à la sclère (fig. 18-6).

Fig. 18-5 IRM de la patiente avec implantation d’une valve de Baerveldt™ 350. PIO de 13 mmHg à 1 an. Noter que le plateau n’est pas en contact direct sur toute sa surface avec le globe oculaire.
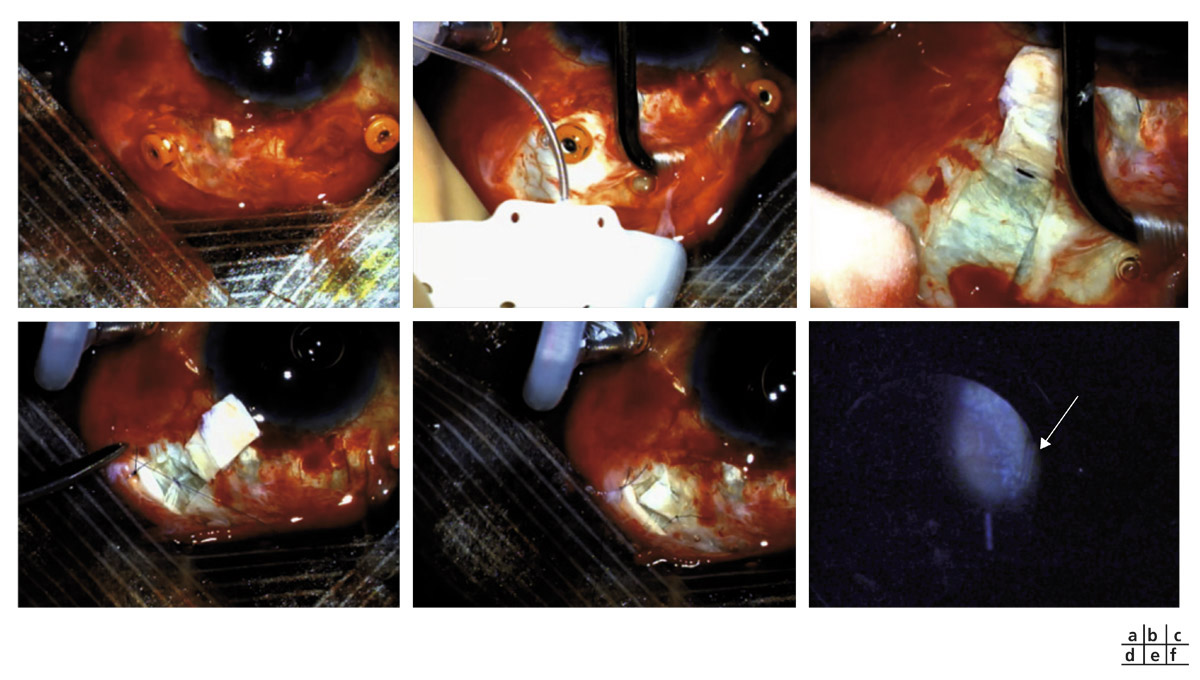
Fig. 18-6 Pose d’une valve postérieure. a. Vitrectomie 23 G ; seul le quadrant recevant la valve sera mis à nu. b, c. Valve de Baerveldt™ et réalisation d’un volet scléral de protection du tube. d. Suture du tube avec un fil résorbable pour limiter les hypotonies postopératoires. e. Aspect en fin d’intervention. f. Tube visible dans la cavité vitréenne.
L’affaiblissement du corps ciliaire est une procédure simple et peu invasive. Par voie trans-conjonctivo-sclérale, celle-ci ne dure que quelques minutes sous anesthésie locale. Par voie endoculaire, sa réalisation nécessite un matériel adapté avec une sonde endoscopique et un moniteur-écran pour suivre la procédure. Préconisée après les échecs des chirurgies filtrantes traditionnelles ou secondaires à la pose de valves, cette technique, qui s’impose si l’acuité visuelle est basse avec un champ visuel proche du point de fixation, est également indiquée dans certaines situations, notamment en cas de mauvais rapport bénéfice/risque de la mise en place d’une valve (cerclage chirurgical, scléromalacie, conjonctive symphysée à la sclère, échec d’un tube).
Nous rappellerons les grands principes de cette technique (plus amplement abordée dans le chapitre 16-I, paragraphe « Cyclodestructions »). Le laser diode (810 nm) transscléral est facile d’utilisation, le problème essentiel étant le repérage des procès ciliaires dont l’ombre se projette au limbe (pars plicata à 2 mm) lorsqu’une lumière est approchée de la pupille dans un bloc toutes lumières éteintes (fig. 18-7).
L’anesthésie est péribulbaire ou topique + gel, potentialisée par antalgiques et bolus de Diprivan®. Les 20 à 30 impacts réalisés en moyenne sur 300° (laissant indemnes les méridiens 3 heures–9 heures pour la vascularisation) auront un effet et une localisation incertains, expliquant la fréquence des récidives (2,2 ± 1,3 procédures), avec un risque éventuel de surdosage augmentant les risques de phtyse secondaire. Une intensité moyenne de 1750 à 2000 mW est appliquée pendant 2 000 ms, délivrant une énergie de 4 joules par pulse. L’efficacité varie en fonction de paramètres tels que l’âge, le type de glaucome, les antécédents de procédures ou le sexe. Le taux de succès augmente avec l’âge, plutôt chez les hommes.
Schlote et al. ont montré un taux de succès proche de 90 % chez les GPAO, de 57 % sur les glaucomes traumatiques et de l’aphake [14]. On observe, selon les critères et la nature de la procédure, une pression intra-oculaire (PIO) < 21 mmHg dans 54 à 92 % des cas [8]. L’étude de Ness et al. en 2012 a montré sur 32 yeux en échec pressionnel après une valve une diminution supplémentaire de 28,6 à 14,7 mmHg à un an, soit une baisse de 43 % de la PIO. Quatre patients ont développé une hypotonie (PIO < 5 mmHg) persistante [13].
Le suivi se fera à J1, J7, M1, M3, M6. Les traitements anti-inflammatoires seront associés pendant 6 à 8 semaines, et les traitements antiglaucomateux diminués selon les résultats tensionnels en débutant par l’arrêt du Diamox®.
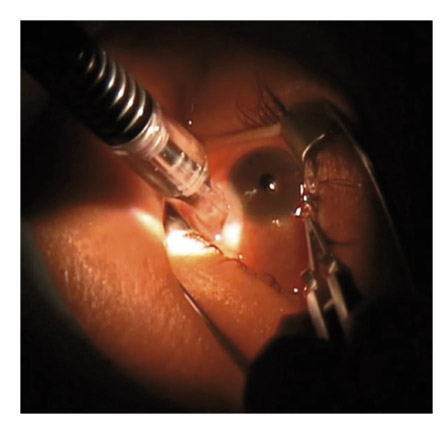
Fig. 18-7 Laser diode transscléral positionné au limbe à 2 mm-2,5 mm.
L’avenir est probablement dans le repérage direct des procès ciliaires. Les premiers résultats ont été publiés au début des années 1990.
L’endo-cyclo-photocoagulation (ECP) est séduisante. Elle peut se faire en chambre antérieure chez l’aphake ou le pseudophake, pendant une chirurgie combinée glaucome-cataracte, ou bien par la pars plana si un traitement vitréorétinien s’associe à la pathologie glaucomateuse [10]. Ce geste complémentaire pourra se faire dans les meilleures conditions : ablation éventuelle de vitré incarcéré dans le tube dans les glaucomes de l’aphake, panphotocoagulation rétinienne (PPR) complémentaire en cas de glaucome néovasculaire (GNV) secondaire, ablation de silicone ou de son émulsion, le tout réalisable même en cas de trouble de la transparence cornéenne. L’ECP postérieure est une alternative si le comptage cellulaire endothélial expose à un risque de décompensation cornéenne postopératoire.
Le matériel se compose d’un endoscope (endolumière xénon couplée à un laser diode 810 nm [OTI™, Endoptiks]) et d’un système d’imagerie. L’image est capturée de la sonde de l’endoscope via des fibres optiques jusqu’à une caméra-CCD. Le chirurgien observe alors une image de 10 000 à 17 000 pixels sur un moniteur. Les sondes vont 18 à 23 G (0,6 à 1,2 mm de diamètre) selon le nombre de fonctions incorporées au sein de l’endoscope. Il existe des modèles droits ou courbes. Les systèmes avec trois fonctions (image, endolumière, laser) se déclinent en 20 G et 10 000 pixels. La profondeur de champ est de 1 à 7 mm avec une vue panoramique d’au moins 70° à 110° pour les versions 10 000 pixels, jusqu’à 140° pour les 17 000 pixels [2].
Un terminal d’infusion est placé à 3,5 mm du limbe lors des procédures postérieures. La voie d’abord est limbique ou cornéenne pour l’ECP antérieure ; la distance optimale entre la sonde et le procès est de 2 à 3 mm. Des impacts de 0,2 à 0,5 W sont répartis sur 210 à 360° directement sur les procès ciliaires pendant quelques secondes, le temps nécessaire au blanchiment de toute la surface du procès (< 2 secondes) (eFig. 18-2).
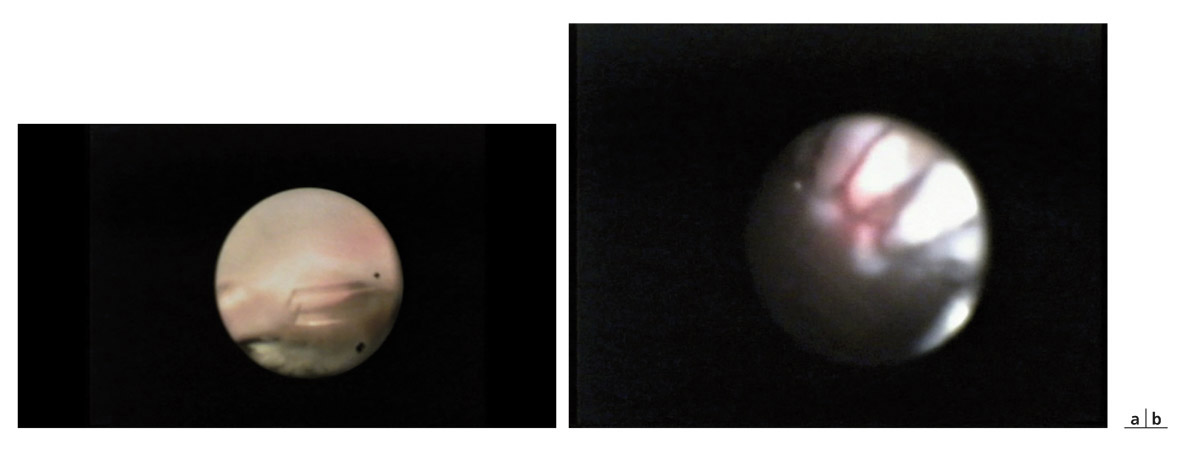
eFig. 18-2 Exemple de champ d’observation par un endoscope 20 G rendant une image de 10 000 pixels. a. Extrémité d’un tube placé en chambre antérieure chez un patient aphake. b. Blanchiment des procès ciliaires en endoscopie par voie postérieure avec une sonde de 20 G avec endolumière, laser diode et fibres optiques. Le contrôle de l’impact est total.
Cette possibilité s’adapte parfaitement lors des chirurgies combinées avec extraction du cristallin, le traitement des procès se faisant après l’implantation sous viscoélastique. Des kystes ciliaires pourront être repérés et traités dans la même séance. Dans le cadre des syndromes d’iris plateau, l’association de la chirurgie de la cataracte avec un traitement physique direct sur les procès ciliaires aura une grande chance de restituer de l’espace à l’angle iridocornéen. Contrairement au laser transscléral, le laser est dirigé directement sur les procès sans créer de lésions périphériques, et les risques d’hypotonie semblent sensiblement réduits. L’ECP est très utile lorsque les options filtrantes ont déjà été utilisées (trabéculectomies itératives, shunts par tube ou valve). Francis et al. retrouvent une baisse de 30 % de la PIO (24,02 à 15,38 mmHg à 12 mois) sur des patients ayant déjà été opérés par valves après traitement sur 360° des procès en ECP. Les médicaments hypotonisants étaient diminués de 3,2 à 1,5 [7].
La diode par voie postérieure est indiquée si la cornée présente des risques de décompensation : greffe de cornée antérieure, cornea guttata, implant de chambre antérieure, implant phake et dès lors qu’une pathologie vitréorétinienne nécessite un traitement spécifique.
Lima et al. ont comparé l’ECP postérieure et la valve d’Ahmed chez 68 patients pseudophakes ayant déjà eu une trabéculectomie avec antimitotique. Le taux de succès (PIO comprise entre 6 et 21 mmHg avec ou sans traitement) était identique dans les deux groupes : > 70 % à 2 ans. Les décollements choroïdiens et l’athalamie étaient nettement plus importants avec les valves [9].
Les complications de la destruction ciliaire par voie endoscopique sont celles des glaucomes difficiles au passé nourri de procédures chirurgicales antérieures. En effet, le taux de complications de l’ECP antérieure en première intention couplée à la cataracte est très faible : pic d’hypertension (14 %), hyphéma (5 %), décollement choroïdien (DC) (0,36 %), perte de deux lignes d’acuité visuelle (AV) (1 %) d’après l’ECP Collaborative Study Group sur 5 824 patients [8]. Dès lors que la technique s’adresse à une population de glaucomes réfractaires, les complications augmentent en fréquence : décompensation de greffe de cornée, hyphéma (12 %), hypotonie (8 %), perte de deux lignes d’AV (6 à 30 %), œdème maculaire cystoïde (OMC) (10 %), décollement de rétine (DR) dans les abords postérieurs [4, 6, 8, 12]. Les cas de phtyse et d’hypotonie persistante seraient nettement moins importants avec l’ECP qu’avec les procédures transsclérales [8, 12].
Cette nouvelle approche de destruction des procès ciliaires se fait par voie externe transsclérale. Les premiers résultats sont prometteurs avec une baisse pressionnelle de 33,9 % à un an [1]. Des travaux complémentaires nous aideront dans l’avenir à trouver la place de cette technique séduisante dans notre pratique courante.
L’étude rétrospective de Malik et al. concernant 54 patients ayant soit un laser transscléral soit un tube de MoltenoTM montre une baisse supplémentaire de 3 mmHg en faveur du tube (21,13 versus 17,12 mmHg) [11]. En retranchant les glaucomes néovasculaires, la courbe de survie des deux groupes est identique. Les complications sont aussi fréquentes dans les deux groupes ; seule la nature de celles-ci varie : plus de DC, de chambres antérieures (CA) étroites et d’œdèmes de cornée avec les tubes, et plus de phtyses et de réactions inflammatoires de CA avec le laser diode. Les drains et tubes sont proposés après au moins deux trabéculectomies par les ophtalmologistes australiens et néozélandais ; les ophtalmologistes américains les conseillent plus volontiers dès qu’une chirurgie pour une autre indication a déjà eu lieu : éponge, greffe de cornée ou vitrectomie [5]. Alors que le nombre de trabéculectomies ne cesse de diminuer aux États-Unis, passant de 51 690 en 1995 à 24 178 en 2004, le nombre de systèmes de drainage posés augmente de 2 728 à 7 744 pendant la même période [3] et les cyclodestructions se chiffrent à 11 536 en 2004 alors qu’elles n’étaient que de 3 264 en 1995.
Choisir entre l’une de ces procédures est le fruit d’une réflexion au cas par cas. Certaines situation semblent évidentes : une AV limitée à la perception lumineuse fera choisir la procédure la moins chère et la plus facile, le diode transscléral ; un glaucome avec une conjonctive inexploitable et une cataracte doit orienter vers une combinaison phacoémulsification–endo-cyclo-diode ou la pose d’une valve.
En cas de décompensation cornéenne préexistante, une valve-greffe peut être proposée, et le tube de la valve peut être suturé à l’iris par un prolène 10/0. L’implantation postérieure d’une valve ou d’un drain est recommandée si un geste chirurgical vitréorétinien s’impose, en cas de déficit des cellules endothéliales ou en présence d’un implant de CA.
Pour les autres cas intermédiaires, il faudra adapter sa procédure en fonction de chaque patient. Les grands principes sont exposés à la figure 18-8.
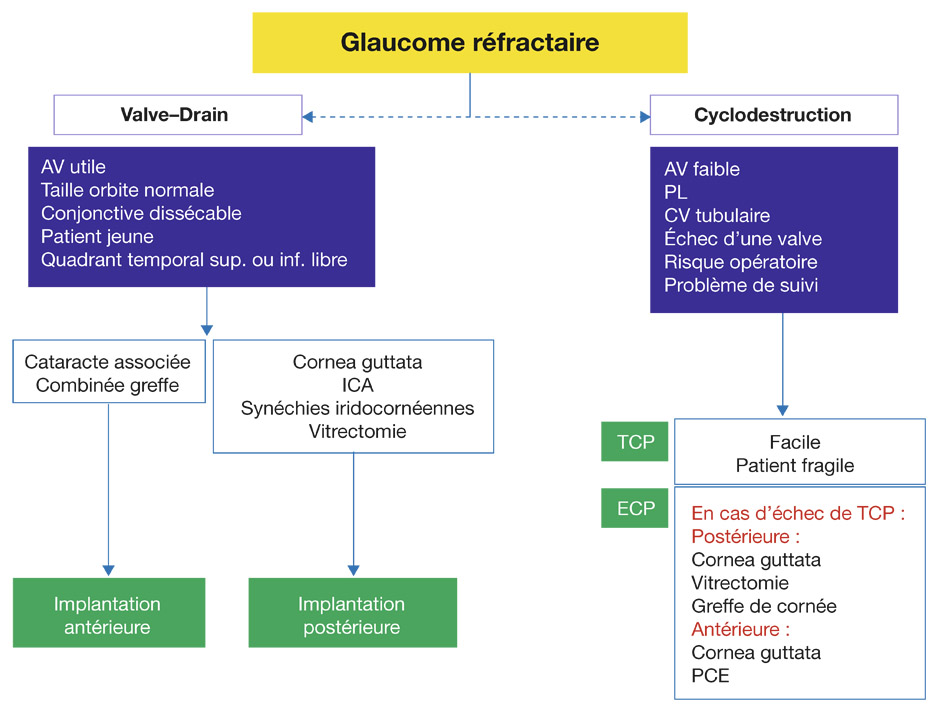
Fig. 18-8 Prise en charge des glaucomes réfractaires. AV : acuité visuelle ; CV : champ visuel ; ECP : endocyclophotocoagulation ; ICA : implant de chambre antérieure ; PCE : phaco-exérèse ; PL : perceptions lumineuses ; TCP : cyclophotocoagulation transsclérale.
La prise en charge des glaucomes réfractaires est souvent trop tardive. Dès lors que l’état du patient s’aggrave sous traitement, une décision concertée s’impose et doit aboutir à un geste prenant en compte le terrain du patient et les possibilités de succès conditionnées par l’âge, la nature des procédures antérieures et l’expérience du chirurgien. Si aucune technique ne s’impose comme premier choix, nous disposons de plusieurs alternatives qu’il faut savoir associer. Malgré tous les efforts entrepris, le pronostic visuel de ces patients reste parfois mal engagé.
Retenir
-
La prise en charge des glaucomes réfractaires doit se faire avant la dégradation majeure de l’AV.
-
La cyclodestruction est un processus irréversible, mais simple à réaliser dans sa version transsclérale.
-
La voie endoscopique (ECP) est probablement plus efficace, mais comporte quelques risques de procédure par rapport à la voie transsclérale. Elle s’impose plus en cas de chirurgie associée de la cataracte.
-
La prise en charge de ces patients nécessite parfois des procédures combinées : vitrectomie, changement d’implant, cataracte, greffe de cornée.
-
Les valves sont d’autant plus indiquées que l’AV et le CV restent chiffrables.
[1] Aptel F, Charrel T, Lafon C, et al. Miniaturized high-intensity focused ultrasound device in patients with glaucoma : a clinical pilot study. Invest Ophthalmol Vis Sci. 2011 ; 52 (12) : 8747-53.
[2] Boscher C. Endoscopic vitreoretinal surgery of the injured eye. In : Virgil Alfaro III D, Liggett PE (Eds). Vitreoretinal surgery of the injured eye. Lippincott-Raven Publishers ; 1999. p. 301.
[3] Campbell RJ, Trope GE, Rachmiel R, Buys YM. Glaucoma laser and surgical procedure rates in Canada : a long-term profile. Can J Ophthalmol. 2008 ; 43 (4) : 449-53.
[4] Chen J, Cohn RA, Lin SC, et al. Endoscopic photocoagulation of the ciliary body for treatment of refractory glaucomas. Am J Ophthalmol. 1997 ; 124 (6) : 787-96.
[5] Chow K, Mora J. Practice preferences for glaucoma drainage device implantation and cyclodestruction in Australia and New Zealand. J Glaucoma. 2012 ; 21 (3) : 199-205.
[6] Falkenberry SM, Siegfried CJ. Endocyclophotocoagulation. Middle East Afr J Ophthalmol. 2009 ; 16 (3) : 130-3. doi : 10.4103/0974-9233.56225.
[7] Francis BA, Kawji AS, Vo NT, et al. Endoscopic cyclophotocoagulation (ECP) in the management of uncontrolled glaucoma with prior aqueous tube shunt. J Glaucoma. 2011 ; 20 (8) : 523-7.
[8] Ishida K. Update on results and complications of cyclophotocoagulation. Curr Opin Ophthalmol. 2013 ; 24 (2) : 102-10. doi : w.PubMed PMID : 23313903.
[9] Lima FE, Magacho L, Carvalho DM, et al. A prospective, comparative study between endoscopic cyclophotocoagulation and the Ahmed drainage implant in refractory glaucoma. J Glaucoma. 2004 ; 13 (3) : 233-7.
[10] Lin SC. Endoscopic and transscleral cyclophotocoagulation for the treatment of refractory glaucoma. J Glaucoma. 2008 ; 17 (3) : 238-47.
[11] Malik R, Ellingham RB, Suleman H, Morgan WH. Refractory glaucoma-tube or diode ? Clin Experiment Ophthalmol. 2006 ; 34 (8) : 771-7.
[12] Murthy GJ, Murthy PR, Murthy KR, et al. A study of the efficacy of endoscopic cyclophotocoagulation for the treatment of refractory glaucomas. Indian J Ophthalmol. 2009 ; 57 (2) : 127-32.
[13] Ness PJ, Khaimi MA, Feldman RM, et al. Intermediate term safety and efficacy of transscleral cyclophotocoagulation after tube shunt failure. J Glaucoma. 2012 ; 21 (2) : 83-8.
[14] Schlote T, Derse M, Rassmann K, et al. Efficacy and safety of contact transscleral diode laser cyclophotocoagulation for advanced glaucoma. J Glaucoma. 2001 ; 10 (4) : 294-301.

