J.-P. Renard, E. Sellem
-
Les taux de progression ont été évalués dans plusieurs études prospectives.
-
Ils présentent une grande variabilité selon la forme de glaucome à angle ouvert.
-
Les patients glaucomateux considérés comme « progresseurs lents » sont majoritaires.
-
La combinaison des tests de la structure et de la fonction, le plus tôt possible dans le suivi du glaucome, doit surtout permettre de repérer les sujets « progresseurs rapides ».
-
La vitesse de progression peut varier chez un même patient d’une période de sa vie à l’autre, et est souvent accélérée par des facteurs de risque, en particulier des facteurs vasculaires.
Déterminer la modalité de progression du glaucome primitif à angle ouvert (GPAO) représente un temps essentiel dès les premiers stades de la prise en charge de tout patient glaucomateux en pratique clinique courante.
Nous disposons de peu de données concernant l’évolution naturelle de la neuropathie optique glaucomateuse. Les résultats des différentes études cliniques rapportent des taux de progression du GPAO très variables en fonction de la durée du suivi, avec respectivement une progression chez 54 % des patients glaucomateux à dix ans dans l’étude St Lucia [7], 60 % à cinq ans dans l’étude CNTGS (Collaborative Normal Tension Glaucoma Study) [1] et de 62 % à six ans dans l’étude EMGT (Early Manisfest Glaucoma Treatment Study) [3, 4]. Concernant l’hypertension intra-oculaire, la conversion vers le glaucome a été de 10 % à cinq ans dans l’étude OHTS (Ocular Hypertension Treatment Study).
Si l’étude CNTGS apporte quelques éléments concernant seulement le glaucome à pression normale (GPN), on peut retenir de l’ensemble de ces études que la progression est lente chez la plupart des patients, mais avec d’importantes variations de ce taux de progression.
L’étude EMGT est la seule étude prospective avec un groupe contrôle de patients glaucomateux non traités, incluant les formes les plus courantes de glaucome à angle ouvert (GPAO) chez les patients caucasiens. Elle permet d’obtenir, à six ans, les résultats chez 116 patients non traités atteints de GPAO, de GPN ou de glaucome exfoliatif (GXF), répartis en trois groupes d’âge similaire. Ces résultats indiquent une grande variabilité de la progression entre ces différents groupes, mais également parmi les patients à l’intérieur de chacun de ces groupes. Ils rapportent à six ans une progression chez 74 % des GPAO, 56 % des GPN et 93 % des GXF, avec des taux moyens de progression respectivement de – 1,31 dB/an, – 0,36 dB/an et – 3,13 dB/an.
La progression est beaucoup plus rapide et plus précoce chez les patients présentant un GXF (19,5 mois en moyenne) que chez les patients présentant un GPAO (44,8 mois) et chez ceux présentant un GPN (61,1 mois) (fig. 11-1).
L’étude CNGTS rapporte un taux moyen de progression dans le GPN de – 0,39 dB/an, similaire à celui trouvé dans l’étude EMGT (– 0,36 dB/an), mais sur une durée d’observation plus courte qui explique vraisemblablement le taux plus faible de « GPN progresseurs » (33 %) dans cette étude.
Un certain nombre de facteurs jouent un rôle sur les modalités de progression du GPAO. Le niveau initial de PIO, l’âge du patient – avec une évolution plus rapide chez le sujet âgé par rapport au sujet jeune –, la bilatéralité du GPAO, les hémorragies du disque optique, mais également une pression artérielle systolique plus basse, une pression de perfusion oculaire systolique plus basse ainsi que l’existence d’une maladie cardiovasculaire ont ainsi été rapportés comme des facteurs prédictifs, suggérant au passage une responsabilité vasculaire dans la progression du glaucome [5].

Fig. 11-1 Temps de progression chez les patients non traités présentant un GPAO à pression élevée, un glaucome à pression normale (GPN) et un glaucome exfoliatif (GXF). (Avec l’aimable autorisation de A. Heijl [4].)
Pour évaluer les modalités de progression, les résultats des différentes études soulignent l’importance d’un suivi simultané de l’atteinte structurale et de l’atteinte fonctionnelle chez tout patient suspect ou atteint de glaucome. Il n’a en effet pas encore été éclairci pourquoi certains patients semblent développer d’abord une modification structurale alors que d’autres présentent d’abord une atteinte fonctionnelle. Ces variations pourraient être en rapport avec la précision des méthodes utilisées pour l’évaluation des modifications structurales et fonctionnelles.
La quantification de la vitesse de progression permet aussi de définir deux groupes de patients glaucomateux : les « progresseurs lents », qui sont majoritaires, et les « progresseurs rapides », qui nécessitent un suivi plus étroit avec une prise en charge thérapeutique différente. La détermination de la vitesse de progression va dicter les modalités de prise en charge, et particulièrement la fréquence des différents examens [2].
Devant une suspicion de GPAO ou lors du diagnostic, les modalités de suivi sont guidées par un impératif : ne pas passer à côté d’un patient « progresseur rapide ».
Des études récentes concernant plus de 300 yeux atteints de GPAO, suivis sur des périodes supérieures à deux ans, rapportent une progression plus rapide pour les glaucomes à un stade avancé (MD = – 10,94 dB) que pour les glaucomes moins évolués (MD = – 0,73 dB) [6].
La détection de la progression nécessite de bien comprendre la variabilité de celle-ci en fonction de la forme clinique, du stade évolutif et d’un certain nombre de facteurs associés. Chez le même patient peuvent se succéder différentes modalités de progression, avec des alternances de progression lente et de progression rapide qu’il faudra savoir dépister afin de les contrôler par une prise en charge adaptée. Les évaluations cliniques combinant les informations structurales et fonctionnelles sont les plus prometteuses sur le long terme, améliorant non seulement les capacités de diagnostic du GPAO et la détermination de son stade évolutif, mais surtout la détection de sa progression. La connaissance du type de progression du GPAO chez un patient donné constitue ainsi la pierre angulaire de la prise en charge en pratique clinique courante du glaucome, afin d’en définir les modalités et de préciser la fréquence optimale des contrôles, celle-ci devant être adaptée à chaque situation clinique et à chaque patient.
Retenir
-
Une progression habituellement linéaire est rapportée par de nombreuses études à long terme.
-
La progression du GPAO est caractérisée par une grande variabilité inter- et intra-individuelle au cours des différentes périodes de l’évolution de la neuropathie, plusieurs facteurs favorisant cette progression.
-
La progression est lente dans la majorité des cas de GPAO.
-
Une minorité de patients présente une progression rapide, jusqu’à trois fois plus élevée que celle de la moyenne des autres patients.
-
L’évaluation du mode de progression chez tout patient est essentielle. Il n’est pas prédictible mais doit être déterminé individuellement tout au long du suivi. Il n’existe à ce jour aucun essai de données disponibles qui puisse être utilisé pour prédire le taux de progression d’un patient donné au moment du diagnostic d’un glaucome débutant ou à un stade modéré.
[1] Collaborative Normal Tension Glaucoma Studies Group. Comparison of glaucomatous progression between untreated patients with normal tension glaucoma and patients with therapeutically reduced intra ocular pressure Am J Ophthalmol. 1998 ; 126 : 487-97.
[2] Crabb DJ, Garway-Heath DF. Intervals between visual field tests when monitoring the glaucomatous patients : wait and see approch. Invest Ophthalmol Visc Sci. 2012 ; 53 : 2770-6.
[3] Gordon MO, Beiser JA, Brandt JD, et al. The EMGTS : baseline factors that predict the onset of primary open angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 114-20.
[4] Heijl A, Leske MC, Bengtsson B, et al. Reduction of IOP and glaucoma progression : results from the EMGT. Arch Ophthalmol. 2002 ; 120 : 1268-79.
[5] Leske MC, Heijl A, Hyman L, et al. Predictors of long term progressions and the EMGT. Ophthalmology. 2007 ; 114 : 1965-7.
[6] Na JH, Sung KR, Baek S, et al. Progression of RNFL signs and glaucoma assessed by Cirrus OCT–GPA. Curr Opin Eye Res. 2013 ; 38 : 386-95.
[7] Wilson MR, Kosoko O, Cowan CL, et al. Progression of visual field lost and untreated glaucoma peaches and glaucoma suspect and St lucia, West Indies. Am J Ophthalmol. 2002 ; 134 : 399-405.
J. Laloum, H. Lemij, J.-P. Renard, J.-F. Rouland, E. Sellem
J.-P. Renard, E. Sellem
« Celui qui aime à apprendre est bien près du savoir. »
Confucius (555-479)
L’identification d’une progression du glaucome primitif à angle ouvert (GPAO) est souvent un véritable défi diagnostique. Sa détection est importante dans la prise en charge de la neuropathie, en raison de l’efficacité des traitements actuels qui apportent la possibilité de ralentir la progression du glaucome.
L’évaluation soigneuse des structures oculaires du segment postérieur est capitale, non seulement dans le diagnostic du glaucome, mais également dans le suivi de la neuropathie optique pour affirmer la stabilité ou la progression de l’affection.
Elle doit se faire à tous les stades de la neuropathie.
Les modifications structurales de la tête du nerf optique (TNO), des fibres nerveuses rétiniennes (FNR), ainsi que du complexe maculaire cellulaire ganglionnaire (GCC) sont précoces. Elles précèdent fréquemment, de plusieurs années, les pertes fonctionnelles du champ visuel dont les fluctuations à long terme et la variabilité des relevés doivent être considérées pour interpréter une stabilité ou une évolution des déficits. Sommer rapporte chez 60 % des patients avec une hypertension intra-oculaire (HTO) ayant évolué vers un glaucome une perte en FNR, et ce jusqu’à six ans avant un changement détectable en périmétrie automatisée standard (PAS) [7]. Lors d’une atteinte du CV, la preuve d’une perte en FNR est retrouvée chez 88 % des patients [8]. La relation entre la perte cellulaire ganglionnaire et la perte de sensibilité fonctionnelle n’est pas linéaire, surtout dans les stades précoces du GPAO pour lesquels on considère qu’il existerait une perte d’environ 30 à 50 % de cellules ganglionnaires lors de l’apparition des premiers déficits en PAS [2, 3].
Ces données ont été largement confirmées par plusieurs grandes études multicentriques (Ocular Hypertension Treatment Study ou OHTS, Early Manisfest Glaucoma Treatment Study ou EMGT, etc.). L’étude OHTS rapporte que plus de la moitié des patients traités ou non (respectivement 55 % et 57 %), suivis pendant cinq ans et ayant évolué vers un glaucome présentaient des lésions structurales isolées progressives du disque optique sans changement associé de la fonction visuelle en PAS, alors qu’une atteinte isolée du champ visuel n’était retrouvée que chez 35 % des patients traités ayant présenté une aggravation de la neuropathie [1, 4].
L’évaluation des structures oculaires postérieures doit donc être systématique dès le 1er examen, à chaque stade du GPAO et lors de chaque contrôle du patient. Elle peut se faire selon plusieurs modalités : l’examen clinique stéréoscopique qui sera toujours systématique, la réalisation régulière de photographies ou de stéréophotographies ; enfin, elle est désormais utilement complétée par une évaluation quantitative de certains paramètres de ces différentes structures à l’aide des systèmes d’imagerie par laser. Ils permettent une analyse qualitative et quantitative de la TNO, des FNR et du GCC [5, 6].
Répétée à chaque examen, l’analyse sera aussi comparative avec les évaluations précédentes qui servent de références et doivent elles aussi être bien documentées. Ces différentes notions soulignent, comme nous l’avons vu, l’importance capitale de l’évaluation initiale de la TNO et des FNR (voir chapitre 10-VI).
[1] Gordon MO, Beiser JA, Brandt JD, et al. The Ocular Hypertension Treatment Study : baseline factors that predict the onset of primary open angle glaucoma. Arch Ophthalmol. 2002 ; 120 : 714-20.
[2] Harwerth RS, Carter-Dawson L, Shen F, et al. Ganglion cell losses underlying visual field defects from experimental glaucoma. Invest Ophthalmol Visc Sci. 1999 ; 40 : 2242-50.
[3] Kerrigan-Baumrind LA, Quigley HA, Pease ME, et al. Number of ganglion cells in glaucoma eyes compared with thresholds in visual tests in the same persons. Invest Ophthalmol Visc Sci. 2000 ; 41 : 741-48.
[4] Leske MC, Heijl A, Hyman L, et al. Factors for progression and glaucoma treatment. The Early Manifest Glaucoma Trial. Curr Opin Ophthalmol. 2004 ; 15 : 102-6.
[5] Renard JP. Comment s’assurer de la stabilité d’un glaucome. J Fr Ophtalmol. 2006 ; 29 : 2S27-2S32.
[6] Renard JP, Giraud JM. Imagerie de la structure : HRT, GDx et OCT. J Fr Ophtalmol. 2006 ; 29 : 64-73.
[7] Sommer A, d’Anna SA, Kues HA, et al. High resolution photography of the retinal nerve fiber layer. Am J Ophthalmol. 1983 ; 96 : 535-9.
[8] Sommer A, Tielsh JM, Katz J, et al. Relationship between intraocular pressure and primary open angle glaucoma among white and black Americans ; The Baltimore Eye Survey. Arch Ophthalmol. 1991 ; 109 : 1090-5.
E. Sellem
L’évaluation clinique stéréoscopique, même si elle est associée à la réalisation régulière de clichés photographiques, ne donne pas toujours suffisamment d’informations pour s’assurer de la stabilité ou de la progression du GPAO. Elle pose également des problèmes d’interprétation, notamment en cas de grande papille et dans les papilles « difficiles » (petite papille, papille dysmorphique, dysversion papillaire, etc.). Ces limites soulignent l’intérêt de l’analyse quantitative de la TNO et des FNR pour améliorer la précision des méthodes d’évaluation d’une stabilité ou d’une progression du glaucome.
Peuvent être considérés comme des signes de progression du GPAO :
-
l’amincissement de l’anneau neurorétinien ;
-
la constatation d’une ou de plusieurs hémorragie(s) papillaire(s), jusqu’à preuve du contraire ;
-
l’élargissement de la zone d’atrophie parapapillaire β, mais elle n’est pas spécifique ;
-
l’apparition de déficits des fibres nerveuses rétiniennes, leur élargissement et leur multiplication.
Il est courant d’affirmer que l’examen biomicroscopique et l’observation des clichés du fond d’œil ne sont pas les éléments cliniques les plus pertinents pour repérer une aggravation du glaucome :
-
avant les analyseurs, c’était classiquement l’observation de la papille et des fibres nerveuses rétiniennes (FNR) qui permettait le diagnostic du glaucome tant l’atteinte fonctionnelle était (et est toujours) souvent retardée. Cependant, dès qu’une atteinte périmétrique était objectivée, la progression était essentiellement affirmée par l’aggravation des déficits du champ visuel, beaucoup plus évidente qu’une modification visible de la papille, petite structure anatomique ;
-
les analyseurs permettent aujourd’hui des mesures et un suivi très précis des paramètres structuraux, avec des résolutions de quelques microns, bien plus performants que l’œil humain examinant le fond d’œil directement ou sur des clichés.
L’observation de la papille, au mieux sur des photographies, doit toutefois être effectuée au moins chaque année, même si les modifications structurales ne peuvent être évidentes que sur le long terme [2, 12] (fig. 11-2). En particulier, la constatation d’une hémorragie papillaire, que ne peut repérer un analyseur, est un signe d’alerte essentiel.

Fig. 11-2 Vingt-six ans séparent ces deux clichés.
L’analyse de ce couple indissociable doit être comparative et méthodique. L’évaluation de l’épaisseur de l’anneau neurorétinien (ANR) est faite sur l’ensemble de sa circonférence et sur chaque méridien. Les caractéristiques de la papille glaucomateuse ont été décrites dans le chapitre 10-VI, paragraphe « Biomicroscopie et rétinographies ». D’observation en observation, l’examinateur recherchera donc l’apparition d’une excavation lorsqu’elle était absente, ou l’augmentation d’une excavation existante pouvant s’exprimer diversement par :
-
sa verticalisation, augmentation en surface et en pâleur, qui progresse vers un seul pôle (d’abord, plus fréquemment vers le bas) ou les deux, rétrécissant d’autant l’ANR sur les mêmes méridiens et évoluant vers une rupture uni- ou bipolaire de l’ANR. Le trajet des vaisseaux et leurs coudures se modifient (fig. 11-3 à 11-6). S’il existe un vaisseau circum-linéaire, élément précieux de cette surveillance, son exclusion au cours du suivi est un signe indiscutable de l’amincissement de l’ANR. Dans les papilles de myopie forte, qui se creusent difficilement, une modification d’une ou de plusieurs coudures vasculaires contre l’anneau scléral est parfois repérable, témoignant d’une progression de la structure (fig. 11-7) ;
-
une perte de la règle « ISNT » (inférieur, puis supérieur, puis nasal, puis temporal) lorsqu’elle était respectée sur les premiers clichés ;
-
un amincissement concentrique de l’ANR (fig. 11-8) ;
-
une encoche localisée de l’ANR (fig. 11-9) ;
-
le rejet nasal du parquet vasculaire émergeant, volontiers retardé (fig. 11-10). Le siège de cette émergence au niveau de la lame criblée doit être repéré, car le méridien qui lui est le plus éloigné est généralement le plus précocement exposé à un amincissement de l’ANR (fig. 11-11) ;
Parallèlement, la pâleur papillaire s’accentue dans l’excavation, les pores de lame criblée peuvent devenir plus visibles et s’élargir, voire fusionner pour réaliser parfois un pseudo-colobome. L’anneau scléral, de moins en moins recouvert par les FNR, est de plus en plus apparent (fig. 11-11). Au stade le plus évolué, où l’excavation a dépassé le rejet nasal des vaisseaux, l’ANR a disparu avec un rapport C/D de 10/10 dans tous les méridiens, affectant l’aspect classique de papille « en chaudron » lorsque l’excavation est profonde. Le champ visuel peut n’être parfois que modérément affecté (voir chapitre 10-VIII), pour s’effondrer rapidement, alors que l’aspect biomicroscopique n’évolue plus, tout au moins à l’échelle biomicroscopique (fig. 11-12).
L’observateur ne doit pas prendre le reflet un peu plus sombre des pentes de l’excavation pour du tissu nerveux résiduel : l’observation biomicroscopique binoculaire et les clichés stéréoscopiques lui confirmeront la disparition de l’ANR, avec des vaisseaux plaqués sur 360° contre l’anneau scléral. À ce stade, la surveillance du fond de l’œil ne doit pas être abandonnée car la survenue d’hémorragies est toujours possible (voir fig. 11-14), l’atrophie parapapillaire peut encore progresser et, indépendamment, une pathologie rétinienne apparaître et/ou coexister.
Il faut enfin rappeler les problèmes d’interprétation fréquemment soulevés par les petites papilles qui ne se creusent que tardivement dans l’évolution du glaucome, et par les papilles dysmorphiques (dysversion, myopie forte, drusen) dans lesquelles le repérage d’une atrophie optique glaucomateuse qui progresse est difficile, aléatoire ou impossible.

Fig. 11-3 Verticalisation de l’excavation, repérable grâce à la progression vers le bas de la pâleur (une année sépare les deux clichés).
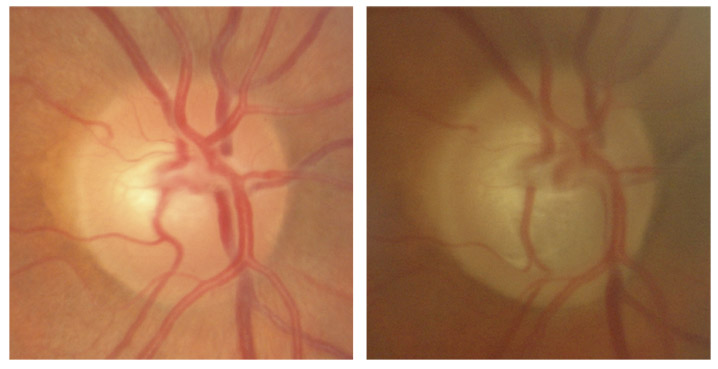
Fig. 11-4 Progression verticale de l’excavation surtout inférieure, avec une modification du trajet des vaisseaux qui sont repoussés en haut et en bas (quatre années séparent les deux clichés).

Fig. 11-5 Rupture inférieure de l’ANR, avec toutefois une aggravation du déplacement vers le bas de la coudure vasculaire sur le cliché de droite, six mois plus tard.

Fig. 11-6 Rupture bipolaire de l’ANR, constituée sur cinq ans.

Fig. 11-7 Myopie forte, augmentation de la coudure de la veine supérieure à 13 heures, contre l’anneau scléral, constatée après 18 mois.

Fig. 11-8 Amincissement relativement concentrique de l’ANR, 30 mois séparant les deux clichés.

Fig. 11-9 Encoche de l’ANR à 7 heures, repérée deux ans après le premier cliché.

Fig. 11-10 Progression de l’excavation, avec rejet nasal des vaisseaux émergeants, six ans séparant les deux clichés.

Fig. 11-11 Évolution vers une excavation pratiquement totale après trois années de suivi. À gauche, l’amincisssement le plus marqué de l’ANR (1-2 heures) se situe au niveau du méridien opposé à celui de l’émergence du paquet vasculaire, et petite hémorragie au bord papillaire à 7 heures.

Fig. 11-12 Papille avec une excavation pratiquement totale, photographiée à quatre reprises sur une période de 15 mois, ne se modifiant pas d’un cliché à l’autre (petite hémorragie à 2 heures sur le premier cliché). En revanche, la progression du champ visuel est considérable sur la même période.

Fig. 11-14 Pétéchies laminaires récidivantes, dans une excavation totale (clichés pris à un an d’intervalle).
Elles ont été décrites dans le chapitre 10-VI, paragraphe « Biomicroscopie et rétinographies ». La constatation d’une hémorragie papillaire doit, jusqu’à preuve du contraire, être considérée comme un symptôme de progression. C’est même le seul élément séméiologique qui, sur une seule observation isolée du fond d’œil, doit faire redouter une progression du glaucome. Toutes les études convergent pour confirmer l’importance évolutive de ce signe [3-6, 9, 11].
Dans l’Ocular Hypertension Treatment Study (OHTS), la conversion était constatée dans 13,6 % des yeux avec une hémorragie, contre 5,2 % sans hémorragie, avec un délai moyen de 13 mois entre les deux événements [3]. Dans le glaucome avéré [10], le taux de diminution annuelle du visual field index (VFI) dans les yeux avec hémorragie papillaire était significativement plus rapide (– 0,88 %) que dans les yeux sans hémorragie (– 0,38 %). Les hémorragies papillaires sont plus fréquentes dans le glaucome à pression normale et dans le GPAO débutant et modéré (voir fig. 11-13). Elles peuvent toutefois encore survenir lorsque l’excavation est subtotale (voir fig. 11-12) ou totale, quoiqu’exceptionnellement, et nous avons observé à plusieurs reprises des pétéchies laminaires volontiers récidivantes lorsque la papille est totalement excavée (fig. 11-14).
Le délai d’apparition de la progression périmétrique peut être très variable, parfois après plusieurs années. Celle-ci est plus rapide et plus importante chez le sujet âgé [11] avec une aggravation périmétrique d’au moins 5 dB dans les quatre ans suivant la survenue d’une hémorragie papillaire. Pour le glaucome à pression normale, dans l’Early Manifest Glaucoma Trial (EMGT), le délai moyen d’apparition d’une progression a été de 3,2 ans [9].
Cela dit, la progression n’est pas systématique après une hémorragie papillaire dans plus de la moitié des cas [9]. Dans l’OHTS, après six années de suivi, aucune conversion vers le glaucome n’a été constatée dans 86,7 % des cas ayant présenté une hémorragie papillaire [3]. Lorsqu’elles sont constatées, les hémorragies papillaires doivent toutefois imposer le renforcement de la baisse de la pression intra-oculaire (PIO). Des travaux ont en effet montré que celui-ci pouvait être efficace pour ralentir la progression du glaucome [7, 10]. Ce ralentissement n’est toutefois pas toujours obtenu, et il reste à savoir pourquoi certains patients avec une hémorragie papillaire répondent bien à une baisse significative de la PIO, alors que d’autres continuent à progresser…
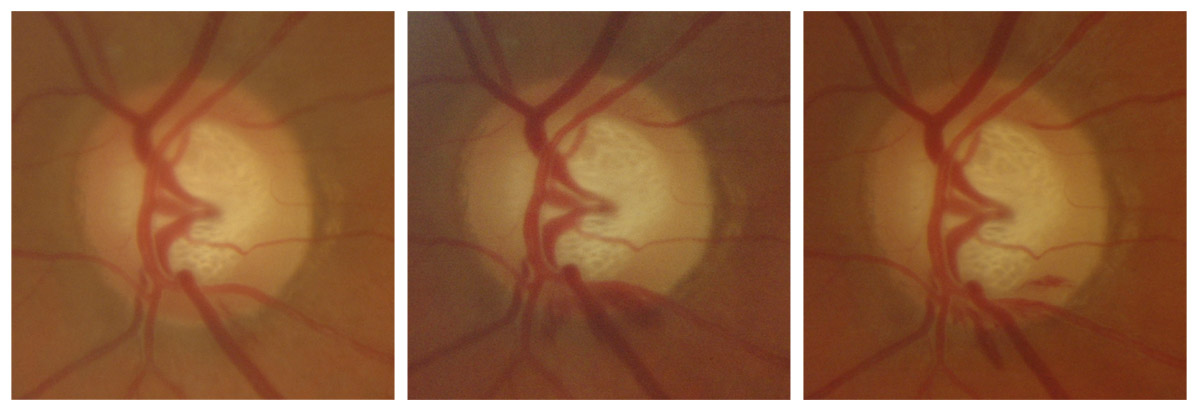
Fig. 11-13 Hémorragies papillaires récidivantes et multiples, localisées chaque fois au pôle inférieur de la papille, avec un amincissement localisé de l’ANR s’aggravant discrètement sur une période de deux ans.
L’augmentation centrifuge de la surface de la zone et sa progression circonférentielle ont été reconnues comme un signe de progression du glaucome [8].
L’atrophie parapapillaire est toutefois inconstante, même dans les glaucomes évolués. Par ailleurs, ces modifications décrites se font sur le long terme habituellement, et ne sont pas spécifiques du glaucome. Elles doivent donc être confrontées avec les autres paramètres cliniques (fig. 11-15).

Fig. 11-15 Aggravation majeure de l’excavation, associée à une progression circonférentielle de la zone β. Deux ans et une phako-exérèse séparent ces deux clichés.
Son étude et son évolution ont largement bénéficié du développement des analyseurs, particulièrement de l’OCT. Cette couche, et a fortiori ses modifications, sont difficilement observables avec précision à l’examen biomicroscopique direct, même au travers d’un filtre anérythre. En revanche, les FNR et leurs déficits peuvent être repérables sur des clichés du fond d’œil en couleurs, sans qu’il ne soit plus nécessaire d’interposer une fibre bleu-vert pour les mettre en évidence. La progression du glaucome peut ainsi être objectivée [1], surtout dans les formes débutantes et modérées, le plus souvent en temporal supérieur ou en temporal inférieur, par :
-
l’apparition d’un déficit fasciculaire, signant par ailleurs la conversion d’une HTO en glaucome ;
-
l’élargissement et/ou l’assombrissement d’un déficit fasciculaire connu (fig. 11-16) ;
-
une raréfaction sectorielle de la striation des FNR, leur donnant un aspect peigné ;
-
l’apparition d’un ou plusieurs nouveaux déficits dans d’autres secteurs rétiniens.
Ces déficits sont habituellement en regard (ou de façon légèrement décalée) d’un amincissement localisé de l’ANR, parfois d’une hémorragie papillaire (fig. 11-17).
Dans quelques cas rares, il ne peut rester plus qu’un seul secteur, habituellement inter-papillo-maculaire, dans lequel est encore visible la striation normale des FNR. Les déficits sont plus difficilement repérables en cas de perte diffuse des FNR et dans les formes évoluées avec une visibilité très nette des capillaires rétiniens.
Retenir
-
L’excavation glaucomateuse progresse habituellement verticalement, avant de rejeter en nasal le paquet vasculaire émergeant.
-
Les hémorragies papillaires sont un signe d’alerte essentiel devant faire craindre une progression du glaucome.
-
Cependant, dans plus de la moitié des cas surveillés sur plus de cinq ans, elles ne sont pas suivies d’une aggravation du glaucome.
-
Parfois, elles accompagnent ou précèdent la constitution d’un déficit fasciculaire des FNR dans le même secteur.
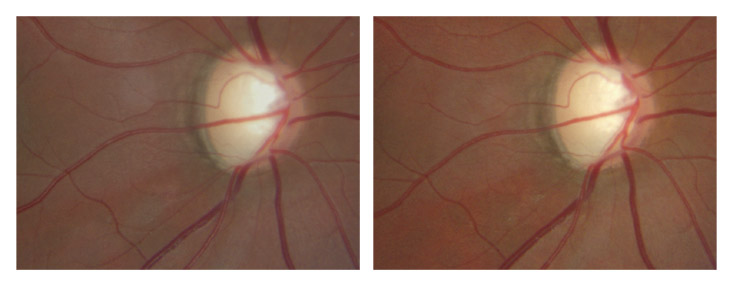
Fig. 11-16 Élargissement et assombrissement d’un large déficit fasciculaire des FNR en temporal inférieur (deux ans séparent les deux clichés).

Fig. 11-17 Déficit fasciculaire temporal inférieur sur le cliché de droite, photographié un an après la survenue d’une petite hémorragie parapapillaire dans le même secteur (cliché de gauche).
[1] Airaksinen PJ, Drance SM, Douglas GR, Mawson DK. Diffused and localized nerve fiber loss in glaucoma. Am J Ophthalmol. 1984 ; 98 : 566-71.
[2] Bron A, Rouland JF. La papille optique. In : Atlas en ophtalmologie. Issy-les-Moulineaux, Elsevier-Masson, 2006, 298 pages.
[3] Budenz DL, Anderson DR, Feuer WJ, et al. Detection and prognostic significance of optic disc hemorrhages during the Ocular Hypertension Treatment Study. Ophtalmology. 2006 ; 113 : 2137-43.
[4] De Moraes CG, Prata TS, Liebmann CA, et al. Spatially consistent localized visual field loss before and after disc hemorrhage. Invest Ophthalmol Visc Sci. 2009 ; 50 : 4727-33.
[5] Drance S, Anderson DR, Schulzer M, et al. Risk factors for progression of visual field abnormalities in normal tension glaucoma. Am J Ophthalmol. 2001 ; 131 : 699-708.
[6] Gunvant P, Zheng Y, Essock EA, et al. Predicting subsequent visual field loss in glaucomatous subjects with disc hemorrhage using retinal nerve fiber layer polarimetry. J Glaucoma. 2005 ; 14 : 20-5.
[7] Heijl A, Leske MC, Bengtsson B, et al. Reduction of intraocular pression and glaucoma progression : results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 ; 120 : 1268-79.
[8] Jonas JB, Nguyen XN, Gusek GC, Naumann GO. Parapapillary chorioretinal atrophy in normal and glaucoma eyes. I. Morphometric data. Invest Ophthalmol Vis Sci. 1989 ; 30 : 908-18.
[9] Leske M, Heijl A, Liebmann M, et al. Predictors of long term progression in the Early Manifest Glaucoma Trial. Ophthalmology. 2007 ; 11 : 1965-72.
[10] Medeiros FA, Alencar LM, Sample PA, et al. The relationship between intraocular reduction and rates of progressive visual field loss in eyes with optic disc hemorrhage. Ophthalmology. 2010 ; 117 : 2061-6.
[11] Prata TS, de Moraes CG, Teng CC, et al. Factors affecting rates of visual field progression and glaucoma patient with optic disc hemorrhage. Ophthalmology. 2010 ; 117 : 24-9.
[12] Renard JP. Comment s’assurer de la stabilité d’un glaucome ? J Fr Ophtalmol. 2006 ; 29 : 2S27-2S32.
J.-P. Renard
La capacité de détecter et de mesurer une lésion structurale est essentielle pour le diagnostic et la prise en charge du glaucome, et nous ne disposons pas encore de critère de référence standard courant bien établi pour le suivi des lésions structurales dans le continuum du glaucome. Il faut également souligner la grande variabilité interindividuelle des caractéristiques structurales qui peuvent être évaluées cliniquement ou avec les techniques d’imagerie au sein des sujets normaux. Un recouvrement des mesures structurales caractéristiques entre certains yeux normaux et des lésions débutantes doit être connu. De plus, beaucoup de sujets sains présentent des anomalies structurales qui viennent parasiter les logiciels couramment disponibles ainsi que les algorithmes et les données de bases normatives aboutissant à leur mauvaise classification en catégorie « anormale ». Il est donc capital et essentiel de toujours confronter les résultats de l’analyse quantitative, en particulier par les techniques d’imagerie automatisée, avec les données de l’examen clinique.
Les trois systèmes d’imagerie automatisée actuellement disponibles, avec la polarimétrie à balayage laser (GDx PRO™), la tomographie confocale à balayage laser (HRT3) et la tomographie par cohérence optique (OCT), sont devenus un complément de l’examen clinique par l’analyse quantitative des structures qu’ils apportent. Ils permettent d’obtenir des mesures objectives et reproductibles des paramètres topographiques de la tête du nerf optique (TNO) et des fibres nerveuses rétiniennes (FNR) pour les trois, et plus spécifiquement de la TNO pour l’HRT et l’OCT.
H. Lemij, J.-P. Renard, E. Sellem
-
Plusieurs algorithmes pour analyser les séries d’examens permettent d’établir l’existence d’une progression ou d’une stabilité de la couche des fibres nerveuses rétiniennes en polarimétrie à balayage laser GDx PRO™.
-
Les critères d’analyse d’une progression doivent être bien connus.
La polarimétrie à balayage laser par GDx PRO™ particulièrement performante en termes de discrimination et de diagnostic avec une reproductibilité élevée des examens et des différentes mesures de tous ses indices reste encore utilisée dans un certain nombre de centres d’ophtalmologie [10, 12]. La connaissance des relevés de cette analyse de la couche des FNR ainsi que leur interprétation, comme nous l’avons vu, sont importantes dans le cadre de la prise en charge d’un GPAO suivi par ce type d’analyseur [9, 11].
L’appareil dispose d’un programme d’analyse d’évolution ou de progression, le GPA (guided progressive analysis), qui utilise pour détecter une progression éventuelle trois approches, comprenant deux analyses d’événements et une analyse de tendance.
Une progression est considérée si, sur une des trois analyses, l’examen relève un résultat caractérisé de « progression possible » :
-
analyse des cartes de progression (fig. 11-18). Étude des différents « clusters » ou groupes de pixels avec un changement significatif par rapport à l’examen de base concernant au moins 150 pixels sur deux scans consécutifs pour lesquels une progression possible est alors retenue ;
-
analyse des diagrammes de progression des courbes de profils TSNIT (temporal supérieur, nasal inférieur, temporal) superposées. Elles correspondent à une évaluation de l’épaisseur de la couche des FNR au niveau du cercle de mesure avec l’analyse de 64 régions contiguës. On considère une progression possible s’il existe un changement significatif sur au moins quatre régions adjacentes (fig. 11-19) ;
-
enfin le graphique de résumé des différents paramètres utilise une régression linéaire pour évaluer une variation de l’épaisseur moyenne globale de la couche des FNR ou celle des quadrants supérieur et inférieur avec un taux de progression quantitatif et, selon le cas, une diminution statistiquement significative (fig. 11-20).
L’ensemble des analyses est regroupé sur le relevé (fig. 11-21 à 11-23). Comme avec les programmes d’analyse de progression de l’atteinte structurale des autres techniques d’imagerie automatisée des FNR ou de la TNO :
-
les progressions significatives sont représentées selon un code coloré (orange en cas de progression possible, rouge en cas de progression probable) ;
-
une progression suspecte doit toujours être confirmée pour être considérée significative et un troisième examen est nécessaire pour lui conférer un caractère probable.
Enfin, si certaines études rapportent une sensibilité de détection de la progression avec une haute spécificité, d’autres données plus récentes soulignent l’importance de la réalisation systématique de trois examens successifs lors de chaque visite de suivi pour améliorer la sensibilité de cette détection avec le GDx PRO™ [1, 2].
Les résultats des analyses de la progression de l’atteinte du champ visuel et de l’atteinte structurale par le GDx sont très variables selon les études, et le plus souvent faiblement corrélées [4-7].
La corrélation entre l’atteinte structurale et l’atteinte fonctionnelle a également été évaluée avec les autres techniques d’imagerie de la couche des FNR. Horn et al. [3] ont comparé les résultats de corrélation entre les déficits du champ visuel et l’amincissement de la couche des FNR obtenus en polarimétrie à balayage laser (GDx VCC, Carl Zeiss Meditec, États-Unis). La corrélation entre déficit périmétrique et amincissement en FNR reste plus forte pour l’OCT-spectral domain que pour le GDx [3, 8].
L’analyse des relevés doit toujours être confrontée avec les données de l’examen clinique et une bonne connaissance des limites de l’appareil. On a démontré, dans le cas d’atrophie ou de cicatrice choriorétinienne, des résultats anormalement élevés et une absence de réponse lors de la présence de fibres à myélines. De même, une pathologie maculaire associée va perturber la mesure nécessaire pour une correction adaptée de la biréfingence cornéenne.
L’interprétation doit donc être prudente car il s’agit d’une analyse statistique pour laquelle un seuil significatif de progression n’a pas été défini précisément, que ce soit en fonction de l’âge du patient ou du stade clinique du GPAO.
Enfin, les modifications régulières par le fabriquant des logiciels de mesures remplacés par des algorithmes plus discriminants ne permettent pas d’analyse de la progression avec la génération du GDx PRO™ pour des patients suivis avec les algorithmes des appareils de précédentes générations.
Retenir
-
Le suivi de la progression du glaucome est possible grâce aux nouveaux algorithmes du GDx PRO™ à condition d’être prudent et de toujours confronter les résultats avec les données de l’examen clinique.
-
Les résultats de l’analyse de la progression sont moins bien corrélés à l’analyse du champ visuel qu’avec l’OCT-spectral domain.
-
L’arrêt de la production et du développement du GDx PRO™ hypothèque son avenir à court terme.

Fig. 11-18 Analyse des cartes de progression.

Fig. 11-19 Analyse des diagrammes de progression.
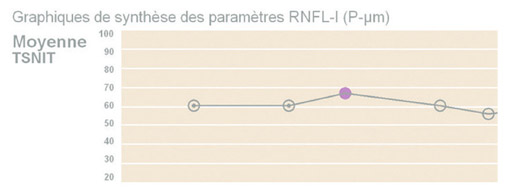
Fig. 11-20 Analyse de régression des paramètres de la couche des FNR.

Fig. 11-21 Exemple de glaucome stable.

Fig. 11-22 Exemple de progression possible.

Fig. 11-23 Exemple de progression évidente de glaucome.
[1] Alencar LM, Zangwill LA, Weinreb RN, et al. Agreement for detection progressive with the GDx Guided Progression Analysis. Optic Disc photography Ophthalmology. 2010 ; 117 : 462-70.
[2] Folio LS, Wollstein G, Kotowski J, et al. Detection of glaucoma progression by population and individual derived variability criteria. Br J Ophthalmol. 2013 ; 97 : 403-7.
[3] Horn FK, Mardin CY, Laemmer R, et al. Correlation between local glaucomatous visual field defects and loss of nerve fiber layer thickness measured with polarimetry and spectral domain OCT. Invest Ophthalmol Vis Sci. 2009 ; 50 : 1971-7.
[4] Lee Pj, Liu CJL, Wojciejowski R. Structure function correlations using scanning laser polarimetry in primary-angle closure glaucoma and primary open angle glaucoma. Am J Ophthalmol. 2010 ; 149 : 817-25.
[5] Mai TA, Reus NJ, Lemij HG. Structure-function relationship is stronger with enhanced corneal compensation than with variable corneal compensation in scanning laser polarimetry. Invest Ophthalmol Vis Sci. 2007 ; 48 : 1651-8.
[6] Medeiros FA, Alencar LM, Zangwill LM. Detection of progressive retinal nerve fiber layer in glaucoma using scanning laser polarimetry with variqble corneal compensation. Invest Ophthamol Vis Sci. 2009 ; 50 : 1675-81.
[7] Moon BG, Sung KR, Cho JW, et al. Glaucoma progression detection by retinal nerve fiber layer using scanning laser polarimetry event and trend analysis Korean. J Ophthalmol. 2012 ; 26 : 174-81.
[8] Na JH, Lee KS, Lee JR. The glaucoma detection capability of SD-OCT and GDx-VCC deviation maps in early glaucoma patients with localized visual field defects. Graefes Arch Clin Exp Ophthalmol. 2013 ; 251 : 2371-82.
[9] Quigley HA, Katz J, Derick RJ, et al. An evaluation of optic disc and nerve fiber layer examinations in monitoring progression of early glaucoma damage. Ophthalmology. 1992 ; 99 : 19-28.
[10] Renard JP Giraud JM. Glaucomes – Imagerie de la structure : HRT, GDx et OCT. J Fr Ophtalmol. 2006 ; 29 : 64-73
[11] Vermeer KA, Vos FM, Lo B, et al. Modeling of scanning laser polarimetry images of the human retina for progression detection of glaucoma. IEEE Trans Med Imaging. 2006 ; 25 : 517-28.
[12] Weinreb RN, Medeiros FA. Is scanning laser polarimetry ready for clinical practice ? Editorial. Am J Ophthalmol. 2007 ; 143 : 674-6.
J.-F. Rouland
-
On distingue trois méthodes d’analyse de la progression en Heidelberg Retina Tomograph (HRT) : la comparaison des paramètres stéréométriques des 45°, 90° ou 180° (supérieurs et inférieurs), l’analyse de tendance des paramètres et l’analyse de modification topographique (topographic change analysis ou TCA).
-
Les critères prédictifs de progression par l’analyse de régression de Moorfields (MRA) sont une aide précieuse dans la détection précoce de la progression du glaucome.
-
La comparaison des stéréophotographies et de l’HRT dans le suivi d’un patient glaucomateux est en faveur des photographies quand elles sont examinées par un expert, mais de l’HRT pour une pratique quotidienne moins spécialisée.
Si l’HRT, lors du premier examen, peut déceler des anomalies « évocatrices » d’une atteinte glaucomateuse, le suivi dans le temps des différents paramètres représente le point fort de cette imagerie confocale [1]. La compatibilité des évolutions successives de l’instrument autorise un suivi prolongé d’un même patient par une procédure identique.
Le nombre d’examens nécessaire est fonction de la vitesse d’évolution du GPAO. Si l’évolution est rapide, deux à trois examens suffiront à détecter la progression. Dans le cas d’une évolution lente, le nombre d’enregistrements devra être plus important. De façon générale, plus le nombre d’examens est important, plus la détection de la progression est précise.
Cependant, en pratique, dans de récentes études réalisées en Asie [4, 7, 9], l’HRT a montré un intérêt limité pour la détection de la progression de l’atteinte papillaire en raison d’une trop grande variabilité des mesures d’un examen à l’autre.
La littérature confirme largement la place de cet instrument pour le suivi de la papille glaucomateuse, l’association du MRA et du score de probabilité de glaucome (GPS) augmentant la spécificité. Les versions successives de l’HRT 1 puis 2 et 3 sont théoriquement compatibles, mais certaines données stéréométriques peuvent différer selon la version 2 ou 3 [3].
ANALYSE DE LA PROGRESSION EN HRT
L’analyse débute par la sélection des examens (eFig. 11-1), puis le logiciel les recale automatiquement avant de les comparer.
Analyse des paramètres stéréométriques
L’examinateur sélectionne et peut comparer les paramètres entre eux au cours du temps.
L’HRT peut diviser en différents secteurs la papille optique et les comparer dans le temps (eFig. 11-2) :
-
comparaison des secteurs temporal supérieur et temporal inférieur sur 45° ;
-
comparaison des secteurs temporal supérieur et temporal inférieur sur 90° ;
-
comparaison des secteurs supérieur et inférieur sur 180°.
Analyse de tendance
Dix paramètres peuvent être sélectionnés dans l’analyse de tendance (dont surface et volume de l’anneau neurorétinien, volume et forme de l’excavation ou une combinaison de tous ces dix paramètres stéréométriques) (eFig. 11-3).
Les tracés n’indiquent pas les valeurs exactes du paramètre sélectionné, mais la variation de celui-ci à partir de l’examen initial qui sert de référence. L’échelle est donc étalonnée entre + 1 amélioration maximale et – 1 détérioration maximale. En horizontal sont affichées les dates des examens.
Analyse de modification topographique
Il s’agit d’une méthode statistique qui compare les valeurs enregistrées dans les différentes zones de l’image d’un examen à l’autre mais qui n’est possible qu’à partir du 4e examen fiable de suivi. Chaque zone correspond à une zone de 4 × 4 pixels (16 pixels) nommés super-pixels (fig. 11-24 et 11-25) [2].
L’analyse est indépendante du plan de référence délimité initialement par l’observateur. Le logiciel utilise l’image initiale et compare, pour chaque super-pixels, la probabilité que la différence de valeur mesurée entre deux examens soit statistiquement significative et non liée au hasard.
Le principal objectif du TCA est représenté par les cartes de probabilité de changement (change probability maps). Les super-pixels apparaissent en rouge quand les valeurs s’aggravent et en vert quand elles s’améliorent de façon statistiquement significative. Ces notions d’aggravation ou d’amélioration sont obtenues en comparant les données du patient à la base de données de sujets sains de l’HRT.
CRITÈRES PRÉDICTIFS DE PROGRESSION
Pour un patient présentant une hypertension intra-oculaire sans déficit du champ visuel, la mise en évidence d’une anomalie de l’analyse MRA, lors de l’examen initial, accroît significativement le risque de voir apparaître un glaucome [10]. À l’inverse, un MRA dans les limites de la normale serait un facteur protecteur vis-à-vis d’une conversion vers un glaucome.
LES STÉRÉOPHOTOGRAPHIES SONT-ELLES COMPARABLES DANS LA DÉTECTION DE LA PROGRESSION ?
Si l’analyse des clichés est réalisée par un expert, les résultats subjectifs détectant la progression de l’atteinte sont égaux, voire meilleurs que ceux obtenus par l’HRT [5, 6]. Mais si la comparaison est faite entre un non-spécialiste de l’analyse de la papille optique l’HRT donne de meilleurs résultats [8].
CONCLUSION
Le suivi de la progression représente le principal intérêt de l’HRT dans le glaucome. Il permet le suivi de chaque paramètre dans le temps, soit globalement, soit secteurs par secteurs.
Les cartes de probabilité de changement visualisent aisément les zones de la papille otique qui progressent ou s’améliorent. La qualité du suivi de la progression par l’HRT confirme l’intérêt de réaliser régulièrement cet examen, au même titre que le champ visuel.
Retenir
-
La principale qualité de l’HRT est sa capacité à suivre l’évolution de la papille optique au cours du suivi du glaucome. Il est totalement indépendant de l’intervention de l’opérateur.
-
L’HRT permet de confirmer ou non une progression par les analyses de tendance ou d’événement.
-
La compatibilité des versions successives en fait un instrument unique comparable aux mesures du champ visuel qui lui est associé.
-
Le recalage automatique des tracés obtenus dans le temps limite l’influence de l’examinateur.

eFig. 11-1 Sélection des examens HRT dans le temps. (Clichés : A. Bron.)

eFig. 11-2 Analyse de la variation des paramètres stéréométriques. L’HRT divise en différents secteurs la papille optique et les compare dans le temps. Dix paramètres stéréométriques sur les 14 disponibles peuvent être analysés.
Tracé du haut : comparaison des paramètres de l’excavation pour toute la papille optique (global : carré rouge) avec les secteurs temporal supérieur (losange vert) et temporal inférieur (triangle bleu) sur 45°.
Tracé du milieu : comparaison des paramètres de toute la papille optique (carré rouge) avec les secteurs temporal supérieur (losange vert) et temporal inférieur (triangle bleu) sur 90°.
Tracé du bas : comparaison des paramètres de toute la papille optique (global : carré rouge) avec les secteurs supérieur (losange vert) et inférieur (triangle bleu) sur 180°.
L’évolution est stable durant les 88 mois du suivi dans l’exemple présenté. (Clichés : A. Bron.)

eFig. 11-3 Exemple de suivi dans le temps des données stéréométriques (excavation) avec une stabilité des paramètres. (Clichés : A. Bron.)

Fig. 11-24 Analyse de la progression de la surface (en bleu) et du volume (en rouge) dans le temps. (Clichés : A. Bron.)

Fig. 11-25 Change probability maps (carte de probabilité de changement). Les super-pixels apparaissent en rouge quand les valeurs s’aggravent et en vert quand elles s’améliorent de façon statistiquement significative. (Clichés : A. Bron.)
[1] Chauhan BC. Detection of glaucomatous changes in the optic disc. In : Fingeret MF, Liebmann JG (eds). The essential HRT primer. San Ramon, Heidelberg Engineering, 2005 : 53-67.
[2] Chauhan BC, Blanchard JW, Hamilton DC, LeBlanc RP. Technique for detecting serial topographic changes in the optic disc and peripapillary retina using scanning laser tomography. Invest Ophthalmol Vis Sci. 2000 ; 41 : 775-82.
[3] Koh V, Loon SC, Wong WL, et al. Comparing stereometric parameters between Heidelberg Retinal Tomography 2 and 3 in Asian eyes : the Singapore Malay Eye Study. J Glaucoma. 2012 ; 21 : 102-6.
[4] Leung CK, Liu S, Weinreb RN, et al. Evaluation of retinal nerve fiber layer progression in glaucoma a prospective analysis with neuroretinal rim and visual field progression. Ophthalmology. 2011 ; 118 : 1551-7.
[5] O’Leary N, Crabb DP, Mansberger SL, et al. Glaucomatous progression in series of stereoscopic photographs and Heidelberg retina tomograph images. Arch Ophthalmol. 2010 ; 128 : 560-8.
[6] Pablo LE, Ferreras A, Fogagnolo P, et al. Optic nerve head changes in early glaucoma : a comparison between stereophotography and Heidelberg retina tomography. Eye (Lond). 2010 ; 24 : 123-30.
[7] Saarela V, Falck A, Airaksinen PJ, Tuulonen A. The sensitivity and specificity of Heidelberg Retina Tomograph parameters to glaucomatous progression in disc photographs. Br J Ophthalmol. 2010 ; 94 : 68-73.
[8] Vessani RM, Moritz R, Batis L, et al. Comparison of quantitative imaging devices and subjective optic nerve head assessment by general ophthalmologists to differentiate normal from glaucomatous eyes. J Glaucoma. 2009 ; 18 : 253-61.
[9] Yang B, Ye C, Yu M, et al. Optic disc imaging with spectral-domain optical coherence tomography : variability and agreement study with Heidelberg retinal tomograph. Ophthalmology. 2012 ; 119 : 1852-7.
[10] Zangwill LMW, et al. Use of the Heidelberg Retina Tomograph (HRT) in the Ocular Hypertension treatment Study (OHTS). In : Fingeret MF, Liebmann JG (eds). The essential HRT primer. San Ramon, Heidelberg Engineering, 2005 : 85-91.
J.-P. Renard, M. Delbarre
-
Les trois examens possibles pour l’analyse de la structure par OCT-SD sont complémentaires : cube d’acquisition au niveau de la tête du nerf optique (TNO), fibres nerveuses rétiniennes (FNR) péripapillaires et complexe cellulaire ganglionnaire maculaire. Les paramètres d’analyse du suivi de la progression de l’atteinte de la structure sont mieux validés et la perte en FNR liée à l’âge est mieux précisée.
-
L’analyse de progression nécessite l’acquisition initiale d’au moins deux relevés d’analyse fiables, qui serviront de référence pour l’analyse des relevés au cours du suivi.
-
L’analyse de la progression est possible à partir du 3e relevé de suivi, mais une progression est considérée possible uniquement si elle est confirmée, et probable si un 4e examen fiable la met à nouveau en évidence.
-
La faible concordance entre les rétinophotographies ou le champ visuel et l’analyse de progression en OCT (GPA), excepté dans les stades précoces du GPAO, souligne l’intérêt d’associer l’analyse fonctionnelle (champ visuel) et l’analyse de la structure pour évaluer la progression. La progression du GPAO ne peut pas de façon fiable être détectée par une seule méthode, et les trois approches établies doivent être utilisées de façon complémentaire en pratique clinique.
L’évaluation de la progression de l’atteinte structurale en OCT-SD représente aujourd’hui l’approche la plus couramment utilisée, pour des raisons de meilleure reproductibilité mais également en raison d’une plus grande diffusion de l’OCT. Les nouveaux algorithmes permettent d’obtenir des données quantitatives plus précises des caractéristiques de la TNO et du complexe maculaire cellulaire ganglionnaire.
L’évaluation doit se faire au niveau des trois sites d’analyse possibles en OCT-SD : à savoir la couche des FNR avec l’acquisition péripapillaire, les paramètres de la TNO ainsi que l’analyse du complexe maculaire cellulaire ganglionnaire, plus récente.
OCT-SD ET ÉVOLUTION DE L’ATTEINTE DES FNR
La génération précédente, l’OCT-time domain, disposait d’un programme d’analyse de progression (guided progression analysis ou GPA) qui permettait un suivi dans le temps, par différentes analyses de tendance, de l’évolution de l’épaisseur de la couche des FNR péripapillaires. Le choix d’un scan-B circulaire de 3,46 mm de diamètre, centré au niveau de la TNO, a été fait en raison des meilleures reproductibilités des résultats en OCT-TD avec un cercle de mesure de cette dimension. Le programme d’analyse de progression du GPA en OCT-TD, comme l’OCT Stratus (Carl Zeiss Meditec), présentait l’inconvénient majeur d’un problème de reproductibilité en raison de la nécessité de la localisation du scan-B à chaque examen par l’observateur. On comprend aisément qu’une minime variation de localisation difficilement reproductible du cercle de mesure soit à l’origine d’une faible reproductibilité et de faux positifs dans l’évaluation de la progression.
Les OCT-SD actuels ont nettement amélioré la reproductibilité des différents examens avec un positionnement automatique, parfaitement reproductible et fiable, des moyens de mesure des examens successifs. L’acquisition est réalisée, pour la majorité des appareils, par l’intermédiaire d’un cube d’acquisition en moyenne de 6 × 6 × 2 mm3, et composée d’un nombre de scans important réalisant un véritable découpage successif qui permet d’acquérir de nombreux points de mesure au niveau de la zone tissulaire analysée (200 scans-B × 200 scans-A pour le Cirrus HD-OCT, 128 scans-B × 512 scans-A pour les SD-OCT Topcon et Nidek, etc.). Le cercle de mesure (3,40 ou 3,46 mm de diamètre) est automatiquement extrait de ces cubes maculaires, avec la même localisation, lors des différentes acquisitions successives. L’analyse de la progression va utiliser des analyses d’événements ainsi que des analyses de tendances.
OCT-SD RTVue 100 (Optovue, États-Unis)
Il utilise un algorithme d’analyse de progression initialement développé par Heidelberg pour le HRT [10]. Il détermine s’il existe une évolution significative et la pente de perte de la couche des FNR. Les images sont recalées grâce à un algorithme qui détecte les vaisseaux rétiniens. Le logiciel analyse l’évolution de l’épaisseur de la couche des FNR au niveau de huit secteurs péripapillaires. Il donne également l’épaisseur moyenne de cette couche ainsi que celle des quadrants supérieur et inférieur. Au fur et à mesure du suivi, chaque paramètre du relevé est comparé à ceux mesurés lors de l’examen initial. La superposition des courbes de profils d’épaisseurs permet également de mettre en évidence une modification au cours du suivi. Enfin, une analyse de tendance permet de suivre l’évolution dans le temps des épaisseurs moyennes supérieure et inférieure de la couche des FNR péripapillaires. Cette analyse de tendance crée une droite de régression dont la pente indique la vitesse de progression. L’ensemble de ces données est représenté sur un graphe avec une interprétation colorimétrique qui exprime l’importance statistique de la déviation des mesures par rapport aux résultats de celles effectuées chez des sujets normaux de même âge (fig. 11-26 et 11-27).
Cirrus 5000 HD-OCT (Carl Zeiss Meditec, États-Unis)
Il dispose d’un programme d’analyse de progression, le GPA, introduit en 2009 afin de faciliter une analyse topographique de la progression de la couche des FNR. Ce module GPA compare chaque examen réalisé au cours du suivi avec les deux examens initiaux qui servent de référence. Le logiciel réaligne automatiquement les acquisitions OCT par rapport à l’image de référence. L’interprétation des résultats comprend également différentes analyses d’événements et de tendances. Chaque élément rapporté sur le graphe doit être analysé.
Analyse de la carte colorimétrique des épaisseurs de la couche des FNR
Elle doit rechercher dans les secteurs temporaux supérieur et inférieur une modification discrète ou progressive de la coloration au niveau des couleurs chaudes qui représentent les zones les plus épaisses de la couche des FNR, avec souvent l’aspect d’interposition au sein du graphe d’une image en coin, de couleur froide. Les modifications débutantes, discrètes, sont souvent en limite de cartographie où elles doivent être recherchées avec attention. Les cartes d’épaisseur des FNR représentent donc une alternative aux photographies en filtre bleu pour la détection des pertes en fibres et la précision de leur localisation qui représente un facteur pronostique. Elles permettent aussi de déterminer une image de progression avec les avantages supplémentaires de donner une analyse objective et quantitative de la progression.
Cartes de déviations ou des écarts
Elles doivent être examinées avec une grande attention. Elles peuvent révéler un déficit initial dont on a montré la localisation fréquente, à distance du cercle de mesure habituel de 3,46 mm de diamètre, au-delà des deux millimètres du centre de la TNO. L’analyse considère une progression uniquement si le résultat est plus important qu’une variabilité de mesure d’un test à l’autre [4]. Cette dernière a été évaluée au sein de la base de sujets de même âge, qui sert de référence. Elle est ainsi prise en compte pour l’analyse du résultat obtenu. Les résultats considèrent l’existence de déficits lorsqu’ils ont une étendue supérieure à 20 pixels adjacents. Ils sont représentés au sein des différentes cartes en fonction de leur importance statistique de couleur jaune ou rouge (p < 5 %, p < 1 %). Il est donc essentiel d’analyser l’ensemble de la carte de déviation à la recherche de ce type de petit déficit débutant au cours de l’analyse de l’évolution. Deux études rapportent que la carte de déviation est plus sensible dans le dépistage de déficits en FNR que les mesures méridiennes ou en quadrants [1, 2] (fig. 11-28).
Superposition des différentes courbes de profils d’épaisseurs de la couche des FNR
La superposition des différentes courbes de profils d’épaisseurs de la couche des FNR représente la seconde analyse d’événement de la progression. Lorsque le déficit concerne plus de 14 points adjacents et dépasse la variabilité inter-test de la base normative, il est considéré comme significatif et alors représenté au niveau du graphe résumant les résultats, avec le même code coloré.
Pour ces deux analyses d’événements, cartes de déviations et courbes de profils d’épaisseurs de la couche des FNR, un déficit est retenu uniquement s’il est confirmé par au minimum deux examens successifs. On parlera alors de « progression possible ». Si un 3e examen le confirme à nouveau, on parlera de « progression probable ». Il faut bien retenir qu’il s’agit ici d’une analyse statistique comparative de résultats numériques avec les résultats obtenus au sein d’une population normale limitée de sujets de même âge, d’où la nécessité impérative d’une confirmation de la détection de tout déficit.
La prédominance de l’apparition des déficits au niveau du méridien temporal inférieur (324°-336° sur un œil droit), zone où se trouvent les couches les plus épaisses des FNR, doit être bien connue et inciter un examen attentif de ce secteur.
Une étude sur quatre ans concernant 186 yeux atteint de GPAO suivis tout les quatre mois rapporte ainsi l’intérêt de l’analyse des cartes des épaisseurs et souligne l’importance de l’observation des cartes de déviations où les déficits précoces débutent au-delà des 2 mm centraux avec une localisation prépondérante dans le méridien temporal inférieur. Elle a permis de mettre en évidence au cours de l’évolution les anomalies les plus fréquemment relevées : l’élargissement d’un déficit existant (85,7 %), l’apparition d’un nouveau déficit (17,9 %) ou encore son approfondissement (7,1 %). À noter qu’il existe un certain nombre de faux résultats positifs possibles (14,3 %) en relation avec une variabilité des mesures. Ils doivent nous inciter à la vigilance dans l’interprétation des résultats dont la spécificité doit être considérée modérée dans l’état actuel de nos connaissances. Ces données soulignent une fois de plus l’importance d’une confrontation systématique des résultats obtenus en imagerie pour l’épaisseur de la couche des FNR avec les données de l’examen clinique et des autres techniques d’examens [4].
Les résultats numériques des paramètres sont parfois associés à un pictogramme d’alerte
Sa présence doit attirer l’attention pour l’interprétation des données du relevé. Il signifie que si l’on tient compte de la variabilité de mesure d’un test à l’autre (en la soustrayant à nouveau de la valeur concernée), le résultat est alors dans la zone des limites inférieures des valeurs normales pour l’âge (p < 5 ou 1 %).
Évolution de l’épaisseur moyenne de la couche des FNR ainsi que de celle des quadrants supérieur et inférieur
L’évolution dans le temps de l’épaisseur moyenne de la couche des FNR ainsi que celle des quadrants supérieur et inférieur est également rapportée. La pente de leur progression ainsi que l’évolution dans le temps du rapport C/D complètent les données. La détection d’une tendance négative significative isolée n’est pas suffisante pour définir la progression d’un GPAO. L’interprétation du taux de changement de la couche des FNR doit tenir compte du taux normal de pertes de FNR lié à l’âge, en particulier quand la mesure initiale de la couche des FNR est importante. Une analyse longitudinale chez des patients âgés de 51 à 63 ans sur une période de 30 mois en moyenne (24-41 mois) a permis après corrections, en fonction de l’épaisseur initiale de la couche des FNR, de la surface du disque optique et de l’équivalence sphérique, d’estimer une perte en fonction de l’âge respectivement de – 0,52 µm/an pour l’épaisseur moyenne, – 1,35 µm/an pour l’épaisseur supérieure et – 1,25 µm/an pour l’épaisseur inférieure de la couche des FNR. S’il n’est pas certain que le taux rapporté dans cette étude soit représentatif au niveau de la population générale, il permet cependant d’avoir une estimation que l’on peut considérer dans l’interprétation des résultats. La valeur de base initiale de l’épaisseur de la couche des FNR paraît être le seul facteur influençant le taux de changement avec l’âge. Plus elle est importante et plus la perte en FNR avec l’âge est marquée avec respectivement, pour des épaisseurs de 100 µm, 110 µm et 120 µm, des pertes en FNR de – 0,55 µm, – 1,03 µm et – 1,51 µm [3, 5].
Des données plus récentes concernant près de 300 yeux atteints de GPAO, suivis sur des périodes supérieures à deux ans, rapportent que la progression du glaucome concerne plus les glaucomes avancés (– 10,94 dB) que les glaucomes plus précoces (MD = – 0,73 dB). Toutefois, l’existence d’une progression détectée seulement à l’examen en imagerie automatisé par OCT-SD concerne plutôt les glaucomes débutants (MD = – 2 dB), et une détection par l’analyse de photographies et/ou le suivi de l’atteinte fonctionnelle (champ visuel) concerne plutôt les glaucomes plus évolués (MD = – 7,7 dB). Ces résultats soulignent à nouveau l’intérêt complémentaire du suivi de l’évolution par l’analyse de l’atteinte structurale et par l’analyse des données du retentissement fonctionnel du champ visuel [7, 13].
Ainsi, le programme d’analyse de progression en OCT pour l’analyse de la couche des FNR est un moyen utile pour détecter la progression, mais il ne peut pas remplacer l’évaluation du disque optique par des photographies et les deux techniques doivent être considérées comme complémentaires.
Autres OCT-SD
Elles utilisent toutes des analyses de suivi dans le temps des différents paramètres relevés au cours de l’évaluation de la couche des FNR avec des analyses des régressions linéaires.
Il est particulièrement important de souligner que les variations des protocoles d’acquisition et des algorithmes de segmentations des différents OCT-SD expliquent leur caractère non interchangeable avec des variations de mesure de la couche des FNR entre les machines.
Le suivi optimal de la progression de l’atteinte structurale en OCT-SD doit donc toujours être réalisé avec le même appareil.
OCT-SD ET ÉVOLUTION DE L’ATTEINTE DE LA TNO
OCT-SD RTVue 100
Les différents scans d’acquisition au niveau de la tête du nerf optique associés à l’acquisition de l’épaisseur de la couche des FNR péripapillaires permettent d’obtenir de nombreux paramètres concernant la TNO (surface, volume de l’ANR, de l’excavation, ainsi que les rapports C/D verticaux et horizontaux) (voir fig. 11-27). Ces paramètres et leur analyse au cours des examens successifs par rapport à l’examen initial de référence sont représentés sur le graphique des résultats, de même que l’importance de leur variation pour suivre l’évolution dans le temps. L’algorithme ne permet toutefois pas une évaluation des variations liées à l’âge de ces différents paramètres.
Cirrus HD-OCT
Les analyses des différents secteurs de la TNO des FNR et du complexe maculaire cellulaire ganglionnaire, relevées sur 279 yeux atteints de GPAO suivis plus de deux ans, soulignent également que l’existence d’une progression concerne les GPAO plus évolués (MD = – 4,3 dB versus MD = – 0,84 dB). Cette étude rapporte les paramètres significatifs intéressants à surveiller :
-
pour les FNR, l’épaisseur moyenne de la couche des FNR ainsi que celle du quadrant inférieur et du secteur 6-7 heures ;
-
pour la TNO : la surface de la l’ANR ainsi que le rapport C/D moyen vertical ;
-
pour l’analyse du complexe maculaire cellulaire ganglionnaire : le secteur temporal inférieur et externe [8].
Cette étude montre la possibilité diagnostique d’une évolution ainsi que les paramètres qui signent la progression à surveiller, quel que soit le niveau de base de l’épaisseur de la couche des FNR. Les valeurs seuils à retenir restent encore à préciser et un plus long recul doit vérifier s’il n’existe pas de variation en fonction du stade évolutif du GPAO en raison des différences de progression possibles avec l’évolution de la neuropathie.
OCT-SD et évolution de l’atteinte du complexe maculaire cellulaire ganglionnaire
L’intérêt de son analyse a largement été démontré. Le suivi de l’évolution, notamment celui d’une progression, a été rapporté dans plusieurs études, en particulier dans les stades de glaucome avancé pour lesquels l’évaluation de l’épaisseur de la couche des FNR péripapillaires, à un certain stade d’évolution, présente un « effet plancher » à partir duquel il n’est plus possible de suivre une progression avec ce paramètre. En revanche, chez ces patients qui présentent encore une fonction visuelle centrale malgré le stade très évolué, les données actuelles soulignent la possibilité de relevés du complexe maculaire cellulaire ganglionnaire (GCC) exploitables ainsi que leur suivi dans le temps aussi bien de l’épaisseur moyenne que des secteurs supérieur et inférieur du secteur maculaire évalué.
Enfin, pour l’analyse du complexe cellulaire maculaire ganglionnaire, certains OCT-SD donnent des indices complémentaires dont il a été souligné la plus grande sensibilité dans le suivi de l’évolution d’une progression.
L’OCT-SD RTVue 100 rapporte, au niveau du GCC, des indices de perte globale (GLV) et focale (FLV) complémentaires de ceux de la mesure d’épaisseur globale et sectorielle de ce complexe (fig. 11-29).
Différentes études ont montré la plus grande sensibilité de ces indices pour une détection plus précoce de la progression par rapport à l’analyse de l’ensemble du GCC [9]. Une élévation de ces indices (GLV, FLV) peut indiquer une progression même en cas de progression fonctionnelle légère. Cependant, ils sont à interpréter avec prudence car particulièrement sensibles à la présence d’une pathologie maculaire débutante quelle qu’elle soit (drusen maculaires, stades précoces de la DMLA, membrane épirétinienne, œdème maculaire, etc.). Si la détection d’une progression peut être plus précoce avec les paramètres GLV et FLV qu’avec les autres paramètres (TNO, couche des FNR et GCC moyen), une évaluation clinique soigneuse de la macula est nécessaire, lors de chaque examen, avant de considérer les variations de ces paramètres comme signe de progression du glaucome [11] (fig. 11-30).
Le Cirrus 5000 HD-OCT a bien démontré la sensibilité de l’analyse du GCC pour la détection de la progression, qui reste similaire à l’évaluation de la progression de la couche des FNR péripapillaires dans le cas de glaucome débutant ou modéré [6].
En cas de glaucome avancé, l’analyse de l’évolution de la progression de l’épaisseur du complexe cellulaire ganglionnaire a montré une plus grande sensibilité que le suivi de l’épaisseur de la couche des FNR péripapillaires chez ces patients avec un déficit moyen de – 14 dB (plus profond que – 10 dB) sur une surveillance moyenne supérieure à deux ans. La détection d’une progression par l’examen du disque optique ou par l’analyse des FNR péripapillaires n’était pas possible chez plus de 50 % des patients de cette étude.
Les résultats rapportent une meilleure détection de la progression de l’épaisseur moyenne du GCC par rapport au à la valeur moyenne de l’épaisseur de la couche des FNR dans les glaucomes avancés [12].
Ainsi les trois examens possibles avec les OCT-SD sont complémentaires pour l’évaluation de la progression du GPAO : les RNFL pour l’analyse en dehors de la macula, la zone maculaire pour le complexe cellulaire ganglionnaire maculaire et le cube d’acquisition au niveau de la tête du nerf optique.
CONCLUSION
La détection de la progression de l’atteinte structurale du GPAO reste un des principaux défis de la prise en charge du glaucome, en raison d’une part de la nature variable de la progression de la maladie, d’autre part de la variabilité des mesures et de l’évaluation par tous les systèmes d’imagerie, avec un manque de référence standard communément acceptable pouvant être utilisé pour indiquer un changement glaucomateux progressif.
Une fois confirmée, la progression marque une étape qui doit faire envisager une modification de la prise en charge thérapeutique.
Il est donc essentiel de toujours confronter, à tous les stades de la neuropathie optique glaucomateuse, les résultats de l’examen en analyse quantitative, par les techniques d’imagerie automatisée avec les données de l’examen clinique. La synthèse des différentes données ne peut être séparée et, en aucun cas, une décision thérapeutique ne peut être envisagée sans une confrontation soigneuse de l’ensemble des résultats.
Retenir
-
Il est important que les patients soient suivis avec le même OCT-SD car les résultats ne sont pas interchangeables.
-
En OCT-SD : intérêt des cartes d’épaisseurs, rechercher les déficits à 2 mm du centre au-delà du cercle de mesure, intérêt des paramètres complémentaires globaux et sectoriels : GLV, FLV, GCPIL minimum (épaisseur minimale de la couche des cellules ganglionnaires et plexiforme interne).
-
Se souvenir des types de progression : l’élargissement du déficit est plus fréquent qu’un nouveau déficit et il précède souvent son approfondissement.
-
Une pente de progression négative isolée de l’épaisseur moyenne de la couche des FNR est insuffisante pour définir la progression d’un GPAO.
-
Une valeur seuil de progression de la couche des FNR en OCT n’est pas établie à ce jour.
-
L’interprétation du taux de changement de la couche des FNR doit tenir compte du taux normal de perte de FNR liée à l’âge, mieux précisé en particulier quand la mesure initiale de la couche des FNR est importante.
-
Nécessité impérative de confirmer la détection de tout déficit.
-
La pertinence et la fiabilité de l’analyse de la progression augmentent avec le nombre d’examens de suivi.
-
Pas de suivi isolé en OCT-SD car possibilité de faux résultats positifs.
-
Imagerie automatisée, examen clinique et rétinophotographies sont complémentaires.
-
Importance d’une confrontation systématique des résultats obtenus en imagerie pour l’épaisseur de la couche des FNR avec les données de l’examen clinique et des autres techniques d’examens.

Fig. 11-26 OCT-SD RTVue 100 : relevé d’analyse d’évolution de la couche des FNR avec les analyses des paramètres des épaisseurs moyennes, des secteurs supérieur et inférieur avec analyses de tendance, ainsi que dans les huit secteurs péripapillaires.
Fig. 11-27 OCT-SD RTVue 100 : relevé ONHMap. Relevé d’analyse d’évolution des paramètres de la TNO et des FNR avec analyse de tendance de l’épaisseur moyenne des FNR.
Fig. 11-28 Cirrus HD-OCT. a. Relevé d’analyse de progression avec mise en évidence d’une progression au niveau de la carte des épaisseurs des FNR dans l’hémi-zone supérieure d’acquisition. b. Relevé d’analyse de progression GPA d’un glaucome évolué avec mise en évidence d’une progression au niveau de la carte des épaisseurs et des courbes de profils des épaisseurs des FNR.

Fig. 11-29 OCT-SD RTVue 100. Relevé d’analyse de progression du GCC avec analyse des cartes des épaisseurs, des cartes de déviations et des cartes de significativité statistique objectivant le suivi de la progression ainsi que l’évolution des indices complémentaires GLV et FLV.

Fig. 11-30 OCT-SD RTVue 100. Relevé d’analyse de progression du GCC avec analyse des différentes cartes des épaisseurs, des déviations et de significativité.
[1] Kim NR, Lee ES, Seong GJ, et al. Spectral-domain optical coherence tomography for detection of localized retinal nerve fiber layer defects in patients with open-angle glaucoma. Arch Ophthalmol. 2010 ; 128 : 1121-8.
[2] Leung CK, Lam S, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography : analysis of the retinal nerve fiber layer map for glaucoma detection. Ophthalmology. 2010 ; 117 : 1684-91.
[3] Leung CK, Yu M, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography : a prospective analysis of age-related loss. Ophthalmology. 2012 ; 119 : 731-7.
[4] Leung CK, Yu M, Weinreb RN, et al. Retinal nerve fiber layer imaging with spectral-domain optical coherence tomography : patterns of retinal nerve fiber layer progression. Ophthalmology. 2012 ; 119 : 1858-66.
[5] Leung CKS, Ye C, Weinreb RN, et al. Impact of age-related change of RNFL and macular thickness on evaluation of glaucoma progression. Ophtahlmology. 2013 ; 120 : 2485-92.
[6] Na JH, Sung KR, Baek S, et al. Detection of glaucoma progression by assessment of segmented macular thickness data obtained using spectral domain optical coherence tomography. Invest Ophthalmol Vis Sci. 2012 ; 53 : 3817-26.
[7] Na JH, Sung KR, Baek S, et al. Progression of retinal nerve fiber layer thinning in glaucoma assessed by cirrus optical coherence tomography-guided progression analysis. Curr Eye Res. 2013 ; 38 : 386-95.
[8] Na JH, Sung KR, Lee JR, et al. Detection of glaucomatous progression by spectral-domain optical coherence tomography. Ophthalmology. 2013 ; 120 : 1388-95.
[9] Naghizadeh F, Garas A, Vargha P, Hollo G. Detection of early glaucomatous progression with different parameters of the RTVue optical coherence tomograph. J Glaucoma. 2012 [Epub ahead of print].
[10] Patterson AJ, Garway-Heath DF, Strouthidis NG, Crabb DP. A new statistical approach for quantifying change in series of retinal and optic nerve head topography images. Invest Ophthalmol Vis Sci. 2005 ; 46 : 1659-67.
[11] Renard JP, Fénolland JR, el Chehab H, et al. analysis of macular ganglion cell complex with spectral-domain OCT in glaucoma. J Fr Ophtalmol. 2013 ; 36 : 299-309
[12] Sung KR, Sun JH, Na JH, et al. Progression detection capability of macular thickness in advanced glaucomatous eyes. Ophthalmology. 2012 ; 119 : 308-13.
[13] Tenkumo K, Hirooka K, Baba T, et al. Evaluation of relationship between RNFL thickness progression and visual field progression in patients with glaucoma. Jpn J Ophthalmol. 2013 [Epub ahead of print].
J. Laloum
Le relevé du champ visuel présente une variabilité irréductible qui est accentuée par le glaucome. Diminuer les effets de cette variabilité sera le fil rouge de la démarche diagnostique d’une progression :
-
à la découverte d’un glaucome primitif à angle ouvert (GPAO), le patient est considéré comme « progresseur rapide » jusqu’à preuve périmétrique du contraire ;
-
de nombreux aspects d’aggravations sont des pièges ;
-
une aggravation centripète est plus significative et plus grave qu’une aggravation centrifuge ;
-
les outils statistiques et les logiciels améliorent et facilitent le suivi, mais doivent rester soumis au jugement clinique ;
-
la quantification de la progression, paramètre clé du suivi, permet d’estimer le risque fonctionnel ;
-
la quantification globale masque les progressions focales.
À l’heure où les examens de structure permettent des mesures rapides, la périmétrie risque de se trouver moins utilisée en pratique courante dans la surveillance du GPAO [32]. Il s’agit d’une triple erreur :
-
l’examen du champ visuel est un moyen de dépistage essentiel, non seulement en montrant, parfois avant les examens de structure, une atteinte glaucomateuse typique, mais aussi en démontrant une progression certaine [3] ;
-
la périmétrie n’offre plus seulement une réponse binaire à la question de la progression, elle est maintenant capable de la quantifier ;
-
le champ visuel est le seul examen qui permet d’évaluer directement la menace visuelle, et le seul qui mesure réellement la fonction visuelle [2].
La fonction visuelle centrale, partie intégrante de l’évaluation fonctionnelle du GPAO, est un paramètre important de la qualité de vie du patient, qui doit rester au centre de nos préoccupations.
La progression du champ visuel occupe une place centrale dans le GPAO :
-
une fois le diagnostic de GPAO affirmé, la quantification de la vitesse de progression permet d’opposer deux groupes : les « progresseurs lents », facilement équilibrés par un traitement médical et qui ne connaîtront pas de gêne visuelle, et les « progresseurs rapides », menacés de handicap visuel, qui eux nécessiteront un traitement plus agressif. Le recensement des facteurs de risque est certes important pour alerter sur des cas particuliers, mais l’histoire naturelle des glaucomes nous enseigne surtout qu’un progresseur sur deux n’est pas prévisible [9] ;
-
les logiciels améliorent le diagnostic de progression et permettent d’en mesurer la vitesse.
Nous limiterons notre étude à la périmétrie automatisée standard (PAS) qui est la seule périmétrie actuellement validée pour le diagnostic de progression, et la seule qui dispose d’outils dédiés.
Les modalités de l’examen, les appareils, les stratégies et les principaux outils d’analyse ont été décrits dans un chapitre précédent. Nous nous attacherons à préciser leur rôle dans le cadre du diagnostic de progression.
L’évaluation de la progression du champ visuel rencontre deux difficultés : les altérations « parasites » qui ne sont pas liées au GPAO : âge et troubles des milieux, et la variabilité.
AGGRAVATIONS NON GLAUCOMATEUSES
Aggravation liée à l’âge
La constitution de bases de données de champ visuel de sujets normaux a permis de constater que les seuils normaux mesurés diminuent avec l’âge. Les deux raisons principales sont l’opacification progressive des milieux, même en l’absence d’une cataracte proprement dite, et la diminution progressive du nombre de fibres nerveuses rétiniennes (FNR) avec l’âge, indépendamment de tout processus pathologique.
Pour filtrer cette altération parasite, le champ visuel du patient est comparé à une base de données de patients du même âge. La différence en chaque point entre le seuil de sensibilité normal pour l’âge et celui du patient est indiquée sur la carte de déviation totale pour le Humphrey (ou de comparaison pour l’Octopus). Elle est exprimée en décibels et sous forme statistique : un symbole indique pour chaque point quelle proportion de patients normaux du même âge présente un seuil aussi bas (p < 5 % pour un point signifie ainsi que moins de 5 % de patients normaux du même âge présentent un seuil aussi bas). Sur la version EyeSuite de l’Octopus, la carte de comparaison est présentée en échelle de gris indiquant le déficit par rapport à la normale pour l’âge sous forme de pourcentages, allant de 0 % (blanc) si le point est normal à 100 % (noir) s’il n’est plus possible de le tester.
Aggravation liée au trouble des milieux
Trouble des milieux et myosis provoquent un abaissement uniforme des seuils de sensibilité. Ce déficit diffus affecte les cartes de déviation totale (ou comparaison) : une grande partie des points est anormale sur les cartes statistiques. Cette altération parasite est filtrée par la carte de déviation individuelle (ou de comparaison corrigée). Son utilisation permet une meilleure détection de la progression que l’utilisation des cartes de déviation totale [17]. Elle peut cependant sous-estimer l’atteinte glaucomateuse dans deux circonstances :
-
aux stades précoces : les cartes individuelles peuvent masquer une atteinte glaucomateuse diffuse ;
-
aux stades évolués : l’atteinte glaucomateuse s’étend alors aux meilleurs points de la carte de déviation totale (comparaison). Or les valeurs de ces points sont utilisées pour construire la carte de déviation individuelle (comparaison corrigée) qui sera donc trop rehaussée et sous-estimera l’atteinte [5, 28] ; il faut dans ces cas revenir aux cartes de déviation totale (comparaison).
VARIABILITÉ
La variabilité du champ visuel est l’obstacle principal au diagnostic de progression. Elle n’est pas identique, même à atteinte égale, pour tous les patients. Elle peut être légèrement améliorée par les explications données au patient, l’apprentissage et le choix de la stratégie périmétrique. Mais cette variabilité est essentiellement structurelle, inscrite dans la définition même de ce qu’est un seuil de sensibilité. Elle est considérable et encore accrue par l’existence d’une atteinte glaucomateuse, cette augmentation concernant non seulement les points déficitaires, mais aussi les points normaux.
La variabilité présente deux composantes : les fluctuations à court terme et à long terme.
Fluctuation à court terme
C’est la variabilité intratest, qui est la fluctuation de mesure constatée pendant un même examen.
La figure 11-31 explique bien son caractère irréductible. La courbe réponse-luminance qui décrit la probabilité de voir le test en fonction de sa luminance présente une pente faible en raison du glaucome : une variation même importante de la luminance modifie peu la probabilité que le test soit vu. Son évaluation, autrefois partie intégrante des stratégies périmétriques, était difficile et imprécise. Elle a été abandonnée sur les stratégies SITA de Humphrey, ainsi que sur les stratégies usuelles de l’Octopus.
Fluctuation à long terme
C’est la variabilité intertest. Elle correspond sur la figure 11.31 à la modification de la courbe réponse-luminance entre deux examens. Cette composante est presque négligeable devant la fluctuation à court terme. On lui décrit deux composantes : l’une uniforme, touchant l’ensemble des points ; l’autre non uniforme, affectant différemment chaque point [21].
Variabilité test-retest
C’est la variabilité globale quand l’examen est répété. C’est elle qui compte en pratique. Quand on reteste un grand nombre de fois un point déficitaire dévié de – 6 dB chez des patients stables, on obtient des valeurs si étalées que lors de l’évolution, seule une déviation excédant – 16 dB permettra de parler d’aggravation significative à p < 5 %. L’intervalle est beaucoup plus étroit quand le point est normal. La composante principale de la variabilité test-retest est, nous l’avons vu, la fluctuation à court terme. La variabilité test-retest est liée à l’apprentissage et à la stratégie périmétrique choisie, mais elle dépend surtout, pour chaque point : de son degré d’atteinte, de son excentricité [18] et de l’importance du déficit glaucomateux global.
La variabilité test-retest augmente avec la profondeur du déficit, pour décroître en fin d’évolution, quand les seuils sont arrivés au bas de l’échelle de mesure de l’appareil [18].
Un dernier point doit être souligné : une variabilité anormalement importante en un point précède souvent l’apparition d’un déficit. Des fluctuations anormales concernant un groupe de points doivent attirer l’attention. Cette propriété est utilisée par le programme EyeSuite (voir plus loin).
TECHNIQUE D’ANALYSE
L’analyse des champs visuels doit, pour être efficace, profiter de l’ensemble des outils à notre disposition, mais en gardant comme fil conducteur le jugement clinique :
-
l’examen clinique apprécie l’opacification des milieux, précise le contexte clinique global du GPAO et recherche une corrélation anatomoclinique : il guide la prescription des champs visuels et aide à leur analyse ;
-
le respect des règles de prescription conditionne la rapidité et la précision future du diagnostic de progression ;
-
la vue d’ensemble recherche sur les cartes de déviation (comparaison) l’apparition ou l’aggravation d’une atteinte localisée. L’étude des indices apprécie le déficit global et la « rugosité » (c’est-à-dire le caractère localisé des déficits) du champ visuel ;
-
les outils statistiques et logiciels améliorent le diagnostic d’évolution. On les classe en deux catégories : analyse d’événement, utilisable dès les deux premières années d’évolution, et analyse de tendance qui seule permet de quantifier la progression.

Fig. 11-31 Variabilités intratest et intertest. Courbes de seuil d’un point du champ visuel (CV) : en vert, la courbe d’un point normal d’un sujet sain ; en rouge, la courbe d’un point glaucomateux : la pente est faible, expliquant l’imprécision de détermination du seuil, c’est-à-dire la variablité intratest ; en bleu, la courbe du même point lors d’un autre examen : la différence de tracé entre les courbes rouge et bleue reflète la variabilité intertest.
CHOIX DE LA STRATÉGIE
Il faut choisir une stratégie et la conserver pour le suivi de la progression. Un changement de stratégie rend la comparaison des champs visuels bruts impossible, celle des indices et des schémas de déviation (comparaison) approximative ; enfin, il empêche les analyses logicielles. Ainsi le passage de la stratégie SITA standard à SITA-Fast est impossible lors du suivi par le guided progression analysis (GPA) (voir plus loin).
Les examens les plus précis et reproductibles (G dynamique, SITA standard) sont privilégiés.
Trois cas particuliers :
-
atteinte centrale : la surveillance doit inclure un champ visuel explorant les 10° centraux. Dans les atteintes glaucomateuses débutantes, les premiers points anormaux se situent généralement à 15° du point de fixation, mais un nombre assez important commence dans les 5°, notamment en supérieur [20] ;
-
concentration difficile ou fatigabilité importante : il ne faut pas hésiter à choisir des stratégies plus rapides (SITA-Fast) ;
-
champs visuels très altérés : les tests de taille V permettent un suivi subjectif de l’évolution, avec une variabilité réduite sur les déficits modérés [33] mais, en revanche, l’analyse statistique des résultats est impossible en raison de l’absence de base de données normatives.
ÉTABLISSEMENT D’UNE BASE DE RÉFÉRENCE
L’effet d’apprentissage explique l’amélioration fréquente des premiers examens. Cette amélioration est souvent plus marquée quand le champ visuel est plus altéré, sans doute parce qu’il y a alors plus de marge pour une amélioration [1]. La base de référence est constituée de deux champs visuels fiables et cohérents entre eux. Le GPA élimine automatiquement de la base de référence le premier examen si le suivant présente une amélioration.
En cas d’atteinte glaucomateuse, l’effet d’apprentissage est fréquent. Il impose la réalisation d’un nombre suffisant d’examens du champ visuel dans un délai de temps assez court afin d’établir une bonne base de données initiales qui serviront de référence pour le suivi et le dépistage d’une progression. Trois examens dans les 6 à 12 premiers mois permettent une prise en charge initiale dans les meilleures conditions.
Des intervalles de temps courts entre les premiers champs visuels améliorent l’apprentissage et la précision ultérieure du suivi.
En cas d’inflexion thérapeutique majeure (laser, chirurgie), la constitution d’une nouvelle base de référence est indispensable.
FRÉQUENCE DES EXAMENS
La répétition des examens doit vaincre l’obstacle de la variabilité, s’adapter à la rapidité de l’évolution et prendre en compte la menace visuelle.
La variabilité des champs visuels rend impossible le diagnostic de progression si la fréquence des examens n’est pas suffisante : même en cas d’aggravation rapide (baisse du MD de 2 dB par an), la progression n’est détectée qu’après 5 ans si l’examen est pratiqué tous les ans, 2,5 ans, s’il est pratiqué tous les 6 mois, 1,7 an s’il est pratiqué tous les 4 mois [11].
L’intervalle entre les examens doit également s’adapter à la vitesse de progression et non pas être fixe. La répétition rapide du champ visuel devant une aggravation nette diminue les faux positifs et diagnostique plus tôt les « progresseurs rapides » [12]. Il ne faut pas hésiter à pratiquer une double confirmation (voir plus bas) : après la première confirmation d’une aggravation, environ 40 % des champs visuels retournent à leur état stable antérieur [26].
Les deux premières années
Devant une suspicion de glaucome ou un glaucome avéré, le début du suivi est guidé par un impératif : ne pas passer à côté d’un progresseur rapide.
-
Dans les six premiers mois : deux examens au moins sont effectués pour établir la base de référence, trois au moins en cas d’atteinte importante. Ces premiers champs visuels fournissent déjà une première indication : une détérioration du 2e ou du 3e examen, alors que l’apprentissage n’est habituellement pas encore terminé, doit inquiéter.
-
Dans les dix-huit mois suivants :
-
deux examens au moins sont pratiqués, mais à condition d’être stables. En cas de suspicion de progression, un premier examen de confirmation est pratiqué rapidement. Le plus souvent, la progression est infirmée [26]. Si au contraire la progression est une première fois confirmée, un 2e examen de confirmation est pratiqué ;
-
si le contexte clinique fait suspecter une progression rapide ou une menace visuelle, trois examens au moins sont nécessaires, avec des examens faits au plus tôt s’il apparaît une aggravation.
-
On retiendra donc qu’à moins d’un contexte et d’examens particulièrement rassurants, six examens au moins, dans la mesure du possible, devraient être pratiqués dans les deux premières années [14].
Après deux ans d’évolution
-
À l’issue des deux premières années, la vitesse de progression précise ne peut pas être réellement calculée : les premiers champs visuels ont seulement permis de déterminer si le patient est ou non un « progresseur rapide ». En l’absence d’une progression rapide, et dans un contexte clinique rassurant, le rythme des champs visuels peut être ralenti, mais un examen montrant une aggravation sera répété rapidement [22, 23]. En cas de progression rapide, ou de contexte clinique de progression probable, le champ visuel sera répété au moins tous les six mois.
-
C’est seulement après quelques années qu’une vitesse de progression peut être calculée : quand les analyses de tendance deviennent suffisamment précises. La rapidité d’évolution précédemment constatée, l’importance des déficits, la menace visuelle (prenant en compte l’espérance de vie) et le contexte clinique sont les critères essentiels pour fixer le rythme de la surveillance. Répétons que cette surveillance ne doit pas être régulière mais s’adapter au contexte propre à chaque patient : l’apparition d’une aggravation réclame un examen de confirmation rapide.
Plus le champ visuel est altéré, plus le suivi de la progression doit être étroit.
SÉLECTION DES EXAMENS
-
Fiabilité. Les explications données au patient, sa mise en confiance et son confort sont les facteurs premiers pour améliorer la fiabilité. Les critères de fiabilité doivent être modulés par le jugement clinique.
-
Pertes de fixation. La limite de 20 % de pertes de fixation est retenue comme acceptable.
-
Faux positifs. Le critère des appareils est trop généreux pour assurer un suivi fiable. Le logiciel GPA élimine automatiquement les examens dont les faux positifs dépassent 15 %.
-
Faux négatifs. Ils sont directement proportionnels à l’importance du déficit [6] et augmentés par la fatigabilité du patient. Les limites de 33 % de faux négatifs sont habituelles pour ce paramètre.
C’est la comparaison simple des champs visuels imprimés. Les examens sont classés œil par œil et par ordre chronologique, le plus récent au-dessus de la pile. Ceux de l’œil gauche sont placés à gauche, et ceux de l’œil droit à droite pour ne pas passer à côté d’un déficit non glaucomateux.
PARAMÈTRES D’ANALYSE DE LA PROGRESSION
Cartes de déviation
Les cartes de déviation totale et individuelle (comparaison et comparaison corrigée), dans leur représentation de l’importance statistique des écarts, permettent de repérer facilement les anomalies.
-
La variabilité intra-individuelle impose un filtrage temporel des anomalies : seuls les points anormaux confirmés sur plusieurs champs visuels consécutifs doivent être pris en compte. Cette pluri-confirmation des atteintes est à la base du principe de fonctionnement du GPA (voir plus loin). Cependant, on notera les fluctuations anormales au niveau d’un groupe de points regroupés car elles peuvent précéder l’installation d’un déficit.
-
Plusieurs points anormaux groupés et correspondant à un même faisceau (clusters) ont une valeur diagnostique majeure.
-
S’il existe un déficit diffus lié à une opacité des milieux, l’attention doit se porter sur la carte de déviation individuelle (comparaison corrigée) à la recherche d’une atteinte localisée
Enfin les anomalies ont d’autant plus de poids diagnostique qu’elles sont proches du centre [30]. La recherche d’une corrélation anatomoclinique au niveau de la tête du nerf optique est indispensable à l’interprétation.
Indices
-
Test de l’hémi-champ glaucomateux (GHT) du Humphrey.
-
Déficit moyen (déviation moyenne).
-
Écart type individuel = pattern standard deviation (PSD) [racine carrée de la variance des pertes = square Loss Variance (sLV)]. Bon critère de conversion, cet indice est trompeur dans les glaucomes sévères (MD > – 15 dB) où la profondeur et l’extension des déficits, en lissant le champ visuel, ne le rend plus fiable.
AGGRAVATION PÉRIMÉTRIQUE DU GLAUCOME
Extension d’un déficit
La variabilité au bord d’un déficit existant est importante : la confirmation de l’atteinte est indispensable. Cette baisse a une significativité sous-estimée sur les cartes statistiques : il faut analyser les écarts des valeurs de sensibilités en décibels. Une extension centripète est bien sûr plus significative et plus grave qu’une extension périphérique.
Approfondissement d’un déficit
La baisse de seuil des points déjà anormaux doit être considérée avec prudence en raison de la variabilité test-retest considérable de ces points. La comparaison des examens doit s’exercer sur les cartes exprimées en dB et non sous forme statistique (fig. 11-32).
L’extension d’un déficit déjà présent est de loin le mode de progression le plus fréquent, et il a été proposé d’élaborer des stratégies périmétriques de suivi focalisées sur les régions déficitaires [7].
Apparition d’un nouveau déficit
On considère les déficits concernant plusieurs points groupés. Une atteinte survenant sur un hémi-champ jusqu’alors indemne est rare en début de progression. Elle doit être considérée comme un tournant dans l’évolution de l’affection [8].
Critères de progression d’Anderson et Patella
-
Nouveau déficit : groupe cohérent de trois points déficitaires sur la carte de déviation individuelle dont un à p < 1 %.
-
Aggravation d’un déficit :
-
approfondissement : trois points déficitaires abaissés de 10 dB ;
-
extension : deux nouveaux points contigus abaissés de 10 dB [1].
-
Les pièges de la progression en pratique
-
Troubles des milieux. Piège habituel qui nécessite toujours une confrontation des données avec l’examen clinique.
-
Déficit non glaucomateux. Une aggravation importante et soudaine doit faire rechercher une autre cause (occlusion vasculaire rétinienne, décollement de rétine, atteinte neurologique, etc.). De même, une extension d’un déficit avec respect de l’axe vertical doit faire éliminer une atteinte neurologique.
L’aggravation d’un déficit important doit s’apprécier sur les cartes en dB, et non pas seulement sur les cartes statistiques car les points déficitaires atteignent vite la significativité maximale et les points proches d’un déficit connaissent des variations de sensibilité très importantes, pour lesquelles les critères statistiques usuels ne sont pas toujours très fiables.

Fig. 11-32 Déviation en dB et sous forme statistique. Le point entouré est dévié de – 6 dB mais sa significativité statistique est déjà maximale. Son évolution doit être suivie sur la carte en dB.
ANALYSE DE TENDANCE D’ÉVOLUTION DU DÉFICIT MOYEN « PENTE DE MD »
Disponible sur les périmètres Humphrey et Octopus, la pente de MD permet d’apprécier la vitesse d’évolution de la perte moyenne de sensibilité du champ visuel. Une droite de régression linéaire est calculée par la méthode des moindres carrés. Sa pente exprime en dB par an la vitesse d’évolution.
Les périmètres affichent la pente de progression en dB par an avec un degré de significativité. Cette significativité diffère selon les appareils :
-
le périmètre Humphrey calcule la significativité par un test de Student (t-test). p < 5 % signifie « moins de 5 % de chance que le MD soit stable » (voir plus loin). Il y a progression nette à partir de 1 dB par an, et progression rapide à partir de 2 dB par an (fig. 11-33) ;
-
le périmètre Octopus (programme EyeSuite) calcule la significativité par comparaison à des pentes mesurées sur des champs visuels équivalents successifs de patients stables (r-test). p < 5 % signifie ici « moins de 5 % de patients stables présentent une pente de progression identique » [24]. Le programme indique aussi la fluctuation des points par rapport à la droite de régression calculée ainsi que la significativité de cette fluctuation. L’existence de fluctuations significatives à distance de l’apprentissage pourrait précéder une aggravation.
En pratique, la pente de MD permet de bien quantifier la progression, en l’absence d’une opacification progressive des milieux oculaires. Sur le périmètre Humphrey, l’analyse doit être complétée par celle de la pente du VFI, quand elle est disponible.
La pente de MD présente des pièges d’interprétation communs à l’ensemble des pentes de régression linéaire que nous rencontrerons dans les autres analyses de tendance : l’existence d’un point erratique fausse la mesure et doit faire retirer l’examen qui risque de fausser l’ensemble des calculs d’évolution (fig. 11-34).
ANALYSE DE TENDANCE D’ÉVOLUTION DE L’INDICE DE PROGRESSION INDIVIDUELLE « PENTE DE PSD (SLV) »
L’évolution du PSD (sLV) est très utile pour la surveillance d’un glaucome débutant et modéré jusqu’à la « conversion périmétrique ». Après conversion, l’évolution du PSD est peu utile et peut même devenir trompeuse pour les glaucomes évolués (MD < – 10 dB). L’étude de sa pente de progression ne présente alors plus d’intérêt.
GRAPHES « BOXPLOTS »
Disponible sur tous les périmètres Humphrey, le boxplot ou « boîte à moustaches » est un graphique de distribution des seuils de sensibilité des différents points testés et de leurs déviations représentées de façon schématique (fig. 11-35) : un rectangle (ou « boîte rectangle ») indique les seuils entre lesquels sont réparties les sensibilités de 70 % de l’ensemble des points testés du champ visuel. En haut et en bas de la boîte, une extension linéaire ou « moustache » indique les 15 % de seuils les moins déviés et les 15 % de seuils les plus déviés.
Ce « résumé » permet de voir d’un coup d’œil l’évolution :
-
le boxplot s’abaisse sans changer de forme en cas de cataracte ou de trouble des milieux ;
-
la moustache inferieure s’allonge avec l’apparition d’un déficit localisé ou si un déficit existant s’approfondit ;
-
la partie inférieure de la boîte s’allonge si le déficit localisé s’étend.
COURBE DE BEBIÉ ET INDICES ASSOCIÉS
La courbe de Bebié est principalement disponible sur le programme Peridata et le périmètre Octopus (fig. 11-36). Les seuils de sensibilité des différents points sont classés du plus sensible au moins sensible sur cette courbe avec une représentation des limites de l’intervalle de confiance. Un déficit localisé se traduit par une cassure de la courbe à son extrémité du côté des sensibilités les plus faibles, alors qu’un déficit diffus s’exprime par un abaissement global de la courbe.

Fig. 11-33 Boxplots et courbe des indices. Abaissement de la partie inférieure de la boîte « boxplots ». La pente de la courbe de MD montre une aggravation significative à p < 0,1 %.

Fig. 11-34 Suppression d’un examen erratique. Le 5e champ visuel est très aggravé [MD très abaissé (rouge), avec pente du MD (rouge) significative]. Le 6e champ visuel (bleu) ne confirme pas l’aggravation, mais la pente (bleue) reste significative si l’on tient compte de l’examen précédent. Le 7e champ visuel confirme que le 5e champ était erratique : il doit être éliminé.

Fig. 11-35 Évolution schématique des « boxplots ». Le « boxplot » est une représentation schématique de la courbe de distribution des points sur la carte de déviation totale.

Fig. 11-36 Correspondance courbe de Bebié et « boxplot ». Dans la courbe de Bebie les points sont rangés selon leurs déviations. La cassure du bas de la courbe correspond à l’allongement de la « moustache ».
GUIDED PROGRESSION ANALYSIS 2 (GPA2)
Le relevé se présente avec à sa partie supérieure les deux champs visuels de référence, au centre l’analyse de progression de l’indice VFI et à la partie inférieure le dernier relevé actuel avec son analyse par rapport aux relevés de référence (fig. 11-37).
Analyse d’événement GPA
Issue de l’étude EMGT [17], l’analyse utilise les valeurs de la carte de déviation individuelle.
La base de référence est constituée des deux examens les plus anciens du patient La stratégie choisie (SITA standard, préférable, ou SITA-Fast) doit rester la même pour la base de référence et le suivi.
Le logiciel compare tous les examens de suivi à cette base. Il signale tout point dont l’aggravation par rapport cette base est significative. La significativité repose sur une estimation de la variabilité test-retest, effectuée sur des patients glaucomateux stables de même âge que celui du patient. Une aggravation est significative quand elle dépasse cette variabilité à p < 5 % (signifiant que moins de 5 % de patients stables présentent une telle variabilité au niveau de ce point) (fig. 11-38).
Une progression détectée une première fois est signalée par un triangle blanc. Lors de sa confirmation à l’examen suivant, le point est représenté par un triangle bicolore et noir après le 3e test qui le confirme. L’existence de trois points déficitaires retrouvés à deux examens successifs est exprimée par la mention : « Progression possible » et par celle de « Progression probable » s’ils sont confirmés par trois examens qui se succèdent.
Dans les glaucomes évolués surtout, le GPA rencontre trois limites :
-
la variabilité considérable des points très déficitaires empêche leur analyse ; ils sont alors indiqués par des croix ;
-
les cartes de déviation individuelle sont artificiellement rehaussées en raison de l’atteinte de l’ensemble des points ;
-
pour cette raison notamment, si la moyenne des MD de la base de référence est inférieure à – 15 dB sur deux champs visuels, le logiciel n’est plus utilisable.
L’utilisation du programme GPA2 est simple, permet des détections précoces et représente un excellent moyen de dépistage des « progresseurs rapides ». Il ne permet pas de quantifier la progression mais l’intervalle de temps entre la base de référence et l’événement peut cependant fournir une appréciation indirecte de la vitesse de progression.
Son utilisation doit être stricte :
-
la qualité de la base de référence est essentielle :
-
le délai entre les deux examens de référence choisis doit être assez court pour éviter une progression,
-
une aggravation confirmée deux fois doit faire établir une nouvelle base constituée des deux derniers examens. Cependant, un changement de cette base de référence peut aussi être nécessaire après un abaissement important de la pression, pour vérifier l’amélioration de la progression ;
-
-
l’existence sur un 1er champ visuel de suivi de plusieurs triangles, a fortiori s’ils sont groupés, doit faire pratiquer un voire deux champs visuels de confirmation rapidement ;
-
le diagnostic de progression probable ne nécessite pas que les points signalés soient contigus. L’appartenance à un cluster est un argument diagnostique supplémentaire majeur ;
-
l’attention doit se porter en priorité sur les déficits déjà présents, quand ils existent, car le mode d’aggravation principal est surtout l’extension et/ou l’approfondissement du déficit ;
-
les scotomes paracentraux sont généralement petits, souvent signalés par un seul point anormal sur le GPA. Dans ce cas, une surveillance au champ visuel 10°, impossible avec le GPA, appréciera alors mieux la progression (voir plus loin) [30].
VISUAL FIELD INDEX (VFI)
Le VFI, ou indice de fonction visuelle, est un nouvel indice d’évaluation de la fonction visuelle exprimé en pourcentage (champ visuel normal pour l’âge = 100 %). Calculé à partir de la profondeur des déficits de chaque point des cartes de déviation individuelle, corrigée en fonction des valeurs normales pour des sujets de même classe d’âge, il est beaucoup moins sensible aux troubles des milieux oculaires et une procédure de pondération est appliquée et tient compte de la densité en cellules ganglionnaires plus importantes dans les zones centrales du champ visuel. Le VFI est ainsi plus influencé que l’indice MD en cas de déficit central et moins influencé en cas de déficit périphérique, qui correspond à une perte plus faible en cellules ganglionnaires. Cette pondération associée à la prise en compte de la déviation individuelle le rendrait, selon ses concepteurs, moins sensible aux troubles de transparence des milieux. Exprimé en pourcentage, variant du 0 % de la cécité au 100 % de la vision d’un œil normal du même âge, le VFI reflète la capacité visuelle périmétrique résiduelle du patient.
Cet indice vient compléter l’indice de déviation moyenne, MD, dans l’évaluation de la fonction visuelle. Il apporte ainsi une information complémentaire avec une possibilité d’analyse de son évolution dans le temps par une analyse de régression.
Interprétation
La pente du VFI permet une évaluation quantifiée de la progression annuelle exprimée en pour cent par an et assortie d’un niveau de significativité. En partant du principe que le taux de progression fondé sur un modèle de régression linéaire présente un caractère prédictif, le programme GPA propose une extrapolation dans le futur de la pente de régression, établissant ainsi une prévision de la progression du VFI pour les années suivantes, qui vient compléter les données de la pente d’évolution de l’indice de perte moyenne de sensibilité (MD) [10]. Le prolongement de la pente au-delà du dernier examen fournit donc une prédiction de l’atteinte future. Cette pente d’évolution est couplée à un histogramme qui indique la « réserve » de fonction visuelle au dernier examen, et sa projection à cinq ans.
La construction de cette pente nécessite au moins cinq examens, réalisés sur une période d’au minimum trois ans (voir fig. 11-37b).
Les limites du VFI sont liées à son mode de calcul, à partir des cartes de déviation individuelles où seuls les déficits localisés sont pris en compte, avec pour conséquence une sous-estimation possible de l’atteinte. Les atteintes déficitaires au niveau des points qui n’atteignent pas la significativité statistique sur la carte de déviation individuelle sont ignorées, et ces points conservent un score de 100 %. Aussi le VFI risque-t-il de sous-estimer l’évolution glaucomateuse précoce de champs visuels initialement normaux [4], et il faut bien retenir qu’il s’agit d’un moyen complémentaire d’évaluation de la progression de l’atteinte fonctionnelle.
L’analyse d’événement du GPA détecte une aggravation plus tôt que l’analyse de la progression du VFI et permet ainsi de dépister rapidement les progresseurs rapides (voir fig. 11-37c). L’analyse de tendance permet une quantification de l’évolution globale mais nécessite, pour diagnostiquer une aggravation, plus d’examens et un temps de suivi plus long que le GPA.

Fig. 11-37 Humphrey, relevé GPA2 – Analyse de progression. a. Deux champs visuels fiables de référence. b. Analyse du VFI : pente d’évolution avec sa significativité et projection de sa progression dans le temps. c. Dernier relevé du champ visuel à la partie inférieure ; chaque triangle noir correspond à une aggravation par rapport aux examens de référence dépassant la variabilité admise, retrouvée sur trois examens consécutifs. Le logiciel signale donc une évolution probable.

Fig. 11-38 Relevé du champ visuel avec analyse GPA générée automatiquement sur le relevé.
Ce programme propose une série d’analyses de tendance. Les suivis des indices globaux MD et PSD et des indices DD (diffuse defect) et LD (localised defect), ainsi que leur taux de progression sont toujours fournis (fig. 11-39).
Le programme Polar Trend est une analyse de tendance point par point (point wise linear regression). La valeur de seuil de chaque point du champ visuel est graphiquement représentée à sa localisation correspondante théorique sur l’anneau neurorétinien, assortie d’un code couleur (rouge pour aggravation, vert pour récupération) (fig. 11-40).
Le Cluster Graph divise le champ visuel en dix zones ou clusters. Pour chaque cluster, le programme calcule la déviation totale, par rapport à un sujet normal de la même tranche d’âge, ainsi que son niveau de probabilité (p < 5 % ou p < 1 %).
L’analyse de tendance Cluster Trend détermine, pour chacun de ces dix clusters, s’il s’est produit une fluctuation, une aggravation ou une récupération à p < 1 % et p < 5 % (calculée par r-test) (fig. 11-41).
L’analyse Corrected Cluster Trend réalise les mêmes calculs mais en se fondant sur la déviation individuelle de chacun des dix clusters (fig. 11-42).
Il existe d’autres logiciels d’analyse de tendance (Progressor et Peridata) très peu utilisés en pratique courante.

Fig. 11-39 Octopus : évolution globale. Les évolutions significatives sont signalées par un triangle rouge.

Fig. 11-40 Octopus : tendance en coordonnées polaires. Les points du champ visuel avec une évolution significative sont indiqués sur le disque optique et une ligne colorée dont la taille est proportionnelle à l’importance de la progression.

Fig. 11-41 Octopus : évolution des clusters. Les triangles indiquent une évolution significative. Les losanges indiquent une fluctuation significative.

Fig. 11-42 Octopus : évolution des clusters corrigés. Quand il existe une amélioration diffuse, cette présentation est choisie automatiquement. Elle doit être choisie manuellement en cas d’apparition de trouble des milieux.
Dans un contexte évocateur d’un GPAO modéré bien équilibré, la « probabilité a priori » de progression du champ visuel est faible. Au contraire, dans un contexte évocateur d’un GPAO sévère mal équilibré, la probabilité a priori de progression du champ visuel est élevée. Un champ visuel montrant une progression aura ici une valeur prédictive de progression réelle élevée. Le contexte clinique peut ainsi aider à ajuster la fréquence de prescription.
L’étude EMGT sur des patients non traités montre une grande disparité des taux de progression :
-
taux de progression médian des GPAO 0,46 dB par an [glaucome à pression normale (GPN) 0,22 dB par an], correspondant à une majorité de progresseurs lents ;
-
taux de progression moyen des GPAO 1,31 dB par an, trois fois plus élevé donc, en raison d’une forte minorité de « progresseurs rapides » (GPN 0,36 dB par an) [16].
Le meilleur prédicteur de la progression future semble être la progression passée : la progression périmétrique globale tend à être linéaire quand l’unité de mesure est logarithmique [19].
Une analyse fiable de la progression suppose une rigueur dans la réalisation des tests successifs :
-
observer les règles de bonne pratique concernant la réalisation d’un examen de champ visuel ;
-
utiliser la même stratégie tout au long du suivi ;
-
préférer les stratégies SITA standard (Humphrey) et Dynamic Strategy (Octopus) ;
-
obtenir des relevés fiables : ne tenir compte que du 3e examen pour éviter le phénomène d’apprentissage et éliminer les relevés présentant de mauvais indices de fiabilité.
Une aggravation du champ visuel sera d’autant plus difficile à identifier que la dégradation est lente et qu’il existe de fortes fluctuations d’un test à l’autre. Un nombre suffisant d’examens est nécessaire pour détecter une aggravation significative. Il a été démontré que trois tests fiables par an étaient nécessaires pendant les deux premières années de suivi, pour identifier et évaluer une progression rapide (taux de progression du MD de – 2 dB par an) chez un patient présentant initialement un glaucome débutant (MD de – 4 dB) avec des fluctuations intertests moyennes. La fréquence des examens ultérieurs sera adaptée en fonction du taux annuel de progression observé ; elle devra raisonnablement être d’autant plus élevée que la progression est rapide.
Les appareils récents de périmétrie automatisée proposent des programmes complets et précis d’analyse de la progression du glaucome. Ils facilitent l’interprétation et permettent de repérer les patients présentant un risque de progression rapide et nécessitant un traitement d’emblée plus incisif. Lors du suivi, l’efficacité du traitement est jugée plus aisément sur l’évolution du taux de progression. Une aggravation est plus facilement et plus précocement détectée, permettant d’adapter sans retard le traitement, afin d’infléchir la pente de progression vers la stabilisation (tableau 11-1).
Dans tous les cas, l’évaluation de la progression de l’atteinte fonctionnelle nécessite de confirmer l’aggravation détectée par un autre examen du champ visuel.
Elle devra enfin toujours être complétée par une corrélation anatomoclinique afin de confronter les résultats de l’analyse fonctionnelle avec les données de l’examen clinique de tête du nerf optique et des fibres nerveuses rétiniennes pour affirmer l’atteinte progressive de la neuropathie glaucomateuse.
Une vraie progression est illustrée par la figure 11-43, et une progression piège par la figure 11-44.
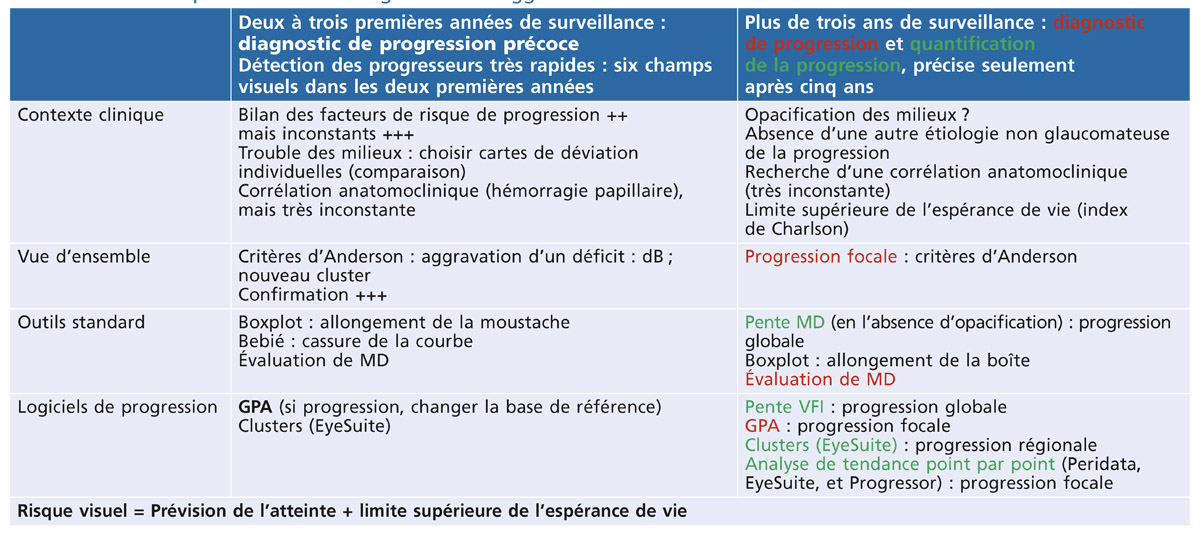
Tableau 11-1 – Étapes de l’évaluation globale de l’aggravation.
Rouge : diagnostic de progression sans quantification ; vert bouteille : quantification de la progression.

Fig. 11-43 Progression vraie. L’analyse du VFI et le GPA montre tous deux l’importance de l’évolution (sur plusieurs années). L’examen de l’évolution en dB montre l’approfondissement du déficit au niveau de certains points marqués par des croix.

Fig. 11-44 Progression piège. La série montrée ici illustre un double piège. Les deux premiers examens correspondent à un apprentissage. Il faut les retirer manuellement sinon les futures aggravations risquent d’être manquées par le logiciel. Un fois la base de référence correctement choisie, la pente du VFI montre une aggravation nette du 4e examen (pente bleue) (a). Toutefois, le pourcentage de faux négatifs rend douteuse sa fiabilité. Le 5e examen infirme l’aggravation. Le 4e examen doit être retiré de la série. Le VFI est stable (pente verte) (b). La nouvelle évolution est rassurante pour le VFI. Elle montre en revanche une évolution possible sur le GPA : choisir une bonne base de référence est essentiel.
La fonction visuelle centrale est évaluée en pratique clinique courante par deux composantes : l’acuité visuelle, abaissée très tardivement, et la mesure de la sensibilité aux contrastes, d’atteinte beaucoup plus précoce. L’étude de leur progression participe à l’appréciation de la gêne visuelle du patient : l’acuité visuelle et la sensibilité aux contrastes permettent de mieux prévoir la capacité à accomplir les activités de la vie courante que le champ visuel binoculaire [31].
L’acuité visuelle corrigée, exprimée sous la forme du pouvoir séparateur de l’œil en logMAR (MAR est l’acronyme anglais désignant la résolution angulaire minimale), se trouve bien corrélée au seuil fovéal calculé au début du champ visuel et exprimé en dB : 68 % des patients ayant moins de 4/10 ont un seuil fovéal compris entre 0 et 30 dB, 47 % des patients ayant 10/10 ont un seuil fovéal supérieur à 37 dB [13]. L’acuité visuelle n’est altérée que dans des GPAO évolués. La meilleure acuité visuelle corrigée peut, dans les cas très évolués, diminuer significativement, malgré une stabilité apparente du champ visuel 10-2 [29].
La sensibilité aux contrastes est, au contraire de l’acuité visuelle, altérée de façon précoce et constitue longtemps un paramètre fonctionnel important. Tant que l’acuité visuelle est supérieure à 5/10, la baisse de la sensibilité aux contrastes se trouve bien corrélée au déficit du champ visuel et explique une partie de la gêne visuelle ressentie par les patients [15]. La sensibilité aux contrastes est étudiée en faisant varier la fréquence spatiale : le test est constitué de bandes dont la luminance suit une courbe sinusoïdale de fréquence donnée.
L’échelle de Pelli-Robson, qui est la plus utilisée en pratique clinique, représente des lettres dont la taille reste identique et dont le contraste décroît de la ligne du haut à la ligne du bas.
Les tests de Gabor représentent un réseau dont l’enveloppe gaussienne définit la taille. Le nombre de cycles étant constant, une augmentation de la fréquence spatiale correspond à une diminution de la taille du test. Une étude reposant sur l’utilisation de ces tests en photopique a confirmé que le glaucome est responsable d’une atteinte fovéale précoce, malgré une acuité visuelle conservée [25].
Une mesure informatisée rapide et précise a été récemment décrite et utilise des tests de dessin proche mais dont un plus grand nombre de paramètres est modifiable. Elle repose sur l’utilisation des probabilités bayésiennes [27].
Retenir
-
Dans la mesure du possible, six champs visuels doivent être pratiqués dans les deux premières années.
-
Les champs visuels non fiables ou erratiques faussent le diagnostic porté sur les séries de champs visuels qui les incluent.
-
La plupart des aggravations sont fausses : les champs visuels de confirmation sont indispensables.
-
Il est plus efficace de grouper les champs visuels, pour la constitution de la base de référence comme pour la confirmation des aggravations (examens faits « à la demande »).
-
C’est le plus souvent la carte de déviation individuelle (ou de comparaison corrigée) qui doit être utilisée, mais cette carte fait disparaître le déficit glaucomateux diffus.
-
Il faut rechercher l’atteinte de points groupés correspondant à un même faisceau de fibres nerveuses rétiniennes.
-
L’aggravation d’un déficit s’apprécie sur la carte en dB.
-
Une atteinte centrale est fréquente et passe facilement inaperçue si les 10° centraux ne sont pas testés.
-
La mesure de l’acuité visuelle doit être systématique dans les glaucomes évolués.
F. Aptel, J.-M. Giraud, H. El Chehab N. Charles, M. Delbarre, J.-P. Renard
L’évaluation de la progression de l’atteinte fonctionnelle est possible, comme nous l’avons vu, grâce à différents programmes d’analyse dans le temps du taux de progression de l’indice de déviation moyenne (MD) et du nouvel indice d’évaluation de la fonction visuelle (visual field index ou VFI) exprimant en pourcentage la fonction visuelle restante [1-7].
Le but de cette étude bicentrique a été d’analyser le taux de progression des indices d’évaluation de la fonction visuelle MD et VFI, aux différents stades évolutifs de la maladie glaucomateuse, au sein d’une cohorte de 228 patients présentant un glaucome primitif à angle ouvert (GPAO) ou une hypertension intra-oculaire (HTO) et suivis semestriellement pendant au moins cinq ans (m = 8,4 ans).
Les patients pris en charge et suivis à l’Hôpital d’Instruction des Armées du Val-de-Grâce à Paris et au Centre Hospitalier Universitaire de Grenoble ont bénéficié au minimum tous les six mois d’un examen ophtalmologique complet. Ils remplissaient tous à l’inclusion les critères suivants : (i) diagnostic d’HTO défini par une PIO > 21 mmHg sans traitement ou de GPAO défini avec une PIO > 21 mmHg sans traitement, présence d’anomalies fiables et reproductibles du champ visuel en périmétrie automatisée (PAS) et anomalies caractéristiques de la TNO ; (ii) les données d’au moins 12 visites consécutives espacées de 6 ± 1 mois disponibles ; (iii) les résultats d’un examen fiable du champ visuel Humphrey réalisé avec une stratégie 24-2 SITA standard disponibles à chaque visite ont été incluses dans une base d’analyse informatisée de données dont les premières remontent à 1998.
Le taux de progression a été calculé en utilisant l’analyse de tendance du logiciel GPA2 (glaucoma progression analysis) du périmètre Humphrey HFA (Carl Zeiss Meditec). Pour l’analyse statistique, les yeux ont été classés à partir des données initiales et finales en cinq groupes : HTO, glaucome débutant (MD > – 6 dB), glaucome modéré (MD = – 6 à – 12 dB), glaucome avancé (MD = – 12 à – 18 dB) et glaucome sévère (MD < – 18 dB).
Quatre cent quarante et un yeux de 228 patients suivis au minimum six ans ont été inclus (121 HTO, 188 glaucomes débutants, 45 glaucomes modérés, 41 glaucomes avancés et 46 glaucomes sévères). Parmi les 121 HTO, 17 avaient initialement été classés en GPAO débutant pour un déficit du champ visuel non retrouvé au cours et en fin de suivi. Ces anomalies initiales, malgré la fiabilité des relevés périmétriques, et identiques à celles rapportées dans l’étude OHTS, ont été attribuées à un phénomène d’apprentissage plus long chez ces sujets. La durée moyenne de suivi était de 8,4 ± 2,7 ans. Sur la catégorisation initiale, 86 % des 121 sujets HTO (dont 100 % des 104 avec champ visuel normal) avaient un indice MD positif, alors que 183 des 188 glaucomes débutants (97,3 %) avaient un MD négatif. L’analyse des données en fin de suivi, qui permet d’éviter les biais d’apprentissage, rapporte que tous les sujets HTO après analyse du relevé de PAS finale avaient un MD positif, tandis que 183 sur 184 (99,5 %) glaucomes débutants avaient un MD négatif.
Les taux de progression de MD et du VFI dans les différents groupes étaient respectivement de : MD = – 0,09 dB/an (VFI = – 0,17 %/an) pour les HTO, – 0,32 dB/an (VFI = – 0,83 %/an) pour les glaucomes débutants, – 0,52 dB/an (VFI = – 1,81 %/an) pour les glaucomes modérés, – 0,54 dB/an (VFI = – 2,35 %/an) pour les glaucomes avancés, et – 0,45 dB/an (VFI = 1,97 %/an) pour les glaucomes sévères étudiés (tableaux 11-2 et 11-3). La relation entre le MD initiale et le taux de progression était significative dans le groupe des glaucomes débutants, modérés et avancés (p < 0,04).
Après segmentation de chacun des quatre premiers groupes de patients (en fonction du diagnostic initial) en deux sous-groupes (en fonction du diagnostic en fin d’étude), une analyse complémentaire a considéré comme sujets stables les patients restés dans la même catégorie du début à la fin de l’étude, et comme sujets évolutifs ceux qui étaient passé dans une catégorie plus évoluée (tableaux 11-4 à 11-6).

Tableau 11-2 – Comparaison des populations selon le diagnostic initial et le diagnostic en fin de période de suivi (m = 8,4 ans).
HTO, glaucome débutant (MD > – 6 dB), glaucome modéré (MD = – 6 à – 12 dB), glaucome avancé (MD = – 12 à – 18 dB) et glaucome sévère (MD < – 18 dB).

Tableau 11-3 – Taux de progression pendant la période de suivi. Analyse de tendance du logiciel GPA.
Diag. initial 1 : HTO. Diag. initial 2 : glaucome débutant (MD > – 6 dB). Diag. initial 3 : glaucome modéré (MD = – 6 à – 12 dB). Diag. initial 4 : glaucome avancé (MD = – 12 à – 18 dB).
Diag. initial 5 : glaucome sévère (MD < – 18 dB).

Tableau 11-4 – Distribution de la population selon la catégorisation diagnostique initiale et finale.
Sujets considérés « stables » sans changement de catégorie entre le début et la fin d’étude, sujets classés « évolutifs » passant dans une catégorie plus évoluée en fin d’étude.

Tableau 11-5 – Taux de progression moyen de l’indice VFI en % par an chez les sujets « stables » et « évolutifs ».
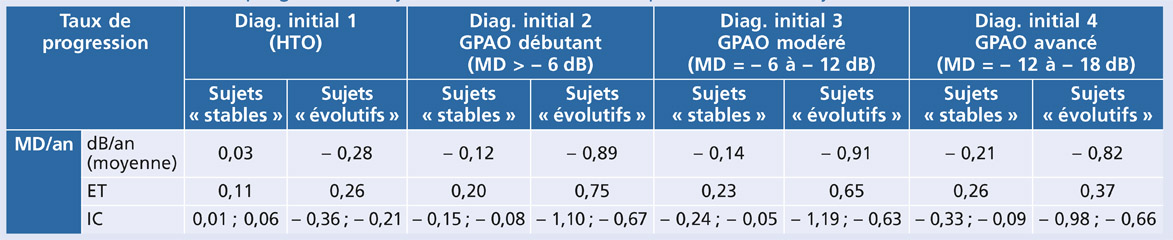
Tableau 11-6 – Taux de progression moyen de l’indice MD en dB par an chez les sujets « stables » et « évolutifs ».
Discussion
Cette étude rapporte, chez les HTO « évolutifs » ayant évolué vers un glaucome, des taux de progression des indices MD et VFI nettement plus faibles que chez les sujets glaucomateux. Les résultats rappellent également que le passage d’une valeur positive à une valeur négative de l’indice MD est un indicateur fiable de l’entrée dans la maladie glaucomateuse.
L’analyse de cette large base de données montre que les patients avec un glaucome plus évolué à l’inclusion ont présenté une dégradation plus rapide de la fonction visuelle pendant la période de suivi, que celle-ci soit évaluée à l’aide du paramètre MD ou VFI. Après segmentation des différents groupes de patients en sujets stables et évolutifs, le calcul des taux de progression moyen du MD et du VFI fait apparaître, outre une différence marquée de ces taux entre eux, une grande homogénéité des taux de progression chez les sujets glaucomateux évolutifs analysés, cohérente avec la notion de caractère linéaire de la progression. En effet, les taux de progression du MD sont de – 0,89 dB/an, – 0,91 dB/an et – 0,82 dB/an respectivement dans les sous-groupes de glaucomes débutants, modérés et avancés évolutifs. Dans ces mêmes sous-groupes, les taux de progression du VFI sont de – 2,51 %/an, – 3,03 %/an et – 3,41 %/an. Ces taux de progression du MD et du VFI semblent constituer de bons indicateurs de glaucome évolutif. Le caractère linéaire de la progression de chaque sujet et le fait que les patients avec un glaucome plus évolué à l’inclusion ont présenté une dégradation plus rapide de la fonction visuelle pendant la période de suivi subséquente, au sein de la cohorte étudiée, sont compatibles avec l’hypothèse selon laquelle les sujets ayant un rythme de progression plus rapide présentaient en début de période de suivi un glaucome plus évolué que ceux qui ont un rythme de progression plus lent. Ces sujets ayant un glaucome plus évolué au début ont continué à présenter un rythme de progression plus rapide pendant cette période, malgré les traitements, amenant ainsi à constater une relation entre le stade du glaucome au début du suivi et la vitesse de progression. La conséquence pratique serait qu’un patient glaucomateux présentant des déficits périmétriques importants lors de sa prise en charge initiale est a priori un patient atteint d’un glaucome à plus fort potentiel évolutif malgré les traitements habituellement utilisés, et nécessiterait de ce fait une prise en charge et un suivi plus étroit.
Enfin, les taux de progression des indices MD et VFI dans le groupe des HTO traités (46/121 = 38 %) ayant évolué vers un glaucome, respectivement de – 0,28 dB/an et – 0,41 %/an, est à retenir.
Conclusion
Cette étude française sur une large population d’HTO et de GPAO avec une durée de suivi de cinq à douze ans apporte plusieurs enseignements importants pour la prise en charge en pratique quotidienne :
-
elle confirme une valeur négative de l’indice MD comme un indicateur fiable de glaucome, par opposition aux valeurs positives des sujets HTO ;
-
en cas d’HTO, un taux de progression des indices MD de – 0,28 dB/an et/ou VFI de – 0,41 %/an doit être considéré comme à risque de conversion vers un GPAO ;
-
des taux de progression de l’indice MD de l’ordre de – 0,03 dB/an en cas d’HTO et de – 0,12 dB/an en cas de glaucome semblent caractériser les sujets avec une évolution stable dans cette cohorte ;
-
des taux de progression des indices MD de – 0,8 dB/an et/ou du VFI de – 2,5 %/an semblent des indicateurs de glaucome évolutif ;
-
tout patient avec des déficits importants du champ visuel au moment du diagnostic doit être considéré à profil de progression rapide et impose une prise en charge particulièrement vigilante et rigoureuse.
Pour en savoir plus
Aptel F, Giraud JM, Aryal-Charles N, et al. Progression of visual field in patients with primary open-angle glaucoma (1) : Preliminary results. Acta Ophthalmol. 2013 ; 91 : 0. doi : 10.1111.
Giraud J, El Chehab H, Aptel F, et al. Progression of visual field in patients with primary open-angle glaucoma (2) : Level of progression. Acta Ophthalmol. 2013 ; 91 : 0. doi : 10.1111.
[1] Ahrlich KG, De Moraes CG, Teng CC, et al. Visual field progression differences between normal-tension and exfoliative high-tension glaucoma. Invest Ophthalmol Vis Sci. 2010 ; 51 : 1458-63.
[2] Anderson DR, Drance SM, Schulzer M. Collaborative Normal-Tension Glaucoma Study Group. Natural history of normal-tension glaucoma. Ophthalmology. 2001 ; 108 : 247-53.
[3] Bengtsson B, Leske MC, Hyman L, Heijl A. Early Manifest Glaucoma Trial Group. Fluctuation of intraocular pressure and glaucoma progression in the early manifest glaucoma trial. Ophthalmology. 2007 ; 114 : 205-9.
[4] Giraud JM, Fénolland JR, May F, Renard JP. Analysis of a new visual field index, the VFI in ocular hypertension and glaucoma. J Fr Ophtalmol. 2010 ; 33 : 2-9.
[5] Heijl A, Bengtsson B, Hyman L, Leske MC. Early Manifest Glaucoma Trial Group. Natural history of open-angle glaucoma. Ophthalmology. 2009 ; 116 : 2271-6.
[6] Hyman L, Heijl A, Leske MC, et al. Early Manifest Glaucoma Trial Group. Natural history of intraocular pressure in the early manifest glaucoma trial : a 6-year follow-up. Arch Ophthalmol. 2010 ; 128 : 601-7.
[7] Wilson MR, Kosoko O, Cowan CL, et al. Progression of visual field loss in untreated glaucoma patients and glaucoma suspects in St. Lucia, West Indies. Am J Ophthalmol. 2002 ; 134 : 399-405.
[1] Anderson D, Patella V. Automated static perimetry. 2nd Ed. St. Louis, Mosby, 1999.
[2] Anderson RS. The psychophysics of glaucoma : improving the structure/function relationship. Prog Retin Eye Res. 2006 ; 25 : 79-97.
[3] Artes PH, Chauhan BC, Keltner JL, et al. Longitudinal and cross-sectional analyses of visual field progression in participants of the Ocular Hypertension Treatment Study. Arch Ophthalmol. 2010 ; 128 : 1528-32.
[4] Artes PH, O’Leary N, Hutchison DM, et al. Properties of the statpac visual field index. Invest Ophthalmol Vis Sci. 2011 ; 52 : 4030-8.
[5] Asman P, Wild JM, Heijl A. Appearance of the pattern deviation map as a function of change in area of localized field loss. Invest Ophthalmol Vis Sci. 2004 ; 45 : 3099-106.
[6] Bengtsson B, Heijl A. False-negative responses in glaucoma perimetry : indicators of patient performance or test reliability ? Am J Ophthalmol. 2000 ; 130 : 689.
[7] Boden C, Blumenthal EZ, Pascual J, et al. Patterns of glaucomatous visual field progression identified by three progression criteria. Am J Ophthalmol. 2004 ; 138 : 1029-36.
[8] Boden C, Sample P, Boehm AG, et al. The structure-function relationship in eyes with glaucomatous visual field loss that crosses the horizontal meridian. Arch Ophthalmol. 2002 ; 120 : 907-12.
[9] Caprioli J, Garway-Heath DF. A critical reevaluation of current glaucoma management : International Glaucoma Think Tank, July 27-29, 2006, Taormina, Sicily. Ophthalmology. 2007 ; 114 (Suppl.) : S1-41.
[10] Casas-Llera P, Rebolleda G, Muñoz-Negrete FJ, et al. Visual field index rate and event-based glaucoma progression analysis : comparison in a glaucoma population. Br J Ophthalmol. 2009 ; 93 : 1576-9.
[11] Chauhan BC, Garway-Heath DF, Goñi FJ, et al. Practical recommendations for measuring rates of visual field change in glaucoma. Br J Ophthalmol. 2008 ; 92 : 569-73.
[12] Crabb DP, Garway-Heath DF. Intervals between visual field tests when monitoring the glaucomatous patient : wait-and-see approach. Invest Ophthalmol Vis Sci. 2012 ; 53 : 2770-6.
[13] Flaxel C, Samples J, Dustin L. Relationship between foveal threshold and visual acuity using the Humphrey visual field analyzer. Am. J. Ophthalmol. 2007 ; 143 : 875-7.
[14] Gardiner SK, Crabb DP. Frequency of testing for detecting visual field progression. Br J Ophthalmol. 2002 ; 86 : 560-4.
[15] Hawkins A, Szlyk J, Ardickas Z, et al. Comparison of contrast sensitivity, visual acuity, and Humphrey visual field testing in patients with glaucoma. J Glaucoma. 2003 ; 12 : 134-8.
[16] Heijl A, Bengtsson B, Hyman L, Leske MC. Natural history of open-angle glaucoma. Ophthalmology. 2009 ; 116 : 2271-6.
[17] Heijl A, Leske MC, Bengtsson B, et al. Measuring visual field progression in the Early Manifest Glaucoma Trial. Acta Ophthalmol Scand. 2003 ; 81 : 286-93.
[18] Heijl A, Lindgren A, Lindgren G. Test-retest variability in glaucomatous visual fields. Am J Ophthalmol. 1989 ; 108 : 130-5.
[19] Heijl A. The times they are a-changin’ : time to change glaucoma management. Acta Ophthalmol. 2013 ; 91 : 92-9.
[20] Hood D, Raza A. Glaucomatous damage of the macula. Prog Retin Eye Res. 2012 ; 32 : 1-21.
[21] Hutchings N, Wild JM, Hussey MK, et al. The long-term fluctuation of the visual field in stable glaucoma. Invest Ophthalmol Vis Sci. 2000 ; 41 : 3429-36.
[22] Jansonius NM. Progression detection in glaucoma can be made more efficient by using a variable interval between successive visual field tests. Graefes Arch Clin Exp Ophthalmol. 2007 ; 245 : 1647-51.
[23] Jansonius NM. Towards an optimal perimetric strategy for progression detection in glaucoma : from fixed-space to adaptive intertest intervals. Graefes Arch Clin Exp Ophthalmol. 2006 ; 244 : 390-3.
[24] Kovalska M, Bürki E. Clinical evaluation of a novel population-based regression analysis for detecting glaucomatous visual field progression. Klin Monbl Augenheilkd. 2011 ; 228 : 311-7.
[25] Lahav K, Levkovitch-Verbin H, Belkin M, et al. Reduced mesopic and photopic foveal contrast sensitivity in glaucoma. Arch Ophthalmol. 2011 ; 129 : 16-22.
[26] Lee AC, Sample P, Blumenthal EZ, et al. Infrequent confirmation of visual field progression. Ophthalmology. 2002 ; 109 : 1059-65.
[27] Lesmes L, Lu Z, Baek J, Albright T. Bayesian adaptive estimation of the contrast sensitivity function : The quick CSF method. J Vis. 2010 ; 10 : 1-21.
[28] Manassakorn A, Nouri-Mahdavi K, Koucheki B, et al. Pointwise linear regression analysis for detection of visual field progression with absolute versus corrected threshold sensitivities. Invest Ophthalmol Vis Sci. 2006 ; 47 : 2896-903.
[29] Much JW, Liu C, Piltz-Seymour JR. Long-term survival of central visual field in end-stage glaucoma. Ophthalmology. 2008 ; 115 : 1162-6.
[30] Nouri-Mahdavi K, Nassiri N, Giangiacomo A, Caprioli J. Detection of visual field progression in glaucoma with standard achromatic perimetry : a review and practical implications. Graefes Arch Clin Exp Ophthalmol. 2011 ; 249 : 1593-616.
[31] Richman J, Lorenzana LL, Lankaranian D, et al. Importance of visual acuity and contrast sensitivity in patients with glaucoma. Arch Ophthalmol. 2010 ; 128 : 1576-82.
[32] Stein JD, Talwar N, Laverne AM, et al. Trends in use of ancillary glaucoma tests for patients with open-angle glaucoma from 2001 to 2009. Ophthalmology. 2012 ; 119 : 748-58.
[33] Wall M, Kutzko KE, Chauhan BC. Variability in patients with glaucomatous visual field damage is reduced using size V stimuli. Invest Ophthalmol Vis Sci. 1997 ; 38 : 426-35.

