Le concept de surface oculaire
B. Kantelip, E. Frouin
La conjonctive est divisée en trois régions : conjonctive palpébrale, fornix (culs-de-sac conjonctivaux) et conjonctive bulbaire.
L’épithélium conjonctival comprend des cellules mucipares, responsables de la sécrétion du mucus, composant du film lacrymal. Elles expriment le MUC5AC, le MUC19.
Le chorion conjonctival comprend des glandes annexes participant à la sécrétion du film lacrymal : glandes séreuses (glandes de Krause et de Wolfring) et glandes muqueuses (glandes ou cryptes de Henle).
La vascularisation est assurée par l’artère palpébrale et l’artère ciliaire antérieure, tandis que l’innervation dépend de la branche ophtalmique de Willis du trijumeau (nerfs lacrymal, nasal, frontal, ciliaires antérieurs et sous-orbitaire).
Le tissu lymphoïde associé à la conjonctive (conjunctiva-associated lymphoid tissue ou CALT) est constitué de lymphocytes dispersés dans l’épithélium et le chorion, et est responsable de la reconnaissance antigénique et allergénique.
La cornée comprend cinq couches qui sont de dehors en dedans : l’épithélium pavimenteux, la couche de Bowman qui correspond à une condensation du stroma antérieur, le stroma cornéen, la membrane de Descemet et les cellules endothéliales. La membrane de Descemet correspond à la membrane basale des cellules endothéliales. La cornée reçoit une riche innervation sensitive (plexus cornéen) à partir des nerfs ciliaires antérieurs de la branche ophtalmique du trijumeau.
La conjonctive est une membrane muqueuse richement vascularisée qui couvre la surface antérieure du globe oculaire et la face postérieure des paupières supérieures et inférieures. Elle est responsable de la sécrétion du mucus, qui est essentiel pour la stabilité du film lacrymal et la transparence cornéenne. Elle contient des cellules immunocompétentes capables d’initier et de participer à la réaction inflammatoire.
La conjonctive est divisée en trois régions [1].
En continuité avec le revêtement cutané, elle comprend trois parties :
la conjonctive marginale qui débute en arrière de la ligne des orifices de la glande de Meibomius et se termine au sillon tarsal. Elle constitue la zone de transition entre l’épiderme (épithélium pavimenteux kératinisé) et l’épithélium conjonctival qui n’est pas kératinisé ;
la conjonctive tarsale qui lui succède et est adhérente au tarse ;
la conjonctive orbitaire qui s’étend du tarse au cul-de-sac conjonctival.
Ils représentent la zone de transition entre les conjonctives palpébrale et bulbaire. On distingue quatre culs-de-sac :
le cul-de-sac supérieur, le plus profond, qui est situé au niveau de la marge orbitaire et à une distance de 8 à 10 mm du limbe ;
le cul-de-sac inférieur qui est distant de 8 mm du limbe ;
le cul-de-sac externe qui est situé à 14 mm du limbe ;
le cul-de-sac interne qui occupé par la caroncule et le repli semi-lunaire (rudiment d’une troisième paupière).
Il s’agit d’une membrane fine et transparente. On en distingue deux parties :
la partie sclérale qui s’étend du cul-de-sac conjonctival au limbe. Elle est facilement clivable car séparée de la capsule de Tenon par le tissu conjonctif sous-conjonctival. À environ 3 mm du limbe, la conjonctive, la sclérotique et la capsule de Tenon sont fermement attachées et, à cet endroit, la conjonctive devient plus difficilement mobilisable ;
la partie limbique qui réalise un anneau de 3 mm de large à la jonction entre les épithéliums conjonctival et cornéen.
La cornée comprend cinq couches qui sont de dehors en dedans : l’épithélium pavimenteux au contact du film lacrymal reposant sur une membrane basale ; la couche de Bowman qui correspond à une condensation du stroma antérieur ; le stroma cornéen ; la membrane de Descemet ; les cellules endothéliales. La membrane de Descemet correspond à la membrane basale des cellules endothéliales.
La conjonctive est une muqueuse formée d’un épithélium pluristratifié non kératinisé contenant des cellules à mucus (ou goblet cells). Il est constitué de deux à huit–dix couches cellulaires selon la localisation reposant sur un tissu conjonctif lâche (stroma), ces deux structures étant séparées par une membrane basale. Le nombre de cellules à mucus varie selon la localisation, comme l’épaisseur de l’épithélium pluristratifié. Ainsi on distingue quatre aspects morphologiques différents développés ci-dessous.
Il s’agit d’une zone de transition entre un épithélium pavimenteux pluristratifié et kératinisé qu’est l’épiderme et un épithélium pavimenteux pluristratifié non kératinisé qu’est l’épithélium conjonctival.
Dans ces deux localisations, l’épithélium se modifie peu à peu pour ressembler à l’épithélium particulier du fornix et les cellules superficielles deviennent progressivement cylindriques. Les cellules à mucus, absentes au limbe et dans l’épithélium de transition, augmentent graduellement en nombre et culminent au fornix, dans la caroncule et le repli semi-lunaire. Elles ont un aspect caliciforme, à pôle sécrétoire ouvert vers la surface, et sont colorées en rose-rouge par la coloration par l’acide périodique de Schiff (periodic acid Schiff ou PAS).
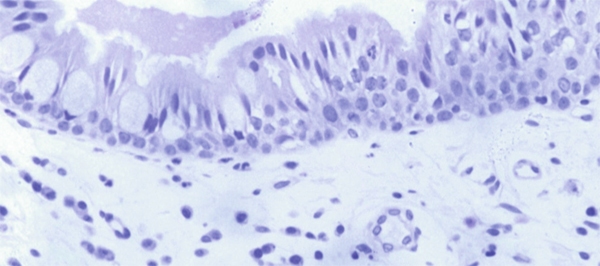
Fig. 1-1 Conjonctive tarsale (hématoxyline–éosine–safran ou HES × 40).
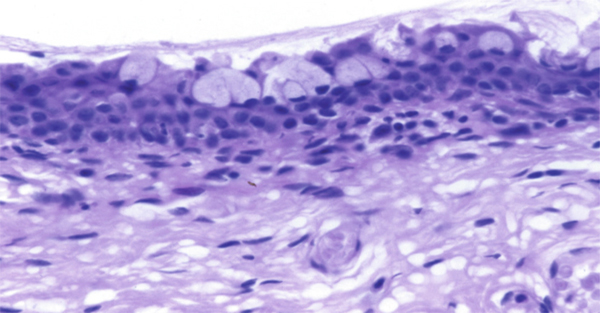
Fig. 1-2 Conjonctive bulbaire (HES × 25).
Il s’agit d’un épithélium pluristratifié cylindrique (fig. 1-3). À cet endroit, les cellules à mucus sont les plus nombreuses.
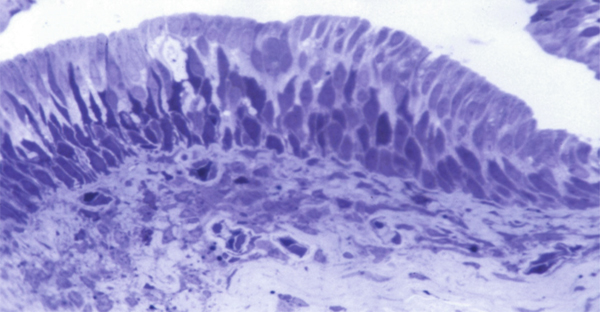
Fig. 1-3 Conjonctive au fornix (bleu de toluidine × 40).
Il constitue une zone de transition entre l’épithélium conjonctival et l’épithélium cornéen. Il est revêtu par un épithélium pluristratifié pavimenteux, qui s’épaissit progressivement, avec une disparition des cellules à mucus.
Elles sont cubiques, réparties sur une seule couche et sont séparées du chorion par la membrane basale. Elles correspondent à des cellules indifférenciées et ont un potentiel d’autorenouvellement. On peut donc observer des mitoses dans cette couche cellulaire.
À l’examen ultrastructural, leur cytoplasme contient des faisceaux de tonofilaments entrecroisés correspondant à des filaments de kératine (voir ci-après). Les organites cellulaires, notamment les mitochondries et le réticulum endoplasmique rugueux, sont essentiellement situés dans l’espace périnucléaire qui est dépourvu de tonofilaments.
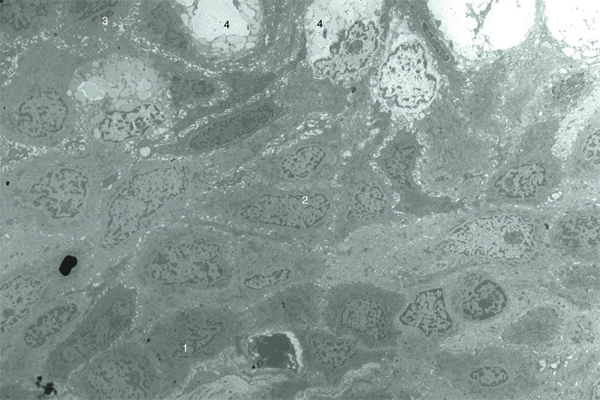
Fig. 1-4 Aspect de l’épithélium conjonctival en ultrastructure (microscopie électronique × 8000).
L’épithélium comprend : des cellules basales cubiques, reparties sur une couche au contact de la membrane basale (1) ; des cellules intermédiaires qui sont pavimenteuses et dont le nombre de couches varie selon la localisation (2) ; des cellules superficielles qui sont pavimenteuses ou cylindriques (3). Il est à noter la présence de cellules à mucus (4).
Cette couche de cellules n’apparaît que dans les zones où l’épithélium conjonctival est le plus épais, surtout au limbe et au fornix. Leur cytoplasme contient des filaments intermédiaires qui mesurent 10 mm et sont groupés en faisceaux plus fins que ceux des cellules basales. Comme dans les cellules basales, les organites sont présents dans l’espace clair périnucléaire et sous la membrane cytoplasmique. Ces organites sont représentés par des mitochondries, du réticulum endoplasmique rugueux, de nombreux polyribosomes et, exceptionnellement, un appareil de Golgi bien développé.
Elles correspondent à toutes les cellules dont le pôle apical est au contact du film lacrymal. Les cellules épithéliales superficielles sont de forme variable : aplaties (pavimenteuses) au limbe, cubiques au tarse, cylindriques au fornix.
Elles sont classées en cinq catégories selon le type de sécrétion ou le type d’organite prépondérant dans la cellule. Leur répartition est variable selon les différentes régions anatomiques de la conjonctive.
Elles sont dispersées entre les autres cellules ou regroupées en amas ou microglandes intra-épithéliales dans le fornix supérieur. Elles sont responsables de la sécrétion de mucines (essentiellement des sialomucines) et sont colorables par le bleu alcian. Les cellules à mucus sont innervées et leur sécrétion serait induite par une stimulation nerveuse. Elles apparaissent comme des cellules au cytoplasme clair du fait de leur abondante sécrétion, refoulant le noyau au pôle basal.
En microscopie électronique (fig. 1-5), les grains de mucus stockés dans le cytoplasme sont denses aux électrons et sont cernés par une membrane. L’appareil de Golgi est bien développé et situé en position supranucléaire. Lorsque la cellule est en fin de phase de synthèse, le mucus occupe la plus grande partie de la cellule, les organites et le noyau étant refoulés au pôle basal de la cellule. La sécrétion des grains de mucus se fait selon un mode apocrine : une expansion cytoplasmique contenant les produits de sécrétion se détache en bloc de la cellule.
En immuno-histochimie, les cellules à mucus sécrètent particulièrement le MUC5AC, constituant majeur du film lacrymal. Plus récemment, le MUC19 a été noté comme étant fortement exprimé dans ces cellules [4]. De même, il a été trouvé une expression de TFF1 (ou pS2) et TFF3 (ou hP1.B/hITF) dans les cellules à mucus, toujours en association avec MUC5AC [5]. Ces peptides (P-domain peptides, trefoils factors) formeraient un dimère avec leur mucine spécifique augmentant leur viscosité. Dans ces cellules, on trouve des filaments intermédiaires correspondant principalement à la cytokératine 7 (CK7) [6]. Les CK8, 18, 19 ont été observées dans ces cellules mais de manière inconstante selon les auteurs (voir ci-après pour la classification des cytokératines) [7].
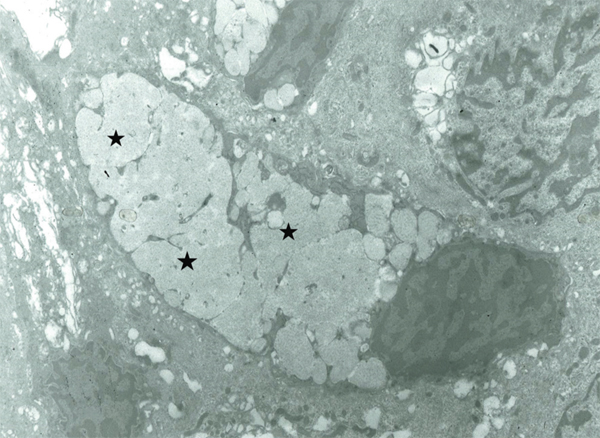
Fig. 1-5 Cellules à mucus en ultrastructure (microscopie électronique × 5000).
Les grains de mucus (*) sont stockés dans le cytoplasme, refoulant le noyau au pôle basal de la cellule.
Ces cellules sont distinguées des précédentes uniquement en microscopie électronique et participeraient à la sécrétion du mucus. Elles constitueraient pour Steuhl et Knorr le second mucus system, c’est-à-dire des cellules non à mucus (non goblet) mais possédant des propriétés sécrétoires mises en évidence en microscopie électronique et par histo-enzymologie [3]. En effet, la coloration du contenu des vésicules par le fer colloïdal (technique de Hale) suggère la présence de mucines. De plus, il a été démontré que les mucoprotéines synthétisées correspondaient à des sialomucines et à des sulfomucines neutres [8], et que les vésicules des cellules de type II contenaient de l’acide sialique et du N-acétyl-galactosamine [9].
Dans ces cellules, les organites cytoplasmiques sont représentés par du réticulum endoplasmique rugueux et un appareil de Golgi. Leur produit de sécrétion se présente sous forme soit de vésicules soit de granules.
Les vésicules formées à partir de l’appareil de Golgi mesurent 100 à 500 nm. Leur contenu est osmiophile (fixant l’acide osmique) et inhomogène. Dans ces cellules, le mécanisme de sécrétion est de type mérocrine (par exocytose des vésicules après fusion à la membrane cytoplasmique apicale) sauf dans le fornix où elle est de type apocrine.
Les granules denses aux électrons mesurent de 30 à 100 nm de diamètre. Ils sont entourés par une double membrane et sont situés sous la membrane cytoplasmique apicale avec laquelle ils sont fréquemment en contact.
Les cellules de type II peuvent être divisées en trois sous-groupes :
des cellules contenant des vésicules osmiophiles inhomogènes, les plus fréquentes et présentes dans toute la conjonctive ;
des cellules contenant des granules osmiophiles homogènes, moins fréquentes mais présentes dans toute la conjonctive ;
des cellules prismatiques avec sécrétion de type apocrine, présentes au fornix.
Elles contiennent un appareil de Golgi important. Elles sont impliquées dans la synthèse du mucus et font partie, comme les cellules de type II, du second mucus system.
Les cellules contiennent un appareil de Golgi mais surtout un réticulum endoplasmique rugueux proéminent formé de citernes de taille variable, situées à proximité du noyau. Le réticulum endoplasmique rugueux est impliqué dans la synthèse des protéines associées au mucus et, surtout, des anticorps, des enzymes et des cytokines présents dans le film lacrymal [10].
Ces cellules contiennent de 40 à 50 mitochondries (par plan de coupe) qui sont localisées préférentiellement au pôle apical de la cellule. Elles sont donc impliquées dans les processus nécessitant de l’énergie : synthèse des protéines, mouvements cellulaires et transport actif des médicaments appliqués localement par exemple [10].
Outre les cellules épithéliales, l’épithélium conjonctival contient des mélanocytes, dont la morphologie est identique aux mélanocytes cutanés. Ils sont situés au sein des cellules basales de l’épithélium. De plus, des lymphocytes sont dispersés dans les couches basales épithéliales et participent aux conjunctiva-associated lymphoid tissues (CALT) (voir ci-après). Enfin, des cellules de Langerhans, cellules immunocompétentes particulièrement impliquées dans les pathologies allergiques de type retardé, sont dispersées dans les couches suprabasales, particulièrement au limbe [11, 12]. Ces éléments expriment le CD1a, la PS100 et la langérine, anticorps utilisés pour les mettre en évidence en pathologie de routine.
En contact avec le film lacrymal, l’épithélium cornéen de surface est de type pavimenteux stratifié. Il comporte de cinq à sept couches de cellules, mesure 50 μm d’épaisseur et représente 10 % de l’épaisseur totale cornéenne (fig. 1-6 et 1-7).
L’endothélium cornéen, sur la face opposée de la cornée, correspond à un épithélium unistratifié composé de cellules polygonales.
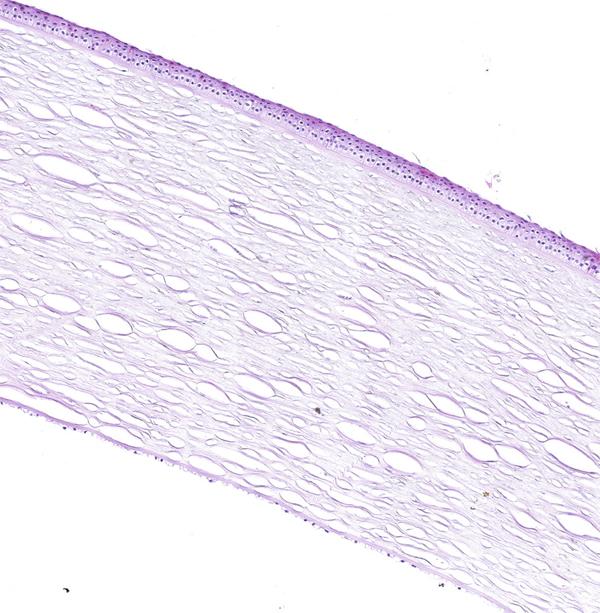
Fig. 1-6 Histologie de la cornée (hématoxyline–éosine [HE] × 5).
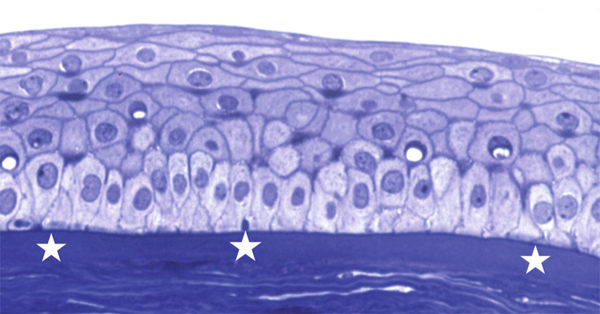
Fig. 1-7 Épithélium cornéen pavimenteux reposant par l’intermédiaire d’une membrane basale fine sur la couche de Bowman (*) (bleu de toluidine × 40).
Elles s’organisent en une seule couche et reposent sur une membrane basale fine qui sépare l’épithélium de la membrane de Bowman et du stroma.
Elles sont cylindriques et mesurent 18 μm de haut pour 10 μm de large. Leur noyau est ovalaire, leur grand axe est perpendiculaire à la membrane basale. En microscopie électronique, leur cytoplasme est riche en glycogène et contient peu d’organites. Il renferme de nombreux filaments de kératine.
Elles sont disposées sur deux ou trois assises à la partie centrale de la cornée, et sur quatre à cinq à sa périphérie. Elles représentent un état de transition entre les cellules basales et les cellules superficielles. Elles sont de forme polygonale, avec une face antérieure convexe et une face postérieure concave. Leur noyau est allongé dans le grand axe de la cellule.
En microscopie électronique, le cytoplasme dense aux électrons contient les organites habituels, mais l’appareil de Golgi est plus important que dans les cellules basales. Dans le cytoplasme des cellules intermédiaires constituant l’assise médiane, des vésicules apparaissent au voisinage de l’appareil de Golgi. Le cytoplasme contient des microtubules et de très nombreux filaments de kératine.
Elles représentent les cellules les plus différenciées de l’épithélium cornéen. Les cellules superficielles sont allongées et aplaties. Elles mesurent 45 μm de longueur et en moyenne 4 μm d’épaisseur. Elles se répartissent en deux ou trois couches. Les cellules les plus profondes ont un noyau allongé dans le grand axe de la cellule. La couche des cellules les plus superficielles correspond aux cellules les plus matures qui vont desquamer. Leur noyau a disparu ou persiste sous forme de mottes chromatiniennes condensées.
En microscopie électronique, le cytoplasme des cellules superficielles contient des filaments, de nombreux granules de glycogène et un appareil de Golgi bien développé associé à de nombreuses vésicules. La membrane cytoplasmique apicale des cellules les plus superficielles est hérissée de microvillosités et de microplis sous-tendus par des filaments d’actine. Le rôle des microvillosités et des microplis n’est pas totalement identifié. Ils entraînent une augmentation de la surface membranaire favorisant ainsi les échanges avec le film lacrymal. De plus, ils pourraient servir de points d’ancrage au film lacrymal.
L’endothélium constitue une couche unique de cellules polygonales qui repose sur la membrane de Descemet. Leur noyau est central. En microscopie électronique, les organites cellulaires sont nombreux et représentés par des microfilaments, des vésicules de pinocytose, des mitochondries, du réticulum lisse et rugueux, de nombreux ribosomes et un important appareil de Golgi (fig. 1-8). Ces organites sont caractéristiques de cellules avec un transport actif vésiculaire intracytoplasmique et d’une importante synthèse de protéines. Ce transport vésiculaire a un rôle notable dans la transparence cornéenne en régulant les mouvements d’eau dans la cornée et en assurant une déturgescence de la cornée.
La membrane de Descemet est une membrane basale synthétisée par les cellules endothéliales dont l’épaisseur augmente avec l’âge. Elle comprend lors de l’examen ultrastructural deux zones : une zone striée postérieure (aussi appelée zone striée) qui apparaît durant la vie fœtale et une zone antérieure non striée qui apparaît durant la vie adulte.
En 2013, Dua et al. [13, 14] ont décrit, à partir de constatations de kératoplasties lamellaires antérieures profondes réalisées ex vivo sur des yeux humains d’une banque de cornée, une couche prédescemétique qu’ils ont dénommée pre-Descemet layer (PDL) ou Dua’s layer (DL). Cette couche serait située entre la face antérieure de la membrane de Descemet et le premier kératocyte du stroma postérieur. Elle serait formée de cinq à huit fines lamelles de faisceaux de collagène orientées en directions longitudinale, transverse et oblique. Elle serait dépourvue de kératocytes (absence de marquage par le CD34). La composition en collagènes serait légèrement différente du stroma cornéen, avec une augmentation des collagènes IV et VI, tandis que la composition en collagènes I (importante) et V (faible) serait similaire. La composition en protéoglycanes (lumicane, mimecane, décorine notamment) serait identique au stroma cornéen.
Cette description soulève toutefois des controverses [15, 16], la PDL pouvant plutôt correspondre à une variation anatomique de la partie postérieure du stroma cornéen. Ces données nécessitent d’être confirmées par d’autres équipes.
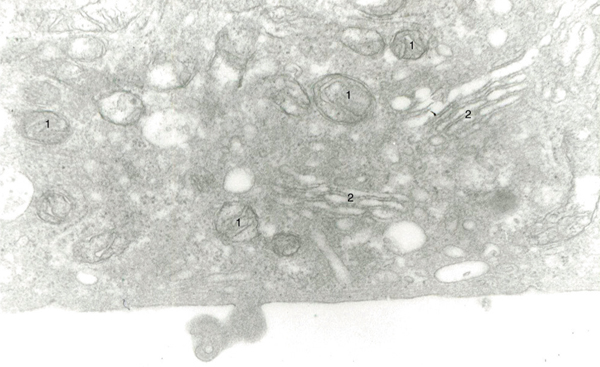
Fig. 1-8 Le cytoplasme des cellules endothéliales est riche en organites, notamment mitochondries (1) et appareil de Golgi (2) (microscopie électronique × 20 000).
Deux mécanismes principaux assurent l’adhérence des cellules entre elles et de l’épithélium au stroma. Le premier, « mécanique », est constitué de structures reconnaissables lors de l’examen morphologique de la membrane cellulaire et de la membrane basale épithéliale (desmosomes notamment). Le second se fait par interaction moléculaire d’un récepteur avec un ligand situé soit dans la membrane cellulaire, soit dans la matrice extracellulaire.
Les cellules épithéliales sont unies entre elles par des complexes jonctionnels développés sur leur membrane cytoplasmique et par des interdigitations membranaires. Trois catégories fonctionnelles sont individualisées :
des jonctions adhérentes (ou desmosomes) ponctuels ou ceinturants assurent la cohésion mécanique des cellules entre elles et servent de points d’ancrage au cytosquelette représenté par les filaments de kératine ou tonofilaments. Les desmosomes sont exceptionnels, voire absents entre les membranes plasmiques latérales des cellules endothéliales ;
des jonctions imperméables, tight junctions, assurent la cohésion cellulaire et représentent un système étanche empêchant le passage des molécules. Elles sont situées à la partie supérieure des faces latérales de la membrane cytoplasmique des cellules superficielles. Elles sont caractérisées par l’apposition étroite des membranes cytoplasmiques et la disparition de l’espace intercellulaire ;
des jonctions communicantes, gap junctions, permettent le passage des petites molécules d’une cellule à l’autre.
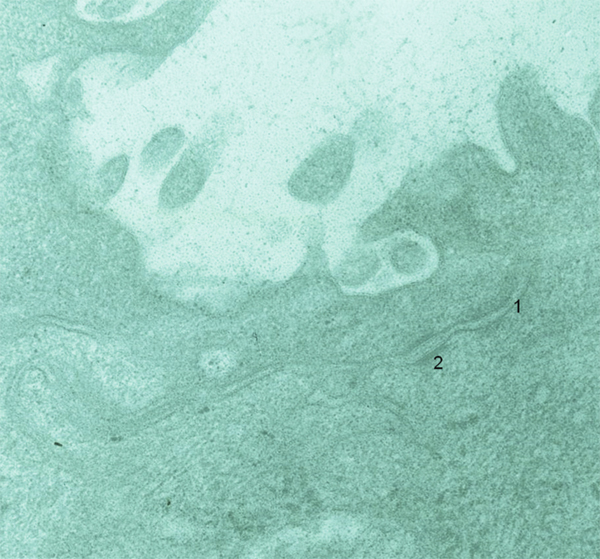
Fig. 1-9 Les membranes cellulaires des cellules superficielles sont accolées, formant des jonctions serrées (tight jonctions [1]) et des desmosomes (2) (cornée, microscopie électronique × 80 000).
La membrane basale, rectiligne sauf au niveau du limbe où elle décrit de nombreux plis, est synthétisée par les cellules basales.
À l’étude ultrastructurale, elle est constituée de deux couches :
la lamina lucida située sur la face cellulaire de la membrane basale, claire aux électrons, mesure 24 μm d’épaisseur ;
la lamina densa, profonde, dense aux électrons, est plus épaisse et mesure 47 μm d’épaisseur.
La membrane basale est composée de protéoglycanes qui sont des cibles potentielles dans les pathologies immunitaires [17]. Sa composition biochimique en laminine, fibronectine et collagènes varie en fonction de sa situation dans la conjonctive, le limbe et la cornée alors même que ces structures sont en continuité [18]. La membrane basale conjonctivale contient du collagène IV et les chaînes α2, β2, β2 de la laminine, tandis qu’au limbe elle possède en plus la chaîne α2 de la laminine.
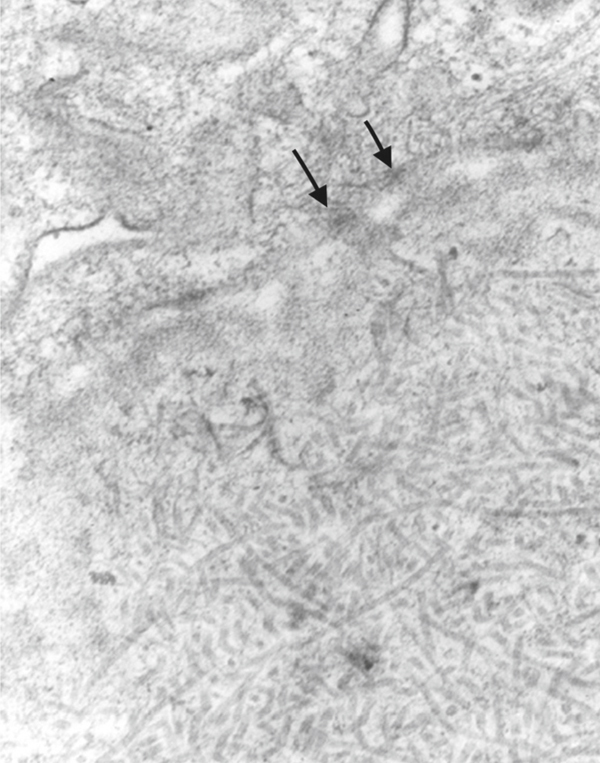
Fig. 1-10 La membrane basale sépare l’épithélium du chorion.
Les cellules basales adhèrent à la membrane basale grâce à des hémidesmosomes (→) en regard desquels se forme dans le chorion le complexe d’adhérence (conjonctive, microscopie électronique × 60 000).
Celui-ci comprend :
les filaments de kératine intracytoplasmique qui s’insèrent sur les hémidesmosomes ;
la plaque hémidesmosomale (zone située dans le cytoplasme au contact de la membrane) : à ce niveau sont situés les antigènes de la pemphigoïde bulleuse (BPAg1 ou BP230 et BPAg2 ou BP180), la plectine et l’intégrine α6/β [19] ;
les filaments d’ancrage qui traversent la membrane basale et relient les hémidesmosomes aux fibres d’ancrage. Ils forment la lamina lucida et on observe à ce niveau la laminine 5 ainsi que l’expression de BPAg2. La laminine 5 est impliquée dans la pemphigoïde cicatricielle oculaire ;
les plaques d’ancrage formant la lamina densa sur lesquelles s’insèrent en profondeur les fibres d’ancrage. Elles sont formées par les collagènes IV et VI, la laminine 6. Les anticorps de la pemphigoïde cicatricielle se fixent aussi à ce niveau ;
les fibres d’ancrage qui s’insèrent sur le versant externe de la membrane basale et qui sont formées de collagène de type VII.
Pour la cornée, ce complexe d’adhérence est observé au sein des fibres de collagène de la couche de Bowman.
Ce sont des glycoprotéines transmembranaires qui jouent un rôle au cours de la vie embryonnaire, mais aussi à l’âge adulte pour maintenir l’intégrité des épithéliums, lors de la cicatrisation, des pathologies immunologiques ou du développement des cancers. Ces molécules assurent la reconnaissance spécifique entre deux cellules, la formation de contacts stables entre deux cellules ou avec la matrice extracellulaire et la transmission de signaux. On les classe en quatre familles : les intégrines, les cadhérines, les sélectines et les immunoglobulines.
Parmi toutes les études réalisées, surtout en immuno-histochimie, il a été montré une expression différente des molécules d’adhésion en conditions normales ou pathologiques. Ainsi, il a été montré une expression de VLA-2 (very late antigens 2), VLA-3, LFA-3 (lymphocyte function antigens 3) et de la sous-unité α de VLA-6 dans l’épithélium conjonctival ainsi qu’un renforcement de cette dernière sur la membrane basale des cellules basales conjonctivales [20]. De plus, dans des conditions pathologiques (inflammation et pathologies dégénératives), la composition de ces molécules est modifiée : ainsi, une augmentation de l’expression de la sous-unité α2 de VLA-2 et l’apparition de ICAM-1 (intercellular adhesion molecule 1) ont été observées dans les cellules basales conjonctivales [21]. D’autres auteurs ont observé une expression d’ICAM-1 et de l’E-cadhérine dans les dystrophies cornéennes, molécules absentes dans la cornée normale [22]. ICAM-1 aurait aussi un rôle important dans la cicatrisation cornéenne [23].
Toutes les cellules épithéliales contiennent dans leur cytoplasme des filaments intermédiaires qui correspondent à des cytokératines (CK). Les CK sont divisées en deux familles : les CK acides (type I) numérotées de 9 à 20 dont les gènes sont situés sur le chromosome 17, sauf pour la CK18 dont le gène est situé sur le chromosome 12, et les CK basiques (type II) numérotées de 1 à 8 dont les gènes sont situés sur le chromosome 12.
La CK3 forme un dimère avec la CK12 et est considérée comme spécifique de l’épithélium cornéen. Des mutations de la CK3 ou CK12 sont responsables de la dystrophie de Meesmann.
La CK19 a été considérée comme spécifique de l’épithélium conjonctival, mais est aussi exprimée par des cellules superficielles cornéennes centrales et elle prédomine à la périphérie de la cornée [24]. De plus, elle est exprimée dans toute la conjonctive et le limbe, à l’exception de la jonction cutanéomuqueuse, et dans l’épiderme [25].
La CK13 n’est exprimée que dans la conjonctive, et son expression serait exclusive de la CK12 [24]. En pratique, la CK13 est exprimée dans les cellules suprabasales du limbe et dans toute l’épaisseur de la conjonctive.
La CK14 est une cytokératine le plus souvent basale des épithéliums stratifiés et est associée sous forme de dimère à la CK5. Elle marque les cellules mitotiquement actives. Ainsi, elle a été observée dans les couches basales de la cornée, de la conjonctive et du limbe [26]. De plus, elle a été trouvée fortement exprimée dans les cellules du canal excréteur de la glande de Meibomius et avec un gradient décroissant de la margelle palpébrale vers le fornix [25]. Ces derniers résultats suggéreraient que les cellules souches conjonctivales seraient situées dans les zones de forte expression de la CK14.
La CK15 a été aussi considérée comme un marqueur des cellules souches limbiques. Elle est exprimée dans les couches basales conjonctivales et limbiques et, dans une moindre mesure, dans les couches suprabasales limbiques [26].
L’endothélium cornéen exprime les CK8/18 et la CK7, qui sont habituellement des marqueurs des épithéliums sécrétoires [27, 28].
Enfin, une étude de 2011, menée par Merjava et al., a analysé l’expression des autres cytokératines dans tous les segments de la cornée, du limbe et de la conjonctive [29] ; nous ne la détaillerons pas ici.
Le chorion conjonctival est un tissu conjonctif qui est subdivisé en un chorion superficiel, ou lamina propria, riche en lymphocytes et un chorion profond. Le tissu conjonctif est formé de fibroblastes responsables de la synthèse de la matrice extracellulaire (fibres élastiques, collagène et substance fondamentale). Le chorion constitue la trame de soutien et contient les vaisseaux sanguins, les lymphatiques et les nerfs.
Les fibroblastes sont des cellules fusiformes possédant un noyau allongé dans le grand axe de la cellule et un cytoplasme riche en organites, notamment en réticulum endoplasmique rugueux. Ils sont responsables de la sécrétion des fibres (élastiques et collagène) et de la substance fondamentale constituant le tissu conjonctif. Ils contiennent dans leur cytoplasme des filaments de vimentine et d’actine que l’on peut mettre en évidence par immuno-histochimie.
L’élastine est disposée en fibres et en lames discontinues dans le milieu extracellulaire. Elle est synthétisée sous forme de tropoélastine qui se polymérise dans la substance fondamentale. Cette polymérisation nécessite la présence d’une protéine de structure, la fibrilline qui s’incorpore dans et autour des fibres élastiques.
Les collagènes sont des protéines fibrillaires extracellulaires dont la principale caractéristique est leur structure hélicoïdale à trois brins. Trois chaînes polypeptidiques appelées chaîne α sont enroulées les unes autour des autres pour former une molécule de collagène. L’association des différentes formes de chaîne α va permettre d’identifier les types de collagène. Les collagènes de types I et III sont les plus abondants dans les tissus conjonctifs.
À l’examen ultrastructural, les collagènes de types I, II, III, V se présentent sous forme de fibres striées (avec une périodicité de 64 nm). Les collagènes de types IV et VIII s’organisent en lames et sont présents dans les membranes basales. Le collagène de types VII entre dans la constitution du système d’ancrage de la membrane basale au chorion. Le collagène de type VI est formé de fibrilles striées distribuées dans la matrice interfibrillaire.
Elle est constituée d’eau et d’électrolytes, dans laquelle baigne la matrice extracellulaire, et de longues chaînes polysaccharidiques non ramifiées correspondant aux aminoglycanes.
Elles participent à la sécrétion du film lacrymal. On différencie deux groupes de glandes lacrymales accessoires conjonctivales en fonction de leur type de sécrétion : séreuse ou muqueuse. La couche lipidique superficielle du film lacrymal est sécrétée par les glandes sébacées palpébrales : les glandes de Meibomius, de Zeiss et de Moll.
Elles sont situées dans le tissu conjonctival profond du fornix. On en dénombre quarante dans le fornix supérieur et six à huit dans le fornix inférieur. Leur aspect histologique est identique à celui des glandes lacrymales orbitaires.
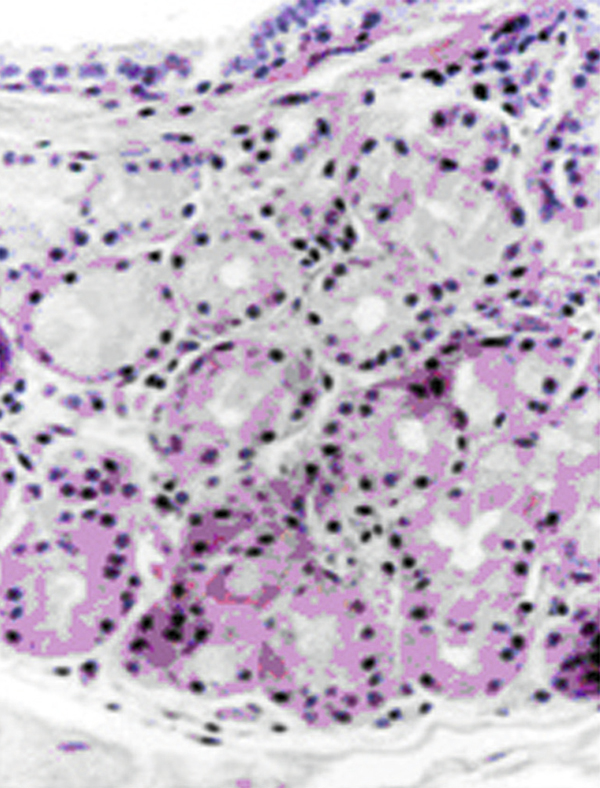
Fig. 1-11 Glande séreuse de Krause (HES × 25).
Deux à cinq glandes sont situées dans la paupière supérieure, le long du bord supérieur du tarse, tandis que seulement deux glandes sont présentes le long du bord inférieur du tarse inférieur. Le canal excréteur est bordé par des cellules basales cubiques identiques à celles de l’épithélium conjonctival.
Le mucus lacrymal est sécrété par les cellules caliciformes présentes dans l’épithélium conjonctival et par des structures d’architecture glandulaire.
Elles sont situées au bord supérieur du tarse supérieur et en temporal. Elles correspondent à des invaginations épithéliales au sein du chorion et sont constituées de cellules caliciformes.
Elles sont présentes au limbe dans de nombreuses espèces animales, mais sont absentes chez l’homme.
Les lymphocytes associés aux muqueuses (mucosa-associated lymphoid tissue [MALT]) sont notés dans la conjonctive (conjunctiva-associated lymphoid tissue [CALT]), la glande lacrymale et le système de drainage lacrymal et ont conduit certains auteurs à proposer le concept de EALT (eye-associated lymphoid tissue) pour tissu lymphoïde associé à l’œil [31]. Le nombre de lymphocytes dépend de l’âge du patient : ils sont absents à la naissance, augmentent jusqu’à la puberté, puis diminuent jusqu’à la mort. Ils prédominent à la jonction entre les conjonctives tarsale et bulbaire sous forme de follicules mesurant 0,3 mm de diamètre et d’aspect ovoïde. Il s’y associe des lymphocytes dispersés dans la lamina propria de la conjonctive. Leur densité varie selon la localisation et ils prédominent dans les parties tarsales et orbitaires de la conjonctive, tandis qu’ils diminuent dans le fornix et la conjonctive bulbaire. Cette disposition place les structures lymphoïdes dans les zones le plus souvent en contact avec les antigènes oculaires.
Les études immuno-histochimiques ont montré que les éléments lymphoïdes dispersés sont principalement des lymphocytes T CD8+, tandis que les lymphocytes B sont rares et prédominent dans les follicules lymphoïdes où ils sont entourés par une couronne d’éléments T. Il s’y associe de nombreux plasmocytes dispersés qui sécrètent des immunoglobulines A.
Elle provient des artères palpébrales et de l’artère ciliaire antérieure.
Les artères palpébrales forment deux arcades :
l’une ciliaire près du bord libre de la paupière se divise en deux rameaux : l’un descendant pour la conjonctive marginale et l’autre ascendant pour la conjonctive tarsale ;
l’autre, périphérique sous-tarsale, se divise en deux rameaux : l’un descendant destiné aux deux tiers supérieurs de la conjonctive tarsale et formant avec l’arcade ciliaire le plexus rétrotarsal et l’autre ascendant qui vascularise les fornix et la conjonctive bulbaire et constitue les artères conjonctivales postérieures qui vont former le réseau des palissades au niveau du limbe.
Les artères ciliaires antérieures assurent la vascularisation de la conjonctive bulbaire et du limbe. À 2 mm du limbe, elles forment les artères conjonctivales antérieures dont les rameaux les plus antérieurs forment un plexus péricornéen : le réseau des mailles terminales.
Elles sont plus nombreuses que les artères. Comme pour les artères, il existe deux réseaux :
un réseau veineux conjonctival palpébral qui draine le réseau veineux rétrotarsien vers les veines palpébrales puis les veines ophtalmiques supérieure et inférieure ;
un réseau veineux ciliaire qui se draine vers les veines musculaires.
Les capillaires conjonctivaux sont de type continu ou fenêtré. Ils ont une innervation orthosympathique et parasympathique.
Il n’existe pas de réseau lymphatique à l’intérieur de l’œil. En revanche, la conjonctive est très riche en vaisseaux lymphatiques qui se répartissent en un réseau profond formé de vaisseaux de gros calibre et un réseau superficiel sous-épithélial. Les troncs externes se drainent vers les ganglions prétragiens et les ganglions parotidiens, les troncs internes vers les ganglions sous-maxillaires.
Elle est assurée par la branche ophtalmique de Willis du trijumeau avec :
le nerf lacrymal innervant le tiers externe de la conjonctive palpébrale et la moitié externe de la conjonctive bulbaire ;
le nerf nasal innervant le tiers interne de la conjonctive palpébrale et la moitié interne de la conjonctive bulbaire ;
le nerf frontal innervant la partie moyenne de la conjonctive palpébrale supérieure ;
les nerfs ciliaires antérieurs, qui vont former le plexus cornéen, innervant la conjonctive limbique ;
le nerf sous-orbitaire, branche du nerf maxillaire supérieur, innervant le tiers moyen de la paupière inférieure.
L’innervation sympathique est représentée par des fibres amyéliniques dans les parois vasculaires, tandis que l’innervation parasympathique est représentée par des fibres amyéliniques issues du nerf facial et se terminant dans les parois vasculaires, notamment au limbe.
Le stroma cornéen (fig. 1-12) représente la majeure partie de l’épaisseur de la cornée (90 %) et mesure 400 μm.
À la partie antérieure sous l’épithélium, la couche de Bowman correspond à une modification du stroma antérieur. Elle est dépourvue de cellules et est constituée de fibres de collagène dont l’organisation est différente de celle du stroma cornéen.
Le stroma cornéen avasculaire est formé de fibres de collagène essentiellement de type I et V. Les fibres sont organisées en faisceaux, eux-mêmes composés de fibrilles. Les fibrilles de collagène sont parallèles entre elles, ont toutes la même taille et sont séparées par un espace fixe. Ces fibres ont une striation périodique (correspondant au quart de la longueur d’une macromolécule de collagène). Les faisceaux de collagène se croisent à angle droit au centre de la cornée (fig. 1-13). De cet arrangement quasi géométrique dépend la transparence de la cornée, condition nécessaire à une bonne transmission de la lumière. Ainsi, leur diamètre est inférieur à la moitié de la longueur d’onde de la lumière et leur indice de réfraction est identique à celui de la substance fondamentale.
Au sein de cette matrice collagénique, les kératocytes (fibrocytes cornéens) s’étendent parallèlement aux lamelles de collagène. Leurs noyaux apparaissent ovalaires, écrasés par le collagène, mais ils ont en fait de multiples expansions (voir fig. 1-12). Leur cytoplasme contient des filaments de vimentine et d’actine. Ces cellules mésenchymateuses dérivent de la crête neurale et ne représentent que 3 % de la surface de la cornée. Ils assurent la biosynthèse du collagène et de la substance fondamentale. Cette dernière assure la cohésion de la cornée. Elle est composée de mucopolysaccharides acides et, notamment, des kératanes sulfates (60 %), de la chondroïtine sulfate (40 %) et des mucopolysaccharides neutres.
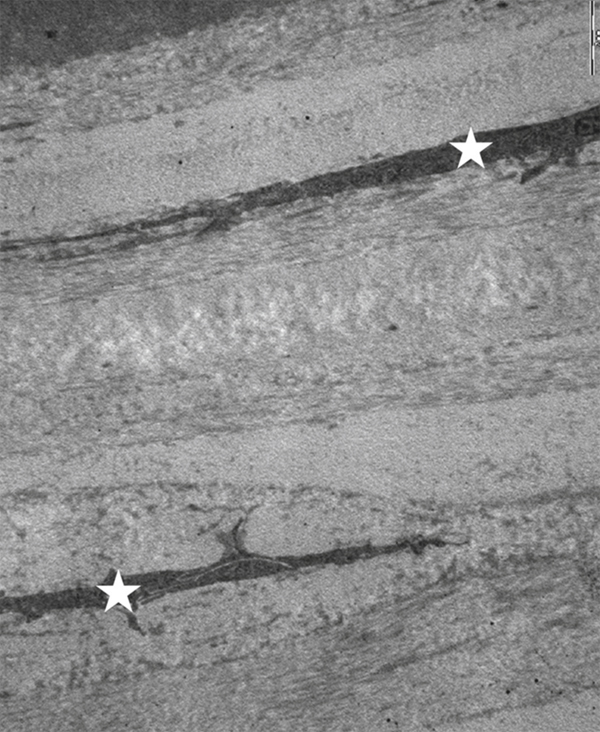
Fig. 1-12 Le stroma cornéen est constitué de fibres de collagène groupées en faisceaux séparés par les kératocytes (*) (microscopie électronique × 30 000).
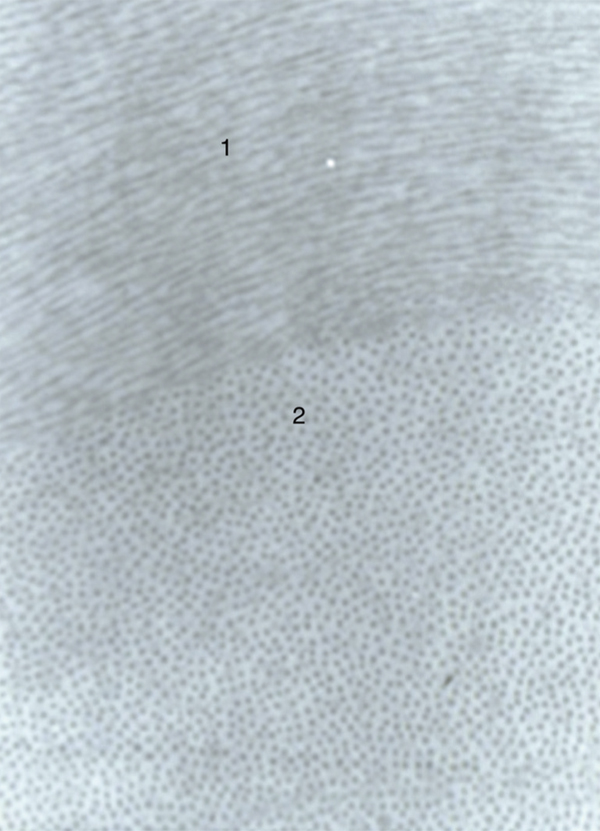
Fig. 1-13 Les faisceaux de collagène se superposent à angle droit dans la partie centrale de la cornée.
Les fibres de collagène sont observées en coupes longitudinales (1) et transversales (2) (microscopie électronique × 70 000).
La cornée elle-même est avasculaire. Elle est irriguée à sa périphérie à partir des vaisseaux conjonctivaux, épiscléraux et scléraux. Ces vaisseaux terminaux se ramifient au limbe. Son apport nutritif provient du limbe mais aussi du film lacrymal et de l’humeur aqueuse. L’absence de vaisseaux sanguins et lymphatiques la rend plus vulnérable aux infections.
La cornée reçoit une riche innervation sensitive à partir des nerfs ciliaires de la branche ophtalmique du trijumeau. Du plexus ciliaire se détachent des rameaux qui vont aborder la cornée au limbe pour former un réseau cheminant soit sous l’épithélium pour devenir intra-épithélial, soit dans le stroma antérieur. Ces rameaux de nerfs cilaires au cours de leur progression vers le centre se séparent et se divisent dichotomiquement. Chaque fibre innerve un territoire cornéen et s’entrecroise pour former un riche réseau nerveux sous la couche de Bowman.
[1] Maurin JF. Anatomie de la conjonctive. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie, 21-004-A-30 ; 1989 : 4 p.
[2] Breitbach R, Spitznas M. Ultrastructure of the paralimbal and juxtacaruncular human conjunctiva. Graefes Arch Clin Exp Ophthalmol 1988 ; 226 : 567-75.
[3] Steuhl KP. Ultrastructure of the conjunctival epithelium. Dev Ophthalmol 1989 ; 19 : 1-104.
[4] Yu DF, Chen Y, Han JM, et al. MUC19 expression in human ocular surface and lacrimal gland and its alteration in Sjogren syndrome patients. Exp Eye Res 2008 ; 86 : 403-11.
[5] Langer G, Jagla W, Behrens-Baumann W, et al. Secretory peptides TFF1 and TFF3 synthesized in human conjunctival goblet cells. Invest Ophthalmol Vis Sci 1999 ; 40 : 2220-4.
[6] Jirsova K, Dudakova L, Kalasova S, et al. The OV-TL 12/30 clone of anti-cytokeratin 7 antibody as a new marker of corneal conjunctivalization in patients with limbal stem cell deficiency. Invest Ophthalmol Vis Sci 2011 ; 52 : 5892-8.
[7] Kasper M. Patterns of cytokeratins and vimentin in guinea pig and mouse eye tissue : evidence for regional variations in intermediate filament expression in limbal epithelium. Acta Histochem 1992 ; 93 : 319-32.
[8] Greiner JV, Weidman TA, Korb DR, Allansmith MR. Histochemical analysis of secretory vesicles in nongoblet conjunctival epithelial cells. Acta Ophthalmol (Copenh) 1985 ; 63 : 89-92.
[9] Versura P, Maltarello MC, Bonvicini F, et al. Detection of mucus glycoconjugates in human conjunctiva by using the lectin colloidal gold technique in TEM. I. A quantitative study in normal subjects. Acta Ophthalmol (Copenh) 1986 ; 64 : 445-50.
[10] Rohen JW, Steuhl P. Specialized cell types and their regional distribution in the conjunctival epithelium of the cynomolgus monkey. Graefes Arch Clin Exp Ophthalmol 1982 ; 218 : 59-63.
[11] Rodrigues MM, Rowden G, Hackett J, Bakos I. Langerhans cells in the normal conjunctiva and peripheral cornea of selected species. Invest Ophthalmol Vis Sci 1981 ; 21 : 759-65.
[12] Yoshida A, Imayama S, Sugai S, et al. Increased number of IgE positive Langerhans cells in the conjunctiva of patients with atopic dermatitis. Br J Ophthalmol 1997 ; 81 : 402-6.
[13 ] Dua HS, Faraj LA, Said DG, et al. Human corneal anatomy redefined : a novel pre-Descemet’s layer (Dua’s layer). Ophthalmology 2013 ; 120 : 1778-85.
[14] Dua HS, Faraj LA, Branch MJ, et al. The collagen matrix of the human trabecular meshwork is an extension of the novel pre-Descemet’s layer (Dua’s layer). Br J Ophthalmol 2014 ; 98 : 691-7.
[15] McKee HD, Irion LC, Carley FM, et al. Re : Dua et al. : Human corneal anatomy redefined : a novel pre-Descemet layer (Dua’s layer) (Ophthalmology 2013 ; 120 : 1778-85). Ophthalmology 2014 ; 121 : e24-25.
[16] Jafarinasab MR, Rahmati-Kamel M, Kanavi MR, Feizi S. Dissection plane in deep anterior lamellar keratoplasty using the big-bubble technique. Cornea 2010 ; 29 : 388-91.
[17] Elder MJ. The immunologic target : antigenic aspects of basement membranes. Dev Ophthalmol 1997 ; 28 : 135-48.
[18] Tuori A, Uusitalo H, Burgeson RE, et al. The immunohistochemical composition of the human corneal basement membrane. Cornea 1996 ; 15 : 286-94.
[19] van der Neut R, Krimpenfort P, Calafat J, et al. Epithelial detachment due to absence of hemidesmosomes in integrin beta 4 null mice. Nat Genet 1996 ; 13 : 366-9.
[20] Vorkauf M, Duncker G, Nolle B, Sterry W. Adhesion molecules in normal human conjunctiva. An immunohistological study using monoclonal antibodies. Graefes Arch Clin Exp Ophthalmol 1993 ; 231 : 323-30.
[21] Vorkauf W, Vorkauf M, Nolle B, Duncker G. Adhesion molecules in normal and pathological corneas. An immunohistochemical study using monoclonal antibodies. Graefes Arch Clin Exp Ophthalmol 1995 ; 233 : 209-19.
[22] Nemeth G, Felszeghy S, Kenyeres A, et al. Cell adhesion molecules in stromal corneal dystrophies. Histol Histopathol 2008 ; 23 : 945-52.
[23] Byeseda SE, Burns AR, Dieffenbaugher S, et al. ICAM-1 is necessary for epithelial recruitment of gammadelta T cells and efficient corneal wound healing. Am J Pathol 2009 ; 175 : 571-9.
[24] Ramirez-Miranda A, Nakatsu MN, Zarei-Ghanavati S, et al. Keratin 13 is a more specific marker of conjunctival epithelium than keratin 19. Mol Vis 2011 ; 17 : 1652-61.
[25] Liu S, Li J, Tan DT, Beuerman RW. The eyelid margin : a transitional zone for 2 epithelial phenotypes. Arch Ophthalmol 2007 ; 125 : 523-32.
[26] Yoshida S, Shimmura S, Kawakita T, et al. Cytokeratin 15 can be used to identify the limbal phenotype in normal and diseased ocular surfaces. Invest Ophthalmol Vis Sci 2006 ; 47 : 4780-6.
[27] Cockerham GC, Laver NV, Hidayat AA, McCoy DL. An immunohistochemical analysis and comparison of posterior polymorphous dystrophy with congenital hereditary endothelial dystrophy. Cornea 2002 ; 21 : 787-91.
[28] Merjava S, Neuwirth A, Mandys V, Jirsova K. Cytokeratins 8 and 18 in adult human corneal endothelium. Exp Eye Res 2009 ; 89 : 426-31.
[29] Merjava S, Neuwirth A, Tanzerova M, Jirsova K. The spectrum of cytokeratins expressed in the adult human cornea, limbus and perilimbal conjunctiva. Histol Histopathol 2011 ; 26 : 323-31.
[30] Kessing SV. Mucous gland system of the conjunctiva. A quantitative normal anatomical study. Acta Ophthalmol (Copenh) 1968 : Suppl 95 : 91+.
[31] Knop E, Knop N. The role of eye-associated lymphoid tissue in corneal immune protection. J Anat 2005 ; 206 : 271-85.
C. Creuzot-Garcher
Anatomie du film lacrymal
Le film lacrymal s’organise en trois couches étroitement intriquées les unes avec les autres. La couche lipidique, la plus superficielle, limite l’évaporation des larmes et assure une bonne adhérence des lipides à la surface du niveau aqueux. La couche muqueuse est organisée sous forme d’un niveau de concentration croissante de la superficie vers la profondeur. Les mucines se retrouvent soit sous forme libre, soit sous forme membranaire. La couche muqueuse profonde contribue à la formation du glycocalyx. Les trois couches participent toutes aux principales fonctions de défenses du film lacrymal.
Régulation du film lacrymal
La régulation nerveuse de la glande lacrymale comporte trois niveaux successifs : les nerfs sensitifs cornéens et conjonctivaux ; le système nerveux central ; les systèmes nerveux sympathique et parasympathique. Cette stimulation agit au niveau des cellules acineuses et des canaux lacrymaux de la glande lacrymale en réponse à un stress. La sécrétion des larmes est par ailleurs largement influencée par le statut hormonal des patients, notamment le statut androgénique. Les androgènes exercent leur effet tant sur la composante aqueuse que sur la composante lipidique.
Le film lacrymal (FL) est l’interface entre l’œil et le monde extérieur. Il doit assurer une bonne qualité réfractive, une défense antimicrobienne efficace et doit être capable de protéger la surface oculaire contre toutes les attaques extérieures. Il est composé d’eau, d’enzymes, de protéines, de sucres, d’immunoglobulines, de lipides, de différents métabolites et de cellules exfoliées multinucléées. Sa variation dans le temps explique qu’il est difficile de définir sa composition exacte à un moment donné. Le volume du film lacrymal est d’environ 7 à 9 μl avec une sécrétion basale de 1 à 2 μl/min. La constitution du film lacrymal dépend de trois éléments : la sécrétion des larmes, l’étalement correct de celles-ci à la surface oculaire et leur résorption en partie par les voies lacrymales (VL) et en partie par évaporation à la surface oculaire. Le flux lacrymal est évalué par fluorophotométrie à 0,9 à 1,2 μl/min. L’épaisseur centrale réelle du film lacrymal serait de 4 μm, en grande majorité formée d’un gel aqueux contenant des mucines, élément essentiel au maintien de la stabilité de celui-ci [1-3]. Le film lacrymal n’est cependant pas homogène puisque les lipides ne peuvent être mélangés à la phase aqueuse et ils constituent en fait un niveau hydrophobique indépendant. En raison de leur densité moins élevée, ce niveau lipidique s’étale à la surface et constitue donc le film lacrymal lipidique (FLL) étalé à la surface d’un niveau aqueux hydrophile enrichi en eau, protéines, hydrocarbones, sels et d’autres composés moins hydrophiles. Les mesures par interférométrie évaluent l’épaisseur de cette phase lipidique de 40 à 90 nm, alors que la phase aqueuse est 100 fois plus épaisse, de l’ordre de 4 μm [4]. Toutefois, cette organisation est dynamique et le film lacrymal modifie ses caractéristiques en permanence selon les facteurs mécaniques comme les mouvements des paupières mais aussi la quantité de sécrétions lipidique et aqueuse, l’évaporation et le drainage par les VL. Cette organisation en trois niveaux n’est donc que purement théorique et représente davantage une variation de ses composants avec un ratio de lipides important en superficie et une concentration de mucines et de glycocalyx majoritaire en profondeur. Cette structure peut être déstabilisée dans différents états pathologiques mais l’est surtout dans les nombreuses situations de la vie courante qui s’accompagnent d’une rupture de l’équilibre entre surface oculaire et environnement. Ainsi, l’ouverture prolongée des paupières par exemple lors de la lecture ou la fixation d’un écran va modifier cette structure trilamellaire. Dans notre pratique courante, elle est utilisée pour la mesure du break-up-time (BUT), bon reflet de l’état du film lacrymal. En mesurant le temps nécessaire à l’apparition de la première rupture du complexe lacrymal, les ophtalmologistes apprécient la cohésion du film lacrymal et ses capacités à se répartir de façon homogène et prolongée à la surface oculaire sous l’effet d’une ouverture prolongée forcée des paupières. La qualité du FLL mais également celle de la phase muqueuse jouent un rôle primordial dans cet équilibre.
Quels que soient les résultats des mesures de l’épaisseur du film lacrymal à un instant « T », les trois niveaux que sont les couches lipidique, aqueuse et muqueuse sont étroitement intriqués : alors que le niveau lipidique s’étale en surface afin de limiter l’évaporation, le mucus est dilué dans l’eau et adhère étroitement aux cellules cornéoconjonctivales superficielles (formant un gel de mucus de densité croissante de la superficie vers la profondeur). Toutefois, pour plus de simplicité, nous décrirons succinctement mais séparément les constituants du film lacrymal que sont les couches lipidique, aqueuse et muqueuse.
La couche lipidique varie dans sa composition d’un patient à l’autre et selon le moment de la journée. Elle s’étale à la surface du FL et constitue donc le premier « rempart » de la surface oculaire au contact du monde extérieur.
Le niveau lipidique est un mélange complexe de triglycérides, d’acides gras libres, de di-esters de cholestérol, de cires, de cholestérol libre produits en grande partie par les glandes de Meibomius [5]. Les sécrétions des glandes de Meibomius sont faites approximativement de 77 % de cires et d’esters de cholestérol, de 8 % de phospholipides et de 9 % de di- et triglycérides et d’hydrocarbones, mais cette distribution varie en fonction du point de fusion.
L’analyse des lipides des larmes a longtemps souffert d’une approche trop simpliste, uniquement analytique, consistant à la simple identification des composés des graisses, alors que leur intrication les uns avec les autres va in fine modifier leur composition. Dans la littérature, plusieurs caractéristiques des lipides peuvent être proposées selon leur caractère simple ou complexe, polaire ou non, ionique ou non, alors qu’en pratique, les études de la phase lipidique du FL se limitent souvent à l’identification des lipides : acides gras, glycérolipides, glycérophospholipides, sphingolipides, stérolipides, saccharolipides, etc.
Les sécrétions meibomiennes, à leur origine, sont ainsi faites d’un assemblage de lipides non polaires alors que le film lipidique est beaucoup plus complexe, fait d’au moins deux niveaux sinon plus. La phase lipidique du film lacrymal est composée dans sa partie interne de lipides polaires (faits avant tout d’acides gras à très longue chaîne, de diacylglécérol et d’une minorité de phospholipides) et dans sa partie externe de lipides non polaires hydrophobes (majoritairement des cires et des esters de cholestérol et en moindre quantité des triglycérides et des hydrocarbones) (fig. 1-14) [6-8]. La composition du meibum peut toutefois varier pour compenser le trop faible taux de renouvellement lipidique.
Les deux couches de lipides ont des caractéristiques différentes :
la phase profonde polaire, couche très fine à l’interface entre la phase sous-jacente mucino-aqueuse et la phase lipidique superficielle fortement hydrophobe, assure la cohésion de l’ensemble. Par sa résistance mécanique à la rupture et ses propriétés surfactantes, la phase polaire joue un rôle clé dans la stabilité du film lacrymal. Cette interface de lipides phosphorylés polaires est donc une structure critique pour permettre l’étalement de la couche lipidique à la surface de la couche aqueuse ;
la couche superficielle non polaire retarde l’évaporation et sert principalement de contrôle des flux (principalement eau, oxygène et dioxyde de carbone) entre le film lacrymal et la surface oculaire d’une part et le milieu environnemental d’autre part [8, 9].
Les glandes de Meibomius ont longtemps été considérées comme une simple « usine » à lipides, mais elles sécrètent également de nombreuses protéines comme les lipocalines ou les protéines de transfert des lipides (phospholipidtransfer protein ou PLTP). La lipocaline permettrait également de déplacer les lipides de surface conférant ainsi une meilleure stabilité au FLL.
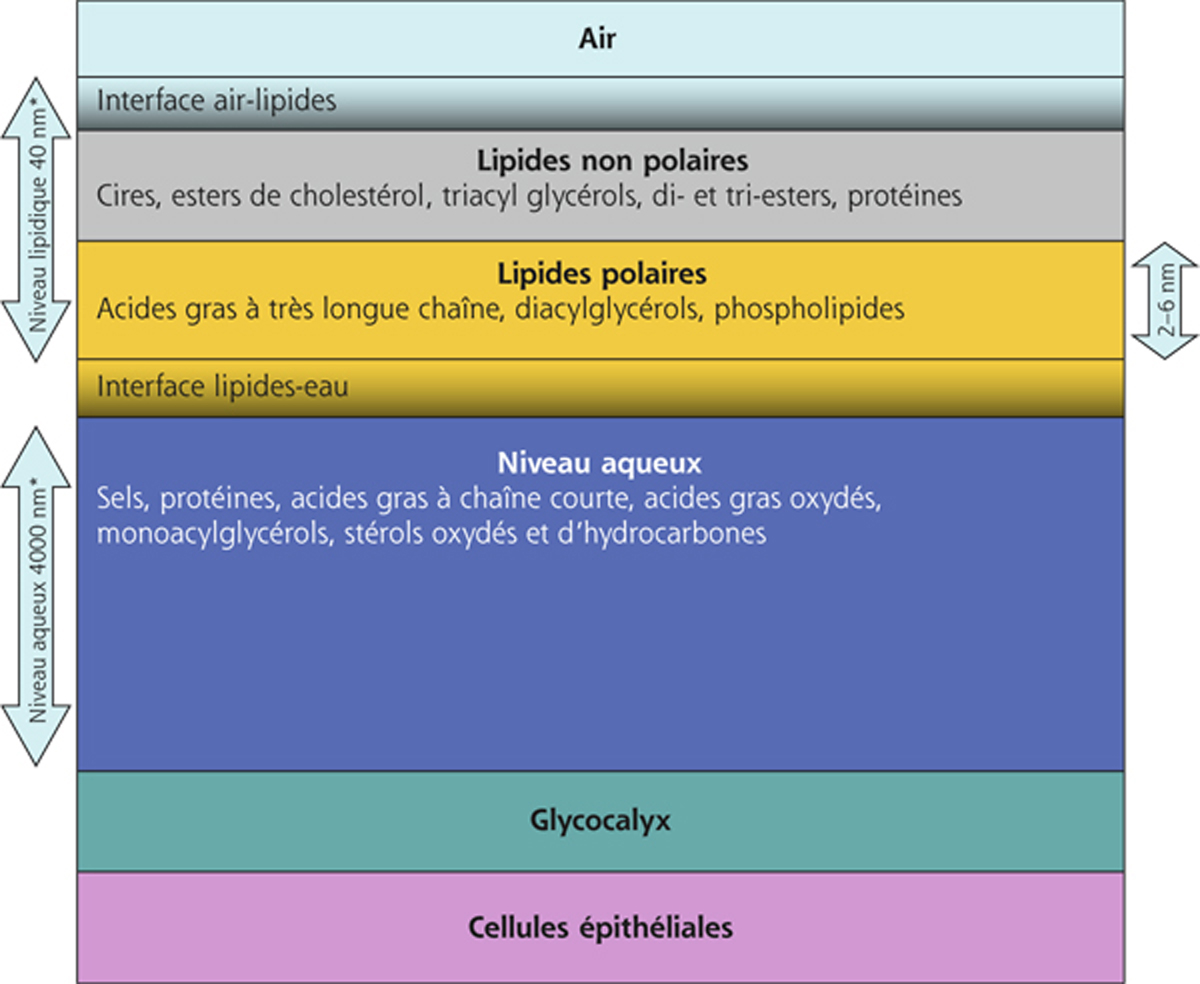
Fig. 1-14 Organisation du film lacrymal en différents niveaux allant de la superficie vers la profondeur : lipidique, aqueux et muqueux.
Ces différents niveaux sont étroitement intriqués notamment grâce à l’interface formée par les lipides polaires et les mucines de membranes (modifié d’après Butovitch) [5].
* Épaisseur définie selon King-Smith [4].
Les lipides sont sécrétés par les glandes de Meibomius, glandes sébacées mises en évidence en 1666 par Heinrich Meibom. Ce sont des glandes tubulo-acineuses holocrines alignées le long de la bordure des paupières. Chez l’homme on trouve de 30 à 40 glandes au niveau de la paupière supérieure et de 20 à 30 au niveau de la paupière inférieure. Les productions meibomiennes (ou meibum ou lipides meibomiens) sont sécrétées au niveau des orifices des glandes de Meibomius, situés derrière la ligne d’implantation des cils (fig. 1-15). Une fois expulsé, le meibum est ensuite réparti à la surface du film lacrymal. D’un point de vue histologique, les glandes de Meibomius sont constituées d’acini reliés par un long canal central.
Chez l’homme, sans anomalie de la surface oculaire, on retrouve 300 μg de graisse meibomienne dans le réservoir lacrymal et 9 μg dans le film préoculaire. Le meibum est produit en continu au niveau des cellules acineuses et est évacué le long du canal central vers les orifices meibomiens. Le meibum peut également être expulsé de façon plus importante lors d’un clignement forcé par exemple. La faible température de fusion des lipides (19–32 °C) facilite leur excrétion dans un environnement tissulaire à une température de 37 °C [10].
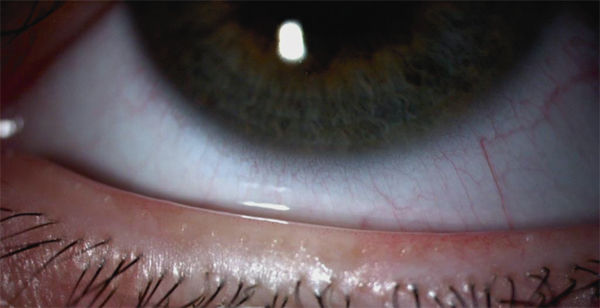
Fig. 1-15 Orifices des glandes de Meibomius situés en arrière de la base d’implantation des cils.
En dépit de sa faible épaisseur (estimée inférieure à 100 nm), la couche lipidique superficielle du film lacrymal joue un rôle prépondérant dans la protection de la surface oculaire [11]. Ses fonctions sont multiples (encadré 1-1) :
1 Obtenir une surface cornéenne homogène sans aberration optique
2 Réduire l’évaporation du film lacrymal (FL)
3 Améliorer la stabilité du FL
4 Favoriser l’étalement du FL
5 Éviter la contamination du FL par les lipides cutanés
6 Éviter le mouvement du FL vers les paupières en le maintenant au niveau de la surface oculaire
7 Renforcer l’apposition des paupières lors du sommeil
elle prévient l’évaporation de la phase mucino-aqueuse des larmes par son caractère hydrophobe ;
elle améliore le drainage et la stabilité du film lacrymal en limitant la tension de surface ;
elle assure la lubrification entre la cornée et les paupières au cours du clignement ;
elle lisse le film lacrymal, améliorant ses qualités optiques ;
elle joue un rôle de défense en protégeant la cornée des corps étrangers et des micro-organismes ;
elle constitue une barrière contre la contamination par les lipides cutanés.
Les lipides peuvent être recueillis par différentes techniques :
expression à partir d’une pression exercée sur les glandes de Meibomius puis recueil avec une spatule ;
microcapillaire recueillant les lipides juste à la sortie de l’orifice de la glande ou dans le ménisque de larmes ;
recueil par le buvard du test de Schirmer.
La première méthode est certainement préférable car plus riche en lipides et moins contaminée par les graisses cutanées. Les techniques modernes comme la high-performance liquid chromatography (HPLC) combinées à la spectrométrie de masse permettent de mieux comprendre l’organisation intriquée du FLL. Des analyses plus poussées associant spectroscopie par résonance magnétique nucléaire, spectroscopie infrarouge, chromatographie gazeuse ou chromatographie en couche fine permettent d’améliorer la finesse de caractérisation des composés lipidiques et de leur intrication [12]. Ces techniques complexes permettent d’effectuer une véritable analyse lipidomique identifiant ainsi des composés négligés autrefois comme l’étaient les acides gras à très longue chaîne – (O-acyl)-omega-hydroxy fatty acid – au premier plan dans la stabilisation du film lacrymal ou les lipides amphiliques polaires – diacylglycérols ou mono-acylglycérols (fig. 1-16). Ces méthodes permettent ainsi de mieux comprendre les modifications biochimiques des lipides associées aux dysfonctionnements meibomiens par exemple [13].
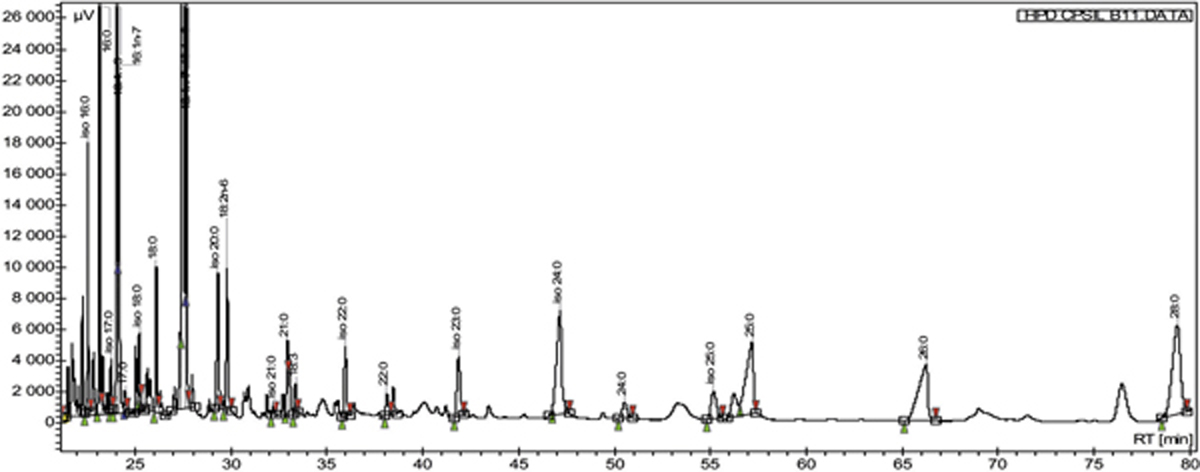
Fig. 1-16 Analyse du film lipidique lacrymal après prélèvement des lipides du meibum.
Aspect de la distribution des lipides par liquid chromatography-mass spectrometry (LCMS).
La phase mucino-aqueuse du film lacrymal, en contact avec l’épithélium cornéen, représente quantitativement la principale composante du film lacrymal. Elle est composée majoritairement d’eau (98 %) mais contient également des gaz dissous. Elle est riche en : mucines libres, électrolytes, facteurs de croissance, hormones, cytokines, immunoglobulines (Ig) et cellules inflammatoires et desquamées [14].
Les électrolytes présents dans les larmes comprennent les ions sodium, potassium, magnésium, calcium, chlorure, bicarbonate et phosphate [15]. Ils induisent une osmolarité normale des larmes de 304 mOsm/l en moyenne et un pH constant entre 7,14 et 7,82 [16]. Les électrolytes des larmes sont apportés par les glandes lacrymales et la conjonctive [15, 17].
Les protéines majoritaires des larmes, l’IgA, le lysozyme, la lactoferrine et les cystatines [18], permettent le maintien d’une forte activité antimicrobienne [15, 18]. La quasi-totalité (99 %) des 60 protéines lacrymales identifiées est produite par la glande lacrymale principale [16]. Dans les conditions normales, les protéines sont synthétisées dans la glande lacrymale principale pour 99 % d’entre elles. Les protéines sériques provenant du secteur vasculaire par filtration ne représentent alors que 1 % de la masse totale des protéines lacrymales. Un troisième contingent de protéines peut être synthétisé par le tissu conjonctif lors des pathologies inflammatoires. Le film lacrymal contient en outre des produits biologiquement actifs comme l’epidermal growth factor (EGF) ou le transforming growth factor β (TGF-β) qui sont sécrétés par la glande lacrymale en réponse à une stimulation nerveuse.
Les changements observés dans la composition de cette couche aqueuse, à savoir l’augmentation de la concentration des électrolytes, la diminution de la concentration en facteurs de croissance ou la présence de cytokines pro-inflammatoires, sont associés aux altérations de la surface oculaire.
La sécrétion est assurée par les glandes lacrymales accessoires de Krause et de Wolfring pour la sécrétion de base, et par la glande lacrymale principale pour la sécrétion réflexe. Chez l’homme, on distingue en effet la glande lacrymale principale et les glandes lacrymales accessoires (ou palpébrales). La glande lacrymale principale est située dans la partie supérieure temporale de l’orbite, tandis que les glandes lacrymales accessoires sont situées dans le stroma de la conjonctive palpébrale. Chez le rongeur, l’équivalent de la glande lacrymale principale est la glande lacrymale exorbitale, située près de l’oreille [19].
La glande lacrymale principale est responsable de la sécrétion lacrymale en réponse à une stimulation au niveau de la cornée. Elle sécrète la phase aqueuse des larmes par les canaux excréteurs qui se déversent au niveau des culs-de-sac conjonctivaux. La glande lacrymale principale est un tissu multilobé constitué d’acini, de canaux et de cellules épithéliales. Un fluide lacrymal riche en protéines et en électrolytes est produit par les cellules acineuses et sécrété par les canaux. L’aquaporine 5, protéine de transport formant un canal hydrique, serait impliquée dans la sécrétion d’eau par la glande lacrymale [20].
La glande lacrymale principale est riche en cellules du système immunitaire, lymphocytes B et T, cellules dendritiques et macrophages jouant un rôle majeur dans la réaction inflammatoire au niveau de la surface oculaire [21]. La glande lacrymale principale est le site principal de production de protéines lacrymales impliquées dans la défense immune spécifique (IgA) ou non spécifique (lactoferrine, lysozyme).
La phase aqueuse joue un rôle antimicrobien essentiel en raison de son fort taux en lysozyme, en β-lysines et en lactoferrine mais également par sa haute concentration en anticorps. L’IgA, immunoglobuline la plus abondante des larmes, constitue la première ligne de défense de la conjonctive [22]. Les IgA sécrétoires s’associent au film muqueux et constituent une barrière efficace contre les infections bactériennes et virales. Le lysozyme (de 20 à 40 % des protéines lacrymales) est un agent antibactérien de haut poids moléculaire qui attaque spécifiquement la paroi des bactéries à Gram positif. La lactoferrine possède des propriétés bactériostatiques et anti-oxydantes (par activité antiradicalaire). Les protéines de la famille des cystatines et la lipocaline lacrymale (environ 20 % du contenu protéique des larmes) semblent posséder une activité inhibitrice de protéases à cystéine et participent ainsi à la protection de la surface oculaire contre les attaques virales ou bactériennes [18 , 23]. L’EGF, principal facteur de croissance détecté dans les larmes, est impliqué dans le maintien de la surface oculaire par la réparation des épithéliums cornéen et conjonctival, ainsi que dans la régulation de la sécrétion lacrymale. Les facteurs de croissance, EGF et TGF-β, inhibent la prolifération cellulaire épithéliale, favorisent la différenciation cellulaire, stimulent la sécrétion de mucus et réduisent l’inflammation [22, 24].
Le mode de prélèvement demeure le principal dilemme lors du dosage des différents composants du FL, chacun d’entre eux nécessitant la sélection de la « moins mauvaise » méthode de prélèvement [25]. Une stimulation, aussi minime soit-elle, liée à un contact avec la conjonctive fait que le prélèvement ne sera plus effectué dans des conditions basales puisqu’il entraîne un larmoiement, donc une dilution de la substance dosée. Pour compliquer le tout, le degré de dilution varie selon les molécules. Une des méthodes pour éviter ce biais est de rapporter la substance dosée à une variable comme la teneur en albumine. Cette pratique influence toutefois les dosages des protéines qui sont augmentées dans les affections conjonctivales inflammatoires. Plus qu’une valeur absolue, il est donc préférable de doser une molécule par rapport à une autre (par exemple, rapport des marqueurs du système Th1/Th2 dans les affections inflammatoires de la conjonctive). Le second obstacle est bien entendu le faible volume de larmes parfois très réduit dans la sécheresse oculaire sévère, ce qui fait privilégier les microméthodes permettant des dosages multiples à partir d’un seul prélèvement.
Pour les études en protéomique, la meilleure méthode consiste également à prélever les larmes avec des microméthodes. Depuis les 25 dernières années, l’analyse du FL a énormément progressé grâce à l’émergence de nouvelles méthodes de recueil, l’amélioration des techniques d’analyse et les seuils très bas de détection des larmes. Initialement limitée à la mise en évidence de 60 composants du FL par électrophorèse, l’identification de composés comme les lipocalines, principales protéines de liaison avec les lipides des larmes, devient possible avec ces méthodes d’analyse plus fines. Différentes méthodes de mesure sont maintenant disponibles pour analyser les composés protéiques des larmes : spectrométrie de masse et chromatographie liquide associée à la spectrométrie de masse (liquid chromatography-mass spectrometry [LC/MS]). Le raffinement de ces techniques ne doit pas faire oublier la problématique du recueil des larmes : les quantités – minimes certes – génèrent immanquablement une sécrétion lacrymale qui va diluer les composants. Cette approche peut s’avérer gênante pour des analyses quantitatives. On attend beaucoup de l’application expérimentée avec succès pour la mesure de l’osmolarité nécessitant une quantité minimale de liquide lacrymal.
Adhérant étroitement aux cellules épithéliales sous-jacentes, la couche de mucus est la plus profonde du film lacrymal. Son épaisseur varie de 0,8 μm en avant de la cornée à 1,4 μm en avant de la conjonctive pour ce qui est de la portion directement au contact des cellules cornéoconjonctivales. Cette couche muqueuse est en effet combinée au niveau aqueux pour sa plus grande partie, constituant ainsi un gel de mucines qui rend hydrophiles les membranes des cellules épithéliales conjonctivales et cornéennes naturellement hydrophobes. Les mucines sont des glycoprotéines de haut poids moléculaire de 600 kDa qui s’agrègent après sécrétion en grosses molécules de 40 MDa grâce à leurs domaines riches en cystéine. Elles sont constituées d’un squelette central fait d’acides aminés organisés en séries répétitives, dites tandem repeat, riches en sérine et thréonine sur lesquelles viennent s’ancrer des chaînes hydrocarbonées O-glycosylées riches en acide sialique. Ces chaînes O-glycosylées ou « glycans » confèrent aux mucines membranaires leurs propriétés [26].
Les mucines sont fabriquées grâce à l’activation de gènes nommés MUC (désignés en italique). Parmi les 21 gènes de mucines mises en évidence chez l’homme, neuf sont exprimés dans l’œil : MUC1, MUC2, MUC4, MUC5AC, MUC7, MUC13, MUC15, MUC16, MUC17.
On distingue ainsi les mucines [27] :
du gel muqueux, fait par multimérisation (par formation de ponts disulfure) et par glycosylation : MUC2, MUC5AC, MUC5B, MUC6, MUC19. Dans les larmes, on retrouve principalement la mucine MUC5AC et en moindre quantité MUC2, qui participe à la viscosité du film lacrymal. Ces membranes du gel muqueux proviennent probablement d’un ancêtre commun apparenté au facteur von Willebrand ;
solubles : MUC7 et MUC9 ;
transmembranaires : MUC1, MUC3A, MUC3B, MUC4, MUC12, MUC13, MUC15, MUC16, MUC17, MUC20 et MUC21. Ces mucines membranaires ont été identifiées chez l’homme, dont trois (MUC1, MUC4 et MUC16) sont exprimées au niveau des épithéliums cornéen et conjonctival mais également retrouvées dans les larmes. Les mucines membranaires sont les principales composantes du glycocalyx et sont particulièrement exprimées au niveau des villosités des cellules.
Les mucines membranaires comme les mucines sécrétées sont anormales dans les affections de la surface oculaire. Différents modèles de souris KO pour ces gènes de mucines peuvent constituer des modèles animaux de sécheresse oculaire. Toutefois, le caractère multifactoriel de la sécheresse oculaire rend ces modèles imparfaits. Ainsi, les souris KO pour le gène MUC5AC révèlent avant tout une altération de la qualité des larmes plutôt que de leur quantité. Elles ne présenteraient alors aucune altération de la surface oculaire même après exposition à une atmosphère asséchée [28].
Les mucines MUC2, MUC5AC sont produites par les cellules à mucus, cellules sécrétrices caliciformes de l’épithélium conjonctival, dont la répartition le long de l’épithélium n’est pas uniforme. Chez l’homme, les cellules à mucus sont souvent isolées, alors que chez le rat elles sont groupées en îlots (fig. 1-17). En revanche, les mucines membranaires MUC1, MUC4 et MUC16 sont présentes au niveau des épithéliums cornéen et conjonctival. La glande lacrymale principale possède également la propriété de produire la mucine soluble MUC7 et la mucine MUC5B participant au gel muqueux.
La sécrétion des mucines par les cellules à mucus est sous dépendance nerveuse. Les rameaux parasympathiques et sympathiques enrobent la partie basolalérale des cellules à mucus. Les agonistes cholinergiques et le peptide vasoactif intestinal (vasoactive intestinal peptide [VIP]), libérés par les nerfs parasympathiques, stimulent la sécrétion des glycoconjugués. L’activation de récepteurs purinergiques P2Y2 module la sécrétion d’eau et d’électrolytes par l’épithélium conjonctival, ainsi que la sécrétion de mucines par les cellules à mucus de l’épithélium conjonctival [29-31]. La sécrétion des mucines est également déclenchée par l’EGF par des mécanismes proches des agonistes cholinergiques.
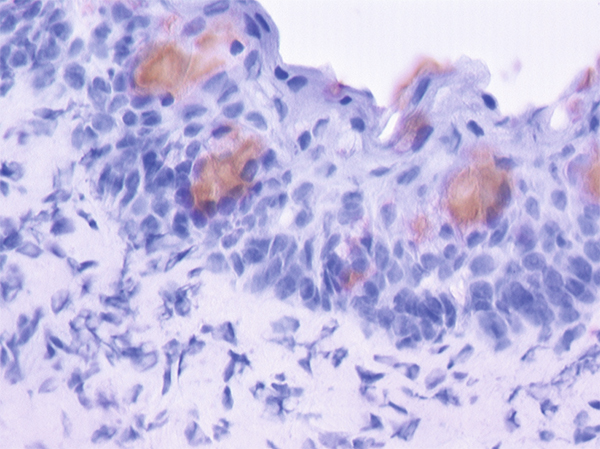
Fig. 1-17 Biopsie conjonctivale avec identification des cellules caliciformes par marquage par l’anticorps anti-MUC5AC.
Les mucines permettent d’assurer l’ancrage du film lacrymal à la surface des cellules cornéennes et conjonctivales. Cet ancrage passe donc par la relation entre mucines membranaires et mucines libres diluées dans le film lacrymal. Monomériques, les mucines membranaires sont ancrées au niveau des cellules épithéliales par leur extrémité carboxylique et participent à la formation d’une couche, dont l’épaisseur est estimée entre 200 et 500 nm, le glycocalyx [32]. Cette structure permet de diminuer la tension de surface et d’abaisser ainsi l’hydrophobicité de la surface oculaire et de favoriser son hydratation.
Les mucines jouent un rôle essentiel tant par leur nature libre, diluée dans le gel muqueux, que par leur nature membranaire (encadré 1-2).
1 Lubrification et hydratation
2 Élimination des germes pathogènes
3 Barrière (galectine-3, MUC16)
4 Prévention de l’endocytose
Dans les larmes, les chaînes hydrocarbonées des mucines améliorent l’hydratation et la lubrification de la surface oculaire : les mucines s’organisent en gels grâce à des domaines riches en cystéine. Elles favorisent aussi l’élimination des germes pathogènes à la surface cornéenne en les « trappant » dans leurs mailles puis en les éliminant lors du clignement. La chaîne O-glyquée serait un ligand pour Pseudomonas aeruginosa permettant son élimination, mais non son adhésion aux cellules.
Au niveau du glycocalyx, les chaînes hydrocarbonées muciniques jouent également un rôle primordial. Les mucines membranaires sont ancrées dans la membrane des cellules mais s’étendent de 200 à 500 nm au-delà des cellules, définissant ainsi des extrémités beaucoup longues que les autres chaînes hydrocarbonées du glycocalyx. Elles participent ainsi à la rigidité des chaînes glycoprotéiques membranaires. Elles confèrent des propriétés anti-adhésives aux muqueuses qu’elles recouvrent, améliorant leur capacité à glisser l’une sur l’autre. Ces propriétés, démontrées par microscopie en force atomique et confirmées par des méthodes d’étude dynamique et statique d’adhésion, sont directement liées aux chaînes hydrocarbonées et non à des effets de charge. Elles diminuent les possibilités d’adhésion des germes comme Staphylococcus aureus et Streptococcus pneumoniae à la surface de l’épithélium. Ces mécanismes protecteurs sont propres aux mucines et indépendants de facteurs liés aux germes et à leur virulence. Les chaînes O-glyquées permettraient enfin de limiter l’endocytose et de moduler l’incorporation des nanoparticules. Cet effet protecteur passe probablement en partie par les lectines et plus particulièrement la galectine-3. Celle-ci renforce la rigidité du film protecteur du glycocalyx limitant ainsi l’accès aux membranes en dépit du mouvement latéral des cellules. Il semble que MUC16 soit particulièrement impliquée dans la qualité de la barrière épithéliale.
Les mucines peuvent être prélevées par microcapillaires dans les larmes, mais le plus souvent, les mucines membranaires ou sécrétées sont arrachées par apposition d’une empreinte conjonctivale. Celle-ci est ensuite soumise à différentes techniques par immunofluorescence, immunoperoxidase, technique ELISA (enzyme-linked immunosorbent assay), PCR (polymerase chain reaction) ou cytométrie en flux (fig. 1-18). Des méthodes par HPLC peuvent également être appliquées notamment pour les chaînes hydrocarbonées. La difficulté demeure alors l’extraction du matériel muqueux plus ou moins adhérent à la membrane cellulosique. Les gènes MUC1, MUC2, MUC4 et MUC5AC constitueraient des marqueurs de sécheresse oculaire, tout particulièrement MUC1 qui allie bonne sensibilité et bonne spécificité.
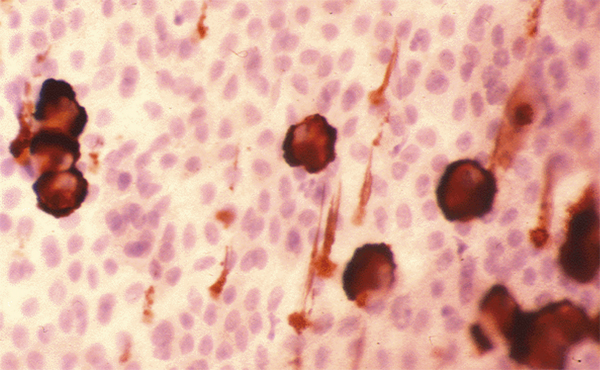
Fig. 1-18 Empreinte conjonctivale.
Les cellules épithéliales forment un tapis multicouche dans lequel on identifie des cellules épithéliales marquées en bleu et des cellules à mucus en rouge marquées par anticorps anti-MUC5AC.
Les larmes sont sécrétées et résorbées en permanence. La sécheresse ou le larmoiement sont donc les résultantes d’un dysfonctionnement de ces deux éléments. Une méta-analyse récente de plusieurs études consacrées au taux de renouvellement des larmes (TRL) mesuré par fluorophotométrie et à l’évaporation mesurée par interférométrie retient, chez le sujet normal, un TRL de 16,19 ± 5,1 %/min et une évaporation de 13,57 ± 6,52 × 10–7 g/cm2/s. Le TRL passe à 9,26 ± 5,08 %/min dans l’œil sec et l’évaporation à 21,05 ± 13,96 × 10–7 g/cm2/s dans l’œil sec avec des variations selon les raisons de la sécheresse (tableau 1-1).
Ces constantes sont donc profondément modifiées que la sécheresse soit évaporative ou par hyposécrétion. On constate ainsi que sécrétion des larmes et évaporation participent à l’équilibre dynamique du film lacrymal et qu’elles sont susceptibles d’être altérées conjointement : un patient atteint d’un syndrome sec par hyposécrétion type Sjögren présentera très fréquemment un dysfonctionnement meibomien. Il semble que l’évaporation soit affectée par l’épaisseur du film lipidique sans qu’il soit clairement démontré qui, de la composition lipidique ou de l’épaisseur du film lipidique, conditionne le plus la stabilité du film lacrymal. En effet, un FLL plus épais est associé à une meilleure stabilité lacrymale mais la qualité des lipides polaires, agissant en tant que surfactant, supportant la phase non polaire, diminue également l’évaporation.
Tableau 1-1 Taux de renouvellement des larmes et évaporation chez les patients normaux et souffrant de syndrome sec.
La stimulation lacrymale est sous la dépendance d’un système neuronal périphérique en étroite association avec le système nerveux central, permettant d’intégrer des composantes émotionnelles. La sécrétion des larmes est par ailleurs largement influencée par le statut hormonal des patients.
La réponse neuronale qui régule la sécrétion de la glande lacrymale est une partie intégrante de l’unité fonctionnelle constituée des nerfs afférents cornéens et conjonctivaux, des nerfs efférents sympathiques et parasympathiques qui innervent la glande lacrymale avec ses cellules et les canaux excréteurs.
Une réponse neuronale rapide entraînant la sécrétion de larmes est indispensable pour combattre une agression de la surface oculaire (température, humidité, stress mécanique, chimique). Toutefois, cette sécrétion n’est pas seulement aqueuse mais comporte également différentes substances (facteurs de croissance, électrolytes, protéines, etc.)
La boucle lacrymale réflexe (fig. 1-19) a pour rôle d’induire une production lacrymale suite à une stimulation cornéenne ; elle fait intervenir la glande lacrymale principale, la cornée et la conjonctive et enfin le système nerveux central [33]. En cas de stimulation au niveau de la cornée, un signal est envoyé au système nerveux central par les nerfs sensitifs de la surface oculaire. Le système nerveux central déclenche alors une stimulation des nerfs sécréto-moteurs, provoquant une augmentation de la production de larmes (eau, électrolytes et protéines) par la glande lacrymale principale et de sécrétion de mucines par les cellules à mucus, associée à un clignement immédiat permettant de répandre le film lacrymal sur l’ensemble de la surface oculaire exposée. Il ne s’agit pas seulement d’un simple déclenchement isolé de larmes, car celui-ci peut être modulé par la stimulation conjointe du noyau lacrymal cérébral associant une composante émotionnelle si besoin. Cette stimulation est contrôlée pour assurer en permanence une sécrétion minimale adaptée aux besoins de la surface oculaire. Elle est susceptible d’augmenter brusquement en cas de nécessité. Cette réactivité nerveuse peut être altérée, notamment lorsque les nerfs sensitifs à la surface de la cornée sont constamment stimulés (en cas d’irritation par exemple). On observe dans ce cas une perte de la réponse de production de larmes suite à un stimulus, sorte de désensibilisation nerveuse de la boucle lacrymale réflexe.
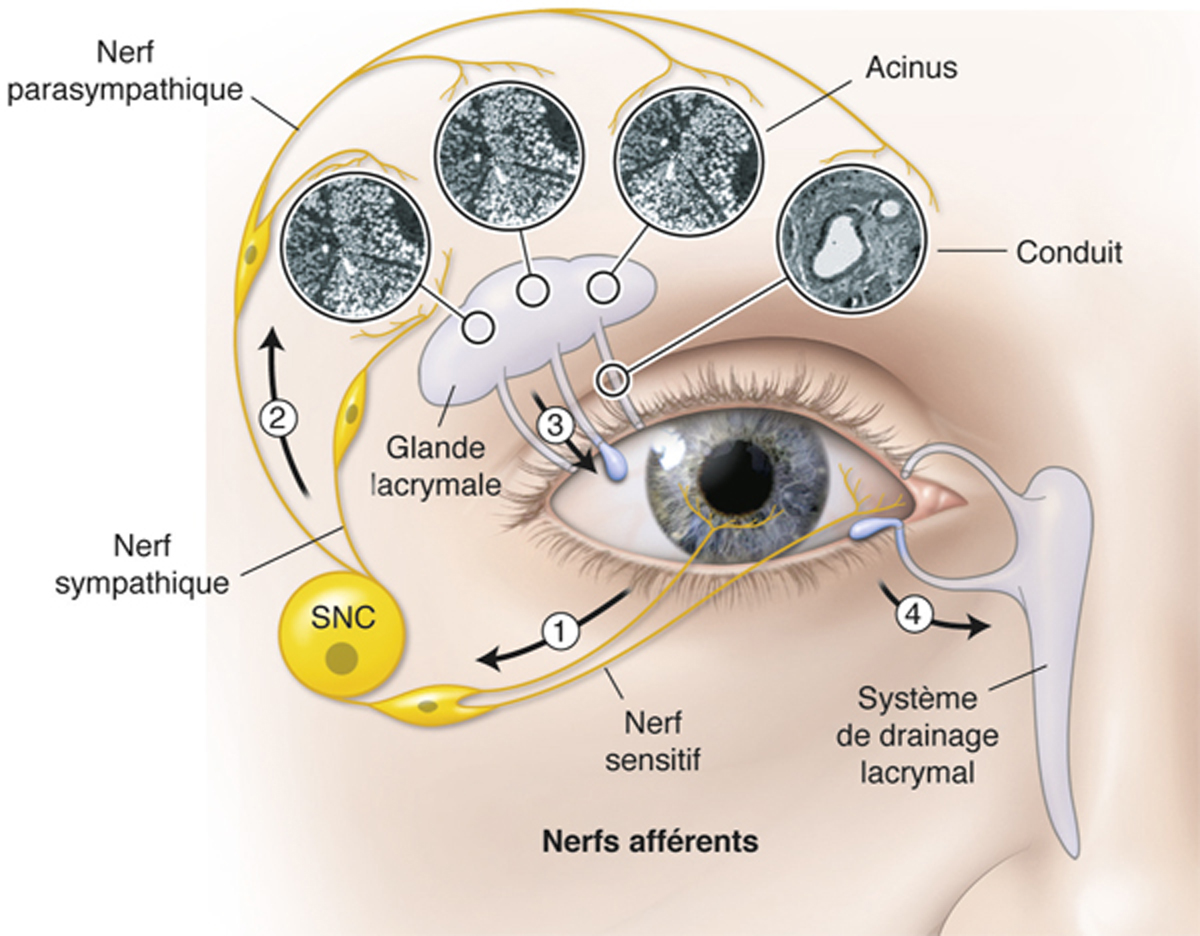
Fig. 1-19 Boucle lacrymale réflexe, adaptée de Argueso, 2013 [23].
Un stimulus au niveau de la cornée envoie un signal nerveux sensitif au système nerveux central (SNC), qui transmet un signal nerveux sécréto-moteur à la glande lacrymale par l’intermédiaire des voies parasympathique majoritairement et sympathique de façon plus secondaire. La production lacrymale induite protège la surface oculaire.
La cornée est un tissu richement innervé (la densité de nerfs sensitifs à sa surface est 20 à 40 fois supérieure à celle de la gencive), permettant une réponse rapide à tout stress à sa surface. La cornée est stimulée en permanence par des éléments environnementaux, tels qu’un courant d’air, la présence d’un corps étranger ou une atmosphère à faible taux d’humidité [33]. Un clignement sur une surface oculaire trop faiblement protégée par un volume de larmes insuffisant représente également une cause de stimulation nerveuse de la sécrétion lacrymale. La stimulation des nerfs sensitifs cornéens passe par un réflexe impliquant le nerf facial dont l’activation entraîne la sécrétion lacrymale. Une stimulation des nerfs cornéens entraîne à la fois une sécrétion de larmes et une vasodilatation dans la glande lacrymale. La sécrétion lacrymale peut ainsi être bloquée par les antagonistes muscariniques.
Les nerfs cornéens répondent à divers stimuli, on dénombre ainsi différents types de récepteurs : des mécanorécepteurs (seuil de réactivité bas), des mécanonocicepteurs (seuil de réactivité élevé), des nocicepteurs multimodaux et des récepteurs au froid [34]. Environ 20 % des nerfs sensitifs sont mécanorécepteurs et mécanonocicepteurs répondant avant tout à une agression mécanique. Environ 70 % des nerfs sont nocicepteurs multimodaux et répondent à des agressions variées (irritants, inflammation, etc.). On conçoit ainsi que l’altération de la sensibilité cornéenne puisse avoir un effet marqué sur la sécrétion lacrymale.
Le déclenchement de la sécrétion lacrymale à la suite de l’information du système nerveux central passe par la voie efférente parasympathique et sympathique. Le système parasympathique est prépondérant à la fois anatomiquement et fonctionnellement. Ainsi, un blocage de la voie sympathique entraîne des effets modérés contrairement à celui de la voie parasympathique qui bloque la sécrétion lacrymale [35]. L’activation des systèmes sympathiques et parasympathiques passe par la sécrétion de neurotransmetteurs qui contrôlent la sécrétion lacrymale (protéine, électrolyte et eau). Le principal neuromédiateur parasympathique est l’acétylcholine et plus accessoirement le VIP, alors que le principal neuromédiateur sympathique adrénergique est la norépinéphrine et plus accessoirement le neuropeptide Y [24]. Il a été mis en évidence chez le rat que les récepteurs cholinergiques présents dans la glande lacrymale principale sont des récepteurs muscariniques de sous-type M3 [36]. Les agonistes cholinergiques entraînent ainsi une sécrétion lacrymale d’eau et de substances associées. Toutefois la stimulation lacrymale par des agonistes cholinergiques est associée à un blocage simultané, sorte de « rétrocontrôle » atténuant la sécrétion lacrymale. Le VIP sécrété par le système parasympathique régule normalement la sécrétion lacrymale chez l’homme comme l’atteste le larmoiement abondant d’un patient atteint d’un VIPome [37, 38].
La boucle neuronale est susceptible d’être altérée à chaque étape : évidente dans toutes les situations qui s’accompagnent d’une anesthésie ou d’une hypoesthésie cornéenne, elle prend des aspects plus discrets dans les atteintes de la voie efférente. Cette boucle est susceptible d’être altérée pour la première étape par toutes les situations altérant la sensibilité cornéenne (âge, diabète, chirurgie réfractive, etc.), pour la seconde étape par les situations s’accompagnant d’une neuropathie périphérique (comme on peut le voir dans le syndrome de Sjögren ou dans le diabète) certainement entretenue par la réaction inflammatoire [39]. De même, les produits anticholinergiques (atropine, antidépresseurs tricycliques, anti-histaminiques) ou les antagonistes muscariniques (scopolamine) entraîneront un syndrome sec, alors que la pilocarpine ou tout autre agent cholinergique entraînera une sécrétion lacrymale [40]. Dans la physiopathologie du syndrome sec lié à l’âge, le mécanisme est probablement mixte, associant une anomalie liée aux neurotransmetteurs et un déficit de l’action des fonctions agonistes cholinergique et alpha-adrénergique.
Même si les glandes lacrymales et accessoires sont considérées comme les sources majeures de larmes, l’épithélium conjonctival sécrète également des mucines, des protéines et des électrolytes [17]. Ces sécrétions sont régulées par les systèmes nerveux parasympathique et sympathique et via l’activation de récepteurs purinergiques P2Y2. Les récepteurs P2Y2 sont impliqués dans la régulation du transport épithélial d’ions [41]. Chez le lapin, l’activation des récepteurs P2Y2 stimule la sécrétion d’eau et d’électrolytes par l’épithélium conjonctival, ainsi que la sécrétion de mucines par les cellules à mucus de l’épithélium conjonctival [29–31].
Différents modèles animaux de sécheresse oculaire ont été proposés. Un modèle d’insuffisance lacrymale totale a été développé en inhibant la boucle lacrymale réflexe par dénervation parasympathique [42]. Ce modèle a été mis en œuvre chez le rat Long-Evans par excision unilatérale d’un nerf du système parasympathique. Les auteurs ont montré dans ce modèle une diminution de la production lacrymale, l’apparition d’ulcères cornéens et une atteinte morphologique de la glande lacrymale [43]. Des signes cliniques de sécheresse oculaire ont été mis en évidence 7 jours après l’opération chirurgicale : augmentation des kératites, perte de l’intégrité du film lacrymal, diminution de la production de larmes et augmentation de la fréquence de clignement. D’autres modèles combinant diminution de la sécrétion lacrymale et sécheresse par évaporation (animaux mis dans une atmosphère asséchée) ont été proposés. Le modèle infusant de la scopolamine en sous-cutané chez l’animal est également une option intéressante pour évaluer les effets de la sécheresse sur la surface oculaire car plus physiologique [44].
On conçoit donc que la régulation nerveuse de la glande lacrymale est complexe avec : l’activation des nerfs sensitifs cornéens et conjonctivaux (premier niveau) ; la stimulation des nerfs sympathiques et parasympathiques (deuxième niveau) ; l’activation des mécanismes intracellulaires des cellules acineuses et des canaux lacrymaux entraînant alors une sécrétion lacrymale (troisième niveau). Le bon équilibre de l’ensemble de ces acteurs est indispensable au maintien de l’homéostasie de la surface oculaire et des larmes sécrétées.
Les principaux sécrétagogues testés dans des essais cliniques sont les agents cholinergiques. La pilocarpine a été évaluée dans plusieurs essais multicentriques mais son utilisation en respectant l’autorisation de mise sur le marché (AMM) reste limitée à la sécheresse buccale post-radiothérapie. Son utilisation pour soigner la xérophtalmie dans le syndrome de Sjögren demeure donc problématique car en principe hors AMM, ce qui peut poser des problèmes de remboursement. Elle a longtemps été prescrite sous forme de préparation magistrale de chlorhydrate de pilocarpine avant d’exister sous une formulation disponible directement dans la pharmacopée (Salagen®). Les principaux effets secondaires sont des sueurs abondantes, des nausées et des vomissements rapportés chez 4 à 8 % des patients. Il est donc judicieux d’atteindre la dose finale de 12 à 15 mg par une escalade progressive d’un comprimé à 4 mg supplémentaire chaque semaine. Les effets secondaires peuvent disparaître en revenant au dosage précédent. L’effet est surtout ressenti par les patients au niveau buccal. La céviméline approuvée aux États-Unis reste non accessible en Europe pour le traitement de la xérophtalmie.
La glande lacrymale principale exprime les récepteurs aux hormones sexuelles, en particulier aux androgènes, ainsi que la 5α-réductase, enzyme clé du métabolisme des androgènes [45–47]. Les androgènes modulent l’anatomie de la glande lacrymale principale et sont nécessaires au maintien de ses activités métabolique et sécrétrice [48]. Le volume de larmes ne semble pas affecté par une déficience en androgènes mais peut être augmenté par un apport exogène en androgènes [49–51]. En outre, même s’il a été montré chez plusieurs espèces (dont la souris, le rat et le lapin) qu’un déficit en androgènes seul n’induit pas l’inflammation de la glande lacrymale principale [50], un apport en androgènes exogènes chez le lapin femelle ovariectomisée protège la glande lacrymale contre la dégénérescence et l’apoptose [52]. Un traitement à la testostérone permettrait aussi de diminuer l’infiltration lymphocytaire dans les glandes lacrymales dans un modèle murin de maladie auto-immune [51]. Il est suggéré que l’activité immunosuppressive des androgènes dans la glande lacrymale soit médiée par la production de la cytokine anti-inflammatoire TGF-β par les cellules épithéliales [53].
En tant que glandes sébacées, l’activité sécrétrice des glandes de Meibomius est régulée par les hormones sexuelles [54]. L’expression des récepteurs aux androgènes dans les glandes de Meibomius a été montrée chez l’homme [45, 47], chez le rat [55] et chez le lapin [47] et celle de la 5α-réductase, enzyme impliquée dans le métabolisme des androgènes, a été mise en évidence chez l’homme [45]. Une déficience en androgènes, en cas de traitement anti-androgénique par exemple, conduit à une atteinte morphologique des glandes de Meibomius, associée à une perte de la qualité et de la quantité de leurs sécrétions lipidiques [56]. Cependant, la corrélation entre déficience en androgènes et intégrité structurelle de la couche lipidique du film lacrymal n’a pu être établie que chez l’homme [56]. Les œstrogènes pourraient entraîner un dysfonctionnement meibomien avec sécheresse oculaire en agissant de façon négative sur la taille, l’activité et la production des glandes de Meibomius.
L’influence des hormones dans la sécrétion lacrymale est bien attestée tant par les études de population qui retrouvent des taux de syndromes secs plus élevés chez les femmes que chez les hommes, que par le fait que la grande majorité des patients atteints de syndrome de Sjögren sont des femmes [57, 58]. Les modifications du statut hormonal chez la femme expliquent en grande partie les effets observés dans les différents états comme la grossesse, la ménopause ou l’allaitement (tableau 1-2). Les femmes étant plus sensibles aux problèmes de sécheresse oculaire que les hommes, les œstrogènes ont été longtemps considérés comme les hormones clés dans la régulation de l’activité des glandes lacrymales. Il est maintenant admis que ce sont les androgènes qui participent de manière primordiale à cette régulation [59]. Les effets du traitement hormonal substitutif (THS) ont fait l’objet d’une littérature abondante avec de nombreux résultats contradictoires : certains auteurs rapportent une amélioration des signes de sécheresse sous THS [60, 61], alors que d’autres ne retrouvent aucun effet [62, 63]. Même dans une pathologie authentiquement inflammatoire, le rôle de la composante hormonale est certainement important : les patients atteins de syndrome de Gougerot-Sjögren auraient un taux de déhydroépiandrostérone sulfate (DHEA-S) abaissé, laissant ainsi supposer que les androgènes seraient impliqués dans la fonction sécrétrice des glandes exocrines de ces patients [64]. Chez les femmes ménopausées, la présence d’un syndrome sec est associée à des taux d’hormones sexuelles diminuées et ces derniers sont corrélés négativement à l’osmolarité des larmes [65]. De façon intéressante, des femmes souffrant d’une ménopause précoce présenteraient avant tout une altération de la qualité des larmes plus que de la sécrétion sur le plan quantitatif. Il est également possible que le déficit hormonal ait un effet pro-inflammatoire direct sur la surface oculaire comme l’atteste l’augmentation des médiateurs inflammatoires. Un dosage des androgènes chez les patients présentant un dysfonctionnement des glandes de Meibomius retrouve des taux diminués [66]. L’administration de testostérone permettrait de restituer un film lipidique quasi normal chez des animaux castrés [50] mais des résultats contradictoires existent là encore [67]. L’effet des hormones implique les métalloprotéinases de type 2. Une étude pilote évaluant l’effet de patch de testostérone chez des patientes atteintes de sécheresse oculaire semble montrer une efficacité sans entraîner d’effet secondaire lié aux androgènes [68].
Tableau 1-2 Variation des hormones selon le sexe, l’âge et la charge hormonale.
N = taux de base dans la norme.
La stabilité, la qualité et la quantité du film lacrymal sont également dépendantes de facteurs environnementaux susceptibles d’avoir un impact sur l’évaporation des larmes ou leur bon étalement sur la surface oculaire. Les conditions ambiantes (température, taux d’humidité, présence de vent ou de courant d’air) influencent de manière importante l’évaporation de la phase aqueuse du film lacrymal [69]. Il en est de même avec la taille de la surface oculaire exposée, liée à l’ouverture palpébrale. Celle-ci est elle-même spécifique de chaque individu et peut être modifiée, par exemple en cas de travail sur écran nécessitant une concentration importante. Il semble d’ailleurs qu’il n’existe pas une très bonne corrélation entre les paramètres d’évaluation de la surface oculaire (BUT) et le clignement, laissant supposer que ce dernier est sous la dépendance d’autres contrôles que la simple stimulation issue de l’état cornéen : ainsi un état de concentration intense limite le clignement probablement pour maintenir d’avantage l’attention en dépit d’un BUT raccourci [70].
[1] Gaffney EA, Tiffany JM, Yokoi N, Bron AJ. A mass and solute balance model for tear volume and osmolarity in the normal and the dry eye. Prog Retin Eye Res 2010 ; 29 : 59-78.
[2] Prydal JI, Artal P, Woon H, Campbell FW. Study of human precorneal tear film thickness and structure using laser interferometry. Invest Ophthalmol Vis Sci 1992 ; 33 : 2006-11.
[3] Prydal JI, Muir MG, Dilly PN. Comparison of tear film thickness in three species determined by the glass fibre method and confocal microscopy. Eye 1993 ; 7 : 472-5.
[4] King-Smith PE, Fink BA, Hill RM, et al. The thickness of the tear film. Curr Eye Res 2004 ; 29 : 357-68.
[5] Butovich IA. The Meibomian puzzle : combining pieces together. Prog Retin Eye Res 2009 ; 28 : 483-98.
[6] Butovich IA. On the lipid composition of human meibum and tears : comparative analysis of nonpolar lipids. Invest Ophthalmol Vis Sci 2008 ; 49 : 3779-89.
[7] Lozato PA, Pisella PJ, Baudouin C. The lipid layer of the lacrimal tear film : physiology and pathology. J Fr Ophtalmol 2001 ; 24 : 643-58.
[8] McCulley JP, Shine W. A compositional based model for the tear film lipid layer. Trans Am Ophthalmol Soc 1997 ; 95 : 79-88 ; discussion -93.
[9] McCulley JP, Shine WE. Meibomian gland function and the tear lipid layer. Ocul Surf 2003 ; 1 : 97-106.
[10] Butovich IA, Arciniega JC, Wojtowicz JC. Meibomian lipid films and the impact of temperature. Invest Ophthalmol Vis Sci 2010 ; 51 : 5508-18.
[11] Foulks GN, Bron AJ. Meibomian gland dysfunction : a clinical scheme for description, diagnosis, classification, and grading. Ocul Surf 2003 ; 1 : 107-26.
[12] Butovich IA, Wojtowicz JC, Molai M. Human tear film and meibum. Very long chain wax esters and (O-acyl)-omega-hydroxy fatty acids of meibum. J Lipid Res 2009 ; 50 : 2471-85.
[13] Souchier M, Joffre C, Gregoire S, et al. Changes in meibomian fatty acids and clinical signs in patients with meibomian gland dysfunction after minocycline treatment. Br J Ophthalmol 2008 ; 92 : 819-22.
[14] Labbe A, Brignole-Baudouin F, Baudouin C. Ocular surface investigations in dry eye. J Fr Ophtalmol 2007 ; 30 : 76-97.
[15] Johnson ME, Murphy PJ. Changes in the tear film and ocular surface from dry eye syndrome. Prog Retin Eye Res 2004 ; 23 : 449-74.
[16] Creuzot-Garcher C. Lacrimal film and the ocular surface. J Fr Ophtalmol 2006 ; 29 : 1053-9.
[17] Dartt DA. Regulation of mucin and fluid secretion by conjunctival epithelial cells. Prog Retin Eye Res 2002 ; 21 : 555-76.
[18] Gachon AM, Lacazette E. Tear lipocalin and the eye’s front line of defence. Br J Ophthalmol 1998 ; 82 : 453-5.
[19] Walcott B. The lacrimal gland and its veil of tears. News Physiol Sci 1998 ; 13 : 97-103.
[20] Ohashi Y, Ishida R, Kojima T, et al. Abnormal protein profiles in tears with dry eye syndrome. Am J Ophthalmol 2003 ; 136 : 291-9.
[21] Zierhut M, Dana MR, Stern ME, Sullivan DA. Immunology of the lacrimal gland and ocular tear film. Trends Immunol 2002 ; 23 : 333-5.
[22] Ohashi Y, Dogru M, Tsubota K. Laboratory findings in tear fluid analysis. Clin Chim Acta 2006 ; 369 : 17-28.
[23] van’t Hof W, Blankenvoorde MF, Veerman EC, Amerongen AV. The salivary lipocalin von Ebner’s gland protein is a cysteine proteinase inhibitor. J Biol Chem 1997 ; 272 : 1837-41.
[24] Dartt DA. Regulation of lacrimal gland secretion by neurotransmitters and the EGF family of growth factors. Exp Eye Res 2001 ; 73 : 741-52.
[25] Norn M. Sampling methods for tear stix tests. Acta Ophthalmol (Copenh) 1992 ; 70 : 754-7.
[26] Argueso P. Glycobiology of the ocular surface : mucins and lectins. Jpn J Ophthalmol 2013 ; 57 : 150-5.
[27] Gipson IK. Distribution of mucins at the ocular surface. Exp Eye Res 2004 ; 78 : 379-88.
[28] Marko CK, Tisdale AS, Spurr-Michaud S, et al. The ocular surface phenotype of Muc5ac and Muc5b null mice. Invest Ophthalmol Vis Sci 2014 ; 55 : 291-300.
[29] Jumblatt JE, Jumblatt MM. Regulation of ocular mucin secretion by P2Y2 nucleotide receptors in rabbit and human conjunctiva. Exp Eye Res 1998 ; 67 : 341-6.
[30] Li Y, Kuang K, Yerxa B, et al. Rabbit conjunctival epithelium transports fluid, and P2Y2(2) receptor agonists stimulate Cl(-) and fluid secretion. Am J Physiol Cell Physiol 2001 ; 281 : C595-602.
[31] Shiue MH, Kulkarni AA, Gukasyan HJ, et al. Pharmacological modulation of fluid secretion in the pigmented rabbit conjunctiva. Life Sci 2000 ; 66 : PL105-11.
[32] Gipson IK, Argueso P. Role of mucins in the function of the corneal and conjunctival epithelia. Int Rev Cytol 2003 ; 231 : 1-49.
[33] Stern ME, Beuerman RW, Fox RI, et al. A unified theory of the role of the ocular surface in dry eye. Adv Exp Med Biol 1998 ; 438 : 643-51.
[34] Acosta MC, Peral A, Luna C, et al. Tear secretion induced by selective stimulation of corneal and conjunctival sensory nerve fibers. Invest Ophthalmol Vis Sci 2004 ; 45 : 2333-6.
[35] Meneray MA, Fields TY, Bennett DJ. Gi/Go couple met-enkephalin to inhibition of cholinergic and beta-adrenergic stimulation of lacrimal secretion. Cornea 2000 ; 19 : 92-8.
[36] Mauduit P, Jammes H, Rossignol B. M3 muscarinic acetylcholine receptor coupling to PLC in rat exorbital lacrimal acinar cells. Am J Physiol 1993 ; 264 : C1550-60.
[37] Dartt DA, Shulman M, Gray KL, et al. Stimulation of rabbit lacrimal gland secretion with biologically active peptides. Am J Physiol 1988 ; 254 : G300-6.
[38] Gilbard JP, Dartt DA, Rood RP, et al. Increased tear secretion in pancreatic cholera : a newly recognized symptom in an experiment of nature. Am J Med 1988 ; 85 : 552-4.
[39] Belmonte C, Acosta MC, Gallar J. Neural basis of sensation in intact and injured corneas. Exp Eye Res 2004 ; 78 : 513-25.
[40] Viau S, Maire MA, Pasquis B, et al. Time course of ocular surface and lacrimal gland changes in a new scopolamine-induced dry eye model. Graefes Arch Clin Exp Ophthalmol 2008 ; 246 : 857-67.
[41] Leipziger J. Control of epithelial transport via luminal P2 receptors. Am J Physiol Renal Physiol 2003 ; 284 : F419-32.
[42] Nguyen DH, Toshida H, Schurr J, Beuerman RW. Microarray analysis of the rat lacrimal gland following the loss of parasympathetic control of secretion. Physiol Genomics 2004 ; 18 : 108-18.
[43] Toshida H, Nguyen DH, Beuerman RW, Murakami A. Evaluation of novel dry eye model : preganglionic parasympathetic denervation in rabbit. Invest Ophthalmol Vis Sci 2007 ; 48 : 4468-75.
[44] Viau S, Maire MA, Pasquis B, et al. Efficacy of a 2-month dietary supplementation with polyunsaturated fatty acids in dry eye induced by scopolamine in a rat model. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 1039-50.
[45] Rocha EM, Wickham LA, da Silveira LA, et al. Identification of androgen receptor protein and 5alpha-reductase mRNA in human ocular tissues. Br J Ophthalmol 2000 ; 84 : 76-84.
[46] Toda I, Wickham LA, Sullivan DA. Gender and androgen treatment influence the expression of proto-oncogenes and apoptotic factors in lacrimal and salivary tissues of MRL/lpr mice. Clin Immunol Immunopathol 1998 ; 86 : 59-71.
[47] Wickham LA, Gao J, Toda I, et al. Identification of androgen, estrogen and progesterone receptor mRNAs in the eye. Acta Ophthalmol Scand 2000 ; 78 : 146-53.
[48] Azzarolo AM, Bjerrum K, Maves CA, et al. Hypophysectomy-induced regression of female rat lacrimal glands : partial restoration and maintenance by dihydrotestosterone and prolactin. Invest Ophthalmol Vis Sci 1995 ; 36 : 216-26.
[49] Azzarolo AM, Mircheff AK, Kaswan RL, et al. Androgen support of lacrimal gland function. Endocrine 1997 ; 6 : 39-45.
[50] Sullivan DA, Krenzer KL, Sullivan BD, et al. Does androgen insufficiency cause lacrimal gland inflammation and aqueous tear deficiency ? Invest Ophthalmol Vis Sci 1999 ; 40 : 1261-5.
[51] Vendramini AC, Soo C, Sullivan DA. Testosterone-induced suppression of autoimmune disease in lacrimal tissue of a mouse model (NZB/NZW F1) of Sjogren’s syndrome. Invest Ophthalmol Vis Sci 1991 ; 32 : 3002-6.
[52] Azzarolo AM, Wood RL, Mircheff AK, et al. Androgen influence on lacrimal gland apoptosis, necrosis, and lymphocytic infiltration. Invest Ophthalmol Vis Sci 1999 ; 40 : 592-602.
[53] Stern ME, Beuerman RW, Fox RI, et al. The pathology of dry eye : the interaction between the ocular surface and lacrimal glands. Cornea 1998 ; 17 : 584-9.
[54] Baudouin C. The pathology of dry eye. Surv Ophthalmol 2001 ; 45 Suppl 2 : S211-20.
[55] Sullivan DA, Sullivan BD, Ullman MD, et al. Androgen influence on the meibomian gland. Invest Ophthalmol Vis Sci 2000 ; 41 : 3732-42.
[56] Krenzer KL, Dana MR, Ullman MD, et al. Effect of androgen deficiency on the human meibomian gland and ocular surface. J Clin Endocrinol Metab 2000 ; 85 : 4874-82.
[57] McCarty CA, Bansal AK, Livingston PM, et al. The epidemiology of dry eye in Melbourne, Australia. Ophthalmology 1998 ; 105 : 1114-9.
[58] Moss SE, Klein R, Klein BE. Incidence of dry eye in an older population. Arch Ophthalmol 2004 ; 122 : 369-73.
[59] Stern ME, Gao J, Siemasko KF, et al. The role of the lacrimal functional unit in the pathophysiology of dry eye. Exp Eye Res 2004 ; 78 : 409-16.
[60] Wenderlein M, Mattes S. The « dry eye » phenomenon and ovarian function. Study of 700 women pre- and postmenopausal. Zentralbl Gynakol 1996 ; 118 : 643-9.
[61] Okon A, Jurowski P, Gos R. The influence of the hormonal replacement therapy on the amount and stability of the tear film among peri- and postmenopausal women. Klin Oczna 2001 ; 103 : 177-81.
[62] Schaumberg DA, Sullivan DA, Buring JE, Dana MR. Prevalence of dry eye syndrome among US women. Am J Ophthalmol 2003 ; 136 : 318-26.
[63] Piwkumsribonruang N, Somboonporn W, Luanratanakorn P, et al. Effectiveness of hormone therapy for treating dry eye syndrome in postmenopausal women : a randomized trial. J Med Assoc Thai 2010 ; 93 : 647-52.
[64] Porola P, Laine M, Virkki L, et al. The influence of sex steroids on Sjogren’s syndrome. Ann N Y Acad Sci 2007 ; 1108 : 426-32.
[65] Gagliano C, Caruso S, Napolitano G, et al. Low levels of 17-beta-oestradiol, oestrone and testosterone correlate with severe evaporative dysfunctional tear syndrome in postmenopausal women : a case-control study. Br J Ophthalmol 2014 ; 98 : 371-6.
[66] Smith JA, Vitale S, Reed GF, et al. Dry eye signs and symptoms in women with premature ovarian failure. Arch Ophthalmol 2004 ; 122 : 151-6.
[67] Song X, Zhao P, Wang G, Zhao X. The effects of estrogen and androgen on tear secretion and matrix metalloproteinase-2 expression in lacrimal glands of ovariectomized rats. Invest Ophthalmol Vis Sci 2014 ; 55 : 745-51.
[68] Nanavaty MA, Long M, Malhotra R. Transdermal androgen patches in evaporative dry eye syndrome with androgen deficiency : a pilot study. Br J Ophthalmol 2014 ; 98 : 567-9.
[69] Bron AJ, Sci FM, Tiffany JM. The contribution of meibomian disease to dry eye. Ocul Surf 2004 ; 2 : 149-65.
[70] Wu Z, Begley CG, Situ P, Simpson T. The effects of increasing ocular surface stimulation on blinking and sensation. Invest Ophthalmol Vis Sci 2014 ; 55 : 1555-63.
P.-Y. Robert, J.-P. Adenis
La ligne grise marque sur le bord libre la séparation de la paupière en lamelles postérieure (orifices des glandes de Meibomius) et antérieure (follicules des cils). Le pli palpébral supérieur marque la limite supérieure des insertions cutanées de l’aponévrose du releveur. La conjonctive a un rôle immunitaire par le tissu lymphoïde (mucosa-associated lymphoid tissue [MALT]) qui lui est associé. Le tendon canthal externe est solide, attaché au rebord orbitaire externe sur le tubercule de Whitnall. Le tendon canthal interne a un rôle dans la pompe lacrymale, avec un chef antérieur sur la crête lacrymale antérieure et un chef postérieur sur la crête lacrymale postérieure. La sécrétion des larmes comprend : des glandes lipidiques situées sur le bord libre ; des glandes aqueuses s’abouchant dans le cul-de-sac conjonctival ; des glandes mucineuses situées sur la surface oculaire.
La pompe lacrymale est un système actif, dont le bon fonctionnement est conditionné par la bonne position et ouverture des points lacrymaux, la faible profondeur du lac lacrymal et la perméabilité des voies lacrymales excrétrices.
Nous décrirons ici l’anatomie des paupières dans leur contribution à la physiologie de la surface oculaire, notamment dans la fabrication, la sécrétion, l’étalement et l’excrétion du film lacrymal.
La fente palpébrale normale est oblique en haut et en dehors, cette obliquité dite « mongoloïde » favorise le drainage physiologique des larmes [1]. À l’état normal, la paupière supérieure recouvre le limbe supérieur de 1 à 2 mm et la paupière inférieure affleure le limbe inférieur [2]. Les paupières sont séparées en lamelles antérieure (peau + orbiculaire) et postérieure (tarse + conjonctive). Cette division, clivable chirurgicalement par un espace dépourvu d’adhérences à la face antérieure du tarse, constitue le socle de toute chirurgie plastique ou reconstructrice des paupières. Les paupières contiennent enfin les glandes qui sécrètent les différentes phases du film lacrymal :
la partie muqueuse qui assure l’accroche du film sur la surface oculaire ;
la partie aqueuse qui représente la quasi-totalité du volume des larmes et permet le larmoiement émotionnel ;
la partie lipidique superficielle (meibum), de structure complexe qui joue le rôle de surfactant et prévient l’évaporation prématurée du film.
Le bord libre des paupières constitue la limite entre les parties muqueuse (conjonctivale) et malpighienne (cutanée) des paupières. D’une largeur de 2 mm, il est constitué en avant par les cils et en arrière par les orifices des glandes de Meibomius. Entre les deux se trouve la ligne grise (fig. 1-20), repère chirurgical. Une incision sur la ligne grise permet de séparer, lors d’une marginoplastie, lamelle antérieure (peau + orbiculaire) et lamelle postérieure (tarse + conjonctive). La ligne grise correspond également histologiquement à la partie la plus superficielle de l’orbiculaire, appelée muscle de Riolan [3].
Lorsque l’on examine les paupières après instillation de vert de lissamine, une ligne se forme sur le bord libre. Cette ligne, appelée ligne de Marx, correspond à la zone de contact du bord libre avec la surface oculaire, elle peut se situer soit en avant soit en arrière des orifices des glandes de Meibomius [4].
Fig. 1-20 Ligne grise.
La partie cutanée des paupières est constituée de la peau et de l’orbiculaire. En paupière supérieure, les fibres terminales de l’aponévrose du releveur s’insèrent directement dans le tissu musculaire de l’orbiculaire, jusqu’à la région du pli palpébral supérieur (fig. 1-21), et assurent ainsi un mouvement « harmonieux et synchrone » de la paupière supérieure. L’orbiculaire, dérivant du deuxième arc branchial, est lui-même individualisé en trois fuseaux concentriques : prétarsal au contact du bord libre ; préseptal au-delà du pli palpébral ; orbitaire pour la partie la plus périphérique. Les lignes de force de l’orbiculaire et des autres muscles du clignement (fig. 1-22) sont responsables des principales lignes et rides cutanées, qui constituent autant de repères chirurgicaux dans la chirurgie palpébrale.
Le tarse constitue la partie solide des paupières, il assure ainsi la stabilité palpébrale et la protection du globe oculaire. Il est constitué de collagène et est parcouru dans son épaisseur par les glandes de Meibomius (fig. 1-23). En avant, il est séparé de l’aponévrose du releveur par un espace lâche qui constitue l’espace de dissection naturel entre lamelles antérieure et postérieure. Le tarse contient également des fibres élastiques, réparties principalement le long des attaches avec la conjonctive et autour des glandes de Meibomius. La présence de ces fibres élastiques explique la capacité du tarse à se déformer et à reprendre sa forme lors des mouvements verticaux de la paupière. Chez le sujet âgé et chez les patients atteints de floppy eyelid syndrome, les fibres élastiques sont altérées et la paupière se distend, pouvant provoquer un trouble statique (entropion ou ectropion). Les fibres élastiques entourant les glandes de Meibomius sont également impliquées dans la sécrétion active du meibum.
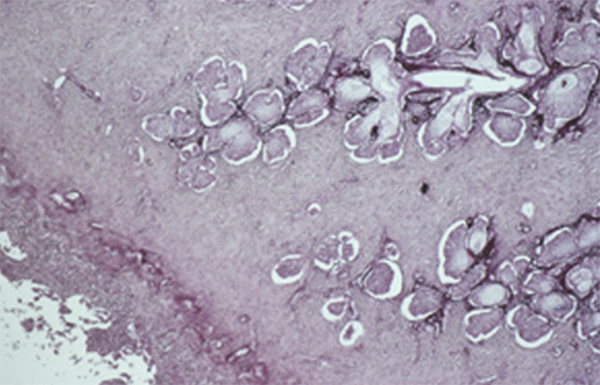
Fig. 1-23 Fibres élastiques entourant les glandes de Meibomius dans le tarse.
La conjonctive est un épithélium muqueux. Elle contient des cellules caliciformes, responsables de la sécrétion de la phase muqueuse des larmes (fig. 1-24), et des cellules de l’immunité formant le tissu lymphoïde associé aux muqueuses (mucosa-associated lymphoid tissue [MALT]). Elle est solidaire du tarse, duquel elle est inséparable chirurgicalement.
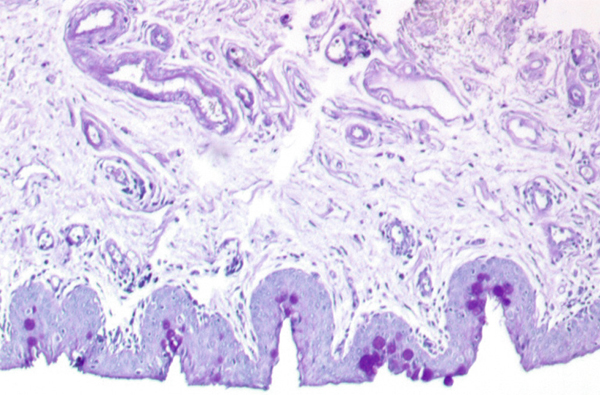
Fig. 1-24 Cryptes de Henle (concentration de cellules caliciformes) au sein de la conjonctive palpébrale.
Le canthus externe est le plus solide, pour des raisons anatomiques (l’orbite est inclinée de 23° en dehors par rapport à l’axe sagittal, donc la force du releveur s’exerce davantage sur le canthus externe). Le ligament canthal externe, bande nacrée facile à disséquer, s’insère sur un petit tubercule osseux (le tubercule de Whitnall) qui donne également insertion au septum orbitaire et à l’aileron latéral du releveur (fig. 1-25) [5]. Le cul-de-sac conjonctival externe est maintenu profond par l’expansion conjonctivale du droit externe [6].
Le fascia profond de l’orbiculaire est attaché au périoste de l’orbite par un ligament. Cette attache est plus développée au niveau du rebord inféro-externe et participe également aux connexions entre le tarse et le rebord orbitaire externe. Ce ligament fusionne latéralement avec le SMAS (superficial musculoaponeurotic system) et rejoint en particulier l’aponévrose temporale. Chez le sujet âgé, ce ligament se relâche et l’orbiculaire préseptal, libre de ses attaches, arrive à migrer en prétarsal, réalisant ainsi l’entropion spasmodique [7].
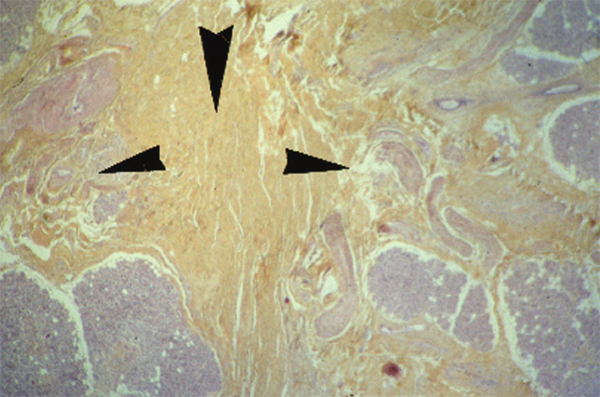
Fig. 1-25 Aileron latéral du releveur séparant la glande lacrymale en ses deux lobes.
Le canthus interne est d’organisation plus complexe et constitué de tissus plus lâches. Le tendon canthal médial est formé de deux chefs distincts, séparés par l’appareil excréteur lacrymal. Le chef antérieur est amarré à la crête lacrymale antérieure par un tendon, mais la convexité des paupières est assurée par l’insertion du chef postérieur sur la crête lacrymale postérieure. Le cul-de-sac conjonctival interne est maintenu en profondeur par l’expansion conjonctivale du droit interne [6].
La sécrétion du meibum est réalisée par trois types de glandes lipidiques : les glandes de Meibomius (glandes tarsales), de Zeiss et de Moll (associées aux follicules pileux des cils). Ces glandes sont en connexion étroite avec les muscles de la statique et peuvent être perturbées par un dysfonctionnement de l’élasticité palpébrale.
Les glandes de Meibomius sont au nombre de vingt-cinq à trente [2]. Elles sont situées au centre du tarse et sont mises en tension à chaque clignement. L’élasticité du tarse participe à leur bon fonctionnement. Le dysfonctionnement des glandes de Meibomius a été reconnu comme une cause de kératoconjonctivite non inflammatoire [8]. Les glandes de Meibomius présentent également des récepteurs pour les œstrogènes qui augmentent avec l’âge, quel que soit le sexe, sans conséquence sur la qualité du film lacrymal [9].
Les glandes de Moll sont des glandes sudoripares (participant à la thermorégulation), dédiées exclusivement au follicule pileux des cils. Elles s’abouchent dans le follicule par un petit canal. Il est à présent admis que ces glandes sécrètent dès la naissance des agents actifs contre les micro-organismes, en particulier lysozyme et immunoglobulines A [10].
Les glandes de Zeiss sont au nombre de deux par cil [2].
La sécrétion de la phase aqueuse des larmes est assurée en très grande partie par la glande lacrymale principale, qui est en outre responsable du larmoiement émotionnel. La glande lacrymale principale est située dans une cavité naturelle de l’os frontal, la fossette lacrymale. Elle est constituée d’acini qui se déversent dans le cul-de-sac supérieur par cinq à douze canaux excréteurs qu’il est possible de repérer cliniquement en éversant le tarse supérieur.
La glande lacrymale principale est traversée par l’aileron latéral du releveur qui scinde son pédicule vasculonerveux et ses canaux excréteurs en deux pédicules distincts. Cette disposition permet de définir deux lobes : un lobe palpébral (inférieur et en arrière) et un lobe orbitaire (supérieur et en avant).
Les glandes lacrymales accessoires sont les glandes de Krause et de Wolfring (fig. 1-26).
Ces glandes accessoires assurent la sécrétion aqueuse de base et expliquent l’absence de sécheresse oculaire lors des exérèses complètes de la glande lacrymale principale.
La glande de Wolfring a une structure en acini, similaire à celle de la glande lacrymale principale, et présente des canaux excréteurs vers la partie palpébrale de la conjonctive qui s’abouchent en un ou plusieurs points proches du cul-de-sac [11].
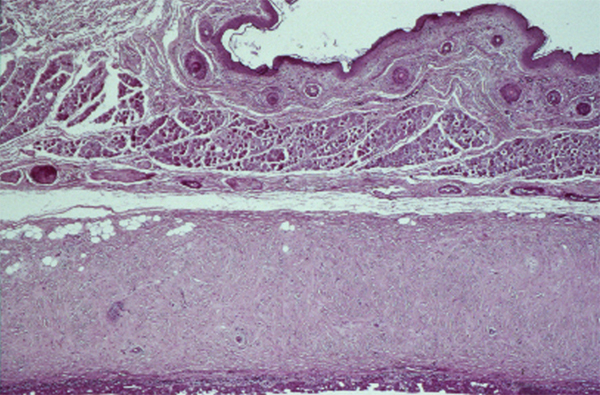
Fig. 1-26 Glandes de Wolfring dans le cul-de-sac supérieur.
Il n’y a pas de glande au sens anatomique du terme pour la sécrétion de la partie mucineuse des larmes. Celle-ci est assurée par les cellules caliciformes conjonctivales qui sont regroupées parfois pour former des excroissances dans la muqueuse conjonctivale, appelées « cryptes de Henle », principalement au fond des culs-de-sac (voir fig. 1-24).
L’examen des points lacrymaux est capital devant tout trouble de la surface oculaire. Ils sont constitués d’un anneau fibreux, l’angustia, assurant l’effet de ventouse à chaque clignement. Leur bon fonctionnement implique leur ouverture (mais pas leur béance) et leur orientation correcte en direction du lac lacrymal.
Les canalicules sont habituellement décrits avec une partie verticale, puis une partie horizontale séparées par une petite valve. La partie horizontale présente ensuite une partie intramusculaire (dans le muscle de Riolan, puis dans le muscle de Duverney) puis une partie extramusculaire.
Les canalicules s’abouchent ensuite dans le sac lacrymal de façon très variable : soit directement, soit par l’intermédiaire d’un canal d’union, soit par l’intermédiaire d’un renflement (le sinus de Maier). À l’entrée du sac est décrite une autre valve : la valve de Rosenmüller. Ces valves sont des valves dynamiques, par mise en tension transitoire de la muqueuse lacrymale.
Outre la perméabilité du système, le bon fonctionnement de la pompe lacrymale implique une bonne position des points lacrymaux, un lac lacrymal plat et un clignement efficace.
Une bonne excrétion des larmes implique une anatomie conservée de tout l’angle interne des paupières. Les larmes s’écoulent de dehors en dedans et s’accumulent dans un triangle appelé lac lacrymal, défini entre la caroncule et les deux points lacrymaux. Pour que la pompe lacrymale fonctionne, les paupières doivent être suffisamment tendues et maintenues en arrière (insérées sur la crête lacrymale postérieure par le chef postérieur du tendon canthal interne). Lorsqu’après un traumatisme, le muscle de Duverney est repositionné incorrectement trop en avant, le lac lacrymal devient creux, la pompe lacrymale ne fonctionne plus et les larmes stagnent, constituant le « syndrome du Centurion », par une antéroposition des paupières dans l’angle interne.
À chaque clignement, les points lacrymaux sont attirés médialement dans le lac lacrymal, créant une pression positive dans le lac lacrymal et une pression négative dans la lumière canaliculaire. Il se produit ainsi un effet de ventouse qui permet une excrétion active des larmes.
Le muscle responsable de la pompe lacrymale est un chef postérieur de l’orbiculaire préseptal, qui s’insère sur la crête lacrymale postérieure et passe en pont devant le diaphragme lacrymal. Ce muscle a été mentionné pour la première fois par le chirurgien français Jacques-Francois-Marie Duverney et décrit ensuite par de nombreux chirurgiens dont William Horner.
Outre les problèmes esthétiques, la bonne position et l’intégrité de ce muscle sont indispensables à un bon fonctionnement de la pompe lacrymale et ne sont pas sans conséquence sur les pathologies chroniques de la surface oculaire.
[1] Aguilar GL, Nelson C. Eyelid and anterior orbital anatomy. In : Hornblass A. Ed. Oculoplastic, orbital and lacrimal surgery. Baltimore : Williams and Wilkins ; 1988, p. 3-14.
[2] Ducasse A. Anatomie des paupières. In : Adenis JP, Morax S. Eds. Pathologie orbito-palpébrale. Paris : Masson ; 1998, p. 3-10.
[3] Wulc AE, Dryden RM, Khatchaturian T. Where is the gray line ? Arch Ophthalmol 1987 ; 105 : 1092-8.
[4] Doughty MJ, Naase T, Donald C, et al. Visualisation of « Marx’s line » along the marginal eyelid conjunctiva of human subjects with lissamine green dye. Ophthalmic Physiol Opt 2004 ; 24 : 1-7.
[5] Knize DM. The superficial lateral canthal tendon : anatomic study and clinical application to lateral canthopexy. Plast Reconstr Surg 2002 ; 109 : 1149-57 ; discussion 1158-63.
[6] Ritleng P. Anatomie des angles palpébraux. In : Adenis JP, Morax S. Eds. Pathologie orbito-palpébrale. Paris : Masson ; 1998, p. 15-22.
[7] Muzaffar AR, Mendelson BC, Adams WP, Jr. Surgical anatomy of the ligamentous attachments of the lower lid and lateral canthus. Plast Reconstr Surg 2002 ; 110 : 873-84 ; discussion 897-911.
[8] Bron AJ, Tiffany JM. The meibomian glands and tear film lipids. Structure, function, and control. Adv Exp Med Biol 1998 ; 438 : 281-95.
[9] Auw-Haedrich C, Feltgen N. Estrogen receptor expression in meibomian glands and its correlation with age and dry-eye parameters. Graefes Arch Clin Exp Ophthalmol 2003 ; 241 : 705-9.
[10] Stoeckelhuber M, Stoeckelhuber BM, Welsch U. Human glands of Moll : histochemical and ultrastructural characterization of the glands of Moll in the human eyelid. J Invest Dermatol 2003 ; 121 : 28-36.
[11] Bergmanson JP, Doughty MJ, Blocker Y. The acinar and ductal organisation of the tarsal accessory lacrimal gland of Wolfring in rabbit eyelid. Exp Eye Res 1999 ; 68 : 411-21.
Adenis JP, Maes-Castellarin S. Anatomie du ligament de Whitnall. In : Adenis JP, Morax S. Eds. Pathologie orbito-palpébrale. Paris : Masson ; 1998, p. 10-4.
Beard C, Quickert M. Anatomy of the orbit. Birmingham : Aesculapius ; 1977.
Carter SR, Seiff SR, Grant PE, Vigneron DB. The Asian lower eyelid : a comparative anatomic study using high-resolution magnetic resonance imaging. Ophthal Plast Reconstr Surg 1998 ; 14 : 227-34.
Codère F, Tucker NA, Renaldi B. The anatomy of Whitnall ligament. Ophthalmology 1995 ; 102 : 2016-9.
Cook T, Goldberg RA, Douglas R, et al. The horizontal dynamic of the medial and lateral canthus. Ophthal Plast Reconstr Surg 2003 ; 19 : 297-304.
Dryden RM, Leibsohn J, Wobig JL. Senile entropion. Arch Ophthalmol 1978 ; 96 : 1883.
Gausas RE, Gonnering RS, Lemke BN, et al. Identification of human orbital lymphatics. Ophthal Plast Reconstr Surg 1999 ; 15 : 252-9.
Hawes MJ, Dortzbach RK. The microscopic anatomy of the lower eyelid retractors. Arch Ophthalmol 1964 ; 57 : 943.
Hwang K, Cho HJ, Chung IH. Pattern of the temporal branch of the facial nerve in the upper orbicularis oculi muscle. J Craniofac Surg 2004 ; 15 : 373-6.
Hwang K, Kim DJ, Chung RS. Pretarsal fat compartment in the lower eyelid. Clin Anat 2001 ; 14 : 179-83.
Hwang K, Kim DJ, Chung RS, et al. An anatomical study of the junction of the orbital septum and the levator aponeurosis in Orientals. Br J Plast Surg 1998 ; 51 : 594-8.
Hwang K, Kim BG, Kim YJ, Chung IH. Lateral septoaponeurotic artery : source of bleeding in blepharoplasty performed in asians. Ann Plast Surg 2003 ; 50 : 156-9.
Jeong S, Lemke BN, Dortzbach RK, et al. The Asian upper eyelid : an anatomical study with comparison to the Caucasian eyelid. Arch Ophthalmol 1999 ; 117 : 907-12.
Kawai K, Imanishi N, Nakajima H, et al. Arterial anatomical features of the upper palpebra. Plast Reconstr Surg 2004 ; 113 : 479-84.
Knize DM. A study of the supraorbital nerve. Plast Reconstr Surg 1995 ; 96 : 564-9.
Nemoto Y. Structure and magnetic resonance imaging of the fiber connection between Whitnall’s ligament and the superior wall of the orbit. Jpn J Ophthalmol 1996 ; 40 : 404-11.
Nemoto Y, Sakaue T, Kubota N. Observation of the eyelid structure with opening and closing of the eye in magnetic resonance imaging. Nippon Ganka Gakkai Zasshi 1994 ; 98 : 846-51.
Persichetti P, Di Lella F, Delfino S, Scuderi N. Adipose compartments of the upper eyelid : anatomy applied to blepharoplasty. Plast Reconstr Surg 2004 ; 113 : 373-8 ; discussion 379-80.
Reifler DM. Early descriptions of Horner’s muscle and the lacrimal pump. Surv Ophthalmol 1996 ; 41 : 127-34.
Santini J. Anatomie chirurgicale des structures superficielles de la face appliquée à la chirurgie des tumeurs cutanées. In : Beauvillain de Montreuil C, Bessède JP. Eds. Chirurgie des tumeurs cutanées de la face. Paris : Société française d’ORL et de chirurgie de la face et du cou ; 2002, p. 61-75.
Wolfram-Gabel R, Sick H. Microvascularization of the mucocutaneous junctions of the head in fetuses and neonates. Cells Tissues Organs 2002 ; 171 : 250-9.
Yuzuriha S, Matsuo K, Kushima H. An anatomical structure which results in puffiness of the upper eyelid and a narrow palpebral fissure in the Mongoloid eye. Br J Plast Surg 2000 ; 53 : 466-72.
F. Majo, T. Hoang-Xuan
Un chapitre sur le limbe n’a d’intérêt que s’il aborde son anatomie fonctionnelle en plus de son anatomie descriptive, tant cette région de l’œil joue un rôle primordial pour le bon fonctionnement de la surface oculaire. Le limbe est impliqué dans la régulation de l’inflammation de la surface oculaire et dans le renouvellement de l’épithélium de la cornée ; il est le lieu de résidence des cellules impliquées dans la défense de la cornée ; il est composé d’un environnement anti-angiogénique empêchant les vaisseaux et les lymphatiques de se développer dans la cornée. Mais le rôle majeur attribué au limbe depuis bientôt 30 ans est celui du renouvellement physiologique de l’épithélium cornéen grâce aux cellules souches épithéliales que ce site héberge. L’absence de ces cellules conduirait à une conjonctivalisation de la cornée. Les pathologies concernées sont regroupées sous le vocable de syndrome d’insuffisance en cellules souches limbiques. Il est indispensable de reconstruire cette unité fonctionnelle pour réparer une surface oculaire détruite.
Le mot limbe est défini dans le dictionnaire comme le bord gradué d’un cercle ou d’un morceau de cercle. En astronomie, le limbe est le bord lumineux du disque de la lune. « Les limbes » dans la religion catholique sont des lieux situés dans l’au-delà, aux marges de l’enfer. On comprend donc pourquoi ce nom a été choisi pour désigner la frontière circulaire qui sépare la cornée transparente de la sclère blanche recouverte par la conjonctive vascularisée.
Le limbe ne peut pas échapper à notre observation lors de l’examen à la lampe à fente. Il joue un rôle primordial dans la physiologie de la surface oculaire. Par ses éléments, il contribue à la défense de la cornée, empêche la pénétration de celle-ci par les vaisseaux sanguins et lymphatiques, et assure le renouvellement de l’épithélium cornéen grâce à ses cellules souches.
Le limbe, en plus d’assurer l’écoulement de l’humeur aqueuse, doit apporter les ressources nutritives à la cornée. Le flux de nutriments dans la cornée périphérique est très lent et le fait que la cornée centrale garde sa transparence signifierait qu’elle dépend très peu de sa partie périphérique pour son fonctionnement physiologique. L’observation que des grandes incisions cornéennes périphériques n’affectent pas la transparence cornéenne en est une autre preuve.
Le limbe est la frontière anatomique entre la cornée avasculaire et transparente et la sclère blanche recouverte par la conjonctive richement vascularisée. C’est à son niveau que se fait la transition entre l’épithélium de la cornée et celui de la conjonctive bulbaire. Historiquement, le limbe a été individualisé car il contient le canal de Schlemm [1] et intéressait les chirurgiens du glaucome. Il existe en fait trois limbes (fig. 1-27a) [2] :
le limbe des anatomopathologistes (fig. 1-27b) : il est compris entre un plan de section antérieur, qui rejoint les extrémités antérieures de la couche de Bowman en surface et de la membrane de Descemet en profondeur (jonction cornéolimbique), et un plan de section postérieur 1,5 mm en arrière, perpendiculaire à la sclère et allant de l’insertion de la conjonctive bulbaire au fond de l’angle iridocornéen (jonction cornéosclérale). Il comprend le canal de Schlemm et le trabéculum ;
le limbe des histologistes (voir fig. 1-27b) : il correspond à la ligne d’enchâssement des fibres de collagène de la cornée périphérique dans la sclère. Cette ligne commence en surface à l’extrémité de la couche de Bowman, dessine une parabole à sommet postérieur vers le canal de Schlemm et se termine dans la chambre antérieure, à l’extrémité de la membrane de Descemet ;
le limbe des chirurgiens (voir fig. 1-27a) : c’est le repère macroscopique qui marque la limite entre le cornée transparente et la sclère blanche où s’insère la conjonctive bulbaire.
Les vaisseaux artériels épiscléraux du limbe s’anastomosent avec leurs homologues conjonctivaux (fig. 1-28). Dans la sclère, des canaux artériels et un plexus veineux sont reliés au canal de Schlemm. Les lymphatiques conjonctivaux limbiques sont organisés en trois groupes : le système périphérique associé aux extrémités terminales du réseau artériel limbique ; les lymphatiques radiaires traversant les palissades de Vogt ; des branches profondes issues des lymphatiques radiaires. Les réseaux nasal et temporal sont drainés respectivement dans les ganglions sous-maxillaires et prétragiens.
Les nerfs sont principalement sensitifs et se terminent autour des vaisseaux sanguins et dans le tissu conjonctif. La plupart d’entre eux sont myélinisés. Le limbe est le lieu de passage des 44 branches sensitives des nerfs ciliaires longs issus du nerf trijumeau qui irradient vers le centre de la cornée [3], le tissu le plus innervé de l’organisme [4]. Il existe aussi une innervation végétative.
L’épithélium limbique est un épithélium de transition entre deux micro-environnements biologiques fondamentalement différents, conjonctival de type lymphoïde et vascularisé, et cornéen avasculaire et très innervé. Il est organisé comme celui de la cornée centrale, mais il est plus épais avec dix à quinze couches cellulaires et est dépourvu de cellules à mucus. Les cellules basales sont plus petites et plus compactes que leurs homologues cornéennes (fig. 1-29a). Elles contiennent dans leur cytoplasme des granules mélanocytaires. Le pigment est synthétisé par les mélanocytes situés dans la couche basale et est transféré dans les cellules épithéliales. L’ultrastructure des cellules limbiques est peu différente de celle des cellules cornéennes, avec des mitochondries de plus grande taille et des tonofilaments cytoplasmiques associés aux desmosomes. Dans les couches basale et suprabasale de l’épithélium, outre des mélanocytes, on trouve des lymphocytes et des cellules de Langerhans caractérisées par leurs granules de Birbeck en forme de raquette de tennis. Le stroma conjonctival limbique contient des fibroblastes, des mélanocytes, des macrophages, des mastocytes, des lymphocytes, des plasmocytes et des polynucléaires. Il est séparé de la sclère par la capsule de Tenon, lame de collagène dense, et l’épisclère, tissu conjonctif serré et peu cellulaire.
L’épithélium et le stroma conjonctival limbique constituent des papilles comme dans le derme. Ces papilles sont orientées radiairement et sont appelées palissades de Vogt (fig. 1-29b). Elles mesurent 0,5 mm de large pour 2 à 4 mm de long. De fins vaisseaux et nerfs courent le long de leur mur externe alors que des canaux lymphatiques de gros diamètre sillonnent leur partie axiale (fig. 1-29c). Les palissades de Vogt seraient le lieu de résidence des cellules souches de la cornée [5–7].
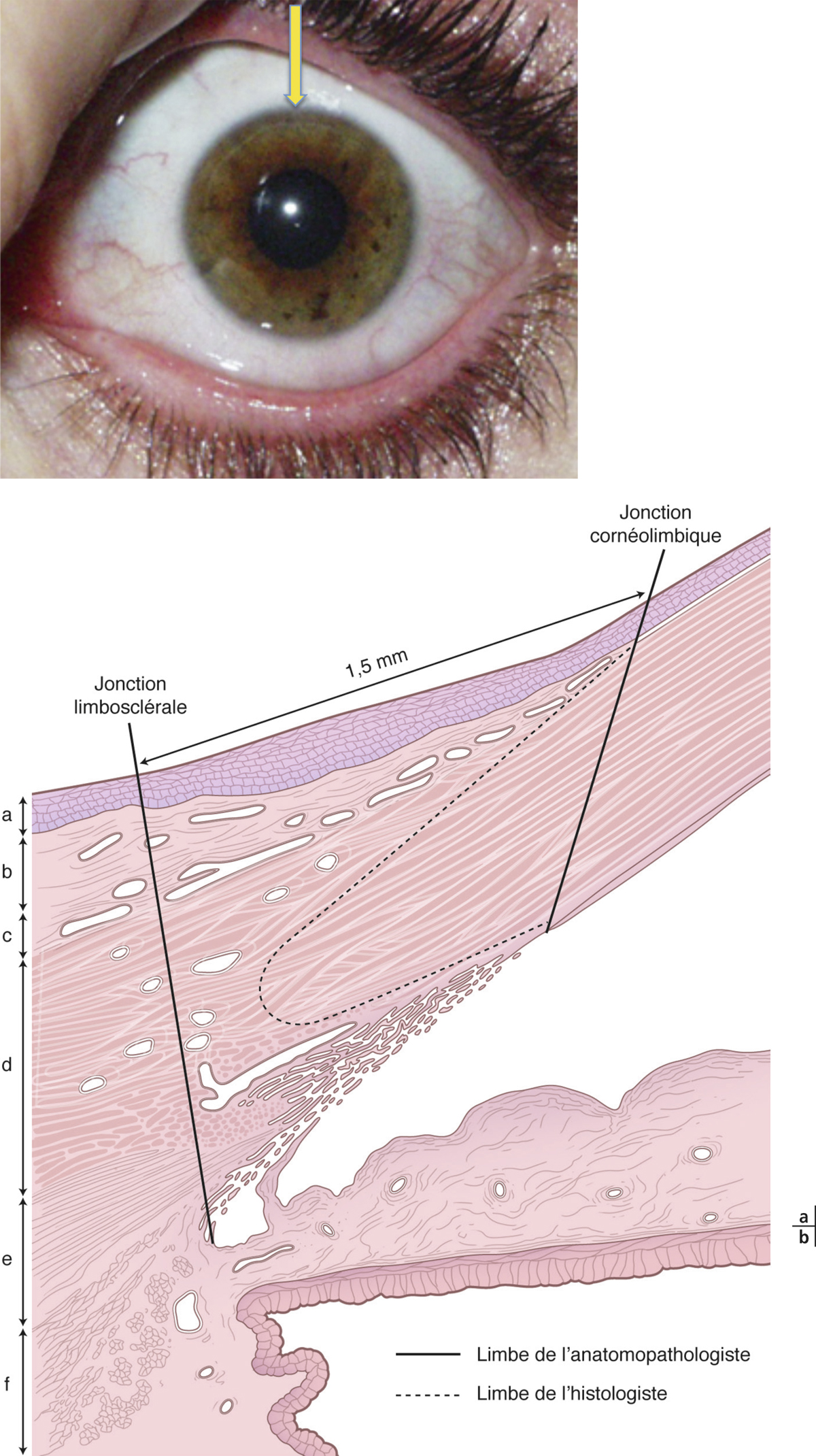
Fig. 1-27 Le limbe selon Hogan, Alvaradero et Wedel [2].
a. Le limbe des chirurgiens (flèche). b. Le limbe des anatomopathologistes (zone comprise entre les traits pleins) et celui des histologistes (ligne pointillée).
a : épithélium conjonctival ; b : stroma conjonctival ; c : capsule de Tenon et épisclère ; d : stroma limbique et cornéoscléral ; e : muscle ciliaire ; f : partie circulaire et radiaire du muscle ciliaire.
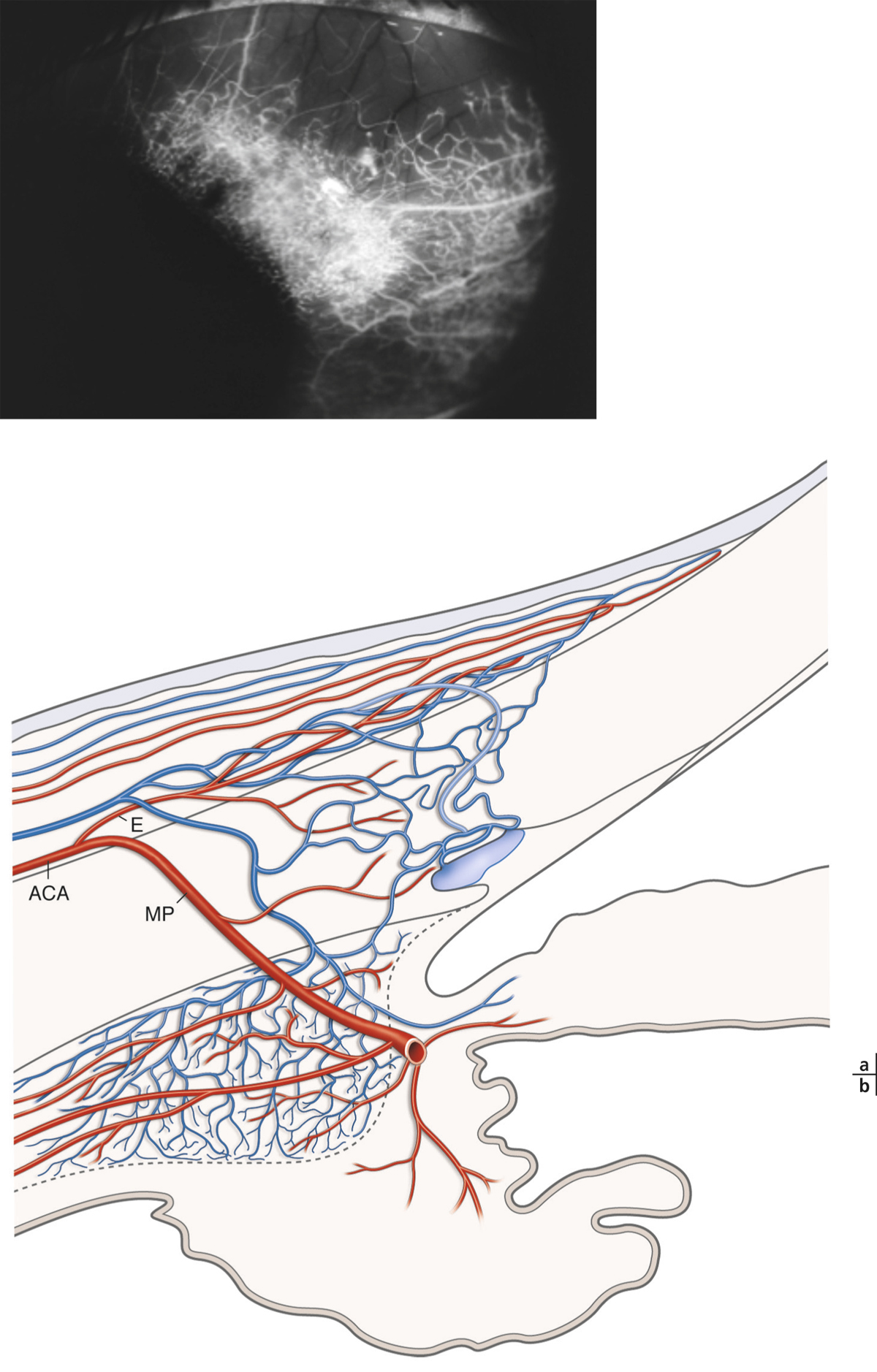
Fig. 1-28 Vascularisation du limbe.
a. Angiographie à la fluorescéine de la région limbique. Forte activité vasculaire en regard d’une épisclérite. b. Réseau vasculaire de la région limbique : artériel (rouge) et veineux (bleu). La vascularisation est terminale au niveau du stroma limbique et il existe des connexions entre les réseaux superficiel et profond. Dans les plans plus profonds, des veines sclérales entrent en contact avec le canal de Schlemm.
ACA : artère ciliaire antérieure ; E : branche épisclérale de l’ACA ; MP : branche perforante.
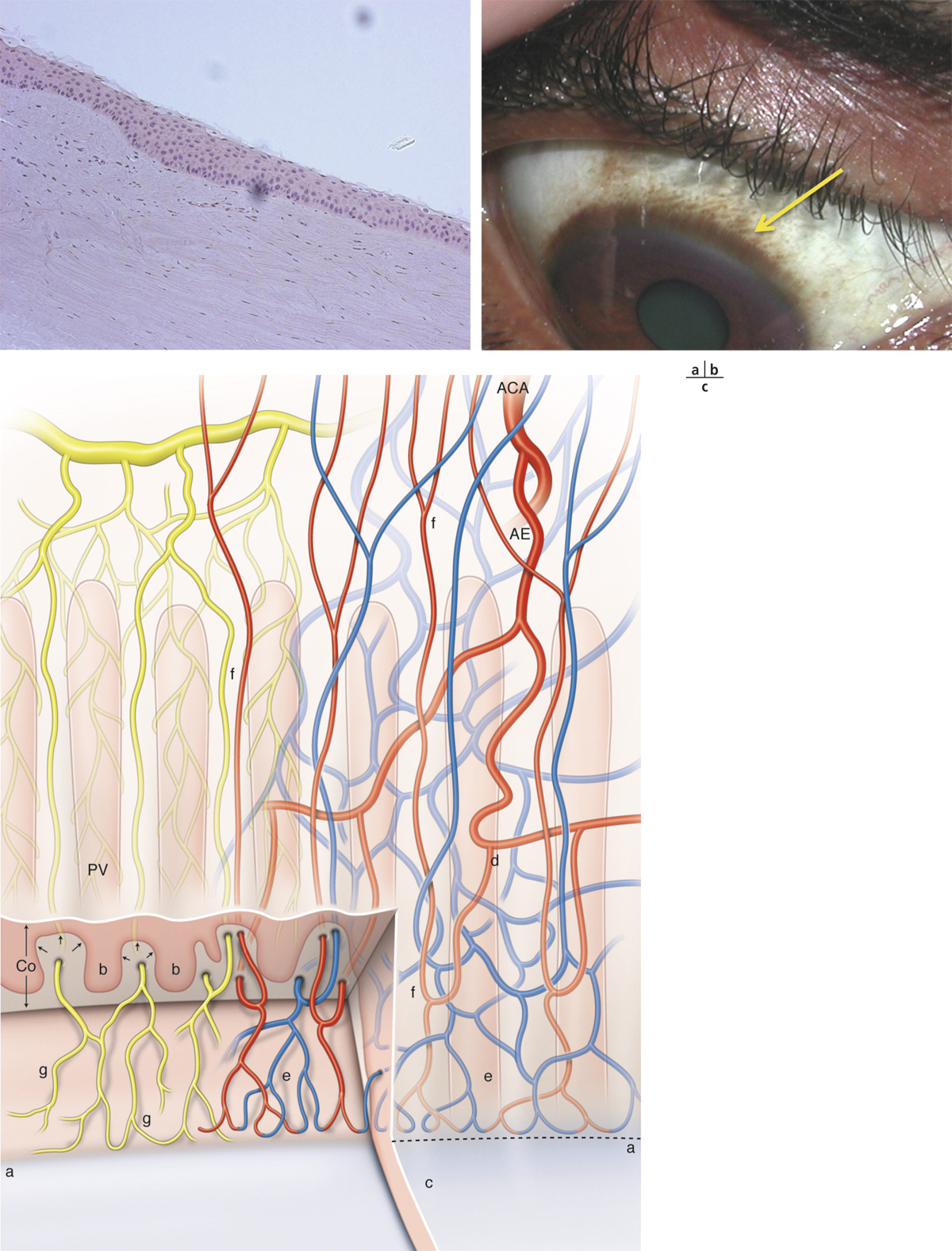
Fig. 1-29 Palissades de Vogt.
a. Coupe histologique humaine de l’épithélium et d’une partie du stroma antérieur du limbe cornéoscléral. À droite de la photo, on retrouve l’épithélium de la cornée périphérique constitué de cinq à sept couches. Puis au niveau du limbe, l’épithélium a une épaisseur qui augmente pour atteindre dix à douze couches. Les cellules basales sont verticalisées et plus nombreuses. On peut noter le changement au niveau de la matrice, vascularisée au niveau du limbe et avasculaire au niveau de la cornée périphérique. b. Région limbique supérieure d’un patient mélanoderme. Chez le patient mélanoderme, les mélanocytes ont une propension à se concentrer dans les palissades de Vogt (flèche). c. Représentation schématique des arcades vasculaires périphériques, des lymphatiques et des palissades de Vogt.
ACA : artère ciliaire antérieure ; Co : section de la conjonctive montrant les palissades de Vogt. Celles-ci sont constituées de papilles stromales (flèches) et de bandes de cellules épithéliales appelées rete pegs ; AE : artère épisclérale ; PV : palissades de Vogt ; a : extrémité de la membrane de Bowman à la périphérie cornéenne ; b : extrémité cornéenne des palissades de Vogt ; c : cornée périphérique ; d : plexus artériels superficiels. En jaune/vert, le réseau lymphatique constitué d’une partie profonde et d’une partie superficielle ; e : vascularisation terminale ; f : artère limbique, branche de l’artère épisclérale (AE) ; g : vaisseaux lymphatiques.
Tous les tissus du corps humain possèdent leurs cellules souches. Par exemple, celles du sang sont dans la moelle osseuse et celles de la peau dans le bulbe, partie du follicule pileux [8]. Les cellules souches de l’épithélium de la cornée sont quant à elles localisées dans l’épithélium limbique, probablement sous la forme d’amas cellulaires situés dans des cryptes au niveau des palissades de Vogt [9–13]. Ces niches seraient le lieu de résidence des cellules souches limbiques.
Une cellule souche est une cellule qui peut s’autorenouveler perpétuellement et se différencier dans tous les types cellulaires [14]. Le concept de cellules souches revient à Till et McCulloch en 1963 [15–17]. Ils définissent les cellules souches comme celles (clone) capables de former une colonie d’autres cellules. Les cellules souches seraient aussi impliquées dans les cancers et 80 % des cancers touchent les épithéliums [18]. On distingue les cellules souches embryonnaires présentes dans un organisme en développement, pluripotentes et provenant du blastocyste, et les cellules souches adultes indifférenciées, non pluripotentes et retrouvées dans des organes spécialisés. Les premières remplissent des fonctions multiples d’induction, d’organisation et de différenciation d’organes, alors que les secondes assurent leur autorenouvellement tout au long de la vie [14]. Seuls les tests fonctionnels in vivo et in vitro permettent de prouver que les cellules sont des cellules souches. In vivo, il n’y a que des cellules souches qui soient capables de régénérer des tissus par transplantation dans plusieurs receveurs successifs [10–12]. In vitro, grâce à des conditions de culture très performantes, Barrandon et Green ont pu obtenir un nombre important de cellules filles à partir de clones de kératinocytes [19, 20]. De nombreux marqueurs des cellules souches existent aussi, mais ils ne sont que des indices de présomption.
L’épithélium de la cornée se renouvelle, car il existe des cellules en mitose dans sa couche basale [21] et des cellules desquamées dans les larmes [22]. Jusqu’en 1980, on pensait que ce renouvellement se faisait à partir des cellules basales épithéliales cornéennes (fig. 1-30a), puis Thoft a émis sa théorie XYZ de la transdifférenciation de l’épithélium de la conjonctive en épithélium de la cornée selon un flux centripète (fig. 1-30b) [23]. Ce n’est qu’à partir de 1986 que naît la théorie des cellules souches limbiques. Mais deux écoles s’affrontent.
La première, plus antérieure et plus répandue, avance que le renouvellement épithélial cornéen est organisé à partir de niches de cellules souches situées dans les palissades de Vogt du limbe, à l’instar de celles des cryptes de l’intestin, et que la division et l’amplification des cellules se font dans l’épithélium de la cornée (fig. 1-30c). Schermer et al. sont à l’origine de cette théorie (fig. 1-31) [6]. L’épithélium de la cornée est marqué par les anticorps monoclonaux K3/K12 et les couches suprabasales du limbe le sont par K3 seulement. Les cellules n’exprimant pas K3/K12 seraient alors un marqueur par défaut de cellules souches. Selon ce schéma, dans les couches basales du limbe se trouvent les cellules souches de la cornée qui sont les moins différenciées ; elles donnent naissance à des cellules d’amplification transitoire (CAT) qui migrent vers la cornée centrale au niveau de sa couche basale tout en se divisant en cellules post-mitotiques [24]. La figure 1-32 représente plusieurs modèles de renouvellement de l’épithélium cornéen [7, 25, 26]. L’étude fonctionnelle des cellules K3 négatives du limbe a confirmé que ce schéma était juste. La localisation des cellules à cycle lent ou label retaining cells (LRCs) dans la surface oculaire de la souris a montré que les cellules basales du limbe en faisaient partie et qu’elles pouvaient proliférer lors d’une blessure de la cornée centrale [7]. Pellegrini et al. ont aussi effectué des analyses clonales sur les cellules de la surface oculaire de l’homme [27]. Ils ont retrouvé des holoclones (haut potentiel de prolifération) dans le limbe et uniquement des paraclones (potentiel intermédiaire de prolifération) dans l’épithélium de la cornée. Dans cette théorie des cellules souches limbiques, la raison de la migration centripète des cellules épithéliales depuis le limbe est inconnue. Le concept de cellules souches limbiques a modifié le traitement de nombreuses pathologies de la surface oculaire chez l’homme. Les ophtalmologistes peuvent traiter des destructions de la surface oculaire en réalisant des autogreffes ou des allogreffes de cellules souches limbiques [28]. Mais il existe encore des questions sans réponses. Ainsi, comment des patients, dont la région limbique est détruite sur 360°, gardent-ils parfois une cornée transparente durant de nombreuses années (fig. 1-33) [29] ?
La seconde école de la théorie des cellules souches limbiques qui est celle de l’auteur propose un modèle dans lequel l’épithélium de la cornée se renouvelle à l’instar des autres épithéliums de l’organisme, à partir de cellules souches distribuées de manière homogène dans l’ensemble de sa couche basale (fig. 1-30d). Ce modèle est fondé sur des résultats obtenus en recherche fondamentale avec des expériences de cultures cellulaires et d’analyse clonale réalisées in vivo et in vitro sur six mammifères différents [26].
Fig. 1-30 Historique du renouvellement de l’épithélium de la cornée chez l’homme.
a. 1943–1981 : dans ce modèle, le concept de cellules souches n’existait pas. L’épithélium de la cornée est renouvelé à partir de ses cellules basales qui peuvent être en mitoses. b. 1981–1986 : théorie de la transdifférenciation de l’épithélium de la conjonctive en épithélium de la cornée selon l’hypothèse XYZ de Thoft [23]. Dans ce modèle, X correspond à la prolifération des cellules basales, Y à la migration centripète des cellules conjonctivales et Z à la desquamation des cellules épithéliales en surface. Une équation résume cette dynamique : X + Y = Z. c. 1986-2008 : théorie des cellules souches limbiques ou renouvellement de l’épithélium de la cornée depuis les cellules basales du limbe. d. Depuis 2008 : modèle du renouvellement de l’épithélium de la cornée à partir de cellules souches distribuées de manière homogène dans la couche basale de l’ensemble de l’épithélium de la cornée. Il n’y a pas de migration physiologique de l’épithélium du limbe vers la cornée centrale. Par contre si la cornée présente une blessure épithéliale large, il y aura migration épithéliale depuis le limbe, mais il s’agit alors d’un phénomène de cicatrisation.
Fig. 1-31 Immunomarquage de la cytokératine 3 (K3) dans la région limbique du cochon.
Dans la partie gauche de la région limbique, il est à noter que la couche basale (*) n’est pas marquée par la K3 qui est un marqueur de différenciation. Ces cellules seraient les cellules souches de l’épithélium cornéen d’après Schermer et al. [6]. Elles donneraient naissance aux cellules K3 positives présentes dans les couches suprabasales de l’épithélium limbique et dans toutes les couches de l’épithélium de la cornée.
C : cornée ; conj : conjonctive ; mb : membrane basale ; L : région limbique (encadré rouge).
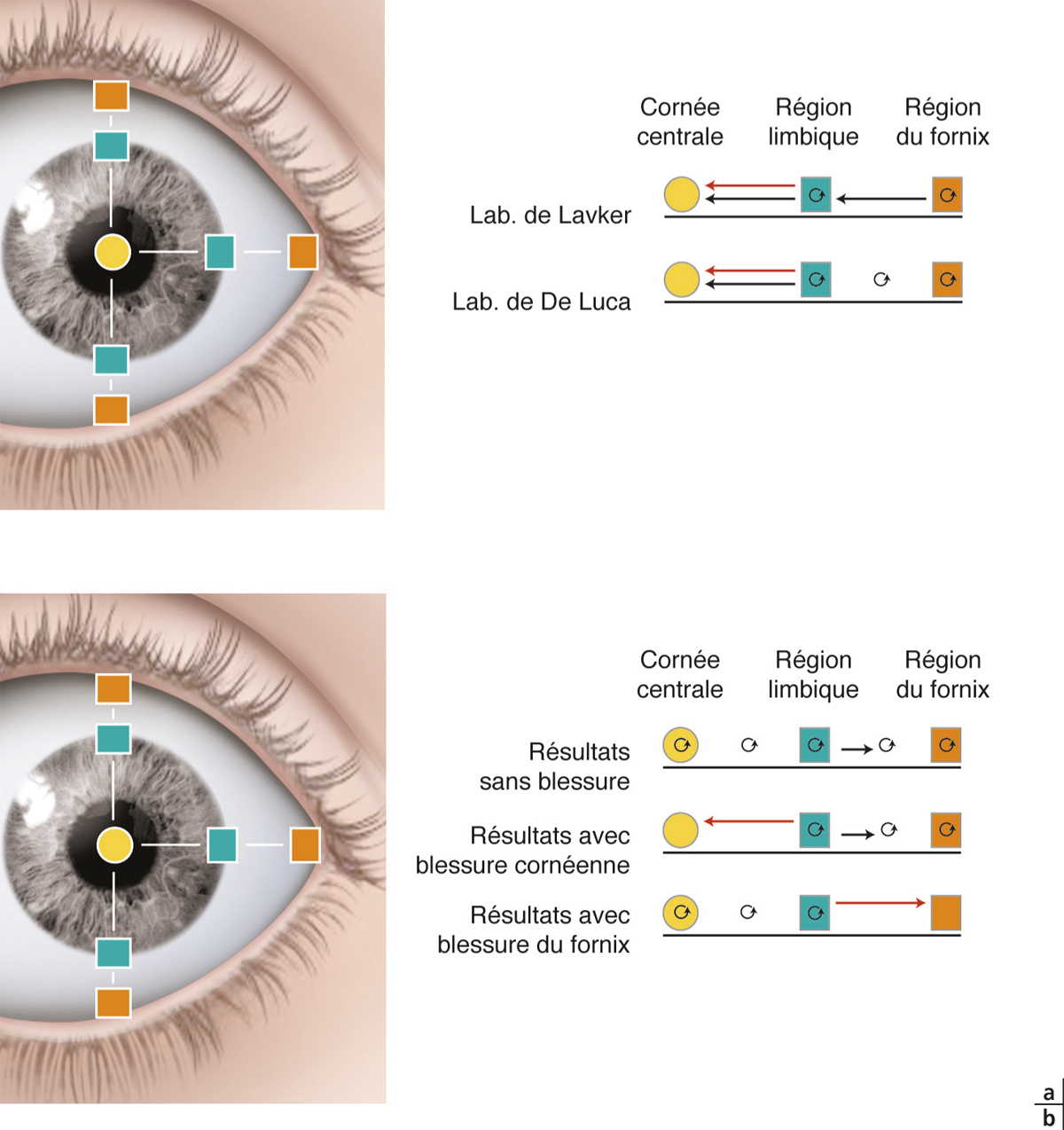
Fig. 1-32 Schémas du renouvellement épithélial cornéen.
a. D’après Lavker [7], les cellules souches de la cornée de souris sont au limbe et celles de la conjonctive sont au fornix. Il existe une migration physiologique (flèches noires) des cellules d’amplification transitoire (CAT) depuis le fornix vers le limbe pour renouveler l’épithélium conjonctival bulbaire et depuis le limbe vers la cornée centrale pour renouveler l’épithélium cornéen. Lors d’une blessure, l’épithélium cornéen cicatrise grâce à la migration des cellules souches limbiques (flèche rouge). D’après De Luca et Pellegrini [25], chez l’homme, on trouve des cellules souches dans l’ensemble de la conjonctive bulbaire. Les cellules souches cornéennes sont au limbe. Il y a une migration physiologique des CAT depuis le limbe vers la cornée centrale pour renouveler l’épithélium cornéen. Lors d’une blessure, les cellules souches du limbe permettent la cicatrisation de l’épithélium cornéen. b. D’après Majo et Barrandon [26], chez les mammifères et chez l’homme. Schéma supérieur : il existe des cellules souches épithéliales distribuées de manière homogène sur l’ensemble de la surface oculaire (cornée, limbe et conjonctive). La surface oculaire se renouvelle physiologiquement comme les autres épithéliums, grâce à des cellules souches présentes à proximité. Schéma intermédiaire : en cas de large blessure de l’épithélium de la cornée, les cellules épithéliales du limbe cicatrisent le défect épithélial de la cornée. Schéma inférieur : en cas de large blessure de la conjonctive bulbaire, les cellules épithéliales du limbe cicatrisent le défect épithélial de la conjonctive.
Rond jaune : épithélium de la cornée central ; carré vert : épithélium limbique ; carré orange : épithélium du fornix ; flèches noires : migration physiologique ; flèche rouge : cicatrisation de l’épithélium cornéen en cas de blessure.
Fig. 1-33 Conjonctivalisation de la cornée respectant le centre.
a. Cornée dont le limbe est détruit sur toute sa circonférence et qui demeure transparente après 4 ans. b. Histologie de la zone prélevée en périphérie de la cornée. La présence de cellules à mucus (flèche) marquées par le PAS signe la conjonctivalisation de la périphérie de la cornée.
Le degré de différenciation épithéliale peut être évalué grâce à des marqueurs qui sont utiles aussi pour définir le syndrome d’insuffisance en cellules souches limbiques [30, 31]. Dans l’épiderme, les kératines 5 (K5/K14) et 1 (K1/K10) sont spécifiques des cellules respectivement basales et suprabasales [32]. L’épithélium de la cornée possède un marqueur spécifique, la kératine 3 (K3/K12) (fig. 1-34) [6] et ne possède pas de cellules à mucus normalement identifiées par une mucine intracytoplasmique spécifique : MUC5AC [33, 34]. Les cellules épithéliales de la conjonctive expriment la kératine 19 et la kératine 7 (K7/K16) [35]. Si toutes les cellules souches de la cornée étaient localisées dans le limbe et étaient entièrement détruites, l’épithélium conjonctival remplacerait celui de la cornée qui perdrait ainsi sa transparence. Le limbe apparaît donc comme un élément central de régulation de la différenciation de l’épithélium cornéen. Ce dernier peut se « conjonctivaliser » ou s’épidermiser (fig. 1-35 et 1-36). L’épithélium limbique est capable aussi de donner naissance à des carcinomes épidermoïdes et muco-épidermoïdes (fig. 1-36 et 1-37).
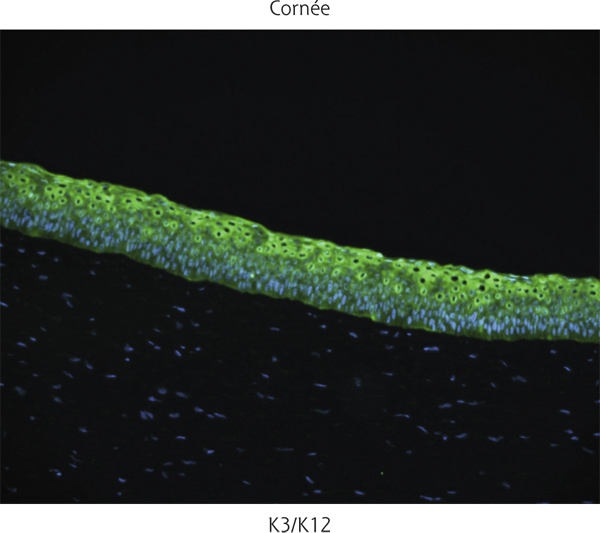
Fig. 1-34 Immunomarquage de l’épithélium cornéen.
L’épithélium de la cornée possède un marqueur spécifique, la kératine 3 (K3/K12). Il ne possède pas de cellules à mucus.
Fig. 1-35 Métaplasie épithéliale cornéenne.
a. Conjonctivalisation de la cornée. b. Kératinisation de la cornée. Noter les squames en surface de la cornée.
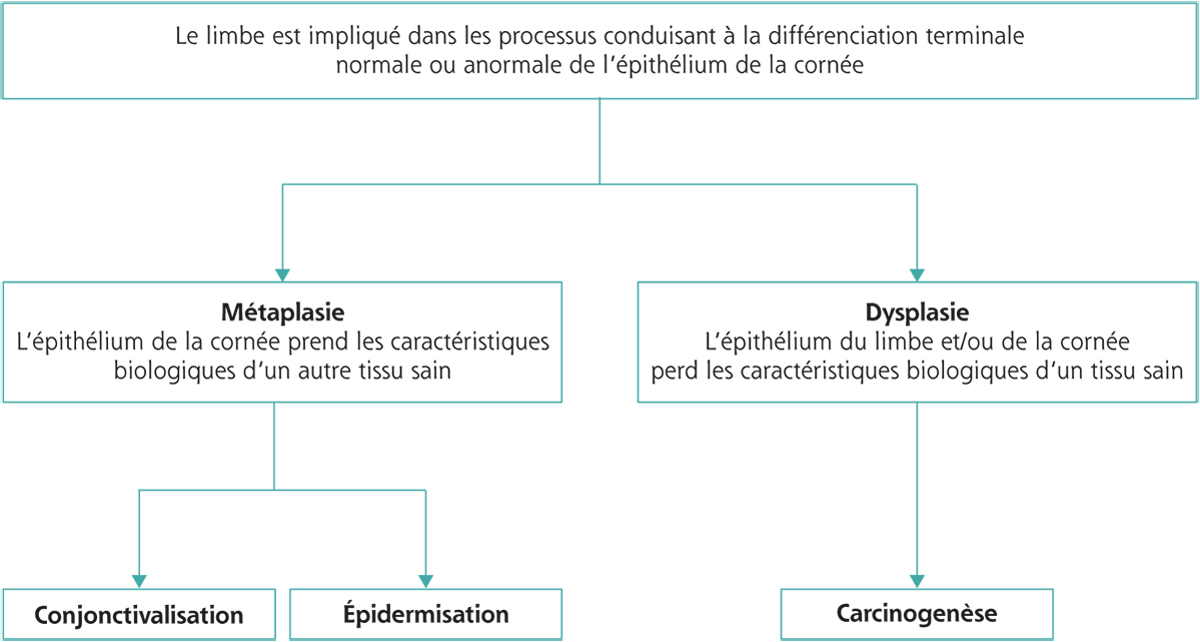
Fig. 1-36 Différenciation de l’épithélium de la cornée.
La cornée peut se différencier en épithélium de type conjonctival (conjonctivalisation) ou en épiderme. Le limbe et la cornée peuvent aussi subir une carcinogenèse.

Fig. 1-37 Carcinome épidermoïde du limbe coloré par le rose Bengale.
Noter l’origine limbique de ce carcinome et son extension vers le fornix et la cornée périphérique.
Les épithéliomas représentent plus de 80 % des cancers chez l’homme. Le micro-environnement anatomique des cellules épithéliales de la cornée jouerait un rôle important et toute modification d’un ou plusieurs de ses éléments agirait sur leur différenciation (voir fig. 1-36). Dans chaque tissu, les carcinomes ont une localisation préférentielle. Les épithéliums de transition ou de jonction sont particulièrement exposés au développement de carcinomes. Une hypothèse pour expliquer cela serait qu’à leur niveau deux micro-environnements se côtoient et les cellules alors soumises à des stimuli contradictoires pourraient souffrir de dysfonctionnements et favoriser l’apparition de dysplasies et de carcinomes in situ puis invasifs [36].
La transformation cancéreuse peut aussi s’expliquer par les différences de vitesse de renouvellement cellulaire. Certains épithéliums comme celui de la cornée et de l’intestin grêle ont un renouvellement très rapide (moins de 3 jours) et seraient relativement protégés des carcinomes, alors que ceux à renouvellement lent seraient plus exposés comme dans le côlon.
Les épithéliums de jonction sont à cycle lent. Ainsi, les carcinomes sont plus fréquents au niveau de la marge palpébrale et du limbe [37, 38]. De surcroît, ces deux localisations sont plus exposées aux irritations chroniques environnementales et aux rayons ultraviolets qui constituent un facteur de risque supplémentaire de cancer.
Le limbe est un élément clé pour la défense de la surface oculaire. Il est riche en vaisseaux et en lymphatiques pouvant transporter in situ des cellules impliquées dans un processus inflammatoire : mastocytes, polynucléaires, neutrophiles, macrophages, fibroblastes, lymphocytes et cellules de Langerhans ou cellules dendritiques présentatrices d’antigènes. De nombreux lymphocytes CD8+ sont retrouvés dans l’épithélium cornéoscléral [39]. Toutes ces cellules font partie du système mucosa-associated lymphoid tissue (MALT). La conjonctive adjacente est aussi riche en immunoglobulines A, G et M [40].
En cas de kératite, il se produit une inflammation du limbe avec dilatation des vaisseaux et diapédèse des cellules inflammatoires dans l’espace extracellulaire qui migrent dans la cornée normalement avasculaire. Une auto-amplification du processus inflammatoire par l’intermédiaire des substances pro-inflammatoires sécrétées favorise son extension à l’ensemble de la surface oculaire. Les antigènes qui sont captés au niveau du limbe sont acheminés vers les ganglions sous-maxillaires puis vers la rate sans passer par le foie. L’inflammation peut juguler l’agression sans séquelles ou le faire au prix de lésions tissulaires avec rupture de l’homéostasie immunitaire physiologique [40]. La réaction inflammatoire limbique est parfois telle qu’elle se traduit par des accumulations macroscopiques cellulaires inflammatoires comme les grains de Horner-Trantas (lymphocytes et polynucléaires éosinophiles) dans la kératoconjonctivite vernale. Le cercle périkératique (CPK) est la rougeur du limbe qui accompagne une kératite. Il existe aussi dans le glaucome aigu et l’uvéite antérieure aiguë. Au niveau du limbe, en effet, le plexus vasculaire conjonctival superficiel est interconnecté avec le plexus profond dépendant des artères ciliaires et situé dans l’uvée antérieure. Le CPK est alors un reflet indirect d’une inflammation intra-oculaire.
Le limbe joue aussi un rôle dans le rejet de greffe. Parmi les facteurs de risque figure la greffe de large diamètre [41]. L’allogreffe est en effet plus proche du limbe qui est vascularisé et héberge des cellules immunocompétentes dont les cellules de Langerhans. En cas de vascularisation cornéenne et d’inflammation de la surface oculaire, les cellules immunocompétentes sont plus nombreuses et le risque de rejet augmente [42].
La surface oculaire est une entité fonctionnelle complexe comprenant un ensemble d’éléments dont le bon fonctionnement permet de maintenir la transparence de la cornée.
Le limbe fait partie de cette entité qui inclut aussi les paupières, la conjonctive, le tissu lymphoïde conjonctival, la cornée, les nerfs sensitifs de la cornée, les glandes lacrymales et le film lacrymal. Il en est un élément clé car il préserve l’avascularité de la cornée, il est le lieu de résidence de son système de défense contre les agressions microbiennes et c’est par lui que transitent les nutriments nécessaires au bon fonctionnement de la cornée périphérique.
Mais sa fonction première est le renouvellement de l’épithélium de la cornée, car il hébergerait toutes les cellules souches épithéliales de la cornée. Sans elles, la cornée subirait une métaplasie conjonctivale, dans le cadre pathologique du syndrome d’insuffisance en cellules souches limbiques.
Connaître l’anatomie du limbe et ses fonctions est un prérequis pour tout ophtalmologiste qui souhaite prendre en charge une reconstruction de la surface oculaire ou traiter une inflammation chronique responsable d’une conjonctivalisation de la cornée périphérique comme la rosacée oculaire.
[1] Van Buskirk EM. The anatomy of the limbus. Eye (Lond) 1989 ; 3 : 101-8.
[2] Hogan MJ, Alvarado JA, Weddell JE. Histology of the human eye. Saunders company ; 1971.
[3] Al-Aqaba MA, Fares U, Suleman H, et al. Architecture and distribution of human corneal nerves. Br J Ophthalmol 2010 ; 94 : 784-9.
[4] Muller LJ, Marfurt CF, Kruse F, et al. Corneal nerves : structure, contents and function. Exp Eye Res 2003 ; 76 : 521-42.
[5] Davanger M, Evensen A. Role of the pericorneal papillary structure in renewal of corneal epithelium. Nature 1971 ; 229 : 560-1.
[6] Schermer A, Galvin S, Sun TT. Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells. J Cell Biol 1986 ; 103 : 49-62.
[7] Cotsarelis G, Cheng SZ, Dong G, et al. Existence of slow-cycling limbal epithelial basal cells that can be preferentially stimulated to proliferate : implications on epithelial stem cells. Cell 1989 ; 57 : 201-9.
[8] Oshima H, Rochat A, Kedzia C, et al. Morphogenesis and renewal of hair follicles from adult multipotent stem cells. Cell 2001 ; 104 : 233-45.
[9] Dua HS, Shanmuganathan VA, Powell-Richards AO, et al. Limbal epithelial crypts : a novel anatomical structure and a putative limbal stem cell niche. Br J Ophthalmol 2005 ; 89 : 529-32.
[10] Greiner JV, Covington HI, Allansmith MR. The human limbus. A scanning electron microscopic study. Arch Ophthalmol 1979 ; 97 : 1159-65.
[11] Shanmuganathan VA, Foster T, Kulkarni BB, et al. Morphological characteristics of the limbal epithelial crypt. Br J Ophthalmol 2007 ; 91 : 514-9.
[12] Yeung AM, Schlotzer-Schrehardt U, Kulkarni B, et al. Limbal epithelial crypt : a model for corneal epithelial maintenance and novel limbal regional variations. Arch Ophthalmol 2008 ; 126 : 665-9.
[13] Kulkarni BB, Tighe PJ, Mohammed I, et al. Comparative transcriptional profiling of the limbal epithelial crypt demonstrates its putative stem cell niche characteristics. BMC Genomics 2010 ; 11 : 526.
[14] Goto Y, Kaneko K. Minimal model for stem-cell differentiation. Phys Rev E Stat Nonlin Soft Matter Phys 2013 ; 88 : 032718.
[15] Becker AJ, Mc CE, Till JE. Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells. Nature 1963 ; 197 : 452-4.
[16] Siminovitch L, McCulloch EA, Till JE. The distribution of colony-forming cells among spleen colonies. J Cell Physiol 1963 ; 62 : 327-36.
[17] McCulloch EA, Siminovitch L, Till JE. Spleen-colony formation in anemic mice of genotype Ww. Science 1964 ; 144 : 844-6.
[18] Kennedy B, Valdimarsdottir U, Sundstrom K, et al. Loss of a parent and the risk of cancer in early life : a nationwide cohort study. Cancer Causes Control 2014 ; 25 : 499-506.
[19] Barrandon Y, Green H. Cell size as a determinant of the clone-forming ability of human keratinocytes. Proc Natl Acad Sci USA 1985 ; 82 : 5390-4.
[20] Barrandon Y, Green H. Three clonal types of keratinocyte with different capacities for multiplication. Proc Natl Acad Sci USA 1987 ; 84 : 2302-6.
[21] Buschke W, Friedenwald JS, Fleischmann W. Studies on the mitotic activity of corneal epithelium. Bull Johns Hopkins Hosp 1943 ; 73 : 143.
[22] Liotet S, Van Bijsterveld OP, Bletry O, et al. Anatomo-physiologie du film lacrymal. Rapport annuel de la Société française d’ophtalmologie. Paris ; 1987.
[23] Thoft RA, Friend J. The X, Y, Z hypothesis of corneal epithelial maintenance. Invest Ophthalmol Vis Sci 1983 ; 24 : 1442-3.
[24] Potten CS, Schofield R, Lajtha LG. A comparison of cell replacement in bone marrow, testis and three regions of surface epithelium. Biochim Biophys Acta 1979 ; 560 : 281-99.
[25] Sun TT, Tseng SC, Lavker RM. Location of corneal epithelial stem cells. Nature 2010 ; 463 : E10-11 ; discussion E11.
[26] Majo F, Rochat A, Nicolas M, et al. Oligopotent stem cells are distributed throughout the mammalian ocular surface. Nature 2008 ; 456 : 250-4.
[27] Pellegrini G, Golisano O, Paterna P, et al. Location and clonal analysis of stem cells and their differentiated progeny in the human ocular surface. J Cell Biol 1999 ; 145 : 769-82.
[28] Tsubota K, Satake Y, Kaido M, et al. Treatment of severe ocular-surface disorders with corneal epithelial stem-cell transplantation. N Engl J Med 1999 ; 340 : 1697-703.
[29] Dua HS, Miri A, Alomar T, et al. The role of limbal stem cells in corneal epithelial maintenance : testing the dogma. Ophthalmology 2009 ; 116 : 856-63.
[30] Majo F, Barrandon Y, Othenin-Girard P, et al. Corneal epithelial diseases related to limbal stem cell deficiency. J Fr Ophtalmol 2006 ; 29 : 1060-9.
[31] Majo F, Nicolas M. Darwin or Lamarck ? Understanding the ocular surface and its normal or abnormal differentiation in order to cure ocular surface destruction with corneal opacification. Biol Aujourdhui 2013 ; 207 : 97-108.
[32] Fuchs E. Keratins and the skin. Annu Rev Cell Dev Biol 1995 ; 11 : 123-53.
[33] Inatomi T, Tisdale AS, Zhan Q, et al. Cloning of rat Muc5AC mucin gene : comparison of its structure and tissue distribution to that of human and mouse homologues. Biochem Biophys Res Commun 1997 ; 236 : 789-97.
[34] Argueso P, Gipson IK. Epithelial mucins of the ocular surface : structure, biosynthesis and function. Exp Eye Res 2001 ; 73 : 281-9.
[35] Jirsova K, Dudakova L, Kalasova S, et al. The OV-TL 12/30 clone of anti-cytokeratin 7 antibody as a new marker of corneal conjunctivalization in patients with limbal stem cell deficiency. Invest Ophthalmol Vis Sci 2011 ; 52 : 5892-8.
[36] McNairn AJ, Guasch G. Epithelial transition zones : merging microenvironments, niches, and cellular transformation. Eur J Dermatol 2011 ; 21 : 21-8.
[37] Wirtschafter JD, McLoon LK, Ketcham JM, et al. Palpebral conjunctival transient amplifying cells originate at the mucocutaneous junction and their progeny migrate toward the fornix. Trans Am Ophthalmol Soc 1997 ; 95 : 417-29 ; discussion 429-32.
[38] Wirtschafter JD, Ketcham JM, Weinstock RJ, et al. Mucocutaneous junction as the major source of replacement palpebral conjunctival epithelial cells. Invest Ophthalmol Vis Sci 1999 ; 40 : 3138-46.
[39] Dua HS, Gomes JA, Jindal VK, et al. Mucosa specific lymphocytes in the human conjunctiva, corneoscleral limbus and lacrimal gland. Curr Eye Res 1994 ; 13 : 87-93.
[40] Smolin G. Cellular response to inflammation at the limbus. Eye (Lond) 1989 ; 3 : 167-71.
[41] Anshu A, Lim LS, Htoon HM, et al. Postoperative risk factors influencing corneal graft survival in the Singapore Corneal Transplant Study. Am J Ophthalmol 2011 ; 151 : 442-8.
[42] Williams KA, Coster DJ. The role of the limbus in corneal allograft rejection. Eye (Lond) 1989 ; 3 : 158-66.
F. Brignole-Baudouin, H. Liang, L. Trinh, E. Warcoin, C. Roubeix, A. Pauly, C. Baudouin
Le système immunitaire joue un rôle fondamental dans la protection des structures complexes et fragiles de la surface oculaire. Cornée et conjonctive constituent des muqueuses adjacentes, soumises aux mêmes stress mais caractérisées par des réponses immunologiques totalement différentes : autant la conjonctive est hyperréactive sur le mode immuno-inflammatoire, autant la cornée bénéficie d’un privilège immunitaire et d’une inhibition des réactions inflammatoires qui pourraient l’endommager. Les réactions immunologiques reposent sur un réseau de cellules inflammatoires extrêmement nombreuses, de natures et de fonctions complémentaires, ainsi que sur une multitude de cytokines et de chimiokines dont le but est de répondre le plus efficacement et le plus rapidement possible aux agressions externes. Une des grandes avancées récentes de l’immunologie oculaire repose sur la découverte d’un double système d’immunité, innée et acquise, dont les modes de fonctionnement sont complémentaires mais également souvent intriqués.
Outre sa fonction de barrière anatomique entre le milieu extérieur et les structures oculaires internes, la conjonctive possède un rôle protecteur fondamental au sein de la surface oculaire et constitue ainsi le principal acteur des modes de défense de l’œil contre les agressions externes. Elle participe en effet à l’élaboration du film lacrymal et, par la sécrétion mucinique, concourt directement à sa qualité. La conjonctive constitue surtout le tissu de protection inflammatoire et immunologique de la surface oculaire. Très vascularisée, connectée au réseau lymphatique, riche en cellules immunocompétentes interconnectées dans une dynamique permanente, des couches les plus superficielles jusqu’aux structures oculaires les plus profondes, la conjonctive s’oppose en tout point à sa voisine la cornée, pourtant elle aussi en contact avec le milieu extérieur. Bien que contiguës, la conjonctive et la cornée sont en effet deux structures très différentes : la conjonctive possède tous les éléments pour réagir avec le maximum d’efficacité et de force en cas d’agression. Cette réactivité très puissante doit être capable, par l’intermédiaire des vaisseaux limbiques et du film lacrymal, de protéger la structure noble qu’est la cornée, en éliminant l’agresseur le plus rapidement possible. Le maintien de la transparence et de l’intégrité cornéennes est en effet un enjeu essentiel du dispositif de défense de la surface oculaire. Autant le réseau immunologique de la conjonctive est très développé, autant celui de la cornée l’est peu et s’avère même en partie inhibé dans ses fonctions, c’est le privilège immunitaire. La réponse immuno-inflammatoire est en effet une arme redoutable, aux effets pervers lorsqu’elle lèse les structures saines de voisinage.
Le système de défense immunitaire de la conjonctive, conçu avant tout pour l’efficacité, est organisé sur plusieurs niveaux en réseaux de communication complexes, connectés entre eux et avec le milieu immunitaire général. Il fait appel à tous les types de systèmes de défense immuno-inflammatoire, dans leur immense subtilité et leur extrême complexité que l’on commence à peine à appréhender. Des éclaireurs repèrent les ennemis, captent ceux qui sont à leur portée, et appellent en renfort non seulement des sentinelles supplémentaires, mais aussi une armée laissée en réserve, constituée de cellules phagocytaires, de cellules libérant de multiples signaux de communication, d’attraction ou d’activation, de cellules tueuses de tous types, mortelles par une étreinte directe ou par l’envoi à distance d’armes redoutables, qui tuent ou blessent l’agresseur, entravent sa progression ou augmentent l’appétit des phagocytes. Pour finir, les restes de l’intrus sont partagés, digérés, analysés soigneusement par les vainqueurs, transmis au commandement général pour que soit mémorisé à jamais l’agresseur, et que la réponse à un nouveau contact détruise et élimine encore plus rapidement, froidement, méthodiquement et efficacement un membre de la même famille qui aurait le malheur de repasser sur n’importe quel territoire de l’organisme. Il est vrai que le monde extérieur n’est pas peuplé que d’amis, et que le nombre et l’efficacité des armes des intrus appellent des réponses sans demi-mesure ni état d’âme, sauf lorsqu’il s’agit de protéger une structure aussi précieuse que la cornée, si proche et si fragile.
La cornée et la conjonctive sont exposées de manière permanente aux agressions mécaniques, toxiques et microbiennes de l’environnement extérieur. La protection palpébrale et le lavage lacrymal éliminent la majeure partie des corps étrangers irritants. Lorsque ces obstacles mécaniques sont franchis, l’épithélium cornéoconjonctival constitue alors la dernière barrière avant la pénétration dans les structures oculaires profondes [1].
Les larmes (voir chapitre 1-II) constituent le premier rempart des défenses de la surface oculaire et concentrent les médiateurs chimiques libérés au cours des réactions inflammatoires qui s’y produisent, d’où leur grand intérêt en immunologie conjonctivale (tableau 1-3). À l’état normal, les défenses lacrymales spécifiques sont assurées essentiellement par les IgA sécrétoires (100 à 500 mg/l) qui sont sécrétées par les plasmocytes des glandes lacrymales et de la conjonctive. Associées en dimères avec le composant sécrétoire, les IgA tapissent la surface oculaire en se liant à l’acide sialique du mucus. Elles s’opposent ainsi à l’adhésion bactérienne et neutralisent certaines toxines et certains virus. On trouve aussi dans les larmes des IgG à concentration plus faible (3 à 10 mg/l), ainsi que des traces d’IgM, d’IgE, des prostaglandines, des leucotriènes, des interférons et plusieurs constituants du complément.
Le film lacrymal a aussi un rôle :
de protection mécanique par un effet de lavage lors du larmoiement réflexe ;
chimique antibactérien par la présence de lysozyme, de lactoferrine et de bêta-lysine ;
trophique par sa richesse en facteurs de croissance, notamment en EGF.
Le lysozyme est une enzyme bactériolytique qui rompt les membranes cellulaires des micro-organismes sensibles, de manière similaire à la pénicilline. Il constitue 30 à 40 % de l’ensemble des protéines lacrymales et sa concentration diminue avec l’âge et au cours des sécheresses oculaires, ce qui favorise le risque infectieux. La lactoferrine en se complexant au fer prive les bactéries de cet élément nutritif essentiel et active les fonctions des lymphocytes NK (natural killer). Elle joue ainsi un rôle primordial de défense antibactérienne non spécifique. Le mucus constitue aussi par lui-même un élément défensif supplémentaire en englobant dans ses mailles d’éventuelles particules étrangères, favorisant ainsi leur élimination mécanique directe vers les culs-de-sac conjonctivaux. Le réseau mucinique produirait en outre des radicaux libres aux propriétés bactéricides [2]. Les mucines solubles sont produites par les mucocytes, de grosses cellules à noyau excentré occupant la quasi-totalité de l’épaisseur de l’épithélium (fig. 1-38).
Un autre mode non spécifique de défense de la surface oculaire est constitué par la flore microbienne normale [2]. Celle-ci, composée essentiellement de Staphylococcus epidermidis, Corynebacterium et Propionibacterium acnes, s’oppose à la prolifération de germes plus agressifs pour les structures oculaires. Dans certaines circonstances, l’équilibre microbiologique est rompu et les germes saprophytes peuvent à leur tour devenir pathogènes.
Tableau 1-3 Composition du film lacrymal.
Fig. 1-38 Cellules à mucus conjonctivales (goblet cells).
a. Biopsie conjonctivale montrant de grosses cellules à contenu optiquement vide. b. Empreinte conjonctivale après coloration en vert des mucines solubles codées par le gène MUC5AC (coloration rouge des noyaux cellulaires). c. Aspect similaire en microscopie confocale in vivo.
L’épithélium conjonctival est composé de cellules épithéliales de recouvrement et de cellules à mucus essentielles à la composition du film lacrymal et à la trophicité de la surface oculaire. Sur le plan immunologique, la conjonctive possède un réseau dense de cellules immunitaires intra-épithéliales, les cellules dendritiques, dont un contingent est formé par les cellules de Langerhans. La densité de celles-ci est estimée de 250 à 300/mm2 chez l’homme au niveau de la conjonctive limbique [1]. Ces cellules, normalement tapies dans la profondeur des couches épithéliales, émettent des prolongements fins et multiples, et se déplacent entre les cellules épithéliales en fonction de l’état inflammatoire local. En cas d’inflammation de surface, leur densité augmente considérablement et une impressionnante migration vers la superficie conjonctivale peut être observée. Philipp et al. [3] ont trouvé des densités plus importantes de cellules de Langerhans dans l’épithélium de la conjonctive bulbaire que dans celui de la conjonctive tarsale. En revanche, au sein de la conjonctive bulbaire, il n’a pas été noté de différence dans leur répartition en fonction des zones de prélèvement.
Les cellules dendritiques intra-épithéliales, conjonctivales et cornéennes, famille à laquelle les cellules de Langerhans appartiennent (fig. 1-39 et 1-40), possèdent sur leur membrane tous les éléments immunitaires nécessaires pour capter un antigène étranger, le phagocyter et le préparer pour qu’il puisse être reconnu puis éliminé par les lymphocytes sous-épithéliaux. Les cellules de Langerhans traversent alors l’épithélium et présentent l’antigène aux lymphocytes qui effectuent et amplifient la réaction immunitaire d’élimination immédiate, et aussi de mémorisation pour que la réponse soit encore plus rapide et efficace en cas de nouvelles rencontres. Il y a très peu d’études sur l’immunophénotype des cellules dendritiques oculaires humaines [4]. Les cellules de Langerhans conjonctivales expriment à leur surface des antigènes de classe II du complexe majeur d’histocompatibilité (CMH) et l’antigène CD1a de façon constitutive, ce qui les rend potentiellement actives immunologiquement [5]. Ces caractéristiques sont importantes et conditionnent leur capacité à présenter les antigènes, car le processus de traitement antigénique impliquerait la co-internalisation du CD1a et des molécules de classe II du CMH. Dans les kératoconjonctivites vernales (KCV), les cellules de Langerhans expriment B7-2 et non B7-1 pour interagir avec le CD28 des lymphocytes. La voie de costimulation CD28/B7-2 pourrait induire le développement de la réponse Th2 dans les kératoconjonctivites vernales [6]. Outre leur statut immunophénotypique qui peut varier en fonction du temps ou de l’état inflammatoire local, les cellules de Langerhans conjonctivales possèdent, par rapport aux autres cellules dendritiques, deux caractéristiques qui leur sont propres : une activité ATPase positive et la présence de granules de Birbeck visibles en microscopie électronique dans leur cytoplasme.
L’épithélium conjonctival contient aussi des lymphocytes intra-épithéliaux (LIE), essentiellement en position basale [7, 8]. Il s’agit surtout de lymphocytes de type T, majoritairement CD3+/CD8+ (rapport CD4/CD8 d’environ 0,3), à l’inverse de la répartition lymphocytaire du stroma sous-épithélial. Ces lymphocytes expriment le CD45RO, caractéristique des cellules à mémoire, et le marqueur CD103 (human mucosal antigen-1 ou HML-1), intégrine αEβ7 exprimée par les lymphocytes intra-épithéliaux et les lymphocytes activés du chorion. Cette intégrine, surexprimée sous l’effet du TGF-β1, interviendrait dans les phénomènes de recirculation lymphocytaire jusqu’à l’épithélium et a pour ligand l’E-cadhérine exprimée par les cellules épithéliales. Il existe également de rares cellules B CD22+ qui sont plus abondantes dans les follicules lymphoïdes (voir CALT ci-après), des cellules NK et des lymphocytes T gamma/delta (Tγδ).
L’épithélium proprement dit joue également un rôle dans le système de défense immunologique de la surface oculaire. En effet, en cas d’inflammation, les cellules épithéliales surexpriment l’intercellular adhesion molecule 1 (ICAM-1), molécule d’adhésion, qui en se liant au lymphocyte function antigens 1 (LFA-1) des lymphocytes et des cellules phagocytaires, permet leur migration à travers l’épithélium. L’interféron gamma (IFN-γ) semble induire cette expression d’ICAM-1 en cas d’inflammation locale. L’expression d’ICAM-1 est très rapide : elle apparaît dès la trentième minute après un test de provocation consistant à instiller un allergène auquel le patient est déjà sensibilisé [9].
Les cellules épithéliales activées dans des processus immuno-inflammatoires, également sous l’effet de l’IFN-γ, expriment les antigènes de classe II HLA-DR, normalement restreints aux cellules immunocompétentes. L’expression de ces marqueurs peut être analysée et quantifiée sur des biopsies ou des empreintes conjonctivales (fig. 1-41) et constitue un test diagnostique d’inflammation [10]. Une expression anormale d’antigènes HLA-DR est ainsi retrouvée au cours du trachome, des syndromes secs, ainsi que chez les patients glaucomateux multitraités [11–13].
Les cellules épithéliales interviennent directement dans l’immunité innée en sécrétant des chimiokines et des cytokines comme IL-8, IL-6, TNF-α, IL-1α, Il-1β [14] et des défensines-β. Ces cytokines jouent probablement un rôle d’amplification des réactions inflammatoires locales. L’IL-1, l’IL-6 ou l’IL-8 sont présentes à l’état normal dans les cellules épithéliales, et leur synthèse est augmentée en cas d’inflammation, au cours des sécheresses oculaires sévères ou chez les patients glaucomateux traités au long cours [13]. L’épithélium possède enfin des récepteurs de type H1 pour l’histamine, dont l’activation entraîne la libération de cytokines inflammatoires [15].
L’épithélium conjonctival constitue en outre un enjeu croissant dans l’étude de la physiopathologie de l’allergie oculaire et pourrait représenter dans l’avenir une cible thérapeutique [16]. Les cellules épithéliales synthétisent des variétés de cytokines différentes en fonction des pathologies allergiques. En effet, l’IL-3 est retrouvée dans les kératoconjonctivites vernales (KCV) et atopiques (KCA), alors que l’IL-8 est retrouvée dans les conjonctivites gigantopapillaires (CGP). RANTES (regulated on activation, normal T cell expressed and secreted) et GM-CSF (granulocyte macrophage-colony stimulating factor) sont quant à eux exprimés dans ces trois pathologies [1]. Une étude a montré l’expression de l’IFN-γ, d’IL-10 et d’IL-13 dans les KCA, et d’IL-4 et d’IL-5 dans les KCV, ce qui suggère le caractère immunologique Th2 des KCV et Th1 des KCA [17]. L’IL-8 semble également jouer un rôle majeur dans les KCV pour le recrutement des neutrophiles, des éosinophiles et dans la pathogénie des lésions cornéennes. L’IFN-γ est un acteur essentiel de la réponse inflammatoire à sa phase d’induction dans les conjonctivites allergiques car l’utilisation d’anticorps anti-IFN-γ diminue l’infiltration d’éosinophiles conjonctivaux [18]. CCR4 et plus faiblement HLA-DR [19] sont exprimés sur les cellules épithéliales conjonctivales dans les pathologies allergiques Th2 de surface telles que les KCV et les CGP, alors que CCR5 associé au Th1 n’est pas retrouvé.
Fig. 1-39 Cellules dendritiques conjonctivales.
a. Empreinte conjonctivale après coloration en vert par un anticorps antivimentine. b. Forte densité en cas de sécheresse oculaire.
Fig. 1-40 Cellules dendritiques cornéennes en microscopie confocale in vivo.
a. Densité normale. b. Cellules dendritiques activées, nombreuses et élargies.
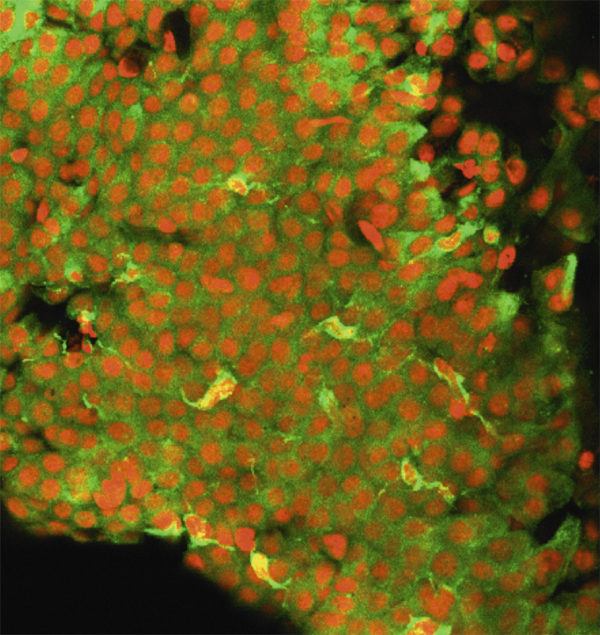
Fig. 1-41 Expression anormale d’antigènes de classe II HLA-DR sur les cellules épithéliales de la conjonctive.
Cette expression témoigne d’une inflammation locale.
Le tissu conjonctif sous-épithélial ou substantia propria est le siège de véritables nappes de cellules immunitaires, prédominant au niveau des culs-de-sac où elles s’organisent inconstamment en follicules. Ce tissu contient environ 10 0000 lymphocytes, entre 20 000 et 40 000 plasmocytes et 5 000 mastocytes/mm3 [1]. Il possède peu de polynucléaires, sauf en cas d’agression microbienne, et d’assez rares macrophages. Le drainage lymphatique s’effectue vers les ganglions prétragiens qui mettent en communication les cellules immunitaires oculaires avec les autres structures immunologiques de l’organisme.
La glande lacrymale et la conjonctive bénéficient du phénomène de recirculation des lymphocytes, activés au niveau d’un des sites du MALT (mucosa-associated lymphoid tissue), généralement digestif, migrant dans les ganglions régionaux, puis dans la circulation sanguine, avant de se répartir dans l’ensemble des muqueuses. Des plasmocytes sécréteurs d’IgA spécifiques des antigènes rencontrés dans une des autres muqueuses sont donc présents dans la glande lacrymale et la substantia propria de la conjonctive [1]. À l’inverse, les autres muqueuses peuvent bénéficier d’une immunisation survenue au niveau de la muqueuse conjonctivale.
En revanche, l’existence d’un CALT structuré est discutée chez l’homme. Si les lymphocytes sont nombreux dans la substantia propria conjonctivale, les agrégats lymphocytaires spécialisés sont inconstants. La conjonctive du poulet, du lapin, du rat ou du cobaye présente en effet un CALT bien développé (fig. 1-42), mais cette organisation n’est retrouvée chez l’homme que dans environ 30 % des cas. Le tissu lymphoïde semble plus important dans la conjonctive palpébrale que dans la conjonctive bulbaire, et prédomine en paupière supérieure [20]. Le tissu lymphoïde est composé de lymphocytes et de plasmocytes sécrétant en majorité des IgA s’organisant en une couche fine dans la lamina propria. Dans certains cas, des follicules de lymphocytes sont individualisés au sein de cette fine couche, essentiellement dans les culs-de-sac conjonctivaux. Les lymphocytes B se concentrent au centre de ces follicules, alors que les lymphocytes T s’accumulent dans la périphérie. En cas d’activation inflammatoire, la densité cellulaire augmente considérablement, tant en périphérie que dans le follicule (fig. 1-43). Les cryptes conjonctivales et la voie de drainage lymphatique contiennent également ce tissu lymphoïde. Les amas lymphocytaires, lorsqu’ils sont organisés en follicules lymphoïdes, sont recouverts d’un épithélium modifié. Les cellules épithéliales y sont plates et allongées, avec des microvillosités et des microplis, semblables aux cellules épithéliales associées aux follicules retrouvées dans les autres MALT, appelées cellules M [21]. Elles interviennent directement dans la présentation antigénique. Quelle qu’en soit la disposition, le système immunitaire conjonctival est riche en lymphocytes, essentiellement de type T (CD3+), avec un rapport C4/CD8 situé entre 1,3 et 2, contrairement à la répartition lymphocytaire intra-épithéliale. Les cellules B, CD22+, sont fréquentes dans les follicules lymphoïdes.
La conjonctive profonde contient, comme l’épithélium, des cellules dendritiques présentatrices de l’antigène. Par contraste avec les cellules de Langerhans intra-épithéliales, les cellules dendritiques du stroma de la conjonctive bulbaire sont plus fréquemment situées dans le quadrant nasal et supérieur. Cette différence est probablement en relation avec une charge antigénique plus importante à ce niveau, qui correspond au chemin emprunté par les larmes lors de leur drainage. De telles variations géographiques dans la répartition des cellules dendritiques et des cellules immunocompétentes en général pourraient être en cause dans certaines pathologies conjonctivales comme le ptérygion ou la pinguécula qui apparaissent plus fréquemment dans le quadrant nasal.

Fig. 1-42 Images de CALT au niveau de la conjonctive palpébrale d’un lapin normal prises en microscopie confocale in vivo à différentes profondeurs.
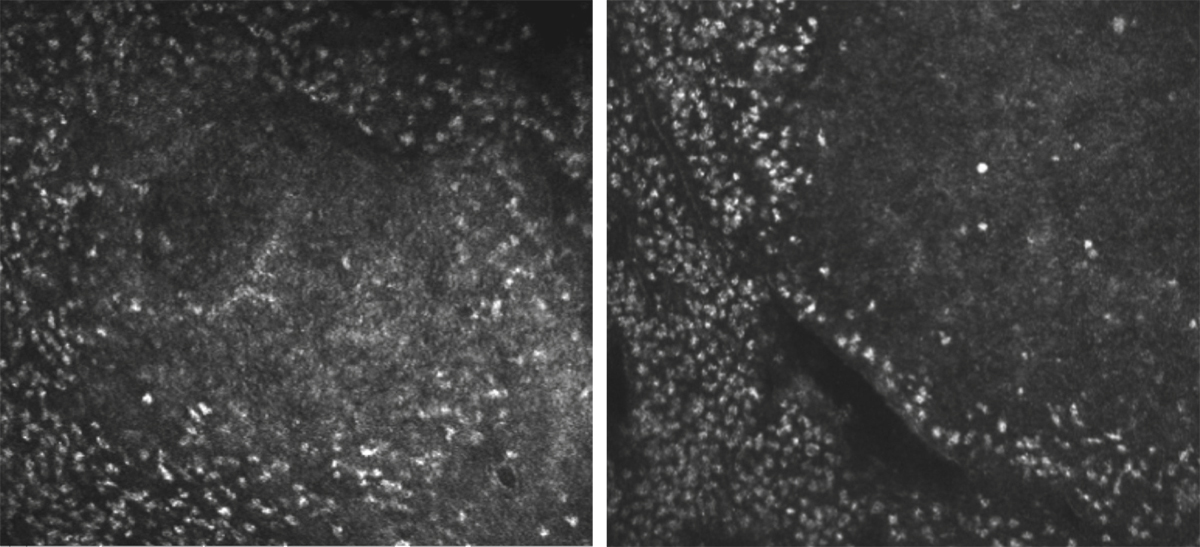
Fig. 1-43 Images de CALT en présence d’un agent toxique, le chlorure de benzalkonium (BAK), prises en microscopie confocale in vivo sur des modèles de lapins à différents temps d’exposition.
Les lymphocytes T constituent un groupe hétérogène, possédant de multiples fonctions, facilitatrices, cytotoxiques ou suppressives. On peut les répartir en fonction des marqueurs membranaires qu’ils portent, grâce à l’utilisation d’anticorps spécifiques : cette identification constitue la technique du typage lymphocytaire. Des études immunophénotypiques et fonctionnelles ont révélé que les lymphocytes T se répartissaient en deux populations, auxiliaires (CD4+) et suppresseurs (CD8+), au sein desquelles pouvaient être distinguées des sous-populations fonctionnelles supplémentaires (cellules naïves, cellules à mémoire, etc.). La caractérisation des lymphocytes de type auxiliaire (CD4+) ou T helper (Th) a permis de découvrir parmi ceux-ci des sous-populations fonctionnelles distinctes, se différenciant non par des marqueurs membranaires, mais par les médiateurs qu’elles produisent et les réactions immunitaires qu’elles entraînent.
Ces lymphocytes CD4+ sont les acteurs principaux dans les conjonctivites allergiques. Le rôle des lymphocytes CD8+ est mal connu mais il semble qu’ils pourraient promouvoir la phase d’induction dans les conjonctivites allergiques, alors qu’ils en diminueraient la phase effectrice [22]. La réponse immunitaire nécessite une coordination parfaite entre les cellules détectrices et effectrices. Les lymphocytes CD4+ jouent un rôle central dans la protection immunitaire : naïfs au départ (Th0), ils peuvent se différencier en quatre types de lymphocytes Th (Th1, Th2, Th17, Treg) suivant les signaux reçus lors de leur interaction initiale avec l’antigène ou évoluer vers la lignée des lymphocytes T régulateurs (Treg) ayant des fonctions immunomodulatrices (fig. 1-44) [23-25].
Fig. 1-44 Différenciation des lymphocytes CD4 en fonction des cytokines auxquelles ils sont soumis.
Les lymphocytes Th1 jouent un rôle dans la réponse immunitaire contre les pathogènes intracellulaires via leur interaction avec les macrophages principalement. Les lymphocytes Th1 produisent des cytokines qui activent les macrophages, stimulent la sécrétion d’immunoglobulines de type A et G par les lymphocytes B et orientent les réactions inflammatoires vers des mécanismes d’hypersensibilité de type retardée. La voie Th1 amplifie le pouvoir cytotoxique des macrophages et induit la prolifération des lymphocytes T cytotoxiques CD8+. Elle s’oppose à la voie Th2 qu’elle inhibe. Les cellules Th1 expriment préférentiellement à leur surface des récepteurs de chimiokines : CXCR3 et CCR5 dont les chimiokines correspondantes sont IP-10, Mig, I-TAC pour CXCR3 et MIP-1α, MIP-1β et RANTES pour CCR5 [25]. De nouvelles théories donneraient aussi un rôle important à l’IL-17 et les lymphocytes Th17 seraient en fait les vrais effecteurs de cette réaction, le système Th1 étant un mode de réaction à l’action de l’IL-17 [26, 27].
La différenciation en Th1 dépend des propriétés de l’antigène (forte affinité pour les récepteurs des lymphocytes, quantité importante d’antigène et présence de répétitions de motifs cytidine–phosphate–guanosine dans l’antigène bactérien). Les principales cytokines intervenant dans les réactions de type Th1 sont l’IL-2, l’IL-12, l’IFN-γ et les TNF. Comme les lymphocytes NK et les lymphocytes cytotoxiques, les lymphocytes Th1 synthétisent l’IFN-γ qui, lors de l’activation des macrophages, augmente leur activité microbicide. Cette cytokine est impliquée dans une variété de fonctions immunitaires, dont le recrutement et la différenciation des cellules CD4+ naïves qui, une fois différenciées en Th1, vont elles aussi produire de l’IFN-γ et activer des NK et des lymphocytes cytotoxiques. La production d’IFN-γ a un effet amplificateur car elle induit la production d’IL-12 par les cellules dendritiques (CD) et les macrophages ainsi que l’expression du récepteur à l’IL-12 sur les lymphocytes Th1 ce qui stimule ainsi, via un rétrocontrôle positif, la production d’IFN-γ par ces mêmes lymphocytes. Ainsi, des chimiokines peuvent aussi moduler le développement de la réponse immunitaire Th1. Les autres cytokines intervenant dans les réactions de type Th1 sont le TNF-α, l’IL-2 et l’IL-12 [23]. Les lymphocytes Th1 expriment préférentiellement à leur surface des récepteurs de chimiokines CXCR3 et CCR5, qui peuvent servir à leur détection, et le facteur de transcription T-bet, principal facteur de transcription régulant la différenciation de Th1 aussi exprimé par les lymphocytes Th17 [26]. Ces lymphocytes sont pro-inflammatoires et peuvent être impliqués dans la pathogenèse et l’entretien de certaines maladies auto-immunes.
De nombreuses études montrent l’implication de la voie Th1 dans la sécheresse oculaire. Un taux élevé d’IFN-γ dans les larmes et la conjonctive est observé chez des patients atteints de sécheresse oculaire ainsi que dans des modèles murins [28–31] et ce taux est corrélé avec la sévérité de la maladie [32]. De plus, les récepteurs de chimiokines associés au Th1 (CCR5 et CXCR3) et leurs ligands apparentés (CCL5, CXCL10, CXCL9 et CXCL11) sont également exprimés sur les cellules CD4+ dans les tissus de la surface oculaire et les larmes des modèles animaux et des patients atteints de sécheresse oculaire [33–36].
La kératoconjonctivite sèche est l’exemple type de l’inflammation oculaire de type Th1 avec une présence importante d’IFN-γ dans les tissus inflammatoires et de CCR5 sur les cellules épithéliales conjonctivales [19, 37]. Au cours d’expériences menées sur la sécheresse oculaire induite par un stress dessicatif, plusieurs phénomènes corrélés avec l’infiltration de cellules Th1 ont pu être observés : une augmentation de la production de cytokines, une augmentation de l’apoptose des cellules épithéliales, une diminution de la densité des mucocytes, une modification des mucines et une métaplasie squameuse [34, 38, 39]. D’autres expériences ont révélé que cette pathologie était médiée par l’IFN-γ confirmant que cette cytokine est une cible thérapeutique pertinente pour traiter la kératoconjonctivite sèche [30, 40].
Les lymphocytes Th2 jouent un rôle dans la défense contre les pathogènes extracellulaires et interviennent directement dans les réactions de défense antiparasitaire mais ils possèdent aussi un rôle dans les réactions d’allergie. La voie Th2 favorise le système immunitaire à médiation humorale via la stimulation de la prolifération des lymphocytes B. Elle induit également la commutation de classe des anticorps et l’augmentation de la production d’anticorps neutralisants. Les lymphocytes Th2 favorisent essentiellement le recrutement et la différenciation des mastocytes et des éosinophiles, ainsi que la production d’IgE.
Les cytokines qui interviennent dans ces réactions sont surtout les interleukines IL-3, 4, 5 et 13 et le GM-CSF. L’IL-4 est un facteur clé dans l’activation des Th2. L’IL-3 stimule les mastocytes, l’IL-5 favorise l’activation et la sécrétion d’immunoglobulines par les lymphocytes B ainsi que l’activation des éosinophiles [41]. À leur tour, ces cellules activées vont libérer les IL-3 et IL-4 et amplifier la réponse immunitaire Th2. Les cellules Th2 expriment à leur surface les récepteurs de chimiokines CCR3 et CCR4 dont les chimiokines correspondantes sont : éotaxine, RANTES, MCP-2 (monocyte chemoattractant protein 2), 3 et 4 pour CCR3 ; TARC (thymus and activation-regulated chemokine) et MDC (macrophage-derived chemokine) pour CCR4 [26].
Les Th2 interviennent ainsi directement dans les réactions d’allergie et de défense antiparasitaire. Or, les lymphocytes T « naïfs », avant d’être en contact avec l’antigène, ont un profil indifférencié, potentiellement aussi bien Th1 que Th2. Certains éléments interviennent donc, lors du contact initial avec l’antigène, pour déclencher une réaction dans l’une ou l’autre direction.
La différenciation en lymphocyte Th2 est aussi privilégiée par certaines propriétés de l’antigène (faible affinité de l’antigène à son récepteur lymphocytaire, faible quantité d’antigène) et par les prédispositions génétiques du sujet à induire une réponse Th2. L’IL-4 ainsi que l’IL-13 favorisent la commutation de classe des Ig vers les IgE par les lymphocytes B [23], cette synthèse d’IgE elle-même favorisant la libération d’histamine par les mastocytes. L’IL-13 est la cytokine prédominante du système Th2 sur la surface oculaire normale. Elle semble avoir une fonction dans le maintien homéostatique en maintenant la sécrétion de mucus par les mucocytes de la conjonctive. Les récepteurs à l’IL-4 et à l’IL-13 sont présents dans l’épithélium conjonctival [42]. De plus, ces deux cytokines ainsi que l’IL-5 ont été détectées dans les larmes humaines et/ou de souris [29, 43].
L’allergie oculaire, notamment dans le cas de la KCV, est l’exemple type d’inflammation oculaire de type Th2, au niveau des cytokines, des chimiokines, des récepteurs de chimiokines et des toll-like receptors ou TLR [17, 19]. Il existe classiquement une inhibition réciproque des deux systèmes Th1 et Th2 : l’IFN-γ produit par les lymphocytes Th1 bloque les réactions Th2 et réduit la sécrétion d’IgE. À l’inverse, l’IL-10, sécrétée par les lymphocytes Th2, inhibe la synthèse d’IFN-γ, diminue la densité d’antigènes de classe II sur les cellules présentatrices et réduit ainsi la stimulation des Th1.
Les lymphocytes Th17 sont impliqués dans la réponse précoce à de nombreux agents pathogènes extracellulaires, y compris les bactéries et les champignons, et ont été trouvés comme étant impliqués dans l’auto-immunité et l’inflammation des tissus. Le TGF-β ainsi que l’IL-6, l’IL-21 et l’IL-23 sont impliqués dans la différenciation des lymphocytes auxiliaires naïfs (Th0) en lymphocytes Th17 [44]. Les Th17 sont dotés d’une remarquable plasticité en se retransformant rapidement en Th1. Ils peuvent aussi être stabilisés par l’IL-23 qui leur confère des fonctions effectrices pathogéniques caractérisées par la production d’IL-17 et d’IFN-γ [45]. Ils sécrètent de l’IL-17 (17a et 17f), qui induit la production de molécules pro-inflammatoires (IL-6, IL-8, métalloprotéinases ou MMP), recrute les neutrophiles [46], notamment durant les réponses immunitaires contre les bactéries extracellulaires et les champignons, et peut participer à l’induction de maladies auto-immunes spécifiques d’organes. Les lymphocytes Th17 produisent également de l’IL-21 et de l’IL-22. L’IL-21 est un facteur stimulant de la différenciation en Th17 et sert ainsi de rétrocontrôle positif amplifiant la différenciation en Th17.
Le récepteur de l’IL-17 est détecté dans l’épithélium de la cornée et de la conjonctive [27, 47]. Le rôle potentiel des lymphocytes Th17 dans la sécheresse oculaire a été beaucoup étudié récemment, via l’étude de l’IL-17 et de CCL-20, le ligand connu de CCR6. Le traitement de la sécheresse oculaire expérimentale avec un anticorps anti-CCL-20 a diminué de manière significative la coloration de la cornée à la fluorescéine, l’infiltration de la conjonctive par des cellules IL-17a+, l’expression des cytokines inflammatoires et des MMP dans la conjonctive [48]. Des modèles murins de sécheresse oculaire montrent que l’IL-17 stimule la production de MMP-3 et MMP-9 contribuant à la perturbation de la fonction de la barrière épithéliale de la cornée. Des études récentes ont montré que la neutralisation de l’IL-17 par des anticorps a amélioré la barrière cornéenne chez ce type de souris et a diminué l’expression de transcrits mRNA de MMP-3 et 9 dans l’épithélium de la cornée ou dans la conjonctive [48, 49]. De nouvelles stratégies thérapeutiques visant à inhiber la migration des cellules Th17+CCR6+ à la surface oculaire ou la production d’IL-17 diminuent la gravité de la maladie de l’œil sec dans des modèles animaux de la sécheresse oculaire [49]. Il a été aussi montré que l’IL-17 et les Th17 participent à la pathogénie de la kératite stromale lors des infections à herpes simplex virus-1 (HSV-1) [47].
Les lymphocytes T régulateurs (Treg) sont, comme leur nom l’indique, des régulateurs des réponses immunitaires et interagissent avec les cellules T et les cellules présentatrices de l’antigène. Ils participent à la tolérance immunitaire via leur action immunosuppressive qui régule les lymphocytes T effecteurs. Il existe plusieurs types de lymphocytes T capables d’exercer une activité suppressive ou régulatrice mais les Treg CD4+CD25+ qui expriment le facteur de transcription FoxP3 (forkhead box P3) sont considérés comme des Treg « professionnels » à action suppressive [50]. Ces Treg comprennent deux sous-populations : les Treg naturels (nTreg) du thymus, les Treg induits (iTreg) en périphérie sous l’effet de IL-2 et de TGF-β ou après contact antigénique. Ils expriment différents récepteurs de chimiokines et des molécules d’adhésion leur permettant de se loger dans des organes lymphoïdes secondaires, par le phénomène de homing, sous la dépendance de CCR7 [51] où ils réduisent la stimulation des cellules T naïves, ou dans les sites inflammatoires contrôlés par la présence de l’intégrine αEβ7 (CD103) [52] où ils atténuent la fonction effectrice des cellules T. Les mécanismes par lesquels ils inhibent les réponses des autres lymphocytes T CD4+ et CD8+ sont encore peu connus, mais la sécrétion de cytokines suppressives (IL-10, TGF-β ou IL-35) en fait partie. Le TGF-β joue un rôle majeur dans la différenciation des lymphocytes CD4+ naïfs en lymphocytes Treg et est nécessaire à la survie et au fonctionnement de ces lymphocytes, tout comme l’IL-2.
Les Treg sont essentiels pour la tolérance aux antigènes du soi possédant un récepteur TCR (T cell receptor) spécifique des auto-antigènes ; ils régulent les réponses immunitaires, luttent contre l’auto-immunité [45] et jouent ainsi un rôle lors des rejets de greffe. Ce rôle est actuellement à l’étude dans les greffes de cornées allogéniques de souris où il a été montré qu’un traitement avec un anticorps monoclonal anti-CD40 ligand favorisait la présence de Treg au détriment de celle de lymphocytes inflammatoires Th1 [53]. Par ailleurs, l’existence d’un dysfonctionnement des cellules Treg a été montrée dans un modèle murin de sécheresse oculaire [27, 38, 50]. Le rôle des Treg dans les pathologies de la surface oculaire est encore mal connu, mais augmenter le nombre de lymphocytes Treg ou augmenter leur fonction suppressive semble un axe de recherche intéressant pour traiter les maladies auto-immunes, donc potentiellement la sécheresse oculaire liée au syndrome de Gougerot-Sjögren. Une telle stratégie semble possible pharmacologiquement puisque Keino a montré récemment que le métabolite de la vitamine A, l’acide tout-trans rétinoïque (ATRA) en synergie avec le TGF-β induirait des FoxP3+ Treg et inhiberait le développement des lymphocytes Th17, induit par TGF et IL-6 [54].
Une autre sous-population de cellules T, les cellules T gamma/delta (γδ), présentant un TCR différent de celui des cellules T alpha/bêta (αβ) et beaucoup moins nombreuses que ces dernières, a été mise en évidence. Elles ont une prédilection pour les sites épithéliaux. Il semble que, dans cette forme, le lymphocyte ait la possibilité de diminuer localement les réponses immunitaires indésirables. Ces cellules n’ont besoin ni que l’antigène soit processé ni qu’il leur soit présenté par une molécule du CMH. Elles ont une action cytotoxique par l’intermédiaire des systèmes perforine/granzyme et Fas/FasL et jouent un rôle dans des inflammations oculaires sévères comme la pemphigoïde cicatricielle ou le syndrome de Stevens-Johnson [55].
L’étude des voies d’inflammation Th1 et Th2 semble cruciale pour la compréhension des mécanismes mis en jeu dans les pathologies de la surface oculaire. Les intrications des systèmes Th1 et Th2 pour réguler la production de cytokines sont complexes et leur antagonisme semble remis en cause. En effet, dans les conjonctivites allergiques, il a été retrouvé de l’IFN-γ dans les KCA, qui suggérerait une participation de Th1 dans les mécanismes immunitaires [17]. Le rejet de greffe de cornée, considéré classiquement comme une stimulation de type Th1, est favorisé sur les terrains atopiques prédisposés au mécanisme de type Th2 [56]. Dans un modèle expérimental d’allergie oculaire, l’IFN-γ est retrouvé et pourrait jouer un rôle majeur inattendu dans la physiopathologie d’une inflammation considérée Th2 par le recrutement des neutrophiles et éosinophiles [18]. Au cours de kératites stromales dues au virus HSV-1, il a été montré que des cellules de l’immunité innée, notamment des lymphocytes Tγδ, étaient les principales sources d’IL-17 tôt lors de l’infection, relayés ensuite par les Th17 infiltrant secondairement la cornée après l’arrivée des Th1 et ceci en fonction de l’environnement local en cytokines et chimiokines [47].
Les mastocytes interviennent à différents niveaux de la réaction inflammatoire, au-delà des réactions allergiques proprement dites (fig. 1-45). On différencie deux types de mastocytes :
les mastocytes du tissu conjonctif (MCTC), contenant de la chymase et de la tryptase, considérés comme non immuns, impliqués dans l’angiogenèse et le remodelage des tissus, retrouvés dans le tissu conjonctif du chorion, dans la substantia propria, essentiellement en localisation périvasculaire ;
les mastocytes muqueux (MCM), cellules reliées au système immunitaire, présentes dans le chorion superficiel, l’épithélium et les follicules lymphoïdes, et qui ne contiennent que de la tryptase.
La majorité (97 %) des cellules mastocytaires de la conjonctive humaine normale est constituée de MCTC, tandis que les MCM sont plutôt retrouvés dans le tractus gastro-intestinal. Chez le rat, les mastocytes sont essentiellement présents à proximité du bord des paupières (10 000 à 12 000 cellules/mm3), du limbe (3 400 à 4 800 cellules/mm3) et sont beaucoup plus rares dans le reste de la conjonctive (500 à 1000/mm3) [1].
Dans des pathologies comme la conjonctivite gigantopapillaire, secondaire au port de lentilles de contact, ou la conjonctivite vernale, la proportion de mastocytes de tissu muqueux est augmentée (20 %) par rapport à la population mastocytaire normale habituelle. Dans les conjonctivites allergiques saisonnières, le nombre des mastocytes dans la substantia propria est également augmenté avec une hausse du taux de mastocytes muqueux par rapport aux mastocytes conjonctifs [57]. Dans les KCA, les pemphigoïdes oculaires cicatricielles et les syndromes de Stevens-Johnson, le nombre de mastocytes conjonctivaux est également augmenté par rapport aux sujets normaux avec une hausse du nombre de mastocytes conjonctifs et muqueux, variable en fonction des pathologies.
Les mastocytes conjonctivaux sécrètent des cytokines telles que IL-4, IL-5, IL-6, IL-8, IL-13, TNF-α et SCF ou stem cell factor (ligand du récepteur tyrosine kinase, c-kit ou CD117). Leur répartition est différente selon le type de mastocytes : IL-4 et IL-13 pour les MCTC et IL-5 et IL-6 pour les MCM. Cette différence confirme la répartition de fonctions spécifiques pour ces deux types de mastocytes [58]. Les mastocytes présentent des récepteurs membranaires (ICAM-1, c-kit, FcεRI, récepteurs à IgE) dont l’expression est modulée par TNF-α et IL-4. Le TNF-α synthétisé par les mastocytes induit une augmentation d’ICAM-1 à la surface des cellules épithéliales conjonctivales. Les mastocytes expriment également des récepteurs pour de nombreuses chimiokines (CCL2, CCL3, CCL5 et CCL11) qui vont les activer [59]. Les mastocytes conjonctivaux expriment ainsi les récepteurs CCR1, CCR2, CCR3, CCR5 et CXCR3. La chimiokine CCL3 (MIP-1α), trouvée fortement augmentée dans un modèle murin de conjonctivite allergique après exposition à l’antigène, stimule la dégranulation dépendante des IgE et la production de cytokines et de chimiokines par les mastocytes.
Les mastocytes peuvent présenter deux modes de dégranulation : l’un, rapide, lié à l’agrégation des IgE de surface et correspondant à la réaction anaphylactique ; l’autre plus lent, appelé peace meal degranulation, mal connu mais intervenant dans différentes pathologies inflammatoires. Ils sont en outre particulièrement sensibles à des stimuli mécaniques non immuns comme le frottement des yeux. La dégranulation mastocytaire entraîne alors une infiltration de polynucléaires neutrophiles en quelques heures suivie d’une élévation du nombre des macrophages entre 8 et 24 heures. La cascade des médiateurs inflammatoires libérés par la dégranulation mastocytaire joue un rôle à long terme lors d’irritations mécaniques à répétition, comme le port de lentilles de contact ou le grattage par les mains et les doigts. Les conjonctivites papillaires, dans ces cas, sont notamment caractérisées par une infiltration de lymphocytes, de macrophages, d’éosinophiles et de polynucléaires. L’activation mastocytaire induit la phase précoce de la réaction allergique mais augmente également la phase tardive dans les blépharoconjonctivites expérimentales immunes.
Fig. 1-45 Coloration immuno-histologique de mastocytes conjonctivaux par un anticorps anti-tryptase.
L’infiltration d’éosinophiles dans la conjonctive est caractéristique des pathologies oculaires allergiques. Dans les pathologies conjonctivales allergiques telles que la KCV, la KCA et la CGP, une infiltration conjonctivale éosinophilique majeure est retrouvée par rapport aux sujets sains [1]. De très nombreuses cytokines sont synthétisées par les éosinophiles et peuvent moduler leur activité et leur fonction. Ces cytokines sont synthétisées différemment par les éosinophiles en fonction des pathologies allergiques. RANTES, TGF-β, TNF-α, IL-3, IL-4, IL-5, IL-6 et IL-8 sont synthétisés avec un taux moindre dans les CGP que dans les KCV et KCA. Des antigènes de surface comme CD4, HLA-DR, ICAM-1, IL-2R ont été retrouvés sur les éosinophiles conjonctivaux dans ces trois pathologies allergiques avec une nette prédominance dans les KCV et KCA par rapport aux CGP. Cette activation particulière des éosinophiles dans les KCV et KCA pourrait expliquer les atteintes cornéennes cliniques, absentes dans les CGP. De plus, les protéines éosinophiliques sont cytotoxiques pour les cellules épithéliales cornéennes [60]. Les éosinophiles jouent donc probablement un rôle central dans le développement des lésions cornéennes dans les conjonctivites allergiques.
Les macrophages peuvent exprimer des antigènes de classe II et, de façon modérée, la molécule CD1a, jouant ainsi un rôle dans la présentation d’antigènes. Les macrophages semblent être les principales cellules présentatrices d’antigène dans les blépharoconjonctivites expérimentales [61]. Au niveau oculaire, les macrophages jouent un rôle dans le maintien et la poursuite des cascades inflammatoires conjonctivales. Des infiltrats de macrophages conjonctivaux sont retrouvés dans diverses affections conjonctivales aiguës ou chroniques comme la pemphigoïde oculaire cicatricielle ou lors de sécheresses oculaires induites après une réaction du greffon contre l’hôte [62]. Une élévation de MIF (macrophage migration inhibitory factor) qui favorise l’infiltration de macrophages a été retrouvée dans les pemphigoïdes oculaires cicatricielles [63].
Le terme « immunité » vient du latin immunis qui signifie « protégé de » et qui correspond à tout ce que met en œuvre un système organisé pour lutter et résister à des agents agressifs, toxiques ou infectieux. Le système immunitaire constitue une organisation de défense remarquable chez de nombreux organismes comme les mammifères, les insectes ou même les plantes. Mais la forme la plus évoluée est retrouvée chez les vertébrés supérieurs. L’œil est un organe en contact avec le milieu extérieur, responsable d’une des fonctions les plus importantes, la vue, dont la qualité dépend de l’efficacité de ce système de défense. L’immunité de l’œil rassemble un ensemble de moyens (organes, tissus, cellules et molécules) permettant de répondre rapidement, de façon souvent spécifique et efficace contre de nombreuses agressions et agents pathogènes tels que virus, bactéries, parasites, champignons etc.
Il existe deux grands volets à la réponse immunitaire (tableau 1-4) :
lors de la rencontre d’un pathogène, des réponses peu spécifiques aux pathogènes sont rapidement mises en œuvre et constituent l’immunité innée ou naturelle ;
des réponses plus tardives et très spécifiques sont également mises en jeu et constituent l’immunité acquise ou adaptative.
Mais ces systèmes ne sont pas totalement étanches et lors des réponses immunitaires, les réponses innée et acquise collaborent souvent, se déléguant et se partageant les tâches.
L’immunité innée/naturelle est le premier système de défense qui permet à un organisme de lutter contre des substances nocives ou irritatives. Elle correspond à une réponse rapide mais n’évolue pas avec le temps. L’immunité naturelle est efficace contre les bactéries dont des constituants de surface communs sont restés constants au cours de l’évolution. Ces éléments structuraux sont conservés chez un grand nombre de bactéries différentes et des récepteurs à ces composants, les pattern-recognition receptors (PRR), sont présents essentiellement à la surface des cellules phagocytaires. Ces PRR reconnaissent des motifs moléculaires conservés à la surface de nombreux pathogènes : c’est pourquoi on dit que cette immunité est non spécifique. Un des mécanismes clés de cette immunité est la reconnaissance du lipopolysaccharide (LPS), constituant principal de la paroi des bactéries à Gram négatif, et constamment produit dans l’environnement pendant la vie et la mort de la bactérie. Le système immunitaire est très réactif aux infections bactériennes, et quelques molécules d’origine bactérienne suffisent à initier des réponses inflammatoires. Le TNF-α est une des plus importantes cytokines stimulées par le LPS et joue un rôle important dans la défense contre de multiples agents pathogènes bactériens, viraux et fongiques en participant à de nombreux processus inflammatoires. Il peut activer les cellules immunitaires comme les lymphocytes, les monocytes, les macrophages, mais aussi des cellules épithéliales et mésenchymateuses, lesquelles produisent alors des cytokines et des substances chimiotactiques. Nous décrirons plus loin cette cytokine en détail.
L’immunité acquise/adaptative se développe au rythme des interactions gène–environnement et c’est une réponse lente dans les premiers temps qui évolue ultérieurement en augmentant sa rapidité, son efficacité et sa spécificité grâce à la mémoire immunologique. Elle devient alors plus spécifique et permet d’éliminer le non-soi d’une manière plus efficace, et d’intensifier la réponse lors des contacts ultérieurs. L’immunité acquise dépend aussi de l’action du système immunitaire et se manifeste sous deux formes : l’immunité à médiation humorale (constituée par l’action de protéines appelées immunoglobulines ou anticorps-Ac) et l’immunité à médiation cellulaire (la seule efficace contre les agents qui ont pénétré à l’intérieur des cellules de l’organisme, comme le font les virus à une certaine phase de leur cycle de reproduction). Le système immunitaire acquis est capable de produire des anticorps, qui peuvent reconnaître spécifiquement les antigènes. Dans tous les cas, les messages entre cellules passent par une multitude de médiateurs, ubiquitaires et multifonctionnels, les cytokines.
Tableau 1-4 Différences entre immunité innée et immunité acquise.
Les cytokines sont des protéines produites en réponse à un signal activateur assurant la communication entre les différentes cellules de l’organisme sur un mode autocrine, paracrine et/ou endocrine. Elles exercent leurs actions sur un nombre élevé de cellules cibles différentes (actions pléïotropiques) en se liant avec une forte affinité à des récepteurs spécifiques. Elles interviennent dans l’infection, l’inflammation, l’immunité et la croissance cellulaire. Elles possèdent des caractéristiques spécifiques qui appartiennent seulement à cette famille (tableau 1-5).
Ce sont des protéines ou glycoprotéines de petit poids moléculaire qui :
régulent l’inflammation, l’hématopoïèse et le système immunitaire ;
contrôlent la nature, l’intensité et la durée de la réponse immunitaire ;
ont une production transitoire, une action à court terme ;
ont des modes d’action très larges et très divers ;
agissent à faibles doses ;
ont des récepteurs spécifiques de forte affinité. Chaque catégorie de cytokines se combine avec son propre type de récepteur en conduisant à des voies de signalisations complètement différentes de l’une à l’autre.
Tableau 1-5 Les familles de cytokines et leurs récepteurs.
Le TNF est un médiateur de l’immunité naturelle, sécrété par les monocytes, macrophages, lymphocytes et mastocytes. C’est une cytokine majeure dans le processus inflammatoire et dans les dommages tissulaires. Mais selon les différents types de cellules, il peut aussi avoir d’autres effets variables, tels que la prolifération cellulaire, la nécrose, la différenciation ou l’apoptose. Il facilite le recrutement des cellules inflammatoires en induisant l’expression des molécules d’adhésion et la production de chimiokines.
Depuis la découverte du TNF, les chercheurs ont trouvé d’autres molécules qui ont des similarités avec lui. La « superfamille » du TNF désigne une famille de molécules ayant des caractéristiques structurales ou fonctionnelles proches de celles du TNF et qui sont essentiellement impliquées dans les réponses immunitaires. Ces diverses protéines sont des maillons essentiels dans la chaîne conduisant soit au signal de l’apoptose, soit à celui de la réponse immune et de l’inflammation. Elles jouent donc des rôles dans la prolifération, la différenciation et la mort cellulaires, notamment dans le contexte de la réponse immunitaire et de la réaction inflammatoire [64]. Leurs effets physiologiques et pathologiques sont très variables. Le TNF et ses membres sont essentiels pour l’hématopoïèse, la protection contre l’infection bactérienne, la régression des tumeurs et la surveillance immunitaire. Leur dysrégulation mène à diverses maladies telles que le lupus érythémateux disséminé, la maladie de Crohn, la maladie d’Alzheimer, etc. Ce type de rôle, induisant tout à la fois la survie et la mort, comme une épée à double tranchant, est typique de la plupart des membres de la superfamille du TNF.
Il existe 29 récepteurs correspondant à la superfamille du TNF, dont FAS, CD40, CD27, RANK (receptor activator of NF-κB), etc. Les récepteurs du TNF (TNFRs : TNFR1 et TNFR2) induisent la transduction d’une variété de signaux à l’intérieur de la cellule, comme la prolifération, la différenciation, la survie ou la mort. L’équilibre entre la vie et la mort pendant les réponses immunitaires est réglé par des membres de la superfamille TNF-NF-κB. Les signaux d’apoptose n’exigent pas la synthèse de protéines actives, tandis que les signaux d’anti-apoptose nécessitent la synthèse et l’activation du NF-κB (nuclear factor-kappa B) [65].
Le NF-κB est un facteur transcriptionnel séquestré dans le cytoplasme de la plupart des cellules des mammifères sous une forme inactive, lié à une protéine inhibitrice appelée IκB. Son activation par des stimuli variables requiert une cascade d’événements qui mettent en jeu une série de protéines kinases permettant la phosphorylation d’IκB nécessaire à sa dégradation par le système ubiquitine–protéasome. Le NF-κB est ensuite libéré et la translocation du cytoplasme vers le noyau cellulaire permet sa fixation aux régions promotrices de ses gènes cibles (par exemple TNF-α) puis leur transcription. L’activation de NF-κB peut protéger les cellules contre l’apoptose induite par TNF-α. On a déjà identifié plusieurs protéines qui sont régulées par NF-κB et qui sont impliquées dans la survie, la prolifération et la protection de cellules contre l’apoptose. Il semble maintenant que quand une cellule est attaquée par un stimulus apoptotique, la cellule répond d’abord en activant les mécanismes anti-apoptotiques, qui ne sont pas toujours efficaces. L’équilibre entre les mécanismes apoptotiques et anti-apoptotiques décide de la prolifération, la survie ou l’apoptose d’une cellule [65]. L’effet anti-apoptotique du NF-κB constitue une des pistes de recherche majeure dans le domaine de la pharmacomodulation des maladies inflammatoires chroniques.
Le TNF est une cytokine impliquée dans de très nombreuses fonctions intervenant lors des pathologies oculaires, pouvant à la fois maintenir la survie cellulaire au travers de l’activation du NFκB et être inducteur d’apoptose cellulaire lorsque le système des caspases est enclenché après activation de TNFR1 [65]. Il a déjà été montré que TNFR1 peut avoir des effets neurodégénératifs, tandis que TNFR2 peut avoir des effets neuroprotecteurs sur un modèle d’ischémie. L’existence de ces deux récepteurs rend l’exploration du rôle de TNF plus complexe mais en constitue un des grands intérêts physiopathologiques et éventuellement thérapeutiques, puisque des stratégies anti-TNF sont déjà utilisées dans de nombreuses pathologies inflammatoires.
Médiateur multifonctionnel, le TNF est impliqué dans beaucoup de pathologies oculaires : glaucome, uvéite avec HLA-B27, prolifération des cellules épithéliales du cristallin après chirurgie, rétinopathie diabétique, etc. Une grande source de synthèse du TNF se situe dans les mastocytes, des lymphocytes T de la conjonctive et dans la grande majorité des cellules épithéliales oculaires, jouant de ce fait un rôle d’amplification dans un processus inflammatoire, toxique ou dégénératif. Le TNF agit synergiquement avec d’autres cytokines, tels que le ligand du Fas, l’IL-1α/β ou l’IFN-γ. Cette interaction active mène à l’apoptose et à l’inflammation, et participe à l’amplification des altérations de la surface oculaire. Les espèces réactives de l’oxygène (reactive oxygen species [ROS]) stimulent aussi la synthèse du TNF et, réciproquement, le TNF peut stimuler la production de ROS. Le TNF peut induire l’apoptose caspase indépendante, tandis que les ROS peuvent être stimulées par beaucoup d’agressions extérieures, telles que les rayons ultraviolets ou les médicaments toxiques.
À l’état normal, le TNF et ses récepteurs principaux TNFR1 et TNFR2 sont exprimés dans toutes les couches cornéennes (de l’endothélium à l’épithélium) et aussi dans l’épithélium conjonctival. Mais dans le cas des pathologies oculaires, une surexpression de cette cytokine est habituellement retrouvée. Le TNF ainsi que l’IL-1α/β sont surexprimés dans la kératoconjonctivite sèche (KCS), le trachome ou l’allergie. Le TNF influence la voie de signalisation des MMP et ces enzymes activent des cytokines sous leur forme active à partir de leurs précurseurs. Dans un système d’épithélium conjonctival humain multicouche, l’exposition des cellules au TNF ou à l’IFN-γ a comme conséquence une surexpression génétique de MUC1, MUC4, MUC16 et MUC5AC [66]. Chez les patients atteints de sécheresse oculaire modérée, de kératite herpétique, de KCV ou de trachome cicatriciel, une augmentation de l’expression de TNF a été mise en évidence. Étant une cytokine pro-inflammatoire, le TNF est aussi impliqué dans des pathologies iatrogènes oculaires en synergie avec d’autres cytokines. Dans les larmes des patients glaucomateux traités sur le long terme, les cytokines pro-inflammatoires (IL-1β, IL-6, IL-12, TNF) augmentent sensiblement par rapport aux sujets normaux. Les cytokines du type Th1 (IFN-γ, IL-2) et du type Th2 (IL-4, IL-5, IL-10) sont également sensiblement plus élevées. L’expression des chimiokines IL-8 et MCP-1 augmente également dans le groupe des patients glaucomateux. L’analyse des empreintes conjonctivales chez les patients souffrant d’œil sec a aussi montré une augmentation de l’expression des cytokines pro-inflammatoires (TNF-α et IL-1β, IL-6, IL-8), proportionnellement à la sévérité des symptômes [67].
Le TNF est non seulement trouvé dans beaucoup de pathologies oculaires, il est aussi un stimulus fort sur les cellules cultivées in vitro. Le TNF a déjà montré sa capacité à amplifier l’expression d’ICAM-1, de HLA-DR, de CD40, et de la caspase 9 sur des lignées cellulaires d’épithélium humain [68, 69]. D’ailleurs, le TNF stimule à son tour ses propres récepteurs ou d’autres membres de la superfamille du TNF et conduit à des signaux de mort cellulaire (CD40 ou FAS) ou à des médiateurs impliqués dans les cascades inflammatoires (ICAM-1 ou IL-8) [17].
Le TNF joue un rôle essentiel dans l’activation des pathologies de la surface oculaire (fig. 1-46) [70]. Face à tous les stress extérieurs, tels que l’air sec, l’hypoxie, l’augmentation de l’osmolarité, les radiations ultraviolettes, les infections ou des collyres toxiques, les cellules épithéliales et les cellules inflammatoires infiltrées peuvent sécréter du TNF, ainsi que d’autres médiateurs (IL-1). Le TNF amplifie ensuite les signaux via le système des MMP, en activant d’autres cytokines, en stimulant la production de ROS et en induisant ses propres récepteurs qui conduisent à l’activation des voies de signalisation de mort et d’inflammation.
Le terme chimiokines a été proposé en 1992. Il combine des propriétés chimiotactiques et les caractéristiques des cytokines, avec un poids moléculaire entre 8 et 12 kDa. Ces petites protéines sont responsables de l’attraction des cellules inflammatoires au site de l’inflammation. Elles jouent donc un rôle essentiel dans la réaction inflammatoire. Il y a actuellement une cinquantaine de chimiokines identifiées. Leurs récepteurs à la surface des cellules cibles sont variés et actuellement vingt d’entre eux sont connus. Plusieurs récepteurs peuvent se lier à une seule chimiokine et réciproquement, de sorte que le réseau des chimiokines est extrêmement complexe.
Les chimiokines sont des polypeptides de petit poids moléculaire qui sont regroupés en différents groupes en fonction de leur structure. Une nomenclature a été proposée pour les chimiokines et leurs récepteurs, dans laquelle les récepteurs sont appelés CC, CXC, C ou CX3C selon le groupe correspondant à leur ligand, suivi de R pour récepteurs et d’un numéro correspondant à celui assigné au gène de la chimiokine correspondante. Il existe quatre sous-classes de chimiokines définies par l’arrangement des résidus conservés de cystéine (fig. 1-47) [71] :
la sous-famille des chimiokines C ou chimiokines γ : deux des quatre résidus cystéine conservés ne sont pas représentés, le premier et le troisième. Elle comprend deux membres, XCL1, SCM-1α ou lymphotactine, peptide chimiotactique pour les lymphocytes et XCL2 ou SCM-1β ;
la sous-famille des chimiokines CC ou chimiokines β : les deux résidus cystéine conservés sont côte à côte. On y trouve par exemple RANTES, éotaxine, MCP, MIP (macrophage inflammatory protein), etc. ;
la sous-famille des chimiokines CXC ou chimiokines α : un résidu acide aminé sépare les deux premiers résidus cystéine conservés. Cette sous-famille peut être divisée en deux groupes selon la présence ou non du triplet d’acides aminés, acide glutamique–leucine–arginine (CXCL8 ou IL-8).
la sous-famille des chimiokines CX3C ou chimiokines δ : trois acides aminés séparent les deux résidus cystéine conservés ; un seul représentant est actuellement identifié, le CX3CL1 ou fractalkine.
Les chimiokines CC et CXC se caractérisent par une certaine spécificité de leur cible : les chimiokines CXC sont plus actives sur les polynucléaires neutrophiles, alors que les chimiokines CC ont tendance à agir sur les monocytes et parfois les polynucléaires basophiles, les lymphocytes et les polynucléaires éosinophiles. La famille CX3C ne contient qu’un seul membre pour l’instant, la fractalkine, la seule chimiokine liée à la membrane par une tige glycosylée semblable aux mucines. Le tableau 1-6 montre les principales chimiokines, leurs récepteurs correspondants et la balance Th1/Th2 correspondante.
Lors d’une réponse immunitaire, les chimiokines agissent principalement en attirant et en activant des leucocytes spécifiques sur le site de l’inflammation. Éotaxine, RANTES, MCP-3, MCP-4 et MIP-1α ont la faculté de mobiliser les polynucléaires (éosinophiles et basophiles) et de nombreuses études ont montré que ces cytokines jouent un rôle primordial dans l’inflammation allergique [72]. Avec leurs récepteurs, les chimiokines participent activement aux mécanismes des maladies inflammatoires et infectieuses [73]. Le SDF-1 ou stromal cell-derived factor 1 (CXCL12) joue un rôle important en coordonnant le recrutement des cellules inflammatoires en réponse à la réparation initiale du tissu et interagit ainsi étroitement avec les stimuli inflammatoires LPS et TNF. Le récepteur cellulaire de la chimiokine SDF-1 est CXCR4. L’importance de cette association SDF-1/CXCR4 est démontrée, notamment dans l’évolution de certains cancers et de maladies infectieuses.
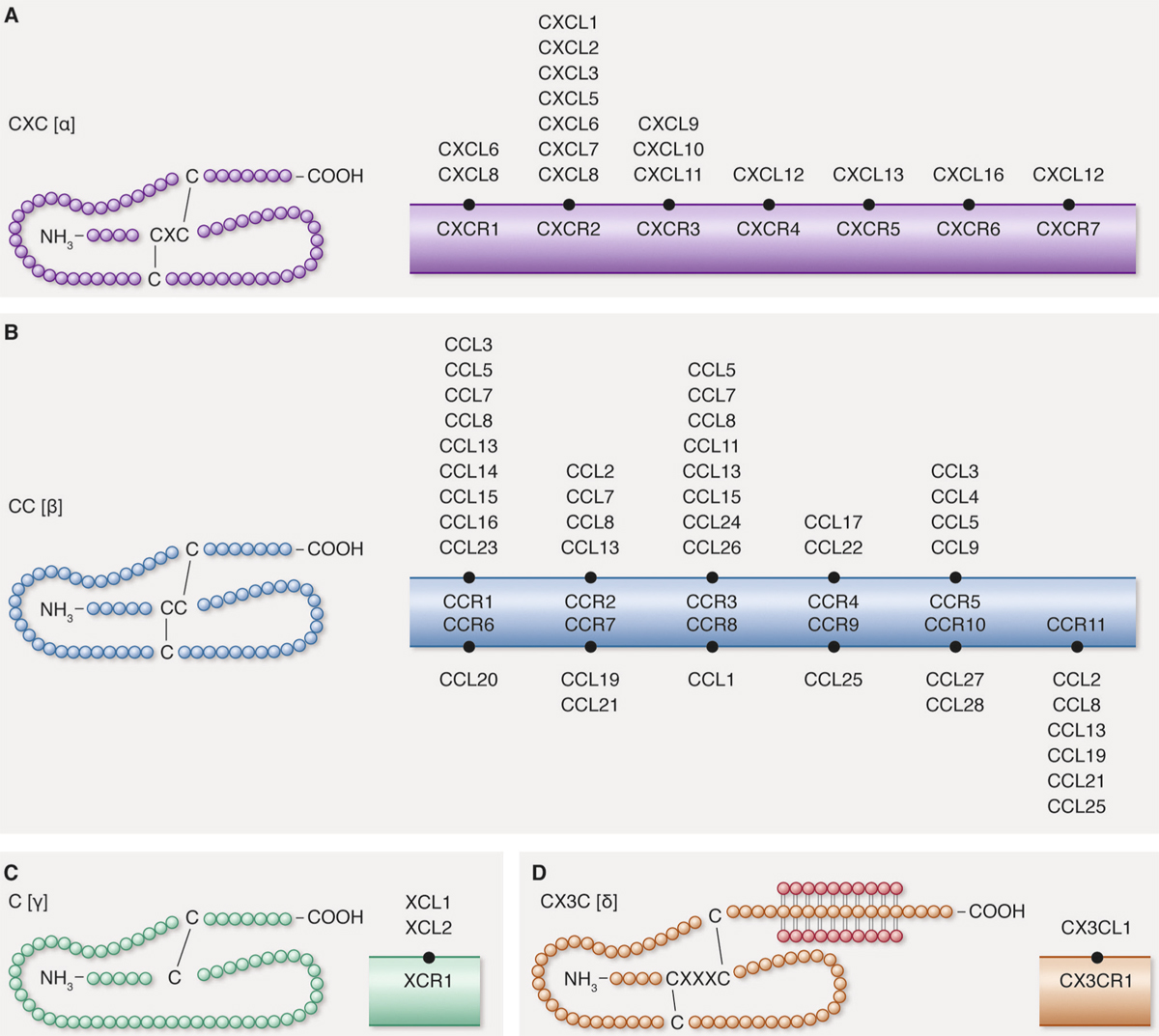
Fig. 1-47 Différentes classes de chimiokines.
Tableau 1-6 Principales chimiokines, leurs récepteurs et leur rôle dans la balance Th1/Th2.
Le système des chimiokines ligand-récepteur constitue un réseau complexe de molécules qui jouent un rôle essentiel dans les processus de migration et d’activation des leucocytes. Ce réseau intervient dans le développement de la réaction inflammatoire allergique, en particulier par ses capacités à réguler le trafic des éosinophiles, basophiles, mais aussi des lymphocytes Th2. CCR4 est identifié comme un récepteur principal dans des réponses immunitaires de type Th2 [74]. CCR5 est exprimé à des niveaux élevés par les cellules Th1 et est pratiquement absent des lymphocytes Th2, ce qui fait de lui un marqueur pour les réactions liées aux cellules Th1 [75]. CCR5 peut être induit sous l’influence de l’IFN-γ. Dans les syndromes secs, une surexpression significative de CCR5 a été trouvée sur les cellules conjonctivales, mais pas en cas de KCV ou sur les yeux normaux, ce qui confirme que l’œil sec est une réponse immuno-inflammatoire du type Th1 et que CCR5 est utile pour évaluer cette voie inflammatoire [19]. Choi et al. ont également confirmé l’implication des chimiokines CCL3, CCL4 et CCL5 et des récepteurs CCR5 et CCR6 chez les patients souffrant de sécheresse oculaire ; de bonnes corrélations ont été observées pour CCL5 avec le temps de rupture du film lacrymal et la clairance des larmes et pour CCR5 avec le score d’épithéliopathie et le taux des cellules à mucus [35].
La chimiokine CXCL12/SDF-1 n’est pas seulement impliquée dans l’inflammation, elle a également un rapport étroit avec l’angiogenèse. SDF-1 est un attractant efficace pour les cellules endothéliales et participe au processus d’angiogenèse en régulation avec le vascular endothelial cell growth factor (VEGF) et le fibroblast growth factor β (FGF-β) [76]. Dans les tissus oculaires, les fibroblastes cornéens humains expriment normalement SDF-1 et son récepteur le CXCR4. Quand ces fibroblastes sont incubés avec MIP-1, RANTES, IL-8, MCP-1, TARC, fractalkine ou éotaxine, il n’y a aucun effet sur les niveaux de calcium intracellulaires. Réciproquement, quand SDF-1 est préalablement incubé avec les diverses chimiokines citées ci-dessus, une augmentation rapide de la concentration intracellulaire en calcium est observée. Ainsi, SDF-1 exerce des effets physiologiques sur la cornée et pourrait être impliqué dans des conditions pathologiques telles que l’angiogenèse cornéenne [77].
La surface oculaire est en contact permanent avec les bactéries. Elle abrite également une flore bactérienne commensale composée de bactéries à Gram positif et négatif. Ainsi, elle a besoin d’utiliser des mécanismes de l’immunité innée pour contrôler et réguler l’inflammation qui pourrait être induite par ces bactéries.
Les lipopolysaccharides (LPS) représentent la principale composante non protéique de la membrane externe des bactéries à Gram négatif. Les LPS sont responsables d’un ensemble d’activités biologiques, parmi lesquelles l’activité toxique et la spécificité antigénique de souche, et sont composés de trois parties [78] :
le lipide A : responsable de l’activité toxique, il représente la partie la plus conservée du LPS et est situé à sa partie proximale et à l’intérieur de la bicouche lipidique, il possède un caractère hydrophobe ;
le noyau : de nature polysaccharidique, il représente le pont entre les deux autres composantes et est divisé en deux parties, le noyau interne hydrophobe et le noyau externe hydrophile ;
l’antigène O : responsable de la spécificité antigénique, il représente la partie la plus variable du LPS. Il est situé à la partie distale du LPS et est de nature polysaccharidique, il possède un caractère hydrophile.
Le lipide A, nommé aussi endotoxine, est la partie responsable de l’induction de la réponse immunitaire non spécifique. Le lipide A, qui est toxique dès quelques picomoles, se fixe sur une protéine fixatrice du LPS, la LBP (LPS binding protein). Le complexe lipide A–LBP se fixe ensuite aux macrophages sur des récepteurs spécifiques. À la surface des macrophages, il existe deux groupes de récepteurs spécifiques pour le complexe lipide A–LBP : le récepteur CD14 et le TLR-4. Le CD14 existe aussi sous une forme soluble en circulation (sCD14). Dans les cellules qui n’ont pas en surface de récepteurs CD14, comme les cellules épithéliales, la réponse au LPS peut se faire par l’intermédiaire du CD14. Cependant, le CD14 ne peut pas être l’initiateur de l’activation de la réponse immunitaire en raison du manque de domaines transmembranaires ou intracellulaires.
Les récepteurs TLR représentent une famille de protéines jouant un rôle essentiel dans la reconnaissance de structures pathogènes, puisqu’ils possèdent des domaines transmembranaires ou intracellulaires. Une fois le lipide A fixé sur les récepteurs CD14 et TLR-4 en surface des macrophages, ces derniers vont sécréter des cytokines pro-inflammatoires comme l’IL-1, l’IL-6, l’IL-8, le TNF et le PAF (platelet-activating factor). Ces différentes cytokines vont activer ensuite, après fixation sur leurs récepteurs spécifiques, la production des médiateurs de l’inflammation. Beaucoup d’études tendent à démontrer un rôle direct du LPS et de ses récepteurs dans des pathologies de la surface oculaire, non seulement dans des infections bactériennes, mais également dans les rapports entre les composants bactériens et les réactions inflammatoires et/ou allergiques.
Les LPS sont des promoteurs de l’inflammation et de l’apoptose et impliquent le TNF. LPS et TNF ont des effets semblables sur des cascades apoptotiques/inflammatoires et sur la maturation des cellules dendritiques. Le LPS induit l’activation de NF-κB, tout en favorisant la surexpression du TNF sur un modèle de kératite chez les souris [79]. Dans un modèle de conjonctivite induite par l’injection de LPS chez les rats, la perméabilité vasculaire de la conjonctive s’est sensiblement accrue 4 h après injection avec une surexpression de la cyclo-oxygénase-2 [80]. Dans un modèle d’uvéite, le traitement par anti-TNF réduit l’infiltration des leucocytes induite par les LPS [81].
Les LPS peuvent déclencher le processus de maturation des cellules dendritiques in vitro et in vivo. Après injection sous-conjonctivale de LPS, les cellules dendritiques s’accumulent à la jonction de l’épithélium et de la substantia propria sur la conjonctive (fig. 1-48) [82]. Ces cellules étendent leurs prolongations vers la surface, quoique le stimulus ait été injecté dans l’espace sous-épithélial. L’origine de ces cellules est probablement une infiltration des leucocytes par les vaisseaux sanguins. Après la stimulation du LPS, ces cellules migrent et possiblement libèrent des quantités élevées de médiateurs inflammatoires, telles que le TNF, qui joue le rôle d’amplificateur des signaux inflammatoires et apoptotiques sur les cellules de l’épithélium et du stroma de la conjonctive.
Fig. 1-48 Cellules dendritiques infiltrant la conjonctive après injection sous-conjonctivale de LPS.
Les toll-like receptors (TLR) sont des composants importants de l’immunité innée en détectant des motifs portés par les agents infectieux. Ils vont ainsi initier des cascades inflammatoires et défendre le tissu contre les agressions microbiennes. Ce sont des protéines transmembranaires phylogéniquement conservées, initialement mises en évidence sur les cellules dendritiques et les macrophages mais exprimées par toutes les cellules de l’organisme dont les cellules épithéliales [83]. Ils reconnaissent des motifs structuraux spécifiques des microbes ou des virus qui sont appelés pathogen-associated molecular patterns (PAMP) ou commensal-associated molecular patterns (CAMP). Il s’agit de micro-organismes qui colonisent l’hôte sans causer de maladie. En outre, des ligands endogènes qui induisent une inflammation en l’absence d’infection peuvent également activer la signalisation TLR-dépendante et sont définis comme des motifs moléculaires associés aux danger-associated molecular patterns (DAMP) [84].
Les PAMP sont produits non seulement par des microbes pathogènes, mais aussi par tous les micro-organismes [85]. Les PAMP, tels que LPS (lipopolysaccharide), sont produits par des microbes mais pas par l’hôte et sont donc des signatures moléculaires uniques qui confèrent sa spécificité à l’immunité innée. Un dysfonctionnement du système de défense innée oculaire, par exemple celui de TLR, a pour conséquence la survenue de diverses inflammations chroniques et, dans certains cas, la pénétration d’agents pathogènes dans l’organisme.
Il y a au moins 11 TLR humains identifiés aujourd’hui. Chaque TLR a ses propres ligands spécifiques et exerce ses propres fonctions, en étant exprimé par différents types cellulaires. Les TLR1 et 6 sont exprimés dans tous les types cellulaires ; les TLR2, 4 et 8 sont principalement présents dans les monocytes CD14+, tandis que les TLR9 et 10 sont exprimés à un niveau élevé dans les cellules B CD19+. Le TLR3 est exprimé sélectivement par les cellules dendritiques.
Concernant leurs fonctions dans la reconnaissance immunitaire :
TLR2 identifie le plus grand nombre de molécules associées aux pathogènes (lipoprotéines, lipoteichoic acid ou LTA, peptidoglycane, lipo-arabinomannane) ;
TLR3 a pour ligand l’ARN double brin associé aux infections virales pendant leur réplication ;
TLR4 identifie surtout les LPS des bactéries à Gram négatif ;
TLR5 a pour ligand la flagelline des bactéries à Gram positif et négatif ;
TLR7 agit lors de la transduction du signal ou de la maturation des cellules dendritiques ;
TLR9 identifie des structures présentes dans l’ADN des mycobactéries, les CpG non méthylés.
Les TLR sont fortement exprimés sur les cellules immunitaires qui sont les plus exposées aux premiers microbes de rencontre, tels que des neutrophiles, des monocytes, des macrophages et des cellules dendritiques. Liés à leurs ligands, les TLR déclenchent l’activation du facteur de transcription NF-κB, menant à l’expression des gènes pro-inflammatoires tels que TNF-α, IL-1 et IL-12. L’identification innée de PAMP par ces cellules et l’activation de TLR induit l’expression de diverses cytokines pro-inflammatoires, chimiokines, molécules d’adhérence, et active les fonctions effectrices des cellules immunisées innées telles que la phagocytose, et lance ainsi une réponse inflammatoire rapide caractérisée par le recrutement des leucocytes à l’emplacement de l’infection pour éliminer les pathogènes envahissants. Les TLR exprimés sur les cellules présentatrices de l’antigène, comme les cellules dendritiques et les macrophages, sont un lien critique entre l’immunité innée et adaptative. L’activation par TLR des cellules présentatrices de l’antigène induit ensuite la maturation des cellules immunitaires, avec la production des cytokines pro-inflammatoires, et mène à l’activation des cellules T naïves, déclenchant l’immunoréaction du type adaptatif.
Des PAMP spécifiques peuvent stimuler des TLR différents et induire une différenciation du système Th1/Th2 vers la réaction la plus appropriée contre l’agent pathogène. Par exemple, l’activation de TLR4 ou de TLR9 dans les cellules dendritiques induit la production d’IL-12, orientant de ce fait la différenciation lymphocytaire vers le type Th1 [86]. Les TLR jouent ainsi un rôle important en déclenchant et en modulant l’activation de l’immunité adaptative. Ils sont des éléments majeurs de la première ligne de défense contre les invasions microbiennes en se situant à l’interface hôte/environnement.
Essentielle à la défense naturelle de la surface oculaire, l’activation des TLR peut être parfois inadéquate et destructrice si elle est en réponse à la flore commensale non pathogène de la surface oculaire. Song et al. ont rapporté l’expression fonctionnelle de TLR4 sur les cellules épithéliales cornéennes humaines avec production de cytokines pro-inflammatoires et de chimiokines après stimulation par le LPS de Pseudomonas aeruginosa (PA) [87]. Ceci peut être important dans le déclenchement rapide de l’immunité innée et dans le recrutement des cellules inflammatoires de la cornée dans des kératites bactériennes à Gram négatif. De même, en réponse au peptidoglycane du Staphylococcus aureus (SA), les cellules épithéliales cornéennes en culture expriment TLR2 et produisent des cytokines, des chimiokines [88]. Pour Ueta et al., cependant, les cellules épithéliales cornéennes humaines expriment TLR2 et TLR4 dans leur cytoplasme mais pas à leur surface en conditions normales d’intégrité tissulaire. De ce fait, ces cellules sont incapables de répondre aux LPS de PA et au peptidoglycane du SA, ce qui évite des déclenchements intempestifs et délétères de réactions inflammatoires dommageables pour la cornée [89]. Le système immunitaire inné constitué par les cellules épithéliales de la surface oculaire peut ainsi créer un état d’immuno-silence pour que l’immunité innée induite par les TLR n’entraîne pas des réponses inflammatoires inutiles en réponse à la flore bactérienne commensale [89]. L’expression de TLR5 dans les couches basales, mais pas dans les couches superficielles de l’épithélium cornéen, suggère encore un mécanisme pouvant inactiver la réponse aux bactéries non pathogènes sur la surface.
Parmi les cellules résidentes de la cornée humaine normale, les kératocytes sont la source principale des chimiokines qui induisent le recrutement sélectif des leucocytes à partir des vaisseaux situés au limbe vers les fibroblastes cornéens. Des fibroblastes cornéens humains en culture expriment TLR4, MD2 et CD14 et répondent à une stimulation par du LPS par la production de chimiokines pour les neutrophiles, les monocytes et par l’expression de molécules d’adhésion [90]. En outre, l’activation de TLR4 est une étape critique dans la pathogénie de la kératite qui se développe après que l’épithélium cornéen murin a été érodé ou exposé au LPS [91].
L’expression des TLR à la surface oculaire est modulée en cas d’infection (kératite herpétique, infection bactérienne ou fongique), ainsi que lors de diverses pathologies inflammatoires (conjonctivite allergique et sécheresse oculaire en particulier). Les TLR en combinaison avec leurs propres récepteurs reconnaissent et répondent aux divers agents infectieux et à des ligands endogènes. En plus de leur fonction de reconnaissance, l’activation des TLR déclenche une cascade complexe de transduction de signal qui induit la production de cytokines inflammatoires et de molécules costimulatrices, initiant ainsi à la fois l’immunité innée et l’immunité adaptative de la surface oculaire [92].
Les TLR sont trouvés dans les cellules conjonctivales et limbiques humaines en réponse à beaucoup d’agents pathogènes oculaires communs (fig. 1-49). Bien que les expressions de TLR4 et TLR2 soient trouvées en ARN messager et en protéine, les cellules conjonctivales ou limbiques ne répondent pas spontanément au LPS ni à la stimulation staphylococcique, en raison du manque de MD2 (une molécule accessoire exigée pour la signalisation induite par TLR4). Ce déficit à la réponse au LPS peut être reconstitué par IFN-γ ou MD2 exogène, mais pas par TNF [93].
Les TLR sont aussi impliqués dans le processus inflammatoire au cours de la sécheresse oculaire. Le TLR4 participe activement à la réponse inflammatoire et au stress dessiccatif de la surface oculaire. Dans un modèle de sécheresse oculaire, l’expression en ARN de TLR4 a été trouvée augmentée dans le stroma cornéen, mais pas dans les cellules épithéliales cornéennes. L’inhibition de TLR4 par l’Eritoran (E5564), un analogue synthétique du lipide A et puissant antagoniste spécifique du LPS par inhibition de la liaison du lipide A au MD2, bloquant la signalisation de MD2/TLR4, a permis de diminuer la gravité de sécheresse en réduisant l’expression d’IL-1β, IL-6 et de TNF et l’infiltration de cellules CD11b+ dans la cornée [94].
Toutes ces recherches ouvrent un jour nouveau sur les interactions entre l’immunité innée et l’immunité acquise, non seulement en cas d’infection mais aussi dans la régulation de la surface oculaire et dans ses pathologies. Les TLRs et leurs ligands pourraient constituer dans le futur autant de nouvelles cibles thérapeutiques potentielles.
Fig. 1-49 Immunomarquage de TLR4 sur les cellules épithéliales conjonctivales (marquage vert).
Les réactions d’hypersensibilité sont des réponses immunitaires exagérées ou inappropriées, responsables de lésions tissulaires. Quatre types ont été décrits : les trois premiers sont dus à des anticorps, le quatrième est lié aux cellules T et aux macrophages.
Devenue synonyme d’allergie, l’hypersensibilité de type I est due à l’activation par un antigène spécifique de mastocytes sensibilisés et recouverts d’IgE. L’allergie survient préférentiellement sur un terrain génétiquement déterminé, caractérisé notamment par une synthèse élevée d’IgE : c’est l’atopie. La réaction allergique s’organise en deux phases : précoce, due à la dégranulation mastocytaire, survenant dans les minutes qui suivent l’exposition à l’allergène ; tardive, survenant dans les 4 à 6 heures suivantes, liée aux éosinophiles et aux macrophages. La violence fréquente de l’hypersensibilité de type I s’explique par les nombreux et puissants médiateurs synthétisés et libérés par les mastocytes et les cellules accessoires de l’allergie. Les réactions allergiques peuvent être explorées par des tests cutanés (prick-test ou patch-test), le dosage d’IgE totales et spécifiques, sériques ou lacrymales, ou encore par des tests de provocation.
L’hypersensibilité de type II est une réaction dirigée contre des antigènes sur lesquels sont déjà fixés des anticorps, essentiellement de type IgG. Ces antigènes sont en général portés par des cellules sanguines (globules rouges, leucocytes ou plaquettes), qui sont lysées à la suite de l’activation du complément ou directement par des lymphocytes K (killer) cytotoxiques par l’intermédiaire des IgG portées par les cellules cibles. D’autres types cellulaires interviennent secondairement, comme les neutrophiles, les mastocytes et les macrophages. La libération de leurs médiateurs peut entraîner des lésions importantes des cellules environnantes. Ce mécanisme est tenu pour responsable de cytopénies médicamenteuses ou alimentaires, de glomérulonéphrite ou de myasthénie. En pathologie inflammatoire chronique de la conjonctive, l’hypersensibilité de type II intervient dans les conjonctivites auto-immunes, telle la pemphigoïde oculaire cicatricielle dans laquelle l’antigène est un constituant de la membrane basale recouvert d’anticorps.
L’hypersensibilité de type III met en jeu des complexes immuns formés d’IgG ou d’IgM, ainsi que l’activation du complément. Plusieurs mécanismes peuvent intervenir. Une infection chronique avec persistance de l’agent infectieux stimule une réponse IgG de faible intensité, avec formation de complexes immuns ; une maladie auto-immune entraîne la formation permanente d’auto-anticorps et les complexes immuns formés se déposent dans les tissus. Enfin, des contacts répétés avec des antigènes exogènes peuvent entraîner une stimulation immunitaire chronique similaire. Les dépôts de complexes immuns dans les vaisseaux ou les tissus sont parfois responsables d’intenses réactions inflammatoires, avec risque de nécrose tissulaire. La conjonctive peut être impliquée dans ce type d’hypersensibilité dans le cadre des vascularites systémiques associées à des ulcères périphériques limbiques ou à des sclérites.
L’hypersensibilité de type IV est liée à des réactions cellulaires. Elle se développe au bout de 48 à 72 heures environ pour l’hypersensibilité de contact ou l’hypersensibilité tuberculinique, en quelques semaines pour les réactions granulomateuses. La réaction typique de l’allergie de contact est l’eczéma. La plupart des antigènes responsables sont des haptènes, molécules trop petites pour être immunogènes. Cependant les haptènes peuvent traverser la peau ou les muqueuses et devenir immunogènes en se combinant aux protéines du receveur. La reconnaissance de ces complexes par les lymphocytes T est spécifique du conjugué haptène-porteur et non de chaque molécule indépendamment.
Le processus initial de sensibilisation nécessite environ 10 à 14 jours. Les complexes sont captés par les cellules présentatrices de l’antigène, essentiellement les cellules de Langerhans cutanées ou muqueuses. Celles-ci migrent par les lymphatiques efférents vers les ganglions où elles présentent le complexe aux lymphocytes T auxiliaires, en association aux antigènes de classe II. Des lymphocytes à mémoire sont ainsi stimulés et déclencheront une réaction plus rapide en cas de contact ultérieur. L’hypersensibilité de contact débute après 4 à 8 heures et devient maximale entre 48 à 72 heures. Le tissu est œdémateux, infiltré de lymphocytes CD4 essentiellement, de CD8, de cellules de Langerhans, puis de macrophages. Des mastocytes et des basophiles interviennent de manière accessoire. De nombreuses cytokines sont sécrétées. Certaines ont un effet direct sur les cellules épithéliales. L’IFN-γ, notamment, stimule l’expression d’antigènes de classe II HLA-DR et d’ICAM-1 par les kératinocytes et les cellules conjonctivales. Ces antigènes favorisent la migration des cellules immunocompétentes qui expriment notamment l’intégrine LFA-1 (lymphocyte function antigens 1), ligand d’ICAM-1.
Les hypersensibilités tuberculiniques et granulomateuses sont caractérisées par la présence de grandes cellules dites épithélioïdes, de lymphocytes et de cellules géantes multinucléées, probablement dérivées des macrophages. Une zone centrale de nécrose ou de fibrose y est souvent associée.
Le système immunitaire oculaire fait l’objet de processus de régulation complexes permettant l’élimination de micro-organismes pathogènes tout en maintenant une tolérance vis-à-vis des antigènes de la flore endogène [95, 96]. Le privilège immunitaire oculaire (PrIO) est censé augmenter le seuil à partir duquel l’immunité innée et adaptative peut déclencher une inflammation intra-oculaire dans le but de préserver l’intégrité de l’axe visuel et la fonction visuelle. Il a été mis en évidence par le fait que certaines tumeurs pouvaient se développer dans la chambre antérieure de l’œil alors qu’elles en étaient incapables ailleurs.
L’existence du PrIO a été démontrée d’une part, par l’induction d’une déviation de la réponse immunitaire normale aux antigènes présents dans la chambre antérieure (anterior chamber associated immune deviation ou ACAID) après l’injection d’antigènes tumoraux et d’autre part, par la capacité du micro-environnement oculaire (particulièrement l’humeur aqueuse) à réprimer des réponses inflammatoires. Medawar dès 1948 démontrait que la règle de l’immunologie de transplantation qui veut que le système immunitaire de l’hôte puisse provoquer le rejet de la greffe en développant une réponse contre les antigènes du greffon et qui s’applique à la plupart des organes du corps, ne s’applique pas à l’œil (cité in Niederkorn, 2013 [96]). Il a aussi constaté que les allogreffes dans la chambre antérieure de l’œil ont une survie prolongée comme c’est le cas également pour le cerveau. De ce fait, le terme de « privilège immunitaire » a été utilisé pour décrire cette propriété spéciale de la chambre antérieure et du cerveau. Aujourd’hui avec les ovaires, les testicules, le cortex surrénalien, le foie, les matrices des poils et la poche jugale du hamster, le cerveau et l’œil sont considérés comme des sites immunologiquement privilégiés au niveau desquels les greffes incompatibles peuvent persister longtemps.
On a longtemps cru que la cornée était dépourvue de cellules myéloïdes et que ceci participait à ce statut immunitaire privilégié. Or, on sait désormais que des cellules dérivées de la moelle osseuse existent dans la cornée normale, au sein de l’épithélium et du stroma cornéens, en particulier en son centre, avec des populations hétérogènes de macrophages et de cellules dendritiques, présentatrices de l’antigène et porteuses d’antigènes de classe II du CMH [97]. En outre, les cellules cornéennes normales, épithéliales, stromales et endothéliales, n’expriment pas d’antigène de classe II du CMH et expriment très faiblement les antigènes de classe I. Ainsi, les antigènes impliqués dans le rejet de greffe ne seraient pas ceux du CMH mais plutôt des antigènes mineurs comme les antigènes H. En revanche, l’exposition à des cytokines inflammatoires, IFN-γ ou TNF, modifie le phénotype de ces cellules qui expriment alors des antigènes de classe II du CMH sans la chaîne invariante [95, 98].
À l’état normal, la cornée est pauvre en cellules présentatrices de l’antigène, monocytes/macrophages du stroma profond, cellules dendritiques (CD) du stroma antérieur et cellules de Langerhans dans l’épithélium. Ces cellules ont : un phénotype immature induisant une tolérance de la part des cellules T ; un phénotype caractérisé par une faible expression de molécules de classe II du CMH chargées de présenter les antigènes aux lymphocytes CD4 ; une absence de molécules de costimulation B7 et CD40 [50]. Toutes ces molécules peuvent être acquises sous l’effet d’un processus inflammatoire pourvoyeur de cytokines inflammatoires, IL-1 et TNF, elles-mêmes contrôlées par le TGF-β présent dans les larmes, le VIP (vasoactive intestinal peptide) produit par les nerfs cornéens et l’antagoniste du récepteur à l’IL-1, IL-1Ra. En outre, la cornée ne comporte aucun vaisseau, ni lymphatique, ni sanguin. Ceci est dû au fait qu’elle exprime des récepteurs du VEGF, le VEGFR1, récepteur soluble qui bloque le VEGF-A, et le récepteur VEGFR3 qui bloque les VEGF-C et D [50, 99]. Ainsi, la circulation des cellules présentatrices d’antigène vers le compartiment lymphatique est ralentie et les cellules effectrices de l’immunité accèdent plus difficilement à la cornée. Parallèlement, dans l’épithélium cornéen normal, existe un équilibre entre facteurs pro- et anti-angiogéniques participant au privilège angiogénique [100]. Enfin, l’endothélium cornéen exprime très peu de molécules du CMH de classe I, diminuant ainsi la probabilité d’infiltration de lymphocytes T cytotoxiques CD8+ [101].
Des facteurs immunosuppresseurs sont également produits dans la cornée normale, le TGF-β surtout, mais aussi l’IL-10 et l’IL-4, et l’intervention du système Fas (CD95)/Fas ligand permet d’éliminer les cellules immunes inopportunes qui expriment Fas et qui seront tuées par apoptose après leur liaison avec les cellules épithéliales et endothéliales de la cornée, porteuses du Fas ligand [102, 103].
L’humeur aqueuse contient également un certain nombre de facteurs anti-inflammatoires et immunosuppresseurs, tels que le VIP, l’alpha-melanocyte stimulating hormone (α-MSH), la thrombospondine (qui participe à la répression de l’angiogenèse inflammatoire), l’IL-10 et le TGF-β [95]. En outre, dans la chambre antérieure, des mécanismes régissent et modifient le comportement des antigènes reconnus par le système immunitaire. En effet, les antigènes présentés dans la chambre antérieure induisent des réactions immunitaires particulières régulatrices, associées aux systèmes Th1 et Th2 [96]. Les cellules présentatrices de l’antigène (CPA), au contact d’un environnement immunosuppresseur comme le TGF-β, acquièrent un phénotype particulier permettant le développement de lymphocytes T régulateurs (Treg), c’est-à-dire faible expression d’effecteurs inflammatoires comme l’IL-12 et le CD40 et forte expression de molécules anti-inflammatoires, IL-10, TGF, TSP-1(thrombospondine 1), IFN-α/β, TNFR2, IκBα, etc. Ainsi, en présentant des antigènes oculaires aux cellules T, les CPA sont responsables de l’induction dans la rate de Treg spécifiques de ces antigènes oculaires, rendant inactives les cellules inflammatoires effectrices et protégeant les tissus oculaires. En revanche, ces CPA produisent du TNF, molécule typiquement inflammatoire mais qui présente des propriétés immunorégulatrices sur les CPA exposées au TGF-β [95]. Cet effet passe par l’augmentation de l’expression du récepteur au TNF, TNFR2 (p75) qui médie les effets anti-inflammatoires du TNF au détriment des effets pro-inflammatoires eux-mêmes médiés par le TNFR1 (p55). Ainsi, la production d’IL-12 se trouve réduite de manière autocrine par le TNF sécrété par les CPA oculaires.
Mais, bien qu’IL-12 soit une cytokine clé de l’induction d’effecteurs du système Th1, la seule inhibition de sa synthèse par les CPA ne suffit pas à prévenir la réponse inflammatoire et réguler les réponses immunes. L’intervention d’autres facteurs, comme la TSP-1, l’IFN et l’IκBα, apparaît indispensable. La TSP-1, en particulier, est capable d’orchestrer les interactions entre CPA et cellules T pour favoriser la génération de Treg. Sa liaison au CD36 portée par les CPA la fixe à la surface cellulaire où elle peut alors activer le TGF-β latent produit par les CPA le rendant ainsi disponible lors de la présentation antigénique. Ainsi, liée à la surface des CPA, la TSP-1 crée un environnement riche en TGF-β, même sur des sites éloignés de l’environnement oculaire. En outre, comme la TSP-1 peut aussi se lier à son autre récepteur, le CD47, exprimé par les T effecteurs, elle contribue à renforcer les interactions CPA/cellules T. En altérant le phénotype fonctionnel des CPA dans la chambre antérieure, la TSP-1 régule à la fois l’état pro-inflammatoire de la microglie dans la rétine et celui des CPA dans la cornée [95]. Par ailleurs, les cellules épithéliales pigmentées de l’iris et du corps ciliaire expriment CD86/B7.2, CD274/PD-L1, CTLA-2α et utilisent aussi les voies dépendantes de la TSP-1 pour générer des Treg.
Finalement, les interactions moléculaires entre cellules oculaires et effecteurs immunitaires dépendant de la TSP-1 résultent en une régulation de la réponse immune locale et systémique faisant de la thrombospondine une molécule importante pour le privilège immunitaire oculaire. Le déficit en TSP-1 compromet le privilège immunitaire oculaire non seulement dans la chambre antérieure et l’espace sous-rétinien mais aussi après greffe de cornée, provoquant un rejet rapide [95].
L’œil est innervé par trois types de nerfs : sensoriels, sympathiques et parasympatiques. Déjà en 1996, Streilein avait montré la perte du PrIO qui accompagnait la perte des nerfs sensitifs cornéens et la réapparition du PrIO avec la réinnervation cornéenne [98].
Les liens entre nerfs sensitifs et PrIO ont été montrés lors d’expériences d’allogreffe de cornée où le phénomène d’ACAID disparaît pendant les 8 premières semaines post-greffe et se trouve restauré après la 12e semaine correspondant à la réinnervation de la nouvelle cornée. Ceci a été confirmé lors d’expériences de résection des nerfs sensitifs cornéens [104].
Leur rôle dans le maintien du PrIO a été montré comme passant par un mécanisme impliquant le TGF-β lors d’expériences de transsections chirurgicales ou de sympathectomies chimiques systémiques par injection de 6-OHDA. En effet, celles-ci conduisent au rejet immunologique de tumeurs faiblement histo-incompatibles et à l’abolition de l’ACAID, en même temps qu’à une diminution du TGF-β [98].
Aucune étude in vivo n’a montré l’implication des fibres parasympathiques dans le PrIO. Mais des études in vitro ont pu mettre en évidence les effets inhibiteurs des neuropeptides produits par les fibres parasympathiques et produits dans l’humeur aqueuse (VIP et somatostatine) sur la prolifération lymphocytaire et la production d’IFN-γ. En outre, le calcitonin gene-related peptide (CGRP) également produit par les fibres parasympathiques dans l’humeur aqueuse empêche la production de NO (nitric oxide) par les macrophages activés en inhibant l’activité de la NOS2 (nitric oxide synthase 2).
Finalement, tout ceci confirme l’importance du système nerveux dans le PrIO, même s’il reste encore à déterminer par quels mécanismes spécifiques le système nerveux peut supprimer l’inflammation autant qu’il peut la stimuler. Les principaux neurotransmetteurs des systèmes sympathique et parasympathique sont connus comme étant impliqués dans la régulation des phénomènes inflammatoires et probablement des effets similaires existent dans l’œil.
Tout semble ainsi fait pour que la conjonctive joue un rôle de sentinelle, en étant extrêmement réactive et efficace en cas d’agression, au contraire de la cornée, tissu dont la protection est l’enjeu essentiel, et qui doit être préservée de réactions inflammatoires risquant de compromettre son intégrité. Les conséquences seraient en effet une stimulation des cellules immunitaires locales, une libération de médiateurs chimiotactiques, mitogènes ou angiogéniques, suivis d’un œdème inflammatoire et d’une prolifération fibroblastique, qui feraient perdre la précieuse transparence cornéenne. C’est probablement une des raisons pour lesquelles la cornée bénéficie d’un système immunitaire réduit, à la différence de la conjonctive, difficile à activer sauf en cas d’agression majeure et spécifique. La différence fondamentale de réactivité entre ces deux structures adjacentes, conjonctive et cornée, constitue probablement une des spécificités les plus fascinantes de l’immunologie de la surface oculaire.
[1] Baudouin C, Trinh L, Creuzot-Garcher C. Anatomie fonctionnelle de la surface oculiaire. In : Pisella PJ, Fauquert JL. Eds. L’allergie oculaire. Bulletin des Sociétés d’ophtalmologie de France. Marseille : Ed. Groupe Ciel ; 2007. p. 25-87.
[2] Mannis MJ, Smolin G. Natural defense mechanisms of the ocular surface. In : Pepose JS, Holland GN, Wilhelmus KR. Ocular infection Immunity. St Louis : Mosby ; 1996, p. 185-90.
[3] Philipp W, Göttinger W. T6 positive Langerhans cells in diseased corneas. Invest Ophthalmol Vis Sci 1991 ; 32 : 2494-7.
[4] Baudouin C, Brignole F, Pisella PJ, et al. Immunophenotyping of human conjunctival dendriform cells. Curr Eye Res 1997 ; 16 : 475-81.
[5] Sacks E, Rutgers J, Jakobiec FA, et al. A comparison of conjunctival and nonocular dendritic cells utilizing new monoclonal antibodies. Ophthalmology 1986 ; 93 : 1089-97.
[6] Abu-El-Asrar AM, Al-Kharashi SA, Al-Mansouri S, et al. Langerhans’ cells in vernal keratoconjunctivitis express the costimulatory molecule B7-2 (CD86), but not B7-1 (CD80). Eye 2001 ; 15 : 648-54.
[7] Hingorani M, Metz D, Lightman SL. Characterization of the normal conjunctival leukocyte population. Exp Eye Res 1997 ; 64 : 905-12.
[8] Rodriguez MM, Rowden G, Hakcett J, Bakos I. Langerhans cells in the normal conjunctiva and peripheral cornea of selected species. Invest Ophthalmol Vis Sci 1981 ; 21 : 759-65.
[9] Ciprandi G, Buscaglia S, Pesce G, et al. Allergic subsets express intercellular adhesion molecule-1 (ICAM-1 or CD54) on epithelial cells of conjunctiva after allergen challenge. J Allergy Clin Immunol 1993 ; 91 : 783-92.
[10] Baudouin C, Brignole F, Becquet F, et al. Flow cytometry in impression cytology specimens : a new method for evaluation of conjunctival inflammation. Invest Ophthalmol Vis Sci 1997 ; 16 : 475-81.
[11] Baudouin C, Haouat N, Brignole F, et al. Immunopathological findings in conjunctival cells using immunofluorescence staining of impression cytology specimens. Br J Ophthalmol 1992 ; 76 : 545-9.
[12] Brignole F, Pisella PJ, Goldschild M, et al. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000 ; 41 : 1356-63.
[13] Baudouin C, Hamard P, Liang H, et al. Conjunctival epithelial cell expression of interleukins and inflammatory markers in glaucoma patients treated over the long term. Ophthalmology 2004 ; 111 : 2186-92.
[14] Ueta M, Mizushima K, Naito Y, et al. Suppression of polyI : C-inducible gene expression by EP3 in murine conjunctival epithelium. Immunol Lett 2014 ; 159 : 73-5.
[15] Sharif NA, Xu SX, Magnino PE, Pang IH. Human conjunctival epithelial cells express Histamine-1 receptors coupled to phosphoinositide turnover and intercellular calcium mobilization : role in ocular allergic and inflammatory diseases. Exp Eye Res 1996 ; 63 : 169-78.
[16] Calonge M, Enriquez-De-Salamanca A. The role of the conjunctival epithelium in ocular allergy. Curr Opin Allergy Clin Immunol 2005 ; 5 : 441-5.
[17] Calder VL, Jolly G, Hingorani M, et al. Cytokine production and mRNA expression by conjunctival T-cell lines in chronic allergic eye disease. Clin Exp Allergy 1999 ; 29 : 1214-22.
[18] Stern ME, Siemasko K, Gao J, et al. Role of interferon-gamma in a mouse model of allergic conjunctivitis. Invest Ophthalmol Vis Sci 2005 ; 46 : 3239-46.
[19] Baudouin C, Liang H, Bremond-Gignac D, et al. CCR 4 and CCR 5 expression in conjunctival specimens as differential markers of T(H)1/ T(H)2 in ocular surface disorders. J Allergy Clin Immunol 2005 ; 116 : 614-9.
[20] Liang H, Baudouin C, Dupas B, Brignole-Baudouin F. Live conjunctiva-associated lymphoid tissue analysis in rabbit under inflammatory stimuli using in vivo confocal microscopy. Invest Ophthalmol Vis Sci 2010 ; 51 : 1008-15.
[21] Giuliano EA, Moore CP, Phillips TE. Morphological evidence of M cells in healthy canine conjunctiva-associated lymphoid tissue. Graefes Arch Clin Exp Ophthalmol 2002 ; 240 : 220-6.
[22] Fukushima A, Yamaguchi T, Fukuda K, et al. CD8+ T cells play disparate roles in the induction and the effector phases of murine experimental allergic conjunctivitis. Microbiol Immunol 2006 ; 50 : 719-28.
[23] Mosmann TR, Sad S. The expanding universe of T-cell subsets : Th1, Th2 and more. Immunol Today 1996 ; 17 : 138-46.
[24] Zhu J, Paul WE. CD4 T cells : fates, functions, and faults. Blood 2008 ; 112 : 1557-69.
[25] Campbell JD, Hayglass KT. T cell chemokine receptor expression in human Th1- and Th2-associated diseases. Arch Immunol Ther Exp 2000 ; 48 : 451-6.
[26] Shabgah AG, Fattahi E, Shahneh FZ. Interleukin-17 in human inflammatory diseases. Postepy Dermatol Alergol 2014 ; 31 : 256-61.
[27] Chauhan SK, El Annan J, Ecoiffier T, et al. Autoimmunity in dry eye is due to resistance of Th17 to Treg suppression. J Immunol 2009 ; 182 : 1247-52.
[28] Pflugfelder SC, Corrales RM, De Paiva CS. T Helper cytokines in dry eye. Exp Eye Res 2013 ; 117 : 118-25.
[29] Boehm N, Riechardt AI, Wiegand M, et al. Proinflammatory cytokine profiling of tears from dry eye patients by means of antibody microarrays. Invest Ophthalmol Vis Sci 2011 ; 52 : 7725-30.
[30] Corrales RM, Villarreal A, Farley W, et al. Strain-related cytokine profiles on the murine ocular surface in response to desiccating stress. Cornea 2007 ; 26 : 579-84.
[31] De Paiva CS, Villarreal AL, Corrales RM, et al. Dry eye-induced conjunctival epithelial squamous metaplasia is modulated by interferon-gamma. Invest Ophthalmol Vis Sci 2007 ; 48 : 2553-60.
[32] Massingale ML, Li X, Vallabhajosyula M, et al. Analysis of inflammatory cytokines in the tears of dry eye patients. Cornea 2009 ; 28 : 1023-7.
[33] Lam H, Bleiden L, de Paiva CS, et al. Tear cytokine profiles in dysfunctional tear syndrome. Am J Ophthalmol 2009 ; 147 : 198-205.
[34] Yoon KC, de Paiva CS, Qi H, et al. Expression of th-1 chemokines and chemokine receptors on the ocular surface of C57BL/6 mice : effects of desiccating stress. Invest Ophthalmol Vis Sci 2007 ; 48 : 2561-9.
[35] Yoon KC, Park CS, You IC, et al. Expression of CXCL9, -10, -11, and CXCR3 in the tear film and ocular surface of patients with dry eye syndrome. Invest Ophthalmol Vis Sci 2010 ; 51 : 643-50.
[36] Choi W, Li Z, Oh HJ, et al. Expression of CCR5 and its ligands CCL3, -4, and -5 in the tear film and ocular surface of patients with dry eye disease. Curr Eye Res 2012 ; 37 : 12-7.
[37] Enriquez-de-Salamanca A, Castellanos E, Stern ME, et al. Tear cytokine and chemokine analysis and clinical correlations in evaporative-type dry eye disease. Mol Vis 2010 ; 16 : 862-73.
[38] Stern ME, Schaumburg CS, Pflugfelder SC. Dry eye as a mucosal autoimmune disease. Int Rev Immunol 2013 ; 32 : 19-41.
[39] De Paiva CS, Villarreal AL, Corrales RM, et al. IFN-gamma promotes goblet cell loss in response to desiccating ocular stress. Invest Ophthalmol Vis Sci 2007 ; 48 : 2553-60.
[40] Zhang X, Chen W, De Paiva CS, et al. Interferon-γ exacerbates dry eye-induced apoptosis in conjunctiva through dual apoptotic pathways. Invest Ophthalmol Vis Sci 2011 ; 52 : 6279-85.
[41] Lee MH, Choi JW, Jang WR, et al. Activation of eosinophils is more closely linked with interleukin-5 and nitric oxide production than tumor necrosis factor-a and immunoglobulin E levels. Acta Haematol 2013 ; 130 : 238-41.
[42] De Paiva CS, Raince JK, McClellan AJ, et al. Homeostatic control of conjunctival mucosal goblet cells by NKT-derived IL-13. Mucosal Immunol 2010 ; 4 : 397-408.
[43] Carreno E, Enriquez-de-Salamanca A, Teson M, et al. Cytokine and chemokine levels in tears from healthy subjects. Acta Ophthalmol 2010 ; 88 : 250-8.
[44] Chen Z, O’Shea JJ, 2008. Th17 cells : a new fate for differentiating helper T cells. Immunol Res 2008 ; 41 : 87-102.
[45] Reyes NJ, Saban DR. T helper subsets in allergic eye disease. Curr Opin Allergy Clin Immunol 2014 ; 14 : 477-84.
[46] Bettelli E, Oukka M, Kuchroo VK. T(H)-17 cells in the circle of immunity and autoimmunity. Nat Immunol 2007 ; 8 : 345-50.
[47] Suryawanshi A, Veiga-Parga T, Rajasagi NK, et al. Role of IL-17 and Th17 cells in herpes simplex virus-induced corneal immunopathology. J Immunol 2011 ; 187 : 1919-30.
[48] Dohlman TH, Chauhan SK, Kodati S, et al. The CCR6/CCL20 axis mediates Th17 cell migration to the ocular surface in dry eye disease. Invest Ophthalmol Vis Sci 2013 ; 54 : 4081-91.
[49] De Paiva CS, Chotikavanich S, Pangelinan SB, et al. IL-17 disrupts corneal barrier following desiccating stress. Mucosal Immunol 2009 ; 2 : 243-53.
[50] Barabino S, Chen Y, Chauhan S, Dana R. Ocular surface immunity : homeostatic mechanisms and their disruption in dry eye disease. Prog Retin Eye Res 2012 ; 31 : 271-85.
[51] Jin Y, Chauhan SK, Saban DR, Dana R. Role of CCR7 in facilitating direct allosensitization and regulatory T-cell function in high-risk corneal transplantation. Invest Ophthalmol Vis Sci 2010 ; 51 : 816-21.
[52] Huehn J, Hamann A. Homing to suppress : address codes for Treg migration. Trends Immunol 2005 ; 26 : 632-6.
[53] Tan X, Zeng H, Jie Y, et al. CD154 blockade modulates the ratio of Treg to Th1 cells and prolongs the survival of allogeneic corneal grafts in mice. Exp Ther Med 2014 ; 7 : 827-34.
[54] Keino H, Watanabe T, Sato Y, Okada AA. Oral administration of retinoic acid receptor-alpha/beta-specific ligand Am80 suppresses experimental autoimmune uveoretinitis. Invest Ophthalmol Vis Sci 2011 ; 52 : 1548-56.
[55] Bialasiewicz AA1, Schaudig U, Ma JX, et al. Alpha/beta- and gamma/delta-t-cell-receptor-positive lymphocytes in healthy and inflamed human conjunctiva. Graefes Arch Clin Exp Ophthalmol 1996 ; 234 : 467-71.
[56] Beauregard C, Stevens C, Mayhew E, Niederkorn JY. Cutting edge : atopy promotes Th2 responses to alloantigens and increases the incidence and tempo of corneal allograft rejection. J Immunol 2005 ; 174 : 6577-681.
[57] Church MK, McGill JI. Human ocular mast cells. Curr Opin Allergy Clin Immunol 2002 ; 2 : 419-22.
[58] Anderson DF, Zhang S, Bradding P, et al. The relative contribution of mast cell subsets to conjunctival TH2-like cytokines. Invest Ophthalmol Vis Sci 2001 ; 42 : 995-1001.
[59] Saban DR, Calder V, Kuo CH, et al. New twists to an old story : novel concepts in the pathogenesis of allergic eye disease. Curr Eye Res 2013 ; 38 : 317-30.
[60] Trocme SD, Hallberg CK, Gill KS, et al. Effects of eosinophil granule proteins on human corneal epithelial cell viability and morphology. Invest Ophthalmol Vis Sci 1997 ; 38 : 593-9.
[61] Ozaki A, Fukushima A, Ishida W, et al. Analysis of Ag-presenting cells in the conjunctiva during the development of experimental immune-mediated blepharoconjunctivitis. Curr Eye Res 2004 ; 29 : 277-86.
[62] Rojas B, Cuhna R, Zafirakis P, et al. Cell populations and adhesion molecules expression in conjunctiva before and after bone marrow transplantation. Exp Eye Res 2005 ; 81 : 313-25.
[63] Razzaque MS, Foster CS, Ahmed AR. Role of macrophage migration inhibitory factor in conjunctival pathology in ocular cicatricial pemphigoid. Invest Ophthalmol Vis Sci 2004 ; 45 : 1174-81.
[64] Mak TW, Yeh WC. Signaling for survival and apoptosis in the immune system. Arthritis Res 2002 ; 4 : S243-S252.
[65] Aggarwal BB. Signalling pathways of the TNF superfamily : a double-edged sword. Nat Rev Immunol 2003 ; 3 : 745-56.
[66] Chung SH, Lee JH, Yoon JH, et al. Multi-layered culture of primary human conjunctival epithelial cells producing MUC5AC. Exp Eye Res 2007 ; 85 : 226-33.
[67] Malvitte L, Montange T, Vejux A, et al. Measurement of inflammatory cytokines by multicytokine assay in tears of patients with glaucoma topically treated with chronic drugs. Br J Ophthalmol 2007 ; 91 : 29-32.
[68] Cejková J, Ardan T, Jirsová K, et al. The role of conjunctival epithelial cell xanthine oxidoreductase/xanthine oxidase in oxidative reactions on the ocular surface of dry eye patients with Sjögren’s syndrome. Histol Histopathol 2007 ; 22 : 997-1003.
[69] Stahl JL, Cook EB, Graziano FM, Barney NP. Differential and cooperative effects of TNFalpha, IL-1beta, and IFNgamma on human conjunctival epithelial cell receptor expression and chemokine release. Invest Ophthalmol Vis Sci 2003 ; 44 : 2010-5.
[70] Baudouin C, Liang H. Amplifying factors in ocular surface diseases : apoptosis. Ocul Surf 2005 ; 3 : S194-7S19.
[71] Rostène W, Kitabgi P, Parsadaniantz SM. Chemokines : a new class of neuromodulator ? Nat Rev Neurosci 2007 ; 8 : 895-903.
[72] Ying S, Taborda-Barata L, Meng Q, et al. The kinetics of allergen-induced transcription of messenger RNA for monocyte chemotactic protein-3 and RANTES in the skin of human atopic subjects : relationship to eosinophil, T cell, and macrophage recruitment. J Exp Med 1995 ; 181 : 2153-9.
[73] Murdoch C, Finn A. Chemokine receptors and their role in vascular biology. J Vasc Res 2000 ; 37 : 1-7.
[74] Ness TL, Kunkel SL, Hogaboam CM. CCR5 antagonists : the answer to inflammatory disease ? Expert Opin Ther Pat 2006 ; 16 : 1051-65.
[75] Loetscher M, Loetscher P, Brass N, et al. Lymphocyte-specific chemokine receptor CXCR3 : regulation, chemokine binding and gene localization. Eur J Immunol 1998 ; 28 : 3696-705.
[76] Salcedo R, Wasserman K, Young HA, et al. Vascular endothelial growth factor and basic fibroblast growth factor induce expression of CXCR4 on human endothelial cells : in vivo neovascularization induced by stromal-derived factor-1alpha. Am J Pathol 1999 ; 154 : 1125-35.
[77] Bourcier T, Berbar T, Paquet S, et al. Characterization and functionality of CXCR4 chemokine receptor and SDF-1 in human corneal fibroblasts. Mol Vis 2003 ; 9 : 96-102.
[78] Erridge C, Bennett-Guerrero E, Poxton IR. Structure and function of lipopolysaccharides. Microbes Infect 2002 ; 4 : 837-51.
[79] Wu XY, Han SP, Ren MY, et al. The role of NF-kappaB activation in lipopolysaccharide induced keratitis in rats. Chinese Med J 2005 ; 118 : 1893-9.
[80] Oka T, Shearer T, Azuma M. Involvement of cyclooxygenase-2 in rat models of conjunctivitis. Curr Eye Res 2004 ; 29 : 27-34.
[81] Koizumi K, Poulaki V, Doehmen S, et al. Contribution of TNF-alpha to leukocyte adhesion, vascular leakage, and apoptotic cell death in endotoxin-induced uveitis in vivo. Invest Ophthalmol Vis Sci 2003 ; 44 : 2184-91.
[82] Liang H, Baudouin C, Labbé A, et al. In vivo confocal microscopy and ex vivo flow cytometry : new tools for assessing ocular inflammation applied to rabbit lipopolysaccharide-induced conjunctivitis. Mol Vis 2006 ; 12 : 1392-402.
[83] Takeda K, Kaisho T, Akira S. Toll-like receptors. Ann Rev Immunol 2003 ; 21 : 335-76.
[84] McClure R, Massari P. TLR-dependent human mucosal epithelial cell responses to microbial pathogens. Front Immunol 2014 ; 5 : 386.
[85] Takeda K, Akira S. Toll-like receptors in innate immunity. Intern Immunol 2005 ; 17 : 1-14.
[86] Mazzoni A, Segal DM. Controlling the Toll road to dendritic cell polarization. J Leukoc Biol 2004 ; 75 : 721-30.
[87] Song PI, Abraham TA, Park Y et al. The expression of functional LPS receptor proteins CD14 and toll-like receptor 4 in human corneal cells. Invest Ophthalmol Vis Sci 2001 ; 42 : 2867-77.
[88] Kumar A, Zhang J, Yu FS. Innate immune response of corneal epithelial cells to Staphylococcus aureus infection : role of peptidoglycan in stimulating proinflammatory cytokine secretion. Invest Ophthalmol Vis Sci 2004 ; 45 : 3513-22.
[89] Ueta M, Nochi T, Jang MH, et al. Intracellularly expressed TLR2s and TLR4s contribution to an immunosilent environment at the ocular mucosal epithelium. J Immunol 2004 ; 173 : 3337-47.
[90] Kumagai N, Fukuda K, Fujitsu Y, et al. Lipopolysaccharide-induced expression of intercellular adhesion molecule-1 and chemokines in cultured human corneal fibroblasts. Invest Ophthalmol Vis Sci 2005 ; 46 : 114-20.
[91] Khatri S, Lass JH, Heinzel FP, et al. Regulation of endotoxin-induced keratitis by PECAM-1, MIP-2, and toll-like receptor 4. Invest Ophthalmol Vis Sci 2002 ; 43 : 2278-84.
[92] Redfern RL, McDermott AM. Toll-like receptors in ocular surface disease. Exp Eye Res 2010 ; 90 : 679-87.
[93] Talreja J, Dileepan K, Puri S, et al. Human conjunctival epithelial cells lack lipopolysaccharide responsiveness due to deficient expression of MD2 but respond after interferon-gamma priming or soluble MD2 supplementation. Inflammation 2005 ; 29 : 170-81.
[94] Lee HS, Hattori T, Park EY, et al. Expression of toll-like receptor 4 contributes to corneal inflammation in experimental dry eye disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 5632-40.
[95] Hori J, Vega JL, Masli S. Review of ocular immune privilege in the year 2010 : modifying the immune privilege of the eye. Ocul Immunol Inflam 2010 ; 18 : 325-33.
[96] Niederkorn JY. Corneal transplantation and immune privilege. Int Rev Immunol 2013 ; 32 : 57-67.
[97] Hamrah P, Dana MR. Corneal antigen-presenting cells. Chem Immunol Allergy 2007 ; 92 : 58-70.
[98] Streilein JW. Ocular immune privilege : therapeutic opportunities from an experiment of nature. Nature Rev 2003 ; 3 : 879-89.
[99] Cursiefen C, Chen L, Saint-Geniez M, et al. Nonvascular VEGF receptor 3 expression by corneal epithelium maintains avascularity and vision. Proc Natl Acad Sci USA 2006 ; 103 : 11405-10.
[100] Ellenberg D, Azar DT, Hallak JA, et al. Novel aspects of corneal angiogenic and lymphangiogenic privilege. Prog Retin Eye Res 2010 ; 29 : 208-48.
[101] Whitsett CF, Stulting RD. The distribution of HLA antigens on human corneal tissue. Invest Ophthalmol Vis Sci 1984 ; 25 : 519-24.
[102] Cousins SW, McCabe MM, Danielpour D, Streilein JW. Identification of transforming growth factor-beta as an immunosuppressive factor in aqueous humor. Invest Ophthalmol Vis Sci 1991 ; 32 : 2201-11.
[103] Streilein JW. Tissue barriers, immunosuppressive microenvironments, and privileged sites : the eye’s point of view. Reg Immunol 1993 ; 5 : 253-68.
[104] Streilein JW, Bradley D, Sano Y, Sonoda Y. Immunosuppressive properties of tissues obtained from eyes with experimentally manipulated corneas. Invest Ophthalmol Vis Sci 1996 ; 37 : 413-24.
A. Réaux-Le Goazigo, S. Mélik Parsadaniantz
Les douleurs chroniques oculaires sont parmi les plus invalidantes et les plus difficiles à traiter, et leurs mécanismes physiopathologiques de nature neurogène et/ou inflammatoire demeurent très mal connus. Les cytokines et chimiokines pro-inflammatoires sont des médiateurs impliqués dans les cascades de réactions cellulaires aboutissant aux sensibilisations centrale et périphérique. Une meilleure compréhension du rôle des interactions neuro-immunitaires dans la chronicisation de la douleur oculaire est nécessaire.
La douleur oculaire superficielle est le symptôme cardinal d’alerte en réaction à une inflammation ou à un traumatisme touchant plus particulièrement les structures composant le segment antérieur de l’œil telles la cornée, la sclère, la conjonctive ou les structures uvéales.
La douleur oculaire superficielle est tout à fait remarquable par la variabilité de l’intensité qu’elle peut générer, allant du simple inconfort oculaire jusqu’à une douleur intense voire insupportable et devenant fortement anxiogène pour le patient. Le terme inconfort oculaire est généralement utilisé pour définir une sensation désagréable d’intensité faible à modérée. Le simple inconfort oculaire est fréquemment rencontré chez des personnes porteuses de lentilles de contact, utilisant des écrans d’ordinateur pendant une longue période quotidienne ou étant soumises à un environnement climatisé. Par ailleurs, des douleurs oculaires intenses ont souvent été rapportées chez des patients ayant subi quelques jours auparavant des interventions chirurgicales de type photokératectomie réfractive ou souffrant de kératites superficielles, en particulier traumatiques. Toutefois, certaines données cliniques, portant sur le ressenti de la douleur oculaire superficielle de patients, font ressortir dans certains cas une absence de corrélation entre l’intensité de leur douleur oculaire et les signes cliniques liés à leur atteinte du segment antérieur de l’œil. Cette dichotomie entre les signes et les symptômes complexifie bien évidemment la compréhension des mécanismes sous-tendant la douleur oculaire superficielle.
Les pathologies de la surface oculaire représentent un des principaux motifs de consultation pour douleurs oculaires en ophtalmologie. Ainsi, on estime qu’entre 15 et 25 % de la population âgée de plus de 65 ans présente une sécheresse oculaire symptomatique avec douleurs [1]. En outre, plus de 60 millions de patients glaucomateux dans le monde sont traités avec des collyres et plus de la moitié d’entre eux se plaignent de symptômes douloureux et d’irritation de la surface oculaire [2]. Cette douleur chronique de la surface oculaire entraîne, au-delà de la souffrance ressentie par les patients, une véritable atteinte de leur qualité de vie puisqu’on estime que près de 60 % des patients sont gênés dans leurs activités quotidiennes [3]. Parallèlement, 80 % de ces patients douloureux estiment que leur douleur n’est pas suffisamment prise en considération [3]. Les douleurs chroniques oculaires sont malheureusement parmi les plus invalidantes et les plus difficiles à traiter, et leurs mécanismes physiopathologique, de nature neurogène et/ou inflammatoire, demeurent de nos jours très mal connus.
Douleur et nociception sont deux termes différents souvent considérés à tort comme synonymes. Le terme « nociception », employé par Sherrington au début du xxe siècle, caractérise un stimulus dont l’intensité entraîne des réactions de défense visant à sauvegarder l’intégrité de l’organisme. Ceci ne fait pas intervenir la nature consciente de la douleur.
La définition de la douleur par l’Association internationale de l’étude de la douleur (1979) illustre bien le caractère pluridimensionnel et plurifactoriel de la notion de douleur : « La douleur est une expérience sensorielle et émotionnelle désagréable, associée à un dommage tissulaire présent ou potentiel, ou décrite en termes d’un tel dommage. »
La douleur est dite chronique lorsqu’elle persiste au-delà de 3 mois. La douleur chronique est une maladie, contrairement à la douleur aiguë qui est un symptôme. Elle est susceptible d’affecter de façon péjorative et de manière prolongée le comportement ou le bien-être du patient, attribuable à toute cause non maligne.
Depuis de nombreuses années, un nombre croissant de données dans la littérature montrent que les cellules non neuronales comme les cellules immunes (macrophages et lymphocytes) et les cellules gliales du système nerveux périphérique (c’est-à-dire les cellules de Schwann et les cellules satellites) et du système nerveux central (astrocytes et cellules microgliales) jouent un rôle critique dans les mécanismes de chronicisation de la douleur [4–6].
En outre, les douleurs de nature neuropathique, conséquences directes d’une lésion ou d’un dysfonctionnement pathologique du système nerveux central ou périphérique, sont souvent caractérisées par une plasticité neuronale. Cette plasticité cellulaire conduit à une sensibilisation périphérique (augmentation de la sensibilité et de l’excitabilité des nocicepteurs périphériques) et centrale (augmentation de l’activité et de l’excitabilité des neurones de second ordre) conduisant ainsi au développement et au maintien d’une douleur chronique [7, 8].
La sensibilité somatique de la face, des cavités buccale et nasale, ainsi que des méninges est assurée, pour l’essentiel, par les trois branches du nerf trijumeau, les nerfs ophtalmique, maxillaire et mandibulaire. Le nerf ophtalmique V1 se divise en trois branches : frontale, lacrymale et nasociliaire. Le nerf nasociliaire se ramifie pour donner naissance aux nerfs ciliaires courts et longs. L’anatomie de l’innervation cornéenne des mammifères a été bien étudiée dans différentes espèces, incluant l’homme [9], le lapin, le chat [10] et le rat [11]. Les fibres nerveuses cornéennes proviennent de ces nerfs ciliaires (branche antérieure), dont 60 à 80 troncs (contenant chacun environ 900 à 1500 axones, le champ récepteur de chaque axone pouvant couvrir 20 à 50 % de la surface cornéenne) pénètrent la cornée selon une direction radiaire au niveau du limbe dans le stroma profond, puis deviennent de plus en plus superficiels pour former un « réseau » ou « plexus » sous l’épithélium cornéen (fig. 1-50a et b).
La densité en terminaisons nerveuses sensitives est une autre caractéristique remarquable de la cornée : cette innervation est la plus dense des tissus de l’organisme. Il est estimé que l’épithélium cornéen comprend 300 à 600 fois plus de terminaisons libres nerveuses que le derme et 20 à 40 fois plus que la pulpe dentaire [12]. L’innervation de la cornée est assurée par un faible nombre de neurones nociceptifs localisés dans le ganglion trigéminé ipsilatéral, cette population de neurones innervant la cornée est estimée à environ 1 à 5 % du nombre total de neurones présents dans le ganglion [13, 14]. Ce faible pourcentage de neurones nociceptifs est surprenant du fait que la cornée soit le tissu le plus richement innervé de l’organisme.
Fig. 1-50 Nerfs cornéens et système trigéminé.
a. Examen d’une cornée humaine en microscopie confocale in vivo permettant la visualisation des nerfs cornéens. b. Image en microscopie à fluorescence de l’immunomarquage des fibres nerveuses cornéennes de souris (échelle = 50 μm). c. Distribution immuno-histochimique des nocicepteurs contenant la substance P dans le ganglion trigéminé de souris (échelle = 100 μm). d. Une stimulation douloureuse au niveau de la cornée induit l’activation de neurones de second ordre (positifs pour le marqueur c-fos) dans le noyau trigéminé sous-caudal de rat (échelle = 100 μm).
Les messages nociceptifs cornéens prennent naissance à la périphérie au niveau des nocicepteurs (récepteur sensoriel de la douleur qui fait naître un message nerveux lorsqu’il est stimulé) constitués des terminaisons libres de fibres de petit calibre, myélinisées (fibres Aδ) ou non (fibres C). Les corps cellulaires de ces afférences primaires cornéennes sont regroupés au sein du ganglion trigéminé ou ganglion de Gasser chez l’homme. Ces prolongements centraux des fibres périphériques trigéminales se distribuent ensuite dans le complexe sensitif du nerf trijumeau qui constitue le premier relais central des informations somesthésiques orofaciales (fig. 1-51).
Tout au long de son trajet nerveux, le message nociceptif fait l’objet de modulations, soit facilitatrices, soit inhibitrices. La rupture de l’équilibre peut être due soit à une hyperactivation des fibres sensitives de petit calibre (c’est-à-dire une douleur par excès de nociception), soit par défaut d’inhibition périphérique ou centrale (une des caractéristiques de la douleur neuropathique).
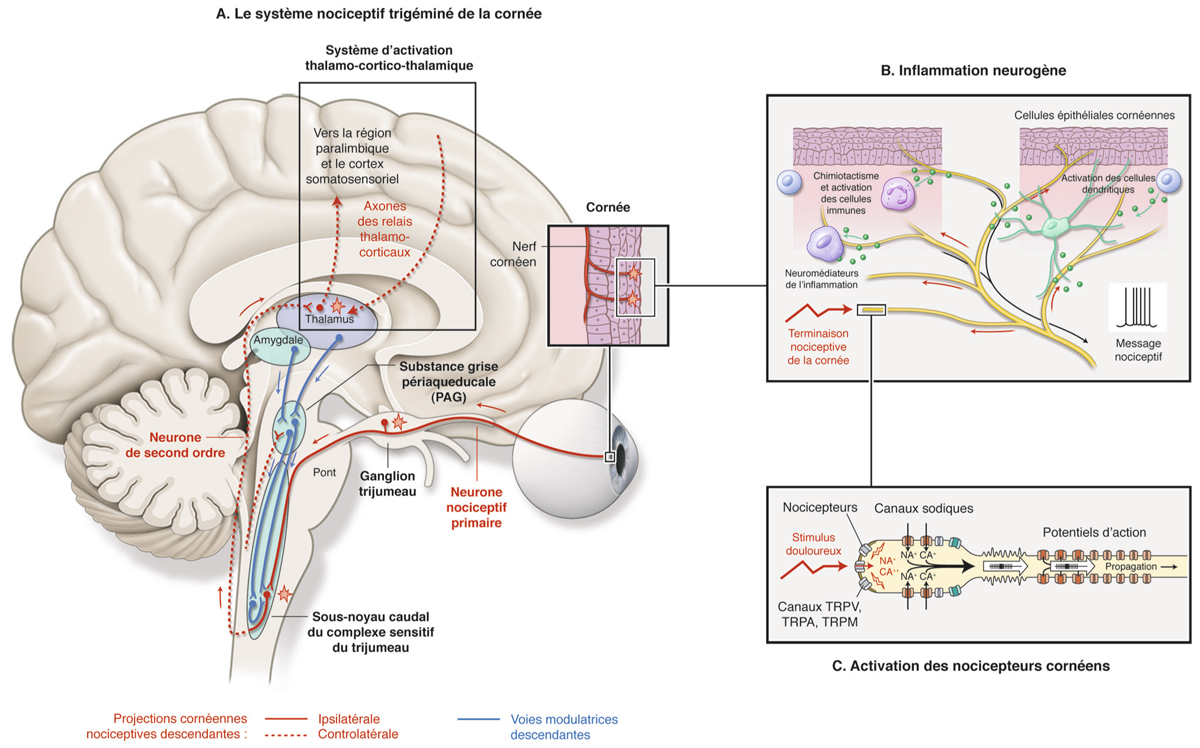
Fig. 1-51 Schématisation du système nociceptif trigéminé de la cornée adapté de Rosenthal et Borsook [34].
a. Les messages nociceptifs prennent naissance au niveau des nocicepteurs périphériques cornéens dont les corps cellulaires sont localisés dans le ganglion trijumeau et qui envoient des prolongements centraux dans le complexe sensitif du trijumeau où ils font relais avec les neurones de second ordre. L’information nociceptive est alors transmise vers les centres supérieurs (thalamus et cortex somatosensoriel). Par ailleurs, l’information nociceptive est modulée par des voies descendantes en provenance du thalamus, de l’amygdale et de la substance grise péri-aqueducale. b. Inflammation neurogène adapté de Chiu et al. [35]. Lors d’une atteinte cornéenne, les fibres nerveuses nociceptives libèrent des neuromédiateurs capables d’influer sur le chimiotactisme des cellules leucocytaires et la réponse immunitaire. Cette inflammation locale conduit à une excitabilité des terminaisons nerveuses donnant naissance à un message nociceptif. c. Activation de nocicepteurs cornéens adapté de Rosenthal et Borsook [34]. Les stimuli douloureux activent les récepteurs canaux de type TRP conduisant à l’activation des canaux sodiques voltage-dépendants, générant des potentiels d’action qui se propagent le long de l’axone.
Des études électrophysiologiques réalisées sur des terminaisons nerveuses libres, individuelles ont permis de mettre en évidence l’existence de différentes populations de neurones sensoriels cornéens [15]. Ainsi, les nocicepteurs polymodaux sont des terminaisons de type Aδ et C répondant à des stimulations mécaniques, thermiques (température supérieure à 39 °C) ou chimiques (substances exogènes et médiateurs de l’inflammation). Ces récepteurs polymodaux représentent la majorité des fibres cornéennes soit environ 70 % de la population totale des fibres cornéennes. Lors d’une forte stimulation, leur activation continue malgré l’arrêt du stimulus, ce qui prolonge la sensation douloureuse de type brûlure.
Environ 15 à 20 % des axones périphériques innervant la cornée répondent uniquement aux stimulations mécaniques, ce sont les mécanonocicepteurs. Cette catégorie de fibres faiblement myélinisées, de diamètre moyen, a une vitesse de conduction rapide.
Une troisième catégorie de nocicepteurs est constituée par les récepteurs au froid qui représente environ 10 à 15 % de la population totale des fibres cornéennes. Ces terminaisons libres, de type Aδ et C, vont décharger spontanément au repos et augmenter leur activité électrique quand la température de la surface cornéenne (se situant aux alentours de 33 °C) diminue, alors qu’elles deviennent transitoirement silencieuses quand la cornée se réchauffe [16]. Ce dernier type de fibres permet le réflexe de clignement spontané déclenché par le refroidissement lié à l’évaporation des larmes, constituant de véritables sentinelles de l’intégrité du film lacrymal.
Notons que la répartition tissulaire de ces trois catégories de nocicepteurs n’est pas homogène au niveau de la cornée. Ces nocicepteurs possèdent une localisation tissulaire bien spécifique qui a été parfaitement décrite par Belmonte et al. [17] et qui est illustrée sur la figure 1-52.
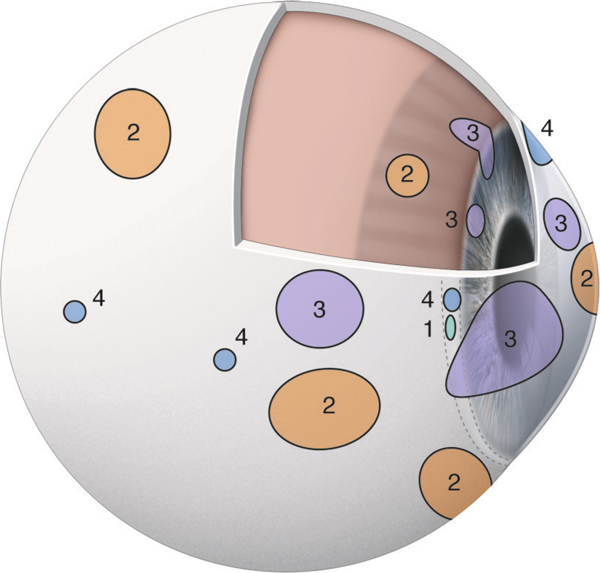
Fig. 1-52 Distribution des champs récepteurs nocicepteurs, modifié d’après Belmonte et al. [17].
Sur ce schéma sont représentés : la distribution et la surface occupée par les champs récepteurs des nocicepteurs mécaniques à bas (1) ou haut (2) seuil, des récepteurs au froid (4) et des nocicepteurs polymodaux (3) sur la surface oculaire, les procès ciliaires et l’iris.
Une grande variété de neuropeptides est exprimée dans les neurones sensoriels primaires des ganglions trigéminés. Ces neuropeptides sont transportés le long des fibres périphériques et centrales. Il est bien établi que les fibres nerveuses nociceptives de type C sont principalement divisées en deux contingents en fonction de leur contenu neurochimique : certaines fibres contiennent des peptides nociceptifs comme la substance P (SP) (fig. 1-50c) ou le CGRP (calcitonin gene related peptide), tandis que d’autres en sont dépourvues, mais sont néanmoins capables de se fixer de façon spécifique à une lectine, l’isolectine B4 [7].
Parmi les neuropeptides autres que la SP et le CGRP impliqués dans l’information sensorielle, la neurokinine, la cholecystokinine, la somatostatine, le peptide vaso-intestinal, le neuropeptide Y et la chimiokine CCL2 (cytokine chimiotactique) sont également exprimés dans le ganglion trijumeau [18].
La présence et le rôle fonctionnel de ces différents peptides n’ont pas été complètement documentés et la liste est bien évidemment non exhaustive. Cependant, plusieurs études ont montré qu’environ 50 % des neurones cornéens sont immunopositifs pour le CGRP, 20 % de ces neurones contenant également la SP et la neurokinine A, et que tous sont impliqués dans l’inflammation neurogène [8, 19–21]. D’un point de vue fonctionnel, l’activation de ces terminaisons libres sensorielles induit une libération des neuropeptides vasoactifs (CGRP et SP) et chimiotactiques (CCL2, CXCL12) pour les cellules immunes. L’inflammation neurogène qui en résulte se traduit par une vasodilatation, l’extravasation des cellules immunes et la libération dans les tissus environnants de substances algogènes capables de stimuler les nocicepteurs des fibres cornéennes trigéminales, conduisant ainsi à une sensibilisation périphérique et à une activation de neurones de second ordre (fig. 1-50d) et jouant un rôle dans la sensibilisation centrale dont les mécanismes sont décrits ci-dessous.
Lorsqu’un nerf est lésé, des médiateurs pro-inflammatoires, cytokines pro-inflammatoires, chimiokines, prostaglandines, histamine, sérotonine, bradykinine, et le facteur de croissance nerveuse (nerve growth factor [NGF]) sont libérés non seulement par le nerf lésé mais également par les cellules dendritiques et immunes recrutées sur le lieu de la lésion.
Il est bien défini qu’une atteinte de la cornée va conduire à une réponse inflammatoire qui se caractérise par une infiltration de cellules immunes dans le stroma et l’épithélium (lymphocytes T, macrophages, cellules dendritiques, neutrophiles) [22] à partir des vaisseaux du limbe. Ces cellules immunes vont alors produire sur le site lésé des cytokines et des chimiokines jouant un rôle central dans la communication entre les cellules immunes et les terminaisons nociceptives. Ainsi, l’activation des récepteurs aux cytokines pro-inflammatoires et, par là même, les voies de signalisation qui en découlent conduisent à la phosphorylation de protéines membranaires incluant les canaux TRP (transient receptor potential) voltage-dépendants et localisés sur les terminaisons nerveuses [23]. Ces mécanismes cellulaires vont ainsi modifier la probabilité d’ouverture des canaux ioniques des terminaisons libres nociceptives et abaisser le seuil d’excitabilité des nocicepteurs, contribuant à un phénomène de plasticité dit de sensibilisation périphérique. L’arrêt de ces stimulations nociceptives va interrompre de façon temporaire leur activité, mais réapparaîtra quelques secondes après comme étant plus soutenue.
De plus, ces nocicepteurs activés vont libérer la SP et le CGRP, des chimiokines qui vont contribuer à la réaction inflammatoire neurogène. Ces médiateurs de l’inflammation sont donc responsables de l’augmentation de la sensibilité et de la réponse à une stimulation nociceptive conduisant à une douleur spontanée et une hyperalgie [24]. En outre ces interactions neuro-immunes sont particulièrement importantes dans la cornée, en raison de la forte densité de terminaisons nerveuses.
Une douleur ectopique prolongée va initier une cascade de changements moléculaires, cellulaires dans l’ensemble des structures composant la voie nociceptive : du complexe sensitif du nerf trijumeau (première synapse dans le tronc cérébral) au thalamus, jusqu’au cortex somatosensoriel et les structures adjacentes. Ces changements phénotypiques peuvent devenir persistants et mal adaptés, résultant en une sensibilisation centrale et générant des signaux douloureux centraux qui continuent même en l’absence de stimulation douloureuse.
Les phénomènes de neuroplasticité centrale, qui ne sont pas l’apanage des douleurs neuropathiques car ils peuvent aussi s’observer dans les douleurs postopératoires, seraient probablement à l’origine de la chronicisation de ces douleurs si celles-ci ne sont pas traitées le plus efficacement possible dès la période péri-opératoire.
Parmi les différents mécanismes impliqués dans cette sensibilisation centrale, un ensemble de données expérimentales récentes a mis l’accent sur le rôle des interactions neuro-immunes, médiées par les cytokines et les cellules gliales [25]. Cependant, les mécanismes cellulaires et moléculaires mis en jeu dans la centralisation de la douleur cornéenne restent mal connus.
L’évaluation de la douleur est indispensable avant toute décision thérapeutique et après la mise en œuvre d’un traitement antalgique pour en apprécier l’efficacité. L’écoute, l’observation, l’interrogatoire et l’examen clinique du patient sont les premières étapes de l’évaluation de la douleur.
Parmi les outils de base de l’évaluation du patient douloureux chronique, le praticien a à sa disposition plusieurs questionnaires ou documents pouvant être remis au patient lors d’une consultation, après lui avoir fourni les explications adéquates. Il s’agit ici d’un bilan d’auto-évaluation. Ces questionnaires permettent une mesure de l’intensité de la douleur par une échelle visuelle analogique, une échelle numérique ou une échelle verbale simple. Le questionnaire par échelle visuelle analogique se présente sous forme d’une réglette comportant une ligne horizontale de 10 cm avec deux extrémités définies par « pas de douleur » et « douleur maximale imaginable ». Pour le questionnaire par échelle numérique, le patient doit entourer la note de 0 à 10 qui décrit le mieux l’importance de sa douleur. La note 0 correspond à « pas de douleur », la note 10 correspond à la « douleur maximale imaginable ».
Il existe également un questionnaire DN4 qui est un questionnaire permettant d’estimer la probabilité d’une douleur neuropathique chez un patient, par le biais de quatre questions réparties en dix items (sept items pour l’interrogatoire du patient et trois items d’examen clinique) à cocher. À chaque item, le patient doit répondre par OUI ou NON. À la fin du questionnaire, le praticien comptabilise les réponses, 1 pour chaque OUI et 0 pour chaque NON. Ainsi, la somme obtenue donne le score du patient, noté sur 10. Si le score du patient est égal ou supérieur à 4/10, le test est considéré comme positif.
Par ailleurs, les échelles d’évaluation du soulagement de la douleur (échelle visuelle analogique, échelle verbale simple ou échelle numérique) sont également utiles pour le suivi du patient.
La Haute autorité de santé a mis en ligne des recommandations dont l’objectif est d’aider à la prise en charge des patients douloureux chroniques, en favorisant la réalisation d’une évaluation initiale rigoureuse pour permettre ensuite un suivi comparatif au cours du temps (http://www.has-sante.fr/portail/jcms/c_540915/evaluation-et-suivi-de-la-douleur-chronique-chez-l-adulte-en-medecine-ambulatoire).
L’esthésiomètre est un instrument permettant l’évaluation semi-quantitative du seuil de sensibilité cornéenne via l’observation d’un clignement en réponse à un stimulus nociceptif appliqué à la surface de la cornée. En clinique humaine, l’esthésiométrie est un outil utile au diagnostic précoce et au suivi thérapeutique d’un certain nombre d’affections oculaires, en particulier celles touchant la surface oculaire.
L’étude de la sensibilité cornéenne a été initiée en 1894 par Von Frey, qui a mesuré cette sensibilité cornéenne avec des crins de cheval. Par la suite, un esthésiomètre de Cochet-Bonnet, muni d’un filament en Nylon, a été inspiré d’une invention faite par Boberg-Ans en 1955 et s’est imposé comme l’instrument de mesure de référence. L’esthésiomètre de Cochet-Bonnet se compose d’un filament en Nylon (diamètre de 0,12 mm) dont la longueur peut varier entre 0 et 6 cm faisant fluctuer la pression exercée de 0,4 à 15,9 g/mm2 (fig. 1-53). Il a été estimé qu’une seule pression mécanique permet de stimuler plus d’une centaine de terminaisons nerveuses. La valeur physiologique de sensibilité en cornée centrale varie selon les espèces, l’humain présentant la sensibilité la plus élevée (5,5 ± 0,8 cm) [26]. L’utilisation de cet esthésiomètre de Cochet-Bonnet a permis de mettre en évidence une diminution significative de la sensibilité cornéenne chez des patients souffrant de sécheresse oculaire comparés à des sujets normaux. De plus, il a été montré que la sensibilité cornéenne est inversement corrélée au nombre d’instillations quotidiennes de collyres contenant un conservateur ainsi qu’à la durée du traitement [27].

Fig. 1-53 Esthésiomètre de Cochet-Bonnet.
C’est un cylindre en plastique contenant un filament de Nylon d’un diamètre de 0,12 mm. La longueur du filament est réglée grâce à une molette et lisible sur une échelle graduée en millimètres.
Belmonte et al. ont développé un esthésiomètre à gaz qui s’affranchit de tout contact avec la surface cornéenne. Outre le fait qu’il soit moins traumatique pour l’épithélium cornéen, cet esthésiomètre à gaz permet de stimuler les trois catégories de nocicepteurs (mécanonocicepteurs, nocicepteurs polymodaux et thermorécepteurs). Le praticien peut, à sa guise, faire varier le flux de gaz, sa température et sa concentration en dioxyde de carbone permettant respectivement d’évaluer la sensibilité cornéenne aux stimulations d’ordres mécanique, thermique et chimique. Cet esthésiomètre a été utilisé dans plusieurs travaux de la littérature pour mesurer la sensibilité cornéenne lors d’ulcères neurotrophiques cornéens ou chez des patients atteints de virus herpétiques [28].
L’éventail thérapeutique permettant de lutter contre la douleur oculaire reste de nos jours très limité, allant de la simple instillation de larmes artificielles, d’anti-inflammatoires jusqu’à la prise par voie générale de médicaments à visée antalgique. En outre, de nombreuses études cliniques portant sur certaines formes de douleurs oculaires chroniques démontrent une efficacité limitée de ces thérapies « antidouleur » [29]. De plus certaines thérapies utilisées lors de traitement au long court favorisent l’aggravation des atteintes de la surface oculaire. À titre d’exemple, nous pouvons citer l’utilisation d’anti-inflammatoires non stéroïdiens en application topique, classiquement utilisés pour contrecarrer la douleur oculaire de type inflammatoire, mais qui présentent, lors de leur utilisation prolongée, un risque d’exacerbation de kératites superficielles, connues pour être elles-mêmes à l’origine de douleurs oculaires [30]. De plus, l’instillation en topique d’agent anesthésique de type proparacaïne, oxybuprocaïne, bien qu’induisant une anesthésie rapide et efficace de la cornée, est strictement contre-indiquée pour une utilisation prolongée car fortement délétère pour la cornée, conduisant rapidement à des altérations de l’épithélium cornéen, des retards de cicatrisation et pouvant dans certains cas extrêmes conduire à une destruction irréversible de cette dernière [31].
Parmi les autres thérapies pouvant être proposées aux patients douloureux, des agents immunosuppresseurs tels que la ciclosporine [32] et le tacrolimus [33] sont devenus en quelques années le traitement de référence pour réduire l’inflammation chronique liée à la kératoconjonctivite sèche et ainsi soulager les patients. Lors d’uvéites antérieures, caractérisées par une forte inflammation oculaire, des agents cycloplégiques peuvent être classiquement prescrits en association avec des corticoïdes pour combattre la douleur de type inflammatoire.
De nombreuses thérapies antalgiques administrées par voie systémique sont parfois utilisées pour lutter contre les formes sévères de névralgies trigéminées chroniques d’origine oculaire. Parmi elles, nous retrouvons les différents médicaments classiquement utilisés pour combattre les douleurs chroniques somatiques tels les antidépresseurs tricycliques, baclofen, gabapentine, vérapamil. Toutefois, il doit être gardé à l’esprit que de telles médications ne sont pas exemptes d’effets secondaires notoires et sont également connues pour leur capacité à altérer la sensibilité cornéenne et la production de larme.
Les douleurs chroniques oculaires sont malheureusement parmi les plus invalidantes et les plus difficiles à traiter à ce jour. La compréhension de la physiopathologie des douleurs du segment antérieur de l’œil est un préalable à l’amélioration des thérapeutiques actuelles [34, 35]. Cela impose évidemment un approfondissement de nos connaissances fondamentales sur le système trigéminé et sur les mécanismes cellulaires et moléculaires impliqués dans l’initiation et la chronicisation de la douleur oculaire. Il est toutefois nécessaire de souligner que nos connaissances de la pathogénicité de la douleur du segment antérieur ont progressé ces dernières années grâce aux recherches précliniques et cliniques [36]. Ces efforts doivent bien évidemment être poursuivis et soutenus pour permettre l’identification et la validation de nouvelles cibles thérapeutiques qui font actuellement cruellement défaut.
[1] The definition and classification of dry eye disease : report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf 2007 ; 5 : 75-92.
[2] Baudouin C, Labbe A, Liang H, et al. Preservatives in eyedrops : the good, the bad and the ugly. Prog Retin Eye Res 2010 ; 29 : 312-34.
[3] Baudouin C, Creuzot-Garcher C, Hoang-Xuan T, et al. Severe impairment of health-related quality of life in patients suffering from ocular surface diseases. J Fr Ophtalmol 2008 ; 31 : 369-78.
[4] McMahon SB, Malcangio M. Current challenges in glia-pain biology. Neuron 2009 ; 64 : 46-54.
[5] Milligan ED, Watkins LR. Pathological and protective roles of glia in chronic pain. Nat Rev Neurosci 2009 ; 10 : 23-36.
[6] Romero-Sandoval EA, Horvath RJ, DeLeo JA. Neuroimmune interactions and pain : focus on glial-modulating targets. Curr Opin Invest Drugs 2008 ; 9 : 726-34.
[7] Julius D, Basbaum AI. Molecular mechanisms of nociception. Nature 2001 ; 413 : 203-10.
[8] Woolf CJ, Salter MW. Neuronal plasticity : increasing the gain in pain. Science 2000 ; 288 : 1765-9.
[9] Schimmelpfennig B. Nerve structures in human central corneal epithelium. Graefes Arch Clin Exp Ophthalmol 1982 ; 218 : 14-20.
[10] Chan-Ling T. Sensitivity and neural organization of the cat cornea. Invest Ophthalmol Vis Sci 1989 ; 30 : 1075-82.
[11] Jones MA, Marfurt CF. Peptidergic innervation of the rat cornea. Exp Eye Res 1998 ; 66 : 421-35.
[12] Rozsa AJ, Beuerman RW. Density and organization of free nerve endings in the corneal epithelium of the rabbit. Pain 1982 ; 14 : 105-20.
[13] Bron R, Wood RJ, Brock JA, et al. Piezo2 expression in corneal afferent neurons. J Comp Neurol 2014 ; 522 : 2967-79.
[14] Goetz CG, Stebbins GT, Tilley BC. Calibration of unified Parkinson’s disease rating scale scores to Movement Disorder Society-unified Parkinson’s disease rating scale scores. Mov Disord 2012 ; 27 : 1239-42.
[15] Belmonte C, Gallar J. Cold thermoreceptors, unexpected players in tear production and ocular dryness sensations. Invest Ophthalmol Vis Sci 2011 ; 52 : 3888-92.
[16] Carr RW, Pianova S, Fernandez J, et al. Effects of heating and cooling on nerve terminal impulses recorded from cold-sensitive receptors in the guinea-pig cornea. J Gen Physiol 2003 ; 121 : 427-39.
[17] Belmonte C, Garcia-Hirschfeld J, Gallar J. Neurobiology of ocular pain. Progr Ret Eye Res 1997 ; 16 : 117-56.
[18] Dauvergne C, Molet J, Reaux-Le Goazigo A, et al. Implication of the chemokine CCL2 in trigeminal nociception and traumatic neuropathic orofacial pain. Eur J Pain 2013.
[19] De Felipe C, Belmonte C. c-Jun expression after axotomy of corneal trigeminal ganglion neurons is dependent on the site of injury. Eur J Neurosci 1999 ; 11 : 899-906.
[20] Muller LJ, Marfurt CF, Kruse F, et al. Corneal nerves : structure, contents and function. Exp Eye Res 2003 ; 76 : 521-42.
[21] Tervo K, Tervo T. The ultrastructure of rat corneal nerves during development. Exp Eye Res 1981 ; 33 : 393-402.
[22] Barabino S, Chen Y, Chauhan S, et al. Ocular surface immunity : homeostatic mechanisms and their disruption in dry eye disease. Prog Retin Eye Res 2012 ; 31 : 271-85.
[23] Murata Y, Masuko S. Peripheral and central distribution of TRPV1, substance P and CGRP of rat corneal neurons. Brain Res 2006 ; 1085 : 87-94.
[24] Belmonte C, Acosta MC, Gallar J. Neural basis of sensation in intact and injured corneas. Exp Eye Res 2004 ; 78 : 513-25.
[25] Wieseler-Frank J, Maier SF, Watkins LR. Glial activation and pathological pain. Neurochem Int 2004 ; 45 : 389-95.
[26] Golebiowski B, Papas E, Stapleton F. Assessing the sensory function of the ocular surface : implications of use of a non-contact air jet aesthesiometer versus the Cochet-Bonnet aesthesiometer. Exp Eye Res 2011 ; 92 : 408-13.
[27] Labbe A, Alalwani H, Van Went C, et al. The relationship between subbasal nerve morphology and corneal sensation in ocular surface disease. Invest Ophthalmol Vis Sci 2012 ; 53 : 4926-31.
[28] Gallar J, Tervo TM, Neira W, et al. Selective changes in human corneal sensation associated with herpes simplex virus keratitis. Invest Ophthalmol Vis Sci 2010 ; 51 : 4516-22.
[29] Gadaria-Rathod N, Lee KI, Asbell PA. Emerging drugs for the treatment of dry eye disease. Expert Opin Emerg Drugs 2013 ; 18 : 121-36.
[30] Gabison EE, Chastang P, Menashi S, et al. Late corneal perforation after photorefractive keratectomy associated with topical diclofenac : involvement of matrix metalloproteinases. Ophthalmology 2003 ; 110 : 1626-31.
[31] Patel M, Fraunfelder FW. Toxicity of topical ophthalmic anesthetics. Expert Opin Drug Metab Toxicol 2013 ; 9 : 983-8.
[32] Pflugfelder SC, De Paiva CS, Villarreal AL, et al. Effects of sequential artificial tear and cyclosporine emulsion therapy on conjunctival goblet cell density and transforming growth factor-beta2 production. Cornea 2008 ; 27 : 64-9.
[33] Garcia DP, Alperte JI, Cristobal JA, et al. Topical tacrolimus ointment for treatment of intractable atopic keratoconjunctivitis : a case report and review of the literature. Cornea 2011 ; 30 : 462-5.
[34] Rosenthal P, Borsook D. The corneal pain system. Part I : the missing piece of the dry eye puzzle. Ocul Surf 2012 ; 10 : 2-14.
[35] Chiu IM, von Hehn CA, Woolf CJ. Neurogenic inflammation and the peripheral nervous system in host defense and immunopathology. Nat Neurosci 2012 ; 15 : 1063-7.
[36] Labbe A, Liang Q, Wang Z, et al. Corneal nerve structure and function in patients with non-sjogren dry eye : clinical correlations. Invest Ophthalmol Vis Sci 2013 ; 54 : 5144-5150.
- Chapitre 1
Le concept de surface oculaire- I - Histologie et anatomie de la surface oculaire
- II - Anatomie et régulation du film lacrymal
- III - Anatomie des paupières adaptée à la surface oculaire
- IV - Le limbe
- V - Régulation immunologique de la surface oculaire
- VI - L’innervation cornéenne : bases anatomophysiologiques de la douleur oculaire