Anti-infectieux
G. Debellemanière, M. Saleh
La pénétration intraoculaire d’un antibiotique topique est d’autant plus grande que son poids moléculaire est faible, que sa lipophilie est élevée et que la viscosité de la solution est basse.
Le but du traitement est d’obtenir rapidement une concentration d’antibiotique élevée à la surface oculaire : l’administration se fait donc avec une dose de charge, à fréquence élevée, et sur une durée courte.
Les molécules possédant la meilleure pénétration oculaire par voie topique sont les fluoroquinolones (en particulier celles de troisième et quatrième génération), le chloramphénicol et l’acide fusidique.
Le recours aux antibiotiques en cas de conjonctivite n’est recommandé qu’en présence de critères de gravité. Dans ce contexte, les antibiotiques ont tous globalement la même efficacité, mais les fluoroquinolones sont à utiliser en deuxième ligne. Dans les autres cas, l’association lavage au sérum physiologique-antiseptique suffit.
L’émergence des résistances bactériennes aux antibiotiques est une problématique qui concerne également les ophtalmologistes. L’utilisation des fluoroquinolones, en particulier, doit être raisonnée et limitée au traitement des kératites bactériennes.
La bonne utilisation des antibiotiques est un enjeu majeur en ophtalmologie qui, en plus des implications en termes de succès thérapeutique pour le patient, a une importance en termes de prévention de l’émergence des résistances bactériennes et un rôle dans la réduction des dépenses de santé engendrées par les infections oculaires et leur traitement. Afin d’optimiser leur utilisation, il faut garder à l’esprit les bases de pharmacologie et de microbiologie et également s’intéresser au devenir de l’antibiotique dans l’œil et ses différents compartiments ; c’est l’étude de la pharmacocinétique/pharmacodynamique oculaire. Enfin, certaines situations particulières comme la grossesse méritent une attention toute particulière.
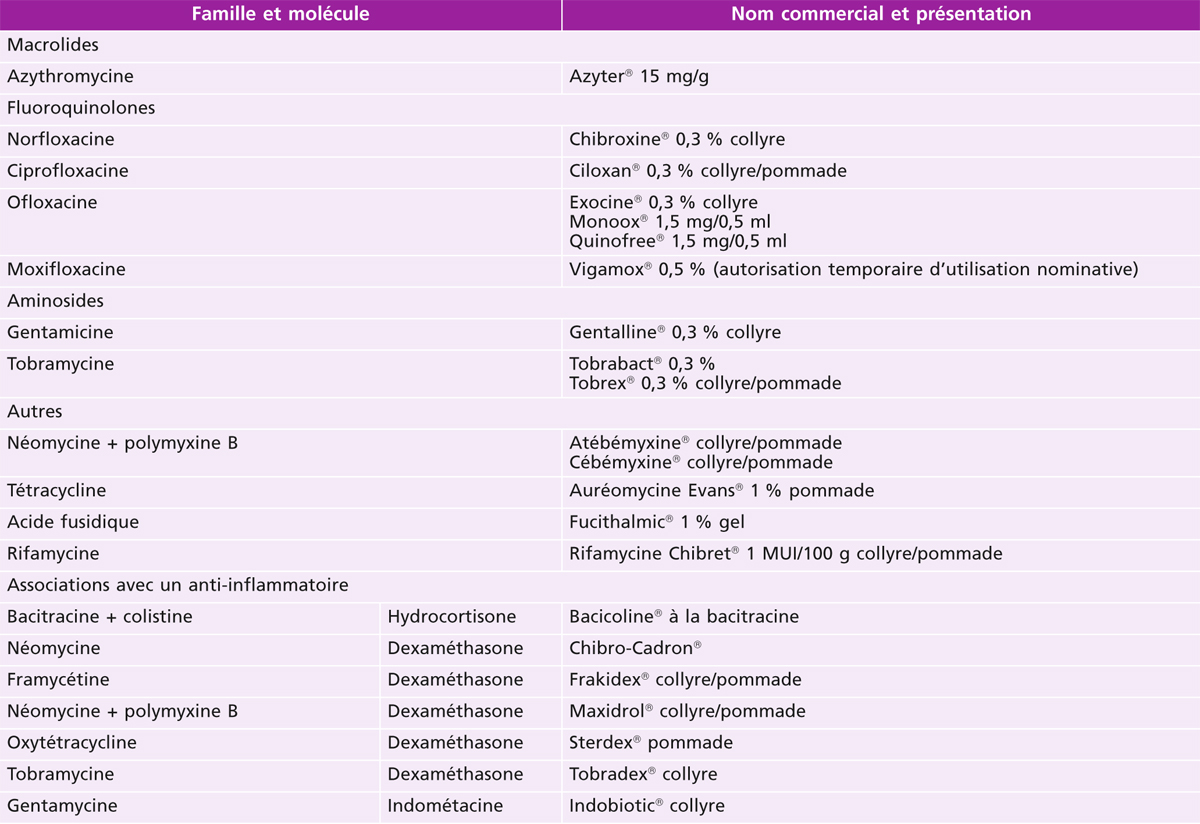
Un certain nombre de molécules d’antibiotiques sont disponibles pour une administration topique par collyre, gel ou pommade ophtalmique. Il peut s’agir d’antibiotique seul, d’association d’antibiotiques ou encore d’une association entre antibiotiques et anti-inflammatoires qu’ils soient stéroïdiens ou non stéroïdiens (tableau 17-1). Il est important de noter qu’au cours des deux dernières décennies, on peut constater une réduction constante dans la découverte de nouvelles molécules d’antibiotiques, l’innovation résidant dans l’amélioration de la biodisponibilité et/ou de la tolérance de molécules déjà existantes.
Tableau 17-1 Collyres et pommades antibiotiques à usage ophtalmologique disponibles en France en officine, en 2014.
La famille des bêta-lactamines comprend la majorité des molécules antibiotiques utilisées par voie générale à l’heure actuelle ; elle regroupe les pénicillines, les céphalosporines, les carbapénèmes et les monobactames. Ces molécules sont bactéricides, ont un mécanisme d’action temps-dépendant et possèdent peu d’effets secondaires, ces derniers étant dominés par la problématique de l’allergie. Elles possèdent toutes un cycle bêta-lactame et ciblent des enzymes présentes sur la face externe de la membrane cytoplasmique et dénommées protéines liant la pénicilline (PLP). La liaison de l’antibiotique à ces PLP entraîne une inhibition de la synthèse du peptidoglycane, et une dégradation de ce dernier, conduisant à la lyse cellulaire.
Les mécanismes de résistance développés par les bactéries sont très divers et comprennent la destruction enzymatique par les bêta-lactamases, l’imperméabilisation de la membrane externe, les systèmes d’efflux et la modification des cibles.
Le spectre des bêta-lactamines est large mais variable selon les molécules et certaines bactéries pathogènes en ophtalmologie échappent à leur action, c’est le cas notamment de Chlamydiae trachomatis et du Staphylococcus résistant à la méticilline.
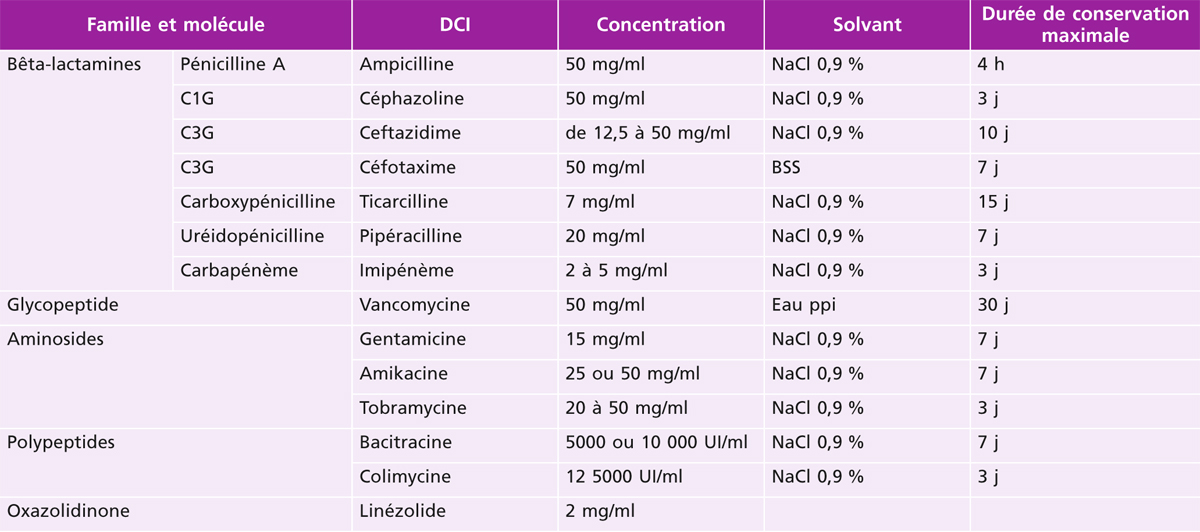
Utilisation en surface oculaire : aucune molécule de la famille des bêta-lactamines sous forme topique n’est commercialisée en raison de leur instabilité en solution ; en revanche, des collyres renforcés (tableau 17-2) et des préparations pour injections péri-oculaires (tableau 17-3) peuvent être préparés en pharmacie hospitalière. La ticarcilline et la ceftazidime, sous forme de collyres renforcés, sont couramment utilisées dans le traitement des kératites bactériennes avec facteurs de gravité [1].
Les quinolones et les fluoroquinolones sont des antibiotiques de synthèse dérivés de l’acide nalidixique, découvert en 1962. Les fluoroquinolones possèdent un large spectre et ont une très bonne biodisponibilité. Ce sont des molécules bactéricides, leur activité est concentration-dépendante et elles possèdent un effet post-antibiotique. Elles inhibent la topo-isomérase IV et l’ADN gyrase (aussi appelée topo-isomérase II), qui jouent un rôle dans la topologie de l’ADN bactérien lors de la réplication, c’est-à-dire sur l’enroulement des deux brins d’ADN. L’inhibition de ces enzymes a pour conséquence le clivage de l’ADN bactérien. Cependant elles sont de plus en plus concernées par l’émergence de résistances bactériennes et font l’objet de nombreuses recommandations afin de restreindre leur utilisation.
Utilisation en surface oculaire : les fluoroquinolones possèdent une bonne pénétration intra-oculaire par voie topique et sont fréquemment prescrites en traitement probabiliste des abcès de cornée du fait de leur large spectre d’activité. La ciprofloxacine a ainsi l’autorisation de mise sur le marché (AMM) pour le traitement des kératites bactériennes. Les fluoroquinolones de quatrième génération telles la gatifloxacine (Zymar®) et la moxifloxacine (Vigamox®) sont commercialisées aux États-Unis sous forme topique depuis une dizaine d’années. Ces molécules possèdent un spectre plus large, incluant les bactéries anaérobies (fig. 17-1). Seule la moxifloxacine (Vigamox®) fait l’objet d’une autorisation temporaire d’utilisation (ATU) nominative en France.
Tableau 17-2 Préparations antibiotiques utilisables sous forme de collyres renforcés.
BSS : balanced salt solution ; DCI : dénomination commune internationale ; ppi : pour préparation injectable.
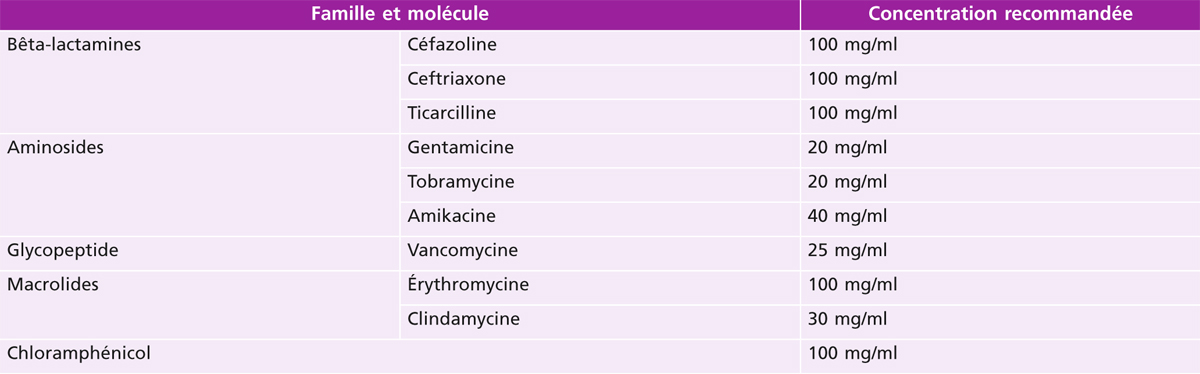
Tableau 17-3 Injections sous-conjonctivales : concentrations recommandées [3].
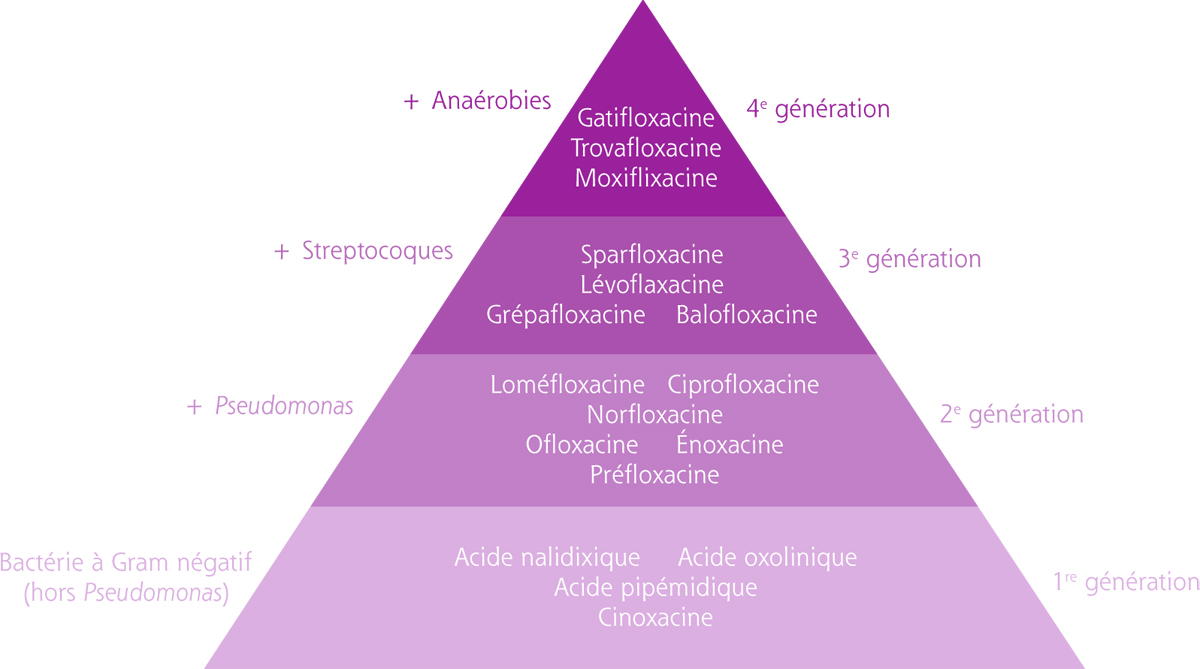
Fig. 17-1 Les différentes générations de fluoroquinolones et leur spectre d’action antibactérien associé.
Ces molécules sont dérivées de la streptomycine, isolée en 1943 à partir de Streptomyces griseus. Elles bloquent la sous-unité 30 S du ribosome bactérien, empêchant la synthèse protéique. Les aminosides sont rapidement bactéricides, possèdent une efficacité concentration-dépendante et un effet post-antibiotique. Leur diffusion tissulaire est mauvaise. Ils possèdent une toxicité rénale et cochléovestibulaire par voie intraveineuse. La néomycine paraît être la molécule la plus allergisante par voie topique.
Utilisation en surface oculaire : les aminosides par voie topique font partie du traitement de première intention des conjonctivites graves et des kératites bactériennes simples.
Ces molécules liposolubles possèdent une bonne pénétration tissulaire. Elles diffusent à travers les porines de la membrane externe et se lient aux ions magnésium pour passer la membrane cytoplasmique avant d’atteindre leur cible qui est la sous-unité 30 S du ribosome, bloquant la phase d’élongation protéique.
Utilisation en surface oculaire : les cyclines sont utilisées par voie générale pour leur activité anti-inflammatoire et anticollagénase dans le traitement de la rosacée (avec ou sans atteinte oculaire) et des brûlures cornéennes.
Cette classe comprend la vancomycine et le teicoplanine. Ces molécules ont une action temps-dépendante, bactéricide, lente, dirigée exclusivement contre les bactéries à Gram positif. Elles présentent une forte affinité pour les précurseurs du peptidoglycane comportant le dipeptide D-alanyl-D-alanine et leur fixation au niveau du cytoplasme et de la paroi en formation provoque, du fait de leur grande taille, un encombrement stérique empêchant l’action des enzymes responsables de l’élongation pariétale et la croissance bactérienne.
Utilisation en surface oculaire : la vancomycine est utilisée sous forme topique, en collyre renforcé (tableau 17-2), dans le traitement des abcès de cornée avec critère de gravité.
Ces molécules, dérivées de l’érythromycine, ont pour cible la sous-unité 50 S ; leur fixation au ribosome entraîne l’inhibition de l’élongation du peptide bactérien. Leur action est temps-dépendante, classiquement bactériostatique, mais également bactéricide à forte concentration pour certaines espèces (staphylocoques, streptocoques, Haemophilus influenzae), particulièrement pour l’azithromycine.
Utilisation en surface oculaire : l’azithromycine est disponible en France par voie topique depuis 2007 (Azyter®) avec une AMM pour le traitement des conjonctivites bactériennes purulentes et des conjonctivites trachomateuses. Cette molécule est aussi utilisée, en cures, dans le traitement des blépharites associées à une rosacée oculaire. Par voie générale, les macrolides sont utilisés dans l’éradication du trachome dans les zones d’endémie.
Cette classe englobe la rifamycine, molécule naturelle isolée à partir de Nocardia mediterranei, et son dérivé administrable par voie orale, la rifampicine. Ces molécules exercent un effet bactéricide via l’inhibition de l’ARN polymérase, en empêchant la transcription de l’ADN bactérien en ARN messager. Leur spectre comprend les bactéries à Gram positif, certains bacilles intracellulaires (Chlamydiae), certains bacilles à Gram négatif (Brucella, Legionella, Bacteroides) et le bacille de Koch responsable de la tuberculose. Cette classe n’est pas active sur les entérobactéries et le Pseudomonas. Il faut éviter de prescrire la rifamycine au long cours en raison du risque de sélection de mutants résistants.
Utilisation en surface oculaire : par voie topique, la rifamycine est utile dans le traitement des conjonctivites bactériennes, en particulier chez les enfants puisqu’elle est active sur Haemophilus influenzae et les streptocoques, ainsi que dans les kératites bactériennes simples et les ulcères cornéens. Son activité sur les staphylocoques est fréquemment conservée y compris en cas de méticillino-résistance. Sa teinte orangée est un indicateur d’observance du traitement ; par ailleurs ce collyre colore les lentilles de contact.
Cet antibiotique est bactériostatique et devient bactéricide à forte concentration. Il inhibe la synthèse protéique en empêchant la dissociation du complexe ribosome-facteurs d’élongation, ce qui empêche la synthèse de l’ARN messager. Les bacilles à Gram négatif sont naturellement résistants.
Utilisation en surface oculaire : l’acide fusidique est commercialisé par voie topique sous forme de gel ophtalmique et a l’AMM pour le traitement des conjonctivites, des kératites bactériennes simples, des blépharites staphylococciques et des orgelets récidivants.
Ce nom regroupe un mélange de polypeptides issus de Bacillus subtilis, exclusivement utilisés par voie locale du fait de leur toxicité par voie générale. La bacitracine bloque la synthèse de la paroi cytoplasmique en se liant de manière irréversible à l’un des précurseurs du peptidoglycane.
Utilisation en surface oculaire : la bacitracine sous forme topique est indiquée dans le traitement des conjonctivites graves, de l’adulte et de la kératite bactérienne simple. Son activité contre le Streptococcus pyogenes en fait un bon traitement de première intention de la conjonctivite de l’enfant.
Cette classe est bactéricide, d’action concentration-dépendante, active sur les bacilles à Gram négatif. Les polymyxines s’intègrent dans les bicouches lipidiques des membranes cellulaires à l’aide de leur extrémité hydrophobe. La désorganisation qui s’ensuit provoque la lyse cellulaire. La colistine par voie intraveineuse est un antibiotique de dernier recours, utilisé dans les infections à Pseudomonas aeruginosa multirésistantes ; sa toxicité rénale limite son utilisation. Par voie locale, la polymyxine B est utilisée dans le traitement des conjonctivites graves et des kératites bactériennes simples.
Ils inhibent la synthèse protéique par fixation sur la sous-unité 50 S du ribosome bactérien. Le chloramphénicol est une molécule possédant un spectre d’action très large, ainsi qu’une excellente pénétration intra-oculaire, mais pouvant être à l’origine d’aplasies médullaires idiosynchrasiques au pronostic gravissime. Cet effet indésirable a également été notifié après utilisation par voie topique, mais ces cas doivent être pondérés par la possibilité de survenue d’aplasies médullaires virales ou secondaires à d’autres traitements administrés de façon concomitante, voire idiopathiques, ainsi que par la pénétration systémique du chloramphénicol sous forme de collyre, considérée comme nulle par la plupart des auteurs. La question du rapport bénéfice/risque de cette molécule fait l’objet d’un débat dans la communauté ophtalmologique, ayant conduit au retrait de sa commercialisation en France. Elle reste cependant largement utilisée dans les pays anglo-saxons, sans être à l’origine de problèmes majeurs, et la place de cette molécule dans notre arsenal thérapeutique mérite d’être reconsidérée.
Les principes d’action des antibiotiques peuvent être ainsi résumés en fonction de la cible cellulaire (fig. 17-2).
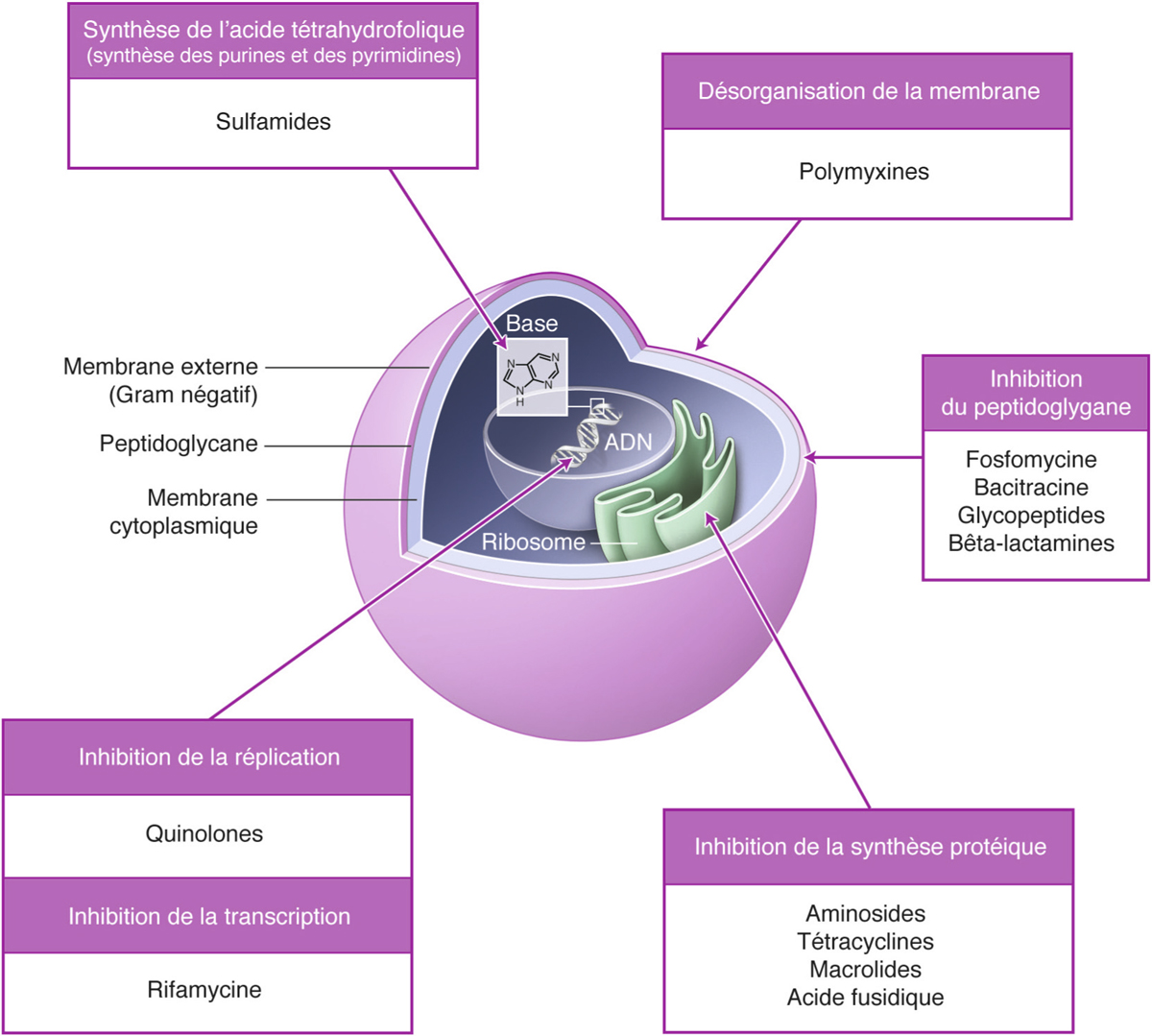
Fig. 17-2 Récapitulatif des différents sites d’action des antibiotiques selon la famille d’antibiotique.
La pharmacocinétique est l’étude du devenir d’une molécule après son administration dans l’organisme. La pharmacodynamique s’attache à décrire la relation entre concentration et effet biologique de la molécule. L’activité in vivo d’un antibiotique dépend de l’efficacité in vitro de l’antibiotique sur la bactérie considérée, mais également de ses caractéristiques pharmacocinétiques au sein du site considéré : la pharmacodynamique appliquée aux antibiotiques étudie donc l’efficacité et la toxicité des antibiotiques en fonction du temps et en fonction de la concentration de l’antibiotique.
Il est rappelé que la concentration minimale inhibitrice (CMI) est la plus faible concentration permettant d’inhiber un certain pourcentage de bactéries à 24 h (CMI-50 ou CMI-90).
Après administration systémique d’un antibiotique, les concentrations en chambre antérieure et dans le vitré sont inférieures à celles obtenues dans le reste de l’organisme. Ce phénomène, retrouvé au niveau du système nerveux central protégé par la barrière hématocérébrale, est dû à l’existence de barrières hémato-aqueuse et hématorétinienne [2]. En effet, les cellules endothéliales des vaisseaux rétiniens, iriens et cérébraux possèdent des jonctions serrées, s’opposant au passage intercellulaire des molécules. L’épithélium ciliaire et l’épithélium postérieur de l’iris constituent également une barrière à la pénétration des molécules en chambre antérieure. L’épithélium cornéen et conjonctival représente un obstacle à la pénétration des molécules par voie topique, et représente la barrière épithéliale. L’administration topique des antibiotiques offre donc des concentrations thérapeutiques au niveau de la surface oculaire tout en minimisant les risques de toxicité générale des antibiotiques.
Les paramètres influençant la pénétration oculaire des antibiotiques comprennent [3-6] :
-
– les caractéristiques de la molécule : une molécule pénètre dans l’œil d’autant mieux qu’elle est lipophile, car cette caractéristique permet de traverser les membranes cellulaires lipidiques ; cependant, une molécule lipophile se dissout mal dans un solvant aqueux, ce qui complique les possibilités d’applications cliniques. De plus, le stroma cornéen est lui plutôt hydrophile. Le chloramphénicol et les fluoroquinolones sont des molécules possédant un rapport hydrophile/lipophile relativement équilibré, et pénètrent bien en chambre antérieure par voie topique à travers la barrière épithéliale et par voie systémique à travers la barrière hémato-aqueuse. Un important poids moléculaire, comme c’est le cas pour la vancomycine ou la polymyxine B, est également un obstacle à la pénétration cornéenne. La viscosité des suspensions ophtalmologiques d’antibiotiques est également un paramètre clé de leur pénétration. Une viscosité diminuée favoriserait la pénétration dans l’humeur aqueuse et les différents tissus [7] ;
-
– des paramètres locaux : la destruction de l’épithélium cornéen, traumatique ou infectieuse, augmente la pénétration des antibiotiques par voie topique.
L’infection, l’inflammation oculaire et les traumatismes augmentent la pénétration oculaire des antibiotiques donnés par voie systémique et topique, dans le vitré et dans l’humeur aqueuse [8-11].
Les études concernant la pénétration oculaire des antibiotiques sont difficilement comparables entre elles, en raison de la diversité des situations cliniques (œil sain ou infecté, statut cristallinien), des posologies employées, des critères d’évaluation (chronologie du dosage de l’antibiotique, mesures répétées ou non), du compartiment étudié (larmes, cornée, humeur aqueuse, vitré), et de la délicate et nécessaire mise en perspective avec la CMI des bactéries qui varie selon le pathogène et son profil de résistance, constitutionnel ou acquis. Il est néanmoins possible de dégager des tendances générales concernant l’administration par voie topique des antibiotiques.
Bien que des différences existent au sein de cette même famille, les fluoroquinolones pénètrent à des concentrations satisfaisantes dans la cornée et l’humeur aqueuse, et sont même retrouvées à des concentrations thérapeutiques dans le vitré dans certaines études. Les fluoroquinolones de troisième et quatrième génération (lévofloxacine, moxifloxacine, gatifloxacine, besifloxacine) possèdent le meilleur rapport concentration maximale/efficacité [12-16]. L’acide fusidique [17, 18], le linézolide [19], le chloramphénicol [20] atteignent également des concentrations thérapeutiques en chambre antérieure par voie topique. Les aminosides et les bêta-lactamines pénètrent mal en chambre antérieure. L’azithromycine reste à concentration thérapeutique dans les larmes plusieurs heures après l’instillation [21].
La résistance naturelle ou intrinsèque est un caractère d’espèce qui touche toutes les bactéries de l’espèce considérée. Elle est stable, transmise à la descendance par le chromosome bactérien mais elle n’est pas ou peu transmissible sur un mode horizontal (d’une bactérie à l’autre au sein d’une même espèce ou entre espèces différentes). Les résistances acquises ne concernent que certaines souches d’une espèce donnée. Elles résultent d’une modification du capital génétique de la bactérie, lui permettant de tolérer une concentration d’antibiotique plus élevée que celle qui inhibe les souches sensibles de la même espèce. Une résistance acquise peut être chromosomique (mutation) ou extrachromosomique (plasmide).
Des facteurs de risque généraux comme l’âge, une hospitalisation récente, un traitement immunosuppresseur, une corticothérapie au long cours, une pathologie auto-immune, le diabète, le cancer, ainsi que des facteurs locaux comme une sécheresse oculaire ou une blépharite chronique ont été décrits comme facteurs de risque de résistance bactérienne acquise en ophtalmologie [22-25].
L’utilisation d’antibiotiques elle-même est une cause classique d’apparition de résistances bactériennes. L’administration répétée de fluoroquinolones ou de macrolides est une cause d’émergence de bactéries multirésistantes [26-28]. Au Royaume-Uni, où le chloramphénicol est en vente libre et largement utilisé dans les infections de la surface oculaire, des taux de résistance très élevés (de l’ordre de 75 %) ont été constatés parmi les bactéries à Gram négatif pour cette molécule [29, 30].
Les données de la littérature sont en faveur d’une augmentation de la résistance aux fluoroquinolones mais cette classe conserve tout son intérêt dans le traitement probabiliste des infections oculaires bactériennes sévères.
La résistance à la ciprofloxacine, parmi les bactéries à Gram négatif issues de prélèvements oculaires, est faible, comprise entre 0 et 20 %, sans qu’une tendance à la hausse ne soit retrouvée [29, 31-33]. Cette molécule reste la fluoroquinolone de référence, en particulier pour le Pseudomonas [23, 30]. La résistance à la ciprofloxacine est plus fréquente chez les bactéries à Gram positif, avec des taux de l’ordre de 15 à 35 % [29, 34]. La figure 17-3 illustre l’évolution de la résistance à la ciprofloxacine constatée au cours de différentes études conduites pendant la dernière décennie.
Les fluoroquinolones de quatrième génération sont représentées principalement par la gatifloxacine et la moxifloxacine. Ces molécules ont une efficacité supérieure à celle des fluoroquinolones de deuxième (ofloxacine, ciprofloxacine) et troisième (lévofloxacine) génération, en particulier sur les bactéries à Gram positif [35-37]. La moxifloxacine semble posséder une activité supérieure à la gatifloxacine [35, 38]. La résistance aux fluoroquinolones de quatrième génération, bien que moins fréquente que celle aux molécules plus anciennes, semble augmenter au cours du temps [23, 34, 39].
Une augmentation des résistances aux antibiotiques est donc également constatée en ophtalmologie. Ce phénomène n’a que peu d’impact thérapeutique à l’heure actuelle, en raison des spécificités pharmacocinétiques de l’œil et des voies d’administration qui assurent un niveau élevé de concentrations d’antibiotiques à la surface oculaire et dans les larmes. Une grande vigilance et une rationalisation des prescriptions, en particulier des fluoroquinolones, s’imposent donc pour éviter une pression de sélection avec émergence des mutants les plus résistants comme cela a été constaté dans les administrations topiques itératives sur la flore nasopharyngée [40].
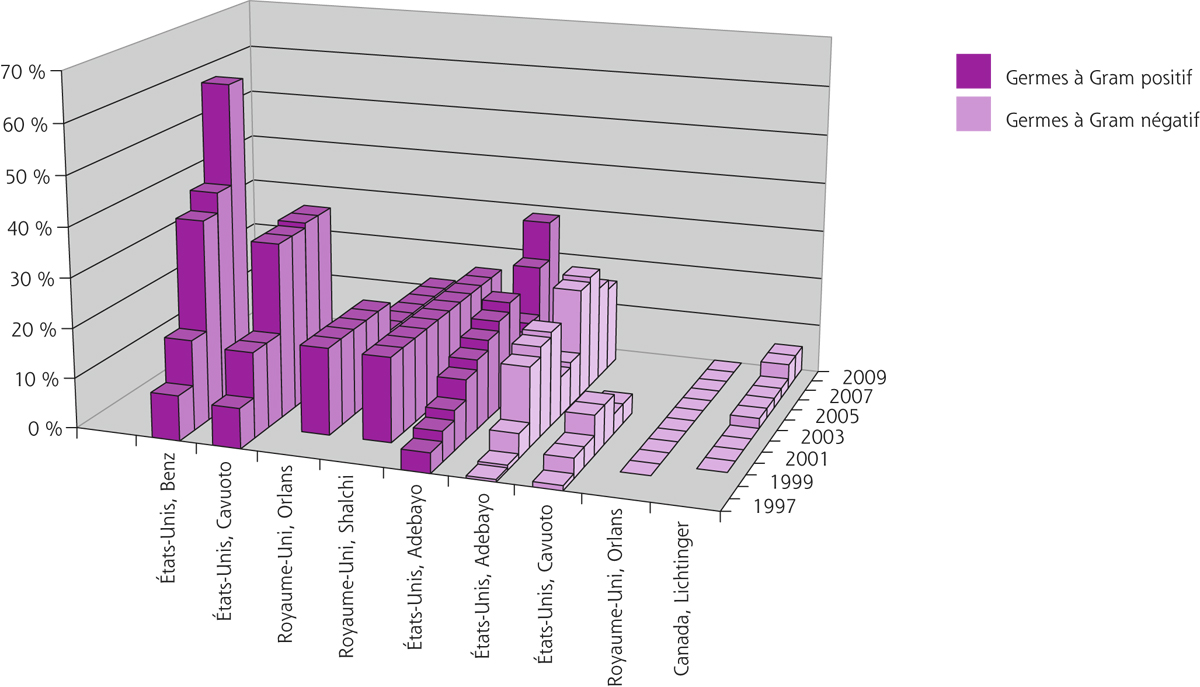
Fig. 17-3 Évolution de la résistance à la ciprofloxacine de germes isolés à partir de prélèvements bactériologiques oculaires aux États-Unis, au Canada et au Royaume-Uni durant la dernière décennie.
Quelques règles simples à respecter permettent une meilleure utilisation des antibiotiques.
Ainsi, devant une kératite bactérienne, quel que soit l’antibiotique prescrit, renforcé ou non, une « dose de charge » (instillations répétées toutes les 5 à 10 min la première heure de traitement) permet d’obtenir rapidement des concentrations cornéennes satisfaisantes. En cas de bi- ou trithérapie, le respect d’un intervalle de 5 min entre chaque instillation de collyre est nécessaire. Les collyres sont ensuite prescrits à la posologie d’une goutte par heure pendant 48 h. Une injection sous-conjonctivale d’antibiotiques peut être utile dans les infections évolutives malgré un traitement topique ou en cas de mauvaise observance des collyres. L’utilisation de pommades antibiotiques est à éviter à la phase aiguë de l’infection pour ne pas diminuer la pénétration des collyres. Néanmoins, cette forme galénique a pour avantage d’augmenter le temps de contact cornéen et est particulièrement indiquée chez l’enfant ou en application nocturne, une fois l’infection contrôlée. En cas de recours à des collyres renforcés, il est nécessaire de tenir compte des conditions de conservation de ces derniers qui est de courte durée et au réfrigérateur (quelques jours à + 4 °C). Il est également nécessaire de tenir compte de leur toxicité locale non négligeable (pH acide, hyperosmolarité relative) qui induit un réflexe de larmoiement lors de l’instillation, ayant pour effet de diminuer la concentration en principe actif. Il est également utile de veiller à ce que les lavages oculaires au sérum physiologique, très utiles pour éliminer les sécrétions et réduire la charge bactérienne, en particulier dans les conjonctivites purulentes, soient réalisés à distance de l’instillation des antibiotiques pour éviter l’élimination prématurée de ces derniers. Les aminosides, les fluoroquinolones, la bacitracine, la polymyxine B, l’acide fusidique et la rifamycine conviennent pour traiter les kératites simples. Un prélèvement bactériologique sera réalisé et un traitement par collyres renforcés, éventuellement en hospitalisation, sera conduit en présence de critères de gravité ou en cas d’échec après 24 h de traitement.
Un traitement antibiotique topique n’est justifié pour les conjonctivites qu’en cas de présence de critères de gravité. En l’absence de ces derniers, les antibiotiques abrègent la durée des symptômes mais leur effet à 8 jours n’est pas significativement supérieur à celui du placebo [41]. Le traitement consiste alors en des lavages oculaires au sérum physiologique, associés à un traitement antiseptique. Chez l’enfant, la rifamycine, la bacitracine, l’azithromycine sont à privilégier du fait de leur spectre d’action.
Toute infection oculaire sévère, en particulier la kératite bactérienne sévère, nécessite un prélèvement microbiologique (bactériologique, ainsi que fongique et amibien s’il y a lieu). Le traitement initial est à large spectre, puis adapté aux bactéries identifiées le cas échéant. Une collaboration étroite avec le bactériologiste est donc indispensable. L’antibiogramme d’une bactérie est la détermination in vitro de sa sensibilité aux antibiotiques, dans une optique essentiellement thérapeutique : il a pour but de définir, pour chaque antibiotique étudié, la probabilité de succès thérapeutique en cas d’utilisation de ce dernier. Ces probabilités sont déterminées en comparant la CMI (c’est-à-dire la plus faible concentration d’antibiotique inhibant la croissance bactérienne après 24 h) aux concentrations d’antibiotiques habituellement obtenues dans les tissus après administration systémique. Ainsi, une bactérie désignée comme « sensible » à une molécule signifie que la probabilité de succès thérapeutique est élevée dans le cas d’un traitement par voie systémique avec la posologie recommandée dans le résumé des caractéristiques du produit (RCP). Une sensibilité « intermédiaire » signifie un succès imprévisible et une « résistance » implique une forte probabilité d’échec thérapeutique quels que soient le type de traitement et la dose d’antibiotique utilisée. Les résultats figurant sur l’antibiogramme d’une bactérie sont donc basés sur les données issues d’une administration systémique. Or les concentrations obtenues à la surface oculaire par des antibiotiques administrés par voie topique peuvent être très supérieures aux CMI de la bactérie étudiée, et un antibiotique qui semble inadapté sur le résultat de l’antibiogramme peu néanmoins se révéler cliniquement efficace. C’est ainsi que les antibiotiques topiques commercialisés ont une efficacité quasi comparable sur la guérison des conjonctivites bactériennes. Bien que l’interprétation du résultat de l’antibiogramme ne soit pas toujours aisée en ophtalmologie, il existe des données établissant un lien entre CMI élevée et vitesse de guérison de l’infection oculaire ralentie, voire faisant état d’échecs thérapeutiques lors de résistances sur l’antibiogramme [42, 43]. Du fait de développement de résistances acquises, la seule identification bactérienne ne permet plus de prédire le comportement d’une souche isolée vis-à-vis des antibiotiques d’où l’intérêt et la nécessité de réaliser des antibiogrammes.
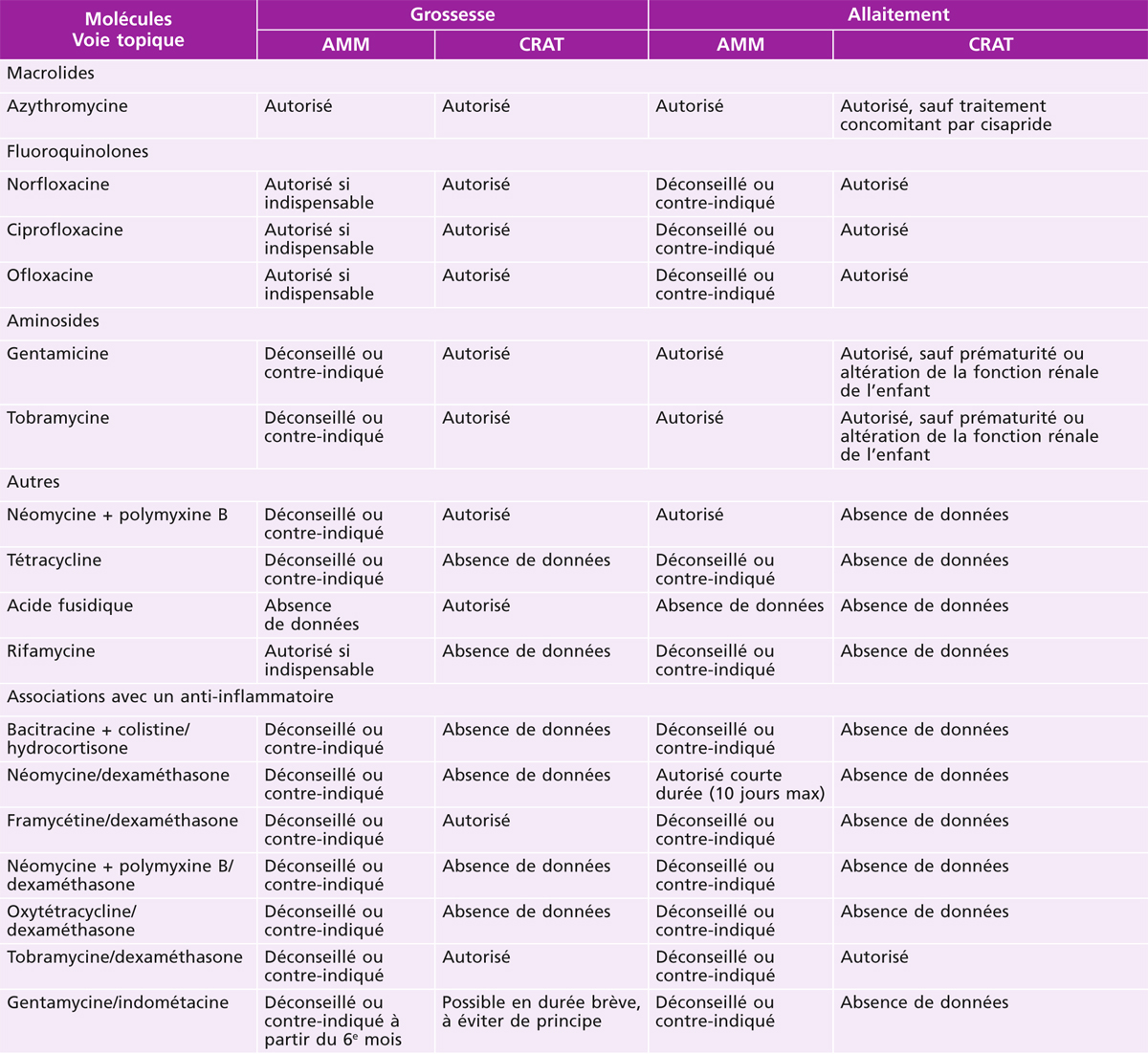
Si l’utilisation des antibiotiques systémiques lors de la grossesse et de l’allaitement est assez bien codifiée, il n’en est pas de même pour les collyres antibiotiques. Les recommandations de l’Afssaps [41] font état de la possibilité d’utiliser les fluoroquinolones et la rifampicine, ainsi que la tétracycline au cours du 1er trimestre. Elles déconseillent l’emploi des aminosides et du chloramphénicol, cette dernière molécule n’étant de toute façon plus commercialisée en France. Le Centre de référence sur les agents tératogènes (CRAT) autorise, quant à lui, l’usage des aminosides topiques lors de la grossesse. En ce qui concerne l’allaitement, l’Afssaps recommande d’éviter la tétracycline, la colistine, l’acide fusidique, les fluoroquinolones, tandis que le CRAT autorise les quinolones et restreint l’interdiction d’usage des aminosides aux seuls cas de prématurité ou pathologie rénale de l’enfant (tableau 17.4).
Il faudra conseiller à la femme enceinte ou allaitante d’occlure les points lacrymaux lors de l’instillation des collyres, afin de réduire la dose absorbée par voie systémique.
Tableau 17-4 Résumé des avis concernant l’utilisation des antibiotiques émis par l’AMM et le CRAT.
AMM : autorisation de mise sur le marché ; CRAT : Centre de référence sur les agents tératogènes.
[1] Bourcier T, Sauer A, Saleh M, et al. Kératites bactériennes. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie. 21-200-D-22. 2013 : p.1-9.
[2] Patte M, Sillaire I, Pauchard E, et al. Barrières hémato-oculaires. Physiologie. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie, 20-020-D-20. 2006 : p. 1-12.
[3] Peyman GA, Lee PJ, Seal DV. Endophthalmitis, diagnosis and management. London : Taylor & Francis ; 2004, 278 p.
[4] Adenis JP, Franco JL. Pénétration intraoculaire des antibiotiques. J Fr Ophtalmol 1987 ; 10 : 789-97.
[5] Dupin O, Trinquand C. Les voies de pénétration endoculaire. J Fr Ophtalmol 2000 ; 23 : 501.
[6] Robert PY, Tassy A. Biodisponibilité des antibiotiques. J Fr Ophtalmol 2000 ; 5 : 510-3.
[7] Scoper SV, Kabat AG, Owen GR, et al. Ocular distribution, bactericidal activity and settling characteristics of TobraDex ST ophthalmic suspension compared with TobraDex ophthalmic suspension. Adv Ther 2008 ; 25 : 77-88.
[8] Alfaro DV, Hudson SJ, Rafanan MM, et al. The effect of trauma on the ocular penetration of intravenous ciprofloxacin. Am J Ophthalmol 1996 ; 122 : 678-83.
[9] Behrens-Baumann W. Absorption of topically administered ciprofloxacin, ofloxacin and gentamicin in the inflamed rabbit eye. Ophthalmologica 1996 ; 210(2) : 119-22.
[10] Mounier M, Adenis JP, Denis F. Intraocular penetration of ciprofloxacin after infusion and oral administration. Pathol Biol 1988 ; 36 : 724-7.
[11] Robinet A, Le Bot MA, Colin J, Riche C. Penetration of piperacillin into the vitreous after intravenous administration. Retina 1998 ; 18 : 526-30.
[12] Fukuda M, Yamada M, Kinoshita S, et al. Comparison of corneal and aqueous humor penetration of moxifloxacin, gatifloxacin and levofloxacin during keratoplasty. Adv Ther 2012 ; 29 : 339-49.
[13] Healy DP, Holland EJ, Nordlund ML, et al. Concentrations of levofloxacin, ofloxacin, and ciprofloxacin in human corneal stromal tissue and aqueous humor after topical administration. Cornea 2004 ; 23 : 255-63.
[14] McCulley JP, Caudle D, Aronowicz JD, Shine WE. Fourth-generation fluoroquinolone penetration into the aqueous humor in humans. Ophthalmology 2006 ; 113 : 955-9.
[15] Robertson SM, Curtis MA, Schlech BA, et al. Ocular pharmacokinetics of moxifloxacin after topical treatment of animals and humans. Surv Ophthalmol 2005 ; 50 Suppl 1 : S32-45.
[16] Solomon R, Donnenfeld ED, Perry HD, et al. Penetration of topically applied gatifloxacin 0.3 %, moxifloxacin 0.5 %, and ciprofloxacin 0.3 % into the aqueous humor. Ophthalmology 2005 ; 112 : 466-9.
[17] Hansen S. Intraocular penetration of fusidic acid with topical Fucithalmic. Eur J Drug Metab Pharmacokinet 1985 ; 10 : 329-31.
[18] Taylor PB, Burd EM, Tabbara KF. Corneal and intraocular penetration of topical and subconjunctival fusidic acid. Br J Ophthalmol 1987 ; 71 : 598-601.
[19] Saleh M, Jehl F, Dory A, et al. Ocular penetration of topically applied linezolid in a rabbit model. J Cataract Refract Surg 2010 ; 36 : 488-92.
[20] Cagini C, Piccinelli F, Lupidi M, et al. Ocular penetration of topical antibiotics : study on the penetration of chloramphenicol, tobramycin and netilmicin into the anterior chamber after topical administration. Clin Experiment Ophthalmol 2013 ; 41 : 644-7.
[21] Chiambaretta F, Garraffo R, Elena PP, et al. Tear concentrations of azithromycin following topical administration of a single dose of azithromycin 0.5 %, 1.0 %, and 1.5 % eyedrops (T1225) in healthy volunteers. Eur J Ophthalmol 2008 ; 18 : 13-20.
[22] Fintelmann RE. Topical fluoroquinolone use as a risk factor for in vitro fluoroquinolone resistance in ocular cultures. Arch Ophthalmol 2011 ; 129 : 399.
[23] Haas W, Pillar CM, Torres M, et al. Monitoring antibiotic resistance in ocular microorganisms: results from the antibiotic resistance monitoring in ocular microrganisms (ARMOR) 2009 Surveillance Study. Am J Ophthalmol 2011 ; 152 : 567-74.
[24] Miño de Kaspar H, Shriver E, Nguyen E, et al. Risk factors for antibiotic-resistant conjunctival bacterial flora in patients undergoing intraocular surgery. Graefes Arch Clin Exp Ophthalmol 2003 ; 241 : 730-3.
[25] Suto C, Morinaga M, Yagi T, et al. Conjunctival sac bacterial flora isolated prior to cataract surgery. Infect Drug Resist 2012 ; 5 : 37-41.
[26] Dave SB, Toma HS, Kim SJ. Ophthalmic antibiotic use and multidrug-resistant staphylococcus epidermidis : a controlled, longitudinal study. Ophthalmology 2011 ; 118 : 2035-40.
[27] Kim SJ, Toma HS. Antimicrobial resistance and ophthalmic antibiotics : 1-year results of a longitudinal controlled study of patients undergoing intravitreal injections. Arch Ophthalmol 2011 ; 129 : 1180-8.
[28] Milder E, Vander J, Shah C, Garg S. Changes in antibiotic resistance patterns of conjunctival flora due to repeated use of topical antibiotics after intravitreal injection. Ophthalmology 2012 ; 119 : 1420-4.
[29] Orlans HO, Hornby SJ, Bowler ICJW. In vitro antibiotic susceptibility patterns of bacterial keratitis isolates in Oxford, UK : a 10-year review. Eye 2011 ; 25 : 489-93.
[30] Shalchi Z, Gurbaxani A, Baker M, Nash J. Antibiotic resistance in microbial keratitis : ten-year experience of corneal scrapes in the United Kingdom. Ophthalmology 2011 ; 118 : 2161-5.
[31] Cavuoto K, Zutshi D, Karp CL, et al. Update on bacterial conjunctivitis in south Florida. Ophthalmology 2008 ; 115 : 51-6.
[32] Fong CF, Hu FR, Tseng CH, et al. Antibiotic susceptibility of bacterial isolates from bacterial keratitis cases in a university hospital in Taiwan. Am J Ophthalmol 2007 ; 144 : 682-9.
[33] Lichtinger A, Yeung SN, Kim P, et al. Shifting trends in bacterial keratitis in Toronto : an 11-year review. Ophthalmology 2012 ; 119(9) : 1785-90.
[34] Adebayo A, Parikh J, McCormick S, et al. Shifting trends in in vitro antibiotic susceptibilities for common bacterial conjunctival isolates in the last decade at the New York Eye and Ear Infirmary. Graefes Arch Clin Exp Ophthalmol 2011 ; 249: 111-9.
[35] Mather R, Karenchak LM, Romanowski EG, Kowalski RP. Fourth generation fluoroquinolones : new weapons in the arsenal of ophthalmic antibiotics. Am J Ophthalmol 2002 ; 133 : 463-6.
[36] Morrissey I, Burnett R, Viljoen L, Robbins M. Surveillance of the susceptibility of ocular bacterial pathogens to the fluoroquinolone gatifloxacin and other antimicrobials in Europe during 2001/2002. J Infect 2004 ; 49 : 109-14.
[37] Ta CN, He L, de Kaspar HM. In vitro antibiotic susceptibility of preoperative normal conjunctival bacteria. Eye 2009 ; 23 : 559-60.
[38] Kowalski RP, Dhaliwal DK, Karenchak LM, et al. Gatifloxacin and moxifloxacin : an in vitro susceptibility comparison to levofloxacin, ciprofloxacin, and ofloxacin using bacterial keratitis isolates. Am J Ophthalmol 2003 ; 136 : 500-5.
[39] Moshirfar M, Mirzaian G, Feiz V, Kang PC. Fourth-generation fluoroquinolone-resistant bacterial keratitis after refractive surgery. J Cataract Refract Surg 2006 ; 32 : 515-8.
[40] Kim SJ, Toma HS, Midha NK, et al. Antibiotic resistance of conjunctiva and nasopharynx evaluation study: a prospective study of patients undergoing intravitreal injections. Ophthalmology 2010 ; 117 : 2372-8.
[41] Afssaps. Collyres et autres topiques antibiotiques dans les infections oculaires superficielles. Recommandations. Paris : Afssaps ; 2004.
[42] Chen A, Prajna L, Srinivasan M, et al. Does In vitro susceptibility predict clinical outcome in bacterial keratitis ? Am J Ophthalmol 2008 ; 145 : 409-12.
[43] Wilhelmus KR. Influence of fluoroquinolone susceptibility on the therapeutic response of fluoroquinolone-treated bacterial keratitis. Arch Ophthalmol 2003 ; 121 : 1229-33.
M. Labetoulle, A. Rousseau, M. M’Garrech, L. Bonin, E. Barreau, T. Bourcier
Les antiviraux actuellement disponibles ne couvrent que les infections liées à herpes simplex virus (HSV) et au virus varicelle–zona (varicella-zoster virus ou VZV). Ils sont disponibles pour un traitement par voie locale ou par voie générale, essentiellement orale dans les infections de surface. Cependant, de nombreux autres outils sont utiles pour la prise en charge des infections virales de la surface oculaire. Ces traitements peuvent être purement symptomatiques (comme l’atropine), destinés à réduire la charge virale en surface (comme le débridement et les larmes artificielles) ou l’importance de la réaction inflammatoire dans la cornée (anti-inflammatoire stéroïdien, ciclosporine). L’arsenal thérapeutique s’est récemment enrichi de thérapeutiques capables de faire régresser les complications des kératites virales les plus sévères, en particulier les néovaisseaux d’origine inflammatoire et les troubles trophiques.
Les outils de prise en charge des maladies virales de la surface ne peuvent se résumer aux antiviraux. Certes, ces derniers sont efficaces, mais leurs cibles sont limitées, puisque les autorisations de mise sur le marché (AMM) des antiviraux ne concernent que herpes simplex virus (HSV) et le virus varicelle-zona (varicella-zoster virus ou VZV). Il reste donc de nombreuses situations pour lesquels des moyens non spécifiques doivent être utilisés. Ils sont d’ailleurs aussi largement utiles dans les infections herpétiques et zostériennes.
Les infections virales de la surface oculaire sont principalement traitées par voie topique, mais il est des situations où les traitements systémiques sont indispensables, notamment dans les formes sévères de kératite herpétique ou zostérienne.
Les antiviraux topiques actuellement sur le marché, et même les plus anciens, ont en commun leur indication (les atteintes herpétiques) et leur mode d’action, puisque ce sont tous des inhibiteurs nucléosidiques de l’ADN polymérase virale, enzyme clé de la réplication des virus HSV-1, HSV-2, VZV et cytomégalovirus (CMV). Ces données expliquent que malgré une AMM réduite aux infections cornéennes et conjonctivales dues à HSV, ils peuvent être aussi utilisés dans les complications des infections à VZV, ainsi que dans l’entité récemment décrite des endothélites à CMV. En revanche, il n’y a pas d’indication officielle, ni même de preuve scientifique suffisamment forte pour utiliser ces antiviraux dans d’autres types d’infections virales de la surface oculaire. Le mécanisme d’action commun explique aussi l’absence de synergie entre les différents traitements topiques disponibles, d’où l’absence d’intérêt clinique de les associer puisque l’efficacité n’en serait pas meilleure [1], alors que la toxicité épithéliale pourrait devenir significative.
On distingue deux grandes classes d’antiviraux topiques, ceux directement actifs sur le virus et ceux qui en réalité sont des promédicaments puisqu’ils nécessitent l’action d’une enzyme virale pour être actifs.
La première catégorie était largement majoritaire parmi les premiers antiviraux topiques arrivés sur le marché, entre 1960 et 1980. Les présentations ophtalmiques présentes en France étaient alors l’idoxuridine (Iduviran®), l’iodo-déoxycitidine (Cébévir®) et la vidarabine (Vira-A®). Il persiste actuellement un représentant de cette classe thérapeutique, la trifluridine (Virophta®) dont l’efficacité est cependant supérieure à celle des molécules précédentes [1, 2]. Le principal avantage de cette catégorie est justement son action directe concernant l’efficacité sur l’ADN polymérase virale. En pratique clinique, les souches virales ayant suffisamment modifié génétiquement l’ADN polymérase pour devenir résistantes sont rares et ont une incidence clinique relativement faible. Malheureusement, cet avantage pharmacologique est aussi à l’origine de la principale limite de ces molécules, à savoir leur toxicité pour les cellules épithéliales non encore infectées, car elles peuvent aussi bloquer l’ADN polymérase cellulaire, dont l’action est nécessaire au cycle de réplication chez ces cellules à renouvellement rapide.
La seconde catégorie correspond aux molécules plus modernes, qui, pour devenir actives, nécessitent trois phosphorylations successives. La première requiert la thymidine-kinase virale (les deux suivantes sont réalisées par des kinases cellulaires). Ceci explique la spécificité de l’action antivirale dans les cellules infectées par le virus, et donc en corollaire la moindre toxicité de cette catégorie d’antiviraux sur l’épithélium cornéen ou conjonctival non infecté [3, 4]. Cependant, en raison même de ce mécanisme d’activation, cette catégorie d’antiviraux est potentiellement limitée par la sélection de souches virales dont la thymidine-kinase est « altérée ». Ce terme recouvre en fait diverses situations dont une réduction de la sensibilité à l’antiviral (la thymidine-kinase n’en assure plus la première phosphorylation) mais avec persistance d’une capacité réplicative normale du virus ou presque (la thymidine-kinase virale continue de jouer son rôle au sein de la cellule infectée). Lorsque des isolats viraux sont examinés de façon systématique, les mutations dans le gène de la thymidine-kinase virale sont fréquentes [5] et varient selon le statut immun du patient (0,3 à 0,5 % des souches isolées chez l’immunocompétent contre 4,7 à 6,3 % chez l’immunodéprimé) [6-12], mais les conséquences cliniques sont heureusement plus rares. En effet, les mutations génétiques dans la thymidine-kinase confèrent le plus souvent une moindre virulence clinique à la souche virale ; les premiers cas cliniques rapportés étaient survenus chez des patients fortement immunodéprimés [13]. Cependant, ce n’est pas toujours la règle, et les conséquences cliniques peuvent parfois être tout aussi désastreuses qu’avec des souches virales sauvages, y compris chez des patients immunocompétents [14]. Les deux molécules actuellement disponibles en France dans cette catégorie d’antiviraux topiques plus modernes à visée ophtalmique sont l’aciclovir (Zovirax®) et le ganciclovir (Virgan®).
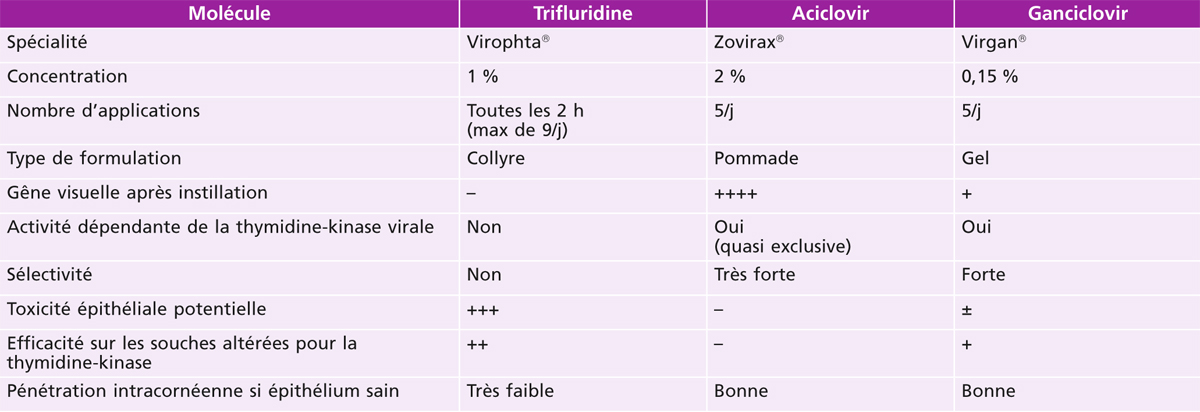
Compte tenu des différences entre les mécanismes d’action et les galéniques des divers antiviraux disponibles, il semble logique de se poser la question du meilleur choix à faire au moment de la prescription. La méta-analyse de Wilhelmus ne montre pas de différence significative entre trifluridine, aciclovir et ganciclovir lorsque le critère de jugement est le délai de cicatrisation des kératites épithéliales herpétiques [1]. Pour autant, l’analyse pratique des modalités de prescription, des données sur la tolérance, la pénétration et le risque de résistance [6, 15-24] peut être synthétisée pour aider le clinicien dans sa prise de décision thérapeutique (tableau 17-5).
Tableau 17-5 Comparaison des différentes présentations pharmaceutiques d’antiviraux topiques d’après Labetoulle [48].
(Extrait de Labetoulle M, Rousseau A, Bourcier T. Atteintes herpétiques du segment antérieur de l’œil : aspects thérapeutiques. EMC Ophtalmologie 2014 [21-200-D 21] Copyright © 2014 Elsevier Masson. Tous droits réservés.)
Trois antiviraux disponibles par voie orale dispose d’une AMM dans ce type d’indications : l’aciclovir (Zovirax®), le valaciclovir (Zelitrex®) et le famciclovir (Oravir®). L’aciclovir peut aussi trouver des indications par voie intraveineuse dans certaines circonstances. Il est en revanche nettement plus rare de devoir recourir au foscarnet (Foscavir®) ou au ganciclovir (Cymevan®) dans leur présentation intraveineuse.
Le valaciclovir, uniquement disponible par voie orale, est un promédicament de l’aciclovir (qui est elle-même inactive sans la présence d’une enzyme virale, voir ci-dessus). Dans le valaciclovir, la molécule d’aciclovir a été enrichie d’une valine liée par une fonction ester afin de mieux résister au passage gastrique et aussi de prolonger le temps de demi-vie. Une fois la valine décrochée par les estérases intestinales, c’est donc finalement de l’aciclovir qui passe dans le sang du patient. La biodisponibilité du valaciclovir, qui n’existe donc que pour la voie orale, est d’ailleurs 3 à 5 fois supérieure à celle de l’aciclovir oral [25-27].
Les indications de l’aciclovir et du valaciclovir oraux sont l’herpès cornéen et le zona ophtalmique. En période aiguë de kératite herpétique, la dose mentionnée dans l’AMM est de 2 g/jour en cinq prises pour l’aciclovir. Elle permet d’obtenir une concentration lacrymale d’aciclovir supérieure à la dose inhibitrice 50 des souches herpétiques de référence [15, 28]. Une concentration sanguine équivalente d’aciclovir est obtenue avec 1 g de valaciclovir/jour en deux prises, ce qui correspond aussi aux posologies de l’AMM dans les kératites herpétiques. Toutefois, ces doses recommandées par l’AMM peuvent s’avérer insuffisantes dans certaines formes sévères de kératites. Des doses plus élevées peuvent alors être nécessaires, jusqu’à un maximum de 4 g/jour en cinq prises pour l’aciclovir et 3 g/jour en trois prises pour le valaciclovir. Il est même certaines situations, comme dans les kératites stromales nécrosantes, où il est légitime d’utiliser des doses encore plus importantes, et l’on a alors recours à l’aciclovir par voie intraveineuse, à la dose de 10 mg/kg/8 h. Les posologies nécessaires dans le cadre préventif sont nettement moins importantes, puisque l’AMM recommande 800 mg/jour en deux prises pour l’aciclovir, c’est-à-dire la posologie ayant fait la preuve de son efficacité dans l’étude pivot de l’Herpetic Eye Disease Study Group (HEDS) [29, 30]. Sur la base de la bio-équivalence, la dose correspondante de valaciclovir est de 500 mg/jour en une prise.
La prescription de valaciclovir oral, ou d’aciclovir par voie générale, nécessite toutefois quelques précautions. En cas d’insuffisance rénale, les posologies doivent être adaptées à la fonction rénale, selon les schémas disponibles dans le dictionnaire Vidal. De plus, ces molécules peuvent entraîner des désordres biologiques, exceptionnellement sévères : modifications du bilan hépatique (augmentation des enzymes de 2 ou 3 fois la normale) et de la formule sanguine (notamment thrombopénie chez les patients déjà cytopéniques). Compte tenu de cela, il est licite d’organiser une surveillance biologique régulière, avec évaluation des fonctions rénale et hépatique, et de la numération sanguine. Quelques effets indésirables cliniques peuvent aussi être observés, le plus souvent sans gravité, dominés par des troubles digestifs et des nausées, et une sensation de fatigue ou de troubles de l’équilibre. Des céphalées, voire des hallucinations, ont aussi été rapportées.
Cet antiviral dispose en France d’une AMM dans le zona à la dose de 1 500 mg/jour en trois prises (Oravir®, comprimés à 500 mg). Son utilisation est aussi approuvée par les autorités de santé nord-américaines dans l’herpès, mais ce n’est pas encore officiellement le cas en Europe, bien que cette molécule puisse effectivement rendre des services dans cette indication. Comme le valaciclovir, le famciclovir (Oravir®) est un promédicament, qui libère du penciclovir dans le sang après une prise orale (un diacétyl estérifié a été ajouté à la molécule de penciclovir pour augmenter la biodisponibilité et la résistance au suc gastrique). Pour être biologiquement efficace, le penciclovir nécessite aussi une triple phosphorylation (la première par la thymidine-kinase virale et les deux autres par des kinases cellulaires) [31]. Outre sa spécificité d’action sur les cellules infectées, ses avantages sont une très longue durée de vie et une bonne pénétration intracellulaire, ce qui permet de réduire le nombre de prises quotidiennes. Par ailleurs, certaines souches virales naturellement peu sensibles à l’aciclovir peuvent l’être comparativement plus au penciclovir [32-34], mais l’inverse est aussi vrai pour d’autres souches. D’ailleurs, comme pour l’aciclovir, l’étude systématique d’isolats viraux a mis en évidence la possibilité de résistance au penciclovir, avec des fréquences de 0,2 % chez les patients immunocompétents et 2,1 % chez les patients immunodéprimés.
Les modalités de prescription et de surveillance biologique et clinique sont sensiblement les mêmes que pour l’aciclovir et le valaciclovir (voir ci-dessus). Il est à noter toutefois une précaution particulière à prendre en cas d’insuffisance hépatique (diminution de la transformation en penciclovir).
Le ganciclovir, ou DHPG pour (9-[1,3-dihydroxy-2-propoxyméthyl]guanine, est commercialisé sous le nom de Cymévan® pour la voie intraveineuse. Comme l’aciclovir, c’est un analogue de la guanosine naturelle, caractérisé par la présence d’un groupement hydroxyméthyl (3'OH) supplémentaire. Comme l’aciclovir, son activité passe par trois phosphorylations successives, dont la première doit être réalisée par une enzyme codée par le CMV lui-même, la phosphotransférase (codée par le gène UL97 du CMV) [35]. Après les deux autres phosphorylations réalisées par les enzymes cellulaires, le ganciclovir triphosphate est incorporé par l’ADN polymérase virale (codée par le gène UL54) dans la molécule d’ADN viral en formation, ce qui ralentit fortement la réplication du virus, sans toutefois la bloquer complètement [36]. Même si l’indication princeps est le traitement des maladies à CMV [37, 38], les thymidine-kinases des virus HSV et VZV peuvent aussi réaliser la première phosphorylation, ce qui explique l’efficacité du ganciclovir dans les infections herpétiques ou zostériennes. Il est d’ailleurs disponible sous forme topique (Virgan®) pour les infections de surface. Exceptionnellement, il peut aussi être administré par voie générale dans les atteintes très sévères de la cornée, sans oublier toutefois que l’administration par voie intraveineuse expose au risque de cytopénie, de troubles neuropsychiques, d’inhibition durable de la spermatogenèse et de tératogénicité.
Le valganciclovir (ValGCV) ou L-valyl ester valganciclovir, commercialisé sous le nom de Rovalcyte®, est un promédicament du ganciclovir qui permet d’améliorer significativement la biodisponibilité du médicament après administration par voie orale. Après absorption dans l’intestin, le valganciclovir est transformé en ganciclovir, ce qui explique une efficacité clinique et des indications similaires [39, 40].
Le foscarnet (acide phosphonoformique ou PFA), commercialisé sous le nom de Foscavir®, est une petite molécule analogue du pyrophosphate, que constitue un groupement naturel de deux phosphates. Son activité ne nécessite aucune phosphorylation virale ou cellulaire préalable. Il inhibe la synthèse d’ADN viral en se fixant au site d’attachement du pyrophosphate naturel de l’ADN polymérase des nombreux virus, dont les herpès virus, le virus de l’hépatite B et le virus de l’immunodéficience humaine (VIH) [41]. Le foscarnet peut être utilisé dans des cas cliniques très sélectionnés d’infection oculaire sévère par les virus HSV et VZV, notamment en cas de résistance prouvée (cliniquement ou biologiquement) à l’aciclovir, puisque son activité ne tient pas compte des kinases virales (thymidine-kinase, phosphotransférase). Il est aussi indiqué dans les infections oculaires à CMV, soit en première intention, soit en cas d’échec ou de contre-indication (neutropénie sévère) d’un traitement par le ganciclovir. Il n’est cependant pas dénué d’effets indésirables, car il peut entraîner une néphrotoxicité, de même qu’une anémie, des nausées et vomissements, une perturbation des électrolytes et des ulcérations génitales [42].
Le débridement épithélial est un temps essentiel de la prise en charge des kératites virales épithéliales car il réduit immédiatement la charge virale sur la surface de l’œil en éliminant les cellules mortes, et surtout celles en pleine période de réplication virale. Du fait de l’effet cytopathogène induit par l’infection, notamment pour HSV et VZV, ces cellules ont en général perdu leurs capacités adhésives, et leur ablation est aisée. En pratique, le débridement de l’épithélium altéré est réalisé en consultation, à la lampe à fente, à l’aide d’une éponge microchirurgicale stérile. Si l’on ne cherche pas à mettre en évidence le virus, il est plus simple de réaliser une instillation de collyres anesthésiques avant le geste, puis de fluorescéine pour visualiser toute la zone à traiter. Si l’on cherche à identifier le virus par polymerase chain reaction (PCR), l’instillation d’anesthésiques ou de colorants peut limiter la sensibilité de ce type de recherches [43, 44]. La méta-analyse de Wilhlemus a montré que le débridement épithélial a une action synergique avec celle des antiviraux, c’est-à-dire qu’il permet de gagner en délai de cicatrisation épithéliale [1].
L’instillation répétée de larmes artificielles est le complément indispensable du débridement dans l’objectif de réduire la charge en particules virales sur la surface oculaire. Les larmes artificielles agissent donc par leur effet de lavage oculaire, et elles permettent aussi de diminuer la concentration locale en effecteurs inflammatoires mobilisés par l’infection, dont certaines enzymes et cytokines qui retardent la cicatrisation épithéliale. Il est donc logique de prescrire des larmes artificielles à des doses importantes (six à huit instillations/jour) pendant la phase aiguë des kératites épithéliales, pour favoriser la réparation épithéliale. Les collyres mouillants sont aussi conseillés au long cours dans les kératites herpétiques récidivantes, en raison de la sécheresse oculaire induite non seulement dans l’œil touché, mais aussi dans l’œil adelphe [45]. Ce type de traitement participe d’ailleurs à la prévention des récidives herpétiques [46].
L’atropine est une aide efficace pour réduire les douleurs observées dans les kératites avec composante épithéliale, ainsi que dans les sclérites et épisclérites infectieuses, grâce à son action cycloplégique. En pratique, on utilise le plus souvent une posologie de trois instillations par jour d’atropine à 1 % (concentration à adapter en fonction de l’âge chez l’enfant). La prescription d’un pansement oculaire permet de compléter l’action cycloplégique et donc antalgique.
Les antiseptiques peuvent être utilisés lors de la période aiguë d’une kératite épithéliale dans le cadre préventif d’une surinfection bactérienne. Cette attitude est certainement justifiée dans certains contextes épidémiques, en milieu défavorisé et/ou chez des patients immunodéprimés. En revanche, cette prévention ne semble pas indispensable dans la plupart des infections herpétiques et zostériennes car la surinfection est rare. Dans tous les cas, les antibiotiques n’ont pas leur place dans ces mesures préventives [47], d’autant qu’ils peuvent retarder la réparation épithéliale.
Les anti-inflammatoires stéroïdiens peuvent être utiles dans les kératites virales, mais sous certaines conditions. Ils n’ont pas d’intérêt dans les kératites à adénovirus à la phase aiguë car ils augmentent le temps de production virale et donc le risque de contamination de l’entourage, mais ils sont en revanche utiles au stade des séquelles, lorsque persistent des opacités sous-épithéliales. Dans les kératites à HSV et VZV, ils sont contre-indiqués en cas d’atteinte épithéliale ou de forme nécrotique d’atteinte stromale (risque de réplication virale massive avec fonte cornéenne). En revanche, ils ont toute leur place dans les formes non nécrotiques de kératite stromale et dans les endothélites, après avoir mis en place un traitement antiviral cliniquement efficace. On utilise habituellement un corticoïde puissant, en pratique la dexaméthasone (ou la rimexolone) à raison de six à huit instillations (éventuellement couplées à des injections sous-conjonctivales de corticoïdes, en évitant les formes retard). Une fois obtenue la régression de l’inflammation, les doses sont réduites progressivement jusqu’au sevrage complet. Pour une réduction encore plus progressive de la corticothérapie, il est possible de substituer les corticoïdes initiaux par des spécialités à base de fluorométholone ou d’hydrocortisone [48, 49].
Dans les kératites virales autres qu’à adénovirus, HSV ou VZV, la place des corticoïdes n’est pas décrite dans la littérature. En pratique, la question se pose surtout dans les kératoconjonctivites à entérovirus où la conduite est calquée sur celles des infections adénovirales. Dans les kératites associées aux maladies éruptives, le recours aux corticoïdes est exceptionnel.
Les immunomodulateurs occupent désormais une place grandissante dans l’arsenal thérapeutique contre les kératites virales. Cette classe est essentiellement représentée par la ciclosporine A, mais d’autres molécules seront probablement utilisées à l’avenir, comme le tacrolimus ou le sirolimus. Compte tenu du mode d’action assez lent, cette classe thérapeutique n’a pas d’intérêt au stade aigu des kératites virales. Elle est plutôt utilisée dans les formes compliquées ou rebelles aux traitements anti-inflammatoires conventionnels. La ciclosporine A est surtout utilisée sous forme de collyres à 2 %. Les principales indications sont les opacités sous-épithéliales séquellaires des infections à adénovirus et les kératites stromales à HSV ou VZV devenues cortico-dépendantes [50-53] ou récidivantes [46]. Les données de la littérature sur les modalités optimales de prescription sont toutefois limitées et il n’existe malheureusement pas de présentation industrielle de ciclosporine adaptée à cette indication. L’ophtalmologiste est donc amené à prescrire ces collyres hors AMM, avec les contraintes que cela impose.
Les anti-inflammatoires non stéroïdiens (AINS) n’ont pas d’indication dans les kératites virales, notamment en raison de leur épithéliotoxicité. En particulier, deux études ont souligné leur inefficacité dans les kératites à HSV [54] et à adénovirus [55].
Les inhibiteurs de l’angiogenèse sont actuellement surtout représentés par les anti-VEGF (anti-vascular endothelial cell growth factor), même si les corticostéroïdes et la ciclosporine participent aussi à la réduction des néovaisseaux par leur effet anti-inflammatoire. Les premières tentatives anti-angiogéniques étaient fondées sur la photothérapie dynamique des zones néovascularisées de la cornée [56], mais l’avènement rapide des premiers anti-VEGF a ouvert la voie à des traitements plus spécifiques, notamment avec le bévacizumab en injection sous-conjonctivale et/ou intrastromale, ou encore sous forme de collyre [57, 58]. D’autres stratégies anti-VEGF, basées sur des anticorps ou des ARN anti-sens ou inhibiteurs, ont été tentées [59-62]. Les résultats sont globalement modérés, puisqu’il apparaît que les néovaisseaux cornéens de grand diamètre et/ou anciens ne sont en général que peu répondeurs à ce type de traitement, et l’utilisation topique d’anti-VEGF risque de précipiter une kératopathie neurotrophique sous-jacente en raison de l’effet inhibiteur de ces molécules sur les facteurs de croissance neuronaux et épithéliaux [63-65].
Les promoteurs de la cicatrisation font aussi partie des nouvelles thérapeutiques dans les kératites virales sévères. En pratiques, leurs indications concernent exclusivement les complications des infections à HSV et VZV. Les préparations magistrales en collyre à base de sérum autologue à 20 % sont fabriquées en salle blanche, dans certaines pharmacies hospitalières. Elles doivent ensuite être conservées avec un respect strict de la chaîne du froid. Leur efficacité tient à la présence de facteurs de croissance et autres composants du sang qui favorisent la réparation épithéliale [66-70]. Elles trouvent donc sa meilleure indication dans les ulcérations chroniques observées dans le cadre des kératites neurotrophiques qui apparaissent à la suite d’un zona sévère ou de multiples épisodes d’herpès cornéen [71].
À l’avenir, les thérapeutiques dites matricielles pourraient aussi jouer ce rôle, comme les polymères mimétiques des héparanes sulfates (Cacicol®), dont le mode d’action est de mimer l’architecture de la matrice extracellulaire du stroma pour en promouvoir la réparation. Des cas cliniques et séries non comparatives ont déjà suggéré une bonne efficacité de ces traitements dans les kératites neurotrophiques post-herpétiques ou post-zostériennes [72-74] et des études prospectives randomisées sont actuellement en cours.
Enfin, dans les cas les plus avancés d’ulcération stromale, on peut aussi utiliser les greffes de membrane amniotique (GMA) [71, 75-77], dont l’action est à la fois architectonique par comblement de l’ulcère et biologique par l’apport de facteurs de croissance [78]. Les GMA peuvent aussi trouver une indication précieuse dans les formes nécrotiques de kératite stromale [79, 80].
[1] Wilhelmus KR. Antiviral treatment and other therapeutic interventions for herpes simplex virus epithelial keratitis. Cochrane Database Syst Rev 2010 ; (12) : CD002898.
[2] Coster DJ, Jones BR, Mcgill JI. Treatement of amoeboid herpetic ulcers with adenine arabinoside or trifluorothymidine. Br J Ophthalmol 1979 ; 63 : 418.
[3] Agut H, Bodaghi B, Calvi P, et al. Traitement des infections virales. In : Offret H. Ed. Œil et virus. Paris : Masson ; 2000.
[4] Deback C, Agut H. Alphaherpesvirinae II : virus varicelle-zona et mode d’action des anti-viraux. In : Labetoulle M. Ed. Herpès et zona oculaire : de la clinique au traitement. Paris : Med’Com Editions ; 2009.
[5] Wang K, Mahalingam G, Hoover SE, et al. Diverse HSV-1 thymidine kinase mutants in individual human neurons and ganglia. J Virol 2007 ; 81 : 6817-26.
[6] Gordon YJ. The evolution of antiviral therapy for external ocular viral infections over twenty-five years. Cornea 2000 ; 19 : 673-80.
[7] Morfin F, Thouvenot D. Herpes simplex virus resistance to antiviral drugs. J Clin Virol 2003 ; 26 : 29-37.
[8] Nugier F, Colin JN, Aymard M, Langlois M. Occurrence and characterization of acyclovir-resistant herpes simplex virus isolates : report on a two-year sensitivity screening survey. J Med Virol 1992 ; 36 : 1-12.
[9] Englund JA, Zimmerman ME, Swierkosz EM, et al. Herpes simplex virus resistant to acyclovir. A study in a tertiary care center. Ann Intern Med 1990 ; 112 : 416-22.
[10] Christophers J, Clayton J, Craske J, et al. Survey of resistance of herpes simplex virus to acyclovir in northwest England. Antimicrob Agents Chemother 1998 ; 42 : 868-72.
[11] Reyes M, Shaik NS, Graber JM, et al. Acyclovir-resistant genital herpes among persons attending sexually transmitted disease and human immunodeficiency virus clinics. Arch Intern Med 2003 ; 163 : 76-80.
[12] Danve-Szatanek C, Aymard M, Thouvenot D, et al. Surveillance network for herpes simplex virus resistance to antiviral drugs : 3-year follow-up. J Clin Microbiol 2004 ; 42 : 242-9.
[13] Bodaghi B, Mougin C, Michelson S, et al. Acyclovir-resistant bilateral keratitis associated with mutations in the HSV-1 thymidine kinase gene. Exp Eye Res 2000 ; 71 : 353-9.
[14] Gueudry J, Boutolleau D, Gueudin M, et al. Acyclovir-resistant varicella-zoster virus keratitis in an immunocompetent patient. J Clin Virol 2013 ; 58 : 318-20.
[15] Poirier RH, Kingham JD, Demiranda P, Annel M. Intraocular antiviral penetration. Arch Ophthalmol 1982 ; 100 : 1964-7.
[16] Wilhelmus KR. The treatment of herpes simplex virus epithelial keratitis. Trans Am Ophthalmol Soc 2000 ; 98 : 505-32.
[17] Colin J, Tournoux A, Chastel C, Renard G. Kératite herpétique superficielle. Traitement comparatif en double insu par aciclovir et idoxuridine. Nouv Presse Med 1981 ; 10 : 2969-75.
[18] Collum LM, Benedict-Smith A, Hillary IB. Randomised double-blind trial of acyclovir and idoxuridine in dendritic corneal ulceration. Br J Ophthalmol 1980 ; 64 : 766-9.
[19] Denis J, Thenault-Giono S, Ray-Cohen ML, et al. Traitement de l’herpès oculaire en double-insu : Vira A et acyclovir. Bull Soc Ophtalmol Fr 1983 ; 83 : 25-9.
[20] Colin J, Hoh Hb, Easty DL, et al. Ganciclovir ophthalmic gel (Virgan ; 0.15 %) in the treatment of herpes simplex keratitis. Cornea 1997 ; 16 : 393-9.
[21] Hoh HB, Hurley C, Claoue C, et al. Randomised trial of ganciclovir and acyclovir in the treatment of herpes simplex dendritic keratitis : a multicentre study. Br J Ophthalmol 1996 ; 80 : 140-3.
[22] Tabbara KF, Al balushi BN. Topical ganciclovir in the treatment of acute herpetic keratitis. Clin Ophthalmol 2010 ; 4 : 905-12.
[23] Croxtall JD. Ganciclovir ophthalmic gel 0.15 % : in acute herpetic keratitis (dendritic ulcers). Drugs 2011 ; 71 : 603-10.
[24] Castela N, Vermerie N, Chast F, et al. Ganciclovir ophthalmic gel in herpes simplex virus rabbit keratitis : intraocular penetration and efficacy. J Ocul Pharmacol 1994 ; 10 : 439-51.
[25] Beutner KR. Valacyclovir : a review of its antiviral activity, pharmacokinetic properties, and clinical efficacy. Antiviral Res 1995 ; 28 : 281-90.
[26] Soul-Lawton J, Seaber E, On N, et al. Absolute bioavailability and metabolic disposition of valaciclovir, the L-valyl ester of acyclovir, following oral administration to humans. Antimicrob Agents Chemother 1995 ; 39 : 2759-64.
[27] Ormrod D, Goa K. Valaciclovir : a review of its use in the management of herpes zoster. Drugs 2000 ; 59 : 1317-40.
[28] Collum LM, Mcgettrick P, Akhtar J, et al. Oral acyclovir (Zovirax) in herpes simplex dendritic corneal ulceration. Br J Ophthalmol 1986 ; 70 : 435-8.
[29] The Herpetic Eye Disease Study Group. Acyclovir for the prevention of recurrent herpes simplex virus eye disease. N Engl J Med 1998 ; 339 : 300-6.
[30] The Herpetic Eye Disease Study Group. Oral acyclovir for herpes simplex virus eye disease: effect on prevention of epithelial keratitis and stromal keratitis. Arch Ophthalmol 2000 ; 118 : 1030-6.
[31] Pavan-Langston D. Herpes zoster antivirals and pain management. Ophthalmology 2008 ; 115 : S13-S20.
[32] Shafran SD, Tyring SK, Ashton R, et al. Once, twice, or three times daily famciclovir compared with aciclovir for the oral treatment of herpes zoster in immunocompetent adults : a randomized, multicenter, double-blind clinical trial. J Clin Virol 2004 ; 29 : 248-53.
[33] Chong DY, Johnson MW, Huynh TH, et al. Vitreous penetration of orally administered famciclovir. Am J Ophthalmol 2009 ; 148 : 38-42.
[34] Field HJ, Vere Hodge RA. Recent developments in anti-herpesvirus drugs. Br Med Bull 2013 ; 106 : 213-49.
[35] Chee MS, Lawrence GL, Barrell BG. Alpha-, beta- and gammaherpesviruses encode a putative phosphotransferase. J Gen Virol 1989 ; 70 (Pt 5) : 1151-60.
[36] Hamzeh FM, Lietman PS. Intranuclear accumulation of subgenomic noninfectious human cytomegalovirus DNA in infected cells in the presence of ganciclovir. Antimicrob Agents Chemother 1991 ; 35 : 1818-23.
[37] Erice A, Jordan MC, Chace BA, Fletcher C, Chinnock BH, Balfour HH. Ganciclovir treatment of cytomegalovirus disease in transplant recipients and other immunocompromised hosts. JAMA 1987 ; 257 : 3082-7.
[38] Goodrich JM, Mori M, Gleaves CA, et al. Early treatment with ganciclovir to prevent cytomegalovirus disease after allogeneic bone marrow transplantation. N Engl J Med 1991 ; 325 : 1601-7.
[39] Jung D, Dorr A. Single-dose pharmacokinetics of valganciclovir in HIV- and CMV-seropositive subjects. J Clin Pharmacol 1999 ; 39 : 800-4.
[40] Martin Df, Sierra-Madero J, Walmsley S, et al. A controlled trial of valganciclovir as induction therapy for cytomegalovirus retinitis. N Engl J Med 2002 ; 346 : 1119-26.
[41] Crumpacker CS. Mechanism of action of foscarnet against viral polymerases. Am J Med 1992 ; 92 : 3S-7S.
[42] Wagstaff AJ, Bryson HM. Foscarnet. A reappraisal of its antiviral activity, pharmacokinetic properties and therapeutic use in immunocompromised patients with viral infections. Drugs 1994 ; 48 : 199-226.
[43] Goldschmidt P, Rostane H, Saint-Jean C, et al. Effects of topical anaesthetics and fluorescein on the real-time PCR used for the diagnosis of Herpesviruses and Acanthamoeba keratitis. Br J Ophthalmol 2006 ; 90 : 1354-6.
[44] Seitzman GD, Cevallos V, Margolis TP. Rose bengal and lissamine green inhibit detection of herpes simplex virus by PCR. Am J Ophthalmol 2006 ; 141 : 756-8.
[45] M’Garrech M, Rousseau A, Kaswin G, et al. Impairment of lacrimal secretion in the unaffected fellow eye of patients with recurrent unilateral herpetic keratitis. Ophthalmology 2013 ; 120 : 1959-67.
[46] Sheppard JD, Wertheimer ML, Scoper SV. Modalities to decrease stromal herpes simplex keratitis reactivation rates. Arch Ophthalmol 2009 ; 127 : 852-6.
[47] Afssaps. Collyres at autres antibiotiques dans les infections oculaires superficielles. Paris : Afssaps ; 2004.
[48] Labetoulle M, Rousseau A, Bourcier T. Herpetic diseases of the anterior segment of the eye: therapeutical aspects (Atteintes herpétiques du segment antérieur de l’œil : aspects thérapeutiques). Encycl Méd Chir (Elsevier, Paris). Ophtalmologie. 2014. In press.
[49] Labetoulle M, Colin J. Aspects actuels du traitement des kératites herpétiques. J Fr Ophtalmol 2012 ; 35 : 292-307.
[50] Boisjoly HM, Woog JJ, Pavan-Langston D, Park NH. Prophylactic topical cyclosporine in experimental herpetic stromal keratitis. Arch Ophthalmol 1984 ; 102 : 1804-7.
[51] Oh Jo, Minasi P, Grabner G, Ohashi Y. Suppression of secondary herpes simplex uveitis by cyclosporine. Invest Ophthalmol Vis Sci 1985 ; 26 : 494-500.
[52] Heiligenhaus A, Steuhl KP. Treatment of HSV-1 stromal keratitis with topical cyclosporin A : a pilot study. Graefes Arch Clin Exp Ophthalmol 1999 ; 237 : 435-8.
[53] Rao SN. Treatment of herpes simplex virus stromal keratitis unresponsive to topical prednisolone 1 % with topical cyclosporine 0.05 %. Am J Ophthalmol 2006 ; 141 : 771-2.
[54] Vajpayee RB, Dhakal BP, Gupta SK, et al. Evaluation of topical 0.03 % flurbiprofen drops in the treatment of herpetic stromal keratitis. Aust NZJ Ophthalmol 1996 ; 24 : 131-5.
[55] Romanowski EG, Gordon YJ. Effects of diclofenac or ketorolac on the inhibitory activity of cidofovir in the Ad5/NZW rabbit model. Invest Ophthalmol Vis Sci 2001 ; 42 : 158-62.
[56] Primbs GB, Casey R, Wamser K, et al. Photodynamic therapy for corneal neovascularization. Ophthalmic Surg Lasers 1998 ; 29 : 832-8.
[57] Hosseini H, Khalili MR. Therapeutic potential of bevacizumab (Avastin) in herpetic stromal keratitis (HSK). Med Hypotheses 2007 ; 69 : 568-70.
[58] Papathanassiou M, Theodoropoulou S, Analitis A, et al. Vascular endothelial growth factor inhibitors for treatment of corneal neovascularization : a meta-analysis. Cornea 2013 ; 32 : 435-44.
[59] Saravia M, Zapata G, Ferraiolo P, et al. Anti-VEGF monoclonal antibody-induced regression of corneal neovascularization and inflammation in a rabbit model of herpetic stromal keratitis. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 1409-16.
[60] Kim B, Tang Q, Biswas PS, et al. Inhibition of ocular angiogenesis by siRNA targeting vascular endothelial growth factor pathway genes : therapeutic strategy for herpetic stromal keratitis. Am J Pathol 2004 ; 165 : 2177-85.
[61] Cursiefen C, Bock F, Horn FK, et al. GS-101 antisense oligonucleotide eye drops inhibit corneal neovascularization: interim results of a randomized phase II trial. Ophthalmology 2009 ; 116 : 1630-7.
[62] Cheng SF, Dastjerdi MH, Ferrari G, et al. Short-term topical bevacizumab in the treatment of stable corneal neovascularization. Am J Ophthalmol 2012 ; 154 : 940-8 e1.
[63] Yu CQ, Zhang M, Matis KI, et al. Vascular endothelial growth factor mediates corneal nerve repair. Invest Ophthalmol Vis Sci 2008 ; 49 : 3870-8.
[64] Li Z, Burns AR, Han L, et al. IL-17 and VEGF are necessary for efficient corneal nerve regeneration. Am J Pathol 2011 ; 178 : 1106-16.
[65] Kim TI, Chung JL, Hong JP, et al. Bevacizumab application delays epithelial healing in rabbit cornea. Invest Ophthalmol Vis Sci 2009 ; 50 : 4653-9.
[66] Jeng BH, Dupps WJ, JR. Autologous Serum 50 % Eyedrops in the treatment of persistent corneal epithelial defects. Cornea 2009 ; 28 : 1104-8.
[67] Lee GA, Chen SX. Autologous serum in the management of recalcitrant dry eye syndrome. Clin Experiment Ophthalmol 2008 ; 36 : 119-22.
[68] Kojima T, Ishida R, Dogru M, et al. The effect of autologous serum eyedrops in the treatment of severe dry eye disease: a prospective randomized case-control study. Am J Ophthalmol 2005 ; 139 : 242-6.
[69] Creuzot-Garcher C, Lafontaine PO, Brignole F, et al. Traitement du syndrome sec grave par serum autologue. J Fr Ophtalmol 2004 ; 27 : 346-51.
[70] Tsubota K, Goto E, Shimmura S, Shimazaki J. Treatment of persistent corneal epithelial defect by autologous serum application. Ophthalmology 1999 ; 106 : 1984-9.
[71] Bourcier T, Semoun O. Kératites métaherpétiques. In : Labetoulle M. Ed. L’herpès et le zona oculaire en pratique : clinique, thérapeutique et prévention. Paris : Med’Com Editions ; 2009.
[72] De Monchy I, Labbe A, Pogorzalek N et al. Management of herpes zoster neurotrophic ulcer using a new matrix therapy agent (RGTA) : a case report. J Fr Ophtalmol 2012 ; 35 : 187.e1-6.
[73] Aifa A, Gueudry J, Portmann A, et al. Topical treatment with a new matrix therapy agent (RGTA) for the treatment of corneal neurotrophic ulcers. Invest Ophthalmol Vis Sci 2012 ; 53 : 8181-5.
[74] Chebbi CK, Kichenin K, Amar N, et al. Pilot study of a new matrix therapy agent (RGTA OTR4120) in treatment-resistant corneal ulcers and corneal dystrophy. J Fr Ophtalmol 2008 ; 31 : 465-71.
[75] Bauer D, Wasmuth S, Hennig M, et al. Amniotic membrane transplantation induces apoptosis in T lymphocytes in murine corneas with experimental herpetic stromal keratitis. Invest Ophthalmol Vis Sci 2009 ; 50 : 3188-98.
[76] Brijacak N, Dekaris I, Gagro A, Gabric N. Therapeutic effect of amniotic membrane in persistent epithelial defects and corneal ulcers in herpetic keratitis. Coll Antropol 2008 ; 32 Suppl 2 : 21-5.
[77] Kim JS, Kim JC, Hahn TW, Park WC. Amniotic membrane transplantation in infectious corneal ulcer. Cornea 2001 ; 20 : 720-6.
[78] Muraine M, Descargues G, Franck O, et al. La greffe de membrane amniotique dans les pathologies oculaires de surface. J Fr Ophtalmol 2001 ; 24 : 798-812.
[79] Heiligenhaus A, Bauer D, Meller D, et al. Improvement of HSV-1 necrotizing keratitis with amniotic membrane transplantation. Invest Ophthalmol Vis Sci 2001 ; 42 : 1969-74.
[80] Shi W, Chen M, Xie L. Amniotic membrane transplantation combined with antiviral and steroid therapy for herpes necrotizing stromal keratitis. Ophthalmology 2007 ; 114 : 1476-81.