Ulcères et ulcérations cornéennes chroniques
J. Gueudry, M. Muraine
La présence d’un ulcère chronique de la cornée impose d’abord l’évaluation de la sensibilité cornéenne, puis l’analyse de la statique palpébrale et la recherche d’un syndrome sec. La priorité est d’exclure une pathologie infectieuse. La localisation paracentrale ou périphérique de l’ulcère ainsi que son caractère infiltré ou non orientent le diagnostic. Le bilan étiologique doit être méthodique à la recherche d’une cause locale ou générale parfois inconnue du patient. La sanction thérapeutique doit être rapide et adaptée car l’intégrité du globe et la fonction visuelle sont le plus souvent menacées, ainsi que parfois le pronostic général.
Quelle que soit la cause d’un ulcère cornéen qui ne cicatrise pas, le risque est l’évolution vers la perforation cornéenne. Une ulcération cornéenne se définit comme une érosion de la couche épithéliale. Un ulcère cornéen se définit comme une érosion de la couche épithéliale avec atteinte du stroma cornéen associée. Les ulcères de cornée représentent donc une entité grave car ils peuvent mettre rapidement en péril l’intégrité anatomique de la surface oculaire ou la transparence de la cornée, et être à l’origine d’une baisse d’acuité visuelle profonde et durable. Leur diagnostic étiologique n’est pas forcément aisé car les causes en sont multiples. La prise en charge d’un ulcère de cornée repose sur deux questions essentielles. La première consiste à savoir s’il s’agit d’un ulcère infectieux ou d’un ulcère stérile. En effet, il est impératif de différencier rapidement une cause infectieuse nécessitant un traitement antibiotique, antifongique ou antiviral urgent d’une cause inflammatoire ou trophique qui va imposer un traitement spécifique. La seconde question consiste à savoir quelle est la cause ou les facteurs favorisants de cet ulcère présents au niveau de la surface oculaire concernant sa structure, son innervation ou son équilibre immunitaire. En effet, un ulcère de cornée infectieux ou non survient rarement sur un œil sain.
Les ulcères de cornée peuvent être de nature infectieuse (bactérienne, virale, mycotique ou amibienne), d’origine inflammatoire, secondaires à une malposition palpébrale ou à un défaut de la sensibilité cornéenne. Ils peuvent également être la conséquence d’une sécheresse oculaire, d’une toxicité médicamenteuse ou d’un déficit en cellules limbiques comme après une brûlure par exemple. Les ulcères d’origine infectieuse se présentent le plus souvent sous un mode d’évolution aiguë même si des difficultés diagnostiques, en particulier en cas de kératites amibiennes, fongiques ou herpétiques, peuvent faire évoluer certains ulcères infectieux sur le mode chronique. Les infections de la surface oculaire ont été traitées précédemment dans cet ouvrage, mais il faut bien garder à l’esprit que les prélèvements microbiologiques sont nécessaires au moindre doute devant un ulcère cornéen chronique suspect ou atypique car il est parfois difficile de faire la part des choses avec une infection ou une surinfection à l’examen clinique, d’autant plus si le patient a déjà reçu un certain nombre de traitements.
La démarche diagnostique devant un ulcère chronique de la cornée nécessite la recherche à l’examen clinique de certains éléments clés. La première donnée de l’examen clinique est d’évaluer la sensibilité cornéenne. Ainsi un ulcère non ou peu douloureux fera évoquer d’emblée un ulcère cornéen trophique. À l’inverse, un ulcère douloureux associé à une photophobie intense fera d’emblée évoquer un ulcère d’origine inflammatoire ou infectieuse, pour lequel il est ensuite nécessaire d’évaluer sa localisation : paracentrale, centrale ou périphérique ; les ulcères périphériques étant quasi toujours d’origine inflammatoire. La démarche diagnostique est résumée dans la figure 8-1. Il faut cependant rester prudent sur ces règles d’orientation initiale car certaines atteintes cornéennes en particulier herpétiques peuvent être extrêmement trompeuses.
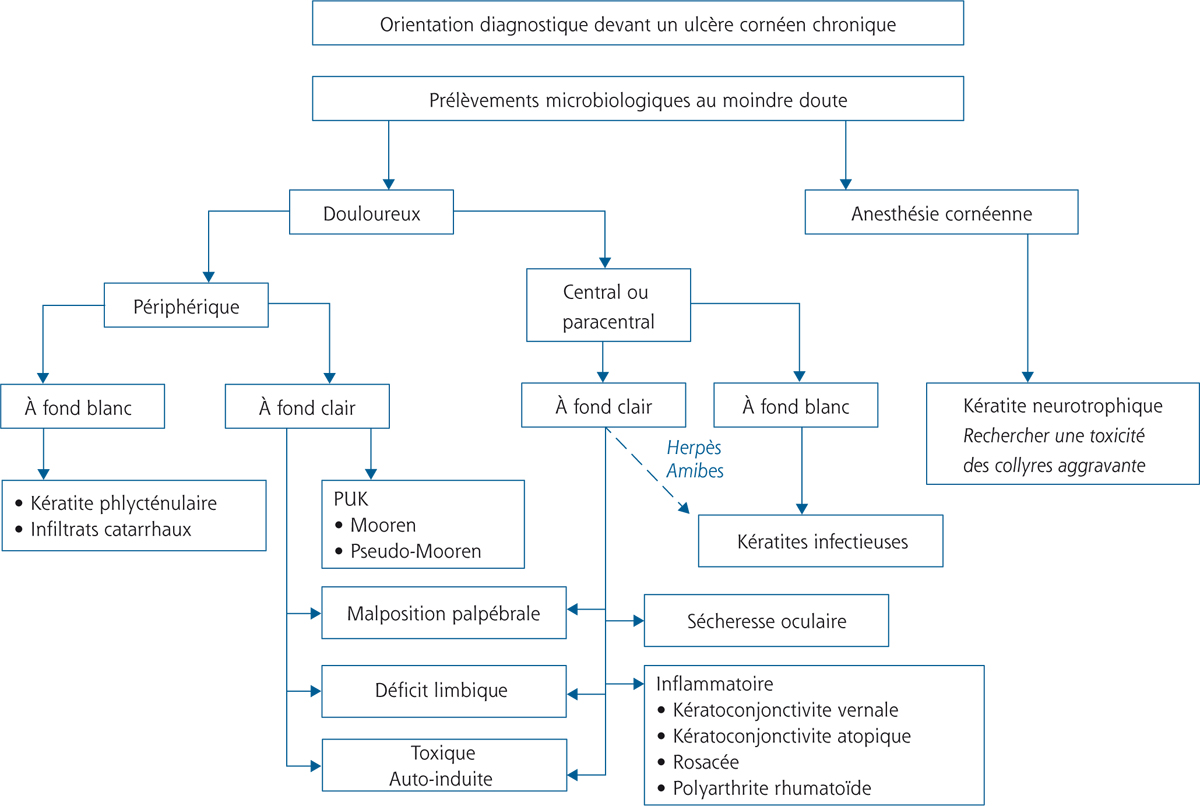
Fig. 8-1 Démarche diagnostique devant un ulcère chronique de la cornée.
PUK : peripheral ulcerative keratitis.
En cas d’anesthésie cornéenne et d’ulcère ou d’ulcération chronique de la cornée, il faudra donc évoquer une kératite neurotrophique. La kératite neurotrophique est une atteinte dégénérative chronique de l’épithélium cornéen caractérisée par un retard de cicatrisation épithéliale lié à la diminution de la sensibilité cornéenne. La survenue d’un ulcère trophique cornéen est une pathologie relativement rare qui nécessite un traitement rapide et agressif. La présentation clinique initiale est caractérisée par une perte du reflet habituel cornéen et un film lacrymal altéré. Même en l’absence de traumatisme, cet état initial peut évoluer vers une kératite ponctuée superficielle, puis l’ulcération épithéliale, puis l’ulcère stromal et finalement la perforation cornéenne. La détection d’une kératopathie neurotrophique est donc capitale devant toute kératopathie ou ulcère en testant la sensibilité cornéenne.
La cornée est densément innervée par des fibres de la branche ophtalmique du nerf trijumeau et les fibres nerveuses sympathiques du ganglion cervical supérieur. L’importance de la Ve paire crânienne dans la trophicité du globe oculaire est connue depuis longtemps. En effet, c’est en 1954 que le rôle propre de l’innervation sensitive sur le maintien d’un épithélium cornéen de bonne qualité a été identifié car auparavant il était admis que seul le syndrome sec était responsable de l’atteinte de l’épithélium cornéen. L’expérience menée sur des rats a permis d’obtenir une kératopathie après section du nerf V malgré une tarsorraphie [1]. Ainsi, la perte des neurones sensitifs semble conduire à un appauvrissement en facteurs trophiques. Par ailleurs, Cavanagh et al. ont avancé que la prolifération de l’épithélium cornéen est sous contrôle antagoniste de l’innervation sympathique et de l’innervation sensitive [2]. Ainsi, lorsqu’une anesthésie cornéenne est induite chez des animaux, les conséquences sur l’épithélium sont amoindries par une dénervation sympathique homolatérale [3]. On peut également rajouter que la substance P, neuropeptide présent dans la cornée, est diminuée significativement après une dénervation sensorielle. Sa déplétion chez l’animal par de la capsaïcine provoque un tableau clinique de kératite neurotrophique [4]. Une meilleure compréhension des différentes cytokines impliquées devrait permettre le développement de traitements spécifiques.
L’hypoesthésie ou l’anesthésie cornéenne entraîne une cascade d’événements aboutissant à un véritable cercle vicieux d’aggravation. Ainsi le film lacrymal se trouve altéré par une diminution de la sécrétion lacrymale, une augmentation de sa viscosité et une diminution du réflexe du clignement. Les cellules épithéliales cornéennes perdent leurs microvillosités entraînant un défaut d’adhésion du film lacrymal et la régénération cellulaire est ralentie, avec la survenue possible d’une ulcération épithéliale. Si celle-ci n’est pas résolutive ou si elle est aggravée par différents traitements locaux, elle peut conduire à une souffrance du stroma.
En effet, les ulcérations stromales cornéennes sont la conséquence d’un défaut de cicatrisation épithéliale, car le stroma reste alors exposé. Au cours d’une ulcération épithéliale chronique, l’équilibre entre synthèse et dégradation de la matrice extracellulaire, mis en place lors du processus physiologique de cicatrisation, est rompu au profit de la lyse stromale. L’élément essentiel est ainsi la surexpression des métalloprotéinases matricielles par les polynucléaires neutrophiles recrutés, les cellules épithéliales blessées et les kératocytes activés. Il s’agit de protéines qui dégradent la matrice extracellulaire et les composants de la membrane basale, ce qui peut provoquer un amincissement du stroma cornéen jusqu’à une possible perforation [5].
La sensibilité cornéenne peut être affectée par des causes locales ou générales. La cause la plus fréquente d’hypoesthésie ou d’anesthésie cornéennes est représentée par les séquelles d’infections cornéennes herpétiques ou zostériennes [6]. Ensuite viennent les lésions tumorales ou post-chirurgicales de la Ve paire crânienne (fig. 8-2). Les causes possibles sont résumées dans l’encadré 8-1 [7].
• Infections : virus de la varicelle et du zona, herpes simplex virus, lèpre
• Paralysie de la Ve paire crânienne : anévrismes ; paralysie post-traumatique, post-chirurgicale, tumorale, congénitale ou héréditaire
• Brûlures chimiques
• Médicaments : abus d’anesthésiques locaux, collyre, AINS
• Étiologies postopératoires ophtalmologiques :
▪ traumatismes chirurgicaux ou par laser des nerfs ciliaires (comme après chirurgies vitréorétiniennes ou photocoagulation rétinienne)
▪ laser in situ keratomileusis (Lasik), etc.
• Diabète, déficit en vitamine A
• Toute inflammation ou tout traumatisme chronique de l’épithélium cornéen
Environ un tiers des patients présentent une diminution de la sensibilité cornéenne 1 an après un épisode de zona ophtalmique [8]. L’utilisation de certains collyres est responsable d’une diminution de la sensibilité cornéenne, en particulier les anti-inflammatoires non stéroïdiens ou AINS (fig. 8-3) [9, 10].
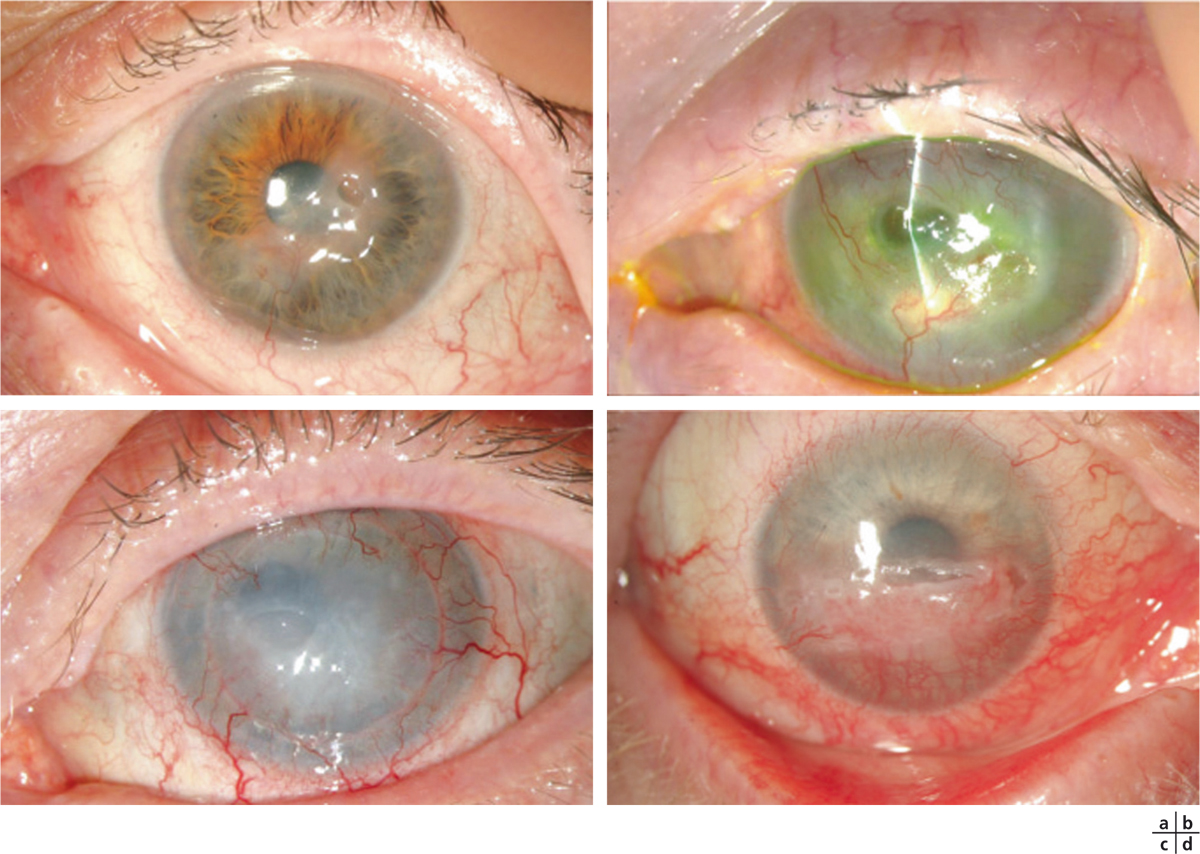
Fig. 8-2 Ulcères neurotrophiques.
a, b. Post-infection herpétique. c. Après kératoplastie transfixiante. d. À la suite de la cure chirurgicale d’un anévrisme intracrânien.
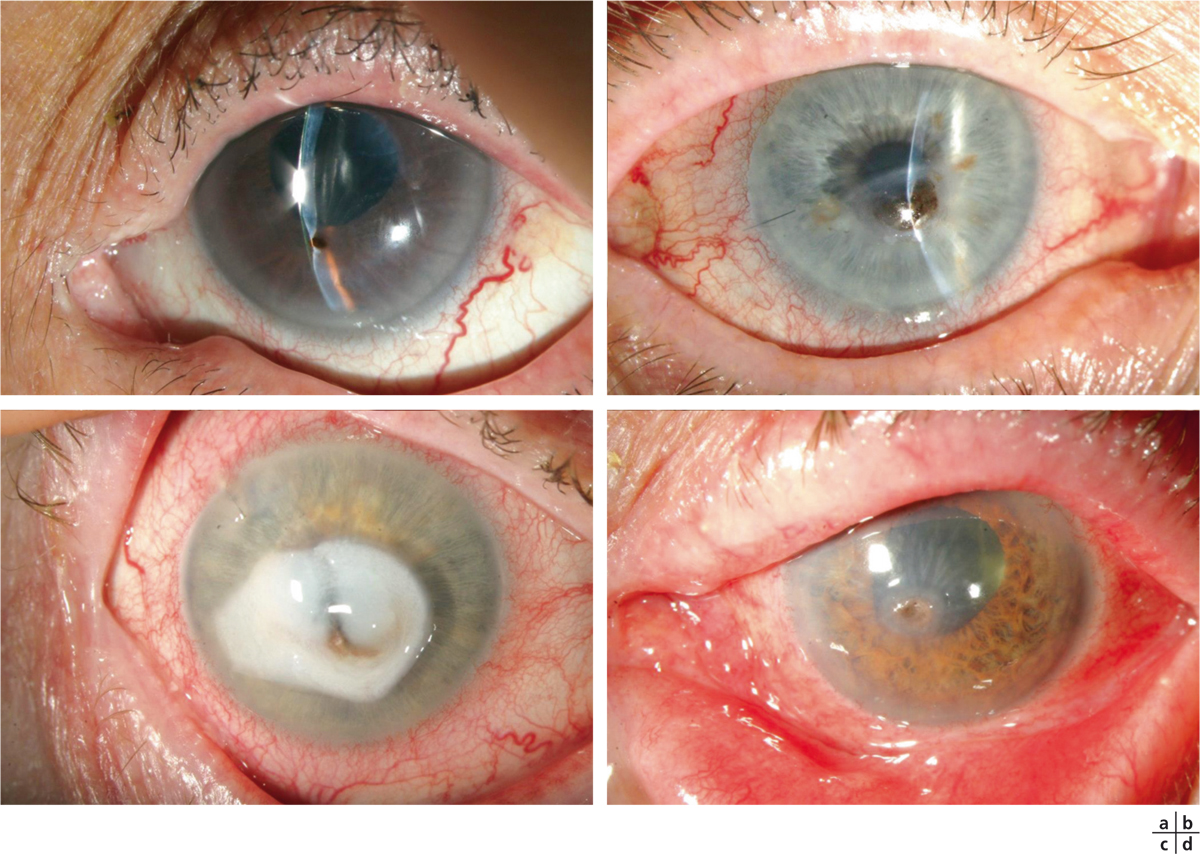
Fig. 8-3 Perforation cornéenne sur ulcère de cornée neurotrophique à la suite de l’utilisation de collyres anti-inflammatoires non stéroïdiens.
a-c. Post-phacoexérèse. d. Post-capsulotomie au laser Nd:YAG dans un contexte de syndrome de Gougerot-Sjögren.
Les signes fonctionnels de la kératite neurotrophique associent une baisse de l’acuité visuelle, une hyperhémie conjonctivale modérée, un larmoiement et une douleur absente ou modérée. Le tableau clinique débute par une instabilité du film lacrymal et une irrégularité de la surface épithéliale, puis s’installe une kératite ponctuée superficielle. Ensuite, l’ulcération épithéliale apparaît, caractérisée par sa forme ovalaire, au niveau de la moitié inférieure de la cornée avec des bords qui s’enroulent avec le temps. Elle est parfois compliquée d’un œdème stromal et d’un effet Tyndall cellulaire et protéique en chambre antérieure. Enfin l’ulcère stromal survient. La kératite neurotrophique évolue selon trois stades cliniques de gravité croissante décrits par Mackie et al. (encadré 8-2) [6].
Stade 1
• Hyperhémie conjonctivale
• Diminution de temps de rupture du film lacrymal ou break-up time (BUT)
• Kératite ponctuée superficielle à la fluorescéine
Stade 2
• Ulcération épithéliale persistante à bords arrondis ou ovalaires
• Kératite entourée d’une zone de fragilité épithéliale
• Œdème stromal
• Tyndall cellulaire et protéique en chambre antérieure
• Épaississement des bords de l’ulcère qui peuvent s’enrouler
Stade 3
• Lyse stromale
• Perforation possible
Une néovascularisation cornéenne peut survenir en cas de non-cicatrisation (fig. 8-4).
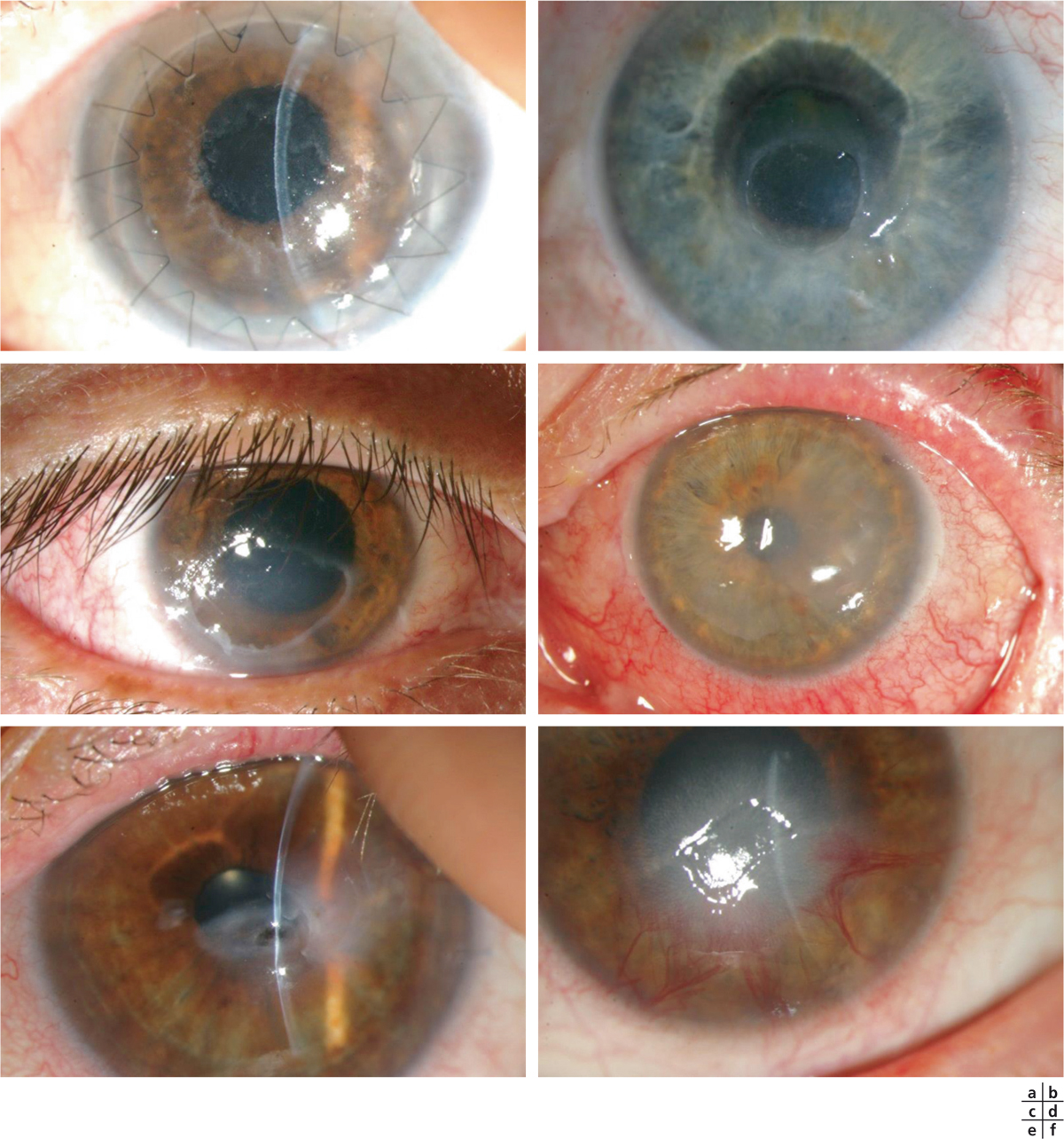
Fig. 8-4 Stades cliniques de la kératite neurotrophique.
a, b. Ulcération épithéliale. c. Forme caractéristique ovalaire, au niveau de la moitié inférieure de la cornée et avec ses bords qui s’enroulent avec le temps. d. Forme compliquée d’un œdème stromal. e. Ulcère stromal. f. Néovascularisation cornéenne possible au stade tardif.
Il n’existe pas de système largement diffusé pour tester la sensibilité cornéenne. Elle peut être testée par des méthodes contact ou non-contact. L’esthésiomètre de Cochet-Bonnet, instrument de référence, permet une mesure quantitative avec un fil de Nylon de longueur comprise entre 0 et 6 cm appliqué sur la surface cornéenne. Plus la sensibilité retrouvée est importante avec un fil de Nylon long, meilleure elle est, car la force appliquée est alors plus faible. À l’inverse, plus le fil de Nylon est raccourci, plus la force appliquée sur la surface cornéenne est importante et donc plus le niveau de sensibilité requis pour pouvoir la distinguer est faible [11]. Cependant, le plus souvent la sensibilité cornéenne est évaluée par l’étude bilatérale du ressenti du patient en touchant sa cornée avec un morceau de coton, même s’il ne s’agit que d’une étude qualitative. Deux autres systèmes ont été décrits ; l’un utilisant une projection d’air et l’autre une projection majoritairement constitué de dioxyde de carbone. Les esthésiomètres non-contact stimulent les nerfs cornéens par des jets de gaz à une pression calibrée en puissance et en durée. Le patient, positionné à la lampe à fente, indique oralement si le stimulus est ressenti ou non. Il semble difficile de comparer l’esthésiomètre de Cochet-Bonnet avec les esthésiomètres non-contact car les deux méthodes semblent tester des fibres nerveuses différentes [12].
La microscopie confocale in vivo permet une analyse des structures cornéennes à un niveau cellulaire, incluant les nerfs cornéens sous-épithéliaux et stromaux. Elle met en évidence une diminution significative du nombre total et de la densité des nerfs sous-épithéliaux en cas de kératite herpétique, et ceci de manière corrélée à la perte de sensibilité clinique. Celle-ci s’accompagne d’une augmentation de la taille des cellules épithéliales et d’une métaplasie squameuse [13]. Plus récemment, la microscopie confocale, réalisée chez des patients atteints de déficit de la Ve paire crânienne suite à une chirurgie, a permis de retrouver également une perte de la densité des cellules endothéliales cornéennes ainsi qu’une augmentation des kératocytes hyper-réflectifs par rapport à l’œil adelphe considéré comme témoin. Cette étude suggère donc que l’innervation cornéenne jouerait également un rôle dans l’homéostasie de l’endothélium cornéen [14]. Par ailleurs, la microscopie confocale permet d’identifier des éléments fongiques ou des kystes amibiens lorsque le diagnostic différentiel est difficile avec une infection bactérienne, fongique, virale ou amibienne. Cependant, la mauvaise reproductibilité de cet examen limite encore son utilisation.
Enfin, le test de Schirmer et les empreintes conjonctivales peuvent aider pour le diagnostic différentiel même si une insuffisance limbique et un syndrome sec oculaire peuvent être secondaires à une kératopathie neurotrophique [15].
Le traitement habituel des ulcères neurotrophiques s’avère souvent difficile. La priorité est l’éviction de tout collyre toxique pour la surface oculaire : collyres avec conservateurs, AINS en collyre et pommades ou collyres antiviraux et/ou antibiotiques. Les anomalies palpébrales associées telles qu’un entropion, un ectropion, un trichiasis ou une lagophtalmie doivent être également corrigées. Les autres pathologies de la surface oculaire (insuffisance limbique, syndrome sec sévère, etc.) doivent être recherchées et traitées, car elles sont susceptibles d’aggraver le pronostic de l’atteinte trophique.
Il n’existe pas à l’heure actuelle de traitement spécifique de la kératite neurotrophique. Quel que soit le stade de gravité, les agents lubrifiants sans conservateurs sont nécessaires. Au besoin, un collyre antiseptique sans conservateurs, plutôt qu’un collyre antibiotique, peut être ajouté. Pour certains, l’utilisation de clous méatiques peut être utile. Les corticoïdes par voie locale sont généralement à proscrire car ils ralentissent la cicatrisation cornéenne et augmentent le risque d’infection [15]. Les tétracyclines par voie systémique pourraient être utiles grâce à leurs propriétés antimétalloprotéinases. Elles pourraient ainsi retarder la fonte stromale et favoriser la cicatrisation épithéliale.
Le traitement non médical des kératites neurotrophiques s’appuie sur différentes stratégies. Selon l’évolution, une lentille souple à visée thérapeutique en port continu peut être proposée. Il semble également que dans cette indication l’adaptation d’un verre scléral puisse permettre une cicatrisation sur certains ulcères réfractaires (fig. 8-5 et 8-6). Le verre scléral est une lentille de grand diamètre qui prend uniquement appui sur la conjonctive sclérale et non sur le limbe et sur la cornée devant lesquels il passe en pont. Son intérêt est à la fois réfractif, car il permet de gommer l’astigmatisme irrégulier, et « trophique » en offrant une protection mécanique contre l’irritation des cils et des paupières et en maintenant un réservoir liquidien permanent devant la cornée. L’efficacité de l’adaptation des verres scléraux en port continu en cas d’ulcères chroniques cornéens a été récemment analysée [16, 17]. Parmi neuf patients, quatre présentaient un ulcère d’origine trophique et tous ont cicatrisé dans le mois suivant la mise en place de la lentille sclérale. Cependant dans cette étude, le taux de récidive après le retrait du verre était important chez huit patients sur neuf. L’avantage des verres scléraux dans cette indication par rapport aux lentilles souples serait l’absence de mouvement lors des clignements et de transmission des frictions liées aux paupières [17]. La tarsorraphie ou les injections de toxine botulique peuvent permettre de passer un cap en cas de malocclusion associée.
Au stade d’ulcère stromal, la préservation de l’intégrité du globe oculaire prévaut sur la réhabilitation de la fonction visuelle. La greffe de membrane amniotique est parfois nécessaire dans les ulcères réfractaires ou en cas d’ulcères pré- ou perforatifs d’emblée. Elle est utilisée le plus souvent suturée parfois collée dans le fond de l’ulcère en une ou plusieurs couches. Elle possède des propriétés anti-inflammatoires, procicatrisantes et fournit également un support physique qui facilite la migration des cellules des berges de l’ulcère (fig. 8-7). En cas d’échec, le recouvrement conjonctival partiel ou total peut parfois s’avérer nécessaire pour préserver anatomiquement le globe oculaire (fig. 8-8) [18]. Les colles cyanoacrylate ou biologique type colle de fibrine sont parfois utilisées pour les perforations de très petite taille [19]. La greffe de cornée lamellaire ou transfixiante à chaud dite « bouchon » est utilisée en dernier recours dans les perforations de grand diamètre associée ou non à un recouvrement conjonctival.
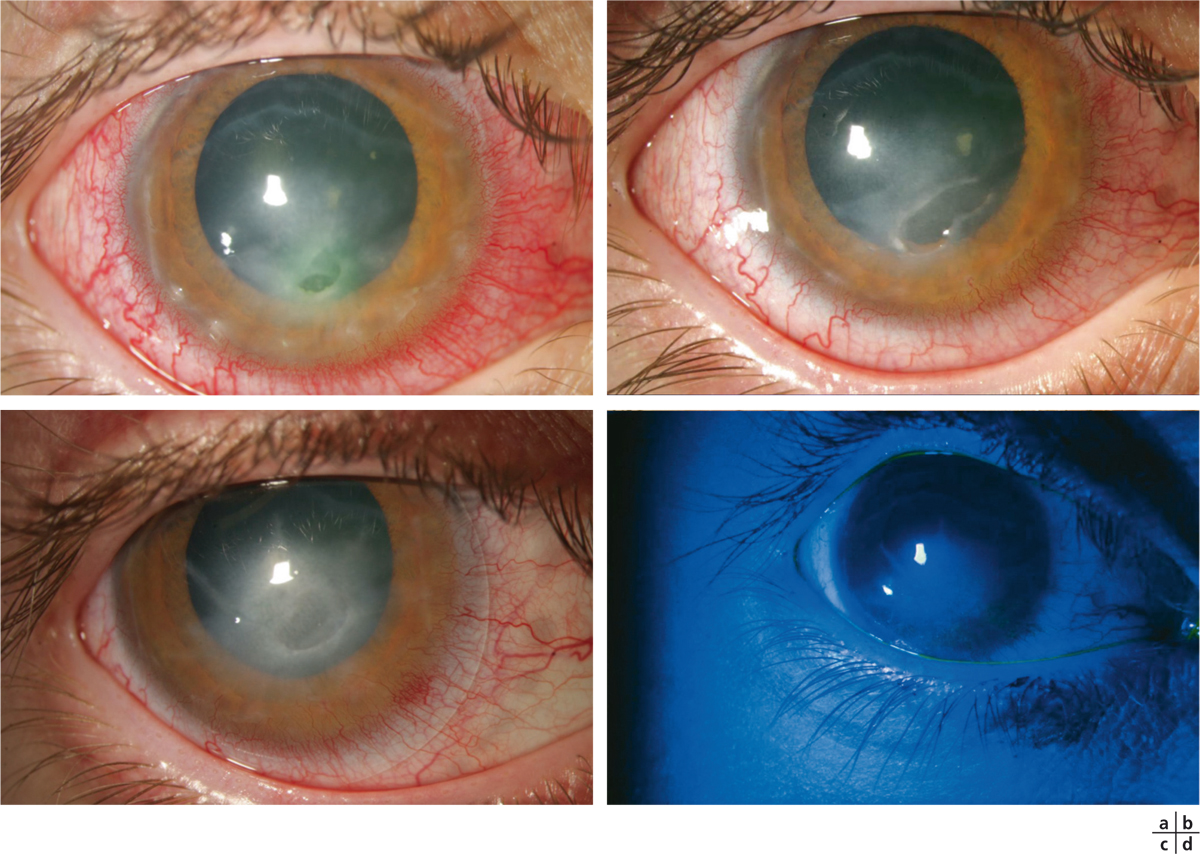
Fig. 8-5 Apport du verre scléral dans la prise en charge des ulcères neurotrophiques.
a. Ulcère neurotrophique post-cyclo-affaiblissement. b. Échec du collyre au RGTA et d’une greffe de membrane amniotique « en patch » puis en greffe. c. Cicatrisation en 2 mois après adaptation par un verre scléral. d. Aspect après instillation de fluorescéine.
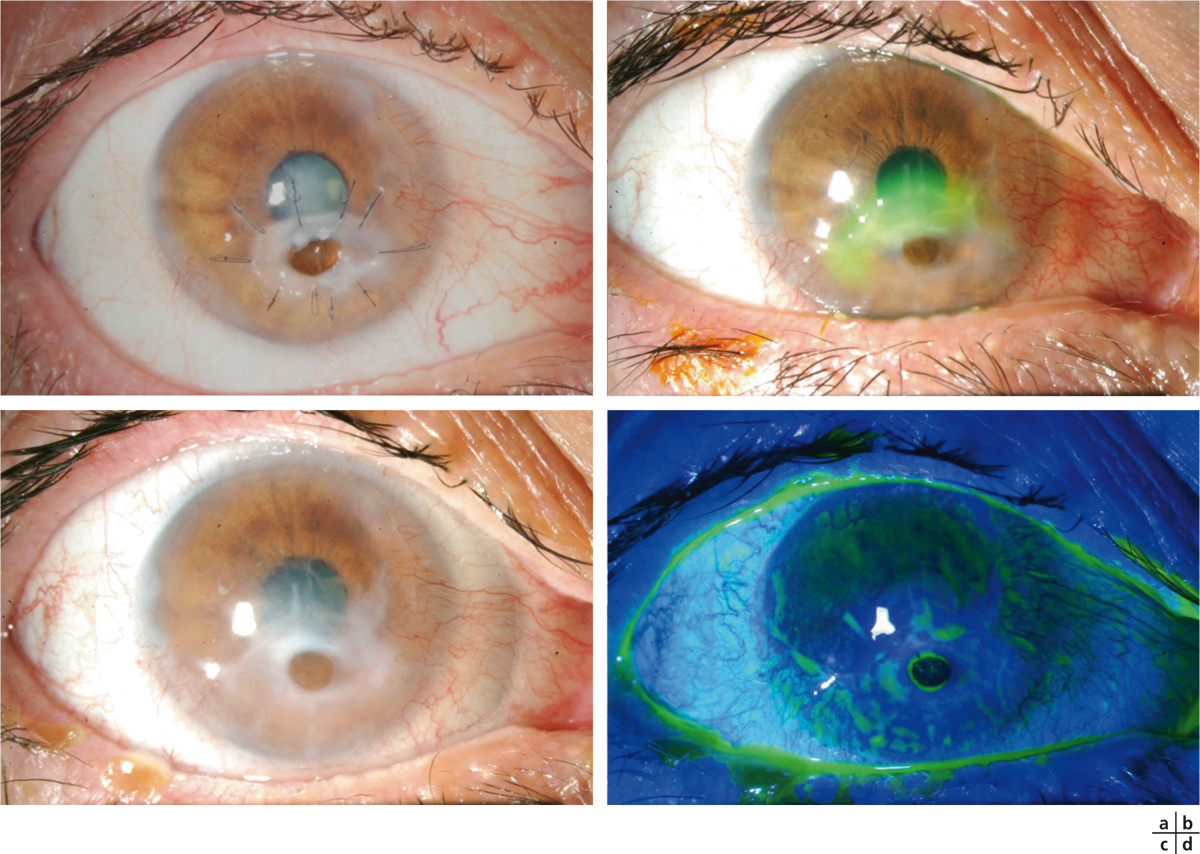
Fig. 8-6 Apport du verre scléral dans la prise en charge des ulcères neurotrophiques.
a. Échec de la prise en charge thérapeutique d’un ulcère neurotrophique par collyre au RGTA, lentille souple, deux greffes de membranes amniotiques. b. Récidive d’un ulcère en supérieur du descemétocèle. c. Évolution favorable après 10 jours de la pose d’un verre scléral. d. Aspect après instillation de fluorescéine.
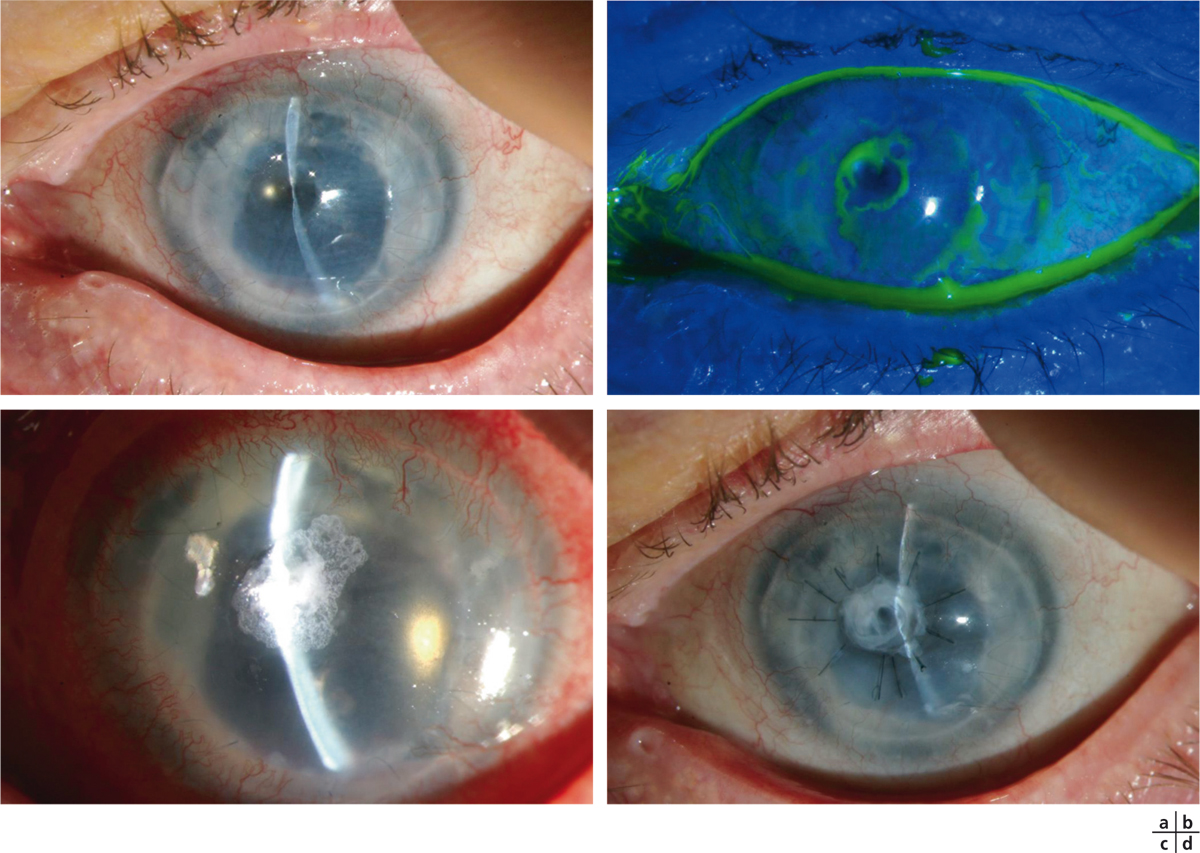
Fig. 8-7 Greffe de membrane amniotique et prise en charge des ulcères neurotrophiques.
a, b. Ulcère neurotrophique perforé après kératoplastie transfixiante. c. Mise en place d’un point de colle de cyanoacrylate, avec récidive précoce. d. Évolution favorable après greffe de membrane amniotique en multicouches.
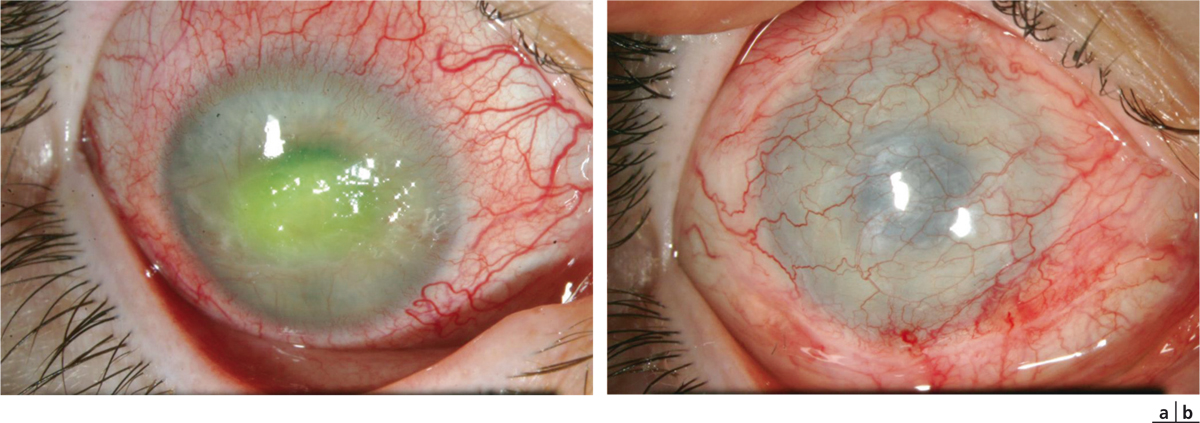
Fig. 8-8 Recouvrement conjonctival et prise en charge des ulcères neurotrophiques.
a. Ulcère neurotrophique après chirurgie intracrânienne résistant après greffe de membrane amniotique. b. Préservation anatomique du globe après recouvrement conjonctival complet, aspect postopératoire à 2 mois.
La kératite neurotrophique fait partie des pathologies ophtalmologiques les plus difficiles à traiter en l’absence de traitement spécifique. Son pronostic dépend de la cause sous-jacente, de la profondeur de l’hypoesthésie ou de l’anesthésie ainsi que de l’existence de pathologies associées de la surface oculaire (comme une sécheresse oculaire ou une lagophtalmie). Il est admis que plus le déficit sensitif est profond, plus le risque de développer une kératite neurotrophique sévère est important [8]. Le traitement d’un ulcère neurotrophique doit être conservateur et une éventuelle greffe de cornée à visée de réhabilitation de la transparence cornéenne doit être évitée sous peine de voir réapparaître le trouble trophique au niveau du greffon engendrant des retards de cicatrisation qui peuvent aboutir à une perforation cornéenne.
De nouveaux traitements médicaux et chirurgicaux ont été avancés pour la prise en charge des kératites neurotrophiques. Ainsi, il a été proposé un transfert nerveux à partir des nerfs controlatéraux dans les atteintes unilatérales [20]. Les autres approches thérapeutiques consistent à essayer d’apporter des facteurs de croissance ou certains neuromédiateurs déficients ou procicatrisants ou bien d’améliorer le micro-environnement cellulaire. Certains de ces traitements sont déjà utilisés, d’autres sont encore au stade de la recherche clinique.
En ce qui concerne la stratégie d’apport de facteurs de croissance des cytokines ou des neuromédiateurs, le collyre au sérum autologue existe déjà, riche en facteurs de croissance et en inhibiteurs de protéases. Il semble efficace dans la prise en charge des kératites neurotrophiques [21] ; cependant, la réglementation contraignante ne le rend disponible que dans certains centres. Le collyre au sérum du sang de cordon semble également efficace et semble contenir plus de cytokines que le collyre au sérum autologue. Il a permis une cicatrisation complète chez 28 patients [22]. L’utilisation locale d’un lysat de plaquettes sanguines humaines sur des ulcères ou ulcérations cornéennes chroniques dont des kératites neurotrophiques a donné des résultats encourageants [23].
Un collyre contenant un tétrapeptide dérivé de la substance P et de l’IGF-1 (insulin-like growth factor-1) a été testé chez 25 patients atteints d’une kératite neurotrophique dans une étude ouverte ; la cicatrisation épithéliale a été obtenue chez 73 % des patients à 4 semaines [24]. Ce même tétrapeptide dérivé de la substance P associé à l’IGF-1 a été utilisé pour traiter 11 patients avec une cicatrisation complète dans 89 % des cas à 1 mois [25].
L’administration en collyre de NGF (nerve growth factor) semble également efficace. En effet, cette molécule avait donné beaucoup d’espoirs après deux publications démontrant une efficacité remarquable sur les ulcères cornéens neurotrophiques. Dans ces deux études ouvertes non contrôlées, la cicatrisation épithéliale a été obtenue chez 100 % des 55 patients après un délai de 12 jours et 6 semaines. L’intensité de l’opacité cornéenne diminuait également et il existait une augmentation de l’acuité visuelle. Pour la plupart des patients, il existait aussi une restauration de la sensibilité cornéenne [26, 27]. Cependant, son développement a probablement pris du retard du fait de l’origine murine de cette protéine. Récemment, le collyre au NGF recombinant humain, c’est-à-dire produit par génie génétique, a été mis au point pour une utilisation clinique. Une étude de phase 1 a permis de montrer sa bonne tolérance [28]. Actuellement un essai multicentrique européen testant son efficacité est en cours1.
En ce qui concerne l’approche qui consiste à améliorer le micro-environnement cellulaire, la « thérapie matricielle » est en cours d’évaluation (fig. 8-9 et 8.10). Le Cacicol® (RGTA en collyre du laboratoire Théa) pourrait être efficace dans le traitement de l’ulcère neurotrophique en se substituant aux héparanes sulfates de la matrice extracellulaire dégradée [29]. Il reconstituerait alors le micro-environnement cellulaire et protégerait les facteurs de croissance au sein de l’épithélium lésé [30]. Une étude pilote prospective, non contrôlée a été menée sur onze yeux de onze patients, présentant un ulcère trophique persistant. La cicatrisation a été obtenue chez huit patients avec des délais variables. Trois échecs thérapeutiques ont été constatés ayant nécessité une greffe de membrane amniotique (deux patients) et une greffe de cornée à chaud (un patient) [31]. Une étude multicentrique randomisée contre placebo européenne est actuellement en cours dans cette indication pour essayer de confirmer ces premiers résultats. Bien qu’il n’existe pas de conduite à tenir codifiée pour le traitement de l’ulcère de cornée trophique, un schéma thérapeutique est proposé dans la figure 8-11.
En résumé. Le diagnostic et la prise en charge des kératites neurotrophiques constituent un véritable défi pour les ophtalmologistes. Devant tout ulcère cornéen chronique, la sensibilité cornéenne doit être testée. Les traitements actuels médicaux ou chirurgicaux visent à améliorer la cicatrisation épithéliale, à freiner l’évolution et à empêcher les complications éventuelles. Des données d’études expérimentales et cliniques « pilotes » semblent montrer que certaines molécules comme certains facteurs de croissance ou certaines molécules du microenvironnement puissent améliorer le pronostic de ces kératites. Des essais cliniques sont actuellement en cours pour essayer de confirmer ces premiers résultats encourageants.

Fig. 8-9 Apport du collyre au RGTA dans la prise en charge des ulcères neurotrophiques.
a, b. Ulcère neurotrophique à la suite d’un zona de la Ve paire crânienne ne cicatrisant pas malgré les collyres mouillants. c, d. Évolution favorable après 3 semaines d’un traitement par collyre au RGTA. e, f. Cicatrisation complète après 6 semaines d’un traitement par collyre au RGTA.
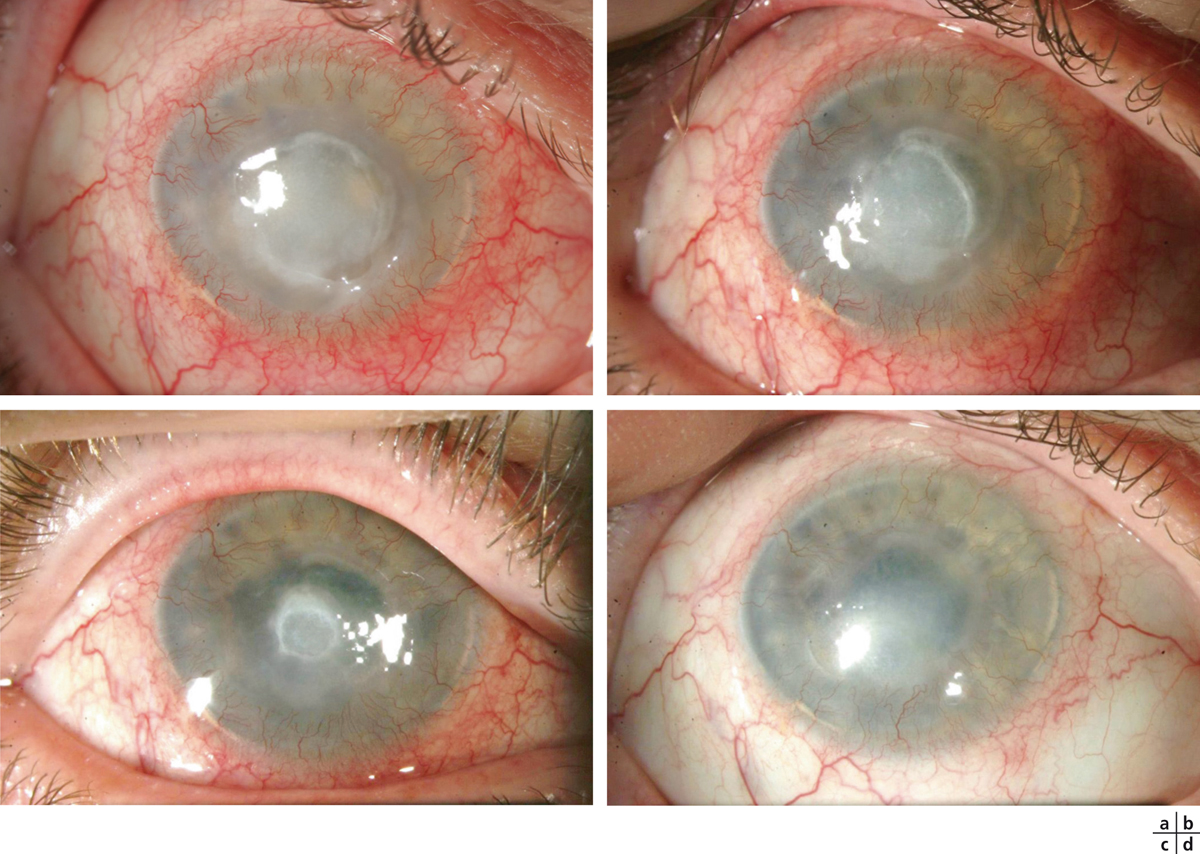
Fig. 8-10 Apport du collyre au RGTA dans la prise en charge des ulcères neurotrophiques.
a. Ulcère neurotrophique post-infectieux sur un œil non fonctionnel multi-opéré chez une patiente diabétique. Absence de cicatrisation malgré l’arrêt des collyres antibiotiques et l’instillation de collyres mouillants sans conservateurs depuis 1 mois. b, c. Évolution favorable après le début du traitement par collyre au RGTA. d. Cicatrisation complète obtenue après 6 semaines de traitement.
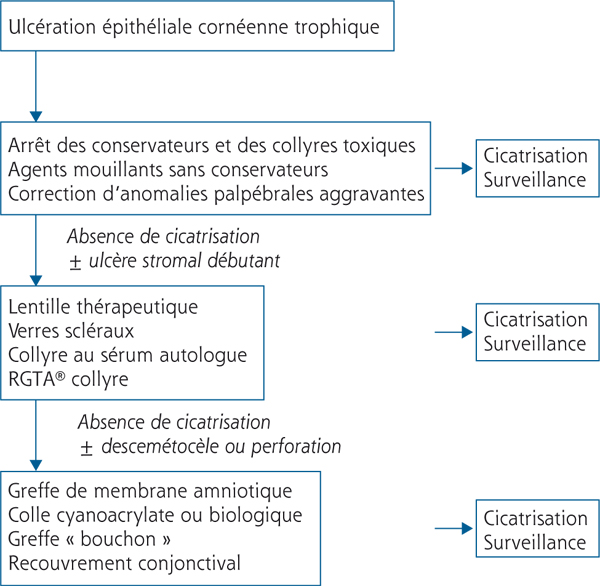
Fig. 8-11 Schéma thérapeutique proposé pour la prise en charge d’un ulcère neurotrophique.
Les ulcères cornéens inflammatoires ont pour point commun une origine immunitaire à l’inflammation causale. Il s’agit d’ulcères stériles même s’ils peuvent être, très rarement, déclenchés par un agent infectieux. Le diagnostic positif repose essentiellement sur l’aspect clinique de l’ulcère cornéen, l’aspect de la conjonctive et des paupières adjacentes et enfin d’un éventuel contexte clinique plus général. Le diagnostic sera parfois aidé par des explorations paracliniques. Deux grands types d’ulcères peuvent être distingués : ceux qui se produisent au niveau de la cornée centrale ou paracentrale et ceux qui sont localisés au niveau de la cornée périphérique. La localisation limbique d’un ulcère est ainsi très évocatrice d’une cause inflammatoire.
Le limbe cornéen constitue une entité propice aux inflammations. En effet, la périphérie cornéenne présente des caractéristiques morphologiques et immunologiques prédisposant aux réactions immunitaires inflammatoires. Ainsi, à l’opposé de la cornée centrale qui est totalement avasculaire, le limbe est en contact direct avec les capillaires qui le pénètrent sur une longueur de 0,5 mm. Cette architecture vasculaire du limbe est ainsi propice à l’accumulation d’immunoglobulines et donc d’immuns complexes. Le dépôt de ces derniers va activer la voie classique du complément jusqu’au complexe d’attaque membranaire et parallèlement recruter les cellules inflammatoires que sont les polynucléaires neutrophiles et les macrophages vers la périphérie cornéenne. Ces cellules vont alors libérer des collagénases qui vont ainsi progressivement lyser le stroma limbique et cornéen périphérique. La libération d’interleukine-1 par les cellules inflammatoires va également favoriser la synthèse de métalloprotéinases par les kératocytes stromaux activés et amplifier le processus de destruction locale. La richesse des capillaires sanguins et lymphatiques va permettre à l’ensemble des acteurs cellulaires de l’inflammation et de l’immunité d’accéder à la zone, d’où l’augmentation de l’inflammation d’origine immunitaire. Il semble également que la conjonctive adjacente puisse jouer un rôle de réservoir pour les cellules de l’inflammation et les cytokines pro-inflammatoires d’où une aggravation supplémentaire de l’inflammation [32].
Ils correspondent aux ulcères marginaux le plus souvent auto-immuns et sont connus dans la littérature anglo-saxonne sous le terme de peripheral ulcerative keratitis (PUK). Les patients présentent un tableau bruyant avec un œil rouge, larmoyant, une photophobie et souvent une baisse d’acuité visuelle avancée en raison de la déformation cornéenne ou d’un début d’opacité. Le tableau clinique débute par une discrète opacité adjacente au limbe causée par l’infiltrat cellulaire stromal (fig. 8-12). Par la suite, l’ulcère apparaît et prend la forme d’un croissant parallèle au limbe, creusant la cornée périphérique, plus ou moins associé à une néovascularisation, avec ou sans espace clair avec le limbe (fig. 8-13). Il est le plus souvent adjacent à une inflammation conjonctivale, épisclérale et sclérale en regard. À ce stade, il peut exister un certain degré d’infiltrat stromal. L’hypopion est rare en dehors des cas de surinfection (fig. 8-14). Les ulcères auto-immuns sont associés à une sclérite dans 10 à 30 % des cas [33, 34]. Ils sont bilatéraux dans près de 40 % des cas [35]. Le diagnostic d’ulcère marginal auto-immun doit être posé sans tarder en raison du risque réel de perforation, mais aussi parce qu’il peut être la première manifestation d’une maladie systémique grave jusqu’alors inconnue chez le patient.

Fig. 8-12 Ulcère marginal débutant dans un contexte de polyarthrite sous anti-TNF-α et méthotrexate.
a, b. Apparition d’une opacité adjacente au limbe, douloureuse, contemporaine de la réapparition de douleurs articulaires et d’une augmentation de la vitesse de sédimentation. c. Absence d’ulcération épithéliale après instillation de fluorescéine. d. Évolution favorable à 5 jours d’une corticothérapie par voie générale à 1/2 mg/kg/jour.

Fig. 8-13 Ulcères de cornée inflammatoires périphériques.
a. Ulcère dans le cadre d’une polyarthrite rhumatoïde. b. Ulcère dans le cadre d’une maladie de Crohn. c. Ulcère de Mooren.
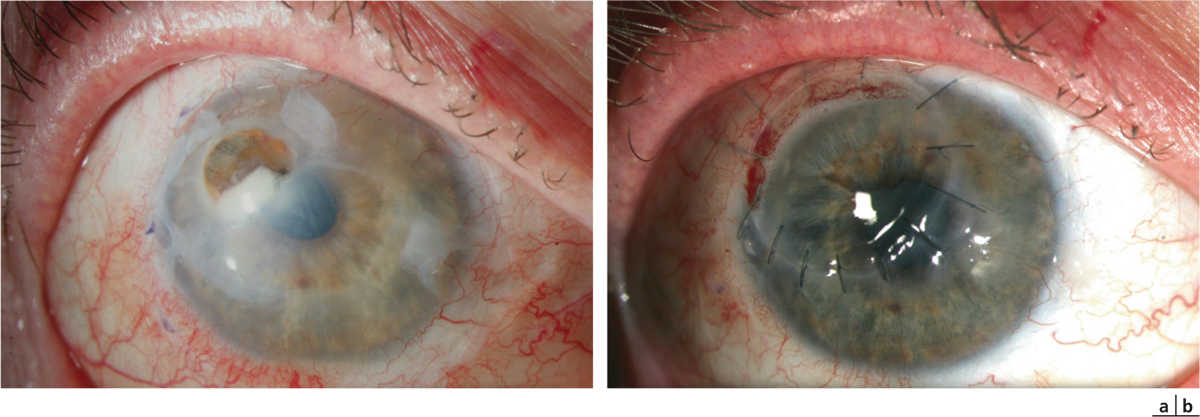
Fig. 8-14 Ulcère marginal associé à un hypopion.
a. Aspect après échec d’une greffe de membrane amniotique et mise en place d’une corticothérapie par voie générale ; noter la lame d’hypopion. b. Aspect à 1 mois après greffe cornéosclérale à visée tectonique, arrêt de la corticothérapie er traitement par voriconazole.
Avant de porter un diagnostic d’ulcère inflammatoire, il est nécessaire d’éliminer les autres étiologies capables d’entraîner un ulcère périphérique de la cornée associé à des néovaisseaux. Ainsi, il faudra éliminer les déficits limbiques (après brûlure chimique par exemple), les cas de kératites infectieuses avec appel néovasculaire, mais également les ulcères trophiques qui finissent souvent par se néovasculariser lorsqu’ils n’évoluent pas vers la perforation. L’examen des paupières permettra de distinguer les malpositions palpébrales et les dysfonctionnements meibomiens sévères.
Les autres diagnostics différentiels sont la dégénérescence marginale de Terrien, les ulcères par effet Dellen qui se développent en regard d’un promontoire conjonctival et les kératites herpétiques marginales qui vont imposer au moindre doute un prélèvement à la recherche du virus par polymerase chain reaction (PCR). La maladie de Terrien peut poser un problème diagnostique. Il s’agit d’une atteinte bilatérale et lentement progressive débutant le plus souvent en périphérie supérieure de la cornée de cause inconnue. Elle touche plus souvent les hommes que les femmes et habituellement entre 20 et 40 ans. Elle s’étend de façon circonférentielle et peut se néovasculariser à la base. Elle est indolore même si parfois elle peut être associée à une épisclérite ou une sclérite responsables d’un inconfort [36]. À l’inverse des ulcères marginaux, l’épithélium est présent au fond de l’amincissement. Il peut exister des dépôts lipidiques (fig. 8-15) et souvent un astigmatisme irrégulier important. Il n’existe pas de traitement spécifique. Les astigmatismes importants sont corrigés par des lentilles rigides ou des verres scléraux.
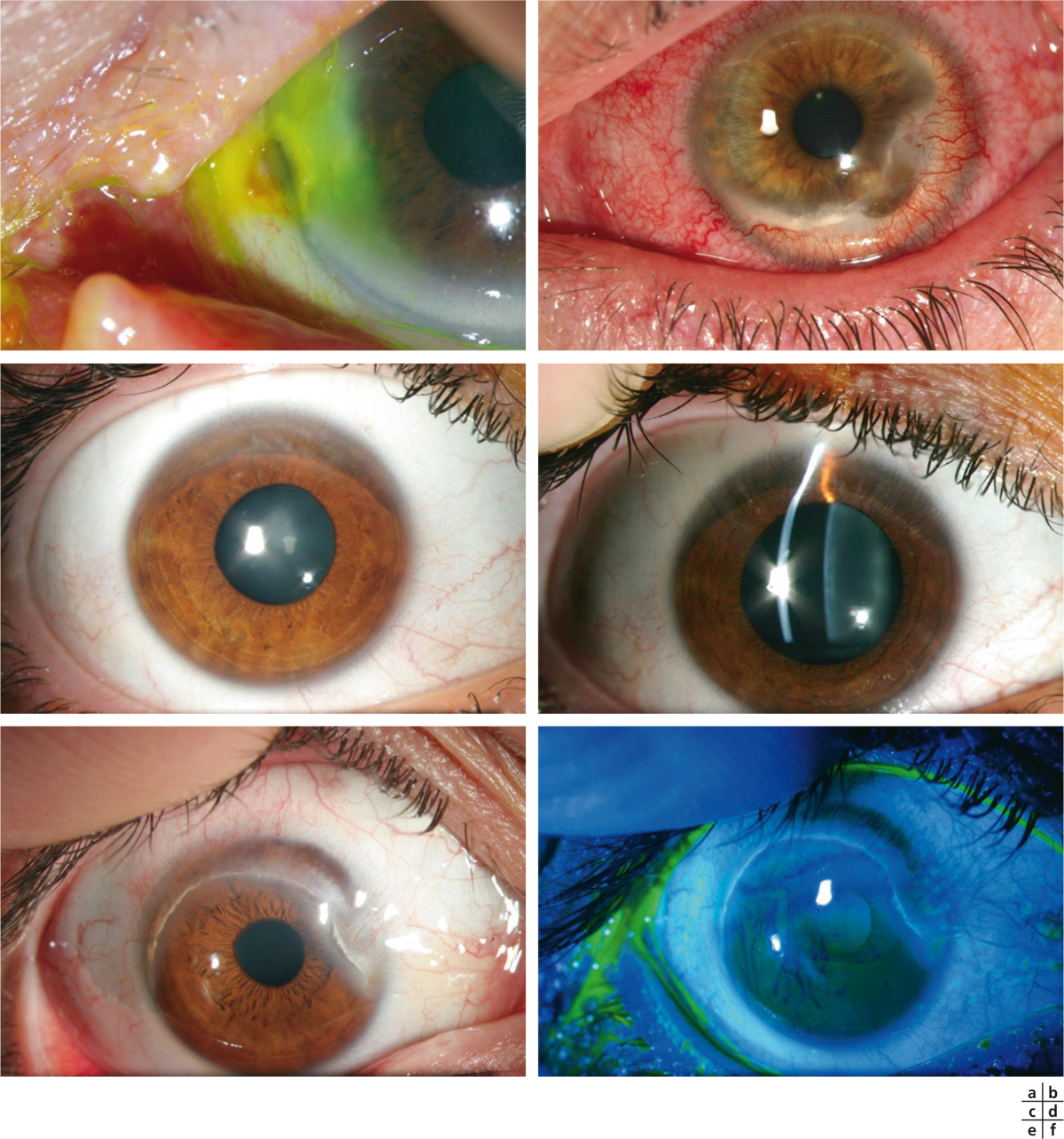
Fig. 8-15 Diagnostics différentiels des ulcères inflammatoires cornéens périphériques.
a. Ulcère par effet Dellen. b. Kératite marginale herpétique. c, d. Maladie de Terrien : noter l’absence d’inflammation de la surface oculaire et l’amincissement supérieur avec néovascularisation au fond. e, f. Maladie de Terrien : noter les dépôts lipidiques, les néovaisseaux cornéens périphériques et la présence de l’épithélium au fond de l’amincissement après instillation de fluorescéine.
La grande majorité des kératites marginales sont liées à un mécanisme auto-immun local ou général, bien que de rares cas soient d’origine infectieuse. Les prélèvements cornéens doivent donc être réalisés au moindre doute. Ainsi, Tauber et al. rapportent qu’un ulcère marginal auto-immun est secondaire à une maladie systémique dans 50 % des cas. Si la pathologie générale est habituellement connue au moment de la survenue de l’ulcère, celle-ci est inconnue dans un quart des cas ce qui renforce l’intérêt d’un examen médical complet, le plus souvent par un médecin interniste. Les examens complémentaires proposés en première intention sont résumés dans l’. Les pathologies le plus fréquemment retrouvées sont avant tout la polyarthrite rhumatoïde avec près de 30 à 40 % des étiologies, puis la maladie de Wegener dont le traitement précoce modifie le pronostic vital de façon très significative. Les autres causes sont résumées dans l’encadré 8-4 [37].
Causes locales non infectieuses
• Cause idiopathique ou ulcère de Mooren
• Rosacée oculaire
• Kératite d’exposition
Causes locales infectieuses
• Bactérienne (Staphylococcus, Streptococcus, Gonococcus)
• Virale (herpes simplex virus ou virus de la varicelle et du zona)
• Parasitaire (Acanthamoeba)
• Fongique
Causes générales non infectieuses
• Connectivites/vascularite :
▪ polyarthrite rhumatoïde
▪ granulomatose de Wegener
▪ périartérite noueuse
▪ polyangéite microscopique
▪ syndrome de Churg et Strauss
▪ polychondrite chronique atrophiante
▪ lupus systémique
▪ sclérodermie
▪ maladie de Behçet
▪ maladie de Horton
• Autres maladies auto-immunes :
▪ maladies inflammatoires chroniques de l’intestin
▪ sarcoïdose
▪ maladie de Gougerot-Sjögren
▪ leucémie
Causes générales infectieuses
• Tuberculose
• Syphilis
• Zona
• Maladie de Lyme
• Hépatite C
• Ascaridioses
En cas de polyarthrite, la localisation cornéenne survient le plus souvent après de longues années d’évolution de la maladie, elle est associée ou non à une sclérite. Une étude rapportait ainsi un délai de près de 17 ans entre le diagnostic de polyarthrite rhumatoïde et la survenue d’ulcère cornéen [38]. À l’inverse, les complications cornéennes sont de survenue beaucoup plus rapide dans l’évolution des autres vascularites systémiques et en particulier la maladie de Wegener [39].
L’absence d’étiologie retrouvée fait poser le diagnostic d’ulcère de Mooren qui est considéré comme une forme idiopathique d’ulcère marginal [40]. Il survient le plus souvent de façon isolée, de manière uni- ou bilatérale. Watson et al. [41] ont classé les ulcères de Mooren en trois tableaux cliniques distincts : le premier est l’ulcère de Mooren unilatéral de la femme plutôt âgée, caucasienne, extrêmement douloureux, de progression rapide mais avec un risque de perforation assez faible et de traitement difficile ; le deuxième est un tableau d’ulcère de Mooren bilatéral, agressif, touchant des hommes jeunes d’origine africaine, indienne ou asiatique. Le risque de perforation y est plus important. Le troisième tableau est celui d’un ulcère de Mooren bilatéral, indolent, touchant les sujets des deux sexes, d’âge moyen, peu agressif et répondant habituellement à la corticothérapie locale. Des facteurs déclenchants ont été décrits dans la littérature, comme les helminthiases ou l’hépatite C chronique active qui interviendraient par un phénomène d’immunité croisée. Classiquement, l’ulcère de Mooren est considéré comme étant plus douloureux qu’un ulcère auto-immun systémique et présente un bord en promontoire du côté cornéen central. Il n’est pas associé à une sclérite (fig. 8-16). Il s’agit d’un diagnostic d’exclusion qui requiert l’élimination des autres pathologies susceptibles d’être à l’origine d’un ulcère cornéen périphérique.
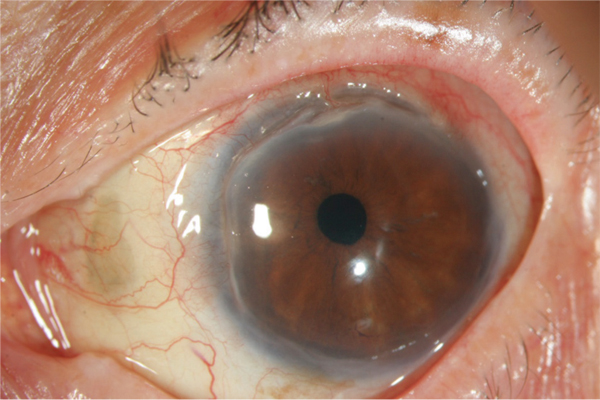
Fig. 8-16 Ulcère de Mooren.
Ulcère en forme de croissant parallèle au limbe, creusant la cornée périphérique. Noter l’absence de sclérite et la présence d’un promontoire au niveau de la berge centrale.
Du fait des complications sévères, le traitement est donc d’une importance capitale. Une cause infectieuse sera écartée. La stratégie habituelle repose sur une escalade thérapeutique en fonction de la sévérité de l’ulcère. Dans les formes modérées et le plus souvent sans atteinte systémique associée, la première ligne de traitement est la corticothérapie par voie locale. À ce stade, la résection de la conjonctive adjacente à l’ulcère paraît être un geste simple et efficace [42]. Ce geste permet de retirer en un bloc un nombre important de cellules et de facteurs de l’inflammation et peut être au besoin répété si nécessaire. Il retire également les immuns complexes, diminue la production de collagénases et par conséquent accélère la réduction de l’inflammation. Ce geste est réalisé sous anesthésie locale et consiste à retirer la conjonctive bulbaire périlimbique adjacente à l’ulcère sur une largeur de 3 à 4 mm [43]. L’application de colle de cyanoacrylate peut être alors appliquée au fond de l’ulcère. Elle agirait comme une barrière entre les facteurs inflammatoires et la cornée touchée [19]. En cas d’évolution favorable, l’inflammation conjonctivale régresse, l’ulcère s’épithélialise mais la fonte stromale n’est pas reconstituée et il persiste alors toujours un amincissement parfois important (fig. 8-17). En cas de cicatrisation, la corticothérapie peut être diminuée progressivement. La ciclosporine en collyre peut être utile en traitement adjuvant [44]. Cependant, l’utilisation de la corticothérapie locale demeure controversée. Ainsi, pour certains, la corticothérapie locale serait inappropriée dans les cas associés à une maladie systémique car elle réduirait la synthèse de collagène et augmenterait le risque de perforation [45]. Le traitement de deuxième intention, en cas d’ulcère réfractaire à la corticothérapie locale, en cas d’atteintes sévères d’emblée ou en cas de maladies systémiques associées, est la corticothérapie par voie générale prescrite à fortes doses (1 mg/kg/jour) [43], parfois débutée sous forme de bolus intraveineux de méthylprednisolone, jusqu’à 1 g/jour pendant 3 jours. Le pronostic local et général reste cependant sombre dans les cas de polyarthrites rhumatoïdes avancées. Lorsque la pathologie demeure cortico-dépendante à de hauts niveaux, il sera nécessaire d’associer un traitement immunosuppresseur adapté à la pathologie systémique. Le cyclophosphamide, le méthotrexate, l’azathioprine ou le mycophénolate mofétil peuvent être utilisés sans consensus établi en l’absence d’études contrôlées, après que le patient a été référé auprès d’un médecin interniste [46, 47]. Depuis l’essor des biothérapies, d’autres molécules comme les agents anti-TNF-α ont été utilisés avec efficacité dans des cas cliniques ou de petites séries de patients rapportés [48-53]. Il s’agit de l’adalimumab (Humira®) ou de l’infliximab (Rémicade®), tous deux des anticorps monoclonaux anti-TNF-α. Une étude sur dix cas rapportés dans la littérature [54] à propos de la prise en charge d’un ulcère marginal par de l’étanercept (Enbrel®) a montré une bonne efficacité, même si cette protéine de fusion est réputée non ou moins active pour les inflammations intra-oculaires [55]. Les anticorps monoclonaux anti-CD20, le rituximab ont également été récemment proposés dans les ulcères marginaux auto-immuns [56].
Si l’ulcère progresse malgré la corticothérapie et le traitement immunosuppresseur ou pour les cas graves avec risque de perforation rapide, un traitement chirurgical afin de préserver l’intégrité anatomique du globe doit être réalisé. L’utilisation de colle cyanoacrylate peut être également associée en cas de préperforation de grande taille ou de perforation inférieure à 2 mm (fig. 8-18) avec la mise en place d’une lentille thérapeutique [19]. L’utilisation d’une greffe de membrane amniotique est aussi souvent judicieuse, éventuellement en multicouches en cas de creusement important, car elle va à la fois combler l’ulcère, réduire l’inflammation et favoriser la cicatrisation épithéliale (fig. 8-19) [57] même en cas de perforation. Enfin, en cas de perforation de plus grande taille, il sera alors nécessaire d’avoir recours à une greffe périphérique en patch, lamellaire ou perforante (fig. 8-20). Bien évidemment, ce type de greffes doit être réalisé chez un patient bénéficiant d’un traitement immunosuppresseur adapté. Cependant, le pronostic en est souvent très décevant car il s’agit de la situation clinique pour laquelle le taux de regreffe est le plus élevé [58]. Dans certains cas, la réalisation d’un recouvrement conjonctival complet ou partiel est nécessaire [18].

Fig. 8-17 Ulcère de Mooren.
a, b. Aspect séquellaire d’un ulcère de Mooren bilatéral traité 3 ans auparavant par corticothérapie locale et résection conjonctivale : noter l’amincissement et la néovascularisation cicatriciels, œil droit et œil gauche.
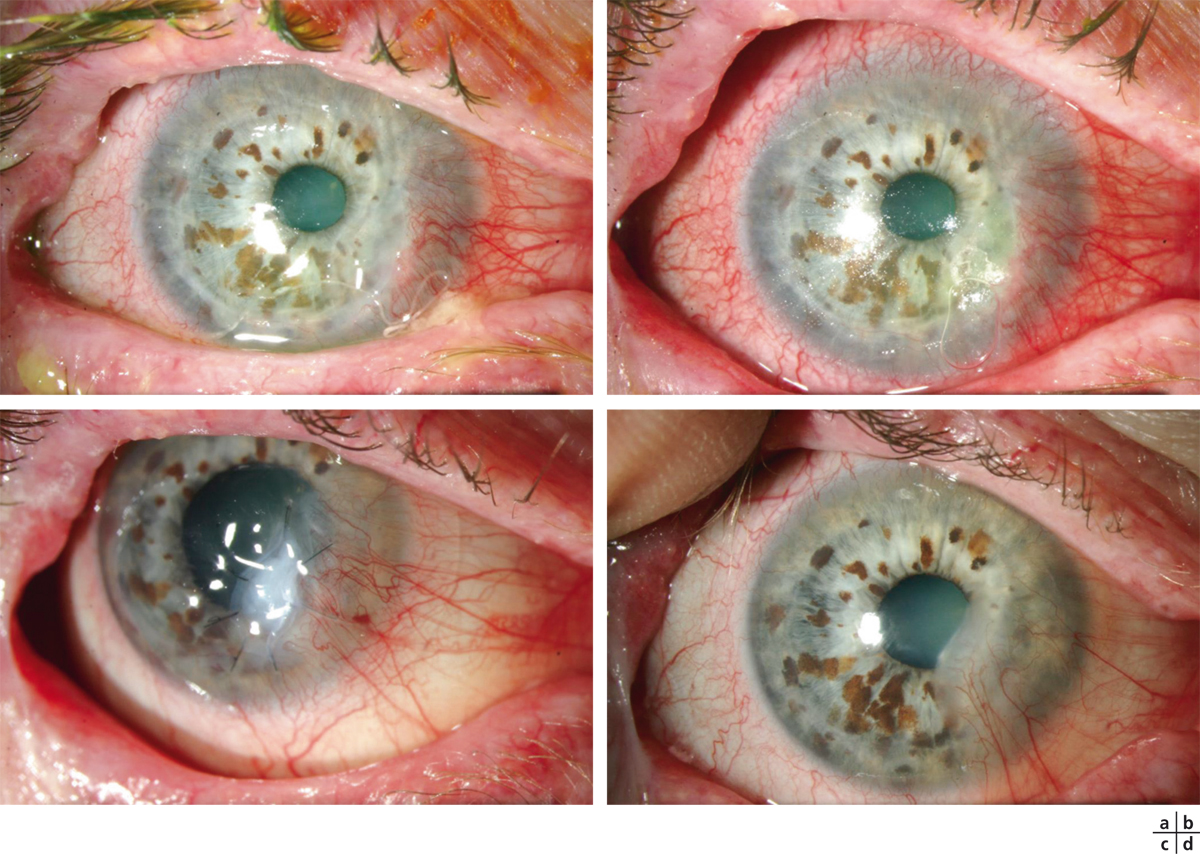
Fig. 8-18 Prise en charge d’un ulcère marginal par colle cyanoacrylate puis greffe de membrane amniotique.
a. Ulcère marginal de l’œil droit perforé dans un contexte de polyarthrite rhumatoïde sous adalimumab. b. Mise en place d’un point de colle temporaire et d’une lentille souple. c. Greffe de membrane amniotique en multicouches et corticothérapie par voie générale à 1 mg/kg/jour. d. Aspect à 5 mois après modification du traitement de fond par tocilizimab et poursuite de la corticothérapie par voie générale.
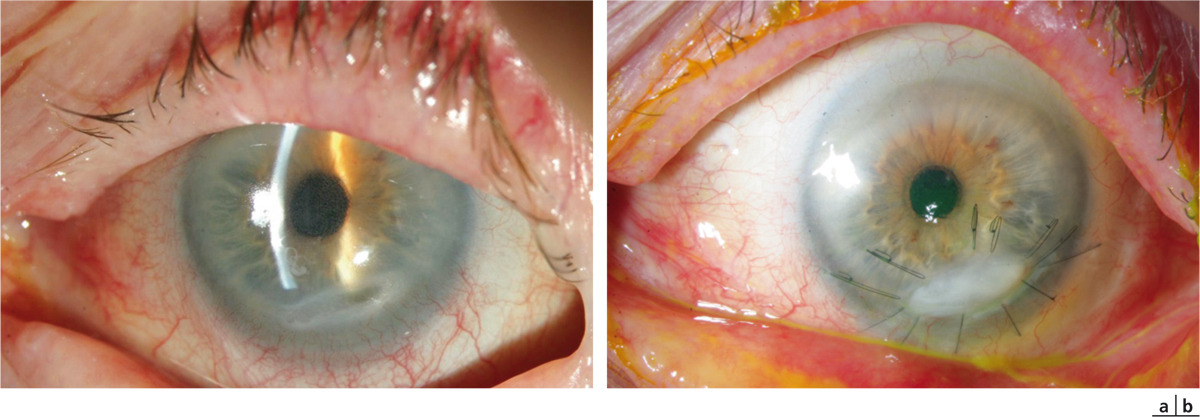
Fig. 8-19 Prise en charge d’un ulcère marginal par greffe de membrane amniotique.
a. Ulcère marginal préperforatif de l’œil droit. b. Aspect à 1 mois postopératoire d’une greffe de membrane amniotique et d’une résection conjonctivale en complément d’une corticothérapie locale. Épithélialisation complète.
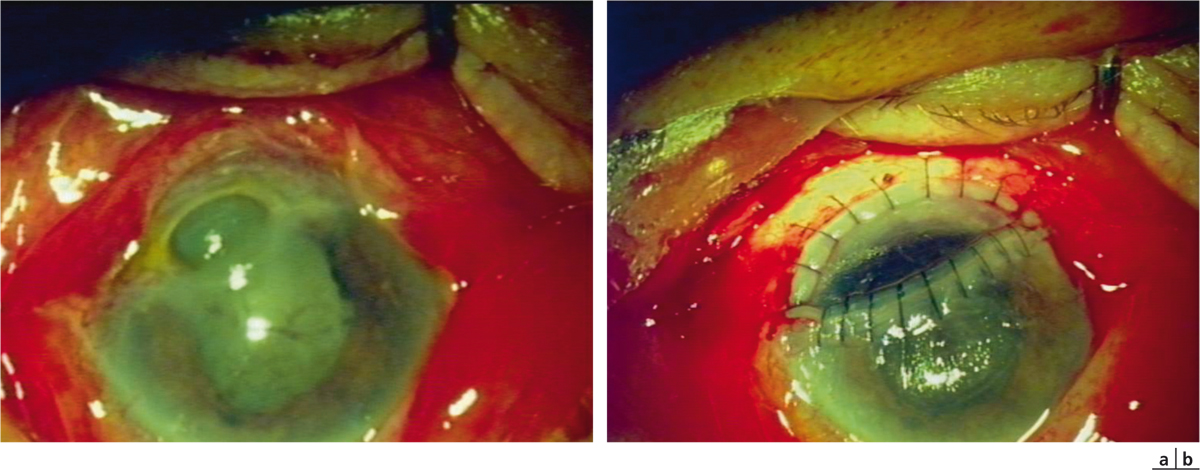
Fig. 8-20 Greffe périphérique en patch (b) dans le cadre d’une perforation cornéenne de grande taille chez un patient porteur d’une granulomatose de Wegener (a).
Les complications des ulcères auto-immuns peuvent être particulièrement sévères. Ainsi dans une série de 24 patients présentant un ulcère marginal et une sclérite associée, tous les patients ont évolué vers la perforation, 67 % présentaient une uvéite associée et 83 % une baisse d’acuité visuelle de plus de deux lignes à la fin du suivi en comparaison de l’examen initial [59]. Dans une autre série de 47 patients avec un ulcère marginal auto-immun, 34 % ont présenté une perforation ou une préperforation et 43 % une acuité visuelle inférieure ou égale à 1/20 [33]. Il faut également ajouter que la présence d’un ulcère cornéen auto-immun, en cas de pathologie systémique, est le témoin d’une phase active de l’inflammation au niveau général et d’une morbidité et d’une mortalité plus importantes. Foster et al. ont rapporté qu’en cas de polyarthrite rhumatoïde compliquée d’une sclérite nécrosante ou d’un ulcère marginal, la mortalité atteignait 50 % à 10 ans en l’absence de traitement par immunosuppresseur [60].
Il s’agit alors d’ulcères beaucoup moins creusants et moins développés en circonférence que les ulcères marginaux auto-immuns. Deux tableaux cliniques existent, les infiltrats catarrhaux et la kératoconjonctivite phlycténulaire. Les deux entités ne sont pas facilement différenciables l’une de l’autre. En effet, il s’agit de deux atteintes non infectieuses inflammatoires de la surface oculaire qui reposent sur un mécanisme commun d’hypersensibilité à des antigènes bactériens.
Les infiltrats catarrhaux sont probablement une réaction d’hypersensibilité aux antigènes staphylococciques qui colonisent les paupières au cours des dysfonctionnements meibomiens de la rosacée à laquelle ils sont associés. Leur répartition est circonférentielle ; ces infiltrats sont séparés du limbe par un espace clair mais il existe également parfois une néovascularisation entre les deux. Leur grand axe est parallèle au limbe. Au cours de l’évolution, le toit de l’infiltrat s’érode aboutissant à l’ulcère périphérique. Ces infiltrats sont habituellement arrondis mais peuvent devenir coalescents pour aboutir à un tableau trompeur de « pseudo-Mooren » ou d’ulcère marginal auto-immun [61]. Cependant, l’évolution est le plus souvent favorable en 2 à 3 semaines avec un risque de récidive important si la blépharite n’est pas traitée (fig. 8-21).
La kératoconjonctivite phlycténulaire résulte d’une hypersensibilité de type IV à certains antigènes bactériens, dans la grande majorité des cas staphylococciques, mais certains autres germes peuvent en être responsables comme la tuberculose historiquement, les Chlamydiae ou le Candida. La plupart des patients présentent une blépharite, notamment chez l’enfant, et certains auteurs se posent la question de savoir si rosacée de l’enfant et kératoconjonctivite phlycténulaire ne sont pas une seule et même maladie [62]. Les phlyctènes peuvent être conjonctivales ou cornéennes. Les phlyctènes cornéennes sont de petites vésicules blanchâtres le plus souvent à proximité du limbe, associées à une inflammation conjonctivale intense. Leurs toits s’érodent créant une ulcération marginale à fond gris périphérique qui ensuite cicatrise, laissant une cicatrice stromale antérieure. Un appel vasculaire limbique est fréquent ; il peut être fasciculaire ou à base plus large. Le cycle complet dure 2 semaines. De nouvelles phlyctènes peuvent se former à la limite centrale de la vascularisation séquellaire d’une poussée précédente donnant le sentiment que la phlyctène puis le néovaisseau « marchent » sur la cornée (fig. 8-22). Le diagnostic est clinique. Des prélèvements bactériologiques ou une recherche de tuberculose sont à effectuer chez des sujets avec facteurs de risque [63]. Le traitement des infiltrats catarrhaux et de la kératoconjonctivite phlycténulaire repose sur une corticothérapie locale dont les effets seront très rapides. Sa prescription doit être urgente et intensive, car le risque est l’évolution vers la cornée centrale et la menace de séquelles définitives. En cas d’intolérance aux corticoïdes locaux ou de cortico-dépendance, ceux-ci peuvent être remplacés par le collyre à la ciclosporine, le plus souvent à 2 % [64], voire par l’application de tacrolimus en pommade [65]. Ce traitement est associé à celui du dysfonctionnement meibomien afin de limiter la colonisation bactérienne palpébrale et les récidives.
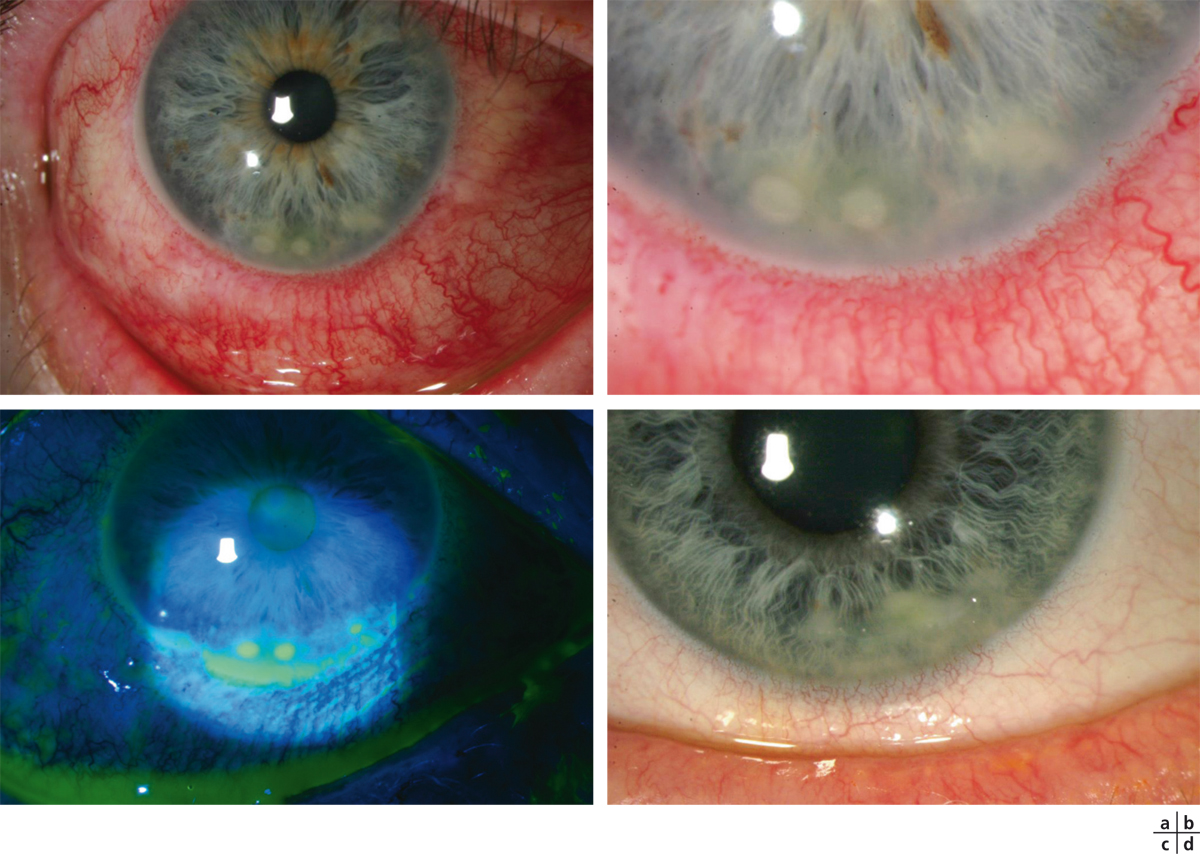
Fig. 8-21 Infiltrats catarrhaux.
a. Infiltrats arrondis à la périphérie cornéenne. b, c. Noter l’espace de cornée saine avec le limbe et l’aspect après instillation de fluorescéine marquant l’ulcération épithéliale associée. d. Ces infiltrats peuvent devenir coalescents.
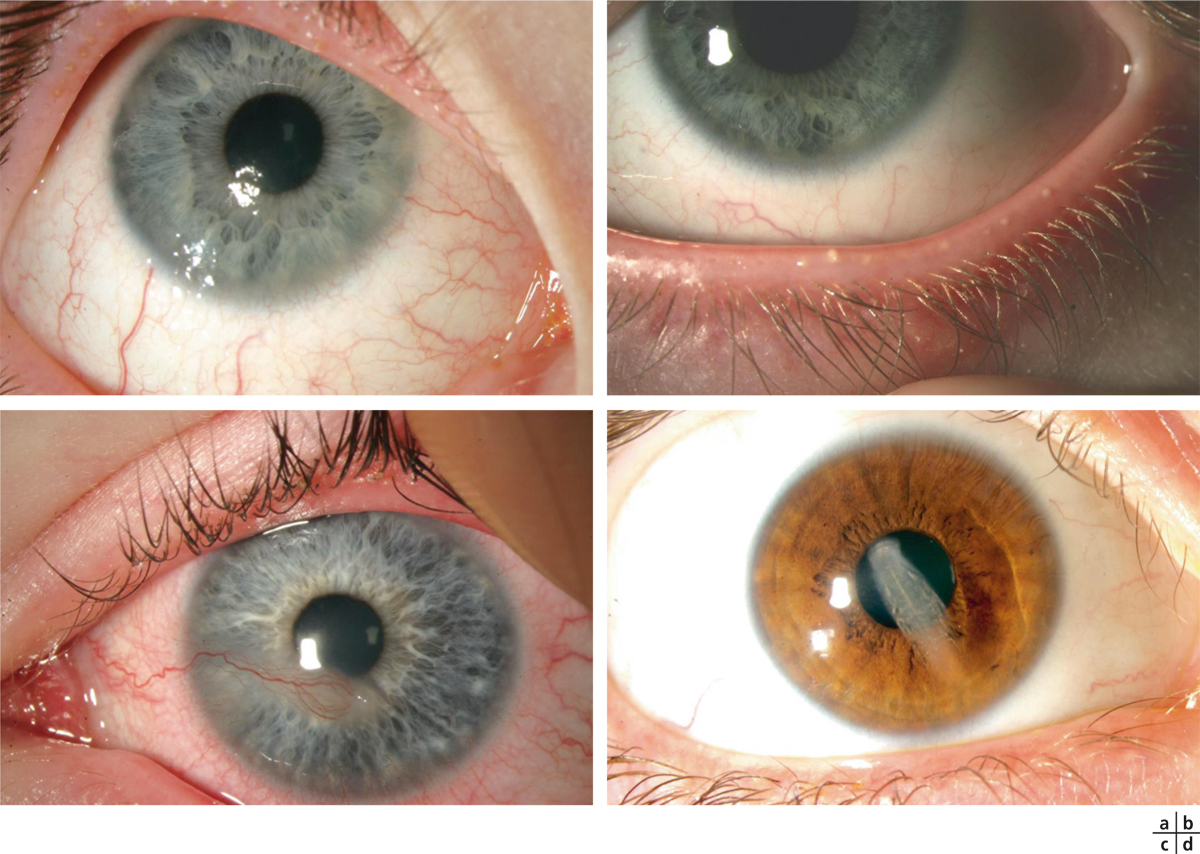
Fig. 8-22 Kératoconjonctivite phlycténulaire.
a, b. Le sommet des phlyctènes reflète la lumière : noter le dysfonctionnement meibomien associé. c. Appel néovasculaire fasciculaire jusqu’à la phlyctène cornéenne. d. Cicatrice stromale d’une kératoconjonctivite phlycténulaire barrant l’axe optique.
La présence d’un ulcère central ou paracentral de la cornée n’exclut pas une cause inflammatoire, mais le diagnostic différentiel sera plus difficile (fig. 8-23). Il faudra d’abord éliminer les ulcères d’origine infectieuse que sont les abcès bactériens, fongiques ou amibiens dont la localisation est souvent paracentrale. Le prélèvement est donc systématique. Celui-ci recherchera également facilement la présence du virus herpétique par PCR. L’ensemble de ces étiologies est cependant le plus souvent facile à exclure du fait d’une infiltration stromale marquée et, quand elle s’y associe dans les formes sévères, une lame d’hypopion. Il conviendra d’éliminer les ulcères secondaires à une anomalie de la statique palpébrale (ectropion, entropion, lagophtalmie) de même que ceux pouvant compliquer un tableau de sécheresse oculaire grave (syndrome de Gougerot-Sjögren ou syndrome du greffon contre l’hôte). Il faudra également toujours rechercher la présence d’un ulcère trophique en testant la sensibilité cornéenne. Le dernier diagnostic différentiel est représenté par les ulcères secondaires à un déficit limbique profond.
Ce n’est qu’après avoir éliminé ces différentes étiologies que l’on pourra évoquer une étiologie inflammatoire et celle-ci peut relever de quatre tableaux cliniques principaux : les kératoconjonctivites vernales responsable de l’ulcère puis de la plaque vernale, les kératoconjonctivites atopiques, la rosacée oculaire et la polyarthrite rhumatoïde. Les trois premières entités ont été traitées en détail dans les chapitres précédents, nous détaillerons l’ulcère central associé à la polyarthrite rhumatoïde.
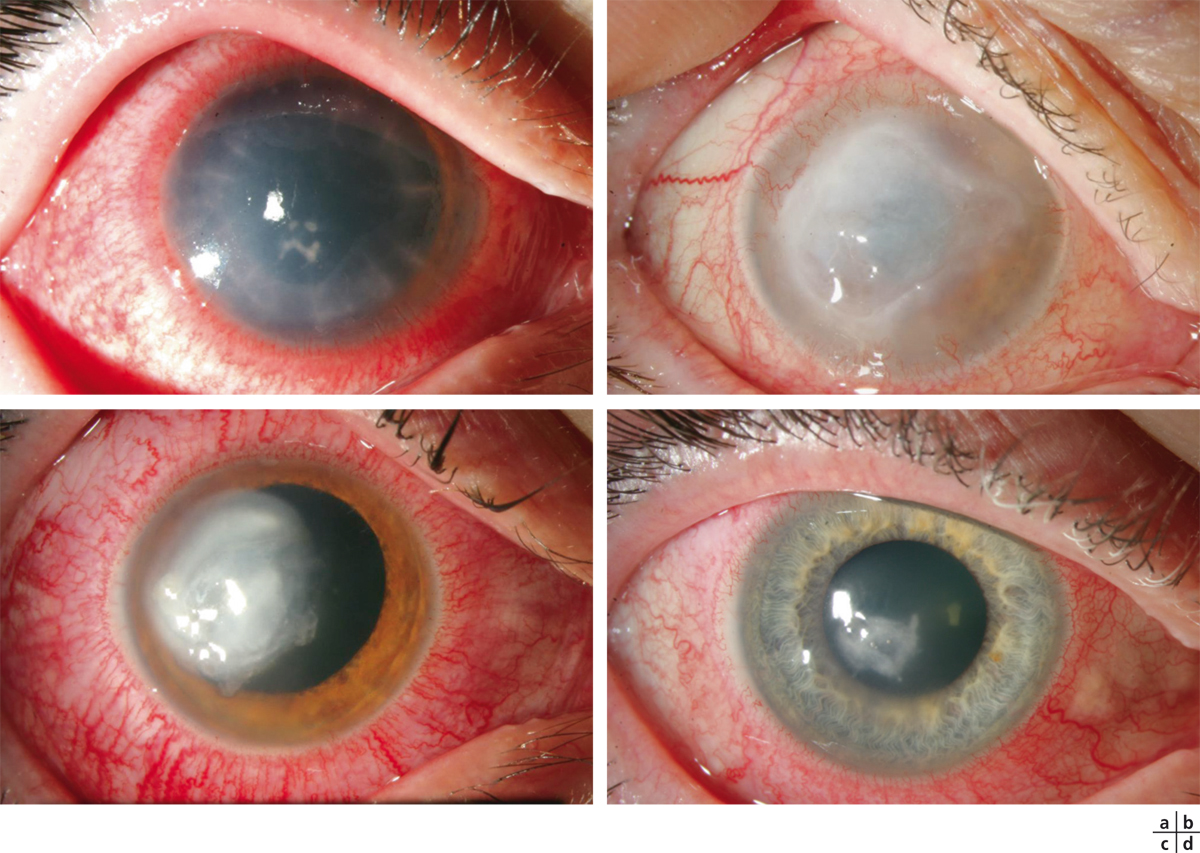
Fig. 8-23 Diagnostic différentiel des ulcères cornéens inflammatoires centraux ou paracentraux.
a. Kératite amibienne évoluant depuis 6 semaines : noter les périnévrites sur 360° et l’absence d’infiltrat stromal. b. Kératite nécrosante herpétique évoluant depuis 2 mois ; PCR positive à HSV-1. c. Abcès à Pseudomonas aeruginosa : noter la lame d’hypopion. d. Kératite fongique à Fusarium solani.
Les complications cornéennes de la polyarthrite rhumatoïde peuvent être périphériques, associées ou non à une sclérite comme nous l’avons précédemment explicité, mais aussi centrales. Elles peuvent être dites « non inflammatoires », et sont alors souvent associées à un syndrome de Gougerot-Sjögren, ou « nécrosantes » avec infiltration stromale et se développer sous un épithélium intact. Cette classification de l’ulcération rhumatoïde ne reflète cependant pas exactement la pathogénie complexe de ces fontes cornéennes encore mal connue et il existe probablement un chevauchement certain entre ces deux groupes. L’instabilité épithéliale dans la kératoconjonctivite sèche et l’inflammation systémique sont des facteurs potentiels qui vont initier le processus d’amincissement et de perforation cornéenne dans la polyarthrite rhumatoïde. Dans les ulcères centraux et paracentraux, survenant en l’absence de phénomène inflammatoire, l’insuffisance lacrymale et l’atteinte épithéliale sont au premier plan. L’hypothèse physiopathologique actuellement acceptée est que les micro-érosions épithéliales permettraient l’entrée dans le stroma cornéen de médiateurs inflammatoires amenés par les larmes, ce qui initierait la kératolyse [66]. Excepté les rares cas de fontes cornéennes associées à des perturbations épithéliales sévères, ces ulcérations surviennent dans le cadre d’une vascularite. Ainsi, les biopsies conjonctivales réalisées chez certains de ces patients retrouvent une vascularite active probablement responsable en partie de cet ulcère [67]. La prise en charge des ulcères centraux associés à la polyarthrite rhumatoïde est difficile et non codifiée. Bien que la corticothérapie locale puisse apporter un certain confort, son utilisation reste controversée. Un traitement par voie générale est le plus souvent nécessaire pour obtenir la cicatrisation. Elle est instaurée en situation d’urgence. Il faudra par la suite y associer un immunosuppresseur car une corticothérapie en monothérapie est le plus souvent insuffisante [68]. La ciclosporine en collyre à 2 % a été proposée avec un certain succès dans cette indication [67] en traitement adjuvant. En cas d’ulcère réfractaire au traitement local, préperforatif ou perforatif, des gestes complémentaires sont nécessaires comme la mise en place de colle et d’une lentille, une greffe de membrane amniotique (fig. 8-24) ou une éventuelle greffe de cornée à visée tectonique et encadrée par une immunosuppression par voie générale.
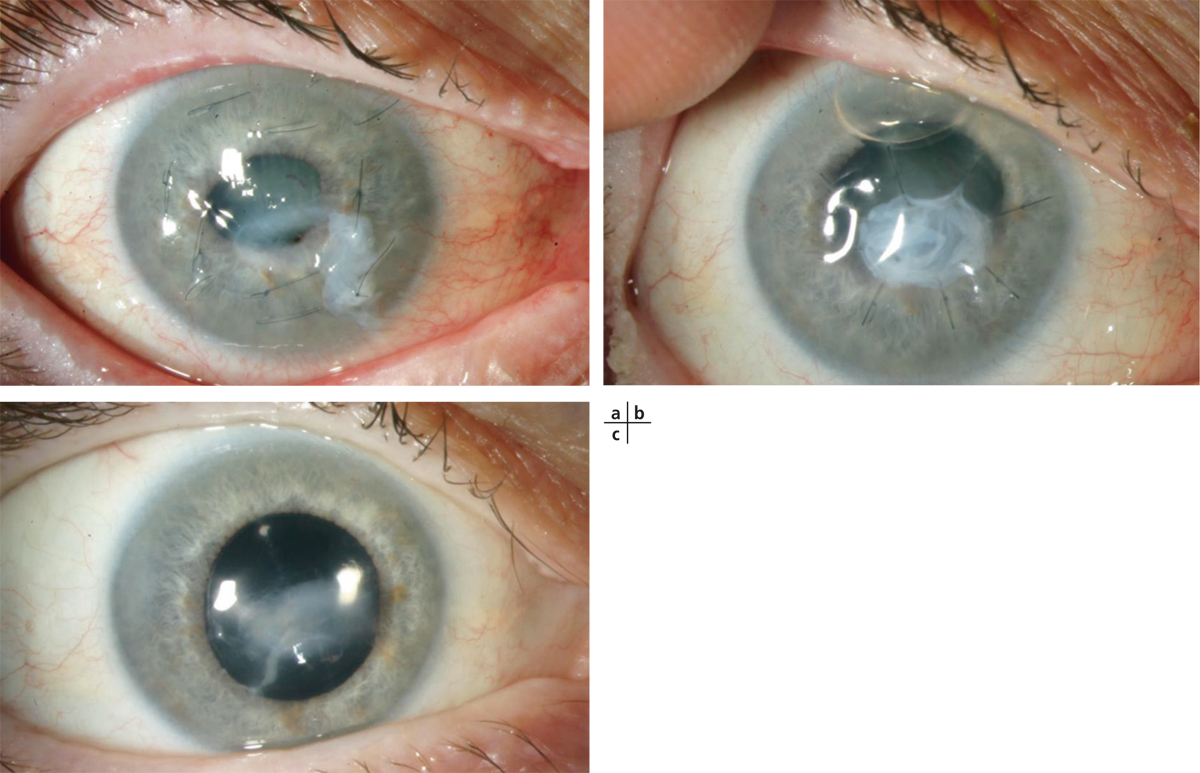
Fig. 8-24 Polyarthrite rhumatoïde et ulcère cornéen central.
a. Patiente adressée pour kératolyse cornéenne aseptique malgré une première greffe de membrane amniotique. b. Évolution favorable après une deuxième greffe de membrane amniotique en multicouches et corticothérapie par voie générale, aspect à 7 jours. c. Aspect à 9 mois après intervention de la cataracte.
Ces causes d’ulcère chronique font l’objet d’un chapitre spécifique dans ce rapport.
L’épithélium cornéen est un tissu à renouvellement rapide qui s’effectue à partir de cellules souches épithéliales. Celles-ci sont concentrées au niveau de la couche basale du limbe, plus particulièrement dans les palissades de Vogt, mais elles ont également été retrouvées plus récemment sur toute la surface de la cornée [69]. En cas de déficience de ces cellules souches, les capacités de renouvellement de l’épithélium cornéen s’épuisent. La destruction du limbe entraîne une régénération à partir de l’épithélium conjonctival adjacent. L’épithélium cornéen est envahi par l’épithélium conjonctival et change son phénotype. Cette situation survient dans plusieurs conditions pathologiques et engendre le syndrome d’« insuffisance en cellules souches limbiques » (ICSL). Cependant, comme la différenciation cellulaire est le résultat de l’interaction d’un groupe cellulaire et de son micro-environnement, toute modification du micro-environnement cornéen (stroma et film lacrymal), comme une kératite stromale chronique, peut entraîner à elle seule un changement de phénotype épithélial et engendrer un tableau d’insuffisance limbique [70].
Le « syndrome d’insuffisance en cellules souches limbiques » peut se traduire par une symptomatologie douloureuse, une photophobie, un larmoiement, une rougeur chronique et une baisse de l’acuité visuelle. Cliniquement, il existe une « conjonctivalisation » de la cornée. Un des premiers signes serait la disparition de l’architecture normale du limbe (palissades de Vogt). Par la suite, à la lampe à fente, est retrouvée une perte du reflet habituel de l’épithélium cornéen qui apparaît plus terne. La surface épithéliale devient irrégulière, composée d’un épithélium plus opaque et d’épaisseur variable. Habituellement, une néovascularisation cornéenne superficielle apparaît. Le syndrome d’insuffisance en cellules souches limbiques peut se compliquer d’ulcères cornéens chroniques ou récurrents pouvant évoluer finalement vers la perforation (fig. 8-25) [71]. À un stade terminal, la surface cornéenne peut se kératiniser, être envahie par un pannus fibrovasculaire et être le siège de dépôts calcaires. La présence de cellules caliciformes à la surface de la cornée, normalement uniquement retrouvées dans la conjonctive, confirme le tableau d’insuffisance limbique. Elles peuvent être mises en évidence par empreintes conjonctivales après coloration au PAS (periodic acid Schiff) [72]. Cependant cet examen peut être pris à défaut du fait du peu de cellules prélevées au stade précoce d’insuffisance limbique.
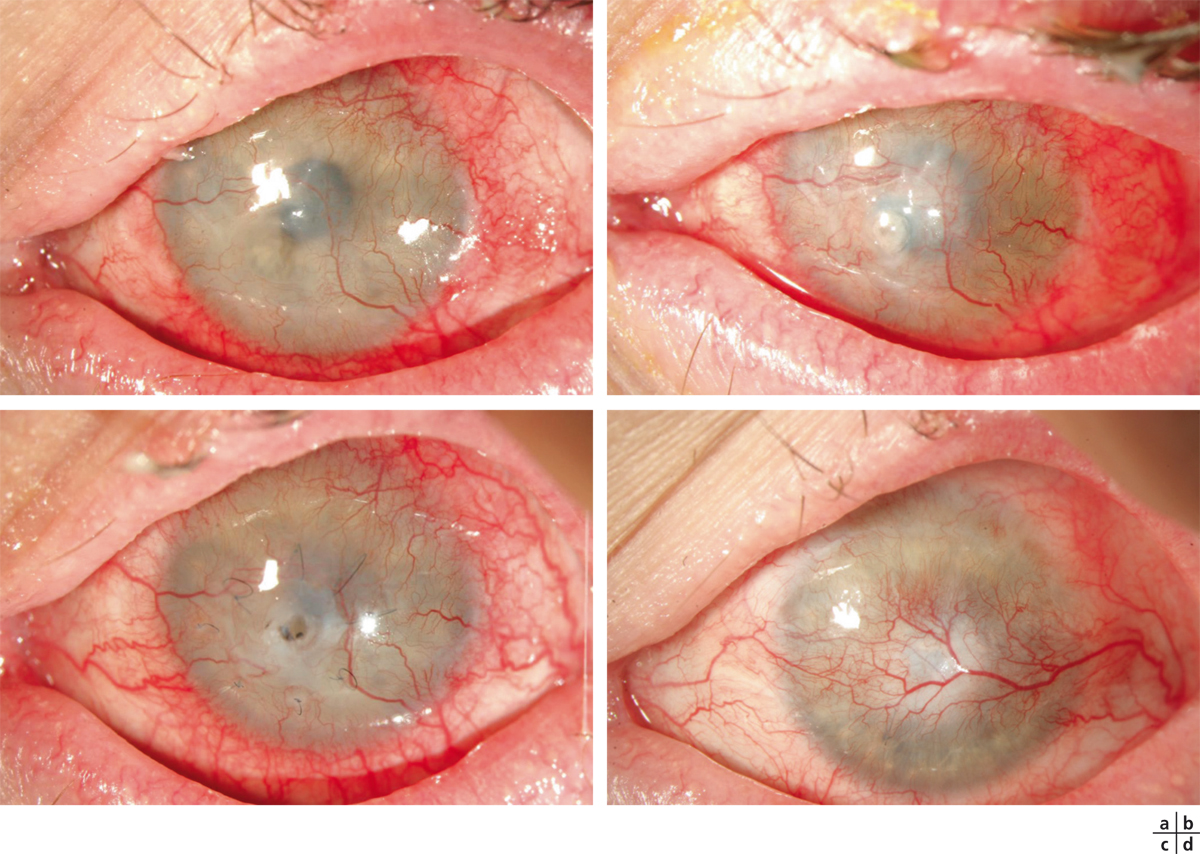
Fig. 8-25 Syndrome d’insuffisance en cellules souches et ulcère perforant dans les suites d’un syndrome de Stevens-Johnson survenu 3 ans auparavant.
a. Néovascularisation complète cornéenne et ulcère stromal creusant paracentral. b. 15 jours après, survenue d’une perforation cornéenne. c. Échec d’une greffe amniotique en multicouche, aspect à 3 semaines. d. Conservation anatomique du globe par recouvrement conjonctival, aspect à 1 an.
Les conditions à l’origine d’une destruction des cellules souches épithéliales limbiques correspondent soit à une perte totale primitive des cellules souches limbiques, soit à un hypofonctionnement, soit à une perte progressive de la fonction des cellules souches limbiques par atteinte du support stromal. Majo et al. les ont classées en fonction de leur physiopathologie [70]. Les causes d’ICSL sont regroupées dans l’encadré 8-5.
• ICSL par destruction chimique, physique ou mécanique :
▪ brûlures chimiques ou thermiques
▪ irradiations
▪ traumatismes chirurgicaux : antécédents de chirurgie (péritomie) ou de cryothérapie atteignant le limbe ; excision chirurgicale de néoplasies du limbe
▪ traumatismes mécaniques : trichiasis, port prolongé de lentilles de contact
• ICSL d’origine infectieuse : kératites bactériennes sévères, trachome, herpès, mycoses
• ICSL d’origine inflammatoire :
▪ syndromes de Stevens-Johnson ou de Lyell
▪ pemphigoïde oculaire cicatricielle
▪ kératoconjonctivite atopique, rosacée oculaire, syndrome de Gougerot-Sjögren
• ICSL d’origine constitutionnelle :
▪ aniridie (héréditaire)
▪ épidermolyses bulleuse constitutionnelle
▪ érythrokératodermie congénitale
▪ endocrinopathies multiples héréditaires
• ICSL et dysplasie ou dystrophies de la surface :
▪ ptérygion
▪ néoplasies du limbe
▪ dystrophies cornéennes
• ICSL iatrogène : agents antimitotiques
• ICSL par destruction d’un élément constitutif de la matrice cornéenne : kératites neurotrophiques (herpès, diabète)
• ICSL idiopathiques
Sa reconnaissance permet d’adapter le traitement spécifique, car dans ces situations, la greffe de cornée est impossible puisque l’épithélium pathologique qui appartient au receveur recouvre invariablement le greffon et l’opacifie rapidement. La seule alternative est, après avoir reconstruit la surface oculaire au niveau conjonctival ou palpébral, de proposer des auto- ou des allogreffes de limbe, en se rappelant que le pronostic des ICSL d’origine inflammatoire est bien plus mauvais que celui des ICSL non inflammatoires [73] probablement du fait du film lacrymal pathologique et de l’atteinte souvent associée des paupières. Les techniques de reconstruction de la surface oculaire par autogreffe limbique, allogreffe limbique, greffe d’expansion de cellules souches épithéliales cornéennes ou d’autres origines ou de réhabilitation visuelle par kératoprothèse sont décrites par ailleurs dans ce rapport. Il faut toutefois noter que les verres scléraux perméables à l’oxygène ont démontré une réelle amélioration de la qualité de vie de ces patients, notamment après atteinte de la surface oculaire dans les suites des syndromes de Lyell et de Stevens-Johnson [74]. Ils permettent une diminution de la symptomatologie douloureuse et une remontée significative de l’acuité visuelle sans recours chirurgical.
Enfin, il ne faut pas oublier d’évoquer ce diagnostic car sa méconnaissance peut engendrer une escalade thérapeutique inadaptée, d’autant plus que le traitement causal est maintenu. La toxicité du traitement local peut être liée au principe actif lui-même ou aux conservateurs associés. Certaines molécules sont réputées pour engendrer des ulcères de cornée toxiques comme les AINS, les antiviraux, certains antibiotiques ou dans le cadre d’abus de collyres anesthésiants locaux [75]. La kératite toxique peut se présenter comme une simple kératite ponctuée superficielle, prendre un tableau de pseudo-dendrite mimant une infection herpétique jusqu’à un ulcère stromal (fig. 8-26). Les signes prédominent en nasal inférieur et sont associés à une conjonctivite papillaire et souvent folliculaire. Ce tableau clinique est également retrouvé dans les kératites auto-induites.
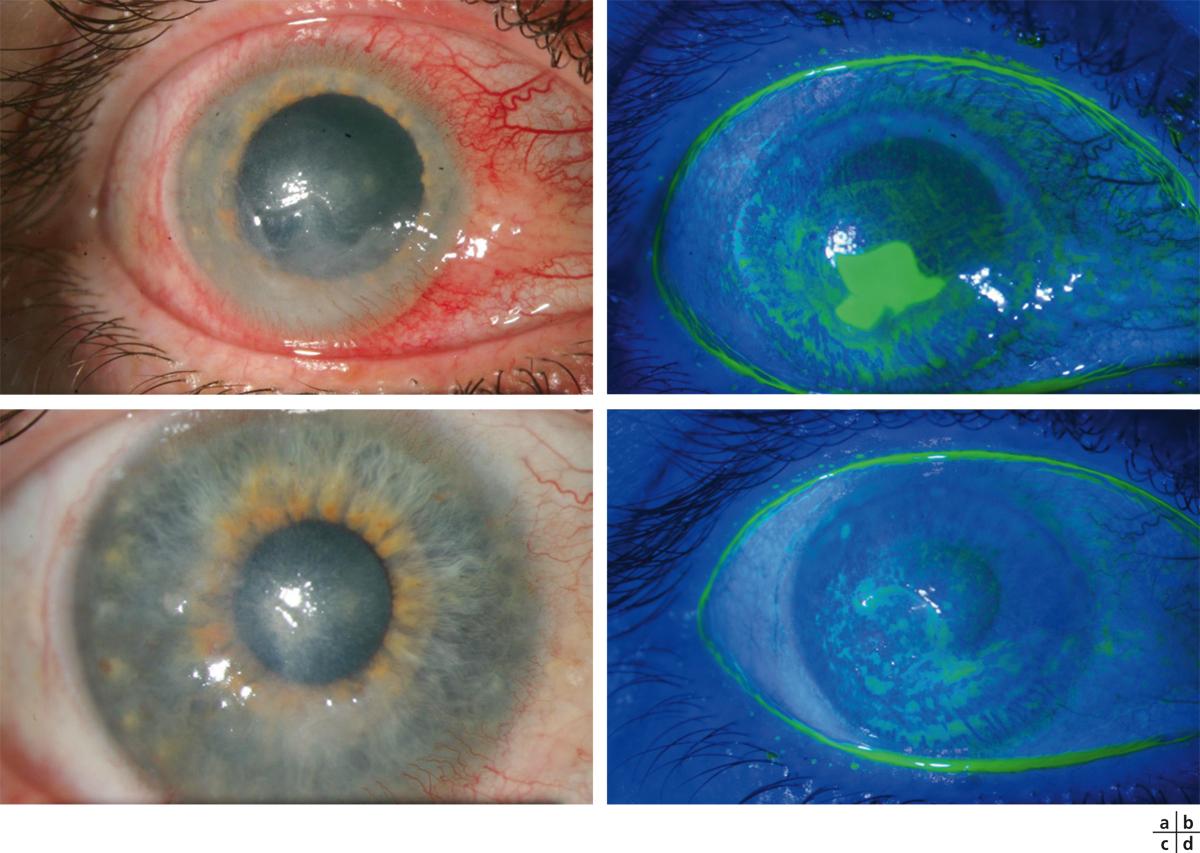
Fig. 8-26 Kératite herpétique traitée par de la trifluridine en collyre (Virophta®).
a, b. Ulcère central évoluant depuis 1 mois. c, d. Cicatrisation épithéliale 15 jours après l’arrêt des collyres toxiques.
La prise en charge des ulcères cornéens est difficile. La démarche clinique doit inclure une anamnèse précise et un examen clinique systématique, au cours duquel l’évaluation de la sensibilité est primordiale. La priorité est d’exclure une pathologie infectieuse. Ces informations guideront si nécessaire les prélèvements microbiologiques. La sanction thérapeutique doit être rapide et adaptée car l’intégrité du globe et la fonction visuelle sont le plus souvent menacées, ainsi que parfois le pronostic général.
[1] Sigelman S, Friedenwald JS. Mitotic and wound-healing activities of the corneal epithelium ; effect of sensory denervation. AMA Arch Ophthalmol 1954 ; 52 : 46-57.
[2] Cavanagh HD, Colley AM. The molecular basis of neurotrophic keratitis. Acta Ophthalmol Suppl 1989 ; 192 : 115-34.
[3] Shimizu T, Izumi K, Fujita S et al. Capsaicin-induced corneal lesions in mice and the effects of chemical sympathectomy. J Pharmacol Exp Ther 1987 ; 243 : 690-5.
[4] Fujita S, Shimizu T, Izumi K, et al. Capsaicin-induced neuroparalytic keratitis-like corneal changes in the mouse. Exp Eye Res 1984 ; 38 : 165-75.
[5] Gabison EE, Huet E, Baudouin C, et al. Direct epithelial-stromal interaction in corneal wound healing : role of EMMPRIN/CD147 in MMPs induction and beyond. Prog Retin Eye Res 2009 ; 28 : 19-33.
[6] Mackie I. Neuroparalytic keratitis. In : Fraunfelder F, Roy FH, Meyer SM. Eds. Current ocular therapy. WB Saunders : Philadelphia : WB Saunders ; 1995.
[7] Chang BH, Groos EB. Neurotrophic keratitis. In : Krachmer JH, Mannis MJ, Holland EJ. Eds. Cornea. 3rd ed. Mosby : St Louis : Mosby ; 2011.
[8] Cobo LM. Corneal complications of herpes zoster ophthalmicus. Prevention and treatment. Cornea 1988 ; 7 : 50-6.
[9] Gueudry J, Lebel H, Muraine M. Severe corneal complications associated with topical indomethacin use. Br J Ophthalmol 2010 ; 94 : 133-4.
[10] Portmann A, Gueudry J, Boidin-Lebel H, et al. Perforation cornéenne associée à l’utilisation d’indométacine en collyre. J Fr Ophtalmol 2012 ; 35 : 72-3.
[11] Cochet P, Bonnet R. Corneal esthesiometry. Performance and practical importance. Bull Soc Ophtalmol Fr 1961 ; 6 : 541-50.
[12] Golebiowski B, Papas E, Stapleton F. Assessing the sensory function of the ocular surface : implications of use of a non-contact air jet aesthesiometer versus the Cochet-Bonnet aesthesiometer. Exp Eye Res 2011 ; 92 : 408-13.
[13] Hamrah P, Cruzat A, Dastjerdi MH, et al. Corneal sensation and subbasal nerve alterations in patients with herpes simplex keratitis : an in vivo confocal microscopy study. Ophthalmology 2010 ; 117 : 1930-6.
[14] Lambiase A, Sacchetti M, Mastropasqua A, et al. Corneal changes in neurosurgically induced neurotrophic keratitis. JAMA Ophthalmol 2013 ; 131 : 1547-53.
[15] Sacchetti M, Lambiase A. Diagnosis and management of neurotrophic keratitis. Clin Ophthalmol 2014 ; 8 : 571-79.
[16] Lim P, Ridges R, Jacobs DS, et al. Treatment of persistent corneal epithelial defect with overnight wear of a prosthetic device for the ocular surface. Am J Ophthalmol 2013 ; 156 : 1095-101.
[17] Ling JD, Gire A, Pflugfelder SC. PROSE therapy used to minimize corneal trauma in patients with corneal epithelial defects. Am J Ophthalmol 2013 ; 155 : 615-19, 19 e1-2.
[18] Boidin H, Gueudry J, Portmann A, et al. Le recouvrement conjonctival : une technique toujours d’actualité. J Fr Ophtalmol 2012 ; 35 : 170-5.
[19] Vera L, Benzerroug M, Gueudry J, et al. Mise au point sur l’utilisation des colles tissulaires en ophtalmologie. J Fr Ophtalmol 2009 ; 32 : 290-305.
[20] Terzis JK, Dryer MM, Bodner BI. Corneal neurotization : a novel solution to neurotrophic keratopathy. Plast Reconstr Surg 2009 ; 123 : 112-20.
[21] Matsumoto Y, Dogru M, Goto E, et al. Autologous serum application in the treatment of neurotrophic keratopathy. Ophthalmology 2004 ; 111 : 1115-20.
[22] Yoon KC, You IC, Im SK, et al. Application of umbilical cord serum eyedrops for the treatment of neurotrophic keratitis. Ophthalmology 2007 ; 114 : 1637-42.
[23] Geremicca W, Fonte C, Vecchio S. Blood components for topical use in tissue regeneration : evaluation of corneal lesions treated with platelet lysate and considerations on repair mechanisms. Blood Transfus 2010 ; 8 : 107-12.
[24] Yamada N, Matsuda R, Morishige N, et al. Open clinical study of eye-drops containing tetrapeptides derived from substance P and insulin-like growth factor-1 for treatment of persistent corneal epithelial defects associated with neurotrophic keratopathy. Br J Ophthalmol 2008 ; 92 : 896-900.
[25] Nishida T, Chikama T, Morishige N, et al. Persistent epithelial defects due to neurotrophic keratopathy treated with a substance p-derived peptide and insulin-like growth factor 1. Jpn J Ophthalmol 2007 ; 51 : 442-7.
[26] Lambiase A, Rama P, Bonini S, et al. Topical treatment with nerve growth factor for corneal neurotrophic ulcers. N Engl J Med 1998 ; 338 : 1174-80.
[27] Bonini S, Lambiase A, Rama P, et al. Topical treatment with nerve growth factor for neurotrophic keratitis. Ophthalmology 2000 ; 107 : 1347-51 ; discussion 51-2.
[28] Ferrari MP, Mantelli F, Sacchetti M, et al. Safety and pharmacokinetics of escalating doses of human recombinant nerve growth factor eye drops in a double-masked, randomized clinical trial. BioDrugs 2014 ; 28 : 275-83.
[29] De Monchy I, Labbe A, Pogorzalek N, et al. Utilisation d’un agent biodégradable de la régénération tissulaire (RGTA) dans le traitement d’un ulcère trophique résistant d’origine zostérienne : à propos d’un cas. J Fr Ophtalmol 2012 ; 35 : 187 e1-6.
[30] Barritault D, Garcia-Filipe S, Zakine G. Basement of matrix therapy in regenerative medicine by RGTA(®) : from fundamental to plastic surgery. Ann Chir Plast Esthet 2010 ; 55 : 413-20.
[31] Aifa A, Gueudry J, Portmann A, et al. Topical treatment with a new matrix therapy agent (RGTA) for the treatment of corneal neurotrophic ulcers. Invest Ophthalmol Vis Sci 2012 ; 53 : 8181-5.
[32] Muraine M, Gueudry J. Les ulcères inflammatoires de la cornée : orientation diagnostique et prise en charge. In : Bodaghi B, Gueudry J. Eds. Inflammations oculaires, du diagnostic au traitement. MED’COM : Paris : MED’COM ; 2014.
[33] Tauber J, Sainz de la Maza M, Hoang-Xuan T, et al. An analysis of therapeutic decision making regarding immunosuppressive chemotherapy for peripheral ulcerative keratitis. Cornea 1990 ; 9 : 66-73.
[34] Gregory JK, Foster CS. Peripheral ulcerative keratitis in the collagen vascular diseases. Int Ophthalmol Clin 1996 ; 36 : 21-30.
[35] Galor A, Thorne JE. Scleritis and peripheral ulcerative keratitis. Rheum Dis Clin North Am 2007 ; 33 : 835-54, vii.
[36] Austin P, Brown SI. Inflammatory Terrien’s marginal corneal disease. Am J Ophthalmol 1981 ; 92 : 189-92.
[37] Soukiasian SH. Peripheral ulcerative keratitis. In : Yanoff M, Duker JS. Ophthalmology. 4th edition. St-Louis : Elsevier ; 2014.
[38] McKibbin M, Isaacs JD, Morrell AJ. Incidence of corneal melting in association with systemic disease in the Yorkshire Region, 1995-7. Br J Ophthalmol 1999 ; 83 : 941-3.
[39] Watkins AS, Kempen JH, Choi D, et al. Ocular disease in patients with ANCA-positive vasculitis. J Ocul Biol Dis Infor 2009 ; 3 : 12-19.
[40] Voegtle R, Borderie V, Baudrimont M, et al. L’ulcère de Mooren. J Fr Ophtalmol 2000 ; 23 : 711-7.
[41] Watson PG. Management of Mooren’s ulceration. Eye (Lond) 1997 ; 11 (Pt 3) : 349-56.
[42] Brown SI. Mooren’s ulcer. Treatment by conjunctival excision. Br J Ophthalmol 1975 ; 59 : 675-82.
[43] Chow CY, Foster CS. Mooren’s ulcer. Int Ophthalmol Clin 1996 ; 36 : 1-13.
[44] Tandon R, Chawla B, Verma K, et al. Outcome of treatment of mooren ulcer with topical cyclosporine a 2 %. Cornea 2008 ; 27 : 859-61.
[45] Messmer EM, Foster CS. Vasculitic peripheral ulcerative keratitis. Surv Ophthalmol 1999 ; 43 : 379-96.
[46] Ladas JG, Mondino BJ. Systemic disorders associated with peripheral corneal ulceration. Curr Opin Ophthalmol 2000 ; 11 : 468-71.
[47] Foster CS. Systemic immunosuppressive therapy for progressive bilateral Mooren’s ulcer. Ophthalmology 1985 ; 92 : 1436-9.
[48] Cordero-Coma M, Benito MF, Fuertes CL, et al. Adalimumab for Mooren’s ulcer. Ophthalmology 2009 ; 116 : 1589, 1589.e1.
[49] Fontana L, Parente G, Neri P, et al. Favourable response to infliximab in a case of bilateral refractory Mooren’s ulcer. Clin Experiment Ophthalmol 2007 ; 35 : 871-3.
[50] Odorcic S, Keystone EC, Ma JJ. Infliximab for the treatment of refractory progressive sterile peripheral ulcerative keratitis associated with late corneal perforation : 3-year follow-up. Cornea 2009 ; 28 : 89-92.
[51] Pham M, Chow CC, Badawi D, et al. Use of infliximab in the treatment of peripheral ulcerative keratitis in Crohn disease. Am J Ophthalmol 2011 ; 152 : 183-88.e2.
[52] Saw VP, Cornelius N, Salama AD, et al. Infliximab therapy for aggressive Mooren ulceration. Arch Ophthalmol 2008 ; 126 : 734.
[53] Thomas JW, Pflugfelder SC. Therapy of progressive rheumatoid arthritis-associated corneal ulceration with infliximab. Cornea 2005 ; 6, 24 : 742-4.
[54] Hernandez-Illas M, Tozman E, Fulcher SF, et al. Recombinant human tumor necrosis factor receptor Fc fusion protein (Etanercept) : experience as a therapy for sight-threatening scleritis and sterile corneal ulceration. Eye Contact Lens 2004 ; 30 : 2-5.
[55] Gueudry J, LeHoang P, Bodaghi B. Anti-tumor necrosis factor-alpha agents in noninfectious uveitis. Dev Ophthalmol 2012 ; 51 : 63-78.
[56] Huerva V, Sanchez MC, Traveset A, et al. Rituximab for peripheral ulcerative keratitis with wegener granulomatosis. Cornea 2010 ; 29 : 708-10.
[57] Muraine M, Gueudry J, Toubeau D, et al. Intérêt des greffes de membranes amniotiques dans les pathologies oculaires de surface J Fr Ophtalmol 2006 ; 29 : 1070-83.
[58] Maeno A, Naor J, Lee HM, et al. Three decades of corneal transplantation : indications and patient characteristics. Cornea 2000 ; 19 : 7-11.
[59] Sainz de la Maza, M, Foster CS, Jabbur NS, et al. Ocular characteristics and disease associations in scleritis-associated peripheral keratopathy. Arch Ophthalmol 2002 ; 120 : 15-9.
[60] Foster CS, Forstot SL, Wilson LA. Mortality rate in rheumatoid arthritis patients developing necrotizing scleritis or peripheral ulcerative keratitis. Effects of systemic immunosuppression. Ophthalmology 1984 ; 91 : 1253-63.
[61] Hoang-Xuan T. La rosacée oculaire. J Fr Ophtalmol 1999 ; 22 : 467-74.
[62] Doan S, Zerbib J, Bodemer C, et al. Kératoconjonctivite phlycténulaire et rosacée oculaire de l’enfant : une même maladie ? J Fr Ophtalmol 2009 ; 32 : 1S31.
[63] Chung G. Phlyctenular keratoconjunctivitis and marginal staphylococcal keratitis. In : Krachmer JH, Mannis MJ, Holland EJ. Eds. Cornea. 3rd ed. Mosby : St-Louis : Mosby ; 2011.
[64] Doan S, Gabison E, Gatinel D, et al. Topical cyclosporine A in severe steroid-dependent childhood phlyctenular keratoconjunctivitis. Am J Ophthalmol 2006 ; 141 : 62-66.
[65] Joseph MA, Kaufman HE, Insler M. Topical tacrolimus ointment for treatment of refractory anterior segment inflammatory disorders. Cornea 2005 ; 24 : 417-20.
[66] Bernauer W, Ficker LA, Watson PG, et al. The management of corneal perforations associated with rheumatoid arthritis. An analysis of 32 eyes. Ophthalmology 1995 ; 102 : 1325-37.
[67] Kervick GN, Pflugfelder SC, Haimovici R, et al. Paracentral rheumatoid corneal ulceration. Clinical features and cyclosporine therapy. Ophthalmology 1992 ; 99 : 80-8.
[68] Harper SL, Foster CS. The ocular manifestations of rheumatoid disease. Int Ophthalmol Clin 1998 ; 38 : 1-19.
[69] Majo F, Rochat A, Nicolas M, et al. Oligopotent stem cells are distributed throughout the mammalian ocular surface. Nature 2008 ; 456 : 250-4.
[70] Majo F, Barrandon Y, Othenin-Girard P, et al. Pathologies épithéliales cornéennes et insuffisance en cellules souches limbiques. J Fr Ophtalmol 2006 ; 29 : 1060-9.
[71] Dua HS, Azuara-Blanco A. Limbal stem cells of the corneal epithelium. Surv Ophthalmol 2000 ; 44 : 415-25.
[72] Puangsricharern V, Tseng SC. Cytologic evidence of corneal diseases with limbal stem cell deficiency. Ophthalmology 1995 ; 102 : 1476-85.
[73] Samson CM, Nduaguba C, Baltatzis S, et al. Limbal stem cell transplantation in chronic inflammatory eye disease. Ophthalmology 2002 ; 109 : 862-8.
[74] Tougeron-Brousseau B, Delcampe A, Gueudry J, et al. Vision-related function after scleral lens fitting in ocular complications of Stevens-Johnson syndrome and toxic epidermal necrolysis. Am J Ophthalmol 2009 ; 148 : 852-9 e2.
[75] Tuli SS, Schultz GS, Downer DM. Science and strategy for preventing and managing corneal ulceration. Ocul Surf 2007 ; 5 : 23-39.