Traitements particuliers
A. Muselier-Mathieu, C. Creuzot-Garcher
Le sérum autologue constitue une source intéressante de facteurs de croissance et d’éléments trophiques pour la cornée. Il est indiqué pour les formes sévères de sécheresse oculaire avec kératoconjonctivite sèche résistant à un traitement lubrifiant bien conduit, alors qu’une thérapeutique anti-inflammatoire locale a été mise en route. Le sérum autologue constitue une approche thérapeutique intéressante dans les kératites neurotrophiques parmi les alternatives telles que la membrane amniotique et les thérapies matricielles. La généralisation du sérum autologue reste problématique en raison de la réglementation et des conditions de fabrication impliquant nécessairement les centres de transfusion sanguine ; cela limite son utilisation en pratique.
La thérapie matricielle est une nouvelle approche thérapeutique ayant pour objectif de rétablir l’architecture de soutien des cellules et de favoriser la communication cellulaire. Elle permet de restaurer le micro-environnement cellulaire perturbé à l’occasion d’une lésion et d’améliorer ainsi la vitesse et la qualité de cicatrisation d’un tissu lésé.
La cicatrisation cornéenne est un phénomène complexe qui met en jeu de multiples acteurs cellulaires et moléculaires. L’équilibre est régi par un ensemble d’interactions et de mécanismes de régulation. En cas d’atteinte grave ou multiple, ceux-ci peuvent être dépassés, la cicatrisation normale ne peut se faire, la cornée peut alors être le lieu d’une digestion plus ou moins sévère conduisant parfois à des lésions cornéennes chroniques. Elles peuvent être à l’origine de douleurs mais surtout de phénomènes cicatriciels fibrotiques qui altèrent de façon irréversible la vision. Ces troubles de la cicatrisation se rencontrent dans de multiples pathologies ophtalmologiques de la surface oculaire (kératoconjonctivite allergique, syndrome sec sévère, atteinte auto-immune, atteinte secondaire à une iatrogénie, etc.). Parmi celles-ci, la kératite neurotrophique (KN) représente un modèle intéressant. Il s’agit d’une anomalie rare de la cornée de nature « dégénérative » secondaire à une diminution ou une abolition de la sensibilité cornéenne par atteinte de l’innervation trigéminale (nerf V). L’épithélium cornéen est la première structure anatomique touchée, avec apparition d’une épithéliopathie et de défects persistants dont la cicatrisation spontanée s’avère difficile (fig. 19-1). Au fur et à mesure de la progression de la maladie, les couches profondes cornéennes sont atteintes. Il en résulte l’apparition de complications stromales avec fonte, opacification, ulcération cornéenne de profondeur variable pouvant aller jusqu’au stade de perforation cornéenne. Comme dans l’ensemble des troubles de la cicatrisation cornéenne, la précocité du diagnostic conditionne leur pronostic. Les principales armes thérapeutiques sont médicales (arrêt des traitements épithéliotoxiques, lubrification par des collyres sans conservateurs, lentilles pansements, molécules anti-inflammatoires, sérum autologue, etc.). Dans quelques centres, une approche thérapeutique innovante, la thérapie matricielle, est disponible depuis le début de l’année 2014. Lors des stades plus sévères, elles peuvent être associées à des procédures chirurgicales (tarsorraphie, greffe de membrane amniotique ou GMA) [1]. Il n’existe pas à l’heure actuelle de consensus réel quant au traitement de la KN ou de ces anomalies de la cicatrisation cornéenne. Le choix au sein de l’arsenal thérapeutique reposera sur le stade de sévérité, l’ancienneté de l’atteinte et de l’habitude du praticien. Nous allons présenter ici les deux principales approches permettant de stimuler la cicatrisation cornéenne : le sérum autologue (SA) et la thérapie matricielle, nouvelle entité pharmacologique à notre disposition.
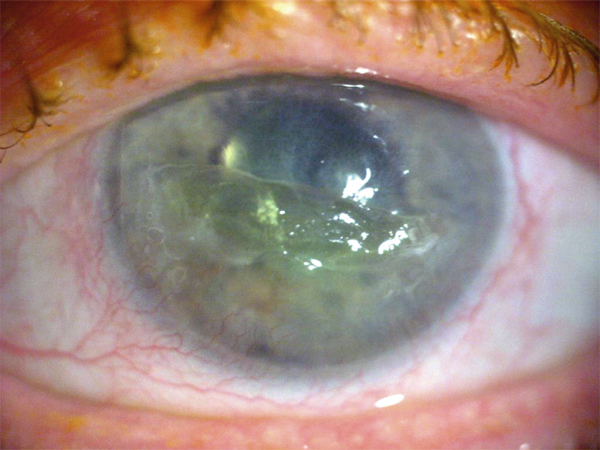
Fig. 19-1 Kératite neurotrophique.
Le principe du traitement par sérum autologue (SA) repose sur la nécessité de supplémenter la surface oculaire en facteurs trophiques. Les facteurs de croissance, les vitamines, la fibronectine présents dans du sérum ont, au moins sur le plan fondamental, démontré un effet bénéfique sur la croissance cellulaire. Plusieurs facteurs de croissance ont révélé des effets positifs sur la cicatrisation épithéliale, notamment l’epidermal growth factor (EGF) et le nerve growth factor (NGF) [2]. Toutefois, la production de facteurs de croissance recombinants, produits par génie génétique, n’étant actuellement accessible que dans le cadre d’essais cliniques (par exemple pour le NGF), d’autres sources de facteurs vitaminés et de facteurs de croissance par instillation de collyre de SA ont été recherchées.
Les approches thérapeutiques dans les syndromes secs (SS) s’organisent de la façon suivante selon leur degré de gravité [3–6] :
supprimer les facteurs aggravants (médicaments asséchants, tabac, mauvaise ergonomie des postes de travail) ;
apporter des facteurs lubrifiants permettant de limiter le manque de larmes (larmes artificielles, gels) ;
limiter l’évacuation des larmes (lunettes à chambre humide, clous méatiques) ;
traiter les réactions inflammatoires presque toujours associées (anti-inflammatoires stéroïdiens et non stéroïdiens, ciclosporine) ;
traiter la surface oculaire par apport de facteurs spécifiques (facteurs de croissance, fibronectine, acide rétinoïque, membrane amniotique ou MA).
On constate donc que l’apport de facteurs trophiques à la surface oculaire constitue une approche thérapeutique même si elle est limitée aux cas les plus sévères. Le plus souvent, le SA ne trouve sa place qu’après l’échec d’une instillation régulière de lubrifiants, de l’instillation de ciclosporine dans les SS et/ou de la mise en place de clous méatiques.
Ce traitement, souvent limité dans le temps, est avant tout intéressant en traitement adjonctif de tout l’arsenal thérapeutique rappelé ci-dessus pour des formes graves de sécheresse oculaire de type kératoconjonctivites sèches (KCS) (fig. 19-2) et dans les KN (voir fig. 19-1). L’apport de la ciclosporine a sans doute un peu limité les indications de SA en dimimuant plus précocement la réaction inflammatoire de la surface oculaire dans la KCS en particulier lors de syndrome de Gougerot-Sjögren ou SGS (fig. 19-3). Le SA constitue toutefois une méthode efficace et rapide d’obtention d’une amélioration des symptômes et des signes cliniques notamment pour les patients présentant des kératites avec ulcération confluente, qui sont parfois très douloureuses. Il est une arme très précieuse pour obtenir une cicatrisation dans les KN qui associent une altération de la sensibilité cornéenne entraînant un défaut de cicatrisation épithéliale. Les conséquences de celle-ci vont d’une simple kératite à des perforations cornéennes de mauvais pronostic. L’évolution torpide de ces affections nécessite une prise en charge rapide et agressive dans laquelle le SA a sa place.
Le SA apporte également un complément essentiel dans des formes graves de kératolyse dans certaines polyarthrites rhumatoïdes parfois responsables de perforation. Il faut savoir distinguer, lors des ulcérations liées aux affections systémiques (périartérite noueuse, maladie de Wegener, polyarthrite rhumatoïde), deux situations distinctes :
les ulcérations périphériques d’origine inflammatoire, aggravées par la conjonctive en regard (fig. 19-4), dans lesquelles le principe est donc d’effectuer, avant tout, une résection de la conjonctive adjacente à l’ulcère ;
les kératolyses centrales liées, avant tout, à un défaut de lubrification de surface ; elles bénéficieront d’une lubrification active et de traitements procicatrisants (pommade, GMA, SA). Certaines kératites sèches très sévères lors des syndromes de rejet du greffon contre l’hôte (GVH) (fig. 19-5) ont été très nettement améliorées par les instillations de SA.
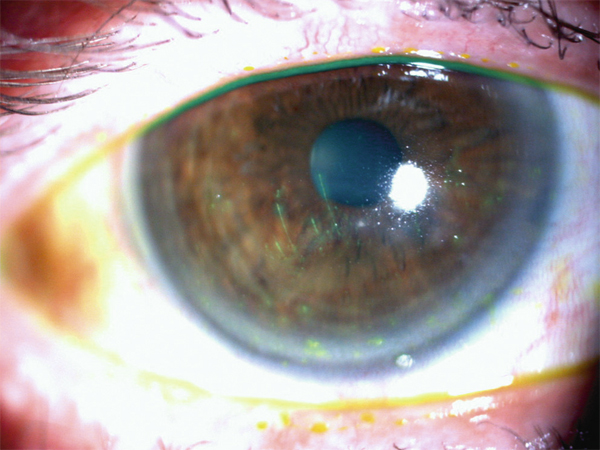
Fig. 19-2 Kératoconjonctivite sèche avec kératite filamenteuse.
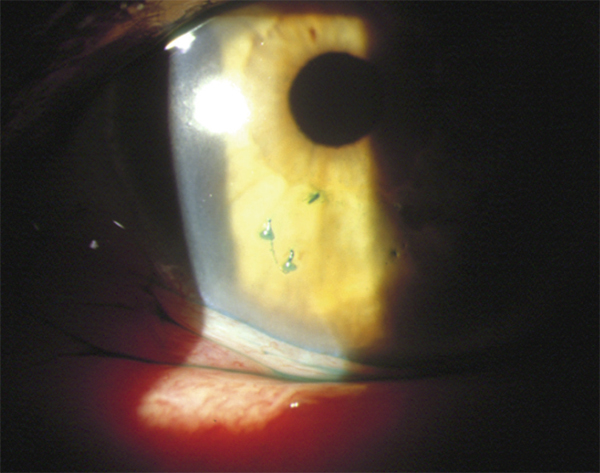
Fig. 19-3 Syndrome de Gougerot-Sjögren avec kératoconjonctivite sèche.
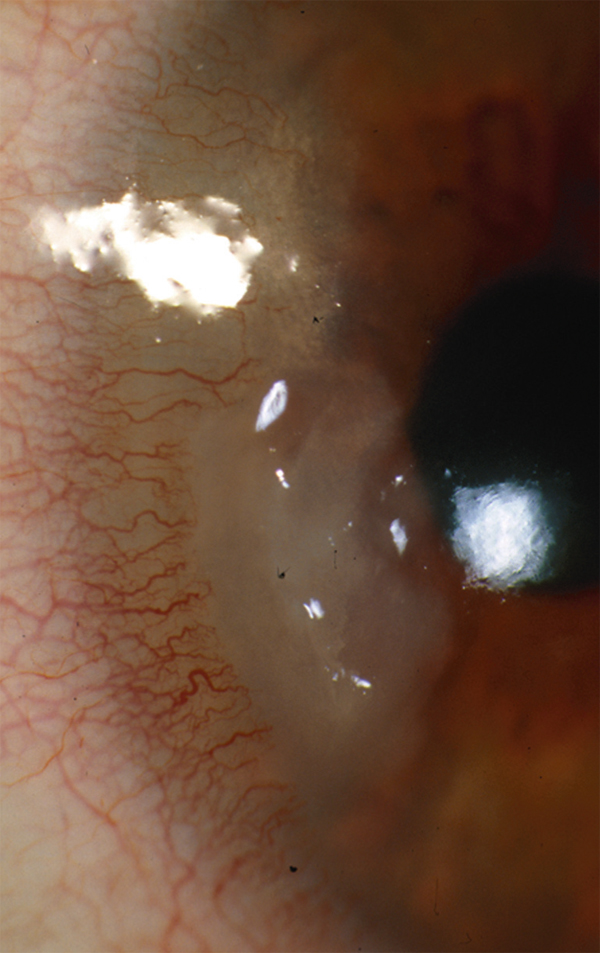
Fig. 19-4 Ulcération périphérique dans le cadre d’une polyarthrite rhumatoïde.
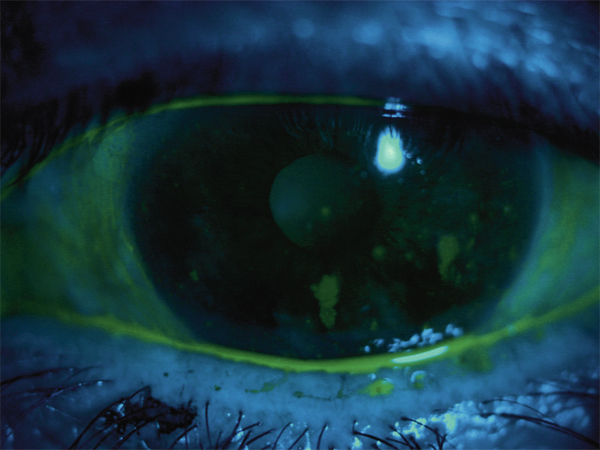
Fig. 19-5 Kératoconjonctivite sèche dans le cadre d’une réaction d’un greffon contre l’hôte.
Fox a proposé pour la première fois en 1984 l’utilisation du SA lors des sécheresses oculaires survenant dans le SGS [7]. Son usage est resté un peu confidentiel jusqu’à ce que Tsubota propose, au début des années 1990, ce traitement lors des déficits chroniques de l’épithélium cornéen et lors des SGS [8, 9]. Depuis ces premières études, de nombreux auteurs ont examiné l’effet du SA pour soigner les différentes affections de la surface oculaire.
Les indications les plus courantes sont les différentes causes de sécheresse oculaire sévère mais le champ d’action est plus vaste (encadré 19-1).
• Syndrome sec (SS) sévère avec kératoconjonctivite sèche (KCS), en particulier le syndrome de Gougerot-Sjögren, qu’il soit primaire ou secondaire mais également les SS survenant dans le cadre de rejet du greffon contre l’hôte ou du syndrome de Steven-Johnson
• Déficits chroniques de l’épithélium (persistent epithelial defect ou PED)
• Kératites neurotrophiques et plus généralement les états de mauvaise cicatrisation (herpès, diabète, greffe de cornée, débridement peropératoire de l’épithélium chez des patients diabétiques)
• Kératalgies récidivantes
• Insuffisances limbiques
• Kératite limbique supérieure de Théodore
Les SS sévères selon le Dry Eye WorkShop (DEWS) sont définis par les critères suivants [5] :
symptômes de sécheresse souvent évalués par le score OSDI (ocular surface disease index) supérieur à 40/100 ;
signes objectifs de sécheresse oculaire. Au moins un signe parmi les suivants :
break-up time (BUT) inférieur à 5 secondes,
imprégnation cornéenne par la fluorescéine supérieure à 2/5 selon le score d’Oxford,
test de Schirmer inférieur à 5 mm à 5 minutes.
Le SA est également indiqué dans les défauts de cicatrisation chroniques de l’épithélium (persistant epithelial defect ou PED). Le diagnostic de PED repose sur l’existence d’une ulcération épithéliale résistante à un traitement lubrifiant depuis au moins 2 semaines [10].
Le SA s’est avéré efficace pour le traitement des SS graves liés aux SGS, aux GVH ou pour traiter certaines kératites épithéliales d’origine trophique [11]. Il a été évalué en comparaison des autres possibilités thérapeutiques mais le plus souvent sans essai randomisé ou avec un insu difficile à contrôler [12–18]. Un essai clinique rapporte même une instillation d’un traitement dans un œil et d’un traitement dans l’autre, car les patients concernés par un traitement par SA sont rares [19].
Les auteurs retrouvent globalement une bonne efficacité du traitement avec une amélioration dans environ 80 % des cas de SS sévères [20, 21]. Celle-ci semble dépendre de la durée des symptômes précédant la mise en route du traitement et de la pathologie systémique sous-jacente. Il semble que les états très inflammatoires soient plus résistants au traitement par SA. Celui-ci serait en effet plus efficace dans les SS primaires que dans les SS secondaires qui s’accompagnent d’une augmentation plus importante de la réaction inflammatoire locale [12].
La rareté des indications, l’hétérogénéité des pathologies causales, les modalités de traitement et la question épineuse de sa fabrication ont sans doute contribué à la difficulté à arriver à un consensus sur les conditions de préparation et d’utilisation du traitement par SA. Parmi les différences relevées dans les études, on note des concentrations du SA qui varient de 20 à 100 %. La concentration de 20 % est la plus commune depuis les travaux de Tsubota [9, 22]. Il avait en effet mesuré la concentration de fibroblast growth factor (FGF) qui avait été retrouvée 5 fois plus importante dans le sérum pur. Ce facteur de croissance ayant des effets potentiellement délétères sur la croissance épithéliale, une dilution au cinquième permettait de limiter cet effet. D’autres auteurs ont toutefois employé des concentrations de 100 %. Cette concentration est parfois jugée peu agréable par les patients en raison de sa viscosité et peut entraîner des dépôts de complexes immuns en périphérie de la cornée donnant un aspect d’infiltrats marginaux [23]. Un traitement du SA à 100 % par « chauffage » à 56 °C pendant 1 heure avant conditionnement semble diminuer la concentration en immunoglobulines E et l’activité du complément tout en préservant son effet biologique. La diminution de la concentration de l’EGF n’aurait pas d’effet sur l’efficacité du produit final [24]. Cho et al. ont retrouvé une meilleure efficacité avec des concentrations de 100 % mais uniquement dans les SGS, alors qu’une concentration de 50 % avec du sérum salé aboutit aux mêmes résultats dans les autres causes de sécheresse grave. Cette différence d’action entre les causes de SS est d’ailleurs fréquemment retrouvée et probablement liée à l’intensité de la réaction inflammatoire locale. L’inconvénient majeur de l’absence de dilution est qu’il faut ainsi une quantité de sérum plus importante pour un traitement au long cours contraignant alors à multiplier les prises de sang. L’avantage, outre une efficacité supposée meilleure, est l’absence de manipulation liée à la dilution permettant de limiter les risques de contamination [25].
Le diluant le plus couramment utilisé est le sérum salé 0,9 % [17, 18, 22]. La crainte d’observer des infections à partir d’un milieu propice au développement des germes a poussé les auteurs à utiliser d’autres diluants. Certains auteurs ont proposé une dilution avec des antibiotiques en raison du risque, au moins théorique, d’infection d’un collyre sans conservateurs et d’instillations répétées. Le risque infectieux ne serait pourtant que relatif en raison de la concentration élevée en lysozyme et en immunoglobulines dans le SA. Le risque de contamination est toutefois bien réel et constaté tant sur les flacons de sérum après utilisation, que cliniquement avec quelques cas d’infection rapportés dans les études [22, 26]. Il semble que l’adjonction d’antibiotiques diminue l’efficacité du sérum, peut-être en raison d’une toxicité des conservateurs ou d’une modification des caractéristiques biochimiques de la solution obtenue. L’utilisation d’un diluant à base d’antibiotiques peut donc se concevoir chez un patient avec des capacités de défense diminuées ou des conditions d’hygiène discutables (mais cette dernière condition doit certainement faire poser l’indication d’un tel traitement). Certains auteurs ont également proposé de diluer le SA avec du hyaluronate de sodium (HS) à différentes concentrations afin d’augmenter le temps de rémanence du SA au niveau de la surface oculaire [19, 25]. Cette dilution ne semble pas réellement augmenter l’efficacité du sérum pour certains auteurs [25], alors que d’autres retrouvent l’effet inverse [19]. Cette dilution avec le HS n’entraîne la modification ni de l’osmolarité ni du pH. Ils rapportent d’ailleurs des résultats significativement meilleurs, tant en termes de caractéristiques cliniques que tissulaires. Ces résultats discordants sont probablement liés au fait que l’action du SA est majeure et que l’effet potentiellement synergique du HS reste marginal.
Enfin, différentes méthodes de conditionnement du SA ont été proposées pour essayer de résoudre le problème de la contamination de l’extrémité des flacons lors des instillations répétées. Toutefois, les flacons compte-gouttes combinent la meilleure facilité d’utilisation et le coût le plus faible [27, 28]. Il faut enfin veiller à utiliser des flacons opaques permettant de préserver les vitamines présentes dans le SA.
La difficulté à organiser une collecte de sang pour reconstituer le SA chez les patients atteints de troubles sévères de la surface oculaire a conduit les auteurs à envisager diverses modalités pour obtenir des vitamines et des facteurs de croissance :
utilisation d’un milieu riche en facteurs de croissance, identique à celui qui est utilisé pour effectuer des cultures de cellules épithéliales [29]. Ce milieu contient de l’EGF, du FGF, de la vitamine C ainsi que différentes protéines et acides aminés. Il est toutefois dépourvu de NGF. Cette option mérite d’être confirmée par des études comparatives multicentriques ;
utilisation de sérum allogénique « prêt à l’emploi » : cette option est intéressante car elle suppose une préparation de sérum à partir de sang de donneurs mâles de groupe AB (pour éviter la présence d’anticorps anti-A ou B). Les premiers essais semblent montrer une efficacité meilleure dans les KCS que dans les troubles de cicatrisation type PED [30] et méritent d’être confirmés par des essais multicentriques. La même option a d’ailleurs été proposée dans certains cas de rejet du greffon contre l’hôte [31] ;
apport de facteurs de croissance plus ou moins purifiés : sérum du sang du cordon [32], NGF (essais actuellement en cours) [33].
La problématique de la généralisation de l’utilisation du SA n’est pas seulement française, elle est rencontrée également partout en Europe et outre-Atlantique. La préparation et la généralisation du traitement par collyre de SA pose des problèmes multiples.
- Encadré 19-2 - Principes de fabrication du sérum autologue (pour une concentration à 20 %)
1. Ponction veineuse (six tubes gélatinés de 6 ml)
2. Mise en position verticale à température ambiante pendant 20 minutes
3. Centrifugation (3500 tours/min pendant 20 minutes)
4. Recueil du sérum autologue (environ 10 ml pour un prélèvement de sang total de 36 ml) sous hotte à flux laminaire
5. Reconstitution de la solution par dilution avec 80 % de sérum physiologique et 20 % de sérum autologue
6. Remplissage de bouteilles stériles, opaques avec compte-gouttes (à raison de 5 ml de solution par flacon) identifiées par l’étiquette du patient
7. Envoi de 1 ml de solution pour analyse bactériologique
8. Conditionnement de la solution, conservée en boîte isotherme avec les flacons et de la glace pour acheminement chez le patient
9. Mise en conservation : un flacon est maintenu au réfrigérateur, les autres flacons sont conservés dans un endroit propre et séparé des aliments, au congélateur à –20 °C durant 3 mois. On rappelle au patient qu’il ne doit pas sortir son traitement longtemps à l’avance et qu’il doit limiter le plus possible les durées de maintien à température ambiante. Le patient doit stopper les instillations en cas d’œil rouge et collé. Il doit alors impérativement ramener son flacon de collyre pour analyse bactériologique
Risque infectieux pour les agents préparant le sérum, en raison de la séropositivité pour l’hépatite B ou C chez les patients prélevés, retrouvé dans 3,3 % des cas [34]. L’utilisation de sérum allogénique chez des donneurs connus permettrait de limiter ce risque.
Reconstitution du sérum supposant une dilution, donc une manipulation, avec un risque infectieux même si celui-ci semble négligeable. Celle-ci doit néanmoins être effectuée dans des conditions d’asepsie stricte (hotte à flux laminaire).
Stockage du sérum à court et moyen terme : les travaux initiaux de Tsubota ont montré la très bonne stabilité des facteurs de croissance d’un sérum congelé pendant 3 mois et cette bonne conservation a été confirmée pour une conservation à –20 °C pendant 6 mois [35].
Durée d’utilisation d’un flacon lors de son utilisation : les études donnent des conditions variables. Certains essais cliniques conditionnent le SA à raison d’un flacon par jour mais d’autres le renouvellent moins fréquemment (entre 1 et 3 semaines). Il semble raisonnable de limiter l’utilisation d’un même flacon à 1 semaine.
Contrôle bactériologique des flacons avant délivrance et après utilisation (aisé à organiser lors d’essais cliniques mais plus complexe en cas de généralisation de la méthode) : les auteurs retrouvent une contamination des bouteilles de SA dans six des onze flacons après 1 mois de traitement. Une série récente fait état de 6,12 % de culture positive avec un taux non négligeable de mycoses en Thaïlande sans qu’aucun patient n’ait développé d’infection clinique [26].
Coût du traitement : la prise en charge du traitement peut s’avérer problématique selon les pays, elle est nulle aux États-Unis (pour un coût évalué à 16 dollars pour une semaine de traitement), alors que son intérêt évalué par certains systèmes d’assurance maladie est indéniable et « coût-efficace » [36].
Problèmes réglementaires : l’utilisation d’un dérivé du sang en tant que traitement n’est absolument pas reconnue par les systèmes d’assurance maladie. Ainsi, en dépit d’une littérature abondante, seuls 17 % des centres hospitaliers ophtalmologiques en Allemagne peuvent assurer la distribution de collyre au SA [20]. Actuellement, la prise en charge en France en pratique reste limitée à des cas sporadiques grâce à la collaboration de certains services d’ophtalmologie et des établissements de transfusion sanguine. La prise en charge financière reste problématique.
L’utilisation du SA relève donc actuellement de l’entière responsabilité des différents acteurs de santé que sont les ophtalmologistes, les infirmières et les équipes des établissements de transfusion sanguine pour réaliser un geste interdit car non codifié. Bien entendu, son utilisation – le plus souvent transitoire – reste à discuter en fonction de chaque cas. Elle ne peut se concevoir de façon isolée, elle précède ou accompagne un autre geste : MA, greffe de cornée dans les formes sévères de kératolyse ou de KN. Le SA est aussi à intégrer dans l’ensemble de l’arsenal thérapeutique des SS sévères en cas d’acutisation de la KCS. Dans certaines formes sévères de kératites liées au GVH, son efficacité remarquable le rend incontournable.
La thérapie matricielle repose sur un agent qui initie le processus naturel de régénération tissulaire permettant d’améliorer la vitesse et la qualité de cicatrisation d’un tissu. Elle a pour objectif de restaurer le micro-environnement cellulaire perturbé au cours d’une lésion. Elle permet de rétablir l’architecture de soutien des cellules et de favoriser la communication entre ces dernières.
La technologie des agents de régénération (regenerating agents ou RGTA) est une nouvelle approche de la thérapie matricielle basée sur la protection des protéines structurales et des facteurs endogènes de la matrice extracellulaire. Elle a été développée initialement pour le traitement des anomalies chroniques de cicatrisation cornéenne (défauts épithéliaux persistants, KN, ulcère neurotrophique et dystrophies cornéennes antérieures chroniques douloureuses). Sa prescription est préconisée chez des patients présentant un échec de cicatrisation malgré un traitement conventionnel bien conduit et avant d’envisager une procédure plus invasive ou chirurgicale. Elle est en cours d’évaluation depuis quelques années en France dans les ulcères de cornée et les dystrophies cornéennes chroniques résistantes aux traitements usuels [37]. L’efficacité de ce traitement a d’abord été décrite dans des pathologies non ophtalmologiques (ulcères dermatologiques d’origine vasculaire ou diabétique par exemple). En ophtalmologie, des études cliniques, pilotes ou compassionnelles menées dans diverses pathologies de la surface oculaire par plusieurs équipes françaises, montrent des résultats prometteurs.
Schématiquement et pour rappel, la matrice extracellulaire (MEC) est un réseau de protéines constituant la charpente de soutien entre les cellules. Elle est composée de protéines de structure (collagène, fibronectine, laminine, élastine) et de protéines de communication cellulaires représentées principalement par les cytokines et les facteurs de croissance. Ces protéines dites matricielles sont reliées entre elles par des sucres complexes appelés les glycosaminoglycanes (GAG). Parmi ceux-ci, l’héparane sulfate joue un rôle central au sein de la MEC. Cette dernière interviendrait dans le stockage, la protection et la régulation de la biodisponibilité des cytokines permettant ainsi l’homéostasie tissulaire. Aussi, lorsqu’une cellule meurt au cours du processus physiologique, elle active des enzymes qui dégradent localement les GAG et entraînent donc une libération locale de cytokines (retenues par les GAG). Les signaux nécessaires à la migration, à la prolifération et à la réparation tissulaire sont libérés permettant le plus souvent une restitution ad integrum. Dans le cas de lésions post-traumatiques ou thermiques, les phénomènes précédemment décrits sont amplifiés ou altérés (les cellules agressées relarguent des enzymes de type protéases conduisant à une destruction de l’architecture matricielle) et peuvent être alors à l’origine de cicatrices tissulaires ou de défects.
Les RGTA constituent une nouvelle classe thérapeutique favorisant la vitesse et la qualité de la réparation tissulaire pouvant même parfois entraîner une régénération complète. Les effets des RGTA ont été étudiés dans plusieurs pathologies (ulcères dermatologiques, brûlures et ulcères cornéens, etc.).
Le RGTA OTR4120 est un polymère de carboxyméthyl dextran sulfate biodégradable conçu pour mimer les glycosaminoglycanes (héparanes sulfates) qui sont spécifiquement liés aux facteurs de croissance et qui sont dégradés en cas d’agression tissulaire [38]. Cet agent de régénération qui est résistant aux héparinases va se substituer aux glycosaminoglycanes détruits par l’agression permettant de recréer un micro-environnement propice à la régénération tissulaire, la migration cellulaire et favoriser ainsi la cicatrisation. Ses modes d’actions sont multiples dont celui de protection de l’ensemble des protéines de communication qui sont liées à l’héparine ou aux héparanes sulfates. Parmi les plus connus, on peut citer les fibroblast growth factors 1 et 2 (FGF-1 et FGF-2), le transforming growth factor β1 (TGF-β1), le vascular endothelial growth factor (VEGF) ainsi que de nombreuses cytokines. Plusieurs auteurs ont décrit les effets in vitro et in vivo du RGTA OTR4120. In vitro, le RGTA favoriserait la formation des composants de la MEC grâce à une action sur le collagène, et notamment le collagène de type 1, 3 et 5, sur la synthèse des GAG, en augmentant le remodelage de la MEC et en inhibant l’effet de certaines enzymes (élastase, héparinase, etc.) [39]. Le nombre de sites de fixation disponibles pour les RGTA est limité dans un tissu lésé. En cas d’apport trop important de RGTA, le RGTA non fixé va pouvoir retirer de la MEC des facteurs de croissance et empêcher leur action pour la cicatrisation, ce pourquoi le nombre d’instillations préconisé est réduit.
Les résultats de multiples études précliniques sur différents modèles animaux et différents tissus (os, tractus digestif, peau, etc.) suggèrent que l’administration locale ou systémique de RGTA améliore la vitesse et la qualité de cicatrisation [39, 40].
En ophtalmologie, Brignole-Baudouin et al. confirment in vivo sur un modèle animal la très bonne tolérance du RGTA OTR4120 et son efficacité comparées à du sérum physiologique sur la cicatrisation cornéenne après brûlure chimique [41]. De plus, d’autres auteurs ont montré qu’après instillation topique de RGTA sur une cornée normale et une cornée ulcérée, on ne retrouvait pas de pénétration en chambre antérieure de la thérapie matricielle. Aucune toxicité cellulaire n’a été démontrée [42].
Les premières données concernant l’efficacité des RGTA en ophtalmologie ont été obtenues suite à des études précliniques effectuées chez le lapin, sur lesquels a été réalisé expérimentalement un ulcère cornéen par brûlure cornéenne chimique par bases [41]. Dans ce modèle, une seule goutte de solution de RGTA à une concentration de 100 µg/ml a permis d’améliorer le processus de cicatrisation cornéenne et d’arriver à une cicatrisation complète au bout d’une semaine. D’un point de vue histologique, à 7 jours et en comparaison au groupe témoin qui avait reçu du sérum physiologique à 0,9 %, il existait de façon significative moins d’œdème stromal, de fibrose, de néovascularisation. Le profil histologique cornéen était proche à 8 jours de l’architecture cornéenne normale dans le groupe traité contrairement au groupe témoin (épithélium aminci, stroma néovascularisé, etc.).
C’est une étude pilote française qui a montré l’efficacité et la bonne tolérance des RGTA dans les dystrophies cornéennes chroniques et les ulcères de cornée rebelles avec une diminution des douleurs et une meilleure cicatrisation [37]. Une étude prospective d’Aifa et al. portant sur 11 yeux présentant une KN avec anesthésie cornéenne totale et recevant une goutte de Cacicol 20® a montré une diminution significative de la surface de l’ulcère neurotrophique avec le temps [43]. Une cicatrisation complète était retrouvée chez 72,7 % des patients après une période moyenne de traitement de 8,7 semaines. Un échec de traitement était présent chez trois patients nécessitant le recours à une thérapeutique plus invasive (GMA, greffe de cornée). Aucune amélioration de l’acuité visuelle n’a été notée avec la cicatrisation cornéenne. Dans les deux études précédemment décrites, aucun effet indésirable local ou systémique n’a été observé. Une troisième étude prospective a été réalisée chez 24 patients présentant des ulcères cornéens réfractaires aux traitements conventionnels et d’étiologies variées (post-infectieux, post-brûlure cornéenne, syndrome de Lyell, glaucome néovasculaire, ulcère de Mooren, ulcère sur greffe de cornée, etc.) [44]. Les patients recevaient une goutte de Cacicol 20® tous les 2 ou 3 jours pendant 1 à 3 mois selon la cicatrisation cornéenne. Une cicatrisation complète était observée chez 16 patients (66,7 %) avec un délai moyen entre 1 semaine et 5 mois. Une étude similaire a étudié l’efficacité du Cacicol 20® dans 20 yeux de 16 patients présentant un ulcère cornéen chronique résistant aux traitements conventionnels [45]. Les causes des ulcères étaient variables : deux ulcères post-brûlure chimique par bases ; deux KN ; un ulcère de Mooren ; un ulcère de pseudo-Mooren ; trois ulcères post-anneaux intracornéens ; neuf ulcères post-chirurgicaux de greffe de cornée ; un ulcère sur rosacée oculaire. Les patients ont reçu un traitement par Cacicol 20® à une posologie d’une goutte tous les 2 jours pendant 1 à 2 mois selon la vitesse de cicatrisation. Une cicatrisation complète était obtenue chez 12 patients (69 % des cas) au bout de quelques jours à quelques semaines. Un échec de cicatrisation était noté chez trois patients et une cicatrisation incomplète chez un patient. La tolérance du traitement était bonne. L’efficacité d’un traitement par Cacicol 20®, dans la prise en charge de patients présentant un syndrome sec sévère secondaire à un SGS avec une kératite ponctuée superficielle (KPS) résistante aux traitements conventionnels, a été montrée chez trois patients [46]. Une amélioration des signes subjectifs (douleurs, sensation de corps étranger, sensation de brûlures oculaires) et objectifs (diminution de la KPS et amélioration de l’acuité visuelle) a été obtenue sans effet secondaire du traitement. D’autres équipes ont testé avec des résultats encourageants la thérapie matricielle dans d’autres pathologies ophtalmologiques : ulcère trophique d’origine zostérienne, défect épithélial persistant, signes fonctionnels de la dystrophie de Cogan, ulcère post-photokératectomie réfractive ou crosslinking, etc. [47–51].
Les RGTA en ophtalmologie sont disponibles et distribués par les laboratoires Théa sous le nom de Cacicol 20®. Il s’agit d’un collyre en unidose, sans conservateur. Une boîte comprend cinq unidoses à stocker à température ambiante et à l’abri de la lumière. Son indication est pour le moment réservée à la prise en charge des anomalies de cicatrisation cornéenne chronique (défect épithélial persistant, dystrophie cornéenne antérieure douloureuse). La posologie recommandée dépend de l’indication clinique et de l’évolution de la cicatrisation. Elle est classiquement préconisée en traitement d’attaque à une goutte 2 fois/semaine puis en traitement d’entretien à une goutte/semaine. Le traitement est aujourd’hui à la charge du patient.
Ce nouvel agent de thérapie matricielle semble donc prometteur et il pourrait devenir une arme thérapeutique de choix dans la prise en charge de nombreuses pathologies affectant la cornée et la surface oculaire et notamment les KN, aujourd’hui et dans le futur. En effet, leur prise en charge actuelle se révèle souvent difficile et parfois invasive (SA, greffe de membrane amniotique). Son schéma posologique simple, sa bonne tolérance locale et générale et son accès plus facile sont des atouts majeurs. Les résultats de l’étude pilote seront bientôt disponibles. Il reste à définir dans un avenir proche la place et les règles de prescription de cette nouvelle famille thérapeutique au sein de l’arsenal thérapeutique ainsi que leur remboursement.
[1] Khokhar S, Natung T, Sony P, et al. Amniotic membrane transplantation in refractory neurotrophic corneal ulcers : a randomized, controlled clinical trial. Cornea 2005 ; 24 : 654-60.
[2] Bonini S, Rama P, Olzi D, Lambiase A. Neurotrophic keratitis. Eye (Lond) 2003 ; 17 : 989-95.
[3] Baudouin C. A new approach for better comprehension of diseases of the ocular surface. J Fr Ophtalmol 2007 ; 30 : 239-46.
[4] Dogru M, Tsubota K. New insights into the diagnosis and treatment of dry eye. Ocul Surf 2004 ; 2 : 59-75.
[5] Research in dry eye : report of the Research Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf 2007 ; 5 : 179-93.
[6] Dogru M, Nakamura M, Shimazaki J, Tsubota K. Changing trends in the treatment of dry-eye disease. Expert Opin Investig Drugs 2013 ; 22 : 1581-601.
[7] Fox RI, Chan R, Michelson JB, et al. Beneficial effect of artificial tears made with autologous serum in patients with keratoconjunctivitis sicca. Arthritis Rheum 1984 ; 27 : 459-61.
[8] Tsubota K, Goto E, Fujita H, et al. Treatment of dry eye by autologous serum application in Sjogren’s syndrome. Br J Ophthalmol 1999 ; 83 : 390-5.
[9] Tsubota K, Goto E, Shimmura S, Shimazaki J. Treatment of persistent corneal epithelial defect by autologous serum application. Ophthalmology 1999 ; 106 : 1984-9.
[10] Young AL, Cheng AC, Ng HK, et al. The use of autologous serum tears in persistent corneal epithelial defects. Eye (Lond) 2004 ; 18 : 609-14.
[11] Rocha EM, Pelegrino FS, de Paiva CS, et al. GVHD dry eyes treated with autologous serum tears. Bone Marrow Transplant 2000 ; 25 : 1101-3.
[12] Hwang J, Chung SH, Jeon S, et al. Comparison of clinical efficacies of autologous serum eye drops in patients with primary and secondary Sjogren syndrome. Cornea 2014 ; 33 : 663-7.
[13] Geerling G, Maclennan S, Hartwig D. Autologous serum eye drops for ocular surface disorders. Br J Ophthalmol 2004 ; 88 : 1467-74.
[14] Noble BA, Loh RS, MacLennan S, et al. Comparison of autologous serum eye drops with conventional therapy in a randomised controlled crossover trial for ocular surface disease. Br J Ophthalmol 2004 ; 88 : 647-52.
[15] Kojima T, Higuchi A, Goto E, et al. Autologous serum eye drops for the treatment of dry eye diseases. Cornea 2008 ; 27 Suppl 1 : S25-30.
[16] Jirsova K, Brejchova K, Krabcova I, et al. The application of autologous serum eye drops in severe dry eye patients ; subjective and objective parameters before and after treatment. Curr Eye Res 2014 ; 39 : 21-30.
[17] Urzua CA, Vasquez DH, Huidobro A, et al. Randomized double-blind clinical trial of autologous serum versus artificial tears in dry eye syndrome. Curr Eye Res 2012 ; 37 : 684-8.
[18] Celebi AR, Ulusoy C, Mirza GE. The efficacy of autologous serum eye drops for severe dry eye syndrome : a randomized double-blind crossover study. Graefes Arch Clin Exp Ophthalmol 2014 ; 252 : 619-26.
[19] Lopez-Garcia JS, Garcia-Lozano I, Rivas L, et al. Autologous serum eye drops diluted with sodium hyaluronate : clinical and experimental comparative study. Acta Ophthalmol 2014 ; 92 : e22-9.
[20] Jeng BH. Use of autologous serum in the treatment of ocular surface disorders. Arch Ophthalmol 2011 ; 129 : 1610-2.
[21] Jeng BH, Dupps WJ Jr. Autologous serum 50 % eyedrops in the treatment of persistent corneal epithelial defects. Cornea 2009 ; 28 : 1104-8.
[22] Creuzot-Garcher C, Lafontaine PO, Brignole F, et al. Treating severe dry eye syndromes with autologous serum. J Fr Ophtalmol 2004 ; 27 : 346-51.
[23] Poon AC, Geerling G, Dart JK, et al. Autologous serum eyedrops for dry eyes and epithelial defects : clinical and in vitro toxicity studies. Br J Ophthalmol 2001 ; 85 : 1188-97.
[24] Anitua E, Muruzabal F, De la Fuente M, et al. Effects of heat-treatment on plasma rich in growth factors-derived autologous eye drop. Exp Eye Res 2014 ; 119 : 27-34.
[25] Cho YK, Huang W, Kim GY, Lim BS. Comparison of autologous serum eye drops with different diluents. Curr Eye Res 2013 ; 38 : 9-17.
[26] Thanathanee O, Phanphruk W, Anutarapongpan O, et al. Contamination risk of 100 % autologous serum eye drops in management of ocular surface diseases. Cornea 2013 ; 32 : 1116-9.
[27] Lopez-Garcia JS, Garcia-Lozano I. Use of containers with sterilizing filter in autologous serum eyedrops. Ophthalmology 2012 ; 119 : 2225-30.
[28] Spaniol K, Koerschgen L, Sander O, et al. Comparison of application systems for autologous serum eye drops. Curr Eye Res 2014 ; 39 : 571-9.
[29] Watson SL, Geerling G, Dart JK. Clinical study of therapeutic ocular surface medium for persistent epithelial defect. Ophthalmic Res 2014 ; 51 : 82-7.
[30] Harritshoj LH, Nielsen C, Ullum H, et al. Ready-made allogeneic ABO-specific serum eye drops : production from regular male blood donors, clinical routine, safety and efficacy. Acta Ophthalmol 2014 ; 92 : 783-6.
[31] Na KS, Kim MS. Allogeneic serum eye drops for the treatment of dry eye patients with chronic graft-versus-host disease. J Ocul Pharmacol Ther 2012 ; 28 : 479-83.
[32] Yoon KC, Heo H, Im SK, et al. Comparison of autologous serum and umbilical cord serum eye drops for dry eye syndrome. Am J Ophthalmol 2007 ; 144 : 86-92.
[33] Bonini S, Lambiase A, Rama P, et al. Topical treatment with nerve growth factor for neurotrophic keratitis. Ophthalmology 2000, 107 : 1347-51; discussion 51-2.
[34] Weisbach V, Dietrich T, Kruse FE, et al. HIV and hepatitis B/C infections in patients donating blood for use as autologous serum eye drops. Br J Ophthalmol 2007 ; 91 : 1724-5.
[35] Fischer KR, Opitz A, Boeck M, Geerling G. Stability of serum eye drops after storage of 6 months. Cornea 2012 ; 31 : 1313-8.
[36] Dalmon CA, Chandra NS, Jeng BH. Use of autologous serum eyedrops for the treatment of ocular surface disease : first US experience in a large population as an insurance-covered benefit. Arch Ophthalmol 2012 ; 130 : 1612-3.
[37] Chebbi CK, Kichenin K, Amar N, et al. Pilot study of a new matrix therapy agent (RGTA OTR4120) in treatment-resistant corneal ulcers and corneal dystrophy. J Fr Ophtalmol 2008 ; 31 : 465-71.
[38] Barritault D, Caruelle JP. Regenerating agents (RGTAs) : a new therapeutic approach. Ann Pharm Fr 2006 ; 64 : 135-44.
[39] Barbier-Chassefiere V, Garcia-Filipe S, Yue XL, et al. Matrix therapy in regenerative medicine, a new approach to chronic wound healing. J Biomed Mater Res A 2009 ; 90 : 641-7.
[40] Desgranges P, Barbaud C, Caruelle JP, et al. A substituted dextran enhances muscle fiber survival and regeneration in ischemic and denervated rat EDL muscle. FASEB J 1999 ; 13 : 761-6.
[41] Brignole-Baudouin F, Warnet JM, Barritault D, Baudouin C. RGTA-based matrix therapy in severe experimental corneal lesions : safety and efficacy studies. J Fr Ophtalmol 2013 ; 36 : 740-7.
[42] Théa Laboratory. Technical dossier : Cacicol. 2014.
[43] Aifa A, Gueudry J, Portmann A, et al. Topical treatment with a new matrix therapy agent (RGTA) for the treatment of corneal neurotrophic ulcers. Invest Ophthalmol Vis Sci 2012 ; 53 : 8181-5.
[44] Cochener B. A new matrix therapy agent in the treatment of corneal ulcers resistant to conventionnal treatments. Ever 2012 Oct 10-13, Nice, France. Abstract 2522.
[45] Cochener B. New device for chronic corneal ulcers healing. ARVO 2013, Fort Lauderdale, USA. E-Abstract 3904/D0148.
[46] Fajnkuchen F. Clinical evaluation of the additive effect of Cacicol 20 in patients with dry eye syndrome. Eucornea 2013 ; POS-1295.
[47] De Monchy I, Labbe A, Pogorzalek N, et al. Management of herpes zoster neurotrophic ulcer using a new matrix therapy agent (RGTA) : a case report. J Fr Ophtalmol 2011 ; 35 : 187 e1-6.
[48] Hovakimyan M GR, Schmitz KP, Stachs O. Modulating Wound Healing after Collagen Cross-linking. ARVO 2014 May 4-8, Orlando, USA. Abstract 4701/A0326.
[49] Labetoulle M, Rousseau A, M’Garrech M, et al. Intérêt des polymères mimétiques des héparanes sulfates pour réduire les signes fonctionnels de la dystrophie épithéliale de Cogan. Société française d’ophtalmologie 2014, 11-14 mai, Paris, France.
[50] Riestra AC I-PA, Artime E, Braga P, et al. Effectiveness of regenerative drops (CACICOL) on corneal ulcers (post-PRK) in an experimental animal model. ARVO 2014 May 4-8, Orlando, USA. Abstract 5176/A0397.
[51] Kymionis GD, Liakopoulos DA, Grentzelos MA, et al. Combined topical application of a regenerative agent with a bandage contact lens for the treatment of persistent epithelial defects. Cornea 2014 ; 33 : 868-72.
[52] Groah SL, Libin A, Spungen M, et al. Regenerating matrix-based therapy for chronic wound healing : a prospective within-subject pilot study. Int Wound J 2010 ; 8 : 85-95.
[53] Desgranges P LT, Allaire E, Kichenin K, et al. First clinical pilot study on critical ischemic leg ulcers with matrix therapy ReGeneraTing Agent (RGTA) technology. Journal of Wound Technology 2011 ; 13.
E. Gabison
Les divisions cellulaires sont essentielles à l’homéostasie et à la cicatrisation tissulaire. Les antimitotiques sont indiqués dans les affections de la surface oculaire pour prévenir les proliférations cellulaires excessives tumorales ou fibreuses. La mitomycine C et le 5-fluorouracile en administration locale sont les principales molécules utilisées aussi bien en prévention primaire d’une fibrose dans une situation à risque qu’en prévention secondaire d’une récidive fibreuse ou tumorale après une chirurgie correctrice.
La mitomycine C (MMC) et le 5-fluorouracile (5-FU), sont les antimitotiques les plus utilisés localement pour limiter la prolifération cellulaire épithéliale et/ou stromale à la surface de l’œil, notamment dans les pathologies tumorales bénignes ou malignes et les lésions fibreuses cornéennes et/ou conjonctivales (encadré 19-3).
5-fluorouracile
• Ptérygion : injection hebdomadaire intralésionnelle de 2,5 à 5 mg de 5-FU
• Carcinomes in situ de la surface oculaire : application topique de 5-FU à 1 % par cycles de 2 semaines
Mitomycine C
• Trabéculectomie : application peropératoire de MMC 0,02 ou 0,04 mg/ml (0,02 ou 0,04 %) pendant 2 à 5 minutes
• Ptérygion : application peropératoire de MMC 0,02 ou 0,04 mg/ml (0,02 ou 0,04 %) pendant 30 à 120 secondes
• Photokératectomie réfractive ou thérapeutique : application de MMC 0,02 % pendant 12 à 120 secondes
• Carcinomes in situ de la surface oculaire : application topique de MMC à 0,02 % par cycles d’une semaine
Le respect des indications et contre-indications, l’information éclairée et la surveillance attentive des patients permettent leur utilisation en limitant la survenue d’effets secondaires.
La MMC est un antibiotique de la famille des quinolones qui se lie de manière covalente à l’ADN (acide désoxyribonucléique). Cet agent alkylant produit par une bactérie, le Streptomyces caespitosus, inhibe la synthèse d’ADN et la prolifération cellulaire et, à forte concentration, il bloque la synthèse d’ARN (acide ribonucléique) et des protéines [1].
Le 5-FU est un médicament appartenant à la classe des antimétabolites. Analogue de la pyrimidine, il est métabolisé dans la cellule comme les nucléotides endogènes et transformé en métabolites cytotoxiques qui seront incorporés dans l’ADN et l’ARN. Il inhibe ainsi la synthèse d’ADN et empêche également la transcription d’ARN, induisant l’arrêt du cycle et l’apoptose cellulaire [2].
Le ptérygion est une tumeur bénigne fibrovasculaire du limbe conjonctivocornéen qui empiète progressivement sur la cornée pour envahir ses couches superficielles. Sa physiopathologie est associée à l’exposition aux ultraviolets et, pour certains, à la présence du papillomavirus humain [3]. Son invasivité est liée à la présence de myofibroblastes et de cellules vasculaires endothéliales activées [4].
La MMC a été utilisée initialement en instillation topique après l’exérèse du ptérygion, puis en application unique peropératoire au niveau de la zone de résection [5]. Mais le premier mode de traitement a été progressivement abandonné au profit du second à cause d’effets secondaires à type de retard de cicatrisation et de toxicité endothéliale cornéenne [6]. Les patients doivent être étroitement surveillés à la recherche d’une ischémie du site opératoire, principal facteur d’échec de la cicatrisation épithéliale et d’ulcération cornéenne. Les pathologies prédisposantes à ce type de complications, telles que le syndrome de Gougerot-Sjögren, les formes sévères de kératoconjonctivite sèche, de kératite neurotrophique ou de kératite herpétique, sont des contre-indications à la MMC. À titre préventif, il est recommandé de ne pas laisser la sclère à nu après l’application peropératoire de MMC. Une autogreffe conjonctivale ou conjonctivolimbique sera réalisée systématiquement en fin d’intervention. L’excision des fibres sclérales superficielles et la cautérisation excessive peropératoire doivent être évitées car elles potentialisent les complications de la MMC que sont l’ischémie et les ulcères scléraux. De véritables sclérites nécrosantes peuvent survenir dans les suites immédiates ou même des années après la chirurgie de ptérygion, favorisées par la MMC [7, 8].
Le 5-FU à la dose de 25 mg/ml a été utilisé en application unique peropératoire, comme la MMC, avec des résultats mitigés. Les chirurgies laissant la sclère à nu donnaient de meilleurs résultats si la MMC était utilisée en association, contrairement à celles avec autogreffes non influencées par l’usage combiné du 5-FU ou de la MMC.
Des investigations récentes ont démontré que l’injection hebdomadaire de 0,1 à 0,2 ml (2,5 à 5 mg) de 5-FU dans le ptérygion au niveau de sa tête réduisait l’inflammation et le faisait régresser. Deux injections à 1 semaine d’intervalle de 5 mg de 5-FU se sont aussi avérées plus efficaces qu’une injection unique de 30 mg de triamcinolone 20 mg. Le recul est cependant encore insuffisant pour conclure à l’intérêt de cette technique pour la prise en charge des ptérygions [10–14].
Le seul traitement des carcinomes in situ de la surface oculaire a longtemps été l’excision chirurgicale complète et large suivie d’une cryothérapie. Les traitements antimitotiques topiques représentent aujourd’hui une alternative efficace à la chirurgie. Ils peuvent être administrés en première intention, principalement lors des récidives, ou lorsque les lésions sont d’emblée très étendues. Ils peuvent également être utilisés en préopératoire pour diminuer la taille de lésions très larges, ou après chirurgie lorsque les limites d’exérèse n’ont pas atteint les zones saines [15, 16].
Le 5-FU ou la MMC sont administrés en instillations quotidiennes aux concentrations respectives de 1 % et 0,04 %. La MMC est délivrée par cycles d’une semaine espacés par une semaine d’arrêt. Le traitement par 5-FU est de 2 semaines continues. L’inconfort oculaire, la rougeur conjonctivale et palpébrale sont les principaux effets secondaires identifiés en dehors des réactions d’hypersensibilité. Des cas de défects épithéliaux, de fonte stromale et de toxicité endothéliale de la cornée ont été rapportés [17]. Mais la toxicité sur l’endothélium peut être évitée si les posologies et les précautions d’administration sont respectées (voir encadré 19-3) [6, 16, 18]. Les effets indésirables à long terme sur l’homéostasie de la surface oculaire sont cependant probablement sous-estimés au regard de la grande efficacité de ces thérapeutiques.
Certaines pathologies cornéennes se caractérisent par une fibrose qui altère la vision. C’est le cas du haze qui est une réaction inflammatoire stromale antérieure compliquant certaines photokératectomies réfractives (PKR) au laser excimer, en général dans le mois qui suit. Le haze peut ne pas régresser et se transformer en cicatrice fibreuse. La dégénérescence nodulaire de Salzmann et les opacités cornéennes séquellaires d’une kératoconjonctivite virale sévère sont aussi caractérisées par une fibrose affectant la vue.
La réaction fibreuse est la conséquence d’une activation des kératocytes du stroma antérieur en myofibroblastes. Ces myofibroblastes ont des propriétés de prolifération et de synthèse de matrice extracellulaire opaque accrues à l’origine d’une perte de la transparence cornéenne. La MMC prévient la transformation des kératocytes en myofibroblastes et diminue la réponse fibreuse du stroma cornéen [1, 17, 18].
La MMC est indiquée dans le traitement des fibroses cornéennes en complément d’une kératectomie lamellaire ou d’une photokératectomie thérapeutique (PKT) au laser excimer. Une micro-éponge imbibée de MMC à 0,02 % est appliquée à la fin de l’intervention pour une durée de 12 à 120 secondes. La durée de contact dépend théoriquement de l’importance du tissu à retirer, mais des études expérimentales ont démontré que les applications courtes sont aussi efficaces que les longues [19–21]. Un rinçage cornéen abondant avec une solution saline de type BSS (balanced salt solution) est enfin nécessaire.
Les complications du Lasik à type de volet incomplet ou perforé (buttonhole) et d’invasion épithéliale sont à l’origine de fibrose secondaire à l’interface épithélium–stroma [19]. Lors du traitement de ces complications, l’application peropératoire de MMC peut prévenir ou diminuer la fibrose postopératoire. Dans le cas où la correction de l’amétropie doit être réalisée, la MMC est appliquée après le traitement de surface en mode PKR par-dessus le volet correctement repositionné [19, 20, 22].
La MMC est également utilisée en prévention primaire du haze après PKR pour les myopies fortes ou les retraitements. L’usage de cet antimitotique est controversé et nécessite un consentement éclairé du patient. Si certains chirurgiens recourent systématiquement à la MMC lors des traitements laser de surface, d’autres la réservent aux photo-ablations de plus de 70 microns (myopies supérieures à 7 dioptries). Quelques-uns, minoritaires, mettent en avant une incertitude concernant la sécurité à long terme de cet agent alkylant et limitent son utilisation à la prévention secondaire des fibroses cornéennes. Ils s’appuient sur des études en laboratoire montrant une diminution importante de la densité des kératocytes du stroma antérieur qui peut parfois même être dépourvu de cellules en certains endroits, pendant de nombreux mois ou années après l’application de MMC [23, 24]. Les études à long terme montrent le plus souvent aussi des résultats réfractifs similaires entre les groupes traités et non traités. Le risque tardif de baisse de la densité cellulaire endothéliale et la faible incidence du haze chez les patients traités en PKR ne poussent pas à légitimer la prophylaxie primaire systématique pour de petites amétropies [18, 20, 25–27].
[1] Abraham LM, Selva D, Casson R, Leibovitch I. Mitomycin : clinical applications in ophthalmic practice. Drugs 2006 ; 66 : 321-40.
[2] Abraham LM, Selva D, Casson R, Leibovitch I. The clinical applications of fluorouracil in ophthalmic practice. Drugs 2007 ; 67 : 237-55.
[3] Chui J, Di Girolamo N, Wakefield D, Coroneo MT. The pathogenesis of pterygium : current concepts and their therapeutic implications. Ocul Surf 2008 ; 6 : 24-43.
[4] Touhami A, Di Pascuale MA, Kawatika T, et al. Characterisation of myofibroblasts in fibrovascular tissues of primary and recurrent pterygia. Br J Ophthalmol 2005 ; 89 : 269-74.
[5] Bekibele CO, Ashaye A, Olusanya B, et al. 5-Fluorouracil versus mitomycin C as adjuncts to conjunctival autograft in preventing pterygium recurrence. Int Ophthalmol 2012 ; 32 : 3-8.
[6] Kaufman SC, Jacobs DS, Lee WB, et al. Options and adjuvants in surgery for pterygium : a report by the American Academy of Ophthalmology. Ophthalmology 2013 ; 120 : 201-8.
[7] Aydin A, Aksoy Y, Unal MH, Ersanli D. Necrotizing scleritis after pterygium surgery using mitomycin C. J Fr Ophtalmol 2012 ; 35 : 74-5.
[8] Tittler EH, Nguyen P, Rue KS, et al. Early surgical debridement in the management of infectious scleritis after pterygium excision. J Ophthalmic Inflamm Infect 2012 ; 2 : 81-7.
[9] Bekibele CO, Baiyeroju AM, Olusanya BA, et al. Pterygium treatment using 5-FU as adjuvant treatment compared to conjunctiva autograft. Eye (Lond) 2008 ; 22 : 31-4.
[10] Akarsu C, Taner P, Ergin A. 5-Fluorouracil as chemoadjuvant for primary pterygium surgery : preliminary report. Cornea 2003 ; 22 : 522-6.
[11] Maldonado MJ, Cano-Parra J, Navea-Tejerina A, et al. Inefficacy of low-dose intraoperative fluorouracil in the treatment of primary pterygium. Arch Ophthalmol 1995 ; 113 : 1356-7.
[12] Kareem AA, Farhood QK, Alhammami HA. The use of antimetabolites as adjunctive therapy in the surgical treatment of pterygium. Clin Ophthalmol 2012 ; 6 : 1849-54.
[13] Pherwani A, Vakil V, Eatamadi H, et al. Postoperative subconjunctival 5-fluorouracil in the management of recurring pterygium. Br J Ophthalmol 2007 ; 91 : 398-9.
[14] Said DG, Faraj LA, Elalfy MS, et al. Intra-lesional 5-fluorouracil for the management of recurrent pterygium. Eye (Lond) 2013 ; 27 : 1123-9.
[15] Khokhar S, Soni A, SinghSethi H, et al. Combined surgery, cryotherapy, and mitomycin-C for recurrent ocular surface squamous neoplasia. Cornea 2002 ; 21 : 189-91.
[16] Khong JJ, Muecke J. Complications of mitomycin C therapy in 100 eyes with ocular surface neoplasia. Br J Ophthalmol 2006 ; 90 : 819-22.
[17] Nanji AA, Sayyad FE, Karp CL. Topical chemotherapy for ocular surface squamous neoplasia. Curr Opin Ophthalmol 2013 ; 24 : 336-42.
[18] Panda A, Pe’er J, Aggarwal A, et al. Effect of topical mitomycin C on corneal endothelium. Am J Ophthalmol 2008 ; 145 : 635-8.
[19] Gabison EE, Huet E, Baudouin C, Menashi S. Direct epithelial-stromal interaction in corneal wound healing : role of EMMPRIN/CD147 in MMPs induction and beyond. Prog Retin Eye Res 2009 ; 28 : 19-33.
[20] De Benito-Llopis L, Teus MA. Efficacy of surface ablation retreatments using mitomycin C. Am J Ophthalmol 2010 ; 150 : 376-80.e2.
[21] Netto MV, Mohan RR, Ambrosio RJ, et al. Wound healing in the cornea : a review of refractive surgery complications and new prospects for therapy. Cornea 2005 ; 24 : 509-22.
[22] Azar G, Doan S, Cochereau I, Gabison EE. Management of post-LASIK recurrent epithelial ingrowth with flap melting using annular amniotic membrane graft. J Cataract Refract Surg 2010 ; 36 : 2207-8.
[23] Santhiago MR, Netto MV, Wilson SE. Mitomycin C : biological effects and use in refractive surgery. Cornea 2012 ; 31 : 311-21.
[24] Netto MV, Mohan RR, Sinha S, et al. Effect of prophylactic and therapeutic mitomycin C on corneal apoptosis, cellular proliferation, haze, and long-term keratocyte density in rabbits. J Refract Surg 2006 ; 22 : 562-74.
[25] Sia RK, Ryan DS, Edwards JD, et al. The U.S. Army Surface Ablation Study : comparison of PRK, MMC-PRK, and LASEK in moderate to high myopia. J Refract Surg 2014 ; 30 : 256-64.
[26] Diakonis VF, Kankariya VP, Kymionis GD, et al. Long term followup of photorefractive keratectomy with adjuvant use of mitomycin C. J Ophthalmol 2014 ; 2014 : 821-920.
[27] Shah RA, Wilson SE. Use of mitomycin-C for phototherapeutic keratectomy and photorefractive keratectomy surgery. Curr Opin Ophthalmol 2010 ; 21 : 269-73.
B. Mortemousque
Les traitements physiques de la surface oculaire prennent toute leur place dans la prise en charge de la sécheresse oculaire. Ils permettent essentiellement d’éviter ou de ralentir l’hyperévaporation de la phase aqueuse du film lacrymal soit en diminuant l’élimination naturelle par les voies lacrymales, soit en saturant l’air ambiant d’humidité réduisant l’évaporation, soit en emprisonnant des larmes devant la cornée ou bien en augmentant la phase lipidique du film lacrymal. Ces traitements sont essentiels dans notre arsenal thérapeutique et dans certains cas restent nos ultimes recours.
La surface oculaire, du fait de sa grande accessibilité, peut faire l’objet de prises en charge physiques dans le traitement de certaines de ses pathologies. Ainsi comme nous l’avons vu précédemment, les lavages oculaires permettent l’élimination mécanique des agresseurs (allergènes) et des médiateurs de l’inflammation. D’autres principes physiques sont mis en application au quotidien pour le traitement d’autres affections ; nous nous attardons plus particulièrement dans ce sous-chapitre sur les traitements physiques de la sécheresse oculaire.
Depuis de nombreuses années, les bases du traitement des syndromes secs reposent en priorité sur la diminution de l’élimination des rares larmes produites, que ce soit en réduisant l’élimination par les voies lacrymales ou en diminuant leur évaporation.
Le principe d’occlure les points lacrymaux remonte au début du siècle dernier. Beetham [1] fait état dès 1935 des premiers résultats positifs de l’effet de l’obstruction des points lacrymaux par électrocoagulation chez quatre patients souffrant de kératite filamenteuse. Ce principe d’occlusion par électrocoagulation est resté d’actualité jusqu’à l’apparition des bouchons méatiques. Foulds [2] est le premier à rapporter l’efficacité de l’obstruction provisoire des voies lacrymales par des implants intracanaliculaires de gélatine. Ce n’est seulement qu’en 1975 que Freeman [3] utilise des bouchons en silicone et rapporte un taux de succès de 50 à 75 % pour une tolérance de 75 %. Le concept d’occlusion des points lacrymaux comme thérapeutique routinière de la sécheresse oculaire prenait son envol. L’utilisation de silicone a permis le développement de toute une gamme de bouchons amovibles ou permanents destinés à retarder la vidange lacrymale chez les patients souffrant de sécheresse oculaire par déficit aqueux. Les bouchons méatiques sont globalement de deux types :
résorbables, en collagène ou en polymère : ils ont une durée de vie de 3 jours à 6 mois et sont le plus souvent intracanaliculaires ;
non résorbables ou « permanents » : ceux en forme de diabolo (type Freeman), les plus courants, se composent d’une collerette s’appuyant sur le méat lacrymal, un corps allongé et une base plus large assurant le blocage du bouchon dans la voie lacrymale. D’autres formes et matériaux existent comme le bouchon de type Herrick en forme de « T » qui se place dans le canalicule ou bien des bouchons cylindriques positionnés en intracanaliculaire capables de se dilater après l’insertion.
L’efficacité des obstructions lacrymales a fait l’objet de nombreuses études généralement de phase II [4–8]. Leur utilisation est associée à la diminution du recours aux substituts lacrymaux, mais aussi à l’amélioration objective et subjective des patients atteints (yeux secs par déficience aqueuse). Les indices objectifs d’amélioration documentés incluent : une meilleure coloration de la cornée ; un temps de rupture du film lacrymal (break-up time ou BUT) prolongé ; une diminution de l’osmolarité lacrymale ; une augmentation de la densité des cellules caliciformes.
L’indication principale de ce dispositif est la sécheresse lacrymale par déficit aqueux. Cependant pour certains auteurs [8], pour retenir des larmes, faut-il d’abord qu’elles soient sécrétées. Ainsi pour Baxter et al. [8], leur meilleure indication reste le patient symptomatique, avec un test de Schirmer II (avec anesthésie) altéré et avec des tests aux colorants vitaux positifs sur la surface.
Les contre-indications aux bouchons sont de façon logique : une allergie à l’un des composants ; un ectropion du point lacrymal (le point lacrymal dans ce cas n’assure pas son rôle de vidange, alors pourquoi le boucher ?) ; une obstruction du canal nasolacrymal. L’existence d’une inflammation des paupières (blépharites) ou de la surface oculaire contre-indique également la pose de bouchons. Ces derniers sont responsables de la stagnation des médiateurs inflammatoires. Il faut alors traiter l’inflammation avant d’envisager la pose de bouchons. Les infections aiguës ou chroniques des canalicules lacrymaux ou du sac lacrymal sont aussi des contre-indications.
L’expulsion ou la perte des bouchons méatiques est la complication la plus courante notamment des bouchons de type Freeman (50 % à J154) [9]. Cette complication est sans conséquence grave si ce n’est la réapparition des symptômes de sécheresse. L’extériorisation de la collerette ou la pose d’une taille trop importante peuvent être responsables de gêne et/ou d’érosion cornéennes ou conjonctivales le plus souvent sans gravité. En revanche, leur migration intracanaliculaire s’accompagne de complications plus sérieuses, comme l’apparition de granulome pyogénique ou de canaliculite [10]. Le retrait de ces bouchons « migrateurs » canaliculaires peut s’avérer difficile et nécessiter une intervention chirurgicale sur le système de canaux nasolacrymaux.
Une autre manière de diminuer l’évaporation des larmes est d’augmenter l’humidité de l’air en contact avec la conjonctive [11, 12] et de diminuer les courants d’air provoquant la dessiccation. Ainsi, le port de lunettes visant à conserver l’humidité est préconisé depuis de nombreuses années pour soulager les sécheresses oculaires. Plusieurs études ont décrit la relation entre l’humidité environnementale et la sécheresse oculaire [13]. L’instillation concomitante de larmes artificielles améliore également les signes et symptômes [14].
Les lentilles de contact semblent également utiles pour protéger et hydrater la surface cornéenne dans les formes de sécheresses graves. L’apport de certains matériaux comme le silicone ou l’utilisation de verres scléraux [15], qui emprisonnent un ménisque de larme devant la cornée, a amélioré le confort des patients et leur acuité visuelle, a permis la diminution de l’épithéliopathie cornéenne et la cicatrisation de défauts épithéliaux cornéens [16–20].
Cette approche thérapeutique prend tout son sens dans la prise en charge des dysfonctionnements meibomiens. L’hygiène des paupières est composée de deux phases : application de chaleur et massage mécanique des paupières. L’application de chaleur avec ou sans humidité est la première étape du traitement. Son but est d’atteindre le point de fusion du meibum (32 à 35 °C) [21] afin d’en faciliter son élimination. Le réchauffement peut être réalisé par beaucoup de moyens comme l’application de compresses ou d’un gant de toilette chauds ou l’utilisation de dispositifs chauffants (masque, lunettes, air réchauffé ou autres dispositifs chauffant).
La température idéale semble se situer à 45 °C et le temps d’application compris entre 4 et 10 minutes a démontré son efficacité sur l’épaisseur du film lacrymal [22–24]. À ce réchauffement s’ajoute l’expression mécanique des paupières afin d’éliminer le meibum ainsi ramolli [25]. Ce massage semble avoir un effet thérapeutique majeur sur la prise en charge des dysfonctionnements meibomiens. Cette approche mécanique doit se faire de façon appropriée pour être pleinement efficace : après avoir réalisé une traction horizontale du canthus externe (afin d’immobiliser la paupière), on exercera une pression de haut en bas (paupière du haut) ou de bas en haut (paupière du bas) en commençant par le canthus interne pour finir au canthus externe. Ces méthodes de vidange mécanique des glandes de Meibomius [26, 27] ont un recul de plus de 80 ans. Elles varient du massage doux des paupières jusqu’à l’écrasement contre un objet rigide (tige en verre, coton-tige, spatule métallique). Ces différents moyens sont en fait limités par la douleur induite. En pratique, on recommande que ce traitement de vidange physique des glandes soit continué jusqu’à ce que le dysfonctionnement soit résolu. Certains dispositifs associant effet thermique et massage ont été élaborés. Ainsi, le système LipiFlow® conjugue l’application de chaleur à la surface des paupières et sur les glandes de Meibomius à la pression des paupières, permettant ainsi l’expression du meibum ramolli par le chauffage. Plusieurs études ont démontré l’intérêt de ce dispositif. Selon Lane et al. [28], un traitement simple de 12 minutes avec le système LipiFlow® a permis d’obtenir une amélioration durable des signes et des symptômes du dysfonctionnement des glandes de Meibomius pendant 4 semaines. Une autre étude [29] démontre qu’une séance de traitement par le LipiFlow® est au moins aussi efficace pendant 3 mois que des soins de paupières biquotidiens. Malgré tout, pour d’autres auteurs [30] aucun changement significatif n’a pu être mesuré par le LipiView® sur le film lacrymal quel que soit le dispositif chauffage/massage utilisé. Cependant, les valeurs tendaient à l’amélioration dans les deux groupes à 3 mois.
Cependant, les études avec grand effectif et sur des durées longues, comparant l’efficacité des nombreuses méthodes disponibles pour le réchauffage et le massage des paupières, manquent dans la littérature.
[1] Beetham WP. Filamentary keratitis. Trans Am Ophthalmol Soc 1935 ; 33 : 413-35.
[2] Foulds WS. Intra-canalicular gelatin implants in the treatment of kerato-conjunctivitis sicca. Br J Ophthalmol 1961 ; 45 : 625-7.
[3] Freeman JM. The punctum plug : evaluation of a new treatment for the dry eye. Trans Sect Ophthalmol Am Acad Ophthalmol Otolaryngol 1975 ; 79 : OP874-9.
[4] Tuberville AW, Frederick WR, Wood TO. Punctal occlusion in tear deficiency syndromes. Ophthalmology 1982 ; 89 : 1170-2.
[5] Willis RM, Folberg R, Krachmer JH, et al. The treatment of aqueous-deficient dry eye with removable punctal plugs. A clinical and impression-cytological study. Ophthalmology 1987 ; 94 : 514-8.
[6] Gilbard JP, Rossi SR, Azar DT, Gray KL. Effect of punctal occlusion by Freeman silicone plug insertion on tear osmolarity in dry eye disorders. CLAO J 1989 ; 15 : 216-8.
[7] Balaram M, Schaumberg DA, Dana MR. Effi cacy and tolerability outcomes after punctal occlusion with silicone plugs in dry eye syndrome. Am J Ophthalmol 2001 ; 131 : 30-6.
[8] Baxter SA, Laibson PR. Punctal plugs in the management of dry eyes Ocul Surf 2004 ; 2 : 255-65.
[9] Sonomura Y, Yokoi N, Komuro A, Inagaki K, Kinoshita S. Clinical investigation of the extrusion rate and other complications of the SuperEagle plug. Nihon Ganka Gakkai Zasshi 2013 ; 117 : 126-31.
[10] Joganathan V, Mehta P, Murray A, Durrani M. Complications of intracanalicular plugs : a case series. Orbit 2010 ; 29 : 271-3.
[11] Tsubota K. The effect of wearing spectacles on the humidity of the eye. Am J Ophthalmol 1989 ; 15 ; 108 : 92-3.
[12] Tsubota K, Yamada M, Urayama K. Spectacle side panels and moist inserts for the treatment of dry-eye patients. Cornea 1994 ; 13 : 197-201.
[13] Korb DR, Greiner JV, Glonek T, et al. Effect of periocular humidity on the tear film lipid layer. Cornea 1996 ; 15 : 129-34.
[14] Tsubota K, Hata S, Okusawa Y, et al. Quantitative videographic analysis of blinking in normal subjects and patients with dry eye. Arch Ophthalmol 1996 ; 114 : 715-20.
[15] Jacobs DS, Rosenthal P. Boston scleral lens prosthetic device for treatment of severe dry eye in chronic graft-versus-host disease. Cornea 2007 ; 26 : 1195-9.
[16] Bacon AS, Astin C, Dart JK. Silicone rubber contact lenses for the compromised cornea. Cornea 1994 ; 13 : 422-8.
[17] Pullum KW, Whiting MA, Buckley RJ. Scleral contact lenses : the expanding role. Cornea 2005 ; 24 : 269-77.
[18] Tappin MJ, Pullum KW, Buckley RJ. Scleral contact lenses for overnight wear in the management of ocular surface disorders. Eye 2001 ; 15 : 168-72.
[19] Romero-Rangel T, Stavrou P, Cotter J, et al. Gas-permeable scleral contact lens therapy in ocular surface disease. Am J Ophthalmol 2000 ; 130 : 25-32.
[20] Rosenthal P, Cotter JM, Baum J. Treatment of persistent corneal epithelial defect with extended wear of a fluid-ventilated gas-permeable scleral contact lens. Am J Ophthalmol 2000 ; 130 : 33-41.
[21] McCulley JP, Shine WE. Meibomian secretions in chronic blepharitis. Adv Exp Med Biol 1998 ; 438 : 319-26.
[22] Blackie CA, Solomon JD, Greiner JV, et al. Inner eyelid surface temperature as a function of warm compress methodology. Optom Vis Sci 2008 ; 85 : 675-83.
[23] Mitra M, Menon GJ, Casini A, et al. Tear film lipid layer thickness and ocular comfort after meibomian therapy via latent heat with a novel device in normal subjects. Eye 2005 ; 19 : 657-60.
[24] Ishida R, Matsumoto Y, Onguchi T, et al. Tear film with “Orgahexa EyeMasks” in patients with meibomian gland dysfunction. Optom Vis Sci 2008 ; 85 : 684-91.
[25] Romero JM, Biser SA, Perry HD, et al. Conservative treatment of meibomian gland dysfunction. Eye Contact Lens 2004 ; 30 : 14-9.
[26] Keith CG. Seborrhoeic blepharo-kerato-conjunctivitis. Trans Ophthalmol Soc UK 1967 ; 87 : 85-103.
[27] Duke-Elder WS, McFaul PA. The ocular adnexa, part II : diseases of the Eyelids. London : H. Kimpton ; 1974.
[28] Lane SS, DuBiner HB, Epstein RJ et al. A New System, the LipiFlow®, for the treatment of meibomian gland dysfunction. Cornea 2012 ; 31 : 396-404.
[29] Finis F, Hayajneh J, König C et al. Evaluation of an automated thermodynamic treatment (LipiFlow®) system for meibomian gland dysfunction : a prospective, randomized, observer-masked trial. The Ocular Surface 2014 ; 12 : 146-54.
[30] Baumann A, Cochener B. Évaluation des moyens modernes de prise en charge du dysfonctionnement meibomien J Fr Ophtalmol 2014 ; 37 : 303-12.