Allergie oculaire
B. Mortemousque, D. Brémond-Gignac
Les conjonctivites médiées par les immunoglobulines E, ou conjonctivites IgE médiées, sont les manifestations allergiques oculaires les plus fréquentes. Elles touchent toutes les tranches d’âge avec cependant une prévalence plus importante chez les enfants et les sujets jeunes. Elles regroupent les conjonctivites allergiques saisonnières et perannuelles ainsi que les conjonctivites allergiques aiguës qui représentent l’expression clinique aiguë des deux premières. Liées à la libération d’histamine, leur expression aiguë est très bruyante et rapide, survenant classiquement quelques minutes seulement après le contact avec l’allergène responsable. Lors de cette phase, le tableau clinique associe souvent des manifestations extra-oculaires comme une rhinite ou une crise d’asthme. En dehors de ces phases aiguës, leur traduction clinique est pauvre et souvent trompeuse. Elles diffèrent malgré tout par l’allergène responsable et sur son comptage plus ou moins chronique. L’interrogatoire va donc être capital pour identifier les terrains à risque et le(s) facteur(s) déclenchant(s). Un bilan allergologique s’impose dans ces formes de conjonctivites allergiques car l’identification de l’agent causal permet une meilleure prise en charge du patient et en particulier un traitement spécifique.
Les manifestations allergiques peuvent toucher différentes parties de l’organisme. L’allergie oculaire est une pathologie fréquente souvent associée à une rhinite allergique. Parmi les manifestations oculaires, les conjonctivites allergiques représentent la localisation la plus observée. De plus, les conjonctivites allergiques constituent la principale expression d’un état de l’organisme vis-à-vis d’un ou plusieurs allergènes. L’appellation « conjonctivite allergique » n’est pas constituée d’une simple entité clinique mais regroupe souvent des pathologies avec des mécanismes différents aussi bien d’un point de vue physiopathologique, que d’un point de vue des mécanismes d’hypersensibilité. Les critères diagnostiques ainsi que leur prise en charge sont souvent hétérogènes mais ces différents types de conjonctivites allergiques présentent des points communs qui sont à identifier. Cette pathologie est rencontrée quotidiennement dans l’exercice médical puisque l’on estime que la maladie allergique affecte 15 à 20 % de la population à l’échelle planétaire, dont 40 à 60 % d’entre eux présentent des manifestations allergiques [1], avec une altération de la qualité de vie [2-4]. Les symptômes à type d’œil rouge ou de point intéressent autant l’ophtalmologiste que l’allergologue, le pédiatre ou le généraliste.
Le rôle de l’environnement et du mode de vie explique probablement que les manifestations allergiques soient plus fréquentes dans les pays industrialisés. Les principaux facteurs incriminés dans la surreprésentation de l’allergie dans les pays industrialisés sont : la pollution atmosphérique ; la vie en atmosphère confinée ; l’utilisation de produits désinfectants ; la diversification alimentaire et la toxicologie alimentaire dont l’utilisation de conservateurs ; l’exposition professionnelle à des produits allergisants et de façon moins certaine le stress.
Il existe très peu de données pour évaluer objectivement l’incidence des allergies oculaires qui est très variable, oscillant entre 24 et 42 % chez l’adolescent [5, 6].
De nombreux facteurs sont impliqués dans la réponse allergique oculaire et ce, dans des proportions différentes en fonction de la forme clinique considérée. Les premiers d’entre eux sont les facteurs environnementaux et en premier lieu les facteurs spécifiques que sont les allergènes car ils sont à l’origine d’une réaction allergique. Ces allergènes spécifiques sont de différents types :
aéroportés : acariens, moisissures, pollens de graminées et d’arbre, pollens des plantes herbacées, phanères d’animaux, cafards et apparentés ;
chimiques : sulfites, conservateurs, latex, etc. ;
alimentaires : crustacées, œufs, poissons, lait, viandes, arachides, céleris, etc. ;
médicamenteux ;
professionnels.
Les facteurs aspécifiques comme la qualité du film lacrymal, les polluants, les agresseurs extérieurs et autres participent à la réaction allergique en déclenchant ou en amplifiant les réponses allergiques. Ainsi, le film lacrymal qui a pour rôle de protéger la surface oculaire, en particulier vis-à-vis des allergènes et des agents infectieux, peut induire ou favoriser une conjonctivite allergique ou majorer les symptômes, notamment à type de sensation de brûlure oculaire en cas d’altération. Le film lacrymal est composé de trois couches (ou phases). La phase aqueuse, la plus importante en quantité, joue un rôle notable dans la protection face aux agents infectieux. La phase mucinique (ou muqueuse) constitue une interface d’adhésion entre la surface conjonctivocornéenne hydrophobe et la phase aqueuse du film lacrymal. Enfin, la phase lipidique évite l’évaporation du film lacrymal. La sécrétion des différentes phases du film lacrymal est régulée par voie neurogène et hormonale. Elle est également modifiée par les processus inflammatoires locaux dont l’allergie oculaire. La pollution est aussi très souvent incriminée dans la genèse ou l’entretien des phénomènes allergiques [7]. Les polluants ne déclenchent pas directement les phénomènes allergiques mais favorisent et potentialisent l’effet des allergènes. Ils entraînent notamment une inflammation conjonctivale majorant la réaction aux allergènes. Si le rôle de la pollution est bien établi dans la pathogénie des rhinites et bronchites notamment asthmatiformes, son rôle dans celle des conjonctivites allergiques est plus difficile à établir. La surface oculaire est soumise aux agressions des polluants qui peuvent déclencher ou majorer certaines pathologies comme la sécheresse oculaire ou une inflammation (en particulier d’origine allergique). Une étude épidémiologique de 2003 effectuée à Paris a montré une corrélation entre le nombre de sujets consultant en urgence pour des problèmes de surface oculaire et les conditions météorologiques et de pollution atmosphérique [8]. Si le rôle du tabagisme est clair dans l’asthme et la rhinite, son implication dans les phénomènes allergiques conjonctivaux, notamment par tabagisme passif, est encore discutée. Les conditions météorologiques jouent un rôle sur la surface oculaire, puisque le degré de pollution atmosphérique modifie le taux de polluants, en particulier d’ozone, et que la force du vent et le taux d’humidité peuvent changer la qualité du film lacrymal. Les rayons ultraviolets (UV) induisent pour leur part une réaction photochimique source d’ozone (O3) et de dioxyde d’azote (NO2). Le principal polluant issu de cette réaction est l’ozone qui apparaît pour des températures élevées (au-delà de 25 °C). Cette température ambiante et ces ultraviolets sont également des facteurs directement influençants. Par ailleurs, le travail prolongé sur écran engendre une diminution du réflexe de clignement qui peut majorer une sécheresse oculaire entraînant alors une augmentation de la concentration d’allergènes sur la surface oculaire.
L’ancienne classification des conjonctivites allergiques, essentiellement fondée sur la clinique [9], distingue : la conjonctivite allergique aiguë (CAA), la conjonctivite allergique perannuelle (CAP), la conjonctivite allergique saisonnière (CAS), la kératoconjonctivite printanière ou vernale (KCV), la kératoconjonctivite atopique (KCA) et la conjonctivite gigantopapillaire (CGP). La nouvelle classification proposée par Leonardi et al. [10] est basée sur la physiopathologie. Ainsi distingue-t-on les conjonctivites allergiques IgE médiées, regroupant les CAA, CAS et CAP de même que les KCV et KCA.
La CAA, la CAS et la CAP ont en commun leur pathogénie avec une réponse de type anaphylactique.
La CAA n’est pas à proprement dite une entité à part. Elle s’observe aussi bien sur les terrains de CAS que de CAP. Elle correspond à une manifestation anaphylactique aiguë en rapport avec un contact massif avec l’allergène sensibilisant. La clinique est le plus souvent « bruyante ». La symptomatologie est marquée par une atteinte souvent bilatérale.
Les symptômes cliniques typiques de la conjonctivite reposent sur le larmoiement, le prurit, l’œil rouge, les brûlures oculaires, les yeux collés et la sensation de corps étranger plus ou moins importante [11-13].
Dans la CAS, le maître symptôme est le prurit oculaire qui peut se présenter sous toutes ses formes, souvent intense à point de départ caronculaire. En particulier chez l’enfant, il est volontiers trompeur. Il est souvent intense entraînant alors parfois des lésions palpébrales de grattage. Le larmoiement fait aussi partie des signes cliniques les plus fréquents dans la CAS. C’est un larmoiement clair, le plus souvent bilatéral mais parfois asymétrique. Les brûlures oculaires sont très variables et ne sont pas spécifiques de l’allergie, pouvant faire penser à une insuffisance lacrymale ou une sécheresse oculaire. Les douleurs oculaires restent modérées et sont, elles aussi, non spécifiques. La sensation de corps étranger peut revêtir divers degrés de sévérité sans grande valeur diagnostique excepté lorsqu’il existe réellement un corps étranger associé. Les sécrétions muqueuses sont en général translucides et peu abondantes mais elles peuvent devenir épaisses et filamenteuses si la pathologie évolue vers la chronicité. En cas de sécrétions très importantes, le diagnostic doit être mis en doute et les arguments diagnostiques revus. Les autres signes cliniques et symptômes comportent un prurit intense souvent à point de départ caronculaire, un larmoiement, accompagné souvent d’un œdème palpébral, d’un chémosis parfois important, masquant la rougeur conjonctivale. L’évolution se fait vers une résolution le plus souvent spontanée pouvant se poursuivre par un certain degré de photophobie et/ou de sensation de brûlures oculaires. En dehors de tout épisode aigu, les manifestations surviennent tout au long de la période de contact avec l’allergène.
Pour une CAP, il s’agit de manifestations mineures toute l’année avec des recrudescences à certaines périodes. Les principaux signes cliniques sont une hyperhémie conjonctivale discrète, la présence de papilles tarsales souvent de petites tailles (fig. 5-1) et plus rarement des follicules. La symptomatologie est marquée par la sensation de corps étranger, d’œil sec, plus que d’un prurit souvent relégué au deuxième plan. Le diagnostic est posé devant une symptomatologie durant depuis plus de 1 an et avec des manifestations se déroulant tout au long de l’année. Elle touche aussi bien l’enfant que l’adulte. Les principaux allergènes impliqués sont les moisissures, les acariens, les phanères d’animaux et les allergènes professionnels. La conjonctivite saisonnière est la forme la plus fréquente. En dehors de la poussée aiguë, les symptômes sont très discrets, très voisins de ceux de la CAP. Les signes biomicroscopiques sont pauvres et souvent peu contributifs, avec le plus souvent une conjonctive très légèrement hyperhémiée ou normale (fig. 5-2). La présence de papilles n’est pas constante ; lorsqu’elles existent, elles sont de petites tailles. Parfois, une kératite ponctuée superficielle discrète est visualisée à distance d’un épisode aigu.
Pour ces trois formes, l’atteinte ophtalmologique isolée est rare (moins de 6 %), les signes et symptômes ORL et/ou bronchiques seront à rechercher s’ils ne sont pas au premier plan de la manifestation allergique.
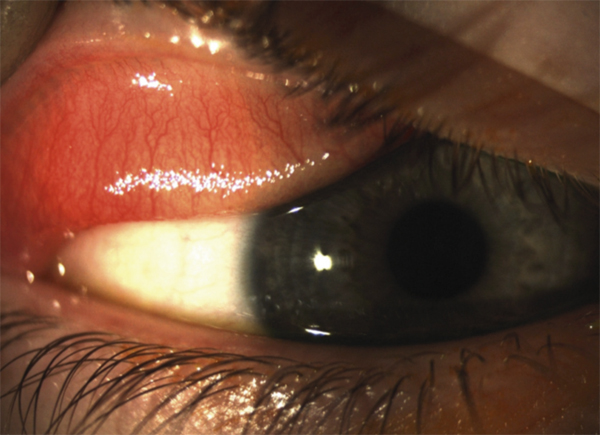
Fig. 5-1 Conjonctivite saisonnière avec follicules et papilles tarsales de petite taille.

Fig. 5-2 Conjonctivite saisonnière avec hyperhémie conjonctivale.
C’est un temps capital de la prise en charge des conjonctivites allergiques. Cet interrogatoire doit être méthodique et approfondi. Il concerne le patient, sa famille et son entourage. Dans un premier temps, l’interrogatoire porte sur la recherche de manifestations allergiques, oculaires ou autres, déjà identifiées chez le patient ou ses apparentés. Les signes et symptômes sont à faire préciser :
certains orientant vers une manifestation allergique seront à rechercher en priorité comme le prurit, la rougeur et le chémosis ;
d’autres comme la photophobie, le blépharospasme, le flou visuel, la baisse d’acuité visuelle et la difficulté d’ouverture des yeux au réveil sont déjà des marqueurs de sévérité de l’atteinte oculaire ;
d’autres moins spécifiques d’allergie comme la sensation de brûlures oculaires, de corps étranger, d’œil sec, ou de larmoiement, témoignent de l’irritation oculaire.
Les manifestations extra-oculaires sont aussi à rechercher (éternuement, écoulement nasal postérieur, etc.). L’évolution des manifestations est aussi à faire préciser : date et mode d’apparition, ancienneté des signes et symptômes, caractère récidivant ou chronique des manifestations. Il faut aussi insister sur la recherche d’un caractère cyclique (spatial ou temporel) et sur le mode de survenue des manifestations (lieu, climat, saison, activité, etc.). Les éléments ainsi recueillis à l’interrogatoire, associés aux signes d’examen à la lampe à fente, vont orienter vers une entité clinique qui devra être précisée à l’allergologue pour orienter les explorations paracliniques.
Il s’agit du moyen le plus simple et le plus couramment utilisé pour l’identification d’un éventuel allergène responsable d’une allergie de type immédiat (prick-test ou intradermoréaction) et/ou responsable d’une allergie de contact (patch-test). Pour ce qui est des prick-tests et intradermoréactions, leur intérêt réside dans la mise en évidence d’une réactivité cutanée associant œdème, érythème et prurit (triade de Lewis) signant une réaction allergique immédiate. Certains allergènes sont souvent systématiquement testés (acariens, pollens, conservateurs, etc.) du fait de : leur grande fréquence, la chronicité des manifestations (perte de relation d’exposition), les possibilités thérapeutiques spécifiques (mesures prophylactiques, immunothérapie). Les autres allergènes seront testés en fonction de l’interrogatoire. Il est important de ne pas oublier que les résultats devront être confrontés à l’interrogatoire et à la clinique. Les patch-tests, dont l’interprétation pour les manifestations oculaires est sans particularité, sont employés comme pour toute exploration en dermato-allergologie : en règle générale, on utilise la batterie européenne à laquelle on ajoute les cosmétiques et topiques incriminés [14, 15]. Des batteries complémentaires sont utilisées en fonction de l’anamnèse. Si les tests épicutanés sont mis en défaut, des tests d’application ouverts répétés (repeated open application tests ou ROAT) en peau saine peuvent être pratiqués.
Le test de provocation conjonctivale (TPC) va permettre, en mettant le sujet en contact avec un allergène contre lequel il est ou semble être sensibilisé, d’attester un lieu fonctionnel entre la pathologie conjonctivale et l’exposition à l’allergène. L’indication la plus classique du TPC est la conjonctivite chronique pour laquelle une polysensibilisation attestée par les tests cutanés est fréquente. Dans la conjonctivite allergique saisonnière où l’allergène est souvent évident car il est présent de manière saisonnière (pollens) ou de façon itérative (phanères des animaux), le TPC peut être indiqué si l’allergène mis en évidence par le bilan allergique est différent de celui attendu. Dans ces formes de conjonctivite typiquement IgE médiée, le TPC spécifique a démontré sa sûreté (y compris chez l’enfant), sa sensibilité, sa spécificité et sa reproductibilité [16-20]. Dans cette population, la plus importante, le but des TPC est essentiellement de faire le diagnostic permettant de rattacher à un allergène la symptomatologie observée. Dans la kératoconjonctivite vernale anciennement printanière, le TPC n’est pas de pratique courante. Environ la moitié des kératoconjonctivites vernales ont des prick-tests positifs [21, 22] mais ceci varie selon les études. Dans cette pathologie souvent sévère, l’intérêt de reconnaître un allergène favorisant les poussées se conçoit aisément.
Celles-ci peuvent porter sur le sang et/ou les larmes. Elles vont s’intéresser aux dosages des médiateurs de l’allergie et à la mise en évidence des acteurs de cette allergie. Ainsi au niveau sanguin, l’éosinophilie (sa détermination reste utilisée en pratique courante, bien que peu spécifique d’un terrain atopique) et les IgE sériques (traduisent les IgE non fixées dans les tissus) pourront être dosées. L’élévation des IgE totales sériques est un témoin valable mais non spécifique de l’état d’atopie. En revanche, le dosage positif des IgE sériques spécifiques est très évocateur d’une sensibilisation contre l’allergène considéré. Plusieurs techniques de dosage sont utilisées (radio-allergo-sorbent test [RAST], paper radioimmunosorbent test [PRIST], etc.). Les médiateurs sériques de l’allergie, comme l’ECP (eosinophil cationic protein), enzyme cytotoxique des éosinophiles, pourraient être un marqueur d’activation de ces cellules, en particulier lors de manifestations allergiques impliquant la phase retardée de l’anaphylaxie. Les ICAMs (intercellular adhesion molecules ou molécules d’adhésion) sont dosables en immuno-enzymologie par la méthode ELISA (enzyme-linked immunosorbent assay). Le dosage de l’histamine et/ou de la tryptase signe une dégranulation des mastocytes sans pour autant confirmer la nature allergique du phénomène. Enfin, l’étude des protéines sérique qui s’effectue en électrophorèse est intéressante, en particulier celle de l’albumine, lors de dosages lacrymaux concomitants. Au niveau lacrymal, les éosinophiles sont dosables ; normalement absents des larmes et des couches superficielles de l’épithélium conjonctival, leur présence oriente vers une manifestation de type allergique. Les IgE lacrymales totales sont également dosables. Il n’existe pas vraiment de standard pour l’œil, cependant le rapport IgE lacrymale/IgE sérique oriente vers une production locale d’IgE [23, 24]. Les médiateurs lacrymaux de l’allergie, comme d’un point de vue sérique l’ECP [25, 26], sont dosables et corrélés au nombre d’éosinophiles lacrymaux. Son augmentation dans les pathologies telles que la kératoconjonctivite vernale signe l’implication de la phase retardée de l’allergie dans cette affection. Le dosage des ICAM est également possible ainsi que celui de la tryptase signant alors un processus de dégranulation mastocytaire en cas d’élévation.
• Pratiquer un interrogatoire détaillé (voir plus haut).
• Identifier la forme clinique.
• Si le tableau est typique : orienter vers l’allergologue pour un bilan étiologique en précisant la forme clinique suspectée. Celui-ci pratiquera des tests cutanés puis sériques ± un TPC en fonction de la pertinence des résultats.
• Si le tableau n’est pas typique : reprendre l’interrogatoire, effectuer un examen plus poussé des paupières, des bords libres et du film lacrymal. Si le doute persiste sur la nature allergique de la conjonctivite, les examens biologiques lacrymaux peuvent orienter. Une orientation vers l’allergologue s’imposera en cas de doute pour terminer les explorations (prick-test, RAST ± TPC).
Tout ceci à pour but d’adapter au mieux la prise en charge thérapeutique.
[1] Petricek I, Prost M, Popova A. The differential diagnosis of red eye : a survey of medical practitioners from Eastern Europe and the Middle East. Ophthalmologica 2006 ; 220 : 229-37.
[2] Smith AF, Pitt AD, Rodruiguez AE, et al. The economic and quality of life impact of seasonal allergic conjunctivitis in a Spanish setting. Ophthalmic Epidemiol 2005 ; 12 : 233-42.
[3] Pitt AD, Smith AF, Lindsell L, et al. Economic and quality of life impact of seasonal allergic conjunctivitis in Oxfordshire. Ophthalmic Epidemiol 2004 ; 11 : 17-33.
[4] Palmares J, Delgado L, Cidade M, et al. Allergic conjunctivitis : a national cross-sectional study of clinical characteristics and quality of life. Eur J Ophthalmol 2010 ; 20 : 257-64.
[5] Ait-Khaled N, Pearce N, Anderson HR, et al. Global map of the prevalence of symptoms of rhinoconjunctivitis in children : The International Study of Asthma and Allergies in Childhood (ISAAC) Phase Three. Allergy 2009 ; 64 : 123-48.
[6] Gradman J, Wolthers OD. Allergic conjunctivitis in children with asthma, rhinitis and eczema in a secondary outpatient clinic. Pediatr Allergy Immunol 2006 ; 17 : 524-6.
[7] Bourcier T, Viboud C, Cohen JC, et al. Effects of air pollution and climatic conditions on the number of ophthalmic emergency examinations. Br J Ophthalmol 2003 ; 87 : 809-11.
[8] Blondin C, Cholley B, Haeffner-Cavaillon N, Goldschmidt P. In vitro effects of antiallergic eyedrops on complement activation induced by particulate matter. J Fr Ophtalmol 2003 ; 26 : 328-36.
[9] Brémond-Gignac D. The clinical spectrum of ocular allergy. Curr Allergy Asthma Rep 2002 ; 2 : 321-4.
[10] Leonardi A, Bogacka E, Fauquert JL, et al. Ocular allergy : recognizing and diagnosing hypersensitivity disorders of the ocular surface. Allergy 2012 ; 67 : 1327-37.
[11] BenEzra D. Blepharoconjunctivitis and conjunctivitis : guidelines for diagnosis and treatment. IOIS/Glosa ; 2006, 245 p.
[12] Hoang-Xuan T, Baudouin C, Creuzot-Garcher C. Les conjonctivites allergiques. In : Inflammation chronique de la conjonctive. Rapport Bull Soc Ophtalmol. Paris : Ed Lamy ; 1998, p. 93-124.
[13] Bielory L. Allergic and immunologic disorders of the eye. Part II : ocular allergy. J Allergy Clin Immunol 2000 ; 106 : 1019-32.
[14] Bourke J, Coulson I, English J. Guidelines for care of contact dermatitis. Br J Dermatol 2001 ; 145 : 877-85.
[15] Le Coz CJ, Sasseville D. Interpretation and relevance of patch testing : false-positive and false-negative test reactions, compound allergy, cross-sensitivity. Ann Dermatol Venereol 2009 ; 136 : 610-6.
[16] Garcia Robaina JC, Sanchez Machin I, Fernandez-Caldas E, et al. Skin tests and conjunctival and bronchial challenges with extracts of Blomia tropicalis and Dermatophagoides pteronyssinus in patients with allergic asthmaand/or rhinoconjunctivitis. Int Arch Allergy Immunol 2003 ; 131 : 182-8.
[17] Riechelmann H, Epple B, Gropper G. Comparison of conjunctival and nasal provocation test in allergic rhinitis tohouse dust mite. Int Arch Allergy Immunol 2003 ; 130 : 51-9.
[18] Marmouz F, Raffard M. Allergic conjunctivitis : diagnosis and treatment. Allerg Immunol 2004 ; 36 : 25-9.
[19] Ciprandi G, Tosca MA, Fasce L, Canonica GW. Allergen-specific conjunctival challenge in children with allergic asthma : a clinical tool. Allergy 1994 ; 49 : 489-91.
[20] Bertel F, Mortemousque B, Sicard H, André C. Test de provocation conjonctival au Dermatophagoides pteronyssinus dans le diagnostic des conjonctivites allergiques aux acariens domestiques. J Fr Ophtalmol 2001 ; 24 : 581-9.
[21] Bonini S, Bonini S, Lambiase A, et al. Vernal keratoconjunctivitis revisited : a case series of 195 patients with long-term followup. Ophthalmology 2000 ; 107 : 1157-63.
[22] Leonardi A, Busca F, Motterle L, et al. Case series of 406 vernal keratoconjunctivitis patients : a demographic and epidemiological study. Acta Ophthalmol Scand 2006 ; 84 : 406-10.
[23] Liotet S, Kogbe O, Maiza S, Laroche L. IgE et conjonctivite allergique. À propos des 1380 premiers dosages. Bull Soc Ophtalmo Fr 1985 ; 85 : 905-8.
[24] Batellier L, Poilane C, Rault J, et al. Measurement of total IgE in tears : the adaptation of an immunoenzyme technique and the value of investigating locally produced IgE in the diagnosis of chronic conjunctivitis. Ann Biol Clin (Paris) 1999 ; 57 : 469-73.
[25] Leonardi A, Borghesan F, Faggian D, et al. Eosinophil cationic protein in tears of normal subjects and patients affected by vernal keratoconjunctivitis. Allergy 1995 ; 50 : 610-3.
[26] Leonardi A, Jose PJ, Zhan H, Calder VL. Tear and mucus eotaxin-1 and eotaxin-2 in allergic keratoconjunctivitis. Ophthalmology 2003 ; 110 : 487-92.
Abelson MB, McLaughlin JT, Gomes PJ. Antihistamines in ocular allergy : are they all created equal ? Curr Allergy Asthma Rep 2011 ; 11 : 205-11.
Ballas Z, Blumenthal M, Tinkelman DG, et al. Clinical evaluation of ketorolac tromethamine 0.5 % ophthalmic solution for the treatment of seasonal allergic conjunctivitis. Surv Ophthalmol 1993 ; 38 : 141-8.
Bielory L, Lien KW, Bigelsen S. Efficacy and tolerability of newer antihistamines in the treatment of allergic conjunctivitis. Drugs 2005 ; 65 : 215-28.
Ciprandi G, Buscaglia S, Cerqueti PM, Canonica GW. Drug treatment of allergic conjunctivitis. A review of the evidence. Drugs 1992 ; 43 : 154-76.
Cook EB, Stahl JL, Barney NP, Graziano FM. Mechanisms of antihistamines and mast cell stabilizers in ocular allergic inflammation. Curr Drug Targets Inflamm Allergy 2002 ; 1 : 167-80.
Devogelaere T, Beresniak A, Raymaeckers A, et al. Étude clinique des lingettes Supranettes dans le traitement des conjonctivites saisonnières et perannuelles de l’enfant. J Fr Ophtalmol 2006 ; 29 : 593-8.
Doan S, Mortemousque B, Pisella PJ. L’allergie oculaire de la clinique au traitement. Med’com éditions ; 2010, p. 233-7.
Foreman JC. Substance P and calcitonin gene-related peptide : effects on mast cells and inhuman skin. Int Arch Allergy Appl Immunol 1987 ; 82 : 366-71.
Leurs R, Church MK, Taglialatela M. H1-antihistamines : inverse agonism, anti-inflammatory actions and cardiac effects. Clin Exp Allergy 2002 ; 32 : 489-98.
Mann RD, Pearce GL, Dunn N, Shakir S. Sedation with ‘non-sedating’ antihistamines : four prescription-event monitoring studies in general practice. BMJ 2000 ; 320 : 1184-7.
Simons FE. Advances in H1-antihistamines. N Engl J Med 2004 ; 351 : 2203-17.
Tauber J, Raizman MB, Ostrov CS, et al. A multicenter comparison of the ocular efficacy and safety of diclofenac 0.1 % solution with that of ketorolac 0.5 % solution in patients with acute seasonal allergic conjunctivitis. J Ocul Pharmacol Ther 1998 ; 14 : 137-45.
A. Muselier-Mathieu, E. Collet, C. Creuzot-Garcher
Les dermatites de contact représentent la cause la plus fréquente des dermatites des paupières. Le diagnostic d’eczéma aigu des paupières est un diagnostic clinique qui ne nécessite pas un recours à des investigations complémentaires. L’eczéma chronique est parfois de diagnostic difficile, car les lésions sont souvent discrètes et perdent leur aspect sémiologique typique. L’allergie de contact peut compliquer une autre affection ophtalmologique (rosacée, dermite séborrhéique, etc.). C’est un piège diagnostique qu’il faut systématiquement évoquer. Un bilan étiologique comprenant les tests allergologiques doit être réalisé en cas de doute sur une allergie de contact. Une collaboration entre ophtalmologistes, dermatologues et allergologues est d’une importance capitale pour une prise en charge optimale des patients.
Le nombre des patients allergiques ne cesse d’augmenter depuis quelques années. L’allergie devient un véritable problème de santé publique [1, 2]. Les raisons de cette évolution sont multiples mais les facteurs immunologiques et environnementaux semblent largement mis en cause.
L’allergie oculaire et palpébrale est une pathologie courante constituée d’entités distinctes par leur aspect clinique et leur gravité. Œil et paupière sont des localisations fréquentes de l’allergie de contact, motif quotidien de consultation auprès de l’ophtalmologiste ou du dermatologue. Les dermatites de contact représentent la cause la plus fréquente des dermatites des paupières [3]. Dans la grande majorité des cas, ces dermatites sont irritatives, non immunologiquement spécifiques, observées par exemple en milieu professionnel (résines plastiques, solvants, etc.), plus rarement avec des cosmétiques (crèmes antivieillissement). Moins fréquemment, ces dermatites sont authentiquement allergiques et répondent soit à un mécanisme d’hypersensibilité immédiate, médié par les immunoglobulines E (IgE), entraînant alors des réactions urticariennes, soit à un mécanisme d’hypersensibilité retardée à l’origine d’un eczéma [4-6]. Au cours de l’eczéma de contact, la molécule sensibilisante est le plus souvent un haptène capable d’induire une réaction immunitaire lorsqu’il se lie à une protéine tissulaire. Trois phases sont classiquement décrites :
phase de sensibilisation : elle est cliniquement asymptomatique. Elle aboutit à la génération de lymphocytes T (LT), mémoires spécifiques de l’haptène qui circulent entre peau et ganglion lymphatique ;
phase de déclenchement de l’eczéma : elle se produit lors d’une nouvelle mise en contact de l’allergène. Les lymphocytes CD8+ et CD4+ spécifiques sont rapidement activés. Ils exercent alors leurs fonctions de cytotoxicité, de production de cytokines capables d’une part d’activer d’autres types cellulaires (dont les kératocytes et les cellules endothéliales) et d’autre part de recruter des leucocytes (dont les polynucléaires neutrophiles et de nouveaux LT spécifiques) dans le derme puis dans l’épiderme où les kératinocytes subissent une intense apoptose. Cliniquement, un eczéma de contact apparaît en 24 à 48 h, parfois plus rapidement lorsqu’il s’agit d’allergènes puissants ;
phase de régulation de l’inflammation : elle permet de mettre un terme à la réaction. Les LT régulateurs inhibent les LT effecteurs, ce qui aboutit à l’extinction de l’inflammation cutanée en quelques jours [7].
Les modes de sensibilisation au cours des eczémas des paupières sont nombreux et parfois inhabituels [5]. La peau fine, située sur une zone exposée et découverte, est particulièrement sensible et la pénétration des allergènes est aisée d’autant plus que les sources peuvent être multiples (cosmétiques, médicaments ou allergènes professionnels). Les différents modes de sensibilisation à un allergène sont les suivants :
par application directe lors de l’usage d’un cosmétique sur les paupières, d’une instillation d’un médicament topique ou d’un produit d’entretien pour lentilles de contact par exemple. L’allergie est facilement identifiée par les malades. Il s’agit d’un eczéma de contact direct ;
par application de l’allergène sur une zone proche des paupières (visage ou cuir chevelu). Le site d’application, comme dans le cas précédent, est indemne de lésions et seules les paupières sont atteintes. Des lésions discrètes d’eczéma seront attentivement recherchées sur le cou ou en lisière du cuir chevelu. Il s’agit d’un eczéma de contact de proximité. Ce type de sensibilisation impose une exploration systématique des allergènes appliqués « à proximité » de la région palpébrale (crème de jour, teintures capillaires, etc.) ;
par transfert d’un autre site du tégument, le plus souvent les mains (eczéma manuporté). Ces dernières ne sont pas toujours atteintes. Parfois, l’allergène est véhiculé de façon involontaire aux paupières comme dans le cas du vernis à ongles par exemple (eczéma dit « ectopique ») ;
par exposition à des gaz, vapeurs, pulvérisation de gouttelettes, plus rarement de particules solides. Il s’agit alors d’un eczéma aéroporté. Ce type de sensibilisation est fréquemment retrouvé en cas d’allergie professionnelle mais il est possible également en milieu domestique (parfums d’intérieur à base d’huiles essentielles) ;
dû à un allergène véhiculé par une tierce personne (conjoint, enfant, ami, etc.) encore appelé « eczéma par procuration » ;
par le biais de photo-allergènes qui nécessitent l’action conjointe de l’exposition solaire. L’atteinte des paupières est dans ce cas exceptionnellement isolée. C’est le cas des eczémas par photo-allergie aux filtres solaires ;
enfin, il peut survenir un eczéma des paupières après exposition systémique à l’allergène. Le plus souvent, le malade est préalablement sensibilisé par voie topique. L’ingestion ou l’injection de l’allergène ou d’un allergène croisé entraîne un eczéma généralisé incluant les paupières.
L’allergie de contact associe fréquemment conjonctivite et eczéma des paupières. Les aspects cliniques sont variés, parfois très bruyants lors d’eczémas aigus ou plus discrets lorsque les lésions deviennent chroniques.
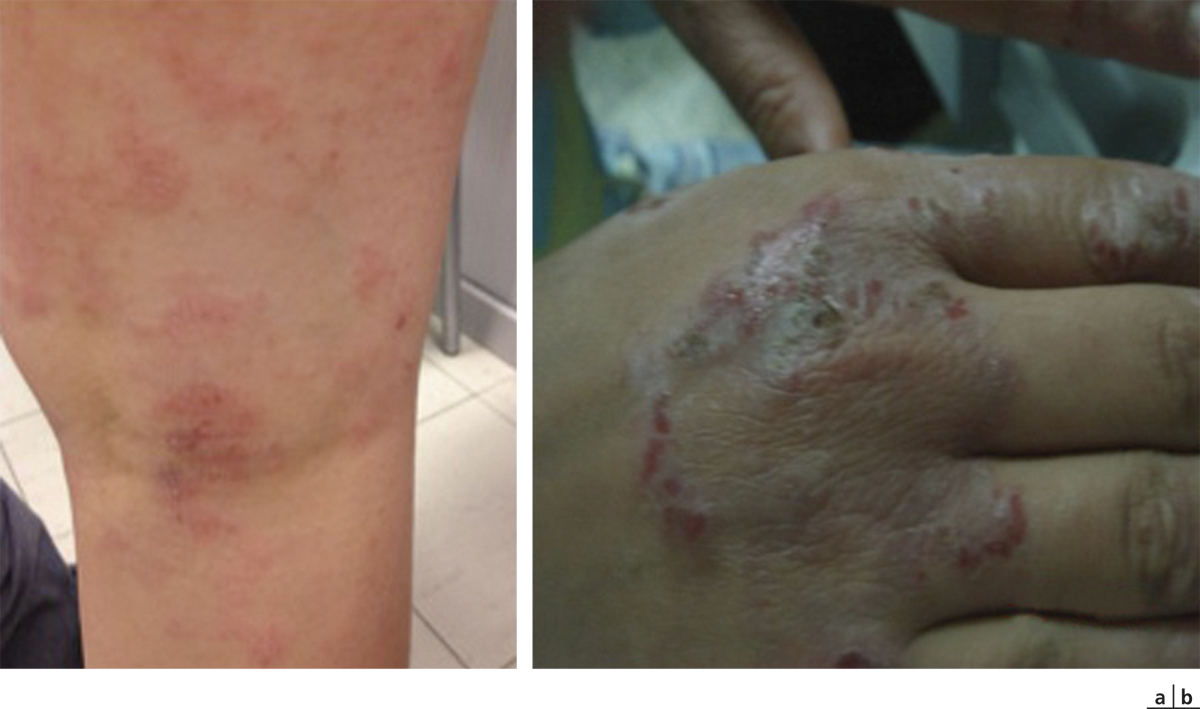
L’eczéma de contact « aigu » des paupières dans sa forme typique est généralement bilatéral et l’atteinte se situe préférentiellement au niveau des paupières supérieures. Il est caractérisé par une éruption érythémateuse, vésiculeuse et suintante, évoluant vers des croûtes par dessiccation du liquide contenu dans les vésicules, et une desquamation par élimination de l’épiderme altéré [8]. Toutes ces lésions élémentaires peuvent coexister. Le prurit est souvent intense (fig. 5.3 et 5.4). Deux points méritent d’être soulignés :
l’œdème au cours des eczémas aigus des paupières est souvent très marqué et fait parfois porter par erreur le diagnostic d’œdème de Quincke lorsque le patient consulte dans un service d’urgence. La présence de lésions vésiculeuses et la durée de l’œdème qui persiste plusieurs heures à plusieurs jours permettent de redresser le diagnostic ;
les eczémas aigus des paupières causés par les collyres ou pommades ophtalmiques sont toujours accompagnés d’une conjonctivite. L’atteinte palpébrale en revanche peut être isolée en cas d’allergie à un cosmétique.
Lorsque l’eczéma devient chronique (fig. 5.5), la peau prend alors un aspect plus sec, érythématosquameux, avec une atteinte mal limitée. Les vésicules sont absentes. L’eczéma est souvent plus discret mais le prurit persiste. Une inspection soigneuse des bords palpébraux permet de le localiser au niveau du canthus interne ou externe. Il est alors difficile à différencier d’une dermatite d’irritation. Quand le prurit est intense, l’évolution se fait vers la lichénification donnant un aspect épaissi, quadrillé des paupières.
Enfin, dans 50 à 70 % des cas, l’eczéma des paupières s’accompagne d’autres localisations cutanées qu’il convient de rechercher systématiquement. Des lésions évocatrices d’eczéma de contact de topographie spécifique permettent d’orienter le diagnostic. En effet, en cas d’atteinte du cou ou du décolleté associée, les parfums ou vernis à ongles sont fortement suspectés. Par contre, en cas d’atteinte de la lisière du cuir chevelu, une orientation vers les produits capillaires est privilégiée. Enfin, des localisations évocatrices d’une dermatite atopique éventuelle sont à rechercher au niveau du pli du coude, creux poplité, cou-de-pied, zone rétro-auriculaire, etc. Des stries de grattage et une peau sèche aident à l’orientation diagnostique puisqu’un terrain atopique serait présent dans 30 à 50 % des dermatites des paupières selon les séries [4, 9].
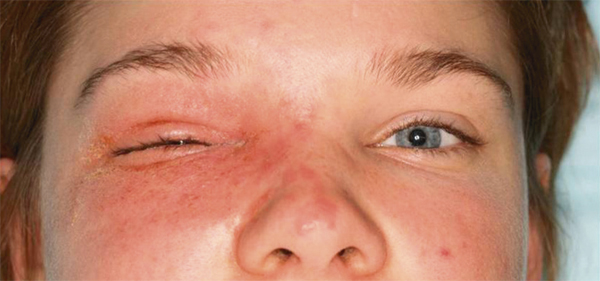
Fig. 5-3 Eczéma aigu après utilisation d’une pommade contenant de l’oxyde jaune de mercure.
(Source : Dr E. Collet.)
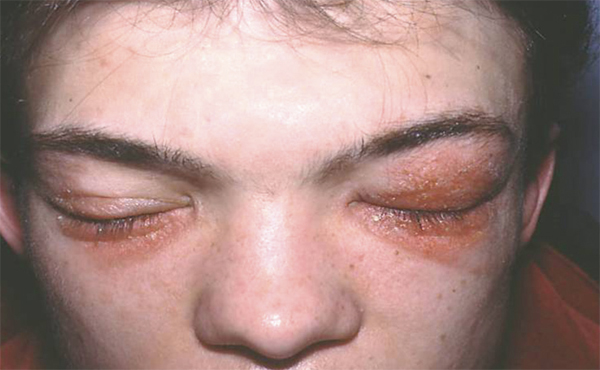
Fig. 5-4 Eczéma de contact des paupières après application d’un antiseptique local contenant du chlorure de benzalkonium.
(Source : Dr E. Collet.)
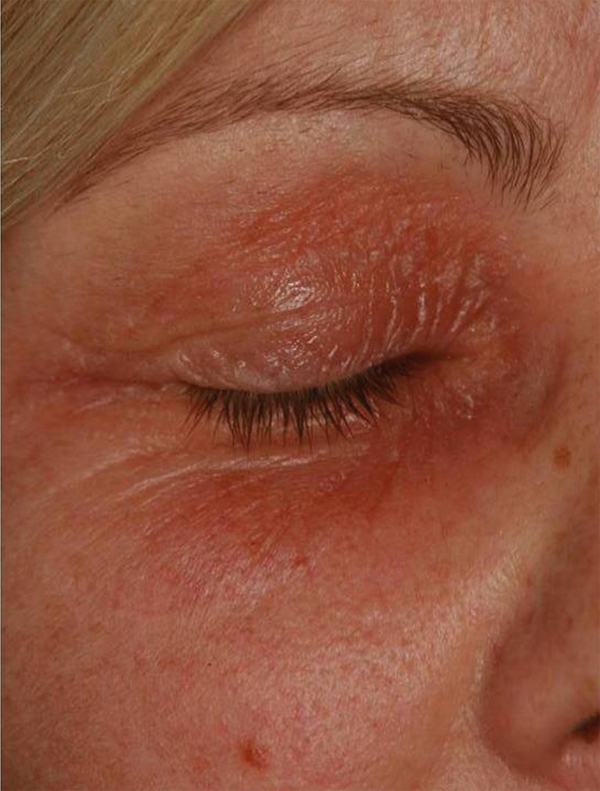
Fig. 5-5 Eczéma chronique des paupières.
(Source : Dr E. Collet.)
L’atteinte conjonctivale et du bord libre palpébral est présente lorsque l’allergène a directement été en contact avec la conjonctive. La symptomatologie exprimée par les patients est le plus souvent un prurit et un larmoiement. L’atteinte peut être uni- ou bilatérale. L’atteinte clinique est caractérisée par une hyperhémie et/ou un chémosis des paupières et de la conjonctive, un larmoiement clair associé à un prurit important. Une conjonctivite papillaire peut être observée. La présence d’une kératite ponctuée superficielle inférieure et d’une imprégnation conjonctivale est souvent causée par la stagnation des médiateurs inflammatoires ou allergènes avant la vidange lacrymale. Cependant, cette imprégnation n’est en aucun cas pathognomonique puisque celle-ci peut être présente en cas d’atteinte toxique. Une blépharite avec œdème et hyperhémie du bord libre palpébral entraînant un dysfonctionnement meibomien est parfois observée de façon concomitante ou isolée pouvant faire poser à tort le diagnostic de rosacée oculaire. L’ensemble du tableau peut se généraliser rendant difficile le diagnostic et ce, d’autant plus que le patient a reçu de nombreux collyres.
Lorsque l’atteinte se pérennise, un aspect de kératoconjonctivite chronique peut faire méconnaître le diagnostic étiologique. Un bon interrogatoire est donc important afin de rétablir la chronologie, d’autant plus que ces formes sont présentes dans 30 % des manifestations oculaires professionnelles.
Œil et paupières peuvent être le siège d’une urticaire ou d’un angiœdème liés à une hypersensibilité immédiate IgE médiée. Les manifestations cliniques sont brutales et aiguës survenant souvent en quelques minutes. Elles sont secondaires à une exposition à un allergène spécifique comme le latex, les hydrolysats de protéine de blé des cosmétiques par exemple. Elles se présentent comme un chémosis, un œdème palpébral majeur associé à une hyperhémie conjonctivale, un larmoiement clair et un prurit intense. Ce cortège de signes peut s’accompagner d’une généralisation de l’urticaire ou de signes généraux comme une rhinite, un asthme et même parfois un angiœdème avec un risque asphyxique.
Malgré un contexte souvent évocateur, il est parfois difficile de poser le diagnostic d’allergie de contact [10].
En cas de forme aiguë conjonctivale, le diagnostic différentiel repose essentiellement sur la conjonctivite allergique saisonnière. La conjonctivite allergique perannuelle devra être suspectée en cas de chronicisation.
Devant une atteinte combinée conjonctivale et palpébrale, surtout lorsqu’une blépharite est associée, le diagnostic de rosacée oculaire est parfois difficile à écarter d’autant plus qu’un dysfonctionnement meibomien peut compliquer une pathologie allergique surtout si elle se chronicise (fig. 5-6).
Le diagnostic différentiel entre eczéma et dermatite d’irritation est souvent difficile à poser devant des lésions évoluant depuis plusieurs semaines ou plusieurs mois. En effet, dans les deux cas, il s’agit d’une éruption érythémateuse, squameuse, prurigineuse sans vésicule. Les mêmes agents (conservateurs, médicaments topiques, tensioactifs, etc.) peuvent donner ces deux types de réactions. L’eczéma succède parfois à l’irritation et seuls l’interrogatoire et les tests épicutanés permettent de différencier les deux. L’intrication avec la dermatite atopique est également possible, hypersensibilité retardée et atopie pouvant coexister.
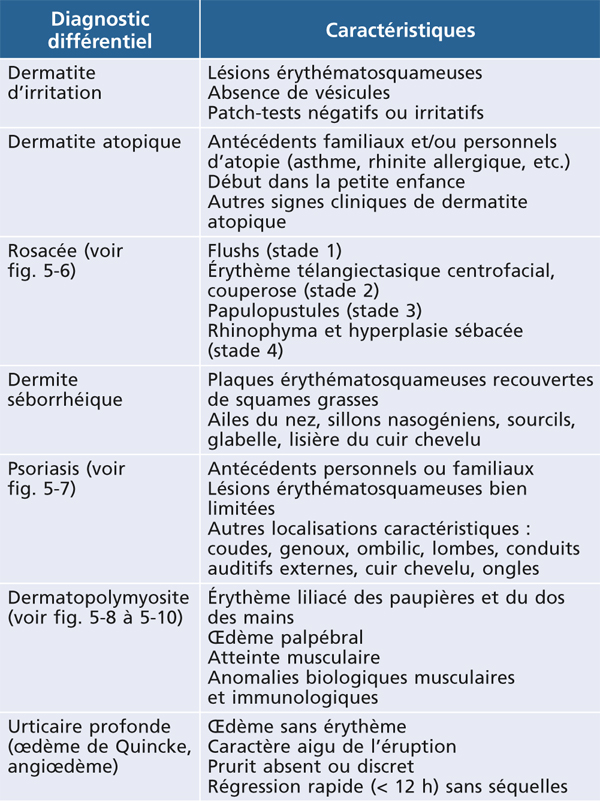
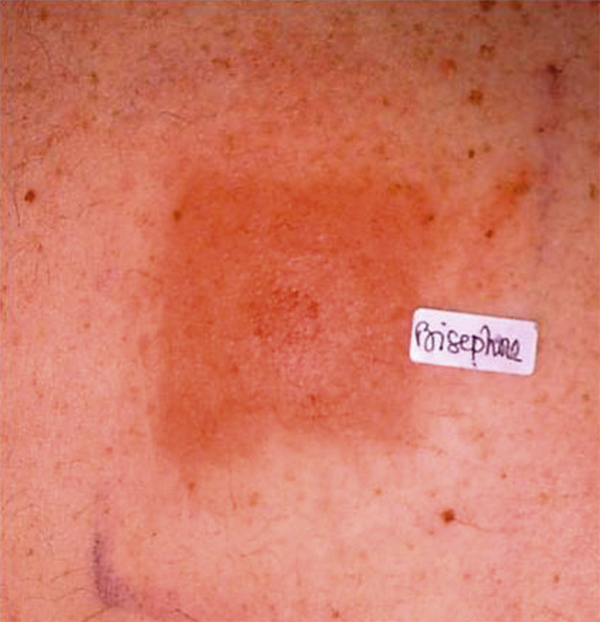
Il est le plus souvent aisé d’écarter une dermite séborrhéique, caractérisée par des lésions érythémateuses recouvertes de squames grasses dans des localisations spécifiques (sourcils, aile du nez). Le psoriasis des paupières a souvent un aspect atypique et c’est l’association à d’autres lésions typiques de psoriasis qui redresse le diagnostic (fig. 5-7). La dermatopolymyosite doit systématiquement être évoquée devant un érythème œdémateux des paupières résistant aux dermocorticoïdes et associé à des signes musculaires (fig. 5-8 à 5-10) [10].
L’eczéma de contact peut compliquer l’évolution de toute dermatose localisée aux paupières. Cette éventualité doit être évoquée devant une aggravation inhabituelle, une modification séméiologique ou l’absence de réponse à un traitement local jusqu’alors efficace d’une dermatose connue du malade (dermite séborrhéique, dermatite atopique ou rosacée) [9]. Le bilan allergologique prend ainsi toute sa place et explorera les différents topiques médicamenteux et cosmétiques utilisés [9].
Tableau 5-1 Principaux diagnostics différentiels des eczémas des paupières.
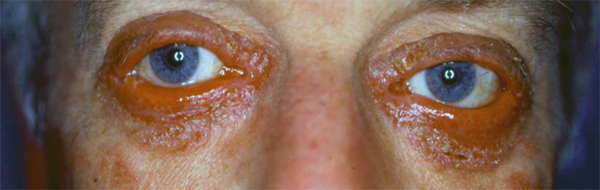
Fig. 5-6 Réaction allergique de contact compliquant une blépharite.
(Source : Dr E. Collet.)
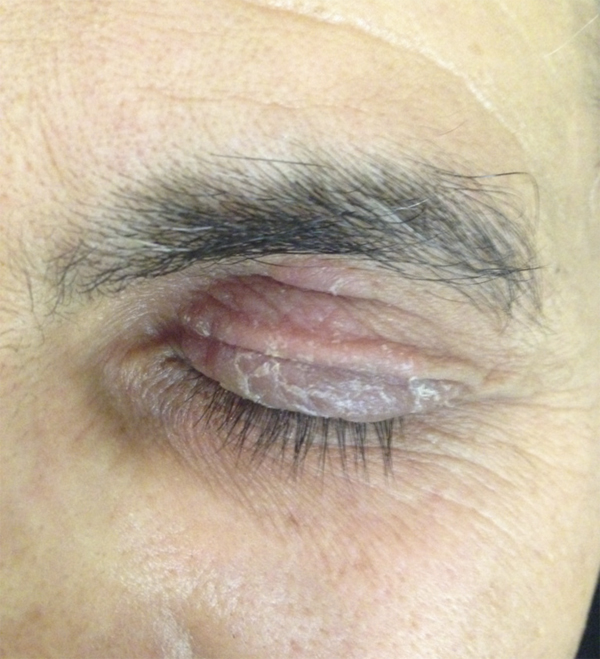
Fig. 5-7 Psoriasis des paupières.
(Source : Dr A. Muselier-Mathieu.)
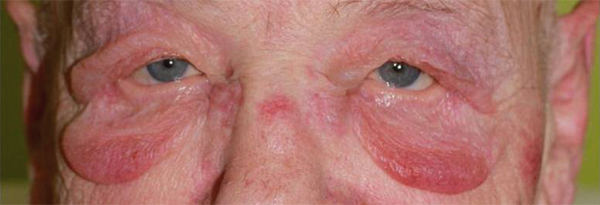
Fig. 5-8 Dermatopolymyosite : érythème et œdème des paupières.
(Source : Dr E. Collet.)
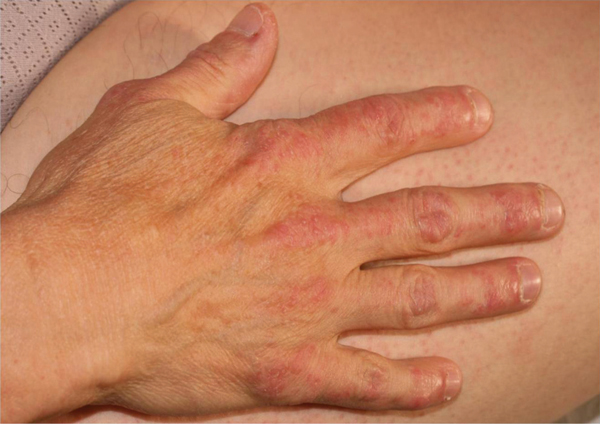
Fig. 5-9 Dermatopolymyosite : éruption caractéristique du dos des mains chez le même malade.
(Source : Dr E. Collet.)
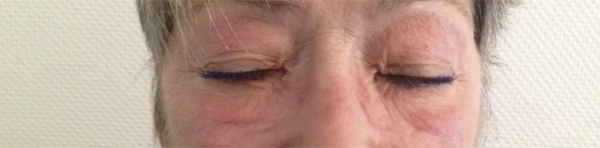
Fig. 5-10 Dermatopolymyosite.
(Source : Dr A. Muselier-Mathieu.)
L’eczéma de contact peut être consécutif à un grand nombre de collyres et de pommades ophtalmologiques. Les atteintes conjonctivales et palpébrales sont associées. Ces observations ont été colligées dans une revue récente de Mughal et al. [10]. Les patients touchés par ce groupe d’allergènes sont plus âgés que ceux allergiques aux cosmétiques ou aux allergènes professionnels. Les médicaments topiques représentent environ 25 % des étiologies allergiques [11]. Ils sont sensibilisants soit par leur principe actif (anti-inflammatoires, antibiotiques, β-bloquants, antiviraux, etc.), leur excipient ou leur conservateur [10-13]. Une atteinte conjonctivale est associée à l’atteinte palpébrale.
Les principes actifs des collyres à l’origine de sensibilisation sont nombreux et sont chimiquement très diversifiés. Les collyres antibiotiques de la famille des aminosides (néomycine, gentamycine, tobramycine, amikacine) sont les sensibilisants les plus fréquents. La néomycine appartient à la batterie standard européenne des patch-tests. Elle ne permet toutefois que de dépister inconstamment la sensibilisation aux aminosides topiques [14]. L’azithromycine est également à l’origine d’eczémas aigus des paupières associés à une conjonctivite [15]. Des allergies de contact aux β-bloquants des collyres sont rapportées avec des patch-tests positifs au collyre lui-même (fig. 5-11) et à son principe actif (timolol, cartéolol, etc.). Ils posent des problèmes de prise en charge thérapeutique car la totalité de la classe thérapeutique est alors contre-indiquée [16]. L’atropine ou les dérivés des catécholamines peuvent être à l’origine d’eczémas aigus. Des sensibilisations de contact à la néosynéphrine sont possibles sans allergie croisée avec l’éphédrine ou l’épinéphrine. Les allergies de contact aux corticoïdes locaux, collyres anti-inflammatoires non stéroïdiens (diclofénac, indométacine) ou anti-histaminiques sont rares mais de diagnostic difficile car ces médicaments sont précisément utilisés pour traiter l’inflammation ou l’allergie oculaire [10]. Plus récemment, plusieurs cas de conjonctivites avec atteinte palpébrale ont été rapportés après utilisation d’analogues des prostaglandines, latanoprost et bimatoprost. Cet effet secondaire est beaucoup plus rare que l’hyperpigmentation et l’hypertrichose observées avec cette classe thérapeutique. Certains auteurs ont montré que l’allergie croisée entre les deux molécules n’est pas systématique [17].
Fig. 5-11 Eczéma de contact au timolol contenu dans différents collyres (patch-tests positifs ++).
(Source : Dr E. Collet.)
Les conservateurs en cause le plus fréquemment sont les ammoniums quaternaires, principalement le chlorure de benzalkonium, plus rarement le cétrimide, le cétrimonium ou le cétylpyridinium (fig. 5-4 et 5-12). Ils sont toujours explorés au cours d’un bilan allergologique d’eczéma des paupières. Le passage à une présentation « unidose » dépourvue de conservateurs, lorsqu’il est possible, permet la guérison du patient et la poursuite du principe actif efficace. Les allergies aux mercuriels (thiomersal ou acétate de phénylmercure) ne sont plus observées actuellement, puisque ces agents ont été supprimés et la découverte d’un patch-test positif à ces molécules témoigne d’une exposition ancienne.
Les allergies de contact secondaires aux produits d’entretien sont plus fréquemment trouvées chez les porteurs de lentilles souples que de lentilles rigides. Le plus souvent, sont en cause les agents antimicrobiens, les surfactants ou un chélateur calcique (acide éthylène-diamine-tétra-acétique ou EDTA) contenus dans les solutions multifonctions [18]. Cette étiologie d’eczéma de contact est devenue très rare dans les consultations d’allergologie.
Les cosmétiques et produits d’hygiène sont de plus en plus fréquemment en cause dans le déclenchement d’eczémas des paupières, qu’il s’agisse de cosmétiques utilisés sur les zones péri-oculaires (maquillage, crèmes, laits, lotions, etc.) ou de ceux appliqués à proximité des paupières (teintures capillaires, parfums, cosmétiques des mains ou des ongles, etc.) [19]. L’eczéma de contact peut se localiser exclusivement au niveau palpébral alors qu’il n’existe aucune atteinte au niveau du site d’application. Au cours des eczémas des paupières liés au vernis à ongles, les lésions péri-unguéales sont discrètes ou absentes [20].
Depuis quelques années, l’étiquetage des cosmétiques (nomenclature INCI ou international nomenclature of cosmetic ingredients) est obligatoire, ce qui a beaucoup facilité la tâche des allergologues dans l’identification des allergènes responsables et celle des malades qui repèrent plus facilement dans les produits les ingrédients qui leur sont déconseillés. Ceci suppose toutefois que des listes d’éviction correctes leur ont été remises au terme du bilan allergologique avec quelques explications afin qu’ils puissent identifier les allergènes cachés ou connaître les allergies croisées. Un très grand nombre de molécules sont incriminées : conservateurs, parfums, tensioactifs, filtres solaires, etc.
Depuis quelques années, on constate une explosion des allergies de contact à une famille de conservateurs, les isothiazolinones (méthylisothiazolinone et méthylchloroisothiazolinone) présents dans les produits d’hygiène (surtout rincés), les lingettes nettoyantes ou démaquillantes (fig. 5-13). L’utilisation de ces conservateurs a fortement augmenté depuis l’interdiction en 2007 de l’Euxyl K400® et la polémique concernant les parabènes. Un certain nombre de fabricants de dermo-cosmétiques ont déjà supprimé ces molécules, mais elles restent toutefois encore très présentes dans les produits d’hygiène de grande distribution [21].
La pratique de l’aromathérapie s’est beaucoup développée. Les huiles essentielles, utilisées sur la peau, en diffuseur ou en pulvérisations sont des sources d’allergie de contact directe ou aéroportée. Leurs propriétés antiseptiques et leurs vertus apaisantes, relaxantes voire thérapeutiques sont des arguments de vente de ces produits que les patients se procurent souvent sur Internet. Ces huiles essentielles présentées comme parfaitement inoffensives car « naturelles » ou « bio » contiennent en réalité les mêmes molécules allergisantes que les parfums (terpènes, etc.). Parmi les plus allergisantes, le tea tree oil ou « arbre à thé » (Melaleuca alternifolia) est à l’origine de nombreux cas de sensibilisation se manifestant souvent par une atteinte palpébrale [22].
Plusieurs articles récents mettent en cause les résines acryliques des colles pour les faux cils. Ces acrylates sont du même type que ceux utilisés dans les gels et les colles des faux ongles et entraînent les mêmes effets [23].
La paraphénylènediamine (PPD) des teintures capillaires reste un des agents responsables le plus fréquemment d’eczéma des paupières. Les symptômes sont aigus et l’œdème important motivent des consultations en urgence. La sensibilisation initiale à la PPD peut se faire par le biais d’un tatouage éphémère au « faux henné ».
Dans quelques cas, les cosmétiques entraînent des réactions immédiates à type d’urticaire ou d’angiœdème. Depuis l’interdiction du collagène bovin, les hydrolysats de protéine de blé, agents hydratants, sont présents dans certains cosmétiques anti-âge. Ils peuvent induire des réactions de type anaphylactique, violentes, confirmées par les prick-tests. D’autres molécules peuvent induire de telles urticaires de contact comme les protéines de poisson, le triclosan ou la chlorhexidine [24].
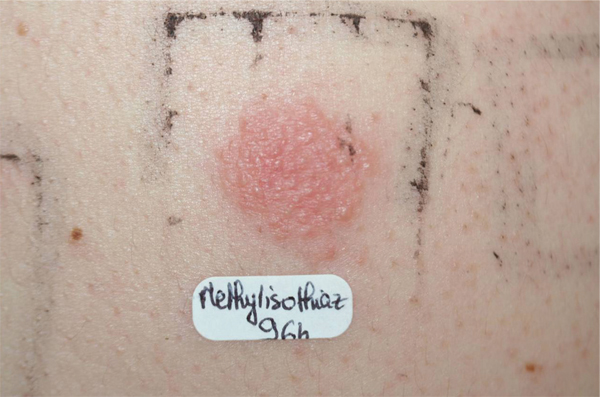
Fig. 5-13 Patch-test positif au méthylisothiazolinone d’une lingette démaquillante.
(Source : Dr E. Collet.)
Les allergènes professionnels sont dans la littérature peu impliqués dans les eczémas de contact mais probablement sous-estimés [25]. Une étude américaine rapporte un taux de 537 atteintes oculaires d’origine professionnelle pour 100 000 consultations [3]. En effet, dans les formes chroniques, la symptomatologie présentée pourra être discrète à type de conjonctivite chronique plus ou moins associée à des lésions eczématiformes des paupières entraînant alors une errance diagnostique.
De nombreux allergènes manuportés ou aéroportés peuvent être en cause. Un grand nombre de produits industriels présents sous forme de suspension dans l’air (vapeurs, poudres, etc.) provoquent des manifestations d’irritation ou d’eczéma. La saison estivale entraîne une recrudescence des pathologies manuportées car les travailleurs transpirant s’essuient fréquemment les yeux avec leurs mains. Divers groupes d’allergènes sont concernés : acrylates (prothésiste dentaire, manucure) ; résines époxydiques (industrie des matières plastiques, colles) ; végétaux (Frullania chez les travailleurs du bois) ; parfums (esthéticiennes) ; colorants capillaires (coiffeuses) ; méthylisothiazolinone (peintres) ; amoniums quaternaires (professions paramédicales) ; farines (boulangers) ; pesticides (viticulteurs, agriculteurs) ; etc.
Très récemment, ont été rapportés des cas d’eczémas de contact professionnels après manipulation de médicaments sous forme de poudre chez des infirmières travaillant dans des services de gériatrie ou de psychiatrie auprès de malades qui nécessitaient le broyage de leurs comprimés. Les molécules en cause étaient les antibiotiques, le tétrazépam actuellement retiré de la vente et les inhibiteurs de la pompe à protons [26].
Les allergies immédiates en milieu professionnel sont essentielles à connaître car leur survenue peut se traduire par des manifestations sévères potentiellement mortelles (asthme, choc anaphylactique). C’est le cas des protéines du latex responsables en milieu hospitalier d’urticaires de contact fréquemment associées à des rhinoconjonctivites chez les professionnels de santé. Cette allergie immédiate est reconnue comme maladie professionnelle (tableau no 95). La fréquence des allergies au latex semble toutefois en baisse depuis quelques années grâce à la suppression des gants poudrés dans les hôpitaux et aux mesures de prévention [27].
Le diagnostic d’allergie de contact en milieu professionnel repose essentiellement sur la connaissance des gestes, des habitudes de travail, du nettoyage des mains et des moyens de protection du salarié. Une sensibilisation allergique peut parfaitement survenir après plusieurs années d’utilisation d’un produit sans aucun problème. L’amélioration des symptômes lors des vacances ou des arrêts de travail, à condition que ceux-ci soient d’une durée suffisante (> 8 jours) est un bon test diagnostique pour suspecter l’origine professionnelle. La collaboration avec le médecin du travail est indispensable mais elle ne suffit pas toujours à identifier les allergènes avec précision, car un grand nombre de produits industriels sont protégés par des secrets de fabrication. L’exploration allergologique aboutit parfois à une déclaration en maladie professionnelle. Il est impératif de bien rédiger la déclaration sous peine de préjudice important pour le salarié pour un reclassement éventuel.
Le bilan sera entrepris en étroite collaboration avec dermatologues et allergologues [28].
Un interrogatoire minutieux, sur les antécédents personnels et familiaux du patient (atopiques, antécédent de conjonctivite allergique aiguë, sensibilisations de contact connues, etc.), la chronologie et les circonstances d’apparition de l’allergie et les habitudes ainsi que l’environnement du patient, s’avère décisif pour une recherche étiologique orientée.
La réalisation d’un bilan biologique n’a que peu d’intérêt en cas d’allergie de contact sauf si un diagnostic différentiel est évoqué. La biopsie cutanée est d’un intérêt limité surtout si l’eczéma est de forme typique. Elle montre alors une spongiose et exosérose caractéristique. En cas d’eczéma chronique, l’histologie n’apporte pas d’éléments décisifs entre eczéma de contact et dermatite irritative.
Les prick-tests réalisés par effraction intra-épidermique de l’allergène par micropuncture explorent la phase d’hypersensibilité immédiate de l’allergie. Ils sont indispensables au bilan étiologique d’une urticaire de contact (latex, etc.) ou d’une recherche de sensibilisation immédiate à un allergène respiratoire (acariens, pollens, phanères d’animaux, etc.). Ils n’ont donc pas de pertinence en cas d’eczéma de contact sauf dans les rares cas de dermatite de contact aux protéines alimentaires (manipulation d’aliments allergisants chez les cuisiniers par exemple). Les prick-tests doivent être réalisés avec prudence dans certaines hypersensibilités immédiates IgE médiées générant parfois des réactions explosives (hydrolysats de protéines de blé).
La technique des patch-tests ou tests épicutanés est la référence dans l’exploration des eczémas. L’allergène est mis en contact avec la peau du patient durant 48 h à l’aide d’une chambre de test fixée par un adhésif. Les lectures s’effectuent à 48, 72 et 96 h. Une lecture au 7e jour est parfois utile pour détecter certains allergènes révélés tardivement comme notamment dans les allergies aux dermocorticoïdes. La batterie standard européenne est systématiquement testée mais elle est insuffisante pour explorer une allergie oculaire de contact. Elle doit être complétée par d’autres allergènes dont le choix est orienté par l’interrogatoire et les facteurs d’exposition du malade (conservateurs, excipients, parfums, acrylates, etc.). Il est très utile de tester les produits apportés par le patient : collyres, produits d’hygiène, maquillage, topiques appliqués sur les paupières, produits industriels, etc. La plupart des cosmétiques et des topiques médicamenteux peuvent être testés tels quels, mais les produits rincés (savons, shampooings) ainsi que les produits industriels seront dilués ou explorés en tests semi-ouverts (produit déposé sur la peau et recouvert d’un simple micropore). Ce type de tests, moins occlusif que le patch-test, permet d’éviter les réactions d’irritation trop intenses. En matière d’allergie de contact industrielle, la connaissance des produits manipulés est indispensable. Les fiches de sécurité apportent surtout des renseignements sur la toxicité des produits mais peu sur leur allergénicité. La collaboration avec le médecin du travail est donc fondamentale.
Il arrive que les patch-tests avec les collyres soient faussement négatifs car la concentration en principe actif est faible. Le patch-test peut alors être complété par un ROAT (repeated open application test) qui consiste à appliquer le produit suspect 2 fois/jour durant 7 jours sur une même zone de la face antérieure de l’avant-bras. Cette technique permet de reproduire l’eczéma et d’incriminer le produit en cause. Lorsqu’une sensibilisation de contact à un topique est prouvée par les tests cutanés, il faut enfin déterminer l’(les) ingrédient(s) responsable(s). L’allergologue contacte le fabricant afin d’obtenir le détail du produit pour tester chacun des ingrédients séparément. Il est impossible de donner des conseils d’éviction si ces différentes phases de l’exploration allergologique n’ont pas été correctement respectées [4].
[1] Bielory L, Katelaris CH, Lightman S, Naclerio RM. Treating the ocular component of allergic rhinoconjunctivitis and related eye disorders. MedGenMed 2007 ; 9 : 35.
[2] Singh K, Axelrod S, Bielory L. The epidemiology of ocular and nasal allergy in the United States, 1988-1994. J Allergy Clin Immunol 2010 ; 126 : 778-83.e6.
[3] Morris S, Barlow R, Selva D, Malhotra R. Allergic contact dermatitis : a case series and review for the ophthalmologist. Br J Ophthalmol 2011 ; 95 : 903-8.
[4] Goossens A. Contact allergic reactions on the eyes and eyelids. Bull Soc Belge Ophtalmol 2004 ; (292) : 11-7.
[5] Collet E, Castelain M. Eyelid contact dermatitis. Ann Dermatol Venereol 2002 ; 129 : 928-30.
[6] Castelain M, Grob JJ. Ocular allergies for the dermatologist : conjunctivitis. Ann Dermatol Venereol 2002 ; 129 : 923-7.
[7] Cours de sémiologie du Collège des enseignants de dermatologie de France. 2011.
[8] Beltrani VS. Eyelid dermatitis. Curr Allergy Asthma Rep 2001 ; 1 : 380-8.
[9] Valsecchi R, Imberti G, Martino D, Cainelli T. Eyelid dermatitis : an evaluation of 150 patients. Contact Dermatitis 1992 ; 27 : 143-7.
[10] Mughal AA, Kalavala M. Contact dermatitis to ophthalmic solutions. Clin Exp Dermatol 2012 ; 37 : 593-7 ; quiz 97-8.
[11] Landeck L, John SM, Geier J. Periorbital dermatitis in 4779 patients - patch test results during a 10-year period. Contact Dermatitis 2013 ; 70 : 205-12.
[12] Herbst RA, Maibach HI. Contact dermatitis caused by allergy to ophthalmic drugs and contact lens solutions. Contact Dermatitis 1991 ; 25 : 305-12.
[13] Novitskaya ES, Dean SJ, Craig JP, Alexandroff AB. Current dilemmas and controversies in allergic contact dermatitis to ophthalmic medications. Clin Dermatol 2011 ; 29 : 295-9.
[14] Landeck L, John SM, Geier J. Topical ophthalmic agents as allergens in periorbital dermatitis. Br J Ophthalmol 2014 ; 98 : 259-62.
[15] Mendes-Bastos P, Bras S, Amaro C, Cardoso J. Non-occupational allergic contact dermatitis caused by azithromycin in an eye solution. J Dtsch Dermatol Ges 2014 ; 12 : 729-30.
[16] Nino M, Napolitano M, Scalvenzi M. Allergic contact dermatitis due to the beta-blocker betaxolol in eyedrops, with cross-sensitivity to timolol. Contact Dermatitis 2010 ; 62 : 319-20.
[17] Perez-Rodriguez E, Gonzalez-Perez R, Poza P, et al. Contact dermatitis caused by latanoprost-containing eye drops with good tolerance to bimatoprost eye drops. Contact Dermatitis 2008, 58 : 370-1.
[18] Cressey BD, Scheinman PL. Systemic allergic dermatitis of the lips resulting from allergy to an antimicrobial agent in a contact lens disinfecting solution. Contact Dermatitis 2012 ; 67 : 239-40.
[19] Ross JS, White IR. Eyelid dermatitis due to cocamidopropyl betaine in an eye make-up remover. Contact Dermatitis 1991 ; 25 : 64.
[20] Guin JD. Eyelid dermatitis from methacrylates used for nail enhancement. Contact Dermatitis 1998 ; 39 : 312-3.
[21] Hosteing S, Meyer N, Waton J, et al. Outbreak of contact sensitization to methylisothiazolinone : an analysis of French data from the REVIDAL-GERDA network. Contact Dermatitis 2014 ; 70 : 262-9.
[22] Christoffers WA, Blomeke B, Coenraads PJ, Schuttelaar ML. Co-sensitization to ascaridole and tea tree oil. Contact Dermatitis 2013 ; 69 : 187-9.
[23] Shanmugam S, Wilkinson M. Allergic contact dermatitis caused by a cyanoacrylate-containing false eyelash glue. Contact Dermatitis 2012 ; 67 : 309-10.
[24] Barrientos N, Vazquez S, Dominguez JD. Contact urticaria induced by hydrolyzed wheat protein in cosmetic cream. Actas Dermosifiliogr 2012 ; 103 : 750-2.
[25] Crepy MN. Eczéma des paupières d’origine professionnelle. INRS Documents pour le médecin du travail no 95 ; 3e trimestre 2003 : 365-71.
[26] Vander Hulst K, Kerre S, Goossens A. Occupational allergic contact dermatitis from tetrazepam in nurses. Contact Dermatitis 2010 ; 62 : 303-8.
[27] Cabanes N, Igea JM, de la Hoz B, et al. Latex allergy : position paper. J Investig Allergol Clin Immunol 2012 ; 22 : 313-30 ; quiz follow 330.
[28] Castelain M, Collet E. Œil sec et paupières : exploration de l’allergie de contact. In : Pisella PJ, Fauquert JL. L’allergie oculaire. Bulletin des Sociétés d’ophtalmologie de France. Marseille : Ed Lamy ; 2007, p. 142-67.
A. Muselier-Mathieu, C. Creuzot-Garcher
La conjonctivite gigantopapillaire se définit comme une anomalie inflammatoire, associant un désordre mécanique à un mécanisme allergique non infectieux, caractérisée classiquement par des papilles de grande taille, une hyperhémie conjonctivale, un excès de sécrétion muqueuse et une sensation de prurit ou de corps étranger. Elle survient le plus souvent chez les porteurs de lentilles de contact, principalement souples. L’atteinte limbique est inhabituelle, contrairement à la kératoconjonctivite vernale, et les nodules de Trantas sont rares. Le plus souvent, il n’y a pas d’atteinte cornéenne associée. La prise en charge thérapeutique passe surtout par la suppression du facteur causal, solution la plus judicieuse.
La conjonctivite gigantopapillaire (CGP) se définit comme une anomalie inflammatoire, non infectieuse, caractérisée par l’existence de papilles de grande taille (> 0,3 mm) siégeant au niveau de la conjonctive tarsale supérieure. Elle associe classiquement des papilles géantes, une hyperhémie conjonctivale, un excès de sécrétion muqueuse et une sensation de prurit ou de corps étranger. Elle survient le plus souvent chez les porteurs de lentilles de contact (LC), mais elle peut résulter d’autres facteurs étiologiques (prothèse oculaire, bulle de filtration, etc.).
La première description de la CGP a été faite en 1950 par McIvor chez des patients porteurs de prothèses oculaires, mais la relation avec une lentille de contact n’a été établie qu’en 1974 par Spring à qui on rapporte la première description de la CGP [1]. Quelques années plus tard, Allansmith a rapproché la CGP de la kératoconjonctivite vernale (KCV) en soulignant toutefois son pronostic moins sévère [2].
Les données concernant la fréquence de survenue de la CGP sont variables dans la littérature puisqu’elles oscillent entre 1 et 45 % [3-5]. Ces variations dépendraient de plusieurs facteurs que sont le type de LC, le mode de port (continu ou non), la durée de port, le délai de renouvellement des LC, les antécédents d’allergie et le type de solution utilisée pour l’entretien des LC [6]. Concernant le port de LC souples, Poggio et Abelson rapportent des taux de 3,4 % en cas de port continu et de 1,2 % en cas de port journalier [7]. Boswall trouve des chiffres de prévalence également très diminués en cas de port de LC jetables [8]. Toutefois, une étude rétrospective portant sur 260 porteurs de LC souples à renouvellement fréquent rapporte des chiffres supérieurs (pouvant aller jusqu’à 24 % dans certains groupes de patients). D’autres études rapportent des chiffres de 1 à 10 % dans une population de porteurs de LC souples et de seulement 1 % chez des porteurs de LC rigides [9]. Le temps nécessaire pour voir apparaître une CGP serait plus court après un port de LC souples (en moyenne 31 mois) qu’en cas de port de LC rigides (en moyenne 8 ans) [10]. La durée prolongée quotidienne du port de LC semble enfin être un facteur d’aggravation.
La possibilité de survenue de CGP dans d’autres conditions plus rares que celles du port de LC ou de prothèse oculaire [11] est de connaissance plus récente. Plusieurs études ont rapporté des CGP survenant successivement au contact de bulles de trabéculectomie [12], de fils de suture [13], d’indentation pour traitement de décollement de rétine, de colle cyanoacrylate, de kératopathies en bandelettes et, plus généralement, de toutes les irrégularités de surface cornéennes (encadré 5-1) [14, 15].
La CGP survient surtout chez des patients jeunes mais cette notion reflète plutôt l’âge jeune des porteurs de LC. Il n’y a pas de facteur de sexe prédisposant [10] même si les symptômes de sécheresse oculaire chez les porteurs de LC sont plus fréquents chez la femme [16].
En revanche, l’atopie est un facteur de risque [17] comme le laissent supposer les poussées de CGP généralement observées au printemps et en automne, période où la pression allergénique est la plus forte. Les patients porteurs de CGP rapportent plus de cas d’allergies aux pollens ou aux médicaments, y compris aux conservateurs. L’adhérence des allergènes aux matériaux, potentialisée par une petite sécheresse oculaire, pourrait expliquer cette association de l’atopie avec cette pathologie que tout désignait initialement comme un conflit purement mécanique [18]. L’association des CGP et des dysfonctionnements meibomiens a également été évoquée même s’il est difficile de savoir qui, de la CGP ou du dysfonctionnement meibomien, a réellement précédé l’autre : il est probable que ces deux faits soient souvent associés, les meibomites venant aggraver l’inflammation rencontrée lors du port de LC. L’augmentation de l’inflammation conjonctivale constatée dans une CGP pourrait parfaitement être à l’origine d’une aggravation d’un dysfonctionnement meibomien. Toutefois, pour Molinari, ceci ne constitue pas un facteur de risque chez le porteur de LC [19]. Cependant, les larmes des patients allergiques sont souvent instables avec un film lipidique épaissi comme l’attestent les mesures en interférométrie [20].
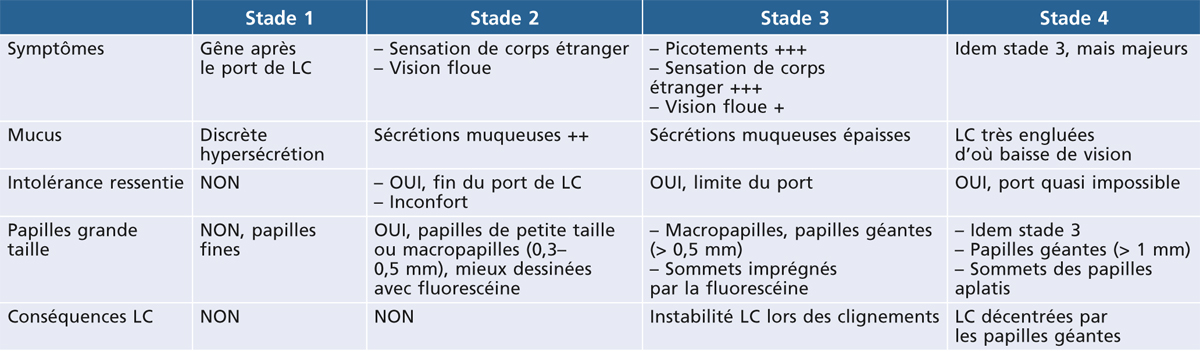
Une intolérance progressive au port des LC doit être un signe d’alerte pour le praticien. En effet, le confort en LC se modifie et s’altère progressivement dans le temps pouvant même conduire jusqu’à une impossibilité de porter les LC. Il est toutefois rare de voir le porteur à ce stade, ce dernier consultant souvent lorsque son temps de port habituel est simplement réduit. Une impression de sécrétion muqueuse présente au réveil au niveau de l’angle interne est un signe précocement ressenti par le patient. Ces sécrétions collantes sont de plus en plus abondantes avec l’évolution de la CGP pouvant entraîner parfois une difficulté à ouvrir les yeux le matin. À cet inconfort progressif et ces sécrétions muqueuses excessives, il s’ajoute un trouble visuel lié à une mobilité anormale de la LC (classiquement un déplacement supérieur de la LC) et à des dépôts importants à sa surface. Spontanément, le patient renouvelle plus souvent sa LC sans véritable amélioration ou peut évoquer des difficultés pour les nettoyer. En l’absence de recours à l’ophtalmologiste, une sensation de picotements sévères apparaîtra ensuite, surtout ressentie en fin de journée. Cette sensation d’inconfort devient progressivement de plus en plus marquée durant la journée jusqu’à devenir permanente. La lentille devenant instable lors des clignements en raison de la présence d’un mucus abondant et de nombreux dépôts à sa surface, la tolérance devient alors difficile et le temps de port est diminué spontanément par le patient. Les symptômes de début rapportés par les patients sont donc variés associant une intolérance légère avec sensation de brûlures oculaires, prurit, sensation de vision floue, augmentation de la sécrétion muqueuse et surcharge de dépôts sur la lentille [21].
Les symptômes subjectifs peuvent précéder les signes cliniques avec une sensation de corps étranger et de flou visuel mais un élément caractéristique de l’évolution de la CGP est que le sentiment d’inconfort augmente dans le temps. La qualité visuelle peut varier avec les mouvements de la LC sur le mucus qui l’englue, avec une amélioration transitoire juste après le clignement.
L’élément sémiologique caractéristique de la CGP est la présence de papilles au niveau de la conjonctive tarsale supérieure (fig. 5-14). Ces papilles sont de grande taille (0,3-1 mm) ou géantes (> 1 mm). La description initiale de la CGP nécessitait la présence de papilles géantes pour porter le diagnostic. Celui-ci est maintenant admis avec des papilles de grande taille si elles s’accompagnent des symptômes décrits ci-dessus.
Dans les stades précoces de CGP, lorsque l’affection est active, une hyperhémie associée à un œdème et une infiltration cellulaire sont présentes et les arcades vasculaires deviennent moins visibles. Le degré d’inflammation et de la réaction papillaire est variable selon la sévérité de l’atteinte. Au fur et à mesure que la CGP progresse, on retrouve alors une hyperhémie accentuée, une conjonctive tarsale épaissie ne laissant plus paraître les arcades vasculaires ainsi que des papilles de grande taille. D’après Elhers, la meilleure façon d’examiner la conjonctive tarsale supérieure dans le cas d’une CGP à la lampe à fente est la suivante [22] :
instiller de la fluorescéine dans le cul-de-sac inférieur ;
demander au patient de cligner à deux ou trois reprises ;
éverser la paupière supérieure et examiner la surface tarsale en lumière blanche puis à l’aide d’un filtre bleu cobalt ;
noter le degré d’inflammation et d’hyperhémie ;
déterminer la visibilité des arcades vasculaires ;
noter la localisation et la taille des papilles.
En effet, l’instillation de fluorescéine permet de bien délimiter le contour des papilles afin d’en apprécier au mieux la taille. Le toit des papilles peut être érodé et pourra ainsi être bien repéré par la fluorescéine. L’apparition d’une hypertrophie papillaire asymptomatique est fréquente lors du port de LC et constatée lors d’examens systématiques. La prise en charge active de cette anomalie à ce stade peut permettre d’éviter l’apparition des symptômes et une aggravation de l’atteinte.
L’augmentation de la sécrétion muqueuse est associée à cette hypertrophie papillaire ; elle est systématiquement rapportée par les patients. Les cellules à mucus ne sont pas plus nombreuses en proportion mais leur nombre augmente en valeur absolue puisque la surface conjonctivale qui recouvre l’ensemble de la surface des papilles est plus étendue. Les cellules épithéliales qui participent à la sécrétion du mucus (second mucus system en anglais) contribuent également à cette hypersécrétion muqueuse. L’excès de mucus concourt à engluer la lentille comme les papilles, ce qui est aisément mis en évidence en retournant les paupières. L’hyperhémie est plus ou moins marquée de même que l’épaississement de la conjonctive qui perd un peu de sa transparence. Cette augmentation du volume de la paupière supérieure peut s’accompagner d’un ptosis.
L’atteinte limbique est inhabituelle, contrairement à la KCV et les nodules de Trantas sont rares. Le plus souvent, il n’y a pas d’atteinte cornéenne associée.
Le délai nécessaire à l’apparition d’une CGP est variable : les signes peuvent apparaître dès 3 semaines après le début du port de LC souples mais demandent parfois plusieurs années avant de se manifester. En moyenne, les signes surviennent entre 18 et 20 mois après le début du port de LC souples [1, 23]. Ce délai est plus long avec les LC rigides puisque les premiers signes peuvent survenir entre 9 et 11 ans après le début d’utilisation [23]. Cet allongement du délai est également observé avec les prothèses oculaires [24]. Au contraire, quelques semaines seulement peuvent être nécessaires avant de voir apparaître une CGP sur un fil de suture, même si ceux-ci peuvent être bien tolérés pendant des années [14].
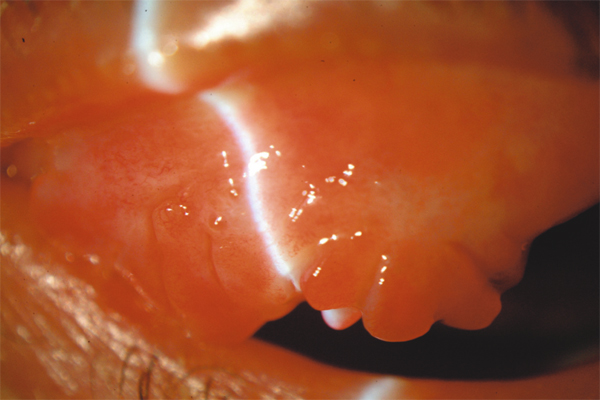
Fig. 5-14 Papilles géantes.
La CGP a été classée en quatre grands stades en fonction des symptômes rapportés par les patients et de l’aspect clinique (tableau 5-2) [25]. Toutefois, il n’existe pas réellement de lien entre ces différents stades car des lésions importantes n’entraînent aucun symptôme et, au contraire, des papilles de très petite taille peuvent être très mal ressenties par les patients. Par ailleurs, les papilles ne sont pas localisées de façon identique selon le type de LC et n’ont pas le même aspect. Pour décrire les caractéristiques de la CGP, le tarse peut être divisé en trois zones (fig. 5-15). Les papilles débutent préférentiellement dans les zones 1 et 2 chez les porteurs de LC souples avant d’envahir progressivement l’ensemble de la paupière supérieure. Les macropapilles apparaissent généralement au niveau de la zone 3 et progressent en zone 2 lors du port de LC rigides. L’aspect des papilles est également légèrement différent : rondes pour les LC souples, elles apparaissent plutôt creusées chez les porteurs de LC rigides [26]. Elles sont très surélevées chez les porteurs de prothèses oculaires et prennent un aspect un peu fibrosé.
On distingue actuellement deux types de présentation en cas de CGP associée aux LC en silico-hydrogel avec un haut Dk (transmissibilité à l’oxygène) : la forme localisée et la forme généralisée similaire à celle observée avec les LC en hydrogel. Dans les formes localisées, ce sont surtout dans les zones 1 et 2 que l’on retrouve les papilles et l’hyperhémie. Dans les formes généralisées, les zones 1, 2 et 3 sont atteintes. La forme localisée est toutefois plus fréquente chez les porteurs de LC en silico-hydrogel.
Tableau 5-2 Principaux signes cliniques des conjonctivites gigantopapillaires.
LC : lentilles de contact.
(Source : Allansmith MR. Giant papillary conjunctivitis. J Am Optom Assoc 1990 ; 61 : S42-6.)
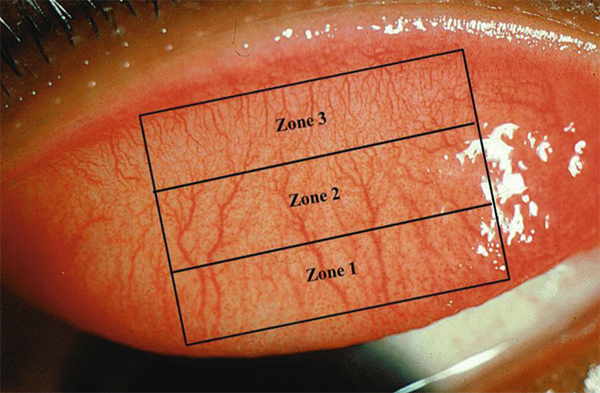
Fig. 5-15 Division en trois zones de la paupière supérieure éversée pour décrire les caractéristiques de la conjonctivite gigantopapillaire.
La physiopathologie de la CGP a erré pendant plusieurs années entre différentes théories. Celles-ci, loin d’être mutuellement exclusives, sont en fait intriquées et contribuent de façon plus ou moins prépondérante aux manifestations observées.
La survenue de la CGP chez des porteurs de LC, de prothèses oculaires ou lors d’un conflit avec un corps étranger qui frotte sur la face postérieure de la paupière supérieure a fait privilégier, pendant de nombreuses années, une théorie uniquement mécanique. Chaque clignement entretient cette agression répétée survenant entre 9 et 16 000 fois par jour. Lors du port de LC, ce n’est pas le matériel qui est en cause mais plutôt les débris cellulaires et protidiques qui se déposent à sa surface et qui ne peuvent être nettoyés même par un entretien soigneux. Les porteurs de LC souffrant de CGP présentent ce type de dépôts dans 90 % des cas (contre 5 % des patients indemnes) [27]. La survenue de ces dépôts pourrait être influencée par un microclimat favorable : une meibomite ou une sécheresse oculaire pourraient entraîner une modification de la flore par altération des moyens de défense comme la lactoférine ou le lysosyme [20, 28].
Les matériaux ne sont pas tous égaux devant la survenue de dépôts de même que leurs capacités à en être débarrassés par un nettoyage courant [28]. Les LC en matériau silico-hydrogel à haut Dk sont faites de matériaux qui sont légèrement moins souples que les LC à bas Dk. Il est possible que l’élasticité des LC à forte perméabilité, le dessin des bords des LC et les caractéristiques de port puissent contribuer à une CGP en entraînant une interaction plus forte avec la conjonctive. S’il est tentant de relier les dépôts présents sur les LC et la survenue de CGP, cette explication est certainement un peu trop simpliste : toutes les LC sont encrassées au bout de 8 heures de port [24]. Ceci a été illustré par l’étude de Ballow qui a consisté en l’équipement d’un singe par des LC appartenant à un patient porteur de CGP : il a alors observé immédiatement chez le singe des signes évoquant une CGP. Ceux-ci n’étaient pas observés avec une LC neuve ou la LC d’un patient indemne de CGP [29].
La survenue d’une CGP peut être observée aussi bien après le port de LC rigides (polyméthylméthacrylate ou perméables au gaz) qu’après le port de LC souples en hydrogel même si l’incidence est nettement augmentée avec les secondes [30]. Le conflit mécanique étant évoqué, l’utilisation de LC très fines ou moins larges devrait permettre de limiter l’apparition des CGP. En pratique, celles-ci peuvent également survenir après port de LC ultrafines [31]. La nature du polymère a également été incriminée mais les résultats sont contradictoires [10, 23]. Les papilles sont localisées préférentiellement au niveau de la zone conjonctivale tarsale au contact de la périphérie de la lentille et en particulier de ses bords : présentes au niveau des zones 2 et 3 pour les petites LC rigides ; retrouvées préférentiellement dans les zones 1 et 2 avec les LC souples. De plus, la CGP serait plus fréquente avec les LC en silico-hydrogel qu’avec les LC en hydrogel [32]. Cette fréquence est augmentée lors de port permanent par rapport au port journalier.
Par ailleurs, si la quantité de dépôts à la surface de la LC est dépendante du matériel, du degré d’hydratation et des propriétés ioniques de cette dernière, l’analyse des dépôts ne permet pas de retrouver de différences nettes entre les patients atteints de CGP et ceux qui ne le sont pas [33]. Certains auteurs ont même évoqué le fait que les dépôts pouvaient être une conséquence et non la cause de la CGP, le bord de la LC ou la bulle de filtration étant en fait à l’origine d’une hypersécrétion muqueuse qui contribuerait à entraîner l’apparition des papilles.
Les papilles associées à un corps étranger (granulome, fil de suture) ou à une bulle de filtration surviennent préférentiellement en regard de l’épine irritative et disparaissent si le responsable de l’agression peut être supprimé. La nature de la suture n’a pas d’influence, il s’agit donc bien ici uniquement d’un conflit mécanique [13, 15, 34, 35].
L’ensemble de ces observations consacrées au conflit mécanique confirme que, plus qu’une réponse à un facteur unique, l’apparition d’une CGP correspond à une susceptibilité individuelle envers un ensemble de variables (nature du polymère, durée du port de la LC, modalité d’entretien, etc.).
De nombreux auteurs ont souligné d’emblée l’association avec l’atopie par les éléments suivants :
facteur saisonnier des poussées [17] : celles-ci surviennent volontiers en mars et en octobre lors des poussées allergéniques ;
taux d’IgE augmenté dans les larmes [36] ;
présence de cellules inflammatoires dans les papilles géantes (polynucléaires ou PN éosinophiles, basophiles, neutrophiles), attirées par l’histamine. Si le nombre de polynucléaires éosinophiles (PNE) est augmenté dans 25 % des étalements conjonctivaux des patients atteints de CGP, le dosage d’EMBP (eosinophil major basic protein) ne semble pas modifié [37] au contraire de celui des MBP (major basic protein) qui semble augmenté dans la conjonctive et au niveau des dépôts retrouvés chez les patients atopiques présentant une CGP ;
présence d’une forte proportion de PNE dans les cellules du stroma des papilles. Ces derniers contiennent des granulations cationiques hautement réactives et responsables de lésions cytotoxiques impliquées dans l’apparition des atteintes conjonctivales [38] ;
présence de mastocytes à l’état dégranulé : dans la CGP, comme dans la kératoconjonctivite vernale (KCV), les mastocytes ont libéré leur contenu histaminique. Toutefois cette libération est nettement moins prononcée dans la première [39]. La tryptase, produit spécifique des cellules mastocytaires, est augmentée alors qu’elle est inchangée dans les atteintes conjonctivales chroniques comme les sécheresses oculaires ou les atteintes non allergiques. Les cellules mastocytaires jouant un rôle essentiel sur le métabolisme du collagène dans de nombreuses pathologies fibrosantes comme les pemphigoïdes, elles sont probablement impliquées dans l’apparition des lésions tissulaires de la CGP ;
les mécanismes allergiques activés ne seraient pas uniquement ceux de l’hypersensibilité immédiate mais également ceux de la forme retardée comme l’atteste la présence de lymphocytes de type CD4 et CD45Ro activés [40] et la présence d’un taux élevé de PN basophiles ;
la présence d’éotaxine en quantité augmentée dans les larmes des patients souffrant de CGP [41] liée aux LC, comme c’est le cas dans la KCV et dans la kératoconjonctivite atopique (KCA). Ce taux est corrélé aux stades des papilles de la CGP. En revanche, ce taux est normal dans les CGP liées au port de prothèse oculaire [42].
L’afflux de cellules inflammatoires pérennise la réponse locale :
augmentation du taux de cytokines impliquées dans la réponse allergique : IL-8, GM-CSF (granulocyte macrophage-colony stimulating factor), RANTES (regulated on activation, normal T cell expressed and secreted). Ces cytokines sont sécrétées par les cellules T, les mastocytes, les éosinophiles mais également les cellules épithéliales. Le profil cytokinique est un peu différent entre KCV et CGP : dans les CGP, le récepteur soluble pour l’interleukine 6 (IL-6R), le M-CSF (macrophage-colony stimulating factor), et le MIG (monokine-induced gamma interferon) est multiplié par quatre par rapport aux témoins. L’IL-6R est augmenté à la fois dans la KCV et dans la CGP alors que le TIMP (tissue inhibitor of metalloproteinase) est augmenté dans le groupe CGP seulement [43]. Le dosage des leucotriènes dans les larmes montre une augmentation du LTC4 (tear fluid leucotrien) chez les patients porteurs de CGP en comparaison avec les patients porteurs de LC indemnes de CGP. Cette molécule pourrait être impliquée dans l’apparition de la symptomatologie inflammatoire de ces patients ;
présence d’une quantité augmentée de molécules d’adhésion de type ICAM-1 (intercellular adhesion molecule) ou E-selectine et de marqueurs inflammatoires HLA-DR dans la conjonctive des patients atteints de CGP. Toutefois les taux présentés dans les CGP sont le plus souvent inférieurs à ceux que l’on mesure dans les KCA ou dans les KCV [44] ;
concentration de lysozyme normale chez les patients atteints de CGP, alors que celle de lactoferrine est diminuée. Si la CGP est inactivée, les taux se normalisent. L’ensemble de ces molécules participe aux moyens de défense non spécifiques de la surface cornéoconjonctivale et il n’est pas impossible que ces modifications puissent contribuer à l’inflammation oculaire peut-être en favorisant la contamination bactérienne [45] ;
augmentation des taux d’IgM et IgG chez les patients atteints de CGP même si les études restent assez contradictoires [33]. Certains auteurs ont mesuré le rapport entre IgM et IgA et l’ont trouvé augmenté chez les patients porteurs de LC de contact [46]. D’autres auteurs ont, au contraire, retrouvé des dosages d’IgA, d’IgG, IgE, de lactoferrine ou de lysozyme inchangés au niveau des dépôts, contrairement aux taux d’IgM présents [33, 46]. Le mucus pourrait agir comme une éponge, trappant les corps étrangers, les irritants, les protéines et le résidu des milieux d’entretien contribuant ensuite à l’encrassement des LC [26] ;
activation de certaines fractions du complément (C3a et C5a) [47].
L’ensemble des cellules – mastocytes, lymphocytes, polynucléaires associés aux différents médiateurs de l’inflammation – contribuent alors à la formation des papilles dans le stroma conjonctival avec agrégation des lymphocytes dans le stroma. Les analyses en microscopie électronique retrouvent un changement de taille des cellules épithéliales et une perte de leurs caractéristiques polygonales lors du port de LC de contact. Par ailleurs, les microvilli sont aplatis et d’aspect branché.
À l’étage cellulaire, les différentes molécules inflammatoires et allergiques concourent à l’apparition de la pathologie conjonctivale : les molécules d’adhésion comme les ICAMs permettent d’attirer les leucocytes, événement facilité par la présence du HLA-DR au niveau des cellules épithéliales ; les cytokines attirent également les PNE et pérennisent l’inflammation.
Toutefois, le mécanisme allergique n’est pas nécessaire à l’apparition des troubles : les dépôts présents à la surface des LC ou les bulles de filtration peuvent être associés à une CGP même chez des patients non atopiques. Le phénomène tissulaire initial est la présence de cellules mastocytaires dégranulées ; celui-ci peut être induit par différents mécanismes qui ne sont pas nécessairement allergiques même si la dégranulation liée à la présence d’IgE est la plus connue : stimulation nerveuse antidromique, activation du complément, sécrétion de somatostatine. Quand on compare la conjonctive des KCV et des CGP, on constate que le degré d’infiltration conjonctivale de la seconde par les cellules T et les éosinophiles est plus faible chez les patients non atopiques ; le système Th1/Th2 exerce alors une certaine inhibition sur l’action des éosinophiles et des cytokines et la dégranulation des mastocytes se fait par un mécanisme non-IgE-dépendant et se trouve pérennisée par la chronicité du traumatisme [48].
Chez les patients atopiques, cette inhibition Th1/Th2 est levée ce qui explique l’apparition plus fréquente et plus intense des symptômes. Le traumatisme pourrait être en fait l’épine irritative initiale entraînant ensuite un afflux de cellules pro-inflammatoires pérennisant ensuite les troubles. Le syndrome sec et le dysfonctionnement meibomien pourraient également intervenir sans que l’on distingue exactement ce qui est cause de ce qui est conséquence [20]. Enfin, depuis la publication de Leonardi et al. en 2012, la CGP ne fait plus partie de la classification des allergies oculaires proprement dite mais serait plutôt secondaire à un mécanisme d’hypersensibilité non spécifique [49].
Le point commun à toutes les causes de CGP est donc le traumatisme initial : on ne connaît pas de CGP sans épine irritative traumatique, mais on ignore la raison pour laquelle des patients présentent une CGP et d’autres pas. L’agression entraîne une dégranulation des mastocytes et une altération de l’épithélium de surface qui agit comme une barrière contre les éléments de l’environnement. Les LC stimulent la production de PN, de facteurs chimiotactiques, de médiateurs de l’inflammation et une amplification de la réponse au traumatisme, le tout étant aggravé par l’atopie. Les dépôts et les corps étrangers sont ensuite présentés grâce aux cellules immunitaires à l’épithélium fragilisé, le mucus jouant certainement un rôle favorisant.
• Intolérance aux lentilles de contact (sans CGP)
• Intolérance aux solutions d’entretien
• Kératoconjonctivite atopique
• Kératoconjonctivite vernale
• Conjonctivite perannuelle
• Conjonctivite à Chlamydia
• Kératoconjonctivite limbique supérieure
La difficulté est sans aucun doute de faire la distinction entre une forme active de CGP et une intolérance liée au port de LC. Cependant, l’éversion de la paupière supérieure, geste systématique chez tout porteur de LC, permet de faire facilement le diagnostic. Les principaux diagnostics à écarter sont les suivants :
les intolérances aux solutions d’entretien : elles se manifestent plutôt par une gêne dès la pose de la LC avec présence d’un piqueté cornéen de siège périphérique parfois typiquement annulaire visible après 2 heures de port et disparaissant dans le courant de la journée. Toutefois cette notion est probablement théorique, car une forme légère d’intolérance devra être détectée précocement pour éviter de voir se pérenniser les troubles ;
les conjonctivites ou kératoconjonctivites allergiques et en particulier la KCA et la KCV. Les symptômes sont identiques quoique plus marqués que dans la CGP avec des picotements intenses, des sécrétions muqueuses et l’existence de papilles de grande taille. La photophobie est en général beaucoup plus intense puisque ces deux formes cliniques s’accompagnent d’une atteinte cornéenne contrairement à la CGP. Par ailleurs, la KCV assortie de papilles géantes, comme la CGP, touche avant tout des enfants de sexe masculin avant l’âge de 10 ans même si des formes de l’adulte existent. La franche recrudescence saisonnière et la survenue d’atteintes cornéennes dans 50 % des cas permettent généralement de redresser le diagnostic. L’atteinte cutanée associée à la KCA ainsi que la gravité de l’atteinte cornéenne permettent généralement d’éliminer rapidement ce diagnostic. Le problème pourra être également celui d’une conjonctivite saisonnière ou perannuelle survenant chez un porteur de LC. Les papilles sont généralement de plus petite taille et la responsabilité directe de l’allergène plus facile à identifier. Cette distinction est toutefois assez théorique puisqu’on sait que l’atopie constitue un terrain favorisant pour l’apparition des CGP ;
les atteintes infectieuses : elles peuvent parfois être évoquées mais les sécrétions sont généralement plus épaisses et troubles. Elles sont d’allure plus aiguë. Les conjonctivites à Chlamydia constituent en revanche un diagnostic parfois difficile à éliminer car certains macrofollicules peuvent être pris à tort pour des papilles de grande taille. On recherchera un élément d’orientation vers une infection chlamydienne se manifestant par un épisode aigu initial associant une conjonctivite folliculaire accompagnée d’une adénopathie prétragienne et des éléments généraux d’orientation pour une infection par le Chlamydia (notion de contamination). Les causes de syndrome de Parinaud peuvent prêter à confusion mais la notion de port de LC ou de prothèse oculaire redresse généralement le diagnostic ;
les kératites limbiques supérieures (KLS) associées aux LC de contact ressemblent beaucoup aux KLS dites de Théodore. Contrairement à ces dernières, elles ne sont pas associées à une pathologie thyroïdienne et ne présentent aucun filament précornéen. Localisées avant tout au niveau du limbe supérieur, elles s’accompagnent d’une sensation de corps étranger, de picotements, de brûlures oculaires, de larmoiement et de photophobie. Le limbe supérieur est épaissi et néovascularisé. Sa survenue serait favorisée par l’emploi de solution d’entretien contenant du thimérosal. Cette molécule n’est plus utilisée depuis longtemps dans les solutions d’entretien de LC. Les réactions d’intolérance aux différents produits d’entretien peuvent d’ailleurs être à l’origine de conjonctivites folliculaires ou de lésions tissulaires parfois très sévères prenant des aspects de pseudo-pemphigoïdes.
La prévention primaire vise à éviter l’apparition des CGP par l’utilisation de LC adaptées, de produits d’entretien générant peu de réactions inflammatoires et de LC dont les caractéristiques physiques permettent de limiter le traumatisme palpébral. Une fois présente, l’affection justifie une prévention secondaire visant à limiter l’agression et les facteurs favorisants. Parmi les facteurs de risque identifiés, le jeune âge, un temps de port très long, une LC couverte de dépôts, une LC peu souvent renouvelée, une LC de grand diamètre, un système de nettoyage souvent insuffisant, une fréquence plus grande d’atopie associée sont les cibles principales. Les grands principes pour minimiser les risques d’apparition d’une CGP sont donc les suivants (encadré 5-3) :
• Nettoyage quotidien de la prothèse avec un savon doux
• Rincage soigneux à l’eau stérile
• Remplacement de la prothèse en cas de dépôts et de rayures avec polissage régulier
• Ablation nocturne éventuelle pour limiter le contact avec les dépôts en cas de CGP avérée
examiner la conjonctive tarsale supérieure chez tout porteur de LC ;
préférer des LC à fréquence de renouvellement élevé ;
préférer un système d’entretien des LC par solution sans conservateur ou par solution oxydante, notamment en cas de terrain atopique ;
traiter les affections associées (sécheresse oculaire, dysfonctionnement meibomien) ;
en cas d’antécédent de CGP, choisir un rééquipement en LC jetables journalières.
Le pronostic de la CGP est bon puisque la guérison est obtenue dans 93,7 % des cas et qu’elle n’évolue qu’exceptionnellement vers une atteinte cornéenne grave [4]. Le dépistage de la CGP permet d’éviter le stade des papilles géantes où le délai de guérison sera d’autant plus long. L’éversion de la paupière supérieure lors des contrôles ophtalmologiques chez tout porteur de LC devra donc être systématique. Il apparaît logique de privilégier des LC ayant le design le plus adapté pour limiter le conflit mécanique en y associant des conseils d’hygiène scrupuleux. L’utilisation des LC jetables journalières dans cette pathologie a modifié le confort des porteurs atteints leur permettant, dans la plus grande majorité des cas, la poursuite du port des LC dans des conditions de tolérance acceptable et d’évolution favorable. Les signes et les symptômes s’amendent par le changement des LC et l’amélioration de l’entretien, mais les papilles exubérantes ne disparaissent pas toujours. Dans les cas réfractaires, l’arrêt du port de LC est obligatoire, combiné avec le traitement médicamenteux. Des récidives sont possibles.
[1] Spring TF. Reaction to hydrophilic lenses. Med J Aust 1974 ; 1 : 449-50.
[2] Allansmith MR, Baird RS, Greiner JV. Vernal conjunctivitis and contact lens-associated giant papillary conjunctivitis compared and contrasted. Am J Ophthalmol 1979 ; 87 : 544-55.
[3] Donshik PC. Giant papillary conjunctivitis. Trans Am Ophthalmol Soc 1994 ; 92 : 687-744.
[4] Donshik P, Porazinski A. Giant papillary conjunctivitis in frequent-replacement contact lens wearers : a retrospective study. Am J Ophthalmol 2000 ; 129 : 703.
[5] Bucci FA, Jr, Lopatynsky MO, Jenkins PL, et al. Comparison of the clinical performance of the Acuvue disposable contact lens and CSI lens in patients with giant papillary conjunctivitis. Am J Ophthalmol 1993 ; 115 : 454-9.
[6] Donshik PC, Porazinski AD. Giant papillary conjunctivitis in frequent-replacement contact lens wearers : a retrospective study. Trans Am Ophthalmol Soc 1999 ; 97 : 205-16 ; discussion 16-20.
[7] Poggio EC, Abelson MB. Complications and symptoms with disposable daily wear contact lenses and conventional soft daily wear contact lenses. CLAO J 1993 ; 19 : 95-102.
[8] Boswall GJ, Ehlers WH, Luistro A, et al. A comparison of conventional and disposable extended wear contact lenses. CLAO J 1993, 19 : 158-65.
[9] Allansmith MR, Ross RN. Giant papillary conjunctivitis. Int Ophthalmol Clin 1988 ; 28 : 309-16.
[10] Hart DE, Schkolnick JA, Bernstein S, et al. Contact lens induced giant papillary conjunctivitis : a retrospective study. J Am Optom Assoc 1989 ; 60 : 195-204.
[11] Srinivasan BD, Jakobiec FA, Iwamoto T, DeVoe AG. Giant papillary conjunctivitis with ocular prostheses. Arch Ophthalmol 1979 ; 97 : 892-5.
[12] Francis IC, Lawless MA. Bilateral giant papillary conjunctivitis related to glaucoma drainage surgery blebs. Cornea 1994 ; 13 : 469.
[13] Skrypuch OW, Willis NR. Giant papillary conjunctivitis from an exposed prolene suture. Can J Ophthalmol 1986 ; 21 : 189-92.
[14] Sugar A, Meyer RF. Giant papillary conjunctivitis after keratoplasty. Am J Ophthalmol 1981 ; 91 : 239-42.
[15] Dunn JP, Jr, Weissman BA, Mondino BJ, Arnold AC. Giant papillary conjunctivitis associated with elevated corneal deposits. Cornea 1990 ; 9 : 357-8.
[16] Nichols JJ, Mitchell GL, Curbow B. Relation between mood and self-reported dry eye in contact lens wearers. Cornea 2006 ; 25 : 937-42.
[17] Begley CG, Riggle A, Tuel JA. Association of giant papillary conjunctivitis with seasonal allergies. Optom Vis Sci 1990 ; 67 : 192-5.
[18] Smolin G. Ocular allergy : the Third Annual Thygeson Lecture, presented at the Ocular Microbiology and Immunology Group Meeting, October 25, 1997. Cornea 1998 ; 17 : 253-6.
[19] Molinari JF, Stanek S. Meibomian gland status and prevalence of giant papillary conjunctivitis in contact lens wearers. Optometry 2000 ; 71 : 459-61.
[20] Mathers WD, Billborough M. Meibomian gland function and giant papillary conjunctivitis. Am J Ophthalmol 1992 ; 114 : 188-92.
[21] Katelaris CH. Giant papillary conjunctivitis--a review. Acta Ophthalmol Scand Suppl 1999 ; (228) : 17-20.
[22] Elhers WH, Donshik PC. Giant papillary conjunctivitis. Curr Opin Allergy Clin Immunol 2008 ; 8 : 445-9.
[23] Allansmith MR, Korb DR, Greiner JV, et al. Giant papillary conjunctivitis in contact lens wearers. Am J Ophthalmol 1977 ; 83 : 697-708.
[24] Meisler DM, Krachmer JH, Goeken JA. An immunopathologic study of giant papillary conjunctivitis associated with an ocular prosthesis. Am J Ophthalmol 1981 ; 92 : 368-71.
[25] Greiner JV, Covington HI, Allansmith MR. Surface morphology of the human upper tarsal conjunctiva. Am J Ophthalmol 1977 ; 83 : 892-905.
[26] Korb DR, Greiner JV, Finnemore VM, Allansmith MR. Biomicroscopy of papillae associated with wearing of soft contact lenses. Br J Ophthalmol 1983 ; 67 : 733-6.
[27] Fowler SA, Gaertner KL. Scanning electron microscopy of deposits remaining in soft contact lens polishing marks after cleaning. CLAO J 1990 ; 16 : 214-8.
[28] Mackie IA, Wright P. Giant papillary conjunctivitis (secondary vernal) in association with contact lens wear. Trans Ophthalmol Soc U K 1978 ; 98 : 3-9.
[29] Ballow M, Donshik PC, Rapacz P, et al. Immune responses in monkeys to lenses from patients with contact lens induced giant papillary conjunctivitis. Clao J 1989 ; 15 : 64-70.
[30] Key JE, 2nd. Are hard lenses superior to soft ? Arguments in favor of hard lenses. Cornea 1990 ; 9 : S9-11 ; discussion S15.
[31] Fowler SA, Greiner JV, Allansmith MR. Soft contact lenses from patients with giant papillary conjunctivitis. Am J Ophthalmol 1979 ; 88 : 1056-61.
[32] Skotnitsky C, Sankaridurg PR, Sweeney DF, Holden BA. General and local contact lens induced papillary conjunctivitis (CLPC). Clin Exp Optom 2002 ; 85 : 193-7.
[33] Richard NR, Anderson JA, Tasevska ZG, Binder PS. Evaluation of tear protein deposits on contact lenses from patients with and without giant papillary conjunctivitis. Clao J 1992 ; 18 : 143-7.
[34] Jolson AS, Jolson SC. Suture barb giant papillary conjunctivitis. Ophthalmic Surg 1984 ; 15 : 139-40.
[35] Heidemann DG, Dunn SP, Siegal MJ. Unusual causes of giant papillary conjunctivitis. Cornea 1993 ; 12 : 78-80.
[36] Donshik PC, Ballow M. Tear immunoglobulins in giant papillary conjunctivitis induced by contact lenses. Am J Ophthalmol 1983 ; 96 : 460-6.
[37] Udell IJ, Gleich GJ, Allansmith MR, et al. Eosinophil granule major basic protein and Charcot-Leyden crystal protein in human tears. Am J Ophthalmol 1981 ; 92 : 824-8.
[38] Trocme SD, Kephart GM, Allansmith MR, et al. Conjunctival deposition of eosinophil granule major basic protein in vernal keratoconjunctivitis and contact lens-associated giant papillary conjunctivitis. Am J Ophthalmol 1989 ; 108 : 57-63.
[39] Henriquez AS, Kenyon KR, Allansmith MR. Mast cell ultrastructure. Comparison in contact lens-associated giant papillary conjunctivitis and vernal conjunctivitis. Arch Ophthalmol 1981 ; 99 : 1266-72.
[40] Metz DP, Bacon AS, Holgate S, Lightman SL. Phenotypic characterization of T cells infiltrating the conjunctiva in chronic allergic eye disease. J Allergy Clin Immunol 1996 ; 98 : 686-96.
[41] Moschos MM, Eperon S, Guex-Crosier Y. Increased eotaxin in tears of patients wearing contact lenses. Cornea 2004 ; 23 : 771-5.
[42] Sarac O, Erdener U, Irkec M, et al. Tear eotaxin levels in giant papillary conjunctivitis associated with ocular prosthesis. Ocul Immunol Inflamm 2003 ; 11 : 223-30.
[43] Shoji J, Inada N, Sawa M. Antibody array-generated cytokine profiles of tears of patients with vernal keratoconjunctivitis or giant papillary conjunctivitis. Jpn J Ophthalmol 2006 ; 50 : 195-204.
[44] Hingorani M, Calder V, Jolly G, et al. Eosinophil surface antigen expression and cytokine production vary in different ocular allergic diseases. J Allergy Clin Immunol 1998 ; 102 : 821-30.
[45] Rapacz P, Tedesco J, Donshik PC, Ballow M. Tear lysozyme and lactoferrin levels in giant papillary conjunctivitis and vernal conjunctivitis. Clao J 1988 ; 14 : 207-9.
[46] Jones B, Sack R. Immunoglobulin deposition on soft contact lenses : relationship to hydrogel structure and mode of use and giant papillary conjunctivitis. Clao J 1990 ; 16 : 43-8.
[47] Bailey CS, Buckley RJ. Nedocromil sodium in contact-lens-associated papillary conjunctivitis. Eye (Lond) 1993 ; 7 : 29-33.
[48] Allansmith MR, Baird RS. Percentage of degranulated mast cells in vernal conjunctivitis and giant papillary conjunctivitis associated with contact-lens wear. Am J Ophthalmol 1981 ; 91 : 71-5.
[49] Leonardi A, Bogacka E, Fauquert JL, et al. Ocular allergy : recognizing and diagnosing hypersensitivity disorders of the ocular surface. Allergy 2012 ; 67 : 1327-37.
Fowler SA, Allansmith MR. Removal of soft contact lens deposits with surfactant-polymeric bead cleaner. CLAO J 1984 ; 10 : 229-31.
Porazinski AD, Donshik PC. Giant papillary conjunctivitis in frequent replacement contact lens wearers : a retrospective study. Clao J 1999 ; 25 : 142-7.
Wan XC, Dimov V. Pharmacokinetic evaluation of topical calcineurin inhibitors for treatment of allergic conjunctivitis. Expert Opin Drug Metab Toxicol 2014 ; 10 : 543-9.
F. Chiambaretta, S. Lazreg
La kératoconjonctivite vernale fait partie des formes sévères des pathologies allergiques oculaires et relève d’une prise en charge en collaboration avec un allergologue. Le diagnostic clinique ne comporte aucune difficulté et doit être associé à une explication détaillée de sa physiopathologie et de sa prise en charge sur sa durée (surveillance semestrielle sur quatre à cinq années jusqu’à la puberté) à l’enfant et à ses parents. La première étape thérapeutique est la réalisation d’un bilan allergologique systématique pour identifier toute allergie oculaire à un allergène responsable de poussées inflammatoires de la surface oculaire, et proposer une éviction et une immunothérapie spécifiques. La gestion de l’état inflammatoire de la surface oculaire associe des mesures non médicamenteuses (lunettes de soleil, casquettes) et des principes actifs anti-allergiques locaux et généraux du début du printemps à la fin de l’été. Le recours à la corticothérapie locale est nécessaire lors d’inflammation importante de la surface oculaire, mais sur une courte période et sous contrôle médical. Les immunosuppresseurs locaux (ciclosporine A, puis tacrolimus) sont à utiliser en cas de cortico-dépendance.
La kératoconjonctivite vernale (KCV) est une maladie inflammatoire chronique de la surface oculaire, relativement rare, qui touche l’enfant et le jeune adulte. Elle est bilatérale, sévère et présente dans la plupart des cas des récurrences saisonnières. Autrefois dénommée conjonctivite printanière, elle a été décrite pour la première fois en 1846 par Arlt dans son atteinte limbique [1]. La KCV constitue une atteinte oculaire de type allergique pouvant induire des complications visuelles majeures, dont l’exacte physiopathologie reste à ce jour énigmatique [2]. Sa prise en charge thérapeutique se doit d’être multidisciplinaire, alliant la vigilance de l’ophtalmologiste et le bilan minutieux de l’allergologue.
La KCV est une maladie rare en Europe de l’Ouest où son incidence est évaluée à 3,2 sur 10 000 habitants [3]. La maladie affecte les enfants avant l’âge de 10 ans dans la majorité des cas, avec une prédominance pour le sexe masculin et un sex-ratio qui varie entre 2 et 4 avant l’âge de 20 ans [4]. Après cet âge, les filles et les garçons sont également affectés [4]. La maladie disparaît le plus souvent à la puberté, mais persiste dans 10 % des cas après l’âge de 20 ans, suggérant une transformation en kératoconjonctivite atopique (KCA).
Si la KCV est rare en Europe de l’Ouest, son incidence est plus élevée dans les zones climatiques chaudes et arides telles que le bassin méditerranéen, l’Afrique centrale, l’Inde, l’Amérique centrale, l’Amérique du Sud et l’Asie. La prédominance masculine est nettement moins marquée sous ces latitudes [5]. La prévalence de la KCV atteint 4 à 5 % des enfants d’Afrique centrale [5] et constitue jusqu’à 90 % des motifs des consultations d’ophtalmologie avant l’âge de 15 ans au Sénégal, où elle est d’ailleurs dénommée limboconjonctivite endémique des tropiques [6]. Ces variations géographiques sont probablement liées à l’exposition solaire et à la chaleur.
La KCV évolue classiquement par poussée sur un fond chronique. Dans les pays occidentaux tempérés, la majorité des KCV connaissent une recrudescence saisonnière aux beaux jours, de février–mars à septembre–octobre [7]. Une forme saisonnière peut devenir perannuelle au fil du temps [7]. La forme perannuelle est cependant plus fréquente dans les pays chauds.
Les symptômes sont maximums le matin majoritairement, rendant le réveil de l’enfant difficile et redouté. La photophobie intense s’oppose à l’ouverture des yeux du matin, qui est souvent associée à d’importantes sécrétions épaisses. Un rituel matinal devient indispensable dans la majorité des cas pour nettoyer les sécrétions oculaires dans un premier temps avant de pouvoir ouvrir les yeux dans l’obscurité avant l’exposition à la lumière.
Des sensations de prurit intense sont les manifestations fonctionnelles les plus fréquentes, exacerbées par le frottement des paupières. Les enfants se plaignent aussi de sensations de brûlure, douleur, présence d’un corps étranger et d’un larmoiement [3]. L’intensité de ces signes fonctionnels est influencée par l’intensité de la chaleur et l’ensoleillement, stimuli de poussée inflammatoire de la surface oculaire non spécifiques.
La photophobie majeure, invalidante, avec larmoiement important doit faire redouter une atteinte de la cornée de type kératite.
Ces signes fonctionnels invalidants lors des poussées inflammatoires ont un retentissement majeur sur la vie des enfants et sur celle des parents [8]. La KCV peut être source de déscolarisation, d’angoisses et de troubles du comportement et un soutien psychologique est parfois nécessaire.
Il faut noter cependant qu’un bon nombre d’enfants peuvent présenter une complication cornéenne sans pour autant rapporter des signes fonctionnels.
L’examen clinique évalue la surface oculaire et retrouve des signes spécifiques essentiellement au niveau de la conjonctive et de la cornée, alors que le bord libre et la peau des paupières sont épargnés dans la KCV. Les atteintes de la conjonctive palpébrale et/ou limbiques permettent un diagnostic clinique sans réelle difficulté. Le principal diagnostic différentiel est la rosacée oculaire chez l’enfant mais l’examen minutieux de la surface oculaire redressera toute erreur.
L’atteinte est presque toujours bilatérale, mais il peut exister des formes strictement unilatérales.
Les trois formes cliniques classiques sont les suivantes :
la forme palpébrale, majoritaire dans les pays tempérés. Elle est caractérisée par la présence de papilles géantes (> 1 mm de diamètre), au niveau de la conjonctive palpébrale supérieure, visibles qu’après éversion de la paupière supérieure (rarement présentes sur la paupière inférieure) (fig. 5.16). Ce geste d’éversion de la paupière supérieure reste donc indispensable pour pouvoir poser le diagnostic et est parfois de réalisation délicate chez le jeune l’enfant. L’examen des papilles géantes permet également de suivre l’évolution de l’inflammation au fil du temps. Les papilles géantes prennent l’aspect de bourgeons très charnus sessiles centrés sur des vaisseaux, aplatis, pouvant réaliser une véritable conjonctivite pavimenteuse (cobblestone conjunctivitis en anglais). Des sécrétions épaisses et filandreuses sont retrouvées entre les papilles. Elles peuvent être à l’origine de manœuvres d’extraction manuelle qui soulagent les patients. Avec le temps et après plusieurs années d’évolution, les papilles géantes rétrécissent progressivement en taille et laissent place à une fibrose conjonctivale [7]. Les conjonctives palpébrales peuvent également être le siège de nombreuses papilles plus petites, et plus rarement de follicules. La KCV a également été associée à des cils particulièrement longs [9] ;
la forme limbique, plus fréquente en Afrique (dénommée limboconjonctivite endémique tropicale), dans le pourtour méditerranéen et en Amérique du Sud [10-12]. L’atteinte limbique caractérise la forme limbique de la KCV, avec un aspect de bourrelets limbiques siégeant majoritairement en supérieur, mais pouvant occuper un ou plusieurs quadrants horaires et parfois devenir circonférentiels. Il existe aussi fréquemment une pigmentation périlimbique caractéristique qui est pour certains un marqueur spécifique de la maladie chez des patients pigmentés [13, 14]. Les bourrelets limbiques inflammatoires sont d’aspect gélatineux, blanchâtres mais peu hyperhémiques en leur centre du fait de l’œdème et cernés par une hyperhémie périphérique (fig. 5.17). Ils peuvent parfois empiéter sur la cornée et devenir très hypertrophiques, prenant un aspect pseudo-tumoral. Lors des poussées, ils se recouvrent souvent de grains de Trantas-Horner qui ont l’aspect de grains de semoule, jaunâtres, très superficiels. Ces lésions quasi pathognomoniques de KCV correspondent à des amas de polynucléaires éosinophiles. Avec le temps, les bourrelets limbiques prennent une forme cicatricielle de fibrose kystique du limbe. La forme du mélanoderme, appelée également limboconjonctivite endémique tropicale, se caractérise par des poussées inflammatoires plus sévères et plus souvent rebelles aux traitements [6, 14]. La maladie évolue également plus longtemps, disparaissant plutôt après 20 ans. Les poussées successives d’inflammation limbique peuvent laisser place à un pannus fibrovasculaire et à une insuffisance en cellules souches limbiques prédominant en supérieur (pannus vernalis de Pascheff). Le pannus progresse de façon centripète avec les poussées et peut alors menacer la vision s’il atteint l’axe optique [15] ;
la forme mixte : elle associe les caractéristiques des deux formes précédentes.
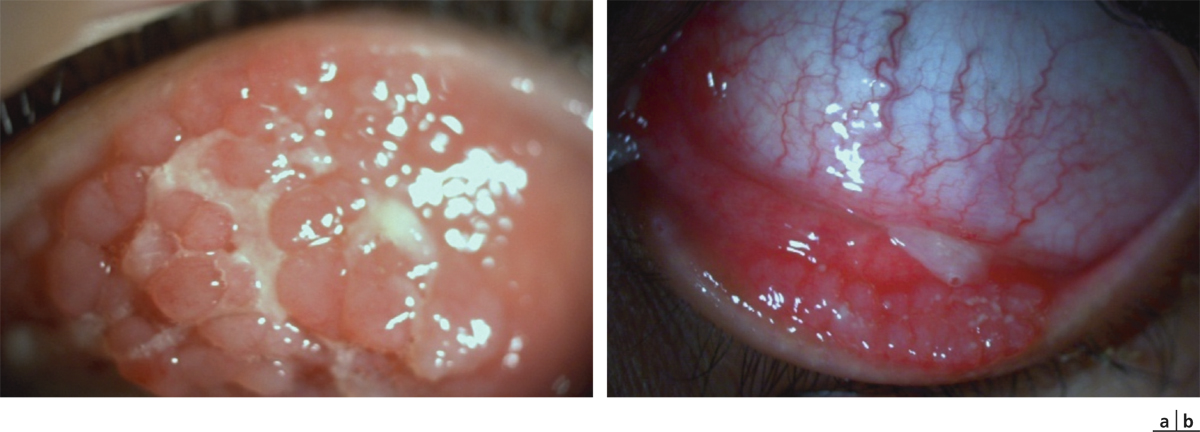
Fig. 5-16 Forme palpébrale.
a. Papilles géantes sur la conjonctive palpébrale supérieure, présence de sécrétions épaisses entre les papilles. b. Papilles géantes plus rarement sur la conjonctive palpébrale inférieure.
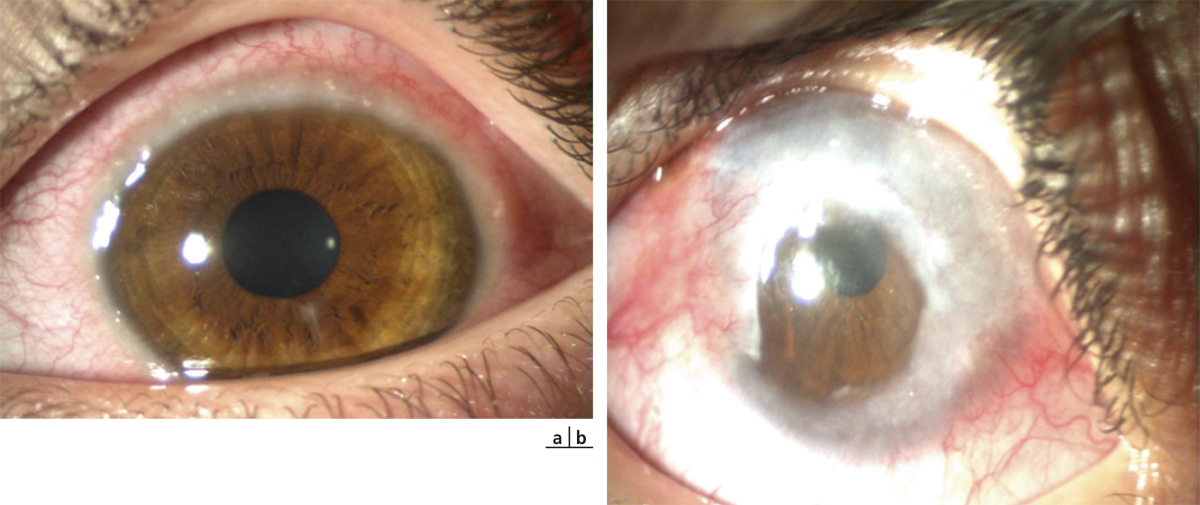
Fig. 5-17 Forme limbique.
a. Aspect gélatineux, blanchâtre du limbe supérieur, avec de nombreux grains de Trantas-Horner jaunâtres. b. Limboconjonctivite endémique tropicale.
Les atteintes cornéennes constituent un élément de sévérité de la KCV, elles surviennent au cours des poussées inflammatoires, sont extrêmement fréquentes pouvant concerner jusqu’à 50 % des patients [4]. Elles nécessitent une surveillance régulière de l’enfant tout au long de la période d’exacerbation, et sous-entendent une prise en charge spécifique de ces enfants avec un accès prioritaire chez leur ophtalmologiste. La photophobie majeure et le larmoiement doivent faire redouter une atteinte cornéenne et pousser la famille à consulter le spécialiste.
Les atteintes cornéennes peuvent prendre plusieurs formes d’une simple kératite à l’ulcère cornéen compliqué d’une plaque vernale. La kératite est le plus souvent de siège supérieur ou central, ponctuée superficielle modérée, mais peut se densifier et s’étendre en taille si l’inflammation de la surface oculaire n’est pas contrôlée (fig. 5.18).
La kératite peut devenir confluente et évoluer vers un ulcère cornéen dénommé ulcère vernal. La forme et la taille de cet ulcère vernal sont variables – ovale ou en bouclier, à l’emporte-pièce –, superficiel le plus souvent, et siégeant classiquement à la jonction tiers supérieur–tiers moyen (fig. 5.19). Cet aspect clinique d’une ulcération à fond propre sans sécrétions définit le stade 1 de la classification de Cameron [16].
La prise en charge doit être rapide pour éviter la survenue de complications essentiellement infectieuses génératrices de séquelles cornéennes. Bien que rare, la surinfection bactérienne ou fongique doit être suspectée en cas d’infiltrat cornéen ou d’ulcère creusant [17]. L’ulcère vernal est secondaire à la toxicité épithéliale des protéines cytotoxiques libérées (en particulier l’eosinophil major basic protein ou EMBP) par les polynucléaires éosinophiles présents dans la conjonctive lors des poussées inflammatoires [18]. Le frottement des papilles géantes sur la cornée n’est qu’un phénomène secondaire dans la genèse de l’ulcère vernal et des formes limbiques pures peuvent se compliquer d’ulcère vernal. Le traitement adapté permettra une cicatrisation de l’ulcère vernal en 1 semaine, en laissant rarement une taie sous-épithéliale. En cas de retard thérapeutique, le fond de l’ulcère se recouvre de débris cellulaires et de mucus, définissant le stade 2 selon Cameron. Sans prise en charge thérapeutique correcte, les dépôts vont progressivement s’épaissir, combler l’ulcère et former une structure opaque en relief, la plaque vernale, indiquant un stade 3 selon Cameron [16]. La cicatrisation est alors impossible, l’inflammation se prolonge et l’évolution aboutit à une cicatrice cornéenne néovascularisée opaque, source potentielle d’amblyopie séquellaire [16]. Une baisse d’acuité visuelle secondaire aux cicatrices cornéennes est retrouvée entre 6 et 35 % dans les formes sévères de la péninsule arabique [19, 20].
En cas d’atopie associée, plusieurs pathologies oculaires peuvent être retrouvées : herpès cornéen, kératocône, cataracte sous-capsulaire antérieure.
La fréquence du glaucome iatrogène par utilisation abusive de corticoïdes locaux reste heureusement peu élevée en Europe, évaluée à 2 % des cas des KCV, comme la cataracte cortisonique sous-capsulaire postérieure à 0,5 % des patients [7]. L’obligation d’une prescription médicale permet un contrôle sécuritaire de l’automédication familiale, qui est très importante dans les pays où l’accès aux corticoïdes locaux est libre. Cette automédication libre aboutit à une majoration dramatique des effets secondaires de ces anti-inflammatoires stéroïdiens, avec une fréquence du glaucome élevée à 7 % et de la cataracte sous-capsulaire postérieure à 15 % [20].
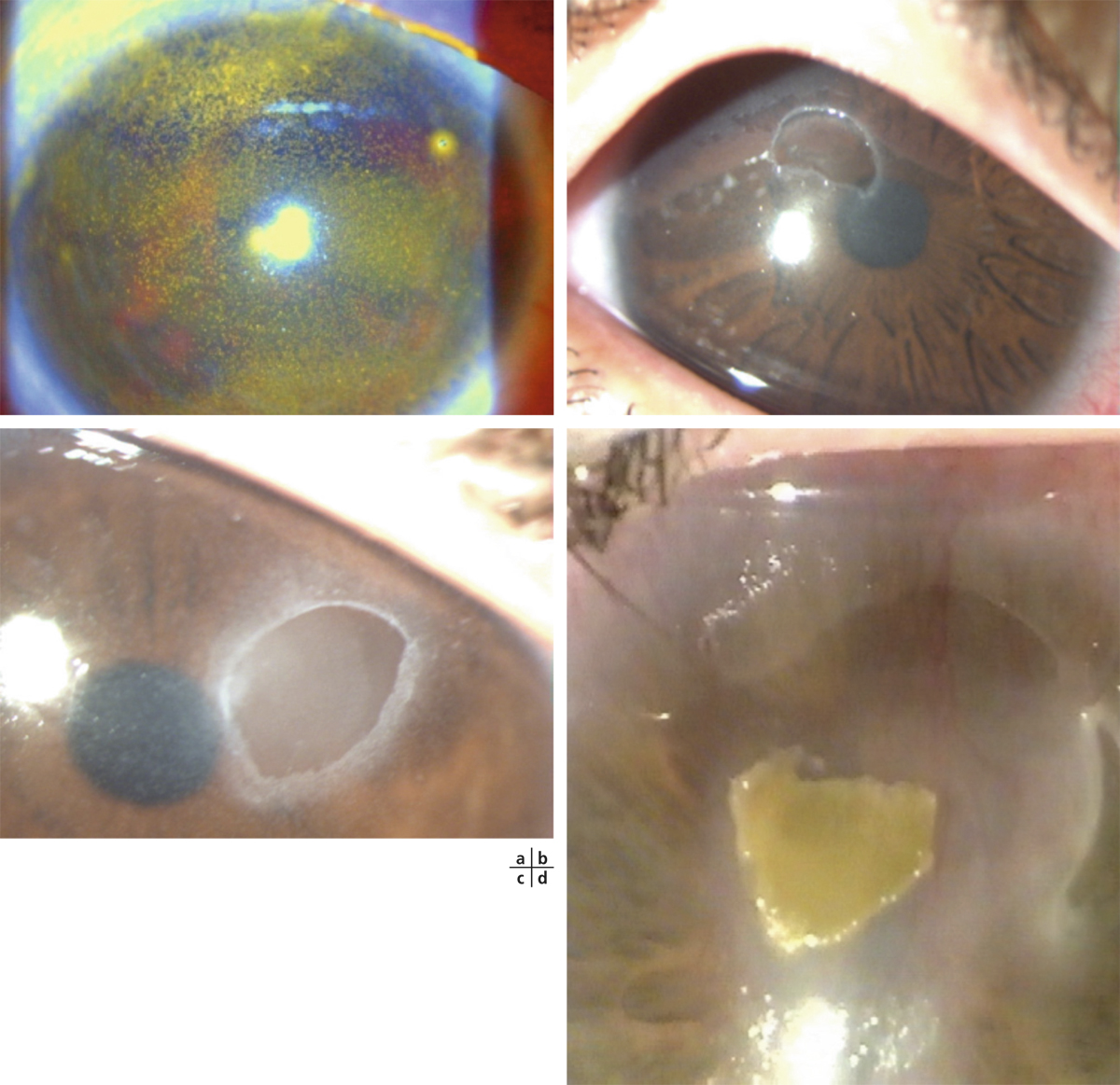
Fig. 5-18 Atteinte cornéenne.
a. Kératite ponctuée superficielle étendue à l’ensemble de la cornée lors d’une poussée inflammatoire. b–d. Ulcère vernal : stade 1 – à fond propre (b) ; stade 2 – fond de l’ulcère recouvert de débris cellulaires (c) ; stade 3 – plaque vernale en relief, avec néovasularisation (d).
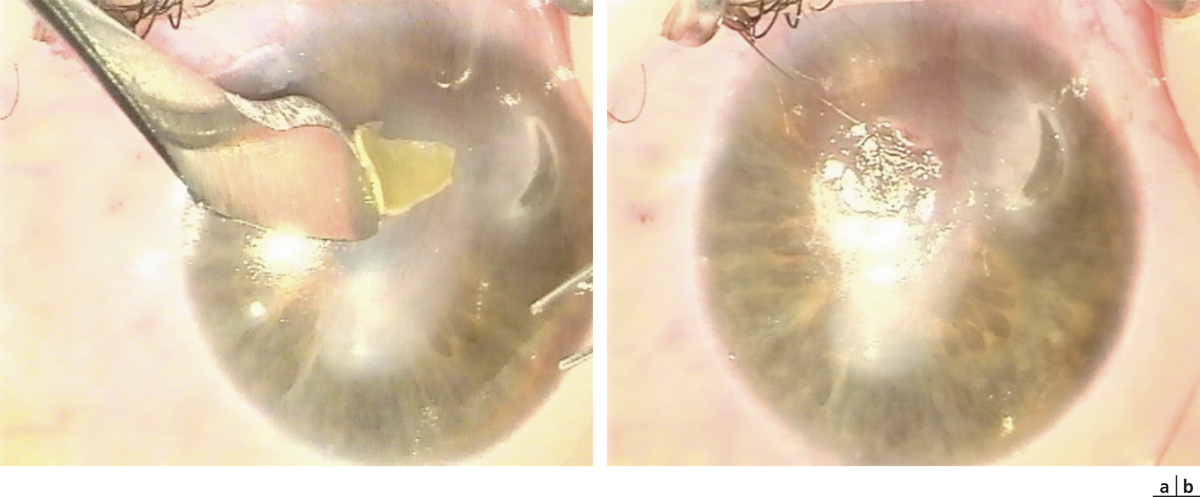
Fig. 5-19 Ablation de la plaque vernale.
Kératectomie superficielle au scarificateur (a) découvrant le stroma cornéen (b) et permettant la cicatrisation.
L’évolution spécifique de la KCV, qui doit être énoncée lors du diagnostic, se fait sur 4 à 5 ans et, dans la majorité des cas, la KCV disparaît avec la puberté. Dans 10 % des cas, l’atteinte oculaire persiste après l’âge de 20 ans, avec une transformation possible en kératoconjonctivite atopique [7]. L’évolution est plus longue et plus sévère dans la forme du mélanoderme, au Japon [21] et en cas d’atopie sévère.
La KCV est une pathologie complexe et multifactorielle. Les mécanismes d’hypersensibilité immédiate IgE médiée ne sont pas les seuls impliqués. L’hyperactivation du système lymphocytaire Th2, des facteurs génétiques et hormonaux contribue aussi à la physiopathologie de la KCV. Il existe également de nombreux facteurs d’aggravation de la maladie qui sont non spécifiques et non allergéniques.
Les données cliniques et biologiques attestent de l’implication d’une réaction d’hypersensibilité immédiate IgE médiée de la surface oculaire dans la KCV. Les lymphocytes B présents au niveau des follicules lymphoïdes de la conjonctive produisent localement des IgE [22]. La dégranulation des mastocytes entraîne la libération de nombreux médiateurs comme l’histamine, ce qui aboutit à la réaction locale classique allergique avec prurit, vasodilatation (hyperhémie), œdème voire chémosis conjonctival et recrutement d’autres cellules inflammatoires. L’action de l’histamine est, de plus, potentiellement amplifiée au niveau de la surface oculaire par un déficit en histaminase des patients atteints de KCV [23].
Le rôle important des éosinophiles dans la KCV est suggéré par leur présence constante au niveau des biopsies de tissus conjonctivaux allergiques et par des taux élevés d’ECP (eosinophil cationic protein) dans les larmes [24, 25]. Les éosinophiles activés provoquent une inflammation de la surface oculaire par leurs médiateurs solubles ainsi que les molécules d’adhésion. L’inflammation peut conduire également à une rupture de l’intégrité de l’épithélium cornéen sous forme d’une kératite modérée [26].
Le fait qu’il n’y ait pas d’obligation stricte d’une sensibilisation allergénique spécifique pour aboutir à cette réponse à éosinophiles dans la KCV et les résultats contradictoires dans la littérature concernant l’association entre KCV et atopie suggèrent que des mécanismes IgE indépendants soient également impliqués [7]. Dans cette voie, il est postulé que les cellules présentatrices d’antigène induisent un afflux d’éosinophiles des vaisseaux sanguins dans le tissu conjonctif par les chimiokines. Celles-ci peuvent également activer des mastocytes indépendants de la réaction à IgE (réaction pseudo-allergique) et attirer les lymphocytes T [27].
Il existe également de plus en plus de preuves de la participation des lymphocytes T helper (Th) ou lymphocytes T auxiliaires (CD4+) dans la KCV. Il existe au niveau de la surface oculaire une augmentation de l’expression de la chimiokine MIG ou CXCL9, molécule chimiotactique des lymphocytes T, ainsi que de son récepteur cellulaire CXCR3, permettant une localisation conjonctivale préférentielle de ces lymphocytes. Une fois activés, ces lymphocytes Th2 jouent un rôle dans le recrutement et l’activation des mastocytes (via l’IL-3), des éosinophiles (via l’IL-5) et de la production d’IgE par les lymphocytes B (via l’IL-4). Ainsi, cette inflammation à médiation initialement lymphocytaire aboutit, par le biais des cytokines Th2, à des réactions de type allergique, avec IgE et mastocytes, et à une activation des polynucléaires éosinophiles. Aucune différence dans le pourcentage de lymphocytes Th2 n’a été trouvée entre les patients atteints de forme palpébrale et ceux porteurs d’une forme limbique. Récemment, il a été suggéré que d’autres cellules T (cellules CD4 Th1 et cellules T CD8) pouvaient aussi jouer un rôle dans l’activation de l’inflammation de la surface oculaire de la KCV.
Classiquement décrit comme une simple barrière physique s’opposant à l’entrée d’agresseurs extérieurs, l’épithélium de la surface oculaire est activement impliqué dans l’initiation et la poursuite du processus inflammatoire allergique. L’épithélium est stimulé par des molécules inflammatoires telles que l’histamine, afin d’exprimer des molécules d’adhésion intercellulaire (ICAM-1) et de sécréter des cytokines inflammatoires ainsi que des chimiokines. L’hyperplasie conjonctivale est modulée par des facteurs de croissance, mais aussi par l’interaction entre les cellules épithéliales conjonctivales et les cellules T activées par l’intermédiaire de la molécule d’adhésion CD40 [28, 29].
Un facteur de risque endocrinien est suggéré dans la KCV par la prédominance masculine, sa disparition fréquente à la puberté, la surexpression de récepteurs aux œstrogènes et à la progestérone retrouvée dans les tissus de patients atteints de KCV, en particulier au niveau des polynucléaires éosinophiles [34].
La différence géographique en termes de prévalence entre les formes limbiques et palpébrales, l’exposition à la lumière ultraviolette, aux fumées de Diesel ou de cigarettes influent aussi sur les signes et symptômes de la KCV. En effet, les rayons UVB induisent au niveau des cellules épithéliales une expression de molécules pro-inflammatoires comme IL-6, IL-8, MMP-1 et VEGF [35].
L’infection de la surface oculaire à différents pathogènes a été évoquée comme mécanisme associé dans la physiopathologie de la KCV. Une réaction d’hypersensibilité non spécifique à Chlamydia a été suggérée mais aucune corrélation n’a été retrouvée entre la prévalence de l’infection à Chlamydia (recherchée par PCR) et la prévalence de la KCV [36, 37].
Les cellules mononucléaires et les éosinophiles modulent l’activité des fibroblastes via l’histamine, des cytokines et différents facteurs de croissance. Dans le cadre du remodelage tissulaire conjonctival dans la KCV, une production de matrice extracellulaire au niveau de la substantia propria est observée incluant du collagène (de type I, III, IV, V et VII), de la ténascine et de la laminine [30, 31]. La laminine et la ténascine facilitent la migration des cellules inflammatoires dans le tissu conjonctival via leurs propriétés adhésives pour ces cellules, mais aussi en activant les métalloprotéinases (MMPs) comme la gélatinase B, qui dégrade la matrice extracellulaire, favorise l’invasion cellulaire et participe au remodelage tissulaire [32]. Les MMPs sont inactivées par l’inhibiteur tissulaire des MMP (TIMP-1), dans un équilibre physiologique spécifique à tout tissu. Une augmentation de la concentration et de l’activité des MMP ainsi qu’un déséquilibre entre MMP et TIMP semblent être identifiés et impliqués dans la physiopathologie de la KCV [33].
[1] Brody J, Foster CS. Vernal conjunctivitis. In : Pepose J, Holland GN, Wilhelmus K. Eds. Ocular infection and immunity. St Louis : Mosby ; 1996, p. 367-75.
[2] Leonardi A, Bogacka E, Fauquert JL, et al. Ocular allergy : recognizing and diagnosing hypersensitivity disorders of the ocular surface. Allergy 2012 ; 67 : 1327-37.
[3] Bremond-Gignac D, Donadieu J, Leonardi A, et al. Prevalence of vernal keratoconjunctivitis : a rare disease ? Br J Ophthalmol 2008 ; 92 : 1097-102.
[4] Leonardi A, Busca F, Motterle L, et al. Case series of 406 vernal keratoconjunctivitis patients : a demographic and epidemiological study. Acta Ophthalmol Scand 2006 ; 84 : 406-10.
[5] De Smedt S, Nkurikiye J, Fonteyne Y, et al. Vernal keratoconjunctivitis in school children in Rwanda and its association with socio-economic status : a population-based survey. Am J Trop Med Hyg 2011 ; 85 : 711-7.
[6] Diallo JS. La limboconjonctivite endémique des tropiques. Rev Int Trach Pathol Ocul Trop Subtrop 1976 ; 53 : 71-80.
[7] Bonini S, Bonini S, Lambiase A, et al. Vernal keratoconjunctivitis revisited : a case series of 195 patients with long-term followup. Ophthalmology 2000 ; 107 : 1157-63.
[8] Hannouche D, Hoang-Xuan T. Les conjonctivites allergiques. In : Hoang-Xuan T. Ed. Pathologies chroniques de la conjonctive. Marseille : Lamy ; 1998, p. 93-123.
[9] Pucci N, Novembre E, Lombardi E, et al. Long eyelashes in a case series of 93 children with vernal keratoconjunctivitis. Pediatrics 2005 ; 115 : e86-e91.
[10] Abiose A. Paediatric ophthalmic problems in Nigeria. J Trop Pediatr 1985 ; 31 : 30-5.
[11] Everaerts MC, Doutetien C. Chronic tropical endemic limboconjunctivitis (TELC) in southern Benin : epidemiological and meteorological data. Rev Int Trach Pathol Ocul Trop Subtrop Sante Publique 1993 ; 70 : 199-214.
[12] Rao SK, Meenakshi S, Srinivasan B, Baluswamy S. Perilimbal bulbar conjunctival pigmentation in vernal conjunctivitis : prospective evaluation of a new clinical sign in an Indian population. Cornea 2004 ; 23 : 356-9.
[13] Rao SK, Padmanabhan P. Perilimbal conjunctival pigmentation in vernal keratoconjunctivitis : a new sign. Cornea 2002 ; 21 : 432.
[14] Resnikoff S, Cornand G, Filliard G, Hugard L. Limboconjonctivite tropicale. Rev Int Trach Pathol Ocul Trop Subtrop Sante Publique 1988 ; 65 : 21-72.
[15] Dahan E, Appel R. Vernal keratoconjunctivitis in the black child and its response to therapy. Br J Ophthalmol 1983 ; 67 : 688-92.
[16] Cameron JA. Shield ulcers and plaques of the cornea in vernal keratoconjunctivitis. Ophthalmology 1995 ; 102 : 985-93.
[17] Kerr N, Stern GA. Bacterial keratitis associated with vernal keratoconjunctivitis. Cornea 1992 ; 11 : 355-9.
[18] Trocme SD, Kephart GM, Bourne WM, et al. Eosinophil granule major basic protein deposition in corneal ulcers associated with vernal keratoconjunctivitis. Am J Ophthalmol 1993 ; 115 : 640-3.
[19] Dart JK. The epidemiology of vernal keratoconjunctivitis. Proceedings of the Second Vision International Ophthalmology Workshop, Bollington, Cheschire, England. Pennine Press ; 1989.
[20] Tabbara KF. Ocular complications of vernal keratoconjunctivitis. Can J Ophthalmol 1999 ; 34 : 88-92.
[21] Takano Y, Dogru M, Tanaka M, et al. Preliminary results of the World Ocular Allergy Study : comparison of the characteristics of patients with severe ocular allergies in Italy and Japan. Invest Ophthalmol Vis Sci 2006 ; 47 : E-Abstract 4991.
[22] Abu El-Asrar A, Fatani RA, Missotten L, et al. Expression of CD23/CD21 and CD40/CD40 ligand in vernal keratoconjunctivitis. Eye 2001 ; 15 : 217-24.
[23] Abelson MB, Leonardi AA, Smith LM, et al. Histaminase activity in patients with vernal keratoconjunctivitis. Ophthalmology 1995 ; 102 : 1958-63.
[24] Tabbara KF. Ocular complications of vernal keratoconjunctivitis. Can J Ophthalmol 1999 ; 34 : 88-92.
[25] Leonardi A, Borhesan F, Faggian D, et al. Eosinophil cationic protein in tears of normal subjects and patients affected by vernal keratoconjunctivitis. Allergy 1995 ; 50 : 610-3.
[26] Trocme SD, Leiferman KM, George T, et al. Neutrophil and eosinophil participation in atopic and vernal keratoconjunctivitis. Curr Eye Res 2003 ; 26 : 319-25.
[27] Abu El-Asrar A, Struyf S, Al-Kharashi S, et al. Expression of T lymphocyte chemoattractants and activation markers in vernal keratoconjunctivitis. Br J Ophthalmol 2002 ; 86 : 1175-80.
[28] Calonge M, Enriquez de Salamanca A. The role of the conjunctival epithelium in ocular allergy. Curr Opin Allergy Clin Immunol 2005 ; 5 : 441-5.
[29] Abu El-Asrar AM, Al-Mansouri S, Tabbara KF, et al. Immunopathogenesis of conjunctival remodelling in vernal keratoconjunctivitis. Eye 2006 ; 20 : 71-9.
[30] Abu El-Asrar AM, Geboes K, Al-Kharashi S, et al. An immunohistochemical study of collagens in trachoma and vernal keratoconjunctivitis. Eye 1998 ; 12 : 1001-6.
[31] Abu El-Asrar A, Meersschaert A, Al-Kharashi S, et al. Immunohistochemical evaluation of conjunctival remodelling in vernal keratoconjunctivitis. Eye 2003 ; 17 : 767-71.
[32] Abu El-Asrar AM, Van Aelst I, Al-Mansouri S, et al. Gelatinase B in vernal 84 keratoconjunctivitis. Arch Ophthalmol 2001 ; 119 : 1505-11.
[33] Leonardi A, Brun P, Abatangelo G, et al. Tear levels and activity of matrix metalloproteinase (MMP)-1 and MMP-9 in vernal keratoconjunctivitis. Invest Ophthalmol Vis Sci 2003 ; 44 : 3052-8.
[34] Bonini S, Lambiase A, Schiavone M, et al. Estrogen and progesterone receptors in vernal keratoconjunctivitis. Ophthalmology 1995 ; 102 : 1374-9.
[35] Di GN, Coroneo M, Wakefield D. Epidermal growth factor receptor signaling is partially responsible for the increased matrix metalloproteinase-1 expression in ocular epithelial cells after UVB radiation. Am J Pathol 2005 ; 167 : 489-503.
[36] Verin P, Mortemousque B, Gendre P, et al. Identification of latent forms of Chlamydia trachomatis in the conjunctiva signifying « new interpretation of ocular chlamydia infections ». Rev Int Trach Pathol Ocul Trop Subtrop Sante Publique 1997 ; 74 : 65-74.
[37] Koulikovska M, Van DP, I, Herrmann B, Montan PG. Respiratory syncytial virus and chlamydia are not detectable by PCR in ongoing vernal keratoconjunctivitis. Ocul Immunol Inflamm 2001 ; 9 : 253-7.
S. Lazreg, F. Chiambaretta
Pathologie rare de l’adulte jeune et de l’enfant, d’origine allergique, la kératoconjonctivite atopique (KCA) représente 1 % des allergies oculaires dont elle est considérée comme la plus sévère. Sur le plan clinique, la KCA associe au niveau oculaire des atteintes palpébrales, conjonctivales et cornéennes d’aspects très polymorphes d’une part, et une dermatose atopique locale ou à distance d’autre part. Ces deux atteintes peuvent être synchrones ou totalement décalées dans leurs débuts et évolutions.
C’est une pathologie inflammatoire dont les mécanismes immunopathogéniques sont très complexes et combinent à la fois une hypersensibilité IgE médiée et une réponse médiée par les lymphocytes T. L’atteinte cornéenne peut être grave et mettre en jeu le pronostic visuel du patient et est en grande partie due aux médiateurs toxiques (eosinophil cationic protein [ECP], major basic protein [MBP]) libérés par les éosinophiles. La prise en charge thérapeutique fait obligatoirement appel aux corticoïdes locaux et, dans certaines formes sévères ou résistantes, aux immunosuppresseurs locaux associés à un traitement anti-allergique au long cours.
La kératoconjonctivite atopique (KCA) constitue une manifestation oculaire de la maladie atopique. Elle a été décrite pour la première fois par Hogan en 1952 comme une atteinte conjonctivale sévère, chronique et bilatérale de la conjonctive, des paupières et de la cornée d’origine inflammatoire, survenant chez des patients porteurs d’une dermatite atopique [1, 2]. Depuis cette description et pendant près de quatre décades, cette pathologie est restée dans l’ombre sauf quelques exceptions. Elle était souvent confondue avec des formes adultes de kératoconjonctivite vernale (KCV). Il a fallu attendre 1990 pour voir la publication de 45 cas de KCA [3] suivie de plusieurs études décrivant les aspects cliniques, thérapeutiques et étiopathogéniques. Ainsi, dans la littérature ophtalmologique toute pathologie inflammatoire de la surface oculaire associée à une dermatite atopique doit être considérée comme KCA jusqu’à preuve du contraire [4] et même si le diagnostic d’une autre forme clinique d’allergie est posé, le risque de développer une KCA reste considérable.
Plus récemment en 2010, Guglielmetti [5] a défini la KCA comme un état chronique, inflammatoire, non infectieux de la surface oculaire associant les caractéristiques suivantes :
toujours combinée avec d’autres manifestations atopiques (au présent, au passé ou au futur) ;
peut se manifester à tout moment de la pathologie atopique associée, indépendamment de son degré de gravité ;
implication constante de la cornée à un certain stade de l’évolution de la maladie.
Les complications oculaires, réunissant une conjonctivite fibrosante, des lésions cornéennes quasi constantes et des lésions palpébrales, peuvent menacer la fonction visuelle.
La KCA est une pathologie rare, qui frappe moins de 1 % des patients souffrant d’allergie oculaire.
C’est une pathologie qui affecte adultes et enfants, avec un pic de fréquence entre 30 et 50 ans. Certains jeunes enfants atteints d’une dermatite atopique active peuvent développer plus précocement une KCA, aussi certaines KCV se transforment en forme atopique à l’adolescence.
Elle a très longtemps été décrite comme une maladie de l’adulte masculin, mais dans la pratique quotidienne, nous observons de plus en plus de formes féminines et à tous les âges.
Il n’existe ni distribution ni prévalence géographique particulières.
La KCA est rapportée dans 25 à 42 % des dermatites atopiques [3, 6]. Les antécédents familiaux et personnels, à rechercher systématiquement, signent classiquement le terrain atopique. Les histoires familiales d’asthme, d’eczéma et de dermatite atopique sont fréquentes et les porteurs de KCA ont souffert ou souffrent d’eczéma dans 95 % et d’asthme dans 87 % [7].
Les manifestations cliniques de la KCA sont très polymorphes et à part quelques signes pathognomoniques, les autres signes cliniques peuvent mimer une KCV ou une autre manifestation chronique inflammatoire de la surface oculaire, ce qui rend parfois le diagnostic différentiel assez compliqué. Dans tous les cas, les atteintes sont toujours sévères multiples et intriquées.
La KCA présente une symptomatologie volontiers perannuelle avec une aggravation saisonnière plus marquée l’été et l’hiver. Des poussées sont aussi décrites par les patients après une exposition à la poussière ou après l’ingestion de certains aliments [8].
L’atteinte est bilatérale et la gêne fonctionnelle est majeure. La symptomatologie associe un prurit, des sensations de brûlures et un larmoiement. Les sécrétions sont fréquentes, classiquement abondantes, séreuses ou épaisses. La photophobie et la vision troublée signent l’atteinte cornéenne.
L’atteinte palpébrale est un élément important pour établir le diagnostic de KCA. Les lésions palpébrales eczématiformes entraînent un épaississement, une induration et une kératinisation des bords libres, un érythème et des fissures des paupières (fig. 5-20).
Ces éléments sont souvent associés à une blépharite chronique le plus souvent secondaire à : des infections à Staphylococcus aureus à l’origine de la macération et de l’induration des bords libres ; une meibomite ; une perte des cils.
La région péri-oculaire est le siège de modifications eczématoïdes, associant un érythème, une dessiccation et des croûtes, donnant un aspect écailleux et squameux à la peau ; il en résulte un simple ou double pli sous-orbitaire classiquement nommé le pli de Dennie-Morgan (fig. 5-21).
Chez certains patients âgés, on observe l’absence de la queue des sourcils (signe de Hertoghe) probablement due aux frottements chroniques des yeux.
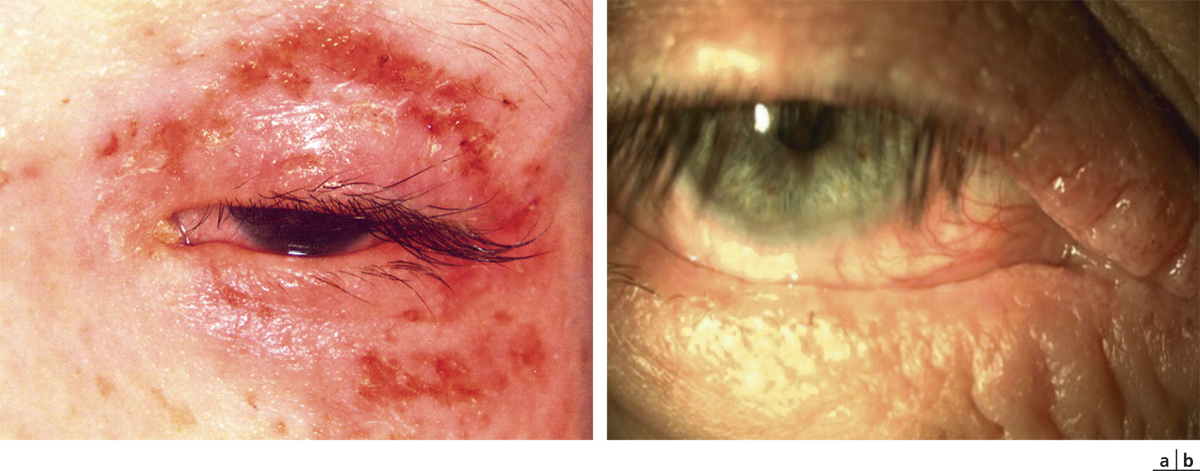
Fig. 5-20 Atteinte palpébrale.
a. Lésions palpébrales eczématiformes typiques. b. Modifications du bord libre avec épaississement, madarose et fissures.
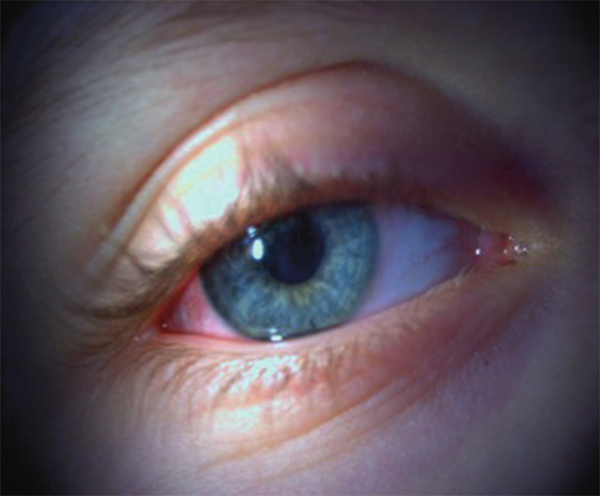
Fig. 5-21 Pli sous-orbitaire, double pli de Dennie-Morgan.
La conjonctive est le siège d’une hyperhémie (rarement d’un chémosis) qui prédomine au niveau du cul-de-sac et de la conjonctive palpébrale inférieure. Une hypertrophie papillaire n’est pas rare et atteint la conjonctive palpébrale supérieure et inférieure plus fréquemment. L’inflammation conjonctivale chronique entraîne une fibrose sous-épithéliale progressive, un comblement des culs-de-sac par ce processus cicatriciel et la formation de symblépharons (fig. 5-22) [9].
La formation de papilles géantes sur la conjonctive tarsale supérieure identiques à celles d’une KCV reste exceptionnelle [9]. L’éversion des paupières supérieures reste indispensable pour les observer.
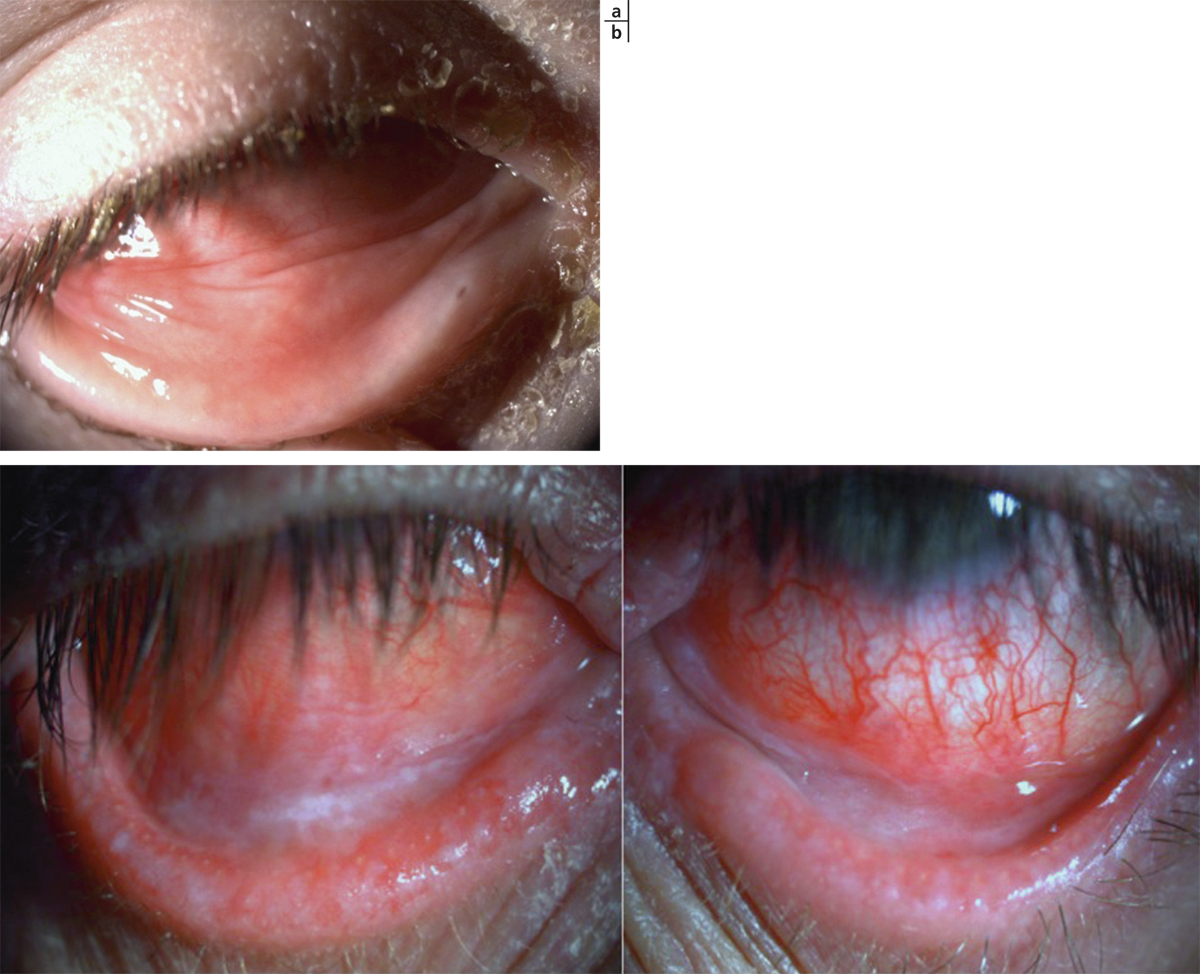
Fig. 5-22 Atteinte conjonctivale.
a. Comblement du cul-de-sac inférieur inflammatoire. b. Processus cicatriciel et fibrose progressive des culs-de-sac.
Une atteinte limbique comprenant un épaississement en forme de bourrelet gélatineux translucide peut être retrouvée comme dans une KCV. Des nodules de Trantas-Horner peuvent aussi être observés [9]. Les épisodes inflammatoires sévères et répétés peuvent aboutir à une insuffisance limbique compromettant la transparence cornéenne.
Les complications cornéennes sont fréquentes (75 % des cas), elles peuvent se développer pendant ou au décours d’épisodes d’exacerbation de la blépharoconjonctivite. Une kératite ponctuée superficielle inaugure l’atteinte épithéliale et peut évoluer à la faveur de l’inflammation récurrente vers des ulcères épithéliaux persistants. Une formation de plaques comme dans la KCV peut se produire. Une surinfection des lésions épithéliales par Staphylococcus aureus (qui colonise la marge palpébrale des sujets atopiques) n’est pas rare. Des kératites herpétiques sévères, bilatérales et récurrentes surviennent dans 10 à 22 % des cas et peuvent être difficiles à contrôler chez ces patients souvent sous corticothérapie locale [3, 10]. Des kératites bactériennes ou à Acanthamœba peuvent aussi être associées.
Progressivement et après de nombreux épisodes inflammatoires ou infectieux, une néovascularisation (dans 65 % des cas) se développe, ainsi que des opacités séquellaires. L’évolution peut se faire vers une sclérose cornéenne progressive avec formation d’un pannus vasculaire touchant le tiers supérieur de la cornée, pouvant aboutir à une cécité cornéenne. Au cours de l’évolution, un amincissement cornéen peut se former et induire un astigmatisme important participant à la baisse d’acuité visuelle.
Le kératocône est associé à la KCA avec une plus grande fréquence, comme il l’est à la dermatite atopique présente chez 16 % des porteurs de cette ectasie cornéenne.
Classiquement, les patients ne présentent pas de déficit lacrymal important, les tests de Schirmer sont proches de la normale. Cependant, la majorité des patients rapporte des signes fonctionnels de sécheresse oculaire, à rapprocher de leur break-up time (BUT) effondré. De plus, les BUT les plus bas sont retrouvés chez les patients présentant des atteintes cornéennes épithéliales significatives, suggérant une aggravation de l’instabilité du film lacrymal avec la progression de la KCA.
En effet, l’état inflammatoire chronique de la surface oculaire entraîne une perte de cellules à mucus et une métaplasie squameuse de la conjonctive, il en résulte une instabilité lacrymale majeure et une sécheresse oculaire manifeste. Une étude récente rapporte que l’expression des dérivés des cellules à mucus MUC5AC ARNm est significativement plus basse dans les KCA compliquées d’ulcère de cornée que dans les groupes sans ulcères et les groupes témoins [10].
Une cataracte complique fréquemment l’évolution d’une KCA [11]. On oppose la cataracte sous-capsulaire antérieure (en peau d’ours tendue), d’évolution lente et progressive compliquant la maladie atopique, à la cataracte sous-capsulaire postérieure d’évolution rapide, favorisée par l’usage prolongé de corticoïdes locaux.
Des cas de décollements de rétine rhegmatogènes ont été décrits, ils pourraient être liés à une dégénérescence vitréenne particulière ou aux frottements oculaires excessifs [12, 13]. Occasionnellement, les patients souffrant de KCA peuvent présenter une sclérite, une épisclérite ou même une uvéite, cependant le lien avec l’atopie reste inconnu et inexpliqué.
L’atteinte cutanée atopique (fig. 5-23) et l’atteinte oculaire n’ont aucun parallélisme évolutif. L’atteinte cutanée peut rester inactive pendant plusieurs années précédant l’atteinte oculaire, ce qui peut être une source d’erreur diagnostique, le patient n’étant pas au courant que les deux atteintes peuvent être liées et oublier de les mentionner à l’ophtalmologiste, d’où la nécessité d’un interrogatoire dirigé.
Le diagnostic différentiel peut être difficile à cause d’un large éventail de manifestations cliniques pouvant mimer d’autres pathologies ou masquer la symptomatologie de la KCA.
En effet, à cause de leur ressemblance clinique, la KCV et la KCA peuvent être confondues, d’autant plus que l’une peut succéder à l’autre, et parfois même il est difficile de trancher pour l’une ou l’autre dans certaines formes limites.
Les dysfonctionnements meibomiens sont très souvent associés à la KCA, ce qui rend parfois difficile de trancher entre le diagnostic d’une blépharo-kératoconjonctivite (rosacée oculaire) ou d’une KCA, seule l’association à une atopie peut les différencier.
Les formes avancées fibrosantes peuvent être confondues avec une pemphigoïde cicatricielle. Dans ces cas, la biopsie conjonctivale montre un dépôt de matériel immun sur la membrane basale de la conjonctive dans la pemphigoïde qui est absent dans la KCA.
Le processus inflammatoire dans la KCA est encore mal élucidé, complexe et combine à la fois une réponse IgE-dépendante et une réponse médiée par les lymphocytes T.
Le processus immunopathogénique implique la libération de différentes cytokines par des cellules effectrices (mastocytes, éosinophiles, lymphocytes T et cellules épithéliales conjonctivales). Après leur activation, les cellules effectrices libèrent des médiateurs qui activent les Th1, les éosinophiles, pathognomoniques de la KCA, et une variété de cytokines qui modifient les fonctions des leucocytes de même que leur propre activité : l’IL-4 qui stimule les lymphocytes B et l’IL-8 qui est chimiotactique pour les neutrophiles ; l’eosin cationic protein (ECP) ; l’éotaxine 1 et 2 [12, 13].
Il en résulte que les deux cascades inflammatoires Th1 et Th2 se retrouvent activées dans la KCA [14]. Les cellules Th1 sécrètent IL-2 et l’interféron γ, alors que les cellules Th2 sécrètent IL-4, IL-5, IL-10 et IL-13, ce qui engendre une hypersensibilité retardée et une réponse inflammatoire sévère.
Le patient atteint d’une KCA est un atopique, le bilan sanguin sera un témoin de la maladie générale et pas forcément un reflet de l’atteinte conjonctivale. Il est classique de retrouver un taux sérique d’IgE élevé dans 80 % des cas et une fréquente hyperéosinophilie. Ces deux tests restent toutefois très peu spécifiques de la KCA.
Cependant, certaines études suggèrent un profil sanguin en faveur d’une KCA. Par exemple le taux sérique d’ECP, de neurotoxine éosinophile et de récepteur à l’IL-2 est significativement plus élevé chez des porteurs de KCA. Un taux élevé reflète l’activation des éosinophiles, cependant sans corrélation avec la sévérité de l’atteinte oculaire [14].
À ce jour, il n’est toujours pas possible de poser un diagnostic de laboratoire de la KCA ; tous les tests proposés ne servent qu’à poser un diagnostic de pathologie allergique de l’œil sans en déterminer la forme clinique.
Les études du liquide lacrymal permettent une approche du profil cellulaire et moléculaire de la surface oculaire dans la KCA. L’analyse en cytométrie de flux objective une élévation du nombre de lymphocytes T naïfs (CD4/45RA+) et mémoires (CD4/29+) dans les larmes et le sang des porteurs de KCA [12]. Le pourcentage de lymphocytes B activés, de lymphocytes T et le ratio Th/T suppresseur sont aussi élevés dans les larmes de ces patients [13]. La diminution des lymphocytes T suppresseurs pourrait favoriser la production des IgE par les lymphocytes B. L’étude de certaines cytokines a retrouvé une élévation lacrymale de cytokines sécrétées par les Th2, l’IL-4 et l’IL-5 dans la KCA [15]. L’IL-4 joue un rôle important dans la maturation des lymphocytes B vers la production d’IgE. L’IL-5 active les éosinophiles, prolonge leur survie et contribue à leur accumulation sur le site inflammatoire [16].
L’éotaxine (CCL11), chimiokine qui permet le recrutement des éosinophiles, a un taux lacrymal élevé dans les formes sévères d’atteintes cornéennes de la KCA [17]. Cet élément est important puisque les éosinophiles jouent un rôle central dans la survenue des lésions cornéennes, qu’ils favorisent en libérant des médiateurs toxiques pour les cellules épithéliales comme l’ECP et la MBP (major basic protrein) [18].
Inada a décrit l’immunochromatographie des larmes, un examen qui peut détecter aussi bien les IgE spécifiques que les IgE totales, leurs valeurs dans les larmes obtenues avec cette méthode sont en corrélation avec la sévérité de la KCA [19].
Plus récemment, dans une étude menée par Wakamatsu et al. sur l’effet anti-inflammatoire du collyre tacrolimus sur le contrôle des signes cliniques de la KCA, le taux d’ECP dans les larmes après traitement était significativement moins élevé que celui mesuré avant traitement avec une forte corrélation linéaire entre les valeurs d’ECP dans les larmes et les signes cliniques. Ces mêmes auteurs retrouvent dans une autre étude des taux élevés d’ECP dans les larmes des patients avec atteintes épithéliales cornéennes comparés au groupe témoin [20].
L’examen histopathologique de la conjonctive dans la KCA est pauvre et ne montre qu’une réduction du nombre des éosinophiles qui, eux-mêmes, contiennent moins de granules que ceux retrouvés dans une KCV.
Récemment, la microscopie confocale in vivo a été décrite comme un examen efficace et non invasif dans l’évaluation quantitative de la surface oculaire dans la KCA [21]. Une autre étude a montré une forte corrélation entre le degré de l’inflammation évalué par la cytologie et celui apprécié par microscopie confocale in vivo.
Le tissu conjonctival dans la KCA est infiltré par les acteurs cellulaires de l’inflammation, producteurs de cytokines pro-inflammatoires, avec une forte concentration de lymphocytes T activés, d’éosinophiles et de mastocytes [22]. Plusieurs chimiokines (cytokines chimiotactiques) semblent impliquées dans le recrutement et l’activation de ces cellules. Ces molécules se lient à des récepteurs spécifiques situés à la surface des différents types cellulaires. Cette liaison spécifique chimiokine–récepteur permet le recrutement de la cellule au niveau d’un tissu. Les deux principales classes de chimiokines CXC et CC sont définies en fonction du nombre d’acides aminés situés entre deux résidus cystéine. Dans le groupe des CC, deux principales chimiokines exercent leur recrutement cellulaire par le biais du récepteur CCR3 :
le monocyte chemoattractant protein 1 (MCP-1) qui est un agoniste recrutant les monocytes, les cellules dendritiques, les basophiles et les cellules T mémoires ;
l’éotaxine (CCL11) qui recrute essentiellement les éosinophiles, mais aussi les mastocytes, basophiles et les lymphocytes Th2.
L’éotaxine et le MCP-1 semblent impliqués dans le recrutement des cellules de l’inflammation au cours de la KCA puisque leur concentration lacrymale est constamment élevée chez ces patients [23].
La libération d’IL-4 stimule la production d’éotaxine au niveau de la surface oculaire. Plus précisément, les fibroblastes cornéens et, à un moindre niveau, les fibroblastes conjonctivaux produisent de l’éotaxine sous l’effet de l’IL-4 [23].
Les cellules de l’épithélium conjonctival semblent impliquées elles aussi dans les réactions immunes au cours de la KCA. Les cellules épithéliales conjonctivales saines expriment peu les molécules ICAM-1 ou HLA-DR. Ce profil d’expression est modifié dans ces mêmes cellules épithéliales au cours de la KCA dans le sens d’une augmentation du niveau d’expression de ces deux gènes [24, 25]. Or, ICAM-1 joue un rôle majeur dans le recrutement de différentes cellules polynucléaires impliquées dans la réaction inflammatoire, ce qui favorise cette dernière.
La prise en charge de la KCA doit être globale et nécessite une approche multidisciplinaire, ophtalmologique, allergologique et dermatologique. Il est fondamental de prendre en compte les autres manifestations générales de l’atopie. Le but du traitement sera d’alléger les symptômes de la KCA et de préserver l’acuité visuelle.
[1] Hogan MJ. Atopic keratoconjunctivitis. Trans Am Ophthalmo Soc 1952 ; 50 : 265-81.
[2] Hogan MJ. Atopic keratoconjunctivitis. Am J Ophthalmol 1953 ; 36 : 937-47.
[3] Tuft SJ, Kemeny DM, Dart JK, Buckley RJ. Clinical features of atopic keratoconjunctivitis. Ophthalmology 1991 ; 98 : 150-8.
[4] Donshik PC. Allergic conjunctivitis. Int Ophthalmol Clin 1988 ; 28 : 294-302.
[5] Guglielmetti S, Dart JK, Calder V. Atopic keratoconjunctivitis and atopic dermatitis. Curr Opin Allergy Clin Immunol 2010 ; 10 : 478-85.
[6] Bielory L. Allergic and immunologic disorders of the eye. Part II : ocular allergy. J Allergy Clin Immun 2000 ; 106 : 1019-32.
[7] Garrity JA, Liesegang TJ. Ocular complications of atopic dermatitis. Can J Ophthalmol 1984 ; 19 : 21-4.
[8] Foster CS, Calonge M. Atopic keratoconjunctivitis. Ophthalmology 1990 ; 97 : 992-1000.
[9] Rich LF, Hanifin JM. Ocular complications of atopic dermatitis and other eczemas. Int Ophthalmol Clin 1985 ; 25 : 61-76.
[10] Easty DL, Entwistle C, Fund A, Witcher J. Herpes simplex keratitis and keratoconus inthe atopic patient. A clinical and immunological study. Trans Ophthalmol Soc UK 1975 ; 95 : 267-76.
[11] Ingram RM. Retinal detachment associated with atopic dermatitis and cataracts. Arch Ophthalmol 1965 ; 49 : 96-7.
[12] Foster CS, Rice BA, Dutt JE. Immunopathology of atopic keratoconjunctivitis. Ophthalmology 1991 ; 98 : 1190-6.
[13] Avunduk AM, Avunduk MC, Dayanir V, Tekelioglu Y. Further studies on the immunopathology of atopic keratoconjunctivitis using flow cytometry. Exp Eye Res 1997 ; 65 : 803-8.
[14] Calder VL, Jolly G, Hingorani M, et al. Cytokine production and mRNA expression by conjunctival T-cell lines in chronic allergic eye disease. Clin Exp Allergy 1999 ; 29 : 1214-22.
[15] Avunduk AM, Avunduk MC, Tekelioglu Y. Analysis of tears in patients with atopic keratoconjunctivitis, using flow cytometry. Ophthalmic Res 1998 ; 30 : 44-8.
[16] Uchio E, Ono SY, Ikezawa Z, Ohno S. Tear levels of interferon-gamma, interleukin (IL)-2, IL-4 and IL-5 in patients with vernal keratoconjunctivitis, atopic keratoconjunctivitis and allergic conjunctivitis. Clin Exp Allergy 2000 ; 30 : 103-9.
[17] Sanderson CJ. Interleukin-5, eosinophilia, and disease. Blood 1992 ; 79 : 3101-9.
[18] Fukagawa K, Nakajima T, Tsubota K, et al. Presence of eotaxin in tears of patients with atopic keratoconjunctivitis with severe corneal damage. J Allergy Clin Immunol 1999 ; 103 : 1220-1.
[19] Inada N, Shoji J, Kato H, et al. Clinical evaluation of total IgE in tears of patients with allergic conjunctivitis disease using a novel application of the immunochromatography method. Allergol Int 2009 ; 58 : 585-9.
[20] Wakamatsu TH, Satake Y, Igarashi A, et al. IgE and eosinophil cationic protein (ECP) as markers of severity in the diagnosis of atopic keratoconjunctivitis, Br J Ophtalmol 2012 ; 96 : 581-6.
[21] Hu Y, Adan ES, Matsumoto Y, et al. Conjunctival in vivo confocal scanning laser microscopy in patients with atopic keratoconjunctivitis. Mol Vis 2007 ; 13 : 1379-89.
[22] Trocme SD, Hallberg CK, Gill KS, et al. Effects of eosinophil granule proteins on human corneal epithelial cell viability and morphology. Invest Ophthalmol Vis Sci 1997 ; 38 : 593-9.
[23] Metz DP, Bacon AS, Holgate S, Lightman SL. Phenotypic characterization of T cells infiltrating the conjunctiva in chronic allergic eye disease. J Allergy Clin Immunol 1996 ; 98 : 686-96.
[24] Yoneda K, Okamoto H, Wada Y, et al. Atopic retinal detachment. Report of four cases and a review of the literature. Br J Dermatol 1995 ; 133 : 586-91.
[25] Dogru M, Okada N, Asano-Kato N, et al. Ocular surface and MUC5AC alteration in atopic patients with corneal shield ulcers. Cur Eye Res 2005 ; 30 : 897-905.
J.-L. Fauquert
La mise en évidence d’une allergie médiée par les immunoglobulines E (IgE) est le plus souvent simple devant une forme bénigne, qu’elle soit récidivante ou persistante. Cette recherche étiologique peut être beaucoup plus délicate devant une kératoconjonctivite allergique, notamment sévère comme la kératoconjonctivite vernale (KCV). Le bilan allergologique prend alors tout son sens ainsi que dans les formes chroniques ou frontières où la réaction d’hypersensibilité n’apparaît pas évidente en clinique. Dans tous les cas, l’ophtalmologiste et l’allergologue doivent collaborer de façon étroite, permettant dans un certain nombre de cas de réduire ou de diminuer les symptômes des patients.
L’hypersensibilité médiée par les immunoglobulines E (IgE) est le mode d’expression le plus habituel de l’allergie oculaire. La mise en évidence d’une allergie oculaire médiée par les IgE doit conduire à un traitement étiologique basé sur des mesures d’éviction allergénique et sur une éventuelle immunothérapie spécifique.
Cette sensibilité exacerbée est médiée par les IgE spécifiques d’un allergène. La classification des hypersensibilités allergiques proposée par l’European Academy of Allergy and Clinical Immunology (EAACI) distingue les pathologies médiées par les IgE des autres pathologies (fig. 5-24) [1].
Comme l’allergie respiratoire, l’allergie oculaire est associée à une hypersensibilité allergique de type immédiat dans un nombre élevé de cas, de l’ordre de 95 %. Elle concerne essentiellement les conjonctivites allergiques bénignes, c’est-à-dire la conjonctivite allergique saisonnière (CAS) et la conjonctivite allergique perannuelle (CAP). Cette hypersensibilité concerne aussi pour partie les conjonctivites sévères compliquées de kératite, comme la kératoconjonctivite vernale (KCV) et la kératoconjonctivite atopique (KCA). Le reste de la pathologie allergique oculaire est associé à une hypersensibilité retardée qui induit des manifestations à type de blépharites et de blépharoconjonctivites. Enfin, il faut savoir que le bilan allergologique systémique ne conduit pas toujours à l’implication précise d’un allergène : l’allergie peut ne s’exprimer qu’in situ. Par ailleurs, de nombreux facteurs non spécifiques peuvent induire, au niveau de la surface oculaire, les mêmes symptômes que ceux de l’allergie oculaire. Chez ces patients, l’implication de mécanismes physiopathologiques proches de ceux de l’allergie explique l’efficacité des traitements anti-allergiques. L’EAACI a décrit de façon précise les liens entre l’hypersensibilité allergique et la pathologie oculaire (fig. 5-25) [2].
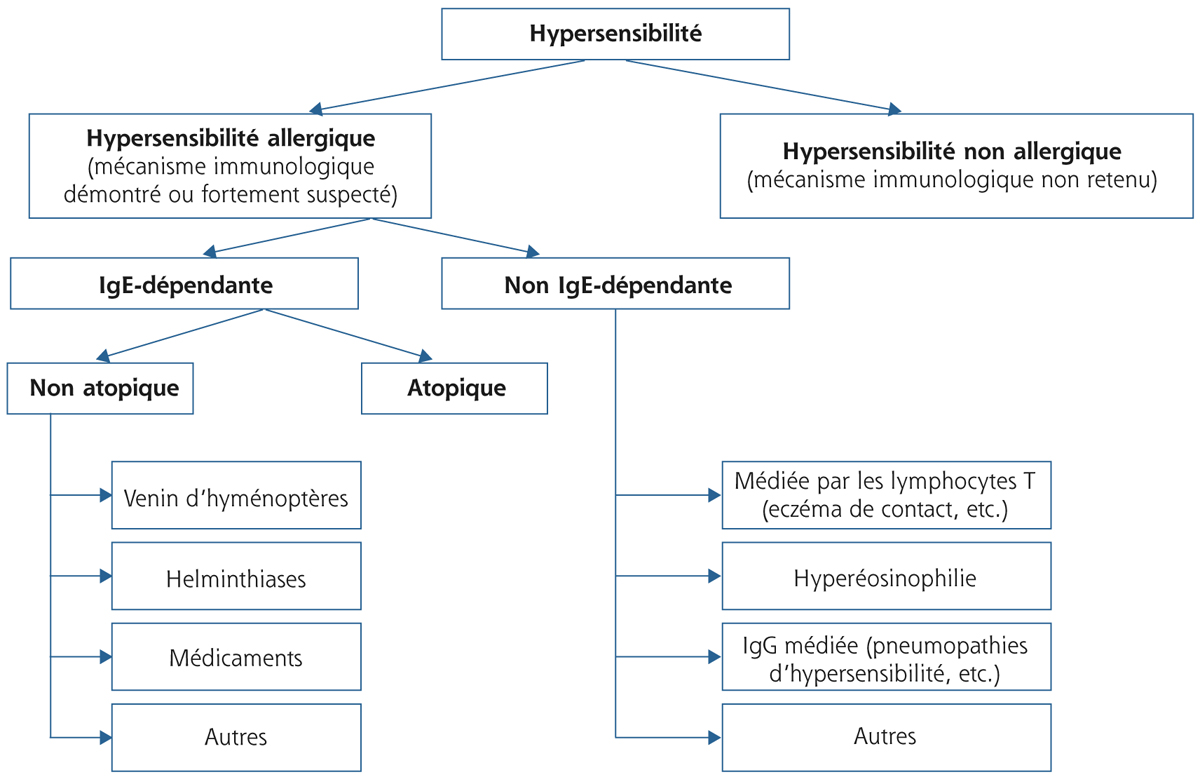
Fig. 5-24 Classification des hypersensibilités selon la nomenclature de l’Académie européenne d’allergie et d’immunologie clinique [1].
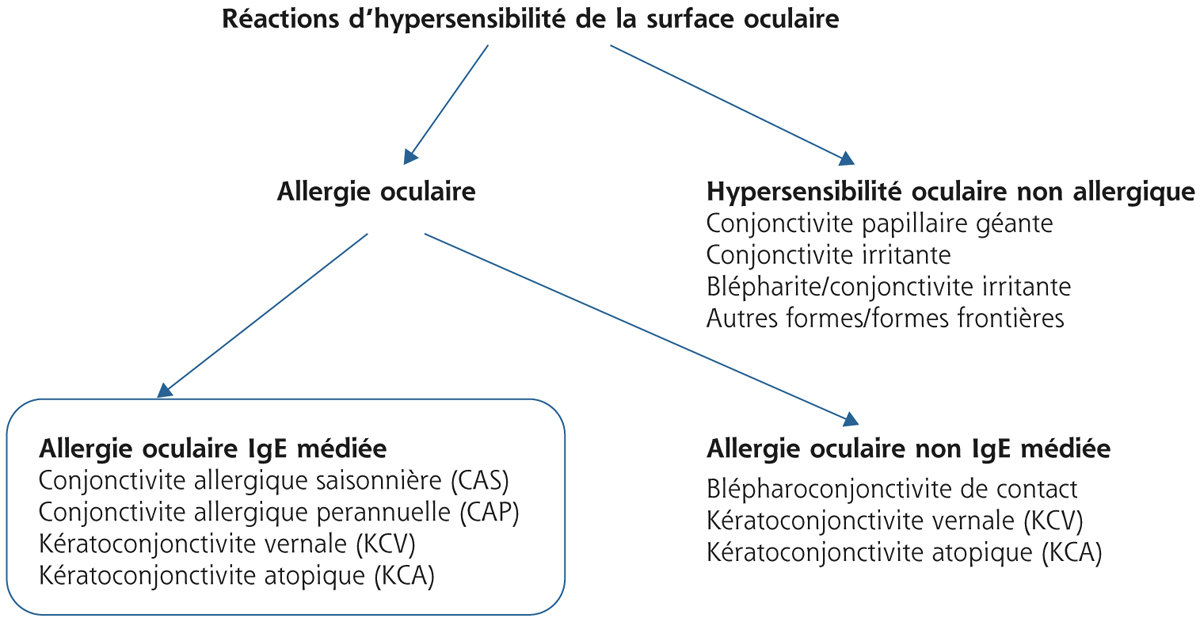
Fig. 5-25 Classification des réactions d’hypersensibilité oculaire basée sur la physiopathologie et la terminologie de l’hypersensibilité allergique [2].
Ces pathologies oculaires médiées par les IgE correspondent à la classique hypersensibilité immédiate de type I décrite par Gell et Coombs [3]. Cette hypersensibilité suppose la captation de l’allergène par la cellule présentatrice de l’antigène, sa reconnaissance et la production d’IgE spécifiques par les lymphocytes B sous l’influence des lymphocytes T helper de type 2 (Th2). Ce premier contact aboutit à la formation d’IgE spécifiques de l’allergène. Lors d’une présentation ultérieure de l’antigène, celui-ci est reconnu par ces IgE spécifiques dont le pontage et la liaison par le récepteur de haute affinité aux IgE induisent l’activation du mastocyte.
Le mastocyte est la cellule centrale de l’hypersensibilité IgE médiée. Il est situé dans les tissus effecteurs de l’allergie et en particulier au sein de la conjonctive. Une fois activé, le mastocyte libère de son cytoplasme le contenu de granules dans lesquels sont stockées d’importantes quantités de tryptase et surtout d’histamine. Cette substance se fixe sur les récepteurs à l’histamine de la cellule cible conjonctivale. Elle est responsable de la majorité des symptômes de l’allergie et en particulier du prurit (fig. 5-26) [4]. Elle induit au niveau de la conjonctive une vasodilatation génératrice de prurit, d’œdème muqueux responsable de chémosis, de larmoiement ainsi qu’un afflux vasculaire responsable de rougeur oculaire.
Lorsque son activation se prolonge, le mastocyte est aussi capable de sécréter des médiateurs néoformés, qui sont des interleukines chémo-attractantes pour l’éosinophile. Une fois activée, l’éosinophile libère des molécules que l’on peut doser dans les larmes. Ces substances, parmi lesquelles l’ECP (eosinophil cationic protein ou protéine cationique des éosinophiles), sont délétères pour l’épithélium conjonctival à court et à moyen terme. La protéine majeure basique (major basic protein ou MBP) est sécrétée en quantité abondante dans les larmes chez les sujets atteints de kératoconjonctivite vernale [5].
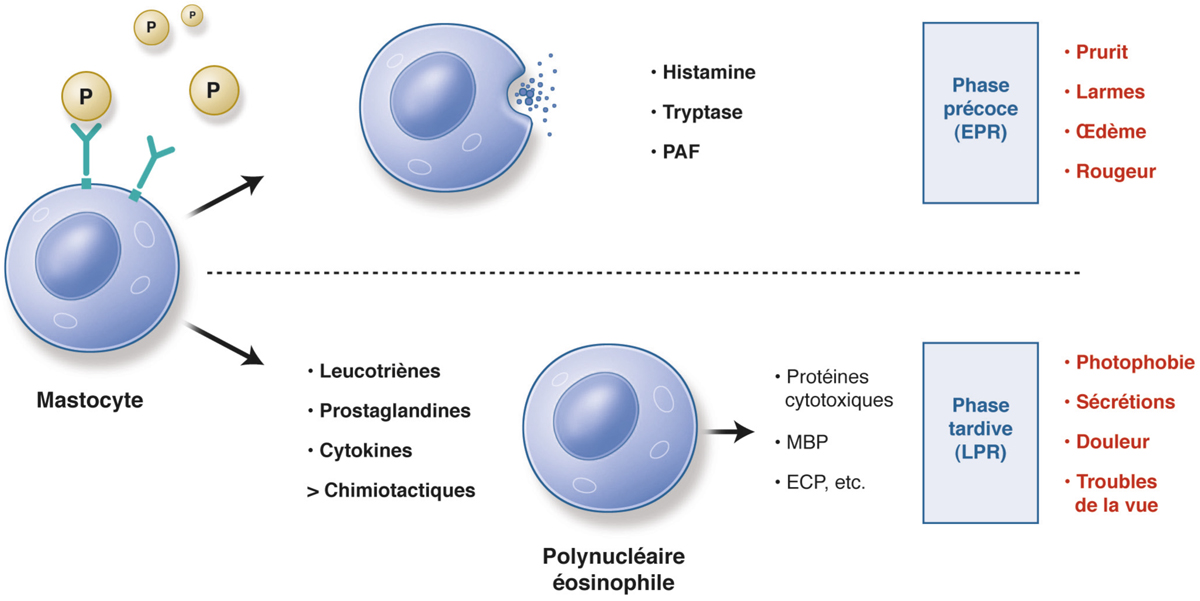
Fig. 5-26 Mécanismes physiopathologiques effecteurs de l’hypersensibilité médiée par les IgE [3].
ECP : eosinophil cationic protein ; EPR : early phase response ; LPR : late phase response ; MBP : major basic protein ; P : protéine ; PAF : platelet-activating factor.
Les allergènes responsables de symptômes oculaires sont avant tout véhiculés par l’air. Ces pneumallergènes sont aussi responsables de symptômes respiratoires qu’ils soient hauts ou bas. Certains allergènes sont testés chez tous les patients, d’autres seulement en fonction du contexte environnemental (habitat collectif, en pays tropical ou sur le pourtour méditerranéen) ou en cas de positivité de dosages d’IgE spécifiques (tableau 5-3). Lorsque les symptômes sont perannuels, les allergènes domestiques sont plus facilement incriminés. Il s’agit surtout des acariens de la poussière domestique de la classe des Dermatophagoides. Les allergènes saisonniers sont dominés par les pollens dont la responsabilité est de plus en plus souvent mise en cause. En cas de pollinose à plusieurs classes de pollens, l’allergie oculaire peut paraître perannuelle. Certaines pollinoses peuvent s’exprimer sur une longue période. Chez l’enfant, les allergènes alimentaires doivent être explorés car ils peuvent constituer un facteur de déclenchement des poussées. La fréquence de plus en plus élevée des allergies aux pollens (bétulacées : bouleau, noisetier, etc.) s’est associée à une augmentation des sensibilisations alimentaires croisées dont la responsabilité sur le développement des symptômes oculaires est discutée [5].
Les méthodes de diagnostic de l’hypersensibilité immédiate sont largement dominées par les prick-tests et les dosages sériques d’IgE spécifiques.
Les tests cutanés à lecture immédiate sont le principal moyen à disposition de l’allergologue pour mettre en évidence une hypersensibilité médiée par les IgE. S’agissant de tests in vivo, leur pertinence clinique est élevée. Cependant comme pour l’allergie ORL, ces tests courants d’hypersensibilité immédiate peuvent rester négatifs en cas d’allergie in situ. Les tests cutanés sont habituellement pratiqués par la méthode du prick-test. Ces tests nécessitent d’interrompre certains traitements par voie générale : anti-histaminiques dans la semaine qui précède les tests ; corticoïdes depuis 5 jours. La surface cutanée testée, habituellement l’avant-bras, doit être libre de toute anomalie ou application de topique depuis 2 jours. L’allergène est déposé sous forme liquide sur la face antérieure de l’avant-bras ou sur le dos et instillé dans le derme par une piqûre très superficielle (fig. 5-27). Ces tests, pratiquement indolores, peuvent être effectués en ambulatoire dès la première année de vie. Ils ont surtout l’avantage de l’innocuité [6]. Aucune réaction générale n’a été décrite à la différence des tests par voie intradermique (IDR) réservés aujourd’hui à des cas particuliers. S’agissant d’une hypersensibilité immédiate, l’allergologue cote l’érythème et surtout l’induration induite par l’allergène au terme de 15 à 20 minutes. Elle est comparée à celle induite par un témoin positif, l’histamine dosée à 2 mg/ml et par un témoin négatif, le sérum physiologique. La surface cutanée étant réputée moins réactive que la surface oculaire, on considère un prick-test comme positif lorsque la taille de l’induration dépasse la moitié de celle induite par le témoin positif histaminique [5]. En pratique, l’allergologue testera les allergènes auxquels le patient est exposé dans son environnement domestique, professionnel, ludique. La batterie standard d’allergènes respiratoires comporte les acariens de la poussière domestique, les pollens, les phanères d’animaux et les moisissures (voir tableau 5-3). Les autres allergènes sont détaillés en fonction de l’habitat du patient, rural ou urbain, de son environnement, professionnel ou ludique, du climat et de la végétation. Des prick-tests alimentaires peuvent être pratiqués, en particulier chez l’enfant.
Les dosages sériques d’IgE spécifiques d’un allergène témoignent d’une sensibilisation in vitro. En pathologie oculaire, ils sont pratiqués quel que soit le résultat des prick-tests, vis-à-vis des principaux allergènes environnementaux (voir tableau 5-3). De plus, des dosages supplémentaires d’IgE spécifiques sont effectués en fonction de l’interrogatoire et de l’environnement, ainsi qu’en cas de positivité de tests cutanés. De nombreuses techniques de ces tests in vitro sont à disposition, soit unitaires soit multi-allergéniques avec des résultats exprimés de façon semi-quantitative ou quantitative. Les dosages unitaires d’IgE spécifiques sont réputés avoir une meilleure sensibilité et spécificité que les dosages multiples. La commercialisation de biopuces (ISAC Thermofischer®) qui permettent de doser avec précision, sur 50 μl de sérum, les IgE spécifiques vis-à-vis de plus de 100 allergènes apporte une aide précieuse en cas de doute ou en l’absence d’orientation fournie par l’anamnèse. Un dosage sérique est considéré comme positif lorsqu’il est supérieur à 0,1 UI/ml.
La positivité d’un test cutané et/ou d’un dosage d’IgE spécifiques témoigne d’une sensibilisation de l’organisme à un allergène. Mais elle n’est pas synonyme d’allergie oculaire. Ainsi l’analyse de la pertinence de cette sensibilisation médiée par les IgE est une étape essentielle du diagnostic allergologique. Elle est basée sur l’interrogatoire détaillé par l’allergologue qui compare les circonstances et les conditions environnementales de survenue des symptômes oculaires et la présence d’une sensibilisation. En cas de doute sur cette pertinence, un test de provocation conjonctivale (TPC) est nécessaire pour confirmer le lien entre la sensibilisation et les symptômes allégués par le patient.
Pratiqué en dehors de la période d’exposition allergénique, le TPC nécessite un examen ophtalmologique préalable car le patient doit être indemne de lésion oculaire significative. Il impose des mesures de précaution, l’information et l’accord signé du patient qui sera surveillé sur place pendant 2 à 4 heures [7]. Sa pratique impose les mêmes évictions médicamenteuses que les prick-tests. Entre des mains expérimentées, ce test est indolore et sans danger : il nécessite cependant du temps et une certaine rigueur. L’instillation de l’allergène induit un prurit, une rougeur oculaire, un larmoiement et un œdème local voire un chémosis. Ces symptômes sont cotés par le clinicien, qui peut ainsi juger de la positivité d’un TPC lorsque le score cumulé dépasse le niveau 5 (tableau 5-4 et fig. 5-28).
L’indication du TPC ne peut être posée qu’après concertation entre l’ophtalmologiste et l’allergologue. Elle doit être large lorsque : le nombre d’allergènes susceptibles d’être responsables est élevé (comme c’est le cas de conjonctivites perannuelles) ; la pathologie en cause est sévère (cas des KCV et KCA) ; l’allergène fait l’objet d’une dénégation ou conduit à une sanction redoutée (cas des phanères d’animaux). Sa répétition permet de quantifier l’évolution du seuil de réactivité oculaire à l’allergène [8].
Tableau 5-3 Principaux allergènes impliqués en allergie oculaire médiée par les IgE (liste non exhaustive).
* Allergènes testés systématiquement.
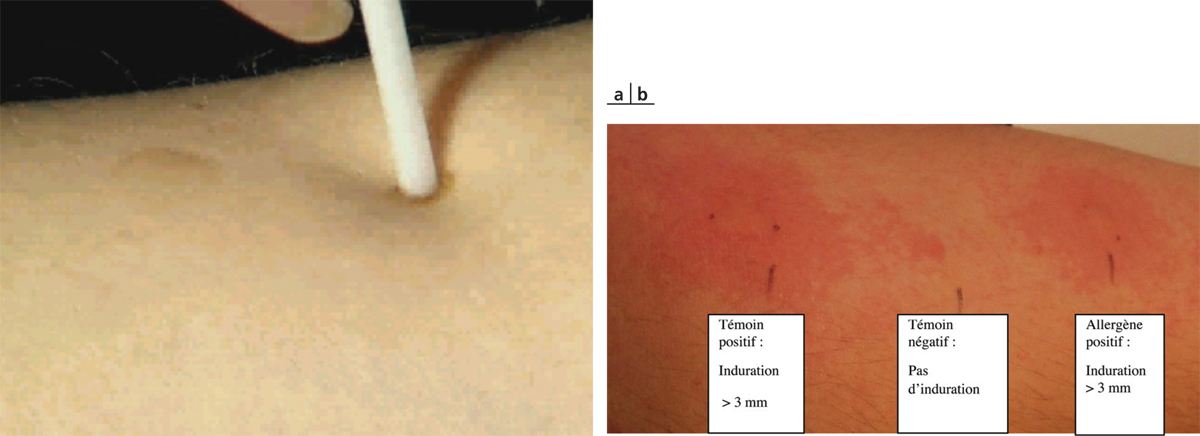
Fig. 5-27 Technique du prick-test.
a. Pratique du prick-test : dépôt d’une goutte d’allergène et instillation avec une lancette. b. Lecture des prick-tests à 15 minutes.
Tableau 5-4 Le test de provocation conjonctivale : le recueil des résultats.
Fig. 5-28 Test de provocation conjonctivale : test positif (œil droit).
Les indications du bilan d’allergie oculaire médiée par les IgE ont été clairement définies par une mise au point récente (voir fig. 5-25) [2].
L’allergie médiée par les IgE survient en particulier lorsque le patient est atopique. Le terrain atopique est défini comme une prédisposition génétiquement déterminée à développer des anticorps de type IgE après avoir été en contact avec un allergène. Le terrain atopique est facile à déceler lorsque l’interrogatoire découvre des antécédents personnels ou familiaux proches (père, mère, fratrie) d’asthme allergique, de rhinite ou de conjonctivite allergique, d’allergie alimentaire ou d’anaphylaxie, de dermatite atopique ou d’urticaire allergique. Ce terrain peut aussi être mis en évidence en l’absence d’autres causes, par la présence d’une hyperéosinophilie sanguine ainsi que par une augmentation du taux sérique d’IgE totales ou par la positivité d’un test de dépistage multi-allergénique des IgE spécifiques (encadré 5-4).
• Antécédents d’atopie, personnels ou familiaux proches (père, mère, fratrie) : asthme allergique, eczéma atopique, urticaire allergique, conjonctivite ou rhinite allergique, allergie alimentaire, anaphylaxie aiguë
• Hyperéosinophilie sanguine (> 500 éléments/dl)
• Augmentation des IgE totales sériques (valeur normale : < 120 UI/ml après 12 ans ; avant 12 ans, le seuil est de 10 × âge)
• Test multi-allergénique de dépistage positif (par exemple : Phadiatop®
Une conjonctivite allergique aiguë ne justifie pas la pratique d’un bilan allergénique si elle cède bien sous traitement symptomatique, ne se complique pas et ne récidive pas. Souvent, sa cause est d’ailleurs évidente dès l’interrogatoire (exposition à un allergène itératif tel que des phanères d’animaux ou un aliment).
Une conjonctivite allergique bénigne mais persistante (plus de 4 semaines) ou récidivante, que ce soit de façon périodique ou itérative, justifie le recours à l’allergologue, de façon à mettre en évidence les facteurs allergéniques de déclenchement. Les résultats des tests in vivo (prick-tests) et d’éventuels dosages d’IgE spécifiques sont analysés par l’allergologue à la lumière des circonstances de survenue des symptômes. Si la pertinence de la sensibilisation est bonne, le diagnostic d’allergie oculaire vis-à-vis de l’allergène est posé et les conséquences thérapeutiques peuvent être actées. Il s’agira d’une éviction allergénique lorsque cela est possible et d’une éventuelle immunothérapie. Cependant, dans un nombre élevé de cas, la preuve de la relation entre l’exposition allergénique et la survenue des symptômes oculaires doit être confirmée par la pratique d’un TPC. Les indications du TPC sont rappelées dans l’encadré 5-5.
Selon l’allergène
• Polysensibilisation allergénique
• Sensibilisation à un allergène dont la responsabilité n’est pas évidente
• Sensibilisation à un allergène auquel le patient n’est pas exposé
• Sensibilisation alimentaire (dans ce cas : test de provocation par voie orale)
Selon le contexte pathologique ou environnemental
• Association à une allergie exprimée sur un autre organe (rhinite, asthme, etc.)
• Dénégation de la responsabilité d’un allergène
• Allergène non réputé responsable de pathologie oculaire
• Allergie oculaire sévère (KCV ou KCA)
• Immunothérapie envisagée ou suivie
Les conjonctivites allergiques perannuelles sont des indications de choix. D’autres conjonctivites récidivantes peuvent évoluer sur un mode perannuel, notamment pour la pollinose si elle implique plusieurs types de pollens (pollens d’arbres, de graminées et de plantes herbacées) : le TPC permettra de préciser l’allergène responsable. Enfin chez l’enfant en particulier, la responsabilité d’un allergène alimentaire peut être prouvée par un test de provocation par voie orale. Dans tous les cas, les modalités thérapeutiques (soins locaux, éviction allergénique et éventuelle désensibilisation spécifique) doivent être intégrées dans un projet global de prise en charge : la collaboration entre l’allergologue et l’ophtalmologiste est donc requise.
Une kératoconjonctivite, qu’elle soit vernale ou atopique, justifie la pratique d’un bilan d’allergie médiée par les IgE et parfois d’un bilan d’allergie non-IgE médiée. Pour ces pathologies sévères, l’implication d’un ou de plusieurs allergènes est importante, car leur prise en charge peut modifier sensiblement l’évolution de la maladie. Des techniques complémentaires au bilan standard, effectuées en milieu spécialisé, permettent d’approcher plus précisément la notion d’allergie IgE médiée au niveau de la surface oculaire, comme la présence d’éosinophiles sur une goutte de larmes, le dosage d’ECP ou le dosage quantitatif des IgE totales dans les larmes. Ce dernier nécessite le prélèvement d’une quantité plus importante de larmes. L’interprétation des résultats doit être prudente, car il faut tenir compte des IgE filtrées à partir du sérum, notamment lorsque l’inflammation conjonctivale est intense. Le rapport des IgE dosées/IgE filtrées établi par Liotet [9] apporte une information utile sur la production d’IgE totales in situ. En pratique, les difficultés du prélèvement de larmes, en particulier chez l’enfant, en limitent donc l’intérêt. La validité des techniques de prélèvement sur bandelettes type Schirmer n’est pas formellement établie. La présence d’IgE spécifiques à un allergène dans les larmes est un argument fort pour la notion d’allergie in situ. Les tests multi-allergéniques sur biopuce méritent d’être validés sur les larmes. Les larmes permettent aussi, par la mesure des protéines, de quantifier le degré d’inflammation locale ou, par des dosages très spécialisés, d’argumenter au niveau de la conjonctive un conflit IgE-dépendant (histamine, tryptase), le recrutement (ICAM-1) ou l’activation cellulaire (ECP, MBP). L’empreinte conjonctivale présente un grand intérêt car cette technique est anodine, mais elle ne remplace pas la biopsie dans l’analyse de l’architecture tissulaire de la conjonctive. L’analyse des cytokines de l’inflammation allergique effectuée en recherche clinique renseigne surtout sur les mécanismes impliqués dans ces pathologies et de leur modification sous traitement [10].
Dans ces formes sévères, l’indication du TPC doit être large. Elle sera systématique lorsqu’une immunothérapie est envisagée. On utilisera le protocole hospitalier, qui justifie des précautions particulières, la présence de deux spécialistes et un examen répété à la lampe à fente [7].
[1] Johansson O, Bieber T, Dahl R, et al. Revised nomenclature for allergy for global use : report of the Nomenclature Review Committee of the World Allergy Organization. Oct 2003. J Allergy Clin Immunol 2004 ; 113 : 832-6.
[2] Leonardi A, Bogacka E, Fauquert JL, et al. Ocular allergy : recognizing and diagnosing hypersensitivity disorders of the ocular surface. Allergy 2012 ; 67 : 1327-37.
[3] Gell PGH, Coombs RRA. Classification of allergic reactions responsible for clinical hypersensitivity and disease. In : Gell PGH, Coombs RRA. Eds. Clinical aspects of immunology. 2nd ed. Oxford : Blackwell ; 1968, 575 p.
[4] Fauquert JL, Jouaville L, Chiambaretta F. How should allergic conjunctivitis be investigated ? Rev Fr Allergol Immunol Clin 2007 ; 47 : 224-7.
[5] Nivenius E, Van der Ploeg I, Gafvelin G, et al. Conjunctival provocation with airborne allergen in patients with atopic keratoconjunctivitis. Clin Exp Allergy 2012 ; 42 : 58-65.
[6] Novembre E, Bernardini R, Bertini G, et al. Skin-prick-test-induced anaphylaxis. Allergy 1995 ; 50 : 511-3.
[7] Fauquert JL, Mortemousque B, Brémond-Gignac D, et al. Le test de provocation conjonctivale allergénique : recommandations pratiques pour le diagnostic des conjonctivites allergiques. Rev Fr Allergol Immunol Clin 2004 ; 44 : 689-99.
[8] Mortemousque B, Bertel F, De Casamayor J, et al. House-dust mite sublingual-swallow immunotherapy in perennial conjunctivitis : a double-blind, placebo-controlled study. Clin Exp Allergy 2003 ; 33 : 464-9.
[9] Liotet S, Warnet VN, Arrata M. Lacrimal immunoglobulin E and allergic conjunctivitis. Ophthalmologica 1983 ; 186 : 31-4.
[10] Leonardi A. Allergy and allergic mediators in tears. Exp Eye Res 2013 ; 117 : 106-17.