Traitement chirurgical
B. Cochener
La photoablation thérapeutique est le recours au laser excimer dans un objectif thérapeutique dans les situations suivantes : érosions récurrentes, épithéliopathies (création d’un néosocle d’ancrage à l’épithélium pathologique), opacités stromales antérieures (dystrophies granulaires, cicatrices, leucomes, etc.), irrégularités (resurfaçage postchirurgical : Lasik, haze de photokératectomie réfractive ou PKR, décentrement, ptérygion, etc.). Ses caractéristiques principales sont les suivantes :
➤ principes : débridement épithélial mécanique ou à l’alcool (épithéliopathies), transépithélial : opacités et resurfaçage ;
➤ limites : affinement, fragilité biomécanique induite, cicatrisation et haze si ablation stromale supérieure à 125 µ, hypermétropisation si ablation stromale supérieure à 20 µ ;
➤ perspectives : stratégie de prise en charge du kératocône : combinée au crosslinking, photokératectomie thérapeutique (PKT) transépithéliale (+ mitomycine 0,02 %) puis crosslinking en une étape, combinable aux autres procédures (anneaux, implants intra-oculaire, etc.).
Le recours au laser excimer dans un but thérapeutique, du fait de son principe de « rabotage » tissulaire, rend possible un remodelage et resurfaçage d’une cornée malade. La photoablation se place alors au service de la cornée en visant, dans bon nombre de cas, à retarder ou à éviter l’heure de la greffe de cornée et en visant une amélioration visuelle et/ou une résolution de la douleur. Cette stratégie séduisante se heurte cependant à l’absence de codification, à la difficulté de la sélection des indications et, par là même, à une prédictibilité inconstante des résultats.
À la différence de la photoablation réfractive, qu’elle soit en surface (photokératectomie réfractive ou PKR) ou sous un volet préalablement découpé devenant le Lasik (laser in situ keratomileusis) qui vise un changement réfractif par un changement des courbures cornéennes en réalisant le retrait d’un volume tissulaire cornéen, la PKT ambitionne de travailler elle aussi en surface mais par un effet de lissage sans modification de la réfraction du patient. Ceci suppose de réaliser une découpe tangentielle qui est offerte comme une option spécifique sur la majorité des plates-formes excimer disponibles. Elle peut se pratiquer sous la forme d’un cercle ou d’une fente avec un centrage ajustable. Sont également modifiables la taille de la zone optique et l’introduction de zones de transition dont l’objectif est d’adoucir l’effet berge exposant à un risque de dégradation visuelle et d’irrégularités induites.
Pour chaque photoablation thérapeutique, il faut savoir la pratiquer aux bonnes dimensions de l’anomalie à traiter et, surtout, décider si elle doit être proposée après débridement mécanique (ou facilité par l’alcool) ou en transépithéliale. Schématiquement, il est recommandé de retirer l’épithélium en cas de dystrophies épithéliales, qui représentent véritablement une maladie des structures d’ancrage source d’érosions récurrentes, ceci afin d’obtenir par le biais du traitement laser une sorte de néosocle d’adhésion solide pour le futur épithélium [1–4]. En revanche, en cas d’opacités cornéennes stromales antérieures, il est important de comprendre que le laser se heurtera à la nature du tissu malade différente de celle du tissu sain de voisinage entraînant une ablation plus aisée de part et d’autre de l’opacité au risque de majorer les irrégularités de surface (fig. 20-1). Beaucoup d’approches ont été tentées depuis la naissance du laser excimer vers 1983 pour parvenir à retarder le « creusé » réalisé par l’excimer autour du dépôt stromal. Une longue liste d’agents resurfaçants a été constituée en tête de laquelle figure l’acide hyaluronique et avant tout l’épithélium du patient maintenu en place [5, 6]. En effet, l’épithélium présente cette capacité à s’hypertrophier par multiplication cellulaire en regard des irrégularités afin d’œuvrer pour un lissage optimal de la surface oculaire (fig. 20-2).
Depuis peu (voir plus loin), il est possible de combiner PKR et PKT transépithéliale dans un but de régularisation de la surface associée de plus à une amélioration réfractive.
Par ailleurs, afin de minimiser le risque de haze et de régression, l’addition de mitomycine 0,02 % pourra être recommandée en particulier en cas de retraitement ou d’ablations profondes [7].
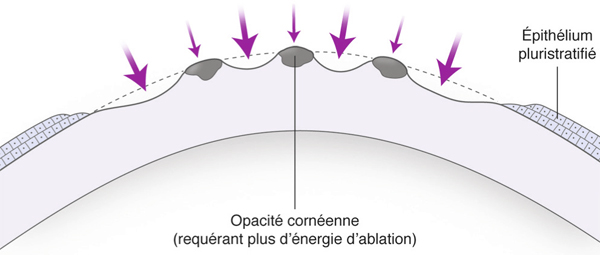
Fig. 20-1 PKT schématique : faisceau laser excimer se heurtant aux opacités (à un taux d’ablation supérieur au stroma sain voisin).
Le laser excimer creuse plus aisément et donc plus profondément les zones saines et sans opacités.
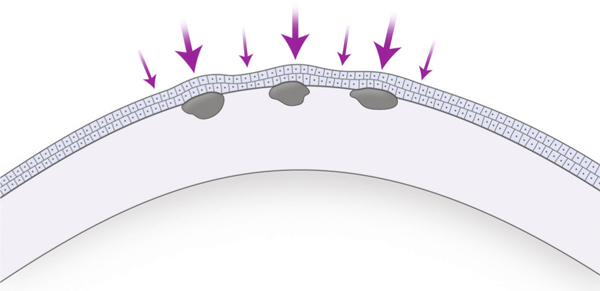
Fig. 20-2 PKT schématique : fonction resurfaçante de l’épithélium laissé en place (qui est affiné en regard des opacités).
L’épithélium joue un rôle de masque à l’ablation permettant de ralentir le creusement du stroma sain.
La liste des applications potentielles d’une PKT n’est pas exhaustive, elle peut se résumer à toute irrégularité de surface ou toute opacité ne dépassant pas le tiers antérieur de la cornée.
Il est ainsi possible d’y recourir dans les situations indiquées ci-dessous.
Elles sont consécutives à un dysfonctionnement de la membrane basale à laquelle l’épithélium ne parvient plus à adhérer solidement ; il s’agit donc à proprement parler d’épithéliopathies. Il existe ainsi des dystrophies épithéliales congénitales volontiers familiales dont le chef de file est la dystrophie de Cogan. Elle se caractérise par la survenue de crises algiques alternant entre les deux yeux, électivement au réveil matinal ou nocturnes, favorisées par l’œdème physiologique s’installant lors du sommeil. Chaque épisode s’accompagne d’un ulcère superficiel qui se comble en quelques heures selon son étendue mais laisse persister, lorsque le processus se chronicise, des microkystes, des irrégularités en cartes de géographie traduisant les plages d’hyperplasie épithéliale en cours de réparation. Toutes ces lésions combinées signant des lésions d’âges différents seront à rechercher scrupuleusement à l’examen en lampe à fente (fig. 20-3).
Mais bien plus fréquente que cette dystrophie congénitale est l’épithéliopathie induite par un traumatisme cornéen de règle linéaire (produit par une branche d’arbre conifère, une feuille de papier ou un coup d’ongle d’enfant, etc.) dont le patient du reste n’aura pas toujours souvenir. Les lésions biomicroscopiques et le tableau clinique seront superposables mais uniquement localisés sur l’œil traumatisé.
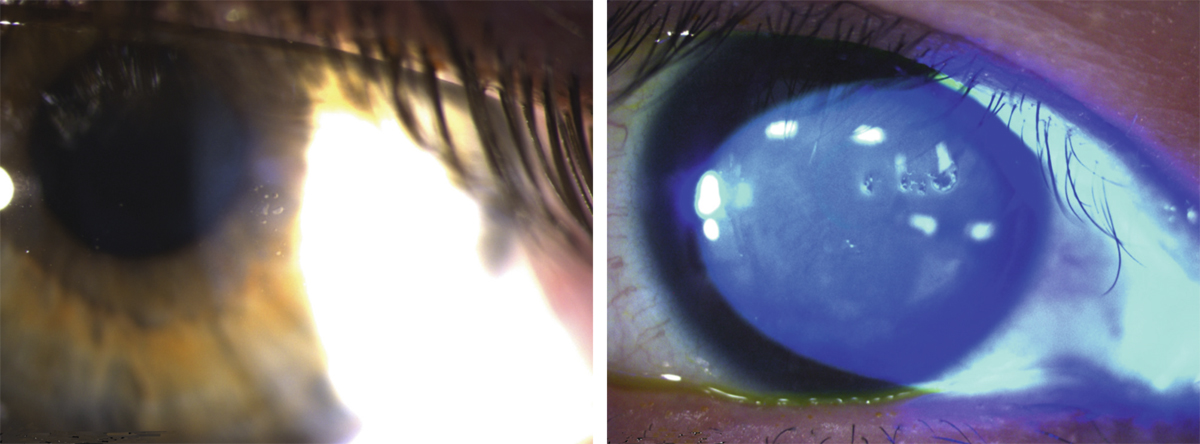
Fig. 20-3 Dystrophie épithéliale.
a. Microkystes. b. Irrégularités épithéliales, traces d’érosions d’âges différents.
Les dystrophies stromales antérieures superficielles constituent le second groupe de maladies cornéennes pouvant bénéficier d’une photoablation thérapeutique [8, 9]. Elles regroupent toutes les anomalies de la transparence induites par des infiltrations ou dépôts dont la progression pourra pénaliser la vision et dont le pronostic repose sur leur aptitude à se reproduire après leur retrait. Leur étude approfondie en biologie moléculaire et typage génétique a permis d’identifier des protéines délétères qui vont conduire à un réarrangement de leur classification et aider probablement à guider la stratégie chirurgicale. Toutefois, à l’heure actuelle, l’ophtalmologie clinique reste coutumière des noms propres correspondant à ceux qui les ont pour la première fois décrites.
Il s’agit sans nul doute de la dystrophie la plus fréquente qui, de génération en génération, du fait de son caractère familial, apparaît sous l’aspect de dépôts laiteux infiltrant le stroma antérieur dans sa forme de type II [10] qui est accessible à la PKT (ce qui n’est pas le cas du type I dont les lésions sont plus profondes) (fig. 20-4). Si l’élimination de ces opacités est aisément contrôlée par photoablation ou greffe de cornée (de préférence lamellaire antérieure), leur récurrence est la limite intrinsèque justifiant que la PKT soit envisagée de première attention et soit éventuellement renouvelée si récidive, voire soit pratiquée sur greffe de cornée en cas de récurrence des dépôts.
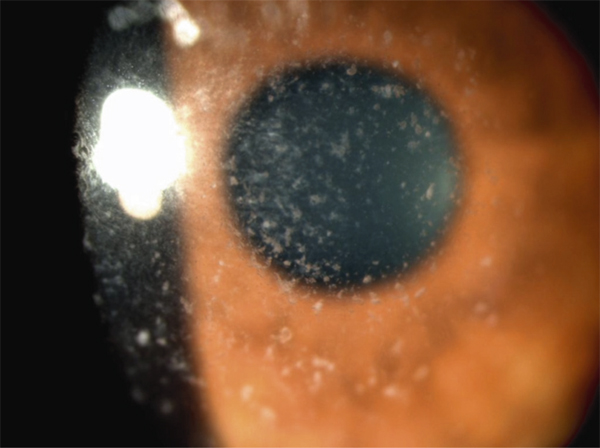
Fig. 20-4 Dystrophie granulaire.
Le recours à la PKT pour éliminer les lésions nodulaires caractéristiques de la dystrophie de Salzman [11] a fait l’objet de diverses publications démontrant l’efficacité et la stabilité des résultats obtenus. Il en est de même de la dystrophie d’Avellino et de la dystrophie grillagée dont le maillage sous-épithélial est facilement abordé là encore par une approche transépithéliale (fig. 20-5).
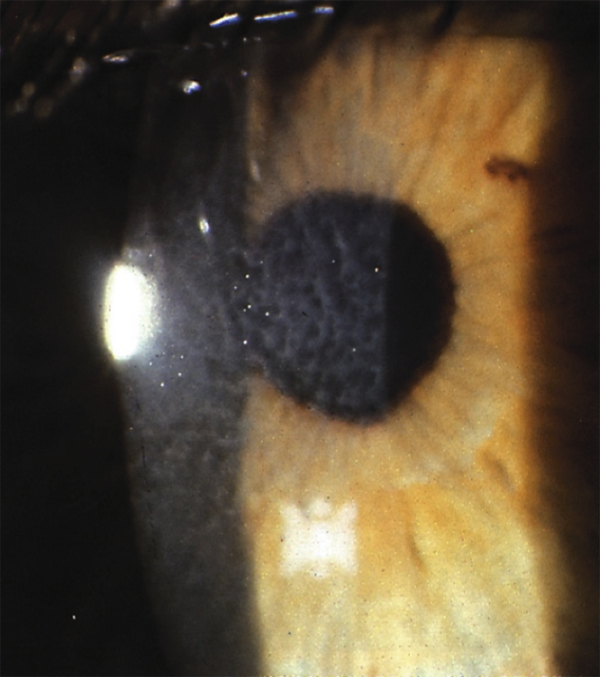
Fig. 20-5 Dystrophie antérieure réticulée de Reis-Bücklers.
Une infection limitée à la cornée antérieure (moins de 200 μ) qu’elle soit fongique ou parasitaire (amibienne), mais dans tous les cas rebelle au traitement local anti-infectieux, a pu tenter certains auteurs à recourir à la PKT avec des résultats rapportés encourageants en termes d’éclaircissement cornéen et de gain en meilleure acuité visuelle corrigée sans recourir à la greffe à chaud [12–14]. Cependant, il ne peut s’agir d’une indication de première intention, le danger étant bien sûr d’interagir sur une infection évolutive, ajoutant l’ulcère de surface induit par le traitement excimer aux germes résistants sous-jacents. Elle a pu être proposée en combinaison avec la mise en place d’une membrane amniotique de recouvrement de la zone débridée destinée à favoriser la trophicité locale pour une réparation de surface accélérée. Cette approche relève de la même démarche que représente l’utilisation plus récente du crosslinking comme facteur d’assèchement d’un foyer infectieux rebelle.
La réalisation d’une PKT pour l’élimination d’une taie herpétique est plus délicate encore, compte tenu du neurotropisme du virus que le laser excimer qui sectionne les terminaisons nerveuses expose à réactiver. Il ne peut être par conséquent envisageable d’aborder ce traitement, comme du reste toute opération cornéenne telle qu’une greffe de cornée dans ce décor, que si une accalmie lésionnelle est obtenue (en moyenne 1 an après la phase aiguë) et seulement sous couverture antivirale orale préventive (entamée au moins 1 semaine avant l’opération et prolongée au-delà du geste pour plusieurs mois). Aussi cette indication s’avère très discutable [15].
L’observation de dépôts hyalins, calciques s’organisant en bandes est fréquente dans un contexte de pathologie inflammatoire chronique de la cornée (fig. 20-6). Elle représente une des indications phares de la PKT qui se positionne comme une alternative à la chélation par EDTA (acide éthylène-diamine-tétra-acétique) et pourra se combiner à la mise en place d’une membrane amniotique afin d’accélérer la réparation de la surface sur un terrain fragile (telle une bandelette apparue sur greffe de cornée au limbe inflammatoire et déficitaire) [16].

Fig. 20-6 Kératopathie en bandelettes.
La décompensation d’un œdème cornéen, en cas de défaillance endothéliale sur dystrophie ou secondaire à un traumatisme chirurgical (secondaire du pseudo-phaque ou suite à une implantation phaque), peut conduire à la formation de bulles de la surface oculaire devenue irrégulières et dont la rupture consécutive est source de douleurs s’ajoutant à la dégradation visuelle majeure. La photoablation dans ce décor thérapeutique a pu être proposée comme l’a été également tout dernièrement le crosslinking, la première pour optimiser la surface oculaire alors que le second viserait à diminuer l’œdème cornéen [17].
Il est à noter que cette indication constituerait le premier motif de PKT dans les pays en voie de développement.
Enfin, si la chirurgie réfractive cornéenne est hautement critiquable en pédiatrie, il faut souligner l’intérêt que peut revêtir la PKT sur la cornée malade d’un enfant pour lutter contre l’amblyopie induite et pour éviter la greffe de cornée avec son haut risque de rejet à un âge jeune [18].
Il n’existe pas de contre-indication absolue à la PKT. Du fait de son principe qui assure une relative innocuité, la tentation serait de la proposer en première ligne comme alternative à la greffe de cornée plus invasive.
Cependant, il est à souligner de mauvaises indications qui conduisent à un échec voire à une aggravation de la situation cornéenne sur le plan anatomique et optique. Il en est ainsi des lésions stromales trop profondes, localisées à plus de 200 μ, dont le retrait par PKT entraîne une réponse cicatricielle pourvoyeuse d’une cicatrice fibreuse se surajoutant à la lésion initiale et dont la persistance partielle est hautement probable dès que celle-ci franchit la moitié de l’épaisseur cornéenne. De plus, l’importance du creusé requis occasionne inévitablement un effet berge retentissant sur la vision sous la forme d’une hypermétropisation invalidante voire d’un astigmatisme irrégulier ne permettant pas l’amélioration visuelle attendue. Le risque de survenue de cet effet indésirable est d’autant plus marqué que la lésion est de petit diamètre et décentrée par rapport au centre de la pupille, comme c’est le cas dans la majorité des cicatrices laissées par la projection d’un corps étranger métallique.
Outre les paramètres de profondeur et de taille de la lésion, le facteur temps doit également être intégré. Ainsi comme précédemment évoqué, en cas de taie cornéenne infectieuse, il est important de s’écarter de la phase active et de travailler sous protection antibiotique. Mais surtout il faut garder à l’esprit que le processus de réparation naturelle d’une cornée s’opère sur 18 mois et peut conduire à une résorption progressive des lésions et/ou à une disparition des douleurs occasionnées par les irrégularités ou défects épithéliaux. C’est pourquoi, il faudra s’efforcer de ne pas recourir trop tôt à la PKT et d’inviter le patient à la patience jusqu’à consolidation cornéenne définissant selon les séquelles persistantes l’heure opportune de la photoablation.
Afin de s’assurer du respect des indications et avant tout de l’élimination des mauvaises indications précitées, il convient de porter un soin particulier à la sélection préopératoire et à l’évaluation quantitative des anomalies cornéennes à traiter.
La mesure de l’acuité visuelle non corrigée et de la meilleure acuité corrigée représente le point de départ nécessaire à la décision chirurgicale. En effet, en cas d’opacité cornéenne, une vision supérieure à 0,4 (échelle décimale) conduira à une grande prudence car la photoablation ne pourra garantir une optimisation de ce niveau de performance et pourra décevoir un patient aux attentes excessives. En revanche, si l’altération de la transparence est dense ou l’irrégularité importante, entraînant une dégradation visuelle majeure avec non-accès à la mesure de la réfraction, il sera intéressant d’ajouter un test au trou sténopéique afin de vérifier l’impact du trouble des milieux et par là même l’intégrité rétinienne. En cas d’érosions récurrentes, le scénario est également délicat puisque, en dehors des crises, le patient présente une acuité préservée. L’intervention entraînera une diminution accompagnant le cortège douloureux dont il faudra informer l’opéré et sera parfois suivi de la nécessité de réajuster les verres correcteurs à distance en cas d’hypermétropisation.
Cette tendance à l’hypermétropisation est en vérité la limite essentielle à la PKT. Elle peut être considérée comme systématique lorsque le retrait tissulaire dépasse 20 μ de stroma. Mais sa survenue et son importance sont imprévisibles et peuvent être source d’une grande déception dans les résultats qui offrent un retour à la transparence mais au prix d’une modification réfractive non tolérable (supérieure à + 3D) pour la balance binoculaire du patient ; une adaptation contactologique ou un geste réfractif secondaire s’imposent alors soit sous la forme d’une photoablation réfractive si la cornée anatomiquement le permet, soit par une implantation intra-oculaire. Dans ces conditions, il est aisé de comprendre que le patient myope est le meilleur candidat, car il offre une réserve pour un traitement qui conduira à une diminution de l’amétropie initiale, voire pourra être combiné et imposera alors souvent un geste réfractif controlatéral.
À cette heure, la vidéotopographie représente le meilleur outil d’évaluation quantitative de la régularité cornéenne. Le concept de Placido (fig. 20-7), spéculaire ou axial, projette ses mires sur les 8 mm centraux de la cornée et évalue la face antérieure en n’accédant cependant pas à la région limbique et en utilisant une unité de grandeur qui est le rayon de courbure (en millimètres) et la kératométrie (en dioptries). Il lui est aujourd’hui souvent préféré la méthode en élévation (fig. 20-8) qui balaye la cornée de limbe à limbe par des lampes à fente et mesure ainsi l’ensemble de la face antérieure, mais aussi la face postérieure et, par la différence entre les deux, fournit la carte de pachymétrie. Son unité de grandeur est l’élévation exprimée en microns, sachant qu’elle calcule également les kératométries cornéennes.
Toutes deux fournissent des indices de régularité et de symétrie qui seront utiles à l’exploration d’une cornée pathologique.
La vidéotopographie en matière de PKT, plus encore que dans tout autre domaine de la chirurgie cornéenne, servira de guide à la programmation du traitement pour justement suivre l’irrégularité et évaluera l’effet postopératoire dans tous les cas.
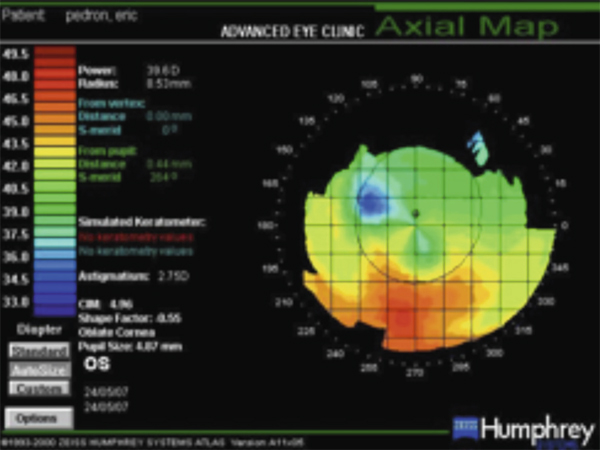
Fig. 20-7 Astigmatisme irrégulier en vidéotopographie de Placido.
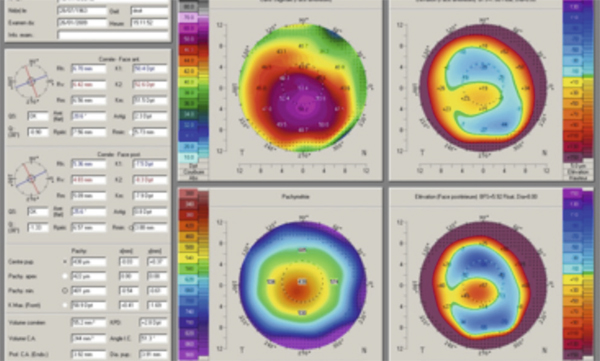
Fig. 20-8 Astigmatisme irrégulier en vidéotopographie d’élévation.
Il est bien évidemment nécessaire de connaître la quantité de tissu disponible afin de valider l’existence d’une réserve tissulaire suffisante pour la pratique d’une ablation ; l’épaisseur en regard de la zone d’ablation doit être d’au moins 480 μ pour autoriser tout geste laser PKT. De la même façon, le suivi postopératoire mesurera l’effet du geste et scrutera toute variation du profil pachymétrique pouvant refléter une modification biomécanique de la cornée. Cette mesure de pachymétrie est donnée par la topographie d’élévation ; mais sans nul doute c’est l’OCT (optical coherence tomography) ou la caméra Scheimpflug en haute définition qui ont apporté un niveau de précision optimisé en quantifiant sur la coupe sagittale de la cornée l’exacte profondeur de l’opacification qui servira de guide à la programmation chirurgicale (fig. 20-9) [19, 20].
Il est à noter une limitation recommandée de la majorité des lasers à une ablation maximale de 125 µ, sachant qu’au-delà un processus de cicatrisation fibreuse s’organise d’autant plus densément que l’on atteint le stroma postérieur. Par expérience, il est conseillé de ne pas dépasser les 80 µ de stroma sous-jacent à un épithélium mécaniquement retiré. Laissé en place, celui-ci représentera une couche variable selon la pathologie en cause et les irrégularités à lisser, pouvant aller de 50 à 90 µ.
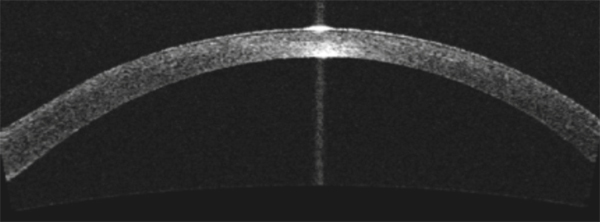
Fig. 20-9 Évaluation lamellaire de la cornée en OCT de segment antérieur (haze central post-PKR).
Il ne faut pas négliger l’analyse en lampe à fente, qui mesure la clarté cornéenne en cinq stades (servant de base en particulier à la gradation du haze après laser excimer) :
0 : transparence parfaite ;
1+ : petites traces superficielles ;
2+ : réticulé sous-épithélial ;
3+ : opacité stromale antérieure ne gênant pas l’accès au segment antérieur ;
4+ : l’opacité pénètre plus profondément dans la cornée et masque les détails de l’iris (fig. 20-10).
Une évaluation soigneuse combinant un examen en éclairage direct et un balayage en fente fine permet une approche de chaque couche cornéenne. L’addition de colorants vitaux permettra de mieux qualifier la surface oculaire et détecter les anomalies épithéliales.
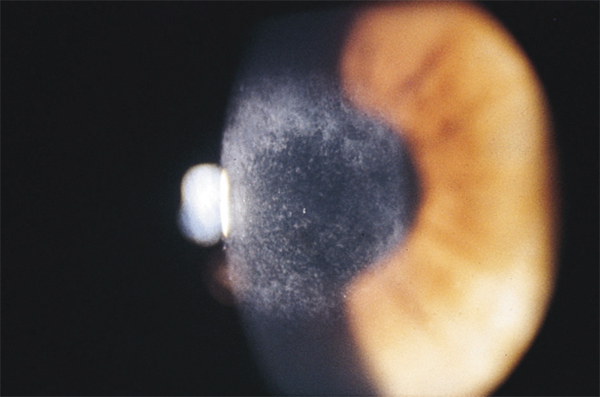
Fig. 20-10 Haze de stade 4, devenant une cicatrice stromale antérieure (masquant l’accès aux détails des structures intra-oculaires).
Il est requis de s’assurer avant toute PKT de l’intégrité de l’endothélium sous-jacent qui devra être maintenu après l’opération en signature de l’innocuité du geste. Ce contrôle peut être assuré par microscopie spéculaire assurant un comptage automatisé de la densité endothéliale et de la morphologie cellulaire.
Plus performante encore, la microscopie confocale réalise une véritable histologie in vivo de l’épithélium à l’endothélium. Son intérêt dans le décor d’une PKT est en particulier de définir la profondeur des lésions et de les caractériser ; il en est ainsi des dépôts d’une dystrophie granulaire ou de l’ablation de leucomes d’origine infectieuse où l’on recherchera la présence de filaments mycotiques ou de kystes amibiens.
Si certains auteurs se sont intéressés aux changements mécaniques potentiels induits par une PKT en s’appuyant sur l’ocular resistance analyser (ORA) et ont montré qu’une photoablation thérapeutique diminuait logiquement par affinement cornéen les deux paramètres que sont l’hystérésie (corneal hysteresis ou CH) et le coefficient de résistance (CR) qui du reste relie le CH à l’épaisseur cornéenne, il faut souligner que cette mesure est une tonométrie dynamique et repose sur les propriétés visco-élastiques de la cornée. Il ne s’agit pas à proprement parler de la mesure de la biomécanique qui serait mieux approchée par l’élastométrie tant attendue en particulier dans le chapitre du kératocône.
Dans un souci didactique et afin d’offrir à un lecteur désireux de disposer d’informations utiles à la pratique courante, quelques conseils schématisant les principales stratégies de PKT sont réunis ici.
Débridement mécanique de l’épithélium instable.
De règle, traitement sur 6 mm + zone de transition 1 à 2,5 mm (surtout si l’ensemble de l’épithélium est concerné par la fragilisation de son attache à sa basale).
PKT tangentielle programmée sur 12 à 14 μ (l’épaisseur de la membrane de Bowman étant estimée à 10 μ en moyenne).
Prévenir le patient, qui s’est dirigé vers la PKT pour remédier à ses kératalgies, de la crise aiguë secondaire au traitement laser.
Durant les 4 jours requis pour réépithélialisation, une lentille pansement pourra être proposée et, de façon systématique, un traitement lubrifiant renforcé dont la poursuite se fera souvent sur quelques mois en raison d’un resurfaçage plus lent que celui d’une photoablation réfractive (PKT) réalisée sur une surface saine.
La réfraction sera évaluée 1 mois plus tard, car elle peut se trouver initialement modifiée.
Programmation transépithéliale à préférer.
Affinement des épaisseurs par OCT, Scheimpflug : épithélium + lésions cornéennes.
Ne pas dépasser 80 à 100 μ d’ablation stromale.
Hypermétropisation à partir de 20 μ de laser sous-épithélial.
Irrégularités cornéennes.
Associées ou non à une opacité.
Le diagnostic et la programmation se font à partir de la topographie cornéenne.
La photoablation a pu atteindre, en particulier dans son application thérapeutique, un niveau de performance optimisé grâce à :
l’évolution de la délivrance énergétique du laser en mode de microfaisceau à balayage visant à lisser la surface d’ablation et à élargir les profils de traitement pouvant réaliser toutes les formes de traitements, sur des zones optiques modulables ;
le couplage direct de la plate-forme de délivrance avec celle de l’imagerie dans le but de guider le traitement laser sur l’image topographique ou aberrométrique dans un but de lissage, mais également réfractif.
La connexion à un système d’imagerie dépend de chaque modèle de laser.
Seule la vidéokératotopographie d’élévation est concernée puisqu’il s’agit de viser une régularisation de la surface cornéenne en lissant ses « dénivelés » mesurés par la carte d’élévation antérieure. Elle peut de façon moderne se combiner à un traitement réfractif (PKR) qui permettra de minimiser l’effet d’hypermétropisation après ablation tissulaire significative mais aussi le retrait d’opacités cornéennes. La PKR pourra se faire dans la même session ou en seconde étape à distance d’au moins 3 mois de stabilisation post-PKT. Dans tous les cas et ceci d’autant plus que l’ablation est profonde, une application peropératoire de 12 à 30 secondes de mitomycine C à 0,02 % a pu être suggérée pour diminuer le risque de haze et de régression.
Ce lien est plus délicat à obtenir dans le registre de la cornée pathologique dont l’irrégularité lorsqu’elle devient significative rend la mesure des aberrations optiques par front d’onde impossible. En revanche, c’est grâce à cet outil qu’a été identifiée la réalité des conséquences optiques des irrégularités cornéennes dont l’effet n’est pas seulement sphéro-cylindrique mais présente, du fait des déformations cornéennes induites, des anomalies optiques plus fines appellées aberrations d’ordre élevé : coma, tilt (décentrement, ballonnisation, etc.) et aberrations sphériques (par changement de l’asphéricité) principalement. Dans l’hypothèse d’une mesure possible, le niveau de prétention ciblera par conséquent plus exactement les altérations optiques en cause.
Les indications de resurfaçage cornéen, réalisé par PKT transépithéliale volontiers associée à la mitomycine C 0,2 mg/ml et éventuellement combinée à une PKR, se posent dans de nombreuses situations qui au-delà des maladies dystrophiques cornéennes précédemment évoquées s’inscrivent dans le domaine des gestes secondaires à une chirurgie réfractive ou réparatrice. Ainsi, peut-on évoquer le lissage d’un volet Lasik compliqué ou d’une cicatrice de ptérygion irrégulière. Un haze rebelle post-ablation, une reprise de kératotomies radiaires pourront également être favorablement abordés par PKT [21–24].
Depuis toujours, la PKT occupe dans la stratégie de prise en charge du kératocône une niche représentée par l’ablation des nodosités apicales induites par l’appui des lentilles de contact rigides mal adaptées [25]. Celles-ci sont à distinguer des opacités du vertex du cône correspondant à un stade 4 du kératocône avec rupture et cicatrisation des fibres de collagène plus profondes. En effet, si une PKT est réalisée dans cette indication, elle ne parviendra pas à éliminer l’opacité mais risque au contraire de l’aggraver et d’accroître la fragilité biomécanique de la cornée kératoconique.
Avoir recours au laser excimer pour le kératocône dans un objectif réfractif ne peut de principe être envisagé, une chirurgie soustractive apparaissant comme une aberration pour une maladie ectasiante par élasticité stromale pathologique et affinement secondaire. Une photoablation risquerait bien évidemment d’accélérer le processus évolutif d’un kératocône avéré, voire de révéler un kératocône sur une cornée fragilisée voyant apparaître une ectasie secondaire correspondant à un kératocône iatrogène. C’est a fortiori pour cette raison que le kératocône représente classiquement une contre-indication absolue à la photoablation (surface ou sous-volet Lasik) et que tous les efforts de l’imagerie sont déployés pour éliminer toute cornée à risque d’ectasie.
L’avènement du crosslinking, offrant une stabilisation du kératocône en figeant le collagène cornéen pathologique par copolymérisation entre le stroma pathologique et la riboflavine (vitamine B2) sous l’action des ultraviolets, a permis de réviser cette position et d’ouvrir des perspectives de traitement réfractif pour le kératocône, voire peut-être demain pour l’abord des cornées à risque.
Il ne s’agit pas de pratiquer à part entière une PKR intégrant l’ensemble de la réfraction mesurée (lorsque cette mesure est accessible) sur un kératocône, mais de recourir à une ablation thérapeutique combinant dans une seule étape une PKT, visant à diminuer l’astigmatisme irrégulier cornéen (volontiers guidée par topographie d’élévation) avec instillation de mitomycine 0,02 %, à un crosslinking a minima (sur cornée fine) pour stabiliser le résultat en plus de limiter l’évolutivité de la maladie.
Parmi les méthodes évaluées, le « protocole d’Athènes » (John Kanelopoulos) est celui qui a été le plus rapporté. Il consiste en une PKT topoguidée (élévation) :
aplanissement inférieur/bombement supérieur ;
avec une zone optique de 5,5 mm + épithélium off ou on + mitomycine 0,2 mg/ml pour 20 secondes ;
non supérieure à 50 μ de profondeur ;
parfois complétée d’un crosslinking.
Ce traitement peut se combiner secondairement à une PKR (après crosslinking ?) ou la mise en place d’anneaux intracornéens de remodelage avant (3 à 6 mois) plutôt qu’après PKT.
Cette option nouvelle dans la gestion du kératocône peut être proposée aux stades débutants du kératocône (stades 1 et 2) où la transparence est maintenue et pourra à ce titre devenir compétitive des segments intrastromaux. Mais elle pourra également s’avérer complémentaire des autres procédures de cornéoplastie ayant également un potentiel d’amélioration visuelle : anneaux [26] ; greffe lamellaire ou transfixiante ; implant intra-oculaire phaque ou pseudo-phaque torique calculé pour diminuer l’astigmatisme irrégulier kératoconique.
Initialement, en 2006, l’approche a été réalisée en deux étapes, commençant par le crosslinking suivi de la PKR 1 an plus tard. Mais certaines limites ont été soulignées : un stroma ayant été « crosslinké » pourrait présenter un taux d’ablation différent, altérant la prédictibilité des résultats, et un risque accru de haze après la PKR secondaire, alors que l’affinement induit par la PKR pourrait compromettre la stabilité de la rigidification apportée par le crosslinking initial.
C’est pourquoi en 2009, dans le souci de contourner ces obstacles, la même équipe grecque a proposé le couplage des deux procédures en une seule séance, à commencer par la PKR guidée par topographie, avec une amélioration significative observée chez un patient atteint de dégénérescence marginale pellucide ainsi traité, passant d’une meilleure acuité visuelle corrigée de 3 à 8/10 avec une diminution de la composante cylindrique de 8,5 à 2,5 D. Un des principaux avantages avancés est l’absence d’interférence entre le laser excimer et le crosslinking. Une série de patients a été ensuite rapportée avec un gain d’une ligne ou plus de meilleure acuité visuelle dans 48 % des cas et une réduction de la kératométrie moyenne la plus bombée de 2,35 D (p<0,001) et de la plus plate de 1,18 D (p=0,013), avec au final, et au travers d’une étude comparative, la démonstration de la supériorité de la méthode en une étape (fig. 20-11) [27–29].
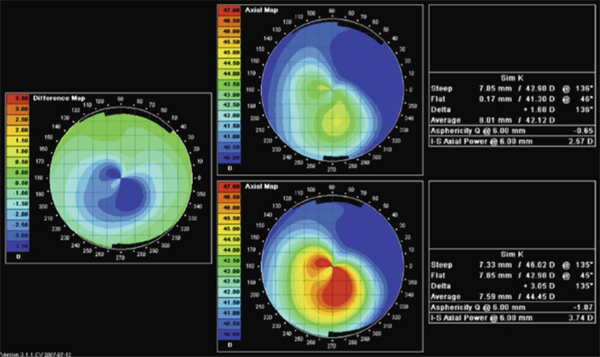
Fig. 20-11 Effet d’une PKT transépithéliale + crosslinking dans le kératocône.
Topographie comparative avant et après PKR (topo-guided) – crosslinking simultanés sur kératocône : bénéfice significatif.
La photoablation thérapeutique se range aux côtés des stratégies de cornéoplastie réparatrice de cornées pathologiques par dystrophies ou par lésions acquises altérant la transparence, la régularité ou la morphologie et, à ce titre, appartient aux méthodes de traitement des troubles de la surface oculaire. La PKT a fait ses preuves dans ses capacités à remédier aux érosions récurrentes, éliminer des opacités antérieures stromales et contribuer au remodelage des irrégularités incluant désormais les ectasies de la cornée. Elle représente dans bon nombre de ses indications une alternative à la kératoplastie et a le mérite de toujours pouvoir être tentée pour éviter cette dernière. Cependant, le patient devra, dans tous les cas, être informé de la prédictibilité inconstante des résultats et de la patience requise pour atteindre la stabilité.
[1] Chan E, Jhanji V, Constantinou M, et al. A randomised controlled trial of alcohol delamination and phototherapeutic keratectomy for the treatment of recurrent corneal erosion syndrome. Br J Ophthalmol 2014 ; 98 : 166-71.
[2] Kymionis GD, Grentzelos MA, Mikropoulos DG, Rallis KI. Transepithelial phototherapeutic keratectomy for recurrent corneal erosions in a patient with previous corneal collagen cross-linking. J Refract Surg 2012 ; 28 : 732-4.
[3] Nassaralla BR, Nassaralla Junior JJ. Ten-year results of phototherapeutic keratectomy on recurrent corneal erosions. Arq Bras Oftalmol 2012 ; 75 : 33-7.
[4] Germundsson J, Fagerholm P, Lagali N. Clinical outcome and recurrence of epithelial basement membrane dystrophy after phototherapeutic keratectomy a cross-sectional study. Ophthalmology 2011 ; 118 : 515-22.
[5] Reinstein DZ, Archer TJ, Gobbe M. Improved effectiveness of transepithelial PTK versus topography-guided ablation for stromal irregularities masked by epithelial compensation. J Refract Surg 2013 ; 29 : 526-33.
[6] Arfaj KA, Jain V, Hantera M, et al. Phototherapeutic keratectomy outcomes in superficial corneal opacities. Ophthalmol Eye Dis 2011 ; 3 : 1-6.
[7] Shalaby A, Kaye GB, Gimbel HV. Mitomycin C in photorefractive keratectomy. J Refract Surg 2009 ; 25 : S93-7.
[8] Rashad MA. Pentacam-based phototherapeutic keratectomy outcome in superficial corneal opacities. Clin Ophthalmol 2012 ; 6 : 885-94.
[9] Ashar JN, Latha M, Vaddavalli PK. Phototherapeutic keratectomy versus alcohol epitheliectomy with mechanical debridement for superficial variant of granular dystrophy : a paired eye comparison. Cont Lens Anterior Eye 2012 ; 35 : 236-9.
[10] Jung SH, Han KE, Stulting RD, et al. Phototherapeutic keratectomy in diffuse stromal haze in granular corneal dystrophy type 2. Cornea 2013 ; 32 : 296-300.
[11] Sharma N, Prakash G, Titiyal JS, Vajpayee RB. Comparison of automated lamellar keratoplasty and phototherapeutic keratectomy for Salzmann nodular degeneration. Eye Contact Lens 2012 ; 38 : 109-11.
[12] Li LM, Zhao LQ, Qu LH, Li P. Excimer laser phototherapeutic keratectomy for the treatment of clinically presumed fungal keratitis. J Ophthalmol 2014 ; 2014 : 963287.
[13] Kandori M, Inoue T, Shimabukuro M, et al. Four cases of Acanthamoeba keratitis treated with phototherapeutic keratectomy. Cornea 2010 ; 29 : 1199-202.
[14] Lin CP, Chang CW, Su CY. Phototherapeutic keratectomy in treating keratomycosis. Cornea 2005 ; 24 : 262-8.
[15] Kaufman SC. Use of photorefractive keratectomy in a patient with a corneal scar secondary to herpes zoster ophthalmicus. Ophthalmology 2008 ; 115 : S33-4.
[16] Jhanji V, Rapuano CJ, Vajpayee RB. Corneal calcific band keratopathy. Curr Opin Ophthalmol 2011 ; 22 : 283-9.
[17] Chawla B, Sharma N, Tandon R, et al. Comparative evaluation of phototherapeutic keratectomy and amniotic membrane transplantation for management of symptomatic chronic bullous keratopathy. Cornea 2010 ; 29 : 976-9.
[18] Rathi VM, Vyas SP, Vaddavalli PK, et al. Phototherapeutic keratectomy in pediatric patients in India. Cornea 2010 ; 29 : 1109-12.
[19] Rush SW, Matulich J, Rush RB. Long-term outcomes of optical coherence tomography-guided transepithelial phototherapeutic keratectomy for the treatment of anterior corneal scarring. Br J Ophthalmol 2014 ; 98 : 1702-6.
[20] Mori H, Miura M, Iwasaki T, et al. Three-dimensional optical coherence tomography-guided phototherapeutic keratectomy for granular corneal dystrophy. Cornea 2009 ; 28 : 944-7.
[21] Reddy JC, Rapuano CJ, Nagra PK, Hammersmith KM. Excimer laser phototherapeutic keratectomy in eyes with corneal stromal dystrophies with and without a corneal graft. Am J Ophthalmol 2013 ; 155 : 1111-1118.e2.
[22] Awdeh RM, Abbey AM, Vroman DT, et al. Phototherapeutic keratectomy for the treatment of subepithelial fibrosis and anterior corneal scarring after descemet stripping automated endothelial keratoplasty. Cornea 2012 ; 31 : 761-3.
[23] Camellin M, Arba Mosquera S. Simultaneous aspheric wavefront-guided transepithelial photorefractive keratectomy and phototherapeutic keratectomy to correct aberrations and refractive errors after corneal surgery. J Cataract Refract Surg 2010 ; 36 : 1173-80.
[24] Muller LT, Candal EM, Epstein RJ, et al. Transepithelial phototherapeutic keratectomy/photorefractive keratectomy with adjunctive mitomycin-C for complicated LASIK flaps. J Cataract Refract Surg 2005 ; 31 : 291-6.
[25] [25. Elsahn AF, Rapuano CJ, Antunes VA, et al. Excimer laser phototherapeutic keratectomy for keratoconus nodules. Cornea 2009 ; 28 : 144-7.
[26] Yeung SN, Low SA, Ku JY, et al. Transepithelial phototherapeutic keratectomy combined with implantation of a single inferior intrastromal corneal ring segment and collagen crosslinking in keratoconus. J Cataract Refract Surg 2013 ; 39 : 1152-6.
[27] Kanellopoulos AJ, Asimellis G. Corneal refractive power and symmetry changes following normalization of ectasias treated with partial topography-guided PTK combined with higher-fluence CXL (the Athens Protocol). J Refract Surg 2014 ; 30 : 342-6.
[28] Kapasi M, Baath J, Mintsioulis G, et al. Phototherapeutic keratectomy versus mechanical epithelial removal followed by corneal collagen crosslinking for keratoconus. Can J Ophthalmol 2012 ; 47 : 344-7.
[29] Kymionis GD, Grentzelos MA, Kounis GA, et al. Combined transepithelial phototherapeutic keratectomy and corneal collagen cross-linking for progressive keratoconus. Ophthalmology 2012 ; 119 : 1777-84.
M. Poli, C. Burillon
Une greffe de cornée ne reste jamais transparente, donc fonctionnelle, si son épithélium n’est pas intact. Elle ne doit pas être envisagée si l’on ne restaure pas préalablement les cellules souches épithéliales dans le déficit en cellules souches limbiques (DCSL). Le DCSL est une pathologie plus fréquente que l’on ne pense. Son diagnostic est principalement clinique, mais les techniques d’immunohistologie permettent de le confirmer et d’évaluer son importance. L’autogreffe limbique est le traitement de référence du DCSL unilatéral. Il est également le traitement le moins onéreux. Les greffes de cellules souches, d’origine limbique ou orale, doivent se développer afin de restituer aux patients atteints de DCSL bilatéral un niveau visuel leur permettant l’autonomie et afin d’améliorer leur qualité de vie effondrée. C’est une thérapie cellulaire réglementée qui ne peut être réalisée que dans certains laboratoires de culture agréés.
Le maintien et le renouvellement de l’épithélium cornéen sont assurés par les cellules souches limbiques (CSL) qui résident dans les couches basales épithéliales de la jonction cornéosclérale, au niveau des palissades de Vogt. Les CSL participent à l’intégrité cornéenne en produisant des cellules amplificatrices transitoires (CAT) qui migrent à la partie profonde de l’épithélium, contre la membrane basale où elles peuvent rester un certain temps, permettant le renouvellement des cellules épithéliales, par un mouvement centripète puis de la profondeur vers la surface. Elles sont en outre une barrière active à un envahissement conjonctival de l’épithélium cornéen.
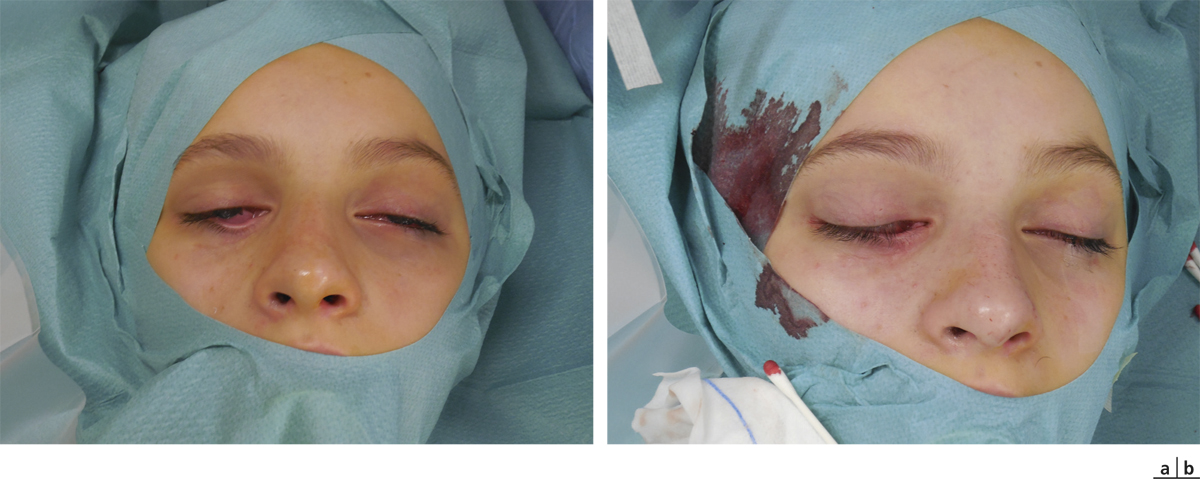
La détérioration des CSL qui se traduit par une déstabilisation de l’épithélium cornéen conduit au syndrome de déficit en cellules souches limbiques (DCSL). Le DCSL peut résulter d’un traumatisme direct des CSL (brûlure caustique ou chimique, traumatisme, anoxie, infectieux), d’une pathologie inflammatoire (syndrome de Stevens-Johnson, syndrome de Lyell, pemphigoïde oculaire cicatricielle ou POC, maladie de Gougerot-Sjögren) ou d’une anomalie génétique (aniridie, dysplasies ectodermiques). Cliniquement, il se caractérise initialement par une inflammation oculaire chronique douloureuse, avec un déficit épithélial persistant (kératite ponctuée superficielle, ulcérations), puis par l’apparition d’une néovascularisation d’origine conjonctivale et d’opacifications cornéennes conduisant à une baisse d’acuité visuelle parfois profonde. Une « conjonctivalisation » progressive permet de guérir les ulcérations mais peut aboutir à une cécité cornéenne (fig. 20-12). Parfois, un amincissement stromal important conduit à la perte anatomique du globe oculaire par perforation cornéenne. Mais le plus souvent, la cornée est épaissie par la prolifération conjonctivale qui l’a recouverte. Le DCSL peut être qualifié de partiel ou total selon qu’il persiste ou non un épithélium de type cornéen. Le diagnostic paraclinique de la maladie repose sur l’identification d’un épithélium de type conjonctival à la surface cornéenne ainsi qu’une disparition des palissades de Vogt. Après recueil cellulaire par empreinte cytologique cornéenne, la détection de cellules conjonctivales peut être réalisée par cytologie conventionnelle (colorations standard hématoxyline – éosine, periodic acid Schiff ou PAS et de Papanicolaou), par immunocytochimie (détection des kératines conjonctivales K7, K13 ou K19, avec analyse quantitative par cytométrie en flux) ou par reverse transcriptase polymerase chain reaction ou RT-PCR (détection des gènes des mucines de la conjonctive normale tels que MUC5AC). La microscopie confocale in vivo (in vivo confocal microscopy ou IVCM) a complété récemment l’arsenal diagnostique du DCSL : métaplasie squameuse épithéliale cornéenne, « conjonctivalisation » de l’épithélium cornéen avec présence de cellules à mucus et de kystes intra-épithéliaux, disparition des palissades de Vogt et de la membrane de Bowman, raréfaction des nerfs sous-épithéliaux et hyperréflectivité stromale sont les caractéristiques classiques du DCSL [1].
Le traitement des DCSL fait appel aux techniques d’apport de cellules souches épithéliales qui permettront de restaurer un épithélium cornéen sain en préalable à la réalisation d’une kératoplastie. Ces techniques sont englobées sous le terme de reconstructions limbiques.
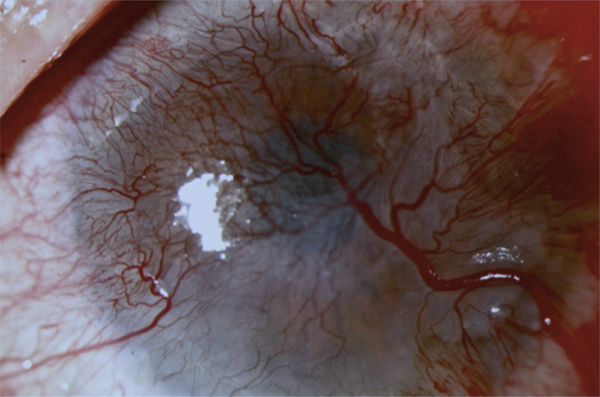
Fig. 20-12 DCSL typique responsable d’une cécité cornéenne.
L’évaluation préthérapeutique a pour objectif d’établir un bilan lésionnel exhaustif de la surface oculaire afin de guider la prise en charge thérapeutique :
statique palpébrale (ptosis, entropion, ectropion, etc.), examen du bord palpébral (recherche de trichiasis, localisation des cils), lagophtalmie ou symblépharon ;
examen du film lacrymal (film, lac et rivière lacrymaux, calcul du temps de rupture du film lacrymal, test de Schirmer), examen des points lacrymaux à la recherche d’une sténose cicatricielle, recherche de complications liées au syndrome sec (kératite ponctuée superficielle, kératite filamenteuse, etc.) ;
quantification clinique et paraclinique du degré de sévérité du DCSL (partiel ou total), évaluation de l’épaisseur du pannus conjonctival précornéen, de la transparence et de l’épaisseur du stroma sous-jacent ;
évaluation de la pression intra-oculaire en n’oubliant pas de la corréler à l’épaisseur cornéenne (la valeur est très souvent surestimée, mais la corticothérapie prescrite au long cours est un facteur de risque indéniable d’hypertonie chronique) ;
évaluation du potentiel visuel : lorsque l’analyse biomicroscopique du fond d’œil est rendue impossible par l’opacification cornéenne, une échographie en mode B ou des examens électrophysiologiques peuvent être nécessaires à l’évaluation du potentiel visuel résiduel ;
bilan systémique du patient : il devra être proposé d’une part pour évaluer les atteintes générales de la maladie inflammatoire et/ou auto-immune, d’autre part lorsqu’on envisage une allogreffe avec immunosuppression postopératoire (bilan biologique standard : numération formule sanguine ; bilan glycémique, hépatique et rénal ; typage HLA ; imagerie pulmonaire au minimum).
Idéalement, les pathologies palpébrales, conjonctivales, tonométriques et autres devront être traitées en préambule à toute reconstruction de la surface cornéenne.
Lorsque l’axe visuel est envahi d’un épithélium de type conjonctival, une ablation mécanique de ce dernier peut être réalisée de façon à ce qu’un épithélium cornéen sain provenant de niches limbiques résiduelles repeuple la zone dénudée [2]. Ceci n’est évidemment possible que lors de DCSL partiel, avant que des lésions stromales n’apparaissent.
Ce traitement peut être réalisé sous anesthésie topique, à la lampe à fente. L’épithélium conjonctival est délicatement et relativement facilement réséqué à l’aide d’une spatule de Desmarres ou d’un couteau crescent, parfois simplement « pelé » à la pince de Bonn. Il est important de s’assurer qu’aucun îlot d’épithélium conjonctival n’est oublié à la jonction des deux épithelia afin d’éviter une inhibition de contact à la repousse de l’épithélium cornéen. Il est possible de ne dégager que l’axe visuel ou au contraire de réséquer l’intégralité de l’épithélium conjonctival ectopique si le limbe résiduel autorise un repeuplement complet sans risquer un retard de cicatrisation ou une repousse conjonctivale. En cas de repousse conjonctivale, l’opération pourra être renouvelée toutes les 24 à 48 heures jusqu’à repousse complète de l’épithélium cornéen. Un néovaisseau cornéen sera coagulé dans le même temps.
Le traitement local postopératoire comporte des antibiotiques topiques et des lubrifiants jusqu’à réépithélialisation complète. Une lentille pansement peut être utilisée.
À la phase aiguë et inflammatoire d’un DCSL sévère ou en cas d’ulcération cornéenne chronique, une greffe de membrane amniotique (GMA) peut être envisagée. Un disque de 15 mm de diamètre environ est préparé afin d’être apposé sur le stroma cornéen, face épithéliale vers le haut. La membrane amniotique est fixée par un surjet de monofilament Nylon 10.0 passé au limbe (nœud enfoui) ou à l’aide de colle biologique [3]. La fixation par du fil résorbable est moins solide et source d’inflammation délétère. Elle peut également déchirer la membrane amniotique qui s’arrachera plus facilement lors de la réfection du pansement.
En cas de DCSL léger à modéré, la GMA peut accompagner une épithéliectomie sectorielle conjonctivale, car elle favorise l’expansion des cellules souches limbiques résiduelles et des CAT logées en profondeur dans l’épithélium cornéen [4].
Introduite par Kenyon et Tseng en 1989 [5], la greffe de cellules souches limbiques est indiquée en cas de DCSL total afin de restituer un pool cellulaire suffisant au maintien et au renouvellement de l’épithélium cornéen. Les CSL peuvent être apportées par une greffe tissulaire limbique ou par celle d’un feuillet épithélial obtenu par culture cellulaire.
Dans cette technique chirurgicale, les cellules souches limbiques peuvent provenir d’un donneur vivant – œil controlatéral du patient traité (autogreffe conjonctivolimbique) ou donneur apparenté (allogreffe conjonctivolimbique) – ou d’un donneur décédé non apparenté (allogreffe kératolimbique).
Décrite en 1965 par Barraquer, l’autogreffe limbique (AL) consiste chez un même patient à prélever un tissu limbique sain bordé d’une collerette conjonctivale pour le transplanter sur l’œil controlatéral atteint de DCSL. La compatibilité immunitaire complète qui la caractérise offre l’avantage de s’affranchir d’un traitement postopératoire immunosuppresseur par voie générale.
En revanche, cette technique chirurgicale expose au risque de DCSL iatrogène sur l’œil adelphe, et le choix de la taille du greffon devra permettre de compenser le DCSL de l’œil greffé sans risquer de compromettre l’intégrité de l’œil prélevé. L’indication des AL est limitée aux cas de DCSL unilatéral strict ; ce traitement sera à l’inverse contre-indiqué en cas de DCSL bilatéral asymétrique (par exemple POC ou syndrome de Stevens-Johnson asymétriques, brûlures bilatérales, etc.) au risque d’induire un DCSL iatrogène.
Comme les greffes de donneurs apparentés, l’AL ne doit pas être envisagée au stade aigu de la maladie, qui est marqué par une inflammation intense.
La technique chirurgicale débute par le prélèvement du greffon.
Le type d’anesthésie est indifférent (topique, locorégionale ou générale), l’anesthésie générale offrant l’avantage d’une relaxation musculaire optimale et d’une chirurgie bilatérale d’emblée. En cas d’importante rétractation musculaire, l’exposition du site opératoire pourra être facilitée par la fixation des muscles droit supérieur et droit inférieur à l’aide d’un fil de soie 4.0.
Selon les chirurgiens, un seul greffon limbique de 90 à 120° sur le méridien supérieur [6] ou bien deux greffons de 60 à 90° de limbe sur les méridiens supérieur et inférieur (classiquement 12 et 6 heures, méridiens protégés par le recouvrement palpébral) seront prélevés. La conjonctive ainsi qu’une mince couche de tissu sous-conjonctival seront disséquées jusqu’au limbe en veillant à préserver la capsule de Tenon sous-jacente. Une fois le limbe atteint, la dissection sera poursuivie à l’aide d’un couteau 30° ou d’un couteau crescent jusqu’à 1 mm environ en cornée périphérique, en avant des palissades de Vogt. Le prélèvement pour greffon devra avoir au moins un tiers de l’épaisseur cornéenne limbique, afin d’emporter un maximum de CSL et de pouvoir être suturé sans difficulté sur l’œil déficient. La cautérisation sera évitée autant que possible afin de préserver le pool de CSL prélevées. Le bord postérieur conjonctival du site prélevé sera rapproché du limbe à l’aide de sutures, au fil non résorbable (Nylon ou soie 10.0) ou résorbable (Vicryl 8 ou 10.0) plus pro-inflammatoire. Le greffon ainsi prélevé sera conservé dans une ambiance humide, face épithéliale vers le haut, et irrigué de façon intermittente à l’aide de balanced salt solution (BSS).
Le traitement postopératoire de l’œil prélevé comporte un collyre antibiotique, des anti-inflammatoires stéroïdiens et lubrifiants non conservés jusqu’à cicatrisation complète.
Les complications postopératoires sont rares et mineures : Durand et al. [6] n’ont noté aucune complication sur 25 yeux prélevés, initialement strictement normaux. Les symptômes à type d’inconfort étaient résolutifs 4 semaines au plus après le prélèvement, la réépithélialisation était complète dans les 2 semaines suivant le prélèvement. Les complications mineures rapportées par Miri et al., sur une série de 50 yeux prélevés, étaient représentées par des kératites filamenteuses et hémorragies sous-conjonctivales prolongées dans quatre yeux sans qu’aucun cas de baisse d’acuité visuelle ait été observé. Des cicatrices stromales pouvaient survenir sur le site de prélèvement. La microscopie confocale confirmait la normalité de l’épithélium cornéen central à distance du prélèvement [7].
Une décompensation épithéliale cornéenne iatrogénique peut survenir en cas de DCSL infraclinique [8]. Le diagnostic de l’unilatéralité du DCSL doit être scrupuleusement porté préalablement à cette chirurgie.
Sur l’œil présentant le DCSL, la préparation du site receveur doit être minutieuse : une péritomie circonférentielle est réalisée, dépassant le limbe sur son versant conjonctival de 1 à 2 mm et plus étendue en regard du ou des sites receveurs. Le pannus fibrovasculaire cornéen est réséqué par kératectomie superficielle jusqu’à atteindre le stroma cornéen sous-jacent, en veillant à ne pas perforer ce dernier. Des plans de clivage facilitent cette dissection mais ils ne sont pas toujours retrouvés en particulier lorsque les ulcères chroniques ont endommagé sérieusement le stroma sous-jacent ou lorsque la brûlure, volontiers chimique, a pénétré profondément dans le stroma. Tous les néovaisseaux cornéens sont détruits par électrocoagulation. Le greffon est alors encastré dans un lit limbique dessiné par le chirurgien, de 1 mm de largeur et de la longueur du prélèvement, le plus souvent à midi, mais parfois plutôt au niveau le plus cicatriciel de la lésion initiale, l’apport de la conjonctive controlatérale pouvant permettre la levée d’un symblépharon en regard. Les extrémités limbiques du greffon sont suturées par un à deux points enfouis de monofilament Nylon 10.0 dans le stroma cornéen et le limbe receveurs, et la portion conjonctivale est suturée à l’épisclère sous-jacente ou à la conjonctive du patient à l’aide de fils résorbables par points séparés [5, 6].
Sangwan et al. décrivent une technique opératoire où la cornée débridée est recouverte d’une membrane amniotique fixée à l’aide de tissu-colle (fibrin glue, TISSEEL® kit, Baxter AG, Vienna, Austria). Le greffon limbique est alors divisé en une dizaine de fragments qui sont positionnés, face épithéliale vers le haut, de façon circonférentielle sur le limbe receveur et fixés à l’aide de tissu-colle. Une lentille pansement est mise en place pour une durée de 7 jours afin de sécuriser le site opératoire [9].
Cette autogreffe de tissu limbique doit être réalisée à distance de l’affection causale (au minimum au-delà de 6 mois, mais plutôt au-delà 1 an), sur un œil calme. Si la surface cornéenne est bien nettoyée et lisse, les CSL provenant du greffon autologue peuvent, en un mois, recouvrir la surface stromale dénudée, sans avoir besoin de l’association avec une membrane amniotique dont les sutures risquent d’induire une inflammation supplémentaire.
À distance de la reconstruction limbique et après réépithélialisation cornéenne, une kératoplastie transfixiante peut être envisagée, si le résultat obtenu n’est pas suffisant (16 % des patients estiment avoir une acuité visuelle correcte sans greffe stromale secondaire dans l’étude de Durand et al.). C’est l’état stromal sous-jacent qui impose la kératoplastie secondaire.
Le risque infectieux postopératoire doit être prévenu par une antibiothérapie locale et une corticothérapie permet de maîtriser l’inflammation, source d’échec de la repousse épithéliale. La durée est adaptée à l’évolution du patient (6 fois/jour pendant 6 semaines en moyenne) [9]. Les collyres non conservés sont largement privilégiés du fait de l’effet pro-apoptotique connu du chlorure de benzalkonium. En cas de retard de cicatrisation cornéenne, une lentille pansement peut être apposée, sous surveillance quotidienne ; l’instillation horaire de sérum autologue a également démontré son efficacité dans cette indication [10], et la fréquence d’instillation des anti-inflammatoires stéroïdiens (AIS) doit être réduite.
Le suivi postopératoire est quotidien, et toute repousse conjonctivale est réséquée dans l’attente d’une réépithélialisation complète du limbe à partir du ou des greffons. Les sutures non résorbables sont retirées à partir de 15 jours de suivi postopératoire.
Les taux de succès à 3 ans (maintien d’un épithélium cornéen de bonne qualité) varient selon les études de 78 à 100 % [5, 6, 9, 11]. L’acuité visuelle est supérieure ou égale à 20/40 dans 69 % des cas [12] et à 20/60 dans 66 % des cas [9].
Les échecs peuvent être liés à la qualité du greffon, dont la densité en cellules souches limbiques peut être amoindrie en cas de DCSL infraclinique [11] ou lors d’un prélèvement insuffisant en profondeur ou largeur. Certains auteurs conseillent l’association avec une GMA afin de stimuler la prolifération des cellules souches [13].
Ce traitement est indiqué en cas de DCSL bilatéral. Il a pour inconvénient de ne pas offrir la compatibilité immunitaire des AL et expose donc à un risque de rejet accru. Par ailleurs, cette technique présente l’inconvénient de ne pas utiliser de tissu frais du fait des contrôles sanitaires imposés par l’allogreffe et la viabilité cellulaire des tissus conservés en est amoindrie. Enfin, elle n’apporte pas de tissu conjonctival et devra donc être évitée en cas de perte concomitante des CSL et des cellules conjonctivales (POC ou syndrome de Stevens-Johnson), d’altération majeure du film lacrymal ou d’inflammation active. Elle trouve son indication dans les cas d’aniridie ou de déficience iatrogène en CSL.
La technique de prélèvement varie selon l’origine :
à partir de globes oculaires énucléés : le globe oculaire, après antisepsie à la povidone iodée 5 % et rinçage au BSS, est rempli d’air à partir du nerf optique. Une trépanation cornéenne est réalisée à une profondeur de 250 µm avec un diamètre de 9 à 10 mm. La dissection lamellaire circonférentielle est alors poursuivie à l’aide d’un couteau crescent vers le limbe jusqu’à 1 mm en arrière de ce dernier [14] ;
à partir de disques sclérocornéens : une trépanation cornéenne de 9 à 10 mm est réalisée, suivie d’une trépanation de la collerette à l’aide d’un trépan de 13 à 14 mm. La collerette ainsi obtenue peut être encollée à l’aide de colle cyanoacrylate sur un support rigide afin de procéder au prélèvement comme décrit ci-dessus [15].
Dua rapporte une technique simplifiée de peeling : la collerette est ouverte de façon radiaire et une dissection est réalisée à la profondeur souhaitée sur une longueur de 3 mm environ. Les deux lamelles, antérieure et postérieure, sont alors fermement maintenues à l’aide d’une pince vasculaire et séparées par traction ferme. Cette technique offre l’avantage de sa simplicité et rapidité mais l’inconvénient de devoir réséquer la partie du greffon endommagée [16].
Après préparation du lit receveur comme décrit dans l’autogreffe limbique, le greffon peut être suturé sous la forme d’un anneau complet [17] ou sous la forme de deux à quatre fragments répartis autour du limbe de façon circonférentielle [14]. Le greffon est alors suturé à l’aide de points séparés enfouis de Nylon 10.0 placés de façon radiaire sur son versant cornéen. Le versant scléral est suturé en miroir par des points enchâssant l’épisclère receveuse ainsi que la conjonctive péritomisée afin que cette dernière lui soit apposée.
Le traitement postopératoire local est identique à celui de l’AL et comporte des collyres AIS, antibiotiques et lubrifiants, sans conservateurs. En cas de retard de cicatrisation épithéliale, les AIS sont réduits et une surveillance rapprochée est instaurée afin de détecter précocement un envahissement conjonctival qui doit être systématiquement débridé jusqu’à réépithélialisation cornéenne complète.
Un traitement systémique immunosuppresseur par corticothérapie orale, ciclosporine, tacrolimus, rapamycine ou mycophénolate mofétil, doit y être associé pour une durée minimale de 2 ans. Le receveur doit donc être médicalement apte à recevoir un traitement immunosuppresseur systémique en termes de tolérance et d’observance, tout en pouvant se conformer à la surveillance et aux examens hématologiques postopératoires rigoureux.
Les résultats postopératoires sont encourageants à court terme mais décevants à long terme en comparaison aux autogreffes ou aux greffes de donneurs apparentés, et cette technique expose aux risques iatrogéniques des traitements immunosuppresseurs.
Les taux de succès à 3 ans varient de 21 à 54 % [18–20].
Solomon et al. rapportent des taux d’acuité visuelle ambulatoire (AV > 20/200) maintenus dans 53,6 % des cas à 3 ans et 44,6 % à 5 ans, avec une dégradation inéluctable dans le temps [20]. Cependant, bien que le gain d’acuité visuelle soit modeste, la qualité de vie des patients est significativement améliorée [21].
L’intérêt de la réalisation d’une kératoplastie transfixiante simultanée demeure incertaine [20].
À 5 ans, le pronostic des allogreffes de donneur décédé est sombre [22, 23].
Dans cette technique, un tissu limbique sain associé à une collerette conjonctivale est prélevé chez un donneur apparenté pour être greffé sans préparation préalable, offrant ainsi les qualités inhérentes aux tissus frais.
Cette technique est destinée aux cas de DCSL bilatéraux et offre l’avantage d’une plus grande compatibilité HLA que celle du donneur décédé, réduisant de ce fait le risque de rejet, mais sans pour autant s’affranchir de la nécessité d’un traitement immunosuppresseur postopératoire.
La technique opératoire est similaire en tout point à celle de l’AL limbique.
Un typage du système HLA de classe I et II est réalisé en préopératoire, et deux mismatches sont acceptés au maximum.
Le traitement postopératoire est identique à celui des greffes de donneur décédé.
Les taux de succès avoisinent ceux de l’AL. À 2 ans, ils varient de 78 à 84 % [24, 25].
Une vision utile est obtenue dans 50 % des cas à 3 ans [25]. Comme la greffe de donneur décédé, cette technique expose aux risques iatrogéniques des traitements immunosuppresseurs.
Cette technique chirurgicale combine la greffe de donneur décédé à celle de donneur apparenté. Elle trouve ses indications dans les DCSL d’origine inflammatoire (syndrome de Gougerot-Sjögren et POC) ainsi que dans les brûlures oculaires sévères. La greffe conjonctivale provenant d’un donneur apparenté apporte des cellules à mucus qui pourvoient la couche mucinique du film lacrymal. Chez ces patients, une reconstruction palpébroconjonctivale est requise avant greffe de cellules souches [26].
La culture cellulaire ex vivo présente l’avantage d’utiliser des cellules immunocompatibles (autogreffe ou greffe de donneur apparenté) tout en réduisant significativement le volume tissulaire prélevé et donc le risque iatrogène. Cependant, elle fait le plus souvent encore appel à l’utilisation de produits animaux (fibroblastes murins, sérum de veau fœtal, sérum de mouton, extrait pituitaire bovin), de tissus humains allogéniques (sérum, membrane amniotique) et/ou de biomatériaux non approuvés qui augmentent le risque potentiel d’infection xénobiotique, de réaction immunitaire et de rejet de greffe. Par ailleurs, le coût des moyens humains et matériels de cette technique limite sa pratique courante.
Les efforts de la recherche se concentrent sur la mise au point de cultures cellulaires libres de produits xéno- ou allogéniques.
La technique de culture cellulaire commence par le prélèvement cellulaire : pour être cultivées, les cellules prélevées à l’issue d’une biopsie doivent initialement être séparées à l’aide d’enzymes protéolytiques (trypsine ou collagénase) qui digèrent la matrice extracellulaire afin de les mettre en suspension dans un milieu de culture.
Le milieu de culture doit reproduire aussi fidèlement que possible les conditions de l’environnement des cellules trouvées in vivo. Il est composé :
d’un milieu synthétique de base ou milieu essentiel minimum qui assure la survie cellulaire en apportant les éléments nutritifs (acides aminés, sels minéraux, glucose et vitamines) et le système tampon ;
d’un sérum (le plus performant étant le sérum de veau fœtal) qui autorise la multiplication et la différenciation cellulaire en apportant hormones, éléments nutritifs et facteurs de croissance, d’attachement et de protection cellulaire.
Les inconvénients du sérum de veau fœtal sont liés à la variabilité de sa composition et à sa nature biologique qui expose au risque d’infection xénobiotique (virus, toxines, prions, mycoplasmes) et de réaction immunitaire, d’où l’avènement des cultures en milieux définis ou milieux synthétiques sans sérum.
In vitro, l’ancrage des cellules à un support est indispensable à leur prolifération, et la nature de ce dernier influence la prolifération et la survie cellulaires. En effet, les connexions mécaniques entre le support de culture et le cytosquelette cellulaire autorisent les cellules à exercer des forces de traction transmises au noyau qui génère en retour des signaux d’adhésion, de migration, de prolifération et de différenciation. Trois types de supports existent : la fibrine et la membrane amniotique qui présentent toutes les deux un pouvoir immunogénique ; les plastiques et polymères qui nécessitent d’être recouverts de cellules nourricières tels les fibroblastes murins 3T3 inactivés qui produisent les cytokines, facteurs de croissance, et protéines de la matrice extracellulaire (MEC) nécessaires à la croissance et différenciation cellulaires, mais exposent au risque d’infection xénobiotique. La membrane amniotique est le support le plus fréquemment utilisé dans la culture de CSL. Elle apporte des facteurs anti-inflammatoires, anti-angiogéniques et de croissance favorables à la reconstruction limbique, et favorise la migration cellulaire grâce à sa membrane basale. Ses inconvénients reposent sur son coût, son caractère biologique qui expose aux risques infectieux et immunologiques, l’absence de transparence de ce tissu qui impacte défavorablement l’acuité visuelle postopératoire et la nécessité de la suturer sur la surface oculaire de l’œil choisi.
D’autres supports cellulaires ont été mis au point afin de s’affranchir des inconvénients de la membrane amniotique : les supports de fibrine ; des supports thermosensibles qui autorisent un clivage du feuillet épithélial sans utilisation d’enzymes lors du passage à température ambiante ; des lentilles de contact recouvertes de fibroblastes 3T3 inactivés, de polymère plasmatique ou de sérum autologue. Des cultures sans support sur colle de fibrine sont en cours d’évaluation.
La technique d’autogreffe limbique (AL) avec expansion cellulaire ex vivo a été introduite en 1997 par Pellegrini et al. [27]. Elle présente le meilleur ratio compatibilité HLA/risque iatrogénique.
Dans la procédure princeps, les progéniteurs limbiques prélevés au décours d’une biopsie de limbe de 1 à 2 mm2 sont mis en culture sur une couche nourricière de fibroblastes 3T3 ou sur une membrane amniotique (MA) pendant 10 à 14 jours [28], l’utilisation de cette dernière permettant de réaliser une greffe composite cellules souches limbiques/MA.
Après une péritomie circonférentielle de 3 mm et un débridement mécanique du pannus conjonctival épicornéen, le feuillet cellulaire est apposé sur la cornée et maintenu par un surjet de Nylon 10.0 passé au limbe. L’intégrité de l’épithélium greffé est assurée par un test à la fluorescéine à la fin de l’intervention, et la surface oculaire est protégée à l’aide d’une lentille pansement qui préserve les cellules épithéliales d’une ablation mécanique. L’hydrophilie, la perméabilité et la souplesse de cette dernière doivent être maximales afin de ne pas risquer de détériorer l’épithélium greffé.
Le traitement postopératoire repose sur l’instillation de collyres antibiotique et AIS au rythme de 4 fois/jour. Les posologies et la durée du traitement sont adaptées à l’évolution clinique et maintenues pour une durée minimale de 2 à 3 mois selon la sévérité de l’inflammation locale. Un traitement lubrifiant local non conservé y est associé. Un traitement oral par bétaméthasone (1 mg/jour) peut être administré en postopératoire précoce et rapidement diminué pour être stoppé à 1 mois, dans le but de minimiser l’inflammation postopératoire.
Le prélèvement est habituellement effectué sur l’œil adelphe, mais Vazirani et al. rapportent dans les cas de DCSL partiels bilatéraux des taux de génération épithéliale cornéenne similaires après prélèvement de l’œil atteint (pas de différence significative d’efficacité entre les deux groupes à 17,5 ± 7 mois sur une série de 70 yeux greffés) [29].
L’efficacité de cette technique varie de 71 à 76 % à 3 ans [28, 30–34], avec un gain de deux lignes ou plus d’acuité visuelle dans 60 % des cas [28]. Elle présente par rapport à l’autogreffe limbique sans expansion cellulaire l’avantage d’un prélèvement de petite superficie n’exposant pas à une décompensation d’un DCSL, d’un délai de réépithélialisation cornéenne plus court (1 versus 3 semaines) et d’une réduction accrue de l’inflammation de la surface oculaire [35].
Elle relève des mêmes modalités que l’autogreffe limbique et est indiquée en cas de DCSL sévère bilatéral. Cette technique réduit le risque immunologique inhérent aux allogreffes mais ne dispense pas d’un traitement immunosuppresseur par voie générale (voir plus haut Allogreffe kératolimbique de donneur décédé).
Basu et al. rapportent des taux de régénération épithéliale cornéenne de 71,4 % à 5 ans. Une kératoplastie transfixiante était réalisée dans 46,4 %, avec une moyenne de survie du greffon de 77 % à 1 an et une survie moyenne de 3,3 ans. L’acuité visuelle était supérieure ou égale à 20/60 dans 68 % des cas [36].
Grâce à leur plasticité de différenciation, les cellules souches (CS) ouvrent la voie aux reconstructions tissulaires. L’ingénierie tissulaire est la science d’induire in vitro une différenciation cellulaire ciblée sous l’influence de facteurs de maintenance et de différenciation tissulaires, afin d’obtenir un tissu biologique différencié destiné à être greffé.
Trois types de cellules souches coexistent : les CS embryonnaires humaines (human embryonic stem cell ou hESC), les CS induites pluripotentes (induced pluripotent stem cells ou iPSC) et les SC tissulaires.
Les CS originelles (hESC), issues des blastocystes humains, sont pluripotentes et possèdent une capacité d’autorenouvellement illimitée, ce qui les rend théoriquement immortelles. Leur réplication in vitro a été employée avec succès, mais leur application en thérapeutique clinique, outre les problèmes éthiques qu’elle soulève, expose au risque élevé de tumorigénicité et d’immunogénicité.
Les iPSC, plus différenciées que les hESC, offrent la possibilité d’une différenciation tissulaire induite, mais en plus de leur fort potentiel tumorigène, leur culture est peu rentable et leur potentiel de différenciation irrégulier.
Les CS tissulaires sont unipotentes, mais constituent des progéniteurs cellulaires de faible tumorigénicité et peu immunogènes. Les CSL en sont un exemple et sont ainsi employées à la réparation des DCSL.
Des sources alternatives de CSL autologues ont été étudiées dans le but d’éviter une immunosuppression systémique chez les patients atteints de DCSL sévère bilatéral, parmi lesquelles les cellules épithéliales de la muqueuse orale, les CS mésenchymateuses, conjonctivales, du follicule pileux, de la pulpe dentaire ou épidermiques.
Elle est aussi appelée cultivated oral mucosal epithelial transplantation (COMET) ou cultured autologous oral mucosal epithelial cell sheet (CAOMECS).
Le faible degré de différenciation, le fort potentiel prolifératif et la stabilité à la culture des cellules de l’épithélium de la muqueuse orale font de ce tissu un site de prélèvement de choix [37–40].
La mise en culture des cellules épithéliales de la muqueuse orale a vu le jour en 1990 [41] et leur première utilisation comme traitement du DCSL a été décrite en 2002 par Kinoshita et al. : des lapins porteurs de DCSL induits bénéficiaient d’une greffe autologue de cellules de la muqueuse orale obtenues à partir d’une biopsie mise en culture sur membrane amniotique durant 3 semaines. Les feuillets cellulaires obtenus comportaient quatre à cinq assises de cellules stratifiées différenciées dont les caractéristiques histologiques étaient comparables à celles des cellules épithéliales cornéennes (multiples desmosomes intercellulaires et adhésion à une membrane basale par le biais d’hémi-desmosomes), tout en conservant les caractéristiques immunohistochimiques de la muqueuse orale (K3, K4 et K13). Les cornées traitées étaient claires et réépithélialisées 10 jours après la chirurgie [42].
Ces mêmes auteurs rapportent la première application clinique sur quatre patients en 2003 avec des résultats similaires : 93 % de réépithélialisation cornéenne 48 heures après traitement et 67 % de stabilité dans le temps à 34 mois. Dans 33 % des cas, des ulcères retardés étaient constatés, spontanément résolutifs dans 20 % des cas et nécessitant une reprise chirurgicale dans 13 % des cas. L’acuité visuelle était améliorée de deux lignes ou plus dans 67 % des cas et deux patients ont bénéficié secondairement d’une greffe de cornée avec un résultat anatomique satisfaisant [37]. L’équipe de Burillon et al. est la première à avoir publié les résultats de 26 yeux de 25 patients [40] en utilisant la technique de culture de muqueuse orale sur support thermosensible (fig. 20-13).
La qualité de la muqueuse orale est évaluée avant biopsie au décours d’une consultation de stomatologie. Dans les suites de maladie auto-immune comme un syndrome de Lyell, l’épithélium de la muqueuse orale peut être altéré et cultivé avec un mauvais résultat. Après antisepsie bétadinée et anesthésie locale, une biopsie de 3 × 3 mm est réalisée au niveau de la muqueuse jugale.
L’épithélium recueilli est incubé à 48 °C pendant 5 heures afin de séparer les cellules épithéliales à l’aide de dispase et de trypsine EDTA. Les cellules ainsi obtenues sont alors ensemencées sur un support (polymère thermosensible, membrane amniotique dénudée, fibrine, etc.) et mises en coculture avec des cellules nourricières (mitomycine C, fibroblastes murins 3T3 inactivés) indispensables au processus de stratification épithéliale.
Le milieu de culture est composé de milieu de croissance kératinocytaire (KGM®, ArBlast Co., Kobe, Japan) supplémenté de 5 % de sérum. La durée de mise en culture est de 2 à 3 semaines avant la mise en interface air – liquide sur une durée de 1 à 2 jours en diminuant le niveau du milieu de culture. Pour le polymère thermosensible, le feuillet épithélial pluristratifié est décollé entièrement avec sa membrane basale sous l’effet de l’abaissement de la température de la pièce de culture (37 °C) à celle d’une salle de bloc opératoire (20 °C).
La technique chirurgicale de la greffe du feuillet épithélial est comparable à celle de la greffe de feuillet autologue.
En postopératoire, un traitement systémique par ciclosporine [37] ou AIS [40] peut être associé au traitement classique pour une durée maximale de 1 mois.
Les taux de succès (maintien d’un épithélium cornéen de bonne qualité) à 3 ans sont de 53 % [39] à 64 % [40]. La viabilité des cellules épithéliales est réduite au cours des 6 premiers mois, puis stabilisée à partir de 1 an (1 an : 65 % ; 2 ans : 59 % ; 3 ans : 53 %) [39].
L’acuité visuelle est : améliorée d’au moins une ligne d’acuité visuelle dans 53 % des cas ; stable dans 37 % des cas ; détériorée dans 11 % des cas [38]. Chiffrée en moyenne à 20/500 (20/2000 à 20/200), elle est cependant moindre que celle obtenue après AL, indiquant de ce fait que soit les caractéristiques biologiques des cellules greffées affectent significativement la qualité visuelle [38], soit l’opacification stromale cornéenne, séquellaire des multiples ulcérations est beaucoup plus importante (DCSL bilatéral). Le résultat au long terme est capital puisqu’il témoigne de la persistance de la viabilité épithéliale cellulaire notée après COMET/CAOMECS et de la qualité de l’épithélium qui aura repoussé sur la greffe transfixiante ou lamellaire réalisée afin d’améliorer l’acuité visuelle après COMET/CAOMECS. Satake [39] sur 40 yeux de 36 patients, avec 25 mois recul, et Kocaba [42] sur 26 yeux de 25 patients, avec 28 mois de recul, ont publié ces résultats avec des acuités visuelles améliorées à long terme dans 70 % des cas en moyenne.
Dans l’étude de Kocaba, l’acuité visuelle a été augmentée à long terme dans 74 % (17/23 yeux) des cas. Il existe une différence significative entre l’AV initiale et l’AV à long terme (1,67 versus 1,44, p<0,01), avec une amélioration de l’AV moyenne de 2,3 lignes. L’AV n’a pas été améliorée pour 4/23 yeux (17,4 %) et s’est aggravée pour 2/23 yeux (8,6 %). De plus, il n’existe pas de différence significative entre l’AV à 1 an et l’AV à long terme (1,45 versus 1,44, p>0,01) lorsqu’il n’y a pas eu de greffe stromale secondaire. Les boutons cornéens trépanés, dans cette même étude, pour la réalisation des greffes stromales, montrent l’existence d’un épithélium pluristratifié de bonne qualité. L’étude immunohistochimique révèle la présence de cytokératine 6, marqueur de l’épithélium de la muqueuse orale, de l’antigène p63, marqueur de cellule souche, et de MUC16, existant habituellement dans les cellules épithéliales cornéennes, à l’interface avec le film lacrymal, et que l’on retrouve ici, dans les cellules cultivées de muqueuse orale (fig. 20-14).
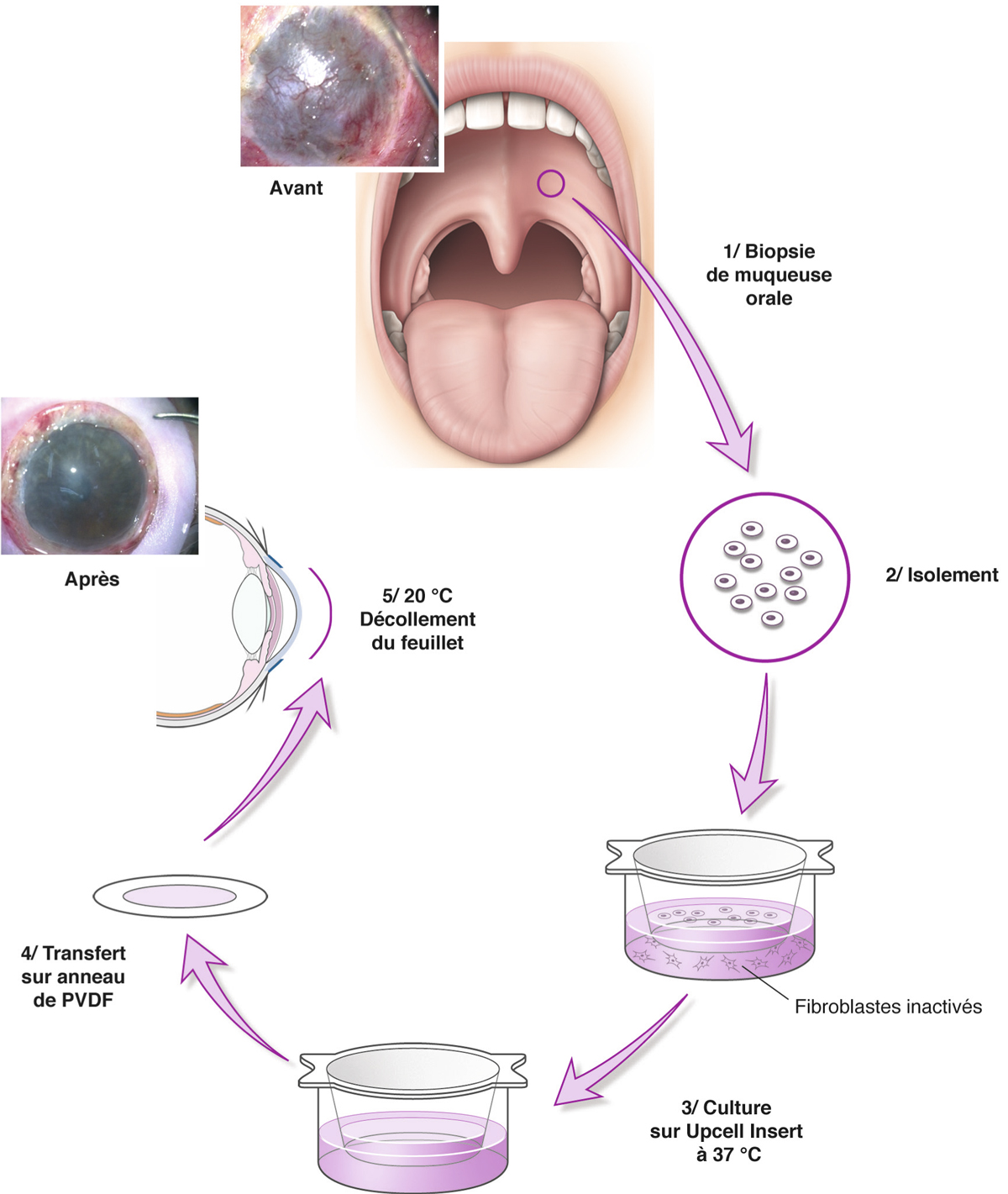
Fig. 20-13 CAOMECS, d’après Burillon et al. [40].
PVDF : . polyfluorure de vinylidène.
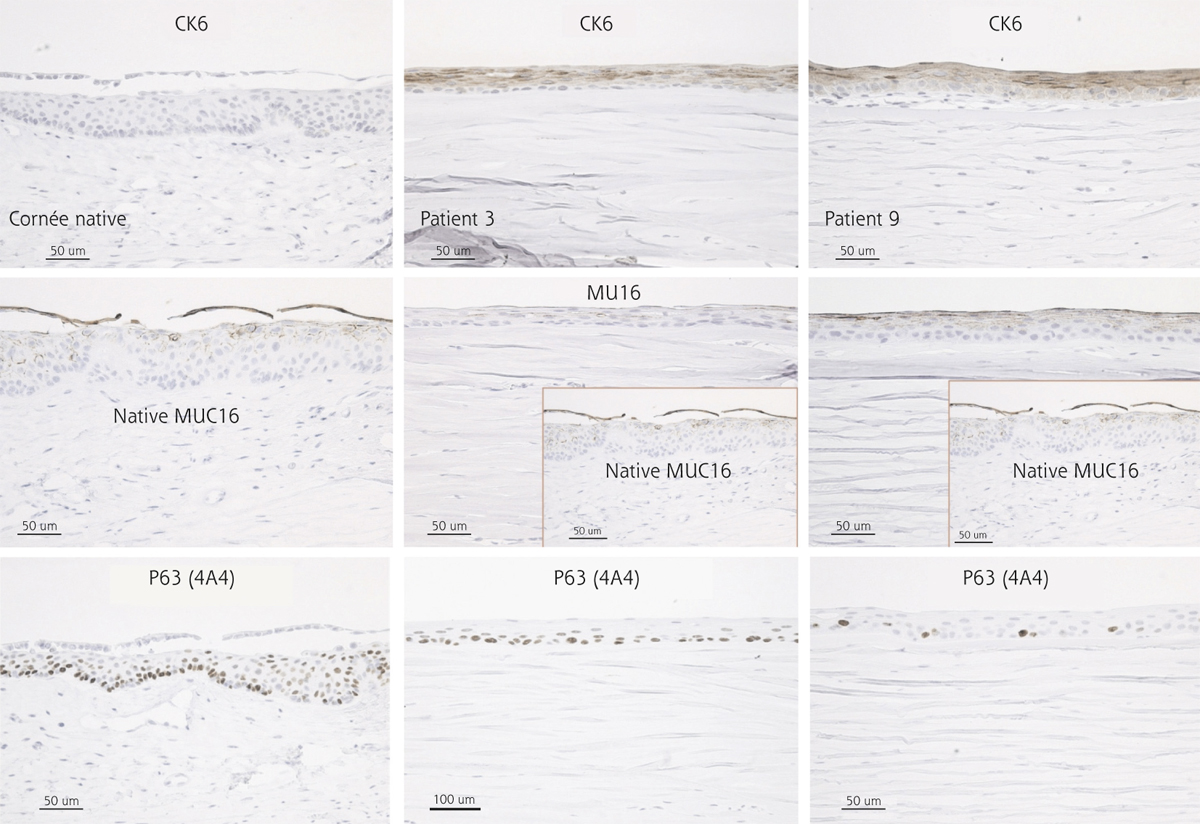
Fig. 20-14 Efficacité : potentiel régénératif, d’après Kocaba et al. [42].
Cette figure montre les résultats représentatifs de deux des quatre cornées excisées analysées en immunohistochimie (patients 3 et 9). La cytokératine CK6, marqueur de différenciation de la muqueuse orale, n’est pas exprimée dans la cornée native témoin (colonne de gauche). Par contre, elle est exprimée dans toutes les couches différenciées de l’épithélium de la cornée excisée, excepté dans la couche basale proliférative. Comme dans la cornée native de contrôle, quelle que soit la cornée excisée 1 an après la greffe de CAOMECS, presque toutes les cellules basales expriment p63, marqueur de prolifération prouvant la capacité de régénération de CAOMECS. De plus, la mucine 16 (MUC16), mucine transmembranaire spécifique de l’épithélium cornéen, apparaît légèrement exprimée dans l’épithélium régénéré. Cette MUC16 permettrait une meilleure adhésion du film lacrymal sur l’épithélium cornéen.
Les cellules souches mésenchymateuses de la moelle osseuse ou bone marrow mesenchymal stem cells (BMSC) ont été employées avec succès dans la mise au point de substituts épithéliaux cornéens d’ingénierie tissulaire (tissue engineered corneal substitute ou TEC) [43].
Après séparation tissulaire par trypsination, les BMSC sont mises en culture sur un support de MA et induites durant 10 jours dans un milieu favorisant la différenciation cellulaire limbique. Le feuillet épithélial ainsi obtenu exprime des marqueurs de différenciation cellulaire cornéenne (K3) et de cellules souches (p63), témoins du potentiel régénératif des cellules greffées [43].
Les études précliniques sur modèles animaux sont encourageantes, confirmant l’obtention d’un épithélium pluristratifié comparable à l’épithélium cornéen dans 80 % des cas en moyenne. Ces derniers expriment à la fois des marqueurs de différenciation cornéenne (K3, K12) et des marqueurs de progéniteurs cellulaires (Ki67 et p63) témoignant du potentiel régénératif du tissu greffé [41].
Les cellules épithéliales conjonctivales, qui partagent avec l’épithélium limbique une même origine embryologique, sont une source attractive de cellules souches hétérotypiques autologues car leurs deux caractéristiques phénotypiques (vascularisation et présence de cellules à mucus) sont perdues au cours de leur mise en culture ex vivo.
Ang et al. rapportent les résultats d’une série de 18 yeux de lapin ayant bénéficié d’une autogreffe de cellules épithéliales conjonctivales versus cornéennes cultivées sur membrane amniotique. Deux semaines après greffe, un épithélium pluristratifié de cinq à six assises cellulaires était retrouvé dans les deux groupes, avec les mêmes caractéristiques microscopiques de jonctions intercellulaires (desmosomes, hémidesmosomes).
L’analyse immunocytochimique mettait en évidence dans les deux groupes des marqueurs de différenciation épithéliale cornéenne (K3, K12) et l’absence de marqueurs de cellules à mucus (MUC5AC). Les caractéristiques cliniques étaient semblables dans les deux groupes (amélioration de la transparence cornéenne, régénération de l’épithélium cornéen, régression de la néovascularisation) [44].
L’application clinique de ce traitement semble apporter des résultats encourageants, avec 83 % d’amélioration clinique sur une série de 12 yeux rapportée par Ricardo et al. (suivi moyen de 18,5 mois). Notons cependant que l’analyse immunocytochimique des épithelia greffés mettait en évidence des marqueurs de différenciation cornéenne (K3), des marqueurs de cellules souches témoins du potentiel régénératif du tissu greffé (K19, p63, connexine 43), mais aussi des marqueurs de différenciation conjonctivale (MUC5AC, K19, coloration PAS positive) [45].
Meyer-Blazejewska et al. ont greffé avec 80 % de succès 31 souris porteuses de DCSL sévère. Le feuillet cellulaire obtenu présentait des caractéristiques immunohistochimiques de l’épithélium cornéen (K12) [46].
Gomes et al. ont étudié chez le rat l’intérêt de la greffe de cellules souches de la pulpe dentaire avec une amélioration de la transparence cornéenne et une réduction de l’activité néovasculaire en cas de DCSL modéré [47].
Yang et al. ont greffé dix moutons atteints de DCSL sévère avec 80 % de succès. L’épithélium greffé présentait initialement des marqueurs de différenciation cornéenne (K3, K12) et épidermique (K1, K10), pour ne plus exprimer que des marqueurs de différenciation cornéenne à 1 an [48].
Le bévacizumab, anticorps monoclonal dirigé contre le facteur de croissance de l’endothélium vasculaire, a montré son efficacité dans la réduction des néovaisseaux cornéens. Son mode d’administration peut être topique, sous-conjonctival ou intrastromal. Ce traitement est cependant symptomatique et ne traite pas le DCSL [49].
Au stade aigu d’un DCSL sévère et total, en l’absence de membrane amniotique, un recouvrement conjonctival pourra être indiqué au stade aigu de la maladie, car tout épithélium est préférable à un stroma dénudé.
En effet, l’absence d’épithélium est responsable d’une fonte cornéenne rapide sous l’action de protéases et expose au risque de perforation cornéenne [50].
Les DCSL légers à modérés pour lesquels l’axe visuel et l’acuité visuelle sont préservés ne nécessitent pas de traitement chirurgical mais une simple surveillance clinique.
Le traitement, symptomatique, repose sur l’instillation de collyres lubrifiants non conservés.
En cas d’envahissement conjonctival de la cornée centrale et de baisse d’acuité visuelle invalidante, un débridement mécanique cornéen sera indiqué, assorti d’un suivi fréquent. Les repousses conjonctivales seront débridées jusqu’à remplacement complet par un épithélium de type cornéen.
Dans les cas de DCSL sévères, à la phase aiguë (< 4 mois) et souvent inflammatoire de la maladie, une greffe de membrane amniotique, ou à défaut un recouvrement conjonctival, sera envisagée afin de recouvrir les ulcérations cornéennes et réduire ainsi le risque de perforation cornéenne.
Après un délai d’attente de 12 mois au minimum, une reconstruction limbique sera réalisée après débridement mécanique de la cornée receveuse et péritomie circonférentielle. En cas d’anomalie palpébrale (entropion, ectropion, trichiasis, etc.) ou conjonctivale (symblépharon), une reconstruction néo-adjuvante sera requise préalablement.
En cas de DCSL unilatéral strict, une AL avec ou sans expansion cellulaire pourra être réalisée. Elle sera à l’inverse contre-indiquée en cas de DCSL bilatéral asymétrique (par exemple POC ou syndrome de Stevens-Johnson asymétriques, brûlures bilatérales, etc.) au risque d’induire un DCSL iatrogène.
En cas de DCSL bilatéral, une allogreffe limbique de donneur apparenté ou décédé ou, mieux, une autogreffe de cellules souches non limbiques (greffe de cellules souches de la muqueuse orale) seront indiquées.
Lorsqu’elle est possible, la greffe conjonctivolimbique de donneur apparenté trouve son indication de choix dans les cas de perte concomitante des cellules souches limbiques et conjonctivales (POC ou syndrome de Stevens-Johnson par exemple) ou en cas d’altération majeure du film lacrymal.
Lorsqu’elle est réalisée isolément, la greffe kératolimbique de donneur décédé, qui n’apporte pas de cellules souches conjonctivales, sera privilégiée dans les cas de DCSL bilatéral sans implication conjonctivale (aniridie, DCSL iatrogène).
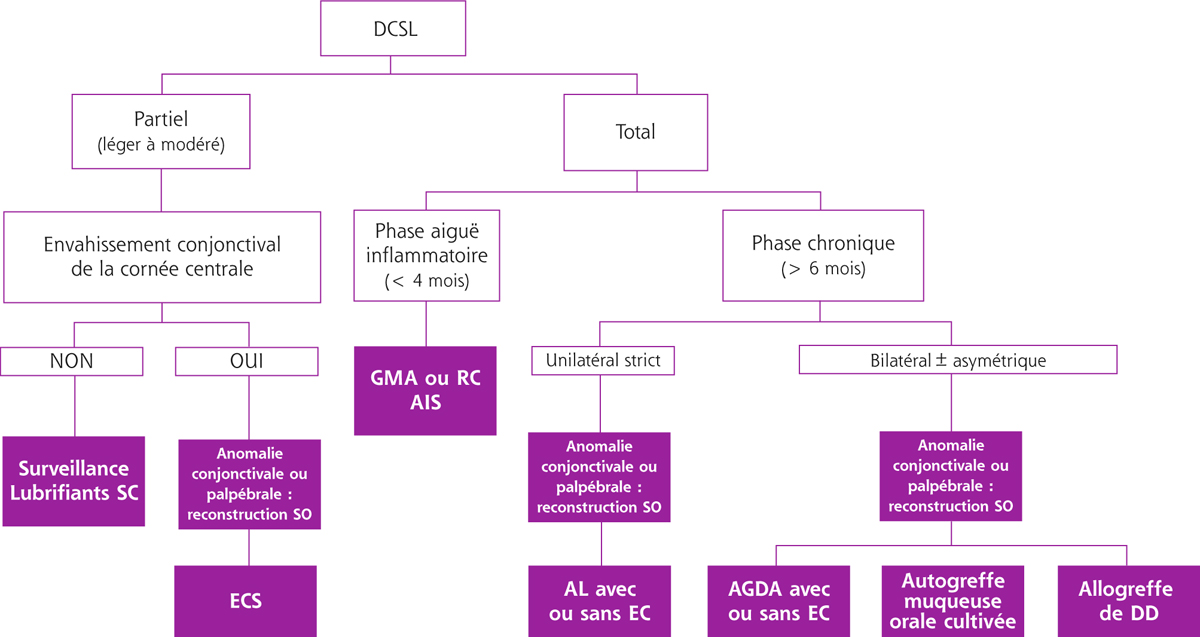
Fig. 20-15 Arbre décisionnel thérapeutique du déficit en cellules souches limbiques (DCSL).
AGDA : autogreffe donneur apparenté ; AIS : anti-inflammatoires stéroïdiens ; AL : autogreffe limbique ; DD : donneur décédé ; EC : expansion cellulaire ; ECS : épithéliectomie conjonctivale sectorielle ; GMA : greffe de membrane amniotique ; RC : recouvrement conjonctival ; SC : sans conservateurs ; SO : surface oculaire.
Toutes les techniques de reconstruction limbique permettent à des degrés variables de rétablir l’intégrité et la transparence de l’épithélium cornéen, d’accroître significativement l’acuité visuelle, de réduire l’activité néovasculaire et d’améliorer le pronostic d’une kératoplastie secondaire. Elles ont également un rôle majeur sur la diminution des plaintes fonctionnelles (photophobie, douleur, sécheresse) qui rendent la vie sociale presque impossible pour ces patients.
Tableau 20-1 Comparaison des techniques de reconstruction limbique.
AL : autogreffe limbique ; AG-DA : allogreffe donneur apparenté ; AG-DD : allogreffe donneur décédé ; CSMO : cellule souches de la muqueuse orale ; DCSL : déficit en cellules souches limbiques.
Il n’existe à ce jour aucun moyen clinique de quantification de la densité des CSL résiduelles, mais il est admis que la profondeur du DCSL est un facteur pronostique majeur. En effet, les reconstructions limbiques sont de meilleur pronostic pour les cas de DCSL légers à modérés.
L’étiologie du DCSL conditionne le devenir des cellules transplantées.
En effet, lorsqu’il est lié à un facteur systémique chronique, les cellules greffées seront assujetties aux mêmes processus de destruction cellulaire que les cellules natives.
Les étiologies de mauvais pronostic sont représentées par :
les pathologies génétiques telles que l’aniridie : mutation du gène PAX6, facteur de transcription clé dans la morphogenèse oculaire dont la mutation perturbe les fonctions protéiniques oculaires [51] ;
les pathologies auto-immunes telles que la POC : destruction d’origine auto-immune du complexe d’adhésion épithéliale ;
les pathologies inflammatoires telles que le syndrome de Stevens-Johnson : apoptose cellulaire et nécrose tissulaire responsables d’une desquamation épithéliale, d’une détérioration massive de la surface oculaire et d’un état inflammatoire marqué [20].
À l’inverse, les pathologies de meilleur pronostic sont représentées par les brûlures oculaires chimiques ou thermiques où les cellules souches limbiques greffées pourront recoloniser les niches limbiques et maintenir leur capacité d’autorenouvellement et de différenciation afin d’assurer le renouvellement constant de l’épithélium cornéen [12].
Les anomalies de la surface oculaire, conjonctivales, palpébrales ou du système lacrymal sont au départ d’une perturbation du micro-environnement limbique d’origine inflammatoire et sources d’échec thérapeutique. L’inflammation active, les anomalies palpébrales et du film lacrymal sont trois sources d’échec majeur des reconstructions limbiques [12, 25].
En cas de dommage étendu, une reconstruction conjonctivale néo-adjuvante devra être envisagée dans le but de restaurer un micro-environnement et un macro-environnement propices à l’homéostasie des cellules souches limbiques : microscopiquement, elle restaure la matrice extracellulaire conjonctivale et la sécrétion locale de facteurs de croissance épithéliaux ; macroscopiquement, elle rétablit une mobilité oculaire optimale et un étalement physiologique du film lacrymal.
De même, les anomalies palpébrales devront être prises en charge avant toute réalisation de greffe limbique [12].
Ce concept explique que dans les cas de DCSL non auto-immuns ou génétiques, la seconde greffe de cellules souches soit de meilleur pronostic que la première. En effet, les cellules épithéliales d’une première greffe migrent au-delà de la membrane amniotique et colonisent durablement l’ensemble de la surface oculaire permettant de restaurer l’environnement limbique optimal à la prolifération et différenciation des cellules souches greffées [20, 32, 38]. La seconde greffe ne souffrira pas d’un environnement défavorable et permettra le maintien d’un épithélium cornéen de bonne qualité pendant de nombreuses années.
Le taux de compatibilité du système HLA des types 1 et 2, qui sont complets en cas d’autogreffe et qui devront être recherchés avant toute greffe de limbe de donneur apparenté ou décédé, conditionne les taux de rejet du tissu greffé.
Ainsi, les taux de survie à 5 ans varient de : 50 à 65 % dans les groupes d’un mismatch ou moins ; 32 à 41 % pour deux à six mismatches ; 14 à 18 % pour des greffons non appariés [52, 53].
Il est admis qu’un taux de plus de deux mismatches est une contre-indication à la greffe d’un tissu limbique.
Elles sont représentées par ordre de fréquence par les hypertonies oculaires (5 à 37 %) qui devront être dépistées tout au long du suivi [18, 38] et qui ne sont pas à rapporter à la technique opératoire de reconstruction limbique, les ulcères chroniques (5 % à 3 ans) et les infections du site opératoire (5 % à 6 mois) [38].
Les complications postopératoires spécifiques à la greffe tissulaire limbique sont souvent liées au greffon (taille, épaisseur, positionnement ou alignement inadéquats) ou à une exposition cornéenne chronique conduisant à la décompensation épithéliale et à une reprise de la conjonctivalisation cornéenne.
Des cas d’amincissement voire de perforation cornéenne sont rapportés avec une incidence très variable, affectant jusqu’à 20 % des yeux traités, et significativement corrélés à la persistance d’ulcères chroniques [39] ou à la dissection lamellaire cornéenne trop profonde au cours de la chirurgie de reconstruction épithéliale.
Ces complications rares ne doivent pas nous dissuader de poursuivre nos prises en charge thérapeutiques et nos essais cliniques avec l’apport de cellules souches épithéliales afin de permettre l’amélioration de la qualité de vie des patients présentant un DCSL entraînant uniquement une cécité cornéenne. La greffe de cornée transfixiante ou lamellaire, nécessaire à la restitution d’une acuité visuelle utile, ne pourra rester transparente qu’après la reconstruction d’un épithélium cornéen de bonne qualité (fig. 20-16).
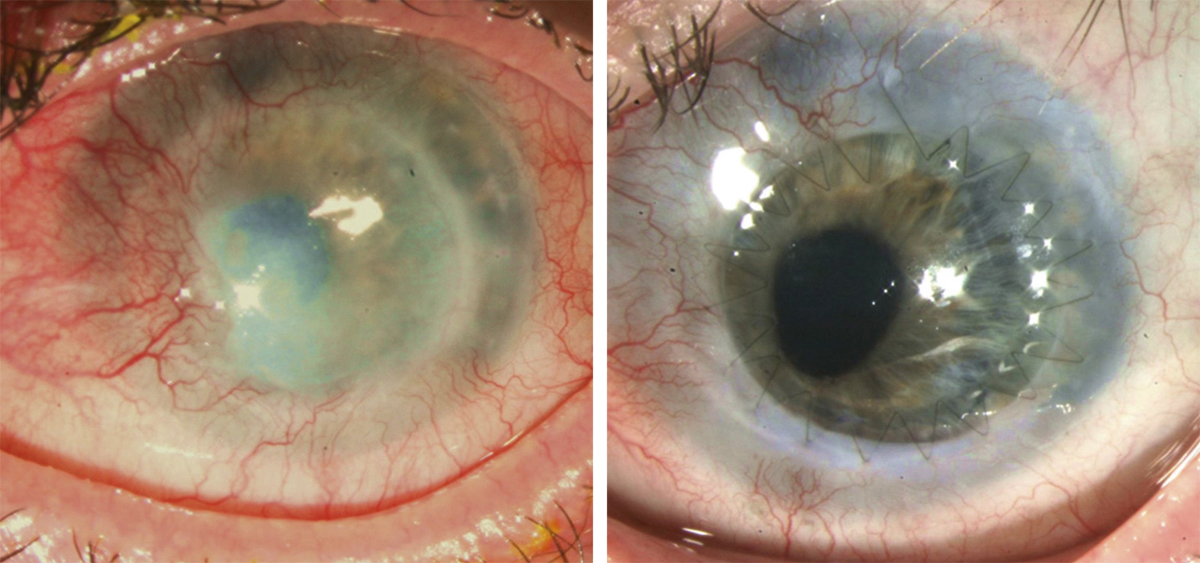
Fig. 20-16 Exemple d’un résultat de greffe de cellules épithéliales souches de muqueuse orale suivie d’une greffe de cornée (kératoplastie transfixiante) sur une cornée ayant subi une brûlure chimique traitée préalablement par multiples membranes amniotiques et kératoplasties transfixiantes.
[1] Nubile M, Lanzini M, Miri A, et al. In vivo confocal microscopy in diagnosis of limbal stem cell deficiency. Am J Ophthalmol 2013 ; 155 : 220-32.
[2] Dua HS. Sequential sector conjunctival epitheliectomy. In : Holland EJ. Ed. Ocular surface disease, medical and surgical management. New York : Springer ; 2002, p. 168-74.
[3] Kheirkhah A, Casas V, Raju VK, Tseng SC. Sutureless amniotic membrane transplantation for partial limbal stem cell deficiency. Am J Ophthalmol 2008 ; 145 : 787-94.
[4] Gomes JA, dos Santos MS, Cunha MC, et al. Amniotic membrane transplantation for partial and total limbal stem cell deficiency secondary to chemical burn. Ophthalmology 2003 ; 110 : 466-73.
[5] Kenyon KR, Tseng SC. Limbal autograft transplantation for ocular surface disorders. Ophthalmology 1989 ; 96 : 709-22 ; discussion 22-3.
[6] Durand L, Fages F, Burillon C. Greffe lamellaire cornéoconjonctivale « in lay », premier temps préparatoire du traitement chirurgical des séquelles de brûlures de cornée. J Fr Ophtalmol 1990 ; 13 : 17-23.
[7] Miri A, Said DG, Dua HS. Donor site complications in autolimbal and living-related allolimbal transplantation. Ophthalmology 2011 ; 118 : 1265-71.
[8] Jenkins C, Tuft S, Liu C, Buckley R. Limbal transplantation in the management of chronic contact-lens-associated epitheliopathy. Eye 1993 ; 7 : 629-33.
[9] Sangwan VS, Basu S, MacNeil S, Balasubramanian D. Simple limbal epithelial transplantation (SLET) : a novel surgical technique for the treatment of unilateral limbal stem cell deficiency. Br J Ophthalmol 2012 ; 96 : 931-4.
[10] Chiang CC, Chen WL, Lin JM, Tsai YY. Allogenic serum eye drops for the treatment of persistent corneal epithelial defect. Eye 2009 ; 23 : 290-3.
[11] Tan DT, Ficker LA, Buckley RJ. Limbal transplantation. Ophthalmology 1996 ; 103 : 29-36.
[12] Rao SK, Rajagopal R, Sitalakshmi G, Padmanabhan P. Limbal autografting : comparison of results in the acute and chronic phases of ocular surface burns. Cornea 1999 ; 18 : 164-71.
[13] Meallet MA, Espana EM, Grueterich M, et al. Amniotic membrane transplantation with conjunctival limbal autograft for total limbal stem cell deficiency. Ophthalmology 2003 ; 110 : 1585-92.
[14] Dua HS, Azuara-Blanco A. Allo-limbal transplantation in patients with limbal stem cell deficiency. Br J Ophtalmol 1999 ; 83 : 414-9.
[15] Lim LT, Bhatt PR, Ramaesh K. Harvesting keratolimbal allografts from corneoscleral buttons : a novel application of cyanoacrylate adhesive. Br J Ophtalmol 2008 ; 92 : 1550-1.
[16] Holland EJ, Schwartz GS. The evolution of epithelial transplantation for severe ocular surface disease and a proposed classification system. Cornea 1996 ; 15 : 549-56.
[17] Espana EM, Di Pascuale M, Grueterich M, et al. Keratolimbal allograft in corneal reconstruction. Eye 2004 ; 18 : 406-17.
[18] Tsubota K, Satake Y, Kaido M, et al. Treatment of severe ocular-surface disorders with corneal epithelial stem-cell transplantation. New Engl J Med 1999 ; 340 : 1697-703.
[19] Ilari L, Daya SM. Long-term outcomes of keratolimbal allograft for the treatment of severe ocular surface disorders. Ophthalmology 2002 ; 109 : 1278-84.
[20] Solomon A, Ellies P, Anderson DF, et al. Long-term outcome of keratolimbal allograft with or without penetrating keratoplasty for total limbal stem cell deficiency. Ophthalmology 2002 ; 109 : 1159-66.
[21] Miri A, Mathew M, Dua HS. Quality of life after limbal transplants. Ophthalmology 2010 ; 117 : 638, e1-3.
[22] Miri A, Al-Deiri B, Dua HS. Long-term outcomes of autolimbal and allolimbal transplants. Ophthalmology 2010 ; 117 : 1207-13.
[23] Henderson TR, Coster DJ, Williams KA. The long term outcome of limbal allografts : the search for surviving cells. Br J Ophtalmol 2001 ; 85 : 604-9.
[24] Daya SM, Ilari FA. Living related conjunctival limbal allograft for the treatment of stem cell deficiency. Ophthalmology 2001 ; 108 : 126-33 ; discussion 33-4.
[25] Wylegala E, Tarnawska D, Wroblewska EM. Limbal stem cell transplantation from HLA-compatible living donors. Long term observation. Klinika Oczna 2003 ; 105 : 378-83.
[26] Chan CC, Biber JM, Holland EJ. The modified Cincinnati procedure : combined conjunctival limbal autografts and keratolimbal allografts for severe unilateral ocular surface failure. Cornea 2012 ; 31 : 1264-72.
[27] Pellegrini G, Traverso CE, Franzi AT, et al. Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet 1997 ; 349(9057) : 990-3.
[28] Sangwan VS, Basu S, Vemuganti GK, et al. Clinical outcomes of xeno-free autologous cultivated limbal epithelial transplantation : a 10-year study. Br J Ophtalmol 2011 ; 95 : 1525-9.
[29] Vazirani J, Basu S, Kenia H, et al. Unilateral partial limbal stem cell deficiency : contralateral versus ipsilateral autologous cultivated limbal epithelial transplantation. Am J Ophthalmol 2014 ; 157 : 584-90e2.
[30] Burman S, Sangwan V. Cultivated limbal stem cell transplantation for ocular surface reconstruction. Clinical Ophthalmol 2008 ; 2 : 489-502.
[31] Baylis O, Figueiredo F, Henein C, et al. 13 years of cultured limbal epithelial cell therapy : a review of the outcomes. J Cellular Biochemistry 2011 ; 112 : 993-1002.
[32] Rama P, Matuska S, Paganoni G, et al. Limbal stem-cell therapy and long-term corneal regeneration. New Engl J Med 2010 ; 363 : 147-55.
[33] Shortt AJ, Secker GA, Notara MD, et al. Transplantation of ex vivo cultured limbal epithelial stem cells : a review of techniques and clinical results. Survey Ophthalmol 2007 ; 52 : 483-502.
[34] Rama P, Bonini S, Lambiase A, et al. Autologous fibrin-cultured limbal stem cells permanently restore the corneal surface of patients with total limbal stem cell deficiency. Transplantation 2001 ; 72 : 1478-85.
[35] Ang LP, Sotozono C, Koizumi N, et al. A comparison between cultivated and conventional limbal stem cell transplantation for Stevens-Johnson syndrome. Am J Ophthalmol 2007 ; 143 : 178-80.
[36] Basu S, Fernandez MM, Das S, et al. Clinical outcomes of xeno-free allogeneic cultivated limbal epithelial transplantation for bilateral limbal stem cell deficiency. Br J Ophtalmol 2012 ; 96 : 1504-9.
[37] Inatomi T, Nakamura T, Kojyo M, et al. Ocular surface reconstruction with combination of cultivated autologous oral mucosal epithelial transplantation and penetrating keratoplasty. Am J Ophthalmol 2006 ; 142 : 757-64.
[38] Nakamura T, Takeda K, Inatomi T, et al. Long-term results of autologous cultivated oral mucosal epithelial transplantation in the scar phase of severe ocular surface disorders. Br J Ophtalmol 2011 ; 95 : 942-6.
[39] Satake Y, Higa K, Tsubota K, Shimazaki J. Long-term outcome of cultivated oral mucosal epithelial sheet transplantation in treatment of total limbal stem cell deficiency. Ophthalmology 2011 ; 118 : 1524-30.
[40] Burillon C, Huot L, Justin V, et al. Cultured autologous oral mucosal epithelial cell sheet (CAOMECS) transplantation for the treatment of corneal limbal epithelial stem cell deficiency. Invest Ophthalmol Vis Sc 2012 ; 53 : 1325-31.
[41] De Luca M, Albanese E, Megna M, et al. Evidence that human oral epithelium reconstituted in vitro and transplanted onto patients with defects in the oral mucosa retains properties of the original donor site. Transplantation 1990 ; 50 : 454-9.
[42] Kocaba V, Thépot A, Yamato M, et al. Long-Term results of cultured autologous oral mucosa epithelial cell-sheet (CAOMECS) graft for the treatment of blindness due to bilateral limbal stem cell deficiency. J Stem Cell Res Ther 2014 ; 181.
[43] Rohaina CM, Then KY, Ng AM, et al. Reconstruction of limbal stem cell deficient corneal surface with induced human bone marrow mesenchymal stem cells on amniotic membrane. Translational research : the journal of laboratory and clinical medicine 2013 ; 163 : 200-10.
[44] Ang LP, Tanioka H, Kawasaki S, et al. Cultivated human conjunctival epithelial transplantation for total limbal stem cell deficiency. Invest Ophthalmol Vis Sc 2010 ; 51 : 758-64.
[45] Ricardo JR, Cristovam PC, Filho PA, et al. Transplantation of conjunctival epithelial cells cultivated ex vivo in patients with total limbal stem cell deficiency. Cornea 2013 ; 32 : 221-8.
[46] Meyer-Blazejewska EA, Call MK, Yamanaka O, et al. From hair to cornea : toward the therapeutic use of hair follicle-derived stem cells in the treatment of limbal stem cell deficiency. Stem Cells 2011 ; 29 : 57-66.
[47] Gomes JA, Geraldes Monteiro B, Melo GB, et al. Corneal reconstruction with tissue-engineered cell sheets composed of human immature dental pulp stem cells. Invest Ophthalmol Vis Sc 2010 ; 51 : 1408-14.
[48] Yang X, Moldovan NI, Zhao Q, et al. Reconstruction of damaged cornea by autologous transplantation of epidermal adult stem cells. Molecular Vision 2008 ; 14 : 1064-70.
[49] Kadar T, Amir A, Cohen L, et al. Anti-VEGF therapy (bevacizumab) for sulfur mustard-induced corneal neovascularization associated with delayed limbal stem cell deficiency in rabbits. Curr Eye Res 2014 ; 39 : 439-50.
[50] Liang L, Sheha H, Li J, Tseng SC. Limbal stem cell transplantation : new progresses and challenges. Eye 2009 ; 23 : 1946-53.
[51] Mishra R, Gorlov IP, Chao LY, et al. PAX6, paired domain influences sequence recognition by the homeodomain. J Biol Chem 2002 ; 277 : 49488-94.
[52] Reinhard T, Spelsberg H, Henke L, et al. Long-term results of allogeneic penetrating limbo-keratoplasty in total limbal stem cell deficiency. Ophthalmology 2004 ; 111 : 775-82.
[53] Reinhard T, Kontopoulos T, Wernet P, et al. Long-term results of homologous penetrating limbokeratoplasty in total limbal stem cell insufficiency after chemical/thermal burns. Der Ophthalmologe : Zeitschrift der Deutschen Ophthalmologischen Gesellschaft 2004 ; 101 : 682-7.
P. Fournié, F. Malecaze
Les greffes de cornée lamellaires améliorent le pronostic de la greffe de cornée en diminuant le risque de survenue de complications pour les greffes antérieures ou en augmentant les résultats visuels pour les greffes endothéliales. Les greffes transfixiantes gardent une place pour les indications de pleine épaisseur ou en alternative aux greffes lamellaires. Rejet de greffe et déperdition endothéliale progressive peuvent limiter la survie du greffon et restent les deux principales complications des greffes transfixiantes. Le pronostic de toute greffe dépend de ses conditions de réalisation mais aussi et surtout de son suivi. Le défaut de surveillance est la principale cause d’échec de greffe de cornée.
La greffe de cornée ou kératoplastie se décline aujourd’hui au pluriel. Si, classiquement, elle consiste à remplacer la cornée anormale d’un receveur par un greffon cornéen sain en provenance d’un donneur, l’approche moderne permet aujourd’hui de remplacer sélectivement la couche cornéenne atteinte. On distingue schématiquement des greffes de pleine épaisseur, transfixiantes, des greffes partielles, lamellaires.
La greffe optique a pour objectif de restaurer la fonction visuelle en rétablissant les caractéristiques cornéennes du point de vue de sa forme et de sa transparence. Les principales indications sont le kératocône, les décompensations endothéliales œdémateuses, les dystrophies de cornée et les cicatrices. Une greffe tectonique restaure l’intégrité cornéenne, dans les cas d’amincissement, de descemétocèle ou de perforation. Une greffe thérapeutique, ou « greffe à chaud », remplace le tissu cornéen infecté en cas d’échappement au traitement médical anti-infectieux. Une greffe cosmétique pour améliorer l’apparence de l’œil est une indication rare.
L’essor des greffes de cornée lamellaires au cours de la dernière décennie permet une économie tissulaire cornéenne, source de nombreux avantages (fig. 20-17). Il convient de définir précisément en préopératoire quelles couches cornéennes sont saines et peuvent être conservées (voir fig. 20-17a).
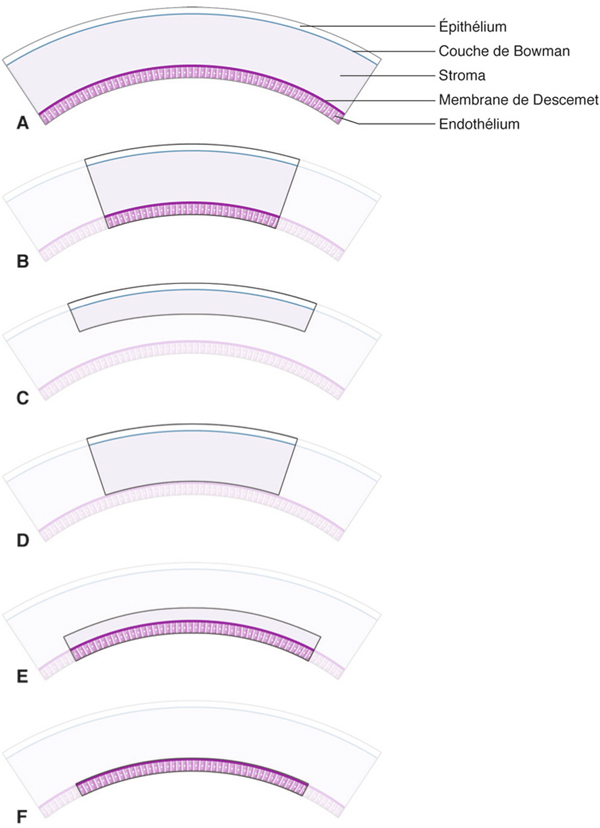
Fig. 20-17 Anatomie cornéenne et greffes de cornée.
a. Cornée normale. La cornée est constituée à 90 % d’un stroma composé de lamelles de collagène et de kératocytes, limité en avant par la couche de Bowman. L’épithélium de surface non kératinisé repose sur une membrane basale. L’endothélium tapisse la face interne de la cornée et repose sur sa membrane basale : la membrane de Descemet. b. Greffe transfixiante. Remplacement de la totalité de l’épaisseur cornéenne. c. Greffe lamellaire antérieure superficielle. Une couche plus ou moins épaisse de stroma cornéen antérieur est remplacée. d. Greffe lamellaire antérieure profonde. La totalité du stroma cornéen est remplacé. e. Greffe lamellaire endothéliale DSAEK. L’endothélium et la membrane de Descemet du receveur sont remplacés par un greffon qui contient une lamelle de stroma postérieur. f. Greffe lamellaire endothéliale DMEK. Le greffon ne comporte que l’endothélium et la membrane de Descemet du donneur, sans stroma postérieur.
La greffe transfixiante conserve des indications dans les atteintes cornéennes de pleine épaisseur, telles que les séquelles de plaies cornéennes perforantes centrales, d’infections sévères ou d’hydrops cornéen en cas de kératocône. Toute l’épaisseur de la cornée est alors remplacée (voir fig. 20-17b). La greffe transfixiante expose principalement à un risque d’astigmatisme géant, de glaucome, de rejet de greffe et de déperdition endothéliale accélérée. Plusieurs facteurs peuvent concourir à créer un astigmatisme géant postopératoire (> 5 dioptries) :
qualité de la trépanation du greffon et de la cornée réceptrice ;
astigmatisme de la cornée réceptrice et du greffon ;
décalage entre la cornée réceptrice et le greffon ;
tension des sutures ;
qualité de la cicatrisation ;
expérience du chirurgien.
Le rejet d’allogreffe de cornée est la première cause d’échec de greffe transfixiante (fig. 20-18). Le registre australien de greffes de cornée rapporte sur 18 686 greffes, suivies sur une période de 1 à 22 ans, 34 % de rejet irréversible toutes indications confondues [1]. Le principal facteur de risque de rejet est l’indication opératoire avec un risque accru en cas d’insuffisance en cellules souches limbiques et de néovascularisation cornéenne. Les greffons de grand diamètre, ou excentrés, périphériques, sont également plus à risque car plus proches du limbe. La deuxième cause d’échec de greffe transfixiante est la déperdition cellulaire endothéliale accélérée. Ing et al. [2] sur une série de 394 greffes dont 119 ayant complété un suivi de 10 ans rapportent une perte cellulaire endothéliale de 4,2 % par an sur une période de 5 à 10 ans après la greffe. Ces valeurs sont 7 fois supérieures à la perte moyenne normale estimée à 0,6 % par an. Cette perte cellulaire endothéliale progressive est à l’origine d’un épuisement du réservoir endothélial périphérique qui limite l’espérance de vie du greffon et d’éventuelles greffes ultérieures. D’autres complications, moins fréquentes, sont liées à la chirurgie « à globe ouvert » de la greffe transfixiante : hémorragie expulsive, complications liées aux sutures et à la corticothérapie prolongée, déhiscence traumatique notamment. Elles sont plus rares après greffes lamellaires.
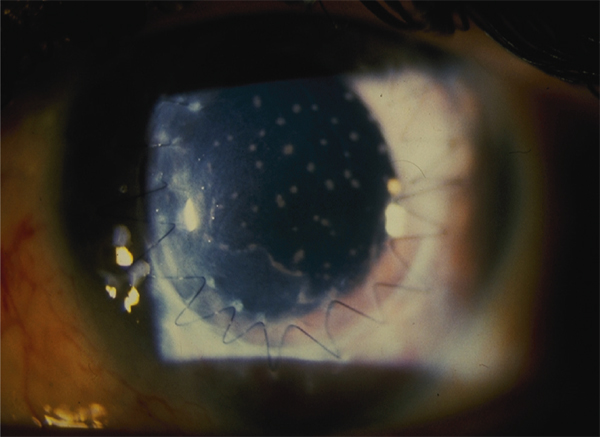
Fig. 20-18 Rejet endothélial d’allogreffe de cornée avec ligne de rejet de Khodadoust et précipités rétrocornéens diffus.
On distingue des greffes de cornée lamellaires antérieures superficielles (fig. 20-17c) des greffes lamellaires antérieures profondes (fig. 20-17d) au mieux prédescemétiques. Les indications sont les atteintes cornéennes stromales respectant les couches profondes endothélio-descemétiques. Le choix entre les deux dépend de la profondeur de l’atteinte stromale. Il est possible de s’aider d’une imagerie cornéenne, OCT (optical coherence tomography) surtout, pour poser l’indication. Les greffes prédescemétiques remplacent la totalité du stroma cornéen, alors que les greffes superficielles ne remplacent qu’une partie du stroma. Les greffes superficielles (superficial anterior lamellar keratoplasty ou SALK) ont bénéficié des progrès des microkératomes (automated lamellar therapeutic keratoplasty ou ALTK). La limite de ces techniques est, mise à part la profondeur de l’atteinte stromale, une récupération visuelle qui peut être circonscrite dans certains cas par des phénomènes cicatriciels de l’interface ou par l’irrégularité de l’épaisseur cornéenne qui est maintenue par la découpe. L’avantage est la simplicité opératoire et postopératoire avec possibilité de retirer les sutures précocement et de « changer » le greffon en cas de récidive de la pathologie initiale (herpès, certaines dystrophies stromales). Une corticothérapie locale est nécessaire en raison d’un risque de rejet épithélial ou stromal. La greffe prédescemétique, ou kératoplastie lamellaire antérieure profonde ou KLAP (deep anterior lamellar keratoplasty ou DALK), a surtout connu un essor considérable par la technique de dissection par visco-élastique [3] ou surtout par bulle d’air (big bubble) [4, 5]. Cette technique permet d’obtenir des résultats visuels comparables à ceux obtenus après kératoplastie transfixiante [6] à la condition que la dissection soit réellement profonde. Le plan de clivage profond peut se situer entre stroma et membrane de Descemet ou surtout dans la couche de Dua décrite par H. Dua et al. [7]. Cette couche, adjacente à la membrane de Descemet, est acellulaire et constituée de lamelles de collagène de type 1 désorganisées d’une épaisseur de 6 à 15 μ (fig. 20-19). L’avantage de la greffe lamellaire profonde est de supprimer le risque de rejet endothélial même si le risque épithélial ou stromal persiste. Le deuxième avantage concerne la durée de vie du greffon a priori allongée en raison de la conservation de l’endothélium cornéen du receveur [8]. Ce type de greffe doit être réalisé en première intention dans les pathologies intéressant la totalité du stroma : kératocône, dystrophies stromales avec atteinte profonde et cicatrices traumatiques ou infectieuses profondes.
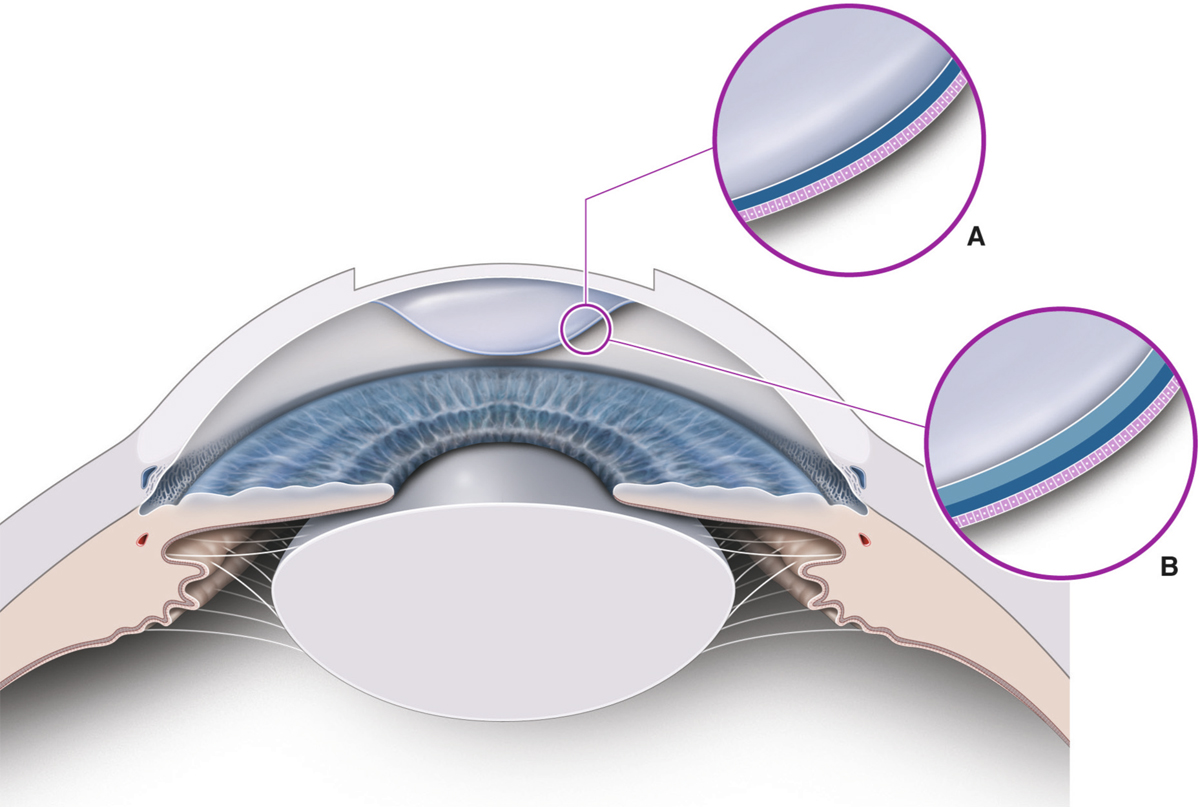
Fig. 20-19 Dissection profonde par technique de big bubble.
a. Plan de clivage entre la membrane de Descemet et le stroma profond. b. Plan de clivage dans la couche de Dua. Le plan postérieur est alors plus résistant car plus épais.
La principale avancée est la description du descemetorhexis qui a permis l’essor des deux principales techniques de greffes endothéliales [9]. Dans les deux cas, les couches endothélio-descemétiques sont retirées sur le receveur. Par analogie avec les greffes antérieures :
l’une est automatisée et apporte, en plus des couches endothélio-descemétiques du donneur, une lamelle de stroma postérieur : Descemet’s stripping automated endothelial keratoplasty ou DSAEK (fig. 20-17e) ;
l’autre est manuelle et n’apporte que les couches endothélio-descemétiques du donneur : descemet membrane endothelial keratoplasty ou DMEK (fig. 20-17f).
Les indications sont l’ensemble des pathologies endothélio-descemétiques sans atteinte stromale associée. Il convient ainsi de greffer avant la constitution d’une fibrose stromale observée à un stade avancé de décompensation endothéliale et pouvant compromettre la récupération visuelle. Dans la DSAEK, une lamelle postérieure du greffon (stroma postérieur + Descemet + endothélium) est découpée sur une chambre artificielle à l’aide d’un microkératome. Cette lamelle est insérée en chambre antérieure et appliquée à la cornée postérieure du receveur par de l’air (fig. 20-20). Les résultats visuels sont meilleurs que ceux obtenus après une greffe transfixiante [10, 11] en raison essentiellement de la conservation du dioptre cornéen antérieur [12]. Les complications inhérentes à la technique (décollement précoce du greffon, décompensation endothéliale primaire du greffon) sont rares après la courbe d’apprentissage. La déperdition endothéliale du greffon est la principale interrogation à long terme de la DSAEK mais ne semble pas en faveur, avec le recul actuel, d’une déperdition plus rapide qu’après greffe transfixiante [13, 14]. Le risque de rejet endothélial est par contre bien présent et incite à maintenir une corticothérapie locale sur la première année après la greffe. Dans la DMEK, seules les couches endothélio-descemétiques sont greffées (fig. 20-21). La description récente de la couche de Dua [7] laisse à penser que le clivage pourrait, dans un certain nombre de cas, se faire à ce niveau. La première difficulté réside dans l’apprentissage de la préparation du greffon avec plusieurs techniques de séparation de la membrane de Descemet du stroma. La principale difficulté concerne par contre le déploiement et la manipulation du greffon en chambre antérieure puis l’accolement du greffon au receveur avec un taux de décollement plus important qu’après DSAEK [15]. Les principaux avantages rapportés de la DMEK sont par contre une récupération visuelle accélérée et un taux de récupération d’acuité supérieur à la DSAEK [16].
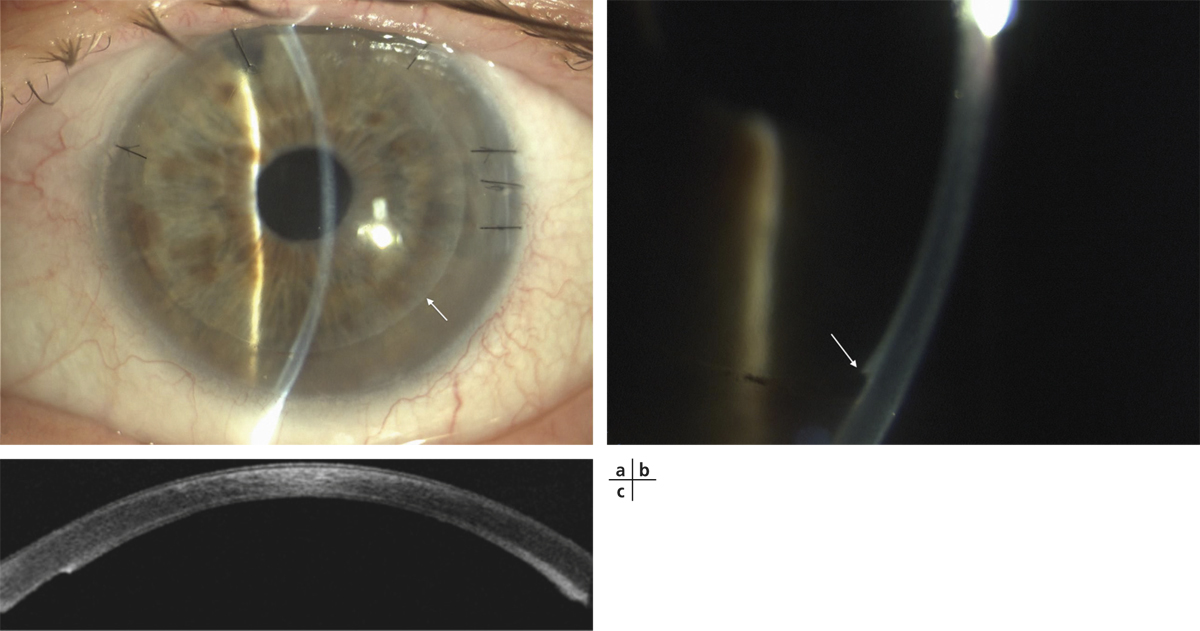
Fig. 20-20 DSAEK.
a. Le bord de la greffe est visible sur la face postérieure de la cornée (flèche). b. En fente, le bord apparaît en relief dans la chambre antérieure (flèche). c. Sur une coupe OCT, le greffon est visible en surépaisseur sur la face postérieure de la cornée réceptrice.
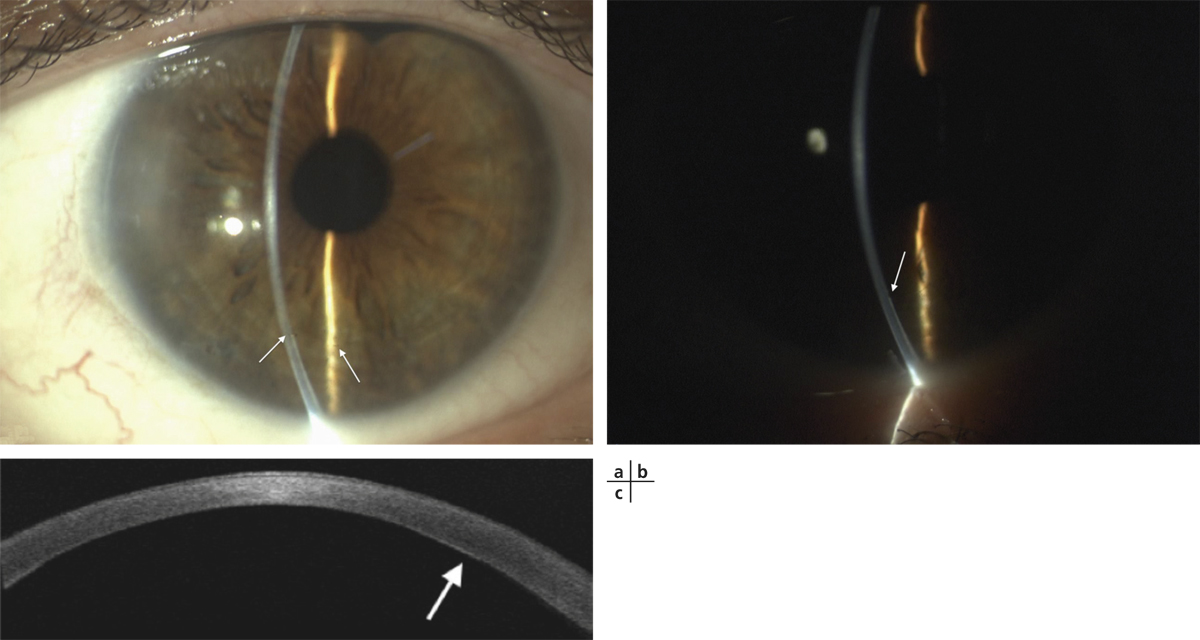
Fig. 20-21 DMEK.
a. La restitution quasi anatomique de la structure cornéenne rend le greffon difficile à voir (flèches). b. En fente, son bord peut être vu même en l’absence de relief (flèche). c. Sur une coupe OCT, le greffon peut se voir sur des zones d’hyperréflectivité (flèche).
L’application du laser femtoseconde dans les greffes de cornée n’en est qu’à son début avec des progrès à venir. Dans la greffe transfixiante d’abord, le laser femtoseconde permet d’adapter la géométrie de découpe des berges à la pathologie cornéenne à traiter pour améliorer la congruence, limiter le décalage vertical, augmenter la surface de cicatrisation et donc la résistance de la cicatrice (zigzag) ou apporter plus (top-hat) ou moins (mushroom) d’endothélium selon l’indication (fig. 20-22). Dans les greffes lamellaires, le laser femtoseconde a surtout un intérêt dans les greffes antérieures superficielles (femtosecond-assisted anterior lamellar keratoplasty ou FALK) à la place du microkératome pour choisir la profondeur de découpe et améliorer la congruence entre le receveur et le greffon. Dans la greffe prédescemétique, le laser femtoseconde ne peut pas permettre une séparation du stroma postérieur de la membrane de Descemet. Par contre, certaines tentatives de découpe des berges en mushroom notamment commencent à être rapportées, associées à une dissection profonde prédescemétique [17]. Dans les techniques postérieures, les premiers résultats sont décevants [18]. Si l’astigmatisme kératométrique, l’équivalent sphérique et la densité cellulaire endothéliale sont superposables à la découpe par microkératome, la récupération visuelle reste inférieure reflétant les limites actuelles du laser femtoseconde dans cette indication. Encore débutantes, les applications du laser femtoseconde dans les greffes de cornée devraient augmenter avec les progrès technologiques à venir. Le couplage du laser avec une imagerie OCT notamment offre des perspectives d’amélioration. La découpe laser soulève également des problèmes organisationnels en raison de la présence le plus souvent du laser femtoseconde au bloc réfractif.
Fig. 20-22 Exemples de découpes cornéennes avec laser femtoseconde.
Une découpe en forme de champignon (mushroom) permet une épargne endothéliale alors qu’une découpe en chapeau (top-hat) sera préférée dans les pathologies endothéliales. Une découpe en zigzag augmente la congruence et la surface de cicatrisation.
Si une technique chirurgicale irréprochable est indispensable, le pronostic final d’une greffe de cornée est indissociable d’une prise en charge postopératoire adéquate. Une surveillance rapprochée initiale permet de dépister les possibles complications les plus fréquentes : infection, rejet de greffe, sécheresse oculaire, glaucome, gestion des sutures et de l’astigmatisme. Le pronostic d’un rejet de greffe dépend de sa rapidité de diagnostic et de prise en charge. L’hypertonie oculaire est la deuxième cause d’échec de greffe après le rejet essentiellement par décompensation endothéliale accélérée [19]. Son incidence est estimée à environ 30 % des cas avec deux pics [20, 21] : le premier, précoce dans les deux premières semaines, est surtout dû à des facteurs chirurgicaux (inflammation, persistance de visco-élastique, hémorragie) ; le second, plus tardif, apparaît vers le quatrième mois. Il est en rapport surtout avec la corticothérapie. Le traitement d’une greffe, quelle que soit la greffe, repose essentiellement sur la corticothérapie, le plus souvent prolongée sur au moins 1 an, parfois moins dans les greffes lamellaires antérieures. La ciclosporine à 2 % en collyre peut être ajoutée en cas de risque de rejet, ou dans certaines contre-indications ou précautions dans l’utilisation des corticoïdes. Les hypotonisants locaux sont souvent nécessaires, parfois transitoirement sur la durée de la corticothérapie. Les lubrifiants oculaires enfin sont indispensables en raison de la sécheresse induite par la trépanation sur 360° et de la section des nerfs cornéens.
Si la greffe de cornée transfixiante garde des indications, sa place est aujourd’hui largement concurrencée par les greffes de cornée lamellaires, aux résultats fonctionnels identiques ou meilleurs avec un moindre risque de complications. Le laser femtoseconde pourrait dans l’avenir occuper une place croissante dans les greffes de cornée.
[1] Williams KA, Lowe M, Bartlett C, et al. Risk factors for human corneal graft failure within the Australian corneal graft registry. Transplantation 2008 ; 86 : 1720-4.
[2] Ing JI, Ing HH, Nelson LR, et al. Ten-year postoperative results of penetrating keratoplasty. Ophthalmology 1998 ; 105 : 1855-65.
[3] Melles GRJ, Remeijer L, Geerards AJ, Beekhuis WH. A quick surgical technique for deep, anterior lamellar keratoplasty using visco-dissection. Cornea 2000 ; 19 : 427-32.
[4] Anwar M, Teichmann KD. Big-bubble technique to bare Descemet’s membrane in anterior lamellar keratoplasty. J Cataract Refract Surg 2002 ; 28 : 398-403.
[5] Fournié P, Malecaze F, Coullet J, Arné JL. Variant of the big bubble technique in deep anterior lamellar keratoplasty. J Cataract Refract Surg 2007 ; 33 : 371-5.
[6] Reinhart WJ, Musch DC, Jacobs DS, et al. Deep anterior lamellar keratoplasty as an alternative to penetrating keratoplasty a report by the american academy of ophthalmology. Ophthalmology 2011 ; 118 : 209-18.
[7] Dua HS, Faraj LA, Said DG, et al. Human corneal anatomy redefined. A novel pre-Descemet’s layer (Dua’s layer). Ophthalmology 2013 ; 120 : 1778-85.
[8] Borderie VM, Boëlle PY, Touzeau O, et al. Predicted long-term outcome of corneal transplantation. Ophthalmology 2009 ; 116 : 2354-60.
[9] Melles GR, Wijdh RH, Nieuwendaal CP. A technique to excise the descemet membrane from a recipient cornea (descemetorhexis). Cornea 2004 ; 23 : 286-8.
[10] Bahar I, Kaiserman I, McAlum P, et al. Comparison of posterior lamellar keratoplasty techniques to penetrating keratoplasty. Ophthalmology 2008 ; 115 : 1525-33.
[11] Price MO, Gorovoy M, Price FW Jr, et al. Descemet’s stripping automated endothelial keratoplasty : three-year graft and endothelial cell survival compared with penetrating keratoplasty. Ophthalmology 2013 ; 120 : 246-51.
[12] McLaren JW, Patel SV, Bourne WM, Baratz KH. Corneal wavefront errors 24 months after deep lamellar endothelial keratoplasty and penetrating keratoplasty. Am J Ophthalmol 2009 ; 147 : 959-65.
[13] Price MO, Fairchild KM, Price DA, Price FW Jr. Descemet’s stripping endothelial keratoplasty five-year graft survival and endothelial cell loss. Ophthalmology 2011 ; 118 : 725-9.
[14] Ang M, Mehta JS, Lim F, et al. Endothelial cell loss and graft survival after Descemet’s stripping automated endothelial keratoplasty and penetrating keratoplasty. Ophthalmology 2012 ; 119 : 2239-44.
[15] Tourtas T, Schlomberg J, Wessel JM, et al. Graft adhesion in descemet membrane endothelial keratoplasty dependent on size of removal of host’s descemet membrane. JAMA Ophthalmol 2014 ; 132 : 155-61.
[16] Monnereau C, Quilendrino R, Dapena I, et al. Multicenter study of Descemet membrane endothelial keratoplasty : first case series of 18 surgeons. JAMA Ophthalmol 2014 ; 132 : 1192-8.
[17] Shehadeh-Mashor R, Chan CC, Bahar I, et al. Comparison between femtosecond laser mushroom configuration and manual trephine straight-edge configuration deep anterior lamellar keratoplasty. Br J Ophthalmol 2014 ; 98 : 35-9.
[18] Heinzelmann S, Maier P, Böhringer D, et al. Visual outcome and histological findings following femtosecond laser-assisted versus microkeratome-assisted DSAEK. Graefes Arch Clin Exp Ophthalmol 2013 ; 251 : 1979-85.
[19] Bertelmann E, Pleyer U, Rieck P. Risk factors for endothelial cell loss post-keratoplasty. Acta Ophthalmol Scand 2006 ; 84 : 766-70.
[20] Kirkness CM, Moshegov C. Post-keratoplasty glaucoma. Eye (Lond) 1988 ; 2 Suppl : S19-26.
[21] Wilson SE, Kaufman HE. Graft failure after penetrating keratoplasty. Surv Ophthalmol 1990 ; 34 : 325-56.
L. Hoffart, L. Guyot
Les kératoprothèses sont indiquées essentiellement en cas de cécité cornéenne bilatérale. Il ne doit pas coexister d’autre atteinte potentiellement cécitante : décollement de rétine, maculopathie, glaucome, etc. En cas de syndrome sec, l’ostéo-odonto-kératoprothèse (OOKP) reste la technique de kératoprothèse à proposer au patient.
Les cécités cornéennes sont une cause majeure de déficience visuelle après la cataracte, le glaucome et la dégénérescence maculaire liée à l’âge [1]. Dans les pays développés, les opacifications cornéennes sont essentiellement liées aux échecs de greffe de cornée et seraient responsables d’environ 9 % de l’ensemble des cas de cécité [2]. Plus de 4000 patients en France reçoivent chaque année une allogreffe de cornée [3] et bien que la transplantation cornéenne ait bénéficié des avancées de la microchirurgie et des thérapeutiques immunosuppressives, le pronostic fonctionnel est toujours conditionné par la survenue d’un rejet immunologique et les altérations inéluctables de la fonction endothéliale du greffon. Ce risque d’échec est significativement corrélé au nombre de procédures réalisées chez le même patient [4] et à l’importance de la néovascularisation cornéenne. Une alternative thérapeutique, chez les patients présentant ces facteurs de risque majeur d’échec de greffe, peut consister en l’implantation d’une « cornée artificielle » ou kératoprothèse. Ce dispositif constitue le dernier recours en présence d’une pathologie cornéenne sévère bilatérale et ne pouvant bénéficier d’une kératoplastie transfixiante. Les kératoprothèses se distinguent selon leurs matériaux, leurs architectures et leurs techniques d’implantation. Parmi celles-ci, les ostéo-odonto-kératoprothèses (OOKP) sont indiquées essentiellement dans les cas de cécités cornéennes associées à un syndrome oculaire sec sévère [5]. Elles nécessitent une chirurgie invasive et sont grevées de complications majeures [6]. Une autre approche vise à l’intégration de la kératoprothèse aux tissus de l’hôte par l’utilisation de biomatériaux pouvant être colonisés par les tissus du receveur tels que le Téflon, le Dacron et des polymères souples hydrophiles [7–12]. Ces modèles sont essentiellement proposés après multiples échecs de kératoplastie avec une surface oculaire conservée.
La substitution d’une cornée opacifiée par une lentille de cristal a été proposée il y a plus de 200 ans par Guillaume Pellier de Quengsy [13] et ce, avant même que la technique de greffe de cornée ne soit maîtrisée. La première implantation d’une cornée artificielle est attribuée à Heusser, ophtalmologiste suisse, en 1859. Par la suite, de nombreux ophtalmologistes ont développé divers procédés au cours du xixe siècle, sans véritable succès du fait des limitations des traitements postopératoires alors disponibles, afin de contrôler la réaction inflammatoire ou les processus infectieux associés. Au début du xxe siècle, les premiers résultats encourageants des allogreffes de cornée, dont la première kératoplastie transfixiante réalisée par Zirm en 1906, limitent l’intérêt porté précédemment aux kératoprothèses. Au cours de la seconde moitié du xxe siècle, les progrès dans la connaissance des biomatériaux relancent l’intérêt pour les kératoprothèses pour aboutir aux dispositifs implantables disponibles actuellement. La plupart des modèles de kératoprothèses associent deux parties distinctes : une optique centrale et un support périphérique permettant la transition entre les tissus du receveur et l’optique. Les complications postopératoires sont essentiellement liées à la compatibilité biologique du matériau dont est constituée la prothèse. La mauvaise tolérance tissulaire et la réaction inflammatoire associée peuvent se compliquer par une nécrose du tissu cornéen receveur et conduire à une expulsion du dispositif. Pour pallier ces difficultés, de nombreuses modifications des prothèses et des techniques chirurgicales ont été progressivement apportées. On distingue ainsi :
les kératoprothèses constituées, au moins partiellement, d’un matériau biocolonisable telles que les prothèses développées par Barber [9], Cardona [8], Choyce [14], Girard [15], Polack [16] ou Chirila [17] ;
les prothèses avec support biologique autologue, tel qu’une dent et de l’os alvéolaire, dominées par le concept de Strampelli [18] ;
plus récemment, des cornées artificielles intégralement biologiques obtenues par génie tissulaire [19, 20].
Ces prothèses peuvent donc être synthétiques (Boston keratoprosthesis ou Boston KPro, AlphaCor®), combiner une optique synthétique et un support biologique (OOKP).
La kératoprothèse idéale devrait égaler les caractéristiques d’une cornée humaine par ses qualités optiques, avec notamment un taux d’aberrations limité et une puissance adaptée à la biométrie de l’œil implanté. Elle devrait également présenter des propriétés de bio-intégration afin de permettre une limitation des complications infectieuses et inflammatoires ainsi qu’une durée de rétention satisfaisante. Elle devrait permettre, également, la pénétration intra-oculaire des substances pharmacologiques ou la mesure de la pression intra-oculaire directement au travers d’une optique souple.
Les kératoprothèses diffèrent selon leur mode de conception notamment en ce qui concerne le support de l’optique et la plupart intègrent un support non biologique poreux tel que le polyméthylméthacrylate ou PMMA (Choyce, Dohlman), le Dacron (Pintucci), l’hydroxyapatite (Leon-Baraquer), le PTFE (polytétrafluoroéthylène) expansé (Legeais) ou les hydrogels (Chirila). Des kératoprothèses à jupe biologique ont pour objectif une intégration aux tissus du receveur, comme l’OOKP qui utilise une dent autologue ainsi que son os alvéolaire comme support d’un cylindre optique en PMMA. Des techniques utilisant du cartilage ou encore de l’os tibial (Temprano) ont également été décrites. Peu de dispositifs ont fait l’objet de publications sur des séries significatives de patients, certaines kératoprothèses n’ayant été implantées que chez quelques patients du fait d’une incidence importante de complications postopératoires sévères et du fait des contraintes réglementaires régissant les dispositifs médicaux implantables.
Les dispositifs disponibles actuellement pour les applications cliniques se limitent aux kératoprothèses suivantes.
Le développement de la « Boston keratoprosthesis » a été initié par Dohlman et Doane en 1965, mais l’agrément de la Food and Drug Administration (FDA) n’a été obtenu qu’en 1992. Il s’agit d’une kératoprothèse synthétique constituée de PMMA.
Deux modèles distincts sont disponibles : le type I comporte une optique de PMMA insérée au centre d’un greffon cornéen « en bouton de col » et maintenue par une contreplaque fixée par un anneau en titane. Le type II présente le même mode d’insertion mais le cylindre optique à une longueur axiale accrue permettant de traverser l’épaisseur de la paupière supérieure, il est donc systématiquement associé à une tarsorraphie définitive, ce qui autorise l’implantation de ce modèle en présence d’un syndrome sec majeur (fig. 20-23a). Cette kératoprothèse est insérée au centre d’un greffon cornéen de 8,5 mm de diamètre au travers d’une trépanation centrale de 3 mm (fig. 20-23b). L’ensemble prothèse – greffon est alors transplanté après une trépanation de la cornée du receveur de 8 mm de diamètre et maintenu par 16 points séparés de monofilament de Nylon (fig. 20-23c à f). Une lentille de contact souple de grand diamètre est indiquée en port permanent afin de limiter l’évaporation du film lacrymal et de maintenir ainsi un niveau suffisant d’hydratation cornéenne garantissant la trophicité du tissu receveur. Le cristallin ou l’implant intra-oculaire en cas d’œil pseudo-phake ne nécessitent pas d’exérèse systématique, la puissance optique du dispositif pouvant être adaptée au statut optique de l’œil receveur.
Vidéo 20-1 Implantation de Boston keratoprosthesis (Boston Kpro).
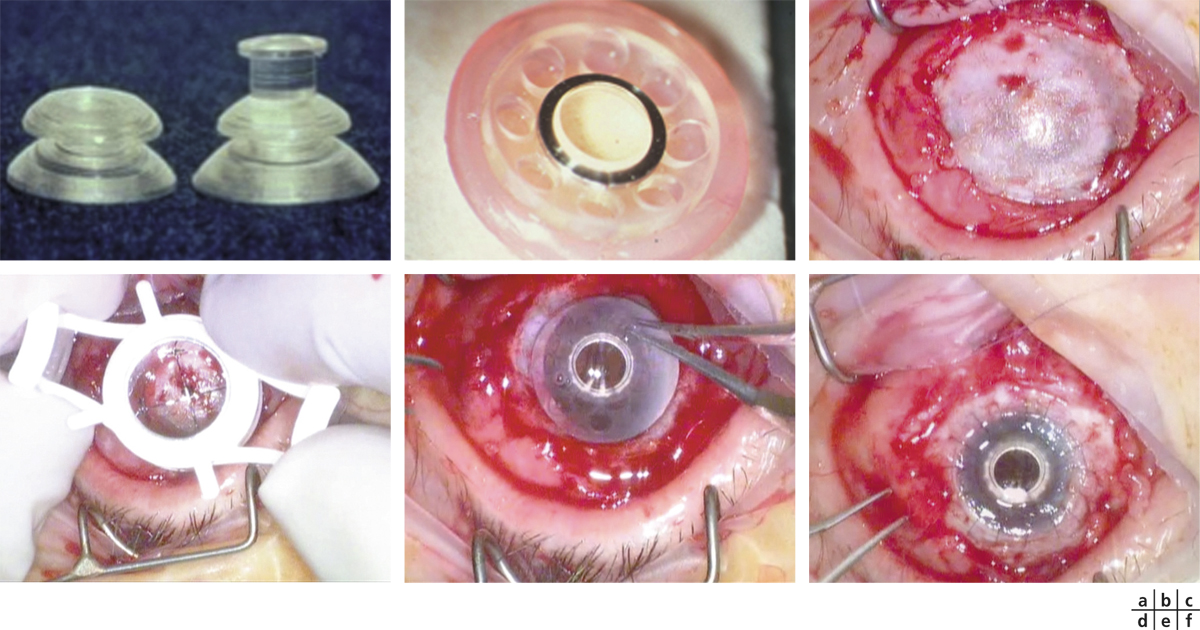
Fig. 20-23 Kératoprothèse de type Boston KPro (Dohlman-Doane).
a. Vue postérieure du dispositif inséré sur un greffon cornéen avant implantation. b. Cornée receveuse après péritomie et résection d’un pannus néovasculaire. c. Trépanation de la cornée receveuse. d. Positionnement de la kératoprothèse fixée sur un greffon cornéen après trépanation centrale. e. Suture de la kératoprothèse à la cornée receveuse par 16 sutures séparées de monofilament de Nylon. f. Aspect en fin d’intervention.
Les indications préférentielles de cette kératoprothèse sont les échecs multiples de kératoplastie ou dans toute atteinte de la surface oculaire avec un film lacrymal peu altéré et en l’absence d’inflammation oculaire active. Les complications sont limitées dans ces indications et la rétention du dispositif est satisfaisante. Les complications postopératoires surviennent essentiellement en cas d’antécédents d’inflammation oculaire. Une antibiothérapie locale en continu est impérative et permet de réduire l’incidence des cas d’endophtalmies postopératoires. Le type II est disponible pour une implantation au stade terminal d’une sécheresse oculaire.
De nombreuses publications rapportent les résultats obtenus avec ce dispositif ; plus de 3500 prothèses ont été implantées à ce jour [21]. Le taux de rétention varie selon les études mais est de l’ordre de 95 % à 12 mois et de 90 % à 24 mois [22]. L’acuité visuelle postopératoire à 1 an est de 1/10e ou mieux chez 56 % des patients et de 5/10e ou mieux dans 27 % des cas. Les complications postopératoires sont principalement représentées par la survenue d’une membrane rétroprothétique et l’apparition d’un glaucome secondaire. Le succès d’une telle intervention est assuré par une sélection stricte des patients en excluant les atteintes sévères de la surface oculaire par syndrome de Stevens-Johnson ou pemphigoïde oculaire cicatricielle. L’obtention d’un marquage CE, toujours en instance à ce jour, devrait permettre la diffusion de ce dispositif en Europe.
D’après la technique originale de Strampelli en 1965 [18], modifiée par Falcinelli [23], une canine est prélevée avec son alvéole osseuse. Une plaque de dentine et d’os alvéolaire est alors façonnée puis un cylindre optique en PMMA y est inséré après fraisage en prenant soin de conserver le périoste. Ce complexe est alors fixé en lieu et place de la cornée receveuse et sera secondairement vascularisé à partir de la sclère sous-jacente, des muscles extra-oculaires environnants et d’une greffe de muqueuse buccale de recouvrement qui permet une protection physique et microbiologique du dispositif. L’implantation d’une OOKP nécessite deux étapes chirurgicales :
au cours de la première phase, une dent monoradiculaire ainsi que l’os alvéolaire environnant est prélevée (fig. 20-24a). Une lame ostéo-odontique est préparée en meulant la moitié de la racine jusqu’au canal pulpaire afin de former un bloc rectangulaire (fig. 20-24b). Le cylindre optique en PMMA est scellé dans un orifice foré dans la lame (fig. 20-24c). Le complexe est alors implanté dans une poche sous-musculaire dans la paupière inférieure de l’œil controlatéral pour une durée de 2 à 4 mois (fig. 20-24d). Au cours de cet intervalle, les tissus mous investissent les pores osseux de la lame alvéolodentaire et assurent sa vascularisation. Ce délai permet également à la dentine de se stabiliser après le dommage thermique lié au façonnage et toute infection importée à partir de la cavité buccale peut être traitée à distance du site opératoire. Un greffon de muqueuse buccale est prélevé au cours du même temps opératoire. Après dissection conjonctivale limbique de 360° et kératectomie lamellaire, la greffe de muqueuse buccale est suturée à la sclère, aux insertions des muscles droits et à la conjonctive bulbaire reculée ;
au cours de la deuxième phase chirurgicale, la lame osseuse enfouie à l’étape précédente est récupérée dans sa poche sous-musculaire. Un lambeau est récliné dans le greffon de muqueuse buccale afin de permettre une trépanation cornéenne. Une phaco-exérèse, une iridectomie totale et une vitrectomie antérieure sont réalisées et la lame osseuse est suturée à la sclère. Le lambeau de muqueuse buccale est repositionné sur le dispositif, une ouverture est effectuée pour le passage de l’optique (fig. 20-24e).
Vidéo 20-2 Implantation d’ostéo-odonto-kératoprothèse (première phase chirurgicale).
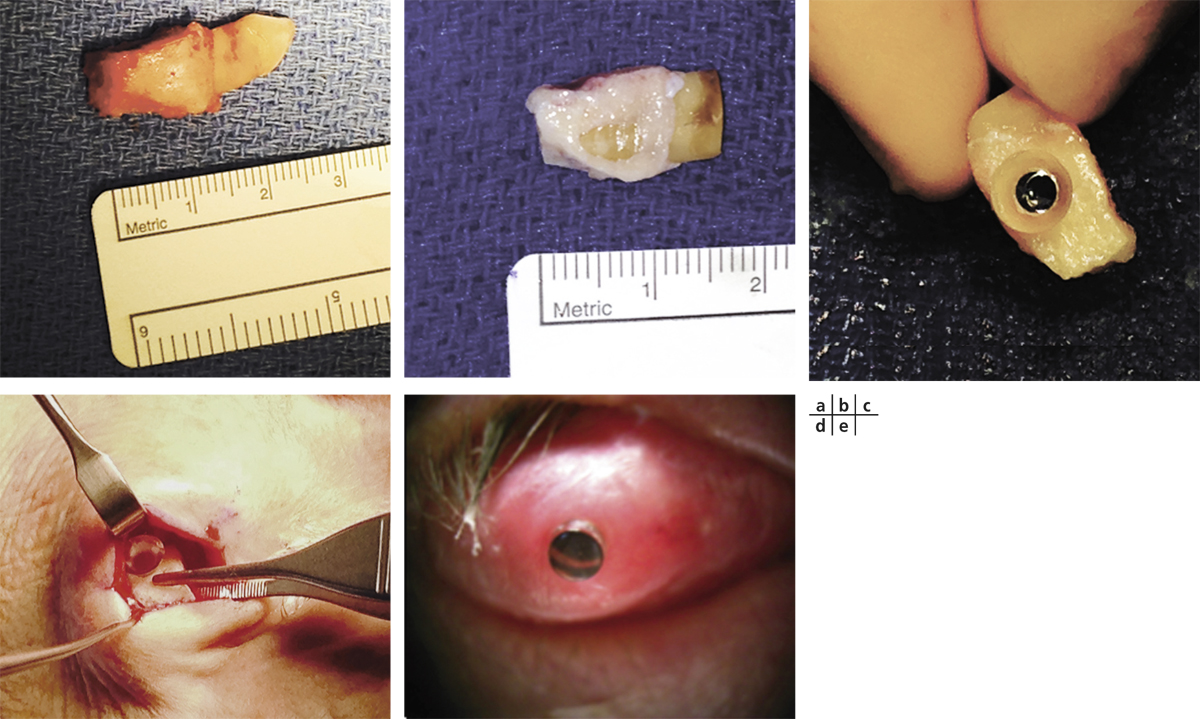
Fig. 20-24 Kératoprothèse de type OOKP.
a. Prélèvement alvéolodentaire. b. Bloc rectangulaire de dentine et d’os alvéolaire préparé à partir de la dent prélevée. c. Cylindre optique en PMMA inséré au sein du bloc alvéolodentaire avant implantation. d. Positionnement du montage dans une poche musculaire. e. Aspect postopératoire après implantation du dispositif et recouvrement par de la muqueuse buccale.
L’OOKP est la seule kératoprothèse en mesure de résister à une surface oculaire totalement dépourvue de film lacrymal, comme dans le cas d’une atteinte par pemphigoïde oculaire cicatricielle ou syndrome de Stevens-Johnson. L’OOKP est donc la technique de référence en présence d’un syndrome sec sévère.
La rétention à long terme et les résultats visuels publiés obtenus avec l’OOKP sont supérieurs aux autres types de kératoprothèses. En 2005, Falcinelli [23] a rapporté les résultats d’une cohorte de 181 patients avec un suivi médian de 12 ans (de 1 à 25 ans). La probabilité de rétention était de 85 % à 18 ans et de 55 % de conservation de la meilleure acuité visuelle postopératoire sur la même durée. L’acuité visuelle postopératoire moyenne se situait entre 4 et 8/10e. Le taux de complications postopératoires sévères était limité à 6 % de cas d’extrusions. Pour les patients édentés, une hétérogreffe d’une dent provenant d’un apparenté ou de l’os tibial [24] peut également être utilisée comme support biologique, mais les taux de rétention sont inférieurs à la technique de référence.
Il s’agit d’une kératoprothèse biocolonisable constituée d’un polymère biocompatible, le poly(2-hydroxyéthyl méthacrylate) ou pHEMA, dont les propriétés de transparence varient en fonction de son degré d’hydratation, ce qui permet de mouler l’optique centrale et la jupe poreuse périphérique en une pièce unique sans jonction mécanique. Cette prothèse présente un diamètre de 7 mm pour une épaisseur de 600 µm. Deux modèles sont disponibles : le type P pour patient phaque ou pseudo-phaque et le type A de puissance dioptrique supérieure pour patient aphaque et qui ne nécessite donc pas d’implantation intra-oculaire complexe complémentaire [25]. La technique chirurgicale comporte deux phases :
une première phase d’implantation intracornéenne du dispositif : après une péritomie limbique supérieure, une incision est réalisée 1 mm en arrière du limbe supérieur sur 180° des méridiens de 3 à 9 heures à une profondeur de 300 µm à l’aide d’un couteau calibré. Une dissection lamellaire intrastromale est alors réalisée à l’aide d’un couteau crescent, une lamelle stromale antérieure est ainsi créée et réclinée. Le lit cornéen postérieur est ensuite trépané en regard de l’axe pupillaire à l’aide d’un punch à biopsie cutanée de 3,5 mm de diamètre. L’AlphaCor® est alors positionnée sur le lit stromal et l’optique centrée en regard de la trépanation postérieure. Le capot cornéen antérieur est alors suturé en place et recouvre la prothèse (fig. 20-25a à e) ;
l’exposition à la surface oculaire de l’optique centrale est réalisée après un intervalle de 3 à 6 mois afin de permettre la biocolonisation de la jupe périphérique de l’AlphaCor®. Cette étape consiste en la trépanation de la lamelle cornéenne antérieure à l’aide d’un punch à biopsie cutanée de 3 mm de diamètre (fig. 20-25f et g). Le traitement postopératoire comporte une corticothérapie topique, décroissante sur 4 semaines, en association à une antibiothérapie locale continue.
Vidéo 20-3 Implantation de kératoprothèse AlphaCor® : première phase.
Vidéo 20-4 Implantation de kératoprothèse AlphaCor® : deuxième phase.
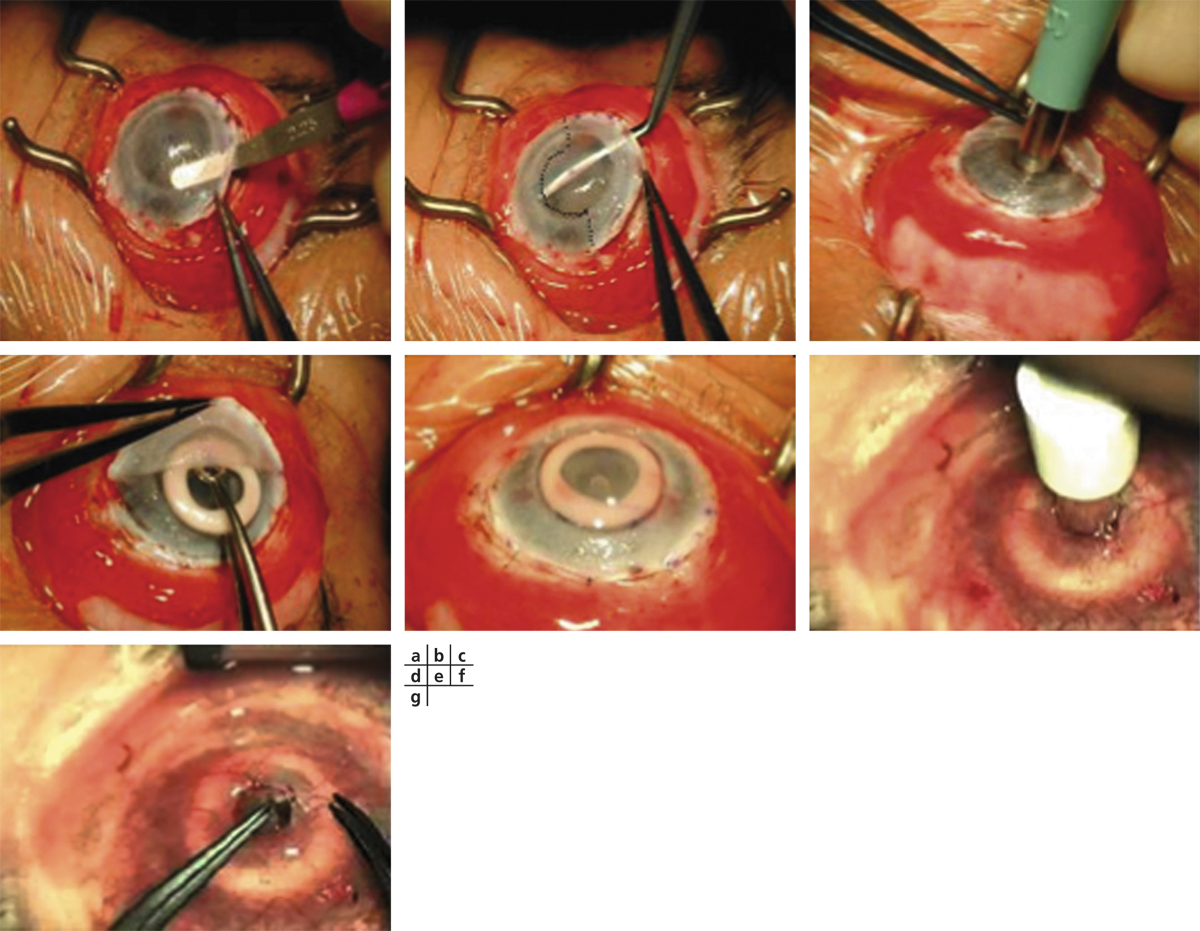
Fig. 20-25 Kératoprothèse de type AlphaCor®.
Première phase chirurgicale : dissection lamellaire stromale (a, b) ; trépanation du lit cornéen postérieur (c) ; positionnement de l’AlphaCor® (d) ; suture du capot cornéen (e). Seconde phase chirurgicale : trépanation du capot cornéen superficiel (f) ; exposition de l’optique de la kératoprothèse (g).
L’indication préférentielle de cette kératoprothèse concerne les patients présentant des échecs de greffe à répétition avec une surface oculaire préservée et non inflammatoire.
Les premières implantations de la kératoprothèse développée par Chirila ont été réalisées chez l’homme dès 1998 [26]. Les principales caractéristiques de cette kératoprothèse sont de présenter une excellente biocompatibilté liée à sa composition en pHEMA [27], l’absence de jonction mécanique entre la jupe et l’optique ainsi qu’une procédure chirurgicale d’implantation peu invasive. Les résultats rapportés dans la littérature comportent plus de 400 implantations [28–33] avec un recul jusqu’à 7 ans. Hicks, Crawford et al. [28] ont rapporté la plus importante série d’implantation de kératoprothèses AlphaCor® avec 322 dispositifs et un suivi moyen de 15,5 mois. L’acuité visuelle moyenne postopératoire était de 20/200 (de compte les doigts à 20/20). La probabilité de rétention de l’AlphaCor• à 6 mois, 1 et 2 ans était respectivement de 92, 80 et 62 %. La principale complication était la nécrose stromale (26,4 %), les membranes rétroprothétiques (5,1 %) et la survenue de dépôts sur l’optique (2,6 %). L’incidence limitée des nécroses tissulaires rapportée dans ces séries peut être rattachée à l’utilisation systématique postopératoire de médroxyprogestérone topique à 1 % et à une sélection stricte des patients excluant tout antécédent de kératite herpétique ou de pathologie inflammatoire évolutive de la surface oculaire. Dans notre série personnelle, avec un recul moyen de 15,6 ± 5,6 mois, les complications postopératoires observées sont essentiellement la survenue d’une kératolyse (50 % des cas) et l’apparition d’une membrane rétroprothétique (21 %). Les cas de nécrose stromale sont survenus chez les patients présentant des antécédents d’atteinte inflammatoire de la surface oculaire, de syndrome sec oculaire ou de kératite herpétique. Le taux de rétention de la prothèse à l’issue du suivi est de 71,4 % dans notre série [34]. Ce chiffre est comparable au taux de survie à 1 an (soit 73 %) d’une quatrième allogreffe de cornée [4], d’où l’intérêt de l’utilisation de ce dispositif au-delà de la troisième kératoplastie sans exposer le patient aux complications potentiellement létales liées à l’utilisation d’une immunosuppression systémique. Nos résultats confirment les études précédentes sur la nécessité de la sélection des candidats à l’AlphaCor® selon des critères d’inclusion stricts.
La kératoprothèse KeraClear® est un modèle de kératoprothèse souple prévu pour une implantation intrastromale par une incision de 3 mm. Cette kératoprothèse permet de remplacer le stroma antérieur d’une façon analogue à une kératoplastie lamellaire antérieure. L’implantation consiste à réaliser une dissection d’une poche intrastromale d’un diamètre de 8 mm à l’aide d’un laser femtoseconde après résection du stroma antérieur. Cette kératoprothèse nécessite donc la présence d’un stroma postérieur ayant conservé une transparence satisfaisante. Ce mode d’implantation permet néanmoins d’éviter la survenue des complications potentiellement sévères liées aux implantations transfixiantes telles que l’endophtalmie ou l’apparition d’une membrane rétroprothétique.
La kératoprothèse KeraClear® est proposée comme une alternative à l’allogreffe de cornée dans les zones géographiques où l’obtention de greffons cornéens est délicate. Elle est également indiquée dans le cas de rejets multiples et en l’absence d’opacités stromales postérieures importantes.
Peu de données sont disponibles dans la littérature ; un cas unique après brûlure oculaire alcaline cas a été rapporté avec un recul postopératoire d’un mois [35].
L’implantation d’une kératoprothèse reste une technique complexe proposée aux patients en cécité cornéenne bilatérale et ne pouvant bénéficier d’une kératoplastie. Un nombre limité de dispositifs sont disponibles pour les applications cliniques et les indications des différents dispositifs peuvent être schématisées selon l’arbre décisionnel de la figure 20-26.
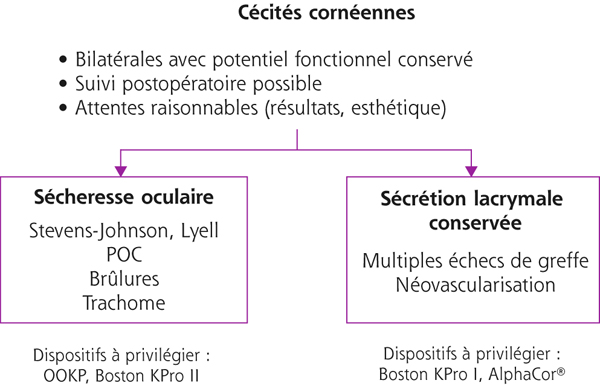
Fig. 20-26 Indications des kératoprothèses.
Le traitement postopératoire précoce nécessite une corticothérapie locale et systémique afin de contrôler les phénomènes inflammatoires oculaires, mais une durée de prescription limitée est recommandée du fait du risque de survenue d’une nécrose des tissus du receveur au contact de la kératoprothèse. Une antibiothérapie par voie générale est nécessaire au cours de la première semaine ainsi qu’une antibiothérapie locale qui sera poursuivie indéfiniment. La surveillance doit rechercher l’apparition ou l’aggravation d’une hypertonie oculaire (par palpation bidigitale, examen de la papille au travers de l’optique ou par une modification du champ visuel) et un traitement hypotonisant sera indiqué le cas échéant. La réalisation d’un champ visuel est indispensable tous les 3 mois la première année, puis de façon biannuelle. La surveillance postopératoire doit être hebdomadaire au cours du premier mois puis mensuelle indéfiniment. Une échographie en mode B est utile pour la détection précoce d’un décollement de rétine ou de la survenue d’une hyalite.
Les principales complications observées après une implantation de kératoprothèse sont essentiellement représentées par :
la survenue d’une hypertonie postopératoire : l’hypertonie intra-oculaire est une complication fréquente après implantation de kératoprothèse (15 % des patients après implantation de Boston KPro [36] et jusqu’à 47 % après OOKP [37]). La surveillance est délicate du fait de l’impossibilité de la mesure de la pression intra-oculaire (PIO) par aplanation au travers des optiques rigides des kératoprothèses. Le diagnostic d’une hypertonie repose sur l’appréciation de la PIO par palpation digitale, de l’aspect de la papille à l’examen du fond d’œil et de modifications du champ visuel. Des dispositifs de mesure transclérale permettent une bonne approximation de la PIO mais sont peu diffusés en pratique clinique. L’utilisation des analyseurs de fibres optiques est possible avec néanmoins des difficultés d’acquisition du signal au travers des optiques prothétiques [38]. Le traitement d’une hypertonie après implantation de kératoprothèse est délicat du fait de la mauvaise pénétration intra-oculaire des substances pharmacologiques au travers d’une surface oculaire remaniée et le recours aux hypotonisants par voie systémique est fréquent. Le traitement chirurgical d’une hypertonie résistante au traitement médical est souvent indiqué et nécessite le recours à une implantation de dispositif de drainage de l’humeur aqueuse telle une valve d’Ahmed [5], ou à une cyclophotodestruction voire une endophotocoagulation des corps ciliaires [39] ;
la nécrose aseptique des tissus receveurs : la désinsertion de la kératoprothèse est associée à une nécrose des tissus au contact du matériau constituant la prothèse. Cette zone nécrotique sera éventuellement spontanément occluse par la formation d’un tissu cicatriciel fibrovasculaire luxant la prothèse en avant. La fréquence de survenue des phénomènes de kératolyse dépend des matériaux utilisés pour la conception du dispositif (18 % après implantation de Boston KPro [40] et jusqu’à 50 % après implantation d’AlphaCor® [34]). L’évolution se fait alors fréquemment vers une phtyse ;
la formation d’une membrane rétroprothétique : jusqu’à 32 % des patients après implantation de Boston KPro [41] et 21 % après implantation d’AlphaCor® [34]. Celle-ci peut relever d’une simple membranotomie par laser Nd:YAG et, en cas d’échec, d’un abord chirurgical par la pars plana avec dissection instrumentale de la membrane fibreuse [5, 42] ;
les atteintes du segment postérieur sont essentiellement représentées par la survenue d’un décollement de rétine (17 % après implantation de Boston KPro [43] et jusqu’à 26 % après implantation d’OOKP [37]). La prise en charge chirurgicale est complexe du fait de la visualisation peropératoire limitée du fond d’œil au travers du système optique de la prothèse et peut nécessiter une chirurgie endoscopique [5, 42]. Une endophtalmie peut être associée à une expulsion de prothèse ou à l’apparition d’une déhiscence entre la cornée receveuse et la prothèse avec une perte de l’étanchéité du montage (incidence de 8 % après OOKP [37]). L’utilisation d’une antibioprophylaxie locale à vie est nécessaire.
L’implantation d’une kératoprothèse reste une technique complexe proposée aux patients au stade de cécité cornéenne bilatérale et ne pouvant bénéficier d’une kératoplastie. Des avancées importantes dans le domaine des kératoprothèses ont été réalisées du fait de la meilleure connaissance des biomatériaux, de l’amélioration des techniques chirurgicales et des traitements postopératoires. Cependant, il persiste de nombreuses interrogations concernant les mécanismes biologiques d’intégration ou de résorption tissulaire associés à l’implantation cornéenne d’un biomatériau. Les complications potentiellement sévères associées aux kératoprothèses et la disponibilité limitée des greffons cornéens humains dans le monde motivent le développement de nouveaux concepts de cornées artificielles. Les principales complications associées aux kératoprothèses sont essentiellement liées à la biocompatibilité et à la stabilité du matériau au sein du tissu receveur ; par ailleurs, des dispositifs requérant une chirurgie moins invasive, tels qu’une implantation supra-descemétique, sont en cours d’évaluation. Les voies de recherche actuelles portent essentiellement sur le développement par génie tissulaire de prothèses composites associant composés biosynthétiques et tissus naturels. Des biopolymères pouvant être colonisés par les kératocytes et les nerfs cornéens du receveur sont également une avancée importante en termes de stabilité des dispositifs. Une série de dix patients présentant un kératocône et ayant bénéficié d’une implantation d’un greffon cornéen biosynthétique avec un suivi de 24 mois postopératoires a démontré la faisabilité d’une telle technique, les implants ayant conservé leur transparence sans réaction de rejet associée [19]. L’indice de réfraction, la transparence et les propriétés mécaniques de ces nouveaux matériaux approchent ceux de la cornée naturelle [44]. Une autre voie de recherche concerne le développement de cornées artificielles totalement biologiques et synthétisées à partir de collagène humain recombinant [20]. Les résultats chez l’animal montrent une bonne intégration tissulaire, avec une recolonisation par les kératocytes et une régénération des nerfs intracornéens. Ces substituts, en cours d’évaluation chez l’homme, semblent prometteurs avec toutefois des résultats encore inférieurs à ceux obtenus avec des greffons d’origine humaine, mais la faisabilité de la production de tissu cornéen par transformation de fibroblastes, de cellules épithéliales et endothéliales sans utilisation de matériel tissulaire exogène a été démontrée [45]. Le champ d’application des kératoprothèses a bénéficié d’importantes avancées dans le domaine des biomatériaux et des traitements postopératoires au cours des dernières décennies. Les développements futurs associeront probablement à ces biomatériaux les techniques de thérapie cellulaire afin de permettre une meilleure intégration de ces dispositifs et de poursuivre la progression des résultats postopératoires en termes de rétention et d’acuité visuelle.
[1] Whitcher JP, Srinivasan M, Upadhyay MP. Corneal blindness : a global perspective. Bull World Health Organ 2001 ; 79 : 214-21.
[2] Klaver CC, et al. Age-specific prevalence and causes of blindness and visual impairment in an older population : the Rotterdam Study. Arch Ophthalmol 1998 ; 116 : 653-8.
[3] Tuppin P, et al. Corneal graft activity in France (1990–2005) : decreasing the gap between supply and demand. J Fr Ophtalmol 2007 ; 30 : 475-82.
[4] Yildiz EH, et al. Third or greater penetrating keratoplasties : indications, survival, and visual outcomes. Cornea 2010 ; 29 : 254-9.
[5] Liu C, et al. The osteo-odonto-keratoprosthesis (OOKP). Semin Ophthalmol 2005 ; 20 : 113-28.
[6] Hughes EH, et al. Vitreoretinal complications of osteoodontokeratoprosthesis surgery. Retina 2008 ; 28 : 1138-45.
[7] Stone W Jr, Herbert E. Experimental study of plastic material as replacement for the cornea ; a preliminary report. Am J Ophthalmol 1953 ; 36 : 168-73.
[8] Cardona, H. Keratoprosthesis ; acrylic optical cylinder with supporting intralamellar plate. Am J Ophthalmol 1962 ; 54 : 284-94.
[9] Barber JC, Feaster F, Priour D. The acceptance of a vitreous carbon alloplastic material, Proplast, in the rabbit eye. Invest Ophthalmol Vis Sci 1980 ; 19 : 182-91.
[10] Legeais JM, et al. Tissue colonization of expanded polytetrafluoroethylene in healthy cornea in the view of its use as a support in keratoprosthesis. J Fr Ophtalmol 1988 ; 11 : 727-32.
[11] Legeais JM, Renard G, Pouliquen Y. Keratoprosthesis with biocolonizable support. J Fr Ophtalmol 1993 ; 16 : 577-83.
[12] Legeais JM, et al. Expanded fluorocarbon for keratoprosthesis cellular ingrowth and transparency. Exp Eye Res 1994 ; 58 : 41-51.
[13] Chirila TV, Hicks CR. The origins of the artificial cornea : Pellier de Quengsy and his contribution to the modern concept of keratoprosthesis. Gesnerus 1999 ; 56 : 96-106.
[14] Choyce DP. The present status of keratoprosthesis. Isr J Med Sci 1972 ; 8 : 1285-9.
[15] Girard LJ, et al. Prosthetosclerokeratoplasty-implantation of a keratoprosthesis using full-thickness onlay sclera and sliding conjunctival flap. Trans Am Acad Ophthalmol Otolaryngol 1969 ; 73 : 936-61.
[16] Polack FM. Editorial : Keratoprosthesis. Invest Ophthalmol 1976 ; 15 : 593-5.
[17] Chirila TV, Crawford GJ. A controversial episode in the history of artificial cornea : the first use of poly(methyl methacrylate). Gesnerus 1996 ; 53 : 236-42.
[18] Strampelli B, Valvo A, Tusa E. Osteo-odonto-keratoprosthesis in a case treated for anchylobepharon and total simbleraphon. Ann Ottalmol Clin Ocul 1965 ; 91 : 462-79.
[19] Fagerholm P, et al. A biosynthetic alternative to human donor tissue for inducing corneal regeneration : 24-month follow-up of a phase 1 clinical study. Sci Transl Med 2010 ; 2 : 46ra61.
[20] Polisetti N, Islam MM, Griffith M. The artificial cornea. Methods Mol Biol 2013 ; 1014 : 45-52.
[21] Gomaa A, Comyn O, Liu C. Keratoprostheses in clinical practice – a review. Clin Experiment Ophthalmol 2010 ; 38 : 211-24.
[22] Aldave AJ, et al. The Boston type I keratoprosthesis : improving outcomes and expanding indications. Ophthalmology 2009 ; 116 : 640-51.
[23] Falcinelli G, et al. Modified osteo-odonto-keratoprosthesis for treatment of corneal blindness: long-term anatomical and functional outcomes in 181 cases. Arch Ophthalmol 2005 ; 123 : 1319-29.
[24] Temprano J. Keratoprosthesis with tibial autograft. Refractive & Corneal Surgery 1993 ; 9 : 192.
[25] Hicks CR, Crawford GJ. Melting after keratoprosthesis implantation : the effects of medroxyprogesterone. Cornea 2003 ; 22 : 497-500.
[26] Hicks C, et al. Development and clinical assessment of an artificial cornea. Prog Retin Eye Res 2000 ; 19 : 149-70.
[27] Hicks CR, et al. PHEMA as a keratoprosthesis material. Br J Ophthalmol 2006 ; 90 : 124.
[28] Hicks CR, et al. AlphaCor : clinical outcomes. Cornea 2006 ; 25 : 1034-42.
[29] Jiraskova N, et al. AlphaCor artificial cornea : clinical outcome. Eye (Lond) 2012 ; 25 : 1138-46.
[30] Holak SA, Holak HM, Bleckmann H. AlphaCor keratoprosthesis : postoperative development of six patients. Graefes Arch Clin Exp Ophthalmol 2009 ; 247 : 535-9.
[31] Ngakeng V, et al. AlphaCor keratoprosthesis : a novel approach to minimize the risks of long-term postoperative complications. Cornea 2008 ; 27 : 905-10.
[32] Bleckmann, H. and S. Holak, Preliminary results after implantation of four AlphaCor artificial corneas. Graefes Arch Clin Exp Ophthalmol 2006 ; 244 : 502-6.
[33] Crawford GJ, Eguchi H, Hicks CR. Two cases of AlphaCor surgery performed using a small incision technique. Clin Experiment Ophthalmol 2005 ; 33 : 10-15.
[34] Trichet E, et al. AlphaCor keratoprosthesis : device, surgical technique and clinical outcomes. J Fr Ophtalmol 2013 ; 36 : 393-401.
[35] Alio J, Abbouda A, Vega-Estrada A. An innovative intrastromal keratoprosthesis surgery assisted by femtosecond laser. Eur J Ophthalmol 2014 ; 24 : 490-3.
[36] Magalhaes FP, Sousa LB, Oliveira LA. Boston type I keratoprosthesis : review. Arq Bras Oftalmol 2012 ; 75 : 218-22.
[37] Tan A, et al. Osteo-odonto keratoprosthesis : systematic review of surgical outcomes and complication rates. Ocul Surf 2012 ; 10 : 15-25.
[38] Kumar RS, et al. Glaucoma management in patients with osteo-odonto-keratoprosthesis (OOKP) : the Singapore OOKP Study. J Glaucoma 2009 ; 18 : 354-60.
[39] Parthasarathy A, et al. Endoscopic cyclophotocoagulation for the management of advanced glaucoma after osteo-odonto-keratoprosthesis surgery. Clin Experiment Ophthalmol 2008 ; 36 : 93-4.
[40] Aldave AJ, et al. International results with the Boston type I keratoprosthesis. Ophthalmology 2012 ; 119 : 1530-8.
[41] Sivaraman KR, et al. Retroprosthetic membrane and risk of sterile keratolysis in patients with type I Boston Keratoprosthesis. Am J Ophthalmol 2013 ; 155 : 814-22.
[42] Khan B, Dudenhoefer EJ, Dohlman CH. Keratoprosthesis : an update. Curr Opin Ophthalmol 2001 ; 12 : 282-7.
[43] Goldman DR, et al. Postoperative posterior segment complications in eyes treated with the Boston type I keratoprosthesis. Retina 2013 ; 33 : 532-41.
[44] Hartmann L, et al. Toward the development of an artificial cornea : improved stability of interpenetrating polymer networks. J Biomed Mater Res B Appl Biomater 2011 ; 98 : 8-17.
[45] Proulx S, et al. Reconstruction of a human cornea by the self-assembly approach of tissue engineering using the three native cell types. Mol Vis 2010 ; 16 : 2192-201.
P.-Y. Robert
La chirurgie palpébrale doit toujours être programmée en tenant compte des éléments suivants : état de la lamelle antérieure et de la lamelle postérieure ; fonctionnement de la pompe lacrymale ; position du bord libre ; position du pli palpébral supérieur ; état des tendons canthaux. En cas de maladie de la membrane basale, la chirurgie est pratiquement contre-indiquée. La réparation de la surface oculaire peut faire appel à une greffe de muqueuse buccale ou de membrane amniotique. La chirurgie de la pompe lacrymale peut faire appel à des techniques très simples (résection caronculaire dans un effet mèche), standard (plastie ou repositionnement du point lacrymal) ou très compliquées (canthoplastie interne pour remettre en tension le muscle de Duverney-Horner). La remise en bonne position de la bordure ciliaire dans l’entropion, l’ectropion ou le trichiasis nécessite une analyse de toutes les forces en présence.
Les paupières sont séparables en deux parties, selon un plan de clivage chirurgical : d’une part la lamelle antérieure, constituée de la peau et du muscle orbiculaire ; d’autre part la lamelle postérieure, constituée du tarse et de la conjonctive. La lamelle antérieure forme la partie visible des paupières, la lamelle postérieure en constitue la charpente. Le tarse a également un rôle dans l’élasticité des paupières et sa bonne tenue devant le globe oculaire dans toutes les positions du regard.
Toute chirurgie des paupières repose sur l’intervention conjointe ou dissociée sur ces deux éléments, qui doivent toujours être considérés chirurgicalement séparément l’un de l’autre [1].
Il est possible de cliver lamelle antérieure et lamelle postérieure depuis la bordure ciliaire, en incisant un espace situé entre les orifices des glandes de Meibomius et les follicules pileux des cils appelé ligne grise.
La peau des paupières est la plus fine de l’organisme, elle est divisée en trois régions : prétarsale, préseptale et orbitaire. La partie prétarsale de la paupière supérieure est parcourue par les fibres terminales de l’aponévrose du releveur, il est impossible de l’en dissocier. Cette partie prétarsale est marquée en haut par le pli palpébral supérieur, qui marque l’insertion du septum orbitaire. Les voies d’abord les plus fréquentes en chirurgie palpébrale sont :
la région du pli palpébral en paupière supérieure (qui permet d’aborder facilement l’orbite à travers le septum, ou l’aponévrose palpébrale en chirurgie du ptosis par exemple) ;
la ligne sous-ciliaire en paupière inférieure ;
les plis de la patte-d’oie en temporal.
Le respect de ces voies d’abord permet de se prémunir d’une cicatrice disgracieuse.
On distingue les muscles rétracteurs (releveur de la paupière supérieure et rétracteurs en paupière inférieure), et les muscles protracteurs (principalement le muscle orbiculaire, mais également d’autres muscles : muscles corrugateur et procerus dans la région de la glabelle et muscle frontal). L’analyse de la fonction de ces différents muscles est indispensable avant toute chirurgie.
Les paupières sont amarrées aux reliefs antérieurs osseux par deux ligaments : le tendon canthal interne (TCI) et le tendon canthal externe (TCE). Le TCE est plus développé car il supporte davantage la force élévatrice du releveur, et le TCI est intimement intriqué avec l’appareil lacrymal. Les tendons canthaux sont également les lieux d’insertion du septum orbitaire et doivent être repérés et réparés à chaque fois qu’on souhaite remettre en tension la sangle tarsoligamentaire.
La chirurgie conjonctivale se pose lorsque la conjonctive est remaniée, lorsqu’il y a une perte de substance ou lorsque des brides (symblépharons : fig. 20-27 à 20-29) viennent perturber la statique palpébrale.
Les indications thérapeutiques dépendent de l’état de la conjonctive et surtout de sa membrane basale. Lorsque le trouble est une perte de substance après exérèse de tumeur ou traumatisme, la membrane basale est présumée normale et la cicatrisation ne posera pas de problème lorsqu’on mettra éventuellement en place une greffe ou un lambeau.
S’il s’agit au contraire d’une maladie de la membrane basale (pemphigoïde oculaire cicatricielle, syndrome de Stevens-Johnson par exemple), le problème vient de la membrane basale et on ne pourra pas compter sur la cicatrisation. Dans ces cas-là, toute chirurgie est pratiquement vouée à l’échec.
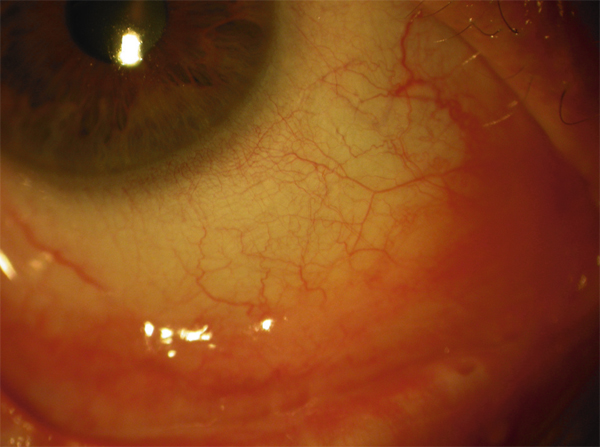
Fig. 20-27 Symblépharon : stade II.
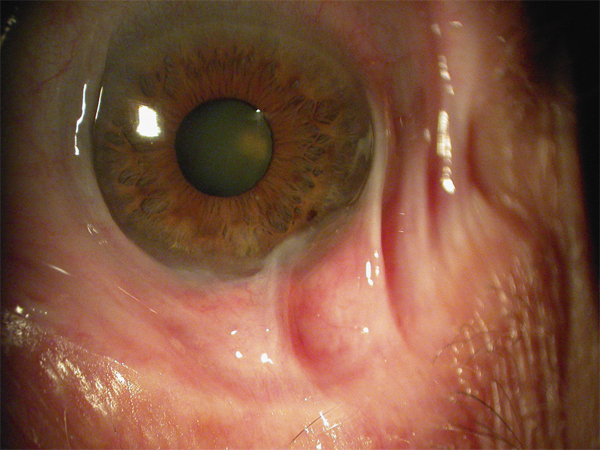
Fig. 20-28 Symblépharon : stade III.
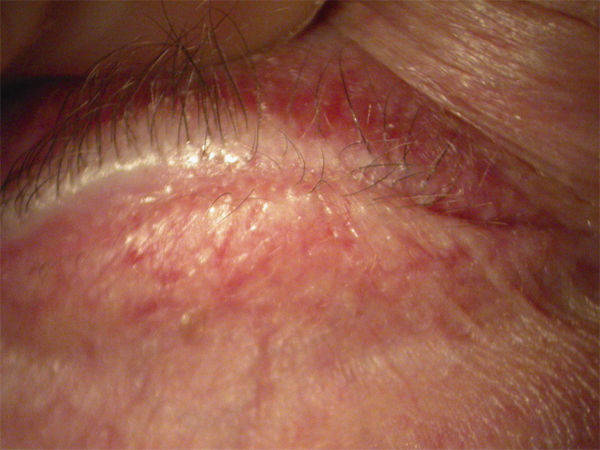
Fig. 20-29 Symblépharon : stade IV.
Dans les cas simples, il est possible de simplement sectionner un symblépharon, libérer la conjonctive de ses attaches ténoniennes, retirer la capsule de Tenon en cause, et laisser la conjonctive en cicatrisation dirigée, guidée éventuellement par un verre scléral [2]. Cette technique, possible uniquement en l’absence de maladie de la membrane basale, a été rapportée avec succès dans 40 yeux de 38 patients atteints de brides post-traumatiques [3].
Lorsque la perte de substance conjonctivale est trop importante, il faut la combler par un tissu de remplacement.
La muqueuse buccale est une greffe de toute l’épaisseur de la muqueuse, qui a l’avantage d’apporter à la fois l’épithélium muqueux et son tissu de soutien. Ses inconvénients sont le risque de nécrose du greffon et l’hypertrophie cicatricielle (bourgeon charnu) [4].
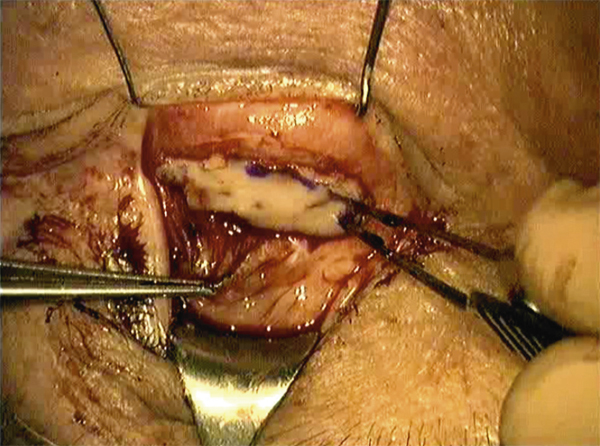
Fig. 20-30 Greffe de muqueuse buccale pour plastie du cul-de-sac inférieur.
La membrane amniotique, à l’inverse, vient jouer le rôle d’une membrane basale de substitution et apporte des facteurs de croissance [5]. La membrane doit être mise en place entre la sclère et la conjonctive, après dissection des tissus muqueux pathologiques. Si l’on veut que la conjonctive cicatrise correctement par-dessus la membrane, il faut prévoir de mettre en place une membrane amniotique plus grande que la perte de substance. Cette greffe peut ainsi réaliser sur de grandes pertes de substances la plastie d’un cul-de-sac entier. Dans ce cas, on pourra mettre en place des points de rappel entre le fond du néo-cul-de-sac et la peau pour éviter la rétraction de la membrane. L’utilisation d’un conformateur est également utile. Les principaux facteurs de risque de récidive postopératoire sont la sécheresse oculaire, les récidives antérieures, la sévérité du tableau initial et la présence ou non de reliquats de conjonctive saine en préopératoire [6, 7].
Le succès d’une greffe de membrane amniotique pour reconstruire un cul-de-sac dépend de l’état conjonctival et de l’inflammation locale. Les complications les plus fréquentes sont l’expulsion prématurée de la membrane, le bourgeon charnu et la récidive d’une bride lorsque l’inflammation postopératoire est trop importante. La corticothérapie postopératoire permet de juguler l’inflammation et de limiter les complications et les récidives.
Les meilleurs résultats sont obtenus avec la pemphigoïde oculaire cicatricielle, notamment avec une stabilisation [8, 9], mais avec souvent une détérioration rapide dans les mois qui suivent [10].
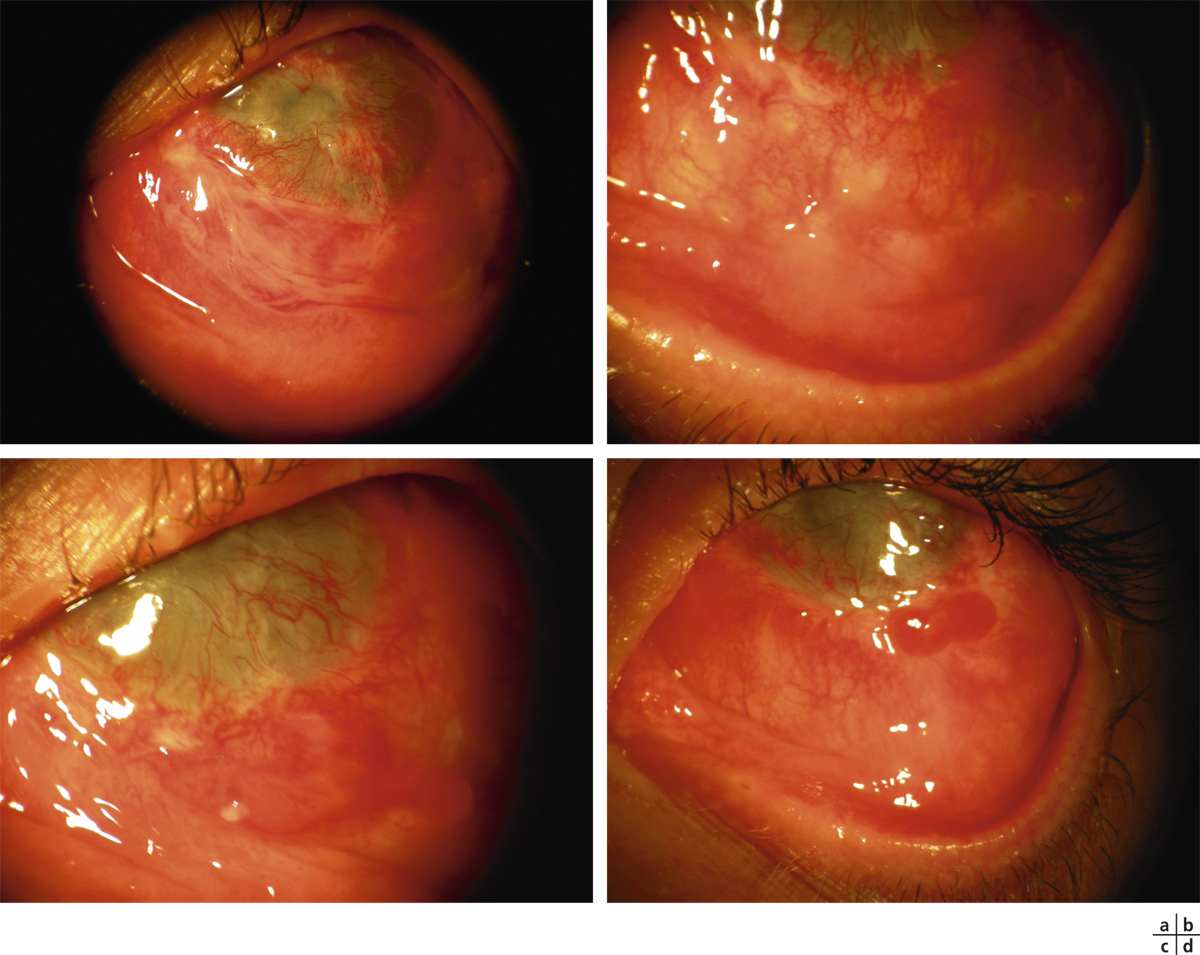
Fig. 20-31 Résultats postopératoires d’une greffe de membrane amniotique en plastie du cul-de-sac inférieur à J1 (a), J8 (b), J15 (c) et J30 (d).
L’évacuation correcte des larmes est essentielle pour un fonctionnement convenable de la surface oculaire. Les points lacrymaux, qui sont les émonctoires des larmes, doivent pour fonctionner correctement réunir les caractères suivants :
ne pas être sténosés ;
être orientés vers la conjonctive bulbaire ;
être au contact de la rivière lacrymale ;
exercer une aspiration active à chaque clignement grâce à la mise en tension du muscle de Duverney-Horner.
Une analyse fine du fonctionnement de la pompe lacrymale permet d’orienter la réparation chirurgicale.
Parfois la région caronculaire est responsable d’un dysfonctionnement de la pompe lacrymale. Une hypertrophie, une cicatrice, une tumeur bénigne placées dans la région caronculaire sont susceptibles de perturber la pompe lacrymale par :
effet clapet : obstruction des points lacrymaux ;
effet mèche (fig. 20-32) : drainage des larmes par capillarité vers la peau par un élément protrusif dans l’angle interne.
Dans ces cas, la simple résection de la caroncule ou de la tumeur en cause suffit à régler le problème. Le piège est de ne pas voir qu’il s’agit d’un larmoiement à voies lacrymales perméables et de se lancer dans une chirurgie inappropriée des voies lacrymales.
Fig. 20-32 Effet mèche par une tumeur de la caroncule.
Les sténoses congénitales, post-traumatiques ou post-inflammatoires des points lacrymaux peuvent être traitées par simple dilatation lorsqu’un orifice est encore visible. Si ce n’est pas le cas, il faut pratiquer une plastie du point lacrymal.
La technique consiste à sectionner la partie proximale du canalicule, dans sa partie verticale, et à marsupialiser l’ouverture du canalicule à la face conjonctivale de la paupière en suturant la muqueuse lacrymale à la muqueuse conjonctivale par deux ou trois points de fil résorbable 8/0 à nœuds auto-enfouis. Pour éviter les sténoses postopératoires, on peut mettre en place une sonde Mini-Monoka® pendant 1 à 3 mois.
Il arrive que le point lacrymal inférieur soit éloigné de la surface oculaire pour des raisons de relâchement sénile des tissus (ectropion sénile) ou par faiblesse de l’orbiculaire et du muscle de Duverney-Horner (paralysie faciale). Dans ce cas, deux techniques sont à considérer : la plastie du point lacrymal inférieur et la canthoplastie interne.
C’est la technique la plus simple. Elle consiste à effectuer une bascule du point lacrymal inférieur par une action directe sur son tissu de soutien. La technique d’Adenis consiste en une incision en losange à la face conjonctivale de la paupière, en regard du point lacrymal. Un fil résorbable 8/0 doublement serti est ensuite passé sur la muqueuse au sommet supérieur de ce losange, puis sur les bords du losange et enfin à son sommet inférieur, et amenés pour finir à la peau à l’aplomb du sommet inférieur. La mise en traction de ce fil permet une entropionisation du point lacrymal qui suffit dans un grand nombre de cas.
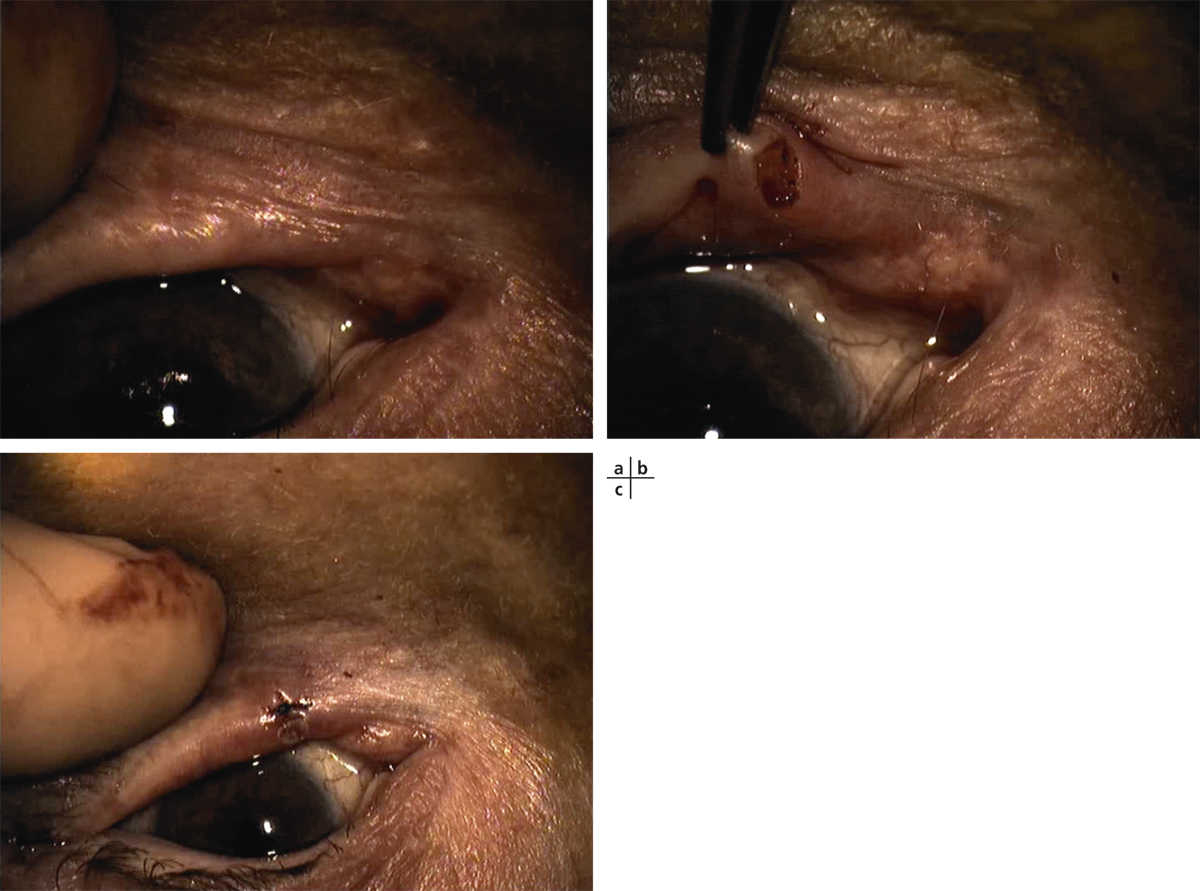
Fig. 20-33 Plastie du point lacrymal inférieur dans un cas d’atrésie post-infectieuse.
Aspects : préopératoire (a), après incision (b) et après suture canaliculaire au fil résorbable 8/0, suture de la peau au fil non résorbable 6/0 et mise en place d’une sonde monocanaliculaire (c).
Dans les autres cas, en particulier lorsqu’il existe un syndrome du lac lacrymal creux (ou syndrome du Centurion), c’est-à-dire lorsqu’il existe un espace trop grand entre les paupières et la surface du globe oculaire dans l’angle interne, les points lacrymaux se trouvent éloignés du globe et ne peuvent plus jouer leur rôle de pompe.
Il convient alors d’effectuer une remise en tension du tendon canthal interne, pour l’amener derrière le sac lacrymal sur la crête lacrymale postérieure. C’est là toute la difficulté qui rend cette opération beaucoup plus délicate que la canthoplastie externe. Plusieurs techniques ont été décrites qui diffèrent notamment dans la voie d’abord (cutanée ou rétrocaronculaire). La technique consiste à passer un fil résorbable 6/0 entre le tarse à l’aplomb du point lacrymal et la crête lacrymale postérieure. Si l’on choisit la voie d’abord cutanée, il faut utiliser la même dissection que pour une dacryocystorhinostomie et soulever le périoste, jusqu’à la crête lacrymale postérieure. On pratique alors une incision cutanée à l’aplomb des points lacrymaux et on dissèque les espaces sous-cutanés jusqu’à la crête lacrymale postérieure. Un fil résorbable 6/0 peut ensuite être passé entre le tarse et la crête lacrymale postérieure, d’où il peut être récupéré par l’abord cutané préalablement réalisé.
Si l’on choisit la voie rétrocaronculaire, on effectue une incision conjonctivale et la dissection amène naturellement à la crête lacrymale postérieure en contournant l’appareil lacrymal latéralement. Il suffit ensuite d’effectuer une incision conjonctivale en regard du point lacrymal, et le fil résorbable 6/0 est ensuite passé entre le tarse et la crête lacrymale postérieure selon un chemin sous-muqueux.
Les principales indications de la canthoplastie interne sont les dysfonctions de la pompe lacrymale secondaires à une paralysie faciale (fig. 20-34).
Les troubles liés au relâchement des tissus sont très fréquents chez les patients âgés. En paupière inférieure, ils occasionnent un ectropion (le plus souvent) ou un entropion (en cas d’hyperaction conjointe de l’orbiculaire).
La solution chirurgicale est la remise en tension de la paupière. Les techniques sont nombreuses, selon l’association des réparations de la lamelle antérieure et de la lamelle postérieure.
La plus courante est la canthoplastie externe selon la technique de la bande tarsale : la voie d’abord est toujours sous-ciliaire se prolongeant dans la patte-d’oie. Il s’agit toujours de sectionner le chef intérieur du tendon canthal externe, de le désépithélialiser, de l’amarrer au rebord orbitaire externe et d’associer une résection cutanée en fonction du tissu en excès.
Les techniques de raccourcissement de la paupière inférieure sont également pratiquées. Il convient toutefois de déterminer la forme de la résection du tarse en fonction de l’effet désiré : compte tenu de la cambrure naturelle du tarse, une résection d’un fragment de tarse plus large en haut aura un effet entropionnant, et une résection d’un fragment de tarse plus large en bas aura un effet ectropionnant.
Le contact des cils sur la cornée peut être lié à un entropion des cils (trichiasis) ou à une implantation d’une deuxième rangée de cils en arrière de la première (distichiasis : fig. 20-35). Les possibilités chirurgicales sont multiples [11].
L’entropion spasmodique, fréquent chez les sujets âgés, est lié à une action excessive de l’orbiculaire qui a rompu ses attaches et se retrouve en excès dans la région prétarsale. La sanction chirurgicale est la résection cutanée simple assortie d’une exérèse de l’orbiculaire en cause.
Pour les entropions avec bascule simple du tarse, les chirurgies de bascule simple peuvent suffire : il s’agit de provoquer la bascule en avant de la paupière, à l’aide de sutures passées dans l’appareil rétracteur (lamelle postérieure) et ramenées à la peau (lamelle antérieure). On peut ainsi réaliser de simples sutures isolées (technique de Wies), associer une exérèse de peau et d’orbiculaire (technique de Celse) ou un raccourcissement de la paupière lorsqu’une hyperlaxité horizontale est associée (technique de Quickert).
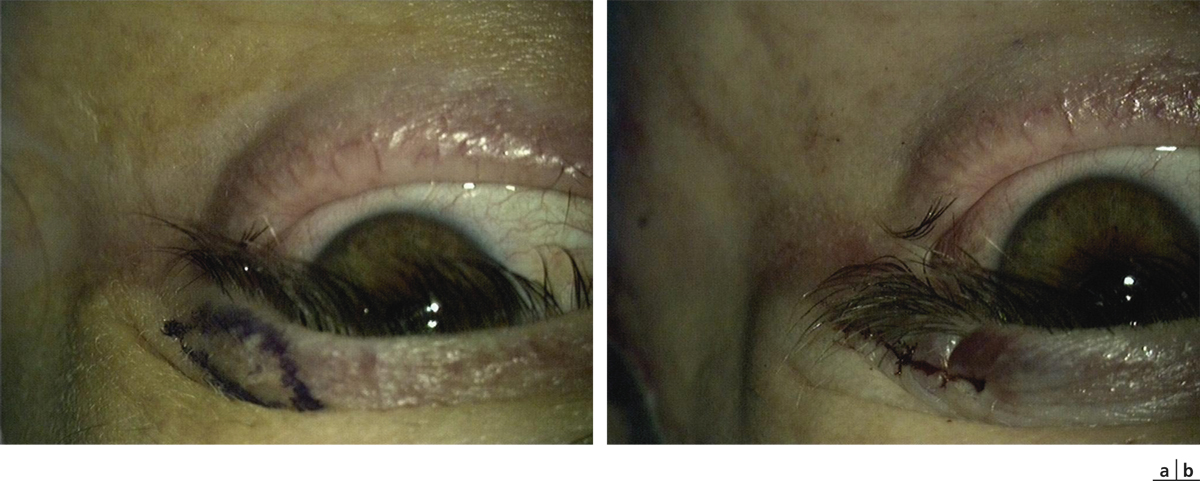
Fig. 20-35 Chirurgie d’éloignement de la bordure ciliaire dans un cas de distichiasis congénital.
Aspects préopératoire (a) et postopératoire immédiat (b).
Le distichiasis est défini comme la présence d’une deuxième rangée de cils, en arrière de la rangée physiologique. Elle peut avoir de graves répercussions sur la surface oculaire et entraîner une gêne importante. Les solutions passent par :
la destruction des follicules pileux (au laser Argon en mode continu, visant la racine du cil tenu à la pince, ou au bistouri électrique) ;
la résection pentagonale de la partie de paupière incriminée : dans ce cas, il faut veiller à reconstruire la paupière en deux temps, avec une suture du tarse directe et une reconstruction cutanée par lambeau.
Le trichiasis, à l’inverse, est défini par un contact des cils sur la cornée généré par une cicatrice conjonctivale et tarsale. Les chirurgies sont plus difficiles car il faut alors intervenir sur le tarse. Plusieurs options sont possibles :
la « fracture du tarse » : par voie postérieure, on pratique un trait de bistouri dans l’épaisseur du tarse et on ramène ainsi la paupière en position physiologique à l’aide de sutures éversantes, ou parfois à l’aide d’une greffe de tarse, prise en paupière controlatérale ou d’une greffe de cartilage rétro-auriculaire par exemple ;
la marginoplastie (fig. 20-36) : le but de cette chirurgie est d’éloigner les cils de la cornée. Il est possible d’inciser la bordure ciliaire selon la ligne grise et de séparer la lamelle antérieure de la lamelle postérieure. La suture se fait alors soit directement sur le tarse, mais à distance du bord libre, soit par interposition d’une greffe (greffe de membrane amniotique, de conjonctive ou de muqueuse buccale) ;
dans les cas les plus graves (trichiasis des syndromes dysimmunitaires ou du trachome par exemple), la technique de Trabut consiste à inciser le tarse et à basculer la bordure ciliaire en avant pour la suturer à la peau avec une bascule de 180°. Le résultat esthétique donne l’impression qu’on a retourné une partie du tarse, mais cette technique met définitivement la cornée à l’abri de la bordure ciliaire.
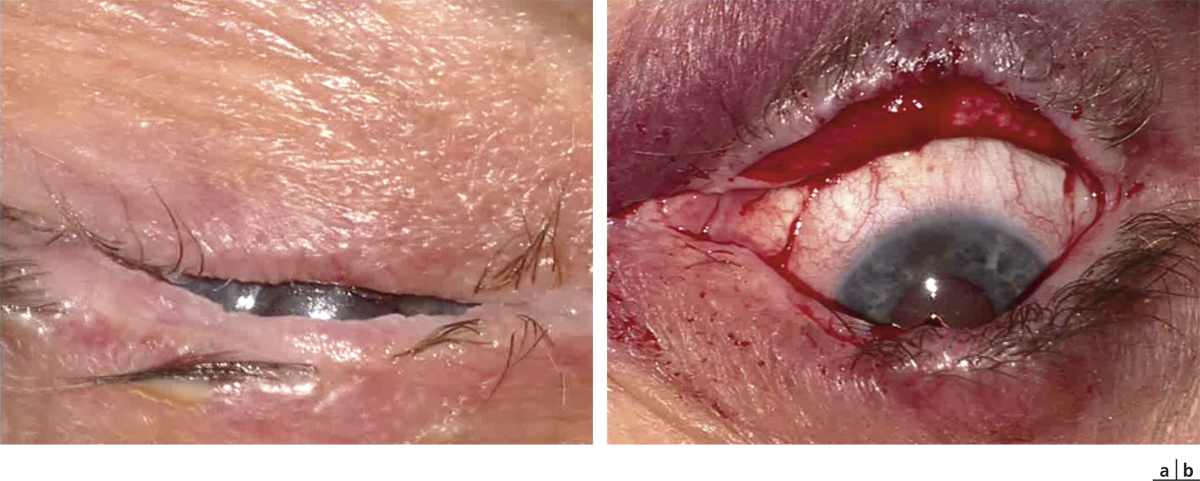
Fig. 20-36 Marginoplastie après syndrome de Stevens-Johnson.
Aspects préopératoire (a) et postopératoire immédiat (b).
[1] Robert PY, Adenis JP. Anatomie des paupières. In : Adenis JP. Chirurgie palpébrale. Issy-les-Moulineaux : Masson ; 2007, p. 1-15.
[2] Robert PY, Adenis JP, Symblépharons. In : Adenis JP. Chirurgie palpébrale. Issy-les-Moulineaux : Masson ; 2007, p. 147-9.
[3] Huang FM, Dong BS, Zhao JF, Hu ZC. A conjunctival pulling-back technique for treatment of serious symblepharon. Zhonghua Zheng Xing Wai Ke Za Zhi 2003 ; 19 : 118-9.
[4] Orth B, Press UP, Hubner H, Pleyer U. Transplantation of autologous oral mucosa in the treatment of a symblepharon in Wegener’s disease. A case report. Klin Monatsbl Augenheilkd 2001 ; 218 : 514-7.
[5] Solomon A, Espana EM, Tseng SC. Amniotic membrane transplantation for reconstruction of the conjunctival fornices. Ophthalmology 2003 ; 110 : 93-100.
[6] Zhou SY, Chen JQ, Chen LS, et al. Long-term results of amniotic membrane transplantation for conjunctival surface reconstruction. Zhonghua Yan Ke Za Zhi 2004 ; 40 : 745-9.
[7] Jain S, Rastogi A. Evaluation of the outcome of amniotic membrane transplantation for ocular surface reconstruction in symblepharon. Eye 2004 ; 18 : 1251-7.
[8] Honavar SG, Bansal AK, Sangwan VS, Rao GN. Amniotic membrane transplantation for ocular surface reconstruction in Stevens-Johnson syndrome. Ophthalmology 2000 ; 107 : 975-9.
[9] Barabino S, Rolando M. Amniotic membrane transplantation elicits goblet cell repopulation after conjunctival reconstruction in a case of severe ocular cicatricial pemphigoid. Acta Ophthalmol Scand 2003 ; 81 : 68-71.
[10] Barabino S, Rolando M, Bentivoglio G, et al. Role of amniotic membrane transplantation for conjunctival reconstruction in ocular-cicatricial pemphigoid. Ophthalmology 2003 ; 110 : 474-80.
[11] Adenis JP. Troubles de la statique palpébrale. In : Adenis JP. Chirurgie palpébrale. Issy-les-Moulineaux : Masson ; 2007, p. 18-67.
F. Majo, T. Hoang-Xuan
La reconstruction chirurgicale de la surface oculaire est le plus souvent complexe et nécessite du temps. Les préalables indispensables au succès de la chirurgie incluent un excellent contrôle de l’inflammation cornéo-conjonctivale et l’obtention d’un film lacrymal correct. Plusieurs actes opératoires sont en général nécessaires avec une séquence bien définie. Ils font appel aux différentes techniques de reconstruction tissulaire : restauration anatomique et fonctionnelle des paupières ; réfection des culs-de-sac conjonctivaux et libération des symblépharons ; greffes de membrane amniotique et de cellules souches limbiques ; kératoplasties pour restaurer la transparence cornéenne. Une connaissance globale de la surface oculaire est indispensable pour proposer la thérapeutique la plus adaptée au meilleur moment.
La destruction de la surface oculaire, dans ses formes les plus sévères, peut provoquer une cécité de transmission. La métaphore utilisée pour expliquer au patient sa maladie est celle d’une voiture inutilisable, non parce que son moteur serait en panne, mais parce que son pare-brise aurait perdu sa transparence (fig. 20-37). La prise en charge de ces patients demeure un « challenge » thérapeutique et a stimulé l’ingéniosité de nombreux ophtalmologistes. C’est ainsi qu’a été inventée l’ostéo-odonto-kératoprothèse pour traiter les cas les plus graves. Reconstruire une surface oculaire nécessite des connaissances provenant de la clinique humaine, de l’expérimentation animale et de la biologie cellulaire et moléculaire des épithéliums, ainsi qu’une excellente expérience chirurgicale.
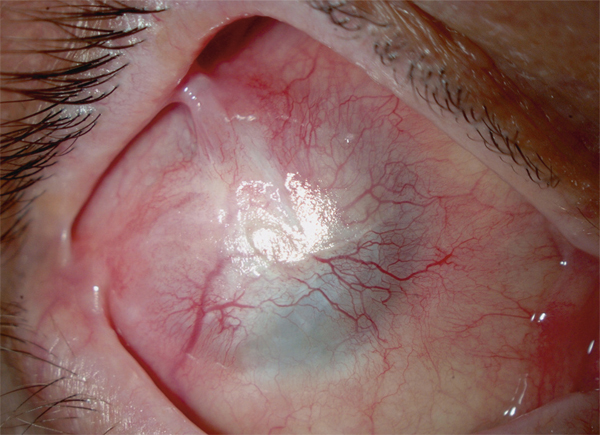
Fig. 20-37 Œil droit : 8 ans après une brûlure thermique par aluminium en fusion. Conjonctivalisation de toute la cornée et symblépharon supérieur.
Indication : reconstruction du fornix supérieur, autogreffe de limbe à partir de l’œil gauche, résection chirurgicale du pannus, greffe de membrane amniotique et greffe lamellaire antérieure profonde.
En 1983, Nelson et al. sont les premiers à parler de maladies de la surface oculaire [1]. Le praticien doit avoir une vision holistique de cette dernière qui est une entité fonctionnelle impliquant les paupières, la conjonctive dans son ensemble avec sa composante inflammatoire lymphoïde, la cornée et son innervation sensitive, la glande lacrymale et ses glandes accessoires et le film lacrymal [2] :
les paupières sont la première protection contre une agression. Leur destruction, même partielle, peut compromettre la reconstruction d’une surface oculaire détruite ;
la conjonctive recouvre la face postérieure des paupières (conjonctive palpébrale) et se replie au niveau des culs-de-sac conjonctivaux pour tapisser la surface antérieure du globe (conjonctive bulbaire) jusqu’au limbe cornéen. Elle possède des cellules épithéliales et des cellules à mucus. Sa matrice est un tissu lymphoïde très riche en cellules immunocompétentes, capables de lutter contre les agents pathogènes ;
le limbe est un élément stratégique de la surface oculaire. Il sépare la cornée transparente de la conjonctive et de la sclère qui sont vascularisées. Des cellules immunocompétentes sentinelles veillent, prêtes à réagir contre toute agression de la cornée. Le limbe est le siège des cellules souches cornéennes et sa reconstruction est essentielle après destruction de la surface oculaire ;
la cornée est le tissu le plus richement innervé sur le plan sensitif, ce qui lui permet une protection des yeux en cas d’agression externe grâce à la fermeture des paupières et au larmoiement réflexes. Cette sensibilité est responsable d’une homéostasie lacrymale assurant l’hydratation permanente de la surface oculaire. Le système de défense de la cornée est situé à sa périphérie, dans le limbe et la conjonctive ;
les glandes lacrymales assurent les larmoiements de base et réflexe ;
le film lacrymal recouvre la surface oculaire. Composé d’une phase mucinique, aqueuse et lipidique, son altération est responsable d’une sécheresse oculaire qui peut être très délétère.
Le modèle actuellement reconnu est celui de cellules souches uniquement situées dans le limbe (voir chapitre 1-IV). Mais il ne faut pas confondre renouvellement physiologique d’un épithélium et réparation d’un défect épithélial secondaire, par exemple, à un traumatisme accidentel ou chirurgical ou à une infection. Une large ulcération peut nécessiter 24 à 48 h pour cicatriser. Les cellules épithéliales basales présentes à la limite de la blessure migrent selon un mouvement amiboïde vers le centre de l’ulcération en formant une couche monocellulaire de cellules aplaties. Cette migration s’arrête lorsque ces cellules rentrent en contact les unes avec les autres selon un mécanisme appelé inhibition de contact [3]. Le stade suivant correspond à la stratification de l’épithélium reconstitué. Pour qu’une blessure de 6 mm de diamètre puisse être fermée en 48 h, il faut que les cellules épithéliales migrent à la vitesse de 60 à 80 µm/heure.
Il existe peu de publications sur la cicatrisation épithéliale de la conjonctive contrairement à celle de la cornée. Les épithéliums de ces tissus de la surface oculaire diffèrent beaucoup ; néanmoins il est décrit des îlots d’épithélium cornéen au sein de l’épithélium conjonctival en situation physiologique [4]. La conjonctive est très résistante et cicatrise rapidement même lorsqu’elle est largement réséquée pour des raisons carcinologiques par exemple. Lorsque tout l’épithélium cornéen est détruit, après une brûlure notamment, sa cicatrisation se fait à partir de l’épithélium de la conjonctive. Celui-ci se transdifférencie progressivement en épithélium cornéen quand il recouvre la matrice de la cornée, à condition que cette dernière ne soit pas inflammatoire [5–7]. En cas de blessure de la conjonctive bulbaire, le défect épithélial peut être comblé par l’épithélium de la conjonctive limbique [8].
Par contre, en cas d’exérèse d’un pannus provenant d’une conjonctivalisation partielle de la cornée, la cicatrisation du défect épithélial se fait à partir de l’épithélium cornéen adjacent et non de celui de la conjonctive ou du limbe [9].
L’ensemble des processus qui aboutissent à la formation d’un tissu ou d’un organe ayant une fonction spécialisée répond à la définition de la différenciation [10]. Au niveau de la surface oculaire, certaines pathologies comme l’aniridie résulteraient d’un dysfonctionnement de la différenciation épithéliale d’origine génétique, alors que d’autres sont la conséquence d’un trouble de la différenciation induit par un événement extérieur comme l’inflammation associée à une brûlure chimique. Un tissu soumis à un irritant chronique développera une inflammation qui l’obligera à s’adapter. Il le fera soit en se transformant en un autre tissu normal par métaplasie, comme l’épithélium cornéen qui prend les caractéristiques de celui de la conjonctive ou de la peau, soit en laissant place à un tissu désorganisé comme une dysplasie, voire un cancer (voir chapitre 1-IV).
Les marqueurs permettent d’évaluer le stade de différenciation des cellules et de définir le syndrome d’insuffisance en cellules souches limbiques [11]. Dans l’épiderme, la kératine 5 (K5/K14) est spécifique des cellules épithéliales basales, alors que la kératine 1 (K1/K10) est spécifique des cellules suprabasales [12]. Les cellules superficielles ou de la différenciation terminale expriment l’involucrine, la loricrine et la fillagrine. L’épithélium de la cornée possède un marqueur spécifique, la kératine 3 (K3/K12) [13]. Il ne possède pas de cellules à mucus. L’épithélium de la conjonctive contient des cellules épithéliales exprimant la kératine 19 et la kératine 7 (K7/K16) [14] et des cellules à mucus identifiées par une mucine intracytoplasmique spécifique, MUC5AC [15, 16].
Une matrice dépourvue d’épithélium pendant plus de 3 semaines suite à une agression quelle qu’en soit la cause, mécanique, infectieuse, inflammatoire ou toxique, est le siège d’une inflammation aiguë [17]. Celle-ci comporte :
une phase vasculaire et cellulaire caractérisée par une néovascularisation avec hyperplasie des vaisseaux de petite taille ;
une phase de destruction par les nombreux enzymes sécrétés par les cellules inflammatoires (macrophages et polynucléaires) et les cellules nécrotiques ;
une phase de réparation tissulaire avec restitution ad integrum d’un épithélium normal.
Mais parfois l’inflammation passe à la chronicité et/ou la cicatrisation est mauvaise, laissant pour séquelles fibrose et opacités qui grèvent le pronostic fonctionnel (fig. 20-38). Ainsi l’inflammation dont le rôle princeps est la défense des tissus contre une agression peut se révéler destructrice. Si elle se prolonge, elle peut s’auto-entretenir et passer à la chronicité. C’est pourquoi il est parfois nécessaire de prescrire des anti-inflammatoires pour contrôler une inflammation aiguë et limiter de la sorte les cicatrices.
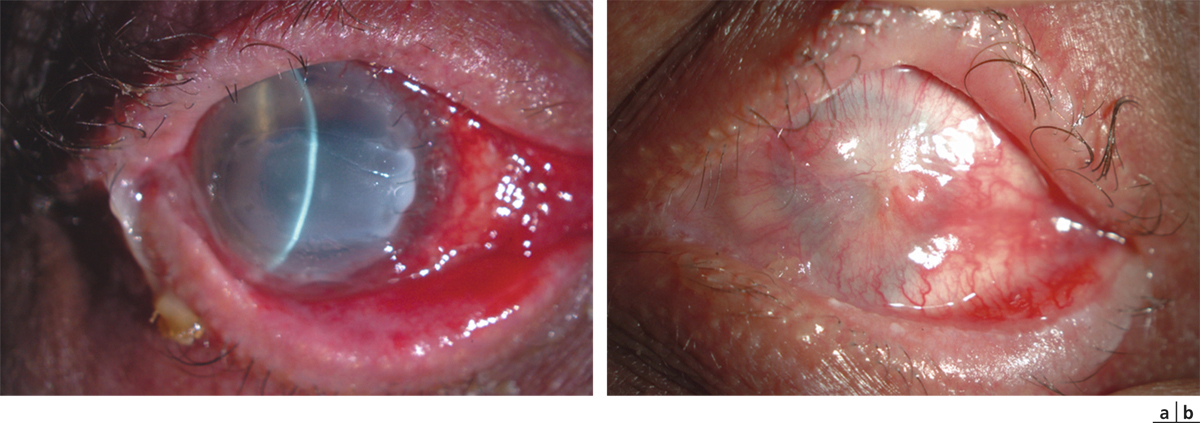
Fig. 20-38 Destruction inflammatoire bilatérale de la surface oculaire d’origine indéterminée avec ulcération persistante sur kératoplastie transfixiante de l’œil droit (a) et ankyloblépharon de l’œil gauche (b).
Indication : arrêt de tous les collyres avec conservateurs et greffe de membrane amniotique sur l’œil droit.
La reconstruction de la surface oculaire conjonctivalisée ou kératinisée, avec ou sans ulcère cornéen, impose le respect d’une certaine chronologie dans les gestes thérapeutiques [3, 18–20].
Lorsqu’une maladie systémique est la cause de la destruction inflammatoire de la surface oculaire, il est indispensable de la traiter au mieux en premier. C’est le cas des maladies bulleuses comme la pemphigoïde oculaire cicatricielle ou le syndrome de Stevens-Johnson, responsables de conjonctivites fibrosantes (voir chapitre 7-I et II).
L’inflammation chronique de la surface oculaire étant délétère pour la cornée et la conjonctive, elle doit être traitée (fig. 20-39) :
un ou plusieurs bolus intraveineux de méthylprednisolone avec relais corticoïde per os sont indiqués en cas d’inflammation aiguë très importante ;
la dexaméthasone en collyre possède l’action anti-inflammatoire la plus puissante de tous ses homologues et la forme sans conservateurs doit être privilégiée chez ces patients à la surface oculaire délicate ;
la membrane amniotique greffée peut être utile en phase aiguë comme pansement biologique et anti-inflammatoire ;
dans de rares cas, la réalisation d’une greffe de cellules souches épithéliales, obtenues par culture et expansion ex vivo de cellules autologues (issues de l’œil controlatéral), hétérologues (issues d’un autre donneur apparenté) ou autologues et hétérotopiques (issues de la muqueuse buccale) [21–25], autorise une meilleure cicatrisation et limite l’inflammation chronique. La surface oculaire recolonisée par les cellules épithéliales retrouve plus rapidement une homéostasie permettant d’envisager après 6 à 12 mois, si nécessaire, la restauration chirurgicale de la transparence cornéenne et la réhabilitation fonctionnelle. Cette technique reste encore confidentielle et coûteuse.
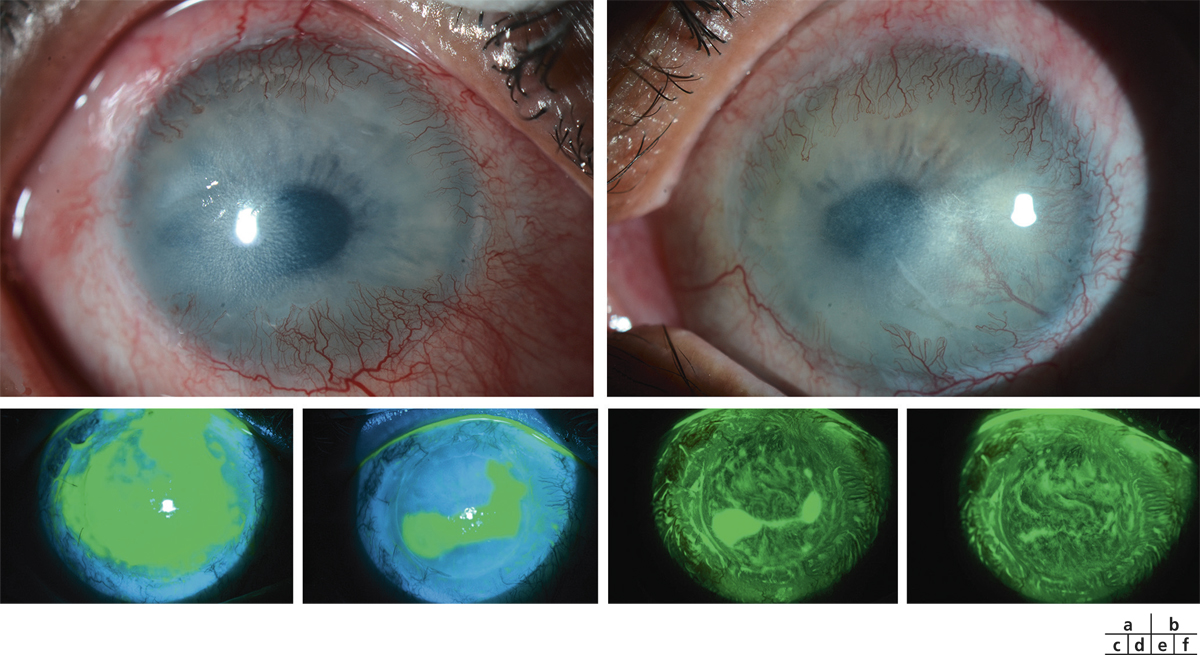
Fig. 20-39 Traitement de l’inflammation associée.
a, b. Brûlure chimique par base touchant les deux yeux. Après une longue prise en charge, l’œil gauche a bénéficié d’une greffe lamellaire antérieure automatisée (ALTK). Plusieurs mois après, récidive du pannus sur la greffe lamellaire qui est excisé avec autogreffe de conjonctive. Stabilisation de la surface oculaire avec un traitement de surface comprenant des agents mouillants sans conservateurs, du sérum autologue, de la vitamine A en collyre et en pommade, une antibiothérapie sans conservateurs et du Cacicol®. Après chirurgie de la cataracte, réactivation de l’inflammation associée à un large ulcère chronique de la cornée. c–f. Guérison en 5 semaines avec bolus intraveineux de méthylprednisolone et relais per os par prednisone. Le traitement corticoïde a permis la cicatrisation épithéliale de la cornée malgré une destruction du limbe sur 360°.
Toute épine irritative mécanique provenant des paupières doit être traitée car elle peut entretenir l’inflammation de la surface oculaire. C’est le cas de cils ectopiques, d’un entropion – trichiasis ou de marges palpébrales kératinisées. Une réfection des culs-de-sac conjonctivaux avec cure de symblépharons est aussi parfois indiquée pour rétablir une anatomie fonctionnelle normale. Dans les cas sévères, on peut être amené à proposer une blépharorraphie partielle ou créer une ptose botulinique pour favoriser la cicatrisation épithéliale. La pose de bouchons méatiques ou la cautérisation définitive des points lacrymaux sont utiles dans certains cas. La prise en charge de ces patients par un spécialiste en chirurgie orbitopalpébrale est nécessaire.
La région limbique est un élément anatomique clé pour l’homéostasie de la surface oculaire. Elle intervient dans la régulation de l’inflammation et a une vertu anti-angiogénique qui prévient l’envahissement de la cornée par des vaisseaux sanguins ou lymphatiques. L’autogreffe de limbe demeure la technique de choix pour traiter les atteintes unilatérales (fig. 20-40). Dans les atteintes bilatérales, l’allogreffe de limbe peut être proposée mais donne de moins bons résultats au long cours. Lorsque l’épithélium est totalement détruit et remplacé par un pannus plus ou moins vascularisé, et si une simple autogreffe ou allogreffe limbique est insuffisante pour pallier le déficit en cellules souches limbiques, on doit avoir recours, après excision du pannus, à une greffe de cellules souches épithéliales obtenues par culture et expansion ex vivo.
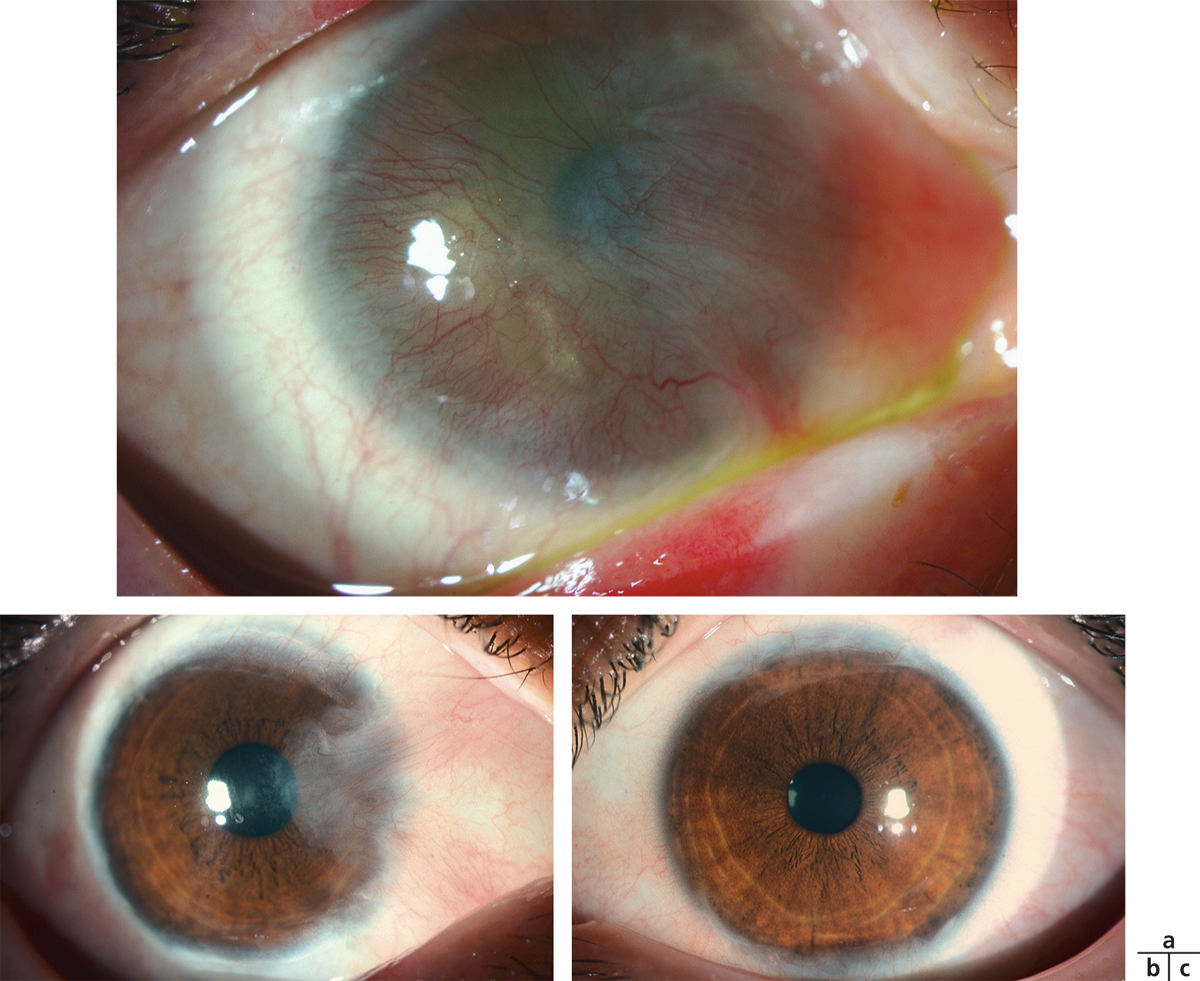
Fig. 20-40 Autogreffe limbique.
a. Brûlure thermique chez une enfant de 10 ans par projection d’une fusée de feu d’artifice. Néovascularisation complète de la cornée une année après l’accident. b. Résultat postopératoire 6 ans après autogreffe de limbe supérieur et inférieur depuis l’œil gauche et photokératoplastie thérapeutique au laser excimer. c. L’œil droit donneur n’a aucune séquelle des prélèvements limbiques effectués pour l’autogreffe.
La cicatrisation de l’épithélium cornéen fait partie intégrante de la réparation de la surface oculaire. Pour que des cellules fabriquent un épithélium in vitro, elles doivent être nourries par un milieu de culture qui présente des paramètres physico-chimiques optimaux pour leur développement (saturation en oxygène, pH, osmolarité, facteurs de croissance, etc.). Il en est de même in vivo. Le milieu de culture naturel dans lequel baignent les épithéliums cornéen et conjonctival est constitué par les éléments appartenant à ce qui est appelé la surface oculaire dont font partie les larmes. Reconstituer ce micro-environnement nécessite d’apporter à la surface oculaire les éléments suivants :
agents mouillants sans conservateurs, riches en acide hyaluronique (idéalement 0,5 % d’acide hyaluronique) [26] ;
osmoprotecteurs (association de levocarnitine et de carmellose) [27] ;
sérum autologue à une concentration de 10 à 20 % qui comprend des vitamines, des facteurs de croissance et des nutriments ;
facteurs de croissance nerveux : nerve growth factor ou NGF [28, 29] ;
vitamine A ou son précurseur, l’acide rétinoïque en pommade à 0,05 % en préparation magistrale (fig. 20-41) [30, 31].
Certains traitements sont aussi utiles à la cicatrisation :
molécules anti-angiogéniques : bévacizumab ou Avastin® en gouttes 3 fois/jour pour 1 mois renouvelable 3 fois [32, 33] ;
thérapie matricielle : poly(carboxyméthylglucose sulfate ou Cacicol®, 1 goutte 1 à 3 jours/semaine pendant 5 semaines [34, 35] ;
lentilles de contact souples ou lentilles sclérales SPOT® sans contact avec la cornée et avec réservoir liquidien pour protéger la surface oculaire (fig. 20-42) [36].
L’ensemble de ces traitements peut être diversement associé ou utilisé d’une manière séquentielle.
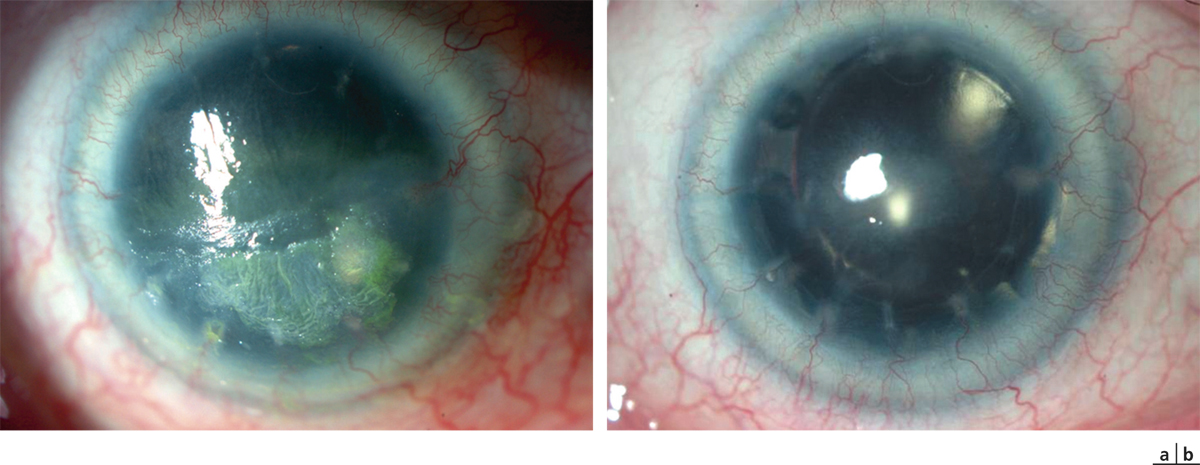
Fig. 20-41 Traitement de la kératinisation par acide rétinoïque.
a. Aniridie congénitale chez un patient alcoolique chronique présentant un déficit en vitamines liposolubles A, D, E et K. Il existe une kératinisation de la surface oculaire. b. Disparition de la kératinisation 5 semaines après un traitement local à base d’acide rétinoïque en pommade concentré à 0,05 %.
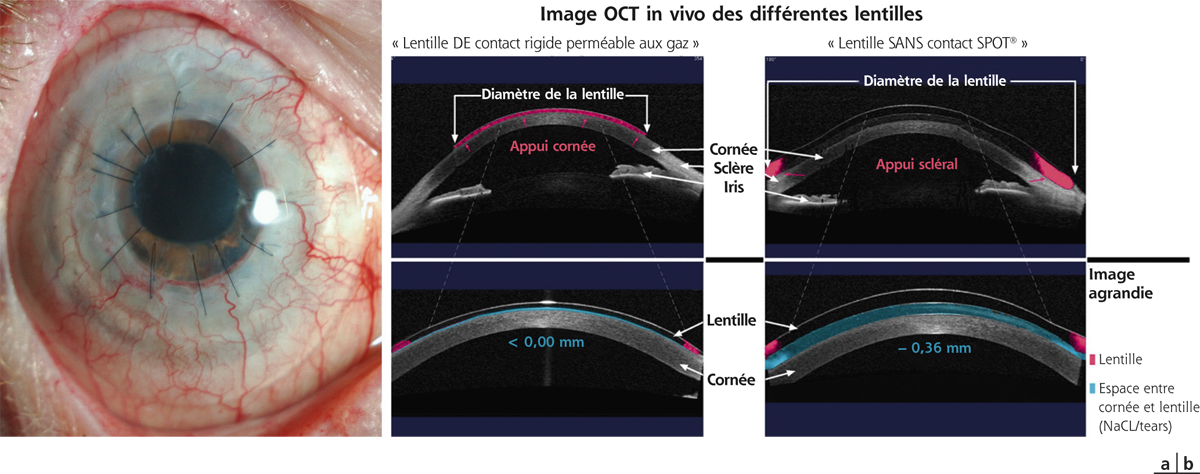
Fig. 20-42 Traitement avec lentilles.
a. Lentille SPOT® sur un œil unique ayant bénéficié d’une reconstruction de la surface oculaire avec greffe transfixiante de la cornée. b. En OCT, il est possible de comparer l’espace existant entre la cornée et, respectivement, une lentille rigide et une lentille sclérale sans contact de type SPOT® : la lentille rigide colle à la cornée, alors qu’avec la lentille SPOT®, il existe un espace servant de réservoir liquide précornéen qui permet une meilleure cicatrisation épithéliale.
Une fois l’inflammation contrôlée et l’épithélium de la cornée cicatrisé avec un film lacrymal rétabli au mieux et des paupières fonctionnelles, il est possible d’envisager de rendre la transparence à la cornée.
Une greffe transfixiante peut être proposée mais les risques de rejet sont élevés dans les pathologies responsables de destruction de la surface cellulaire. La greffe lamellaire est plus indiquée : greffe lamellaire antérieure automatisée (automated lamellar therapeutic keratoplasty ou ALTK) ou greffe lamellaire antérieure profonde (deep anterior lamellar keratoplasty ou DALK). Ces greffes peuvent être associées à la mise en place d’une membrane amniotique ou à une blépharorraphie temporaire, partielle ou totale.
La prise en charge d’une destruction de la surface oculaire demeure un défi médical et chirurgical. Le traitement est très long, généralement d’une à plusieurs années. Une connaissance globale de la surface oculaire est nécessaire pour proposer la thérapeutique adaptée le moment venu. La séquence des traitements proposés est un élément clé pour la guérison. Un suivi clinique personnalisé est indispensable ainsi qu’un ajustement thérapeutique à chaque consultation.
La restauration de la transparence de la cornée est l’objectif ultime de la prise en charge du patient. Elle ne survient qu’après la reconstruction complète de la surface oculaire avec contrôle indispensable de l’inflammation et de l’angiogenèse dans la cornée. Cette inflammation est la cause principale d’échec de la reconstruction de la surface oculaire. Elle est probablement l’enjeu le plus important dans la prise en charge de ces pathologies gravissimes et complexes.
[1] Nelson JD, Havener VR, Cameron JD. Cellulose acetate impressions of the ocular surface. Dry eye states. Arch Ophthalmol 1983 ; 101 : 1869-72.
[2] Tseng SC, Tsubota K. Important concepts for treating ocular surface and tear disorders. Am J Ophthalmol 1997 ; 124 : 825-35.
[3] Dua HS, Forrester JV. Clinical patterns of corneal epithelial wound healing. Am J Ophthalmol 1987 ; 104 : 481-9.
[4] Kawasaki S, Tanioka H, Yamasaki K, et al. Clusters of corneal epithelial cells reside ectopically in human conjunctival epithelium. Invest Ophthalmol Vis Sci 2006 ; 47 : 1359-67.
[5] Geggel HS, Friend J, Thoft RA. Conjunctival epithelial wound healing. Invest Ophthalmol Vis Sci 1984 ; 25 : 860-3.
[6] Kinoshita S, Friend J, Thoft RA. Ocular surface epithelial regeneration and disease. Int Ophthalmol Clin 1984 ; 24 : 169-77.
[7] Kinoshita S, Friend J, Thoft RA. Biphasic cell proliferation in transdifferentiation of conjunctival to corneal epithelium in rabbits. Invest Ophthalmol Vis Sci 1983 ; 24 : 1008-14.
[8] Majo F, Rochat A, Nicolas M, et al. Oligopotent stem cells are distributed throughout the mammalian ocular surface. Nature 2008 ; 456 : 250-4.
[9] Dua HS. The conjunctiva in corneal epithelial wound healing. Br J Ophthalmol 1998 ; 82 : 1407-11.
[10] Majo F, Nicolas M. Darwin or Lamarck ? Understanding the ocular surface and its normal or abnormal differentiation in order to cure ocular surface destruction with corneal opacification. Biol Aujourdhui 2013 ; 207 : 97-108.
[11] Majo F, Barrandon Y, Othenin-Girard P, et al. Corneal epithelial diseases related to limbal stem cell deficiency. J Fr Ophtalmol 2006 ; 29 : 1060-9.
[12] Fuchs E. Keratins and the skin. Annu Rev Cell Dev Biol 1995 ; 11 : 123-53.
[13] Schermer A, Galvin S, Sun TT. Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells. J Cell Biol 1986 ; 103 : 49-62.
[14] Jirsova K, Dudakova L, Kalasova S, et al. The OV-TL 12/30 clone of anti-cytokeratin 7 antibody as a new marker of corneal conjunctivalization in patients with limbal stem cell deficiency. Invest Ophthalmol Vis Sci 2011 ; 52 : 5892-8.
[15] Inatomi T, Tisdale AS, Zhan Q, et al. Cloning of rat Muc5AC mucin gene : comparison of its structure and tissue distribution to that of human and mouse homologues. Biochem Biophys Res Commun 1997 ; 236 : 789-97.
[16] Argueso P, Gipson IK. Epithelial mucins of the ocular surface : structure, biosynthesis and function. Exp Eye Res 2001 ; 73 : 281-9.
[17] Guimezanes A, Mathieu M, Thimonier J. Inflammation et maladies : clés de compréhension. INSERM ; 2011.
[18] Shimmura S, Tsubota K. Ocular surface reconstruction update. Curr Opin Ophthalmol 2002 ; 13 : 213-9.
[19] Dogru M, Tsubota K. Current concepts in ocular surface reconstruction. Semin Ophthalmol 2005 ; 20 : 75-93.
[20] Inatomi T, Nakamura T, Koizumi N, et al. Current progress and challenges in ocular surface reconstruction using cultivated epithelial sheet transplantation. Med J Malaysia 2008 ; 63 Suppl A : 42.
[21] Gipson IK, Geggel HS, Spurr-Michaud SJ. Transplant of oral mucosal epithelium to rabbit ocular surface wounds in vivo. Arch Ophthalmol 1986 ; 104 : 1529-33.
[22] Pellegrini G, Traverso CE, Franzi AT, et al. Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet 1997 ; 349 : 990-3.
[23] Nakamura T, Koizumi N, Tsuzuki M, et al. Successful regrafting of cultivated corneal epithelium using amniotic membrane as a carrier in severe ocular surface disease. Cornea 2003 ; 22 : 70-1.
[24] Nishida K, Yamato M, Hayashida Y, et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med 2004 ; 351 : 1187-96.
[25] Rama P, Matuska S, Paganoni G, et al. Limbal stem-cell therapy and long-term corneal regeneration. N Engl J Med 2010 ; 363 : 147-55.
[26] Aragona P, Papa V, Micali A, et al. Long term treatment with sodium hyaluronate-containing artificial tears reduces ocular surface damage in patients with dry eye. Br J Ophthalmol 2002 ; 86 : 181-4.
[27] Baudouin C, Cochener B, Pisella PJ, et al. Randomized, phase III study comparing osmoprotective carboxymethylcellulose with sodium hyaluronate in dry eye disease. Eur J Ophthalmol 2012 ; 22 : 751-61.
[28] Lambiase A, Manni L, Bonini S, et al. Nerve growth factor promotes corneal healing : structural, biochemical, and molecular analyses of rat and human corneas. Invest Ophthalmol Vis Sci 2000 ; 41 : 1063-9.
[29] Tan MH, Bryars J, Moore J. Use of nerve growth factor to treat congenital neurotrophic corneal ulceration. Cornea 2006 ; 25 : 352-5.
[30] Herbort CP, Zografos L, Zwingli M, et al. Topical retinoic acid in dysplastic and metaplastic keratinization of corneoconjunctival epithelium. Graefes Arch Clin Exp Ophthalmol 1988 ; 226 : 22-6.
[31] Tei M, Spurr-Michaud SJ, Tisdale AS, et al. Vitamin A deficiency alters the expression of mucin genes by the rat ocular surface epithelium. Invest Ophthalmol Vis Sci 2000 ; 41 : 82-8.
[32] Barros LF, Belfort R, Jr. The effects of the subconjunctival injection of bevacizumab (Avastin) on angiogenesis in the rat cornea. An Acad Bras Cienc 2007 ; 79 : 389-94.
[33] Bock F, Onderka J, Dietrich T, et al. Bevacizumab as a potent inhibitor of inflammatory corneal angiogenesis and lymphangiogenesis. Invest Ophthalmol Vis Sci 2007 ; 48 : 2545-52.
[34] Aifa A, Gueudry J, Portmann A, et al. Topical treatment with a new matrix therapy agent (RGTA) for the treatment of corneal neurotrophic ulcers. Invest Ophthalmol Vis Sci 2012 ; 53 : 8181-5.
[35] Brignole-Baudouin F, Warnet JM, Barritault D, et al. RGTA-based matrix therapy in severe experimental corneal lesions : safety and efficacy studies. J Fr Ophtalmol 2013 ; 36 : 740-7.
[36] Tougeron-Brousseau B, Delcampe A, Gueudry J, et al. Vision-related function after scleral lens fitting in ocular complications of Stevens-Johnson syndrome and toxic epidermal necrolysis. Am J Ophthalmol 2009 ; 148 : 852-9.e2.