Principes thérapeutiques : galénique
F. Behar-Cohen, A. Dirani
Les pathologies de la surface oculaire sont dans la majorité des cas accessibles à des traitements topiques. Cependant, la biodisponibilité du principe actif dépend de sa structure physico-chimique et les doses et cinétiques de libération thérapeutique relèvent de leurs mécanismes d’action. Les barrières oculaires de surface s’opposent à la pénétration passive de la majorité des composés.
Pour cibler des tissus de la surface oculaire, les préparations galéniques vont avoir pour but selon l’indication : d’améliorer le temps de résidence à la surface de l’œil ; de favoriser l’absorption par les tissus de la surface oculaire ; d’améliorer la tolérance ; de réduire la fréquence des administrations ; de réduire la toxicité d’une molécule ou de l’un de ses produits de dégradation.
Ce chapitre résume les principaux types de formulations et méthodes utilisées ou en développement pour le traitement des maladies de la surface oculaire.
La pharmacocinétique comprend l’étude au cours du temps de l’absorption, de la distribution, du métabolisme et de l’élimination d’une molécule suite à son administration par une voie donnée. Les principes actifs (PA) utilisés pour le traitement des pathologies de la surface oculaire sont principalement administrés par voie topique et la première étape, celle de leur absorption, est fortement dépendante de leur formulation. En effet, l’absorption d’une molécule dépend de ses propriétés physico-chimiques, de la viscosité du véhicule utilisé et de l’état fonctionnel du tissu formant une barrière à sa pénétration. Le principal facteur qui influence l’absorption d’un principe actif est le temps de résidence à la surface de l’œil.
La distribution du médicament au fil du temps et sa biodisponibilité sur le site d’action peuvent généralement se prévoir par les interactions entre les compartiments et les barrières de l’œil. Le métabolisme joue un rôle important dans l’élimination des médicaments et de leurs métabolites qui sont parfois toxiques. Les enzymes métaboliques ont été récemment étudiés pour permettre la conception de « promédicaments » (ou prodrogue), qui sont des molécules converties en forme active après leur pénétration dans les tissus. L’autre partie du spectre inclut l’utilisation de composants qui, une fois dans l’œil, subissent de manière prévisible une transformation par les enzymes en forme inactive, ceci permettant de diminuer les effets secondaires associés avec la forme de base.
La galénique est l’art de préparer un principe actif sous une forme qui permet son utilisation comme un médicament. Ceci concerne principalement la modification d’un principe actif en une forme absorbable par le tissu cible, mais la galénique peut aussi être requise pour diminuer la toxicité d’un produit ou modifier sa vitesse d’élimination (c’est le cas des systèmes à libération contrôlée).
Pour cibler des tissus de la surface oculaire, les préparations galéniques vont avoir pour but, selon l’indication, de :
améliorer le temps de résidence à la surface de l’œil ;
favoriser l’absorption par les tissus de la surface oculaire ;
améliorer la tolérance ;
réduire la fréquence des administrations ;
réduire la toxicité d’une molécule ou de l’un de ses produits de dégradation.
Les photons traversent des milieux oculaires parfaitement clairs et avasculaires pour parvenir au site de la phototransduction dans la rétine externe. Cette « avascularité » de certaines structures limite l’absorption des principes actifs (PA) dans la circulation systémique. Par ailleurs, les tissus de la surface oculaire, en contact avec l’extérieur, sont organisés pour assurer une fonction de barrière efficace qui limite la pénétration oculaire des PA. Les formulations galéniques des molécules pharmacologiquement actives visent à franchir ces barrières sans les altérer. Du fait des barrières et de la faible diffusion systémique des PA instillés, on peut considérer la pharmacocinétique du segment antérieur comme indépendante de la pharmacocinétique générale, ce qui permet de considérer l’œil comme un organe « isolé » du reste de l’organisme sur le plan pharmacocinétique.
Pour plus détails sur le film lacrymal, il convient de se référer au chapitre 1. Nous rappelons ici les éléments importants à la formulation des PA. La couche lipidique, la plus externe, stabilise la couche aqueuse sous-jacente et retarde son évaporation. Cette couche lipidique disparaît rapidement si l’œil est irrigué avec une solution saline ou avec un médicament, résultant en une évaporation 10 fois plus rapide du film lacrymal. La phase aqueuse des larmes est la plus importante avec une épaisseur moyenne de 7 µm. Cette couche est en soi instable et commence à disparaître depuis le centre entre deux clignements des yeux. Le film lacrymal normal a un temps de rupture qui varie entre 25 et 30 secondes. Le pH des larmes est approximativement de 7,4. Le film lacrymal contient certaines protéines, y compris des lysozymes, des lactoferrines, des gammaglobulines mais aussi des enzymes capables de métaboliser des médicaments (prodrogues) et/ou de les inactiver. Le volume normal du film lacrymal est de 8 à 10 µl, y compris le volume contenu dans les culs-de-sac conjonctivaux.
Quand une goutte de 50 µl est instillée, 80 % sont éliminés par le conduit nasolacrymal et 10 % sont rejetés sur la peau par le clignement de l’œil. Ainsi, seuls 10 % du volume instillé restent à la surface pendant un temps variant de 2 à 6 minutes. C’est pendant cette durée qu’une fraction faible (entre 2 et 10 %) de la concentration en PA est finalement absorbée (fig. 13-1). L’augmentation du volume de la goutte, contrairement à l’intuition première, n’améliore pas la pénétration du PA dans les tissus oculaires, mais augmente son absorption systémique. Une fois drainée par le conduit nasolacrymal, la goutte sera en effet généralement absorbée par la muqueuse nasale ou avalée (voir fig. 13-1). Pour les médicaments ayant des effets secondaires systémiques, tels que les bêtabloquants, on tente de réduire l’absorption systémique mais il est impossible de diminuer le volume d’une goutte administrée par effet de gravité à partir d’un flacon en dessous de 25 µl (qui est 3 fois le volume du film lacrymal). Le volume optimal théoriquement proposé pour une goutte médicamenteuse permettant de diminuer la perte en volume et en substance médicamenteuse serait très proche du zéro. Mais des dispositifs adaptés peuvent permettre d’instiller des gouttes de 2 à 5 µl.
Le flux lacrymal de base chez l’homme est de 1 à 2,2 µl/min. Il décroît avec l’âge et est augmenté en particulier par des formulations irritantes (pH par exemple). La concentration de médicaments disponible dans les larmes pour une absorption transcornéenne est inversement proportionnelle au flux lacrymal, à cause de la dilution du médicament d’une part et de l’évacuation du médicament par le conduit lacrymonasal d’autre part. Ainsi, le flux et le volume des larmes influencent l’absorption du médicament par le segment antérieur de l’œil.
Pour augmenter l’absorption du médicament par la cornée, la concentration du médicament dans le film lacrymal peut être augmentée en bloquant manuellement les conduits lacrymonasaux ou en penchant la tête en arrière pour réduire le drainage. Une autre technique efficace pour augmenter la pénétration consiste à administrer une série de solutions ophtalmiques à des intervalles réguliers de 10 minutes. Il a été cependant constaté que quand différentes formulations de médicaments sont administrées sous forme de gouttes en succession rapide, les médicaments appliqués en premier lieu sont dilués et ne parviennent plus au seuil thérapeutique désirable.
Chez les patients dont le flux est réduit (< 0,5 µl/min), l’absorption est augmentée par la faible dilution de la formulation instillée et par l’existence fréquente de micro-érosions cornéennes superficielles qui facilitent la pénétration des molécules médicamenteuses. Les médicaments qui stimulent la sécrétion des larmes par irritation directe des yeux ou par stimulation des glandes lacrymales (ex. pilocarpine) doivent être formulés avec une plus forte concentration pour compenser la dilution.
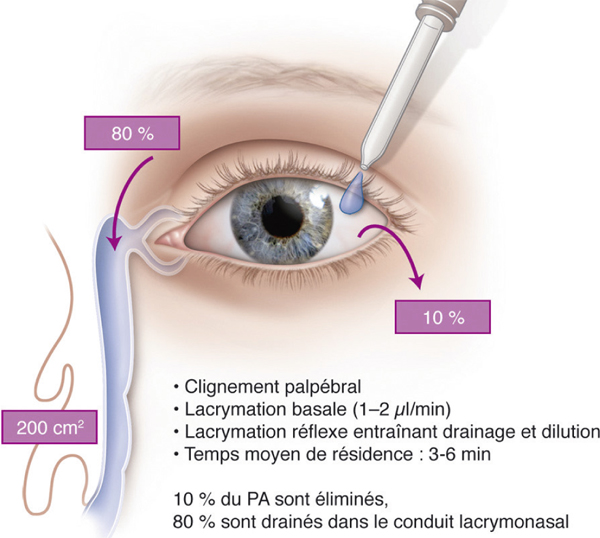
Fig. 13-1 Devenir d’une goutte instillée sur la surface oculaire.
La cornée est une barrière majeure à la pénétration oculaire des PA instillés mais est aussi le site principal de l’absorption des médicaments administrés par voie topique. La cornée forme une structure « sandwich » lipide (épithélium)/eau (stroma)/lipide (endothélium), constituant un obstacle à la pénétration de molécules hydrophiles (épithélium) ou hydrophobes (stroma). La barrière épithéliale constitue 90 % de la résistance à la pénétration des molécules de poids moléculaire supérieur à 500 D (fig. 13-2). C’est l’une des résistances les plus élevées de l’organisme, environ 7 500 Ohm/cm2. En effet, les jonctions serrées des cellules épithéliales de la cornée ont une résistance comparable à celle de l’intestin. Par ailleurs, la surface épithéliale présente des charges négatives favorisant l’interaction avec des molécules cationiques. Ainsi, l’épithélium sain présente une barrière à la pénétration des molécules hydrophiles. L’exemple type est la fluorescéine qui est une molécule anionique. Sa pénétration est très limitée dans le cas d’un épithélium sain ; mais en présence d’une érosion cornéenne, la fluorescéine pénètre plus facilement et permet la coloration de la lésion. Les médicaments lipophiles par contre peuvent facilement pénétrer l’épithélium, car sa barrière est composée de membranes phospholipidiques. La membrane plasmique de l’épithélium constitue plus des deux tiers de la masse totale de membrane plasmique cornéenne et par conséquent, l’épithélium est le lieu de stockage le plus important pour les molécules lipophiles. L’exemple type est celui de la ciclosporine formulée en milieu huileux du fait de son extrême hydrophobicité.
Pour pouvoir pénétrer dans la cornée de manière efficace, un médicament doit posséder des propriétés à la fois hydrophiles et lipophiles. La représentation du coefficient de partition en fonction de la perméabilité cornéenne a l’aspect d’une parabole. Les molécules dont le coefficient de partition tombe près de l’apex, c’est-à-dire la parabole, sont facilement transférées à travers la cornée ; celles qui ont un coefficient de partition trop faible ne pénètrent pas bien à travers la barrière épithéliale externe. Celles qui ont un coefficient de partition trop grand ont tendance à rester dans l’épithélium et puis sont réparties dans la chambre antérieure lentement, ce qui entraîne un niveau dans l’humeur aqueuse faible mais prolongé.
Ainsi, les molécules qui, en solution à un pH physiologique, se présentent sous forme de bases ou d’acides faibles peuvent pénétrer à travers les couches de la cornée (fig. 13-3).
Les autres molécules capables de pénétrer les couches cornéennes sont les molécules amphiphiles. En dehors de ces deux catégories de PA qu’il est possible de formuler en solution sans conservateurs, la formulation des PA absorbés par voie transcornéenne requiert l’addition d’excipients qui déstabilisent la barrière cornéenne.
La résistance de l’épithélium conjonctival est beaucoup plus faible d’environ 1 500 Ohm/cm2. La pénétration transsclérale des PA a été sous-estimée et on sait aujourd’hui qu’il est possible d’administrer des médicaments dans l’œil par cette voie. Cependant, la vascularisation de la conjonctive et des tissus épiscléraux est responsable d’un passage systémique important. Le limbe et la sclère antérieure restent des zones particulièrement intéressantes pour la pénétration de molécules hydrophiles de haut poids moléculaire, telles que des peptides ou des protéines [1]. La figure 13-3 donne les poids moléculaires limites pour la pénétration de molécules à travers les barrières et tissus de la surface oculaire (voir fig. 13-2).
Par le limbe, des molécules de haut poids moléculaire peuvent être délivrées vers la cornée mais cela requiert de franchir la barrière épithéliale conjonctivale, possiblement par une injection sous-conjonctivale. En cas de néovascularisation cornéenne profonde, l’injection sous-conjonctivale de bévacizumab peut être efficace [2]. Dans un modèle de rejet de greffe, les anti-VEGF (anti-vascular endothelial cell growth factor) étaient plus efficaces par voie sous-conjonctivale que par voie topique, même en cas d’altération de la surface oculaire [3]. En effet, les molécules hydrophiles de haut poids moléculaire ne pénètrent ni dans la chambre antérieure, ni dans les couches profondes de la cornée par voie transcornéenne, mais par voie transsclérale expliquant que même la désépithélialisation a peu d’influence sur leur pénétration [4].
Les injections sous-conjonctivales de systèmes particulaires ont permis une libération prolongée de PA dans les segments antérieur et postérieur de l’œil. En particulier, des particules de taille supérieure à 200 nm permettraient une rétention prolongée dans les espaces péri-oculaires [5]
La voie transsclérale est également la voie préférentielle pour la pénétration oculaire des prostaglandines [6, 7].
La surface conjonctivale agit comme un réservoir pour certains médicaments qui sont stockés superficiellement, puis libérés dans le film lacrymal. Ainsi les particules d’une suspension ophtalmique appliquée dans le cul-de-sac conjonctival permettent une dissolution lente du médicament dans le film lacrymal et le seuil thérapeutique est longtemps maintenu. Le même mécanisme se produit après une injection sous-conjonctivale.
L’endothélium cornéen est formé d’une monocouche de cellules polygonales de 3 µm d’épaisseur. Les cellules de l’endothélium cornéen n’ont pas de propriétés régénératives. Elles ont pour fonction de pomper le liquide à partir du stroma vers la chambre antérieure. Les jonctions intercellulaires permettent la diffusion du liquide et des solutés dans le sens inverse du liquide pompé.
La pompe endothéliale est probablement une pompe à base d’ion bicarbonate couplée à la pompe Na+-K+-ATPase. Le canal de transport passif est composé d’une protéine de 12 µm de longueur et de largeur de 20 nm, se rétrécissant à 5 nm en face de la chambre antérieure. Ce diamètre a une taille suffisante pour permettre le transport de molécules, telles que des particules. Ainsi, l’endothélium n’agit pas comme une barrière mais il est perméable pour de nombreuses molécules. Il peut aussi permettre le transport de protéines de haut poids moléculaire par pinocytose. À cause de son petit volume, l’endothélium n’agit cependant pas comme un réservoir de médicaments.
La cornée peut concentrer certaines substances à partir de l’humeur aqueuse, ce qui permet de potentialiser la fonction de réservoir du stroma cornéen. En effet, il y a constamment une diffusion passive de fluide et de substances de l’humeur aqueuse vers le stroma, et la pompe endothéliale active compense pour la phase aqueuse en favorisant le retour du fluide dans la chambre antérieure. La liaison des molécules aux charges anioniques du stroma permet aussi de favoriser la fonction de réservoir du stroma cornéen.
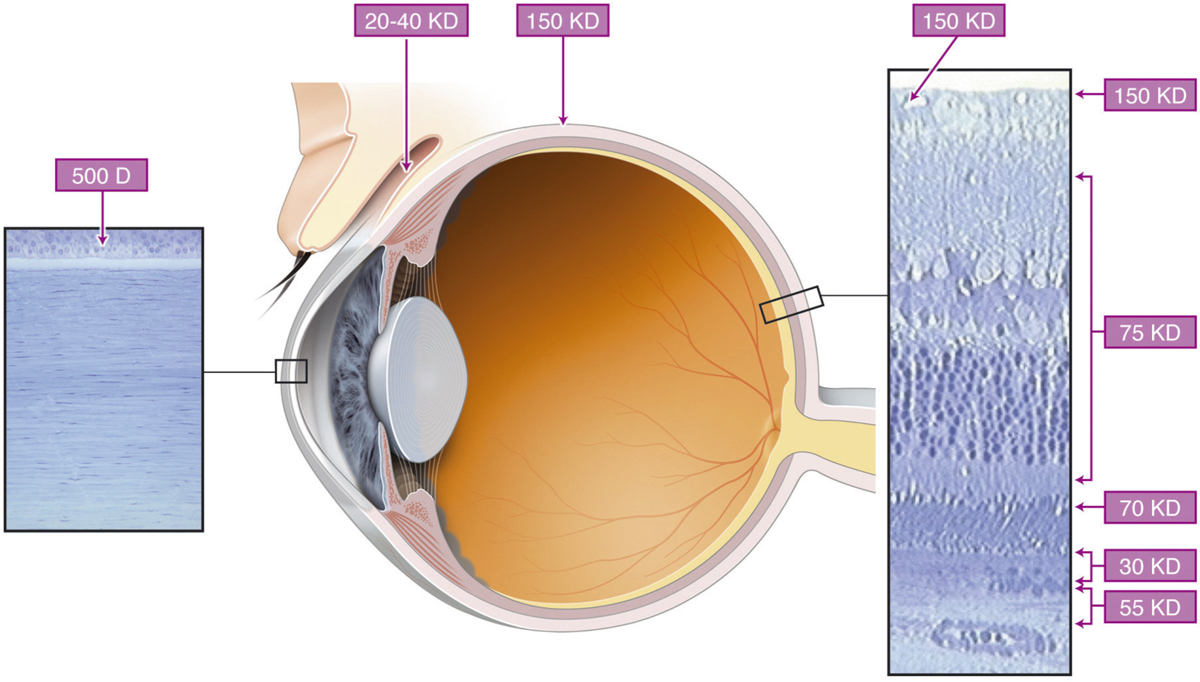
Fig. 13-2 Représentation schématique des limites de poids moléculaires des différents tissus formant les barrières oculaires.
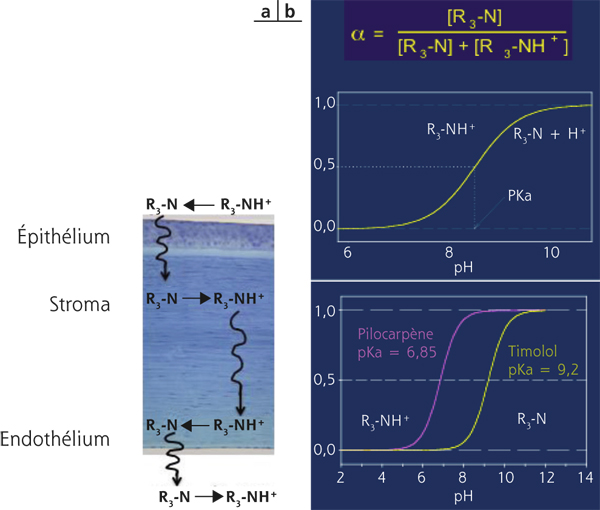
Fig. 13-3 Passage transcornéen de molécules acides ou bases faibles.
a. Changement d’état physique d’un acide faible permettant son passage de l’épithélium (hydrophobe), au stroma (hydrophile), à l’endothélium (hydrophobe) et vers l’humeur aqueuse. b. Équation de l’équilibre d’un acide faible et du maléate de tomolol ou de la pilocarpine.
L’œil est un organe unique car une grande partie de ses tissus et de ses fluides (film lacrymal, cornée, humeur aqueuse, cristallin et vitré) est presque totalement transparente. Chacun d’entre eux peut être considéré comme un compartiment séparé. Un compartiment est défini comme un espace de tissu ou de fluide à travers lequel peut diffuser un médicament pour atteindre un équilibre. Chaque compartiment est généralement séparé des autres compartiments par une barrière si bien que le flux entre les compartiments adjacents demande plus de temps que la diffusion à l’intérieur de chaque compartiment.
Les larmes sont un exemple de compartiment qui est constamment en renouvellement ; le volume de larmes sécrétées est égal au volume évacué. Une barrière est définie comme une région qui limite deux compartiments et qui a une perméabilité moindre et une diffusion restreinte. Si l’épithélium est considéré comme une barrière pour les médicaments et que la cornée forme un compartiment, on peut parler d’un modèle à deux compartiments. En l’absence d’un mécanisme actif de transport, les médicaments diffusent à travers les barrières selon les lois de la thermodynamique, c’est-à-dire d’une région à haute concentration vers une région à basse concentration. La première loi de diffusion de Fick énonce que le taux de diffusion d’une molécule à travers une barrière est proportionnel au gradient de concentration entre les deux compartiments de part et d’autre de la barrière. D’après la loi de Fick, le taux de diffusion d’un médicament à travers une barrière est une fonction linéaire de la différence de concentration entre les deux compartiments de part et d’autre de la barrière. L’absorption d’un médicament amphiphile par la cornée dépend de la concentration du médicament dans le film lacrymal et de son temps de résidence. La majeure partie du médicament en dépôt dans la cornée pénètre l’humeur aqueuse et la concentration dans l’humeur aqueuse atteint son maximum après 3 heures environ. Après ce délai, la concentration du médicament dans la cornée et dans l’humeur aqueuse diminue parallèlement de façon logarithmique. Les propriétés moléculaires des PA déterminent quel tissu va assurer le rôle de réservoir et quel tissu va assurer le rôle de barrière. Un médicament lipophile et également soluble dans l’eau pénétrera l’épithélium cornéen plus aisément que ne le fait la fluorescéine qui est plus hydrophile.
La répartition d’un médicament dépend généralement du taux de diffusion passive du médicament à l’intérieur et entre les compartiments. C’est lié à la résistance de la barrière qui sépare les deux compartiments. Dans certains cas, les molécules s’accumulent contre un gradient de concentration d’un côté de la barrière. C’est expliqué par la présence d’un transport actif couplé à des pompes ou à la présence des forces ioniques qui peuvent contrecarrer l’effet du gradient de concentration. Les propriétés de libération passive d’un médicament à partir d’un tissu ou d’un dispositif artificiel peuvent varier selon les circonstances. Par exemple, dans une cinétique d’« ordre zéro », la libération du médicament est constante au fil du temps. Les conditions d’une cinétique d’« ordre zéro » sont remplies lorsque la quantité du médicament libéré est indépendante de sa concentration. Une substance obéit généralement à une loi d’« ordre zéro » lorsqu’il existe une barrière qui limite le taux de libération, comme lorsqu’un système de transport est saturé par un excès de médicament.
Le transport oculaire d’une substance est un exemple de cinétique de « premier ordre ». Dans ce cas, la vitesse de mouvement des molécules est directement proportionnelle à la différence de concentration à travers la barrière et change avec le temps parallèlement à la différence des concentrations à travers la barrière. La diffusion passive de molécules à travers une barrière non saturée suit généralement une cinétique de premier ordre.
La biodisponibilité se définit comme la quantité de PA présente au site récepteur souhaité. La dose du médicament qui produit 50 % de l’effet maximal est appelée la DE50. Les exigences de concentration et de temps pour atteindre la DE50 varient largement, en fonction du mécanisme d’action du médicament et de la réponse souhaitée.
Aucune molécule n’est indéfiniment stable en solution et les formulations peuvent améliorer la stabilité, critère requis pour autoriser la commercialisation du médicament. Une durée de conservation de moins de 18 mois rend la mise sur le marché et la distribution d’un médicament économiquement irréalisable. Les médicaments formulés dans une solution acide sont parfois plus stables que ceux dans une solution à pH neutre ou alcalin, en particulier lorsque le médicament est une base faible. Souvent, un médicament doit être stocké à un pH acide pour augmenter la protonation et pour éviter une dégradation rapide. Des polypeptides, tels que les facteurs de croissance, peuvent nécessiter le stockage en solution alcaline. Dans l’œil, le pH normal est d’environ 7,4. Le pH des larmes peut être modifié pendant plus de 30 minutes après l’addition d’une solution fortement tamponnée. Ce changement de pH peut causer une irritation et un larmoiement réactionnel, ce qui diminue l’absorption de la molécule.
Certaines formulations de médicaments ne sont pas stables en solution. Le mélange de la molécule avec la solution aqueuse se fait juste avant l’emploi. Ce problème de stabilité est aussi un obstacle au développement de nombreux médicaments et en particulier des prodrogues.
La combinaison du PA et du véhicule forme généralement une formulation hypotonique (< 290 mOsm). Des sels simples ou complexes, des agents tampons ou certains sucres sont alors ajoutés pour ajuster l’osmolarité de la solution. Le film lacrymal tolère une certaine variation de la pression osmotique.
La formulation des médicaments oculaires inclut des agents conservateurs antimicrobiens depuis la survenue d’infections sévères historiques induites par des solutions de fluorescéine non conservées.
Divers types d’agents de conservation sont utilisés. Les surfactants sont des molécules ioniquement chargées à activité bactéricide par disruption des membranes plasmiques. Le chlorure de benzalkonium (BAC) et le chlorure de benzéthonium sont des surfactants quaternaires, utilisés par de nombreux fabricants en raison de leur stabilité, leur activité antimicrobienne en formulation acide et leur longue durée de vie. Ils possèdent des effets toxiques sur l’épithélium cornéen et augmentent ainsi la pénétration des PA. La toxicité de ces composés augmente avec le degré d’acidité de la formulation. Une seule goutte de 0,01 % de BAC peut interrompre la continuité de la couche lipidique superficielle du film lacrymal et favoriser la création de nombreuses gouttelettes d’huile (action détergente). Le BAC réduit ainsi le temps de rupture du film lacrymal à la moitié [8-10].
La chlorhexidine est un diguanide qui possède une activité antimicrobienne dans la même gamme de concentrations que celles utilisées pour le BAC. Pour cela, elle est utilisée à des concentrations inférieures dans les formulations commercialisées. Elle ne modifie pas la perméabilité de la cornée au même degré que le BAC pour deux raisons. Premièrement, la structure de la chlorhexidine comporte deux charges positives séparées par un long squelette de carbone, et elle ne peut pas s’intercaler dans la couche lipidique de la même manière que le fait le BAC. Deuxièmement, les protéines présentes dans le film lacrymal peuvent neutraliser la toxicité de la chlorhexidine.
Les toxines chimiques telles que le mercure, l’iode et leurs dérivés, ainsi que les alcools bloquent les processus métaboliques normaux de la cellule et sont considérées bactériostatiques ou bactéricides. Contrairement aux antibiotiques qui peuvent sélectivement détruire ou immobiliser un groupe spécifique d’organismes, les agents conservateurs agissent de façon non sélective contre toutes les cellules. Un autre groupe, les agents oxydants, peut pénétrer dans la membrane cellulaire et interférer avec la fonction cellulaire. Le peroxyde d’hydrogène et le Purite® sont des exemples d’agents conservateurs récents.
On retrouve dans les produits de larmes artificielles le Purite® (Refresh Tears®) et le perborate de sodium (GenTeal®). Les conservateurs oxydants, contrairement à la substance chimique des agents de conservation, peuvent être neutralisés par les cellules et ne s’accumulent pas. Ces agents permettent ainsi de fournir une activité efficace contre les micro-organismes tout en produisant des métabolites de très faible toxicité.
Pour plus de détails sur les agents conservateurs et leurs effets, se référer au chapitre 3.
Un véhicule est une molécule différente du PA du médicament et de l’agent de conservation. Il est ajouté à la formulation pour fournir la tonicité, une propriété de tamponnement et une viscosité appropriée pour permettre l’action du médicament.
Les molécules polyioniques peuvent se lier à la surface de la cornée et augmentent la rétention du médicament. Le pétrolatum ou les suspensions à base d’huile fournissent une disponibilité plus prolongée des médicaments à la surface de la cornée et permettent de constituer un réservoir temporaire.
Dans les larmes artificielles, les véhicules eux-mêmes peuvent être le PA qui hydrate et lubrifie la cornée et la conjonctive et qui permet de stabiliser le film lacrymal et d’empêcher l’assèchement des cellules épithéliales. L’indice thérapeutique des médicaments, en particulier ceux qui sont systématiquement absorbés, peut être maximisé par de nombreux moyens, y compris la modification du véhicule utilisé pour l’administration du médicament.
La viscosité moléculaire, qui est mesurée en centistokes, est une fonction non linéaire du poids moléculaire et de la concentration. Ainsi, une solution à 2 % de polymère dans de l’eau généralement ne peut pas avoir 2 fois la viscosité d’une solution à 1 %. Chaque type de polymère commercial doit avoir une viscosité donnée à la concentration appropriée. L’ajout de sels peut changer la viscosité finale de certains polymères. Les anions et cations bivalents peuvent avoir un impact majeur sur la structure des polymères en solution, et provoquent parfois une incompatibilité lorsque des formulations sont mélangées ensemble.
Introduit dans la pratique ophtalmologique en 1942, l’alcool de polyvinyle (PVA) est un agent soluble dans l’eau qui améliore la viscosité avec des sites à la fois hydrophiles et hydrophobes. La concentration couramment utilisée dans les préparations ophtalmiques est de 1,4 %. Le PVA est utile dans le traitement de l’érosion cornéenne et des syndromes de sécheresse oculaire parce qu’il n’est pas irritant, et il semble faciliter la guérison de l’épithélium abrasé. Il est utilisé aussi pour augmenter la durée de survie de la drogue dans les larmes, facilitant ainsi son absorption.
L’hydroxypropyl méthylcellulose est disponible sous une variété de poids moléculaires et dans des formulations avec différents groupes. Il permet de diminuer le temps de rupture du film lacrymal et d’augmenter la pénétration transcornéenne de certains PA (comme la dexaméthasone ou la rifamycine).
La carboxyméthylcellulose possède une charge anionique, ce qui peut favoriser la muco-adhésion et augmenter le temps de rupture lacrymale.
Le hyaluronate de sodium, avec sa viscosité élevée, favorise la stabilisation du film lacrymal et augmente le temps de résidence précornéen. Sa tolérance est excellente.
Une prodrogue (ou promédicament) est un médicament dont le métabolite est plus actif au niveau du site d’action que la molécule initiale. Pour être efficace, une prodrogue doit être transformée en métabolite actif avant d’atteindre son site d’action. L’avantage des molécules administrées sous la forme d’une prodrogue est d’améliorer la pénétration du médicament à travers la cornée et de diminuer certains effets indésirables. En particulier, les prodrogues sont développées pour permettre l’administration de PA hautement hydrophobes, tels que la ciclosporine. Au contact de la surface oculaire, la prodrogue est clivée par des estérases présentes dans les larmes (fig. 13-4) [11]. La solution de prodrogue est parfaitement limpide et son instillation a permis de diminuer le taux de rejet de greffe de façon équivalente à une administration systémique de ciclosporine dans un modèle animal, avec un passage systémique négligeable de ciclosporine [12]. Ainsi, non seulement la prodrogue permet la formulation en solution d’une molécule hautement hydrophobe, uniquement formulable dans des huiles, dans sa forme chimique native, mais elle offre également une pénétration intracornéenne profonde, ce que ne permettent pas les formulations huileuses de ciclosporine. Ce produit n’a pas pu être développé en clinique, car il n’a pas franchi les exigences de stabilité de conservation au long cours.
Le latanoprost et le travoprost sont aussi considérés comme des prodrogues ; le groupe à liaison ester est clivé après avoir pénétré la cornée et l’acide libre reste dans l’humeur aqueuse.
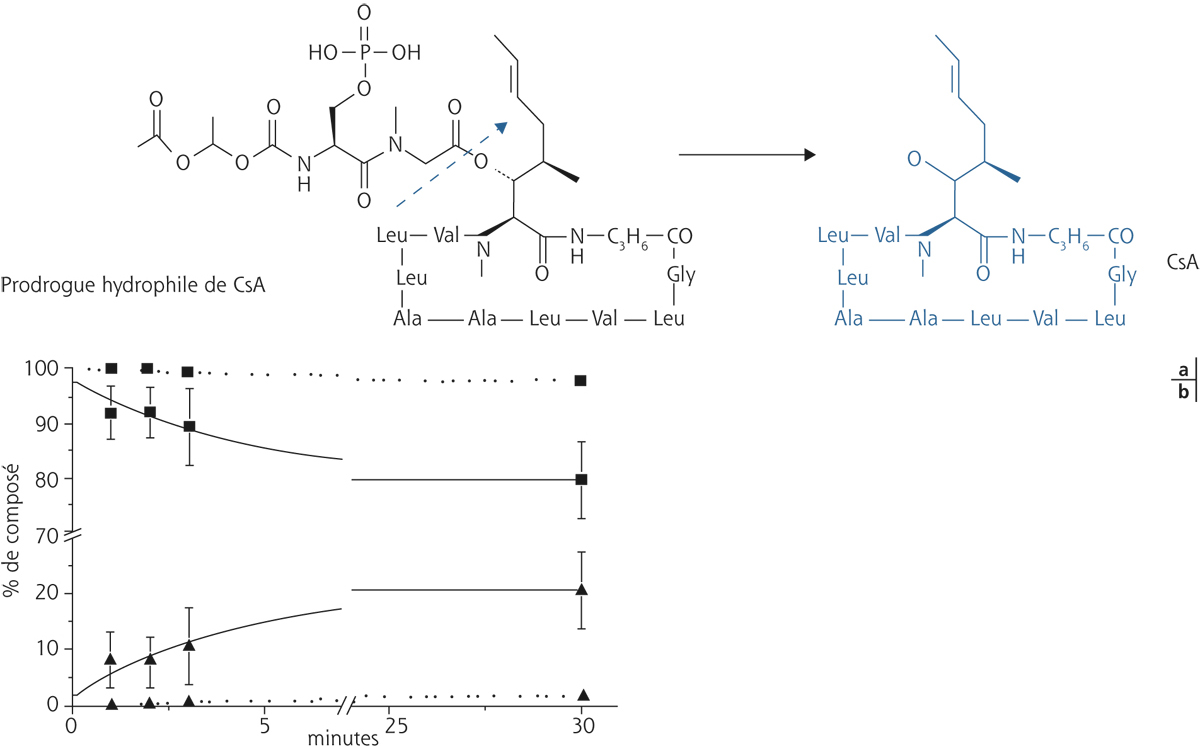
Fig. 13-4 Exemple de promédicament ou (prodrogue).
Exemple de prodrogue de ciclosporine (CsA) hydrosoluble convertie en CsA active en quelques minutes (a) par estérification ex vivo (b) dans des larmes (ligne continue) et non convertie dans une solution tampon (lignes discontinues).
Une goutte aqueuse instillée peut se transforme en gel de manière réversible au contact avec le film lacrymal précornéen. De tels changements dans les propriétés visqueuses peuvent être induits par les altérations de la température, de pH et la composition en électrolytes.
Gelrite®, un polysaccharide acétylé, forme des gels clairs en présence de cations mono- ou divalents se trouvant généralement dans le film lacrymal. Un véhicule hétéropolysaccharidique (gomme de xanthane) produit aussi un temps de contact avec la surface oculaire plus prolongé et il a été incorporé dans une formulation à prise unique quotidienne de gel de timolol. Ces systèmes permettent de réduire la fréquence des instillations.
Le poloxamère 407 possède un noyau hydrophobe de polyoxypropylène et des groupes terminaux hydrophiles de polyoxyéthylène, capables de produire un micro-environnement artificiel dans le film lacrymal qui améliore la biodisponibilité de médicaments lipophiles tels que les stéroïdes.
Les émulsions sont des solutions biphasiques lipide–eau ou eau–lipide qui peuvent se dissoudre et se transformer en produits hydrophiles et lipophiles. Un agent de liaison, tel que le polymère de l’acide polyacrylique Carbopol® 934P, ajouté à la formulation améliore la stabilité physique et la mise en suspension du PA. Ce système a été utilisé avec le médicament antiglaucomateux topique bétaxolol.
Les pommades sont couramment utilisées pour l’application topique des médicaments oculaires. Ces véhicules sont principalement des mélanges de vaseline et d’huile minérale liquide avec ou sans un agent miscible dans l’eau, comme la lanoline. L’huile minérale est ajoutée à la vaseline pour permettre au véhicule d’être à l’état fondu à la température du corps, et la lanoline est ajoutée à la pommade pour absorber l’eau. En général, les pommades sont bien tolérées par les tissus oculaires et lorsque les antibiotiques y sont incorporés, ils sont généralement plus stables en pommade que dans une solution.
L’objectif clinique principal pour un véhicule à base de pommade est d’augmenter le temps de contact oculaire de l’application médicamenteuse. Le temps de contact oculaire est environ 2 fois plus long en cas de clignement des yeux et 4 fois plus long dans l’œil non clignant par rapport à une solution saline. Les pommades sont retenues plus longtemps dans le cul-de-sac conjonctival parce que les grosses molécules de la pommade ne peuvent pas être éliminées facilement dans le système de drainage lacrymal. Les larmes contiennent naturellement une huile non polaire et ceci permet une rétention prolongée des médicaments. Cependant, les pommades présentent plusieurs inconvénients comme la vision trouble transitoire, la difficulté d’administration et la possibilité de traumatisme mineur de la cornée. Par ailleurs, les pommades sont utilisables uniquement pour la formulation de PA lipophiles.
Les colloïdes, ou « solutions » colloïdales, sont des mélanges (liquide, gel) qui contiennent, en suspension, des particules. Ces particules, ou objets colloïdaux, ont une taille supérieure aux molécules qui les constituent (taille supramoléculaire) mais suffisamment petite pour que le mélange demeure homogène. D’après la définition officielle, leur taille est comprise entre un nanomètre et une dizaine de micromètres.
Divers systèmes colloïdaux ont été développés pour une utilisation ophtalmique : des liposomes, des nano-émulsions, des nanoparticules polymériques ou peptidiques, des micelles, etc. Ces dernières années, des nano-émulsions anioniques ou cationiques ont été commercialisées en particulier pour la formulation de ciclosporine (Restasis® est une nano-émulsion anionique et Cationorm® est une émulsion cationique [13, 14]).
Les systèmes colloïdaux présentent de nombreux avantages :
libération prolongée et contrôlable du PA au site choisi ;
fréquence réduite d’administration ;
possibilité de contourner les barrières oculaires et les problèmes d’afflux rencontrés avec le PA natif ;
augmentation de la stabilité de la drogue (en particulier pour les molécules sensibles à une dégradation enzymatique) ;
formulation de PA hautement hydrophobes ;
amélioration de la tolérance locale de certains PA.
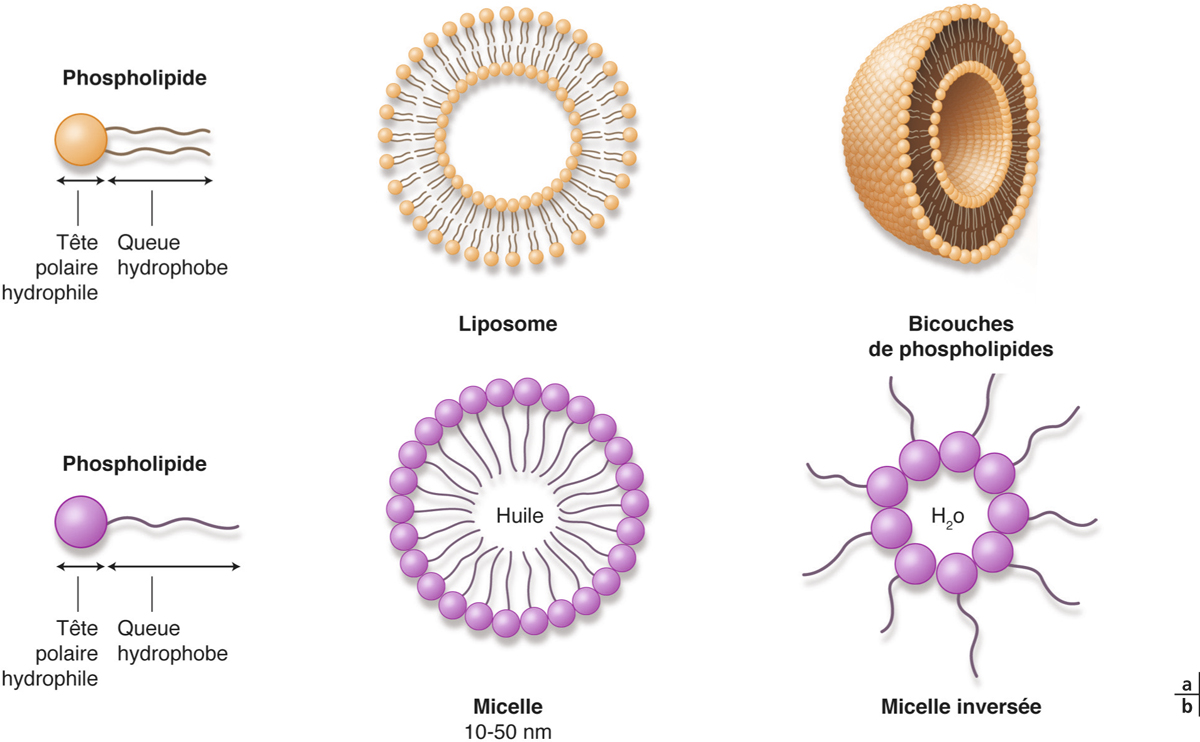
Les liposomes sont des systèmes lipidiques vésiculaires dont le diamètre varie de 50 nanomètres à quelques microns. Ils se prêtent à l’encapsulation de molécules polaires dans leur compartiment aqueux ou de molécules apolaires dans leur compartiment lipidique (ou aussi de molécules dites amphiphiles).
Les liposomes sont composés de phospholipides (surtout phosphatidylcholine) ou de sphingolipides (moins utilisés), qui forment une bicouche lipidique en milieu aqueux (fig. 13-5). Des composants additionnels peuvent être utilisés tels le cholestérol, les lipides chargés ou la phosphatidyléthanolamine. L’adjonction de cholestérol (jusqu’à 20 à 30 %) semble stabiliser le liposome et en prolonger la durée de vie, tandis que les lipides chargés modifient la charge du liposome, donc l’interaction avec le principe actif plus ou moins chargé. La phosphatidyléthanolamine permet le couplage de ligands à la surface du liposome afin de les fonctionnaliser. Les liposomes sont des systèmes biocompatibles et biodégradables.
En ophtalmologie, les liposomes ont été administrés par les voies topique, sous-conjonctivale, intravitréenne et veineuse. Actuellement, la seule préparation liposomale commerciale est un spray de liposomes de lécithine de soja pour le traitement de l’œil sec (Vyseo®) qui se vaporise sur les paupières closes. Les préparations liposomales magistrales de fluconazole (2 mg/ml) sont également utilisées avec succès pour le traitement des kératites fongiques chez l’homme [15]. L’injection sous-conjonctivale de liposomes d’amphotéricine B (contenant 1,5 mg) s’est avérée efficace dans un modèle de kératite amibienne chez le lapin [16]. Les liposomes présentent pourtant de nombreux avantages, en particuliers quand ils sont positivement chargés, ils prolongent le temps de résidence à la surface cornéenne et selon leur taille et composition, certains liposomes pénètrent dans les couches épithéliales formant un réservoir de PA [17, 18]. Des systèmes combinant des liposomes dans des hydrogels sont développés pour réduire la fréquence d’instillation du timolol [19].
L’utilisation des liposomes est limitée par des problèmes de stérilisation et de stabilité des préparations expliquant leur faible développement commercial.
Une micelle est un agrégat sphérique de molécules de petite taille (de 1 à 50 nm) dont la tête polaire chargée est tournée vers le solvant et la queue hydrophobe est tournée vers l’intérieur. Des micelles inverses peuvent se former dans des solvants organiques (voir fig. 13-5). Les micelles sont particulièrement adaptées pour la formulation de PA hydrophobes, elles présentent une grande stabilité et peuvent être formées de polymères biocompatibles. Récemment, une nouvelle technologie de préparation de micelles formées d’acide hydroxy-octanoïque 3,6-dihexyl-1,4-dioxane-2,5-dione (dihexyl substitut de l’acide lactique) et de méthoxypoly(éthylène)glycol-hexylsubstituted poly(lactides) chargées de 0,5 % de ciclosporine (CsA/MPEG-hexPLA) a démontré son efficacité à franchir la barrière épithéliale après instillation, sans la rompre, assurant ainsi des concentrations efficaces de ciclosporine dans les segments antérieur et postérieur de l’œil (fig. 13-6). L’instillation de ces micelles de ciclosporine (5 fois/jour) a permis d’inhiber un rejet de greffe de cornée sur un modèle animal, ce que la formulation huileuse classique de ciclosporine ne permet pas, car sa pénétration est limitée à l’épithélium cornéen du fait de son hydrophobicité [20, 21].
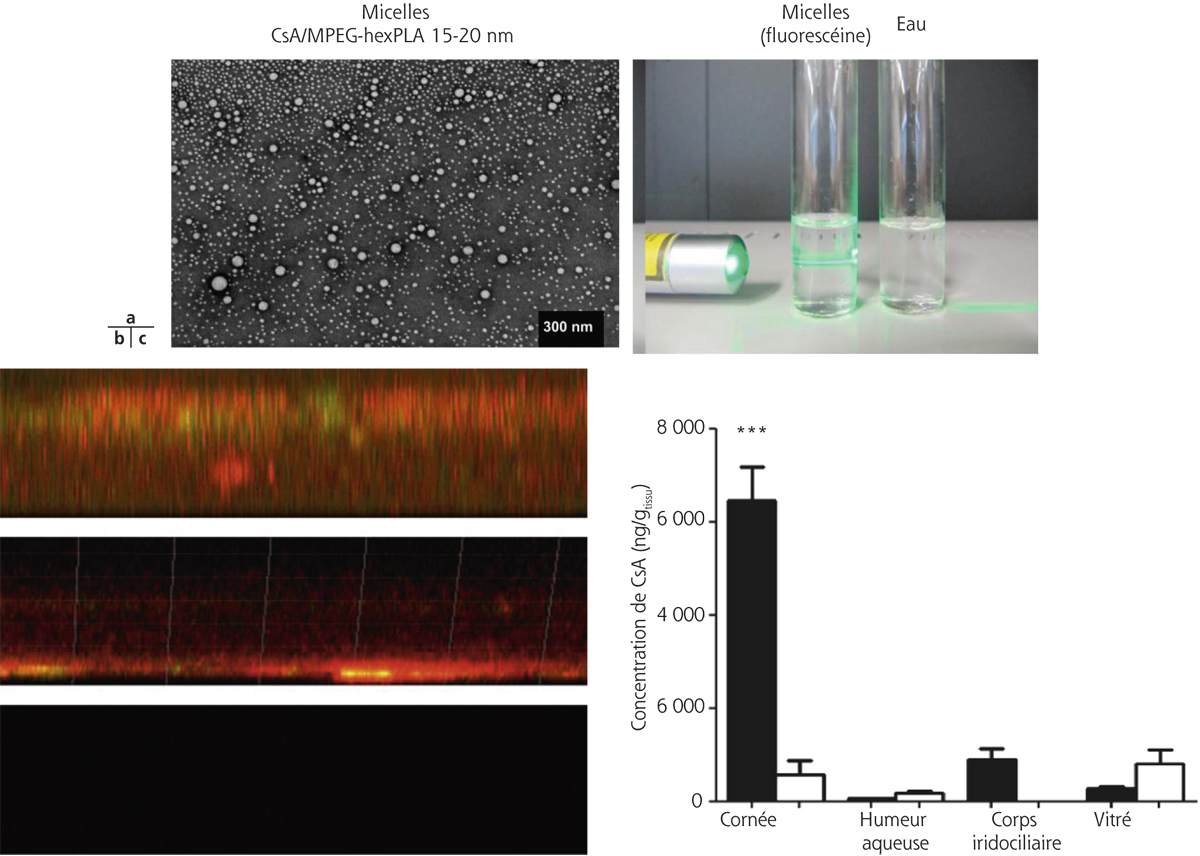
Fig. 13-6 Exemple de micelles polymériques de ciclosporine.
a. Micelles chargées de fluorescéine formant une solution parfaitement transparente. b. Après 5 instillations/jour pendant 5 jours, les micelles (vertes) ont pénétré dans l’épithélium, puis elles libèrent de la rhodamine (rouge) dans l’épithélium et aussi dans l’endothélium. c. Comparaison des taux de ciclosporine dans les différents tissus des yeux de rongeur après instillation de prodrogue ou de formulation huileuse classique.
Les nanoparticules sont parmi les systèmes colloïdaux les plus étudiés pour non seulement protéger les PA de la dégradation et améliorer leur biodisponibilité mais également dans le but de cibler certaines cellules et de franchir des membranes biologiques. Les nanoparticules de polymères colloïdales sont constituées de matériaux macromoléculaires formant des sphères de 10 à 1 000 nm. Selon les méthodes de préparation, le PA peut être dissous, enchevêtré, adsorbé, lié ou encapsulé dans la matrice polymérique. On distingue les nanosphères ou les nanocapsules dont les profils de libération sont différents. Les nanosphères sont des sphères polymériques solides où le PA est soit incorporé, soit adsorbé à la surface. Les nanocapsules comportent une cavité centrale entourée d’une capsule polymérique. Les nanoparticules prolongent considérablement le temps de résidence à la surface de l’œil et si elles sont des très petites tailles (< 10 nm), elles sont parfaitement tolérées [17].
Les nanoparticules peuvent être formées de :
différents polymères biodégradables : polylactides, poly(D, L-lactides), PLGA, e-caprolactone, polyacrylamide, polycyanoacrylate et poly(méthyl-méthacrylate) ;
polymères naturels : gélatine, sodium alginate, albumine, tamarind kernel polysaccharide.
De façon intéressante, les nanoparticules peuvent pénétrer dans les cellules de la cornée et/ou de la conjonctive et sont la cible en particulier des cellules à haut pouvoir phagocytique, comme les macrophages, ce qui permet de cibler les cellules inflammatoires. Après une injection intracamérulaire, des nanoparticules polymériques peuvent être pinocytées par les cellules endothéliales de la cornée et migrer jusqu’à l’épithélium sans altérer l’intégrité des barrières (fig. 13-7) [22]. Certaines particules peuvent également être utilisées comme vecteurs d’acides nucléiques à des fins de thérapie génique non virale. Administrés par voie sous-conjonctivale, des systèmes complexes de microsphères contenant des nanoparticules d’oligonucléotides ont permis de réduire la fibrose post-trabéculectomie en réduisant l’expression de TGF-β [23].
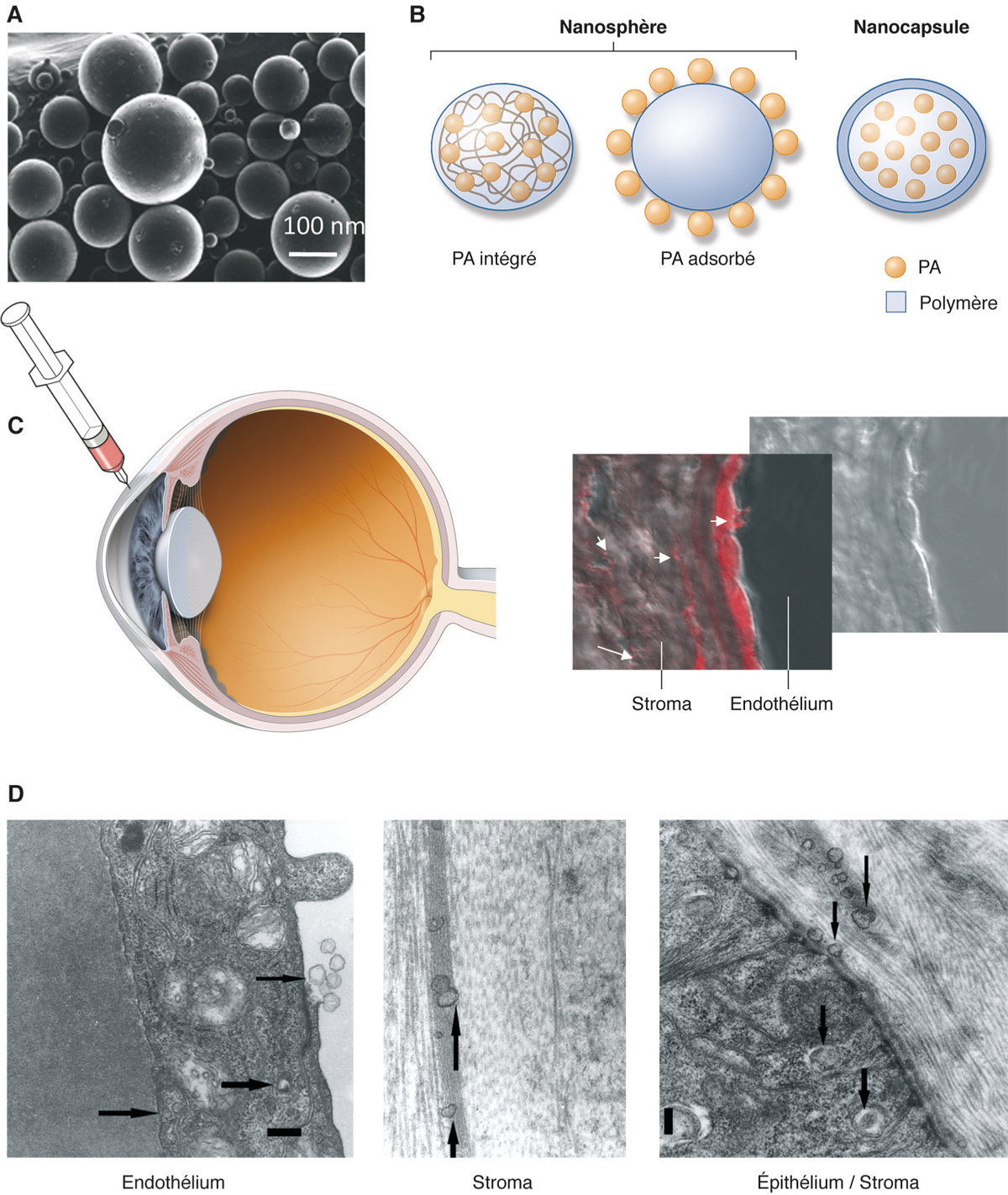
Fig. 13-7 Nanoparticules.
a. Microphotographie de nanoparticules polymériques. b. Différents types de particules (PA : principe actif). c. Devenir de nanoparticules chargées de Nole red après injection dans la chambre oculaire. d. Microscopie électronique.
Les cyclodextrines sont des oligosaccharides cycliques constitués d’une surface externe hydrophile formée de six à huit unités de glucose incorporant dans leur centre des médicaments lipophiles. Elles sont solubles dans l’eau et sont souvent utilisées pour améliorer la solubilité, la stabilité de divers composés. Elles ont démontré une biodisponibilité oculaire élevée et ont été étudiées pour une administration ophtalmique potentielle.
L’iontophorèse est un procédé permettant la pénétration de molécules chargées dans des cellules ou des tissus sous l’effet d’un courant électrique direct ou alternatif. Les molécules hydrophiles, de faible poids moléculaire, sont les meilleurs candidats pour l’administration par iontophorèse. Bien que la pénétration par iontophorèse soit inversement dépendante du poids moléculaire, des molécules neutres et des molécules de haut poids moléculaire telles que des protéines ont aussi pu être transférées à travers la peau par ce procédé.
Les mécanismes biophysiques et biologiques précis impliqués dans la pénétration tissulaire de produits actifs sous l’effet de l’iontophorèse demeurent mal connus. La majorité des études théoriques ont été effectuées sur la peau et ne sont pas forcément applicables à l’œil.
En 1908, Wirtz a réalisé pour la première fois une iontophorèse transcornéenne de sel de zinc afin de traiter des ulcères de cornée. En 1965, Lachaud a rapporté l’utilisation de l’iontophorèse transsclérale d’hydrocortisone dans le traitement des uvéites. En 1966, Jones et Maurice ont pu mesurer le flux d’humeur aqueuse grâce à une iontophorèse transcornéenne de fluorescéine. Cependant, malgré près d’un siècle de publication, l’iontophorèse en ophtalmologie s’est peu développée. Les études précliniques ont cependant montré que l’iontophorèse par voie transcornéenne était efficace pour administrer des antibiotiques, des antiviraux ou des corticoïdes [22, 24]. Cependant, les risques de lésions cornéennes n’ont pas permis de transposer cette méthode en clinique.
L’iontophorèse transsclérale, utilisant un anneau périlimbique (fig. 13-8) est parfaitement tolérée et indolore chez les patients. Elle permet l’administration de corticoïdes non seulement dans la cornée, démontrant son efficacité dans le traitement du rejet de greffe [25, 26], mais également dans les tissus de la surface oculaire, ayant été testée pour le traitement de l’œil sec [27]. Cette méthode est aussi efficace dans le traitement des uvéites antérieures aiguës [28]. L’iontophorèse peut être considérée comme une injection sous-conjonctivale « optimisée » assurant une excellente pénétration des médicaments dans les tissus du segment antérieur et du segment postérieur, avec un passage systémique minimal et un effet prolongé liés à l’imprégnation des tissus péri-oculaires. Son effet clinique, par exemple sur le rejet de greffe de cornée, s’explique par une diffusion des corticoïdes non seulement dans la cornée mais également dans les ganglions drainants.
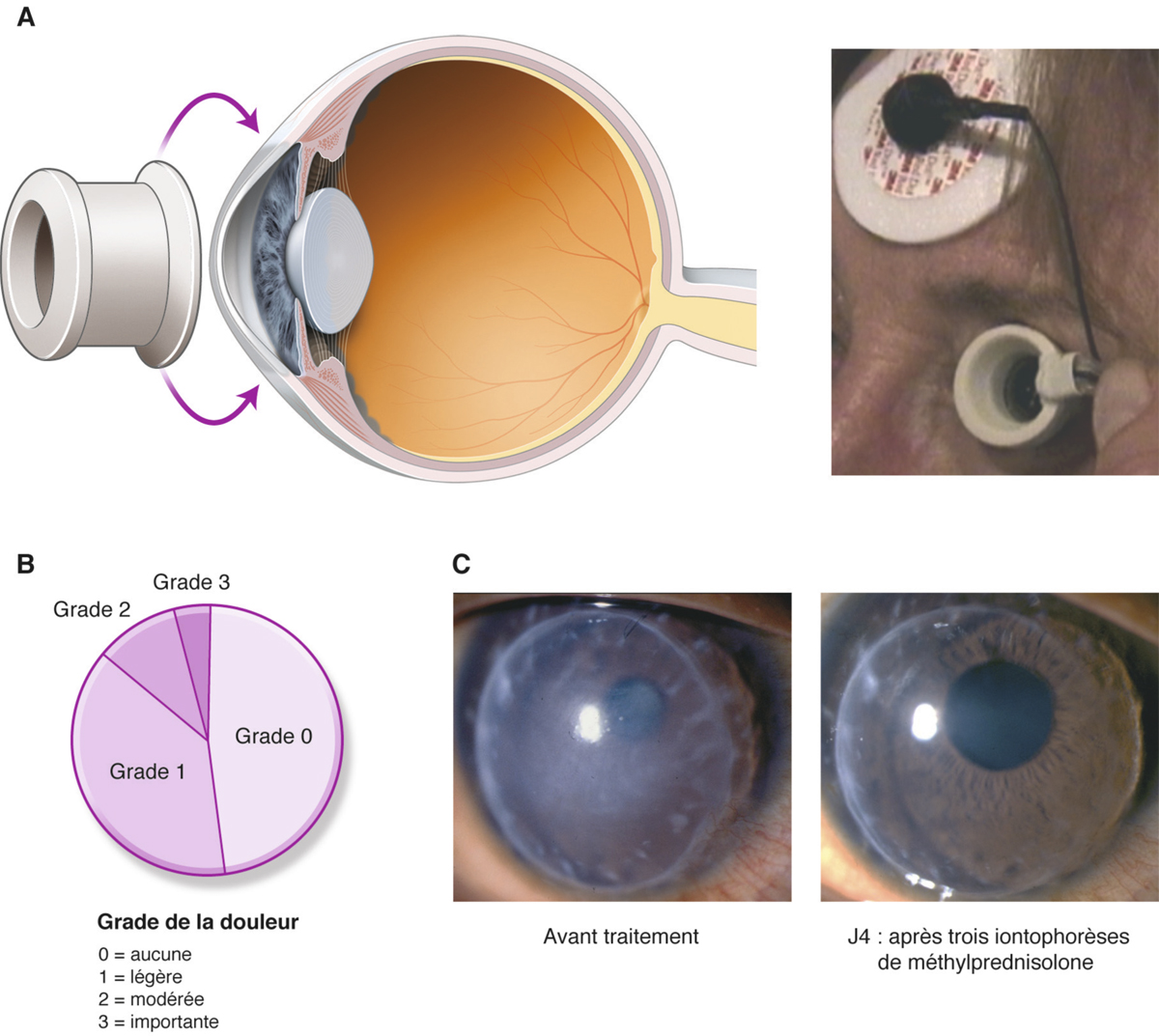
Fig. 13-8 Iontophorèse transsclérale.
a. Représentation schématique de la diffusion d’un principe actif dans le segment antérieur après application. b. Tolérance subjective d’une iontophorèse chez des patients ; à J4, évolution d’un rejet de greffe de cornée, traitée par iontophorèse de solumédrol.
Des lentilles de contact souples et des pansements de collagène ont la propriété d’absorber des médicaments en solution et de les libérer lentement quand ils sont placés sur l’œil. Avec de nouveaux matériaux de lentilles, des libérations prolongées d’antifongiques sur plusieurs semaines sont possibles mais les risques d’insérer une lentille sur un œil infecté restent un frein au développement de ces produits [29]. Toutefois des technologies nouvelles combinent l’incorporation de nanosystèmes dans les matériaux des lentilles de contact, assurant des libérations bien contrôlées de PA pour traiter le glaucome par exemple [29] et ouvrant de nouvelles perspectives pour ces systèmes d’administration.
Les inserts conjonctivaux sont une autre alternative ; formés de polymères biodégradables ou non, ils évitent les instillations fréquentes de médicaments mais leur tolérance est médiocre.
La voie topique représente 80 % des prescriptions en ophtalmologie. Elle est le plus souvent efficace pour traiter les pathologies de la surface oculaire bien que dans les cas les plus graves, des applications très fréquentes puissent être requises. L’utilisation de systèmes à libération prolongée serait alors idéale. D’autres voies d’administration sont efficaces pour traiter les tissus de la surface oculaire, telle la voie sous-conjonctivale qui non seulement permet d’atteindre les ganglions drainants et les tissus péri-oculaires, mais agit comme un « réservoir » de PA. Cependant, la voie sous-conjonctivale n’est pas une voie locale et le passage systémique équivaut à une administration par voie générale. L’administration systémique de médicaments est rarement requise mais peut être nécessaire quand il s’agit d’induire une immunosuppression qu’un traitement « local » ne permet pas d’atteindre.
Pour les biothérapies, telles que l’utilisation de protéines thérapeutiques, il est préférable d’envisager des injections sous-conjonctivales, efficaces pour atteindre la cornée, plutôt que des administrations topiques conduisant à une faible biodisponibilité des protéines thérapeutiques.
Enfin, l’utilisation de vecteurs de thérapie génique, viraux ou non viraux, est une alternative intéressante qui permet la production prolongée de protéines thérapeutiques localement afin de contrôler le micro-environnement locorégional.
Le choix de la voie d’administration et de la formulation dépend du type de molécule thérapeutique requis, du tissu cible et de la cinétique de libération nécessaire à l’obtention d’un effet thérapeutique optimal.
Avant de conclure à l’inefficacité d’un traitement, il faut toujours s’assurer que la biodisponibilité d’un médicament administré est suffisante.
[1] El Sanharawi M, Kowalczuk L, Touchard E, et al. Protein delivery for retinal diseases : from basic considerations to clinical applications. Prog Retin Eye Res 2010 ; 29 : 443-65. Review.
[2] Hosseini H, Nowroozzadeh MH, Salouti R, Nejabat M. Anti-VEGF therapy with bevacizumab for anterior segment eye disease. Cornea 2012 ; 31 : 322-34.
[3] Rocher N, Behar-Cohen F, Pournaras JA, et al. Effects of rat anti-VEGF antibody in a rat model of corneal graft rejection by topical and subconjunctival routes. Mol Vis 2011 ; 17 : 104-12.
[4] Berdugo M, Larsen IV, Abadie C, et al. Ocular distribution, spectrum of activity, and in vivo viral neutralization of a fully humanized anti-herpes simplex virus IgG Fab fragment following topical application. Antimicrob Agents Chemother 2012 ; 56 : 1390-402.
[5] Gaudana R, Ananthula HK, Parenky A, Mitra AK. Ocular drug delivery. AAPS J 2010 ; 12 : 348-60.
[6] Madhu C, Rix P, Nguyen T, et al. Penetration of natural prostaglandins and their ester prodrugs and analogs across human ocular tissues in vitro. J Ocul Pharmacol Ther 1998 ; 14 : 389-99.
[7] Ichhpujani P, Katz LJ, Hollo G, et al. Comparison of human ocular distribution of bimatoprost and latanoprost. J Ocul Pharmacol Ther 2012 ; 28 : 134-45.
[8] Vaede D, Baudouin C, Warnet JM, Brignole-Baudouin F. Preservatives in eye drops : toward awareness of their toxicity. J Fr Ophtalmol 2010 ; 33(7) : 505-24.
[9] Baudouin C. The pathology of dry eye. Surv Ophthalmol 2001 ; 45 Suppl 2 : S211-20. Review.
[10] Baudouin C. Side effects of antiglaucomatous drugs on the ocular surface. Curr Opin Ophthalmol 1996 ; 7 : 80-6. Review.
[11] Rodriguez-Aller M, Kaufmann B, Guillarme D, Stella C, et al. In vivo characterisation of a novel water-soluble cyclosporine A prodrug for the treatment of dry eye disease. Eur J Pharm Biopharm 2012 ; 80 : 544-52.
[12] Bourges JL, Lallemand F, Agla E, et al. Evaluation of a topical cyclosporine A prodrug on corneal graft rejection in rats. Mol Vis 2006 ; 12 : 1461-6.
[13] Lallemand F, Felt-Baeyens O, Besseghir K, et al. Cyclosporine A delivery to the eye : a pharmaceutical challenge. Eur J Pharm Biopharm 2003 ; 56 : 307-18. Review.
[14] Di Tommaso C, Behar-Cohen F, Gurny R, Möller M. Colloidal systems for the delivery of cyclosporin A to the anterior segment of the eye. Ann Pharm Fr 2011 ; 69 : 116-23.
[15] Abdel-Rhaman MS, Soliman W, Habib F, Fathalla D. A new long-acting liposomal topical antifungal formula : human clinical study. Cornea 2012 ; 31(2) : 126-9.
[16] Kaji Y, Yamamoto E, Hiraoka T, Oshika T. Toxicities and pharmacokinetics of subconjunctival injection of liposomal amphotericin B. Graefes Arch Clin Exp Ophthalmol 2009 ; 247(4) : 549-53.
[17] Ali J, Fazil M, Qumbar M, Khan N, Ali A. Colloidal drug delivery system : amplify the ocular delivery. Drug Deliv 2014 : 1-17.
[18] Souza JG, Dias K, Pereira TA, et al. Topical delivery of ocular therapeutics : carrier systems and physical methods. J Pharm Pharmacol 2014 ; 66(4) : 507-30.
[19] Zhang HH, Luo QH, Yang ZJ, et al. Novel ophthalmic timolol meleate liposomal-hydrogel and its improved local glaucomatous therapeutic effect in vivo. Drug Deliv 2011 ; 18(7) : 502-10.
[20] Di Tommaso C, Bourges JL, Valamanesh F, et al. Novel micelle carriers for cyclosporin A topical ocular delivery : in vivo cornea penetration, ocular distribution and efficacy studies. Eur J Pharm Biopharm 2012 ; 81 : 257-64.
[21] Di Tommaso C, Valamanesh F, Miller F, et al. A novel cyclosporin a aqueous formulation for dry eye treatment : in vitro and in vivo evaluation. Invest Ophthalmol Vis Sci 2012 ; 53 : 2292-9.
[22] Behar-Cohen F. Drug delivery systems to target the anterior segment of the eye : fundamental bases and clinical applications. J Fr Ophtalmol 2002 ; 25 : 537-44. Review.
[23] Gomes dos Santos AL, Bochot A, Doyle A, et al. Sustained release of nanosized complexes of polyethylenimine and anti-TGF-beta 2 oligonucleotide improves the outcome of glaucoma surgery. J Control Release 2006 ; 112(3) : 369-81.
[24] Halhal M, Renard G, Courtois Y, et al. Iontophoresis : from the lab to the bed side. Exp Eye Res 2004 ; 78 : 751-7.
[25] Halhal M, Renard G, Bejjani RA, Behar-Cohen F. Corneal graft rejection and corticoid iontophoresis : 3 case reports J Fr Ophtalmol. 2003 ; 26 : 391-5.
[26] Patane MA, Cohen A, From S, et al. Ocular iontophoresis of EGP-437 (dexamethasone phosphate) in dry eye patients : results of a randomized clinical trial. Clin Ophthalmol 2011 ; 5 : 633-43.
[27] Cohen AE, Assang C, Patane MA, et al. Evaluation of dexamethasone phosphate delivered by ocular iontophoresis for treating noninfectious anterior uveitis. Avion Study Investigators. Ophthalmology 2012 ; 119 : 66-73.
[28] Phan CM, Subbaraman L, Jones L. Contact lenses for antifungal ocular drug delivery : a review. Expert Opin Drug Deliv 2014 ; 11 : 537-46.
[29] González-Chomón C, Concheiro A, Alvarez-Lorenzo C. Soft contact lenses for controlled ocular delivery : 50 years in the making. Ther Deliv 2013 ; 4 : 1141-61.