Définitions
C. Meyniel , P. -Y. Robert
Voir, regarder, viser, scruter, chercher, découvrir, admirer, contempler, appréhender, surprendre, remarquer, rencontrer, percevoir, distinguer, entrevoir, discerner, observer, apercevoir, constater, remarquer, être témoin, surveiller, épier, repérer, fixer, toiser, mater, dévisager, désigner, poursuivre, aviser, examiner, inspecter, reconnaître, revoir, visualiser, lire, étudier, consulter, visionner, etc.
Plus de 200 verbes ou expressions différentes témoignent de la richesse et de la complexité de la fonction visuelle chez l’homme. Originellement destinée à détecter le danger, chercher la nourriture ou choisir un partenaire sexuel, la fonction visuelle est devenue aujourd’hui socialement déterminante, notamment dans l’accès à l’image, au texte ou à la beauté.
Elle peut être schématisée en trois fonctions génériques : fonction de perception, fonction d’exploration, fonction de veille.
On estime que 80 % de notre perception du monde extérieur est visuelle; le cortex occipital représente à lui seul entre 20 et 25 % de la surface du cortex cérébral humain [1].
L’information visuelle qui parvient à la rétine a traversé les milieux transparents de l’œil, ses erreurs réfractives et opacités, a été rendue nette par l’accommodation, a été adaptée à l’intensité lumineuse par le jeu pupillaire, et à la vision nocturne par la synthèse du pourpre rétinien.
Un grand nombre de déficiences visuelles trouvent leur cause dans ces premiers éléments, mais la rééducation implique de comprendre comment l’information est ensuite traitée.
La perception rétinienne de l’information visuelle n’est pas uniforme. Chantal Milleret explique comment la perception rétinienne s’organise en champs récepteurs (voir chap. 2.1).
La rétine effectue ensuite un tri actif de l’information visuelle, assuré par les cellules bipolaires, et dans une moindre mesure les cellules amacrines et les cellules de Müller. Dès le stade rétinien, les informations de couleur, de mouvement, de fréquence spatiale sont traitées différemment. Il n’existe ainsi que 1 million de cellules ganglionnaires pour 4,6 millions de cônes et 92 millions de bâtonnets. L’ingénierie des prothèses rétiniennes les plus avancées essaie aujourd’hui de restaurer ce prétraitement rétinien de l’information visuelle (voir chap. 9.3).
L’information issue des cellules ganglionnaires est acheminée au cortex visuel après avoir fait un relais dans le thalamus au niveau du corps géniculé latéral. Ce système, appelé géniculostrié, est composé de trois voies :
la voie P (parvocellulaire), issue des cônes L ou M et des bâtonnets, qui véhicule la vision scotopique et photopique, les hautes fréquences spatiales (vision des détails) et la vision des couleurs (rouge-vert). Elle représente 80 % de l’information visuelle
la voie M (magnocellulaire), issue des cônes L et M, qui véhicule la vision photopique uniquement, les faibles contrastes et les fréquences temporelles élevées (vision du mouvement). Elle représente 20 % de l’information visuelle;
la voie K (koniocellulaire), issue des cônes S, qui véhicule la vision des couleurs (bleu-jaune). Elle représente moins de 1 % de l’information visuelle (voir chap. 2.1).
Parallèlement, une petite partie (moins de 10 %) des axones des cellules ganglionnaires vont se diriger dès la sortie de la rétine vers le colliculus supérieur, puis faire relais dans une région du thalamus, au niveau du pulvinar, pour se terminer dans les lobes temporaux et pariétaux. Ce système, appelé tectopulvinarien, a principalement un rôle dans la sélection de la cible.
Le cortex visuel primaire, appelé aussi cortex strié ou V1, est organisé en colonnes, allant de la surface du cortex jusqu’à la substance blanche sous-corticale. Chaque colonne traite les caractéristiques d’une région donnée du champ visuel : contraste, forme, mouvement, couleur.
L’ensemble du champ visuel est ainsi représenté au niveau de l’aire V1; c’est la rétinotopie. L’hémichamp visuel droit va se projeter sur l’hémisphère gauche et inversement. La fovéa, zone centrale de la macula où la vision des détails est la plus précise, se projette sur près de 60 % de V1.
Les autres aires visuelles du cortex occipital sont appelées cortex extrastrié ou aires visuelles secondaires. De V1, l’information est acheminée à V2, où les signaux concernant la forme, la couleur et le mouvement restent différenciés, formant deux voies principales : la voie dorsale et la voie ventrale.
Les signaux codant pour la forme et le mouvement sont intégrés au niveau des aires visuelles secondaires (V3 et V5) et vont se diriger vers le lobe pariétal, formant la voie dorsale (voie du « où ? » et du « comment ? »).
Elle permet de réaliser des mouvements sous le contrôle de la vue afin de guider en temps réel les actions. Les lésions de cette voie peuvent entraîner une agnosie spatiale, composée de deux principaux tableaux cliniques :
l’héminégligence : le patient ignore les éléments situés dans l’espace opposé à la lésion pariétale ;
le syndrome de Balint : il est constitué d’une incapacité du patient d’analyser plusieurs objets à la fois (simultagnosie), d’une réduction de l’exploration visuelle spontanée (apraxie oculomotrice) et de difficultés à réaliser des mouvements sous le contrôle de la vue (ataxie optique) [2].
Les signaux codant pour la forme et la couleur sont intégrés au niveau des aires visuelles secondaires V3 et V4 et vont se diriger vers le lobe temporal, formant la voie ventrale (voie du « quoi ? »).
La voie ventrale permet l’identification des objets, à travers, tout d’abord, une analyse perceptive, entraînant une reconnaissance de la forme en 2 puis en 3 dimensions, suivie, dans un second temps, d’une analyse associative de cette représentation visuelle qui sera comparée aux objets connus. Les lésions de cette voie peuvent entraîner une agnosie visuelle, dont il existe deux principales catégories :
l’agnosie aperceptive : le patient est incapable de reconnaître ou de copier des formes simples;
l’agnosie visuelle associative : le patient perçoit les objets et peut les décrire mais n’arrive pas à les identifier visuellement [2].
L’information visuelle est ensuite traitée par de très nombreuses zones corticales de reconnaissance associées par exemple à la mémoire et aux émotions. La façon dont nous percevons une scène visuelle est intimement liée à notre mémoire, notre histoire, notre culture et nos affects : c’est le cerveau qui voit.
Toutes les démarches de réadaptation visuelle s’appuient sur les capacités de plasticité cérébrale, notamment dans les capacités de mémoire visuelle, d’attention, d’accroche visuelle et de reconnaissance.
Par exemple, la réadaptation de certaines tâches (par exemple jouer aux cartes, faire la cuisine) sera facilitée si le patient en a gardé une image mentale précise. De la même façon, certains patients devenus non voyants sont capables d’utiliser leur mémoire visuelle au point d’apprécier assidûment le cinéma, en reconstituant mentalement les scènes à partir des seules informations sonores. À l’inverse, l’éducation visuelle des jeunes enfants doit toujours prendre en considération l’absence de représentations mentales préalables.
La fonction d’exploration visuelle sous-entend la notion de cible visuelle, et suppose plusieurs capacités (voir chap. 2.2) :
recherche, balayage visuel;
accroche;
fixation;
poursuite.
La fonction d’exploration est indépendante de la fonction de perception : certains patients atteints de dégénérescence maculaire liée à l’âge (DMLA) avec un scotome central limité peuvent avoir un comportement de non-voyant si leur fonction d’exploration est inopérante.
La notion d’attracteur a été modélisée par le mathématicien français René Thom en 1971 dans sa théorie des catastrophes [3].
Cette théorie propose des modèles géométriques pour expliquer ce qui se passe lorsque plusieurs attracteurs sont en concurrence. Par exemple, lorsqu’un funambule est en équilibre, il est sous l’influence de deux attracteurs de la pesanteur pouvant le faire tomber respectivement à droite ou à gauche. Il suffit d’un événement brutal infiniment petit (une « catastrophe ») pour qu’un attracteur prenne irréversiblement l’ascendant sur l’autre.
La théorie des catastrophes a permis de modéliser un grand nombre de phénomènes de changements biologiques. Le mathématicien français Jacques Viret a proposé ainsi une modélisation pour quatre niveaux de traitement du signal visuel : la phototransduction d’une information lumineuse, la genèse d’un potentiel d’action, la perception visuelle corticale et l’intégration cognitive [4].
En réadaptation visuelle, la théorie des catastrophes peut nous aider à comprendre, par exemple, les enjeux de rééducation du point de fixation. Lorsqu’un patient est atteint de maculopathie, il doit apprendre à développer un nouveau point de fixation extrafovéolaire (voir chap. 5.5) extrafovéolaire. La fixation est alors soumise à deux attracteurs compétitifs : la fovéa malade et le nouveau point de fixation. La Fig. 1-1 illustre comment un patient qui perd progressivement sa vision centrale peut passer par un stade de quasi-cécité avant d’être capable d’utiliser une fixation extrafovéolaire.
Enfin, la fonction visuelle joue un rôle déterminant dans le rythme nycthéméral, dans le rythme veille/sommeil, notamment par les cellules ganglionnaires photosensibles (voir chap. 4.5), qui peut expliquer la gêne de certains patients (par exemple les glaucomateux) liée au dérèglement de leur horloge biologique.
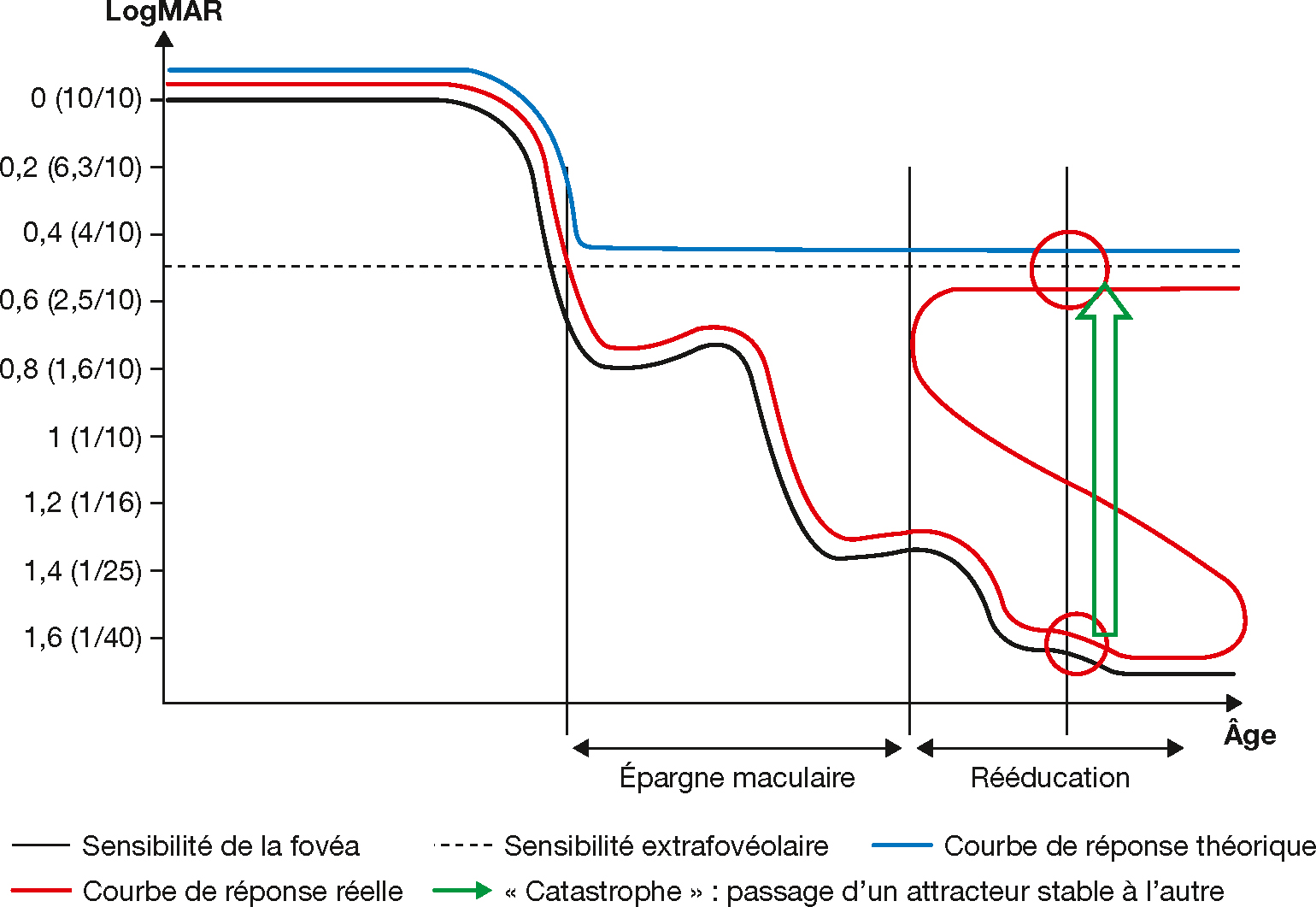
Fig. 1-1 Le schéma figure l’évolution de la sensibilité rétinienne (chiffrée en degrés potentiels d’acuité visuelle), en fonction du temps, chez un patient maculopathe évolutif suivi pendant de nombreuses années.
À mesure que la sensibilité de l’attracteur fovéolaire décroît, certains points de fixation extrafovéolaires devenus plus sensibles que la fovéola peuvent constituer un deuxième attracteur. La courbe de réponse en termes d’acuité visuelle pourrait être tracée en choisissant à chaque temps donné la meilleure acuité visuelle possible (courbe bleue). Dans ce modèle, le patient serait capable de tirer profit de sa meilleure acuité visuelle, passant facilement d’un attracteur à l’autre au profit du plus performant. En revanche, si l’on modélise la courbe de réponse en introduisant une catastrophe élémentaire de type pli (courbe rouge), on voit que lorsque le point extrafovéolaire devient plus sensible que la fovéa, à chaque temps donné, deux attracteurs stables entrent en concurrence. Le patient est ainsi susceptible de passer par un stade de quasi-cécité avant de trouver le chemin du nouvel ERP. Cette brusque bascule vers le nouveau point extrafovéolaire constitue une catastrophe au sens de René Thom.
[1] Wandell BA, Dumoulin SO, Brewer AA Visual field maps in human cortex Neuron 2007 ; 56(2) : 366-383.
[2] Barton JJ Disorder of higher visual function Curr Opin Neurol 2011 ; 24(1) : 1-5
[3] Thom R Stabilité structurelle et morphogenèse Paris: Dunod (1984).
[4] Viret J Attracteur ou adaptabilité de survie fonctionnelle Avancées en ophtalmologie. Apport de la conquête spatiale Paris: Tec et Doc-Lavoisier (2012).
V. Daien, S. Reznikov, X. - M. Lucas, P. -Y. Robert
L’ouverture des droits et l’éligibilité à une réadaptation impliquent de définir et classifier les déficiences visuelles. Les débats issus de la conférence internationale de consensus de l’Organisation mondiale de la santé (OMS) à Rome en décembre 2015 ont permis de dégager une définition large [1] : « Peuvent être éligibles à la réadaptation visuelle, les patients avec une basse vision définie par l’OMS (WHO/PBL/93.27), et généralement les patients avec des déficits visuels bilatéraux ou des troubles de la cognition visuelle interférant avec la vie quotidienne ».
Cette définition se fonde sur la classification de référence OMS [2], éditée en 1993, et révisée en 2006 (Tableau 1-1), qui a été reprise dans la 10e édition (2008) de la Classification internationale des maladies (CIM-10, ICD-10 en anglais pour International Classification of Diseases), sous le chapitre H54, « Cécité et baisse de la vision » [3].
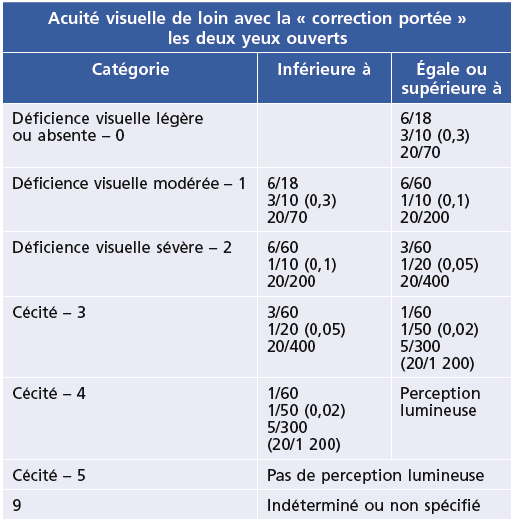
Tableau 1-1 Déficience visuelle dans la Classification internationale des maladies (CIM-10)*.
* -D’après Classification internationale des maladies : http://apps.who.int/classifications/icd10/browse/2008/fr.
Dans cette classification qui comprend 5 catégories, la déficience visuelle commence lorsque l’acuité visuelle est inférieure à 6/18 (3/10), ou le champ visuel inférieur à 10 degrés à partir du point de fixation, sur le meilleur œil, malgré tout traitement et toute correction réfractive; et la « cécité » est définie par une acuité inférieure à 3/60 (1/20) sur le meilleur œil (catégories 3, 4 et 5). Ces catégories correspondent, dans le barème en droit commun, à des incapacités fonctionnelles de 40 % à 85 % (Tableau 1-2).
Selon les recommandations de l’OMS, lorsqu’il s’agit d’évaluer la fonction visuelle dans son ensemble, à l’échelle des individus, l’acuité visuelle devrait être mesurée les deux yeux ouverts et avec la correction – quelle qu’elle soit – que la personne porte habituellement et non pas avec la meilleure correction théoriquement possible. Au cours des enquêtes épidémiologiques, il est cependant fréquent que l’acuité visuelle soit mesurée pour chaque œil séparément, puis c’est l’acuité visuelle du « meilleur œil » qui est retenue pour définir le niveau de la fonction visuelle.
Si le champ visuel est pris en considération, seront classées dans la catégorie 3 les personnes dont le champ visuel est inférieur à 10° mais supérieur à 5° autour du point de fixation, et dans la catégorie 4 les personnes dont le champ visuel est inférieur ou égal à 5° autour du point de fixation, même si l’acuité centrale est intacte.
Il est à noter que le terme « basse vision », qui était utilisé dans les versions antérieures de la classification internationale, a été remplacé par « déficience visuelle modérée » et « déficience visuelle sévère » pour éviter toute confusion entre un niveau d’acuité visuelle et le besoin d’une réhabilitation visuelle du fait d’une situation incurable.
Depuis quelques années, une révision complète de la classification internationale des maladies est en cours. Cette ICD-11 différera sensiblement de la version actuelle pour deux raisons. D’une part, le processus de révision s’appuie sur une consultation très large et très ouverte à toutes les contributions; d’autre part, elle devrait intégrer la Classification internationale du fonctionnement, du handicap et de la santé (CIF).
La proposition actuelle est d’avoir deux codes différents : l’un pour la déficience visuelle, l’autre pour l’incapacité visuelle. Le premier mesurera la façon dont chaque œil fonctionne; le second évaluera dans quelle mesure les activités de la personne sont limitées. En outre, il est prévu que l’acuité visuelle de près rentre dans la classification internationale et vienne s’ajouter à l’acuité visuelle de loin. Cet ajout aura aussi pour conséquence de faire enfin apparaître la presbytie non corrigée dans les statistiques internationales. C’est d’autant plus important que la déficience de vision de près a un impact au moins aussi important – si ce n’est plus – que la déficience de vision de loin, et ce quels que soient le niveau socio-économique, le cadre ou le mode de vie des personnes concernées.
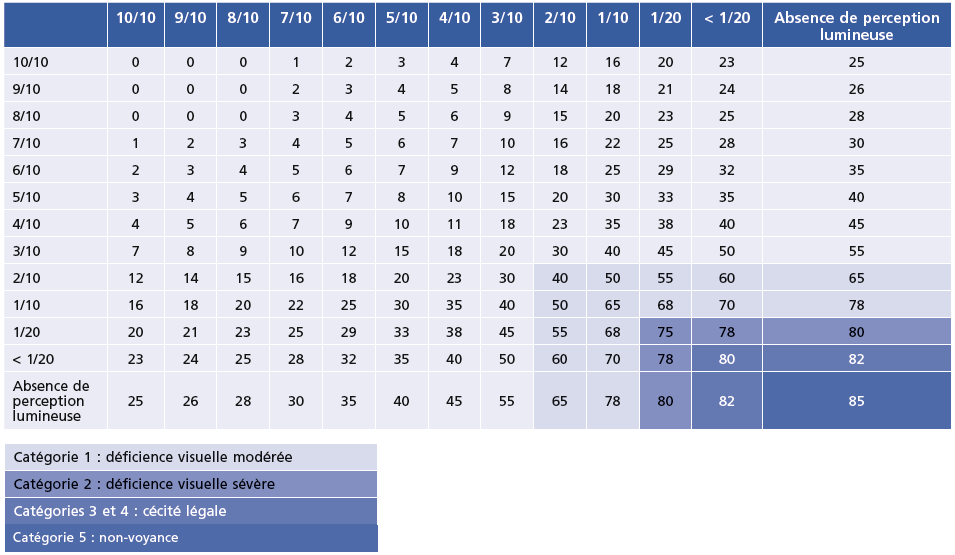
Tableau 1-2 Barème indicatif des incapacités fonctionnelles en droit commun.
En plus de la classification OMS, l’Union européenne des aveugles (European Blind Union [EBU]) a établi et diffusé une liste de 9 paramètres principaux et 5 paramètres annexes, connue sous le nom « Nine-Plus parameters », pour évaluer les déficiences visuelles [4], qui peut par exemple servir de canevas dans un processus de dépistage ou d’évaluation :
–« Nine » parameters :
1 Sensibilité aux contrastes
2 Adaptation et sensibilité à la lumière
3 Sensibilité à l’éblouissement
4 Vision des couleurs
5 Vision nocturne
6 Fixation
7 Nécessité d’un agrandissement pour lire un journal
8 Acuité visuelle de loin et de près
9 Champ visuel, incluant hémianopsie, scotomes et corps flottants
–« Plus » parameters :
1 Diplopie
2 Horror fusionis
3 Dominance du plus mauvais œil
4 Fatigue
5 Lecture : vision, vitesse, erreurs, amplitude, quantité de lumière nécessaire.
Le terme « handicap » provient de la contraction de l’expression anglaise « hand in the cap » signifiant « main dans le chapeau ». À l’origine, le terme « handicapé » n’était pas associé à ceux qui avaient quelque chose en moins, mais plutôt à ceux dont les performances dépassaient celles des autres, que l’on pénalisait pour égaliser les chances de tous.
Les termes « handicap » et « personnes handicapées » ont ensuite progressivement remplacé les termes « infirme », « invalide », « paralytique », « mutilé », « débile », « idiot », etc. qui portaient des connotations péjoratives et dévalorisantes, et qui insistaient sur la dimension de privation (préfixe « in- »). Aujourd’hui, le terme « handicap » est utilisé très largement et dans tous les domaines, pour indiquer un désavantage, qu’il soit économique, social, physique, etc
En 1980, l’OMS a proposé une définition du handicap : « est handicapé un sujet dont l’intégrité physique ou mentale est passagèrement ou définitivement diminuée, soit congénitalement, soit sous l’effet de l’âge, d’une maladie ou d’un accident, en sorte que son autonomie, son aptitude à fréquenter l’école ou à occuper un emploi s’en trouvent compromises ».
Dans la loi du 11 février 2005 pour l’égalité des droits et des chances, la participation et la citoyenneté des personnes handicapées, la définition donnée est la suivante : « constitue un handicap, au sens de la présente loi, toute limitation d’activité ou restriction de participation à la vie en société subie dans son environnement par une personne en raison d’une altération substantielle, durable ou définitive d’une ou plusieurs fonctions physiques, sensorielles, mentales, cognitives ou psychiques, d’un polyhandicap ou d’un trouble de santé invalidant. » La notion de handicap évoque donc un déficit, des limitations, mais surtout les conséquences sur la vie sociale des individus.
L’OMS a publié en 1980 la Classification internationale des handicaps : déficiences, incapacités et désavantages (CIH), révisée en 2001 en Classification internationale du fonctionnement, du handicap et de la santé (CIF ou CIH-2, en anglais ICF pour International Classification of Functioning, Disability and Health).
Dans la première classification de 1980 (CIH), les conséquences d’un état de santé étaient déclinées en déficience (par exemple scotome central), incapacité (par exemple incapacité de lire) et handicap (par exemple impossibilité d’un maintien à domicile).
La nouvelle classification de 2001 (CIH-2) propose une approche différente :
la notion de déficience est remplacée par l’évaluation des fonctions de l’organisme (lettre b), et des structures anatomiques (lettre s);
la notion d’incapacité est remplacée par l’évaluation des activités (exécution d’une tâche) et de la participation (implication du patient) (lettre d);
la notion d’environnement apparaît (lettre e);
les facteurs personnels ne sont pas évalués dans la CIH-2.
À titre d’exemple pour les déficiences visuelles, la CIH-2 propose les catégories suivantes (liste non exhaustive), elles-mêmes déclinées en sous-catégories, à coter sur une échelle de 0 (pas de déficience) à 4 (déficience absolue) :
fonctions de l’organisme (b) :
b210 Fonctions visuelles (fonctions sensorielles associées à la perception de la présence de lumière et à la perception de la forme, de la taille et de la couleur du stimulus visuel)
structures corporelles (s) :
s110 Structure du cerveau
s220 Structure du globe oculaire
activités et participation (d) :
d110 Regarder
d130 Copier
d140 Apprendre à lire
d145 apprendre à écrire
d166 Lire
d169 Écrire
d325 Communiquer – recevoir – des messages écrits
d345 Écrire des messages
d360 Utiliser des appareils et des techniques de communication
d450 Marcher
d455 Se déplacer
d460 Se déplacer dans différents lieux
d465 Se déplacer en utilisant des équipements spéciaux
d475 Conduire un véhicule
d510 Se laver
d520 Prendre soin de parties de son corps
d530 Aller aux toilettes
d540 S’habiller
d550 Manger
d560 Boire
d630 Préparer les repas
d640 Faire le ménage
facteurs environnementaux (e) :
e11 5 Produits et systèmes techniques à usage personnel dans la vie quotidienne
e120 Produits et systèmes techniques destinés à faciliter la mobilité et le transport à l’intérieur et à l’extérieur
e125 Produits et systèmes techniques pour la communication
e310 Famille proche
e315 Famille élargie
e320 Amis
e325 Connaissances, pairs, collègues, voisins et membres d’une communauté
La CIH-2 constitue l’échelle de référence pour l’évaluation du handicap visuel. Elle permet une évaluation objective et reproductible du patient tout au long d’un processus de réadaptation.
[1] WHO International Conference Consensus, Rome 2015 (à paraître).
[2] Management of low vision in Children, WHO/PBL/93.27.
[3] Classification internationale des maladies fr
[4] Implementing standards for low vision services in Europe EBU-low-vision-toolkit.pdf
[5] WHO/EIP/GPE/CAS/ICIDH-2 FI/01.1.
V. Daien, S. Reznikov
D’après une revue systématique de la littérature publiée par le groupe d’experts sur la déficience visuelle, en 2010, au niveau mondial, les principales causes de cécité étaient : la cataracte (33,0 %), les erreurs réfractives non corrigées (21 %), les dégénérescences maculaires (6,6 %), le glaucome (6,5 %) et la rétinopathie diabétique (2,6 %) [1]. Dans les pays européens, les principales causes de cécité étaient les dégénérescences maculaires (41,4 %), les amétropies non corrigées (13,8 %), le glaucome (10,6 %) et la rétinopathie diabétique (4,2 %) [1].
La dégénérescence maculaire liée à l’âge (DMLA) est la principale cause de cécité légale dans les pays industrialisés après l’âge de 50 ans [2]. Au niveau mondial, la prévalence de la maculopathie liée à l’âge et de la DMLA a été estimée à 8,01 % (intervalle de confiance [IC] 95 %, 3,98–15,49) et 0,37 % (0,18–0,77), respectivement [3]. Cette prévalence était plus élevée en Europe qu’en Asie et en Afrique [3]. La prévalence de la DMLA augmente avec l’âge; elle est de 1,4 % (IC 95 %, 1,0 %–2,0 %) à 70 ans, 5,6 % (IC 95 %, 3,9 %–7,7 %) à 80 ans, et de 20 % (IC 95 %, 14 %–27 %) à 90 ans. En cas d’antécédent familial de DMLA, le risque est multiplié par 3 à 4 et des gènes de susceptibilité ont été mis en évidence [4]. Le principal facteur de risque environnemental est le tabac, avec un risque multiplié par trois, une relation dose-effet et une réversibilité du facteur de risque à l’arrêt [5]. Les autres facteurs de risque sont moins évidents. Ont été évoqués les facteurs de risques cardiovasculaires, l’exposition aux ultraviolets et des facteurs nutritionnels.
Le glaucome primitif à angle ouvert (GPAO) est la troisième cause mondiale de cécité derrière la cataracte et les dégénérescences maculaires. Il s’agit de la première cause de cécité irréversible et le GPAO représente environ 6,6 % (IC 95 %, 6,0 %–7,9 %) de toutes les cécités au niveau mondial [1]. La prévalence du GPAO est très variable selon les études et la définition utilisée, variant de 0,71 % à 7 %. D’après une méta-analyse publiée en 2006, la prévalence du GPAO est évaluée à 2,1 % (IC 95 %, 1,6 %–2,7 %) pour la population caucasienne, 4,2 % (IC 95 %, 3,1 %–5,8 %) pour la population noire et 1,4 % (IC 95 %, 1,0 %–2,0 %) pour la population asiatique [6]. Le taux de GPAO non diagnostiqués reste élevé; il est autour des 50 % dans la population caucasienne selon les études [16, 17, 18]. La prévalence du GPAO augmente avec l’âge, avec un odds ratio estimé entre 1,04 et 1,06 par année écoulée [10]; entre 40 et 49 ans, la prévalence est estimée à 1,3 % (IC 95 %, 0,9 %–1,9 %), et entre 70 et 79 ans, de 5,1 % (IC 95 %, 3,6 %–7,2 %) En cas d’hérédité au premier degré, le risque de GPAO est multiplié par trois [10]. Des facteurs de susceptibilité génétique impliqués dans les paramètres cliniques du glaucome ont été mis en évidence : épaisseur cornéenne centrale, rapport cup/disc, taille de la papille [11]. Parmi les facteurs de risque environnementaux de GPAO, nous pouvons retenir les pesticides et agents neurotrophiques, la myopie, les fluctuations de pression artérielle [12].
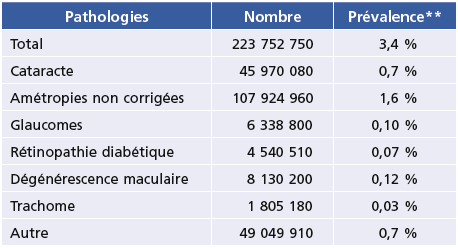
Tableau 1-3 Estimation de la prévalence de la déficience visuelle* dans le monde d’après une revue systématique de la littérature réalisée en 2010 [1].
* Acuité visuelle < 3/10 avec la correction habituellement portée.
** Prévalence standardisée sur l’âge.
À travers le monde, environ 415 millions de personnes souffrent de diabète et ce chiffre pourrait bien atteindre 642 millions en 2014 [13], Aux États-Unis, plus de 2,5 % de la population de plus de 18 ans souffre de rétinopathie diabétique [14]. D’après une méta-analyse regroupant 35 études et 22 896 individus, la prévalence globale de la rétinopathie diabétique était de 34,6 % (IC 95 %, 34,5 %–34,8 %), de 6,96 % (6,87 %–7,04 %) pour la rétinopathie proliférante, de 6,81 % (6,74 %–6,89 %) pour l’œdème maculaire diabétique, et dans 10,2 % des cas (10,1 %–10,3 %), une baisse d’acuité visuelle était observée [15]. La détection et le traitement précoce de l’atteinte de la rétine permettraient de prévenir une majorité des baisses d’acuité visuelle chez les diabétiques [16].
La prévalence de la rétinopathie diabétique augmente avec l’ancienneté du diabète [15]. Pour les diabétiques de type 1 après 12 ans d’ancienneté du diabète, des taux de prévalence de 45 % pour la rétinopathie diabétique, de 3,7 % pour la rétinopathie diabétique proliférante et de 16,4 % pour les formes menaçant la vision ont été retrouvés [17]. Pour les diabétiques de type 2 avec une ancienneté connue de la maladie de 3 à 9 ans, des prévalences plus faibles ont été observées, de l’ordre de 25 à 31 % pour la rétinopathie diabétique, de 0,5 à 2,9 % pour la rétinopathie diabétique proliférante, de 5,3 % pour les œdèmes maculaires cliniquement significatifs et de 6 % de formes menaçant la vision [14, 15]. Plusieurs études ont montré qu’un mauvais équilibre de la glycémie était corrélé à la présence de la rétinopathie diabétique ou à sa progression [15]. L’hypertension artérielle favorise la survenue et la progression de la rétinopathie diabétique [15].
La cataracte est la première cause de cécité dans le monde. Elle représente 11 des 32 millions de personnes ayant une acuité visuelle < 1/20 [1]. Sa prévalence augmente avec l’âge. Selon diverses études épidémiologiques, la prévalence de la cataracte est inférieure à 10 % avant l’âge de 65 ans; elle est de 18 % à 29 % entre les âges de 65 et 74 ans; elle est de 37 % à 59 % entre les âges de 75 et 84 ans, et elle est de 60 % à 67 % à 85 ans et plus [27, 28, 29]. Actuellement, environ 700 000 cataractes de l’adulte sont opérées chaque année en France [21]. Les principaux facteurs de risque de cataracte sont : la myopie forte, le diabète, l’alcool, le tabac, une corticothérapie et l’exposition aux ultraviolets [19, 23, 24, 25].
Les amétropies non corrigées ne sont pas l’apanage des pays en développement. Elles représentent la deuxième cause de cécité aussi bien dans le monde (21 %) que dans les pays industrialisés (14 %) [1]. Ainsi, dans une analyse d’étude POLA (Pathologies oculaires liées à l’âge) réalisée chez 1947 sujets entre 1998 et 2000 dans la ville de Sète, 38,5 % des sujets avaient une correction optique qui n’était pas optimale [26].
Le Tableau 1-3 présente une estimation de la prévalence de la déficience visuelle dans le monde et de ses causes [1,27]. Plusieurs initiatives internationales lancées par l’OMS ont visé l’élimination de la cécité en tant que problème de santé publique, d’abord en se focalisant sur des causes précises : élimination de la cécité due à l’onchocercose (programmes Onchocerciasis Control Programme, African Programme for Onchocerciasis Control, Onchocerciasis Elimination Program for the Americas), puis élimination du trachome cécitant à travers l’Alliance mondiale GET (Global Elimination of Trachoma) 2020. Puis, en 1999, l’objectif a été d’éliminer la cécité évitable d’ici l’an 2020 (initiative « VISION 2020 – le Droit à la Vue »). Enfin a été lancé un plan d’action mondial qui vise à réduire de 25 % la prévalence des déficiences visuelles évitables entre 2010 et 2019 grâce au développement de l’accès universel à la santé oculaire [28]. On voit donc que les objectifs ont été progressivement de plus en ambitieux et larges, mais aussi de plus en plus spécifiques.
Force est de constater que la situation s’est améliorée au cours des 20 dernières années. Le succès est patent en ce qui concerne l’onchocercose : il n’y a plus de nouveaux cas de cécité liés à cette parasitose et la maladie a même été éliminée dans la plupart des foyers en Amérique centrale. Il en est de même pour le trachome qui a reculé non seulement du fait du développement socio-économique, mais aussi sous l’effet des programmes de lutte. Dans les deux cas, ces progrès sont dus à la collaboration entre l’OMS, des réseaux d’organisations non gouvernementales, l’industrie pharmaceutique qui fait don des médicaments et les pays endémiques [29].
Sur un plan plus général, le nombre d’aveugles dans le monde est resté stable au cours des 20 dernières années malgré un accroissement de 30 % de la population et, surtout, malgré son vieillissement rapide. En Europe occidentale, la diminution a été spectaculaire tant en nombre de personnes (–19 %) que de prévalence (–26 %) (Tableau 1-4). Les prévalences ont diminué pour presque toutes les causes, mais pas uniquement grâce aux interventions médicales. Malgré ces points positifs, nulle part la cataracte cécitante n’a été éliminée en tant que cause de cécité, et les amétropies non corrigées demeurent, de loin, la première cause de déficience visuelle, y compris dans les pays les plus développés. Les déficiences visuelles dues au diabète diminuent dans les pays développés, mais augmentent ailleurs (Tableau 1-5). Un problème prend des aspects qui ont été qualifiés de « pandémiques » : la myopie, et en particulier la myopie forte, qui est en progression rapide partout dans le monde [30]. En Asie, la dégénérescence maculaire myopique représente déjà une cause majeure de cécité, parfois la première [28].
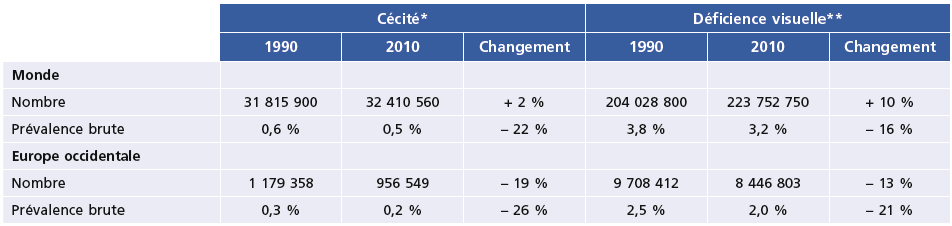
Tableau 1-4 Aveugles et déficients visuels dans le monde et en Europe occidentale : nombre et prévalence brute.Changements entre 1990 et 2010.
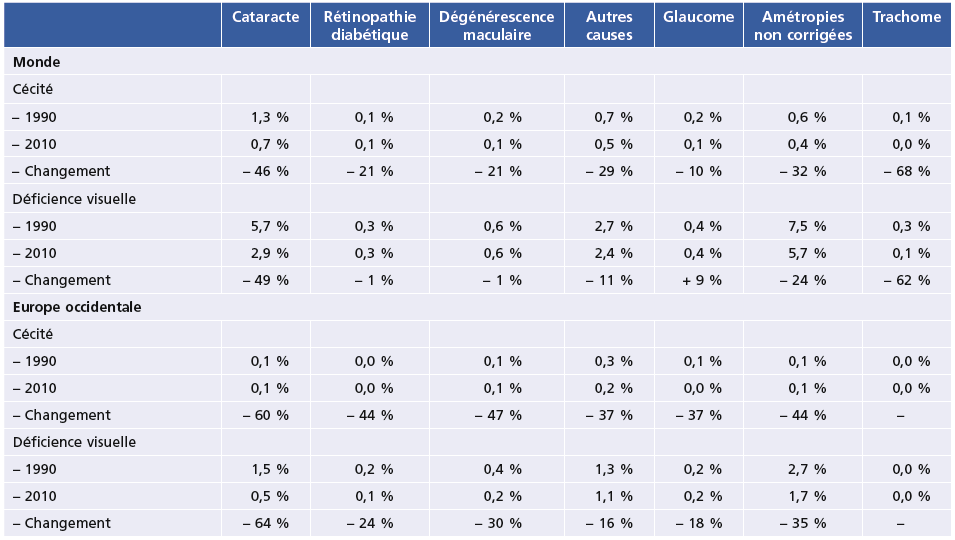
Tableau 1-5Principales causes de cécité et de déficience visuelle dans le monde et en Europe occidentale : prévalence standardisée sur l’âge (adultes de 50 ans et plus). Changements entre 1990 et 2010.
[1] Bourne RRA, Stevens GA, White RA, et al. Causes of vision loss worldwide, 1990-2010: a systematic analysis Lancet Glob Health 2013 ; 1(6) : e339-e349
[2] Augood CA, Vingerling JR, de Jong PTVM, et al. Prevalence of age-related maculopathy in older Europeans: the European Eye Study (EUREYE) Arch Ophthalmol Chic Ill 1960 2006 ; 124(4) : 529-535
[3] Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis Lancet Glob Health 2014 ; 2(2) : e106-e116
[4] Rudnicka AR, Kapetanakis VV, Jarrar Z, et al. Incidence of latestage age-related macular degeneration in American whites: systematic review and meta-analysis Am J Ophthalmol 2015 ; 160(1) : 85-93.e3
[5] Thornton J, Edwards R, Mitchell P, et al. Smoking and age-related macular degeneration: a review of association Eye Lond Engl 2005 ; 19(9) : 935-944
[6] Rudnicka AR, Mt-Isa S, Owen CG, et al. Variations in primary open-angle glaucoma prevalence by age, gender, and race: a Bayesian meta-analysis Invest Ophthalmol Vis Sci 2006 ; 47(10) : 4254-4261
[7] Topouzis F, Coleman AL, Harris A, et al. Factors associated with undiagnosed open-angle glaucoma: the Thessaloniki Eye Study Am J Ophthalmol 2008 ; 145(2) : 327-335
[8] Topouzis F, Wilson MR, Harris A, et al. Prevalence of open-angle glaucoma in Greece: the Thessaloniki Eye Study Am J Ophthalmol 2007 ; 144(4) : 511-519
[9] Friedman DS, Jampel HD, Muñoz B, West SK The prevalence of open-angle glaucoma among blacks and whites 73 years and older: the Salisbury Eye Evaluation Glaucoma Study Arch Ophthalmol Chic Ill 1960 2006 ; 124(11) : 1625-1630
[10] Hollands H, Johnson D, Hollands S, et al. Do findings on routine examination identify patients at risk for primary open-angle glaucoma? The rational clinical examination systematic review JAMA 2013 ; 309(19) : 2035-2042
[11] Khan AO Genetics of primary glaucoma Curr Opin Ophthalmol 2011 ; 22(5) : 347-355
[12] Doucette LP, Rasnitsyn A, Seifi M, Walter MA The interactions of genes, age, and environment in glaucoma pathogenesis Surv Ophthalmol 2015 ; 60(4) : 310-326
[13] IDF diabetes atlas. 7th edition www.diabetesatlas.org/.
[14] Prevent Blindness America, National Eye Institut. Vision problems in the US – Prevalence of adult vision impairment and age-related eye disease in America. 2002.
[15] Yau JWY, Rogers SL, Kawasaki R, et al. Global prevalence and major risk factors of diabetic retinopathy Diabetes Care 2012 ; 35(3) : 556-564
[16] Lee R, Wong TY, Sabanayagam C Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss Eye Vis Lond Engl 2015 ; 2 : 17
[17] Younis N, Broadbent DM, Harding SP, Vora JR Prevalence of diabetic eye disease in patients entering a systematic primary carebased eye screening programme Diabet Med J Br Diabet Assoc 2002 ; 19(12) : 1014-1021
[18] Hirvelä H, Luukinen H, Laatikainen L Prevalence and risk factors of lens opacities in the elderly in Finland. A population-based study Ophthalmology 1995 ; 102(1) : 108-117
[19] Delcourt C, Carrière I, Delage M, et al. Associations of cataract with antioxidant enzymes and other risk factors: the French Age-Related Eye Diseases (POLA) Prospective Study Ophthalmology 2003 ; 110(12) : 2318-2326
[20] Congdon N, Vingerling JR, Klein BEK, et al. Prevalence of cataract and pseudophakia/aphakia among adults in the United States Arch Ophthalmol Chic Ill 1960 2004 ; 122(4) : 487-494
[21] Daien V, Le Pape A, Heve D, et al. Incidence and characteristics of cataract surgery in France from 2009 to 2012: a national population study Ophthalmology 2015 ; 122(8) : 1633-1638
[22] Mukesh BN, Le A, Dimitrov PN, et al. Development of cataract and associated risk factors: the Visual Impairment Project Arch Ophthalmol Chic Ill 1960 2006 ; 124(1) : 79-85
[23] Delcourt C, Carrière I, Ponton-Sanchez A, et al. Light exposure and the risk of cortical, nuclear, and posterior subcapsular cataracts: the Pathologies Oculaires Liées à l’Âge (POLA) study Arch Ophthalmol Chic Ill 1960 2000 ; 118(3) : 385-392
[24] Chang MA, Congdon NG, Bykhovskaya I, et al. The association between myopia and various subtypes of lens opacity: SEE (Salisbury Eye Evaluation) project Ophthalmology 2005 ; 112(8) : 1395-1401
[25] Delcourt C, Cristol JP, Tessier F, et al. Risk factors for cortical, nuclear, and posterior subcapsular cataracts: the POLA study. Pathologies Oculaires Liées à l’Âge Am J Epidemiol 2000 ; 151(5) : 497-504
[26] Daien V, Pérès K, Villain M, et al. Visual impairment, optical correction and their impact on activity limitations in the elderly: the POLA Study Arch Intern Med Press 2011 ; 171(13) : 1206-1207
[27] Stevens GA, White RA, Flaxman SR, et al. Global prevalence of vision impairment and blindness: magnitude and temporal trends, 1990-2010 Ophthalmology 2013 ; 120(12) : 2377-2384
[28] Universal eye health: a global action plan 2014-2019 Geneva: World Health Organization (2013).
[29] WHO alliance for the global elimination of Blinding trachoma by the year 2020 Weekly Epidemiological Record 2014 ; 89(39) : 421-428
[30] Holden BF, Wilson T, Jong D, et al. Global prevalence of myopia, high myopia, and temporal trends from 2000 to 2050 Ophthalmology 2016 ; 23(5) : 1036-1042
Daien V, Peres K, Villain M, et al. Visual acuity thresholds associated with activity limitations in the elderly. The Pathologies Oculaires Liées à l’Âge study Acta Ophthalmol (Copenh) 2014 ; 92(7) : e500-e506
International Classification of Functioning, Disability and Health (ICF) Geneva: World Health Organization (2001).
World Health Organization, International Statistical Classification of Diseases and Health Related Problems (2007): ICD-10. 10th revision. Vol 1. Geneva: World Health Organization Changements.pdf