Traitement physiologique de l’information visuelle
C. Milleret
De façon générale, la scène visuelle peut se décomposer en différents « attributs » : la localisation spatiale, l’orientation (horizontale, verticale, etc.), la fréquence spatiale, le contraste, la direction de mouvement, la couleur et la dominance oculaire (qui sous-tend les visions 2D et 3D). De la rétine au cortex visuel primaire, ces attributs sont chacun traités séparément, en parallèle, via des circuits anatomofonctionnels spécifiques. Ils sont ensuite traités au niveau des aires visuelles supérieures en fonction de leur contribution dans la perception en termes de « où ? », « comment ? » et « quoi ? ». Ce n’est qu’au-delà que toutes les informations ainsi obtenues sont reliées entre elles pour élaborer la perception visuelle. Toute lésion ou tout dysfonctionnement à un quelconque niveau du système visuel altérera ce processus et donc la perception.
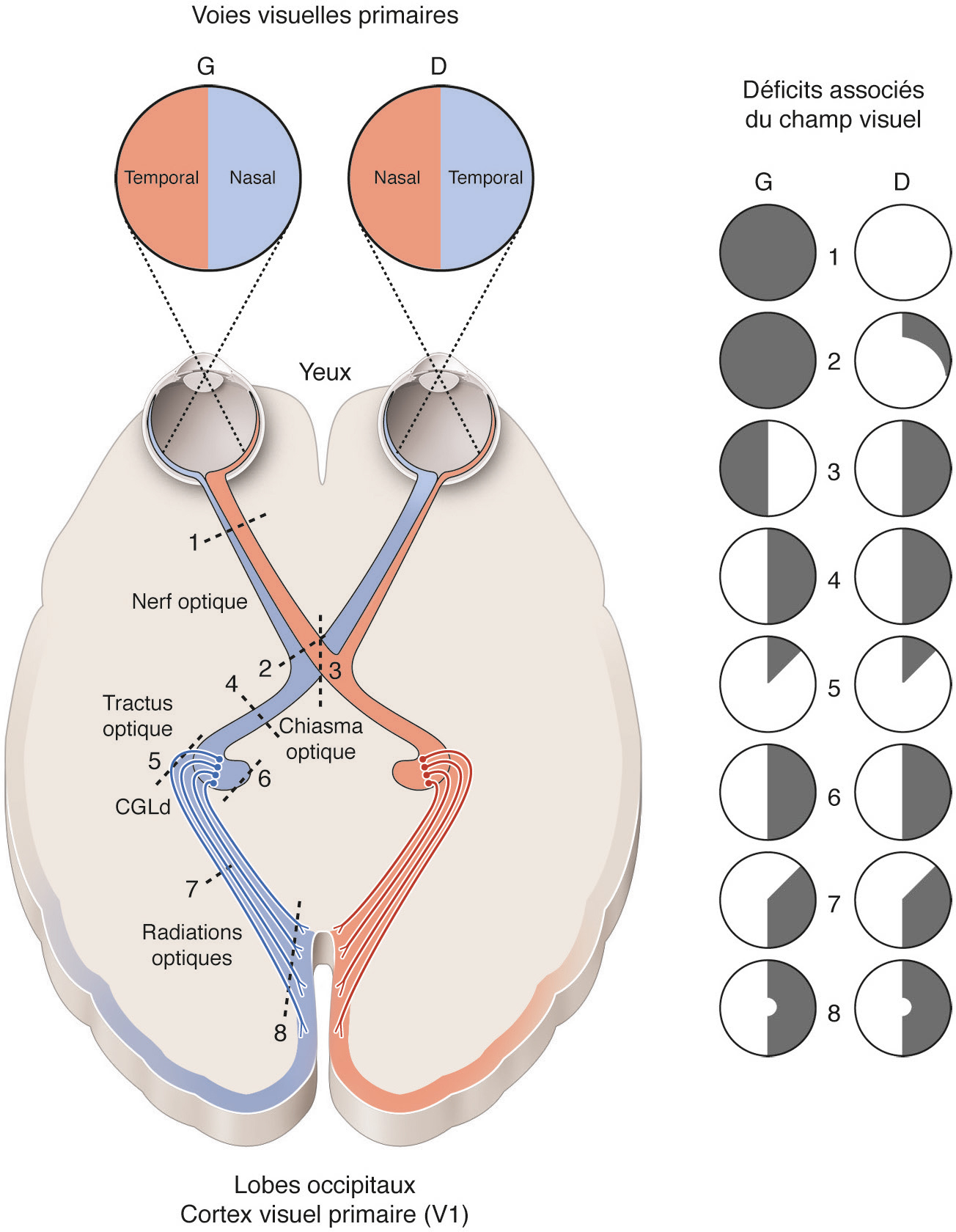
Avant toute chose, notre système visuel doit permettre la localisation précise de chacun des éléments qui se trouvent dans la scène visuelle. À cet effet, chaque hémisphère cérébral est impliqué dans la perception de l’hémichamp visuel controlatéral en intégrant les informations issues de la rétine temporale ipsilatérale et celles de la rétine nasale controlatérale (Fig. 2-1). Ainsi, tout neurone visuel localisé dans ledit hémisphère « voit » une portion (restreinte) de l’espace situé dans l’hémichamp visuel controlatéral via son « champ récepteur ». Tous les faisceaux de fibres de la rétine au cortex (nerfs, tractus et radiations optiques) et toutes les structures visuelles centrales, sous-corticales et corticales (voir plus loin), sont de plus organisés de façon rétinotopique. Ainsi, des fibres contiguës dans un faisceau de fibres donné véhiculent des informations visuelles spatialement proches; des neurones proches dans une structure visuelle donnée « voient » des portions proximales dans le même hémichamp visuel. En d’autres termes, leurs champs récepteurs se superposent ou sont localisés très proches les uns des autres (voir Fig. 2-3a) [1].
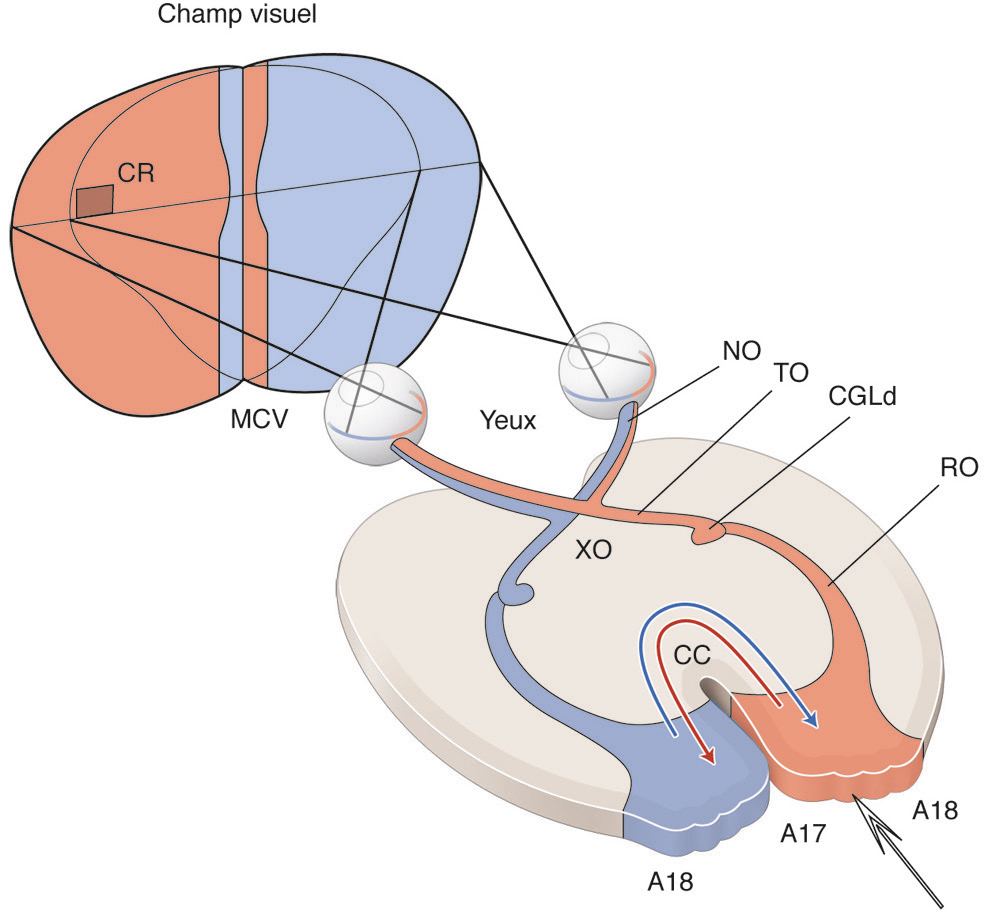
Cette voie inclut la rétine, le corps genouillé latéral dorsal (CGLd) du thalamus et le cortex visuel primaire (aire V1). Elle est organisée de telle sorte que chaque hémichamp visuel (en rouge et en bleu) est représenté de façon rétinotopique au niveau du cortex visuel primaire controlatéral en impliquant la rétine temporale d’un oeil et la rétine nasale de l’autre oeil. Corrélativement, un neurone dont on enregistre l’activité avec une microélectrode dans un cortex visuel primaire donné (ici le droit) aura son champ récepteur (champ récepteur) dans l’hémichamp visuel controlatéral. CC : corps calleux ; MVC : méridien vertical central du champ visuel ; NO : nerf optique ; RO : radiations optiques ; TO : tractus optique ; XO : chiasma optique.
La voie rétino-géniculo-corticale est la voie visuelle « primaire » de notre système visuel (Fig. 2-2a) [2]. Elle est majeure puisqu’elle véhicule environ 90 % des informations rétiniennes vers la région occipitale de notre cerveau où se situe le cortex visuel primaire appelé aussi « aire V1 » ou « aire striée » (voir Fig. 2-4a). Le corps genouillé latéral dorsal (CGLd), structure sous-corticale du thalamus, sert de relais entre la rétine et l’aire V1. En plus de coder la localisation spatiale, cette voie « primaire » analyse chacun des attributs de la scène visuelle séparément, via des voies parallèles parfaitement caractérisables anatomiquement et fonctionnellement. Classiquement, les auteurs se sont focalisés sur les voies qui traitent de trois attributs particuliers : le mouvement, la forme et la couleur. Aussi nous focaliserons-nous sur ces trois voies ci-dessous.
Signalons brièvement cependant que les 10 % d’afférences rétiniennes restantes forment la voie extragéniculée. Elles quittent la voie primaire au niveau du tractus optique, pour innerver différentes structures sous-corticales, telles que le colliculus supérieur, le noyau suprathalamique, le prétectum et les noyaux du système optique accessoire, qui sont impliquées entre autres dans la genèse des mouvements oculaires.
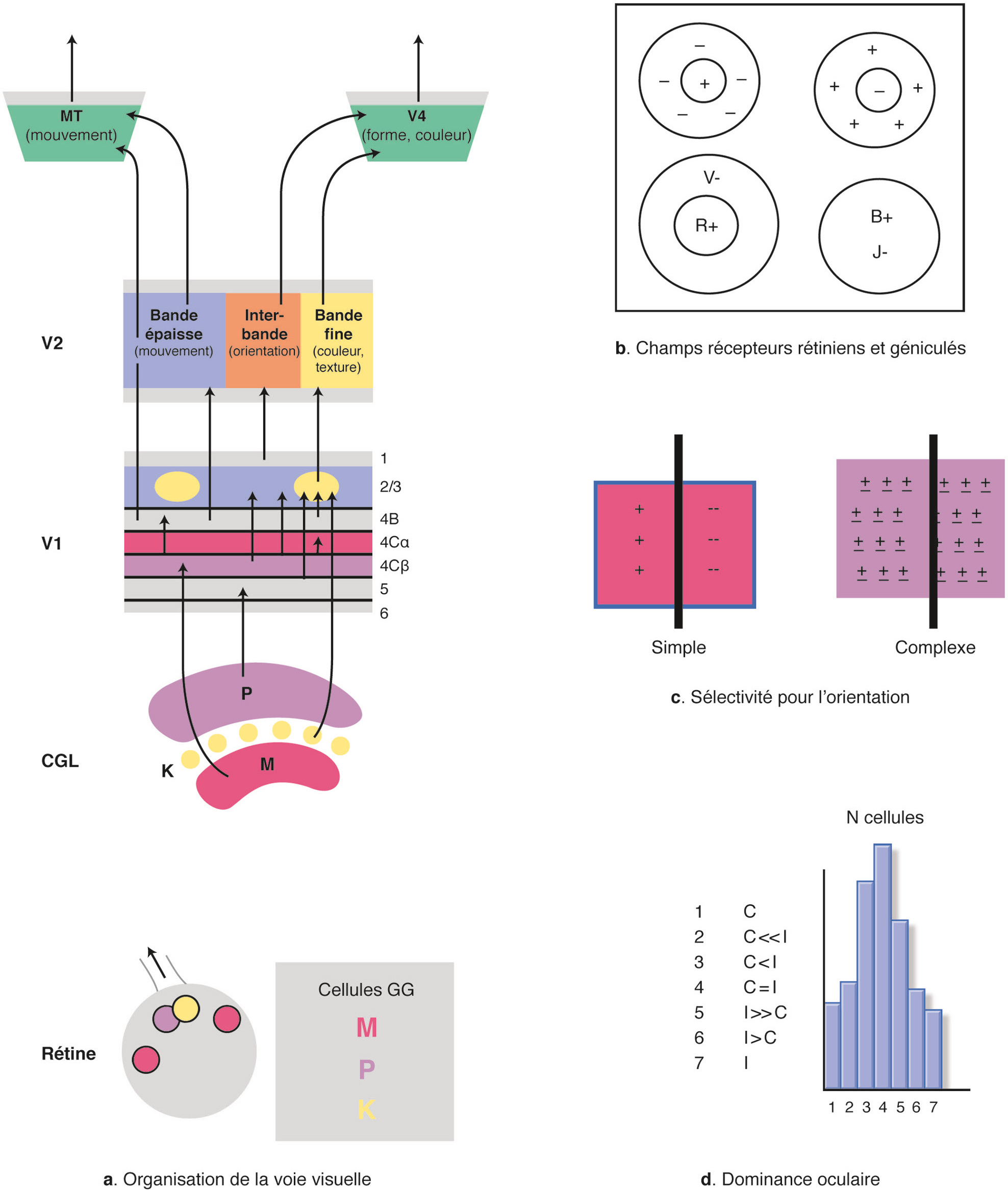
a. Organisation anatomofonctionnelle de la voie visuelle primaire. b. Illustration de différents types d’organisation de champs récepteurs rétiniens.c. Champs récepteurs de cellules simples versus cellules complexes de l’aire V1. d. Distribution des dominances oculaires des neurones de l’aire V1 en 7 classes : c, neurones activés seulement par l’oeil controlatéral à la zone corticale explorée (classe 1) ; i, neurones activés seulement par l’oeil ipsilatéral (classe 7) ; i=c, cellules binoculaires activées de façon équivalente par les deux yeux (classe 4) ; c>i, c>>i, i>c et i>>c (classes 2, 3 et 5, 6 respectivement), neurones binoculaires mais avec une dominance pour un oeil ou l’autre.
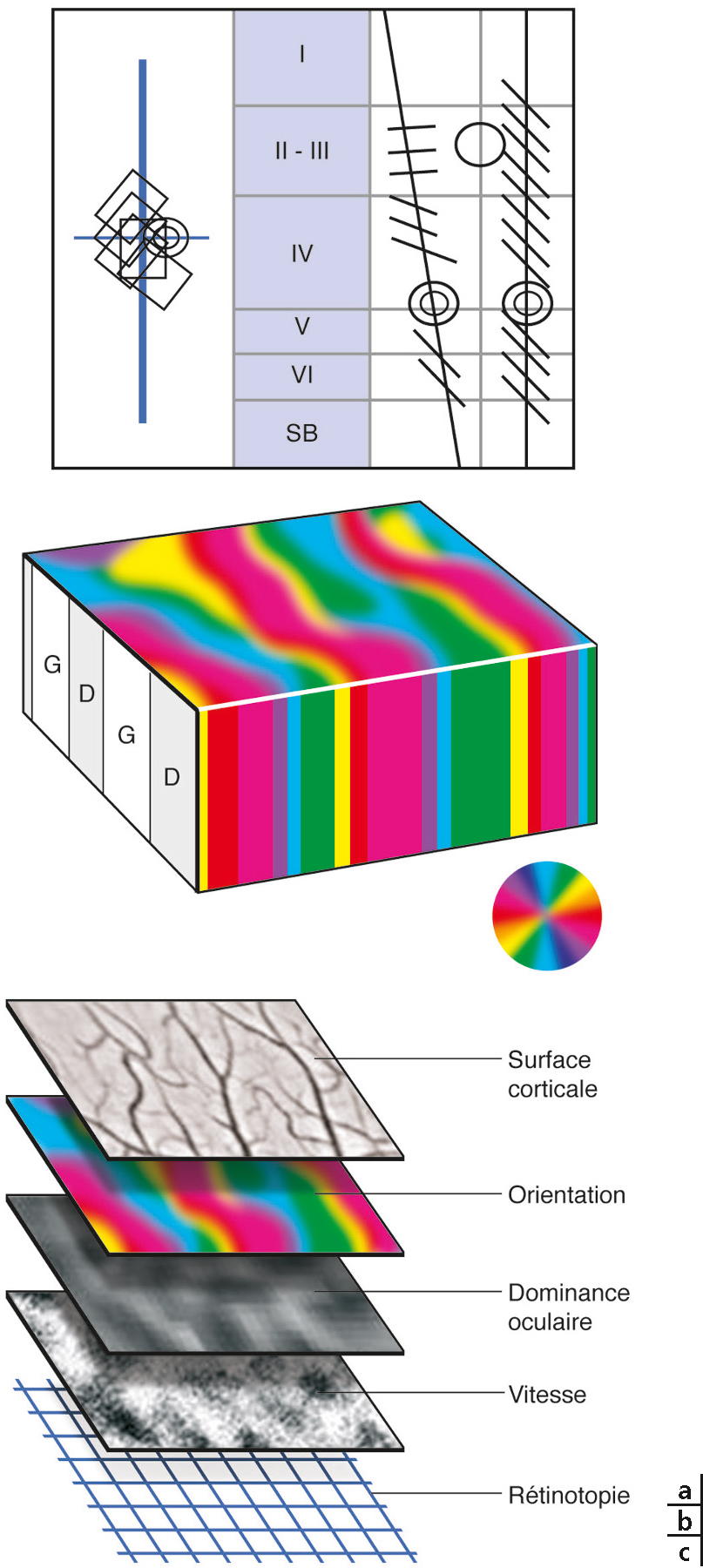
a. En colonnes. En enregistrant successivement l’activité de neurones individuels dans les différentes couches du cortex visuel primaire (I à VI) à l’aide d’une microélectrode et d’une chaîne d’enregistrement électrophysiologique, il apparaît que les neurones enregistrés perpendiculairement à la surface corticale codent tous préférentiellement pour le même attribut de la scène visuelle, ici la même orientation du stimulus (à l’extrême droite). En revanche, si la descente de microélectrode est oblique, on voit changer progressivement les caractéristiques de l’attribut en question : ici, l’orientation préférée change progressivement parce qu’on traverse successivement plusieurs colonnes contiguës (à droite). Les champs récepteurs de ces mêmes cellules (à gauche) restent quant à eux confinés dans la même région du champ visuel si les deux descentes de microélectrode sont suffisamment proches, respectant ainsi la représentation rétinotopique du champ visuel au niveau cortical. b. Illustration de l’organisation en colonnes des neurones dans tout le cortex visuel, avec un ensemble de colonnes pour le codage de chaque attribut de la scène visuelle. On peut visualiser ici les colonnes d’orientation (en couleur) qui s’étendent dans toute l’épaisseur du cortex et les colonnes de dominance oculaire (blanc, oeil gauche ; gris, oeil droit) surtout visibles quant à elles en couche IVC. Ces colonnes forment des « cartes fonctionnelles » dont on peut visualiser l’organisation à partir de la surface corticale à l’aide d’une technique ad hoc telle l’imagerie optique (chez l’animal). c. Représentation de la partie supérieure de différentes cartes fonctionnelles présentes dans le cortex visuel, chacune « codant » pour un attribut donné de la scène visuelle.
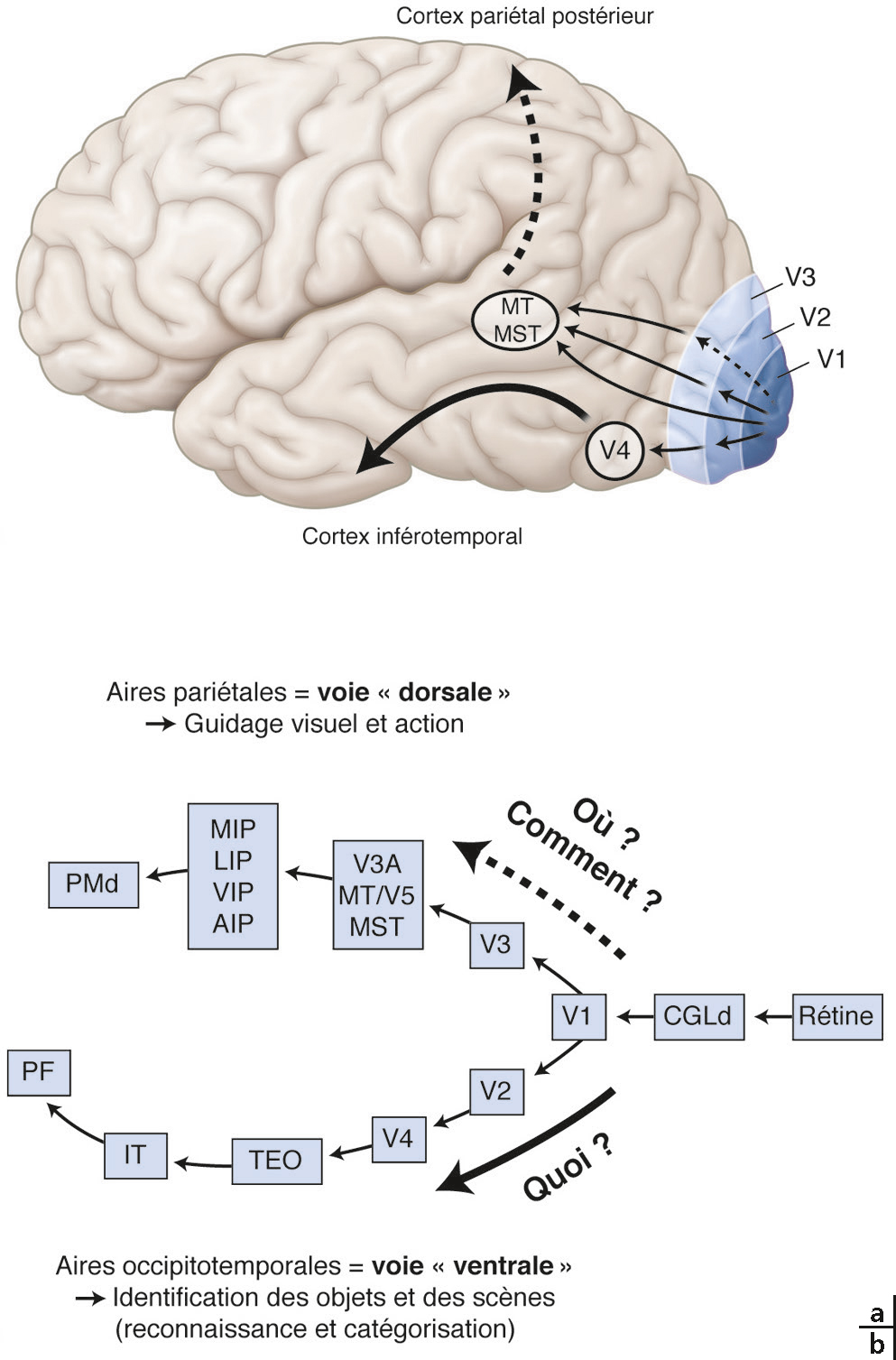
a. Illustration générale de ces deux voies visuelles « supérieures ». b. Détail. V1, V2, V3 sont en quelque sorte des aires visuelles « primaires ». L’aire V4 correspond au début de la voie ventrale qui va se terminer au niveau du cortex inférotemporal, alors que les aires MT/V5 (aires médianes temporale/V5) et MST (aire médiane supérieure temporale) amorcent la voie dorsale qui s’oriente quant à elle vers le cortex pariétal postérieur. Notons que ces deux voies communiquent, bien que ce ne soit pas illustré ici.
AIP : aire antérieure intrapariétale ; CGLd : corps genouillé latéral dorsal. IT : cortex inférotemporal ; LIP : aire latérale intrapariétale ; MIP : aire médiale intra-pariétale ; PF : aire préfrontale ; PMd : aire prémotrice dorsale ; TEO : cortex inférotemporal, partie postérieure ; VIP : aire ventrale intrapariétale.
L’amorce des voies « primaires » traitant le mouvement, la forme et la couleur est identifiable dès le niveau rétinien, en particulier au niveau des cellules ganglionnaires (GG) dont les axones, rappelons– I e, forment les nerfs optiques qui transmettent les informations rétiniennes aux structures centrales visuelles. Les anatomistes ont tout d’abord distingué trois grandes classes de cellules GG. Les physiologistes les ont ensuite associées à des fonctions spécifiques en termes de perception visuelle :
les cellules GG de type « M » (magnocellulaire) qui ont un gros corps cellulaire et un axone de gros diamètre (= 10 % de la population). Transmettant l’influx nerveux rapidement, sensibles à des mouvements rapides (parfois même sélectifs à une direction de mouvement donnée), présentant des décharges phasiques à la stimulation visuelle, très sensibles au contraste (même faible) entre le noir et le blanc, possédant un grand champ récepteur, ces cellules ont très vite été considérées comme le premier stade du codage du mouvement;
les cellules GG de type « P » (parvocellulaire) qui ont au contraire un petit corps cellulaire et un axone de fin diamètre (= 80 % de la population »). Capables de transmettre l’influx nerveux seulement lentement, sensibles à des mouvements lents des stimuli, parfois présentant une certaine sélectivité pour l’orientation de ces stimuli, présentant des décharges toniques en réponse à la stimulation visuelle, très sensibles aux longueurs d’onde, possédant un petit champ récepteur, ces cellules ont été considérées quant à elles comme le premier stade du codage des formes et des couleurs;
les cellules GG de types γ qui incluent toutes les autres cellules GG, avec donc des morphologies (et donc sans doute des fonctions) très variées (10 % de la population). Une sous-classe, appelée « cellules GG bistratifiées », présentant des réponses toniques ou phasiques, répondant à de petits objets, a toutefois été isolée. Elle s’est avérée jouer un rôle majeur dans la perception de certaines couleurs. Compte tenu de ce qui va suivre, nous les appellerons dès ce stade les cellules GG de type K (pour « koniocellulaire »).
Les cellules GG de types M et P ont des champs récepteurs circulaires, avec une organisation concentrique et un antagonisme des réponses à la lumière entre le centre et la périphérie (Fig. 2-2b, en haut) : réponse à l’allumage (ON, +) au centre et réponse à l’extinction (OFF, –) en périphérie ou l’inverse. Les cellules GG de type P peuvent quant à elles présenter en outre des réponses antagonistes au rouge et au vert entre le centre et la périphérie : R+/V–, R–/V+, V+/R–, V–/R+ (Fig. 2-2b, en bas, à gauche). Des antagonismes du type (R+V)+/(R+V)– ou l’inverse existent également. Les champs récepteurs des cellules GG bi-stratifiées (type K) ne présentent quant à eux pas d’organisation concentrique. Mais des antagonismes entre le bleu et le jaune (= R+V) y ont été identifiés (Fig. 2-2b, en bas, à droite). Il ressort donc ici les deux familles d’antagonismes spectraux bien connus pour être à l’origine de la vision des couleurs : rouge/vert et bleu/jaune.
Le CGLd est donc une structure sous-corticale localisée dans le thalamus qui sert de relais entre la rétine et l’aire V1. Anatomiquement, chez le primate, il inclut six couches cellulaires « empilées » les unes sur les autres, innervées à peu près en alternance par l’œil controlatéral et l’œil ipsilatéral (couches 1-4-6 et 2-3-5 respectivement). Cette structure est donc la première à recevoir des afférences des deux yeux mais, pour l’essentiel, la ségrégation œil droit/œil gauche y subsiste. Seules quelques cellules binoculaires existent entre les couches. Par ailleurs, les cellules GG de type M se projettent sur les deux couches les plus profondes (5 et 6), les cellules P sur les quatre couches les plus superficielles (1 à 4) et les cellules K entre ces différentes couches. Les cellules du CGLd localisées dans chacune de ces régions présentent respectivement les mêmes caractéristiques anatomiques et fonctionnelles que les cellules GG qui les innervent (voir plus haut). La ségrégation M, P, K et, par conséquent, le traitement du mouvement, des formes et des couleurs subsistent donc dans cette structure relais.
L’aire V1 inclut également six couches cellulaires : I à VI de la surface (voir Fig. 2-2a), avec une couche IV qui se sous-divise en trois sous-couches IVA, IVB et IVC. C’est la couche IVC qui reçoit la grande majorité des afférences géniculées, en conservant d’ailleurs la ségrégation œil droit/œil gauche sous forme de colonnes alternées. Elle se sous-divise elle-même en deux sous-couches : IVCα et IVCβ Là encore, les cellules M, P et K se projettent différemment sur ces couches, et activent des réseaux intracorticaux différents. Les mouvements, les formes et les couleurs impliquent donc là encore un traitement séparé.
Anatomiquement, cette voie alimentée par les cellules GG et géniculées de type M est la suivante : IVCα (V1) >>> IVB (V1). Fonctionnellement, alors que les cellules GG et géniculées de type M ont des champs récepteurs circulaires, les cellules corticales de la couche IVCα qui reçoivent ces afférences ont des champs récepteurs allongés, de forme rectangulaire. Ils présentent là encore des zones ON et OFF antagonistes, mais celles-ci sont placées cette fois en parallèle et en alternance. On parle de champs récepteurs de « type simple » (Fig. 2-2c) [3]. Contrairement aux cellules GG et géniculées qui sont activables surtout par des spots lumineux, ces cellules simples sont activables de façon maximale par un bord d’une orientation bien définie, préférentiellement en mouvement, parallèlement aux zones ON et OFF. On parle de cellules « sélectives pour l’orientation », habileté évidemment essentielle pour notre perception. À ce niveau, elles sont encore monoculaires, comme la plupart des cellules GG et géniculées. Mais elles deviennent « binoculaires » (c’est-à-dire activables par les deux yeux) dans la couche IVB, innervée par la couche IVCα via le réseau intracortical « vertical ». La « binocularité » et la perception de la profondeur qui en dépend sont donc des propriétés surtout d’origine corticale.
Les cellules GG et géniculées de type K se projettent strictement sur de petites régions ovoïdes de la couche II/III appelées « blobs » en anglais, caractérisées par une forte activité de l’enzyme cytochrome oxydase [4]. Les cellules situées dans ces « blobs » présentent exactement les mêmes caractéristiques fonctionnelles que les cellules K sous-corticales : monoculaires (quelquefois binoculaires), non sélectives pour l’orientation du stimulus et surtout très sensibles aux longueurs d’onde (et non aux couleurs en tant que telles).
Cette dernière voie, appelée « voie P-I B », peut se résumer ainsi : IVCβ + IVA (V1) >>> II/III (V1) – régions inter-blobs. Elle est alimentée par les cellules rétiniennes et géniculées de type P au niveau des couches IVCβ et IVA, lesquelles se projettent ensuite sur les zones « inter-blobs » de la couche II/III. Fonctionnellement, les cellules de la couche IVCβ du cortex visuel primaire ont des propriétés proches des cellules GG et géniculées de type P : monoculaires, avec de petits champs récepteurs concentriques; elles présentent pour la plupart un antagonisme rouge/vert (R/V) entre le centre et la périphérie, mais des combinaisons plus complexes du type G + R-/G-R+, B + J-/B-J+ ont aussi été identifiées. Les cellules des régions inter-blobs de la couche II/III deviennent quant à elles à nouveau binoculaires et présentent des champs récepteurs allongés, sélectifs pour une orientation donnée du stimulus visuel. Mais ces cellules sont dites « complexes » car leurs champs récepteurs présentent uniformément des réponses de type ON/OFF (Fig. 2-2c) [3].
À l’exception des neurones de la couche IVCβ et des « blobs » de la couche II/III (voir ci-dessus), grâce aux connexions intracorticales verticales et horizontales, chaque neurone de l’aire V1 est activable par chacun des attributs de la scène visuelle, mais de façon très sélective : chacun code précisément une orientation, une fréquence spatiale, une vitesse, une direction de mouvement et une longueur d’onde. Tous les neurones sont aussi activables par un œil et/ou l’autre [3]. Leurs réponses sont maximales avec des contrastes maximaux.
Si l’on considère maintenant l’ensemble des neurones du cortex visuel primaire (V1), toutes les orientations (horizontales, verticales, obliques), fréquences spatiales (basses, moyennes et hautes), vitesses et directions de mouvement (des plus lentes aux plus élevées, vers la droite, la gauche, etc.) sont codées de façon équivalente, évitant ainsi normalement tout biais perceptif. La plupart des cellules sont aussi binoculaires (Fig. 2-2d) [3].
Mais les neurones qui codent pour un même attribut sont regroupés sous deux formes :
perpendiculairement à la surface, des couches I à VI, sous forme de colonnes [5]. Aussi existe-il par exemple des colonnes de cellules qui codent pour la même orientation du stimulus visuel. Deux colonnes contiguës codent pour des orientations différentes mais proches l’une de l’autre (Fig. 2-3);
sous forme de carte fonctionnelle, également dans toute l’épaisseur du cortex, incluant l’ensemble des colonnes de neurones correspondantes (Fig. 2-3b). On peut visualiser la partie supérieure de chacune de ces cartes à partir de la surface corticale avec par exemple la technique d’imagerie optique chez l’animal (Fig. 2-3c). On peut aussi maintenant les visualiser avec la technique d’imagerie par résonance magnétique fonctionnelle (IRMf) (4 Tesla [T]) chez l’homme [6]. À chaque attribut correspond une carte fonctionnelle neuronale bien précise. Ces cartes fonctionnelles présentent toutes un caractère « discontinu », à l’exception de la carte rétinotopique qui est « continue » pour des raisons évidentes [7, 8, 9].
Au final, en termes de perception, l’aire V1 va ainsi permettre d’extraire le contour extérieur des objets en se fondant sur la luminance, la texture et la profondeur. Elle va permettre de décider de la partie des images qui est à l’intérieur du contour des objets et déduire la forme d’une partie manquante de ceux-ci. Cette aire mesure aussi des mouvements locaux. Elle active les aires V2 et V3, dont les fonctions sont assez proches (voir Fig. 2-2a).
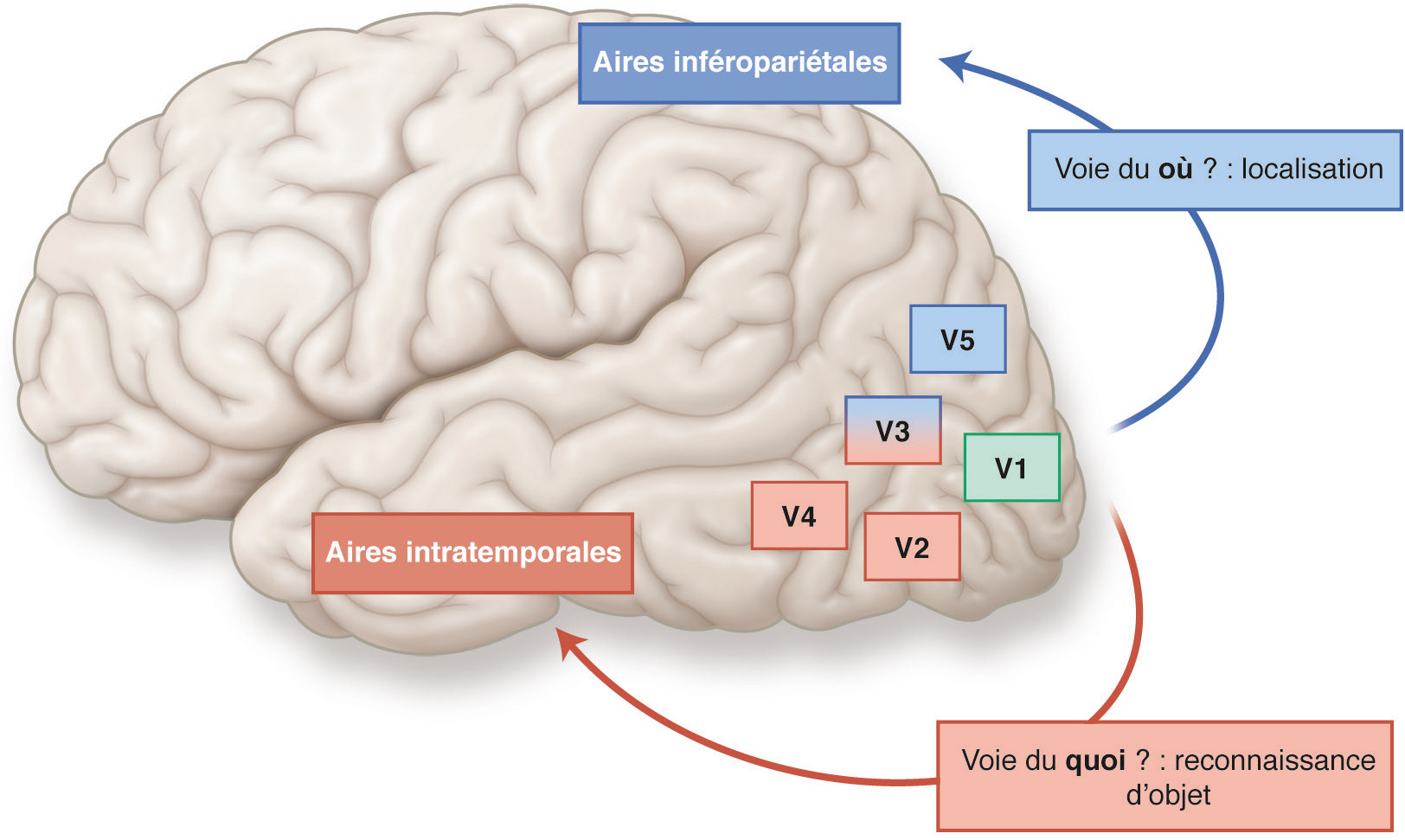
Le traitement de l’information visuelle au niveau cortical ne se limite évidemment pas aux seules aires V1, V2 et V3. À cet effet, au-delà, près de 40 aires visuelles supplémentaires dites « supérieures », couvrant près d’un tiers de la surface corticale, vont poursuivre ce traitement en abordant des aspects de plus en plus complexes d’un point de vue perceptif. Elles se séparent toutefois en deux grandes voies associées chacune à une fonction bien précise (Fig. 2-4) [10, 11, 12, 13] :
la voie « dorsale » qui aboutit dans le lobe pariétal inférieur. Elle répond aux questions « Où est-ce ? » et « Comment ? » (établi plus récemment) et est impliquée globalement dans les actions qu’effectue le sujet en interaction avec son environnement, lors de la perception d’objets ou d’événements dans l’espace. Elle contient des informations sur la fixation du regard, la poursuite oculaire, l’attention en relation avec les objets d’intérêt. Elle code aussi spécifiquement le mouvement des objets dans l’espace ainsi que les déplacements du sujet dans l’environnement lui-même (tel le flux optique). Elle inclut différentes aires telles : V3A > > > MT/V5 >>> MST >>> MIP, LIP, VIP, AIP >>> PMd, qui ont toutes une organisation modulaire (c’est-à-dire en colonnes) comme les aires V1, V2 et V3, mais chacune a une fonction bien précise. Ainsi, par exemple, l’aire MT/V5 traite entre autres spécifiquement le mouvement global des objets dans l’espace, leur direction de mouvement, mais également les gradients de vitesse et l’inclinaison en profondeur. L’aire MST code le flux optique et ses différentes composantes (translations, rotations, etc.), le tout permettant d’analyser les mouvements de soi dans l’espace;
la voie « ventrale » qui aboutit quant à elle dans le lobe occipitotemporal (ou inférotemporal) et répond à la question « Qu’est-ce que c’est ? ». Elle est impliquée globalement dans l’identification des objets lors de la perception. Elle inclut également différentes aires ayant une organisation modulaire : V4 >>> TEO >>> IT, et le cortex fusiforme dont les fonctions respectives sont là encore complémentaires et de plus en plus élaborées. Ainsi, par exemple, l’aire V4 a pour fonction d’identifier les couleurs en tant que telles mais est aussi impliquée dans les processus de segmentation (ségrégation image/fond), l’analyse des figures (formes et contours) et la représentation des surfaces (angles et courbures). L’aire inférotemporale a quant à elle pour fonction de coder sélectivement la forme des objets. Par exemple, certains neurones dans cette aire sont sélectivement activés par des visages humains ! Ils sont aussi sélectifs pour une certaine courbure en profondeur (spécifiée par la vision 3D).
Après toutes ces étapes, c’est la synchronisation (c’est-à-dire la corrélation temporelle) des activités neuronales entre toutes les différentes aires visuelles corticales précitées qui est considérée comme permettant le « liage perceptif » des différents attributs de la scène visuelle et donc l’élaboration de la perception visuelle. Cette théorie a été initialement proposée par Von der Malsburg [14] et largement démontrée par Singer et ses collaborateurs au cours des dernières décennies [15]. Cette synchronisation est assurée par les connexions (« feed-forward » et « feed-back ») qui existent entre toutes ces aires [16]. N’oublions pas par ailleurs que toute cette « machinerie » se met en place progressivement au cours du développement prénatal et postnatal [17]. Pendant cette seconde période, l’expérience visuelle non seulement en termes de vision mais également de mouvements oculaires joue un rôle essentiel.
Il va de soit qu’une lésion à un niveau ou un autre de nos voies visuelles altérera la perception visuelle. Ainsi, par exemple, une lésion totale d’un nerf optique privera l’œil ipsilatéral de toute vision (Fig. 2-5). La lésion d’un tractus optique privera le sujet de perception visuelle au niveau de l’hémichamp visuel controlatéral. Une lésion totale de l’aire V1, par exemple après intoxication au monoxyde de carbone, provoquera quant à elle une sévère agnosie [18]. Au-delà de V1, dans la voie dorsale, une lésion bilatérale de l’aire MT/V5 ne permettra au sujet que de voir des objets immobiles. Dans la voie ventrale, une lésion de l’aire inférotemporale empêchera la reconnaissance des formes ou au moins de certaines d’entre elles [19, 20, 21].
CGLd : corps genouillé latéral dorsal.
[1] Bear MF, Connors BW, Paradiso MA. Neuroscience. À la découverte du cerveau. Paris: Pradel; 1997, 2007. Trad. fr. Nieoullon A.
[2] Bullier J, Barone P Voies optiques incracrâniennes et lobe occipital: anatomie, fonction et développement Encycl Méd Chir (Elsevier, Paris) Ophthalmologie 1987 ; 21 : 008-A-40
[3] Hubel DH, Wiesel TN Receptive fields, binocular interaction and functional architecture in the cat’s visual cortex J Physiol 1962 ; 160 : 106-154
[4] Livingstone MS, Hubel DH Anatomy and physiology of a color system in the primate visual cortex J Neurosci 1984 ; 4(1) : 309-356
[5] Hubel DH, Wiesel TN Shape and arrangement of columns in cat’s striate cortex J Physiol 1963 ; 165 : 559-568
[6] Goodyear BG, Nicolle DA, Menon RS High resolution fMRI of ocular dominance columns within the visual cortex of human amblyopes Strabismus 2002 ; 10(2) : 129-136
[7] Tootell RB, Mendola JD, Hadjikhani NK, et al. Functional analysis of V3A and related areas in human visual cortex J Neurosci 1997 ; 17(18) : 7060-7078
[8] Wandell BA, Dumoulin SO, Brewer AA Visual field maps in human cortex Neuron 2007 ; 56(2) : 366-383
[9] DeYoe EA, Raut RV Visual mapping using blood oxygen level dependent functional magnetic resonance imaging Neuroimaging Clin N Am 2014 ; 24(4) : 573-584
[10] Ungerleider LG, Haxby JV ‘What’ and ‘where’ in the human brain Curr Opin Neurobiol 1994 ; 4(2) : 157-165Review..
[11] Van Essen DC, Gallant JL Neural mechanisms of form and motion processing in the primate visual system Neuron 1994 ; 13(1) : 1-10
[12] Shen L, Hu X, Yacoub E, Ugurbil K Neural correlates of visual form and visual spatial processing Hum Brain Mapp 1999 ; 8(1) : 60-71
[13] Kravitz DJ, Saleem KS, Baker CI, Mishkin M A new neural framework for visuospatial processing Nat Rev Neurosci 2011 ; 12(4) : 217-230
[14] Von der Malsburg C Binding in models of perception and brain function Curr Opin Neurobiol 1995 ; 5(4) : 520-526Review..
[15] Singer W Cortical dynamics revisited Trends Cogn Sci 2013 ; 17(12) : 616-626
[16] Gilbert CD, Li W Top-down influences on visual processing Nat Rev Neurosci 2013 ; 14(5) : 350-363
[17] Klaver P, Marcar V, Martin E Neurodevelopment of the visual system in typically developing children Prog Brain Res 2011 ; 189 : 113-136
[18] Benson DF, Greenberg JP Visual form agnosia. A specific defect in visual discrimination Arch Neurol 1969 ; 20(1) : 82-89
[19] Barton JJ Disorder of higher visual function Curr Opin Neurol 2011 ; 24(1) : 1-5
[20] Atkinson J, Braddick O From genes to brain development to phenotypic behavior: “dorsal-stream vulnerability” in relation to spatial cognition, attention, and planning of actions in Williams syndrome (WS) and other developmental disorders Prog Brain Res 2011 ; 189 : 261-283
[21] Goodale MA Separate visual systems for perception and action: a framework for understanding cortical visual impairment Dev Med Child Neurol 2013 ; 55 Suppl 4 : 9-12
C. Meyniel
L’information visuelle, perçue par la rétine, est traitée dans un premier temps au niveau du cortex occipital, puis des régions souscorticales. Cette perception entraîne la mise en place de stratégies visuelles, dans lesquelles interviennent notamment les mouvements oculaires.
La vision d’une cible de petite taille met en jeu deux types de mouvements oculaires : les mouvements lents et les mouvements rapides. Les mouvements lents comprennent la poursuite, les vergences et les phases lentes des réflexes vestibulo-oculaires et optocinétiques, réflexes qui permettent de stabiliser l’image de la cible sur la fovéa. Les mouvements rapides sont constitués principalement par les saccades. Ces dernières déplacent le centre d’intérêt de la perception visuelle. En passant d’une cible à une autre, les mouvements rapides assurent la sélection d’une nouvelle image. Les saccades sont fréquemment étudiées en laboratoire par l’oculométrie (electro-oculographe moteur, eye traker). L’intérêt de ces études est d’identifier les zones corticales et sous-corticales qui dysfonctionnent, notamment dans l’étude des pathologies neurodégénératives.
Les saccades sont caractérisées par leur latence (temps de déclenchement du mouvement, en moyenne 160 ms), leur précision par rapport à la cible (amplitude) et leur vitesse (300 degrés par seconde en moyenne). Elles peuvent être automatiques, réflexes ou volontaires :
– les saccades automatiques sont présentes pendant le sommeil ou lors de la réflexion; elles sont sans but visuel et semblent n’être que le reflet d’une activité cérébrale autonome;
– les saccades réflexes sont déclenchées par un stimulus externe, auditif ou visuel. Leur latence et leur amplitude dépendent de ce stimulus;
– les saccades volontaires sont de déclenchement interne; le sujet en détermine le moment et l’amplitude.
L’exécution d’une saccade est le résultat de plusieurs étapes. Tout d’abord, l’identification d’un stimulus va entraîner l’activation corticale des zones oculomotrices. L’information est ensuite transmise aux centres de genèse des saccades horizontales ou verticales, qui sont connectés aux nerfs crâniens. Chaque nerf crânien innerve des muscles oculomoteurs, responsables d’un mouvement oculaire rapide, la saccade. Parallèlement, des systèmes de contrôle sont impliqués dans les différentes étapes.
L’intégration visuelle du stimulus est réalisée au niveau du cortex pariétal postérieur. Elle permet la sélection de la cible et évalue la localisation de celle-ci. Selon le type de mouvements à réaliser, le signal est ensuite transmis aux différentes aires corticales qui contrôlent le déclenchement des saccades, essentiellement frontales et pariétales, avant d’être envoyé au colliculus supérieur.
Les études des lésions cérébrales focales, la stimulation électrique profonde et l’imagerie par résonance magnétique fonctionnelle ont permis d’identifier cinq régions corticales spécifiquement impliquées dans le contrôle des saccades (Fig. 2-6 et Fig. 2-7) :
– le champ oculomoteur pariétal (parietal eye field [PEF]), situé dans le sulcus intrapariétal; son activation entraîne le déclenchement de saccades réflexes;
– le champ oculomoteur frontal (frontal eye field [FEE]), ou aire oculomotrice principale, qui appartient à l’aire 6 de Brodmann. Il joue un rôle lors des saccades volontaires. Il permet le désengagement de l’attention pour déclencher des saccades volontaires controlatérales et contrôle leur amplitude;
– le cortex préfrontal dorsolatéral (dorsolateral prefontal cortex [DLPFC]), situé dans l’aire 46 de Brodmann, qui a une fonction principalement décisionnelle dans le contrôle de l’oculomotricité. Il contribue à la préparation des saccades par l’inhibition des saccades réflexes inappropriées, le maintien de l’information mémorisée et la facilitation des saccades anticipées en fonction de l’environnement;
– le champ oculomoteur supplémentaire (supplementary eye field [SEF]), situé dans le lobule paracentral, qui intervient dans l’élaboration de programmes moteurs complexes. Il permet l’apprentissage des stratégies oculomotrices, telles que le comportement oculomoteur du sportif de haut niveau;
– le champ oculomoteur cingulaire (cingulate eye field [CEF]), situé dans le cortex cingulaire antérieur, qui joue un rôle dans la modulation des saccades volontaires en fonction de la motivation [1, 2].
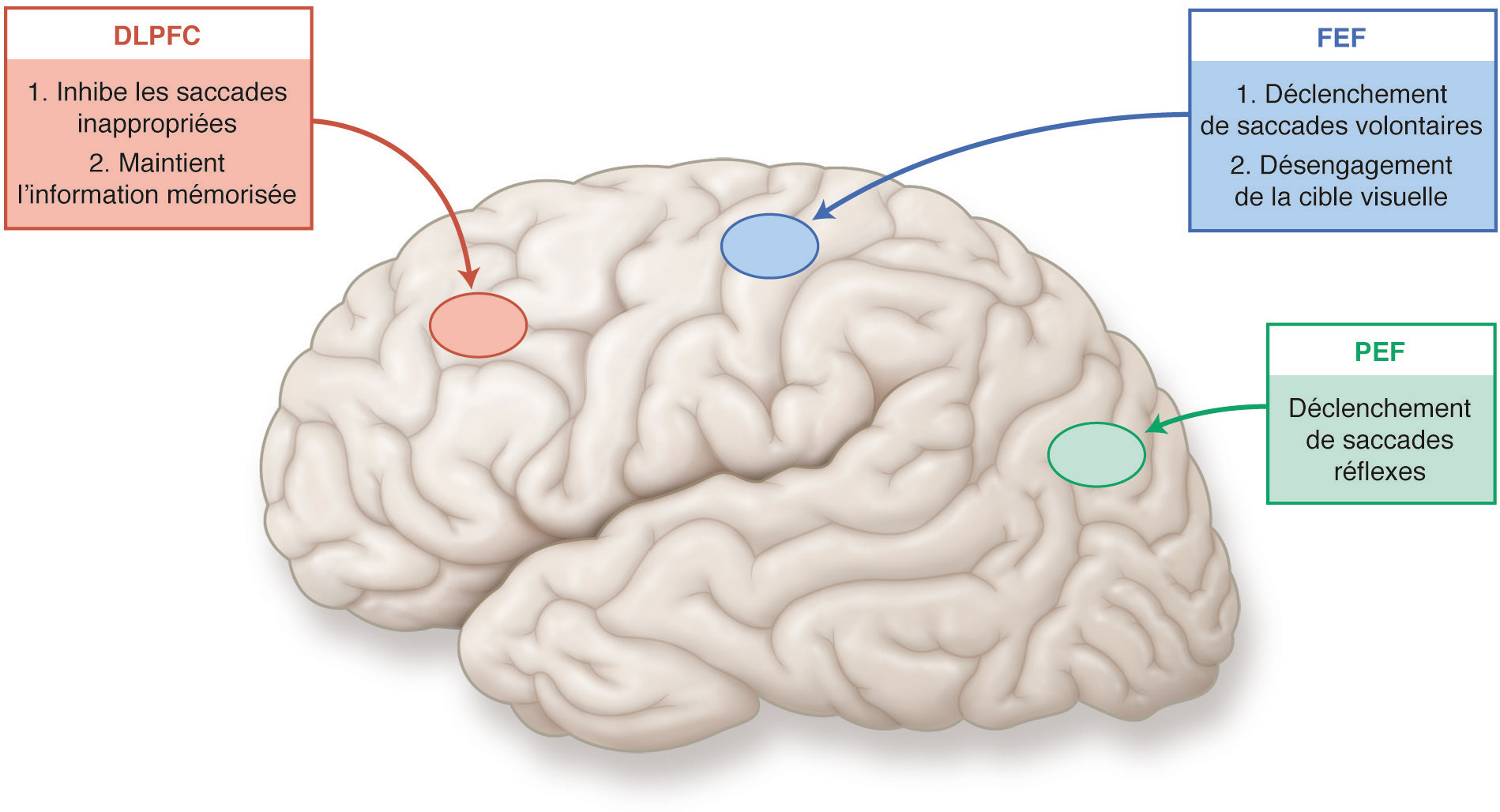
DLPFC : dorsolateral prefontal cortex ou cortex préfrontal dorsolatéral ; FEF : frontal eye field ou champ oculomoteur frontal ; PEF : parietal eye field ou champ oculomoteur pariétal.
Au niveau sous-cortical, les ganglions de la base et le colliculus supérieur (toit du mésencéphale) permettent la génération des programmes ainsi que l’inhibition des saccades réactives.
Le colliculus reçoit une partie des afférences sensorielles visuelles au niveau de sa couche superficielle. Ces afférences, vestigiales, ont un rôle accessoire et n’ont pas de connexions directes avec les autres couches. À l’inverse, les couches intermédiaires et profondes du colliculus supérieur sont un relais important entre le cortex et les structures prémotrices et motrices du tronc cérébral. Lieu de l’intégration multisensorielle, elles sont impliquées dans la génération de saccades réflexes et volontaires.
Le cervelet joue également un rôle clé dans la précision du mouvement. Il permet la correction des erreurs et l’adaptation du mouvement oculomoteur.
Le générateur des saccades, localisé au niveau du tronc cérébral dans la formation réticulée, regroupe deux centres différents, à l’origine des mouvements de versions horizontaux et verticaux :
- la formation réticulée pontique paramédiane (FRPP), localisée dans le pont; elle génère les saccades horizontales;
- le noyau rostral interstitiel du faisceau longitudinal médian, localisé dans la formation réticulée mésencéphalique; il est à l’origine des saccades verticales.
La réticulée génère une activation qui est transmise aux noyaux oculomoteurs, dont le rôle est d’activer les muscles extraoculaires agonistes et d’inhiber les antagonistes. Les noyaux oculomoteurs sont au nombre de trois :
– le nerf oculomoteur commun (III) provenant du noyau moteur du III, situé à l’avant du mésencéphale; il innerve les muscles droit supérieur et droit inférieur, droit interne et petit oblique;
- le nerf oculomoteur externe (VI), ou nerf abducens, dont le noyau se situe à la jonction bulbopontique; il innerve le muscle droit externe;
- le nerf trochléaire (IV); il innerve le muscle grand oblique [2].
De nombreuses pathologies peuvent entraîner un dysfonctionnement des saccades. Un des symptômes fréquemment associés est la diplopie. L’examen oculomoteur permet d’orienter vers une étiologie supranucléaire (dont l’étiologie est située au-dessus des noyaux oculomoteurs, le plus souvent au niveau de la formation réticulée) ou une atteinte des nerfs et/ou des muscles oculomoteurs. Un exemple d’atteinte supranucléaire est la paralysie supranuclaire progressive, ou maladie de Steele-Richardson, responsable d’un ralentissement progressif des mouvements verticaux lié à la dégénérescence de la formation réticulée mésencéphalique; à ces symptômes oculomoteurs s’associent souvent un syndrome parkinsonien et des troubles de l’équilibre. Les atteintes des nerfs oculomoteurs (III, IV, VI) sont principalement liées à des mécanismes vasculaires, inflammatoires ou post-traumatiques, par exemple une ischémie du III chez un patient diabétique, une atteinte du IV post-traumatique ou une paralysie du VI inflammatoire chez un patient atteint de sclérose en plaques. Les pathologies musculaires oculomotrices sont plus rares. L’une des étiologies fréquentes en ophtalmologie est l’orbitopathie dysthyroïdienne. La myasthénie peut également être responsable d’une diplopie, typiquement fluctuante, par atteinte de la jonction neuromusculaire, située entre les nerfs et les muscles oculomoteurs.
Une bonne connaissance des mécanismes impliqués dans la perception et dans l’intégration des stimuli visuels ainsi que des mécanismes à l’origine des mouvements oculaires permet une meilleure appréhension de nombreux symptômes visuels ou neurologiques. Cette connaissance est particulièrement utile pour localiser les zones de dysfonctionnement qui y sont associées.
[1] Gaymard B, Pierrot-Deseilligny C Neurology of saccades and smooth pursuit Curr Opin Neurol 1999 ; 12(1) : 13-19
[2] Pierrot-Deseilligny C, Milea D, Müri RM Eye movement control by the cerebral cortex Curr Opin Neurol 2004 ; 17(1) : 17-25
Barton JJ Disorder of higher visual function Curr Opin Neurol 2011 ; 24(1) : 1-5
Diederich NJ, Stebbins G, Schiltz C, Goetz CG Are patients with Parkinson’s disease blind to blindsight? Brain 2014 ; 137 : 1838-1849
Naccache L. Visual consciousness explained by its impairments Curr Opin Neurol 2015 ; 28(1) : 45-50
P. Lebranchu
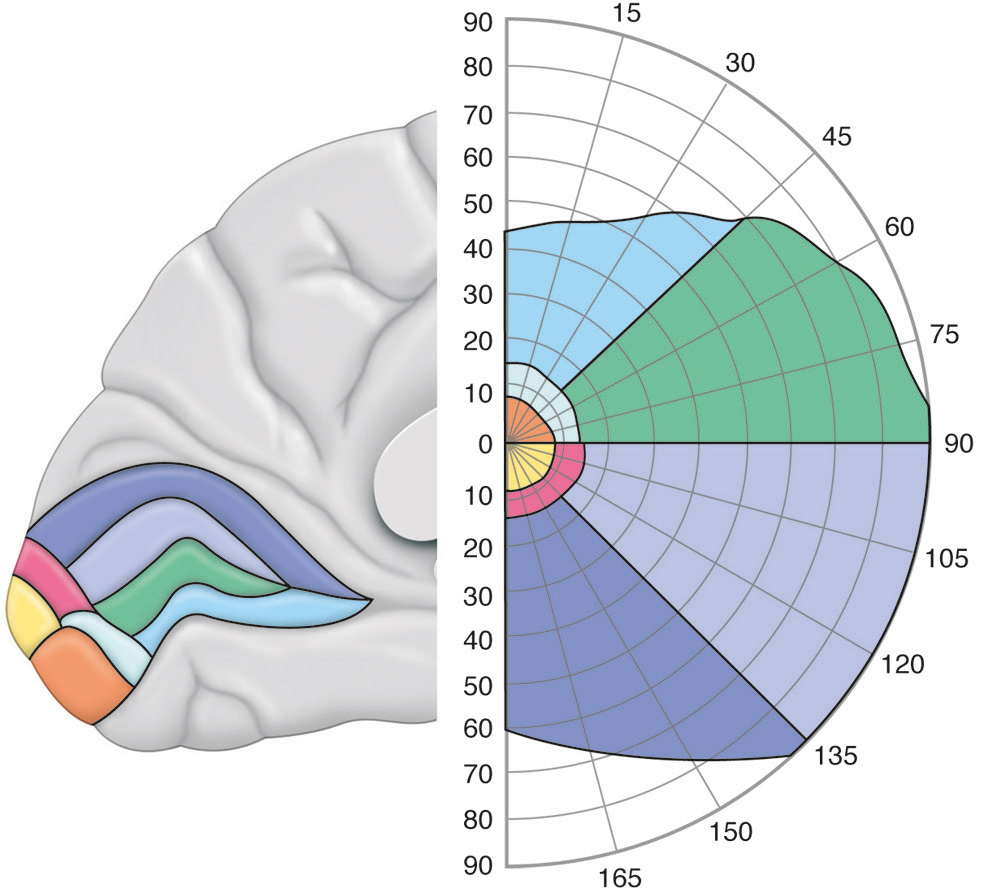
L’organisation du cortex visuel primaire préserve grossièrement l’organisation de l’espace perçu par l’œil : les signaux captés par deux points rétiniens adjacents sont codés au niveau du cortex par deux groupes de neurones adjacents [1]. Ses neurones sont alors organisés selon un plan rétinotopique (Fig. 2-8), dont le degré d’activation dépend de la position de l’image (degré d’excentricité et d’angulation polaire) par rapport à la fovéa. Au-delà de V1, d’autres aires visuelles associatives préservent cette organisation, et la décomposition des caractéristiques de la vision se fait dans une succession de cartes rétinotopiques plus ou moins complètes.
Cette organisation particulière des neurones a permis d’explorer le fonctionnement des différentes aires visuelles chez l’homme grâce à l’imagerie fonctionnelle. Sa technique repose sur l’enregistrement du signal BOLD (blood oxygen level dependent), reflet indirect de la consommation d’oxygène corrélé au degré d’activation des neurones [2]. Comme il existe en permanence une activité corticale, ce signal n’est interprétable que sous forme de ratio : le plus souvent « signal provoqué par une stimulation/signal au repos ». Les travaux d’imagerie fonctionnelle ont montré qu’un stimulus lumineux placé en un point précis du champ de vision provoque une augmentation de l’activité des neurones au niveau de la zone corticale représentant cette partie du champ visuel [3, 4]. En se fondant sur leur organisation rétinotopique, un paradigme classique a été très tôt développé pour topographier l’ensemble de ces aires. Dans un premier temps, les neurones sont stimulés par des cercles concentriques s’éloignant de la fovéa. L’enregistrement du signal BOLD au niveau cortical révèle des cartes d’excentricité, correspondant à des vagues d’activation partant des neurones répondant à la stimulation fovéalaire vers les neurones répondant aux stimuli plus périphériques. Dans un deuxième temps, un stimulus radiaire (comme l’aiguille d’une horloge dont le centre serait la fovéa) balaye la rétine en tournant progressivement sur l’ensemble des méridiens rétiniens. L’activité corticale enregistrée représente des cartes d’angulation polaire, représentant au niveau cortical chacun des méridiens rétiniens (Fig. 2-9). La combinaison des cartes d’excentricité et d’angulation polaire met en évidence des territoires corticaux rétinotopiques (Fig. 2-10). Pour visualiser ces cartes, l’activité corticale est plaquée sur une représentation 3D du cerveau, avec cependant le risque de masquer une partie de l’activation à l’intérieur des sillons corticaux. Pour y remédier, une première méthode consiste à déplier les sillons corticaux en gonflant la surface corticale comme un ballon (inflated cortex).
Chaque hémisphère prend alors la forme d’un ballon de rugby, et il est possible de représenter l’activité corticale en regardant les six faces de chaque hémisphère (supérieure, inférieure, antérieure, postérieure, latérale et médiale). Une deuxième technique (flat map) consiste à découper ce ballon le long de sillons anatomiquement reproductibles (scissure calcarine, etc.), pour étaler la surface corticale « comme une peau de bête ». Si cette technique rend à première vue la visualisation compliquée (car elle nécessite d’apprendre où est représenté chaque lobe par rapport à l’anatomie classique), elle offre l’avantage incomparable de pouvoir représenter en une seule vue l’ensemble de la surface corticale (là où six vues sont nécessaires pour un cerveau 3D ou gonflé).
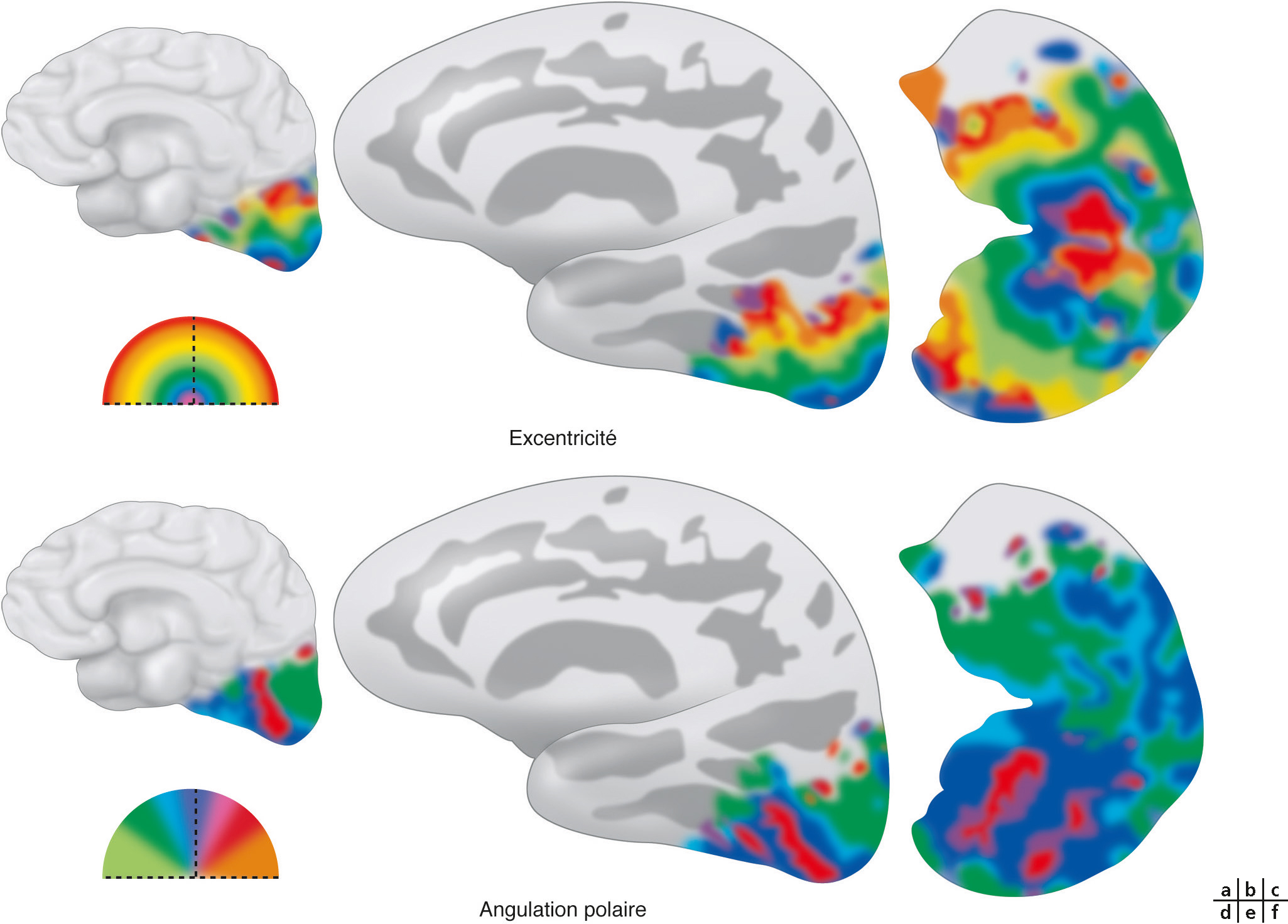
La partie supérieure représente l’excentricité codée en fonction de la couleur (rouge = fovéa bleu → vert = parafovéa → jaune → rouge = périphérie), représentée sur la surface corticale (a), la surface corticale gonflée (b) et aplatie, coupée le long de la scissure calcarine (c). La partie inférieure représente la carte d’angulation polaire (rouge = méridien vertical supérieur → bleu = méridien horizontal → vert = méridien vertical inférieur) représentée sur les mêmes trois surfaces (d, e et f) respectivement.
(D’après [3].)
Le cortex visuel primaire (V1) présente une reproductibilité anatomique au niveau du sillon calcarin, mais sa taille varie d’un individu à l’autre. Les aires visuelles associatives ont une plus grande variabilité, et certaines ne sont pas toujours visualisables. Le cortex visuel primaire (V1) se loge dans la partie médiale du lobe occipital, représentant l’hémichamp visuel controlatéral. Sa représentation fovéale se situe au niveau du pôle occipital, et l’excentricité est codée dans un sens caudorostral en s’avançant vers la partie antérieure du sillon. Ces neurones se répartissent également de la berge inférieure (représentation du méridien vertical supérieur) vers le fond de la scissure (méridien horizontal controlatéral) puis vers la berge supérieure (méridien vertical inférieur) selon un système de coordonnées polaires. Les quadrants supérieurs et inférieurs du champ visuel sont codés respectivement dans les parties ventrales et dorsales de V1. La richesse des champs récepteurs fovéolaires par rapport aux champs récepteurs périphériques explique la sur-représentation spatiale du centre de notre champ de vision dans V1 (phénomène de magnification).
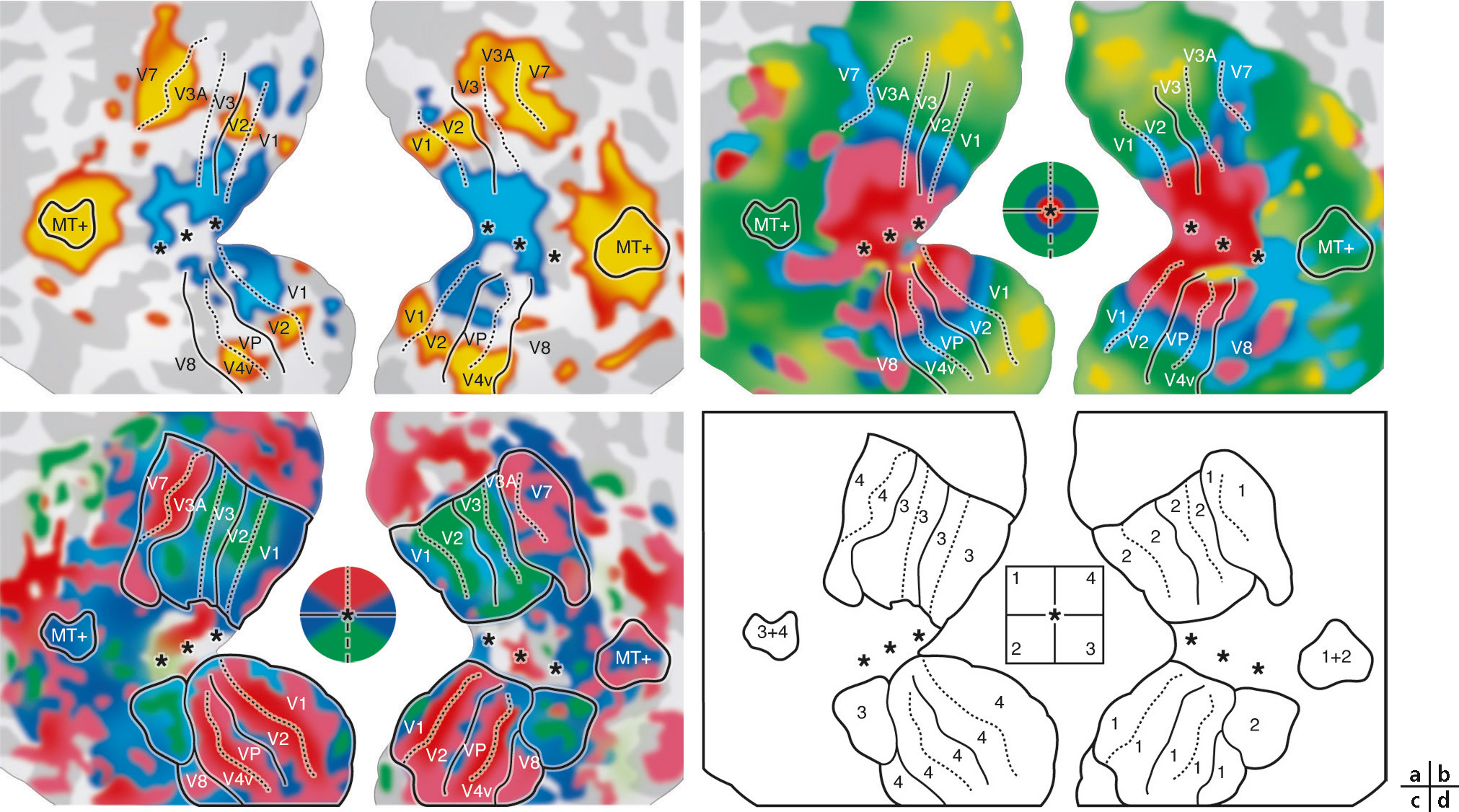
Les trois premières aires visuelles présentent une répartition symétrique de part et d’autre de la scissure calcarine, centrée sur V1, dont la continuité s’étend vers V2 puis V3 (Fig. 2-11). Pour chacune, il est possible de décrire une partie dorsale (représentant un quart de champ visuel inférieur) et une partie ventrale (quart de champ visuel supérieur). La frontière séparant chaque aire est réalisée par un méridien (vertical entre V1 et V2, horizontal entre V2 et V3). Les parties dorsale et ventrale des aires associatives n’entrent en contact qu’au niveau de leur centre fovéolaire, situé en continuité avec le pôle occipital (complexe fovéolaire). Si, par exemple, nous étudions la valeur spatiale des neurones du cortex occipital dorsal en nous éloignant progressivement du sillon calcarin, V1d représente le quart de champ visuel controlatéral inférieur s’étendant du méridien horizontal vers le méridien vertical; V2d représente cette même portion de champ visuel mais du méridien vertical vers le méridien horizontal, et V3d, de nouveau du méridien horizontal vers le méridien vertical.
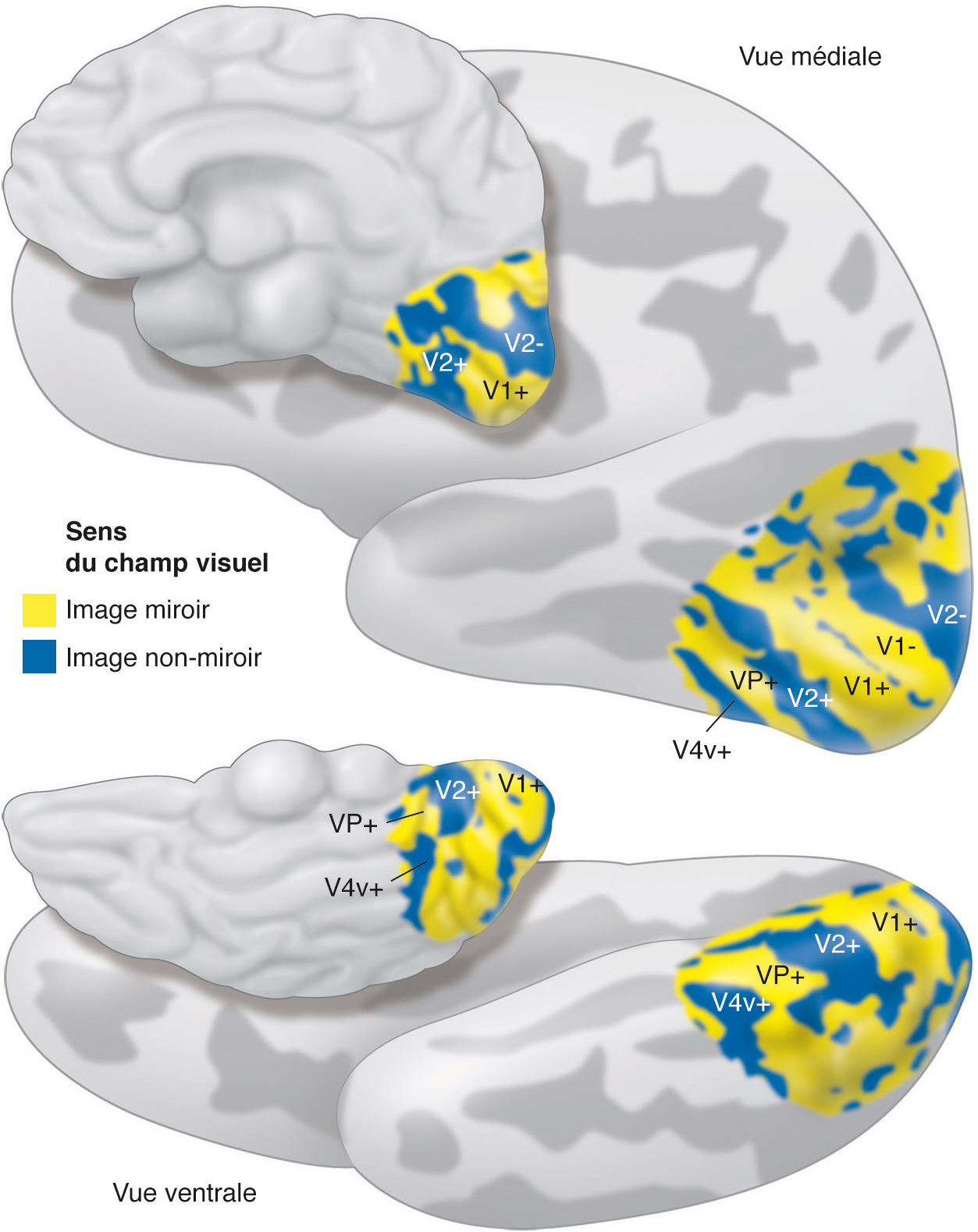
Au-delà de V3, l’organisation spatiale des aires extrastriées se complexifie. Des particularités apparaissent chez l’homme par rapport au macaque, certaines aires occupant une surface plus grande (V3), d’autres réorientant leur fonction (V3A) ou apparaissant avec l’évolution (LO). Toutes conservent une organisation rétinotopique, représentant d’emblée un hémichamp complet (Fig. 2-12). Cependant, les angulations polaires et la direction de leur excentricité ne sont plus toujours alignées avec les trois premières aires visuelles, et leur représentation fovéolaire peut être indépendante du pôle occipital [5]. Certaines ne sont présentes que dans la partie ventrale (Fig. 2-13), au-delà de V3v : hV4, puis VO-1 et VO-2 (ventral-occipital areas 1 et 2). D’autres sont spécifiques de la partie dorsale (Fig. 2-14), s’étendant latéralement, LO-1 et LO-2 (lateral-occipital areas 1 et 2), puis atteignant la jonction occipitotemporale, TO-1 et TO-2 (temporal-occipital areas 1 et 2). Ces dernières recouvrent un complexe sensible au traitement du mouvement visuel (hMT/V5) organisé autour d’un centre fovéolaire et regroupant différentes aires rétinotopiques juxtaposées « en quart de camembert successifs » (hMT ou human middle temporal area, pMST ou putative homologue of middle superior temporal area, pFST ou putative homologue of fundus of the superior temporal area, etc.). Dorsalement par rapport à V3d s’étendent V3A et V3B. Au-delà, un ensemble d’aires rétinotopiques peut encore être identifié le long du sillon intrapariétal (intraparietal sulcus, IPS 0-1-2-3) et dans le lobule pariétal supérieur (SPL-1). La découverte progressive de ces nombreuses aires par des équipes différentes a abouti à des dénominations redondantes : V7 pour IPS-0, LIP (lateral intraparietal area) pour IPS-3, etc. Par ailleurs, l’ensemble des aires est rarement identifié au cours de la même expérience chez tous les sujets : taille trop petite par rapport à la définition utilisée (taille des voxels), recouvrement d’aires au sein du même voxel brouillant le signal, sensibilité de certaines aires à certains stimuli, etc.
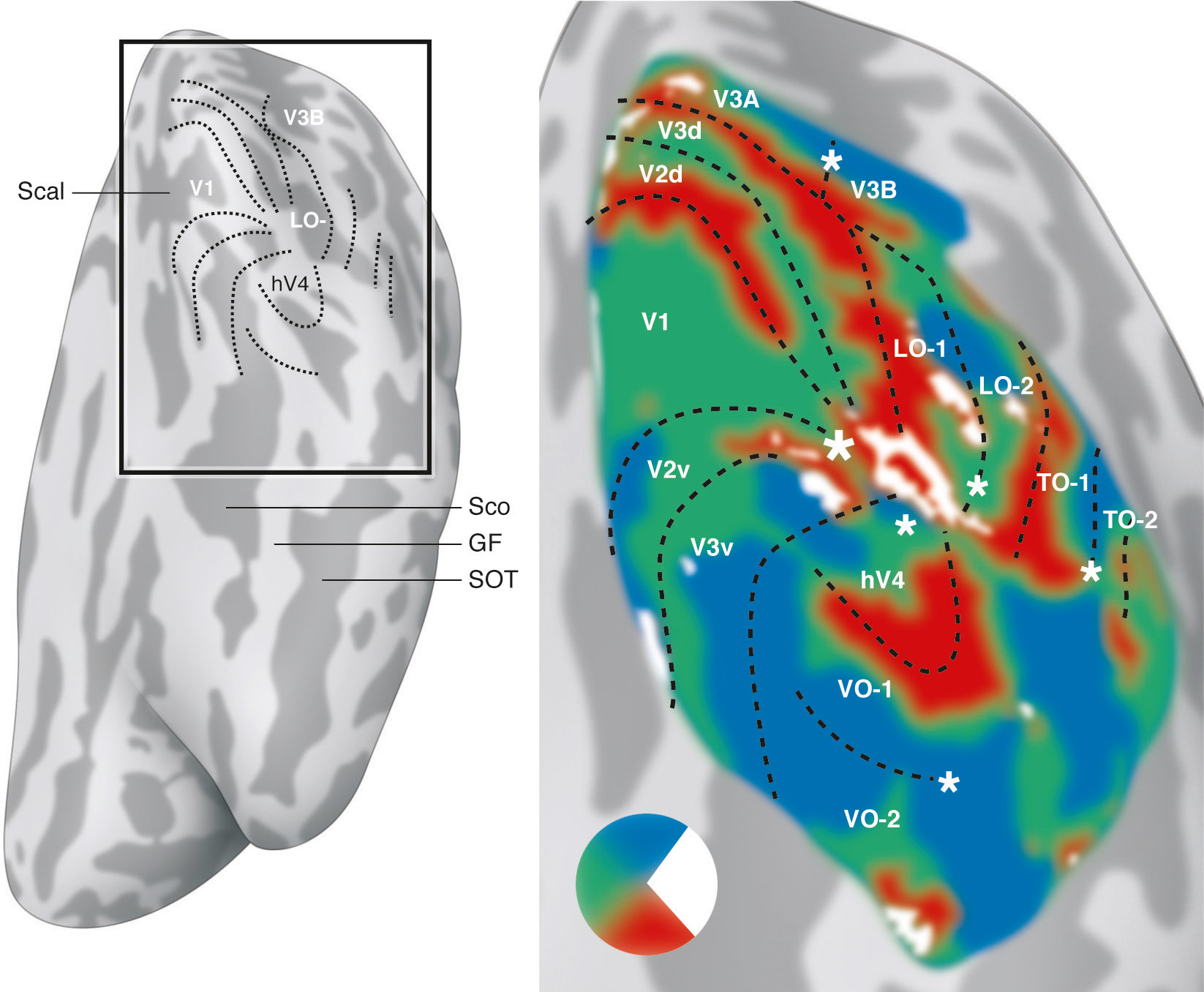
Les zones gris clair et gris foncé représentent respectivement les gyrus et les sulcus. Les sillons calcarin (Scal), collatéral (Sco), occipitotemporal (SOT) et le gyrus fusiforme (GF) sont indiqués. Les couleurs représentent l’angle de stimulation qui provoque le maximum d’activation corticale. Le centre de la vision est représenté par un astérisque. (Voir aussi le texte pour les abréviations.) (D’après Wandell BA, Winawer J. Imaging retinotopic maps in the human brain. Vis Res 2011 ; 51(7) : 718-37.)
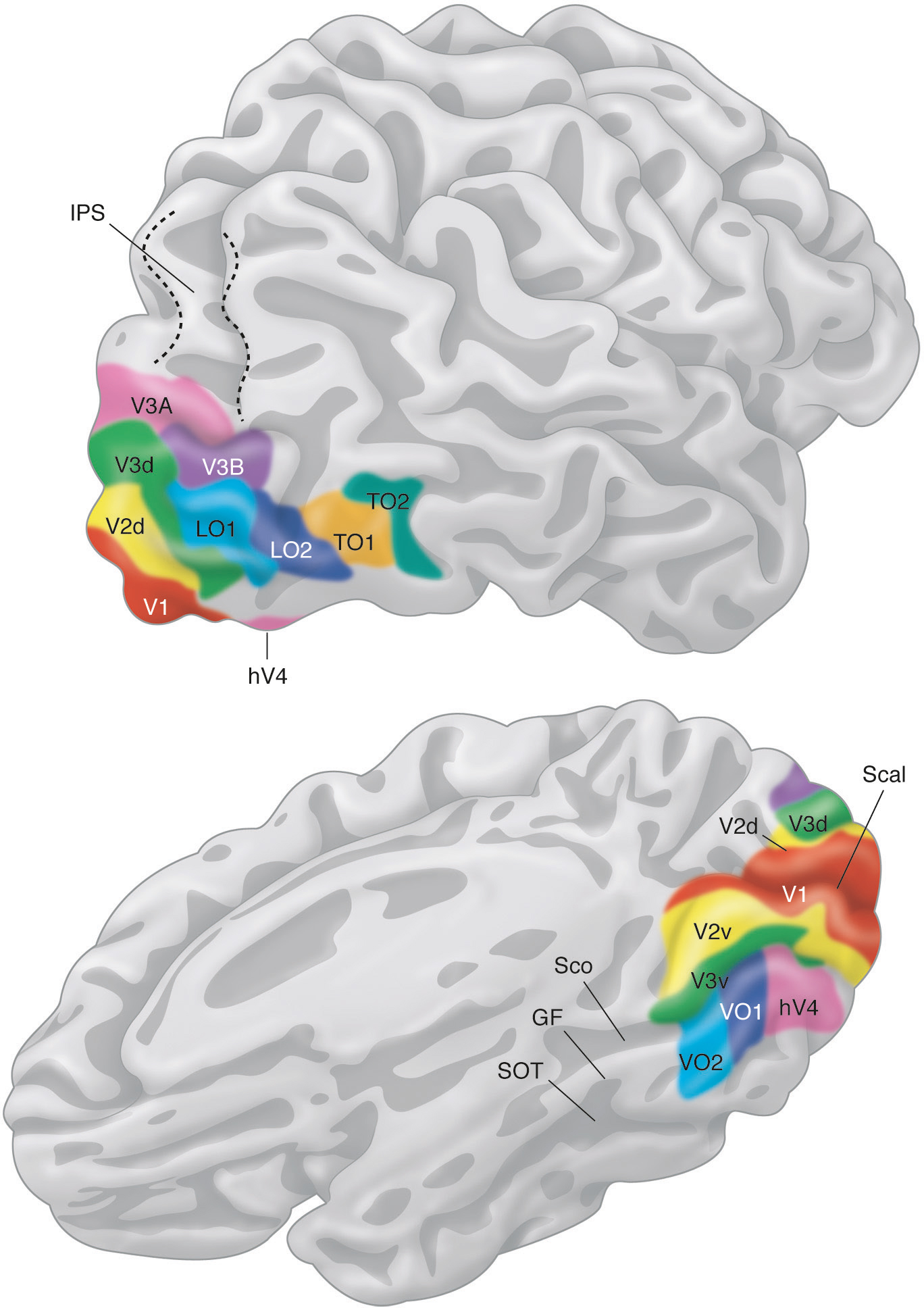
Les cartes sont définies par une couleur et leur nom indiqué.
(D’après Wandell BA, Winawer J. Imaging retinotopic maps in the human brain. Vis Res 2011 ; 51(7) : 718-37.)
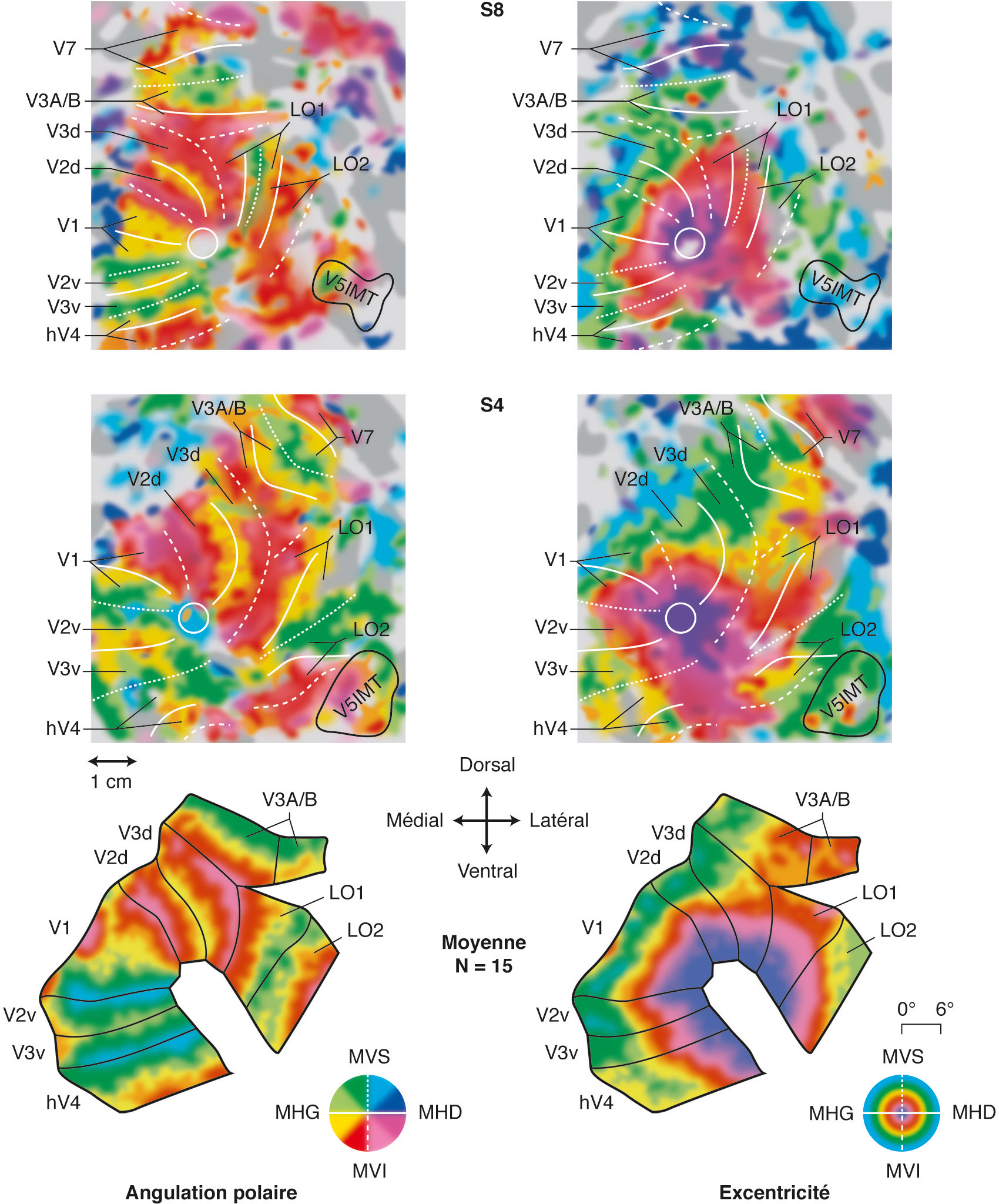
Les représentations corticales des angulations polaires (colonne de gauche) et de l’excentricité (colonne de droite) sont réalisées sur des flat-maps (cartes corticales aplaties) du cortex occipital de l’hémisphère droit de deux sujets (S8 et S4) et sur un cerveau moyenné entre 15 sujets. Ligne blanche continue : méridien horizontal ; ligne blanche pointillée : méridien vertical supérieur (MVS) ; ligne blanche discontinue : méridien vertical inférieur (MVI) ; cercle blanc : localisations approximatives de la représentation fovéale de V1/V2/V3. MHD : méridien horizontal droit ; MHG : méridien horizontal gauche.
(D’après [9].)
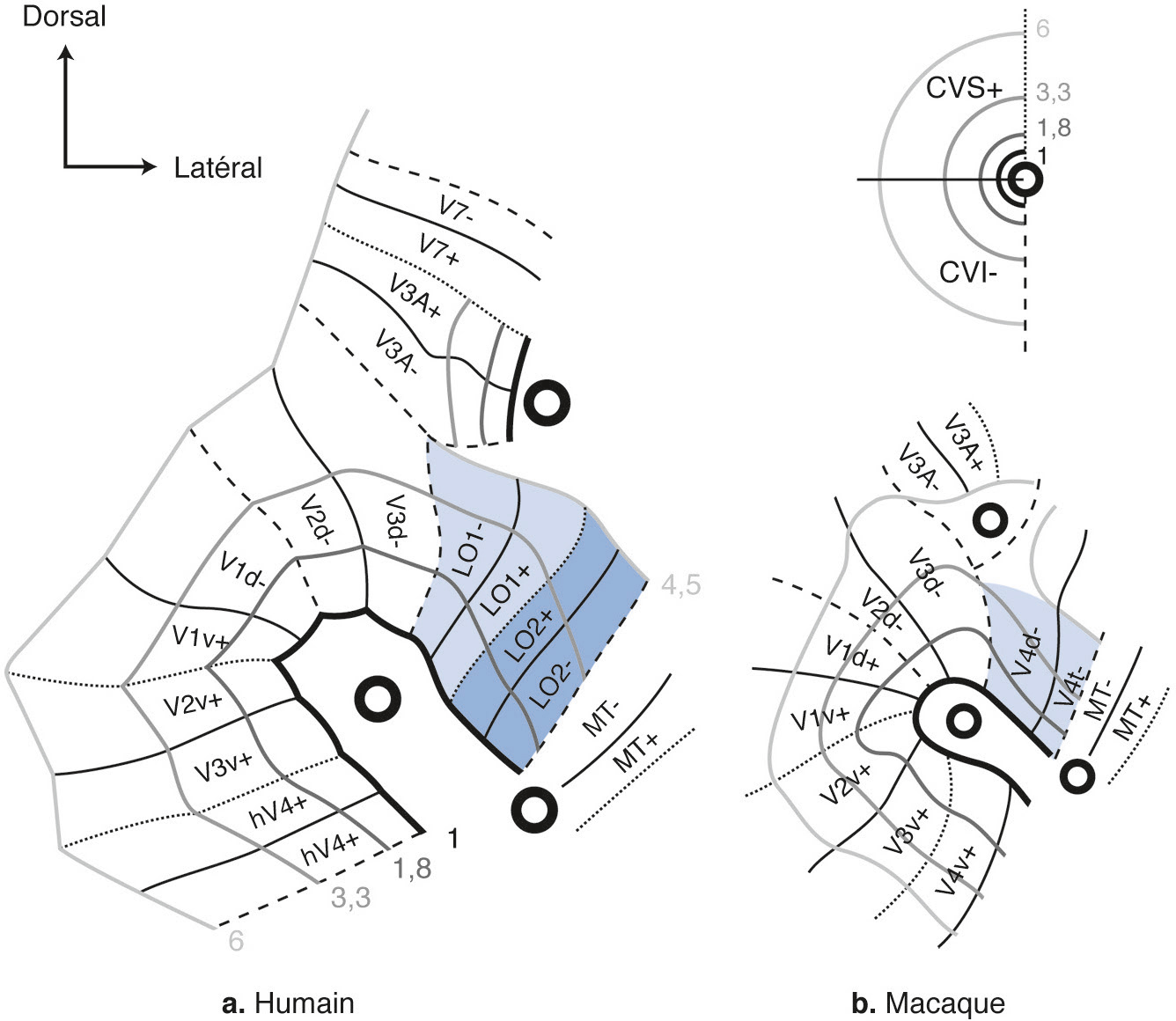
a. Cortex visuel humain (représenté sur un hémisphère droit aplati, moyenné entre 30 hémisphères). b. Cortex visuel du macaque en comparaison. Deux différences majeures sont à noter : (1) l’apparition chez l’homme des aires visuelles LO 1 et LO 2 (lateral-occipital area) entre les aires dorsales V3 et MT (middle temporal area) ; (2) V4 n’est représenté que dans la partie ventrale du cortex visuel chez l’homme (hV4), par le basculement de la représentation du champ visuel inférieur de V4 (V4d chez le macaque) qui devient continu à la représentation du champ visuel supérieur (V4v chez le macaque). CVI : champ visuel inférieur ; CVS : champ visuel supérieur.
(D’après [9].)
Non seulement l’information visuelle adressée par la rétine est réceptionnée au niveau de V1, mais de plus elle va par la suite être distribuée à un ensemble successif d’aires rétinotopiques qui décomposeront le signal en fonction de ses caractéristiques (couleur, forme, déplacement, etc.). En plus de passer par V1, certains signaux (comme la perception du mouvement) peuvent être adressés directement à une aire spécialisée (V5). En utilisant des paradigmes spécifiques à une caractéristique visuelle, il est possible d’identifier la spécialisation d’une aire rétinotopique. Cependant, il serait trop simpliste de penser qu’une aire ne réalise qu’une fonction, ou qu’a contrario une fonction n’est réalisée que par une aire. Il est toutefois possible de dégager schématiquement deux voies de traitement, impliquant les aires ventrales pour la reconnaissance des formes et les aires dorsales pour la localisation spatiale des stimuli (voies du « quoi ? » et du « où ? »). Le traitement du mouvement a été une des premières caractéristiques visuelles étudiées, et a très vite mis en évidence l’implication de la jonction temporo-occipitale. Les travaux plus récents y révèlent l’existence de plusieurs cartes rétinotopiques (Fig. 2-15), regroupées au sein du complexe hMT/V5+ [6]. V3A présente une forte sensibilité au mouvement chez l’homme. Cette fonction est une acquisition de l’évolution, cette aire étant insensible au mouvement chez le singe [5]. Une augmentation de l’activité corticale est observée dès les premières aires visuelles (V1 et V2) lors du traitement de la vitesse de déplacement d’une cible [7]. Contrairement au singe où le traitement de la couleur est réalisé à la fois dans les parties dorsale et ventrale du cortex occipital, l’IRMf a montré que seules les aires ventrales (principalement hV4, mais également VO-1 et VO-2) sont impliquées chez l’homme [8]. La reconnaissance spécifique d’objet provoque un surcroît d’activation dans le complexe lateral-occipital (LO) situé entre V3d et V5 [9]. La reconnaissance des visages fait intervenir au moins trois zones (Fig. 2-16), dans le gyrus occipital inférieur (occipital face area [OFA]) ou plus ventrale dans le gyrus fusiforme (fusiform face area [FFA]), ou dans la voie dorsale au niveau de pSTS (posterior superior temporal sulcus). La reconnaissance des visages pourrait ainsi suivre une voie hiérarchique d’analyse du niveau le plus bas (OFA, reconnaissance d’un visage par rapport à un objet) vers un niveau plus élevé (FFA et voie temporale, reconnaissance de l’identité) [10]. Une seconde hypothèse repose sur la dissociation entre la reconnaissance de la forme du visage (voie ventrale) et de son expression (mouvement, voie dorsale) [11]. La reconnaissance de mots (par rapport à des fausses lettres) provoque une activation latéralement par rapport à VO, au niveau de sillon occipitotemporal postérieur (visual word form area) [12].
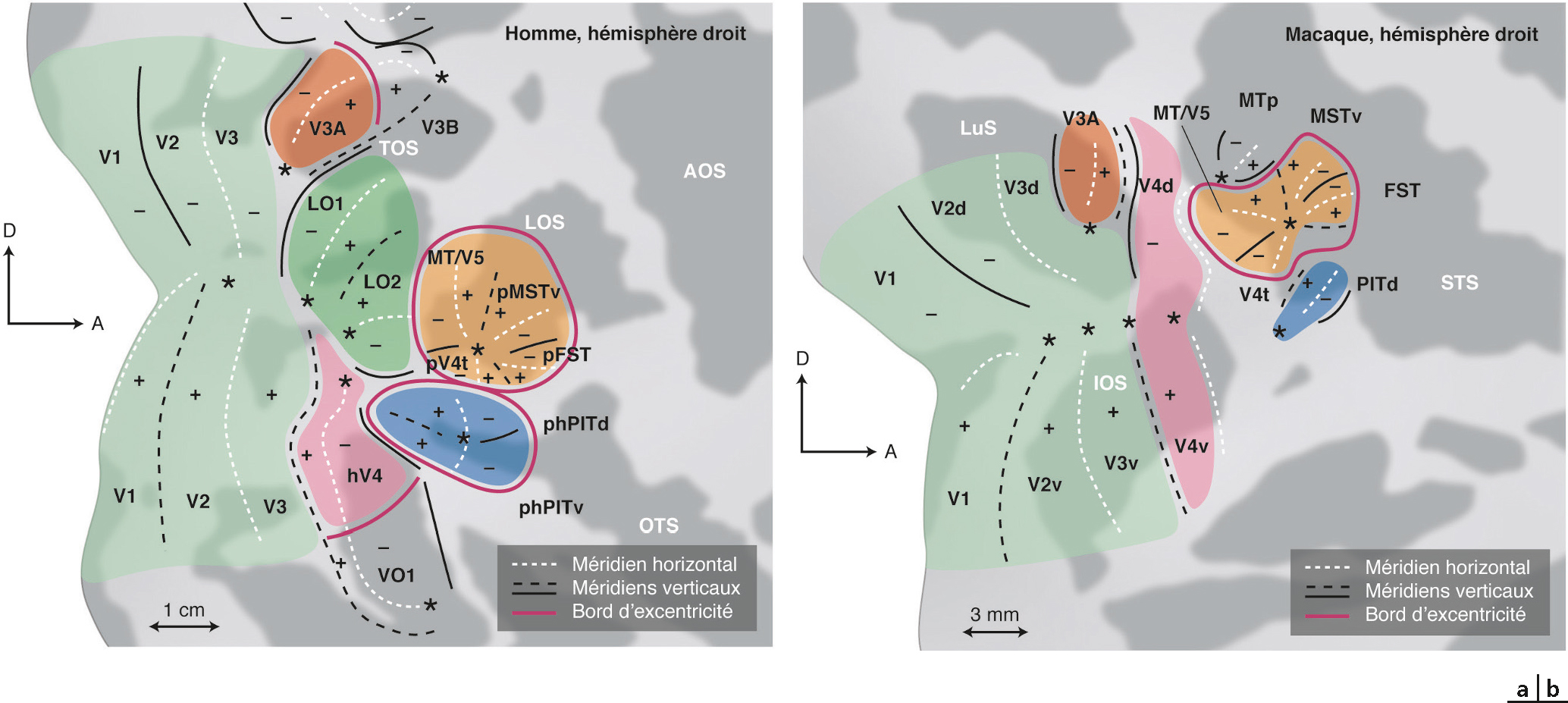
AOS : anterior occipital sulcus ; FST et pFST : (putative) fundus of the superior temporal area ; LOS : lateral occipital sulcus ; MT/V5 : middle temporal area/visual area 5 ; MTSv et pMSTv : (putative) ventral part of the medial superior temporal area ; OTS : occipito-temporal sulcus ; PIT et phPIT : (putative human) posterior inferior temporal area (d = dorsal, v = ventral) ; TOS : transverse occipital sulcus ; V4t et pV4t : (putative) V4 transitional zone.
(D’après [6].)
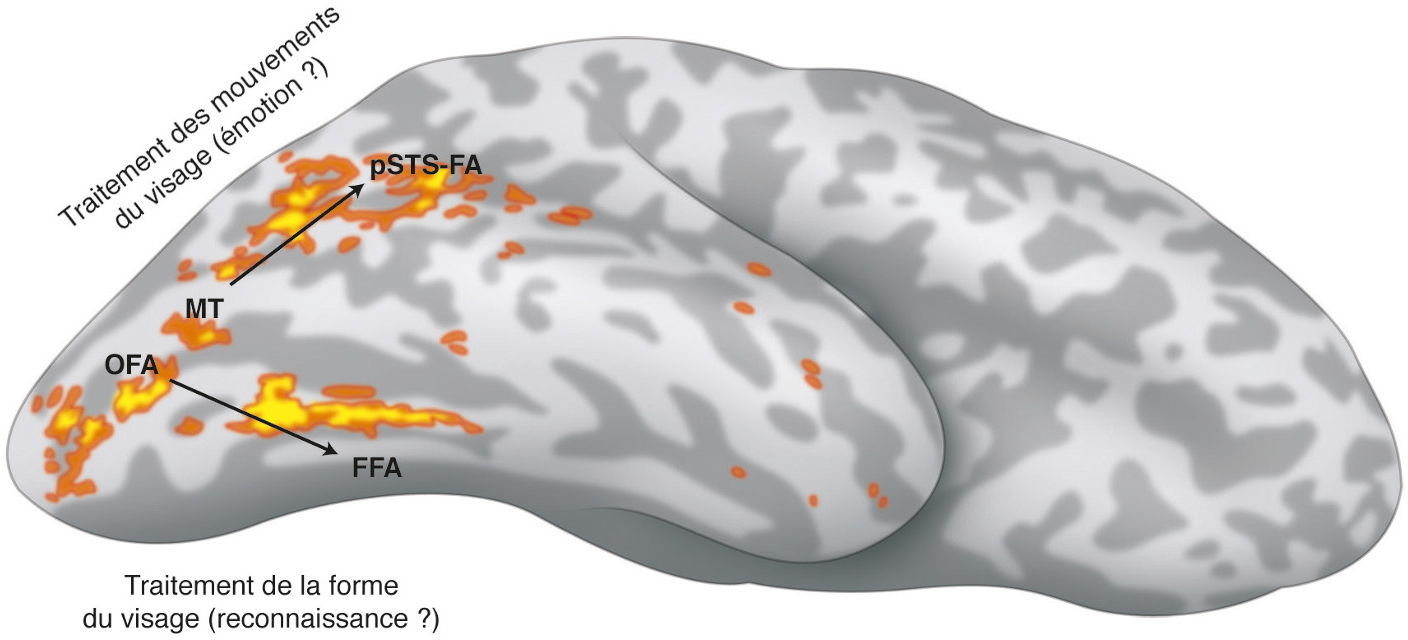
Selon cette théorie, le courant ventral (OFA → FFA) est impliqué dans le traitement de la forme de la face, alors que la courant dorsal (STS-FA) est impliqué dans les mouvements de la face. MT : middle temporal area.
(D’après [11].)
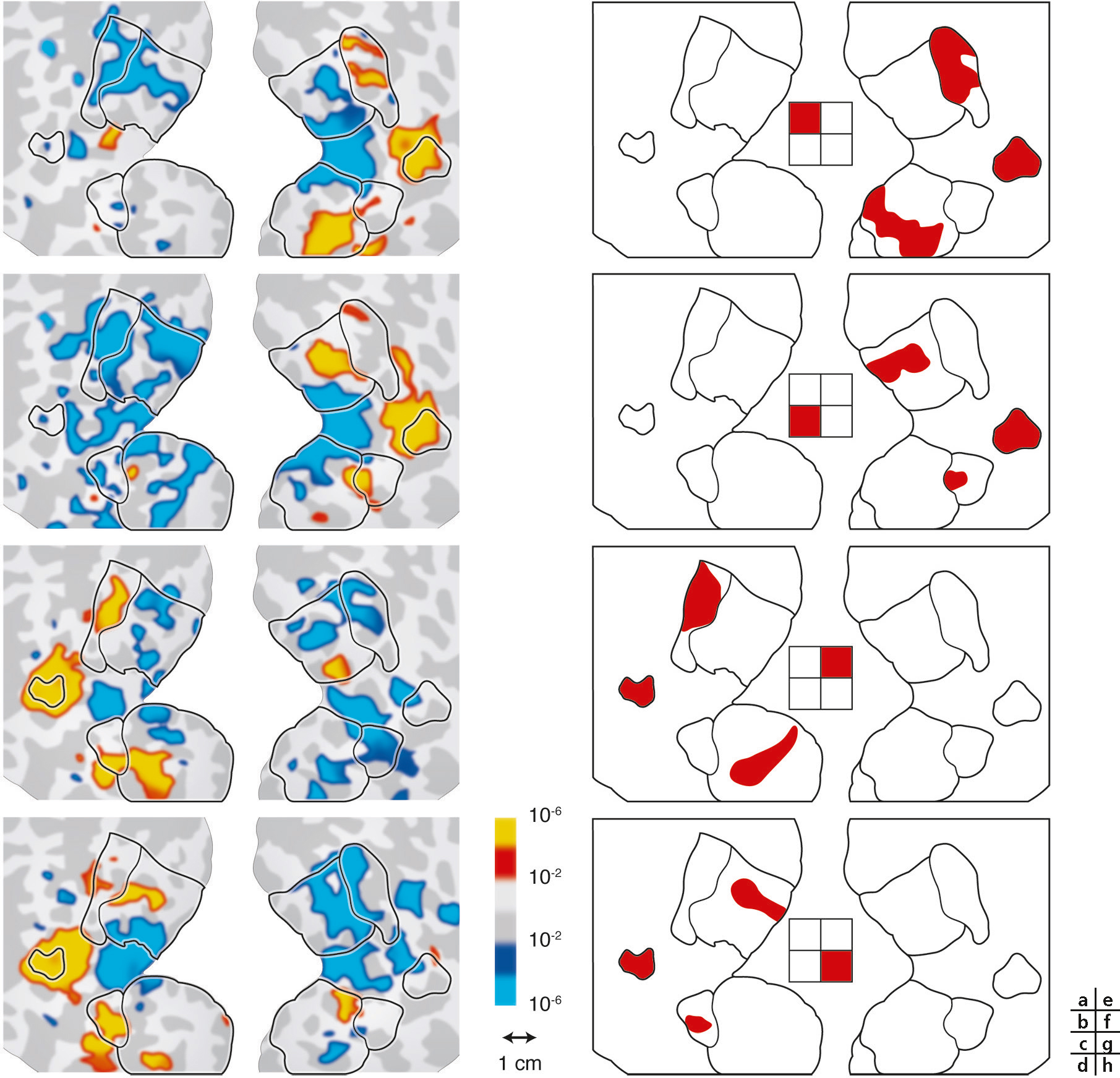
L’attention visuospatiale pourrait être définie comme un processus modulant le traitement de l’information sensorielle d’une partie de notre environnement pour en faciliter l’analyse [13]. L’imagerie fonctionnelle a révélé que l’attention module localement l’activité corticale des cartes rétinotopiques [14] : l’attention dirigée vers une zone spécifique du champ de vision provoque une augmentation de l’activité corticale de la région rétinotopique correspondante du cortex visuel, même en l’absence de stimulation visuelle (Fig. 2-17 et Fig. 2-18). Cette modulation d’activité se retrouve dans toutes les aires, du cortex visuel primaire (niveau de modulation le plus faible) aux aires extrastriées V3A et V4 ventrale (niveau de modulation le plus élevé). Cette augmentation localisée de l’activité corticale pourrait faciliter le traitement de l’information sensorielle dans la partie du champ visuel où nous anticipons l’apparition du stimulus. L’homme est capable d’ajuster la taille de la zone d’attention afin de traiter en parallèle différents stimuli (modèle de la lentille zoom [15]). Cependant, Eriksen constate que l’efficacité du traitement de l’information est inversement proportionnelle à la taille du champ d’attention : plus le sujet doit élargir son champ d’attention, moins il est performant. L’imagerie fonctionnelle a permis de confirmer cette théorie [16]. L’ajustement de la taille du champ attentionnel provoque au niveau des cartes corticales un ajustement proportionnel de la surface d’activation. Plus le champ d’attention est étroit, plus la zone corticale activée est étroite, mais le niveau moyen d’activation en son sein est élevé. Au contraire, un élargissement du champ attentionnel agrandit la surface rétinotopique activée, mais en diminuant le niveau global d’activation (Fig. 2-19). Tout se passe comme si le système possédait une quantité limitée d’énergie à distribuer sur son champ de vision, focalisant en un endroit précis pour augmenter les performances, ou la répartissant de façon plus large, au prix d’une diminution des résultats. Lorsque nous concentrons notre attention en un endroit de l’espace, nous oublions tout ce qui nous entoure. La psychophysique a ainsi démontré une diminution des performances perceptives dans les zones entourant le foyer attentionnel [17]. Au sein des cartes rétinotopiques, des expériences en IRMf (Fig. 2-20) ont montré une désactivation de la zone entourant le foyer attentionnel, en accord avec l’inhibition perceptive notée expérimentalement [18, 19].
a. Cartes rétinotopiques dans les premières aires visuelles avec une activité neuronale accrue (en jaune) ou diminuée (en bleu) dans la zone de l’espace où l’on attend l’apparition du stimulus. b. Cartes d’excentration rétinienne. c. Cartes d’angulation polaire. d. Aires visuelles (en fonction des cartes d’excentricité et d’angulation polaire).
(D’après [14].)
(D’après [14].)
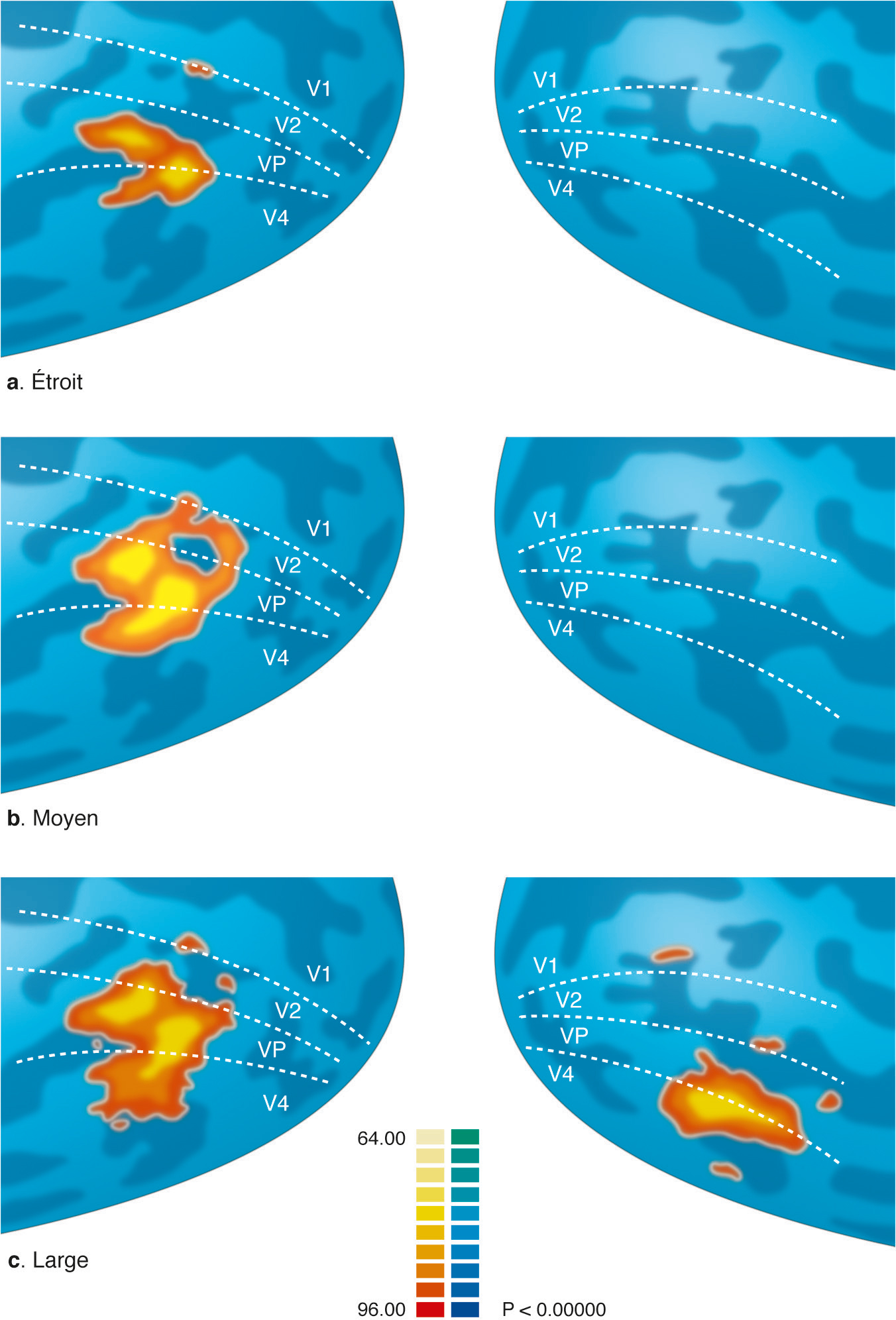
a–c. Champ attentionnel étroit, moyen ou large.
(D’après [16].)
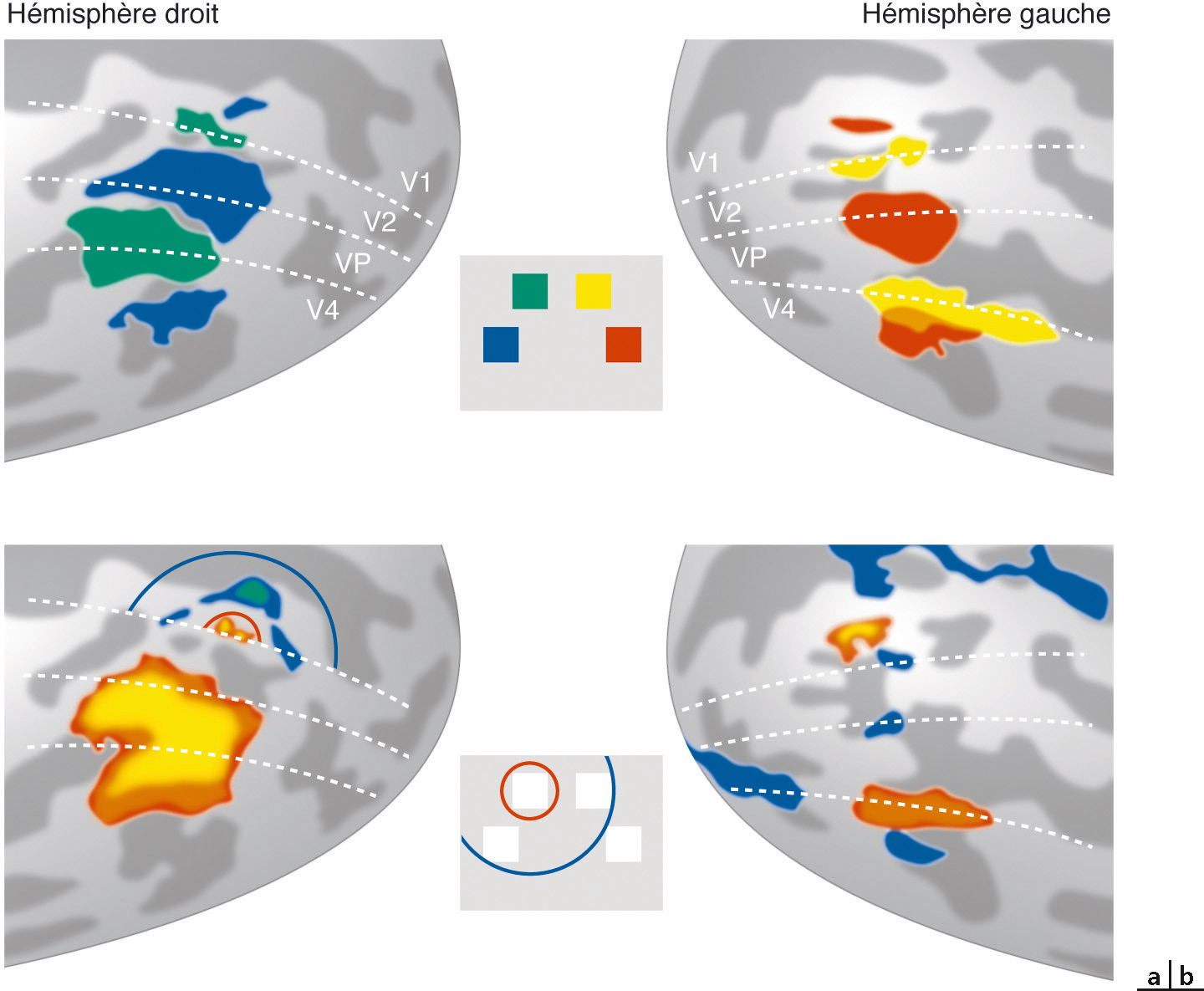
a. Réponse à la stimulation passive des méridiens du champ visuel, permettant de définir des cartes rétinotopiques. b. Réponse à l’orientation de l’attention vers une partie du champ visuel, avec au niveau de V1 une activation du centre (en orange) entouré d’un pourtour inhibiteur (en bleu).
(D’après [19].)
Orienter son attention vers un objet est souvent synonyme de fovéation. Les yeux sont déplacés vers l’objet par une saccade, permettant d’améliorer le traitement visuel de cet objet par la zone de meilleure acuité. Cependant, il est également possible de traiter cet objet sans déplacer son regard, en déplaçant le « focus » d’attention vers ces objets. Nous réalisons alors un déplacement implicite (c’est-à-dire sans mouvement oculaire) de l’attention visuospatiale. Ces déplacements explicites (saccades) et implicites de l’attention sont supportés en partie par les mêmes mécanismes neuronaux. Ces concepts sont regroupés sous le nom de théorie prémotrice de l’attention visuospatiale [20]. L’imagerie fonctionnelle a permis de mieux appréhender ces phénomènes de déplacement attentionnel. Dans une expérience réalisée par tomographie par émission de positrons (TEP), les auteurs rapportent une augmentation de l’activité corticale bilatérale des champs oculomoteurs frontaux (frontal et supplementary eye fields) lors de la réalisation de saccades imaginées [21]. Les auteurs concluent que « l’exécution motrice et l’imagerie mentale de cette exécution sont liées par un réseau corticale commun ». Ce réseau (Fig. 2-21) inclut des aires frontales (dont le frontal eye field [FEF] et le supplementary eye field [SEF]), pariétales (dont IPS) et temporo-occipitales (dont hMT/V5+) et les premières aires du cortex visuel [22, 23]. Les études de connectivités fonctionnelles au repos confirment l’interconnexion de ces aires, véritable réseau anatomofonctionnel [24]. Certaines études retrouvent un surcroît d’activation du réseau en cas de déplacement implicite [25], d’autres en cas de déplacement explicite [23, 26]. L’activation du réseau pourrait également être paramétrée en fonction de la fréquence du mouvement [24].
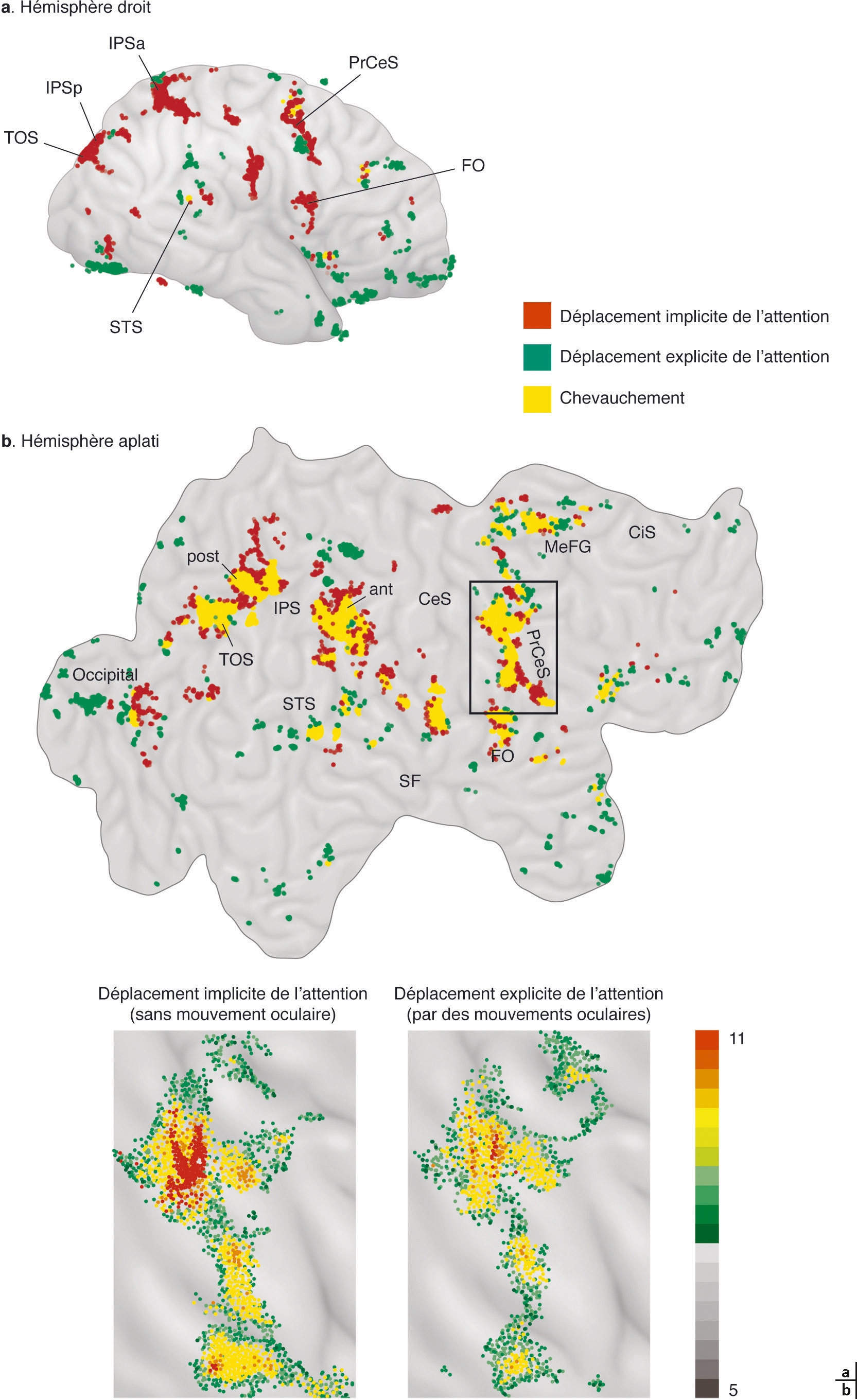
b. Idem sur un hémisphère aplati, avec en jaune les voxels significativement activés dans les deux tâches. Mise en évidence d’un réseau commun comprenant des aires postérieures (IPS : intraparietal sulcus) et frontal (precentral sulcus).
(D’après Corbetta M, Akbudak E, Conturo TE, et al. Acommon network of functional areas for attention and eye movements. Neuron 1998 ; 21(4) : 761-73.)
Les conséquences d’une déficience visuelle peuvent apparaître en imagerie cérébrale anatomique et fonctionnelle, d’autant plus que le déficit est survenu tôt dans la vie. Sur le plan histologique, les patients présentant une altération précoce de la perception visuelle développent une amblyopie, qui se traduit au niveau des cellules du cortex visuel par une désorganisation (perte des colonnes de dominance, etc.) [27]. Cette altération a lieu au niveau cellulaire, et ne peut se voir en imagerie. Sur le plan anatomique, les études de connectivité fonctionnelle en IRM révèlent que les aires visuelles occipitales préservent une organisation grossière sur un mode « rétinotopique », malgré l’absence de stimulation visuelle, avec un respect des rapports « haut/bas », « droite/gauche » et « centre/périphérie », y compris en cas de malformation congénitale de l’œil [28, 29]. Cependant, des modifications profondes anatomiques et fonctionnelles sont observables : réduction de la surface occupée par les aires visuelles striées et extrastriées, augmentation de l’épaisseur corticale du cortex strié, modification des connexions anatomiques et fonctionnelles, etc. (revue dans [30]). Ainsi, le cortex occipital présente une plasticité transmodale en cas de handicap visuel précoce, l’activité du cortex occipital enregistré en IRMf augmentant en cas de stimulation auditive ou tactile [31]. Cette réorganisation pourrait s’étendre à d’autres aires visuelles corticales ou sous-corticales [32] et surtout au niveau des connexions entre les différentes aires [27].
La réversibilité de ces modifications anatomiques n’est actuellement pas bien étudiée. Si la plasticité des neurones corticaux apparaît faible en cas d’amblyopie traitée à l’âge adulte, une amélioration des connexions visuelles pourrait être apportée par les nouveaux traitements. Par exemple, les patients atteints de dystrophie rétinienne présentent une désorganisation des radiations optiques, alors même que l’épaisseur des cellules ganglionnaires (RNFL ou retinal nerve fiber layer) est normale [33]. L’origine de cette désorganisation est discutée, car elle ne relève pas du processus de dégénérescence antérograde visible dans d’autres neuropathies optiques. Une absence de stimulation visuelle pourrait en être l’origine, aboutissant à une altération de la myélinisation. L’anatomie du corps calleux est également modifiée en cas cécité congénitale, avec une atrophie de sa partie postérieure [30]. Les premiers résultats IRM du traitement par thérapie génique de ces dystrophies sont assez encourageants, observant une certaine réversibilité de ces anomalies « macroscopiques » à l’âge adulte à la fois sur l’organisation des radiations optiques ipsilatérales et du corps calleux postérieur [34].
[1] Holmes G Disturbances of vision by cerebral lesions Br J Ophthalmol 1918 ; 2(7) : 353-384
[2] Ogawa S, Tank DW, Menon R, et al. Intrinsic signal changes accompanying sensory stimulation: functional brain mapping with magnetic resonance imaging Proc Natl Acad Sci US A 1992 ; 89(13) : 5951-5955
[3] Sereno MI, Dale AM, Reppas JB, et al. Borders of multiple visual areas in humans revealed by functional magnetic resonance imaging Science 1995 ; 268(5212) : 889-893
[4] Qiu A, Rosenau BJ, Greenberg AS, et al. Estimating linear cortical magnification in human primary visual cortex via dynamic programming Neuroimage 2006 ; 31(1) : 125-138
[5] Tootell RB, Mendola JD, Hadjikhani NK, et al. Functional analysis of V3A and related areas in human visual cortex J Neurosci Off J Soc Neurosci 1997 ; 17(18) : 7060-7078
[6] Kolster H, Peeters R, Orban GA The retinotopic organization of the human middle temporal area MT/V5 and its cortical neighbors J Neurosci Off J Soc Neurosci 2010 ; 30(29) : 9801-9820
[7] Lebranchu P, Bastin J, Pelegrini-Issac M, et al. Retinotopic coding of extraretinal pursuit signals in early visual cortex Cereb Cortex N Y N 1991 2010 ; 20(9) : 2172-2187
[8] Wade A, Augath M, Logothetis N, Wandell B fMRI measurements of color in macaque and human J Vis 2008 ; 8(10) : 6.1-619
[9] Larsson J, Heeger DJ. Two retinotopic visual areas in human lateral occipital cortex. J Neurosci Off J Soc Neurosci 200; 26(51): 13128-42.
[10] Atkinson AP, Adolphs R The neuropsychology of face perception: beyond simple dissociations and functional selectivity Philos Trans R Soc Lond B Biol Sci 2011 ; 366(1571) : 1726-1738
[11] Bernstein M, Yovel G Two neural pathways of face processing: A critical evaluation of current models Neurosci Biobehav Rev 2015 ; 55 : 536-546
[12] Ben-Shachar M, Dougherty RF, Deutsch GK, Wandell BA Differential sensitivity to words and shapes in ventral occipito-temporal cortex Cereb Cortex N Y N 1991 2007 ; 17(7) : 1604-1611
[13] Posner MI, Petersen SE The attention system of the human brain Annu Rev Neurosci 1990 ; 13 : 25-42
[14] Tootell RB, Hadjikhani N, Hall EK, et al. The retinotopy of visual spatial attention Neuron 1998 ; 21(6) : 1409-1422
[15] Eriksen CW, St James JD Visual attention within and around the field of focal attention: a zoom lens model Percept Psychophys 1986 ; 40(4) : 225-240
[16] Müller NG, Bartelt OA, Donner TH, et al. A physiological correlate of the “Zoom Lens” of visual attention J Neurosci Off J Soc Neurosci 2003 ; 23(9) : 3561-3565
[17] Castiello U, Umiltà C Size of the attentional focus and efficiency of processing Acta Psychol (Amst) 1990 ; 73(3) : 195-209
[18] Slotnick SD, Schwarzbach J, Yantis S Attentional inhibition of visual processing in human striate and extrastriate cortex Neuro-Image 2003 ; 19(4) : 1602-1611
[19] Müller NG, Mollenhauer M, Rosier A, Kleinschmidt A The attentional field has a Mexican hat distribution Vision Res 2005 ; 45(9) : 1129-1137
[20] Rizzolatti G, Riggio L, Dascola I, Umilta C Reorienting attention across the horizontal and vertical meridians: evidence in favor of a premotor theory of attention Neuropsychologia 1987 ; 25(1A) : 31-40
[21] Lang W, Petit L, Höllinger P, et al. A positron emission tomography study of oculomotor imagery Neuroreport 1994 ; 5(8) : 921-924
[22] Beauchamp MS, Petit L, Ellmore TM, et al. A parametric fMRI study of overt and covert shifts of visuospatial attention Neuro-Image 2001 ; 14(2) : 310-321
[23] Corbetta M, Shulman GL Control of goal-directed and stimulusdriven attention in the brain Nat Rev Neurosci 2002 ; 3(3) : 201-215
[24] Corbetta M, Shulman GL Spatial neglect and attention networks Annu Rev Neurosci 2011 ; 34 : 569-599
[25] Nobre AC, Gitelman DR, Dias EC, Mesulam MM Covert visual spatial orienting and saccades: overlapping neural systems Neuro-Image 2000 ; 11(3) : 210-216
[26] Ohlendorf S, Kimmig H, Glauche V, Haller S Gaze pursuit, “attention pursuit” and their effects on cortical activations Eur J Neurosci 2007 ; 26(7) : 2096-2108
[27] Hubel DH, Wiesel TN Anatomical demonstration of columns in the monkey striate cortex Nature 1969 ; 221(5182) : 747-750
[28] Bock AS, Binda P, Benson NC, et al. Resting-state retinotopic organization in the absence of retinal input and visual experience J Neurosci Off J Soc Neurosci 2015 ; 35(36) : 12366-12382
[29] Striem-Amit E, Ovadia-Caro S, Caramazza A, et al. Functional connectivity of visual cortex in the blind follows retinotopic organization principles Brain J Neurol 2015 ; 138(Pt 6) : 1679-1695
[30] Tomaiuolo F, Campana S, Collins DL, et al. Morphometric changes of the corpus callosum in congenital blindness PloS One 2014 ; 9(9) : e107871
[31] Collignon O, Dormal G, Albouy G, et al. Impact of blindness onset on the functional organization and the connectivity of the occipital cortex Brain J Neurol 2013 ; 136(Pt 9) : 2769-2783
[32] Coullon GSL, Jiang F, Fine I, et al. Subcortical functional reorganization due to early blindness J Neurophysiol 2015 ; 113(7) : 2889-2899
[33] Ogawa S, Takemura H, Horiguchi H, et al. White matter consequences of retinal receptor and ganglion cell damage Invest Ophthalmol Vis Sci 2014 ; 55(10) : 6976-6986
[34] Ashtari M, Zhang H, Cook PA, et al. Plasticity of the human visual system after retinal gene therapy in patients with Leber’s congenital amaurosis Sci Transl Med 2015 ; 7(296) : 296ra110
C. Lamirel
Les « neurones miroirs » (NM) ont été découverts par accident en 1992 et ont reçu leur nom en 1996 [1, 2]. Ils ont très vite suscité une grande attention de la part de la communauté scientifique et aussi des médias : ce sont « les cellules qui lisent l’esprit », « les neurones qui ont formé la civilisation » [3]. Ces neurones pourraient être la base neuronale du comportement social des primates. Ils participeraient à la compréhension de l’action des autres, à l’apprentissage par l’imitation, à la théorie de l’esprit, à l’empathie, voire à la communication par des gestes et par la parole. Pourquoi parler de tels neurones dans un rapport sur la déficience visuelle ? C’est que leur propriété principale est de répondre de la même manière (en miroir) à la réalisation motrice d’une action et à la vision de la même action réalisée par un autre : il s’agit donc de neurones visuomoteurs.
Les NM ont été découverts par enregistrement cellulaire dans le cortex prémoteur des singes [1, 2] (Fig. 2-22). Chez l’homme, l’existence des NM repose sur un ensemble de preuves indirectes utilisant les techniques de neuro-imagerie et de stimulation magnétique transcrânienne [3, 4, 5]. Une seule étude utilisant des techniques d’enregistrement cellulaire chez l’homme permet d’apporter des preuves directes de la présence de NM chez l’homme [6].
Les NM ne répondent pas à un mouvement mais à l’observation ou à la réalisation d’une action dirigée vers un objet ou un but. La vision de l’objet seul ou de l’action mimée sans objet n’active pas les NM. La réponse des NM est indépendante de l’objet ou de la taille de l’objet, pourvu que l’action qui en résulte soit la même : la préhension à pleine main d’un objet en bois ou de nourriture activera de la même manière un NM. Sa réponse est également indépendante du point de vue de l’observateur. Toutes ces propriétés font supposer que c’est l’idée générale d’une « action vers un objet ou vers un but » qui active la réponse du NM, et non la vision d’un mouvement ou d’un enchaînement de stimuli visuels.
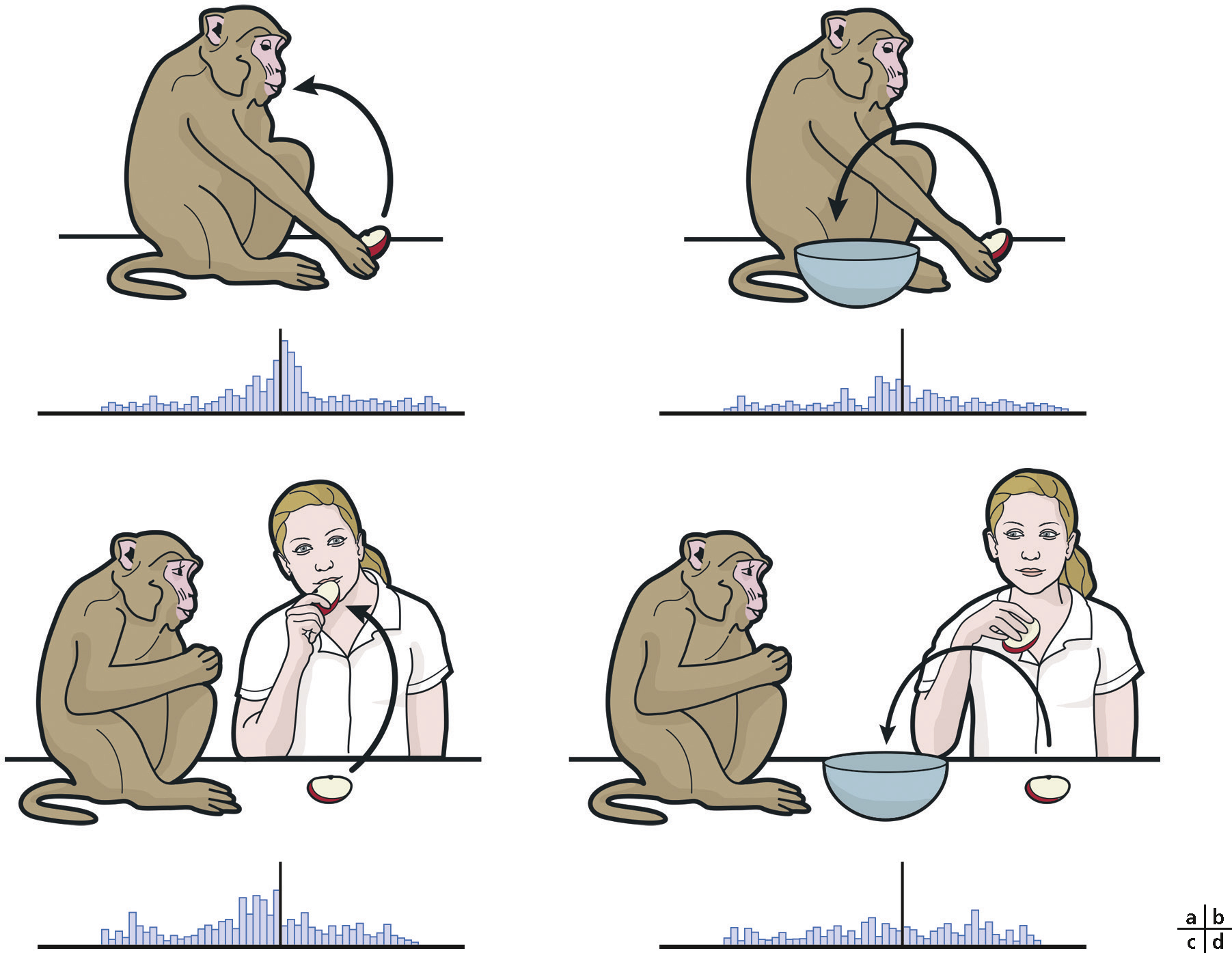
Le graphique en bas de chaque figure montre le nombre de décharges du neurone au cours du temps. a. Le singe saisit un quartier de pomme pour le manger. L’enregistrement du neurone montre une augmentation du nombre de décharges pendant la réalisation de l’action. b. Ce même neurone ne répond pas lorsque le singe place un quartier de pomme dans un bol. La réponse de ce neurone est donc spécifique de l’action de saisir un aliment pour le manger. c. Le même neurone répond quand il voit la femme prendre le quartier de pomme pour le manger, alors que le singe est immobile : ’est la réponse miroir. d. Ce neurone ne répondra pas à la vision de la femme déposant le quartier de pomme dans le bol. La réponse miroir est elle aussi spécifique d’une action.
Avant la découverte des NM, la reconnaissance et la compréhension de l’action des autres étaient considérées comme un processus purement visuel reposant sur un réseau hiérarchique d’aires visuelles permettant l’extraction d’informations visuelles de plus en plus complexes. Ces informations visuelles étaient ensuite comparées à un répertoire de représentations visuelles analogues acquises par l’expérience et stockées dans la mémoire de l’individu.
La découverte des NM, au contraire, montre un couplage direct du système visuel de perception de l’action et du système moteur de réalisation de l’action. L’habileté des primates à reconnaître et comprendre l’action de leurs congénères serait la conséquence de cette capacité de mettre en correspondance la représentation visuelle d’une action effectuée par un autre et une représentation interne motrice de la même action effectuée par soi-même. Chaque fois qu’un individu observe une action faite par un autre, des neurones codant pour la même action s’activent dans son cortex prémoteur. Cela induit automatiquement une représentation motrice qui est habituellement générée pendant la réalisation de cette action et dont le résultat est connu de l’individu. C’est ainsi que les NM transforment l’information visuelle en connaissance. La compréhension des interactions sociales du monde externe prend son sens par référence à des connaissances internes de ses propres actions. Ce système permet de reconnaître le but et le sens des actions des autres sans être perturbé par la richesse et la diversité de la scène visuelle et en utilisant l’expérience motrice acquise de ses actions passées et de leurs conséquences. Ce système de couplage direct entre perception et action faciliterait l’apprentissage par l’imitation, la compréhension des états mentaux des autres, appelée « théorie de l’esprit », l’empathie et la communication gestuelle. En effet, le système des NM est un mécanisme neuronal de base qui met directement en relation celui qui réalise une action et celui qui l’observe sans aucun autre processus de médiation tel qu’un langage ou un code appris. De manière extrêmement simplifiée : « on reconnaît l’action des autres parce qu’on la rejoue dans notre cortex prémoteur ».
Certains chercheurs ont vu dans le système des NM un processus génétique et déterministe des propriétés visuomotrices en miroir de ces neurones. Ce mécanisme aurait été ensuite « favorisé » par la sélection naturelle grâce aux avantages induits dans la vie sociale des primates.
Si c’est le cas, est-ce que la compréhension des actions des autres est perturbée en cas de déficience visuelle ?
Plusieurs études montrent que ce n’est pas le cas chez les malvoyants congénitaux. Le système des NM est un système capable d’adaptation, de plasticité neuronale. Il est possible par l’entraînement de modifier l’action observée qui provoque la réponse du NM, voire de le faire répondre pour une action opposée à sa réponse initiale. Ainsi, certains auteurs pensent que les propriétés visuomotrices des NM ne résultent pas d’un mécanisme génétique mais d’un apprentissage par association lors du développement des enfants [3]. Ces propriétés découleraient de la stimulation simultanée de neurones sensoriels et de neurones moteurs codant pour des actions similaires; par exemple, lorsqu’un adulte imite un bébé, lorsqu’un enfant se regarde dans un miroir, ou lorsqu’il regarde d’autres enfants réalisant les mêmes actions au cours d’un sport ou de la danse (Fig. 2-23) [3]. Chez le malvoyant, une autre modalité sensorielle pourrait remplacer la vision, comme les sons émis lors d’une action ou la description verbale de cette action [7]. Les déficients visuels activent les mêmes réseaux neuronaux que les voyants lorsqu’ils réalisent des tâches qui engagent les NM comme le jugement porté sur soi-même [8] ou l’attribution d’un état mental aux autres (théorie de l’esprit) [9].
Chez l’enfant voyant, l’acquisition de cette capacité d’attribuer un état mental aux autres proviendrait d’au moins trois sortes d’expériences lors du développement. La première est visuelle en observant les conséquences externes de l’état mental d’un autre sur son expression faciale, sur les mouvements des yeux, de sa tête et de son corps. Pour expliquer ces comportements, l’enfant va formuler des hypothèses sur l’état mental de l’autre. L’enfant va aussi apprendre en observant et en analysant ses propres états mentaux et leurs conséquences sur son comportement. En comparant la similarité des réactions des autres par rapport à ses propres réactions dans certaines circonstances, l’enfant va pouvoir inférer à un autre un état mental qu’il a éprouvé lui-même. Enfin, l’enfant va entendre d’autres personnes parler et décrire leur état mental, leurs émotions et formuler des hypothèses sur l’état d’esprit des autres. La malvoyance va perturber les deux premières sources d’expériences qui permettent à l’enfant d’inférer un état d’esprit aux autres : il ne pourra pas observer les conséquences physiques externes d’un état mental chez les autres, ni chez lui. Ces difficultés retardent l’apparition de cette capacité d’attribuer un état d’esprit aux autres chez les enfants malvoyants. Cependant, ces enfants vont au final acquérir cette capacité et ils vont utiliser des réseaux neuronaux similaires aux voyants pour ce faire. Il semble qu’entendre parler les autres de leurs états mentaux soit la source d’expérience la plus importante pour acquérir cette capacité à la fois chez les voyants et chez les malvoyants [9]. Ainsi, chez les enfants malentendants, l’acquisition de cette capacité est retardée chez les enfants dont les parents ne sont pas malentendants à cause des difficultés de communication. Au contraire, chez les enfants dont les parents sont eux aussi malentendants, il n’y a pas de retard dans l’acquisition de cette théorie de l’esprit, car parents et enfants vont pouvoir communiquer à propos de leurs états d’esprit.
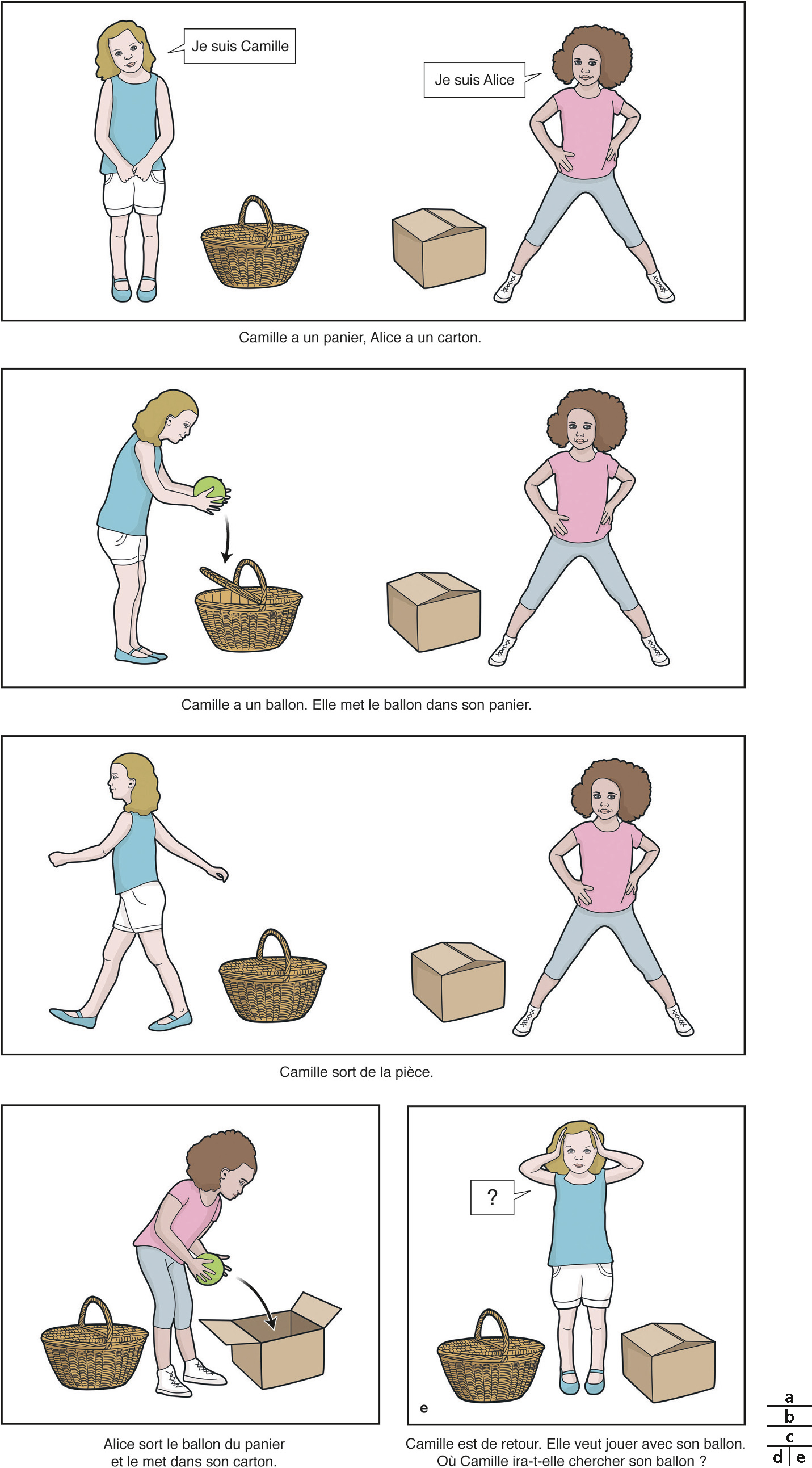
Cette capacité de raisonner sur l’état mental d’autres personnes est appelée « théorie de l’esprit » et elle ferait appel aux propriétés des neurones miroirs. Si l’on raconte cette histoire à un enfant de moins de 4 ans, il va répondre à la question posée par « dans le carton » car il ne peut pas attribuer à Camille une autre connaissance que la sienne et il sait que le ballon est dans le carton. Vers l’âge de 4 à 5 ans, un enfant comprendra que Camille ne peut pas savoir que le ballon a été déplacé en son absence et qu’elle va chercher le ballon « dans le panier ». Les enfants non voyants présentent un retard dans ce type de test de la théorie de l’esprit. Ce retard pourrait être lié directement à l’absence de vision où à la diminution des interactions de l’enfant non voyant avec son entourage. Par exemple, les enfants sourds présentent également un retard dans l’acquisition de ces capacités s’ils vivent dans une famille qui ne sait pas signer, mais ils n’ont pas de retard quand leurs parents utilisent la langue des signes.
Il est probable que le système des NM soit supramodal : il peut répondre à toute perception d’une action quelle que soit la modalité perceptive. Le message le plus important dans la découverte des NM est que la perception et l’action sont étroitement liées, au niveau neuronal, et dans les mécanismes cognitifs qui nous permettent de comprendre les actions des autres, et plus largement de vivre avec eux. Enrichir la perception d’un individu provient alors aussi de la richesse des actions, interactions et situations motrices vécues en utilisant l’audition et la verbalisation pour compenser la vision absente.
[1] Di Pellegrino G, Fadiga L, Fogassi L, et al. Understanding motor events: a neurophysiological study Exp Brain Res 1992 ; 91 : 176-180
[2] Gallese V, Fadiga L, Fogassi L, Rizzolatti G Action recognition in the premotor cortex Brain 1996 ; 119 : 593-609
[3] Cook R, Bird G, Catmur C, et al. Mirror neurons: from origin to function Behav Brain Sci 2014 ; 37 : 177-192
[4] Rizzolati G, Craighero L The mirror-neuron system Annu Rev Neurosci 2004 ; 27 : 169-192
[5] Casile A, Caggiano V, Ferrari PF The mirror neuron system: a fresh view Neuroscientist 2011 ; 17 : 524-538
[6] Mukamel R, Ekstrom AD, Kaplan J, et al. Single-neuron responses in humans during execution and observation of actions Curr Biol 2010 ; 20 : 750-756
[7] Ricciardi E, Bonino D, Sani L, et al. Do we really need vision? How blind people “see” the actions of others? J Neurosci 2009 ; 29 : 9719-9724
[8] Ma Y, Han S Neural representation of self-concept in sighted and congenitally blind adults Brain 2011 ; 134 : 235-246
[9] Bedny M, Pascual-Leone A, Saxe RR Growing up blind does not change the neural bases of Theory of Mind Proc Natl Acad Sci U S A 2009 ; 106 : 11312-11317