Évolution de la fonction visuelle au cours de la vie
F. Vital - Durand
Les examens échographiques peuvent montrer que le foetus se détourne de la lumière d’une lampe électrique approchée de l’abdomen de la mère dès 5,5 mois de grossesse. Il est photophobe et le restera des mois après la naissance. Cependant, sous faible éclairement, des réponses visuelles organisées peuvent être obtenues dès la naissance. La technique du regard préférentiel permet déjà de mesurer une acuité de 1/20. Cette acuité visuelle est basse mais est suffisante pour obtenir une réponse d’imitation au bout de quelques jours. Celle-ci est déclenchée par l’adulte qui tire la langue ou ouvre la bouche largement (fig. 3-1). Au bout de 8 jours, le nouveau-né reconnaît le visage de sa mère et le mémorise. Ces observations ont conduit à évaluer une large gamme des capacités précoces et à orienter la démarche de soins en cas d’anomalies.
La résolution spatiale est contrainte par trois facteurs d’importance très inégale : la croissance du globe, la transparence des milieux et la maturation des cônes. D’abord, la croissance du bulbe oculaire, passant de 16,5 mm environ à la naissance à 25,5 mm de diamètre à l’âge adulte, ne contribue que marginalement à l’augmentation de l’acuité visuelle mais participe à l’emmétropisation. Ensuite, la transparence incomplète des milieux intraoculaires joue un rôle mineur dans la résolution spatiale. En effet, la vascularisation foetale, encore présente à la naissance, disparaît rapidement de manière physiologique pour laisser des milieux transparents. Une persistance de trouble des milieux relève de situations pathologiques (cataracte congénitale, dystrophie cornéenne, hémorragie vitréenne, etc.). Enfin, le troisième facteur est le plus important : le développement de l’article externe des cônes et leur concentration dans la fovéa. La région fovéale est différenciée ophtalmoscopiquement à partir de 40 semaines d’aménorrhée. Cette zone d’environ 500 μm de diamètre restera avasculaire pour permettre le développement de la vision. Les photorécepteurs croissent progressivement pour atteindre la moitié de la valeur adulte à 15 mois et les deux tiers à 45 mois. Ces données sont corrélées à la résolution spatiale mesurée avec les cartes d’acuité qui suit la même progression [1]. L’acuité morphoscopique est obtenue plus tardivement et reste toujours inférieure à la résolution spatiale (fig. 3-2). Vers 5 ans, l’enfant atteint 10/10 morphoscopique et 12/10 vers 8 à 9 ans.

Fig. 3-1 Imitation néonatale.

Fig. 3-2 Les cartes d’acuité et la résolution spatiale au cours de la première année.
(Vital-Durand, 1992.)
À la naissance, la densité pigmentaire des mélanocytes est déjà visible dans l’iris dont la couleur dépend du patrimoine génétique. Sa teinte définitive sera connue vers 6 mois. Mais la couche pigmentaire est encore très pâle, presque transparente et, comme les axones des cellules ganglionnaires ne sont pas encore myélinisés, la papille est très peu réfringente. Ces éléments expliquent la photophobie du nourrisson.
Non, mais il ne fixe correctement que s’il est bien éveillé, c’est-à-dire quelques heures par jour. Des déviations sont donc observées de manière physiologique jusqu’à 4 mois de vie chez l’enfant né à terme. À 3 mois, cet élément s’estompe, mais la fixation binoculaire ne devient précise que vers 7 à 8 mois [2]. Évidemment, une déviation constante justifie une consultation. Le soupçon de strabisme convergent est souvent suscité par l’épicanthus, présent chez près d’un tiers des enfants. Il s’atténue avec la croissance du nez, mais c’est un motif fréquent de consultation en ophtalmopédiatrie, une motivation parentale justifiée pour une visite que l’orthoptiste devrait gérer aisément.
L’enfant naît hypermétrope de 2 dioptries. Compte tenu de la faible acuité, cela ne constitue pas une gêne fonctionnelle. Normalement, l’emmétropisation accompagne la croissance du bulbe oculaire pour se terminer vers 7 ans [3]. Cependant, on observe de 6 à 14 % d’hypermétropies excessives (≥ 3 dioptries) et un peu moins de 1 % de myopies (≥ 1 dioptrie). Ces amétropies ne donnent pas de signes avant des années. Les amétropies fortes peuvent être responsables de strabismes ou d’amblyopie, ce qui justifie un examen systématique de la réfraction lors des consultations, en cas de facteurs de risque (prématurité, faible poids de naissance, antécédents familiaux d’amétropie ou strabisme, troubles neurologiques, craniosténoses, etc.).
Comme l’acuité du nourrisson est faible, restreinte par la distance qui sépare les cônes fovéaux, l’accommodation n’est jamais un facteur limitant de l’acuité visuelle. La preuve en est que les valeurs d’acuité angulaire mesurées restent les mêmes que le stimulus soit présenté à 30 cm de distance ou à 6 mètres [4]. On peut montrer que, dès 2 mois, les nourrissons sont capables d’épisodes d’accommodation parfaite mais labile et inconstante. Si, dans les meilleures conditions, l’enfant peut manifester une accommodation de type adulte vers 4 mois, c’est seulement vers la fin de la première année que l’accommodation est précise et constante [3]. Si le nourrisson peut percevoir des objets éloignés, il manifeste une préférence forte pour les stimuli suffisamment saillants situés dans son espace de préhension. Vers 3 ans, la puissance accommodative atteint plusieurs dizaines de dioptries et commence à décroître avant même l’adolescence.
La possibilité de percevoir une image en relief sur la base de la disparité des deux images rétiniennes a été étudiée avec trois méthodes en parallèle : le regard préférentiel, la poursuite de randots (random dot stereograms ou stéréogrammes de points aléatoires) et les potentiels évoqués. Les résultats indiquent que le nombre d’enfants indemnes de pathologies capables de percevoir l’image en relief augmente significativement autour du 4e mois pour atteindre 100 % vers le 7e mois [5, 6]. Après son apparition vers le 4e mois, la stéréoscopie atteint rapidement les valeurs adultes au cours de la première année.
L’oculomotricité évolue avec la fovéation et se décompose en fixation, saccades, poursuite lisse, vergence et nystagmus optocinétique.
La fixation est obtenue à la naissance si le nouveau-né est placé en éclairement mésopique bas. L’instabilité précoce de la fixation est probablement la conséquence du faible niveau d’acuité centrale car elle se stabilise au cours des premières semaines pour devenir stable, précise et soutenue vers le 2e mois.
Des éléments de saccades peuvent être obtenus dès la naissance en réponse à un déplacement lent du stimulus [7]. Les enregistrements sont réalisés par une technique de réflexion d’un signal infrarouge sur le limbe de l’iris. Cette technique montre un développement rapide de la précision des saccades [8], qui deviennent comparables à celles de l’adulte entre 4 et 7 mois dans les meilleurs des cas [9]. Le nombre de saccades réalisées pour effectuer un déplacement de grande amplitude se réduit progressivement. L’accélération, la précision et la vitesse des saccades augmentent jusque vers 7 à 10 ans et, inversement, leur latence diminue [10].
Cette capacité de déplacer le regard de façon continue, sans rattrapage saccadique, requiert la maturation du cortex pariétal et la vision binoculaire [11]. Elle reste donc défectueuse chez l’enfant atteint d’un strabisme précoce. Des éléments de poursuite lisse sont observables à quelques semaines, mais une poursuite soutenue n’est observée que vers le 5e mois, et constitue un bon indice de maturation de la fonction binoculaire et de la maturation corticale.
La vergence accommodative est obtenue vers 2 mois [12] et la vergence fusionnelle vers 4 mois [2].
Le nystagmus optocinétique est une réponse oculomotrice alternant poursuite du stimulus et retour saccadique déclenchée par le déplacement continu de la scène. Il est mesuré en utilisant un réseau ou une constellation de motifs contrastés. En condition binoculaire, le nystagmus est observé dès les premières semaines, pourvu que la vélocité soit adaptée, inférieure à 10 degrés par seconde. C’est un test intéressant de la sensibilité au mouvement dans les cas de suspicion de malvoyance.
En condition monoculaire, seule la réponse au stimulus se déplaçant dans la direction temporonasale est présente dès la naissance. La réponse à la direction nasotemporale apparaît vers le 4e mois [13, 14] et devient symétrique à la réponse temporonasale au-delà d’un an. La persistance d’une réponse asymétrique est un indice de strabisme précoce (fig. 3-3).
Le champ visuel est mesuré par confrontation. Un observateur attire l’attention du nourrisson sur son visage et un aide introduit très lentement la cible à partir du dos de l’enfant. L’observateur évalue l’angle à partir duquel la cible déclenche la capture visuelle [15]. Le champ visuel du bébé de 2 ou 3 mois est très petit, mais il s’élargit très vite, de sorte qu’à un an le champ visuel est presque complet (fig. 3-4).
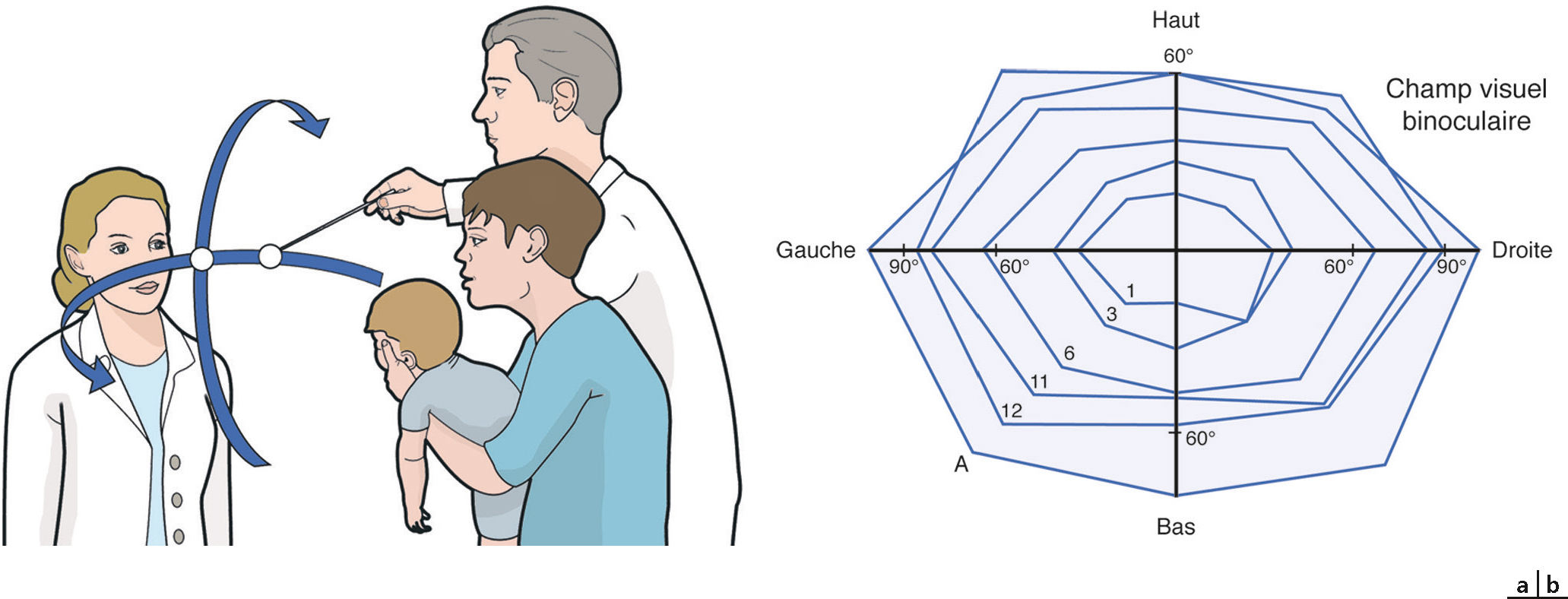
Fig. 3-4 a, b. Le champ visuel du nourrisson de 1 mois à l’âge adulte.
La sensibilité chromatique peut être étudiée à l’aide de potentiels évoqués ou par la méthode du regard préférentiel. Elle dépend de la maturation des trois types de cônes L, M, S, abusivement dénommés respectivement rouge, vert et bleu. Les potentiels évoqués révèlent une réponse spécifique des cônes S sensibles aux courtes longueurs d’onde dès la fin du 2e mois. Cette réponse est bientôt suivie de celle des deux autres types de cônes, L et M.
La méthode du regard préférentiel utilise un stimulus constitué de deux zones carrées de même luminance moyenne dont les éléments varient en luminance de façon aléatoire autour d’une valeur moyenne. L’enfant préfère regarder le stimulus comportant une composante chromatique dès le 3e mois sans préférence pour un des axes protan, deutan et tritan du triangle des couleurs de la CIE (Commission internationale de l’éclairage) [16].
Mais il n’est pas certain que les enfants utilisent leurs capacités de vision chromatique avant l’âge de 6 ou 7 mois.
La sensibilité adulte n’est pas atteinte avant l’adolescence.
La sensibilité au mouvement est relativement indépendante de l’acuité visuelle et joue un rôle dans le contrôle de la station debout et la marche.
Le nouveau-né suit des yeux et de la tête une cible bien visible déplacée très lentement dans la gamme 2 à 5 degrés/seconde (fig. 3-5). La gamme de sensibilité s’élargit progressivement aussi bien vers les vélocités inférieures que supérieures. Vers 6 mois, la sensibilité est maximale vers 15 degrés par seconde (deg/s) et atteindra 100 deg/s vers 5 ans [11]. L’adulte suit des yeux jusque vers 400 deg/s et, après entraînement, peut atteindre 700 deg/s.
La sensibilité au contraste a été étudiée par la méthode des potentiels évoqués visuels et confirmée par la technique du regard préférentiel [13]. L’enfant de 5 semaines ne perçoit pas les contrastes inférieurs à 20 %. Cette sensibilité s’améliore rapidement au cours des premières années et atteint le niveau adulte, soit 0,4 %, après 7 ans [17]. La faible sensibilité au contraste ne constitue pas une limitation fonctionnelle significative chez l’enfant car il n’est pas amené à discriminer des objets très pâles.

Fig. 3-5 Le damier et l’oeil- de- boeuf utilisés pour évaluer la sensibilité au mouvement.
C’est au cours de la première année que se mettent en place la plupart des composantes de la fonction visuelle. Cette maturation se manifeste par l’apparition du sourire social, une étape fondamentale au 2e mois, le raffinement de la fixation et de l’exploration oculaire, presque adultes vers 7 mois, la conquête du monde extérieur au 4e mois avec la maîtrise visuelle de la préhension. À la fin de la première année, la participation visuelle au contrôle postural va permettre la marche ; d’où l’importance de surveiller le bon développement de ces composantes pour pallier les déficits éventuels (encadré 3-11).
- Nouveau- né
-
Examen sous faible éclairement
Capacité d’imitation
Acuité 1/20
Nystagmus optocinétique binoculaire
- 8 jours
-
Reconnaissance du visage de la mère
- 2 mois
-
Fixation stable
Vergence accommodative
Sourire social
Nystagmus optocinétique monoculaire temporonasal
- 4 mois
-
Vergence fusionnelle
Nystagmus optocinétique monoculaire nasotemporal
Maîtrise visuelle de la préhension
- 5 mois
-
Capacité de poursuite lisse soutenue
- 6 mois
-
Acuité 2/10
- 7 mois
-
Vérification de la perception du relief
Raffinement de la fixation et de l’exploration oculaires
- 1 an
-
Champ visuel complet
Acuité 4/10
Participation visuelle au contrôle postural
- Adolescence
-
Fin du développement de l’acuité, de la sensibilité au contraste et du sens chromatique
[1] Vital-Durand F Acuity card procedures and the linearity of grating resolution development during the first year of human infants Behav Brain Res 1992 ; 49(1) : 99-106
[2] Slater AM, Findlay JM Binocular fixation in the newborn baby J Exp Child Psychol 1975 ; 20(2) : 248-273
[3] HHowland HC Early refractive development Early visual development. Normal and abnormal New York: Oxford University Press (1993). 5-13
[4] Cornell EH, McDonnell PM Infants’ acuity at twenty feet Invest Ophthalmol Vis Sci 1986 ; 27(9) : 1417-1420
[5] Held R, Birch E, Gwiazda J Stereoacuity of human infants Proc Natl Acad Sci U S A 1980 ; 77(9) : 5572-5574
[6] Teller DY Scotopic vision, color vision, and stereopsis in infants Curr Eye Res 1982-1983 ; 2(3) : 199-210Review.
[7] Buquet C, Desmidt A, Charlier J, Querleu D [Evaluation of spatial discrimination performances of newborn infants with the visual pursuit of structured stimuli] C R Acad Sci III 1992 ; 314(3) : 133-140
[8] Hainline L, Riddell PM Binocular alignment and vergence in early infancy Vision Res 1995 ; 35(23-24) : 3229-3236
[9] Harris CM, Jacobs M, Shawkat F, et al. The development of saccadic accuracy in the first seven months Clin Vis Sci 1993 ; 8 : 85-96
[10] Yang Q, Bucci MP, Kapoula Z. The latency of saccades, vergence, and combined eye movements in children and in adults. Invest Ophthalmol Vis Sci 2002 ; 43(9) : 2939-49.
[11] Wattam- Bell JRB. Development of visual motion processing. In : Vital- Durand F, Atkinson J, Braddick OJ (Eds). Infant vision. Oxford : Oxford University Press ; 1996. p. 79-94.
[12] Fox R, Aslin RN, Shea SL, Dumais ST. Stereopsis in human infants. Science 1980 ; 207(4428) : 323-4.
[13] Atkinson J, Braddick O, Moar K. Contrast sensitivity of the human infant for moving and static patterns. Vision Res 1977 ; 17(9) : 1045‑47.
[14] Naegele JR, Held R. The postnatal development of monocular optokinetic nystagmus in infants. Vision Res 1982 ; 22(3) : 341‑6.
[15] Mohn G, Van Hof-Van Duin J. Development of the binocular and monocular visual fields in infants during the first year of life. Clin Vis Sci 1986 ; 1 : 51‑64.
[16] Knoblauch K, Vital-Durand F, Barbur JL. Variation of chromatic sensitivity across the life span. Vision Res 2001 ; 41(1) : 23‑36.
[17] Ellemberg D, Lewis TL, Liu CH, Maurer D. Development of spatial and temporal vision during childhood. Vision Res 1999 ; 39(14) : 2325‑33.
[18] Les anomalies de la vision chez l’enfant et l’adolescent Cachan: Lavoisier (2014).
1. Je remercie le Dr Sophie Boucher pour la relecture efficace de cette contribution.
2. La grande époque de l’exploration de la vision du nourrisson et de l’enfant s’est épuisée à la fin des années 1980 au profit du développement cognitif, ce qui explique cette bibliographie. Le
K. Lagrené, A. Arleo
Le vieillissement naturel affecte progressivement tous les niveaux du traitement visuel : de l’optique de l’oeil aux processus rétiniens de transduction du signal lumineux en activité neuronale, jusqu’aux différentes étapes du traitement perceptif réalisées par les aires visuelles sous-corticales et corticales [1]. Depuis 25 ans, la recherche sur le vieillissement visuel s’est intensifiée afin de mieux comprendre les mécanismes physiologiques et pathogéniques sous-tendant les altérations des fonctions visuelles. Ces études ont également permis de mieux identifier (et départager) les facteurs optiques et neurosensoriels à l’origine de ces altérations [2].
Les propriétés optiques de l’oeil changent au cours du vieillissement, engendrant une réduction de l’illumination rétinienne (due à l’augmentation de la densité du cristallin et au myosis pupillaire), une augmentation de la diffusion de la lumière intraoculaire et une augmentation des aberrations optiques. Il a été montré que les changements au niveau des caractéristiques optiques de l’oeil contribuent significativement aux altérations de certaines fonctions visuelles avec l’âge (par exemple perte de sensibilité au contraste) [1]. Toutefois, de nombreuses études ont mis en évidence le rôle fondamental des modifications des facteurs neurosensoriels dans le processus de vieillissement des fonctions visuelles [2].
Au niveau rétinien, le nombre de photorécepteurs, essentiellement les bâtonnets, et celui des cellules ganglionnaires diminuent avec l’âge, majoritairement dans la région maculaire (fig. 3-6) [3]. Les propriétés spatiales et temporelles des photorécepteurs et des cellules ganglionnaires changent [2] (par exemple la taille des champs récepteurs des cellules ganglionnaires augmente). Le couple épithélium pigmentaire (EP) et membrane de Bruch change également. En particulier, l’accumulation de lipofuscine semble jouer un rôle dans le dysfonctionnement de l’EP et conduire à la perte des photorécepteurs [5]. Au niveau des aires corticales, si les mécanismes de neurogenèse permettent de maintenir le nombre de neurones tout au long de la vie [6], les propriétés des circuits neuronaux changent avec l’âge : le nombre de connexions synaptiques a tendance à décroître [7] ; la distribution spatiale des neurones corticaux et la structure des arbres dendritiques sont modifiées [8] ; la démyélinisation réduit la vitesse des connexions à longue portée [9] (la latence des réponses neuronales des aires visuelles V1, V2, etc. augmente avec l’âge [10]). Enfin, au niveau des propriétés électriques des neurones, seul le mécanisme d’après-hyperpolarisation, lié à la concentration de Ca2+ [11], semble être affecté par le vieillissement. Cette concentration joue un rôle important dans les processus de plasticité synaptique, eux aussi affectés par l’âge.
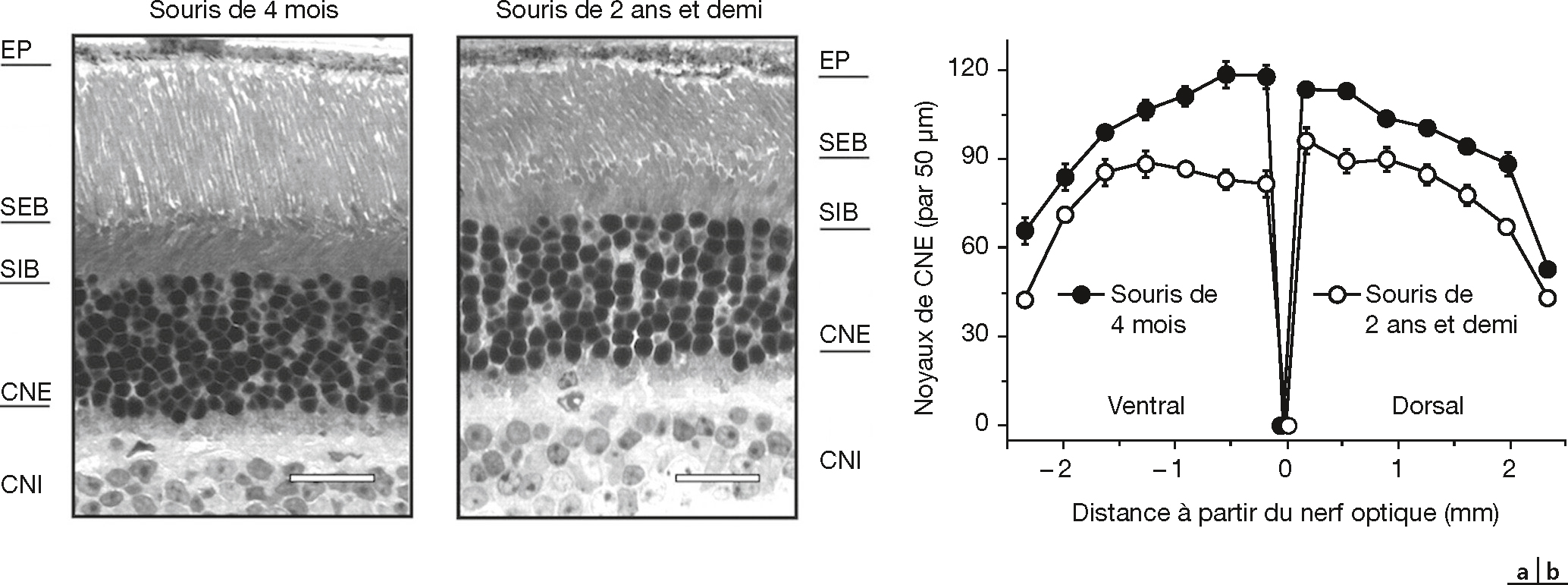
Fig. 3-6 Diminution du nombre de photorécepteurs (bâtonnets) avec l’âge.
Analyse de la morphologie rétinienne et de la densité des noyaux des photorécepteurs chez des souris âgées de 4 mois et de 2,5 ans. a. Micrographie en lumière d’une section de rétine (région dorsale à 0,18 mm de la tête du nerf optique). EP : épithélium pigmentaire ; SEB : segment externe des bâtonnets ; SIB : segment interne des bâtonnets ; CNE : couche nucléaire externe ; CNI : couche nucléaire interne. Échelle = 20 μm. b. Densité des noyaux des photorécepteurs en 14 différents emplacements couvrant toute la rétine. Les données sont exprimées en moyenne ± l’écart type de la moyenne (par emplacement). Toutes les p-values sont < 0,001.
(D’après [4].)
L’acuité visuelle (AV) est la capacité de discriminer les détails fins d’un objet à 100 % de contraste. Stable jusqu’à environ 43 ans, l’AV diminue d’environ 0,3 LogMAR de 44 à 80 ans [12]. Cette diminution, non linéaire, s’accentue après 70 ans (fig. 3-7) [13]. En moyenne, jusqu’à 82 à 88 ans, les sujets âgés maintiennent une AV supérieure ou égale à 0,3 LogMAR. Toutefois, les études diffèrent dans la méthodologie et les modèles utilisés. Les facteurs optiques n’expliquent qu’en partie la perte d’AV avec l’âge. Celleci pourrait également être due à des changements rétiniens et cérébraux [12].
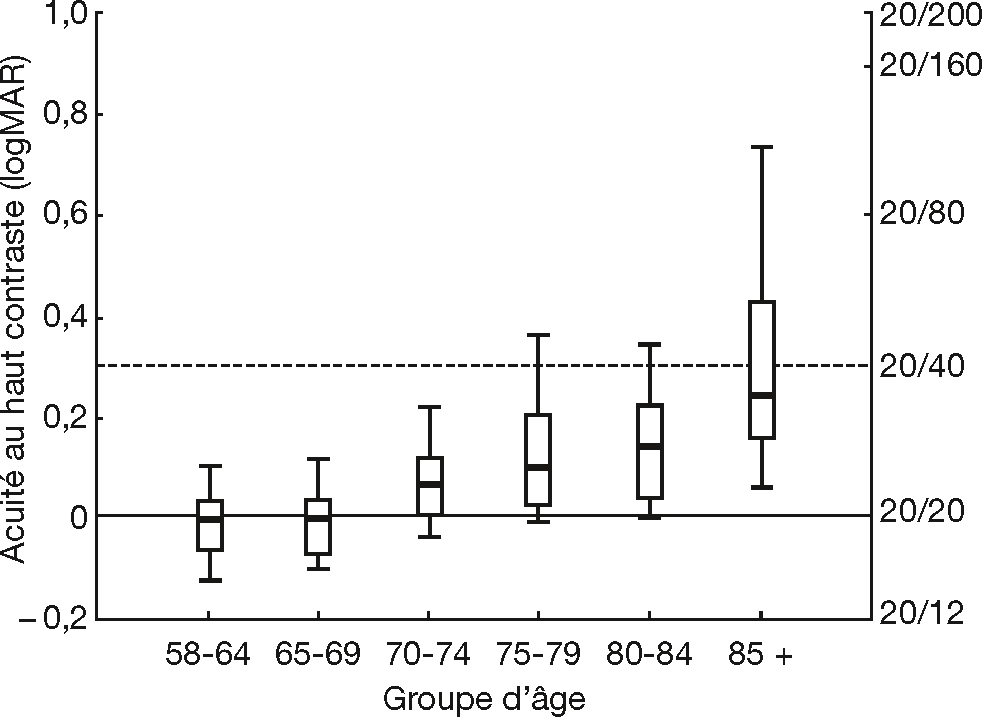
Fig. 3-7 Diminution de l’acuité visuelle (AV) avec l’âge.
Meilleure AV corrigée mesurée en binoculaire à 100 % de contraste. Les axes des ordonnées sont exprimés en LogMAR à gauche et en équivalent Snellen à droite. L’AV a été mesurée avec l’équipement optique habituel de chaque participant. Les participants ont été regroupés en fonction de leur âge en 6 groupes (axe des abscisses). Pour chaque groupe sont représentés la moyenne (trait plein), les 25e et 75e percentiles (boîte), et les 10e et 90e percentiles (trait fins). La ligne continue horizontale correspond à une AV considérée comme normale (20/20 ou 0,0 LogMAR) et la ligne en pointillée correspond à une AV divisée par un facteur 2 (20/40 ou 0,3 LogMAR).
(D’après [13].)
La sensibilité au contraste est un élément fondamental de la vision des motifs et fait référence à la capacité de discriminer des variations de luminance dans une image.
Le vieillissement induit une perte de sensibilité spatiale au contraste en condition photopique, plus particulièrement pour les hautes fréquences spatiales (jusqu’à 16 cycles/degré) (fig. 3-8) [14]. La sensibilité aux basses fréquences spatiales (inférieures à 2 cycles/degré) n’est pas affectée pour des stimuli présentés à basses fréquences temporelles [2], mais est réduite lors de modulations temporelles rapides [1]. La différence entre le seuil de sensibilité au contraste chez les sujets jeunes (20 ans) et les sujets âgés (70 ans) varie de 0,2 à 0,57 unité logarithmique (à environ 8 cycles/degré). La différence entre les études pourrait s’expliquer par la grande variabilité dans les critères d’inclusion des sujets [1]. La contribution optique (par exemple la présence de cataracte) serait prépondérante dans la perte de sensibilité au contraste en condition photopique. Des études suggèrent toutefois que les altérations neurales, telles que la perte de densité des cellules ganglionnaires [3] et les changements des propriétés des neurones du cortex visuel [10], jouent un rôle, en particulier aux hautes fréquences spatiales [1].
La perte de sensibilité au contraste se majore en conditions mésopique ou scotopique et celle-ci est plus sévère à basses fréquences spatiales (fig. 3-9) [15]. Le déficit chez le sujet âgé est trois fois supérieur à celui d’un sujet jeune. Dans ces conditions, l’impact des facteurs neurosensoriels semble être prédominant. Des études suggèrent que les modifications liées à l’âge au niveau du traitement réalisé au sein de la rétine [3] ne permettent pas d’expliquer la perte de sensibilité [1], et suggèrent que cette perte pourrait être due à des modifications synaptiques aux différents niveaux de la voie visuelle [15]. Les mécanismes rétiniens et corticaux restent à élucider pour déterminer si la perte de sensibilité pourrait être réversible.
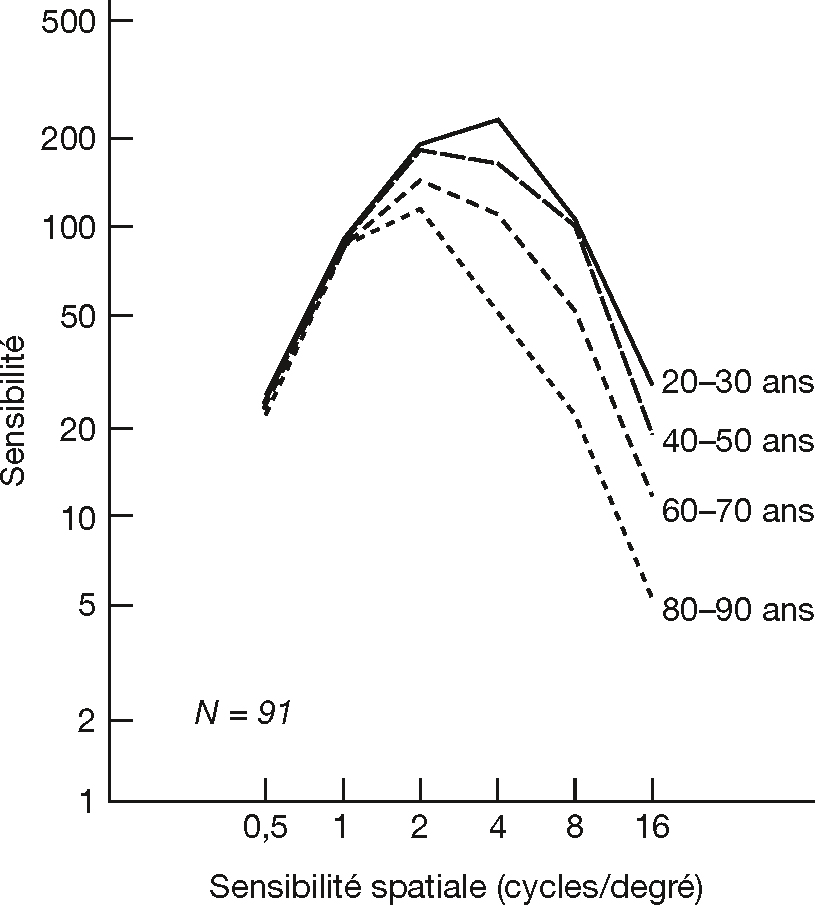
Fig. 3-8 Perte de sensibilité spatiale au contraste en condition photopique en fonction de l’âge.
Sensibilité au contraste en fonction de la fréquence spatiale (en cycles/degré) pour différents groupes d’âge.
(D’après [14].)
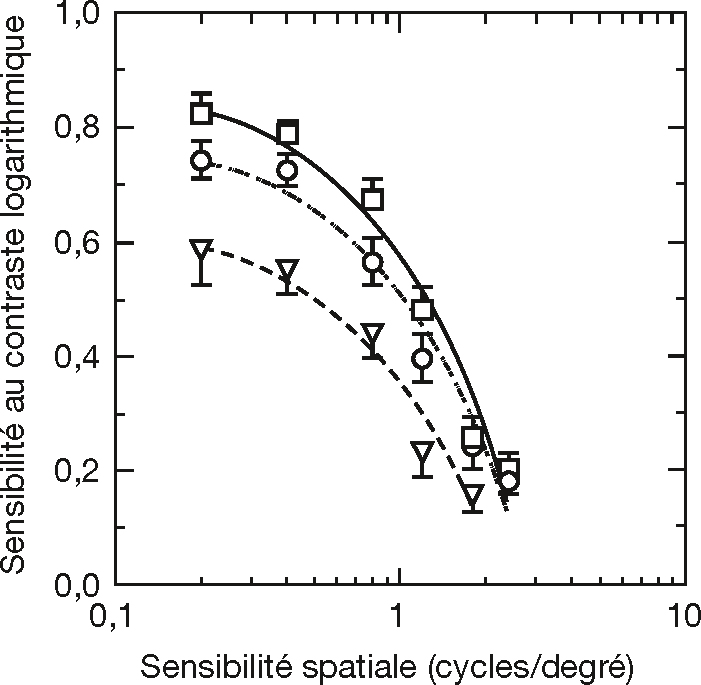
Fig. 3-9 Perte de sensibilité spatiale au contraste en condition scotopique en fonction de l’âge.
Moyenne de la sensibilité spatiale au contraste pour trois groupes d’âge. Les carrés correspondent au groupe de sujets dont l’âge est compris entre 20 et 40 ans, les cercles à celui dont l’âge est compris entre 41 et 60 ans, et les triangles à celui dont l’âge est compris entre 61 et 88 ans. La perte de sensibilité à basses fréquences spatiales avec l’âge est significative et ne peut être attribuée aux contributions optiques, suggérant une origine neurale.
(D’après [15].)
La sensibilité lumineuse en condition scotopique diminue avec l’âge, se traduisant par un allongement du temps d’adaptation à l’obscurité (fig. 3-10) [16]. La diminution du nombre de bâtonnets n’interviendrait pas dans l’allongement de la cinétique d’adaptation à l’obscurité [16]. Celui-ci pourrait s’expliquer par un allongement de la durée du cycle visuel et, en particulier, par un ralentissement de la dégradation de la rhodopsine [17] qui est étroitement lié au fonctionnement du complexe membrane de Bruch/EP. Les modifications liées à l’âge de ce complexe peuvent perturber les échanges métaboliques et conduire à une dispersion de la vitamine A [18]. Or, de récents travaux montrent que l’apport de vitamine A améliore la sensibilité de récupération à l’obscurité [19].
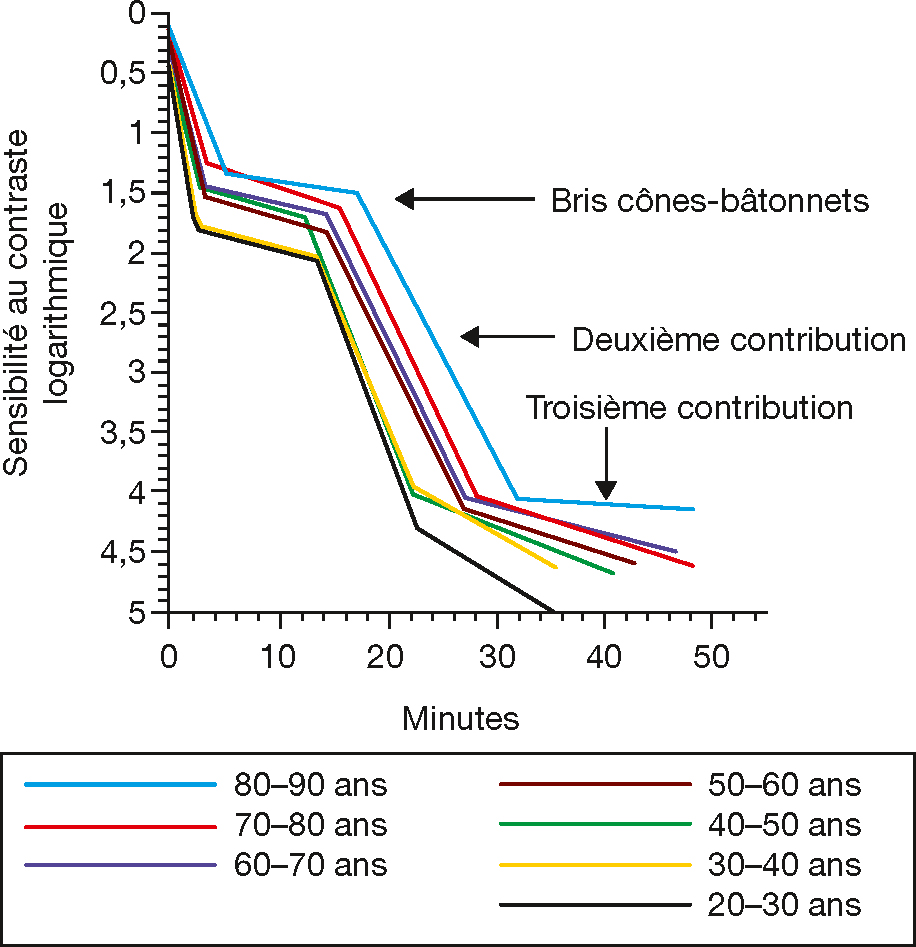
Fig. 3-10 Adaptation de la sensibilité à l’obscurité en fonction de l’âge.
Courbes d’adaptation à l’obscurité en fonction de l’âge. Les flèches indiquent le bris cônes-bâtonnets, la deuxième et la troisième contributions des bâtonnets à l’adaptation à l’obscurité. Les tracés sont décalés vers la droite avec l’âge, indiquant un ralentissement dans la cinétique d’adaptation à l’obscurité au cours du vieillissement.
(D’après [16].)
Le champ visuel (CV) présente avec l’âge un rétrécissement progressif concentrique des isoptères, plus marqué dans la région temporale que dans la région nasale (fig. 3-11) [20]. La sensibilité différentielle, stable jusqu’à 40 ans, décroît ensuite rapidement et l’apprésente une plus grande variabilité [21]. La sensibilité différentielle est réduite avec des cibles bleues et vertes par rapport aux cibles rouges ou blanches [22]. La perte de sensibilité avec l’âge s’explique en partie par des facteurs optiques, mais serait principalement liée à la perte des cellules ganglionnaires de la rétine. La relation entre la perte des cellules ganglionnaires et les déficits du CV a largement été étudiée dans le cas du glaucome [23]. La perte de sensibilité du CV affecte la mobilité et majore le risque de chute [24].
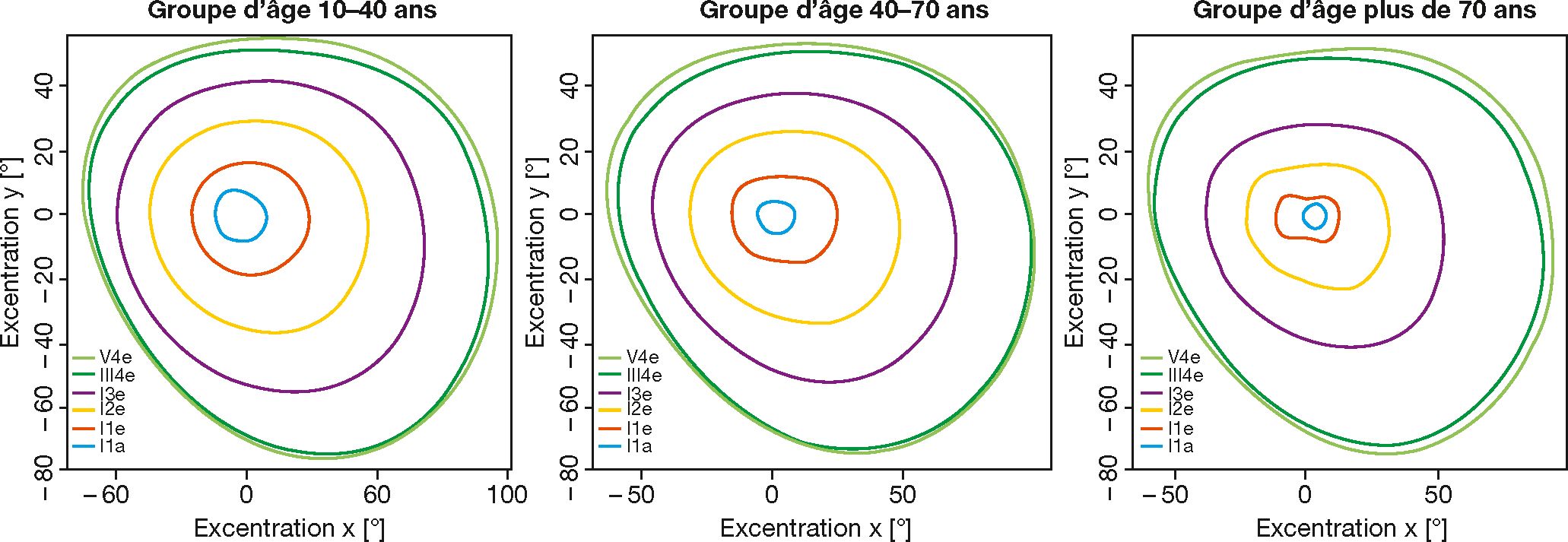
Fig. 3-11 Rétrécissement progressif concentrique des isoptères du champ visuel en fonction de l’âge.
Moyenne des isoptères obtenus au périmètre semi-automatique (Octopus® 900) pour trois groupes d’âge compris entre 10 à 40 ans, entre 40 et 70 et au-delà de 70 ans. Le rétrécissement lié à l’âge est négligeable pour les stimuli lumineux larges et intenses, mais peut aller jusqu’à 15° au I/3e et pour les stimuli plus fins et moins lumineux. (D’après [20].)
La perception du mouvement est perturbée chez les sujets âgés qui présentent une élévation des seuils de détection et de discrimination des directions et changements de vitesse de stimuli visuels (fig. 3-12) [25]. Ces déficits apparaîtraient après 70 ans [25] et seraient plus importants dans le CV central [22]. L’allongement du temps d’observation permettrait de compenser en partie le déficit de perception du mouvement [25]. Des travaux chez le singe âgé ont montré que la perte de sélectivité directionnelle des neurones du cortex visuel primaire V1 pouvait être restaurée à l’aide d’agonistes de neurotransmetteurs GABA [26]. Ces résultats suggèrent que la perte de sélectivité serait due à une perte d’inhibition au niveau du cortex visuel et que celle-ci pourrait être réversible [26].
Le traitement visuel requiert l’intégration d’informations spatiales et temporelles. En effet, le monde visuel est organisé de façon hiérarchique, la perception étant élaborée d’une part grâce à l’intégration spatiale de petits éléments contenus dans une scène visuelle, et d’autre part grâce à l’intégration temporelle d’éléments à différents intervalles de temps. Les mouvements oculaires jouent un rôle essentiel à la fois pour explorer l’environnement et suivre des cibles en mouvement [27]. La dynamique oculomotrice est aussi fondamentale pour élaborer la perception visuelle lors de la fixation car elle permet la mise en place d’une représentation spatiotemporelle de l’objet fixé [27]. Néanmoins, les effets du vieillissement sur les signatures oculomotrices restent méconnus et font l’objet d’études en cours.
L’intégration multi-échelle réalisée par le système visuel combine des éléments sensoriels de bas niveau pour élaborer des perceptions de formes en 2D, de la profondeur, de scènes visuelles ou l’analyse du flux optique afin de se déplacer et d’éviter les collisions. L’altération de ces processus d’intégration au cours du vieillissement fait l’objet de nombreuses études. La vitesse de traitement de l’information visuelle diminue avec l’âge, notamment lors de tâches attentionnelles ou en présence de distracteurs [28]. Les modifications des traitements perceptifs traduisent des changements au niveau des régions corticales telles que V3A, MT+, LO ou des aires visuelles supérieures [2].
L’entraînement perceptif est un outil prometteur pour ralentir les altérations fonctionnelles induites par le vieillissement naturel du système visuel. En effet, des études ont montré que l’apprentissage perceptif permet d’augmenter la vitesse de traitement de l’information visuelle [28] et d’améliorer de façon significative les fonctions visuelles [29]. Ces travaux attestent d’un haut niveau de plasticité du système visuel et, de manière plus générale, soulignent la propriété fondamentale du système nerveux central qui consiste à se réorganiser et s’adapter par lui-même. De plus amples études sur le maintien des fonctions visuelles grâce à l’apprentissage perceptif pourraient apporter des éléments de compréhension supplémentaires sur l’adaptation et la plasticité cérébrale au cours du vieillissement.
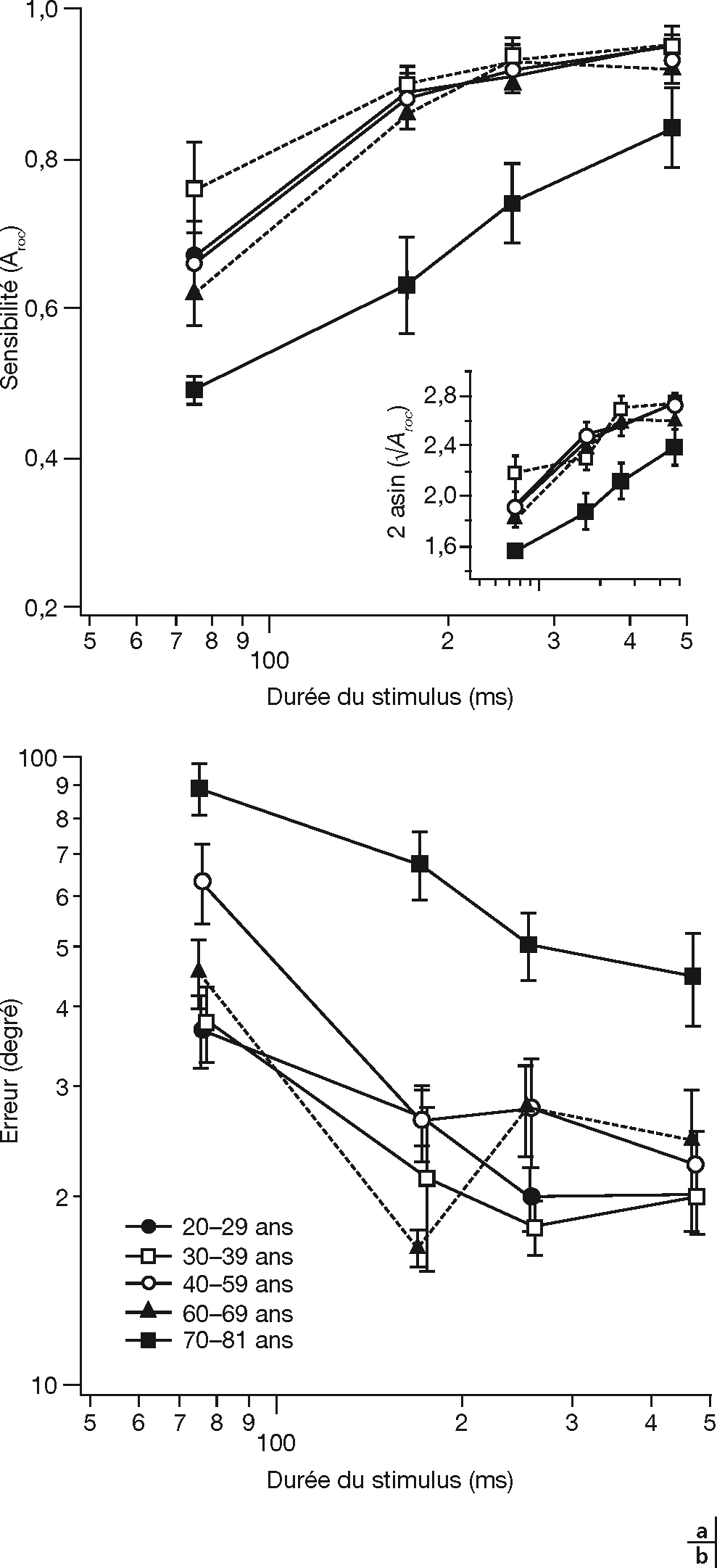
Fig. 3-12 Perception du mouvement en fonction de l’âge.
a. La sensibilité au mouvement pour différents groupes d’âge en fonction de la durée du stimulus. La sensibilité au mouvement est exprimée en tant que l’aire sous la courbe ROC (Aroc). L’insert présente les données après une transformation trigonométrique (arc sinus). Les adultes de 70 ans et plus présentent un abaissement significatif de la sensibilité au mouvement. b. L’amplitude de l’erreur lors du jugement de la direction du mouvement (sur les essais où le mouvement a été détecté) pour différents groupes d’âge en fonction de la durée de stimulation. Les sujets de 70 ans et plus présentent une plus grande amplitude d’erreur dans leur jugement de la direction du mouvement. (D’après [25].)
Le vieillissement naturel modifie progressivement les aspects neurophysiologiques, perceptifs et cognitifs de la vision. Ces modifications ont un impact significatif sur la qualité de vie et l’autonomie des personnes âgées [30]. L’enjeu est majeur étant donné la nécessité de mieux comprendre et anticiper l’impact socio-économique et de santé publique lié au vieillissement de la population mondiale. Par conséquent, une meilleure compréhension de la nature multifactorielle du vieillissement visuel naturel et la prise en compte des différences à l’échelle individuelle sont désormais nécessaires. L’objectif est d’identifier des marqueurs génétiques et/ ou fonctionnels pouvant aider à prévenir, réduire, ou limiter les facteurs de risque et préserver la vision jusqu’à des âges avancés.
[1] Owsley C. Aging and vision. Vision Res 2011 ; 51(13) : 1610‑22.
[2] Andersen GJ. Aging and vision : changes in function and performance from optics to perception. Wiley Interdiscip Rev Cogn Sci 2012 ; 3(3) : 403‑10.
[3] Eliasieh K, Liets LC, Chalupa LM. Cellular reorganization in the human retina during normal aging. Invest Ophthalmol Vis Sci 2007 ; 48(6) : 2824‑30.
[4] Kolesnikov AV, Fan J, Crouch RK, et al. Age-related deterioration of rod vision in mice. J Neurosci 2010 ; 30(33) : 11222‑31.
[5] Marshall J. The ageing retina : physiology or pathology. Eye (Lond) 1987 ; 1(2) : 282‑95.
[6] Lehmann K, Steinecke A, Bolz J. GABA through the ages : regulation of cortical function and plasticity by inhibitory interneurons. Neural Plast 2012 ; 2012 : 892784.
[7] Petralia RS, Mattson MP, Yao PJ. Communication breakdown : the impact of ageing on synapse structure. Ageing Res Rev 2014 ; 14 : 31‑42.
[8] Luebke JI, Medalla M, Amatrudo JM, et al. Age-related changes to layer 3 pyramidal cells in the rhesus monkey visual cortex. Cereb Cortex 2015 ; 25(6) : 1454‑68.
[9] Xi MC, Liu RH, Engelhardt JK, et al. Changes in the axonal conduction velocity of pyramidal tract neurons in the aged cat. Neuroscience 1999 ; 92(1) : 219‑25.
[10] Wang Y, Zhou Y, Ma Y, et al. Degradation of signal timing in cortical areas V1 and V2 of senescent monkeys. Cereb Cortex 2005 ; 15(4) : 403‑8.
[11] Barnes CA. Normal aging : regionally specific changes in hippocampal synaptic transmission. Trends Neurosci 1994 ; 17(1) : 13‑8.
[12] Sjöstrand J, Laatikainen L, Hirvelä H, et al. The decline in visual acuity in elderly people with healthy eyes or eyes with early age-related maculopathy in two Scandinavian population samples. Acta Ophthalmol 2011 ; 89 : 116‑23.
[13] Schneck ME, Haegerström-Portnoy G. Practical assessment of vision in the elderly. Ophthalmol Clin North Am 2003 ; 16(2) : 269‑87.
[14] Owsley C, Sekuler R, Siemsen D. Contrast sensitivity throughout adulthood. Vision Res 1983 ; 23(7) : 689‑99.
[15] Schefrin BE, Tregear SJ, Harvey LO, et al. Senescent changes in scotopic contrast sensitivity. Vision Res 1999 ; 39(22) : 3728‑36.
[16] Jackson GR, Owsley C, McGwin G. Aging and dark adaptation. Vision Res 1999 ; 39(23) : 3975‑82.
[17] Lamb TD, Pugh EN. Dark adaptation and the retinoid cycle of vision. Prog Retin Eye Res 2004 ; 23(3) : 307‑80.
[18] Kemp CM, Jacobson SG, Faulkner DJ, et al. Visual function and rhodopsin levels in humans with vitamin A deficiency. Exp Eye Res 1988 ; 46(2) : 185‑97.
[19] Owsley C, McGwin G, Jackson GR, et al. Effect of short-term, high-dose retinol on dark adaptation in aging and early age-related maculopathy. Investig Ophthalmol Vis Sci 2006 ; 47(4) : 1310‑8.
[20] Grobbel J, Dietzsch J, Johnson CA, et al. Normal values for the full visual field, corrected for age-and reaction time, using semiautomated kinetic testing on the octopus 900 perimeter. Transl Vis Sci Technol 2016 ; 5(2) : 2.
[21] Spry PG, Johnson CA. Senescent changes of the normal visual field : an age-old problem. Optom Vis Sci 2001 ; 78(6) : 436‑41.
[22] Zhang C, Hua T, Li G, et al. Visual function declines during normal aging. Curr Sci 2008 ; 95(11) : 1544‑50.
[23] Harwerth RS, Quigley HA. Visual field defects and retinal ganglion cell losses in patients with glaucoma. Arch Ophthalmol 2006 ; 124(6) : 853‑9.
[24] Freeman EE, Muñoz B, Rubin G, et al. Visual field loss increases the risk of falls in older adults : the Salisbury eye evaluation. Invest Ophthalmol Vis Sci 2007 ; 48(10) : 4445‑50.
[25] Bennett PJ, Sekuler R, Sekuler AB. The effects of aging on motion detection and direction identification. Vision Res 2007 ; 47(6) : 799‑809.
[26] Leventhal AG, Wang Y, Pu M, et al. GABA and its agonists improved visual cortical function in senescent monkeys. Science 2003 ; 300(5620) : 812‑5.
[27] Martinez-Conde S, Macknik SL, Hubel DH. The role of fixational eye movements in visual perception. Nat Rev Neurosci 2004 ; 5(3) : 229‑40.
[28] Ball K, Edwards JD, Ross LA. The impact of speed of processing training on cognitive and everyday functions. J Gerontol B Psychol Sci Soc Sci 2007 ; 62(Spec No 1) : 19‑31.
[29] DeLoss DJ, Watanabe T, Andersen GJ. Improving vision among older adults : behavioral training to improve sight. Psychol Sci 2015 ; 26(4) : 456‑66.
[30] Swenor BK, Simonsick EM, Ferrucci L, et al. Visual impairment and incident mobility limitations : The health, aging and body composition study. J Am Geriatr Soc 2015 ; 63(1) : 46‑54.
