Baisse d’acuité visuelle non organique
Coordonné par P. Wary
P. Wary, P. Lebranchu
« Ut imago est animi voltus sic indices oculi. » (Le visage est le miroir de l’âme, les yeux en sont les interprètes.)
Cicéron, L’orateur
En pratique quotidienne d’ophtalmologie pédiatrique, l’enjeu principal est le dépistage de l’amblyopie. Toute baisse d’acuité visuelle chez un enfant est donc un maître symptôme. Lorsque ce symptôme répond à une cause psychogène, l’ophtalmologiste doit avoir recours à des procédés cliniques ou des examens paracliniques pour poser le diagnostic avec certitude et éliminer une pathologie organique. De présentation trompeuse, protéiforme, parfois difficile dans un contexte familial et émotionnel qu’il ne faut jamais ignorer, ces affections posent de vraies difficultés diagnostiques mais également thérapeutiques. Le diagnostic est d’autant plus compliqué qu’il peut se surajouter à une réelle pathologie organique, ophtalmologique ou neurologique. Il est important de repérer ces affections psychiatriques précocement pour une prise en charge adaptée.
Les déficits visuels non organiques pourraient représenter 1 % des consultations en ophtalmologie [1]. Chez l’enfant, nous disposons de peu de données sur l’épidémiologie des troubles fonctionnels uniquement visuels. Des études ont défini la prévalence de tous les troubles conversifs (visuels mais également neurologiques, etc.), graves (nécessitant une hospitalisation ou un suivi en pédopsychiatrie) chez l’enfant, représentant 0,2 à 2 % des enfants pris en charge en pédopsychiatrie et 2 à 4/100 000 parmi les enfants pris en charge en clinique pédiatrique (pour une revue, voir [2]). Le sex-ratio est dépendant de l’âge : les filles représentent 57 % avant 10 ans et 76 % après. Les atteintes fonctionnelles sont rares avant l’âge de 8 ans. Deux types de familles peuvent être considérés « à risque » [2] : les familles « chaotiques » avec un contexte de symptôme somatique ou psychopathologique chez d’autres membres de la famille, ou les familles sans difficulté sociale ou psychopathologique mais avec un niveau d’attente cognitive et académique élevé. Les facteurs de stress sont diversement retrouvés [2], de 10 à 90 % selon les études : stress scolaire (12,5 à 58 % ), stress dÛ à l’entourage (52 % ), maladies chez des proches (25 % ), séparation parentale (19 % ), confrontation avec la mort (17 % ).
Sur le plan ophtalmologique, la plainte la plus fréquente est la baisse isolée de l’acuité visuelle (36 à 80 % ) et l’atteinte isolée du champ visuel (14 à 20 % ). L’atteinte est binoculaire dans la majorité des cas (50 à 80 % ) [1]. Il est généralement admis que la baisse d’acuité visuelle non organique de l’enfant est très rarement d’origine psychiatrique (moins de 5 % des cas [3]), et l’enfant ne sera adressé en pédopsychiatrie qu’en cas d’ancrage du symptôme ou de signes associés [1].
S’il n’est pas rare de recevoir en consultation un enfant se plaignant de troubles ou de symptômes visuels plus ou moins complexes (perceptions de taches colorées, céphalées, impression de flou visuel) traduisant simplement une envie de lunettes comme un(e) camarade de classe, l’existence de troubles fonctionnels visuels non pathologiques peut résulter d’un processus psychologique plus ou moins subconscient. La plainte fonctionnelle est alors « vague » et l’ensemble des symptômes variables ne cadre pas avec un diagnostic clinique particulier, ne répondant pas aux lois de l’anatomie et de la physiologie. Quand l’invention des symptômes est consciente, il s’agit d’une simulation qui recherche un bénéfice immédiat, mais parfois également des bénéfices secondaires et il devient alors difficile de la distinguer de l’hystérie, ou des syndromes de conversion.
Pour reprendre les mots de P. Juignet [4] : « L’hystérie ne s’entend pas dans le sens populaire du terme, mais dans son sens médical […] caractérisée par la présence de symptômes physiques en l’absence de maladie ou de pathologie pouvant expliquer ces symptômes. Plus précisément, il s’agit d’une hystérie de conversion où un conflit psychique est transformé (“converti”) en symptôme physique, affectant typiquement le système nerveux de relation avec autrui (motricité, sensibilité, vision). »
Ainsi, il est préférable de choisir le terme d’amblyopie psychogène ou de réaction visuelle de conversion plutôt que d’employer le terme d’hystérie qui va heurter les parents et rompre le lien de confiance nécessaire à l’aboutissement de la démarche clinique. Les parents doivent effectivement sentir qu’ils sont écoutés tout comme leur enfant au cours d’une prise en charge clinique sérieuse, complète et complexe.
Les amblyopies psychogènes et l’ensemble des troubles psychosomatiques visuels sont rares avant l’âge de 6 ans sans sex-ratio, alors qu’elles surviennent plus volontiers au cours de la deuxième décennie (10-14 ans) avec une prédominance féminine et un sex-ratio de 3,1 [5]; chez l’adulte, a contrario, elles restent beaucoup plus rares et ne se rencontrent classiquement qu’après un traumatisme ou dans un contexte de trouble psychiatrique. Classiquement chez l’enfant, les symptômes sont d’apparition brutale, dans un contexte de stress psychologique ou de souffrance émotionnelle qui sont à cet âge essentiellement des difficultés domestiques ou scolaires :
à la maison avec l’existence de rivalité ou de jalousie dans la fratrie ou l’existence de difficultés relationnelles avec les parents (tensions familiales, divorce, décès) aggravées parfois par des difficultés psychosociales [4];
à l’école, il faut évoquer les brimades scolaires, les difficultés scolaires et la peur de l’échec;
dans tous les cas, il faut garder une vigilance sur le contexte possible de l’existence d’abus physiques, psychiques ou sexuels [6].
La plainte visuelle devient le symptôme de la recherche d’attention ou de compassion auprès des parents, devient une excuse par rapport à un échec ou des difficultés scolaires, ou une motivation inconsciente pour fuir un problème en déplaçant l’attention de l’entourage. Il est souvent noté une attention accrue d’un des deux parents sur son enfant, qui est le principal bénéfice secondaire de la somatisation mettant, par exemple, en relief un lien privilégié entre le père et la fille ou un conflit maternel. Il existe une avidité affective et, pour le cas d’une jeune patiente, une demande à un personnage paternel (médecin) de s’occuper de son corps [4]. Affirmer le caractère psychogène des déficits visuels de l’enfant repose alors sur une méthodologie d’examen rigoureuse pour confirmer l’absence de cause organique par des contre-épreuves cliniques et paracliniques hiérarchisées qui nécessitent parfois la coopération de l’enfant (tests subjectifs); en cas de mauvaise coopération (le mutisme étant un obstacle majeur), il convient de multiplier les explorations objectives : électrophysiologie, tomographie par cohérence optique (optical coherence tomography [OCT]), imagerie. Il ne faut jamais donner l’impression de suspecter la simulation, toutes les manifestations cliniques, leur variabilité et leurs contradictions sont à noter, et il ne faut jamais indiquer précocement que les symptômes paraissent psychosomatiques ou imaginaires.
Ces symptômes sont plus fréquemment une baisse d’acuité visuelle uni- ou bilatérale, parfois des troubles du champ visuel (hémianopsies ou scotomes) et plus rarement des hallucinations visuelles, des micropsies ou des macropsies, et une diplopie (dysfonctionnements oculomoteurs) [7].
La baisse d’acuité visuelle unilatérale est la symptomatologie de loin la plus fréquente [7,8,9]. Elle se traduit par un tableau de cécité unilatérale [10] avec une acuité visuelle très limitée entre 1 et 3/10. Les signes évocateurs d’une baisse d’acuité visuelle psychogène sont :
la variabilité des réponses dans le temps;
l’amélioration de l’acuité visuelle après suggestion ou encouragement;
l’absence d’amélioration lorsque l’on rapproche l’image;
les contradictions entre la vision de loin et la vision de près;
l’absence ou le peu de handicaps par la gêne occasionnée.
L’atteinte bilatérale peut se voir chez un enfant plus grand, mais elle reste beaucoup plus rare et difficile à simuler de manière constante. L’attitude de l’enfant est caractéristique avec un tableau d’exagération comportementale : « l’enfant est plus aveugle que l’aveugle lui-même » . Il présente un tableau évocateur caricatural : marche menton baissé (le non-voyant a la tête droite ou le menton relevé), il porte des verres teintés, se heurte au moindre obstacle, mais de manière générale ne peut se déplacer sans l’aide d’une tierce personne, etc. Pour le confondre, il faut jouer sur des tests comportementaux avec notamment la recherche du réflexe de clignement à la menace, le signe de l’obstacle (faire déplacer le sujet dans une pièce encombrée de différents obstacles et recommencer cette épreuve en bandant les yeux).
Un autre test très simple est de demander au sujet, bras écartés, de joindre ses index tendus. Ce geste est réalisé aisément par un non-voyant (explorant la sensibilité profonde extralemniscale) et peut être réalisé sans difficulté les yeux bandés par un jeune enfant, alors que le jeune patient présentant un tableau d’amblyopie psychogène bilatérale fait classiquement des gestes désordonnés et manque sa cible.
Il faudra systématiquement et rigoureusement éliminer une cause réelle de cécité d’origine rétinienne (examen du fond d’œil, électrophysiologie : électrorétinogramme [ERG], électro-oculogramme [EOG]) ou secondaire à une neuropathie optique (examen de la papille, réflexes photomoteurs, OCT, potentiels évoqués visuels [PEV]), mais le plus difficile sera de dépister des troubles neurovisuels et établir le diagnostic différentiel de cécité corticale [11]. En cas de doute, une hospitalisation courte en service de pédiatrie avec une surveillance discrète mais soutenue peut orienter sur l’étiologie psychogène.
La simulation d’une amputation campimétrique est relativement rare chez le jeune enfant par rapport aux adultes. Le patient peut alléguer soit un rétrécissement habituellement concentrique, plus rarement un déficit localisé ou systématisé notamment inférieur gênant la lecture. Si un rétrécissement concentrique important allant jusqu’à 10 ou 20° du point de fixation est incompatible avec des possibilités normales de déplacement, il est très informateur d’observer le comportement de l’enfant en salle d’attente, et relever ses difficultés ou non de déplacement. Il sera en effet parfois très difficile de réaliser un relevé du champ visuel chez un jeune enfant dont la coopération doit être optimale pour avoir un relevé interprétable.
Certains déficits sont plus évocateurs de la conversion hystérique ou de la simulation :
le rétrécissement concentrique (Fig. 24-1a) : il peut caractériser certaines maladies organiques comme la neuropathie glaucomateuse, une rétinopathie pigmentaire, des drusen compliquées de la papille mais également se manifester lors d’un syndrome post-commotionnel après une chute avec traumatisme crânien et perte de connaissance;
le rétrécissement en forme de spirale (Fig. 24-1b) ne peut s’expliquer sur le plan physiopathologique, il est toujours le symptôme d’une souffrance psychologique, fréquent dans l’hystérie et surtout dans la simulation.
D’autres déficits sont rarement simulés et sont très difficiles à reproduire au cours d’examens successifs, tels que les déficits systématisés ou scotomateux. Le dépistage se fait en périmétrie cinétique par la réalisation de deux relevés successifs, un classique et le second en déplaçant le point de fixation de 20°. Le simulateur retrouvera son déficit au même endroit, ignorant que le déplacement du point de fixation doit modifier la localisation du scotome.
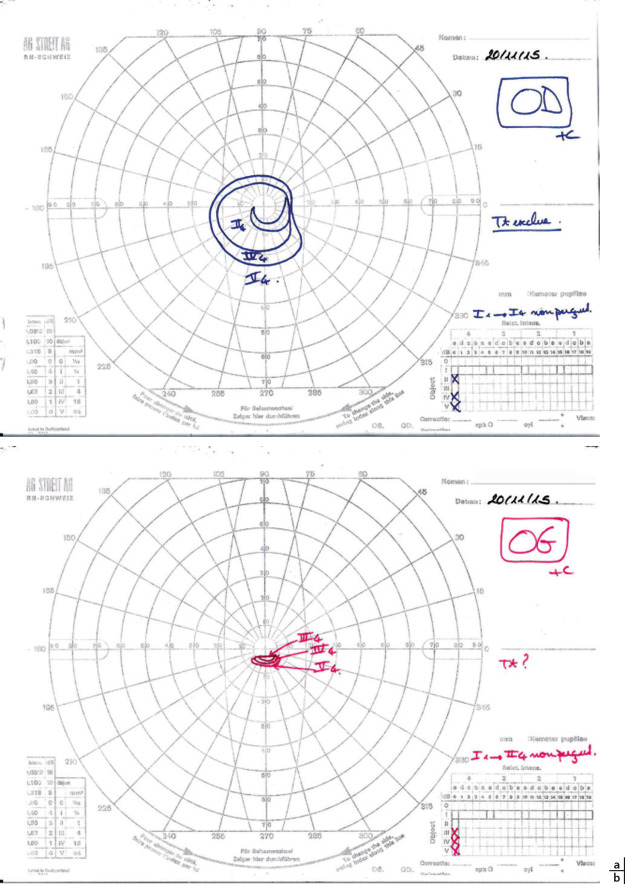
Fig. 24-1 Champ visuel : tubulaire (a) ; en escargot (b).
Symptôme d’appel trompeur, elle peut être de cause organique réfractive avec spasme accommodatif et apparaître de manière intermittente, en étant exagérée par l’enfant. Le bilan réfractif sous cycloplégie et oculomoteur associé à un bilan orthoptique sensori-moteur permet d’éliminer les causes de diplopie monoculaire, et de rechercher et caractériser une atteinte de la motilité oculaire extrinsèque. Une épreuve de Lancaster peut enrichir le suivi du trouble oculomoteur éliminant notamment les causes neurogènes innervationnelles au tracé caractéristique.
C’est une simulation inconsciente, mythomane d’une infirmité ou de symptômes d’une maladie. Le trouble factice [6] est un trouble mental au cours duquel le sujet éprouve le besoin morbide de simuler une maladie en s’imposant des signes ou des symptômes, et en pouvant aller pour cela jusqu’à endommager son propre corps pour y provoquer délibérément des lésions. Les atteintes cliniques ophtalmologiques sont multiples et non spécifiques : les plus fréquentes sont des kératites superficielles mécaniques (compresses) ou iatrogènes (instillation d’anesthésiques locaux, produits toxiques), des blépharoconjonctivites. Plus rarement, sont retrouvées par ordre décroissant des ptérygoïdes, des atteintes inflammatoires du segment antérieur et des atteintes cristalliniennes. Ces lésions sont souvent liées à des traumatismes directs induits. Cette affection frontière, dont le but est essentiellement inconscient, conduit à un comportement obstiné et répétitif, pouvant mener à une cécité grave. Elle peut être précoce dès 3 ans et l’enfant présente une personnalité caractéristique [4] : besoin de valorisation, avidité affective (personnalité collante), avec forte jalousie, égocentrisme le plus souvent et parfois des pensées magiques. Entrant dans le cadre des personnalités histrioniques, l’évolution de cette affection borderline est peu favorable spontanément, avec un risque suicidaire élevé justifiant une prise en charge spécialisée précoce.
Le spasme accommodatif (spasms of the near reflex) correspond cliniquement à une hyperactivité de la syncinésie en vision de près : excès d’accommodation, pupille en myosis, parfois associée à un excès de convergence. Il s’agit d’une présentation rare de baisse d’acuité visuelle non organique de l’enfant [1] ou de l’adulte. Cliniquement, le patient se plaint d’une baisse d’acuité visuelle bilatérale, souvent inférieure à 1/10. L’autoréfractométrie sans cycloplégie révèle une myopie (souvent importante), dont la correction n’améliore pas l’acuité visuelle. Un indice révélateur est l’augmentation importante de la sphère myopique sur le rapport de l’autoréfractomètre ( « le ticket » ) entre la première et la dernière mesure. En dehors du myosis, aucune anomalie n’est révélée par l’examen de l’œil. La cycloplégie retrouve une franche diminution de la sphère, et la lecture sous cycloplégique améliore souvent l’acuité visuelle (mais pas toujours). L’association avec un spasme en convergence est inconstante, mais est un élément pathognomonique du trouble lorsqu’il est présent [12].
Les étiologies du spasme accommodatif sont dominées par l’origine psychogène. Cependant, il faut systématiquement éliminer une origine neurologique, car ce trouble a été également identifié en cas de traumatisme crânien [13], de pathologies démyélinisantes [14] ou d’hypertension intracrânienne [15].
La thérapeutique doit associer des mesures de prise en charge de la cause et des conséquences. Une fois exclut l’origine neurologique, la prise en charge psychologique de ce trouble fonctionnel ira de la simple réassurance à la recommandation d’un suivi psychiatrique. La prescription simple de la correction optique (quelle qu’elle soit) n’est souvent pas suffisante (sauf en cas de traumatisme psychologique bénin de l’enfant), car le patient ne présente jamais une réfraction stable en raison du spasme myopique. On optera généralement pour la prescription de la correction optique totale (COT) associée à des cures courtes de cycloplégique de courte durée d’action à instiller le soir au coucher (en prévenant des effets secondaires, en particulier les difficultés d’accommodation et la mydriase). En cas de troubles persistants, une porte de sortie peut être laissée à l’enfant en lui prescrivant sa COT en verres progressifs (addition maximale de + 3,00) et des cures d’atropine, ce qui permet à la fois de paralyser le spasme tout en permettant de ne pas handicaper les activités de près. D’autres thérapeutiques ont été proposées (toxine botulique, chirurgie de cristallin clair, etc.) mais restent des exceptions, et surtout ne doivent s’envisager que dans un projet global de prise en charge, incluant un versant psychiatrique.
L’Encadré 24-1 propose le cas clinique d’une enfant de 13 ans suivie depuis 4 ans pour acuité visuelle basse.
L’examen clinique concerne donc plus souvent un enfant entre 6 et 16 ans, plus classiquement une fille âgée de 10 ans.
Le premier temps de l’examen est l’interrogatoire et l’observation relevant, dans un contexte familial particulier à bien faire préciser, le mode évolutif des plaintes fonctionnelles.
Les examens obligatoires à réaliser sont communs à toute la pratique ophtalmologique pédiatrique chez un enfant en âge verbal.
La mesure de l’acuité visuelle sera un temps essentiel réalisé en binoculaire, puis en monoculaire, en vision de loin puis en vision de près.
La mesure de la réfraction au réfractomètre automatique sans cycloplégie, puis avec cycloplégie ne déroge pas aux règles classiques du bilan d’une amblyopie pour laquelle il faut éliminer une cause organique, strabique et réfractive :
Cas clinique d’acuité visuelle non organique
Enfant adressée à l’âge de 13 ans pour second avis. Elle est suivie depuis l’âge de 9 ans pour baisse d’acuité visuelle non organique (baisse d’acuité visuelle bilatérale, pas d’anomalie ophtalmologique ; imagerie par résonance magnétique [IRM], ERG, PEV normaux). Elle est réfractaire aux cures d’atropine ; le suivi pédopsychiatrique ne montre pas d’amélioration, et des mesures de basse vision ont été mises en place en milieu scolaire (scolarisation normale en 4e).
Lors de la première consultation, on relève :
acuité visuelle OD 0,25 P14; OG 0,32 P10;
correction optique : OD + 0,25 (+ 0,25 à 90°); OG + 0,25;
réfraction automatisée (RA) : OD –7,25 (+ 0,75 à 65°); OG –7,00 (+ 1,00 à 70°);
acuité visuelle sous cycloplégique : OD 1,00 avec + 0,75; OG 1,00 avec + 0,75;
forte suspicion de spasmes accommodatifs;
IRM de contrôle excluant une pathologie neurologique.
À la suite de cette première consultation, une COT en verres progressifs (+ 3,50) est prescrite associée à de l’atropine 1 % tous les soirs dans les deux yeux pendant 3 mois. Avec ce traitement, on note la disparition du gène visuelle et la possibilité d’arrêter les mesures de basse vision en milieu scolaire. Après 3 mois, de l’atropine 0,50 % o est prescrite le soir pendant 6 mois, puis de l’atropine 0,30 % o le soir pendant 6 mois. Après 1 an de traitement, il est possible d’arrêter l’atropine et les verres progressifs.
Dans ce cas, nous ne pouvons juger si c’est le nouveau traitement (atropine + verres progressifs) qui a été efficace, ou le simple fait de laisser une porte de sortie chez un enfant qui s’est ancré pendant 4 ans dans son symptôme.
éliminer une erreur réfractive et mesurer la meilleure acuité visuelle corrigée en vision de loin et en vision de près;
rechercher la possibilité de spasmes accommodatifs.
Un examen oculomoteur sensori-moteur, avec évaluation de la stéréoscopie (test de Lang et test TNO) et bilan orthoptique (avec vision des couleurs), doit être réalisé en lien avec une orthoptiste avertie du contexte.
L’examen systématisé comparatif bilatéral du segment antérieur et du fond d’œil au biomicroscope, avec examen rétinien après dilatation, plus ou moins complété de rétinophotographie, permet d’éliminer une cause oculaire et déjà d’orienter vers une cause non organique [11,16,17].
L’étude de la motilité pupillaire est importante à la recherche d’un déficit pupillaire afférent entrant dans le cadre d’une neuropathie optique rétrobulbaire qu’il faut systématiquement éliminer dans un contexte de baisse d’acuité visuelle sans signe d’appel évident ophtalmoscopique.
L’accès rapide à une exploration du nerf optique avec réalisation d’un OCT est d’un apport capital [18] pour éliminer une souffrance infraclinique du nerf optique en analysant les épaisseurs du retinal nerve fiber layer (RNFL) en secteur temporal, et en vérifiant l’intégrité de la région maculaire.
La réalisation d’un relevé campimétrique de Goldmann sera discutée sur un second examen, et avec une procédure spécifique de dépistage de la simulation décrite ci-après.
La réalisation systématique d’un OCT maculaire et d’une autofluorescence rétinienne est également indiquée. En effet, il n’est pas rare de faire par excès le diagnostic d’atteinte psychogène chez un adolescent présentant une baisse visuelle bilatérale à fond d’œil normal, alors qu’il s’agit d’une pathologie maculaire débutante (dystrophie des cônes, etc.). Dans ce cas, seul l’examen attentif de la ligne des photorécepteurs fovéolaires sur l’OCT, les anomalies de l’autofluorescence spontanée de la rétine ou un électrorétinogramme multifocal permettent de redresser le diagnostic.
Ce ne sera le plus souvent que la répétition des mesures de l’acuité visuelle malgré un traitement médical bien conduit d’une amblyopie, et des examens paracliniques, qui permettra d’orienter dans un second temps vers une cause fonctionnelle non organique. L’incohérence clinique et la variabilité du symptôme entre deux examens voire même au cours du même examen renforcent la suspicion de pathologie simulée.
Au cas par cas, les explorations complémentaires de neuro-imagerie seront discutées d’autant plus qu’il existe un cortège de signes fonctionnels associés (céphalées, troubles du sommeil, nausées, vomissements, douleurs digestives, etc.).
Dès qu’une atteinte fonctionnelle non organique est suspectée, il faut pouvoir affirmer l’hypothèse en mettant en défaut la plainte de l’enfant par la réalisation d’examens plus spécifiques, dont les procédures particulières vont être hiérarchisées. Dans tous les cas, un praticien qui suspecte une cause fonctionnelle de baisse de vision doit se garder de porter une conclusion hâtive (particulièrement en cas de second avis) et réaliser de façon objective l’ensemble des examens qui permettent d’écarter les rares causes d’altération de la fonction visuelle à fond d’œil normal.
Le test de mesure de l’acuité visuelle par les optotypes de Thibaudet (Fig. 24-2a) est un test subjectif des plus faciles et des plus rapides pour apprécier une valeur d’acuité visuelle. On utilise ces optotypes comparables au E de Snellen, avec un nombre variable de jambages présentés sur des cartes d’égale dimension. Ils sont proposés successivement à 5 m en ordre aléatoire, dans des conditions d’éclairage photopique.
Ce test [8,9] est un classique du bilan de simulation, le simulateur ne discerne pas les tests de petite taille qu’il assimile à une bonne acuité visuelle, alors qu’il reconnaîtra les tests de plus grande taille correspondant pourtant à la même acuité visuelle.
Il faut répéter cet examen pour relever les discordances dans les réponses sur la fiche de réponse tout en se méfiant de ce test, qui a tendance à surestimer les basses acuités visuelles, induisant une fausse discordance entre les mesures classiques et au Thibaudet (Fig. 24-1b).
C’est une manœuvre d’examen simple à utiliser dans le cadre d’une amblyopie monolatérale profonde en provoquant une diplopie binoculaire par un léger déplacement du globe induit par une pression digitale sur la paupière inférieure de l’œil « sain » . L’enfant lit sur une échelle d’acuité visuelle de près. Cette diplopie provoquée le gêne pendant la lecture du texte. S’il voit réellement des deux yeux, cette manœuvre provoque une diplopie gênante qui n’existe pas chez le vrai monophtalme.
Il faut réaliser au préalable une réfraction sous cycloplégie et mettre en place la correction optique totale en laissant les deux yeux découverts.
Placer ensuite devant l’œil sain, corrigé à l’emmétropie, un verre de + 8 D rendant impossible la lecture des optotypes à 5 m. Placer devant l’œil soi-disant amblyope ou aveugle, corrigé sous cycloplégie en correction optique totale, un verre de + 3 D. Enfin réaliser le test en binoculaire en surveillant attentivement les clignements des paupières : faire varier progressivement de –1 D en –1 D comme un test de brouillard classique : le sujet est convaincu de voir les optotypes en binoculaire.
Lorsque le sujet est à la valeur de sa COT sur l’œil déclaré amblyope ou aveugle, il peut lire les optotypes avec son œil déclaré aveugle, alors que l’œil sain est pénalisé avec un verre convexe de + 5 D sur une COT rendant la lecture en vision de loin impossible. Si le sujet ne répond pas, l’épreuve peut être reprise plusieurs fois en alternant la place du verre de + 8 D devant l’un ou l’autre œil, ce qui déroute le fraudeur et peut provoquer une réponse correcte alors que le verre convexe se trouve devant l’œil reconnu sain.
Réaliser au préalable une réfraction sous cycloplégie et mettre en place la correction optique totale sur l’œil sain, et réaliser une réfraction avec fausse cycloplégie de l’œil considéré comme amblyope avec du sérum physiologique. Ensuite placer la correction de vision de loin mesurée :
faire lire les optotypes en binoculaire à 5 m ce qui n’entraîne aucune difficulté puisqu’en vision de loin l’œil sain est en correction optique totale;
faire lire l’échelle 2 ou 3 de Parinaud ou échelle de Rossano-Weiss en vision de près, seul l’œil présumé amblyope lit, l’œil sain étant sous cycloplégie sans addition. Habituellement, le simulateur lit sans méfiance l’échelle de Parinaud croyant toujours lire avec son bon œil.
Il faudra veiller à la correction de la réfraction du sujet toujours réalisée sous cycloplégie avec port de la correction optique totale, et s’assurer que celui-ci ne présente pas un trouble du sens chromatique (Fig. 24-3). Sur fond blanc, le verre coloré éteint les caractères de même couleur. On place un verre rouge devant l’œil sain et un verre vert devant l’œil déclaré amblyope et on présente au sujet un texte écrit sur fond blanc avec certaines lettres en noir et d’autres en rouge :
soit le sujet ne voit véritablement pas d’un œil et seul l’œil porteur du verre rouge verra les caractères écrits en noir (car le verre rouge efface les traits rouges);
soit le sujet voit des deux yeux et il verra en noir tous les caractères du texte (le verre vert, couleur complémentaire du rouge, fait voir noir ce qui est rouge).

Fig. 24-3 Test duochrome de Bravais.
Il s’agit d’un procédé très semblable à celui de Bravais mais avec lecture des optotypes de dimension décroissante de couleur rouge et verte sur fond blanc à travers un écran rouge et l’autre vert. L’utilisation des verres polarisés du réfracteur permet de faire lire simultanément des optotypes de tailles décroissantes avec l’œil droit (ligne du haut) et avec l’œil gauche (ligne du bas). Ce test simple est très utile en cas de baisse profonde unilatérale de l’enfant, permettant de faire la part des choses entre une atteinte organique (l’enfant ne lit pas une des deux lignes) et une atteinte fonctionnelle (l’enfant lit tout, ou ne lit pas les petits optotypes de chacune des deux lignes).
Il s’agit d’un test objectif fondé sur le recueil du nystagmus optocinétique, nystagmus physiologique provoqué. Le but est de révéler l’existence d’un pouvoir séparateur, donc de déterminer un chiffre d’acuité visuelle avec une précision relative, sans tenir compte des réponses du sujet. Un tambour de Barany (Fig. 24-4)qui présente une alternance de bandes noires et de bandes blanches est présenté en rotation devant les yeux de l’enfant. Il déclenche un mouvement de poursuite d’une cible en mouvement.
Ce n’est pas un moyen sÛr pour évaluer l’acuité visuelle car la réponse n’est pas strictement corrélée à l’acuité visuelle fovéolaire, mais il permet de déterminer de façon simple s’il existe ou non une perception et de tester la maturation du système visuel. Ainsi, ce test ne s’avère utile que pour confondre les simulateurs qui prétendent avoir une baisse très profonde de l’acuité visuelle (absence de perception).
On admet qu’un patient qui possède des mouvements oculaires de chaque œil jusqu’à 2 m aurait une acuité visuelle chiffrée à 2/10, et à 2,75 m l’acuité visuelle serait de 6/10.
On peut utiliser la mesure de la stéréoscopie avec un test à points aléatoires (TNO) pour apprécier la valeur de l’acuité visuelle. Une acuité visuelle stéréoscopique à 30” est en effet impossible à retrouver en cas de baisse profonde unilatérale de l’acuité visuelle. Il faut cependant se méfier des résultats des autres tests stéréoscopiques, plus grossier (Lang) ou qui peuvent utiliser des zones para-fovéolaires pour créer le relief (test à contours), et pour lesquels on peut avoir une réponse stéréoscopique tout en ayant une baisse profonde unilatérale de la vision.
Avec un peu d’habitude, le dépistage de la simulation d’un déficit du champ visuel corrélé avec une simulation d’un déficit de la vision centrale est extrêmement facile en utilisant le périmètre de Goldmann. Bien sÛr, il ne peut être réalisé qu’à partir de l’âge de 6-7 ans chez l’enfant, nécessitant son entière coopération et une bonne maîtrise de la part de l’orthoptiste. Plusieurs procédés peuvent compliquer la périmétrie afin de confondre l’enfant :
la combinaison entre surface et luminosité des tests peut être utilisée : un test III4 est équivalent à un test IV3, les deux isoptères sont superposables. Le patient simulateur surtout plus sensible à la réduction de la surface du test qu’à son intensité déclare un isoptère au test IV3 plus large qu’au test III4. La variation de l’ordre de présentation du test – aller tantôt de proche en proche, tantôt vers un point diamétralement opposé – permet parfois d’obtenir une image en étoile totalement anarchique et ne reposant sur aucune pathologie organique;
le phénomène d’inversion des isoptères de Kluyskens (1958) : les limites périphériques du champ visuel ne sont pas les mêmes selon que le test est déplacé dans le sens centripète ou dans le sens centrifuge. Chez le sujet normal, les limites centrifuges sont plus larges que les limites centripètes, car lorsque le test est déplacé dans le sens centrifuge, le sujet garde pendant quelques instants le souvenir de sa perception. Au contraire, lorsque le test est déplacé dans le sens centripète, le sujet ne peut signaler sa présence que lorsqu’il est réellement perçu. Dans les conversions hystériques, l’isoptère étudié de manière centrifuge est plus rétréci que l’isoptère centripète, ce qui est contraire aux résultats d’un sujet normal, compte tenu du phénomène de persistance de l’image rétinienne;
le procédé d’éloignement de Dubois-Poulsen : il consiste à tracer un isoptère puis à éloigner l’enfant de 20 cm de la mentonnière, et à présenter le même test; cela devrait aboutir à un isoptère plus grand que le premier. Le simulateur ne se doute pas que l’éloignement modifie les limites périphériques de son champ visuel et affirme qu’elles restent les mêmes ou diminuent paradoxalement.
La périmétrie automatique est un examen plus limité en ophtalmologie pédiatrique à réserver aux jeunes adolescents car il n’existe pas la même interaction entre le patient et l’examinateur. Rodalec [19] a démontré que les différents paramètres analysés par les programmes informatiques aident peu l’ophtalmologue à dépister les simulateurs qui, suffisamment avertis, peuvent facilement tromper la machine.
L’ERG permet la comparaison des deux rétines par l’enregistrement de l’activité bioélectrique de la rétine en réponse à une stimulation lumineuse brève explorant l’activité des photorécepteurs et des cellules bipolaires. Les PEV sont définis par la sommation des réponses corticales qui résultent d’un changement temporel dans les caractéristiques du stimulus [20, 21].
Si les PEV flashs explorent la réception et la transmission d’un stimulus lumineux, ils ne permettent pas d’évaluer l’acuité visuelle [21], alors que les travaux de Hache [20] ont montré la corrélation entre l’amplitude du PEV par damiers et la baisse de l’acuité visuelle liée à une amétropie. Cependant en cas d’atteinte du nerf optique, il existe des altérations du PEV plus marquées que la valeur de l’acuité visuelle ne le laissait prévoir, avec un allongement des latences ou des modifications globales des PEV. Il est prudent de ne pas vouloir assimiler trop rapidement la présence d’une réponse évoquée visuelle à un certain degré d’acuité visuelle, et vouloir donner des valeurs d’acuité visuelle objective par mesures électrophysiologiques. Notons qu’un ERG et des PEV normaux sont incompatibles avec une acuité visuelle inférieure à 6/10. La présence d’un potentiel détectable (amplitude de la réponse> 4 µV) avec les damiers 7 min correspondrait à une acuité visuelle supérieure à 4-5/10 d’autant plus que l’ERG est normal. En cas d’acuité visuelle sous-optimale (entre 5 et 8/10), sans explication anatomique franche et avec des ERG globaux et PEV normaux, il est licite de réaliser un ERG multifocal pour ne pas diagnostiquer à tort un caractère simulé en lieu et place d’une maculopathie débutante.
Face à un ou des symptômes de conversion, la conduite à tenir reste toujours du cas par cas, bien qu’il existe des conseils généraux.
Dès que l’ophtalmologiste suspecte un déficit visuel non organique, il doit prendre en compte le caractère stressant de cette souffrance tant pour l’enfant que pour ses parents, sans indiquer d’emblée la suspicion du caractère simulé. Il est donc important de rassurer la famille (parents et patient) en assurant que l’examen clinique complet n’a révélé aucune lésion noble rétinienne ou du nerf optique. Mais il existe un problème ressenti réel, bien qu’inconscient qui nécessite réflexion; il faut certainement revoir l’enfant et envisager une prise en charge pluridisciplinaire. La conduite de l’examen clinique est capitale :
ne jamais donner l’impression de suspecter la simulation;
examiner autant que faire se peut le patient seul, avec un tiers non impliqué (étudiant, infirmière, secrétaire, etc.) dans la salle;
réaliser les manœuvres de dépistage naturellement et rapidement;
avoir recours dans le doute aux examens complémentaires en sachant répéter certains d’entre eux.
Dans un premier temps, il peut être utile de revoir l’enfant en l’absence des parents, pour re-tester la vision. La communication sans les parents peut être profitable. Le premier traitement consiste le plus souvent à satisfaire une demande cachée sans perdre la face. Une simple correction peut être prescrite avec discernement, associée à une prescription de rééducation orthoptique qui permettra de voir la variabilité des symptômes, de refaire les examens complémentaires et d’amorcer une prise en charge de la plainte. « Le diagnostic de simulation est une bataille de l’esprit que peut très bien perdre l’examinateur » selon Shelton. Aussi, l’ophtalmologiste doit rester vigilant. En cas de baisse profonde de l’acuité visuelle sans explication clinique franche, il est conseillé de faire une demande en urgence de PEV pour écarter rapidement toute organicité. En cas de réponses normales, cela rassure les parents (et le praticien); en cas d’anormalité, cela permet d’étendre plus rapidement le bilan (compression du nerf optique, inflammation, etc.).
L’absence de progrès ou de disparition des symptômes dans le mois qui suit, et ce d’autant plus que le contexte familial apparaît compliqué, indique qu’il faut adresser ce jeune patient au pédiatre, lequel adressera lui-même l’enfant à un(e) psychologue ou pédopsychiatre selon son jugement clinique.
[1] Beatty S. Non-organic visual loss. Postgrad Med J 1999 ; 75 : 201-7.
[2] Ouss L, Tordjman E. Conversive disorders among children and adolescents : towards new “complementarist” paradigms ? Neurophysiol Clin 2014 ; 44 : 411-6.
[3] Catalano RA, Simon JW, Krohel GB, Rosenber PN. Functional visual loss in children. Ophthalmology 1986 ; 93 : 385-90.
[4] Juignet P. Manuel de psychopathologie générale. (Enfant - Adolescent - Adulte). Coll. Libres cours Psychologie. Grenoble : PUG ; 2015.
[5] Neurological conversion disorders in childhood. Lancet 1991 ; 337 : 889-90.
[6] Rosenberg PN, Krohel GB, Webb RM. Ocular Munschausen’s syndrom. Ophthalmology 1986 ; 93 : 1120-4
[7] Catalano RA, Simon JW, Krohel GB, Rosenberg PN. Functional visual loss in children. Ophthalmology 1986 ; 93 : 385-90.
[8] Mouriaux F, Defoort-Dhellemmes S, Kochman F, et al. Eye disorders in children and adolescents. J Fr Ophthalmol 1997 ; 20 : 175-82.
[9] Yasuna ER. Hysterical amblyopia in children and young adults. Arch Ophthalmol 1951 ; 45 : 70-6.
[10] Incesu AI, Sobacı G Malingering or simulation in ophthalmology-visual acuity. Int J Ophthalmol 2011 ; 4 : 558-66.
[11] Leavitt JA. Diagnosis and management of functional visual deficits. Curr Treat Options Neurol 2006 ; 8 : 45-51.
[12] Goldstein JH, Schneekloth BB. Spasm of the near reflex : a spectrum of anomalies. Surv Ophthalmol 1996 ; 40 : 269-78.
[13] Monteiro ML, Curi AL, Pereira A, et al. Persistent accommodative spasm after severe head trauma. Br J Ophthalmol 2003 ; 87 : 243-4.
[14] Sitole S, Jay WM. Spasm of the near reflex in a patient with multiple sclerosis. Semin Ophthalmol 2007 ; 22 : 29-31.
[15] Kawasaki A, Borruat FX. Spasm of accommodation in a patient with increased intracranial pressure and pineal cyst. Klin Monbl Augenheilkd 2005 ; 222 : 241-3.
[16] Ledoux-Skivee C, Ledoux A. simulation and dissimulation in ophthalmology. Bull Soc Belge Ophtalmol 2004 ; (291) : 29-36.
[17] Geer I, Westall CA. A comparison of tests to determine acuity deficits in children with amblyopia. Ophthalmic Physiol Opt 1996 ; 16 : 367-74.
[18] Civelekler M, Halili I, Gundogan FC, Sobaci G. Retinal nerve fiber layer thickness analysis in suspected malingerers with optic disc temporal pallor. Indian J Ophthalmol 2009 ; 57 : 365-70.
[19] Rodalec T, Hamelin N. Peut-on tricher en périmétrie automatisée ? J Fr Ophtalmol 2003 ; 26 : 591-5.
[20] Hache JC, Payen P, Tirtaine D, et al. Measurement of visual acuity using visual evoked potentials obtained by stimulation by reversal of checker-board sight. Bull Soc Ophtalmol Fr 1979 ; 79 : 1089-90.
[21] Marechal L, Faidherbe J. Trial. On the objective evaluation of visual acuity and its maturation by the method of evoked visual potentials. Arch Int Physiol Biochim 1990 ; 98 : 1-6.
C. Orssaud
Le « retard de maturation visuelle » (RMV) est une affection rare mais non exceptionnelle, également connu sous le nom de « maladie de Beauvieux » , du nom du médecin qui en fit la première description en 1926 [1], Uemura a proposé une classification en trois groupes, qui est la plus utilisée (Tableau 24-1) [2], Elle présente l’avantage de séparer les patients en fonction de leurs éventuelles atteintes associées visuelles ou neurologiques et donc de leur pronostic fonctionnel, Fielder a séparé le premier groupe en deux, IA et IB [3], Ce RMV se manifeste par un tableau de profonde malvoyance au cours des premiers mois de la vie qui évolue « brutalement » vers la récupération complète de la vision avant l’âge de 6 mois lorsque la malvoyance est isolée [4,5], Son diagnostic ne peut être porté qu’après avoir éliminé toutes les autres causes de cécité du nourrisson et n’est confirmé que lorsque survient la récupération visuelle.
Les mécanismes physiopathogéniques permettant d’expliquer l’origine du RMV sont encore mal connus et ont donné lieu à de nombreuses théories. L’hypothèse d’un retard de myélinisation du nerf optique évoqué par Beauvieux a été réfutée par les données portant sur la chronologie d’apparition de la myéline et de ses gaines au niveau du système nerveux central en général et des voies optiques en particulier. Tressidder a suggéré que la symptomatologie du RMV puisse être due à un trouble de maturation du système extra-géniculostrié [4]. Celui-ci aurait un rôle prépondérant chez le jeune enfant avant que le système géniculostrié ne devienne progressivement fonctionnel à partir du 3e mois de vie. À l’inverse, l’existence d’anomalies du développement moteur dans certaines observations et l’aspect des réponses du nystagmus optocinétique ou des PEV plaident également pour un retard de maturation de la voie géniculostrié. Mais Hoyt évoque plutôt une anomalie du contrôle cortical de l’attention visuelle [6].
Tableau 24-1 Récapitulatif des différentes formes de retard de maturation visuelle.
ERG : électrorétinogramme ; FO : fond d’oeil ; IRM : imagerie par résonance magnétique ; N : normal ; PEV : potentiels évoqués visuels.
Dans la forme I (ou IA), le RMV se manifeste par un tableau de cécité apparente chez un nouveau-né né à terme ou n’ayant qu’une discrète prématurité ou un petit poids de naissance. Cet enfant ne montre aucun intérêt ni réponse aux stimuli visuels. Il n’y a aucun contact visuel avec cet enfant qui ne sourit pas en réponse aux stimulations de ces parents et dont il n’est pas possible d’accrocher le regard. L’examen ophtalmologique est normal, notamment les réflexes photomoteurs témoignant de la perméabilité de la voie rétinogéniculée. L’étude du fond d’œil est sans particularité, quoiqu’il a été rapporté une teinte « gris fer » caractéristique de la papille très évocatrice de ce RMV. Une légère incoordination oculomotrice, un nystagmus ou un strabisme divergent plus que convergent sont volontiers retrouvés [7]. Cette cécité est isolée quoiqu’un cas de retard de maturation auditive ait été rapporté [5].
La phase rapide du réflexe vestibulo-oculaire peut être absente. L’ERG est normal, alors qu’il est retrouvé une immaturité de la réponse des PEV avec une augmentation du temps de culmination des ondes dont l’amplitude est réduite et une absence de réponse N1, principalement sous stimulation par flashes [8]. La normalisation des PEV se fait en parallèle à la récupération visuelle. Il est inutile de demander des examens neuroradiologiques lorsque le bilan initial est suffisamment évocateur de RMV. Néanmoins, il peut être préférable de les demander sans urgence à ce stade, car ils s’imposeront au plus vite si la récupération complète de la fonction visuelle n’est pas survenue à 6 mois.
La survenue de cette récupération visuelle avant l’âge de 6 mois vient confirmer le diagnostic. Elle est marquée par une recoloration de la papille et une disparition des troubles oculomoteurs [7]. Un nystagmus transitoire peut être constaté lors de cette période d’éveil visuel [9]. Il est admis que ces enfants ne présentent aucun trouble neurologique ultérieur. Néanmoins, il a été rapporté la survenue de tableaux cliniques proche du minimal brain disease [10].
La forme IB regroupe des enfants ayant présenté des problèmes périnataux sévères sans séquelle ultérieure. La récupération visuelle du RMV serait moins favorable que dans le groupe IA [4].
Dans la forme II sont inclus des enfants porteurs d’atteintes du système nerveux central ne permettant pas d’expliquer l’existence du RMV. C’est pourquoi les circonstances de sa découverte sont très différentes de celles du groupe précédant. Les manifestations neurologiques sont au premier plan alors que le tableau de cécité est souvent considéré comme secondaire. L’examen clinique retrouve la même absence de contact visuel que dans le premier groupe et la même normalité de l’examen du globe oculaire ou de la réfraction.
Le bilan électrophysiologique peut être moins évocateur de RMV. En effet, si l’ERG est normal, l’altération des PEV est d’interprétation difficile. Il faut faire la part du RMV lui-même et celle secondaire à l’atteinte du système nerveux central, notamment si celle-ci intéresse les voies optiques. L’examen neuropédiatrique et neuroradiologique a généralement été déjà réalisé lorsque l’enfant est vu en ophtalmologie et a permis de caractériser la pathologie neurologique sous-jacente : séquelle de prématurité, d’anoxie péri- ou néonatale, d’hémorragie méningée ou intraventriculaire, etc.
L’évolution visuelle est plus lente et plus prolongée que dans le groupe I puisqu’elle ne survient en moyenne que vers la 60e semaine [3]. Les séquelles neurologiques sont constantes.
La forme III correspond à un RMV survenant chez des enfants présentant une atteinte ophtalmologique (cataracte non obturante, albinisme, aniridie, troubles réfractifs, etc.) ne pouvant à elle seule expliquer le tableau de cécité observé [11].
L’interprétation du bilan électrophysiologique est difficile, car l’ERG peut être anormal du fait des anomalies ophtalmologiques associées, en imposant à tort pour une atteinte rétinienne. Le bilan neuroradiologique s’impose dès la découverte du tableau de cécité.
La récupération visuelle est tardive et lente, ne débutant en moyenne que vers la 30e semaine [3]. Au terme de l’évolution, la fonction visuelle est comparable à celle normalement attendue en présence des anomalies ophtalmologiques associées.
Le RMV, ou maladie de Beauvieux, est une pathologie non exceptionnelle qu’il faut évoquer devant un nouveau-né ayant un comportement d’aveugle ou de profond malvoyant sans anomalie ophtalmologique ni antécédent familiaux de malvoyance ou d’accident au cours de la grossesse. C’est pourquoi il faut être prudent avant d’annoncer un diagnostic de malvoyance et s’aider d’un bilan électrophysiologique qui permet d’éliminer les autres étiologies de cécité congénitale, au premier rang desquelles l’amaurose congénitale de Leber. Mais le diagnostic de RMV ne peut être porté avec certitude que devant la normalisation de la vision, qui survient avant le 6e mois de vie dans la forme isolée. C’est pourquoi il peut être utile de demander un bilan neuroradiologique sans urgence qui ne sera réalisé qu’en cas de non-récupération visuelle.
[1] Beauvieux J. La pseudo-atrophie optique des nouveau-nés (dysgénésie myélinique des voies optiques). Ann Ocul 1926 ; 163 : 881-921.
[2] Uemura Y, Oguchi Y, Katsumi O. Visual developmental delay. Ophthalmic Paediatrics and Genetics 1981 ; 1 : 49-58.
[3] Fielder AR, Russell-Eggitt IR, Dodd KL, Mellor DH. Delayed visual maturation. Trans Ophthalmol Soc U K 1985 ; 104 (Pt 6) : 653-61.
[4] Tresidder J, Fielder AR, Nicholson J. Delayed visual maturation : ophthalmic and neurodevelopmental aspects. Dev Med Child Neurol 1990 ; 32 : 872-81.
[5] Lambert SR, Kriss A, Taylor D. Delayed visual maturation. A longitudinal clinical and electrophysiological assessment. Ophthalmology 1989 ; 96 : 524-8.
[6] Hoyt CS. Constenbader lecture. Delayed visual maturation : the apparently blind infant. J AAPOS 2004 ; 8 : 215-9.
[7] Bianchi PE, Salati R, Cavallini A, Fazzi E. Transient nystagmus in delayed visual maturation. Dev Med Child Neurol 1998 ; 40 : 263-5.
[8] Kraemer M, Sjöström A. Lack of short-latency-potentials in the VEP reflects immature extra geniculate visual function in delayed visual maturation (DVM). Doc Ophthalmol 1998 ; 97 : 189-201.
[9] Godde-Jolly D, Dufier JL. Ophtalmologie pédiatrique. Troubles cliniques du développement visuel. I. Retard de maturation visuelle. Paris : Masson ; 1992, p. 85-6.
[10] Cole GF, Hungerford J, Jones RB. Delayed visual maturation. Arch Dis Child 1984 ; 59 : 107-10.
[11] Winges KM, Zarpellon U, Hou C, Good WV. Delayed visual attention caused by high myopic refractive error. Strabismus 2005 ; 13 : 75-7.

