Pathologies conjonctivales
Coordonné par D. Denis
Ce chapitre aborde une vaste étendue de pathologies responsables d’une inflammation de la conjonctive bulbaire et/ou tarsale. Elles comprennent essentiellement des causes infectieuses, vasculaires, tumorales, traumatiques et les sécheresses oculaires. Elles ont des aspects spécifiques qui les distinguent de celles de l’adulte, en particulier sur leur risque d’aggravation rapide.
B. Mortemousque
Les conjonctivites du nouveau-né se définissent comme une inflammation conjonctivale qui apparaît au cours des quatre premières semaines de vie (28 jours). Trois facteurs les favorisent : l’infection non traitée de l’appareil génital de la mère, les traumatismes obstétricaux lors de l’accouchement et l’exposition du nouveau-né aux germes de la mère (par rupture prématurée de la poche des eaux ou travail prolongé). Les principaux agents infectieux sont Neisseria Gonorrhoeae (gonocoque), Chlamydia trachomatis, l’herpès et les germes à Gram positif ou négatif. Il existe aussi des formes néonatales nosocomiales dues au staphylocoque doré, à Streptococcus pneumoniæ, Hæmophilus, aux streptocoques viridans et aux entérobactéries.
Elles peuvent être dues à une infection bactérienne acquise à la naissance, une infection à gonocoque ou à Chlamydia trachomatis constituant une véritable urgence thérapeutique. Elles peuvent se compliquer d’une infection des voies lacrymales (dacryocystite) : les germes les plus fréquemment retrouvés sont des staphylocoques, streptocoques, Hæmophilus et aussi Chlamydia trachomatis. Pour les infections à staphylocoque ou à streptocoque, la guérison se fait le plus souvent avec une bonne hygiène locale et un collyre antibiotique. La récidive doit faire évoquer une imperforation du canal lacrymonasal [1, 2, 3].
Le diagnostic de la conjonctivite bactérienne est clinique (œil rouge, sécrétions purulentes abondantes, souvent bilatérales), avec une notion d'épidémie. Dans certains cas, à partir de quelques signes cliniques, on peut suspecter certaines étiologies et donc adapter l'antibiothérapie probabiliste. Ainsi, par exemple :
kératite ponctuée superficielle + conjonctivite purulente = staphylocoque doré;
conjonctivite prédominant aux angles externes + lésions érythémateuses cutanées = Moraxella;
association otite-conjonctivite = Hæmophilus ou pneumocoque;
conjonctivites à répétition de l’enfant = imperforation des voies lacrymales;
pourtour méditerranéen + conjonctivite aiguë hémorragique = Hæmophilus ægyptus.
Les infections à gonocoque (Neisseria gonorrhoeæ) sont à l’origine de l’intérêt porté aux conjonctivites bactériennes du nouveau-né. Elles ont posé de sérieux problèmes dans le passé. Responsables d’une conjonctivite purulente floride, elles peuvent entraîner la cécité par atteinte cornéenne (opacification ou perforation). La méthode de Crédé n’est plus d’actualité, l’instillation de nitrate d’argent n’ayant plus l’autorisation de mise sur le marché (AMM) depuis 2008. La prévention n’est pas systématique, elle dépend de chaque maternité (abstention; instillation de collyre d’azythromycine, de rifamycine à raison d’un flacon par nouveau-né, ou de povidone iodée diluée à 2,5 % ).
Cependant, en raison de l’observation d’une recrudescence des infections sexuellement transmissibles (IST) et notamment des infections gonococciques dans les pays industrialisés (y compris en France), l’Afssaps a rédigé en 2010 des recommandations sur la prophylaxie des infections conjonctivales du nouveau-né. Rappelons que les infections gonococciques sont le plus souvent asymptomatiques chez la femme, justifiant un prélèvement vaginal en cas de signe clinique découvert à l’examen au spéculum, complété par un prélèvement systématique entre 35 et 38 semaines d’aménorrhée. Ce dépistage permet de déterminer les nouveau-nés « à risque » qui devront bénéficier d’une prophylaxie. Ces risques sont clairement établis : des parents à risque d’IST (antécédents, facteurs de risque, prélèvement en faveur) ou une grossesse non ou mal suivie. La prophylaxie recommandée est : instillation de 1 goutte de rifamycine collyre dans les deux yeux à la naissance. Cette conjonctivite à gonocoque débute classiquement dans les 5 premiers jours. Elle est rapidement très inflammatoire et très purulente, avec parfois des membranes séro-hémorragiques. En 15 jours, la cornée devient grisâtre et l’usage des stéroïdes expose au risque de perforation. Le traitement est une urgence, il repose sur l’association d’un traitement local et général. Le traitement général repose sur la céfotaxime à 100 mg/kg/j ou la ceftriaxone pendant 7 jours.
Les conjonctivites à Chlamydia sont plus fréquentes. Le nouveau-né se contamine avec Chlamydia trachomatis principalement lors du passage de la filière génitale à partir de l’infection vaginale de la mère. Le taux de transmission au nouveau-né à la naissance est élevé (50 à 70 % ). Le délai d’apparition est classiquement plus long que pour le gonocoque (5 à 14 jours). Le tableau clinique est souvent très inflammatoire avec conjonctivite pseudo-membraneuse. Le traitement est urgent en raison des risques de cicatrices cornéennes et doit passer par voie systémique : érythromycine 50 mg/kg/j pendant 14 jours ± collyres quinolone et traitement de la mère.
En raison de l'immaturité immunitaire du nouveau-né, les conjonctivites avec follicules sont rares.
Les prélèvements bactériologiques ne sont utiles qu’en cas d’échec thérapeutique (suspicion de résistance, récidive précoce), de terrain particulier (nouveau-né, retour de zone d’endémie, immunodéprimé) et de signes de gravité. Le prélèvement conjonctival est réalisé de préférence dans le cul-de-sac inférieur par écouvillonnage de l’angle externe à l’angle interne, sans instillation préalable d’anesthésique local. Il permet : un examen direct qui, s’il est positif, précise les affinités tinctoriales des bactéries et apporte des informations sur la réaction cellulaire associée (à polynucléaires neutrophiles classiquement); une mise en culture; la réalisation éventuelle d’un antibiogramme. En cas de conjonctivite infectieuse, les techniques de biologie moléculaire sont rarement utiles : polymerase chain reaction (PCR) spécifique méningocoque ou staphylocoque; PCR universelle acide ribonucléique (ARN) 16S; techniques de comparaison (random amplified polymorphic DNA [RAPD], pulsed field gel electrophoresis [PFGE]).
Bien que rare, l'agent viral responsable est le virus herpès simplex. La transmission maternofœtale se fait lors du passage par la filière génitale au cours de l'accouchement si la mère a une infection herpétique génitale active. Il s'agit du virus herpès simplex de type 2 dans 70 % des cas avec un contage fœtomaternel. L'herpès néonatal est rare (1/7 500 naissances) et touche davantage les jeunes primipares. Le tableau s'installe classiquement 15 jours après la naissance.
On observe quelques vésicules herpétiques sur la face (territoire V1) et/ou au bord palpébral, pouvant être associées à une conjonctivite uni- ou bilatérale peu sécrétante, non purulente, séro-hémorragique compliquée, et parfois à une kératite avec quelques microdendrites ou kératite ponctuée superficielle. Les lésions cornéennes sont souvent atypiques, car limbiques. La prévention de la conjonctivite à herpes virus passe par la surveillance des femmes porteuses d’herpès génital et la pratique d’une césarienne en cas d’herpès évolutif (voir chapitre 27-2) [3, 4].
B. Mortemousque
La conjonctivite allergique aiguë n'est pas à proprement dit une entité à part entière. Elle est l'expression aiguë des conjonctivites allergiques saisonnière (CAS) et perannuelle (CAP), encore appelées IgE médiée. Elle correspond à une manifestation anaphylactique aiguë en rapport avec un contact massif avec l'allergène sensibilisant. Sa clinique est le plus souvent « bruyante » . La symptomatologie est marquée par une atteinte souvent bilatérale. Les signes et symptômes sont un prurit intense souvent à point de départ caronculaire, un larmoiement accompagné d'un œdème palpébral et un chémosis parfois important masquant la rougeur conjonctivale. L'évolution se fait vers une résolution le plus souvent spontanée, pouvant se poursuivre par un certain degré de photophobie et/ou de sensation de brÛlures oculaires. Elle survient soit sur un terrain de conjonctivite perannuelle (lorsque l'allergène est présent toute l'année), soit sur un terrain de conjonctivite saisonnière (lorsque l'allergène est présent sur certaines périodes de l'année). Ainsi, en dehors de tout épisode aigu, les manifestations persistent tout au long de l'année avec des recrudescences à certaines périodes, en particulier au printemps et à l'automne. Les principaux signes cliniques de CAP sont une hyperhémie conjonctivale discrète, la présence de papilles tarsales, souvent de petite taille (Fig. 8-1) et plus rarement de follicules. La symptomatologie est marquée par la sensation de corps étranger, d'œil sec, plus que de prurit, souvent relégué au deuxième plan. Le diagnostic est posé devant une symptomatologie durant depuis plus d'un an et avec des manifestations se déroulant tout au long de l'année. Elle touche aussi bien l'enfant que l'adulte. Les principaux allergènes impliqués sont les moisissures, les acariens, les phanères d'animaux et les allergènes professionnels. La CAS est la forme la plus fréquente. Là aussi, en dehors de la poussée aiguë, les symptômes sont très discrets, voisins de ceux de la CAP. Les signes biomicroscopiques sont pauvres et souvent peu contributifs, avec le plus souvent une conjonctive très légèrement hyperhémiée ou normale. La présence de papilles n'est pas constante et, lorsqu'elles sont là, elles sont de petite taille. Parfois une kératite ponctuée superficielle discrète est visualisée à distance d'un épisode aigu.
Pour ces trois formes, l'atteinte ophtalmologique isolée est rare (moins de 6 % ), les signes et symptômes ORL et/ou bronchiques seront à rechercher, s'ils ne sont pas apparus avant la manifestation allergique [5, 6].
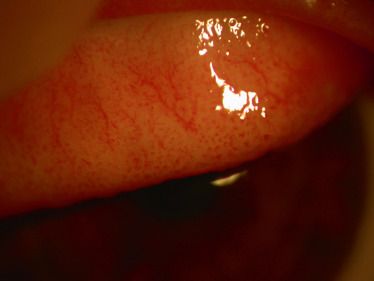
Fig. 8-1 Conjonctivite allergique IgE médiée, pailles tarsales de petite taille.
De nombreux virus sont impliqués dans les atteintes conjonctivales virales. Nous n'aborderons là que les formes les plus fréquentes [4, 7].
Elles surviennent généralement dans un contexte épidémique. Le plus souvent initialement unilatérales, elles se bilatéralisent de manière fréquente. Elles associent un œil rouge, peu ou pas prurigineux et un larmoiement clair abondant. À l'examen clinique, la palpation du visage peut retrouver des adénopathies prétragiennes et/ou sous-angulo-maxillaires. À la lampe à fente, follicules, chémosis et hémorragies sont fréquemment retrouvés. Selon le virus en cause, l'évolution peut se faire entre 2 et 6 semaines.
La cause la plus fréquente de conjonctivites virales est l’adénovirus dont on dénombre actuellement 51 sérotypes pathogènes pour l’homme. La kératoconjonctivite épidémique est associée aux sérotypes 8, 19 et 37. Ce sont les enfants et les adultes jeunes (à partir de 20 ans) qui sont les plus touchés par cette entité clinique. La maladie est hautement contagieuse et survient en petites épidémies en été et en hiver, se répandant au sein des collectivités. De façon inconstante, on peut observer des signes généraux de l’infection : une adénopathie prétragienne, une atteinte récente du tractus respiratoire supérieur, une fièvre et/ou des troubles gastro-intestinaux. Dans les formes sévères, la conjonctivite peut prendre une forme pseudo-membraneuse voire se compliquer de symblépharons ou d’une obstruction canaliculaire, immédiatement en aval des méats lacrymaux. Cette conjonctivite également peut se compliquer d’atteintes cornéennes. Celles-ci apparaissent dès la première semaine sous la forme d’une kératite ponctuée superficielle, responsable d’une photophobie. Dans la plupart des cas, ces lésions régressent spontanément, mais dans les cas sévères, les lésions fusionnent en fin de première semaine et donnent naissance à des infiltrats sous-épithéliaux qui font toute la gravité de la maladie (lésions immunologiques : infiltrats de lymphocytes). Leur localisation typiquement centrale sur l’axe optique peut avoir un impact visuel direct ou entraîner un astigmatisme irrégulier, qui chez l’enfant, expose au risque d’amblyopie. L’affection inflammatoire conjonctivale peut durer des mois. Pour d’autres sérotypes, les atteintes sont différentes, ainsi les sérotypes 3, 4 et 7 sont associés à la fièvre adéno-pharyngo-conjonctivale, alors que le sérotype 2 est associé à une forme chronique de kératoconjonctivite. Les autres sérotypes (1, 5, 6, 11, 13, 14, 15, 20, 21, 23, 24 et 29) sont, quant à eux, associés à des formes sporadiques.
L’aspect le plus évocateur de ces conjonctivites habituellement d’emblée bilatérales est la forme aiguë hémorragique en contexte épidémique. L’incubation est très courte (24 heures) et le début des symptômes est brutal (œdème palpébral, chémosis, larmoiement) avec des follicules très marqués dans les deux culs-de-sac. La conjonctive bulbaire supérieure est le siège d’hémorragies multiples dont la taille est variable. Les signes fonctionnels sont majeurs, à type de sensation de corps étranger, de brÛlures, voire de photophobie en cas d’atteinte cornéenne. La kératite ponctuée prédomine dans la cornée inférieure. Elle apparaît souvent 2 à 4 jours après la conjonctivite, sous forme de ponctuations superficielles qui peuvent devenir confluentes. La présence de ganglions prétragiens douloureux est notée dans 15 à 40 % des cas et leur apparition est légèrement retardée (2 ou 3 jours) après le début de la conjonctivite. Malgré un aspect impressionnant à la phase aiguë, l’évolution est souvent favorable en 1 semaine environ. Cependant, des opacités cornéennes peuvent aussi être observées, tout comme des uvéites hypertensives et des névrites rétrobulbaires. Comme pour les adénovirus, la transmission des entérovirus se fait surtout par le manuportage et les eaux souillées, en particulier par les matières fécales. Les deux virus les plus classiquement impliqués sont l’entérovirus 70 (EV70) et le coxsackievirus A24 (CA24).
Depuis l’éradication du virus de la variole, le principal poxvirus responsable d’une atteinte de la surface oculaire est l’agent responsable du Molluscum contagiosum. Ces conjonctivites se rencontrent principalement chez l’enfant et le jeune adulte. Le virus se propage par le biais des mains contaminées lors du grattage de multiples lésions cutanées, typiques de cette atteinte virale. Elles sont facilement identifiables sur le visage, sous forme d’une petite tuméfaction de 1 à 2 mm de diamètre, avec en son centre une dépression (ombilic), pathognomonique de l’affection. La conjonctivite peut être chronique et folliculaire, parfois accompagnée d’une kératite ponctuée superficielle. L’atteinte oculaire est le plus souvent seulement réactionnelle aux lésions cutanées situées à distance. Il peut exister, rarement, des cas de Molluscum contagiosum de la conjonctive ou du limbe, notamment chez les patients immunodéprimés.
Les atteintes se manifestent pendant les premiers jours de l’invasion virale, sous forme catarrhale le plus souvent, avec parfois une tache de Köplick (pathognomonique de la rougeole), directement visible en regard de la conjonctive. L’atteinte est souvent associée à une kératite qui peut être ponctuée superficielle, ou avec des dépôts intrastromaux antérieurs. Le pronostic demeure en général excellent, sauf chez les enfants dénutris (déficit en vitamine A et/ou milieu défavorisé) pour lesquels la surinfection bactérienne peut être sévère avec des tableaux de fausses membranes, d’ulcérations majeures, voire de perforations (risque de perte du globe ou de taie centrale).
L’atteinte se manifeste sous la forme d’une conjonctivite folliculaire ou folliculopapillaire qui apparaît en général en même temps que les autres signes habituels de l’infection ourlienne et peut s’accompagner d’un chémosis et d’hémorragies sous-conjonctivales. Des formes sévères peuvent aussi associer une atteinte conjonctivale à une épisclérite, une sclérite, une uvéite antérieure ainsi qu’une dacryoadénite. Les kératites sont rares.
Leur fréquence est totalement inconnue, car ces conjonctivites sont souvent attribuées à tort à d’autres agents infectieux en raison de leur présentation souvent banale. La forme clinique la plus fréquente est celle d’une conjonctivite folliculaire avec présence d’un ganglion prétragien sensible à la palpation. La guérison est spontanément favorable en quelques jours, voire en 1 à 2 semaines. Les caractéristiques pouvant orienter l’enquête étiologique vers une infection herpétique sont l’unilatéralité de l’atteinte (88 % des cas) et une ulcération dendritique ou géographique de l’épithélium conjonctival (50 % des cas). On sait cependant que ces caractéristiques peuvent manquer, notamment dans les cas de primo-infection oculaire (moins de 6 % de toutes les primo-infections herpétiques) et/ou chez l’enfant, même s’il s’agit déjà d’un épisode récurrent. En réalité, les tableaux cliniques de l’atteinte pédiatrique et de la primo-infection herpétique sont très difficiles à discerner : la conjonctivite est souvent bilatérale et associée à une blépharite vésiculaire, voire à une atteinte cornéenne.
Elles sont essentiellement observées dans le cadre ou des suites d’une varicelle ou du zona. Ces conjonctivites à VZV, survenant dans le cadre d’une varicelle sont fréquentes mais discrètes, bien que catarrhales et bilatérales. Une conjonctivite est rapportée dans 38 % des cas de varicelle avec complication oculaire. L’origine varicelleuse ne fait pas de doute lorsque sont observées des phlyctènes limbiques associées aux vésicules cutanées sur les paupières, comme sur l’ensemble du corps, mais cette triade typique n’est pas la plus fréquente. Des uvéites antérieures peuvent être associées aux complications conjonctivales de la varicelle. Les conjonctivites contemporaines d’un zona ophtalmique signent une atteinte de la branche nasociliaire du nerf trigéminé. L’atteinte homolatérale à l’éruption cutanée peut être folliculaire ou folliculopapillaire, avec parfois un œdème conjonctival, des vésicules, des fausses membranes. Des hémorragies conjonctivales sont possibles ainsi que des formes avec fibrose conjonctivale, symblépharon et atrésie du point lacrymal [4, 7].
B. Mortemousque
La kératoconjonctivite vernale (KCV) est à mécanisme immuno-allergique complexe faisant intervenir des réponses à médiation humorale et cellulaire. Elle débute tôt dans l'enfance (80 % avant 10 ans), avec une moyenne entre 8 et 12 ans. Avant l'âge de 20 ans, le sex-ratio est de 2 sur 4 en faveur des garçons. Après 20 ans, la maladie atteint autant les hommes que les femmes. Elle est le plus souvent résolutive à l'adolescence, mais dans 10 % des cas environ, on observera une chronicisation avec évolution vers la forme de l'adulte ou vers une forme atopique. Son profil évolutif est variable selon les pays avec des formes souvent sévères en Afrique et au Japon. L'évolution est en général perannuelle avec, dans 77 % des cas, des recrudescences en période de chaleur et d'ensoleillement à savoir de février à septembre.
La symptomatologie est marquée par une sensation de corps étranger, plus ou moins associée à un prurit, un larmoiement et une photophobie intense. À cela s'associe, de façon fréquente, un blépharospasme avec difficulté d'ouverture des yeux le matin. Lors des épisodes aigus, des sécrétions muqueuses conjonctivales abondantes et épaisses peuvent prendre parfois un aspect de pseudo-membranes. Il faut garder à l'esprit que la gêne ressentie par l'enfant peut être responsable de véritables troubles du comportement et de retard scolaire. En raison des angoisses individuelle et familiale qu'elle suscite, cette forme clinique peut nécessiter un soutien psychologique.
La forme tarsale se caractérise par la présence de papilles géantes (diamètre > 1 mm) sur la conjonctive, le plus souvent supérieure (Fig. 8-2a). Elles aboutissent parfois à un épaississement palpébral responsable d’un pseudo-ptosis. La forme limbique peut être isolée ou associée à la forme palpébrale. La forme limbique pure est fréquemment rencontrée chez les sujets mélanodermes. On y observe un aspect de bourrelet gélatineux (Fig. 8-2b) du limbe au sein duquel on peut individualiser des nodules blanc jaunâtre appelés grains de Trantas. Il s’agit d’amas d’éosinophiles responsables de la libération de protéases (eosinophil cationic protein ou ECP ++), de chémokines et d’autres médiateurs de l’inflammation dont certains entraînent des lésions cornéennes parfois sévères. Un infiltrat stromal peut être retrouvé en regard de ces lésions limbiques réalisant un aspect de pseudo-gérontoxon. D’autres lésions cornéennes sont retrouvées dans ces KCV (voir chapitre 9). En fait, l’allergie n’est qu’un facteur aggravant ou déclenchant de la maladie, tout comme la sécheresse oculaire, la chaleur, les rayons ultraviolets et la corticothérapie au long cours [5, 6].
Elle se caractérise par une atteinte cornéoconjonctivale associée à une dermatite atopique et/ou un asthme. Elle touche le plus souvent l'adulte jeune (30 à 40 ans) de sexe masculin et est rapportée dans 25 à 40 % des dermatites atopiques. Mais elle est également rapportée chez l'enfant [8]. Elle est potentiellement cécitante par ses complications cornéennes.
La kératoconjonctivite atopique est chronique, la symptomatologie est caractérisée par une photophobie, un larmoiement et un prurit important. Comme dans la KCV, les sécrétions sont abondantes et épaisses. Les signes sont marqués par un eczéma quasi constant des paupières (Fig. 8-3), avec un aspect lichénifié de la peau des paupières, une meibomite, une madarose fréquente et une inflammation conjonctivale marquée par la présence de follicules et de papilles de la conjonctive tarsale. Ces papilles souvent géantes ne sont pas constantes. La conjonctive peut être le siège d’une fibrose et de symblépharons au stade avancé de la maladie (Fig. 8-4). Les complications cornéennes sont multiples et fréquentes (75 % des cas) à type de kératite ponctuée superficielle, d’ulcération et au maximum d’insuffisance limbique. L’évolution est souvent marquée par des complications iatrogènes (glaucome et cataracte cortisoniques) ainsi que des surinfections en cas de forme cortico-dépendante. Le kératocône est fréquemment associé à la maladie. Il existe une incidence plus marquée de décollement de rétine rhegmatogène.
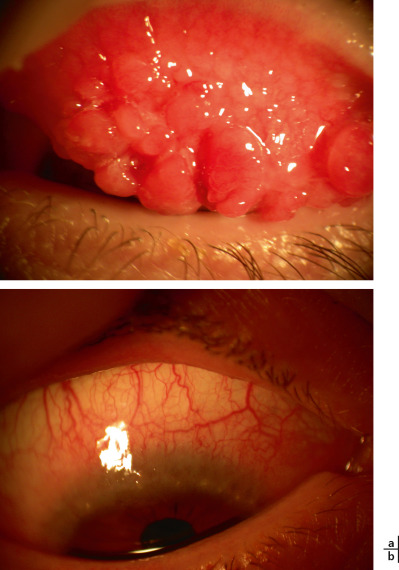
Fig. 8-2 Kératoconjonctivite vernale de forme tarsale (a) et de forme limbique (b).
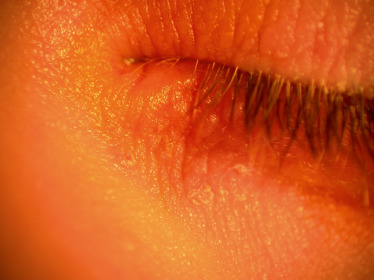
Fig. 8-3 Eczéma des paupières chez un patient souffrant de dermatite atopique.
D'un point de vue physiopathologique, cette entité est complexe. Elle associe des composantes mécaniques et des phénomènes d'hypersensibilité. Un terrain allergique est souvent retrouvé, mais n'est pas constant. Elle se définit par la présence de papilles géantes (Fig. 8-5) de la conjonctive tarsale et est induite par le port prolongé de lentilles de contact plus souvent souples que rigides. Elle peut cependant se rencontrer sur fil de suture cornéenne, bulle de filtration d'une chirurgie filtrante, matériel chirurgical (en particulier matériel d'indentation) ou tout autre « corps étranger » de la surface de l'œil.
La symptomatologie est marquée par une sensation de prurit (augmentée à l'ablation de la lentille), un larmoiement, des sécrétions muqueuses (pouvant être importantes) et une photophobie. La conjonctive tarsale est le siège de papilles de taille variable passant d'un aspect banal à celui de papille de grande taille (de 0,3 à 1 mm) ou à celui de papilles géantes (diamètre > 1 mm).
La forme typique est induite par le port prolongé de lentille souple (dans 47,5 % des cas), mais la conjonctivite gigantopapillaire peut survenir sur port de lentille rigide. Elle apparaît en moyenne après 8 ans de port de lentilles, les facteurs de risque essentiels sont la mauvaise hygiène des lentilles, un port trop prolongé et le jeune âge. L'état du film lacrymal, la courbure cornéenne et la réfraction n'influent pas.
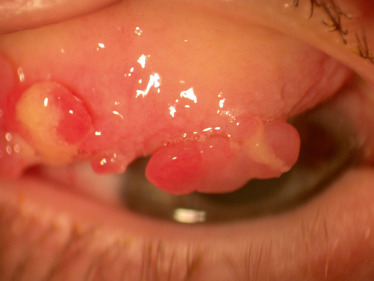
Fig. 8-4 Atteinte tarsale lors d’une kératoconjonctivite atopique avec papilles géantes et fibrose conjonctivale.
Celle-ci sera abordée plus en détail dans le chapitre 9 tant il est difficile d’en parler sans aborder l’atteinte cornéenne. L’expression clinique de la rosacée oculaire est extrêmement polymorphe, ce qui fait souvent errer et retarder le diagnostic. C’est un dysfonctionnement des glandes de Meibomius qui est à l’origine de l’affection. Chez l’enfant, les chalazions récidivants sont un bon signe d’appel. La conjonctivite est en général unilatérale ou asymétrique. On y retrouve des papilles qui orientent souvent à tort vers une allergie. Une hyperhémie conjonctivale bulbaire fluctuante est habituelle et prédominante dans la partie inférieure de l’œil. Dans les formes évoluant depuis un bon moment, une fibrose conjonctivale est classique, en général discrète mais elle est parfois à l’origine de symblépharons et d’un comblement des culs-de-sac conjonctivaux pouvant évoquer une pemphigoïde des muqueuses. Une conjonctivite phlycténulaire est plutôt l’apanage de la rosacée du sujet jeune (Fig. 8-6) [9].
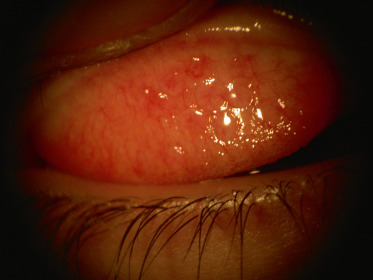
Fig. 8-5 Conjonctivite gigantopapillaire.
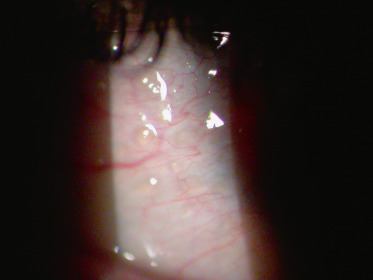
Fig. 8-6 Conjonctivite phlycténulaire sur dysfonctionnement des glandes de Meibomius de l’enfant.
B. Mortemousque
Il s’agit d’une conjonctivite chronique membraneuse rare (une centaine de cas dans la littérature), sa prévalence étant estimée à 1/625 000 naissances. Elle touche surtout les enfants. Elle débute par une conjonctivite aiguë pseudo-membraneuse, avec ou sans signes systémiques satellites (fièvre, atteinte des voies aériennes et de la sphère urogénitale). La phase « chronique » se caractérise par la formation récurrente de ces pseudo-membranes prédominantes sur la conjonctive tarsale avec une infiltration palpébrale dure comme du bois, d’où le terme de ligneuse. Les lésions peuvent toucher la cornée. Cette affection est liée à un déficit congénital en plasminogène (0,13 à 0,42 % des individus en bonne santé présentent un déficit congénital en plasminogène hétérozygote). L’affection peut atteindre les autres muqueuses. Le traitement ophtalmologique repose sur une ablation des membranes avec greffes de membranes amniotiques et instillation de collyres d’argatroban et d’héparinate de sodium toutes les heures, collyres anti-inflammatoires et plasma frais congelé [10, 11].
La maladie de Kawasaki est une vascularite systémique fébrile qui, en l'absence de traitement, se complique d'anévrismes coronaires dans 25 à 30 % des cas. Elle est la cause la plus fréquente de cardiopathies acquises chez les enfants dans les pays industrialisés et peut constituer un risque de cardiopathie ischémique de l'adulte. L'incidence de la maladie chez les enfants de moins de 5 ans est estimée à 8,1/100 000 au Royaume-Uni, 17,1/100 000 aux États-Unis et 112/100 000 au Japon. Le tableau associe, à une fièvre constante, des signes cutanéomuqueux (conjonctivite, pharyngite, langue framboisée, chéilite, éruption cutanée polymorphe, desquamation des extrémités) et des adénopathies cervicales. Le diagnostic de maladie de Kawasaki peut être retenu si la fièvre est associée à au moins quatre des cinq critères suivants : atteinte des extrémités, atteinte buccale, conjonctivite, exanthème polymorphe et adénopathie cervicale. La conjonctivite apparaît avec la fièvre; l'atteinte de la conjonctive bulbaire y est plus importante que l'atteinte palpébrale et il n'y a pas d'exsudat. L'examen à la lampe à fente montre parfois une uvéite antérieure.
Sa pathogénie est encore inconnue et plusieurs théories ont été proposées, incluant la possibilité d'une infection par micro-organismes sécrétant des toxines et d'un processus lié aux superantigènes. Malgré de nombreuses recherches, il n'y a pas encore de test diagnostique disponible et son diagnostic repose sur des critères cliniques après exclusion d'autres maladies comportant une fièvre élevée et persistante. Un diagnostic rapide est fondamental, car l'administration précoce d'immunoglobulines par voie intraveineuse associée à l'acide acétylsalicylique diminue la fréquence d'anomalies des artères coronaires à moins de 5 % [12].
La dysautonomie familiale (DF) est une maladie héréditaire caractérisée par une perte des sensations et par une altération sévère de l’activité du système nerveux autonome entraînant des dysfonctionnements multisystémiques. La DF affecte presque exclusivement la population juive d’Europe de l’Est avec une incidence annuelle de 1 sur 3600 naissances. Elle touche aussi bien les hommes que les femmes. Elle est présente dès la naissance et progressive. Les symptômes initiaux (de la naissance à 3 ans) associent des troubles de la déglutition, des pneumonies d’inhalation, une hypotonie, une instabilité thermique et un retard du développement. À la naissance, il n’y a pas de dysmorphie évidente mais une expression faciale caractéristique peut apparaître au cours du temps. Une cyphoscoliose sévère et une petite taille sont fréquentes. L’absence de larmes lors des pleurs est un des principaux signes de la maladie mais il peut ne pas être immédiatement reconnu (l’absence de débordement lacrymal est normale jusqu’à environ 7 mois). La sécheresse est sévère et expose à de nombreuses complications conjonctivo-cornéennes. En général, le dysfonctionnement autonomique est révélé en premier lieu par des difficultés d’alimentation dues à des troubles de la motricité digestive. Une maladie pulmonaire chronique (secondaire aux aspirations répétées), une maladie pulmonaire restrictive (due à une scoliose), une faiblesse musculaire et un dysfonctionnement des chimiorécepteurs (entraînant une réduction de la réponse à l’hypoxémie) sont fréquents. Une hypotension orthostatique sans tachycardie compensatoire est souvent rapportée. Une modification de la personnalité peut aller de l’irritabilité et du repli sur soi à l’excitation généralisée. Des crises cycliques de fréquence quotidienne, hebdomadaire ou mensuelle se manifestent chez 40 % des patients et surviennent au réveil. La perception de la chaleur et de la douleur est diminuée dans presque tous les cas mais n’est pas absente. Les réflexes tendineux profonds sont diminués. Une absence de réponse axonale à l’injection intradermique d’histamine et une absence de papilles fongiformes sur la langue sont des signes caractéristiques de la DF. Sa transmission est autosomique récessive. La DF est due à des mutations du gène IKBKAP localisé sur le bras long du chromosome 9 (9q31). Le diagnostic repose sur la reconnaissance clinique des dysfonctionnements sensitifs et autonomes. Les « principaux » critères incluent une alacrymie, une absence de papilles fongiformes, une diminution des réflexes rotuliens et un test histaminique anormal. Le diagnostic est définitivement confirmé par une analyse moléculaire [13].
Le syndrome triple A est une maladie multisystémique très rare, caractérisée par une insuffisance surrénale avec un déficit isolé en glucocorticoïdes, une achalasie, une alacrymie, une dysfonction autonomique et une neurodégénerescence. La prévalence est inconnue mais moins de 100 cas ont été rapportés depuis la première description en 1978.
La maladie débute dans la petite enfance ou à l'âge adulte. Dans la petite enfance, les signes révélateurs sont l'alacrymie et parfois l'achalasie. Dans l'enfance et à l'adolescence, les signes révélateurs sont une achalasie et une insuffisance surrénalienne. Enfin, à l'âge adulte, la présentation est majoritairement neurologique avec une atteinte autonomique et une polyneuropathie.
L'alacrymie est le premier signe clinique et se manifeste dans les premiers mois de vie mais l'achalasie du cardia, entraînant une dysphagie, est généralement le premier symptôme notable menant au diagnostic. L'insuffisance surrénale peut causer une hypoglycémie et une épilepsie. Les trois signes cardinaux peuvent ne pas être tous présents ou être associés à la dysfonction autonomique et à d'autres manifestations neurologiques, respectivement à l'origine des dénominations « syndrome des 2A » et « syndrome des 4A » . Les manifestations neurologiques sont diverses : la dysautonomie s'exprime par une dyshidrose et une dysfonction digestive, sexuelle, circulatoire et urinaire. Un syndrome pyramidal et une neuropathie périphérique entraînent des troubles de la marche et parfois un déficit sensoriel; les déficits bulbaires et faciaux sont responsables d'une insuffisance vélaire, d'une amyotrophie de la langue ou d'une parésie, d'une dysfonction du muscle orbiculaire de la bouche et d'une dysphagie oropharyngée.
La maladie est due à des mutations du gène AAAS (12q13), codant pour la nucléoporine ALADIN. Le diagnostic repose sur l’examen clinique et le test de la fonction surrénale. Il peut être confirmé par l’analyse moléculaire.
La présence de deux des trois signes cliniques (achalasie, alacrymie ou insuffisance surrénale) étant pathognomique, un autre diagnostic est possible quand un seul des signes cliniques est observé, par exemple au début de la maladie. Le diagnostic différentiel inclut aussi d'autres causes d'insuffisance surrénale, d'achalasie ou d'alacrymie telles que des formes fréquentes d'hyperplasie congénitale des surrénales (exclues facilement avec le dosage des précurseurs d'hormones surrénaliennes) et des formes périphériques rares d'insuffisance surrénalienne congénitale ou d'adrénoleucodystrophie qui peuvent être associées à des manifestations neurologiques. Le syndrome triple A se transmet sur un mode autosomique récessif [14].
B. Mortemousque
Le syndrome de Stevens-Johnson, encore appelé ectodermose érosive pluri-orificielle, est une dermatose bulleuse inflammatoire, survenant à tout âge et caractérisée par de possibles récurrences, parfois purement conjonctivales. Les facteurs déclenchants sont nombreux, médicamenteux (sulfamides, barbituriques, anti-inflammatoires non stéroïdiens, etc.) et infectieux (Mycoplasma pneumoniæ, virus herpès simplex, etc.). Dans les formes classiques, on note une éruption cutanée fugace prenant l’aspect de cocardes en certains endroits. Cette atteinte cutanée s’associe à des lésions muqueuses qui en font toute la gravité de la maladie. Les complications oculaires surviennent dans 50 % des cas et sont très polymorphes. Lors de la phase aiguë, l’inflammation palpébrale peut être associée à une conjonctivite simple ou pseudo-membraneuse pouvant se surinfecter s’associe à l’inflammation palpébrale. L’atteinte oculaire se caractérise surtout par la possibilité de séquelles cicatricielles sous forme de fibrose sous-conjonctivale et de symblépharons, d’un entropion-trichiasis entraînant une exposition cornéenne et d’un syndrome sec oculaire avec son cortège de complications cornéennes allant jusqu’au xérosis. Les récurrences oculaires, purement immunologiques, relèvent de la corticothérapie locale, générale ou d’un traitement immunosuppresseur en fonction de la gravité. À la phase séquellaire, des agents mouillants et une chirurgie conjonctivo-palpébrale sont nécessaires [15].
La maladie du greffon contre l'hôte est une pathologie systémique qui survient après greffe de cellules souches hématopoïétiques, pour traiter une leucémie ou une drépanocytose par exemple. Le nouveau système immunitaire du donneur s'attaque aux cellules de l'hôte, avec en particulier une atteinte qui peut être pulmonaire, hépatique, cutanée, digestive, muqueuse (muqueuse buccale notamment). Au plan ophtalmologique, il existe une atteinte oculaire du fait de la réaction immunitaire contre les molécules d'adhésion des cellules épithéliales de la conjonctive et de la cornée. Il existe une kératite ponctuée superficielle plus ou moins diffuse, les cellules épithéliales forment des filaments qui lèsent la cornée au clignement. Le traitement peut être difficile et repose sur : les agents mouillants, le traitement anti-inflammatoire local (corticothérapie ponctuelle et ciclosporine au long cours) et systémique, le collyre au sérum autologue, les bouchons lacrymaux, le port de verres scléraux, parfois la greffe ponctuelle de membrane amniotique, etc. [16].
Remerciements au Pr S. Milazzo et au Dr E. Zanin.
S. Milazzo
Le frottis conjonctival ne doit pas retarder la mise en route du traitement. Il est rarement nécessaire dans les formes aiguës.
Quand le réaliser ? Avant toute antibiothérapie.
Critères de gravité [17] :
sécrétions purulentes importantes ;
oedème palpébral ;
chémosis, fausses membranes ;
larmoiement important ;
photophobie ;
baisse d’acuité visuelle même modérée ;
ET
conjonctivite néonatale ;
échec du traitement.
Comment le réaliser ?
écouvillonages réalisés avec des gants stériles (deux écouvillons);
mettre un écouvillon dans le milieu de transport. L’autre est utilisé pour ensemencer deux boîtes de culture ;
raclage conjonctival sans anesthésique local (curette ophtalmologique ou cytobrush) ;
si culture cellulaire effectuée (suspicion de Chlamydia), placer ensuite dans un milieu M4R (retourner la paupière pour prélever préférentiellement les zones inflammatoires) ;
étalement du pus entre lame et lamelle : examen direct ;
ensemencement sur milieu enrichi et gélose au sang ;
demande coloration de Gram (examen direct) ;
immunofluorescence directe ;
ELISA (enzyme-linked immunosorbent assay) et PCR.
Le transport au laboratoire doit être le plus rapide possible [18]. Le prélèvement doit être accompagné d’une fiche de renseignements cliniques et d’une demande ciblée spécifique pour la recherche de certains germes (cocci à Gram négatif, Chlamydia).
Conclusion : le prélèvement n’est pas obligatoire sauf devant des signes de gravité, une forme résistante au traitement et chez le nouveau-né. Les parents doivent avoir donné leurs accords.
Un résultat bactériologique discordant ne doit pas faire modifier un traitement efficace.
A. Sauer
Le diagnostic de la conjonctivite de l'enfant est clinique. Il repose sur la présence d'un œil rouge accompagné d'une gêne (prurit, sensation de corps étranger) et d'un larmoiement. Le diagnostic étiologique de conjonctivite infectieuse est porté par élimination des autres causes (allergiques, toxiques, rosacée de l'enfant, etc.).
La différenciation entre une conjonctivite bactérienne et une conjonctivite virale repose encore sur les données de l’examen clinique. Les éléments en faveur d’une conjonctivite bactérienne (pathogènes les plus fréquents : Hæmophilus et Streptococcus pneumoniæ) sont : le caractère unilatéral, les sécrétions purulentes, l’association à une angine ou une otite. Les éléments en faveur d’une conjonctivite virale (pathogènes les plus fréquents : rhinovirus et adénovirus) sont : le caractère bilatéral, un larmoiement clair séromuqueux, un syndrome grippal et un catarrhe respiratoire, la présence d’un ganglion prétragien et la notion de contage 5 à 10 jours avant la poussée. Il n’y a pas d’indication à un écouvillonage des sécrétions pour préciser le diagnostic étiologique. La seule indication à un examen microbiologique est la présence d’une kératite.
Le traitement de la conjonctivite de l'enfant repose sur la présence de facteurs de risque et/ou de critères de gravité, qui font craindre une évolution péjorative de la conjonctivite. Les facteurs de risque tiennent compte d'une éventuelle immunodépression (corticothérapie locale en cours, chirurgie oculaire récente, patient greffé de cornée ou diabète) ou d'un terrain particulier (monophtalme, nouveau-né, port de lentilles de contact et troubles palpébraux). Les critères de gravité sont les suivants : sécrétions très purulentes, œdème palpébral, chémosis et signes de kératite (photophobie et baisse d'acuité visuelle).
En l’absence de facteur de risque et de critère de gravité, le traitement repose sur un lavage oculaire abondant associé éventuellement à un antiseptique en collyre. Seuls les antiseptiques majeurs ont démontré une efficacité clinique dans les infections cornéennes. Les antiseptiques majeurs utilisables en pratique routinière sont ceux de la famille des biguanides : chlorhydrate de picloxydine (Vitabact®) ou chlorhexidine (Dacryne®).
En présence de facteurs de risque ou de critères de gravité, le traitement repose sur un lavage oculaire abondant associé à un antibiotique collyre. Le choix de la molécule antibiotique est probabiliste sur le pathogène supposé responsable et tient compte du spectre de résistance des pathogènes impliqués dans les conjonctivites de l'enfant. Les trois possibilités sont :
azithromycine : 1 goutte matin et soir pendant 3 jours ;
tobramycine : 1 goutte 4 fois/j pendant 7 jours ;
rifamycine collyre : 1 goutte 4 fois/j pendant 7 jours.
Les quinolones ne sont pas un traitement de première intention des conjonctivites infectieuses de l'enfant. L'ajout de collyres anti-inflammatoires n'est pas indiqué.
V. Promelle
C. Costet
Une conjonctivite à la crèche ou à l'école pose deux problèmes :
l’orientation étiologique devant une pathologie généralement bénigne pour laquelle il faudra parfois savoir éliminer des problèmes potentiellement amblyogènes;
la décision possible d’une éviction au sein d’une collectivité pédiatrique, devenant un problème de santé publique.
Le Conseil supérieur d’hygiène publique de France (CSHPF), à la demande du directeur général de la santé, a édité le 28 septembre 2012 un Guide des conduites à tenir en cas de maladies infectieuses dans une collectivité d’enfants ou d’adultes (actualisation du Guide des conduites à tenir en cas de maladies transmissibles dans une collectivité d’enfants du 14 mars 2003), avec pour objectifs la considération d’une éviction temporaire, les mesures de prévention à prendre dans la collectivité et l’établissement d’une fiche précise de recommandation pour chaque pathologie contagieuse [24]. Dans ce guide, repris sur le site Internet www.amelie.fr de l’Assurance maladie et diffusé dans les collectivités, l’éviction n’est formellement préconisée que pour un nombre restreint de pathologies : coqueluche, diphtérie, gale, gastroentérite à Escherichia coli ou à Shigella, hépatite A ou E, impétigo étendu, infections à Clostridium difficile, infections à streptocoque A, angine, scarlatine, infections à méningocoque, méningite à Hæmophilus et à pneumocoque, rougeole, teigne, tuberculose, typhoïde. Ainsi, selon le CSHPF, la conjonctivite ne relève pas d’une éviction ou d’un isolement, mais d’une « application stricte des mesures globales d’hygiène et des mesures d’hygiène des mains » . Il est cependant, de manière générale, rappelé que « la fréquentation de la collectivité à la phase aiguë d’une maladie infectieuse n’est pas souhaitable, même si l’agent pathogène ne justifie pas par lui-même une éviction temporaire de la collectivité » . Chaque crèche ou école a de plus un règlement intérieur propre, sur lequel il est souvent stipulé « éviction si conjonctivite » . Le médecin traitant ou l’ophtalmologiste peuvent ainsi décider, même en l’absence de caractère réglementé obligatoire, d’une éviction et de sa durée. Selon la circulaire de rationalisation des certificats médicaux de 2011 [25], un certificat médical n’est nécessaire qu’en cas d’absence supérieure ou égale à 4 jours en crèche, et qu’en cas de maladie contagieuse pour une absence à l’école. La réintégration scolaire ne nécessite pas de certificat.
L'ophtalmologiste, tant pour mettre en route un traitement que pour décider d'une éviction d'une collectivité d'enfant, devra, comme déjà explicité dans les précédentes questions courantes de ce chapitre, savoir différencier une conjonctivite infectieuse bactérienne ou virale d'une conjonctivite allergique. Il aura éliminé devant des problèmes itératifs, un trouble de réfraction, une asthénopie, une rosacée oculaire, toutes pathologies pouvant à des niveaux de gravité différents, pénaliser la scolarité de l'enfant.
La décision de l'éviction scolaire sera prise devant une conjonctivite infectieuse (Fig. 8-7) en fonction de son importance, de sa gravité, de la durée présumée selon l'étiologie et de la phase de contagiosité après le début des symptômes (1 à 7 jours pour une conjonctivite bactérienne, 14 jours pour une conjonctivite virale). Il faut rappeler la fréquence, chez l'enfant par rapport à l'adulte, des conjonctivites bactériennes [26] : 50 à 75 % des conjonctivites infectieuses de l'enfant [27] touchent un enfant d'âge scolaire sur huit [28], avec une résolution généralement rapide en 4 à 7 jours, par rapport à celle plus longue de l'adulte de 1 à 3 semaines. Les fièvres adéno-pharyngo-conjonctivales ou les kératoconjonctivites épidémiques sont beaucoup plus rares. La durée de la contagiosité est importante à préciser aux parents afin d'orienter les mesures préventives d'hygiène, tant au domicile de l'enfant que dans la collectivité (lavages des mains, des jouets, des doudous, des surfaces pouvant être en contact avec l'enfant malade, serviettes et gants de toilette dédiés). L'ophtalmologiste en tiendra également compte pour la désinfection au sein du cabinet, sachant qu'un virus peut survivre 4 semaines sur une surface inerte. Enfin, il faut souligner la particularité du nourrisson en crèche, avec le problème de l'obstruction congénitale des voies lacrymales (Fig. 8-8), se manifestant par un larmoiement clair chronique entrecoupé d'épisodes de sécrétions conjonctivales : l'éviction de la crèche ne peut se justifier que lors des épisodes potentiellement contagieux de surinfection.
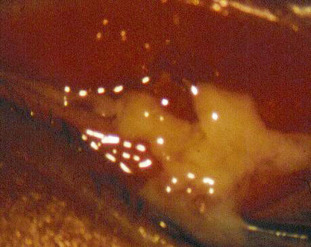
Fig. 8-7 Conjonctivite bactérienne à Hæmophilus influenzæ.
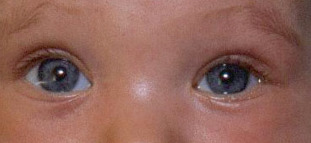
Fig. 8-8 Obstruction des voies lacrymales du nourrisson.
[1] Robert PY, Sabatier A. Conduite à tenir devant une conjonctivite infectieuse. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie, article 21-130-D-10. 2011 : p. 1-12.
[2] Muselier-Mathieu A, Bron A, Creuzot-Garcher C. Conjonctivites bactériennes aiguës et chroniques. In : Rapport SFO 2015, La surface oculaire. Issy-les-Moulineaux : Elsevier Masson ; 2015, p. 274-82.
[3] Gaudray Hebert AS. Démarche d’optimisation de la prévention de la conjonctivite du nouveau-né [thèse pour le diplôme d’État de docteur en pharmacie]. Rouen ; 2012.
[4] Labetoulle M, Rousseau A, M’garrech M, et al. Atteintes virales de la surface oculaire. Herpes Simplex Virus et virus varicelle–zona. In : Rapport SFO 2015, La surface oculaire. Issy-les-Moulineaux : Elsevier Masson ; 2015, p. 291-304.
[5] Mortemousque B. Conjonctivites allergiques. Encycl Méd Chir (Elsevier, Paris). Ophtalmologie, article 21-130-E-10. 2013 : p. 1-11.
[6] Mortemousque B, Brémond-Gignac D. Allergie oculaire : conjonctivites allergiques IgE médiée. In : Rapport SFO 2015, La surface oculaire. Issy-les-Moulineaux : Elsevier Masson ; 2015, p. 229-232.
[7] Labetoulle M, Bonin L, Rousseau A, et al. Atteintes virales de la surface oculaire hors herpes simplex virus et virus varicelle–zona. In : Rapport SFO 2015, La surface oculaire. Issy-les-Moulineaux : Elsevier Masson ; 2015, p. 283-91.
[8] Brémond-Gignac D, Nischal KK, Mortemousque B, et al. Atopic keratoconjunctivitis in children : clinical features and diagnosis. Ophthalmology 2016 ; 123(2) : 435-7.
[9] Doan S, Brémond-Gignac D, Castelain M, et al. Dysfonctionnements meibomiens et blépharites. In : Rapport SFO 2015, La surface oculaire. Issy-les-Moulineaux : Elsevier Masson ; 2015, p. 213-29.
[10] Schuster V, Seregard S. Ligneous conjunctivitis. Surv Ophthalmol 2003 ; 48 : 369-88.
[11] Schuster V, Hügle B, Tefs K. Plasminogen deficiency. J Thromb Haemost 2007 ; 5 : 2315-22.
[12] Cimaz R, Lega JC. La maladie de Kawasaki. Encyclopédie Orphanet, décembre 2007. En ligne : http://www.orpha.net/data/patho/Pro/fr/Kawasaki-FRfrPro788.pdf
[13] Axelrod F, Gold-Von Simson G. Syndrome de Riley day. Orphanet Journal of Rare Diseases 2007 ; 2 : 39.
[14] Nicolino M. Syndrome du triple A d’Allgrove. Encyclopédie Orphanet, avril 2013. En ligne : http://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=FR&Expert=869
[15] Gabison E, Doan S, Hoang-Xuan T. Pathologie immunologique de la conjonctive (en dehors de l’allergie). Encycl Méd Chir (Elsevier, Paris). Ophtalmologie, article 21-130-E- 15. 2006 : p. 1-9.
[16] Balasubramaniam SC, Raja H, Nau CB, et al. Ocular Graft-Versus-Host Disease : a review. Eye Contact Lens 2015 ; 41 : 256-61.
[17] Agence française de sécurité sanitaire des produits de santé (AFSSAPS). Collyres et autres topiques antibiotiques dans les infections superficielles. Recommandations et argumentaire, juillet 2004.
[18] Manuel de prélèvement Bioexcel 2014. En ligne : www.bioexcel.fr
[19] Speeg-Schatz C, Bourcier T. Conjonctivites du nouveau-né et de l’enfant. Réflexions Ophtalmologiques 2009 ; 14 : 248-52.
[20] Matejcek A, Goldman RD. Treatment and prevention of ophthalmia neonatorum. Can Fam Physician 2013 ; 59 : 1187-90.
[21] Dageville C. La prophylaxie des infections conjonctivales du nouveau-né est-elle justifiée dans les maternités françaises ? Archives de Pédiatrie 2015 ; 22 : 128-29.
[22] Agence française de sécurité sanitaire des produits de santé (AFSSAPS). Prophylaxie des infections conjonctivales du nouveau-né. Mise au point, novembre 2010.
[23] Mishori R, McClaskey EL, Winklerprins VJ. Chlamydia trachomatis infections : screening, diagnosis and management. Am Fam Physician 2012 ; 86 : 1127-32.
[24] Guide des conduites à tenir en cas de maladies transmissibles dans une collectivité d’enfants. CSHPF, 28 septembre 2012.
[25] Circulaire DSS/MCGR/DGS no 2011-331 du 27 septembre 2011 relative à la rationalisation des certificats médicaux. En ligne : http://www.social-sante.gouv.fr/IMG/ pdf/331Circulaire_certificats_medicaux.pdf
[26] Doan S. Infections. In : Goberville M, Dureau P. Ophtalmologie pédiatrique et strabismes. Segment antérieur et annexes. Paris : Lavoisier ; 2014, p. 45-53.
[27] Gabison E, Doan S, Hoang-Xuan T. Infectious conjunctivitis and keratitis. In : Benitez- Del-Castillo J, Lemp M. Ocular surface disorders. London : JP Medical ; 2013.
[28] Speeg-Schatz C. Conjonctivites infectieuses du nouveau-né et de l’enfant. In : Bourcier T, Bodaghi B, Bron A. Les infections oculaires – Rapport des Sociétés d’Ophtalmologie de France. Marseille : Groupe Ciel ; 2010, p. 108-10.
C. Levy-Gabriel
Chez l’enfant, la plupart des tumeurs conjonctivales sont bénignes (97 % des 262 tumeurs conjonctivales de l’enfant publiées par Shields en 2007 [1]). Les plus fréquentes sont les nævi et les choristomes. Les papillomes et les tumeurs vasculaires (hémangiome capillaire et lymphangiectasies conjonctivales) arrivent en troisième et quatrième positions par ordre de fréquence mais ne représentent plus que 10 à 15 % des cas [2, 3]. Les tumeurs conjonctivales malignes sont exceptionnelles : elles surviennent en général sur des terrains prédisposés très particuliers comme le xeroderma pigmentosum. Enfin, certaines lésions non néoplasiques ne doivent pas être confondues avec des pathologies tumorales : les kystes d’inclusion épithéliale, les granulomes inflammatoires et pyogéniques.
Le nævus est la plus fréquente des tumeurs conjonctivales de l'enfant. Il représente 64 % des tumeurs conjonctivales dans la série clinique pédiatrique de Shields et 30 % des tumeurs ayant bénéficié d'une exérèse chirurgicale dans les deux séries anatomopathologiques pédiatriques.
En histologie, le nævus est constitué de cellules næviques arrangées en thèques. Ces thèques, initialement localisées à la jonction entre l'épithélium et le chorion, descendent ensuite dans le chorion et perdent leurs connexions avec l'épithélium. Un nævus localisé à la jonction épithélium-chorion est appelé nævus jonctionnel, alors qu'un nævus exclusivement localisé au niveau du chorion sera appelé nævus sous-épithélial ou intrastromal. Lorsque la prolifération est à la fois jonctionnelle et sous-épithéliale, on parle de nævus composé (Fig. 8-9). Sur une série histologique pédiatrique de 33 nævi conjonctivaux, Thiagalingam retrouve 80 % de nævi composés. L'auteur insiste sur les particularités histologiques des nævi pédiatriques qui posent parfois des problèmes de diagnostic différentiel délicats avec les mélanomes malins [4].
Cliniquement, le nævus peut être présent à la naissance ou apparaître au cours de la première ou deuxième décade. Il se présente sous la forme d'une lésion plane ou sessile très discrètement en relief. Chez le petit enfant, il est souvent peu pigmenté voire totalement achrome avec un aspect rosé, la pigmentation de la lésion apparaissant progressivement pendant l'enfance et surtout l'adolescence (Fig. 8-10). Chez l'enfant mélanoderme, le nævus peut à l'opposé présenter précocement une pigmentation dense et plus marquée. La présence de kystes intralésionnels est possible et plaide en faveur de la bénignité de la lésion. Dans environ un cas sur trois, on peut visualiser un fin réseau vasculaire au sein de la lésion (21 à 38 % ) ou la présence de vaisseaux nourriciers dilatés (27 à 33 % ). La localisation de prédilection du nævus est la conjonctive bulbaire dans l'aire de la fente palpébrale (67 % ) (Fig. 8-11). La localisation caronculaire ou au niveau du repli semi-lunaire est moins fréquente (31 % ) (Fig. 8-12), et les nævi sont très rares au niveau de la conjonctive palpébrale (moins de 3 % ) [5, 6]. Le diamètre du nævus est en moyenne de 4 mm mais peut varier de 0,2 à 30 mm (Fig. 8-13).
Devant un aspect pigmenté de la surface oculaire chez l'enfant, les principaux diagnostics différentiels à évoquer sont la mélanose ethnique et la mélanocytose uvéale. La mélanose ethnique est très courante mais ne se voit que chez les patients à la peau pigmentée (Fig. 8-14). La pigmentation conjonctivale est bilatérale et relativement symétrique, plane, à bords irréguliers, elle prédomine au voisinage du limbe sur 360°. En anatomopathologie, elle se caractérise par une prolifération lentigineuse de mélanocytes d'aspect bénin le long de la membrane basale de l'épithélium. La mélanocytose uvéale n'est toutefois pas une lésion de la conjonctive mais un nævus bleu localisé au niveau du tractus uvéal. Elle se présente sous la forme d'une pigmentation bleu-gris congénitale et unilatérale visible au niveau de la sclère (Fig. 8-15a). La mélanocytose uvéale est souvent associée à une mélanocytose irienne (avec aspect d'hétérochromie irienne avec iris plus foncé et mamillation) et à une mélanocytose dermique (avec nævus bleu de la zone cutanée péri-oculaire), on parle alors de nævus d'Ota (Fig. 8-15b). Dans ce contexte, le risque de mélanome uvéal est augmenté et justifie une surveillance annuelle du fond d'œil.
Devant une tumeur conjonctivale achrome, les principaux diagnostics différentiels du nævus chez l'enfant sont le granulome inflammatoire et le papillome. Les nævi sont en général stables dans le temps. Ils peuvent cependant présenter quelques discrètes et très lentes modifications de la taille ou de la pigmentation, en particulier pendant la puberté, et donner une fausse impression d'apparition récente ou de croissance. Le risque de transformation maligne en mélanome est cependant très faible, inférieur à 1 % [1, 6]. La meilleure attitude consiste donc en une surveillance régulière avec réalisation de photos comparatives. L'exérèse chirurgicale ne sera réalisée qu'en cas de modification objective et suspecte, ou à la demande du patient pour des raisons esthétiques.
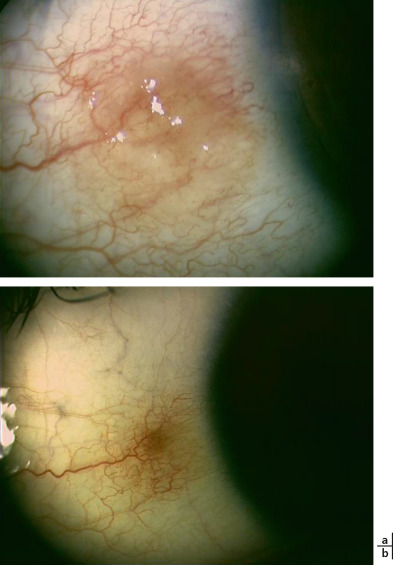
Fig. 8-10 Nævus achrome (a) chez un enfant de 8 ans avec début de pigmentation du nævus 2 ans plus tard (b).
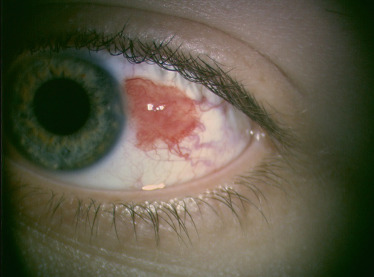
Fig. 8-11 Nævus composé kystique peu pigmenté chez un garçon de 13 ans.
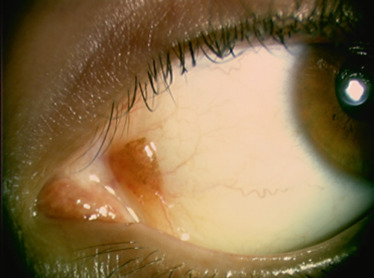
Fig. 8-12 Nævus du repli semi-lunaire déjà pigmenté chez un enfant mélanoderme de 5 ans.
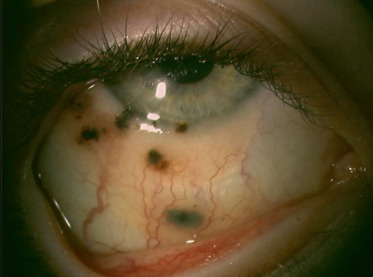
Fig. 8-13 Nævus géant étendu au limbe de 4 h à 9 h 30 chez un garçon de 9 ans, connu depuis l’âge de 1 an.
Le nævus est essentiellement achrome avec nombreux kystes
Les choristomes représentent entre 10 et 33 % des tumeurs conjonctivales de l’enfant. Ce sont des malformations congénitales bénignes constituées d’éléments tissulaires histologiquement matures, normalement non présents dans l’organe concerné. Les plus fréquents au niveau de la surface oculaire sont les dermoïdes du limbe et les dermolipomes. Les dermoïdes sont des choristomes simples constitués d’éléments cutanés (épiderme, poils, glandes sébacées). Plus fréquents chez les filles, ils se présentent comme une lésion surélevée en forme de dôme, ferme, blanc jaunâtre, typiquement située au niveau ou à cheval sur le limbe, souvent dans le quadrant inférotemporal (Fig. 8-16). Ils contiennent souvent des structures annexes dermiques. L’épithélium de surface peut être kératinisé ou non. Leur taille est variable, de quelques millimètres à plus d’un centimètre, les plus volumineux pouvant parfois envahir le centre de la cornée [7]. Dans la plupart des cas, la lésion est petite et asymptomatique et on se contente d’une surveillance. Les dermoïdes volumineux à l’origine d’un important astigmatisme avec perte d’acuité visuelle peuvent bénéficier d’une exérèse par kératosclérectomie lamellaire avec fermeture éventuelle par greffe de cornée. L’aspect esthétique est souvent amélioré mais l’astigmatisme et l’acuité visuelle peuvent rester inchangés [8, 9]. Le dermolipome est constitué des mêmes éléments que les dermoïdes mais avec plus de graisse. C’est aussi une lésion congénitale, mais elle n’est souvent détectable qu’à l’âge adulte, sous la forme d’une masse molle, jaune pâle, fusiforme, localisée au voisinage du pôle palpébral de la glande lacrymale, au niveau du cul-de-sac conjonctival temporal supérieur. Des structures annexes dermiques peuvent ou non être présentes. Ces lésions asymptomatiques ne requièrent aucun traitement. Les dermolipomes comme les tumeurs dermoïdes peuvent apparaître isolément ou, particulièrement en cas de forme bilatérale, faire partie d’un syndrome malformatif congénital (syndrome de Goldenhar ou syndrome du nævus sébacé linéaire). Les choristomes osseux (qui contiennent de l’os) et les choristomes complexes (qui associent différents composants choristomateux, par exemple, dermoïde ou dermolipome avec choristomes osseux) sont plus rares, et sont souvent difficiles à différencier cliniquement d’une dermoïde ou d’un dermolipome.
Le papillome est une tumeur épithéliale bénigne. Chez l’enfant, les papillomes sont en général petits, multiples et localisés au niveau du cul-de-sac inférieur (Fig. 8-17a). Ils se présentent sous la forme d’excroissances rosées d’aspect papillomateux et framboisé, sessile ou pédiculé (Fig. 8-17b). Ils sont associés au human papillomavirus (HPV) sous-types 6 et 11. L’examen histologique retrouve des papilles fibrovasculaires recouvertes d’un épithélium malpighien hyperplasique. Ces papillomes ont une évolution bénigne. Ils peuvent involuer spontanément sur plusieurs mois ou années et les papillomes bien tolérés peuvent donc être surveillés. En cas de papillome irritant ou inesthétique ou en cas de doute diagnostique (problème de diagnostic différentiel avec un rhabdomyosarcome par exemple comme dans le cas rapporté par Smith en 2007) [10], une exérèse chirurgicale sera proposée. L’exérèse chirurgicale doit être complète pour éviter les récidives et il faut se garder de manipuler directement la lésion pour ne pas libérer de particules virales dans les tissus avoisinants. Des traitements adjuvants locaux ou par voie orale sont possibles en cas de papillome récidivant ou invasif [11] : cryothérapie, laser, immunothérapie par le dinitrochlo-robenzène, collyres à l’interféron ou à la mitomycine. Une réponse spectaculaire à la cimétidine par voie orale a aussi été décrite.
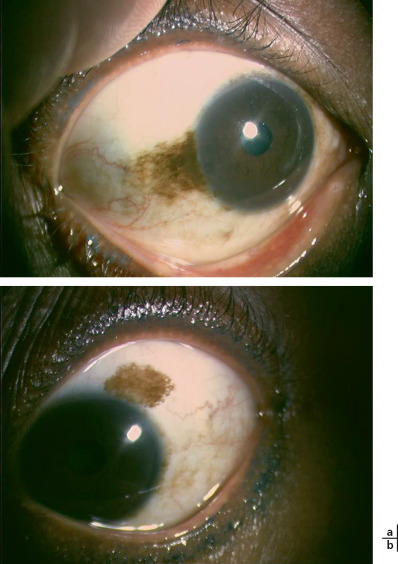
Fig. 8-14 a, b. Mélanose ethnique : oeil droit et oeil gauche.
Pigmentation plane périlimbique bilatérale chez un patient originaire d’Afrique centrale.
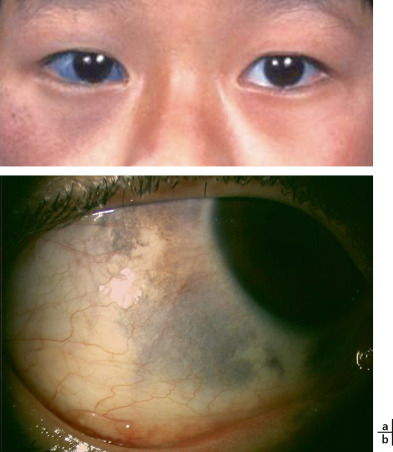
Fig. 8-15 Nævus d’Ota.
a. Mélanocytose oculodermique avec nævus bleu péri-oculaire chez une petite fille d’origine asiatique de 7 ans. b. Mélanocytose uvéale au niveau de l’oeil droit avec aspect gris-bleu de la sclère.
L'angiome capillaire est un hamartome, c'est-à-dire une tumeur congénitale bénigne correspondant à une prolifération anormale de tissu mature normalement présent dans l'organe concerné. Il apparaît rapidement après la naissance, grossit progressivement pendant 2 ans puis régresse lentement, tout comme les angiomes capillaires palpébraux ou orbitaires auxquels il est parfois associé [12]. En histologie, il est caractérisé par des proliférations de cellules endothéliales lobulaires séparées par un fin septum fibreux. Les lésions involuées sont moins vasculaires et plus fibreuses. À l'examen, l'angiome capillaire se présente comme une petite masse rouge plus ou moins étendue. La plupart sont de petite taille et asymptomatiques, ne nécessitant qu'une surveillance. Quelques cas de régression sous timolol topique ont été rapportés [13].
Les lymphangiectasies conjonctivales (Fig. 8-18) peuvent être isolées ou correspondre à la partie visible superficielle d'un lymphangiome orbitaire. Ces tumeurs conjonctivales sont rares, elles apparaissent cliniquement au cours de la première décade comme une masse unilatérale polylobée constituée de vaisseaux kystiques dilatés de taille variable. Dans la plupart des cas, les kystes ont un contenu sanguin brun violacé. Le traitement est souvent difficile, la chirurgie et la radiothérapie ne permettant pas d'éradiquer complètement la masse.
Les kystes d’inclusion épithéliale et les granulomes représentent selon les séries entre 10 et 30 % des tumeurs et pseudo-tumeurs conjonctivales de l’enfant.
Le kyste d’inclusion épithéliale apparaît sur le site d’un traumatisme accidentel ou chirurgical (après énucléation, chirurgie rétinienne ou pour strabisme) [14]. Cliniquement, la lésion a l’aspect d’une tuméfaction kystique et transparente au niveau de la surface oculaire (Fig. 8-19). Une hyperémie conjonctivale peut être associée. En histologie, on retrouve au niveau du chorion une cavité kystique entourée par un épithélium conjonctival. La lumière peut être vide, ou contenir du matériel protéique condensé et des débris cellulaires. Le traitement est l’excision chirurgicale complète, mais parfois une simple incision peut produire une communication avec l’épithélium de surface entraînant la régression du kyste.
Le granulome pyogénique est une prolifération fibrovasculaire survenant dans un contexte de chalazion (au niveau de la conjonctive palpébrale), de traumatisme accidentel ou chirurgical (granulome au niveau de l’insertion musculaire avec antécédent de chirurgie du strabisme, cavité d’énucléation). Il apparaît comme un nodule rouge, en relief, très vascularisé, au niveau de la conjonctive (Fig. 8-20) [12]. En histologie, il correspond à un tissu de granulation, c’est-à-dire une masse pédiculée composée d’un mélange de cellules inflammatoires aiguës et chroniques, avec prolifération capillaire. Les granulomes pyogéniques peuvent parfois répondre aux corticoïdes topiques, mais nécessitent souvent une exérèse chirurgicale.
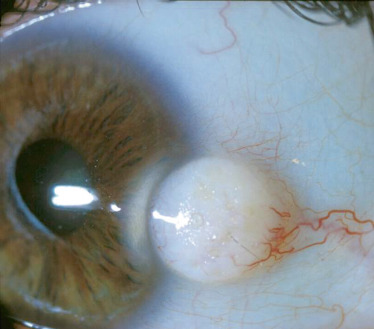
Fig. 8-16 Dermoïde du limbe chez une petite fille de 2 ans.
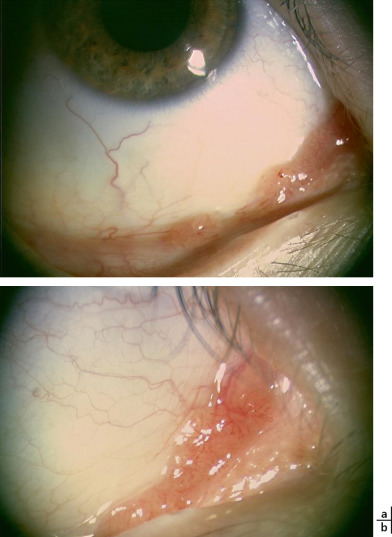
Fig. 8-17 Papillomes multiples du cul-de-sac conjonctival inférieur (a). À plus fort grossissement : excroissances rosées d’aspect framboisé pédiculé (b).
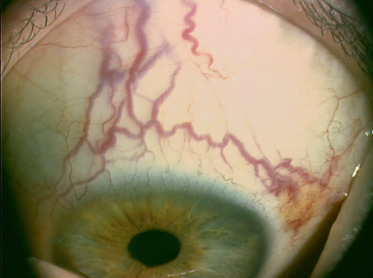
Fig. 8-18 Lymphangiectasies conjonctivales.
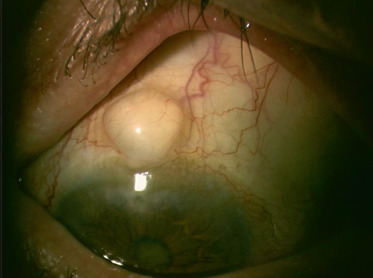
Fig. 8-19 Kyste d’inclusion épithélial.
Le développement pendant l'enfance de tumeurs conjonctivales malignes est tout à fait exceptionnel et se voit essentiellement chez des enfants présentant un xeroderma pigmentosum (XP). Le XP est une affection héréditaire à transmission autosomique récessive entraînant un défaut de la réparation de l'ADN [15]. Elle est très rare en Europe et aux États-Unis (prévalence 1/1 000 000), plus fréquente au Maghreb (1/10 000 en Tunisie) et au Moyen-Orient. Le tableau clinique est dominé par des manifestations cutanées et oculaires d'hypersensibilité au soleil avec apparition inéluctable de cancers cutanéomuqueux (risque 1 000 à 4 800 fois plus élevé que dans la population générale) (Fig. 8-21). Des néoplasies épithéliales de la surface oculaire (dysplasie modérée à sévère, carcinome in situ et carcinome invasif) apparaissent dans 10 à 70 % des cas selon les séries. Des mélanomes conjonctivaux et carcinomes sébacés peuvent aussi survenir dans ce contexte. La prise en charge thérapeutique pose souvent des problèmes thérapeutiques complexes : elle repose essentiellement sur des mesures de prévention, le but étant d'éviter au maximum l'apparition de carcinomes ou mélanomes invasifs et l'utilisation de la radiothérapie. La qualité de vie des patients est médiocre et le pronostic sombre (deux tiers des malades décèdent avant l'âge adulte).
Noter les lésions dysplasiques limbiques au niveau de l'œil droit.
Les tumeurs conjonctivales malignes de l'enfant sans contexte de XP ne représentent que quelques rares publications dans la littérature mondiale (mélanomes, tumeurs lymphoïdes ou leucémiques).
Enfin, devant une tuméfaction conjonctivale chez l'enfant, il faut toujours avoir à l'esprit la possibilité d'un rhabdomyosarcome. Bien que n'étant pas d'origine conjonctivale, cette tumeur maligne et agressive peut parfois se présenter sous la forme d'une masse sous-conjonctivale rosée, de croissance particulièrement rapide [16] : une biopsie et une prise en charge oncologique doivent être organisées en urgence.
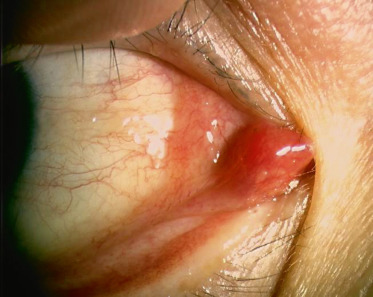
Fig. 8-20 Granulome conjonctival.
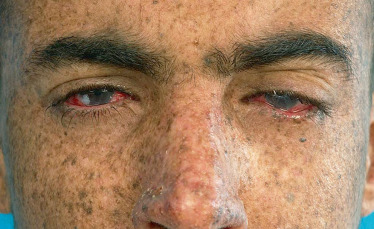
Fig. 8-21 Aspect de poïkilodermie chez un jeune homme de 16 ans présentant un xeroderma pigmentosum.
Noter les lésions dysplasiques limbiques au niveau de l’oeil droit.
[1] Shields CL, Shields JA. Conjunctival tumors in children. Curr Opin Ophthalmol 2007 ; 18 : 351-60.
[2] Cunha RP, Cunha MC, Shields JA. Epibulbar tumors in children : a survey of 282 biopsies. J Pediatr Ophthalmol Strabismus 1987 ; 24 : 249-54.
[3] Elsas FJ, Green WR. Epibulbar tumors in childhood. Am J Ophthalmol 1975 ; 79 : 1001-7.
[4] Thiagalingam S, Johnson MM, Colby KA, Zembowicz A. Juvenile conjunctival nevus : clinicopathologic analysis of 33 cases. Am J Surg Pathol 2008 ; 32 : 399-406.
[5] Levecq L, De Potter P, Jamart J. Conjunctival nevi clinical features and therapeutic outcomes. Ophthalmology 1016 ; 117 : 35-40.
[6] Shields CL, Fasiuddin AF, Mashayekhi A, Shields JA. Conjunctival nevi : clinical features and natural course in 410 consecutive patients. Arch Ophthalmol 2004 ; 122 : 167-75.
[7] Burillon C, Durand L. Solid dermoids of the limbus and the cornea. Ophthalmologica 1997 ; 211 : 367-72.
[8] Jeong J, Song YJ, Jung SI, Kwon JW. New surgical approach for limbal dermoids in children : simple excision, corneal tattooing, and sutureless limboconjunctival autograft. Cornea 2015 ; 34 : 720-3.
[9] Pirouzian A. Management of pediatric corneal limbal dermoids. Clin Ophthalmol 2013 ; 7 : 607-14.
[10] Smith A, Gupta A, Bonshek R, Leatherbarrow B. Conjunctival rhabdomyosarcoma presenting as a squamous papilloma. Eye (Lond). 2007 ; 21 : 281-3.
[11] Kothari M, Mody K, Chatterjee D. Resolution of recurrent conjunctival papilloma after topical and intralesional interferon alpha2b with partial excision in a child. J Aapos 2009 ; 13 : 523-5.
[12] Shields JA, Mashayekhi A, Kligman BE, et al. Vascular tumors of the conjunctiva in 140 cases. Ophthalmology 2011 ; 118 : 1747-53.
[13] Chang TC, Estes R. Beta blocker treatment of infantile conjunctival hemangiomas- -observations from 2 cases. J Aapos 1016 ; 18 : 80-2.
[14] Guadilla AM, de Liano PG, Merino P, Franco G. Conjunctival cysts as a complication after strabismus surgery. J Pediatr Ophthalmol Strabismus 2011 ; 48 : 298-300.
[15] Brooks BP, Thompson AH, Bishop RJ, et al. Ocular manifestations of xeroderma pigmentosum: long-term follow-up highlights the role of DNA repair in protection from sun damage. Ophthalmology 2013 ; 120 : 1324-36.
[16] Polito E, Pichierri P, Loffredo A, Lasorella G. A case of primary botryoid conjunctival rhabdomyosarcoma. Graefes Arch Clin Exp Ophthalmol 2006 ; 244 : 517-9.
D. Bremond-Gignac
L’œil sec ou kératoconjonctivite sèche est une maladie multifactorielle de la surface oculaire qui entraîne classiquement une gêne oculaire et une perturbation de la fonction visuelle. L’œil sec de l’enfant est une pathologie peu commune qui répond à plusieurs types de pathologies. Il est caractérisé par différents signes cliniques qui résultent d’une instabilité du film lacrymal et entraîne une perte de qualité de vie. Le film lacrymal est présent dès la naissance [1, 2], similaire à celui de l’adulte. Il est cependant inférieur chez l’enfant prématuré. Parmi les différentes formes d’œil sec, le syndrome de Sjögren est une maladie auto-immune avec une kératoconjonctivite sèche très sévère et affectant les autres muqueuses telles la muqueuse buccale. En 2007, un groupe d’étude, le Dry Eye WorkShop (DEWS), a publié un rapport fondé sur l’evidence-based medicine et portant sur la classification, les techniques diagnostiques, la recherche clinique et les stratégies thérapeutiques de l’œil sec [3]. Une nouvelle édition a été réalisée en 2016.
Le National Eye Institute a révisé la définition de l’œil sec de la manière suivante : « L’œil sec est une pathologie multifactorielle des larmes et de la surface oculaire qui entraîne des symptômes d’inconfort, de désordre visuel et d’instabilité du film lacrymal avec possiblement une atteinte de la surface oculaire. II est accompagné par une augmentation de l’osmolarité du film lacrymal et une inflammation de la surface oculaire. » La classification [3] différencie l’œil sec par déficit aqueux (aqueous deficient dry eye [ADDE]) et l’œil sec par évaporation (evaporative dry eye [EDE]).
L’ADDE est due à une réduction des sécrétions de larmes pas uniquement par la glande lacrymale, mais aussi par les glandes accessoires conjonctivales résultant des anomalies de la surface oculaire y compris la kératite. Il existe deux sous-groupes d’ADDE : le syndrome de Sjögren et le non-syndrome de Sjögren (par exemple quand le déficit lacrymal est dÛ à une toxicité par des traitements systémiques).
L’EDE peut être associé à une dysfonction des glandes de Meibomius, une anomalie de position des paupières ou un clignement oculaire anormal. Le déficit en vitamine A, le port de lentilles de contact, les conservateurs des collyres et l’allergie oculaire peuvent s’observer dans l’œil sec par évaporation.
La symptomatologie oculaire chez l’enfant peut être classique comme les picotements ou la sensation de corps étranger ou même d’œil sec. Des symptômes peu spécifiques comme une rougeur oculaire, un larmoiement, une photophobie ou un blépharospasme sont fréquemment observés [4]. Cependant elle peut être plus spécifiquement pédiatrique avec simplement un prurit oculaire ou frottement qui peut passer inaperçu auprès des parents et même des professionnels de santé. De surcroît les symptômes oculaires sont souvent très frustes chez l’enfant [5]. Un interrogatoire précis auprès des parents et si possible de l’enfant doit inclure le début et le mode d’apparition, la gêne alléguée ainsi que l’évolution sous traitement et les éventuelles complications. Il sera utile de rechercher des manifestations systémiques par exemple les anomalies rhumatismales accompagnant un syndrome de Sjögren. Il faut aussi rechercher les prises médicamenteuses pouvant entraîner une sécheresse oculaire comme les dérivés de l’isotrétinoïne, les cyclines ou les psychotropes. Plusieurs études ont évalué la symptomatologie de l’œil sec chez l’enfant versus celle observée chez l’adulte. Elles ont démontré que la plainte de l’enfant est très inférieure à celle des adultes, ainsi les praticiens pédiatres et ophtalmologistes doivent être très vigilants pour l’examen de l’enfant et éviter un diagnostic retardé entraînant une altération majeure et parfois irréversible de la surface oculaire. Le plus souvent, le diagnostic porté initialement est erroné, telle une conjonctivite infectieuse, une irritation oculaire ou un traumatisme. Chez l’enfant, le diagnostic d’œil sec doit être évoqué devant plus de deux épisodes de rougeur oculaire récidivants et non résolutifs en moins d’une semaine.
La plupart des tests utilisés chez l’adulte pour le diagnostic d’œil sec peuvent être effectués chez l’enfant, cependant certaines adaptations sont nécessaires dans la réalisation ou l’interprétation. L’examen des paupières et du clignement est souvent informatif. Il faut examiner le revêtement cutané à la recherche de sécheresse, les canthi médiaux et latéraux à la recherche de fissures et le rebord palpébral. La meilleure acuité visuelle corrigée doit être réalisée à l’examen initial puis suivie régulièrement. Le test à la fluorescéine permet de caractériser les conséquences de l’œil sec allant de la kératite ponctuée superficielle (Fig. 8-22) à l’ulcère de cornée. La kératite peut être évaluée et suivie grâce au score d’Oxford. Le test au vert de lissamine marque les anomalies conjonctivales. Pour l’évaluation de la sécrétion lacrymale, le test de Schirmer est difficile à réaliser chez l’enfant. En revanche, le break-up time (BUT) est simple et non invasif. Cependant les valeurs du temps de rupture du film lacrymal sont très différentes de celles de l’adulte. Selon l’étude de Jones, le BUT de l’enfant est en moyenne de 21,76 ± 4,06 s et doit être pris en compte pour l’évaluation de la sécheresse oculaire de l’enfant [6].
Les examens complémentaires ne sont pas toujours réalisables en particulier chez le jeune enfant. Une évaluation de l’osmolarité lacrymale (qui a été incorporée dans la première version du DEWS) est utile dans certains cas complexes ainsi qu’une analyse de la surface oculaire. Les empreintes conjonctivales mettent en évidence une sécheresse oculaire éventuellement associée à une inflammation oculaire. Un bilan pédiatrique est nécessaire dès lors que l’on suspecte une pathologie générale ou un syndrome associé.
Les étiologies de l’œil sec chez l’enfant sont souvent plus spécifiques de la pédiatrie. Les syndromes secs observés procèdent de nombreuses causes et se divisent de façon similaire à l’adulte en déficience aqueuse (ADDE) et en excès d’évaporation lacrymale (EDE). La Fig. 8-23 récapitule les nombreuses étiologies des syndromes secs de l’enfant. Certaines étiologies sont congénitales et d’autres acquises, certaines sont isolées et d’autres sont syndromiques. Une série prospective de 99 enfants avec clignement excessif a retrouvé 37 % d’anomalies du segment antérieur ou des paupières dues à une allergie, une sécheresse ou d’autres étiologies [7]. Les déficiences aqueuses regroupent le syndrome de Sjögren, les syndromes secs par déficience aqueuse non-Sjögren et les anomalies auto-immunes et inflammatoires incluant les réactions de greffon contre l’hôte et les étiologies virales [8]. L’excès d’évaporation lacrymale comporte les étiologies intrinsèques du film lacrymal et les causes extrinsèques. Le syndrome de Sjögren peut être primaire ou plus souvent secondaire à une arthropathie juvénile ou une maladie de Crohn et entraîne alors un syndrome sec sévère complexe à traiter. Certains syndromes sont classiques chez l’enfant mais rares tels que : le syndrome de Riley-Day, ou dysautonomie familiale d’origine génétique, comportant une alacrymie et des anomalies du système sympathique et parasympathique central et périphérique; le syndrome d’Allgrove associant une alacrymie, une achalasie et un déficit cortico-surrénalien; les dysplasies ectodermiques d’origine génétique comme le syndrome EEC (ectrodactyly-ectodermal dysplasia-cleft syndrome) associant des anomalies de l’ectoderme (peau, annexes, dents) et une kératite avec insuffisance limbique. Certains déficits multi-endocrines ou la mucoviscidose peuvent aussi entraîner un syndrome sec oculaire. Les causes iatrogènes de type médicamenteux doivent être recherchées devant une déficience lacrymale. Devant un excès d’évaporation, il faut rechercher et éliminer en premier les causes extrinsèques comme le déficit en vitamine A, l’allergie oculaire, la pollution, le port de lentilles de contact [9] et les autres sources d’anomalies de la surface oculaire favorisant l’évaporation des larmes. Parmi les causes intrinsèques d’excès d’évaporation, l’étiologie la plus fréquente et longtemps méconnue est le dysfonctionnement des glandes de Meibomius soit isolé, soit dans le cadre d’une rosacée oculaire. Les chalazions récidivants constituent souvent le premier signe d’appel et méritent systématiquement un examen soigneux de la surface oculaire, car ils peuvent s’accompagner de kératite souvent asymptomatique. Les anomalies de clignement ou palpébrales peuvent causer une évaporation excessive. Enfin, un examen par le dermatopédiatre peut être nécessaire si des anomalies cutanées sont visibles. La recherche de sécheresse oculaire et d’un double pli palpébral de Dennie-Morgan oriente vers une atopie cutanée et oculaire. Quoi qu’il en soit, l’étiologie doit être recherchée soigneusement selon le type d’œil sec observé afin d’adapter le traitement à effectuer.
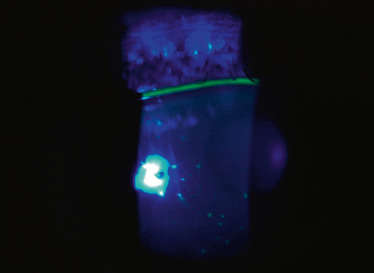
Fig. 8-22 Kératite ponctuée superficielle chez une enfant avec un syndrome de Sjögren.
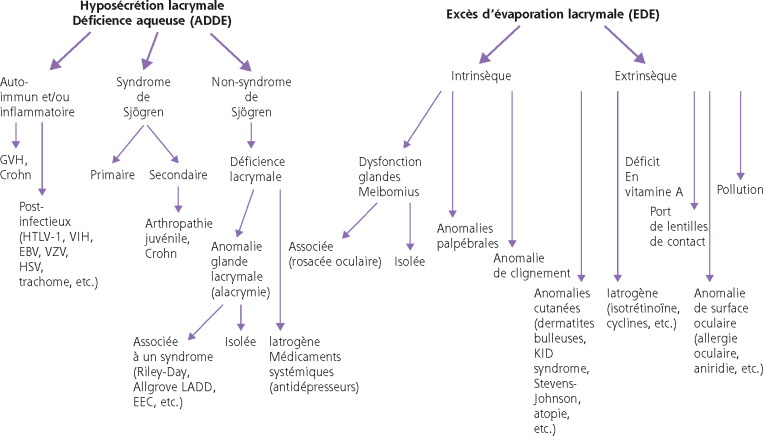
Fig. 8-23 Étiologies de l’oeil sec de l’enfant selon la classification du DEWS.
EBV : virus d’Epstein-Barr ; EEC : ectrodactyly-ectodermal dysplasia-cleft syndrome ; GVH : graft versus host ; HSV : herpes simplex virus ; TLV-1 : human T-lymphotropic virus de type 1 ; LADD : lacrymo-auriculo-dento-digital ; VIH : virus de l’immunodéficience humaine ; VZV : virus varicelle-zona.
Le traitement est complexe, car il implique le plus souvent une prise en charge au long cours [10]. Le traitement initial consiste en l'application de prévention de mesures environnementales et en une supplémentation lacrymale non conservée. De nouvelles formulations des supplémentations lacrymales existantes sur le marché peuvent être choisies en fonction du type de sécheresse oculaire. Certains traitements topiques innovants ciblent plus particulièrement certaines couches du film lacrymal et il sera intéressant de cibler la thérapeutique en fonction de la physiopathologie du syndrome sec observé. Des molécules en développement sont aussi prometteuses [11]. Dans les cas sévères, des corticoïdes topiques peuvent être ajoutés avec une surveillance étroite et sur une durée limitée. Les risques de iatrogénie existent ainsi que la cortico-dépendance. La ciclosporine topique ayant reçu récemment l'AMM chez l'adulte est très utile pour les cas chroniques de sécheresse oculaire avec inflammation de la surface oculaire. La ciclosporine topique permet aussi d'être cortico-épargneur.
L'œil sec de l'enfant est souvent négligé, s'agissant d'une pathologie peu fréquente. L'étiologie doit être recherchée minutieusement pour ajuster au mieux la stratégie thérapeutique. Un suivi rapproché et au long cours doit être effectué en impliquant les parents.
[1] Dogru M, Karakaya H, Baykara M, et al. Tear function and ocular surface findings in premature and term babies. Ophthalmology 2004 ; 111 : 901-5.
[2] Isenberg SJ, Apt L, McCarty J, et al. Development of tearing in preterm and term neonates. Arch Ophthalmol 1998 ; 116 : 773-6.
[3] The definition and classification of dry eye disease : report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop (2007). Ocul Surf 2007 ; 5 : 75-92.
[4] Alves M, Dias AC, Rocha EM. Dry eye in childhood : epidemiological and clinical aspects. Ocul Surf 2008 ; 6 : 44-51.
[5] Han SB, Yang HK, Hyon JY, Hwang JM. Children with dry eye type conditions may report less severe symptoms than adult patients. Graefes Arch Clin Exp Ophthalmol 2013 ; 251 : 791-6.
[6] Jones SM, Nischal KK. The non-invasive tear film break-up time in normal children. Br J Ophthalmol 2013 ; 97 : 1129-33.
[7] Coats DK, Paysse EA, Kim DS. Excessive blinking in childhood : a prospective evaluation of 99 children. Ophthalmology 2001 ; 108 : 1556-61.
[8] Alves M, Angerami RN, Rocha EM. Dry eye disease caused by viral infection : review. Arq Bras Oftalmol 2013 ; 76 : 129-32.
[9] Greiner KL, Walline JJ. Dry eye in pediatric contact lens wearers. Eye Contact Lens 2010 ; 36 : 352-5.
[10] Mac Cord Medina F, Silvestre de Castro R, Leite SC, et al. Management of dry eye related to systemic diseases in childhood and longterm follow-up. Acta Ophthalmol Scand 2007 ; 85 : 739-44.
[11] Bremond-Gignac D, Gicquel JJ, Chiambaretta F. Pharmacokinetic evaluation of diquafosol tetrasodium for the treatment of Sjögren’s syndrome. Expert Opin Drug Metab Toxicol 2014 ; 10 : 905-13.