D. Denis, M. Cousin, E. Zanin, N. Girard1
Grâce aux progrès continuels réalisés dans le domaine de la neuro-imagerie, l’imagerie cérébro-orbitaire prend une place de plus en plus importante dans la prise en charge des troubles oculomoteurs aussi bien sur le plan diagnostique que thérapeutique. Le clinicien pose l’indication de l’imagerie et rédige l’ordonnance de prescription pour le radiologue. Le dialogue entre clinicien et radiologue est indispensable ; la demande doit être claire et comporter des renseignements cliniques précis : muscles touchés, côté, contexte général, orientations étiologiques, afin de guider l’examen neuroradiologique (plans, type de coupe, de séquence, injection ou non) qui sera, le plus souvent en ophtalmologie, cérébral et orbitaire.
L’imagerie dans le cadre d’un bilan oculomoteur est essentiellement représentée par le scanner et l’IRM. Le scanner est un examen facile à réaliser, de durée courte (moins de cinq minutes) peu bruyant mais irradiant. L’IRM est un examen bruyant, long (dix à vingt minutes) et réalisé dans un tunnel serré (donc difficile pour les patients jeunes ou claustrophobes). Il est en revanche très supérieur au scanner au niveau de l’étude des structures cérébrales ; il est, de plus, non irradiant. Pour les jeunes enfants et les grands enfants non coopérants, ces examens (en particulier l’IRM) sont réalisés sous anesthésie générale afin d’éviter les artefacts de mouvement. L’utilisation d’un produit de contraste est bien souvent nécessaire pour examiner une tumeur ou une lésion infectieuse et obligatoire pour mettre en évidence une thrombose ou un anévrysme, ce qui impose la pose d’une voie veineuse, pas toujours facile chez les enfants, de telle sorte qu’il est commun de prescrire une anesthésie locale de surface (pommade de type EMLA).
La tomodensitométrie (TDM) est un excellent examen pour examiner la pathologie intraorbitaire et évaluer l’intégrité osseuse de l’orbite et de la base du crâne. Il est l’examen de choix des indications d’urgence car très facile d’accès. Il permet de sélectionner les urgences à prendre en charge au plus vite et d’orienter l’examen IRM complémentaire si nécessaire. Dans certaines indications, le scanner permet des reconstructions surfaciques de la voûte crânienne et de la face comme dans le bilan des craniosténoses par exemple. Le scanner utilise des rayons X. Il est donc irradiant et nécessite des précautions en termes de protection : des protocoles d’acquisition optimisés avec dose la plus basse admissible pour un diagnostic efficace ; par exemple, dans le cadre de la survenue d’une paralysie oculomotrice, le patient bénéficiera d’une angio-TDM en urgence afin d’éliminer une urgence neurologique ou vasculaire puis le suivi sera fait par IRM cérébro-orbitaire pour limiter l’irradiation.
Les indications du scanner sont essentiellement : les urgences, la pathologie traumatique, les atteintes myogènes, en particulier l’orbitopathie dysthyroïdienne.
L’IRM est la technique de choix pour évaluer le tissu cérébral dans son ensemble (tronc cérébral et fosse postérieure compris) ainsi que les tissus des cavités orbitaires comme les muscles oculomoteurs. C’est de plus la seule technique d’imagerie permettant d’évaluer le cerveau en développement. Elle apporte des informations anatomiques excellentes et permet, à travers des techniques avancées d’IRM, d’étudier la microstructure des tissus, la connectivité cérébrale (IRM de diffusion ou DTI, Diffusion Tensor Imaging, fournissant des caractéristiques de la substance blanche), la myélinisation, la composition biochimique des tissus (spectroscopie par résonance magnétique ) et enfin l’activation cérébrale (IRM fonctionnelle). L’IRM est particulièrement sensible aux mouvements et impose une immobilité parfaite du sujet de telle sorte que toute indication chez un enfant non coopérant nécessite la réalisation d’une anesthésie générale ou d’une autre méthode de sédation. Elle doit être réalisée dans un centre spécialisé par des neuroradiologues formés aux pathologies oculomotrices. L’IRM utilise le fait que les différents tissus de l’organisme soumis à un champ magnétique puissant émettent des rayonnements différents. Elle est non irradiante mais présente des contre-indications liées à l’utilisation de ce champ magnétique : patient porteur d’un pacemaker, d’une valve cardiaque mécanique ou de clips neurochirurgicaux. Les sources d’artefacts sont multiples : matériels dentaires inamovibles, maquillage, crèmes cosmétiques…
Les indications sont larges en oculomotricité puisque l’IRM permet d’étudier au cours du même examen, avec des séquences dédiées, le parenchyme cérébral, les nerfs et les muscles oculomoteurs.
Ce chapitre n’abordera pas l’IRM fonctionnelle et l’IRM en cours de contraction musculaire qui appartiennent au domaine de la recherche et ne sont pas utilisées en pratique clinique courante. Les situations cliniques qui ont particulièrement bénéficié des apports de l’IRM ces dernières années sont : les syndromes de rétraction, les nystagmus congénitaux, les strabismes, les troubles oculomoteurs dus à une impotence et la paralysie de l’oblique supérieur.
Les syndromes de rétraction de Stilling-Duane et de Brown appartiennent à une forme particulière de strabisme dite restrictive. Ces entités bien définies et classées cliniquement (cf. chapitre 14) ont particulièrement bénéficié du développement de l’IRM cérébro-orbitaire, permettant de réels progrès dans la compréhension de l’étiopathogénie de ces syndromes.
Les séquences IRM utilisées sont spécifiques : 3D T2 CISS pour l’exploration des nerfs oculomoteurs, en particulier le VI pour le syndrome de Stilling-Duane, coupes inframillimétriques jointives avec acquisitions en trois dimensions au niveau orbitaire pour l’exploration des muscles oculomoteurs et des poulies.
Cette pathologie congénitale a fait l’objet de plusieurs études d’imagerie ayant permis de confirmer l’hypothèse étiopathogénique évoquée lors d’autopsies : défaut d’innervation du muscle droit latéral par le nerf abducens (VI) avec innervation aberrante par une branche du nerf oculomoteur commun (III) entraînant une fibrose des muscles droits horizontaux. Ces anomalies peuvent être observées dans chaque type clinique de syndrome de Stilling-Duane dans des proportions variables selon le type étudié [7].
Les anomalies musculaires concernent essentiellement les muscles droits horizontaux. Il peut s’agir d’anomalies trophiques (hypertrophie ou hypotrophie) pouvant s’associer à des anomalies morphologiques (muscle bosselé, fendu ou « splitté ») (fig. 15-1).

Fig. 15-1 Coupe coronale en séquence CISS chez un patient ayant un syndrome de Stilling-Duane de type I gauche montrant une hypertrophie du droit médial gauche. Noter aussi la différence de morphologie entre les deux droits latéraux, avec une hypertrophie et un aspect « bosselé » du côté gauche.
Les anomalies peuvent concerner le nerf abducens et/ou le nerf oculomoteur. La fréquence de ces anomalies dépend des études et du type clinique concerné [11, 14]. L’agénésie du nerf abducens dans les types I et III peut être retrouvée dans 60 % à 100 % des cas selon les séries (fig. 15-2). Pour les types II, l’agénésie est moins fréquente mais reste non exceptionnelle. Quant au nerf oculomoteur, peu d’études l’ont analysé ; il a été décrit comme hypotrophique [10] ou, à l’inverse, hypertrophique du côté du syndrome de syndrome de Stilling-Duane (fig. 15-3).

Fig. 15-2 Coupe IRM en reconstruction axiale sur une séquence 3D T2 CISS chez un patient présentant un syndrome de Stilling-Duane de type I gauche avec agénésie du nerf abducens (VI) gauche (nerf abducens droit : flèche rouge).

Fig. 15-3 Coupe IRM en reconstruction axiale sur une séquence 3D T2 CISS chez un patient présentant un syndrome de Stilling-Duane de type I montrant un épaississement du nerf oculomoteur (III) gauche (flèche rouge).
Les anomalies IRM retrouvées dans le cadre d’un syndrome de Brown concernent principalement le muscle oblique supérieur et peuvent toucher tout ou partie de celui-ci. Ces anomalies peuvent être :
trophiques, à type d’hypertrophie intéressant la poulie, le tendon et/ou le corps musculaire de l’oblique supérieur (fig. 15-4) ;
morphologiques au niveau du tendon [3].
D’autres anomalies rares ont également été décrites : l’hypotrophie de l’oblique supérieur dans le cadre d’une paralysie congénitale du VI ou encore un complexe oblique supérieur-trochlée normal avec une luxation inférieure de la poulie du droit latéral en adduction [2].
L’IRM par les nombreuses informations qu’elle apporte sur l’origine et les conséquences musculaires de ces syndromes de rétraction aide à comprendre leurs mécanismes et à mieux appréhender leur prise en charge thérapeutique. L’IRM guide l’indication chirurgicale en fonction de l’anomalie musculo-tendineuse observée (intervention soit sur le muscle oblique supérieur soit sur les muscles controlatéraux de l’œil sain).
Néanmoins, la corrélation entre la sévérité clinique et les anomalies observées en IRM n’est pas toujours évidente à établir, en particulier dans le syndrome de Brown congénital où un même tableau clinique peut correspondre à différentes anomalies anatomiques.

Fig. 15-4 Coupe axiale en séquence 3D T1 avec saturation de graisse et gadolinium (VIBE) chez un patient ayant un syndrome de Brown droit congénital. On remarque l’élargissement du tendon droit dès son insertion sclérale ainsi que de sa poulie (complexe tendon-poulie entouré en rouge) par rapport au côté sain.
Les nystagmus congénitaux peuvent être moteurs, sensoriels ou encore isolés idiopathiques. Devant un tableau de nystagmus congénital, il est indispensable de réaliser dans le cadre du bilan étiologique une IRM cérébrale [6]. En effet, il a été constaté, quel que soit le type de nystagmus, des lésions ou anomalies cérébrales fréquentes à l’IRM. Il s’agit essentiellement d’anomalies de signal et d’anomalies morphologiques (malformatives et non malformatives) retrouvées au niveau de la fosse postérieure (tronc cérébral, cervelet, grande citerne) ou en sus-tentoriel : substance blanche hémisphérique (fig. 15-5a), espaces vasculaires, commissures interhémisphériques, noyaux gris centraux. Les anomalies de signal ont été fréquemment observées au niveau du tronc cérébral : images « en cocarde » sur la partie postérieure de la protubérance (fig. 15-5b), du cervelet (noyaux dentelés) et des radiations optiques. Par exemple, dans le cadre des anomalies morphologiques retrouvées, la figure 15-5c montre une malformation du colliculus supérieur et du pédoncule cérébral chez un enfant présentant un nystagmus sensoriel par albinisme.
Dans les nystagmus avec contexte neurologique, ces anomalies sont souvent associées. L’association anomalie de signal de la substance blanche avec dilatation ventriculaire et dilatation des espaces périvasculaires témoignant d’une perte de volume cérébral est la plus fréquente (60,4 %). Il est intéressant de constater que ces lésions, bien que moins fréquentes, existent également dans les nystagmus isolés idiopathiques.
La plupart de ces anomalies sont localisées sur des structures qui contribuent directement ou indirectement à la motricité oculaire et témoignent de l’organicité de ce type de pathologie. Il y a trente ans, l’étiologie la plus fréquemment retenue devant un nystagmus congénital était la cause idiopathique. Actuellement, grâce à l’amélioration des techniques neuroradiologiques, le contingent des nystagmus dits idiopathiques a considérablement diminué, indiquant que la nature organique est probablement constante, a fortiori lorsque le nystagmus est important.
Ceci explique l’importance de l’IRM dans la prise en charge des nystagmus congénitaux aussi bien sur le plan du diagnostic étiologique que sur le plan du pronostic.

Fig. 15-5 Nistagmus congénital.
a. Coupe axiale T2 montrant la substance blanche hyperintense au niveau des régions frontale et pariétale, associée à une dilatation du ventricule latéral droit. b. Coupe axiale en pondération T2 au niveau de la protubérance : image bilatérale « en cocarde » dans la région réticulaire. c. Coupe axiale T2 montrant une atrophie bilatérale des colliculus.
L’exotropie précoce survient entre le premier mois et la deuxième année de vie. Devant un tableau d’exotropie précoce, il est indispensable de réaliser un examen ophtalmologique complet et une imagerie cérébrale. En effet, dans la majorité des cas, l’exotropie précoce est associée à une pathologie ophtalmologique organique et/ou à une pathologie générale [1]. Une corrélation entre l’importance de la déviation et les anomalies cérébrales retrouvées à l’IRM a été décrite. Ces anomalies sont essentiellement morphologiques et de signal et ont fréquemment concerné des structures impliquées dans la voie du mouvement oculaire. En effet, les anomalies morphologiques au niveau cérébral ont été des atrophies, des défauts d’enroulement, des nécroses et glioses des lobes cérébraux, des atrophies et hypoplasie du corps calleux (fig. 15-6), des atrophies des radiations et/ou des bandelettes optiques. Au niveau du tronc cérébral, les anomalies ont été à type de dysplasie, de dysmorphie, d’atrophie et de désorientation : colliculus, cervelet (fig. 15-7). Les anomalies de signal ont surtout concerné les lobes occipital et pariétal et le tronc cérébral.
La contribution de l’IRM cérébrale dans l’exotropie infantile est fondamentale car elle aide à une prise en charge pluridisciplinaire la plus précoce possible.
La conduite est différente pour une ésotropie précoce sans contexte général. La définition exclut l’existence de pathologie associée ophtalmologique et/ou neurologique. Néanmoins, une étude IRM pratiquée chez soixante-cinq enfants sans trouble neurologique clinique, dont trente-huit présentaient une ésotropie précoce a montré des atteintes à type de leucomalacie périventriculaire chez 8 % des enfants strabiques, aucune atteinte n’ayant été constatée chez les enfants orthotropiques [12]. Ces résultats indiquent que l’IRM réservée préférentiellement aux exotropies précoces devrait être étendue aux ésotropies précoces dans l’optique d’une prise en charge globale optimale de l’enfant.

Fig. 15-6 Coupe sagittale chez deux patients présentant une exotropie précoce.
a. Le corps calleux est fin au niveau du corps. b. Le corps calleux est court au niveau du bec avec agénésie.
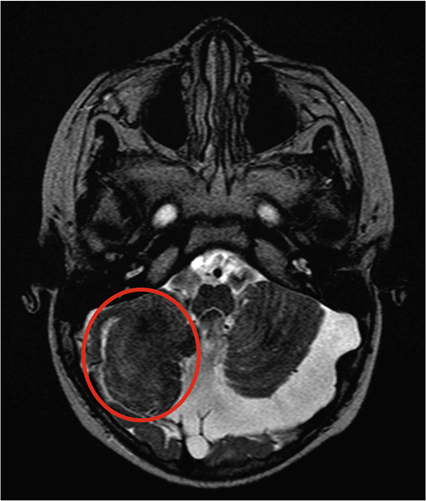
Fig. 15-7 Coupe axiale T2 montrant une dysplasie de l’hémisphère cérébelleux droit (les sillons du cervelet ne sont pas identifiables comparés au côté controlatéral), associée à un kyste arachnoïdien gauche.
Une impotence musculaire peut avoir différentes origines. Nous insisterons particulièrement sur quatre étiologies : la chirurgie du strabisme récente ou ancienne, la chirurgie du décollement de rétine, la myopie forte et les fractures de l’orbite.
L’IRM orbitaire apporte de nombreuses informations sur l’état musculaire : taille, forme, trajet, rapports avec les autres éléments aponévrotiques de l’orbite et aide à la prise en charge thérapeutique de ces troubles.
Lors d’un lâchage de suture simple ou secondaire à une infection locorégionale, la réintervention ne peut être envisagée qu’après réalisation d’une imagerie (IRM de référence). Cette dernière va permettre de localiser le muscle impotent et guider la voie d’abord lors de la reprise chirurgicale (le plus souvent retrouvé au niveau du foramen).
Dans les strabismes consécutifs, l’IRM va permettre l’analyse du ou des muscles suspectés d’être à l’origine de l’impotence. Un glissement du muscle, des adhérences, un placard cicatriciel, une absence de muscle, un kyste réactionnel à un cil ou au matériel de suture peuvent être mis en évidence. Si besoin, un scanner pourra venir compléter l’exploration radiologique pour une analyse de la paroi osseuse (par exemple, de la paroi ethmoïdale dans le cas d’un kyste du droit médial).
L’IRM joue un rôle important dans le traitement des patients qui présentent des complications dues aux éponges en hydrogel posées entre 1980 et 1990 pour décollement de rétine. Elle permet de faire le diagnostic différentiel entre les éponges hydrogel et une pathologie orbitaire autre. Elle permet aussi de préciser la localisation de ce matériel d’indentation [8].
L’IRM est indispensable pour étudier la déformation du globe du myope fort et orienter vers l’indication chirurgicale afin de restaurer la régularité du cône musculaire (intervention de Yokohama). L’IRM permet le contrôle du chemin des muscles droits supérieurs et latéraux avant et après chirurgie.
Dans les fractures de l’orbite récentes, le scanner (cadre osseux) et l’IRM (taille des muscles, trajets) sont indispensables pour préciser la conduite à tenir [9]. Certaines hypertropies/hypotropies constantes ou intermittentes peuvent être secondaires à un traumatisme orbitaire.
La notion d’un traumatisme orbitaire ayant bénéficié d’une reconstruction chirurgicale peut être :
connue : l’apparition ou la réapparition de troubles oculomoteurs impose la vérification par IRM ou TDM de la bonne place du matériel d’ostéosynthèse [13] ;
absente car passée inaperçue, par conséquent non relatée par le patient : ainsi, il a été retrouvé dans certains dérèglements verticaux des fractures du mur interne, du plancher ou des deux associées [4].
La paralysie de l’oblique supérieur peut être congénitale ou acquise (cf. chapitre 14). La réalisation d’une IRM dans le bilan des paralysies de l’oblique supérieur permet l’exploration du muscle oblique supérieur dans sa globalité. En effet, jusqu’en 1990, la prise en charge de la paralysie de l’oblique supérieur était fondée sur l’exploration chirurgicale du tendon plus ou moins associée au test d’élongation musculaire. L’utilisation nouvelle de l’IRM a permis l’évaluation de la taille, de la morphologie et de la contractilité musculaire (IRM de contraction) [5]. Dans la paralysie de l’oblique supérieur, des anomalies morphologiques et trophiques mises en évidence sont surtout à type d’hypotrophie, d’atrophie et, plus rarement, d’agénésie. Quelle que soit l’origine de la paralysie (congénitale, traumatique, vasculaire), il est important d’évaluer l’état musculaire par IRM afin de guider la prise en charge chirurgicale (fig. 15-8). Toutefois, il n’existe aucune corrélation entre la sévérité du tableau clinique et les anomalies musculaires retrouvées, ceci en raison des mécanismes compensateurs propres à chaque patient (muscles oculomoteurs, muscles cervicaux, système vestibulaire…).
L’amélioration des techniques d’imagerie avec l’émergence de l’IRM en pratique clinique courante a permis une meilleure prise en charge de certains troubles oculomoteurs. Le succès de cette prise en charge passe par la qualité de la coopération multidisciplinaire : la précision rédactionnelle de l’ordonnance permet au neuroradiologue d’adapter son examen et d’orienter son interprétation. De nombreux progrès sont en cours, en particulier dans le domaine de l’IRM réalisée en cours de contraction musculaire, qui contribueront à améliorer encore la compréhension étiopathogénique des troubles oculomoteurs

Fig. 15-8 Coupe axiale T1 montrant une atrophie du muscle oblique supérieur gauche (flèche rouge) chez une adulte présentant une paralysie du nerf trochléaire (IV) gauche.
[1] Baeteman C, Denis D, Loudot C, Toesca E, Bronsard J, Benso C, Fogliarini C, Hadjdaj E, Antoniotti S, Chabrol B, Mancini J, Girard N. Intérêt de l’IRM cérébrale dans les exotropies précoces. J Fr Ophtalmol, 2008 ; 31 : 287-294.
[2] Bhola R, Rosenbaum AL, Ortube MC, Demer JL. High-resolution magnetic resonance imaging demonstrates varied anatomic abnormalities in Brown syndrome. JAAPOS, 2005 ; 9 : 438-448.
[3] Cousin M, Girard N, Denis D. Apport de l’IRM dans le syndrome de Brown congénital. J Fr Ophtalmol, 2012 (sous presse).
[4] Demer JL, Clark RA, Kono R, Wright W, Velez F, Rosenbaum AL. A 12-year, prospective study of extraocular muscle imaging in complex strabismus. J AAPOS, 2002 ; 6 : 337-347.
[5] Demer JL, Kerman BM. Comparison of standardized echography with magnetic resonance imaging to measure extraocular muscle size. Am J Ophthalmol, 1994 ; 118 : 351-361.
[6] Denis D, Girard N, Toesca E, Zanin E, Gambarelli N, Lebranchu P, Mancini J. Intérêt de l’IRM dans le nystagmus congénital. J Fr Ophtalmol, 2010 ; 33 : 189-205.
[7] Denis D, Cousin M, Zanin E, Toesca E, Girard N. Apport de l’IRM dans le syndrome de Stilling-Duane : résultats préliminaires. J Fr Ophtalmol, 2011 ; 34 : 476-481.
[8] Ginat DT, Singh AD, Moonis G. Multimodality imaging of hydrogel sclera buckels. Retina, 2012 ; 32 : 1449-1452.
[9] Guyot L, Lari N, Benso-Layoun C, Denis D, Chossegros C, Thiery G. Fractures orbitaires chez les enfants. J Fr Ophtalmol, 2011 ; 34 : 265-274.
[10] Kang NY, Demer JL. Comparison of orbital magnetic resonance imaging in Duane syndrome and abducens palsy. Am J Ophthalmol, 2006 ; 142 : 827-834.
[11] Kim JH, Hwang JM. Presence of the abducens nerve according to the type of Duane’s retraction syndrome. Ophthalmology, 2005 ; 112 : 109-113.
[12] Ohtsuki H, Yoshifumi K, Hasebe S, Kono R, Harada Y. Comparative study of brain lesions detected by magnetic resonance imaging between strabismus and non strabismus in infancy. Ophthalmologica, 2000 ; 214 : 105-110.
[13] Ortube MC, Rosenbaum AL, Goldberg RA, Demer JL. Orbital imaging demonstrates occult blow out fracture in complex strabismus. J AAPOS, 2004 ; 8 : 264-273.
[14] Ozkurt H, Basak M, Oral Y, Ozkurt Y. Magnetic resonance imaging in Duane’s retraction syndrome. J Pediatr Ophthalmol Strabismus, 2003 ; 40 : 19-22.

