G. Le Meur, Ch. Rémy
Le strabisme est un trouble oculomoteur commun dont l’étiopathogénie n’est pas totalement élucidée. Les facteurs de risque de cette pathologie sont, en revanche, bien connus. Nous abordons dans une première section, les généralités sur l’épidémiologie du strabisme puis des diverses formes cliniques, pour ensuite aborder les divers facteurs de risque connus comme générateur de strabisme. Les connaissances actuelles concernant la génétique des strabismes concomitants sont abordées dans la seconde section.
G. Le Meur
La prévalence du strabisme est comprise entre 0,99 % et 2,6 % [14, 26, 34, 43]. Cette prévalence est relativement stable dans le temps. Matsuo, dans son étude de 2003, l’a estimée à 1,26 % et dans son étude de 2005 à 0,99 % [26]. La fréquence de l’ésotropie est de 0,22 % dans la population japonaise âgée de six à douze ans et celle de l’exotropie est de 0,62 % [26]. Dans la population américaine, la fréquence est de 1,02 % pour l’ésotropie mais également de 1,02 % pour l’exotropie [10]. Les études américaines MEPEDS (Multiethnic Pediatric Eye Disease Study) et BPEDS (Baltimore Pediatric Eye Disease Study) ont examiné en analyse multivariée les facteurs de risque de survenue d’une ésotropie ou d’une exotropie chez 8 491 enfants âgés de six à soixante-dix-huit mois. Pour l’exotropie, les facteurs de risque retrouvés sont le tabagisme actif de la mère durant la grossesse, un âge gestationnel inférieur à 33 SA (semaines d’aménorrhée) lors de la naissance, le sexe féminin, un astigmatisme supérieur à 1,5 d et plus, ainsi qu’une histoire familiale de strabisme [10]. Concernant l’ésotropie, les facteurs de risque associés sont le tabagisme actif de la mère durant la grossesse, un âge gestationnel inférieur à 33 SA lors de la naissance, une anisométropie supérieure à 1 d ou plus, une hypermétropie supérieure à + 2 d [10]. Au Danemark, la grande étude DNBC (Danish National Birth Cohort), réalisée chez 96 842 enfants en analyse multivariée, a permis d’associer à un risque accru de strabisme d’autres facteurs comme l’hypoxie néonatale et, de manière reliée, la naissance par césarienne, la prééclampsie maternelle, les septicémies néonatales, les grossesses multiples, un périmètre crânien augmenté ou diminué, la présence d’anomalies congénitales [43].
De nombreuses études de prévalence se sont intéressées à la prévalence du strabisme en fonction de l’origine ethnique de l’enfant, car il est reconnu que l’origine africaine maternelle serait un facteur protecteur vis-à-vis du strabisme pour l’enfant. La Millenium Cohort Study au Royaume-Uni a trouvé que les enfants qui avaient une origine ethnique blanche avaient seulement un risque sur quinze d’avoir un strabisme isolé [34]. Dans l’étude australienne, Sydney Childhood Eye Study, il a été retrouvé que les enfants d’origine ethnique non blanche avaient trois fois moins de risque d’avoir une ésotropie par rapport aux enfants d’origine blanche. En revanche, le risque était le même quelle que soit l’ethnie pour l’exotropie [36]. Dans l’étude BPEDS réalisée aux États-Unis, le taux de strabisme chez les enfants blancs est de 3,3 % alors qu’il est de 2,1 % chez les enfants noirs américains. L’étude réalisée à Bethesda aux États-Unis a montré que l’ésotropie était plus commune chez les enfants blancs américains que chez les enfants noirs américains (3,5 % versus 2,2 %), ce qui n’était pas le cas pour l’exotropie, où l’origine ethnique ne semble pas avoir d’influence au cours de cette étude [14]. De même, l’étude MEPEDS a trouvé un taux de strabisme de 2,4 % chez les Latino-Américains et de 2,5 % chez les Noirs américains [31].
En fonction du type de strabismes, certaines caractéristiques épidémiologiques peuvent être extraites ou reliées à la pathologie strabique. Dans les deux paragraphes suivants, nous allons nous intéresser aux particularités liées aux strabismes convergents puis aux strabismes divergents. Les facteurs de risque de strabisme sont abordés dans les paragraphes suivants.
L’ésotropie non accommodative acquise est définie selon les publications américaines comme une ésotropie survenant après l’âge de six mois chez un enfant en bonne santé. La fréquence de cette forme d’ésotropie a été estimée à un cas sur 287 naissances dans l’état du Minnesota par l’équipe du Mayo Clinic lors d’une étude rétrospective sur trente ans [19]. Ce type d’ésotropie est plus fréquemment retrouvé chez les garçons (61 %). Il est à noter qu’une histoire familiale de strabisme dans cette population strabique est fréquemment retrouvée (34 %). Dans cette étude du Mayo Clinic, l’âge médian de diagnostic de ce type de strabisme est de quatre ans et 73 % des enfants ont eu besoin d’une chirurgie oculomotrice. De manière logique, il a été retrouvé une relation entre l’âge d’installation du strabisme et le développement de la vision stéréoscopique : plus le strabisme est survenu tard (4,6 ans), meilleur est la stéréoscopie lors du suivi ophtalmologique (40 à 60’) ; en revanche, quand l’âge de survenue du strabisme est de 2,6 ans, aucune vision stéréoscopique n’était présente lors de l’examen clinique final après la réalisation de la chirurgie oculomotrice.
L’ésotropie accommodative représente 28 % des strabismes [28]. Dans une étude réalisée par Mohney chez 304 enfants, 80 % des enfants ont une ésotropie totalement accommodative et 20 % une ésotropie partiellement accommodative dont l’angle se réduit d’au moins 10 ? après correction de l’amétropie. L’amétropie moyenne retrouvée lors d’une ésotropie purement accommodative est de + 3,9 d [28].
Les strabismes en convergence sont plus aisément rencontrés, d’après Torp-Pedersen, lors d’anomalies chromosomiques ou syndromiques par rapport aux formes en divergence [43]. De plus, les enfants avec des malformations du cou auraient un risque plus élevé de strabisme convergent, sauf pour la forme accommodative [43].
Le strabisme divergent est la forme la plus fréquemment retrouvée dans les pays asiatiques, notamment de l’est. Au cours de l’étude STARS (Strabismus, Amblyopia and Refractive error in Singapore preschool children) à Singapour, le ratio exotropie/ésotropie retrouvé est de 7:1 dans une population d’enfants âgés de six mois à soixante-douze mois [7]. C’est le ratio le plus fort rencontré dans les études récentes d’Asie ou d’Australie où, en général, le ratio est déséquilibré mais de manière moins importante (compris entre 2,4:1 et 1,2:1 [26, 36]). Cette différence par rapport aux études américaines ou européennes, où le ratio est plus près de 1:1 ou 1:2 avec une fréquence plus grande pour l’ésotropie, est probablement lié au taux d’hypermétropie forte beaucoup moins important dans la population asiatique par rapport aux populations américaines ou européennes [7, 14].
L’exotropie intermittente est la forme la plus fréquente d’exotropie (58 % pour l’étude de Chia, 55 % pour Tinley) [7, 42]. Ce qui explique probablement que le taux d’amblyopie soit moindre dans les exotropies : 20 % dans la MEPEDS et la BPEDS [10].
Il existe certains facteurs associés plus spécifiquement à la survenue d’une exotropie. Dans leur étude, Torp-Pedersen et al. retrouvent que lors d’une naissance par césarienne, le risque de survenue d’un strabisme divergent augmente de 65 % [43]. Le fait que la souffrance fœtale soit une indication fréquente de césarienne en est probablement la cause — en France, en 2001, la souffrance fœtale était la deuxième indication de césarienne après l’antécédent de césarienne. Dans cette grosse étude épidémiologique réalisée chez 84 842 enfants au Danemark [43], la présence d’anomalies congénitales, comme les atteintes du système musculo-squelettique ou les malformations du système nerveux central ou de la face, sont associées plus fortement à la survenue d’une exotropie plutôt qu’à la survenue d’une ésotropie : 22 % des enfants ayant une exotropie présentent de manière associée une malformation congénitale contre 12 % des enfants qui ont une ésotropie (p < 0,001).
Dans les paragraphes suivants, nous abordons les diverses circonstances où nous pouvons être amenés à rencontrer, chez nos patients, plus de strabisme et nous verrons par la même occasion les différents facteurs de risque du strabisme.
Des valeurs d’amétropies sont associées à un risque augmenté de survenue de strabisme. Il est important de connaître ces valeurs afin de pouvoir corriger celles-ci en raison des relations qui existent entre amétropies non corrigées et survenue d’un strabisme. Des facteurs de risque de survenue de strabisme, c’est quasi le seul facteur sur lequel nous pouvons, en tant que thérapeute, avoir une influence. Lors de l’analyse multivariée des études MEPEDS et BPEDS, il est retrouvé qu’un astigmatisme de plus de 2,5 d est associé à un risque de six fois plus d’exotropie [10]. Il y a une relation quasi linéaire entre la prévalence de l’exotropie et le degré d’astigmatisme [13]. L’hypermétropie de 3 d ou plus est un facteur de risque fort de survenue d’une ésotropie. Pour des valeurs de plus de 6 d, Cotter et al., estiment la prévalence de l’ésotropie à plus de 22 % chez des enfants âgés de six à soixante-douze mois [10]. Il y a une relation à peu près linaire entre la prévalence de l’ésotropie et la puissance de l’erreur réfractive en équivalent sphérique [13]. L’odd ratio pour une hypermétropie comprise entre + 2,00 d et + 3,00 d est de 6,4 ; pour une hypermétropie comprise entre + 3,00 d et + 4,00 d, il est de 23 ; pour une hypermétropie comprise entre + 4,00 d et + 5,00 d, il est de 60 ; pour une hypermétropie supérieure à + 6,00 d, il est d’environ 120. En d’autres termes, le risque d’avoir un strabisme si l’enfant a une hypermétropie supérieure à + 5 d par rapport à un enfant ayant une hypermétropie jusqu’à + 1 d est de 120.
Guy Clergeau définit comme valeurs seuils (obtenues sous cycloplégique) exposant au risque amblyopique et strabique [9] :
la sphère maximale : > + 3,50 d ;
l’astigmatisme : > 1,50 d ;
l’anisométropie : > 1,00 d ;
la sphère minimale : < – 1,75 d.
La prématurité est un des facteurs de risque les plus connus concernant le développement d’un strabisme. Pour l’OMS, la prématurité est définie comme une naissance survenant avant 37 semaines révolues d’aménorrhée (SA). Quatre stades de prématurité sont définis : la petite prématurité qui s’étend du début de la 33e à la fin de la 36e SA, la grande prématurité qui va du début de la 28e à la fin de la 32e SA, la très grande prématurité qui concerne les enfants nés au cours des 26e et 27e SA, l’extrême prématurité qui est définie par une naissance survenant avant la 26e SA. En accord avec ce principe, Torp-Pedersen et al. retrouvent un risque significatif augmenté de strabisme lors de naissance prématurée avant 37 SA comparé aux enfants nés entre 37 et 41 SA [43]. Pour les ésotropies, le risque relatif le plus élevé (1,39) concerne les enfants nés entre 31 et 33 SA. En revanche, lorsque le risque est corrélé avec le terme de naissance ajusté par rapport au poids de l’enfant à la naissance, ce risque de strabisme diminue [43]. D’après cet auteur, pour évaluer parfaitement le risque potentiel de strabisme d’un enfant né prématuré, il convient plutôt de s’attacher dans l’analyse à attribuer à l’enfant un terme théorique. Ce terme se recherche en attribuant, à cet enfant prématuré, le terme de naissance d’un enfant qui aurait le même poids. Cette adaptation pondérale permet de minorer le risque strabique encouru par l’enfant prématuré lorsque seule la prématurité est présente. Le retard de croissance intra-utérin chez les enfants prématurés est un facteur qui augmente le risque de strabisme [43]. Cotter et al. ont retrouvé, que ce soit pour les ésotropies ou les exotropies, que le terme inférieur à 33 SA était associé à un risque augmenté de strabisme chez les enfants [10]. Dans la Millenium Cohort Study, ce risque est estimé à 8,1 pour des enfants nés avant 34 SA comparé à des enfants né après 37 SA [34]. Des études récentes ont montré que le taux de strabisme chez les prématurés qui ont eu dans la période néonatale une rétinopathie du prématuré sévère était encore plus important que pour les prématurés qui n’avaient pas eu de rétinopathie du prématuré sévère [5, 33, 45, 46]. D’ailleurs, pour O’Connor, la prévalence du strabisme s’accroît avec la sévérité de la rétinopathie du prématuré [33]. Dans l’étude ETROP (Early Treatment For Retinopathy of Prematurity), qui concerne le traitement par laser rétinien des rétinopathies du prématuré de stade « seuil », trois cent quarante-deux enfants ont été évalués tous les ans jusqu’à l’âge de six ans pour la prévalence du strabisme [45]. La prévalence du strabisme dans cette population est de 30 % lors de l’examen des six mois et est de 42,2 % à l’examen des six ans. La prévalence cumulée de strabisme au cours de ces six années est de 59,4 %. Au cours de cette étude, le taux de strabisme le plus élevé est pour les enfants né entre 28 SA et 31 SA (63,8 %). Dans 56 % des cas, une ésotropie est retrouvée lors de l’examen à six ans. Une chirurgie oculomotrice a été réalisée chez pratiquement la moitié des enfants strabiques de l’étude (cinquante-trois sur cent dix). Dans une étude plus ancienne, O’Connor retrouve une différence statistiquement significative sur l’association exotropie et rétinopathie du prématuré sévère parmi les enfants ayant une exotropie, probablement à cause de la malvoyance induite par la rétinopathie du prématuré sévère [39].
Un poids inférieur à 1 701 g est associé à un risque de strabisme de 18 % chez les cent quatre-vingt-dix-neuf enfants suivi sur une durée de dix ans [39]. Tous les enfants qui avaient un strabisme à l’âge de sept mois corrigé ont vu la persistance de ce strabisme à l’âge de douze ans. Pour Torp-Pedersen, les enfants nés à un poids inférieur à 2 500 g ont un risque relatif (RR) statistiquement significatif plus important de présenter un strabisme comparé aux enfants nés à un poids de plus de 2 500 g (RR = 2, p < 0,001) [43]. Il est à noter que, souvent, le petit poids de naissance est associé à une prématurité. Afin d’évaluer l’impact du poids sur la vision en dehors d’une prématurité, une étude spécifique a été réalisée par Lindqvist [24]. Trois populations ont été évaluées à l’âge de quatorze ans afin de tester leur capacité visuelle en fonction du poids de naissance : un groupe dont le poids de naissance était inférieur à 1 500 g, un groupe dont le poids de naissance était inférieur au 10e percentile et un groupe témoin. Le groupe au poids de naissance inférieur à 1 500 g présente un taux de strabisme de 30 %, alors que le groupe dont le poids de naissance était inférieur au 10e percentile présente un taux identique au groupe contrôle, entre 19 % et 11 % [24].
Depuis de nombreuses années, l’exposition au tabac du fœtus durant la grossesse est un facteur de risque connu dans la survenue ultérieure de strabisme chez l’enfant né à la suite de cette grossesse [6, 16]. Dans une étude danoise réalisée chez 3 128 enfants, il a été observé un risque pour le strabisme plus élevé de 26 % chez les enfants dont les mères avaient fumé durant la grossesse [44]. Le risque retrouvé au cours de cette étude est le même pour les exotropies ou les ésotropies. Dans les études américaines MEPEDS et BPEDS, il est retrouvé une relation linéaire entre la survenue d’une ésotropie et l’intoxication tabagique à partir de quinze paquets par mois [10]. Globalement, le risque de survenue d’un strabisme chez l’enfant augmente de 5 % pour chaque cigarette fumée quotidiennement durant la grossesse. Toutefois, il semble y avoir un seuil d’intoxication nécessaire car le fait de fumer moins de cinq cigarettes par jour n’augmente pas le risque de survenue de strabisme. Par contre, les enfants dont les mères ont fumé durant les deux premiers trimestres ou durant toute la grossesse ont respectivement 46 % et 35 % de risque augmenté de survenue de strabisme par rapport aux enfants nés de mères non fumeuses [44]. Si l’intoxication tabagique a lieu uniquement durant le premier trimestre de la grossesse, cela n’a pas d’incidence sur le risque de survenue de strabisme. L’utilisation de substitut nicotinique n’augmente pas le risque de survenue de strabisme. Des études ont également rapporté que le tabac augmentait la fréquence de facteurs comme l’astigmatisme et l’hypermétropie, qui sont des facteurs de risque inducteurs de strabisme [3, 10].
L’exposition d’un fœtus à l’alcool durant la grossesse est pourvoyeur d’anomalies et de malformations ophtalmologiques. Néanmoins, l’alcool est aussi un facteur de risque de survenue de strabisme chez l’enfant qui a été soumis à une exposition éthanolique durant la gestation sans qu’il y ait de malformations ophtalmologiques associées [44]. Les enfants dont la mère a consommé de l’alcool durant la grossesse, comparés aux enfants dont les mères n’ont pas consommé d’alcool durant la grossesse, ont un risque plus élevé de 14 % pour une consommation comprise entre 0 g et 12 g d’alcool par semaine, de 23 % pour une consommation comprise entre 12 g et 36 g d’alcool par semaine et de 36 % pour une consommation d’alcool comprise entre 36 g et 60 g d’alcool par semaine [44]. Les épisodes d’alcoolisation aiguë n’auraient pas d’incidence sur la survenue de strabisme.
Il est connu que les enfants avec des troubles neurologiques ont plus de risque de présenter un strabisme. L’étude CPP (Collaborative Perinatal Project) a retrouvé une association entre strabisme et anomalie neurologique avec un odd ratio de 3,03 pour les ésotropies et les exotropies [6]. Dans la Millenium Cohort Study, 15,4 % des enfants ayant une infirmité motrice cérébrale et 9,1 % des enfants ayant des troubles mentaux ou du comportement présentent un strabisme [34]. Dans les études MEPEDS et BPEDS, la fréquence de strabisme en cas d’infirmité motrice cérébrale est encore plus élevée, notamment pour les exotropies où 25 % des enfants présentent un strabisme [10]. Il semble que tout événement défavorable qui modifie l’environnement intra-utérin dans la dernière partie de la grossesse puisse avoir une répercussion sur la mise en place de la coordination et du contrôle des mouvements oculomoteurs. La survenue d’une hémorragie intraventriculaire de haut grade (III-IV) dans la période périnatale est associée une prévalence élevée de strabisme : 73 % contre 14 % lors d’une hémorragie de bas grade (I-II) chez des enfants prématurés [8]. La leucomalacie périventriculaire est une anomalie neurologique retrouvée lors d’une hypoxie cérébrale prénatale au niveau des radiations optiques. Muen et al. ont rapporté le cas de sept enfants strabiques où la présence d’une leucomalacie périventriculaire non suspectée aux examens cliniques neurologiques a été retrouvée lors de la réalisation d’imageries cérébrales [30]. Pour Brodsky, les exotropies sont plus fréquentes par rapport aux ésotropies dans les atteintes corticales, alors que les ésotropies sont plus fréquentes que les exotropies dans les atteintes sous-corticales comme la leucomalacie périventriculaire [4].
Un strabisme est fréquemment présent au cours du suivi d’enfants qui présentent des anomalies ophtalmologiques congénitales. Ces anomalies congénitales sont multiples : cataracte congénitale, ptosis, colobomes, microphtalmie, hyperplasie du vitré… Il est parfois difficile de savoir si c’est l’amblyopie qui est à l’origine du strabisme qu’on voit apparaître ou si le strabisme est secondaire à la pathologie ou à l’amblyopie présentée par ces patients. Dans de tel cas, il est alors essentiel de savoir prévenir l’amblyopie et de savoir traiter la part fonctionnelle de l’amblyopie chez ces patients qui peuvent être strabiques.
Le strabisme est un élément clinique régulièrement retrouvé lors du suivi clinique de jeunes patients ayant présenté une cataracte, que celle-ci soit d’origine congénitale ou d’origine acquise. Dans une étude rétrospective réalisée chez huit cent vingt-deux enfants ayant été opérés d’une cataracte, le taux de strabisme est de 24,2 % [37]. Ce taux augmente lorsque les cataractes congénitales sont isolées des autres causes de cataractes infantiles, plus particulièrement dans le cas de cataractes survenant précocement dans la vie. Dans l’étude d’une cohorte de patients opérés précocement de cataracte congénitale bilatérale mais implantés secondairement après trois ans, Kim trouve un taux de 46 % de strabisme [21], alors que pour Birch, le taux de strabisme est de 66 % chez des enfants dont la cataracte a été opérée avant l’âge de cinq ans. La densité de la cataracte et une durée de déprivation visuelle de plus de six semaines augmentent le risque de survenue de strabisme (OR = 9,1 ; 95 % IC : 1,9-54,2) [2]. La répartition entre le pourcentage d’exotropie et le pourcentage d’ésotropie varie quelque peu en fonction des études. Pour l’exotropie, ce taux est compris entre 43,2 % et 52,9 % et pour l’ésotropie entre 41,2 % et 56,8 % [21, 37]. Il semble que l’ésotropie soit plus fréquemment la forme clinique présentée lors de cataracte précoce et l’exotropie lors des formes plus tardives [2, 37]. L’incidence du strabisme semble plus élevée lors des cataractes unilatérales (27,4 %) que lors des cataractes bilatérales (19,6 %) [37].
Le strabisme est un signe fréquemment associé au ptosis congénital, d’autant plus que celui-ci est unilatéral ou fortement asymétrique. La survenue d’un strabisme dans les ptosis est d’autant plus fréquente que le ptosis est pourvoyeur d’anisométropie et d’amblyopie. Srinagesh retrouve l’association strabisme et amblyopie chez 66,7 % des patients qui présentent un ptosis sévère au cours de son étude [38]. La survenue d’un strabisme est estimée dans cette étude à 10,3 % mais, dans de nombreuses études, ce chiffre avoisine plutôt les 20 % [38]. Il est à noter que le strabisme survient d’autant plus que le ptosis est asymétrique lorsqu’il est bilatéral, d’autant plus qu’il est sévère et, de même, plus fréquemment lorsque le ptosis est unilatéral. Tous les types de strabismes peuvent se rencontrer dans les ptosis.
Les colobomes, qu’ils soient iriens, papillaires, choriopapillaires ou choriorétiniens, sont associés à une fréquence élevée de strabisme et d’amblyopie. Dans une étude rétrospective menée sur quarante ans par le Mayo Clinic, un taux de strabisme de 30 % au début du suivi ophtalmologique et de 22 % à la fin du suivi ophtalmologique a récemment été rapporté [32]. Toutes les formes cliniques de strabismes peuvent être associées à la présence d’un colobome [32]. Lorsque l’atteinte est unilatérale, le risque de strabisme est plus important.
Les craniosténoses résultent de la fusion prématurée d’une ou plusieurs sutures crâniennes. La majorité des craniosténoses surviennent sur une seule suture crânienne et de manière non syndromique. Les formes syndromiques les plus communes sont le syndrome de Crouzon, le syndrome d’Apert, le syndrome de Pfeiffer et le syndrome de Saethre-Chotzen. La fréquence des strabismes dans les craniosténoses est très élevée [40]. Dans les diverses études épidémiologiques, que ce soit pour les formes syndromiques ou les formes isolées, la fréquence des strabismes est comprise entre 70 % et 89 % pour les strabismes horizontaux et 55,5 % pour le syndrome « V » [41]. Il est noté des différences de forme de strabismes en fonction du type de craniosténoses : les plagiocéphalies sont plus fréquemment associées à des strabismes verticaux avec torticolis [12] ; des hyperactions de l’oblique inférieur ou de l’oblique supérieur sont présentes dans 85 % des syndromes d’Apert [20]. Une mutation du gène FGFR2 (Fibroblast Growth Factor Receptor 2), localisé en 10q26, est fréquemment retrouvée dans certaines formes syndromiques (Crouzon, Apert, Pfeiffer). Les deux mutations Ser252Trp et Pro253Arg sont les deux mutations spécifiques présentes dans le syndrome d’Apert. Les strabismes et les amblyopies sont plus fréquemment rencontrés lors de la mutation Ser252Trp [23] et ces strabismes nécessitent plus souvent une correction chirurgicale avec la découverte, peropératoire, d’anomalies des muscles extraoculaires comme des agénésies de l’oblique supérieur [20]. Dans cette population, il est important d’effectuer des contrôles réguliers car des atteintes ophtalmologiques pouvant compromettre l’avenir visuel sont très fréquentes (strabisme, amblyopies, neuropathies optiques par compression, expositions cornéennes et anomalies nasolacrymales).
La trisomie 21 est un syndrome génétique où un strabisme est très fréquemment retrouvé. En fonction des études, les chiffres varient entre 21,1 % et 26,5 % [22, 25]. Motley, dans une étude spécifique concernant les trisomies 21 par mosaïque, retrouve même un taux de 35 % de strabismes dans sa cohorte de dix-sept patients [29]. L’ésotropie est alors la forme prépondérante : retrouvée dans 71,1 % des cas dans une population infantile pour Ljubic [25] et dans 82,2 % des cas dans une population adulte pour Krinsky-McHale [22]. Il faut noter que les patients porteurs de trisomie 21 ont un risque augmenté de présenter des amétropies. Chez cent quarante-cinq sujets ayant une trisomie 21, une emmétropie est retrouvée uniquement dans 24,1 % des cas, une myopie dans 20,7 % des cas et une hypermétropie dans 55,2 % des cas. Quand une myopie est présente, sa valeur est supérieure à – 6 d pour des patients de plus de quinze ans, alors que l’amétropie moyenne pour la même classe d’âge dans la population générale est comprise entre +1 d et +2,75 d [25]. C’est pourquoi, dans cette population, il est important d’insister pour la réalisation d’un dépistage systématique des anomalies ophtalmologiques. Dans une étude anglaise, il a été retrouvé que 38 % des patients qui ont une trisomie 21 n’avaient jamais eu d’examens ophtalmologiques [11]. Dans la Millenium Cohort Study, trois enfants parmi les dix ayant une trisomie 21 présentent un strabisme (30 %).
La trisomie 21 n’est pas la seule anomalie cytogénétique où un strabisme est souvent rencontré. La fréquence du strabisme dans la tétrasomie 18 est estimée à 42 %, avec une prépondérance de l’ésotropie [47]. Dans la trisomie 13, la trisomie 18 et la tétrasomie 22 (syndrome cat eye), un strabisme peut être présent [35].
Plusieurs syndromes sont connus pour avoir un taux de strabisme plus élevé que dans la population générale. Le syndrome de l’X fragile, lié à une mutation du gène FMR1, était connu pour avoir une forte prévalence de strabisme, allant de 30 % à 44 % dans les anciennes études ; mais les dernières publications n’ont retrouvé qu’une prévalence allant de 8 % à 4,4 % [1, 17], ce qui est moins que les chiffres retrouvés auparavant mais de deux à huit fois plus que la fréquence du strabisme dans la population générale. Les autres syndromes où un strabisme est fréquemment présent sont le syndrome de Sotos, le syndrome de Mœbius, le syndrome de Rubinstein-Taybi, le syndrome d’Angelman, le syndrome de Goldenhar, le syndrome de Cornelia de Lange, le syndrome du cri du chat, le syndrome de Waardenburg, le syndrome de Leigh, le syndrome de Franceschetti et le syndrome de Joubert [35].
Les cytopathies mitochondriales sont un groupe de maladies multiviscérales rares, liées à la présence de mutations dans l’ADN mitochondrial, où l’atteinte oculomotrice peut être un des signes cliniques présentés par le patient. Les autres anomalies, souvent présentes depuis l’enfance, peuvent inclure une acidose lactique, une anémie, une myopathie, des anomalies neurologiques, une perturbation endocrinienne, une maladie rénale, une perte d’audition, une dystrophie rétinienne et des anomalies de la conduction cardiaque souvent à l’origine du décès précoce du patient. Les troubles ophtalmologiques présentés par ces patients incluent divers signes cliniques, comme un strabisme, des mouvements oculomoteurs anormaux voire une ophtalmoplégie externe progressive (strabisme, ptosis puis ophtalmoplégie) ou un syndrome de Kearns-Sayre (ptosis, dystrophie rétinienne, ophtalmoplégie progressive) [27]. Dans son étude réalisée chez cinquante-neuf patients présentant une mutation prouvée de l’ADN mitochondrial, Grönlund trouve une ophtalmoplégie externe sévère chez neuf des patients (15,25 %) et un strabisme chez quatre des patients (6,8 %) [15]. La prise en charge des troubles oculomoteurs présentés par ces patients est souvent difficile, d’autant plus que les troubles cardiaques compliquent parfois la prise en charge chirurgicale.
Nous avons vu que la prévalence du strabisme dans la population générale est peu élevée (entre 0,99 % et 2,6 %) [14, 26, 34, 43] mais qu’elle peut être augmentée de manière importante dans des circonstances cliniques particulières : prématurité, faible poids de naissance, exposition à l’alcool ou au tabac durant la grossesse, troubles neurologiques associés, atteintes ophtalmologiques congénitales, craniosténoses et anomalies génétiques. Il est important en tant que thérapeute d’avoir à l’esprit ces facteurs de risque de strabisme durant nos consultations afin d’être particulièrement vigilant lorsque de telles situations cliniques se présentent.
[1] Alanay Y, Unal F, Turanli G, Alikasifoglu M, Alehan D, Akyol U, Belgin E, Sener C, Aktas D, Boduroglu K, Utine E, Volkan-Salanci B, Ozusta S, Genç A, Basar F, Sevinç S, Tunçbilek E. A multidisciplinary approach to the management of individuals with fragile X syndrome. J Intellect Disabil Res, 2007 ; 51 : 151-161.
[2] Birch EE, Wang J, Felius J, Stager DR Jr, Hertle RW. Fixation control and eye alignment in children treated for dense congenital or developmental cataracts. J AAPOS, 2012 ; 16 : 156-160.
[3] Borchert MS, Varma R, Cotter SA, Tarczy-Hornoch K, McKean-Cowdin R, Lin JH, Wen G, Azen SP, Torres M, Tielsch JM, Friedman DS, Repka MX, Katz J, Ibironke J, Giordano L. Multi-Ethnic Pediatric Eye Disease Study and the Baltimore Pediatric Eye Disease Study Groups. Risk factors for hyperopia and myopia in preschool children the multi-ethnic pediatric eye disease and Baltimore pediatric eye disease studies. Ophthalmology, 2011 ; 118 : 1966-1973.
[4] Brodsky MC, Fray KJ, Glasier CM. Perinatal cortical and subcortical visual loss: mechanisms of injury and associated ophthalmologic signs. Ophthalmology, 2002 ; 109 : 85-94.
[5] Cats BP, Tan KE. Prematures with and without regressed retinopathy of prematurity: comparison of long-term (6-10 years) ophthalmological morbidity. J Pediatr Ophthalmol Strabismus, 1989 ; 26 : 271-275.
[6] Chew E, Remaley NA, Tamboli A, Zhao J, Podgor MJ, Klebanoff M. Risk factors for esotropia and exotropia. Arch Ophthalmol, 1994 ; 112 : 1349-1355.
[7] Chia A, Dirani M, Chan YH, Gazzard G, Au Eong KG, Selvaraj P, Ling Y, Quah BL, Young TL, Mitchell P, Varma R, Wong TY, Saw SM. Prevalence of amblyopia and strabismus in young singaporean chinese children. Invest Ophthalmol Vis Sci, 2010 ; 7 : 3411-3417.
[8] Christiansen SP, Fray KJ, Spencer T. Ocular outcomes in low birth weight premature infants with intraventricular hemorrhage. J Pediatr Ophthalmol Strabismus, 2002 ; 39 : 157-165.
[9] Clergeau G, Morvan M. La vision de l’enfant. Développement et surveillance. FNRO éditions, Nantes, 2010 : 10.
[10] Cotter SA, Varma R, Tarczy-Hornoch K, McKean-Cowdin R, Lin J, Wen G, Wei J, Borchert M, Azen SP, Torres M, Tielsch JM, Friedman DS, Repka MX, Katz J, Ibironke J, Giordano L. Joint Writing Committee for the Multi-Ethnic Pediatric Eye Disease Study and the Baltimore Pediatric Eye Disease Study Groups. Risk factors associated with childhood strabismus: the multi-ethnic pediatric eye disease and Baltimore pediatric eye disease studies. Ophthalmology, 2011 ; 18 : 2251-2261.
[11] Creavin AL, Brown RD. Ophthalmic assessment of children with down syndrome: is England doing its bit? Strabismus, 2010 ; 18 : 142-145.
[12] Denis D, Genitori L, Conrath J, Lena G, Choux M. Ocular findings in children operated on for plagiocephaly and trigonocephaly. Childs Nerv Syst, 1996 ; 12 : 683-689.
[13] Donnelly UM. Horizontal strabismus worldwide – What are the risk factors? Ophthalmic Epidemiol, 2012 ; 19 : 117-119.
[14] Friedman DS, Repka MX, Katz J, Giordano L, IbironkeJ, Hawse P, Tielsch JM. Prevalence of amblyopia and strabismus in white and african american children aged 6 through 71 months. The Baltimore Pediatric Eye Disease Study. Ophthalmology, 2009 ; 116 : 2128-2134.
[15] Grönlund MA, Honarvar AK, Andersson S, Moslemi AR, Oldfors A, Holme E, Tulinius M, Darin N. Ophthalmological findings in children and young adults with genetically verified mitochondrial disease. Br J Ophthalmol, 2010 ; 94 : 121-127.
[16] Hakim RB, Tielsch JM. Maternal cigarette smoking during pregnancy. A risk factor for childhood strabismus. Arch Ophthalmol, 1992 ; 110 : 1459-1462.
[17] Hatton DD, Buckley E, Lachiewicz A, Roberts J. Ocular status of boys with fragile X syndrome: a prospective study. J AAPOS, 1998 ; 2 : 298-302.
[18] Hsu CM, Lin MC, Sheu SJ. Manifested strabismus in a case of Apert syndrome. J Chin Med Assoc, 2011 ; 74 : 95-97.
[19] Jacobs SM, Green-Simms A, Diehl NN, Mohney BG. Long-term follow-up of acquired nonaccommodative esotropia in a population-based cohort. Ophthalmology, 2011 ; 118 : 1170-1174.
[20] Jadico SK, Young DA, Huebner A, Edmond JC, Pollock AN, McDonald-McGinn DM, Li YJ, Zackai EH, Young TL. Ocular abnormalities in Apert syndrome: genotype/phenotype correlations with fibroblast growth factor receptor type 2 mutations. J AAPOS, 2006 ; 10 : 521-527.
[21] Kim DH, Kim JH, Kim SJ, Yu YS. Long-term results of bilateral congenital cataract treated with early cataract surgery, aphakic glasses and secondary IOL implantation. Acta Ophthalmol, 2012 ; 90 : 231-236.
[22] Krinsky-McHale SJ, Jenkins EC, Zigman WB, Silverman W. Ophtalmic disorders in adults with down syndrome. Curr Gerontol Geriatr Res, 2012 ; Article ID 974253.
[23] Khong JJ, Anderson PJ, Hammerton M, Roscioli T, Selva D, David DJ. Differential effects of FGFR2 mutation in ophthalmic findings in Apert syndrome. J Craniofac Surg, 2007 ; 18 : 39-42.
[24] Lindqvist S, Vik T, Indredavik MS, Skranes J, Brubakk AM. Eye movements and binocular function in low birthweight teenagers. Acta Ophthalmol, 2008 ; 86 : 265-274.
[25] Ljubic A, Trajkovski V, Stankovic B. Strabismus, refractive errors and nystagmus in children and young adults with down syndrome. Ophthalmic Genet, 2011 ; 4 : 204-211.
[26] Matsuo T, Matsuo C. Comparison of prevalence rates of strabismus and amblyopia in Japanese elementary school children between the years 2003 and 2005. Acta Med Okayama, 2007 ; 61 : 329-334.
[27] Michaelides M, Moore AT. The genetics of strabismus. J Med Genet, 2004 ; 41 : 641-646.
[28] Mohney BG, Lilley CC, Green-Simms AE, Diehl NN. The long-term follow-up of accommodative esotropia in a population-based cohort of children. Ophthalmology, 2011 ; 118 : 581-585.
[29] Motley WW 3rd, Saltarelli DP. Ophthalmic manifestations of mosaic Down syndrome. J AAPOS, 2011 ; 15 : 362-366.
[30] Muen WJ, Saeed MU, Kaleem M, Abernethy L, Chandna A. Unsuspected periventricular leukomalacia in children with strabismus : a case series. Acta Ophthalmol Scand, 2007 ; 85 : 677-680.
[31] Multi-ethnic Pediatric Eye Disease Study Group. Prevalence of amblyopia and strabismus in african american and hispanic children ages 6 to 72 months. The Multi-ethnic Pediatric Eye Disease Study. Ophthalmology, 2008 ; 115 : 1229-1236.
[32] Nakamura KM, Diehl NN, Mohney BG. Incidence, ocular findings, and systemic associations of ocular coloboma: a population-based study. Arch Ophthalmol, 2011 ; 129 : 69-74.
[33] O’Connor AR, Stephenson TJ, Johnson A, Tobin MJ, Ratib S, Fielder AR. Strabismus in children of birth weight less than 1701 g. Arch Ophthalmol, 2002 ; 120 : 767-773.
[34] Pathai S, Cumberland PM, Rahi JS. Prevalence of and early-life influences on childhood strabismus: findings from the Millennium Cohort Study. Arch Pediatr Adolesc Med, 2010 ; 164 : 250-257.
[35] Paul TO, Hardage LK. The heritability of strabismus. Ophthalmic Genet, 1994 ; 15 : 1-18.
[36] Robaei D, Rose KA, Kifley A, Cosstick M, Ip JM, Mitchell P. Factors associated with childhood strabismus. Findings from a population-based study. Ophthalmology, 2006 ; 113 : 1146-1153.
[37] Spanou N, Alexopoulos L, Manta G, Tsamadou D, Drakos H, Paikos P. Strabismus in pediatric lens disorders. J Pediatr Ophthalmol Strabismus, 2011 ; 48 : 163-166.
[38] Srinagesh V, Simon JW, Meyer DR, Zobal-Ratner J. The association of refractive error, strabismus, and amblyopia with congenital ptosis. J AAPOS, 2011 ; 15 : 541-544.
[39] Stephenson T, Wright S, O’Connor A, Fielder A, Johnson A, Ratib S, Tobin M. Children born weighing less than 1701 g: visual and cognitive outcomes at 11-14 years. Arch Dis Child Fetal Neonatal Ed, 2007 ; 92 : 265-270.
[40] Tay T, Martin F, Rowe N, Johnson K, Poole M, Tan K, Kennedy I, Gianoutsos M. Prevalence and causes of visual impairment in craniosynostotic syndromes. Clin Experiment Ophthalmol, 2006 ; 34 : 434-440.
[41] Tay T, Martin F, Rowe N, Johnson K, Poole M, Tan K, Kennedy I, Gianoutsos M. Visual manifestations of craniofrontonasal dysplasia. J Pediatr Ophthalmol Strabismus, 2007 ; 44 : 251-254.
[42] Tinley C, Grötte R. Comitant horizontal strabismus in South African black and mixed race children – A clinic-based study. Ophthalmic Epidemiol, 2012 ; 19 : 89-94.
[43] Torp-Pedersen T, Boyd HA, Poulsen G, Haargaard B, Wohlfahrt J, Holmes JM, Melbye M. Perinatal risk factors for strabismus. Int J Epidemiol, 2010 ; 39 : 1229-1239.
[44] Torp-Pedersen T, Boyd HA, Poulsen G, Haargaard B, Wohlfahrt J, Holmes JM, Melbye M. In-utero exposure to smoking, alcohol, coffee, and tea and risk of strabismus. Am J Epidemiol, 2010 ; 171 : 868-875.
[45] VanderVeen DK, Bremer DL, Fellows RR, Hardy RJ, Neely DE, Palmer EA, Rogers DL, Tung B, Good WV ; Early Treatment for Retinopathy of Prematurity Cooperative Group. Prevalence and course of strabismus through age 6 years in participants of the Early Treatment for Retinopathy of Prematurity randomized trial. J AAPOS, 2011 ; 15 : 536-540.
[46] Warrasak S, Nawarutkulchai S, Sinsawat P. Functional result and visual outcome in early versus conventional treatment of retinopathy of prematurity. J Med Assoc Thai, 2012 ; 95 : S107-S115.
[47] White WA, Schatz MP, Sebold C, Hale DE, Cody J. Ophthalmic manifestations of tetrasomy 18p. J AAPOS, 2011 ; 15 : 268-271.
De nombreux éléments sont connus comme étant des facteurs de risque du strabisme ou comme facteurs favorisants leur survenue (cf. supra), mais il y a peu d’explications biochimiques ou génétiques qui ont été apportées, ces dernières années, concernant l’hérédité des strabismes concomitants, alors que des découvertes génétiques ont été faites concernant les strabismes incomitants [3, 11, 21, 22]. Depuis très longtemps, une susceptibilité familiale dans la survenue d’un strabisme au sein d’une famille est suspectée. Outre la phrase ancienne dont l’origine est rapportée à Hippocrate « Les loucheux engendrent des loucheux », de nombreuses études ont évalué le risque de survenue d’un strabisme chez les enfants dans des familles où il y a un antécédent de strabisme. Les enfants des familles où déjà un membre présente un strabisme ont un risque estimé à 15 % d’avoir un défaut d’alignement des globes oculaires [1, 14]. Ce chiffre, extrêmement plus important que la prévalence du strabisme dans la population générale (entre 0,99 % et 2,6 %), fait évoquer un caractère héréditaire à la survenue de ce trouble oculomoteur [4, 9, 13, 18]. Mais ce taux de 15 %, comme l’a montré Ziakas, peut varier en fonction du type de strabisme et en fonction du degré de parenté [23]. Dans une analyse épidémiologique réalisée sur trois générations de quatre-vingt-seize cas index de strabisme — comprenant des ésotropies infantiles (vingt-six cas), des ésotropies accommodatives (quarante-neuf cas), des ésotropies liées à une anisométropie (quinze cas) et des exotropies (six cas) —, la prévalence de strabisme est évaluée entre 4 % et 26,1 % pour les apparentés de premier degré en fonction du type de strabisme [23]. Le risque le plus fort (26,1 %) concerne les apparentés de premier degré dans le cas du strabisme accommodatif ; le plus faible (4 %) concerne les apparentés de premier degré de patients ayant une exotropie. Le pourcentage concernant les deux autres types de strabismes est proche du chiffre de 15 % retrouvé dans des populations de familles strabiques lors d’une analyse globale. En revanche, le pourcentage de strabisme dans les cas de strabisme accommodatif diminue à 7,5 % pour les apparentés de second degré et à 4,8 % pour les apparentés de troisième degré. Toutefois, pour toutes les catégories de strabisme, même si le degré d’apparenté s’éloigne, la prévalence de strabisme reste toujours plus élevée que dans la population générale. Ceci est-il lié uniquement à l’information génétique ou aussi à des facteurs environnementaux familiaux ?
Afin de savoir si le strabisme était lié dans une même famille à l’hérédité ou à la présence de facteur de risque lors de grossesse, Podgor a fait une analyse épidémiologique chez 40 000 familles dont 5 000 avaient plus de deux enfants afin d’évaluer, dans des fratries d’enfants ayant moins de sept ans, les associations entre survenue d’une ésotropie ou d’une exotropie et le déroulement de la grossesse [15]. Dans une même fratrie, quand un enfant présente une ésotropie, l’odd ratio pour le risque de survenue d’une ésotropie pour les autres enfants de la même famille a été retrouvé à 2,6. Si les grossesses dans cette famille sont multiples, l’odd ratio s’élève alors à 5,4. Dans cette même étude, le risque familial est peu marqué lors de grossesses simples en ce qui concerne les exotropies. En revanche, l’odd ratio s’élève à 330 lors de grossesses multiples [15]. L’ajustement avec les autres facteurs de risque connus comme pourvoyeurs de strabisme diminue l’odd ratio à 130 pour l’association grossesse multiple et exotropie.
Les études réalisées chez les jumeaux monozygotes et dizygotes n’ont fait que conforter l’idée d’un subtratum génétique dans la survenue d’un strabisme. Wilmer, dans une méta-analyse des études réalisées entre 1956 et 2002 chez des jumeaux monozygotes et dizygotes, a mis en évidence une concordance phénotypique de 66 % chez les jumeaux monozygotes, contrairement aux jumeaux dizygotes où cette concordance est de 19 % [19]. Cette différence de concordance entre la survenue de strabisme chez des jumeaux monozygotes et dizygotes est statistiquement significative pour Mastuo [8]. Il a d’ailleurs noté que la concordance dans la présentation phénotypique était prédominante chez les jumeaux monozygotes dans le cas des ésotropies accommodatives et des exotropies intermittentes [8].
Que ce soit lors des études familiales ou lors des études gémellaires, les constatations cliniques et épidémiologiques évoquent la présence d’un fond héréditaire dans la genèse des strabismes, mais la mise en évidence de ces liens génétiques reste compliquée, notamment du fait que le strabisme, comme nous avons pu le voir dans la première partie, est une maladie multifactorielle dont certains facteurs peuvent, eux-mêmes, avoir une origine héréditaire. Shah et al. ont montré que, parmi cent quinze frères et sœurs d’enfants qui avaient un strabisme, ils retrouvaient des anomalies ophtalmologiques significatives, comme un astigmatisme important ou une hypermétropie, chez 42,6 % des frères et sœurs [17]. Une anisométropie significative était retrouvée dix fois plus fréquemment dans cette population que dans une population appariée pour l’âge [17]. C’est pourquoi, une détection précoce des amétropies et un traitement dans les familles ayant une histoire d’ésotropie accommodative sont essentiels pour réduire les amblyopies et permettre le développement d’une vision binoculaire normale.
Un rôle favorable d’une prédisposition génétique dans le développement des anomalies réfractives a été montré dans des études d’hérédité et de ségrégation familiale [20]. Notamment, il a été montré une liaison génétique entre l’hypermétropie et la région chromosomique 3q26 [6]. Des études complémentaires sont nécessaires pour déterminer l’origine des troubles réfractifs mais leur caractère multifactoriel avec des éléments possiblement d’origine génétique est le plus probable. Ce qui complexifie d’autant plus la recherche génétique dans le cas de strabismes concomitants où l’on sait que la présence d’une amétropie peut être un facteur déclenchant.
Des difficultés dans la connaissance de la transmission intrafamiliale du strabisme, plus particulièrement dans l’étude de la pénétrance, sont présentes à cause d’une caractérisation parfois imprécise de la forme clinique du strabisme au cours de certaines études [23]. Souvent, il y a une facilité de diagnostic du strabisme devant le symptôme visuel présenté par le patient ; par contre, dans sa famille, les sujets non symptomatiques ne sont pas analysés pour la présence d’un syndrome phorique ou d’une mauvaise vision stéréoscopique. Il n’y a qu’une seule étude ancienne qui inclut l’étude des phories [19]. Cet élément biaise les études de transmission familiale en sous-estimant la fréquence des strabismes et en rendant erronée la réflexion concernant le mode de transmission au cours des études.
Le mode de transmission polygénique ou multifactoriel est actuellement le mode de transmission retenu [7]. Charles Rémy, dans une étude mathématique réalisée à partir de l’observation clinique de cinq cent trente-quatre cas d’ésotropies infantiles arrive à la même conclusion, qui est celle d’une transmission multigénique (cf. infra). Selon lui, deux hypothèses concernant le mode de transmission sont possibles : le système pourrait être multigénique avec un gène récessif et deux ou trois gènes dominants — mais il faudrait déterminer le facteur de dilution pour les haplotypes dans la population générale — ou encore une transmission avec quatre dominants et ceci indépendamment de la fréquence des haplotypes dans la population générale. Maunenee et al. concluent, quant à eux, à une transmission de deux gènes autosomiques dominants avec une pénétrance incomplète ou une hérédité multifactorielle [10]. Actuellement, peu d’études sur les liaisons génétiques dans les strabismes concomitants ont été publiées. Le premier locus de susceptibilité génétique de strabisme a été publié par Parikh en 2003 [12]. Chez sept familles sélectionnées parmi cent cinquante familles où de nombreux cas d’ésotropies avaient été confirmés, une analyse de liaison avec séquençage complet du génome a été réalisée, permettant de trouver un locus de susceptibilité génétique. Ce locus, situé en position 7p22.1, a été retrouvé dans une grande famille de patients en partant de l’hypothèse d’un modèle d’hérédité récessive [12]. Depuis, des travaux japonais ont également retrouvé une forte liaison pour ce locus en 7p22.1 dans un panel de cinquante-cinq familles d’ésotropies [16]. Dans ces mêmes cinquante-cinq familles japonaises, il a été mis en évidence une liaison pour le marqueur D4S1575 en position 4q28.3 en utilisant un modèle dominant, où le calcul de probabilité suggère que le gène responsable de cette liaison génétique serait contenu dans cette région à 90 % mais, depuis, le gène n’a pas été plus précisément localisé [16]. Cette même équipe a également retrouvé un locus de susceptibilité de strabisme concomitant en position 7q31.2 [16]. On voit donc ici que l’hérédité strabique semble hétérogène, avec une transmission probablement selon un modèle multifactoriel où la génétique ne serait qu’un élément parmi d’autres dans la survenue des formes primitives de strabisme concomitant [15].
Même si les études épidémiologiques et cliniques suggèrent une origine génétique au strabisme, celle-ci n’a pas été, pour le moment, clairement démontrée. Une transmission multifactorielle est pour le moment le plus probable, avec trois locus de susceptibilité publiés (7p22.1, 4q28.3, 7q31.2) sans qu’un gène n’ait été isolé. Nous devons donc nous contenter de rechercher les facteurs de risque connus dans nos familles de patients strabiques et, quand c’est possible, les corriger.
Le strabisme est une maladie fréquente pour laquelle une hérédité est souvent observée. Cette étude est partie de l’observation clinique de cinq cent trente-cinq cas d’ésotropies. La fréquence d’une hérédité strabique permet-elle de prévoir son mode de transmission ? Est-ce une maladie génétique ? Au sein d’une même famille, l’existence de plusieurs expressions de la maladie évoque une hérédité plurifactorielle.
Position du problème
Le polymorphisme d’expression de la maladie au sein d’une même famille (hypermétropie pure, ésotropie accommodative normosensorielle, microtropie, macrotropie opérée, amblyopie) évoque une absence d’hérédité spécifique à chaque type d’ex-pression de la maladie mais une hérédité polyfactorielle de transmission multigénique [5, 2].
Un haplotype (ap????, ?, ???, « simple », antonyme de d?p????) est la moitié d’un équipement génétique, composé de vingt-deux autosomes et d’un gonosome X ou Y, hérité de chaque parent. L’haplotype est donc un ensemble de gènes s’exprimant chacun sous différents allèles.
AB × CD = AC + AD + BC + BD en première génération.
Donc il y a 50 % de chance de trouver un haplotype commun entre parents et enfants, puisque l’haplotype A, B, C ou D se retrouve dans deux des quatre combinaisons chez les enfants.
Là encore, l’haplotype A, B, C ou D se retrouve avec une probabilité de 50 % (deux sur quatre) entre frères et sœurs.
La combinaison des enfants AC, AD, BC, BD avec chacun un étranger UnVn donnera les combinaisons suivantes : AU1, AV1, CU1, CV1, AU2, AV2, DU2, DV2, BU3, BV3, CU3, CV3, BU4, BV4, DU4, DV4, c’est-à-dire 16 cousins possibles.
La probabilité d’haplotypes entre cousins et oncles (AC, AD, BC, BD) est de 4/16, soit 25 %, car on retrouve quatre fois l’haplotype A, B, C, D chez les cousins.
Entre cousins, on retrouve également 4 fois cet haplotype sur les 16 possibilités, soit 25 %.
En résumé, probabilité qu’un individu X ait un haplotype commun avec :
ses parents : 50 % ;
ses frères et sœurs : 50 % ;
ses oncles ou tantes : 25 % ;
ses cousins germains : 25 %.
Une étude sur 534 cas d’ésotropies infantiles avait montré que, pour un sujet X, on retrouvait 9,9 % de parents atteints, 9,4 % de frères et sœurs, 6,9 % d’oncles et tantes et 5,8 % de cousins germains, sans caractère lié au sexe (50 %/50 %).
Ces fréquences sont mises en relation avec la probabilité d’haplotype commun selon le tableau suivant (effectif 534) avec une bonne corrélation statistique, puisque le ?2 des cellules entre les deux distributions est inférieur à 0,7 et la régression r est égale à 0,99 :
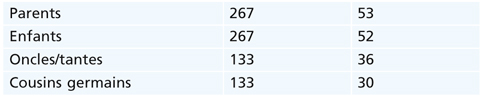
Conclusion : les fréquences observées cliniquement sont conformes à la probabilité d’haplotype commun.
À partir d’une observation clinique de base, sachant que la probabilité d’avoir un enfant qui louche entre parents qui ne louchent pas est de 2 % et passe à 10 % si l’un des deux parents louche, peut-on construire un modèle de transmission génétique ? Nous verrons successivement les transmissions monogéniques « mendélienne », puis leurs recombinaisons.
Soit (A) l’allèle sain et (a) l’allèle malade.
Étudions la transmission entre parents et enfants dans une population saine qui peut être AA ou Aa :
AA × AA = AA + AA + AA + AA soit 4 possibilités ;
AA × Aa = AA + AA + Aa + Aa soit 4 possibilités ;
Aa × Aa = AA + Aa + Aa + aa, soit 4 cas dont un malade (aa).
Donc, sur 16 possibilités, une est malade, c’est-à-dire 1/16 (= 6%) : c’est la probabilité théorique la plus élevée de la maladie qu’on puisse trouver. En réalité, la fréquence observée de la maladie est plus faible et correspond au « bruit de fond » de la maladie. Entre les deux existe un coefficient multiplicatif, le « facteur de dilution » du gène malade dans la population générale.
Le « facteur de dilution » est égal à 1 si le gène est présent dans toute la population (les groupes sanguins, par exemple) ou très élevé dans le cas d’une maladie rare (maladie génétique orpheline, par exemple). Entre les deux existe un facteur multiplicatif qui traduit la fréquence du gène entre fréquence maximale, celle du calcul précédent, et la fréquence observée (augmentée par consanguinité).
Dans le daltonisme, maladie relevant d’une hérédité récessive liée au sexe, 8 % des hommes et 0,4 % des femmes sont atteints, ce qui atteste d’un facteur de dilution de 30 et d’une probabilité composée.
Supposons un parent atteint (aa) :
AA × aa = Aa + Aa + Aa + Aa.
Aa × aa = Aa + Aa + aa + aa.
Sur 8 possibilités, 2 sont malades, soit 25 %.
Si les deux parents sont malades :
aa × aa = aa + aa + aa + aa.
Tous les sujets sont malades, soit 100 %.
En résumé, la probabilité d’expression la plus élevée d’un gène récessif (présent chez tous les individus) est :
aucun parent malade : 1/16, soit 6 % ;
un parent malade : 4/16, soit 25 % ;
deux parents malades : 4/4, soit 100 %.
La seule combinaison possible est Aa + Aa chez un premier couple donnant des enfants (AA, Aa, aA, aa) et idem chez l’autre couple ; les cousins atteints répondront à la combinaison aa, soit une probabilité de 25 %.
NB : Ceci donnerait 8,3 % avec un facteur de dilution de 3, proche de la fréquence observée (cf. infra).
Population saine : AA × AA = AA + AA + AA + AA, aucun sujet atteint.
Un parent atteint :
AA × Aa = AA + Aa + AA + Aa, 4 dont 2 malades ;
AA × aa = Aa + Aa + Aa + Aa, 4 dont 4 malades ;
donc : 6 malades sur 8 possibilités.
Deux parents atteints :
Aa × Aa = AA + Aa + aA + aa, 4 dont 3 malades ;
Aa × aa = Aa + Aa + aa + aa, 4 dont 4 malades ;
aa × Aa = aA + aa + aA + aa, 4 dont 4 malades ;
aa × aa = aa + aa + aa + aa, 4 dont 4 malades ;
donc : sur deux parents malades, 16 possibilités dont 15 pathologiques.
Entre cousins strabiques à parents sains : aucune combinaison n’est possible puisqu’il faudrait un parent atteint.
En résumé, la probabilité la plus élevée est :
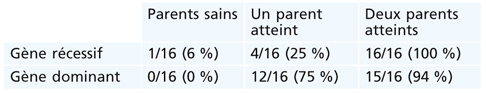
Cette probabilité absolue (ou maximale) sera modulée par un facteur d’expressivité variable ou de pénétrance incomplète, et par le facteur de « dilution ».
Il s’agit de déterminer le nombre (entier) et la nature des gènes (récessifs ou dominants) impliqués dans le mode transmission de la maladie en fonction des fréquences observées.
Type de transmission :
non liée au sexe ;
non liée au système HLA : nous l’avons démontré dans une précédente étude ;
autosomique récessive monogénique ?
oui, si on admet un bruit de fond de 2 %, soit un facteur de dilution de 3 (probabilité théorique absolue de 6 %) ; comme on observe 9,9 % chez les parents et 9,4 % dans la fratrie, ce qui conduirait à une probabilité de 27-30 % assez proche des 25 % théoriques ;
mais si le bruit de fond est différent de 2 % : hypothèse rejetée ;
autosomique dominante monogénique ? non, car il faut un parent obligatoirement atteint sauf si on admet une pénétrance incomplète et une expressivité variable ;
polygénique ? deux approches sont possibles :
multiplication des probabilités de présence de chaque gène ;
combinaisons d’allèles sains et malades des différents haplotypes.
En cas d’association de gènes indépendants, on multiplie les probabilités : P = P1 × P2. Si les gènes sont dépendants, on parle de probabilité conditionnelle : P = PB (prob de B sachant A) × PA ; dans ce cas, la probabilité globale peut être supérieure ou inférieure à une probabilité indépendante selon la valeur de la probabilité conditionnelle du second événement.
Dans ce type d’hérédité, un seul gène ne suffit plus à expliquer la transmission ; il faut une combinaison de plusieurs gènes récessifs ou dominants.
Deux gènes récessifs conduiraient au maximum à 6 % × 6 % = 0,03 %, trop faible. Il y a donc association au moins d’un gène récessif et d’un gène dominant.
Étudions la population des strabiques dont un parent est malade :
la fréquence observée est de 9,9 %, soit cinq à six fois la fréquence spontanée ;
la probabilité d’expression d’un gène récessif est de 25 %, dominant 75 %, avec un facteur de dilution génique 1 ; or le facteur de dilution se doit d’être inférieur à 3 (sinon on pourrait faire appel à une hérédité récessive : cf. supra), d’où les combinaisons des gènes :
1R + 1D = 19 %, 1R + 2D = 14 %, 1R + 3D = 10 %, 1R + 4D = 7 %, 1R + 5D = 5 %, 8D = 9 %, 2R = 6 %, 3R = 1,5 %, 4R = 0,4 % ;
avec un facteur de dilution 1, les combinaisons 1R + 3D (10 %) ou 8D (9 %) sont concordantes ;
avec un facteur de dilution 2 : 1R + 1D (9,5 %) ;
étant donné la fréquence importante du strabisme dans la population générale, un facteur de dilution de 1 et 3 conduirait à une combinaison de 1 à 2R maximum et 2 à 3D.
Dans cette hypothèse, le système serait donc multigénique avec un gène récessif et deux à trois gènes dominants.
Nous allons voir que la combinaison de plusieurs gènes dominants exprime la maladie à partir de parents apparemment sains.
Un gène est représenté par deux allèles, (A) est l’allèle sain et (a) le malade ; les combinaisons possibles sont : AA, Aa, aa, trois possibilités dont deux sont malades — souvent le gène doublement dominant aa est létal et non viable.
La question est de savoir de combien de gènes dépend la maladie.
Dans le cas où aucun parent n’est malade, on voit rapidement que la maladie ne peut dépendre d’un seul gène dominant car des parents sains (AA) ne peuvent donner que des enfants sains (AA). Si un parent est malade (Aa) ou (aa), sa combinaison avec un parent sain (AA) donne deux mariages possibles et 8 enfants (4 × 2) dont 6 sont malades (75 %). Dans l’hypothèse d’un seul gène dominant, un enfant malade a obligatoirement un parent malade.
En revanche, si on admet que la maladie dépend de plusieurs gènes dominants, nous allons montrer que des parents apparemment sains peuvent engendrer des enfants malades.
Dans la suite des calculs, nous utiliserons un mode d’écriture binaire avec A = 1 et a = 0 ; le premier haplotype apparaît ainsi sous la forme d’une matrice ligne qui va se multiplier avec l’autre haplotype sous forme d’une matrice colonne, le résultat donnant un chiffre ; si le produit est nul, le sujet est malade ; si le résultat n’est pas nul, le sujet est normal ou porteur sain (le produit inverse d’une matrice colonne par une matrice ligne de même ordre donne une matrice carrée).
Soit par exemple (AA) et (BB) deux gènes. Pour que la maladie apparaisse, il faut que la combinaison résultante comporte à la fois (a) et (b) chez l’enfant, mais peu importe de savoir par quel parent ils sont apportés (ils n’ont pas besoin de siéger sur le même haplotype), soit par exemple du type (Aa,bB).
NB : Dans le cas de l’enfant (Aa,bB), un parent est Ab et l’autre aB.
Dans toute l’étude qui suit, nous allons nous intéresser à deux populations d’enfants : une première issue de deux parents apparemment sains, mais qui peuvent être porteurs d’une partie des gènes pathologiques, et une seconde issue d’un parent malade et d’un parent apparemment sain.
Le gène A existe sous trois formes : AA, Aa et aa, dont deux sont pathogènes Aa et aa ;
Idem pour le gène B : BB, Bb, bb (NB : Les formules Aa et aA, Bb et bB sont-elles équivalentes et redondantes dans les échiquiers d’hybridation ? Non si on opte pour la combinaison des haplotypes).
Leur combinaison donne 3 × 3 possibilités soit 32, ou 9 formules génotypiques possibles.
S’il y avait n gènes, on aurait 3n génotypes possibles dont 2n seraient malades.
Les porteurs sains, c’est-à-dire ceux qui ne portent pas tous les allèles pathogènes et n’expriment pas la maladie, sont au nombre de 3n – 2n.
Pour deux gènes A et B, il y a cinq types de parents sains possibles :
1 : (AA,BB) ;
2 : (AA,Bb) ;
3 : (AA,bb) ;
4 : (Aa,BB) ;
5 : (aa,BB).
Cela vérifie la formule précédente : 9 – 4 = 5.
Sur un haplotype, il y n allèles (A, B, C…) ou (a, b, c…), ce qui donne 2n haplotypes possibles qui, en se recombinant, vont donner 2n(2n + 1)/2 génotypes possibles (on ne reprend pas le premier de la série) :
pour n = 1, il y a donc 2 haplotypes (1 ou 0) et 3 génotypes (1,1), (1,0) et (0,0) dont 2 malades ;
pour n = 2, il y a 4 haplotypes, donc 10 génotypes dont 5 malades ;
pour n = 3, il y a 8 haplotypes, donc 36 génotypes dont 13 malades.
On rappelle que seule la combinaison porteuse de (a) et (b) sera malade, que (a) ou (b) soit à droite ou à gauche de la formule, c’est-à-dire sur un parent ou sur l’autre.
Combinons chacun des premiers types de parents 1, 2, 3, 4, 5 :
1 peut se combiner à 1, ce qui donnera 4 enfants possibles dont aucun malade, puis à 2, ce qui donnera toujours 4 enfants dont aucun malade et ainsi de suite avec 3, 4, et 5 ; soit 20 enfants possibles dont aucun n’est malade ;
2 se combinera à 2 (non plus à 1 puisque c’est déjà fait), ce qui donnera 4 enfants possibles dont aucun ne sera malade, idem pour 2 + 3, 2 + 4 donnera un malade, et 2 + 5 donnera deux malades ; soit au total 16 enfants possibles dont 3 malades ;
3 + 3 ne donne pas d’enfant malade, 3 + 4, 4 enfants dont 2 malades, 3 + 5, 4 enfants dont 4 malades ; soit 12 enfants possibles dont 6 malades ;
4 + 4, 4 + 5 donneront 8 enfants possibles dont aucun n’est malade ;
5 + 5, 4 enfants dont aucun malade.
Donc, au total, nous avons eu 20 + 16 + 12 + 8 + 4 = 60 enfants possibles, dont 9 malades.
On voit que le nombre de mariages M entre parents P est une somme arithmétique de : M = P(P + 1)/2, et le nombre d’enfants est de 4M ou 2P(P + 1).
En appliquant la formule du nombre de parents, on établit la relation entre les différents types de mariages, totaux M, parents sains MS, parents malades Mm : M = Mm + MS + PM × PS, où PM est le nombre de parents malades et PS le nombre de parents sains.
Ainsi, on peut énoncer que :
des parents sains peuvent engendrer des enfants malades ;
la probabilité d’avoir un enfant malade si les deux parents sont apparemment sains (mais porteurs de gènes pathologiques disparates) est de 9/60, soit 15 % lorsque deux gènes dominants sont impliqués.
Il y a quatre types de parents malades :
1 : (Aa,Bb) équivalent à (Aa,bB) ;
2 : (aa,bB) ;
3 : (aA,bb) ;
4 : (aa,bb).
Toujours en cas de deux gènes dominants, étudions la combinaison d’un parent sain (5 cas) et d’un parent malade (4 cas), en sachant que (Aa,Bb) et (Aa,bB) sont équivalents quant au nombre d’enfants malades (sinon on aurait 5 parents malades au lieu de 4).
Le nombre de mariages est de 20 (5 × 4) et d’enfants de 80 (4 × 20) dont le décompte donne 48 malades (60 %).
Il y a cinq types de parents malades ; dans ce cas nous aurons 61 génotypes pathologiques sur 100 enfants provenant de 25 mariages.
Remarque : Avec un facteur de dilution de 7 et deux gènes dominants, nous avons 2 % de sujets malades à parents sains et 9 % de sujets malades dont un parent est malade, ce qui est assez proche des fréquences observées (2 % de bruit de fond et 10 % si un parent est malade).
La question qui se pose alors est de généraliser l’étude à n gènes et de trouver la probabilité d’enfant malade généré par des parents sains mais porteurs d’une partie des allèles pathogènes, que ces allèles soient sur l’un ou l’autre des deux parents.
Par exemple, pour trois gènes A, B, C.
Entre parents sains : l’étude des combinaisons montre qu’il y a 190 mariages possibles, donc 760 enfants dont le dénombre donne 133 enfants malades (18 %).
Entre un parent sain et un parent malade : il y a 152 mariages possibles, donc 608 enfants, dont le décompte donne 377 malades (62 %).
Rappelons que la généralisation de la formule fait entrer une base de calcul matriciel en transformant tout haplotype en une matrice composée de n éléments, représentant chaque gène, de valeur 1 (allèle normal « A ») ou 0 (allèle pathologique « a »).
Le produit d’une matrice ligne par une matrice colonne donne un chiffre, le résultat d’un génotype : s’il est égal à 0, le sujet est pathologique ; s’il est différent de 0, il est normal ou porteur sain.
L’étude se généralise à un nombre n de gènes en utilisant des algorithmes et un logiciel de calcul de type Excel. On s’aperçoit que si n augmente, la fréquence d’enfants malades issus d’un parent sain et d’un parent malade diminue, ce qui paraît normal compte tenu de la plus grande difficulté à réunir tous les recombinants pathologiques :
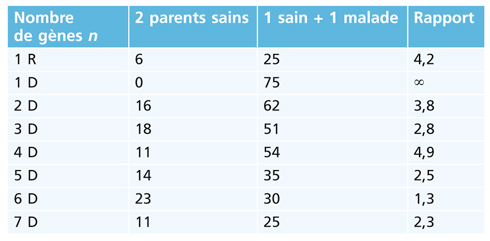
Ainsi pour n = 4, on observe un rapport de 4,9 entre les populations d’enfants issus de parents sains et un malade, assez voisin de ce qui est observé en clinique.
D’après le tableau, la valeur du rapport la plus proche de 5 à 6 est 4,9 et correspond à quatre gènes impliqués, auxquels certains attribueraient les fonctions suivantes :
des gènes de fonctionnalité : binocularité (microstrabisme de Lang), accommodation ;
des gènes de conformation : hypermétropie, mensurations de l’œil (rayon de courbure, longueur axiale), anomalies musculaires.
Ce mode de calcul ne fait pas intervenir le « facteur de dilution ».
Cette conception mérite quelques critiques.
La répartition des allèles (A) et (a) n’est pas identique dans la population générale ; la question serait de savoir quelle est la proportion de l’allèle malade (a), c’est-à-dire la valeur du facteur de dilution dans la population générale.
Cette conception « mendélienne » de la transmission est-elle toujours d’actualité : faut-il parler de gènes au sens classique ou de recombinants multifactoriels ?
Problème des haplotypes et des génotypes redondants dans le calcul des combinaisons ?
Répartition des haplotypes dans la population générale ? Prévalence de certains haplotypes comme en atteste la génétique des populations.
Le facteur de dilution : si le nombre de gènes présumés augmente, on s’aperçoit qu’entre population à deux parents sains et population à un parent malade, le rapport des enfants malades diminue ; c’est la combinaison à quatre gènes qui donne la valeur la plus proche (4,9) de celle observée cliniquement (5 à 6).
Rapport avec l’hypermétropie ? Fréquence de l’hypermétropie ? Mode de transmission génétique de l’hypermétropie ? Rapport avec le strabisme ?
D’après les calculs, résumons les différentes hypothèses quant au mode de transmission du strabisme :
un gène récessif ? non, car n’expliquerait pas le polymorphisme de la maladie au sein d’une même famille ;
un récessif plus deux à trois dominant ? pourquoi pas, mais il faudrait déterminer un facteur de dilution des haplotypes ;
quatre dominants, indépendamment de la fréquence des haplotypes.
La question de la nature et de la localisation des recombinants reste entière.
Eugénisme strabique ?
Si on assimile fréquence et probabilité, on peut énoncer que la probabilité d’avoir un enfant qui louche lorsqu’un parent ou un frère louche déjà est voisine de 10 %.
[1] Donnelly UM. Horizontal strabismus worldwide – What are the risk factors? Ophthalmic Epidemiol, 2012 ; 19 ; 117-119.
[2] Dufier J-L, Kaplan J. Œil et génétique. Rapport à la Société Française d’Ophtalmologie. Masson, Paris, 2005.
[3] Engle EC. Human genetic disorders of axon guidance. Cold Spring Harb Perspect Biol, 2010 ; 2 : a001784.
[4] Friedman DS, Repka MX, Katz J, Giordano L, IbironkeJ, Hawse P, Tielsch JM. Prevalence of amblyopia and strabismus in white and african american children aged 6 through 71 months. The Baltimore Pediatric Eye Disease Study. Ophthalmology, 2009 ; 116 : 2128-2134.
[5] Goddé-Jolly D, Dufier J-L. Ophtalmologie pédiatrique. Paris, Masson, 1992.
[6] Klein AP, Duggal P, Lee KE, Klein R, Bailey-Wilson JE, Klein BE. Linkage analysis of quantitative refraction and refractive errors in the Beaver Dam Eye Study. Invest Ophthalmol Vis Sci, 2011 ; 52 : 5220-5225.
[7] Lorenz B. Genetics of isolated and syndromic strabismus: facts and perspectives. Strabismus, 2002 ; 10 : 147-156.
[8] MatsuoT, Havashi M, Fujiwara H, Yamane T, Ohrsuki. Concordance of strabismic phenotypes in monozygotic versus multizygotic twins and other multiple birth. Jpn I Ophthalmol, 2002 ; 46 : 59-64.
[9] Matsuo T, Matsuo C. Comparison of prevalence rates of strabismus and amblyopia in Japanese elementary school children between the years 2003 and 2005. Acta Med Okayama, 2007 ; 61 : 329-334.
[10] Maumenee IH, Alston A, Mets MB, Flynn JT, Mitchell TN, Beaty TH. Inheritance of congenital esotropia. Trans Am Ophthalmol Soc, 1986 ; 84 : 85-93.
[11] Miyake N, Chilton J, Psatha M, Cheng L, Andrews C, Chan WM, Law K, Crosier M, Lindsay S, Cheung M, Allen J, Gutowski NJ, Ellard S, Young E, Iannaccone A, Appukuttan B, Stout JT, Christiansen S, Ciccarelli ML, Baldi A, Campioni M, Zenteno JC, Davenport D, Mariani LE, Sahin M, Guthrie S, Engle EC. Human CHN1 mutations hyperactivate alpha2-chimaerin and cause Duane’s retraction syndrome. Science, 2008 ; 321 : 839-843.
[12] Parikh V, Shugart YY, Doheny KF, Zhang J, Li L, Williams J, Hayden D, Craig B, Capo H, Chamblee D, Chen C, Collins M, Dankner S, Fiergang D, Guyton D, Hunter D, Hutcheon M, Keys M, Morrison N, Munoz M, Parks M, Plotsky D, Protzko E, Repka MX, Sarubbi M, Schnall B, Siatkowski RM, Traboulsi E, Waeltermann J, Nathans J. A strabismus susceptibility locus on chromosome 7p. Proc Natl Acad Sci USA, 2003 ; 100 : 12283-12288.
[13] Pathai S, Cumberland PM, Rahi JS. Prevalence of and early-life influences on childhood strabismus: findings from the Millennium Cohort Study. Arch Pediatr Adolesc Med, 2010 ; 164 : 250-257.
[14] Paul TO, Hardage LK. The heritability of strabismus. Ophthalmic Genet, 1994 ; 15 : 1-18.
[15] Podgor MJ, Remaley NA, Chew E. Associations between siblings for esotropia and exotropia. Arch Ophthalmol, 1996 ; 114 : 739-744.
[16] Shaaban S, Matsuo T, Fujiwara H, Itoshima E, Furuse T, Hasebe S, Zhang Q, Ott J, Ohtsuki H. Chromosomes 4q28.3 and 7q31.2 as new susceptibility loci for comitant strabismus. Invest Ophthalmol Vis Sci, 2009 ; 50 : 654-661.
[17] ShahS, Torner J, Mehta A. Prevalence of amblyogenic risk factors in siblings of patients with accommodative esotropia. J AAPOS, 2008 ; 12 : 487-489.
[18] Torp-Pedersen T, Boyd HA, Poulsen G, Haargaard B, Wohlfahrt J, Holmes JM, Melbye M. Perinatal risk factors for strabismus. Int J Epidemiol, 2010 ; 39 : 1229-1239.
[19] Wilmer JB, Backus BT. Genetic and environmental contributions to strabismus and phoria: evidence from twins. Vision Res, 2009 ; 49 : 2485-2493.
[20] Wojciechowski R. Nature and nurture: the complex genetics of myopia and refractive error. Clin Genet, 2011 ; 79 : 301-320.
[21] Yamada K, Andrews C, Chan WM, McKeown CA, Magli A, de Berardinis T, Loewenstein A, Lazar M, O’Keefe M, Letson R, London A, Ruttum M, Matsumoto N, Saito N, Morris L, Del Monte M, Johnson RH, Uyama E, Houtman WA, de Vries B, Carlow TJ, Hart BL, Krawiecki N, Shoffner J, Vogel MC, Katowitz J, Goldstein SM, Levin AV, Sener EC, Ozturk BT, Akarsu AN, Brodsky MC, Hanisch F, Cruse RP, Zubcov AA, Robb RM, Roggenkäemper P, Gottlob I, Kowal L, Battu R, Traboulsi EI, Franceschini P, Newlin A, Demer JL, Engle EC. Heterozygous mutations of the kinesin KIF21A in congenital fibrosis of the extraocular muscles type 1 (CFEOM1). Nat Genet, 2003 ; 35 : 318-321.
[22] Yazdani A, Chung DC, Abbaszadegan MR, Al-Khayer K, Chan WM, Yazdani M, Ghodsi K, Engle EC, Traboulsi EI. A novel PHOX2A/ARIX mutation in an Iranian family with congenital fibrosis of extraocular muscles type 2 (CFEOM2). Am J Ophthalmol, 2003 ; 136 : 861-865.
[23] Ziakas NG, Woodruff G, Smith LK, Thompson JR. A study of heredity as a risk factor in strabismus. Eye, 2002 ; 16 : 519-521.

