Ch. Costet, G. Demetz, N. Gambarelli, M.-N. George, A. Gomez, F. Oger-Lavenant, A. Péchereau, D. Thouvenin
A. Gomez, G. Demetz
L’importance de la prise en charge ophtalmologique précoce de l’enfant dès les premiers mois est cruciale pour le bon développement visuel. C’est pour cela que l’équipement optique par l’opticien doit être irréprochable et doit répondre parfaitement aux demandes de l’ophtalmologiste et de l’orthoptiste.
La réalisation d’une paire de lunettes pour enfant requiert de la part de l’opticien des compétences à la fois techniques (choix, conseils, prises de mesures, ajustage, etc.) et psychologiques (établir une coopération avec l’enfant mais aussi, parfois surtout, faire comprendre la finalité de l’équipement optique aux parents).
En effet, l’équipement optique est le support indispensable de la prescription, véritable traitement thérapeutique nécessaire au bon développement visuel de l’enfant.
C’est en quelque sorte une lunette sur mesure, dont la précision est directement liée au résultat attendu. C’est le support indispensable, véritable pierre angulaire de la prescription, véritable traitement thérapeutique nécessaire au bon développement visuel de l’enfant. Comme l’a démontré Jean-Pierre Bonnac, alors directeur technique Lissac, dès les années soixante, la monture enfant n’est pas une monture adulte en miniature : elle doit répondre précisément à un ensemble de critères techniques. Il a ainsi, grâce à ses travaux, créé la première collection de montures optiques de six mois à huit ans, véritable innovation exclusive de l’enseigne Lissac (fig. 17-1).

Fig. 17-1 Différentes montures adaptées aux besoins visuels et à la morphologie du jeune enfant.
(Avec l’aimable autorisation de Lissac Opticien.)
Le visage de l’enfant peut se définir par une morphologie particulière, qui n’est pas comparable à un visage adulte en réduction. Pour concevoir et proposer la monture la mieux adaptée aux besoins visuels et à la morphologie du jeune enfant, il faut prendre en compte plusieurs facteurs et les comparer à ceux de l’adulte (fig. 17-2).
La surface du champ de regard de l’enfant est sensiblement identique à celle de l’adulte. La différence porte surtout dans le cadran inféro-nasal. En effet, la racine de nez inexistante chez le tout petit, ne vient pas amputer le champ de regard (fig. 17-3).
L’absence de racine de nez impose également un appui nasal bas, pour assurer un positionnement correct des verres. Cette particularité entraîne un recouvrement des deux champs de regard. Les ponts des lunettes doivent donc être peu larges afin de ne pas occulter cet espace privilégié du champ binoculaire ou tout le développement de la convergence et de l’accommodation s’établit (fig. 17-3).
La position du champ de regard évolue également avec l’âge. La zone la plus employée se situe dans la partie supérieure ; elle correspond au regard vers le haut, c’est-à-dire vers le monde des adultes. Au cours de sa croissance, l’enfant grandit et ce champ bascule vers le bas pour occuper la position inverse, soit un tiers au-dessus de la position primaire du regard et deux tiers au-dessous (fig. 17-4) [1].
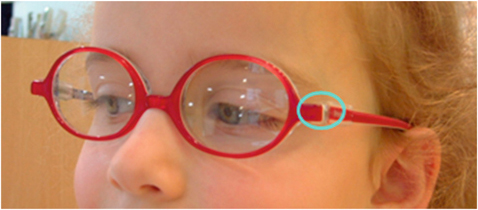
L’adéquation entre la morphologie du nez de l’enfant et celle de la monture est capitale dans l’adaptation des jeunes enfants. De plus, grâce au coussin nasal amortisseur en silicone qui joue un rôle antidérapant et antiallergique, cette petite monture reste bien en place et procure le confort nécessaire à l’acceptation de la prescription.
Afin de permettre un ajustage précis en confort et en stabilité, la monture doit être réalisée en acétate renforcé plutôt qu’en caoutchouc ou en Nylon, mais en aucun cas en métal avant l’âge de six ans. Elle peut être incolore ou proposée dans des teintes pastel, réalisables immédiatement et sur mesure.

Fig. 17-2 Champ du regard chez l’enfant et chez l’adulte.
(D’après J.-P. Bonnac, 2004 [1].)

Fig. 17-3 Monture pour bébé.
(Avec l’aimable autorisation de Lissac Opticien.)
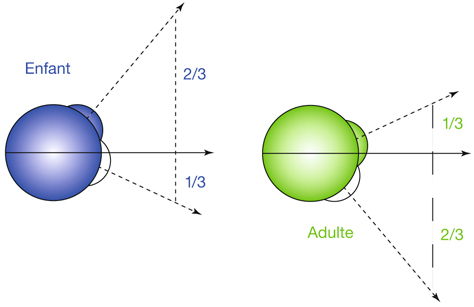
Fig. 17-4 Comparaison de l’orientation des champs de regard avec l’âge.
(D’après J.-P. Bonnac, 2004 [1].)
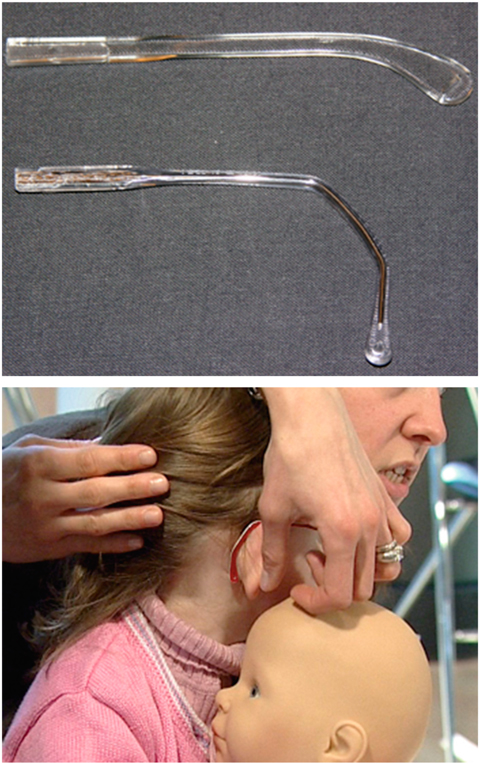
Il existe deux types de branches adaptables sur la face d’une monture enfant.
Nous proposons des branches extraplates thermoformables. La longueur est adaptée à la morphologie de chaque visage lors du choix de la monture. L’avantage réside dans le fait qu’elles permettent à l’enfant de rester allongé dans son berceau sans que la monture ne soit projetée vers l’avant.
Nous adaptons des branches plus longues que la normale afin de pouvoir réaliser un ajustage anatomique, dénommé périvistage, c’est-à-dire deux coudes francs qui suivent le sillon rétroauriculaire (fig. 17-5). Ces branches sont systématiquement équipées de ressort, ce qui évite les déformations et la casse en cas de choc ou tout simplement en cas de manipulations vigoureuses de la part de l’enfant. Afin de prévenir tout traumatisme, ces charnières en métal sont recouvertes d’un manchon en caoutchouc non allergique, qui joue le rôle de coussin protecteur en cas de choc (fig. 17-6).
Les verres correcteurs destinés aux enfants doivent répondre aux critères suivants :
-
qualité optique : la qualité d’image donnée par le verre doit être irréprochable sur tout le champ du verre, ce qui correspond à l’une des normes définies par la Communauté européenne ;
-
sécurité : les risques d’accident ou de chute sont assez fréquents chez les enfants, seule la matière organique répond aux normes de résistance. C’est pour cette raison, la sécurité, que le verre organique ORMA 1000 s’est imposé et a été rendu obligatoire, sur les directives du ministère de la Santé, pour l’équipement des enfants et des adolescents ;
-
légèreté : on comprend aisément que le confort et la stabilité des lunettes dépendent aussi du poids des verres ;
-
coût : cette notion est importante car l’enfant change en moyenne tous les douze mois de correction contre trente-six à quarante-huit mois chez l’adulte ; les pouvoirs publics proposent d’ailleurs un remboursement spécial pour les enfants.
La qualité optique d’un verre organique correcteur pour enfant peut se définir par différents facteurs, dont l’indice, la constringence, la densité et la transmission.
Il conditionne l’épaisseur et la cambrure du verre. Plus l’indice est élevé plus le verre sera mince et plat.
La constringence représente le chromatisme du verre. Chaque longueur d’onde composant la lumière solaire est réfractée différemment. Les courtes longueurs d’onde sont plus déviées que les grandes. L’étalement de ces radiations constitue l’aberration chromatique du verre, qu’on matérialise par un chiffre abstrait dénommé constringence.
La sensibilité à l’aberration chromatique est très différente d’un sujet à l’autre. Elle entraîne une diminution de la sensibilité aux contrastes (dans les moyennes et hautes fréquences). Il est prudent de ne pas utiliser de verres à faible constringence, généralement liée aux verres à forts indices, dans les compensations prismatiques ou pour les forts amétropes.
Elle conditionne le poids des verres. Les verres organiques sont deux fois plus légers que les verres minéraux, ce qui peut expliquer aussi leur utilisation dans le cadre de l’équipement de l’enfant.
La transmission caractérise le pouvoir d’absorption aux radiations ultraviolettes du verre. Tous les verres organiques sans coloration absorbent, c’est-à-dire protègent l’œil de la quasi-totalité des UVA sans aucun traitement d’appoint. De plus, pour les plus grands, afin d’améliorer les contrastes et par conséquent la qualité de l’image rétinienne, on peut proposer un traitement antireflet dont l’intérêt est d’optimiser la transmission du flux lumineux.
Verres commercialisés
Les plus adaptés aux enfants répondant aux critères que nous venons d’énumérer (qualité optique, sécurité, légèreté et coût) sont :
-
le CR39 (ORMA) : c’est la matière la moins onéreuse possédant d’excellentes qualités optiques du fait de l’absence d’aberration chromatique. Les possibilités de fabrication sont grandes (+ ou – 20,00 d) ; on peut réaliser des verres unifocaux, bifocaux, progressifs et prismatiques ;
-
le moyen indice 1,61 : son indice de réfraction permet de diminuer la cambrure et l’épaisseur des verres par rapport au CR39. C’est un verre destiné aux parents soucieux de l’esthétique. Le prix est légèrement plus élevé que celui de l’ORMA ;
-
le polycarbonate 1,59 : c’est le verre le plus résistant aux chocs, le plus plat, le plus mince et surtout le plus léger de la gamme. Cependant la faible constringence du matériau [3] risque de provoquer une gêne visuelle pour les amétropies supérieures à + 4,00 d.
Le précalibrage est une option qui permet d’optimiser l’épaisseur des verres, en particulier sur les montures d’enfant dont la taille de l’oculaire, ou calibre, est réduite. L’opticien peut donc transmettre au fabricant les cotes de la monture choisie afin d’optimiser le surfaçage des verres correcteurs et, à puissance égale, obtenir un verre plus fin et par conséquent plus léger, ce qui facilite le port des lunettes et améliore l’efficacité des verres correcteurs par une meilleure position sur le visage (fig. 17-7).
Pour illustrer l’intérêt du précalibrage pour les enfants, la comparaison poids-épaisseur donne les résultats suivants (tableau 17-I et fig. 17-8). C’est en combinant ce procédé de surfaçage avec l’indice du verre et le choix judicieux de la monture qu’on obtient les meilleurs résultats et, par conséquent, les équipements optiques qui seront portés par les enfants parce qu’acceptés par eux et les parents.
Enfin, pour augmenter la durée de vie et préserver la qualité optique des verres, ils sont généralement traités par un vernis rendant la surface plus résistante aux rayures.
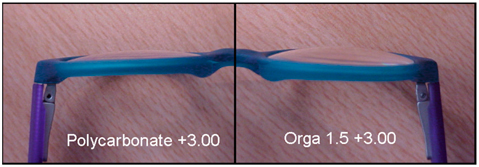
Fig. 17-7 Optimisation d’un verre.
(Avec l’aimable autorisation de Lissac Opticien.)
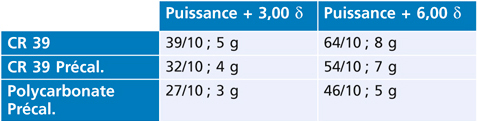
Tableau 17-I – Intérêt du précalibrage pour les enfants. Comparaison poids-épaisseur.

Fig. 17-8 Précalibrage d’un verre pour les enfants.
(Avec l’aimable autorisation de Lissac Opticien.)
Les verres multifocaux sont utilisés par les strabologues dans certains cas de dérèglements accommodatifs. Cette surcorrection bilatérale de près a des effets antiaccommodatifs, luttant ainsi contre l’incomitance loin-près. Cette surcorrection peut être apportée par des verres bifocaux ou progressifs.
En vision rapprochée, l’enfant abaisse très peu ses lignes de regard mais applique son menton sur la poitrine pour converger en position primaire. Cette attitude réflexe est spécifique à l’enfant et impose dans le cas d’équipements multifocaux un montage particulier (fig. 17-9).
Pour les très jeunes (fig. 17-10), il est souhaitable d’utiliser des verres bifocaux « grand champ » à segment courbe qu’on peut basculer dans le secteur inféro-nasal, de façon à recouvrir la zone habituellement utilisée en vision de près. Le décentrement de 10° est insuffisant pour les jeunes porteurs : les mesures effectuées en magasin nous amènent à réaliser des rotations allant de 10° à 20°.
Au début de la période de scolarisation, jusqu’à l’âge de cinq ou six ans, l’adaptation de verres bifocaux, lunule ronde ou hémichamps, est souhaitable, de façon à couvrir un grand champ de vision de près.
Dès l’âge de six ou sept ans, il est souhaitable d’adapter des verres progressifs pour des raisons esthétiques. Il est maintenant possible d’équiper avec un prix modique (celui d’un verre à double foyer) en verres progressifs Varilux® enfant en CR39, sur prescription médicale.
Certaines précautions sont à prendre lors du montage des verres. Par le fait de la taille de l’enfant et de son regard vers le haut, dans le monde des adultes, le verre doit se trouver rehaussé de 4 mm par rapport au centrage habituel de l’adulte (fig. 17-11).
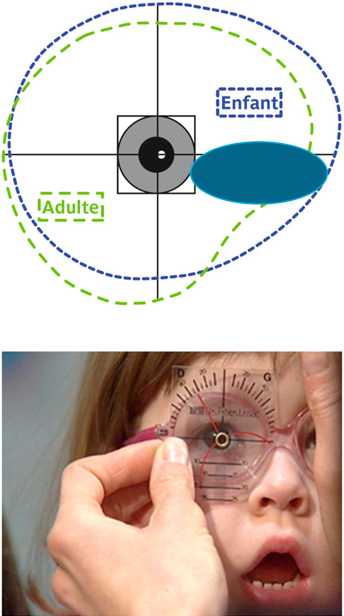
Fig. 17-9 Aire de vision de près chez l’enfant.
(Avec l’aimable autorisation de Lissac Opticien.)

Fig. 17-10 Verres bifocaux « grand champ ».
(Avec l’aimable autorisation de Lissac Opticien.)

Fig. 17-11 Équipement en verres progressifs.
(Avec l’aimable autorisation de Lissac Opticien.)
Un œil sain et adulte possède de nombreuses défenses naturelles qui le protègent contre le soleil : constriction pupillaire, obturation des paupières, filtration des différentes structures transparentes oculaires, etc. (fig. 17-12). Pour le bébé ou le jeune enfant, ces structures sont encore inefficaces, le cristallin ne joue pas son rôle de filtre avant dix à douze ans et l’abus de lumière par absorption ou effet cumulatif peut s’avérer nocif voire destructeur pour certaines structures de l’œil, en particulier la rétine (fig. 17-13). Il est indispensable d’avoir recours à la protection supplémentaire des filtres solaires, qui vont avoir la double tâche de filtrer et donc éliminer les plus courtes longueurs d’ondes, les plus nocives, mais aussi de protéger l’œil contre une forte intensité lumineuse réduisant ainsi l’éblouissement de l’enfant.
La protection solaire doit être de 3 ou de 4 (échelle de 0 à 4) (cf. infra, tableaux 17-II et 17-III). Les verres doivent être garantis « protection UV normalisée » pour les UVA et UVB, porter le marquage « norme CE », et être supportés par une monture répondant aux critères cités ci-dessus, alliant une bonne tenue sur le visage à des branches plus épaisses afin d’arrêter les rayons lumineux latéraux.

Fig. 17-12 Équipement en verres teintés.
(Avec l’aimable autorisation de Lissac Opticien.)
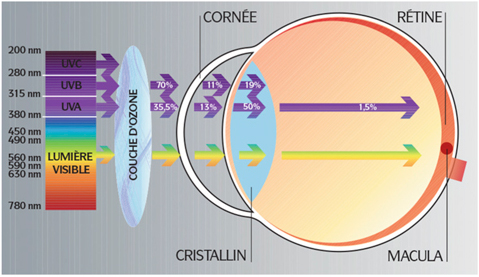
Fig. 17-13 Transmission de la lumière à travers les différentes structures de l’œil.
(Essilor International.)
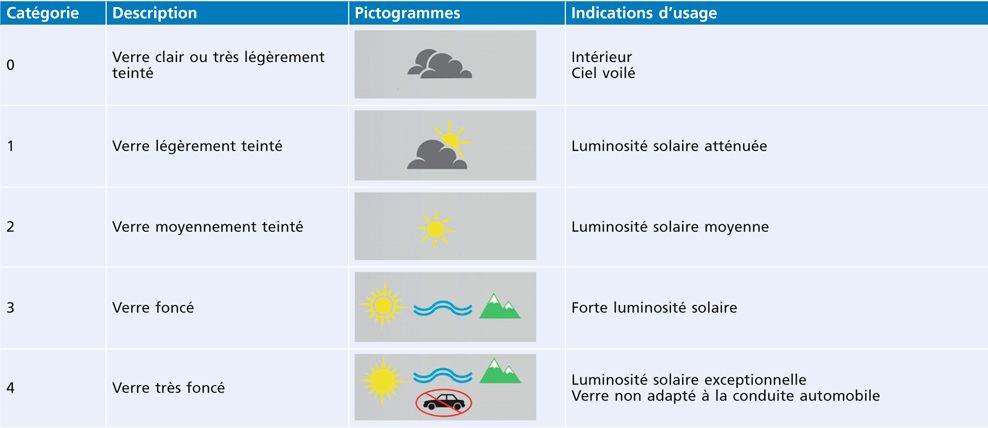
Tableau 17-II – Description et indications d’usage des différentes catégories de transmission lumineuse (Essilor International).
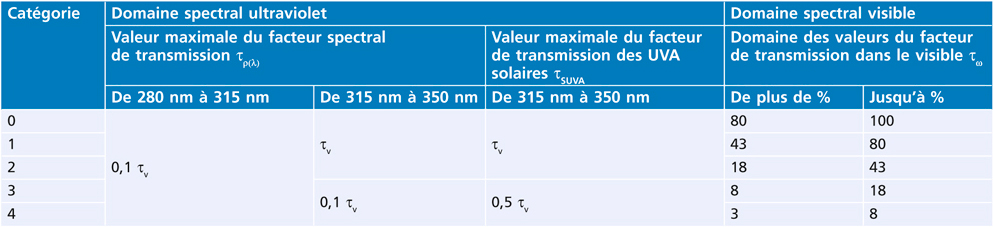
Tableau 17-III – Classification des verres selon leur transmission lumineuse (Essilor International).
Dans certains cas de pathologies (angiomes, asymétrie faciale, aplasie de l’oreille), le visage de l’enfant s’éloigne des standards d’une morphologie classique. Pour les équiper d’une correction aérienne, il faut alors créer une monture sur mesure permettant la bonne tenue de celle-ci dans le plus grand confort possible, afin que les verres soient portés bien centrés devant les pupilles de l’enfant.
Un service exclusif d’une enseigne d’optique propose aujourd’hui des solutions personnalisées et adaptées à toutes les nécessités. Nous pouvons, par exemple, avoir des cercles déportés pour les cas d’angiomes, un support crânien ou une branche plus longue qui s’appuie sur le rocher pour certains cas d’aplasie, une monture à chambre humide pour des cas de syndrome sec sévère (fig. 17-14).

Fig. 17-14 Différents types de monture sur mesure.
(Avec l’aimable autorisation de Lissac Opticien.)
À la demande de l’ophtalmologiste et/ou de l’orthoptiste, l’opticien s’engage sur prescription médicale à fournir et à poser un Ryser ou un prisme provisoire ou press-on (dont les possibilités de fabrication sont ci-dessous) et à en vérifier régulièrement le bon état et la bonne qualité optique.
-
Fourniture et pose de filtres de Bangerter (Ryser) :

-
Fourniture et pose de prismes press-on :
Grâce à l’expertise des particularités de l’équipement optique de l’enfant, par le respect strict des règles d’adaptation et de l’ajustage spécifi que, également avec la collaboration étroite et régulière de l’ophtalmologiste et de l’orthoptiste, l’opticien participe au projet thérapeutique de l’équipement optique du tout-petit, qui permet le bon développement visuel de l’enfant (fig. 17-15).
Plus d’un Français sur deux pratique une activité sportive. Ces pratiques nécessitent l’utilisation d’un voire de plusieurs de nos sens. La vue est l’un de ces sens majeurs, qui conduit 80 % de nos informations au cerveau. L’importance de la vision est donc primordiale pour la bonne pratique d’un sport, quel que soit le niveau.
Les yeux déterminent la vitesse, la synchronisation et la maîtrise du corps par le cerveau. Lorsque des fractions de seconde peuvent faire toute la différence pour la performance et la sécurité, la vitesse de réaction est cruciale. La capacité de discerner les détails et de repérer les obstacles pendant une compétition fait toute la différence.
Les traumatismes oculaires sont assez fréquents dans la pratique d’un sport ; ils pourraient être évités par une protection appropriée. Malgré tout, certains athlètes qu’ils soient amateurs ou professionnels ont été forcés d’abandonner leur pratique voire leur carrière à la suite d’accidents aux yeux.
Contrairement à d’autres parties de notre corps, les lésions aux yeux sont très souvent permanentes. Une blessure en apparence mineure peut provoquer un décollement de rétine ou une cécité partielle ou totale. Une hémorragie (hyphéma) peut se produire à l’intérieur de l’œil et entraîner un glaucome des années plus tard.
Il est donc impératif de proposer une double compétence en ce qui concerne l’adaptation optique des sportifs : compétence en termes de sécurité, compétence en termes de performance optique de l’équipement.
Pour le sportif, la réponse aux besoins visuels doit mettre en adéquation : le sport pratiqué, le défaut visuel, l’environnement dans lequel il pratique son sport, le niveau (amateur, licencié d’une fédération, professionnel).
C’est pourquoi, l’ensemble des produits proposés sur le marché ont été créés en grande partie avec l’aide de sportifs amateurs et professionnels. L’élaboration des montures se fait en suivant deux lignes directrices :
-
la protection : des poussières, du vent, des chocs, des infrarouges, des ultraviolets, des embruns, de toutes projections éventuelles… ;
-
l’amélioration des performances : sécurité, meilleure perception visuelle, filtres de couleur adaptés à l’environnement, adaptation du champ visuel…
Une fois ces impératifs respectés, il nous faut prendre en compte des critères spécifiques à chaque sport, comme le choix de matériaux supportant les variations de température, offrant une excellente stabilité et un très bon confort.
La synergie de ses impératifs avec la conception des montures et le choix des verres sont les facteurs de réussite de l’adaptation visuelle des sportifs.
Les fabricants de lunettes de sport utilisent maintenant des matériaux qui ont démontré leur capacité à satisfaire les normes exigeantes de poids et de résistance à la température, au vent, à la lumière et aux chocs. Les matières utilisées sont retenues pour leurs bonnes qualités atraumatiques, leur résistance aux chocs, à la torsion, et elles offrent une bonne stabilité (matières antidérapantes, anallergiques)…
Les formes sont adaptées aux normes de sécurité, aux champs visuels souhaités, à la mode et au confort (assise du nez en silicone), quels que soient les mouvements effectués grâce aux branches crochets, aux branches réglables, aux bandeaux…
Qu’ils soient correcteurs ou non, ils sont réalisés en matière organique ou, plus rarement, minérale, sécurisés.
Dans la majorité des cas et surtout dans les cas de sports violents, à haut risque oculaire (comme le squash, la pelote basque, le tir, etc.), il est impératif de choisir le polycarbonate qui offre la plus haute résistance aux chocs.
La lunette de sport dans son ensemble et par ses caractéristiques doit répondre à un double défi : protéger les yeux et améliorer les performances visuelles.
Nous allons étudier les différentes catégories de sport pour y souligner les solutions apportées en matière de confort visuel et de protection appropriée, solutions souvent issues de la recherche, mais également de l’expérience acquise directement par les sportifs eux-mêmes.
Étanchéité, champ visuel, agression de l’eau salée ou chlorée, résistance à la pression, correction visuelle (vision de loin ou/et vision de près).
Nous pouvons segmenter la plongée de la manière suivante : la plongée avec bouteille ; la plongée liée à l’apnée et à la chasse sous-marine :
-
pour la plongée avec bouteille, il faut préférer une jupe et un cerclage de masque translucide afin d’augmenter la luminosité et le champ visuel périphérique ;
-
pour la plongée en apnée et la chasse sous-marine, les masques « petit volume » évitent de gâcher de l’air lors de la compensation de la pression liée à la profondeur. Les jupes en silicone noire atténuent les reflets parasites du soleil à la surface de l’eau.
En termes de correction visuelle, les verres correcteurs, qu’ils soient pour myope, hypermétrope, astigmate ou presbyte, peuvent s’adapter sur les différents masques de plongée.
La matière de verre utilisé est le minéral afin que celui-ci ne se raye pas trop vite et que l’on garde une qualité optique le plus longtemps possible. Pour des mesures de sécurité, afin de mieux résister aux chocs, ils font au minimum 3 mm d’épaisseur et sont trempés.
Toutefois, nous conseillons, pour des raisons techniques, de choisir un masque binoculaire.
Concernant l’étanchéité, comment la tester ? Mettre le masque sur le visage, inspirer profondément pour le maintenir en place, retenir sa respiration et lâcher le masque. S’il tient, il est étanche.
De plus, le milieu dans lequel évoluent les plongeurs (sel marin, humidité, UV) nécessite afin de garantir l’efficacité et la longévité de l’équipement une protection de son matériel par des housses, étuis rigides ou semi-rigides (fig. 17-16).
Étanchéité, agression du sel marin ou du chlore, formation de buée, correction visuelle.
Si vous passez beaucoup de temps dans l’eau chlorée des piscines, vous devez savoir que le chlore est corrosif et qu’il peut attaquer votre cornée. Selon le temps que vous passez dans l’eau, les symptômes peuvent aller d’une irritation ou de démangeaisons des yeux à une cécité temporaire.
Les lentilles de contact présentent un autre problème dans les piscines — mis à part ceux qui ferment les yeux par peur de les perdre — : si vous ouvrez vos yeux dans une piscine lorsque vous portez vos lentilles de contact, vous pouvez y piéger des micro-organismes vivant dans l’eau (des plus résistants car ils viennent de passer l’épreuve du chlore…) et vous risquez d’infecter vos yeux.
Les bonnes lunettes de natation sont équipées de jupes en silicone anallergique pour une parfaite étanchéité et d’un traitement antibuée et anti-UV des oculaires, afin de répondre aux caractéristiques du milieu aquatique.
L’ensemble des corrections optiques est proposé en coques correctrices pour les plus courantes des corrections et d’un verre « sur mesure » souvent taillé en forme d’épaulement pour les fortes puissances.
Des lunettes de natation teintées ne sont pas nécessairement recommandées à l’intérieur (piscine) mais sont fortement conseillées à l’extérieur (mer) en plein soleil.
Après utilisation, il est impératif de rincer ses lunettes de natation uniquement à l’eau claire pour une meilleure durabilité.
La gamme de fabrication s’étend pour les myopes de – 1 d à – 6 d par pas de 0,50 d, jusqu’à – 8 d par pas de 1 d. Pour les hypermétropes, de + 1 d à + 8 d par pas de 1 d (fig. 17-17).
En ski et en snowboard, la plupart des accidents des yeux se produisent parce que le blessé portait le mauvais type de protection (lunettes pas adaptées, monture fragile voire dangereuse et/ou verres pas assez filtrants) ou n’en portait pas du tout.
Protection contre les ultraviolets, les infrarouges, la neige, le vent… Réverbération, formation de buée ou de condensation générée par le choc thermique (brusque changement de température), manque de visibilité des reliefs.
L’adaptation optique des masques de ski s’établit selon deux procédés :
-
le masque surlunette : il permet de skier avec ses lunettes de vue sous le masque. Celui-ci possède des décrochements temporaux pour laisser passer les branches et un volume intérieur suffisant pour laisser passer la monture ;
-
le kit optique Opticob® : qu’il soit avec ventouse ou à lamelle de stabilisation, il permet de pouvoir directement intégrer des verres correcteurs à l’intérieur du masque.
Que vous gardiez vos lunettes sous votre masque ou que vous ajoutiez un kit optique, l’utilisation d’un spray antibuée est nécessaire. Afin d’éviter la formation de condensation due à la différence de température entre l’intérieur et l’extérieur du masque, demandez un masque double écran. L’objectif est d’avoir une vision claire en toutes conditions (fig. 17-18).
Les lunettes de glacier ou de haute montagne sont équipées de verres en polycarbonate ou minéral sécurisés de catégorie 4 et de teinte marron (bonne vision du relief) avec un flash miroir (meilleure protection aux rayons réfléchis). Un traitement polarisé peut compléter la protection. Les coques latérales et protections nasales sont indispensables pour remédier aux conditions extrêmes de la pratique de ce sport (fig. 17-19).
En montagne, l’action du soleil est beaucoup plus importante qu’en plaine. En effet, ses rayons sont moins filtrés par l’atmosphère : la quantité d’UV augmente de 4 % tous les 300 m. De plus, la neige réfléchit 85 % des UV (quatre-vingts fois plus que l’herbe et quatre fois plus que l’eau). Les infrarouges sont nocifs à partir de 3 500 mètres d’altitude et la protection des yeux est d’autant plus importante.
Une norme européenne de juillet 1995 oblige les fabricants à un marquage CE indiquant le nom du fabricant et la catégorie du filtre. Cette échelle indique la filtration de la lumière visible mais n’indique d’aucune façon la protection vis-à-vis des ultraviolets ou des infrarouges.
En France, les modèles vendus protègent obligatoirement à 100 % des UV (tableaux 17-II et 17-III). Le filtrage est indiqué selon une échelle allant de 0 à 4 :
-
0 : laisse passer 80 % à 100 % de la lumière ;
-
1 : laisse passer 43 % à 80 % de la lumière ;
-
2 : laisse passer 18 % à 43 % de la lumière ;
-
3 : laisse passer 8 % à 18 % de la lumière ;
-
4 : laisse passer 3 % à 8 % de la lumière.
En montagne ou en haute montagne sur les zones glaciaires ou enneigées, l’indice de protection 4 est impératif. Le traitement polarisé est fortement recommandé, il absorbe toute réverbération. En moyenne montagne et en l’absence de neige ou par temps nuageux, l’indice 3 peut être suffisant.
Vent, projections, mouvements brusques, champ visuel latéral et vertical, chocs, chutes, secousses et tout élément dépendant de l’environnement où se pratique ce sport. Le vent, les insectes et les diverses projections sont principalement responsables des traumatismes visuels chez les cyclistes.
Choisir des lunettes équipées d’écrans interchangeables pour une meilleure adéquation entre les conditions climatiques et le terrain : écran jaune par brouillard, pour augmenter la perception des reliefs ; écran teinté en cas d’ensoleillement, réverbération sur des surfaces réfléchissantes…
Les conditions d’utilisation et l’environnement ont un impact fort en termes de design. Les lunettes sont profilées, pour une protection latérale au vent et aux projections et ont des champs visuels adaptés au besoin :
-
VTT, cyclotourisme : choisir un écran profilé avec un grand champ vers le haut et une monture légère et munie de branches fines pour ne pas gêner sous le casque (fig. 17-20) ;
-
tennis : un écran bleu turquoise améliore le contraste entre la balle, les lignes et le terrain sur le fond du terrain de couleur terre battue ;
-
équitation : une monture à branche fine ne gêne pas sous la bombe, profilée pour se protéger du vent et d’éventuelles projections (boue…) ;
-
golf : un écran panoramique de teinte rose/violet fait ressortir le blanc de la balle sur un fond boisé et augmente le relief, donc le dénivelé sur le green. Il doit aussi avoir une protection latéralement contre le vent.
Du point de vue de l’équipement optique, il est conseillé des verres de loin plutôt qu’un équipement progressif, qui peut perturber le porteur dans le regard vers le bas, comme au golf par exemple.
On constate qu’une dominante se dégage en termes de performance : l’importance du bon choix de couleur des écrans (cf. infra).

Fig. 17-20 Lunettes pour le vélo, le tennis, le golf et l’équitation.
(Avec l’aimable autorisation de la société Demetz).
En termes d’éléments à prendre en compte, les lunettes s’apparentent à celles du vélo ; cependant, préférez les montures très légères éventuellement munies de sangle pour un meilleur maintien (fig. 17-21).
Soleil, reflets sur l’eau, brume, embruns et vent…
Les lunettes de pêche ou de bateau sont équipées de verres polarisés atténuant les reflets sur l’eau et l’éblouissement pour une meilleure perception des fonds et des objets à la surface de l’eau. Elles protègent latéralement du vent et des embruns. Attention à la lecture d’instruments digitaux sur certains bateaux qui pourrait être rendue difficile avec des verres polarisés.
Champ visuel latéral, forte luminosité, conditions climatiques difficiles (vent, froid dû à l’altitude ou à la vitesse), buée, résistance à la pression, secousses, chutes, projections, soleil, reflets sur l’eau ou la glace…
Des lunettes semi-étanches (pour les sports de glisse aquatique) équipées de multiples systèmes d’aération ou d’évacuation de l’eau. Les verres devront être traités antibuée et hydrophobes. Si cela n’est pas le cas, vous disposez, pour un traitement temporaire, de spray et tissu antibuée qui vous donneront un bon confort. Choisir de préférence des lunettes galbées munies d’une sangle amovible pour un meilleur maintien pour la pratique de sports extrêmes.
Pour les sports de glisse, de plus en plus de masques se développent avec une sangle dotée sur la face interne de silicone permettant un bon maintien de la sangle sur le masque.
Vision latérale importante et sécurisante, se protéger du vent et des conditions climatiques variées (soleil, pluie, nuit, vitesse, projections, buée…).
L’équipement de plus en plus fréquent est le casque intégral avec une visière solaire qui limite l’utilisation des lunettes ou de masque spécifique. Pour les porteurs de lunettes de vue, nous conseillerons donc de choisir des montures avec des branches fines et dans une matière inoxydable telle que le titane qui ne se corrode pas et est à mémoire de forme. Ainsi, les pressions effectuées sur les branches par les parties latérales du casque n’abîmeront pas votre monture. Lors de l’utilisation de casque « jet », des lunettes au look rétro vous protégeront du vent, de la pluie ou de la boue. Elles sont équipées de systèmes d’aération pour une bonne évacuation de la buée.
De plus en plus de modèles proposent des teintes différentes, afin de répondre au mieux aux exigences de la conduite en extérieure (brouillard, soleil, éblouissement).
Dix pour cent des traumatismes oculaires sont d’origine sportive. Il est donc impératif de se protéger durant la pratique de sports de balle, de ballons ou de raquettes (fig. 17-22).
Les sports de raquette se trouvent être les plus dangereux car les balles, les raquettes et les gens se déplacent tous à grande vitesse et dans un espace de jeu relativement réduit.
Devant cette augmentation de traumatismes oculaires, certaines fédérations sportives — comme par exemple la FFS (fédération française de squash) — ont pris des mesures en rendant obligatoire le port de lunettes de protection pour les moins de dix-huit ans en compétition.
Pour les sports collectifs, les coups et les chocs liés au ballon, aux partenaires (doigt ou coup de coude dans l’œil notamment) sont les principaux facteurs des traumatismes oculaires.
La vitesse de la balle est directement liée à la dangerosité du sport : un enfant apprenant à jouer au squash peut projeter une balle à 130 km/h et celle-ci peut arriver facilement à 200 km/h pour un joueur confirmé. Un joueur de baseball professionnel peut lancer des balles à 150 km/h, tandis qu’au badminton, le volant peut se déplacer jusqu’à 230 km/h.

Fig. 17-22 Lunettes de basket, football, handball, squash, badminton.
(Avec l’aimable autorisation de la société Demetz).
Le joueur a besoin d’un très large champ de vision (vision périphérique), d’une bonne protection contre les coups et les chocs, et d’une limitation des effets négatifs des lumières artificielles, de la buée, voire de la transpiration…
Les lunettes de protection sont impérativement équipées de verres en polycarbonate conformes aux normes de protection. Concernant la monture, il est important de protéger l’orbite afin de limiter les lésions en cas de choc. Un bon maintien et une bonne protection imposent de munir l’équipement d’une sangle élastique et de renforts silicones (renforts nasal et temporal).
De plus en plus de sports de salle nécessitent de prendre en compte l’intensité de l’éclairage qui, parfois, éblouit le sportif dans sa pratique (tennis indoor, squash, volley-ball, badminton). N’oublions pas ici le second critère d’élaboration des montures : la performance — on est performant si on n’est pas ébloui.
Le choix d’un traitement hydrophobe sur les verres permettra de limiter considérablement la buée ; sinon, un spray antibuée sera aussi efficace.
Pour des sports de précision tels que le tir au pistolet, à la carabine ou à l’arc, il est inutile de rappeler à quel point une déficience visuelle peut avoir des conséquences néfastes pour la performance, voire dangereuses.
C’est pour cette raison que nous conseillons au tireur, même amateur porteur ou non d’équipement visuel, d’aller consulter un médecin ophtalmologiste afin de faire un contrôle visuel régulier.
Il est aussi important de porter des lunettes équipées de protections latérales.
Différentes conditions climatiques (pluie, soleil, brouillard…), projection de poudre, ricochets de plomb, position particulière du tireur, acuité visuelle, champ visuel (pour le ball-trap)…
Les lunettes de tir sont spécialement étudiées pour obtenir l’axe de visée parallèle à l’axe optique du verre. De nombreux accessoires, qui s’adaptent facilement sur les montures appropriées, sont disponibles pour améliorer les performances comme les coques latérales de protection, des diaphragmes, des filtres… Pour le ball-trap, utilisez des lunettes avec un très grand champ visuel et équipées de verres en polycarbonate « haute résistance ».
Chaque teinte présente une spécificité et des compétences.
Elle est la teinte la plus courante pour les lunettes de soleil car sa principale caractéristique est sa transmission uniforme à travers tout le spectre lumineux. Cette teinte ne modifie donc pas la vision naturelle des couleurs.
Elle procure une augmentation des contrastes très perceptible, ce qui améliore la perception visuelle du relief. Les verres solaires en base ambre ou brune offrent une excellente protection solaire dans la majorité des circonstances, y compris pour la lumière bleue.
Elle offre une impressionnante amélioration des contrastes en situation de faible luminosité et par temps de nuage ou de brouillard. Le jaune est particulièrement recommandé pour la conduite automobile et les sports cyclistes, tandis que l’orange sera préféré pour les sports de glisse parce qu’il augmente aussi la vision du relief tout en protégeant légèrement de la luminosité.
Teinte polyvalente, elle augmente la perception visuelle et accentue le contraste des couleurs. Comme l’ambre, elle filtre efficacement la lumière bleue. Elle offre le champ de vision le plus clair et est particulièrement adaptée à la pratique du tir, du ball-trap ou du golf, ainsi que dans tous les cas de faible luminosité.
Ces teintes peuvent être réalisées sur la totalité du verre ou en teinte dégradée sur la partie supérieure et quasi blanc sur la partie inférieure, ce qui peut être un avantage en améliorant la transparence en vision de près.
La découverte des besoins visuels dans l’activité quotidienne professionnelle mais également dans les activités de loisirs et sportives est importante, afin de répondre plus efficacement aux demandes du sujet. Car, en effet, l’opticien peut proposer ensuite un équipement optique parfaitement approprié au sport pratiqué et améliorer les performances visuelles tout en assurant une sécurité optimale des yeux.
[1] Bonnac J-P. Diplôme universitaire de strabologie. Session II. Cahier de Sensori-Motricité. Nantes, Édition FNRO, 2004.
[2] Corbé C, Menu J-P, Chaine G. Traité d’optique physiologique et clinique. Paris, Doin, 1993.
[3] Kovarski C. L’opticien lunetier : guide théorique et pratique. 2e édition. Paris, Lavoisier, 2009.
[4] Meslin D. Les cahiers d’optique oculaire. Varilux International. Édition Essilor.
[5] Roth A, Gomez A, Péchereau A. La réfraction de l’œil. Du diagnostic à l’équipement optique. Paris, Elsevier, 2007.
M.-N. George
Les strabismes, voire l’hypermétropie, ont été longtemps considérés comme des contre-indications au port de lentilles de contact. Ces dernières s’avèrent au contraire être un outil majeur dans le traitement médical des strabismes grâce au repos accommodatif qu’elles induisent et aux conséquences positives sur la motricité oculaire qui en découlent.
On connaît depuis longtemps les effets favorables des lentilles dans la correction des myopies ; on ignore plus souvent les résultats positifs qu’elles apportent dans la correction de l’hypermétropie et ses conséquences possibles sur les vergences.
En supprimant certains effets délétères de la distance verre-oeil, elles sont reconnues aujourd’hui comme étant un des éléments incontournables dans la prise en charge de ces anomalies réfractives et motrices.
Les verres correcteurs induisent des effets secondaires qui sont en rapport avec la distance verre-œil et avec les effets prismatiques inhérents à la géométrie d’un verre. Ceux-ci interviennent sur l’acuité visuelle, l’accommodation et les vergences.
En réduisant la distance verre-œil, les lentilles optimisent l’image rétinienne qui, de plus, reste constante dans toutes les directions du regard. Elles suppriment les effets prismatiques des verres correcteurs dans le regard décentré, effets générateurs d’aberrations optiques d’autant plus importantes que l’amétropie est forte [16]. Elles suppriment les effets dynamiques apparents, directs chez le myope et indirects chez l’hypermétrope, qui se traduisent par le déplacement des images lors du déplacement du regard.
Les lentilles rigides perméables aux gaz (LRPG) assurent une correction parfaite et permanente, en axe et en puissance, des astigmatismes cornéens purs, grâce au ménisque de larmes entre lentille et cornée, quelle que soit la position de l’œil. Elles peuvent, en outre, être le support de la correction d’un éventuel astigmatisme résiduel (astigmatisme interne). Elles diminueraient les aberrations optiques [10].
Les lentilles souples supportent une puissance optique équivalente à la correction optique totale. Elles sont souvent moins performantes optiquement que les lentilles rigides, particulièrement en cas d’astigmatisme associé, car elles sont responsables de microfluctuations de la correction lors des changements de position du globe oculaire [7]. Mais la suppression de la distance verre-œil reste un facteur d’optimisation de l’image rétinienne.
Les deux types de lentilles, rigides et souples, diminueraient la défocalisation périphérique induite par des verres correcteurs sur l’œil myope, avec une efficacité supérieure pour les LRPG [30]. Si la sollicitation du champ visuel périphérique ne semble pas apporter d’amélioration dans le traitement des strabismes, les lentilles restaurent un champ visuel global identique à celui du sujet non corrigé, facteur de confort visuel, particulièrement dans les fortes amétropies. Ceci ne peut qu’être favorable pour les performances globales du système visuel [14].
Les lentilles, plus particulièrement les lentilles rigides, ont donc un rôle important à jouer dans la prise en charge de l’amblyopie, fréquemment associée au strabisme. Elles font partie intégrante de l’arsenal thérapeutique à mettre en œuvre pour traiter l’amblyopie [13], précocement en cas d’anisométropie importante ou plus tardivement après échec des procédés thérapeutiques habituels.
Elles concernent la vision de loin et la vision de près.
Le déplacement des plans principaux, en relation avec la suppression de la distance verre-œil, induit une mise au repos de l’accommodation, rapidement révélée lors du port des lentilles.
Ce repos accommodatif, s’il n’est pas pris en compte lors du calcul de puissance de la lentille, est à l’origine d’un inconfort dans la vision éloignée comme dans la vision rapprochée, voire d’une baisse effective d’acuité visuelle. Pour cette raison, toutes les surréfractions faites sur une lentille de contact, que ce soit pour déterminer la puissance d’une lentille définitive au cours d’une adaptation ou pour rechercher une éventuelle modification de la réfraction, doivent toujours commencer par une correction additionnelle positive.
Les lentilles modifient également l’accommodation mise en jeu lors du parcours accommodatif. Chez le sujet emmétrope, lors du passage de la vision de loin à la vision de près, l’accommodation sollicitée est de 3 d (accommodation réelle). Chez un sujet hypermétrope équipé de lunettes, l’accommodation sollicitée (accommodation apparente) augmente. Chez un sujet myope équipé de lunettes, l’accommodation sollicitée diminue. La différence entre accommodation réelle et accommodation apparente est d’autant plus importante que l’amétropie est forte.
Les lentilles de contact suppriment cette différence entre accommodation réelle et apparente. Lorsqu’il passe de la vision de loin à la vision rapprochée, le sujet hypermétrope voit son accommodation apparente diminuer lors du passage aux lentilles, tandis que le sujet myope, à l’inverse, doit mettre en œuvre un effort accommodatif plus important lorsqu’il est équipé en lentilles. Ces effets ont des conséquences sur les vergences et sont particulièrement remarquables dans les incomitances loin-près.
Elles sont de deux ordres. On peut distinguer ce qui est lié aux modifications de l’accommodation par suppression de la distance verre-œil et ce qui est lié à la suppression des effets prismatiques des verres.
En normalisant l’accommodation, les lentilles de contact modifient très fréquemment les vergences, tout au moins celles dépendant de l’accommodation. Ainsi, les hypermétropes avec ésodéviation, dont l’accommodation dans la vision rapprochée est soulagée, voient fréquemment leur déviation améliorée en vision de près lors du passage des lunettes aux lentilles. S’il existe une incomitance loin-près chez un sujet hypermétrope, celle-ci est donc classiquement améliorée par le port de lentilles.
À l’inverse, les myopes dont l’accommodation est majorée par rapport à ce qu’elle est avec des lunettes en vision rapprochée, ont un effort accommodatif plus important à fournir en vision de près lorsqu’ils portent des lentilles. Ceci explique les difficultés d’accommodation dont peuvent se plaindre certains sujets myopes lorsqu’ils débutent tardivement un port de lentilles. Ces difficultés peuvent être décrites par des sujets jeunes, bien avant l’âge de la presbytie. Elles sont généralement transitoires, compensées d’autant plus rapidement que le patient est jeune, mais leur survenue éventuelle doit être clairement expliquée afin d’éviter un abandon des lentilles dans les premières semaines de port. Leur présence nécessite cependant de s’assurer de l’absence de surcorrection des lentilles, cette dernière pouvant être le résultat de la mise au repos accommodatif évoquée ci-dessus.
Le port de lunettes, selon que le verre est concave ou convexe, est à l’origine de modifications de l’axe visuel dès lors que l’œil n’est plus en position primaire. Lorsque le regard quitte le centre optique du verre et passe à distance de celui-ci, par exemple lors de la convergence dans la vision rapprochée, les verres de lunettes induisent un effet prismatique qui modifie les phories. Ces effets diffèrent selon que le sujet est myope ou hypermétrope, c’est-à-dire selon que le verre de lunettes est concave ou convexe :
-
dans la myopie, le verre concave est assimilable à deux prismes opposés par le sommet. Lors de la vision de près, le rayon lumineux subit une déviation qui soulage la convergence (fig. 17-23). Cet effet disparaît avec le port de lentilles, ce qui oblige le myope à converger davantage ;
-
dans l’hypermétropie, le verre convexe est assimilable à deux prismes opposés par la base. Lors de la vision de près, le rayon lumineux subit une déviation qui sollicite davantage la convergence (fig. 17-24). En passant au port de lentilles, le sujet hypermétrope voit donc sa convergence soulagée dans la vision rapprochée.
S’il n’existe pas de relation directement proportionnelle entre la différence de convergence mise en jeu dans la vision rapprochée avec des lunettes et celle mise en jeu avec des lentilles — en raison des diverses causes qui en sont responsables —, la modification de convergence est cependant d’autant plus importante que l’amétropie est élevée.
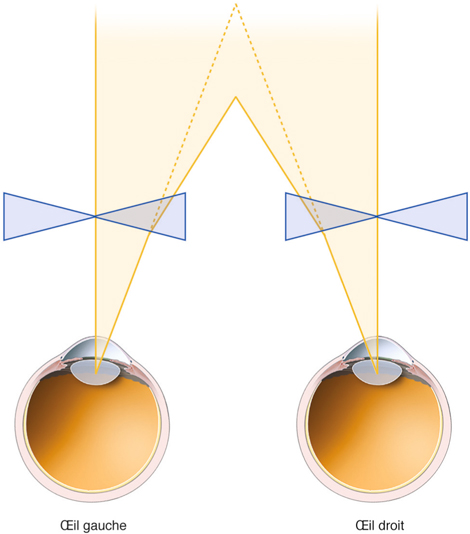
Fig. 17-23 Déviation du rayon lumineux chez le myope lors de la convergence.

Fig. 17-24 Déviation du rayon lumineux chez l’hypermétrope lors de la convergence.
Ce sont celles dans lesquelles les lentilles apportent un résultat sensorimoteur supérieur à celui des lunettes.
En cas d’amblyopie relative persistante, les lentilles, particulièrement les lentilles rigides, doivent faire systématiquement l’objet d’un essai afin de tenter d’optimiser une acuité visuelle qui reste décevante malgré d’autres moyens mis en œuvre pour combattre une amblyopie relative récalcitrante. La pose d’une lentille à visée diagnostique est impérative pour tenter d’optimiser la vision. Le partage de compétences entre le strabologue et le contactologue est incontournable dans ce cas pour améliorer à la fois l’acuité visuelle et la motricité oculaire, car on sait que la qualité de l’image rétinienne peut être propice à l’acquisition de la fusion, constituant ainsi un élément favorable dans la recherche d’un équilibre oculomoteur.
Les effets indésirables des verres de lunettes dans la correction des hypermétropies peuvent être un frein à l’obtention d’une amélioration de l’oculomotricité (cf. supra). Les lentilles de contact offrent une opportunité de mise au repos accommodatif, parfois plus efficace que les cycloplégiques, car leurs effets s’étendent sur une durée plus longue. Elles ont un effet bénéfique sur les vergences, particulièrement lors de la vision rapprochée (fig. 17-25).

Fig. 17-25 Effet bénéfique des lentilles de contact sur les vergences, lors de la vision rapprochée.
Elles sont le plus souvent en rapport avec une hypermétropie. L’ésodéviation liée au parcours accommodatif est diminuée, voire supprimée par une correction additionnelle de + 2 d ou +3 d. Dans les hypermétropies, les lentilles de contact, en permettant de confondre accommodation réelle et apparente, permettent de réduire l’ésodéviation apparaissant ou majorée lors du parcours accommodatif [8], et ce d’autant plus que l’amétropie est importante. En cas d’hypermétropie moyenne ou faible, les effets des lentilles de contact sont beaucoup plus discrets et l’utilisation de lentilles multifocales peut alors être évoquée (cf. encadré).
Dans les myopies, lors du parcours loin-près, les anomalies du rapport AC/A suivent normalement la même logique. L’existence d’une ésodéviation en vision de près est classiquement augmentée par le port de lentilles de contact, tandis que la majoration d’une exodéviation avec des verres correcteurs devrait disparaître avec les lentilles, puisque ces dernières obligent le sujet myope à fournir une accommodation apparente plus importante que l’accommodation réelle. Mais le raisonnement théorique et les observations cliniques sont parfois en opposition et nombreux sont les cas où ces résultats ne sont pas en accord avec cette logique. En effet, l’optimisation de l’image rétinienne procurée par les lentilles est un facteur qui, en favorisant la fusion, stimule la convergence du sujet myope.
Les lentilles multifocales ont-elles une place dans le traitement contactologique des incomitances loin-près ?
Les patients hypermétropes présentant une incomitance loin-près sont classiquement, avant tout acte chirurgical, équipés de verres progressifs. Plusieurs études ont été publiées, destinées à évaluer les résultats des lentilles multifocales dans cette situation [12, 21, 26], mais leurs conclusions ne sont pas statistiquement significatives car elles ne concernent que de très faibles populations (de trois à dix sujets selon les études).
Les résultats variables concernent les sujets jeunes, non presbytes, adaptés avec des lentilles progressives. L’expérience montre que ces derniers ont, de façon constante, en raison de leur plasticité cérébrale, une acuité visuelle optimale de loin et de près. Malheureusement, si un certain nombre d’entre eux sont améliorés par le port de lentilles multifocales, d’autres ne présentent aucune amélioration de la majoration de leur déviation en vision de près. Ceci s’explique par le fait qu’il leur est souvent plus facile de mettre en jeu leur accommodation — et donc de solliciter une hyperconvergence — que de faire le tri cortical normalement utilisé par le sujet presbyte, en perte d’accommodation, pour utiliser la zone additionnelle de vision rapprochée des lentilles à vision simultanée. Néanmoins, ces résultats incitent à ne pas récuser l’adaptation en lentilles multifocales dans cette indication avant tout essai de lentilles aux puissances requises, car les résultats ne sont pas prédictibles mais ils peuvent, s’ils sont positifs, éviter une chirurgie. En outre, les sujets présentant une incomitance loin-près, s’ils étaient équipés de verres progressifs avant leur adaptation en lentilles, gardent l’habitude, lorsqu’ils portent ces dernières, d’utiliser le regard vers le bas lors de la vision rapprochée. Or, il est fréquent d’observer une diminution du rapport AC/A lors du regard vers le bas. Cette diminution de l’ésodéviation, ajoutée au soulagement de la convergence procuré par les lentilles, permet souvent d’éviter l’utilisation de lentilles multifocales car, si la déviation en vision de près reste marquée en position primaire, elle diminue de façon importante dans le regard vers le bas. Dans les autres cas, les lentilles multifocales doivent être essayées.
Il est donc indispensable, avant de récuser une adaptation de lentilles en présence d’une anomalie du rapport AC/A, quel qu’il soit, au motif que les lentilles pourraient le dégrader, de procéder à un examen complet de la motricité oculaire avec des lentilles d’essai à la puissance requise, car les résultats cliniques sont souvent très éloignés des résultats théoriques prévisibles.
En cas d’aniso-hypermétropie, les spasmes accommodatifs de l’œil en apparence le moins hypermétrope doivent être évoqués, car s’il est classique de les retrouver chez l’enfant, ils peuvent perdurer chez l’adulte jusque vers la cinquantaine [28]. Ces spasmes sont volontiers rebelles aux cycloplégiques et nécessitent d’être recherchés [24]. Succédant à des cycloplégies répétées, les lentilles facilitent la mise au repos accommodatif de l’œil dominant. Elles réduisent en outre les effets délétères des verres correcteurs sur l’œil le plus amétrope, favorisant ainsi l’acquisition d’une potentielle vision binoculaire.
Une anisométropie importante est, chez l’enfant, amblyogène. En cas d’échec des moyens classiques du traitement de l’amblyopie fonctionnelle, un essai de lentilles est indispensable pour évaluer le potentiel visuel de l’œil amblyope, sachant que le moindre gain d’acuité obtenu avec une lentille est prometteur en termes de résultats sur la maturation visuelle, y compris chez l’adolescent.
Chez le sujet myope, au-delà du débat récurrent sur les conséquences d’un port de lentilles en cas d’anisométropie axile, l’objectif premier est de vaincre l’amblyopie secondaire à l’anisométropie. L’adaptation de lentilles, dans ce cas, trouve son indication dans le traitement de l’amblyopie, avant toute recherche de vision binoculaire [27].
Chez le sujet myope en ésodéviation, il est classique de conclure qu’en augmentant l’accommodation apparente, les lentilles de contact vont augmenter l’ésodéviation. Ici encore, la clinique est souvent en désaccord avec la théorie et l’adaptation ne doit jamais être récusée avant un essai de lentilles à la puissance requise pour la correction de l’amétropie (fig. 17-26). De plus, au-delà des mesures dioptriques de l’angle de déviation, c’est le confort du patient qui doit être pris en compte.
Chez le sujet myope en exodéviation, les lentilles, en sollicitant une accommodation et donc une convergence plus importantes, sont responsables d’une amélioration de l’angle de déviation mais induisent fréquemment une diminution du confort du patient, particulièrement dans la vision rapprochée. Il est nécessaire de prolonger les essais de lentilles sur quelques semaines afin de laisser le temps au patient de recouvrer ses capacités d’accommodation, ce qui sera d’autant plus rapide que le patient est jeune et que sa réserve accommodative est importante.

Fig. 17-26 Adaptation d’un myope en lentilles de contact avec diminution de la déviation strabique en vision rapprochée.
Dans les exotropies primitives, tous les subterfuges destinés à modifier la déviation par des compensations optiques ou orthoptiques aléatoires sont voués à l’échec. Ces exotropies relèvent de la chirurgie [14].
Les exodéviations intermittentes sont par définition inconstantes, mais peuvent évoluer défavorablement jusqu’à devenir constantes. Leur mesure est difficile car la déviation varie en fonction des conditions de l’examen. Le traitement consiste en premier lieu à supprimer tous les effets liés à des perturbations de l’accommodation, et dépend donc de la correction optique totale. À ce titre, que le patient soit myope ou hypermétrope, les lentilles sont une aide importante à l’obtention d’une vision optimale et à la mise au repos accommodatif. Elles suppriment les effets des verres correcteurs en relation avec la distance verre-œil et permettent de mettre en évidence et mesurer la déviation résiduelle pouvant relever d’une éventuelle chirurgie.
Les sujets myopes en exodéviation devraient bénéficier d’un port de lentilles, qui sollicitent davantage leur accommodation et donc leur convergence. À l’inverse, les sujets hypermétropes en exodéviation devraient voir leur état s’aggraver avec des lentilles. Mais l’examen clinique montre parfois des effets inattendus, particulièrement chez l’hypermétrope dont la déviation diminue souvent, probablement en raison d’une optimisation de l’image rétinienne, qui améliore la fusion, ou d’une normalisation des troubles accommodatifs. Ces résultats témoignent de la complexité des phénomènes neurosensoriels régissant la motricité oculaire, qui ne se limite pas au simple rapport « accommodation/convergence ».
Les exodéviations post-traumatiques, survenant dans les suites d’un traumatisme oculaire grave, sont le résultat d’une déprivation plus ou moins partielle de l’œil atteint. Elles sont le plus souvent constantes et plus fréquentes que les ésodéviations. Elles apparaissent dans les semaines ou les mois qui suivent l’accident et sont probablement une décompensation d’un état antérieur latent d’exodéviation. Outre qu’elle permet d’identifier les responsabilités respectives d’une cicatrice cornéenne ou de lésions rétiniennes, l’adaptation d’une lentille peut restaurer de façon spectaculaire l’acuité visuelle. Elle est alors généralement responsable d’une diplopie qui peut être dans certains cas difficile à accepter pour le patient. Il faut savoir encourager ce dernier en lui expliquant l’espoir de restauration des fusions, d’autant plus présent qu’il existait une vision binoculaire antérieurement au traumatisme, amélioration qui survient progressivement avec une raréfaction puis une disparition des épisodes de diplopie, dans un délai classiquement inférieur à deux mois. Lorsque l’acuité visuelle reste très décevante, la lentille ne doit cependant pas être exclue, car il est fréquent d’observer une diminution de la déviation, probablement en rapport avec la sollicitation de la vision périphérique ; cela est particulièrement vrai en cas d’aphaquie post-traumatique, c’est-à-dire de forte amétropie induite.
Les lentilles corrigeant un défaut de réfraction n’ont aucun effet sur les diplopies d’origine paralytique. Elles peuvent au contraire majorer la gêne subjective en améliorant l’image rétinienne ou en contrariant un éventuel processus de neutralisation. Les lentilles à pupille opaque peuvent être utilisées dans le traitement symptomatique des diplopies de l’adulte [2, 6].
Dans les diplopies secondaires à un traitement inadapté du strabisme (rééducation orthoptique inappropriée, par exemple), les fortes surcorrections ou sous-corrections par lentilles destinées à brouiller la vision sont généralement mal tolérées ou inefficaces, même en présence d’une amblyopie profonde dont on sait qu’elle ne préserve pas d’une diplopie [14]. Cependant, il a été récemment décrit des améliorations subjectives chez des sujets présentant des diplopies mineures (déviations inférieures à 10 ?) équipés en monovision avec une addition de + 2,50 d ou + 3,00 d sur l’œil dominé [5].
Certains cas de diplopies incoercibles peuvent bénéficier d’un implant intraoculaire opaque après échec des traitements classiques dont font partie les lentilles à pupille opaque [17, 18, 29].
L’association d’un nystagmus ne rajoute ni difficulté particulière ni contre-indication à l’adaptation [14]. La correction optique est toujours parfaitement centrée dans toutes les directions du regard, les effets prismatiques des verres de lunettes sont supprimés. Les lentilles permettent donc d’utiliser une éventuelle position de blocage tout en préservant une image rétinienne optimale. Plusieurs publications font état d’une amélioration des conditions optiques apportée par les lentilles de contact [1, 4, 15, 31]. Les lentilles rigides, de préférence de grand diamètre, sont parfaitement tolérées ; la présence fréquente d’un astigmatisme est prise en charge de façon plus stable par les LRPG que par les lentilles souples toriques, plus volontiers déstabilisées par les secousses oculaires. Tous les patients décrivent une amélioration de leur qualité de vie, mais les résultats objectifs semblent plus difficiles à mettre en évidence, avec des disparités importantes selon les auteurs.
Les strabismes de l’enfant sont une indication première des lentilles de contact, mais la décision d’adaptation ne doit intervenir que lorsque les verres correcteurs ont atteint leur limite d’efficience, donc le plus souvent après l’âge de six à huit ans. Les lentilles permettent alors d’optimiser la vision dans les cas où persisteraient une amblyopie résiduelle et une déviation incoercibles avec les verres de lunettes. Dans des amblyopies rebelles, certains auteurs ont réalisé des occlusions avec des lentilles à pupille opaque ou avec des hypercorrections positives sur l’œil sain [11, 19]. Ces moyens ne semblent pas avoir été retenus par la communauté ophtalmologique et, dans tous les cas, l’utilisation d’une lentille de ce type sur un œil sain considéré comme un œil fonctionnellement unique semble présenter trop de risques en termes de potentiel infectieux pour pouvoir en faire une règle thérapeutique.
L’âge n’est pas un facteur de choix de l’adaptation et il n’y a pas de règle en la matière ; mais la recommandation est d’attendre d’avoir utilisé tous les moyens classiques pour traiter l’amblyopie puis améliorer la motricité oculaire, c’est-à-dire de faire porter la correction optique totale après des cycloplégies répétées sous cyclopentolate ou atropine. En effet, si le port de lentilles est aisé à mettre en œuvre chez le nourrisson, il devient beaucoup plus complexe chez le jeune enfant. Celui-ci est souvent demandeur de lentilles, mais en refuse les manipulations qui peuvent devenir, même en cas de port continu nuit et jour, un véritable sujet de conflits entre les parents et l’enfant. En dehors d’une anisométropie amblyogène non résolue par les thérapeutiques habituelles, le strabisme de l’enfant en dessous de sept à huit ans n’est donc pas une indication des lentilles. Dans les cas où les verres correcteurs apportent des résultats satisfaisants pour l’acuité visuelle et l’oculomotricité, il est souhaitable d’attendre la demande de l’enfant pour répondre à son souhait de lentilles. Dans les autres cas, les lentilles doivent être présentées comme un traitement du strabisme, mais elles ne peuvent être prescrites que si l’enfant adhère à la décision. En la matière, il faut savoir qu’un enfant peut s’opposer violemment aux manipulations des lentilles à un moment donné et changer totalement de comportement en quelques semaines ou mois. La disponibilité de l’ophtalmologiste adaptateur est donc essentielle pour reprendre en charge ces enfants lorsque leur attitude vis-à-vis des lentilles varie, quitte à se heurter à un nouveau refus et reprendre les essais ultérieurement. L’expérience montre qu’une attitude rigide de l’équipe soignante dans ce domaine peut conduire à un refus de l’enfant durant de nombreuses années, avec une perte de chance significative, tandis qu’une souplesse de comportement permet à un grand nombre d’enfants d’accéder rapidement à un traitement contactologique qui sera optimal en quelques mois. Le refus d’adaptation de lentilles par un enfant ne doit donc jamais être présenté comme un échec, mais plutôt comme un agenda mal adapté à sa maturité.
Pour des raisons d’innocuité, ce sont les lentilles rigides (LRPG) qui sont les lentilles de première intention. Cette innocuité intéresse tout à la fois la maturation visuelle (efficacité optique des lentilles rigides) et la surface oculaire. Il n’est en effet pas question, particulièrement en cas d’amblyopie résiduelle, quelle qu’en soit l’importance, de prendre le moindre risque inflammatoire et infectieux dans le cadre de ces adaptations. Or il est démontré, toutes études confondues, que si les lentilles souples en matériaux silicone hydrogel favorisent l’oxygénation cornéenne, elles n’en sont pas moins facteur de réactions inflammatoires, et les effets indésirables sévères (kératites microbiennes) n’ont pas diminué avec ce type de lentilles [9, 20].
Les strabismes de l’adulte sont souvent complexes car ils peuvent être compliqués de perturbations neurosensorielles anciennes, dont les conséquences sont extrêmement difficiles à traiter.
Dans les cas les plus simples, la correction optique totale avec les lentilles apporte les bénéfices décrits plus haut. Mais paradoxalement, alors que la correction optique totale est remarquablement tolérée chez l’enfant, ce n’est pas toujours le cas chez l’adulte : les lentilles permettent alors d’évoluer par étapes vers cette dernière, plus facilement qu’avec les verres de lunettes.
En cas de problèmes neurosensoriels complexes, particulièrement en présence d’antécédents chirurgicaux parfois lourds, les lentilles méritent d’être essayées ; mais les résultats sont aléatoires, car souvent indépendants de la qualité de la correction et de la composante accommodative. Chaque cas doit être traité en fonction des résultats subjectifs rapportés par les patients.
À l’âge où se décompense la capacité d’accommodation, les lentilles permettent de prendre en charge l’apparition de la presbytie. Dans tous les cas, les patients précédemment porteurs de lentilles sont heureux de pouvoir prolonger leur port alors qu’ils pensaient que la presbytie marquerait un point d’arrêt à leur équipement. Mais l’existence d’un strabisme dans les antécédents d’un sujet presbyte nécessite une approche particulière.
Les dominances marquées d’un œil ou de l’autre, comme on les retrouve souvent chez ces patients, modifient les critères d’adaptation des lentilles progressives. Classiquement, en cas d’œil fortement préférentiel, ce dernier est équipé de façon à favoriser la vision éloignée, l’équipement de l’autre œil favorisant la vision rapprochée. Différents systèmes peuvent être utilisés.
L’œil dominant est équipé pour la vision de loin, l’autre pour la vision de près. Malgré ses limites, la monovision devrait trouver ici son indication, en particulier chez les patients n’ayant pas de vision binoculaire. La surcorrection adaptée sur l’œil dominé, choisi pour la vision rapprochée, devrait inciter le patient à utiliser préférentiellement ce dernier pour lire, comme c’est le cas dans les anisométropies.
En réalité, les résultats sont souvent différents de ce qui est espéré :
-
la réelle dominance d’un œil exclut l’utilisation de l’autre œil pour la vision rapprochée : le même œil est très nettement préféré de loin et de près, et cela souvent même en cas d’isoacuité. Le patient éprouve alors des difficultés à mettre en jeu l’utilisation de l’œil dominé en vision rapprochée, car cela perturbe l’état sensoriel dans lequel il se trouve depuis de nombreuses années ;
-
la monovision est susceptible de décompenser un équilibre oculomoteur fragile. Des décompensations de phories ont été décrites, pouvant survenir tardivement jusqu’à deux ans après la mise en place de la dissociation, qu’elle soit induite par des lentilles ou par une procédure de chirurgie réfractive [23]. Les systèmes dissociants sont donc à utiliser avec une extrême prudence dans les cas d’ésophories ou d’exophories latentes ou inconstantes ;
-
il n’en est pas de même en cas d’anisométropie sans troubles moteurs (donc hors strabismes) : la monovision peut dans ces cas apporter une solution confortable pour le patient.
Elles font partie des méthodes dissociantes [22] mais utilisent le principe de la vision simultanée pour chaque œil, l’œil préféré de loin étant équipé d’une lentille à vision de loin centrale, l’autre étant équipé d’une lentille à vision de près centrale. Bien qu’elles ne leur soient pas réservées, elles sont une indication préférentielle des anisométropies, mais peuvent être à l’origine d’un échec si la dominance de loin et celle de près concernent le même œil.
Elles sont non dissociantes et permettent au patient de choisir son œil de vision de loin et/ou de vision de près. Mais le système de vision simultanée fait volontiers appel à la vision binoculaire pour optimiser l’acuité de loin comme celle de près : cette vision binoculaire est le plus souvent défaillante chez les patients strabiques. Les lentilles rigides progressives pourraient alors être préférées aux lentilles souples dans ces cas, car elles offrent une excellente qualité visuelle, de loin comme de près [25]. Différentes études montrent la supériorité des lentilles multifocales sur la monovision [3], hors problèmes de dominances marquées.
La monovision aménagée consiste à équiper l’œil préféré avec une lentille monofocale pour la vision de loin et l’autre avec une lentille multifocale. Elle peut être tentée en cas d’échec des autres méthodes d’adaptation, mais elle se heurte également à la présence d’une forte dominance.
Ce sont des lentilles rigides bifocales (certaines sont disponibles avec un triple foyer), qui permettent une excellente vision de loin et de près, en préservant la vision des contrastes puisque chacun des deux segments offre une vision de plein champ. Leur adaptation ne nécessite pas de faire appel à l’œil préféré : le patient choisit ses dominances. Cependant, leur utilisation limite la qualité de la vision intermédiaire (ordinateur), sauf à modifier la puissance de l’une des deux lentilles pour favoriser le travail sur écran. Dans ce dernier cas, cette méthode conduit à nouveau à choisir un œil de préférence et on retrouve alors les problèmes posés par les autres adaptations.
Le strabisme associé à la presbytie pourrait donc être considéré comme une contre-indication relative au port de lentilles. Cependant, il faut faire émettre deux réserves :
-
les patients strabiques bénéficiant d’une vision binoculaire ne sont pas concernés ;
-
en outre, nombre de patients n’ayant pas de vision binoculaire sont adaptés avec succès pour leur presbytie. Les essais de lentilles doivent laisser la part au résultat subjectif, la motivation, particulièrement celle des patients auparavant porteurs de lentilles, ayant une part prépondérante dans les succès de ces adaptations. Ces dernières doivent être conduites en tenant compte des dominances particulièrement présentes dans cette pathologie sans se limiter aux réflexions théoriques, car la complexité des situations neurosensorielles conduit parfois à des résultats inattendus. Il est donc important de prévenir tout candidat strabique à l’adaptation de lentilles dans le contexte de sa presbytie que les résultats sont difficilement prédictibles mais non systématiquement décevants. La motivation de l’adaptateur est également un facteur évident de réussite.
En dehors des contre-indications, rares, au port de lentilles de contact, celles liées au strabisme sont exceptionnelles.
La question peut se poser dans les cas où le passage des lunettes aux lentilles aggrave une exodéviation chez l’hypermétrope ou une ésodéviation chez le myope. Mais, en réalité, les effets artificiellement maintenus par les verres correcteurs, qu’il s’agisse de la distance verre-œil ou des effets prismatiques des verres, ne sont pas le reflet de la situation motrice réelle du patient. Les lentilles, en supprimant ces effets secondaires, permettent d’évaluer véritablement l’état des phories. Elles aboutissent donc dans certains cas à éviter une chirurgie qui semblerait indiquée lors du bilan réalisé avec les lunettes ; dans d’autres cas, elles permettent de connaître la déviation résiduelle qui apparaîtra quoi qu’il arrive plus tardivement, lors de la disparition du potentiel accommodatif du patient.
On parlera donc, plutôt que de contre-indications, des limites de la correction par lentilles :
-
les déviations verticales ne sont pas modifiées par le passage des lunettes aux lentilles ;
-
les incomitances loin-près répondent peu au passage des lunettes aux lentilles dans les faibles amétropies, et les lentilles multifocales à vision simultanée peuvent donner des résultats beaucoup plus décevants que les verres progressifs chez les sujets jeunes ;
-
les spasmes de convergence non accommodatifs, qui sont des dérèglements de la vergence tonique, souvent majorés dans la vision de près, ne sont pas influencés par la correction optique totale ou la surcorrection destinée à la vision rapprochée. Les lentilles n’ont pas davantage d’effet sur ces spasmes que les lunettes. Ces spasmes ne sont pas une contre-indication au port de lentilles si le patient souhaite abandonner le port de des lunettes, mais elles n’apporteront aucune amélioration et ne doivent pas faire occulter les autres options thérapeutiques [14].
Les véritables contre-indications sont plutôt liées aux modifications majeures de la surface oculaire pouvant être induites par des chirurgies antérieures : cicatrices paralimbiques en saillie, volontiers responsables d’un effet Dellen en présence d’une lentille rigide. Certaines cicatrices conjonctivales peuvent être une source de conflit avec un port de lentilles souples en raison de leur diamètre. Il peut également persister une hyperhémie conjonctivale cicatricielle importante, qui doit être notée avant toute adaptation afin de ne pas ignorer une cause liée au port de lentilles. Ces hyperhémies respectent toujours une zone paralimbique de largeur variable, ce qui permet de les distinguer d’une réaction inflammatoire en rapport avec le port de lentilles.
Ces équipements ne font pas seulement appel à des techniques d’adaptation, elles nécessitent également une connaissance approfondie de la prise en charge des strabismes. Une excellente approche clinique des désordres neurosensoriels induits par cette pathologie prend ici toute son importance pour apporter une réponse contactologique satisfaisante, sans obérer les résultats obtenus souvent par des années de traitement de l’amblyopie et de phories anormales, quel que soit l’âge du patient. Dans ces conditions, tout en permettant à ceux qui le souhaitent d’oublier le port des lunettes, les lentilles deviennent une aide précieuse pour optimiser l’acuité visuelle et l’état oculomoteur, constituant ainsi un véritable traitement médical des strabismes.
[1] Allen ED, Davies PD. Role of contact lenses in the management of congenital nystagmus. Br J Ophthalmol, 1983 ; 67 : 834-836.
[2] Astin CL. The use of occluding tinted contact lenses. CLAO J, 1998 ; 24 : 125-127.
[3] Bennett ES. Contact lens correction of presbyopia. Clin Exp Optom, 2008 ; 91 : 265-278.
[4] Biousse V, Tusa RJ, Russell B, Azran MS, Das V, Schubert MS, Ward M, Newman NJ. The use of contact lenses to treat visually symptomatic congenital nystagmus. J Neurol Neurosurg Psychiatry, 2004 ; 75 : 314-316.
[5] Bujak MC, Leung AK, Kisilevski M, Margolin E. Monovision correction for small-angle diplopia. Am J Ophthalmol, 2012 ; 154 : 586-592.
[6] Burger DS, London R. Soft opaque contact lenses in binocular vision problems. J Am Optom Assoc, 1993 ; 64 : 176-180.
[7] Chamberlain P, Morgan PB, Moody KJ, Maldonao-Codina C. Fluctuation in visual acuity during soft toric contact lens wear. Optom Vis Sci, 2011 ; 88 : E534-538.
[8] Colasanti A, Ambrosio G, D’Esposito M, Del Prete A. The AC/A ratio and convergence in hypermetropia corrected with spectacles or contact lenses. Am J Optom Physiol Opt, 1982 ; 59 : 51-59.
[9] Dart JK, Radford CF, Minassian D, Verma S, Stapleton F. Risk factors for microbial keratitis with contemporary contact lenses: a case-control study. Ophthalmology, 2008 ; 115 : 1647-1654.
[10] Dorronsoro C, Barbero S. Llorente L. Marcos S. On-eye measurement of optical performance of rigid gas permeable contact lenses based on ocular and corneal aberrometry. Optom Vis Sci, 2003 ; 80 : 115-125.
[11] Elmer J, Fahmy YA, Nylholm M, Nerskov K. Extended wear soft contact lenses in the treatment of strabismic amblyopia. Acta Ophthalmol (Copenh), 1981 ; 59 : 546-551.
[12] Eustis HS. Monovision for treatment of accommodative esotropia with high AC/A ratio. J. AAPOS, 1999 ; 3 : 87-90.
[13] Evans BJ. Orthoptic indications for contact lens wear. Contact Lens Anterior Eye, 2006 ; 29 : 175-181.
[14] George M-N, de Bideran M. Strabismes. In : Les lentilles de contact. Rapport de la Société Française d’Ophtalmologie. Paris, Elsevier Masson, 2009 : 711-720.
[15] Golubovic S, Marjanovic S, Cvetkovic D, Manic S. The application of hard contact lenses in patients with congenital nystagmus. Fortschr Ophthalmol, 1989 ; 86 : 535-539.
[16] Gomez A. In : La réfraction de l’œil. Roth A, Péchereau A, Gomez A (éd.). Paris, Elsevier, 2007.
[17] Hadid OH, Wride NK, Griffiths PG, Strong NP, Clarke MP. Opaque intraocular lens for intractable diplopia: experience and patients’ expectations and satisfaction. Br J Ophthalmol, 2008 ; 92 : 912-915.
[18] Krieger FT, Lambert AC, Alves TC, Arruda Mde F. Opaque intraocular lens in intractable diplopia: case report. Arq Bras Oftalmol, 2006 ; 69 : 597-600.
[19] Mintz-Mittner HA, Fernandez KM. Successful amblyopia therapy initiated after age 7 years: compliance cures. Arch Ophthalmol, 2000 ; 118 : 1535-1541.
[20] Morgan PB, Efron N, Hill EA, Raynor MK, Whiting MA, Tullo AB. Incidence of keratitis of varying severity among contact lens wearers. Br J Ophthalmol, 2005 ; 89 : 430-436.
[21] Morton GV, Kushner BJ, Lucchese NJ, Shapiro MB, Bredeson DC. The efficacy of SimulVue and Unilens RGP aspheric bifocal contact lenses in the treatment of esotropia associated with a high accommodative convergence/accommodation ratio. J AAPOS, 1998 ; 2 : 108-112.
[22] Peyre C. Presbytie et lentilles. In : Les lentilles de contact. Rapport de la Société Française d’Ophtalmologie. Paris, Elsevier Masson, 2009 : 510.
[23] Pollard ZF, Greenberg MF, Bordenca M, Elliott J, Hsu V. Strabismus precipitated by monovision. Am J Ophthalmol, 2001 ; 152 : 479-482.
[24] Quéré M-A. Le traitement médical des strabismes. Nantes, ERA, 1991.
[25] Rajagopalan AS, Bennett ES, Lakshminarayanan V. Visual performance of subjects wearing presbyopic contact lenses. Optom Vis Sci, 2006 ; 83 : 611-615.
[26] Rich LS, Glusman M. Tangent Streak RGP bifocal contact lenses in the treatment of accommodative esotropia with high AC/A ratio. CLAO J, 1992 ; 18 : 56-58.
[27] Roberts CJ, Adams GG. Contact lenses in the management of high anisometropic amblyopia. Eye (Lond), 2002 ; 16 : 577-579.
[28] Roth A. Péchereau A. Gomez A. La réfraction de l’œil. Paris, Elsevier, 2007 : 179-181.
[29] Sandy CJ, Wilson S, Brian Page A, et al. Phacoemulsification and opaque intraocular lens implantation for the treatment of intractable diplopia. Ophthalmic Surg Lasers, 2000 ; 31 : 429-431.
[30] Shen J, Clark CA, Soni PS, Thibos LN. Peripheral refraction with and without contact lens correction. Optom Vis Sci, 2010 ; 87 : 642-655.
[31] Taibbi G, Wang ZI, Dell’Osso LF. Infantile nystagmus syndrome: Broadening the high-foveation-quality field with contact lenses. Clin Ophthalmol, 2008 ; 2 : 585-589.
Ch. Costet, N. Gambarelli
La chirurgie réfractive peut améliorer mais aussi aggraver, voire déclencher un strabisme : avant d’envisager la correction d’un trouble de réfraction, il est indispensable d’évaluer l’équilibre oculomoteur du patient (fig. 17-27).
Les différentes situations cliniques, bonnes ou mauvaises, auxquelles peuvent être confrontés les chirurgiens réfractifs et/ou strabologues doivent être connues. Cela permet d’optimiser la prise en charge de patients qui attendent beaucoup de la correction de leur trouble réfractif, sans en connaître le possible retentissement oculomoteur [5].
Les auteurs du rapport à la Société Française d’Ophtalmologie en 2001 présentent la chirurgie réfractive comme une discipline nouvellement apparue, avec des techniques rapidement évolutives depuis une vingtaine d’années [22]. Ils soulignent la difficulté de réaliser un travail homogène sur une période de cinq ans, dans un domaine en permanente évolution. Aujourd’hui, dix ans plus tard, le chemin parcouru est immense : les indications des différentes techniques se sont clarifiées en ce qui concerne la myopie, l’hypermétropie et l’astigmatisme, et les choses sont en train d’évoluer très vite en matière de chirurgie de la presbytie.
Toute nouvelle technique est appréhendée au départ avec méfiance. On se souvient de l’avènement des implants intraoculaires, l’enthousiasme des uns se heurtant aux réticences de beaucoup d’autres. L’implantation est pourtant devenue incontournable en chirurgie du cristallin et joue un rôle de plus en plus important sur le plan réfractif.
En strabologie, la mise en place de la correction optique totale reste la base de tout traitement ultérieur. Les strabologues ont encore du mal à penser que la chirurgie réfractive puisse générer une correction fiable et reproductible, équivalente aux verres correcteurs ou aux lentilles de contact. Il est vraisemblable que, dans quelques années, les pensées auront évolué, parallèlement aux avancées techniques.
Si on reprend le parallèle avec la chirurgie de la cataracte, on se souvient de nouvelles complications induites sur le plan binoculaire, soit par des modifications imprévues de l’état réfractif du patient, soit par les techniques d’anesthésie locale au début de la phakoémulsification. De la même façon, la chirurgie réfractive à ses débuts a créé des déséquilibres binoculaires, que nous évoquerons, qui sont à l’heure actuelle connus et prévenus en grande partie. Ceci constituera, après un premier temps d’historique, la deuxième partie de notre exposé. Avec le développement de la précision de la correction, les techniques de chirurgie réfractive peuvent à l’heure actuelle, dans certains cas bien précis, venir se substituer à la correction optique classique pour corriger une déviation strabique, ceci constituera la troisième partie de notre exposé.
-
Il est indispensable en préopératoire d’évaluer les capacités fusionnelles du sujet.
-
La chirurgie réfractive peut entraîner des troubles binoculaires si les cas « à risque » ne sont pas dépistés.
-
La chirurgie réfractive peut se substituer aux verres ou aux lentilles dans le cadre des strabismes accommodatifs.
Fig. 17-27 Troubles oculomoteurs et chirurgie réfractive.
a. Évaluation de l’équilibre oculomoteur. b. Après une photokératectomie réfractive.
Le principe de la chirurgie réfractive est de modifier le pouvoir réfractif de l’œil pour permettre une bonne focalisation de l’image sur la rétine, au même titre qu’une correction par lunettes ou lentilles de contact. Ce principe est connu depuis le xixe siècle et a alimenté de nombreux travaux de recherche. Sur le plan clinique, ce n’est que dans les années quatre-vingt que la kératotomie radiaire et le kératomileusis ont commencé à réellement exister. À l’heure actuelle, au terme de nombreuses évolutions que nous allons décrire rapidement, deux sortes de technique dominent :
-
la chirurgie cornéenne : on sait que la cornée représente les deux tiers du pouvoir prismatique de l’œil ; le but va donc être de modifier ce pouvoir dioptrique de la cornée ;
-
la chirurgie extracornéenne : en ajoutant une lentille à l’intérieur de l’œil, soit sur un œil phake soit en pratiquant un échange du cristallin par une lentille à visée réfractive.
Dès le xixe siècle, la chirurgie cornéenne a suscité des travaux de recherche, au départ essentiellement pour corriger l’astigmatisme.
Dans les années trente, Sato, au Japon, a réalisé des travaux importants sur le kératocône et a, à cette occasion, commencé à travailler sur l’astigmatisme. Il utilisait pour le kératocône des incisions cornéennes postérieures, et l’idée de reprendre la technique pour l’astigmatisme puis la myopie a été ensuite exploitée [1]. Les incisions, portant sur la face descemétique de la cornée, ont créé à distance des complications de kératite bulleuse, entraînant l’abandon de la technique mais aussi la compréhension de l’importance de l’endothélium cornéen.
Dans les années soixante-dix, c’est en Union soviétique que la chirurgie incisionnelle réapparaît. Le nom de Fyodorov reste attaché à cette période de développement de la kératotomie radiaire. Sa contribution à cette technique a été importante au niveau des protocoles (nombre d’incisions, taille de la zone optique), mais également au niveau de l’évolution de l’instrumentation [27]. En Europe et aux États-Unis, la technique s’est développée dans les années quatre-vingt. Tout était à définir et encadrer dans cette technique nouvelle, sujette à ce moment-là à de nombreuses controverses. De nombreux travaux ont été réalisés sur de grandes séries, afin d’établir des règles précises pour encadrer les techniques et les indications : à retenir, entre autres, l’étude PERK (Prospective Evaluation of Radial Keratotomy) qui a permis de dresser un cadre à cette nouvelle technique [26].
Les indications seront précisées : puissance à corriger, nombre et caractère des incisions (direction, nombre, longueur et profondeur). Les complications seront évaluées, en particulier le risque d’hypermétropisation progressive au fil du temps. L’instrumentation va évoluer, avec remplacement des bistouris à lame acier par des couteaux à lame diamant pour une meilleure précision. La kératotomie radiaire n’est à l’heure actuelle plus utilisée mais nous voyons toujours des patients opérés à cette époque et qui arrivent à l’heure actuelle à l’âge de la chirurgie de la cataracte (fig. 17-28)…
Parallèlement à la kératotomie radiaire, une autre approche de la chirurgie cornéenne a évolué pendant la même période : le principe est de réaliser une soustraction de tissu cornéen pour modifier la puissance de la cornée, ceci pour corriger la myopie dans un premier temps, puis avec affinement des techniques, l’hypermétropie et l’astigmatisme. Ce principe reste totalement actuel et à la base de la chirurgie réfractive moderne. C’est en effet José Ignacio Baraquer qui, dans les années soixante, a posé les bases de la technique du kératomileusis qui est bel et bien à l’origine du LASIK. Dans les années quarante et cinquante, José Baraquer s’intéressait essentiellement à la kératoplastie et a été à l’origine de nombreuses avancées sur le plan des sutures et de l’instrumentation chirurgicale. Dans les années soixante, il va s’installer à Bogota et axer ses études sur la chirurgie réfractive lamellaire. Ses travaux ont porté sur la découpe lamellaire de la cornée avec l’évolution des microkératomes, ainsi que sur la découpe réfractive de la lamelle prélevée. Il a été le créateur du kératomileusis par congélation, où la lamelle prélevée est congelée avant d’être refaçonnée pour lui donner une valeur réfractive et finalement resuturée [3]. Krumeich, Schwinger ont utilisé le même principe sans congélation [6]. Baraquer avait évoqué des années auparavant la possibilité de réaliser la chirurgie réfractive dans le lit stromal postérieur, mais les résultats avaient été décevants. Luis Antonio Ruiz, un de ses élèves, a repris la technique en la perfectionnant : c’est le kératomileusis in situ automatisé (ALK) [23]. Tous les principes de la chirurgie réfractive cornéenne actuelle ont été ici mis en place, à savoir microkératome, anneaux de succion, etc. Toutes ces techniques se heurtaient malheureusement à des résultats un peu décevants, dus à des imprécisions techniques au niveau de la zone optique ou du mode de la découpe réfractive.
Autour de l’année 1985, le laser à excimères apparaît en chirurgie réfractive. C’est un laser pulsé capable de rompre des liaisons intermoléculaires sans créer d’effet thermique important. Il était utilisé dans l’industrie depuis de nombreuses années. Sur le plan cornéen, chaque impact réalise l’ablation de 0,25 µm de tissu cornéen. Le principe est donc de remplacer les incisions de kératotomie radiaire par l’action du laser : c’est la photokératectomie réfractive (PRK), qui réalise une photoablation réfractive au niveau de la couche de Bowman. Le nom de Marguerite McDonald reste attaché au développement de cette technique avec une première PRK en 1988. La procédure est toujours utilisée aujourd’hui, mais avec des indications limitées [16]. En effet, malgré l’amélioration de la technique, il était évident que les phénomènes cicatriciels induits par l’altération des couches antérieures de la cornée limitaient l’utilisation de la PRK à des amétropies d’assez faible puissance. Le laser à excimères a donc été réenvisagé dans les techniques de kératomileusis, le laser réalisant ici la photoablation réfractive dans le stroma cornéen (Pallikaris, Buratto). La réunion du kératomileusis in situ au laser a donné, par contraction, le nom de LASIK.
Les progrès des microkératomes automatisés, l’utilisation d’un lambeau cornéen à charnière, puis la découpe actuelle du lambeau au laser femtoseconde déterminent les conditions de réalisation de la chirurgie réfractive d’aujourd’hui (fig. 17-29).
La correction de la presbytie (presbyLASIK) a pour principe de réaliser, au centre de l’axe visuel, une zone cornéenne plus bombée, plus convergente, corrigeant la vision de près. C’est la zone périphérique de la cornée qui fournit la vision de loin ; elle aura été préalablement emmétropisée si besoin par un traitement laser conventionnel [12]. La zone intermédiaire permet la vision intermédiaire entre 40 et 120 cm. L’addition réalisée de près n’est pas très importante, ne dépasse pas + 1,50 d. Les résultats obtenus les plus intéressants concernent donc les hypermétropes presbytes autour de la cinquantaine. En fait, dans toutes les séries rapportées, on s’aperçoit qu’on y rajoute souvent un certain degré de monovision.
Le principe de monovision est plus couramment utilisé chez les patients myopes.
Pour en terminer avec la chirurgie réfractive cornéenne, nous passerons rapidement sur certaines techniques utilisées puis abandonnées au cours de ces années. Il s’agit des techniques d’épikératoplastie ou de kératophakie qui utilisaient des lamelles cornéennes ajoutées « dans l’épaisseur de la cornée » pour modifier la courbure et, ainsi, corriger l’aphakie ou de fortes myopies. Dans les mêmes indications, des gestes analogues utilisant des biomatériaux ont été réalisés puis abandonnés. Les anneaux intracornéens sont à l’heure actuelle encore utilisés mais uniquement dans des indications précises, en particulier le kératocône. La thermokératoplastie avait été proposée par Fyodorov dans les années quatre-vingt. Reprenant le principe des incisions radiaires de la kératotomie, il réalisait une thermokératoplastie radiaire, la contraction des fibres périphériques de la cornée entraînant un bombement de la cornée centrale pour corriger l’hypermétropie. La technique présentait un effet spontanément régressif et a donc été abandonnée. Le concept reste néanmoins valable et des travaux sont réalisés en utilisant des lasers pour remplacer la thermokératoplastie, en particulier le laser olmium:YAG ou le laser diode.
Malgré les progrès de la chirurgie réfractive cornéenne, il est évident que des limites existent, en particulier pour les fortes amétropies. C’est pour ces indications que les implants intraoculaires gardent tout leur intérêt. Il peut s’agir d’implants phakes, pour de fortes amétropies chez des sujets jeunes, ou d’implants cristalliniens classiques, qu’il s’agisse d’une chirurgie de la cataracte ou de l’extraction d’un cristallin clair chez un sujet de plus de cinquante-cinq ans. Les implants phakes peuvent être posés en chambre antérieure ou en chambre postérieure.
Le concept remonte aux années soixante (Strampelli, Choyce, Barraquer). Ils peuvent être à support angulaire ou à support irien.
Le premier implant réfractif à support angulaire moderne a été utilisé en 1988 par Georges Baïkoff : l’implant ZB. La qualité optique, la précision de la correction sont excellentes [2]. Dans les deux années suivant l’implantation, on a pu constater des pertes endothéliales importantes dues à la saillie de l’optique dans la chambre antérieure. Le dessin de l’implant a donc été amélioré afin de diminuer le risque cornéen et également de limiter le risque d’ovalisation pupillaire en rapport avec le support angulaire (implants ZB5M puis Nuvita MA20).
Avec le développement de la chirurgie à petite incision dans la cataracte, le concept d’implants souples a été également envisagé en chirurgie réfractive et on a utilisé soit des implants totalement souples (Kelman) soit des implants à haptiques rigides soutenant une optique souple (Baïkoff).
Pour la correction de l’aphakie, Worst en 1978 avait développé l’implant « iris-claw » (implant Artisan) et plusieurs centaines de milliers d’yeux ont été implantées avec ce type de lentilles pour corriger l’aphakie (fig. 17-30). En 1986, Worst et Fechner ont implanté pour la première fois chez des patients phakes des lentilles dérivées de cet implant [9].
Les implants vont donc être posés ici dans l’espace limité en avant par la face postérieure de l’iris, en arrière par la capsule antérieure du cristallin et la zonule, en périphérie par le sulcus ciliaire. Ce premier type d’implantation a été réalisé par Fyodorov en 1986, il s’agissait d’implants monoblocs en silicone. En France, Laurence Lesueur, à Toulouse, présente en 2002 une série de dix-huit yeux d’enfants traités par implant précristallinien ICL en collamère, pour de fortes myopies unilatérales, avec un recul de dix ans et aucune cataracte induite, même pour des implants de première génération [14]. À l’heure actuelle, les implants ICL sont régulièrement utilisés (fig. 17-31).
Fig. 17-31 OCT du segment antérieur d’un ICL.
La chirurgie cristallinienne a fait de tels progrès durant ces dernières années qu’elle a réellement atteint un niveau « réfractif ». Les progrès de la phakoémulsification, la diminution de la taille des incisions, le perfectionnement des implants souples ont permis d’atteindre des résultats excellents en matière d’implants monofocaux. De très bons résultats sont obtenus avec les implants toriques pour des astigmatismes supérieurs à 1,5 d.
Les implants multifocaux sont à l’heure actuelle de plus en plus utilisés [25]. Ils sont de deux types :
-
système réfractif, donnant un résultat visuel satisfaisant en vision de loin et intermédiaire, un peu insuffisant en vision de près ;
-
système diffractif, donnant un résultat visuel satisfaisant en vision de loin et de près, un peu insuffisant en vision intermédiaire.
Un nouveau groupe d’implant trifocal est à ce jour en évaluation.
La chirurgie cornéenne a des indications bien codifiées : PRK pour les petites et moyennes myopies, LASIK pour les myopies plus importantes, les hypermétropies et astigmatismes.
La chirurgie cornéenne entraîne, à des degrés divers : modification du film lacrymal, haze, aberrations optiques, modification de l’asphéricité cornéenne, réduction de la zone optique fonctionnelle. Des examens paracliniques de plus en plus précis sont utilisés en préopératoire pour diminuer le risque de ces effets collatéraux : réfractométrie, kératométrie, topographie cornéenne (fig. 17-32), pachymétrie, OCT de chambre antérieure en cas de fortes amétropies avec pachymétrie inférieure à 490 µm.
Pour les implants, on connaît les risques endothéliaux des implants phakes de chambre antérieure, les risques de cataracte secondaire des implants phakes de chambre postérieure avec, en corollaire, une surveillance rigoureuse par microscopie spéculaire et OCT.
Fig. 17-32 Topographie cornéenne.
Plusieurs mécanismes peuvent être mis en cause :
-
l’aniséiconie :
-
en cas d’aniséiconie axile (myopie unilatérale, par exemple), l’aniséiconie est minime avec lunettes, bien plus importante avec lentilles ou chirurgie réfractive ;
-
en cas d’aniséiconie de puissance (aphakie unilatérale, par exemple), c’est l’inverse ;
-
la modification des mouvements oculaires :
-
chez le myope fort équipé en lunettes, l’effet prismatique des verres limite les versions. Cette limitation peut se révéler dans les suites de la chirurgie réfractive ;
-
chez l’hypermétrope, c’est l’inverse ;
-
-
le non-respect de la dominance oculaire : changement d’œil fixateur tant en chirurgie réfractive qu’en chirurgie de la cataracte ou lorsqu’on utilise la monovision dans la chirurgie de la presbytie ;
-
la décompensation d’une phorie préexistante ;
-
la méconnaissance ou l’aggravation d’un trouble binoculaire ancien.
La chirurgie réfractive, alliée ou ennemie du strabisme ?
Deux types de situations, deux gestions différentes.
Le strabisme est connu
Il convient de déterminer si la chirurgie réfractive peut améliorer en partie, voire en totalité le trouble oculomoteur ou si, à l’opposé, elle risque de le décompenser. Le bilan strabologique est généralement demandé avant toute décision de chirurgie réfractive. La hiérarchie des deux gestes chirurgicaux, réfractif et strabologique, s’ils s’avèrent nécessaires, est discutée.
Aucun antécédent strabologique n’est spontanément rapporté
Le patient acceptera très difficilement une complication oculomotrice inattendue. Le bilan préopératoire de toute chirurgie réfractive doit permettre de dépister un équilibre binoculaire fragile et de programmer si besoin un examen de la vision binoculaire plus complet.
Il est indispensable de connaître les cas où la chirurgie réfractive est « alliée » ou « ennemie » d’un trouble oculomoteur.
Certaines anomalies de la vision binoculaire peuvent être « traitées » par la chirurgie réfractive. Ainsi, la correction d’une hypermétropie est connue pour améliorer un strabisme convergent, celle d’une myopie est susceptible d’aider à contrôler un strabisme divergent.
Il s’agit du type de strabisme le plus connu pour son amélioration potentielle par la chirurgie réfractive (fig. 17-33). Il a fait l’objet d’un nombre croissant de publications depuis une dizaine d’années [4, 13, 15, 17, 21]. La majorité des auteurs conclut à un effet bénéfique de la chirurgie de l’hypermétropie sur l’élément accommodatif du strabisme. Celle-ci a même pu être présentée comme une « alternative » thérapeutique du strabisme accommodatif [10]. Elle ne doit bien entendu être envisagée que chez l’adulte avec réfraction stable, après traitement médical bien conduit et mesure de l’hypermétropie sous cycloplégique en préopératoire, ce jusqu’à l’âge de cinquante ans.
Les résultats les meilleurs sont obtenus sur un strabisme accommodatif pur, où le patient est porteur d’une correction optique qui corrige totalement le strabisme (vidéos 17-1 et 17-2).
La situation est plus délicate en cas de strabisme accommodatif partiel. Il en est de même si le patient n’est pas porteur d’une correction optique totale. Cette correction, souhaitable sur un plan strabologique, risque d’être mal tolérée, surtout en vision de loin. Un essai en lentilles et une bonne information peuvent aider à la faire accepter de la manière la plus optimale et la plus tolérable.
Dans tous les cas, le patient sera informé d’un possible geste chirurgical strabologique ultérieur même si, parfois, à l’opposé, celui-ci pourra s’avérer inutile alors qu’il paraissait quasi inéluctable.
Il ne faut pas oublier qu’une régression de l’effet chirurgical sur l’hypermétropie peut exposer à une récidive du strabisme. Il en sera de même, de manière différée, si l’hypermétropie n’a pas été corrigée en totalité, surtout chez un sujet jeune : ceci conduira à un nouveau besoin de correction optique et à un risque de décompensation du strabisme au fil des années.
Fig. 17-33 Strabisme accommodatif.
a. Avec sa correction optique totale en lunettes. b. Sans correction. c. Avec la correction optique totale de son hypermétropie par une chirurgie réfractive (correction totale de l’hypermétropie mesurée sous cycloplégique).
Proposée par certains auteurs en cas d’amblyopie par forte anisométropie résistant aux traitements conventionnels, elle doit être considérée avec beaucoup de prudence et de réserve. Aucune étude multicentrique randomisée n’a encore été réalisée à ce sujet [7].
Des décompensations de troubles oculomoteurs sont régulièrement rapportées dans la littérature. Il peut s’agir de décompensations d’exodéviations survenues après chirurgie de myopie [24], parfois après régression secondaire de l’effet réfractif [28]. Des décompensations de paralysie du IV ont également été décrites [11].
Chez le patient anisométrope, l’aniséiconie est minime avec correction par lunettes, mais devient maximale après chirurgie réfractive, entraînant une asthénopie de fixation avec céphalées, confusion ou diplopie pouvant aller jusqu’à obliger à fermer un œil.
Le statut sensorimoteur préexistant doit être respecté, un changement d’œil fixateur pouvant devenir désastreux (fig. 17-34).
Il est indispensable en préopératoire d’évaluer les capacités fusionnelles du sujet. Une bonne fusion laisse espérer un bon résultat de la correction réfractive ; une mauvaise fusion doit rendre très prudent. En cas de correspondance rétinienne anormale, la chirurgie est très discutable. Elle est à proscrire en l’absence de neutralisation, risquant d’exposer à une diplopie incoercible. À l’opposé, si une neutralisation existe, elle est envisageable, mais le patient risque de ne pas ressentir de bénéfice réel de la correction de son problème réfractif, ce qui pose la question de l’intérêt du geste chirurgical.
À l’âge de la presbytie, une correction en monovision ou une bascule loin-près risque d’être mal tolérée en cas de mauvaise appréciation de la dominance oculaire et de phénomènes de suppression préexistants pouvant être levés en postopératoire.
Dans tous ces cas délicats, une simulation du résultat réfractif par essai en lentilles de contact est souhaitable avant de poser l’indication chirurgicale.
Il est indispensable en préopératoire d’évaluer les capacités fusionnelles du sujet : une bonne fusion laisse espérer un bon résultat de la correction réfractive, une mauvaise fusion doit rendre très prudent.
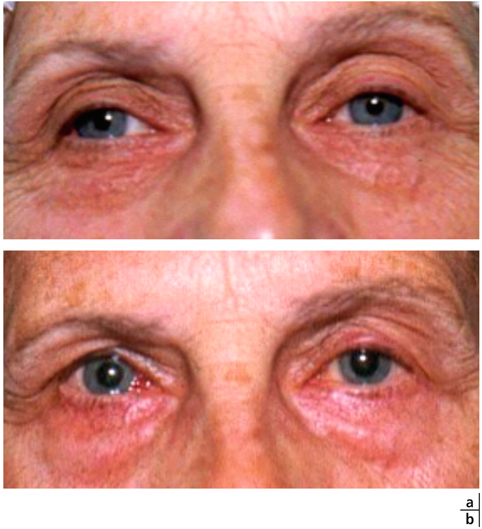
Fig. 17-34 Patiente opérée d’un strabisme convergent dans l’enfance.
a. Décompensation d’une exotropie par inversion de dominance oculaire dans les suites d’une chirurgie réfractive. b. Nécessité d’un second temps opératoire strabologique.
« La chirurgie réfractive peut perturber, de façon parfois irréversible, un système oculomoteur fragile, en particulier chez l’anisométrope, l’amblyope unilatéral et le strabique. » (A. Péchereau) [22].
Les premières observations portent sur des chirurgies de la myopie : il s’agit de myopies unilatérales, ou bilatérales avec anisométropie [11, 24].
Cas clinique 1
Mme M., 43 ans :
-
adressée en 2002 pour diplopie post-traitement LASIK d’une myopie unilatérale ;
-
au départ : OD : emmétrope ; OG : myope de – 5,50 (150°, – 4,00) ;
-
deux traitements LASIK sur l’oeil gauche ;
-
vue 2 ans plus tard avec équipement prismatique :
-
AVL : OD : 10/10 sc ; OG : 6/10 sc, avec – 0,75 d 10/10 ;
-
hypertropie droite 18 ? ; AOS : + 5° ;
-
-
chirurgie : test de duction passive, élévation OG négatif, antéroposition oblique inférieure droit ;
-
hypertropie droite 2 ? ; AOS : + 4° ;
-
mécanisme :
-
décompensation d’une paralysie de l’oblique supérieur droit ?
-
rupture prolongée de la fusion (OG correction peu portée) ?
-
Cas clinique 2
M. E., 42 ans :
-
adressé en 2001 pour diplopie post-traitement LASIK d’une myopie bilatérale ;
-
au départ : OD : – 2,00 d ; OG : – 5,00 d ;
-
traitement LASIK ODG ;
-
vu 1 an plus tard :
-
AVL : OD : sc 10/10 ; OG : sc 7/10, avec 0 (50°, – 0,50) 9/10 ;
-
exotropie (OG) : loin : 8 à 10° ; près : 6° ;
-
AOS : – 8° ;
-
-
chirurgie : recul de 8 mm du droit latéral gauche ;
-
postopératoire : AOS : – 1°.
-
mécanisme : décompensation d’une exophorie préexistante ?
On rencontre également des complications au début de la chirurgie de l’hypermétropie, soit par mauvaise évaluation de l’élément accommodatif, soit même par méconnaissance du terrain strabique. Dans le cas clinique 3, la chirurgie réfractive a mis en place la correction totale chez un patient sous-corrigé depuis des années, ce qui a entraîné le passage en exotropie consécutive.
Cas clinique 3
M. B., 25 ans :
-
adressé pour une exotropie apparue post-traitement d’une hypermétropie bilatérale ;
-
mise en place d’implants hypermétropiques de forte puissance (OD : +8 d ; OG : +9 d) après une cycloplégie sous cyclopentolate donnant OD : +6 d ; OG : +7 d ;
-
AVL : ODG sc 10/10 ;
-
exotropie : loin : 14° ; près : 12° ;
-
chirurgie : recul de 7 mm des deux droits latéraux ;
-
postopératoire : exotropie de 1° loin et près ;
-
mécanisme : méconnaissance du passé strabologique du patient, opéré deux fois pour ésotropie dans l’enfance et stabilisé depuis des années avec + 3,00 d ODG.
Les chirurgiens réfractifs ont été sensibilisés aux problèmes binoculaires. Ils sont souvent aidés par des orthoptistes qui ont pour mission de les alerter sur les cas « à risque ». Pour tout candidat à une chirurgie réfractive, rappelons les points essentiels :
-
étude soigneuse de la réfraction avec cycloplégie sous cyclopentolate, au moins pour les hypermétropes ;
-
test à l’écran pour dépister un éventuel trouble oculomoteur ;
-
évaluation de la stéréoscopie ;
-
détermination de l’œil dominant.
Au moindre doute, un bilan binoculaire plus complet doit être envisagé, avec avis d’un strabologue, démarche en général bien acceptée par le patient, et parfois utile sur le plan médico-légal.
À l’heure actuelle, les complications par méconnaissance d’un état binoculaire précaire, tels que les trois cas décrits plus haut, deviennent donc exceptionnelles [29].
La chirurgie de la presbytie, qui fait toujours intervenir un certain degré de monovision, est en général précédée d’un bilan binoculaire : les cas à risque sont alors écartés.
On commence à voir des récidives de l’hypermétropie et, par là même, du strabisme chez des patients déjà traités il y a une dizaine d’années.
Cas clinique 4
M. O., 36 ans :
-
adressé en 2012 pour apparition d’une convergence chez un patient traité 10 ans plus tôt par LASIK hypermétropique, avec un bon résultat sur le plan réfractif et sur le plan binoculaire ; vraisemblable strabisme accommodatif pur ;
-
AVL : OD sc 5/10, OG sc 6/10 ; AVP : ODG sc P4. Vision binoculaire P et L sc Et 16° ;
-
essai de + 2 d : OD : AVL : 7/10, AVP : P3 ; OG : AVL : 8/10, AVP : P3. Ésotropie de loin et de près : 8° ;
-
réfraction sous cyclopentolate : ODG + 3,50 d ;
-
mécanisme : rechute de l’hypermétropie, vraisemblablement sous-évaluée lors du LASIK ?
En 2012, les problèmes le plus fréquemment rencontrés concernent finalement la chirurgie de la cataracte. Elle devient « chirurgie réfractive », mais tous les chirurgiens de la cataracte ne sont pas chirurgiens réfractifs, et encore moins strabologues…
Cas clinique 5
Mme N., 69 ans :
-
adressée en 2012 pour inconfort visuel majeur depuis ses interventions de cataracte ;
-
au départ, OD : – 9 d, OG : – 7 d ;
-
opérée de la cataracte ODG 8 mois plus tôt ;
-
AVL : OD avec + 1,75 (10°, + 0,75) : 9/10 ; OG sc : 10/10. AVP : OD avec + 5,50 d : P3 ; OG avec + 3,50 d : P2. Minime exophorie + insuffisance de convergence ;
-
aucun équipement optique supporté, en particulier ne supporte pas que OD soit corrigé ; essaie d’oublier son OD… ;
-
mécanisme : la patiente a toujours utilisé son oeil droit, le plus myope, en vision de près. L’hypermétropisation de cet oeil est insupportable. La solution aurait été un changement d’implant dans les suites immédiates de la chirurgie. Six mois plus tard, le résultat n’est pas assuré. Essai prolongé d’une lentille myopisante de l’oeil droit avant changement d’IOL ou mise en place d’un piggyback ?
Parmi nos patients strabiques, les hypermétropes sont les plus nombreux. Lorsqu’ils arrivent à l’âge adulte, ils ont derrière eux un long parcours ophtalmologique : verres correcteurs dès le plus jeune âge, traitement d’occlusion, pénalisations et, souvent, une ou plusieurs interventions chirurgicales.
On peut les diviser en quatre groupes.
Ils vont bien avec leur correction optique, lunettes ou lentilles (fig. 17-35). Leur acuité visuelle est bonne aux deux yeux, il n’y a pas d’amblyopie. Ils sont centrés avec leur correction, mais convergent lorsqu’ils l’enlèvent. Ils sont en correspondance rétinienne normale. Ce sont des strabismes accommodatifs « purs » ou plutôt « réfractifs ». Ils rêvent de ne plus avoir de correction et, surtout, de ne plus converger au retrait des verres.
Ils vont bien avec leur correction. Il y a parfois une amblyopie, au moins relative, de l’œil dévié. Ils sont en microstrabisme avec leur correction, mais convergent lorsqu’ils l’enlèvent. Ils sont en correspondance rétinienne normale (CRN) ou anormale (CRA). Leur demande est la même que dans le groupe précédent.
Il y a parfois une amblyopie, au moins relative, de l’œil dévié (fig. 17-36). La déviation augmente sans correction. Ils sont souvent en CRA. Ce sont des strabismes « partiellement accommodatifs ». Ils voudraient une solution pour leur double problème : l’hypermétropie et le strabisme.
Il y a parfois une amblyopie, au moins relative, de l’œil dévié. La déviation augmente sans correction. Ils sont souvent en CRA. Leur demande est la même que dans le groupe précédent.
La prise en charge est double, par l’équipe strabologique et par l’équipe de chirurgie réfractive.
Le bilan binoculaire sera complet et l’importance de la réfraction sous cyclopentolate est primordiale, bien que tous les patients soient des adultes. C’est au terme de ce bilan que le patient sera adressé au chirurgien réfractif, en indiquant l’hypermétropie à corriger. Le choix de la puissance à corriger n’est pas toujours facile :
-
dans les strabismes réfractifs purs, ce sera toujours la correction totale, habituellement portée ;
-
dans les autres cas, les choses sont parfois plus complexes :
-
un sujet âgé de trente-cinq ans ou plus supportera toujours la correction totale ; son strabisme s’est d’ailleurs souvent décompensé récemment pour cause de correction insuffisante ;
-
inversement, un sujet âgé de vingt ans est souvent gêné de loin par la correction totale : si on choisit de corriger l’hypermétropie habituellement portée, sous-estimée, on s’expose à un résultat provisoire, avec rechute quelques années plus tard.
-
Dans la mesure du possible, la correction totale doit être testée en lentilles et doit être respectée si on veut assurer un résultat durable ; parfois, en mettant en place une correction plus forte, on va créer une divergence qui devra être traitée ultérieurement.
L’information au patient est primordiale. Il doit être prévenu des risques inhérents aux deux prises en charge.
La chirurgie réfractive va toujours être réalisée dans un premier temps :
-
pour les hypermétropies petites et moyennes, avec ou sans astigmatisme associé, un LASIK sera réalisé ;
-
pour les hypermétropies très importantes, on utilisera des implants intraoculaires, implants phakes chez le sujet jeune, implants cristalliniens après cinquante ans.
Quelques semaines plus tard, la déviation strabique est réévaluée et le temps chirurgical oculomoteur est décidé chaque fois que nécessaire. Il s’agit souvent d’une chirurgie sur des muscles déjà opérés dans le passé.
Les résultats sont globalement satisfaisants sur une série de cinquante patients présentée à la SAFIR en 2009 [10]. Il s’agit de patients adultes :
-
quarante patients ont été traités par LASIK ;
-
dix ont été traités par implants hypermétropiques (type Artisan à fixation irienne) pour de fortes hypermétropies, sous réserve d’un segment antérieur adapté.
L’indication idéale est celle des strabismes réfractifs purs : une fois l’hypermétropie opérée, le patient se retrouve orthophorique sans correction ; nous n’avons jamais eu à intervenir sur les muscles oculomoteurs dans ce groupe de patients (douze cas).
Cas clinique 6
Mlle M., 26 ans :
-
suivie depuis l’enfance pour strabisme accommodatif ;
-
correction lunettes : OD : + 4,50 d ; OG : + 4,00 d ;
-
cycloplégie sous cyclopentolate : OD + 4,75 d ; OG + 4,50 d ;
-
supporte très mal les lentilles, demandeuse d’une chirurgie réfractive ;
-
AVL : OD asc 10/10 ; OG asc 10/10. E 2 ? et E’ 4 ?. AOS : + 2°. Lang 550’’. Ésotropie loin et près sc : 16 ?. AOS : +10° ;
-
chirurgie : LASIK ODG ;
-
postopératoire : ODG sc AVL 10/10 P2 ;
-
vision binoculaire superposable à l’examen préopératoire avec correction.
Chez les patients opérés dans l’enfance et stabilisés sur un microstrabisme (dix cas), la chirurgie réfractive assure le même résultat que les équipements optiques, sans chirurgie oculomotrice, sauf un cas dans notre série.
Pour les autres cas, où une déviation strabique existe malgré la correction totale, une chirurgie musculaire est donc prévue après la chirurgie réfractive, pour corriger l’angle résiduel.
Cas clinique 7
M. C., 36 ans :
-
suivi depuis l’enfance pour strabisme ;
-
correction lunettes : OD + 3,00 d ; OG + 2,50 d ;
-
cyclopentolate : OD + 3,00 d ; OG + 3,00 d ;
-
stabilisé depuis des années, le patient se sent converger depuis quelques mois ;
-
demandeur d’une solution pour son double problème, réfractif et binoculaire ;
-
demandeur d’une solution pour son double problème, réfractif et binoculaire ;
-
AVL : OD asc 9/10 ; OG asc 10/10 ; AVP : OD asc P2 ; OG asc P2 ;
-
ésotropie loin : 10° ; près : 6° ; AO + 8° ;
-
chirurgie : LASIK ODG ;
-
postopératoire : AVL OD sc 9/10 ; OG sc 10/10. AVP ODG sc P2 ;
-
vision binoculaire superposable à l’examen préopératoire avec correction ;
-
chirurgie oculomotrice dans un second temps : recul de 8 mm du droit médial droit ;
-
postopératoire : ésotropie loin et près : 2° ; AO : + 2°.
Dans les strabismes réfractifs partiels (onze cas), deux interventions prévues sur les muscles oculomoteurs ont été évitées grâce à une meilleure prise en charge de l’élément accommodatif. De même, chez les patients opérés dans l’enfance et ayant une déviation résiduelle (dix-sept cas), une intervention prévue sur les muscles oculomoteurs a pu être évitée.
Sur l’ensemble des cinquante cas, trois retouches LASIK et deux retouches du strabisme ont été nécessaires.
De nombreuses équipes arrivent à des conclusions analogues pour ces types d’indications [18, 19]. Mais des réserves sont à faire :
-
on connaît le risque de régression de l’effet du laser hypermétropique à plus ou moins long terme, une retouche pouvant néanmoins être alors envisagée ;
-
les mesures de la réfraction sont difficiles après LASIK, même avec les meilleurs réfractomètres, ce qui complique la surveillance ;
-
en cas d’intervention précoce, vers dix-huit ou vingt ans, même dans les meilleurs cas, quelle sera l’évolution vingt ans plus tard, si on tient compte de la régression de l’effet et de l’approche de la presbytie ;
-
il faut bien noter toutefois que ces patients sont moins exigeants que d’autres sur le plan réfractif, dans la mesure où ils peuvent vivre la plupart du temps sans correction et sans strabisme ; ils acceptent également assez bien une correction d’appoint si nécessaire.
Un dépistage et une analyse précise des troubles oculomoteurs éventuels doivent être effectués chez tout candidat à une chirurgie réfractive, avec :
-
un interrogatoire à la recherche d’antécédents de strabisme, de rééducation orthoptique ;
-
un examen orthoptique de base : test de l’écran uni- puis bilatéral, étude de la motilité oculaire et de la convergence, test de vision stéréoscopique (test de Lang ou TNO) (cf. chapitre 11) ; un bilan orthoptique complet peut s’imposer ;
-
une acuité visuelle subjective et objective : la mesure sous cycloplégique est souhaitable jusqu’à l’âge de cinquante ans ;
-
une étude de la dominance oculaire est indispensable à l’âge de la presbytie ;
-
devant toute situation à risque, une simulation en lentilles de contact sera une aide importante à la prise de la décision chirurgicale.
Un trouble oculomoteur même mineur doit faire l’objet d’une évaluation précise.
Le patient sera informé du risque de décompensation d’un état binoculaire fragile, de la possibilité d’un geste chirurgical ultérieur sur le strabisme. Il est généralement licite de débuter par le temps opératoire réfractif.
En cas de survenue inattendue d’un problème strabologique, la situation est à évaluer au cas par cas, parfois en plusieurs étapes : correction optique, rééducation, prismes, réintervention. On pourra discuter soit d’un second temps opératoire réfractif (sous-correction, mauvaise appréciation de la dominance oculaire, correction inappropriée d’une anisométropie…), soit d’une chirurgie oculomotrice (strabisme non améliorable par des thérapeutiques optiques ou orthoptiques).
L’effet chirurgical réfractif est bénéfique dans certains troubles oculomoteurs comme les strabismes accommodatifs. Le degré de satisfaction des patients, qui voient résoudre simultanément problèmes réfractif et oculomoteur, est très élevé. À l’opposé, la décompensation d’un strabisme préexistant ou, pire encore, d’un problème oculomoteur méconnu peut s’avérer désastreuse, source d’une insatisfaction profonde. Un bilan préopératoire soigneux, la connaissance et l’évaluation des situations oculomotrices précaires, une information précise doivent permettre d’apporter à ces patients à risque un gain fonctionnel à la hauteur des progrès effectués par la chirurgie réfractive. La collaboration entre chirurgiens réfractifs et strabologues aidera à gérer au mieux les cas délicats.
[1] Akiyama K, Shibata H, Kanai A, Akiyama S, Yamaguchi T. Developpment of radial keratotomy in Japan 1939-1960. In : Refractive Keratotomy. Waring GO (ed.). St Louis, Mosby, 1992 : 179-219.
[2] Baïkoff G, Joly P. Correction chirurgicale des fortes myopies par implants phakes de chambre antérieure. Principes et résultats. Bull Soc Belge Ophtalmol, 1989 ; 233 : 109-125.
[3] Barraquer JI. The history and evolution of keratomileusis. Int Ophthalmol Clin, 1996 ; 36 : 1-7.
[4] Brugnoli de Pagano OM, Gabrielle L, Pagano GL. Laser in situ keratomileusis for the treatment of refractive accommodative esotropia. Ophthalmology, 2012 ; 119 : 159-163.
[5] Costet-Fighiera C. Troubles oculomoteurs et chirurgie réfractive. Pratiques en Ophtalmologie, 2012 ; 6 : 2-5.
[6] Couderc J-L. Keratomileusis ou épikératoplastie sans congélation. Principes techniques, premiers résultats. Ophtalmologie, 1987 ; 1 : 247-248.
[7] Daoud YJ, Hutchinson A, Wallace DK, et al. Refractive surgery in children: treatment options, outcomes, and controversies. Am J Ophthalmology, 2009 ; 147 : 573-582.
[8] Espinasse-Berrod M-A. Strabologie : approches diagnostique et thérapeutique. Paris, Elsevier, 2004.
[9] Fechner PU, Van der Heijde GL, Worst JG. Intraocular lens for the correction of myopia of the phakic eye. Klin Monatsbl Augenheilkd, 1988 ; 193 : 29-34.
[10] Gambarelli N, Baïkoff G, Lagrange C, Aranzana C. La Chirurgie de l’hypermétropie : Une alternative « thérapeutique » dans le strabisme accommodatif. Ophtalmologies, 2009 ; 3 : 28.
[11] Godts D, Tassignon M-J, Gobin L. Binocular vision impairment after refractive surgery. J Cataract Refract Surg, 2004 ; 30 : 101-109.
[12] Holzer MP, Knorz MZ, Tomalla M, Neuhann TM, Auffarth GU. Intrastromal femtosecond laser presbyopia correction: 1-year results of a multicenter study. J Refract Surg, 2012 ; 28 : 182-188.
[13] Kirwan C, O’Keefe M, O’Mullane G, Sheehan C. Refractive surgery in patients with accommodative and non-accommodative strabismus: one year prospective follow up. Br J Ophtahlmol, 2010 ; 94 : 898-902.
[14] Lesueur L, Arné J-L. Phakic intraocular lens to correct high myopic amblyopia in children. J. Refract Surg ; 2002 ; 18 : 519-523.
[15] Magli A, Lovine A, Gagliardi V. LASIK and PRK in refractive accommodative esotropia: a retrospective study on 20 adolescent and adult patients. Eur J Ophthalmol, 2009 ; 19 : 188-195.
[16] Mc Donald MB, Liu JC, Byrd TJ, Abdelmegeed M, Andrade HA, Klyce SD, Varnell R, Munnerlyn CR, Clapham TN, Kaufman HE. Central Photorefractive keratectomy for myopia. Partially sighted and normally eyes. Ophthalmology, 1991 ; 98 : 1327-1337.
[17] Nemet P, Levenger S, Nemet A. Refractive surgery for refractive errors which cause strabismus. A report of 8 cases. Binocul Vis Strabismum Q, 2002 ; 17 : 187-190.
[18] Nucci P, Serafino M, Hutchinson AK. Photorefractive keratectomy followed by strabismus surgery for the treatment of partly accommodative esotropia. J AAPOS, 2004 ; 8 : 555-559.
[19] Pacella E, Abdolrahimzadeh S, Mollo R, Mazzeo L, Pacella F, Mazzeo F, Gabrieli CB. Photorefractive keratectomy in the management of refractive accommodative esotropia in young adult patients. J Cataract Refract Surg, 2009 ; 35 : 1873-1877.
[20] Péchereau A. Vision binoculaire, troubles oculomoteurs et chirurgie réfractive. In : Saragoussi J-J, Arné J-L., Colin J., Montard M. Chirurgie réfractive. Rapport de la Société Française d’Ophtalmologie. Paris, Masson, 2001 ; 134-137.
[21] Polat S, Can C, Ilhan B, et al. Laser in situ keratomileusis for treatment of fully or partially refractive accommodative esotropia. Eur J Ophthalmol, 2009 ; 19 : 733-737.
[22] Saragoussi J-J, Arné J-L, Colin J, Montard M. Chirurgie réfractive. Rapport de la Société Française d’Ophtalmologie. Paris, Masson, 2001.
[23] Slade SG, Updegraff SA. Advances in lamellar refractive surgery. Int Ophthalmol Clin, 1994 ; 34 : 147-162.
[24] Snir M, Kremer I, Weinberger D, Sherf I, Axel-Sieger R. Decompensation of exodeviation after corneal refractive surgery for moderate to high myopia. Ophthalmic Surg Lasers Imaging, 2003 ; 34 : 363-370.
[25] Visser N, Nuijts RM, de Vries NE, Bauer NJ. Visual outcomes and patient satisfaction after cataract surgery with toric multifocal intraocular lens implantation. J Cataract Refract Surg, 2011 ; 37 : 2034-2042.
[26] Waring GO, Lynn MJ, Nizam A, Kutner MH, Cowden JW, Culbertson W, Laibson PR, McDonald MB, Nelson JD, Obstbaum SA, et al. Results of the Prospective Evaluation of Radial Keratotomy (PERK) Study five years after surgery. The Perk Study Group. Ophthalmology, 1991 ; 98 : 1164-1176.
[27] Waring GO. Developpment of Refractive Keratotomy in Soviet Union 1960-1990. In : Refractive keratotomy. Waring GO (ed.). St Louis, Mosby, 1992 : 221-235.
[28] Yildirim R, Oral Y, Uzun A. Exodeviation following monocular myopic regression after laser in situ keratomileusis. J Cataract Refract Surg, 2003 ; 29 : 1031-1033.
[29] Zamojska E, Loba P, Archacka E, Broniarczyk-Loba A. Refractive laser eye surgery and binocular vision disorders. Klim Oczna, 2010 ; 112 : 67-69.
F. Oger-Lavenant
La neurotoxine A, sécrétée par Clostridium botulinum, a été proposée chez l’homme en 1970 et utilisée en 1977 pour le traitement des strabismes infantiles par Alan B. Scott. En France, elle est utilisée depuis 1984 en oculomotricité. La toxine botulique est devenue un moyen incontournable de notre arsenal thérapeutique dans les troubles oculomoteurs, remplaçant dans certains cas la chirurgie ou la complétant dans d’autres. Pour les muscles oculomoteurs, seule la toxine fournie par le laboratoire Allergan a obtenu une AMM en France, sous le nom de Botox®, et ce après l’âge de douze ans.
Nous verrons successivement le mode d’action de la toxine botulique, les avantages et les inconvénients de la toxine, ses indications thérapeutiques et la législation.
La toxine botulique appartient à l’arsenal thérapeutique de tout ophtalmologiste devant gérer la pathologie oculomotrice. Son injection effectuée sous microscope est un geste rapide et peu invasif. Bien qu’effectuée hors AMM chez l’enfant lors des strabismes précoces, il faut savoir le proposer aux parents. Devant toute paralysie oculomotrice susceptible de régresser spontanément, il est licite de proposer au patient une injection de toxine botulique afin d’attendre avec beaucoup plus de confort l’heure d’une éventuelle chirurgie.
Nous envisagerons l’action chimique périphérique et ses conséquences périphériques et centrales sur les troubles oculomoteurs.
La toxine botulique bloque la libération d’acétylcholine au niveau des plaques motrices des jonctions neuromusculaires. Son action ne concerne que la libération de quantums d’acétylcholine par exocytose, sans perturber les autres modes de libération comme le transport membranaire et la libération calcium-dépendante. Cette action provoque une paralysie flasque du muscle oculomoteur. Trois étapes se succèdent pour cette action : la fixation rapide et irréversible à un récepteur présynaptique, l’internalisation permettant à la toxine botulique de pénétrer dans la terminaison nerveuse et le blocage proprement dit de la libération d’acétylcholine dans la fente synaptique.
Les muscles oculomoteurs ayant un nombre très élevé de plaques motrices, la paralysie apparaît quarante-huit heures après l’injection, soit beaucoup plus tôt que sur un muscle strié non oculomoteur. Quelques jours plus tard, de nouvelles terminaisons nerveuses apparaissent qui seront fonctionnelles en deux à trois semaines.
La toxine diffusant autour du point d’injection, l’apparition d’un ptosis est possible.
Les conséquences de l’injection de toxine sont différentes selon l’origine supranucléaire ou périphérique du trouble oculomoteur. On peut séparer les troubles oculomoteurs selon l’existence d’une impotence musculaire ou non.
L’impotence musculaire existe au cours des paralysies oculomotrices périphériques du III, du IV et du VI et dans certaines pathologies musculaires comme la dysthyroïdie et dans les séquelles musculaires de la chirurgie strabique. À l’inverse, les strabismes primitifs qui représentent une atteinte supranucléaire ne présentent pas d’impotence.
Dans les strabismes primitifs, la paralysie flasque du muscle oculomoteur hyperactif injecté, du fait de l’absence d’impotence musculaire, inverse totalement la déviation initiale : l’injection d’un droit médial transforme transitoirement une ésotropie de 40 ? en exotropie de 40 ? avec l’impotence due à la paralysie flasque (fig. 17-37). Cette inversion est majeure vers le quinzième jour et l’impotence disparaît, laissant place à une déviation inverse sans impotence qui diminuera en quatre à cinq semaines. La modification périphérique de la déviation des globes oculaires retentit sur les centres de commande oculogyre qui doivent alors se réadapter peu à peu aux changements périphériques. Il se produit une « démémorisation » des anomalies positionnelles antérieures au fur et à mesure des modifications positionnelles périphériques post-toxine. Ce mécanisme explique que, souvent, une seule injection suffit pour réduire le strabisme à une microtropie.
Dans les déviations avec impotences musculaires, l’injection du muscle à paralyser — l’antagoniste du muscle paralysé dans les paralysies oculomotrices et le muscle infiltré dans les dysthyroïdies —, la déviation initiale diminue ou disparaît sans inversion angulaire avec simplement l’impotence musculaire post-toxine transitoire. Dans ces indications, les injections sont souvent répétées plusieurs fois comme nous le verrons ultérieurement.
Dans les nystagmus acquis, il a été proposé des injections de toxine afin que la paralysie post-toxine diminue les oscillopsies, les injections devant être répétées régulièrement.
Fig. 17-37 Ésotropie précoce.
a. J1 post-toxine. b. J2 post-toxine, ptosis et divergence. c. J3 post-toxine, accentuation du ptosis. d. J4 post-toxine, ptosis majeur.
En France, nous disposons de la toxine botulique Botox® présentée en flacon de 50 UI ou 100 UI sous forme lyophilisée à diluer dans du sérum physiologique à 0,9 % sans conservateur.
L’injection de toxine botulique dans le muscle oculomoteur est pratiquée sous microscope opératoire comme toute chirurgie oculomotrice, ce qui permet de contrôler le trajet de l’aiguille, d’autant qu’une boutonnière conjonctivale en regard du tendon du muscle est réalisée. La boutonnière conjonctivale est fermée par un point de Vicryl® 8/0.
L’injection est réalisée sous anesthésie générale sans curare chez l’enfant et sous topique chez l’adulte. Une sédation est parfois nécessaire dans les déviations permanentes de l’adulte pour mobiliser le globe en vue de l’injection. L’enfant sort quatre heures après son injection et l’adulte aussitôt après. Dans les deux cas est prescrite une instillation d’un collyre anti-inflammatoire pendant cinq jours au rythme de trois fois par jour.
L’injection est réalisée avec des aiguilles de 30 gauges et pénètre dans le muscle à 5 à 6 mm du limbe jusqu’à la garde, ce qui libère la toxine à 12 mm du point d’injection (fig. 17-38). Pour limiter la diffusion de la toxine, l’injection s’effectue doucement. L’électromyogramme est inutile lorsqu’une boutonnière conjonctivale est pratiquée. De plus, les aiguilles-électrodes, qui sont plus grosses, ont provoqué des perforations ; en effet, elles étaient introduites dans le muscle en transconjonctival sans contrôle visuel. Par ailleurs, sous anesthésie générale, le muscle oculomoteur présente un silence électrique.
Afin d’éviter la diffusion de la toxine, le volume injecté doit être le plus faible possible : un volume de 0,1 ml est idéal. Chez l’enfant, la dose de toxine varie entre 2,5 UI et 5 UI selon l’âge et l’importance du strabisme. Chez l’adulte, les doses varient entre 5 UI pour un strabisme et 10 UI à 20 UI pour une paralysie oculomotrice.
Tous les muscles oculomoteurs peuvent recevoir de la toxine. Mais, en raison de la diffusion, le droit médial est le plus souvent injecté car il est anatomiquement le seul muscle parfaitement isolé. Une injection dans les muscles verticaux peut entraîner une paralysie dans les muscles obliques associés et une injection dans le droit latéral peut diffuser dans l’oblique inférieur. La faible épaisseur du droit latéral facilite également la diffusion de la toxine. Il en est de même chez les muscles des personnes âgées où les muscles sont devenus très peu épais.
Fig. 17-38 Injection de toxine sous microscope.
L’utilisation de la toxine relève d’un geste simple, ce qui constitue son avantage principal, mais ses effets chimiques constituent quelques inconvénients.
Une injection de toxine botulique est un geste simple : sous topique, elle demande quelques minutes pour un œil ; la nécessité d’une anesthésie générale ajoutera une dizaine de minutes à ce temps. Dans certaines pathologies que nous reverrons, elle peut éviter la chirurgie. La toxine peut être associée à la chirurgie, comme nous le verrons ultérieurement.
Ils sont dus aux effets chimiques de la toxine : la diffusion de la toxine peut provoquer un ptosis transitoire. Le résultat n’est pas immédiat dans certaines pathologies contrairement à la chirurgie (strabisme). La modification de la déviation initiale peut révéler des déviations jusque-là masquées (déviation verticale dissociée).
Dans les troubles oculomoteurs sans impotence, l’inversion de la déviation spectaculaire est difficilement supportée par un adulte ou un grand enfant pour des raisons esthétiques.
Chez l’enfant, la nécessité de l’anesthésie générale et l’utilisation hors AMM de la toxine peuvent freiner son utilisation.
Les indications de la toxine botulique sont nombreuses en oculomotricité, tant dans le traitement final qu’en phase d’attente de récupération du trouble oculomoteur.
Les strabismes concernés sont essentiellement des ésotropies.
Avant l’âge de quatre ans, 20 % d’ésotropies précoces qui étaient dans une zone chirurgicale passent spontanément en microtropies (ELISSS) [5], condamnant ainsi l’utilisation de la chirurgie qui entraînerait une exotropie consécutive ; de même, 5 % à 8 % d’ésotropies précoces chirurgicales passent spontanément en exodéviation vers sept à huit ans. Dans le premier groupe, la toxine permet d’atteindre la microtropie avant l’âge de quatre ans ; dans le second groupe, le diagnostic d’exotropie est fait beaucoup plus tôt devant la divergence post-toxine qui persiste six mois après l’injection.
L’injection de toxine n’est envisagée qu’après le port de la correction optique totale au moins pendant quatre à cinq mois associée à la prévention ou à la cure d’une amblyopie et, bien sûr, quand la déviation est visible. C’est la déviation qui souvent gêne le plus les parents. De ce fait, certains ne voient pas l’intérêt du traitement médical contraignant imposé à leur enfant. Les injections peuvent donc être réalisées dès l’âge de huit à neuf mois au plus tôt et jusqu’à l’âge scolaire, car les effets secondaires d’inversion angulaire sont peu compatibles avec l’école. L’injection est pratiquée lors des ésotropies dans les deux droits médiaux et lors des exotropies dans les deux droits latéraux. Le choix des deux muscles a pour but de les placer dans la même situation de paralysie périphérique, forçant ainsi par les effets de feedback les centres oculogyres à se réorganiser chez ces enfants au système oculomoteurs encore immature. Cette réorganisation explique que dans 50 % d’ésotropies une seule injection est nécessaire pour neutraliser la déviation et que deux injections suffisent à réduire 75 % d’ésotropies [6]. La paralysie d’adduction des deux droits médiaux dans les ésotropies injectées limite la convergence. En raison de la synergie accommodation-convergence, l’impossibilité de la convergence peut diminuer l’accommodation ; à son tour la convergence est réduite et ainsi de suite. Ceci explique, dans certaines ésotropies, l’évolution vers une micro-ésotropie. Inversement, dans certaines exotropies, l’injection des droits latéraux provoque une convergence.
L’injection provoque donc une inversion de la déviation primitive à la quarante-huitième heure en raison de la paralysie flasque du muscle injecté. L’effet majeur avec impotence entre le dixième et le quinzième jour diminue, laissant la place à un strabisme inverse pendant six à huit semaines. Cette inversion angulaire doit persister suffisamment longtemps pour que les centres oculogyres puissent se réorganiser. Un ptosis le plus souvent partiel peut survenir [4] ; il nécessite une prise en charge vigilante afin de ne pas créer ou accentuer une amblyopie strabique.
Après l’injection, on peut noter quatre situations différentes dont on informe les parents :
-
la toxine ne provoque aucun effet, ce qui évoque une forte hypoélongation des deux droits médiaux : la chirurgie risque d’être le seul recours ;
-
la toxine provoque une inversion angulaire discrète qui disparaît en trois à quatre semaines, une seconde injection peut être envisagée dans les trois mois post-injection. Après deux injections sans l’obtention d’une microtropie, il suffit d’attendre l’heure de la chirurgie ;
-
la toxine entraîne une inversion angulaire importante pendant trois à quatre mois qui évolue vers une microtropie. Si celle-ci se maintient, la chirurgie n’intéressera plus que les facteurs verticaux éventuellement associés au strabisme précoce. En règle générale, si la microtropie n’est que transitoire, la déviation initiale est réduite de façon notable. Une autre injection pourra être proposée si l’heure de la chirurgie est encore loin ;
-
dans les ésotropies précoces, dans 5 % à 8 % des cas la divergence post-toxine persiste, révélant une divergence statique masquée par une ésotropie dynamique résultant de phénomènes compensateurs intenses. En l’absence de toxine, ces ésotropies précoces font place à une micro-ésotropie vers cinq à six ans et une exotropie vers huit à dix ans. Ainsi, la divergence apparue plus tôt est traitée vers quatre à cinq ans et elle obère peu la scolarité de l’enfant.
Ainsi, nous expliquons aux parents le rôle diagnostique ou thérapeutique de la toxine botulique, la nécessité d’une anesthésie générale pour effectuer ce geste, l’enfant sortant quatre heures après son injection. La microtropie obtenue satisfait les parents. Il faut se méfier que ceux-ci ne se démotivent pas quant au traitement médical.
En raison des effets secondaires, l’injection de toxine botulique est peu compatible avec une vie professionnelle. Elle est donc réservée à des patients ne pouvant supporter ou refusant une anesthésie générale. Chez l’adulte, la toxine a parfois remplacé le test d’adaptation prismatique pour évaluer le risque de diplopie postopératoire, tout en sachant qu’aucun test n’est véritablement contributif. Contrairement au strabisme précoce, l’injection est souvent unilatérale dans l’œil dominé, en raison de l’ancienneté de la déviation qui a pu entraîner des anomalies d’élongation musculaire. Chez ces patients, il est parfois nécessaire d’injecter la toxine à plusieurs reprises, l’effet ne parvenant pas à durer dans le temps.
S’il ne s’agit pas de la décompensation tardive d’une microtropie, ce strabisme s’accompagne d’une vision binoculaire. S’il survient chez un adolescent ou un adulte jeune, une injection de toxine botulique peut neutraliser la déviation. [1]. L’injection est souvent unilatérale dans l’œil en permanence dévié.
L’injection dans un muscle déjà opéré donne souvent des réductions angulaires transitoires en raison des modifications conjonctivomusculaires et ténoniennes. Le choix de l’œil à injecter est guidé par l’existence ou non d’impotence musculaire. Le résultat est souvent transitoire, nécessitant des réinjections.
L’injection de l’antagoniste du muscle paralysé permet de diminuer la déviation en position primaire, réduisant la diplopie et permettant de minimiser le torticolis dû à l’impotence paralytique et au spasme de l’antagoniste.
Dans 80 % des cas, ces paralysies oculomotrices se résolvent spontanément en douze mois mais, en attendant leur disparition éventuelle, une injection de toxine peut permettre : un traitement orthoptique plus simple, comme remplacer une occlusion alternée par un port de prismes de faible valeur, l’agrandissement de la zone non diplopique, la réduction du torticolis antidiplopique. L’injection de toxine botulique peut être faite dès l’absence de résolution de la paralysie au deuxième mois et être répétée si nécessaire tous les trois à quatre mois jusqu’à l’heure de la chirurgie si la paralysie persiste. Parfois, l’impotence paralytique a disparu mais le spasme de l’antagoniste, provoquant une déviation résiduelle, perdure chez des patients n’ayant pas reçu régulièrement de la toxine : une injection de toxine dans cet antagoniste suffit le plus souvent à lever le spasme, évitant ainsi la chirurgie.
Les paralysies oculomotrices les plus concernées sont celles du VI [3] car le droit médial est isolé anatomiquement, ce qui réduit les effets inappropriés par diffusion aux muscles voisins. Dans les paralysies du IV, l’injection de l’oblique inférieur peut voir ses effets bénéfiques minimisés par la diffusion au droit latéral et au droit inférieur, provoquant respectivement une convergence et une élévation que l’on cherchait à combattre : seule l’extorsion est réduite. Dans les paralysies du III horizontales, on peut provoquer des déviations verticales lors de l’injection du droit latéral et une intorsion par diffusion dans l’oblique inférieur. Dans les paralysies du III verticales, l’injection dans les droits verticaux provoque des troubles torsionnels en raison du voisinage des muscles obliques. Néanmoins, le patient peut être soulagé de la diplopie engendrée par la paralysie oculomotrice et il est licite de lui proposer ce traitement en le prévenant des effets secondaires de l’injection.
L’injection de toxine permet de réduire la déviation en attendant que l’état du patient autorise une éventuelle chirurgie oculomotrice.
Les troubles oculomoteurs de la dysthyroïdie pendant la phase aiguë sont dus à l’œdème musculaire et à l’infiltration graisseuse orbitaire ; or, la chirurgie oculomotrice n’intervient que lors de l’obtention de l’euthyroïdie, soit parfois dix-huit mois à deux ans plus tard. Pour minimiser l’inconfort des patients, l’injection de toxine dans le muscle responsable de l’impotence la plus grande, le droit inférieur le plus souvent, permet par son action paralysante de réduire de façon significative la déviation [2]. En effet, la déviation est très incomitante et importante donc non prismable de façon satisfaisante. Une myasthénie, pouvant être associée à la dysthyroïdie, constituera une contre-indication à l’injection de toxine et devra donc être éliminée.
La toxine botulique peut être utilisée conjointement avec la chirurgie oculomotrice afin que, lors de déviation ancienne responsable d’une rétraction importante du muscle non mobilisé, celle-ci n’entrave pas la cicatrisation chirurgicale : par exemple, lorsqu’un droit médial a été en adduction permanente depuis plusieurs années, les fibres musculaires ont mémorisé cette position et le recul du droit médial doit être très important pour neutraliser cet état, devenant à son tour délétère par l’effet paralytique permanent qu’il va provoquer. La toxine (10 UI à 20 UI), en paralysant transitoirement le droit médial, permet avec un recul moins important que le muscle ne reprenne pas la position préopératoire pendant les premières semaines, ce qui facilite la cicatrisation en bonne position. L’association chirurgie oculomotrice et toxine peut remplacer les sutures à la peau utilisées dans des déviations anciennes et plaçant le globe opéré pendant deux à trois jours dans la position inverse de celle présente durant de nombreuses années. La toxine permettra d’obtenir cette inversion plus longtemps et de façon moins agressive. Tout strabisme ancien ou paralysie oculomotrice ancienne peut bénéficier de cette technique.
Il a été proposé lors des nystagmus acquis générant des oscillopsies des injections de toxine botulique dans les muscles oculomoteurs concernés, afin de ralentir leur activité et donc de diminuer les oscillopsies, et ce pour éviter les grands reculs des muscles droits. Les patients reçoivent en moyenne trois injections dans l’année [4].
Législation
Tout ophtalmologiste peut pratiquer des injections de toxine botulique, sa formation se faisant par compagnonnage. L’injection de toxine botulique dans un muscle oculomoteur est, de façon surprenante, la seule utilisation de ce produit qui soit gratuite. La toxine botulique étant un médicament de réserve hospitalière, il implique une hospitalisation de jour administrative.
En France, l’utilisation de la toxine botulique dans les muscles oculomoteurs est réservée aux patients âgés de plus de douze ans : son utilisation chez les jeunes patients atteints de strabisme précoce est donc hors AMM ; mais elle est parfaitement justifiée devant les publications internationales parues depuis plus de trente ans.
Chaque patient reçoit la feuille d’information éditée par la Société Française d’Ophtalmologie sur le thème de la toxine botulique (n° 021b).
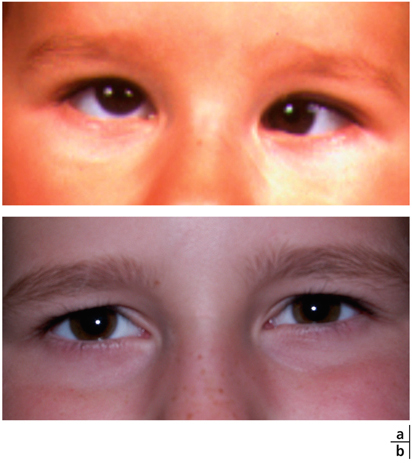
Fig. 17-39 Évolution à long terme.
a. Ésotropie précoce (DVD OD), injection de toxine botulique dans les deux droits médiaux. b. Après 6 ans de surveillance, la réduction angulaire est maintenue (ésotropie et DVD).
La toxine botulique a transformé la prise en charge des troubles oculomoteurs, soit en évitant la chirurgie soit en permettant son attente avec beaucoup plus de confort. Il faut regretter que son utilisation dans le strabisme précoce, où elle joue un rôle majeur, le soit hors AMM (fig. 17-39).
[1] Dawson EL, Maarsham WE, Adams GG. The role of botulinum toxin A in acute-onset esotropia. Ophthalmology, 1999 ; 106 : 1727-1730.
[2] Dunn WJ, Arnold AC, O’Connor PS. Botulinum toxin for the treatment of dysthyroid ocular myopathy. Ophthalmology, 1986 ; 93 : 470-475.
[3] Holmes JM, Beck RW, Kip KE, Droste PJ, Leske DA. Botulinum toxin treatment versus conservative management in acute traumatic sixth nerve palsy or paresis. J AAPOS, 2000 ; 4 : 145-149.
[4] Lavenant F. Toxine botulique. In : Espinasse-Berrod M-A. Strabologie. Approches diagnostique et thérapeutique. Paris, Elsevier, 2004 : 333-337.
[5] Simonsz HJ, Kolling GH, Unnebrink K. Final report of the early vs. late infantile strabismus surgery study (ELISSS), a controlled, prospective, multicenter study. Strabismus, 2005 ; 13 : 169-199.
[6] Thouvenin D, Lesage-Beaudon C, Arné J-L. Injection de toxine botulinique dans les strabismes précoces. Efficacité et incidences sur les indications chirurgicales ultérieures à propos de 74 cas. J Fr Ophtalmol, 2008 ; 31 : 42-50.
F. Oger-Lavenant, D. Thouvenin
La chirurgie du strabisme ne bénéficie pas autant que les autres domaines de l’ophtalmologie des fortes avancées technologiques des trente dernières années. Toutefois, des éléments importants ont permis une optimisation de ce qui était connu et certaines techniques se sont développées et font partie maintenant de l’arsenal chirurgical courant :
-
amélioration de la qualité des gestes chirurgicaux, grâce à :
-
l’utilisation du microscope opératoire qui permet le respect des tissus de soutien, des muscles, une précision et une sécurité accrue du geste et une optimisation des techniques « classiques » ;
-
un choix plus rationnel des sutures et aiguilles utilisées ;
-
-
techniques mieux maîtrisées :
-
la Fadenoperation, ou fixation postérieure, s’est considérablement développée ; elle est à la base de la chirurgie « innervationnelle » ;
-
l’utilisation de la chirurgie réglable permet d’oser des protocoles opératoires plus agressifs et directs, évitant souvent un temps opératoire supplémentaire dans les strabismes complexes ;
-
la toxine botulique (cf. supra) fait partie de l’arsenal thérapeutique et a des indications assez bien codifiées [31] ; d’autres traitements par substance active sont à l’étude, notamment la bupivacaïne [29] ;
-
-
imagerie orbitaire, notamment l’IRM, qui a largement contribué à l’évolution de nos connaissances de la physiologie oculomotrice et de la physiopathologie de certains syndromes ; elle peut même apporter des renseignements important pour guider le geste chirurgical dans des cas particuliers (cf. chapitre 15).
Au-delà de l’aspect purement technique, c’est la stratégie chirurgicale qui évolue le plus.
L’analyse purement musculaire de la déviation a évolué : d’une vision « géométrique » de la déviation strabique, on est passé à une analyse tenant compte d’une meilleure compréhension de l’anatomie et de la physiologie musculaire, notamment par le biais de l’analyse de la courbe longueur/tension des muscles oculomoteurs [13] et, plus récemment, tenant compte de l’existence des poulies musculaires [6, 15]. Les outils informatiques permettant de simuler l’oculomotricité et les effets chirurgicaux sont en cours de développement.
Depuis quelques années, notamment en France, la chirurgie tient compte de la physiopathologie du strabisme et donc non seulement du facteur musculaire mais aussi de l’aspect neurologique par l’analyse de la dystonie responsable du strabisme. A. Spielmann [33] insistait déjà beaucoup sur l’identification clinique de cette dystonie dans une déviation. Elle en tirait des conséquences sur ses protocoles chirurgicaux. M.-A. Quéré attachait une importance fondamentale à l’analyse de la modification d’un strabisme sous anesthésie et modifiait ses protocoles opératoires en fonction de ces constatations [21, 19]. L’analyse du devenir des strabismes sous anesthésie a progressé [18], ainsi que celle de la part musculaire ou anatomique [27]. L’évolution se fait donc vers la réalisation de protocoles opératoires tenant compte non seulement du bilan préopératoire mais aussi du devenir du strabisme sous anesthésie (différenciation de la part « tonique » de la part « anatomique »), du degré de rétraction musculaire (test d’élongation musculaire), de l’état des tissus non musculaires (conjonctive, capsule de Tenon, poulies, orbite, globes oculaires). Le but est d’obtenir des résultats au moins aussi bons que par des protocoles classiques, mais avec une meilleure stabilité dans le temps.
Cette évolution améliore probablement le résultat chirurgical final et sa stabilité, mais complique en même temps la chirurgie strabologique. L’apprentissage en devient plus long et ne se résume plus au simple apprentissage des techniques chirurgicales qu’on applique à un protocole préétabli mais à un réel compagnonnage pour en apprendre tous les tenants et aboutissants.
La chirurgie oculomotrice bénéficie maintenant :
-
de la microchirurgie ;
-
de l’imagerie orbitaire ;
-
de techniques récentes constamment améliorées, telles que les fixations postérieures, les sutures ajustables et l’utilisation de la toxine botulique.
La stratégie chirurgicale tient compte autant des facteurs innervationnels que mécaniques, afin d’améliorer les résultats immédiats mais aussi à long terme.
F. Oger-Lavenant
Le moyen indispensable est le microscope opératoire dont nous verrons qu’il ne présente que des avantages. Nous avons besoin d’une équipe de médecins anesthésistes qui a compris qu’elle participe au succès chirurgical en raison des contraintes que nous lui demandons. Ensuite, nous envisagerons le champ opératoire, le matériel microchirurgical et les fils qui permettent d’assurer une chirurgie rapide et soigneuse. Enfin, nous terminerons par trois tests peropératoires qui contribuent au succès chirurgical. Nous ne verrons pas ici la toxine botulique, traitée dans la section précédente.
Le microscope opératoire (fig. 17-40) permet au chirurgien de travailler avec un excellent éclairage, de contrôler le passage des aiguilles même à 18 mm ou 20 mm du limbe et de limiter ainsi les risques de perforation du globe et ce d’autant plus que l’aide opératoire visualise le champ opératoire dans les mêmes conditions grâce aux oculaires latéraux. Le microscope étant relié à une caméra et à un écran, l’équipe qui accompagne le chirurgien (anesthésistes et panseuses) suit en permanence le déroulement de l’intervention et peut le cas échéant faire face à tout imprévu. Deux niveaux à bulle permettent de contrôler l’horizontalité du microscope.
Fig. 17-40 Microscope opératoire.
Lors de la chirurgie effectuée sur les muscles droits horizontaux et l’oblique inférieur, inséré sous le droit latéral, le chirurgien se place latéralement par rapport à la tête du patient, l’aide opératoire étant lui à la tête du patient (fig. 17-41). Le chirurgien sera à droite du patient pour opérer les muscles horizontaux de l’œil droit et inversement pour les muscles horizontaux de l’œil gauche.
Lors de la chirurgie effectuée sur les muscles verticaux et l’oblique supérieur, inséré sous le droit supérieur, le chirurgien se place à la tête du patient et l’aide opératoire latéralement du côté de l’œil opéré.
Fig. 17-41 Position du chirurgien et de l’aide.
Le protocole anesthésique est capital car il joue un rôle dans le choix de l’œil à opérer dans les strabismes et intervient dans l’appréciation de l’élongation musculaire dans toute la chirurgie oculomotrice. Il doit donc être reproductible et assurer une anesthésie suffisamment profonde pour éviter une bradycardie lors de la traction musculaire. L’utilisation de curares à élimination rapide permet d’apprécier correctement l’élongation musculaire et impose une intubation trachéale ou un masque laryngé.
La prémédication comporte le midazolam (Hypnovel®) en sublingual à la dose de 0,1 mg/kg et l’atropine en sublingual à la dose de 10 µg/kg. Les enfants reçoivent sur le dos des mains de la lidocaïne en crème (Emla®).
L’induction comprend un analgésique, l’alfentanil chlorhydrate (Rapifen®), à la dose de 10 µg/kg, un barbiturique, le propofol (Diprivan®) à la dose de 5 mg/kg, et un curare, l’atracurium bésilate (Tracrium®) à la dose de 0,75 mg/kg.
L’entretien de l’anesthésie est assuré par le propofol à la seringue électrique ou le sévoflurane. Une réinjection de Rapifen® (10 µg/kg) est effectuée avant chaque geste sur un muscle oculomoteur.
Au cours de cette phase, la prévention des nausées et vomissements postopératoires est assurée par l’injection de dexaméthasone à la dose de 0,1 mg/kg et de dropéridol (Droleptan®) à la dose de 0,05 mg/kg. La prévention de la douleur postopératoire est réalisée par l’injection de paracétamol (Perfalgan®) à la dose de 15 mg/kg et de kétoprofène (Profénid®) à la dose de 1 mg/kg.
En cas de douleurs non calmées par les collyres anti-inflammatoires, une réinjection de paracétamol quatre heures après celle faite en peropératoire est possible ; si elle s’avère insuffisante, une injection de nalbuphine (Nubain®) à la dose de 0,2 mg/kg peut être prescrite.
Devant la persistance de nausées ou de vomissements, il est parfois utile d’injecter de l’ondansétron (Zophren®) à la dose de 0,1 mg/kg.
Le patient reçoit successivement au niveau de la face une détersion à la Bétadine® Scrub 4 % et une décontamination à la Bétadine® ophtalmique pour irrigation oculaire à 5 %. Des champs stériles collants recouvrent toute la tête hormis la région orbitopalpébrale (fig. 17-42).
Fig. 17-42 Champ opératoire.
Les instruments sont disposés sur une table recouverte d’un champ stérile (fig. 17-43). La plupart sont stérilisés dans une boîte (fig. 17-44) et certains, tels que le bistouri électrique et les cupules recevant le Ringer et la Bétadine®, sont stérilisés individuellement.
Fig. 17-43 Instruments nécessaires à une chirurgie du strabisme.

Fig. 17-44 Boîte de chirurgie du strabisme.
Les fils résorbables de suture utilisés pour les muscles oculomoteurs sont du Vicryl® 6/0 avec des aiguilles spatulées de courbure 3/8. Les fils de suture utilisés pour la conjonctive sont du Vicryl® 7/0 ou 8/0 selon les chirurgiens. La réalisation de l’ancrage marginal de De Decker se fait au moyen de fil non résorbable l’Ethylon® 5/0 ; les aiguilles sont également spatulées (fig. 17-45).
Fig. 17-45 Aiguilles et fils pour une chirurgie du strabisme.
Trois tests, un préopératoire et deux peropératoires, sont indispensables pour une chirurgie moderne raisonnée [16, 17] : l’appréciation de la position des yeux sous anesthésie générale, dénommée « signe de l’anesthésie », la mesure de l’élongation musculaire et, pour certaines pathologies, le test de duction.
Ces tests sont d’autant plus contributifs qu’ils sont utilisés chez des patients multi-opérés [1].
L’effet de l’anesthésie générale sur l’angle strabique a été remarqué peu après l’utilisation de celle-ci [7]. Mais les connaissances neurophysiologiques de l’époque ne permettaient pas d’en tirer les conséquences qui semblent évidentes de nos jours. Il est indissociable d’une équipe anesthésique qui travaille étroitement avec les ophtalmologistes et qui a compris l’importance d’une anesthésie générale profonde et stable. Avant d’apprécier la position des yeux sous anesthésie générale, celle-ci doit être stable et profonde depuis dix minutes ; un myosis bilatéral en est le témoin.
Dans les troubles oculomoteurs, la position des yeux sous anesthésie générale (fig. 17-46) permet de définir si un œil reste plus dévié que l’autre, si la déviation est plus marquée ou moins importante qu’à l’état de veille. On peut comparer la position des yeux à l’état de veille avec celle sous anesthésie générale et en déduire, dans les strabismes, l’œil qui présente la pathologie la plus importante — ce n’est pas obligatoirement l’œil qui semble directeur à l’état de veille. Grâce à un logiciel, on peut obtenir des valeurs très précises. À l’inverse, on peut découvrir une absence de déviation ou une déviation symétrique sous anesthésie générale, alors qu’à l’état de veille il semblait s’agir d’un strabisme important avec une forte dominance monoculaire. Toutes ces variations vont guider le chirurgien dans la conduite à tenir vis-à-vis du strabisme opéré. Pour cette raison, le patient (ou ses parents) est toujours avisé de ce test afin de ne pas être surpris du choix de l’œil opéré.
Lors de l’anesthésie générale, l’accommodation est mise hors circuit. Un relâchement musculaire net grâce aux curares est obtenu. On peut penser qu’on s’approche ainsi de l’état musculaire qui existerait à la presbytie, c’est-à-dire que, chez un jeune patient, la position des yeux sous anesthésie générale observée correspond au strabisme qu’il aurait à l’âge adulte en l’absence d’intervention. Cela signifie que pour un strabisme de 40 ? à l’état de veille réduit de moitié sous anesthésie générale, la chirurgie doit être prudente. Celle-ci, en fonction de l’élongation musculaire, sera peut-être minime. Le paramètre qu’on quantifie difficilement est le rôle des fascias musculaires et de la capsule de Tenon qui, physiologiquement, involuent au fil des années.
Fig. 17-46 Position à l’état de veille et sous anesthésie générale profonde.
Comme son nom l’indique, ce test apprécie l’élongation d’un muscle libéré de ses ailerons ténoniens. Le test d’élongation musculaire nécessite pour être précis un myomètre et une réglette millimétrée (myomètre de Rapp-Roth et réglette de Péchereau). Il est réalisé avec ces instruments pour les muscles droits.
Le test s’effectue en plaçant le muscle sur le crochet du myomètre alors que le globe est positionné en position centrale grâce au reflet des lampes du microscope ; dans cette position, le point zéro de la réglette est placé devant le reflet lumineux centré (fig. 17-47a). L’aide peut alors déplacer le globe dans le sens d’élongation du muscle en respectant son plan d’action. La mesure s’effectue lorsque, sans forcer, la butée du myomètre est atteinte : il suffit alors de noter au niveau de quelle division de la réglette se trouve le crochet du myomètre.
L’élongation considérée comme normale pour les muscles droits est de + 1 à + 2 mm (fig. 17-47b). Les valeurs inférieures témoignent d’une hypoélongation (fig. 17-48) et les valeurs supérieures d’une hyperélongation (fig. 17-49).
L’élongation de l’oblique supérieur nécessite une désinsertion du tendon. Ce dernier est étalé et doit affleurer le canthus externe (fig. 17-50). L’élongation de l’oblique inférieur est une appréciation visuelle et tactile.
Le test d’élongation musculaire permet ainsi de doser la chirurgie de façon précise, évitant de trop raccourcir un muscle déjà hypoélongable et de reculer trop intensément un muscle hyperélongable. Il permet également de poser l’indication d’un ancrage marginal de De Decker devant la normalité ou la très faible hypoélongation d’un muscle droit médial.
Fig. 17-47 Test d’élongation musculaire.
a. Position zéro de la réglette pour mesurer l’élongation des droits horizontaux. b. Élongation normale.
Fig. 17-48 Test d’élongation musculaire.
a. Hypoélongation d’un droit médial à – 4 mm. b. Hypoélongation d’un droit médial à – 8 mm.
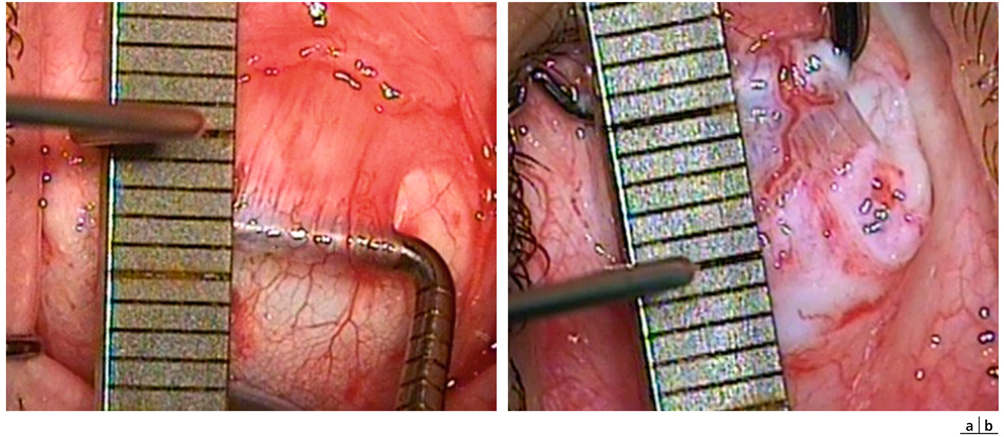
Fig. 17-49 Test d’élongation musculaire.
a. Hyperélongation d’un droit médial à + 3 mm. b. Hyperélongation d’un droit médial à + 6 mm.
Fig. 17-50 Test d’élongation : élongation de l’oblique supérieur.
Le test de duction s’effectue avant toute incision conjonctivale. Il apprécie en bloc la liberté du muscle et de son système capsuloténonien et éventuellement inclut l’effet de brides conjonctivoténoniennes. Il est donc le plus souvent utilisé quand, cliniquement, une impotence musculaire est notée : fracture d’orbite, paralysie oculomotrice, syndrome de rétraction ou fibrose oculomotrice. Il sera suivi du test d’élongation musculaire qui permettra un protocole opératoire adapté de façon précise.
La chirurgie oculomotrice moderne est effectuée sous microscope opératoire afin d’avoir les gestes les plus précis possible. Les protocoles opératoires tiennent compte de la position des yeux sous anesthésie générale chez l’adulte et l’enfant dans la chirurgie des strabismes. Le test d’élongation musculaire permet dans toutes les chirurgies oculomotrices d’affiner le protocole opératoire, minimisant le risque de sur- ou sous-corrections chirurgicales.
La chirurgie ne guérit que rarement un strabisme : elle est proposée dans un but précis à chaque fois, mais variable selon chaque cas ; elle intervient comme étape du traitement et non comme finalité et fait donc partie de l’ensemble de la stratégie thérapeutique du strabisme.
La chirurgie du strabisme est une chirurgie réparatrice, visant à rétablir autant que possible la normalité oculomotrice [41]. C’est aussi une chirurgie fonctionnelle, visant à améliorer l’état visuel binoculaire et parfois monoculaire des patients. Ce n’est en tout cas pas une chirurgie esthétique, qui vise à modifier un état « normal », ce qui n’est pas le cas d’un strabisme.
Le but que se fixe le chirurgien avant d’opérer un strabisme n’est pas toujours celui attendu par le patient ou la famille. Les deux parties doivent en tout cas bien s’accorder sur la finalité de l’intervention. Le chirurgien doit écouter le patient ou les parents et, réciproquement, le chirurgien doit bien se faire comprendre. Le patient ou ses parents ont souvent une demande précise (torticolis, diplopie, asthénopie, esthétique…), qui n’est pas toujours ni spontanément exprimée, ni celle qui paraît évidente au chirurgien. D’un autre côté, le chirurgien a des limites et des objectifs que le patient ne comprend pas obligatoirement. Un vrai dialogue doit donc précéder l’intervention.
Enfin, le but de l’intervention varie considérablement selon le type de strabisme dont on s’occupe. Il est fondamental de bien identifier le strabisme pour donner des explications claires au patient.
Nous analyserons donc les objectifs chirurgicaux en fonction du type de strabisme rencontré.
Il s’agit de dérèglements du système des vergences, de la coordination oculomotrice et non d’une atteinte des nerfs effecteurs ou des muscles oculomoteurs. La précocité d’installation et la durée du strabisme sont les deux facteurs majeurs qui influent sur la qualité du lien binoculaire résiduel et donc la profondeur du trouble sensoriel et moteur.
Ce sont des strabismes liés à l’absence de développement de la fusion dans les premiers mois de vie. L’absence définitive de tout lien sensoriel binoculaire normal ne laisse espérer de la chirurgie qu’une amélioration motrice.
L’objectif de la chirurgie est donc :
-
d’obtenir un quasi-parallélisme des axes visuels avec un angle de strabisme résiduel en dessous de 8 ? horizontales et 4 ? verticales : ce petit angle permet d’obtenir la meilleure coopération binoculaire possible sous forme d’une « union binoculaire » [20]. Il est équivalent à celui d’un microstrabisme congénital primitif et on le dénomme « ortho-microtropie ». Cet état sensoriel, avec pseudo-fusion et vision stéréoscopique médiocre, est le meilleur qu’on puisse espérer du traitement chirurgical d’un strabisme précoce, aussi précoce que soit l’acte ;
-
de normaliser au mieux l’oculomotricité : en effet, dans un strabisme précoce, on peut être amené à traiter des anomalies motrices spécifiques du syndrome, telles que l’attraction vers l’adduction, le nystagmus manifeste latent, la DVD, ou d’autres non spécifiques telles que les syndromes alphabétiques et les troubles cycloverticaux ;
-
d’obtenir un résultat stable dans le temps ; ceci est une approche récente : l’assimilation d’un strabisme à un trouble de la fonction musculaire qu’on évalue par un angle de déviation ne permet que de traiter le strabisme existant à un moment donné ; or, il est bien connu que les strabismes évoluent avec le temps. On traitera de façon différente :
-
la déviation anatomisée : angle persistant sous anesthésie générale, avec anomalie de l’élasticité musculaire, souvent définitive et stable ;
-
la déviation tonique, ou innervationnelle : disparaissant sous anesthésie générale et, surtout, qui risque de se modifier dans le temps.
-
Ce sont des strabismes apparaissant « tardivement » (après dix-huit mois), alors que le développement visuel initial s’est déroulé sans anomalies. Il existe en arrière-plan une anomalie des vergences (phorie) rendue jusque-là latente par la fusion. Si cette phorie est trop importante, elle déborde les possibilités fusionnelles, soit de manière intermittente (phorie-tropie) soit permanente (tropie normosensorielle).
Le but de la chirurgie est de normaliser au mieux l’anomalie sous-jacente, de manière à ce que la fusion motrice puisse de nouveau verrouiller les axes visuels.
Dans ces strabismes, une véritable guérison sensorielle et motrice doit être le but du traitement médico-chirurgical. Une rééducation binoculaire est parfois utile avant et/ou après chirurgie pour renforcer l’amplitude de fusion.
Chez l’enfant, le strabisme induit une adaptation sensorielle progressive, notamment grâce à la neutralisation. Il ne faut donc pas laisser trop longtemps en état de strabisme : l’intervention sera proposée dès qu’on aura obtenu une stabilité (réfraction, amblyopie) ou une impasse sensorimotrice (récidive malgré la rééducation et/ou la prismation).
Entre un vrai strabisme précoce, donc sans aucun développement de la vision binoculaire, et un strabisme apparu après dix-huit mois, alors que les liens binoculaires sont déjà assez solides, de nombreuses formes intermédiaires existent. Le trouble moteur et sensoriel est d’autant plus complexe et irréversible que le strabisme est apparu précocement et que le trouble dure longtemps, sans frontière formelle entre les deux grands types de strabisme, précoce ou normosensoriel.
Il est donc des cas où un doute existe sur le potentiel de récupération de la vision binoculaire. Dans ces conditions, après un éventuel test prismatique, il vaut mieux envisager l’intervention sans tarder pour réduire au maximum le temps passé en strabisme et la profondeur du trouble sensoriel. Parfois, contre toute attente, la vision binoculaire se réinstallera spontanément. Dans le cas contraire, l’intervention aura remis en état de microstrabisme avec union binoculaire. Dans tous les cas, tant que la preuve de la correspondance rétinienne normale n’est pas faite, il faut impérativement éviter toute rééducation binoculaire déneutralisante.
Buts de la chirurgie des strabismes
-
Strabismes précoces, en correspondance rétinienne anormale : ortho-microtropie (inférieure à 8 ? horizontales et inférieure à 4 ? verticales) et traitement des anomalies de la motilité.
-
Strabismes normosensoriels : guérison sensorielle et traitement des anomalies de la motilité. Une intervention est envisagée pour éviter une dégradation de la vision binoculaire dès que la stabilité est obtenue ou que le traitement médical est dans une impasse. Il y a possibilité, dans certains cas, de traitement orthoptique binoculaire complémentaire.
-
Formes intermédiaires : raisonner comme pour les strabismes normosensoriels, sauf pour la rééducation binoculaire qui est formellement contre-indiquée tant qu’on n’a pas fait la preuve de la présence d’une correspondance rétinienne normale.
La chirurgie peut s’appuyer le plus souvent sur des vergences et une vision binoculaire normales. Notamment, la fusion va aider à verrouiller au mieux le parallélisme des axes visuels. Ce n’est bien sûr pas le cas si un strabisme précoce se surajoute à ce strabisme périphérique (5 % à 10 % des cas).
Il est le plus souvent impossible de rendre une fonction normale à un muscle paralysé ou anormal (fibreux…).
Le but de la chirurgie est donc ici de procurer le meilleur confort visuel possible, en fonction de la situation et de la motivation de l’intervention :
-
améliorer au mieux la motilité oculaire ;
-
traiter un torticolis de fixation pour en éviter les conséquences orthopédiques ;
-
élargir le plus possible le champ de vision simple en privilégiant les directions visuelles les plus utilisées : droit devant et regard en bas ;
-
en cas d’anomalie préexistante de la vision binoculaire (strabisme précoce associé à un trouble oculomoteur périphérique), la diplopie est souvent moins présente car une neutralisation ancienne est présente. Les buts ci-dessus restent valables, notamment les deux premiers. Chaque cas est particulier ; il faudra traiter avant tout ce dont le patient se plaint depuis l’apparition du trouble oculomoteur !
Ici encore, la chirurgie ne peut guérir un nystagmus. Elle permet :
-
d’aider le patient à utiliser une position de moindre battement du nystagmus, afin d’améliorer sa vision ;
-
d’éviter les conséquences orthopédiques d’un torticolis de fixation ;
-
dans quelques cas, d’essayer de réduire l’intensité du nystagmus.
D. Thouvenin
Chaque technique chirurgicale a un mode d’action spécifique qu’il faut connaître, afin d’utiliser la plus adaptée à chaque cas. La chirurgie modifie ou utilise la physiologie oculomotrice pour le bénéfice du strabisme.
Il existe une relation entre tension, force active et longueur du muscle (fig. 17-51) :
-
la force active du muscle, liée à sa contraction, est maximale quand le muscle est positionné en extension moyenne. Pour un muscle oculomoteur, cela correspond à l’extension obtenue physiologiquement en position primaire et un peu au-delà. Si la longueur diminue (lors d’un recul musculaire) ou au contraire si le muscle est plus étiré (lors d’une résection musculaire), sa force de contraction diminue progressivement. La force active est appréciée par le test clinique de duction active, en fait rarement réalisé ;
-
la force passive du muscle est représentée par sa résistance à l’étirement, sa tension. Plus le muscle est étiré, plus sa tension augmente et plus l’élasticité diminue. Elle est bien appréciée, sous anesthésie, par le test d’élongation musculaire. Elle diminue lors d’un recul musculaire et augmente lors d’une résection.
Fig. 17-51 Relation entre longueur et force d’un muscle strié.
Lo est la longueur du muscle en élongation moyenne, soit en position primaire pour les muscles oculomoteurs. FA, force active ; FP, force passive ; FT, force totale.
(D’après Kayser, 1969 [11].)
Les muscles oculomoteurs ont cette particularité de s’enrouler autour du globe :
-
à partir de leur point de contact avec le globe, point où s’exerce leur force (insertion physiologique) ;
-
jusqu’à leur insertion sclérale (insertion anatomique).
Tant que le muscle est tangent au globe oculaire, la totalité de sa force est rotatoire et l’efficacité du muscle pour l’oculomotricité est maximale. Tant que l’arc de contact se déroule, cette force est constante. Quand l’insertion anatomique dépasse l’insertion physiologique, la force musculaire n’est plus uniquement rotatoire mais a une part rétractrice (perpendiculaire à la surface du globe) dont la proportion augmente progressivement. Le muscle perd ainsi progressivement son efficacité concernant la rotation du globe (fig. 17-52).
Fig. 17-52 Arc de contact d’un muscle droit.
I. Anat, insertion anatomique du muscle ; I. Phy, insertion physiologique (point de tangence avec le globe) ; AC, arc de contact ; Fm, force musculaire ; Ft, force tangentielle (seule efficace pour la rotation du globe) ; Fr, force de rétraction (inefficace en oculomotricité).
a. En position primaire, la totalité de la force musculaire s’exerce tangentiellement au globe. Cette situation dure tant que la rotation du globe déroule l’arc de contact. L’insertion anatomique est plus antérieure que l’insertion physiologique du muscle. b. Une fois que l’insertion anatomique dépasse l’insertion physiologique, l’arc de contact est épuisé, le muscle n’est plus tangent et sa force ne s’exerce plus uniquement pour la rotation du globe.
Ce plan est défini par trois points :
-
l’insertion anatomique du muscle ;
-
l’insertion orbitaire du muscle ;
-
le centre de rotation du globe.
La contraction d’un muscle oculomoteur provoque une rotation du globe dans ce plan. Une intervention simple ne doit pas le modifier : elle déplace l’insertion sur la ligne d’action (ligne entre insertion sclérale et orbitaire). Si la réinsertion du muscle se fait en dehors de ce plan, toute sa physiologie s’en trouve modifiée.
Exemple — Le droit médial est uniquement adducteur, puisque son plan d’action est horizontal. Si on déplace son insertion sclérale vers le haut, on modifie son plan d’action et le droit médial devient non seulement adducteur mais aussi élévateur et incyclotorseur…
La modification des forces actives et passives d’un muscle lors de la chirurgie provoque un réajustement de son innervation. Cette adaptation innervationnelle se reporte :
-
sur l’antagoniste homolatéral par la loi d’innervation réciproque de Sherrington (1893) (« Lorsque l’agoniste se contracte, son antagoniste homolatéral se relâche, et réciproquement ») ;
-
sur le synergiste controlatéral par la loi de la correspondance motrice de Hering (1860) (« Les couples musculaires synergiques se contractent de façon équivalente »).
Exemple — Considérons que l’œil opéré reprend la fixation après intervention, ce qui correspond à une intervention sur l’œil fixateur dans un strabisme en correspondance rétinienne anormale ou en cas d’intervention unilatérale dans un strabisme normosensoriel ou paralytique. Après affaiblissement d’un muscle, il faut un excédent d’innervation sur ce même muscle afin de pouvoir permettre le recentrement de cet œil et la fixation. Ceci induit, par la loi de Hering, un renforcement innervationnel du synergiste controlatéral et, par la loi de Sherrington, une inhibition innervationnelle de l’antagoniste homolatéral. Tout cela permet le redressement de l’œil non fixateur.
Tenon a décrit le tissu qui entoure le globe oculaire en 1806. Cet appareil suspenseur du globe a été dénommé capsule de Tenon. Son étude a été remise au goût du jour récemment grâce à sa description précise, anatomique et histologique et en IRM, notamment par J. Demer [5]. Le rôle de cette capsule et de ses relations avec les muscles dans l’oculomotricité est connu depuis longtemps [9, 24]. La capsule de Tenon maintient la stabilité antéropostérieure du globe et sa stabilité dans le mouvement, réalisant une véritable articulation. Les muscles droits sont non seulement stabilisés dans l’orbite par cette capsule, mais ils la traversent par un orifice, ou foramen. Ces orifices forment des anneaux fibreux et peuvent être considérés comme des poulies de réflexion pour les muscles. Leur rôle dans la physiologie oculomotrice est encore incomplètement connu mais sans doute important [25]. Il semble, en résumé :
-
que les poulies jouent un rôle fondamental pour stabiliser le trajet musculaire quelle que soit la position du globe, notamment dans les positions secondaires et tertiaires. Grâce à elles, la partie postérieure du muscle (en arrière de la poulie) garde un trajet stable quelle que soit la position du globe. Puis, le muscle se réfléchit sur la poulie pour se diriger vers son insertion sclérale. Ce trajet antérieur du muscle varie selon la direction de fixation du globe. Il semble en fait que le plan d’action physiologique du muscle doive inclure l’insertion sclérale, le point de réflexion sur la poulie (et non l’insertion orbitaire postérieure) et le centre de rotation du globe. Le principe est finalement le même que pour l’oblique supérieur, à la différence que la poulie de l’oblique supérieur est fixée au périoste orbitaire. Ceci ne change pas grand-chose à la physiologie oculomotrice classique en cas de position « normale » des poulies, mais pourrait expliquer certains syndromes oculomoteurs complexes, notamment certains syndromes alphabétiques, par une anomalie de position de la poulie d’un ou plusieurs muscles droits ;
-
qu’elles aident à stabiliser les saccades par un effet mécanique de frein, puisqu’elles sont suspendues vers l’avant au périoste orbitaire antérieur par une expansion fibromusculaire (« check ligament », ou ligament d’arrêt) (fig. 17-53) ;
-
qu’il existe des pathologies spécifiques des poulies, par malpositions ou malformations :
-
congénitales, expliquant certains syndromes oculomoteurs atypiques, comme certains syndromes alphabétiques, mais aussi certains syndromes de rétraction (Brown, par exemple) ;
-
acquise, avec le temps (la poulie du droit latéral aurait tendance à s’abaisser avec l’âge) ou suite à une agression chirurgicale ou traumatique ;
-
-
que la position des poulies, qui varie d’un cas à l’autre, doive être prise en compte dans certains types de chirurgie, Fadenoperation ou fixation postérieure, par exemple [37].
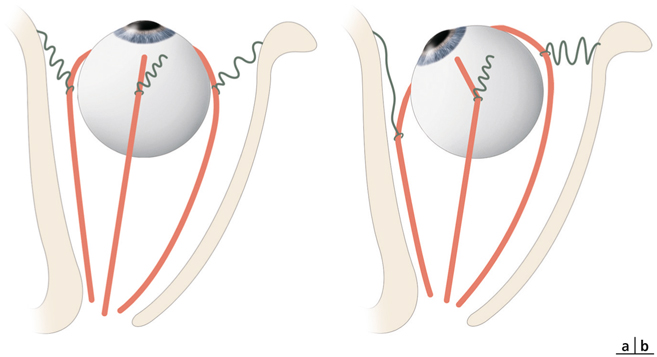
Fig. 17-53 Orbite droite vue du dessus. Schématisation du système oculomoteur et du rôle des poulies.
a. Œil en position primaire. b. Œil en adduction : la poulie du droit médial est attirée en arrière mais retenue par la mise en tension du ligament d’arrêt. Le droit supérieur subit une inflexion au niveau de sa poulie. Son plan d’action lui permet ainsi de rester purement élévateur malgré la position secondaire du globe.
Règles de base de la chirurgie strabologique
-
Utiliser d’emblée le microscope opératoire et en prendre l’habitude.
-
Respecter les tissus périmusculaires.
-
Respecter l’anatomie musculaire.
-
Rester simple en première intention.
-
Pas plus de deux muscles droits par oeil lors d’un même temps opératoire, sauf exception.
Plusieurs éléments interviennent dans ce choix :
-
l’absence de régression du strabisme malgré un traitement médical bien conduit. Ce traitement médical précède toujours la chirurgie qui est donc proposée en phase de stabilité de l’affection :
-
être certain qu’un strabisme n’évolue plus, une fois qu’il est équipé d’une correction adaptée et que l’amblyopie est équilibrée ;
-
être certain qu’une paralysie ne régresse plus ;
-
être certain que la position compensatrice d’un nystagmus est bien identifiée et stable dans le temps ;
-
-
quand, malgré un traitement médical adapté, la situation se dégrade :
-
apparition d’une neutralisation dans un strabisme en correspondance rétinienne normale récemment décompensé (exophorie-tropie, ésotropie normosensorielle) ;
-
perte du torticolis compensateur et neutralisation dans une paralysie ou un syndrome de rétraction ;
-
-
la durée passée en strabisme semble aggraver les conséquences sensorielles binoculaires. C’est ce qui pousse certains chirurgiens à opérer très précocement les enfants porteurs de strabismes précoces, en négligeant parfois la condition précédente (stabilité du strabisme). Dans le cas d’un strabisme normosensoriel, l’intervention doit être proposée dès que le traitement médical n’arrive plus à stabiliser le strabisme de manière satisfaisante pour éviter une réelle dégradation de la vision binoculaire.
Quand opérer un strabisme chez l’enfant ?
Il n’y a pas d’âge précis mais un moment adapté à chaque type de strabisme :
-
le plus tôt possible (meilleure plasticité cérébrale) ;
-
mais après traitement médical (lunettes vérifiées, amblyopie stabilisée, alternance, parfois prismes, rééducation…) ;
-
et sur un strabisme stable au moins six mois, sauf exception, et surtout pour lequel le résultat du traitement médical est non satisfaisant et en impasse.
Le bilan préopératoire doit apporter les éléments dont le chirurgien a besoin pour mener à bien l’intervention. Il n’est pas question d’en détailler ici les détails et techniques. Nous n’insisterons que sur les points les plus importants.
-
Skiascopie, lunettes portées.
-
Acuité visuelle monoculaire, binoculaire, de loin, de près, éventuellement en position de torticolis spontané, en binoculaire et monoculaire.
-
Œil dominant.
-
État des correspondances rétiniennes. On différencie ainsi les deux grandes familles de strabisme : en CRN ou sans CRN (CRA), ce qui permet de fixer le but de l’intervention : respectivement orthotropie ou microtropie.
-
Neutralisation.
-
Fusion et sa qualité.
-
Vision stéréoscopique (le test de référence est le TNO).
-
Champ de vision simple en cas de paralysie oculomotrice ou de syndrome restrictif.
-
Œil fixateur ou au moins préférentiel.
-
Présence d’un torticolis et ses variations selon l’œil fixant.
-
Angle de déviation mesuré en position primaire, fixation de loin, avec correction optique optimale :
-
au test à l’écran unilatéral, soit l’angle minimal, valable pour les ésotropies précoces ;
-
au test à l’écran alterné, soit l’angle maximal, valable pour les phories en cours de décompensation (exophorie ou ésophorie), pour lesquelles la fusion et l’habitude de compensation masquent une part plus ou moins importante de la déviation.
-
-
Signes éventuels de détente en faveur d’une part tonique de la déviation c’est-à-dire une diminution de l’ésotropie ou une augmentation de l’exotropie :
-
sous les doubles écrans translucides (A. Spielmann) ;
-
à l’éblouissement (N. Jeanrot).
-
-
Variations de cet angle :
-
de près, ce sont le rapport CA/A et les réflexes de convergence de près ;
-
avec et sans correction, soit le facteur accommodatif ;
-
dans les positions diagnostiques du regard à la recherche d’anomalies de motilité.
-
-
Étude de la motilité :
-
cliniquement ;
-
par le test en trois étapes de Parks en cas de déviation verticale ;
-
déviométrie en l’absence de CRN ;
-
coordimétrie en cas de CRN (paroi de Harms pour étudier la torsion).
-
-
Renseignements complémentaires :
-
compte rendu opératoire précédent, cicatrices conjonctivales des opérations précédentes ;
-
état des paupières, de la fente palpébrale ; synergie oculopalpébrale lors des mouvements oculaire ; présence d’une énophtalmie ou exophtalmie et variations selon les mouvements du globe ;
-
motifs de l’intervention, pour le patient, pour le chirurgien ;
-
parfois IRM orbitaire avec coupes axiales (PNO) pour les droits horizontaux, coupes sagittales (PNOTO) pour les droits verticaux, et coupes coronales pour le volume en coupe des corps musculaires et leurs positions relatives.
-
Rendu obligatoire par la loi, au moins cinq jours avant intervention, il permet de faire le point des contre-indications ou précautions spécifiques à chaque patient. Il permet aussi de choisir le type d’anesthésie (générale, locale, topique) et le type d’hospitalisation, ambulatoire ou non.
Une intervention de strabisme a des suites spécifiques et il est important d’en parler avec le patient ou sa famille avant intervention.
Une gêne oculaire, plus ou moins douloureuse, est possible pendant quelques heures à jours. Elle est atténuée par l’instillation de collyres ou pommades antibiotiques et corticoïdes. La durée de traitement varie de quinze jours à un mois. Un traitement antalgique peut être associé ainsi qu’un antiémétique si besoin pour les premiers jours.
Des complications infectieuses ou inflammatoires sont rarement observées. Une baisse visuelle, des sécrétions abondantes, un chémosis ou un gonflement palpébral, une exophtalmie, des douleurs ne cédant pas dans les jours qui suivent l’intervention doivent bien sûr faire consulter en urgence.
La rougeur conjonctivale est variable selon l’intervention et l’état local (en cas de reprise chirurgicale notamment). Elle dure de quelques jours à plusieurs mois. L’utilisation de la microchirurgie doit permettre d’obtenir des cicatrices conjonctivales planes et le plus souvent invisibles à l’œil nu, sauf reprise chirurgicale ou sensibilité particulière.
Tous ces éléments nécessitent une organisation péri-opératoire :
-
pour un enfant : absence scolaire entre trois et huit jours, limitation des activités risquant d’irriter les yeux pendant deux à quatre semaines (vent, poussière, eau) ;
-
pour un adulte : arrêt de travail à prévoir, dépendant du type de profession et de l’importance de l’intervention, entre huit jours et un mois ; arrêt de la pratique sportive pendant quelques semaines.
Même si le résultat est d’emblée appréciable pour le chirurgien, le patient et son entourage, il n’est pas toujours le reflet du résultat final. Plusieurs semaines ou mois peuvent être nécessaires avant d’obtenir une stabilisation de l’état oculomoteur.
Le résultat visé a dû être discuté avec le patient en fonction du type de strabisme, tant sur le plan du résultat fonctionnel qu’oculomoteur.
La technique chirurgicale employée peut provoquer à dessein une limitation de certaines ductions (après résection musculaire ou après fixation postérieure, par exemple) qui se modifieront dans le temps.
Certains strabismes ou paralysies évoluent spontanément vers la récidive et une surcorrection initiale est souhaitée, quitte à provoquer une diplopie.
Certains strabismes risquent au contraire de s’inverser ou encore une diplopie est crainte autour de l’angle objectif. On peut dans ce cas choisir une sous-correction volontaire.
Il existe peu de complications postopératoires et, quand elles surviennent, elles s’expriment à l’évidence. Le patient doit donc être prévenu des principaux signes inquiétants et devant motiver une consultation rapide. Ceux-ci concernent :
-
l’état oculaire : écoulements abondants et sales, douleurs ne cédant pas, baisse visuelle, gonflement palpébral ;
-
le résultat oculomoteur : modification brutale ou rapide de l’état oculomoteur, faisant craindre un lâchage de suture.
Les autres signes seront évalués lors des bilans postopératoires.
Un premier bilan oculomoteur sommaire est réalisé en postopératoire immédiat, souvent par le chirurgien lui-même. Il permet de confirmer que le résultat correspond bien à ce qui est attendu et de rassurer le patient en ce qui concerne la présence d’une diplopie transitoire, d’une sur- ou sous-correction volontaire.
Une prise en charge orthoptique postopératoire est souhaitable. Elle peut débuter rapidement dans les jours qui suivent. Elle permet de suivre l’évolution, de rassurer ou, au contraire, d’alerter en cas de problème. Parfois, une rééducation postopératoire rapide est demandée par le chirurgien. Celle-ci peut concerner une rééducation « motrice », exercices simples de motilité, ou une rééducation « sensorielle » basée sur la fusion, dans les strabismes en correspondance rétinienne normale. Le plus souvent, cette rééducation devra être freinée durant la période de fonte des points, soit entre trois et six semaines postopératoires, afin d’éviter le glissement d’un muscle encore fragile. Chez l’enfant, il est important de reprendre rapidement le port de la correction optique et tout traitement qui était en cours avant l’intervention (amblyopie notamment).
Au moins une consultation ophtalmologique doit avoir lieu durant le premier mois postopératoire, plus ou moins tôt selon l’intervention réalisée, afin de s’assurer de l’évolution locale.
Il doit être délicat, adapté au geste qu’on va réaliser, et fournir une bonne visibilité de la zone de travail. Il doit être aussi respectueux des tissus de soutien du globe, afin d’obtenir à terme une cicatrice discrète, non rétractée, ne limitant pas les résultats de l’intervention musculaire et permettant un éventuel deuxième geste chirurgical ultérieur.
Plusieurs types d’ouverture conjonctivale existent, ayant chacune leur intérêt (fig. 17-54). Les tissus périmusculaires sont ensuite délicatement disséqués. Le muscle est chargé sur crochet à strabisme. Les extensions périmusculaires de la capsule de Tenon et le périmysium sont réclinés, au maximum jusqu’à la poulie musculaire.
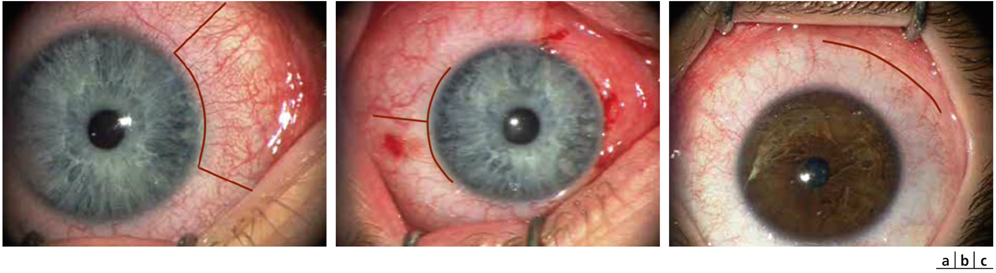
Fig. 17-54 Ouverture conjonctivale.
a. Ouverture au limbe en « enveloppe », la plus réalisée. b. Ouverture au limbe en « T », facile mais laissant une cicatrice un peu plus visible. c. Ouverture à distance du limbe, au fornix.
C’est la technique chirurgicale la plus ancienne, la plus analysée et la plus réalisée (fig. 17-55).
On réinsère le muscle en arrière de son insertion sclérale physiologique, sur sa ligne d’action. L’anatomie musculaire doit être respectée et le muscle réinséré en l’étalant comme il l’était auparavant.
Le recul permet de réduire la déviation en direction du muscle qu’on recule, et ce, quelle que soit la cause : muscle trop tonique (hyperaction) ou trop tendu (rétraction). Pour cela, il diminue les forces actives et passives du muscle et diminue l’arc de contact. Il a enfin un rôle innervationnel indirect par le biais des lois de Hering et Sherrington comme nous l’avons dit.
L’efficacité d’un recul est exponentielle. On peut considérer qu’elle est quasi nulle en dessous de 2 mm pour un droit médial et 3 mm pour un droit latéral. En revanche, au-delà de 6 mm pour un droit médial et 8 mm pour un droit latéral, l’effet est imprévisible avec risque non négligeable d’inversion de l’ange.
Le recul musculaire est l’intervention idéale et efficace pour traiter un muscle rétracté (déviation anatomisée) ou présentant une hyperaction stable dans le temps. La quantité de recul est guidée par la déviation mesurée en préopératoire et le degré de rétraction mesuré sous anesthésie. Dans les ésotropies, la part de déviation liée à une hypertonie musculaire, disparaissant sous anesthésie générale, qui risque de se modifier dans le temps, devrait idéalement être traitée par une autre technique de type fixation postérieure.
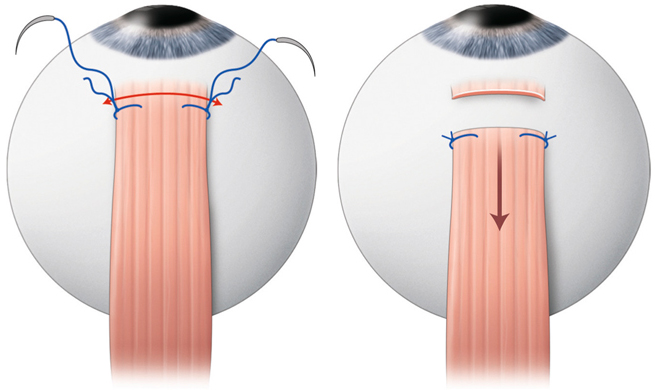
Fig. 17-55 Technique du recul musculaire simple.
C’est une technique chirurgicale développée à partir de la description de la géniale Fadenoperation par Cüppers en 1976 [4]. La dénomination de Fadenoperation n’est pas adaptée et plusieurs termes ont été proposés : opération du fil, myopexie rétro-équatoriale. Le terme de « fixation postérieure » paraît le plus descriptif, sans tenir compte du type de fixation utilisée.
La « fixation postérieure » répond à un principe physique simple (fig. 17-56). En fixant le muscle contre la sclère en arrière de l’équateur, elle supprime simplement l’arc de contact du muscle sans jouer sur la force active ou passive du muscle en position primaire. Quand le muscle se contracte et attire le globe en rotation dans sa direction d’action, l’absence d’arc de contact fait que le muscle perd d’emblée son efficacité rotatoire, n’étant plus tangent au globe. La « fixation postérieure » agit comme un frein d’autant plus efficace que le muscle se contracte. Elle est inactive en position primaire ou en élongation du muscle et freine d’autant plus le muscle que celui-ci se contracte.
Il semble qu’au-delà de son action sur l’arc de contact, la « fixation postérieure » soit aussi active en fixant la poulie musculaire contre la sclère [3]. Quand le muscle se contracte, le mouvement de rotation du globe est aussi freiné par la mise en tension du ligament d’arrêt de la poulie (fig. 17-56).
En résumé, la « fixation postérieure » freine l’action du muscle de façon progressive, l’effet est nul en position primaire et augmente dans la direction d’action. Elle est donc utile pour les déviations inconstantes, variables, disparaissant sous anesthésie, d’origine tonique. Ce mode d’action s’oppose et complète celui des reculs musculaires. Ces deux techniques peuvent être associées pour traiter les deux composantes des ésotropies voire d’autres déviations (DVD, par exemple) : partie tonique ou innervationnelle disparaissant sous anesthésie générale et partie anatomique persistant sous anesthésie générale.
La « fixation postérieure » a souffert d’une mauvaise réputation liée à l’agressivité de la technique initiale, réalisée sans microscope, donc difficilement, et avec des inquiétudes sur les risques de perforation sclérale. Le fil utilisé était non résorbable et tressé. Il créait une fibrose périmusculaire majeure rendant très difficile toute réintervention. La crainte de cette intervention était telle qu’elle a été quasiment bannie de l’arsenal chirurgical par beaucoup de chirurgiens. La technique a considérablement progressé grâce au développement de la microchirurgie, à l’apparition d’aiguilles spatulées et l’utilisation de fils Nylon (5 ou 6/0), donc beaucoup plus biocompatibles. On n’observe pas plus de complications que pour toute autre technique et les réinterventions sont devenues tout à fait possibles.
Plusieurs techniques existent. On peut réaliser :
-
un ancrage marginal du muscle par deux points de monofil fixés latéralement à la sclère puis au muscle. Ce geste doit être réalisé après un éventuel recul musculaire (fig. 17-57) ;
-
un sanglage en pont : la suture est fixée à la sclère de chaque côté du muscle et passe en pont au-dessus du muscle, puis elle est tendue pour plaquer le muscle contre la sclère (fig. 17-58). On peut le réaliser avant un autre geste musculaire puisque le muscle peut coulisser sous le sanglage. Surtout, cela évite de blesser le muscle et de provoquer une atrophie de la partie antérieure du tendon, facilitant ainsi toute reprise ultérieure.
Le positionnement de la « fixation postérieure » est important : trop éloignée, elle devient paralysante ; trop antérieure, elle est inefficace. La distance recommandée par rapport à l’insertion sclérale du muscle est de 13 mm pour les droits médial et supérieur, 11 mm pour le droit inférieur, et 15 mm pour le droit latéral, ce qui montre une relation avec la longueur de l’arc de contact de chacun de ces muscles. Nous avons montré qu’il faut en fait sans doute positionner la « fixation postérieure » à l’endroit de la poulie [35] et que celui-ci varie d’un muscle à l’autre et surtout d’un patient à l’autre [37]. La mesure de la position de la poulie doit donc être effectuée avant de positionner une « fixation postérieure » (fig. 17-59 et 17-60).
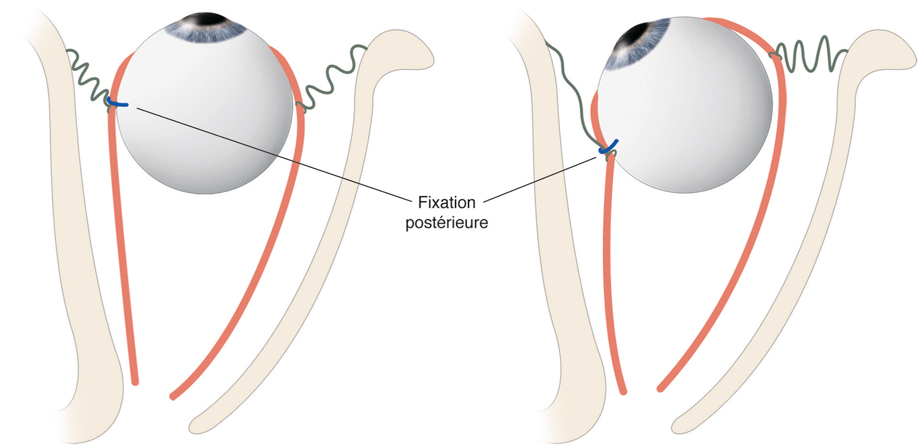
Fig. 17-56 La fixation postérieure, outre son effet de suppression de l’arc de contact du muscle, plaque la poulie contre le globe. Le ligament d’arrêt se met donc en tension dès que le globe tourne et freine la rotation du globe.
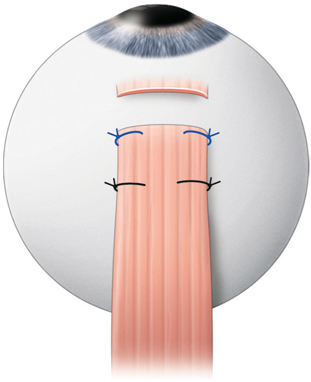
Fig. 17-57 Technique originale de la Fadenoperation, avec ancrage marginal rétroéquatorial du muscle à la sclère, ici associée à un recul musculaire.
Fig. 17-58 Fixation postérieure : sanglage postérieur du droit médial sans recul.
Fig. 17-59 Fixation postérieure.
a, b, c. En haut : poulie à 10 mm (a), à 12 mm (b), à 13 mm (c).
d, e, f. En bas, même œil avec un sanglage placé à la position de la poulie dans chaque cas.
Fig. 17-60 Association d’un recul musculaire et d’un sanglage postérieur.
La règle millimétrée montre qu’il s’agit d’un recul de 5 mm, avec sanglage à 12 mm de l’insertion initiale (pince).
Renforcer un muscle consiste à le retendre afin d’augmenter son efficacité. Le plus souvent, le geste consiste à le raccourcir en éliminant une longueur donnée de la partie antérieure du tendon, soit en la retirant (résection) (fig. 17-61), soit en réalisant un pli (plissement). Le plissement permet d’éviter de sectionner le muscle et surtout les vaisseaux ciliaires qu’il amène. Il a comme inconvénient de laisser une cicatrice plus en relief pendant quelque temps.
Parfois, un muscle est hypoactif dans les suites d’une intervention d’affaiblissement réalisée auparavant. S’il s’agissait d’un recul musculaire excessif, le renforcement va consister en un avancement de l’insertion sclérale trop postérieure, parfois même associé à une résection.
Le renforcement n’agit ni sur l’arc de contact ni sur la force active du muscle. Il ne fait que le remettre en tension (augmentation de la tension passive).
Il existe toutefois une autoadaptation du muscle qui va synthétiser de nouveaux sarcomères. On observe donc souvent une atténuation progressive de l’effet d’une résection musculaire isolée car le muscle se réadapte. Il est possible que cette adaptation soit moindre si un affaiblissement de l’antagoniste homolatéral est associé au renforcement [32].
Le renforcement est utilisé pour des muscles hypoactifs (baisse de la force active, par exemple dans les paralysies) et/ou hyperélastiques (baisse de la force passive ou tension du muscle). La quantité de résection ou plissement doit absolument être adaptée au degré d’élasticité du muscle évalué au test d’élongation musculaire, afin d’éviter une sous-correction par résection insuffisante d’un muscle très hyperélastique ou une surcorrection en cas de résection excessive sur un muscle d’élasticité normale voire diminuée. Pour un droit médial, cette résection varie entre 2 mm et 7 mm et pour un droit latéral entre 3 mm et 9 mm.
Bien entendu, un renforcement peut être associé à l’affaiblissement de l’antagoniste homolatéral, souvent hyperactif, que ce soit dans les strabismes ou les paralysies oculomotrices.
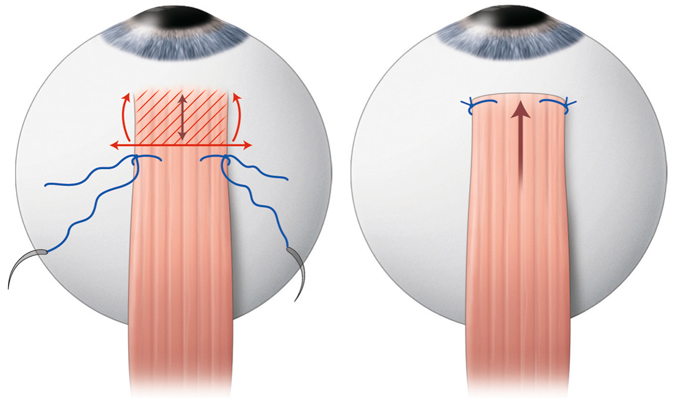
Fig. 17-61 Résection de la partie antérieure du tendon d’un muscle droit.
Les mêmes interventions de renforcement sont réalisables sur les muscles obliques et selon les mêmes principes que pour les muscles droits.
L’abord se fait dans le quadrant temporal inférieur par une incision au fornix en cas de chirurgie isolée ou en élargissant l’abord d’un muscle droit adjacent, le droit latéral en général.
Il faut veiller à sectionner la totalité du muscle, notamment les fibres postérieures qui s’insèrent très loin en arrière sur le globe. Lors de la réinsertion, bien étaler le muscle en séparant les fibres antérieures et postérieures.
Le recul dosé est l’intervention la plus courante et physiologique : on recule le muscle sur sa ligne d’action. On réalise en général un recul de 8 mm, 10 mm ou 12 mm selon le degré d’hyperaction.
Les affaiblissements sans réinsertion (myotomie, myectomie) sont peu réalisés en France : leur effet n’est pas contrôlable et l’évolution locale postopératoire non plus.
En cas d’hyperaction majeure dans des cas d’exception, des interventions de type antérotransposition (réinsertion sur la spirale de Tillaux juste en temporal de l’insertion du droit inférieur) ou transposition nasale (réinsertion au bord nasal du droit inférieur) sont discutées.
On peut soit réséquer une partie donnée de l’extrémité distale du muscle, soit l’avancer en le passant sous le droit latéral. Ce type d’intervention est rarement utilisé.
C’est un muscle délicat de par sa finesse, sa fragilité, sa position (passage sous le droit supérieur), sa grande réactivité à la chirurgie.
L’abord se fait soit dans le quadrant temporal supérieur pour son insertion sclérale, s’étalant en éventail sous le bord temporal du droit supérieur, soit dans le quadrant nasal supérieur pour le tendon réfléchi ou pour réinsérer un recul de ce muscle.
Il faut vraiment veiller à dissocier les fibres antérieures (torsion) et les fibres postérieures (abaissement) lors de sa chirurgie.
Il est réalisé le plus souvent par recul de l’insertion sclérale : le muscle est désinséré, passé sous le droit supérieur, et réinséré sur sa ligne d’action à une distance donnée.
Des interventions visant à allonger le tendon réfléchi ont été proposées : allongement en chicane, interposition d’une languette de silicone… Elles sont beaucoup plus agressives pour le muscle et doivent rester des méthodes de recours dans des cas particuliers.
Le renforcement total du muscle se fait par plissement ou résection de l’extrémité distale du tendon. Il faut surtout adapter ce geste à l’élasticité du tendon. Un geste excessif risque de provoquer un blocage mécanique de l’élévation, notamment en adduction (syndrome de Brown iatrogène). En fin de renforcement, il faut donc s’assurer par un test de duction passive que l’élévation en adduction ne sera pas trop limitée. Pour cela, on vérifie que le bord inférieur cornéen peut facilement dépasser l’axe horizontal quand l’œil est porté en élévation en adduction (Guyton). On peut le sensibiliser en provoquant une rétropulsion du globe dans le même temps.
Le renforcement partiel est utilisé pour traiter sélectivement une excyclotorsion, en renforçant les fibres antérieures (plissement oblique ou avancement des fibres antérieures selon Harada, Ito ou Fells), ou, plus rarement, pour augmenter l’effet abaisseur, en renforçant les fibres postérieures.
De nombreux facteurs interviennent dans l’établissement final du protocole opératoire, et si les techniques chirurgicales se sont naturellement améliorées, sans changer fondamentalement, c’est surtout leur utilisation qui est en mutation [22, 25, 35, 36].
Si l’on en reste à une vision purement musculaire de la chirurgie des strabismes, des tables d’efficacité chirurgicales très précises ont été établies. Elles permettent d’assurer un résultat immédiat correct de l’intervention. La chirurgie moderne doit en plus intégrer les modifications du strabisme sous anesthésie et le degré d’élasticité de chaque muscle opéré.
L’efficacité d’une intervention de recul des deux droits médiaux pour ésotropie concomitante est de 3,5 ? par millimètre de chirurgie, qu’il faut répartir entre chaque muscle. L’efficacité est la même pour une intervention de recul/résection unilatérale des droits horizontaux en cas d’ésotropie ou exotropie concomitante.
Le double recul des droits latéraux pour traiter une exotropie a une efficacité moindre : 2 ? par millimètre de recul.
Pour Rosenbaum, l’efficacité des reculs musculaires est exponentielle ; les auteurs nord-américains proposent des tableaux d’efficacité progressive de la chirurgie [22].
Dans ces cas (excès de convergence de près, variabilité importante, rapport CA/A élevé, angle disparaissant sous anesthésie), on peut choisir entre :
-
la mise en place d’une fixation postérieure sur les droits médiaux, qui traite idéalement ce type de déviation hypertonique. On la placera entre 11 mm et 14 mm en fonction de l’âge et de la réfraction. Thouvenin recommande de la placer à la distance de la poulie du droit médial [35]. Si l’angle de base est nul ou très faible, on peut choisir de ne faire qu’une fixation postérieure sans désinsérer le muscle [39] ;
-
augmenter la quantité de chirurgie conventionnelle évaluée à partir de la mesure de l’angle maximal de l’ésotropie. On considère alors une efficacité du geste de 4,5 ? par millimètre de recul. Cette stratégie expose beaucoup plus aux divergences secondaires si la part hypertonique du strabisme diminue ultérieurement.
L’association de ces deux techniques permet de traiter idéalement l’ensemble de la déviation strabique et devrait améliorer la stabilité du résultat chirurgical à long terme :
-
le recul et/ou la résection musculaire traitent la part « anatomique » du strabisme, déviation persistante sous anesthésie liée à la rétraction ou l’élongation progressive des muscles, conséquences de la permanence de la déviation. Le degré de rétraction est bien évalué par le test d’élongation musculaire qui peut guider la quantité de chirurgie qu’on réalise ;
-
la « fixation postérieure » traite la partie tonique de la déviation, celle qui disparaît sous anesthésie générale.
Indication en fonction du signe de l’anesthésie
-
Une déviation inchangée sous anesthésie générale est dite « anatomique » : elle sera traitée classiquement par chirurgie de recul/résections.
-
Une déviation qui s’annule voire s’inverse sous anesthésie générale est dite « tonique » : c’est l’indication idéale de la « fixation postérieure » seule [39]. Certains rajoutent malgré tout un léger recul du droit médial pour compenser la mise en tension théorique du droit médial par la « fixation postérieure ».
-
Une déviation réduite sans s’annuler sous anesthésie générale est dite « mixte » : c’est l’indication de l’association entre une « fixation postérieure » pour traiter la part tonique et d’un recul pour traiter la part anatomique de la déviation. Pour calculer la quantité de recul/résection, Roth conseille de diminuer de 20 % le protocole de recul/résection calculé sur l’angle de base du strabisme. Thouvenin se guide sur l’appréciation quantifiée de la rétraction du muscle au test d’élongation musculaire. Ce type de protocole permet de diminuer considérablement la quantité de recul et résections dans les ésotropies de l’enfant.
Dans certains cas exceptionnels, les dosages opératoires dépassent les limites habituelles. Il s’agit de cas de paralysies totales, de traitement de positions de fixation très excentrées (nystagmus notamment) ou de l’affaiblissement volontaire des quatre muscles droits horizontaux dans les nystagmus sans blocages.
Le geste est plus difficile à quantifier puisque l’action des obliques est variable selon la direction de fixation. On quantifie l’excès ou l’insuffisance de l’oblique en léger (+), moyen (++), fort (+++) ou très fort (++++). Respectivement, on recule l’oblique inférieur de 8 mm, 10 mm ou 12 mm, voire antérotransposition au-delà de (+++). Pour l’oblique supérieur, on le recule de 6 mm à 10 mm selon son degré d’hyperaction. Le renforcement de l’oblique supérieur varie de 6 mm à 8 mm selon son degré d’hypoaction et surtout de son extensibilité.
La chirurgie réglable permet d’ajuster le résultat opératoire une fois le patient pleinement conscient et ayant retrouvé une oculomotricité « normale », par le biais de l’utilisation de sutures ajustables (fig. 17-62 à 17-64). Son utilisation pallie en partie les impondérables de la chirurgie strabologique. Elle permet d’oser un protocole plus direct et agressif et, parfois, d’éviter un temps opératoire supplémentaire en cas de strabisme complexe.
La technique est utile principalement dans des cas de réinterventions, de syndromes oculomoteurs complexes, pour lesquels les résultats chirurgicaux sont moins prévisibles, mais aussi en cas de risque de diplopie postopératoire, afin d’aller à la limite des zones de neutralisation.
La méthode a ses intérêts mais aussi ses contraintes et ses limites :
-
tout d’abord, l’examen préopératoire doit être aussi précis que si on utilise une technique non réglable et le protocole opératoire est construit de la même manière ;
-
le patient doit être prévenu, avoir compris la méthode et pouvoir participer le plus sereinement possible. Chez l’enfant et l’adulte trop pusillanime, quand la technique est vraiment nécessaire mais que la participation du patient est mauvaise, on peut réaliser une chirurgie réglable et terminer le geste en rendormant brièvement le patient après l’avoir examiné ;
-
la technique doit être sûre et maîtrisée, afin de permettre un réglage facile répondant aux situations qu’on risque de rencontrer en postopératoires (sur- ou sous-correction). Quelques exemples :
-
l’accès à la suture au travers de la conjonctive doit être facile ;
-
le choix du muscle à ajuster est important. Il s’agit en général du muscle le plus hyperactif ou pour lequel la réaction à la chirurgie est le plus aléatoire. On évite de mettre la suture ajustable sur un muscle parétique car l’ajustage sera impossible ;
-
en cas de résection réglable, il vaut mieux augmenter la résection de 2 mm par rapport au protocole prévu afin de pouvoir ajuster dans les deux sens et ne pas être bloqué si la résection est insuffisante ;
-
-
l’intervention doit viser le même résultat qu’en chirurgie non réglable. L’état postopératoire des premiers jours n’est pas le reflet de l’état définitif. Le réglage doit donc viser une sur- ou sous-correction si nécessaire, comme en chirurgie classique.
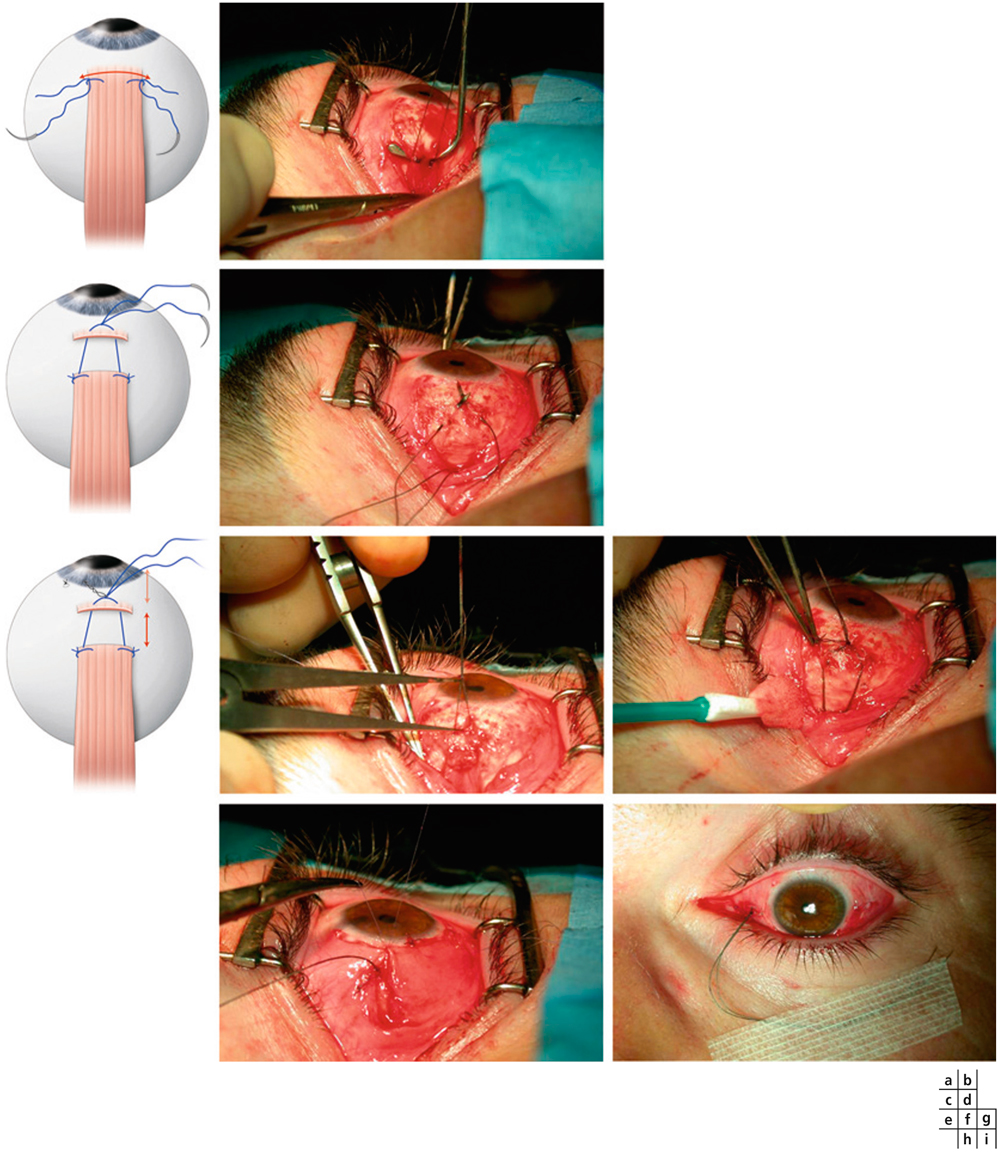
Fig. 17-62 Mise en place d’une suture ajustable.
a, b. Faufilage solide, section du tendon. c, d. Passage oblique de la suture dans l’insertion sclérale. e, f, g. Mise en place du nœud coulissant et d’une boucle sclérale de préhension du globe. Préréglage grâce au nœud coulissant. h. Fermeture conjonctivale permettant un abord simple au nœud. i. Fermeture finale simple.
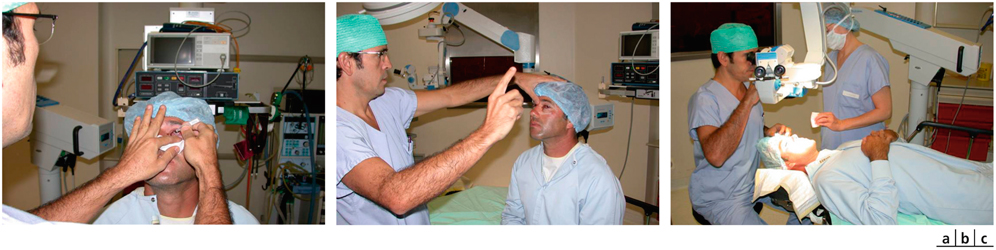
Fig. 17-63 Ajustage.
a. Instillation de collyre anesthésique. b. Examen. c. Ajustage sous microscope.
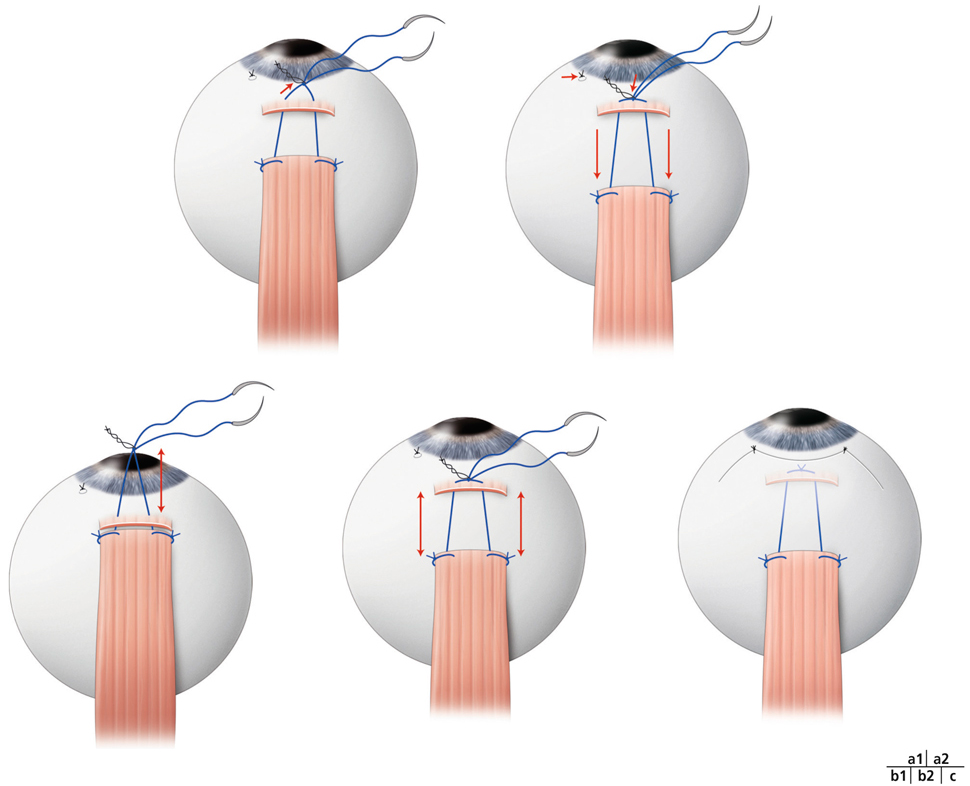
Fig. 17-64 Ajustage.
a. Augmenter un recul : (a1) tirer le nœud coulissant ; (a2) tenir la boucle sclérale, demander une duction active du muscle ajusté. b. Diminuer un recul : (b1) tirer la suture de la quantité désirée ; (b2) ramener le nœud coulissant. c. Nouer et sectionner la suture principale, retirer le nœud coulissant et la boucle sclérale, fermer la conjonctive en enfouissant le nœud.
L’action d’un muscle est en général assimilée à son action globale. En fait, les muscles sont étalés à leur insertion sclérale de plus de 10 mm et les deux extrémités de l’insertion ont un rôle différent. La chirurgie peut agir de manière dissociée sur chaque faisceau dans certaines situations [25].
Les droits horizontaux ont une action purement horizontale. Toutefois, dans le regard en haut ou en bas, le faisceau le plus proche de l’horizontale est plus en tension et travaille plus.
Exemple — En cas de syndrome en « V » avec excès d’adduction dans le regard en bas, ce sont les faisceaux supérieurs des droits médiaux qui sont le plus en tension dans cette direction du regard. Il a donc été proposé de détendre sélectivement le faisceau supérieur des droits médiaux par un recul oblique et/ou, selon la même logique, de retendre le faisceau supérieur des droits latéraux. Ce raisonnement peut être transposé à une exotropie avec syndrome « V » par excès d’abduction dans le regard en haut : recul de la partie inférieure des droits latéraux et/ou renforcement de la partie inférieure des droits médiaux. On inverse le raisonnement pour les syndromes « A ».
La différence de recul ou résection entre les deux chefs musculaires doit être comprise entre 3 mm et 6 mm pour être efficace ; 1 mm de recul oblique traite 3 ? d’incomitance (fig. 17-65).
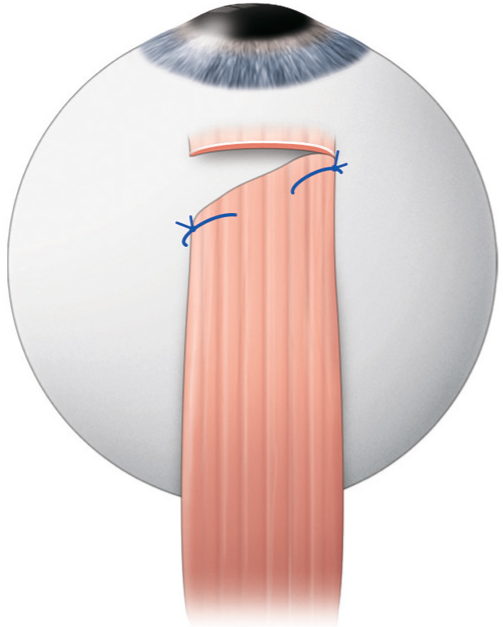
Fig. 17-65 Recul oblique d’un muscle droit.
Les droits verticaux ont une action principalement verticale, mais également un rôle sur la torsion et dans une moindre mesure sur l’horizontalité. Les fibres temporales, plus sollicitées en adduction, sont bien sûr élévatrices mais provoquent aussi une torsion non négligeable (incyclotorsion pour le droit supérieur, excyclotorsion pour le droit inférieur). En abduction, les fibres nasales sont légèrement plus tendues. Les droits verticaux ont une action purement verticale à 23° d’abduction. Si un geste est envisagé sur les droits verticaux, en général pour traiter une déviation verticale, on pourra en augmenter l’effet sur la torsion en jouant plus sur les fibres temporales ou le réduire en jouant plus sur les fibres nasales.
Cette chirurgie dissociée est encore plus efficace sur les muscles obliques dont les fibres antérieures ont un rôle principal sur la torsion, mises en tension dans les mouvements d’abduction, et les fibres postérieures sur la verticalité, d’autant plus que l’œil est en adduction. Des chirurgies de renforcement ou affaiblissement « oblique » des muscles obliques sont proposées depuis plusieurs années :
-
Harada et Ito ont proposé les premiers, en 1961, de traiter sélectivement les cyclotropies par un geste sur les fibres antérieures des obliques. L’intervention qui porte leur nom traite les excyclotorsions majeures qui peuvent accompagner les paralysies de l’oblique supérieur. Elle consiste à renforcer la moitié antérieure de l’oblique supérieur. La technique a été améliorée par Fells, c’est la variante la plus utilisée ;
-
des techniques de plissement sélectif de la partie antérieure du tendon pour traiter l’excyclotorsion ou de la partie postérieure pour traiter la verticalité ont aussi été développées.
Transposer chirurgicalement un muscle consiste à le désinsérer en totalité ou en partie, puis à le réinsérer en dehors de son plan d’action physiologique (fig. 17-66). On modifie ainsi son effet sur la rotation du globe. Cela peut être utilisé dans différentes situations et avec des techniques variées. Il faut toujours se souvenir que l’action de déplacer un muscle hors de son plan d’action physiologique peut agir dans un sens désiré pour une action mais à l’inverse pour une autre : il faut peser les avantages et inconvénients de chaque geste.
Exemple — Le droit médial est purement adducteur. Si on le réinsère plus bas que son plan d’action, il devient abaisseur, mais aussi excyclotorseur ; enfin, son action adductrice diminue dans le regard en bas et augmente dans le regard en haut.
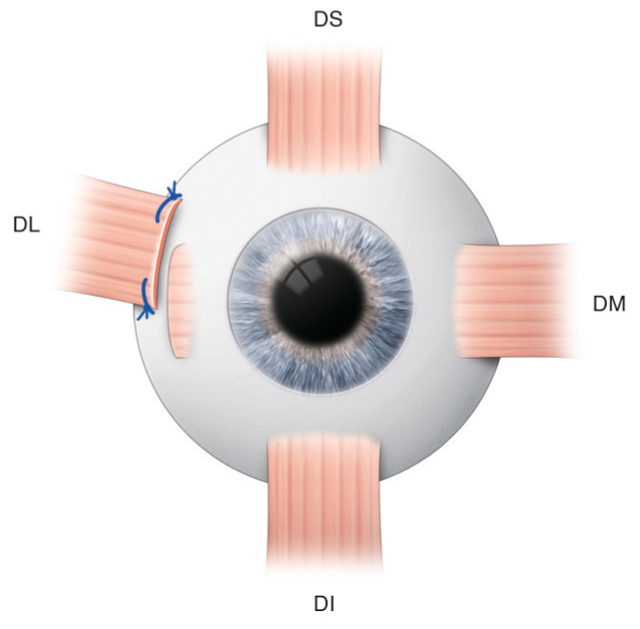
Fig. 17-66 Transposition supérieure de l’insertion sclérale d’un muscle droit latéral.
Si un syndrome alphabétique est associé à une dysfonction des muscles obliques, le traitement chirurgical passe d’abord par celui des muscles obliques. Il n’y a pas lieu de transposer les muscles droits [26].
En l’absence de dysfonction des obliques, on peut améliorer l’incomitance entre le regard en haut et en bas, en décalant la position des muscles droits :
-
Costenbader puis Knapp ont proposé pour cela la technique de décalage vertical des droits horizontaux :
-
par exemple, dans un syndrome « V » avec ésotropie majorée dans le regard en bas, on peut réaliser un décalage des droits médiaux vers le bas, afin de diminuer leur action adductrice dans le regard en bas. On y associe un affaiblissement des droits médiaux pour traiter l’ésotropie ;
-
dans un syndrome « V » associé à une exotropie prédominant dans le regard en haut, on aura tendance à traiter l’exotropie par un recul des droits latéraux, qu’on transposera vers le haut dans le même temps, afin de diminuer leur action abductrice dans le regard en haut ;
-
on raisonne de manière inverse dans les syndromes « A » ;
-
-
Fink puis Miller ont proposé d’agir sur les muscles droits verticaux :
-
leur action adductrice peut être renforcée par une transposition nasale de leur insertion, ou leur action abductrice peut être renforcée par transposition temporale ;
-
dans un syndrome « V », on peut donc transposer en nasal un droit supérieur ou un droit inférieur en temporal, et réciproquement dans un syndrome « A ».
-
La transposition des droits horizontaux est bien plus utilisée pour les syndromes alphabétiques que celle des verticaux, mais elle passe après le traitement d’une hyperaction des muscles obliques. Il faut se souvenir que la transposition aura un effet bénéfique sur la déviation mais souvent un effet aggravant sur la torsion : par exemple, le décalage inférieur du droit médial améliore le syndrome « V » mais aggrave l’excyclotorsion qui y est souvent associée.
La quantité de décalage dépend de l’importance du syndrome alphabétique [41] :
-
3 mm de décalage corrigent 10 ? d’incomitance ;
-
5 mm (une demi-insertion) corrigent 12 ? à 15 ? ;
-
8 mm à 10 mm (largeur de l’insertion physiologique) corrigeraient 20 ?, mais ce doit être utilisé avec précaution en raison de l’effet torsionnel majeur qui en découlerait.
En général, on réalise le décalage sur la paire de muscles opérés, soit bilatéralement soit sur un seul œil.
La transposition de l’insertion d’une paire de muscles antagonistes d’un œil permet de suppléer à l’hypoaction du muscle vers lequel on les transpose. Cela peut être proposé dans une déviation simple ou une parésie afin de limiter le nombre de muscles à opérer, ou dans une paralysie totale afin de suppléer le muscle paralysé.
Ce procédé est ancien et consiste à transposer l’insertion d’un (Foster, 1946) ou deux (Alvaro, 1950) droits horizontaux vers le bas pour traiter une hypertropie, ou vers le haut pour traiter une hypotropie. Knapp (1969) a proposé une transposition totale des droits horizontaux au bord du droit supérieur pour traiter les paralysies des élévateurs, selon les mêmes principes que pour les paralysies horizontales.
On peut associer ce procédé à un affaiblissement d’un droit et au renforcement d’un autre pour traiter une déviation horizontale associée.
Le décalage d’une largeur d’insertion corrigerait 10 ? à 15 ? de déviation verticale. Le protocole de Knapp corrige plus de 30 ? selon Helveston [8].
La correction d’une déviation verticale passe avant tout par un traitement des droits verticaux, ou des muscles obliques s’ils sont en cause. Les transpositions décrites ci-dessus sont indiquées quand on ne veut ou ne peut multiplier le nombre de muscles opérés.
Exemple — Dans une parésie du III avec exotropie et hypotropie modérée, on pourra réaliser un recul du droit latéral, éventuellement réglable, et un renforcement du droit médial, associé à un décalage supérieur de l’insertion de ces deux muscles, ce qui évite de toucher un troisième muscle droit et de s’exposer à des complications ischémiques.
Il s’agit ici de suppléer la paralysie le plus souvent totale et surtout définitive d’un muscle oculomoteur. Ces techniques ne sont donc proposées qu’après un temps d’observation permettant d’affirmer l’absence de régression spontanée de la paralysie. Elles étaient classiquement réservées aux réinterventions, après avoir épuisé l’efficacité de techniques simples (affaiblissement/renforcement), mais elles sont de plus en plus proposées en première intention, quitte à réintervenir ultérieurement. Le principe consiste à transposer la totalité ou une partie des deux muscles droits voisins du muscle paralysé vers celui-ci, de manière à suppléer son action.
La complication oculomotrice la plus fréquente des transpositions est l’apparition d’une déviation verticale secondaire, de survenue imprévisible malgré le soin apporté à la technique. Une réintervention rapide peut être nécessaire pour la traiter.
De très nombreuses variantes existent, dont l’intérêt ou les inconvénients spécifiques sont bien synthétisés par Roth et Speeg-Schatz [26]. On différencie surtout les transpositions partielles et les transpositions totales.
Il s’agit de transposer la moitié le plus souvent temporale des droits supérieur et inférieur en direction du droit latéral, selon la technique de Hummelsheim (1907) améliorée progressivement (fig. 17-67). Kaufmann croise les languettes en les passant sous le droit latéral [12]. D’autres nouent les languettes entre elles et les passent sur (Rüssmann) ou sous (Jampolsky) le droit latéral.
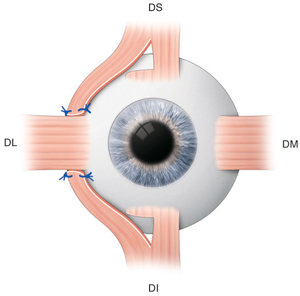
Fig. 17-67 Hémitransposition selon Hummelsheim.
On transpose ici la totalité des muscles concernés vers l’insertion du muscle paralysé.
O’Connor a décrit la méthode initiale (1921) avec réinsertion légèrement oblique des droits verticaux, leur extrémité nasale étant réinsérée en regard de l’insertion supérieure (droit supérieur) et inférieure (droit inférieur) du droit latéral. L’extrémité temporale de ces muscles est réinsérée à légère distance des bords du droit latéral (fig. 17-68).
De nombreuses variantes ont été proposées. Il faut retenir celles visant à augmenter l’effet de cette transposition, en rajoutant une fixation postérieure de la partie temporale du muscle vertical transposé contre le droit latéral (Rosenbaum) ou en passant les droits verticaux sous le droit latéral avant de les réinsérer (Kaufmann).
Exemple — Nous prenons comme exemple la paralysie de la VIe paire crânienne, situation la plus fréquemment rencontrée. La transposition touchera donc tout ou partie des droits supérieur et inférieur en direction du droit latéral paralysé, après s’être assurée que la paralysie est stable, définitive et totale ou subtotale. Il ne faut jamais sectionner plus de deux muscles droits sur un œil lors du même temps opératoire pour éviter le risque d’ischémie du segment antérieur, et ce d’autant plus que le terrain y prédispose. Un plissement musculaire du droit latéral prudent n’interrompt pas la vascularisation ciliaire et peut donc être envisagé en supplément. Si un geste complémentaire est nécessaire, un délai minimal de six mois de cicatrisation est nécessaire entre deux interventions sur le même œil.
-
Si le droit médial n’est pas trop rétracté, la plupart des auteurs conseillent la réalisation d’une transposition d’emblée, éventuellement associée à une injection de toxine botulique dans le droit médial et/ou un plissement prudent du droit latéral.
-
Si le droit médial est totalement rétracté, la transposition seule sera insuffisante pour traiter la déviation. Kaufmann pense que cette situation est rare et qu’une injection de toxine peut être suffisante pour détendre un droit médial même très rétracté. Malgré tout, le plus souvent dans cette situation, on choisit soit de réaliser dans un premier temps une intervention classique sur le couple droit latéral/droit médial, suivie au moins six mois plus tard de la transposition, soit de réaliser prudemment une hémitransposition qu’on associe à un recul du droit médial, éventuellement ajustable, et/ou un plissement ou résection du droit latéral et/ou une injection de toxine botulique dans le droit médial.
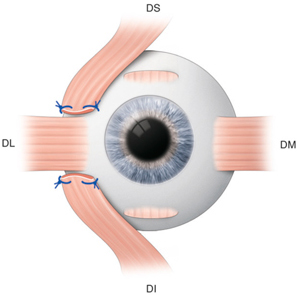
Fig. 17-68 Transposition totale des droits supérieur et inférieur selon O’Connors.
Les myopes forts peuvent développer une forme de strabisme progressif devenant majeur et considéré jusqu’à présent comme irréductible (strabismus fixus) (fig. 17-69). Ces strabismes avaient été bien analysés par Magnard et Hugonnier [10], mais c’est avec le développement de l’imagerie orbitaire qu’on a mieux analysé leur cause. On a d’abord insisté sur le conflit de volume entre l’orbite de taille normale et un globe allongé, volumineux, perdant ses facultés de mobilité habituelle. On a surtout mis en évidence un réel conflit entre le volume du globe et celui de l’orbite, surtout une tendance à l’extrusion de la partie postérieure du globe entre droits supérieur et latéral, hors du cône musculaire. Le droit supérieur est ainsi refoulé en nasal et perd son action élévatrice pour devenir adducteur. Le droit latéral est refoulé en bas, perd son action abductrice pour devenir abaisseur. Le droit médial, n’ayant plus d’antagoniste, se rétracte progressivement. Tous ces phénomènes expliquent les grandes déviations en ésotropie et hypotropie dans le cadre de myopies fortes, parfois dénommées « syndrome de l’œil lourd ».
Krzizok et Kaufmann (1997) [13] ont été les premiers à proposer de tenter de remettre ces muscles dans leur plan d’action par des myopexies. Cette idée a été reprise et modifiée, notamment par Yokohama [42] à qui l’on doit les principes de la technique la plus utilisée actuellement et qui a montré des résultats excellents au prix d’un risque modéré sur ces globes très fragiles [28, 34, 38].
Lors de l’intervention, le trajet très inférieur du droit latéral et le trajet nasal du droit supérieur sont évidents à l’inspection. L’insertion sclérale de l’oblique inférieur dépasse même le plus souvent le bord supérieur du droit latéral.
La technique chirurgicale consiste à ligaturer la moitié temporale du droit supérieur avec la moitié supérieure du droit latéral en rétroéquatorial (au niveau de la poulie qu’on identifie facilement, entre 16 mm et 19 mm de l’insertion des muscles) (fig. 17-70). Cela crée un éventail musculaire repoussant le globe à l’intérieur du cône musculaire et permet de remettre ces muscles dans leur plan d’action physiologique. Nous utilisons pour cela la même suture que pour les fixations postérieures, soit un monofilament de Nylon 5/0. On associe le plus souvent un recul réglable du droit médial, car celui-ci est le plus souvent très rétracté. L’efficacité de ce recul associé au sanglage des droits supérieur et latéral est évaluée autour de 7 ? par millimètre de recul. Outre son efficacité remarquable, cette technique a l’avantage, chez ces patients aux globes oculaires très distendus, avec une sclère mince, de ne pas nécessiter de positionner de suture sur la sclère en arrière de la spirale de Tillaux.
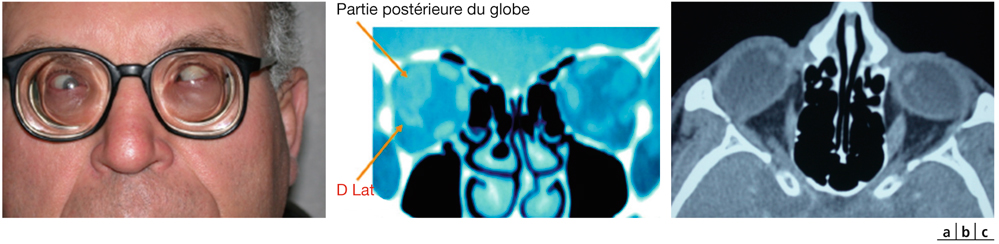
Fig. 17-69 Myopie forte.
a. Strabismus fixus. b, c. Extrusion de la partie postérieure du globe hors du cône musculaire, refoulant droits supérieur et latéral. La physiologie de ces deux muscles est donc totalement bouleversée.
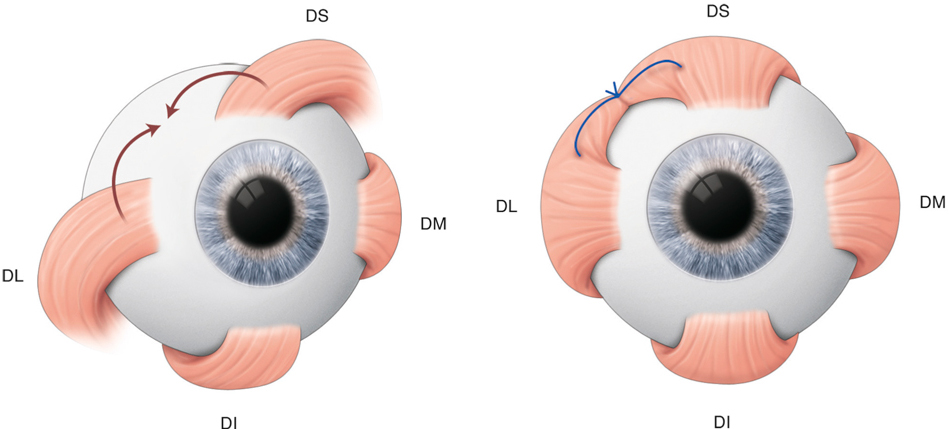
Fig. 17-70 Myopie forte.
Sanglage de la moitié supérieure du droit latéral et temporal du droit supérieur, au niveau de leur poulie, afin de les étaler en éventail devant le quadrant temporal supérieur et de permettre la réintégration du globe dans le cône musculaire, et de remettre ces muscles dans leur plan d’action.
Certaines très grandes déviations résistent à la chirurgie, avec récidive systématique de la déviation. Il existe le plus souvent une fibrose musculaire irréductible. Ces situations nécessitent d’utiliser des techniques chirurgicales d’exception. Il s’agit le plus souvent de situations de grandes exotropies secondaires, de pathologies musculaires primitives ou iatrogènes, parfois congénitales, ou enfin de déviation secondaires à une cécité monoculaire (strabismes sensoriels).
La désinsertion simple du muscle sans réinsertion a été proposée, mais une récidive de l’exotropie est le plus souvent notée car le muscle rétracté se réinsère sur le globe.
Velez a proposé de suturer le muscle rétracté et fibreux au périoste adjacent afin d’éviter sa réinsertion sur le globe [40].
Les sutures de traction [25] permettent de maintenir le globe dans la direction qu’il ne pouvait atteindre en préopératoire, et d’éviter ou limiter la récidive immédiate de la déviation. Elles sont retirées au bout de quelques jours.
L’élastopexie permet de créer une contre-tension en suppléant un muscle totalement paralysé et hypoactif. Elle consiste à placer une bandelette silicone entre l’insertion sclérale de ce muscle et le périoste adjacent et de la tendre de manière adéquate pour résister à la rétraction de l’antagoniste homolatéral. Proposée initialement par Woillez (1977), la technique a été reprise par A. Scott en 1992 [30].
[1] Bouchut P. Les ésotropies récidivantes. Études statistiques d’une série de 217 cas (Thèse). Nantes, UER de médecine, 1993.
[2] Christiansen S, Madhat M, Baker L, Baker R. Fiber hypertrophy in rat extraocular muscle following lateral rectus resection. J Pediatr Ophthalmol Strabismus, 1988 ; 25 : 167-171.
[3] Clark RA, Isenberg SJ, Rosenbaum AL, Demer JL. Posterior fixation sutures: A revised mechanical explanation based on rectus extraocular muscle pulleys. Am J Ophthalmol, 1999 ; 128 : 702-714.
[4] Cüppers C. The so-called “Fadenoperation” (surgical considerations by well defined changes of the arc of contact). In : The 2nd Congress of International Strabismological Associations. Fells P (ed.). Diffusion Générale de librairie, 1976 : 395-400.
[5] Demer JL, Miller JM, Poukens V, Vinters HV, Glasgow BJ. Evidence for fibromuscular pulleys of the recti extraocular muscles. Invest Ophthalmol Vis Sci, 1995 ; 36 : 1125-1136.
[6] Demer JL, Miller JM, Poukens, V. Surgical implications of the rectus extraocular muscle pulleys. J Pediatr Ophthalmol Strabismus, 1996 ; 33 : 208-218.
[7] Grut HE. A contribution of the pathogeny of concomitant squinting. Trans Ophthalmol Soc UK, 1890 ; 10 : 1.
[8] Helveston EM. Surgical management of strabismus. 5th edition. Oostende, Wayenborgh JP, 2005.
[9] Hugonnier R, Hugonnier S. Strabismes hétérophories, paralysies oculomotrices. 4e edition. Paris, Masson, 1981 : 51-52.
[10] Hugonnier R, Magnard P. Les déséquilibres oculo-moteurs observés en cas de myopie forte. Ann Ocul (Paris), 1969 ; 202 : 713-724.
[11] Kayser Ch. Traité de physiologie. Tome II : Système nerveux. Muscle. 2e édition. Paris, Flammarion, 1969.
[12] Kaufmann H. Strabismus. Stuttgart, Thieme, 2004.
[13] Krzizok TH, Kaufmann H, Traupe H. New approach in strabismus surgery in high myopia. Br J Ophthalmol, 1997 ; 81 : 625-630.
[14] Kushner BJ. How do recessions and resections of extraocular muscles work? J AAPOS, 2006 ; 10 : 291-292.
[15] Miller AM, Mims JL 3rd. The influence of pulleys on the quantitative characteristics of medial rectus muscle recessions: the torque vector model. J AAPOS ; 2006 ; 10 : 318-323.
[16] Péchereau A. Le signe d’anesthésie et le test d’élongation musculaire dans les ésotropies primitives. In : Les ésotropies. XXIe Colloque de Nantes (1996). Édition Péchereau et Richard pour FNRO, Nantes, 2004 : 75-82.
[17] Péchereau A, Quéré M-A, Oger-Lavenant F. Le signe d’anesthésie et le test d’élongation musculaire dans les strabismes divergents. In : Les exotropies. XVIIIe Colloque de Nantes (1993). Édition Péchereau et Richard pour FNRO, Nantes, 2003 : 63-70.
[18] Péchereau A. Évaluation peropératoire des strabismes. In : Espinasse-Berrod M-A (éd.). Strabologie : approches diagnostique et thérapeutique. Paris, Elsevier, 2004 : 245-250.
[19] Quéré M-A, Péchereau A, Clergeau G. Opération du Fil et chirurgie classique dans les ésotropies fonctionnelles. Clinique Ophtalmologique. Paris, Martinet Ed., 1978 : 184.
[20] Quéré M-A. Le traitement médical des strabismes. Nantes, Et regarde attentivement éd., 1990.
[21] Quéré M-A. Physiopathologie clinique de l’équilibre oculomoteur. Paris, Masson, 1983.
[22] Rosenbaum A. In : Espinasse-Berrod M-A (éd.). Strabologie : approches diagnostique et thérapeutique. Paris, Elsevier, 2004.
[23] Rosenbaum AL, Santiago AP. Clinical strabismus management. Principles and surgical techniques. Philadelphia, WB Saunders, 1999 : 552-555.
[24] Roth A, Mülhendick H, De Gottrau P. La fonction de la capsule de Tenon revisitée. J Fr Ophtalmol, 2002 ; 25 : 968-976.
[25] Roth A, Speeg-Schatz C, Klainguti G, Péchereau A. Chirurgie oculomotrice. Chirurgie des strabismes et des nystagmus. Paris, Elsevier Masson, 2012 : 23-29.
[26] Roth A, Speeg-Schatz C. La chirurgie oculomotrice. Paris, Masson, 1995 : 24.
[27] Roth A. ESA Lecture. What’s at stake in infantile esotropia. In : Gomez de Llaño R (ed.). Trans 32nd meeting European Strabismological Association 2008, Münich : 7-20.
[28] Rowe FJ, Noonan CP. Surgical treatment for progressive esotropia in the setting of high-axial myopia. J AAPOS, 2006 ; 10 : 596-597.
[29] Scott AB, Alexander DE, Miller JM. Bupivacaine injection of eye muscles to treat strabismus. Br J Ophthalmol, 2007 ; 91 : 146-148.
[30] Scott AB, Miller JM, Collins CC. Eye muscle prosthesis. J Pediatr Ophthalmol Strabismus, 1992 ; 29 : 216-218.
[31] Scott AB. Botulinum toxin into extraocular muscles as an alternative to strabismus surgery. Ophthalmology, 1980 ; 87 : 1044-1049.
[32] Scott AB. Change of eye muscle sarcomeres according to eye position. J. Pediatric Ophthalmol Strabismus, 1994 ; 32 : 85-88.
[33] Spielmann A. Les strabismes. De l’analyse clinique à la synthèse chirurgicale. 2e edition. Paris, Masson, 1991.
[34] Sturm V, Menke MN, Chaloupka K, Landau K. Surgical treatment of myopic strabismus fixus: a graded approach. Graefes Arch Clin Exp Ophthalmol, 2008 ; 246 : 1323-1329.
[35] Thouvenin D, Lesage C, Norbert O, Chapotot E. Improved efficiency of posterior strapping when placed at the exact position of Medial Rectus Pulley in Purely Tonic Esotropias. Update on Strabismology. Proceedings of 11th International Strabismological Association Meeting. Istanbul. Turkey, SB Özkan, 2010 : 359-361.
[36] Thouvenin D, Norbert O, Chapotot E. Purely Tonic Esotropias or the interest the position of the eyes under anesthesia. Proceedings of 34th European Strabismological Association Meeting. Bruges, Belgique, O. Haugen, 2011 : 67-70.
[37] Thouvenin D, Norbert O. Intraoperative assessment of medial rectus pulley location in strabismus. Eur J Ophthalmol, 2013 ; 23 : 16.
[38] Thouvenin D. Oculomotricité, pathologie orbitaire et myopie forte. In : La sensorialité. XXXVe Colloque de Nantes (2010). A & J Péchereau éditeurs, pour FNRO Éditions, Nantes, 2011.
[39] Thouvenin D, Sotiropoulos M-C, Arné J-L, Fournié P-R. Esotropias that totally resolve under general anesthesia treated exclusively with bilateral fadenoperation. Strabismus, 2008 ; 16 : 131-138.
[40] Velez FG, Thacker N, Britt MT, Alcorn D, Foster RS, Rosenbaum AL. Rectus muscle orbital wall fixation: a reversible profound weakening procedure. J AAPOS, 2004 ; 8 : 473-480.
[41] Von Noorden GK, Campos EC. Binocular vision and ocular motility. Theory and management of Strabismus. 6th édition. St Louis, Mosby, 2002 : 566.
[42] Yokohama T, et al. The mechanism of development in progressive esotropia with high myopia. In 26th Meeting, European Strabismological Association. 2000. Barcelona, Spain : Lisse (Netherlands) : Sweets & Zeitlinger.
A. Péchereau
Dans le domaine de la thérapeutique, notre époque est caractérisée par des évolutions très contradictoires :
-
des exigences de plus en plus rigoureuses quant à la qualification des traitements, en particulier leur sécurité ;
-
une multiplication de traitements non validés ou reposant sur des bases scientifiques les plus minces.
Ces tendances sont le reflet de l’opposition entre la rigueur de la démarche scientifique qui laisse peu de choix quand à la stratégie thérapeutique — bien que les études PEDIG montrent qu’il est parfois difficile d’obtenir un consensus (cf. chapitre 6) — et la liberté que chaque patient souhaite garder pour lui-même ou pour ses enfants entre les diverses options thérapeutiques. Par ailleurs, et il faut bien en convenir, la sécheresse de la réponse scientifique ne répond pas aux angoisses légitimes du patient. Ces angoisses et ces incertitudes justifient pour certains patients et thérapeutes une approche que l’on pourrait qualifier de « magique » (approche très valorisante pour le thérapeute). D’autant plus que les ignorances et incertitudes de la démarche scientifique, et les bénéfices de l’effet placebo ouvrent un champ où les deux approches se superposent parfois.
Par ailleurs, on ne peut que constater une perte de l’empathie pour le patient de certains thérapeutes (le meilleur marqueur de cette empathie étant le temps consacré à son patient). Cette perte contraste avec les capacités souvent remarquables d’empathie chez les tenants d’une médecine plus « magique ».
Dans cet espace et du fait de l’attente de certains patients et thérapeutes, un certain nombre de méthodes se sont développées et se développent de façon incontrôlée et incontrôlable. Leur succès est imprévisible et dépend fortement de la personnalité de leur promoteur. Les motivations pour ces méthodes sont multiples, allant des plus nobles aux plus concrètes.
Toutefois, dans certains cas, fort rares, il s’agit de réelles nouveautés qu’un clinicien particulièrement intuitif a pu remarquer. C’est la raison pour laquelle toutes ces méthodes doivent faire l’objet d’une analyse critique rigoureuse et sans a priori.
Malheureusement, l’expérience montre que, quelle que soit la méthode, aucune ne disparaît jamais complètement. Il persiste toujours des pratiques très marginales. Nombre de ces méthodes, telles le phénix, renaissent de leurs cendres avec un habillage qui fait passer le « vieux cuit » comme de la nouveauté pour des esprits inattentifs ou mal formés.
Le nombre de méthodes utilisé dans le traitement de l’amblyopie et du strabisme est considérable. Il n’est pas possible d’en faire le tour. Le lecteur qui ne trouvera pas une méthode qu’il recherche dans cet article ou dans cet ouvrage se doit de penser de façon fort simple que celle-ci n’a pas été validée tant pour son efficacité et, ceci est encore plus important, pour son innocuité.
Nous nous limiterons à quelques aspects.
De cette méthode proposée par Berrondo en 1967, il ne reste pratiquement plus rien. Pour le traitement de l’amblyopie, l’occlusion a démontré sa très nette supériorité dans la phase initiale. Les pénalisations, unilatérale ou alternante, sont par ailleurs plus simples et efficaces pour la phase d’entretien.
Pour le traitement du strabisme (fig. 17-71), aucune étude n’a pu montrer la pertinence de ces choix.
Il persiste deux indications où elle reste une option thérapeutique (non supérieure aux autres méthodes) :
-
la prise en charge du nourrisson strabique avant l’âge de la marche présentant une ésotropie à grand angle. Cependant, la remarquable efficacité de la toxine botulique rend son utilisation de plus en plus rare et très occasionnelle ;
-
le traitement de la diplopie de l’adulte lorsque celle-ci est limitée à une zone précise et périphérique de l’espace. Cette méthode peut être intéressante dans l’attente d’une guérison spontanée ou avant un geste chirurgical.
Cette méthode restée franco-française après une phase d’enthousiasme est en train, tout doucement, d’être abandonnée du fait de l’absence de validation.

Fig. 17-71 « Secteurs », dont la finalité est mystérieuse.
La pratique quotidienne montre que cette méthode est actuellement dans sa phase ascendante.
Elle consiste à faire des saccades à l’aide de différents systèmes de stimulation. La consultation de différents sites Internet montre que des matériels des plus simples aux plus sophistiqués sont proposés. Elle est louée par certains orthoptistes. Cependant, la littérature est vide d’études contrôlées. Cette technique soulève de multiples questions.
On sait que le sujet normal lorsqu’il est soumis à un entraînement intensif de saccades raccourcit son temps de latence et améliore sa performance. Cet effet n’est spécifique que pour les saccades d’entraînement et n’existe pas pour les autres saccades : il suffit de changer un des paramètres de la saccade pour qu’il disparaisse. De plus, cet effet disparaît relativement rapidement avec le temps.
L’observateur ne peut en même temps surveiller si l’objet fixé est vraiment fixé au départ et à l’arrivée de la saccade.
On sait que tout mouvement dont la vitesse est supérieure à environ 40° par seconde déclenche une saccade. Par ailleurs, toute saccade est précédée et s’accompagne d’une dépression perceptive (pour les amoureux du football, c’est sans doute une des multiples explications qui empêchent les arbitres de bien juger le hors-jeu). L’observateur se trouve devant un choix difficile : soit il s’approche et la vitesse du mouvement va lui déclencher une saccade qui empêche une analyse précise du mouvement, soit il s’éloigne et la précision de sa propre vision ne permettra pas une analyse fine.
On sait que le système visuel humain réalise 50 000 à 100 000 saccades par jour. Une journée de 24 heures (sans sommeil) comprend 86 400 secondes. On peut donc estimer qu’un sujet réalise une saccade à la seconde. De ce fait, dans cet océan de saccades, on a de la difficulté à comprendre comment 200 saccades par semaine (versus 350 000 à 700 000) pourraient changer la motricité oculaire.
Il est de ce fait légitime de demander aux promoteurs de cette méthode que des études fondées sur des protocoles rigoureux soient réalisées avant qu’elle soit proposée comme méthode thérapeutique validée.
Pour certains, l’utilisation d’un écran d’ordinateur semble la panacée dans la prise en charge des troubles fonctionnels (amblyopie, insuffisance de convergence, etc.) de la vision. Là encore, si ce n’est l’attrait de la modernité, il faut s’interroger sur cet enthousiasme.
En effet, il me suffit de comparer successivement l’image de mon écran d’ordinateur et la vue par ma fenêtre pour constater combien la première est pauvre tant sur le plan des réseaux que sur le plan chromatique par rapport à la seconde.
De ce fait, il est actuellement illusoire d’espérer une information plus pertinente et plus complexe que l’image « naturelle » auquel l’œil depuis des millions d’années s’est adapté par le biais de la sélection naturelle.
De même la stéréopsie [9] induite par les anaglyphes et les systèmes de vision en relief (d’ailleurs basés sur les mêmes techniques) n’induisent pas une stéréoscopie naturelle mais une stéréoscopie artificielle (d’où le nom de stéréopsie). Les principes physiques qui gèrent cette stéréopsie font que la stéréopsie augmente avec la diminution de l’écart interpupillaire à l’inverse de la stéréoscopie naturelle.
La vision d’un espace naturel reste la stimulation la plus pertinente pour le système visuel. Cette situation devrait perdurer pendant de longues années. Il faut que les thérapeutes en conviennent. L’échec du CAM stimulator au début des années quatre-vingt est là pour nous le rappeler.
Elle fait l’objet d’un débat d’une rare intensité outre-Atlantique. On constate que ces approches thérapeutiques commencent à s’étendre en France. Pourtant, l’évaluation de cette méthode fait l’objet de publications régulières [5] des Section on Ophthalmology and Council on Children with Disabilities, American Academy of Ophthalmology, Association for Pediatric Ophthalmology and Strabismus, and American Association of Certified Orthoptists. Cette évaluation aboutit à une conclusion répétée de nombreuses fois : « Il n’y a aucun argument prouvant que les enfants qui participent à ce traitement aient de meilleures réponses aux instructions éducatives que les enfants n’y participant pas. »
Par ailleurs, il faut noter que l’effet délétère de ces thérapeutiques dans certaines circonstances a été démontré, tant dans la dyslexie [2, 4, 6, 11], les dyspraxies [10] que les troubles neurovisuels chez l’enfant [3].
Pour tous les thérapeutes, il est donc nécessaire de se tenir parfaitement informé de l’évolution des connaissances dans ces domaines [7, 8, 12] et de ne proposer que des méthodes thérapeutiques validées.
Tout au long de ce bref article, plusieurs méthodes ont été évoquées. De nombreuses autres méthodes (ostéopathie, aimants, etc.) ont été oubliées. La question du pourquoi de ces méthodes et de leur développement se pose. Nous avons vu déjà un certain nombre de ces raisons. Chez l’enfant, il faut bien souligner l’importance de la demande parentale pour ces jeunes patients parfois en difficulté. Le caractère profondément normalisateur de notre société, dont l’institution scolaire dans son évolution en est une représentation caricaturale, fait que les parents expriment des demandes de plus en plus importantes.
Cependant, il paraît nécessaire de rappeler aux thérapeutes que si un projet thérapeutique peut être inefficace, cela ne garantit pas son innocuité. La devise première de la médecine reste « primum non nocere ». Celle-ci rentre parfois en opposition avec une certaine vision prométhéenne de la médecine et de certains de ses acteurs. La constitution et le suivi de protocoles rigoureux d’évaluation sont là pour empêcher ces dérives.
[1] Berrondo P. Contribution à l’étude du traitement de l’amblyopie fonctionnelle par changement de dominance oculaire. Bull Soc Ophtalmol Fr, 1967 ; 67 : 569-580.
[2] Chaix Y. Dyslexie. 7e JOI. Ophtalmopédiatrie. Strabismes de l’enfant. Toulouse, 24 septembre 2011.
[3] Chokron S. Les troubles neurovisuels chez l’enfant. Colloque : les « DYS ». Nantes, les 25 et 26 septembre 2009.
[4] Demonet J-F. Cerveau et dyslexie. Colloque : les « DYS ». Nantes, les 25 et 26 septembre 2009.
[5] Handler SM, Fierson WM. Learning disabilities, dyslexia, and vision. Pediatrics, 2011 ; 127 : e818-e856.
[6] Jucla M. Méthodes de rééducation de la dyslexie. Colloque : les « DYS ». Nantes, les 25 et 26 septembre 2009.
[7] Landerl K, Ramus F, Moll K, Lyytinen H, Leppänen PH, Lohvansuu K, O’Donovan M, Williams J, Bartling J, Bruder J, Kunze S, Neuhoff N, Tóth D, Honbolygó F, Csépe V, Bogliotti C, Iannuzzi S, Chaix Y, Démonet J-F, Longeras E, Valdois S, Chabernaud C, Delteil-Pinton F, Billard C, George F, Ziegler J-C, Comte-Gervais I, Soares-Boucaud I, Gérard CL, Blomert L, Vaessen A, Gerretsen P, Ekkebus M, Brandeis D, Maurer U, Schulz E, Van der Mark S, Müller-Myhsok B, Schulte-Körne G. Predictors of developmental dyslexia in European orthographies with varying complexity. J Child Psychol Psychiatry, 10 Dec. 2012. doi : 10.1111/jcpp.12029.
[8] Lobier M, Zoubrinetzky R, Valdois S. The visual attention span deficit in dyslexia is visual and not verbal. Cortex, 2012 ; 48 : 768-773.
[9] Rémy C. La stéréoscopie. In : La sensorialité. XXXVe Colloque de Nantes (2010). FNRO, Nantes, 2011 : 99-103.
[10] Vaivre-Douret L. Dyspraxie développementale et troubles de l’acquisition de la coordination : aspects théoriques et cliniques. Colloque : les « DYS ». Nantes, les 25 et 26 septembre 2009.
[11] Valdois S. Attention et dyslexie Colloque : les « DYS ». Nantes, les 25 et 26 septembre 2009.
[12] Wahlberg-Ramsay M, Nordström M, Salkic J, Brautaset R. Evaluation of aspects of binocular vision in children with dyslexia. Strabismus, 2012 ; 20 : 139-144.