E. Bui Quoc, P. Lebranchu, A. Péchereau, Ch. Rémy
Avertissement
Il n’est pas question ici de faire un traité de physiologie visuelle sensorielle et motrice, qui nécessiterait bien plus qu’un volume mais une véritable encyclopédie, mais de tenter d’intéresser le lecteur en rappelant de façon bien incomplète et non exhaustive des notions physiologiques simples utiles au strabologue. Quel aurait été l’intérêt d’exposer ou de réexposer un catalogue de notions soit connues car répétées tant de fois, soit inconnues car complexes ou tout simplement exposées de façon rébarbative ? Être simple sans être simpliste, cela a été notre gageure. Que le lecteur nous pardonne nos raccourcis, mais qu’il prenne plaisir à parcourir cette partie souvent laissée de côté dans de nombreux ouvrages…
Et citons Claude Bernard :
« Les connaissances en physiologie sont les bases scientifiques indispensables au médecin ; par conséquent, il faut cultiver et répandre les sciences physiologiques si l’on veut favoriser le développement de la médecine expérimentale. Cela est d’autant plus nécessaire que c’est le seul moyen de fonder la médecine scientifique, et nous sommes malheureusement encore loin du temps où nous verrons l’esprit scientifique régner généralement parmi les médecins. »
Claude Bernard, Professeur au Collège de France
(Introduction à l’étude de la médecine expérimentale, 1865)
E. Bui Quoc, P. Lebranchu
La fovéola est la zone centrale de la rétine dont on peut établir une définition anatomo-fonctionnelle. Si la macula est cette « tache » (en latin) visible au centre du fond d’œil, la fovéa est une « excavation », un « trou », une « fosse » (toujours en latin). Notre fovéola serait donc la petite excavation du centre de la rétine, que les OCT désormais peuvent analyser presque aussi précisément que les coupes anatomiques.
La fovéola est la zone qui correspond à trois particularités anatomiques majeures :
zone avasculaire centrale ;
zone dépourvue de bâtonnets et donc où ne sont présents que des cônes ;
zone au sein de laquelle les photorécepteurs, qui ne sont que des cônes, sont dépourvus de pédicules, le pédicule étant la terminaison synaptique qui relie le photorécepteur aux cellules bipolaires (fig. 21-1) ; de fait, les pédicules prennent une orientation radiaire pour se connecter aux cellules bipolaires en dehors de la fovéola.
C’est au sein des segments externes des photorécepteurs que le stimulus visuel, sous forme de lumière c’est-à-dire de photons selon la théorie corpusculaire ou sous forme d’onde de longueur variable selon la théorie ondulatoire, va engendrer la transformation de ce signal en signal électrique après modification structurale (réversible) du pigment visuel [6].
Il existe de minimes différences dans la taille exacte de la fovéola selon la prise en compte de l’un des trois critères précédents mais, globalement, cette zone correspond à une zone d’un diamètre de 400 µm à 500 µm. La densité spatiale des cônes au centre de la fovéola atteint son maximum : 200 000 cônes/mm2, alors qu’elle chute à environ 80 000 cônes/mm2 en bordure de la fovéola. D’une part l’absence de vaisseaux et, d’autre part, la présence quasi unique des segments externes et internes des photorécepteurs permet au signal sensoriel de ne pas être parasité au sein de la fovéola.
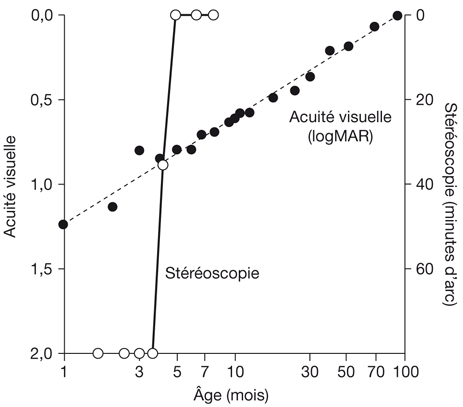
Ces caractéristiques (signal pur non parasité et densité des cônes) font de la fovéola la zone de vision la plus précise de la rétine et c’est en son sein que l’acuité visuelle maximale est atteinte. Rappelons qu’une acuité visuelle de 10/10 correspond à la discrimination de deux points distincts à contraste maximal (égal à 1, c’est-à-dire noir sur blanc) visible à 5 mètres (équivalent de l’infini) pour un angle de 1 minute d’arc (il y a 60 minutes d’arc dans un degré d’angle visuel). Ces considérations optiques corrélées à la taille des cônes et à leur densité au centre de la fovéola expliquent pourquoi l’acuité visuelle maximale (du fait de la distance entre deux cônes) n’est pas de 10/10 (0,0 LogMAR) mais de 20/10 (– 0,3 LogMAR) (fig. 21-2).
Au plan angulaire, la zone fovéolaire de 500 µm de diamètre correspond à un angle visuel d’environ 1,4°, soit environ 2,5 Δ — rappelons que l’équivalence entre degré et dioptrie prismatique est approximative et varie légèrement selon l’angle de déviation d’un strabisme, d’autant plus que l’angle est grand ; la dioptrie prismatique équivaut à une déviation du rayon émergent d’un centimètre à un mètre de distance, soit un rapport de 1/100 ; il s’agit d’une tangente trigonométrique, soit un facteur de 1,745 puisque tan 1 = 0,01745. Cette zone des deux degrés centraux est stratégique. C’est la zone du méridien vertical central ; c’est la zone dont les projections dans les hémisphères cérébraux vont être doubles : à la fois directes et croisées (cf. infra « Méridien vertical central et unification des deux hémichamps visuels par le corps calleux »).
L’acuité visuelle maximale n’est pas de 10/10 mais de 20/10. Dans le traitement d’une amblyopie, l’isoacuité est l’obtention de l’acuité visuelle maximale pour les deux yeux, ce qui nécessite de la mesurer avec des optotypes adéquats : il existe encore une amblyopie si l’œil amblyope a 10/10 alors que l’autre œil a 16/10.
La fusion des deux images nécessite que les deux images reçues par chacun des yeux soient fovéolaires. Ainsi, du fait de l’architecture anatomo-fonctionnelle de la fovéola, la marge du strabologue est ténue et le rétablissement de la rectitude des yeux à moins de 5 Δ en horizontalité est probablement nécessaire pour que les capacités fusionnelles permettent de rétablir une correspondance à 0° des deux fovéolas — en dehors du strabisme précoce, bien sûr.
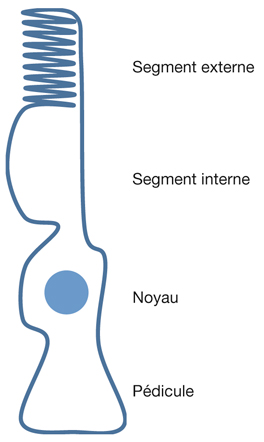
Fig. 21-1 Représentation schématique d’un cône.
Fig. 21-2 Densité fovéolaire des cônes et acuité visuelle maximale.
À droite, concentration maximale des cônes au niveau de la fovéola. L’angle correspondant à la distance entre deux cônes est 30 secondes d’arc, soit 0,5 minute d’arc. Cela explique que la vision maximale est de 20/10, la vision de 10/10 correspondant à 1 minute d’arc. L’angle minimum de résolution (MAR, Minimum Angle Resolution) est de 1 minute d’arc pour une vision de 10/10, soit 0 en LogMAR.
La rétine est le premier niveau d’intégration de l’information visuelle. C’est une obligation impérative de toute façon, contrainte par la simple nécessité de faire passer l’information visuelle reçue par cent millions de photorécepteurs à travers un câble (le nerf optique) d’un million de fibres…
Le lecteur se souvient de ses cours de physiologie d’un siècle ou d’un autre et doit imaginer la rétine selon son organisation en trois dimensions [7] :
d’une part, selon l’organisation radiaire : nous entendons par là l’organisation des photorécepteurs vers les cellules ganglionnaires en passant par les cellules bipolaires ;
d’autre part, selon l’organisation tangentielle, c’est-à-dire la structuration et l’orientation des axones des cellules ganglionnaires les uns par rapport aux autres.
Dans son organisation radiaire, la rétine est un circuit ou un réseau de neurones parfaitement organisé et agencé mais extrêmement compliqué. Trois classes principales de cellules se succèdent de la partie externe vers la partie interne. La partie externe est dirigée vers la sclère, la partie interne est dirigée vers le vitré. De l’extérieur vers l’intérieur (fig. 21-3), on retrouve :
les photorécepteurs : cônes et bâtonnets ;
les cellules bipolaires ;
les cellules ganglionnaires.
Ces cellules sont connectées entre elles par des connexions synaptiques. Il existe d’autres cellules au sein de la rétine : les cellules amacrines et les cellules horizontales. Comme chacun sait, l’information sensorielle visuelle traverse la rétine pour aller stimuler les photorécepteurs, puis cette information est décodée, intégrée et fait le chemin inverse pour revenir vers la partie interne de la rétine.
Le message visuel est composé de lumière, c’est-à-dire d’une radiation électromagnétique (onde/photon). La lumière visible, c’est-à-dire qui est captée par les photorécepteurs, va de 400 nm à 700 nm de longueur d’onde. Le stimulus a donc une longueur d’onde, une intensité lumineuse, mais aussi un contraste, un mouvement. Il existe un premier traitement de l’information au niveau de la rétine, des photorécepteurs aux cellules bipolaires. Les afférences synaptiques entre les photorécepteurs et les cellules bipolaires se font par deux voies : directe et indirecte, correspondant à une opposition centre/périphérie, avec ainsi des champs récepteurs « centre ON »/« périphérie OFF » ou l’inverse. Le second traitement de l’information au niveau de la rétine se fait des cellules bipolaires aux cellules ganglionnaires. Le message est transmis des cellules bipolaires aux cellules ganglionnaires qui présentent la même organisation ON/OFF ou OFF/ON. Il existe différents types de cellules ganglionnaires : on en trouve trois types dans la rétine du chat (selon la taille du corps cellulaire et des arborisations dendritiques) : α, β et γ ; chez le macaque comme chez l’homme, on trouve de grandes cellules de type M (magnus) et de petites cellules de type P (parvus). Elles correspondent à deux voies :
la voie M, pour laquelle les champs récepteurs sont grands et pour laquelle les cellules traitent des informations de faible contraste et participent à la détection du mouvement ;
la voie P, pour laquelle les champs récepteurs sont petits et pour laquelle les cellules traitent des informations colorées, de la forme et des détails.
Les bâtonnets fonctionnent en ambiance dite « scotopique » (pour faire simple : la pénombre) avec une saturation de leur activité à mesure que la luminosité augmente. En revanche, les cônes voient leur activité augmenter au fur et à mesure que la luminosité augmente, avec des seuils de saturation beaucoup plus élevée. Ceci explique que :
la nuit, l’acuité visuelle est physiologiquement limitée à 3/10 ou 4/10, car seuls les bâtonnets fonctionnent ;
le jour (en ambiance dite « photopique »), la fonction visuelle peut atteindre son maximum 12/10,16/10, 20/10, car les cônes fonctionnent alors.
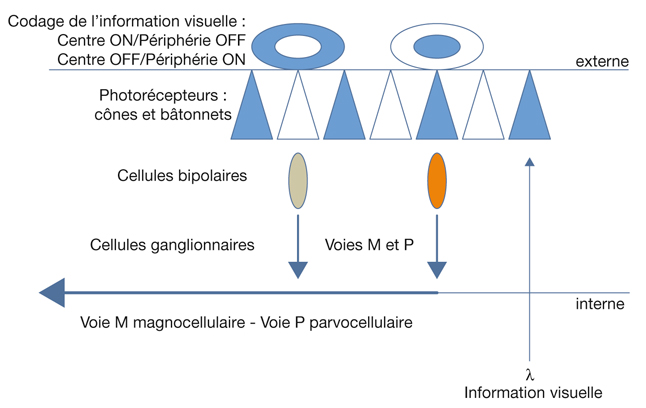
Fig. 21-3 Architecture radiaire de la rétine.
Dans son organisation tangentielle, il existe une systématisation dans l’orientation des axones des cellules ganglionnaires qui vont former le nerf optique. Les fibres des quadrants nasal supérieur et nasal inférieur chemine de façon directe vers le nerf optique, de même que le faisceau interpapillomaculaire. Les axones des quadrants temporaux prennent une orientation d’autant plus arquée qu’ils sont proches de la macula qu’ils contournent. Cette organisation point par point est conservée au niveau du nerf optique : les fibres centrales correspondent au faisceau interpapillomaculaire alors que les fibres périphériques se répartissent autour de façon concentrique (fig. 21-4).
La bonne fonction sensorielle visuelle est le préalable à la bonne fonction motrice. Le message visuel est traité au sein de la rétine par un réseau neuronal qui aboutit à deux voies principales dites magnocellulaire et parvocellulaire, traitant plutôt de l’information en mouvement et de faible contraste, et de l’information statique, de fort contraste et de résolution spatiale fine, respectivement.
La rétine a une organisation spatiale aboutissant à des fibres ganglionnaires et du nerf optique en cinq faisceaux : un faisceau interpapillomaculaire et un faisceau pour chaque quadrant rétinien.
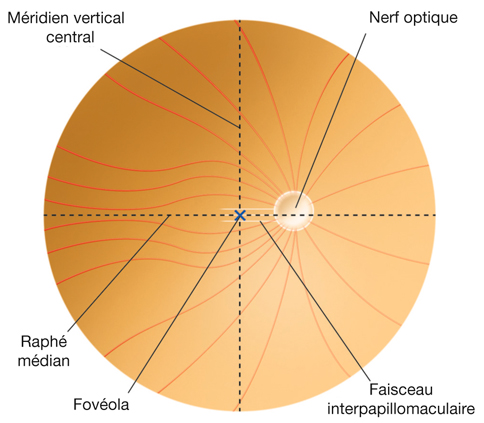
Fig. 21-4 Architecture tangentielle de la rétine.
E. Bui Quoc
Le champ récepteur d’une cellule du système visuel (quel que soit l’étage étudié) peut être défini comme la région de la rétine au niveau de laquelle une variation de la stimulation lumineuse (stimulus positif ou négatif) entraîne une modification du potentiel membranaire de la cellule [8]. Sur la figure 21-5, on retrouve une schématisation d’une étude électrophysiologique dans le cortex visuel d’un mammifère. Une microélectrode reliée à une chaîne d’enregistrement est introduite dans le cortex visuel dans une zone précise et connue, selon des repères stéréotaxiques — c’est-à-dire que la tête de l’animal est fixée dans un plan précis de telle sorte que l’expérimentateur sait, lorsque le cerveau est découvert, que tel endroit du cortex par rapport à des repères osseux va correspondre au cortex visuel 17 ou 18, dans une région centrale ou périphérique du champ visuel. La microélectrode permet d’enregistrer l’activité électrique évoquée d’un neurone ou d’un groupe de neurones du cortex visuel. Dans un tel paradigme expérimental, on peut stimuler visuellement un œil ou l’autre ou les deux. En effet si, pas exemple, la microélectrode se situe dans la couche IV du cortex visuel primaire où se trouvent des cellules monoculaires, il y aura une réponse à la stimulation d’un seul des deux yeux ; en revanche, si la microélectrode se situe dans la couche II/III du cortex visuel primaire où se situent des cellules binoculaires, elles répondront à la stimulation des deux yeux. On a donc un œil ipsilatéral à l’enregistrement et un œil controlatéral à l’enregistrement. Quelle que soit la zone étudiée (IV ou II/III), la (ou les) cellule(s) ne va (vont) répondre — c’est-à-dire engendrer une activité électrique qu’on enregistre — que si la zone du champ visuel stimulé correspond à son (leurs) champ(s) récepteur(s). Ce champ récepteur correspond à une zone du champ visuel stimulé et, partant, à une zone rétinienne précise. Cette zone rétinienne correspond au champ récepteur. L’enregistrement peut être réalisé dans le cortex visuel primaire mais aussi à n’importe quel endroit du système visuel : corps géniculé latéral dorsal, cortex visuel secondaire, etc.
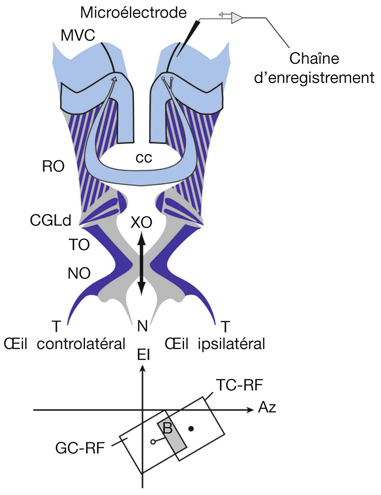
Fig. 21-5 Rétinotopie : de la rétine au cortex visuel.
La rétinotopie reflète une organisation particulière et précise des neurones visuels [8]. Ainsi, des cellules voisines de la rétine transmettent des informations à des sites voisins de leurs structures cibles, quelles qu’elles soient. Cependant, la rétinotopie ne correspond pas à une superposition exacte, car les cellules visuelles de la rétine ne représentent pas l’espace de la même façon : de même qu’au niveau du cortex moteur existe une surreprésentation de la main, il existe une surreprésentation de la macula dans les structures cérébrales impliquées dans la vision. La cartographie du champ visuel sur une structure cérébrale où l’on retrouve une rétinotopie est donc souvent déformée, car les cellules de la rétine ne représentent pas toutes l’espace visuel de façon proportionnelle. Sur la figure 21-6 sont représentés de façon schématique la rétine de l’œil droit et les cortex visuels droit et gauche. La rétine est artificiellement divisée en une zone maculaire, une zone moyenne et une zone périphérique. La rétine temporale (zones 1, 3, 5, 7, 9, 11) se projette de façon directe dans le cortex visuel droit. La rétine nasale (zones 2, 4, 6, 8, 10, 12) se projette dans le cortex visuel gauche. La rétinotopie est reflétée par le fait que les zones adjacentes d’une hémirétine se retrouvent adjacentes dans une même configuration au niveau de la carte rétinotopique corticale : par exemple, la zone 1 adjacente aux zones 3 et 5, la zone 11 adjacente aux zones 7 et 9.
La notion d’amplification maculaire provient du fait que la représentation des zones rétiniennes n’est pas proportionnelle au niveau du cortex, mais que — comme on le devine sur la figure 21-6 — la zone maculaire a une représentation disproportionnée par rapport aux autres zones plus périphériques.
Il existe une superposition au niveau cortical :
de la carte rétinotopique rétinienne nasale de l’œil droit avec la carte rétinotopique temporale de l’œil gauche, dans le cortex visuel gauche ;
de la carte rétinotopique rétinienne temporale de l’œil droit avec la carte rétinotopique nasale de l’œil gauche, dans le cortex visuel droit.
La rétinotopie est conservée en cas de strabisme car les cartes rétinotopiques sont présentes à la naissance. C’est pourquoi, en cas de déviation oculaire d’un œil par rapport à l’autre, les cartes rétinotopiques rétiniennes d’un œil ne se superposent pas avec les cartes rétinotopiques rétiniennes de l’autre œil au niveau cortical. Il y a :
soit diplopie ;
soit suppression de l’information en provenance d’un œil (d’où risque d’amblyopie).
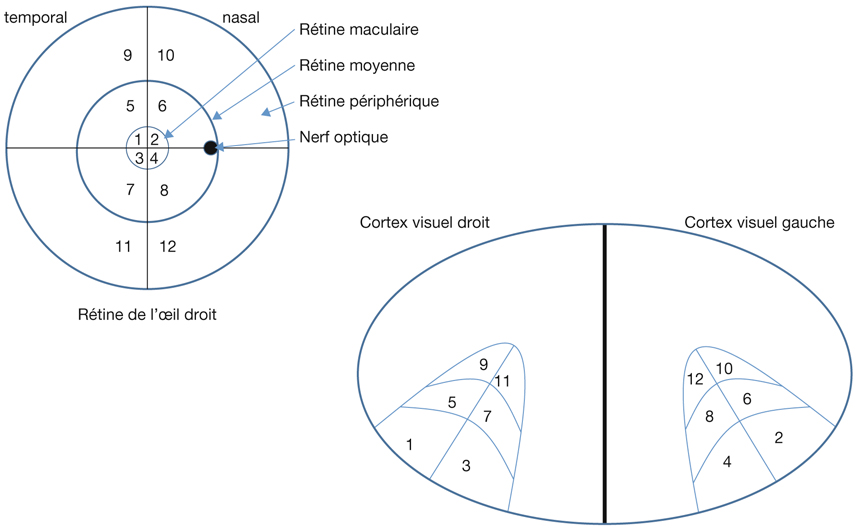
Fig. 21-6 Rétinotopie : amplification maculaire.
La scène visuelle est d’une richesse extrême. Le physiologiste va lui attribuer des propriétés (avec l’arrière-pensée de les relier aux propriétés fondamentales des neurones visuels qu’il va étudier) : localisation dans l’espace, orientation, fréquence spatiale (haute ou basse, c’est-à-dire détails fins ou plus grossiers, respectivement), contraste, direction de mouvement, binocularité, couleur [9], etc.
Tout cela est dans la figure 21-7 que nous présentons : cette vue de la baie de Sydney montre la ville dans la partie haute du champ visuel en opposition à la nature et la mer dans la partie basse, des détails des arbres du premier plan et des images plus flous des immeubles de la ville, un contraste du ciel bleu mais presque blanc lorsqu’on se rapproche de l’horizon, un mouvement des bateaux, une perspective, donc un relief, des couleurs bleus venant stimuler nos cônes de courtes longueurs d’onde et des couleurs vertes venant stimuler nos cônes de moyenne longueur d’onde…
Les psychophysiciens cherchant à étudier les capacités de reconnaissance visuelle définissent d’autres attributs, et cela pourrait être renouvelé à l’infini. Ainsi, Green et Wolfe en 2011 [5] définissent :
le caractère naturel (fig. 21-8) ou urbain (fig. 21-9) d’une scène visuelle ;
la profondeur importante (fig. 21-10) ou faible (fig. 21-11) ;
la « navigabilité », c’est-à-dire la possibilité pour le sujet d’imaginer qu’il puisse se mouvoir facilement ou pas sur la scène représentée, cette navigabilité pouvant être haute (fig. 21-12) ou faible (fig. 21-13) ;
le caractère éphémère bas (fig. 21-14) ou élevé (fig. 21-15) d’un paysage…
Les informations brutes à transformer en une perception significative (qui a du sens) sont donc innombrables et le système visuel accomplit des tâches très diverses telles que la lecture — tâche sensorielle, motrice…, mais bien différente selon qu’on lise des mots dans un alphabet occidental ou des idéogrammes extrême-orientaux — ou la reconnaissance des visages, pour laquelle il est défini des aires corticales particulières impliquées situées dans l’hémisphère droit : l’aire occipitale des visages (dans le lobe occipital inférieur), l’aire fusiforme des visages (qui constitue la partie centrale du gyrus fusiforme), l’aire des visages dans le sillon temporal supérieur. C’est l’IRM fonctionnelle qui a permis en particulier de mettre en évidence ces aires atteintes dans la prosopagnosie (affection caractérisée par l’impossibilité de reconnaître des visages) [11]. Mais comment définir un visage ? Comment imaginer qu’un neurone alpha ou bêta va savoir reconnaître ce doux visage dont le caractère de profil accentue la difficulté de reconnaissance (fig. 21-16). Quels attributs de cette image permettent la reconnaissance : le contour du visage, l’expression devinée, la couleur ou la texture de la chevelure ?
La fragmentation des attributs de la scène visuelle a plusieurs objectifs :
relier ce qu’enseigne la neurophysiologie qui étudie les différentes propriétés des neurones visuels (intégration du message au plan fondamental) à la réalité de la perception de l’image ;
envisager une « thérapeutique visuelle » adaptée, ciblée, voire optimisée dans le ou les traitements de l’amblyopie. C’est la base des théories de traitement de l’amblyopie par :
l’apprentissage perceptuel, dans lequel la signification des images est particulièrement étudiée pour obliger le sujet à une « réflexion visuelle » afin de déterminer le sens de l’image et, ainsi, stimuler sa mécanique visuelle de façon plus importante que par présentation d’une image plus basique ;
la stimulation différentielle haploscopique entre les deux yeux, les attributs en particulier binoculaires des scènes visuelles présentées étant séparés entre les deux yeux (cf. « VI – Perspective d’avenir » au chapitre 6).
Ceci dit, pour conclure, les attributs de la scène visuelle sont si riches, si complexes que, dans le traitement de l’amblyopie, il suffit d’ouvrir l’œil — l’autre, l’œil sain, étant occlus — pour avoir une stimulation particulièrement riche de l’œil amblyope.

Fig. 21-7 Vue de la baie de Sydney : opposition de couleurs, perspectives, mouvements…

Fig. 21-8 Image de caractère naturel : les Alpes néo-zélandaises.

Fig. 21-9 Image de caractère urbain : la ville d’Auckland en Nouvelle-Zélande.

Fig. 21-10 Image en perspective et large profondeur : un torrent qui devient rivière.

Fig. 21-11 Image en faible profondeur : des paillettes de soufre.

Fig. 21-12 Image de haute navigabilité : une route se perdant dans les montagnes, quelque part dans l’hémisphère sud.

Fig. 21-13 Image de faible navigabilité : une forêt inextricable.

Fig. 21-14 Image de caractère éphémère bas : Ayers Rock en Australie.

Fig. 21-15 Image de caractère éphémère élevé : un bloc du glacier Perito Moreno se rompt dans le Lago Argentino.

Fig. 21-16 De la difficulté de la reconnaissance d’un visage…
L’accommodation correspond à une modification dynamique du pouvoir dioptrique de l’œil permettant de garder net le point de focalisation de l’image sur la rétine, quelle que soit la distance entre l’œil et l’objet [4, 10, 12]. Cette modification du pouvoir dioptrique de l’œil en fonction de la distance passe par une modification de la forme du cristallin. L’accommodation est une réaction physiologique, principalement déclenchée par la défocalisation de l’image sur la rétine (le flou rétinien), mais également par la convergence ou la sensation de proximité.
Considérons un œil emmétrope non accommodant : l’image d’un objet situé à l’infini (au-delà de 6 mètres) est projetée nette sur la rétine. Lorsque cet objet se rapproche, le pouvoir dioptrique de l’œil doit augmenter pour maintenir une image nette sur la rétine.
Un œil est défini comme emmétrope lorsque les rayons lumineux d’un objet situé à l’infini (optiquement, au-delà de 6 mètres) se focalisent sur la rétine sans l’aide d’une correction optique ni phénomène accommodatif. Son pouvoir optique est alors parfaitement adapté à sa longueur axiale, permettant de focaliser les rayons lumineux qui pénètrent par la cornée sur la rétine, en traversant la pupille et le cristallin. Pour un œil emmétrope regardant à l’infini, le pouvoir dioptrique est d’environ 63 δ, réparti pour environ deux tiers dans la cornée et pour un tiers dans le cristallin. Lorsque cet objet se rapproche, le pouvoir dioptrique de l’œil doit augmenter pour maintenir une image nette sur la rétine.
Le punctum remotum de l’œil au repos correspond au point le plus éloigné que l’œil voit net sans accommoder. Optiquement, il s’agit de l’intersection entre l’axe optique et les rayons lumineux qui, partant de la fovéola, traversent les dioptres cristalliniens et cornéens :
lorsque l’œil est emmétrope, ces rayons émergent de façon parallèle : le punctum remotum est situé à l’infini ;
lorsque l’œil est myope, ces rayons émergent de façon convergente : le punctum remotum est situé entre la cornée et l’infini ;
lorsque l’œil est hypermétrope, ces rayons émergent de façon divergente : le punctum remotum est virtuellement placé en arrière de l’œil.
Le punctum proximum correspond au point le plus proche vu net lorsque l’accommodation est maximale. Le parcours accommodatif correspond à la distance entre les punctum remotum et punctum proximum, zone de vision nette sur l’axe visuel. L’inverse de cette distance correspond au pouvoir accommodatif, exprimé en dioptries.
Les capacités d’accommodation se mettent en place dans les trois premiers mois. Elles sont d’emblée maximales et diminuent progressivement tout au long de la vie (fig. 21-17), passant progressivement de 18,5 δ à l’âge d’un an à moins de 1 δ après soixante ans. Cette diminution progressive est principalement due à la majoration de la rigidité cristallinienne. La presbytie correspond au moment de la vie où cette perte d’accommodation devient symptomatique, généralement lorsque le pouvoir accommodatif devient inférieur à 3 δ. Elle survient en général au cours de la cinquième décennie.
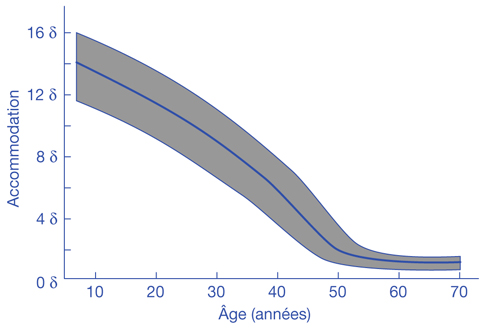
Fig. 21-17 Évolution de l’accommodation avec le temps : relation entre le pouvoir accommodatif exprimé en dioptries et l’âge en années.
(D’après Duane, 1922 [3]).
Le cristallin est composé de protéines solubles organisées autour d’un noyau puis d’un cortex, entouré d’une capsule élastique. Les fibres cristalliniennes qui le composent peuvent glisser les unes sur les autres. Il s’agit d’une structure déformable sphérique, dont le rayon de courbure est plus court sur la face postérieure (6 mm) que sur la face antérieure (6 mm au repos, 10 à 11 mm allongé). Le cristallin est suspendu par des centaines de fibres zonulaires, s’insérant de son équateur aux procès ciliaires. Au repos, le corps ciliaire exerce sur les fibres zonulaires une traction constante, imposant au cristallin une forme allongée. L’accommodation entraîne la contraction du muscle ciliaire (fig. 21-18), situé sous les procès ciliaires. Le diamètre du cercle musculaire zonulaire diminue, relâchant la traction des fibres zonulaires sur le cristallin. L’élasticité intrinsèque du cristallin lui permet alors de reprendre une forme sphérique, en augmentant principalement le rayon de courbure de sa face antérieure. Différents mécanismes simultanés permettent une augmentation du pouvoir réfractif cristallinien. La principale contribution est due à la modification de forme de la lentille cristallinienne, en particulier la variation du rayon de courbure de la capsule antérieure. Dans une moindre mesure, l’arrondissement asymétrique du cristallin vers l’avant déplace son centre optique antérieurement. Enfin, l’accumulation de fibres cristalliniennes sous la capsule antérieure augmente son indice de réfraction. Parallèlement, ces phénomènes s’accompagnent d’une diminution du diamètre pupillaire. Ce myosis diminue les aberrations optiques pénétrant dans le globe.
La désaccommodation est un mécanisme actif, correspondant anatomiquement aux phénomènes inverses. Le relâchement du muscle ciliaire diminue le diamètre du cercle musculaire ciliaire, augmente la tension des fibres zonulaires, allonge le cristallin en diminuant son rayon de courbure : le pouvoir dioptrique du cristallin est alors diminué.
L’accommodation est à la fois un mécanisme rapide (latence : 400 ms) mais pouvant se maintenir de façon prolongée. Le muscle ciliaire est un muscle lisse atypique, présentant des fibres musculaires dont la contraction rapide provoque des modifications brusques de la tension sur le cristallin. Il contient également des fibres musculaires toniques, qui se contractent plus lentement mais maintiennent une tension permanente des fibres zonulaires. Il est innervé par les fibres parasympathiques cheminant dans les nerfs ciliaires courts, qui provoquent sa contraction. Au contraire, les fibres sympathiques, cheminant dans le ganglion cervical supérieur, provoquent son relâchement. Les systèmes parasympathiques et sympathiques contrôlent respectivement l’accommodation et la désaccommodation. Les parasympathicomimétiques provoquent une contraction du muscle ciliaire et du sphincter de l’iris ; les parasympatholytiques (atropine, cyclopentolate…) inhibent le muscle ciliaire et le sphincter de l’iris.
La rigidité du cristallin augmente avec l’âge. L’amplitude d’accommodation diminue progressivement jusqu’à disparaître complètement durant la cinquantaine [2]. Au-delà, la lecture à mi-distance est essentiellement permise par la profondeur de champ secondaire à la contraction pupillaire, plutôt qu’à une réelle modification de courbure cristallinienne.
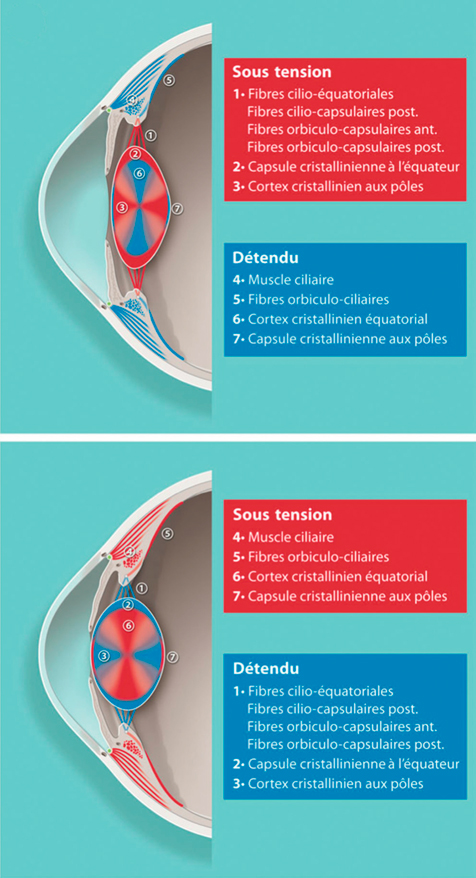
Fig. 21-18 Dynamique cristallinienne avant la presbytie.
(Source : Cochener B., Albou-Ganem C., Renard G., Rapport SFO, 2012 [2]).
L’information sensorielle (le stimulus visuel) qui arrive sur la rétine subit un traitement de l’information (rôle de décodeur et d’intégrateur de la rétine) avant d’être transmise au cerveau où se fait l’intégration du message (perception). La division en deux voies principales magnocellulaire et parvocellulaire évoquée plus haut (cf. « Architecture fonctionnelle de la rétine ») existe tout le long des voies visuelles vers le cortex visuel primaire en passant par le corps géniculé latéral dorsal, structure située sous le thalamus qui est le premier relais synaptique des axones des cellules ganglionnaires — système à trois neurones : un neurone ganglionnaire dont l’axone fait synapse avec un neurone du corps géniculé latéral dorsal dont l’axone va lui faire synapse avec un neurone du cortex visuel dans la couche IV.
L’étude anatomique de la couche des cellules ganglionnaires de la rétine montre qu’il existe trois types principaux de cellules (une vingtaine a été individualisée) [1] :
les cellules ganglionnaires P, dites « naines », de petite taille, dont l’axone est fin, qui vont constituer la voie parvocellulaire ;
les cellules ganglionnaires M, dites « parasols », de grande taille, dont l’axone est épais, qui vont constituer la voie magnocellulaire ;
parmi les nombreux types de cellules ganglionnaires non-M non-P, le plus souvent à champ récepteur de grande taille, les cellules ganglionnaires bistratifiées, qui sont à opposition de couleur bleu/jaune.
Lorsqu’on enregistre l’activité électrique évoquée de ces cellules (par électrophysiologie, par exemple), on réalise que les cellules ganglionnaires M ont un champ récepteur de grande taille, qu’elles répondent à un faible contraste (différentiel de luminosité entre « centre ON » et « périphérie OFF », ou l’inverse). Des cellules bipolaires font synapse avec elles. Au contraire, les cellules ganglionnaires P ont un champ récepteur de petite taille et l’opposition centre/périphérie du couple photorécepteur/cellule bipolaire qui lui est relié correspond à une opposition de couleur — cône de type M (medium, pour longueur d’onde moyenne « verte ») en opposition avec cône de type L (long, de longueur d’onde longue « rouge ») (fig. 21-19).
Ainsi, la voie des cellules ganglionnaires P est responsable de la vision des détails, des couleurs, des contrastes, alors que la voie des cellules ganglionnaires M est impliquée dans la détection du mouvement.
Il existe par ailleurs une voie accessoire dont le réseau correspond à des champs récepteurs de grande taille et à une opposition de couleur bleu/jaune, car en lien avec les cônes de type S (short) de longueur d’onde courte « bleue », en opposition avec les cônes L et M combinés.
Les axones des cellules ganglionnaires M, P et non M-non P sont ségrégés selon trois voies M, P et K et vont former synapse avec les neurones correspondants du corps géniculé latéral dorsal (CGLd) (fig. 21-20). Le CGLd comporte six couches de corps cellulaires séparées par des couches d’axones et de dendrites :
les deux couches ventrales sont composées des neurones dont le corps cellulaire est de taille relativement grande, d’où le nom de couches magnocellulaires (magnus, « grand ») ; leurs afférences proviennent des cellules ganglionnaires M ;
les quatre couches dorsales, nommées parvocellulaires, ont des neurones de petite taille (parvus, « petit ») qui reçoivent leurs afférences de cellules ganglionnaires de type P ;
la voie koniocellulaire correspond aux cellules ganglionnaires non M-non P qui projettent sur des cellules K (au corps cellulaire très petit : konio, « poussière ») à la face ventrale des couches magnocellulaires et parvocellulaires.
Il existe au niveau du CGLd une rétinotopie, une ségrégation entre les afférences venant de l’œil droit et de l’œil gauche.
Les deux ensembles magnocellulaire et parvocellulaire comportent des neurones dont les champs récepteurs ont des propriétés concentriques « centre ON » et « centre OFF », comme les cellules rétiniennes ganglionnaires. Une couche donnée du CGLd reçoit ses afférences uniquement de la rétine ipsilatérale (champ rétinien temporal) ou controlatérale (champ rétinien nasal). Ceci est la conséquence de la bifurcation des axones au niveau du chiasma. De ce fait, le CGLd d’un hémisphère reçoit les informations de la moitié opposée du champ visuel : hémichamp visuel droit pour le CGL gauche et respectivement hémichamp visuel gauche pour le CGL droit.
Comme les cellules ganglionnaires, les neurones P et M du CGLd possèdent des propriétés différentes. La principale différence réside dans la sensibilité au contraste de couleur. Les neurones P répondent aux changements de couleurs et peu aux changements de luminance des couleurs. Les neurones M répondent faiblement aux changements de couleur, mais sont très sensibles aux contrastes de luminance entre la partie sombre et la partie brillante du stimulus.
Le stimulus visuel est la somme permanente d’informations colorées et non colorées, statiques ou en mouvement, de détails et de figures plus grossières… Les voies M, P, K sont donc stimulées de façon combinée et simultanée en permanence ; la distinction de ces différentes voies est le fruit de l’expérimentation qui permet de décomposer les attributs élémentaires du stimulus visuel (taille, couleur, etc.). L’atteinte d’une voie ou l’autre de façon préférentielle ou précoce l’une par rapport à l’autre explique que dans les neuropathies optiques il y ait une dyschromatopsie ; dans la neuropathie optique glaucomateuse, l’atteinte plus précoce de la voie K explique l’intérêt du champ visuel bleu/jaune. Pour le strabologue, la compréhension de la systématisation fonctionnelle des voies visuelles peut paraître bien éloignée des préoccupations quotidiennes ; pour autant, la « décomposition » de l’information visuelle en divers attributs et l’atteinte des voies visuelles toute particulière dans l’amblyopie peuvent expliquer ce que décrit un amblyope dans son « ressenti » visuel : outre une baisse d’acuité visuelle variable, l’image perçue est parfois décrite comme déformée, non contrastée, « étrange »…
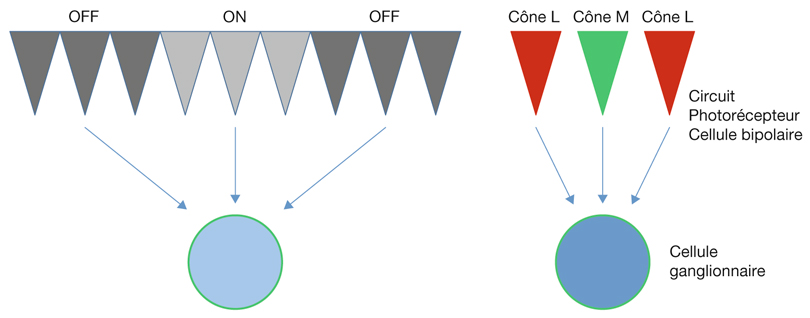
Fig. 21-19 Connectivité des cellules ganglionnaires. Schématisation des voies M et P.
a. Schématisation de la voie M : opposition à faible contraste centre/périphérie et grand champ récepteur. b. Schématisation de la voie P : opposition de couleur centre/périphérie et petit champ récepteur.
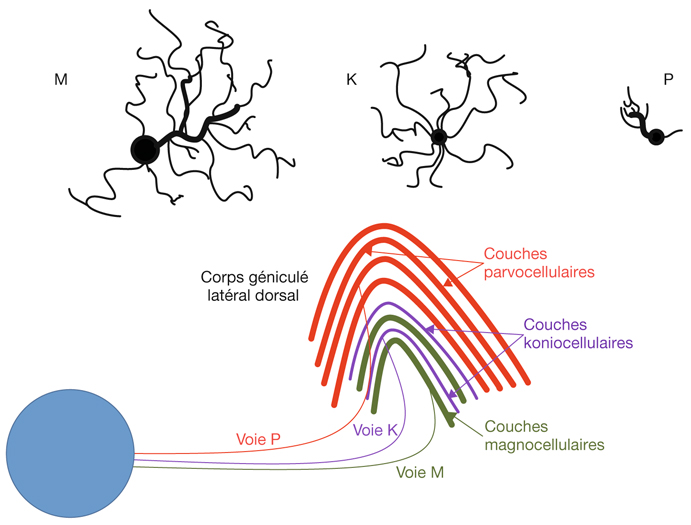
Fig. 21-20 Voies magnocellulaire, parvocellulaire, koniocellulaire.
[1] Bullier J, Barone P. Voies optiques intracrâniennes et lobe occipital : anatomie, fonction, développement. Encycl Méd Chir (Elsevier, Paris), Ophtalmologie, 21-008-A-40, 1997.
[2] Cochener B, Albou-Ganem C, Renard G. La presbytie. Rapport à la Société Française d’Ophtalmologie. Paris, Elsevier Masson, 2012.
[3] Duane A. Studies in monocular and binocular accommodation with their clinical applications. Am J Ophthalmol, 1922 ; Series 3, 5 : 865-877.
[4] Glasser A. Accommodation. In : Adler’s Physiology of the eye. 11th edition. Elsevier Saunders, 2011.
[5] Green MR, Wolfe JM. Global image properties do not guide visual search. J Vis, 2011 ; 11 : 1-9.
[6] Rodieck RW. Pluie de photons sur les cônes. In : La Vision. Bruxelles, De Boeck, 2003 : 68-101.
[7] Rodieck RW. Architecture fonctionnelle de la rétine. In : La Vision. Bruxelles, De Boeck, 2003 : 36-55.
[8] Rodieck RW. Voir. In : La Vision. Bruxelles, De Boeck, 2003 : 326-360.
[9] Ross MG, Oliva A. Estimating perception of scene layout properties from global image features. J Vis, 2010 ; 10 : 21-25.
[10] Roth A. Accommodation. In : La réfraction de l’œil : du diagnostic à l’équipement optique. Roth A, Gomez A, Péchereau A (éd.). Paris, Elsevier Masson, 2007.
[11] Sacks O. L’Œil de l’esprit. Paris, Le Seuil, 2012.
[12] Von Noorden GK, Campos EC. The near vision complex. In : Binocular vision and ocular motility. 6th edition. St Louis, Mosby, 2002 : 85-100.
Ch. Rémy
Le but de la correction optique est d’emmétropiser l’œil amétrope, c’est-à-dire de focaliser sur sa rétine l’image d’un objet situé à l’infini sans effort accommodatif de mise au point. En fait, il s’agit plutôt d’une compensation optique que d’une correction au sens strict, car le port de cette correction ne supprimera pas l’amétropie ni ne modifiera son évolution.
Un œil est dit emmétrope lorsque l’image d’un objet situé à l’infini se forme sur sa rétine sans effort accommodatif. Une véritable emmétropie ne peut s’affirmer qu’après cycloplégie. S’il existe un défaut de réfraction, la focalisation de l’image ne se fait plus sur la rétine : ce défaut réfractif constitue une amétropie (fig. 21-21).
L’œil amétrope est donc un œil dans lequel l’image d’un objet situé à l’infini ne se forme plus sur la rétine ; elle se forme soit en avant, œil myope (fig. 21-22 et 21-23), soit un arrière, œil hypermétrope (fig. 21-24 et 21-25). Selon que la focalisation se fait en un point ou en deux focales, l’amétropie sera stigmate ou astigmate (fig. 21-26).
La normalisation du système accommodatif en vision de loin est nécessaire à l’équilibre oculomoteur en stabilisant la vergence accommodative.
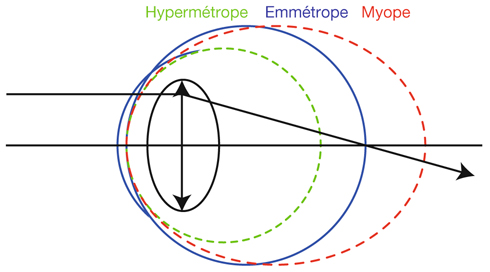
Fig. 21-21 L’œil amétrope.
Focalisation rétinienne : œil emmétrope (« bonne mesure ») ; focalisation antérieure : œil myope (trop long) ; focalisation postérieure : œil hypermétrope (trop court).
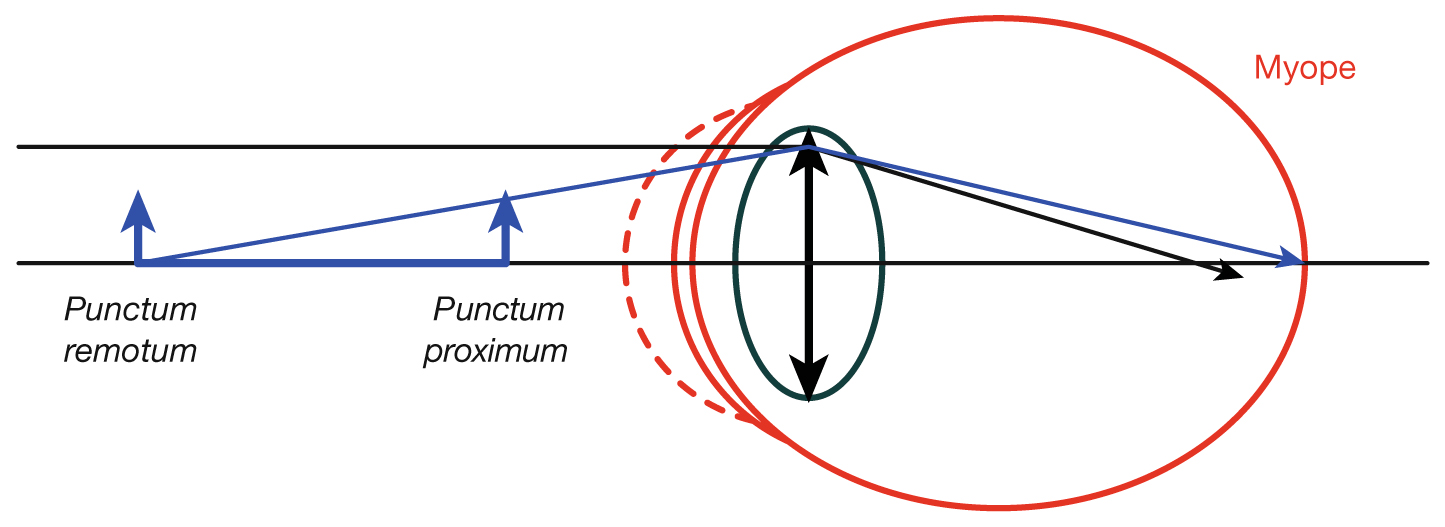
Fig. 21-22 La myopie (œil myope surconvergent).
Myopie de puissance : cornée trop bombée (par exemple, kératocône). Myopie d’indice : cristallin trop puissant (par exemple, cataracte nucléaire). Myopie axile : œil trop long.
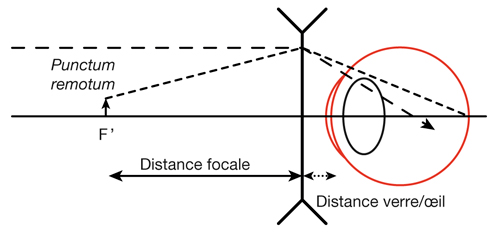
Fig. 21-23 Correction du myope. Le rayon infini se focalise en avant de la rétine. Le punctum remotum focalise sur la rétine. Principe de la correction : le punctum remotum est placé au foyer image F’ de la lentille et est projeté à l’infini.
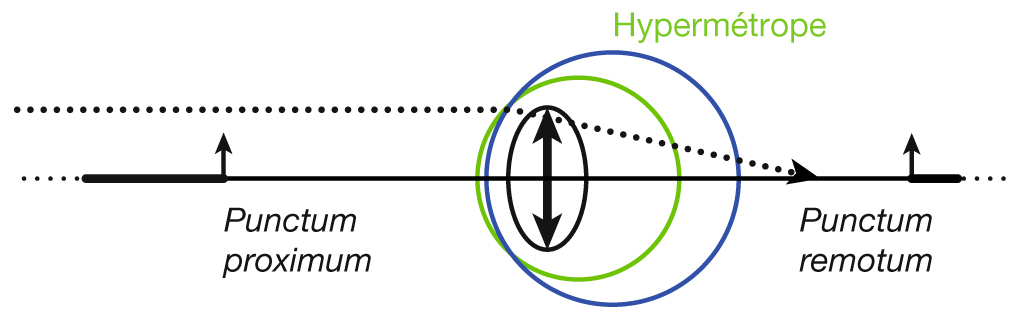
Fig. 21-24 L’hypermétropie (puissance optique insuffisante avec punctum remotum virtuel et punctum proximum éloigné).
Hypermétropie axile : œil trop court. Hypermétropie de puissance : œil aphaque et cornée plate.
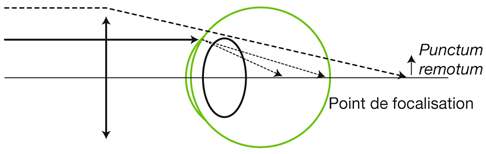
Fig. 21-25 Correction de l’hypermétropie. Le punctum remotum est virtuel en arrière de l’œil hypermétrope : le foyer image de la lentille convergente coïncide avec le punctum remotum virtuel en arrière de l’œil.
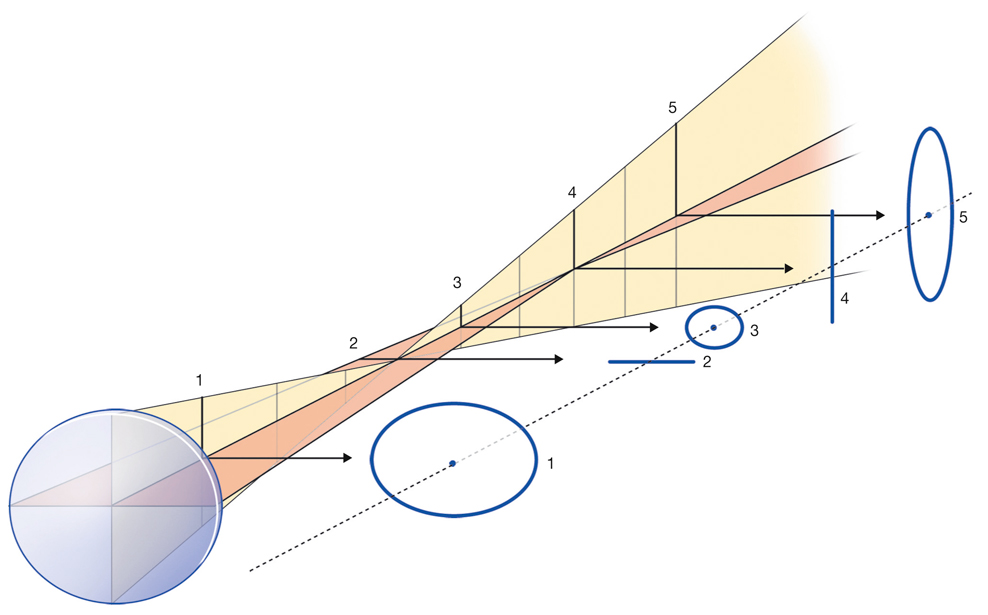
Fig. 21-26 L’astigmatisme : conoïde de Sturm (enveloppe des rayons réfractés après passage dans un dioptre astigmate).
Dans la figure présentée le méridien vertical est plus convergent que l’horizontal. Après la traversée du dioptre, les rayons « verticaux » vont converger plus rapidement que les « horizontaux », ce qui explique : (1) la section elliptique à grand axe horizontal ; (2) la première focale horizontale correspondant au méridien vertical le plus convergent ; (3) le cercle de moindre diffusion situé entre les deux focales ; (4) la deuxième focale verticale, correspondant au méridien horizontal le moins convergent ; (5) l’élargissement du faisceau dont la section elliptique est à grand axe vertical.
La prescription d’une correction optique a plusieurs buts :
compenser l’amétropie en focalisant les images sur la rétine et en permettant une perception nette des images, nécessaire en particulier au développement cérébral chez l’enfant ;
servir de support au traitement d’une éventuelle amblyopie par la mise en place de pénalisations optiques ;
compenser une déviation oculaire par l’incorporation de prismes (qui ne se fera qu’en cas de correction « aérienne »).
La compensation de l’amétropie comporte deux étapes :
déterminer la quantité d’amétropie à compenser : la connaissance objective de l’amétropie passe obligatoirement par une cycloplégie pharmacologique (cyclopentolate ou atropine collyre). Le principe de la correction optique totale en est toujours le but, autant que faire se peut. Il en existe quelques accommodements chez l’adulte jeune ;
le mode de correction : la correction dite « aérienne » par verres correcteurs placés dans une monture reste la plus fréquente ; c’est la seule manière de réaliser une correction prismatique ; plus tard, une correction par lentille de contact ou par chirurgie réfractive (cornéenne ou intraoculaire) sera discutée selon le contexte.
Lorsque l’amétropie est connue, il convient de mesurer l’acuité visuelle de chaque œil, dépistant ainsi une éventuelle amblyopie, unilatérale ou bilatérale, si une valeur seuil n’est pas obtenue.
Dès lors, la correction optique peut également participer au traitement de cette amblyopie, comme support de verres pénalisants.
La correction optique connaît différentes modalités de prescription selon l’âge du patient. Rappelons les quatre âges réfractifs :
l’enfant, chez lequel le système visuel se met en place : nécessité d’une focalisation rétinienne ;
l’adulte jeune où la correction de l’amétropie conduit à la « paix oculogyre » ;
le presbyte et ses troubles de l’accommodation ;
la personne âgée et ses troubles dégénératifs : cataracte, dégénérescence maculaire.
Le dogme de la correction optique totale reste intangible ainsi que celui de l’obtention et du maintien de l’isoacuité visuelle. C’est donc le problème du dépistage des défauts réfractifs, de celui de l’amblyopie et de son traitement. Les corrections par lunettes sont au premier plan.
Mentionnons deux cas particuliers :
les surcorrections bilatérales en double foyer ou verres progressifs chez les strabiques réfractifs normosensoriels ;
la surcorrection unilatérale de l’œil dominant qui maintient la prophylaxie de rechute de l’amblyopie et diminue le spasme accommodatif en vision de près.
La compensation de l’amétropie en totalité est à rechercher. Ce but n’est pas toujours aisé chez les hypermétropes jusqu’alors non corrigés : une correction progressive, aidée par l’instillation de cycloplégiques, aidera à atteindre la correction optique totale le plus rapidement possible afin d’assurer la stabilité oculomotrice (« paix oculogyre » de M.-A. Quéré [1]).
Les corrections aériennes sont largement utilisées, mais les corrections par lentilles de contact seront proposées chez les « allergiques à la lunette » ; la correction par chirurgie réfractive ne se fera qu’au cas par cas.
Elle marque un tournant dans la vie réfractive du patient, puisqu’il doit porter une correction en vision de près afin de suppléer sa déficience accommodative due à la sclérose de son cristallin (presbus, « vieux » ; opsis, « la vue »). C’est souvent l’âge de décompensation de vieux strabismes car les amétropies frustes non corrigées jusqu’alors sont révélées par la presbytie. Le principe de la correction optique totale s’applique toujours et suffit à résoudre grand nombre d’asthénopies.
Rappelons que le travail sur écran, s’il ne dégrade pas la vision, sert de révélateur aux amétropies légères, surtout astigmates, aux déséquilibres oculomoteurs latents, ainsi qu’aux syndromes secs a minima aggravés par la rareté du clignement devant l’écran.
La correction optique viendra en complément, soit par une implantation après chirurgie de la cataracte, soit sous forme d’aide visuelle par différents systèmes grossissants en cas de dégénérescence maculaire (type lunettes de Galilée, fig. 21-27).
En somme, nous retiendrons que la correction optique totale reste le but à atteindre, aidée par la cycloplégie qui devrait être systématique avant tout diagnostic d’amétropie, quel que soit l’âge.
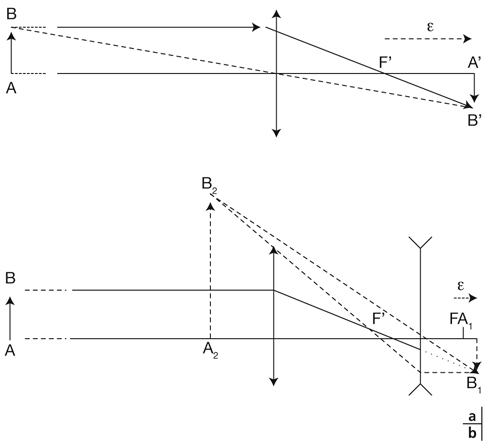
Fig. 21-27 Lunette de Galilée.
a. Une première lentille convergente donne d’un objet éloigné AB une image réelle renversée A’B’ dans son plan image à ε près ; F’A’ = ε est très petit. b. Une seconde lentille divergente, dont le foyer F est à gauche de la convergente, donne une image définitive virtuelle renversée et agrandie vue sous un angle α.
L’œil normal ou emmétrope (eu, « bon » ; metron, « mesure ») est composé essentiellement de deux dioptres, l’un fixe, la cornée, d’une puissance de 44 δ en moyenne (rayon de courbure moyen de 7,7 mm), l’autre variable, le cristallin, permettant la mise au point en vision de près, de puissance moyenne 21 δ (fig. 21-28). Ces paramètres n’étant pas constants d’un sujet à l’autre, l’emmétropie est un rapport harmonieux entre la longueur L de l’œil (22 mm à 25 mm) et la puissance de la cornée (rayon R, de 7,2 mm à 8,3 mm), permettant une focalisation rétinienne de l’image d’un objet situé à l’infini, sans effort. L’analyse statistique de ces deux paramètres, longueur L et rayon R, montre qu’il est possible d’établir une relation linéaire de régression avec une excellente corrélation (r2 = 0,97), résumée par la formule :
L (mm) = 8,5 × R (mm) – 42,5.
Cette harmonie est la conséquence du processus d’emmétropisation dont les mécanismes ne sont pas parfaitement connus (rôle de la rétine).
Une dysharmonie entre longueur de l’œil et puissance réfractive, conduit à une amétropie :
de puissance : longueur normale mais convergence inadaptée ;
axile : convergence maintenue mais longueur anormale.
Citons les principales amétropies (cf. fig. 21-21) :
la myopie : œil trop long ou trop convergent ;
l’hypermétropie : œil trop court ou insuffisamment convergent ;
l’astigmatisme : cornée ovale présentant deux rayons de courbure, en général perpendiculaires.
Dans l’anisométropie (aniso, « différent » ; metron, « mesure ») apparaît une asymétrie réfractive entre les deux yeux. Les yeux sont des jumeaux réfractifs ; pour plus de 95 % de la population, la différence d’amétropie n’excède pas une dioptrie. L’anisométropie est légère (1 δ à 2 δ), moyenne (2 δ à 4 δ) ou forte (supérieure à 5 δ). L’anisométropie risque d’entraîner une différence de taille d’images perçues par chaque rétine, nommée aniséiconie (fig. 21-29), source de gêne fonctionnelle.
Il existe deux types fondamentaux d’anisométropie :
les anisométropies congénitales, ou encore innées, constitutionnelles : leur pourcentage est faible dans la population générale (quelques pour cent) ; il existe des anisométropies myopiques, moyennes ou fortes (de pronostic redoutable et de traitement difficile car une composante organique vient s’ajouter au désordre fonctionnel), des anisométropies hypermétropiques et des astigmatismes forts unilatéraux ;
les anisométropies acquises, de plus en plus fréquentes compte tenu du développement de la chirurgie réfractive et de la chirurgie de la cataracte.
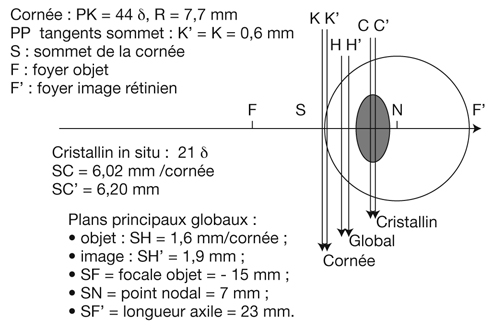
Fig. 21-28 Éléments cardinaux de l’œil réduit.
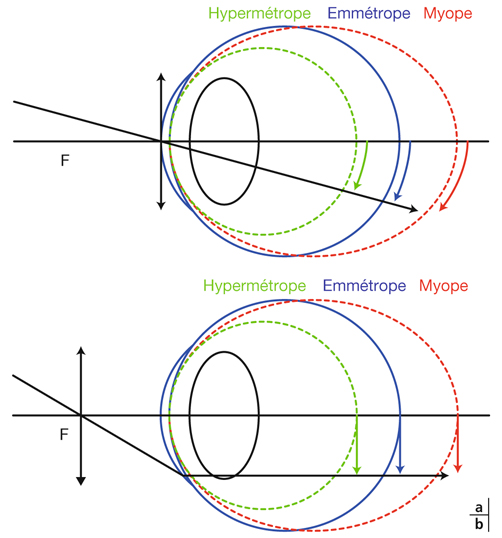
Fig. 21-29 Amétropie axile.
a. L’aniséiconie géométrique apparaît en cas de correction de contact ou intraoculaire. La taille des images rétiniennes grandit si l’œil s’allonge. b. Absence d’aniséiconie géométrique si le verre correcteur est placé au foyer objet de l’œil. La taille des images rétiniennes reste la même quelle que soit l’amétropie.
Les conséquences de l’anisométropie congénitale sont multiples.
Le risque d’amblyopie monoculaire n’est pas strictement proportionnel à l’anisométropie mais augmente avec elle ; ce risque existe dès qu’un œil focalise mal et perçoit des images rétiniennes floues ; à la différence de l’amblyopie strabique, qui est une amblyopie par inhibition, l’amblyopie anisométropique est une amblyopie par privation d’afférences visuelles correctes provoquant un défaut de maturation des cellules cérébrales (corps genouillés, cortex occipital).
Dans ses formes légères, son pronostic est meilleur que celui de l’amblyopie strabique mais son diagnostic plus tardif, en dehors d’un examen systématique, allongera son traitement.
Elle s’associe parfois à l’amblyopie strabique, l’œil le plus amétrope étant la plupart du temps l’œil dominé.
Il faut distinguer cette anisométropie de la pseudo-anisométropie des yeux amblyopes dont le pouvoir accommodatif est faible ; la différence se comblera après cycloplégies successives dégorgeant l’hypermétropie de l’œil dominant.
Elles apparaissent dans le sillage de l’amblyopie monoculaire, l’emmétropisation réfractive et l’isoacuité étant les piliers de la vision binoculaire :
mauvaise vision binoculaire avec altération du sens stéréoscopique ;
décompensation d’une hétérophorie conduisant au pire à un strabisme avec déviation constante ;
apparition d’une aniséiconie, autre trouble de la vision binoculaire, en fonction du mode de correction : passage d’une correction aérienne (lunettes) à une correction de contact ou réfractive.
La correction optique totale, prescrite sous cycloplégie, est obligatoire et reste l’épine dorsale de tout traitement en sensorimotricité.
C’est après l’essai de la correction optique totale qu’il convient de mesurer l’acuité visuelle ; le juge de paix de toute mesure d’acuité visuelle reste sa valeur obtenue subjectivement sous cycloplégie dès que la coopération le permet ; si l’enfant est trop jeune, la correction optique totale, mesurée au réfractomètre sous cycloplégie, sera prescrite.
Une différence de valeur d’acuité visuelle entre les deux yeux signe la présence d’une amblyopie, qualifiée de :
légère (rapport d’acuité supérieur à 50 %) ;
moyenne (rapport d’acuité compris entre 50 % et 25 %) ;
profonde (rapport d’acuité inférieure à 20 %).
Cette amblyopie sera traitée par les moyens classiques de l’amblyopie :
correction optique totale après cycloplégie ;
occlusion totale du bon œil tant que le rapport d’acuité n’est pas supérieur à 50 % ; le traitement sera plus long en cas de strabisme associé ;
traitement d’entretien ou prophylaxie de la rechute d’amblyopie sur plusieurs années.
Il ne faut pas craindre la survenue d’un déséquilibre oculomoteur en cas de correction paradoxale (myopique chez le convergent ou hypermétropique chez le divergent) : toujours se souvenir que le monoculaire a le pas sur le binoculaire, et la correction sur la déviation.
De nombreux cas de figure sont possibles.
Elle en est un exemple éloquent : longtemps considérée comme impossible à appareiller, la correction de l’aphaquie unilatérale a été bouleversée par l’apparition des lentilles de contact puis des implants intraoculaires. En effet, une correction optique aérienne unilatérale de 13 δ provoque une aniséiconie de 25 %, réduite à 8 % par une lentille de contact en vision de loin, à 5 % par une lentille de contact en vision de près additionnée d’un verre de – 3 δ en vision de loin, et annulée par un implant intraoculaire (fig. 21-30).
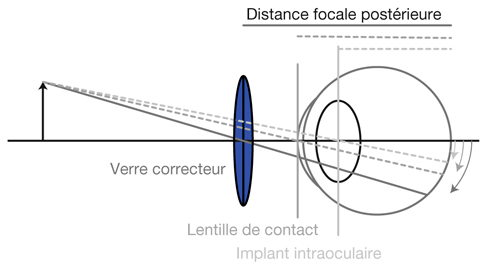
Fig. 21-30 Aphaquie. Plans principaux selon la correction. La taille de l’image rétinienne dépend de la distance focale postérieure. Aniséiconie : 23 % ; lentilles de contact : 5 % à 8 % ; implant : 0 %.
La restauration d’une isométropie postopératoire, ou emmétropisation, n’est pas toujours à rechercher : il faut respecter l’état antérieur et ne pas trop s’en écarter. Certes, la chirurgie de la cataracte, par la pose d’un implant, efface une amétropie soit en la diminuant (myopie forte devenant moyenne) soit en la supprimant (hypermétropie ou myopie). Là encore, la connaissance de l’état antérieur est capitale ; en particulier, il faut chercher à savoir si le sujet était porteur de lentilles de contact et avait connu l’emmétropie réfractive.
Un bilan orthoptique est obligatoire avant toute chirurgie réfractive, ainsi qu’une cycloplégie.
Bien expliquer au patient la situation et lui donner le choix quant à l’état réfractif postopératoire souhaité (faire signer la fiche d’information).
En chirurgie réfractive, avant tout geste opératoire devant une anisométropie, faire un test de tolérance réfractive par un essai de lentilles de contact, dont les conditions optiques sont identiques à celles de la chirurgie réfractive.
Dans le strabisme, éviter une inversion de dominance de fixation, toujours source d’inconfort visuel.
Ils ne sont pas faciles à mettre en évidence. Rarement, le sujet déclare voir plus gros d’un œil ; le plus souvent, l’« asthénopie aniséiconique » se traduit par des céphalées, une fatigue visuelle à la lecture, des picotements, larmoiements, la décompensation d’une hétérophorie.
Le diagnostic est délicat, essentiellement par des tests dissociants montrant l’asymétrie de taille des images exprimée en pourcentage — le seuil de tolérance est variable, en général inférieur à cinq pour cent.
Rappelons les multiples origines des asthénopies : asthénopie réfractive d’une hypermétropie mal corrigée, asthénopie fusionnelle d’une hétérophorie décompensée, asthénopie anisométropique et aniséiconique.
La prise en charge de ces complications relèvera du traitement de l’aniséiconie.
L’aniséiconie (aniso, « différent » ; eikon, « image ») est un trouble de la vision binoculaire provoqué par une perception d’image de taille différente par chaque œil (Bangerter).
Classiquement, il existe une aniséiconie :
géométrique, optique, ou encore de transmission : celle des physiciens, donnée par le calcul optique de la taille des images sur la rétine ;
physiologique, ou de perception : mesurée par les tests ;
corticale, ou d’intégration : celle ressentie par le patient et dont la correction fait disparaître les troubles.
Insistons sur la nécessité de la prévention de telles situations par un bilan préopératoire sensorimoteur complet : c’est la connaissance de l’état antérieur :
lorsqu’un œil a subi une chirurgie réfractive ou cristallinienne et qu’un déséquilibre apparaît, il est encore possible de corriger le trouble par la chirurgie du second œil : c’est le cas d’une opacification asymétrique des cristallins, où un œil est plus atteint que l’autre qui conserve encore une bonne vision ; s’il existe une forte amétropie antérieure, le choix de l’amétropie résiduelle postopératoire est délicat si on hésite à opérer immédiatement le second œil qui garde encore une bonne vision ; en cas de complication sur celui-ci, l’analyse expertale risquerait de mettre en cause la responsabilité du praticien lors d’une procédure ;
si les deux yeux ont déjà été opérés et que le déséquilibre apparaît après la chirurgie du second œil, les possibilités de traitement sont plus limitées : explantation d’un cristallin artificiel, lentille de contact ou retouche réfractive.
Bien expliquer la situation et donner le choix au patient.
Une erreur lors de calcul ou de pose d’implant se voit dans certains cas ; le problème est résolu en général par une explantation et un changement pour un implant idoine.
Pour mémoire, la correction optique par verre iséiconisant afocal (fig. 21-31) est peu utilisée devant la forte épaisseur des verres (10 mm), leur inconfort et leur effet limité (3 % à 5 %).
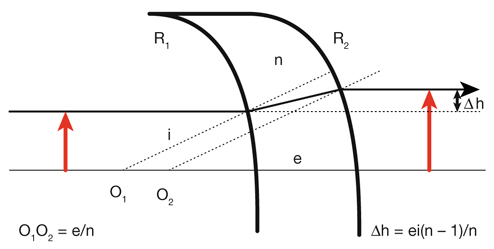
Fig. 21-31 Verres iséiconisants.
Application : i = 9°, n = 1,5, R2 – R1 = 7 mm, Δh = 6 % → e = 20 mm.
La réfraction subjective correspond à la correction optique donnée au patient qui lui autorise la meilleure acuité visuelle en fonction de ses réponses. Dans ce cas, le patient, qui n’est soumis à aucun test pharmacologique, répond aux questions de l’examinateur qui lui propose des verres d’essai en lui demandant s’il voit mieux ou non. Ces verres d’essai sont présentés dans une monture ou par un réfracteur. La formule de correction sphérocylindrique qui donne la meilleure acuité est notée pour chaque œil. Un essai en binoculaire est toujours obligatoire.
La correction ainsi trouvée est-elle la bonne ? D’aucuns pourraient le croire, mais un facteur intercurrent vient perturber cette mesure : il s’agit de l’accommodation.
L’accommodation, due au muscle ciliaire qui se contracte à la manière d’un sphincter, augmente la puissance optique du cristallin en détendant la zonule, lui donnant une forme plus sphérique. Ainsi, le sujet qui accommode voit de près. La capacité d’accommodation, ou réserve accommodative, varie avec l’âge ; elle est d’une quinzaine de dioptries chez l’enfant, puis diminue avec l’âge, pour devenir insuffisante vers la cinquantaine ; c’est la presbytie (presbus, « vieux » ; opsis, « vue ») ; le point de vision proximal (punctum proximum) s’éloigne alors progressivement de l’œil.
L’accommodation peut parasiter la mesure de la réfraction subjective à tous les âges et dans tous les types d’amétropies. Si le sujet examiné accommode, il se myopise, entraînant une correction vers des puissances moindres algébriquement : il y a spasme accommodatif.
Une sous-correction chez l’hypermétrope ou une surcorrection chez le myope sera source de troubles fonctionnels, regroupés sous le terme d’asthénopie accommodative ou asthénopie réfractive : les patients se plaindront de céphalées, de fatigabilité à la lecture, de photophobie, de larmoiement, de picotements oculaires.
Il existe un moyen de supprimer cette accommodation parasite, c’est la cycloplégie.
La cycloplégie (dont les modalités sont décrites au chapitre 4) ouvre la porte de la réfraction objective.
Elle est mesurable lorsque le sujet est cycloplégié, ne pouvant plus accommoder : tout spasme accommodatif devient impossible. Dès lors, il existe deux éventualités :
réaliser une réfraction entièrement objective en se fiant aux données d’un réfractomètre automatique (équivalent d’une skiascopie électronique), ce qui se fera chez l’enfant d’autorité s’il est strabique et a fortiori amblyope ; la correction optique totale objective reste l’épine dorsale du traitement de tout désordre sensorimoteur chez l’enfant ;
une réfraction subjective sous cycloplégie, c’est-à-dire que l’examinateur demande au sujet qu’elle est sa meilleure vision en fonction des verres d’essai présentés ; comme le sujet a les pupilles dilatées, il est recommandé de pratiquer le test dans la pénombre ; ce test est recommandé dès l’adolescence ; il est réalisable sur lentilles de contact afin d’en vérifier l’exactitude.
Cette dernière éventualité, la réfraction subjective sous cycloplégie, reste le juge de paix ultime de l’examen de la réfraction.
Faut-il pour autant toujours prescrire cette correction ? La réponse doit être nuancée. Plusieurs cas de figure sont possibles :
le sujet n’a jamais porté de correction optique et présente des signes fonctionnels (baisse de vision ou asthénopie) : la réfraction subjective d’emblée n’aura qu’un intérêt indicatif et ne sera jamais un absolu ; il faut recourir à la cycloplégie et à la réfraction objective complétée par un essai subjectif, et revoir le patient après dissipation de l’effet de la cycloplégie pour confrontation des résultats ;
primocorrections d’hypermétropie décompensée par l’âge : la correction sera à moduler en fonction de l’âge, de la gêne et de l’acceptation du patient à porter des lunettes ; une trop forte correction d’emblée n’est pas toujours supportée ; il y a plusieurs palliatifs : prescription d’un cycloplégique avant le coucher (cyclopentolate, tropicamide), afin de rompre le spasme accommodatif, ou indication de verres progressifs avec une sous-correction de loin, augmentant ensuite par paliers (nécessité de plusieurs corrections optiques) ;
spasme accommodatif dans la correction des petites myopies, qui est un grand classique : un sujet jeune présente une baisse de vision de loin améliorée par une correction négative d’une demie voire une dioptrie ; seule la cycloplégie permettra d’affirmer la réalité de cette myopie car, dans bon nombre de cas, il s’agit de petits hypermétropes d’une à deux dioptries spasmés en vision de près ;
le sujet présente déjà une correction optique bien supportée : il est préférable de ne pas trop s’éloigner de cette dernière, en se limitant à quelques ajustements.
Dans les cas où une correction optique serait mal supportée, il convient toujours de recourir à la cycloplégie.
Ce qu’il ne faut pas faire :
se fier aux réponses subjectives d’un patient qui présente des signes fonctionnels ;
donner une petite correction de myopie sans vérification cycloplégique (ce qui évitera bien des désagréments) ;
éviter une correction totale d’emblée chez l’hypermétrope adulte.
Ce qu’il faut faire :
recourir, autant que faire se peut, à la cycloplégie lors d’une première correction ;
chez l’enfant strabique, amblyope ou amétrope, la correction optique totale objective est obligatoire ;
chez l’adulte, le juge de paix reste la réfraction subjective sous cycloplégie ;
la correction sera modulée en fonction du contexte, adaptée après dissipation de la cycloplégie ; c’est pourquoi une bonne prescription optique relèvera toujours de l’art médical.
[1] Quéré M-A. Physiopathologie de l’équilibre oculomoteur. Paris, Masson, 1983.
E. Bui Quoc
L’information visuelle constitue un stimulus qui va être transformé en information électrique dans la rétine et se propager de neurone en neurone via leurs connexions synaptiques, au moyen de neurotransmetteurs, au sein de la rétine puis le long des voies visuelles (fig. 21-32). Ces voies sont connues. Anatomiquement, chaque œil émet son « câble » principal que constitue le nerf optique ; les deux nerfs optiques se rejoignent au niveau du chiasma, qui est une structure se situant sur la ligne médiane à l’étage moyen de la base du crâne, sur la partie antérieure de la selle turcique. C’est au niveau du chiasma que se produit la décussation des axones des cellules ganglionnaires en provenance des rétines nasales, c’est-à-dire que les fibres nerveuses correspondantes traversent le plan médian pour aller rejoindre l’hémisphère cérébral controlatéral, alors que les axones des cellules ganglionnaires en provenance des rétines temporales demeurent en direction de l’hémisphère cérébral ipsilatéral. Ainsi, on définit une voie directe rétino-géniculo-corticale et une voie croisée rétino-géniculo-corticale [2]. Les fibres axonales situées entre le chiasma et le corps géniculé latéral dorsal constituent les bandelettes optiques.
Le premier réseau neuronal part des photorécepteurs faisant synapse avec les cellules bipolaires qui elles-mêmes font synapse avec les cellules ganglionnaires (cf. supra, « Architecture fonctionnelle de la rétine »). Le premier relais des cellules ganglionnaires rétiniennes se situe dans le corps géniculé latéral dorsal (CGLd) qui est une structure se situant sous le thalamus. C’est un organe pair où demeurent ségrégées les informations en provenance de chaque œil. Il faut noter que 90 % des fibres nerveuses en provenance des yeux projettent sur les corps géniculés latéraux, 10 % des fibres projetant vers les colliculus supérieurs.
Depuis le CGLd sont émises des efférences vers la couche IV du cortex visuel primaire. Les axones cheminent dans la substance blanche cérébrale vers le cortex (fig. 21-33) et constituent les radiations optiques.
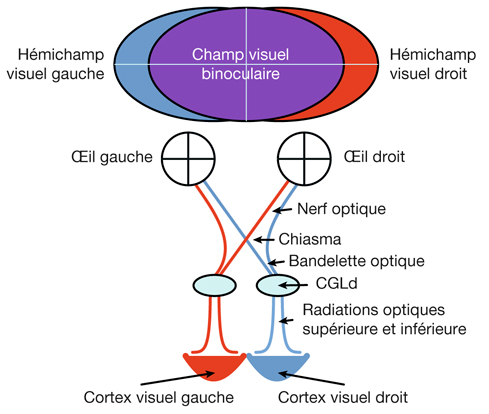
Fig. 21-32 Câbles et relais.
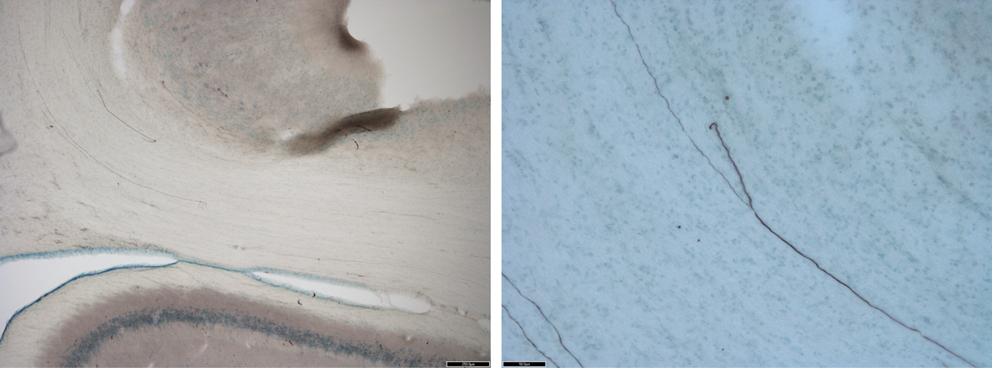
Fig. 21-33 Axones visuels (marqué à la biocytine) des radiations optiques cheminant dans la substance blanche cérébrale vers le cortex.
Il existe une systématisation rétinotopique dans les voies optiques telle que les fibres correspondant aux quadrants temporal et nasal, supérieur et inférieur sont réparties pour constituer les quatre quadrants du nerf optique. Puis, après le chiasma où la moitié des fibres décussent, les fibres correspondant à la moitié temporale en provenance de l’œil droit vont cheminer avec les fibres correspondant à la moitié nasale en provenance de l’œil gauche (car elles recoupent la même partie de l’hémichamp visuel, à savoir l’hémichamp visuel gauche) ; cet ensemble de fibre constitue donc la bandelette optique droite. Il existe de même une systématisation équivalente pour la bandelette optique gauche. Par ailleurs, il existe une organisation telle que les fibres supérieures cheminent avec les fibres supérieures et les fibres inférieures avec les fibres inférieures. En ce qui concerne les radiations optiques, on distingue des radiations optiques supérieures gauches correspondant au quadrant inférieur de l’hémichamp visuel droit (fibres nasales supérieures droites et temporales supérieures gauches), et des radiations optiques inférieures gauches (rétine nasale supérieure droite et temporale supérieure droite). Les radiations optiques droites, supérieures et inférieures, ont une organisation symétrique.
Cette systématisation explique les atteintes du champ visuel selon le lieu d’atteinte des voies optiques, par exemple :
atteinte du nerf optique : cécité unilatérale ;
atteinte chiasmatique : hémianopsie bitemporale (atteinte des hémichamps temporaux de chaque œil) ;
atteinte de la bandelette optique gauche : hémianopsie latérale homonyme droite (atteinte de l’hémichamp visuel droit) ;
atteinte de la bandelette optique droite : hémianopsie latérale homonyme gauche (atteinte de l’hémichamp visuel gauche) ;
atteinte des radiations optiques inférieures droites : quadranopsie latérale homonyme supérieure gauche (atteinte du quadrant supérieur gauche du champ visuel) ;
atteinte des radiations optiques supérieures droites : quadranopsie latérale homonyme inférieure gauche (atteinte du quadrant inférieur gauche du champ visuel) ;
atteinte des radiations optiques inférieures gauches : quadranopsie latérale homonyme supérieure droite (atteinte du quadrant supérieur droit du champ visuel) ;
atteinte des radiations optiques supérieures gauches : quadranopsie latérale homonyme inférieure droite (atteinte du quadrant inférieur droit du champ visuel).
L’organisation des voies optiques de la rétine au cortex visuel se met en place avant la naissance, faisant intervenir des protéines de guidage axonal. Ainsi, par exemple, c’est la présence de protéines appelées les éphrines B2, sécrétées au niveau du chiasma, qui est responsable de la décussation (fig. 21-34). L’organisation rétinotopique est la conséquence de la sécrétion d’éphrines A et B selon un gradient en deux dimensions (fig. 21-35). Encore une fois, cette rétinotopie est « innée » et indépendante de l’expérience visuelle.
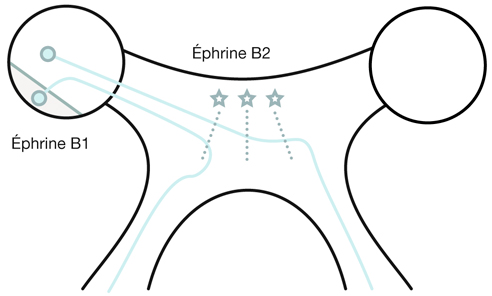
Fig. 21-34 Développement des voies visuelles : facteurs de guidage neuronal au niveau chiasmatique.
La sécrétion d’éphrine B1 dans la rétine temporale permet aux cellules ganglionnaires issues de cette région de détecter la présence d’éphrine B2 sécrétée, elle, au niveau chiasmatique par les cellules gliales, ce qui entraîne un effet de répulsion pour ces axones en provenance de la rétine temporale qui ne vont pas prendre une orientation croisée mais directe.
(D’après Petros, 2009 [5].)
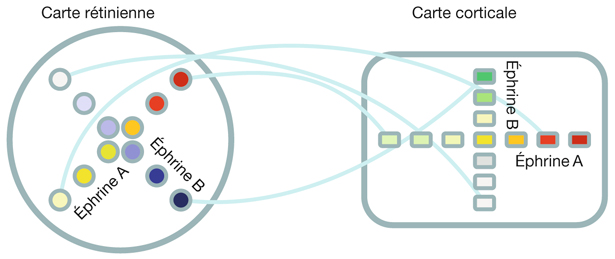
Fig. 21-35 Développement des voies visuelles : guidage neuronal de la rétine au tectum optique.
Il existe un gradient de sécrétion d’éphrines différentes par les cellules gliales, selon des axes orthogonaux qui se retrouvent à la fois sur la carte rétinienne et sur la carte corticale. Les axones issus d’une zone donnée de la rétine, où il existe une combinaison précise de concentrations d’éphrine A et d’éphrine B, vont aboutir aux neurones corticaux du cortex où les concentrations d’éphrines correspondent, ceci de façon innée.
(D’après Cang, 2005 [3].)
La description classique des voies visuelles doit se poursuivre par la notion de réseau de neurones synchronisés. Nous avons décrit les voies visuelles comme des câbles (nerfs optiques, bandelettes optiques, radiations optiques) interrompus par des structures relais (chiasma, CGLd…) ; mais, en fait, cet ensemble de neurones reliés entre eux, en provenance d’un œil et de l’autre, vont constituer un réseau de neurones dont l’activité va être synchronisée ou pas. Une cellule binoculaire de la couche corticale II/III reçoit des influx en provenance d’une cellule monoculaire de la couche IV. En l’absence de strabisme, l’activité de chaque neurone monoculaire est corrélée dans le temps et dans l’espace, et les deux neurones monoculaires vont stimuler le neurone binoculaire en même temps : leur activité est synchronisée (fig. 21-36). Selon la loi de Hebb [4], qui est une loi d’apprentissage classique dérivée de la psychologie et que les modélisateurs et neurophysiologistes ont appliquée à la description des réseaux neuronaux du cerveau : « Si deux cellules sont activées en même temps, alors la force de connexion augmente. » Dans le réseau décrit de deux cellules monoculaires reliées à une cellule binoculaire, la synchronisation de l’activité des deux cellules monoculaires va renforcer leurs connexions avec la cellule binoculaire. En cas de strabisme, cette synchronisation est perturbée, le lien connectique disparaît. La cellule binoculaire devient quiescente puis non fonctionnelle, de façon réversible puis irréversible.
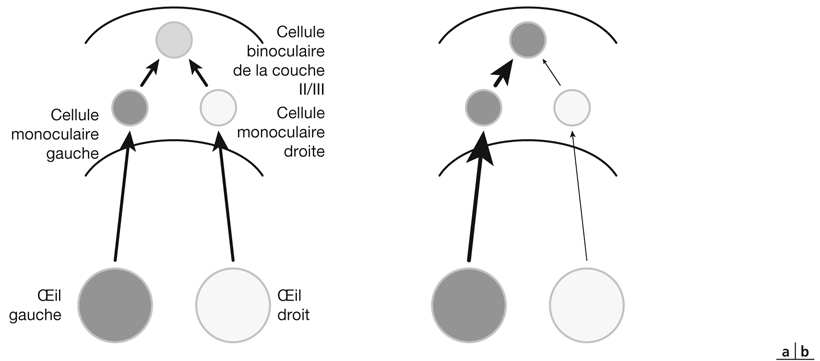
Fig. 21-36 Synchronisation entre cellules monoculaires et cellule binoculaire.
a. Activité concordante dans le temps et dans l’espace entre les influx en provenance de l’œil droit et de l’œil gauche : synchronisation. b. Activité disconcordante dans le temps et dans l’espace entre les influx en provenance de l’œil droit et de l’œil gauche : désynchronisation.
Prenons l’exemple du modèle du strabisme précoce pour évoquer de nouveau cette notion de synchronisation (fig. 21-37). Il a été démontré qu’il existe en cas de strabisme unilatéral précoce induit chez le chat une asymétrie de l’intégration interhémisphérique visuelle via le corps calleux : exubérances des terminaisons axonales des neurones calleux activés par stimulation de l’œil non dévié (condition « CV1 »), alors que les terminaisons des axones calleux activés par stimulation de l’œil dévié (condition « CV2 ») sont proches de la normale [1]. Ceci est surprenant si on considère que la zone du méridien vertical central projette une information rétino-géniculo-corticale de façon directe mais aussi croisée (double projection corticale de l’information en provenance de cette zone). L’information reçue par chacun des deux hémisphères, en provenance de chaque œil, qu’il soit dévié ou non, devrait être équivalente et symétrique. Nous rapportons cette asymétrie à un défaut de synchronisation binoculaire des informations visuelles en provenance de chacun des deux yeux.
En cas de strabisme convergent unilatéral précoce de l’œil droit, la synchronisation ne serait pas possible entre l’activité évoquée au niveau de la région corticale du méridien vertical central de l’hémisphère gauche par les projections rétino-géniculo-corticales directes venant de l’œil gauche et l’activité de l’hémisphère droit. En effet, lorsque la stimulation visuelle active la zone maculaire de l’œil gauche fixateur, la zone correspondante activée de l’œil droit se situe dans la rétine nasale, qui ne projette pas au niveau de l’hémisphère droit. La synchronisation des activités des projections issues de l’œil gauche non dévié serait aléatoire ; leurs connexions synaptiques seraient stabilisées selon l’activité spontanée aléatoire des neurones corticaux de l’hémisphère droit, présente non pas dans une portion restreinte de la carte rétinotopique, mais diffuse ; ceci explique les exubérances tangentielles observées (condition « CV1 »).
Considérons les neurones calleux issus de l’hémisphère droit : leur activité spontanée (puisque non évoquée par la rétine nasale, où se situe le point de fixation excentrique qui ne projette pas à l’hémisphère droit) se synchroniserait avec l’activité prépondérante rétino-géniculo-corticale correspondant au méridien vertical central, situé à la bordure 17/18 de l’hémisphère gauche. Ainsi, le caractère limité de leur zone de projection par rapport à l’autre hémisphère pourrait être expliqué, et donc l’asymétrie interhémisphérique dans cette condition expérimentale (conditions « CV1 » et « CV2 »).
La mise en place de l’asymétrie dépend du processus de développement et de l’influence différente des voies rétino-géniculo-corticales directes et croisées.
Concernant la zone de terminaison des axones calleux, c’est la voie rétino-géniculo-corticale directe ipsilatérale qui est responsable de la stabilisation des projections. Si la voie rétino-géniculo-corticale envoie un signal normal (dans la condition « CV2 », les projections directes viennent de l’œil non dévié), la distribution des terminaisons calleuses est normale. Inversement, si la voie rétino-géniculo-corticale envoie un signal anormal (dans la condition « CV1 », les projections directes viennent de l’œil dévié), la distribution des terminaisons calleuses est anormale.
Cette interprétation découle du fait que les projections rétino-géniculo-corticales sont établies dès la naissance, avec une rétinotopie conservée, même en cas d’amblyopie. Les projections calleuses en revanche se mettent en place dans les premiers mois de vie.
Les voies visuelles constituent le câblage de l’information sensorielle visuel de l’œil au cerveau.
Le réseau neuronal constitué fonctionne selon une synchronisation, qui est particulièrement perturbée dans le strabisme, avec asynchronie des informations en provenance de chaque œil.
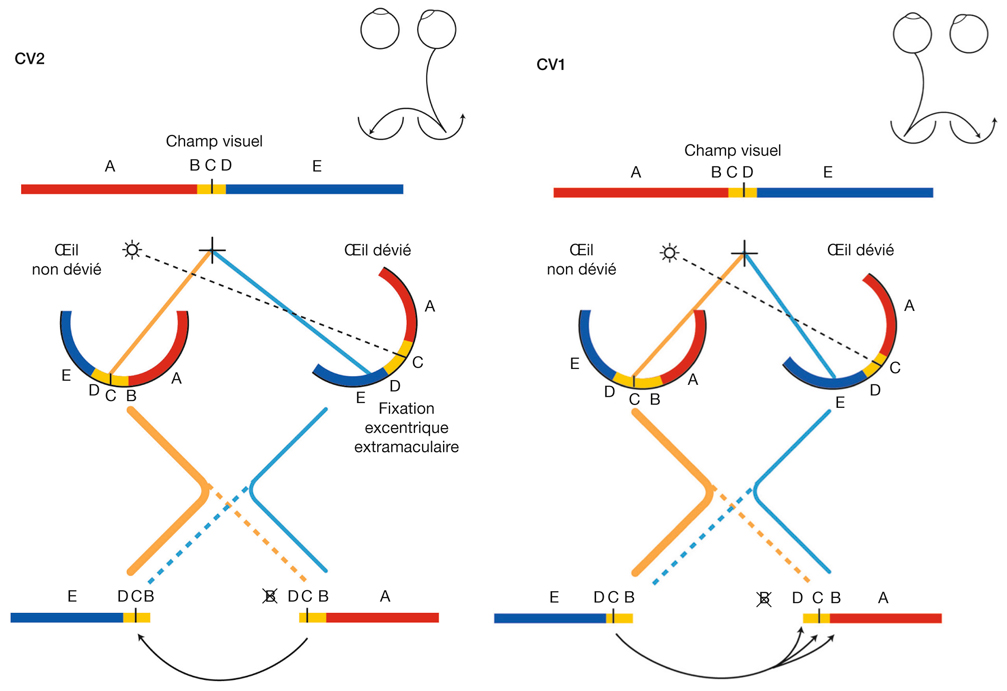
Fig. 21-37 Synchronisation et asynchronie dans un strabisme convergent précoce. Rôle de la correspondance rétinienne anormale.
Condition CV2. Transfert calleux à partir de l’œil dévié : synchronisation des neurones calleux (activité spontanée) avec l’activité prépondérante des neurones activés en C. Condition CV1. Transfert calleux à partir de l’œil non dévié : synchronisation aléatoire selon l’activité spontanée des neurones A, B, C, D ; dispersion spatiale.
[1] Bui Quoc E, Ribot J, Quenech’du N, Doutremer S, Lebas N, Grantyn A, Aushana Y, Milleret C. Asymmetrical interhemispheric connections develop in cat visual cortex after early unilateral convergent strabismus: anatomy, physiology, and mechanisms. Front Neuroanat, 2011 ; 5 : 1-29.
[2] Bullier J, Barone P. Voies optiques intracrâniennes et lobe occipital : anatomie, fonction, développement. Encycl Méd Chir (Elsevier, Paris), Ophtalmologie, 21-008-A-40, 1997.
[3] Cang J, Kaneko M, Yamada J, Woods G, Stryker MP, Feldheim DA. Ephrin-As guide the formation of functional maps in the visual cortex. Neuron, 2005 ; 48 : 577-589.
[4] Hebb D. The Organization of Behavior. New York, John Wiley & Sons, 1949.
[5] Petros TJ, Shrestha BR, Mason C. Specificity and sufficiency of EphB1 in driving the ipsilateral retinal projection. J Neurosci, 2009 ; 29 : 3463-3474.
E. Bui Quoc, A. Péchereau
Le cortex visuel primaire est la zone corticale qui reçoit des afférences directes du corps géniculé latéral dorsal (CGLd). Il s’agit chez l’humain de l’aire V1, ou aire 17 de Brodmann. Elle est située dans la partie postérieure du cerveau (cortex occipital). L’aire V1 de chaque hémisphère reçoit des informations du champ visuel controlatéral. Il existe aussi une projection de la zone du méridien vertical central dans chaque hémisphère. La rétinotopie est conservée, avec une amplification maculaire considérable, puisque la moitié de la surface de V1 correspond aux projections en provenance de la fovéa. Le cortex primaire est épais de 2 mm chez l’humain. Les colorations histologiques (fig. 21-38) permettent de distinguer six couches de neurones (substance grise) entre la surface et la substance blanche sous-jacente (composée des axones myélinisés) ; les couches II et III sont regroupés en ce qu’on nomme habituellement la couche II/III. Les afférences du CGLd se projettent principalement dans la couche IV qui se subdivise en quatre sous-couches : IVA, IVB, IVCα sur laquelle se projettent les cellules M du CGLd et IVCβ sur laquelle se projettent les cellules P du CGLd. Il existe des connexions intracorticales multiples, horizontales et verticales, et, de même qu’il reçoit des afférences, le cortex strié émet de nombreuses efférences vers les cortex secondaires, vers l’autre hémisphère via le corps calleux, mais aussi vers le CGLd.
Il existe différents types de neurones au niveau du cortex visuel. Deux principaux types de neurones sont à définir. Les grandes cellules pyramidales (fig. 21-39) sont des neurones excitateurs de projection vers d’autres régions cérébrales. Les cellules étoilées sont soit lisses, correspondant à des interneurones locaux inhibiteurs, soit à épines, correspondant à des interneurones excitateurs. Les informations visuelles en provenance du CGLd projettent d’abord aux interneurones étoilés à épines dans la couche IV. Elles projettent ensuite verticalement vers les autres couches corticales. Au niveau de la couche IV, les champs récepteurs des neurones sont semblables à ceux du CGLd (« centre ON » ou « centre OFF »).
Au niveau des autres couches, en particulier II/III, on retrouve des champs récepteurs différents et une réponse des cellules de façon préférentielle à des stimulations ayant des propriétés linéaires, comme une ligne ou une barre. On distingue les neurones simples des neurones complexes. Les neurones simples répondent préférentiellement à une barre de lumière qui possède une orientation spécifique. Ainsi, une cellule qui répond le mieux à une barre verticale ne répondra pas à une barre horizontale ou même oblique. Les champs récepteurs des cellules simples possèdent des régions excitatrices et des régions inhibitrices qui sont parallèles les unes avec les autres. Les régions ON excitatrices des champs récepteurs reçoivent leurs afférences de cellules « centre ON » du CGLd et inversement les régions OFF reçoivent les projections de cellules « centre OFF » du CGLd. Les neurones complexes ont des champs récepteurs plus larges que ceux des neurones simples. Ils sont également sélectifs pour l’orientation, mais la position précise du stimulus à l’intérieur du champ récepteur est moins cruciale, car il n’existe pas de zones ON ou OFF bien délimitées. C’est pourquoi un mouvement du stimulus au travers du champ récepteur représente un stimulus efficace pour certains neurones complexes. Les propriétés des neurones complexes sont telles qu’elles paraissent utiles à la détection des contours des objets. En fait, l’information de contour peut être suffisante pour reconnaître un objet.
Il existe au niveau de la couche II/III des cellules qui ont une propriété de binocularité. Ces cellules sont sensibles à la disparité rétinienne et sont impliquées dans la vision stéréoscopique.
Le cortex visuel primaire est organisé en modules fonctionnels [58]. Les terminaisons axonales font connexion avec d’autres neurones par des boutons synaptiques (fig. 21-40). Les terminaisons des neurones dans le cortex visuel sont organisées. Les axones forment des bouquets terminaux dans une zone localisée correspondant à une colonne fonctionnelle, regroupant des neurones sensibles à des propriétés semblables, par exemple la sélectivité à l’orientation. Une arborescence peut former plusieurs bouquets allant rejoindre chacun une colonne fonctionnelle (fig. 21-41). Par exemple également, les neurones dont les champs récepteurs sont semblables sont organisés en colonnes. Chaque colonne est large de 300 µm à 500 µm, profonde de 2 mm. Les champs récepteurs sont concentriques dans la couche IV. Dans les autres couches corticales, on retrouve les neurones à champ récepteur simple qui reçoivent des informations en provenance de la même région rétinienne et dont la propriété fondamentale est la sélectivité à l’orientation. Les colonnes d’orientation ainsi définies comportent également des neurones complexes. Toutes les orientations sont représentées et, pour une même région du champ visuel, on retrouve les différentes orientations codées, de 10° en 10°, avec un cycle de 180° répété tous les 0,75 mm. Ceci a été mis en évidence par l’expérimentation électrophysiologique couplée à des colorations histologiques et, à partir des années quatre-vingt-dix, par l’imagerie optique. On retrouve d’autres propriétés fondamentales des neurones visuels, comme la sélectivité de direction des cellules de la couche IVβ (canal M). Ces mêmes cellules sont aussi sensibles à la vitesse.
Toutes ces propriétés sont superposées et on peut définir des cartes corticales fonctionnelles.
Il existe un autre système d’alternance de colonnes en plus des deux précédents, qui correspond à la séparation des afférences en provenance des deux yeux. Ce sont les colonnes de dominance oculaire visualisées par étude histologique du cerveau après injection intravitréenne d’un acide aminé radioactif injecté dans un œil, transporté par voie axonale et transsynaptique, et entraînant un aspect zébré du cortex visuel.
Le décalage systématique des axes des colonnes d’orientation est interrompu en différents endroits par des amas de neurones (« blobs »), présents dans les couches corticales II et III. Ces amas sont visibles sous forme de taches sombres sur une coupe de 40 µm d’épaisseur — l’histochimie révèle la densité en cytochrome oxydase, une enzyme mitochondriale qui dénote une forte activité métabolique — et sont associés à la vision des couleurs car ils comportent des neurones qui sont sensibles aux contrastes de couleurs.
Hubel et Wiesel, prix Nobel de physiologie et médecine en 1981, ont proposé le terme d’hypercolonne pour dénommer la région qui regroupe toutes les colonnes d’orientations d’une région particulière de l’espace visuel [40]. Une séquence complète de colonnes de dominance oculaire et de colonnes d’orientation se répète en effet régulièrement et précisément sur toute la surface du cortex visuel primaire, chacune occupant une région d’environ 1 mm2. Cette disposition systématiquement répétée, comme une pixellisation, correspond à l’organisation fonctionnelle modulaire du cortex visuel. L’intégration et l’analyse des différentes propriétés de chaque « pixel » : orientation, classes de binocularité, couleur, mouvement, permet de percevoir finalement l’image.
L’architecture précise du cortex visuel est la base de la fonction visuelle précise. En cas d’expérience visuelle anormale, c’est la désorganisation de cette architecture, normalement symétrique avec égalité/équivalence de la fonctionnalité des afférences en provenance de deux yeux, qui sous-tend l’amblyopie.
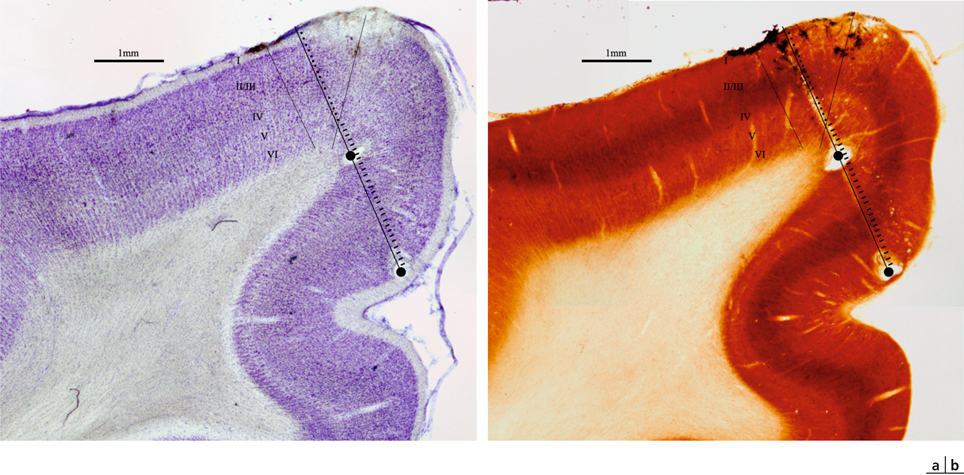
Fig. 21-38 Coupes histologiques au niveau du cortex visuel.
a. Coloration de Nissl. b. Coloration en cytochrome oxydase.
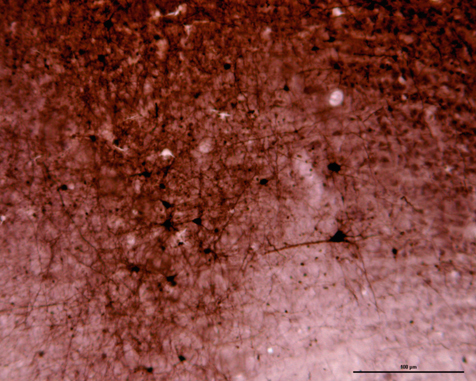
Fig. 21-39 Cellule pyramidale visible en coloration à la biocytine.
Fig. 21-40 Terminaisons axonales et boutons synaptiques.
Fig. 21-41 Terminaisons axonales dans le cortex et notion de colonnes fonctionnelle.
(D’après Houzel J.-C., Milleret C., Innocenti G., 1994 [28].)
Il est difficile de se faire une représentation de l’information visuelle le long de la voie visuelle. En tout cas, il est certain qu’il n’existe pas d’image au sens où nous l’entendons. Le signal photonique est transformé en un ensemble de signaux suivant la qualité de ce signal et la nature des cellules rétiniennes qui le traitent. Dans la rétine, nous passons d’un signal analogique à un signal numérique dont la nature est spécifique pour chaque type de cellules ganglionnaires. De ce fait, toute représentation analogique est une interprétation arbitraire. Dans une approche pédagogique1, c’est la seule que nous pouvons faire et que nous vous proposons (fig. 21-42). Nous allons donc décomposer cette figure.
La colonne de gauche correspond à la vision monoculaire, la colonne de droite à la vision binoculaire :
a. La première ligne est l’image vue en monoculaire et binoculaire (identique).
b. La deuxième ligne correspond : à gauche de la colonne de gauche, à l’image projetée sur l’œil gauche ; à droite de la colonne de gauche, à l’image projetée sur l’œil droit. La colonne de droite correspond à l’image projetée en binoculaire. Sur ces trois images, les isoptères d’un champ visuel de Goldman ont été dessinés.
c. La troisième ligne correspond strictement à la ligne précédente mais les images ont été traitées par Photoshop en fonction de la sensibilité rétinienne déterminée par les isoptères.
d. La quatrième ligne correspond au traitement de l’image précédente par Photoshop en fonction de la densité des cellules ganglionnaires, ce qui entraîne une surreprésentation maculaire et une sous-représentation de la périphérie. On peut considérer qu’il s’agit de la représentation au niveau du nerf optique.
e. La cinquième ligne correspond à la situation après la décussation chiasmatique.
f. La sixième ligne correspond, à gauche, à la représentation au niveau de chaque cortex visuel : à gauche de la colonne de gauche, cela correspond au champ visuel droit ; à droite de la colonne gauche, cela correspond au champ visuel gauche. À droite, l’image est reconstituée par transfert calleux.
Ce « petit exercice » de manipulation informatique en fonction des connaissances physiologiques tente de montrer de façon analogique le devenir de l’information visuelle qui arrive au système visuel. Toutefois, il permet de souligner l’importance du signal fovéolaire et la faible qualité de la perception périphérique (spécialisée dans le mouvement). Il montre de façon indirecte l’importance de la mobilité oculaire dans la perception de notre espace visuel.
Il souligne la gravité de l’amblyopie, qui s’accompagne à la fois d’une baisse d’acuité visuelle et d’une désorganisation de la vision (non représentée ici). Il confirme l’importance d’une rééducation de l’amblyopie. Il montre également la gravité de la dégénérescence maculaire liée à l’âge dans la perception visuelle.

Fig. 21-42 De l’image au cerveau.
Colonne de gauche : vision monoculaire. Colonne de droite : vision binoculaire.
Si on entend par « vision binoculaire » la vision du relief, la vision est binoculaire en monoculaire et, en fermant un œil, on a des notions du relief — même si on sera un piètre joueur de tennis… En effet la scène visuelle a des attributs « binoculaires » (cf. supra), on les retrouve sur la figure 21-43, qui est une photographie en deux dimensions. La perspective linéaire fait que, lorsque deux lignes parallèles se rejoignent à l’horizon sur une image en deux dimensions, l’observateur aura l’impression qu’un élément proche de ce point de réunion des lignes sera situé en arrière d’un élément qui est plus éloigné de ce point de réunion ; de fait, ce dernier élément éloigné du point de réunion est situé plus en avant dans la scène visuelle. De même, un personnage plus petit sera situé sur une image en deux dimensions plus en arrière qu’un personnage plus grand : c’est l’indice de taille. L’interposition est le phénomène tel que l’objet en avant va cacher l’objet en arrière. Indépendamment d’une image en deux dimensions, dans la « réalité », les mouvements de parallaxe indiquent à l’observateur « monoculaire » la place d’un objet par rapport à l’autre dans l’espace ; deux objets se déplaçant à la même vitesse « réelle » n’auront pas une vitesse perçue équivalente selon qu’ils sont proches (mouvement rapide) ou éloignés (mouvement lent).
Pour autant, revenons à la neurophysiologie… Un premier neurone ganglionnaire vient faire synapse avec un neurone du corps géniculé latéral dorsal (CGLd) dans lequel il existe une ségrégation œil droit/œil gauche persistante. Puis ce neurone du CGLd va envoyer son axone vers le cortex visuel primaire — par définition, le cortex visuel est dit primaire s’il reçoit des afférences directes du CGLd ; il s’agit de l’aire 17 chez l’humain, mais à la fois de l’aire 17 et de l’aire 18 chez le chat ; le cortex visuel est dit secondaire si les afférences qu’il reçoit transitent par le cortex visuel primaire. Les neurones visuels monoculaires du CGLd vont faire synapse avec des neurones monoculaires de la couche IV du cortex visuel primaire : couche IVCα pour les neurones de la voie M et couche IVCβ pour les neurones de la voie P. Ce n’est qu’au niveau de la couche II/III du cortex visuel primaire qu’on trouve des neurones binoculaires qui reçoivent à la fois des afférences des neurones monoculaires droit et gauche de la couche IVC (fig. 21-44).
Le caractère binoculaire de ces neurones est sous-tendu par le fait qu’ils répondent à la stimulation d’un œil ou de l’autre. Ce sont Hubel et Wiesel qui, en électrophysiologie, ont défini les premiers ces cellules et les ont classés selon leur réponse prédominante ou préférentielle à la stimulation d’un œil ou de l’autre. En effet, on enregistre les cellules dans un des deux hémisphères cérébraux et l’œil stimulé peut être ipsilatéral (hémisphère droit et œil droit ou hémisphère gauche et œil gauche) ou controlatéral (hémisphère droit et œil gauche ou hémisphère gauche et œil droit). On distingue sept classes de cellules dans la couche II/III [59] (cf. encadré).
Cellules de la couche II/III du cortex visuel primaire
Classe 1 : Réponse à la stimulation de l’œil controlatéral (ce sont donc en fait des cellules monoculaires).
Classe 2 : Fort biais controlatéral, c’est-à-dire que ces cellules répondent à la stimulation des deux yeux mais de façon très prédominante à la stimulation de l’œil controlatéral.
Classe 3 : Faible biais controlatéral, c’est-à-dire que ces cellules répondent à la stimulation des deux yeux mais de façon préférentielle à la stimulation de l’œil controlatéral.
Classe 4 : Équivalence entre la réponse évoquée par stimulation d’un œil ou de l’autre.
Classe 5 : Faible biais ipsilatéral, c’est-à-dire que ces cellules répondent à la stimulation des deux yeux mais de façon préférentielle à la stimulation de l’œil ipsilatéral.
Classe 6 : Fort biais ipsilatéral, c’est-à-dire que ces cellules répondent à la stimulation des deux yeux mais de façon très prédominante à la stimulation de l’œil ipsilatéral.
Classe 7 : Réponse à la stimulation de l’œil ipsilatéral (ce sont donc en fait des cellules monoculaires).
Le strabologue est le médecin de la vision binoculaire : il se doit donc de préserver l’existence de ces cellules binoculaires de la couche II/III, qui disparaissent en cas de strabisme.

Fig. 21-43 Attributs binoculaires d’une scène visuelle monoculaire.
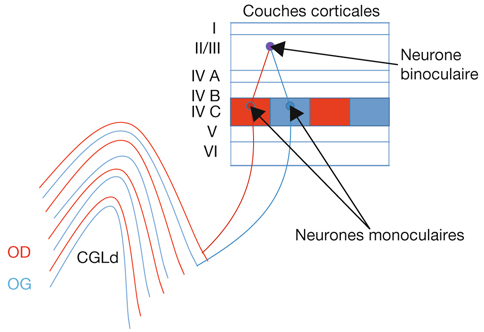
Fig. 21-44 Où la vision monoculaire devient-elle binoculaire ?
Le référentiel de la vision est l’œil, cela paraît une évidence, mais cette évidence est erronée. Les yeux voient et transmettent cette information au cerveau qui traite les images… En fait, il faut renverser la perspective et considérer le cerveau et en l’occurrence le cortex visuel primaire droit et le cortex visuel primaire gauche comme les véritables centres de la vision, les yeux dans ce modèle n’étant que des « appendices » récepteurs de l’information.
De ce fait et à cause de la décussation de la moitié des fibres visuelles nasales vers l’hémisphère controlatéral, on comprend aisément que chaque hémisphère voit un hémichamp visuel [60]. Comme cela est représenté sur la figure 21-45, les fibres directes en provenance de la rétine temporale de l’œil gauche rejoignent les fibres croisées en provenance de l’hémirétine nasale de l’œil droit, pour atteindre le cortex visuel gauche. Elles sont schématisées en rouge. Inversement, les fibres directes en provenance de la rétine temporale de l’œil droit rejoignent les fibres croisées en provenance de l’hémirétine nasale de l’œil gauche, pour atteindre le cortex visuel droit. Elles sont schématisées en bleu. Ainsi, puisque rétine nasale d’un œil et rétine temporale de l’autre œil voient le même hémichamp visuel, ipsilatéral pour la première et controlatéral pour la seconde, on comprend aisément que chaque hémisphère est responsable de la vision d’un hémichamp visuel : le cerveau droit voit l’hémichamp visuel gauche et le cerveau gauche voit l’hémichamp visuel droit.
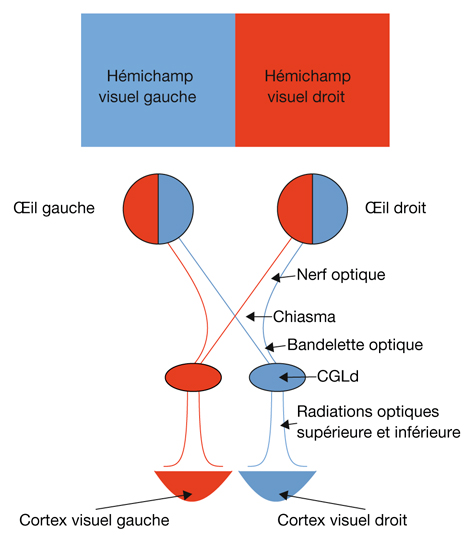
Fig. 21-45 Hémichamps visuels.
Le cerveau droit voit l’hémichamp visuel gauche et le cerveau gauche voit l’hémichamp visuel droit. Pour autant, notre représentation de l’espace n’est pas séparée en deux hémichamps. Ainsi, la vision que chacun a de l’arche de Saint-Louis dans le Missouri aux États-Unis est unique (fig. 21-46) et n’aurait pas cet aspect coupé que décrivaient des patients dont le corps calleux avait été sectionné (fig. 21-47). Ce sont les connexions interhémisphériques via le corps calleux entre les deux cortex visuels qui permettent une unification de la scène visuelle.
De fait, les deux hémisphères du cerveau des mammifères, bien qu’anatomiquement séparés, coopèrent l’un avec l’autre par l’intermédiaire de faisceaux de fibres qui constituent les commissures cérébrales. Parmi celles-ci, c’est le corps calleux qui est le plus important, du moins par son nombre de fibres (200 à 800 millions suivant les espèces) [12].
Pont entre les deux cerveaux et entre les deux cortex visuels, dans chacun desquels est représenté un hémichamp visuel, le corps calleux est impliqué dans la fusion des deux hémichamps visuels et du méridien vertical central (fig. 21-48) au niveau duquel se trouve la fovéa, représentée également dans les deux cortex. En effet, le système visuel des mammifères supérieurs est organisé de telle façon que chaque moitié (droite et gauche) du champ visuel est représentée dans l’hémisphère controlatéral et que le corps calleux participe activement à la fusion perceptive des deux hémichamps visuels par l’intermédiaire de connexions interhémisphériques réciproques. Le corps calleux est impliqué dans la fusion des deux hémichamps représentés chacun dans un hémisphère. Les neurones calleux — qui sont étudiés par des expérimentations sur des modèles avec chiasmotomie, afin que la stimulation d’un œil avec étude de l’hémisphère controlatéral ne corresponde qu’à l’étude de l’information passée par la voie calleuse (et non par la voie croisée rétino-géniculo-corticale) — présentent comme les neurones visuels du cortex primaire des propriétés de binocularité, de sélectivité à l’orientation, de sélectivité à la vitesse. Il existe par ailleurs une rétinotopie calleuse. Ainsi, les neurones visuels calleux correspondant à la vision du méridien vertical central font un lien entre les deux zones rétinotopiques des deux cortex visuels correspondant à ce méridien vertical central, c’est-à-dire la zone maculaire et les bandes rétiniennes supérieure et inférieure à la macula correspondant aux 3° à 4° centraux. L’architecture des connexions callosales est précise et, par exemple, chez le chat, les connexions calleuses se font vers une zone corticale étroite entre les aires 17 et 18, dénommée bordure ou zone de transition. Ces connexions callosales précises sont désorganisées en cas de strabisme précoce, ce qui fait suspecter un rôle de celles-ci dans la genèse du strabisme [45].
Le méridien vertical central est de fait une zone visuelle hautement stratégique, ne serait-ce que parce qu’elle inclut la macula. Soulignons ici que cette zone du méridien vertical central (3° à 4° centraux) est la zone pour laquelle il existe une double projection ipsilatérale et controlatérale des fibres ganglionnaires. En effet, il n’existe pas une stricte séparation entre les fibres issues des rétines nasales croisées et les fibres issues des rétines temporales directes, mais, concernant les fibres issues du méridien vertical central, une double projection directe et croisée. Ceci explique la notion d’épargne maculaire en cas d’atteinte des radiations optiques ou d’un hémicortex visuel, puisqu’il existe une compensation par la double projection passant par les radiations optiques controlatérales.

Fig. 21-46 L’arche de Saint-Louis.

Fig. 21-47 L’arche de Saint-Louis vue en cas de callosotomie.
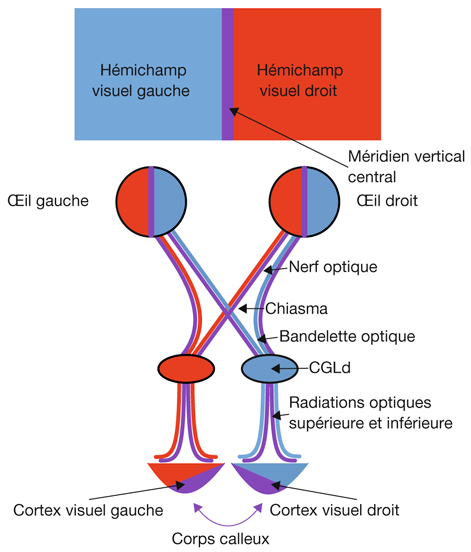
Fig. 21-48 Le méridien vertical central.
La vision binoculaire/stéréoscopique implique la présence de cellules corticales binoculaires [8, 29]. Celles-ci se situent dans la couche II/III du cortex visuel. Ces cellules reçoivent une information en provenance des cellules monoculaires de la couche IV du cortex. Ces cellules binoculaires doivent pouvoir déceler la différence d’information en provenance des deux cellules monoculaires, c’est-à-dire la disparité des deux images, et, de fait, ces cellules sont des cellules binoculaires sensibles à la disparité.
Que le lecteur ferme par exemple son œil gauche et aligne ses deux index devant son œil droit, l’index droit à une dizaine de centimètres de l’œil et l’index gauche à une dizaine de centimètres en arrière du droit. Si alors il ferme l’œil droit et ouvre l’œil gauche, il ne verra plus les deux index alignés, mais l’index droit un peu décalé à droite. Les deux images reçues par les deux yeux sont différentes. À l’échelle neuronale, cela signifie que les champs récepteurs des cellules rétiniennes correspondantes sont légèrement décalés. Du fait de la rétinotopie, ceci se maintient au niveau des neurones visuels du cortex : deux neurones monoculaires de la couche IV recevant des images différentes vont transmettre une information différente au neurone binoculaire de la couche II/III. Les deux champs récepteurs en provenance de chaque neurone monoculaire sont décalés. Il existe une disparité entre eux.
On note sur la figure 21-49 que les champs récepteurs des deux cellules monoculaires ont une disparité qui peut être variable. Selon la stimulation visuelle, ces cellules monoculaires ont une activité évoquée variable. La cellule binoculaire a quant à elle deux champs récepteurs monoculaires, dont la disparité varie. Les cellules binoculaires peuvent ne pas être sensibles à la disparité et leur réponse est indépendante de la disparité entre les champs récepteurs des cellules monoculaires qui les activent (fig. 21-49a). D’autres cellules sont sensibles à une grande disparité et leur activité est maximale lorsque la disparité entre leurs deux cellules monoculaires est maximale (fig. 21-49b). Et enfin, il existe des cellules sensibles à une faible disparité dont l’activité est maximale lorsque la disparité entre les champs récepteurs de leurs deux cellules monoculaires est minimale (fig. 21-49c).
Le strabologue s’intéresse à la différence d’axe entre les deux yeux, à la différence des images reçues par chacun des yeux. C’est précisément cette différence d’image entre les deux yeux, exactement la disparité qui existe entre les deux images et, au plan physiologique, l’analyse de la disparité entre les champs récepteurs des neurones monoculaires par les neurones binoculaires sensibles à la disparité, qui sous-tend la vision binoculaire.
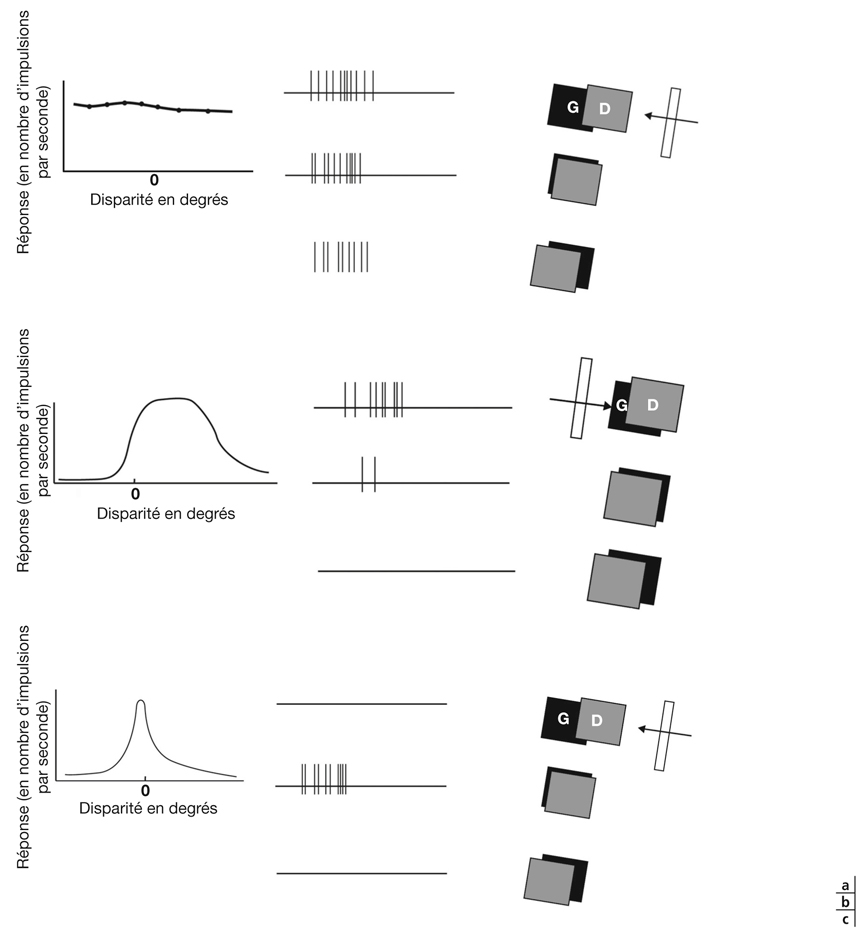
Fig. 21-49 Champs récepteurs de deux cellules monoculaires (en noir pour l’œil gauche et en gris pour l’œil droit) : la disparité est variable.
a. Neurone insensible à la disparité. b. Neurone sensible à la disparité sur une zone étendue. c. Neurone sensible à la disparité sur une zone étroite centrée par la disparité zéro.
La terminologie de la stéréoscopie est importante et il faut préciser les différentes acceptions possibles de ce terme de « vision binoculaire ». Si on se rappelle des trois degrés de Worth, la vision binoculaire au sens de vision du relief correspond au troisième degré. La perception du relief fait intervenir une « comparaison » des images en provenance des deux yeux et repose sur le principe de disparité (cf. supra) [9, 57, 72]. Pour des raisons géométriques, et ceci en fonction de la distance entre les deux yeux, les deux images se projetant sur les deux rétines sont différentes. Il existe une absence d’homologie exacte entre les points se projetant sur chaque rétine, ceci créant une disparité. Il faut imaginer un point de fixation des deux yeux, ce point se projetant sur chacune des fovéas (en l’absence de pathologie oculomotrice). À distance de ce point de fixation, un point n’aura pas toujours une projection sur des points correspondants rétiniens (à la même distance du point de fixation). C’est l’intégration perceptive de cette disparité rétinienne qui sous-tend la vision stéréoscopique. Les voies magnocellulaire et parvocellulaire n’interviennent pas de façon identique, puisque la voie parvocellulaire est impliquée dans la stéréoscopie statique (cellules sensibles à une disparité de 2’’ à 1 200’’ soit 0 à 0,33°, avec latence de 250 ms, fréquence temporelle de moins de 2 Hz), alors que la voie magnocellulaire est impliquée dans la stéréoscopie dynamique (cellules sensibles à une disparité de 40’’ à 360 000’’ soit 0,1 à 10°, avec latence de 130 ms, fréquence temporelle de plus de 3 Hz).
Les cellules binoculaires corticales reçoivent des afférences en provenance de chaque œil et sont activées par la stimulation d’un ou des deux yeux. Il existe des cellules dont le profil de mise en activité varie selon la distance qui sépare le stimulus visuel du point de fixation. Ce sont les cellules sensibles à la disparité.
En avant ou en arrière du point de fixation, le long du méridien vertical central, on comprend bien que la projection d’un point se situera dans la même hémirétine, c’est-à-dire en rétine nasale pour les points en avant et en rétine temporale pour les points en arrière. Or les points correspondants de l’hémirétine nasale d’un œil correspondent à des points de l’hémirétine nasale de l’autre œil du fait de la décussation chiasmatique. Ceci n’est pas parfaitement exact pour la zone des 2° centraux pour lesquels il existe des projections à la fois directes et croisées (démontré chez le macaque). Cependant, cette simple démonstration géométrique implique, pour que les informations des deux yeux puissent être comparées, un lien fonctionnel entre les deux hémisphères (fig. 21-50).
L’intégration interhémisphérique visuelle (via le corps calleux) est donc nécessaire à la vision stéréoscopique. Ceci est corroboré par la localisation du champ visuel calleux qui a, dans A17 chez le chat, une forme de sablier centré sur le méridien vertical central (selon Payne : 4° sur le méridien horizontal et jusqu’à 15° en supérieur et 25° en inférieur) [55].
Le corps calleux est une structure cérébrale à laquelle cliniciens et chercheurs se sont peu intéressés jusque dans les années cinquante. Les neurochirurgiens pratiquaient parfois dans des cas d’épilepsie sévère des sections partielles ou totales du corps calleux, sans conséquence majeure… On faisait peu de cas du corps calleux.
Les premières expériences frappantes sur le corps calleux ont été menées dans les années cinquante ; Myers, un élève de Robert Sperry, montre le premier une fonction fondamentale de transfert interhémisphérique [52, 53]. L’expérience consistait à placer un chat dans un environnement clos en face de deux écrans sur lesquels étaient projetées deux images différentes. L’apprentissage consistait en la reconnaissance d’une image, avec un œil ou l’autre, ou bien en vision binoculaire. Après chiasmotomie, il était procédé à la reconnaissance d’une image par un seul œil puis au test de reconnaissance par l’autre œil, qui était positif : il existait donc un transfert d’information visuelle entre les deux hémisphères par la seule voie fonctionnelle calleuse, la voie rétino-géniculo-corticale croisée ayant été lésée. En cas de chiasmotomie et de callosotomie en revanche, le test de reconnaissance par un œil alors que l’apprentissage avait été fait sur l’autre œil était négatif.
Chez l’humain, ce sont Gazzaniga [22, 23] et Bogen [11] qui ont montré un rôle visuel au corps calleux, puisqu’en cas de section du corps calleux pour traitement d’épilepsie sévère, les patients sont incapables de décrire verbalement un objet présent dans le champ visuel gauche, c’est-à-dire dont l’image est traitée par le cortex visuel droit. Or, l’aire du langage se situe dans l’hémisphère gauche.
Parallèlement, dans les années soixante a été décrit un syndrome par le professeur Jean Aicardi en 1965, associant épilepsie sévère réfractaire, agénésie du corps calleux, microcéphalie, hypotonie axiale avec hypertonie des extrémités, retard au développement et retard intellectuel, anomalies vertébrales, anomalies oculaires choriorétiniennes périphériques (ne touchant pas la macula) mais aussi strabisme [1]…
Enfin, chez les sujets strabiques, Saint-John et Timney ont montré par une simple expérience psychophysique consistant en une réponse manuelle à un stimulus visuel qu’il existait un retard de transmission lorsque la cible était présentée dans les 5° centraux, c’est-à-dire précisément au niveau du champ visuel calleux [63]. Il est maintenant bien établi que le corps calleux permet le transfert entre les deux hémisphères de messages aussi divers que visuels, limbiques, auditifs, somesthésiques et moteurs. En conséquence, il s’est révélé impliqué dans des fonctions cognitives supérieures comme la perception visuelle, la motricité, l’apprentissage et la mémoire.
La vision binoculaire normale requiert une vision monoculaire normale de chaque œil, bien entendu une rectitude des yeux, la présence de neurones binoculaires normaux au niveau du cortex visuel, mais aussi de connexions interhémisphériques normales.
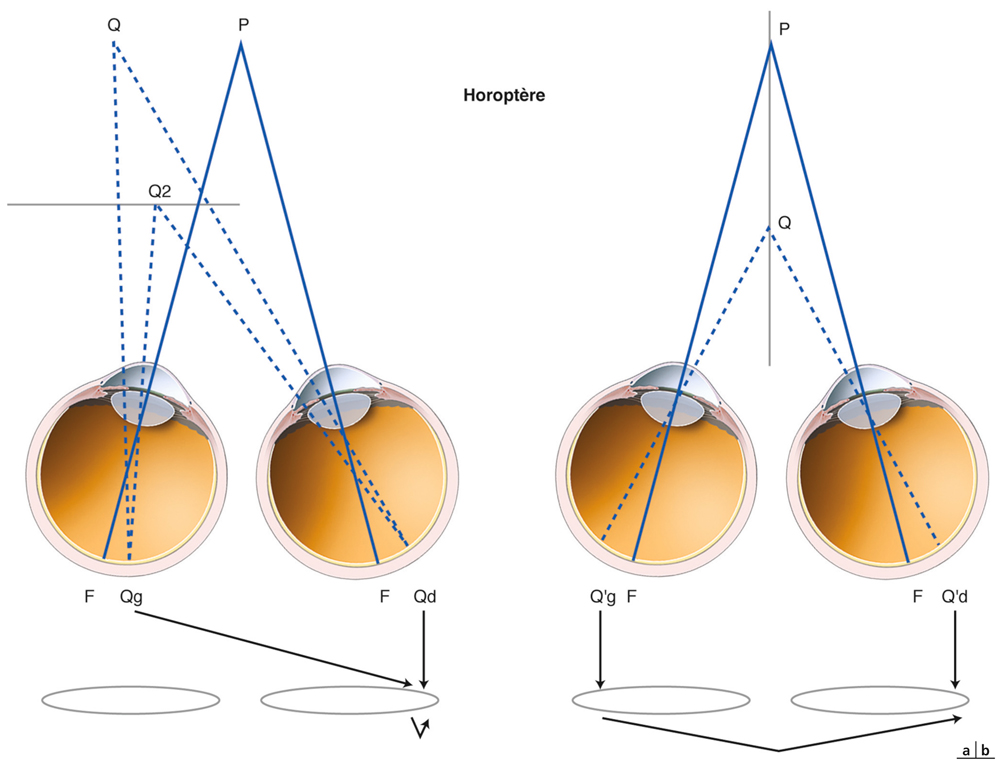
Fig. 21-50 Analyse de la disparité selon la localisation du point Q par rapport au point de fixation P.
a. Le point Q situé dans le champ visuel gauche par rapport au point de fixation P se projette sur la rétine temporale de l’œil droit et sur la rétine nasale de l’œil gauche, se projetant toutes deux dans l’hémisphère droit sur des points correspondants. Un point Q2 situé en avant de l’horoptère se projette sur des points non correspondants. La disparité entre ces points est analysée par des cellules sensibles à la disparité. b. Le point Q (qui se situe sur le méridien vertical central par rapport au point de fixation P) se projette sur les deux rétines temporales, se projetant dans deux hémisphères différents. Les connexions analysant la disparité entre ces points sont interhémisphériques.
Au sein d’un hémisphère, il existe des connexions entre les neurones visuels permettant l’analyse de la disparité. Considérons la figure en b : le point de fixation est P ; un point Q situé dans l’hémichamp visuel gauche va se projeter sur les deux hémirétines nasale gauche et temporale droite, lesquelles se projettent toutes deux dans l’hémisphère droit, sur des points homonymes. Si le point Q se situe un peu en avant, il va quitter la zone de l’horoptère et ses deux projections dans les hémirétines nasale gauche et temporale droite vont se placer dans des points non homonymes. L’analyse de la disparité entre F et Q est alors assurée par des connexions intracorticales dans l’hémisphère gauche. Considérons à droite le point Q qui maintenant se situe le long du méridien vertical central, ici en avant du point de fixation. Il se projette dans les deux hémirétines temporales, lesquelles se projettent dans deux hémisphères différents. C’est pourquoi on peut prédire la nécessité de connexions interhémisphériques pour la perception de la profondeur en avant ou en arrière du point de fixation.
En cas de strabisme chez l’enfant, il n’existe pas de diplopie, du fait de la neutralisation d’une image en provenance d’un œil.
L’existence d’une neutralisation au plan clinique dépend de la profondeur de l’amblyopie et il existe une corrélation négative entre neutralisation et amblyopie, c’est-à-dire que les phénomènes de neutralisation sont importants en absence d’amblyopie monoculaire (cette neutralisation étant alternante et correspondant à une fonctionnalité intermittente de synapses normales), alors que la neutralisation est faible en cas d’amblyopie (puisque dans ce cas les synapses sont anormales). Holopigian a étudié neuf sujets présentant une neutralisation du fait d’un strabisme ou d’une forte anisométropie, avec amblyopie plus ou moins sévère dans sept cas sur neuf. La neutralisation était attestée par un test avec verres de Bagolini et test de Worth. L’expérience psychophysique consistait en l’évaluation de la profondeur de la neutralisation par un test présenté en monoculaire ou binoculaire avec contraste variable ; la profondeur de neutralisation était corrélée à la profondeur de l’amblyopie [25].
Au plan expérimental, les fondements neurophysiologiques du phénomène de neutralisation ont été étudiés particulièrement dans le modèle de strabisme précoce. Ce phénomène de neutralisation existe chez le sujet normal et correspond à la diminution de la réponse évoquée au niveau d’un neurone visuel binoculaire lorsque l’autre œil reçoit un stimulus d’une orientation différente [66] ou d’une fréquence spatiale différente [62]. Ce phénomène est similaire chez le sujet strabique [66].
Chez les sujets strabiques et/ou anisométropes, l’image perçue par l’œil amblyope (non fixateur) est en général supprimée. Ceci résulte d’un processus de neutralisation interoculaire. En général, cette neutralisation a lieu très rapidement (en environ 80 ms) pour éviter la diplopie [17]. D’après les données électrophysiologiques effectuées chez l’animal (chat ou singe), cette neutralisation trouve son origine au niveau du cortex. La plupart des cellules du cortex visuel primaire chez les sujets strabiques ou anisométropes sont monoculaires. Pourtant, des interactions binoculaires persistent à leur niveau lorsque les deux yeux sont stimulés simultanément, mais elles sont suppressives au lieu d’avoir un effet facilitateur [14]. Cette inhibition s’exprime après que l’œil fixateur a eu son image. Cette inhibition est plus prononcée pour les neurones qui codent les hautes fréquences spatiales et cet effet est plus important chez les amblyopes de longue durée. Ces phénomènes de neutralisation seraient liés à des interneurones corticaux inhibiteurs médiés par un neuromédiateur inhibiteur : l’acide gamma-aminobutyrique (GABA) [64, 67, 68].
Le phénomène de neutralisation correspond à l’arrêt de la fonctionnalité de synapses normales. Il permet d’éviter la diplopie en l’absence de rectitude des yeux et existe en cas d’alternance du strabisme. La neutralisation est un phénomène intermittent qui protège de l’amblyopie car, en l’absence de neutralisation, deux alternatives s’offrent au strabique :
la diplopie ;
l’amblyopie, c’est-à-dire la disparition de synapses normales en provenance de l’œil dominé.
A. Péchereau
La correspondance rétinienne2 est un processus d’association des informations données par chaque œil pour obtenir une image simple. La correspondance rétinienne est normale quand les informations des fovéolas des deux yeux sont associées [35].
La correspondance rétinienne normale est la superposition au niveau cortical des images provenant des deux directions visuelles principales, c’est-à-dire de l’information visuelle provenant des deux fovéolas (fig. 21-51).
Elle indique que la cellule binoculaire (fig. 21-52) traitant l’information de deux colonnes de dominance (cellules monoculaires : couche IV du cortex visuel) juxtaposées et spécialisées dans le traitement du signal des deux fovéolas — colonne spécialisée dans l’information de l’œil droit et colonne spécialisée dans l’information de l’œil gauche — reçoit une information provenant de l’image d’un même objet d’attention, projetée sur ces deux dernières [56, 71, 75].
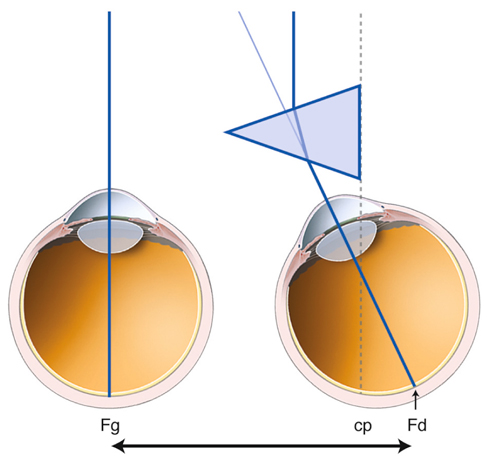
Fig. 21-51 Correspondance rétinienne normale. Grâce à l’interposition d’un prisme égal à la déviation (angle objectif, AO), les images des deux fovéolas sont superposées au niveau cortical.
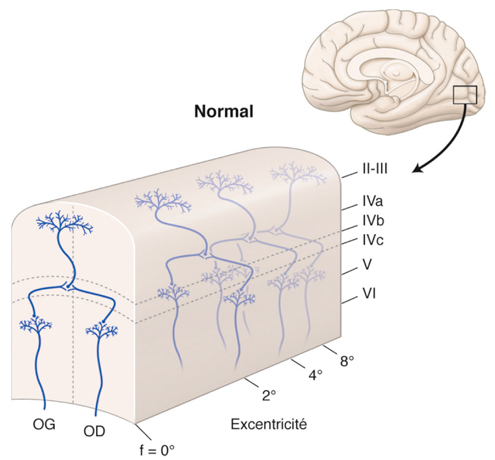
Fig. 21-52 Juxtaposition des colonnes de dominance oculaire dans le cortex.
Cette condition a les conséquences suivantes :
elle ne peut être étudiée que par un système haploscopique, c’est-à-dire produisant un signal différent pour l’œil droit et pour l’œil gauche ;
elle ne peut être étudiée qu’à l’angle objectif de l’espace : l’angle objectif est l’angle entre l’axe visuel (ou ligne de direction principale) de l’œil dévié et la ligne de direction secondaire de cet œil qui passe par le point objet de fixation3 ;
elle est sensible à une très petite déviation : en effet, le diamètre de la fovéola étant de 1,2° (fig. 21-53), cela veut dire qu’entre le centre et le bord de la fovéola (entre la CRN et la CRA), l’écart angulaire n’est que de 0,6° soit environ 1 Δ. Or, nous avons vu que la précision de la mesure aux prismes (la moins imprécise des méthodes) est de l’ordre de 2°.
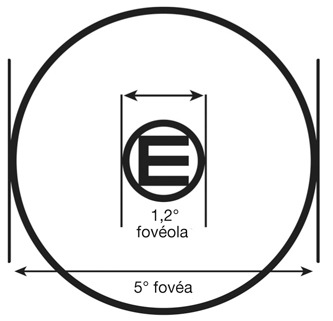
Fig. 21-53 Diamètre fovéolaire et fovéaire.
La correspondance rétinienne est normale dans les circonstances suivantes :
l’angle objectif est égal à l’angle subjectif (l’angle subjectif est l’écart perçu par le sujet strabique entre les deux images visuelles d’un même objet au cours de la diplopie binoculaire4 ; l’angle subjectif varie de zéro jusqu’à la taille de l’angle objectif et n’est jamais plus grand que lui [35]) ;
l’angle d’anomalie5 est égal à zéro (différence entre l’angle objectif et l’angle subjectif [35]).
A. Péchereau
La correspondance rétinienne6 est un processus d’association des informations données par chaque œil pour obtenir une image simple. La correspondance rétinienne est anormale quand la fovéola de l’œil fixateur est associée avec une zone rétinienne non fovéolaire de l’œil adelphe [35].
La correspondance rétinienne anormale est la superposition au niveau cortical des images provenant de la direction visuelle principale d’un œil et d’une direction visuelle secondaire de l’autre œil, c’est-à-dire d’informations visuelles provenant de la fovéola d’un œil et d’une zone non fovéolaire de l’autre œil (fig. 21-54).
Elle indique que le traitement du signal de l’image de l’objet d’attention des deux yeux n’est pas réalisé par des colonnes de dominance juxtaposées (fig. 21-55) [56, 71, 75]. Une image est traitée par une colonne de dominance fovéolaire (œil fixateur), l’autre image est traitée par une colonne non fovéolaire (œil non fixateur). Ceci a des conséquences monoculaires et binoculaires.
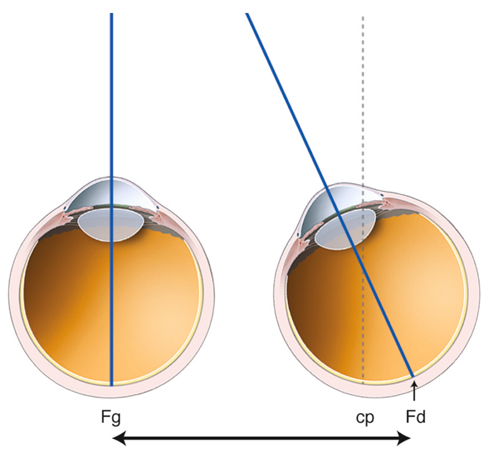
Fig. 21-54 Correspondance rétinienne anormale. La fovéola de l’œil gauche (Fg) n’est pas associée avec la fovéola de l’œil droit (Fd) mais avec un autre point rétinien (cp).
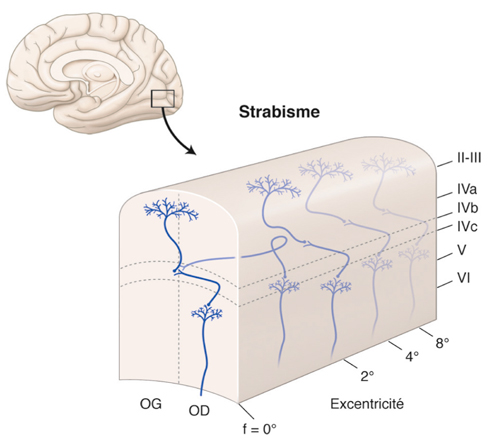
Fig. 21-55 Le signal fovéolaire de l’œil fixateur va de colonne de dominance en colonne de dominance jusqu’au signal fovéolaire de l’œil dévié.
Deux conséquences sont essentielles :
la qualité du signal provenant de la zone rétinienne stimulée de l’œil dévié par l’objet d’attention sera d’autant moins bonne que la déviation sera importante (la qualité du pouvoir de discrimination de la rétine diminue de façon très rapide avec l’excentration) ;
la qualité du signal (acuité visuelle) provenant des cellules de la couche monoculaire (couche IV) du cortex visuel traitant le signal provenant de la zone rétinienne de l’œil dévié sur laquelle se projette l’image de l’objet d’attention, sera d’autant moins bonne que l’amblyopie sera importante (par atteinte globale du pouvoir de discrimination et désorganisation des réseaux neuronaux, cf. chapitre 6).
Le signal de la colonne de dominance traitant le signal provenant de la zone de la rétine de l’œil dévié sur laquelle se projette l’image de l’objet d’attention doit parcourir une (2°) à plusieurs (plus de 2°) cellules binoculaires traitant d’autres colonnes de dominance avant de rejoindre la cellule binoculaire qui traite l’information provenant de la colonne de dominance qui traite l’information fovéolaire de l’œil fixateur [75] (fig. 21-56).
La théorie de l’information nous apprend qu’il existe une perte de la qualité du signal d’autant plus importante qu’un plus grand nombre de cellules doivent être parcourues. On sait par ailleurs que :
la distance entre deux colonnes de dominance est estimée à 2° (4 Δ [75]) ;
ce lien (c’est-à-dire, dans le développement de la CRA) est d’autant plus efficace que la distance du lien n’est pas plus grande que 4° à 5 ° (8 Δ à 10 Δ) soit la distance rétinotopique correspondant à un espace visuel enjambé par deux neurones binoculaires de V1.
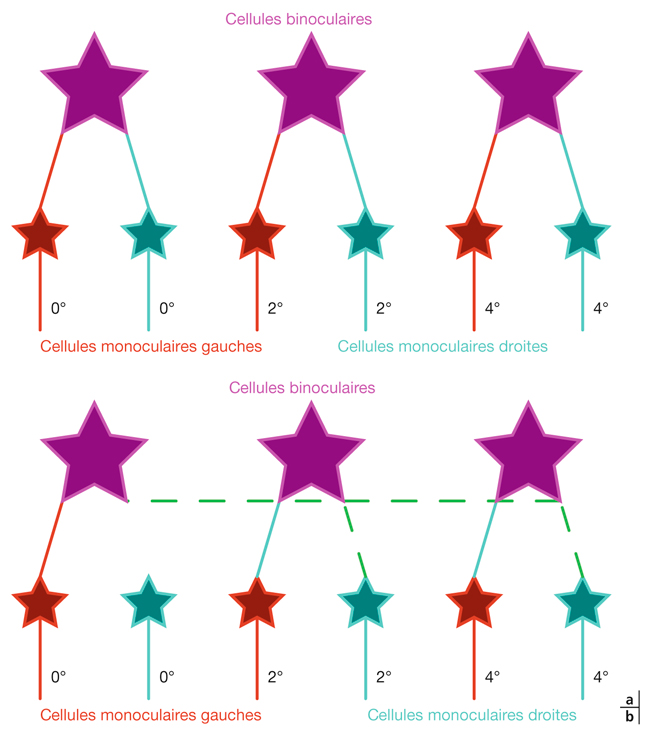
Fig. 21-56 Colonnes de dominance oculaire.
a. Organisation du sujet normal. b. Organisation du sujet strabique en fonction de l’angle.
De ce fait, on comprend deux éléments essentiels :
« Le monoculaire précède le binoculaire. » (Charles Rémy) : l’amblyopie en altérant le signal d’un œil provoque une baisse importante de la relation binoculaire ;
« La binocularité est angle-dépendante. » (André Roth) : plus l’angle est petit, plus la relation binoculaire est forte.
En termes orthoptiques (cf. chapitre 11), la correspondance rétinienne est anormale dans les circonstances suivantes :
l’angle subjectif n’est pas égal à l’angle objectif ;
l’angle d’anomalie n’est pas égal à zéro.
Ces dernières années, la physiopathologie du strabisme précoce ayant fait des progrès importants (cf. « I – Syndrome de strabisme précoce » au chapitre 12), deux signes moteurs ne peuvent apparaître qu’en cas de correspondance rétinienne anormale :
le nystagmus latent ;
la divergence verticale dissociée.
Ces deux signes moteurs sont pathognomoniques d’un strabisme précoce et donc d’une correspondance rétinienne anormale. Ces deux signes permettent de réunir le versant sensoriel et moteur de la déviation strabique.
Par le passé, une séméiologie de la correspondance rétinienne avait été décrite [31] : correspondance rétinienne anormale harmonieuse, correspondance rétinienne anormale dysharmonieuse, dualité de correspondance. En fonction des données neurophysiologiques actuelles, on peut dire :
la correspondance rétinienne est toujours harmonieuse et adaptée à l’angle objectif. Bagolini l’a démontré [4] ;
la correspondance rétinienne dysharmonieuse n’est liée qu’à une variation de l’angle objectif ou à des situations sans rapport avec le fonctionnement normal de la sensorialité ;
au sujet de la dualité de correspondance : vu les connaissances neurophysiologiques actuelles, il est difficile d’imaginer deux organisations neuronales dignes de ce nom cohabitant avec les mêmes neurones ; de ce fait : soit il existe une double relation binoculaire, elle est très labile et il n’est pas la peine d’en parler ; soit il y a une organisation prédominante qui se met en sommeil dans certaines circonstances, le lecteur aura compris que nous penchons pour la seconde solution.
Si cette relation est intéressante tant pour la coopération binoculaire que pour la stabilité de la déviation, elle n’est qu’un succédanée de la relation binoculaire normale. Et comme nous savons qu’une relation binoculaire normale n’est pas suffisante pour contrôler une déviation (strabismes réfractifs, strabismes accommodatifs, exophorie, tropies, etc.), il serait vain de croire qu’on pourrait bâtir un projet thérapeutique sur une telle relation anormale.
La fonction visuelle n’est pas mature à la naissance et il existe une période de développement de la fonction visuelle après la naissance.
Au plan neurophysiologique, ceci est démontré par les études de chronologie du développement visuel normal et repose sur le principe suivant : les propriétés du système visuel, dans des conditions expérimentales données, sont étudiées à différents âges de la vie. Lorsque le profil anatomo-fonctionnel adulte est atteint, la période sensible s’achève et la fonction visuelle a atteint son stade mature.
La chronologie développementale du corps géniculé latéral dorsal a par exemple été étudiée chez le singe par étude morphologique : il a été montré que des synapses exubérantes sont présentes à la naissance mais disparaissent à l’âge de trois mois (neuf mois chez l’homme) [21]. Chez le chat, les terminaisons géniculées des axones provenant des cellules ganglionnaires de la rétine atteignent leur profil adulte à l’âge de cinq à six semaines [43, 44].
Blakemore et Van Sluyters ont étudié la physiologie corticale normale au niveau du cortex visuel à l’âge adulte mais aussi à différents âges, chez le chat, en procédant à l’étude de la sélectivité à l’orientation en fonction de l’âge. Cette sélectivité à l’orientation est acquise entre le troisième et le quatrième mois de vie [10]. Étudiant également cette sélectivité à l’orientation, Milleret montre que l’acquisition de cette propriété est différente entre les neurones des aires 17 et 18 et elle estime que la fin de la période sensible est retardée de deux semaines pour les neurones de A18 par rapport à ceux de A17 [47]. Les études montrent toutes qu’il existe un développement postnatal, même si probablement la chronologie est variable, car les paradigmes expérimentaux diffèrent. Ainsi, par exemple, Frégnac et Imbert ont quant à eux estimé que la fin de la période sensible est plus précoce, puisque la sélectivité à l’orientation atteint quasiment un profil adulte à la quatrième semaine de vie chez le chat [20].
Dans un autre modèle animal, chez la souris, l’étude de mobilité des dendrites dans le cortex visuel, par microscopie photonique, a montré que la mobilité importante à la troisième semaine commence à diminuer entre le vingt et unième jour et le vingt-huitième jour, pour se stabiliser au quarante-huitième jour, où la connectivité neuronale a alors atteint son stade mature [42].
Chez l’homme, l’étude qualitative et quantitative des synapses du cortex visuel montre des exubérances présentes dès la naissance, qui augmentent du fait d’une importante synaptogenèse jusqu’à l’âge de huit mois, pour atteindre un profil adulte stable à l’âge de onze ans [21].
Les connexions interhémisphériques visuelles se développent également pendant la période postnatale. Ainsi, chez le chat, même si dès douze jours après la naissance, les cellules mises en jeu par le corps calleux sont strictement localisées à la bordure 17/18, comme chez l’adulte, elles présentent à cet âge des caractéristiques fonctionnelles très immatures [49]. Elles sont initialement peu sélectives pour l’orientation. Leurs champs récepteurs sont de grande taille, recouvrent également le méridien vertical central du champ visuel mais s’étendent cette fois très largement dans l’hémichamp ipsilatéral (jusqu’à 20°). Elles sont également binoculaires dès le plus jeune âge, avec également de grands champs récepteurs via la voie directe rétino-géniculo-corticale. Il en résulte de très larges disparités de position entre les couples de champs récepteurs de ces cellules binoculaires. Elles peuvent atteindre 16°. Elles se caractérisent en général par une absence totale de recouvrement entre ces champs et sont surtout de type croisé. Le type de disparité non croisée n’apparaît que plus tard avec l’âge. Les cellules mises en jeu par le corps calleux n’atteignent un profil adulte qu’entre le troisième et le quatrième mois.
Comme chez les autres mammifères, les fonctions visuelles du nouveau-né humain ne sont pas d’emblée optimales. Ce n’est qu’avec l’âge que celles-ci se développent. De nombreuses études d’estimation de ces fonctions visuelles à différents âges, par des tests d’acuité visuelle monoculaire, des tests de vision binoculaire mais aussi d’autres tests psychovisuels, peuvent permettre d’évaluer le profil chronologique de développement de la fonction visuelle chez l’humain. Il faut souligner la difficulté de l’étude de la fonction visuelle, du fait de la multiplicité même de l’éventail des paramètres étudiés : acuité visuelle, vision des couleurs, champ visuel, fonction de sensibilité aux contrastes… L’intérêt de l’appréciation du développement de la fonction visuelle chez l’homme est sous-tendu par le fait qu’on peut considérer que la période sensible se termine lorsque la maturation visuelle du paramètre étudié est parachevée.
L’évolution de l’acuité visuelle normale est difficile à évaluer chez l’enfant. Sa mesure est estimée le plus souvent par des tests cliniques (Bébé-Vision à l’aide de cartons de Teller avant l’âge de dix-huit mois), par mesure de l’acuité visuelle par lecture d’optotypes (échelle de Pigassou) à partir de trois ans. Les différents auteurs s’accordent pour estimer que l’acuité visuelle est de 1/10 à trois mois, 3/10 à un an, 10/10 à quatre ans [69].
La mesure de la vision binoculaire dépend du test utilisé : tests de stéréoscopie qualitative reposant sur la notion de parallaxe stéréoscopique (vues d’un même objet selon un angle différent par les deux yeux, créant ainsi une disparité rétinienne) ; tests de stéréoscopie fine, constitués de deux stéréogrammes superposés avec des nappes de points aléatoires.
Chez l’adulte, la stéréoscopie normale est inférieure à 30 secondes d’arc.
Chez l’enfant, l’évaluation peut être faite selon la méthode du regard préférentiel, avec des stéréogrammes. On considère que la stéréoscopie est absente dans les premiers mois de vie pour apparaître, brutalement, entre le troisième et le cinquième mois [71]. Elle n’atteint cependant des valeurs stables et de profil « adulte » qu’après six ans, comme l’a montré Romano. Ses travaux ont porté sur l’étude par le stéréotest de Titmus de la stéréoscopie de trois cent vingt et un enfants d’un an et demi à treize ans, considérés comme ayant des fonctions visuelles normales, c’est-à-dire sans anomalie ophtalmologique ou antécédents à risque d’altérer ou d’avoir altéré la stéréoscopie — cet a priori est un facteur limitant la validité de cette étude par ailleurs intéressante. La stéréoscopie atteint à cinq ans 140 secondes d’arc, à six ans 80 secondes d’arc, à neuf ans 40 secondes d’arc [61].
Le paramètre électrophysiologique « VERBS » (pattern Visual-Evoked Response Binocular Summation), c’est-à-dire la sommation binoculaire de la réponse évoquée visuelle à des stimulations structurées — définie par l’équation : 2 × Amplitude de la réponse évoquée visuelle à la stimulation binoculaire/(Amplitude de la réponse évoquée visuelle à la stimulation de l’œil droit + Amplitude de la réponse évoquée visuelle à la stimulation de l’œil gauche) — serait un reflet de la fonction stéréoscopique. Leguire a montré que ce paramètre présente un pic à l’âge de trois mois et décroît jusqu’au cinquante-huitième mois ; il correspondrait à la période sensible du développement de la vision stéréoscopique [37].
L’examen du champ visuel, qu’il soit statique ou dynamique, est bien entendu impossible chez le petit enfant. On peut cependant l’estimer en étudiant les saccades consécutives à des stimulus périphériques, en nasal ou en temporal. Ainsi, il a été estimé à 30° en nasal comme en temporal à la naissance, pour n’atteindre une taille presque adulte qu’à la fin de la première année [2].
La fonction de sensibilité au contraste de même ne peut qu’être estimée chez l’enfant, à partir de déductions sur le développement des canaux de codage de fréquence spatiale (couples ON/OFF de cellules ganglionnaires). Ce n’est qu’à trois mois que la fonction de sensibilité au contraste atteindrait un profil adulte (profil d’une courbe « en cloche »), avec cependant [3, 5] :
un décalage vers les basses fréquences spatiales, corrélativement à l’acuité visuelle qui demeure basse à cet âge ;
un décalage vers le bas de la sensibilité au contraste, qui demeure plus faible jusqu’au début de l’adolescence.
Les potentiels évoqués visuels chez l’enfant doivent être interprétés avec précaution. Les résultats dépendent bien évidemment de la maturation rétinienne, de la myélinisation des voies optiques. Ils doivent être systématiquement comparés au bruit de fond électrique. Pour les potentiels évoqués stationnaires, l’amplitude maximale recueillie va dépendre de la fréquence temporelle de stimulation : 2 Hz à la naissance, 4 Hz à six mois, 6 Hz à dix mois, 10 Hz après douze mois. Les potentiels évoqués par damiers permettent une évaluation de la discrimination spatiale mais nécessitent une fixation. Ainsi, l’interprétation des potentiels évoqués visuels dans le développement de la fonction visuelle est difficile. Rappelons que, du fait de la magnification maculaire, les potentiels évoqués visuels reflètent la fonction maculaire et la conduction des voies visuelles. Teller rappelle que, pour la majorité des auteurs, les potentiels évoqués visuels montreraient un profil adulte à six à huit mois [70].
La vision d’un enfant n’est pas optimale : l’acuité visuelle est estimée à 1/10 à la naissance et ne progresse au-delà de 10/10 qu’après quatre ou cinq ans. De même, la fonction binoculaire et toutes les fonctions visuelles sensorielles et motrices arrivent peu à peu à maturité pendant la période sensible du développement visuel. Ceci est sous-tendu au plan neural par une mise en place des réseaux neuronaux de façon précise avec régression d’exubérances précoces anormales au plan architectural, avec acquisition par les neurones visuels de leurs propriétés de sélectivité à l’orientation, de binocularité, comme le démontrent de très nombreuses études développementales.
Une altération de l’expérience visuelle précoce est une condition pathologique dont un risque majeur est l’amblyopie. Ce risque survient au cours d’une période après la naissance définie comme période critique, ou période sensible, du développement visuel. Les fondements de la notion de période sensible du développement visuel reposent sur les données neurophysiologiques et cliniques suivantes :
au plan fondamental, il existe :
une maturation des propriétés des neurones visuels ;
une altération de ces propriétés pendant une période postnatale en cas d’altération expérimentale de l’expérience visuelle ;
et, enfin, une réversibilité de ces altérations si une expérience visuelle normale est restaurée avant un certain délai ;
parallèlement, au plan clinique :
les fonctions visuelles maturent après la naissance ;
une pathologie ophtalmologique précoce est à risque d’amblyopie ;
la rééducation de l’amblyopie n’est efficace qu’avant un âge déterminé.
Ce sont encore une fois Hubel et Wiesel qui ont mené les premiers les expériences d’induction expérimentale d’amblyopie, essentiellement à l’aide de deux modèles : l’occlusion unilatérale par suture palpébrale et le strabisme précoce unilatéral par résection musculaire, chez le chaton. Ce sont eux qui ont introduit les premiers la notion de période sensible du développement visuel et qui ont mené les expériences de réversibilité de l’amblyopie.
Au plan neurophysiologique, les travaux de Hubel et Wiesel ainsi que de nombreux travaux ultérieurs ont montré les anomalies des propriétés des neurones corticaux en cas de strabisme précoce : perte de sélectivité à l’orientation, perte de binocularité… Il est en revanche remarquable de noter une rétinotopie conservée [41], ce qui est en désaccord avec l’hypothèse ancienne de Burian d’une modification des cartes corticales correspondant à la « correspondance rétinienne anormale » clinique [13].
Comment la mécanique visuelle est-elle modifiée en cas d’expérience visuelle anormale ? En physiologie normale sont définies les propriétés fondamentales des neurones visuels. Une modification de ces propriétés par une altération de l’expérience visuelle — nous retrouvons encore Hubel et Wiesel qui ont procédé à des enregistrements de l’activité multi-unitaire dans le cortex visuel, chez le chat normal, à différents âges de vie, puis après altération précoce de l’expérience visuelle telle que l’occlusion monoculaire ou le strabisme — a conduit à la connaissance des bases neurales de l’amblyopie. Il a été par ailleurs défini la période sensible du développement visuel pour plusieurs raisons :
existence d’un profil de développement des propriétés neuronales jusqu’au profil adulte ;
modifications des propriétés neuronales par une altération de l’expérience visuelle différentes en fonction de l’âge et absence de modifications au-delà d’un certain âge ;
réversibilité de ces altérations avant un certain âge.
Cette approche fondamentale est tout à fait parallèle à l’expérience clinique : profil de développement des fonctions visuelles, amblyopie par altération de l’expérience visuelle précoce, possibilité de traitement de l’amblyopie jusqu’à un certain âge.
S’il existe des éléments montrant que rétine et nerf optique poursuivent une maturation en postnatal, il n’a pas été montré de modifications structurelles en cas d’amblyopie.
Après altération de l’expérience visuelle, on retrouve une modification des propriétés électrophysiologiques des neurones du corps géniculé latéral dorsal (CGLd), dont la chronologie est variable selon les études, les animaux, le modèle expérimental (occlusion, strabisme). De même pour les propriétés fondamentales des neurones visuels, il a été montré une perte de la binocularité, une perte de la sélectivité à l’orientation après altération de l’expérience visuelle, mais selon des profils chronologiques variables et une période sensible du développement visuel chez le chat variant entre un et six mois. Un élément intéressant a été montré par Daw [16] qui étudie la dominance oculaire : la période sensible serait plus longue pour les cellules de II/III par rapport à celles de IV. Les caractéristiques anatomo-fonctionnelles des neurones calleux sont altérées après strabisme convergent unilatéral précoce. Enfin, plusieurs études ont montré la réversibilité des altérations fonctionnelles neuronales après rétablissement d’une expérience visuelle normale (prismation mise puis enlevée) chez le chat, le singe, le furet.
Les bases neurales de l’amblyopie sont fondées sur la modification des caractéristiques anatomo-fonctionnelles des neurones visuels en cas d’altération de l’expérience visuelle précocement. L’amblyopie peut être réversible si les altérations ne sont pas fixées (synapse non fonctionnelle mais présente). En revanche, une amblyopie sévère fixée peut schématiquement correspondre au plan neural à l’établissement de connexions anormales et aberrantes.
Rappelons enfin que la maturation neuronale normale comme anormale repose sur des cascades moléculaires avec intervention de gènes du développement, de phénomènes de synchronisation entre assemblées de neurones.
Lorsque le physiologiste altère l’expérience visuelle, il peut le faire à différents âges et les conséquences d’une altération de l’expérience visuelle pourront être différentes selon l’âge, car la plasticité cérébrale est variable au cours du développement ; après la fin de la période sensible du développement visuel, l’altération de l’expérience visuelle créera plus ou moins de modifications du profil anatomo-fonctionnel étudié. De très nombreux paradigmes peuvent être employés pour procéder à l’altération de l’expérience visuelle : occlusion monoculaire ou binoculaire par suture de paupière ou pose de lentilles opaque (de façon alternante ou non), induction d’une anisométropie par surcorrection optique, induction d’un strabisme convergent ou divergent… Par ailleurs, les paradigmes expérimentaux peuvent être très variables en fonction de l’âge de l’animal au moment de l’altération de l’expérience visuelle.
Baumbach et Chow ont montré que la suture des paupières d’un œil chez le lapin entre le huitième et le vingt-cinquième jour entraîne une nette diminution de l’amplitude de la réponse évoquée des cellules du CGLd et de la taille des champs récepteurs, sans toutefois altérer la sélectivité directionnelle [6]. Ces altérations fonctionnelles sont moins importantes pour une privation induite à partir du vingt et unième jour ; elles sont absentes en cas de privation à l’âge adulte. Cette expérience montre qu’il existe une période sensible pour la propriété étudiée, dont le sommet est très précoce, sans toutefois pouvoir en préciser le terme, en l’absence d’expérience entre le vingt et unième jour et l’âge adulte.
La période sensible du développement du CGLd a été étudiée par Ikeda dans un modèle de strabisme bilatéral induit à différents âges de vie chez le chat [32]. Le strabisme était induit à différents âges entre trois et seize semaines et un enregistrement électrophysiologique de l’activité des neurones du CGLd évoquée par stimulation de l’area centralis, était réalisé entre les âges de quatre et huit mois (âge adulte). Le seuil de résolution spatiale du stimulus nécessaire à la mise en activité des neurones du CGLd augmentait graduellement avec la date de la chirurgie d’induction du strabisme, pour atteindre un seuil normal entre treize et seize semaines, ce qui peut correspondre dans ce modèle à la fin de la période sensible.
De très nombreuses études montrent qu’une altération de l’expérience visuelle précoce, monoculaire (occlusion, strabisme) ou bilatérale (élevage d’animaux à l’obscurité), entraîne des conséquences anatomiques et fonctionnelles majeures au niveau du cortex visuel.
Les travaux de Olson et Freeman ont, par exemple, porté sur l’étude par enregistrement électrophysiologique de la binocularité des cellules corticales visuelles de treize chats soumis à une occlusion monoculaire de douze jours à différents âges entre la naissance et l’âge de quatre mois. La perte de binocularité induite par l’occlusion monoculaire, correspondant à une réponse prédominante après stimulation de l’œil sain, était majeure, augmentait graduellement entre la naissance et le vingt-huitième jour, pour se stabiliser au quarante-huitième jour, décroître mais persister au quatrième mois, ce qui suggère que la période sensible ne s’achève finalement pas avant cette date [54].
Berman et Murphy ont étudié la perte de binocularité induite par un strabisme à différents âges de vie chez le chat et estiment la fin de la période sensible entre le quatre-vingt-unième et le quatre-vingt-dix-septième jour de vie, puisque l’animal opéré à l’âge de quatre-vingt-un jours avait un pourcentage diminué de cellules binoculaires complexes, alors que celui opéré à quatre-vingt-dix-sept jours avait un pourcentage normal de cellules binoculaires, qu’elles soient simples ou complexes. Ceci correspond donc à une fin de la période sensible à la fin du troisième mois [7].
Les travaux de Mower ont montré que la sensibilité à une occlusion monoculaire de deux jours chez le chat, faible à trois semaines, augmentait jusqu’à la sixième semaine puis déclinait jusqu’à la seizième semaine, celle-ci marquant la fin de la période sensible [51]. Ces travaux ont par ailleurs montré pour une expérience similaire, mais chez des chats élevés à l’obscurité, que le pic de la période sensible était retardé et se situait entre la douzième et la seizième semaine.
Les travaux de Daw ont porté sur une occlusion monoculaire chez le chat, durant trois mois, débutée à huit ou neuf mois, douze mois, quinze mois. L’étude des propriétés visuelles a été réalisée par analyse des colonnes de dominance oculaire des couches II/III, IV et V/VI [16]. La dominance oculaire est modifiée pour les couches II/III et V/VI si l’occlusion est commencée au huitième ou neuvième mois, ou bien au douzième mois, mais pas au quinzième mois, ce qui place la fin de la période sensible entre douze et quinze mois pour ces couches. En revanche, il n’y a pas de modification de dominance oculaire pour la couche IV, ce qui place la fin de la période sensible avant le huitième mois pour cette couche.
Chez le macaque, les colonnes de dominance oculaire ont été étudiées par autoradiographie des coupes de cortex, après injection d’un traceur, la proline tritiée, injectée en intravitréen, à l’âge adulte, huit mois au moins après l’occlusion monoculaire par suture palpébrale réalisée à un, trois, cinq, sept et douze semaines de vie [26]. Ces travaux de Horton et Hocking ont montré une nette réduction des colonnes correspondantes à l’œil occlus jusqu’à l’âge de sept semaines. En revanche, l’occlusion monoculaire réalisée à la douzième semaine n’entraîne pas de modification de la dominance oculaire. Cela suggère une fin de la période sensible pour la dominance oculaire entre sept et douze semaines, ce qui concorde avec l’étude de LeVay qui l’estimait dans un modèle similaire à dix semaines [38]. Horton et Hocking ont poursuivi leurs travaux en réalisant une énucléation d’un œil de macaque à un, cinq et douze semaines [26]. Ils ont montré que l’énucléation précoce entraînait une disparition de colonnes de dominance oculaire dans la couche IVC du cortex visuel primaire V1 — c’est-à-dire des modifications plus importantes qu’en cas de suture palpébrale — ; l’énucléation plus tardive à cinq semaines laissait subsister 20 % des colonnes du cortex visuel primaire V1 issues de l’œil énucléé ; l’énucléation à douze semaines n’entraînait quasi aucune modification des colonnes de dominance. Il n’y avait aucune altération des colonnes de dominance du cortex visuel secondaire V2 quel que soit l’âge d’énucléation.
Un strabisme convergent unilatéral induit de façon précoce chez le chat modifie significativement le développement des terminaisons calleuses dans l’hémisphère ipsilatéral à l’œil dévié. Les caractéristiques fonctionnelles des neurones qu’elles activent sont également anormales [48]. Les études fonctionnelles à l’âge adulte montrent en effet que ces neurones sont localisés non seulement à la bordure 17/18, comme dans le cas normal, mais également dans une portion significative des aires 17 et 18. La moitié d’entre eux sont non sélectifs pour l’orientation. Leur habilité à coder la vitesse des stimulus visuels est altérée par rapport à la normale. Il a été également établi que leurs champs récepteurs sont plus grands que la normale et s’étendent très significativement dans l’hémichamp ipsilatéral à l’hémisphère exploré, perdant même tout contact avec le méridien vertical central du champ visuel. Certains de ces neurones sont binoculaires, mais leurs paires de champs récepteurs présentent une grande disparité, exclusivement de type croisé, et ne se recouvrent pas du tout. Cette étude suggère bien qu’il existe une période sensible du développement de l’intégration interhémisphérique visuelle via le corps calleux, sans toutefois en préciser les limites, en l’absence d’étude à différents âges. Cependant, une étude parallèle de la même équipe a étudié les propriétés des neurones calleux chez le chat adulte dont le strabisme avait été induit non pas peu après la naissance mais à l’âge d’un an [73]. Elle montre une perte de sélectivité à l’orientation et une augmentation de taille des champs récepteurs des neurones calleux, ce qui montre qu’une plasticité est possible à l’âge adulte ; la période sensible ainsi définie se poursuivrait donc jusqu’à l’âge adulte.
Elberger avait, dans les années quatre-vingt, mené une expérience consistant à sectionner le corps calleux à différents âges de vie du chat (une, deux, trois, quatre et vingt-neuf semaines), puis avait testé l’acuité visuelle de ces chats par méthode comportementale. Seule une section du corps calleux réalisée avant la quatrième semaine modifiait cette acuité visuelle estimée, ce qui suggère une très brève période sensible dans cette condition [18]. Il a par la suite étudié avec Smith la binocularité des neurones corticaux visuels après une même section du corps calleux ; ils ont montré que cette propriété n’était affectée que si la section du corps calleux avait lieu avant le dix-neuvième jour, ce qui situe la fin de la période sensible dans cette condition à la troisième semaine [18].
Chez le singe peuvent être observées les conséquences d’une altération de l’expérience visuelle, par exemple un strabisme, en étudiant les conséquences sur la fonction visuelle par des tests psychophysiques. Ainsi, les travaux de Kiorpes [33, 34] ont montré qu’une amblyopie est induite par un strabisme chez 75 % des singes si le strabisme survient avant l’âge de cinq semaines, alors que seuls 40 % des singes dont le strabisme survient après l’âge de cinq semaines présentent une amblyopie.
Une altération précoce de l’expérience visuelle, telle que le strabisme lorsqu’il survient à un âge précoce de la vie, et d’autant plus que cet âge est précoce, modifie profondément les caractéristiques anatomo-fonctionnelles des neurones visuels, au niveau du corps géniculé latéral dorsal, au niveau du cortex visuel, au niveau du corps calleux, ce qui explique l’amblyopie monoculaire et/ou binoculaire.
À la naissance, dans l’espèce humaine comme chez tous les mammifères supérieurs, le développement anatomo-fonctionnel des structures oculaires, des voies visuelles et des zones cérébrales impliquées dans la perception visuelle (cortex primaire mais aussi aires associatives et corps calleux postérieur) n’est pas terminé. Il existe une période de construction des réseaux neuronaux nécessaire à une fonction visuelle optimale, monoculaire et binoculaire, sensorielle et motrice. Cette période de construction est cruciale car le cerveau est encore plastique et peut être modelé avant d’atteindre un état « figé » chez l’adulte (ce n’est pas totalement vrai ; cf. « Plasticité cérébrale chez l’adulte »). La plasticité cérébrale peut être négative ; ainsi, une altération précoce de l’expérience visuelle chez l’enfant, quelle que soit la pathologie oculaire en cause, peut engendrer une amblyopie [50]. Mais cette plasticité cérébrale peut également être positive et, ainsi, c’est avant la fin de cette période plastique qu’il faut réorienter un développement visuel pathologique vers un développement normal ou proche de la normale [39].
La constatation d’un développement différentiel de la vision en fonction de l’expérience visuelle a permis de faire émerger le concept de « période critique » du développement visuel. Hubel et Wiesel ont utilisé le terme de « period of susceptibility », d’autres ont utilisé le terme de « sensitive period », mais c’est le terme de « critical period » qui finalement est le plus souvent employé [30]. Dans la terminologie francophone, on retrouve indifféremment les termes de « période sensible » ou « période critique » du développement visuel, employés comme synonymes. Il pourrait néanmoins être suggéré que l’utilisation du terme de période sensible sous-tende les notions de développement et de chronologie, puisqu’il s’agit de la période pendant laquelle la perception visuelle est sensible, donc vulnérable à une altération de l’expérience visuelle. Parallèlement, l’utilisation du terme de période critique sous-tendrait la notion d’urgence thérapeutique, puisqu’il s’agit de la période pendant laquelle la rééducation de l’amblyopie peut être efficace. Nous utiliserons le terme de période sensible, qui s’appliquera cependant à l’ensemble de ces notions, développementale et thérapeutique.
Les fondements de la notion de période sensible du développement visuel sont de deux ordres, fondés d’une part sur l’expérience fondamentale, d’autre part sur l’expérience clinique.
La notion de période sensible du développement visuel a été démontrée au plan fondamental, puisque les altérations des propriétés anatomo-fonctionnelles des neurones visuels ne sont pas retrouvées au-delà d’un certain âge. Le clinicien sait parfaitement qu’une altération de l’expérience visuelle n’a pas le même pronostic en fonction de l’âge de l’enfant. La période sensible du développement visuel va donc pouvoir se définir comme la période au cours de laquelle le système visuel se met en place, au plan anatomique comme au plan fonctionnel. Lorsque le profil adulte est atteint, on peut considérer que la période sensible se termine. Cette approche nécessite au plan fondamental des études à différents âges de vie, jusqu’à l’âge adulte, études dont les résultats sont hautement variables en fonction des propriétés étudiées, du protocole expérimental et de l’animal étudié puisque la durée de la période sensible varie en fonction de l’espèce et des caractéristiques considérées.
Cette même période sensible peut aussi se définir comme la période au cours de laquelle une altération de l’expérience visuelle modifie les propriétés du système visuel (création d’un déficit sur le long terme) ; la période sensible serait alors terminée lorsque l’altération de l’expérience visuelle devient sans conséquence significative.
Enfin, la période sensible peut correspondre à la période au cours de laquelle les altérations neurophysiologiques des propriétés des neurones visuels sont encore réversibles, car les phénomènes de plasticité cérébrale qui ont engendré les modifications des propriétés neuronales dans un sens négatif peuvent également modifier ces propriétés dans un sens positif de la restauration d’une fonctionnalité proche de la normale. Cela nécessite au plan fondamental des expériences de privation puis de rétablissement de la fonction visuelle ; il s’agit d’expérimentations plus difficiles à mettre en œuvre.
La date limite au cours de ces expériences marque la fin d’une période sensible, mise en évidence dans le développement des neurones du corps géniculé latéral dorsal, des neurones du cortex visuel et des voies calleuses visuelles.
D’ores et déjà, nous réalisons qu’il est impossible de définir « une » période sensible du développement visuel, et que plusieurs définitions vont être nécessaires. La période sensible semblait être une notion évidente. Pour le praticien, les conséquences étaient simples : au-delà d’un certain âge chez l’homme, la rééducation de l’amblyopie est difficile voire illusoire, même si on pouvait toujours se féliciter d’un cas exceptionnel de rééducation tardive… Les contours du début de la période sensible sont flous ; il est clair qu’il existe un « sommet » de la période sensible au cours duquel la guérison est la plus fréquente, mais les limites de la fin de la période sensible du développement visuel sont plus hypothétiques. De fait, les conséquences d’une altération de l’expérience visuelle et les possibilités de les faire régresser dépendent des caractères précis de la privation visuelle en cause (temps, durée, type). Mais la réalité et la chronologie précise de la période sensible restent floues et de nombreux mécanismes fondamentaux restent inconnus. Les phénomènes de plasticité semblent sous-tendus par une expression différentielle de gènes au cours du développement [36], mais les mécanismes de régulation sous-jacents restent à établir.
Au plan clinique, les fondements de la période sensible reposent sur une chronologie particulière du développement des propriétés de la fonction visuelle. Il est par ailleurs constaté d’une part que l’altération de l’expérience visuelle n’a pas les mêmes conséquences selon la date d’apparition du déficit et, d’autre part, que la probabilité de succès d’une rééducation d’amblyopie augmente avec la précocité de la prise en charge. Les constatations chez l’humain corroborent parfaitement les données fondamentales. Il existe un profil de développement des propriétés visuelles : acuité visuelle, mais aussi fonction binoculaire, fonction de sensibilité au contraste, champ visuel, motilité oculaire (la vision est une fonction sensorielle et motrice). En cas d’altération précoce de l’expérience visuelle, par exemple un strabisme précoce, une cataracte congénitale, un angiome palpébral occluant l’axe visuel — la liste est loin d’être exhaustive —, il existe un risque d’amblyopie fonctionnelle, même si la part organique de l’amblyopie a été traitée (chirurgie de la cataracte, par exemple). Les conséquences de la perturbation visuelle varient en fonction de l’âge, car la plasticité cérébrale, en ce qui concerne la fonction visuelle, a un sommet entre un et deux ans. Il est difficile cependant dans les études cliniques d’étudier la réversibilité de l’amblyopie en fonction de l’âge, du fait de la sévérité même de l’amblyopie qui est très variable dans ces cohortes non homogènes, dans lesquelles la date de survenue de la pathologie est variable, souvent imprécise ou méconnue. Quant à la fin de la période sensible, c’est l’objet de la section suivante de cet ouvrage.
Le modèle visuel a permis de nombreuses études de la plasticité cérébrale. En effet, il est facilement accessible (œil ou cortex visuel) et il est facilement modifiable (strabisme, occlusion, pénalisations optiques ou pharmacologiques, élevage à l’obscurité). La plasticité cérébrale est une notion évidente désormais, et la plasticité visuelle un de ses exemples majeurs. La plasticité visuelle est variable, selon l’âge, la propriété étudiée, car il existe en fait plusieurs périodes sensibles du développement visuel. Quoi qu’il en soit, cette plasticité explique le phénomène d’amblyopie, qui est une préoccupation majeure en ophtalmopédiatrie, car son traitement est urgent, puisqu’il doit être conduit alors même que la plasticité visuelle existe encore.
La question du développement visuel a fait couler beaucoup d’encre depuis les années soixante. Le modèle visuel est tellement séduisant dans l’étude de la plasticité cérébrale ! La littérature scientifique et médicale sur le sujet est abondante.
Les concepts définissant la (les) période(s) sensible(s) du développement visuel étaient déjà établis il y a trente ans, grâce aux travaux d’électrophysiologie fonctionnelle de Hubel et Wiesel, qui écrivaient en 1970 [74] : « La sensibilité aux effets de la privation visuelle unilatérale commence soudainement au début de la quatrième semaine, demeure élevée jusqu’à un moment entre la sixième et la huitième semaine, disparaissant finalement à la fin du troisième mois. » Les travaux ultérieurs ont précisé ces concepts, ont élargi le champ d’étude à d’autres modèles animaux que le chat, ont introduit de nouveaux protocoles d’induction d’amblyopie, ont étudié d’autres structures cérébrales, ont utilisé d’autres méthodes d’étude de la physiologie visuelle (ainsi, par exemple, l’imagerie optique chez l’animal, l’imagerie fonctionnelle par résonance magnétique nucléaire chez l’homme ou l’animal in vivo), ont profité des avancées considérables des connaissances de biologie moléculaire et de génétique. Une formidable complexité est donc apparue du fait de la multiplicité des nouveaux concepts introduits.
Il est une gageure de tenter de définir une seule période sensible du développement visuel. Il est évident qu’il existe une multiplicité de périodes sensibles, de par la diversité même des différents éléments de la fonction visuelle qu’on mesure. Par ailleurs, pour un même type de mécanisme d’amblyopie et pour une même fonction visuelle mesurée, la période sensible se modifie en fonction de l’état de l’animal testé. Par exemple, la période sensible semble être prolongée en cas d’absence d’expérience visuelle (élevage à l’obscurité). En ce qui concerne les dates chronologiques, il est hasardeux de faire des corrélations entre la chronologie estimée chez l’animal et la chronologie humaine, au moyen d’un « facteur multiplicatif » bien arbitraire. Il n’est pas certain que les mécanismes moléculaires qui sous-tendent la période sensible qu’on étudie chez l’animal soient les mêmes chez l’homme.
Existe-t-il une unicité de la période sensible du développement visuel ? Il ne semble pas. Daw suggère un modèle selon lequel la période sensible est d’autant plus longue que l’intégration perceptive est élaborée, c’est-à-dire que la période sensible de développement du corps géniculé latéral dorsal est plus courte que celle du cortex visuel primaire, elle-même plus courte que celles des cortex visuels secondaires et associatifs [15].
Il est intéressant de réaliser que, quelle que soit l’imprécision qui entoure la notion de période sensible, la courbe d’évolution de la période sensible (début, sommet, fin ; cf. fig. 6-7) a un aspect semblable que ce soit dans les expériences fondamentales ou dans les études cliniques. Cependant, les limites de la courbe d’évolution de la période sensible demeurent elles-mêmes imprécises : la période sensible se termine-t-elle brusquement (ce qui correspondrait à un arrêt d’expression d’un gène de développement) ou bien se termine-t-elle en pente « douce », ce qui au plan moléculaire correspondrait à une expression génique diminuant progressivement ? Ces hypothèses sont bien simplistes et il est probable que d’innombrables cascades métaboliques interviennent au cours du développement, en prénatal comme en postnatal. On peut supposer que certaines expressions de gènes du développement seraient innées et ne dépendraient pas de l’expérience visuelle. D’autres seraient acquises ou régulées en fonction de l’expérience visuelle. Le formidable et terrifiant défi à relever pour comprendre la mécanique du développement visuel est de connaître toutes les pièces du puzzle et leur ordre d’entrée en scène, comme de vastes pièces de domino, basculant à un moment précis pour faire basculer la suivante, jusqu’à la pièce finale. Que le mécanisme soit interrompu à quelque endroit que ce soit et le processus est perturbé.
La question du début de la période sensible est rarement abordée. La période sensible débute-t-elle dès la naissance, voire in utero ? Existe-t-il plutôt un délai entre la naissance et le début de la période sensible ? L’expérimentation animale comme les études cliniques suggèrent une courte période postnatale où il n’existe pas d’altération de la fonction visuelle induite par une altération de l’expérience visuelle. Les études concernant la période postnatale immédiate sont cependant difficiles et les résultats dépendent des méthodes d’étude.
Cette question du début de la période sensible sous-tend également la problématique de ce qui est inné et ce qui est acquis. Quelle part du développement de la fonction visuelle a un support génétique non modifiable par l’expérience, ce qui en fait une propriété innée ? Quelle part au contraire dépend de l’expérience visuelle, ce qui en fait une fonction acquise ?
La période sensible du développement visuelle est cette période aux frontières encore incertaines au cours de laquelle une altération asymétrique de l’expérience visuelle engendre une amblyopie. C’est la période au cours de laquelle il est indispensable de diagnostiquer l’amblyopie, afin de la traiter de façon urgente et déterminée.
La plasticité cérébrale prend deux formes : plasticité anatomique précoce, pendant la période de construction des connexions neurales, et plasticité fonctionnelle, qui peut être plus tardive, voire exister à l’âge adulte [24, 73]. Ce phénomène de plasticité tardive serait la conséquence du passage d’un état quiescent à un état activé des connexions synaptiques. Milleret donne un exemple de cette plasticité adulte sur ses travaux concernant les connexions interhémisphériques [46].
Existe-t-il réellement une fin de la période sensible ? Les expériences cliniques de rééducation tardive, les modèles montrant une plasticité à l’âge adulte (par études fonctionnelles ou par approches moléculaires) semblent suggérer que la période sensible ne se termine pas, mais « s’endort », pour se rétablir si les conditions visuelles se modifient. Cependant, certaines modifications sont irréversibles : la proportion de cellules monoculaires ou binoculaires dans le cortex visuel, les zones de terminaison normales ou pathologiques des axones calleux. C’est-à-dire qu’après la « fin » estimée de la période sensible, seules les altérations anatomiques sont définitives, alors que les altérations fonctionnelles — que l’on peut supposer correspondre au caractère fonctionnel ou non d’une synapse existante — sont réversibles. En d’autres termes, un axone ne peut modifier à l’âge adulte la localisation de ses terminaisons, mais ses synapses peuvent être fonctionnellement activées ou non, et il peut y avoir une synaptogenèse locale. Ces données sont corroborées par l’expérience moléculaire.
Il est toujours utile d’entreprendre un traitement de l’amblyopie car il existe une plasticité cérébrale même après six ans, même à l’adolescence voire même à l’âge adulte. Le praticien face à un grand enfant amblyope doit toujours être dans l’incertitude des traitements antérieurs réalisés ou pas, et tenter un traitement si nécessaire.
[1] Aicardi J, Chevrie J-J, Rousselie F. Le syndrome spasmes en flexion agénésie calleuse, anomalies chorio-rétiniennes. Arch Fr Pediatr, 1969 ; 26 : 1103-1120.
[2] Atkinson J, Braddick O. Stereoscopy discrimination in infants. Perception, 1976 ; 5 : 29-38.
[3] Atkinson J, Braddick O, Moar K. Development of contrast sensitivity over the first 3 months of life in the human infant. Vision Res, 1977 ; 17 : 1037-1044.
[4] Bagolini B. Diagnostic et possibilités thérapeutiques de l’état sensorial du strabisme concomitant avec des instruments peu dissociant (les verres striés et la barre à filtres). Ann Ocul (Paris), 1961 Mar ; 194 : 236-58.
[5] Banks MS. The development of spatial and temporal contrast sensitivity. Curr Eye Res, 1982 ; 2 : 191-198.
[6] Baumbach HD, Chow KL. Receptive field development in the dorsal lateral geniculate nucleus in rabbits subjected to monocular eyelid suture. Brain Res, 1978 ; 159 : 69-83.
[7] Berman N, Murphy EH. The critical period for alteration in cortical binocularity resulting from divergent and convergent strabismus. Brain Res, 1981 ; 254 : 181-202.
[8] Blake R, Wilson H. Binocular vision. Vision Res, 2011 ; 51 : 754-770.
[9] Blakemore C. Binocular depth discrimination and the nasotemporal division. J Physiol, 1969 ; 205 : 471-497.
[10] Blakemore C, Van Sluyters RC. Innate and environmental factors in the development of the kitten’s visual cortex. J Physiol, 1975 ; 248 : 663-716.
[11] Bogen JE, Fisher ED, Vogel PJ. Cerebral commissurotomy. A second case report. JAMA, 1965 ; 194 : 1328-1329.
[12] Bunt AH, Minckler DS. Foveal sparing. New anatomical evidence for bilateral representation of the central retina. Arch Ophthalmol, 1977 ; 95 : 1445-1447.
[13] Burian HM. Anomalous retinal correspondence: Its essence an its significance in diagnosis and treatment. Am J Ophthalmol, 1951 ; 34 : 237.
[14] Chino YM, Smith EL 3rd, Yoshida K, Cheng H, Hamamoto J. Binocular interactions in striate cortical neurons of cats reared with discordant visual inputs. J Neurosci, 1994 ; 14 : 5050-5067.
[15] Daw NW. Critical periods and amblyopia. Arch Ophthalmol, 1998 ; 116 : 502-505.
[16] Daw NW, Fox K, Sato H, Czepita D. Critical period for monocular deprivation in the cat visual cortex. J Neurophysiol, 1992 ; 67 : 197-202.
[17] De Belsunce S, Sireteanu R. The time course of interocular neutralisation in normal and amblyopic subjects. Invest Ophthalmol Vis Sci, 1991 ; 32 : 2645-2652.
[18] Elberger AJ. The existence of a separate, brief critical period for the corpus callosum to affect visual development. Behav Brain Res, 1984 ; 11 : 223-231.
[19] Elberger AJ, Smith EL 3rd. The critical period for corpus callosum section to affect cortical binocularity. Exp Brain Res, 1985 ; 57 : 213-223.
[20] Frégnac Y, Imbert M. Early development of visual cortical cells in normal and dark-reared kittens: relationship between orientation selectivity and ocular dominance. J Physiol, 1978 ; 278 : 27-44.
[21] Garey L-J, de Courten C. Structural development of the lateral geniculate nucleus and visual cortex in monkey and man. Behav Brain Res, 1983 ; 10 : 3-13.
[22] Gazzaniga MS, Bogen JE, Sperry RW. Some functional effects of sectioning the cerebral commissures in man. Proc Natl Acad Sci USA, 1962 ; 48 : 1765-1769.
[23] Gazzaniga MS, Bogen JE, Sperry RW. Observations on visual perception after disconnexion of the cerebral hemispheres in man. Brain, 1965 ; 88 : 221-236.
[24] Gilbert CD, Li W. Adult visual cortical plasticity. Neuron, 2012 ; 75 : 250-264.
[25] Holopigian K, Blake R, Greenwald MJ. Clinical suppression and amblyopia. Invest Ophthalmol Vis Sci, 1988 ; 29 : 444-451.
[26] Horton JC, Hocking DR. Timing of the critical period for plasticity of ocular dominance columns in macaque striate cortex. J Neurosci, 1997 ; 17 : 3684-3709.
[27] Horton JC, Hocking DR. Effect of early monocular enucleation upon ocular dominance columns and cytochrome oxidase activity in monkey and human visual cortex. Vis Neurosci, 1998 ; 15 : 289-303.
[28] Houzel J-C, Milleret C, Innocenti G. Morphology of callosal axons interconnecting areas 17 and 18 of the cat. Eur J Neurosci, 1994 ; 6 : 898-917.
[29] Hubel D. L’œil, le cerveau et la vision. Paris, Belin, 1994.
[30] Hubel DH. Single unit activity in striate cortex of unrestrained cats. J Physiol, 1959 ; 147 : 226-238.
[31] Hugonnier R. Strabismes, hétérophories et paralysies oculo-motrices. Paris, Masson, 1959.
[32] Ikeda H, Tremain KE, Einon GE. Loss of spatial resolution of lateral geniculate nucleus neurones in kittens raised with convergent squint produced at different stages in development. Exp Brain Res, 1978 ; 31 : 207-220.
[33] Kiorpes L, Carlson MR, Alfi D. Development of visual acuity in experimentally strabismic monkeys. Clin Vision Sci, 1989 ; 4 : 95-106.
[34] Kiorpes L. Development of spatial resolution and contrast sensitivity in naturally strabismic monkeys. Clin Vision Sci, 1989 ; 4 : 279-293.
[35] Lanthony P. Dictionnaire du strabisme. Paris, Maloine, 1983.
[36] Lee WC, Nedivi E. Extended plasticity of visual cortex in dark-reared animals may result from prolonged expression of cpg15-like genes. Neurosci, 2002 ; 22 : 1807-1815.
[37] Leguire LE, Rogers GL, Bremer DL. Visual-evoked response binocular summation in normal and strabismic infants. Defining the critical period. Invest Ophthalmol Vis Sci, 1991 ; 32 : 126-133.
[38] LeVay S, Wiesel TN, Hubel DH. The development of ocular dominance columns in normal and visually deprived monkeys. J Comp Neurol, 1980 ; 191 : 1-51.
[39] Levitt FB, Van Sluyters RC. Recovery of binocular function in kitten visual cortex. J Neurophysiol, 1982 ; 48 : 1336-1346.
[40] Livingstone MS, Hubel DH. Specificity of intrinsic connections in primate primary visual cortex. J Neurosci, 1984 ; 4 : 2830-2835.
[41] MacCormack G. Normal retinotopic mapping in human strabismus with anomalous retinal correspondence. Invest Ophthalmol Vis Sci, 1990 ; 31 : 559-568.
[42] Majewska A, Sur M. Motility of dendritic spines in visual cortex in vivo: changes during the critical period and effects of visual deprivation. Proc Natl Acad Sci USA, 2003 ; 100 : 16024-16029.
[43] Mason CA. Development of terminal arbors of retino-geniculate axons in the kitten – I. Light microscopical observations. Neuroscience, 1982 ; 7 : 541-559.
[44] Mason CA. Development of terminal arbors of retino-geniculate axons in the kitten – II. Electron microscopical observations. Neuroscience, 1982 ; 7 : 561-582.
[45] Milleret C. Visual callosal connections and strabismus. Behav Brain Res, 1994 ; 64 : 85-95.
[46] Milleret C, Buser P. Reorganization processes in the visual cortex also depend on visual experience in the adult cat. Prog Brain Res, 1993 ; 95 : 257-269.
[47] Milleret C, Gary-Bobo E, Buisseret P. Comparative development of cell properties in cortical area 18 of normal and dark-reared kittens. Exp Brain Res, 1988 ; 71 : 8-20.
[48] Milleret C, Houzel J-C. Visual interhemispheric transfer to areas 17 and 18 in cats with convergent strabismus. Eur J Neurosci, 2001 ; 13 : 137-152.
[49] Milleret C, Houzel J-C, Buser P. Pattern of development of the callosal transfer of visual information to cortical areas 17 and 18 in the cat. Eur J Neurosci, 1994 ; 6 : 193-202.
[50] Mittelman D. Amblyopia. Pediatr Clin North Am, 2003 ; 50 : 189-196.
[51] Mower GD. The effect of dark rearing on the time course of the critical period in cat visual cortex. Brain Res Dev Brain Res, 1991 ; 58 : 151-158.
[52] Myers RE. Function of corpus callosum in interocular transfer. Brain, 1956 ; 79 : 358-363.
[53] Myers RE, Sperry RW. Interhemispheric communication through the corpus callosum: mnemonic carry-over between the hemispheres. AMA Arch Neurol Psychiatry, 1958 ; 80 : 298-303.
[54] Olson CR, Freeman RD. Profile of the sensitive period for monocular deprivation in kittens. Exp Brain Res, 1980 ; 39 : 17-21.
[55] Payne B. Visual-field map in the transcallosal sending zone of area 17 in the cat. Vis Neurosci, 1991 ; 7 : 201-219.
[56] Péchereau A. Polycopié du DU de Strabologie. Tome 1. FNRO, 2009.
[57] Pettigrew JD, Dreher B. Parallel processing of binocular disparity in the cat’s retinogeniculocortical pathways. Proc R Soc Lond B Biol Sci, 1987 ; 232 : 297-321.
[58] Reid RC. From functional architecture to functional connectomics. Neuron, 2012 ; 75 : 209-217.
[59] Rodieck RW. Informer le cerveau. In : La Vision. Bruxelles, De Boeck, 2003 : 266-291.
[60] Rodieck RW. Regarder. In : La Vision. Bruxelles, De Boeck, 2003 : 292-325.
[61] Romano PE, Romano JA, Puklin JE. Stereoacuity development in children with normal binocular single vision. Am J Ophthalmol, 1975 ; 79 : 966-971.
[62] Saint-Amour D, Leporé F, Guillemot J-P. Binocular fusion/suppression to spatial frequency differences at the border of areas 17/18 of the cat. Neuroscience, 2004 ; 124 : 121-136.
[63] Saint-John R, Timney B. Interhemispheric transmission delays in human strabismics. Human Neurobiol, 1986 ; 5 : 97-103.
[64] Sale A, Vetencourt JFM, Medini P, Cenni MC, Baroncelli L, De pasquale R, Maffei L. Environmental enrichment in adulthood promotes amblyopia recovery through a reduction of intracortical inhibition. Nature Neuroscience, 2007 ; 10 : 679-681.
[65] Sengpiel F, Blakemore C, Harrad R. Interocular suppression in the primary visual cortex: a possible neural basis of binocular rivalry. Vision Res, 1994 ; 35 : 179-195.
[66] Sengpiel F, Blakemore C, Kind PC, Harrad R. Interocular suppression in the visual cortex of strabismic cats. J Neuroscience, 1994 ; 14 : 6855-6871.
[67] Sengpiel F, Vorobyov V. Intracortical origins of interocular suppression in the visual cortex. J Neuroscience, 2005 ; 25 : 6394-6400.
[68] Sengpiel F, Jirmann KU, Vorobyov V, Eysel UT. Strabismic suppression is mediated by inhibitory interactions in the primary visual cortex. Cereb Cortex, 2006 ; 16 : 1750-1758.
[69] Speeg-Schatz C. Développement des fonctions visuelles chez le jeune enfant. Ann Pédiatr (Paris), 1996 ; 43 : 372-378.
[70] Teller DY. Visual development. Vision Res, 1986 ; 26 : 1483-1506.
[71] Tychsen L. Binocular vision. In : Adler’s Physiology of the eye. 9th edition. Elsevier Saunders, 1992 : 773-853.
[72] Von Noorden GK. Binocular vision and space perception. In : Binocular vision and ocular motility. Theory and management of strabismus. 6th edition. St Louis, Mosby, 2002.
[73] Watroba L, Buser P, Milleret C. Impairment of binocular vision in the adult cat induces plastic changes in the callosal cortical map. Eur J Neurosci, 2001 ; 14 : 1021-1029.
[74] Wiesel TN, Hubel DH. Comparison of the effects of unilateral and bilateral eye closure on cortical units responses in kittens. J Neurophysiol, 1965 ; 26 : 1029-1040.
[75] Wong AM, Lueder GT, Burkhalter A, Tychsen L. Anomalous retinal correspondence: Neuroanatomic mechanism in strabismic monkeys and clinical findings in strabismic children. J AAPOS, 2000 ; 4 : 168-174.
E. Bui Quoc, P. Lebranchu
L’intégration perceptive visuelle ne se limite par au cortex visuel primaire. À partir de celui-ci, il existe (selon un modèle théorique proposé par Mishkin et Ungerleider dès 1982 [7, 12]) deux voies (fig. 21-57) :
une voie dorsale vers le cortex pariétal postérieur, le cortex prémoteur latéral et le cortex préfrontal ;
une voie ventrale vers le cortex inférotemporal puis le cortex préfrontal.
Les informations visuelles font plusieurs relais le long de ces voies, ces relais correspondant à des degrés supérieurs d’intégration perceptive.
L’altération précoce de l’expérience visuelle entraîne des modifications du cortex visuel primaire, comme nous l’avons exposé. Mais, au-delà, dans d’autres zones corticales, il existe également en cas d’amblyopie de profonds phénomènes de réorganisation. Ainsi, par exemple, chez le singe présentant une occlusion monoculaire de la naissance à l’âge d’un an, l’enregistrement multi-unitaire extracellulaire transdural au niveau de l’aire 7 de Brodmann montre que l’activité évoquée par stimulation de l’œil occlus est diminuée ; au contraire, dans cette même zone, les activités somesthésique et motrice sont augmentées. Cependant, un an après le rétablissement de la fonction visuelle binoculaire, l’activité visuelle de l’aire 7 augmente sans toutefois atteindre le niveau normal ; cela suggère des phénomènes de réversibilité tardive et, donc, une période sensible plus longue au niveau de ces aires visuelles secondaires [2].
D’autres études ont montré que l’aire suprasylvienne postéromédiale latérale et l’aire 21a sont affectées par une amblyopie strabique chez le chat, puisque la dominance oculaire (étudiée par enregistrement électrophysiologique après stimulation visuelle) est altérée dans cette condition [17]. Il n’a pas encore été toutefois réalisé d’études développementales à ce niveau.
Rappelons enfin l’intérêt de l’IRM fonctionnelle pour l’étude des aires extra-striées en cas d’amblyopie. Ainsi, par exemple, l’étude de Lerner montre qu’en cas d’amblyopie, l’activité des aires occipito-temporales est altérée dans la reconnaissance des visages (mais, de façon surprenante, pas des bâtiments) [10].
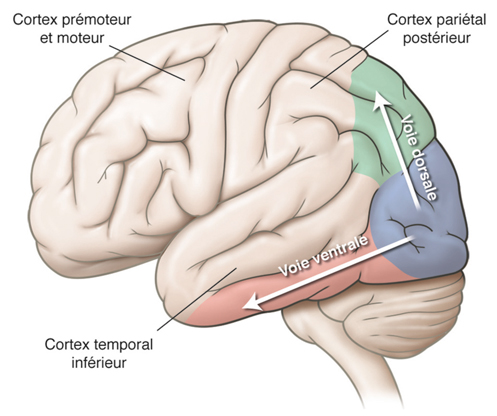
Fig. 21-57 Voie ventrale et la voie dorsale.
Entendre sans écouter, cela pourrait être l’équivalent auditif du vaste ensemble constituant les agnosies visuelles. L’agnosie visuelle est la condition pathologique dans laquelle il existe un défaut de la capacité de reconnaissance, alors même qu’au plan sensoriel il n’y a pas de déficit. En cas d’agnosie visuelle, le patient voit mais ne perçoit pas. Le cerveau reçoit l’image mais ne l’interprète pas. Il existe en fait une multitude d’agnosies visuelles que les neurologues (plus rarement les ophtalmologistes) décrivent avec force détails.
Avant d’évoquer ces agnosies visuelles, évoquons un trouble visuel conséquence d’une anomalie du cerveau et non pas de l’œil, qui finalement pourrait s’opposer à l’agnosie visuelle, en ce sens que le sujet ne voit pas mais utilise son information visuelle. Ainsi, dans certaines lésions du cortex visuel primaire, il existe un scotome ou un déficit du champ visuel mais les patients sont souvent capables d’utiliser l’information visuelle présente dans leur scotome bien qu’ils ne soient pas capables de la percevoir consciemment. Ce phénomène est dénommé la « vision aveugle » ou « blindsight ». On peut retrouver de telles manifestations de cécité corticale en cas de destruction du cortex strié de façon unilatérale ou bilatérale, par anoxie, traumatisme, intoxication oxycarbonée, leucoencéphalite…
On retrouve en fait des tableaux finalement rarissimes, mais variés à l’infini, selon l’étiologie et la localisation de l’atteinte. On retrouve des comportements de malvoyance extrême, avec perte des réflexes photomoteurs mais aussi des réflexes de clignement à la menace ou à la lumière. L’examen anatomique est normal. Il existe souvent des lésions neurologiques associées, d’où la difficulté de faire le diagnostic différentiel avec des troubles neuropsychiatriques. L’examen anatomique ophtalmologique est normal. L’électrorétinogramme est normal. Les potentiels évoqués visuels sont normaux sauf en cas de destruction occipitale sévère. Le nystagmus optocinétique est aboli, ce qui fait le diagnostic différentiel avec une cécité psychogène/hystérique dans lequel il est conservé. L’imagerie cérébrale et le contexte guident le diagnostic. La mise en évidence de l’utilisation de l’information visuelle a été faite par exemple dans les lésions occipitales unilatérales en présentant un stimulus visuel dans l’hémichamp visuel controlatéral à la lésion. Alors que le sujet ne le voit pas, ne le reconnaît pas, il devine un stimulus, et fait marquant, il peut s’en servir. De Gelder a merveilleusement décrit le cas de ce fameux patient T.N., atteint de cécité corticale par deux accidents vasculaires cérébraux postérieurs successifs [4]. Aveugle, il a été demandé au sujet de se mouvoir dans un couloir, sans sa canne blanche, alors qu’il avait été volontairement mis des obstacles sur le chemin. Les expérimentateurs ont noté que le sujet, alors qu’ils ne les voyaient pas, a pu éviter les obstacles de façon inconsciente, mais réelle, et non par hasard. De fait, cette « vision aveugle » serait due soit à l’activité de cellules résiduelles du cortex occipital, insuffisante pour permettre une vision consciente, mais suffisante pour permettre au cerveau de détecter les obstacles. L’autre hypothèse serait un rôle de la voie optique accessoire via le colliculus supérieur ou encore un rôle du corps géniculé latéral dorsal dont les neurones demeurent intacts dans ce cas.
À l’inverse de ces tableaux sévères, on retrouve des tableaux plus subtils de perte de fonctions visuelles élaborées. Ce sont donc les agnosies visuelles. Il faut ici se référer au merveilleux auteur qu’est Oliver Sacks, auteur célèbre de L’Homme qui prenait sa femme pour un chapeau et, très récemment, de L’Œil de l’esprit, publié en 2011 [16]. Oliver Sacks est sans pareil pour décrire avec détail le cas par exemple de Lilian. Cette pianiste virtuose a ressenti l’apparition progressive d’un phénomène étrange : alors qu’elle lisait parfaitement les notes, les portées, les lignes, cet ensemble si familier pour elle était devenu dépourvu de sens. Elle reconnaissait chaque note, mais mise bout à bout, cela n’avait plus de sens. Cette alexie musicale est devenue avec le temps une alexie plus conventionnelle, c’est-à-dire que la patiente, dont l’acuité visuelle demeurait parfaite, pouvait distinguer les lettres une par une d’un mot, par exemple « S-T-R-A-B-I-S-M-E », mais dont la capacité à lire et déchiffrer le mot « STRABISME » était devenue absente. Curieusement, sa capacité d’écriture était intacte : il s’agissait d’une alexie sans agraphie. Lilian a réussi pendant des années à compenser son trouble progressif, due en fait à une atrophie corticale postérieure, ce qui est souvent plus difficile dans le cas d’une alexie brutale à la suite d’un accident vasculaire cérébral. Il existe des zones du cerveau impliquées dans la lecture, de façon plus ou moins spécifique et Stanislas Dehaene a su décrire avec bonheur ces neurones de la lecture [5], dont l’existence est traquée par l’imagerie par résonance magnétique fonctionnelle. On connaît une aire du cortex inférotemporal : l’aire de la forme visuelle des mots. Pour autant, le cerveau reste bien mystérieux, et on ne comprend pas encore bien pourquoi des Japonais peuvent être atteints d’alexie aux idéogrammes mais pas à l’écriture syllabique et inversement, le japonais pouvant être écrit au moyen de kanjis (idéogrammes) comme le chinois, mais aussi de façon syllabique (signes syllabiques : hiraganas et katakanas) ; probablement que les zones impliquées du cerveau sont différentes. Le cerveau est si merveilleux — et le neurophysiologiste si subtil — qu’il a même été mis en évidence des neurones qui reconnaissent les visages et qui vont vous dire à qui vous avez à faire : un neurone pour Napoléon, un neurone pour votre boulanger, un neurone pour votre mère… Aussi incroyable que cela paraisse, c’est une zone précise du cerveau qui commande cette faculté, au niveau du cortex visuel associatif droit, plus précisément au niveau du cortex occipitotemporal : la structure dite gyrus fusiforme est quasiment toujours lésée en cas de prosopagnosie — c’est le terme médical qui décrit cette absence de reconnaissance des visages : le sujet voit le visage, peut le décrire (les yeux, le grain de peau, l’expression, la couleur des cheveux, etc.), mais tous ces détails ne lui permettent pas de dire s’il s’agit de Pierre ou de Jacques, alors qu’en l’absence de pathologie, c’est « au premier coup d’œil » et sans avoir besoin de descriptifs particulier qu’un sujet va pouvoir reconnaître son interlocuteur.
Ainsi, on peut voir sans lire, connaître sans reconnaître. L’œil a été rétrogradé à un appendice du cerveau, un capteur périphérique qui n’est que peu de chose sans le cortex visuel ; pourtant, ce dernier est comme un navire sans gouvernail si le reste du cerveau est déficient : une Castafiore aphone, une automobile morte de soif après le énième choc pétrolier… La mécanique visuelle est un réseau de neurones, de structures dont chacune a un rôle fondamental : l’une sans l’autre n’est rien.
Nous souhaitons ici citer René et Suzanne Hugonnier qui, dans l’introduction de leur ouvrage de 1959 [8], écrivaient : « Si la vision binoculaire normale et pathologique attire un certain nombre d’ophtalmologistes (il existe maintenant des spécialistes plus ou moins exclusifs, les « strabologues »), elle rebute la plupart d’entre eux. » Ils terminaient cette introduction par : « Il faut tâcher de rétablir la vision binoculaire toutes les fois que cela est possible… »
La vision binoculaire est un raffinement des espèces animales qualifiées de « supérieures », permises par la frontalisation des yeux, dont l’intérêt pour le prédateur est de connaître dans l’espace la position précise de sa proie : songeons à l’aigle qui s’abat depuis les cieux vers l’objet lointain de sa convoitise… Pour l’homme au xxie siècle, la vision binoculaire est aussi un loisir délicat permettant la vision en trois dimensions dans les nouvelles salles obscures.
Ne pas voir en trois dimensions est donc un handicap (relatif) que la qualification de « cécité binoculaire » souligne avec force. En cas de cécité binoculaire — quand bien même la vision est à 10/10 (voire plus) des deux yeux —, il n’y a pas de vision du relief et le patient est un amblyope car sa vue (ήώπή) est faible (άμβλεία) au plan stéréoscopique : l’absence de vision binoculaire est une absence de caractère « robuste, vigoureux » (στερεός) de la vision ! En somme, ne voir qu’en deux dimensions, c’est ne voir qu’à moitié… L’objectif thérapeutique des strabologues est le rétablissement de la rectitude des yeux — c’est ce que les parents notent en premier —, mais c’est également (voire surtout) le rétablissement d’une vision binoculaire normale ; la rectitude des yeux n’en est que le préalable ou le prérequis. Désormais, ceci dit, les parents et les enfants vont comprendre de plus en plus la problématique de la cécité binoculaire, voire exiger que celle-ci soit normale car quel dommage que le bambin ne puisse distinguer en relief son héros de cinéma favori.
Comment définir ou redéfinir alors nos objectifs thérapeutiques, au regard de ce que nous enseigne la physiologie d’une part, les études cliniques d’autre part ? René et Suzanne Hugonnier, à raison, demeurent prudents quant aux possibilités thérapeutiques dans le strabisme. Alain Péchereau souligne quant à lui que le strabisme précoce demeure une maladie incurable, précisément car dans ces cas, quelle que soit la thérapeutique employée, la cécité binoculaire demeure, c’est-à-dire que la vision binoculaire n’est jamais normale [14]. Pour autant, nos collègues d’outre-Atlantique continuent de s’interroger sur l’opportunité de la chirurgie précoce dans l’ésotropie « congénitale » (le terme de strabisme précoce est plus approprié) et imaginent parfois pouvoir réparer le cerveau [18].
Les études cliniques demeurent incertaines, parfois avec des biais, et certaines publications préconisent toujours la chirurgie précoce dans le strabisme précoce car elle permettrait dans de rares cas d’obtenir quelques améliorations de la stéréoscopie de contour (grossière). Mais est-ce vraiment une vision binoculaire normale qu’on arrive à obtenir, c’est-à-dire un TNO inférieur à 40 secondes ? Il semble que non.
Revenons à la physiologie : une altération de l’expérience visuelle précoce entraîne des séquelles au niveau du cerveau définitives, irréversibles, ce qui explique l’impossibilité de rétablir une vision binoculaire normale. Le cerveau en développement est un réseau de neurones partiellement organisés, et les câbles sont encore désorganisés : il existe des axones trop nombreux, des connexions synaptiques exubérantes. Au plan visuel, c’est l’expérience visuelle normale qui permet une synchronisation de l’activité des neurones entre eux et la régression des exubérances anormales. La mise en place du réseau de neurones se fait très tôt après la naissance. Ainsi, par exemple, un neurone calleux en provenance du cortex visuel d’un œil va établir ses connexions avec une zone précise de l’hémisphère controlatéral : la bordure de transition (fig. 21-58). En cas de strabisme précoce, ses terminaisons sont anormales, exubérantes et se terminent à des endroits tout à fait anormaux dans les aires 17 et 18 du cerveau (fig. 21-59). Cette anomalie anatomique est définitive et ne régresse pas.
Si l’amblyopie monoculaire peut être rapportée aux modifications de la voie rétino-géniculo-corticale en cas d’altération précoce de l’expérience visuelle, comme cela a été montré à de nombreuses reprises depuis les travaux pionniers de Hubel et Wiesel, chez le singe ou le chat — ces anomalies se situent au niveau du thalamus (corps géniculé latéral), du cortex, voire de la rétine pour certains auteurs [11] —, l’amblyopie binoculaire quant à elle résulte de la diminution du nombre de cellules binoculaires en cas d’altération de l’expérience visuelle (avec courbe en « U » caractéristique de répartition des dominances oculaires), mais aussi d’une altération des connexions interhémisphériques via le corps calleux. L’amblyopie strabique se caractérise par la mise en place d’une asymétrie anatomo-fonctionnelle des connexions de l’hémisphère droit vers l’hémisphère gauche et inversement au cours du développement postnatal. Il en résulte une asymétrie dans l’intégration interhémisphérique de l’information visuelle elle-même.
Les exubérances calleuses sont-elles un mécanisme de compensation du strabisme, ces exubérances, tout du moins les exubérances médiolatérales, tentant de compenser la disparité spatiale des champs récepteurs issus de chacun des deux yeux, mais correspondant à une même cellule corticale ? On pourrait le penser puisque ces exubérances se projettent de façon organisée : d’une part en conservant l’architecture anatomique en « colonnes » ou amas, d’autre part en se situant dans des régions corticales orientées de façon perpendiculaire à la bordure, c’est-à-dire correspondant à un axe horizontal du champ visuel. Ces phénomènes de compensation demeurent très certainement vains : la vision binoculaire demeure altérée en cas de strabisme précoce, même si l’acuité visuelle est conservée. Cette dernière constatation est encore une fois corroborée par l’expérience fondamentale.
En revanche, en cas de strabisme plus tardif (par exemple, dans le strabisme accommodatif), les réseaux neuronaux sont en place et les anomalies induites par le strabisme ne sont pas « anatomiques » mais « fonctionnelles », c’est-à-dire que les connexions synaptiques entre les neurones visuels sont localisées au bon endroit mais elles ne fonctionnent pas de façon normale. C’est dans ces cas que le traitement du strabisme a une relative urgence, car il faut rétablir la rectitude des yeux rapidement avant la fin de la période sensible du développement visuel afin de rétablir/restaurer/préserver la fonction binoculaire.
La cécité binoculaire est l’absence de vision binoculaire normale ; elle est constante en cas de strabisme précoce.
Il est nécessaire en cas de strabisme (à l’exclusion du strabisme précoce) de rétablir la rectitude des yeux avant la fin de la période sensible du développement visuelle afin de préserver la vision binoculaire.
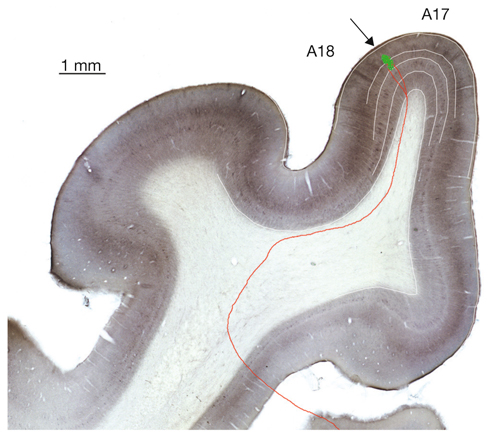
Fig. 21-58 Axone calleux aux terminaisons normales dans la bordure entre les aires 17 et 18.
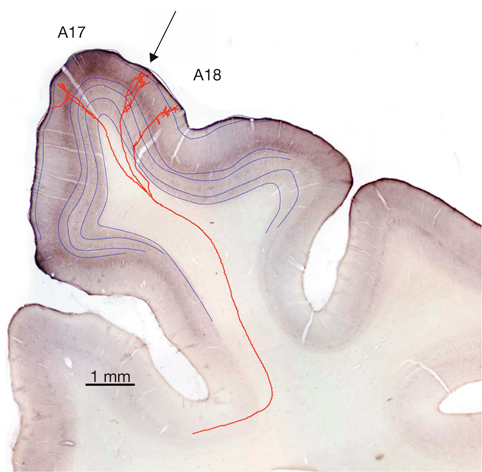
Fig. 21-59 Axone calleux aux terminaisons exubérantes dans les aires 17 et 18 en cas de strabisme.
La relation œil-main est une relation fondamentale, qui est encensée et soulignée dans tout bilan orthoptique respectable. Pour autant, croire que la relation œil-main existe est très certainement se mettre le doigt dans l’œil… Et la science découle de faits et non de croyances.
Comme cela a été exposé dans l’article sur les hémichamps visuels, on a compris que le cerveau droit voit l’hémichamp visuel gauche et que le cerveau gauche voit l’hémichamp visuel droit. Qu’en est-il de la commande centrale de la main ? Parmi les voies de la motricité, on distingue :
le système pyramidal, qui est responsable de la motricité volontaire ; il s’agit d’un système à deux neurones dans lequel le neurone central va faire synapse avec le motoneurone situé dans le tronc cérébral ou dans la moelle spinale ;
le système extrapyramidal, qui est système de contrôle involontaire des mouvements.
Or les fibres du système pyramidal présentent une décussation qui se fait à deux niveaux : la majorité des fibres motrices décussent au niveau de la jonction bulbomédullaire et constituent le faisceau corticospinal latéral ; l’autre partie, constituant le faisceau corticospinal direct latéral, va croiser secondairement aux différents étages du tronc cérébral et de la moelle pour constituer le faisceau pyramidal secondairement croisé. La commande centrale des membres provient au niveau cortical de l’aire 4 de Brodmann, qui occupe la moitié postérieure du gyrus précentral, avec une partie pour le membre supérieur et une partie pour le membre inférieur (fig. 21-60). Au sein du cortex moteur du membre supérieur, la zone responsable de la motricité de la main constitue une zone surreprésentée du fait de l’importance de la main — ce qui explique la difformité de l’homonculus de Penfield, qui est cette célèbre représentation d’un humain allongé sur le cortex avec une taille de ses membres et structures proportionnelle à la topographie corticale (fig. 21-61). Ainsi, le cerveau droit (qui voit l’hémichamp visuel gauche) commande la main gauche et le cerveau gauche (qui voit l’hémichamp visuel droit) commande la main droite [15].
Même s’il existe des connexions interhémisphériques et intracorticales, le concept de relation œil-main est une ineptie inutile, dont la description conventionnelle ne permettrait quand bien même que de dire qu’elle est bonne/moyenne/anormale (?) ce qui conduirait à la traiter/rééduquer par des moyens d’ailleurs bien inconnus voire obscurs…
Fig. 21-60 La décussation des fibres motrices.
Fig. 21-61 Homonculus de Penfield.
3 : partie inférieure et latérale du cortex moteur primaire (aire 4) ; 22 : partie supérieure et interne du cortex moteur primaire (aire 4).
Notre espace est organisé comme la combinaison d’une multitude de référentiels spatiaux. « La question des référentiels utilisés par le cerveau pour guider nos actions dans l’espace est cruciale. En effet, aucun système artificiel ne peut échapper à la construction d’une référence par rapport à laquelle sont codées la perception et l’action. Nous pouvons coder la place d’un objet dans l’espace par rapport à la pièce dans laquelle nous nous trouvons, mais aussi par rapport à notre main ou par rapport aux objets qui l’entourent… [1] »
Ce référentiel est centré sur l’œil. C’est un système organisé de façon rétinotopique. Chaque point de ce référentiel est associé à la valeur directionnelle d’un point rétinien, basée sur un ensemble de coordonnées analogues à celles définissant l’excentricité du champ visuel :
le point de fixation sert de référence au système oculocentrique ;
le méridien vertical sépare le système oculocentrique droit du gauche ;
le méridien horizontal sépare le système oculocentrique supérieur de l’inférieur.
Ainsi, la direction oculocentrique peut être considérée comme la localisation d’un objet dans le champ visuel. Tous les signes locaux captés par ce référentiel ne sont pas égaux. Ils dépendent de l’acuité visuelle, qui diminue avec le degré d’excentration rétinienne. Au sein de ce référentiel siège un signe local particulier : la direction visuelle principale. Elle provoque la sensation de « regarder vers » un objet. Elle correspond à l’association du point de fixation avec l’objet, impliquant que son image se projette sur le centre de la rétine.
Quand un objet inattendu apparaît dans notre champ de vision, son image se projette sur une zone extrafovéolaire de notre rétine. En comparant la direction visuelle principale et la direction oculocentrique de la cible, le système peut déduire ses coordonnées, permettant de générer un mouvement amenant l’image de la cible sur la fovéa. Ainsi, la direction visuelle principale guide la fixation fovéolaire chez les individus possédant une vision normale. Chez le patient amblyope, la direction visuelle principale peut être altérée : en cas de fixation excentrique, elle correspond à une position rétinienne extrafovéolaire.
Ce référentiel est centré sur le corps [3]. Alors que le référentiel oculocentrique est en permanence en mouvement, nous conservons une perception stable de notre environnement. Prenons l’exemple d’une rotation horizontale de notre environnement de 20° alors que notre tête reste fixe. Elle peut correspondre :
soit à un déplacement conjugué des yeux de 20° dans une direction ;
soit à un déplacement de 20° de l’environnement dans la direction opposée.
Les deux cas comprennent exactement les mêmes informations oculocentriques (rétiniennes) et pourtant la perception de l’environnement n’est pas identique :
dans le premier cas, nous ne percevons pas de modification de notre environnement : la direction visuelle principale n’est plus congruente avec la position primaire, nous avons conscience que la variation d’information rétinienne est secondaire au mouvement des yeux ;
dans le second cas, la position primaire reste congruente avec la direction visuelle principale : nous interprétons la variation d’information rétinienne comme un déplacement de l’environnement.
Lorsque la tête est fixe, le référentiel égocentrique correspond à une combinaison :
du référentiel oculocentrique ;
avec la perception de la direction du regard, permettant d’intégrer les mouvements réalisés par le globe oculaire.
Afin d’illustrer une anomalie de la perception égocentrique, nous pouvons étudier le cas d’une paralysie oculomotrice de survenue récente. Les erreurs de jugement de la direction égocentrique peuvent être mises en évidence en demandant au patient de fixer un objet avec l’œil dont le muscle est parésié. Lorsque la cible se positionne dans le champ d’action du muscle atteint, l’œil ne peut se déplacer vers elle qu’en augmentant anormalement le niveau d’innervation de ce muscle. Lorsque nous demandons alors au sujet de pointer la cible, sa main va au-delà de la direction réelle de l’objet. L’élévation du niveau innervationnel a été interprétée de façon erronée par le système égocentrique comme une localisation plus excentrique qu’elle ne l’est réellement. Ce phénomène s’appelle le past pointing.
Le référentiel craniotopique est un référentiel égocentrique combinant le référentiel oculocentrique aux mouvements de la tête et du corps dans l’espace. Il intègre aux informations fournies par la rétine les données des mouvements des yeux, de la tête voire de l’ensemble du corps. Ces informations, provenant du système visuel mais également vestibulaire ou proprioceptif, pourraient converger au niveau du cortex pariétal postérieur, lieu de l’intégration multimodale [6, 19].
Notre cerveau utilise différents référentiels pour cartographier notre environnement et nous avons la possibilité de passer de l’un à l’autre pour le décrire. Prenons l’exemple de la place du Carrousel à Paris, située entre le palais du Louvre et le jardin des Tuileries. Dans un référentiel égocentrique, le sujet utilise son corps comme référence. Si nous nous trouvons sur la place du Carrousel en regardant vers le Louvre (fig. 21-62a), la pyramide est située face à nous. Si nous regardons désormais vers les Tuileries (fig. 21-62b), la pyramide se situe dans notre dos. Dans un référentiel allocentrique, le sujet déplace son point de vue au-dessus de lui, regardant l’espace comme une carte. Nous localiserons ainsi la pyramide selon d’autres repères géographiques, entre la place du Carrousel et les ailes Richelieu, Sully et Denon. L’exemple typique des différentes modes de navigation est aujourd’hui le GPS, chaque individu préférant l’un ou l’autre des modes d’affichage (mode égocentrique : point de vue de l’individu ; mode allocentrique : mode carte). Un référentiel mixte est également possible [9].
Fig. 21-62 Place du Carrousel à Paris.
Dans un référentiel égocentrique, la localisation des éléments change suivant la façon dont le sujet se positionne. a. Le sujet se situant sur la place du Carrousel et regardant vers le Louvre, voit la pyramide en face de lui. b. Le sujet se situant toujours sur la place du Carrousel mais regardant vers les Tuileries, la pyramide se situe dans son dos. La place des choses varie en fonction de la position du corps (cela ne dépend ni de la position des yeux ni de la tête). Dans un référentiel allocentrique, la place des choses est un invariant. C’est d’ailleurs un fait d’observation courante que les visiteurs d’une ville inconnue tournent la carte de la ville et la superposent à leur situation réelle pour se repérer sur le plan. Avec ce geste, il transforme un référentiel allocentrique en égocentrique ce qui facilite le repérage, opération qui est faite le plus souvent automatiquement par les GPS des smartphones.
Nous avons vu que les informations sensorielles visuelles étaient décomposées en une multitude de cartes, adoptant souvent un référentiel rétinotopique sur un plan en deux dimensions. Notre cerveau y intègre les mouvements des globes oculaires pour créer une représentation visuelle stable de notre environnement visuel. Les mouvements de la tête sont codés par trois canaux semi-circulaires orthogonaux les uns par rapport aux autres (trois à gauche, trois à droite). Ces capteurs vestibulaires permettent de coder les mouvements de notre tête dans un référentiel tridimensionnel, transférant ces informations aux noyaux vestibulaires. Les mouvements d’une partie du corps peuvent être codés dans un référentiel intrinsèque au membre, comme une partie du corps (la main) par rapport à un ensemble plus vaste (le bras). C’est le cas du codage des mouvements des membres au niveau du putamen. Ainsi, le cerveau relève le défi de créer un espace unique à partir d’informations visuelles, vestibulaires ou proprioceptives codées dans des référentiels très différents. Par exemple, différents systèmes neuronaux sont utilisés pour coder l’orientation. La rotation de la tête dans l’espace est transmise des noyaux vestibulaires vers la jonction temporopariétale. Il existe au niveau des noyaux thalamiques, mamillaires et dans le cortex rétrosplénial des neurones « de direction de la tête », activés spécifiquement lorsque la tête est orientée dans une certaine direction cardinale (nord, sud, est, ouest). Il existe par ailleurs dans l’hippocampe des neurones « de place », activés uniquement lorsque la tête occupe une certaine position (dans le sens de « lieu », c’est-à-dire que notre corps occupe une certaine position sur une carte spatiale) [13]. Une recomposition de ces éléments perçus pourrait s’effectuer dans un espace commun au niveau de la jonction temporopariétale.
[1] Berthoz A, Recht R. Les espaces de l’homme. Paris, Odile Jacob, 2005.
[2] Carlson S, Pertovaara A, Tanila H. Late effects of early binocular visual deprivation on the function of Brodmann’s area 7 of monkeys (Macaca arctoides). Brain Res, 1987 ; 430 : 101-111.
[3] Daum KM, McCormack GL. Fusion and binocularity. In : Borish’s Clinical refraction. Elsevier, 2006 : 148.
[4] De Gelder B, Tamietto M, Van Boxtel G, Goebel R, Sahraie A, Van den Stock J, Stienen BM, Weiskrantz L, Pegna A. Intact navigation skills after bilateral loss of striate cortex. Curr Biol, 2008 ; 18 : R1128-1129.
[5] Dehaene S. Les neurones de la lecture. Paris, Odile Jacob, 2007.
[6] Duhamel J-R, Bremmer F, BenHamed S, Graf W. Spatial invariance of visual receptive fields in parietal cortex neurons. Nature, 1997 ; 389 : 845-848.
[7] Haxby JV, Grady CL, Horwitz B, Ungerleider LG, Mishkin M, Carson RE, Herscovitch P, Schapiro MB, Rapoport SI. Dissociation of object and spatial visual processing pathways in human extrastriate cortex. Proc Natl Acad Sci USA, 1991 ; 88 : 1621-1625.
[8] Hugonnier R. Strabismes. Paris, Masson, 1959 : 5-22.
[9] Igloi K, Doeller CF, Berthoz A, Rondi-Reog L, Burgess N. Laterelized human hippocampal activity predicts navigation based on sequence or place Memory. Proc Natl Acad Sci USA, 2010 ; 107 : 14466-14471.
[10] Lerner Y, Pianka P, Azmon B, Leiba H, Stolovitch C, Loewenstein A, Harel M, Hendler T, Malach R. Area-specific amblyopic effects in human occipitotemporal object representations. Neuron, 2003 ; 40 : 1023-1029.
[11] Milleret C. Visual callosal connections and strabismus. Behav Brain Res, 1994 ; 64 : 85-95.
[12] Mishkin M, Ungerleider LG. Contribution of striate inputs to the visuospatial functions of parieto-preoccipital cortex in monkeys. Behav Brain Res, 1982 ; 6 : 57-77.
[13] Nakazawa K, Quirk MC, Chitwood RA, Watanabe M, Yeckel MF, Sun LD, Kato A, Carr CA, Johnston D, Wilson MA, Tonegawa S. Requirement for hippocampal CA3 NMDA receptors in associative memory recall. Science, 2002 ; 297 (5579) : 211-218.
[14] Péchereau A. Strabisme chez l’enfant. Rev Prat, 2003 ; 53 : 1827-1833.
[15] Rodieck RW. Regarder. In : La Vision. Bruxelles, De Boeck, 2003 : 292-325.
[16] Sacks O. L’Œil de l’esprit. Paris, Seuil, 2012.
[17] Schröder JH, Fries P, Roelfsema PR, Singer W, Engel AK. Ocular dominance in extrastriate cortex of strabismic amblyopic cats. Vision Res, 2002 ; 42 : 29-39.
[18] Tychsen L. Can ophthalmologists repair the brain in infantile esotropia? Early surgery, stereopsis, monofixation syndrome, and the legacy of Marshall Parks. J AAPOS, 2005 ; 9 : 510-521.
[19] Van Donkelaar P, Müri R. Craniotopic updating of visual space across saccades in the human posterior parietal cortex. Proc Biol Sci, 2002 ; 269 : 735-739.
P. Lebranchu
C’est la contraction des muscles extraoculaires qui permet de déplacer le globe oculaire dans la position souhaitée [33, 51]. Lorsque sa contraction permet d’attirer l’œil vers la direction souhaitée, le muscle est dénommé agoniste. S’il attire le globe dans la direction opposée, il correspond à l’antagoniste. Classiquement les six muscles oculomoteurs forment trois couples d’agoniste-antagoniste en fonction de leurs actions respectives (cf. infra, « Action musculaire : modèle de l’agoniste isolé ») : droit médial-droit latéral, droit supérieur-droit inférieur, oblique supérieur-oblique inférieur. Nous verrons dans les chapitres suivants que cette opposition deux à deux n’est que schématique, la participation de chaque muscle lors d’un mouvement du globe étant beaucoup plus complexe. Cependant, cette présentation simplifiée permet d’appréhender simplement les principaux mouvements oculaires et les réseaux neuronaux qui les contrôlent (fig. 21-63).
Le terme de muscles synergistes est utilisé lorsque la contraction simultanée de deux muscles déplace le globe dans la même direction. Par exemple, le droit supérieur et l’oblique inférieur homolatéral participent à l’élévation du globe, alors que le droit inférieur et l’oblique supérieur provoquent son abaissement (fig. 21-64).
En déplaçant le regard, les deux globes oculaires ne peuvent être considérés comme deux entités indépendantes. Les mouvements de version (ou mouvements conjugués) correspondent à un déplacement des axes oculaires dans la même direction (fig. 21-65). Les muscles de chaque œil peuvent être associés par paire lorsque leur action commune permet de déplacer le regard dans la même direction. Ainsi, lors des mouvements de latéroversion droite (tableau 21-I), le muscle droit médial gauche est le synergiste controlatéral (ou agoniste controlatéral) du muscle droit latéral droit ; le droit latéral gauche est l’antagoniste homolatéral du droit médial gauche et l’antagoniste controlatéral du droit latéral droit.
Les mouvements de vergences correspondent à un déplacement des axes des globes oculaires dans des directions différentes, qui peuvent se rapprocher (convergence) ou s’éloigner (divergence). Lors d’un mouvement de vergence, le synergiste controlatéral du droit médial droit est le droit médial gauche (fig. 21-66).
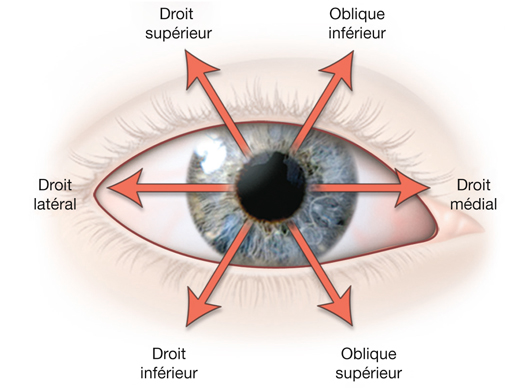
Fig. 21-63 Champ d’action des muscles (conception classique).
Fig. 21-64 Muscles synergistes homolatéraux. Abaissement du globe oculaire réalisé par la contraction conjointe du droit inférieur et de l’oblique supérieur.
Fig. 21-65 Muscles synergistes : version. Le droit latéral droit et le droit médial gauche sont des synergistes controlatéraux. Le droit médial droit est l’antagoniste homolatéral du droit latéral droit. Le droit latéral gauche est l’antagoniste controlatéral.

Tableau 21-I – Conjugaisons et disconjugaison : exemple de paires de muscles antagonistes homolatéraux lors des mouvements de latéroversion.
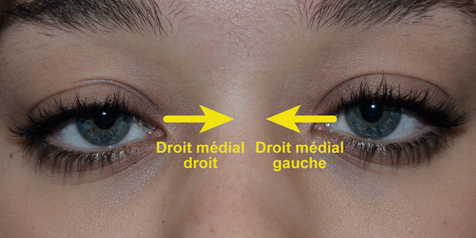
Fig. 21-66 Muscles synergistes controlatéraux : vergence. Les deux droits médiaux (droit et gauche) sont des synergistes controlatéraux dans les vergences.
Les mouvements du globe oculaire permettent de répondre à différents besoins, de la stabilisation réflexe du regard lors d’une perturbation de notre environnement à des fonctions plus complexes, comme l’exploration de ce qui nous entoure. Il est possible de distinguer les mouvements oculaires rapides des mouvements lents en fonction de la rapidité de déplacements des globes oculaires [40] :
les mouvements lents : phase lente du nystagmus, poursuite oculaire, fixation ;
les mouvements rapides : phase rapide du nystagmus, saccade.
Les mouvements lents permettent de stabiliser notre regard sur un objet mobile ou une scène en mouvement. C’est le cas de la poursuite oculaire, mais également de la phase lente du nystagmus physiologique. Les mouvements rapides permettent de réorienter notre attention d’un objet vers un autre. Les saccades permettent l’exploration de ce qui nous entoure. Les phases rapides du nystagmus recentrent le globe dans l’orbite. Il existe ainsi un répertoire de mouvements oculaires, chacun représentant un système physiologique avec ses caractéristiques propres (latence de déclenchement, rapidité d’exécution…) et sa finalité (stabilisation, réorientation…). Notre regard est le produit de la combinaison de ses différents systèmes.
En condition physiologique, il est possible d’observer un nystagmus chez un sujet sain lorsque sa tête est soumise à un brusque changement d’orientation (réflexe oculocéphalique) ou lorsque son environnement se met à défiler (réflexe optocinétique). Dans les deux cas, il s’agit d’un nystagmus à ressort, alternant une phase lente qui stabilise les variations de l’image sur la rétine et une phase rapide qui permet de recentrer le globe dans l’orbite. Ces mouvements de l’œil, générés en moins de 10 ms par les perturbations de la tête, sont beaucoup plus rapides que les mouvements visuellement guidés. Ils permettent de maintenir une vision de qualité pendant nos déplacements.
Le système vestibulaire permet de répondre à la fois aux déplacements angulaires (rotation) et linéaires (translation) de la tête. Ces différents types de déplacements sont détectés par des capteurs sensoriels différents : les canaux semi-circulaires détectent les premiers, l’utricule et le saccule les seconds [19]. Un mouvement brusque de la tête est compensé par un mouvement des yeux de même amplitude mais de sens opposé. Cette compensation fait intervenir une voie oligosynaptique, permettant des délais de réaction très rapides (latence de 7 ms à 15 ms). Chaque labyrinthe possède trois canaux semi-circulaires, orthogonaux les uns par rapport aux autres. Chaque canal code les rotations angulaires de la tête dans son propre plan, ce système permettant de coder les déplacements dans les trois directions de l’espace. Les canaux fonctionnent par paires, un canal du labyrinthe droit étant placé dans le même plan que son homologue dans le labyrinthe gauche. Un canal se présente comme un tube cylindrique orienté dans un plan de l’espace, rempli d’endolymphe, avec une ampoule à sa base. Cette ampoule contient une cupule aux propriétés élastiques et les cellules ciliées (capteurs sensoriels). En réponse à une rotation, l’endolymphe est déplacée par inertie à l’intérieur du canal, déformant la cupule. Le mouvement de celle-ci entraîne l’inclinaison des cils des capteurs sensoriels dans une direction. Selon que les cils sont inclinés dans un sens ou dans un autre, l’information excite ou inhibe le neurone vestibulaire primaire. Les canaux fonctionnant par paire gauche-droite, une rotation de la tête dans un plan se traduira toujours par l’excitation des neurones vestibulaires primaires d’un côté (déplacement de la cupule dans un sens) et l’inhibition des neurones vestibulaires primaires controlatéraux (déplacement de la cupule dans l’autre sens).
Les organes à otolithes sont des structures planaires du labyrinthe, orientées dans un plan de l’espace pour mieux détecter les translations de la tête horizontalement (l’utricule) ou verticalement (le saccule). Pour chacun de ces capteurs, les cellules ciliées sont réparties sur une surface plane et recouverte d’un gel rempli de cristaux (otoconies, ou otolithes). Le déplacement des cils est provoqué par le mouvement inertiel du gel et des otoconies lors d’une translation. Comme pour les canaux semi-circulaires, le sens d’inclinaison des cils modifie le rythme de décharge des neurones vestibulaires primaires. Utricule et saccule sont des capteurs ambigus, activés soit par le déplacement inertiel des otoconies lors d’une translation, soit par le déplacement gravitationnel lors d’un changement de position de la tête. Ces différents capteurs permettent de coder les mouvements de la tête dans l’espace : accélération angulaire (canaux semi-circulaires), accélération linéaire et position de la tête (utricule et saccule) (fig. 21-67).
Malgré le mécanisme de stockage interne de la vitesse, le réflexe vestibulo-oculaire s’éteint en dix à vingt secondes lors d’une rotation à vitesse constante. Un second réflexe oculomoteur se substitue progressivement au réflexe vestibulo-oculaire, permettant d’alterner les phases lentes de stabilisation de l’image sur la rétine et les phases rapides de recentrage : c’est le réflexe optocinétique. Ce réflexe est également observé lorsque notre environnement défile devant nos yeux : il permet d’avoir une vision nette du paysage lorsque nous regardons à travers la fenêtre du train. Il s’agit d’un mouvement visuellement guidé, déclenché par le défilement de l’image sur la rétine et comprenant deux phases. La composante initiale du nystagmus optocinétique apparaît en une à deux secondes. La vitesse de l’œil pendant la phase lente atteint rapidement la vitesse du stimulus. Ce mouvement initial reflète essentiellement l’activité de la poursuite oculaire. Dans une seconde phase, l’activité neurale est progressivement stockée. Cette activité stockée peut être mise en évidence en plaçant brusquement le sujet dans le noir : le nystagmus persiste pendant encore plusieurs secondes (OKAN, OptoKinetic-After Nystagmus). Les neurones vestibulaires centraux répondent à la fois lors du réflexe vestibulo-oculaire et lors du réflexe optocinétique : les deux systèmes utilisent la même voie commune, permettant ainsi au second de remplacer le premier si le mouvement perdure dans le temps.
Fig. 21-67 Tracés vidéo-oculographiques de nystagmus optocinétiques horizontaux enregistrés pour différentes vitesses et directions de stimulation étudiées.
NOC, nystagmus optocinétique ; droit, battant à droite.
(Source : Lefetz J., 2011 [18].)
Une saccade définit un mouvement conjugué des deux yeux permettant de passer d’un point de fixation à un autre. C’est un mouvement rapide (moins de 100 ms), dont la vitesse de déplacement de l’œil est corrélée à l’amplitude de déplacement (vitesse pouvant atteindre 500° par seconde) (fig. 21-68). Plusieurs types de saccades sont décrits, correspondant à différents substrats anatomo-physiologiques [20] :
la phase rapide du nystagmus (mouvement de recentrage rapide de l’œil évitant son blocage dans un coin de l’orbite) ;
saccades réflexes (à un stimulus visuel ou auditif) ;
saccades volontaires (vers un stimulus) ;
saccades prédictives (en prévision de l’apparition d’un stimulus) ;
saccades guidées par la mémoire (vers un stimulus qui a disparu) ;
anti-saccades (réalisation d’une saccade de même amplitude mais de direction opposée par rapport au stimulus visuel).
La saccade est un mouvement balistique, c’est-à-dire qu’une fois programmée et déclenchée, l’exécution du mouvement ne peut être influencée par de nouvelles informations visuelles (fig. 21-69). Il faudra attendre la fin de la période réfractaire (environ 200 ms) pour pouvoir exécuter un nouveau mouvement oculaire.
Une autre particularité des saccades est l’absence de perception visuelle lors de leur réalisation motrice : malgré le rapide glissement de l’image du monde sur la rétine, nous n’avons pas conscience de la rotation de l’environnement. Plusieurs hypothèses permettent d’expliquer ce phénomène de dépression perceptive. Le système pourrait utiliser un « masquage visuel », lié à la perception nette de l’environnement immédiatement avant et après le mouvement. Il pourrait également inhiber activement la perception visuelle pendant le mouvement, en particulier grâce à la copie efférente du mouvement sur les ganglions géniculés latéraux et le cortex visuel primaire.
Enfin, une dernière particularité de ce mouvement est la stabilité de la perception de l’espace (et de sa propre orientation dans l’espace) malgré le changement brutal de position des indices visuels sur la rétine entre le début et la fin du mouvement. Pour réaliser ce mouvement, le système nerveux doit être capable de transformer des coordonnées rétiniennes codées en deux dimensions en un ordre moteur, codé en durée et fréquence de décharges de potentiels d’action dans des coordonnées craniotopiques (en trois dimensions).
Fig. 21-68 Tracés vidéo-oculographiques de saccades horizontales pour différentes amplitudes de stimulation. Les mouvements de version vers la droite sont représentés en positif, les versions vers la gauche en négatif. L’échelle temporelle est affichée en secondes. Par convention, les tracés de l’œil droit sont en rouge, ceux de l’œil gauche en bleu.
(Source : Lefetz J., 2011 [18].)
Fig. 21-69 Comparaison en vidéo-oculographie des vitesses moyennes observées pour chaque œil pour des saccades en abduction ou en adduction pour différentes amplitudes de stimulation.
(Source : Lefetz J., 2011 [18].)
La poursuite oculaire est un mouvement apparu chez les animaux fovéaux, permettant de maintenir l’image d’un objet en mouvement congruent avec le centre de la rétine. Pour cela, la vitesse de déplacement de l’œil (Vo) doit devenir équivalente à la vitesse de déplacement de la cible (Vc). Deux phases peuvent être distinguées dans la construction du mouvement [21] :
la phase initiale de la poursuite correspond à la mise en mouvement de l’œil en réponse au déplacement d’un objet dans notre champ visuel. Durant cette brève première période, l’image de l’objet n’est pas congruente avec la fovéa et il existe un signal d’erreur de position rétinien qui participe à la construction du mouvement ; ce signal va s’amoindrir rapidement à mesure que la fovéa se rapproche de l’image de l’objet ;
la phase d’état correspond à la persistance du mouvement de l’œil pour maintenir l’image de l’objet congruente avec la fovéa. Dans ce cas, les signaux d’erreur rétiniens sont nuls et le gain de la poursuite est proche de 1 (gain = Vo/Vc). Le système, pour déduire la vitesse de déplacement et maintenir un mouvement constant, doit faire appel à d’autres signaux dont l’origine est encore débattue (analyse du flux optique ? analyse de la décharge corollaire à la commande oculomotrice ?).
La poursuite oculaire est un déplacement conjugué, lisse et continu des yeux (fig. 21-70 et 21-71). Les autres mouvements visuellement guidés (comme le réflexe optocinétique) sont inhibés et la perception de l’environnement qui glisse sur le reste de la rétine est amoindrie. Ce mouvement est déclenché rapidement (latence de 80 ms à 120 ms). Dans certaines circonstances, ce système est capable de prédiction. Lors de la réalisation d’une simple poursuite, le cerveau doit traiter de nombreuses informations visuelles et extravisuelles simultanément, permettant d’initier le mouvement oculaire, puis de le poursuivre en fonction des caractéristiques de la cible (taille, vitesse, orientation…).
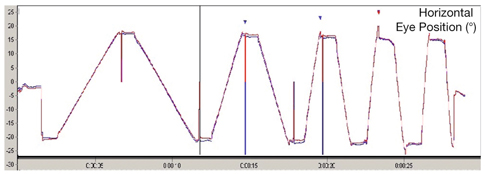
Fig. 21-70 Enregistrement en vidéo-oculographie du déplacement des yeux en fonction du temps lors de poursuites linéaires à différentes vitesses de stimulation. Des saccades de rattrapage apparaissent lors des stimulations les plus rapides.
(Source : Lefetz J., 2011 [18].)
Fig. 21-71 Enregistrement en vidéo-oculographie du déplacement des yeux en fonction du temps lors de poursuites sinusoïdales à différentes vitesses de stimulation. Des saccades de rattrapage apparaissent lors des stimulations les plus rapides et le gain diminue.
(Source : Lefetz J., 2011 [18].)
L’apparition des mouvements de vergence correspond au développement de la vision frontale et binoculaire. Ce mouvement permet de diriger nos deux fovéas vers le même centre d’intérêt. Les yeux réalisent donc un mouvement non conjugué, se dirigeant dans deux directions opposées.
Les deux principaux stimulus permettant de provoquer un mouvement de vergence sont :
la disparité rétinienne, c’est-à-dire la différence de localisation entre les deux images vues par chaque rétine ; ce mouvement est décrit comme la vergence fusionnelle, indispensable à la vision binoculaire ;
le flou rétinien, qui provoque l’accommodation de l’œil et éventuellement un mouvement oculaire (vergence accommodative).
D’autres facteurs peuvent intervenir : les facteurs attentionnels de proximité, le contrôle volontaire…
Lors des mouvements de version, les yeux se déplacent de manière conjuguée et l’ensemble du mouvement peut être symbolisé par le déplacement d’un œil « unique ». Cependant, les quelques centimètres qui séparent nos deux yeux impliquent que, pour garder l’image d’un point au centre de chaque fovéa, les mouvements ne peuvent être totalement similaires. Ceci est encore plus vrai lorsque l’objet se rapproche de nous, les mouvements devenant alors dysconjugués. Les mouvements de vergence sont apparus avec la frontalisation des orbites chez certains primates. Il s’agit d’un mouvement lent, d’amplitude réduite (5° à 10°) et optiquement élicité. La vergence correspond à une cascade syncinétique de réflexes, dépendant d’une combinaison multiple d’afférences s’additionnant les unes aux autres [23] :
vergence tonique (niveau de base du tonus vergentiel) ;
vergence proximale, induite par la perception égocentrique de la distance ;
vergence accommodative, induite par la focalisation cristallinienne ;
vergence fusionnelle, induite par la disparité de fixation.
La position anatomique de repos des globes oculaires pourrait être en légère divergence. La vergence tonique correspond au tonus de base délivré en permanence aux muscles extraoculaires pour maintenir les yeux « droits » (ou position physiologique de repos), luttant contre les forces passives entraînant les globes oculaires dans leur position de repos anatomique. Cette vergence se met en place dans les six premières semaines de vie et s’adapte tout au long de la vie aux modifications anatomiques et réfractives. La mesure de cette vergence n’est pas accessible en pratique clinique, l’examen sous anesthésie générale ne permettant que d’approcher la position anatomique des yeux au repos.
La vergence proximale est déclenchée par la conscience de la proximité de la cible visuelle. Elle peut être stimulée par les indices monoculaires de profondeur ou par la simple sensation de proximité. Elle explique que la mesure de la déviation d’une ésotropie au synoptophore est en général plus importante que la mesure prismatique au test à l’écran en vision de loin. Sa mesure est extrêmement variable d’un sujet à l’autre et selon les méthodes utilisées. L’examen clinique doit essayer de minimiser au maximum son effet.
La défocalisation des images sur la rétine provoque une variation du pouvoir réfractif du cristallin. Par un réflexe syncinétique, cette accommodation provoque également un mouvement de vergence. La vergence accommodative peut être évaluée par le ratio AC/A, qui correspond à quantité de convergence provoquée par chaque dioptrie d’accommodation (cf. infra, « Syncinésie de la vision de près »). Ce rapport adopte chez les sujets normaux une distribution gaussienne centrée sur 3,5 Δ/δ. Cette valeur est le plus souvent insuffisante pour permettre un parfait alignement des globes oculaires lorsque la cible se rapproche.
La séparation de quelques centimètres des deux orbites entraîne une différence minime des images perçues par chaque œil. Pour permettre une perception visuelle unique, les images doivent alors être perçues par des points rétiniens correspondants permettant une fusion sensorielle. La disparité rétinienne correspond à la perception des différences entre les images rétiniennes. C’est un stimulus puissant des mouvements de vergence, qui visent à minimiser au maximum cette disparité. Cet alignement n’est jamais parfait et les différences minimes entre les deux images sont appelées « disparité de fixation ». Cette vergence fusionnelle permet un rétrocontrôle permanent de l’alignement des deux globes oculaires, ajustant précisément leur alignement.
En condition binoculaire normale, les vergences fusionnelle et accommodative travaillent ensemble à maintenir les axes oculaires fixés sur l’objet.
Les subdivisions des vergences telles qu’elles ont été définies par Maddox [26] permettent de mieux comprendre la pathologie strabique. Cependant, il s’agit d’une distinction artificielle, le mouvement de vergence mêlant simultanément les différentes afférences pour aligner les axes visuels [52]. La part de chaque vergence dans le mouvement global de vergence semble encore à déterminer.
Un mouvement de vergence oculaire correspond à un mouvement en forme d’onde, souvent biphasique. Sa phase initiale est rapide, grossière, probablement préprogrammée. Elle répond aux larges disparités rétiniennes, à la stéréoscopie grossière. Sa phase finale est un mécanisme plus lent, permettant d’atteindre précisément le plateau de fixation. Elle permet la stéréoscopie fine. Contrairement aux mouvements oculaires « sous-corticaux », sa latence est relativement lente (environ 200 ms). C’est un mouvement capable d’anticipation, comme beaucoup de mouvements oculaires « corticaux ». Comme dans les saccades, la vitesse de déplacement du globe est corrélée à l’amplitude du déplacement. Les niveaux atteints sont cependant dix fois moins rapides, la vitesse maximale n’excédant pas 30° par seconde. Il a longtemps été postulé que les mouvements étaient plus rapides en convergence qu’en divergence, mais il pourrait s’agir d’un artefact de mesure. Latence et vitesse de déplacement sont modulées par la position des globes oculaires lors des mouvements de divergence (fig. 21-72 à 21-74).
Fig. 21-72 Cinétique des mouvements de convergence et de divergence symétriques (position des yeux en degrés, en fonction du temps en secondes, lors d’une alternance entre la fixation de près et la fixation de loin).
1. Plateau de fixation en vision de près. 2. Divergence rapide. 3. Divergence lente. 4. Plateau de fixation en vision de loin. 5. Convergence rapide. 6. Convergence lente.
Le phénomène de Johannes Müller est observé lorsque les vergences ne sont pas centrées, c’est-à-dire lorsque le stimulus est plus proche d’un des deux yeux. Ce dernier présente initialement un mouvement rapide de version, avant une phase de vergence lente de rappel, permettant d’obtenir le plateau de fixation.
(Source : Lefetz J., 2011 [18].)
Fig. 21-73 Cinétique des mouvements de vergence asymétriques : enregistrement de la position de l’œil droit (en rouge) et de l’œil gauche (en bleu) lors d’un mouvement de convergence asymétrique dans l’axe de l’œil droit. Le schéma à gauche représente la position initiale (en pointillé) et finale (en traits pleins) des deux yeux. Le schéma de droite représente la position des deux yeux en fonction du temps : les deux yeux réalisent un mouvement initial rapide de version, puis un mouvement de vergence lent de rappel jusqu’à ce que l’œil droit reprenne sa position initiale. On peut noter que le mouvement de l’œil désaxé respecte les trois phases décrites (vergence rapide, lente puis plateau). En revanche, le mouvement de l’œil axé reste globalement stable, dans l’alignement de la cible.
Si les mécanismes de vergence permettent le maintien d’une vision binoculaire de qualité, la vision des deux yeux n’est pas nécessaire à la réalisation de ce mouvement. Masquer un œil diminue en général de moitié l’amplitude des mouvements de vergence, l’analyse cinétique du mouvement de l’œil occlus révélant une combinaison de version rapide et de vergence beaucoup plus lente. Le mouvement de vergence pourrait être la résultante d’une combinaison de réflexes rapides monoculaires et de réflexes lents binoculaires.
(Source : Lefetz J., 2011 [18].)
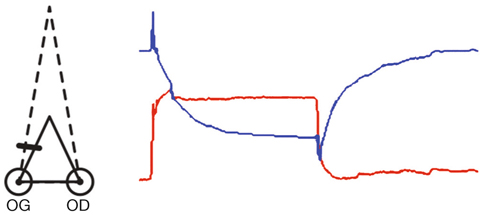
Fig. 21-74 Cinétique des mouvements de vergence symétriques lors de l’occlusion d’un œil : enregistrement de la position de l’œil droit (en rouge) et de l’œil gauche (en bleu) en fonction du temps. L’œil non masqué présente toujours un mouvement rapide suivi d’un mouvement lent de vergence. L’œil masqué ne présente qu’un mouvement lent de vergence (le mouvement rapide de vergence disparaît).
(Source : Lefetz J., 2011 [18].)
Le contrôle des mouvements oculaires n’est pas un phénomène mature dès la naissance [49]. Le contrôle volontaire de la convergence apparaît progressivement entre la huitième et la seizième semaine de vie, précédant juste le développement de la stéréopsie. Entre trois et six mois, la plupart des enfants présentent des mouvements matures de vergence, peu différents de ceux de l’adulte. Avec la perte progressive des capacités accommodatives, particulièrement après quarante ans, les temps de latence s’allongent (d’environ 10 ms) et les vitesses maximales diminuent. L’étude de la cinétique des vergences chez le patient presbyte observe une phase initiale identique, invariable, mais une diminution de la réponse accommodative lente.
Les mouvements de vergence verticale sont possibles, mais beaucoup plus lentement (plusieurs secondes) et avec une amplitude plus limitée (moins de 2°). Cependant, il est possible d’augmenter cette amplitude de fusion verticale avec l’entraînement, particulièrement dans certaines conditions pathologiques comme la paralysie congénitale de la IVe paire crânienne. Il existe également des mouvements limités de vergence torsionnelle (cyclovergence), avec une intorsion relative dans le regard en haut et une extorsion relative dans le regard en bas. Lorsque les deux globes oculaires convergent l’un vers l’autre, on observe une rotation temporale du plan de Listing. Demer explique cette rotation du plan par la rotation en bloc des poulies oculaires (cf. infra, « Poulies »).
Il existe une controverse concernant la validité de la loi de Hering lors des mouvements de vergence. Quéré [35] notait que le mouvement des deux yeux n’était jamais rigoureusement identique, y compris lorsque le mouvement de convergence était parfaitement axé par rapport aux deux yeux. Il en déduisait que la loi d’égale innervation pour les muscles agonistes ne pouvait pas s’appliquer aux mouvements disconjugués. Cependant, l’étude des interactions entre les mouvements conjugués (saccades ou poursuite) et dysconjugués met en évidence la conjonction des différentes commandes oculomotrices pour réaliser le mouvement. La loi de Hering pourrait donc être respectée, tout mouvement devenant une combinaison d’une commande pure de vergence et d’une commande pure de version (fig. 21-75 et 21-76).
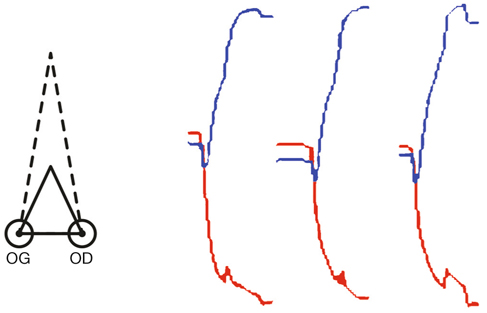
Fig. 21-75 La loi de Hering est-elle valable dans les vergences ? Enregistrement électro-oculographique de la position des yeux lors de trois mouvements successifs de vergence de même amplitude chez le même sujet (le mouvement de l’œil droit n’est jamais parfaitement symétrique par rapport à celui de l’œil gauche).
(Source : Quéré M.-A., 1983 [35].)
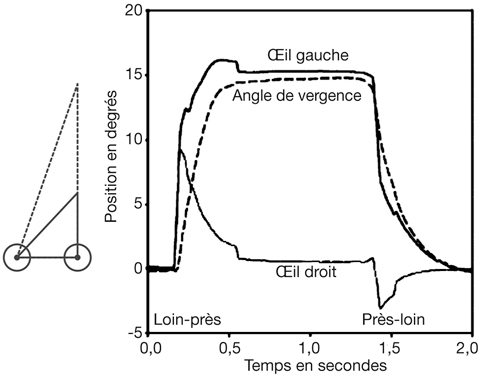
Fig. 21-76 Mouvement de vergence axial droit binoculaire. L’apparence de mouvements indépendants entre les deux yeux peut résulter de la sommation d’une commande de vergence pure et d’une commande de version pure.
(Source : Leigh R.J. et al., 2006 [20]).
Le motoneurone alpha est l’élément terminal systématiquement activé lors d’une contraction musculaire, qu’elle soit volontaire ou réflexe. Son corps cellulaire est situé dans la corne antérieure de la moelle spinale. Il s’agit de l’effecteur final de toute action motrice [44, 51]. La voie finale commune a été définie comme l’ensemble s’étendant de son corps cellulaire jusqu’aux fibres musculaires (incluant son axone et ses synapses). Elle correspond au lieu de convergence d’afférences locales (circuits intraspinaux) et corticales (voies descendantes) ; son activité est le reflet d’influences excitatrices et inhibitrices, réflexes ou volontaires.
En oculomotricité, chaque groupe cellulaire innervant un des six muscles extraoculaires peut être défini comme une voie finale commune : noyau du VI pour le droit latéral, noyau du IV pour l’oblique supérieur, sous-noyaux du III destinés aux droit médial, droit supérieur, droit inférieur et oblique inférieur.
Cependant, une des particularités du système oculomoteur est l’absence d’indépendance des mouvements d’un globe oculaire par rapport à l’autre — dans des conditions physiologiques, il est impossible de déplacer un œil sans modifier la position de l’autre. Cette non-indépendance est une des particularités du système oculomoteur par rapport au système périphérique et repose sur un réseau d’interaction neuronale entre les noyaux oculomoteurs. Schématiquement, trois autres voies finales communes peuvent être décrites : voie finale commune des mouvements conjugués horizontaux, voie finale commune des mouvements conjugués verticaux et voie finale commune des mouvements de version.
Ainsi, un mouvement de version des deux yeux sur le plan horizontal utilisera toujours le même réseau final pour réaliser le mouvement, que celui-ci soit rapide (saccade) ou lent (poursuite), réflexe ou volontaire. Il débute au niveau du noyau du VI, qui comprend deux groupes de neurones : les motoneurones destinés au muscle droit latéral et des interneurones, qui décussent et descendent par le faisceau longitudinal médian jusqu’au noyau du III controlatéral destiné au muscle droit médial. Toutes les informations neuronales arrivant sur le noyau du VI seront transmises en quantité égale aux deux muscles synergistes, provoquant un mouvement conjugué des deux yeux dans la même direction (fig. 21-77). La voie finale commune des mouvements conjugués verticaux est plus complexe, puisqu’elle lie entre eux les noyaux du III et du IV ipsilatéraux et controlatéraux, faisant intervenir quatre groupes musculaires au lieu de deux. Si elle est moins bien décrite, son principe reste identique.
Ainsi s’explique la loi de Hering (ou loi d’égale innervation) [11], propre à l’oculomotricité. Dans La Théorie de la vision binoculaire, Hering postule : « Tant que leurs mouvements au service de la direction du regard sont concernés, les deux yeux peuvent être considérés comme un même organe… La même et unique impulsion nerveuse dirige les deux yeux simultanément, comme on peut diriger une paire de chevaux avec des reines uniques. » Cette théorie est confirmée lors des mouvements de version, l’influx nerveux étant envoyé en quantité égale aux muscles agonistes.
La voie finale commune des mouvements de vergence est différente, reliant entre eux les sous-noyaux du III.
Si ces trois voies sont présentées schématiquement séparées, la réalisation de tout mouvement physiologique du regard implique en général une combinaison de chacune.
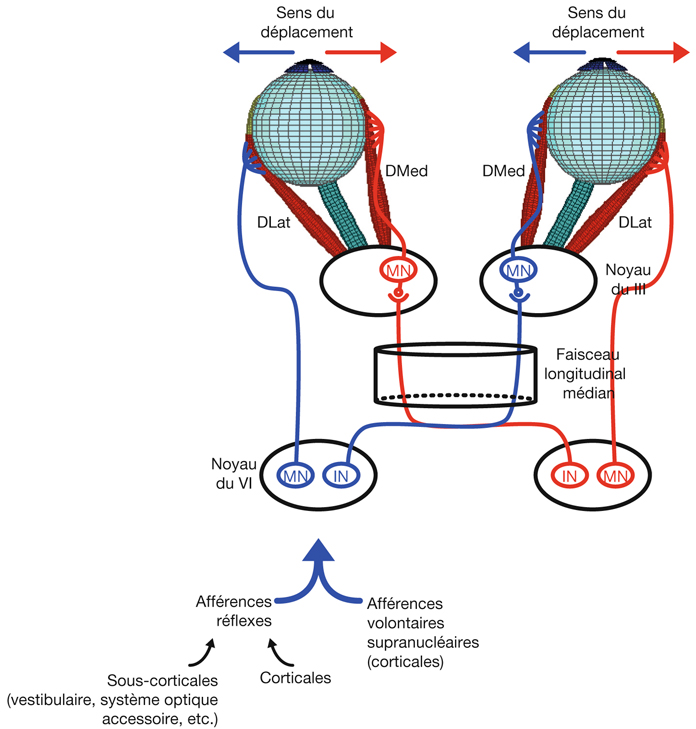
Fig. 21-77 Loi de Hering : schéma de la voie finale commune de l’horizontalité [11, 22, 44].
MN, motoneurone ; IN, interneurone.
Cette loi s’applique à l’ensemble des muscles striés de l’organisme. La loi d’innervation réciproque de Sherrington dit que lorsqu’un muscle agoniste reçoit un influx nerveux excitateur pour se contracter, un influx inhibiteur équivalent est adressé à son antagoniste : « Quand un muscle agoniste se contracte, son antagoniste se relâche. » Cette interaction réciproque entre les couples musculaires permet de créer une force de déplacement constante tout au long du mouvement du globe.
Il existe un support anatomique à la loi de Sherrington. Par exemple, lorsque la tête est brutalement tournée vers la gauche sur un plan strictement horizontal, il va se produire un mouvement réflexe des deux yeux vers la droite. C’est le réflexe oculocéphalique. Sur le plan musculaire, il y a contraction simultanée du droit médial gauche et du droit latéral droit, associé à un relâchement du droit latéral gauche et du droit médial droit. Sur le plan neuroanatomique, un influx excitateur est transmis du canal semi-circulaire horizontal gauche à deux neurones du noyau vestibulaire gauche [43] (fig. 21-78) : le neurone vestibulaire secondaire excitateur, qui active la voie finale commune controlatérale, et le neurone vestibulaire secondaire inhibiteur, qui inhibe la voie finale commune ipsilatérale. Le neurone vestibulaire secondaire excitateur gauche inhibe par ailleurs les neurones vestibulaires controlatéraux par le biais d’un interneurone vestibulaire inhibiteur. L’ensemble aboutit à la réalisation d’un mouvement lent des deux globes oculaires dans le sens opposé à la rotation de la tête.
Un autre exemple de la loi de Sherrington est illustré par le système saccadique [20] (fig. 21-79). Une même information supranucléaire est transmise au centre générateur des saccades. Celui-ci possède deux types de neurones : un neurone excitateur phasique qui stimule la voie finale commune ipsilatérale et un neurone inhibiteur phasique qui inhibe la voie finale commune controlatérale.
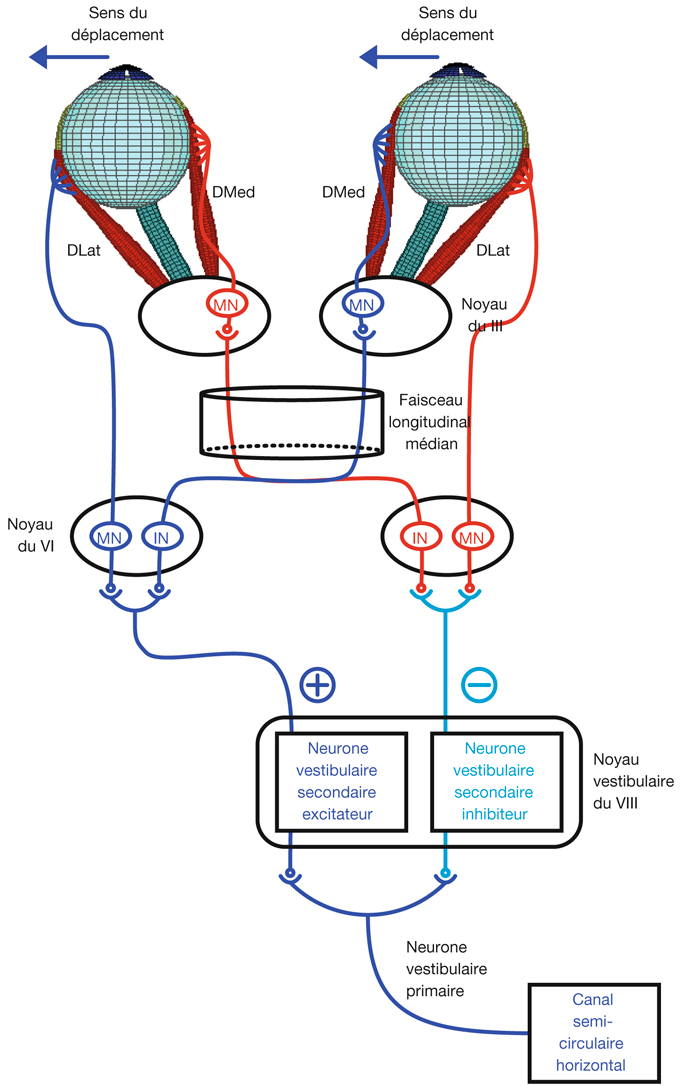
Fig. 21-78 Démonstration de la loi d’innervation réciproque de Sherrington lors du réflexe vestibulo-oculaire.
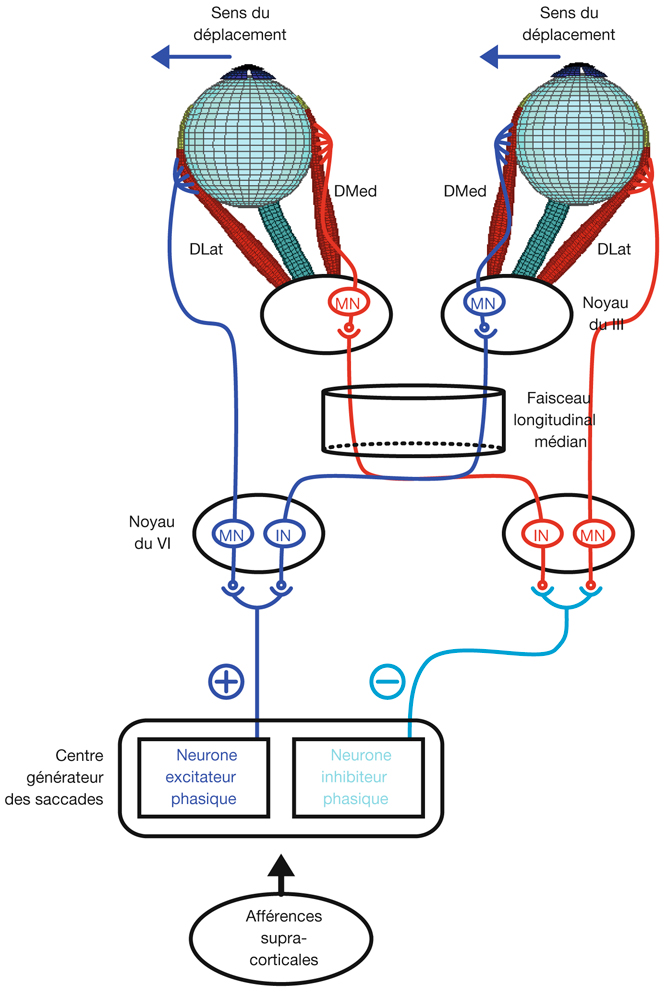
Fig. 21-79 Démonstration de la loi d’innervation réciproque de Sherrington lors de la saccade.
Les différents types de mouvements oculaires reposent sur des bases neurales qui leur sont propres. Selon les mouvements, ces circuits prémoteurs peuvent être en partie communs ou totalement indépendants. Ils peuvent être d’une extrême simplicité (trois neurones pour le réflexe vestibulo-oculaire) ou d’une totale complexité. Cependant, il est possible de discerner un schéma d’organisation commun [3, 46] (fig. 21-80) :
voie finale commune ;
centre générateur du mouvement :
horizontal versus vertical ;
lent versus rapide ;
afférences supranucléaires :
centres sous-corticaux ;
centres corticaux ;
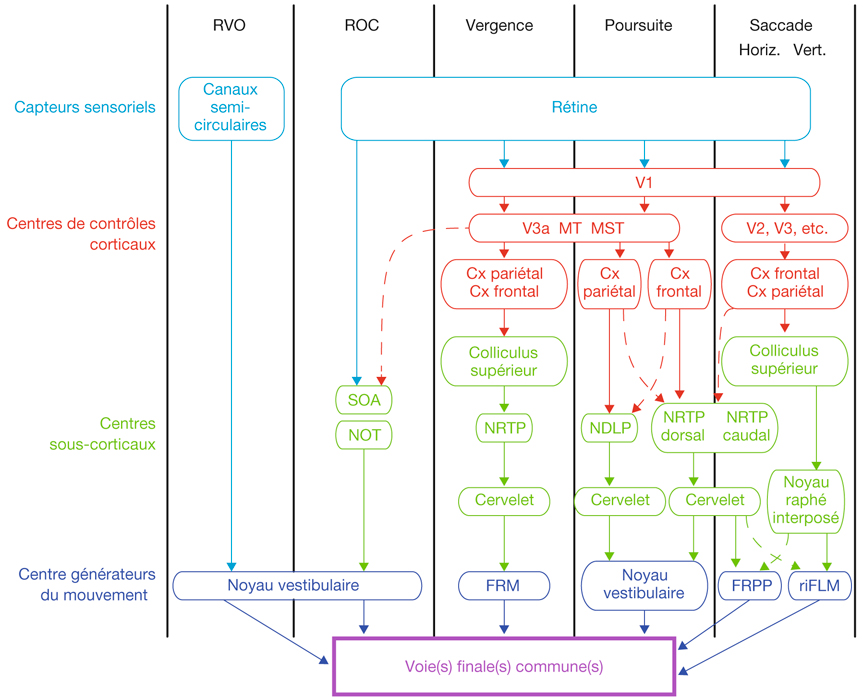
Fig. 21-80 Représentation schématique des différents réseaux corticaux indépendants des mouvements oculomoteurs qui convergent vers la voie finale commune.
RVO, réflexe vestibulo-oculaire ; ROC, réflexe optocinétique ; V1, cortex visuel primaire ; V2, aire visuelle extra-striée ; V3, aire visuelle extra-striée V3 ; V3a, aire visuelle extra-striée V3a ; MT, aire visuelle extra-striée temporale médiane ; MST, aire visuelle extra-striée temporale supéromédiane ; Cx, cortex ; SOA, système optique accessoire ; NOT, noyau du tractus optique ; NRTP, noyau réticulé du toit du pont ; NDLP, noyau dorsolatéral du pont ; FRM, formation réticulée mésencéphalique ; FRPP, formation réticulée paramédiane pontique ; riFLM, noyau rostral interstitiel du faisceau longitudinal médian.
Le centre générateur des mouvements oculaires horizontaux lents est le noyau vestibulaire. Il se situe entre la partie caudale du pont et la partie crâniale de la moelle allongée. Il possède des neurones vestibulaires qui activent la voie finale commune controlatérale et inhibent la voie finale commune ipsilatérale. Il reçoit des afférences de trois des grands circuits prémoteurs : le réflexe oculocéphalique, le réflexe optocinétique et la poursuite oculaire. Ce noyau est contrôlé par différents centres sous-corticaux en fonction du circuit prémoteur impliqué. Ainsi, les neurones des noyaux dorsolatéraux du pont (NDLP) et du noyau réticulé du toit du pont (NRTP) participent à la poursuite oculaire.
Le centre générateur des mouvements oculaires horizontaux rapides est la formation réticulée paramédiane pontine (FRPP). Ses neurones à bouffées excitatrices activent la voie finale commune ipsilatérale. D’autres neurones inhibent la voie finale commune controlatérale. Elle est située juste à côté du noyau du nerf abducens. Cette structure est en permanence inhibée par les cellules omnipauses du noyau interpositus du raphé. L’initiation d’une saccade nécessite l’inhibition supranucléaire de cellules omnipauses, permettant le déclenchement d’une bouffée excitatrices par les neurones de la FRPP vers le noyau du nerf abducens. Le noyau du prepositus hypoglossi correspond à l’intégrateur neuronal du regard horizontal. Pour maintenir le globe en position excentré, il faut fournir aux muscles une commande nerveuse tonique supplémentaire. Celle-ci résulte de l’intégration du signal de vitesse fourni par les neurones à bouffées, transformé en signal de position par le noyau du prepositus hypoglossi. Les pathologies qui provoquent un dysfonctionnement de l’intégrateur de position empêchent le maintien du globe en position latérale, provoquant un nystagmus du regard excentré. Les causes sont souvent toxiques (alcool) ou médicamenteuses.
Le faisceau longitudinal médian (FLM) correspond à une voie de passage relayant les signaux entre les différents noyaux du tronc cérébral. Il constitue deux rubans parallèles depuis la moelle spinale jusqu’au mésencéphale. Il contient principalement des afférences ipsilatérales et controlatérales provenant des noyaux vestibulaires, mais également les interneurones reliant le noyau du nerf abducens au sous-noyau du III du droit médial controlatéral. Il s’agit donc d’une structure essentielle à la voie finale commune des mouvements de version horizontale. Son interruption provoque une dissociation clinique des yeux lors des tentatives de version (cf. chapitre 14).
Le noyau vestibulaire correspond également au centre générateur des mouvements oculaires verticaux lents.
Le centre générateur des mouvements oculaires verticaux rapides correspond au noyau rostral interstitiel du faisceau longitudinal médian (riFLM). Il se situe dans les pédoncules cérébraux. Il contient des neurones à bouffées, générant les saccades verticales et torsionnelles en projetant leurs axones directement sur les noyaux du III homolatéraux et controlatéraux.
Le noyau interstitiel de Cajal correspond à l’intégrateur neuronal pour le regard vertical et torsionnel. Il reçoit des afférences provenant du riFLM et du noyau vestibulaire, et projette ses efférences sur les noyaux controlatéraux du III et du IV en passant par la commissure postérieure.
Les informations concernant les mouvements vers le haut croisent la ligne médiane au niveau de la commissure postérieure pour atteindre le riFLM. Les neurones excitateurs phasiques projettent ensuite de façon bilatérale vers les sous-noyaux du nerf oculomoteur destiné au droit supérieur et à l’oblique inférieur. Une lésion unique de la commissure postérieure coupe l’information destinée aux deux riFLM, empêchant toute saccade vers le haut.
Les afférences supranucléaires destinées au mouvement vers le bas ne passent pas par la commissure postérieure. Elles restent latéralisées jusqu’au riFLM, dont les neurones excitateurs phasiques projettent également de façon ipsilatérale sur le sous-noyau du droit inférieur et le noyau du nerf trochléaire. Seule une lésion bilatérale des deux riFLM pourra provoquer une atteinte des saccades vers le bas. C’est le cas dans la paralysie supranucléaire progressive (maladie de Steele-Richardson), qui provoque une dégénérescence bilatérale progressive de ces structures.
La voie oligosynaptique à l’origine du réflexe vestibulo-oculaire comprend un capteur sensoriel et trois neurones. La cellule sensorielle transmet son information au neurone vestibulaire primaire, dont le corps cellulaire se situe dans le ganglion de Scarpa. Son axone se prolonge jusqu’au tronc cérébral, dans le noyau vestibulaire où il fait synapse avec un neurone vestibulaire secondaire. Ce second neurone prolonge son axone vers le noyau abducens, pour faire synapse avec un motoneurone du VI. Dans le noyau vestibulaire, le neurone vestibulaire primaire réalise des synapses avec deux types de neurones : un neurone vestibulaire secondaire excitateur (NSE) et un neurone vestibulaire secondaire inhibiteur (NSI). Le NSE projette sur un ensemble de structure controlatérale :
les corps cellulaires des motoneurones du VI et des neurones internucléaires (liant le noyau du VI au noyau du III controlatéral) ;
les neurones du noyau prepositus hypoglossi ;
les neurones contrôles de la phase rapide (NCP) ;
les interneurones vestibulaires (interneurones inhibiteurs de type II).
Le NSI projette sur ce même ensemble de structure, mais du côté ipsilatéral au canal stimulé.
Un déplacement de la tête (fig. 21-81) va provoquer la rotation angulaire d’au moins un canal semi-circulaire. Cette rotation va être codée par un capteur sensoriel, puis transmise par la voie oligosynaptique au motoneurone du VI controlatéral en 7 ms à 15 ms. Cette activation du canal semi-circulaire entraîne l’activation des motoneurones du VI controlatéraux (NSE) et l’inhibition des neurones du VI ipsilatéraux (NSI). Par ailleurs, le message neuronal excitateur est transmis aux neurones internucléaires, dont le corps cellulaire se situe dans le noyau abducens et qui projettent sur les motoneurones du III (après décussation par le faisceau longitudinal médian). Dans un premier temps, la rotation de la tête provoque :
l’excitation des motoneurones du VI controlatéral et du III ipsilatéral ;
l’inhibition des motoneurones du VI ipsilatéral et du III controlatéral.
Cela provoque un mouvement conjugué des yeux dans la direction opposée à la rotation de la tête.
De façon à maintenir l’image du monde stable sur la rétine, le mouvement de rotation angulaire des yeux doit être égal à celui de la tête, mais de sens opposé. Pour que le déplacement de l’œil soit précis, les neurophysiologistes ont montré que la commande motrice reçue par les motoneurones du VI doit être codée à la fois en signal de vitesse mais aussi en signal de position. Les capteurs sensoriels des canaux semi-circulaires détectent essentiellement les accélérations rotatoires. Grâce aux propriétés biophysiques de ces capteurs, le message est codé pour les fréquences moyennes en signal de vitesse angulaire puis transmis aux motoneurones du VI par la voie oligosynaptique. Les neurones du noyau prepositus hypoglossi reçoivent simultanément ce message. En intégrant ce signal de vitesse (au sens mathématique), ils pourraient en déduire un signal de position de l’œil qui serait alors transmis aux neurones du VI. De cette façon, la commande motrice disposerait à la fois du signal de vitesse et du signal de position de l’œil, permettant de réaliser un mouvement d’amplitude équivalente à la rotation angulaire de la tête mais de sens contraire : c’est la phase lente du réflexe vestibulo-oculaire.
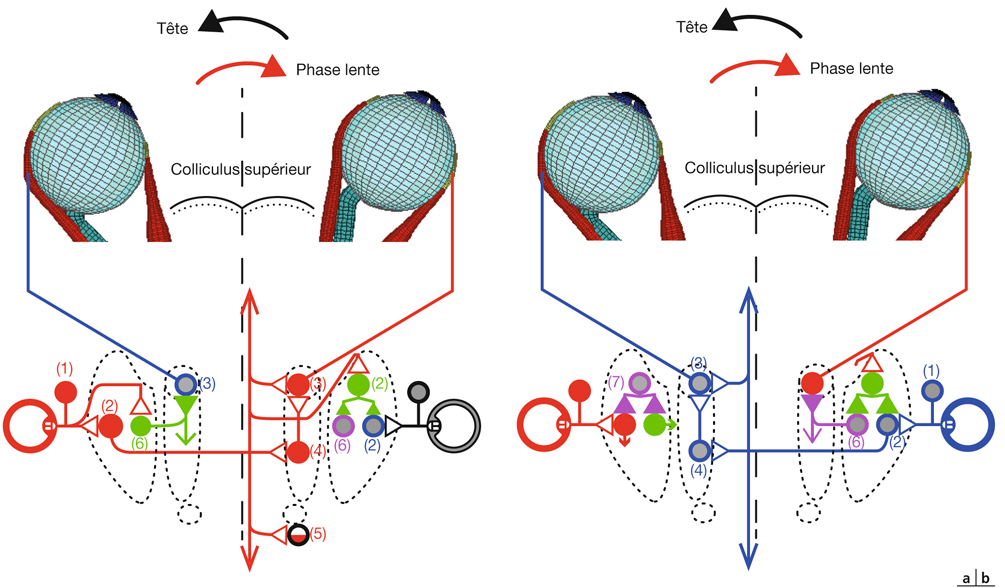
Fig. 21-81 Réflexe oculocéphalique, ou vestibulo-oculaire.
a. Circuit neuronal simplifié de la phase lente du réflexe vestibulo-oculaire : circuit en lien direct avec le canal semi-circulaire activé. b. Circuit neuronal simplifié de la phase lente du réflexe vestibulo-oculaire : circuit en lien direct avec le canal semi-circulaire inhibé.
L’activation du motoneurone du VI droit est le produit d’une double influence : activation directe (a) et levée de l’inhibition (b). De même, l’inhibition du motoneurone du VI gauche est le produit d’une absence d’activation combinée à une inhibition active.
1. Neurone vestibulaire primaire. 2. Neurone vestibulaire secondaire excitateur. 3. Motoneurone du VI. 4. Neurone du prepositus hypoglossi. 5. Neurone contrôle de la phase rapide. 6. Neurone vestibulaire secondaire inhibiteur. 7. Interneurone vestibulaire inhibiteur (couleur rouge : neurone excitateur dont l’activité augmente ; couleur verte : neurone inhibiteur dont l’activité augmente ; couleur bleu : neurone activateur dont l’activité diminue ; couleur magenta : neurone inhibiteur dont l’activité diminue).
(Adapté de Vibert N. et al., 1997 [50]).
Le système précédemment décrit permet à nos yeux de garder une image stable sur la rétine lors d’un mouvement brusque de la tête, en conservant une vision de bonne qualité. Cependant, si la rotation de la tête se poursuit sans que rien ne se passe, les yeux vont se bloquer dans le coin opposé de l’orbite sans pouvoir assurer leur rôle. Il y a donc nécessité de recentrer les yeux : c’est la phase rapide du réflexe vestibulo-oculaire, qui dirige les yeux du côté de la rotation angulaire. Ce mouvement présente un double intérêt : il évite le blocage des yeux dans un coin excentré de l’orbite et il porte le regard vers la zone de l’environnement où se dirige notre tête.
Tout au long de la phase lente, les neurones contrôles de la phase rapide (NCP) controlatéraux à la rotation reçoivent le signal de vitesse des neurones vestibulaires secondaires excitateurs. Cette entrée provoque une dépolarisation membranaire progressive. Au-delà d’un certain seuil de dépolarisation, le NCP déclenche une bouffée de potentiels d’action. Les axones des NCP se projettent sur les neurones excitateurs phasiques (NEP) et inhibiteurs phasiques (NIP) ipsilatéraux à la rotation de la tête :
les NEP activent les motoneurones du VI ipsilatéraux à la rotation de la tête ;
les NIP inhibent les motoneurones du VI controlatéraux.
L’information qu’ils transmettent sous forme de bouffées de potentiels d’action permet de coder la durée, l’amplitude et la vitesse de la phase rapide. Ces neurones (NEP et NIP) sont inhibés durant la phase lente par les neurones omnipauses. Leur activation durant la phase rapide nécessite donc à la fois la réception d’un signal excitateur par les NCP et une levée de l’inhibition par la mise au silence des neurones omnipauses. Ce système complexe permet de réaliser un mouvement rapide de recentrage des yeux.
Le système nerveux utilise des systèmes d’activation-désinhibition et d’inhibition-désactivation pour coder les mouvements des yeux à la fois en durée, amplitude et vitesse. Le réflexe vestibulo-oculaire alterne l’utilisation de ces différents systèmes, provoquant des phases lentes de mouvements compensatrices de la rotation de la tête et des phases rapides de recentrage des yeux. Finalement, ce mouvement permet de maintenir le plus possible une image fixe du monde sur la rétine, permettant une vision nette malgré les perturbations de la position de la tête.
Quand la rotation angulaire de la tête se poursuit à vitesse constante dans l’obscurité, l’accélération est nulle. La cupule des capteurs sensoriels reprend alors progressivement sa position initiale grâce à ces propriétés élastiques et le neurone vestibulaire primaire retrouve son rythme de décharge de potentiel d’action en un peu plus de cinq secondes. Cependant les modifications de décharges du neurone vestibulaire secondaire vont perdurer pendant quinze secondes, de même que le mouvement alterné des yeux. Cette particularité est liée à un mécanisme de stockage interne de la vitesse.
Par ailleurs, lorsqu’un sujet est soumis de façon répétée aux mêmes stimulations vestibulaires, le réflexe vestibulo-oculaire va progressivement exprimer une diminution du gain et des constantes temporelles : c’est le phénomène d’habituation.
Le réflexe vestibulo-oculaire est ainsi contrôlé par d’autres voies neuronales. Le noyau vestibulaire est le lieu de convergence des neurones vestibulaires primaires, mais aussi des neurones portant des informations visuelles, oculomotrices et proprioceptives. La réponse vestibulaire est ainsi modulée par les autres informations disponibles pour localiser le corps dans l’espace et déplacer les yeux en fonction. Un exemple particulièrement frappant de l’influence des stimulations visuelles sur le réflexe vestibulo-oculaire est apporté par le port de prismes inversant pendant trois à quatre semaines : à terme, les mouvements de la tête entraîneront la phase lente dans la même direction rotatoire, permettant de maintenir l’image stable sur la rétine. Les informations visuelles ont permis de « recalibrer » le système.
Les influences vestibulo-cérébelleuses jouent un rôle important dans le contrôle du réflexe vestibulo-oculaire. Le flocculus reçoit par les fibres moussues des influences vestibulaires (en provenance du noyau vestibulaire et du noyau prepositus hypoglossi), mais aussi des informations visuelles et oculomotrices (copie efférente de la commande oculomotrice). Les cellules de Purkinje (voie de sortie du cervelet) présentent ainsi une décharge corrélée à la vitesse de rotation de l’œil. Le flocculus projette ses efférences sur les noyaux vestibulaires. Le cervelet pourrait ainsi jouer un rôle modulateur du réflexe vestibulo-oculaire, permettant la comparaison du mouvement programmé avec le mouvement effectué. Ces phénomènes pourraient intervenir dans le contrôle du gain et dans les apprentissages moteurs.
Une petite partie (peut-être 10 %) des fibres ganglionnaires rétiniennes ne font pas synapses au niveau du ganglion géniculé latéral. Elles se détachent du tractus optique pour se diriger vers les noyaux mésencéphaliques du système optique accessoire et le noyau du tractus optique. Ces deux systèmes reçoivent également des afférences corticales et projettent leurs efférences vers les noyaux du pons [19].
Les informations visuelles transitent directement des fibres ganglionnaires de la rétine dans le tractus optique accessoire vers quatre noyaux du mésencéphale controlatéral : le noyau terminal latéral (LTN), le noyau terminal médial (MTN), le noyau terminal dorsal (DTN) et le noyau terminal interstitiel (ITN). Ce circuit est spécialisé dans le traitement du glissement rétinien, les neurones du système optique accessoire (Accessory Optic System, AOS) étant sélectifs pour le mouvement dans une direction donnée. En particulier, LTN et MTN sont sensibles au flux optique vertical. Ces noyaux projettent leurs efférences vers l’olive inférieure et les structures vestibulaires (noyau prepositus hypoglossi et noyau vestibulaire médial).
Ce système ne répond au mouvement de l’image sur la rétine que pour des vitesses inférieures à 15° par seconde. Ainsi, le système optique accessoire joue probablement un rôle plus important dans l’adaptation du réflexe vestibulo-oculaire aux informations visuelles que dans la génération du nystagmus optocinétique (fig. 21-82).
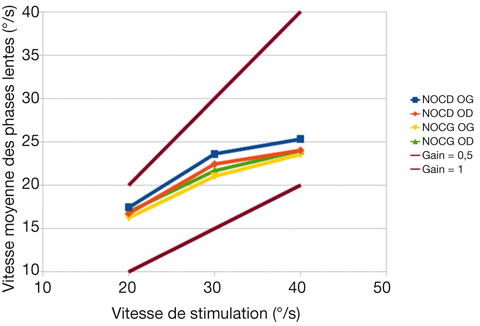
Fig. 21-82 Nystagmus optocinétique. Vitesse moyenne de la phase lente du mouvement du globe en fonction de la vitesse de stimulation. Notez la chute du gain à mesure que la vitesse de stimulation augmente.
(Source : Lefetz J., 2011 [18]).
Ce noyau prétectal reçoit des informations rétiniennes par le colliculus supérieur et d’autres afférences visuelles provenant des cortex visuels striés et extra-striés. Les afférences rétiniennes directes sont croisées, l’hémirétine nasale projetant ses afférences sur le noyau controlatéral. Les afférences corticales proviennent principalement des informations des aires visuelles ipsilatérales temporales MT (Middle Temporal area) et MST (Medial Superior Temporal area), spécialisées dans le traitement du mouvement (fig. 21-83). Ces aires visuelles associatives fournissent un codage du mouvement pour des valeurs de vitesse allant jusqu’à 60° par seconde, ce qui est beaucoup plus élevé que le codage réalisé par le système optique accessoire. Ainsi, le noyau du tractus optique reçoit des afférences sous-corticales directes provenant de l’hémirétine nasale controlatérale et des afférences corticales indirectes provenant de l’hémirétine nasale homolatérale et l’hémirétine temporale ipsilatérale. Il existe une sensibilité rétinienne à la direction du mouvement détecté : flux temporonasal et hémirétine nasale, flux nasotemporal et hémirétine temporale.
Les neurones du noyau du tractus optique projettent vers les noyaux du pont, principalement vers l’olive inférieure, le noyau réticulé du toit du pont (NRTP) et le noyau dorsolatéral du pont (NDLP). Ils ne projettent que faiblement vers le complexe vestibulaire noyau prepositus hypoglossi-noyau vestibulaire médial. Les noyaux du tractus optique fournissent un signal visuel aux noyaux vestibulaires qui permet de construire une réponse motrice identique à celle du réflexe vestibulo-oculaire. Les neurones du noyau du tractus optique sont capables de coder les signaux d’erreurs rétiniens. Ces neurones sont sensibles au mouvement du flux optique, en particulier lorsque les mouvements se dirigent vers le côté du noyau. Cette voie du noyau du tractus optique joue un rôle essentiel dans la génération du nystagmus optocinétique.
À la naissance, les projections sous-corticales sont effectives alors que les projections corticales sont encore immatures. Le noyau du tractus optique est donc essentiellement sensible aux stimulations provenant de l’hémirétine nasale controlatérale. Lors de l’occlusion monoculaire, seules les stimulations temporonasales permettent d’éliciter un nystagmus optocinétique. Les voies corticales se myélinisent entre le troisième et le quatrième mois, permettant d’obtenir une des réponses symétriques monoculaires dans les sens nasotemporal et temporonasal.
Cette asymétrie du nystagmus optocinétique au profit des stimulations temporonasales peut être observée chez les patients présentant un strabisme précoce, même à l’âge adulte.
L’absence de développement de la binocularité entraîne un développement différent des voies cortico-sous-corticales. Ainsi, le nystagmus optocinétique apparaît comme la combinaison d’un système sous-cortical primitif robuste et d’un système cortical fragile.
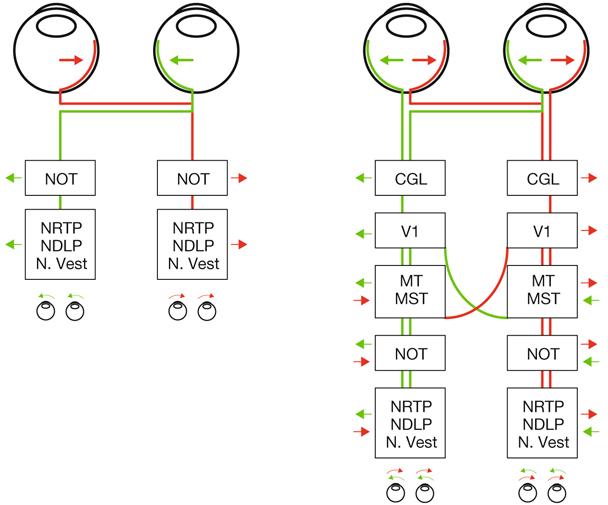
Fig. 21-83 Schéma simplifié des afférences sous-corticales et corticales contrôlant le nystagmus optocinétique. Les afférences sous-corticales sont matures à la naissance et latéralisées ; les afférences corticales deviennent effectives après quelques mois.
(Source : Schor C.M., 2011 [40], adapté de Hoffmann K.P. et al., 1992 [12]).
Trois phases de décharge peuvent être enregistrées dans le motoneurone d’un muscle oculomoteur lors de la réalisation d’une saccade [20] (fig. 21-84) :
initialement, le motoneurone présente une activité de décharge phasique à haute fréquence (burst) débutant 8 ms avant le mouvement de l’œil : cette activité est nécessaire pour délivrer aux muscles oculomoteurs une force de contraction suffisante pour lutter contre les résistances inertielles qui retiennent le globe dans sa position primitive ;
une phase intermédiaire, transition entre les décharges phasique et tonique ;
à la fin de la saccade, le motoneurone présente une élévation de la fréquence tonique de décharge par rapport à sa fréquence de base, permettant au muscle de générer une force suffisante pour maintenir le globe dans une position excentrée (et ainsi lutter contre les forces élastiques qui ramènent le globe dans sa position primitive).
Deux générateurs de pulse de saccades ont été identifiés dans le tronc cérébral [4, 40]. Ils contiennent un ensemble de neurones (neurones phasiques) qui projettent sur les noyaux oculomoteurs et dont la décharge provoque une saccade :
la formation réticulée paramédiane pontine (FRPP) est située dans la partie caudale du pont ; ses neurones phasiques projettent essentiellement vers le noyau abducens ; ils sont responsables des saccades horizontales ;
le noyau interstitiel rostral du faisceau longitudinal médian (riMLF) est situé dans la partie rostrale du mésencéphale ; ses neurones phasiques projettent essentiellement sur le noyau oculomoteur ; ils sont responsables des saccades verticales.
Les neurones phasiques de ces deux structures sont inhibés en permanence par des neurones omnipauses, situés dans la partie médiane du pont (noyau interpositus du raphé).
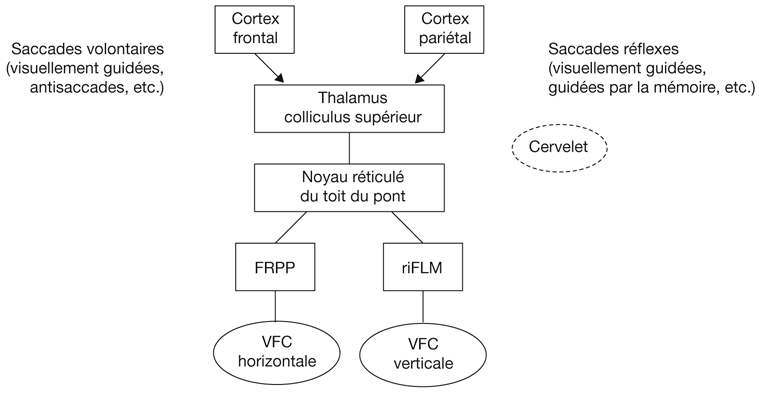
Fig. 21-84 Schéma simplifié des bases neurales des saccades.
Les neurones burst sont responsables de la commande prémotrice des saccades. Les caractéristiques de leur décharge sont corrélées à l’amplitude et à la vitesse de l’œil. Ils sont inhibés par les neurones omnipauses.
La formation réticulée paramédiane pontine (FRPP) contient deux types de neurones impliqués dans la réalisation de saccades horizontales. Les neurones phasiques excitateurs (NEP) projettent du côté ipsilatéral sur le noyau abducens, le noyau prepositus hypoglossi, le noyau vestibulaire et sur le tractus parmédian (relais de la copie efférente vers le cervelet). Les neurones phasiques inhibiteurs (NIP) projettent sur les mêmes structures du côté controlatéral. Ainsi, lors de la réalisation d’une saccade horizontale, les NEP vont activer les neurones du VI ipsilatéral (et du III controlatéral via le neurone internucléaire), alors que les NIP vont inhiber les noyaux innervant les muscles antagonistes (VI controlatéral et III ipsilatéral) : c’est un exemple des lois d’innervation réciproque décrite par Sherrington.
Le noyau interstitiel rostral du faisceau longitudinal médian (riMLF) contient les neurones phasiques excitateurs (NEP) impliqués dans la réalisation de saccades verticales. Les NEP impliqués dans les saccades ascendantes projettent de façon bilatérale sur les motoneurones du III, alors que ceux impliqués dans les saccades descendantes ne projettent que sur les motoneurones ipsilatéraux. Alors qu’aucun neurone phasique inhibiteur n’a été mis en évidence dans le noyau riMLF, les neurones du noyau de Cajal pourraient envoyer des projections GABAergiques (inhibitrices) aux motoneurones controlatéraux du III et du IV.
Ils sont situés dans le noyau interpositus du raphé, sur la ligne médiane entre les racines des deux nerfs abducens. Leur décharge est continue, sauf immédiatement avant et pendant la saccade. Ils reçoivent des afférences du colliculus supérieur, de formations corticales (en particulier du Frontal Eye Field, FEF) ou cérébelleuses (noyau fastigial) ou d’autres structures du tronc cérébral (formation centrale mésencéphalique réticulaire, ou long-lead burst neurons). Leurs efférences inhibent l’ensemble des cellules phasiques du tronc cérébral. Ainsi, l’inhibition des neurones omnipauses est indispensable à la réalisation d’une saccade.
L’inhibition initiale pourrait provenir d’un signal « gâchette », délivré par une zone du colliculus supérieur : ce signal précède la réalisation du mouvement, levant l’inhibition des NEP.
Pendant le reste du mouvement, le niveau d’hyperpolarisation de la membrane cellulaire du neurone omnipause est corrélé à la vitesse instantanée de l’œil. Les NEP pourraient fournir ce signal inhibiteur, via une cellule relais (latch neuron) située dans la FRPP.
Ces neurones qui se localisent dans l’ensemble du tronc cérébral débutent leur décharge 40 ms avant l’exécution de la saccade. Ils reçoivent des afférences du colliculus supérieur, du noyau fastigial ou du Supplementary Eye Field (SEF). Ils projettent leurs efférences sur les NEP, les NIP, les neurones omnipauses et les neurones du NRTP. Ils pourraient jouer un rôle temporel dans la réalisation de saccades, notamment en déclenchant le début ou la fin du mouvement (fig. 21-85).
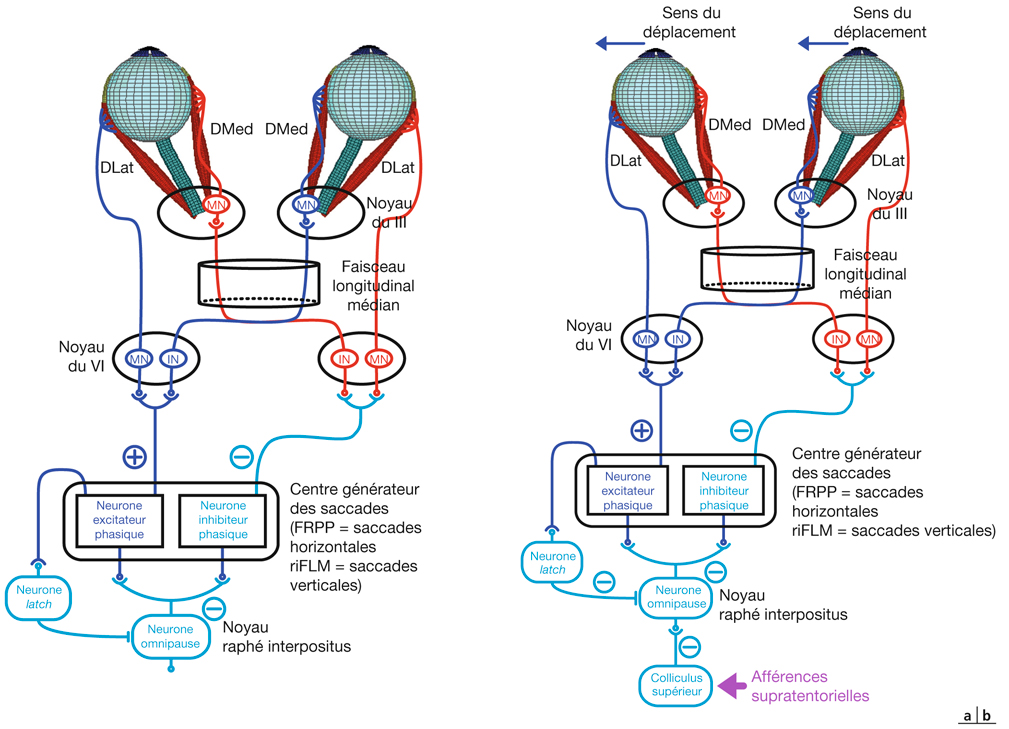
Fig. 21-85 Génération d’une saccade.
a. À l’état de base, les neurones du générateur de saccade sont inhibés en permanence par la cellule omnipauses du noyau interpositus du raphé. b. Le colliculus supérieur adresse un signal inhibiteur « gâchette » sur les neurones omnipauses, levant l’inhibition des neurones excitateurs et inhibiteurs phasiques, provoquant la saccade.
Les neurones du noyau réticulé du toit du pont (NRTP) situés dans sa portion caudale sont capables de coder les saccades à la fois en amplitude et en direction, dans un référentiel en trois dimensions. Ils interviennent en particulier dans la composante torsionnelle du mouvement. Par ailleurs, sur ce noyau convergent les circuits de la poursuite oculaire et de la vergence. Ce noyau pourrait ainsi constituer un centre de coordination entre ces différents types de mouvement.
Parmi les noyaux du cervelet, les lobules VI et VII (vermis oculomoteur dorsal) comportent des cellules de Purkinje qui commencent à décharger 15 ms avant la réalisation d’une saccade. Ces neurones sont sélectifs pour la direction. En comparant le mouvement programmé et le mouvement effectué (via une copie efférente de la commande motrice), ce noyau serait impliqué dans le contrôle de l’amplitude du mouvement. Le noyau fastigial tiendrait un rôle dans l’arrêt du mouvement.
Le colliculus supérieur présente une portion visuelle et une portion motrice. L’activité de ces deux couches est globalement indépendante. La partie visuelle du colliculus supérieur est située dorsalement, et s’organise selon un plan rétinotopique. Elle reçoit des informations visuelles directement de la rétine ou indirectement du cortex strié, et elle envoie des efférences vers le tronc cérébral (noyaux prétectaux), le ganglion géniculé latéral ou les noyaux gris centraux.
La partie motrice du colliculus supérieur est ventrale. Cette couche intervient plus particulièrement dans la génération des saccades. Les neurones s’organisent dans une « carte motrice », sur laquelle ils sont répartis spatialement en fonction des mouvements qu’ils codent (amplitude et orientation des saccades) :
le pôle rostral comprend la « zone de fixation » ;
la taille des saccades est codée dans un axe rostro-caudal : plus les neurones sont situés loin du pôle rostral, plus l’amplitude des saccades codées est grande ;
la direction des saccades est codée dans un axe médiolatéral.
Cette répartition des neurones réalise une carte motrice aux coordonnées planaires (en deux dimensions).
Les afférences reçues par la partie ventrale du colliculus supérieur proviennent de l’ensemble du cortex (aires occipitales, pariétales et ventrales), soit directement soit indirectement (après relais dans les noyaux gris centraux). D’autres afférences proviennent de la formation réticulée mésencéphalique centrale, du noyau prepositus hypoglossi ou du cervelet (noyau fastigial). Les efférences des neurones colliculaires se projettent essentiellement sur les noyaux du tronc indispensables à la génération de saccades : FRPP et noyau riMLF, noyau prepositus hypoglossi et noyau vestibulaire, NRTP… Il existe aussi des projections ascendantes vers le thalamus et les aires frontales.
La microstimulation expérimentale du colliculus supérieur permet d’étudier son rôle dans le contrôle des saccades. La stimulation de la zone de fixation rostrale supprime totalement la réalisation de saccade : ses neurones envoient directement leur projection excitatrice directe vers les neurones omnipauses, inhibant la réalisation motrice de saccade. Une stimulation plus caudale provoque une saccade dans la direction controlatérale, dont l’amplitude et l’orientation sont liées spatialement à la zone stimulée. Le colliculus supérieur possède des neurones « build-up », dont l’activité débute lorsque le stimulus visuel devient la cible de la saccade. Le site d’activité maximale de la carte motrice est fonction du déplacement de l’œil nécessaire pour atteindre la cible : le taux de décharge des neurones diminue à mesure que la fovéa se rapproche de la cible.
En conclusion, le colliculus supérieur permet de localiser la cible dans un système de coordonnées rétinotopiques. Il intervient par ailleurs dans la sélection de la cible (parmi les différents stimulus visuels) et éventuellement dans le déclenchement du mouvement.
Le Frontal Eye Field (FEF) se situe dans la face antérieure du sillon précentral, à son intersection avec le sillon frontal supérieur. Les neurones y sont également organisés dans une carte motrice : la microstimulation du FEF provoque une saccade controlatérale dont la direction et l’orientation dépendent de la localisation spatiale de la zone stimulée. Le FEF possède aussi une zone de fixation qui projette dans la partie rostrale du colliculus supérieur. Le FEF est généralement impliqué dans les saccades volontaires, les saccades guidées par la mémoire et les tâches d’anti-saccades (en particulier dans le processus décisionnel).
Le Supplementary Eye Field (SEF) se situe dans la partie supérieure du sillon précentral. Cette structure a été essentiellement impliquée dans la programmation motrice de séquences de saccades.
Le cortex préfrontal dorsolatéral intervient dans les tâches complexes de réalisation de saccade : saccades prédictives, saccades guidées par la mémoire, anti-saccades (en particulier dans l’inhibition des saccades réflexes dirigées du côté de la cible).
Le cortex pariétal postérieur intervient dans la transformation des coordonnées rétinotopiques de stimulus visuels en coordonnées craniotopiques. Le Parietal Eye Field (PEF) est localisé le long du sillon intrapariétal. Il intervient plus spécifiquement dans les saccades réflexes.
Le thalamus a été impliqué dans les processus de déplacement de l’attention visuel et dans la programmation des saccades. Les ganglions de la base constituent des structures relais entre les aires corticales (FEF et PEF) et les centres de génération des saccades dans le tronc cérébral. Ces voies indirectes interviennent essentiellement dans les processus complexes de réalisation de saccades (saccades guidées par la mémoire, prédiction…), facilitant les mouvements volontaires ou stabilisant la fixation (en inhibant les mouvements réflexes).
Les lésions isolées du colliculus supérieur, du FEF ou du cortex pariétal postérieur ne provoquent que rarement des déficits majeurs et persistants des saccades. Cependant, des lésions bilatérales des deux FEF et des deux colliculus supérieurs provoquent un déficit chronique dans l’exécution de saccades. C’est également le cas lorsque ces lésions bilatérales touchent les FEF et les cortex pariétaux postérieurs. Cette constatation souligne le fait qu’il existe au moins deux voies descendantes contrôlant la génération de saccades, complémentaires et interconnectées.
La poursuite oculaire est une acquisition importante qui permet d’analyser les objets en mouvement en stabilisant leur image sur la fovéa [13, 21, 24, 25]. Ce mouvement oculaire est dépendant de l’attention que nous portons à la cible en mouvement [54]. Nous sommes ainsi capables de déplacer notre attention visuospatiale sur un objet en mouvement en gardant le regard fixe ou en le poursuivant des yeux. Lors de la réalisation d’une simple poursuite, le cerveau doit traiter de nombreuses informations visuelles et extravisuelles simultanément, permettant d’initier le mouvement oculaire, puis de le poursuivre en fonction des caractéristiques de la cible (taille, vitesse orientation…). Les récentes études en imagerie fonctionnelle nous permettent d’appréhender la complexité de cette tâche, en identifiant les nombreuses aires corticales activées : lors d’une poursuite oculaire par rapport à une simple tâche de fixation, le signal BOLD est significativement augmenté dans les aires FEF (Frontal Eye Field), SEF (Supplementary Eye Field), MT (human Middle Temporal visual area), MST (Middle Superior Temporal visual area), PEF (Parietal Eye Field, incluant le sillon intrapariétal), dans le cortex cingulaire et le cervelet (fig. 21-86). Le degré d’activation respectif de ces différentes aires est dépendant de la tâche effectuée. Ces résultats, associés à ceux obtenus par les études lésionnelles ou par l’enregistrement de l’activité neuronale intracérébrale chez le singe, ont permis de proposer un modèle de circuit cérébral de la poursuite oculaire (fig. 21-87).
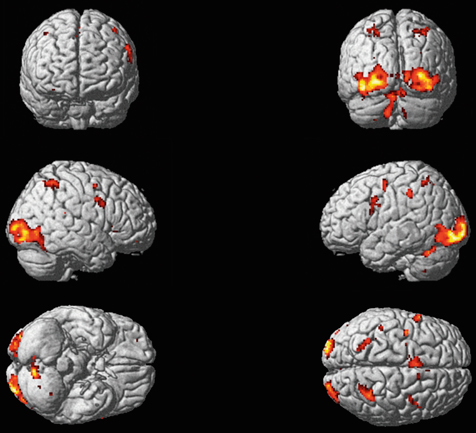
Fig. 21-86 Exemple des activations corticales enregistrées en IRM fonctionnelle lors d’une tâche de poursuite oculaire par rapport à une tâche de fixation. Cartes statistiques paramétriques montrant les voxels activés de façon significative (p < 0,001, corrigé pour les comparaisons multiples en utilisant FDR) projetées sur le cerveau MNI (Montreal Neurological Institute) fourni par le logiciel SPM (Statistical Parametring Mapping).
Vues antérieure, postérieure, droite, gauche, inférieure et supérieure.
(D’après Lebranchu P. et al., 2010 [17].)
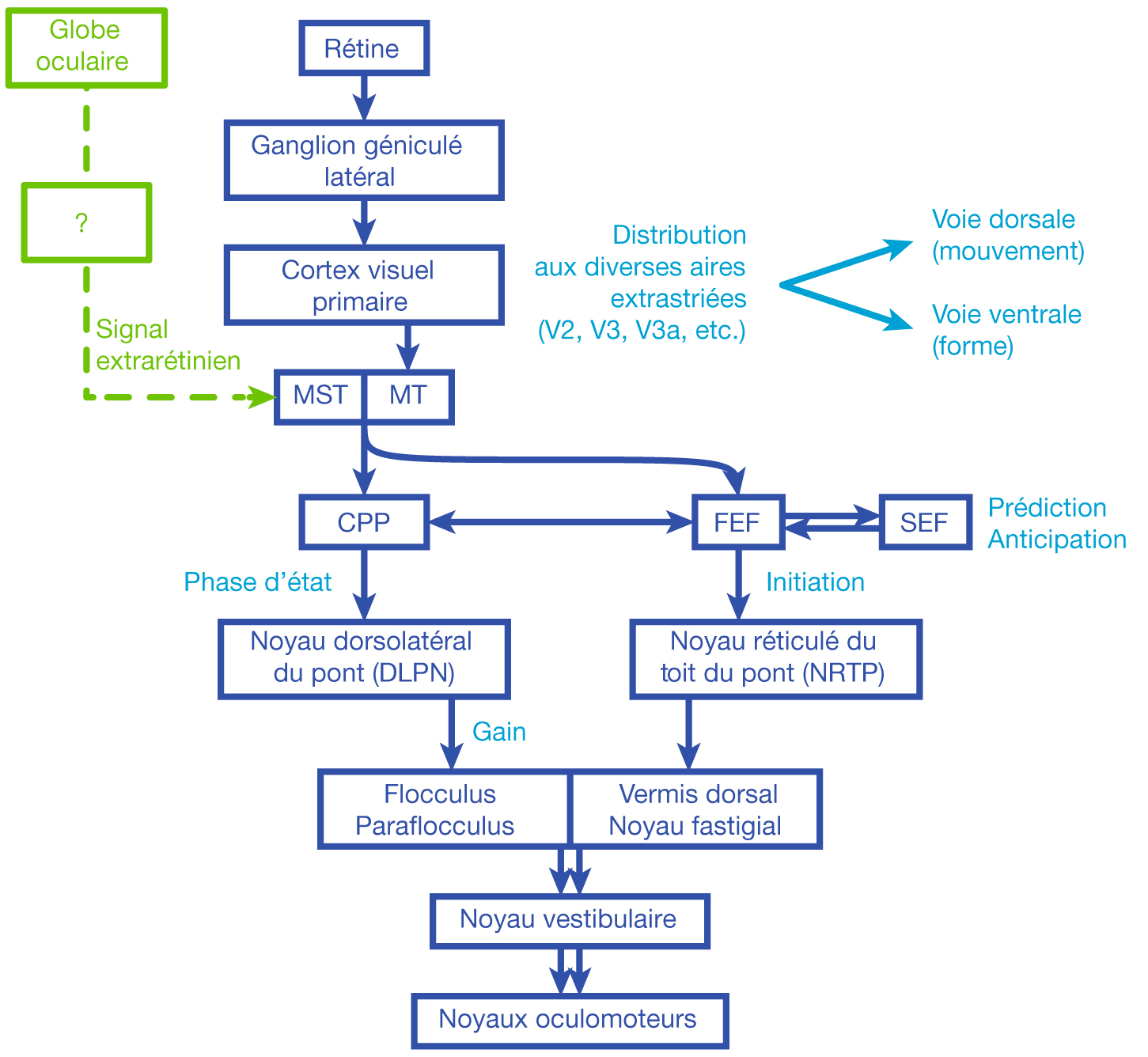
Fig. 21-87 Circuits corticaux et sous-corticaux impliqués dans la réalisation d’une poursuite oculaire.
(D’après Lebranchu P. et al., 2010 [17].)
Les cellules rétiniennes transmettent leurs informations via les corps géniculés latéraux sur la couche IV du cortex visuel primaire. Des projections sont ensuite réalisées sur les aires extra-striées (incluant hMT/V5+ et MST) puis sur le cortex pariétal postérieur. Le cortex visuel primaire (V1) est indispensable à la réalisation de la poursuite oculaire : un sujet qui présente une lésion focale unilatérale du cortex visuel primaire est incapable de poursuivre une cible se déplaçant dans l’hémichamp controlatéral.
L’aire MT (Middle Temporal visual area) reçoit des afférences visuelles ipsilatérales directement de V1 ou indirectement par les premières aires extra-striées. Son organisation est rétinotopique. Cette aire est spécialisée dans le traitement du mouvement visuel : ces neurones sont capables de coder la vitesse, l’accélération et la direction du stimulus visuel. La stimulation expérimentale de MT pendant la poursuite augmente la vitesse de l’œil. Une lésion de MT provoque une altération de la perception du mouvement et une dégradation de la phase initiale de la poursuite, qui devient parasitée de saccades.
L’aire MST (Medial Superior Temporal visual area) reçoit des afférences ipsilatérales et controlatérales de MT, mais aussi des signaux extrarétiniens provenant du système vestibulaire ou de la copie efférente de la commande oculomotrice. Ainsi, les neurones de MST sont capables de prendre en compte les effets du mouvement de l’œil. Les neurones de la partie dorsale de MST participent à l’analyse du flux optique (défilement de l’image sur l’ensemble de la rétine). Leur activité est modulée par la disparité rétinienne et l’angle de vergence. Une lésion de MST provoque un déficit unidirectionnel de la poursuite, quel que soit le champ visuel stimulé.
Le cortex pariétal postérieur reçoit des afférences de MT et MST. Ces neurones peuvent modifier leur décharge en fonction de la nature de la cible. L’aire ventrale intrapariétale possède également des neurones sélectifs pour la vitesse lors de la poursuite oculaire. Par ailleurs, ces aires pariétales pourraient participer à la transformation des coordonnées rétinotopiques des informations visuelles en coordonnées craniotopiques, qui tiennent compte de la position des yeux dans l’orbite mais aussi de la position de la tête dans l’espace. Enfin, ces aires participeraient au traitement du flux rétinien, inhibant sa perception.
Le Frontal Eye Field (FEF) présente des connexions réciproques avec les aires corticales postérieures (MT, MST, cortex pariétal postérieur). Il existe dans la partie inférolatérale du FEF un ensemble de neurones dont l’activité est spécifiquement liée à la poursuite oculaire et indépendante de la réalisation de saccades. Ces neurones présentent une sélectivité pour la direction du mouvement et leur taux de décharge est corrélé à la vitesse de l’œil. Le FEF est activé environ 100 ms après le début du mouvement de la cible et précède le mouvement de l’œil de 10 à 20 ms. La microstimulation de cette région chez le singe évoque un mouvement de poursuite. Une lésion du FEF entraîne un déficit de la poursuite oculaire, en général ipsilatéral ; l’altération de la poursuite est aussi bien visible dans la phase d’initiation du mouvement que dans la phase d’état ; la prédiction du mouvement devient également impossible.
Le Supplementary Eye Field (SEF) reçoit des afférences des autres aires corticales (MST, cortex pariétal postérieur et FEF). L’activité neuronale des cellules de SEF impliquées dans la poursuite oculaire pourrait également prendre en compte la vitesse du mouvement de la tête. Une lésion de SEF n’entraîne pas de déficit majeur de la poursuite. La microstimulation de cette région chez le singe améliore la prédiction du mouvement (notamment en diminuant la latence et en augmentant la vitesse initiale de l’œil). Ainsi, SEF participe essentiellement au contrôle de l’anticipation du mouvement.
Comme pour le circuit des saccades, deux ensembles d’aires corticales se distinguent par le rôle qu’ils jouent dans l’élaboration du mouvement oculaire : les centres les plus postérieurs (MT, MST, cortex pariétal postérieur) semblent essentiellement impliqués dans les aspects réflexes ; les aires frontales (FEF et SEF) participent aux phénomènes prédictifs et volontaires du mouvement. Cependant cette distinction n’est pas si nette : de nombreuses interconnexions existent entre ces différentes aires. Toutes projettent par les voies descendantes vers les noyaux du pont et du cervelet. Les aires frontales se connectent de préférence au noyau réticulé du toit du pont (NRTP), au vermis dorsal puis au noyau fastigial. Le circuit antérieur code les informations permettant l’initiation de la poursuite. Les aires postérieures se projettent préférentiellement vers le noyau dorsolatéral du pont (DLPN), puis vers le flocculus et le paraflocculus. Ce réseau postérieur permet le maintien du mouvement, en particulier lorsque le gain de la poursuite est proche de l’unité. Ces réseaux s’interconnectent avec le tractus optique accessoire et le circuit striatopallidal. Tous convergent vers les noyaux oculomoteurs extrinsèques des yeux. Ainsi apparaît un modèle complexe, avec une subdivision des différents centres de traitement du stimulus en fonction d’une caractéristique spécifique ou d’une tâche à effectuer.
La poursuite oculaire est une transformation sensorimotrice qui peut être modélisée comme un circuit en boucle (modèle de Robinson [36]) (fig. 21-88). Le récepteur (la rétine) adresse un signal de vitesse aux centres corticaux qui le transforme en commande oculomotrice au niveau des muscles du globe (l’effecteur). La boucle de rétrocontrôle visuelle permet de comparer la vitesse du mouvement effectué à la vitesse du mouvement programmé. Durant les cent premières millisecondes de la poursuite oculaire, cette boucle est ouverte : tant que la cible n’est pas congruente avec la fovéola, un signal d’erreur de vitesse est réinjecté pour augmenter la vitesse du globe. Dès que l’image de la cible devient congruente avec la fovéola, le signal d’erreur de vitesse devient nul. Pour maintenir constant le mouvement du globe, le système doit injecter un autre signal pour en déduire la vitesse de la cible. Ce signal alternatif pourrait correspondre à une copie efférente de la commande oculomotrice, qui code la vitesse de déplacement du globe. Ce signal extrarétinien est réinjecté en amont, dans une autre boucle de rétrocontrôle, permettant de maintenir une vitesse constante sans information visuelle. Le circuit fonctionne alors en boucle fermée. D’autres modèles ont été proposés, en particulier par Krauzlis et Lisberger (1989) [15]. Tous comportent une boucle de rétrocontrôle renseignant le signal d’erreur de vitesse. Il existe enfin un mécanisme de modulation du gain en direct, siégeant dans la région du FEF dévolue à la poursuite. Ce gain est de 0 lors de la fixation et de 1 durant une poursuite visuellement guidée.
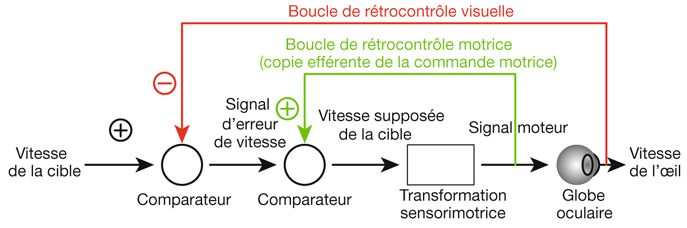
Fig. 21-88 Schéma de modélisation de la poursuite oculaire.
(D’après Robinson D.A. et al., 1986 [36].)
Il existe depuis le xixe siècle un débat sur l’origine de la coordination des deux yeux lors des mouvements du regard. Pour Helmholtz, le ciblage précis des mouvements binoculaire est le produit d’un apprentissage. Selon cette hypothèse, chacun de nos globes présente à la naissance une oculomotricité indépendante et l’apprentissage progressif nous apprend à déplacer de plus en plus précisément nos deux yeux dans la même direction, ce qui permet l’émergence d’une vision binoculaire. Au contraire pour Hering, l’habilité à déplacer nos yeux de manière coordonnée provient d’un signal de commande commun et correspond à un phénomène inné.
Des mécanismes corticaux différents ont été proposés pour illustrer ces deux hypothèses. Une saccade disjointe correspond à un mouvement des yeux qui permet de refixer son regard d’un objet sur un autre, situé à la fois dans une autre direction et à une distance différente. En conséquence, le mouvement d’un œil n’est pas parfaitement identique au mouvement de l’autre. La théorie de Hering permet de créer deux mouvements différents en associant sur les muscles oculomoteurs deux influx, l’un provenant d’une commande conjuguée des saccades, l’autre provenant d’une commande vergentielle (fig. 21-89). Par opposition, la théorie de Helmholtz suggère que le mouvement de chaque œil est programmé de manière indépendante, les commandes vergentielle et saccadique devenant ainsi intégrées en amont, indépendantes pour chaque effecteur (fig. 21-90). Ils existent actuellement des arguments électrophysiologiques étayant chacune de ces hypothèses (pour la théorie de Hering, voir : [23] ; pour la théorie de Helmholtz, voir : [5]).
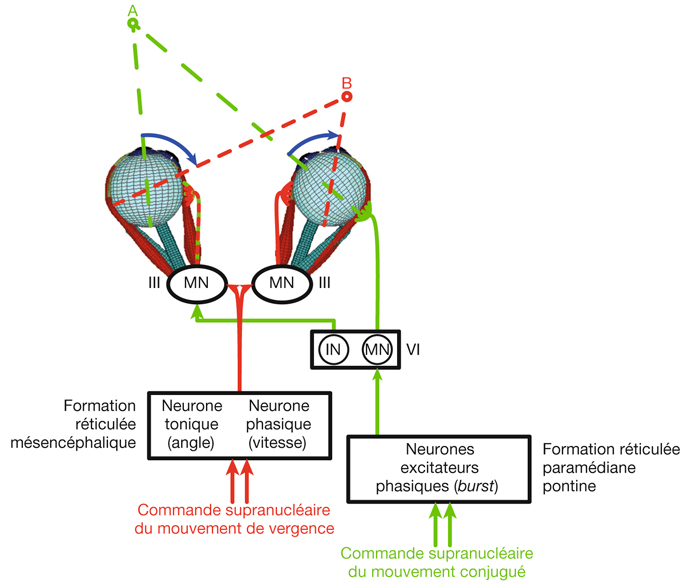
Fig. 21-89 Contrôle binoculaire lors des vergences : théorie de Hering.
(D’après Cullen K.E. et Van Horn M.R., 2011 [5].)
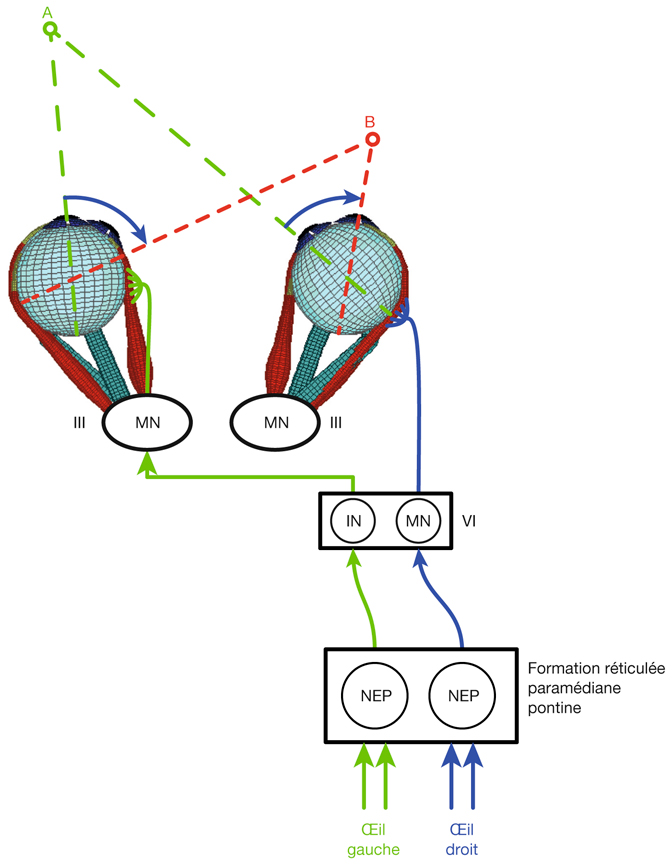
Fig. 21-90 Contrôle binoculaire lors des vergences : théorie de Helmholtz.
(D’après Cullen K.E. et Van Horn M.R., 2011 [5].)
Les motoneurones innervant le muscle droit médial jouent un rôle primordial dans la réalisation des mouvements de vergence. Trois contingents ont été distingués dans la sous-partie du noyau oculomoteur innervant le muscle droit médial. Parmi eux, le sous-groupe C se répartit dans la portion dorsomédiale et rostrale du noyau et innerve les fibres musculaires à contraction lente susceptibles d’être impliquées dans les mouvements de vergence. Les afférences du sous-groupe C proviennent en partie des commandes prémotrices des mouvements lents, en particulier du noyau vestibulaire. Cependant, la ségrégation entre voies oculomotrices conjuguée et disconjuguée n’est pas si claire : la plupart des motoneurones innervant les muscles impliqués dans les mouvements de vergence (principalement les muscles droits latéraux et médiaux) présentent également une activité neuronale dans les mouvements conjugués.
Les résultats de nombreux travaux plaident pour l’existence d’un centre supranucléaire vergentiel (théorie de Hering). Cette commande prémotrice pourrait se situer dans la formation réticulée mésencéphalique, juste en arrière des noyaux oculomoteurs (III). Trois différents types de neurones y ont été identifiés, dont la décharge est corrélée au mouvement de vergence :
les neurones de type « tonique » (dénommés également near-response neurons) : ils augmentent ou diminuent leur activité pendant les vergences symétriques, leur fréquence de décharge étant proportionnelle à l’angle de vergence. Ils sont directement connectés au sous-noyau du III destiné au droit médial. Leur activité apparaît plusieurs dizaines de millisecondes avant la réalisation du mouvement. Une minorité est spécifique des mouvements de divergence. L’activité de ces cellules est indépendante de la direction du regard conjugué ;
les neurones de type « burst » (phasiques) : leur décharge apparaît avant le mouvement et se poursuit pendant sa réalisation ; elle est directement corrélée à la vitesse de l’œil ;
les neurones « toniques-burst » : ils codent à la fois la vitesse et l’angle de vergence.
D’autres travaux ont montré que les neurones burst des saccades codent une information suffisante pour intégrer le mouvement de vergence lors de la réalisation de saccades disconjuguées (théorie de Helmholtz). Cependant, ces neurones restent silencieux lors des mouvements lents de vergence. Ces données électrophysiologiques ont amené à l’élaboration d’une hypothèse mixte, combinant les deux théories précédentes (fig. 21-91). Les mouvements rapides de vergence dépendraient directement des neurones burst des saccades, permettant d’aligner grossièrement les axes oculaires dans la direction d’intérêt. Les neurones toniques de la formation réticulée mésencéphalique coderaient les mouvements lents de vergence, permettant un ajustement fin des deux axes oculaires vers l’objet d’intérêt.
Cette commande prémotrice est en interaction avec d’autres structures du tronc cérébral. Les neurones du colliculus supérieur modulent leurs décharges pendant les saccades en fonction des mouvements de vergence associés. Une lésion de la partie rostrale du colliculus peut provoquer une paralysie de la vergence et de l’accommodation. Les neurones internucléaires relient les noyaux abducens et oculomoteurs par le faisceau longitudinal médian (FLM). Ils pourraient être porteurs d’un message inhibant la vergence. Le noyau réticulé du toit du pont (NRTP) possède des neurones dont l’activité est modulée par la vergence, mais qui déchargent également pendant la réalisation de saccades (NRTP caudal) et de poursuites (NRTP dorsal). Ce relais pontique pourrait jouer un rôle dans l’interaction entre les mouvements conjugués et disconjugués, avant de transmettre ces informations au cervelet.
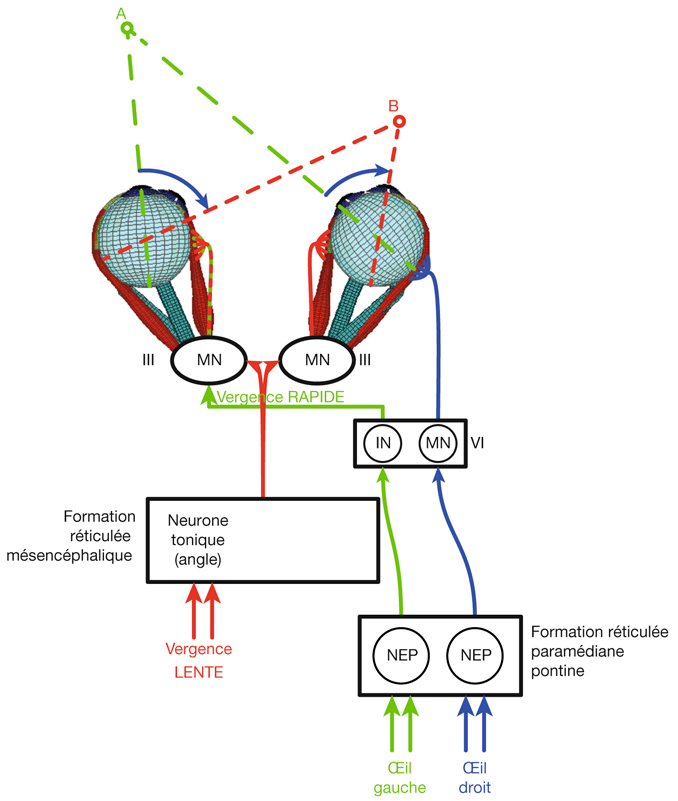
Fig. 21-91 Contrôle binoculaire lors des vergences : théorie mixte.
(D’après Cullen K.E. et Van Horn M.R., 2011 [5].)
Son implication dans la réalisation des mouvements de vergence a été initialement décrite lors des études chez le patient lésé. Une anomalie cérébelleuse provoque (entre autres) une faiblesse de la convergence, voire une paralysie aiguë de la vergence. Le flocculus possède des neurones dont l’activité est modulée par l’angle de vergence. Ces neurones pourraient jouer un rôle dans l’adaptation du réflexe vestibulo-oculaire en fonction de la distance de l’image en mouvement. D’autres structures, comme le noyau fastigial et le vermis dorsal, présentent des connexions réciproques avec les centres de commande prémotrice du mésencéphale.
Comme pour les autres circuits oculomoteurs, les aires les plus postérieures semblent impliquées dans les processus réflexes du mouvement, alors que les aires plus frontales participent probablement aux actions volontaires et conscientes.
Quelques neurones du cortex visuel primaire répondent aux stimulus de disparité rétinienne, participant à l’estimation de la profondeur. D’autres répondent au flou rétinien. Les aires extra-striées V3A, MT et MST sont cependant plus impliquées dans la perception de la profondeur stéréoscopique. En particulier, les neurones de MST, en participant à l’analyse du flux optique, pourraient initier un mouvement de vergence secondaire au changement brutal de ce flux. L’aire intrapariétale latérale participe à l’extraction de la forme tridimensionnelle et probablement aux interactions saccades-vergence. Certains neurones du FEF présentent une activité lors des mouvements de vergence liés aux saccades ou à la poursuite sur différents plans de profondeur. Les neurones du SEF seraient plus impliqués dans les phénomènes prédictifs.
L’effort de focalisation vers un objet de près déclenche une cascade de réflexes syncinétiques provoquant simultanément une accommodation des deux yeux, une convergence des axes oculaires et un rétrécissement des diamètres des pupilles [10, 39, 52]. Cette syncinésie est dénommée « triade accommodative » ou « syncinésie de la vision de près ». Elle permet de maintenir nette l’image d’un objet se rapprochant : la convergence oriente les deux axes visuels, la déformation cristallinienne focalise l’image sur la rétine et le myosis augmente la profondeur de champ.
Le support neurologique de cette syncinésie provient des fibres parasympathiques du noyau d’Edinger-Westphal. Une partie de leur contingent est destinée au muscle constricteur de la pupille ou au muscle ciliaire. Une autre partie interagit avec les motoneurones des muscles extraoculaires. Cette réaction est neurologiquement couplée, c’est-à-dire que la stimulation accommodative ou vergentielle monoculaire provoque une réponse des deux yeux.
Les phénomènes accommodatifs sont déclenchés principalement par des stimulus visuels (fig. 21-92). Le flou rétinien induit par la défocalisation de l’image sur la rétine est le principal stimulus de l’accommodation, mais les aberrations sphériques et chromatiques interviennent également. L’accommodation est également déclenchée par la disparité rétinienne, essentiellement par le biais du mouvement provoqué de vergence. De même, la sensation de proximité provoque à la fois une accommodation et un mouvement de vergence.
Les réflexes accommodatifs et vergentiels peuvent tous les deux être décrits comme un système de contrôle en boucle fermé, c’est-à-dire que l’action réalisée est contrôlée par un feedback négatif : le flou rétinien provoque l’accommodation jusqu’à ce que l’image soit nette, la disparité rétinienne provoque un mouvement de vergence jusqu’à ce que les images soient superposables. Ces deux systèmes réflexes interagissent entre eux, le mouvement de vergence induisant une certaine quantité d’accommodation et inversement l’accommodation provoquant un mouvement vergentiel.
Une première relation syncinétique peut être étudiée entre la convergence induite par l’accommodation (AC, Accommodation-linked Convergence pour les anglophones, ou CA, convergence accommodative pour les francophones) et l’accommodation (A), exprimée par le rapport AC/A. Ce rapport correspond à la quantité de convergence (exprimée en dioptries prismatiques) induite par chaque dioptrie sphérique d’accommodation. Avec un rapport idéal d’environ 6, la quantité de vergence induite par l’accommodation permet en tout point la fixation binoculaire. En pratique, ce rapport est d’environ 3,5, ce qui implique qu’en vision de près l’orientation des axes visuels dépend également d’autres mécanismes, en particulier de la vergence fusionnelle.
Le rapport AC/A varie grandement d’un sujet à l’autre (fig. 21-93). Il peut apparaître anormalement élevé dans certaines formes de strabisme, provoquant une déviation angulaire plus importante en vision de près qu’en vision de loin (strabisme avec incomitance loin-près).
À l’inverse, il existe également une seconde relation syncinétique entre l’accommodation induite par la convergence (CA, Convergence-linked Accommodation pour les anglophones, ou AC, accommodation convergentielle pour les francophones) et la convergence (C). Le rapport CA/C exprime ainsi la quantité d’accommodation (en dioptries sphériques) induite par dioptrie prismatique de convergence. Ce rapport est compris en général entre 0,08 et 0,15 mais apparaît bien supérieur chez les sujets jeunes.
Le mouvement pupillaire déclenché par la syncinésie accommodation-convergence présente une cinétique très différente du myosis provoquée par une brusque illumination. Sa contraction comme sa relaxation apparaissent beaucoup plus toniques et lentes.
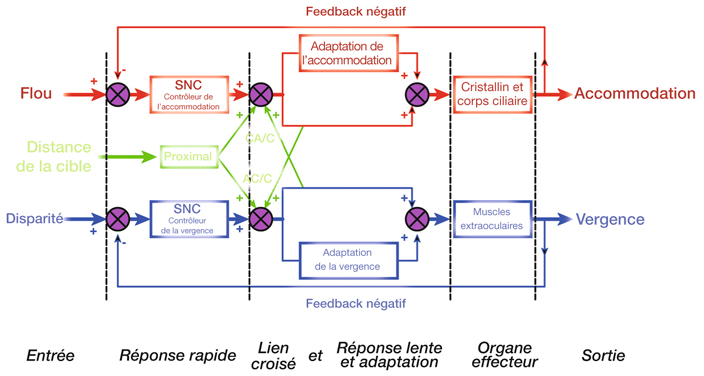
Fig. 21-92 Modélisation du contrôle de l’accommodation et de la convergence et de leurs interactions réciproques.
Les deux systèmes fonctionnent comme deux boucles fermées avec rétrocontrôle négatif. Deux relations syncinétiques (AC/A et CA/C) lient les deux circuits entre eux. La vergence proximale intervient également.
(Source : Roth A, Gomez A, Péchereau A., 2007 [39], redessiné d’après Brautaset R.L. et Jemmings J.A.M., 2004 [2], et Semmlow J.L. et Hung G.K., 1981 [42].)
Fig. 21-93 Schéma de Donders.
Relation entre accommodation et convergence pour une distance interpupillaire de 60 mm. L’angle métrique (a.m.), inverse d’une distance, s’exprime en dioptries et mesure l’angle de convergence en fonction de l’écart interpupillaire.
(D’après Lang J., 2003 [16].)
Pour maintenir une vision nette d’un objet, sa projection sur la rétine doit rester proche de la fovéa (elle ne doit pas dépasser les 0,5° centraux) et son mouvement sur notre rétine doit être le plus lent possible (au moins inférieur à 5° par seconde). Cependant, pour des raisons d’habituation des capteurs sensoriels de la rétine au stimulus d’intensité constante, l’absence de mouvement entraîne une atténuation de la transmission du signal et une dégradation de l’acuité visuelle (cf. infra).
Dans la vie quotidienne, ces perturbations de la fixation sont essentiellement secondaires aux mouvements de notre tête et le système vestibulaire permet de maintenir notre regard orienté dans une direction constante. Cependant, si nous fixons notre tête de manière expérimentale en la maintenant parfaitement immobile, il est toujours possible d’observer des micromouvements involontaires. Trois types principaux ont été décrits (fig. 21-94) :
le tremor : il s’agit d’un tremblement de haute fréquence (90 Hz à 150 Hz) et de faible amplitude (inférieure à 0,01°) ; plus petit mouvement de l’œil enregistrable, il n’est pas identique sur chaque œil et sa contribution au processus visuel est encore débattue ;
les dérives lentes (drift) : elles correspondent à des mouvements lents (moins de 30 minutes d’angle par seconde) et, le plus souvent, conjugués des deux yeux, d’amplitude faible (moins de 0,1°) ; cette dérive lente est majorée lorsque le sujet est placé dans l’obscurité ; un signal visuel est donc nécessaire pour maintenir le regard fixe ;
les microsaccades : mouvements rapides et conjugués, essentiellement observées chez les animaux fovéaux ; leur rôle principal serait de compenser les dérives lentes en recentrant le point de fixation sur la zone fovéolaire ; leur amplitude dépend donc de la somme des dérives précédentes, généralement inférieure à 15 minutes d’arc (mais pouvant atteindre 120 minutes d’arc) ; cette réponse a une latence très courte (70 ms) ; leur fréquence est beaucoup plus faible, de l’ordre de trois à quatre par seconde, et elles disparaissent sous l’effet de la volonté, en particulier lors des tâches nécessitant de hautes acuités visuelles.
Les microsaccades et les dérives lentes participent ensemble à éviter les phénomènes d’adaptation neuronale des photorécepteurs fovéolaires. Aucun de ces mouvements n’est consciemment perçu, probablement grâce à un mécanisme de suppression corticale de la perception du mouvement de l’image.
Outre la stabilisation de l’image sur la rétine, la fixation oculaire nécessite le maintien de l’alignement des deux axes oculaires dans la direction de la cible (fig. 21-95). La vision binoculaire requiert un alignement correct et constant des deux yeux. Il existe en permanence de petites erreurs de convergence (inférieure à 15 minutes d’arc). Elles correspondent à la « disparité de fixation », signal d’erreur qui permet le rétrocontrôle permanent de l’alignement des globes. Que ce soit en condition monoculaire ou binoculaire, le système de fixation oculaire n’a pas pour but de rendre les yeux immobiles. Paradoxalement, il contrôle et adapte le mouvement de l’image sur la rétine et l’alignement des globes à des niveaux optimums pour permettre la perception.
Quelles sont les bases neurales de la fixation oculaire ? Il est intéressant de considérer la fixation comme un cas particulier de poursuite oculaire, pendant lequel les vitesses de la cible et de l’œil sont égales à zéro. De cette manière, l’image de l’objet reste congruente avec la fovéa : le signal d’erreur rétinien reste nul, induisant un rétrocontrôle sensoriel qui maintient l’alignement de l’œil vers la cible. Une autre caractéristique commune des systèmes de poursuite et de fixation oculaire réside dans la possibilité d’inhiber les réflexes optocinétique, oculovestibulaire et les saccades réflexes. Un des arguments anatomiques en faveur de cette hypothèse est la proximité anatomique des neurones du FEF déchargeant dans les tâches de fixation et ceux de poursuite oculaire, tous situés dans sa partie inférolatérale.
Cependant, d’autres arguments plaident en faveur d’un système neural de fixation visuelle indépendant des autres systèmes, permettant de détecter des petits mouvements lents et involontaires de l’image (drifts) et de programmer des mouvements correctifs, tout en inhibant les autres mouvements réflexes. Ainsi, certains neurones pariétaux sont spécifiquement impliqués dans les tâches de fixation oculaire et ne déchargent pas lors de la poursuite. Le pôle rostral du colliculus supérieur semble impliquer dans les processus de fixation, inhibant les saccades d’amplitude large ; ses neurones environnants sont impliqués dans la genèse des microsaccades. Le rôle du colliculus supérieur semble donc important dans le contrôle des micromouvements, alors qu’il n’intervient pas dans le circuit de la poursuite oculaire. Enfin, la microstimulation de la plupart des aires impliquées dans la poursuite oculaire modifie quantitativement et qualitativement la poursuite oculaire, mais pas la fixation.
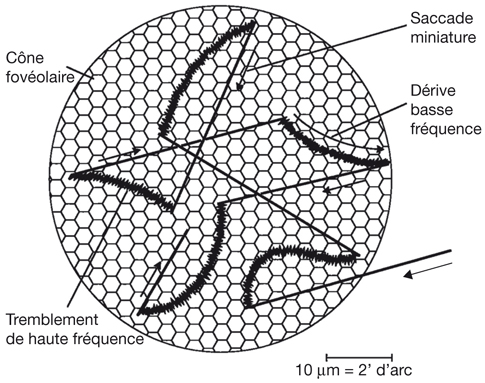
Fig. 21-94 Mouvements de l’image sur la rétine pendant la fixation oculaire. Un tremblement à haute fréquence est superposé à des dérives lentes (lignes courbées). Les microsaccades sont des mouvements linéaires rapides qui, en général, ramènent l’image au centre de la rétine.
(Source : Martinez-Conde S. et al., 2004 [27], d’après Pritchard R.M., 1960 [34].)
Fig. 21-95 Enregistrement des mouvements des deux yeux pendant la fixation en fonction du temps.
Le tracé avant la flèche correspond à la fixation d’un point lumineux dans l’obscurité. Après la flèche, le point lumineux disparaît et le sujet doit maintenir la fixation.
D, œil droit ; G, œil gauche ; H, mouvements horizontaux ; V, mouvements verticaux ; T, mouvements torsionnels.
(D’après Leigh R.J. et Zee D.S., 2006 [21].)
L’adaptation neuronale correspond à la perte progressive de la sensibilité d’un récepteur lorsque son stimulus est maintenu de manière constante (fig. 21-96 et 21-97). Les photorécepteurs de la rétine présentent une adaptation neuronale. Si l’illumination qu’ils reçoivent est constante, leur réponse diminue. Au contraire, une variation de la quantité de photon provoque une réponse intense.
La principale synapse de la couche plexiforme externe contient toujours trois éléments [37] :
la terminaison du photorécepteur ;
les dendrites d’une ou plusieurs cellules bipolaires ;
les dendrites (ou télodendrites) d’au moins deux cellules horizontales.
La liaison entre le photorécepteur et la cellule bipolaire constitue la voie principale de la transmission du message visuel. Lorsque le photorécepteur reçoit brutalement une certaine quantité de photons, l’isomérisation du pigment visuel entraîne une variation du potentiel de membrane. La quantité de glutamate relarguée dans la fente synaptique augmente, activant à la fois la cellule bipolaire et la cellule horizontale. Alors que la première propage le message lumineux vers les voies visuelles, la seconde effectue un rétrocontrôle inhibiteur sur le photorécepteur. Cette synapse joue donc le rôle de filtre. Elle permet de ne pas répondre en fonction de la quantité absolue de photons perçus par le photorécepteur, mais uniquement à des variations d’intensité. Un des avantages de cette organisation consiste à réduire l’influence du niveau générale de l’intensité lumineuse sur le système. Chez l’homme, la vision est relativement stable au cours de la journée, malgré une forte variation de la quantité de photons captés par l’œil. Un autre avantage réside dans l’épargne d’énergie provoquée : le champ récepteur n’émet pas en permanence un message vers le cortex visuel ; seule l’information pertinente est transmise (la variation d’intensité perçue).
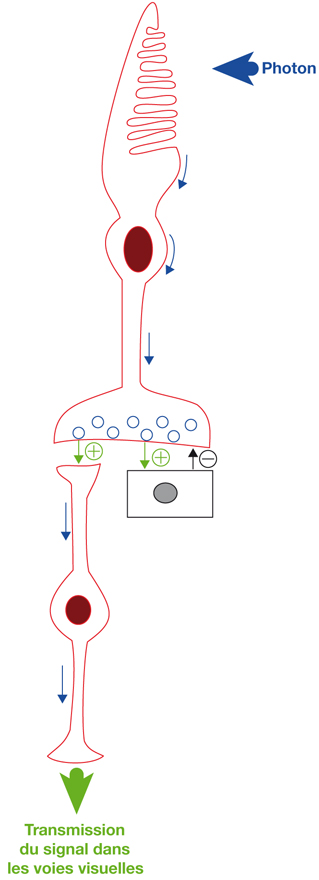
Fig. 21-96 Adaptation neuronale (exemple de la première synapse de la rétine).
Si cette organisation permet une économie dans le traitement de l’information, elle implique que la vision d’un œil immobile regardant une image immobile devrait s’éteindre. Ce phénomène peut être observé expérimentalement lorsque nous fixons attentivement une croix entourée d’un cercle de faible contraste (figure suivante). À mesure que nous maintenons notre fixation, le cercle tend à s’effacer, jusqu’à ne plus être visible. Dès que notre œil effectue un mouvement, il réapparaît. Ce phénomène est connu sous le nom d’effet Troxler. Initialement, les champs récepteurs de notre périphérie rétinienne permettent la perception du cercle. Alors que la fixation se prolonge, ces récepteurs reçoivent une quantité constante de stimulation lumineuse et finissent par ne plus transmettre de signal au cortex visuel.

Fig. 21-97 Effet Troxler.
Lors de cette expérience, à aucun moment la croix fixée en permanence ne disparaît. Pourquoi ce qui est vrai pour notre champ visuel périphérique n’est-il pas vrai pour notre vision centrale ? Nous avons vu que l’œil n’est jamais immobile pendant la fixation oculaire, y compris lorsque la tête est parfaitement stable. Afin d’étudier l’effet de ces micromouvements sur la perception visuelle, différentes expériences ont été proposées pour compenser le mouvement de l’œil en déplaçant l’image perçue dans la même direction, à la même vitesse et de la même amplitude. L’expérience la plus connue consiste à fixer sur la cornée une lentille ventouse à laquelle est fixée une image. L’image visualisée s’efface alors en quelques secondes. D’autres expériences contrôlant parfaitement le mouvement de l’œil suppriment l’image en moins de 100 ms. Le mouvement est donc indispensable à notre perception. En condition normale, ce mouvement est assuré par les perturbations de notre tête, imparfaitement compensée par notre système vestibulo-oculaire. Dès que notre tête reste fixe, le rôle des micromouvements est indispensable, particulièrement les microsaccades. Dans l’expérience de Troxler, l’amplitude des micromouvements est inférieure à la taille des champs récepteurs périphériques : leur signal est constant, l’image de l’anneau n’est plus perçue. En revanche, leur amplitude est supérieure à la taille des champs récepteurs centraux (fovéolaires) : la stimulation varie en permanence et l’image de la croix est perçue constamment.
Le mouvement de l’image sur la rétine est donc crucial pour maintenir une perception visuelle constante. Le rôle du système de fixation est ainsi paradoxal : amoindrir les grandes perturbations de nos capteurs visuels pour maintenir à peu près fixe l’image sur la rétine, tout en maintenant en permanence un mouvement pour prévenir l’adaptation neuronale de nos photorécepteurs.
L’étude de l’oculomotricité sépare un ensemble de mouvements selon des caractéristiques physiologiques et neurologiques. Cette distinction apparaît artificielle à certains, car ces mêmes mouvements ne s’observent que rarement en condition naturelle. En particulier, un mouvement lisse et pur de poursuite oculaire n’est pas très fréquent ; l’enregistrement précis révélera généralement un mouvement lent parasité par des petits mouvements rapides de rattrapage. La poursuite oculaire est-elle un mouvement physiologique ? Lorsqu’un cheval se déplace, il peut le faire plus ou moins rapidement. L’étude de son déplacement selon sa cadence permettra de distinguer le pas, le trot ou le galop. Pour chacun de ces systèmes, il sera alors possible de décrire des caractéristiques physiologiques et neuroanatomiques, séparant artificiellement ses différents modes de déplacement. Cependant nous savons parfaitement qu’un cheval qui se déplace sur une grande distance alternera le pas avec le trot ou le galop, en fonction des stimulus extérieurs (distance, terrain, motivation…). Son déplacement n’est jamais le fruit d’un système, mais d’une combinaison de systèmes. De manière identique, le déplacement des yeux en condition réel n’est jamais le fruit d’une unique sorte de mouvement oculaire. De même qu’une poursuite pure n’est que rarement observée, une saccade est quasi toujours combinée à un mouvement de vergence. Les réseaux corticaux sont totalement entremêlés et le regard devient le produit des interactions permanentes entre eux. Aucun des mouvements purs n’est réellement physiologique ou tous le sont de manière identique. Gardons cela à l’idée quand nous réalisons nos examens cliniques et gardons-nous de retrouver une pathologie dissociée des saccades ou de la poursuite ; sauf exceptionnelle lésion focale sur une sous-partie de notre système oculomoteur, saccade et poursuite sont liées [40].
Nous avons vu précédemment les relations entre les réseaux neuronaux des saccades et des vergences. La théorie de Hering plaide pour deux systèmes indépendants se combinant au niveau de la voie finale commune. La théorie de Helmholtz repose sur une combinaison des deux systèmes en amont, avec une séparation des afférences adressées à chacun des deux yeux. Les modèles actuels proposent désormais une solution mixte, combinaison des théories de Helmholtz pour les vergences rapides et de Hering pour les vergences lentes. Le centre supranucléaire de la vergence, situé dans la formation réticulée mésencéphalique, contient une population hétérogène de neurones : certains répondent préférentiellement aux stimulus de vergence, d’autre aux stimulus accommodatifs, d’autres enfin à une combinaison d’informations accommodatives et vergentielles. Ces neurones projettent à la fois leurs efférences vers le sous-noyau du III destiné au muscle droit médial, mais également vers le noyau d’Edinger-Westphal. L’origine neuronale de la syncinésie de la vision de près réside ainsi probablement dans cette structure mésencéphalique. Les neurones omnipauses situés dans le noyau interpositus du raphé pourraient inhiber à la fois les neurones phasiques (burst) des systèmes saccadiques et vergentiels. La levée brutale de leur inhibition lors d’une saccade disconjuguée pourrait faciliter à la fois le mouvement rapide des deux yeux vers la cible (combinaison de saccade et de vergence), mais également synchroniser l’accommodation nécessaire pour maintenir une vision nette de près [40].
À partir du même stimulus, le système saccadique utilise un signal d’erreur de position, celui de la poursuite un signal d’erreur de vitesse. Les neurophysiologistes ont artificiellement subdivisé les mouvements oculaires pour mieux les comprendre. Les études comportementales ont toutefois montré que nous n’utilisons pas un seul type de mouvement pour déplacer notre regard, mais plutôt une combinaison permanente pour assurer le suivi oculaire [32]. Par exemple, si une cible passe à vitesse constante dans notre champ de vision, nous pouvons décider de la poursuivre. Le délai de réflexion de cette décision implique que nos yeux sont déjà en retard sur cette cible. Ils réaliseront initialement une saccade de rattrapage (catch-up saccade) avant de débuter un mouvement lisse de poursuite. Si notre attention est distraite, le gain de la poursuite oculaire ne sera pas parfait et nous réaliserons plutôt une série de catch-up saccades. Si, au contraire, notre attention est élevée et que la cible effectue plusieurs fois le même mouvement, nous anticiperons son départ par un mouvement lisse dénué de saccade. Cette coopération entre les différents systèmes peut également être observée lorsqu’une cible poursuivie est transitoirement cachée. Une ou plusieurs saccades sont alors réalisées pour maintenir la performance oculomotrice. L’amplitude de la saccade sera alors adaptée à la vitesse supposée de la cible et à la vitesse de déplacement du globe, estimée à partir de la copie du signal efférent qui commande le mouvement de l’œil. Le choix entre la réalisation d’une saccade ou d’une poursuite peut alors résulter d’un processus décisionnel dépendant de multiples facteurs, comme l’attention, la mémoire des déplacements antérieurs, la perception actuelle et sa probabilité de modification (fig. 21-98).
Au niveau cortical, on constate une superposition des réseaux corticaux intervenant dans différents types de mouvement oculaires, en particulier entre les réseaux de poursuite et de saccade. L’exemple le plus typique est le Frontal Eye Field (FEF), qui se situe dans la partie latérale du sillon précentral, recouvrant une partie des gyrus précentral, frontal moyen et frontal supérieur. Cette structure corticale est impliquée dans les saccades, la poursuite oculaire, la fixation et la vergence. Il existe une spécialisation anatomique au sein du FEF, différents sous-groupes de neurones intervenant dans les différents types de mouvements oculaires. D’autres structures frontales (SEF, cortex préfrontal dorsolatéral) ou pariétales (cortex pariétal postérieur) jouent à la fois un rôle dans les saccades et la poursuite oculaire. Cette superposition anatomique des réseaux est fondée sur des populations distinctes de neurones au sein de chaque sous-région. Au contraire, certains neurones de noyaux sous-corticaux (noyau dorsolatéral du pont), cérébelleux (vermis) sont à la fois impliqués dans la poursuite et les saccades. Les réseaux corticaux sont en réalité très interconnectés les uns aux autres, formant un système beaucoup plus intégré, créant des synergies entre les répertoires de mouvement. Son but est d’analyser les stimulus visuels pour générer la réponse oculomotrice la plus performante.
Fig. 21-98 Modèle des synergies entre saccade et poursuite, exemple des saccades de rattrapage (catch-up saccades).
Les influx rétiniens sont transformés en signaux d’erreur de vitesse et de position. En absence de signal rétinien, ces signaux sont estimés à partir de la copie efférente de la commande oculomotrice. Ces signaux sont adressés aux systèmes de poursuite et de saccade, qui les transforment en commandes motrices. Le mécanisme « gâchette » utilise ces informations pour décider si une saccade de rattrapage est nécessaire. La somme des ordres moteurs est alors adressée à la commande prémotrice.
(D’après Orban de Xivry J.-J. et Lefèvre P., 2007 [32].)
L’expérience décrite par Descartes dans le Traité de l’homme (1644) [6] mettait déjà en exergue l’importance de connaître la position du globe oculaire dans l’orbite pour analyser les informations rétiniennes. Cette expérience peut être reproduite aisément en fermant un œil et en manipulant passivement l’autre avec un doigt : la mobilisation passive du globe provoque une sensation de déplacement de l’univers. Le même mouvement oculaire effectué de manière active ne provoque pas la même sensation, la perception de notre univers restant stable malgré le changement d’informations rétiniennes (fig. 21-99). La force de cette combinaison est ainsi de pouvoir coder l’espace qui nous entoure dans un référentiel stable malgré le changement incessant des références visuelles dues aux mouvements des yeux. Comme nous l’avons vu (cf. supra, « Concept de référentiel spatial »), notre place dans l’environnement est la somme des informations visuelles et des informations sur la direction de notre regard. L’origine des signaux permettant d’identifier la position des globes oculaires dans l’orbite est un sujet de controverse, séparant deux principaux courants : l’origine proprioceptive et la décharge corollaire.
À partir du modèle issu des travaux de Sherrington [45], les informations proprioceptives issues de la contraction des muscles extraoculaires lors du mouvement du globe sont comparées aux informations sensorielles issues de la rétine pour créer au niveau du cerveau une perception égocentrique (fig. 21-100). Les fibres multi-innervées des muscles extraoculaires pourraient jouer un rôle proprioceptif (cf. infra, « Particularités des muscles extraoculaires »). Elles s’étendent sur toute la longueur du muscle et participent à la contraction tonique des muscles oculomoteurs. Elles sont couplées à des terminaisons palissadiques au niveau de la jonction musculo-tendineuse. Ce couplage pourrait représenter une forme immature d’organe tendineux de Golgi, qui fournirait un feedback proprioceptif au système nerveux central [3]. Plusieurs expériences physiologiques ont étudié l’influence de ces données proprioceptives dans la perception de notre environnement [7, 9]. Cependant, de nombreux travaux ont remis en cause le rôle des propriocepteurs des muscles extraoculaires, démontrant qu’ils n’étaient pas nécessaires à la stabilité perceptuelle [53].
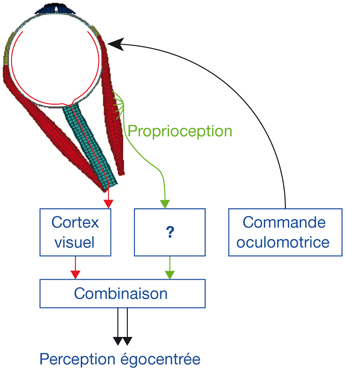
Fig. 21-100 Modèle de Sherrington : les informations proprioceptives permettent de connaître la position du globe dans l’orbite.
Dans le modèle de von Helmholtz, une copie de la commande neuronale envoyée aux muscles extraoculaires est dérivée vers un « comparateur cérébrale », qui intègre ce signal aux informations visuelles pour créer une perception de la direction du regard. Cette copie neuronale est appelée « décharge corollaire » (fig. 21-101).
De nombreuses données scientifiques existent sur l’étude de la décharge corollaire. Dans une série d’articles publiés ces dernières années, Sommer et Wurtz [47] étudient l’influence de la décharge corollaire sur les mouvements oculomoteurs du singe. Pour cela, ils utilisent une tâche préprogrammée dite « double-step » (fig. 21-102) : initialement, le singe regarde un point de fixation, qui disparaît alors qu’une première cible apparaît en périphérie ; alors que le singe a programmé une première saccade vers cette cible, celle-ci disparaît et une seconde cible apparaît verticalement ; l’animal devra effectuer alors une seconde saccade vers la seconde cible ; pour que cette seconde saccade soit exacte, le singe doit avoir intégré le mouvement réalisé par l’œil lors de la première saccade. Si la décharge corollaire est intacte, la première saccade sera horizontale et la seconde verticale. Si la décharge corollaire n’est pas prise en compte, la première saccade sera horizontale mais la seconde sera oblique, le cerveau n’ayant pas intégré le mouvement réalisé par l’œil et se comportant comme s’il fixait toujours le point de fixation initiale. Cette décharge corollaire transite du colliculus supérieur vers une structure frontale (le FEF, Frontal Eye Field) en réalisant un relais au niveau du thalamus médiodorsal. Par des stimulations orthodromiques et antidromiques, les auteurs ont identifié les neurones thalamiques supportant le relais de la décharge corollaire. Ils ont ensuite enregistré les mouvements oculaires lors de cette tâche « double-step », avant puis après inactivation des neurones thalamiques par une injection de muscimol. En interrompant les neurones thalamiques, la position finale de la seconde saccade a ainsi été statistiquement déportée, ce qui confirme le rôle indispensable de la décharge corollaire pour créer une stabilité perceptuelle. En reproduisant une expérience similaire chez des patients victimes d’accident vasculaire au niveau du thalamus médiodorsal, Bellembaum et al. ont confirmé les hypothèses de Wurtz chez l’homme [1].
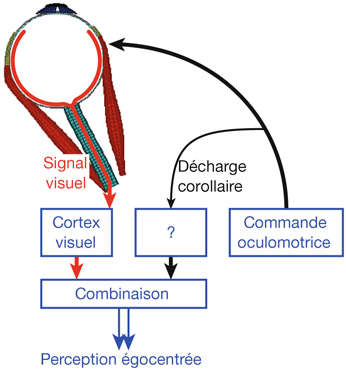
Fig. 21-101 Modèle de Helmholtz : la décharge corollaire, copie efférente de la commande oculomotrice, permet de déduire la position du globe dans l’orbite.
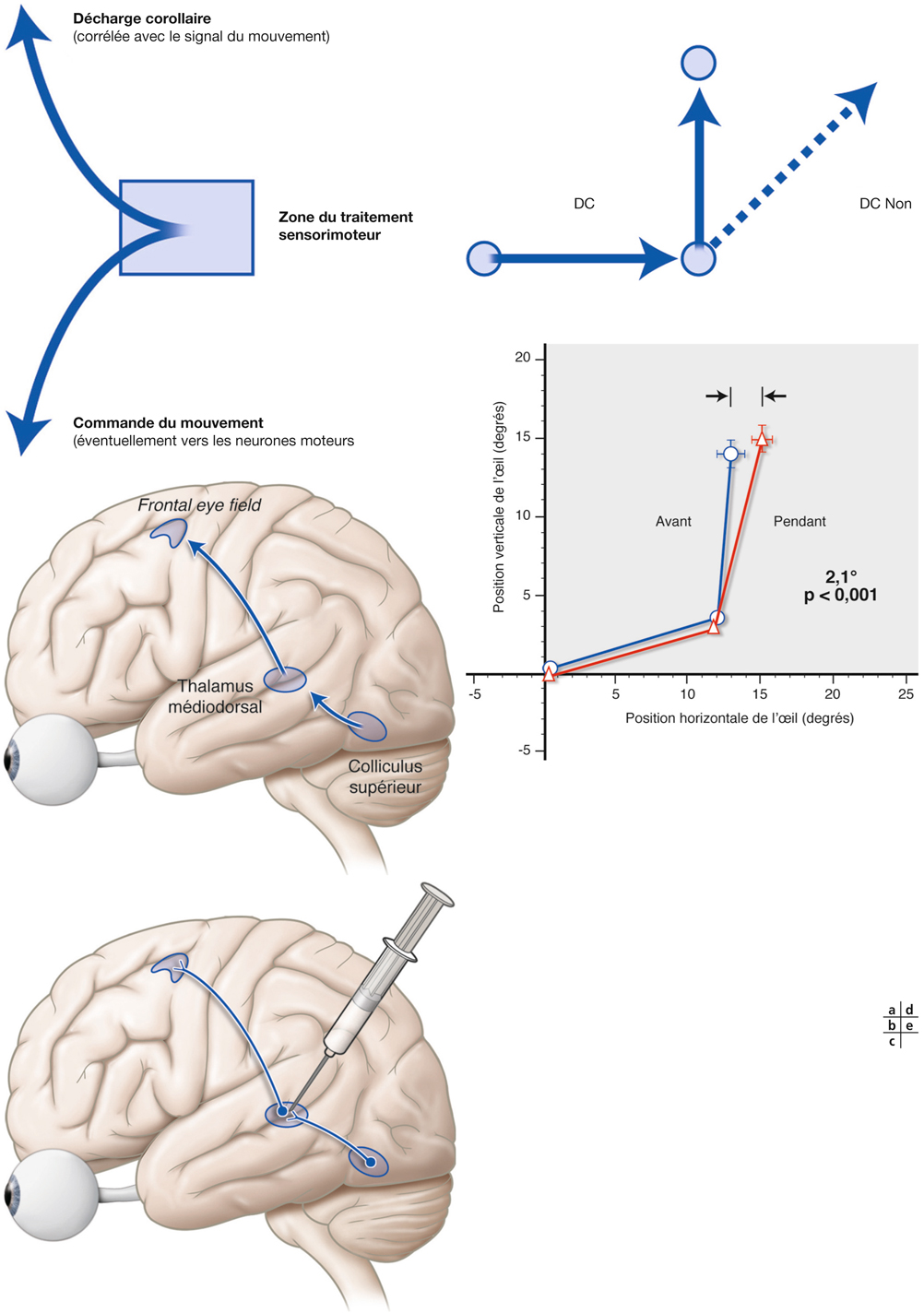
Fig. 21-102 Expérience de Sommer et Wurtz, rôle de la décharge corollaire.
a, b. La décharge corollaire provient de la même origine que la commande oculomotrice (a). La décharge corollaire étudiée dans l’expérience transite du colliculus supérieur vers le FEF en passant par le thalamus médiodorsal (b).
c, d, e. La décharge corollaire provenant du colliculus supérieur est nécessaire pour guider les mouvements rapides séquentiels : inactivation du trajet de la décharge corollaire par injection de muscimol dans le thalamus médiodorsal (c) ; la tâche « double-step » a besoin de la décharge corollaire pour maintenir sa performance (d) ; en absence de décharge corollaire, la seconde saccade sera oblique. Enregistrement du mouvement de l’œil avant et après inactivation de la décharge corollaire (e) : il existe un décalage de la seconde saccade.
(D’après Sommer M.A., Wurtz R.H., 2008 [47].)
Dans son ouvrage Physiopathologie clinique de l’équilibre oculomoteur [35], le Professeur Quéré a étudié les mouvements de l’œil amblyope. En comparant les mouvements de poursuite ou de saccades en condition binoculaire ou monoculaire, aucune différence n’apparaissait chez le sujet normal. La même expérience répétée chez des sujets présentant un trouble visuel unilatéral acquis (comme une atteinte maculaire ou une névrite optique) ou un trouble neurologique du champ visuel (comme une hémianopsie latérale homonyme) aboutissait à un résultat équivalent. Au contraire, l’enregistrement des mouvements oculaires en cas d’amblyopie strabique était fortement altéré en condition monoculaire (avec œil amblyope fixant). Cette différence n’était pas observée en cas d’amblyopie anisométropique pure. Le Professeur Quéré concluait « que l’amblyopie par inhibition bouleverse de telle façon l’organisation spatiale perceptive qu’elle pervertit l’induction motrice ». Selon cette théorie, le mouvement anarchique présenté par l’œil amblyope ne résulte pas uniquement d’un déficit visuel, mais d’une désorganisation plus profonde qui altère les informations motrices transmises.
De façon surprenante, très peu de travaux ont été menés depuis pour explorer l’oculomotricité de l’œil amblyope. Maxwell et al. comparent le mouvement des deux yeux en cas d’amblyopie unilatérale [28]. En condition binoculaire, la plupart des saccades ne sont pas totalement conjuguées en cas d’amblyopie strabique. Les deux yeux présentent une différence d’amplitude, en général inférieure à 10 %. Cette étude souligne l’importance du contrôle binoculaire pour l’ajustement exact du mouvement. Des résultats contradictoires ont été présentés pour comprendre le rôle joué par la profondeur de l’amblyopie dans la dégradation de la performance oculomotrice. Dans une première étude, les auteurs [29] ont d’abord comparé la précision des saccades effectuées en condition monoculaire chez des sujets normaux (dont la vision est artificiellement brouillée par une lentille de contact) et chez des sujets avec une amblyopie anisométropique (dont le niveau d’acuité visuel est comparable). Ces derniers présentent des cinétiques différentes, incluant une latence allongée et des accélérations moins importantes. Le niveau d’acuité visuelle n’explique pas par lui-même l’anomalie du mouvement. Dans une seconde étude [31], ils ont comparé l’enregistrement des saccades chez des sujets présentant un strabisme avec ou sans amblyopie par rapport à des sujets normaux. En condition binoculaire, la latence est meilleure dans le groupe normal par rapport aux deux groupes strabiques ; les latences sont allongées de manière similaire en cas de strabisme, quel que soit le degré d’amblyopie. En condition monoculaire, la latence est significativement augmentée chez le sujet qui utilise son œil amblyope, particulièrement pour les amblyopies profondes. Il existe par ailleurs une diminution de la précision chez les sujets qui utilisent leur œil amblyope, essentiellement en cas d’amblyopie moyenne ou profonde. Cette étude montre que les performances oculomotrices du patient strabique sont légèrement perturbées, même en condition binoculaire. En condition monoculaire, la motricité de l’œil amblyope est d’autant plus perturbée que l’amblyopie est profonde.
Un déficit de sélection attentionnel a été retrouvé chez les patients amblyopes, qu’ils utilisent l’œil atteint ou l’œil controlatéral [41]. Cette étude d’imagerie fonctionnelle retrouve une activation moindre en cas d’amblyopie (même avec une vision normalisée) dans différentes aires corticales, en particulier MT, sillon intrapariétal et FEF. Ces trois aires interviennent dans le contrôle des principaux mouvements oculomoteurs, comme dans le contrôle de l’attention visuospatiale. Si la désorganisation des aires visuelles en cas d’amblyopie est connue depuis les travaux de Hubel et Wiesel, sa répercussion sur les contrôles oculomoteur et attentionnel commence à être appréhendée. Les enfants amblyopes présentent de moins bonnes performances motrices pour saisir un objet par rapport à des sujets contrôles [48]. Cette augmentation de la maladresse persiste en condition monoculaire, y compris lorsque le sujet amblyope utilise son œil sain. La planification motrice semble perturbée, particulièrement en cas d’amblyopie sévère [30].
L’ensemble de ces travaux confirme partiellement l’hypothèse du Professeur Quéré : bien au-delà des conséquences visuelles, l’amblyopie provoque un développement différent du contrôle oculomoteur et des processus d’attention visuospatiale.
[1] Bellebaum C, Daum I, Koch B, Schwarz M, Hoffmann KP. The role of the human thalamus in processing corollary discharge. Brain, 2005 ; 128 : 1139-1154.
[2] Brautaset RL, Jemmings JAM. Trans 28th Meeting ESA. Taylor & Francis, 2004 : 115-120.
[3] Büttner-Ennerver JA. Anatomy of the oculomotor system. In : Straube A, Büttner U (eds). Neuro-Ophthalmology. Dev Ophthalmol. Vol. 40. Basel, Karger, 2007 : 1-14.
[4] Catz N, Thier P. Neural control of saccadic eye movements. In : Straube A, Büttner U (eds). Neuro-Ophthalmology. Dev Ophthalmol. Vol. 40. Basel, Karger, 2007 : 52-75.
[5] Cullen KE, Van Horn MR. The neural control of fast vs. slow vergence eye movements. Eur J Neurosci, 2011 ; 33 : 2147-2154.
[6] Descartes R. Traité de l’homme, 1644.
[7] Donaldson IM. The functions of the proprioceptors of the eye muscles. Philos Trans R Soc Lond B Biol Sci, 2000 ; 355 : 1685-1754.
[8] Fetter M. Vestibulo-ocular reflex. In : Straube A, Buttner U (eds). Neuro-Ophthalmology. Dev Ophthalmol. Basel, Karger, 2007, vol. 40 : 35-51.
[9] Gauthier G-M, Nommay D, Vercher J-L. The role of ocular muscle proprioception in visual localization of targets. Science, 1990 ; 249 : 58-61.
[10] Glasser A. Accommodation. In : Adler’s Physiology of the eye. 11th edition. Elsevier Saunders, 2011.
[11] Hering E. Die Lehre vom binocularen sehen. Leipzig, Wilhelm Engelmann, 1968. Cité par King WM. Binocular coordination of eye movements: Hering’s law of equal innervation of uniocular control? Eur J Neurosci, 2011 ; 33 : 2139-2146.
[12] Hoffmann KP, Distler C, Ilg U. Callosal and superior temporal sulcus contributions to receptive field properties in the macaque monkey’s nucleus of the optic tract and dorsal terminal nucleus of the accessory optic tract. J Comp Neurol, 1992 ; 321 : 150-162.
[13] Ilg UJ, Thier P. The neural basis of smooth pursuit eye movements in the rhesus monkey brain. Brain Cogn, 2008 ; 68 : 229-240.
[14] Kowler E. Eye movements: the past 25 years. Vision Res, 2011 ; 51 : 1457-1483.
[15] Krauzlis RJ, Lisberger SG. A control systems model of smooth pursuit eye movements with realistic emergent properties. Neural Computation, 1989 ; 1 : 116-122.
[16] Lang J. Strabismus. Diagnostk, Schielformen, Therapie. Huber Hans, 2003.
[17] Lebranchu P, Bastin J, Pelegrini-Issac M, Lehericy S, Berthoz A, Orban GA. Retinotopic coding of extraretinal pursuit signals in early visual cortex. Cereb Cortex, 2010 ; 20 : 2172-2187.
[18] Lefetz J. Enregistrement des mouvements oculomoteurs du sujet sain par vidéo-oculographie. Thèse de doctorat en médecine. Nantes, 2011 : 109.
[19] Leigh RJ, Zee DS. The vestibular-optokinetic system. In : The neurology of the eye movements. 4th edition. Oxford Univeristy Press, 2006 : 20-107.
[20] Leigh RJ, Zee DS. The saccadic system. In : The neurology of the eye movements. 4th edition. Oxford Univeristy Press, 2006 : 108-187.
[21] Leigh RJ, Zee DS. Smooth pursuit and visual fixation. In : The neurology of the eye movements. 4th edition. Oxford Univeristy Press, 2006 : 187-240.
[22] Leigh RJ, Zee DS. Synthesis of the command for conjugate eye movements. In : The neurology of the eye movements. 4th edition. Oxford Univeristy Press, 2006 : 261-314.
[23] Leigh RJ, Zee DS. Vergence eye movements. In : The neurology of the eye movements. 4th edition. Oxford Univeristy Press, 2006 : 343-372.
[24] Lencer R, Trillenberg P. Neurophysiology and neuroanatomy of smooth pursuit in humans. Brain Cogn, 2008 ; 68 : 219-228.
[25] Lisberger SG, Morris EJ, Tychsen L. Visual motion processing and sensory-motor integration for smooth pursuit eye movements. Annu Rev Neurosci, 1987 ; 10 : 97-129.
[26] Maddox EC. Clinical use of prisms and decentering of lenses. Bristol, John Wright & Sons, 1893.
[27] Martinez-Conde S, Macknik SL, Hubel DH. The role of fixational eye movements in visual perception. Nat Rev Neurosci, 2004 ; 5 : 229-240.
[28] Maxwell GF, Lemij HG, Collewijn H. Conjugacy of saccades in deep amblyopia. Invest Ophthalmol Vis Sci, 1995 ; 36 : 2514-2522.
[29] Niechwiej-Szwedo E, Kennedy SA, Colpa L, Chandrakumar M, Goltz HC, Wong AM. Effects of induced monocular blur versus anisometropic amblyopia on saccades, reaching, and eye-hand coordination. Invest Ophthalmol Vis Sci, 2012 ; 53 : 4354-4362.
[30] Niechwiej-Szwedo E, Goltz HC, Chandrakumar M, Wong AM. The effect of sensory uncertainty due to amblyopia (lazy eye) on the planning and execution of visually-guided 3D reaching movements. PLoS One, 2012 ; 7 : e31075.
[31] Niechwiej-Szwedo E, Chandrakumar M, Goltz HC, Wong AM. Effects of strabismic amblyopia and strabismus without amblyopia on visuomotor behavior. I : Saccadic eye movements. Invest Ophthalmol Vis Sci, 2012 ; 53 : 7458-7468.
[32] Orban de Xivry J-J, Lefèvre P. Saccades and pursuit: two outcomes of a single sensorimotor process. J Physiol, 2007 ; 584 : 11-23.
[33] Péchereau A. Physiologie de l’oculomotricité. In : Strabologie. Espinasse-Berrod M-A. Paris, Elsevier, 2008 : 13-26.
[34] Pritchard RM. Stabilized images on the retina. Sci Am, 1961 ; 204 : 72-78.
[35] Quéré M-A. Physiopathologie clinique de l’équilibre oculomoteur. Paris, Masson, 1983.
[36] Robinson DA, Gordon JL, Gordon SE. A model of the smooth pursuit eye movement system. Biol Cybern, 1986 ; 55 : 43-57.
[37] Rodieck RW. La Vision. Bruxelles, De Boeck Université, 2003.
[38] Roth A, Gomez A, Péchereau A. La réfraction de l’œil : du diagnostic à l’équipement optique. Paris, Elsevier Masson, 2007.
[39] Roth A. Accommodation. In : Roth A, Gomez A, Péchereau A. La réfraction de l’œil : du diagnostic à l’équipement optique. Paris, Elsevier Masson, 2007.
[40] Schor CM. Neural control of eye movements. In : Adler’s Physiology of the eye. 11th edition. Elsevier Saunders, 2011 : 220-242.
[41] Secen J, Culham J, Ho C, Giaschi D. Neural correlates of the multiple-object tracking deficit in amblyopia. Vision Res, 2011 ; 51 : 2517-2527.
[42] Semmlow JL, Hung GK. Doc Ophthalmol, 1981 ; 51 : 209-224.
[43] Sherrington CS. Experimental note on two movements of the eyes. J Physiol (Lond), 1894, 17 : 27. Cité par : Von Noorden GK, Campos EC. Binocular vision and ocular motility. 6th edition. St Louis, Mosby, 2002 : 52-84.
[44] Sherrington CS. The integrative action of the nervous system. New Haven, Yale University Press, 1906. Cité par Burke RE. Sir Charles Sherrington’s The integrative action of the nervous system: a centenary appreciation. Brain, 2007 ; 130 : 887-894.
[45] Sherrington CS. Observations on the sensual role of the proprioceptive nerve-supply of the extrinsic ocular muscles? Brain, 1918 ; 41 : 332-343.
[46] Skuta GL, Cantor LB, Weiss J-S. Système visuel efférent (voies de l’oculomotricité), anatomie neuro-ophtalmologique. In : Basic and Clinical Science Course. Section 5 : Neuro-ophthalmology. 2010. American Academy of Ophthalmology. Traduit sous l’égide de la Société Française d’Opthalmologie. Paris, Elsevier Masson, 2012 : 37-50.
[47] Sommer MA, Wurtz RH. Visual perception and corollary discharge. Perception, 2008 ; 37 : 408-418.
[48] Suttle CM, Melmoth DR, Finlay AL, Sloper JJ, Grant S. Eye-hand coordination skills in children with and without amblyopia. Invest Ophthalmol Vis Sci, 2011 ; 52 : 1851-1864.
[49] Thorn F, Gwiazda J, Cruz AA, Bauer JA, Held R. The development of eye alignment, convergence, and sensory binocularity in young infants. Invest Ophthalmol Vis Sci, 1994 ; 35 : 544-553.
[50] Vibert N, De Waele C, Serafin M, Babalian A, Mühlethaler M, Vidal P-P. The vestibular system as a model of sensorimotor transformations. A combined in vivo and in vitro approach to study the cellular mechanisms of gaze and posture stabilization in mammals. Prog Neurobiol, 1997 ; 51 : 243-286.
[51] Von Noorden GK, Campos EC. Physiology of the ocular movements. In : Binocular vision and ocular motility. 6th edition. St Louis, Mosby, 2002 : 52-84.
[52] Von Noorden GK, Campos EC The near vision complex. In : Binocular vision and ocular motility. 6th edition. St Louis, Mosby, 2002 : 85-100.
[53] Wurtz RH. Neuronal mechanisms of visual stability. Vision Res, 2008 ; 48 : 2070-2089.
[54] Wyatt HJ, Pola J. Smooth eye movements with step-ramp stimuli: the influence of attention and stimulus extent. Vision Res, 1987 ; 27 : 1565-1580.
P. Lebranchu, A. Péchereau
Comme les autres muscles striés, les muscles oculomoteurs [13, 26] se composent d’une multitude de myofibrilles parallèles, chacune composée de filaments fins d’actine et de filaments épais de myosine. C’est justement cette alternance de bandes fines et épaisses qui donne un aspect strié au muscle. Le sarcomère correspond à l’unité de base d’une myofibrille, délimité par un matériel protéique (disque Z). Il existe au sein du sarcomère une organisation géométrique alternant régulièrement deux filaments d’actine (chacun relié à l’un des disques Z) avec un filament de myosine. Au repos, les interactions actine-myosine sont inhibées. La contraction musculaire correspond à un raccourcissement du sarcomère. Elle résulte en général de la libération de calcium dans le réticulum sarcoplasmique, modifiant la conformation de la troponine C et permettant la liaison entre les filaments d’actine et de myosine. Cela provoque alors un glissement des filaments d’actine sur les filaments de myosine, rapprochant les disques Z et aboutissant à la contraction de la myofibrille. Lorsqu’une fibre musculaire reçoit une stimulation supraliminaire, sa contraction est totale et maximale. Cela correspond à la loi de contraction du « tout ou rien », propre aux muscles squelettiques. La variation globale de la contraction du muscle n’est pas liée à une variation de la contraction de chaque myofibrille, mais plutôt au recrutement de plus ou moins de myofibrilles.
Les muscles oculomoteurs possèdent une structure bilaminaire : la partie la plus externe est dénommée couche orbitaire, la partie la plus interne (face au globe) couche globale (fig. 21-103). La couche orbitaire est composée de fibres de petit diamètre, riches en mitochondries et en apport vasculaire. Ses myofibrilles peuvent être mono-innervées ou multi-innervées. Elle s’insère sur la capsule de Tenon au niveau de l’anneau fibroélastique enserrant le muscle (cf. infra, « Poulies »). La couche globale contient des fibres d’un diamètre plus important, mono- ou multi-innervées. Elle traverse la capsule de Tenon pour atteindre l’insertion sclérale.
Fig. 21-103 Schématisation des muscles extraoculaires et de leurs rapports dans l’orbite.
(D’après Büttner-Enever J.A., 2007 [2].)
Plus de la moitié du muscle extraoculaire se compose de fibres mono-innervées. Chacune reçoit au niveau d’une terminaison « en plaque » un unique motoneurone dont le diamètre varie de 10 µm à 15 µm. Toutes répondent à la loi d’activation du « tout ou rien ». Elles présentent un temps de contraction rapide, inférieur à 10 ms. La quasi-totalité des muscles squelettiques sont composés uniquement de fibres mono-innervées.
Les fibres multi-innervées sont extrêmement rares chez les mammifères. Elles se retrouvent essentiellement chez les amphibiens, les reptiles et les poissons. Chez l’homme, elles ne sont observées que dans les muscles oculomoteurs, le muscle tympanique et, peut-être, les cordes vocales. Elles représentent 10 % à 30 % des fibres des muscles extraoculaires. Leur motoneurone est de petit diamètre (5 µm à 10 µm). Contrairement aux myofibrilles mono-innervées, chaque fibre est innervée en plusieurs endroits par des terminaisons nerveuses « en grappe », chacune générant une contraction locale qui ne se propage pas tout le long de la fibre. Leur contraction est plus lente mais plus prolongée, à un coût énergétique moindre en raison du cycle plus lent des liaisons actine-myosine. Si leur rôle n’est pas totalement élucidé, elles interviendraient lors des contractions toniques du muscle et dans le maintien permanent d’une tension basale. Elles pourraient également être impliquées dans le contrôle proprioceptif.
Un muscle oculomoteur reçoit entre mille et trois mille motoneurones, chacun innervant entre deux et vingt fibres musculaires : 50 % de fibres mono-innervées, 10 % à 30 % de fibres multi-innervées, le reste étant composé de fibres intermédiaires. Tous les types d’innervation sont identifiables dans chacune des couches musculaires, les fibres multi-innervées étant plus abondantes dans la couche orbitaire.
La jonction neuromusculaire des muscles extraoculaires présente certaines spécificités par rapport aux autres muscles squelettiques (fig. 21-104). La terminaison « en plaque » qui innerve chaque myofibrille est plus petite et rudimentaire. Les terminaisons « en grappe » qui innervent la myofibrille en plusieurs endroits ne s’observent pas dans les autres types de muscles. Le neuromédiateur utilisé est l’acétylcholine. L’arrivée du potentiel d’action au niveau de la partie terminale synaptique provoque l’ouverture de canaux calciques présynaptiques. La variation intracellulaire de la concentration calcique provoque l’exocytose des vésicules qui libèrent l’acétylcholine dans la fente synaptique. L’acétylcholine, en se fixant au récepteur postsynaptique, provoque une augmentation du potentiel de plaque et la contraction de la myofibrille.
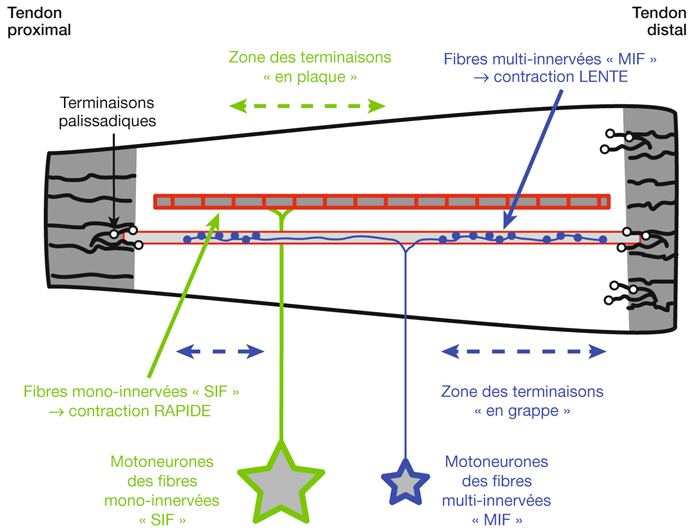
Fig. 21-104 Schéma d’innervation des muscles extraoculaires.
(D’après Büttner-Enever J.A., 2007 [2].)
La proprioception des muscles extraoculaires est encore un sujet de débat (cf. supra, « Physiologie des muscles extraoculaires : proprioception ou décharge corollaire ? »). Chaque couche musculaire possède ses propres récepteurs sensoriels : les fuseaux musculaires au niveau de la couche orbitaire et les terminaisons palissadiques au niveau de la couche globale. Les fuseaux musculaires n’ont été identifiés dans les muscles extraoculaires que chez l’homme et le singe. Ils se composent de deux types de myofibrilles entourés d’un manchon de tissu connectif, recevant à la fois une innervation sensorielle et motrice. Ils présentent une concentration très élevée dans la couche orbitaire (particulièrement à ses extrémités), mais sont totalement absents de la couche globale. Leur ultrastructure pourrait ne pas être fonctionnelle, mais certains leur prêtent un rôle de contrôle de la tension statique du muscle. Les terminaisons palissadiques ne sont présentes que dans la couche globale et sont spécifiques des muscles extraoculaires. Elles correspondent à une excroissance nerveuse pénétrant le tendon pour entrer en contact avec les fibres multi-innervées de la couche globale. Certains les identifient à des organes de Golgi immatures ; d’autres leur prêtent plus un rôle moteur que sensoriel.
Les muscles extraoculaires sont des muscles striés spécialisés, comportant certaines caractéristiques histologiques, anatomiques et fonctionnelles qui leur sont propres [13, 26]. Les muscles extraoculaires sont schématiquement organisés en deux couches distinctes tant sur le plan anatomique que fonctionnel : la couche orbitaire et la couche globale. Par rapport aux muscles squelettiques, le diamètre de leurs fibres musculaires est beaucoup plus fin, variant de 3 µm à 17 µm. Ils sont beaucoup plus innervés que la plupart des muscles squelettiques, présentant un ratio d’une fibre nerveuse pour deux à vingt fibres musculaires. Contrairement aux autres muscles squelettiques, certaines de leurs myofibrilles sont multi-innervées. Leurs récepteurs proprioceptifs sont extrêmement différents — leur rôle fonctionnel est encore débattu. Certaines de leurs fibres musculaires présentent une vitesse de contraction excessivement rapide (8 ms) par rapport aux autres muscles (40 ms à 100 ms). Leurs réponses électromyographiques sont de plus petite amplitude (20 µV à 150 µV contre 100 µV à 3 000 µV), de durée plus brève (1 ms à 2 ms contre 5 ms à 10 ms) et de fréquence beaucoup plus élevée (jusqu’à 150 cps contre 50 cps) [2]. Contrairement aux autres muscles squelettiques, les muscles extraoculaires présentent des vitesses de contraction extrêmement rapides et sont très résistants à la fatigue.
Les muscles oculomoteurs doivent répondre à deux fonctions :
une fonction phasique permettant de mobiliser rapidement le globe d’une position à une autre ;
une fonction tonique permettant de maintenir le globe dans cette position excentrée.
Nous avons vu qu’il existe différents types de motoneurones en fonction de leur fréquence de décharge. Certains possèdent une activité tonique pure, d’autres une activité phasique pure, d’autres une activité mixte. Les motoneurones phasiques sont silencieux avant le mouvement et deviennent actifs par un train d’unités motrices sur l’étendue complète du déplacement. Les motoneurones toniques sont actifs pendant les périodes de fixation et augmentent leur activité pendant le mouvement.
Nous avons également vu que chacune des couches des muscles extraoculaires possède des myofibrilles à contraction rapide (mono-innervée) ou lente (multi-innervée). Y a-t-il un support anatomique aux mouvements oculaires [14] : les fibres à contraction lente sont-elles dévolues aux mouvements de poursuite et de vergence, celles à contraction rapide aux saccades ? Cette hypothèse n’est pas validée par l’enregistrement cellulaire des motoneurones de la voie finale commune, qui sont impliqués de manière systématique dans les mouvements de poursuite, saccades et vergences. Les enregistrements des fibres rapides et lentes lors des mouvements oculaires ne confirment pas non plus cette dissociation. Les fibres rapides sont inactives durant la fixation en dehors du champ d’action du muscle. Leur activité augmente à mesure que le globe s’oriente dans le champ d’action maximal du muscle. Les fibres lentes sont actives même lorsque le globe n’est pas dans le champ d’action du muscle. Leur activation augmente de façon non linéaire à mesure que le sujet fixe dans le champ d’action du muscle. Les enregistrements sont superposables lors des mouvements oculaires lents. Lors des mouvements rapides, les deux types de fibres présentent d’emblée une activité maximale, qui va décroître de manière logarithmique dès que sera atteint le point d’équilibre. Ainsi, les deux types de fibres musculaires participent à tous les types de mouvements, les fibres mono-innervées principalement au mouvement du globe, les fibres multi-innervées principalement dans le maintien tonique de la contraction musculaire.
La capsule de Tenon correspond à un ensemble de tissus conjonctifs et musculaires enveloppant le globe oculaire. Sa partie la plus antérieure débute sous la conjonctive au niveau du limbe et s’étend jusqu’à l’insertion sclérale des muscles extraoculaires. Elle forme alors un manchon engainant le muscle sur une longueur variable (de 8 mm pour le droit inférieur à 20 mm pour le droit latéral), jusqu’au foramen. Le foramen correspond à une densification fibroélastique annulaire, séparant le muscle entre sa partie orbitaire et sa portion sclérale. Tous les muscles droits, le muscle oblique inférieur et le tendon réfléchi du muscle oblique supérieur sont enserrés d’un manchon conjonctival entre leur insertion sclérale et leur foramen. La capsule de Tenon forme également un anneau péribulbaire enserrant le globe, en reliant entre eux par un feuillet conjonctif chaque couple « foramen-manchon ». Cet anneau est lié fermement aux parois orbitaires, principalement par des expansions issues des foramens, assurant la suspension du globe au centre de l’orbite [5].
L’étude de la position d’un muscle droit lors du mouvement du globe révèle une immobilité de sa portion postérieure par rapport aux parois de l’orbite. Seule la partie antérieure, liée à la sclère, apparaît mobile. Pour expliquer la relative stabilité des corps musculaires malgré le mouvement du globe, Demer a formalisé le concept de poulie oculaire, structure fixe dans l’orbite qui permet de contraindre le trajet du muscle lors des rotations du globe. Les muscles droits s’étendent de leur origine anatomique orbitaire jusqu’au foramen, pénètrent cette structure de tissu conjonctivoténonien pour s’insérer sur le globe oculaire. Ce foramen anatomique correspond fonctionnellement à la poulie oculaire [5] (fig. 21-105 et 21-106). Il prend la forme d’un anneau, se localisant quelques millimètres en arrière de l’équateur du globe dans les fascias de la capsule de Tenon. Il est principalement composé de collagène, d’élastine et de muscle lisse [19] ; il apparaît richement innervé [6]. Cette poulie est suspendue à la paroi orbitaire par une bande formée de tissu conjonctif et musculaire lisse. Grâce à ces structures, le trajet musculaire reliant l’anneau de Zinn à la poulie est stable et constant quelle que soit la direction de l’œil, et seule la partie s’étendant de la poulie au globe est mobile. La localisation anatomique des poulies ténoniennes apparaît uniforme et reproductible entre les individus [3]. Le muscle oblique inférieur possède également une poulie ténonienne, solidaire de la poulie du droit inférieur. Leur position est ainsi interdépendante [8].
Chaque muscle extraoculaire est formé de deux couches musculaires (cf. supra) : la couche globale traverse la poulie pour s’insérer sur le globe, la couche orbitaire s’insère sur la poulie. La modélisation des forces musculaires sur le globe oculaire a montré que l’origine de la traction est déplacée de l’insertion anatomique au fond de l’orbite vers la poulie oculaire. Par opposition aux origines anatomiques, les poulies ténoniennes (comme la trochlée pour le muscle oblique supérieur) correspondent alors aux origines fonctionnelles des muscles extraoculaires. Ces poulies ne sont pas parfaitement fixes pendant la réalisation des mouvements oculaires. Une partie du muscle s’insère sur la poulie (couche orbitaire) et sa contraction provoque un léger recul de sa position. Cette modification de la position des poulies oculaires en fonction des mouvements du globe est à l’origine de l’hypothèse des poulies actives (fig. 21-107) [7, 8]. Alors que la couche globale du muscle provoque la rotation du globe, la couche orbitaire déplace l’insertion fonctionnelle du muscle. Le déplacement de la poulie est équivalent à celui réalisé par l’insertion sclérale. Ces modifications pourraient rendre la loi de Listing purement « mécanique », simplifiant ainsi le codage central des mouvements oculaires [10].
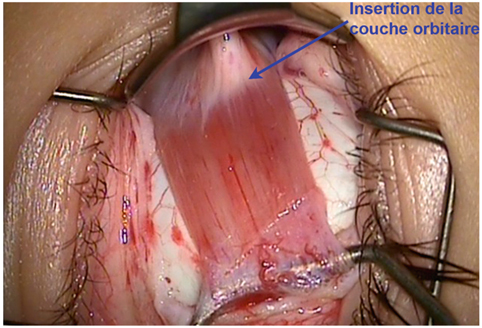
Fig. 21-105 Exposition chirurgicale de l’insertion du droit médial et de sa poulie.
Le globe oculaire a été placé en abduction grâce à un crochet passé sous le droit médial. Le tissu blanc brillant dans la partie nasale du droit médial sous l’écarteur forme la partie antérieure de la poulie et est rattaché à la surface orbitaire du muscle droit médial par des bandes fibreuses situées à environ 12 mm de l’insertion du droit médial quand l’œil est en abduction maximum.
(D’après Demer J.L. et al., 2000 [7].)
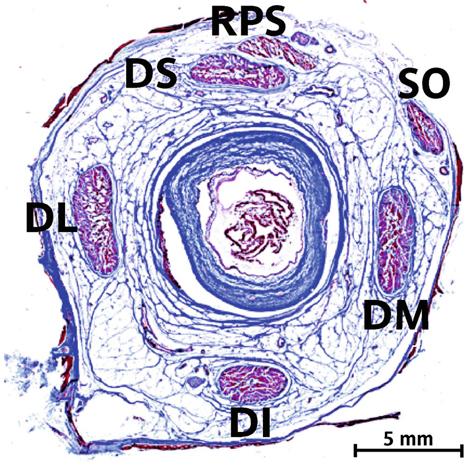
Fig. 21-106 Chez un enfant de 17 mois, microphotographie d’une coupe (basse définition) coronale (orbite moyenne à postérieure) en coloration trichrome de Masson où on distingue les couches de fibres orbitaire (plus violette en surface) et globale (plus rouge au centre et sur la surface globale). Le releveur de la paupière n’a pas de couche globale.
RPS, releveur de la paupière supérieur ; DS, droit supérieur ; SO, oblique supérieur ; DM, droit médial ; DL, droit latéral ; DI, droit inférieur.
(D’après Demer J.L. et al., 2000 [7].)
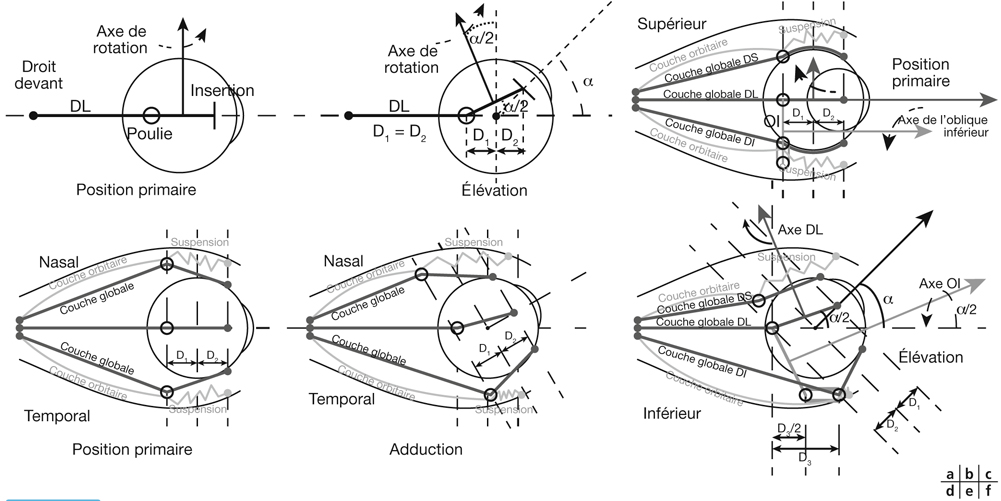
Fig. 21-107 Schéma du fonctionnement des muscles droits et de la poulie de l’oblique inférieur pendant un déplacement d’un demi-angle α en conformité avec la loi de Listing.
a. Vue latérale. Pour chaque muscle droit, l’axe de rotation est perpendiculaire au segment allant de la poulie à l’insertion sclérale. L’axe pour le droit latéral est vertical en position primaire. b. Vue latérale. En élévation d’un angle α, l’axe de rotation du droit latéral s’incline vers l’arrière d’un angle α/2 si la distance D1 (poulie-centre du globe) est égale à la distance D2 (centre du globe-insertion). c. Vue latérale. En position primaire, l’extrémité de l’oblique inférieur se situe dans le plan des poulies du droit latéral et du droit inférieur dans lesquelles s’insère la couche orbitaire de l’oblique inférieur OI. L’axe de rotation de l’oblique inférieur est parallèle à l’axe visuel en position primaire. d. Vue supérieure des muscles droits et des poulies en position primaire, correspondant à (a). e. vue supérieure. En adduction pour maintenir D1 = D2 dans un référentiel oculocentré, la poulie du droit médial doit se déplacer dans l’orbite vers l’arrière et la poulie du droit latéral vers l’avant. Ceci est mis en œuvre par des changements contractiles dans les couches orbitaires de ces muscles, en opposition aux suspensions élastiques des poulies. f. Vue latérale identique à (c). En élévation d’un angle α, la poulie du droit inférieur se déplace d’une distance D3, comme le demande la relation représentée en (e). La poulie de l’oblique inférieur se déplace vers l’avant de D3/2, en déplaçant l’axe de rotation de l’oblique inférieur vers le haut d’un angle α/2.
(D’après Demer J.L., 2004 [9].)
Pour étudier les mouvements de l’œil, un cadre de référence définissant les axes de rotation est nécessaire.
Le centre de rotation du globe n’est pas fixe. Il est dépendant de la position du globe dans l’orbite. Les mouvements non rotatoires (translationnels) liés à la rotation du globe forment un ensemble semi-circulaire de points appelé « centroïd » (fig. 21-108). Pour établir les coordonnées de référence, le globe peut être considéré comme tournant autour d’un point fixe situé à 13,5 mm en arrière de l’apex cornéen et à 1,6 mm du côté nasal par rapport au centre géométrique du globe [1, 17, 18]. Ces valeurs sont très faibles pour un système dynamique et on peut considérer que le centre de rotation du globe est fixe, ce que nous faisons en clinique.
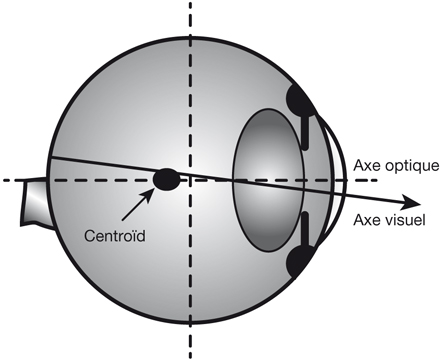
Fig. 21-108 Position du « centroïd ».
Les mouvements du globe sont décrits par un système de coordonnés avec trois axes perpendiculaires les uns aux autres et se croisant au centre de rotation (fig. 21-109). Ils ont été nommés par Fick les axes X, Y, et Z [1, 16-18] :
l’axe horizontal est l’axe des X ; la rotation autour de cet axe produit les mouvements verticaux :
« élévation » (supraduction) si le pôle antérieur s’élève ;
« abaissement » (infraduction) si le pôle antérieur s’abaisse ;
l’axe vertical est l’axe des Z ; la rotation autour de cet axe produit les mouvements horizontaux :
« adduction » si le pôle antérieur de l’œil tourne vers le nez (en dedans) ;
« abduction » si le pôle antérieur de l’œil tourne vers la tempe (en dehors) ;
l’axe antéropostérieur est l’axe des Y ; la rotation autour de cet axe produit les mouvements torsionnels :
« intorsion » si l’extrémité supérieure du méridien vertical de l’œil s’incline vers le nez ;
« extorsion » si l’extrémité supérieure du méridien vertical de l’œil s’incline vers la tempe.
Fig. 21-109 Les trois axes de Fick et les trois plans, dont le plan de Listing.
Ces trois axes perpendiculaires définissent trois plans (fig. 21-109) : les plans horizontal, vertical (sagittal) et frontal [1, 16-18]. Parmi ceux-ci, le plan de Listing (frontal), c’est-à-dire le plan défini par les axes horizontal et vertical, est tout particulièrement remarquable. Ce plan frontal correspond grossièrement au plan équatorial de l’œil en position primaire. Il était admis que ce plan était fixe dans l’orbite. Ce fait est remis en question par la théorie des poulies.
A. Péchereau
La position primaire des yeux est la position à partir de laquelle tous les autres mouvements oculaires sont initiés, ou la position du globe oculaire dans l’orbite à partir de laquelle tous mouvements de torsion, de rotation et de translation sont mesurés (fig. 21-110) [1, 18].
Cette position est essentielle car elle est le point zéro du système oculomoteur7. On peut proposer deux définitions classiques (parmi d’autres) :
« C’est la position quand les axes visuels (lignes du regard) des yeux sont parallèles, lorsque le sujet regarde un objet situé très loin, et perpendiculaire au plan frontal de la tête tenue droite. »
« C’est la position des yeux où les plans sagittal, frontal et horizontal des yeux sont parallèles aux mêmes trois plans de la tête quand ils passent par le centre de rotation des yeux. »
Cette position correspond à la position du sujet au garde-à-vous. Il est par ailleurs intéressant de noter que dans ces deux définitions la position primaire n’est pas définie en elle-même mais qu’elle est définie par rapport à un autre référentiel, le référentiel orbitaire.
Fig. 21-110 Positions primaire, secondaire et tertiaire.
a. Position primaire. b, c, d, e. Positions secondaires. f, g, h, i. Positions tertiaires.
Elle présente plusieurs caractéristiques :
la position primaire correspond très probablement à la position où la somme des innervations de tous les muscles extraoculaires est la moindre ;
il ne s’agit pas d’une position résultant des forces passives mécaniques mais bien d’une position active dont la base est neurologique (fig. 21-111) ;
cette position, quand elle est normale, permet une position équilibrée du centre de gravité du crâne par rapport aux articulations atlanto-occipitale et atlanto-axoïdienne.
Fig. 21-111 Diagramme des points de retour à zéro d’un œil après un mouvement latéral. Il n’y a pas de différence significative entre les deux conditions éclairées, mais il y a une différence significative entre les conditions éclairées et l’obscurité.
a. Mur blanc avec un point de fixation. b. Mur blanc. c. Obscurité.
(D’après Jampel R.S. et Shi D.X., 1992 [11].)
Nous ne soulignerons que deux aspects :
cette position peut être l’objet d’un processus pathologique qui la modifie et dont l’expression clinique est le torticolis ;
ce point d’équilibre peut varier au cours du temps et sous différentes influences (neurologique, mécaniques, etc.).
C’est une rotation uniquement autour de l’axe vertical ou de l’axe horizontal. Il n’y a aucune rotation du globe autour de l’axe Y. En conséquence, les positions secondaires n’entraînent pas de torsion.
Les positions obliques de regard sont dénommées positions tertiaires. Les positions tertiaires sont réalisées par une rotation simultanée autour des axes vertical et horizontal. C’est un mouvement qui peut être considéré comme étant effectué autour d’un axe oblique se situant dans le plan de Listing.
La force exercée par un muscle varie suivant la direction du regard. Elle est maximum dans le champ d’action et augmente au fur et à mesure du déplacement dans ce champ d’action. Elle diminue lorsque le mouvement l’éloigne de son champ d’action, passe par un minimum à environ un tiers dans le champ opposé à son champ d’action (fig. 21-112) [16]. À aucun moment elle est nulle.
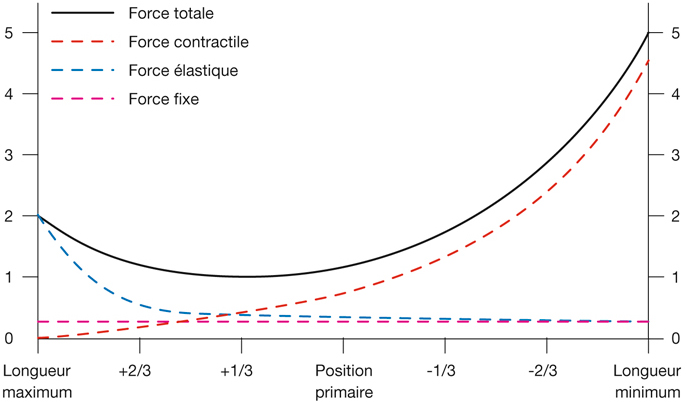
Fig. 21-112 Force d’un muscle oculomoteur en fonction de la position dans le champ d’action.
(D’après Oyster C.W., 1999 [16] et Péchereau A., 2009 [18].)
La force musculaire est formée de deux composantes [1, 16-18] :
la force active liée à l’innervation : elle est quasi exclusive dans le champ d’action ;
la force passive liée à l’étirement : elle augmente lorsque le muscle s’éloigne de son champ d’action ; elle est exclusive dans le champ d’action opposée au champ d’action du muscle (fig. 21-113).
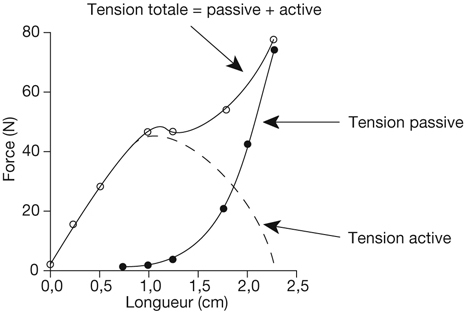
Fig. 21-113 Part des composantes passive et active dans la force d’un muscle en fonction de l’étirement.
(D’après Kayser Ch., 1969 [12].)
C’est l’équation générale des forces exercées par l’ensemble des structures extraoculaires sur le globe oculaire [22] :
FD.méd. + FD.lat. + FD.sup. + FD.inf. + FO.sup. + FO.inf. + FOrbite = 0
FTotal est toujours égale à zéro quelle que soit la direction du regard, sauf dans le mouvement.
La force exercée par un muscle sur le globe oculaire est déterminée par le vecteur allant du point d’origine fonctionnelle (en règle générale, la poulie) au point d’insertion fonctionnelle (la limite postérieure de l’arc de contact de ce muscle dans cette position). Différentes conséquences peuvent en être tirées :
la projection de chaque force musculaire sur les trois axes de Fick montre que chaque muscle exerce une force dont les caractéristiques sont uniques. Il est donc extrêmement difficile (voire impossible dans l’état actuel de nos moyens) d’apporter une force dont les qualités sont les mêmes en cas de déficit important (paralysie). Ce fait est bien démontré par le logiciel de simulation Orbit 1.8 [15] ;
le franchissement de l’un des plans (acte chirurgical) par l’insertion fonctionnelle va entraîner un changement de l’effet de ce muscle par rapport à l’un ou les deux axes de projection, ce qui modifie la force exercée suivant un ou deux axes de Fick. Cette situation peut se rencontrer dans toutes les chirurgies de l’oblique inférieur qui antéroposent l’insertion ou qui ne suturent pas le point postérieur ;
la projection de chaque force musculaire sur les trois axes de Fick n’est pas liée à la position et à la direction de l’insertion du muscle sur le globe.
De ce bref survol, nous pouvons retenir que la force d’un muscle n’est jamais nulle, que la somme des forces sur un globe oculaire est nulle sauf dans le mouvement et que les caractéristiques de la force d’un muscle sont uniques.
Certains effets mécaniques des poulies ont déjà été abordés (cf. supra, « Poulies », et [24)]. Nous allons aborder ici d’autres aspects sur le plan théorique. L’application de ces données à la clinique, tant sur le plan diagnostique que thérapeutique, reste à faire.
Tous les muscles oculomoteurs ont une partie en contact avec le globe oculaire, ou arc de contact (fig. 21-114). Cette partie est plus ou moins importante suivant que l’œil se situe plus ou moins dans le champ d’action du muscle [17, 18]. Plus le muscle se situe dans son champ d’action, plus l’arc de contact est court (il disparaît même pour le droit médial dans l’adduction extrême), et inversement. Cet arc de contact a une origine et une terminaison :
l’origine de l’arc de contact pour un muscle oculomoteur est :
pour les muscles droits, la limite postérieure de l’arc de contact ;
pour les muscles obliques, la limite antérieure de l’arc de contact ;
la terminaison de l’arc de contact pour un muscle oculomoteur est l’insertion du muscle dans la sclère.
Sur le plan mécanique, les conséquences sont les suivantes :
l’origine de l’arc de contact pour les six muscles oculomoteurs est l’insertion physiologique (fig. 21-115) ;
le point d’application de la force de chaque muscle est la limite postérieure de l’arc de contact ;
la présence d’un arc de contact assure que la totalité de la force musculaire est utilisée pour la rotation du globe ;
le point d’application et la direction de la force rotatoire de chaque muscle restent stables quel que soit le mouvement de l’œil puisque ce point est toujours sensiblement au même endroit (dans les coordonnées de l’orbite) : l’extrémité postérieure de l’arc de contact (c’est la longueur de cet arc de contact qui varie). En tout cas, ce point d’application est fixe pour tout mouvement dans le plan d’action du muscle.
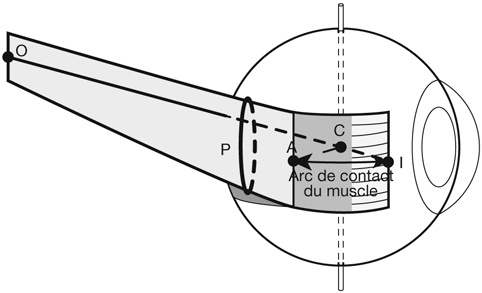
Fig. 21-114 Arc de contact d’un muscle.
O. Origine du muscle. C. Centre de rotation du globe. P. Poulie ténonienne. A. Origine (limite postérieure pour les droits, limite antérieure pour les obliques) de l’arc de contact. I. Terminaison (insertion du tendon musculaire dans la sclère) de l’arc de contact. L’arc de contact va de A à I.
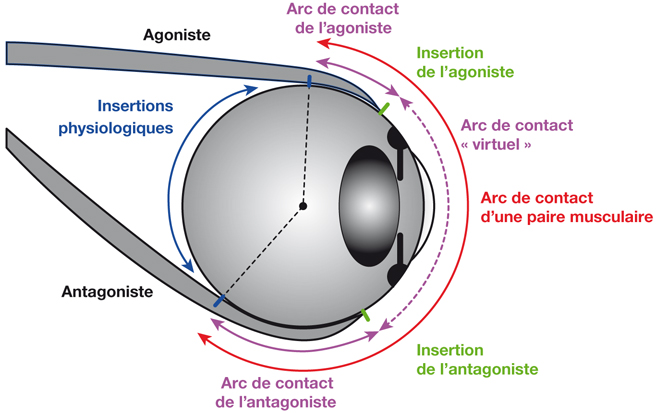
Fig. 21-115 Insertions anatomiques et physiologiques (fonctionnelles), arcs de contact des muscles et d’une paire musculaire.
Chaque muscle participe à une paire musculaire (agoniste-antagoniste). L’arc de contact d’une paire musculaire est la zone du globe allant de l’origine de l’arc de contact de l’agoniste à l’origine de l’arc de contact de l’antagoniste de la paire (limite postérieure de deux arcs de contact pour une paire de muscle droit). Cette zone comprend trois parties (fig. 21-115) :
deux zones réelles qui vont de l’origine à la terminaison de l’arc de contact de chaque muscle de la paire ;
une zone virtuelle qui relie les deux terminaisons des arcs de contact de la paire musculaire ;
pour tout mouvement dans le plan de la paire musculaire, la longueur et la position spatiale de l’arc de contact (l’arc de contact de la paire) sont des invariants dans le référentiel orbitaire. La position de l’insertion de chaque muscle de la paire (donc la longueur de l’arc de contact de chaque muscle) varie mais de façon inverse. Cela a pour conséquence une stabilité générale.
Ce concept est identique pour la paire des obliques. On peut considérer que chaque paire musculaire constitue une fronde dans laquelle le globe oculaire vient s’enchâsser.
La notion de poulie8 suppose un élément mobile tournant autour d’un axe (roue) et un lien. Cet ensemble va permettre de transmettre une force (un mouvement) ou de lui changer sa direction. On distingue les poulies fixes et les poulies mobiles. Nous ne parlerons que des premières.
Nous allons voir que certains éléments anatomiques correspondent bien à cette définition mais que d’autres (la trochlée et les poulies ténoniennes) correspondent plus au concept d’anneau que de poulies, du moins sous l’aspect que nous verrons.
À l’aune de cette définition et en dehors de la trochlée, on peut considérer qu’il existe trois types anatomiques de poulies regroupés en deux groupes : les poulies ténoniennes et les poulies oculaires.
C’est la poulie type que nous connaissons. Elle est formée par un anneau cartilagineux situé très en avant de l’orbite. Par son intermédiaire, la force du corps musculaire de l’oblique supérieur qui se dirige de l’avant vers l’arrière, change de direction. Lorsqu’elle s’applique au globe oculaire (fig. 21-116), elle tire de l’arrière vers l’avant (verticalité), du dehors en dedans (torsion).
Sur le plan sémantique et mécanique, comparer la trochlée à une poulie pose un problème de définition car une poulie suppose une partie mobile qui n’existe pas dans ce cas. Le terme d’anneau aurait été plus approprié.
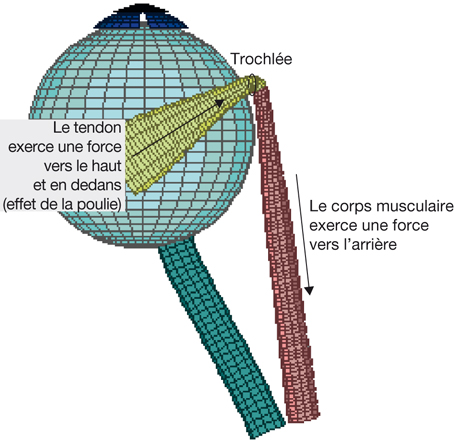
Fig. 21-116 Modification de la direction de la force de l’oblique supérieur sous l’effet de la poulie.
On devrait plutôt les appeler des anneaux ténoniens. Elles ont pour conséquence de fixer l’origine de la force, quels que soient les mouvements du globe oculaire. Elles reprennent le modèle de la trochlée. Elles sont faites d’un renforcement de la capsule de Tenon, d’éléments musculaires, de fascias et d’éléments suspenseurs (cf. supra, « Poulies », et [24]). Ces poulies (anneaux) sont l’origine fonctionnelle de la force musculaire. Elles sont relativement fixes dans l’orbite. Dans les mouvements oculaires et pour permettre le respect de la loi de Listing, elles se déplacent d’avant en arrière et inversement d’un angle égal au demi-angle de rotation, ce qui entraîne une relative stabilité.
Ces poulies (anneaux à l’origine des forces musculaires) sont à peu près fixes quels que soient les mouvements du globe. De ce fait, l’origine des forces musculaires est à peu près stable quelles que soient les rotations.
Chaque muscle participe à une poulie par l’intermédiaire d’une paire musculaire (trois poulies physiques). Comme cela existe de façon évidente pour la paire des obliques (« fronde des obliques ») (fig. 21-117), chaque paire musculaire forme avec le globe oculaire une poulie (fig. 21-118) :
le corps de la poulie est le globe oculaire ;
les parties libres des deux muscles d’une paire, la « corde » ;
la « corde » en contact avec la poulie est formée par l’arc de contact de la paire (deux parties réelles et une partie virtuelle, cf. supra).
Sur le plan mécanique, cela donne une très grande efficience à l’ensemble, assure une grande stabilité et donne une grande résistance de l’ensemble aux variations anatomiques.
Cet ensemble de « poulies » — la trochlée, cinq anneaux ténoniens (ou poulies ténoniennes) et trois poulies oculaires — a pour conséquence de stabiliser à la fois le point d’origine et le point d’application de la force de chaque muscle extraoculaire et ceci même pour des rotations importantes. Cela donne une très grande simplicité au fonctionnement du système oculomoteur et renforce l’hypothèse de Robinson sur l’oculomotricité [22].
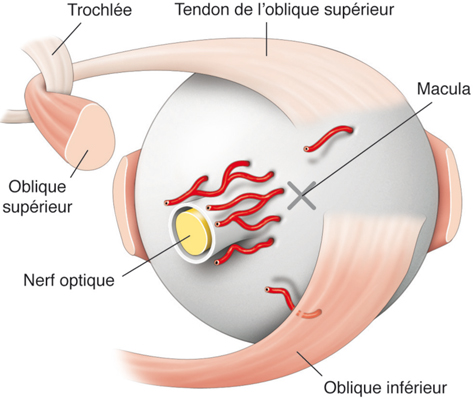
Fig. 21-117 Paire des obliques (« fronde »).
Fig. 21-118 Arcs de contact des muscles droits horizontaux sur un cliché IRM.
A. Péchereau
Un muscle exerce un vecteur Force sur le globe oculaire. La géométrie de ce vecteur Force est déterminée par l’origine fonctionnelle et l’insertion fonctionnelle (cf. supra, « De l’arc de contact aux poulies : conséquences mécaniques ») :
l’origine fonctionnelle n’est pas l’origine anatomique mais la poulie ténonienne du muscle ;
l’insertion fonctionnelle n’est pas l’insertion anatomique mais l’origine de l’arc de contact de ce muscle (cf. fig. 21-115).
C’est la projection de ce vecteur Force sur les trois axes de Fick qui va donner les actions primaire, secondaire et tertiaire d’un muscle. De ce fait, tous les muscles exercent trois actions : primaire, secondaire et tertiaire — par le fait que les vecteurs Force des muscles droit médial et droit latéral sont parfaitement situés dans le plan horizontal, leurs actions ne peuvent être qu’une rotation autour de l’axe vertical d’où les caractéristiques de leur action. Les différentes actions des muscles sont précisées dans le tableau 21-II. Cependant, celles-ci ont été déterminées par une méthode géométrique sans tenir compte de la force réellement exercée par le muscle et de la part de cette force dans le mouvement pris en référence. Par exemple, le tableau dit que l’oblique inférieur est élévateur, mais il ne nous dit pas qu’elle est la part de l’oblique inférieur dans l’élévation : s’il s’agit de 10 %, cela est anecdotique ; s’il s’agit de 70 %, cette information est essentielle. Nous y reviendrons (cf. infra, « Part de la force de chaque muscle dans les neuf positions du regard ») [1, 17, 18].
Enfin, il est important de noter que raisonner en termes de muscle isolé est un concept qui n’est pas exact en physiologie car tout muscle fait partie d’une paire et le concept de référence devrait être la paire. Le raisonnement par muscle n’a de valeur que sur le plan didactique.
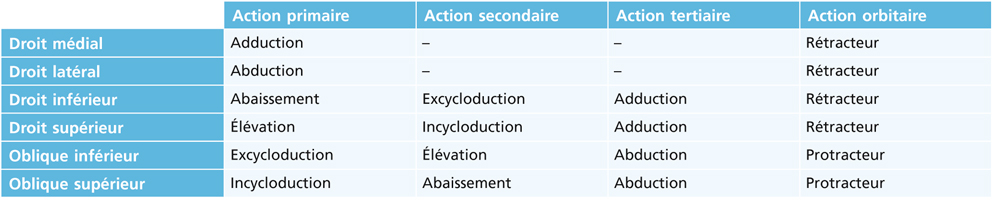
Tableau 21-II – Action des muscles oculomoteurs [1, 17, 18].
Les muscles supérieurs sont incyclotorseurs ; les muscles inférieurs excyclotorseurs.
Les muscles verticaux sont adducteurs ; les muscles obliques abducteurs.
C’est la situation oculomotrice où un muscle est sollicité pour une de ses fonctions à son maximum [1, 17, 18]. Ceci ne veut pas dire que cela est une situation oculomotrice où ce muscle agit de façon exclusive ou est le principal responsable du mouvement étudié.
Le schéma classique (cf. fig. 21-63) est donc toujours d’actualité. Cependant, ce schéma présente deux défauts majeurs mais qui correspondent bien à la clinique actuelle : il n’intègre ni la notion de paires musculaires ni la torsion, que nous avons beaucoup de mal à apprécier en clinique journalière.
La force développée par un muscle est complexe et nous nous sommes limités à la position primaire et à son voisinage. Il n’y a pas d’action musculaire isolée. Toute action d’un muscle doit être mise en perspective non seulement avec son antagoniste mais avec tous les autres muscles oculomoteurs.
A. Péchereau
Nous avons vu qu’elle était l’évolution spatiale d’un muscle extraoculaire en fonction de sa position dans son champ d’action (cf. supra, « Forces musculaires ») [1, 16, 18].
Nous avons déjà vu que chaque muscle a un antagoniste unilatéral, c’est-à-dire un muscle dont l’action est le contraire à son action (cf. « VI – Le contrôle du mouvement »).
L’évolution spatiale des forces d’une paire musculaire est synthétisée sur la figure 21-119. On peut voir sur ce graphique que la force exercée par chaque muscle suit une courbe parabolique, tandis que la résultante des forces est une droite [16, 18]. Là aussi, le résultat simplifie le contrôle oculomoteur.
Ceci nous indique bien que, dans une paire musculaire, l’autre muscle est un antagoniste parfait de l’agoniste et que les deux muscles d’une paire fonctionnent comme les rênes attachées à un mors (le globe oculaire).
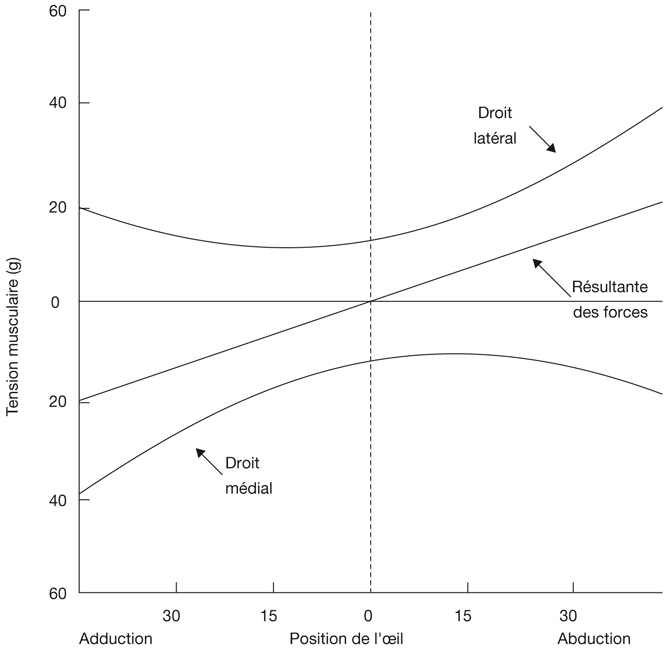
Fig. 21-119 Courbe représentant la force d’un droit médial (agoniste), d’un droit latéral (antagoniste) et la force résultante en fonction de la position de l’œil.
Trois paires de muscles peuvent être décrites (tableau 21-III). Elles constituent avec le globe oculaire une poulie. Elles représentent les trois unités fonctionnelles des forces exercées sur le globe oculaire.
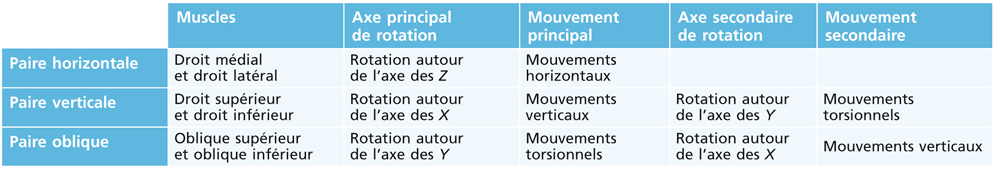
Tableau 21-III – Les paires musculaires et leur action.
Cette linéarité de la force développée par une paire musculaire est une excellente raison pour que la chirurgie unilatérale (recul d’un agoniste et résection de l’antagoniste) soit le protocole de base de tout acte chirurgical. Le geste doit être équilibré sur les deux muscles : résection égale au recul à moduler suivant les données cliniques et per-opératoires.
Grâce à la modélisation théorique de Robinson [22], aux travaux expérimentaux de Collins [4] sur le sujet normal et à la création par Miller [15] de Orbit 1.8, logiciel de modélisation des mouvements oculaire, les forces développées par chaque muscle dans toutes les directions du regard peuvent être calculées. De ce fait, les parts de chaque muscle dans toutes les directions du regard peuvent être précisées [17, 18].
En position primaire, la force exercée par chaque muscle suivant les trois axes de Fick est précisée sur le tableau 21-IV. On constate que :
les muscles horizontaux sont les principaux contributeurs à l’adduction et l’abduction ; la part des autres muscles peut être considérée comme négligeable ;
les muscles verticaux sont les principaux contributeurs à l’élévation et l’abaissement ; la part des obliques est faible mais non négligeable.
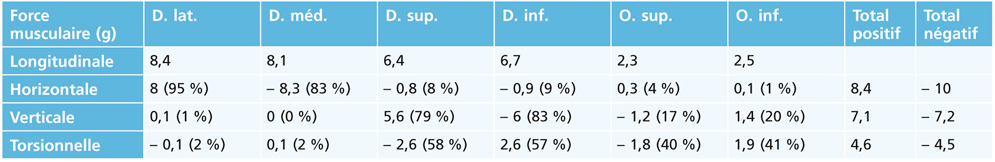
Tableau 21-IV – Part de chaque muscle dans les forces développées en position primaire.
Par convention, l’abduction, l’élévation et l’extorsion sont positives ; l’adduction, l’abaissement et l’intorsion sont négatifs.
Les pourcentages indiquent la part du muscle dans le mouvement de référence.
Pour cette section, nous avons repris mot pour mot un texte que nous avons déjà publié [17, 18]. À ces références, le lecteur y trouvera une analyse plus détaillée.
Exprimer la force en force totale est peu lisible. Nous préférerons l’expression en pourcentage de la force développée par un muscle suivant un des axes de Fick par rapport à la force totale suivant cet axe (pour une position donnée du regard) (tableaux 21-V à 21-VII).
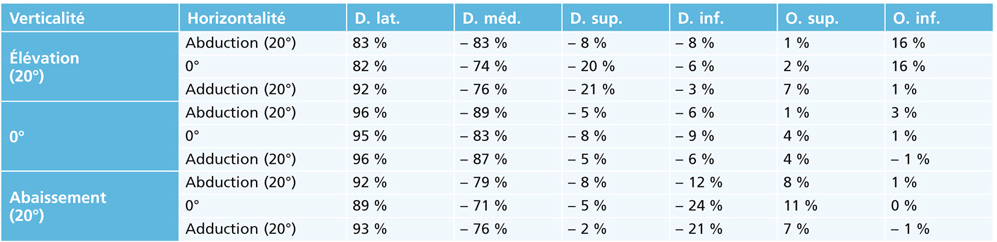
Tableau 21-V – Composantes rotatoires de la force musculaire (CRFM) en pourcentage : horizontalité (rotation autour de l’axe des Z).
Pourcentage de la force développée par un muscle suivant un des axes de Fick par rapport à la force totale suivant cet axe [17, 18]. D’après le logiciel Orbit 1.8 [15]. L’abduction, l’élévation et l’extorsion sont exprimées en valeurs positives.
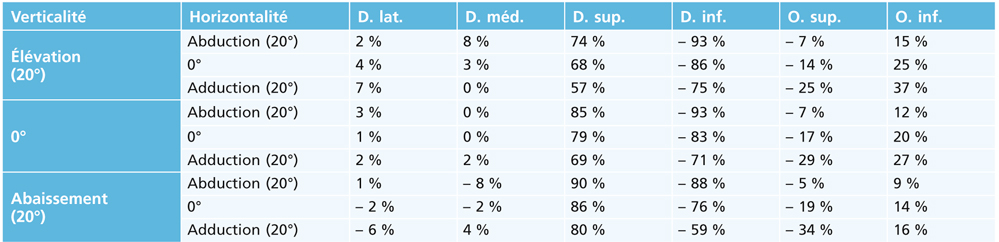
Tableau 21-VI – Composantes rotatoires de la force musculaire (CRFM) en pourcentage : verticalité (rotation autour de l’axe des X).
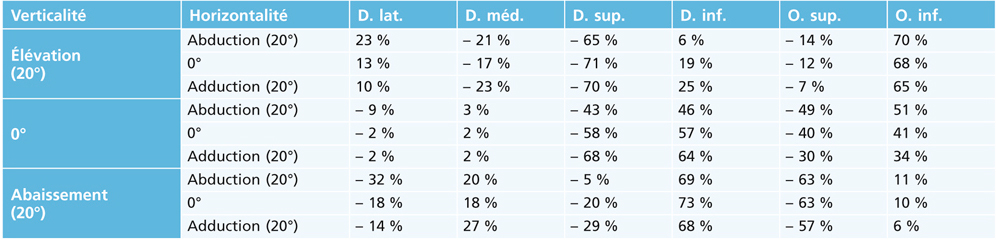
Tableau 21-VII – Composantes rotatoires de la force musculaire (CRFM) en pourcentage : torsion (rotation autour de l’axe des Y).
Dans le champ d’excursion utilisé habituellement et pour les neuf positions, les deux droits horizontaux sont l’adducteur et l’abducteur principaux. Les autres muscles n’ont une action horizontale que très accessoire (tableau 21-V).
L’évolution de la composante verticale a été étudiée pour les neuf positions (tableau 21-VI).
Le principal élévateur dans le domaine clinique habituel de fonctionnement d’un sujet (élévation de 20°) est le droit supérieur. Pour une même position verticale, les variations de la composante verticale en fonction de l’horizontalité sont faibles.
L’évolution de la composante d’abaissement est légèrement différente de l’évolution de la composante d’élévation, mais elle est grossièrement en miroir : le droit supérieur devenant le droit inférieur et l’oblique inférieur devenant l’oblique supérieur.
L’évolution de la composante d’élévation a été étudiée pour neuf positions (tableau 21-VII). Le tableau montre bien l’équilibre entre les torseurs. Pour une même position verticale, les variations de la composante torsionnelle en fonction de l’horizontalité sont faibles.
L’équilibre entre les différents muscles est stable de l’adduction à l’abduction pour une verticalité donnée. On peut noter également la relative indépendance de la torsion et de la verticalité.
Pour les mouvements verticaux, le tableau 21-VI montre que, de façon très nette, le principal élévateur est le droit supérieur de l’abduction à l’adduction (de 85 % à 69 %) ; dans l’abaissement, il en va de même pour le droit inférieur (de 93 % à 71 %). Dans les deux cas, les obliques sont soit un élévateur soit un abaisseur accessoires. Leurs actions ne sont négligeables ni dans l’abduction (oblique inférieur : 7 % ; oblique supérieur : 12 %), ni en position primaire (oblique inférieur : 20 % ; oblique supérieur : 17 %). Ces deux obliques ont bien pour champ d’action l’adduction mais, dans cette position, il reste des verticaux accessoires (oblique inférieur : 27 % ; oblique supérieur : 29 %) (fig. 21-120). Le clinicien doit s’en souvenir.
L’interprétation des signes cliniques suppose une connaissance fine de la physiologie. Nous venons d’en voir un exemple. Les progrès dans ce domaine sont rapides. Le clinicien doit être attentif à ces évolutions qui peuvent modifier radicalement son analyse clinique.
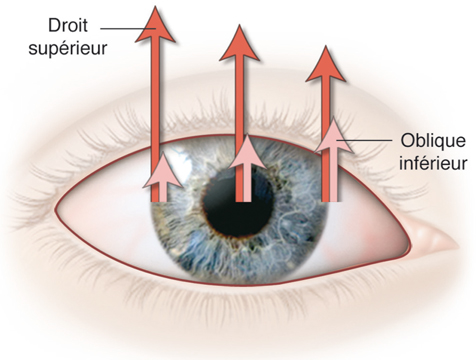
Fig. 21-120 Champs d’action des verticaux de l’abduction à l’adduction. Chaque flèche est proportionnelle à la part que chaque muscle prend dans l’élévation à partir d’un mouvement débutant sur l’horizontal (adduction et abduction de 20°).
Le système oculomoteur du sujet normal est régi par un certain nombre de lois. Cinq nous paraissent essentiels. Elles sont globalement respectées chez le sujet normal. Ces cinq lois sont les piliers de l’oculomotricité et elles sont un remarquable outil de compréhension.
En pathologie, une ou plusieurs de ces lois peuvent ne pas être respectées.
Loi de Donders
« Pour chaque position de la ligne de visée, il existe une orientation définie des méridiens horizontaux et verticaux rétiniens par rapport aux coordonnées dans l’espace [1, 16-18, 25]. »
Cette loi indique simplement l’invariant du système oculomoteur périphérique, c’est-à-dire que l’œil est toujours orienté de la même façon pour une même position.
Loi de Listing
« Pour chaque mouvement de l’œil de la position primaire à une autre position, la rotation est effectuée autour d’un seul axe situé dans le plan équatorial [1, 16-18, 25] [plan de Listing : cf. supra, « Centre de rotation, axes et plans »]. »
Ceci veut dire que tous les mouvements des yeux, à partir de la position primaire, sont des mouvements « vrais », c’est-à-dire sans torsion. Ce fait a été démontré pour les rotations secondaires (axes horizontal et vertical), mais également pour les mouvements tertiaires (combinaison des deux) par la technique des post-images [1, 16, 25]. Une autre conséquence de cette loi est que les mouvements oculaires n’ont que deux degrés de liberté et non trois : ceux-ci peuvent être décrits par les seules directions et distance du mouvement [25]. Les mouvements oculaires (sauf exception : convergence et inclinaison de la tête) n’induisent pas de rotation suivant l’axe antéropostérieur [1, 16, 25]. L’inclinaison notée dans les positions tertiaires ne correspond pas à une rotation réelle autour de l’axe antéropostérieur, il s’agit de la « fausse torsion » (fig. 21-121) [1, 16, 25]. Les mécanismes qui expliquent cette loi sont l’objet d’une forte activité spéculative.
Loi de Sherrington
C’est la loi d’innervation réciproque [1, 16-18, 21, 25] : « Quand les agonistes se contractent, les antagonistes se relâchent. » ou : « Quand un agoniste reçoit un influx pour se contracter, un influx inhibiteur équivalent est envoyé à son antagoniste, qui se relâche et s’allonge. »
Loi de Hering
C’est la loi d’égale innervation [1, 16-18, 21, 25] : « Une quantité d’énergie nerveuse adaptée est transmise aux couples musculaires synergiques, ce qui permet aux deux yeux de tourner de façon égale. » ou : « Pour tous les mouvements volontaires conjugués des yeux, une innervation égale et simultanée provient des centres oculomoteurs aux muscles concernés par l’élaboration de la nouvelle direction du regard. Autrement dit, la quantité d’énergie nerveuse, envoyée aux muscles des deux yeux, entraîne par les yeux un mouvement égal dans une direction particulière. »
Ce concept a été étendu à l’ensemble des mouvements oculaires. La loi de Hering est une loi unique et spécifique de l’oculomotricité. Elle est la réponse motrice au chiasma : on peut dire qu’elle est le « chiasma moteur » (fig. 21-122).
Loi d’équivalence optomotrice conjuguée
« Toute version induite par un stimulus optomoteur donné est identique quelle que soit la modalité de la fixation : binoculaire, monoculaire droite ou monoculaire gauche [18]. »
Cette loi montre la remarquable robustesse du système des versions, tandis qu’au contraire les vergences ne respectent que très rarement cette loi. Ceci souligne le caractère phylogénétiquement récent du système des vergences.
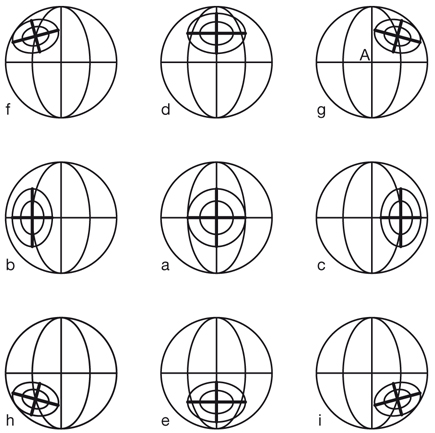
Fig. 21-121 Servant de référence, une croix est placée sur la cornée. Dans les positions primaires et secondaires (a, b, c, d et e), la croix coïncide avec le référentiel vertical et horizontal. Dans toutes les autres positions (positions tertiaires), la croix est inclinée (fausse torsion) par rapport au référentiel vertical et horizontal de la position primaire (référentiel orbitaire).
Cette fausse torsion est liée à la différence entre des rotations équivalentes autour d’axes ayant pour référentiel l’œil dans un cas, l’orbite dans l’autre (l’observateur utilisant comme référentiel l’orbite, d’où l’apparition de la « fausse torsion »). Cette quantité de fausse torsion peut être calculée [20, 25].
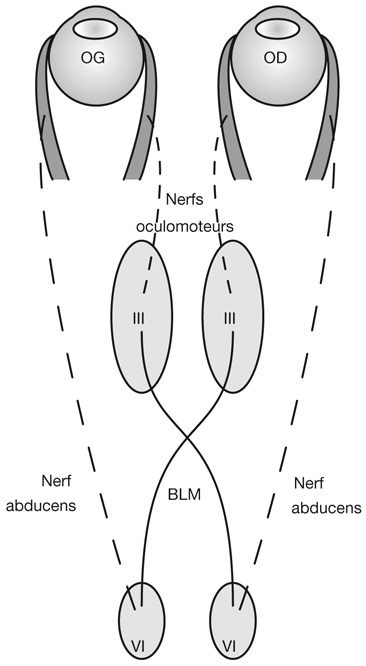
Fig. 21-122 Support et organisation anatomique de la loi de Hering.
[1] Burde RE, Feldon SE. The extraocular muscles. In : Adler’s Physiology of the eye. 9th edition. Elsevier Saunders, 1992 : 101-134.
[2] Büttner-Enever JA. Anatomy of the oculomotor system. In : Straube A, Büttner U (eds). Neuro-Ophthalmology. Dev Ophthalmol. Vol. 40. Basel, Karger, 2007 : 1-14.
[3] Clark RA, Miller JM, Demer JL. Location and stability of rectus muscle pulleys. Muscle paths as a function of gaze. Invest Ophthalmol Vis Sci, 1997 ; 38 : 227-240.
[4] Collins CC, Carlson MR, Scott AB, Jampolsky A. Extraocular muscle forces in normal human subjects. Invest Ophthalmol Vis Sci, 1981 ; 20 : 652-664.
[5] Demer JL, Miller JM, Poukens V, Vinters HV, Glasgow BJ. Evidence for fibromuscular pulleys of the recti extraocular muscles. Invest Ophthalmol Vis Sci, 1995 ; 36 : 1125-1136.
[6] Demer JL, Poukens V, Miller JM, Micevych P. Innervation of extraocular pulley smooth muscle in monkeys and humans. Invest Ophthalmol Vis Sci, 1997 ; 38 : 1774-1785.
[7] Demer JL, Oh SY, Poukens V. Evidence for active control of rectus extraocular muscle pulleys. Invest Ophthalmol Vis Sci, 2000 ; 41 : 1280-1290.
[8] Demer JL, Oh SY, Clark RA, Poukens V. Evidence for a pulley of the inferior oblique muscle. Invest Ophthalmol Vis Sci, 2003 ; 44 : 3856-3865.
[9] Demer JL. Pivotal role of orbital connective tissues in binocular alignment and strabismus: the Friedenwald lecture. Invest Ophthalmol Vis Sci, 2004 ; 45 : 729-738.
[10] Demer JL. Mechanics of the orbita. Dev Ophthalmol, 2007 ; 40 : 132-157.
[11] Jampel RS, Shi DX. The primary position of the eyes, the resetting saccade, and the transverse visual head plane. Head movements around the cervical joints. Invest Ophthalmol Vis Sci, 1992 ; 33 : 2501-2510.
[12] Kayser Ch. Traité de physiologie. Tome II. Système nerveux. Muscle. 2e édition. Paris, Flammarion, 1969.
[13] McLoon L. The extraocular muscles. In : Adler’s Physiology of the eye. 11th edition. Elsevier Saunders, 2011 : 182-207.
[14] Miller JE. Cellular organization of rhesus extraocular muscle. Invest Ophthalmol, 1967 ; 6 : 18-39.
[15] Miller JM. Orbit 1.8, gaze mechanics simulations. Eidactics, 1999.
[16] Oyster CW. The human eye. Ed. Sinauer Associates, 1999.
[17] Péchereau A. Physiologie de l’oculomotricité. In : Espinasse-Berrod M-A et al. Strabologie, approches diagnostique et thérapeutique. 2e édition. Paris, Elsevier, 2008 : 13-26.
[18] Péchereau A. Polycopié du DU de Strabologie. Tome 1. FNRO éditions, 2009.
[19] Porter JD, Poukens V, Baker RS, Demer JL. Structure-function correlations in the human medial rectus extraocular muscle pulleys. Invest Ophthalmol Vis Sci, 1996 ; 37 : 468-472.
[20] Quaia C, Optican LM. Three-dimensional rotations of the eye. In : Adler’s physiology of the eye. Kaufman P.L., Alm A (eds). 10th edition. St Louis, Mosby, 2003 : p 818-829.
[21] Quéré M-A. Physiopathologie de l’équilibre oculomoteur. Paris, Masson, 1983.
[22] Robinson DA. A quantitative analysis of extraocular muscle cooperation and squint. Invest Ophthalmol, 1975 ; 14 : 801-825.
[23] Roth A. Anatomie des muscles oculomoteurs et des fascias orbitaires. In : Espinasse-Berrod M-A et al. Strabologie. Approches diagnostique et thérapeutique. 2e édition. Paris, Elsevier, 2008 : 7-11.
[24] Roth A. Chirurgie oculomotrice. Paris, Elsevier, 2012.
[25] Scott AB. Ocular motility. In : Physiology of the human eye and visual system. Records R.E. (ed.). Hagerstown, Harper & Row, 1979 : 577-642.
[26] Von Noorden GK, Campos EC. Histology and physiology of the extraocular muscles. In : Binocular vision and ocular motility. 6th edition. St Louis, Mosby, 2002 : 101-113.
A. Péchereau
Chaque point de l’espace est localisé par rapport à l’observateur. Ceci tient au fait que chaque zone de la rétine (au sens du complexe rétinocortical) a une valeur localisatrice précise et intangible [8, 9, 15] sauf fixation excentrée et/ou excentrique.
Dans cet ensemble, la fovéola a une valeur toute particulière :
elle est une des extrémités de la direction visuelle principale, l’autre étant l’objet d’attention (fig. 21-123) ;
c’est le point zéro du système oculomoteur (centre et chef d’orchestre) ;
cette qualité est liée à une structure anatomique précise et importante, qu’on peut considérer comme non malléable (aucune autre zone de la rétine n’ayant une telle structure) [7].
Fig. 21-123 Direction visuelle principale (Ff) et directions visuelles secondaires (Aa et Bb).
Toutes les autres zones de la rétine ont :
une valeur fonctionnelle (fig. 21-124) : elle dépend de son anatomie ;
une valeur motrice (valeur rétinomotrice) : c’est la distance entre la fovéola et le point rétinien stimulé qui donne la valeur localisatrice de ce dernier (en haut, en bas, à droite, à gauche, etc.) ; toute stimulation d’un point correspondant à une direction visuelle secondaire peut déclencher un mouvement.
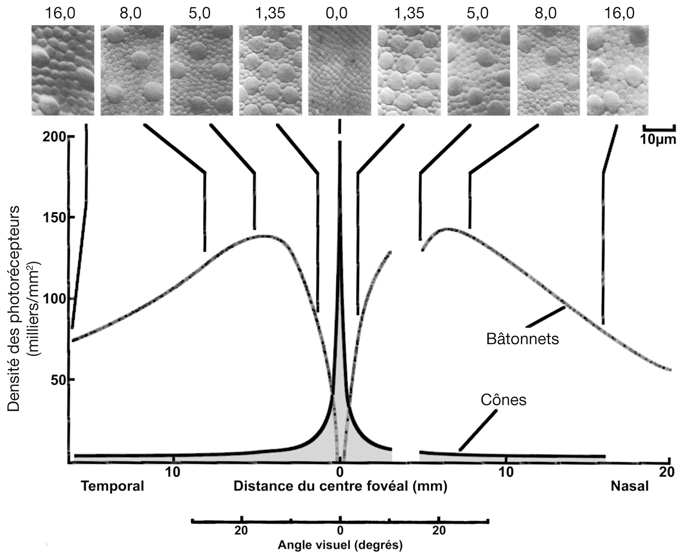
Fig. 21-124 Valeur fonctionnelle de la rétine en fonction de sa structure anatomique.
(D’après Oyster C.W., 1999 [7].)
Nous en retiendrons deux :
la correspondance rétinienne est :
normale quand, au niveau cortical, les images provenant des deux directions visuelles principales, c’est-à-dire de l’information visuelle provenant des deux fovéolas, se superposent (cf. supra, « Correspondance rétinienne normale ») ;
anormale quand, au niveau cortical, les images provenant de la direction visuelle principale d’un œil et d’une direction visuelle secondaire de l’autre œil se superposent (cf. supra, « Correspondance rétinienne anormale ») ;
cette valeur rétinomotrice permet de transformer le champ visuel en champ de fixation grâce aux mouvements oculaires qui ont tous (sauf le nystagmus vestibulaire) pour objet d’amener ou de maintenir l’objet d’attention sur la fovéola.
On distingue principalement deux types de disparité qu’il ne faut pas confondre.
Elle est le fait que chaque œil voit une image différente d’un même objet [9, 10, 15].
C’est Wheatstone en 1838 qui a décrit pour la première fois ce phénomène fondamental (fig. 21-125).
Fig. 21-125 Phénomène de disparité horizontale.
En binoculaire (dessin du milieu) : mettons les deux index l’un derrière l’autre de façon suffisamment écartés et dans l’axe du nez. Fixation de l’index le plus éloigné : par l’œil droit (OG fermé, dessin de gauche), l’index le plus près est à gauche de l’index le plus loin ; par l’œil gauche (OD fermé, dessin de droite), l’index le plus près est à droite de l’index le plus loin. Fixation de l’index le plus près : c’est l’inverse. Dans la première situation (en avant du point de fixation), la disparité est croisée. Dans la seconde situation (en arrière du point de fixation), la disparité est décroisée.
(D’après Tychsen L., 1992 [15].)
Bien comprendre cette observation est essentiel (fig. 21-125) [9, 10, 15].
Chaque œil voit le monde de façon différente comme le montre la position relative de chaque index non fixé. C’est le phénomène de disparité. Il est fondé sur les lois de la géométrie qui permettent de calculer son angle et de réaliser les tests qui l’utilisent. L’effet est variable suivant :
l’écart interpupillaire : plus l’écart interpupillaire est grand, plus l’effet est important ;
la distance : plus la distance est grande, plus la différence est faible pour disparaître à l’infini (géométrie).
La disparité est à la base de la vision stéréoscopique et du contrôle vergentielle (neurones sensibles à la disparité).
C’est le constat que, dans la réalité, les deux axes visuels ne sont pas orientés strictement vers le point de fixation (fig. 21-126). Chez les humains, il existe souvent une erreur de la vergence statique. Quand le sujet croit qu’il fixe exactement une cible avec les deux yeux, un seul œil est réellement sur la cible. L’autre est dévié en convergence ou en divergence de 1 à 5 minutes d’arc. Cette erreur normale de la vergence a été appelée disparité de fixation par Ogle [9, 10, 15]. La différence est en moyenne de 1 à 5 minutes d’arc (la valeur d’un optotype de 10/10).
Si la disparité de fixation est toujours actuellement une « curiosité », la disparité est essentielle à comprendre car c’est à partir d’elle que l’alignement visuel sur une cible s’organise. Par ailleurs, elle est l’origine physique de la vision stéréoscopique.
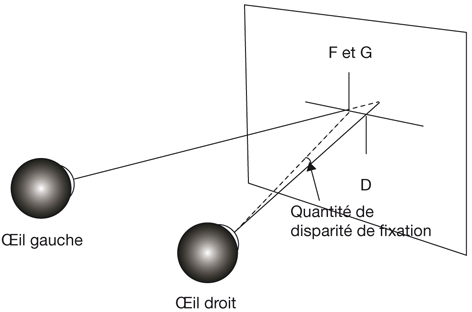
Fig. 21-126 Disparité de fixation.
L’alignement visuel des deux directions visuelles principales n’est pas parfait sur l’objet d’attention. La direction visuelle principale de l’œil gauche est parfaitement alignée sur l’objet d’attention (F). La direction visuelle principale de l’œil droit n’est parfaitement alignée sur l’objet d’attention. La quantité de disparité de fixation pour l’œil droit est l’angle entre la direction visuelle principale théorique et la direction visuelle principale réelle.
On trouve essentiellement deux définitions pour l’horoptère [9, 10, 15] :
une définition géométrique : l’horoptère est l’ensemble des points correspondants binoculaires. C’est un cercle (cercle de Vieth-Müller) situé dans le plan horizontal de la tête, passant par les centres optiques et par le point de fixation momentanée (fig. 21-127) ;
une définition physiologique : l’horoptère est la zone de l’espace sans disparité.
L’horoptère est donc un plan centré sur le croisement des directions visuelles principales (l’objet d’attention) et comprenant l’ensemble des points correspondants binoculaires. La totalité de l’espace visuel d’un sujet est organisée autour de ce plan. Ce plan n’a aucune épaisseur et ne génère aucune stéréoscopie du fait de l’absence de disparité.
L’horoptère longitudinal (Hering-Hillebrand) est légèrement plus plat (plus grand rayon de courbure) que l’horoptère géométrique (Vieth-Müller) (fig. 21-128). Les raisons en sont complexes [9, 15].
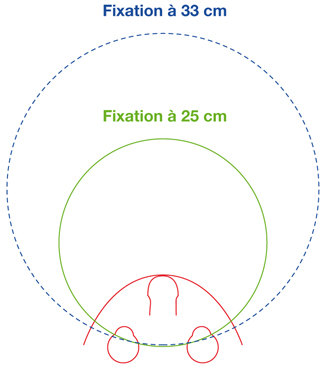
Fig. 21-127 Variations de l’horoptère en fonction de la distance de fixation.
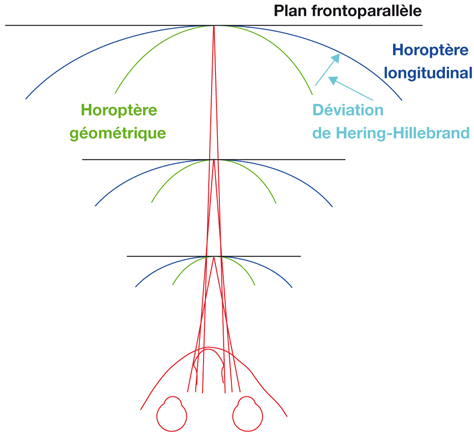
Fig. 21-128 Plan frontoparallèle, horoptère longitudinal (l’horoptère mesuré chez le sujet normal) et horoptère géométrique.
Chez le singe, il a été trouvé dans l’aire V1 quatre types de neurones binoculaires sensibles à de petites disparités à l’intérieur ou au voisinage de l’horoptère [9, 10, 15] :
les neurones accordés au point zéro (T0) : ils répondent de façon maximale aux cibles situées sur l’horoptère (à l’absence de disparité) ;
les neurones accordés au près (TN) : ils répondent de façon maximale à la disparité en avant de l’horoptère (disparité croisée, tailles d’image plus grandes en temporal) ;
les neurones accordés au loin (TF) : ils répondent de façon maximale à la disparité en arrière de l’horoptère (disparité décroisée, tailles d’image plus grandes en nasal) ;
les neurones accordés inhibiteurs (TI) : ils (image en miroir des neurones T0) ne répondent pas quand l’objet d’attention est situé sur l’horoptère (absence de disparité) mais répondent au maximum quand celui-ci est au voisinage de l’horoptère (présence d’une disparité).
C’est à partir de ce mécanisme que le mécanisme de la régulation vergentielle s’établit. Il n’est pas nécessaire de signaler l’importance de la qualité du signal monoculaire pour que ce contrôle soit efficace. Par ailleurs, une hypothèse non validée [16] impliquerait une modification dans la répartition de ces populations neuronales (deux tiers pour la convergence, un tiers pour la divergence) dans l’origine de certains strabismes tant convergents que divergents.
En 1858, le physiologiste danois Peter Ludvig Panum (fig. 21-129) constate que légèrement ou en arrière ou en avant de l’horoptère, un objet est vu simple mais en relief [9, 10, 15]. Cette « aire de Panum » présente les propriétés suivantes :
plus étroite dans l’axe, elle s’évase en périphérie du champ visuel, dessinant une sorte de « nœud papillon » ;
plus étroite pendant la fixation stable et plus large quand les yeux et ou la tête se déplacent librement.
Elle est la zone de la vision stéréoscopique, c’est-à-dire la zone de l’espace où la disparité n’est ni trop petite (la disparité est nulle sur l’horoptère) ni trop grande (elle est alors diplopiante).
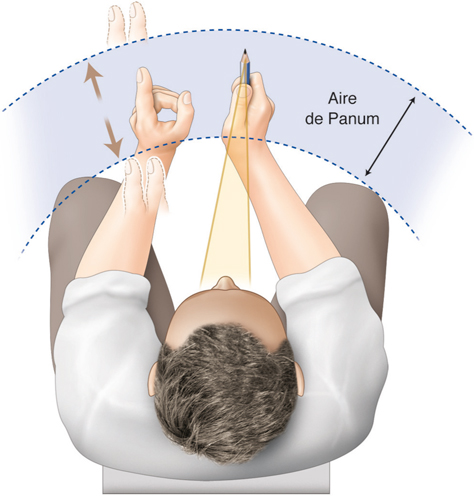
Fig. 21-129 Aire de Panum.
Le sujet tient et regarde un crayon situé à environ 30 cm en avant de son nez. Il place l’index de son autre main entre 5 cm et 10 cm à gauche de son crayon (attention à ne pas aller trop sur la gauche, l’aire de Panum s’élargissant, la diplopie n’est pas perceptible). Le crayon et le doigt sont parallèles. Tout en regardant le crayon, le sujet déplace son index d’arrière en avant et inversement. L’index gauche sera vu double par la vision périphérique à plusieurs centimètres devant ou derrière le crayon, lors du passage du doigt devant l’aire de Panum, dans l’aire de Panum, et derrière l’aire de Panum.
(D’après Tychsen L., 1992 [15].)
L’espace visuel d’un sujet normal pour un point de fixation donné va se diviser en plusieurs zones (fig. 21-130) :
une zone de vision simple : c’est un plan, l’horoptère, le lieu de coïncidence des points rétiniens correspondants ;
l’aire de Panum : elle a une certaine épaisseur avec une limite antérieure et une limite postérieure (l’horoptère est à peu près, pas tout à fait, au centre de l’aire de Panum) ; c’est l’aire de la stéréoscopie ;
deux zones de diplopie : ce sont les zones de la diplopie dite « physiologique » ; elles sont situées en avant et en arrière de l’horoptère ; la diplopie est physiologiquement non perçue (neutralisée dans la vie courante) mais suffisante pour stimuler la fixation.
Cette organisation est très structurée chez le sujet normal et centrée sur l’horoptère.
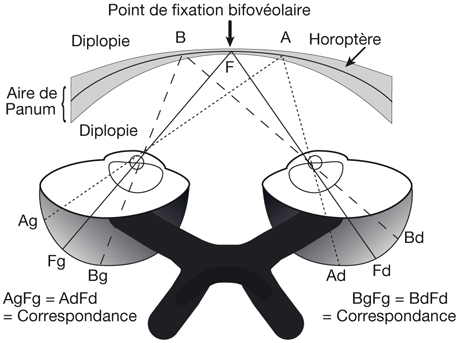
Fig. 21-130 Organisation spatiale de la vision.
La confusion et la diplopie sont les conséquences de la diplopie extra-horoptériques. Elles entraînent une désorganisation profonde de l’espace visuelle perçue.
C’est la stimulation d’une même zone de l’horoptère (non fovéolaire) par deux images extra-horoptériques (fig. 21-131) [9, 10, 15]. Cette confusion est extrêmement invalidante. Elle est tellement invalidante que le cerveau préfère supprimer la confusion et voir double que l’inverse.
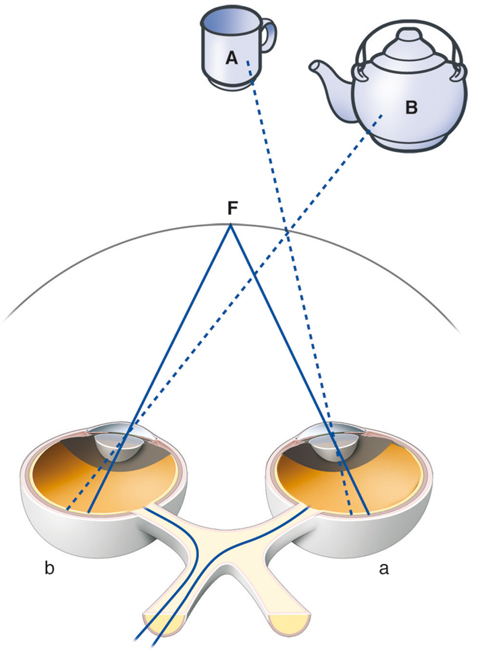
Fig. 21-131 Les deux images extra-horoptériques appartiennent à deux directions visuelles secondaires correspondantes, c’est-à-dire à des directions visuelles qui se croisent sur l’horoptère. Cette situation a pour conséquence la confusion.
(D’après Tychsen L., 1992 [15].)
La rivalité décrit la confusion visuelle provoquée par des images non corrélées stimulant en même temps les deux fovéolas (fig. 21-132). Durant la rivalité, des zones du domaine visuel sont dominées par une image puis par une autre. Ces zones fluctuent d’un moment à l’autre. La rivalité est inconfortable et confuse [9, 10, 15].
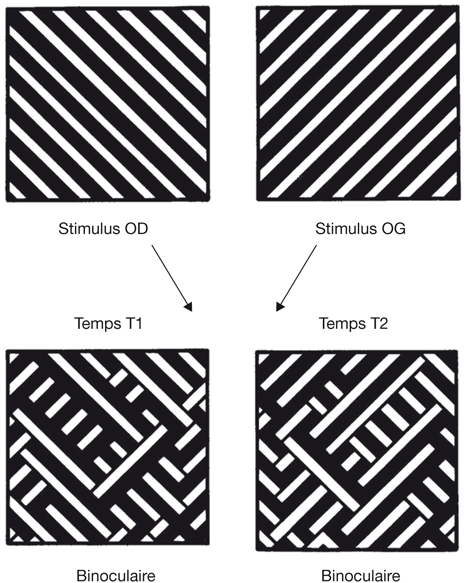
Fig. 21-132 La perception par les deux fovéolas d’une image non corrélée entraîne une rivalité provoquant une fluctuation d’un instant à l’autre de la perception. La sensation est très pénible pour le patient.
(D’après Tychsen L., 1992 [15].)
La confusion et la rivalité entraînent rarement une plainte par les patients qui perdent de façon soudaine l’alignement normal des yeux (paralysie oculomotrice). Une des deux images fovéales est rapidement neutralisée. Le système perceptif utilise alors l’image fovéale d’un œil et la même image d’une région non correspondante de la rétine de l’autre œil, donnant naissance à la diplopie (la perception d’un même objet situé à deux endroits de l’espace). La diplopie est gênante mais beaucoup moins invalidante que la rivalité (la perception de deux objets différents au même endroit de l’espace).
En d’autres termes, devant le choix entre diplopie ou confusion et rivalité qui sont particulièrement invalidantes, le sujet préfère la diplopie. Cependant, il existe une situation clinique qui ne laisse aucun choix au patient, c’est l’aniséiconie. Cette dernière est une source majeure de confusion et de rivalité. Quand la déneutralisation a lieu pour une raison ou une autre, la situation est extrêmement invalidante pour le patient qui ne peut se réfugier que dans la diplopie.
Les bases d’une partie importante de l’activité du cortex visuel sont donc en place. Les deux yeux envoient une image plane du même objet d’attention au cerveau. Cette image est vue simple sur l’horoptère, faiblement double (la disparité) dans l’aire de Panum et double en dehors de l’aire de Panum. L’activité cérébrale va avoir trois objectifs :
voir simple au moyen de la fusion motrice et sensorielle ;
voir en relief grâce à l’analyse de la disparité ;
ne pas voir double dans l’espace en dehors de l’aire de Panum.
Les outils que le cerveau utilise sont la fusion et la neutralisation.
On distingue fusion sensorielle et fusion motrice :
« La fusion sensorielle est l’unification des informations visuelles provenant de zones rétiniennes correspondantes en une simple perception visuelle, une simple image visuelle [17] » : la fusion sensorielle fait appel aux informations de l’aire fovéolaire et de la rétine périphérique9 ;
« La fusion motrice est la capacité d’aligner les yeux de telle façon que la fusion sensorielle puisse se maintenir. La fusion motrice est une fonction exclusive de la rétine périphérique extrafovéolaire [17] » : les stimulus de la fusion motrice sont la disparité rétinienne en dehors de l’aire de Panum (zone de l’espace de vison simple) ; il n’y a pas de stimulus de fusion motrice quand les images sont fixées par les deux fovéolas (absence de disparité).
Ce sont les neurones binoculaires sensibles à la disparité qui servent de support neuronal à la fusion. C’est la réponse des neurones NE (près), FA (loin) et TI (neurones accordés inhibiteurs) (cf. supra, « Horoptère ») pour de petites quantités d’image non corrélées (disparité) qui va entraîner la fusion d’images légèrement différentes dans l’aire de Panum [9, 15]. La qualité du signal monoculaire sera naturellement essentielle.
La confusion et plus encore la rivalité (conséquence de la diplopie extra-horoptérique en dehors de l’aire de Panum) sont extrêmement invalidantes pour le sujet. Celui-ci va devoir lutter en permanence contre cette perception anormale et permanente de l’espace. Chez le sujet normal et pathologique, c’est la neutralisation (« suppression » en anglais, retraduit en Français par « suppression ») qui est chargée de ce travail (fig. 21-133).
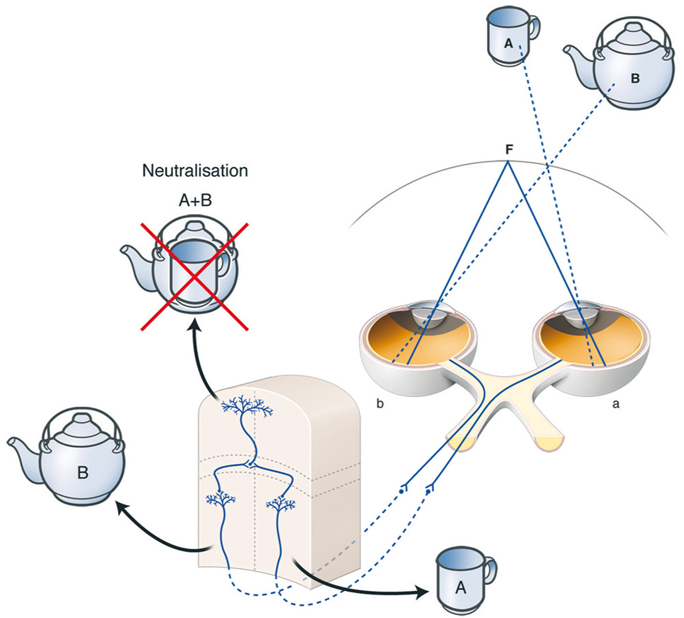
Fig. 21-133 Nécessaire neutralisation de l’activité de certains neurones binoculaires pour éviter la confusion visuelle ou la rivalité.
Supposons un neurone de la couche IV3 du cortex visuel gauche avec un champ binoculaire réceptif accordé à la disparité zéro (c’est-à-dire sur l’horoptère). Aucun stimulus n’est présent à sa disparité binoculaire préférée. Les champs récepteurs monoculaires (A et B) sont occupés par des stimulus non corrélés qui sont situés au-delà de l’horoptère mais dont les directions visuelles se croisent sur l’horoptère.
(D’après Tychsen L., 1992 [15].)
Chez le sujet normal, cette neutralisation peut prendre différentes formes : neutralisation du flou, suspension de l’information d’un œil, neutralisation alternante de la rivalité binoculaire et neutralisation permanente de l’information visuelle d’un œil [2-4, 14].
Chez le sujet strabique, à ces mécanismes d’autres plus spécifiques à cette pathologie peuvent se rajouter. Nous avons vu antérieurement le résultat de ces mécanismes (cf. « I – La vision du sujet strabique » au chapitre 16).
Dans tous les cas, il y a une diminution de l’activité des neurones binoculaires.
Chez le sujet normal, la neutralisation est une activité normale qui doit être respectée.
En pathologie, deux faits doivent être particulièrement soulignés :
« Plus la stimulation monoculaire est élaborée, plus la suppression binoculaire est efficace [5, 10]. » Ceci nous indique que la meilleure protection contre la diplopie chez l’amblyope est la guérison complète de l’amblyopie. Une petite amblyopie volontairement laissée par le thérapeute ne protège de rien ; au contraire, elle augmente les risques de diplopie ;
chez le sujet strabique, la confusion comme la diplopie envahit la totalité de l’espace visuel. Grâce à la neutralisation, les sujets ne prennent pas conscience de leur confusion (et de leur diplopie). C’est une raison supplémentaire de respecter en toutes circonstances la neutralisation. De plus, il n’a jamais été démontré que la neutralisation est le phénomène premier dans l’apparition d’un strabisme.
Nous venons de voir les outils qui permettent au sujet de voir simple et en relief. Ils lui permettent d’éliminer la diplopie et la rivalité. Pour le thérapeute, différents aspects semblent particulièrement importants (ceux sur lesquels il peut agir) :
la qualité du signal monoculaire ;
l’alignement des axes visuels ;
le respect de la neutralisation.
Cette dernière est un bienfait : elle est une réponse normale soit à une situation intolérable soit à un processus pathologique. Elle n’est pas une cause, elle est une conséquence. Déneutraliser est un risque que le thérapeute n’a pas le droit de prendre, la conséquence pouvant être la diplopie permanente.
La mesure de l’acuité visuelle est l’analyse de la capacité de discrimination du système visuel dans le plan frontal. En clinique, l’unité anatomique de cette capacité d’analyse est le cône fovéolaire. Son diamètre (3 µm) fait que l’angle maximum de discrimination est de 30 secondes d’arc, soit 20/10 soit – 0,3 logMAR.
La mesure de la stéréoscopie est l’analyse de la capacité de discrimination du système visuel dans le plan sagittal [12]. En clinique, l’unité anatomique de cette capacité d’analyse est le cône fovéolaire. Son diamètre (3 µm) fait que l’angle maximum de discrimination est de 30 secondes d’arc.
Comme nous venons de le voir, la stéréoscopie et l’acuité visuelle ne sont que les deux faces d’une même pièce. Leur support anatomique est donc le même jusqu’au cortex visuel. Cependant, il existe une différence importante :
l’acuité visuelle est le résultat de l’analyse de l’image perçue par les cellules monoculaires ;
la stéréoscopie est le résultat de l’analyse de la disparité par les cellules binoculaires.
Naturellement, la seconde est dépendante de la première.
Comme nous l’avons dit (cf. supra, « Horoptère »), la vision stéréoscopique est l’analyse de la disparité par les cellules binoculaires du cortex visuel, sensibles à la disparité. Suivant le type de disparité, ce ne sont pas les mêmes types de population neuronale qui répondent.
On distingue différents types de stéréoscopie [15] :
la stéréoscopie statique, ou fine :
sensible à une disparité de 2 à 1 200 secondes d’arc ;
fondée sur des signaux fovéolaires ;
utilisant la voie parvocellulaire ;
la stéréoscopie dynamique, ou grossière :
sensible à une disparité de 40 à 3 600 secondes d’arc ;
fondée sur des signaux parafovéolaires ;
utilisant la voie magnocellulaire.
En plus de ces termes, Julez [5] a utilisé les termes de « global » et « local ». On peut rapprocher « global » de statique (au sens où le processus stéréoscopique nécessite plus de moyens, donc des moyens globaux ; ce processus est donc lent) et « local » de dynamique (au sens où le processus stéréoscopique nécessite peu de moyens, donc des moyens locaux ; ce processus est donc rapide.). Cependant, certains auteurs [15] ont interprété la pensée de Julez en rapprochant « global » de binoculaire et « local » de monoculaire (cf. « Perception du relief » au chapitre 3).
La stéréoscopie est fondée sur l’analyse d’une disparité. Cette disparité d’un même objet est liée à la différence d’angle géométrique sous lequel un même objet d’attention est vu par chacun des deux yeux. Le calcul de cet angle donne l’angle de disparité (fig. 21-134), c’est-à-dire la valeur de la stéréoscopie.
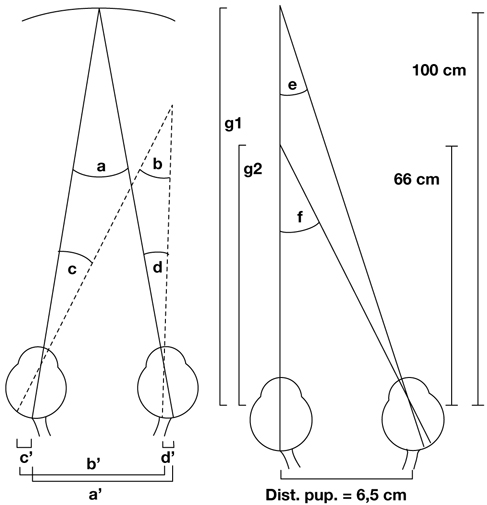
Fig. 21-134 Angle de disparité.
L’angle (b – a) ou (c – d) est l’angle de disparité. Le changement c’ sur la rétine correspond à l’angle c et le changement d’ correspond à l’angle d. De la même façon, a’ correspond à la distance sous-tendue par l’angle a, et b’ à celle sous-tendue par l’angle b. On mesure les distances g1, g2 et l’écart interpupillaire de l’observateur (EIP) (cm). Les angles e et f sont les arcs tangents du rapport de l’écart interpupillaire sur chaque distance. La disparité est la différence entre les angles e et f.
Exemple : e = arctan (EIP/g1) soit arctan (6,5/100) = 3,7° ; f = arctan (EIP/g1) soit arctan (6,5/66) = 5,6°. La disparité est de 1,9° soit de 6 840 secondes d’arc.
La stéréoscopie apparaît de façon brutale et presque totalement mature vers le quatrième mois de vie (fig. 21-135). La période où elle est encore susceptible d’apparaître n’est pas bien connue.
Ils ont été traités antérieurement. Nous nous limiterons aux principes de ces tests, dont on distingue trois types.
Ce sont le test des deux crayons et le test de Frisby. Ils reproduisent le monde réel. Seul le test de Frisby est calibré. Il nécessite une méthodologie rigoureuse.
C’est essentiellement le test de Wirt. Il explore la stéréoscopie grossière. Il ne doit pas ou peu être employé.
Ce sont les tests de Randot, Lang, TNO et « E » de Reinecke. Ils reposent sur des corrélogrammes (fig. 21-136 et 21-137). Ils présentent un certain nombre de particularités :
il s’agit de stéréopsie et non de stéréoscopie [12] : la stéréopsie est un processus artificiel, la stéréoscopie un processus naturel ; par ailleurs, la stéréopsie varie inversement avec l’écart interpupillaire ;
l’angle de disparité varie avec la distance : le test doit être présenté à la distance indiquée par le fabriquant. Par exemple, un test de Lang tenu par un jeune enfant sera à environ 20 cm, alors qu’il devrait être à 40 cm. Dans ce cas, l’angle de disparité étudié sera le double de celui indiqué par le fabriquant (600 secondes d’arc deviendront 1 200 secondes d’arc). Pour toutes les conversions en fonction de la distance et du test, voir : [11].
De tous ces tests de vision stéréoscopique (stéréopsique), le plus robuste est sans aucun doute le TNO (le Randot a aussi beaucoup de qualités). Il est le test de référence pour l’étude de la stéréoscopie.
Fig. 21-136 Nappes de points distribués de façon aléatoire identiques pour les deux yeux.
L’identité des deux nappes permet la fusion des deux images. Chaque œil reçoit une image qui lui est propre grâce à un procédé haploscopique (prismes, lunettes duochromes, lunettes polarisées).
(D’après Tychsen L., 1992 [15].)
Fig. 21-137 Tests à points aléatoires : corrélogrammes.
1. Calcul des nappes de points. La partie centrale d’un des deux corrélogrammes est déplacée d’une quantité précise : la partie centrale des troisième et quatrième lignes du corrélogramme de droite est déplacée d’une colonne ; la partie droite des deux lignes est remplie de façon aléatoire. 2. Les nappes de points aléatoires sont réalisées. 3. En binoculaire et grâce à un procédé haploscopique, la partie centrale des signaux visuels de l’œil droit et de l’œil gauche est séparée. Chaque œil voit un signal commun (la périphérie du test) qui lui permet de fusionner. La partie centrale est vue légèrement différente par les deux yeux. Cette différence est interprétée comme un signal de disparité. À partir de celui-ci, le cerveau construit une image en relief.
(D’après Tychsen L., 1992 [15].)
Un point devra toujours être vérifié par l’examinateur : lui-même est-il capable de répondre en monoculaire ? Si la réponse est oui, la valeur du test est probablement très faible.
Nous avons vu la similitude entre l’acuité visuelle et la stéréoscopie. Cette façon de procéder peut s’étendre au concept de stéréoamblyopie [12]. Par esprit de système et comme pour l’amblyopie, on peut appliquer la même classification à la stéréoamblyopie [11]. On constate alors que les angles de disparité mesurés par le test de Lang sont l’équivalent d’une amblyopie — pour le Lang I de 1 200 à 550 secondes d’arc (0,5 à 1,1/10) et pour le Lang II de 600 à 200 secondes d’arc (1 à 3/10) ; ces valeurs sont pour des tests tenus à 40 cm.
La vision stéréoscopique est la clé de voûte du système visuel chez l’homme. Malheureusement, nous n’avons pas aujourd’hui de stratégie thérapeutique permettant qu’elle se développe de façon satisfaisante quand elle ne s’est pas mise en place naturellement. Elle échappe au thérapeute. Celui-ci ne peut que se contenter de placer le système visuel du patient dans les meilleures conditions pour qu’elle soit à nouveau utilisée. De plus, dans certaines circonstances, sa normalité ne peut empêcher qu’une déviation se mette en place.
Pour la vision binoculaire, il existe un véritable problème de définitions. Les concepts de vision bi-oculaire, de vision binoculaire qui doit être précisée par un adjectif semblent bien confus. Pour bien comprendre l’ensemble des « visions », nous allons partir de la vision la plus simple pour terminer par la plus élaborée [1, 9, 10, 15].
C’est la vision d’un seul œil d’un animal possédant une fovéa (nous ne parlerons pas de la vision sans fovéa). C’est la vision dans un plan de l’espace, plan passant par la normale (perpendiculaire) à l’axe de visée. Ce dernier est défini comme la droite allant de l’objet fixé à la fovéola. Le référentiel oculocentrique est déterminé par la fovéola.
La qualité de la vision va dépendre de la valeur sensorielle de l’œil, en particuliers de la valeur fonctionnelle de la fovéola.
Y a-t-il toujours une unicité de la perception chez les animaux présentant deux yeux ? Cette union de la perception visuelle de chaque œil en un percept unique suppose un support anatomique permettant une reconstruction de la perception par juxtaposition des images — reconstruction par un transfert calleux ?
Or : « Chez les vertébrés inférieurs (fig. 21-138), les deux yeux sont indépendants l’un de l’autre, toutes les fibres de chaque nerf optique vont dans le lobe optique opposé. De plus, il semblerait qu’il n’y ait pas de connexion au niveau des deux lobes optiques [13]. »
Il semble donc exister des animaux qui n’ont pas d’espace visuel unique à partir des sensations visuelles provenant des deux yeux. Les référentiels oculocentriques déterminés par les fovéolas sont indépendants.
Fig. 21-138 Vision bi-oculaire chez les vertébrés inférieurs.
a. Système visuel et encéphale d’un poisson. b. Système visuel et encéphale du poulet.
(Source : Salaud C., 2005 [13].)
Elle est appelée plus communément « vision binoculaire anormale », dont une des expressions est l’« union binoculaire ». Elle correspond à un stade plus élaboré de la perception visuelle avec construction d’un percept visuel unique. Celui-ci peut être défini de la façon suivante :
sommation des informations de chaque œil ;
création d’un espace visuel unique ;
construction d’une image plane ou faiblement stéréoscopique.
C’est la situation qu’on rencontre chez de très nombreux mammifères.
Chez l’homme, on la trouve chez les sujets strabiques, en particulier chez les sujets atteints de strabisme précoce. Le référentiel oculocentrique est déterminé par la fovéola de l’œil fixateur.
Elle est appelée plus communément « vision binoculaire normale ».
Une image cyclopéenne est une image simple créée par le cerveau en combinant les images provenant des deux yeux, y compris le percept stéréoscopique. L’idée présentée ici est l’idée que développa Bela Julez dans son livre de 1971 [5].
La vision cyclopéenne comprend :
une vision monoculaire élaborée ;
une orientation des deux directions visuelle principales vers l’objet fixé ;
une association des images des deux fovéas ;
une unicité de la perception visuelle :
sommation des informations de chaque œil ;
élimination des rivalités et confusions ;
la création d’un nouvel espace ordonné autour d’un nouveau référentiel ;
la création d’un nouveau percept : le relief.
En monoculaire, le référentiel spatial de chaque œil est la direction visuelle principale. En vision cyclopéenne, il se produit un double phénomène :
la construction du percept stéréoscopique que nous avons déjà vu ;
la modification du référentiel spatial de la perception visuelle.
En effet, en binoculaire, le tout droit est situé entre les deux yeux comme chez le cyclope, d’où son nom (fig. 21-139). Ce phénomène disparaît à la fermeture d’un œil. À ce moment-là, le référentiel spatial visuel se déplace vers le seul œil ouvert et la stéréoscopie disparaît. La réouverture de l’œil fermé remodifie instantanément ce référentiel.
Ce phénomène est fascinant. Par ailleurs, cet effet brutal (effet de l’occlusion ou de la désocclusion d’un œil sur le référentiel spatial) qui est une véritable commutation dans la perception de l’espace, n’est pas unique en sensorialité. Nous le rencontrons également en pathologie chez l’amblyope strabique pour la fovéola de l’œil dévié.

Fig. 21-139 Un enfant de 2 ans cherchant à voir avec son œil cyclope : son référentiel est son œil cyclope ; il n’a pas encore « conscience » de la vision monoculaire de chacun de ses yeux.
À la fin de ce parcours, il est évident que la meilleure façon actuellement de tester cette vision cyclopéenne est la mesure de la vision stéréoscopique.
Les quatre visions nous aident dans notre compréhension du fonctionnement du système visuel. Cela nous montre combien la vision chez l’homme est un phénomène élaboré. C’est le système visuel le plus élaboré parmi toutes les espèces sur notre planète.
[1] Bui Quoc E. La vision binoculaire chez l’animal. In : La sensorialité. Nantes, FNRO, 2011 : 3-10.
[2] Harwerth RS, Schor CM. Binocular vision. In : Adler’s physiology of the eye. Clinical application. Kaufman PL, Alm A (eds). 10th edition. St Louis, CV Mosby, 2002.
[3] Horton JC, Hocking DR, Adams DL. Metabolic mapping of suppression scotomas in striate cortex of macaques with experimental strabismus. J Neurosci, 1999 ; 19 : 7111-7129.
[4] Huang PC, Baker DH, Hess RF. Interocular suppression in normal and amblyopic vision: spatio-temporal properties. J Vis, 2012 ; 12 : 29.
[5] Julesz B. Foundations of cyclopean perception. Chicago, The University of Chicago Press, 1971; The MIT Press, 200610.
[6] Ogle KN, Martens TG, Dyer JA. Oculomotor imbalance in binocular vision and fixation disparity. Philadelphia, Lea & Febiger, 1967.
[7] Oyster CW. The human eye. Ed. Sinauer Associates, 1999.
[8] Péchereau A. Physiologie de l’oculomotricité. In : Espinasse-Berrod M-A et al. Strabologie. Approches diagnostique et thérapeutique. 2e édition. Paris, Elsevier, 2008 : 13-26.
[9] Péchereau A. Polycopié du DU de Strabologie. Tome 1. FNRO éditions, 2009.
[10] Péchereau A et al. La sensorialité. XXXVe Colloque de Nantes (2010). A & J Péchereau éditeurs, pour FNRO Éditions, Nantes, 2011.
[11] Péchereau A. Acuité visuelle. In : Santallier M. Motricité et sensorialité oculaire. Milon-la-Chapelle, S-Éditions, 2012 : 105-119.
[12] Rémy Ch. La stéréoscopie. In : La sensorialité. Nantes, FNRO, 2011 : 103-108.
[13] Salaud C. Anatomie comparée du « chiasma optique » chez les vertébrés. Université de Nantes, 2005.
[14] Sengpiel F, Blakemore C, Kind PC, Harrad R. Interocular suppression in the visual cortex of strabismic cats. J Neurosci, 1994 ; 14 (11 Pt 2) : 6855-6871.
[15] Tychsen L. Binocular vision. In : Adler’s Physiology of the eye. 9th edition. Elsevier Saunders, 1992 : 773-853.
[16] Tychsen L. Strabismus: the scientific basis. In : Pediatric ophtalmology and strabismus. Taylor D, Hoyt CS (eds). Philadelphia, Elsevier-Saunders, 2005 : 836-845.
[17] Von Noorden GK, Campos EC. Binocular vision and ocular motility. Theory and management of strabismus. St Louis, Mosby, 2002.
-
Chapitre 21
Physiologie-
I - L’œil
- Pourquoi voit-on ? Le rôle de la fovéola
- Architecture fonctionnelle de la rétine
- Champs récepteurs, rétinotopie
- Propriétés de la scène visuelle (orientation, mouvement, vitesse, relief, etc.)
- Mise au point de l’image sur la rétine
- Pourquoi divise-t-on la fonction visuelle selon une organisation magnocellulaire, parvocellulaire et koniocellulaire ?
- Bibliographie
- II - Optique et réfraction
- III - Les voies visuelles
-
IV - Le cortex visuel
- Architecture fonctionnelle du cortex visuel primaire
- De l’image au cerveau
- Où la vision monoculaire devient-elle binoculaire ?
- Le cerveau droit voit l’hémichamp visuel gauche et le cerveau gauche voit l’hémichamp visuel droit
- Méridien vertical central et unification des deux hémichamps visuels par le corps calleux
- Comment la vision de deux images différentes par chacun des yeux permet-elle de voir en relief et non double ? Notion de disparité
- Voir en relief : les cellules binoculaires sont-elles nécessaires et suffisantes ?
- Voir double ou être borgne ? Le phénomène de neutralisation
- Correspondance rétinienne normale
- Correspondance rétinienne anormale
- Développement de la fonction visuelle
- Conséquences d’une altération précoce de l’expérience visuelle
- Plasticité cérébrale et période sensible
- Plasticité cérébrale chez l’adulte
- Bibliographie
- V - Le cortex
-
VI - Le contrôle du mouvement
- Mouvements conjugués et disconjugués
- Explorer ou fixer notre attention : la différence entre les mouvements oculaires rapides et lents
- Vergences de Maddox
- Qu’est-ce que la voie finale commune ?
- Loi d’innervation réciproque de Sherrington
- Organisation type des bases neurales des mouvements oculaires
- Réflexe oculocéphalique, ou vestibulo-oculaire
- Réflexe optocinétique
- Saccades oculaires
- Poursuite oculaire
- Mouvements vergentiels : Hering versus Helmhultz
- Syncinésie de la vision de près
- Fixation oculaire
- La vision est-elle possible sans mouvement ?
- Imbrication des réseaux neuronaux
- Physiologie des muscles extraoculaires : proprioception ou décharge corollaire ?
- Mouvements de l’œil amblyope
- Bibliographie
-
VII - L’effecteur périphérique
- Particularités des fibres musculaires des muscles extraoculaires
- Implication des muscles dans les mouvements rapides et les mouvements lents
- Poulies
- Centre de rotation, axes et plans
- Positions primaire, secondaire et tertiaire
- Forces musculaires
- De l’arc de contact aux poulies : conséquences mécaniques
- Action et champ d’action des muscles oculomoteurs
- Forces des paires musculaires
- Part de la force de chaque muscle dans les neuf positions du regard
- Lois de l’oculomotricité
- Bibliographie
- VIII - La sensorialité
-
I - L’œil